1000 Брендов! БАДы из Америки - Заказ без посредников
Цены в Интернет-магазине iHerb 2-3 раза дешевле чем в России!
Для получения скидки 10 % используйте реферальный код: TSH163 (скидки действуют в любой стране)
введите этот код в корзине iHerb.com, и получите скидку на Вашу первую покупку.
Интернет-магазин iHerb.com >>>
Бесплатная доставка(Boxberry) при заказе свыше .... .Читать далее ...
Щелочная система оздоровления
ПРИЛОЖЕНИЯ
ЩЕЛОЧНАЯ СИСТЕМА ОЗДОРОВЛЕНИЯ
ПРИЛОЖЕНИЕ 1
КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ.
Во-первых, здесь из разных источников собрана информация по кислотно-щелочному равновесию. С разных сторон, разным языком, под разными углами зрения, порой просто короткие факты.
А во-вторых, разумеется, здесь же я собираю и всё, что касается нарушения этого равновесия - все факторы, которые его нарушают в ту или иную сторону.
В основном это, конечно проблема закисления - ацидоза.
ВСЁ ПО НАУКЕ:)
Первым делом - о рН строго научно. Из курсов лекций по биохимии для студентов-медиков. И тут мы, кстати, можем увидеть роль бикарбоната натрия вообще в обмене веществ. Ведь существует целая система, основанная на бикарбонате натрия, и называется - "буфер бикарбоната натрия"!
И чтобы увидеть как это всё работает мы тут коснемся не только этого буфера, но и других буферных систем крови - систем, которые участвуют в поддержании кислотно-щелочного равновесия (которое на этом - строго научном языке - называется кислотно-основное состояние).
Показатели кислотно-основного состояния
Кислотно-основное состояние крови является важнейшим показателем для жизни организма.
В настоящее время исследование кислотно-основного состояния крови проводится на газовых анализаторах, которые с учетом температуры крови и давления напрямую определяют концентрацию ионов Н+ (величину рН) и показатель pCO2 (количество СО2).
Остальные параметры рассчитываются, исходя из уравнения Гендерсона-Гассельбаха:
![]()
где рК' – константа диссоциации угольной кислоты (рК'=6,1)
Водородный показатель
Водородный показатель (рН) – отрицательный десятичный логарифм активности (или концентрации) водородных ионов в растворе.
Он является основной количественной характеристикой кислотности водных растворов:
рН = –lg[H+]
В случае равенства концентраций ионов H+ и ОН– величина рН среды соответствует 7,0, т.е. среда нейтральная. Именно таковой и является простая вода - Н2О
В растворах кислот и щелочей концентрация ионов H+ не равна концентрации ионов ОН– и рН соответственно меньше или больше 7.
Повышение концентрации ионов Н+ вызывает соответствующее уменьшение концентрации ионов ОН–, и наоборот.
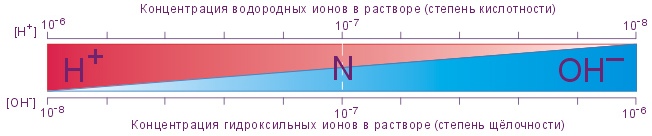
В норме концентрация ионов Н+ колеблется от 36 до 45 нмоль/л, в среднем она составляет 40 нмоль/л, что соответствует рН 7,4.
Снижение величины рН или накопление ионов Н+ называется ацидоз (закисление) , увеличение рН или дефицит ионов Н+ – алкалоз (защелачивание).
Водородный показатель является главным и его значение определяет диагноз ацидоза или алкалоза. Изменение показателя происходит при накоплении кислотных или щелочных эквивалентов.
Парциальное давление углекислого газа
Парциальное давление или напряжение углекислого газа (рСО2) – давление СО2 в газовой смеси, находящейся в равновесии с плазмой артериальной крови при температуре 38°С. Показатель является критерием концентрации углекислоты в крови.
Изменение показателя рСО2 играет ведущую роль при респираторных нарушениях кислотно-основного состояния (респираторного ацидоза и респираторного алкалоза)
При респираторном ацидозе рСО2 увеличивается из-за нарушения вентиляции легких, что и вызывает накопление угольной кислоты,
При респираторном алкалозе рСО2 снижается в результате гипервентиляции легких, которая приводит к повышенному выведению из организма углекислоты и перещелачиванию крови.
При нереспираторных (метаболических) азидозах/алкалозах показатель рСО2 не изменяется.
Если налицо такие сдвиги рН и показатель pCO2 не в норме, то имеются вторичные (или компенсаторные) изменения.
При клинической оценке сдвига показателя рСО2 важно установить, являются ли изменения причинными или компенсаторными!
Таким образом, повышение показателя pCO2 происходит при респираторных ацидозах и компенсированном метаболическом алкалозе, а снижение– при респираторных алкалозах и компенсации метаболического ацидоза.
Колебания величины рСО2 при патологических состояниях находятся в диапазоне от 10 до 130 мм рт.ст.
При респираторных нарушениях направление сдвига величины рН крови противоположно сдвигу рСО2, при метаболических нарушениях – сдвиги однонаправлены.
Концентрация бикарбонат-ионов
Концентрация бикарбонатов (ионов HCO3-) в плазме крови является третьим основным показателем кислотно-основного состояния.
На практике различают показатели актуальных (истинных) бикарбонатов и стандартных бикарбонатов.
Актуальные бикарбонаты (AB, АБ) – это концентрация ионов HCO3– в исследуемой крови при 38°С и реальных значениях pH и pCO2.
Стандартные бикарбонаты (SB, СБ) – это концентрация ионов HCO3– в исследуемой крови при приведении ее в стандартные условия: полное насыщение кислородом крови, уравновешивание при 38°С с газовой смесью, в которой pCO2 равно 40 мм рт.ст.
У здоровых людей концентрация актуальных и стандартных бикарбонатов практически одинакова.
Диагностическое значение концентрации бикарбонатов в крови состоит, прежде всего, в определении характера нарушений кислотно-основного состояния (метаболического или респираторного).
Показатель в первую очередь изменяется при метаболических нарушениях:
• при метаболическом ацидозе показатель HCO3– снижается, т.к. расходуется на нейтрализацию кислых веществ (буферная система)
• при метаболическом алкалозе – повышается
Так как угольная кислота очень плохо диссоциирует и ее накопление в крови практически не отражается на концентрации HCO3–, то при первичных респираторных нарушениях изменение бикарбонатов невелико.
При компенсации метаболического алкалоза бикарбонаты накапливаются вследствие урежения дыхания, при компенсации метаболического ацидоза – в результате усиления их почечной реабсорбции.
Концентрация буферных оснований
Еще одним показателем, характеризующим состояние кислотно-основного состояния, является концентрация буферных оснований (buffer bases, ВВ), отражающая сумму всех анионов цельной крови, в основном анионов бикарбоната и хлора, к другим анионам относятся ионы белков, сульфаты, фосфаты, лактат, кетоновые тела и т.п.
Этот параметр почти не зависит от изменения парциального давления углекислого газа в крови, но отражает продукцию кислот тканями и частично функцию почек.
По величине буферных оснований можно судить о сдвигах кислотно-основного состояния, связанных с увеличением или уменьшением содержания нелетучих кислот в крови (т.е. всех, кроме угольной кислоты).
На практике используемым параметром концентрации буферных оснований является параметр "остаточные анионы" или "неопределяемые анионы" или "анионное несоответствие" или "анионная разница".
В основе использования показателя анионной разницы лежит постулат об электронейтральности, т.е. количество отрицательных (анионов) и положительных (катионов) в плазме крови должно быть одинаковым.
Если же экспериментально определить количество наиболее представленных в плазме крови ионов Na+, K+, Cl–, HCO3–, то разность между катионами и анионами составляет примерно 12 ммоль/л.
![]()
Увеличение величины анионной разницы сигнализирует о накоплении неизмеряемых анионов (лактат, кетоновые тела) или катионов, что уточняется по клинической картине или по анамнезу.
Показатели общих буферных оснований и анионной разницы особенно информативны при метаболических сдвигах кислотно-основного состояния, тогда как при респираторных нарушениях его колебания незначительны.
Избыток буферных оснований
Избыток оснований (base excess, BE, ИО) – разница между фактической и должной величинами буферных оснований.
По значению показатель может быть положительным (избыток оснований) или отрицательным (дефицит оснований, избыток кислот).
Показатель по диагностической ценности выше, чем показатели концентрации актуальных и стандартных бикарбонатов. Избыток оснований отражает сдвиги количества оснований буферных систем крови, а актуальные бикарбонаты – только концентрацию.
Наибольшие изменения показателя отмечаютcя при метаболических нарушениях: при ацидозе выявляется нехватка оснований крови (дефицит оснований, отрицательные значения), при алкалозе – избыток оснований (положительные значения).
Предел дефицита, совместимый с жизнью, 30 ммоль/л.
При респираторных сдвигах показатель меняется незначительно.
Величина рН формирует активность клеток
Кислотно-основное равновесие – это состояние, которое обеспечивается физиологическими и физико-химическими процессами, составляющими функционально единую систему стабилизации концентрации ионов Н+.
Нормальные величины концентрации ионов Н+ около 40 нмоль/л, что в 106 раз меньше, чем концентрация многих других веществ (глюкоза, липиды, минеральные вещества).
Совместимые с жизнью колебания концентрации ионов Н+ располагаются в пределах 16-160 нмоль/л.
Так как реакции обмена веществ часто связаны с окислением и восстановлением молекул, то в этих реакциях обязательно принимают участие соединения, выступающие в качестве акцептора или донора ионов водорода. Участие других соединений сводится к обеспечению неизменности концентрации ионов водорода в биологических жидкостях.
Стабильность внутриклеточной концентрации Н+ необходима для:
• оптимальной активности ферментов мембран, цитоплазмы и внутриклеточных органелл
• формирования электро-химического градиента мембраны митохондрий на должном уровне и достаточную наработку АТФ в клетке.
Сдвиги концентрации ионов Н+ приводят к изменению активности внутриклеточных ферментов даже в пределах физиологических значений.
Например, ферменты глюконеогенеза в печени более активны при закислении цитоплазмы, что актуально при голодании или мышечной нагрузке, ферменты гликолиза – при обычных рН.
Стабильность внеклеточной концентрации ионов Н+ обеспечивает:
• оптимальную функциональную активность белков плазмы крови и межклеточного пространства (ферменты, транспортные белки),
• растворимость неорганических и органических молекул,
• неспецифическую защиту кожного эпителия,
• отрицательный заряд наружной поверхности мембраны эритроцитов.
При изменении концентрации ионов Н+ в крови активируется компенсационная деятельность двух крупных систем организма:
1. Система химической компенсации
• действие внеклеточных и внутриклеточных буферных систем,
• интенсивность внутриклеточного образования ионов Н+ и НСО3–.
2. Система физиологической компенсации
• легочная вентиляция и удаление СО2,
• почечная экскреция ионов Н+ (ацидогенез, аммониегенез), реабсорбция и синтез НСО3–.
Кислород-связанные показатели
Оксигемоглобин (HbО2) – отражает процентное отношение количества оксигемоглобина (HbО2) к сумме всех гемоглобиновых фракций (общему гемоглобину).
В норме это должно быть 94-97%
Насыщение (сатурация) гемоглобина кислородом (HbOSAT, SО2), представляет собой отношение фракции оксигенированного гемоглобина к тому количеству гемоглобина в крови, который способен транспортировать О2.
Например, насыщение гемоглобина кислородом составляет 95%, величина оксигемоглобина составляет 53%. Это означает, что несмотря на нормальное поступление кислорода, существует некоторая часть гемоглобина, не способная к его связыванию.
Показатель используется при цианозе и эритроцитозе, он помогает различить пониженную оксигенацию крови (например, при заболеваниях легких) и смешивание крови с венозной кровью при артерио-венозном шунте.
Хотя растворенный кислород составляет менее 10% общего кислорода в крови, он находится в динамическом равновесии между кислородом эритроцитов и тканей.
Данный показатель является основным при характеристике гипоксии.
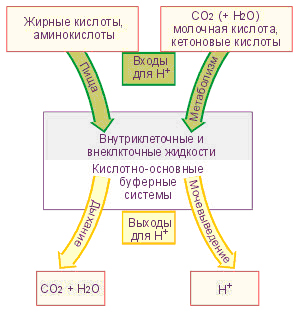
Быстрая компенсация сдвигов рН
Быстрая, т.е. повседневная компенсация сдвигов рН осуществляется за счет т.наз. буферных систем крови.
Буферные системы – это соединения, противодействующие резким изменениям концентрации ионов Н+.
Буферные системы вступают в действие практически моментально, и через несколько минут их эффект достигает максимума возможного.
Существует несколько буферных систем организма – бикарбонатная, фосфатная, белковая, гемоглобиновая.
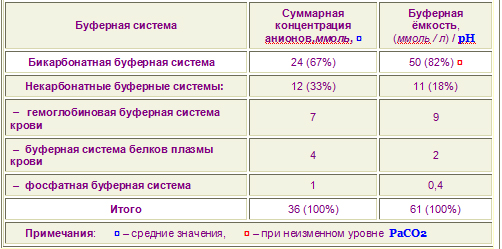
Бикарбонатная буферная система
Эта система состоит из бикарбонат-иона (НСО3–) и угольной кислоты (Н2СО3), буферная мощность составляет 65% от общей буферной емкости крови.
В норме отношение HCO3– к H2CO3 равно 20 : 1.
Работа этой системы неразрывно и тесно связана с легкими.
При поступлении в кровь более сильной кислоты, чем угольная, ионы бикарбоната натрия взаимодействуют с ней, происходит реакция обмена и образуется соответствующая соль и угольная кислота.
В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
NaНСО3 + Н-Анион > H2CO3 + Na+ + Анион–
При поступлении оснований они реагируют с угольной кислотой и образуют соли бикарбонатов:
H2CO3 + Катион-ОН > Катион+ + HCO3– + Н2О
Возникающий при этом дефицит угольной кислоты компенсируется уменьшением выделения CO2 легкими (и в этот момент мы сами не замечаем как задерживаем дыхание на какое-то время. А еще лучше в этом плане работает регулярная практика задержки дыхания в пранаяме - кумбхака. ALG)
При накоплении угольной кислоты в крови не происходит параллельного значимого увеличения концентрации H2CO3-, т.к. угольная кислота очень плохо диссоциирует (к вопросу о безопасности практики кумбхаки в параняме. Как только дыхание восстанавливается, излишек угольной кислоты тут же удаляется. ALG)
Благодаря работе бикарбонатного буфера концентрация водородных ионов понижается по двум причинам:
• угольная кислота является очень слабой кислотой и плохо диссоциирует
• в крови легких благодаря присутствию в эритроцитах фермента карбоангидразы, угольная кислота быстро расщепляется с образованием CO2, удаляемого с выдыхаемым воздухом:
H2CO3> Н2О + СО2^
(и тоже, получается, сто очков в плюс к дыхательной практике, ведь если легкие работают не на полный объем - как это у нас столь распространено - СО2 выделяется не в полном объеме, и эффективность работы этого важнейшего буфера существенно снижается. ALG)
Кроме эритроцитов, значительная активность карбоангидразы отмечена в эпителии почечных канальцев, клетках слизистой оболочки желудка, коре надпочечников и клетках печени, в незначительных количествах – в центральной нервной системе, поджелудочной железе и других органах.
Фосфатная буферная система
Фосфатная буферная система составляет около 1-2% от всей буферной емкости крови и до 50% буферной емкости мочи.
Она образована дигидрофосфатом (NaH2PO4) и гидрофосфатом (Na2HPO4) натрия.
Первое соединение слабо диссоциирует и ведет себя как слабая кислота, второе обладает щелочными свойствами.
В норме отношение HРO42– к H2РO4– равно 4 : 1.
При взаимодействии кислот (ионов водорода) с двузамещенным фосфатом натрия (Na2HPO4) натрий вытесняется, образуется натриевая соль дигидрофосфата (H2PO4–). В результате, благодаря связыванию введенной в систему кислоты, концентрация ионов водорода значительно понижается.
HPO42– + Н-Анион > H2PO4– + Анион–
При поступлении оснований избыток ОН– групп нейтрализуется имеющимися в среде Н+, а расход ионов Н+ восполняется повышением диссоциации NaH2PO4.
H2PO4– + Катион-ОН > Катион+ + HPO42– + Н2О
Основное значение фосфатный буфер имеет для регуляции pH интерстициальной жидкости и мочи.
В моче роль его состоит в сбережении бикарбоната натрия за счет дополнительного иона водорода (по сравнению с NaHCO3) в составе выводимого NaH2PO4:
Na2HPO4 + Н2СО3 > NaH2PO4 + NaНСО3
Кислотно-основная реакция мочи зависит только от содержания дигидрофосфата, т.к. бикарбонат натрия в почечных канальцах реабсорбируется.
Белковая буферная система
Буферная мощность этой системы составляет 5% от общей буферной емкости крови.
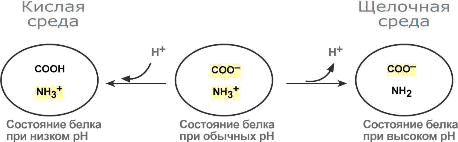
Белки плазмы, в первую очередь альбумин, играют роль буфера благодаря своим амфотерным свойствам.
В кислой среде подавляется диссоциация СООН-групп, а группы NH2 связывают избыток Н+, при этом белок заряжается положительно.
В щелочной среде усиливается диссоциация карбоксильных групп, образующиеся Н+ связывают избыток ОН–-ионов и pH сохраняется, белки выступают как кислоты и заряжаются отрицательно.
Гемоглобиновая буферная система
Наибольшей мощностью обладает гемоглобиновый буфер, который можно рассматривать как часть белкового. На него приходится до 30% всей буферной емкости крови.
В буферной системе гемоглобина существенную роль играет гистидин, который содержится в белке в большом количестве.
Изоэлектрическая точка гистидина равна 7,6, что позволяет гемоглобину легко принимать и легко отдавать ионы водорода при малейших сдвигах физиологической рН крови (в норме 7,35-7,45).
Данный буфер представлен несколькими подсистемами:
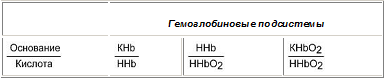
Пара ННb/ННbО2 является основной в работе гемоглобинового буфера.
Соединение ННbО2 является более сильной кислотой по сравнению с угольной кислотой, HHb - более слабая кислота, чем угольная. Установлено, что ННbО2 в 80 раз легче отдает ионы водорода, чем ННb.
Присоединение ионов водорода к остатку гистидина дезоксигемоглобина выглядит так:
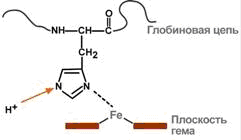
Работа гемоглобинового буфера неразрывно связана с дыхательной системой (к вопросу о значении пранаямы! - ALG)
В легких после удаления СО2 (угольной кислоты) происходит защелачивание крови.
При этом присоединение О2 к дезоксигемоглобину H-Hb образует кислоту ННbО2 более сильную, чем угольная. Она отдает свои ионы Н+ в среду, предотвращая повышение рН:
Н-Hb + O2 > [H-HbO2] > НbO2 + Н+
В капиллярах тканей постоянное поступление кислот (в том числе и угольной) из клеток приводит к диссоциации оксигемоглобина НbO2 (Эффект Бора) и связыванию ионов Н+ в виде Н-Hb:
НbO2+ Н+ > [H-HbO2] > Н-Hb + O2
Длительная стабилизация сдвигов рН
Это так называемая физиологическая компенсация нарушений кислотно-основного состояния, которая происходит прежде всего за счет работы дыхательной системы и почек, и в меньшей степени - за счет печени и костной системы.
Дыхательная система
Легочная вентиляция обеспечивает удаление угольной кислоты, образованной при функционировании бикарбонатной буферной системы. По скорости реакции на изменение рН – это вторая система после буферных систем.
Дополнительная вентиляция легких приводит к удалению СО2, а значит и Н2СО3, и повышает рН крови, что компенсирует закисление межклеточной жидкости и плазмы крови продуктами метаболизма, в первую очередь, органическими кислотами.
Сдвиги значений рО2 не являются сильно значимыми для изменения легочной вентиляции. Только снижение рО2 до 8 кПа в артериальной крови (норма 11,04-14,36 кПа или 83-108 мм рт.ст.) приводит к увеличению активности дыхательного центра.
Более существенным фактором для активации дыхательной системы является концентрация ионов Н+.
Накопление ионов Н+ в крови уже через 1-2 минуты вызывает максимальную (для данной их концентрации) стимуляцию дыхательного центра, повышая его активность до 4-5 раз, что приводит к снижению рСО2 до 10-15 мм рт.ст.
И, наоборот, снижение кислотности крови понижает активность дыхательного центра на 50-75%, рСО2 при этом способен возрастать до 60 мм рт.ст и выше.
Костная ткань
Это наиболее медленно реагирующая система. Механизм ее участия в регуляции рН крови состоит в возможности обмениваться с плазмой крови ионами Са2+ и Na+ в обмен на протоны Н+. Происходит растворение гидроксиапатитных кальциевых солей костного матрикса, освобождение ионов Са2+ и связывание ионов НРО42– с Н+ с образованием дигидрофосфата, который уходит с мочой.
Параллельно при снижении рН (закисление) происходит поступление ионов H+внутрь остеоцитов, а ионов калия – наружу.
Печень
Существенную, но пассивную роль в регуляции кислотно-основного состояния крови берет на себя печень, в которой происходит метаболизм низкомолекулярных органических кислот (молочная кислота и др). Кроме этого, кислые и щелочные эквиваленты выделяются с желчью.
Почки
Развитие почечной реакции на смещение кислотно-основного состояния происходит в течение нескольких часов.
Регуляция концентрации ионов H+ осуществляется опосредованно, через потоки ионов Na+, движущихся по градиенту концентрации, и через перераспределение потоков ионов К+ и Н+, которые выходят из эпителиоцитов (секретируются) в обмен на ионы Na+.
Также для обеспечения электронейтральности внутри- и внеклеточной жидкости при реабсорбции ионов Na+ усиливается реабсорбция ионов Cl–, однако их не хватает, поэтому возникает необходимость в усилении реабсорбции и дополнительном синтезе ионов HCO3– (и вот тут-то как раз и играет свою роль сода - бикарбонат натрия NaHCO3. Если мы поставляем организму дополнительное количество ионов HCO3 посредством соды, мы существенно снижаем нагрузку с почек и помогаем им в работе - ALG)
В почках активно протекают три процесса, связанных с уборкой кислых эквивалентов. Благодаря этим процессам рН мочи в состоянии снижаться до 4,5-5,2 :
1. Реабсорбция бикарбонатных ионов HCO3–.
2. Ацидогенез – удаление ионов Н+ с титруемыми кислотами (в основном в составе дигидрофосфатов NaH2PO4).
3. Аммониегенез – удаление ионов Н+ в составе ионов аммония NH4+.
Реабсорбция бикарбонат-ионов
В проксимальных канальцах ионы Na+ мигрируют в цитозоль эпителиальных клеток в силу концентрационного градиента, который создается на базолатеральной мембране при работе фермента Na+,К+ АТФазы.
В обмен на ионы Na+ эпителиоциты канальцев активно секретируют в канальцевую жидкость ионы водорода.
Ионы HCO3– первичной мочи и секретируемые ионы Н+ образуют угольную кислоту Н2СО3.
В гликокаликсе эпителиоцитов фермент карбоангидраза катализирует распад угольной кислоты на СО2 и воду.
В результате возникает градиент концентрации углекислого газа между просветом канальцев и цитозолем и СО2диффундирует в клетки.
Внутриклеточная карбоангидраза использует пришедший СО2 и образует угольную кислоту, которая диссоциирует.
Ионы НСО3– транспортируются в кровь, ионы Н+ – секретируются в мочу в обмен на ионы Na+. Таким образом, объем реабсорбции НСО3– полностью соответствует секреции ионов Н+.
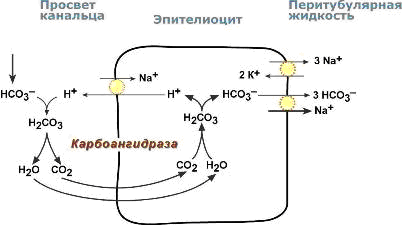
Процесс реабсорбции бикарбонат-ионов
В проксимальных канальцах происходит реабсорбция 90% профильтрованного НСО3–.
В петле Генле и дистальных канальцах реабсорбируется оставшееся количество карбонат-иона. Всего в почечных канальцах реабсорбируется более 99% от фильтруемых бикарбонатов.
(Из всего вышесказанного становится очевидным, что дополнительное поступление в систему бикарбонат-ионов благодаря приему бикарбоната натрия - соды - снижает нагрузку на эту сторону работы почек. Чем больше свободных бикарбонат-ионов имеется в системе, тем меньше зависимость организма от этого процесса их реабсорбции. Соответственно, почки не сильно напрягаются в этом плане, в результате чего мы на выходе имеем мочу с более щелочной реакцией! Известно же, что у новорожденных показатель мочи близок к 8...ALG)
Ацидогенез
В процессе ацидогенеза в сутки с мочой выделяется 10-30 ммоль кислот, называемых титруемыми кислотами.
Фосфаты, являясь одной из этих кислот, играют роль буферной системы в моче.
Роль этой системы состоит экскреции кислых эквивалентов без потерь бикарбонат-ионов за счет дополнительного иона водорода в составе выводимого NaH2PO4 (по сравнению с NaHCO3):
Na2HPO4 + Н2СО3 > NaH2PO4 + NaНСО3
После того как бикарбонат натрия в почечных канальцах реабсорбируется, кислотность мочи зависит только от связывания ионов Н+с HPO42– и содержания дигидрофосфата.
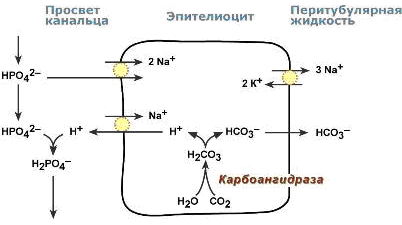
Процесс ацидогенеза в почечных канальцах
Хотя в крови соотношение HРO42– : H2РO4– равно 4 : 1, в клубочковом фильтрате оно меняется на 1 : 9.
Происходит это из-за того, что менее заряженный H2РO4– лучше фильтруется в клубочках.
Связывание ионов Н+ ионами HРO42– на протяжении всего канальца приводит к увеличению количества H2РO4–.
В дистальных канальцах соотношение может достигать 1 : 50.
Аммониегенез
Аммониегенез происходит на протяжении всего почечного канальца, но более активно идет в дистальных отделах – дистальных канальцах и собирательных трубочках коркового и мозгового слоев. Глутамин и глутаминовая кислота, попадая в клетки канальцев, быстро дезаминируются ферментами глутаминаза и глутаматдегидрогеназа с образованием аммиака.
Являясь гидрофобным соединением, аммиак диффундирует в просвет канальца и акцептирует ионы Н+ с образованием аммонийного иона.
Источником ионов H+ первичной мочи в проксимальных отделах канальца является Na+, H+-антипорт. В дистальных отделах, в отличие от проксимальных, секреция ионов Н+ происходит с участием Н+-АТФазы, локализованной на апикальной мембране вставочных клеток.
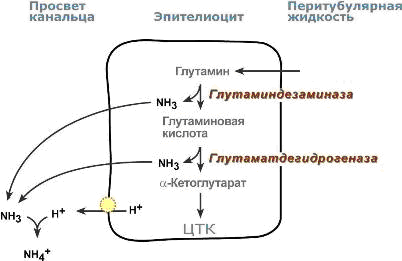
Процесс аммониегенеза в дистальных канальцах
Аммонийный катион NH4+ способен взаимодействовать с анионами Cl–, SO42–, с органическими кислотами (лактат и другие) с образованием аммонийных солей, которые выводятся с мочой.
АЦИДОЗ
Закисление организма - ацидоз - это поистине бич нашей современной западной цивилизации. Соответственно.если мы хотим быть здоровыми, то нужно иметь хорошее представление обо всех факторах окружающей среды, ведущих к закислению.
Первым делом, конечно, опять же, всё по науке:)
Виды ацидоза.
1. Респираторный ацидоз (лат. acidosis gasea).
Возникаект при гиповентиляции или вдыхания воздуха с повышенным содержанием углекислого газа.
2. Метаболический ацидоз (лат. acidosis metabolica). Возникает из-за накопления кислых продуктов в тканях, недостаточного их связывания или разрушения (кетоацидоз, лактатацидоз).
3. Выделительный ацидоз (лат. acidosis excretoria). Возникает при затруднениях выведения нелетучих кислот почками (почечный ацидоз) или увеличенной потере оснований через желудочно-кишечный тракт (гастроэнтеральный ацидоз);
4. Экзогенный ацидоз (лат. acidosis exogena). Наступает при введении в организм большого количества кислот или веществ, образующих кислоты в процессе метаболизма, напр.лекарств (особенно - химиотерапия)
5. Смешанный ацидоз (лат. acidosis mixta). Сочетание различных видов ацидозов. Например, при патологии сердечно-сосудитой или дыхательной систем затруднено выведение углекислого газа, что вызывает уменьшение кислорода в крови и последующее накопление недоокисленных продуктов метаболизма.
*************************************************
Основа рака - кислая среда.
рН человеческой крови при рождении 7,45-7,50, а умирает человек с показателем 5,41-5,45. На всю жизнь ему отведено 2 единицы.
Рак возникает при снижении водородного показателя до величины 5,41.
Самая большая активность лимфатических клеток по уничтожению раковых заболеваний проявляется при РН 7,4.
Однако обычно вокруг клеток, пораженных раком , существует более кислая среда, которая препятствует активности лимфатических клеток.
В кислой среде более часто возникают злокачественные новообразования слизистой оболочки пищевода. Замечено, что во многих странах возрастание потребления газированных прохладительных напитков сопровождалось параллельным увеличением распространенности рака пищевода.
Нормальное состояние внутренних жидкостей человеческого организма - слабо-щелочное.
Кислая среда - благоприятная среда для буйного роста бактерий и раковых клеток.
Метастазы рака это такие же плодовые тела "грибные" уже по всей "грибнице". Созрев, метастазы отрываются и разносятся по всему организму, ищут слабое место и растут снова.
А слабое место - это кислая среда в организме, различные воспаления в органах и системах.
Вот и получается, чтобы вылечить рак и для его профилактики, нужно поддерживать в организме щелочную среду.
Содержание материала
- Щелочная система оздоровления
- ЧАСТЬ 1. ОСНОВНЫЕ ХИМИЧЕСКИЕ ПРОЦЕССЫ В ОРГАНИЗМЕ
- ЧАСТЬ 2. ОСНОВЫ РЕГУЛЯЦИИ ОРГАНИЗМА
- ЧАСТЬ 3. ПОНЯТИЯ ЗДОРОВЬЯ, БОЛЕЗНИ И ИСЦЕЛЕНИЯ В КИСЛОТНО-ЩЕЛОЧНОЙ ТЕОРИИ
- ЧАСТЬ 4. НАСЛАЖДЕНИЕ В КИСЛОЕ И ЩЕЛОЧНОЕ
- ЧАСТЬ 5. ОТЛОЖЕНИЕ ШЛАКОВ И КАК ОНО ПРОТЕКАЕТ
- ЧАСТЬ 6. ОБМЕН ВЕЩЕСТВ У МУЖЧИН И ЖЕНЩИН В СВЕТЕ ШЛАКООБРАЗОВАНИЯ
- ЧАСТЬ 7. СТАРЕНИЕ В СВЕТЕ ПРОЦЕССА ШЛАКООБРАЗОВАНИЯ
- ЧАСТЬ 8. БЕРЕМЕННОСТЬ В СВЕТЕ ШЛАКООБРАЗОВАНИЯ
- ЧАСТЬ 9. ЦЕЛЛЮЛИТ С ТОЧКИ ЗРЕНИЯ ШЛАКООБРАЗОВАНИЯ
- ЧАСТЬ 10. ВЫПАДЕНИЕ ВОЛОС КАК РЕЗУЛЬТАТ ЗАШЛАКОВКИ ОГРАНИЗМА
- ЧАСТЬ 11. ОСОБЕННОСТИ ШЛАКООБРАЗОВАНИЯ ПРИ СПОРТИВНЫХ НАГРУЗКАХ
- ЧАСТЬ 12. ЩЕЛОЧНЫЕ МЕТОДИКИ ОЗДОРОВЛЕНИЯ
- ЧАСТЬ 13. КУРСЫ ЩЕЛОЧНОГО ОЗДОРОВЛЕНИЯ
- ЧАСТЬ 14. ХИМИЯ ВЫВЕДЕНИЯ ШЛАКОВ
- ЧАСТЬ 15. ЦЕЛЕНАПРАВЛЕННОЕ ВЫВЕДЕНИЕ ШЛАКОВ
- ЧАСТЬ 16. КРИЗИС ГОЛОДАНИЯ КАК КИСЛОТНАЯ АТАКА
- ЧАСТЬ 17. ОСТОРОЖНОЕ ВЫВЕДЕНИЕ ШЛАКОВ
- ЧАСТЬ 18. ПРЕДУПРЕЖДЕНИЕ БОЛЕЗНИ И ПРОФИЛАКТИЧЕСКАЯ МЕДИЦИНА
- ПРИЛОЖЕНИЯ 1. КИСЛОТНО-ЩЕЛОЧНОЕ РАВНОВЕСИЕ
- ПРИЛОЖЕНИЕ 2. ПИТАНИЕ С ТОЧКИ ЗРЕНИЯ КИСЛОТНО-ЩЕЛОЧНОГО РАВНОВЕСИЯ
- ПРИЛОЖЕНИЕ 3. СОДА В ЩЕЛОЧНОМ ОЗДОРОВЛЕНИИ
- ПРИЛОЖЕНИЕ 4. ПЕРЕПИСКА ПО ЩЕЛОЧНОМУ ОЗДОРОВЛЕНИЮ