ПРОЦЕДУРА ТЕСТИРОВАНИЯ НА ВИЧ – ИНФЕКЦИЮ
Кому нужны тесты на ВИЧ?
ВИЧ — это вирус. В отличие от людей, вирусы не знают, что такое дискриминация. Вирусу безразличен пол, возраст, социальное положение и сексуальная ориентация — все, что нужно ВИЧ — это возможность проникнуть в организм. Не существует «групп риска», существуют ситуации, которые являются потенциально опасными с точки зрения передачи ВИЧ:- — Вагинальный или анальный секс без презерватива.
- — Инъекционный прием наркотиков при помощи иглы, шприца или посуды, которыми ранее пользовались другие люди.
Если вас беспокоит возможность передачи ВИЧ, то до обращения в кабинет тестирования вам может потребоваться информация о риске заражения, а также о самих тестах.
Зачем идти в кабинет тестирования?
Люди решают пройти тестирование на ВИЧ по самым разным причинам:
— Знание о своем положительном ВИЧ-статусе может помочь людям вовремя получить медицинскую помощь, которая способна предотвратить серьезные и угрожающие жизни заболевания.
— Знание об отсутствии у себя инфекции, может помочь человеку принять решение о том, как сделать свое поведение наиболее безопасным в отношении ВИЧ. Также для человека может быть важно, знать о наличии у себя ВИЧ, так как его волнует безопасность сексуального партнера.
— Диагностика ВИЧ-инфекции позволяет предотвратить передачу ВИЧ ребенку во время беременности.
— Для некоторых людей знание о своем ВИЧ-статусе, пусть даже положительном, может быть менее страшным, чем постоянное беспокойство и навязчивые мысли о возможном заражении. В любом случае, сдача анализа позволяет положить конец мучительной неопределенности, и принимать решения о своей дальнейшей жизни на основе знаний о состоянии своего здоровья.
Причины отказа от тестирования
У человека также могут быть причины для того, чтобы не сдавать тест. Он может быть уверен, что в его жизни не было рискованных в отношении ВИЧ ситуаций. Также у человека могут быть более личные причины для отказа от теста. Для многих людей стресс, вызванный знанием о ВИЧ-инфекции, а также возможное влияние диагноза на отношения с окружающими и образ жизни может быть гораздо более пугающим, чем незнание ВИЧ-статуса. Некоторые люди опасаются разглашения тайны диагноза. Также они могут беспокоиться о возможной дискриминации, с которой приходиться сталкиваться ВИЧ-положительным людям.
Подобные вопросы беспокоят большинство людей. Каждый самостоятельно решает, что для него важнее: страх возможного диагноза или преимущества тестирования на ВИЧ. В подобной ситуации человеку может потребоваться консультирование, или обращение на телефон доверия, где ему помогут в принятии решения. Достижения и прогресс медицины в области лечения ВИЧ-инфекции являются главным доводом в пользу теста на ВИЧ.
Если ВИЧ-инфекция неизлечима и вакцины не существует, есть ли смысл узнавать о том, что у тебя ВИЧ?
Даже если у человека есть ВИЧ, он может позаботиться о том, чтобы сохранить свое здоровье. Хотя на сегодняшний день невозможно полностью избавить человека от ВИЧ, существуют способы замедлить развитие ВИЧ-инфекции, а также излечить или предотвратить опасные заболевания.
Если был риск заражения ВИЧ, когда можно сделать тест?
Иммуноферментный анализ (ИФА), который используется для диагностики ВИЧ, может показать результат только через несколько недель после инфицирования. Данный тип анализа определяет не сам вирус, а антитела к нему. У некоторых людей антитела присутствуют в крови в достаточном количестве уже через 2 недели. Тем не менее, у большинства образование антител (сероконверсия) занимает больше времени. Чтобы результат теста был достаточно достоверен, необходимо, чтобы прошло около 3 месяцев после рискованной ситуации. После 3 месяцев тест ИФА достоверен у 95-98% людей, то есть у подавляющего большинства. Иногда образование антител занимает больше времени — от 3 до 6 месяцев.
Данный тип анализа определяет не сам вирус, а антитела к нему. У некоторых людей антитела присутствуют в крови в достаточном количестве уже через 2 недели. Тем не менее, у большинства образование антител (сероконверсия) занимает больше времени. Чтобы результат теста был достаточно достоверен, необходимо, чтобы прошло около 3 месяцев после рискованной ситуации. После 3 месяцев тест ИФА достоверен у 95-98% людей, то есть у подавляющего большинства. Иногда образование антител занимает больше времени — от 3 до 6 месяцев.
Если результат теста отрицательный через 3 месяца, обязательно ли делать повторный тест через 6 месяцев?
У подавляющего большинства людей тест вполне достоверен через 3 месяца (у большинства антитела появляются еще раньше). Можно полностью исключить возможность заражения, сдав анализ через 6 месяцев. Тем не менее, для многих людей ожидание результатов теста является очень тяжелым переживанием. Если у человека не было очень рискованных контактов с заведомо ВИЧ — положительным партнером, то вероятность, что он окажется среди тех немногих людей, чей тест недостоверен через 3 месяца ничтожно мала.
Как долго нужно ждать результатов теста?
Результат анализа, как правило, готов через 3 рабочих дня. Учитывая, что ожидание результатов может быть весьма неприятным периодом, лучше всего уточнить этот вопрос заранее, до сдачи анализа. Также можно узнать, не повлияют ли на сроки теста выходные дни и праздничные дни.
Где лучше сделать тест?
Тестирование на ВИЧ – инфекцию должно обязательно сопровождаться процедурой до – и послетестового консультирования, в процессе которых пациент получает достоверную информацию о ВИЧ – инфекции, обсуждает с консультантом индивидуальный риск инфицирования и пути снижения рисков, получает ответы на все интересующие вопросы, касаемые процедуры теста на ВИЧ.
Тестирование бывает двух видов: конфиденциальное и анонимное.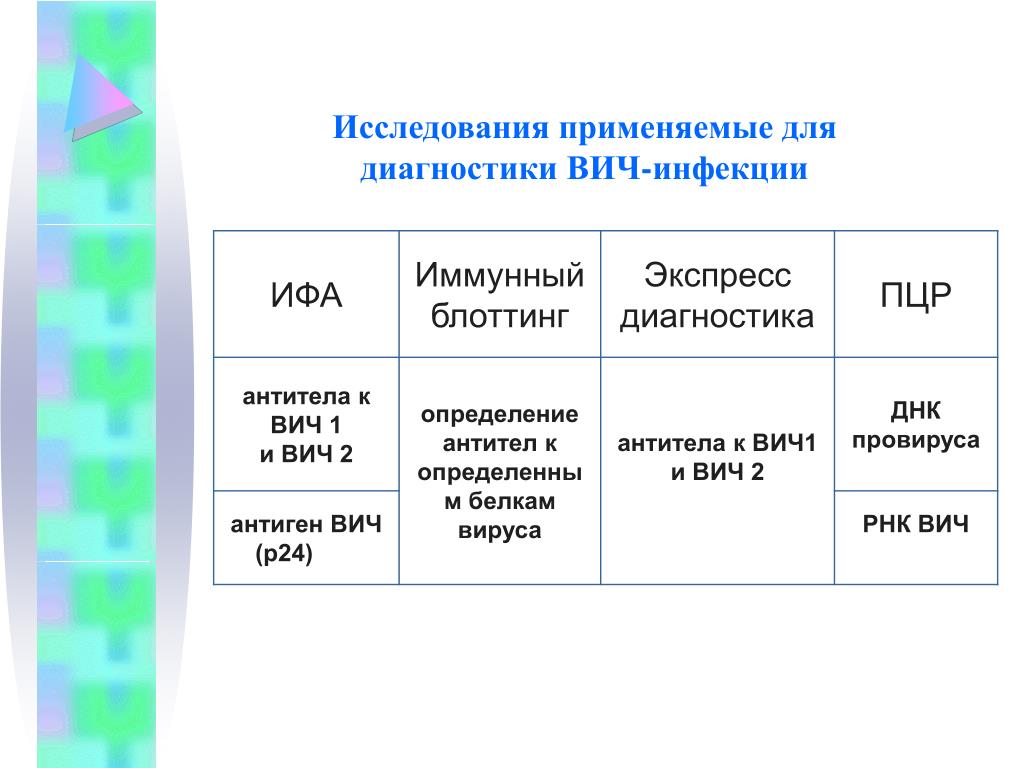 Если вы делаете тест конфиденциально, то сотрудникам лаборатории будет известно ваше имя, но следует учесть, что они не могут сообщить его куда-либо, так как это будет нарушением врачебной тайны. В анонимных кабинетах тестирования вы не сообщаете своего имени, а вам присваивается номер или имя по которым вы сможете узнать результат теста.
Если вы делаете тест конфиденциально, то сотрудникам лаборатории будет известно ваше имя, но следует учесть, что они не могут сообщить его куда-либо, так как это будет нарушением врачебной тайны. В анонимных кабинетах тестирования вы не сообщаете своего имени, а вам присваивается номер или имя по которым вы сможете узнать результат теста.
Пройти тестирование на ВИЧ — инфекцию вы можете в любом филиале Удмуртского республиканского СПИД – центра, а также в консультативной поликлинике по адресам:
Консультативная поликлиника Удмуртского СПИД – центра: г. Ижевск, ул. Труда, 17а,
e-mail: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript . Телефон: 8(3412) 21-15- 94, 21-35-94, 21-37-86
Сарапульский зональный центр СПИД: г. Сарапул, ул. Гагарина, 67, лит. «Д».
(34147)3-27-43, e-mail:
Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript
.
Воткинский зональный центр СПИД: г. Воткинск, ул. Школьная, 2.
(34145)3-36-23, e-mail: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript .
Можгинский зональный центр СПИД: г. Можга, ул. Сюгаильская, 19.
(34139)3-26-65, e-mail: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript .
Игринский зональный центр СПИД: пос. Игра, ул. Милиционная, 6.
(34134)4-04-85, e-mail: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript .
Глазовский зональный центр СПИД: г. Глазов, ул. Кирова, 27, лит «Л».
(34141)3-37-07, e-mail: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript .
Увинский зональный центр СПИД: пос. Ува, ул. Чкалова, 20.
Чкалова, 20.
(34130)5-28-19, e-mail: Этот e-mail адрес защищен от спам-ботов, для его просмотра у Вас должен быть включен Javascript .
Если результат отрицательный, значит больше волноваться не надо?
Если тест был сделан через достаточный период времени, в течение которого у вас не было опасных контактов, это значит, вы ВИЧ — отрицательны. Тем не менее, тестирование на ВИЧ и профилактика — это не одно и то же. Недостаточно просто регулярно сдавать анализ, если ваше поведение остается рискованным, то через какое-то время результат теста может оказаться положительным. По счастью, пути передачи ВИЧ изучены лучше, чем у любого другого вируса. Получение отрицательного результата — это хороший повод узнать как можно больше о профилактике ВИЧ, и принять решение о том, как снизить для себя риск заражения.
Насколько достоверен положительный результат теста?
Иногда у ИФА бывают ложноположительные результаты (примерно в 1% случаев), причиной подобного результата может быть беременность, различные вирусные инфекции, а также простая случайность. После получения положительного результата необходим более точный тест — иммуноблот, по результатам которого и ставится диагноз. Положительный результат иммуноблота после положительного ИФА достоверен на 99,9% — это максимальная точность для любого медицинского теста. Если иммуноблот отрицательный, значит, первый тест был ложноположительным, и на самом деле ВИЧ у человека нет.
После получения положительного результата необходим более точный тест — иммуноблот, по результатам которого и ставится диагноз. Положительный результат иммуноблота после положительного ИФА достоверен на 99,9% — это максимальная точность для любого медицинского теста. Если иммуноблот отрицательный, значит, первый тест был ложноположительным, и на самом деле ВИЧ у человека нет.
Что такое неопределенный результат?
Если ИФА бывает положительным или отрицательным, то иммуноблот может быть положительным, отрицательным или неопределенным. Неопределенный результат иммуноблота, т.е. наличие в иммуноблоте хотя бы одного белка к вирусу, может наблюдаться, если заражение произошло недавно и в крови еще мало антител к ВИЧ, в этом случае иммуноблот станет положительным через некоторое время. Также неопределенный результат может появиться при отсутствии ВИЧ-инфекции при гепатите, некоторых хронических заболеваниях обменного характера, или при беременности. В этом случае, либо иммуноблот станет отрицательным, либо будет обнаружена причина неопределенного результата.
В этом случае, либо иммуноблот станет отрицательным, либо будет обнаружена причина неопределенного результата.
Есть ли тест, который можно сделать раньше?
Диагностика ВИЧ-инфекции производиться только с помощью тестов, определяющих антитела. Помимо этого есть тест полимеразной цепной реакции (ПЦР), который определяет генетический материал самого вируса, поэтому он достаточно достоверен через 10 дней после возможного заражения. Иногда люди делают тест ПЦР, т. к. для них тяжело ждать 3 месяца, в других случаях его может назначить врач, например, его делают детям, рожденным от ВИЧ — положительных матерей. Тем не менее, несмотря на высокую чувствительность и надежность, были зафиксированы случаи ложноположительных и ложноотрицательных результатов ПЦР. По этой причине, даже если был сделан ПЦР, может понадобиться подтверждающее тестирование методом ИФА.
Если мой партнер сделал тест на ВИЧ, зачем делать тест мне?
Результат теста партнера не всегда говорит о вашем статусе. У вашего партнера может быть ВИЧ, при этом вы могли остаться ВИЧ — отрицательным даже после опасного секса. Также при отсутствии ВИЧ у постоянного сексуального партнера, вирус мог передаться вам во время других случаев рискованного поведения. Если речь идет о стабильных отношениях, то зачастую тестирование рекомендуется обоим партнером одновременно.
У вашего партнера может быть ВИЧ, при этом вы могли остаться ВИЧ — отрицательным даже после опасного секса. Также при отсутствии ВИЧ у постоянного сексуального партнера, вирус мог передаться вам во время других случаев рискованного поведения. Если речь идет о стабильных отношениях, то зачастую тестирование рекомендуется обоим партнером одновременно.
Что делать, если результат теста отрицательный, но до сих пор есть симптомы?
Прежде всего, обратитесь к врачу по поводу всех своих симптомов. Их причиной может быть все, что угодно помимо ВИЧ-инфекции. Единственным достоверным способом диагностики ВИЧ является тестирование. Даже опытный врач не может определить ВИЧ-инфекцию по симптомам. Если прошло уже достаточно времени и результат повторного анализа отрицательный, то у вас нет ВИЧ, независимо от наличия или отсутствия симптомов. Тем не менее, подобные переживания могут быть симптомом СПИДофобии, и в этом случае следует уделить больше внимания своему психологическому здоровью.
Что делать, если все-таки будет обнаружен ВИЧ?
Следует помнить, что ВИЧ и СПИД — это не одно и то же. Если у вас обнаружат ВИЧ, это значит, что в вашем теле присутствует вирус, от которого на данный момент вы не сможете полностью избавиться. СПИД — это лишь одна из стадий ВИЧ-инфекции, во время которой у людей действительно начинаются серьезные проблемы со здоровьем, тем не менее, существуют медикаменты, которые способны замедлить развитие ВИЧ-инфекции и избавить человека от СПИДа. У большинства людей, живущих с ВИЧ, не наблюдается никаких симптомов, они могут продолжать вести привычный образ жизни. Тем не менее, диагноз ВИЧ-инфекция может привести к психологическим проблемам, человеку может потребоваться много времени, чтобы научиться жить с ВИЧ.
Материал подготовлен с использованием информации портала http://aids.ru/
Центр СПИД — Анализы на ВИЧ ПЦР реал тайм
Как то стыдно писать, но деваться некуда, весь интернет перекопал, но никак не разберусь что делать. Был я вобщем в салоне эротического массажа, при этом был в драбадан, помыла массажиска в ванной меня где первый раз мастурбировала мне до эокуляции, т.к.я был очень пьян лизал и брал в рот её соски. Потом на кроватb делала массаж и не знаю как получилось, началась взаимная мастурбация, я не помню вводила ли она мой член к себе в вагину, на 100% сказать не могу, но я трогал свой член руками, которыми мастурбировал массажистке, трогал в области слизистых члена и уздечки.При этом член был очень натёрт. После этого меня опять помыли и я протёр член мирамистином. В общем утром начался трэш, до этого я на лево не ходил( а теперь точно не буду) и не знал что можно провести пост контактную профилактику. Через 4 дня мучений и сжигающего стыда пошёл к урологу, сдал ПЦР и анализы на ВИЧ(комбо), Сифилис, Гепатиты, сейчас то я начитавшись понял, что с меня тупо содрали бабки, т.к. анализы было делать рано, всё конечно отрицательно, врач сказал, что 4 дня достаточно и анализы верные. Я обрадовался, начал половую жизнь с девушкой своей, тут она ( а вней я уверен) через 2,5 недели пошла на планирование беременности сдавать анализы и нашли микоплазму гениталиум.
Был я вобщем в салоне эротического массажа, при этом был в драбадан, помыла массажиска в ванной меня где первый раз мастурбировала мне до эокуляции, т.к.я был очень пьян лизал и брал в рот её соски. Потом на кроватb делала массаж и не знаю как получилось, началась взаимная мастурбация, я не помню вводила ли она мой член к себе в вагину, на 100% сказать не могу, но я трогал свой член руками, которыми мастурбировал массажистке, трогал в области слизистых члена и уздечки.При этом член был очень натёрт. После этого меня опять помыли и я протёр член мирамистином. В общем утром начался трэш, до этого я на лево не ходил( а теперь точно не буду) и не знал что можно провести пост контактную профилактику. Через 4 дня мучений и сжигающего стыда пошёл к урологу, сдал ПЦР и анализы на ВИЧ(комбо), Сифилис, Гепатиты, сейчас то я начитавшись понял, что с меня тупо содрали бабки, т.к. анализы было делать рано, всё конечно отрицательно, врач сказал, что 4 дня достаточно и анализы верные. Я обрадовался, начал половую жизнь с девушкой своей, тут она ( а вней я уверен) через 2,5 недели пошла на планирование беременности сдавать анализы и нашли микоплазму гениталиум. Тогда я стал читать в инете про болезни и анализы. Сдавал через 3 недели после салона опять ПЦР(отрицательно 12 шт.), взяли на микрофлору, тоже сказали потологий не обнаружено… И я сдавал на сифилис (ИФА и RPR), гепатиты и ВИЧ (ИФА комбо Эббот), через 1,5 мес.,3 мес., 4,5 мес.- отрицательно. Но всё боюсь за свою девушку, она тоже сдавала через 2 мес. на ВИЧ, сифилис, гепатиты-отрицательно, что могу её заразить или мог заразить. Не могу ждать 6 месяцев, очень плохо себя чувствую психологически и физически, вылезли разные болезни- обострился желчный пузырь(болит бок на узи взвесь), лимфоузлы на задней части шеи болят, горло воспалилось, слабость. Скажите пожалуйста, если сдавать через 4,5 мес. ПЦР реал тайм, то будет он информативен? Нужно ли при отрицательных анализах сдавать каждый месяц до 12 месяцев, чтобы исключить ВИЧ?
Тогда я стал читать в инете про болезни и анализы. Сдавал через 3 недели после салона опять ПЦР(отрицательно 12 шт.), взяли на микрофлору, тоже сказали потологий не обнаружено… И я сдавал на сифилис (ИФА и RPR), гепатиты и ВИЧ (ИФА комбо Эббот), через 1,5 мес.,3 мес., 4,5 мес.- отрицательно. Но всё боюсь за свою девушку, она тоже сдавала через 2 мес. на ВИЧ, сифилис, гепатиты-отрицательно, что могу её заразить или мог заразить. Не могу ждать 6 месяцев, очень плохо себя чувствую психологически и физически, вылезли разные болезни- обострился желчный пузырь(болит бок на узи взвесь), лимфоузлы на задней части шеи болят, горло воспалилось, слабость. Скажите пожалуйста, если сдавать через 4,5 мес. ПЦР реал тайм, то будет он информативен? Нужно ли при отрицательных анализах сдавать каждый месяц до 12 месяцев, чтобы исключить ВИЧ?Вопрос-ответ — СПИД центр
Задать вопросГуля
5 марта 2021 12:44Здравствуйте тоже спросить можно ли передать ВИЧ через слюни ? Поцелуи ?
Здравствуйте, Гуля! Заражение ВИЧ при поцелуях маловероятно, но возможно при наличии ранок на губах, деснах у обоих партнеров. Слюна фактором передачи ВИЧ не является.
Слюна фактором передачи ВИЧ не является.
вопрос
Дмитрий
5 марта 2021 09:10А может ошибка быть,при взятии анализа на ВИЧ?
Здравствуйте, Дмитрий! Если Вы не доверяете результатам обследования, рекомендуем повторить тест в другой лаборатории.
вопрос
Виталий Новичков
4 марта 2021 18:29здравствуйте как записатся по телефону на приём к терапевту?!
Доброго времени суток, Виталий. В настоящий момент записи по телефону на прием к терапевту нет. Вы можете записаться на прием в день обращения через регистратуру. До конца марта Вахрушева Е.Ю. принимает по четным числам, Арефьева Т.В. – по нечетным. Ждем Вас.
В настоящий момент записи по телефону на прием к терапевту нет. Вы можете записаться на прием в день обращения через регистратуру. До конца марта Вахрушева Е.Ю. принимает по четным числам, Арефьева Т.В. – по нечетным. Ждем Вас.
вопрос
Имрон
4 марта 2021 16:44Вчера утром пробился и были порезы кровоточашие через несколько минут кровь остановилось. Потом ушел на работу вечером был глубокий поцелуй с девушкой у нее была ли ранки или больные десны не знаю при таких случаях есть ли заражение вич
Здравствуйте, Имрон! Заражение ВИЧ при наличии ранок на губах, деснах у обоих партнеров исключить нельзя, поэтому необходимо пройти обследование на ВИЧ через 3, 6, 12 месяцев.
вопрос
Люда
4 марта 2021 15:55Через какое время можно сбить вирусную нанрузку до нулевой и смогу ли я родить сдорового ребенка если сейчас нашрузка 200000 копий
Здравствуйте, Люда! Вирусная нагрузка снижается после 1 месяца приема АРВТ, но это зависит от правильности приема АРВТ – принимать по времени и строго без пропусков, также чтобы родить здорового ребенка необходимо принимать АРВТ, наблюдаться, сдавать анализы крови и соблюдать все рекомендации инфекциониста.
вопрос
Люда
4 марта 2021 15:09Через полтора года после контакта узнала что вич инфицированная 200000 краий вируса сд 100. Интересно сколько я проживу и что со мной будет.
Интересно сколько я проживу и что со мной будет.
Здравствуйте, Люда! Залогом успеха лечения больных ВИЧ-инфекцией, увеличения продолжительности жизни и сохранения качества жизни является антиретровирусная терапия (АРВТ). Прием АРВТ ведет к снижению вирусной нагрузки до неопределяемого уровня и росту уровня СД4. Эффективность лечения будет зависеть от Вас, от Вашей приверженности диспансерному наблюдению и лечению.
вопрос
анна
4 марта 2021 06:08Здравствуйте, работаю в стоматологии, при выбрасывании иглы уколола палец иглой из желтого контейнера, которая там уже была, есть вероятность заражения?
Здравствуйте, Анна! Вероятность заражения ВИЧ, при случайном уколе использованной инъекционной иглой составляет 0,3%. Рекомендуем Вам пройти тестирование на антитела к ВИЧ через 3, 6 и 12 месяцев после данной ситуации.
Все аварийные ситуации с нарушением целостности кожных покровов или попаданием биоматериала на слизистые подлежат регистрации с оформлением соответствующего акта. При наличии акта в нашем Центре можно получить антиретровирусные препараты для проведения постконтактной профилактики.
Рекомендуем Вам пройти тестирование на антитела к ВИЧ через 3, 6 и 12 месяцев после данной ситуации.
Все аварийные ситуации с нарушением целостности кожных покровов или попаданием биоматериала на слизистые подлежат регистрации с оформлением соответствующего акта. При наличии акта в нашем Центре можно получить антиретровирусные препараты для проведения постконтактной профилактики.
вопрос
Виталий Р
4 марта 2021 05:11Здравствуйте, у меня тревога: моя собака недавно сильно поцарапалась об мусорный бак на улице(он заострённый) и у неё пошла кровь, я стал ее вытирать и кровь попала мне на кожу, где находились ранки(засохшие). Вопрос такой: мог ли я заразиться от такого случая вич, гепатитами b,c, сифилисом?
Вопрос такой: мог ли я заразиться от такого случая вич, гепатитами b,c, сифилисом?
Здравствуйте, Виталий! В вашей ситуации риск заражения ВИЧ, гепатитами и сифилисом отсутстсвует.
вопрос
Виталий Р
4 марта 2021 05:05Здравствуйте, у меня тревога: моя собака недавно сильно поцарапалась об мусорный бак на улице(он заострённый) и у неё пошла кровь, я стал ее вытирать и кровь попала мне на кожу(и штаны), где находились ранки. Вопрос такой: мог ли я заразиться от такого случая вич, гепатитами b,c, сифилисом?
Здравствуйте, Виталий! В вашей ситуации риск заражения ВИЧ, гепатитами и сифилисом отсутстсвует.
вопрос
Алла
3 марта 2021 02:45Добрый день! В преле 2019 поставили диагноз вич при том что анализ методом ИФА был полржителен, а метод имунного блота отрицателен, вирусная нагрузка не определялась и при этом меня поставили на учёт и назначили терапию. Я до сих пор не могу понять где могла заразиться, в 2018- 2019 лечилась у 2 разных стоматологов, была травма колена делали пункциб откачивалм кровь, в данных случаях возможен риск заражения? Заражение от мужа исключаю, он каждые 3 месяца проверяется у него отрицательно.
Здравствуйте, Алла! Рекомендуем Вам еще раз обсудить результаты анализов с врачом-инфекционистом, у которого Вы наблюдаетесь. В случае необходимости, анализы можно будет повторить.
Риск заражения ВИЧ при использовании нестерильного медицинского инструментария составляет 0,3%. Случаи заражения ВИЧ при оказании медицинской помощи зарегистрированы, в том числе и в Самарской области.
В случае необходимости, анализы можно будет повторить.
Риск заражения ВИЧ при использовании нестерильного медицинского инструментария составляет 0,3%. Случаи заражения ВИЧ при оказании медицинской помощи зарегистрированы, в том числе и в Самарской области.
вопрос
Задать вопрос
Нажимая кнопку «ОТПРАВИТЬ», я подтверждаю свое согласие на обработку персональных данных в соответствии с указанным здесь текстом.
Все поля обязательны для заполнения.
Уважаемые посетители сайта!
Для получения обратной связи обязательно оставляйте корректный контактный адрес электронной почты, телефон.
Администрация сайта оставляет за собой право не публиковать анонимные вопросы.
В соответствии со ст. 12 Федерального закона Российской Федерации от 02.05.2006 г. №59-ФЗ «О порядке рассмотрения обращений граждан Российской Федерации» предусмотрен срок размещения ответов на вопросы на сайте — в течение 30 дней.
Ответ — ГБУЗНО «Нижегородский областной центр по профилактике и борьбе со СПИД и инфекционными заболеваниями»
Уважаемые посетители!
Здесь Вы можете оставить свое сообщение для ГБУЗНО «Нижегородский областной центр по профилактике и борьбе со СПИД и инфекционными заболеваниями» , задать вопрос специалистам центра, оставить отзыв о нашей работе.
Для получения ответов на вопросы, не терпящие отлагательств, пожалуйста, обращайтесь
по телефону анонимной линии доверия: +7 (831) 214-0-214 (добавочный 847)
Задать вопрос
Татьяна
Здравствуйте. Скажите пожалуйста кушали хачапури у знакомой. Готовила она сама. Потом она рассказала что болеет ВИЧ. Но руке заметила порез. Какова вероятность заразиться? Порез был не свежий. Но думаю что когда готовила она парез уже был на пальце
Скажите пожалуйста кушали хачапури у знакомой. Готовила она сама. Потом она рассказала что болеет ВИЧ. Но руке заметила порез. Какова вероятность заразиться? Порез был не свежий. Но думаю что когда готовила она парез уже был на пальце
Здравствуйте. В описанной ситуации шансов заразиться нет.
Алинa
Добрый день! Получила в больнице внутримышечно укол, после медсестра решила йодом сетку сделать, достала со своего стола ушную палочку, не заметила вроде уже йодом обработанную, снова намочила ее йодом и провела по месту укола откуда кровь шла. Возможно ли заражение Вич инфекцией?
Ответ:Здравствуйте. Заражение в описанной ситуации невозможно.
Аноном
Здравствуйте, передаётся ли вич, если вич инфицированный дотронулся своим пальцем , на котором была его высохшая кровь, до моей царапины от котёнка (царапина была утренняя,но на ней была запечённая кровь)?
Ответ:Здравствуйте. В описанной ситуации передача ВИЧ исключена. ВИЧ не живет в высохшей крови.
ВИЧ не живет в высохшей крови.
Вадим
Здравствуйте. Скажите может ли вич появится у человека который переболел туберкулёзом. Из за упадка иммунитет?
Ответ:Здравствуйте. ВИЧ — это вирус, он не может возникнуть сам по себе. Только в результате передачи от человека к человеку.
Ольга
Добрый день. Ситуация следующая. У меня гингивит. При чистке зубов бывает кровотечение дёсен. Я пила воду из одной бутылки с ВИЧ+ (лечение не принимает). Знаю, что через слюну заражение невозможно, но что если в его слюне содержалась кровь? Какая в этом случае вероятность заражения и с какой периодичностью следует делать анализы на ВИЧ?
Ответ:Здравствуйте. Пользоваться одной посудой ВИЧ-положительным, пить воду из одной бутылки безопасно. Даже если зараженная кровь попадает в бутылку, в воде концентрация становится не опасной.
Всем гражданам старше 18 лет рекомендовано сдавать анализы не реже одного раза в год. Если были опасные ситуации (например, незащищенный сексуальный контакт), то рекомендуют сдавать анализы через месяц, три месяца, пол года и далее каждый год.
Инна
Перед забором крови из вены у ребенка медсестра открывала контейнер с использоваными инструментами.,ручку которого открывают грязными перчатками.Не меняя перчатки брала кровь.Есть ли риск заражения?Волнует факт,что примерно через 40 дней у ребенка была ангина с налетом на миндалинах и незначительным увеличением лимфоузлов в районе миндалин.После курса антибиотиков все прошло,Слава Богу!температура до 37.8.была 1 день.
Ответ:Добрый день! В описываемой вами ситуации риск заражения ВИЧ-инфекцией исключен. Для возникновения риска заражения необходимо, что бы видимая капля зараженной крови попала в открытую, кровоточащую рану.
Ирина
Добрый день, подскажите пожалуйста есть ли риск заражения ВИЧ? Была в кафе салфеткой вытерла губу, потом заметила, что на салфетке кровь, но у меня на губе были две трещинки свежие но не кровоточили. Времени от того как принесли салфетки и до того как я их использовала прошло минут 30. Скажите были риски?
Скажите были риски?
Здравствуйте. ВИЧ живет вне тела человека только несколько минут. Заражение невозможно.
Толстеневв Лариса
Очень нравится ваш сайт
Ответ:Спасибо!
Камила
Можно ли заразиться если взять( бокал и стакан должна была помыть за ним) с которого пил ВИЧ инфицированный и нечайно задеть пальцем с ранкой которой уже 2дня , я так понимаю не свежей..через пол минуты обработала спиртом и йодом
Ответ:Здравствуйте. В описанном случае риска заражения нет.
Наталья
Добрый день. Купила трусы в интернет магазине, получила в обед. Вечером (через 5часов после получения) померяла их на голое тело. При этом утром брилась и были ранки. Есть ли риск заразиться ВИЧ, так как непонятно, мерял ли их кто-нибудь до меня.
Ответ:Здравствуйте. Таким образом заразиться ВИЧ нельзся. ВИЧ не живет вне тела человека, погибает через несколько минут.
Задать вопрос
Обследование на ВИЧ. Кому и когда следует проходить тестирование?
Обычно тест на ВИЧ является строго добровольной процедурой. Однако существуют обстоятельства, когда обследоваться на ВИЧ-инфекцию просто необходимо.
В глазах общества обследование на ВИЧ до сих пор выглядит необычно и даже странно. Возможно, ваши знакомые и родные, узнав о ваших планах пройти тестирование, заподозрят вас в «плохом» поведении. А зря. Потому что обследование на ВИЧ – это, прежде всего, признак заботы о своём здоровье.Обследование по желанию Тестирование на ВИЧ в большинстве случаев носит добровольный характер. Бывают случаи, когда обследование на ВИЧ является обязательным.
Половая активность
Обследоваться на ВИЧ следует каждому, кто начинает вести половую жизнь. Оптимально выяснить ВИЧ-статус партнёра ещё до вступления с ним в интимные отношения. Если это не удалось сделать, то обследоваться на ВИЧ-инфекцию нужно через 3 месяца после начала половой жизни. То же самое касается и ситуации смены полового партнёра. Если на протяжении долгого времени половой партнёр всегда постоянный, то необходимости в периодическом обследовании на ВИЧ нет.
То же самое касается и ситуации смены полового партнёра. Если на протяжении долгого времени половой партнёр всегда постоянный, то необходимости в периодическом обследовании на ВИЧ нет.
Обследование после опасных ситуаций
В ситуации случайного полового контакта с партнёром, ВИЧ-статус которого неизвестен, информативное определение антител к ВИЧ в крови возможно только через три месяца. Первые три месяца после инфицирования ВИЧ длится период «окна», когда антитела к вирусу только начинают вырабатываться и их уровень – ниже порогового значения, определяемого тест-системами.
Аналогичная ситуация – при подозрении заражения через кровь, например, при употреблении инъекционных наркотиков нестерильным шприцем. После опасных, с точки зрения заражения ВИЧ, ситуаций при отрицательных результатах первого обследования повторные анализы желательно сдавать каждые три месяца в течение года.
Если есть признаки болезни
Иногда анализ крови на ВИЧ необходим по клиническим признакам – например, если у человека имеется выраженный иммунодефицит или есть клинические признаки, позволяющие заподозрить ВИЧ-инфекцию или СПИД. Рекомендовано обследование также при выявлении заболеваний, передающихся половым путём, гепатита В или С, туберкулёза.
Рекомендовано обследование также при выявлении заболеваний, передающихся половым путём, гепатита В или С, туберкулёза.
Представители некоторых профессий
Представителям ряда профессий, которые при работе непосредственно контактируют с кровью и биологическими жидкостями – врачам, лаборантам, медицинским сёстрам – анализ крови на ВИЧ-инфекцию следует делать ежегодно. Кроме того, обследоваться нужно медицинским работникам СПИД-центров, которые постоянно контактируют с ВИЧ-позитивными.
Представители некоторых профессий
Представителям ряда профессий, которые при работе непосредственно контактируют с кровью и биологическими жидкостями – врачам, лаборантам, медицинским сёстрам – анализ крови на ВИЧ-инфекцию следует делать ежегодно. Кроме того, обследоваться нужно медицинским работникам СПИД-центров, которые постоянно контактируют с ВИЧ-позитивными.
Контакты с ВИЧ-положительными
Особенно важно тестирование для лиц, контактирующих с ВИЧ-инфицированными, в том числе в быту. Людям, имеющим регулярные половые контакты с ВИЧ-инфицированным, нужно обследоваться каждые три месяца, даже при условии постоянного использования презерватива.
Людям, имеющим регулярные половые контакты с ВИЧ-инфицированным, нужно обследоваться каждые три месяца, даже при условии постоянного использования презерватива.
После переливания крови и трансплантации
Пациентам, которым переливались компоненты крови (особенно это касается эритроцитарной массы), через три месяца желательно сделать исследование на ВИЧ. То же самое касается тех, кому были пересажены донорские органы и ткани.
Обследование беременных
Обследоваться на ВИЧ также нужно беременным женщинам на ранних сроках – при обращении в женскую консультацию. При отрицательном результате тестирование повторяют в третьем триместре беременности, чтобы исключить период «окна».
Обследование детей, рождённых от ВИЧ-позитивных женщин
Что касается детей, рождённых от ВИЧ-инфицированных женщин, в течение первых 12-18 месяцев анализ крови на антитела к ВИЧ проводить нецелесообразно. Дело в том, что при беременности материнские антитела к ВИЧ переносятся с кровью к плоду и сохраняются у ребёнка в крови до 18-ти месяцев даже при отсутствии ВИЧ-инфекции.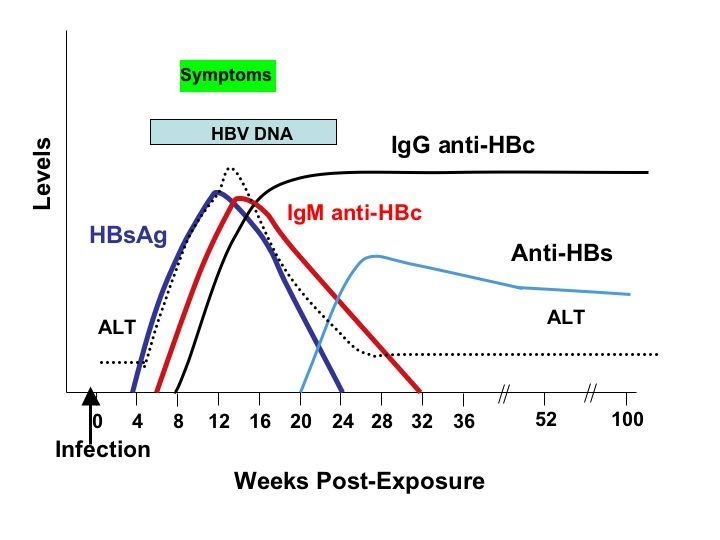 Таким образом, новорожденным или выполняют ПЦР-диагностику ВИЧ, или после 18-ти месяцев – анализ на антитела к ВИЧ.
Таким образом, новорожденным или выполняют ПЦР-диагностику ВИЧ, или после 18-ти месяцев – анализ на антитела к ВИЧ.
Обследование представителей групп риска по заражению ВИЧ
Людям из групп риска по заражению ВИЧ – гомосексуалам и коммерческим секс-работникам – следует тестироваться на ВИЧ каждые три месяца, независимо от того, пользуются ли они презервативом при половых контактах. Употребляющим наркотики также нужно обследоваться регулярно, раз в три месяца, в том числе и тем, кто употребляет неинъекционные формы наркотиков.
Повторное обследование
Повторные и дальнейшие тесты на ВИЧ-инфекцию определяются специалистом на основании результатов первоначального обследования, клинических данных и в зависимости от ситуации.
ВИЧ-1, определение РНК (HIV, RNA) в плазме крови
Метод определения Количественное определение, ПЦР с детекцией в режиме реального времени (real-time).
Исследуемый материал Плазма крови (ЭДТА)
Доступен выезд на дом
Определение РНК ВИЧ типа 1 в плазме крови методом ПЦР с детекцией в режиме реального времени.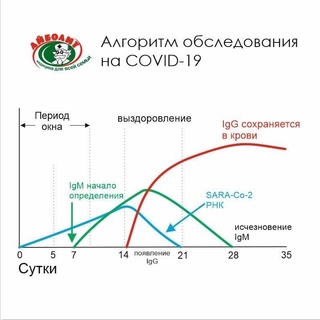 Исследование выполняется на оборудовании компании Hoffmann-La Roche (Щвейцария) по стандартизованной технологии с автоматизированной пробоподготовкой.
Исследование выполняется на оборудовании компании Hoffmann-La Roche (Щвейцария) по стандартизованной технологии с автоматизированной пробоподготовкой.Исследование концентрации в крови РНК ВИЧ типа 1, которое применяют для прогноза и мониторинга эффективности терапии.
Вирус иммунодефицита человека (ВИЧ) является этиологическим агентом синдрома приобретенного иммунодефицита (СПИД). ВИЧ-инфекция может передаваться половым путем, через контаминированную кровь и ее продукты, или от инфицированной матери плоду. В период 3 – 6 недель после инфицирования обычно развивается недлительный острый синдром, для которого характерны гриппоподобные симптомы и высокие уровни виремии в периферической крови. В большинстве случаев после этого развивается ВИЧ-специфичный иммунный ответ и снижение виремии в плазме, обычно в течение 4 – 6 недель после появления симптомов. После сероконверсии (появления специфических антител) наступает клинически стабильная бессимптомная фаза, способная длиться годами. Для бессимптомного периода характерен невысокий уровень персистирующей виремии в плазме и постепенное снижение уровней CD4+ T-лимфоцитов, которое приводит впоследствии к развитию тяжелого иммунодефицита, множественным оппортунистическим инфекциям, онкогенезу и гибели. У лиц с установленной ВИЧ-1 инфекцией количественное измерение уровня РНК ВИЧ-1 в крови используют в целях прогноза и контроля антиретровирусной терапии.
Для бессимптомного периода характерен невысокий уровень персистирующей виремии в плазме и постепенное снижение уровней CD4+ T-лимфоцитов, которое приводит впоследствии к развитию тяжелого иммунодефицита, множественным оппортунистическим инфекциям, онкогенезу и гибели. У лиц с установленной ВИЧ-1 инфекцией количественное измерение уровня РНК ВИЧ-1 в крови используют в целях прогноза и контроля антиретровирусной терапии.
Аналитические показатели:
-
Клиническая специфичность теста: 100%, при доверительном интервале 99,6-100%.
-
Чувствительность теста: от 20 копий/мл.
-
Линейный диапазон теста: 20 – 1*107 копий/мл
-
Анализируются субтипы группы M и О (ВИЧ-1).
Сдать анализ крови на ВИЧ в Перми, цена
ВИЧ-инфекция коварна тем, что не существует ни одного симптома, который бы точно указывал на это заболевание. Обычно оно начинается как простуда: кашлем, сыпью, повышением температуры. Естественно, человеку не приходит в голову идти и сдавать анализ крови на ВИЧ.
Обычно оно начинается как простуда: кашлем, сыпью, повышением температуры. Естественно, человеку не приходит в голову идти и сдавать анализ крови на ВИЧ.
Но если симптомы нарастают, долго не проходит кашель или держится температура, есть смысл сдать все-таки анализ, предварительно обратившись к врачу.
Кроме того, анализ крови на ВИЧ обязательно сдают все беременные женщины, потому что вирус может передаваться малышу уже в утробе матери.
Типы анализов на ВИЧ
При подозрении на ВИЧ врач назначает анализ иммуноферментный (ИФА). Берется кровь из вены. Этот метод надежен и проверен временем. Если в сыворотке обнаруживаются искомые антитела, то делается второй анализ на ВИЧ ПЦР.
Одна особенность, о которой должен знать каждый, это инкубационный период. В это время анализ сдавать бесполезно, антитела еще не выработались. Длится такой период от 3 недель до 3 месяцев. Если после 3 месяцев анализ показал положительный результат, то вирус почти наверняка есть.
Почему почти? Потому что метод ИФА подчас выдает ложноположительные результаты, например, у больных с аутоиммунными, инфекционными (хроническими) недугами, у онкобольных и др.
Этим объясняется и тот факт, что после получения при ИФА-анализе положительного результата, его дублируют более чувствительным ПЦР-методом.
Во время анализа на ВИЧ ПЦР определяется РНК и ДНК вируса. Метод точный, никак не зависит от присутствия или отсутствия антител. Он основан на способности фрагментов ДНК и РНК вируса к самостоятельной репродукции (размножению) отдельных участков. Отрицательная сторона методики — это большая чувствительность к различным внешним факторам. Положительная сторона — ранняя диагностика страшного недуга.
В связи с этим кроме перечисленных, врачи нашей лаборатории используют и вспомогательные методы обнаружения фрагментов вируса или антител. Передовое оборудование лаборатории позволяет на ранних этапах диагностировать болезнь, подготовить пациента и врачей к лечению.
Как правильно сдать анализ крови на ВИЧ
Специальной подготовки к анализу не требуется, кровь возьмут у вас из вены с помощью новейших устройств-контейнеров. Если вы принимаете препараты, которые разжижают кровь, предупредите об этом специалиста лаборатории, место пункции закрепят плотнее и повязку придется подержать подольше.
На результаты анализа крови на ВИЧ могут повлиять некоторые болезни: сифилис, лейкемия, алкоголизм. Квалифицированные специалисты нашей лаборатории проведут анализ с учетом всех перечисленных факторов.
Типы тестов, что означают результаты
Ваша вирусная нагрузка дает вам представление о том, сколько вируса ВИЧ находится в вашем организме. Тест измеряет количество копий ВИЧ в миллилитре крови.
Результаты ваших анализов помогают врачу отслеживать, что происходит с вашей инфекцией, насколько эффективно ваше лечение, и определять варианты лечения. Вирусная нагрузка ВИЧ предсказывает, насколько быстро будет прогрессировать заболевание, в то время как другие тесты, такие как подсчет CD4, показывают, какой ущерб уже нанес вирус.
Этот тест также может помочь диагностировать недавнюю ВИЧ-инфекцию у кого-то с неубедительными тестами на антитела к ВИЧ. Однако в этих случаях для подтверждения диагноза следует использовать последующий положительный тест на антитела к ВИЧ.
Сохранение низкой вирусной нагрузки сохранит вашу иммунную систему здоровой, снизит вероятность осложнений, связанных с ВИЧ, и поможет вам прожить дольше. Это возможно, если вы будете придерживаться своего лечения, чтобы получить нормальную или почти нормальную продолжительность жизни.
Как это проверено
Тесты на вирусную нагрузку ВИЧ ищут РНК, часть ВИЧ, у которой есть рецепт для самовоспроизведения.Они добавляют фермент, своего рода белок, чтобы сделать больше копий РНК. Это упрощает измерение количества ВИЧ в вашем образце крови.
Продолжение
Эти тесты ОТ-ПЦР (полимеразная цепная реакция в реальном времени) намного более чувствительны, чем тесты на ВИЧ, используемые в прошлом. Они могут найти всего 20 копий РНК ВИЧ в миллилитре крови.
Ваш врач должен каждый раз использовать один и тот же тест на вирусную нагрузку ВИЧ, потому что тесты, проведенные разными производителями, могут дать вам несколько разные результаты.Если ваша вирусная нагрузка меняется, вы должны быть уверены, что это происходит из-за того, что происходит внутри вас, а не из-за метода тестирования.
Ученые работают и над новыми, еще более чувствительными методами.
Что означают результаты
Высокая вирусная нагрузка обычно считается около 100 000 копий, но у вас может быть 1 миллион или больше. Вирус работает, копируя себя, и болезнь может быстро прогрессировать.
Более низкая вирусная нагрузка ВИЧ — менее 10 000 копий.Вероятно, вирус активно не размножается так быстро, и повреждение вашей иммунной системы может быть замедлено, но это не оптимально.
Продолжение
Невозможно определить вирусную нагрузку — менее 20 копий — всегда является целью лечения ВИЧ. Это не значит, что вы излечились. К сожалению, вирус все еще может выжить в различных клетках организма. Но поддержание неопределяемой вирусной нагрузки совместимо с нормальной или почти нормальной продолжительностью жизни. Очень важно продолжать принимать лекарства в соответствии с предписаниями, чтобы вирус не обнаруживался.
Это не значит, что вы излечились. К сожалению, вирус все еще может выжить в различных клетках организма. Но поддержание неопределяемой вирусной нагрузки совместимо с нормальной или почти нормальной продолжительностью жизни. Очень важно продолжать принимать лекарства в соответствии с предписаниями, чтобы вирус не обнаруживался.
Когда ваша вирусная нагрузка ВИЧ не определяется, риск заражения других людей практически отсутствует, но большинство врачей по-прежнему советуют использовать презервативы для предотвращения заражения другими штаммами ВИЧ и другими инфекциями, передаваемыми половым путем.
Когда проходить тест
Сразу после постановки диагноза вам следует пройти тест на вирусную нагрузку для «базового измерения». Это дает вашему врачу возможность сравнить будущие результаты анализов.
Когда вы начинаете принимать лекарство или меняете его, тест примерно через 4 недели после этого помогает вашему врачу решить, насколько хорошо оно работает.Эффективная комбинация лекарств, принятая в соответствии с предписаниями, часто может снизить вирусную нагрузку ВИЧ до одной десятой от того, что было в течение месяца. Вирусная нагрузка обычно не определяется к 3 месяцам, почти всегда к 6 месяцам.
Вирусная нагрузка обычно не определяется к 3 месяцам, почти всегда к 6 месяцам.
После этого вы должны сдавать анализы так часто, как рекомендует ваш врач, чтобы узнать, как ваши лекарства контролируют вирус. Если кажется, что ваш ВИЧ находится под контролем, вы, вероятно, сможете проходить тестирование реже.
Тест на вирус иммунодефицита человека (ВИЧ)
Обзор теста
Тест на вирус иммунодефицита человека (ВИЧ) выявляет антитела или антигены к ВИЧ или генетический материал (ДНК или РНК) ВИЧ в крови или образце другого типа.Это может показать, присутствует ли ВИЧ-инфекция (ВИЧ-положительный). ВИЧ инфицирует лейкоциты, называемые CD4 + клетками. Они являются частью иммунной системы организма, которая помогает бороться с инфекциями. ВИЧ может прогрессировать до синдрома приобретенного иммунодефицита (СПИД).
После первоначального заражения требуется от 4 до 12 недель, чтобы антитела или антигены к ВИЧ появились в крови. Период между заражением ВИЧ и моментом, когда антитела или антигены к ВИЧ могут быть обнаружены в крови, называется сероконверсией или периодом «окна».В течение этого периода ВИЧ-инфицированный человек все еще может распространять болезнь, даже если тест не обнаружит никаких антител или антигенов в его или ее крови.
Несколько тестов могут обнаружить антитела или генетический материал (РНК) вируса ВИЧ. Эти тесты включают:
- Иммуноферментный анализ (ELISA).
Этот тест обычно является первым, который используется для выявления ВИЧ-инфекции. При наличии антител к ВИЧ (положительных) тест обычно повторяется для подтверждения диагноза.Если ИФА отрицательный, другие тесты обычно не нужны. Этот тест имеет низкую вероятность получения ложного результата после первых нескольких недель заражения человека.
- Полимеразная цепная реакция (ПЦР).
Этот тест обнаруживает либо РНК вируса ВИЧ, либо ДНК ВИЧ в лейкоцитах, инфицированных этим вирусом. ПЦР-тестирование проводится не так часто, как тестирование на антитела, поскольку требует технических навыков и дорогостоящего оборудования.Этот тест можно провести через несколько дней или недель после контакта с вирусом. Генетический материал может быть обнаружен, даже если другие тесты на вирус отрицательны. ПЦР-тест очень полезен для выявления недавно перенесенной инфекции, определения наличия ВИЧ-инфекции, когда результаты теста на антитела были неопределенными, а также для проверки крови или органов на ВИЧ перед сдачей крови.
- Непрямое флуоресцентное антитело (IFA).
Этот тест выявляет антитела к ВИЧ с помощью специального флуоресцентного красителя и микроскопа.Этот тест может использоваться для подтверждения результатов теста ELISA.
Если антитела или антигены к ВИЧ не обнаружены, тест можно повторить через несколько месяцев.
Если у вас положительный результат теста, обратитесь к своим половым партнерам, чтобы сообщить им. Они могут захотеть пройти тестирование. В этом вам может помочь местный отдел здравоохранения.
Домашние тестовые наборы
Некоторые домашние наборы для тестирования на ВИЧ были одобрены U.S. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). Если результаты домашнего тестирования показывают, что у вас ВИЧ-инфекция, поговорите с врачом. И имейте в виду, что эти наборы для тестирования иногда могут показать, что у вас ВИЧ, когда вы этого не сделаете (ложноположительный результат). Или они могут показать, что у вас нет ВИЧ (ложноотрицательный результат).
- Набор для быстрого домашнего тестирования даст вам результаты в течение часа. Для этого теста вы натираете десны тампоном, входящим в комплект. Затем поместите тампон во флакон с жидкостью.Тест-полоска на тампоне показывает, есть у вас ВИЧ или нет.
- Другой тип набора для тестирования на ВИЧ — это набор для домашнего анализа крови. В этом комплекте есть инструкции и материалы для взятия небольшого образца крови с помощью ланцета. Кровь помещается на специальную карту, которая затем отправляется в лабораторию для анализа. Вы можете узнать свои результаты по телефону, используя анонимный кодовый номер. Консультации также доступны по телефону для людей, использующих тестовый набор.
Почему это делается
Тест на вирус иммунодефицита человека (ВИЧ) сдают по:
- Выявить ВИЧ-инфекцию.
- Скрининг крови, продуктов крови и доноров органов для предотвращения распространения ВИЧ.
- Скрининг беременных на ВИЧ-инфекцию. Беременные женщины, инфицированные ВИЧ и получающие лечение, с меньшей вероятностью передают инфекцию своим детям, чем женщины, не получающие лечения.
- Выясните, инфицирован ли ВИЧ-инфицированный ребенок, рожденный ВИЧ-инфицированной женщиной. В этом случае часто проводят ПЦР-тест, потому что ребенок может получить антитела против ВИЧ от матери, но при этом не заразиться.
Этот тест не проводится для определения наличия у человека СПИДа. Диагноз СПИД означает, что человек ВИЧ-инфицирован и есть другие проблемы.
Как подготовить
В общем, вам ничего не нужно делать перед этим тестом, если только ваш врач не скажет вам об этом.
Тест на ВИЧ-инфекцию нельзя сдать без вашего согласия. Большинство врачей предлагают консультации до и после теста для обсуждения:
- Как проводится тест, что означают результаты и любые другие тесты, которые могут быть выполнены.
- Как диагноз ВИЧ-инфекции может повлиять на ваши социальные, эмоциональные, профессиональные и финансовые перспективы.
- Преимущества ранней диагностики и лечения.
Перед тестом важно сообщить врачу, как и где с вами связаться, когда будут готовы результаты теста. Если ваш врач не связался с вами в течение 1-2 недель после теста, позвоните и узнайте результаты.
Как это делается
Медицинский работник использует иглу для взятия пробы крови, обычно из руки.
Часы
Каково это
При взятии пробы крови игла может вообще ничего не чувствовать. Или вы можете почувствовать укол или ущипнуть.
Риски
Вероятность возникновения проблемы из-за этого теста очень мала. При заборе крови на месте может образоваться небольшой синяк.
Результаты
Ваш врач может попросить вас вернуться, чтобы рассказать о ваших результатах.Это может произойти независимо от того, что говорят ваши результаты. Это не всегда означает, что у вас ВИЧ.
Нормальный результат
- Нормальный результат означает, что в вашей крови не было обнаружено антител или антигенов к ВИЧ. Нормальные результаты называются отрицательными.
- Вам может потребоваться повторный тест, чтобы убедиться в правильности результатов. Если повторный тест через 3 месяца отрицательный, инфекции нет.
Неопределенный результат
- Если результаты неясны, это называется неопределенным результатом.Это может произойти до того, как появятся антитела или антигены к ВИЧ. Или это может произойти, когда какой-либо другой тип антител или антигенов мешает результатам. Если это произойдет, вам, вероятно, сразу же придется пройти еще один тест.
Ненормальный результат
- Аномальный результат означает, что в вашей крови есть антитела или антигены к ВИЧ. Эти результаты называются положительными.
- Положительный тест повторяется на том же образце крови. Если два или более результата положительны, они должны быть подтверждены другим типом теста.Это связано с тем, что некоторые тесты могут давать ложноположительные результаты. Никто не считается ВИЧ-инфицированным до тех пор, пока результат не будет подтвержден тестом, который показывает РНК ВИЧ в крови человека.
- Если результат вашего анализа положительный, вы получите консультацию. Вы можете узнать, как обрабатывать результаты и что делать дальше.
- Если у вас положительный результат теста, обратитесь к своим половым партнерам, чтобы сообщить им. Они должны быть проверены. Возможно, вам удастся получить помощь в вашем местном отделе здравоохранения, чтобы связаться с вашими половыми партнерами.Во многих местах с вами свяжутся сотрудники отдела здравоохранения, чтобы предложить эту помощь.
Кредиты
Текущий по состоянию на: 23 сентября 2020 г.
Автор: Healthwise Staff
Медицинский обзор:
Э. Грегори Томпсон, врач-терапевт
Адам Хусни, доктор медицины, семейная медицина
Питер Шалит, доктор медицины, врач-терапевт
По состоянию на: 23 сентября 2020 г.
Автор: Здоровый персонал
Медицинское обозрение: E.Грегори Томпсон, врач-терапевт, Адам Хусни, доктор медицины, семейная медицина, и Питер Шалит, доктор медицины, врач-терапевт,
Тестирование младенцев на ВИЧ при рождении с использованием традиционной ПЦР ДНК на ВИЧ: экспериментальное исследование возможности внедрения в Кении | Пилотные и технико-экономические исследования
Дизайн исследования
В этом технико-экономическом обосновании новая временная точка тестирования EID при рождении и две платформы диагностики новорожденных POC будут внедрены в пилотном масштабе в Кении.Xpert и Alere q Платформы POC для ВИЧ-инфекции будут внедрены в четырех государственных больницах Кении для родов и 6-недельного тестирования. Это 18-месячное исследование было инициировано как дополнение к родительскому исследованию (R01HD076673), в котором использовалась и оценивалась система слежения за ВИЧ-инфицированными младенцами (HITSystem) [30]. Четыре больницы, назначенные в качестве исследовательских центров, являются государственными больницами со средним и большим количеством пациентов и географическими различиями: две в округе Кисуму, одна в округе Накуру и одна в округе Момбаса. Расчетные уровни передачи ВИЧ от матери ребенку в этих трех округах в 2015 г. составляли 20%, 5% и 18% соответственно [31].Фаза 1 — это 6-месячный формирующий этап, на котором мы проведем качественные интервью с родителями, поставщиками медицинских услуг и членами сообщества, чтобы оценить отношение заинтересованных сторон к тестированию при рождении и POC, а также препятствиям на пути принятия или принятия. Обратная связь будет использоваться для уточнения оперативных планов с точки зрения осуществимости и приемлемости. Фаза 2 — это 12-месячный пилотный проект по реализации двух новых стратегий тестирования POC. 12-месячный период внедрения дает поставщикам время для принятия новых методов и отслеживания любых колебаний в использовании или приемлемости в течение этого длительного периода.POC-тестирование на ВИЧ будет проводиться параллельно со стандартной лабораторной ПЦР ДНК ВИЧ, направленной на сбор образцов при рождении (от 0 до 2 недель) и через 6 недель (от 4 до <24 недель).
Этап 1: формирующее исследование
Этап 1 направлен на получение информации от ключевых заинтересованных сторон, которая будет определять операционное планирование для оптимизации использования, приемлемости и осуществимости услуг на каждом участке исследования. Приблизительно n = 25 формирующих интервью с родителями, поставщиками медицинских услуг и членами сообщества будут проведены на каждом участке; Всего 100 интервью.Интервью с родителями (ВИЧ-инфицированными матерями с предыдущим опытом ВЗН и их партнерами-мужчинами, если таковые имеются, и мать уже сообщила о своем ВИЧ-статусе, n = 10 на участок) будут сосредоточены на влиянии на ребенка и семью (конфиденциальность / раскрытие информации, приемлемость). сроков тестирования и результатов, а также поддержки партнеров). Интервью с поставщиками медицинских услуг, которые будут участвовать в тестировании POC в каждом учреждении (медсестры по ППМР, материнства и материнства и детства (MCH); матери-наставники; лаборанты; и клиницисты по АРТ; примерно n = 5 на место) выявят проблемы. обучения, логистики в конкретном месте, подготовки пациентов и консультирования, а также соображений по персоналу и ресурсам для реализации.Мы также проведем интервью с членами сообщества (работники здравоохранения, традиционные повитухи, уважаемые общественные и религиозные лидеры; примерно n = 10 на участок) в одной сельской общине в зоне обслуживания каждой больницы, чтобы выявить отношение и предложения относительно возможность периодического тестирования на ВИЧ в труднодоступных общинах. Информированное согласие будет получено до проведения интервью в частной обстановке. Участники получат 500 кенийских шиллингов (примерно 5 долларов США.00), чтобы компенсировать дорогу и время.
Анализ
Интервью будут записаны на аудио для последующей транскрипции, перевода, кодирования и анализа. Стенограммы будут независимо закодированы двумя членами исследовательской группы для определения априорных и возникающих тем. Расхождения в коде будут устранены групповым консенсусом. Мы разработаем кодовую книгу с типичными образцами для каждой темы, отмечая частоту и распределение тем в более крупных тематических областях. Исследовательская группа рассмотрит темы, чтобы проинформировать пилота СПУ (фаза 2).
Этап 2: вмешательство
Дизайн исследования
Мы проведем пилотное внедрение POC и тестирования при рождении в четырех государственных больницах в течение 12 месяцев. Четыре исследовательских центра будут рандомизированы с использованием генератора случайных чисел для пилотного тестирования одной из двух систем POC (Xpert HIV-1 Qual для РНК ВИЧ или Alere q HIV-1/2 Detect). Диагностическое тестирование SOC (тест ПЦР ДНК ВИЧ на образцах DBS) будет проводиться параллельно во всех исследовательских центрах, включая недавно введенное время тестирования при рождении.Поток пациентов в пилотной программе показан на рис. 1.
Рис. 1Поток пациентов во время оценки стратегий тестирования младенцев на ВИЧ. В исследовании будет отслеживаться участие зарегистрированных пар мать-младенец в технологиях тестирования по месту оказания медицинской помощи (POC) и в стандартных технологиях тестирования ДНК-полимеразной цепной реакции (ПЦР) ВИЧ через периоды тестирования при рождении и 6-недельные периоды тестирования
Набор участников, право на участие, и согласие
ВИЧ-инфицированные беременные женщины или матери младенцев, контактировавших с ВИЧ, находящиеся на лечении в исследуемых больницах, будут приглашены для участия в пилотном проекте.Женщины могут быть зачислены либо через ППМР, либо во время беременности; во время беременности и родов; или через отделение охраны здоровья матери и ребенка при первом посещении новорожденного в послеродовой период. Для участия в исследовании женщины должны быть не моложе 18 лет, а их младенцы, контактировавшие с ВИЧ, — моложе 24 недель. Обученный исследовательский или клинический персонал проинформирует беременных женщин / матерей о цели исследования, потенциальных преимуществах и рисках. Они также будут проинформированы об ожидаемых результатах тестирования POC во время родов или в течение 2 недель, если роды не происходят в больнице, а также о важности возврата результатов ПЦР при рождении и повторного тестирования через 6 недель.Те, кто соглашается участвовать, предоставят письменное информированное согласие до включения в исследование (дополнительный файл 1). Клинический персонал будет способствовать удержанию участников и полному последующему наблюдению за счет продолжения работы с зарегистрированными матерями на приемах в ДРП и ОМД. Младенцы от матерей, отказавшихся от участия в исследовании, получат EID по стандарту медицинского обслуживания (SOC) на месте (лабораторное ПЦР-тестирование ДНК ВИЧ через 6 недель). Протокол исследования соответствует Хельсинкской декларации и был рассмотрен и одобрен экспертными советами Института медицинских исследований Кении (протокол KEMRI / SERU / CVR / 018/3390) и Медицинского центра Канзасского университета (протокол № 00140399).Комитет по мониторингу данных не требовался, потому что вмешательства представляют собой минимально инвазивные диагностические стратегии, не создающие повышенного риска тяжелых исходов. Изменения протокола будут доведены до сведения персонала объекта координаторами исследовательской группы.
Вмешательство пилотного POC
Обучение персонала
Исследовательский персонал будет обучен процедурам получения информированного согласия и включения в исследование, а также защите конфиденциальности пациентов.Персонал родильного дома будет обучен проводить пяточную палку и собирать по две пробы в каждый момент времени (DBS и цельная кровь). Персоналу EID будет предоставлена полдня обучения оборудованию, картриджам и процедурам, используемым для проведения тестов POC в их больнице. Координаторы исследований на каждом объекте будут организовывать периодические курсы повышения квалификации и обучение нового персонала по мере того, как происходит ротация персонала.
Тест на рождение
Для всех младенцев, поступающих на тестирование при рождении (в возрасте до 2 недель), назначенный персонал в каждом учреждении возьмет два образца крови.Образец цельной крови для тестирования POC (Xpert HIV-1 Qual или Alere q HIV-1/2 Detect) будет обработан на месте поставщиками медицинских услуг с использованием тестовых картриджей и устройства POC. Результаты тестирования POC будут записаны в журналы исследования, а результаты распечатки с каждого из компьютеров POC будут прикреплены к клиническому файлу младенца (см. Сбор данных ниже). Матери будут уведомлены о результатах теста POC в тот же день, что и тестирование, или перед выпиской ребенка из больницы (в течение 24 часов). Второй образец будет соответствовать установленным процедурам SOC для тестирования ДНК ВИЧ с помощью ПЦР: образец сухого пятна крови (DBS) будет отправлен курьером в назначенную центральную лабораторию больницы для стандартной ПЦР ДНК ВИЧ.Результаты ПЦР ДНК ВИЧ, обработанные в центральной лаборатории, будут записаны на бумажных бланках и отправлены в больницу курьерской службой. Когда результат ПЦР ДНК на ВИЧ будет получен в больнице, мать будет вызвана для уведомления о результате и консультации. Если у младенца будет положительный результат теста на ВИЧ (с помощью POC или PCR), мать и ребенок будут направлены в Центр комплексного ухода (CCC) для начала АРТ в тот же день. ВИЧ-инфицированные младенцы, выявленные в ходе этого исследования, будут проходить дополнительный клинический мониторинг (соблюдение режима АРТ, подавление вируса и сила иммунной системы) в течение 24 месяцев.ВИЧ-отрицательные младенцы должны будут вернуться в больницу на шестинедельный послеродовой прием и пройти повторное тестирование на ВИЧ (ПЦР ДНК на ВИЧ и POC).
Шестинедельное тестирование
Все младенцы, поступившие на лечение в возрасте от 4 до <24 недель, у которых ранее не был диагностирован ВИЧ, будут иметь право на 6-недельное тестирование. Последовательность сбора образцов DBS и цельной крови, отправки DBS для обработки за пределы учреждения, обработки POC в клинике, уведомления о результатах и начала АРТ (для ВИЧ-положительных младенцев) будет такой же, как при рождении.Оптимальная последовательность тестирования ВИЧ-отрицательного младенца будет завершена, когда матери будут предоставлены результаты теста на ВИЧ при рождении и через 6 недель после родов.
Несогласованные результаты
В случае несовпадения результатов теста POC / HIV DNA PCR при рождении или в 6-недельном возрасте младенцу будет назначена АРТ на основании положительного результата любого из методов. Второй подтверждающий образец будет собран и обработан с использованием процедур POC и ПЦР ДНК ВИЧ.Третий образец также будет отправлен в национальную справочную лабораторию для обработки ПЦР ДНК ВИЧ. Младенец будет продолжать АРТ до тех пор, пока не будут получены результаты теста ПЦР ДНК ВИЧ и результаты Национальной справочной лаборатории. Продолжение АРТ будет основываться на результатах ПЦР ДНК ВИЧ.
Мониторинг приверженности к АРТ у ВИЧ-положительных младенцев
Чтобы контролировать приверженность к АРТ и подавление вируса, мы будем заказывать ежеквартальные тесты на CD4 и вирусную нагрузку (ВН) для всех ВИЧ-положительных младенцев до 24 месяцев.В каждый момент времени матери ВИЧ-положительных младенцев будут проходить краткий опрос, проводимый педиатрическим поставщиком АРТ, относительно приверженности АРТ и побочных эффектов. Поскольку мы ожидаем, что младенцы начнут АРТ значительно раньше, чем в SOC, этот усиленный мониторинг предназначен для характеристики вирусологической и иммунологической реакции младенцев на раннее лечение, предоставляя предварительные данные для разработки более масштабного рандомизированного исследования.
Сбор данных
Используя программное обеспечение Epi Info (Центры США по контролю и профилактике заболеваний), координаторы сайта будут собирать и поддерживать полную электронную запись соответствующих клинических данных каждого ребенка, включая дату рождения, место рождения, даты сбора и обработки образцов для ПК, результаты тестов на ПК. , Уведомление матерей о результатах POC, даты сбора образцов SOC и возврата результатов в больницу, результаты теста ПЦР ДНК ВИЧ, уведомление матери о результатах ПЦР ДНК ВИЧ и дата начала АРТ для ВИЧ-положительных младенцев.Чтобы обеспечить полный и точный ввод клинических данных, координаторы сайта будут периодически проверять файлы Epi Info с различными медицинскими записями, включая журналы ДРП, записи о беременности и роде, журналы регистрации новорожденных, инфицированных ВИЧ, медицинские файлы матери и ребенка, а также бумажные копии результатов лабораторной диагностики. Данные, относящиеся конкретно к лечению ВИЧ-положительных младенцев (включая начало АРТ, профилактику ОИ, вирусную нагрузку и мониторинг CD4 в течение 24 месяцев), будут доступны из регистров инфицированных ВИЧ младенцев, записей CCC и медицинских карт младенцев.
Журналы сбора данных по конкретным исследованиям будут отслеживать регистрацию в разных отделах, причины отказа в регистрации, использование машин POC, включая даты и время сбора и обработки образцов, а также персонал, обрабатывающий тест, ошибки машины POC и их влияние на клиническую помощь, побочные эффекты, возникающие в результате исследования, общения между клиническим или исследовательским персоналом и участниками, а также событий на уровне больниц или страны, которые могут повлиять на клиническую помощь и операции исследования.Эти журналы помогут оценить осуществимость внедрения и опыт поставщика. Главный исследователь и исследовательский персонал, сертифицированный IRB, будут иметь доступ к окончательному набору данных испытания без каких-либо договорных препятствий.
Опыт провайдеров
Будут собраны качественные данные об опыте внедрения провайдерами. Координатор исследовательского центра в каждой больнице будет проводить ежемесячные встречи с руководителями отделений (ППМР, родильное отделение, ОЗМР, лаборатория, амбулаторное отделение и CCC) и всеми поставщиками, участвующими в реализации исследования.Хотя руководства по встречам были разработаны с использованием Консолидированной основы для исследований по внедрению (CFIR) в качестве руководства [32], вопросы будут варьироваться, чтобы обеспечить возможность реагирования на опасения и проблемы поставщиков, выраженные на разных этапах исследования. Темы этих дискуссий будут включать обучение и повышение осведомленности персонала; координация заинтересованных сторон; сенсибилизация, зачисление и удовлетворение матерей; развертывание POC-тестирования; оптимизация рабочего процесса; управление потоком подачи тестового картриджа; технические проблемы; и контекстно-зависимые решения.Исследовательская группа будет рассматривать темы после каждого собрания, чтобы сообщить о любых необходимых изменениях в реализации POC (фаза 2). Участники завершат информированное согласие на первом собрании для получения разрешения на аудиозапись сеансов для последующей транскрипции и анализа опыта реализации в каждой больнице.
Расчет стоимости POC
Затраты, связанные с каждой стратегией POC, будут собраны и сравнены с существующим процессом тестирования EID.Мы оценим затраты с точки зрения донора или правительства, чтобы рассчитать и вычислить затраты на интеграцию каждой стратегии POC в существующую систему по сравнению с ПЦР ДНК ВИЧ, обработанной в центральных лабораториях, текущим золотым стандартом для лечения EID. Мы будем использовать стандартные процедуры для оценки стоимости вмешательства [33].
Процедуры обеспечения верности
Стандартные операционные процедуры (СОП) были разработаны для стандартизации обучения, набора и сбора данных.Персонал будет обучен работе с СОПами, которые будут доступны на каждом объекте для удобного использования. Руководство исследования будет ежеквартально проводить поддерживающие супервизии для оценки соблюдения протокола. Цели этих посещений включают наблюдение и помощь в проведении формирующих интервью с ключевыми заинтересованными сторонами, обеспечение обучения клинического и исследовательского персонала протоколам исследования на уровне объекта, рассмотрение форм согласия и обсуждение любых проблем с исследовательской группой. Техническая компетентность и соответствие СОП для POC будут оцениваться с помощью контрольного списка, который включает в себя техническое обслуживание рабочего пространства, технику взятия крови, работу машины, технику загрузки картриджей, следование инструкциям машины до отчетности и архивирования результатов, биобезопасность и процедуры удаления отходов, тестовая документация.Кроме того, исследовательская группа будет проводить раз в две недели исследовательские звонки для обновления номеров участников, просмотра журналов исследования и решения любых проблем или проблем, связанных с процессом получения согласия или проведением исследования. Координаторы на местах должны немедленно сообщать о любых побочных эффектах основным исследователям, базирующимся в США и Кении. Неблагоприятные события включают непреднамеренное раскрытие ВИЧ-статуса или эмоциональный стресс, связанный с участием в исследовании. Смерть младенцев — это нежелательное явление, не связанное с исследованием, о котором также сообщается в IRB.
Производительность и надежность тестов POC будут контролироваться путем отправки каждого десятого образца в национальную справочную лабораторию для подтверждающего тестирования с помощью ПЦР ДНК ВИЧ. По согласованию с национальной технической рабочей группой по контрольным больным, после каждой пробы младенцев с положительным положительным результатом теста на ВИЧ или ПЦР ДНК ВИЧ будет проведен сбор второй пробы для подтверждающего тестирования в национальной справочной лаборатории.
Конфиденциальность
Персонал исследования будет обучен принципам защиты конфиденциальности пациента.Перед исследованием координаторы исследовательского центра встретятся с персоналом клиники и коллегами-консультантами, чтобы определить дополнительные стратегии, соответствующие местным условиям, для повышения конфиденциальности участников. Доступ к электронным данным будет предоставлен только исследовательскому персоналу, непосредственно участвующему в реализации и оценке пилотного проекта. Все электронные данные будут обезличены и записаны с использованием идентификационного номера для каждой ВИЧ-инфицированной женщины и ее младенца, контактировавшего с ВИЧ. Связь между именем участника и идентификационным номером известна только координатору сайта, который проводит регистрацию, и провайдеру, который имеет установленные отношения по уходу с участником.Запись, связывающая имя пациента и электронный идентификатор, будет надежно храниться в закрытом офисе. Деидентифицированные данные будут использоваться для всех анализов, а результаты будут представлены в виде агрегатов и соотношений.
Результаты исследования
Приемлемость и распространение
В ходе интервью с ключевыми информантами будут задокументированы отношения, предпочтения, предполагаемые выгоды и опасения с точки зрения заинтересованных сторон (ВИЧ-инфицированных матерей, поставщиков услуг EID, членов сообщества) (Таблица 1).Распространение тестирования методами POC и SOC будет определяться количественно с точки зрения доли младенцев, прошедших тестирование (имеющих задокументированный сбор образцов) в период родов и 6-недельного периода, а также доли младенцев, у которых при рождении был определен ВИЧ-отрицательный результат. снова представлен на повторное тестирование в 6-недельном окне.
Таблица 1 Реализация и технико-экономические мерыРезультаты тестирования младенцев
Будет измеряться полнота и эффективность выполнения кенийских руководящих принципов тестирования EID после проведения тестирования при рождении и POC в исследовательских центрах (Таблица 1).Меры полноты будут включать пропорции родов и 6-недельные тесты с возвращенными результатами и с уведомлением матерей о результатах. Кроме того, мы будем отслеживать «полное удержание» — долю матерей, получивших уведомление о результатах анализа образцов, собранных как в период родов, так и в течение 6-недельного периода. Меры эффективности включают время обработки (TAT), связанное с ключевыми этапами POC или диагностики на основе ПЦР ДНК ВИЧ: TAT от сбора образца до доступности результатов, TAT от доступности результатов до уведомления матери о результатах и общий TAT от сбора образца до уведомления матери. .Младенческий возраст на момент завершения каждого этапа диагностики (и в начале АРТ, если тест на ВИЧ положительный) будет дополнительным показателем эффективности ВИЗ, который подразумевает клиническую своевременность конкретных этапов ВИЗ.
Производительность платформы POC
Оценка платформ Xpert и Alere q HIV POC будет включать оценку надежности тестирования (Таблица 1). Меры, которые необходимо отслеживать, включают количество неудачных тестов (и потраченных впустую картриджей), а также количество упущенных возможностей привлечь младенцев к тестированию POC из-за задокументированной поломки машины, ошибки машины или отсутствия картриджей.Ожидаемое число идентифицированных ВИЧ-положительных младенцев слишком мало для надежных расчетов чувствительности или специфичности, но мы будем отслеживать соответствие между результатами тестов с каждой платформы POC и соответствующими результатами ПЦР ДНК ВИЧ.
Отзыв поставщика EID
Проведение собеседований с поставщиками медицинских услуг во время пилотного исследования позволит запросить отзывы поставщиков о проблемах, с которыми сталкиваются при внедрении тестирования при рождении и POC, включая вопросы обучения персонала, оптимизации рабочего процесса, вовлечения матерей, управления поставками картриджей и технических проблем.Мнения медработников о преимуществах и рисках родов и тестирования POC для пациентов будут записаны.
Затраты на внедрение POC-тестирования
Измерения затрат, которые необходимо отслеживать и анализировать для каждой испытательной платформы POC, включают предварительную закупку машин и вспомогательного оборудования; индивидуальное обучение и безопасное хранение оборудования; покупка тестовых картриджей, включая доставку и таможенные сборы; и ремонт машин.
Статистический анализ
Это исследование предназначено для сбора предварительных данных о результатах для информирования руководства по внедрению и пилотных данных для последующего более крупного исследования.Мы ожидаем, что в среднем ежемесячно в каждом исследовательском центре будет участвовать примерно 15 подходящих участников, что дает предполагаемое общее количество участвующих в исследовании 720 пар мать-ребенок к концу 12-месячной фазы вмешательства. Ожидается, что сокращение участия в исследовании будет результатом документально подтвержденного перевода в другие учреждения, потери возможности последующего наблюдения, выкидыша и младенческой смертности до тестирования. Тем не менее, мы ожидаем достаточных возможностей для описания и сравнения результатов тестирования при рождении, а также между стратегиями тестирования POC и PCR для оценки величины эффекта и коэффициента внутрикластерной корреляции (ICC) для информирования будущего размера выборки и расчетов мощности.
Категориальные переменные будут представлены как пропорции, а непрерывные переменные как средние (SD) или медианы (IQR) в зависимости от распределения данных. Количественные показатели, сравниваемые на разных платформах POC или между методами тестирования POC и ДНК ВИЧ, будут анализироваться с использованием параметрических и непараметрических тестов (точные тесты или тесты Вилкокса и сумма рангов).
Статус исследования
Мы провели формирующие интервью с заинтересованными сторонами (поставщиками медицинских услуг, ВИЧ-положительными родителями и членами сообщества).Мы начали набор матери и ребенка в исследование в июне 2017 года. В течение первых 6 месяцев набор участников и полное выполнение пилотного проекта были ограничены внешними проблемами (длительная национальная забастовка медсестер и дефицит картриджей у производителя Alere q), которые были решены, что подготовило почву для нормальной работы. Набор участников продолжается и, как ожидается, завершится в декабре 2018 года. Мы планируем доложить о результатах исследования национальной технической рабочей группе по внедрению тестирования при рождении и POC в Кении, Министерству здравоохранения и администраторам участвующих учреждений.Данные будут опубликованы в рецензируемых научных журналах.
Отказ плановых тестов на ВИЧ-1 в случае передачи инфекции с пресероконверсионными компонентами крови в период инфекционного окна | ВИЧ | JAMA
Контекст Текущая практика скрининга донорской крови была успешной в снижении передачи вируса иммунодефицита человека (ВИЧ) через получение загрязненных продуктов крови. Однако сдача крови ВИЧ-инфицированными до сероконверсии и до появления высоких уровней вирусной репликации может дать отрицательный результат с использованием тестов на серологические антигены и антитела.Тестирование на основе амплификации нуклеиновых кислот (NAT) внедряется для скрининга ВИЧ-инфицированная кровь, сданная в этот период, однако Скрининг донорства минибассейна остается нерешенным.
Задачи Определить генетическую связь ВИЧ-1 между вирусами в 2 ВИЧ-1-инфицированных реципиенты компонентов крови и вирус у донора, который был антигеном ВИЧ и отрицательные антитела на момент сдачи крови; для проверки донорской крови плазмы с тестами NAT ВИЧ, включая те, которые в настоящее время предлагаются для использования в Скрининг донорства крови в США.
Дизайн и установка Тематическое исследование, проведенное в октябре 1997 г., связанное с инфекционным заболеванием Центр, Сингапурская больница общего профиля и Сингапурская служба переливания крови, Сингапур.
Субъекты Донор крови и 2 реципиента донорских тромбоцитов и красной крови клетки.
Основные показатели результатов Генетический анализ кодирующей области ВИЧ-1 p17 gag и области C2V5 env для определения генетическое родство вируса от донора и реципиента; реактивность в количественных и качественных анализах и реактивности при скрининге доноров Тесты NAT на ВИЧ в контексте однократного донорства и минибассейна.
Результаты Прямое секвенирование ДНК продемонстрировало идентичные вирусные последовательности ВИЧ-1 подтипа E у донора и реципиентов. На основе сравнений качественного и количественного анализ уровня РНК ВИЧ-1, низкий уровень виремии (диапазон 5-39 копий / мл в плазме), по оценкам, находился в неразбавленной крови донора в то время пожертвования. Дополнительное тестирование с использованием тестов NAT для скрининга доноров показало обнаружение РНК ВИЧ в неразбавленной донорской плазме, тогда как обнаружение было непоследовательным при уровнях разведения 1:16 и 1:24, используемых в настоящее время при скрининге мини-бассейнов донорства крови в Соединенных Штатах.
Выводы Передача ВИЧ от донора крови реципиенту тромбоцитов и реципиент эритроцитов произошел в инфекционном окне пресероконверсии период. Вирусная нагрузка в предполагаемой донорской крови была оценена как меньшая. более 40 копий / мл плазмы. Текущие протоколы скрининга NAT в мини-бассейне США может быть недостаточно чувствительным, чтобы обнаружить все инфекционные донорства в период окна.
В США сданная кровь и плазма проверяются на антитела. к вирусу иммунодефицита человека типов 1 (ВИЧ-1) и 2 (ВИЧ-2) путем скрининга с помощью иммуноферментного анализа (EIA), а также EIA на антиген p24 ВИЧ-1. 1 Несмотря на резкое снижение риска за счет улучшенного чувствительность этих тестов, по оценкам, от 1 из 450 000 до 1 дюйма 660 000 донорских крови в США могут передавать ВИЧ, 2 , 3 почти все случаи ВИЧ-инфекции, связанной с переливанием крови, были вызваны пожертвованиями, сделанными в период инфекционного окна до сероконверсии. В современных ОВОС на ВИЧ средний период инфекционного окна составляет 25 дней. 4 Антиген p24 становится обнаруживаемым через 2–3 недели после ВИЧ-инфекция в период высокой виремии, связанной с начальный всплеск репликации вируса 5 , 6 и, в среднем, может быть обнаружен примерно за 6 дней до того, как тесты на антитела станут положительный. 7 Использование теста на нуклеиновой кислоте амплификации (NAT), можно обнаружить РНК ВИЧ за 5-10 дней до Обнаружение антигена p24, которое оказалось полезным для подтверждения диагностики ВИЧ. серология. 8 , 9 В настоящее время HIV NAT тестирование оценивается в клинических испытаниях на предмет его использования в повседневной скрининг донорской крови и плазмы. Девяносто девять процентов собранной плазмы в США тестируется с помощью теста NAT на ВИЧ и вирус гепатита С. (ВГС). 10
В настоящее время проводится NAT на ВИЧ и ВГС (в рамках новых исследований). Заявки на лекарства, одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов [FDA]) на минибассейны на 16-24 сдачи цельной крови из-за стоимости и логистики сложность проверки индивидуальных образцов донорства. 11 В недавних исследованиях с использованием математического моделирования 12 есть оценки риска заражения ВИЧ на 10 миллионов пожертвований в США, снижение с 25 только при тестировании на антитела до 13 или 14 при добавлении минибассейна тестирования NAT на ВИЧ.Есть разногласия относительно того, NAT-скрининг минибассейна или однократного донорства будет адекватно чувствителен к запретить все пожертвования инфекционных заболеваний.
В этом исследовании мы исследовали возможную связь между вирусом из ВИЧ-инфицированный донор крови и 2 ВИЧ-инфицированных реципиента его компонентов крови у которых не было другого риска заражения ВИЧ. Сдача и переливание крови компонентов крови произошло в Сингапуре, где сдача крови на ВИЧ аналогичен протоколам США, включая анти-ВИЧ-1 и анти-ВИЧ-2. ИФА и ИФА на антиген р24 ВИЧ-1.
В июне 1997 г. цельная кровь была взята у повторного донора крови в Служба переливания крови Сингапура, Сингапур, после того, как донор отказал наличие каких-либо факторов риска, связанных с ВИЧ. На тот момент сыворотка от донора протестирована. отрицательный на оба антитела к ВИЧ (3-е поколение Plus HIV EIA, Abbott, Abbott Park, штат Иллинойс) и антиген p24 (Coulter Corporation, Майами, Флорида). При возвращении в октябре 1997 года у донора были обнаружены антитела к ВИЧ.Два получателя тромбоцитов и эритроцитов, полученных из донации в июне 1997 г. положительный результат теста на ВИЧ (уход за пациентами и их лабораторное тестирование проходили место в Центре инфекционных заболеваний Сингапурской больницы общего профиля). В Единица плазмы из донорского периода окна не была перелита и был доступен для дальнейшего тестирования. Мононуклеар плазмы и периферической крови клетки (PBMC) были собраны в октябре 1997 г. у реципиента тромбоцитов и реципиента красных кровяных телец и были доступны для тестирования.Пресероконверсия плазму тестировали на определяемую вирусную нагрузку (РНК ВИЧ-1) с использованием количественного Анализатор Amplicor HIV-1 Monitor (см. Подтверждение; Roche Molecular Systems, Бранчбург, штат Нью-Джерси), имеющий предел чувствительности 200 копий / мл.
После тестирования с Amplicor Центры по контролю за заболеваниями США и Prevention приняли участие и начали дальнейшие испытания, в том числе количественный анализ NucliSens HIV-1 RNA QT (Organon Teknika, Дарем, Северная Каролина), который имеет нижний предел 80 копий на входной объем (в данном случае 2 мл), что эквивалентно до 40 копий / мл.Проведено качественное определение пресероконверсионной РНК ВИЧ. с тестом NucliSens HIV-1 RNA QL (Organon Teknika), который имеет более низкий уровень обнаружения около 5 копий / мл (оценка производителя) при использовании 2 мл плазмы. РНК экстрагировали экстракцией нуклеиновой кислоты NucliSens. метод (первая фаза тестов NucliSens QT и QL) и амплифицирован во второй качественный анализ (полимеразная цепная реакция с обратной транскриптазой [ОТ-ПЦР]) с использованием набора Promega RT (Promega, Мэдисон, Висконсин) с праймером ED12 13 для получения комплементарной ДНК (кДНК).КДНК затем использовали для ПЦР-амплификации и секвенирования ДНК. Пресероконверсия донора плазма была отрицательной по антигену ВИЧ и антителам и ранее тестировалась в ниже уровня обнаружения в Австралии с использованием анализа Amplicor. Таким образом, 2 мл образца был использован для получения наивысшего уровня чувствительности с помощью NucliSens QT и NucliSens QL тесты. Только 1 мл образца был использован с NucliSens. Анализ QT (для определения вирусной нагрузки ВИЧ-1) для тестирования донора и реципиента образцы плазмы, взятые через 4 месяца после сдачи крови и переливания (октябрь 1997), поскольку они уже были протестированы в Сингапуре и оба были антигенами ВИЧ-1. и антитела положительные.Впоследствии образец донорской плазмы пресероконверсии был протестирован с помощью двух качественных анализов РНК ВИЧ (NAT) (Roche COBAS AmpliScreen Тест на ВИЧ-1, версия 1.5, Roche Molecular Systems, Плезантон, Калифорния; Хирон Прокликс TMA HIV-1 / HCV Assay, Chiron Corporation, Emeryville, Calif) проходит оценку для тестирования донорской цельной крови в США. Тестирование было проведено с этими анализами в соответствии с инструкциями производителя по неразбавленным образец и разведение 1: 8 и разведения мини-пула (1:16 и 1:24) донорской крови плазма. 14 , 15 Неразбавленный образец и образец разведения 1: 8 были включены в тестовую панель для проверки согласованности реактивности при нескольких уровнях разбавления.
Последовательности ВИЧ также были получены из исходной донорской плазмы. в качестве образцов PBMC донора и реципиента через 4 месяца после донорства / трансфузии. Обработка PBMC была, как описано, 16 за исключением того, что ДНК экстрагировали либо с помощью наборов колонок Generation Capture (Generation Inc, Миннеаполис, Миннесота) или как описано. 16 ПЦР-амплификация препаратов ДНК и кДНК была также описана, 16 , за исключением того, что первичная ПЦР выполнялась с праймерами. ED5 и ED12. 13
Продукты, амплифицированные ПЦР, очищали с помощью ПЦР-очистки Qiagen. комплекты (Qiagen Inc, Чатсуорт, Калифорния). Очищенную ДНК секвенировали с использованием Готовый реакционный набор для секвенирования цикла ABI PRISM Big Dye Terminator (применяется Биосистемы / Перкин Элмер, Фостер-Сити, Калифорния).Праймеры для секвенирования были различными комбинации вложенных праймеров ПЦР. 16 ВИЧ Секвенированные области включали область C2V5 (716 нуклеотидов) env и кодирующую область p17 (396 нуклеотидов) gag , обе области, обычно используемые для филогенетического анализа и сравнения штаммов ВИЧ в случаях передачи. Данные последовательности не включали области с которыми будут отжигаться праймеры набора NucliSens QT и QL. Тестирование проведено в Центры по контролю и профилактике заболеваний на эти образцы не вовлекать исследования людей.
Выполнены амплификация и прямое секвенирование ДНК продуктов ПЦР. на 4 образцах (Таблица 1) с участием 396 нуклеотидов области p17 и 716 нуклеотидов области C2V5. Всего было сравнено 1112 нуклеотидов ВИЧ для вируса из каждого из 4 образца. Полная идентичность наблюдалась на всех позициях; вирус имел идентичные последовательности в областях p17 и C2V5. Результат филогенетического анализа в объединении этого штамма вируса с подтипом E ВИЧ-1, который является одним из преобладающих штаммы, циркулирующие в Сингапуре (M.Л. К., неопубликованные данные, 1996 г.).
В таблице 1 приведены вирусные Результаты нагрузочного тестирования и секвенирования для пресероконверсии и 4-х месячного образцы от донора после донорства и образцы через 4 месяца после трансфузии от получателей. Два коммерческих количественных анализа РНК не смогли обнаружить РНК ВИЧ в период окна. РНК ВИЧ была обнаружена как в качественном Анализ ОТ-ПЦР (с использованием набора Promega RT, экстракции РНК NucliSens и амплификации кДНК, как описано в разделе «Методы») и качественный анализ NucliSens (ВИЧ-1 РНК QL).При использовании 2 мл плазмы качественный анализ NucliSens имеет более низкую предел обнаружения около 5 копий / мл, а количественный NucliSens QT анализ имеет более низкий уровень обнаружения — 40 копий / мл. 17 Это могло бы предсказать, что образец плазмы пресероконверсии периода окна имел вирусную нагрузку от 5 до 39 копий / мл. Поскольку оба NucliSens QT и QL-анализы используют одни и те же праймеры и зонды для амплификации и обнаружения. РНК ВИЧ отрицательный результат теста QT связан с более высокой детектируемостью предел для QT, а не из-за гетерогенности последовательности ВИЧ.Определение вирусной нагрузки для образцов через 4 месяца были 16000 копий / мл для донора и 2800 и 13000 копий / мл для 2 получателей.
Таблица 2 обобщает результаты оценки 2 тестов NAT на ВИЧ, которые в настоящее время проходят клинические испытания для скрининга сдача крови в США. Маскированная панель из образцов плазмы, которая включала неразбавленную и разбавленную плазму крови из сингапурской донорской крови, так как а также отрицательный и положительный контроли.Подразумеваемое пожертвование неизменно обнаруживался при тестировании неразбавленным с помощью тестов Roche и Chiron. системы. Однако при тестировании донорской плазмы возникла непостоянная реактивность. при уровнях разведения, используемых в настоящее время для скрининга донорства минибассейна (1:16 и 1:24) и даже при разведении 1: 8. Поскольку Amplicor и исходный NucliSens количественные тесты были отрицательными, а результаты NAT при 1:16 и Уровни разбавления 1:24 не всегда были реактивными, это также маловероятно. что низкий результат вирусной нагрузки был вызван гетерогенностью последовательности.Так же Анализы AmpliScreen и Chiron имеют разные наборы зондов и праймеров, которые постоянно обнаруживаемый вирус в неразбавленном виде. Праймеры для тестов Amplicor и зонды изменены по сравнению с таковыми в AmpliScreen; Таким образом отрицательный результат анализа Amplicor может отражать неудачный праймер / зонд комбинация и / или меньшая чувствительность по сравнению с AmpliScreen.
С самого начала этой оценки мы ввели строгие процедуры чтобы не допустить загрязнения или перепутывания образцов.К ним относятся следующее: (1) все образцы были амплифицированы отдельно, в разные дни, в чистой комнате, предназначенной только для первичного усиления; (2) все образцы PBMC были повторно усилены, переупорядочены и сравнены на соответствие; и (3) вирус из донорского забора крови до сероконверсии и 4-месячного образца PBMC сравнивались. Никогда мы не наблюдали противоречивых последовательностей, которые предполагали бы загрязнение. Плазменный вирус из 4-месячных образцов донора и реципиента был также секвенирован, и было обнаружено, что оно согласуется с данными о последовательности PBMC.Кроме того, в то время, когда мы секвенировали ДНК из этих образцов, другие Образцы ДНК были амплифицированы и секвенированы, и ни в одном из них не было последовательностей, которые аналогично вирусу донора или реципиента, который предполагал заражение.
Центры донорства крови в США и Сингапуре полагаются на несколько подходы к защите кровоснабжения. Современные методы донорского фактора риска скрининг и лабораторные исследования очень эффективны для минимизации риска ВИЧ-инфекции, переданной при переливании крови.Донор крови в этом расследовании сфальсифицированные ответы интервьюеру, исключив тем самым одно из проверочных гарантии. Тестирование образцов донорской крови на ВИЧ с помощью ИФА на антитела (следовало с помощью подтверждающего вестерн-блоттинга для образца с положительным EIA) и захвата антигена анализ (с последующей процедурой нейтрализации реактивных образцов) имеют чувствительность и специфичность более 99%. 18 Системы обнаружения плазменной РНК также использовались для подтверждения EIA антигена p24. реактивность и разрешающие неопределенные результаты теста на антитела, 9 , 19 что могло отражать ранние инфекции.Учитывая прогнозируемую низкую урожайность и плохую рентабельности, существенные разногласия по поводу достоинств добавления NAT РНК ВИЧ к скринингу доноров крови. Более того, даже самые чувствительные Анализы NAT имеют предел обнаружения РНК ВИЧ, и, следовательно, неясно. предотвратит ли NAT все передачи ВИЧ в контексте минибассейна или алгоритмы тестирования разового пожертвования. Технически категория ВИЧ NAT Тесты включают коммерческие наборы, специально разработанные для обнаружения РНК ВИЧ. а также более общие тесты на основе нуклеиновых кислот (включая ОТ-ПЦР), модифицированы на месте для анализа на ВИЧ.Коммерческие наборы HIV NAT имеют преимущества контроля качества и оценки чувствительности / специфичности. На сегодняшний день несколько наборы были разработаны и протестированы, но ни один из них не был одобрен FDA.
Путем прямого секвенирования вируса в образцах от донора и реципиентов, мы обнаружили, что последовательности p17 и C2V5 идентичны во всех 1112 положениях. Прямые последовательности представляют собой наиболее распространенный нуклеотид в каждой позиции или согласованная последовательность всех квазивидов вируса в человеке.С RT ВИЧ очень подвержен ошибкам, включая в среднем 1 неверный нуклеотид во время каждого раунда репликации, идентичное соответствие вирусного последовательности между донором и двумя реципиентами подтверждают недавний общий источник заражения.
Мы показали, что донорская стадия заражения на момент взятия крови сбор был очень ранним, еще до того времени, когда антиген или антитело p24 Тесты EIA могут выявить ВИЧ-инфекцию. Кроме того, вирусная нагрузка плазмы была чрезвычайно высокой. низкий, всего от 5 до 39 копий / мл.Следовательно, можно было бы ожидать что вирусная популяция будет очень однородной и не подвергнется столько же циклов репликации, сколько при более высоком уровне виремии. Эта высокая степень гомогенности наблюдалась даже на раннем этапе сероконверсии и во время раннее заражение. 20 , 21 Так как варианты в доноре не успели эволюционировать от «основателя» вируса, вполне очевидно, что вирус, переданный получателям, быть идентичными по большей части своего генома вариантам, идентифицированным в образцах от донора.Даже через 4 месяца после переливания консенсусная последовательность вируса не успел эволюционировать от вируса-основателя. Поскольку популяция вируса на ранних стадиях инфицирования очень однороден, утверждалось, что во время передача только одного вируса может передаваться и вызывать инфекцию, или несколько вирусов могут передаваться, но производится выбор, чтобы ограничить количество вирусов, которые могут реплицироваться на новом хосте. 22 , 23 В любом случае, кажется, что ранний реплицирующийся вирус от этого донора был эффективным в установлении инфекция, несмотря на небольшое количество присутствующих вирионов.
В другом случае 24 ВИЧ-инфицированных донор крови, у которого реципиент эритроцитов и реципиент тромбоцитов одновременно заразился, сдача крови проводилась в 1985 году, до рутинной передачи ВИЧ начат скрининг (ретроспективно протестирован на ВИЧ-инфекцию). Рано считалось, что это бессимптомная стадия из-за однородности V3 env вирусные последовательности. Передача произошла, хотя вирусная нагрузка донора составила всего 3500 копий / мл. 24 Для сравнения, в нашем исследовании передача произошла от донора. вирусная нагрузка которых была оценена на 2 порядка ниже (5-39 копий / мл). В другом отчете случай передачи ВИЧ через кровь в 1995 г. пожертвование 25 собрано в период окна был описан. У донора были отрицательные антитела к ВИЧ и антиген p24. отрицательный, но (впоследствии) положительный результат ПЦР на РНК ВИЧ. Нет генетического анализа или Данные о вирусной нагрузке были описаны для этого исследования.
Учитывая текущие оценки скорости передачи ВИЧ через кровь переливание крови, стандартный подход с использованием теста EIA и анализа антигена p24 в сочетании с подтверждающим тестом Вестерн-блот отлично зарекомендовали себя в значительном снижении показателей ВИЧ-инфекции, связанной с переливанием крови. Тем не менее, редкий случай сдачи крови во время пресероконверсионной фазы ВИЧ-инфекция вызвала интерес во всем мире к использованию NAT-скрининга. всех сдач крови 26 на ВИЧ, гепатит Вирус B, HCV и, возможно, другие вирусные патогены, передающиеся через кровь.Разнообразие коммерческие комплекты, а также внутренние испытания проходят оценку в Европе, где начало оценки протоколов тестирования началось в 1997 году. 27 Тестирование доноров на основе нуклеиновых кислот на экспериментальном база в настоящее время используется в Соединенных Штатах. Проблемы более высоких затрат для анализов NAT и увеличение необходимого времени тестирования решаются первоначальный скрининг донорской плазмы с использованием объединенных аликвот. Однако объединение обладает эффектом разбавления, что может существенно снизить чувствительность анализа по сравнению с полученным при индивидуальном тестировании пожертвованных образцов. 26 -28 Концентрация вируса шаг перед тестированием пулов плазмы может повысить уровни чувствительности, 29 за счет добавления еще одного шага к тестированию процедура. FDA предложило минимальный стандарт для любого анализа объединенных образцов, то есть анализ должен иметь возможность обнаруживать 100 вирусных копий / мл (5000 вирусных копий / мл на одно донорство). 30 2 NAT, использованные здесь для анализа разведений донорской плазмы, показали лучшие результаты. чем этот стандарт (постоянная реактивность до 1: 8 разбавление расчетного 5-39 копий / мл образца), но не дали однозначного положительного результата на уровни разбавления мини-пула, предлагаемые в настоящее время для скрининга партий.Это указывает может потребоваться тестирование NAT одного пожертвования, чтобы потенциально закрыть окно потенциальной инфекции при пресероконверсионной сдаче крови.
Существует по крайней мере 1 исследование на животных моделях (шимпанзе) 31 подразумевая, что период окна от инфекции до обнаружения антител имеет неинфекционную фазу инкубации (затмения), за которой следует инфекционная фаза, когда вирусные нуклеиновые кислоты могут быть обнаружены в периферической крови.Этот исследование показало, что тесты HIV NAT могут обнаруживать вирус в течение всего инфекционного периода. фазы и, следовательно, может практически устранить инфекцию, передаваемую при переливании крови. Перенос результатов этой модели на ВИЧ-инфекцию человека может быть проблематичным, тем не менее, и указывает на необходимость выявления и характеристики других случаев передачи ВИЧ. случаи, когда первоначальное тестирование на ВИЧ не помогло решить критический вопрос взаимосвязи между вирусной нагрузкой и инфекционностью во время раннего окна фаза.Наконец, хотя ясно, что тестирование нуклеиновой кислоты, вероятно, еще больше минимизировать и без того низкий риск передачи ВИЧ-инфекции через кровь переливание крови, существует постоянная потребность в улучшении донорского фактора риска скрининг и разработка процедур инактивации патогенов, кровезаменителей, и более чувствительные, технически простые тесты.
1.Лакриц Э.М., Саттен Г.А., Аберль-Грасс Дж. и другие. Предполагаемый риск передачи вируса иммунодефицита человека по проверенной крови в Соединенных Штатах. N Engl J Med. 1995; 333: 1721-1725.Google Scholar 2. Schreiber GB, Busch MP, Kleinman SH, Korelitz JJ. Риск вирусных инфекций, передаваемых при переливании крови. N Engl J Med. 1996; 334: 1685-1690.Google Scholar3.Busch MP, Lee LL, Satten GA. и другие. Динамика выявления вирусных и серологических маркеров, предшествующих человеческому сероконверсия вируса иммунодефицита 1 типа. Переливание. , 1995; 35: 91-97. Google Scholar 4.Рекомендации по скринингу доноров с лицензированным тестом на ВИЧ-1 антиген [меморандум].Роквилл, Мэриленд: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов, Центр биопрепаратов. Оценка и исследования; 8 августа 1995 г.
5. Кларк SJ, Saag MS, Decker WD. и другие. Высокие титры цитопатического вируса в плазме пациентов с симптоматическим первичная инфекция ВИЧ-1. N Engl J Med. , 1991; 324: 954-960. Google Scholar 6. Даар ES, Moudgil T, Meyer RD, Ho DD. Преходящие высокие уровни виремии у пациентов с первичным иммунодефицитом человека вирусная инфекция 1 типа. N Engl J Med. , 1991; 324: 961-964.Google Scholar7. Рекомендации Службы общественного здравоохранения США по анализу и консультированию крови и доноры плазмы для антигена вируса иммунодефицита человека типа 1. MMWR Morb Mortal Wkly Rep. 1996; 45 (RR-2): 1-9. Google Scholar8.Busch MP, Satten GA, Herman SA. и другие. РНК плазмы ВИЧ для подтверждения реактивности ВИЧ-1 p24 ag / анти-ВИЧ у доноров с сероконверсией [аннотация]. Переливание. 1996; 36 (доп.): 41S. Abstract S163.Google Scholar 9. Браун А.Е., Джексон Б., Фуллер С.А. и другие. Вирусная РНК в разрешении вируса иммунодефицита человека 1 типа диагностическая серология. Переливание. 1997; 37: 926-929.Google Scholar 10. FDA проводит семинары по пригодности доноров крови, снижению лейкоцитов, и NAT. AABB Wkly Rep. 17 декабря 1999 г .; 5: 3. Google Scholar 11. Отчет межорганизационной рабочей группы по Тестирование доноров крови на амплификацию нуклеиновых кислот. Тестирование амплификации нуклеиновых кислот доноров крови, передающихся при переливании инфекционные заболевания. Переливание. , 2000; 40: 143-159. Google Scholar, 12.Клейнман Ш., Буш М.П. Риски инфекции, передаваемой при переливании крови: прямая оценка и математические расчеты. моделирование.В: Contreras M, ed. Передовой опыт и исследования в клинической гематологии. Лондон, Англия: Bailliere Tindall Publishing. В прессе.
13.Делварт Э.Л., Шпаер Э.Г., Луваги Дж. и другие. Генетические отношения, определенные с помощью анализа подвижности гетеродуплекса ДНК. Наука. 1993; 262: 1257-1261.Google Scholar14.Анализ ТМА на ВИЧ-1 / ВГС, набор для тестов 5000 [вкладыш в черновую упаковку]. Эмеривилл, Калифорния: Chiron Procleix; 1998.
15.Тест COBAS AmpliScreen HIV-1, v1.5 [черновик-вкладыш]. Плезантон, Калифорния: Roche Molecular Systems, Inc.; 1999.
16.Schochetman GS, Subbarao S, Kalish ML. Методы вирусного генома. Бока-Ратон, Флорида: CRC Press Inc; 1996: 25-41.
17, Джиноккио С.К., Тетали С., Уошберн Д. и другие. Сравнение уровней РНК вируса иммунодефицита человека 1 типа в плазма, измеренная с помощью амплификации на основе последовательности нуклеиновых кислот NucliSens и анализы Quantiplex разветвленной ДНК. J Clin Microbiol. 1999; 37: 1210-1212.Google Scholar 18. Обновление: серологическое тестирование на антитела к ВИЧ-1 — США, 1988 г. и 1989. MMWR Morb Mortal Wkly Rep. 1990; 39: 380-383. Google Scholar 19. Кляйнман С., Буш М.П., Холл Л. и другие. Ложноположительный результат теста на ВИЧ-1 в условиях скрининга с низким уровнем риска добровольная сдача крови. JAMA. 1998; 280: 1080-1085.Google Scholar. 20. McNearney T, Westervelt P, Thielan BJ. и другие. Ограниченная гетерогенность последовательности среди биологически отличных иммунодефицитов человека изоляты вируса типа 1 от лиц, вовлеченных в кластерный инфекционный вспышка. Proc Natl Acad Sci U S. A. 1990; 87: 1917-1921. Google Scholar 21. Wolfs TFW, Zwart G, Bakker M, Goudsmit J. Диверсификация геномной РНК ВИЧ-1 после полового и парентерального вируса. коробка передач. Вирусология. 1992; 189: 103-110.Google Scholar 22. Zhu T, Mo H, Wang N. и другие. Генотипическая и фенотипическая характеристика пациентов с ВИЧ-1 с первичным инфекционное заболевание. Наука. 1993; 261: 1179-1181.Google Scholar 23. Zhang LQ, MacKenzie P, Cleland A. и другие. Отбор конкретных последовательностей в белке внешней оболочки вирус иммунодефицита человека 1 типа при первичном инфицировании. J Virol. 1993; 67: 3345-3356. Google Scholar, 24. Диаз Р.С., Чжан Л., Буш М.П. и другие. Дивергенция квазивидов ВИЧ-1 в эпидемиологическом кластере. СПИД. 1997; 11: 415-422. Google Scholar. 25. Лаперш С., Моро П., Лэр Дж., Курус AM. Два последовательных заражения ВИЧ от субъектов в период окна. СПИД. 1998; 12: 1397-1398. Google Scholar, 26.Busch MP, Stramer SL, Kleinman SH. Развивающиеся применения анализов амплификации нуклеиновых кислот для профилактики передачи вируса компонентами и производными крови.В: Garratty G, ed. Приложения молекулярной биологии в медицину переливания крови. Bethesda, Мэриленд: Американская ассоциация Банки крови; 1997: 123-176.
27. Кардосо М.С., Кернер К., Кубанек Б. Скрининг мини-пула путем тестирования нуклеиновых кислот на вирус гепатита В, вирус гепатита С и ВИЧ. Переливание. 1998; 38: 905-907.Google Scholar 28. LeCorfec E, Le Pont F, Tuckwell HC. и другие. Прямое тестирование на ВИЧ при сдаче крови. Переливание. 1999; 39: 1141-1144.Google Scholar29.Yerly S, Pedrocchi M, Perrin L. Использование полимеразной цепной реакции в пулах плазмы для сопутствующих обнаружение вируса гепатита С и РНК ВИЧ 1 типа. Переливание. 1998; 38: 908-914.Google Scholar 30. Организации крови излагают планы тестирования нуклеиновых кислот на семинаре FDA. Информационный бюллетень центров крови Америки. 25 сентября 1998 г .: 9-10. Google Scholar 31. Мерти К.К., Хенрард Д.Р., Эйхберг Дж. У. и другие. Новое определение периода окна заражения ВИЧ на модели шимпанзе. Переливание. 1999; 39: 688-693. Google Scholar.Последовательных процедур LASER ART и CRISPR для устранения ВИЧ-1 в подгруппе инфицированных гуманизированных мышей
Реагенты для культивирования клеток
Буфер 4- (2-гидроксиэтил) -1-пиперазинэтансульфоновой кислоты (HEPES) и ципрофлоксацин были приобретены у Sigma-Aldrich, Сент-Луис, Миссури. Были приобретены диэтиловый эфир, вода без эндотоксинов, гентамицин, ацетонитрил (ACN), метанол, KH 2 PO 4 , бычий сывороточный альбумин (BSA), Triton X-100, вода класса LC-MS и реагент TRIzol. от Fisher Scientific, Сан-Диего, Калифорния.Линия репортерных клеток TZM-bl (AIDS Reagent Program, Division of AIDS, NIAID, NIH, Bethesda, MD) и клетки HEK-293T (Американская коллекция типовых культур (ATCC), Манассас, штат Вирджиния) культивировали в среде DMEM с высоким содержанием глюкозы. с 10% FBS и гентамицином (10 мкг / мл). Клетки Jurkat (Clone E6–1, TIB-152 ™) были приобретены в ATCC и культивированы в среде Roswell Park Memorial Institute (RPMI), содержащей 10% FBS и гентамицин (10 мкг / мл) (Sigma-Aldrich, St. Louis, MO ). PBMC выделяли из лейкопаков градиентным центрифугированием на Ficoll-Paque в течение 30 минут при 600 g.PBMC, собранные из лейкоцитарной пленки, стимулировали PHA (5 мкг / мл) в течение 24 часов в RPMI с 10% FBS и гентамицином (10 мкг / мл) с добавлением человеческого рекомбинантного интерлейкина-2 (rIL-2) в концентрации 30 нг / мл ((STEMCELL Technologies, Сиэтл, Вашингтон). Свежую среду меняли каждые 2–3 дня.
Инфекция ВИЧ-1 клеточной культуры
Клетки HEK-293T трансфицировали с использованием метода преципитации CaPO 4 в присутствии хлорохин (50 мкМ) с 30 мкг плазмиды pNL 4–3 -EGFP-P2A-Nef 22 /2.5 × 10 6 ячеек / чашка 100 мм. На следующий день были заменены носители; и через 24 и 48 часов супернатанты собирали, осветляли при 1400 g в течение 10 минут, фильтровали через фильтр 0,45 мкм и концентрировали ультрацентрифугированием в течение 2 часов с 20% сахарозной подушкой. Осадки вирусов ресуспендировали в основном солевом растворе Хэнка (HBSS) осторожным встряхиванием в течение ночи, разделяли на аликвоты и титровали в клетках Jurkat с помощью FACS для экспрессии GFP. Клетки Jurkat инфицировали спинокуляцией в течение 1,5 ч при 32 ° C в 500 мкл инокулята, содержащего 8 мкг / мл полибрена, затем ресуспендировали и оставляли на 4 ч, затем добавляли 500 мкл ростовой среды.На следующий день клетки промывали 3 раза фосфатно-солевым буфером (PBS) и повторно суспендировали в среде для выращивания.
Дизайн гРНК, конструирование плазмиды экспрессии CRISPR-Cas9 и вектора AAV
9Биоинформатический дизайн и клонирование гРНК LTR1 и GagD в вектор AAV-CMV-saCas9 были ранее описаны 19,23 . Вкратце, инструмент разработки гРНК Института Броада (https://www.broadinstitute.org/rnai/public/analysis-tools/sgrna-design) использовался для скрининга последовательностей ВИЧ-1 NL4-3 или ADA на предмет возможных Области протоспейсера гРНК, за которыми следует saCas9-специфический PAM: NGGRR (N).Была выбрана пара гРНК, демонстрирующая наилучшую предсказуемую активность на мишени (в геноме ВИЧ-1) и минимальную активность вне мишени (в геноме человека): одна нацелена на промоторную область LTR ВИЧ-1, а другая нацелена на ген gag. Последовательности соответствующих гРНК LTR1 и GagD плюс PAM были дополнительно подвергнуты перекрестной ссылке с базой данных последовательностей ВИЧ Лос-Аламоса, подтверждающей высокие уровни консервативности (> 90%) для последовательностей ВИЧ-1. Затем пара олигонуклеотидов для каждого сайта-мишени с выступами 5′-CACC и 3′-AAAC Bsa1 была получена от Integrated DNA Technologies (IDT, Coralville, Iowa, Table S1), отожжена, фосфорилирована и лигирована в расщепленный Bsa I. , дефосфорилированный pX601-AAV-CMV: NLS-saCas9-NLS-3xHA-bGHpA; U6 :: BsaI-sgRNA (подарок от Feng Zhang через Addgene) (61591; Addgene).Для мультиплексного клонирования гРНК кассету каркаса U6-LTR1-gRNA из pX601-CMV-saCas9-LTR1 амплифицировали с использованием праймеров T795 / T796 (таблица S1) и клонировали с помощью набора для клонирования In-Fusion HD (Clontech, Mountain View, CA) в EcoR I и KpnI линеаризовали плазмиду pX601-CMV-saCas9-GagD, что привело к вектору доставки AAV pX601-CMV-saCas9-LTR1-GagD. Наконец, плазмиду с подтвержденной последовательностью отправляли для упаковки в серотип AAV-9 (Vigene Biosciences Inc., Milton Park Abingdon, UK). AAV 9 был выбран в качестве вектора для доставки CRISPR-Cas9 из-за его высокой эффективности трансдукции во многих тканях, включая центральную нервную систему, как предполагаемых значительных резервуарах для ВИЧ-1.Идея заключалась в том, чтобы обеспечить эффективное проникновение AAV во все предполагаемые ткани-мишени ВИЧ-1, включая мозг.
Инфекция ВИЧ-1 гуманизированных мышей CD34 +
Мышей NSG (NOD.Cg-Prkdc scid Il2rgt m1Wjl / SzJ) были получены от Jackson Laboratories, Бар-Харбор, штат Мэн, и их разводили в определенных условиях, свободных от патогенов. в Медицинском центре Университета Небраски (UNMC) в соответствии с этическими принципами, установленными Национальными институтами здравоохранения для ухода за лабораторными животными.CD34 + HSC были обогащены из пуповинной крови человека или клеток печени плода с использованием иммуномагнитных шариков (набор для отбора CD34 +; Miltenyi Biotec Inc., Auburn, CA, USA). Чистота клеток CD34 + составила> 90% по данным проточной цитометрии. Клетки трансплантировали новорожденным мышам, облученным в дозе 1 Гр с использованием облучателя RS-2000 × -Ray (Rad Source Technologies, Buford, GA). Клетки трансплантировали путем внутрипеченочной (i.h.) инъекции 50000 клеток / мышь в 20 мкл фосфатно-солевого буфера (PBS) с помощью иглы 30-го размера. Эксперименты, представленные на рис.2–6 были из клеток печени плода человека, выделенных от одного донора. В исследовании, описанном на рис. 7 и 8, HSC из пуповинной крови были получены от двух доноров. Мышей от одного донора использовали для всех мышей с двойным лечением. Гуманизация животных была подтверждена с помощью проточной цитометрии 31,60 на присутствие CD45- и CD3-положительных иммунных клеток крови, как показано на фиг.4. В возрасте 18 недель 25 мышей NSG-hu были инфицированы внутрибрюшинно (ip ) с ВИЧ-1 NL4–3 32,36 при 10 4 инфекционная доза культуры ткани 50 (TCID 50 ) / мл и умерщвление в дни 1, 3, 7 и 14; n = 5 в каждый момент времени.Во все оценки испытаний были включены пять неинфицированных контрольных животных. Уровни вирусных копий РНК / мл анализировали с помощью автоматизированной системы COBAS Ampliprep System V2.0 / Taqman-48 (Roche Molecular Diagnostics, Базель, Швейцария) 30,31 . Для этого анализа 100 мкл мышиной сыворотки разбавляли до 1 мл стерильной фильтрованной нормальной сывороткой человека. Предел обнаружения анализа после разведения составляет 200 копий вирусной РНК / мл. Хотя фаза затмения для вирусной инфекции у людей остается изменчивой 61 , вирусная нагрузка и уровни истощения CD4 + Т-клеток, наблюдаемые у инфицированных гуманизированных мышей, на самом деле отражают течение болезни у инфицированного человека-хозяина.Действительно, только после нескольких недель заражения мы действительно наблюдаем значительную потерю клеток 12,17,29,37,50 . Эти результаты можно рассматривать как подтверждение модели, включающей временное восстановление CD4 + Т-клеток, наблюдаемое после АРТ, как это наблюдается у людей.
Наноформованные антиретровирусные препараты
DTG, 3TC и ABC были щедрыми подарками от ViiV Healthcare, Research Triangle Park, NC. КРП был приобретен у Hangzhou Bingo Chemical Co., Ltd, Ханчжоу, Китай. Антиретровирусные пролекарства и их полимерные оболочки получали, как описано ранее 12,13,14 .Были сделаны миристоилированные модификации для DTG, 3TC и ABC (называемые MDTG, M3TC и MABC) для усиления включения в наночастицы полоксамера 407 (P407), в то время как RPV был заключен в оболочку только полоксамером 338 (P338) в немодифицированной форме с использованием высокой гомогенизация под давлением с образованием кристаллических наноформулированных лекарств. Размер частиц, индекс полидисперсности и дзета-потенциал определяли с помощью динамического светорассеяния с использованием Malvern Nano-ZS (Malvern, Worcestershire, UK) 49 . Конечные концентрации лекарственного средства в суспензиях наноформулировок и растворах для инъекций определяли с помощью HPLC-UV / Vis и UPLC-MS / MS.Объем 40-50 мкл для каждой комбинации наноформ (NMDTG / NRPV и NM3TC / NMABC) вводили внутримышечной (IM) инъекцией в противоположные мышцы бедра мышей.
Антитела
Для проточного цитометрического анализа мы использовали панель антител (все от BD Biosciences, Сан-Хосе, Калифорния), состоящую из конъюгированных с FITC мышиных антител к человеческому CD45 (номер по каталогу 555482), мышиных антител, конъюгированных с Alexa Fluor 700. -человеческий CD3 (№ по каталогу 557943), APC-конъюгированные мышиные антитела к человеческому CD4 (№ по каталогу 555349) и BV421-конъюгированные мышиные антитела к человеческому CD8 (№ по каталогу 562428), PE-конъюгированные мышиные антитела к человеческому CD14 (№ по каталогу 555398). ), и мышиные антитела против CD19 человека (№ по каталогу 555414), конъюгированные с PE-Cy5.Для иммуногистохимического окрашивания мы использовали моноклональные мышиные антитела против человеческого ВИЧ-1p24 (клон Kal-1, M0857, Dako, 1:10), моноклональные мышиные антитела против лейкоцитов человека (HLA-DR; клон CR3 / 43, Dako, 1: 100), а вторичные антитела против EnVision + мыши, конъюгированные с HRP, были приобретены у Dako (Carpinteria, CA). Периферическую кровь собирали из подчелюстной вены в пробирки, покрытые этилендиаминтетрауксусной кислотой (ЭДТА), или путем сердечной пункции в конце исследования. Лейкоциты крови тестировали на человеческие маркеры pan-CD45, CD3, CD4, CD8, CD14 и CD19 в виде шестицветных комбинаций с использованием анализатора LSR-II FACS (BD Biosciences).Антитела и контрольные изотипы получали от BD Pharmingen, San Diego, CA, и окрашивание анализировали с помощью FlowJo (BD Immunocytometry Systems, Mountain View, CA). Стратегия стробирования показана на дополнительном рис. 20. Результаты выражали в процентах от общего числа ограниченных лимфоцитов. Процентное содержание CD4- и CD8-положительных клеток было получено из человеческого CD3 + гейта 17 . Мы использовали абсолютное количество человеческих клеток CD45 + для нормализации каждого набора данных о человеческих клетках. Эквивалентные количества общего количества клеток крови / мышь использовали в каждый момент времени.
Иммуногистохимические исследования (ИГХ)
Селезенку, легкие, печень и лимфатические узлы перфузировали PBS, затем 4% параформальдегидом, а затем фиксировали в течение ночи и обрабатывали для заливки парафином. Из парафиновых блоков вырезали срезы толщиной пять микрон, помещали на предметные стекла и метили мышиными моноклональными антителами (Dako) к HLA-DQ / DP / DR (клон CR3 / 43, 1: 100) и ВИЧ-1p24 (1 : 10). Система Dako EnVision на основе полимера, конъюгированная с HRP, использовалась в качестве вторичного детектирующего реагента и была разработана с использованием 3,3′-диаминобензидина (DAB).Все залитые парафином срезы контрастировали гематоксилином Майера. Делеция первичных антител или использование мышиного IgG служили контролем. Изображения были получены с помощью камеры Nikon DS-Fi1, закрепленной на Nikon Eclipse E800 (Nikon Instruments, Мелвилл, Нью-Йорк), с использованием программного обеспечения NIS-Elements F 3.0.
Экстракция нуклеиновых кислот и анализы кПЦР
В исследованиях, представленных на рис. 2-8, общие вирусные нуклеиновые кислоты (РНК и ДНК) были экстрагированы из селезенки, клеток костного мозга, легких, кишечника, печени, почек и мозга с использованием набор Qiagen (Qiagen, Hilden, Германия) в соответствии с инструкциями производителя.Общая клеточная ДНК, полученная из инфицированной ВИЧ-1 клеточной линии ACh3, служила положительным контролем и стандартами, тогда как геномная ДНК человека, полученная от неинфицированных мышей NSG-hu, служила отрицательным контролем. Связанные с клетками РНК и ДНК ВИЧ-1 количественно определяли с помощью количественной ПЦР в реальном времени и капельной цифровой ПЦР (ddPCR). Из-за чрезвычайно низкого количества латентно-инфицированных человеческих клеток у ВИЧ-инфицированных мышей NSG-hu после длительной АРТ для обнаружения общей ДНК ВИЧ-1 потребовалось два раунда амплификации ПЦР. Первый раунд ПЦР проводили на обычном ПЦР-аппарате (T100 Thermal Cycler, Biorad, CA) в 25 мкл реакционной смеси для ПЦР, содержащей 500 нг матрицы и по 50 нг каждого из обоих праймеров, отжигаемых к области gag ВИЧ-1 и реакции Условия следующие: 94 ° C в течение 3 минут, затем 15 циклов 94 ° C в течение 30 секунд, 55 ° C в течение 30 секунд и 72 ° C в течение 1 минуты.Продукт первой ПЦР впоследствии был использован в качестве матрицы во второй полувложенной ПЦР-амплификации в реальном времени, выполненной на машине для ПЦР в реальном времени ABI Step One Plus (Applied Biosystems, Фостер-Сити, Калифорния) с использованием детекторного зонда TaqMan и праймеров. 30 . Два мкл первого продукта ПЦР разбавляли до 50 мкл основной смесью ПЦР, содержащей два праймера по 0,2 мкМ каждый и 0,2 мкМ TaqMan флуоресцентный зонд с двойной меткой. Параметры ПЦР в реальном времени были следующими: 50 ° C в течение 2 минут, затем 95 ° C в течение 10 минут, затем 40 циклов при 95 ° C в течение 15 секунд и 60 ° C в течение 1 минуты.Размеры ампликона составляют 221 п.н. для первого раунда ПЦР и 83 п.н. для второго раунда (в реальном времени) ПЦР. ДНК, выделенная из клеток ACh3, содержащих одну интегрированную копию ВИЧ-1 на клетку, была использована в качестве стандарта в серийных 10-кратных разведениях с числом копий ВИЧ в диапазоне от 10 1 до 10 5 копий ДНК / реакция 36,37 . Интегрированная ДНК (iDNA) провируса была количественно определена с использованием адаптированного анализа Alu-gag PCR, как описано Agosto et al. 62 с модификациями для второго раунда ПЦР, следуя ранее опубликованным методам 63 .Вкратце, образцы подвергали амплификации ПЦР в первом раунде (95 ° C в течение 2 минут; 20 циклов 95 ° C в течение 15 секунд, 50 ° C в течение 15 секунд и 72 ° C в течение 150 секунд) с использованием 100 нМ Alu и 600 нМ. gag обратные праймеры. Пять мкл продукта первого цикла амплифицировали во вложенном протоколе с использованием анализа на ген gag ВИЧ-1 (вторые праймеры и зонд ПЦР), как описано выше. ПЦР в первом раунде включала 3 повтора с использованием только обратного праймера gag (только gag) в качестве фонового неинтегрированного контроля. Уровни интеграции на клетку рассчитывали путем вычитания сигналов только gag из количественного определения Alu-gag.Полувложенная ОТ-ПЦР в реальном времени на РНК ВИЧ-1 выполнялась, как описано 36,37 . Элюированную клеточную РНК сначала подвергали обработке ДНКазой для удаления ДНК ВИЧ-1, чтобы избежать вмешательства в количественный анализ. Для анализа обратной транскрипции случайные гексамеры использовали в качестве праймеров и SuperScript III (Invitrogen, MA) для синтеза кДНК первой цепи при 42 ° C в течение 60 мин. кДНК использовали для анализа без сплайсинга (usRNA). Два раунда ПЦР были выполнены в тех же условиях ПЦР, что описаны для общей вирусной ДНК.Для анализа usRNA проводили ПЦР в реальном времени в течение 45 циклов и использовали те же праймеры и флуоресцентный зонд, что и для анализа общей вирусной ДНК. Видоспецифичные праймеры и зонды CD45 человека были получены от Thermo-Fisher Scientific (США) (номер по каталогу 433182 для Hs0036534_g1).
Для тестирования вирусного иссечения замороженные ткани, отправленные в Университет Темпл из Медицинского центра Университета Небраски, гомогенизировали с использованием гомогенизатора Bullet Blender (Next Advance, Averill Park, NY) с использованием комбинаций гранул и настроек, специфичных для каждой ткани, в соответствии с протоколами производителя.Буфер T1 из набора NucleoSpin Tissue (Macherey-Nagel, Duren, Германия) использовали для гомогенизации / начального лизиса с последующим расщеплением протеиназой K в течение ночи. Экстракция геномной ДНК была завершена в соответствии с протоколом производителя. Для стандартных ПЦР (дополнительная таблица 1) 500 нг экстрагированной ДНК подвергали ПЦР с использованием набора Fail Safe PCR и буфера D (Epicenter, Madison, WI) в следующих условиях ПЦР: 94 ° C, 5 мин, 30 циклов (94 ° C). C 30 с, 55 ° C 30 с, 72 ° C 30 с), 72 ° C 7 мин с использованием праймеров 1-го раунда с последующей вложенной ПЦР с использованием разбавленной реакции 1-го раунда ПЦР.Вложенные продукты ПЦР подвергали секвенированию по Сэнгеру напрямую, если только одна популяция ампликонов была обнаружена электрофорезом в агарозном геле. Для обнаружения множества ампликонов для исследования состава иссечения ВИЧ каждую популяцию ампликонов отделяли и очищали с помощью электрофореза в агарозном геле, а затем клонировали в вектор ТА (Invitrogen, Карлсбад, Калифорния). Плазмидную ДНК, содержащую вырезанный ампликон ВИЧ, очищали из каждой бактериальной колонии для секвенирования по Сэнгеру (Genewiz, South Plainfield, NJ).ДНК ВИЧ-1 количественно определяли с использованием TaqMan qPCR, специфичного для генов pol и env ВИЧ-1, и клеточного гена бета-глобина в качестве эталона (дополнительная таблица 1). Перед кПЦР геномную ДНК разводили до 10 нг / мкл, а затем отбирали по 5 мкл (50 нг) на реакцию / лунку. Реакционные смеси готовили с использованием ДНК-полимеразы Platinum Taq (Invitrogen) в соответствии с упрощенной процедурой 64 . Стандарт был приготовлен из серийных разведений геномной ДНК клеток U1, поскольку он содержит две одиночные копии провируса ВИЧ-1 на диплоидный геном, равное количеству копий гена бета-глобина.Условия КПЦР: 98 ° C 5 мин, 45 циклов (98 ° C 5 мин, 45 циклов (98 ° C 15 с, 60 ° C 30 с с получением данных, 72 ° C 1 мин). a LightCycler96 (Roche, Базель, Швейцария). Для ОТ-ПЦР использовали реагент TRIzol (Ambion, Остин, Техас) для начальной экстракции РНК с последующей очисткой с помощью набора RNeasy (Qiagen, Hilden, Германия) с расщеплением ДНКазой I в колонка для экстракции. Всего 0,5 мкг РНК использовали для обратной транскрипции M-MLV (Invitrogen). Для скрининга экспрессии гРНК специфический обратный праймер (каркас pX601gRNA / R, дополнительная таблица 1) использовали в реакции RT с последующей стандартной ПЦР с использованием мишени LTR 1 или GagD-смысловые олигонуклеотиды в качестве прямых праймеров (дополнительная таблица 1) и электрофорез в агарозном геле.Для проверки экспрессии мРНК saCas9 смесь олиго-dT праймеров использовали в RT, а кДНК подвергали ПЦР с использованием пар специфичных для saCas9 праймеров и β-актина в качестве эталона (дополнительная таблица 1). Результаты секвенирования по Сэнгеру анализировали с использованием инструмента множественного выравнивания последовательностей Clustal Omega (EMBL-EBI) и программного обеспечения сканера последовательностей 2 (Applied Biosystems).
ddPCR для обнаружения нуклеиновых кислот ВИЧ-1
ddPCR выполняли на основе капельной технологии водно-масляной эмульсии с использованием реагентов ddPCR ™ Supermix for Probes в системе QX200 ™ Droplet Digital ™ PCR (Bio-Rad Laboratories, Hercules , Калифорния).Для количественного определения ДНК ВИЧ-1 элюированную клеточную ДНК амплифицировали с помощью ПЦР 36,37,63 с использованием наборов Taqman, нацеленных на LTR ВИЧ-1, гены gag и pol, и в качестве эталонного бета-актина мыши или человека (дополнительная таблица 1). Всего 100–200 нг ДНК из каждой ткани использовали в качестве матрицы для амплификаций ddPCR с теми же условиями термоциклирования, которые использовались для детекции q-PCR в реальном времени. Сбор и анализ данных проводились с использованием устройства для считывания капель QX200 и программного обеспечения QuantaSoft ™, поставляемого с прибором.Геномную ДНК, экстрагированную из 50 000 клеток, включая клетки человека и мыши, использовали в качестве матрицы для каждого анализа ddPCR. Уменьшение Gag представляет собой удаление между 5’LTR и Gag или от 5’LTR до 3’LTR, в то время как уменьшение Pol представляет собой удаление между Gag и 3’LTR или 5’LTR до 3’LTR. Однако один LTR всегда будет обнаруживаться во всех трех условиях. Таким образом, мы использовали отношение Gag или Pol к LTR для оценки эффективности удаления. Например, у мыши M4349 (рис. 6e) отношения Gag / LTR и Pol / LTR равны 19.7% (15 клеток с обнаруживаемым gag из 76 клеток с обнаруживаемым LTR) и 19,5%, соответственно, в геномной ДНК, экстрагированной из селезенки обработанных мышей. Таким образом, эффективность удаления 5’LTR в Gag и Gag в 3’LTR была оценена примерно в 80% для обоих (100% -19,7% или 100% -19,5%). В селезенке той же мыши эффективность трансдукции AAV9 была рассчитана до 1,03 копий вектора AAV на клетку в общей популяции, включая трансплантаты человека и мышиные клетки-хозяева (фиг. 6g). В другой мыши M4346 (файл исходных данных для рис.6e), мы продемонстрировали, что иссечение произошло в основном в Gag до 3’LTR, потому что соотношение Pol / LTR составляет 38,4%, а Gag / LTR — 89,5%. Таким образом, эффективность удаления оценивается в 61,6% в 5’LTR к Gag и 10,5% в Gag к 3’LTR. Тем не менее, наличие 2 LTR в неразрезанной провирусной ДНК ВИЧ не учитывалось для упрощения оценки.
РНКскоп
Вирусная РНК была обнаружена в виде отдельных коричневых точек или кластеров точек в парафиновых срезах ткани селезенки и лимфатических узлов толщиной 5 мкм с использованием антисмыслового зонда V-HIV1-Clade-B (кат. № 416111), нацеленного на 854–8291 п.н. ВИЧ-1 NL4–3 65 .Человеческую пептидилпролилизомеразу B (PPIB) использовали в качестве положительного контроля для анализируемой ткани селезенки (изображения получали при 40-кратном увеличении). Все реагенты поставляются компанией Advanced Cellular Diagnostics, Ньюарк, Калифорния.
Выделение вируса
PBMC, полученные из лейкопаков от серонегативных доноров ВИЧ-1,2, стимулировали PHA и IL-2 и совместно культивировали с клетками костного мозга или селезенки человека, выделенными из 3 групп мышей CD34 + HSC-NSG, которые включали ВИЧ-1 инфицированных, инфицированных и получавших LASER ART, и мышей, получавших LASER ART и AAV 9 -CRISPR-Cas9.PBMC использовали в анализах после 3-дневной обработки, поддерживаемой в 10% RPMI с 30 ед. / Мл IL-2, затем культивировали совместно с человеческим костным мозгом или клетками селезенки в концентрациях (1: 5) 66,67,68 . Клетки собирали через восемь дней на ДНК (А) и РНК (В) ВИЧ-1, используя полувложенный анализ кПЦР в реальном времени, и надосадочные жидкости анализировали на активность обратной транскриптазы в течение периода до 14 дней. Данные выражены в виде общего количества копий ДНК (А) или РНК (В) ВИЧ-1/10 6 CD45 + клеток человека. Одно из двух животных, получавших двойное лечение, было протестировано и подтверждено вирусной стерилизацией.Спасение от вирусов наблюдалось и в других испытанных группах животных.
Адаптивные переносы
Спленоциты и клетки костного мозга (8–10 × 10 6 ) были собраны во время умерщвления от мышей NSG-hu, которые были ВИЧ-1 ADA , инфицированные LASER ART и AAV и без них. 9 -CRISPR-Cas9. Клетки адоптивно переносили необработанным 18-недельным мышам CD34 + HSC-NSG. Подсчет клеток и тесты на жизнеспособность определялись как по трипановому синему, так и по окрашиванию живых / мертвых клеток на автоматическом счетчике клеток TC-20 (Bio-Rad).Клетки вводили мышам внутрибрюшинно и наблюдали в течение дополнительных 4 недель. Эти эксперименты проводились для перекрестной проверки искоренения вирусной инфекции, которая могла произойти из латентных резервуаров и не обнаруживалась ни с помощью количественной ПЦР, ни РНКскопа, ни ддПЦР. Вирусную нагрузку измеряли в образцах крови адоптивно перенесенных мышей с использованием автоматизированной системы COBAS Ampliprep System V2.0 / Taqman-48 и параллельно записывали профили иммунных клеток (CD4 и CD8 + Т-клетки с помощью проточной цитометрии). Остаточный вирус из всех тканей гуманизированных мышей исследовали с помощью анализов qPCR и ddPCR.Вирус не был обнаружен в плазме или тканях двух усыновленных животных (мыши M3319 и M3336).
Анализы вне мишени
Клетки TZM-bl помещали в 6-луночные планшеты по 1 × 10 5 клеток / лунку и котрансфицировали с использованием реагента Lipofectamine 2000 (Invitrogen) с 1 мкг контроля pX601-AAV-CMV: NLS-SaCas9-NLS-3xHA-bGHpA; U6 :: Bsa1-sgRNA (Addgene catalogue # 61591) или 1 мкг плазмиды pX601-LTR1-GagD (20) вместе с 0,2 мкг pKLV-U6gRNA (Bbs1) -PGKpuro каталог № 50946) для получения маркера селекции пуромицина.На следующий день клетки переносили в чашки диаметром 100 мм и культивировали в присутствии пуромицина (Sigma) в концентрации 1 мкг / мл. Через две недели выжившие клоны выделяли с помощью цилиндров для клонирования (Corning, Corning, NY, USA). Геномную ДНК получали из каждого клона отдельной клетки и ПЦР, специфичные для LTR, с последующей очисткой в геле; Было выполнено клонирование ТА и секвенирование по Сэнгеру. Клоны, показывающие наличие индуцированных CRISPR-Cas9 на мишени мутаций InDel в целевом сайте LTR 1 в интегрированной последовательности LTR ВИЧ-1 ( n = 6), вместе с двумя контрольными клонами были отобраны для дальнейшего in vitro анализа вне мишени.Список потенциальных сайтов-мишеней OFF в геноме человека для ВИЧ-1-мишени LTR 1 и GagD был создан с использованием инструмента разработки Benchling CRISPR (https://benchling.com/, дополнительная таблица 2). Всего было выбрано три потенциальных ВЫКЛЮЧЕННЫХ целевых сайта (наивысший результат плюс два верхних специфичных для гена потенциальных вне целевых сайтов, см. Дополнительную таблицу 2, выделенную желтым цветом) для скрининга на основе ПЦР в выбранных клонах отдельных клеток. Потенциальные области мишеней OFF были амплифицированы с помощью ПЦР, клонированы в вектор TA и выполнено секвенирование по Сэнгеру (3–6 последовательностей / клон одной клетки / одна мишень OFF) (дополнительная таблица 3).
Анализ генетической изменчивости среди трех обработок был выполнен с помощью секвенирования следующего поколения (с помощью средства Novogen NGS) и инструментов биоинформатики для четырех образцов животных, одного животного из LASER ART, одного животного из CRISPR-Cas9- и двух нет- рикошетные животные из групп LASER ART / CRISPR-Cas9. Основная цель заключалась в обнаружении возможных сайтов, нецелевых для CRISPR-Cas9. Помимо этого, для этих четырех животных были проанализированы некоторые генетические вариации, такие как однонуклеотидные полиморфизмы (SNP), вставки-делеции (InDels), структурные варианты (SV) и варианты числа копий (CNV); и результаты представлены в дополнительных таблицах 4–5.После этапа тщательного контроля качества полученные короткие считывания с парными концами были сопоставлены с эталонным геномом человека (Human_G1K_V37) с использованием алгоритма выравнивания Берроуза-Уиллера (BWA). Для животных M4356 (CRISPR-Cas9), M4348 и M4349 (LASER ART + CRISPR-Cas9) и M3539 (LASER ART) 8 покрытий составили 92,01%, 91,97%, 92,01% и 91,92%, в то время как Глубина секвенирования составляла 36,08, 63,11, 45,22 и 15,41 соответственно.
Эффективность удаления и иерархическая кластеризация
Эффективность удаления для каждого животного, ткани и сегмента гена ВИЧ-1 рассчитывалась как отношение количества продукта ПЦР, подтвержденного секвенированием, ко всем членам в каждой группе с обозначенными экспериментальными условиями ( я.е. лечения, клетки и ткани, показанные на фиг. 3, 4, 5, 6 и дополнительный рис. 4). Определяется таким образом, что эффективность удаления можно рассматривать как частотные вероятности, то есть отношение частоты появления интересующего события к общему количеству экспериментальных повторов. Такая интерпретация эффективности удаления дает пользователю прогностическую ценность, так как ее можно использовать для установки предварительного ожидания в отношении вероятности успеха каждого лечения (LASER ART, CRISPR-Cas9 и LASER ART плюс CRISPR-Cas9) при удалении желаемого сегментов гена ВИЧ-1 в исследуемых тканях и в дальнейшем связать это с вероятностью излечения.Иерархическая кластеризация проводилась для значений эффективности событий усечения при различных обработках и для разных животных, тканей и сегментов гена ВИЧ-1. После того, как эффективности вырезания были рассчитаны при различных комбинациях экспериментальных условий, была использована схема иерархической кластеризации для группирования значений эффективности в многоуровневое кластерное дерево, представленное дендрограммой. Эта тепловая карта с иерархической кластеризацией может предложить возможность прогнозирования элиминации вируса.Биоинформатический анализ данных о последовательности генома человека выявил участки генома человека, которые могут служить нецелевыми для гРНК, предназначенных для редактирования ДНК ВИЧ-1. Соответствующие значения эффективности были перечислены в таблице тепловой карты, чтобы кластеры можно было визуально обнаружить. С этой целью были рассмотрены три комбинации: i) вероятность удаления различных сегментов ВИЧ-1 в 6 различных тканях животных, подвергающихся антиретровирусной терапии, редактированию, опосредованному CRISPR-Cas9, и комбинированному лечению; ii) вероятности удаления различных сегментов у разных животных при трех обработках; и iii) вероятности наблюдения по крайней мере одной положительной полосы для каждой указанной ткани у всех животных.Кластеры дополнительных инжиров. 10–16 также включают дополнительные условия излечения и данные количественной ПЦР, чтобы определить, какие животные испытали полное выздоровление и максимальное уничтожение вирусного генома.
Одобрение исследования
Все экспериментальные протоколы с использованием лабораторных животных были одобрены Комитетом по уходу и использованию животных (IACUC) Медицинского центра Университета Небраски (UNMC), обеспечивающим этичный уход и использование лабораторных животных в экспериментальных исследованиях. Клетки крови человека были выделены с помощью лейкафереза от доноров, серонегативных по ВИЧ-1/2 и гепатиту, и считались освобожденными от утверждения Советом по институциональному надзору (IRB) UNMC.Человеческие CD34 + гемопоэтические стволовые клетки были выделены из печени плода и пуповинной крови человека и не подлежат утверждению UNMC IRB.
Статистика
Данные были проанализированы с использованием программного обеспечения GraphPad Prism 7.0 (La Jolla, CA) и представлены как среднее значение ± стандартная ошибка среднего (SEM). Эксперименты проводились с использованием минимум трех биологически различных повторов. Размеры выборки не были основаны на анализе мощности, поскольку эффективность элиминации ВИЧ-1 не была известна и не могла быть спрогнозирована.Для сравнения двух групп использовался тест Стьюдента t (двусторонний). Уровни лекарственного средства в тканях, активность ОТ ВИЧ-1, окрашивание антигена ВИЧ-1p24, популяции Т-клеток, вирусная РНК и ДНК, а также вирусная нагрузка были проанализированы с помощью однофакторного дисперсионного анализа с поправкой Бонферрони для множественных сравнений. Для исследований с множественными временными точками были выполнены двухфакторный факторный дисперсионный анализ и апостериорные тесты Бонферрони для множественных сравнений. Крайние выбросы, превышающие 99% доверительный интервал среднего и в 3 раза превышающие SEM, были исключены.Значимые различия были определены при P < 0,05.
Краткое изложение отчета
Дополнительная информация о дизайне исследования доступна в Резюме отчета по исследованию природы, связанном с этой статьей.
Ложноотрицательные подтверждающие тесты на ВИЧ у детей часто появляются после начала АРТ
Ложноотрицательные экспресс-тесты на антитела, при отсутствии вирусологического тестирования в возрасте 18 лет месяцев у детей, получающих антиретровирусное лечение, могут прерывание лечения, ложноотрицательные результаты возникают при высоком частота, согласно результатам исследования, проведенного в Лесото, опубликовано в предварительном онлайн-издании AIDS .
Шестьдесят процент детей с отрицательным или несогласованным подтверждением после 18 месяцев экспресс-тесты на ВИЧ были окончательно положительными с помощью ПЦР ДНК на ВИЧ, в то время как только 4% были окончательно положительными. отрицательно, как сообщают Гарсиа-Пратс и его коллеги в ретроспективном обзоре стандартные программные данные из клиники ВИЧ в Масеру, Лесото.
Запуск АРТ в раннем возрасте (до девяти месяцев) в значительной степени ассоциировалась с ложноотрицательный или противоречивый результат экспресс-теста (OR = 4,25, p = 0,002). 94% (46/49) этих детей с отрицательным Результат были на АРТ.
Глоссарий
Полимеразная цепная реакция (ПЦР)
Метод усиления фрагментов генетического материала для их обнаружения. Некоторые тесты на вирусную нагрузку основаны на этом методе.
Иммуноферментный анализ (ИФА)
Диагностический тест, в котором сигнал, производимый ферментативной реакцией, используется для обнаружения и количественной оценки количества определенного вещества в растворе. Может использоваться для обнаружения антител к ВИЧ, антигену p24 или другим веществам.
ложноотрицательный
Когда у человека есть заболевание, но диагностировано его отсутствие.
дискордантный
Серодискордантная пара — это пара, в которой один партнер имеет ВИЧ, а другой — нет. Многим не нравится это слово, поскольку оно подразумевает несогласие или конфликт. Альтернативные термины включают смешанный статус, магнитный или серодифференциальный.
В исследуя проблемы подтверждающего тестирования на ВИЧ после 18 месяцев, авторы выделить это частое явление ложноотрицательных экспресс-тестов, которые могут привести к к ненадлежащему прерыванию лечения у детей с ВИЧ, что потенциально может привести к прогрессированию заболевания и развитию резистентности.
В в условиях высокой распространенности ВИЧ (более 5%) стратегия серийного тестирования с двумя тестами рекомендуется для диагностики ВИЧ.
В условия с ограниченными ресурсами, диагностика ВИЧ у взрослых и детей старше Возраст 18 месяцев основан на двух положительных тестах на антитела к ВИЧ и включает быстрый тесты на антитела (RT) или иммуноферментный анализ (ELISA); тесты на антитела.
Среди младенцы, риски передачи ВИЧ при грудном вскармливании, вместе с передачей во время беременности материнских антител, которые могут сохраняться до 18 месяцев еще больше осложняет тестирование на ВИЧ.
вирусологический тестирование с помощью ДНК-полимеразной цепной реакции (ПЦР) ВИЧ рекомендуется для подтверждения ВИЧ-инфекция в этой группе.
В нехватка ресурсов, финансовые или другие ограничения ограничивают использование PCR либо для первого теста, либо для второго подтверждающего. В первом случае, Всемирная организация здравоохранения (ВОЗ) рекомендует клинический диагноз для определения использование АРТ у младенцев в возрасте до 18 месяцев. В обоих случаях ВОЗ 2006 г. руководящие принципы рекомендуют тестирование на антитела к ВИЧ после 18 месяцев для подтверждения первоначальный диагноз.
В несмотря на эту рекомендацию, существуют скудные данные об оценке результатов после 18 лет. месячное подтверждающее тестирование среди младенцев, немедленно начинающих АРТ.
Так авторы решили взглянуть на проблемы такого тестирования среди младенцев зачислен в Детский клинический центр передового опыта Бэйлора (COE), a педиатрическая и семейная клиника ВИЧ в Масеру, Лесото.
В Лесото показатель распространенности ВИЧ среди взрослого населения составляет 23,6%, что является третьим по величине во всем мире. по оценкам, 28000 детей в возрасте до 15 лет, живущих с ВИЧ, и 14000 дети рождаются от матерей, инфицированных ВИЧ каждый год.
ВИЧ тестирование в клинике проводится в соответствии с национальными стандартами. В апреле 2006 г. программа ранней диагностики младенцев с использованием сухих пятен крови (DBS) ПЦР ДНК ВИЧ начал. Руководящие принципы позволяли проводить однократный положительный ПЦР-тест для детям до 18 месяцев и рекомендуемое тестирование на антитела после 18 лет месяцев для подтверждения.
Выводы основаны на трех иллюстративных тематических исследованиях и ретроспективной диаграмме рассмотрение. Дети включены в зачисленные с декабря 2005 г. по январь 2009 г. с подтвержденным положительным результатом ПЦР ДНК ВИЧ в младше 18 месяцев и задокументированные экспресс-тесты (RT) на ВИЧ после 18 месяцев возраст.
Определение окончательного ВИЧ-статуса определялся следующим образом:
- Окончательно ВИЧ-положительный — две положительные ПЦР или одна положительный результат ПЦР либо с положительным тестом на антитела ELISA через 18 месяцев, либо с двумя положительный результат после 18 месяцев экспресс-тестов на антитела.
- Считалось, что дети, вероятно, положительны с одним положительный результат ПЦР и противоречивые экспресс-тесты на антитела после 18 месяцев.
- Дети считались окончательно отрицательными, если они это делали не соответствуют указанным выше критериям и после проверки результатов испытаний и клинических данных.
- Дети, не соответствующие ни одному из вышеперечисленных критериев, были считается неопределенным.
Среди из 109 детей 49 (45%) имели отрицательный (22) или дискордантный (27) подтверждающие экспресс-тесты.
Двадцать из 22 детей с отрицательными подтверждающими экспресс-тестами на антитела получали АРТ. Средний возраст в начало АРТ составляло 8,0 месяцев, стандартное отклонение 3,6, диапазон 2,4–15,7 месяцев. Из этих 22 60% (9/15) с последующими ПЦР были отрицательными. Из этих девяти четыре были признаны положительными после тестирования антител к ВИЧ с помощью ИФА.
Среди 49, 29 (60%) были окончательно положительными, 17 (35%), вероятно, положительными, в то время как только два были окончательно отрицательными, а один — с неопределенным статусом.
Пока молодой возраст в начале АРТ был значительно связан с ложноотрицательными Авторы отмечают, что это проблема не только младенцев.
авторы признают, что неправильные процедуры тестирования — быстрые тесты на антитела в полевых условиях. сотрудниками, не имеющими отношения к лаборатории — возможно, способствовали их выводам, но не могут объяснить высокий уровень ложноотрицательных результатов.
Их выводы, добавляют они, вносят свой вклад в феномен серореверсии у детей, получающих эффективную АРТ, но в пределах контекст подтверждающего тестирования в условиях ограниченных ресурсов.
Серореверсия, было выдвинуто предположение, что у маленьких детей начало АРТ связано с подавление вирусной репликации в то время, когда иммунные ответы ослаблены, поэтому антигенная стимуляция снижается.
Предыдущая отчеты, отмечают авторы, показывают, что экспресс-тесты на антитела могут быть менее чувствительными чем ELISA при более низких уровнях антител, что объясняет положительный результат ELISA после отрицательного экспресс-тесты на антитела.Однако потеря определяемых антител также происходит в детей, получающих эффективную АРТ для ИФА и Вестерн-блоттинга, они Добавлять.
авторы отмечают, что АРТ не должна влиять на результаты ПЦР ДНК, однако их выводы показали детей, идентифицированных как ВИЧ-инфицированные с помощью ПЦР ДНК ВИЧ, имеющих последующие отрицательные результаты ПЦР после начала антиретровирусного лечения.
Исследования, они добавляют, показали обнаруживаемую провирусную ДНК ВИЧ, несмотря на продолжительное вирусное подавление (менее 50 копий / мл), но в большинстве из них у небольшого процента уровни провирусной ДНК ниже пределов обнаружения.Они также приводят пример ребенка с перинатальной ВИЧ-инфекцией, начавшего АРТ в десять месяцев возраст и после трех лет супрессивной АРТ имели отрицательный результат ELISA на ВИЧ, Western блоттинг и ПЦР-тестирование.
“Низкий количество копий провирусной ДНК является наиболее частым объяснением ложноотрицательных результатов. ПЦР », — заявляют они. Они предполагают, что взятие проб высушенной крови может влиять на обнаруживаемость ДНК ВИЧ в случаях, когда количество копий ДНК ВИЧ низкий из-за раннего начала антиретровирусной терапии.
Ограничения исследования включают отсутствие стандартизации тестирования после 18 месяцев. Популярный нагрузочное тестирование обычно недоступно, поэтому не было возможности показать однозначно, что ложноотрицательные результаты имели место у детей, получающих АРТ с подавленным вирусная нагрузка.
авторы добавляют, что в соответствии с рекомендациями ВОЗ 2010 г. их выводы подтверждают два вирусологических теста, если таковые имеются, для установления окончательного диагноза перед длительным периодом приема АРТ, поэтому избегайте подтверждающего тестирования после 18 месяцев.
В детям старше 18 месяцев, получающим АРТ и без подтвержденного диагноза, Авторы предполагают, что экспресс-тесты на антитела позволят поставить окончательный диагноз. в некоторых случаях, но тестирование ELISA может быть лучше, и ПЦР ДНК ВИЧ может быть использована в другие.
Однако даже если все подтверждающие тесты отрицательны, прекращение АРТ необходимо осторожность, добавляют они, и дети внимательно наблюдали и повторяли тестирование. для установления окончательного диагноза.
авторы приходят к выводу, что «существует острая необходимость в тестах на ВИЧ в пунктах оказания медицинской помощи. у детей в возрасте до 18 месяцев, что увеличивает доступ к раннему младенцу диагноз, ограничивая потребность в предполагаемом клиническом диагнозе и начальное и подтверждающее тестирование проще и быстрее… и обеспечить всем детям получить точные тесты на ВИЧ для такого диагноза, который изменит вашу жизнь.”
Лабораторные операции, обработка образцов и обращение с вирусной нагрузкой Тестирование и надзор | Журнал инфекционных болезней
Аннотация
РНКостается наиболее информативным и точным биомаркером для диагностики нагрузки вируса иммунодефицита человека 1 типа и для наблюдения за маркерами лекарственной устойчивости. Тестирование вирусной нагрузки путем амплификации нуклеиновых кислот в настоящее время является сложным и дорогостоящим тестом, который ограничивается централизованными лабораторными исследованиями.Успешное распространение централизованного тестирования на вирусную нагрузку на сельские или удаленные районы является серьезной проблемой. Новые технологии на основе нуклеиновых кислот быстро развиваются в направлении платформ, подходящих для использования в полевых условиях в условиях ограниченных ресурсов, оставляя растущий пробел для дополняющих их технологий обработки образцов. Одной из областей, в которой могут быть применены новые технологии для улучшения доступа, является сохранение и обработка клинических образцов. Новые технологии, позволяющие извлекать нуклеиновую кислоту из клинических образцов и стабилизировать ее в момент сбора образцов, могут восполнить этот пробел.Кроме того, эти технологии могут предоставить альтернативные решения по обнаружению вирусной нагрузки и надзору по сравнению с нынешней парадигмой централизованного лабораторного тестирования.
Эпидемия вируса иммунодефицита человека (ВИЧ) побудила несколько стран и организаций, как в сотрудничестве, так и индивидуально, расширить доступ к терапии в развивающихся странах. Это включало постановку задач, таких как Инициатива Всемирной организации здравоохранения (ВОЗ) 3 к 5 и «Все к 2010», или программ финансирования, таких как Глобальный фонд для борьбы со СПИДом, туберкулезом и малярией; Чрезвычайный план президента США по борьбе со СПИДом; Программа Ботсваны Маса; и Южноафриканский всеобъемлющий план профилактического лечения и ухода.Поскольку это тесно связано с доступом к терапии, были предприняты значительные усилия по внедрению лабораторного тестирования как части мониторинга эффективности лечения и последующей неудачи лечения, что отражается, в частности, в количестве лимфоцитов CD4 и нагрузочном тестировании на ВИЧ-1 и Тестирование на лекарственную устойчивость ВИЧ-1 [1–3].
Недавно были рассмотрены технологии тестирования вирусной нагрузки [2, 4]. Их можно разделить на 3 типа анализов: (1) коммерчески доступные тесты на основе нуклеиновых кислот (NAT), одобренные Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США или маркированные CE, такие как тест Roche Amplicor HIV-1 Monitor, bioMe’rieux Тест NucliSENS EasyQ System HIV-1 QT и тест Bayer Versant HIV-1 RNA bDNA; (2) внутренние или «домашние» NAT [5, 6]; и (3) тесты, не основанные на нуклеиновой кислоте, такие как тест Cavidi ExaVir Load на ВИЧ-специфическую активность обратной транскриптазы, который, как было показано, хорошо коррелирует с вирусной нагрузкой по всем классам ВИЧ-1 [7, 8], и Perkin Elmer Ultrasensitive p24 анализ обнаружения антигена, который все еще требует дальнейшей проверки [2, 4]
В настоящее время все нагрузочные тесты на ВИЧ-1 на основе NAT в развивающихся странах проводятся в централизованных учреждениях (рис. 1).Это имеет смысл, поскольку центральные лаборатории позволяют проводить тесты в оптимальных размерах партий в тщательно контролируемой среде с контролем качества (обсуждается ниже). Однако число центральных лабораторий невелико по сравнению с прогнозируемым населением, которое они должны обслуживать, и их охват ограничен пациентами, образцы которых можно эффективно собрать и доставить в лабораторию, а результаты правильно передать их поставщику медицинских услуг.
Рисунок 1.
Текущая парадигма тестирования вирусной нагрузки. Образцы сохраняются на месте оказания медицинской помощи и обычно отправляются в рамках холодовой цепи в центральную лабораторию, которая имеет оборудование для высокопроизводительной обработки образцов и тестирования амплификации нуклеиновых кислот.
Рисунок 1.
Текущая парадигма тестирования вирусной нагрузки. Образцы сохраняются на месте оказания медицинской помощи и обычно отправляются в рамках холодовой цепи в центральную лабораторию, которая имеет оборудование для высокопроизводительной обработки образцов и тестирования амплификации нуклеиновых кислот.
Попытки упростить работу централизованных лабораторий должны дополняться новыми технологиями и системами, которые расширяют зону действия лабораторных средств тестирования, позволяя собирать образцы вдали от лаборатории, позволяя проводить тестирование вирусной нагрузки в лабораториях более низкого уровня и / или перенос тестирования в пункт оказания медицинской помощи (POC). Для разных настроек потребуются разные решения.
Здесь мы представляем преимущества и проблемы расширения охвата централизованного тестирования и сосредотачиваемся на конкретных проблемах обеспечения безопасного обращения с образцами и обработки для NAT нагрузки ВИЧ-1.Мы обсуждаем технологический пробел в обработке образцов, который следует устранить в рамках решения, которое повысит универсальность текущих вариантов тестирования на вирусную нагрузку.
Централизованное нагрузочное тестирование на ВИЧ-1
Текущий лабораторный потенциал и особые требования, присущие только нагрузочному тестированию на ВИЧ-1, частично определяют выбор между централизованным тестированием, децентрализованным тестированием или комбинацией централизованного и регионального или многоуровневого тестирования в стране. Также можно принять во внимание политические решения относительно приверженности к антиретровирусному лечению, устойчивости к лекарствам ВИЧ-1 и типа тестов на вирусную нагрузку, которые необходимо выполнить.Как оценить научное обоснование таких решений, требует исследования. Например, клиническая оценка ответов или использование мониторинга количества лимфоцитов CD4 не оказались полностью полезными, и поэтому использование тестирования на вирусную нагрузку для мониторинга ответов настоятельно рекомендуется [1]. Как часто следует измерять вирусную нагрузку и какие пороговые уровни следует использовать, является частью более широкой дискуссии и связано с обсуждениями уровней тестирования [3, 4].
Текущее состояние лабораторной поддержки в Африке. Задокументированные подходы к системам обеспечения качества отражают неравномерность лабораторных систем в Африке. Различия можно увидеть в одной и той же стране, где современные справочные лаборатории сосуществуют с лабораториями с минимальными ресурсами на более низких уровнях системы здравоохранения. Существует острая необходимость в улучшении лабораторных услуг в странах Африки и между ними [9]. Реальность такова, что для создания необходимой инфраструктуры (например, лабораторных и транспортных систем; набора, обучения и удержания персонала; а также развития и поддержания систем обеспечения качества [9]) требуются ресурсы за счет различных усилий.В настоящее время правительства и / или консорциумы предпринимают различные усилия на разных уровнях для обеспечения удовлетворения потребностей в лабораторном потенциале. В их число входят Группа клинических испытаний СПИДа Национального института аллергии и инфекционных заболеваний, Национальная лабораторная служба здравоохранения (NHLS) в Южной Африке, Объединенный центр клинических исследований в Уганде и Чрезвычайный план президента США по оказанию помощи в связи со СПИДом через Центры США по лечению СПИДа. Контроль и профилактика заболеваний и партнеры.
Централизованное тестирование: лабораторные и производственные требования. С момента внедрения коммерческого тестирования на вирусную нагрузку в 1996 году произошел технологический прогресс, особенно в области автоматизации высокого уровня, которая включает в себя автономные системы, не требующие обучения на высоком уровне. Совсем недавно были предприняты шаги по предоставлению собственных альтернатив или менее технически продвинутых подходов, таких как анализ Кавиди [10, 11]. Решение о внедрении определенной технологии может быть довольно сложным процессом. Одним из преимуществ внедрения, например, технологий, одобренных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (США) или имеющих маркировку CE (Европа), является то, что существует некоторая форма прослеживаемой стандартизации по сравнению с внутренними подходами.Выбор конкретного нагрузочного теста на ВИЧ-1 также должен основываться на региональных оценках эффективности [12, 13].
Стоимость анализа вирусной нагрузки является важным фактором.
Очень подробный подход к оценке затрат был недавно представлен в случае двух анализов: тест бДНК Bayer Versant и тест Roche Amplicor PCR COBAS, выполненный с автоматической пробоподготовкой на приборе COBAS AmpliPrep в центральном учреждении в США [14 ]. Такой подробный подход важен, чтобы избежать различных ловушек при рассмотрении вопроса о внедрении передовых технологий в централизованных лабораториях.Модели затрат, разработанные Эльбейком и др. [14], включают тесты комплектов, расходные материалы, оборудование, планы обслуживания и ремонта оборудования, площадь оборудования, удаление отходов и рабочую силу. На основе этих моделей количество образцов, проверенных предприятием, имеет наибольшее влияние на стоимость каждого отчетного испытания. Минимальное количество контролей, необходимое для каждого цикла, и конфигурация набора и платформы определяют оптимальное количество образцов для каждого цикла. Стоимость каждого отчетного теста для теста bDNA и теста ПЦР снизилась с ∼ 131 до ∼ 60 и с ∼ 140 до ∼ 68, соответственно, с самыми низкими затратами для обоих тестов, что связано с использованием полных наборов за запуск [14].Центральное предприятие с высокой пропускной способностью отчетных тестов с большей вероятностью будет тестировать оптимальное количество образцов за цикл и будет иметь меньше неоптимальных циклов и, таким образом, обеспечит максимальную стоимость каждого отчетного теста. Дополнительные расходы, которые следует учитывать, включают затраты на внешний контроль качества и проверку квалификации, а также на внутренний контроль качества. Затраты не обязательно являются абсолютными и включают дифференцированное согласованное ценообразование в рамках существующих процессов закупок. Соглашения об уровне обслуживания, доступ к технической помощи и поддержке, а также управление цепочкой поставок — это другие факторы, влияющие на окончательную стоимость тестирования.
Обеспечение качества как ключ к лабораторной поддержке. Ключевым аспектом обеспечения результатов качества является разработка лабораторных систем обеспечения качества. Важная роль обеспечения качества и контроля качества в контексте внедрения новых технологий, таких как нагрузочное тестирование на ВИЧ-1 и определение числа лимфоцитов CD4 для лечения и мониторинга ВИЧ, рассматривается в другом месте [15]. Подход, описанный для тестирования на ВИЧ, аналогичен подходу, принятому при разработке мониторинга испытаний вакцины против ВИЧ, как описано в другом месте [16].Акцент в мониторинге испытаний вакцин, как в диагностическом, так и в терапевтическом, делается на разработке системных подходов для обеспечения высококачественных данных.
Для централизованного и / или регионального тестирования можно контролировать ограниченное количество лабораторий. При наличии хорошей информационной инфраструктуры можно осуществлять мониторинг внешнего обеспечения качества, проверки квалификации и внутреннего контроля качества. Например, Национальный институт инфекционных заболеваний (справочная лаборатория NHLS) в сотрудничестве с отделом контроля качества молекулярной диагностики предоставляет отчет по NHLS, в котором представлена информация о деятельности всех участвующих лабораторий NHLS.Что касается отчетности, то в настоящее время в NHLS лаборатории открывают формы разрешения и проводят анализ первопричины, если оценки ниже ожидаемых. Национальный институт инфекционных заболеваний и контроля качества молекулярной диагностики недавно приступил к реализации программы внутреннего контроля качества, которая поддерживается с помощью платформы информатики.
Потребности в персонале. Централизованное тестирование с использованием вышеупомянутых автоматизированных платформ требует персонала с высоким уровнем подготовки и опыта, хотя это требование частично снижается за счет простоты использования тестов.Тем не менее, обучение по текущему обслуживанию и ремонту является полезным дополнением, когда инструменты размещены, а техническая поддержка ограничена. В Южной Африке продолжительность обучения обычно составляет 3-4 года в техническом университете (technikon), за которым следует практическое обучение продолжительностью до 18 месяцев. В некоторых случаях требуется зарегистрироваться для практики, и объем практики относительно хорошо определен.
Отслеживание данных и образцов. Централизованное тестирование требует хорошо развитой информационной системы, чтобы гарантировать, что входящий и исходящий поток информации (например, информация о пациенте и результаты отчетов) фиксируются последовательно, и что есть возможность хранить и интегрировать информацию.Этот подход требует больших затрат как человеческих ресурсов, так и инфраструктуры и требует систем резервного копирования и обслуживания, как и лаборатории, которые проводят испытания в форме резервного питания и других требований, таких как принтеры штрих-кода и считыватели штрих-кода.
Данные могут поступать на сайты из централизованных точек тестирования в электронном виде при условии, что информационная система доступна для всех сайтов. Это требует человеческого потенциала и инфраструктуры. Альтернативный подход — доставка бумажных копий с помощью курьерских служб, которые собирают образцы.Однако должны существовать системы, обеспечивающие получение результатов как часть процесса обеспечения качества. Необходимо обеспечить взаимодействие географически удаленных лабораторий с клинической поддержкой с точки зрения доступа к результатам, интерпретации результатов и поддержки клинических проблем, таких как требования к тестированию на лекарственную устойчивость. Разработка доступных систем связи в труднодоступных районах может быть достигнута за счет использования таких инструментов, как мобильные телефоны, для обеспечения как результатов, так и технической поддержки через системы коротких сообщений.Такие системы должны быть безопасными, чтобы гарантировать конфиденциальность пациента. Последние достижения в этой области включают систему TherapyEdge (Advanced Biological Laboratories), которая в настоящее время проходит оценку в Южной Африке. Он предназначен для предоставления информации сайтам клиник через серверы, использующие технологию мобильных телефонов 3G. Цель состоит в том, чтобы интегрировать лабораторные данные как часть клинического управления в удаленных местах.
Обработка и транспортировка образцов. Централизованное и / или региональное тестирование требует, чтобы образцы, такие как цельная кровь, поступали в лабораторию своевременно, чтобы сохранялась целостность образцов и результаты предоставлялись в разумные сроки.Подходы включают использование стабилизаторов нуклеиновых кислот, размещение образцов в холодильниках, использование сухих пятен крови (DBS) и оценку схем сбора (например, многоуровневые системы сбора или прямой сбор из клиник или больниц; обсуждается ниже). Лаборатории с ограниченным временем работы могут перейти на «посменную работу», чтобы обеспечить обработку образцов для обеспечения разумного времени оборота. Такие соображения имеют очевидные последствия с точки зрения затрат на человеческий потенциал, накладных расходов на инфраструктуру и обслуживания.Тип транспорта, который необходимо использовать, включает внутреннюю транспортировку или курьерские услуги, или их комбинацию, как в случае с NHLS в Южной Африке. Важное значение имеют разработка протоколов, обучение водителей и предоставление необходимых и достаточных материалов для сбора (например, боксов-холодильников и бланков заявок). Правильное управление курьерами также требует внимания. Дополнительные соображения могут быть связаны с типом используемых транспортных средств, таких как стандартные автомобили для доставки или пикапа, или мотоциклы для труднодоступных мест, а также накладные расходы на эти услуги.
Технологии сохранения и обработки образцов и их влияние на нагрузочное тестирование на ВИЧ
Стандартные протоколы тестирования вирусной нагрузки на основе РНК требуют извлечения РНК непосредственно из плазмы. Проведение теста на вирусную нагрузку таким образом требует значительных ресурсов для правильного сбора и хранения образцов, а также разумных методов, обеспечивающих биобезопасность при работе с образцами с живым вирусом. Более простые технологии, такие как сохранение пятен фильтра на образцах, имеют большое влияние на затраты на обработку образцов (таблица 1).Основным фактором, определяющим сложность и стоимость обработки образцов, является предполагаемый целевой предел обнаружения. Достижение низкого предела обнаружения (50 копий / мл) требует обработки больших объемов образцов (≥1 мл плазмы). Это вносит сложность и затраты на ресурсы и / или реагенты на весь процесс, от сбора образцов (венепункции) и отправки образцов до экстракции РНК. Более высокий целевой предел обнаружения (> 1000 копий / мл) значительно снижает сложность и затраты на ресурсы и реагенты для сбора образца (пальчиковой палочки), транспортировки образца и экстракции РНК.
Таблица 1.
Краткое изложение текущих методов обращения с образцами вирусной РНК и их хранения для тестирования вирусной нагрузки
Таблица 1.
Краткое описание текущих методов обработки и сохранения образцов вирусной РНК для тестирования вирусной нагрузки
Сбор образцов и сохранение. Существует потребность в разработке стандартных протоколов и руководств для оценки новых технологий сбора и хранения образцов специально для нагрузочного тестирования на ВИЧ-1.Однако существует консенсус в отношении того, что плазма с ЭДТА, по сравнению с плазмой других антикоагулянтов, сывороткой или цельной кровью, является лучшим источником для бесклеточного определения вирусной РНК [17–20]. Вакутайнеры PPT (пробирки для подготовки плазмы; Beckton Dickinson) являются хорошим решением для сохранения образцов плазмы во время транспортировки [17, 21]. Цельную кровь с ЭДТА и бесклеточную плазму с ЭДТА можно хранить при комнатной температуре до 30 часов, при 4 ° C до 14 дней и при -70 ° C в течение продолжительных периодов времени без значительного снижения сигнала вирусной нагрузки. [17, 22].В одном исследовании буфер для хаотропного лизиса неэффективен против ЭДТА в плазме [23], тогда как RNAlater (Qiagen), как было показано, стабилизирует РНК ВИЧ при комнатной температуре на срок до 28 дней и обеспечивает большую степень целостности образца РНК. [24].
Использование меньших объемов крови, например, от укола пальца или пяточной палочки, если достаточно, устранит необходимость в флеботоме для сбора пробы. Высушенные пятна плазмы (DPS) или DBS широко использовались для тестов на основе ДНК, а в последнее время — для тестов на основе вирусной РНК [25, 26].Этот метод имеет ряд преимуществ, которые делают его полезным в развивающихся странах. После высыхания пятна крови или плазмы РНК остается стабильной при температуре окружающей среды в течение длительных периодов (зарегистрированное время варьировалось от 4 недель до 1 года), и вирус инактивируется [27, 28]. Было продемонстрировано, что DBS являются очень эффективной технологией сохранения образцов для диагностики ВИЧ-инфекции в младенчестве, с помощью тестирования вирусной РНК или ДНК, с незначительным влиянием на чувствительность теста [29, 30].DBS и DPS были успешно оценены для тестирования вирусной нагрузки с хорошей корреляцией между двумя методами [25, 27, 31, 32]. Пятна фильтрации обеспечивают большую гибкость при хранении и транспортировке образцов, а DBS также устраняют необходимость венепункции и отделения плазмы от клеток и требуют недорогих материалов (ланцет и фильтровальная бумага). Польза DBS и DPS для мониторинга терапии все еще не ясна [23, 33]. Эффективность экстракции РНК и воспроизводимость NAT вирусной нагрузки из пятен фильтра зависит как от протокола экстракции РНК, так и от нижестоящего NAT.Необходима дальнейшая работа для оценки и стандартизации различных комбинаций этих двух шагов. Хотя загрязнение во время удаления пятен фильтра можно предотвратить [34], этот шаг по-прежнему является значительно громоздким и трудоемким или требует дорогостоящих автоматизированных инструментов. Кроме того, поскольку текущий предел обнаружения для тестирования вирусной нагрузки с использованием DBS или DPS составляет нагрузку РНК ВИЧ-1 3 log 10 или 4 log 10 копий / мл, эта технология может нуждаться в дальнейшем улучшении для удовлетворения требований. для мониторинга терапии.
Появляются новые технологии стабилизации образцов. Две такие технологии — SampleTanker (Technology Think Tank) [52] и RNAStable (Biomatrica). Последний утверждает, что сохраняет очищенную РНК при 50 ° C до 4 месяцев. Как упоминалось выше, требуется разработка стандартных протоколов для оценки этих и других новых технологий сохранения образцов.
Экстракция РНК. Был разработан ряд методов для извлечения вирусной РНК из плазмы и отделения ее от ингибиторов, которые могут нарушить амплификацию [35].Обычно они включают (1) лизирование виронов и денатурирующих белков, (2) адсорбцию РНК на твердой фазе, (3) удаление интерферентов и (4) десорбцию РНК из твердой фазы. В случае образцов плазмы лизирование и денатурация проводится с помощью хаотропных агентов, таких как тиоцианат гуанидина; детергенты, такие как Triton X-100 или Tween 20; и протеолитический фермент протеиназа K. Альтернативно, когда плазма или цельная кровь сушат на фильтровальной бумаге 903, РНК высвобождается и защищается от РНКаз [31].
Поверхности из твердых частиц кремнезема широко используются для адсорбции РНК в присутствии спирта, что снижает ее растворимость.Разделение осуществляется либо проточными колонками, заполненными твердыми частицами кремнезема [36, 37], либо магнитным способом путем покрытия парамагнитных частиц поверхностями кремнезема [38, 39]. С другой стороны, было показано, что заряженные поверхности эффективно адсорбируют РНК без использования спирта [40, 41]. После адсорбции РНК частицы промывают серией буферов для удаления мешающих веществ. Если на начальном этапе используется спирт, его также необходимо удалить испарением, поскольку он является очень сильным ингибитором полимераз.Для поверхностей из диоксида кремния РНК высвобождается за счет снижения ионной силы буфера, а заряженные поверхности отключаются путем изменения pH буфера.
Извлечение РНК из плазмы — ресурсоемкий процесс, требующий специального оборудования, одноразовых реагентов и обучения. Анализ затрат на проведение тестирования вирусной нагрузки с коммерческими наборами и собственными тестами показал, что на подготовку образца уходит 65–81% трудозатрат, необходимых для выполнения теста, и 60–75% стоимости расходных материалов (выше стоимости наборов) ) [6, 14, 42].Кроме того, для имеющихся в продаже наборов требуется значительное количество расходных материалов и инструментов, помимо тех, что входят в комплект. Управление потребностями в рабочей силе и логистикой закупок для экстракции РНК в условиях со средней и плохой лабораторной инфраструктурой становится серьезным препятствием для внедрения нагрузочного тестирования на ВИЧ-1.
Обработка и стабилизация образцов POC
Требования к холодовой цепи при транспортировке образцов вирусов, а также технические и ресурсные требования для экстракции нуклеиновых кислот являются одними из нескольких препятствий на пути расширения охвата NAT на удаленные страны с ограниченными ресурсами.Более простые и недорогие технологии обработки образцов, которые могут «подключать и играть» в существующие и новые NAT, подходящие для условий с ограниченными ресурсами и одновременно стабилизирующие вирусную нуклеиновую кислоту, могут устранить некоторые из этих препятствий.
Доступная по цене, простая в использовании технология обработки проб POC может распределять труд, необходимый для обработки проб, от высококвалифицированных лаборантов до поставщиков медицинских услуг, которые, как правило, получают более низкую заработную плату. Кроме того, такое распределение рабочей нагрузки для лабораторий среднего уровня в сочетании с появляющимися низко требующими ресурсов NAT, такими как петлевые платформы изотермической амплификации [43], может облегчить их способность определять нагрузку ВИЧ-1 (рис. 2A). .
Рисунок 2.
Добавленная гибкость к существующим системам тестирования вирусной нагрузки за счет недорогой, простой в использовании технологии извлечения и стабилизации РНК. Такая технология могла бы расширить возможности лабораторий второго уровня для проведения тестов на вирусную нагрузку (A) или для использования в новых диагностических средствах на основе нуклеиновых кислот (B) в местах оказания медицинской помощи.
Рисунок 2.
Добавленная гибкость к существующим системам тестирования вирусной нагрузки за счет недорогой, простой в использовании технологии извлечения и стабилизации РНК.Такая технология могла бы расширить возможности лабораторий второго уровня для проведения тестов на вирусную нагрузку (A) или для использования в новых диагностических средствах на основе нуклеиновых кислот (B) в местах оказания медицинской помощи.
Несколько исследовательских групп и частных предприятий разрабатывают технологии нуклеиновых кислот POC, некоторые из которых описаны в этом приложении. Некоторые платформы являются законченными в том, что они предоставляют решение для обработки образцов в POC, тогда как другие предлагают только амплификацию и обнаружение нуклеиновых кислот.Технология обработки образцов POC может быть интегрирована с различными платформами POC, чтобы обеспечить полное решение (рис. 2B). Технология обработки образцов POC может также расширить возможности наблюдения, предоставив стабилизированную нуклеиновую кислоту (рис. 2A и 2B). Важно то, что технология обработки образцов должна способствовать предоставлению широкого предложения универсальных технологических решений, чтобы помочь тестируемым пользователям принять решения, наилучшим образом отвечающие их потребностям.
Желаемые технические характеристики
Технические характеристики недорогого теста на вирусную нагрузку описаны в другом месте [1].Мы описываем характеристики продукта для технологии обработки образцов POC, которая извлекает РНК из клинического образца в момент сбора образца и стабилизирует РНК для нагрузочного тестирования и надзора на ВИЧ-1 (Таблица 2). Основные характеристики продукта определяются приемлемостью продукта для конечных пользователей и разработчиков NAT, а также стоимостью производства. Интегрированное устройство обработки проб, содержащее все реагенты, может быть более приемлемым для пользователей, но затраты на производство могут быть непомерно высокими.
Таблица 2.
Технические характеристики интегрированной технологии обработки одноразовых проб
Таблица 2.
Технические характеристики интегрированной технологии обработки одноразовых проб
В таблице 1 представлены характеристики продукта для двух потенциальных технологий. Вариант A (оптимальный и надзорный) должен соответствовать спецификациям продукта для клинических исследований вирусной нагрузки, как для мониторинга ответа на терапию, так и для диагностики в младенчестве, а также для приложений эпиднадзора и мониторинга испытаний вакцин.Вариант B (минимальные клинические требования) будет иметь предел обнаружения ниже стандартных протоколов тестирования вирусной нагрузки, но будет предлагать значительно упрощенный сбор образцов. Вариант B более ограничен в последующих приложениях, но потенциально значительно дешевле по сравнению с вариантом A. Истинную целевую цену определить нетривиально, и она должна быть основана на подробных операционных исследованиях и анализе затрат на текущую практику, как это предлагается в «Future Research». ” В отсутствие подробного анализа цен и затрат мы предлагаем целевую цену в таблице 2, которая основана на текущих ценах на коммерчески доступные наборы для экстракции РНК.Мы ожидаем, что продукт, предлагаемый по этой цене, приведет к экономии, поскольку для проведения экстракции не потребуются дополнительные расходные материалы и реагенты; они предназначены для коммерчески доступных наборов для экстракции РНК. Мы также ожидаем, что экономия средств будет достигнута за счет обеспечения логистической гибкости систем тестирования (позволяющей дозировать образцы), а также за счет сокращения трудозатрат, необходимых для извлечения РНК, и переноса этого труда из лаборатории на пункт сбора образцов. Сложнее предсказать финансовые последствия улучшения логистики и затрат на рабочую силу.
Rouet and Rouzioux [3] предложили трехуровневый подход для решения задач тестирования вирусной нагрузки. Каждый уровень направлен на разные потребности в тестировании и имеет панель типов тестов, которые подходят для выполнения этой задачи. Предложение разнообразных решений для удовлетворения конкретных потребностей в различных настройках будет иметь важное значение при создании оптимальных систем тестирования.
Другое применение
Универсальная и модульная технология обработки образцов может облегчить распространение эпиднадзора и молекулярной диагностики на удаленные настройки для нескольких ключевых патогенов.РНК-вирусы являются виновниками нескольких инфекционных заболеваний, которые представляют собой серьезное бремя для здоровья во всем мире (например, гриппа, гепатита С и ВИЧ-инфекции). В отношении большинства этих патогенов, помимо диагностической потребности, существует острая потребность общественного здравоохранения в надзоре путем дальнейшего анализа образцов с точки зрения типирования вирусов и мониторинга маркеров лекарственной устойчивости [44–46]. В частности, для ВИЧ-1 и вирусная РНК, и ДНК необходимы для идентификации циркулирующих маркеров антиретровирусной устойчивости [47, 48].
Дальнейшие исследования
Приемлемость методов пробоподготовки, которые ставят под угрозу чувствительность ради стоимости и простоты использования, в значительной степени зависит от клинически значимых пределов обнаружения. Возможно, не следует жертвовать доступом к тестированию за счет увеличения производительности, выходящей за рамки клинических потребностей конкретной обстановки. Четкие рекомендации относительно клинически значимых пределов обнаружения для каждого конкретного приложения помогут в разработке новых технологий, соответствующих критериям, по разумной цене.
Elbeik et al [14, 42] проводят тщательный анализ затрат на тестирование в регионах с высоким и средним доходом. Аналогичные анализы необходимы для существующих систем тестирования вирусной нагрузки в странах с низким уровнем дохода. При оценке стоимости систем тестирования вирусной нагрузки следует принимать во внимание значительную потерю успешных результатов тестирования из-за потери образцов, потери результатов теста и потери для последующего наблюдения [49–51]. Расширение анализа для исследования сбора, транспортировки и хранения образцов, а также эффективности, с которой результаты правильно передаются обратно пациенту, поможет выявить возможности для улучшения системы тестирования в целом, а не только лабораторного компонента.Также было бы полезно смоделировать влияние потенциальных решений, таких как включение тестирования вирусной нагрузки в лабораториях нижнего уровня, перенос обработки образцов в точку сбора образцов или использование полностью интегрированного теста на вирусную нагрузку POC. Эти модели должны включать стоимость внедрения соответствующих процессов обеспечения качества на этом уровне. Определение того, окажут ли эти улучшения благоприятное воздействие и по какой цене, поможет направить усилия по разработке технологий для их облегчения.Альтернативный подход, который в настоящее время изучается в Южной Африке, — это использование высококлассной лабораторной установки для загрузки ВИЧ-1 и связанного тестирования в переделанных мобильных контейнерах, которые можно доставить в периферийные регионы. Лаборатории связаны с центральной лабораторией с точки зрения связи и мониторинга. Осуществимость и устойчивость такого подхода заслуживают рассмотрения.
Список литературы
1.« и др.Мониторинг вирусной нагрузки ВИЧ в регионах с ограниченными ресурсами: необязательно или необходимо?
,Clin Infect Dis
,2007
, т.44
1
(стр.128
—134
) 2.,,, Et al.Анализ вирусной нагрузки ВИЧ-1 в условиях ограниченных ресурсов
,PLoS Med
,2006
, vol.3
10
стр.e417
3.,.Стоимость тестирования на вирусную нагрузку ВИЧ-1 в развивающихся странах: что нового?
,Эксперт Рев Мол Диаг
,2007
, т.7
6
(стр.703
—707
) 4.,.Измерение вирусной нагрузки ВИЧ-1 в условиях ограниченных ресурсов: как и где?
,Clin Lab
,2007
, т.53
3–4
(стр.135
—148
) 5.,,, Et al.Сверхчувствительный мониторинг вирусной нагрузки ВИЧ-1 с помощью недорогого ПЦР-анализа с обратной транскрипцией в реальном времени с внутренним контролем для домена длинных 5′-концевых повторов
,Clin Chem
,2006
, vol.52
7
(стр.1258
—1266
) 6.,,, Et al.Перенос и оценка автоматизированного недорогого ПЦР-теста с обратной транскрипцией в реальном времени для диагностики и мониторинга инфекции вируса иммунодефицита человека типа 1 в условиях ограниченных ресурсов Западной Африки
,J Clin Microbiol
,2005
, т.43
6
(стр.2709
—2717
) 7.,,, Et al.Оценка недорогого анализа обратной транскриптазы для мониторинга вирусной нагрузки ВИЧ-1 в плазме
,Curr HIV Res
,2005
, vol.3
2
(стр.183
—190
) 8.,,, Et al.Активность обратной транскриптазы для количественного определения ВИЧ-1 подтипа C в плазме: отношение к количеству копий РНК и количеству Т-лимфоцитов CD4
,J Med Virol
,2006
, vol.78
2
(стр.161
—168
) 9.,,,,.Лабораторная медицина в Африке: барьер на пути к эффективному здравоохранению
,Clin Infect Dis
,2006
, vol.42
3
(стр.377
—382
) 10.,,, Et al.Сравнение двух тестов суррогатной РНК вируса иммунодефицита человека (ВИЧ) со стандартным анализом РНК ВИЧ
,J Clin Microbiol
,2005
, vol.43
12
(стр.5950
—5956
) 11.,,,,.Оценка двух коммерчески доступных недорогих альтернативных анализов, используемых для оценки вирусной нагрузки в когорте пациентов, инфицированных вирусом иммунодефицита человека типа 1 подтипа C, из Южной Африки
,J Clin Microbiol
,2005
, vol.43
2
(стр.857
—861
) 12.,,, Et al.Частота и причины неудач коммерческих анализов вирусной нагрузки вируса иммунодефицита человека типа 1 в Бразилии
,J Clin Microbiol
,2007
, vol.45
6
(стр.2061
—2063
) 13.,,, Et al.Влияние генетического разнообразия ВИЧ-1 на плазму. Количественная оценка РНК ВИЧ-1: полезность Национального агентства исследований SIDA. Полимеразная цепная реакция на основе длинных концевых повторов второго поколения на основе обратной транскриптазы в реальном времени.
,Syndr
,2007
, т.45
4
(стр.380
—388
) 14.,,,.Модели затрат на вирусную нагрузку ВИЧ-1 и ВГС для бДНК: 440 Молекулярная система в сравнении с ПЦР в реальном времени Тест AmpliPrep / TaqMan
,Expert Rev Mol Diagn
,2007
, vol.7
6
(стр.723
—753
) 15.Форум по совместным исследованиям ВИЧ
,Обеспечение / контроль качества тестов на CD4 и вирусную нагрузку в условиях ограниченных ресурсов
,2003
16.,,,.Расширение лаборатории до крупномасштабных международных испытаний вакцины для профилактики ВИЧ
,Curr Opin HIV AIDS
,2007
, vol.2
3
(стр.201
—206
) 17.,,, Et al.Влияние условий сбора, обработки и хранения образцов на стабильность уровней РНК вируса иммунодефицита человека типа 1 в плазме
,J Clin Microbiol
,1997
, vol.35
11
(стр.2886
—2893
) 18.,,, Et al.Определение уровней РНК вируса иммунодефицита человека типа 1 в плазме: переоценка параметров, влияющих на результат анализа TUBE Meeting Workshop Участники семинара Использование технологий для оценки и стандартизации крови на ВИЧ-1 в педиатрии
,J Clin Microbiol
,1998
, vol.36
6
(стр.1471
—1479
) 19 ..Количественное определение нагрузки ВИЧ-1: 17-летняя перспектива
,J Infect Dis
,2006
, vol.194
Дополнение 1
(стр.S38
—S44
) 20.,,, Et al.Сравнительная стабильность количественной РНК вируса иммунодефицита человека в плазме образцов, собранных в пробирки VACUTAINER CPT, VACUTAINER PPT и стандартные пробирки VACUTAINER
,J Clin Microbiol
,1995
, vol.33
6
(стр.1562
—1566
) 21.,,,.Стабильность нагрузки вируса иммунодефицита человека в плазме крови в пробирках с препаратом плазмы VACUTAINER PPT при транспортировке в течение ночи
,J Clin Microbiol
,2000
, vol.38
1
(стр.323
—326
) 22.,,.Стабильность нуклеиновых кислот HCV, ВИЧ-1 и HBV в образцах плазмы при длительном хранении
,Biologicals
,2005
, vol.33
1
(стр.9
—16
) 23.,,, Et al.Использование высушенных пятен цельной крови, плазмы и материнского молока, собранных на фильтровальной бумаге, для измерения бремени вируса иммунодефицита человека типа 1
,J Clin Microbiol
,2007
, vol.45
3
3
(стр.891
—896
) 24.,,,.Стабилизированные вирусные нуклеиновые кислоты в плазме как альтернативный способ доставки для NAT
,Transfusion
,2002
, vol.42
4
(стр.409
—413
) 25.,,, Et al.Количественное определение РНК вируса иммунодефицита человека типа 1 из пятен высушенной плазмы, собранных на фильтровальной бумаге
,J Clin Microbiol
,1997
, vol.35
11
(стр.2795
—2801
) 26.,,,,.Обнаружение РНК вируса кори в цельной крови, хранящейся на фильтровальной бумаге
,J Med Virol
,2002
, vol.67
4
(стр.596
—602
) 27.,,, И др.Многоцентровая оценка использования образцов сухой крови и пятен плазмы в количественных анализах РНК вируса иммунодефицита человека: измерение, точность и стабильность РНК
,J Clin Microbiol
,2003
, vol.41
5
(стр.1888
—1893
) 28.,,,,,.Использование сухих пятен цельной крови для количественного определения РНК ВИЧ-1
,AIDS
,1999
, vol.13
5
(стр.630
—631
) 29.,,,,.Сухие пятна крови улучшают доступ к диагностике ВИЧ и уходу за младенцами в условиях ограниченных ресурсов
,J Acquir Immune Defic Syndr
,2005
, vol.38
5
(стр.615
—617
) 30.,,, Et al.Экспресс-скрининг для раннего выявления передачи вируса иммунодефицита человека типа 1 от матери ребенку
,J Clin Microbiol
,1994
, vol.32
11
(стр.2641
—2645
) 31.,,,,.Количественное определение РНК вируса иммунодефицита человека типа 1 в плазме с использованием крови, высушенной на фильтровальной бумаге
,J Clin Microbiol
,1998
, vol.36
1
(стр.258
—260
) 32.,,, Et al.Цельная кровь по сравнению с пятнами плазмы для измерения вирусной нагрузки ВИЧ-1 у ВИЧ-инфицированных африканских пациентов
,Lancet
,2003
, vol.362
9401
(стр.2067
—2068
) 33.,,.Оценка использования высушенных пятен и различных условий хранения плазмы для количественного определения РНК ВИЧ-1.
,HIV Med
,2007
, vol.8
6
(стр.396
—400
) 34.,,,,.Низкий риск заражения при автоматизированном и ручном удалении сухих пятен крови для ПЦР ДНК ВИЧ в рутинной лаборатории
,J Virol Methods
,2007
, vol.146
1–2
(стр.397
—400
) 35.,,.Подготовка образцов: задача при разработке анализов на основе нуклеиновых кислот в местах оказания медицинской помощи для условий с ограниченными ресурсами
,Analyst
,2007
, vol.132
(стр.1193
—1199
) 36.,,,,,.Быстрый и простой метод очистки нуклеиновых кислот
,J Clin Microbiol
,1990
, vol.28
3
(стр.495
—503
) 38.Ambion / Applied Biosystems
,Выделение вирусной РНК MagMAX
,2008
40.Cortex Biochem / Promega
,Выделение нуклеиновых кислот MagaZorb.
,2008
41.Invitrogen
,ChargeSwitch Технология очистки нуклеиновых кислот
,2008
42.,,,,,.Моделирование глобальной стоимости анализов вирусной нагрузки ВИЧ-1 и ВГС
,Expert Rev Pharmacoecon Outcomes Res
,2003
, vol.3
(стр.383
—407
) 43.,,, Et al.Оперативная возможность использования петлевой изотермической амплификации для диагностики туберкулеза легких в микроскопических центрах развивающихся стран
,J Clin Microbiol
,2007
, vol.45
6
(стр.1936
—1940
) 44.Консенсусное заявление NIH по ведению гепатита C: 2002
,NIH Consens State Sci Statements
,2002
, vol.19
3
(стр.1
—46
) 45.Глобальное бремя болезней (ГББ) гепатита C
,J Clin Pharmacol
,2004
, vol.44
1
(стр.20
—29
) 46 ..Глобальная программа по гриппу. Консультация специалиста по диагностике инфекции птичьего гриппа H5N1 у людей
,Грипп, другие респираторные вирусы
,2007
, vol.1
(стр.131
—138
) 47., , , и другие.Как секвенирование клеточной ДНК вируса иммунодефицита человека, так и секвенирование РНК плазмы можно использовать для обнаружения мутаций лекарственной устойчивости в образцах крови пациентов, ранее не принимавших тиретровирусные препараты.
,J Clin Microbiol
,2007
, vol.45
6
(стр.1783
—1788
) 48.,,, Et al.Возможность выявления лекарственной устойчивости вируса иммунодефицита человека типа 1 в ДНК, выделенной из цельной крови или сухих пятен крови
,J Clin Microbiol
,2007
, vol.45
10
(стр.3342
—3351
) 49.,,, Et al.Использование автобусов для перевозки образцов мокроты в Центральную справочную лабораторию: влияние на рутинную службу посева туберкулеза в Малави
,Int J Tuberc Lung Dis
,2004
, vol.8
2
(стр.204
—210
) 50.,,,.Забытые для последующего наблюдения: способствующие факторы и проблемы у южноафриканских пациентов, получающих антиретровирусную терапию
,S Afr Med J
,2007
, vol.97
9
(стр.853
—857
) 51.,,, Et al.Истинные результаты для пациентов, получающих антиретровирусную терапию, которые «потеряны для последующего наблюдения» в Малави
,Bull World Health Organ
,2007
, vol.85
7
(стр.550
—554
) 52.,,, Et al.Транспорт сухой плазмы с использованием новой матрицы и системы сбора для вирусологического тестирования вируса иммунодефицита человека и вируса гепатита С
,J Clin Microbiol
,2009
, vol.47
5
(стр.1491
—1496
)Заметки автора
© 2010 Американского общества инфекционистов
.