Нобелевская премия по физиологии и медицине — 2019

В этом году Нобелевской премии в области физиологии и медицины удостоены американцы Уильям Кэлин и Грегг Семенза, а также британец Питер Рэтклифф. В 2016 году работы этих исследователей уже получили оценку в виде другой престижной награды — премии Альберта Ласкера, ежегодно присуждаемой в США за фундаментальные медицинские исследования. Согласно официальной формулировке Нобелевского комитета, лауреаты отмечены «за открытие механизмов, посредством которых клетки воспринимают доступность кислорода и адаптируются к ней».
Следует отметить, что в действительности речь идет не о любых клетках, а в первую очередь о клетках человека и животных. Пожалуй, отправным пунктом исследований в области адаптации к гипоксии можно считать период конца 60-х годов XX века, когда физиологи приступили к внимательному изучению реакций организма человека на подъем в горы или анемические состояния. Эти исследования привели к открытию эритропоэтина — гормона, который выделяется в кровь (преимущественно тканями почек, а также печени), причем продукция его резко возрастает в ответ на дефицит кислорода.
Распространяясь по организму, и достигая костного мозга, эритропоэтин стимулирует формирование эритроцитов, что обеспечивает значительное улучшение снабжения тканей кислородом уже в течение нескольких часов после начала гипоксии. Однако еще долгое время никто не знал, во-первых, как именно клетки «оценивают» количество кислорода, во-вторых, все ли клетки на это способны, и, в-третьих, какие механизмы лежат в основе реализации клеточного ответа. Именно за решение этих вопросов и была присуждена Нобелевская премия по физиологии и медицине в этом году.
Исследования, которые получили высшую оценку Нобелевского комитета, были начаты на рубеже 80-х и 90-х годов XX века. Причем каждый из трех лауреатов пришел в эту область своим особым путем.
Питер Рэтклифф первоначально получил медицинское образование, затем перепрофилировался на молекулярную биологию. В конце 80-х его исследовательская работа была связана с изучением болезней почек, среди которых некоторую долю составляют патологии ишемической этиологии. Как уже было сказано, именно почки вырабатывают эритропоэтин в ответ на состояние гипоксии. В 1990 году Рэтклифф основал в Оксфорде лабораторию биологии гипоксии, которую возглавлял более 20 лет, поставив перед собой цель разобраться в механизмах регуляции экспрессии гена эритропоэтина.
Тематика работ Грегга Семензы до начала 90-х годов касалась заболеваний, обусловленных нарушениями эритропоэза, таких как талассемия. В 1992 году он выделил новый белок, связывающийся с регуляторным участком в гене эритропоэтина и обеспечивающий стимуляцию транскрипции данного гена при недостатке кислорода. Также, как и Рэтклифф, Семенза с этого момента практически полностью переключился на исследование молекулярных и клеточных механизмов адаптации организма к гипоксии.
Уильям Келин — специалист по опухолям, занимавшийся в конце 80-х — начале 90-х годов проблемой наследственного заболевания Гиппеля — Линдау. Этот синдром с аутосомно-доминантным наследованием выражается в повышенном риске возникновения рака (чаще всего образуются опухоли головного или спинного мозга, сетчатки, почек). В 1988 году было установлено, что причиной заболевания являются мутации в гене VHL (аббревиатура, образованная от англоязычного названия заболевания, von Hippel — Lindau disease). И, как выяснилось впоследствии, белок, кодируемый этим геном, является еще одним из ключевых игроков в ответе клеток на вариации в концентрации кислорода в среде.
Любопытно отметить, что в первое время статьи из всех трех лабораторий выходили одна за другой, и нередко практически одновременно исследователи параллельно публиковали полученные результаты, описывающие одни и те же детали механизма. Впрочем, десятилетие спустя у них начали появляться и совместные публикации.
Механизм клеточного ответа на гипоксию
Первоначальной моделью для изучения механизма реакции клеток на гипоксию стала регуляция гена эритропоэтина в клетках почек или печени. За десяток лет выяснились основные этапы этой регуляции, общая схема которой приведена на рис. 2.
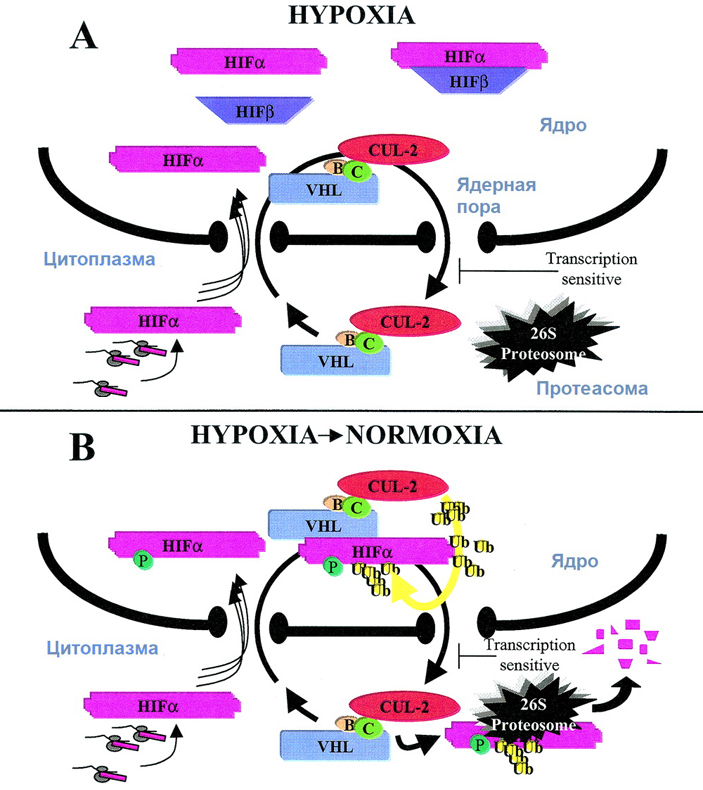
Первоначально в 1991 году Рэтклифф с коллегами обнаружил около 3′-концевого участка гена эритропоэтина регуляторный участок (энхансер), присутствие которого определяет способность гена повышать уровень экспрессии при дефиците кислорода (C. W. Pugh et al., 1991. Functional analysis of an oxygen-regulated transcriptional enhancer lying 3′ to the mouse erythropoietin gene). Годом позже в лаборатории, где работал Грегг Семенза был выделен и исследован транскрипционный фактор, связывающийся с ДНК в этой области, — он получил название HIF (G. L. Semenza, G. L. Wang, 1992. A nuclear factor induced by hypoxia via de novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation). Этот белок формируется из двух субъединиц: одна из них обозначается как HIFα, другая — HIFβ. Вскоре было установлено, что HIF работает не только в почках и печени, но и во всех прочих типах клеток организма (G. L. Wang, G. L. Semenza, 1993. General involvement of hypoxia-inducible factor 1 in transcriptional response to hypoxia).
Здесь можно отметить, что у человека и других позвоночных обе субъединицы фактора HIF представлены семействами, включающими по 3 паралогичных гена, которые работают в разных типах клеток и регулируют разные наборы генов. Причем белковый продукт гена HIF3α, по-видимому, является ингибитором по отношению к продукту гена HIF1α. Тонкости функциональных особенностей всех паралогов все еще не до конца изучены.
Количество мРНК и белка HIFβ в клетках относительно постоянно, оно не зависит от концентрации кислорода, а вот субъединица HIFα является регулируемой. Во-первых, ее количество в клетке держится на низком уровне при нормальном уровне кислорода, но резко возрастает при гипоксии. Во-вторых, при гипоксии он обнаруживается исключительно в ядре, а при нормальном уровне кислорода — преимущественно в цитоплазме, что обеспечивается взаимодействием белка с вспомогательными белками системы переноса белков между ядром и цитоплазмой.
Исследования Кэлина позволили выяснить, что количество белка HIFα регулируется посредством протеолиза — разрушения при помощи протеасом (M. Ivan et al., 2001. HIFα Targeted for VHL-Mediated Destruction by Proline Hydroxylation: Implications for O
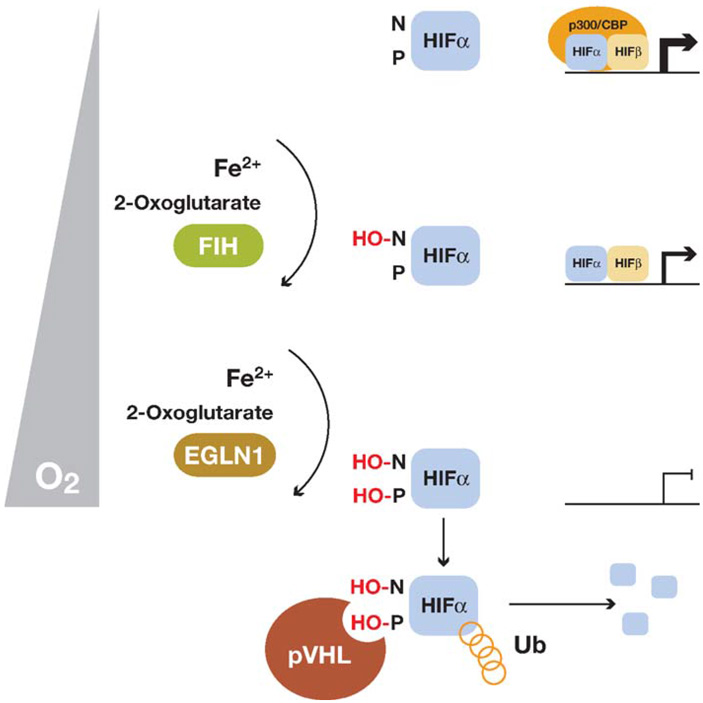
Позднее были установлены новые подробности. Оказалось, что для взаимодействия с VHL требуется появление гидроксильных групп (-OH) на двух остатках пролина в молекуле HIFα. Гидроксилирование осуществляется ферментами PHD (Prolil hydroxylase), которые кодируются тремя паралогичными генами (
Еще одной составляющей изученного механизма оказалось гидроксилирование по остатку аспарагина в молекуле HIFα, которое осуществляется (при тех же условиях, что и гидроксилирование по пролину) другим ферментом, названным FIh2 (Factor inhibiting HIF). Гидроксилирование остатка аспарагина препятствует взаимодействию HIFα с транскрипционным коактиватором (CBP или p300), без которого уровень активации транскрипции генов-мишеней оказывается заметно ниже.
Аспарагин-гидроксилаза и пролин-гидроксилазы имеют разный порог активации. Полномасштабный ответ на гипоксию развивается при парциальном давлении кислорода около 1% от нормы или ниже. При этой концентрации гидроксилазы абсолютно неактивны. По мере повышения концентрации кислорода после гипоксии первым активируется белок FIH-1, который гидроксилирует остатки аспарагина, приводя к частичному подавлению активаторной функции HIF, а при дальнейшем приближении концентрации кислорода к нормальному уровню становится активной и диоксигеназа PHD, гидроксилирующая остатки пролина, и концентрация HIFα начинает быстро снижаться (рис. 3).
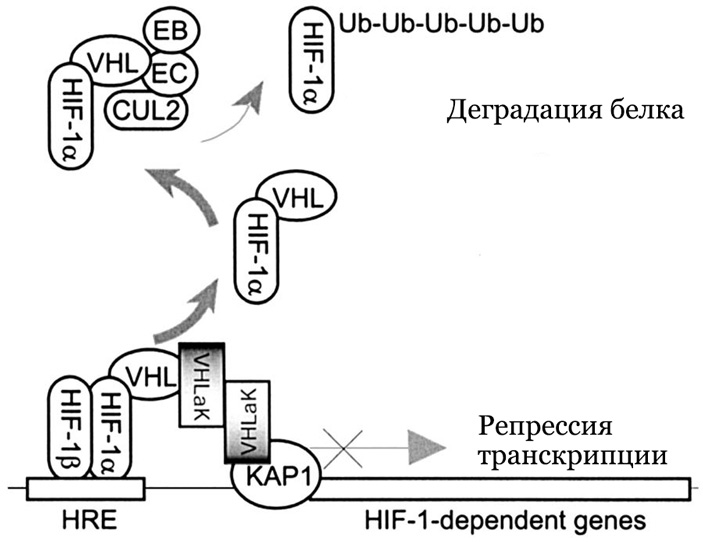
Позже оказалось, что помимо убиквитинирования, VHL способен блокировать работу HIF еще и другим путем — привлекая к нему белки-репрессоры, препятствующие активации транскрипции генов-мишеней, как показано на рис. 4.
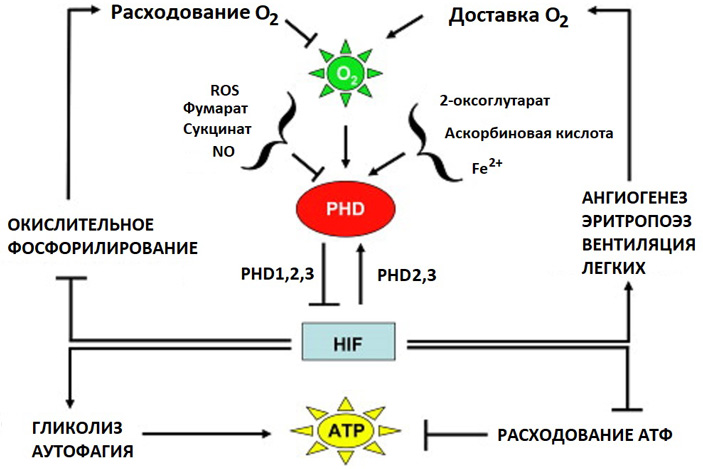
Регуляция с участием HIF затрагивает в сумме более трех сотен генов, функция которых заключается в обеспечении снабжения тканей кислородом, стимулировании регенеративных процессов и включении защитных механизмов внутри клеток, подвергшихся воздействию гипоксии (J. Schödel et al., 2011. High-resolution genome-wide mapping of HIF-binding sites by ChIP-seq).
Например, одной из таких защитных реакций является повышение интенсивности реакций гликолиза (расщепления глюкозы до молочной кислоты в цитозоле клеток), как альтернативного пути наработки АТФ (в обычных условиях основная доля АТФ производится за счет кислородного дыхания, осуществляемого митохондриями). Также гипоксия стимулирует аутофагию, и одновременно подавляет некоторые особенно энергозатратные процессы. На уровне межтканевой регуляции происходит стимуляция не только эритропоэза, но и ангиогенеза (роста сосудов) — благодаря стимуляции синтеза и секреции фактора роста эндотелия сосудов VEGF, расширения капилляров, интенсивности вентиляции легких и целого ряда других физиологических процессов. В нервной ткани обнаружилась выраженная реакция на колебания снабжения мозга кислородом в клетках астроцитах. Оказалось, что выделяемый ими эритропоэтин не только участвует в активации эритропоэза, но и стимулирует миграцию нейробластов в область ишемического повреждения мозга, то есть регенерацию нервной ткани (J. C. Chavez et al., 2006. The Transcriptional Activator Hypoxia Inducible Factor 2 (HIF-2/EPAS-1) Regulates the Oxygen-Dependent Expression of Erythropoietin in Cortical Astrocytes).
Вся система реакций на уровне молекул, клеток и организма включает множественные взаимовлияния, как положительные, так и отрицательные, формирующие разнообразные обратные связи (рис. 5). Весьма примечательно, что в число генов, активируемых фактором HIF, входят гены ферментов гидроксилаз, которые в конечном итоге ограничивают реализацию ответа на гипоксию.
А при чрезмерно затянувшемся состоянии гипоксии к регуляции подключается p53 — еще один известный супрессор опухолей. В комплексе с белком Mdm2, он связывает HIFα, что приводит опять же к убиквитинированию и протеасомной деградации этого белка. К тому же белок p53 конкурирует c HIF за связывание коактиваторных белков CBP/p300.
Гипоксия, HIF и медицинская практика
Все многоклеточные организмы, а животные в особенности, чрезвычайно зависимы от кислорода. Этот элемент совершенно необходим нам для дыхания — процесса, который обеспечивает производство в митохондриях молекул АТФ, используемых практически во всех процессах жизнедеятельности клеток. Неудивительно, что целый ряд медицинских проблем связан именно с нарушениями снабжения тканей кислородом и ответом на это состояние. Это определяет тесную связь фундаментальной составляющей сделанных открытий с медицинской практикой.
Во-первых, потенциальное практическое применение связано с проблемой адаптации организма к каким-то специфическим условиям, где по той или иной причине возникает более или менее длительная кислородная недостаточность — подъем на высоту, подводные погружения и т. д. Во-вторых, — с лечением нарушений в тканях, обусловленных ишемическими состояниями, к примеру, из-за атеросклеротических изменений сосудов, гипертонии, заболеваний дыхательных путей или анемии. В-третьих, — с воспалительными процессами, включая, в частности, заживление ран и отторжение трансплантатов. В-четвертых, оно связано с проблемой возрастных изменений, которые могут выражаться в неспособности организма в полной мере реализовать необходимый адаптивный ответ на гипоксию тканей.
Все вышеупомянутые проблемы могут иметь решение в виде дополнительной активации ответа организма на гипоксию. Для этого разрабатываются препараты, ингибирующие белки гидроксилазы и VHL. В частности, в настоящее время для лечения анемии испытывается препарат Роксадустат (Roxadustat), который ингибирует ферменты PHD (пролилгидроксилазы).
С другой стороны, HIF очень часто бывает гиперактивирован в опухолевой ткани. Эта повышенная активность бывает обусловлена как фактическим недостатком доступа кислорода к клеткам опухоли вследствие очень быстрого ее роста, так и мутациями в гене белка HIFα или его регуляторов. В этом случае потенциально возможным решением является, напротив, применение подавителей ответа на гипоксию, которые препятствуют интенсивному ангиогенезу в опухолевой ткани и тем самым замедляют рост и понижают агрессивность раковой опухоли. Некоторые синтетические препараты, прямо или косвенно подавляющие HIF (например, сердечный гликозид дигоксин), в настоящее время проходят клинические испытания для лечении нескольких форм рака.
О проонкогенном влиянии избыточной активации HIF, конечно, следует помнить, разрабатывая стратегии решения проблем гипоксии, упомянутые чуть выше. Гиперактивация ответа на гипоксию может иметь и другие негативные последствия.
Наконец, нельзя не сказать о том, что система ответа на концентрацию кислорода оказывается критически важной не только в каких-то специфических условиях среды или при патологии тканей, но и в ходе нормального эмбрионального развития. HIF участвует в росте, дифференцировке, контроле апоптоза клеток многих тканей, включая сердечно-сосудистую, скелетогенную и иммунную системы. Эксперименты на животных показали, что эмбрион, лишенный функционального фактора HIF, очень рано погибает вследствие нарушения процессов формирования кровеносной системы по мере роста зародыша и невозможности нормального развития организма.
В последние годы становится ясно, что реакции клеток на изменения доступности кислорода достаточно многокомпонентны и что есть и другие сигнальные пути, не включающие HIF. И трое ученых, удостоенных Нобелевской премии, как и сотни других исследователей по всему миру, продолжают активно развивать данную область. С этими новыми подробностями можно познакомиться в совсем недавних публикациях, напримеру: M. Ivan, W. G. Kaelin, 2017. The EGLN-HIF O2-Sensing System: Multiple Inputs and Feedbacks, A. A. Chakraborty et al., 2019. Histone demethylase KDM6A directly senses oxygen to control chromatin and cell fate и C. W. Pugh, P. J. Ratcliffe, 2017. New horizons in hypoxia signaling pathways. И есть все основания ожидать, что эти исследования сыграют важную роль в решении практических задач здравоохранения.
Татьяна Романовская
elementy.ru
Нобелевские лауреаты по медицине 2019 года
2019-10-07T15:20+0300
2019-10-07T15:20+0300
https://ria.ru/20191007/1559512820.html
Нобелевские лауреаты по медицине 2019 года
https://cdn22.img.ria.ru/images/155951/26/1559512682_0:95:3072:1823_1036x0_80_0_0_564223789ef4b0a3901cef28ac84c341.jpg
РИА Новости
https://cdn22.img.ria.ru/i/export/ria/logo.png
РИА Новости
https://cdn22.img.ria.ru/i/export/ria/logo.png
Келин Уильям
Американский ученый-медик, онколог Уильям Келин (William Kaelin) родился в 1957 году в Нью-Йорке (США).В 1982 году получил степень доктора медицины в Университете Дьюка (Duke University), США.
Проходил терапевтическую подготовку в госпитале Джонса Хопкинса (Johns Hopkins Hospital).
Работал онкологом в Институте раковых исследований Дана-Фарбер (Dana-Farber Cancer Institute), проходил докторантуру в лаборатории доктора Дэвида Ливингстона (laboratory of Dr. David Livingston), где он начал свои исследования белков-супрессоров опухолей.
В 1992 году Келин стал независимым исследователем в Институте раковых исследований Дана-Фарбер. С 1998 года – независимый исследователь Медицинского института Говарда Хьюза (Howard Hughes Medical Institute).С 2002 года – профессор Гарвардской медицинской школы (Harvard Medical School).
Член Национальной академии наук США (2010).
Среди его наград также Международная премия Гайрднера (Gairdner International Award, 2010), Премия Альфреда Кнудсона (Alfred Knudson Award, 2011), Премия Ласкера (Lasker Award, 2016) и др.
Ратклиф Петер
Британский ученый-медик и молекулярный биолог Петер Ратклифф (Peter Ratcliffe) родился 14 мая 1954 года в Ланкашире (Великобритания). В 1978 году получил степень бакалавра медицины, в 1987 году – докторскую степень в Колледже Гонвилл-энд-Киз (Gonville and Caius College, входит в состав Кембриджского университета). Прошел клиническую подготовку в больнице Святого Варфоломея (St. Bartholomew’s Hospital) в Лондоне, затем переехал в Оксфорд, где присоединился к Институту молекулярной медицины Weatherall. Прошел переподготовку по молекулярной и клеточной биологии.В 1990 году, получив финансирование в качестве старшего научного сотрудника Wellcome Trust, он создал лабораторию биологии гипоксии в Институте молекулярной медицины Weatherall.
С 1996 года – профессор нефрологии в Университете Оксфорда (University of Oxford).
С 2004 по 2016 года в должности профессора возглавлял кафедру клинической медицины Наффилда (Nuffield Department of Clinical Neurosciences), Оксфорд.
В 2016 году стал директором исследовательского центра Target Discovery Institute, созданного Департаментом медицины Наффилда и Оксфордским университетом.С 2016 года также занимает должность директора по клиническим исследованиям в Институте Фрэнсиса Крика (The Francis Crick Institute), Лондон.
Член Института Людвига по исследованию рака (Ludwig Institute of Cancer Research), Лондонского королевского общества и Академии медицинских наук (2002). Почетный член Американской академии искусств и наук.
7 октября 2019 года Петеру Ратклиффу была присуждена Нобелевская премия по медицине совместно с Уильямом Келином, и Греггом Семенце за исследование того, как живые клетки реагируют на присутствие кислорода.Среди его наград также премия Луи-Жанте в области медицины (Louis-Jeantet Prize in Medicine), Международная премия Гайрднера (Gairdner International Award), Премия Ласкера (Lasker Award).
В 2014 году он был посвящен в рыцари за заслуги перед медициной.
Семенце Грегг
Американский ученый-медик, педиатр и генетик Грегг Семенце (Gregg Semenza) родился в 1956 году в Нью-Йорке (США). В 1978 году получил степень бакалавра в Гарвардском университете (Harvard University), в 1984 году – степень доктора медицины и доктора философии в университете Пенсильвании (University of Pennsylvania). Окончил резидентуру по педиатрии в Медицинском центре Университета Дьюка (Duke University Medical Center) и занимался докторскими исследованиями в области медицинской генетики в Университете Джона Хопкинса (Johns Hopkins University).С 1990 года Грегг Семенце работает в Университете Джона Хопкинса.Он является профессором педиатрии, радиационной онкологии и молекулярно-радиационных наук, биологической химии, медицины и онкологии в Медицинской школе Университета Джона Хопкинса (Johns Hopkins University School of Medicine).
Он также возглавляет сосудистую программу в Институте клеточной инженерии имени Джона Хопкинса (Johns Hopkins’ Institute for Cell Engineering).
В 2012 году он был избран в Институт генетической медицины МакКусика-Натанса (McKusick-Nathans Institute of Genetic Medicine) Университета Дж. Хопкинса.
В 2012-2016 годах был профессором-исследователем Американского онкологического общества (American Cancer Society).
Грегг Семенце занимается исследованием молекулярных механизмов регуляции кислорода. Ученый наиболее известен своим новаторским открытием белка HIF-1 (фактор, индуцируемый гипоксией 1), который контролирует гены в ответ на изменения в доступности кислорода.
Семенце – один из основателей Американского колледжа медицинской генетики (American College of Medical Genetic). Ученый является членом Американского общества клинических исследований (American Society for Clinical Investigation, 1995), членом Национальной академии наук США (National Academy of Sciences USA, 2008).
Является автором более 250 исследовательских статей. Входит в редакционную коллегию нескольких журналов, и является главным редактором журнала молекулярной медицины (Journal of Molecular Medicine).
7 октября 2019 года Греггу Семенце совместно с Уильямом Келином и Петером Ратклиффом присуждена Нобелевская премия по медицине. Работы ученого отмечены также несколькими другими наградами, в том числе гран-при Лефулона-Делаланде (Lefoulon-Delalande) от Института Франции (2012), Международной премией Гэйрднера (Gairdner International Award, 2010) и др.Материал подготовлен на основе информации РИА Новости и открытых источников
ria.ru
Нобелевская премия по физиологии и медицине — 2018

В 2018 году лауреатами Нобелевской премии по физиологии и медицине стали двое ученых с разных концов света — Джеймс Эллисон из США и Тасуку Хондзё из Японии, — независимо открывшие и изучавшие один и тот же феномен. Они обнаружили два разных чекпоинта — механизма, с помощью которых организм подавляет активность Т-лимфоцитов, иммунных клеток-убийц. Если заблокировать эти механизмы, то Т-лимфоциты «выходят на свободу» и отправляются на битву с раковыми клетками. Это называют иммунотерапией рака, и она уже несколько лет применяется в клиниках.
Нобелевский комитет любит иммунологов: по меньшей мере каждая десятая премия по физиологии и медицине вручается за теоретические иммунологические работы. В этом же году речь зашла о практических достижениях. Нобелевские лауреаты 2018 года отмечены не столько за теоретические открытия, сколько за последствия этих открытий, которые уже шесть лет помогают онкобольным в борьбе с опухолями.
Общий принцип взаимодействия иммунной системы с опухолями выглядит следующим образом. В результате мутаций в клетках опухоли образуются белки, отличающиеся от «нормальных», к которым организм привык. Поэтому Т-клетки реагируют на них как на чужеродные объекты. В этом им помогают дендритные клетки — клетки-шпионы, которые ползают по тканям организма (за их открытие, кстати, присудили Нобелевскую премию в 2011 году). Они поглощают все проплывающие мимо белки, расщепляют их и выставляют получившиеся кусочки на свою поверхность в составе белкового комплекса MHC II (главный комплекс гистосовместимости, подробнее см.: Кобылы определяют, беременеть или нет, по главному комплексу гистосовместимости… соседа, «Элементы», 15.01.2018). С таким багажом дендритные клетки отправляются в ближайший лимфатический узел, где показывают (презентируют) эти кусочки пойманных белков Т-лимфоцитам. Если Т-киллер (цитотоксический лимфоцит, или лимфоцит-убийца) узнает эти белки-антигены своим рецептором, то он активируется — начинает размножаться, образуя клоны. Дальше клетки клона разбегаются по организму в поисках клеток-мишеней. На поверхности каждой клетки организма есть белковые комплексы MHC I, в которых висят кусочки внутриклеточных белков. Т-киллер ищет молекулу MHC I с антигеном-мишенью, который он может распознать своим рецептором. И как только распознавание произошло, Т-киллер убивает клетку-мишень, проделывая дырки в ее мембране и запуская в ней апоптоз (программу гибели).

Но этот механизм не всегда работает эффективно. Опухоль — это гетерогенная система клеток, которые используют самые разные способы ускользнуть от иммунной системы (об одном из недавно открытых таких способов читайте в новости Раковые клетки повышают свое разнообразие, сливаясь с иммунными клетками, «Элементы», 14.09.2018). Некоторые опухолевые клетки скрывают белки MHC со своей поверхности, другие уничтожают дефектные белки, третьи выделяют вещества, подавляющие работу иммунитета. И чем «злее» опухоль, тем меньше шансов у иммунной системы с ней справиться.

Классические методы борьбы с опухолью предполагают разные способы убийства ее клеток. Но как отличить опухолевые клетки от здоровых? Обычно используют критерии «активное деление» (раковые клетки делятся гораздо интенсивнее большинства здоровых клеток организма, и на это нацелена лучевая терапия, повреждающая ДНК и препятствующая делению) или «устойчивость к апоптозу» (с этим помогает бороться химиотерапия). При таком лечении страдают многие здоровые клетки, например стволовые, и не затрагиваются малоактивные раковые клетки, например спящие (см.: Удалось выяснить, почему рак может уснуть и проснуться через много лет, «Элементы», 10.06.2016). Поэтому сейчас часто делают ставку на иммунотерапию, то есть активацию собственного иммунитета больного, так как иммунная система лучше, чем внешние лекарства, отличает опухолевую клетку от здоровой. Активировать иммунную систему можно самыми разными способами. Например, можно забрать кусочек опухоли, выработать антитела к ее белкам и ввести их в организм, чтобы иммунная система лучше «видела» опухоль. Или же забрать иммунные клетки и «натаскать» их на распознавание специфических белков. Но Нобелевскую премию в этом году вручают за совсем другой механизм — за снятие блокировки с Т-киллерных клеток.
Когда эта история только начиналась, никто не думал об иммунотерапии. Ученые пытались разгадать принцип взаимодействия Т-клеток с дендритными клетками. При ближайшем рассмотрении оказывается, что в их «общении» участвуют не только MHC II c белком-антигеном и рецептор Т-клетки. Рядом с ними на поверхности клеток расположены и другие молекулы, которые тоже участвуют во взаимодействии. Вся эта конструкция — множество белков на мембранах, которые соединяются друг с другом при встрече двух клеток, — называется иммунным синапсом (см. Immunological synapse). В состав этого синапса входят, например, костимулирующие молекулы (см. Co-stimulation) — те самые, которые посылают сигнал Т-киллерам активироваться и отправляться на поиски врага. Их обнаружили первыми: это рецептор CD28 на поверхности Т-клетки и его лиганд В7 (CD80) на поверхности дендритной-клетки (рис. 4).
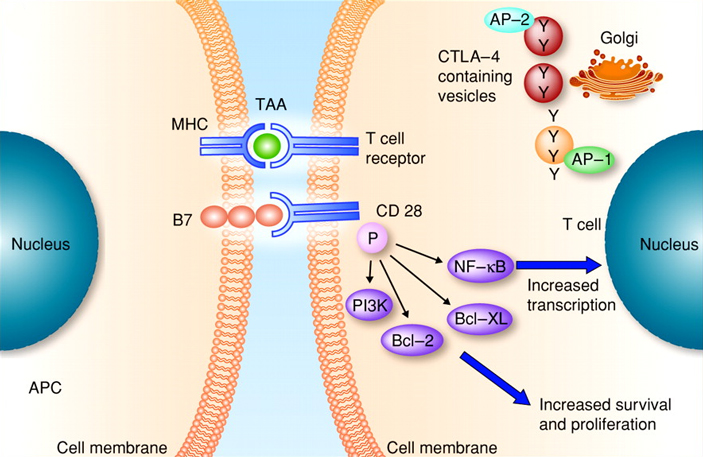
Джеймс Эллисон и Тасуку Хондзё независимо обнаружили еще две возможные составляющие иммунного синапса — две ингибирующие молекулы. Эллисон занимался открытой в 1987 году молекулой CTLA-4 (cytotoxic T-lymphocyte antigen-4, см.: J.-F. Brunet et al., 1987. A new member of the immunoglobulin superfamily — CTLA-4). Изначально считалось, что это еще один костимулятор, потому что она появлялась только на активированных Т-клетках. Заслуга Эллисона в том, что он предположил, что всё наоборот: CTLA-4 появляется на активированных клетках специально, чтобы их можно было остановить! (M. F. Krummel, J. P. Allison, 1995. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation). Дальше оказалось, что CTLA-4 похожа по структуре на CD28 и тоже может связываться с B7 на поверхности дендритных клеток, причем даже сильнее, чем CD28. То есть на каждой активированной Т-клетке есть ингибирующая молекула, которая конкурирует с активирующей молекулой за прием сигнала. А поскольку в состав иммунного синапса входит множество молекул, то результат определяется соотношением сигналов — тем, сколько молекул CD28 и CTLA-4 смогли связаться с B7. В зависимости от этого Т-клетка либо продолжает работу, либо замирает и не может никого атаковать.
Тасуку Хондзё обнаружил на поверхности Т-клеток другую молекулу — PD-1 (ее название — сокращение от programmed death), которая связывается с лигандом PD-L1 на поверхности дендритных клеток (Y. Ishida et al., 1992. Induced expression of PD‐1, a novel member of the immunoglobulin gene superfamily, upon programmed cell death). Оказалось, что мыши, нокаутные по гену PD-1 (лишенные соответствующего белка), заболевают чем-то похожим на системную красную волчанку. Это аутоиммунное заболевание, то есть состояние, когда иммунные клетки атакуют нормальные молекулы организма. Поэтому Хондзё заключил, что PD-1 тоже работает как блокатор, сдерживая аутоиммунную агрессию (рис. 5). Это еще одно проявление важного биологического принципа: каждый раз, когда запускается какой-либо физиологический процесс, параллельно запускается противоположный ему (например, свертывающая и противосвертывающая системы крови), чтобы избежать «перевыполнения плана», которое может оказаться губительным для организма.
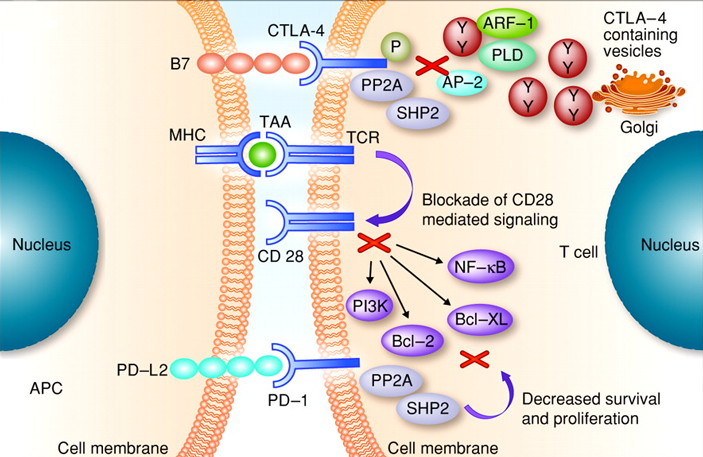
Обе блокирующие молекулы — CTLA-4 и PD-1 — и соответствующие им сигнальные пути назвали иммунными чекпоинтами (от англ. checkpoint — контрольная точка, см. Immune checkpoint). По всей видимости, это аналогия с чекпоинтами клеточного цикла (см. Cell cycle checkpoint) — моментами, в которые клетка «принимает решение», может ли она продолжать делиться дальше или какие-то ее компоненты существенно повреждены.
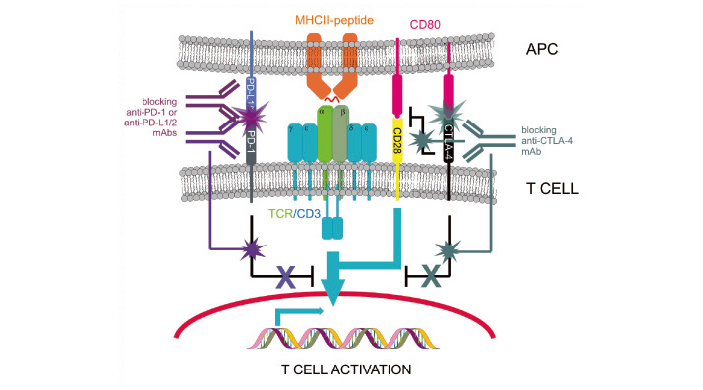
Но на этом история не закончилась. Оба ученых решили найти применение новооткрытым молекулам. Их идея состояла в том, что можно активировать иммунные клетки, если заблокировать блокаторы. Правда, побочным эффектом неизбежно будут аутоиммунные реакции (как и происходит сейчас у пациентов, которых лечат ингибиторами чекпоинтов), зато это поможет победить опухоль. Блокировать блокаторы ученые предложили с помощью антител: связываясь с CTLA-4 и PD-1, они механически их закрывают и мешают взаимодействовать с B7 и PD-L1, при этом Т-клетка не получает ингибирующих сигналов (рис. 6).
Прошло не меньше 15 лет между открытиями чекпоинтов и одобрением лекарств на основе их ингибиторов. На данный момент применяют уже шесть таких препаратов: один блокатор CTLA-4 и пять блокаторов PD-1. Почему блокаторы PD-1 оказались удачнее? Дело в том, что клетки многих опухолей тоже несут на своей поверхности PD-L1, чтобы блокировать активность Т-клеток. Таким образом, CTLA-4 активирует Т-киллеры в целом, а PD-L1 более специфично действуют на опухоль. И осложнений в случае блокаторов PD-1 возникает несколько меньше.
Современные методы иммунотерапии пока, увы, не являются панацеей. Во-первых, ингибиторы чекпоинтов всё равно не обеспечивают стопроцентной выживаемости пациентов. Во-вторых, они действуют не на все опухоли. В-третьих, их эффективность зависит от генотипа пациента: чем более разнообразны его молекулы MHC, тем выше шанс на успех (о разнообразии белков MHC см.: Разнообразие белков гистосовместимости повышает репродуктивный успех у самцов камышовок и снижает у самок, «Элементы», 29.08.2018). Тем не менее получилась красивая история о том, как теоретическое открытие сначала меняет наши представления о взаимодействии иммунных клеток, а затем рождает лекарства, которые можно применять в клинике.
А нобелевским лауреатам есть над чем работать дальше. Точные механизмы работы ингибиторов чекпоинтов всё еще не известны до конца. Например, в случае CTLA-4 так и непонятно, с какими именно клетками взаимодействует лекарство-блокатор: с самими Т-киллерами, или с дендритными-клетками, или вообще с Т-регуляторными клетками — популяцией Т-лимфоцитов, отвечающей за подавление иммунного ответа. Поэтому эта история, на самом деле, еще далека от завершения.
Полина Лосева
elementy.ru
Нобелевку по физиологии и медицине присудили за исследования адаптации клеток к кислороду — Наука
СТОКГОЛЬМ, 7 октября. /ТАСС/. Нобелевскую премию 2019 года по физиологии и медицине вручили Уильяму Кэлину, Питеру Рэтклиффу и Грэгу Семенце за открытия в области того, как клетки адаптируются к недостатку кислорода. Об этом Нобелевский комитет сообщил на пресс-конференции.
«Плодотворные открытия нобелевских лауреатов этого года прояснили механизм одного из наиболее важных для жизни адаптивных процессов. Они подвели основу под наше понимание того, как уровень кислорода регулирует клеточный обмен веществ и физиологические функции. Кроме того, их открытия проложили путь для создания новых стратегий борьбы с анемией, раком и многими другими заболеваниями», — сообщается в официальном пресс-релизе комитета.
Почему эта премия важна
Кислород очень важен как для жизни в принципе, так и для работы клеток. В ходе эволюции человеческий организм выработал ряд механизмов, которые регулируют, достаточно ли в него поступает кислорода для того, чтобы всё в нем нормально работало. В частности, от уровня кислорода зависят дыхание, обмен веществ, эмбриональное развитие и реакция иммунной системы на инфекции и других «захватчиков».
За реакцию на гипоксию (то есть недостаток кислорода) в организме человека отвечают, в частности, гормон эритропоэтин. Чем больше этого гормона, тем больше в нашей крови образуется красных кровяных телец. То, что это механизм важен, ученые знали еще в начале XX века, однако то, как именно он работает, было неизвестно.
Именно этим занимались два из трех лауреатов – Грэгг Семенца и Питер Рэтклифф. Они независимо друг от друга изучали гены, которые регулируют работу эритропоэтина в зависимости от количества кислорода. В ходе своих исследований ученые обнаружили белок HIF-1, который активируется только при недостатке кислорода и позволяет раковым клеткам адаптироваться к таким условиям. Кроме того, они обнаружили, что механизм восприятия кислорода присутствует практически во всех тканях, а не только в клетках почек, где обычно вырабатывается.
Примерно в то же время другой лауреат – онколог Уильям Кэлин – изучал, как развивается редкое генетическое заболевание — болезнь Гиппеля-Ландау. Он обратил внимание, что опухоли, которые образуются во время этой болезни, развиваются так, будто получают избыток кислорода. Позже он обнаружил, что ген, работающий против этой болезни, связан с белком HIF-1.
Таким образом, открытия лауреатов позволили узнать подробности того, как именно человеческий организм реагирует на недостаток или избыток доступного кислорода. Это важно для лечения анемии, рака, инсультов и инфарктов.
Лауреаты 2019 года
Сэр Питер Рэтклифф — британский врач и молекулярный биолог, родился в 1954 году в Ланкашире. Он входит в Королевское общество, занимает руководящие посты в Оксфордском университете в Наффилде и Институте Фрэнсиса Крика в Лондоне. Рэтклифф изучал медицину в Кэмбридже и в 1989 году открыл лабораторию по изучению эритропоэтина.
Уильям Кэлин-младший — профессор Гарвардского университета, родился в 1957 году в Нью-Йорке. В 2008 году он стал заместителем директора в Институте онкологии имени Дана-Фарбер, где изучал, как мутации в генах-супрессорах (то есть генах, которые противостоят им) опухолей влияют на развитие раковых заболеваний. Кроме того, Кэлин входит в комитеты ряда благотворительных организаций, которые борются с раком. Отдельные его работы посвящены опухоли сетчатки глаза у детей и болезни Гиппеля — Линдау.
Доктор Грэг Семенца родился в 1956 году в Нью-Йорке, закончил Гарвардский (в 1978-м) и Пенсильванский университеты (в 1984-м). Сейчас Семенца работает профессором Школы медицины при Университете Джонса Хопкинса (США), занимается педиатрией, биохимией и онкологией. Наибольшую известность в мире медицины 63-летнему Семенце принесло открытие фактора HIF-1, который позволяет раковым клеткам адаптироваться к среде с низким содержанием кислорода.
Премии прошлых лет
В прошлом году Нобелевскую премию по физиологии и медицине получили Джеймс Эллисон и Тасуку Хондзё за иммунотерапию рака. Ученые исследовали механизмы работы разных белков, которые блокировали иммунную систему, помогая ей таким образом бороться с клетками опухоли.
Впервые Нобелевскую премию по физиологии и медицине вручили в 1901 году, с тех пор ее лауреатами становились 216 человек. Сейчас члены Нобелевского комитета только объявляют лауреатов, а само вручение состоится 10 декабря, в Стокгольме. Кроме медали лауреатам достанется 9 млн шведских крон (около $914,5 млн.)
nauka.tass.ru
Нобелевскую премию по медицине дали за открытия клеточных чувств
Профессор медицины Гарвардского университета Уильям Келин-младший в 2016 году стал лауреатом Премии Ласкера за фундаментальные медицинские исследования. Билл Келин-младший занимается исследованиями роли мутаций в генах-супрессорах опухоли (т. е. генов, чья нормальная функция связана с подавлением опухолевого роста) при развитии рака. Профессор был женат на хирурге, специализировавшейся на борьбес раком молочной железы, докторе Кэролин Келин (она сама стала жертвой онкологического заболевания и умерла в 2015 году).
Британский доктор сэр Питер Джон Рэтклиф специализируется на клеточной и молекулярной биологии. Он известен более всего как специалист по восприятию кислорода и в особенности по гипоксии (пониженное содержание кислорода в организме или отдельных органах и тканях). Имея ряд званий, должностей и титулов, сэр Питер – практикующий врач, занимающийся клиническими исследованиями, в оксфордском госпитале Джона Рэдклиффа.
Третий лауреат-2019, Грегг Семенца – профессор по педиатрии, радиационной онкологии, биологической химиии, медицине и онкологии в Школе медицины Джонса Хопкинса (Балтимор, США). Как и Билл Келин-младший, он стал в 2016 году лауреатом Ласкеровской премии за фундаментальные медицинские исследования.
Каждому из этой научной троицы достанется по трети Нобелевской премии.
Вот как Каролинский институт описал важность открытия, сделанного лауреатами: «Животным нужен кислород для превращения пищи в полезную энергию. Фундаментальное значение кислорода понималось веками, но как клетки приспосабливаются к изменениям уровня кислорода, давно неизвестно. Уильям Г. Келин-младший, сэр Питер Дж. Рэтклифф и Грегг Л. Семенца обнаружили, как клетки могут чувствовать и адаптироваться к изменяющейся доступности кислорода. Они определили молекулярный механизм, который регулирует активность генов в ответ на различные уровни кислорода. Оригинальные открытия, сделанные нобелевскими лауреатами этого года, раскрыли механизм одного из самых важных адаптационных процессов в жизни. Они заложили основу для нашего понимания того, как уровни кислорода влияют на клеточный метаболизм и физиологическую функцию. Их открытия также проложили путь к многообещающим новым стратегиям борьбы с анемией, раком и многими другими заболеваниями… Благодаря новаторской работе этих нобелевских лауреатов, мы знаем гораздо больше о том, как различные уровни кислорода регулируют фундаментальные физиологические процессы. Кислородное зондирование позволяет клеткам адаптировать свой метаболизм к низким уровням кислорода: например, в наших мышцах во время интенсивных упражнений. Другие примеры адаптивных процессов, контролируемых кислородным зондированием, включают образование новых кровеносных сосудов и выработку эритроцитов».
Традиционно различные СМИ и интернет-ресурсы, особенно те, которые специализируются на науке, пытаются предугадать, кто же станет лауреатом самой престижной премии. Так, издание Inside Science в числе возможных претендентов на медицинского «Нобеля» называют ученых, которые внесли вклад в изучение генов рака молочной железы. В частности, названо имя Мэри-Клер Кинг из Вашингтонского университета, которая в 1990 году определила область генома, которая составляла большую долю риска в семьях, склонных к раку молочной железы и яичников. Ее открытие было развито командой Марка Сколника в Университете Юты. Открытие генов BRCA позволило тысячам людей принять профилактические меры, основанные на их генетическом риске. Оно также создало новую область исследований в области связи между генами и здоровьем, открывая дверь для точной медицины, которая адаптирована для отдельных пациентов.
Нобелевской премии достойны и ученые, внесшие вклад в борьбу с гепатитом С, уверены авторы Inside Science. Такие исследователи как Чарльз Райс из Университета Рокфеллера и Ральф Бартеншлагер из Университета Гейдельберга, выяснили, как выращивать вирус в клеточных культурах, прокладывая путь к разработке новой группы высокоэффективных противовирусных препаратов.
Не менее важны для науки и исследования в сфере оптогенетики (это метод, который использует свет для запуска или подавления активности в нейронах, и ученые пользуются, чтобы показать, как мозг работает с беспрецедентной точностью). Например, Чжуо-Хуа Пан из Уэйнского государственного университета использует оптогенетику в нейронах сетчатки для лечения слепоты. «Если Нобелевский комитет решит присудить премию за оптогенетику, – пишет Inside Science, – у него могут возникнуть проблемы с выбором между такими именами, как Эдвард Бойден, Эрнст Бамберг, Геро Мизенбёк и Питер Хегеманн, все из которых получили престижные награды за свою роль в развитии техники. Но они наверняка должны включить Карла Дайссерота, чья лаборатория в Стэнфорде выпустила основную статью 2005 года, в которой оптогенетика была представлена миру».
В прошлом году лауреатами премии по медицине и физиологии стали Джеймс Эллисон и Тасуку Хондзё «за их открытие раковой терапии путем ингибирования негативной иммунной регуляции». Разработанная этими учеными терапия иммунных контрольных точек стала революционным прорывом в лечении онкологических заболеваний и фундаментально изменила способы противостояния раку.
Помимо собственно премии, имеющей денежное выражение, эквивалентное 9 млн шведских крон, лауреаты получают диплом и медаль. Дизайн Нобелевской медали в области физиологии и медицины разработал шведский скульптор и гравер Эрик Линдберг. На ней изображен гений медицины, держащий на коленях открытую книги и собирающий воду, текущую из камня, чтобы смочить горлом больной девушки.
За период с 1901-го до 2018 года нобелевская премия за достижения в области физиологии и медицины присуждалась 109 раз. Примерно в трети случаев премию давали только одному лауреату. Примерно по трети пришлось на случаи, когда награждали двух и трех ученых. Всего медицинского «Нобеля» присудили за это время 216 ученым. При этом по состоянию на прошлый год лишь 12 женщин были удостоены премии в этой номинации (из них лишь одна ученая, Барбара Макклинток стала в 1983 году «за ее открытие мобильных генетических элементов» обладательницей целой премии, не деля ее с другими лауреатами). Самым молодым лауреатом в области медицины остается Фредерик Бантинг, которому ко времени присуждения ему премии в 1932 году за открытие инсулина было всего 32 года. А самым пожилым среди нобелевцев в этой сфере остается американский ученый Пейтон Роус, ставший лауреатом в 87-летнем возрасте в 1966 г. «за открытие онкогенных вирусов». Средний же возраст награжденных по-прежнему составляет 58 лет.
Лауреатов премии по медицине определяет состоящая из 50 профессоров Нобелевская ассамблея Каролинского университета (Стокгольм). Список номинантов на лауреатство держится в секрете в течении 50 лет, зато по прошествии этого срока можно узнать весьма интересные детали. «Отца» учения о психоанализе Зигмунда Фрейда номинировали на премию целых 32 раза, но нобелевцем «папаша Фрейд» так и не стал. Почему? Хотя бы потому, что в 1929 г. один из экспертов Нобелевского комитета счел, что труды Фрейда не имеют доказанной научной ценности.
www.mk.ru
Объявлены лауреаты Нобелевской премии по физиологии и медицине 2019 года
В Стокгольме озвучены имена учёных, удостоившихся Нобелевской премии по физиологии и медицине 2019 года.
Ими стали Уильям Кэлин-младший (William Kaelin Jr.), Питер Рэтклифф (Peter Ratcliffe) и Грэг Семенца (Gregg Semenca) за открытие того, как клетки чувствуют и адаптируются к количеству поступающего кислорода.
Кислород необходим клеткам, чтобы получать энергию из питательных веществ, поступающих с пищей. Когда уровень кислорода меняется, у живых существ меняется частота сердцебиения и дыхания, на нехватку кислорода или его переизбыток откликаются кроветворные органы, иммунная система и так далее. Подобные механизмы адаптации существуют не только у организма в целом, но и в каждой конкретной клетке.
И если значение кислорода для жизни в целом изучалось веками, то только работы нынешних лауреатов показали, как именно клетки организмов приспосабливаются к изменению содержания этого важного вещества.
Онколог Кэлин-младший, молекулярный биолог сэр Рэтклифф и генетик Семенца выявили биохимический механизм, посредством которого количество кислорода в клетке влияет на активность её генов. Как сообщили учёные на пресс-конференции в Стокгольме, работы лауреатов могут проложить путь к лечению анемии, рака и многих других заболеваний.

Томас Перлманн (Thomas Perlmann), секретарь Нобелевского комитета по физиологии и медицине, сообщает радостную новость лауреату.
Белки управляют генами
Грегг Семенца и Питер Рэтклифф изучали ген EPO, ответственный за выработку гормона эритропоэтина. Это вещество вырабатывается почками в ответ на нехватку кислорода и стимулирует производство эритроцитов, переносящих кислород к клеткам. С начала XX века было загадкой, как недостаток кислорода запускает процесс синтез нужного гормона.
Будущие лауреаты выделили гены, которые включаются в ответ на нехватку живительного газа и влияют на работу EPO. Они обнаружили, что открытый ими механизм восприятия уровня кислорода есть практически во всех клетках, а не только в продуцирующих эритропоэтин.
Семенца выделил белковый комплекс, который в условиях кислородного голодания (гипоксии) связывался с нужными участками ДНК. Он был назван фактором, индуцируемым гипоксией (Hif).
После нескольких лет исследований Семенца выяснил состав молекулы Hif и выявил кодирующие его гены. Оказалось, что комплекс Hif состоит из двух белков: HIF-1α и ARNT. Однако почему снижение уровня кислорода приводит к возникновению этого комплекса, действующего на ДНК? Это всё ещё оставалось тайной.
Кто подставил белок HIF-1α
Несколько научных групп позднее показали, что при нормальном уровне кислорода к белку HIF-1α, входящему в состав Hif, присоединяется короткий пептид убиквитин. Это вещество – своеобразная чёрная метка. Оно сигнализирует протеасоме (своего рода мусорщику наших клеток), что без молекулы этого белка мир станет лучше.
Таким образом, дело в том, что в обычных условиях убиквитин присоединяется к молекулам HIF-1α (из-за чего их тут же распознаёт и разрушает протеасома), а при гипоксии – не присоединяется. Но почему поведение убиквитина зависит от уровня кислорода? Это следующий вопрос, на который предстояло ответить учёным.

Исследования, которые проводились учёными, касаются самых разных аспектов жизни человека. Перевод Вести.Наука (nauka.vesti.ru).
Ответ из раковой опухоли
Ответ пришёл с самой неожиданной стороны. Примерно в то же время онколог-исследователь Кэлин-младший изучал мутацию в гене VHL, приводящую к болезни Гиппеля–Линдау. На тот момент уже было известно, что этот наследственный недуг, помимо всех прочих неприятностей, значительно повышает у пациента вероятность развития некоторых видов рака.
Учёный показал, что белок, кодируемый геном VHL, предохраняет клетку от онкологического перерождения.
Попутно будущий нобелевский лауреат выяснил любопытный факт. Отсутствие в ДНК раковых клеток нормально работающего гена VHL приводило к тому, что гены, на которые действовала гипоксия, усиленно работают (экспрессируются). При этом введение в клетку нормальной копии гена возвращало уровень их экспрессии в норму. Таким образом, стало понятно, что VHL участвует в механизме клеточной реакции на уровень кислорода.
Несколько исследовательских групп заинтересовались этим вопросом. Их работы впоследствии показали, что белок, кодируемый VHL, участвует в нанесении на молекулы других белков предательской убиквитиной метки, по которой беспощадная протеасома его узнаёт и уничтожает.
Группа Рэтклиффа показала, что именно взаимодействие с VHL приводит белок HIF-1α (о котором читатель, надеемся, ещё не забыл) к маркировке убиквитином при нормальном уровне кислорода. Но всё-таки, как в этом процессе задействован кислород?
Терпение и труд
Таким образом исследователи вытаскивали на свет одно звено цепочки за другим. Реакция на уровень кислорода вызывается генами, которые регулируются белковым комплексом Hif, состоящим из белков VHL и HIF-1α, который разрушается протеасомой из-за убиквитиновой метки, нанесённой при участии гена VHL, в доме, который построил Джек. Причём последний процесс идёт только при нормальном уровне кислорода. Но почему только при нормальном уровне?
Можно предложить такую аналогию. Некто, ничего не знающий об устройстве автомобиля, обнаружил, что колёса вращаются, только когда в баке есть бензин. Покопавшись в устройстве машины, он убедился, что колёса приводятся в движение полуосями. Замечательно, но причём тут бензин?
На следующих этапах «исследователь» шаг за шагом выяснял для себя устройство всей сложной системы трансмиссии и восхищался конструкцией коробки передач… Прекрасно, да только зачем машине бензин? К моменту открытия кривошипно-шатунного механизма впору уже было прийти в отчаяние. Бензин!.. Где в этой растущей как снежный ком цепочке… бензин?
Гипотетический инженер мог бы впасть в депрессию и прекратить исследования, не зная, что до истины оставался всего один шаг: бензин сгорает в цилиндрах и толкает поршни, которые и приводят в движение всю открытую им сложную машинерию.
Последние кусочки паззла
К счастью для человечества, реальные, не воображаемые учёные – на редкость упорный народ. Исследователи выявили определённый участок молекулы HIF-1α, который, как показали эксперименты, был важен для нанесения убиквитиной метки в присутствии кислорода. И вот в 2001 году были одновременно опубликованы две статьи с решающим открытием.
Было показано, что к двум конкретным точкам молекулы HIF-1α при нормальном, и только при нормальном, уровне кислорода присоединяются гидроксильные группы (ОН—). По этим группам белок VHL распознаёт молекулу HIF-1α и связывается с ней.
Дальнейшие звенья цепи нам уже известны. VHL навешивает на HIF-1α убиквитиновый маркер. По этой метке его распознаёт и уничтожает протеасома. Поэтому в клетке, нормально обеспеченной кислородом, уровень HIF-1α всегда низкий.
А вот в при гипоксии к молекуле HIF-1α ОН-группы не цепляются, белок VHL не находит её и не цепляет на неё убиквитин. Белок без убиквитина совершенно не интересует добропорядочную протеасому и не уничтожается.
Не разлагаясь, белок скапливается в ядре клетки и связывается с белком ARNT в белковый комплекс Hif. Hif воздействует на молекулу ДНК и запускает работу генов для реакции на гипоксию. И всё от того, что в кузнице не было гвоздя, вернее, в клетке – достаточного количества кислорода.
Схема этого процесса показана на иллюстрации.
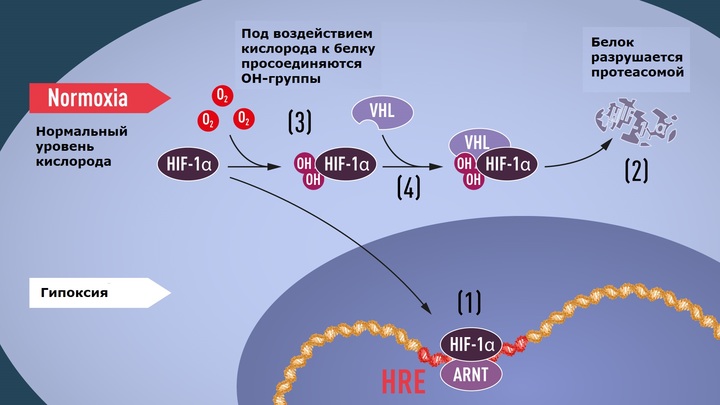
Регуляторная цепь, запускающая работу генов ответа на гипоксию (описание в тексте). Перевод Вести.Наука.
1. Когда уровень кислорода низкий (гипоксия), белок HIF-1α защищён от разложения и накапливается в ядре клетки. Там он связывается с белком ARNT и навешивается на чувствительные к нему участки ДНК (HRE). Это активизирует гены, запускающие ответ на гипоксию. 2. При нормальном уровне кислорода белок HIF-1α быстро расщепляется протеасомой. 3. Воздействие кислорода заключается в добавлении гидроксильных групп (OH—) к молекуле HIF-1α. 4. По этим группам белок VHL распознаёт молекулу HIF-1α и связывается с ней, в итоге навешивая убиквитиной маркер, по которому его и распознаёт протеасома.
Такая цепочка может показаться фантастически сложной. Но она далеко не самая длинная из тех, с которыми приходится сталкиваться учёным (что, разумеется, не умаляет невероятной важности открытий нынешних лауреатов). Биохимические каскады зачастую куда более запутаны и неоптимальны, чем устройство упомянутого выше автомобиля. Изучая сложнейшие регуляторные сети, которые на первый, второй и даже двадцать второй взгляд можно и нужно было бы сделать гораздо проще, биохимики-профессионалы встречают заявления креационистов о продуманном совершенстве живой клетки с горькой усмешкой.
Зачем нам это знать?
Знать истину – это замечательно, но есть ли от подобных открытий практическая польза? Разумеется. Все клетки человека нуждаются в кислороде и в случае необходимости приспосабливаются к его нехватке. Механизмы такого контроля могут стать терапевтической мишенью для новых методик лечения таких заболеваний, как анемия, рак, инфаркт миокарда. Достаточное количество кислорода важно и для внутриутробного развития человека, о котором наука всё ещё знает меньше, чем хотелось бы родителям родившихся больными малышей.
Но сегодня многие исследовательские группы используют открытия Кэлина-младшего, Рэтклиффа и Семенца и на благо спортсменов.
К слову, ранее «Вести.Наука» (nauka.vesti.ru) писали о лауреатах Нобелевской премии по физиологии и медицине за 2018 и 2017 годы.
nauka.vesti.ru
Что открыли нобелевские лауреаты по медицине — Сноб
Грег Семенца, Питер Ратклифф и Уильям Кейлин 20 лет назад поняли, как клетка реагирует на кислород. А вчера получили за это Нобелевскую премию
 Фото: Travis Yewell/Unsplash
Фото: Travis Yewell/UnsplashНобелевскую премию по физиологии и медицине могли бы, конечно, дать и за что-то другое, но дали за открытие механизма адаптации клеток к концентрации кислорода. Не очень честно, если подумать: нобелевки «за кислород» — за понимание того, как мы им дышим и что происходит, когда его маловато — уже дали Отто Варбургу (1931) и Корнею Хеймансу (1938). А с другой стороны, это захватывающая научная история, а нам, научным журналистам, только такие и подавай: не все же время писать про скучное.
Историю надо бы начать с гормона с поэтичным названием эритропоэтин. Про этот гормон физиологи знают уже больше ста лет. Эритропоэтин синтезируется клетками почек при недостатке кислорода и включает усиленное производство эритроцитов.
Такое описание процесса казалось исчерпывающим вплоть до второй половины ХХ века, а потом наука физиология незаметно изменилась: никакой ответ на вопрос «Как?» уже не котировался, если в нем не упоминалось о генах и ДНК. И вот в 1980-х Грег Семенца задумался о том, как бы и в эту историю вплести упоминание о генах. Эритропоэтин — белок, а значит, у него есть ген. Очевидно, когда кислорода становится совсем мало, что-то этот ген включает, — так, видимо, рассудил Семенца и принялся искать в окрестностях гена кусочки ДНК, проявляющее свое действие в присутствии или отсутствии кислорода.
Тут его ждал первый сюрприз: как оказалось, этот регуляторный механизм работал не только с эритропоэтиновым геном. И далеко не только в клетках почек: самые разные типы клеток (человека и мышей) одинаковым образом откликались на гипоксию, причем в них включались целые букеты самых разных генов. Тем временем в Британии этой историей параллельно занимался другой нобелиат, Питер Ратклифф, и видел ровно то же самое.
Семенца оказался чуть упорнее и через несколько лет нашел то самое нечто, которое умеет включать разные гены в разных клетках в отсутствие кислорода. Он назвал этот белок «фактором, индуцируемым гипоксией» (HIF). Как эта штука реагировала на кислород? На первый взгляд, безумно просто: в присутствии кислорода HIF был нестабилен, а как только дышать становилось нечем, белок начинал накапливаться и включал требуемые букеты генов.
Но такими словами научный журналист может объясняться с его доверчивыми читателями, а ученым хотелось большего: с чего это он вдруг был нестабилен? Чем ему так вредит кислород?
 Фото: Michael Longmire/Unsplash
Фото: Michael Longmire/UnsplashЭту неуемную жажду познания помог утолить третий герой нашей истории, Уильям Кейлин, занимавшийся, казалось бы, совершенно посторонней проблемой. Есть такая «болезнь Гиппеля-Линдау», она же цереброретинальный ангиоматоз, при котором у больного образуются опухоли в разных частях тела, и очень часто на сетчатке глаза. Как раз опухолями и интересовался Уильям Кейлин, — он был врачом-онкологом. Самое же интересное в синдроме ГЛ было то, что он наследственный, а значит, у Кейлина была возможность выловить ген, из-за которого все эти бедняги болели раком.
Ген вскоре нашелся: в семьях, где встречался синдром ГЛ, действительно передавалась сломанная копия одного гена. И вот тут наблюдательный Кейлин заметил, что опухолевые клетки со сломанным геном ГЛ (его научное название VHL) вели себя так, как будто мучились от сильнейшей гипоксии. Очевидно, место гена ГЛ в этой истории надо было искать, как выражаются молекулярные генетики, «выше по течению» от HIF: после того, как накопился HIF, вроде бы все ясно, а вот причинно-следственная связь между кислородом и HIF мутновата, и там вполне могло найтись место еще одной ступеньке рассуждений.
Дальше началась добрая научная гонка: ее, конечно, сильно подстегнул тот факт, что в сюжете появился рак, а как раз в это время на исследования рака в США выделялись колоссальные деньги. И финишировали исследователи достойно: в 2001 года в одном номере Science были подряд опубликованы статьи группы Кейлина и группы Ратклиффа, где и излагались все подробности: что там такое происходит в клетках от кислорода.
Происходит кое-что с белком HIF: на две из его аминокислот навешиваются гидроксильные группы. Эта конфигурация — два торчащих из белковой молекулы гидроксипролила — выглядит довольно нетипично, и ее сразу же узнает ГЛ. Этот самый ГЛ, как оказалось — ничто иное как компонент клеточной мусороуборочной машины, которая отправляет на утилизацию ненужные белки. Именно эта участь и уготована HIF: вот он был, и вот его нет.
А что будет, если кислорода не хватает — или если один из винтиков этой машины вдруг сломается, как у больных синдромом Гиппеля-Линдау? Тогда HIF никуда не девается. Здоровый и бодрый, он включает один за другим все гены, ответственные за правильную реакцию клетки на гипоксию. Если при этом никакой гипоксии не было и в помине, а клетка оказалась опухолевой — все становится совсем неприятно.
Но есть и хорошие новости. Эта химическая машинка с навешиванием гидроксилов на пролин, последующим их узнаванием и отправкой всей этой штуковины в мусорный бак — идеальная по своей простоте мишень для всяких лекарств. Оставалось только эти лекарства изобрести, и победа над раком нам гарантирована.
Примерно этим ученые и занимались последующие 18 лет. Были особенно яркие моменты: в 2016 году лекарство компании Threshold Pharmaceuticals с треском провалило клинические испытания, и компания уволила 2/3 своих сотрудников — всех, вовлеченных в разработку этого бесплодного направления. Нечто похожее произошло и с другими героями — Cerulean. Восемнадцать лет и одну нобелевскую премию спустя после открытия надежды исп
snob.ru
