Молекулярная диагностика рака
Молекулярно-генетическое тестирование является неотъемлемой частью обследования и лечения онкологических больных во всем мире.
Причина появления опухоли – это мутации, т.е. генетические нарушения, возникшие в одной из миллиардов клеток человеческого организма. Эти мутации нарушают нормальную работу клеток, что приводит к их неконтролируемому и неограниченному росту, воспроизведению и распространению по организму — метастазированию. Однако наличие таких мутаций позволяет отличать опухолевые клетки от здоровых и использовать это знание при лечении больных.
Анализ опухоли каждого конкретного пациента и формирование индивидуального перечня потенциальных молекул-мишеней стало возможным благодаря внедрению методик молекулярно-генетического анализа в клиническую практику. Научная лаборатория молекулярной онкологии НМИЦ онкологии им.
Кому и чем могут помочь генетические исследования?
- Пациентам с установленным онкологическим диагнозом – поможет подобрать эффективную лекарственную терапию.
- Пациентам моложе 50 лет с диагнозом рак молочной железы, рак яичников, рак желудка или рак поджелудочной железы – определить наличие онкологической предрасположенности и скорректировать лечение.
- Здоровым людям с неблагоприятной семейной «онкологической историей» – определить наличие онкологической предрасположенности и заблаговременно провести профилактические мероприятия по раннему выявлению опухоли.
НМИЦ онкологии им. Н.Н. Петрова осуществляет полный комплекс мероприятий, связанных с диагностикой наследственной предрасположенности к раку молочной железы.
Н.Н. Петрова осуществляет полный комплекс мероприятий, связанных с диагностикой наследственной предрасположенности к раку молочной железы.
Подробнее узнать о Группе молекулярно-генетических методов исследований референс-центра по ссылке.
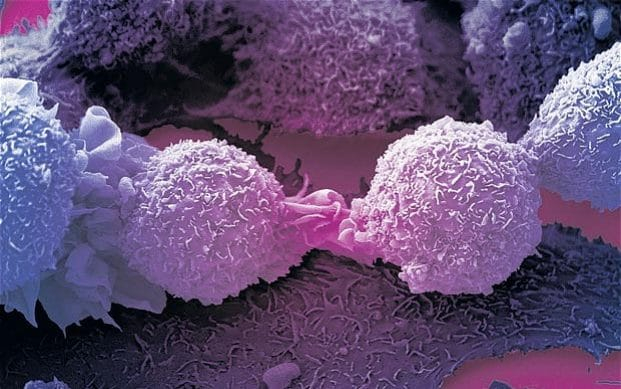
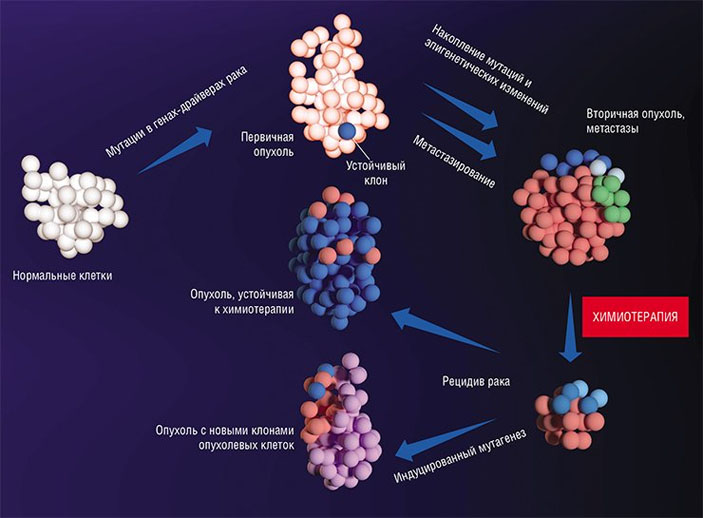
Мутации в раковых клетках подчиняются эволюционным законам
Структура опухоли заметно отличается от структуры здоровых тканей.‹
›
Рак возникает из-за мутаций, вызывающих бесконтрольное деление клеток. Долгое время считалось, что мутации случайным образом накапливаются в клеточной ДНК, «одаряя» раковые клетки разными свойствами, например устойчивостью к лекарствам. Однако опухоль живёт не сама по себе, она находится в организме рядом с множеством клеток и тканей. Можно сказать, что у неё есть определённое окружение, с которым она делит питательные вещества и жизненное пространство. Взаимоотношения между раковыми клетками и их соседями напоминают отношения между живыми организмами в экосистемах. Так нельзя ли применить к развивающейся опухоли те же эволюционные законы, которые мы обычно обнаруживаем в популяциях животных, растений, бактерий?
Одни животные, например слоны, делают ставку на большую продолжительность жизни, но оставляют мало потомства.
Чтобы проверить это предположение, Роберт Гатнби (Robert A. Gatenby) и его коллеги из Онкоцентра им. X. Ли Моффита (США) создали компьютерную модель, в которой можно отслеживать судьбу мутаций в раковых клетках. Действительно, оказалось, что частота различных дефектов в ДНК не случайна, а зависит от того, что тот или иной дефект даёт клетке, повышает ли он её шансы выжить самой либо дать потомство. Обычно «раковые» мутации делят на две группы: мутации-драйверы (или, если угодно, ведущие мутации), которые помогают опухоли расти, и мутации-«пассажиры», которые никакого эффекта на рост не оказывают и просто так переходят из поколения в поколение. Влияние тех и других на развитие опухоли зависит от конкретных условий внешней среды: кровоснабжения, конкуренции с другими клетками и т. д. Кроме того, роль мутации может меняться: мутация-драйвер может становиться «пассажиром» и наоборот.
Обычно «раковые» мутации делят на две группы: мутации-драйверы (или, если угодно, ведущие мутации), которые помогают опухоли расти, и мутации-«пассажиры», которые никакого эффекта на рост не оказывают и просто так переходят из поколения в поколение. Влияние тех и других на развитие опухоли зависит от конкретных условий внешней среды: кровоснабжения, конкуренции с другими клетками и т. д. Кроме того, роль мутации может меняться: мутация-драйвер может становиться «пассажиром» и наоборот.
Поскольку мутации-драйверы помогают опухоли расти, то и новые способы лечения разрабатываются против них. Новое лекарство может быть очень эффективным, может уничтожить множество раковых клеток и сильно уменьшить размер опухоли, однако в результате эволюционное преимущество получают те злокачественные клетки, у которых не было этого конкретного драйвера и которые, следовательно, оказались устойчивы к терапии — в таком случае мутацией-драйвером может стать бывший «пассажир».
Кстати говоря, два года назад Роберт Гатнби вместе с сотрудниками уже обсуждали проблему лекарственной устойчивости опухолей в свете эволюционного подхода. В статье в «Nature Reviews Cancer» авторы работы уподобляли химиотерапию селекции: подобно тому, как человек старается отобрать самые холодоустойчивые сорта пшеницы, в случае с раком он, сам того не желая, отбирает те клетки, которые устойчивы к лекарству. То есть устойчивость к терапии у раковых клеток неизбежно будет возникать, по крайней мере, до тех пор, пока мы при разработке новых лекарств будем исходить из текущего состояния опухоли, вместо того чтобы попытаться сыграть на опережение. Опухоль, как и всякая популяция, приспосабливается к текущим условиям, но она не в силах предсказать, как именно они будут меняться. Грубо говоря, от врачей требуется «удивить» опухоль так, чтобы она не смогла прийти в себя, — примерно так, как в своё время «удивились» динозавры перед тем как вымереть.
В статье в «Nature Reviews Cancer» авторы работы уподобляли химиотерапию селекции: подобно тому, как человек старается отобрать самые холодоустойчивые сорта пшеницы, в случае с раком он, сам того не желая, отбирает те клетки, которые устойчивы к лекарству. То есть устойчивость к терапии у раковых клеток неизбежно будет возникать, по крайней мере, до тех пор, пока мы при разработке новых лекарств будем исходить из текущего состояния опухоли, вместо того чтобы попытаться сыграть на опережение. Опухоль, как и всякая популяция, приспосабливается к текущим условиям, но она не в силах предсказать, как именно они будут меняться. Грубо говоря, от врачей требуется «удивить» опухоль так, чтобы она не смогла прийти в себя, — примерно так, как в своё время «удивились» динозавры перед тем как вымереть.
В работе, опубликованной в «Nature Communications», Гатнби вместе с коллегами обобщают свои предположения на основе новых результатов. Разработанная эволюционно-компьютерная модель позволила не только увидеть динамику разных типов мутаций в раковых клетках, но и вычислить гены, которые у них никогда не мутируют.
Но противораковые гены, как было сказано, нашли с помощью компьютерного моделирования. А есть ли они в действительности? Оказывается, есть: поиск по медицинским базам данных, в которых собрана информация о различных видах рака, выявил около 1100 человеческих генов, в которых у раковых клеткок никогда не бывает мутаций. Возможно, такие гены могли бы стать «точкой опоры» при разработке терапии нового поколения: целенаправленно внося изменения в их ДНК, можно было бы справиться с любыми видами злокачественных опухолей.
Напоследок стоит сказать, что специалисты из Онкоцентра им. X. Ли Моффита не единственные, кто разрабатывает эволюционный подход относительно рака. Например, несколько лет назад Пол Дэвис (P. Davies) из Аризонского государственного университета (г. Темп) и его коллега из Австралийского национального университета описали в «Physical Biology» своеобразную эволюционную модель устройства рака, в которой опухоль рассматривалась как единый многоклеточный организм, существующий внутри нас в роли атавизма, тяжёлого наследия эволюционного прошлого. Так можно было объяснить некоторые особенности её жизнедеятельности, например формирование в толще злокачественного образования сети кровеносных сосудов для лучшего снабжения питательными веществами. Правда, выводы из этой модели в целом были более оптимистичными: из неё, в частности, следовало, что способность опухолей противостоять медикаментозному лечению рано или поздно должна сойти на нет.
Темп) и его коллега из Австралийского национального университета описали в «Physical Biology» своеобразную эволюционную модель устройства рака, в которой опухоль рассматривалась как единый многоклеточный организм, существующий внутри нас в роли атавизма, тяжёлого наследия эволюционного прошлого. Так можно было объяснить некоторые особенности её жизнедеятельности, например формирование в толще злокачественного образования сети кровеносных сосудов для лучшего снабжения питательными веществами. Правда, выводы из этой модели в целом были более оптимистичными: из неё, в частности, следовало, что способность опухолей противостоять медикаментозному лечению рано или поздно должна сойти на нет.
что это и зачем это вам?
После установки диагноза рак легкого вас ждет еще несколько важных исследований, среди которых может быть и молекулярно-генетическое. В чем его важность и как проводят этот анализ?
Что такое мутации?
Чтобы понять суть предстоящего вам исследования, придется разобраться, как же так случилось, что нормальная, здоровая клетка вдруг стала злокачественной, способной к неограниченному делению. Напомним, что клетки – это маленькие кирпичики, основная структурная единица в нашем теле. Из них состоят все органы и системы человеческого организма. Клетки имеют различные функции, выполнение которых возложено на органеллы – компоненты, обеспечивающие существование клетки. К ним относится и клеточное ядро, в котором заключен генетический материал, или геном. Он содержит всю биологическую информацию, которая необходима для развития и существования живого организма.
Напомним, что клетки – это маленькие кирпичики, основная структурная единица в нашем теле. Из них состоят все органы и системы человеческого организма. Клетки имеют различные функции, выполнение которых возложено на органеллы – компоненты, обеспечивающие существование клетки. К ним относится и клеточное ядро, в котором заключен генетический материал, или геном. Он содержит всю биологическую информацию, которая необходима для развития и существования живого организма.
Внутри каждого ядра находится 46 хромосом, по 23 от каждого родителя. Хромосомы содержат множество генов, состоящих из ДНК (дезоксирибонуклеиновой кислоты). Эти гены и контролируют, как работают клетки.
Природой заложено так, что гены функционируют в штатном режиме, и все происходящие в нашем организме процессы находятся под чутким их «руководством». Однако со временем ситуация может измениться: гены повреждаются, «теряются» или копируются дважды. В генетике эти перемены называют мутациями (от латинского mutatio – изменение). Следует сразу же отметить, что изменения в генах всегда имеют необратимый характер.
Следует сразу же отметить, что изменения в генах всегда имеют необратимый характер.
Известны два основных типа генных мутаций:
- Приобретенные мутации происходят вследствие повреждения генов на протяжении жизни человека. Они не передаются по наследству. Причин приобретенных мутаций множество – это негативное воздействие никотина, ультрафиолетового излучения, вирусов, мутагенных веществ, находящихся в воздухе или пище, и другие факторы. Развитию приобретенных мутаций способствуют некоторые вирусы. Известно, что вероятность появления «ошибок» увеличивается с возрастом. Иногда они имеют случайный характер.
- Генетические мутации передаются от родителей детям через дефектные гены и хромосомы. Они встречаются реже, чем приобретенные. При генетических мутациях изменения могут происходить в каждой клетке человеческого организма, включая репродуктивные мужские и женские клетки, что и обусловливает передачу «поломок» по наследству.
Мутации и рак
Ген – это инструкция, которая «предписывает» каждой клетке нашего организма, что ей делать и как жить.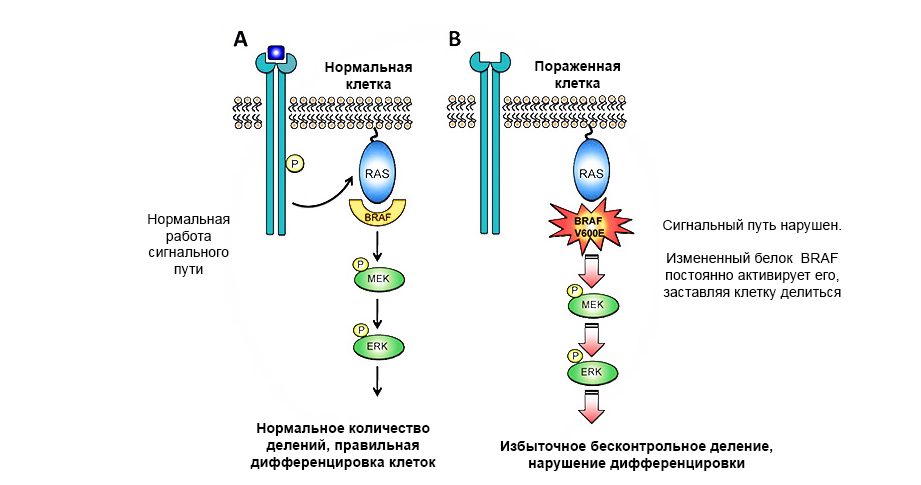 Заложенная в инструкции программа «решает», что это за клетка, в чем состоит ее функция, когда ей нужно делиться, а когда приходит пора погибнуть. Здоровые гены уверенно контролируют процесс роста и воспроизводства клеток, и он имеет упорядоченный и предсказуемый характер. Появление мутаций нарушает этот механизм. Как и вышедший из строя центр управления на космическом корабле, мутировавшие гены становятся причиной сложной «ошибки», имеющей порой фатальные последствия для всей системы.
Заложенная в инструкции программа «решает», что это за клетка, в чем состоит ее функция, когда ей нужно делиться, а когда приходит пора погибнуть. Здоровые гены уверенно контролируют процесс роста и воспроизводства клеток, и он имеет упорядоченный и предсказуемый характер. Появление мутаций нарушает этот механизм. Как и вышедший из строя центр управления на космическом корабле, мутировавшие гены становятся причиной сложной «ошибки», имеющей порой фатальные последствия для всей системы.
Мутации, «запускающие» злокачественный процесс, могут появляться в самых разных генах.
Известны четыре основных типа генов, вовлеченных в процесс деления клеток, и большинство опухолей имеют дефектные копии более чем одного из них:
- Гены, активизирующие размножение клеток (онкогены).
При нормальных обстоятельствах они «сообщают» клеткам, когда им «пора» делиться. Их можно сравнить с педалью газа в автомобиле. Пока на нее не нажимают, машина не двигается, но стоит вдруг сильно надавить на газ – и она понесется вперед со страшной скоростью. Так и с онкогенами: в норме они совершенно безобидны, но стоит им «сломаться» – и клетки начнут делиться с неистовой силой.
Так и с онкогенами: в норме они совершенно безобидны, но стоит им «сломаться» – и клетки начнут делиться с неистовой силой. - Гены, останавливающие деление клеток (гены супрессоры опухолей).
Обычно клетки могут «ремонтировать» генные поломки. Если они очень серьезны, гены супрессоры опухолей останавливают рост и деление клеток. Мутации в генах супрессорах опухолей приводят к тому, что клетка перестает понимать «инструкцию» и начинает бесконтрольно размножаться. Так развивается рак.
Наиболее известным геном супрессором опухоли является р53.
Он поврежден у большинства больных раком.
- Гены, восстанавливающие другие поврежденные гены (гены восстановления ДНК).
ДНК в каждой клетке организма постоянно находится под угрозой повреждения, однако ему противостоят различные белки, содержащиеся в клетках. Благодаря этому большинство повреждений ДНК немедленно устраняется без каких-либо последствий. Если же повреждается ген, ответственный за производство этого чудесного «восстановительного» белка, клетка становится неспособной к восстановлению. Со временем число «ошибок» нарастает, и развивается рак.
Со временем число «ошибок» нарастает, и развивается рак.
Ученые выяснили, что гены восстановления ДНК повреждаются при ряде раковых заболеваний, в том числе раке кишечника.
- Гены, программирующие гибель клетки (гены саморазрушения).
Ряд генов сообщают слишком «возрастной» или поврежденной клетке о самоуничтожении. Этот процесс называют апоптозом, или запрограммированной гибелью клеток. Они погибают всякий раз, когда какие-то процессы выходят из-под контроля, предотвращая таким образом развитие опухоли. Повреждение генов саморазрушения приводит к тому, что неисправная клетка выживает, превращаясь в злокачественную.
Независимо от того, какие точно перемены «запускают» мутировавшие гены, их результат приводит к изменениям в клетке или группе клеток, вследствие чего они начинают расти и многократно делиться, образуя опухоль.
Наш организм состоит из более чем ста миллионов миллионов клеток. Рак может начинаться с изменений в одной-единственной из них. Прежде чем нормальная клетка превратится в злокачественную, должно произойти несколько мутаций.
Рак может начинаться с изменений в одной-единственной из них. Прежде чем нормальная клетка превратится в злокачественную, должно произойти несколько мутаций.
Приобретенные мутации – причина развития так называемого спорадического рака. Они считаются самой распространенной причиной злокачественных новообразований. Наследственные же поломки несут ответственность всего за 5-10% случаев рака.
Большая разница
Изменения в генах, ответственных за клеточное деление, бывают разными. От онкологов, химиотерапевтов вы можете слышать множество терминов: мутации, слияния, альтерации, транслокации, трансформации, делеции, перестановки – все они описывают различные «поломки», происходящие внутри клеток и вызвавшие их аномальное, губительное для вашего организма поведение.
При раке легкого могут происходить мутации в ряде генов, о которых некоторым из вас придется слышать регулярно.
Таблица. Гены, в которых могут происходить изменения при раке легкого.
| Символ | Название гена |
| EGFR | Рецептор эпидермального фактора роста |
| ALK | Рецептор тирозинкиназы анапластической лимфомы |
| KRAS | Вирусный онкогенный гомолог саркомы крыс 2 Кирстен |
| ROS1 | ROS протоонкоген 1, рецептор тирозинкиназы |
| MET | MET протоонкоген, рецептор тирозинкиназы |
| ERBB2 (HER2) | Erb2 рецептор тирозинкиназы 2 (также известен как человеческий рецептор эпидермального фактора роста 2) |
| BRAF | B-Raf протоонкоген, серин/треонин киназа |
| RET | Ret протоонкоген |
| FGFR1 | Рецептор 1 фактора роста фибробластов |
Как вы видите, мутации, которые вызывают рак легкого, могут происходить во множестве генов.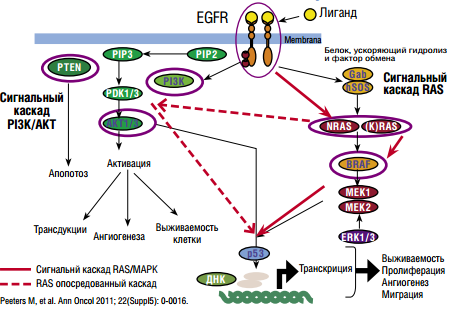
В онкологии мутации, с которыми связано развитие злокачественных заболеваний, иногда называют «драйвер-мутациями» (от английского driver – водитель).
Еще каких-то 15 лет назад онкологам было совершенно неважно, в каком именно геноме произошли трагические изменения, запустившие злокачественный процесс. Однако в нулевых годах от этих данных стало зависеть и дальнейшее лечение рака легкого, и даже течение заболевания.
Существенные коррективы в терапию рака легкого внесли результаты исследований, доказавших эффективность ряда препаратов. Эти препараты способны ингибировать, то есть блокировать активность «целевых» рецепторов, в которых произошли мутации и, действуя непосредственно на причину злокачественного процесса, останавливать деление раковых клеток. За способность прицельно попадать в мишень эти средства получили название таргетных (от английского слова target – цель).
Сегодня таргетная, или молекулярно-таргетная терапия – это целое направление лечения рака, которое используется наряду с химиотерапией.
За последние годы в арсенале онкологов появился ряд таргетных препаратов, в том числе и действующих при мутациях, ассоциированных с раком легкого. Каждый из них «работает» только при наличии «целевой» мутации. Поэтому, чтобы подобрать препарат, онкологам важно знать, есть ли в вашей опухоли мутация и если да, то какая именно. Для этого каждый больной раком легкого стразу же после установки диагноза должен пройти молекулярно-генетическое тестирование, которое и позволяет выявить «драйвер-мутации».
Когда проводят молекулярно-генетическое тестирование?
Чтобы выявить «драйвер-мутации», врачам понадобится образец вашей опухоли. Его получают во время биопсии, которая является необходимым и очень важным диагностическим этапом.
Биопсия – это метод исследования, в ходе которого врачи иссекают небольшой участок органа или опухолевой ткани и тщательно изучают его клеточный состав.
Молекулярное исследование опухоли – ключ к пониманию изменений, которые произошли в вашем организме и спровоцировали развитие рака. С его помощью онкологи смогут подобрать тот препарат, который будет максимально эффективно работать именно в вашем случае.
С его помощью онкологи смогут подобрать тот препарат, который будет максимально эффективно работать именно в вашем случае.
Биопсия чаще всего проводится еще на этапе диагностики. Во время изучения образца тканей врач-паталогоанатом подтверждает наличие в ней опухолевых клеток, определяет тип рака легкого – мелкоклеточный или немелкоклеточный, указывает гистологической тип опухоли (аденокарцинома, плоскоклеточная карцинома и так далее) и проводит молекулярно-генетическое тестирование на наличие мутаций. На основании полученной картины онкологи и составляют дальнейшую схему лечения.
Выявление «драйвер-мутаций» является основанием для назначения таргетных препаратов, которые целенаправленно «отключают» процессы неудержимого роста и размножения злокачественных клеток, запущенные генными «поломками». На таргетную терапию положительно отвечает подавляющее большинство больных, опухоли которых имеют соответствующую мутацию. Но, к сожалению, раковые клетки пока оказываются хитрее фармакологов.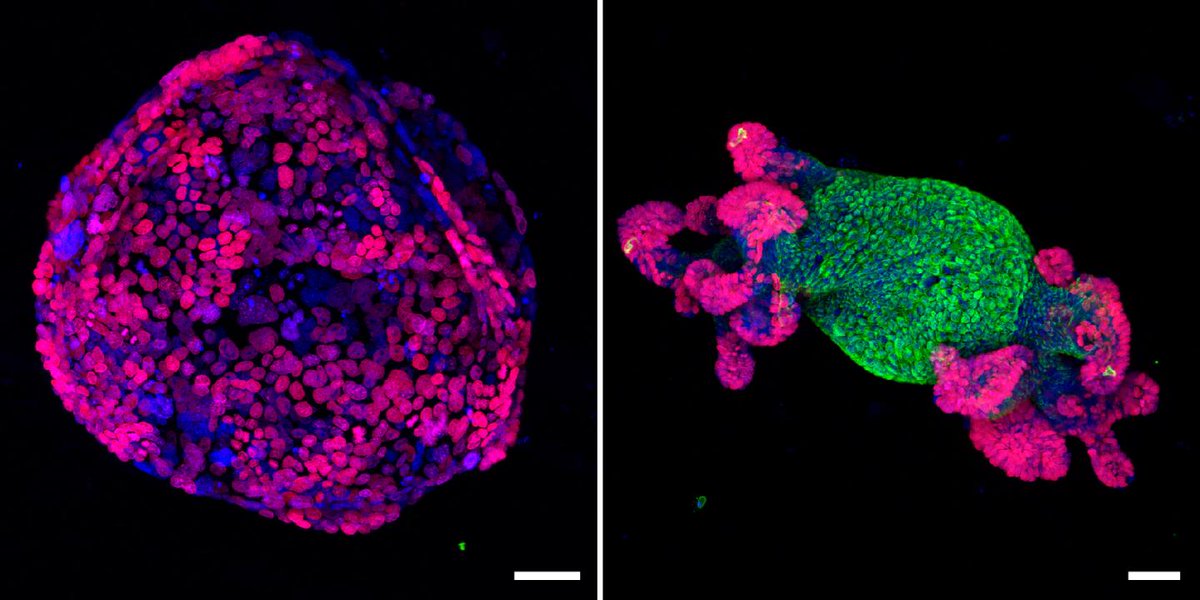 Примерно через год после начала таргетной терапии в опухоли появляются новые «поломки», после чего она становится устойчива к целевым препаратам.
Примерно через год после начала таргетной терапии в опухоли появляются новые «поломки», после чего она становится устойчива к целевым препаратам.
Выявление на фоне таргетной терапии признаков прогрессирования рака свидетельствует о развитии устойчивости. Чаще всего это происходит из-за появления новых мутаций, например, мутации Т790М.
Если таргетная терапия перестала «работать», онколог может предложить вам пройти повторную биопсию, чтобы провести молекулярно-генетическое тестирование еще раз. Результаты исследования помогут понять причину устойчивости (например, выявить новую мутацию) и определиться с дальнейшей тактикой лечения.
Сегодня молекулярно-генетическое тестирование является неотъемлемой частью комплексной диагностики рака легкого. Его результаты доступны уже через 1-3 недели после забора материала, что позволяет онкологам как можно быстрее приступить к наиболее эффективному лечению рака легкого.
Наследственные формы рака
Онкогеномика.
 Мастер-класс проф. Д.В. Залетаева
Мастер-класс проф. Д.В. ЗалетаеваНаследственные формы рака
Классическим примером гена-супрессора, осуществляющего негативную регуляцию клеточного цикла, является ген RB1. Наследственные формы рака молочной железы составляют около 5%. Мутации двух генов, BRCA1 и BRCA2, участвующих в репарации двухцепочечных разрывов, имеют практически равноценный вклад. Кроме рака молочной железы, герминальные мутации BRCA1 повышают риск возникновения рака яичников, а мутации BRCA2 предрасполагают к раку молочной железы у мужчин и раку поджелудочной железы. В то же время соматические мутации этих генов довольно редки при указанных новообразованиях. Спектр мутаций показывает, что их основная масса приводит к потери функции гена и представлена небольшими делециями и инсерциями, в том числе и в регуляторных областях генов. Две мутации BRCA1, 185delAG и 5382insC, составляют 20%, а мутации 617delT и 997del5 гена BRCA2 составляют почти 33%. Все мутации BRCA2, определяющие высокий риск развития рака яичников, локализуются в 3,3 т.п.н. экзона 11.
Все мутации BRCA2, определяющие высокий риск развития рака яичников, локализуются в 3,3 т.п.н. экзона 11.
Наследственная форма неполипозного рака толстой кишки развивается в результате мутаций в генах MSh3 и MLh2, участвующих в образовании репарационных комплексов. Наиболее характерным признаком заболевания является нестабильность микросателлитных последовательностей. У женщин, имеющих герминальную мутацию в одном из этих генов, чаще всего возникают рак яичников и эндометрия. Среди мутаций MSh3 наиболее часто обнаруживается замена A→T в донорном сайте сплайсинга, приводящая к делеции 5 экзона. Для MLh2 преимущественного типа мутаций не показано, но установлено, что основным механизмом инактивации гена в опухолях является метилирование его промоторного района.
Предрасположенность к возникновению ретинобластомы обусловлена герминальной мутацией в одном из аллелей гена RB1, передающейся потомству по аутосомно-доминантному типу наследования с варьированием экспрессивности и неполной (90%) пенетрантностью. Опухоль развивается при инактивации неповрежденного аллеля гена, происходящей с высокой вероятностью в клетках сетчатки у детей в раннем возрасте или даже внутриутробно. Так как мишенью возникновения второй мутации могут быть и другие соматические клетки, то у пациентов, несущих герминальную мутацию в RB1, существует большой риск развития таких опухолей, как остеосаркома, лимфолейкоз, МРЛ, РМЖ, опухоли половых органов, поэтому за больными с наследственной формой заболевания необходимо наблюдение. Соматические мутации гена вызывают только ретинобластому, хотя нарушения функции RB1 обнаруживают во многих других опухолях, но уже как вторичные, являющиеся признаком дестабилизации генома опухолевой клетки.
Опухоль развивается при инактивации неповрежденного аллеля гена, происходящей с высокой вероятностью в клетках сетчатки у детей в раннем возрасте или даже внутриутробно. Так как мишенью возникновения второй мутации могут быть и другие соматические клетки, то у пациентов, несущих герминальную мутацию в RB1, существует большой риск развития таких опухолей, как остеосаркома, лимфолейкоз, МРЛ, РМЖ, опухоли половых органов, поэтому за больными с наследственной формой заболевания необходимо наблюдение. Соматические мутации гена вызывают только ретинобластому, хотя нарушения функции RB1 обнаруживают во многих других опухолях, но уже как вторичные, являющиеся признаком дестабилизации генома опухолевой клетки.
Наследственные формы меланомы, синдрома диспластического невуса и атипичных родинок в ряде случаев вызываются герминальными мутациями гена-супрессора CDKN2A/p16. В семьях, несущих мутацию CDKN2A, кроме меланомы обнаруживаются опухоли поджелудочной железы, ОГШ.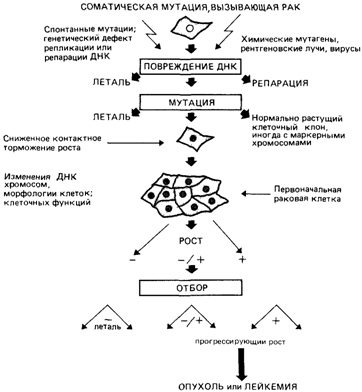 В то же время функциональная и структурная инактивация гена, обеспечивающего негативную регуляцию клеточного цикла путем ингибирования циклин-зависимых киназ, обнаруживается в различных типах опухолей, но преимущественно в мезотелиомах, спорадических меланомах и глиобластомах. Почти треть соматических мутаций гена представлена делециями, в то время как среди герминальных мутаций делеции и инсерции составляют не более 5%.
В то же время функциональная и структурная инактивация гена, обеспечивающего негативную регуляцию клеточного цикла путем ингибирования циклин-зависимых киназ, обнаруживается в различных типах опухолей, но преимущественно в мезотелиомах, спорадических меланомах и глиобластомах. Почти треть соматических мутаций гена представлена делециями, в то время как среди герминальных мутаций делеции и инсерции составляют не более 5%.
Нефробластома – генетически гетерогенное заболевание, но около трети случаев – результат инактивации гена-супрессора WT1.
Гемизиготные делеции хромосомного района 11p13 вызывают синдром WAGR, при котором кроме опухоли Вильмса обнаруживаются аномалии развития мочеполового тракта, аниридия и задержка физического и умственного развития.
Точковые мутации в 7-10 экзонах, кодирующих мотив цинковых пальцев, определяются у больных с синдромом Дениса-Драша, для которого характерна прогрессирующая нефропатия, псевдогермафродитизм, нефро— и гонадобластомы. Соматические точковые и структурные мутации гена выявлены в мезотелиомах, десмопластических мелко-кругло-клеточных опухолях и при острых лейкозах.
Соматические точковые и структурные мутации гена выявлены в мезотелиомах, десмопластических мелко-кругло-клеточных опухолях и при острых лейкозах.
К хранителям клеточного цикла относятся оба гена NF1 и NF2, вызывающие нейрофиброматоз I и II типов, но выполняющие в геноме различную функцию. Первый обеспечивает негативную регуляцию онкогена Ras, второй стабилизирует клеточные контакты. Мутации и структурные перестройки первого гена вызывают шванномы периферической нервной системы, а второго – шванномы ЦНС и менингиомы. Изменений этих генов не обнаружено в опухолях другого происхождения.
Синдромы множественной эндокринной неоплазии I и II типов (МЭН 1, МЭН 2) возникают в результате мутаций в гене-супрессоре MEN1 и протоонкогене RET соответственно. В случае синдрома МЭН 1 могут развиваться карциноидные опухоли, ангиофибромы лица, липомы, коллагеномы, гастриномы и инсулиномы.
Герминальные миссенс-мутации RET выявлены у пациентов с синдромом МЭН 2A (медуллярный рак щитовидной железы, феохромоцитома, гиперплазия паращитовидных желез, ганглионейромы слизистой ротовой полости) и семейной формой медуллярного РЩЖ, причем мутации в основном затрагивают пять цистеиновых кодонов в 10 и 11 экзонах и на них приходится 97% и 85% всех мутаций в этих экзонах соответственно.
Спорадические мутации в тирозинкиназном домене гена более характерны для синдрома МЭН 2В, отличающегося от типа 2А более агрессивным течением и отсутствием гиперплазии паращитовидных желез и ганглионейром, а точковая мутация в экзоне 16 (T918C) была идентифицирована в 93% случаев.
Синдром фон Хиппель-Линдау наследуется аутосомно-доминантно с частотой 1 на 36 тыс. Среди злокачественных новообразований, являющихся диагностическим признаком и позволяющих выделить 4 типа заболевания, наиболее часто встречаются гемангиобластомы ЦНС, карциномы почки, феохромоцитомы и опухоли поджелудочной железы. При заболевании обнаруживаются мутации в гене VHL, клонированном в коротком плече хромосомы 3p25.5. Мутации представлены большими делециями, мутациями сдвига рамки считывания и миссенс-мутациями, повреждающими преимущественно 1 и 3 экзоны. Соматические мутации, повреждающие 1 и 2 экзоны гена, выявлены только в светлоклеточном раке почки. Почти в 20% опухолей обнаружено аномальное метилирование промоторной области гена.
При заболевании обнаруживаются мутации в гене VHL, клонированном в коротком плече хромосомы 3p25.5. Мутации представлены большими делециями, мутациями сдвига рамки считывания и миссенс-мутациями, повреждающими преимущественно 1 и 3 экзоны. Соматические мутации, повреждающие 1 и 2 экзоны гена, выявлены только в светлоклеточном раке почки. Почти в 20% опухолей обнаружено аномальное метилирование промоторной области гена.
Семейный аденоматозный полипоз желудочно-кишечного тракта – аутосомно-доминантное заболевание, вызываемое мутациями в гене APC. Вариантом заболевания является синдром Гарднера, при котором преимущественно поражается толстый кишечник. При заболевании достаточно часто выявляются гепатоцеллюлярный рак, опухоли щитовидной железы, медуллобластомы, фибромы и другие опухоли. Основным типом мутаций являются делеции и нонсенс-мутации, приводящие к преждевременной терминации синтеза белка.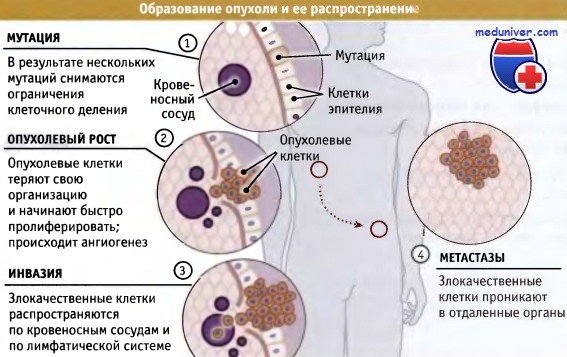 Герминальные мутации преимущественно повреждают первую половину гена, причем обнаружено два «горячих» кодона – 1061 и 1309. Мутации последнего кодона приводят к раннему появлению полипов и быстрой малигнизации. Соматические мутации в основном локализуются в районе кодонов 1286-1513, с преимущественным повреждением кодонов 1309 и 1450.
Герминальные мутации преимущественно повреждают первую половину гена, причем обнаружено два «горячих» кодона – 1061 и 1309. Мутации последнего кодона приводят к раннему появлению полипов и быстрой малигнизации. Соматические мутации в основном локализуются в районе кодонов 1286-1513, с преимущественным повреждением кодонов 1309 и 1450.
Синдром Горлина или базально-клеточных невусов – редкое аутосомно-доминантное заболевание (частота 1:57000), возникает в результате мутаций в гене-супрессоре PTC1, представленных в 86% делециями и инсерциями, равномерно распределенными по длине гена. Проявляется множественными аномалиями развития, невусами и различными новообразованиями, наиболее частыми среди которых являются базально-клеточные рак кожи, медуллобластомы, астроцитомы, фибромы и аденокарциномы яичников. Во всех опухолях у синдромальных пациентов и в спорадических базально-клеточных карциномах обнаруживается потеря гетерозиготности по маркерам района хромосомы 9q22.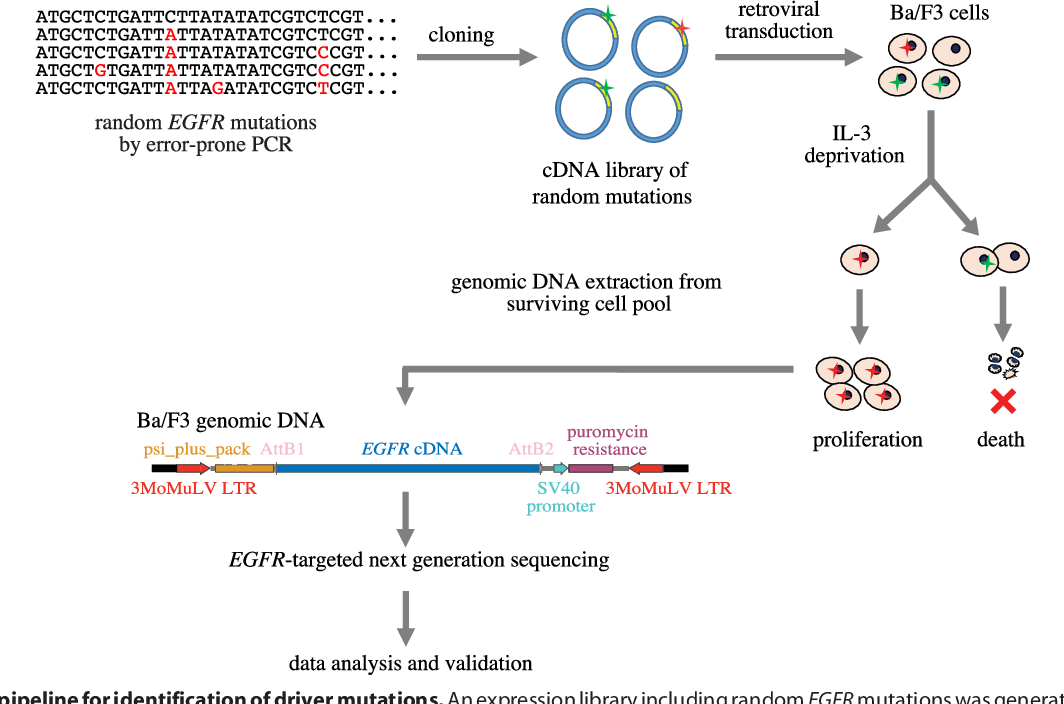 3.
3.
Целая группа синдромов – Ковдена, Банаяна-Зонана, Банаяна-Райли-Рувалкаба и часть случаев ювенильного полипоза характеризуется сходными фенотипическими аномалиями и предрасположенностью к злокачественным новообразованиям. Причиной всех заболеваний является патология гена-супрессора PTEN. У больных наиболее часто встречаются рак молочной железы, предстательной железы, яичников, эндометрия, щитовидной железы. Мутации равномерно повреждают весь ген и представляют полный спектр. Только при синдроме Ковдена установлено, что 43% мутаций повреждают 5 экзон, а в экзонах 1, 4 и 9 мутаций не описано. Соматические делеции и мутации PTEN обнаружены в глиобластомах, раках простаты, молочной железы и неходжкинских лимфомах.
Герминальные миссенс-мутации гена-супрессора p53, участвующего в задержке клеточного цикла необходимой для репарации ДНК, приводят к довольно редкому синдрому Ли-Фраумени, при котором типичными являются опухоли мозга, саркомы костей и мягких тканей, лейкозы и РМЖ. Выявлена кластеризация мутаций в районе 14 кодонов (245-258). В то же время различные повреждения гена выявляют практически во всех типах опухолей. Частота миссенс-мутаций гена составляет 74%, сдвига рамки считывания – 11%, нонсенс-мутаций – 7%, мутаций сайта сплайсинга – 4%. Определено 7 «горячих» точек, повреждаемых мутациями: кодоны 130-142, 151-164, 171-181, 193-200, 213-223, 234-258 и 270-286, причем все они локализованы в эволюционно консервативном ДНК-связывающем домене, кодируемом экзонами 5-8. Мутации кодонов 157 и 179 наиболее часто выявляются при раке легкого, кодона 175 – при раке толстой кишки, кодона 248 – при плоскоклеточном раке головы и шеи, кодона 249 – при гепатоцеллюлярном раке и кодона 278 – при опухолях кожи.
Выявлена кластеризация мутаций в районе 14 кодонов (245-258). В то же время различные повреждения гена выявляют практически во всех типах опухолей. Частота миссенс-мутаций гена составляет 74%, сдвига рамки считывания – 11%, нонсенс-мутаций – 7%, мутаций сайта сплайсинга – 4%. Определено 7 «горячих» точек, повреждаемых мутациями: кодоны 130-142, 151-164, 171-181, 193-200, 213-223, 234-258 и 270-286, причем все они локализованы в эволюционно консервативном ДНК-связывающем домене, кодируемом экзонами 5-8. Мутации кодонов 157 и 179 наиболее часто выявляются при раке легкого, кодона 175 – при раке толстой кишки, кодона 248 – при плоскоклеточном раке головы и шеи, кодона 249 – при гепатоцеллюлярном раке и кодона 278 – при опухолях кожи.
Атаксия-телангиоэктазия – аутосомно-рецессивное заболевание, сопровождающееся ломкостью хромосом, причем ионизирующее излучение повышает нестабильность кариотипа. При заболевании наиболее часто обнаруживаются Т-клеточные лейкозы, В-лимфомы, медуллобластомы и глиомы. Причиной являются гомозиготные мутации или делеции гена ATM, регулирующего клеточный цикл, причем делеции составляют основную массу патологии. У гетерозиготных носителей герминальных мутаций часто возникают карциномы молочной железы. Основным типом являются мутации, приводящие к преждевременной терминации синтеза белка.
Причиной являются гомозиготные мутации или делеции гена ATM, регулирующего клеточный цикл, причем делеции составляют основную массу патологии. У гетерозиготных носителей герминальных мутаций часто возникают карциномы молочной железы. Основным типом являются мутации, приводящие к преждевременной терминации синтеза белка.
Недавно клонирован еще один ген, участвующий в репарации двухцепочечных разрывов ДНК. Герминальные мутации гена NBS1 приводят к синдрому Ниджмиген – очень редкому аутосомно-рецессивному заболеванию, основными признаками которого являются аномалии фенотипа, иммунодефицит, предрасположенность к возникновению опухолей (лимфома, лимфолейкоз, нейробластома) и нестабильность хромосом, чувствительных к ионизирующему излучению. Наиболее характерными мутациями гена являются делеции и инсерции, преимущественно повреждающие 6 и 7 экзоны, а мутация 675del5 выявлена у 90% пациентов.
Клонирование генов, вовлеченных в развитие наследственных онкологических заболеваний, практически полностью изменило тактику медико-генетического консультирования, определение конкретной мутации конкретного гена в семье позволяет эффективно проводить пренатальную диагностику.
Молекулярно-генетическое тестирование пациентов с немелкоклеточным раком легкого
Значительные успехи в понимании патогенеза и лечения немелкоклеточного рака легкого (НМРЛ), открытие биологической и терапевтической важности приобретенных генетических изменений в двух генах, кодирующих фармакологически целевые тирозинкиназы рецептора эпидермального фактора роста (EGFR) и киназы анапластической лимфомы (ALK), внесли существенные коррективы в алгоритмы диагностики и, прежде всего, обусловили необходимость обязательного молекулярно-генетического тестирования пациентов.
Основы молекулярно-генетического тестирования
Целесообразность молекулярно-генетического тестирования опухолей легкого стала очевидной после публикации результатов IPASS – первого рандомизированного исследования, продемонстрировавшего преимущества терапии ингибитором тирозинкиназы (ИТК) EGFR гефитинибом у пациентов с прогрессирующим НМРЛ при наличии мутации EGFR по сравнению со стандартной химиотерапией на основе препаратов платины [1].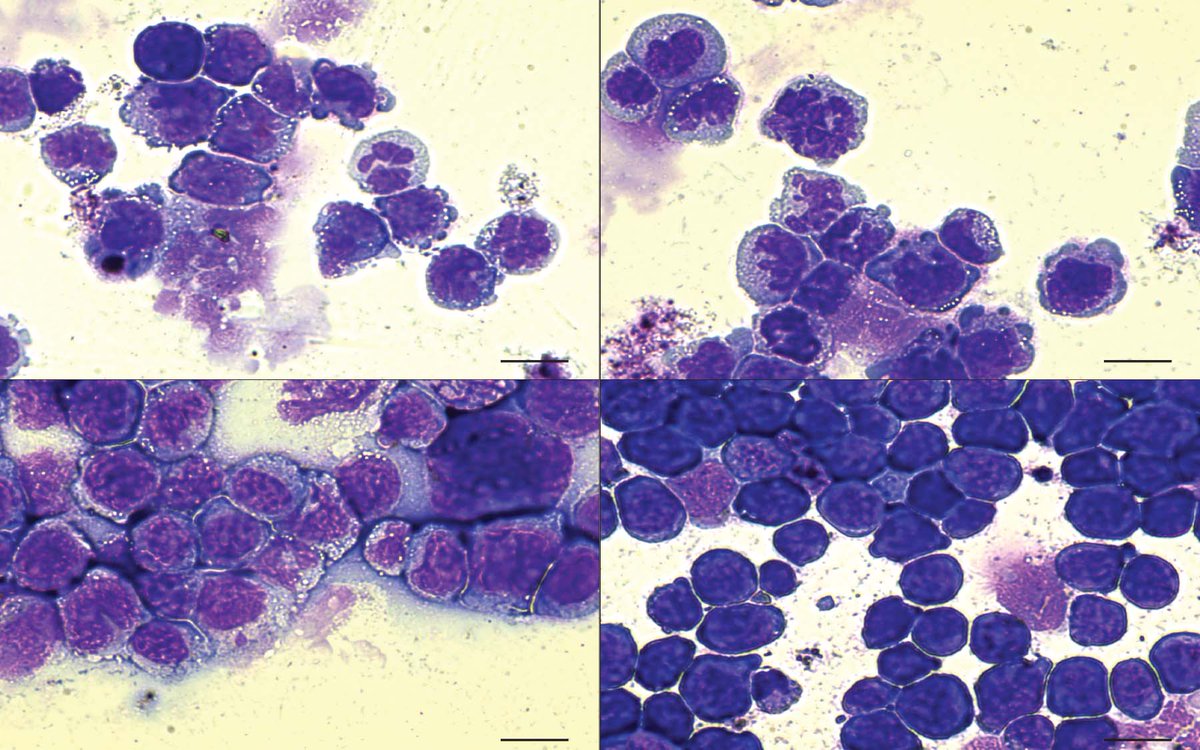
Двумя годами ранее, в 2007 году, в исследовании Soda с соавт. [2] было выявлено, что инверсия плеча хромосомы 2p ассоциирована с образованием гена слияния EML4-ALK у больных раком легкого. Он выявляется в 7% случаев НМРЛ. При этом скорость ответа на ингибитор ALK кризотиниб при лечении на протяжении 6,4 мес. составляла 57%, а 6-месячная выживаемость без прогрессии, по данным исследования [2], была достигнута у 77% ALK-позитивных пациентов.
Учитывая опубликованные данные о возможностях терапии НМРЛ с мутацией EGFR и быстрый темп работ, открывающих новые горизонты в лечении НМРЛ с транслокацией ALK, три профессиональные организации – Колледж американских патологов CAP, Международная ассоциация по изучению рака легкого IASLC и Ассоциация молекулярной патологии AMP – разработали и опубликовали в 2013 году рекомендации по молекулярному тестированию рака легкого на предмет наличия двух критических предиктивных биомаркеров в клинической практике [3]. В них рассматриваются 5 принципиальных вопросов в отношении молекулярного тестирования НМРЛ:
В них рассматриваются 5 принципиальных вопросов в отношении молекулярного тестирования НМРЛ:
- Когда должно проводиться молекулярное тестирование?
- Как должно осуществляться молекулярное тестирование на мутацию EGFR?
- Как должно проводиться тестирование транслокации ALK?
- Необходимо ли проводить исследование других генов при аденокарциноме легкого?
- Как необходимо внедрять молекулярное тестирование аденокарциномы на практике?
Когда должно проводиться молекулярное тестирование?
Согласно рекомендациям [3], молекулярному тестированию на мутацию EGFR и транслокацию ALK подлежит либо первичная опухоль, либо ее метастазы. Исследование показано всем пациентам, у которых опухоль содержит элемент аденокарциномы, независимо от клинических характеристик. Цель молекулярно-генетического тестирования заключается в выделении пациентов для таргетной терапии ингибиторами тирозинкиназы EGFR и ALK.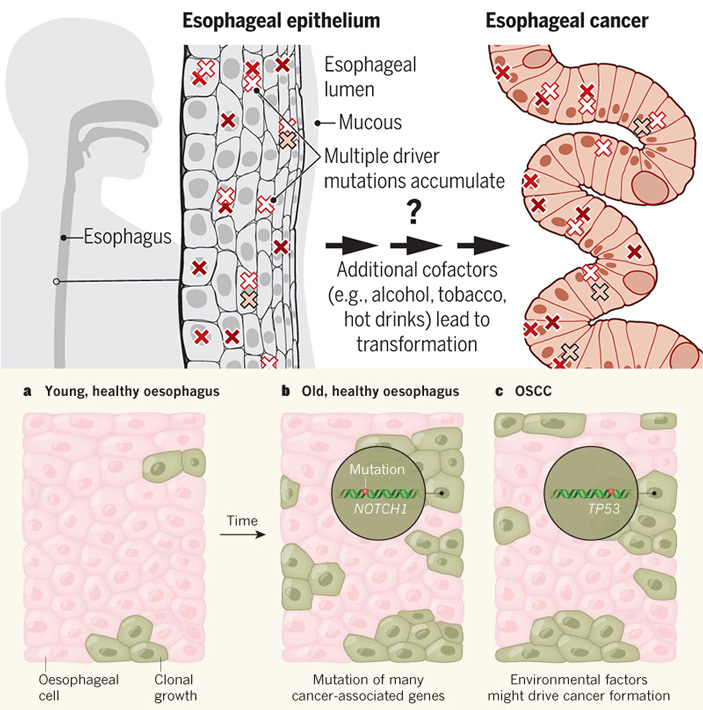
Исследование мутаций EGFR и транслокации ALK должно проводиться во время диагностики для пациентов с поздней стадией заболевания (IV стадия) или во время рецидива или прогрессии у пациентов с более ранними стадиями, которые не прошли тестирование ранее. Для пациентов I, II и III стадии молекулярно-генетическое тестирование также целесообразно, но решение о его проведении должно приниматься индивидуально [3].
Как выполняется молекулярно-генетическое тестирование на мутации EGFR и ALK?
Методики скрининга пациентов с НМРЛ на наличие «драйвер-мутаций» постоянно совершенствуются, поэтому единых стандартов не существует. Требования, которым должны отвечать современные способы диагностики, включают быстроту проведения тестирования (в идеале – две недели и меньше), доступную стоимость, возможность проведения на клинически доступных образцах материала, а также желательно устранение человеческого фактора с целью исключения вероятности получения ошибочных результатов.
В современной клинической практике для скрининга различных «драйвер-мутаций» используются:
- Метод полимеразной цепной реакции (ПЦР), который отличается высокой скоростью проведения (менее 2 недель, анализу подлежат образцы ткани или крови), применяется для обнаружения мутаций EGFR
- Секвенирование ДНК, в ходе которого исследуется вся длина одного гена на наличие мутации. Имеет более низкую чувствительность по сравнению с другими методами, поскольку для получения корректного результата в образце ткани должно содержаться более 10% клеток опухоли с мутацией. В противном случае тест может быть ложноотрицательным
- Аллель-специфическое ПЦР секвенирование, анализирующее ДНК на наличие аномалий. Позволяет обнаруживать редкие сигналы с большей чувствительностью, чем при прямом секвенировании, к тому же проводится в еще более краткие сроки и имеет более низкую стоимость. Отрицательной стороной является возможность идентифицировать только заранее предопределенные мутации.
 Используется для скрининга мутаций EGFR, HER2, METex14 и некоторых других, более редких аномалий
Используется для скрининга мутаций EGFR, HER2, METex14 и некоторых других, более редких аномалий - Секвенирование следующего поколения (англ. Next-generation sequencing – NGS) позволяет в краткие сроки проводить количественный анализ редких аллелей и одновременно оценивать множественные гены или даже целые геномы. Сохраняет высокую чувствительность в том числе и при анализе образцов ткани с низким содержанием опухолевых клеток, что предоставляет возможность выявлять новые аномалии, которые невозможно выявить аллель-специфическим тестированием. Недостатком метода является его высокая стоимость. Используется для скрининга мутаций EGFR, HER2, METex14, транслокации ALK
- Флуоресцентная гибридизация in situ, или метод FISH (от англ. fluorescence in situ hybridization), позволяет определить последовательность ДНК на метафазных хромосомах или в интерфазных ядрах in situ. Обычно применяется для обнаружения транслокаций генов и других аномалий, в том числе транслокации ALK
- Иммуногистохимический метод (ICH) представляет собой чувствительный способ определения транслокации ALK, который является более точной альтернативой FISH.
 Кроме того, позволяет выявить экспрессию белка PD-L1 при НМРЛ
Кроме того, позволяет выявить экспрессию белка PD-L1 при НМРЛ
Возможности дополнительного тестирования у пациентов с приобретенной резистентностью к ИТК EGFR
Хотя положительные клинические и рентгенографические ответы пациентов с НМРЛ и мутацией EGFR на терапию ИТК EGFR наблюдаются примерно в 70% случаев [3], у большинства больных возникает рецидив и прогрессирование заболевания через 8-16 месяцев после начала лечения, оправдывая клинический феномен, известный под названием приобретенная резистентность.
Самая частая причина развития приобретенной резистентности, мутация Т790М, по данным исследований, крайне редко обнаруживается в образцах материала пациентов, не получавших лечение [4]. В тех единичных случаях, когда ее удается выявить во время начальной диагностики, целесообразно подтвердить ее соматический или зародышевый статус путем тестирования нормальной ДНК пациента. Зародышевые мутации Т790М ассоциируются с семейным раком легкого, и подтверждение этого факта должно стать основанием для обследования и консультирования членов семьи больного [4].
В отношении исследований других мутаций, служащих основанием для развития приобретенной резистентности к ИТК EGFR, в том числе амплификации МЕТ, и других, более редких аномалий, пока не накоплен достаточный клинический опыт, поэтому для формулировки четких рекомендаций требуются дальнейшие исследования [3].
В настоящее время проводится несколько клинических исследований, изучающих возможности преодоления основных механизмов развития резистентности. Вероятно, в скором времени будут сформулированы дальнейшие рекомендации по определению статуса Т790М и амплификации генов, кодирующих другие рецепторы тирозинкиназ. Более того, статус Т790М может стать важным аспектом при принятии решения о целесообразности продолжения терапии ИТК EGFR в случае развития приобретенной резистентности. С целью ее выявления в подобных случаях может проводиться жидкостная биопсия. Она дает возможность определить генотип менее инвазивным и дорогостоящим способом, чем обычная биопсия. К тому же жидкостная биопсия позволяет контролировать молекулярные особенности рака уже в ходе лечения или прогнозировать рецидив после адъювантной терапии [5].
К тому же жидкостная биопсия позволяет контролировать молекулярные особенности рака уже в ходе лечения или прогнозировать рецидив после адъювантной терапии [5].
Согласно рекомендациям NCCN по лечению НМРЛ 2017 года, жидкостная биопсия с целью выявления мутаций, ассоциированных с приобретенной резистентностью к ИТК EGFR, назначается только при невозможности проведения традиционной тканевой биопсии [8].
Принцип жидкостной терапии основан на выявлении молекул, которые часто продуцирует опухоль при НМРЛ, с помощью анализа циркулирующих опухолевых клеток (ЦОК) и/или циркулирующей опухолевой ДНК (цоДНК) [6]. Он может давать информацию о молекулярной эволюции опухоли в процессе терапии.
Ограничение жидкостной биопсии, которая предоставляет возможность предсказывать клинический ответ на таргетные препараты, состоит в достаточно низкой ее чувствительности, которая колеблется в пределах 60-80% [7]. Для жидкостной биопсии характерен высокий риск получения ложноотрицательных результатов по сравнению с традиционной биопсией, обусловленный незначительным и нестабильным количеством цоДНК.
Полученные в последнее время данные свидетельствуют, что пациенты с приобретенной резистентностью к ИТК, ассоциированной с мутацией Т790М, могут получать клиническую пользу, продолжая принимать в качестве препаратов первой линии ИТК EGFR [9].
Выбор терапии на основании результатов молекулярно-генетического тестирования
Современные рекомендации по лечению НМРЛ [8] настаивают на необходимости проведения развернутого молекулярно-генетического тестирования с целью выявления не только распространенных, но и редких «драйвер-мутаций» и последующего индивидуального подбора таргетной терапии.
Мутация EGFR
Выявление мутации EGFR является предиктором чувствительности к ИТК EGFR. В частности, протоколы NCCN рекомендуют назначать пациентам с мутацией EGFR в качестве первой линии терапии эрлотиниб или афатиниб или гефитиниб.
Если мутация выявлена уже после того, как начата химиотерапия, рекомендуется завершить терапию или прервать ее и заменить на ИТК EGFR.
Транслокация ALK
Транслокации ALK могут быть выявлены с помощью FISH, иммуногистохимического анализа, а также большинства панелей секвенирования следующего поколения. Их присутствие ассоциируется с высокой чувствительностью к ингибиторам ALK кризотинибу, церитинибу, алктинибу [8]. Пациентам с положительной транслокацией ALK в качестве терапии первой линии показан кризотиниб или церитиниб. Если аномалия выявлена уже во время химиотерапии, предлагается дополнить ее поддерживающей терапией или прервать, заменив на кризотиниб или церитиниб.
Транслокация ROS1
ROS1 представляет собой рецепторную тирозинкиназу, действующую как онкоген у более молодых никогда не курящих пациентов с аденокарциномой. Скрининг транслокации проводится с помощью метода FISH, а также некоторых панелей NGS. Пациенты с транслокацией ROS1 высокочувствительны к терапии кризотинибом[8].
Мутация BRAF
BRAF представляет собой сигнальный медиатор, активирующий митоген-активированную протеинкиназу. Его мутации могут встречаться как в положении экзона 15 V600, так и вне этого домена и обычно ассоциируются с историей курения [10]. Обнаружение аномалии возможно методом секвенирования ПЦР или NGS.
Его мутации могут встречаться как в положении экзона 15 V600, так и вне этого домена и обычно ассоциируются с историей курения [10]. Обнаружение аномалии возможно методом секвенирования ПЦР или NGS.
FDA одобрило назначение комбинации дабрафениба и траметиниба пациентам с метастатическим НМРЛ с мутацией BRAF V600E. Также эффективной стратегией, судя по всему, является ингибирование BRAF с помощью низкомолекулярных ИТК вемурафениба и дабрафениба [11].
Мутация HER2
HER2 относится к семейству рецепторов ТК EGFR. Мутация HER2 может быть выявлена методом ПЦР или секвенирования следующего поколения. Пациенты с мутацией HER2 часто реагируют на HER2-таргетные препараты, в частности, трастузумаб [12], и химиотерапию, а также афатиниб [12].
МЕТ-аномалии
Аномалии MET, рецептора тирозинкиназы для фактора роста гепатоцитов, включают «пропуск» 14 экзона в гене MET (встречается при аденокарциноме легких), амплификацию гена MET (выявляется у пациентов с НМРЛ, не проходивших лечение) и комбинацию MET и EGFR (в опухолях с приобретенной резистентностью к ИТК EGFR) [9].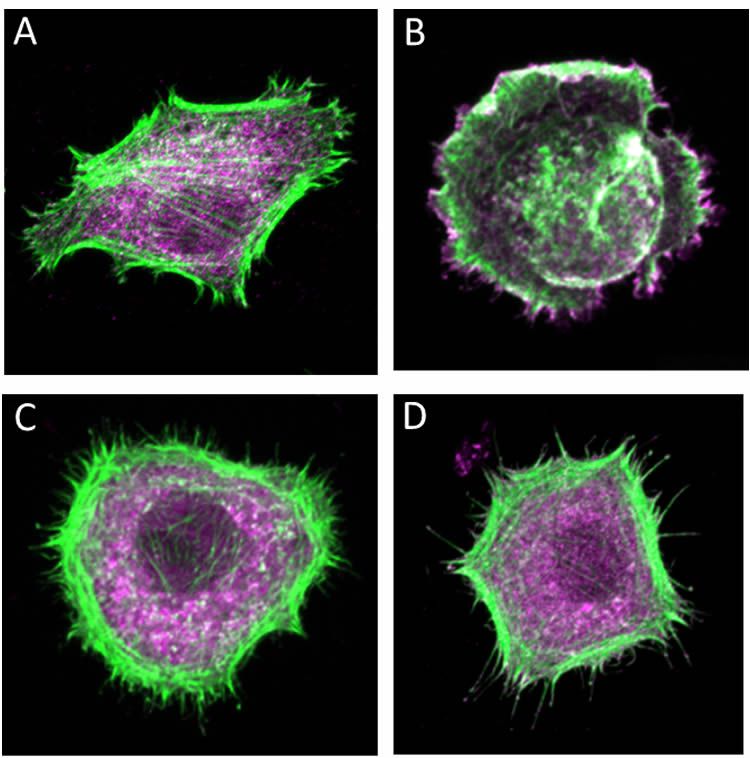
Применение кризотиниба при амплификации МET и мутациях MET и EGFR изучается [14].
Транслокации RET
Ген RET кодирует рецептор тирозинкиназы клеточной поверхности. Его транслокации могут выявляться при аденокарциномах, чаще у более молодых пациентов и курильщиков [15], методами FISH или NGS. При выявлении транслокации RET целесообразно назначать RET-ингибиторы, например, кабозантиниб [16], вандетаниб или алектиниб [17-19].
Список литературы
- Fukuoka M., et al. Biomarker analyses and final overall survival results from a phase III, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS). J. Clin. Oncol. American Society of Clinical Oncology, 2011. Vol.29, №21, P. 2866-2874.
- Soda M., et al. Identification of the transforming EML4-ALK fusion gene in non-small-cell lung cancer.
- Lindeman N.
 I., et al. Molecular Testing Guideline for Selection of Lung Cancer Patients for EGFR and ALK Tyrosine Kinase Inhibitors: Guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J. Thorac. Oncol. 2013. Vol.8, №7, P. 823-859.
I., et al. Molecular Testing Guideline for Selection of Lung Cancer Patients for EGFR and ALK Tyrosine Kinase Inhibitors: Guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J. Thorac. Oncol. 2013. Vol.8, №7, P. 823-859. - Oxnard G.R., et al. Screening for Germline EGFR T790M Mutations Through Lung Cancer Genotyping. J. Thorac. Oncol. 2012. Vol.7, №6, P. 1049-1052.
- Abbosh C., et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 2017. Vol.545, №7655, P. 446-451.
- Haber D.A., Velculescu V.E. Blood-Based Analyses of Cancer: Circulating Tumor Cells and Circulating Tumor DNA. Cancer Discov. 2014. Vol.4, №6.
- Oxnard G.R., et al. Association Between Plasma Genotyping and Outcomes of Treatment With Osimertinib (AZD9291) in Advanced Non-Small-Cell Lung Cancer. // J. Clin. Oncol. American Society of Clinical Oncology, 2016.
 Vol. 34, № 28. P. 3375–3382.
Vol. 34, № 28. P. 3375–3382. - Ettinger D.S., et al. Non-Small Cell Lung Cancer, Version 5.2017, NCCN Clinical Practice Guidelines in Oncology. J. Natl. Compr. Canc. Netw. Harborside Press, LLC, 2017. Vol.15, №4, P. 504-535.
- Sequist L.V., et al. Genotypic and Histological Evolution of Lung Cancers Acquiring Resistance to EGFR Inhibitors. Sci. Transl. Med. 2011. Vol.3, №75.
- Sequist L.V., et al. Implementing multiplexed genotyping of non-small-cell lung cancers into routine clinical practice. Ann. Oncol. Oxford University Press, 2011. Vol.22, №12, P. 2616-2624.
- Planchard D., et al. Dabrafenib in patients with BRAFV600E-positive advanced non-small-cell lung cancer: a single-arm, multicentre, open-label, phase 2 trial. Lancet Oncol. 2016. Vol.17, №5, P. 642-650.
- Mazières J., et al. Lung cancer that harbors an HER2 mutation: epidemiologic characteristics and therapeutic perspectives. J. Clin. Oncol. American Society of Clinical Oncology, 2013.
 Vol.31, №16, P. 1997-2003.
Vol.31, №16, P. 1997-2003. - Paik P.K., et al. Response to MET Inhibitors in Patients with Stage IV Lung Adenocarcinomas Harboring MET Mutations Causing Exon 14 Skipping. Cancer Discov. 2015. Vol.5, №8.
- Camidge D.R. Efficacy and safety of crizotinib in patients with advanced c-MET-amplified non-small cell lung cancer (NSCLC). J. Clin. Oncol. 2014.
- Takeuchi K., et al. RET, ROS1 and ALK fusions in lung cancer. Nat. Med. 2012. Vol.18, №3, P. 378-381.
- Drilon A., et al. Cabozantinib in patients with advanced RET-rearranged non-small-cell lung cancer: an open-label, single-centre, phase 2, single-arm trial. Lancet Oncol. 2016. Vol.17, №12, P. 1653-1660.
- Drilon A., et al. Response to Cabozantinib in Patients with RET Fusion-Positive Lung Adenocarcinomas. Cancer Discov. 2013. Vol.3, №6.
- Falchook G.S., et al. Effect of the RET Inhibitor Vandetanib in a Patient With RET Fusion-Positive Metastatic Non-Small-Cell Lung Cancer.
 J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol.34, №15, P. e141-4.
J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol.34, №15, P. e141-4. - Detterbeck F.C., et al. The IASLC Lung Cancer Staging Project: Background Data and Proposed Criteria to Distinguish Separate Primary Lung Cancers from Metastatic Foci in Patients with Two Lung Tumors in the Forthcoming Eighth Edition of the TNM Classification for Lung Cancer. J. Thorac. Oncol. 2016. Vol.11, №5, P. 651-665.
🎧 «Думали: всех вылечим. Но вышло не совсем так». Что такое генетические тесты в онкологии и как их читать | Громадское телевидение
В новом эпизоде подкаста «Я и оно: как пережить онко» автор и ведущая Яна Седова поднимает тему генетических исследований в онкологии. Как давно они появились и чем отличаются? Зачем и когда их делают? Какие наследственные виды рака можно выявить с их помощью? Кому они показаны, если речь идет об установленном диагнозе — пациентам на ранних стадиях или тем, у кого болезнь дала метастазы, и как правильно читать иммунограмму — результат исследования биологического материала? На эти вопросы отвечает молекулярный биолог Дмитрий Шапочка, заместитель директора по научной работе лаборатории CSD.
Слушайте этот эпизод на Castbox, Soundcloud, Apple Podcasts, Google Podcasts и YouTube.
Слушайте весь второй сезон подкаста на Castbox и Soundcloud.
Диагностика наследственной предрасположенности и выявление мутаций
Есть два основных направления: превентивная диагностика, то есть, выявление поломки в генах, которые передаются по наследству, и выявление генетических мутаций для выбора лечебной тактики при уже установленном диагнозе.
Самыми известными являются мутации в генах BRCA1 и BRCA2. Если обнаруживаются такие мутации, то вероятность возникновения рака молочной железы составляет до 80% в течение жизни, а риск возникновения рака яичников — 40-50%. Однако с этими видами рака связаны не только вышеупомянутые гены, поэтому стоит проводить тестирование и других генов, это называется исследованием генных панелей.
При этом тестировании используется метод секвенирования нового поколения, NGS (Next-Generation Sequencing), он позволяет тестировать не один ген, не два, а сразу несколько десятков, это значит, что есть возможность протестировать все гены, которые связаны с высоким риском развития онкологических заболеваний.
За разные виды онкологических заболеваний отвечают разные гены.
Не только рак молочной железы и яичников может передаваться по наследству, это также может быть колоректальный рак, в этом случае за него отвечают гены, которые относятся к синдрому Линча (наследственный рак толстой кишки без полипоза, связан с высоким риском возникновения рака толстой кишки в возрасте до 50 лет).
Если в семейном анамнезе есть случаи колоректального рака и рака эндометрия (развивается в слизистой оболочке органа), то в семье может быть такой синдром, и тогда ближайшим родственникам показано тестирование NGS. Оно позволит в будущем правильно построить скрининг, чтобы выявить заболевание на максимально ранней стадии.
Третья форма рака, которая часто бывает наследственной, это рак желудка, в народе его называют синдромом Бонапарта (у которого в семейном анамнезе это онкологическое заболевание встречалось часто).
Кому показаны тесты?
Потребность в генетических тестах возникла с появлением таргетной терапии — это конец 90-х и начало 2000-х. Первым был изучен ген HER2/neu при раке молочной железы.
Первым был изучен ген HER2/neu при раке молочной железы.
Это гены, белки, которые в норме стимулируют рост и размножение клеток при наличии внешнего сигнала: клетке поступает сигнал, что надо размножаться и делиться. Когда она выполнила эту функцию, сигнал исчезает. Но в этих генах может происходить активация белка путем, к примеру, мутаций. И он начинает постоянно передавать сигнал к размножению клетки. Есть специальные таргетные препараты, цель которых — прекратить передачу сигнала поломанным геном, поломанным белком. Так можно блокировать рост опухоли.
На сегодняшний день описано несколько десятков таких мишеней. При меланоме это мутация в гене BRAF или C-KIT, при раке легкого это может быть мутация в гене EGFR, ALK и других.
В некоторых видах рака такие мутации встречаются довольно часто, есть много клинических исследований, доказывающих, что определенные таргетные препараты при этих видах мутация и при этих видах рака дают хороший ответ на терапию. Тогда тестирование на эти мутации входит в стандарты диагностики и лечения.
Бывает, что у пациента таких мишеней нет, и тогда ему предлагают стандартные виды лечения. Однако обычно после третьей линии терапии никаких стандартов уже нет. Но если физическое состояние пациента позволяет получать терапию, тогда часто заказывают генные панели, это называется молекулярное профилирование, чтобы посмотреть, есть ли нестандартная мутация именно для этого вида рака, которая позволит предположить, что будет эффективен какой-то из таргетных препаратов. И это будет уже экспериментальное лечение, но оно может стать шансом для пациента.
Как изменяется опухоль во время лечения?
До лечения опухоль можно назвать «наивной». У нее есть некие генетические характеристики, но любая линия терапии будет давать эффект, и большинство клеток будет погибать от действия лекарств. Но при этом останутся некоторые резистентные клетки, не чувствительные к этой терапии, которые выживут. Это закон эволюции, и здесь работают те же биологические принципы, что и в мире, который нас окружает. Так с каждой линией будет повышаться резистентность и гетерогенность опухоли (отличные от большинства клеток характеристики), поэтому бороться с опухолью с каждой новой линией терапии все сложнее.
Так с каждой линией будет повышаться резистентность и гетерогенность опухоли (отличные от большинства клеток характеристики), поэтому бороться с опухолью с каждой новой линией терапии все сложнее.
С появлением мощных таргетных препаратов и иммунотерапии стала возможной длительная ремиссия и для пациентов с продвинутыми стадиями при некоторых видах рака, если они получают полный ответ на терапию.
Ремиссия также возможна, когда есть мишень для таргетного препарата, сильная мутация, и когда полный ответ дает первая линия терапии.
Также длительной ремиссии позволяет достичь иммунотерапия, она может разблокировать механизм уничтожения опухоли, который по какой-то причине в организме застопорился.
Как читать результаты иммунограммы?
Генетические тесты стали активно использовать в 2010-х. Тогда думали: теперь можно каждому пациенту подобрать персональное лечение и вылечить его. Однако при одной и той же мутации у одного пациента препарат работал, а у другого — нет.
Затем появилась возможность проверять множество генов и выявлять разные мутации, которые по-разному влияют на функцию генов.
По мнению Дмитрия Шапочки, интерпретировать результаты мультигенных панелей должны не только клинические онкологи, но и молекулярные биологи (молекулярные патологи). Ведь первые знают анамнез пациента, а вторые понимают разницу в мутациях генов и как клинически их применить.
Автор «Я и оно: как пережить онко» Яна Седова также благодарит за информационную поддержку подкаста фандрайзинговую платформу онлайн-благотворительности Dobro.ua, которая собирает средства на благотворительные и социальные проекты любого направления.
В этом месяце всеукраинский фонд КРОНА на платформе Dobro.ua открыли сбор денег, благодаря которым Яна сможет заплатить за генетический тест Oncodeep. Он рекомендован лечащим врачом и поможет подобрать новый протокол лечения, ведь на сегодня все стандартные линии терапии она уже получила.
Мутации в ассоциированных с раком генах не обязательно приводят к раку
Процесс накопления мутаций в нормальных тканях организма на протяжении жизни, а также их связь с возникновением раковых опухолей, пока изучены недостаточно. Две группы исследователей из Великобритании и Японии провели детальный анализ структуры генов, которые считаются ассоциированными с раком эпителия пищевода, у людей разного возраста. Результаты обеих работ хорошо согласуются друг с другом. Оказалось, что вследствие естественных ошибок при репликации ДНК в тканях пищевода с возрастом возникает всё больше мутаций, причем даже у здоровых людей в основном они были сосредоточены в самых «онкогенных» генах. По-видимому, злокачественного перерождения не произошло из-за того, что наборы мутаций в здоровых тканях сильно отличаются от наборов, характерных для раковых заболеваний. Полученные результаты — это только первые попытки разобраться в этих процессах.
Две группы исследователей из Великобритании и Японии провели детальный анализ структуры генов, которые считаются ассоциированными с раком эпителия пищевода, у людей разного возраста. Результаты обеих работ хорошо согласуются друг с другом. Оказалось, что вследствие естественных ошибок при репликации ДНК в тканях пищевода с возрастом возникает всё больше мутаций, причем даже у здоровых людей в основном они были сосредоточены в самых «онкогенных» генах. По-видимому, злокачественного перерождения не произошло из-за того, что наборы мутаций в здоровых тканях сильно отличаются от наборов, характерных для раковых заболеваний. Полученные результаты — это только первые попытки разобраться в этих процессах.
На протяжении всей жизни многоклеточного организма многим его клеткам приходится делиться: сначала — чтобы из оплодотворенной яйцеклетки развился полноценный эмбрион со всеми необходимыми тканями, затем, уже после рождения, ткани и органы должны развиваться, а взрослому организму надо их поддерживать в исправном состоянии. При каждом делении ДНК материнской клетки передается дочерним клеткам. В идеале каждая из них должна получить по одной точной копии всех молекул ДНК, которые были у материнской клетки. Удвоение молекул ДНК происходит в процессе репликации.
При каждом делении ДНК материнской клетки передается дочерним клеткам. В идеале каждая из них должна получить по одной точной копии всех молекул ДНК, которые были у материнской клетки. Удвоение молекул ДНК происходит в процессе репликации.
Проблема в том, что системы репликации клеточного генома могут иногда ошибаться, то есть изменять последовательность нуклеотидов ДНК. Если такая ошибка случилась достаточно рано при развитии эмбриона и не привела к каким-то радикальным последствиям вроде смерти, она будет унаследована многими клетками и тканями организма. Но ошибки возникают и в делящихся клетках взрослого организма: если это произошло в клетке какого-нибудь органа или ткани и клетка с ошибкой смогла продолжить делиться, то дальше в этом органе появится популяция клеток с той же ошибкой. Можно сказать, что ткани — как здоровые, так и уже переродившиеся в раковые опухоли — претерпевают эволюцию (см. Somatic evolution in cancer).
Эволюция раковых опухолей изучается довольно давно и во многих случаях прослежена иерархия возникающих в них мутаций (см. , например, Злокачественные опухоли и их метастазы не только растут, но и активно изменяются независимо друг от друга, «Элементы», 25.04.2012). При этом эволюция нормальных тканей, в том числе и пути, приводящие к их превращению в раковые опухоли, изучена слабо. Например, известно, что во многих случаях мутации в ткани, хоть и копятся постепенно, не приводят к развитию онкологических заболеваний. Но чем определяется тот или иной исход такой эволюции — пока непонятно. Некоторое время назад в журналах Nature и Science вышли статьи двух научных групп, которые существенно продвигают наши познания в этой области.
, например, Злокачественные опухоли и их метастазы не только растут, но и активно изменяются независимо друг от друга, «Элементы», 25.04.2012). При этом эволюция нормальных тканей, в том числе и пути, приводящие к их превращению в раковые опухоли, изучена слабо. Например, известно, что во многих случаях мутации в ткани, хоть и копятся постепенно, не приводят к развитию онкологических заболеваний. Но чем определяется тот или иной исход такой эволюции — пока непонятно. Некоторое время назад в журналах Nature и Science вышли статьи двух научных групп, которые существенно продвигают наши познания в этой области.
Исследователи из нескольких английских научных учреждений, чья статья была опубликована в журнале Science, работали с образцами эпителия, взятыми из верхней области пищевода девяти скончавшихся человек, завещавших свои органы для исследований и трансплантации. В исследовании участвовали 3 женщины и 6 мужчин, возрастом (на момент смерти) от 20 до 75 лет. У них были разные сочетания вредных привычек (курение, употребление алкоголя) или их отсутствия, но ни у кого не было онкологических проблем. Всего было использовано 844 образца эпителия.
Всего было использовано 844 образца эпителия.
Ученые секвенировали 74 гена, которые чаще всего ассоциируются с различными типами рака (то есть это гены, связь которых с онкогенезом либо доказана, либо подозревается). Для 21 образца этим не ограничились и геном был секвенирован полностью. В изученных образцах от молодых доноров наблюдалось намного меньше мутаций, чем в образцах от пожилых людей (рис. 2).
Ранее были получены данные об очень частых мутациях в клетках кожи (I. Martincorena et al., 2015. High burden and pervasive positive selection of somatic mutations in normal human skin), но в тканях пищевода, по-видимому, ситуация другая: в изученных образцах эпителия пищевода мутации возникают в 10 раз реже. Это, вероятно, связано с тем, что кожа подвергается гораздо более сильному воздействию мутагенных факторов (особенно — ультрафиолетовому облучению). При этом — и это совершенно неожиданно — оказалось, что в эпителии пищевода гораздо более высокая доля мутаций в генах, ассоциированных с раком.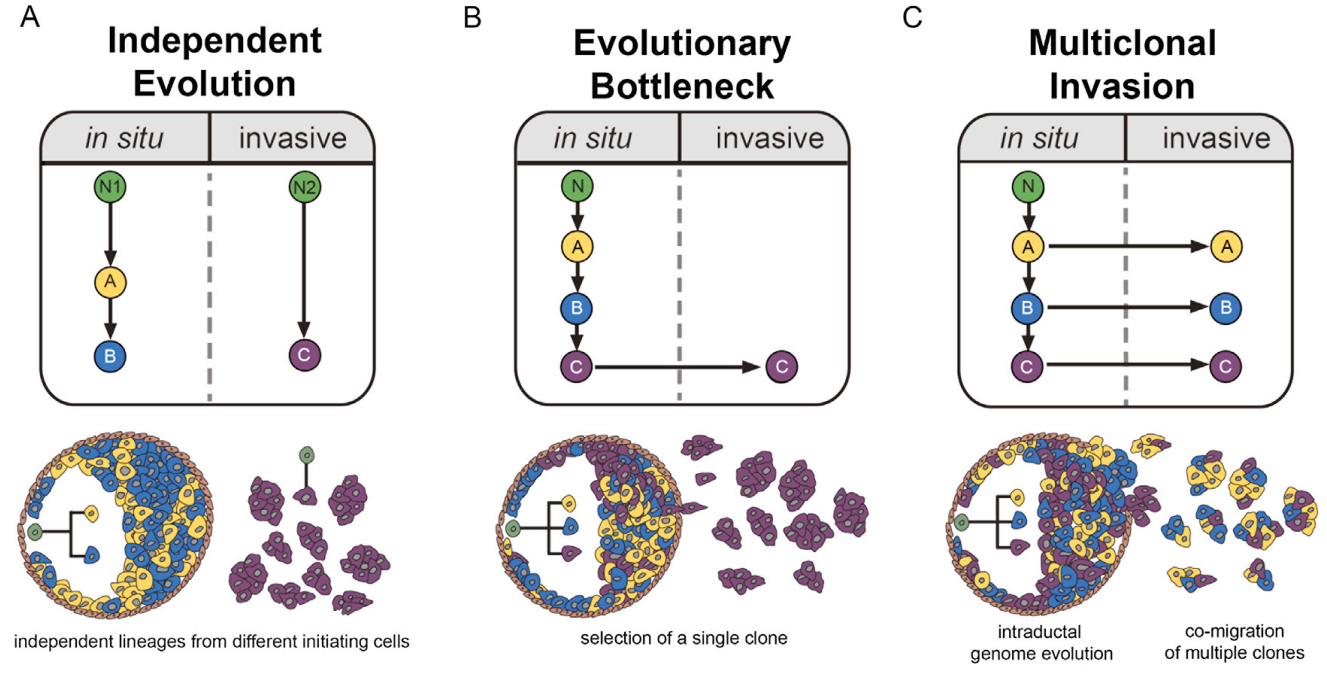 Более того, по крайней мере часть из этих мутантных генов обеспечивала клеткам позитивную селекцию: в таких клетках активизировались программы деления, что приводило к формированию в эпителии клонов, несущих эти мутации. Однако гистологические исследования не выявили каких-либо заметных отличий морфологии мутантных клеток от нормальных, раковыми они не становились (рис. 3).
Более того, по крайней мере часть из этих мутантных генов обеспечивала клеткам позитивную селекцию: в таких клетках активизировались программы деления, что приводило к формированию в эпителии клонов, несущих эти мутации. Однако гистологические исследования не выявили каких-либо заметных отличий морфологии мутантных клеток от нормальных, раковыми они не становились (рис. 3).
Из проверенных потенциальных онкогенов самым часто мутирующим в здоровом эпителии оказался NOTCh2. Этот ген кодирует один из трансмембранных рецепторных белков и считается ассоциированным с некоторыми видами рака, в том числе и с плоскоклеточной карциномой пищевода (oesophageal squamous cell carcinoma, OSCC) — самым распространенным видом рака пищевода в Южной Америке и Азии, но при этом сравнительно редким в Европе и Северной Америке (M. Arnold et al., 2015. Global incidence of oesophageal cancer by histological subtype in 2012). Показано, что одни из основных факторов риска для него — употребление алкоголя и курение.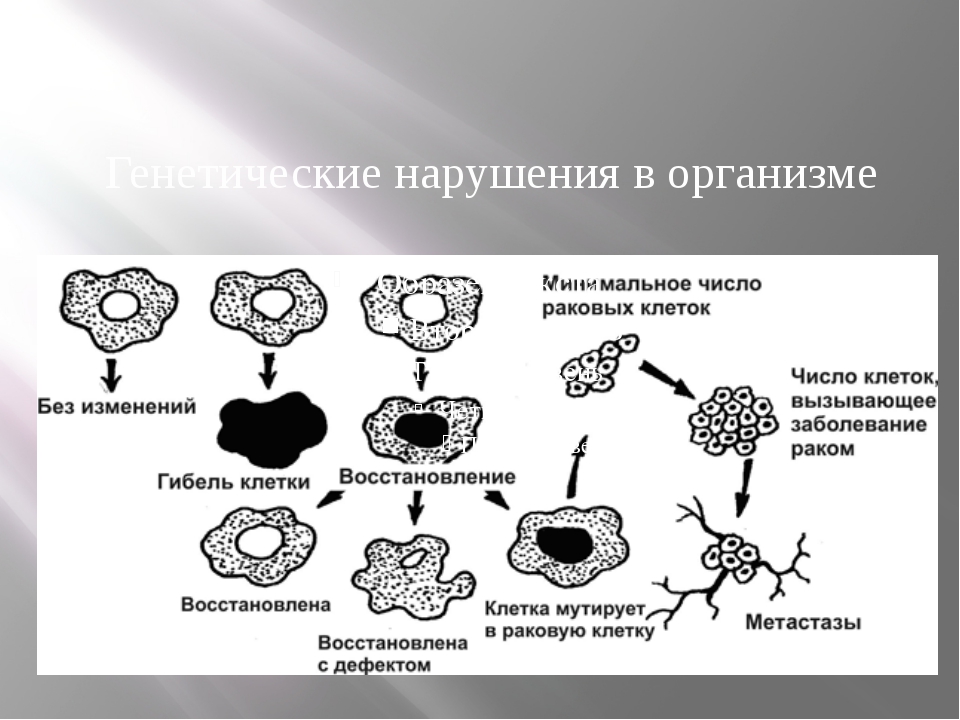 Из предыдущих исследований следует, что мутации в NOTCh2 наблюдаются примерно в 10% случаев этого вида рака.
Из предыдущих исследований следует, что мутации в NOTCh2 наблюдаются примерно в 10% случаев этого вида рака.
В изученных образцах эпителия пищевода наблюдалось в среднем 120 различных мутаций NOTCh2 в пересчете на квадратный сантиметр (рис. 4). У пожилых людей частота мутаций в этом гене была заметно выше, чем у молодых. Но вот что важно: было обнаружено сравнительно мало сопутствующих мутаций в гене TP53 (которые обнаруживаются более чем в 90% опухолей OSCC): их было примерно в 10 раз меньше, чем в среднем в клетках раковых опухолей. Также было найдено сравнительно мало аномалий структуры хромосом (это признак злокачественности клеток, типичный для клеток OSCC и многих других раков).
В общем полученные в этой работе результаты показали, что в здоровом пищеводе мутации накапливаются главным образом вследствие нормальных физиологических процессов, ошибок при репликации ДНК и что они совсем не обязательно приводят к раку. Чтобы развился рак, этот процесс должен зайти дальше: происходят дополнительные мутации, нарушается контроль репликации генома, возникают хромосомные аномалии. Этому может способствовать дополнительное воздействие внешних канцерогенов.
Этому может способствовать дополнительное воздействие внешних канцерогенов.
Вторую работу, опубликованную в журнале Nature, выполнила большая группа ученых из нескольких научных организаций Японии. Они работали с образцами эпителия пищевода, взятыми у 139 человек (всего было изучено 682 образца), среди которых у 95 были онкологические проблемы с пищеводом (OSCC или предраковое состояние), а 44 были здоровыми. Среди участников исследования (как и в первой работе) были люди как с вредными привычками, так и без них. У больных образцы эпителия брались из участков пищевода, которые не были поражены опухолью.
Мутации искали с помощью полного секвенирования генома или секвенирования кодирующих последовательностей. Было идентифицировано 24 гена, которые мутируют чаще всего. Так же, как в работе британских ученых, было показано, что в здоровом эпителии чаще всего мутирует ген NOTCh2, а в опухолях — ТР53.
Частота мутаций у японцев также возрастала с возрастом и при нездоровом образе жизни (регулярное курение, потребление алкоголя, очень горячей пищи и напитков). Как и в первой работе, частота хромосомных аномалий в здоровом эпителии была незначительной в отличие от OSCC. Примечательно, что авторам удалось показать, что ген PAX9, кодирующий один из факторов транскрипции, достаточно часто мутирует в нормальном эпителии, но не в опухолях OSCC. А у одного из японцев мутация в гене ТР53 произошла еще в детстве, но он дожил до 70 лет без признаков OSCC (при этом клоны клетки с этой мутацией разрослись на площадь 7 мм2). Японские ученые также пришли к выводу, что одних только мутаций отдельных генов, ассоциированных с раком, в эпителии пищевода для развития OSCC недостаточно.
Как и в первой работе, частота хромосомных аномалий в здоровом эпителии была незначительной в отличие от OSCC. Примечательно, что авторам удалось показать, что ген PAX9, кодирующий один из факторов транскрипции, достаточно часто мутирует в нормальном эпителии, но не в опухолях OSCC. А у одного из японцев мутация в гене ТР53 произошла еще в детстве, но он дожил до 70 лет без признаков OSCC (при этом клоны клетки с этой мутацией разрослись на площадь 7 мм2). Японские ученые также пришли к выводу, что одних только мутаций отдельных генов, ассоциированных с раком, в эпителии пищевода для развития OSCC недостаточно.
В обсуждаемых исследованиях впервые получено достаточно детальное описание молекулярной эволюции конкретной ткани (эпителия пищевода) человека с возрастом. Показано, что новые мутации постоянно возникают, большинство из них нейтральны — не вредны и не полезны. Чаще всего мутации происходят в генах, ассоциированных с раком, хотя при этом вовсе не обязательно, что рак развивается. Клетки с такими мутациями остаются нормальными, но могут получить преимущества перед соседями, в результате чего их клоны могут заполонить значительный участок стенки пищевода. Экспансия клонов мутантных клеток эпителия пищевода сама по себе рака не вызывает, но без нее, судя по всему, раковая опухоль не разовьется — для этого должны произойти еще какие-то события, например, дополнительные мутации, ослабляющие защитные механизмы клетки.
Клетки с такими мутациями остаются нормальными, но могут получить преимущества перед соседями, в результате чего их клоны могут заполонить значительный участок стенки пищевода. Экспансия клонов мутантных клеток эпителия пищевода сама по себе рака не вызывает, но без нее, судя по всему, раковая опухоль не разовьется — для этого должны произойти еще какие-то события, например, дополнительные мутации, ослабляющие защитные механизмы клетки.
Рассмотренные работы следует считать лишь началом картирования генетических изменений и нарушений в нормальных тканях. На следующем этапе нужно будет понять их роль в развитии онкологических заболеваний, а также — где граница между нормальным состоянием ткани и раком.
Источники:
1) Iñigo Martincorena et al. Somatic mutant clones colonize the human esophagus with age // Science. 2018. V. 362. P. 911–917. DOI: 10.1126/science.aau3879.
2) Akira Yokoyama et al. Age-related remodelling of oesophageal epithelia by mutated cancer drivers // Nature. 2019. V. 565. P. 312–317. DOI: 10.1038/s41586-018-0811-x.
2019. V. 565. P. 312–317. DOI: 10.1038/s41586-018-0811-x.
3) Francesca D. Ciccarelli. Mutations differ in normal and cancer cells of the oesophagus — популярный синопсис к обсуждаемым статьям.
4) Stephen J. Chanock. The paradox of mutations and cancer — популярный синопсис к обсуждаемой статье в Science.
Вячеслав Калинин
Генетика рака | Cancer.Net
Гены находятся в ДНК каждой клетки вашего тела. Они контролируют работу клеток, в том числе:
Как быстро растет
Как часто делится
Сколько живет
По оценкам исследователей, каждая клетка содержит 30 000 различных генов. Внутри каждой клетки гены расположены на хромосомах.
О хромосомах
Хромосомы — это нитевидные структуры в клетках, содержащие гены.46 хромосом, расположенных в 2 наборах по 23.
Вы наследуете один набор от матери и один от отца. Одна хромосома в каждом наборе определяет, мужчина вы или женщина. Остальные 22 пары хромосом определяют другие физические характеристики. Эти пары хромосом называются аутосомами.
Остальные 22 пары хромосом определяют другие физические характеристики. Эти пары хромосом называются аутосомами.
Как работают гены
Гены контролируют работу ваших клеток, производя белки. Белки выполняют определенные функции и действуют как посредники для клетки.
Каждый ген должен иметь правильные инструкции по производству белка.Это позволяет белку выполнять правильную функцию для клетки.
Все виды рака начинаются при мутации одного или нескольких генов в клетке. Мутация — это изменение. Он создает аномальный белок. Или это может предотвратить образование белка.
Аномальный белок предоставляет иную информацию, чем нормальный белок. Это может привести к неконтролируемому размножению клеток и стать злокачественными.
О генетических мутациях
Существует 2 основных типа генетических мутаций:
Приобретенные мутации. Это наиболее частая причина рака. Они возникают в результате повреждения генов в конкретной клетке в течение жизни человека. Например, это может быть клетка груди или клетка толстой кишки, которая затем многократно делится и образует опухоль. Опухоль — это аномальная масса. Рак, который возникает из-за приобретенных мутаций, называется спорадическим раком. Приобретенные мутации не обнаруживаются в каждой клетке тела и не передаются от родителя к потомку.
Например, это может быть клетка груди или клетка толстой кишки, которая затем многократно делится и образует опухоль. Опухоль — это аномальная масса. Рак, который возникает из-за приобретенных мутаций, называется спорадическим раком. Приобретенные мутации не обнаруживаются в каждой клетке тела и не передаются от родителя к потомку.
Факторы, вызывающие эти мутации, включают:
Мутации зародышевой линии. Это реже. Мутация зародышевой линии происходит в сперматозоиде или яйцеклетке. Он переходит непосредственно от родителя к ребенку в момент зачатия. По мере того, как эмбрион превращается в ребенка, мутация исходной сперматозоида или яйцеклетки копируется в каждую клетку в организме. Поскольку мутация затрагивает репродуктивные клетки, она может передаваться из поколения в поколение.
Рак, вызванный мутациями зародышевой линии, называется наследственным раком. На его долю приходится от 5% до 20% всех случаев рака.
Мутации и рак
Мутации случаются часто. Мутация может быть полезной, вредной или нейтральной. Это зависит от того, где в гене происходит изменение. Обычно организм исправляет большинство мутаций.
Мутация может быть полезной, вредной или нейтральной. Это зависит от того, где в гене происходит изменение. Обычно организм исправляет большинство мутаций.
Одна мутация, скорее всего, не вызовет рак. Обычно рак возникает в результате нескольких мутаций в течение жизни. Вот почему рак чаще возникает у пожилых людей. У них было больше возможностей для развития мутаций.
Типы генов, связанных с раком
Многие из генов, которые способствуют развитию рака, попадают в широкие категории:
Гены-супрессоры опухолей. Это защитные гены. Обычно они ограничивают рост клеток на:
При мутации гена-супрессора опухоли клетки бесконтрольно растут. И со временем они могут образовать опухоль.
Примеры генов-супрессоров опухолей включают BRCA1 , BRCA2 и p53 или TP53 .
Мутации зародышевой линии в генах BRCA1 или BRCA2 увеличивают риск развития у женщин наследственного рака груди или яичников, а у мужчин — риск развития наследственного рака простаты или груди.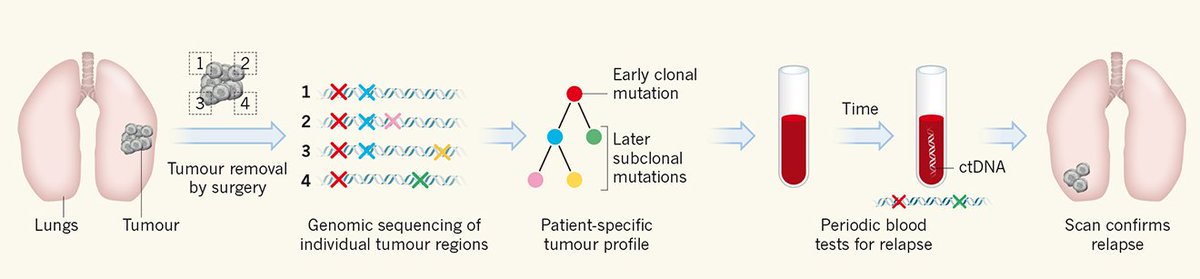 Они также увеличивают риск рака поджелудочной железы и меланомы у женщин и мужчин.
Они также увеличивают риск рака поджелудочной железы и меланомы у женщин и мужчин.
Наиболее часто мутирующий ген у людей, больных раком, — это p53 или TP53 . Более чем в 50% случаев рака присутствует отсутствующий или поврежденный ген p53 . Приобретается большинство мутаций гена p53 и . Мутации зародышевой линии p53 встречаются редко, но пациенты, которые их носят, подвергаются более высокому риску развития многих различных типов рака.
Онкогены. Они превращают здоровую клетку в раковую.Мутации в этих генах не передаются по наследству.
Два общих онкогена:
HER2, специализированный белок, контролирующий рост и распространение рака. Он содержится в некоторых раковых клетках. Например, раковые клетки груди и яичников.
Семейство генов RAS , которое заставляет белки участвовать в путях клеточной коммуникации, росте и гибели клеток.
гены репарации ДНК. Это исправляет ошибки, сделанные при копировании ДНК.Многие из них действуют как гены-супрессоры опухолей. BRCA1 , BRCA2 и p53 — все гены репарации ДНК.
Это исправляет ошибки, сделанные при копировании ДНК.Многие из них действуют как гены-супрессоры опухолей. BRCA1 , BRCA2 и p53 — все гены репарации ДНК.
Если у человека есть ошибка в гене репарации ДНК, ошибки остаются неисправленными. Тогда ошибки становятся мутациями. Эти мутации могут в конечном итоге привести к раку, особенно мутации в генах-супрессорах опухолей или онкогенах.
Мутации в генах репарации ДНК могут передаваться по наследству или приобретаться. Синдром Линча является примером наследственного вида.Мутации BRCA1 , BRCA2 и p53 и связанные с ними синдромы также передаются по наследству.
Проблемы в понимании генетики рака
Исследователи многое узнали о том, как работают гены рака. Но многие виды рака не связаны с конкретным геном. Рак, вероятно, связан с множественными генными мутациями. Более того, некоторые данные свидетельствуют о том, что гены взаимодействуют с окружающей средой. Это еще больше усложняет наше понимание роли генов в развитии рака.
Это еще больше усложняет наше понимание роли генов в развитии рака.
Исследователи продолжают изучать, как генетические изменения влияют на развитие рака. Эти знания привели к улучшениям в лечении рака, включая раннее выявление, снижение риска, использование таргетной терапии и выживаемость.
Дальнейшее изучение генетики рака может помочь врачам найти более эффективные способы:
Связанные ресурсы
Генетическое тестирование на риск рака
Понимание риска рака
Наследственные синдромы, связанные с раком
Что такое персонализированная противораковая медицина?
Дополнительная информация
Национальный институт рака (NCI): Генетика рака
NCI: Как генетические изменения приводят к раку (инфографика)
Мутация | CancerQuest
Рак — это результат разрушения элементов управления, регулирующих клетки.Причины поломки всегда включают изменения важных генов. Эти изменения часто являются результатом мутации , изменения последовательности ДНК хромосом. Мутации могут быть очень небольшими изменениями, затрагивающими только несколько нуклеотидов, или могут быть очень большими, что приводит к серьезным изменениям в структуре хромосом.
Мутации могут быть очень небольшими изменениями, затрагивающими только несколько нуклеотидов, или могут быть очень большими, что приводит к серьезным изменениям в структуре хромосом.
Как маленькие, так и большие мутации могут влиять на поведение клеток. Комбинации мутаций в важных генах могут привести к развитию рака. Материал, представленный на этой странице, описывает взаимосвязь между мутацией и раком, различные виды мутаций и их причины.Дополнительную информацию по темам на этой странице также можно найти в большинстве вводных учебников по биологии, мы рекомендуем «Биология Кэмпбелла», 11-е издание.
Тем на этой странице:
Мутация и рак
Аномальное поведение, демонстрируемое раковыми клетками, является результатом серии мутаций в ключевых регуляторных генах. Клетки становятся все более аномальными по мере того, как повреждается все больше генов.Часто гены, которые контролируют репарацию ДНК, сами повреждаются, делая клетки еще более восприимчивыми к постоянно растущим уровням генетического хаоса.
Клетки становятся все более аномальными по мере того, как повреждается все больше генов.Часто гены, которые контролируют репарацию ДНК, сами повреждаются, делая клетки еще более восприимчивыми к постоянно растущим уровням генетического хаоса.
Ниже представлена анимация, демонстрирующая взаимосвязь между хромосомами, генами и ДНК.
Считается, что большинство видов рака возникает из-за единственной мутантной клетки-предшественника. По мере деления этой клетки образующиеся «дочерние» клетки могут приобретать различные мутации и различное поведение в течение определенного периода времени.Те клетки, которые получают преимущество в делении или сопротивлении клеточной гибели, будут стремиться захватить популяцию. Таким образом, опухолевые клетки могут получить широкий спектр возможностей, которые обычно не наблюдаются в здоровой версии представленного типа клеток. Изменения в поведении, наблюдаемые в раковых клетках, находятся в центре внимания раздела сайта «Биология рака».
Изменения в поведении, наблюдаемые в раковых клетках, находятся в центре внимания раздела сайта «Биология рака».
Мутации в ключевых регуляторных генах (супрессоры опухолей и протоонкогены) изменяют поведение клеток и потенциально могут привести к нерегулируемому росту, наблюдаемому при раке.
Кажется, что почти для всех типов рака, изученных на сегодняшний день, переход от нормальной здоровой клетки к раковой — это поэтапный прогресс, требующий множества генетических изменений, которые в сумме приводят к образованию раковой клетки. Эти мутации возникают как в онкогенах, так и в супрессорах опухолей. Это одна из причин, почему рак гораздо чаще встречается у пожилых людей. Чтобы образовалась раковая клетка, в одной и той же клетке должна произойти серия мутаций. Поскольку вероятность мутации любого гена очень мала, очевидно, что вероятность появления нескольких разных мутаций в одной и той же клетке действительно очень маловероятна.По этой причине у клеток 70-летнего организма было больше времени для накопления изменений, необходимых для образования раковых клеток, но у клеток ребенка гораздо меньше шансов приобрести необходимые генетические изменения. Конечно, некоторые дети и заболевают раком, но он гораздо чаще встречается у пожилых людей. На приведенном ниже графике показана зависимость заболеваемости раком толстой кишки в США от возраста. График был получен из Национального института рака.
Конечно, некоторые дети и заболевают раком, но он гораздо чаще встречается у пожилых людей. На приведенном ниже графике показана зависимость заболеваемости раком толстой кишки в США от возраста. График был получен из Национального института рака.
Глядя на форму кривых, подобных показанным выше, был сделан вывод, что необходимо несколько генетических изменений , чтобы создать клетки, которые становятся злокачественными.
В лаборатории исследователи пытались создать опухолевые клетки путем изменения или введения ключевых регуляторных белков. Несколько исследований пытались определить минимальное количество генетических изменений, необходимых для создания раковой клетки, с интригующими результатами.
В природе мутации могут накапливаться в клетках с течением времени, и если мутирует «правильная» группа генов, может возникнуть рак. Исследование 2012 года показало, что стволовые клетки костного мозга у здорового человека накапливают множество мутаций с возрастом. Еще несколько изменений ключевых генов могут вызвать рак. Результаты показывают, что во многих случаях «нормальные» клетки и раковые клетки не так уж сильно отличаются.
Еще несколько изменений ключевых генов могут вызвать рак. Результаты показывают, что во многих случаях «нормальные» клетки и раковые клетки не так уж сильно отличаются.
Наследственные мутации при раке
Чтобы усложнить ситуацию, ясно, что изменения, необходимые для создания раковой клетки, могут быть выполнены разными способами. Хотя все виды рака должны преодолевать один и тот же спектр регуляторных функций, чтобы расти и прогрессировать, вовлеченные гены могут отличаться . Кроме того, порядок , в котором гены перестают регулироваться или теряются, также может варьироваться.Например, опухоли рака толстой кишки у двух разных людей могут включать очень разные наборы опухолевых супрессоров и онкогенов, даже если исход (рак) одинаков.
Большая неоднородность, наблюдаемая при раке, даже при раке одного и того же органа, означает, что диагностика и лечение сложны. Текущие достижения в молекулярной классификации опухолей должны позволить рациональную разработку протоколов лечения, основанных на реальных генах, задействованных в каждом конкретном случае. Новые диагностические тесты могут включать скрининг сотен или тысяч генов для создания персонализированного профиля опухоли у человека.Эта информация должна позволить адаптировать лечение рака, адаптированное к индивидууму. Для получения дополнительной информации см. Раздел «Геномика / протеомика».
Новые диагностические тесты могут включать скрининг сотен или тысяч генов для создания персонализированного профиля опухоли у человека.Эта информация должна позволить адаптировать лечение рака, адаптированное к индивидууму. Для получения дополнительной информации см. Раздел «Геномика / протеомика».
Генетические изменения, которые приводят к нерегулируемому росту клеток, могут быть приобретены двумя разными способами. Возможно, что мутация может происходить постепенно, в течение ряда лет, что приводит к развитию «спорадического» случая рака. В качестве альтернативы можно унаследовать дисфункциональные гены, ведущие к развитию семейной формы определенного типа рака.Некоторые примеры рака с известными наследственными компонентами включают:
- Рак груди — Наследование мутантных версий генов BRCA 1 и BRCA 2 являются известными факторами риска. Хотя у многих, если не у большинства людей с раком груди , а не , обнаруживаются изменения в этих генах, наличие мутантной формы увеличивает вероятность развития рака груди.

- Рак толстой кишки — Известно, что дефекты в генах репарации ДНК, такие как MSH 2, предрасполагают людей к наследственному неполипозному колоректальному раку (HNPCC).
- Ретинобластома — Известно, что дефекты гена-супрессора опухоли Rb вызывают этот рак глаза и несколько других типов рака. Подробнее об этом заболевании читайте в разделе о Rb .
Это неполный список известных унаследованных типов рака, и несомненно, что более наследственные формы рака будут идентифицированы по мере выяснения генетики различных типов рака.
Более подробную информацию по этой теме можно найти в главах 2 и 4 книги Роберта А.Вайнберг.
Типы мутации
Процесс создания белков, трансляция, основан на «чтении» мРНК, которая была произведена в процессе транскрипции. Любые изменения ДНК, кодирующей ген, приведут к изменению продуцируемой мРНК. В свою очередь, измененная мРНК может привести к выработке белка, который больше не функционирует должным образом. Даже изменение одного нуклеотида в ДНК гена может привести к полностью нефункциональному белку.
Даже изменение одного нуклеотида в ДНК гена может привести к полностью нефункциональному белку.
Есть несколько разных способов изменить ДНК.В следующем разделе более подробно описаны различные типы генетических изменений.
Точечных мутаций
Генетические изменения можно разделить на две общие категории. Первая категория состоит из изменений, которые изменяют только один или несколько нуклеотидов в цепи ДНК. Эти типы изменений получили название точечных мутаций .
Когда рибосомы считывают молекулу информационной РНК, каждые три нуклеотида интерпретируются как одна аминокислота. Эти трехбуквенные коды называются кодонами.Проведя аналогию с английским предложением: «Толстый кот съел крысу» будет содержать 6 кодонов. Изменения, вызванные мутацией, могут привести к таким вещам, как «жир b at съел крысу». или «Фа», или «Жир или , заманивающий ее в…» Воздействие на белок зависит от того, где происходит изменение, и от его типа.
Трехбуквенные кодоны, считываемые рибосомами, могут быть изменены путем мутации одним из трех способов:
Бессмысленные мутации
Новый кодон вызывает преждевременное завершение белка, в результате чего образуется укороченный белок, который часто не функционирует должным образом или вообще.
Миссенс-мутации
Новый кодон вызывает вставку неправильной аминокислоты в белок. Воздействие на функцию белка зависит от того, что вставлено вместо нормальной аминокислоты.
Мутации сдвига рамки считывания
Потеря или увеличение 1 или 2 нуклеотидов приводит к неправильному считыванию пораженного кодона и всех последующих кодонов.Это приводит к совершенно другому и часто нефункциональному белковому продукту.
Ошибки транскрипции
Некоторые повреждения ДНК приводят к образованию модифицированного нуклеотида или небольшой группы нуклеотидов, которые не могут быть «прочитаны» РНК-полимеразой. Когда комплекс РНК-полимеразы достигает этих точек, они иногда обходят повреждение, добавляя нуклеотиды, чтобы продолжить работу, даже если это означает установку неправильного элемента. Этот процесс известен как транскрипционный мутагенез и может играть важную роль в развитии рака.
Когда комплекс РНК-полимеразы достигает этих точек, они иногда обходят повреждение, добавляя нуклеотиды, чтобы продолжить работу, даже если это означает установку неправильного элемента. Этот процесс известен как транскрипционный мутагенез и может играть важную роль в развитии рака.
Транслокации
Другая категория мутаций включает изменения большего количества ДНК, часто на уровне хромосомы. Они называются транслокациями и связаны с разрывом и перемещением фрагментов хромосом. Часто разрывы двух разных хромосом позволяют сформировать две «новые» хромосомы с новыми комбинациями генов.
Хотя может показаться, что это не вызовет особых проблем, поскольку все гены все еще присутствуют, процесс может привести к нарушению регуляции роста клеток несколькими способами —
1.Гены могут не транскрибироваться и транслироваться надлежащим образом в новом месте.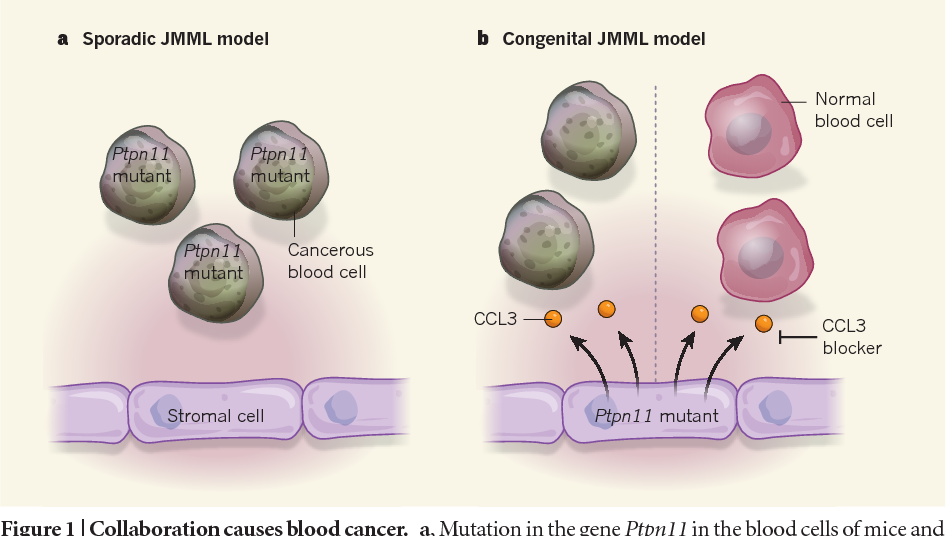
2. Движение гена может привести к увеличению или снижению уровня его транскрипции.
3. Разрыв и повторное соединение могут также происходить в пределах гена (как показано зеленым цветом выше), что приводит к его инактивации.
Для некоторых видов рака очень часто встречаются определенные транслокации, которые даже могут использоваться для диагностики болезни. Транслокации распространены при лейкозах и лимфомах и реже выявляются при раке твердых тканей.Примером может служить обмен между хромосомами 9 и 22, наблюдаемый у более чем 90% пациентов с хроническим миелолейкозом (ХМЛ). Обмен приводит к образованию укороченной формы хромосомы 22, называемой филадельфийской хромосомой (по месту ее открытия). Эта транслокация приводит к образованию онкогена из протоонкогена abl .
Другие виды рака, которые часто (или всегда) связаны с определенными транслокациями, включают лимфому Беркитта, B-клеточные лимфомы и несколько типов лейкемии.
Амплификация гена
В этом очень необычном процессе нормальный процесс репликации ДНК серьезно нарушен. В результате вместо одной копии участка хромосомы создается множество копий. Это приводит к образованию множества копий генов, расположенных в этой области хромосомы. Иногда создается так много копий амплифицированной области, что они фактически могут образовывать свои собственные маленькие псевдохромосомы, называемые двухминутными хромосомами.
В результате вместо одной копии участка хромосомы создается множество копий. Это приводит к образованию множества копий генов, расположенных в этой области хромосомы. Иногда создается так много копий амплифицированной области, что они фактически могут образовывать свои собственные маленькие псевдохромосомы, называемые двухминутными хромосомами.
Гены на каждой из копий могут транскрибироваться и транслироваться, что приводит к избыточной продукции мРНК и белка, соответствующих амплифицированным генам, как показано ниже. Волнистые линии представляют мРНК, продуцируемую транскрипцией каждой копии гена.
Хотя этот процесс не наблюдается в нормальных клетках, он довольно часто встречается в раковых клетках. Если онкоген включен в амплифицированную область, то результирующая сверхэкспрессия этого гена может привести к нарушению регуляции роста клеток.Примеры этого включают амплификацию онкогена myc в широком диапазоне опухолей и амплификацию онкогена Erb B-2 или HER-2/ neu при раке груди и яичников. В случае онкогена HER-2/ neu клинические методы лечения были разработаны для нацеливания на клетки, сверхэкспрессирующие белковый продукт.
В случае онкогена HER-2/ neu клинические методы лечения были разработаны для нацеливания на клетки, сверхэкспрессирующие белковый продукт.
Амплификация гена также способствует возникновению одной из самых больших проблем в лечении рака: лекарственной устойчивости. Опухоли с лекарственной устойчивостью могут продолжать расти и распространяться даже в присутствии химиотерапевтических препаратов.Обычно вовлеченный ген называется MDR m ultiple d rug r esistance. Белковый продукт этого гена действует как насос, расположенный в мембране клеток. Он способен избирательно выбрасывать молекулы из клетки, в том числе химиотерапевтические препараты. Такое удаление делает лекарства неэффективными.
Ваш браузер не поддерживает встроенное видео HTML5.
Более подробно это обсуждается в разделе «Устойчивость к лекарствам». Амплификация различных генов может сделать другие химиотерапевтические препараты неэффективными.
Инверсии, дублирование и удаление
Инверсии
При этих изменениях сегменты ДНК высвобождаются из хромосомы, а затем повторно вставляются в противоположной ориентации. Как и в предыдущих примерах, эта перестройка может приводить к аномальной экспрессии гена либо за счет активации онкогена, либо за счет деактивации гена-супрессора опухоли.
Как и в предыдущих примерах, эта перестройка может приводить к аномальной экспрессии гена либо за счет активации онкогена, либо за счет деактивации гена-супрессора опухоли.
Ваш браузер не поддерживает встроенное видео HTML5.
Дублирование / удаление
Из-за ошибок репликации ген или группа генов могут копироваться более одного раза в пределах хромосомы.Это отличается от амплификации генов тем, что гены не реплицируются за пределами хромосомы, и они копируются только за один дополнительный раз, , а не сотни или тысячи раз. Гены также могут быть потеряны из-за сбоя процесса репликации или других генетических повреждений.
Анеуплоидия
Анеуплоидия — это генетическое изменение, которое включает потерю или приобретение целых хромосом. Из-за проблем в процессе деления клеток реплицированные хромосомы могут не разделяться на дочерние клетки точно.Это может привести к тому, что клетки будут иметь слишком много хромосом или слишком мало хромосом. Примером довольно распространенного анеуплоидного состояния, не связанного с раком, является синдром Дауна, при котором есть дополнительная копия хромосомы 21 во всех клетках пораженного человека.
Примером довольно распространенного анеуплоидного состояния, не связанного с раком, является синдром Дауна, при котором есть дополнительная копия хромосомы 21 во всех клетках пораженного человека.
На приведенной ниже анимации копии двух хромосом сделаны, но когда клетка делится, хромосомы не распределяются равномерно между двумя образующимися клетками (дочерними клетками). В результате в одной из клеток слишком много хромосом, а в другой их недостаточно.
Ваш браузер не поддерживает встроенное видео HTML5.
Раковые клетки очень часто анеуплоидны . У людей обычно 46 хромосом в клетках, но раковые клетки часто имеют намного больше, иногда более 100. Наличие дополнительных хромосом делает клетки нестабильными и серьезно нарушает контроль деления клеток. В настоящее время продолжаются дискуссии о том, являются ли все раком анеуплоидными. Независимо от того, так ли это, очевидно, что анеуплоидия — общая черта раковых клеток.
Эпигенетические изменения
В дополнение к фактическим изменениям в последовательности ДНК, экспрессия генов может быть изменена изменениями в ДНК и хроматине, которые не изменяют последовательность. Поскольку эти изменения не изменяют последовательность ДНК в генах, их называют epi генетическими изменениями . Ниже описаны два типа эпигенетических изменений.
Поскольку эти изменения не изменяют последовательность ДНК в генах, их называют epi генетическими изменениями . Ниже описаны два типа эпигенетических изменений.
Метилирование
В этом изменении некоторые нуклеотиды в ДНК модифицируются путем добавления метильной (-Ch4) группы к основанию.Метилирование ДНК связано с инактивацией этой конкретной области ДНК. Паттерны аномального метилирования ДНК были замечены в раковых клетках. Как и описанные изменения, метилирование изменяет экспрессию затронутых генов.
Ацетилирование
В этом эпигенетическом изменении гистоновые белки, вокруг которых намотана ДНК, модифицируются путем добавления ацетильных (-Ch4CHO) групп. Это изменение приводит к ослаблению взаимодействия ДНК: гистон и связано с повышенной экспрессией гена .Модификация процессов добавления и удаления ацетильных групп в ДНК является активной областью исследований в области лечения рака.
Подробнее об эпигенетических изменениях и лечении рака.
Причины мутации
Как мы видели, раковые клетки создаются из нормальных клеток-предшественников в результате накопления генетических повреждений. Механизмы, вызывающие изменения, разнообразны. В широком смысле агенты генетических изменений (мутаций) в основном относятся к категориям, описанным ниже, и подробно рассматриваются в следующем разделе.
Спонтанные мутации
Спонтанные мутации : Основания (A, T, G, C) в ДНК изменены или потеряны из-за неисправленных ошибок репликации или случайных молекулярных событий . Например, потеря аминогруппы из цитозина, нормального основания, обнаруженного в ДНК, приводит к образованию урацила, основания, обычно не обнаруживаемого в ДНК. Если это изменение не обнаружено и не отменено, может произойти мутация. Иногда целое основание может быть потеряно в результате разрыва связи между основной цепью ДНК и основанием.Это приводит к разрыву в двойной спирали ДНК, который, если его не восстановить, может привести к мутации при следующем копировании ДНК (то есть во время репликации).
Ваш браузер не поддерживает встроенное видео HTML5.
Индуцированные мутации
Индуцированные мутации : Мутации могут быть индуцированы путем воздействия на организмы (или клетки) различных видов лечения. Вот некоторые из наиболее распространенных:
Радиация — Один из первых известных мутагенов, радиация является мощным индуктором мутаций.Различные типы излучения вызывают разные типы генетических изменений. Ультрафиолетовое (УФ) излучение вызывает точечные мутации. Рентгеновские лучи могут вызывать разрывы двойной спирали ДНК и приводить к транслокациям, инверсиям и другим типам повреждений хромосом. Воздействие ультрафиолетовых лучей на солнечном свете связывают с раком кожи. Обратите внимание, что повреждающие ДНК свойства излучения использовались в нескольких различных лучевых методах лечения рака.
Ниже показан тип мутации, вызванной ультрафиолетовым излучением.В этом примере бомбардировка двойной спирали ДНК ультрафиолетовыми лучами вызывает соединение двух оснований. Это изменяет структуру ДНК и может привести к необратимым изменениям, если ее не исправить.
Это изменяет структуру ДНК и может привести к необратимым изменениям, если ее не исправить.
Другой тип излучения — это энергия, излучаемая естественными радиоактивными элементами (такими как радон и уран) или искусственными источниками, такими как обнаруженные (и созданные) в ядерных реакторах. Излучение этого типа бывает разных типов и может вызывать разные типы повреждений клеток и тканей.Радиация может напрямую повредить ДНК или вызвать образование химикатов (например, активных форм кислорода или АФК), которые затем могут повредить ДНК или другие компоненты клетки.
Облучение радиоактивных материалов хорошо задокументировано. Анализы людей, переживших атомные бомбы, сброшенные на Японию во время Второй мировой войны, показали значительное увеличение лейкозов вскоре после воздействия, а затем рост других типов рака в течение следующих десятилетий.
Опасные количества радиоактивных материалов также были случайно выброшены с атомных электростанций.Радиационное облучение в результате аварийного выброса радиоактивных материалов из Чернобыльского ядерного реактора было связано с увеличением заболеваемости раком щитовидной железы и другими злокачественными опухолями.
Медицинское оборудование для визуализации (например, рентгеновские аппараты и компьютерные томографы) также подвергает пациентов воздействию радиации. Считается, что количества, используемые для любого отдельного теста, не вызывают значительного количества рака, но долгосрочное влияние многих тестов в течение нескольких лет неясно. Точно так же не считается, что сканирование всего тела пассажиров самолетов в аэропортах создает риск рака.Пассажиры, летящие в самолетах, также подвергаются облучению из космоса, но на низком уровне и, как считается, не представляют риска рака даже для членов летного экипажа.
Химические мутагены — Известно, что многие различные химические вещества вызывают мутации. Эти химические вещества проявляют свое действие, связываясь с ДНК или строительными блоками ДНК и вмешиваясь в процессы репликации или транскрипции. Некоторыми примерами сильнодействующих мутагенов являются бензо-а-пирен, химическое вещество, содержащееся в сигаретном дыме, и афлатоксин, мутаген, наиболее часто встречающийся в неправильно хранимых сельскохозяйственных продуктах.
Эти химические вещества проявляют свое действие, связываясь с ДНК или строительными блоками ДНК и вмешиваясь в процессы репликации или транскрипции. Некоторыми примерами сильнодействующих мутагенов являются бензо-а-пирен, химическое вещество, содержащееся в сигаретном дыме, и афлатоксин, мутаген, наиболее часто встречающийся в неправильно хранимых сельскохозяйственных продуктах.
Хроническое воспаление — Хроническое воспаление может привести к повреждению ДНК из-за производства мутагенных химических веществ клетками иммунной системы. Примером может служить длительное воспаление, вызванное инфицированием вирусом гепатита. Узнайте больше о вирусах и раке.
Кислородные радикалы — Во время захвата энергии из пищи, которая происходит в наших митохондриях, могут образовываться химические вещества, которые очень реактивны и способны повредить клеточные мембраны и саму ДНК.Эти промежуточные продукты (ROI) могут также образовываться при воздействии на клетки радиации, как показано ниже.
Ваш браузер не поддерживает встроенное видео HTML5.
Мутагенная активность ROI связана с развитием рака, а также с активностью нескольких противоопухолевых методов лечения, включая лучевую и химиотерапию.
Отделение аномальных клеток
Во время митоза возможно, что в процессе деления клетки не удается точно разделить реплицированные хромосомы на две дочерние клетки.Ошибка этого типа приведет к образованию анеуплоидных клеток. Клетки либо будут отсутствовать, либо они получат значительное количество генов. Этот редкий процесс может создавать клетки, более склонные к нерегулируемому делению клеток. Как указывалось ранее, большой процент раковых заболеваний, выделенных у людей, является анеуплоидным.
Если в клетке есть мутация в гене, белковый продукт которого отвечает за «проверку» процесса деления, все может быстро выйти из-под контроля, и дочерние клетки каждого деления могут становиться все более ненормальными.
Вирусы как мутагены
Считается, что вирусы ответственны за значительный процент случаев рака. Вирусы могут вызывать рак по-разному, и то, как работает каждый тип вируса, вероятно, будет немного отличаться. Некоторые вирусы (включая многие ретровирусы) могут вызывать мутации, вставляя свои гены в геном инфицированной клетки. Вставленная ДНК может разрушить или изменить активность затронутых генов.
Вирусы могут вызывать рак по-разному, и то, как работает каждый тип вируса, вероятно, будет немного отличаться. Некоторые вирусы (включая многие ретровирусы) могут вызывать мутации, вставляя свои гены в геном инфицированной клетки. Вставленная ДНК может разрушить или изменить активность затронутых генов.
Вирусы также могут вызывать мутации косвенным путем.Например: заражение вирусом гепатита может длиться много лет. В это время защитная система организма пытается избавиться от вируса, производя токсичные химические вещества. Эти химические вещества могут нанести вред здоровым клеткам-свидетелям, отправляя их по дороге, ведущей к раку. Есть множество других способов, которыми вирусы могут вызывать рак.
Из-за важности вирусов в развитии многих видов рака мы создали раздел, посвященный вирусам и раку.
Транспозоны как мутагены
Транспозоны — это короткие последовательности ДНК, которые могут перемещаться из одного места в ДНК в другое. Транспозоны кодируют фермент, транспозазу, который действует для сращивания транспозона в новые места в геноме (см. Схему транспозона внизу слева). Транспозоны были открыты Барбарой МакКлинток, и она получила Нобелевскую премию за свою работу. Геном человека содержит множество инактивированных копий транспозонов, утративших способность перемещаться или «прыгать» в новые места.Около 50% генома человека состоит из «мертвых» транспозонов.
Схему транспозона внизу слева). Транспозоны были открыты Барбарой МакКлинток, и она получила Нобелевскую премию за свою работу. Геном человека содержит множество инактивированных копий транспозонов, утративших способность перемещаться или «прыгать» в новые места.Около 50% генома человека состоит из «мертвых» транспозонов.
Перемещение активных транспозонов может приводить к мутациям, изменяющим активность генов. Наглядным примером движения транспозона (называемого транспозицией) является окраска зерен индийской кукурузы (см. Внизу справа). Считается, что транспозоны, которые активны у людей, участвуют в заболеваниях человека, включая рак.
Сводка мутаций
Генетическое изменение (мутация) Введение
- Аномальное поведение, демонстрируемое раковыми клетками, является результатом серии мутаций в ключевых регуляторных генах (т.е. Гены репарации ДНК).
- Считается, что большинство видов рака возникает из-за одной клетки-предшественника, которая приобретает достаточно мутаций, чтобы стать раковой клеткой.

Мутации ДНК
- Генетические изменения могут быть небольшими, затрагивая только один или несколько нуклеотидов (точечные мутации), или они могут быть довольно большими, изменять структуру хромосомы или хромосом.
- точечных мутаций
- Трансляция — это производство белка ферментами, которые «читают» трехнуклеотидные «слова» (кодоны) вдоль информационной РНК (мРНК).
- Даже изменение одного нуклеотида в ДНК гена может привести к полностью нефункциональному белку. Мутации сгруппированы в соответствии с изменениями, которые они вызывают в результирующем белковом продукте пораженного гена.
- Нонсенс-мутации — Новый (мутантный) кодон вызывает преждевременную остановку синтеза белка.
- Миссенс-мутации — Измененный кодон приводит к вставке неправильной аминокислоты в белок.
- Мутации сдвига рамки — Потеря или увеличение 1 или 2 нуклеотидов в мРНК приводит к неправильному считыванию кодонов.
 Часто приводит к укороченным и нефункциональным белкам.
Часто приводит к укороченным и нефункциональным белкам.
- Изменения уровня хромосомы
- Транслокации — Обрыв и (иногда) обмен фрагментами хромосомы.
- Амплификация гена — Аномальная репликация создает несколько копий области хромосомы. В конечном итоге это приводит к перепроизводству соответствующих белков.
- Инверсии — Сегменты ДНК высвобождаются из хромосомы и затем повторно вставляются в противоположной ориентации.
- Дупликации / удаления — Ген или группа генов могут быть полностью потеряны или скопированы более одного раза в пределах хромосомы.
- Анеуплоидия — Генетическое изменение, которое включает потерю или приобретение целых хромосом.
- Спонтанные мутации могут происходить из-за неисправленной ДНК или случайных молекулярных событий.
- Анеуплоидия очень распространена в раковых клетках.
Эпигенетические изменения
- Экспрессия гена может быть изменена изменениями в ДНК и хроматине, которые не изменяют генетическую последовательность.
 Примеры включают метилирование ДНК и ацетилирование гистонов.
Примеры включают метилирование ДНК и ацетилирование гистонов. - Метилирование — Некоторые нуклеотиды в ДНК модифицируются добавлением метильной группы, что связано с инактивацией этой области ДНК
- Ацетилирование — Добавление ацетильных групп ослабляет ДНК и увеличивает экспрессию генов.
Индуцированные мутации
- Мутации могут быть вызваны воздействием на организмы (или клетки) различных видов лечения:
- Радиация — УФ-лучи вызывают точечные мутации, а рентгеновские лучи вызывают множественные повреждения.
- Химические мутагены — могут связываться с ДНК или строительными блоками ДНК и мешать процессам репликации или транскрипции.
- Хроническое воспаление — повреждение ДНК из-за производства мутагенных химических веществ клетками иммунной системы
- Кислородные радикалы — образуются в результате производства энергии клеткой и могут повредить ДНК.
Другие генетические изменения
- Аберрантное деление клеток, приводящее к неправильному делению хромосом, может привести к анеуплоидии.

- Вирусы могут вызывать генетические повреждения несколькими различными способами и связаны с широким спектром видов рака.
Мутация и рак
- Кажется, что переход от нормальной здоровой клетки к раковой — это постепенный прогресс.
- Развитие рака требует генетических изменений в нескольких различных онкогенах и опухолевых супрессорах.
- Все виды рака должны преодолевать один и тот же спектр регуляторных функций, чтобы расти и прогрессировать, но вовлеченные гены могут отличаться.
- Неоднородность рака затрудняет диагностику и лечение.
- Возможно унаследовать дисфункциональные гены, ведущие к развитию семейной формы определенного типа рака.
Знай поток: мутация
Know the Flow — это интерактивная игра, в которой вы можете проверить свои знания. Играть:
- Перетащите соответствующие варианты из столбца справа и разместите их по порядку в полях слева.Обратите внимание, что вы будете использовать только пять из шести вариантов для завершения игры.

- Когда закончите, нажмите «Проверить», чтобы увидеть, сколько вы ввели правильно.
- В случае неправильных ответов нажмите «Описание», чтобы просмотреть информацию о процессах.
- Чтобы повторить попытку, выберите «Сброс» и начните заново.
Знай поток: мутация
Процессы
Узнать больше
Клетка в процессе синтеза ДНК
Узнать больше
Сделано много копий участка хромосомы
Узнать больше
Транскрипция амплифицированных генов
Узнать больше
Трансляция амплифицированных генов
Узнать больше
Избыточное производство ключевого белка приводит к росту лекарственно-устойчивой опухоли
Узнать больше
Происходит дублирование
Проверить ответы Перезагрузить
Вы сделали это!
Процесс в правильном порядке!
Играть снова Для игры в Know the Flow требуется Javascriptзародышевых линий и соматические мутации: в чем разница?
Рак возникает в результате мутаций или вредных изменений в результате изменения последовательности ДНК гена. Большинство мутаций связано с изменением порядка пар оснований, включая замены, делеции, добавления или сдвиги. Мутации можно разделить на широкие категории в зависимости от ткани, в которой они возникают.
Большинство мутаций связано с изменением порядка пар оснований, включая замены, делеции, добавления или сдвиги. Мутации можно разделить на широкие категории в зависимости от ткани, в которой они возникают.
Соматические или приобретенные мутации — наиболее частая причина рака. Эти мутации происходят из-за повреждения генов в отдельной клетке в течение жизни человека. Раковые заболевания, возникающие из-за соматических мутаций, называются спорадическими раками.Соматические мутации не обнаруживаются в каждой клетке тела и не передаются от родителей к детям. Некоторые общие канцерогены, вызывающие эти мутации, включают употребление табака, ультрафиолетовое излучение, вирусы, химическое воздействие и старение.
Мутации зародышевой линии Мутации зародышевой линии встречаются гораздо реже. Мутация зародышевой линии происходит в сперматозоиде или яйцеклетке и передается непосредственно от родителя ребенку во время зачатия. По мере того, как эмбрион превращается в ребенка, мутация исходной сперматозоида или яйцеклетки копируется в каждую клетку тела.Поскольку мутация затрагивает репродуктивные клетки, она может передаваться из поколения в поколение.
По мере того, как эмбрион превращается в ребенка, мутация исходной сперматозоида или яйцеклетки копируется в каждую клетку тела.Поскольку мутация затрагивает репродуктивные клетки, она может передаваться из поколения в поколение.
Рак, вызванный мутациями зародышевой линии, называется наследственным или наследственным раком. На его долю приходится около 5-10% всех раковых заболеваний. Выявлено более 50 различных наследственных синдромов рака, которые могут передаваться от одного поколения к другому. Семейные и личные истории, указывающие на мутации зародышевой линии, включают:
- Ранний рак (рак груди, толстой кишки или эндометрия в возрасте до 50 лет)
- Редкие виды рака (рак груди у мужчин)
- Определенные патологии (тройной отрицательный рак груди)
- Раковых заболеваний в семье больше, чем можно было бы ожидать
Дополнительные красные флажки, которые могут указывать на риск возникновения зародышевой линии, см. На боковой панели.
На боковой панели.
- Рак, возникший в более молодом возрасте, чем ожидалось в общей популяции (например, рак груди, эндометрия или толстой кишки в возрасте 50 лет и младше)
- Более одного первичного рака у одного человека или двусторонний рак в парном органе (например, рак груди в обеих молочных железах)
- Доказательства аутосомно-доминантного наследования (например, затронуты два или более поколений, затронуты как мужчины, так и женщины)
- Любая форма рака, связанная с известным онкологическим синдромом (например,g., рак груди, яичников и поджелудочной железы; рак толстой кишки, эндометрия и яичников)
- Наличие предраковых состояний (например, 20 колоректальных аденоматозных полипов)
- Диагноз рака, связанный с наследственным риском (например, рак груди у мужчин, рак яичников, ретинобластома, поджелудочная железа, параганглиома, феохромоцитома)
- Специфические клинические характеристики опухоли, связанной с синдромами наследственного рака (например, микросателлитная нестабильность при раке толстой кишки или тройной отрицательный рак груди)
- Лица из семей с известной мутацией, связанной с повышенным риском рака
В целом, раковые клетки имеют больше генетических изменений, чем нормальные клетки, но рак каждого человека имеет уникальное сочетание генетических изменений. Некоторые из этих изменений могут быть результатом деления раковых клеток, а не исходным событием, которое привело к развитию рака. По мере того, как рак продолжает расти, произойдут дополнительные изменения. Даже в пределах одной опухоли раковые клетки могут иметь разные генетические изменения.
Некоторые из этих изменений могут быть результатом деления раковых клеток, а не исходным событием, которое привело к развитию рака. По мере того, как рак продолжает расти, произойдут дополнительные изменения. Даже в пределах одной опухоли раковые клетки могут иметь разные генетические изменения.
позволяют идентифицировать мутации как зародышевой линии, так и соматические, сравнивая последовательность ДНК с последовательностью в нормальных клетках. Мутации зародышевой линии можно идентифицировать, используя образец слюны, который содержит буккальные клетки, или образец крови.Генетическое тестирование опухоли может быть использовано для выявления генетических изменений в раковых клетках, которые могут способствовать развитию рака у человека. Эта информация может помочь определить, какие методы лечения могут быть наиболее эффективными для лечения того или иного злокачественного новообразования. Информация, полученная при тестировании зародышевой линии и опухоли, может частично совпадать. Например, человек со злокачественным новообразованием, имеющий мутацию BRCA в опухоли, может иметь или не иметь унаследованную мутацию BRCA . Тестирование зародышевой линии необходимо, чтобы определить, наследуется ли мутация.В зависимости от типа рака для выбора вариантов лечения может использоваться тестирование как опухоли, так и зародышевой линии. Таким образом, секвенирование ДНК опухоли также может указывать на наличие унаследованных мутаций. Пациентов следует направлять на тестирование на мутацию зародышевой линии, если у них есть личный или семейный анамнез, указывающий на наследственный риск, опухоль имеет микросателлитную нестабильность, ген в опухоли является геном предрасположенности к раку, ген считается патогенным или вероятным патогенным, или аллель частота приближается к 50%.
Например, человек со злокачественным новообразованием, имеющий мутацию BRCA в опухоли, может иметь или не иметь унаследованную мутацию BRCA . Тестирование зародышевой линии необходимо, чтобы определить, наследуется ли мутация.В зависимости от типа рака для выбора вариантов лечения может использоваться тестирование как опухоли, так и зародышевой линии. Таким образом, секвенирование ДНК опухоли также может указывать на наличие унаследованных мутаций. Пациентов следует направлять на тестирование на мутацию зародышевой линии, если у них есть личный или семейный анамнез, указывающий на наследственный риск, опухоль имеет микросателлитную нестабильность, ген в опухоли является геном предрасположенности к раку, ген считается патогенным или вероятным патогенным, или аллель частота приближается к 50%.
Медсестрам-онкологам предлагается знать, когда направлять пациентов для тестирования зародышевой линии, и объяснять разницу между генетическими изменениями зародышевой линии и соматическими генетическими изменениями, а также то, что изменения зародышевой линии могут присутствовать в опухолях.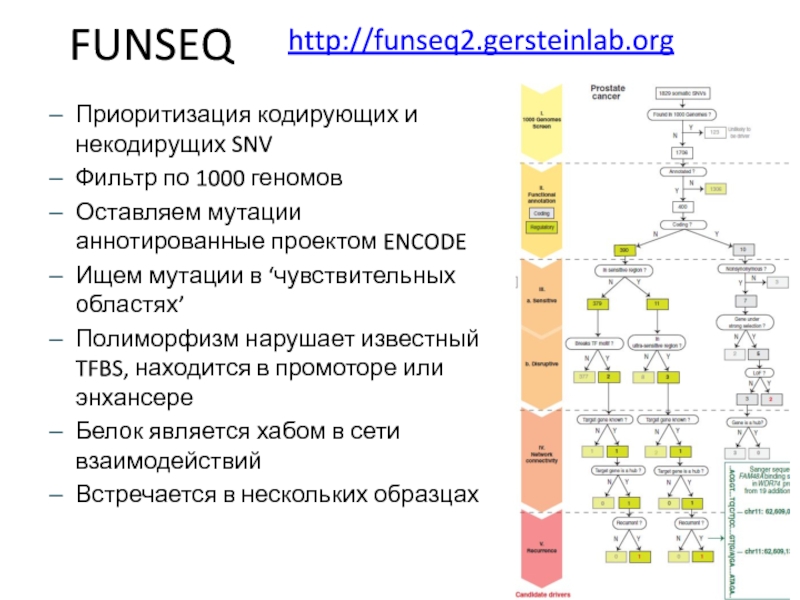 Это сбивает с толку и вызывает стресс для пациентов и их семей, особенно если тестирование опухоли предполагает риск зародышевой линии, потому что пациенты должны справляться не только с диагнозом рака, но и с возможностью того, что другие члены семьи имеют наследственную предрасположенность к развитию злокачественных новообразований.Генетическое тестирование также может спасти жизнь и снизить заболеваемость и смертность, связанные со злокачественными новообразованиями, когда информация о соматических генетических изменениях определяет выбор лечения, а знания о мутациях зародышевой линии выявляют людей с риском развития злокачественных новообразований и их соответствующие стратегии профилактики и раннего выявления рака.
Это сбивает с толку и вызывает стресс для пациентов и их семей, особенно если тестирование опухоли предполагает риск зародышевой линии, потому что пациенты должны справляться не только с диагнозом рака, но и с возможностью того, что другие члены семьи имеют наследственную предрасположенность к развитию злокачественных новообразований.Генетическое тестирование также может спасти жизнь и снизить заболеваемость и смертность, связанные со злокачественными новообразованиями, когда информация о соматических генетических изменениях определяет выбор лечения, а знания о мутациях зародышевой линии выявляют людей с риском развития злокачественных новообразований и их соответствующие стратегии профилактики и раннего выявления рака.
Раковые мутации, клетка за клеткой | Дайджесты eLife Science
Поделитесь своим мнением + Открытые аннотации.Текущее количество аннотаций на этой странице вычисляется.
Клетки рака груди. Изображение предоставлено: Энни Кавана (CC BY-NC 4.0)
Клетки в организме остаются здоровыми, тщательно предотвращая и исправляя случайные изменения или мутации в их генетическом материале. Однако в раковых клетках эти механизмы могут нарушаться. Когда эти клетки растут и размножаются, они могут накапливать множество мутаций. В результате раковые клетки в одной и той же опухоли могут содержать уникальную комбинацию генетических изменений.
Эта генетическая неоднородность может повлиять на реакцию рака на лечение, и ее все чаще начинают ценить в клинической практике. Например, если лекарство действует только против раковых клеток, несущих определенную мутацию, любые клетки, лишенные этого генетического изменения, будут продолжать расти и вызывать рецидив. Однако до сих пор сложно количественно оценить и понять генетическую гетерогенность рака.
Изменения числа копий (или CNA) — это класс мутаций, при котором большие и малые участки генетического материала приобретаются или теряются. Это может привести к образованию клеток с ненормальным количеством копий генов в этих участках. Здесь Baslan et al. намереваются изучить, как CNA могут различаться между отдельными раковыми клетками в одной и той же опухоли.
Это может привести к образованию клеток с ненормальным количеством копий генов в этих участках. Здесь Baslan et al. намереваются изучить, как CNA могут различаться между отдельными раковыми клетками в одной и той же опухоли.
Для этого из опухолей молочной железы человека были выделены тысячи отдельных раковых клеток, а для проверки генетической информации каждой из них был использован метод, называемый секвенированием одноклеточного генома. Эти эксперименты подтвердили, что CNA действительно различаются — иногда резко — между пациентами и клетками, взятыми из одной и той же опухоли.Например, многие из клеток несли дополнительные копии хорошо известных раковых генов, важных для лечения, но точное количество копий варьировалось от клетки к клетке. Эта гетерогенность существовала как для отдельных генов, так и для более крупных участков ДНК: это имело место, например, для всего участка хромосомы 8, области, часто поражаемой в опухолях молочной железы и других опухолях.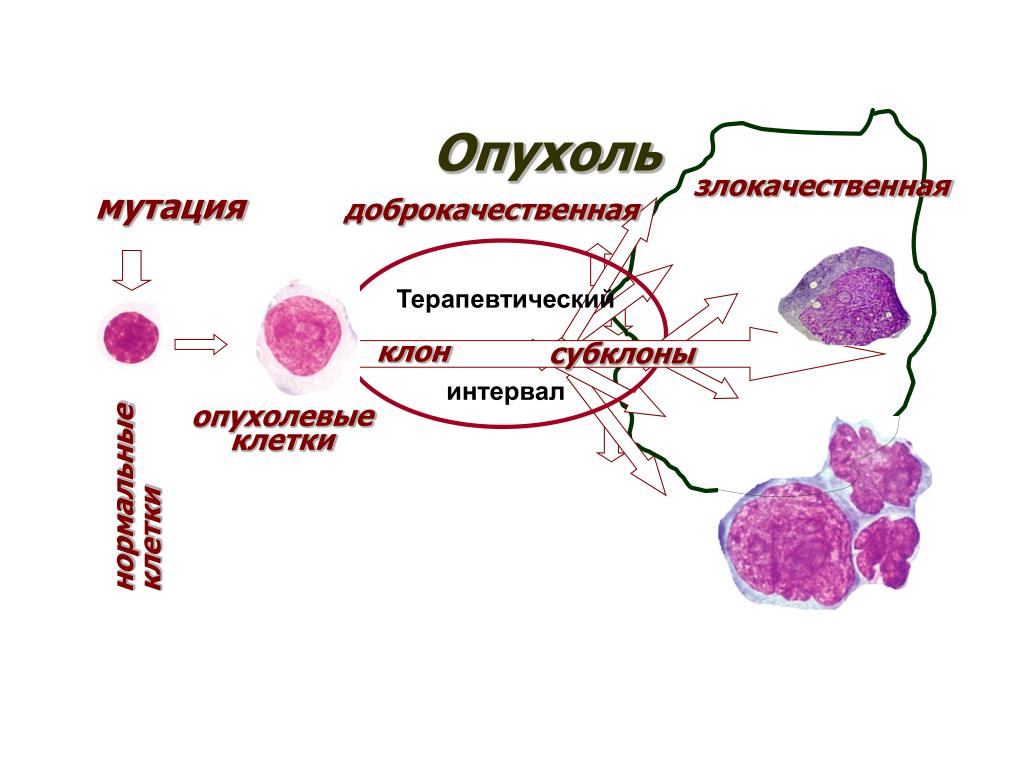
Работа Baslan et al. отражает явную степень генетической гетерогенности рака и тем самым подчеркивает силу секвенирования одноклеточного генома.В будущем более глубокое понимание генетических изменений, присутствующих на уровне отдельной раковой клетки, может помочь клиницистам более эффективно управлять заболеванием.
Генетическое тестирование и расширенное геномное тестирование на рак
Генетическое тестирование и
расширенное геномное тестирование
Генетическое тестирование и геномное тестирование могут показаться похожими, но это очень разные процедуры. Генетика относится к генам, с которыми родился человек, которые унаследованы от прошлых поколений.Генетические тесты могут помочь определить, унаследованы ли у человека генные мутации, которые могут увеличить риск рака. Геномика относится к молекулярному составу опухоли. Расширенное геномное тестирование может помочь найти генные мутации, которые могут влиять на развитие рака. Оба типа тестов могут помочь вам и вашему врачу принять информированное решение о типах лечения, которые следует рекомендовать для вашего конкретного рака.
Оба типа тестов могут помочь вам и вашему врачу принять информированное решение о типах лечения, которые следует рекомендовать для вашего конкретного рака.
Узнайте больше о различиях генетики и геномики
Расширенное геномное тестирование
При расширенном геномном тестировании берется биопсия опухоли пациента, раковые клетки выделяются и извлекаются из образца биопсии, а ДНК раковых клеток секвенируется в лаборатории.Затем используется сложное оборудование для сканирования секвенированного генетического профиля на предмет аномалий, которые определяют, как функционирует опухоль.
Если обнаруживаются идентифицируемые аномалии, они анализируются, чтобы определить, соответствуют ли они известным мутациям, которые, возможно, отреагировали на определенные методы лечения, или если данные свидетельствуют о том, что может существовать потенциальный вариант лечения, который ранее не рассматривался. Если есть совпадение, врачи могут использовать результаты, чтобы предложить методы лечения, которые использовались в прошлом для нацеливания на те же мутации.
Хотя обычное геномное тестирование является стандартом лечения для некоторых пациентов, расширенные оценки не рекомендуются или доступны не всем пациентам. Тесты генного картирования могут быть подходящими для пациентов с редкими, необычными или трудноизлечимыми формами рака, а также для пациентов, опухоли которых не поддаются адекватному лечению традиционными методами лечения.
Подробнее о расширенном геномном тестировании
Генетическое тестирование
Генетическое тестирование состоит из анализа крови или жидкости для полоскания рта. Анализ образца может определить вероятность развития у человека определенного типа рака, способствовала ли мутация гена существующему диагнозу рака и подвергается ли человек большему риску повторного развития того же рака или развития другого типа рака.
Положительный результат генетического теста не всегда означает, что у человека разовьется рак. Это только означает, что он или она несет одну или несколько генных мутаций. Точно так же отрицательный результат теста не означает, что у человека не разовьется рак.
Точно так же отрицательный результат теста не означает, что у человека не разовьется рак.
Подробнее о генетическом тестировании
Генные мутации
Генные мутации — это постоянные аномальные изменения в ДНК гена. Эти мутации могут увеличить риск развития рака и других заболеваний. Есть два типа генных мутаций:
Приобретенные мутации возникают, когда клетки повреждаются во время репликации вирусами или воздействием канцерогенов, таких как табачный дым или радиация.
Наследственные мутации или мутации зародышевой линии передаются из поколения в поколение.
Не у всех с генной мутацией развивается рак, но любой тип генной мутации может привести к неконтролируемому росту клеток и образованию опухолей. Приобретенные мутации — самые частые причины рака. Наследственные мутации составляют около 10 процентов всех видов рака.
Генные мутации, которые могут играть роль в развитии рака, включают:
BRCA1 и BRCA2
Мутации в генах BRCA1 и BRCA2 (рак груди 1 и рак груди 2) могут повышать риск рака груди и / или яичников. Мутации BRCA могут передаваться по наследству и связаны с повышенным риском развития рака. Тест на ген BRCA обычно рекомендуется людям с личным или семейным анамнезом рака, а также тем, у кого есть определенный тип рака груди. Обычно этот тест не проводится людям со средним риском рака груди или яичников.
Мутации BRCA могут передаваться по наследству и связаны с повышенным риском развития рака. Тест на ген BRCA обычно рекомендуется людям с личным или семейным анамнезом рака, а также тем, у кого есть определенный тип рака груди. Обычно этот тест не проводится людям со средним риском рака груди или яичников.
Нестабильность микроспутника и дефект восстановления несоответствия
Рак иногда возникает при повреждении ДНК в нормальных клетках.Но организм часто устраняет это повреждение до того, как образуется рак, используя механизмы, обнаруженные в нормальных клетках, которые ищут дефекты восстановления в ДНК. Один из этих механизмов называется исправлением несоответствия, который исправляет ошибки, возникающие при делении клеток. Когда эта функция нарушается, клетки имеют так называемый дефицит репарации несоответствия (dMMR). Клетки с дММР могут создавать еще более нестабильную клеточную среду, которая заставляет микросателлиты или повторяющиеся участки ДНК в клетке образовывать несовпадения вместо точных дубликатов профиля ДНК. Эта нестабильность называется микросателлитной нестабильностью (MSI-H), и иногда она заставляет клетки мутировать и бесконтрольно расти, образуя опухоли.
Эта нестабильность называется микросателлитной нестабильностью (MSI-H), и иногда она заставляет клетки мутировать и бесконтрольно расти, образуя опухоли.
MSI-H и dMMR обнаруживаются при различных формах рака. Например, MSI-H был обнаружен в 15 процентах всех колоректальных опухолей, а также в некоторых случаях рака матки, мочевого пузыря, груди, простаты и щитовидной железы. Этот дефект также был обнаружен у 90 процентов пациентов с колоректальным раком, которые также страдают синдромом Линча, генетическим заболеванием, повышающим риск некоторых видов рака.Не все клетки с дММР развивают MSI-H. И в редких случаях MSI-H может возникать в клетках без dMMR. Препараты иммунотерапии, называемые ингибиторами контрольных точек, были одобрены для лечения рака с помощью dMMR или MSI-H.
ПД-L1
Рецептор запрограммированной клеточной смерти 1, или PD-1, представляет собой белковый рецептор, обнаруженный на Т-клетках, которые представляют собой иммунные клетки, защищающие организм от болезней и инфекций. PD-1 называют белком контрольной точки, потому что он ищет клетки и проверяет, вредны ли они. Когда PD-1 на иммунной клетке взаимодействует с PD-L1 на другой клетке, он отключает иммунный ответ.Некоторые раковые клетки могут иметь множество рецепторов PD-L1, что позволяет им маскироваться под здоровые клетки, когда их «контролирует» иммунная система. Ингибиторы контрольных точек предназначены для блокирования взаимодействия рецепторов PD-1 и PD-L1 и позволяют иммунной системе лучше распознавать раковые клетки и атаковать их. Эти препараты были одобрены для лечения различных видов рака, включая меланому, рак легких и мочевого пузыря.
PD-1 называют белком контрольной точки, потому что он ищет клетки и проверяет, вредны ли они. Когда PD-1 на иммунной клетке взаимодействует с PD-L1 на другой клетке, он отключает иммунный ответ.Некоторые раковые клетки могут иметь множество рецепторов PD-L1, что позволяет им маскироваться под здоровые клетки, когда их «контролирует» иммунная система. Ингибиторы контрольных точек предназначены для блокирования взаимодействия рецепторов PD-1 и PD-L1 и позволяют иммунной системе лучше распознавать раковые клетки и атаковать их. Эти препараты были одобрены для лечения различных видов рака, включая меланому, рак легких и мочевого пузыря.
Другие генные мутации, которые могут быть обнаружены при раке, включают:
| Генетическая мутация | Ассоциированный рак | Тест | Комментарии |
|---|---|---|---|
| Ген ALK | Рак легкого, неходжкинская лимфома | Биопсия опухоли | Тесты могут помочь определить варианты лечения и ответ. |
| Филадельфийская хромосома | Лейкемия | Анализ крови или костного мозга | Тесты могут помочь диагностировать рак и определить варианты лечения. |
| BRAF V600 | Меланома толстой кишки | Биопсия опухоли | Анализы могут помочь определить варианты лечения. |
| Комплект C / CD117 | Опухоль стромы желудочно-кишечного тракта, меланома | Биопсия опухоли | Тесты могут помочь диагностировать рак и определить варианты лечения. |
| Рецептор эстрогена (ER) и рецептор прогестерона (PR) | Рак груди | Биопсия опухоли | Анализы могут помочь определить варианты лечения. |
| KRAS | Колоректальный рак, рак легких | Биопсия опухоли | Анализы могут помочь определить варианты лечения. |
Раковые клетки более склонны к генетической мутации — ScienceDaily
Когда клетки становятся злокачественными, они также становятся в 100 раз более склонными к генетической мутации, чем обычные клетки, как выяснили исследователи.Полученные данные могут объяснить, почему клетки опухоли имеют так много генетических мутаций, но также могут быть плохой новостью для лечения рака, нацеленного на конкретный ген, контролирующий злокачественное новообразование.
Исследование проводилось доктором Лоуренсом Лоэбом, профессором патологии и биохимии Медицинской школы Вашингтонского университета в Сиэтле. Леб представит свое исследование 18 февраля на заседании Американской ассоциации содействия развитию науки в Сан-Франциско.
Считается, что большинство видов рака начинаются со случайной генетической мутации, из-за которой нормальная клетка начинает работать неправильно.За этим следуют мутации, которые наделяют раковые клетки свойствами, позволяющими им расти без нормального контроля и превращаться в опухоль. Эти мутировавшие гены будут мишенями для химиотерапии.
Эти мутировавшие гены будут мишенями для химиотерапии.
Но у Леба была другая идея, которую он первоначально вынашивал много лет назад — что, если раковые клетки каким-то образом изменятся и станут более склонными к мутации? Эти «мутаторные» клетки будут развивать опасные генетические мутации намного быстрее, чем нормальные клетки, что может объяснить большое количество мутаций, наблюдаемых в опухолевых клетках.
Поскольку технология генетики рака значительно улучшилась, Леб и его коллеги только недавно смогли проверить эту гипотезу. Они обнаружили, что в опухолевой ткани частота случайных мутаций до 100 раз выше, чем в нормальной ткани того же пациента. Гипотеза «мутатора» кажется верной.
А теперь о плохих новостях: если раковые клетки действительно станут клетками-«мутаторами», традиционная химиотерапия и другие лекарства могут никогда не оказаться очень эффективными против прогрессирующих опухолей.
«Это очень плохая новость, потому что это означает, что раковые клетки в опухоли будут иметь мутации, защищающие их от лечения», — пояснил Лоеб.
Химиотерапевтический препарат может воздействовать на конкретный онкоген, который представляет собой ген, влияющий на злокачественность конкретной клетки. Но если раковые клетки являются клетками-мутаторами, одна опухоль может иметь клетки с множеством различных типов онкогенов и генов, устойчивых к лекарствам. Этот химиотерапевтический препарат может убить некоторые раковые клетки, но миллионы других клеток опухоли будут жить.Чтобы химиотерапевтическое лечение было эффективным, оно может быть нацелено на более чем один онкоген — так называемая комбинированная химиотерапия.
Но не все новости плохие. Леб считает, что это исследование может в конечном итоге помочь врачам определить стадию и злокачественность опухоли, проверив количество ее мутаций. Чем больше мутаций, тем дальше опухоль может перейти в злокачественное новообразование или метастаз.
Работа Леба может также привести к открытию того, почему раковые клетки становятся клетками-мутаторами.Если ученые поймут, что происходит в раковой клетке, заставляя ее стать мутатором, они смогут предотвратить это в других клетках или замедлить скорость мутации.
«Идея состоит в том, что если в 20 лет вы обычно можете столкнуться с чем-то в окружающей среде, что вызывает у вас рак к 55 годам, то, если мы снизим частоту мутаций вдвое, вы можете не заболеть раком до 90 лет, и вы можете даже умереть от чего-то еще до этого, — объяснил Лоэб.
История Источник:
Материалы предоставлены Вашингтонским университетом . Примечание. Содержимое можно редактировать по стилю и длине.
Понимание функций соматических и наследственных генетических мутаций
Рак по своей сути является генетическим заболеванием. В каждой клетке тела есть множество генов, контролирующих процесс деления и размножения клеток. Когда мутация происходит в одном или нескольких из этих генов, клетки могут делиться ненормально и неконтролируемо, и этот неконтролируемый рост аномальных клеток определяет рак. Со временем в раковых клетках могут развиваться дополнительные мутации в других генах, которые делают их все более и более аномальными. Эти развивающиеся аномальные клетки могут затем распространяться на другие части тела, что приводит к более поздней стадии метастатического рака. Понимание генетических характеристик рака пациента имеет решающее значение для точного лечения с помощью таргетных методов лечения.
Эти развивающиеся аномальные клетки могут затем распространяться на другие части тела, что приводит к более поздней стадии метастатического рака. Понимание генетических характеристик рака пациента имеет решающее значение для точного лечения с помощью таргетных методов лечения.
В опухоли могут быть от сотен до тысяч мутаций, но только некоторые из них, которые напрямую регулируют рост клеток и приводят к прогрессированию рака. Если мы сможем понять генетические мутации и пути развития рака, мы сможем усовершенствовать способы остановки или замедления роста рака.
Как возникают генетические мутации?
Некоторые виды рака вызываются наследственными мутациями в генах, которые, как предполагается, регулируют рост. Наследственная мутация или мутация зародышевой линии присутствует при рождении и встречается в каждой клетке тела. Такие мутации могут создавать предрасположенность к раку или повышать вероятность развития рака в течение жизни. Наследственные мутации могут передаваться по наследству.
Генетические мутации также могут возникать в соматических клетках и быть вызваны факторами окружающей среды, такими как курение, воздействие определенных химических веществ или радиации, естественный процесс старения, а иногда и просто случайный случай, когда клетка делится и копирует свою ДНК.Эти соматические или приобретенные мутации происходят в 1 клетке и специфичны для последующей опухолевой ткани, полученной из этой клетки. Приобретенные соматические мутации не передаются детям.
Генетическое тестирование позволяет анализировать оба типа мутаций: соматические и наследственные. Выявив точные генетические изменения, которые вызывают рак, онкологи могут лучше нацелить их и лечить рак более точно, чем лечение только на основе локализации рака.
Как используются соматические биомаркеры?
Все тесты по профилированию опухолей направлены на обеспечение точного лечения рака у пациента, но не все тесты по профилированию опухолей одинаковы, потому что существует много типов опухолеспецифических биомаркеров.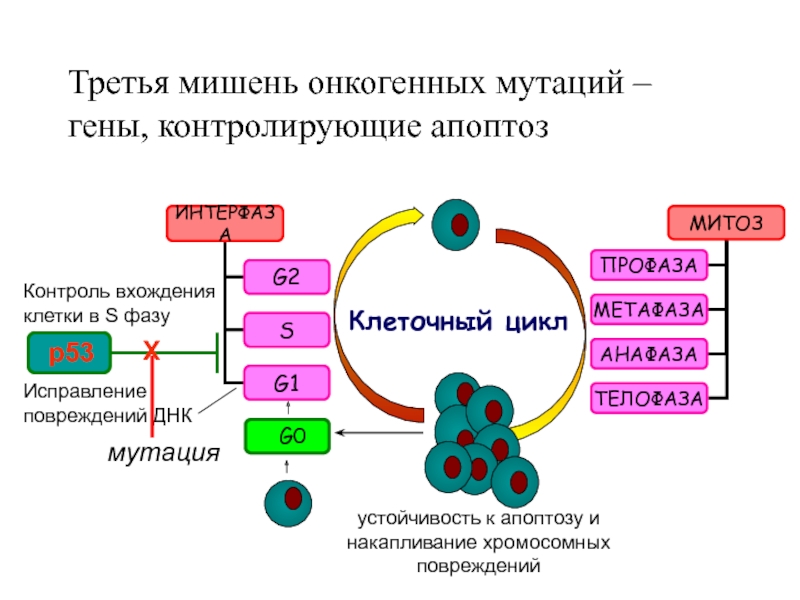 Некоторые тесты анализируют генетические мутации в опухоли, поэтому терапию можно сопоставить с конкретными присутствующими изменениями. Другие помогают определить, насколько вероятно, что пациент ответит на терапию или каковы шансы, что рак вернется в будущем.
Некоторые тесты анализируют генетические мутации в опухоли, поэтому терапию можно сопоставить с конкретными присутствующими изменениями. Другие помогают определить, насколько вероятно, что пациент ответит на терапию или каковы шансы, что рак вернется в будущем.
Опухолево-специфическое или соматическое генетическое тестирование помогает идентифицировать специфические молекулярные биомаркеры в опухолевой ткани. Это тестирование включает в себя анализ последовательности ДНК опухоли, чтобы определить, есть ли какие-либо мутации, связанные с лучшим ответом на лечение или конкретным типом таргетной терапии. Это отличается от традиционной химиотерапии, которая в целом нацелена на все быстро делящиеся клетки, как здоровые, так и раковые. Вот почему традиционная химиотерапия часто вызывает более широкие побочные эффекты, такие как выпадение волос, тошнота и усталость.Таргетная терапия, напротив, предназначена для взаимодействия с конкретными клетками, имеющими определенные мутации, которые делают эти клетки особенно уязвимыми для целевого лечения.
Например, в гене раковых клеток может развиться мутация, которая позволяет ему экспрессироваться на аномально высоком уровне, способствуя росту рака. Затем можно использовать таргетную терапию для подавления этого гена или блокирования других молекул, с которыми он взаимодействует, останавливая рост рака.
Примером таргетной терапии является использование ингибиторов иммунных контрольных точек, которые могут быть эффективными при различных типах рака.Т-клетки иммунной системы играют важную роль в распознавании и атаке аномальных клеток, включая раковые клетки. Белок лиганда запрограммированной смерти 1 (PD-L1) часто экспрессируется на аномально высоком уровне на поверхности раковых клеток по сравнению со здоровыми клетками. Нормальная функция PD-L1 — сигнализировать Т-клеткам иммунной системы, чтобы они не атаковали нормальные клетки. Однако при сверхэкспрессии PD-L1 позволяет раковым клеткам уклоняться от атаки иммунной системы. Ингибитор иммунных контрольных точек нацелен на PD-L1 и молекулы, с которыми он взаимодействует, блокируя его функцию. Рак больше не может прятаться от иммунной системы, и Т-клетки понимают, что аномальная клетка должна быть атакована. Некоторые типы рака, при которых была эффективна терапия с ингибированием иммунных контрольных точек, — это немелкоклеточный рак легких, меланома, уротелиальная карцинома и определенные типы рака толстой кишки.
Рак больше не может прятаться от иммунной системы, и Т-клетки понимают, что аномальная клетка должна быть атакована. Некоторые типы рака, при которых была эффективна терапия с ингибированием иммунных контрольных точек, — это немелкоклеточный рак легких, меланома, уротелиальная карцинома и определенные типы рака толстой кишки.
Важно отметить, что опухолеспецифические биомаркеры могут отличаться в разные моменты времени прогрессирования рака по мере его развития. Если развивается более запущенное заболевание, может потребоваться новый образец ткани для дополнительного генетического тестирования, чтобы лечение соответствовало изменяющемуся генетическому ландшафту опухоли.
Что такое наследственные биомаркеры?
Тестирование на наследственный риск развития рака отличается от генетических тестов, специфичных для опухолей. Тесты на наследственный рак обычно проводятся на образцах крови или слюны.
Наследственные мутации составляют от 5% до 10% всех случаев рака. Хотя они менее распространены, чем приобретенные мутации, они могут оказывать значительное влияние на пациентов, являющихся их носителями. Наследственные биомаркеры могут предоставить информацию о пожизненном риске развития у человека определенных типов рака, который может быть значительно выше, чем у населения в целом.В зависимости от гена и типа обнаруженной наследственной мутации могут быть доступны различные варианты лечения, наблюдения и хирургического вмешательства для лечения текущего рака или снижения риска рака в будущем.
Хотя они менее распространены, чем приобретенные мутации, они могут оказывать значительное влияние на пациентов, являющихся их носителями. Наследственные биомаркеры могут предоставить информацию о пожизненном риске развития у человека определенных типов рака, который может быть значительно выше, чем у населения в целом.В зависимости от гена и типа обнаруженной наследственной мутации могут быть доступны различные варианты лечения, наблюдения и хирургического вмешательства для лечения текущего рака или снижения риска рака в будущем.
Хорошо известными примерами наследственных биомаркеров являются унаследованные мутации в генах BRCA1 или BRCA2 , которые связаны с наследственным синдромом рака груди и яичников. Женщины с мутацией BRCA1 или BRCA2 имеют риск развития рака груди к 70 годам от 43% до 87% по сравнению с 12% в общей популяции.У этих женщин также есть от 40% до 64% риска повторного, нового рака груди в течение жизни. Следовательно, женщины, у которых есть рак груди с мутацией в одном из этих генов, могут решить удалить другую здоровую грудь во время операции, чтобы предотвратить риск второго рака груди. Женщины с мутацией в одном из этих генов также имеют повышенный риск развития рака яичников. Для пациентов с раком яичников унаследованная мутация BRCA1 или BRCA2 предоставляет важную информацию о молекулярном механизме роста опухоли.Если присутствует унаследованная мутация BRCA1 или BRCA2 , это указывает на то, что опухоль имеет нарушенную способность восстанавливать ДНК, что приводит к нерегулируемому росту. Этим пациентам может быть полезна таргетная терапия, которая использует эту нарушенную репарацию ДНК для уничтожения раковых клеток.
Женщины с мутацией в одном из этих генов также имеют повышенный риск развития рака яичников. Для пациентов с раком яичников унаследованная мутация BRCA1 или BRCA2 предоставляет важную информацию о молекулярном механизме роста опухоли.Если присутствует унаследованная мутация BRCA1 или BRCA2 , это указывает на то, что опухоль имеет нарушенную способность восстанавливать ДНК, что приводит к нерегулируемому росту. Этим пациентам может быть полезна таргетная терапия, которая использует эту нарушенную репарацию ДНК для уничтожения раковых клеток.
В других случаях может потребоваться более частый или более ранний скрининг. Мужчины и женщины, несущие наследственную мутацию в генах MLh2 , MSh3 , MSH6 , PMS2 или EPCAM , имеют синдром Линча, состояние, характеризующееся высоким риском колоректального, эндометриального и других заболеваний. раки.Из-за высокого риска рака толстой кишки (до 87% по сравнению с 5-6% в общей популяции), который часто возникает в возрасте до 50 лет, люди с синдромом Линча обычно начинают колоноскопический скрининг в возрасте от 20 до 25 лет. лет по сравнению с возрастом 45 лет в общей популяции. Они также проходят обследование на колоноскопию каждые 1-2 года по сравнению с каждые 10 лет. Таким образом, предраковые полипы толстой кишки могут быть обнаружены на ранней стадии и удалены, что значительно снижает риск развития рака толстой кишки.
лет по сравнению с возрастом 45 лет в общей популяции. Они также проходят обследование на колоноскопию каждые 1-2 года по сравнению с каждые 10 лет. Таким образом, предраковые полипы толстой кишки могут быть обнаружены на ранней стадии и удалены, что значительно снижает риск развития рака толстой кишки.
Определение наследственного биомаркера также может иметь важные последствия для членов семьи пациента. Путем тестирования на наследственные мутации члены семьи из группы риска могут оценить свой риск и получить наиболее подходящие обследования и вмешательства. Лица в семье, у которых есть эти наследственные биомаркеры, могут получить расширенные возможности скрининга, наблюдения и снижения риска. Лица, не являющиеся носителями семейной мутации, могут пройти скрининг среднего риска, как и все население, потому что они не унаследовали риск рака, присутствующий в их семье.
Частичное совпадение наследственных и опухолевых биомаркеров
Хотя тесты на наследственные и соматические биомаркеры имеют разные цели, иногда информация о наследственных генах может быть случайно получена с помощью генетического тестирования опухоли.
Каждая клетка в организме содержит наш код ДНК, и опухолевые клетки ничем не отличаются — они происходят из нормальных клеток, но приобрели генетические изменения по сравнению с их исходными здоровыми аналогами. Технология, используемая для секвенирования ДНК (иногда называемая секвенированием следующего поколения или NGS), не всегда может отличить генетические изменения, которые присутствовали в клетке до того, как она превратилась в рак, и генетические изменения, которые развивались в раковой клетке с течением времени.
Иногда может быть полезно провести парное тестирование, в котором наследственные биомаркеры и опухолеспецифические биомаркеры анализируются в дополнительных тестах. Результаты наследственного тестирования могут быть сопоставлены с результатами опухолеспецифического тестирования, чтобы обеспечить дополнительное понимание о наследственном или приобретенном происхождении мутации, механизме заболевания, риске пациента для других видов рака и эффективных вариантах лечения. . Консультант-генетик и медицинский онколог могут просмотреть результаты обоих тестов и сравнить их, чтобы выбрать наилучшие варианты лечения для каждого пациента.
. Консультант-генетик и медицинский онколог могут просмотреть результаты обоих тестов и сравнить их, чтобы выбрать наилучшие варианты лечения для каждого пациента.
Что это значит для ваших пациентов?
Начните с основКак навигатор, вы можете помочь своим пациентам понять некоторые генетические аспекты рака и его лечения. Следующие темы и предложения предназначены для передачи вашим пациентам:
- Биомаркеры определяются с помощью специального анализа тканей или крови (а не обычного анализа крови). Вместе со своей онкологической бригадой подберите для вас лучшие тесты.Если вы используете коммерческий тест, который не требует назначения врача, принесите результат теста на следующий прием. Дальнейшее тестирование может быть указано
- Точная медицина — это лечение, специфичное для вашего типа рака, на основе биомаркеров и генетических тестов. Нет двух одинаковых людей с генетической структурой или раком
- Соберите свои результаты: держите подшивку / досье со всеми своими медицинскими записями, включая результаты биомаркеров / генетического тестирования
- Используйте надежные источники информации.
 Попросите у своей онкологической бригады литературу и используйте веб-сайты, заканчивающиеся на «.org», для получения научной и объективной информации. См. Список рекомендуемых ресурсов для пациентов ниже
Попросите у своей онкологической бригады литературу и используйте веб-сайты, заканчивающиеся на «.org», для получения научной и объективной информации. См. Список рекомендуемых ресурсов для пациентов ниже - Поддерживайте постоянный и открытый диалог со своей онкологической бригадой. Всегда задавайте вопросы, даже если они кажутся глупыми или излишними
Тестирование / повторное тестирование: Если в прошлом вы проходили генетическое тестирование, убедитесь, что ваша бригада онкологов имеет этот результат и может дать его полную интерпретацию.Биотехнология развивается очень быстрыми темпами, и могут появиться новые тесты. Рак также развивается очень быстро, даже после лечения. Ваш онколог может предложить новый образец ткани для биопсии или иссечения. Это дает врачам представление о раке, с которым они имеют дело в конкретное время, что помогает определить наилучшие варианты лечения.
Знайте свою патологию: Легко быть ошеломленным советом, который вы получили или получите от друзей и семьи по поводу вашего диагноза.Убедитесь, что вы получили копию своего полного отчета о патологии и просмотрите его со своим онкологом, чтобы иметь полное представление о типе рака, который у вас есть. Ваша унаследованная генетическая структура уникальна для вас, и генетическая структура вашей опухоли также уникальна для вашей опухоли.
Клинические испытания: Регулярно спрашивайте своего врача, есть ли у вас клинические испытания. Клинические испытания рака доступны для многих типов рака в разное время во время скрининга рака, лечения и за его пределами.Даже если в настоящее время для вас нет пробной версии, она может быть подходящей для вас позже. Добавьте клинические испытания в свой контрольный список / темы для обсуждения на запланированном приеме у онколога. Некоторые испытания представляют собой испытания донорства тканей или крови, разработанные для продвижения изучения генетики, чтобы помочь людям в будущем.
Будьте в курсе событий и полны надежд: Запишите все вопросы, которые у вас есть, даже если вы не совсем понимаете, что спрашивать о своей генетике. Это сложная область науки, которая постоянно развивается.Ваша команда онкологов и сертифицированные генетические консультанты могут ответить на многие общие и конкретные вопросы, которые могут у вас возникнуть о точной медицине и вашем уникальном раке.
Вывод
Вместо того, чтобы использовать универсальный подход, прецизионная онкология стремится понять уникальные биомаркеры каждого отдельного пациента, а также его или ее рака, и сопоставить их с наиболее эффективными методами лечения. Исследования продолжаются, и достижения в области точной онкологии будут по-прежнему приводить к улучшенным вариантам лечения рака.
Источники
- Харгадон К.М., Джонсон К.Э., Уильямс С.Дж. Терапия блокадой иммунных контрольных точек при раке: обзор одобренных FDA ингибиторов иммунных контрольных точек.
 Инт Иммунофармакол . 2018; 62: 29-39.
Инт Иммунофармакол . 2018; 62: 29-39. - Кольманн В., Грубер С.Б. Синдром Линча. В: Адам М. П., Ардингер Х. Х., Пагон Р. А. и др., Ред. GeneReviews (Интернет). Сиэтл, Вашингтон: Вашингтонский университет; 5 февраля 2004 г.
- Национальная всеобъемлющая онкологическая сеть. Руководство NCCN по клинической практике в онкологии (Руководство NCCN). Генетическая / семейная оценка высокого риска: грудь и яичники . V.3.2019. https://www.nccn.org/professionals/physician_gls/pdf/colon.pdf. По состоянию на март 2019 г.
- Национальная всеобъемлющая онкологическая сеть. Руководство NCCN по клинической практике в онкологии (Руководство NCCN) . Оценка высокого генетического / семейного риска: колоректальный. V.1.2018. www.nccn.org/professionals/physician_gls/f_guidelines.asp.По состоянию на март 2019 г.
- Петручелли Н., Дейли М.Б., Пал Т. BRCA1- и BRCA2- Ассоциированный наследственный рак груди и яичников.


 Так и с онкогенами: в норме они совершенно безобидны, но стоит им «сломаться» – и клетки начнут делиться с неистовой силой.
Так и с онкогенами: в норме они совершенно безобидны, но стоит им «сломаться» – и клетки начнут делиться с неистовой силой. Со временем число «ошибок» нарастает, и развивается рак.
Со временем число «ошибок» нарастает, и развивается рак. Используется для скрининга мутаций EGFR, HER2, METex14 и некоторых других, более редких аномалий
Используется для скрининга мутаций EGFR, HER2, METex14 и некоторых других, более редких аномалий Кроме того, позволяет выявить экспрессию белка PD-L1 при НМРЛ
Кроме того, позволяет выявить экспрессию белка PD-L1 при НМРЛ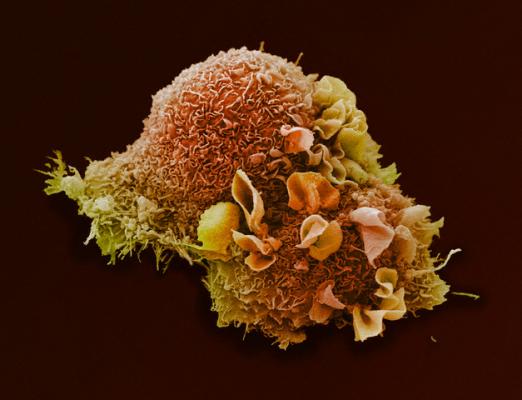 I., et al. Molecular Testing Guideline for Selection of Lung Cancer Patients for EGFR and ALK Tyrosine Kinase Inhibitors: Guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J. Thorac. Oncol. 2013. Vol.8, №7, P. 823-859.
I., et al. Molecular Testing Guideline for Selection of Lung Cancer Patients for EGFR and ALK Tyrosine Kinase Inhibitors: Guideline from the College of American Pathologists, International Association for the Study of Lung Cancer, and Association for Molecular Pathology. J. Thorac. Oncol. 2013. Vol.8, №7, P. 823-859./GettyImages-85756997-f62a6349ccf4482090bb81a18824448b.jpg) Vol. 34, № 28. P. 3375–3382.
Vol. 34, № 28. P. 3375–3382.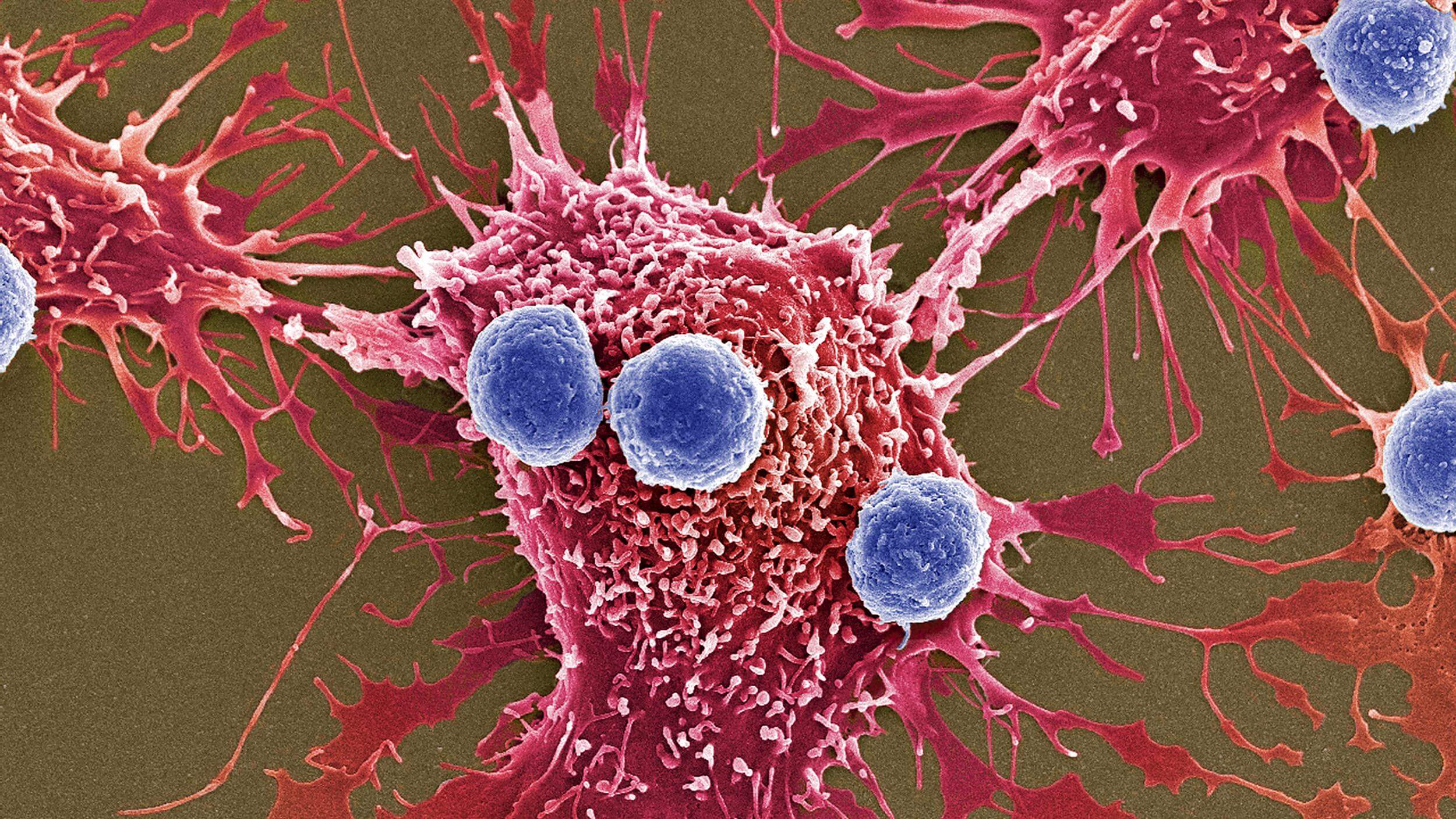 Vol.31, №16, P. 1997-2003.
Vol.31, №16, P. 1997-2003.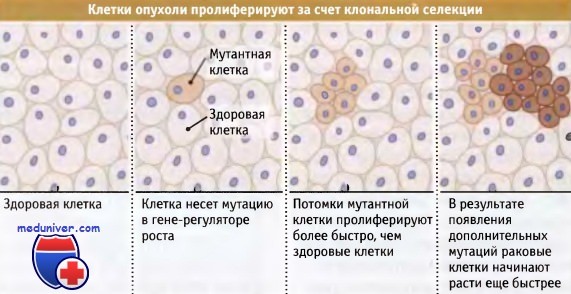 J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol.34, №15, P. e141-4.
J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol.34, №15, P. e141-4.

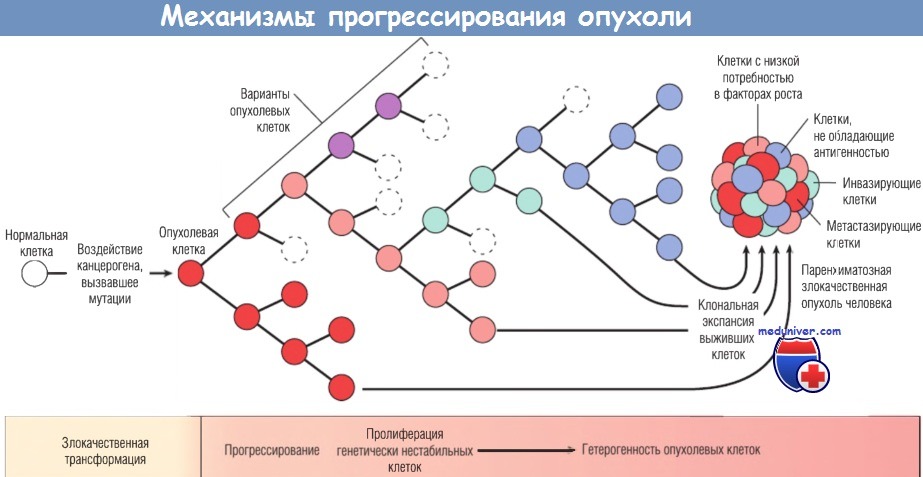 Часто приводит к укороченным и нефункциональным белкам.
Часто приводит к укороченным и нефункциональным белкам. Примеры включают метилирование ДНК и ацетилирование гистонов.
Примеры включают метилирование ДНК и ацетилирование гистонов.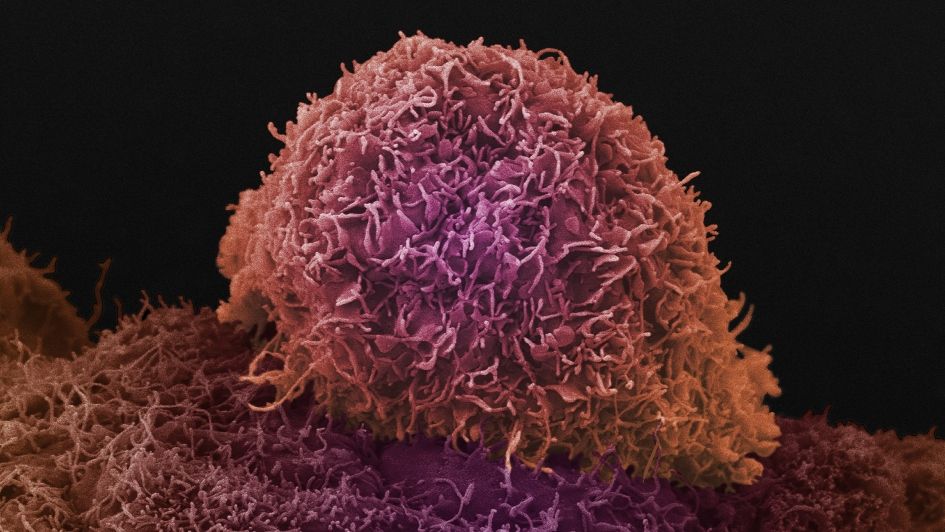
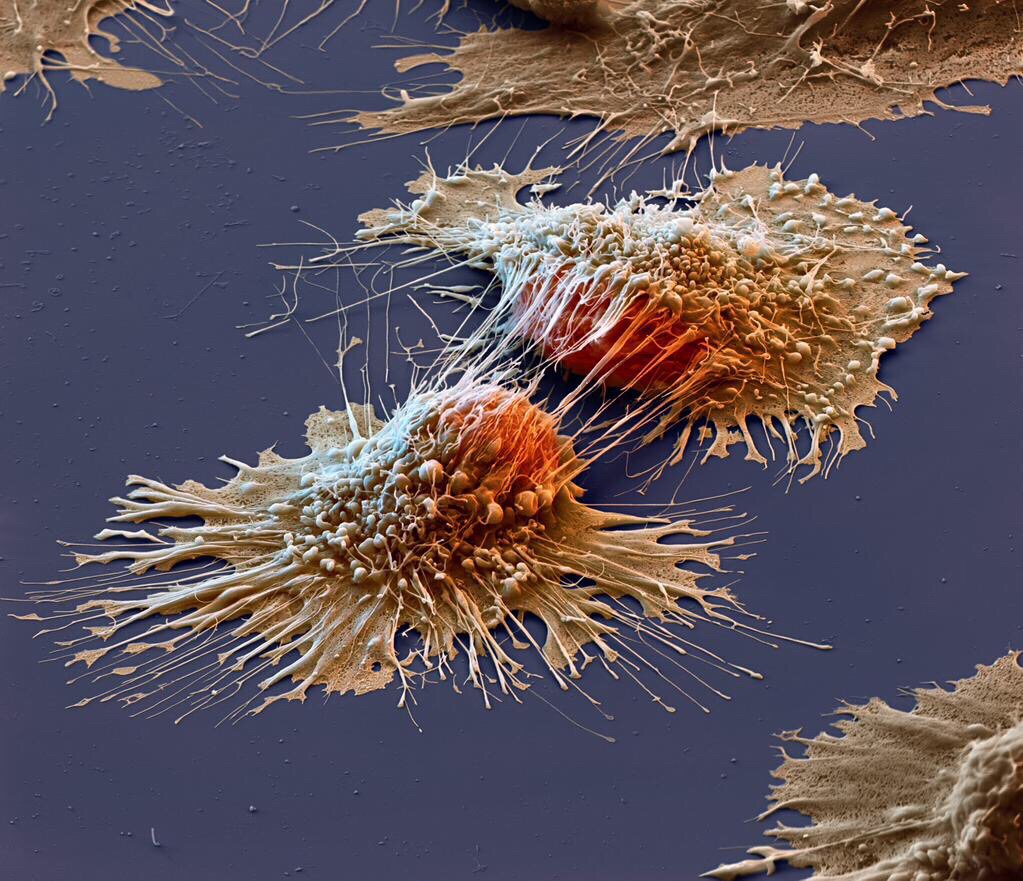
 Попросите у своей онкологической бригады литературу и используйте веб-сайты, заканчивающиеся на «.org», для получения научной и объективной информации. См. Список рекомендуемых ресурсов для пациентов ниже
Попросите у своей онкологической бригады литературу и используйте веб-сайты, заканчивающиеся на «.org», для получения научной и объективной информации. См. Список рекомендуемых ресурсов для пациентов ниже Инт Иммунофармакол . 2018; 62: 29-39.
Инт Иммунофармакол . 2018; 62: 29-39.