симптомы и лечение в СПБ, отзывы и цены
Аномалия Киммерли – врожденная патология строения зоны сочленения черепа с первым шейным позвонком, когда в структуре позвонка есть дополнительная костная дужка, ограничивающая движения позвоночной артерии и сдавливающая ее. Это сказывается на кровообращении головного мозга и способствует развитию ишемии в задних его отделах.
Причинами развития патологии (а она возникает еще в утробе матери) считают:
- генетическую предрасположенность;
- нездоровый образ жизни родителей;
- плохую экологию и т.д.
Симптомы
О наличии аномалии Киммерли могут говорить такие признаки:
- внезапное потемнение и «фейерверки» в глазах;
- мигрени, при которых боль обычно концентрируется в затылочной части;
- тремор рук;
- проблемы с координацией;
- частые головокружения и неустойчивая походка, возникающие после резкого поворота головы;
- обмороки;
- шум и звон в ушах.

Такие признаки, впрочем, могут говорить о многих других болезнях, но оставлять проявления нездоровья без внимания нельзя в любом случае. Сама патология не угрожает жизни человека, но если аномалию Киммерли не лечить, возможны серьезные осложнения. И прежде всего – ишемический инсульт, который может повлечь за собой инвалидность и даже смерть.
Диагностика и лечение
Поставить диагноз можно только на основании целого ряда исследований:
- электроэнцефалограммы;
- дуплексного сканирования сосудов шеи и головы;
- ультразвукового исследования шейного отдела позвоночника и др.
Также нужно посетить отоларинголога, чтобы удостовериться в отсутствии проблем с органами слуха.
Лечение направлено на то, чтобы улучшить самочувствие пациента и минимизировать проявления аномалии. Обычно назначаются препараты для активизации мозгового кровообращения и реологических свойств крови. Также в списке лекарств могут быть антиоксиданты, ноотропы, метаболические препараты, нейропротекторы – список медикаментов подбирается сугубо индивидуально.
Помимо этого, рекомендована физиотерапия, в частности, массаж. Но иногда единственной возможностью помочь пациенту становится операция – дужку в позвонке удаляют хирургически.
Обязательное наблюдение невролога
Если у человека выявлена аномалия Киммерли, но она не проявляется, ему в любом случае рекомендуется наблюдаться у невролога. Врач расскажет, как поддерживать хороший кровоток мозга и избежать неприятных проявлений этой анатомической особенности в будущем.
Почему Вам нужна клиника «Долголетие»
Обращаясь к нам, не сомневайтесь, что с Вами будут работать отличные неврологи, врачи высшей категории. Лечение в клинике «Долголетие» имеет целый ряд преимуществ:
- методы лечения – эффективные, современные, признанные в мировой практике;
- медикаменты – качественные, безопасные, прошедшие всестороннее тестирование;
- результат – стабильный и устойчивый.
Мы работаем без выходных и праздников, поэтому для встречи с врачом и прохождения исследований можно подобрать максимально удобный для пациента день. Персонал клиники позаботится о том, чтобы процесс лечения проходил максимально гладко, спокойно и позитивно.
Персонал клиники позаботится о том, чтобы процесс лечения проходил максимально гладко, спокойно и позитивно.
Клиника «Долголетие» вернет Вам радость здоровой жизни!
Запись на прием осуществляется по телефону: +7 (812) 671-01-70.
Аномалия Киммерли
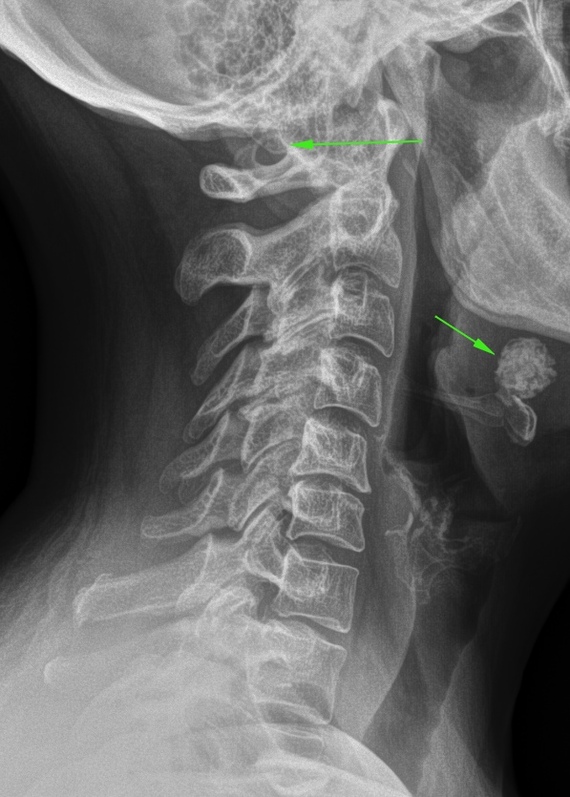
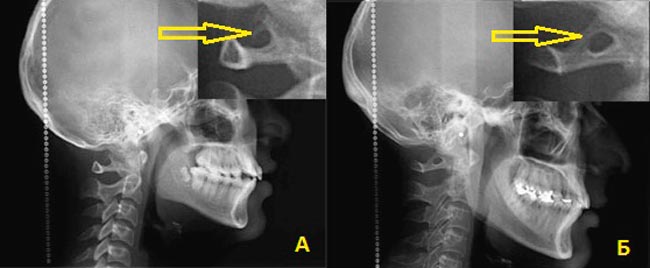
Аномалия Киммерли – это патологическое изменение атланта, первого шейного позвонка. Заболевание наиболее распространенно как врожденный порок развития, встречается также аномалия Киммерли в форме заболевания, приобретенного в течение жизни. Аномалия Киммерли — наличие в структуре первого шейного позвонка дополнительной костной дужки, ограничивающей движения позвоночной артерии и вызывающей синдром ее сдавления. Аномалия Киммерли характеризуется головокружением, шумом в ушах, шаткостью походки и расстройством координации, «мушками» и потемнением в глазах, приступами потери сознания и внезапной мышечной слабости. Возможны двигательные и чувствительные расстройства, возникновение ТИА и ишемического инсульта. Диагностируется аномалия Киммерли при рентгенографическом исследовании краниовертебрального перехода, проведении магнитно-резонансной ангиографии, дуплексного сканирования и УЗДГ сосудов головы и шеи.


 Лечение аномалии Киммерли Аномалия Киммерли требует лечения в случае наличия клинических и гемодинамических признаков нарушения кровообращения в вертебрально-базилярном бассейне, связанного именно с данной патологией. Пациенты, у которых имеется аномалия Киммерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима. При аномалии Киммерли следует избегать форсированных физических нагрузок, резких поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.). При прохождении массажа или мануальной терапии шейного отдела позвоночника пациенту необходимо предупреждать массажиста и мануального терапевта о том, что у него аномалия Киммерли. Ухудшение состояния пациента является поводом к незамедлительному обращению к врачу. В большинстве случаев аномалия Киммерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Проводится сосудистая терапия направленная на улучшение мозгового кровотока.
Лечение аномалии Киммерли Аномалия Киммерли требует лечения в случае наличия клинических и гемодинамических признаков нарушения кровообращения в вертебрально-базилярном бассейне, связанного именно с данной патологией. Пациенты, у которых имеется аномалия Киммерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима. При аномалии Киммерли следует избегать форсированных физических нагрузок, резких поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.). При прохождении массажа или мануальной терапии шейного отдела позвоночника пациенту необходимо предупреждать массажиста и мануального терапевта о том, что у него аномалия Киммерли. Ухудшение состояния пациента является поводом к незамедлительному обращению к врачу. В большинстве случаев аномалия Киммерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Проводится сосудистая терапия направленная на улучшение мозгового кровотока.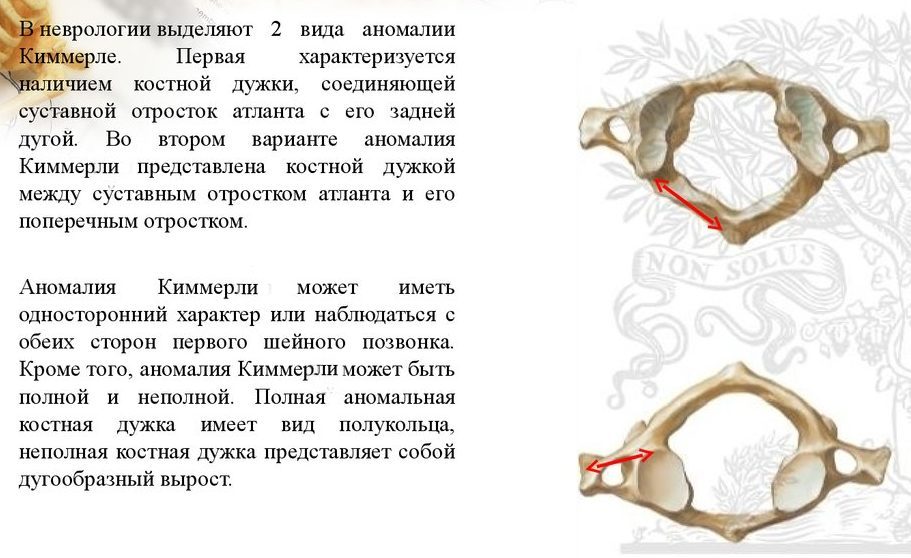 По показаниям под контролем коагулограммы при аномалии Кимерли применяются препараты, улучшающие реалогические свойства крови. В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты. Аномалия Киммерли на сегодняшний день не является показанием для проведения хирургического лечения. Необходимость в оперативном лечении может возникнуть при декомпенсированном течении синдрома позвоночной артерии, приводящем к выраженной недостаточности кровообращения в вертебрально-базилярном бассейне при отсутствии достаточного коллатерального кровоснабжения. Операция при аномалии Киммерли заключается в резекции аномальной дуги и мобилизации позвоночной артерии. В послеоперационном периоде пациентам необходимо ношение воротника Шанца сроком от 2 до 4 недель.
По показаниям под контролем коагулограммы при аномалии Кимерли применяются препараты, улучшающие реалогические свойства крови. В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты. Аномалия Киммерли на сегодняшний день не является показанием для проведения хирургического лечения. Необходимость в оперативном лечении может возникнуть при декомпенсированном течении синдрома позвоночной артерии, приводящем к выраженной недостаточности кровообращения в вертебрально-базилярном бассейне при отсутствии достаточного коллатерального кровоснабжения. Операция при аномалии Киммерли заключается в резекции аномальной дуги и мобилизации позвоночной артерии. В послеоперационном периоде пациентам необходимо ношение воротника Шанца сроком от 2 до 4 недель.Аномалия Кимерли
Узнать больше о заболеваниях на букву «А»:
Абдоминальная мигрень,
Абсанс,
Абсцесс головного мозга,
Абузусная головная боль,
Агнозия,
Аденома гипофиза,
Адренолейкодистрофия,
Акалькулия,
Акатизия,
Альтернирующие синдромы,
Амавротическая идиотия,
Амиотрофия Верднига-Гоффмана,
Амиотрофия Кугельберга-Веландера,
Амнезия,
Ангионеврозы,
Аневризмы головного мозга,
Аномалии развития головного мозга,
Аномалия Киари,
Аномалия Кимерли,
Апаллический синдром.
Аномалия Кимерли — это патология, которая бывает, как приобретенной, так и врожденной. Встречается данное заболевание у 12-30% людей на Земле. Болезнь заключается в присутствии дополнительной костной дужки в структуре первого шейного позвонка. Ограничивается свободное движение позвоночной артерии при помощи этой дужки, а также появляется синдром сдавливания артерии.
Аномалия проявляется в виде шума в ушах, неровной походки, головокружении, слабости в мышцах и нарушении координации. При наличии патологии возможны возникновение ишемического инсульта, а также ТИА. Для обнаружения этой патологии используют дуплексное сканирование сосудов головы и шеи, проводят магнитно-резонансную ангиографию и рентгенографическое исследование краниовертебрального перехода. Нарушения в сосудах необходимо подвергать консервативно-комплексному лечению.
Патология Кимерли является краниовертебральной мальформацией, то есть врожденными нарушениями в строении сочленения черепа и первых шейных позвонков. Аномалия вызывает как сдавливание позвоночной артерии, так и хроническую ишемию в задних отделах мозга. Этот недуг сам по себе не относится к ряду заболеваний и его присутствие в организме не сообщает о том, что это причина всех нарушений в области позвоночной артерии.
Аномалия вызывает как сдавливание позвоночной артерии, так и хроническую ишемию в задних отделах мозга. Этот недуг сам по себе не относится к ряду заболеваний и его присутствие в организме не сообщает о том, что это причина всех нарушений в области позвоночной артерии.
При обследовании пациентов с имеющимися данной аномалией, лишь у одного из 4 людей обнаруживается взаимосвязь между самой аномалией и развитием синдрома.
Патогенез
Обе позвоночные артерии (левая и правая) имеют свое начало в соответствующих подключичных артериях. Каждая из этих позвоночных артерий находится в канале, образованном с помощью отверстий поперечных отростков позвонков, располагающихся в районе шейного отдела позвоночника. Проходя через весь шейный отдел, позвоночная артерия попадает в череп через большое затылочное отверстие. Мозжечок кровоснабжается с помощью вертебробазилярного бассейна, который образован благодаря левой и правой позвоночным артериям с их ответвлениями.
Позвоночная артерия может свободно перемещаться в широкой костной борозде, в которой она находится горизонтально во время движения головы. Попадает она в эту борозду прямиком из шейного канала, при этом, огибая на своем пути шейный позвонок.
Попадает она в эту борозду прямиком из шейного канала, при этом, огибая на своем пути шейный позвонок.
Болезнь Кимерли характеризуется наличием костной дужки, которая имеет свое расположение над костной бороздой, а также эта дужка полностью может ограничивать движения позвоночной артерии, проходящей через это место.
Атеросклероз, поражения сосудистой стенки при наличии васкулита, остеохондроз и спондилоартроз шейного отдела позвоночника — все эти перечисленные заболевания могут исходить от патологии.
Классификация
В современной неврологии существует всего 2 типа патологии:
- первая заключается в наличии костной дужки, соединяющей отросток атланта с его задней дугой;
- во втором же варианте представляется заболевание в виде костной дужки между поперечным отростком атланта с его суставным отростком.
Болезнь Кимерли может проявляться как с обеих сторон первого шейного позвонка, так и с односторонним характером (находится с одной из сторон первого шейного позвонка). Так же к этому всему добавляется деление аномалии на неполную и полную. При наличии полной формы болезни костная дужка представляет из себя форму полукольца, тогда как в неполной аномалии она выражена в виде дугообразного выроста.
Так же к этому всему добавляется деление аномалии на неполную и полную. При наличии полной формы болезни костная дужка представляет из себя форму полукольца, тогда как в неполной аномалии она выражена в виде дугообразного выроста.
Симптоматика
Болезнь сопровождается клиническими проявлениями, которые появляются благодаря уменьшению притока крови к задним отделам головного мозга. Из-за этих проявлений у пациентов появляется наличие таких симптомов как шум в ушах, проявляющийся в виде шипения, свиста или звона, также появляется мерцание «звездочек» и потемнение в глазах.
Все эти факторы начинают действовать более усиленно во время поворотов головы. Из-за того, что при патологии Кимерли значительно снижается приток крови к мозжечку, то могут появиться такие симптомы, как головокружение и неустойчивость во время ходьбы. Все это также усиливается во время поворотов головой в любую сторону.
Если у людей с наличием аномалии Кимерли перенапрягаются мышцы шеи или голова находилась в не комфортном для нее положении, то в результате этого могут быть даже потери сознания.
При более тяжелом протекании болезни может проявляться тремор рук и ног, нарушения координации, гипестезия, также мышечная слабость частей лица или тела и головная боль. Ко всему прочему, может быть наличие транзиторных ишемических атак в области вертебробазилярного бассейна, но наиболее опасным из всего вышеперечисленного является проявление ишемического инсульта.
Диагностические методы
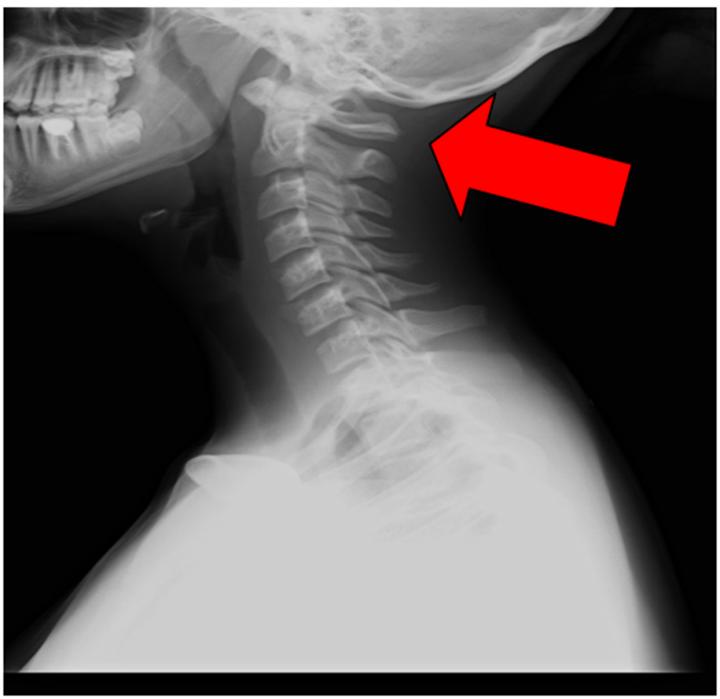
При наличии у пациента недостатка кровообращения в вертебробазилярном бассейне сначала производят рентгенографию черепа и позвоночника в шейном отделе. Обычно такая болезнь четко просматривается на боковых рентгенограммах области краниовертебрального перехода.
Также может понадобиться консультация с отоларингологом при наличии у пациента шума в ушах для последующего исключения лор-патологии. Производится аудиометрия, а также другие исследования слуха. Ко всему прочему назначают исследование вестибулярного анализатора.
Неврологу требуется устранить другие возможные причины возникновения вертебробазилярной недостаточности, так как выявленная ранее аномалия Кимерли необязательно может быть причиной появления синдрома позвоночной артерии..jpg) В этом случае необходимо провести контрастную ангиографию, которая поможет обнаружить такие заболевания, как тромбоз. Также ангиография выявит сдавливание сосуда каким-либо объемным образованием, представленным в виде опухоли, кисты или абсцесса головного мозга.
В этом случае необходимо провести контрастную ангиографию, которая поможет обнаружить такие заболевания, как тромбоз. Также ангиография выявит сдавливание сосуда каким-либо объемным образованием, представленным в виде опухоли, кисты или абсцесса головного мозга.
Целый ряд гемодинамических исследований поможет определить насколько значима клинически аномалия Кимерли. При помощи этих исследований при данной болезни можно выявить место, где происходит сдавливание позвоночной артерии, а также ее зависимость от положения головы и шеи.
Лечение
Лечение обязательно только, если у пациента присутствуют клинические и гемодинамические признаки нарушения кровообращения в вертебробазилярном бассейне, которые связаны с присутствием в шейном отделе аномалии Кимерли.
Люди с наличием данной патологии следует остерегаться сильных физических нагрузок, резких поворотов головы и многих видов спорта, таких как борьба, гимнастика и прочее. При посещении массажа и мануальной терапии необходимо предупреждать врача о наличии болезни.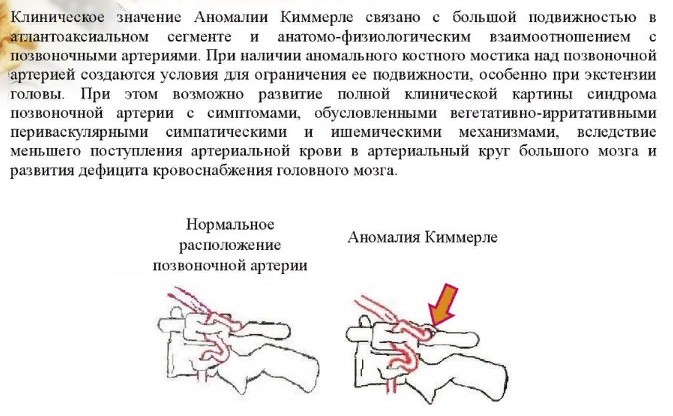 Если состояние пациента ухудшилось, то это является поводом незамедлительного обращения за помощью к специалисту.
Если состояние пациента ухудшилось, то это является поводом незамедлительного обращения за помощью к специалисту.
В основном болезнь Кимерли, которая может приводить к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Производится сосудистая терапия, которая направлена в основном на улучшение притока крови в отделы мозга.
Также при наличии аномалии Кимерли применяются специальные препараты под строгим надзором коагулограмма, которые улучшают реологические свойства крови. При этом всем в комплексную терапию входят ноотропы, нейропротекторы а также такие метаболические медикаменты, как «Пирацетам», «Аминобутировая кислота», «Мельдоний».
Сегодня при наличии у пациента аномалии Кимерли нет острой необходимости в хирургическом лечении. Операция может потребоваться только в том случае, если происходит декомпенсированное течение синдрома позвоночной артерии, которое приводит к явному недостатку притока крови к вертебробазилярному.
Если все-таки операция происходит при патологии Кимерли, то она заключается в резекции аномальной дуги и мобилизации позвоночной артерии. После операции пациенту требуется ходить около 2-4 недель со специальным воротником Шанца. Но чаще всего больному достаточно наблюдаться периодически у квалифицированного невролога для предотвращения развития синдрома позвоночной артерии.
После операции пациенту требуется ходить около 2-4 недель со специальным воротником Шанца. Но чаще всего больному достаточно наблюдаться периодически у квалифицированного невролога для предотвращения развития синдрома позвоночной артерии.
Ко всему прочему очень многих интересует вопрос с отсрочкой от армии при обнаружении у них аномалии Кимерли. Сама по себе эта аномалия не позволяет получить отсрочку от армии, так как не является заболеванием. Отсрочку могут дать лишь в случае каких-либо осложнений, которые появились благодаря данной болезни.
Профилактические меры
При физических нагрузках следует проконсультироваться с квалифицированным врачом о безопасности данных мероприятий. Вместе подберите себе наиболее подходящие упражнения лечебной гимнастики для улучшения кровотока. Можно обратиться к опытному мануальному терапевту, который сможет своими «волшебными» руками улучшить кровообращение в области шеи, где находится болезнь.
Ко всему вышеперечисленному иногда достаточно чаще гулять на свежем воздухе.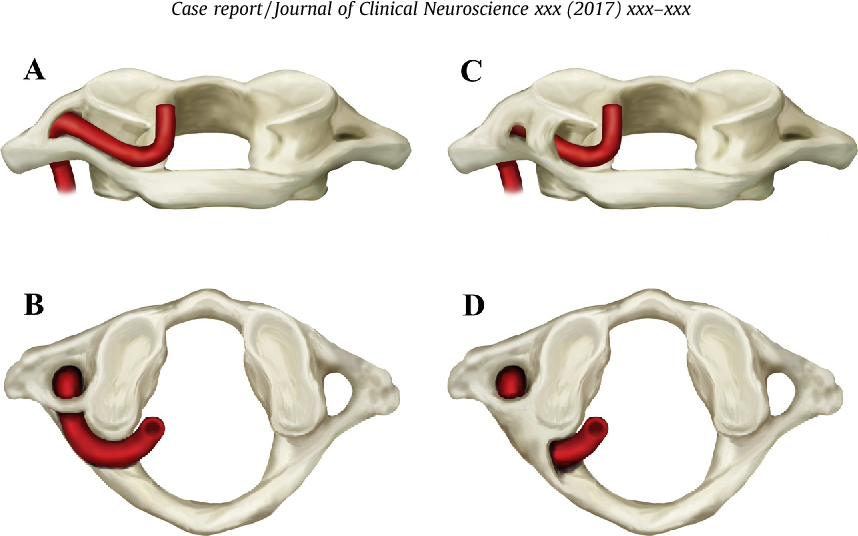 Такие прогулки стимулируют иммунитет и стабилизируют общее состояние человека, участвуют в улучшении кровяного давления и ограничивают выработку гормона стресса, который встречается практически на каждом шагу современных людей.
Такие прогулки стимулируют иммунитет и стабилизируют общее состояние человека, участвуют в улучшении кровяного давления и ограничивают выработку гормона стресса, который встречается практически на каждом шагу современных людей.
Лечение Киммерли
Аномалия Киммерле или костный мостик атланта приводит к ограничению подвижности позвоночной артерии при разгибании шейного отдела позвоночника, поворотах головы. Это может привести к сдавлению либо ирритации периартериального нервного сплетения с соответствующими клиническими проявлениями
— консервативно-терапевтическое лечение;
— хирургическое устранение костного мостика.
Выбор тактики лечения клинических проявлений АК базировался на патогенетическом принципе, потому что этиологическое лечение требует проведения оперативного вмешательства не только на самом костном образовании кольца атланта, но и проведения реконструктивной ангиопластики позвоночной артерии, что не всегда целесообразно на ранних стадиях заболевания, представляющих большинство клинических случаев.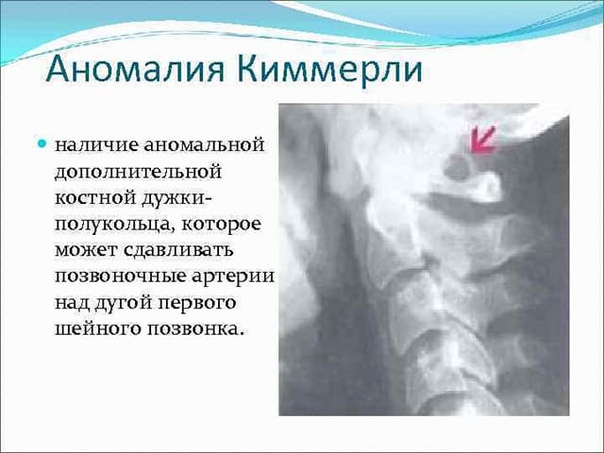 Поэтому предпочтение в выборе схемы лечения было отдано терапевтическим методам. Основная патогенетическая модель базировалась на принципах «порочного круга», в основе которого находится раздражение затылочного нерва, приводящее к возникновению болевого синдрома и защитного напряжения мышц шеи и скальпа. В свою очередь, формирующаяся миотония приводит к нарушению нормальных биомеханических соотношений, что вызывает еще большее раздражение затылочного нерва и соответствующую прогрессию боли с присоединением вегетативных нарушений из-за раздражения нерва Франка и сопровождающих позвоночную артерию сплетений, а также синдромов недостаточности кровоснабжения ВБС на более поздних этапах.
Поэтому предпочтение в выборе схемы лечения было отдано терапевтическим методам. Основная патогенетическая модель базировалась на принципах «порочного круга», в основе которого находится раздражение затылочного нерва, приводящее к возникновению болевого синдрома и защитного напряжения мышц шеи и скальпа. В свою очередь, формирующаяся миотония приводит к нарушению нормальных биомеханических соотношений, что вызывает еще большее раздражение затылочного нерва и соответствующую прогрессию боли с присоединением вегетативных нарушений из-за раздражения нерва Франка и сопровождающих позвоночную артерию сплетений, а также синдромов недостаточности кровоснабжения ВБС на более поздних этапах.
В основу терапевтического воздействия на данную патогенетическую модель были положены методы, позволяющие купировать болевой синдром, редуцировать миотонические симптомы и улучшить трофику сосудистых и нервных структур. В качестве базовых медикаментозных средств использовались нестероидные противовоспалительные препараты быстрого действия (лорноксикам), миорелаксанты периферического действия (толперизон), комплексные витамино-содержащие препараты трофического и анаболического действия. Дополнительно в курс лечения включались лечебная физкультура, массаж. Лорноксикам, назначаемый для купирования болевого синдрома, был эффективен у всех пациентов. Кардиальные дисфункции, нарушения функций ЖКТ преобладали у пациентов старшей возрастной группы. Таким образом, исходя из полученных данных, НПВП лорноксикам показал себя как высокоэффективное обезболивающее средство у пациентов всех возрастных групп, однако из-за быстрого развития побочных эффектов препарат лучше назначать однократно для экстренного купирования болевого синдрома.
Дополнительно в курс лечения включались лечебная физкультура, массаж. Лорноксикам, назначаемый для купирования болевого синдрома, был эффективен у всех пациентов. Кардиальные дисфункции, нарушения функций ЖКТ преобладали у пациентов старшей возрастной группы. Таким образом, исходя из полученных данных, НПВП лорноксикам показал себя как высокоэффективное обезболивающее средство у пациентов всех возрастных групп, однако из-за быстрого развития побочных эффектов препарат лучше назначать однократно для экстренного купирования болевого синдрома.
В большинстве случаев аномалия Кимерли, приводящая к клиническим проявлениям сосудистой недостаточности, подлежит консервативному лечению. Проводится сосудистая терапия направленная на улучшение мозгового кровотока (ницерголин, винпоцетин, винкамин, циннаризин). По показаниям под контролем коагулограммы при аномалии Киммерли применяются препараты, улучшающие реалогические свойства крови (пентоксифиллин). В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты (пирацетам, никотиноил-гамма-аминобутировая кислота, мельдоний).
Пациенты, у которых имеется аномалия Кимерли, должны соблюдать некоторые меры предосторожности в рамках охранительного режима. При аномалии Киммерли следует избегать форсированных физических нагрузок, резких околозапредельных поворотов головой, стоек на голове, кувырков, спортивных занятий и игр, связанных с ударами головой (борьба, футбол, спортивная гимнастика и пр.).
Обсуждение и выводы
Оссификация атлантоокципитальной связки представляет собой нередкий вариант аномалии строения КВО. Данная аномалия встречается практически во всех возрастных группах с максимальной представленностью в возрасте 25 лет и старше.
В клинической картине заболевания преобладают три основных синдрома:
— болевой синдром;
— синдром сосудистой недостаточности;
— синдром вегетативных дисфункций.
Тяжесть клинических проявлений соответствует трем степеням, отражающим разные типы течения, – легкой, среднетяжелой и тяжелой, характеризуется частотой обострений и зависит от выраженности анатомического дефекта.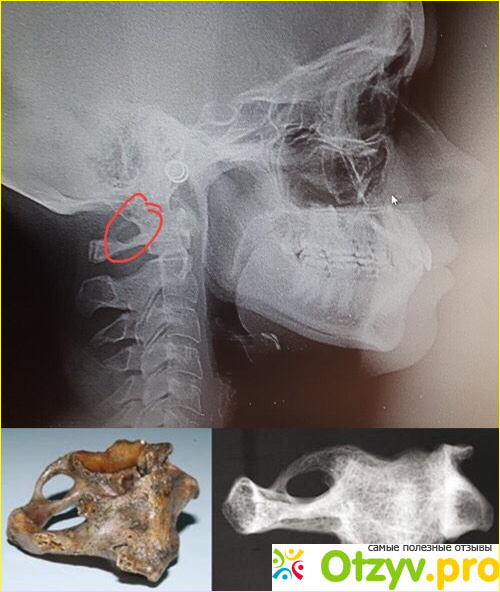 Тесное расположение различных элементов, а также сочетание разных патологических процессов, развивающихся в шейном отделе позвоночника, в большинстве случаев затрудняет активные хирургические вмешательства, что требует разработки консервативных методов лечения, направленных на купирование болевого синдрома, редуцирование миотонического напряжения мышц шеи и скальпа, а также активацию репаративных процессов в пораженной зоне. Использование обезболивающих препаратов группы оксикамов, в частности лорноксикама, высокоэффективно у пациентов с АК в качестве экстренной помощи при развитии болевого синдрома в однократном применении. При необходимости более длительного использования данного препарата необходимо проводить защитные меры по профилактике поражения структур ЖКТ. Также препарат следует назначать с осторожностью лицам старших возрастных групп из-за риска развития кардиальной патологии. Применение в схеме лечения препаратов миорелаксирующего и репаративного (витаминного) действия позволяет эффективно убрать основные клинические проявления АК и ввести заболевание в состояние ремиссии на период до 9 месяцев.
Тесное расположение различных элементов, а также сочетание разных патологических процессов, развивающихся в шейном отделе позвоночника, в большинстве случаев затрудняет активные хирургические вмешательства, что требует разработки консервативных методов лечения, направленных на купирование болевого синдрома, редуцирование миотонического напряжения мышц шеи и скальпа, а также активацию репаративных процессов в пораженной зоне. Использование обезболивающих препаратов группы оксикамов, в частности лорноксикама, высокоэффективно у пациентов с АК в качестве экстренной помощи при развитии болевого синдрома в однократном применении. При необходимости более длительного использования данного препарата необходимо проводить защитные меры по профилактике поражения структур ЖКТ. Также препарат следует назначать с осторожностью лицам старших возрастных групп из-за риска развития кардиальной патологии. Применение в схеме лечения препаратов миорелаксирующего и репаративного (витаминного) действия позволяет эффективно убрать основные клинические проявления АК и ввести заболевание в состояние ремиссии на период до 9 месяцев.
Как Вы поняли терапевтический метод дает пациенту временной облегчение и не устраняет саму причину.
Побочные эффекты, не стойкий клинический эффект, а также сложности курса консервативно-терапевтического лечения данной аномалии, побудили врачей нашей клиники разработать собственную методику по устранению костного мостика атланта (ponticulus posterior atlantis). Лечение состоит из нескольких курсов. В основе курса лежит физиотерапия на оборудовании компании BTL.
— первый курс направлен на снятие воспаления и остановку дегенеративных процессов КВО;
— второй курс направлен на размягчение костного мостика при помощи ударной волны и инъекций рассасывающих препаратов;
— третий курс направлен на закрепление результатов, в этом курсе мы увеличиваем дозировку физиотерапии и рассасывающих препаратов.
Физкультурно-лечебный комплекс от реабилитолога Казакевич В. В.
В.
причины, симптомы, диагностика, лечение, профилактика
Патологическое состояние, обусловленное обнаружением в структуре первого шейного позвонка дополнительной костной дужки, которая ограничивает движения позвоночной артерии и провоцирует развитие синдрома ее сдавления.
ПричиныСовместно с аномалией Киари, платибазией и ассимиляцией атлантааномалия Кимерли определяется при краниовертебральных мальформациях, представляющих собой врожденное нарушение строения зоны сочленения черепа с первым шейным позвонком. Некоторые сведенья указывают на то, что аномалия Кимерли встречается от 12 до 30% людей. Провоцируя сдавление позвоночной артерии, заболевание сопровождается развитием хронической ишемии в задних отделах мозга.
Однако такая ситуация возникает далеко не всегда. В действительности аномалия – это не заболевание и ее наличие не указывает на то, что именно она стала причиной сосудистых нарушений в бассейне позвоночной артерии. Во время обследования лиц, страдающих синдромом позвоночной артерии и аномалией Кимерли, только у 25% пациентов выявляется причинно-следственная взаимосвязь между наличием патологии и возникновением синдрома.
Правая и левая позвоночные артерии являются ответвлениями соответствующих участков подключичных артерий. Каждая из позвоночных артерий проходит вдоль шейного отдела позвоночника, находясь в канале, сформированном отверстиями поперечных отростков его позвонков. Потом она входит в большое затылочное отверстие, а оттуда в полость черепа. Позвоночные артерии формируют вертебробазилярный бассейн, посредством которого происходит кровоснабжение спинного мозга в шейном отделе позвоночника, мозжечка и ствола мозга. При выходе из шейного канала позвоночная артерия огибает шейный позвонок и горизонтально проходит в широкой костной борозде, где она может свободно перемещаться при движениях головы. Аномалия Кимерли обусловлена наличием костной дужки, расположенной над костной бороздой, ограничивающей движения позвоночной артерии в данной зоне.
Аномалия Кимерли обусловлена наличием костной дужки, расположенной над костной бороздой, ограничивающей движения позвоночной артерии в данной зоне.
Формирование дополнительной костной дужки в структуре первого шейного позвонка может вызывать развитие синдрома позвоночной артерии посредством развития периваскулярных вегетативно-ирритативных механизмов симпатической иннервации или посредством снижения поступления крови в вертебробазилярный бассейн, что вызывается механическим сдавлением позвоночной артерии.
СимптомыДанная аномалия сопровождается ухудшением кровоснабжения задних отделов головного мозга. В следствии таких нарушений у больного возникает шум в одном или обеих ушах, мелькание мушек или мерцание звездочек перед глазами, внезапное преходящее потемнение в глазах. Такие симптомы могут усиливаться при поворотах головы. В связи с тем, что аномалия Кимерли связана с нарушением кровоснабжения мозжечка у пациента может развиваться головокружение и шаткость при ходьбе, усиливающиеся при поворотах головой.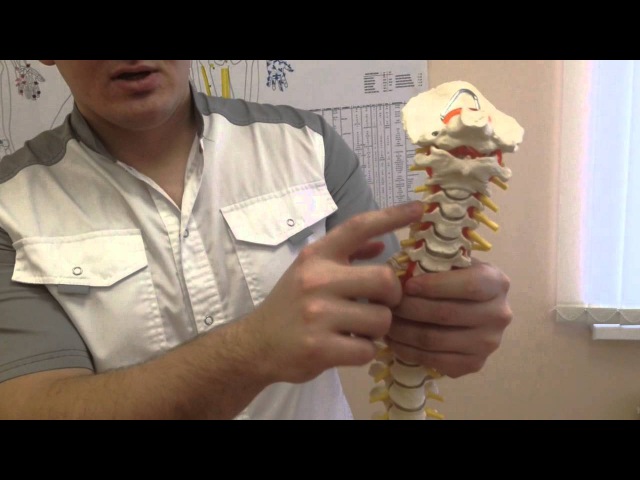 На фоне некомфортного положения головы или перенапряжения мышц шеи при аномалии Кимерли у пациентов могут наблюдаться эпизоды потери сознания. Возможны случаи развития внезапной мышечной слабости, сопровождающейся падением без потери сознания. Также возможно появление приступов головных болей, дрожания конечностей, нистагма, нарушения координации, транзиторных ишемических атак. Одним из самых грозных осложнений аномалии является ишемический инсульт.
На фоне некомфортного положения головы или перенапряжения мышц шеи при аномалии Кимерли у пациентов могут наблюдаться эпизоды потери сознания. Возможны случаи развития внезапной мышечной слабости, сопровождающейся падением без потери сознания. Также возможно появление приступов головных болей, дрожания конечностей, нистагма, нарушения координации, транзиторных ишемических атак. Одним из самых грозных осложнений аномалии является ишемический инсульт.
Лицам с нарушением кровообращения в вертебробазилярном бассейне головного мозга при обращении к специалисту назначается рентгенографию черепа и рентгенографию позвоночника в шейном отделе. Также может потребоваться обследование отоларинголога для исключения ЛОР-патологии. Помимо этого, больному может быть назначена вестибулометрия, электронистагмографии или стабилографии.
В обязательном порядке проводится определение выраженности и клинической значимости аномалии Кимерли посредством ультразвуковой допплерографии экстракраниальных сосудов, транскраниальной допплерографии, дуплексного сканирования и магнитно-резонансной ангиографии сосудов головного мозга. Также посредством таких обследований удается выявить локализацию сдавления позвоночной артерии и ее зависимость от положения головы и шеи.
Также посредством таких обследований удается выявить локализацию сдавления позвоночной артерии и ее зависимость от положения головы и шеи.
Лечение заболевания оправданно только при наличии у больного клинически выраженной симптоматики. Для снижения выраженности симптомов таким больным назначаются препараты, улучшающие мозговое кровообращение и реалогические свойства крови. В комплексную терапию включают также антиоксиданты, ноотропы, нейропротекторы и метаболические препараты.
ПрофилактикаНа данный момент не разработано действенных способов профилактики развития данной аномалии.
Аномалия Киммерли: берут ли в армию?
Если аномалия привела к сдавливанию артерии и снижению притока крови, категория годности будет определяться по статье 24 Расписания болезней.
В этом случае призывная комиссия может принять два решения:
- Юноше поставят категорию «Б» и вручат повестку на отправку;
- Молодого человека признают ограниченно годным и спишут в запас по категории «В».

Категория годности «Б-4» выставляется при начальных стадиях недостаточности мозгового кровообращения, ВСД с редкими кризами. Категория «В» утверждается при частых и редких нарушениях мозгового кровообращения, гипертонических церебральных кризах, различных формах мигрени с частыми (1 и более раз в месяц) и длительными (сутки и более) приступами, потребовавшими лечения в стационарных условиях, ВСД с частыми кризами, сопровождающимися простыми и судорожными обмороками, подтвержденными медицинскими документами.
На момент прохождения призывных мероприятий у призывника должны иметься зафиксированные обращения к врачу – неврологу. Если патология сопровождается обмороками, то потеря сознания также должна быть подтверждена документами от врача. Обычно в этом и заключается главная сложность. У большинства молодых людей, обращающихся в Службу Помощи Призывникам, нет таких документов, так как они либо не вызывали скорую помощь, либо позже не запросили необходимые справки.
Без документального доказательства врачи могут отказать призывнику в отправке на дополнительное обследование.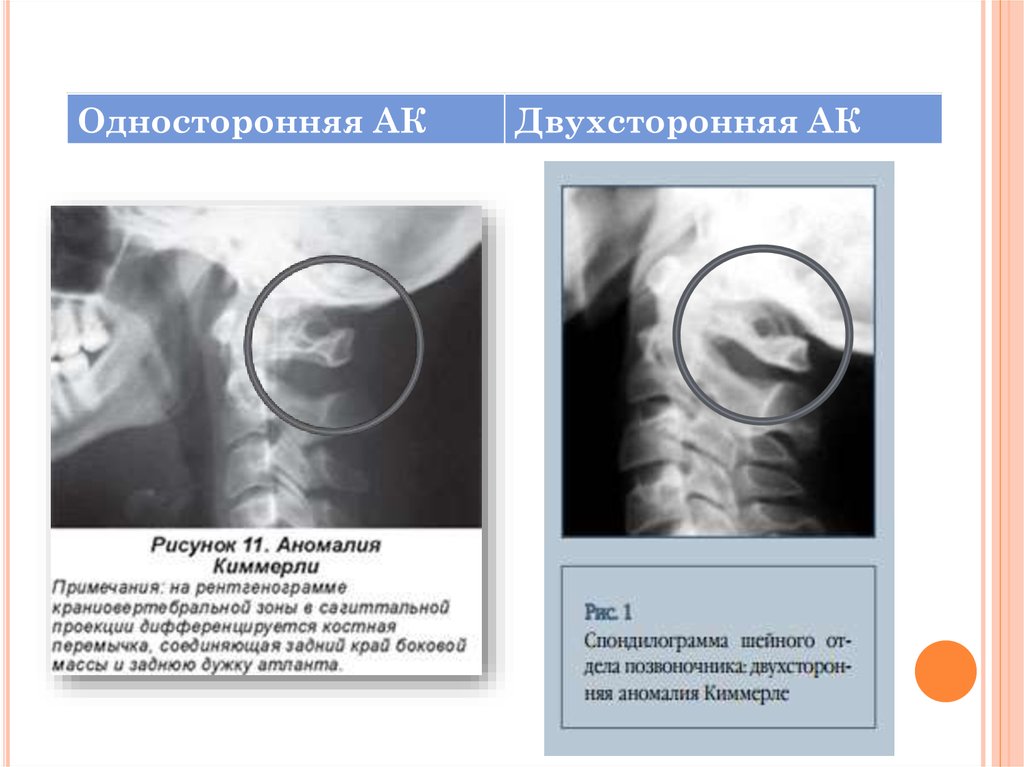 В таких случаях даже при наличии выраженной симптоматики с аномалией Киммерли берут в армию.
В таких случаях даже при наличии выраженной симптоматики с аномалией Киммерли берут в армию.
Также нужно помнить, что для освобождения от призыва одних медицинских документов недостаточно. Они нужны, чтобы показать членам военно-врачебной комиссии имеющиеся проблемы со здоровьем и получить направление на дополнительное обследование. Окончательная категория годности будет определена после прохождения обследования от военкомата и получения результатов ортостатической и клиностатической проб, исследования вариабельности ритма сердца.
При прохождении призывных мероприятий важно помнить, что призывник вправе обжаловать решение призывной комиссии. Это следует делать до отправки в воинскую часть: после освободиться от службы можно будет только по комиссации.
Мы запустили бесплатный сервис «Карта здоровья призывника». Пройдите небольшое тестирование и узнайте, какие у вас могут быть непризывные заболевания.
Два редких медицинских вмешательства выполнены в Центре Алмазова в Санкт-Петербурге
В Национальном медицинском исследовательском центре им. В. А. Алмазова (Санкт-Петербург) впервые проведена нейрохирургическая операция 14-летней пациентке с тяжелой формой аномалии Киммерли. Патология не поддавалась лекарственной терапии.
В. А. Алмазова (Санкт-Петербург) впервые проведена нейрохирургическая операция 14-летней пациентке с тяжелой формой аномалии Киммерли. Патология не поддавалась лекарственной терапии.
Как правило, врачи прибегают к консервативному лечению аномалии в связи с экстремальным риском при проведении операции: повреждение позвоночной артерии приводит к остановке сердца. Однако в ряде случаев только операция позволяет избежать инвалидности.
Девочка, которой была сделана операция по квоте в рамках ВМП, в течение нескольких лет была прикована к постели из-за ежедневных внезапных обмороков. Ни одна медицинская организация в Новгородской области, откуда поступила пациентка, не была готова провести операцию по высвобождению обеих позвоночных артерий из патологического костного канала. Хирург Центра Алмазова Константин Самочерных выполнил это вмешательство на современном оборудовании, сведя риск операции к минимуму. Кровоснабжение головного мозга пациентки через обе позвоночные артерии было полностью восстановлено, уже через несколько дней после операции девочка вернулась домой.
Центр Алмазова сообщил также об успешном излечении еще одного ребенка. Бригада врачей клиники Института перинатологии и педиатрии при Центре Алмазова провела ортопедическую коррекцию младенцу в течение третьего дня жизни. У девочки был диагностирован врожденный порок развития левой голени – ее сгиб в обратную сторону. В России ежегодно рождается около 40 таких детей. В результате первичной ортопедической коррекции ребенок был выведен из состояния инвалидности. Затем девочку долечивали и реабилитировали в течение трех месяцев в амбулаторных условиях. При этом ортопеды Центра Алмазова применили вибромассажное воздействие различных частот.
Аппаратный вибромассаж, адаптированный к детскому возрасту, впервые в России внедрен в практику около пяти лет назад травматологом-ортопедом Центра Алмазова Николаем Румянцевым. Совместно с коллегами врач разработал также единый протокол лечения врожденного переднего вывиха голени, примененный и в данном случае. В ходе планового осмотра, проведенного спустя год после коррекции, подтверждена успешность метода, который предложили петербургские специалисты. Ранняя консервативная коррекция по авторской методике помогает существенно сократить сроки лечения (в среднем до трех дней), снизить количество оперативных вмешательств на 12% и число случаев отказа от детей с патологией в роддомах. Результативность лечения достигает 92%.
Ранняя консервативная коррекция по авторской методике помогает существенно сократить сроки лечения (в среднем до трех дней), снизить количество оперативных вмешательств на 12% и число случаев отказа от детей с патологией в роддомах. Результативность лечения достигает 92%.
Кортикотропин-рилизинг-гормон оказывает прямое действие на нейрональные клетки-предшественники: значение для нейрозащиты
Цитирование
Коутмани, Ю., П. К. Политис, М. Элькурис, Г. Агроджианнис, М. Кемерли, Е. Пацурис, Е. Рембоуцика и К. П. Каралис. 2013. Кортикотропин-рилизинг-гормон оказывает прямое влияние на нейрональные клетки-предшественники: значение для нейрозащиты. Молекулярная психиатрия 18 (3): 300-307.Аннотация
Нейрогенез во время эмбриональной и взрослой жизни строго регулируется сетью транскрипционных, ростовых и гормональных факторов.Новые данные указывают на то, что активация стрессовой реакции через связанное с ней повышение уровня глюкокортикоидов снижает нейрогенез и способствует развитию заболеваний у взрослых. Поскольку кортикотропин-рилизинг-гормон (CRH) или фактор является основным медиатором адаптивного ответа на стрессоры, мы стремились исследовать его участие в этом процессе. Соответственно, мы обнаружили, что CRH может обратить вспять повреждающие эффекты глюкокортикоида на нервные стволовые клетки / клетки-предшественники (NS / PC), в то время как его генетический дефицит приводит к нарушению пролиферации и усилению апоптоза во время нейрогенеза.Анализы мозга эмбрионов и взрослых мышей выявили значительную экспрессию рецепторов CRH в пролиферирующих нейронах-предшественниках. Кроме того, используя первичные культуры NS / PC, мы охарактеризовали молекулярные механизмы и идентифицировали рецептор-1 CRH как рецептор, опосредующий нейропротекторные эффекты CRH. Наконец, мы демонстрируем экспрессию рецепторов CRH в мозге плода человека с раннего гестационного возраста в областях активной пролиферации нейронов. Эти наблюдения открывают интригующую возможность применения CRH-опосредованной фармакологии при заболеваниях, характеризующихся измененным гомеостазом нейронов, включая депрессию, деменцию, нейродегенеративные заболевания, травмы головного мозга и ожирение.
Поскольку кортикотропин-рилизинг-гормон (CRH) или фактор является основным медиатором адаптивного ответа на стрессоры, мы стремились исследовать его участие в этом процессе. Соответственно, мы обнаружили, что CRH может обратить вспять повреждающие эффекты глюкокортикоида на нервные стволовые клетки / клетки-предшественники (NS / PC), в то время как его генетический дефицит приводит к нарушению пролиферации и усилению апоптоза во время нейрогенеза.Анализы мозга эмбрионов и взрослых мышей выявили значительную экспрессию рецепторов CRH в пролиферирующих нейронах-предшественниках. Кроме того, используя первичные культуры NS / PC, мы охарактеризовали молекулярные механизмы и идентифицировали рецептор-1 CRH как рецептор, опосредующий нейропротекторные эффекты CRH. Наконец, мы демонстрируем экспрессию рецепторов CRH в мозге плода человека с раннего гестационного возраста в областях активной пролиферации нейронов. Эти наблюдения открывают интригующую возможность применения CRH-опосредованной фармакологии при заболеваниях, характеризующихся измененным гомеостазом нейронов, включая депрессию, деменцию, нейродегенеративные заболевания, травмы головного мозга и ожирение.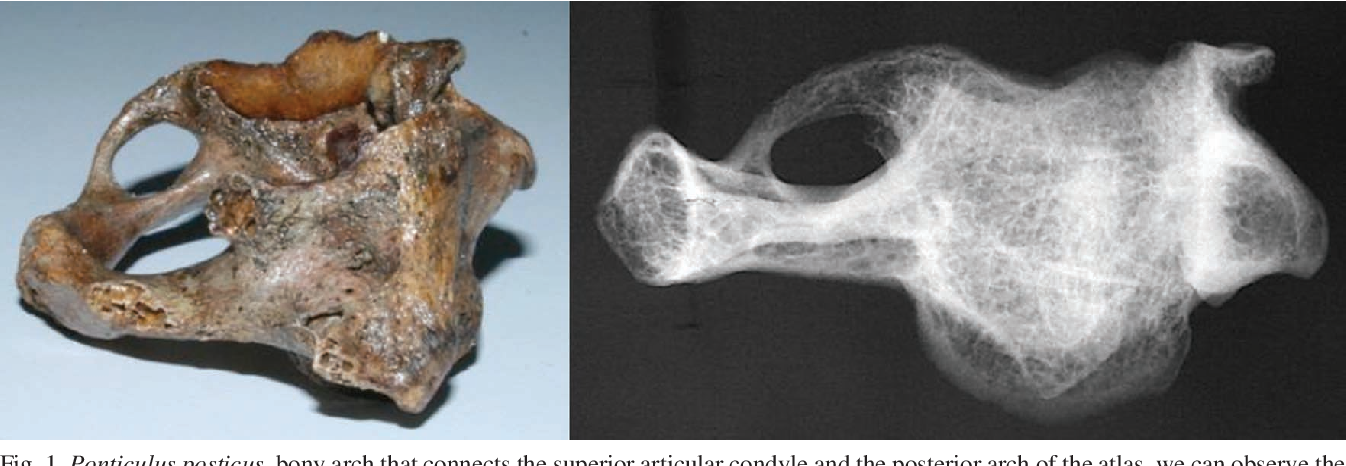
Другие источники
http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3578949/pdf/Условия эксплуатации
Эта статья доступна в соответствии с условиями, применимыми к Другим опубликованным материалам, как указано на http://nrs.harvard.edu/urn-3:HUL.InstRepos:dash.current.terms-of-use#LAAЦитируемая ссылка на эту страницу
http://nrs.harvard.edu/urn-3:HUL.InstRepos: 10589792Перекрестные помехи между эритроцитами и иммунной системой и его влияние на атеросклероз
Атеросклероз — это хроническое многофакторное заболевание артериальной стенки, характеризующееся воспалением, окислительным стрессом и активацией иммунной системы. Существуют доказательства патогенной роли окисленных эритроцитов (эритроцитов), накопленных в поражении после кровоизлияния в бляшку. В этом обзоре представлены современные знания о влиянии окислительного стресса на модификации эритроцитов с появлением на поверхности стареющих сигналов, характеризующихся сниженной экспрессией CD47 и гликофорина А и более высокой экстернализацией фосфатидилсерина. В обзоре обобщены результаты, указывающие на то, что окисленные, стареющие или сохраненные эритроциты из-за модификации поверхностного антигена и высвобождения прооксидантных и провоспалительных молекул оказывают нарушенное модулирующее действие на врожденные и адаптивные иммунные клетки и на то, как эта активность способствует атеросклеротическому заболеванию. В частности, эритроциты пациентов с атеросклерозом, в отличие от эритроцитов от здоровых субъектов, не могут контролировать индуцированное липополисахаридом созревание ДК и апоптоз Т-лимфоцитов. Накопленные эритроциты, сопровождающиеся выделением внеклеточных везикул, стимулируют мононуклеарные клетки периферической крови к высвобождению провоспалительных цитокинов, увеличивают управляемую митогенами пролиферацию Т-клеток и поляризуют макрофаги в направлении провоспалительного пути активации M1.В совокупности литературные данные предполагают, что перекрестные помехи между эритроцитами и иммунными клетками представляют собой новый механизм, с помощью которого окислительный стресс может способствовать прогрессированию атеросклеротического заболевания и может использоваться для терапевтических вмешательств.
В обзоре обобщены результаты, указывающие на то, что окисленные, стареющие или сохраненные эритроциты из-за модификации поверхностного антигена и высвобождения прооксидантных и провоспалительных молекул оказывают нарушенное модулирующее действие на врожденные и адаптивные иммунные клетки и на то, как эта активность способствует атеросклеротическому заболеванию. В частности, эритроциты пациентов с атеросклерозом, в отличие от эритроцитов от здоровых субъектов, не могут контролировать индуцированное липополисахаридом созревание ДК и апоптоз Т-лимфоцитов. Накопленные эритроциты, сопровождающиеся выделением внеклеточных везикул, стимулируют мононуклеарные клетки периферической крови к высвобождению провоспалительных цитокинов, увеличивают управляемую митогенами пролиферацию Т-клеток и поляризуют макрофаги в направлении провоспалительного пути активации M1.В совокупности литературные данные предполагают, что перекрестные помехи между эритроцитами и иммунными клетками представляют собой новый механизм, с помощью которого окислительный стресс может способствовать прогрессированию атеросклеротического заболевания и может использоваться для терапевтических вмешательств.
1. Введение
Атеросклероз — хроническое воспалительное заболевание артериальной стенки и основная причина смертности в западном мире [1]. Исследования последних лет определили атеросклероз как многофакторное заболевание, поскольку в нем участвуют несколько факторов, таких как гиперлипидемия, гипертония, сахарный диабет, мужской пол, ожирение и семейный анамнез сердечно-сосудистых заболеваний.Многие из этих факторов способствуют развитию механизмов воспаления и окислительного стресса, которые являются основными характеристиками атеросклероза, который начинается как «ответ на повреждение», способствующий активации иммунной системы и эндотелиальной дисфункции [1, 2]. Иммунная система с элементами врожденного и адаптивного иммунитета положительно и отрицательно способствует развитию сложных атеросклеротических бляшек. Макрофаги бляшек, дендритные клетки (ДК) и активированные Т- и В-лимфоциты составляют большую часть лейкоцитов в атеросклеротических поражениях, и их секреторная активность, включая провоспалительный цитокин и высвобождение разрушающей матрикс протеазы, может быть связана с разрывом бляшки [3–5] .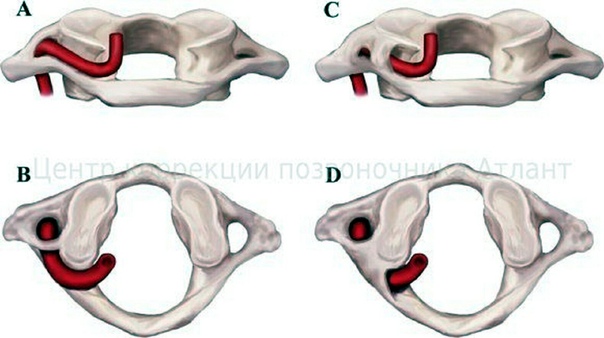 В частности, иммунные клетки как врожденного, так и адаптивного иммунитета могут быть активированы различными эндогенными молекулами, которые подверглись химической и / или структурной модификации после процессов окисления или гликации. Таким образом, активация иммунной системы вызывает воспаление низкого уровня, ведущее к медленному развитию атеросклеротического заболевания [6].
В частности, иммунные клетки как врожденного, так и адаптивного иммунитета могут быть активированы различными эндогенными молекулами, которые подверглись химической и / или структурной модификации после процессов окисления или гликации. Таким образом, активация иммунной системы вызывает воспаление низкого уровня, ведущее к медленному развитию атеросклеротического заболевания [6].
Кровоизлияние в зубной налет, частое явление при уязвимых атеросклеротических поражениях, приводит к отложению эритроцитов (эритроцитов) и высвобождению гемоглобина (Hb) [7].Отложение мембран эритроцитов в атеросклеротической бляшке, обеспечивающее большое количество липидов, представляет собой критическое событие в нестабильности бляшки [8]. Несколько линий доказательств привлекли внимание к возможной патогенной роли окисленных эритроцитов в атерогенезе, гипертонии [9], ишемической болезни сердца [10] и инсульте [11, 12]. Взаимодействие эритроцитов с иммунной системой исследовали в области основных физиологических процессов [1, 2, 13–15].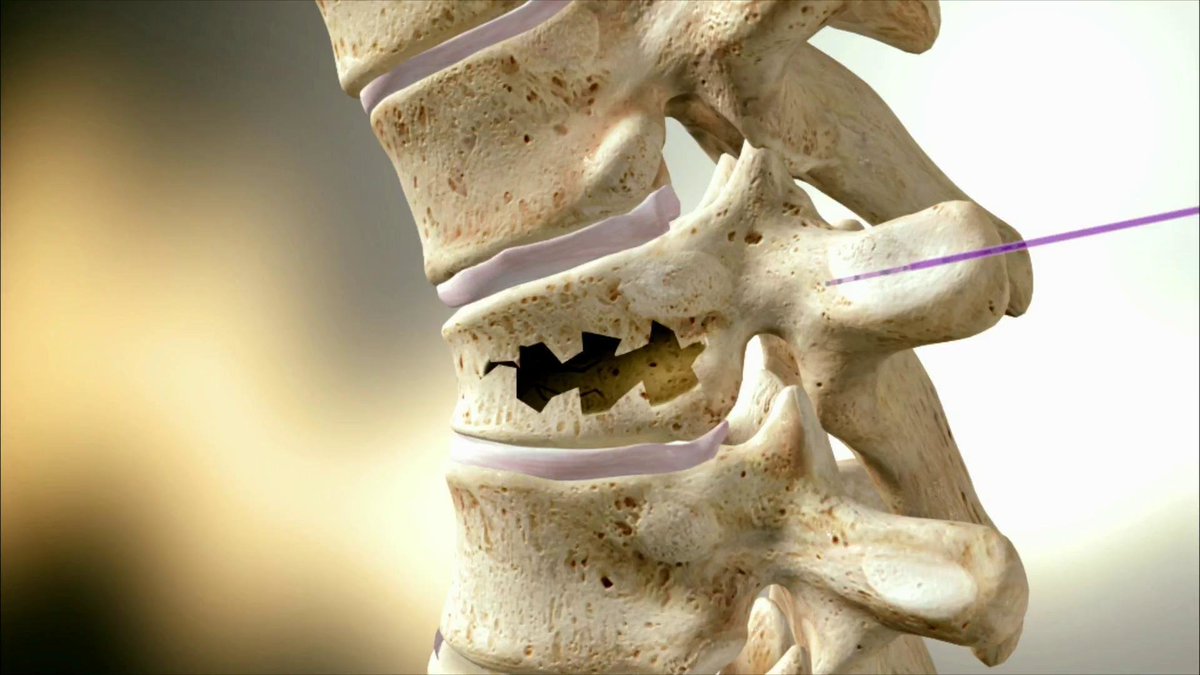 Недавно мы представили доказательства того, что окисленные эритроциты обладают различной иммуномодулирующей активностью, и предположили, что эта активность может способствовать сохранению воспаления в патогенезе атеросклероза [16, 17].
Недавно мы представили доказательства того, что окисленные эритроциты обладают различной иммуномодулирующей активностью, и предположили, что эта активность может способствовать сохранению воспаления в патогенезе атеросклероза [16, 17].
В этом обзоре мы суммируем данные об участии окисленных эритроцитов в атеросклеротическом заболевании и, в частности, о взаимодействии этих клеток с врожденным и адаптивным иммунитетом, процессом, который традиционно не связан с патогенезом этого заболевания (рис. 1).
2. Эритроциты от мусорщика до прооксидантных клеток
В физиологических условиях эритроциты действуют как циркулирующие поглотители кислорода и азот-активных форм, образующихся в сосудистой сети благодаря их хорошо оборудованным антиоксидантным механизмам, таким как восстановленный глутатион, тиоредоксин, аскорбиновая кислота. кислота и витамин Е [18].Когда эритроциты пересекают ткань, где происходит интенсивное производство прооксидантно-активных форм, защита эритроцитов оказывается подавленной или не может противодействовать новому прооксидантному статусу микросреды, и эритроциты сами становятся источником активных форм кислорода (АФК) [18].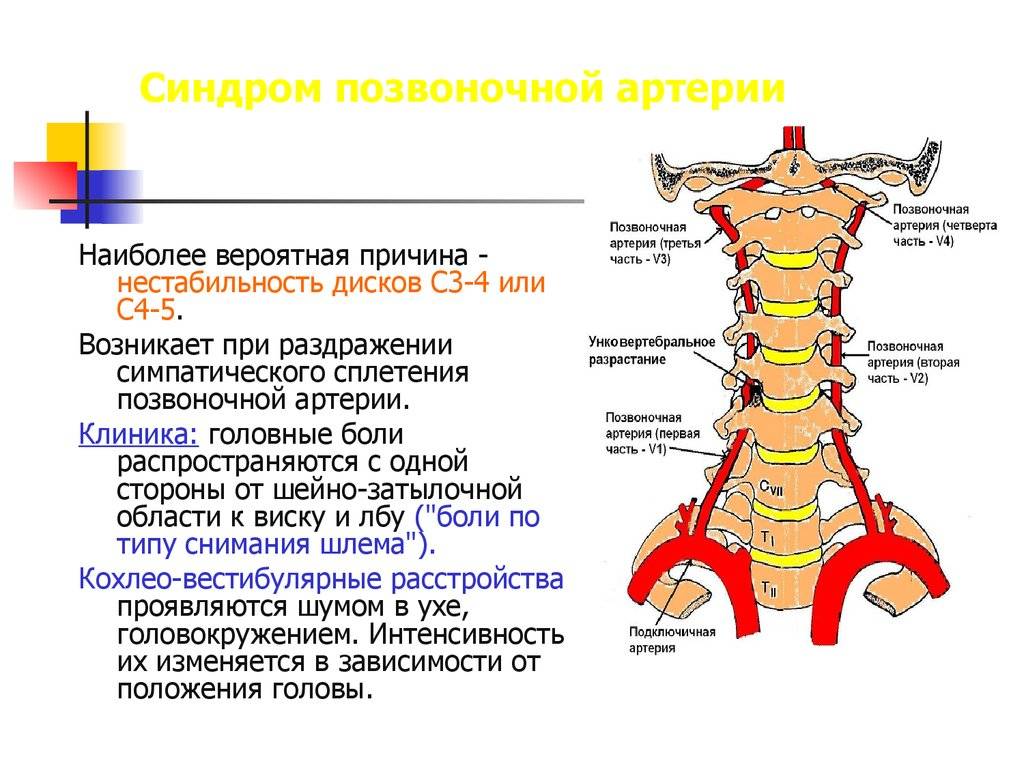
Окислительный стресс вызывает множество изменений эритроцитов, среди которых перестройка и окисление цитоскелета, а также потеря липидной асимметрии. Эти клетки становятся более жесткими и, таким образом, легче подвергаются лизису, высвобождая цитотоксические виды в сосудистую сеть.Окисленные эритроциты выделяют Hb, гем-Fe и железо [19, 20]. Эти молекулы являются мощными окислителями и источниками радикалов и способны активировать провоспалительным образом эндотелиальные клетки и клетки врожденного иммунитета [21-25], тем самым способствуя нестабильности атеросклеротических бляшек [24, 26]. Более того, эритроциты, подвергающиеся воздействию как эндогенных, так и экзогенных источников АФК, претерпевают не только механические изменения, такие как снижение деформируемости, но также накапливают продукты окислительного повреждения, такие как продукты окисления липидов [27] и 4-гидроксиноненал [28], которые могут представлять собой эндогенно образованные продукты. факторы, способные вызвать воспаление сосудов [29].
Насколько известно, ROS представляют собой важный фактор в генерации мощных устаревших сигналов на RBC. Следует отметить, что окисленные эритроциты не являются синонимом стареющих эритроцитов. Окисление эритроцитов может участвовать в старении эритроцитов, а окисленные эритроциты проявляют фенотип старения. Основной особенностью стареющих эритроцитов является кластеризация и / или разрушение полосы 3, включая связывание окисленного гемоглобина с сайтами с высоким сродством на полосе 3 [30, 31], а также комплексообразование гемоглобина со спектрином также является заметным и, вероятно, предшествующий маркер in vivo процесса старения эритроцитов, тесно коррелировавший с повышенной жесткостью эритроцитов, снижением деформируемости, эхиноцитозом и эритрофагоцитозом [32, 33].Принимая во внимание, что модификации Band 3 и модификации уже существующих путей образования молекул в основном являются нисходящим следствием окислительных провокаций, вполне вероятно, что в условиях искаженного гомеостаза окисленные эритроциты возникают как продукт патологии «ускоренного старения», связанной с преждевременным появлением клеточного старения. фенотип в более молодых эритроцитах.
фенотип в более молодых эритроцитах.
Что касается других сигнальных путей эритроцитов, были документально подтверждены потеря гликофорина A [34], экстернализация фосфатидилсерина (PS) [35] и снижение экспрессии «маркера собственного» интегрин-ассоциированного белка CD47 [36]. в циркулирующих стареющих эритроцитах.
Сходный фенотип старения был зарегистрирован для эритроцитов во время периода хранения [37, 38], за исключением PS, который не был обнаружен на внешней стороне сохраненной мембраны эритроцитов [39]. Хранение в холодильнике единиц эритроцитов для переливания приводит к сложному комплексу физико-химических изменений в эритроцитах, называемых повреждениями накопления [40, 41]. Ряд связанных с хранением изменений аналогичен изменениям, наблюдаемым в стареющих или поврежденных эритроцитах in vivo , и может снизить выживаемость эритроцитов при переливании.
Окислительные модификации эритроцитов описаны при нескольких хронических воспалительных заболеваниях, таких как атеросклероз, ишемическая болезнь сердца, метаболический синдром и рассеянный склероз [10, 16, 17, 42, 43].
Наша исследовательская группа обнаружила изменения в маркерах окислительно-восстановительного потенциала и старения эритроцитов у пациентов с атеросклерозом сонных артерий [16, 17]. Эритроциты пациентов проявляли стареющий фенотип и представляли увеличение внутриклеточных активных форм кислорода и азота и уменьшение внутриклеточных восстановленных тиолов по сравнению с эритроцитами от здоровых доноров.Следует отметить, что наши результаты подчеркивают увеличение количества окисленных эритроцитов в группе пациентов мужского пола в соответствии с хорошо известными гендерными различиями, обнаруженными в начале и прогрессе сердечно-сосудистых заболеваний [44, 45]. Наши экспериментальные данные о фенотипе старения, полученном эритроцитами от здоровых субъектов после окисления in vitro , предполагают, что у пациентов с атеросклерозом сонных артерий появление окислительно-восстановительных маркеров и маркеров старения эритроцитов может быть связано с высоким окислительным стрессом, связанным с патологией [17]. .Высокий уровень окислительного стресса у пациентов может быть вызван факторами риска атеросклероза, такими как диабет, курение и гиперхолестеринемия.
.Высокий уровень окислительного стресса у пациентов может быть вызван факторами риска атеросклероза, такими как диабет, курение и гиперхолестеринемия.
При окислительном стрессе или плохом гликемическом контроле эритроциты могут подвергаться посттрансляционным модификациям из-за реакции неферментативного гликозилирования (гликозилирования), процесса, который приводит к образованию гликозилированных белков, называемых конечными продуктами продвинутого гликозилирования (AGE) [46, 47]. Взаимодействие AGE с их рецептором на эндотелиальных клетках или иммунных клетках [48–51] может способствовать сосудистым нарушениям при хронических заболеваниях, связанных с дисфункцией эндотелиальных клеток, таких как диабет и атеросклероз [52].
Интересно, что мышиные эритроциты, обработанные in vitro антиоксидантом N-ацетил-L-цистеином (NAC), а затем внутривенно введенные мышам-братьям и сестрам, показали более длительный период полужизни по сравнению с необработанными эритроцитами [53]. Есть также свидетельства того, что эритроциты, хранящиеся под действием антиоксидантного и мембраностабилизирующего действия маннита, демонстрируют другой паттерн экспрессии маркеров старения [54]. Эти данные подтверждают гипотезу о том, что окисление эритроцитов участвует в старении эритроцитов, и дополняют данные об увеличении появления окисленных эритроцитов при сердечно-сосудистых заболеваниях.
Есть также свидетельства того, что эритроциты, хранящиеся под действием антиоксидантного и мембраностабилизирующего действия маннита, демонстрируют другой паттерн экспрессии маркеров старения [54]. Эти данные подтверждают гипотезу о том, что окисление эритроцитов участвует в старении эритроцитов, и дополняют данные об увеличении появления окисленных эритроцитов при сердечно-сосудистых заболеваниях.
Примечательно, что окисленные / стареющие эритроциты были предложены в качестве полезных биомаркеров для мониторинга окислительных изменений при прогрессировании хронических или острых заболеваний [18, 55–57].
3. Перекрестные помехи между эритроцитами и врожденными и адаптивными иммунными клетками
3.1. Перекрестные помехи между эритроцитами и дендритными клетками
Несколько исследований выявили роль DCs в прогрессировании и дестабилизации атеросклеротической бляшки [58–61]. Дендритные клетки являются ключевыми сигнальными клетками врожденной иммунной системы, которые обладают способностью стимулировать адаптивный иммунитет [62, 63].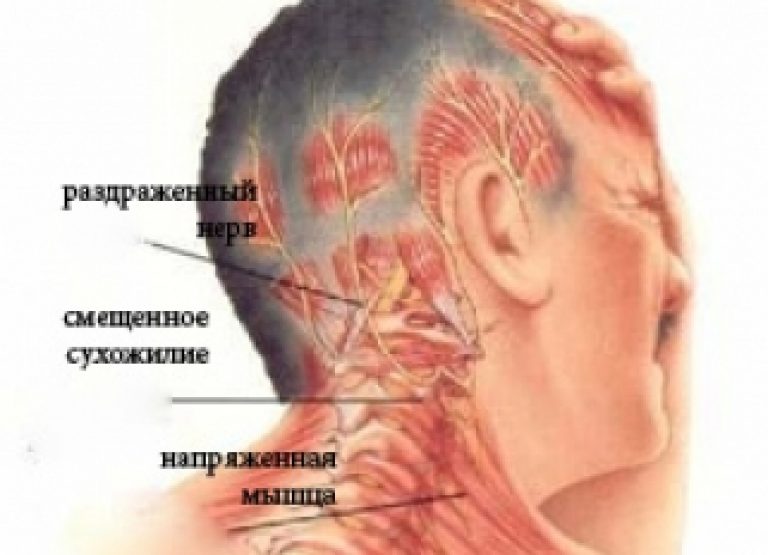 Во время этого процесса активированные DCs претерпевают отчетливые изменения фенотипа и функции, называемые созреванием DC [62, 64]. Этот процесс включает перераспределение основных молекул комплекса гистосовместимости, увеличение поверхностной экспрессии костимулирующих молекул, морфологические изменения, секрецию хемокинов, цитокинов и протеаз, а также поверхностную экспрессию молекул адгезии и хемокиновых рецепторов. Разнообразные факторы могут индуцировать созревание ДК до профиля ДК, способного вызывать первичные Т-клеточные ответы, включая липополисахарид (ЛПС), воспалительные цитокины, лигирование выбранных рецепторов клеточной поверхности и вирусные продукты [62].Напротив, несколько факторов роста и цитокинов, включая IL-10, модулируют созревание DC, таким образом, способствуя дифференцировке толерогенных DCs, предназначенных для поддержания иммунологической толерантности [62].
Во время этого процесса активированные DCs претерпевают отчетливые изменения фенотипа и функции, называемые созреванием DC [62, 64]. Этот процесс включает перераспределение основных молекул комплекса гистосовместимости, увеличение поверхностной экспрессии костимулирующих молекул, морфологические изменения, секрецию хемокинов, цитокинов и протеаз, а также поверхностную экспрессию молекул адгезии и хемокиновых рецепторов. Разнообразные факторы могут индуцировать созревание ДК до профиля ДК, способного вызывать первичные Т-клеточные ответы, включая липополисахарид (ЛПС), воспалительные цитокины, лигирование выбранных рецепторов клеточной поверхности и вирусные продукты [62].Напротив, несколько факторов роста и цитокинов, включая IL-10, модулируют созревание DC, таким образом, способствуя дифференцировке толерогенных DCs, предназначенных для поддержания иммунологической толерантности [62].
Schäkel и его коллеги [2] показали in vitro , что избыток эритроцитов, имитирующих физиологические условия в крови, полностью предотвращает фенотипическое созревание провоспалительной субпопуляции циркулирующих DCs (6-sulfo LacNAc + DCs). Это же исследование показывает, что эритроциты способны контролировать выработку интерлейкина (ИЛ) -12 и фактора некроза опухоли альфа (TNF- α ) циркулирующими DC в ответ на LPS.Экспрессия CD47 на эритроцитах и экспрессия белка альфа, регулирующего сигнал ингибиторного рецептора, на циркулирующих DC, по-видимому, имеет решающее значение для этого ингибирования [2].
Это же исследование показывает, что эритроциты способны контролировать выработку интерлейкина (ИЛ) -12 и фактора некроза опухоли альфа (TNF- α ) циркулирующими DC в ответ на LPS.Экспрессия CD47 на эритроцитах и экспрессия белка альфа, регулирующего сигнал ингибиторного рецептора, на циркулирующих DC, по-видимому, имеет решающее значение для этого ингибирования [2].
Исходя из концепции, что in vitro стареющих, окисленных или эриптотических эритроцитов модулируют поверхностные антигены [65, 66] и что эти изменения могут значительно влиять на гомотипические (эритроциты-эритроциты) и гетеротипические (например, эритроцитарно-эндотелиальные) взаимодействия, таким образом Изменяя функциональные характеристики эритроцитов [67], наша исследовательская группа исследовала, сохраняют ли эритроциты пациентов с атеросклерозом сонных артерий свою иммуномодулирующую активность в отношении ДК, полученных из моноцитов человека [16].В этом исследовании мы подтвердили, что здоровые эритроциты человека способны предотвращать полное созревание ДК в ответ на ЛПС, тем самым вызывая фенотипические и функциональные характеристики, типичные для толерогенных ДК и характеризующиеся сниженным уровнем CD83, человеческим лейкоцитарным антигеном-DR (HLA-DR), Поверхностная экспрессия CD80 и CD86 связана с низким уровнем IL-12, IL-6 и TNF- α и высокой продукцией IL-10. В том же исследовании мы также предоставили первое доказательство того, что эритроциты пациентов с атеросклерозом сонных артерий, в отличие от здоровых субъектов, не могут контролировать созревание ДК, вызванное ЛПС.LPS-стимулированные DC, культивированные в присутствии эритроцитов пациентов, представляли полностью зрелый фенотип, характеризующийся повышенной регуляцией поверхностных молекул CD83, CD80, HLA-DR и CD86 и производством более высоких уровней провоспалительных цитокинов. Эти результаты показывают, что эритроциты пациентов с атеросклерозом сонных артерий обладают нарушенной иммуномодулирующей активностью в отношении функций ДК, скорее всего, из-за фенотипа окисленных / стареющих эритроцитов [16]. Измененная экспрессия CD47 на поверхности эритроцитов или его потеря из-за везикуляции может представлять собой основной механизм, определяющий функциональное нарушение эритроцитов пациента при их перекрестном взаимодействии с DC.
В том же исследовании мы также предоставили первое доказательство того, что эритроциты пациентов с атеросклерозом сонных артерий, в отличие от здоровых субъектов, не могут контролировать созревание ДК, вызванное ЛПС.LPS-стимулированные DC, культивированные в присутствии эритроцитов пациентов, представляли полностью зрелый фенотип, характеризующийся повышенной регуляцией поверхностных молекул CD83, CD80, HLA-DR и CD86 и производством более высоких уровней провоспалительных цитокинов. Эти результаты показывают, что эритроциты пациентов с атеросклерозом сонных артерий обладают нарушенной иммуномодулирующей активностью в отношении функций ДК, скорее всего, из-за фенотипа окисленных / стареющих эритроцитов [16]. Измененная экспрессия CD47 на поверхности эритроцитов или его потеря из-за везикуляции может представлять собой основной механизм, определяющий функциональное нарушение эритроцитов пациента при их перекрестном взаимодействии с DC.
3.2. Перекрестное взаимодействие между эритроцитами и макрофагами
В микросреде атеросклеротических бляшек состояние поляризации макрофагов может ускорять или замедлять прогрессирование атеросклеротического заболевания за счет активации или ослабления воспалительных реакций. Однако механизмы, лежащие в основе поляризации и активации макрофагов внутри бляшки, остаются неясными [68, 69]. Взаимодействия между макрофагами и эритроцитами важны для выведения эритроцитов и гомеостаза [57].В печени и селезенке жилые макрофаги тщательно исследуют проходящие эритроциты и удаляют из кровообращения те, которые находятся в конце своей жизни или получили повреждения, не подлежащие восстановлению [57]. В настоящее время нет единого мнения относительно того, как макрофаги определяют, какие эритроциты необходимо очистить, а какие можно восстановить и / или поддерживать. Принимая во внимание, что эритроциты не могут синтезировать новые белки, все маркеры «удаления» должны происходить из модификаций в уже существующих молекулах или из-за приобретения опсонинов плазмы, направленных против этих модификаций.Более того, новые данные свидетельствуют о том, что экспериментальное старение эритроцитов вызывает конформационные изменения в CD47, которые переключают молекулу с ингибирующей на активирующую [70].
Однако механизмы, лежащие в основе поляризации и активации макрофагов внутри бляшки, остаются неясными [68, 69]. Взаимодействия между макрофагами и эритроцитами важны для выведения эритроцитов и гомеостаза [57].В печени и селезенке жилые макрофаги тщательно исследуют проходящие эритроциты и удаляют из кровообращения те, которые находятся в конце своей жизни или получили повреждения, не подлежащие восстановлению [57]. В настоящее время нет единого мнения относительно того, как макрофаги определяют, какие эритроциты необходимо очистить, а какие можно восстановить и / или поддерживать. Принимая во внимание, что эритроциты не могут синтезировать новые белки, все маркеры «удаления» должны происходить из модификаций в уже существующих молекулах или из-за приобретения опсонинов плазмы, направленных против этих модификаций.Более того, новые данные свидетельствуют о том, что экспериментальное старение эритроцитов вызывает конформационные изменения в CD47, которые переключают молекулу с ингибирующей на активирующую [70]. Хотя эритроциты не подвергаются классическому апоптозу, поскольку они не содержат ядра, митохондрий или других клеточных органелл, процесс, которому они подвергаются, уже был назван «эриптозом», поскольку он имеет много общего с запрограммированной гибелью клеток [71].
Хотя эритроциты не подвергаются классическому апоптозу, поскольку они не содержат ядра, митохондрий или других клеточных органелл, процесс, которому они подвергаются, уже был назван «эриптозом», поскольку он имеет много общего с запрограммированной гибелью клеток [71].
После кровоизлияния в бляшку большая часть эритроцитов откладывается и разлагается в течение нескольких дней под действием фагоцитозной активности макрофагов через PS-рецепторы или естественные антитела к Band 3 или взаимодействию CD47-SIRP α [72–75] как часть защиты. механизм против окислительной нагрузки, и это событие способствует нестабильности атеросклеротического поражения [7, 76].Весьма вероятно, что фагоцитоз стареющих или эриптотических эритроцитов в гомеостатических условиях является невоспалительным [77]. Влияние фагоцитоза эритроцитов на секрецию цитокинов при воспалительном состоянии еще предстоит выяснить. Другой вопрос, который необходимо решить, заключается в том, участвуют ли макрофаги в разрешении ангиогенеза бляшек (который, вероятно, был причиной кровоизлияния) или активно вносят в него свой вклад [78].
Язданбахш и др. [79] предложили интересную гипотетическую модель для объяснения влияния переливания сохраненной и свежей крови на пластичность макрофагов.В этом исследовании они проанализировали эффекты эритроцитов в ответ на гемоглобин и продукт его распада на макрофаги. Пластичность макрофагов рассматривается как спектр состояний активации, начиная от классического провоспалительного (M1) состояния, которое индуцируется Th2 цитокином интерфероном (IFN-) γ и бактериальными компонентами, такими как LPS, и альтернативно активированным (M2) состояние, связанное с фазой разрешения воспаления и управляемое IL-4, IL-10, трансформирующим фактором роста бета и глюкокортикоидами [80].На модели хранения и переливания эритроцитов мышей Hod et al. [81] показали, что переливание эритроцитов после длительного хранения индуцировало поляризацию макрофагов в направлении классического пути активации макрофагов M1, связанного с бактерицидной активностью и производством провоспалительных цитокинов, способствующих иммуностимуляции. Переливание свежей крови в невоспалительных условиях связано с меньшим клиренсом эритроцитов [81] и, следовательно, с меньшей загрузкой макрофагов гемом, а также с активацией гемоксигеназы и сдвигом в сторону пути дифференцировки M2, который связан с иммунорегуляцией через индукция регуляторных Т-клеток [79].
Переливание свежей крови в невоспалительных условиях связано с меньшим клиренсом эритроцитов [81] и, следовательно, с меньшей загрузкой макрофагов гемом, а также с активацией гемоксигеназы и сдвигом в сторону пути дифференцировки M2, который связан с иммунорегуляцией через индукция регуляторных Т-клеток [79].
В течение жизни эритроцитов потеря гемоглобина и частей мембраны происходит из интактных эритроцитов in vivo . На модели крыс было показано, что везикулы, происходящие из эритроцитов, быстро удаляются из кровотока, главным образом, купферовскими клетками печени и, в меньшей степени, другими макрофагами системы мононуклеарных фагоцитов через рецепторы скавенджеров [82].
Эти данные требуют исследований in vivo, и in vitro, , чтобы проверить роль окисленных, стареющих эритроцитов или везикул, полученных из эритроцитов, на поляризацию макрофагов в геморрагических атеросклеротических поражениях.Перекрестное взаимодействие между макрофагами и эритроцитами может представлять потенциально новый механизм, с помощью которого окислительный стресс может способствовать прогрессированию атеросклеротического заболевания.
3.3. Перекрестные помехи между эритроцитами и Т-лимфоцитами
Связывание циркулирующих иммунных клеток со стенкой сосудов является центральным процессом в воспалении, метастазировании и доставке терапевтических клеток. In vivo и in vitro Исследования показывают, что эритроциты способствуют вовлечению циркулирующих лимфоцитов в эндотелий сосудов [15, 83].Хорошо известно, что во время воспаления и местного иммунного ответа диаметр капилляров и кровоток увеличиваются. Это может привести к экстравазации эритроцитов вместе с активированными Т-лимфоцитами в место воспаления. Ряд исследований за последние три десятилетия представили доказательства, указывающие на то, что эритроциты являются предполагаемыми модуляторами пролиферации Т-клеток, как in vitro и in vivo [1]. В частности, эритроциты способны увеличивать экспансию и выживаемость Т-клеток, ингибируя вызванную активацией гибель Т-клеток, эффект, возможно, связанный со снижением окислительного стресса в активированных Т-клетках [14]. В предыдущих исследованиях оптимальная пролиферация и выживаемость Т-клеток наблюдались только с интактными эритроцитами и когда эритроциты находились в тесном контакте или близости с активированными Т-клетками [14]. Необходимость целостности и близости эритроцитов может подразумевать участие во взаимодействии между рецепторами каждого типа клеток, как предполагают некоторые авторы [84, 85]. Недавно было продемонстрировано, что эритроциты выделяют белковые факторы, способные поддерживать рост и выживание Т-клеток [13]. Наша группа продемонстрировала, что эритроциты пациентов с атеросклерозом сонных артерий сохраняют способность поддерживать in vitro пролиферативный ответ активированных Т-лимфоцитов [17].Наши результаты показывают, что структурные изменения и окислительно-восстановительный дисбаланс в эритроцитах пациентов не препятствуют высвобождению ими некоторых белковых факторов, способствующих пролиферации Т-клеток. В нашем исследовании пролиферирующие Т-клетки продуцировали высокие концентрации IFN- γ , цитокина Th2, участвующего в воспалительных процессах, ведущих к прогрессированию бляшек [86, 87].
В предыдущих исследованиях оптимальная пролиферация и выживаемость Т-клеток наблюдались только с интактными эритроцитами и когда эритроциты находились в тесном контакте или близости с активированными Т-клетками [14]. Необходимость целостности и близости эритроцитов может подразумевать участие во взаимодействии между рецепторами каждого типа клеток, как предполагают некоторые авторы [84, 85]. Недавно было продемонстрировано, что эритроциты выделяют белковые факторы, способные поддерживать рост и выживание Т-клеток [13]. Наша группа продемонстрировала, что эритроциты пациентов с атеросклерозом сонных артерий сохраняют способность поддерживать in vitro пролиферативный ответ активированных Т-лимфоцитов [17].Наши результаты показывают, что структурные изменения и окислительно-восстановительный дисбаланс в эритроцитах пациентов не препятствуют высвобождению ими некоторых белковых факторов, способствующих пролиферации Т-клеток. В нашем исследовании пролиферирующие Т-клетки продуцировали высокие концентрации IFN- γ , цитокина Th2, участвующего в воспалительных процессах, ведущих к прогрессированию бляшек [86, 87]. В отличие от нас, некоторые исследования предполагают, что экзосомы, полученные из эритроцитов, являются потенциальными модификаторами Т-клеточных ответов в дополнение к их известной роли в врожденном иммунитете и В-клеточных ответах [88, 89].Неблагоприятные исходы для пациентов, связанные с длиной хранения эритроцитов, наблюдаемые в нескольких клинических исследованиях, хорошо подтверждают нашу гипотезу о патогенной роли окисленных / стареющих эритроцитов в сложных воспалительных заболеваниях, таких как атеросклероз.
В отличие от нас, некоторые исследования предполагают, что экзосомы, полученные из эритроцитов, являются потенциальными модификаторами Т-клеточных ответов в дополнение к их известной роли в врожденном иммунитете и В-клеточных ответах [88, 89].Неблагоприятные исходы для пациентов, связанные с длиной хранения эритроцитов, наблюдаемые в нескольких клинических исследованиях, хорошо подтверждают нашу гипотезу о патогенной роли окисленных / стареющих эритроцитов в сложных воспалительных заболеваниях, таких как атеросклероз.
Накопленные эритроциты, сопровождающиеся выделением и высвобождением внеклеточных везикул, способны стимулировать мононуклеарные клетки периферической крови (PBMC) in vitro и провоцировать провоспалительный цитокиновый ответ [41, 90]. Кроме того, эритроциты, происходящие из пузырьков, усиливают управляемую митогеном пролиферацию Т-клеток в культурах PBMC антиген-презентирующим клеточным и клеточным контактно-зависимым образом [91, 92].
Апоптотическая гибель клеток была продемонстрирована в прогрессирующих атеросклеротических бляшках человека [93], а нарушение фагоцитоза апоптотических клеток было предложено как механизм, который способствует формированию некротического ядра, уязвимости и разрыву бляшек [94, 95]. Наша исследовательская группа показала, что в отличие от эритроцитов, полученных от здоровых субъектов, эритроциты от пациентов и in vitro окисленных эритроцитов не защищают активированные Т-лимфоциты от апоптоза [17]. Следовательно, эритроциты пациентов с атеросклерозом сонных артерий, вероятно, из-за их окислительного дисбаланса, влияют на целостность и функцию Т-клеток.
Наша исследовательская группа показала, что в отличие от эритроцитов, полученных от здоровых субъектов, эритроциты от пациентов и in vitro окисленных эритроцитов не защищают активированные Т-лимфоциты от апоптоза [17]. Следовательно, эритроциты пациентов с атеросклерозом сонных артерий, вероятно, из-за их окислительного дисбаланса, влияют на целостность и функцию Т-клеток.
4. Заключение
В совокупности литературные данные демонстрируют, что эритроциты представляют собой не только эффективный механизм противодействия окислительному стрессу, но и дополнительный инструмент для поддержания иммунологического гомеостаза. Однако, когда имеет место интенсивная продукция реактивных видов, эритроциты могут приобретать прооксидантное поведение [18] и терять свои типичные структурные и функциональные особенности [16–18, 96]. В частности, окислительные повреждения мембраны эритроцитов, цитоскелета и компонентов цитоплазмы, вероятно, представляют собой опасные сигналы для врожденных (например,g. , DC и макрофаги) и адаптивный иммунитет (например, Т-лимфоциты), тем самым способствуя или даже запуская повреждающий процесс, усугубляющий атеросклеротическое заболевание. Улучшение наших знаний о молекулярной основе клеточных взаимодействий может открыть возможности для клинического вмешательства с использованием кооперации эритроцитов и иммунных клеток.
, DC и макрофаги) и адаптивный иммунитет (например, Т-лимфоциты), тем самым способствуя или даже запуская повреждающий процесс, усугубляющий атеросклеротическое заболевание. Улучшение наших знаний о молекулярной основе клеточных взаимодействий может открыть возможности для клинического вмешательства с использованием кооперации эритроцитов и иммунных клеток.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации данной статьи.
Благодарность
Авторы благодарят г.Массимо Делле Феммине за графическую поддержку фигур.
На иммунолокализацию кластерина / аполипопротеина J в сонной артерии влияет TNF-альфа, курение сигарет и лечение тромбоцитами | Липиды в здоровье и болезнях
Популяция и протокол исследования
Исследование было проведено у 42 пациентов (32 мужчины и 10 женщин), страдающих высоким стенозом сонной артерии (стеноз ≥ 70% от почти полной окклюзии) в клинике сосудистой хирургии больницы Красного Креста. , Афины, Греция. Испытуемые были кавказцами из одного географического региона.Все пациенты соответствовали критериям заболевания сонной артерии для хирургической операции в соответствии с рекомендациями Европейского общества сосудистой хирургии [26]. Стеноз сонной артерии диагностировали после цифровой субтракционной ангиографии (ДСА) дуги аорты, сонных и позвоночных артерий и ультразвуковой ангиографии (цветной дуплекс). Критериями исключения были аутоиммунные или гематологические нарушения, сердечная или почечная недостаточность, нарушение функции печени, хроническая инфекция и злокачественные новообразования. Были выполнены антропометрические измерения (возраст, масса тела, рост, индекс массы тела, рассчитанный как масса тела (кг) / рост 2 (m 2 )), и были записаны личные привычки в отношении курения и физической активности.Курение считалось историей регулярного курения (ежедневное употребление табака в течение длительного времени как привычка). Был заполнен подробный анкетный опрос, включающий предыдущий инфаркт миокарда, симптоматику заболевания сонной артерии, клинические синдромы, такие как ишемическая болезнь сердца (ИБС), и положительный семейный анамнез подтвержденных сердечно-сосудистых заболеваний с учетом родственников первой степени родства.
, Афины, Греция. Испытуемые были кавказцами из одного географического региона.Все пациенты соответствовали критериям заболевания сонной артерии для хирургической операции в соответствии с рекомендациями Европейского общества сосудистой хирургии [26]. Стеноз сонной артерии диагностировали после цифровой субтракционной ангиографии (ДСА) дуги аорты, сонных и позвоночных артерий и ультразвуковой ангиографии (цветной дуплекс). Критериями исключения были аутоиммунные или гематологические нарушения, сердечная или почечная недостаточность, нарушение функции печени, хроническая инфекция и злокачественные новообразования. Были выполнены антропометрические измерения (возраст, масса тела, рост, индекс массы тела, рассчитанный как масса тела (кг) / рост 2 (m 2 )), и были записаны личные привычки в отношении курения и физической активности.Курение считалось историей регулярного курения (ежедневное употребление табака в течение длительного времени как привычка). Был заполнен подробный анкетный опрос, включающий предыдущий инфаркт миокарда, симптоматику заболевания сонной артерии, клинические синдромы, такие как ишемическая болезнь сердца (ИБС), и положительный семейный анамнез подтвержденных сердечно-сосудистых заболеваний с учетом родственников первой степени родства. Гипертония, когда пациент не принимал никаких лекарств, определялась как систолическое артериальное давление ≥140 мм рт.ст. и / или диастолическое артериальное давление ≥90 мм рт.ст., а сахарный диабет — как два уровня глюкозы в плазме натощак 126 мг / дл или выше.
Гипертония, когда пациент не принимал никаких лекарств, определялась как систолическое артериальное давление ≥140 мм рт.ст. и / или диастолическое артериальное давление ≥90 мм рт.ст., а сахарный диабет — как два уровня глюкозы в плазме натощак 126 мг / дл или выше.
Лекарства пациента были подробно зарегистрированы и разделены на следующие категории: бета-адреноблокаторы ( β -блокаторы), ингибиторы ангиотензинпревращающего фермента (АПФ), блокаторы кальциевых каналов (CaCB), диуретики, клопидогрель, ацетилсалициловая кислота (ASA), противодиабетические средства, инсулин и статины. Пациенты принимали лекарства не менее одного года.
Пациентам была выполнена эндартерэктомия внутренней сонной артерии с использованием пластыря из синтетического политетрафторэтилена (ПТФЭ) (W.L. Gore & Associates, Ньюарк, Делавэр) под общей анестезией.Шунт для поддержания мозгового кровотока в этих операциях не использовался. После эндартерэктомии бляшки сонной артерии осторожно помещали в 10% забуференный формалин для дальнейшей обработки. В послеоперационном периоде пациенты обычно выздоравливали и выписывались из больницы без осложнений примерно через 4 дня после операции.
В послеоперационном периоде пациенты обычно выздоравливали и выписывались из больницы без осложнений примерно через 4 дня после операции.
Комитет по этике Афинского госпиталя Красного Креста одобрил протоколы исследования, и все пациенты дали письменное информированное согласие.
Забор и анализы крови
Венозную кровь забирали в 8 р.м. накануне вечером хирургической операции после 6 часов голодания. Образцы для выделения сыворотки оставляли для свертывания на 30 мин при комнатной температуре, а затем центрифугировали при 3000 об / мин в течение 15 мин при 4 ° C. Выделенные образцы хранили в аликвотах при -80 ° C до анализа. Для гематологических определений использовали пробирки с ЭДТА, и измерения были выполнены немедленно.
Лейкоциты (WBC), тромбоциты (PLT), гематокрит (HCT) и гликозилированный гемоглобин (HbA1c) автоматически измерялись гематологическим анализатором (Beckman Coulter LH 750).Параметры, связанные с тромбозом, такие как фибриноген, антитромбин III, протеин C и протеин S, измеряли с помощью компактного анализатора коагуляции Stago STA.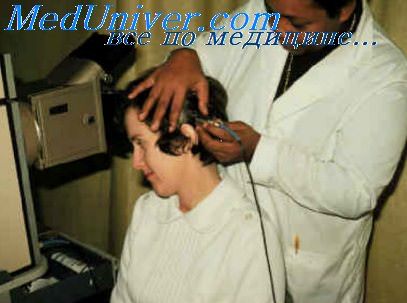
Глюкоза сыворотки, общий холестерин, липопротеины низкой плотности (ЛПНП) -холестерин, холестерин ЛПВП, триацилглицерины, аполипопротеины A-1 и B, липопротеины (а) (Lp (a)) и гомоцистеин определялись в Cobas Integra 800 (Roche ) биохимический анализатор.
Чувствительный сэндвич-иммуноферментный анализ ELISA (Immunodiagnostik AG, Бенсхайм, Германия) использовали для определения фактора некроза опухоли-a (TNF-a), интерлейкина-6 (IL-6) и С-реактивного белка (высокочувствительный CRP) в соответствии с в соответствии с инструкциями производителя.Скорость оседания эритроцитов (СОЭ) оценивали через 1 час в крови с антикоагулированной ЭДТА.
Иммуногистохимия
Репрезентативные серийные срезы для иммуногистохимии вырезали на 3 мкм из залитых парафином образцов, помещали на предметные стекла поли-L-лизина и давали высохнуть при 37 ° C в течение ночи. Перед нанесением первичного антитела срезы обрабатывали в микроволновой печи при 750 Вт в течение 3 циклов по 5 минут каждый в 10 ммоль / л натрийцитратного буфера, pH 6,0. Слайды оставляли охлаждаться в растворе для поиска антигена на 20 минут.Эндогенную пероксидазную активность подавляли, сначала инкубируя образцы в течение 5 минут в 3% перекиси водорода (поставляется пользователем). Затем образцы инкубировали с первичным антителом против Apo-J (клон sc-6420, козье поликлональное антитело, Santa Cruz Biotechnology Inc, Калифорния) в разведении 1: 200 с последующими последовательными инкубациями с биотинилированным связывающим антителом и стрептавидином, меченным пероксидазой. (LSAB + System-HRP, код K0690, Dako, Glostrup, Дания). Окрашивание завершали после инкубации с раствором субстрат-хромоген (большой объем DAB +, код K3468, Dako, Glostrup, Дания).Гематоксилин использовали для контрастного окрашивания. Известные положительные контроли, а также отрицательные контроли (срезы, в которых первичное антитело было заменено неиммунной мышиной сывороткой) также окрашивались в каждом прогоне.
Слайды оставляли охлаждаться в растворе для поиска антигена на 20 минут.Эндогенную пероксидазную активность подавляли, сначала инкубируя образцы в течение 5 минут в 3% перекиси водорода (поставляется пользователем). Затем образцы инкубировали с первичным антителом против Apo-J (клон sc-6420, козье поликлональное антитело, Santa Cruz Biotechnology Inc, Калифорния) в разведении 1: 200 с последующими последовательными инкубациями с биотинилированным связывающим антителом и стрептавидином, меченным пероксидазой. (LSAB + System-HRP, код K0690, Dako, Glostrup, Дания). Окрашивание завершали после инкубации с раствором субстрат-хромоген (большой объем DAB +, код K3468, Dako, Glostrup, Дания).Гематоксилин использовали для контрастного окрашивания. Известные положительные контроли, а также отрицательные контроли (срезы, в которых первичное антитело было заменено неиммунной мышиной сывороткой) также окрашивались в каждом прогоне.
Анализ изображений
Изображения иммуногистохимически окрашенных срезов были получены с помощью цветной ПЗС-камеры Nikon DS-2 MW, установленной на микроскопе Nikon Eclipse 80i (Nikon Co, Токио, Япония), при 20-кратном исходном увеличении и сохранены в формате JPG высокого качества. файлы.Были сделаны от трех до пяти репрезентативных изображений на каждый раздел. Затем изображения анализировали с помощью программного обеспечения Image-Pro Plus 5.1 (Media Cybernetics, SilverSpring, MD). Параметрами, измеренными программой анализа изображений, были интенсивность окрашивания CLU в атеросклеротической бляшке, а также степень окрашивания по отношению к общей площади [27]. Окрашивание коричневым диаминобензидином (DAB), указывающее на экспрессию CLU, отличалось от синего контрастного окрашивания гематоксилином с порогами оттенка. Параметры цветового порога для пикселей, окрашенных DAB, устанавливались вручную перед анализом и оставались неизменными на всем протяжении.Общие атеросклеротические области на каждом изображении были ограничены с помощью инструмента «Область интереса», включенного в программу Image-Pro Plus в сочетании с оцифровкой Intuos (Wacom Technology; Ванкувер, Вашингтон), и была рассчитана общая ограниченная область. Площадь, окрашенная представляющим интерес антителом, была идентифицирована и рассчитана с использованием программного алгоритма цветного куба.
файлы.Были сделаны от трех до пяти репрезентативных изображений на каждый раздел. Затем изображения анализировали с помощью программного обеспечения Image-Pro Plus 5.1 (Media Cybernetics, SilverSpring, MD). Параметрами, измеренными программой анализа изображений, были интенсивность окрашивания CLU в атеросклеротической бляшке, а также степень окрашивания по отношению к общей площади [27]. Окрашивание коричневым диаминобензидином (DAB), указывающее на экспрессию CLU, отличалось от синего контрастного окрашивания гематоксилином с порогами оттенка. Параметры цветового порога для пикселей, окрашенных DAB, устанавливались вручную перед анализом и оставались неизменными на всем протяжении.Общие атеросклеротические области на каждом изображении были ограничены с помощью инструмента «Область интереса», включенного в программу Image-Pro Plus в сочетании с оцифровкой Intuos (Wacom Technology; Ванкувер, Вашингтон), и была рассчитана общая ограниченная область. Площадь, окрашенная представляющим интерес антителом, была идентифицирована и рассчитана с использованием программного алгоритма цветного куба.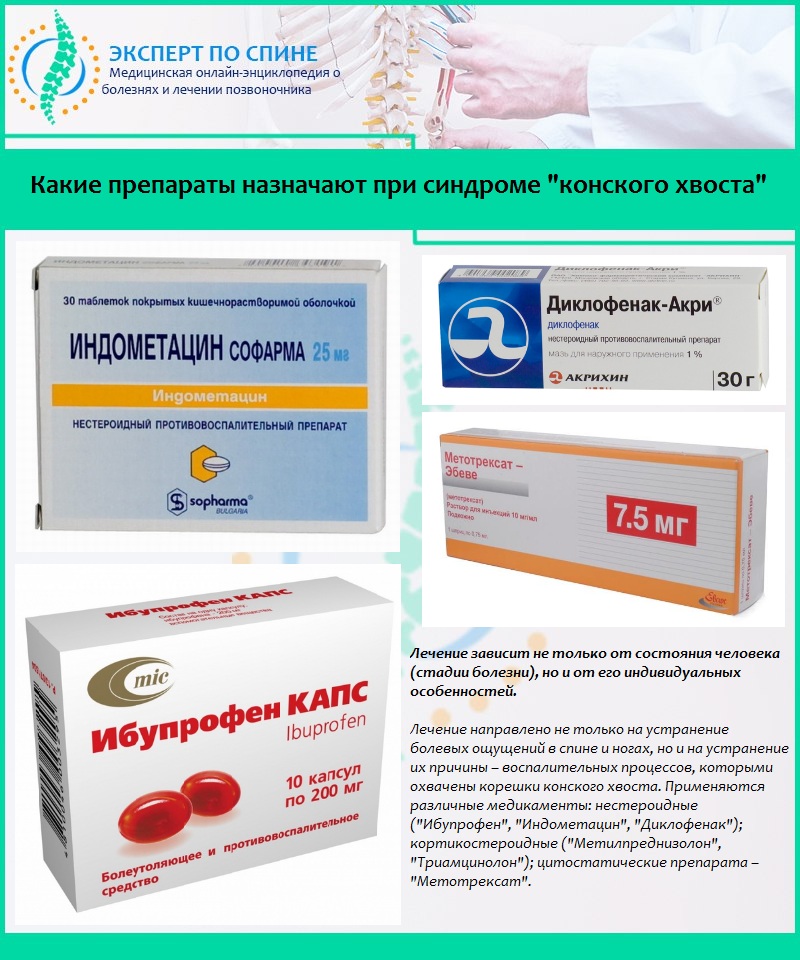 Уровни интенсивности окрашивания CLU измеряли с использованием линейной шкалы в диапазоне от 0 (неопределяемый) до 255 (самая высокая интенсивность).Патолог, выполняющий компьютеризированный анализ изображений, не знал о клинических исходах пациентов.
Уровни интенсивности окрашивания CLU измеряли с использованием линейной шкалы в диапазоне от 0 (неопределяемый) до 255 (самая высокая интенсивность).Патолог, выполняющий компьютеризированный анализ изображений, не знал о клинических исходах пациентов.
Статистический анализ
Данные анализировали с помощью программного обеспечения SPSS 17.0. Статистическая значимость принята при p <0,05. Значения были выражены как среднее ± стандартное отклонение для непрерывных переменных и в процентах для категориальных данных. Тест Стьюдента t был проведен для сравнения непрерывных переменных между двумя группами и дисперсионного анализа (ANOVA) для более чем двух групп.Для оценки различий между категориальными данными использовался критерий хи-квадрат. На корреляцию между непрерывными переменными указывает коэффициент корреляции Пирсона (r). Был проведен линейный регрессионный анализ для выявления независимых ассоциаций с экспрессией CLU на сонной ткани.
Нарушение мозгового кровообращения
Как показывает практика, нарушения мозгового кровообращения сопровождаются заболеваниями сосудов, в основном атеросклерозом. Это расстройство также появляется на фоне повышенного артериального давления.
Это расстройство также появляется на фоне повышенного артериального давления.
Нарушение мозгового кровообращения у детей развивается, как правило, из-за недостаточности шейного отдела позвоночника.
Белки, холестерин и другие жиры циркулируют в крови и образуют жирово-белковый комплекс. Организм воспринимает их как аутоантигены при их качественном изменении. В этом случае происходит выработка антител и биологически активных веществ (гистамин, серотонин), поражаются стенки сосудов. Это, в свою очередь, провоцирует повышение их проницаемости, сопровождающееся нарушением обменных процессов.
Нарушение мозгового кровообращения возникает также при нервно-психических расстройствах, малоподвижности, вазомоторной дистонии, а также при употреблении калорийной пищи.
При длительном перевозбуждении коры полушарий головного мозга происходит перевозбуждение гипоталамо-гипофизарно-надпочечниковой системы.
Клиническая картина, сопровождающая атеросклеротическое нарушение мозгового кровообращения, проявляется снижением работоспособности, нарушением сна, головными болями, раздражительностью, шумом в голове. Кроме того, отмечаются парадоксальные состояния, потеря памяти, ухудшение слуха, нарушение внимания.
Кроме того, отмечаются парадоксальные состояния, потеря памяти, ухудшение слуха, нарушение внимания.
Гипертоническая болезнь может спровоцировать возникновение застойных очагов возбуждения, распространяющихся на гипоталамическую область. В результате нарушается регуляция тонуса сосудов. Это состояние, в свою очередь, вызывает нарушение электролитного баланса, увеличение выброса альдостерона, увеличение симпатико-надпочечниковой системы. В результате развивается гиперреактивность сосудов и повышенное артериальное давление.Течение болезни провоцирует изменение типа кровообращения. Это проявляется в снижении сердечного выброса и повышении периферического сопротивления сосудов.
К одной из клинических форм, характеризующих нарушение мозгового кровообращения, относят первичные проявления недостаточного кровоснабжения головного мозга.
Диагноз ставится с учетом жалоб больных на потерю памяти, головокружение, нарушение сна, инвалидность, шум в ушах. Комбинированное проявление двух и более симптомов, особенно в случаях их длительного существования и частого повторения, дает основание для установления диагноза. Органических поражений нервной системы не отмечается.
Органических поражений нервной системы не отмечается.
Гипертония и атеросклеротические сосудистые поражения часто вызывают нарушение мозгового кровообращения. Клиническая картина может проявляться различными симптомами.
Симптоматические симптомы включают головокружение, боль в голове и глазных яблоках, усиливающуюся при движении, рвоту, тошноту, заложенность и шум в ушах. В ряде случаев наблюдается изменение сознания, проявляющееся в психомоторном возбуждении, оглушении, потере сознания. В редких случаях отмечаются судорожные состояния.
Проявление очаговых симптомов зависит от ареалокализации. При нарушении кровообращения полушарий головного мозга, как правило, возникает нарушение в чувствительной зоне. Это может проявляться онемением или покалыванием, которые чаще всего захватывают определенные части конечностей, кожи или лица. Возможно снижение болевой чувствительности.
Расстройства чувствительности могут сопровождаться нарушением движений. Они проявляются как ограниченный парез или паралич. В ряде случаев также прибывают нарушения речи, контуров тела.
В ряде случаев также прибывают нарушения речи, контуров тела.
Поражения ствола мозга могут вызвать шаткость походки, двоение в глазах, нарушение координации и т. Д.
Дусунен Адам Журнал психиатрии и неврологических наук
Озлем SARIOĞLU 1 , Кемаль АВЛАР 1 , M.Мурат ТАŞКИН 1 , Энгин ОЗАР 1 , Исмаил КАРА 1 , Чагатай КЕМЕРЛИ 1
1 Отделение неврологической хирургии, Больница психиатрических и неврологических заболеваний Бакыркёй
Дусунен Адам Журнал психиатрии и неврологических наук 1999; 1 (12): 59-61
Полный текст PDF Полный текст PDF (турецкий)Аннотация
Авторы сообщили о случае сирингогидрорниеллы без мальформации Киари, симптомами которого были сильная субокципитальная и шейная боль и сенсорные нарушения в его правой руке. Проведено сиринго-субарахноидально-перитонеальное шунтирование до коллапса кистозной полости. Обсуждаются предоперационные и послеоперационные клинические данные (как объективные, так и субъективные) и результаты МРТ шейки матки. Состояние пациента улучшилось как в неврологическом, так и в рентгенологическом отношении после операции. Этот результат показал, что сиринго-субарахриоидно-перитонеальное шунтирование эффективно в обращении вспять неврологического ухудшения у пациентов с сирингогидромиелией без мальформации Киари.
Проведено сиринго-субарахноидально-перитонеальное шунтирование до коллапса кистозной полости. Обсуждаются предоперационные и послеоперационные клинические данные (как объективные, так и субъективные) и результаты МРТ шейки матки. Состояние пациента улучшилось как в неврологическом, так и в рентгенологическом отношении после операции. Этот результат показал, что сиринго-субарахриоидно-перитонеальное шунтирование эффективно в обращении вспять неврологического ухудшения у пациентов с сирингогидромиелией без мальформации Киари.
Ключевые слова: сирингидромиелия, сиринкс, шунт, лечение.
Сиринго-субарахноидально-перитонеальное шунтирование для лечения сирингогидромиелии
Озлем SARIOĞLU 1 , Кемаль АВЛАР 1 , M.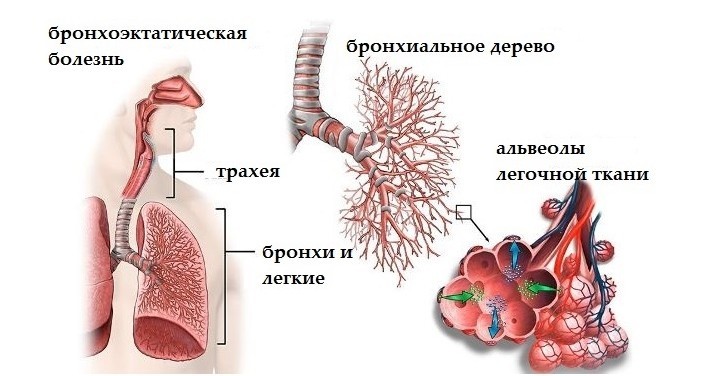 Мурат ТАКИН 1 , Энгин ОЗАР 1 , Исмаил КАРА 1 , Чагатай КЕМЕРЛИ 1
Мурат ТАКИН 1 , Энгин ОЗАР 1 , Исмаил КАРА 1 , Чагатай КЕМЕРЛИ 1
1 Bakırköy Psikiyatrik ve Nörolojik Hastalıklar Hastanesi, Nörolojik Cerrahi Kliniği
Дусунен Адам Журнал психиатрии и неврологических наук 1999; 1 (12): 59-61
Бу yazıda şiddetli suboksipital ве servikal а rı yakınmaları olan ве саğ kolunda duyu bozuklu ğu bulunan, Chiari malformasyonu ile birlikte olmayan, bir siringohidromyeli olgusu sunulmu ştur.Кистин sönmesi için hastaya siringo- subaraknoido-plevral şant uygılanmıştır. Ameliyat öncesi ve sonras ı dönemdeki objektif ve subjektif klinik bulgular ile serviko-dorsal MRI bulguları tartışılmıştır. Hasta ameliyattan sonra hem nörolojik, hem de radyolojik olarak iyileşmiştir. Bu sonuç Chiari malformasyonu bulunmayan siringohidromyeli olgularındaki nörolojik bozuklukların siringo-subaraknoido-plevral şant uygulaması ile düzeltilebilece ini göstermektedir.
Hasta ameliyattan sonra hem nörolojik, hem de radyolojik olarak iyileşmiştir. Bu sonuç Chiari malformasyonu bulunmayan siringohidromyeli olgularındaki nörolojik bozuklukların siringo-subaraknoido-plevral şant uygulaması ile düzeltilebilece ini göstermektedir.
Анахтар Келимелер: Сирингоидромьели, сиринкс, шант, тедави
Связь гипоглутатионемии со сниженной активностью Na + / K + АТФазы при диабете 2 типа и микроангиопатии
Thornalley PJ, McLellan AC, Lo TW, Benn J, Sonksen PH: Отрицательная связь между сниженной концентрацией глутатиона в эритроцитах и диабетическими осложнениями. Clin Sci 91: 575–582, 1996
PubMed CAS Google ученый
Джейн С.К., Макви Р: Влияние гликемического контроля, расы (белый по сравнению с черным) и продолжительности диабета на снижение содержания глутатиона в эритроцитах больных диабетом. Метаболизм 43: 306–309, 1994
Статья. PubMed CAS Google ученый
Dincer Y, Alademir Z, Ilkova H, Akcay T: Восприимчивость глутатиона и антиоксидантная активность, связанная с глутатионом, к перекиси водорода у пациентов с диабетом 2 типа: эффект гликемического контроля. Clin Biochem 35: 297–301, 2002
PubMed CAS Статья Google ученый
Хиль-дель Валле Л., де ла С. Милиан Л., Толедо А., Виларо Н., Тапанес Р., Отеро М. А.: Измененный окислительно-восстановительный статус у пациентов с сахарным диабетом типа I. Pharmacol Res 51: 375–380, 2005
Pharmacol Res 51: 375–380, 2005
PubMed CAS Google ученый
Ceriello A, Motz E: Является ли окислительный стресс патогенетическим механизмом, лежащим в основе инсулинорезистентности, диабета и сердечно-сосудистых заболеваний? Пересмотр гипотезы общей почвы. Артериосклер Thromb Vasc Biol 24: 816–823, 2004
PubMed CAS Google ученый
Робертсон Р.П., Хармон Дж., Тран П.О., Танака Ю., Такахаши Х .: Токсичность глюкозы в бета-клетках: диабет 2 типа, плохие радикалы и соединение глутатиона.Диабет 52: 581–587, 2003
PubMed CAS Google ученый
Рудич А., Тирош А., Поташник Р., Хеми Р., Канети Х., Башан Н.: Длительный окислительный стресс нарушает индуцированную инсулином транслокацию GLUT4 в адипоцитах 3T3-L1. Диабет 47: 1562–1569, 1998
PubMed CAS Google ученый
Конукоглу Д., Кемерли Г.Д., Сабунку Т., Хатеми Х .: Связь эритроцитов Na + / K + АТФазная активность, холестерин и оксидативный стресс у пациентов с сахарным диабетом 2 типа.Clin Invest Med 26: 279–284, 2003
PubMed CAS Google ученый
Kourie JI: Взаимодействие активных форм кислорода с механизмами переноса ионов. Am J Physiol 275: C1-24, 1998
PubMed CAS Google ученый
Дипа М., Прадипа Р., Рема М., Мохан А., Дипа Р., Шантирани С., Мохан В.: Исследование городской сельской эпидемиологии Ченнаи (CURES) — дизайн и методология исследования (городской компонент) (CURES-I) .J Assoc Physitors India 51: 863–870, 2003
PubMed CAS Google ученый
Исследовательская группа по раннему лечению диабетической ретинопатии: Оценка диабетической ретинопатии по стереоскопическим цветным фотографиям глазного дна — расширение модифицированной классификации Эйрли Хаус, отчет ETDRS 10. Офтальмология 98: 786–806, 1991
Google ученый
Рема М., Мохан В., Дипа Р., Равикумар Р.: Связь толщины интима-медиа сонных артерий и жесткости артерий с диабетической ретинопатией: исследование городской сельской эпидемиологии Ченнаи (CURES-2). Уход за диабетом 27: 1962–1967, 2004
Уход за диабетом 27: 1962–1967, 2004
PubMed Google ученый
Friedewald WT, Levy RI, Fredrickson DS: Оценка концентрации холестерина липопротеинов низкой плотности в плазме без использования препаративной ультрацентрифуги. Clin Chem 18: 499–502, 1972
PubMed CAS Google ученый
Манджунатх Г., Сарнак М.Дж., Леви А.С.: Оценка скорости клубочковой фильтрации.Что можно и чего нельзя делать при оценке функции почек. Postgrad Med 110: 55–62, 2001
PubMed CAS Статья Google ученый
Beutler E, Duran O, Duarte BMK: Улучшенный метод определения глутатиона в крови. J Lab Clin Med 51: 882–888, 1963
J Lab Clin Med 51: 882–888, 1963
Google ученый
Raccah D, Gallice P, Pouget J, Vague P: Гипотеза: низкая активность Na + / K + АТФазы мембраны красных клеток, потенциальный маркер предрасположенности к диабетической невропатии.Diabet Metab 18: 236–241, 1992
CAS Google ученый
Сампаткумар Р., Баласубраманьям М., Рема М., Премананд С., Мохан В.: Новый усовершенствованный индекс гликирования (AGI) и его связь с диабетом и микроангиопатией. Метаболизм 54: 1002–1007, 2005
Статья PubMed CAS Google ученый
Яги К. Простой флуорометрический анализ липопероксида в плазме крови.Biochem Med 15: 212–216, 1976
Статья PubMed CAS Google ученый
Adaikalakoteswari A, Balasubramanyam M, Mohan V: Укорочение теломер у пациентов с диабетом 2 типа. Diabet Med 22: 1151–1156, 2005
Статья PubMed CAS Google ученый
Хайден М.Р., Тиаги С.К.: Островковой окислительно-восстановительный стресс: множественная токсичность инсулинорезистентности, метаболического синдрома и амилоидного амилоида островков при сахарном диабете 2 типа.JOP 3: 86–108, 2002
PubMed Google ученый
Greismacher A, Kindhauser M, Andert SE, Toma C, Knoebl P, Pietschmann P, Prager R, Schnack C, Schemthaner G, Mueller MM: Повышенные уровни сывороточных веществ, реагирующих с тиобарбитуровой кислотой, при сахарном диабете. Am J Med 98: 469–474, 1995
Google ученый
Телчи А., Чакатай У., Каяли Р., Эрдоган С., Орхан Ю., Сивас А., Акчай Т.: Окислительное повреждение белков в плазме у пациентов с диабетом 2 типа.Horm Metab Res 32: 40–43, 2000
PubMed CAS Статья Google ученый
Дандона П., Сузу К., Кук С., Снайдер Б., Маковски Дж., Армстронг Д., Никотера Т.: Окислительное повреждение ДНК при сахарном диабете. Ланцет 347: 444–445, 1996
Статья PubMed CAS Google ученый
Дармаун Д., Смит С.Д., Свитен С., Сагер Б.К., Велч С., Маурас Н.: Доказательства ускоренного использования глутатиона и истощения глутатиона у подростков с плохо контролируемым диабетом 1 типа.Диабет 54: 190–196, 2005
PubMed CAS Google ученый
Сундарам Р.К., Бхаскар А., Виджаялингам С., Вишванатан М., Мохан Р., Шанмугасундарам К.Р.: Антиоксидантный статус и перекисное окисление липидов при сахарном диабете II типа с осложнениями и без них. Clin Sci 90: 255–260, 1996
PubMed CAS Google ученый
Sima AA, Sugimoto K: Экспериментальная диабетическая невропатия: обновленная информация.Диабетология 42: 773–88, 1999
Статья PubMed CAS Google ученый
Michea L, Irribarra V, Goecke IA, Marusic ET: снижение накачки Na-K, но увеличение котранспортера Na-K-2Cl в аорте крысы с индуцированным стрептозотоцином диабетом. Am J Physiol Heart Circ Physiol 280: H851 – H858, 2001
PubMed CAS Google ученый
Beutler E, Kuhl W., Sacks P: На активность натрий-калий-АТФазы влияет этническое происхождение, а не ожирение.N Engl J Med 29 (309): 756–760, 1983
Google ученый
Vague P, Dufayet D, Coste T., Moriscot C, Jannot MF, Raccah D: Ассоциация диабетической невропатии с Na + / K + полиморфизм гена АТФазы. Диабетология 40: 506–511, 1997
PubMed CAS Google ученый
Jannot MF, Raccah D, De La Tour DD, Coste T, Vague P: Генетическая и экологическая регуляция активности аденозинтрифосфатазы Na + / K + у пациентов с диабетом.Метаболизм 51: 284–291, 2002
Статья PubMed CAS Google ученый
Huschenbett J, Zaidi A, Michaelis ML: Чувствительность обменника синаптической мембраны Na + / Ca 2+ и экспрессированной изоформы NCX1 к реактивным формам кислорода. Biochim Biophys Acta 1374: 34–46, 1998
PubMed CAS Google ученый
Като К., Шао К., Элимбан В., Лукас А., Дхалла Н.С.: Механизм депрессии сердечной сарколеммы Na + / K + -АТФаза хлорноватистой кислотой. Am J Physiol Cell Physiol. 275: C826 – C831, 1998
Am J Physiol Cell Physiol. 275: C826 – C831, 1998
CAS Google ученый
Jenner AM, Ruiz JE, Dunster C, Halliwell B, Mann GE, Siow RC: Витамин C защищает от вызванного хлорноватистой кислотой истощения глутатиона и повреждения оснований ДНК и белков в гладкомышечных клетках сосудов человека. Артериосклер Thromb Vasc Biol 22: 574–580, 2002
PubMed CAS Google ученый
Ramamurthy B, Jones AD, Larsson L: Глутатион обращает вспять ранние эффекты гликирования на функцию миозина. Am J Physiol 285: C419 – C424, 2003
CAS Google ученый
Tsakiris S, Schulpis KH, Marinou K, Behrakis P: Защитный эффект l-цистеина и глутатиона на модулированный Na + , K + -АТФаза и Mg 2+ — Активность АТФазы, вызванная галактоземией in vitro.Pharmacol Res 49: 475–479, 2004
Статья PubMed CAS Google ученый
Streck EL, Zugno AI, Tagliari B, Franzon R, Wannmacher CM, Wajner M, Wyse AT: Ингибирование Na + , K + в мозге крысы, индуцированная гомоцистеином активность -АТФазы, вероятно, опосредована окислительный стресс. Neurochem Res 26: 1195–1200, 2001
Статья PubMed CAS Google ученый
Гиблин FJ: Глутатион: жизненно важный антиоксидант хрусталика. J Ocul Pharmacol Ther 16: 121–135, 2000
PubMed CAS Статья Google ученый
Sampathkumar R, Balasubramanyam M, Sudarslal S, Rema M, Mohan V, Balaram P: Повышенный уровень глутатионилированного гемоглобина (HbSSG) у субъектов диабета 2 типа с микроангиопатией. Clin Biochem (в печати), 2005
Джустарини Д., Росси Р., Милзани А., Коломбо Р., Далле-Донн I: S -глутатионилирование: от окислительно-восстановительной регуляции функций белков до заболеваний человека.J Cell Mol Med 8: 201–212, 2004
PubMed CAS Google ученый
Араи К., Магучи С., Фуджи С., Ишибаши Х., Оикава К., Танигучи Н.: Гликирование и инактивация Cu-Zn-супероксиддисмутазы человека. Идентификация сайтов гликозилирования in vitro. J Biol Chem 262: 16969–16972, 1987
PubMed CAS Google ученый
Стивенс A: Вклад гликирования в образование катаракты при диабете.J Am Optom Assoc 69: 519–530, 1998
PubMed CAS Google ученый
Wada R, Nishizawa Y, Yagihashi N, Takeuchi M, Ishikawa Y, Yasumura K, Nakano M, Yagihashi S: Эффекты OPB-9195, антигликирующего агента, на экспериментальную диабетическую невропатию. Eur J Clin Invest 31: 513–520, 2001
Статья PubMed CAS Google ученый
Gopaul NK, Manraj MD, Hebe A, Lee Kwai Yan S, Johnston A, Carrier MJ, Anggard EE: Окислительный стресс может предшествовать эндотелиальной дисфункции и инсулинорезистентности у индийских маврикийцев с нарушенным метаболизмом глюкозы.Диабетология 44: 706–712, 2001
Статья PubMed CAS Google ученый
Balasubramanyam M, Koteswari A, Samapthkumar R, Premanand C, Mohan V: Скрининг оксидантного стресса у населения в целом: Повышенное перекисное окисление липидов в естественной истории диабета. Диаб Метаб 29: 4S167, 2003
Google ученый
Менон В., Рам М., Дорн Дж., Армстронг Д., Мути П., Фройденхайм Дж. Л., Браун Р., Шунеманн Х., Тревизан М.: Окислительный стресс и уровни глюкозы в популяционной выборке.Diabet Med 21: 1346–1352, 2004
Статья PubMed CAS Google ученый
Лю Б., Бхат М., Падиваль А.К., Смит Д.Г., Нагарадж Р.Х .: Влияние дикарбонильной модификации фибронектина на перициты капилляров сетчатки. Invest Ophthalmol Vis Sci 45: 1983–1995, 2004
Статья PubMed Google ученый
Miwa K, Nakamura J, Hamada Y, Naruse K, Nakashima E, Kato K, Kasuya Y, Yasuda Y, Kamiya H, Hotta N: роль пути полиола в индуцированном глюкозой апоптозе культивированных перицитов сетчатки .Diabetes Res Clin Pract 60: 1–9, 2003
Статья PubMed CAS Google ученый
Cicik E, Tekin H, Akar S, Ekmekci OB, Donma O, Koldas L, Ozkan S: статус интерлейкина-8, оксида азота и глутатиона при пролиферативной витреоретинопатии и пролиферативной диабетической ретинопатии. Ophthalmic Res 35: 251–255, 2003
Статья PubMed CAS Google ученый
Craghill J, Cronshaw AD, Harding JJ: Идентификация места реакции образования смешанного дисульфида глутатиона на гамма-S-кристаллине в хрусталике человека. Biochem J 379: 595–600, 2004
Biochem J 379: 595–600, 2004
Статья PubMed CAS Google ученый
Ceballos-Picot I, Witko-Sarsat V, Merad-Boudia M, Nguyen AT, Thevenin M, Jaudon MC, Zingraff J, Verger C, Jungers P, Descamps-Latscha B: антиоксидантная система глутатиона в качестве маркера окислительного стресса при хронической почечной недостаточности.Free Radic Biol Med 21: 845–853, 1996
Статья PubMed CAS Google ученый
Locatelli F, Canaud B, Eckardt KU, Stenvinkel P, Wanner C, Zoccali C: Окислительный стресс при терминальной стадии почечной недостаточности: возникающая угроза исходу лечения пациента. Трансплантат Nephrol Dial 18: 1272–1280, 2003
PubMed CAS Google ученый
Santangelo F, Witko-Sarsat V, Drueke T, Descamps-Latscha B: Восстановление глутатиона как терапевтическая стратегия при хронической болезни почек.Трансплантат нефрола Dial 19: 1951–1955, 2004
PubMed CAS Google ученый
Мохан В. Почему индийцы более склонны к диабету? J Assoc Physitors India 52: 468–474, 2004
PubMed CAS Google ученый
Мисра А., Викрам Н.К .: Синдром инсулинорезистентности (метаболический синдром) и азиатские индейцы. Curr Sci 83: 1483–1496, 2002
CAS Google ученый

Мохан В., Дипа Р., Прадипа Р.: Связь низкого уровня адипонектина с метаболическим синдромом — исследование городской сельской эпидемиологии Ченнаи (CURES-4). Метаболизм 54: 476–481, 2005
Статья PubMed CAS Google ученый
% PDF-1.4
%
403 0 объект
>
endobj
xref
403 170
0000000016 00000 н.
0000004688 00000 п.
0000004924 00000 н.
0000005053 00000 н.
0000005111 00000 п.
0000005644 00000 н.
0000005859 00000 н.
0000006008 00000 н.
0000006223 00000 п.
0000006371 00000 п.
0000006586 00000 н.
0000006736 00000 н.
0000006909 00000 н.
0000007059 00000 н.
0000007232 00000 н.
0000007382 00000 н.
0000007555 00000 н.
0000007705 00000 н.
0000007877 00000 н.
0000008027 00000 н.
0000008199 00000 н.
0000008345 00000 п.
0000008518 00000 н.
0000008664 00000 н.
0000008837 00000 н.
0000008983 00000 п.
0000009156 00000 н.
0000009300 00000 н.
0000009473 00000 н.
0000009619 00000 н.
0000009792 00000 н. 0000009936 00000 н.
0000010109 00000 п.
0000010254 00000 п.
0000010427 00000 п.
0000010572 00000 п.
0000010745 00000 п.
0000010889 00000 п.
0000011062 00000 п.
0000011208 00000 п.
0000011381 00000 п.
0000011525 00000 п.
0000011697 00000 п.
0000011843 00000 п.
0000012015 00000 п.
0000012161 00000 п.
0000012333 00000 п.
0000012483 00000 п.
0000012655 00000 п.
0000012805 00000 п.
0000012977 00000 п.
0000013123 00000 п.
0000013294 00000 п.
0000013441 00000 п.
0000013612 00000 п.
0000013759 00000 п.
0000013932 00000 п.
0000014079 00000 п.
0000014252 00000 п.
0000014400 00000 п.
0000014573 00000 п.
0000014719 00000 п.
0000014859 00000 п.
0000015005 00000 п.
0000015145 00000 п.
0000015291 00000 п.
0000015431 00000 п.
0000015579 00000 п.
0000015719 00000 п.
0000015867 00000 п.
0000016005 00000 п.
0000016155 00000 п.
0000016295 00000 п.
0000016445 00000 п.
0000016585 00000 п.
0000016735 00000 п.
0000016874 00000 п.
0000017022 00000 п.
0000017202 00000 п.
0000009936 00000 н.
0000010109 00000 п.
0000010254 00000 п.
0000010427 00000 п.
0000010572 00000 п.
0000010745 00000 п.
0000010889 00000 п.
0000011062 00000 п.
0000011208 00000 п.
0000011381 00000 п.
0000011525 00000 п.
0000011697 00000 п.
0000011843 00000 п.
0000012015 00000 п.
0000012161 00000 п.
0000012333 00000 п.
0000012483 00000 п.
0000012655 00000 п.
0000012805 00000 п.
0000012977 00000 п.
0000013123 00000 п.
0000013294 00000 п.
0000013441 00000 п.
0000013612 00000 п.
0000013759 00000 п.
0000013932 00000 п.
0000014079 00000 п.
0000014252 00000 п.
0000014400 00000 п.
0000014573 00000 п.
0000014719 00000 п.
0000014859 00000 п.
0000015005 00000 п.
0000015145 00000 п.
0000015291 00000 п.
0000015431 00000 п.
0000015579 00000 п.
0000015719 00000 п.
0000015867 00000 п.
0000016005 00000 п.
0000016155 00000 п.
0000016295 00000 п.
0000016445 00000 п.
0000016585 00000 п.
0000016735 00000 п.
0000016874 00000 п.
0000017022 00000 п.
0000017202 00000 п. 0000017350 00000 п.
0000017804 00000 п.
0000018320 00000 п.
0000018744 00000 п.
0000018781 00000 п.
0000018884 00000 п.
0000019268 00000 п.
0000019622 00000 п.
0000021966 00000 п.
0000024086 00000 п.
0000024494 00000 п.
0000024862 00000 п.
0000025034 00000 п.
0000025313 00000 п.
0000025371 00000 п.
0000025823 00000 п.
0000026022 00000 п.
0000028305 00000 п.
0000028489 00000 п.
0000028789 00000 п.
0000029537 00000 п.
0000029786 00000 п.
0000030013 00000 п.
0000030537 00000 п.
0000032044 00000 п.
0000032222 00000 п.
0000032291 00000 п.
0000032845 00000 п.
0000033047 00000 п.
0000033461 00000 п.
0000035686 00000 п.
0000035848 00000 п.
0000038088 00000 п.
0000040441 00000 п.
0000042223 00000 п.
0000042252 00000 п.
0000106720 00000 н.
0000110050 00000 н.
0000116122 00000 н.
0000116592 00000 н.
0000118539 00000 н.
0000119862 00000 н.
0000123337 00000 н.
0000123667 00000 н.
0000123864 00000 н.
0000124407 00000 н.
0000124534 00000 н.
0000146812 00000 н.
0000017350 00000 п.
0000017804 00000 п.
0000018320 00000 п.
0000018744 00000 п.
0000018781 00000 п.
0000018884 00000 п.
0000019268 00000 п.
0000019622 00000 п.
0000021966 00000 п.
0000024086 00000 п.
0000024494 00000 п.
0000024862 00000 п.
0000025034 00000 п.
0000025313 00000 п.
0000025371 00000 п.
0000025823 00000 п.
0000026022 00000 п.
0000028305 00000 п.
0000028489 00000 п.
0000028789 00000 п.
0000029537 00000 п.
0000029786 00000 п.
0000030013 00000 п.
0000030537 00000 п.
0000032044 00000 п.
0000032222 00000 п.
0000032291 00000 п.
0000032845 00000 п.
0000033047 00000 п.
0000033461 00000 п.
0000035686 00000 п.
0000035848 00000 п.
0000038088 00000 п.
0000040441 00000 п.
0000042223 00000 п.
0000042252 00000 п.
0000106720 00000 н.
0000110050 00000 н.
0000116122 00000 н.
0000116592 00000 н.
0000118539 00000 н.
0000119862 00000 н.
0000123337 00000 н.
0000123667 00000 н.
0000123864 00000 н.
0000124407 00000 н.
0000124534 00000 н.
0000146812 00000 н. 0000146851 00000 н.
0000147398 00000 н.
0000147532 00000 н.
0000169810 00000 н.
0000169849 00000 н.
0000170347 00000 п.
0000170444 00000 н.
0000170979 00000 н.
0000171100 00000 н.
0000184595 00000 н.
0000184634 00000 н.
0000207880 00000 н.
0000207919 00000 н.
0000208466 00000 н.
0000208600 00000 н.
0000230878 00000 н.
0000230917 00000 п.
0000231464 00000 н.
0000231598 00000 н.
0000253876 00000 н.
0000253915 00000 н.
0000254462 00000 н.
0000254596 00000 н.
0000276874 00000 н.
0000276913 00000 н.
0000277460 00000 н.
0000277594 00000 н.
0000278175 00000 н.
0000278228 00000 н.
0000278664 00000 н.
0000289391 00000 п.
0000289463 00000 н.
0000289760 00000 н.
0000289911 00000 н.
00002 00000 н.
00002 00000 н.
00002 00000 н.
00002
0000146851 00000 н.
0000147398 00000 н.
0000147532 00000 н.
0000169810 00000 н.
0000169849 00000 н.
0000170347 00000 п.
0000170444 00000 н.
0000170979 00000 н.
0000171100 00000 н.
0000184595 00000 н.
0000184634 00000 н.
0000207880 00000 н.
0000207919 00000 н.
0000208466 00000 н.
0000208600 00000 н.
0000230878 00000 н.
0000230917 00000 п.
0000231464 00000 н.
0000231598 00000 н.
0000253876 00000 н.
0000253915 00000 н.
0000254462 00000 н.
0000254596 00000 н.
0000276874 00000 н.
0000276913 00000 н.
0000277460 00000 н.
0000277594 00000 н.
0000278175 00000 н.
0000278228 00000 н.
0000278664 00000 н.
0000289391 00000 п.
0000289463 00000 н.
0000289760 00000 н.
0000289911 00000 н.
00002 00000 н.
00002 00000 н.
00002 00000 н.
00002
00000 п. 00002
00000 н. 0000290822 00000 н. 0000291222 00000 н. 0000291553 00000 н. 0000003696 00000 н. трейлер ] / Назад 886846 >> startxref 0 %% EOF 572 0 объект > поток hb«`g`a«H, cb @.