ДИСМЕТАБОЛИЧЕСКАЯ НЕФРОПАТИЯ У ДЕТЕЙ | ГУЗ «Плавская ЦРБ имени С.С. Гагарина»
Дисметаболическая нефропатия — это группа почечных заболеваний, развитие которых связано с нарушением обмена веществ.
В последнее время у детей все чаще встречаются нарушения обмена, которые приводят к повышенному выведению с мочой различных солей — оксалатов, уратов, фосфатов и др. Этому способствуют загрязнение окружающей среды, употребление в пищу продуктов с химическими добавками, а также наследственные факторы. Дети с обменной нефропатией имеют повышенный риск образования мочевых камней.
При прогрессировании дизметаболической нефропатии могут возникнуть воспаление почек (нефрит, пиелонефрит), мочекаменная болезнь, цистит.
Дисметаболическая нефропатия проявляется общими симптомами нарушения обмена веществ и изменениями в моче. Изменения в моче проявляются в виде примеси солей (оксалаты, ураты, фосфаты и др.), эритроцитов, белка, лейкоцитов.
Причины дисметаболической нефропатии
Причинами дисметаболической нефропатии могут быть:
- различные нарушения обмена веществ (наследственные или приобретенные нарушения обмена кальция, щавелевой кислоты, мочевой кислоты, цистина, фосфатов)
- инфекции мочевыводящих путей
- застой мочи (например, при несвоевременном опорожнении мочевого пузыря, сужении мочевыводящих путей и др.
 )
)
- эндокринные заболевания
- заболевания желудочно-кишечного тракта (глисты, лямблиоз)
- прием некоторых лекарственных препаратов
- лучевая терапия
Чаще всего дисметаболическая нефропатия встречается в виде оксалурии (выделение с мочой оксалатов) и уратурии (выделение с мочой уратов)
Причины оксалурии:
- наследственные дефекты некоторых ферментов
- повышенное поступление оксалатов с пищей
- воспалительные заболевания кишечника
- перенесенные операции на кишечнике
- болезнь Крона
- язвенный колит
- дефицит витамина В6
- избыточное потребление аскорбиновой кислоты
Причины уратурии:
- наследственные причины (дефект почечных канальцев, усиленные обмен пуринов)
- повышенное потребление мясных продуктов
- лечение химиопрепаратами
- длительный прием фуросемида
Проявления дисметаболической нефропатии
У детей до 5 лет не имеет специфических проявлений. У детей старшего возраста и взрослых: повышенная утомляемость, боли в животе, характерна задержка жидкости в организме, что проявляется отечностью век, уменьшением количества выделяемой мочи, колющими болями в пояснице. Часто наблюдаются зуд, боль и покраснение в области наружных половых органов. Моча мутная, с осадком, на стенках горшка образуется трудно смываемый налет. Для уточнения диагноза врач назначает исследование суточного выделения солей с мочой.
У детей старшего возраста и взрослых: повышенная утомляемость, боли в животе, характерна задержка жидкости в организме, что проявляется отечностью век, уменьшением количества выделяемой мочи, колющими болями в пояснице. Часто наблюдаются зуд, боль и покраснение в области наружных половых органов. Моча мутная, с осадком, на стенках горшка образуется трудно смываемый налет. Для уточнения диагноза врач назначает исследование суточного выделения солей с мочой.
Мочу собирают следующим образом. Первое утреннее мочеиспускание не учитывают. Все последующие порции мочи, включая утреннюю порцию следующего дня, сливают в одну банку, которую хранят в прохладном месте. Утром измеряют общее суточное количество мочи, хорошо перемешивают, затем отливают 200 мл для анализа.
При лечении обменной нефропатии, помимо приема лекарственных препаратов, требуется соблюдение диеты, особенности которой зависят от характера солей. Рекомендуется значительно увеличить объем потребляемой жидкости. В качестве питья можно использовать отвары сухофруктов, отвар овса — 2 столовых ложки неочищенного овса нужно вымыть, залить стаканом воды и кипятить на медленном огне в течение 10 минут, затем настаивать в термосе 4 часа, процедить и пить, в зависимости от возраста, до одного стакана в день.
Из минеральных вод при оксалатах лучше использовать слабощелочные: боржоми, славяновскую, смирновскую. При уратных солях — джермук, боржоми, исти-су. Если в анализах мочи определяют фосфаты, щелочные минеральные воды противопоказаны.
Диета при лечении оксалатурии
Разрешаются:
Брюссельская, цветная, белокочанная капуста, абрикосы, бананы, бахчевые, груши, тыква, огурцы, горох, все виды круп, белый хлеб, растительное масло. Периодически — картофельно-капустная диета. Картофельно-капустная диета.
Ограничиваются:
Морковь, зеленая фасоль, цикорий, лук, помидоры, крепкий чай, говядина, курица, заливное, печень, треска, смородина, антоновские яблоки, редис.
Исключаются:
Шоколад, свекла, сельдерей, шпинат, щавель, ревень, петрушка, экстрактивные вещества (бульоны).
Диета при лечении уратурии
Разрешаются:
Молочные продукты в первую половину дня. Картофельно-капустная диета. Цветная и белокочанная капуста, крупы (гречневая, овсяная, пшенная, рис), фрукты, курага, чернослив, морская капуста, пшеничные отруби, сливочное и растительное масло, хлеб пшеничный, ржаной из муки грубого помола. Нежирное мясо и рыба -3 раза в неделю по 150 г. старшим детям в отварном виде в первую половину дня.
Картофельно-капустная диета. Цветная и белокочанная капуста, крупы (гречневая, овсяная, пшенная, рис), фрукты, курага, чернослив, морская капуста, пшеничные отруби, сливочное и растительное масло, хлеб пшеничный, ржаной из муки грубого помола. Нежирное мясо и рыба -3 раза в неделю по 150 г. старшим детям в отварном виде в первую половину дня.
Ограничиваются:
Горох, бобы, говядина, курица, кролик.
Исключаются:
Крепкий чай, какао, кофе, шоколад, сардины, печень животных, чечевица, свинина, субпродукты, жирная рыба, мясные и рыбные бульоны.
Диета при лечении фосфатурии
Разрешаются:
Масло сливочное, растительное, рис, манная крупа, макароны, мука высшего и первого сорта, картофель, капуста, морковь, огурцы, свекла, томаты, абрикосы, арбуз, груши, сливы, клубника, вишня.
Ограничиваются:
Говядина, свинина, колбаса вареная, яйцо, крупа кукурузная, мука второго сорта, молоко, сметана.
Исключаются:
Сыр, творог, печень говяжья, мясо куриное, рыба, икра, фасоль, горох, шоколад, крупа овсяная, перловая, гречневая, пшенная.
В случае сочетанных метаболических нарушений диета назначается индивидуально.
Дисметаболические нефропатии в педиатрической практике | #08/10
Синдром обменной нефропатии является одной из актуальных и спорных проблем современной педиатрии. Причем сегодня, по статистическим данным, отмечается повсеместный рост обменных нарушений в почках. Так, обменная нефропатия составляет от 27% до 64% в структуре заболеваемости мочевыделительной системы у детей, а в повседневной практике врача-педиатра синдром обменных нарушений в моче отмечается практически у каждого третьего больного. Необходимо отметить, что дисметаболическая или обменная нефропатия не является отдельной нозологической единицей, а по своей сути — это синдромальное состояние и включает в себя большую группу нефропатий различной этиологии и патогенеза (Е79 — нарушение обмена пуринов, Е74.
Хорошо известно, что моча в норме представляет собой перенасыщенный солевой раствор, находящийся в состоянии динамического равновесия за счет веществ, которые способствуют растворению или дисперсии составных частей мочи. Процесс образования кристаллов в мочевых путях представляет процесс, в основе которого лежат нарушения коллоидного равновесия в тканях организма и в почечной паренхиме. То есть можно говорить о нарушении равновесия между повреждающими (предрасполагающими) и защитными факторами.
Предрасполагающие факторы делятся на две большие группы — экзогенные и эндогенные. К экзогенным относятся: климатические (сухой и жаркий климат), особенности состава питьевой воды (высокая жесткость), уровень солнечной радиации, содержание микро- и макроэлементов во внешней среде (недостаток магния, йода, избыток кальция, стронция), особенности пищевого режима (дефицит витаминов А, В6, РР, гипервитаминоз D, избыточное употребление продуктов, богатых белком, пуринами, щавелевой кислотой, недостаточное употребление продуктов, содержащих ненасыщенные жирные кислоты), недостаточность питьевого режима, частое посещение сауны, прием алкоголя, лекарственные воздействия (сульфаниламиды, диуретики, цитостатики).
Защитные факторы
К защитным факторам относятся вещества, которые удерживают соли в растворенном состоянии, зачастую они называются защитными коллоидами. Эти вещества частично представлены в плазме крови, фильтруются в первичную и окончательную мочу, секретируются канальциевым эпителием. Кроме того, размеры коллоидных частиц мочи определяются биологически активными веществами — трипсином, пепсином, катепсинами и другими. Их действие опосредуется через рН-среды, влиянием активаторов и ингибиторов. Таким образом, при недостаточности факторов защиты, превалировании предрасполагающих факторов и на фоне разрешающего воздействия (инфекции, травмы, прием лекарств, дефицит жидкости и т. п.) начинается процесс кристаллообразования и как крайняя степень выраженности — процесс камнеобразования.
Их действие опосредуется через рН-среды, влиянием активаторов и ингибиторов. Таким образом, при недостаточности факторов защиты, превалировании предрасполагающих факторов и на фоне разрешающего воздействия (инфекции, травмы, прием лекарств, дефицит жидкости и т. п.) начинается процесс кристаллообразования и как крайняя степень выраженности — процесс камнеобразования.
Типичными морфологическими изменениями при обменных нефропатиях является отложение кристаллов в собирательных трубочках, канальцах и интерстиции почек. В ответ на отложение кристаллов первоначально развивается неспецифический воспалительный процесс, в последующем возможно развитие иммунокомплексного воспалительного процесса с вторичным поражением различных отделов нефрона. В зависимости от уровня поражения нефрона обменная нефропатия может протекать по следующим клиническим вариантам: острая почечная недостаточность, тубуло-интерстициальный нефрит, уролитиаз, мочекислый диатез, бессимптомное течение.
Вне зависимости от варианта клинического течения длительное существование дисметаболических нарушений приводит к фиброзу интерстиция, снижению канальциевых функций и, как следствие этого, к нарушению концентрационной функции почек.
Чаще всего в клинической практике встречаются дисметаболические нефропатии, связанные с нарушением обмена оксалатов (солей щавелевой кислоты) и уратов. Все варианты обменных нефропатий вне зависимости от клинического варианта течения можно разделить на две большие группы: связанные с наследственным или врожденным нарушением обмена веществ и вторичные дисметаболические нефропатии.
Первичная оксалурия встречается редко. Педиатры имеют дело со вторичной оксалурией. Большинство оксалатов, выводимых с мочой, образуются в процессе обмена веществ из аминокислот — серина, глицина, оксипролина и частично из аскорбиновой кислоты. Незначительное количество поступает из кишечника при приеме с пищей оксалогенных продуктов. В обычной диете содержится от 97 до 930 мг оксалатов (в зависимости от времени года), но только от 2% до 5% из них всасываются в кишечнике. В физиологических условиях 10% экскретируемых с мочой оксалатов образуются из аскорбиновой кислоты и 40% из глицина. Поступление глицина в организм обусловлено его содержанием в пищевых продуктах, но возможно и ятрогенное развитие оксалурии при назначении глицина. Глицин® — лекарственный препарат на основе аминокислоты глицина, применяется в неврологической практике с целью улучшения обменных процессов в головном мозге. Причем в аннотации к препарату указано, что он не обладает побочными действиями, что не противоречит истине, но, к сожалению, аннотация составлена без учета метаболизма препарата.
В обычной диете содержится от 97 до 930 мг оксалатов (в зависимости от времени года), но только от 2% до 5% из них всасываются в кишечнике. В физиологических условиях 10% экскретируемых с мочой оксалатов образуются из аскорбиновой кислоты и 40% из глицина. Поступление глицина в организм обусловлено его содержанием в пищевых продуктах, но возможно и ятрогенное развитие оксалурии при назначении глицина. Глицин® — лекарственный препарат на основе аминокислоты глицина, применяется в неврологической практике с целью улучшения обменных процессов в головном мозге. Причем в аннотации к препарату указано, что он не обладает побочными действиями, что не противоречит истине, но, к сожалению, аннотация составлена без учета метаболизма препарата.
Возможно локальное образование оксалатов в почках в связи с разрушением фосфолипидов клеточных мембран, вследствие чего образуются предшественники оксалатов, с которыми кальций образует нерастворимые соли. Причинами распада мембран являются бактериальные фосфолипазы при воспалительных процессах в почках, воздействие мембранотоксических соединений, например сульфаниламидных препаратов, ишемия почек и др. , при этом морфологически выявляют выраженную деструкцию щеточных каемок проксимальных и дистальных канальцев, заполнение просветов канальцев кристаллами, выраженную лимфогистиоцитарную инфильтрацию интерстиция. В последние годы получены интересные данные о том, что при оксалуриях снижено число вставочных клеток в собирательных трубочках, секретирующих Н+-ионы, т. е. оксалурия может быть отнесена к тубулопатиям — дистальному почечному ацидозу.
, при этом морфологически выявляют выраженную деструкцию щеточных каемок проксимальных и дистальных канальцев, заполнение просветов канальцев кристаллами, выраженную лимфогистиоцитарную инфильтрацию интерстиция. В последние годы получены интересные данные о том, что при оксалуриях снижено число вставочных клеток в собирательных трубочках, секретирующих Н+-ионы, т. е. оксалурия может быть отнесена к тубулопатиям — дистальному почечному ацидозу.
Специфических симптомов оксалатной нефропатии нет. Чаще всего выявляются рецидивирующие боли в животе, при мочеиспускании может возникать чувство жжения, иногда развивается воспаление гениталий за счет постоянного раздражения кожи и слизистой, возможно появление других дизурических расстройств. При визуальной оценке мочи отмечается ее насыщенный характер, возможно спонтанное образование осадка. Ведущим признаком патологии почек является мочевой синдром; повышение удельного веса мочи, микрогематурия, протеинурия, лейкоцитурия, оксалурия.
У детей с оксалурией отмечается снижение антикристаллообразующей способности мочи. В большинстве случаев оксалатная нефропатия обнаруживается случайно, иногда на фоне провоцирующих интеркуррентных заболеваний. Дебют заболевания приходится на младший возраст — 1–6 лет, а обострения чаще отмечаются в периоды интенсивного роста 7–8 лет и 10–14 лет.
Первичная урикозурия. К первичной гиперурикемической нефропатии относится подагра. Распространенность гиперурикемии колеблется от 3,3% в Англии до 40% в Новой Зеландии, встречаясь в среднем у 8–13% населения. Заболевание наследуется аутосомно-доминантным путем. В основе развития болезни лежит генетический дефект, приводящий к изменению активности ряда ферментов (глюкозо-6-фосфатазы, частичный дефицит гипоксантин-гуанинфосфорибозилтрансферазы) и повышение каталитической активности фосфорибозилпирофосфатсинтетазы, что приводит к повышению эндогенной продукции пуриновых соединений. В условиях гиперпродукции мочевой кислоты гиперурикемии предшествует повышенная экскреция мочевой кислоты (гиперуратурия). У взрослого человека в нормальных условиях через клубочки почек за сутки фильтруется 5–10 г мочевой кислоты, из которых около 1 г реабсорбируется, а остальное выделяется с мочой. При нарушении обмена количество профильтрованной и выделенной мочевой кислоты увеличивается в 3–4 раза. До 5–6% уратов в организме могут быть связаны с белками плазмы, т. е. не все ураты способны свободно фильтроваться в клубочках, при подагре значительно возрастает количество уратов, прочно связанных с белком.
У взрослого человека в нормальных условиях через клубочки почек за сутки фильтруется 5–10 г мочевой кислоты, из которых около 1 г реабсорбируется, а остальное выделяется с мочой. При нарушении обмена количество профильтрованной и выделенной мочевой кислоты увеличивается в 3–4 раза. До 5–6% уратов в организме могут быть связаны с белками плазмы, т. е. не все ураты способны свободно фильтроваться в клубочках, при подагре значительно возрастает количество уратов, прочно связанных с белком.
Подагру считают полиорганным заболеванием, что подтверждается поражением не только почек, но и нервной системы, сердца, практически постоянно подагре сопутствуют ожирение, артериальная гипертензия, мигрень, суставной синдром, аллергия (бронхиальная астма, крапивница, нейродермит и др.). По данным эпидемиологических исследований гиперурикемия является фактором риска ишемической болезни сердца (ИБС), инфаркта, диабета, мочекаменной болезни. Считается, что подагрой болеют после 40 лет, однако трудно себе представить на протяжении столь длительного времени совершенно здорового человека с наследственным дефектом ферментных систем. Одним из первых проявлений подагры в детском возрасте и является дисметаболическая урикозурическая нефропатия.
Одним из первых проявлений подагры в детском возрасте и является дисметаболическая урикозурическая нефропатия.
Вторичная урикозурическая нефропатия. Повышение концентрации мочевой кислоты может отмечаться при ряде заболеваний, что позволяет говорить о вторичном характере процесса. Это заболевания крови — гемолитические анемии, лейкозы, новообразования, гипопаратиреоз, лекарственные воздействия; прием цитостатиков, сульфаниламидных препаратов, глюкокортикоидов, антибиотиков широкого спектра действия. Специфических отличий в клинической симптоматике и характере мочевого синдрома, за исключением кристаллурии, вторичная оксалурическая и урикозурические нефропатии практически не имеют.
Вне зависимости от механизма образования, вида кристаллурии, повышенное содержание кристаллов в моче на фоне нарушения коллоидного равновесия мочи приводит к отложению кристаллов в канальцах, собирательных трубочках почек с последующим нарушением пассажа мочи. Тем самым создаются условия для присоединения инфекции и развития пиелонефрита, тубулоинтерстициального нефрита, мочекаменной болезни. Итак, диагностика обменных нефропатий базируется на анализе: генеалогического анамнеза, учете факторов риска, жалобах пациента, клинической симптоматике, характерных изменениях в анализах мочи, характеристике салуреза (в норме за сутки выделяется с мочой до 40 мг оксалатов, в детской практике обязателен пересчет на единицу веса — не более 1 мг/кг/сут, уратов 5,5–6,0 ммоль/сут, не более 0,1 ммоль/кг/сут), определении уровня мочевой кислоты в крови, данных ультразвукового исследования почек — гиперэхогенные включения в чашечно-лоханочный комплекс, обызвествление кончиков пирамидок, в тяжелых случаях обызвествление всех пирамидок, данных рентгенологического исследования почек — выявление конкрементов, врожденных пороков развития. Нужно отметить, что диагноз обменной нефропатии ставится только на основании сочетания клинических и лабораторных данных. Постановка диагноза обменной нефропатии только по изолированным лабораторно-инструментальным признакам является ошибочной и приводит к нерациональной терапии и ограничению жизнедеятельности детей и подростков.
Тем самым создаются условия для присоединения инфекции и развития пиелонефрита, тубулоинтерстициального нефрита, мочекаменной болезни. Итак, диагностика обменных нефропатий базируется на анализе: генеалогического анамнеза, учете факторов риска, жалобах пациента, клинической симптоматике, характерных изменениях в анализах мочи, характеристике салуреза (в норме за сутки выделяется с мочой до 40 мг оксалатов, в детской практике обязателен пересчет на единицу веса — не более 1 мг/кг/сут, уратов 5,5–6,0 ммоль/сут, не более 0,1 ммоль/кг/сут), определении уровня мочевой кислоты в крови, данных ультразвукового исследования почек — гиперэхогенные включения в чашечно-лоханочный комплекс, обызвествление кончиков пирамидок, в тяжелых случаях обызвествление всех пирамидок, данных рентгенологического исследования почек — выявление конкрементов, врожденных пороков развития. Нужно отметить, что диагноз обменной нефропатии ставится только на основании сочетания клинических и лабораторных данных. Постановка диагноза обменной нефропатии только по изолированным лабораторно-инструментальным признакам является ошибочной и приводит к нерациональной терапии и ограничению жизнедеятельности детей и подростков.
Лечение
Тактика лечения зависит от варианта клинического течения и вида кристаллурии. В тяжелой форме, с развитием острой почечной недостаточности (ОПН), тубуло-интерстициального нефрита 2–3 степени активности, дисметаболическая нефропатия встречается редко, как правило, в случаях первичных врожденных нарушений обмена веществ, подобные больные госпитализируются в специализированное нефрологическое отделение. При среднетяжелом течении заболевания пациенты могут направляться как в специализированное нефрологическое отделение, так и получать лечение в условиях соматического стационара. В остальных случаях дисметаболической нефропатии с оксалурией и/или уратурией, протекающей с минимальными клинико-лабораторными изменениями, лечение проводится амбулаторно.
Основой лечения любой формы дисметаболической нефропатии является обеспечение дополнительной водной нагрузки, до 500–1000 мл по отношению к возрастной потребности. Так, например, средняя физиологическая потребность детей в воде в зависимости от возраста следующая: 1–2 года — 1300–1500 мл, 4–6 лет 1800–2000, от 10 лет и старше 2000–2500 мл в день. Необходимо понимать, что жидкость ребенок и взрослый человек получает не только с питьем (чай, соки, супы и т. д.), но и со всеми продуктами питания. Нужно отметить, что ребенок первого и второго года жизни получает достаточное количество жидкости за счет контроля со стороны педиатров и родителей за объемом питания. К сожалению, дети старшего возраста при превалирующем нерегулярном питании вместе с продуктами получает в среднем за сутки 1500–1700 мл воды, что приводит к нарушению обменных процессов на уровне всего организма.
Так, например, средняя физиологическая потребность детей в воде в зависимости от возраста следующая: 1–2 года — 1300–1500 мл, 4–6 лет 1800–2000, от 10 лет и старше 2000–2500 мл в день. Необходимо понимать, что жидкость ребенок и взрослый человек получает не только с питьем (чай, соки, супы и т. д.), но и со всеми продуктами питания. Нужно отметить, что ребенок первого и второго года жизни получает достаточное количество жидкости за счет контроля со стороны педиатров и родителей за объемом питания. К сожалению, дети старшего возраста при превалирующем нерегулярном питании вместе с продуктами получает в среднем за сутки 1500–1700 мл воды, что приводит к нарушению обменных процессов на уровне всего организма.
Другим базисным компонентом терапии является диетическая коррекция. При оксалурии исключаются из питания продукты с высоким и средним содержанием щавелевой кислоты. Продукты с высоким содержанием щавелевой кислоты (от 10 до 1 г/кг веса продукта): какао, шоколад, свекла, сельдерей, шпинат, щавель, петрушка, ревень. Продукты со средним содержанием щавелевой кислоты (от 1,0 до 0,3 г/кг веса продукта): морковь, цикорий, зеленая фасоль, лук, помидоры, чай. Разрешаются продуты со средним и низким содержанием щавелевой кислоты: белокочанная капуста, абрикосы, бананы, картофель, грибы, баклажаны, кабачки, горох, огурцы, тыква. Ограничиваются продукты, богатые витамином С: шиповник, перец сладкий, смородина, облепиха, капуста брюссельская, цветная, рябина, апельсины. При построении диеты необходимо помнить, что аскорбиновая кислота в человеческом организме не синтезируется и является жизненно необходимым элементом питания, поэтому нельзя полностью элиминировать продукты, содержащие витамин С, из рациона питания.
Продукты со средним содержанием щавелевой кислоты (от 1,0 до 0,3 г/кг веса продукта): морковь, цикорий, зеленая фасоль, лук, помидоры, чай. Разрешаются продуты со средним и низким содержанием щавелевой кислоты: белокочанная капуста, абрикосы, бананы, картофель, грибы, баклажаны, кабачки, горох, огурцы, тыква. Ограничиваются продукты, богатые витамином С: шиповник, перец сладкий, смородина, облепиха, капуста брюссельская, цветная, рябина, апельсины. При построении диеты необходимо помнить, что аскорбиновая кислота в человеческом организме не синтезируется и является жизненно необходимым элементом питания, поэтому нельзя полностью элиминировать продукты, содержащие витамин С, из рациона питания.
На фоне диетических мероприятий экскреция оксалатов с мочой уменьшается на 40% и более. Экскреция оксалатов может быть уменьшена в результате изменения метаболизма глицина при введении в организм бензоата натрия, который блокирует эндогенный синтез оксалатов из глицина, то есть при введении в рацион (дополнительное питье) клюквы и брусники. Уменьшение выделения оксалатов на фоне дачи бензоата натрия происходит благодаря превращению глицина в гиппуровую кислоту.
Уменьшение выделения оксалатов на фоне дачи бензоата натрия происходит благодаря превращению глицина в гиппуровую кислоту.
При урикозурических нефропатиях рекомендована диета с ограничением пуриновых веществ. Продукты с высоким содержанием пуринов: сардины, сельдь, скумбрия, субпродукты. Среднее содержание пуринов: чечевица, говядина, свинина, кролик, речная и озерная рыба.
С учетом того, что кристаллы оксалатов и уратов осаждаются в кислой среде, необходимо следить за соотношением кислых и щелочных валентностей в пище, кислые валентности содержатся в продуктах животного происхождения и злаковых, щелочные во фруктах и овощах, то есть ориентироваться на молочно-растительный (из разрешенного перечня) стереотип питания.
Кроме того, с ощелачивающей целью назначаются щелочные минеральные воды типа «Боржоми», «Нарзан», «Ессентуки» и т. п., средней минерализации в возрастных дозах, курсами по 2–3 недели.
К методам диетической коррекции также можно отнести прием растительных масел как поставщиков полиненасыщенных жирных кислот по 5,0–15,0 мл 1–3 раза в день.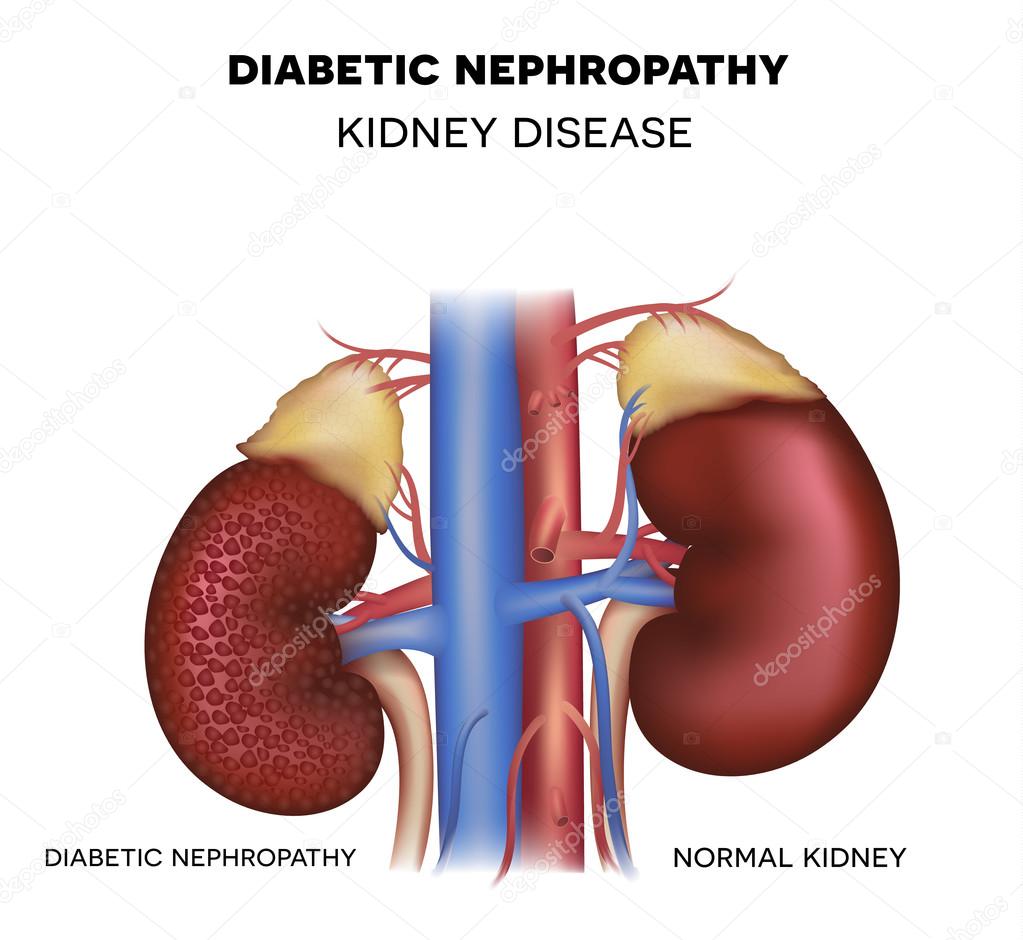 Растительные масла логично использовать в качестве заправок для овощных салатов, пюре или каши.
Растительные масла логично использовать в качестве заправок для овощных салатов, пюре или каши.
Медикаментозное лечение
Основу медикаментозного лечения любой формы дисметаболических нефропатий составляет метаболическая и мембранопротекторная терапия.
При оксалозе рекомендовано назначение витаминов В1 и В6 с целью активизации метаболизма глицина, назначают витамины per os в высоких дозах от 20–60 мг/сут до 100 мг/сут в утренние и дневные часы, курс 2–3 недели. При оксалозе можно применять и комплексные препараты, содержащие витамины В1 и В6.
Магне В6 содержит пиридоксин и магний. Разрешен к применению у детей старше 12 лет. Принимается по 1–2 таблетки 3 раза в день. Курс 2–3 недели.
Мульти-табс В-Комплекс. Содержит: витамин В1 (тиамина нитрат) — 15 мг, витамин В2 (рибофлавин) — 15 мг, витамин В6 (пиридоксина гидрохлорид) — 15 мг, витамин В12 (цианокобаламин) 5 мкг, никотинамид — 60 мг, пантотеновую кислоту (кальция пантотенат) — 30 мг, фолиевую кислоту — 200 мкг. Применять по 1–2 таблетки в день, курс 2–3 месяца.
Применять по 1–2 таблетки в день, курс 2–3 месяца.
При оксалурии и уратурии показаны курсы метаболической терапии и мембранопротекторов, витамины А, Е, Аевит в возрастных дозах.
Димефосфон (15% раствор). Является антигипоксантом и антиоксидантом, регулятором водно-электролитного баланса и кислотно-щелочного состояния. Применяют внутрь, запивая водой, в виде раствора, взрослым и детям по 30–50 мг/кг (или из расчета 1 мл 15% раствора на 5 кг массы тела), 1–4 раза в сутки, длительность приема 3 недели — 2 месяца. Обладает горьким вкусом, поэтому для облегчения приема детям рекомендуется запивать молоком, фруктовым соком или сладким чаем.
Элькар (L-карнитин) — 20% водный раствор для перорального применения, содержащий 200 мг действующего вещества в 1 мл раствора. Препарат относится к фармакологической группе «Метаболические средства» и выпускается во флаконах по 25, 50 и 100 мл. Элькар представляет собой прозрачную бесцветную жидкость без запаха, содержащую L-карнитин, по химической структуре и биологической активности идентичный природному. Участвует в процессах обмена веществ. Нормализует структуру и функцию митохондрий, оптимизирует энергетический обмен в клетках. После приема внутрь хорошо всасывается в кишечнике, концентрация в плазме крови достигает максимума через 3 ч и сохраняется в терапевтическом диапазоне в течение 9 ч, выводится почками. Препарат разрешен к применению у детей с первого года жизни. Легко дозируется, можно применять в качестве питья или в виде добавки к сладким блюдам. До 3 лет 5–10 капель на прием, от 3 до 6 лет — по 0,1 г (14 капель) 2–3 раза в день (суточная доза — 0,2–0,3 г), от 6 до 12 лет — по 0,2–0,3 г (28–42 капли) 2–3 раза в день (суточная доза — 0,4–0,9 г). Курс лечения — 1 мес. Противопоказаний для назначения препарата нет.
Участвует в процессах обмена веществ. Нормализует структуру и функцию митохондрий, оптимизирует энергетический обмен в клетках. После приема внутрь хорошо всасывается в кишечнике, концентрация в плазме крови достигает максимума через 3 ч и сохраняется в терапевтическом диапазоне в течение 9 ч, выводится почками. Препарат разрешен к применению у детей с первого года жизни. Легко дозируется, можно применять в качестве питья или в виде добавки к сладким блюдам. До 3 лет 5–10 капель на прием, от 3 до 6 лет — по 0,1 г (14 капель) 2–3 раза в день (суточная доза — 0,2–0,3 г), от 6 до 12 лет — по 0,2–0,3 г (28–42 капли) 2–3 раза в день (суточная доза — 0,4–0,9 г). Курс лечения — 1 мес. Противопоказаний для назначения препарата нет.
Эссенциале форте Н. Содержит эссенциальные фосфолипиды (EPL) из соевых бобов, содержащие 76% (3-sn-фосфатидил) холина, сочетающиеся с природными эндогенными фосфолипидами по химической структуре, нормализуют метаболизм липидов и белков, способствуют активации и защите фосфолипидзависимых ферментных систем, восстанавливают клеточную структуру, улучшают регенерацию. Ежедневный прием — по 2 капсулы 2–3 раза в день, во время еды, проглатывая целиком, запивая небольшим количеством воды.
Ежедневный прием — по 2 капсулы 2–3 раза в день, во время еды, проглатывая целиком, запивая небольшим количеством воды.
Эссливер форте. Выпускается в капсулах. Содержит эссенциальные фосфолипиды (фосфатидилхолин — 29%, фосфатидилэтаноламин и др.) — 300 мг, витамин B1 — 6 мг, витамин В2 — 6 мг, витамин В6 — 6 мг, витамин В12 — 6 мкг, токоферола ацетат — 6 мг, никотинамид — 30 мг. Регулирует проницаемость биомембран, активность мембраносвязанных ферментов, обеспечивая физиологическую норму процессов окислительного фосфорилирования в клеточном метаболизме. Восстанавливает мембраны путем структурной регенерации и методом конкурентного ингибирования перекисных процессов. Применяется внутрь по 2 капсулы 3 раза в день во время еды. У детей до 12 лет применяется с осторожностью.
Фосфоглив. Комплексный препарат, содержащий фосфатидилхолин растительного происхождения и тринатриевую соль глицирризиновой кислоты из корня солодки. Фосфатидилхолин является основным компонентом фосфолипидного биослоя биологических мембран. При пероральном введении в организм фосфатидилхолин восстанавливает целостность клеточных мембран. Глицирризиновая кислота обладает противовоспалительными свойствами. Форма выпуска — капсулы. По 1–2 капсулы 3 раза в день в течение 30 дней регулярно. Высшая разовая доза — 4 капсулы, суточная — 12 капсул. Разрешен к применению у взрослых.
Фосфатидилхолин является основным компонентом фосфолипидного биослоя биологических мембран. При пероральном введении в организм фосфатидилхолин восстанавливает целостность клеточных мембран. Глицирризиновая кислота обладает противовоспалительными свойствами. Форма выпуска — капсулы. По 1–2 капсулы 3 раза в день в течение 30 дней регулярно. Высшая разовая доза — 4 капсулы, суточная — 12 капсул. Разрешен к применению у взрослых.
Тыквеол. Формы выпуска: капсулы, масло для приема внутрь, свечи ректальные. Содержит комплекс биологически активных веществ из семян тыквы (каротиноиды, токоферолы — не менее 4%, фосфолипиды, стерины, фосфатиды, флавоноиды, витамины B1, B2, C, PP, насыщенные, ненасыщенные и полиненасыщенные жирные кислоты — пальмитиновая, стеариновая, олеиновая, линолевая, линоленовая). Оказывает выраженное антиоксидантное действие, угнетающее процессы перекисного окисления липидов в биологических мембранах. Эссенциальные фосфолипиды — структурные элементы клеточных мембран и мембран органелл, регулируют проницаемость мембран и процессы окислительного фосфорилирования, способствуют восстановлению структуры и функции мембран. Применяется внутрь, по 1 чайной ложке экстракта за 30 мин до еды или по 2–4 капсулы, во время или после еды 3–4 раза в сутки.
Применяется внутрь, по 1 чайной ложке экстракта за 30 мин до еды или по 2–4 капсулы, во время или после еды 3–4 раза в сутки.
Длительность курса протекторной терапии 2–3 недели, проводится 3–4 раза в год.
Помимо мембранопротекторной терапии широко используются комбинированные препараты на основе лекарственных трав и эфирных масел.
Фитотерапия традиционно популярна для лечения самых разных заболеваний почек. В целом, надо отметить, что при дисметаболической нефропатии целесообразно использовать лекарственные травы с диуретическими и мембраностабилизирующими свойствами и избегать трав с высоким содержанием оксалатов и аскорбиновой кислоты при оксалурии. Несмотря на большой выбор лекарственных растений и их препаратов, важно выделять те из них, в отношении которых имеются научные данные в плане эффективности лечения и безопасности. Одним из наиболее популярных в лечении дисметаболических нефропатий препаратов является растительный лекарственный препарат Канефрон Н. В исследованиях показано мочегонное, уросептическое, мембраностабилизирующее и антиоксидантное действие Канефрона Н при различных инфекционно-воспалительных и обменных заболеваниях почек. Препарат может использоваться как в лечебном комплексе, так и отдельно длительным курсом у детей с дисметаболическими нефропатиями.
В исследованиях показано мочегонное, уросептическое, мембраностабилизирующее и антиоксидантное действие Канефрона Н при различных инфекционно-воспалительных и обменных заболеваниях почек. Препарат может использоваться как в лечебном комплексе, так и отдельно длительным курсом у детей с дисметаболическими нефропатиями.
Канефрон Н. Выпускается в виде водно-спиртового раствора и в драже. В состав лекарственного препарата растительного происхождения входят: травы золототысячника (Centaurii herba), корня любистока (Levistici radix), листьев розмарина (Rosmarini folia). Фармакологическое действие: диуретическое, спазмолитическое, противовоспалительное, антибактериальное. Способ применения и дозы: внутрь, грудным детям — по 10 капель 3 раза в сутки; детям дошкольного возраста — по 15 капель 3 раза в сутки; детям школьного возраста — по 25 капель или по 1 драже 3 раза в сутки. Курс 2–4 недели. При необходимости (для улучшения вкуса) капли можно принимать вместе с другими жидкостями. Драже следует принимать не разжевывая, запивая небольшим количеством воды.
Драже следует принимать не разжевывая, запивая небольшим количеством воды.
Олиметин. Комплексный препарат, содержащий масло мяты перечной, масло терпентинное очищенное, масло аира, масло оливковое, серу очищенную. Оказывает спазмолитическое, желчегонное, мочегонное и противовоспалительное действие. Форма выпуска — капсулы. Применяют по 1–2 капсулы 3 раза в день до еды. Курс 2–3 недели. С профилактической целью применяют по 1 капсуле в день длительным курсом.
Фитолизин. Препарат — паста мягкой консистенции, зелено-коричневого цвета со специфическим ароматом. Содержит экстракты растений: корня петрушки, корневища пырея, травы полевого хвоща, листьев березы, травы горца птичьего и др., а также масла — мятное, шалфейное, сосновое, апельсиновое и ванилин. Оказывает мочегонное, противовоспалительное, спазмолитическое действие. Применяют для разрыхления и удаления мочевых конкрементов и облегчения их выведения с мочой. Принимают по 1 чайной ложке в 1/2 стакана теплой подслащенной воды 3 раза в день после еды. Форма выпуска: в тубах по 100 г.
Принимают по 1 чайной ложке в 1/2 стакана теплой подслащенной воды 3 раза в день после еды. Форма выпуска: в тубах по 100 г.
Цистон. За счет комбинированного состава препарат нормализует коллоидное равновесие мочи, обладает противовоспалительным, антисептическим и спазмолитическим, диуретическим действием, что позволяет его использовать в качестве одного из основных средств лечения дисметаболической нефропатии, причем длительным курсом до 6 месяцев, в возрастных дозах.
Уролесан. Форма выпуска — капли. Состав: масла пихтовое, масло перечной мяты, масло касторовое, экстракт семян моркови дикой, экстракт шишек хмеля, экстракт травы душицы обыкновенной. Применяют при мочекаменной и желчнокаменной болезни. Препарат оказывает спазмолитическое и противовоспалительное действие. Принимают внутрь по 8–10 капель перед едой. Курс лечения 3–4 недели.
Фитотерапия. При выборе лекарственных растений учитывается наличие мочегонного действия, зависящего от содержания эфирных масел, сапонинов, силикатов (можжевельник, петрушка, листья березы, хвощ полевой), противовоспалительного действия, связанного с присутствием танинов и арбутина (листья брусники, толокнянка), антисептического, обусловленного фитонцидами (ромашка, зверобой, тысячелистник, пол-пола), и литолитического эффекта (почечный чай, василек, марена красильная, пол-пола).
При интеркуррентных заболеваниях назначается постельный режим, обильное питье, обязательно мембранопротекторная или фитотерапия, при необходимости тщательно подбираются антибактериальные препараты, не обладающие нефротоксическим действием, сдаются контрольные анализы мочи при выздоровлении и через 10–14 дней.
Диспансерное наблюдение проводится индивидуально в зависимости от клинического варианта течения дисметаболической нефропатии.
Литература
Эрман М. В. Нефрология детского возраста в схемах и таблицах, С.-Пб: Специальная литература, 1997, с. 182–203, 319–339.
Игнатова М. С., Вельтищев Ю. Е. Детская нефрология. М.: Медицина, 1989, с. 276–293.
Шулутко Б. И. Болезни печени и почек. С.-Пб: Ренкор, 1995, с. 399–408.
Нефрология. Под ред. Тареевой И. Е. М.: Медицина, 1995, с. 312–321.

Регистр лекарственных средств России-2007.
Химический состав пищевых продуктов. Справочные таблицы содержания основных пищевых веществ и энергетической ценности пищевых продуктов. Под ред. Покровского А. А. М.: Пищевая промышленность, 1976, 227 с.
С. В. Рычкова, доктор медицинских наук, доцент
СПб МАПО, Санкт-Петербург
Контактная информация об авторе для переписки: rychkova.sv@rambler.ru
Клинические рекомендации по диагностике и лечению мембранозной нефропатии | Бобкова
1. Аткинс РК. Гломерулонефриты. Нефрология и диализ 2000; 2 (4)
2. Захарова ЕВ. Роль циклоспорина в лечении идиопатического гломерулонефрита и волчаночного нефрита. Нефрология и диализ 2010; 12(2): 126-141
Нефрология и диализ 2010; 12(2): 126-141
3. Козловская ЛВ. Хронический гломерулонефрит: аргументы в пользу циклоспорина. Клин нефрол 2010; 3: 56-61
4. Мухин НА, Козловская ЛВ. Мембранозная нефропатия: как дифференцировать первичный и вторичный варианты. Клин нефрол 2009; 2: 75-78
5. Смирнов АВ. Лечение гломерулопатий циклоспорином: правильный подход с неверным обоснованием. Нефрология 2010; 14 (4): 9-22
6. Смирнов АВ. Практические вопросы применения циклоспорина в лечении гломерулопатий. Нефрология 2010; 14 (4): 96-102
7. Beck LH, Bonegio RG, Lambeau G et al. M-type phospholipase A2 receptor as target antigen in idiopathic membranous nephropathy. N Eng J Med 2009; 361:11-21
N Eng J Med 2009; 361:11-21
8. Beck LH, Fervenza FC, Beck DM et al. Rituximab-induced depletion of anti-PLAjR autoantibodies predicts response in membranous nephropathy. J Am Soc Nephrol 2011; 22: 1543-1550
9. Bomback AS, Derebail VK, McGregor JG. Rituximab therapy for membranous nephropathy. Clin J Am Soc Nephol 2009; 4: 734-744
10. Branten AJ. Mycophenolate mofetil in idiopathic membranous nephropathy. Clinical trial with comparison to a historical control group treated with cyclophosphamide. Am J Kidney Dis 2007; 50: 248-256
11. Cattran DC. Cyclosporin in idiopathic glomerular disease associated with the nephritic syndrome: workshop recommendations. Kidney Int 2007; 72(12): 1429-1447
12. Cattran DC. North America nephrotic syndrome study G: Cyclosporin in patients with steroid resistant membranous nephropathy: a randomize trial. J Am Soc Nephrol 2001; 59: 1484-1490
Cattran DC. North America nephrotic syndrome study G: Cyclosporin in patients with steroid resistant membranous nephropathy: a randomize trial. J Am Soc Nephrol 2001; 59: 1484-1490
13. Cattran DC. Management of Idiopathic membranous nephropathy. What and When for treatment. J Am Soc Nephrol 2005; 16: 1188-1194
14. Debeick H, Lefeu F, Kemper MJ et al. Early childhood membranous nephropathy induced by antibodies to cationic bovine serum albumin. N Eng J Med 2011; 364: 2101-2110
15. Glassock RJ. The pathogenesis of idiopathic membranous nephropathy: a 50-year odyssey. Am J Kidney Dis 2010; 38: 157-167
16. Glassock R.J. Diagnosis and natural course of membranous nephropathy. Sem Nephrol. 2003; 23: 324-332.
2003; 23: 324-332.
17. Kidney Diseases: Improving Global Outcomes (KDIGO) Glomerulonephritis Work Group. KDIGO Clinical Practice Guideline for glomerulonephritis. Kidney Int Suppl 2012; 2(2):139-274
18. Ponticelli C. Membranous nephropathy. J Nephrol 2007; 20(3): 268-287
19. Ronco P, Debeic H. Advances in membranous nephropathy: success stories of a long journey. Clin and Experiment Pharmacol and Physiol 2011; 38: 410-416
Нарушения минерального обмена в почках (дисметаболические нефропатии)
Дисметаболические нефропатии (наршения минерального обмена почек — НМО) представляют собой группу заболеваний, характеризующихся поражением почек вследствие нарушения обмена веществ и приводящим к развитию мочекаменной болезни (МКБ), воспалению почек (пиелонефрит), которые могут осложниться хронической почечной недостаточностью (ХПН).
В зависимости от причины развития выделяют первичные и вторичные НМО.
Первичные нарушения представляют собой наследственно обусловленные формы заболеваний, характеризующихся прогрессирующим течением, ранним развитием мочекаменной болезни (МКБ) и хронической почечной недостаточности (ХПН). Первичные дисметаболические нефропатии встречаются редко и начало клинических проявлений развивается уже в детском возрасте.
Вторичные дисметаболические нефропатии могут быть связаны с повышенным поступлением определенных веществ в организм, нарушением их метаболизма в связи с поражением других органов и систем (например, желудочно-кишечного тракта), применением ряда лекарственных средств и др.
Подавляющее большинство (от 70 до 90%) дисметаболических нефропатий связаны с нарушением обмена кальция, при этом около 85–90% из них обусловлены избытком солей щавелевой кислоты в виде оксалата кальция — оксалатов, 3–10% — перегрузкой фосфатами (фосфаты кальция), существуют смешанный вариант нарушений – оксалатно/фосфатно-уратные.
Оскалатно-кальциевая нефропатия
Оксалатно-кальциевая нефропатия наиболее часто встречается в детском возрасте. Ее возникновение может быть связано с нарушением обмена кальция или оксалатов (солей щавелевой кислоты).
Причины образования оксалатов:
- повышенное поступление оксалатов с пищей
- заболевания кишечника – воспалительные заболевания кишечника (болезнь Крона, язвенный колит), кишечные анастомозы при проведении оперативных вмешательств на кишечнике
- повышенная выработка оксалатов самим организмом
Оксалатная нефропатия представляет собой многофакторный патологический процесс. Наследственная предрасположенность к развитию оксалатной нефропатии встречается в 70–75%. Помимо генетических, большую роль играют такие внешние факторы, как: питание, стресс, экологические проблемы и др.
Первые проявления болезни могут развиться в любом возрасте, даже в период новорожденности. Чаще всего они выявляются в 5–7 лет в виде обнаружения кристаллов оксалатов, небольшим содержанием белка, лейкоцитов и эритроцитов в общем анализе мочи. Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Характерно повышение удельной плотности мочи. Заболевание обостряется в период полового созревания в возрасте 10–14 лет, что, по-видимому, связано с гормональной перестройкой.
Прогрессирование оксалатной нефропатии может привести к формированию мочекаменной болезни, развитию воспаления почек — пиелонефриту при наслоении бактериальной инфекции.
Фосфатная нефропатия
Фосфатная нефропатия встречается при заболеваниях, сопровождающихся нарушением фосфорного и кальциевого обмена. Основная причина фосфатурии – хроническая инфекция мочевой системы. Часто фосфатно-кальциевая нефропатия сопровождает оксалатно-кальциевую, но при этом выражена в меньшей степени.
Уратная нефропатия (нарушения обмена мочевой кислоты)
Эта группа обменных нарушений наиболее часто встречается у взрослых. Первичные уратные нефропатииобусловлены наследственными нарушениями обмена мочевой кислоты. Вторичные возникают как осложнениядругих заболеваний (болезней крови и др.), являются следствием применения некоторых препаратов (тиазидовых диуретиков, цитостатиков, салицилатов, циклоспорина А и др. ) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
) или нарушения функции канальцев почек и физико-химических свойств мочи (при воспалении почек, например). Кристаллы уратов откладываются в ткани почек – это приводит к развитию воспаления и снижению почечных функций.
Первые признаки заболевания могут выявляться в раннем возрасте, хотя в большинстве случаев наблюдается длительное скрытое течение процесса.
Цистиновая нефропатия
Цистин является продуктом обмена аминокислоты метионина. Можно выделить две основные причины повышения концентрации цистина в моче:
- избыточное накопление цистина в клетках почки
- нарушение обратного всасывания цистина в почечных канальцах.
Накопление цистина в клетках происходит в результате генетического дефекта фермента цистинредуктазы. Это нарушение обмена носит системный характер и называется цистинозом. Внутриклеточное и внеклеточное накопление кристаллов цистина выявляется не только в канальцах и интерстиции почки, но и в печени, селезенке, лимфоузлах, костном мозге, клетках периферической крови, нервной и мышечной ткани, других органах. Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
Нарушение обратного всасывания цистина в канальцах почек наблюдается вследствие генетически обусловленного дефекта транспорта через клеточную стенку для аминокислот – цистина, аргинина, лизина и орнитина.
По мере прогрессирования заболевания определяются признаки мочекаменной болезни, а при присоединении инфекции – воспаление почек.
Симптомы НМО
НМО почек, как правило, клинически течет бессимптомно до формирования мочекаменной болезни или пиелонефрита, но в ряде случаев могут проявляться следующими симптомами:
- дискомфорт при мочеиспускании
- учащенное мочеиспускание
- ноющая боль или дискомфорт, локализующиеся преимущественно в поясничной области или животе
- приступообразная («почечная колика») или постоянная боль, отдающая в. подвздошную или паховую область, на внутреннюю поверхность бедра, в половые органы
- боль над лоном может развиваться при отложении солей или наличии камней в мочевом пузыре
Диагностика НМО
Необходимое комплексное обследование включает лабораторные и инструментальные методы.
Лабораторная диагностика
- Общий анализ мочи, в котором выявляются кристаллы солей той или иной кислоты. Однако данное исследование не позволяет с полной уверенностью утверждать о присутствии дисметаболической нефропатии. Выявление кристаллов солей только в общих анализах мочи не является основанием для постановки диагноза дисметаболической нефропатии. Следует иметь в виду, что выделение кристаллов с мочой часто бывает преходящим и оказывается не связанным с нарушением обмена веществ. Поэтому для уточнения диагноза прибегают ко второму этапу исследования – проведению биохимического исследования мочи.
- Биохимический анализ мочи позволяет оценить концентрации тех или иных солей в порции мочи. Метод является более точным и чувствительным для определения количественного уровня оксалатов, фосфатов, уратов и других кристаллов солей.
- АКОСМ — определение антикристаллобразующей способности мочи. Метод достаточно сложный, проводится не в каждом лечебном заведении.

- Ряд тестов на перекиси в моче и кальцифилаксию. Данная методика позволяет выявить нарушения кальциевого обмена и оценить степень активности перекисного окисления мембран клеток почечной ткани, что является важным звеном в процессах развития дисметаболических нефропатий.
Инструментальная диагностика
УЗИ органов брюшной полости. Изменения, выявляемые при УЗИ почек, как правило, мало специфичны. Возможно выявление в почке микролитов или «песка» (включений). УЗИ почек, как правило, является неспецифичным методом диагностики, однако в ряде случаев позволяет отследить формирование мелких камней и, таким образом, зафиксировать время возникновения мочекаменной болезни.
Лечение
Рекомендации по питанию являются основой терапии как в детском, так и во взрослом состоянии.
| Вид нефропатии | Запрещенные продукты |
| Оксалатная нефропатия | Мясные блюда, щавель, шпинат, клюква, свекла, морковь, какао, шоколад |
| Уратная нефропатия | Печень, почки, мясные бульоны, горох, фасоль, орехи, какао, алкогольные напитки |
| Фосфатная нефропатия | Сыр, печень, икра, курица, бобовые, шоколад |
| Цистиновая нефропатия | Творог, рыба, яйца, мясо |
Лечение оксалатной нефропатии
Диета
- при лечении больных с оксалатной нефропатией назначается картофельно-капустная диета, при которой снижается поступление оксалатов с пищей и нагрузка на почки
- необходимо исключить холодец, крепкие мясные бульоны, щавель, шпинат, клюкву, свеклу, морковь, какао, шоколад
- рекомендуется ввести в рацион курагу, чернослив, груши
- из минеральных вод используются такие, как славяновская и смирновская, по 3–5 мл/кг/сут.
 в 3 приема курсом 1 месяц 2–3 раза в год
в 3 приема курсом 1 месяц 2–3 раза в год
Лекарственная терапия включает мембранотропные препараты и антиоксиданты. Лечение должно быть длительным. Применяются витамины группы В, А, Е. Назначаются специальные препараты при кристаллурии. Помимо этого, назначается окись магния, особенно при повышенном содержании оксалатов.
Лечение уратной нефропатии
Диета
- при лечении уратной нефропатии диета предусматривает исключение богатых пуриновыми основаниями продуктов (печени, почек, мясных бульонов, гороха, фасоли, орехов, какао и др.)
- преимущество должно отдаваться продуктам молочного и растительного происхождения
- важным условием успешной терапии является достаточное употребление жидкости – от 1 до 2 л в сутки. Предпочтение следует отдавать слабощелочным и слабоминерализованным водам, отварам трав (хвощ полевой, укроп, лист березы, брусничный лист, клевер, спорыш и др.), отвару овса
Для поддержания оптимальной кислотности мочи можно использовать цитратные смеси. При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
При уратной нефропатии важно уменьшить концентрацию мочевой кислоты. Для этого используются средства, снижающие синтез мочевой кислоты.
Лечение фосфатной нефропатии
Назначается диета с ограничением продуктов, богатых фосфором (сыр, печень, икра, курица, бобовые, шоколад и др.).
Лечение при фосфатной нефропатии должно быть направлено на подкисление мочи (минеральные воды – нарзан, арзни, дзау-суар и др.; препараты – цистенал, аскорбиновая кислота, метионин).
При любой степени тяжести заболевания необходимо незамедлительно обратиться к врачу нефрологу или урологу за помощью, так как длительно текущие, в целом обратимые, нарушения обмена при отсутствии лечения могут привести к развитию мочекаменной болезни с последующим оперативным вмешательством и хронической почечной недостаточности. Самолечение не допустимо!
Все виды лекарственной терапии должен назначать и обязательно контролировать врач нефролог или уролог, так как:
- эти лекарства имеют серьезные побочные эффекты на другие органы и системы
- у части пациентов отмечается изначальная невосприимчивость или постепенно развивается устойчивость к препаратам
На первом этапе лечения составляется план лечения. Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
Лечение любой дисметаболической нефропатии можно свести к четырем основным принципам:
- нормализация образа жизни
- правильный питьевой режим
- диета
- специфические методы терапии
Прием большого количества жидкости является универсальным способом лечения любой дисметаболической нефропатии, так как способствует уменьшению концентрации растворимых веществ в моче.
Одной из целей лечения является увеличение ночного объема мочеиспускания, что достигается приемом жидкости перед сном. Предпочтение следует отдавать простой или минеральной воде.
Диета позволяет в значительной степени снизить солевую нагрузку на почки.
Специфическая терапия должна быть направлена на предупреждение конкретного кристаллообразования, выведение солей, нормализацию обменных процессов.
На втором этапе терапии производится оценка эффективности диеты, проводятся контрольные УЗ-исследования и анализы.
Третий этап лечения осуществляется после достижения стойкой ремиссии. Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Он представляет собой схему постепенного снижения доз назначенных препаратов до поддерживающих или полной их отмены с сохранением диетических рекомендаций.
Даже после достижения долгожданной ремиссии пациенту рекомендуется быть внимательным к себе и регулярно наблюдаться у врача нефролога или уролога, так как высок риск рецидива заболеваний.
Практически всем пациентам необходимо принимать рекомендованные врачом средства противорецидивной терапии или придерживаться ранее разработанной диеты для предотвращения формирования или прогрессирования МКБ, воспаления почек.
Прогноз
Прогноз при дисметаболической нефропатии в целом благоприятен. В большинстве случаев при соответствующем режиме, диете и лекарственной терапии удается добиться стойкой нормализации соответствующих показателей в моче. В отсутствие лечения или при его неэффективности наиболее естественным исходом дисметаболической нефропатии является мочекаменная болезнь и воспаление почек.
Самым частым осложнением дисметаболической нефропатии является развитие инфекции мочевой системы, в первую очередь пиелонефрита.
Если вы обнаружили у себя какие-либо из перечисленных выше симптомов (нарушение мочеотделения, изменения свойств мочи, боли), необходимо в ближайшее время обратиться к врачу за помощью.
Помните, что очень важно начать лечение на ранних стадиях болезни, так как НМО в почках является преимущественно обратимым состоянием, а в случае отсутвтия лечения итогом является развитие мочекаменной болезни, пиелонефрита.
Рекомендации
Для профилактики развития заболевания, а так же рецидива, необходимо придерживаться правильного, сбалансированного и регулярного питания – избегать острой пищи, маринадов и пр. В период обострения пациентам рекомендуется щадящая диета, соответствующая требованиям биохимического вида нефропатии (оксалатная, уратная и пр.).
С целью профилактики рецидивов всем пациентам рекомендуется один раз в квартал консультация врача нефролога или уролога для необходимой коррекции медикаментозной терапии и пищевых рекомендаций.
Пациенты, длительно страдающие НМО в почках, относятся к группе повышенного риска по МКБ. Поэтому в период ремиссии им необходимо ежегодно проходить по назначению врача контрольные обследования (общий анализ мочи, биохимия мочи, УЗИ почек, мочеточников, мочевого пузыря) мочевыводящей системы.
Часто задаваемые вопросы
Излечимы ли НМО?
НМО часто обусловлено наследственными нарушениями обмена, что требует постоянного соблюдения как минимум диетических рекомендаций.
Из-за чего возникает заболевание?
НМО может быть связано с наследственной предрасположенностью, а также с заболеваниями внутренних органов (желудочно-кишечные проблемы, заболевания крови и пр.), применением определенных групп лекарственных препаратов (мочегонные средства, цитостатики и пр.).
Является ли заболевание противопоказанием к беременности?
Само НМО в почках требует наблюдения весь период беременности с соблюдением диетических рекомендаций.
При развитии МКБ, пиелонефрита и их осложнений в виде ХПН, возможность беременности и ее сохранения зависит от обострения процесса и стадии осложнений и решается в каждом конкретном случае.
Может ли заболевание почек проявляться снижением потенции?
Непосредственно НМО конечно не влияет на потенцию, но в случае развития осложнений МКБ, воспаления почек или развития ХПН снижение потенции может появиться как реакция на хроническое заболевание.
Увеличивается ли риск заболеть, если близкий родственник страдает данным заболеванием?
Да, существует группа первичных обменных нефропатий (НМО в почках), имеющая наследственную предрасположенность.
Дисметаболическая нефропатия у детей – клинические рекомендации
Дисметаболическая нефропатия у детей – это распространенное заболевание среди пациентов младшей возрастной группы, которое считается группой патологических процессов, поражающих почки, развившихся на фоне нарушенного процесса обмена веществ. Зачастую первая явная симптоматика просматривается в 4-5 лет, но может возникнуть и в младенчестве. Обостряются признаки в подростковом периоде, когда происходит гормональная перестройка.
При развитии первичной нефропатии у детей рассматривают как основную причину развития наличие хронических заболеваний, например, наследственные патологии или мочекаменная болезнь. Симптоматика при этом выражена явно, соответственно, терапия более трудная. Вторичный тип развивается в результате нарушения обмена веществ в организме, когда рацион питания ребенка изменяется, происходит неправильное усвоение кальция, либо малыш принимает лекарства.
Симптоматика при этом выражена явно, соответственно, терапия более трудная. Вторичный тип развивается в результате нарушения обмена веществ в организме, когда рацион питания ребенка изменяется, происходит неправильное усвоение кальция, либо малыш принимает лекарства.
Клинические рекомендации
Если была диагностирована диабетическая нефропатия у детей, клинические рекомендации будут отличаться в зависимости от характера заболевания. При тяжелой форме у пациента отмечается прогрессирование почечной недостаточности острого типа, а также острое или хроническое воспаление интерстициальной ткани и канальцев органа фильтрации второй и третьей степени. Однако в такой комбинации заболевание встречается довольно редко.
Основной причиной его возникновения считается врожденный нарушенный обмен веществ. Главной рекомендацией в плане терапевтического подхода выступает обязательная госпитализация пациента в специализированное нефрологическое отделение для дальнейшего стационарного лечения.
Если состояние больного средней тяжести, тогда медицинские мероприятия могут быть проведены как амбулаторно, так и в условиях больницы. В остальном, если дисметаболическая нефропатия, совмещенная с оксалурией, уратурией или их комбинацией, протекающая в легкой форме, подлежит лечению амбулаторно.
Вне зависимости от типа патологического процесса, основной задачей выступает повышение водной нагрузки на организм. К возрастным нормам употребленной жидкости дополнительно прибавляется 500-1000 мл. Для детей 1-2 года жизни показано употребление 1,3-1,5 л в сутки, 4-6 лет – 1,8-2,0 литра в сутки, старше 10 лет от 2 до 2,5 литров. Однако стоит помнить, что учитывается весь объем жидкости, а не только вода, чай, соки и прочие напитки.
Специалисты должны обратить внимание на тот факт, что пациенты первого года жизни практически всегда получают необходимый объем жидкости, поскольку процесс их развития контролируется со стороны педиатрии. Что касается малышей старшего возраста, то они нередко питаются нерегулярно, поэтому в среднем получают не более 1,7 литра жидкости в течение суток. Это и становится основной причиной нарушения обмена веществ.
Что касается малышей старшего возраста, то они нередко питаются нерегулярно, поэтому в среднем получают не более 1,7 литра жидкости в течение суток. Это и становится основной причиной нарушения обмена веществ.
В комплексе базовой терапии обязательно присутствует диетическая коррекция. Если дисметаболическая нефропатия протекает на фоне оксалурии, тогда из рациона питания необходимо исключить все пищевые продукты, которые насыщены щавелевой кислотой, например: какао, шоколад, свекла, сельдерей, шпинат, щавель, петрушка, ревень.
Таблица щелочных и кислотных валентностей продуктов. Источник: j96242r7.beget.techОграничить необходимо употребление продуктов, в которых среднее содержание щавелевой кислоты (морковь, цикорий, зеленая фасоль, лук, помидоры, чай). Разрешается употреблять блюда, в которых имеются ингредиенты с минимальным содержанием данного вещества. Сюда относится белокочанная капуста, абрикосы, бананы, картофель. Также разрешены грибы, баклажаны, кабачки, горох, огурцы, тыква.
Под ограничение попадают также продукты, которые содержат высокий уровень витамина C (шиповник, сладкий перец, смородина, облепиха, капуста цветная и брюссельская, апельсины, рябина). Поскольку данный элемент в организме человека не вырабатывается, полностью исключать его поступление нельзя. Это следует учитывать при разработке диетического меню.
Согласно проведенным медицинским исследованиям удалось установить, что после регуляции питания пациента уровень выводимых вместе с уриной оксалатов понижается примерно на 40%, а иногда и больше. Если вводить бензоат натрия, то он заблокирует эндогенный синтез оксалатов из глицина (меняется процесс метаболизма глицина). Для лучшей трансформации глицина в гиппуровую кислоту, в рационе должна присутствовать клюква и брусника.
Если диагностирована урикозурическая нефропатия, рекомендуется разрабатывать принцип диетического питания с учетом ограниченного поступления в организм пуриновых веществ. Поэтому стоит минимизировать блюда, в которых присутствует сардина, скумбрия, сельдь и субпродукты. Среднее содержание пуринов приходится на чечевицу, говядину, кролика, речную и озерную рыбу.
Среднее содержание пуринов приходится на чечевицу, говядину, кролика, речную и озерную рыбу.
Необходимо помнить то, что кристаллы уратов и оксалатов могут осаживаться в кислой среде. Поэтому важно учитывать кислотные и щелочные пищевые валентности. Первый тип преобладает в продуктах животного происхождения, а также злаковых культах, а второй – фрукты, овощи. Соответственно, рекомендован молочно-растительный рацион питания.
Для того чтобы добиться максимального ощелачивания среды, необходимо регулярно пить такие минеральные воды как Нарзан, Ессентуки и Боржоми. Они имеют средний уровень минерализации, согласно возрастным дозам. Курс составляет 2-3 недели. Также рекомендуется принимать по 5-15 мл 1-3 раза в сутки растительные масла в виде заправок для блюд.
Особенности диагностики
Для диагностирования дисметаболической нефропатии у детей врачи обязательно должны детально изучить полученный анамнез. В нем необходимо обратить внимание на образ жизни ребенка, характер питания, вероятность воздействия факторов окружающей среды. В качестве подтверждения назначают лабораторные, инструментальные методики обследования.
В нем необходимо обратить внимание на образ жизни ребенка, характер питания, вероятность воздействия факторов окружающей среды. В качестве подтверждения назначают лабораторные, инструментальные методики обследования.
Изначально стоит задача, обнаружения кристаллурии посредством изучения состава сочи. Для этого проводится общий анализ урины, исследуется антикристаллобразующую способность почек (АКОСМ), выполняются тесты на кальцифилаксию и перекиси в моче, обязательно проведение ультразвукового скрининга почек.
Если кристаллы солей были определены исключительно в общем анализе урины, то это не может являться подтверждение наличия у пациента дисметаболической нефропатии. Нередко у пациентов младшей возрастной группы отмечается транзиторная кристаллурия, которая не имеет какой-либо связи с нарушением процесса обмена веществ в организме.
Подтвердить диагноз можно посредством выполнения биохимического исследования урины. Здесь особое внимание уделяется уровню концентрации оксалатов, мочевой кислоты, кальция, фосфора и прочих веществ. Также оценивается функция канальцев (глюкоза, титруемая кислотность, аммиак pH и прочее).
Также оценивается функция канальцев (глюкоза, титруемая кислотность, аммиак pH и прочее).
Медикаментозное лечение
Вне зависимости от формы патологического процесса, за основу медикаментозного лечения принято брать метаболическую и мембранопротекторную терапию. Если заболевание протекает на фоне оксалоза, тогда пациенту обязательно необходим прием витаминов B1, 6, которые помогут улучшить процесс обмена глицина.
Данные вещества можно получать как из комплексных лекарственных препаратов, в составе которых они присутствуют, так и из узкоспециализированных средств. Прием необходимо осуществлять перорально, и обязательно в повышенной дозировке от 20-60 до 100 мг в сутки. Процедуру лучше проводить утром или днем, а средний курс терапии составляет 14-21 день.
Витаминный препарат в оригинальной упаковке. Источник: gosapteka.proЧаще всего терапия состоит из препарата Магне B6, который содержит дополнительно магний и пиридоксин. В детском возрасте разрешен с 12 лет. Пить следует по 1-2 таблетки трижды в день. Продолжительность курса составляет 14-21 день. По такой же схеме можно принимать Мульти Табс B-комплекс. Но продолжительность лечения составит 60-90 дней.
Пить следует по 1-2 таблетки трижды в день. Продолжительность курса составляет 14-21 день. По такой же схеме можно принимать Мульти Табс B-комплекс. Но продолжительность лечения составит 60-90 дней.
Обязательно пациентам с оксалурией и уратурией необходимо принимать витамины A и E, в дозировке, соответствующей возрастной группе. Нередко используется такой медикамент как АЕвит. Для восстановления водно-электролитного баланса и кислотно-щелочной среды, в комплекс вводится раствор Димефосфон в 15% концентрации.
Дозировка рассчитывается согласно массе тела (1 мл на 5 кг веса). Разрешен к приему взрослым и детям по 30-50 мкг/кг. Продолжительность лечения составляет от трех недель до двух месяцев. Поскольку раствор имеет горький привкус, его можно запивать молоком, чаем, фруктовым соком, для облегчения приема.
Среди эффективных метаболических средств хорошо себя зарекомендовал раствор Элькар в 20% концентрации. В каждом миллилитре средства содержится 200 мг активного действующего вещества. Производится во флаконах, объем которых 25, 50 и 100 мл. Внутри находится прозрачная жидкость без запаха, содержащая L-карнитин, идентичный по химическим и биологическим свойствам природному веществу.
Производится во флаконах, объем которых 25, 50 и 100 мл. Внутри находится прозрачная жидкость без запаха, содержащая L-карнитин, идентичный по химическим и биологическим свойствам природному веществу.
Он принимает активное участие в различных обменных процессах, происходящих в организме. Благодаря ему восстанавливается функционирование митохондрий, улучшается энергетический обмен внутри клеток. Препарат характеризуется хорошим уровнем всасываемости в кишечник после перорального приема.
Препарат Элькар для терапии ДН. Источник: lekarstva.plusНаивысший уровень концентрации активного вещества в составе плазмы крови наблюдается спустя 180 минут, а терапевтический эффект сохраняется в течение девяти часов, после чего средство выводится почками. Разрешается использовать для лечения детей, начиная с первого года жизни. Доза индивидуальна и зависит от возраста, курс терапии составляет 30 дней. У препарата отсутствуют противопоказания к использованию.
Для предотвращения патологических изменений в почечных сосудах заключается в контроле и поддержки показателей сахара в составе крови на нормальном уровне. С этой целью рекомендуется вводить в терапевтический комплекс медикаменты, действие которых направлено на понижение выработки глюкозы организмом.
С этой целью рекомендуется вводить в терапевтический комплекс медикаменты, действие которых направлено на понижение выработки глюкозы организмом.
При развитии микроальбинурии обязательно необходимо проводить лечение, направленное на устранение симптоматики артериальной гипертонии. С этой целью используются ингибиторы ангиотензинпревращающих ферментов. В большинстве случаев предпочтение отдается назначению Эналаприла в малых дозах. Также пациенту рекомендуется придерживаться белковой диеты.
Фитотерапия ДН
Помимо медикаментозного лечения при борьбе с дисметаболической нефропатией у детей активно используется фитотерапия. В ней применяются лекарственные препараты, в состав которых входят медикаменты на растительной основе. Стоит отметить, что подобное воздействие на организм используется при различных заболеваниях почек.
В частности при ДН предпочтение в выборе медикаментов отдается тем, которые характеризуются диуретическими и мембраностабилизирующими свойствами. Категорически недопустимо назначать лекарства, в которых присутствует большое количество оксалатов, а также аскорбиновой кислоты.
Категорически недопустимо назначать лекарства, в которых присутствует большое количество оксалатов, а также аскорбиновой кислоты.
При разработке линии фитотерапевтического воздействия необходимо выбирать такую тактику, которая будет наиболее безопасной для пациента. Именно поэтому специалисты нередко вводят в медикаментозный комплекс такие лекарства как Канефрон, Олиметин, Фитолизин, Цистон и Уролесан.
Профилактические мероприятия
Если своевременно выявить дисметаболическую нефропатию у детей, соблюдать клинические рекомендации, придерживаться медикаментозной тактики лечения, а также диетического питания, то в будущем можно рассчитывать на благоприятный прогноз. Положительная динамика фиксируется посредством наблюдения устойчивых нормальных показателей биохимического состава мочи.
Канефрон используют в составе комплексного медикаментозного лечения как фитопрепарат. Источник: gloriamed.ruВ случае отклонения от терапевтической тактики, пренебрежения приемом лекарственных препаратов и неполноценное питание, в последующем у ребенка разовьется мочекаменная болезнь и пиелонефрит. Если имеет место цистиноз, то единственным выходом будет выполнение операции по трансплантации почки.
Если имеет место цистиноз, то единственным выходом будет выполнение операции по трансплантации почки.
Как показывает медицинская практика, такие мероприятия не позволяют исключать летальный исход, поскольку кристаллы цистина откладывают и в трансплантате. Это становится причиной смертности пациентов в возрасте от 15 до 19 лет. Пациенты с данным диагнозом находятся на диспансерном наблюдении у педиатра и нефролога.
О заболевании (видео)
Поделиться:
Дисметаболическая нефропатия у детей и взрослых: причины и лечение
Нарушение обменных процессов отрицательно отражается на работе организма: избыток солей накапливается в суставах, мочевыводящих путях, почках.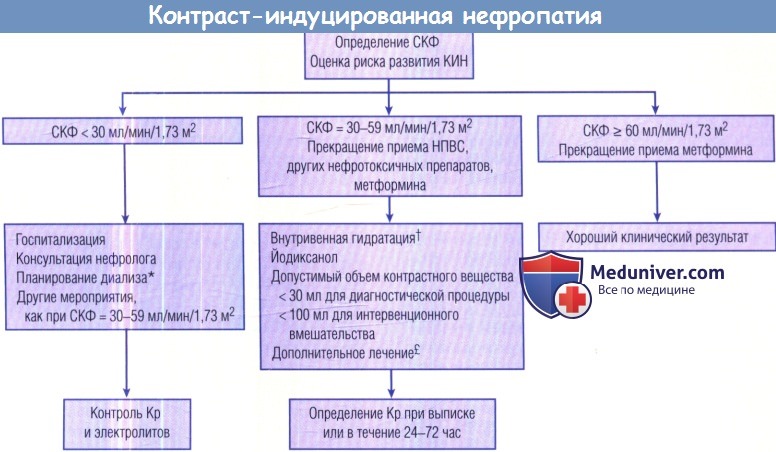 Дисметаболическая нефропатия у детей и взрослых провоцирует почечные патологии, развивается воспаление при сочетании неправильного минерального обмена с проникновением инфекции.
Дисметаболическая нефропатия у детей и взрослых провоцирует почечные патологии, развивается воспаление при сочетании неправильного минерального обмена с проникновением инфекции.
Какие формы дисметаболической нефропатии наиболее опасны? Какие виды пищи можно есть при оксалатной, уратной, фосфатной и смешанной форме заболевания? Какие препараты предупреждают появление камней в почках? Ответы в статье.
Что это такое
Второе название патологии – обменная нефропатия. Этот термин объединяет нарушения в работе почек, вызванные неправильным течением метаболизма. Большая часть негативных процессов связана с накоплением оксалатов, уратов, фосфатов, солей кальция или недостаточным выведением минеральных веществ.
Нередко проблемы возникают в возрасте 5–7 лет, иногда – у новорожденных. Негативные признаки дисметаболической нефропатии проявляются не только в зоне мочевыводящих путей и поясницы, но и затрагивают суставы. Неправильный минеральный обмен провоцирует сбои в работе нервной, сердечно-сосудистой систем, головную боль, ярко-выраженную отечность.
Виды заболевания
Медики выделяют две формы патологии в зависимости от причин:
- первичная обменная нефропатия. Проблема связана с наследственной предрасположенностью. Опасная разновидность заболевания: активно накапливаются конкременты, развивается хроническая почечная недостаточность;
- вторичная обменная нефропатия. Нарушение метаболизма развивается при избыточном продуцировании или слабом выведении определенного вида минеральных солей, длительном приеме медикаментов, поражении почек при эндокринных патологиях и заболеваниях различных органов. При устранении провоцирующих факторов прогноз благоприятный, возможно полное излечение.
Узнайте о причинах бактерий в моче при беременности и об особенностях терапии заболеваний.
Как вывести соли из почек? Эффективные методы лечения собраны в этой статье.
Нарушение обмена определенного вида солей вызывает следующие виды дисметаболической нефропатии:
- Фосфатная.
Причины поражения почечной ткани – неправильный метаболизм солей кальция и фосфора. Избыточное накопление фосфатов и кальцинатов часто развивается на фоне недолеченных патологий мочевыводящих путей.
- Оксалатная. Проблема возникает при неправильном питании (избыток щавелевой кислоты), частых стрессах, плохой экологии, воздействии радиации, наследственной предрасположенности. В моче медики выявляют оксалатные кристаллы, эритроциты, лейкоциты, белок. Накопление оксалатов провоцирует образование труднорастворимых конкрементов, воспалительный процесс на фоне проникновения бактерий.
- Уратная. Опасность нарушения обмена мочевой кислоты – длительное бессимптомное течение. Нередко патология появляется в детстве, но ярко-выраженные признаки пациент фиксирует через несколько лет. Уратная нефропатия чаще развивается у мужчин. Причины: неправильное питание, избыток мяса, пива, крепкого кофе, субпродуктов, врожденные нарушения обмена мочевой кислоты, прием определенных медикаментов, сбои в работе почечных канальцев, резкое изменение уровня рН мочи и состава урины.
- Оксалатно-кальциевая. Нарушение чаще диагностируют у детей. Заболевание развивается при повышенном содержании оксалатов в пище, заболеваниях кишечника. Нередко неправильный минеральный обмен связан с врожденными нарушениями метаболизма: организм вырабатывает избыточное количество оксалатов.
- Цистиноз. При метаболизме метионина вырабатывается цистин. Избыток вещества появляется при наследственных нарушениях обмена цистинредуктазы. Повышенное содержание цистина медики выявляют в нефронах и урине. Кристаллы накапливаются не только в мочевыводящих путях, но и в лимфоузлах, нейронах, мышечной ткани, селезенке, печени. Цистиноз – это системное нарушение метаболизма. В раннем детстве симптоматика слабо-выражена, отсутствие терапии при скрытом течении патологии приводит к накоплению цистиновых камней в почках, воспалительным процессам на фоне застоя мочи.
Причины развития патологии
Нарушенный солевой обмен – результат влияния нескольких отрицательных факторов.
Причины дисметаболической нефропатии бывают врожденными и приобретенными. В первом случае бороться с последствиями тяжело, требуется поддерживающая терапия, у пациентов часто развиваются тяжелые поражения почек. Второй вариант нарушений проще устранить, если выяснить, действие каких факторов спровоцировало нарушение минерального обмена.
У детей
В раннем возрасте и у дошкольников проявляются отрицательные симптомы на фоне врожденных проблем с почками, нарушением усвояемости определенных ферментов. Дисметаболические нарушения на ранней стадии протекают без характерной симптоматики. Неправильное питание, стрессы усиливают тяжесть патологии.
Если организм продуцирует избыточное количество солей, например, уратов или оксалатов, то болезнь быстро прогрессирует, в почках, суставах активно накапливаются кристаллы. При появлении избытка минеральных отложений в урине (по результатам общего анализа мочи) нельзя медлить с визитом к нефрологу или детскому урологу: первичная форма дисметаболической нефропатии быстро прогрессирует, возможны опасные осложнения.
У взрослых
Многие виды обменной нефропатии имеют вторичный характер. Взрослые часто провоцируют сбои в обменных процессах нарушением правил питания, бесконтрольным приемом лекарств. Ежедневное употребление крепкого кофе (по несколько чашек) и пива, обилие в меню мясных блюд, кислых фруктов, овощей, потребление сверх меры молочных продуктов приводит к накоплению вредных солей. Почки не успевают вывести минеральные отложения, избыток оседает в тканях и органах.
Существуют и другие причины:
- воздействие ионного излучения;
- вода с избытком кальцинатов;
- эндокринные патологии;
- гормональные сбои;
- хронические заболевания различных органов.
Дисметаболическая нефропатия код по МКБ – 10 – N00-N08 (класс Гломерулярные болезни).
Первые признаки и симптомы
Нарушение метаболизма провоцирует накопление солевых отложений в почечной ткани. Песок и камни закупоривают мочеточники, царапают нежные ткани, вызывают болезненные ощущения.
Появляются сложности с выведением урины, в застоявшейся моче активно размножаются вредные бактерии.
Основные признаки:
- дизурия;
- головные и суставные боли;
- пониженное давление;
- при поколачивании по области поясницы и суставным поверхностям ощущается болезненность;
- уменьшается аппетит;
- отечность век и суставов;
- эпидермис становится суше, шелушится;
- усиливается потливость;
- часто мучает жажда;
- развивается недержание мочи;
- мучают запоры.
На заметку! Дисметаболическая нефропатия имеет характерные признаки. У взрослых и детей отрицательные проявления во многом схожи, но у дошкольников возможна задержка физического развития даже при отсутствии ярко-выраженной симптоматики. При соблюдении диеты негативная симптоматика слабеет, песок и камни растворяются, исчезают без отрицательных последствий для организма.
Диагностика
При выявлении кристаллов в урине медики всегда назначают повторную сдачу материала для исследования.
Нередко употребление определенной пищи влияет на уровень мочевой кислоты, других продуктов минерального обмена. Для подтверждения дисметаболической нефропатии, при первичном выявлении кристаллов цистина назначают биохимический анализ выведенной жидкости.
Для оценки работы органа проводят УЗИ почек. По результатам исследования врач получает полную картину изменений: наличие конкрементов и песка, участки уплотнения паренхимы, признаки воспалительного процесса.
Общие правила и методы лечения
Направления терапии:
- предупредить дальнейшее накопление солей в организме;
- активизировать минеральный обмен;
- растворить и вывести песок, камни из почек и мочевыводящих путей;
- купировать воспаление при наличии бактериальной инфекции либо асептического процесса;
- улучшить работу мочевыделительной системы;
- снизить риск бактериурии при застойных явлениях;
- избавить от негативной симптоматики, нормализовать почечное давление;
- прекратить неконтролируемый выброс мочи;
- предупредить развитие почечной недостаточности.
Почему у мужчины красная моча и как лечить сопутствующие патологии? У нас есть ответ!
Список и особенности применения гомеопатических препаратов для лечения почек можно увидеть в этой статье.
Перейдите по адресу https://vseopochkah.com/bolezni/drugie/pieloetaziya-sprava.html и узнайте о причинах пиелоэктазии правой почки и о вариантах терапии заболевания.
Рекомендации:
- употреблять больше жидкости для промывания бобовидных органов и мочевого пузыря, удаления мелких конкрементов и песка;
- выпивать за час до сна чистую воду: опорожнение пузыря снижает риск застоя урины и воспаления в мочевыводящих путях;
- уменьшение нормы соли: снижается риск отечности, показатели давления приходят в норму;
- при воспалительных процессах рекомендованы уросептики, антибиотики. Положительно влияют на состояние пораженных тканей противомикробные препараты – нитрофураны;
- для удаления мочи при застойных явлениях назначают диуретики.
Оптимальный вариант – препараты с минимальным перечнем побочных эффектов. По назначению врача можно пить почечный чай, клюквенный морс, отвар из брусники, листьев березы, толокнянки, кукурузных рылец, петрушки, плодов и корней шиповника;
- при спазмах и болевом синдроме назначают анальгетики, спазмолитики. По мере улучшения состояния препараты отменяют.
Питание при нарушении метаболизма
Диета – важный нюанс при лечении обменной нефропатии. Исключение определенных продуктов снижает риск накопления минеральных отложений, положительно влияет на метаболизм. Для каждого вида патологии врачи составили перечень продуктов, которые не стоит включать в меню.
Ограничения:
- уратная нефропатия. Крепкие мясные бульоны, субпродукты, бобовые, орехи. Нежелательно употреблять шоколад, телятину и говядину, треску, черный чай, кофе;
- цистиноз. Важно отказаться от рыбы, мясных продуктов, яиц (в любом виде), творога;
- оксалатная нефропатия.
Пациентам не подходят холодцы, наваристые мясные и рыбные бульоны, какао и шоколад, шпинат, щавель, клюква. Свекла и морковь разрешена в минимальном количестве, обязательно в отварном виде;
- фосфатный вид нефропатии. Не стоит есть шоколад, сыры, субпродукты, куриное мясо, бобовые культуры.
Для профилактики обменных нарушений важно употреблять все продукты в умеренном количестве, каждый день пить достаточно жидкости, обращать внимание на первые признаки почечных патологий. Обязательно придерживаться диеты в зависимости от выявленной разновидности патологии. При хроническом течении заболеваний важно регулярно посещать лечащего врача, соблюдать правила, предупреждающие обострения. Дети и взрослые с врожденной формой дисметаболической нефропатии состоят на учете у нефролога или уролога.
Подробнее о причинах, симптомах и особенностях терапии дисметаболической нефропатии у детей расскажет педиатр в следующем ролике:
клинические рекомендации, лечение и диета
Среди нефрологических патологий в педиатрии распространена дисметаболическая нефропатия у детей.
Ее частотность составляет до 60% от всех заболеваний мочеполовой системы у детей. Болезнь имеет сложный патогенез и может стать причиной других болезней мочевыделительной системы.
Что такое дисметаболическая нефропатия?
Это заболевание вызвано нарушением обменных процессов, в результате чего изменяется состав мочи. В ней обнаруживается повышенное содержание белка, эритроцитов, лейкоцитов и солей. Последние приводят к возникновению камней и развитию мочекаменной болезни, повреждению почечных структур, нарушению функционирования почек.
Дисметаболическая нефропатия у детей сопровождается структурными изменениями почек
К сожалению, за последние годы дисметаболическая нефропатия (ДН) помолодела. Она диагностируется даже у детей младшей возрастной группы, в возрасте 4–5 лет, что значительно ухудшает прогнозы.
Причины
Дисметаболическая нефропатия чаще развивается у детей при воздействии нескольких предрасполагающих факторов, которые могут быть внутренними или внешними.
К первым принадлежат обменные нарушения, в частности нарушенный обмен оксалатов, кальция, фосфатов, уратов, цистина, триптофана.
Не последнюю роль в появлении ДН играют такие факторы:
- наследственность;
- врожденные аномалии почек и мочевых путей;
- избыток или дефицит витаминов и полезных веществ – А, В6, С, Д, Е, магния и калия;
- гемолитическая анемия;
- энтерит, колит, болезнь Крона;
- панкреатит;
- мезаденит;
- болезни желудочно-кишечного тракта;
- глистные инвазии;
- сахарный диабет;
- эндокринные нарушения, например гиперфункция паращитовидных желез;
- пиелонефрит;
- дискинезия желчевыводящих путей;
- миеломная болезнь;
- инфекция мочевыводящих путей;
- онкологические заболевания, когда есть необходимость проведения курса химиотерапии или облучения.
Вероятность появления признаков данной болезни повышается при воздействии внешних факторов.
К ним принадлежат:
- интоксикация или отравление;
- прием медикаментов, в частности длительная терапия цитостатиками, диуретиками, циклоспоринами или салицилатами;
- неправильное или скудное питание, повышение доли животных белков, щавелевой кислоты в рационе ребенка;
- сухой и жаркий климат, воздействие интенсивного ультрафиолетового излучения;
- неблагоприятная экологическая обстановка;
- несоблюдение питьевого режима, употребление воды повышенной жесткости;
- тяжелые физические нагрузки.
В группе риска также находятся дети, рожденные при беременности, протекавшей с гипоксией и токсикозом.
Классификация
Согласно этиологии происхождения существует две формы:
- первичная – вызвана наследственной предрасположенностью и возникшими вследствие этого обменными нарушениями;
- вторичная – развивается на фоне болезней, воздействия неблагоприятных факторов окружающей среды.
Первичная форма чаще сопровождается возникновением осложнений.
Существует классификация в зависимости от состава солей. Есть такие разновидности ДН:
- оксалатная;
- фосфатная;
- уратная;
- цистиновая;
- смешанная.
Первая разновидность встречается в 80–90% случаев, вызвана нарушенным обменом кальция.
Симптомы
Для заболевания характерно латентное течение, то есть болезнь может не давать о себе знать длительное время. Чаще выявляется случайно в ходе обследования. Именно изменение мочи – первый признак ДН. Меняется не только ее состав, но также и цвет. Она становится мутной; если долго находится в горшке, то выпадает осадок, на стенках может оставаться налет, который без бытовой химии тяжело удалить.
При образовании камней симптомы становятся более выраженными
Основные признаки болезни:
- головная боль;
- усталость;
- мышечная слабость;
- боль в пояснице, в области почек;
- субфебрильная температура тела;
- покраснение в области половых органов, зуд, дискомфортные ощущения;
- вздутие живота;
- аллергические высыпания на коже;
- понижение артериального давления;
- вегето-сосудистая дистония;
- лишний вес.
Накопление солей сопровождается воспалением, запускается процесс формирования камней, мочеиспускание становится болезненным, возможен энурез.
Диагностика
При появлении симптомов ДН ребенка нужно показать педиатру, а затем нефрологу и урологу. Именно эти специалисты назначат комплексное обследование:
- общий анализ мочи;
- пробы мочи по Земницкому;
- моча по Нечипоренко;
- определение кислотности.
Если в анализах заметны отклонения, назначается инструментальная диагностика, которая предполагает УЗИ органов мочевыделительной системы.
Лечение
Терапия не базируется на одних только медицинских препаратах. Основу составляет изменение рациона питания и питьевого режима. Клинические рекомендации следующие:
- увеличение объема потребляемой жидкости до 1,5–2 литров в день;
- принудительное мочеиспускание каждые 2 ч. для очищения почек;
- диета.
Без диетического питания выздоровление невозможно. Подбор диеты осуществляется врачом исходя из вида заболевания. При оксалатной ДН стоит отдать предпочтение капусте и картофелю. Именно эти овощи снижают уровень оксалатов. Полезно есть сухофрукты, пить минеральную воду. Нужно отказаться от наваристых мясных бульонов, свеклы, моркови, щавелевой кислоты, которая содержится в щавеле, а также от продуктов, содержащих какао.
Клинические рекомендации играют важную роль в лечении
При повышении содержания уратов стоит исключить мясные блюда, животные субпродукты и бобовые. Полезна молочная продукция и растительная пища. При фосфатной ДН стоит ограничить потребление фосфатных продуктов, например бобовых, шоколада. Подкисление мочи производится с помощью минеральной воды. Также оправдан прием витамина С.
При цистинозе нельзя употреблять в пищу продукты, богатые серой и метионином. Поэтому из рациона ребенка исключается рыбная и мясная пища, под запретом творог и яйца.
Диетического питания стоит придерживаться не менее месяца. Возвращаться к обычному меню можно только после одобрения врача.
В лечении заболеваний мочевыводящей системы важен именно питьевой режим. Чем чаще происходит мочеиспускание, тем меньше вероятность отложения солей и формирования камней.
Одновременно с диетическим питанием проводится медикаментозное лечение, которое предполагает использование антиоксидантов, фитопрепаратов и витаминных средств. Медикаменты назначаются врачом.
При отсутствии правильного и эффективного лечения могут возникнуть последствия в виде моче- или желчнокаменной болезни, пиелонефрита, цистита, артропатии, подагры. Самым тяжелым осложнением является почечная недостаточность.
Профилактика
Профилактические мероприятия предполагают терапию существующих заболеваний и поддержание нормальных обменных процессов. Важно обеспечить ребенка всеми необходимыми питательными веществами, для этого питание должно быть сбалансированным, пищевая ценность продуктов подобрана по возрасту.
При обменных нарушениях нужно придерживаться диеты. Также необходимо укреплять иммунитет ребенка, не допускать переохлаждения и оградить малыша от сильных стрессов.
Прогноз при данном заболевании благоприятный. Главное – нормализовать состав мочи до появления осложнений. После стоит беречь ребенка, поскольку он находится в группе риска, важно следить за тем, что он ест и сколько он пьет жидкости.
Читайте также: цистит у детей
Неинтервенционное проспективное многоцентровое исследование по оценке использования лекарственного растительного препарата Канефрон® Н в педиатрической амбулаторной популяции в России | Clinical Phytoscience
С сентября 2015 г. по июнь 2016 г. в 26 центрах было включено 636 детей. Из них 620 пациентов завершили исследование по протоколу (Таблица 1), 16 пациентов были преждевременно прекращены из-за НЯ ( n = 8), потери для последующего наблюдения ( n = 5) и по другим причинам ( n ).
Таблица 1 Расположение пациентов Таблица 2 Характеристики пациентов (все включенные пациенты)= 3).В общей сложности 634 пациента (99,7% всех включенных в исследование пациентов) получили по крайней мере одну дозу HMP и были включены в набор безопасности, который использовался для анализа (проценты относятся к набору безопасности, если не указано иное). Подгруппа из 37 пациентов уже начала лечение HMP до включения в ННГ. Характеристики пациентов приведены в таблице 2.
Пероральный раствор HMP был назначен 66 пациентам.4% включенных пациентов, а таблетки назначены 33,6% включенных пациентов. Большинству детей младше шести лет раствор назначался (таблица 2). Разницы в гендерном распределении между раствором и таблетками не наблюдалось.
Большинство пациентов (98,3%) принимали HMP 3 раза в день. У 48% пациентов HMP был назначен для лечения острого или хронического заболевания, 25% пациентов получали HMP для профилактики, а 27% пациентов HMP был назначен как для профилактики, так и для лечения.
Распределение пациентов, принимавших раствор или таблетки, было аналогичным.
75,2% всех пациентов HMP был назначен по показаниям, закодированным в Системном классе органов (SOC) «Инфекции и инвазии». В рамках этого SOC наиболее частыми показаниями были ИМП (34,1%) и пиелонефрит (30,0%). Для 36% пациентов показания SOC «Заболевания почек и мочевыводящих путей» были задокументированы как причина для лечения с помощью HMP (Таблица 3). В некоторых случаях HMP использовался при немаркированных показаниях, таких как нейрогенный мочевой пузырь, гидронефроз и гипотонический мочевой пузырь.В редких случаях (1,6%) ГМП назначали по показаниям в рамках SOC «Врожденные, семейные и генетические нарушения».
Таблица 3 Показания к лечению (> 3%) (Набор безопасности)Пациенты были распределены следующим образом на шесть групп показаний для дальнейшего анализа (Таблица 4): группа неуточненных ИМП (216 пациентов), группа «пиелонефрит» (190 пациентов). ), дисметаболическая нефропатия / кристаллурия (120 пациентов), группа «цистит» (73 пациента), мочекаменная болезнь (26 пациентов) и группа «нефрит» (23 пациента).
Таблица 4 Группы показанийИз 120 пациентов с дисметаболической нефропатией / кристаллурией у 106 пациентов (88%) была гипероксалурия, а у 31 пациента (26%) была гиперкальциурия (у пациента могло быть более одного диагноза — у 120 пациентов было 150 диагнозов).
Доля ИМП была самой высокой в самой молодой возрастной группе (51%) и снизилась у пациентов старшего возраста, тогда как доля показаний группы «цистит» увеличилась у пациентов старше 2 лет. Соответствующие пропорции мочекаменной болезни и признаки группы «нефрит» наблюдались только у пациентов в возрасте от 12 до 17 лет (рис.2). Показания группы «цистит» чаще встречались у пациентов женского пола, чем у пациентов мужского пола (15% против 1%), тогда как признаки группы «нефрит», мочекаменная болезнь и дисметаболическая нефропатия / кристаллурия чаще встречались у пациентов мужского пола (рис. 3).
Рис. 2Распределение групп показаний по возрасту
Рис.3
Распределение групп показаний по полу
392 пациента (61,8%) получали сопутствующие препараты в любой момент наблюдения, т.е.е. не обязательно одновременно с лечением HMP. 377 из этих пациентов получали сопутствующие лекарства вместе с HMP и, таким образом, были классифицированы как пациенты с комбинированной терапией, а 257 были пациентами монотерапии. Пациенты с монотерапией — это пациенты, которые могли получать сопутствующие лекарства, но не одновременно с лечением HMP, или у которых вообще не было сопутствующих лекарств. 22% пациентов получали одно комбинированное лекарство, 16% получали два комбинированных препарата, а 9% получали три или более комбинированных препарата.Группой показаний с наибольшей долей пациентов, получавших комбинированную терапию, был нефрит (65%, рис. 4). Самые высокие показатели использования монотерапии наблюдались при дисметаболической нефропатии / кристаллурии (61%), мочекаменной болезни (58%) и инфекциях мочевыводящих путей, а также «цистите» (по 51%) (рис.
Рис. 44).
Сопутствующее лечение при включении по группам показаний (Safety Set)
Назначенная продолжительность приема HMP варьировала от 7 до 84 дней.В среднем, HMP принимался примерно на два дня дольше, чем предписано исследователями, что привело к степени соблюдения 106,3 ± 23,6% без заметных различий между лекарственными формами и группами показаний. Средняя продолжительность лечения была самой короткой для ИМП и самой продолжительной для группы «нефрит» (рис. 5). Фактическая продолжительность приема HMP составляла 30,6 дня у пациентов, получавших монотерапию, и на 32,5 дня несколько больше, если HMP принимался в сочетании с другим лечением.Продолжительность лечения не различалась между пациентами, получавшими профилактику, лечение или и то, и другое. После шести недель лечения у большинства пациентов отмечалось уменьшение симптомов мочеиспускания (например, бледности кожи, частых и порционных изменений мочеиспускания, макроскопических изменений мочи).
Рис. 5Анализ исходов заболевания мочевыводящих путей в конце периода наблюдения показал, что заболевание не разрешилось менее чем у 4% всех включенных пациентов. К концу исследования сообщалось, что 20% пациентов выздоровели от болезни, а у 65% отмечалось улучшение.13% сообщили об отсутствии изменений, а 1% сообщили об ухудшении или рецидиве (в каждом случае). Самый высокий показатель выздоровления был отмечен при ИМП (37,4%). Всего на 10% больше пациентов, которые оценили «выздоровление» в конце исследования, чем на 2-м визите, и на 5% меньше оценок «без изменений» в конце исследования, чем на 2-м визите, тогда как количество пациентов с ухудшением и рецидив не изменился (рис. 6).
Средняя продолжительность лечения на группу показаний (Safety Set)
Рис.6Исходы заболеваний мочевыводящих путей (набор безопасности, пациенты с доступными данными о результатах)
Для 88% и 91% всех пациентов с монотерапией HMP исследователи оценили эффективность HMP как «хорошо» или «очень хорошо» во время визита 2.
Рис. 7(2 неделя) и в конце исследования соответственно. Доля оценки эффективности как «очень хорошая» увеличивалась за период наблюдений (рис. 7 и 8). Различий между монотерапией и комбинированной терапией не наблюдалось.Пациенты оценивали эффективность аналогично исследователям.
Оценка исследователями эффективности при посещении 2 (монотерапия)
Рис. 8Оценка исследователями эффективности в конце исследования (монотерапия)
99% пациентов оценили переносимость как «хорошо» или очень хорошо »в конце исследования. Во всех возрастных группах соотношение оценок «хорошо» и «очень хорошо» было одинаково высоким (рис. 9). 96 нежелательных явлений (НЯ) были зарегистрированы у 82 (12.9%) пациентов в течение периода наблюдения, причем наиболее часто регистрировались «инфекции и инвазии» (55 пациентов) и «почечные и мочевыводящие расстройства» (11). Наиболее частыми НЯ по предпочтительному термину были «вирусная инфекция дыхательных путей» (15 пациентов), «назофарингит» (7), «цистит» (5) и «инфекция дыхательных путей» (5).
Рис. 9Все другие НЯ были зарегистрированы у ≤4 пациентов. Большинство НЯ были легкой степени (67 пациентов). Тяжелых НЯ не было.
Оценка переносимости пациентами в конце исследования (монотерапия)
Неблагоприятные лекарственные реакции (НЛР) были зарегистрированы только у 5 пациентов: у 3 пациентов был аллергический дерматит, у 1 — диспепсия у пациента и у 1 ‘почечная колика’.4 из этих пациентов относились к группе комбинированной терапии и только 1 пациент («аллергический дерматит») к группе монотерапии. Одна побочная реакция («почечная колика») в группе комбинированной терапии была оценена как серьезная. Почечная колика привела к отхождению почечного камня.
Только 8 (1,3%) пациентов преждевременно отказались от НИС из-за побочных эффектов / нежелательных реакций (монотерапия: 3, комбинированная терапия: 5), в том числе 3 пациента с дерматитом и 1 пациент с функциональными желудочно-кишечными расстройствами, рвотой, пиелонефритом, ИМП, и почечная колика (Таблица 5).
Таблица 5 Побочные реакции на лекарственные препараты во время периода наблюдения (набор безопасности без 37 пациентов, которые начали прием ГМФ до включения в исследование)Прогнозирование течения хронического пиелонефрита у детей
ПЕРИНАТОЛОГИЯ И ПЕДИАТРИЯ.2019.2 (78): 32-37; doi 10.15574 / PP.2019.78.32
Абатуров О. Е., Вакуленко Л. И.
ГУ «Днепропетровская медицинская академия МОЗ Украины», г. ДнепрВведение. Определяющими факторами, способствующими развитию и прогрессированию хронического пиелонефрита (ХПН) у детей, является своевременное принятие профилактических и адекватных лечебных мероприятий, улучшающих прогноз заболевания и снижающих прогрессирование хронической болезни почек.
Цель — определение прогностических факторов развития ХПН у детей для проведения ранней диагностики и своевременного лечения.
Пациенты и методы.
Проведен анализ 176 случаев хронического пиелонефрита у детей от 1 года до 18 лет.В группу сравнения вошли 74 ребенка с острым пиелонефритом, выздоровевшим. Для выявления ведущих прогностических факторов риска развития ХПН у детей и определения наиболее информативных показателей использовались теорема Байеса и последовательный анализ Вальда с оценкой информативности признаков, рассчитанной по критерию Кульбака (І). Знак с коэффициентом 1 и более 0,5 считался информативным.
Результаты. Высокую прогностическую информативность для развития хронического пиелонефрита у детей имели 11 клинико-лабораторных факторов риска: аномалии мочевыделительной системы, уродинамические нарушения (пузырно-мочевой рефлюкс), затяжное течение первого эпизода пиелонефрита или рецидив в течение 3 месяцев; наличие более 5 дизэмбриогенных рыльц; урогенитальный микоплазмоз у девочек; артериальная гипертензия; нормохромная анемия в дебюте болезни; нейрогенная киста / энурез; оксалатная дисметаболическая нефропатия с экскрецией оксалата кальция более 1,5 мг / кг / сут; гидронефроз; сопутствующие хронические очаги инфекции.Для более информативных прогностических признаков хронического пиелонефрита в их суммировании рассчитаны диагностические коэффициенты, возможно накопление диагностической информации. Вставив диагностические симптомы, полученные при осмотре пациента, в таблицу, можно вычислить сумму соответствующих диагностических коэффициентов. При сумме диагностических коэффициентов, равных (+13), прогнозируется вероятное развитие хронического пиелонефрита с вероятностью ошибки <5% (p <0,05); при сумме диагностических коэффициентов равных (+20) вероятность прогноза составляет 99% (p <0.01). Если сумма диагностических коэффициентов меньше (+13) и больше (-13), делается вывод о недостаточном количестве информации для принятия решения о вероятном развитии хронического пиелонефрита с заданным уровнем ошибки (отрицательный ответ ).
Выводы. Таблица прогнозов может использоваться для определения вероятности развития хронического пиелонефрита у детей в возрасте от 1 до 18 лет.
Ключевые слова: детей, хронический пиелонефрит, хроническая болезнь почек, факторы риска, прогноз.
ССЫЛКИ
1. Борисова Т.П., Багдасарова И.В. (2012). Инфекции мочевыводящей системы у детей. Пиелонефрит. Диагностические подходы и лечебная тактика на уровне первичной медико-санитарной помощи. Здоровье ребенка. 4 (39): 9–13.
2. Вакуленко Л.И. (2018). Дисметаболическая нефропатия как фактор риска развития пиелонефрита у детей. Здоровье ребенка. 1 (13): 85–89. https://doi.org/10.22141/2224-0551.13.1.2018.127063
3.Иванов ДД. (2009). Артериальная гипертензия у детей и подростков: нефрологический аспект. Детский врач. 2 (2): 22–25.
4. Лукьяненко Н.С., Петрица Н.А., Кенс К.А. (2015). Место недифференцированной дисплазии соединительной ткани в детской патологии (обзор литературы). Здоровье ребенка. 2 (61): 80–85.
5. Макеева Н.И., Морозова О.О. (2018). Уровень биологических маркеров фиброгенеза и ангиогенеза в моче у детей с пузырно-уретральным рефлексом. Здоровье ребенка. 13 (5).URL: http://www.mif-ua.com/archive/article_print/46422. https://doi.org/10.22141/2224-0551.13.5.2018.141560
6. Мальцев С.В., Мансурова ГШ. (2012). Инновационный подход к оценке факторов риска заболеваний почек у детей. Международный журнал педиатрии, акушерства и гинекологии. 2 (3): 5–11.
7. Просова Е.Е., Горемыкин В.И. (2018). Прогнозирование обострений хронического пиелонефрита у детей. Современные проблемы науки и образования. 6. ISSN 2070-7428.URL: http://www.science-education.ru/ru/article/view?id=28318.
8. Савенкова Н.Д. (2017). Почечная артериальная гипертензия у детей и подростков: причины, классификация, диагностика. Российский вестник перинатологии и педиатрии. 62 (4): 43–48. https://doi.org/10.21508/1027-4065-2017-62-4-43-48.
9. Амансио Л., Федрицци М., Брезолин Н.Л., Пенидо М.Г. (2016). Детская мочекаменная болезнь: опыт работы в педиатрической больнице третичного уровня. J Bras Nefrol. 38 (1): 90–98. https: // doi.org / 10.5935 / 0101-2800.20160014; PMid: 27049370.
10. Arena S, Iacona R, Impellizzeri P, Russo T., Marseglia L, Gitto E, Romeo C. (2016). Патология пузырно-мочеточникового рефлюкса. Ital J Pediatr. 42: 103. https://doi.org/10.1186/s13052-016-0316-x; PMid: 27899160 PMCid: PMC5129198.
11. Аткинсон М.А., Сяо Р., Коттген А., Вул Э., Вонг С.С., Вуттке М. и др. (2019). Генетические ассоциации гемоглобина у детей с хронической болезнью почек в Консорциуме PediGFR. Pediatr Res.85 (3): 324–328. https://doi.org/10.1038/s41390-018-0148-z; PMid: 30140068 PMCid: PMC6377354.
12. Бечеруччи Ф., Роперто Р.М., Матерасси М., Романьани П. (2016). Хроническая болезнь почек у детей. Clin Kidney J. 9 (4): 583–591. https://doi.org/10.1093/ckj/sfw047; PMid: 27478602 PMCid: PMC4957724.
13. Cheung KK, Montgomery D, Benjamins LJ. (2015). Распространенность инфекций, передаваемых половым путем, среди подростков, обращающихся в службы защиты детей. J Pediatr Adolesc Gynecol.28 (5): 324–326. https://doi.org/10.1016/j.jpag.2014.09.011; PMid: 26094906 PMCid: PMC4478275
14. Frej-Madrzak M, Teryks-Wolyniec D, Jama-Kmiecik A, Sarowska J et al. (2015). Диагностика инфекций мочевыводящих путей Chlamydia Trachomatis — предварительный отчет. Adv Clin Exp Med. 24 (3): 441–445. https://doi.org/10.17219/acem/43719; PMid: 26467132
15. Хайд Б., Текгул С. (2017). Первичный и вторичный энурез: патофизиология, диагностика и лечение. Eur Urol Focus. 3: 198–206.https://doi.org/10.1016/j.euf.2017.08.010; PMid: 28888814.
16. Харамбат Дж., Ван Стрален К.Дж., Ким Дж. Дж., Тизард Э.Дж. (2012). Эпидемиология хронической болезни почек у детей. Педиатр Нефрол. 27 (3): 363–373. https://doi.org/10.1007/s00467-011-1939-1; PMid: 21713524 PMCid: PMC3264851.
17. Хьюитт И.К., Монтини Г. (2011). Детские фебрильные инфекции мочевыводящих путей: текущее состояние дел. Ital J Pediatr. 30: 37–57. https://doi.org/10.1186/1824-7288-37-57; PMid: 22128870 PMCid: PMC3269370
18.Цзян Р., Келли М.С., Раус Дж. (2018). Оценка детской дисфункции кишечника и мочевого пузыря: критическая оценка литературы. J Pediatr Urol. 14 (6): 494–501. https://doi.org/10.1016/j.jpurol.2018.08.010; PMid: 30297226.
19. Заболевание почек: улучшение глобальных результатов (KDIGO), рабочая группа по ХБП. (2012). KDIGO Руководство по клинической практике анемии при хронической болезни почек. Kidney Int Suppl. 2 (4): 331–335.
20. Заболевание почек: улучшение глобальных результатов (KDIGO), рабочая группа по ХБП.(2013). KDIGO 2012 Руководство по клинической практике для оценки и ведения хронической болезни почек. Kidney Int Suppl. 3 (1): 1–150.
21. Михаил А., Браун С., Уильямс Дж. А., Матрани В., Шривастава Р., Эванс Дж., Исаак Х., Бхандари С. (2017). Руководство по клинической практике почечной ассоциации по анемии при хронической болезни почек. BMC Nephrol. 18 (1): 345. https://doi.org/10.1186/s12882-017-0688-1; PMid: 29191165 PMCid: PMC5709852.
22. Морин Ф., Ахавизадеган Х., Кавана А., Мур К.(2018, апрель). Дисфункциональное мочеиспускание: проблемы перехода болезни из детства во взрослую жизнь.Can Urol Assoc J. 12; 4; Дополнение 1: S42 – S47. https://doi.org/10.5489/cuaj.5230; PMid: 29681274 PMCid: PMC5926919.
23. Морозова О. (2018). Особенности формирования и прогрессирования хронической болезни почек у детей с пиелонефритом и пузырно-мочеточниковым рефлюксом. Интер Коллегас. 3 (5): 132–136. https://doi.org/10.35339/ic.5.3.132-136
24. Парк Ю.С. (2012). Образование почечных рубцов после инфекции мочевыводящих путей у детей.Корейский J Pediatr. 55 (10): 367–370. https://doi.org/10.3345/kjp.2012.55.10.367; PMid: 23133482 PMCid: PMC3488611
25. Радмайр С., Богерт Дж., Доган Х.С., Коцвара Р., Ниджман М., Стейн Р. и др. (2018). Рекомендации ЕАУ по детской урологии: 159. ISBN 978-94-92671-01-1.
26. Соуза А.С., Вейга М.Л., Брага А.А., Карвалью М.К., Баррозу У. (2016). Энурез и гиперактивный мочевой пузырь у детей: какова связь между этими двумя состояниями? Int Braz J Urol. 42 (4): 798–802. https: // doi.org / 10.1590 / S1677-5538.IBJU.2015.0579; PMid: 27564293 PMCid: PMC5006778.
27. Y1lmaz I, Peru H, Y1lmaz FH, Sekmenli T., Ciftci I, Kara F. (2018). Ассоциация пузырно-мочеточникового рефлюкса и рубцевания почек при инфекциях мочевыводящих путей. Арка Арджента Мередит. 116 (4): e542-e547. https://doi.org/10.5546/aap.2018.eng.e542.
28. Зи Р.С., Хербст К.В., Ким С., Маккенна П.Х., Бентли Т., Купер С.С., Херндон С.Д. (2016). Инфекции мочевыводящих путей у детей с пренатальным гидронефрозом: оценка риска, проведенная Регистром гидронефроза Общества урологии плода.J Pediatr Urol. 2 (4): 261. e1-7. https://doi.org/10.1016/j.jpurol.2016.04.024; PMid: 27290614
Товар получен : 18 января 201 9 . Принята к публикации : 11 июня 201 9 .
Факторы риска, диагностика и осложнения
Что такое метаболический синдром?
Метаболический синдром — это группа из пяти факторов риска, которые увеличивают вероятность развития сердечных заболеваний, диабета и инсульта.Пятью факторами риска являются:
- повышенное артериальное давление (более 130/85 мм рт. или HDL
Наличие одного из этих факторов риска не означает, что у вас метаболический синдром. Однако наличие одного увеличивает ваши шансы на развитие сердечно-сосудистых заболеваний. Наличие трех или более из этих факторов приведет к диагностике метаболического синдрома и увеличит риск осложнений для здоровья.
Американская кардиологическая ассоциация (AHA) сообщает, что в настоящее время метаболический синдром есть у 23 процентов взрослых.
Факторы риска метаболического синдрома связаны с ожирением. Два наиболее важных фактора риска определены Национальным институтом сердца, легких и крови как:
- центральное ожирение или избыточный жир вокруг средней и верхней части тела
- инсулинорезистентность, которая затрудняет работу организма. употреблять сахар
Есть и другие факторы, которые могут увеличить риск метаболического синдрома.К ним относятся:
- возраст
- семейный анамнез метаболического синдрома
- недостаточная физическая нагрузка
- женщины, у которых был диагностирован синдром поликистозных яичников
Чтобы диагностировать метаболический синдром, вашему врачу потребуется выполнить несколько различных тестов. Результаты этих тестов будут использоваться для поиска трех или более признаков расстройства. Ваш врач может проверить одно или несколько из следующего:
- окружность талии
- триглицериды крови натощак
- уровень холестерина
- артериальное давление
- уровень глюкозы натощак
аномалии, отмеченные в трех или более из этих тестов, будут указывать на наличие метаболического синдрома.
Осложнения, которые могут возникнуть в результате метаболического синдрома, часто бывают серьезными и долгосрочными (хроническими). К ним относятся:
- склерозирование артерий (атеросклероз)
- диабет
- сердечный приступ
- болезнь почек
- инсульт
- неалкогольная жировая болезнь печени
- болезнь периферических артерий
- у вас сердечно-сосудистое заболевание могут иметь риск дополнительных осложнений со здоровьем, в том числе:
- повреждение глаз (ретинопатия)
- повреждение нервов (невропатия)
- болезнь почек
- ампутация конечностей
Если у вас диагностирован метаболический синдром, цель лечения позволит снизить риск развития дальнейших осложнений со здоровьем.Ваш врач порекомендует изменить образ жизни, который может включать в себя потерю от 7 до 10 процентов вашего текущего веса и выполнение не менее 30 минут умеренных или интенсивных упражнений пять-семь дней в неделю. Они также могут посоветовать вам бросить курить.
Ваш врач может назначить лекарства для снижения артериального давления, холестерина и / или сахара в крови. Они также могут назначить низкие дозы аспирина, чтобы снизить риск инсульта и сердечного приступа.
Перспективы людей с метаболическим синдромом могут быть неплохими, если симптомы будут устранены.Люди, которые следуют советам врача, правильно питаются, занимаются спортом, бросают курить и худеют, уменьшают свои шансы на развитие серьезных проблем со здоровьем, таких как сердечный приступ или инсульт.
Хотя лечение симптомов снизит количество осложнений со здоровьем, у большинства людей с этим заболеванием есть долгосрочный риск сердечно-сосудистых заболеваний. Если у вас разовьется это заболевание, вам необходимо будет находиться под наблюдением врача, чтобы предотвратить серьезные проблемы со здоровьем, такие как сердечный приступ и инсульт.
Предотвратить метаболический синдром, безусловно, можно.Поддержание здоровой окружности талии, артериального давления и уровня холестерина снижает риск метаболического синдрома. Упражнения и потеря веса могут помочь в этих усилиях и снизить инсулинорезистентность.
В частности, придерживайтесь здоровой диеты, которая включает фрукты, овощи и цельнозерновые продукты. Когда дело доходит до предотвращения этого состояния, также важны упражнения. Регулярная физическая активность снижает кровяное давление, уровень сахара в крови и холестерина. Главное — поддерживать здоровый вес.Посоветуйтесь со своим врачом, прежде чем начинать программу упражнений или радикально менять свой рацион.
Профилактика метаболического синдрома также потребует регулярных медицинских осмотров. Ваш врач может измерить ваше кровяное давление и выполнить полный анализ крови, что может указывать на раннее развитие метаболического синдрома. Ранняя диагностика состояния и лечение уменьшат количество осложнений для здоровья в долгосрочной перспективе.
Идиопатическая мембранозная нефропатия у педиатрических пациентов: клинические проявления, ответ на терапию и отдаленные результаты | BMC Nephrology
В этом ретроспективном обзоре одного центра мы описываем 13 случаев IMN, выявленных за 17-летний период.На основании в общей сложности 715 биопсий почек, выполненных в течение периода исследования, мы оцениваем вероятность того, что у пациента, перенесшего эту процедуру для оценки гломерулярной болезни, есть IMN, составляет примерно 2%. Хотя IMN является редким заболеванием в педиатрической популяции, оно может возникать в первое десятилетие жизни, о чем свидетельствует наш вывод о том, что 9 из 13 случаев были зарегистрированы у детей в возрасте до 10 лет. Мужчины и женщины страдают одинаково, и заболевание встречается у всех этнических групп.Преобладание белых пациентов (62%) по сравнению с чернокожими (15%) и латиноамериканцами (23%) отражает демографию нашего учреждения. Тем не менее, гендерное и этническое распределение в нашей серии схоже с другими сообщениями о болезни у детей и подростков [5].
Пациенты с IMN имели различные признаки и симптомы, чаще всего гематурию (75%), протеинурию (50%) и отек (38%), что согласуется с другими публикациями [5]. У пациентов может быть гипоальбуминемия, но у большинства — гиперхолестеринемия.Причина разрыва между изменениями сывороточного альбумина и холестерина неясна. У всех пациентов была нормальная функция почек, но почти у четверти на момент постановки диагноза была гипертензия.
В нашем исследовании гистопатологическое определение стадии IMN в биоптатах почек не было стандартной процедурой [6]. В литературе есть несколько сообщений, указывающих, что у взрослых эта процедура полезна для прогнозирования прогноза и ответа на лекарственную терапию [7, 8]. У детей Ramirez и др. [9] сообщили о повышенной вероятности прогрессирования почечной недостаточности со стадиями III и IV при начальной биопсии по сравнению с поражениями стадии I или II.Однако Latham P et al [10] не описали корреляции между начальной гистологической стадией и клиническим исходом. Obana et al [11] недавно сообщили о сегментарном по сравнению с диффузным гломерулярным поражением и предположили, что эти паттерны могут отражать два патологических объекта или подкатегории IMN. Однако в этой статье постановка не рассматривалась как прогностический инструмент.
Существует много дискуссий о характере и продолжительности лечения IMN у взрослых пациентов без четкого консенсуса относительно наиболее подходящего терапевтического выбора [12].Преднизон является стандартной иммуносупрессивной терапией первой линии для IMN у педиатрических пациентов, а стероидорезистентное заболевание является обычным показанием для начала лечения другим иммунодепрессантом. Трудно оценить эффективность иммуносупрессивных препаратов второго ряда, прописанных в нашем исследовании, потому что эти препараты были начаты только после того, как пациент стал невосприимчивым к преднизону. Таким образом, может быть внесено смещение, основанное на назначении тем, кто был невосприимчив к стероидам и у кого могло быть более тяжелое заболевание почек.Кроме того, мы не можем сравнивать эффективность микофенолятмофетила, азатиоприна, циклоспорина и такролимуса, поскольку небольшое количество пациентов в нашем исследовании не позволяет провести такой анализ. Более того, некоторые пациенты получали два или более препарата второго ряда. Это отражает нечастое появление IMN в педиатрии и одноцентровый характер этого отчета. Для оценки эффективности иммуносупрессивных препаратов у детей и подростков с IMN почти наверняка потребуется совместное рандомизированное клиническое исследование.
ИАПФ и / или БРА обладают ренопротекторным действием у взрослых пациентов с гломерулярной болезнью. Мы не можем сравнить результаты у пациентов, получавших терапию ИАПФ или БРА и тех, кто не лечился, потому что только два пациента не получали лечение одним из этих антигипертензивных средств. Если эти препараты используются отдельно, их может быть недостаточно для адекватного контроля артериального давления или замедления развития болезни у пациентов с IMN. Таким образом, для контроля артериального давления в дополнение к максимально переносимым антипротеинурическим дозам ИАПФ и / или БРА следует назначать другие гипотензивные препараты, учитывая повышенную частоту гипертонии, которую мы наблюдали в течение периода наблюдения.
На момент окончательной оценки средняя СКФ и снизилась по сравнению с исходным показателем, у 3 пациентов (23%) была ХБП стадия 3, описанная как умеренное снижение СКФ и [3]. Эти три пациента были также с гипертонической болезнью и были теми же тремя пациентами, у которых в начале болезни была гипертония. Более того, у 4 других пациентов развилась артериальная гипертензия с поддержанием нормальной СКФ и . Таким образом, увеличилась доля пациентов с артериальной гипертензией с 23% при первоначальном обращении до 54% при последнем визите.Несмотря на иммуносупрессивную терапию, включающую более одного класса препаратов у некоторых пациентов, ИМН может быть прогрессирующим заболеванием у детей и подростков.
За последние три десятилетия было 7 других сообщений о IMN у детей, которые содержали не менее 10 пациентов. (Таблица 2) По оценкам большинства специалистов, частота возникновения IMN составляет 1,0–6,7% от всех биопсий почек, выполненных в их учреждении [9–11, 13–16], что согласуется с нашими наблюдениями. Все они подтверждают, что заболевание может возникать у детей младше 10 лет.Распределение по полу варьируется от равномерного, как в нашей серии [9, 15, 16], до преобладания мужчин [10, 11, 13, 14]. Процент пациентов с протеинурией нефротического диапазона, а также степень долговременной почечной патологии сильно различаются. Наши данные об исходах наиболее похожи на данные Latham et al [10] и Trainin et al [15], которые сообщили, что 21–29% пациентов проявляли почечную недостаточность при последнем наблюдении. Большинство исследований у взрослых пациентов с IMN предполагают прогрессирование ХБП как минимум на четверть [17].Наличие только гипертонии при последнем наблюдении у 4 из 13 наших пациентов, наблюдение, которое обычно не сообщается в педиатрических исследованиях, вызывает дополнительные опасения по поводу прогноза у этих пациентов. Стоит отметить, что в исследовании Latham [10] дети с IMN, у которых в начале болезни была гипертензия, имели более низкую вероятность ремиссии. Заметная вариабельность результатов у педиатрических пациентов с IMN может зависеть от различий в этнической принадлежности, практике биопсии и генетических факторов.Это свидетельствует в пользу осторожности при обсуждении прогноза с отдельными педиатрическими пациентами, у которых обнаружено IMN.
Таблица 2 Предыдущие отчеты о IMN у педиатрических пациентов: сравнительный обзорГломерулярная болезнь (педиатрическая) | Детская больница CS Mott
Детские клубочковые заболевания включают такие заболевания, как
- Нефротический синдром
- Фокальный сегментарный гломерулосклероз (ФСГС)
- Болезнь минимальных изменений
- IgM Нефропатия
- IgA Нефропатия
- C3 Гломерулопатия
- Мембранозная нефропатия
Эти заболевания могут вызывать утечку из почек избыточного белка и крови с мочой, повышенное кровяное давление и могут привести к потере функции почек.В педиатрической клинике гломерулярных заболеваний при детской больнице C.S. Mott наша цель — установить диагноз, определить варианты лечения и замедлить или остановить повреждение почек. Наша многопрофильная команда специалистов обеспечивает всесторонний и внимательный уход, а также доступ к новейшим методам лечения и клиническим испытаниям.
Симптомы клубочковой болезни
Дети с гломерулярной болезнью могут испытывать некоторые или все следующие симптомы или признаки:
- Отек стоп, лодыжек или вокруг глаз из-за скопления жидкости
- Кровь в моче под микроскопом или видимая часть
- Чувство усталости и снижение энергии
- Проблемы со сном
- Тошнота
- Увеличение веса из-за отека
- Пенистая или пузырьковая моча
- Гипертония
Диагностика клубочковой болезни
Диагностика гломерулярной болезни проводится с помощью анализов мочи и крови, а также генетических тестов и биопсии почек, если это необходимо.Для определения потенциальной причины гломерулярной болезни может быть рекомендовано генетическое тестирование. Биопсия почки может потребоваться для установления диагноза (заболевание, поражающее почки), а также для оценки долгосрочного воздействия заболевания на здоровье почек.
Лечение клубочковой болезни
Лечение зависит от конкретного заболевания и тяжести состояния. Лечение может включать:
- Специальная диета
- Лекарства, изменяющие болезнь
- Лекарства от кровяного давления
- Управление симптомами
- Соображения, касающиеся образа жизни
Клинические испытания
Улучшение вариантов лечения является приоритетом для C.Бригада детской нефрологии С. Мотта. Мы обеспечиваем доступ к новым кандидатам на лечение посредством клинических испытаний, разработанных и проводимых в рамках Программы детской нефрологии. Участие в клинических испытаниях является добровольным и требует согласия родителя / опекуна.

 )
)

 в 3 приема курсом 1 месяц 2–3 раза в год
в 3 приема курсом 1 месяц 2–3 раза в год
 Причины поражения почечной ткани – неправильный метаболизм солей кальция и фосфора. Избыточное накопление фосфатов и кальцинатов часто развивается на фоне недолеченных патологий мочевыводящих путей.
Причины поражения почечной ткани – неправильный метаболизм солей кальция и фосфора. Избыточное накопление фосфатов и кальцинатов часто развивается на фоне недолеченных патологий мочевыводящих путей.
 Причины дисметаболической нефропатии бывают врожденными и приобретенными. В первом случае бороться с последствиями тяжело, требуется поддерживающая терапия, у пациентов часто развиваются тяжелые поражения почек. Второй вариант нарушений проще устранить, если выяснить, действие каких факторов спровоцировало нарушение минерального обмена.
Причины дисметаболической нефропатии бывают врожденными и приобретенными. В первом случае бороться с последствиями тяжело, требуется поддерживающая терапия, у пациентов часто развиваются тяжелые поражения почек. Второй вариант нарушений проще устранить, если выяснить, действие каких факторов спровоцировало нарушение минерального обмена.
 Появляются сложности с выведением урины, в застоявшейся моче активно размножаются вредные бактерии.
Появляются сложности с выведением урины, в застоявшейся моче активно размножаются вредные бактерии. Нередко употребление определенной пищи влияет на уровень мочевой кислоты, других продуктов минерального обмена. Для подтверждения дисметаболической нефропатии, при первичном выявлении кристаллов цистина назначают биохимический анализ выведенной жидкости.
Нередко употребление определенной пищи влияет на уровень мочевой кислоты, других продуктов минерального обмена. Для подтверждения дисметаболической нефропатии, при первичном выявлении кристаллов цистина назначают биохимический анализ выведенной жидкости.
 Оптимальный вариант – препараты с минимальным перечнем побочных эффектов. По назначению врача можно пить почечный чай, клюквенный морс, отвар из брусники, листьев березы, толокнянки, кукурузных рылец, петрушки, плодов и корней шиповника;
Оптимальный вариант – препараты с минимальным перечнем побочных эффектов. По назначению врача можно пить почечный чай, клюквенный морс, отвар из брусники, листьев березы, толокнянки, кукурузных рылец, петрушки, плодов и корней шиповника; Пациентам не подходят холодцы, наваристые мясные и рыбные бульоны, какао и шоколад, шпинат, щавель, клюква. Свекла и морковь разрешена в минимальном количестве, обязательно в отварном виде;
Пациентам не подходят холодцы, наваристые мясные и рыбные бульоны, какао и шоколад, шпинат, щавель, клюква. Свекла и морковь разрешена в минимальном количестве, обязательно в отварном виде; Ее частотность составляет до 60% от всех заболеваний мочеполовой системы у детей. Болезнь имеет сложный патогенез и может стать причиной других болезней мочевыделительной системы.
Ее частотность составляет до 60% от всех заболеваний мочеполовой системы у детей. Болезнь имеет сложный патогенез и может стать причиной других болезней мочевыделительной системы. К первым принадлежат обменные нарушения, в частности нарушенный обмен оксалатов, кальция, фосфатов, уратов, цистина, триптофана.
К первым принадлежат обменные нарушения, в частности нарушенный обмен оксалатов, кальция, фосфатов, уратов, цистина, триптофана. К ним принадлежат:
К ним принадлежат:


 Диетического питания стоит придерживаться не менее месяца. Возвращаться к обычному меню можно только после одобрения врача.
Диетического питания стоит придерживаться не менее месяца. Возвращаться к обычному меню можно только после одобрения врача.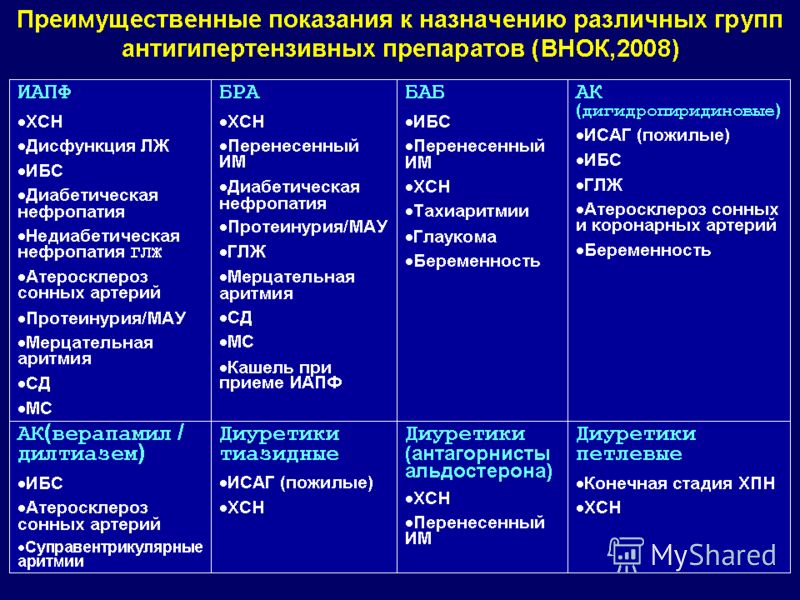
 = 3).В общей сложности 634 пациента (99,7% всех включенных в исследование пациентов) получили по крайней мере одну дозу HMP и были включены в набор безопасности, который использовался для анализа (проценты относятся к набору безопасности, если не указано иное). Подгруппа из 37 пациентов уже начала лечение HMP до включения в ННГ. Характеристики пациентов приведены в таблице 2.
= 3).В общей сложности 634 пациента (99,7% всех включенных в исследование пациентов) получили по крайней мере одну дозу HMP и были включены в набор безопасности, который использовался для анализа (проценты относятся к набору безопасности, если не указано иное). Подгруппа из 37 пациентов уже начала лечение HMP до включения в ННГ. Характеристики пациентов приведены в таблице 2. Распределение пациентов, принимавших раствор или таблетки, было аналогичным.
Распределение пациентов, принимавших раствор или таблетки, было аналогичным. Из 120 пациентов с дисметаболической нефропатией / кристаллурией у 106 пациентов (88%) была гипероксалурия, а у 31 пациента (26%) была гиперкальциурия (у пациента могло быть более одного диагноза — у 120 пациентов было 150 диагнозов).
Из 120 пациентов с дисметаболической нефропатией / кристаллурией у 106 пациентов (88%) была гипероксалурия, а у 31 пациента (26%) была гиперкальциурия (у пациента могло быть более одного диагноза — у 120 пациентов было 150 диагнозов). 3
3  4).
4). Анализ исходов заболевания мочевыводящих путей в конце периода наблюдения показал, что заболевание не разрешилось менее чем у 4% всех включенных пациентов. К концу исследования сообщалось, что 20% пациентов выздоровели от болезни, а у 65% отмечалось улучшение.13% сообщили об отсутствии изменений, а 1% сообщили об ухудшении или рецидиве (в каждом случае). Самый высокий показатель выздоровления был отмечен при ИМП (37,4%). Всего на 10% больше пациентов, которые оценили «выздоровление» в конце исследования, чем на 2-м визите, и на 5% меньше оценок «без изменений» в конце исследования, чем на 2-м визите, тогда как количество пациентов с ухудшением и рецидив не изменился (рис. 6).
Анализ исходов заболевания мочевыводящих путей в конце периода наблюдения показал, что заболевание не разрешилось менее чем у 4% всех включенных пациентов. К концу исследования сообщалось, что 20% пациентов выздоровели от болезни, а у 65% отмечалось улучшение.13% сообщили об отсутствии изменений, а 1% сообщили об ухудшении или рецидиве (в каждом случае). Самый высокий показатель выздоровления был отмечен при ИМП (37,4%). Всего на 10% больше пациентов, которые оценили «выздоровление» в конце исследования, чем на 2-м визите, и на 5% меньше оценок «без изменений» в конце исследования, чем на 2-м визите, тогда как количество пациентов с ухудшением и рецидив не изменился (рис. 6). (2 неделя) и в конце исследования соответственно. Доля оценки эффективности как «очень хорошая» увеличивалась за период наблюдений (рис. 7 и 8). Различий между монотерапией и комбинированной терапией не наблюдалось.Пациенты оценивали эффективность аналогично исследователям.
(2 неделя) и в конце исследования соответственно. Доля оценки эффективности как «очень хорошая» увеличивалась за период наблюдений (рис. 7 и 8). Различий между монотерапией и комбинированной терапией не наблюдалось.Пациенты оценивали эффективность аналогично исследователям. Все другие НЯ были зарегистрированы у ≤4 пациентов. Большинство НЯ были легкой степени (67 пациентов). Тяжелых НЯ не было.
Все другие НЯ были зарегистрированы у ≤4 пациентов. Большинство НЯ были легкой степени (67 пациентов). Тяжелых НЯ не было.
 Проведен анализ 176 случаев хронического пиелонефрита у детей от 1 года до 18 лет.В группу сравнения вошли 74 ребенка с острым пиелонефритом, выздоровевшим. Для выявления ведущих прогностических факторов риска развития ХПН у детей и определения наиболее информативных показателей использовались теорема Байеса и последовательный анализ Вальда с оценкой информативности признаков, рассчитанной по критерию Кульбака (І). Знак с коэффициентом 1 и более 0,5 считался информативным.
Проведен анализ 176 случаев хронического пиелонефрита у детей от 1 года до 18 лет.В группу сравнения вошли 74 ребенка с острым пиелонефритом, выздоровевшим. Для выявления ведущих прогностических факторов риска развития ХПН у детей и определения наиболее информативных показателей использовались теорема Байеса и последовательный анализ Вальда с оценкой информативности признаков, рассчитанной по критерию Кульбака (І). Знак с коэффициентом 1 и более 0,5 считался информативным.