Хронический миелолейкоз: лечение, симптомы, диагностика
Хронический миелолейкоз (ХМЛ, хронический миелоидный лейкоз) занимает третье место среди онкогематологических заболеваний. Еще несколько десятилетий назад болезнь плохо поддавалась лечению, но современные препараты позволяют значительно продлить жизнь пациентов и при этом сохранить ее качество.
Чаще всего миелолейкоз развивается у взрослых, примерно в 90% случаев болезнь обнаруживается именно в хронической форме. Чаще диагностируется у мужчин. Фактор, увеличивающий риск заболевания, – воздействие ионизирующего излучения.
Хронический миелоидный лейкоз относится к группе миелопролиферативных заболеваний.
Болезнь развивается из-за случайной хромосомной поломки, которая происходит в стволовой клетке. Стволовые клетки способны дифференцироваться в различные виды клеток, которые выполняют свои функции в организме, в том числе и в форменные элементы крови. Поломка получила название «филадельфийской» хромосомы.
Хронический миелолейкоз не относится к наследуемым патологиям. В отличие от острых форм лейкозов, болезнь развивается постепенно.
Стадии заболевания
Хроническая фаза
Менее 10% клеток в крови и костном мозге являются патологическими. Клинические признаки в этот период отсутствуют, но могут наблюдаться слабость, утомляемость, чувство тяжести в животе. Фаза может длиться до пяти лет, поэтому при наличии данных симптомов очень важно проводить ежегодные исследования показателей крови, а при их отклонениях обязательно получить консультацию специалиста.
Фаза ускорения (акселерации)
От 10% до 19% клеток в крови и костном мозге являются патологическими. Появляются признаки анемии, из-за нехватки тромбоцитов развиваются кровотечения, повышается утомляемость и усиливается риск развития инфекционных заболеваний, возможно развитие неврологических и зрительных нарушений, может появиться боль в суставах. Пациент нуждается в госпитализации и лечении.
Бластный криз
Из-за резкого увеличения количества патологических клеток (более 20%) возникает бластный криз, который по клиническим признакам напоминает острый миелобластный лейкоз. Это быстро прогрессирующее состояние, сопровождающееся значительным повышением температуры тела, увеличением селезенки, слабостью. Бластный криз – угрожающее жизни и плохо поддающееся лечению состояние.
Фаза ремиссии
Благодаря эффективному лечению, пациенты достигают ремиссии. В этот период максимально уменьшается количество клеток с «филадельфийской» хромосомой, благодаря чему нормализуется количество лейкоцитов, гемоглобина и тромбоцитов. У пациента в этот период отсутствуют клинические симптомы болезни.
У пациента в этот период отсутствуют клинические симптомы болезни.
Симптомы ХМЛ
На начальном этапе симптомы заболевания отсутствуют.
Затем возникают и постепенно усиливаются вялость, утомляемость, повышенная потливость (особенно ночью), чувство тяжести в левом боку из-за увеличения селезенки. Пациенты теряют аппетит и вес. Из-за накопления патологических клеток может появиться боль в суставах, а также — повышаться температура. В связи с тем, что в крови увеличивается количество аномальных клеток и возникает дефицит «здоровых» клеток, снижается иммунитет и усиливается предрасположенность к инфекционным заболеваниям. Развивается анемия, бледность кожных покровов, на ногах и на слизистой оболочке полости рта появляется сыпь в виде мелких красных точек (петехии), могут появляться кровоподтеки или развиваться кровотечения.
Для установления точной причины обнаруженных симптомов следует обязательно пройти полное диагностическое обследование. Обратитесь в LISOD, чтобы быть уверенным в точности результатов и в высоком качестве диагностики.
Диагностика
Онкогематолог. Доктор медицинских наук. Заслуженный врач Украины.
В Больнице израильской онкологии LISOD выполняют различные виды биопсий. Все они проводятся с высококлассным анестезиологическим обеспечением, что полностью исключает болевые ощущения при проведении данной процедуры. Полученный материал направляется на исследование, позволяющее выявить «филадельфийскую» хромосому и определить количество патологических клеток. Мы можем быть уверены в правильности и точности выполнения исследований, поскольку они выполняются в референтной патологической лаборатории Германии, являющейся одной из ведущих в этом направлении.
Все они проводятся с высококлассным анестезиологическим обеспечением, что полностью исключает болевые ощущения при проведении данной процедуры. Полученный материал направляется на исследование, позволяющее выявить «филадельфийскую» хромосому и определить количество патологических клеток. Мы можем быть уверены в правильности и точности выполнения исследований, поскольку они выполняются в референтной патологической лаборатории Германии, являющейся одной из ведущих в этом направлении.
При необходимости дообследования пациентов в LISOD есть возможность проведения всех современных диагностических исследований (КТ, ПЭТ-КТ и т. д.).
Лечение
Команда специалистов LISOD руководствуется рекомендациями международных медицинских протоколов (NCCN, AHA, EHA, ESMO
 При этом возможно достичь долговременной ремиссии.
При этом возможно достичь долговременной ремиссии.В LISOD определением тактики лечения для каждого пациента занимается консилиум специалистов. Это дает возможность учесть все нюансы заболевания и назначить наиболее эффективное лечение с учетом возраста пациента, общего состояния здоровья, фазы заболевания.
Основные препараты для лечения ХМЛ — ингибиторы тирозинкиназы. Пациенты, обратившиеся в LISOD, имеют возможность лечения препаратами последних поколений из этой группы. При развитии бластного криза лечение проводится по схеме лечения острых лейкозов.
Лечение хронического миелолейкоза в LISOD позволяет пациентам достичь длительной ремиссии и после лечения вернуться к привычной жизни. На всех этапах лечения специалисты больницы контролируют состояние здоровья пациента, при необходимости — меняют схему лечения и назначают сопроводительную терапию.
Хронический миелоидный лейкоз (ХМЛ) у детей и подростков
Существующие методы лечения ХМЛ у детей основаны на опыте лечения взрослых.
Эта концепция подтверждается наличием нескольких геномных различий между детьми и взрослыми пациентами, некоторые из которых связаны с ответом на терапию. Дальнейшее исследование этих открытий и оценка их влияния на течение заболевания имеют большое значение для ведения детей с ХМЛ. Например, обнаружение генетических изменений, на которые можно прицельно воздействовать таргетными препаратами параллельно с применением ИТК, что в настоящее время невозможно без трансплантации костного мозга.
Существующие прогностические шкалы, позволяющие предсказывать исход, не учитывают особенностей детей. Систематическое исследование большого числа детей с ХМЛ, получавших ИТК, может помочь получить информацию для улучшения лечения.
До сих пор неизвестно, почему у подгруппы детей с ХМЛ, получавших ИТК, развиваются побочные эффекты.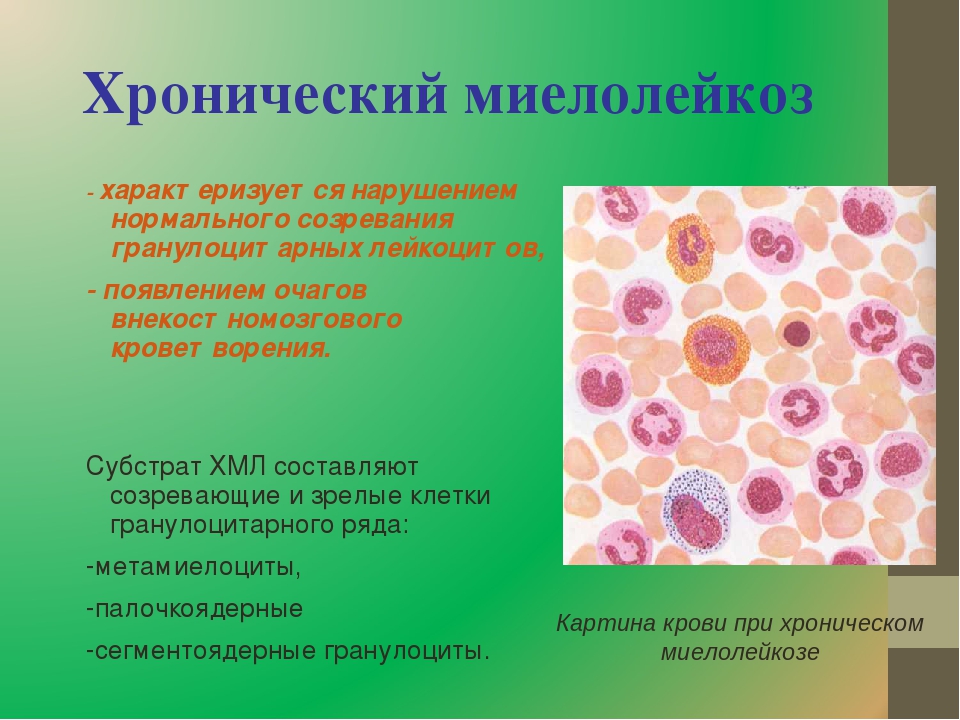 Вероятно, эти ответы опосредуются генетическими факторами организма. Изучение возможных факторов организма, связанных с токсичностью ИТК, может способствовать выявлению подгруппы пациентов, которым может помочь альтернативное лечение, такое как трансплантация костного мозга.
Вероятно, эти ответы опосредуются генетическими факторами организма. Изучение возможных факторов организма, связанных с токсичностью ИТК, может способствовать выявлению подгруппы пациентов, которым может помочь альтернативное лечение, такое как трансплантация костного мозга.
Еще одной областью клинических испытаний является вмешательство, направленное на уменьшение длительных побочных эффектов, например применение гормона роста у детей с низким ростом, обусловленным приемом ИТК. Принимая во внимание ожидаемую долгую продолжительность жизни детей и относительно короткий период — около 15 лет, — в течение которого использовался ИТК, все еще существует неопределенность относительно потенциальных побочных эффектов у пациентов, подвергавшихся воздействию ИТК в течение длительного времени. Поэтому тщательное наблюдение этих детей представляет собой еще одну область исследований. Показания для трансплантации костного мозга являются областью исследований, в которых преимущества и токсичность трансплантата сравниваются с преимуществами контроля заболевания, а также острыми и отдаленными осложнениями, вызванными применением ИТК.
Наконец, приблизительно у 40% пациентов, которые оставались в молекулярной ремиссии в течение нескольких лет, прекращение приема ИТК было связано с безрецидивным состоянием. Областью исследования также являются попытки выявить пациентов, для которых можно безопасно прекратить применение ИТК.
ХРОНИЧЕСКИЙ МИЕЛОБЛАСТНЫЙ ЛЕЙКОЗ
Хронический миелобластный лейкоз (ХМЛ), называемый также хроническим миелоидным или миелоцитарным лейкозом, – это наиболее часто встречаемая разновидность лейкоза.
Хроническим миелобластным лейкозом чаще болеют взрослые, но около 2% случаев приходится на долю детей. Ежегодно в России фиксируется около 2000 новых случаев этого заболевания.
Хронический миелобластный лейкоз не является стопроцентно наследственным заболеванием, но можно говорить о передающейся по наследству склонности к этой болезни. Заболевшие ХМЛ люди имеют дефект, который заставляет одну хромосому прерываться и присоединяться к другой хромосоме, что приводит к образованию неправильной короткой хромосомы, известной как Филадельфийская хромосома.
Этот обмен генетической информацией заставляет два гена, BCR и ABL, объединяться в один ген, называемый BCR-ABL. Ген BCR-ABL вынуждает клетки костного мозга производить аварийный фермент, который стимулирует предшественники лейкоцитов, в конечном счете, приводя к повышению уровня лейкоцитов в периферической крови и увеличению селезенки. В итоге болезнь, имеющая в дебюте хронический характер, может преобразоваться в более агрессивную форму, названную острым лейкозом. Термин «хронический» подчеркивает тот факт, что болезнь обычно развивается медленно, хотя возможен переход болезни в стадию ускорения или акселерации, когда скорость развития болезни значительно увеличивается.
Различают следующие стадии хронического миелолейкоза:
Доклиническая или начальная стадия хронического миелолейкоза
В этой стадии хронический миелолейкоз практически никогда не диагностируется или выявляется при случайном исследовании крови, поскольку симптоматика в этот период почти отсутствует.
Обращает на себя внимание только постоянное и, вроде бы, абсолютно немотивированное повышение лейкоцитов. Важным гематологическим признаком неблагополучия является увеличение количества базофилов и эозинофилов различной зрелости. Анемия в этот период не наблюдается.
Увеличивается селезенка, что может проявляться неприятными ощущениями в левом подреберье, чувством тяжести, особенно после еды.
Развернутая стадия хронического миелолейкоза
На момент выявления ХМЛ приблизительно 85% людей находятся в хронической фазе. Эта фаза продолжается несколько лет и хорошо контролируется лекарственными препаратами.
Характеризуется появлением клинических признаков заболевания:
- Отмечается быстрая утомляемость, потливость, повышенная температура и потеря веса.
- Почти постоянным признаком в этот период является увеличение селезенки, достигающее в ряде случаев значительных размеров.
 Появляются тяжесть и боли в левом подреберье, особенно после ходьбы. Почти у половины больных могут развиться инфаркты селезенки, проявляющиеся острыми болями в левом подреберье.
Появляются тяжесть и боли в левом подреберье, особенно после ходьбы. Почти у половины больных могут развиться инфаркты селезенки, проявляющиеся острыми болями в левом подреберье. - Печень также увеличена, но функциональные нарушения выражены незначительно, то есть при биохимическом исследовании крови изменений либо отсутствуют, либо минимальны.
- Могут наблюдаться нарушения со стороны сердечно-сосудистой системы (боли в сердце, аритмия). Эти изменения обусловлены интоксикацией организма, нарастающей анемией.
В этой фазе в костном мозге выявляется менее 5% незрелых бластных клеток.
Именно на этот период приходится обычно и подозрение на наличие болезни, и диагностирование, и основное течение болезни. Под действием химиотерапии достигается состояние ремиссии: уменьшается размер селезенки, печени, выравнивается формула крови. Такое состояние у больных, принимающих специальное лечение, может длиться 5-6 лет и более.
Ускоренная фаза
Во время ускоренной фазы, созревание лейкоцитов прогрессивно нарастает, уровень бластных клеток в костном мозге и периферической крови повышается до 10-19%, могут развиваться новые генетические мутации, что делает болезнь трудно управляемой.
Развёрнутая и яркая клиническая симптоматика.
Бластный криз
Эта стадия по течению болезни аналогична очень агрессивному острому лейкозу. В фазе бластного криза в периферической крови и костном мозге определяется более 20% бластных клеток.
Прогрессивно нарастают симптомы заболевания, состояние значительно ухудшается.
Лечение
Выбор терапии зависит от фазы ХМЛ, доступности донора стволовых клеток, кандидатуры пациента для трансплантации стволовой клетки и предпочтения самого пациента.
Химиотерапия остается единственным методом лечения многих больных, чье физическое состояние не позволяет проводить трансплантацию, не всякий пациент имеет гистологически совместимого донора. Другие пациенты выбирают химиотерапию, не желая подвергаться высокому риску (в т.ч. летальному), сопутствующему трансплантации.
Как правило, ХМЛ диагностируется в хронической фазе, и первая линия лечения представлена ингибиторами тирозин-киназы – наиболее эффективные средства. В настоящее время доступны три препарата: иматиниб (Gleevec®), дазатиниб (Sprycel®) и нилотиниб (Tasigna®).
Официально признанным средством первичной терапии считается иматиниб (Gleevec®). При неэффективности переходят на лечение дазатинибом (Sprycel®) и нилотинибом (Tasigna®).
Для лечения ХМЛ у больных, не отвечающих на ингибиторы тирозин-киназы и не являющимися кандидатами для трансплантации, используются гидреа и интерферон альфа с или без цитарабина.
Лечение при его эффективности приводит к нормализации анализа крови – гематологический ответ. Достижение гематологического ответа важно, но оно не гарантирует, что болезнь полностью контролируется. Важно уменьшить или полностью уничтожить клетки с Филадельфийской хромосомой, это расценивается как цитогенетический ответ. Наиболее ценно достижение молекулярного ответа на лечение – отсутствие гена BCR-ABL.
Потенциальным методом лечения является трансплантация гемопоэтических стволовых клеток.
Руководитель отделения гематологии
Медицинского центра Банка России,
кандидат медицинских наук
Колганов Александр Викторович
Что такое ХМЛ и как с ним бороться — Фонд борьбы с лейкемией
Врач-онкогематолог Михаил Фоминых про хронический миелоидный лейкоз
Михаил Фоминых — научный сотрудник Российского НИИ гематологии и трансфузиологии, Санкт-Петербург. Практикующий онкогематолог, который посвятил свою научную деятельность хроническому миелолейкозу, и в 2016 году защитил на эту тему диссертацию. В ходе дискуссии он раскрыл основные симптомы ХМЛ, рассказал про зоны риска и ограничения, а также объяснил, можно ли родить здорового ребенка с таким диагнозом.
Каковы основные симптомы ХМЛ?
Зачастую самого человека ничего особо не беспокоит. Очень часто пациент попадает к нам от другого специалиста: терапевта или хирурга. Люди сдают плановые анализы и выясняется, что у них повышенное количество белых кровяных телец. Обнаружив повышенные лейкоциты, терапевт или хирург направляет пациента к гематологу.
Если говорить о симптоматике, то это может быть повышенная усталость, потливость, немотивированные подъемы температуры тела до 38 без явных признаков инфекции, тяжесть в левом подреберье за счет того, что селезенка увеличивается в размере. Если следить за здоровьем и каждый год сдавать анализы, то хронический миелоидный лейкоз можно выявить на ранней стадии. На сегодняшний день 95% случаев ХМЛ диагностируется в хронической фазе и только 5% — в запущенных, продвинутых. Это фазы акселерации и бластного криза, когда начинают проявляться симптомы опухолевой интоксикации.
Самый яркий симптом ранней стадии ХМЛ — немотивированная потеря массы тела в течение полугода. Если вы не сидите на диете и не работаете над снижением веса, но теряете килограммы, а помимо этого наблюдается повышенная потливость и температура выше 38 — это повод насторожиться и пойти сдать анализы.
ХМЛ в «продвинутой» стадии проявляется слабостью и повышенной утомляемостью вследствие анемии, может появляться повышенная кровоточивость из десен или из носа, появление синяков. В принципе, эти симптомы характерны для всех гематологических болезней, которые связаны с поражением костного мозга.
Насколько должны быть повышены лейкоциты, чтобы заподозрить ХМЛ?
На сегодняшний день норма лейкоцитов составляет от 4 до 9 на десять в девятой степени в литре. Но нужно понимать, что эти цифры зависят от многих факторов: перенесенная инфекция, операция. Только по количеству лейкоцитов никто не скажет, что у вас лейкоз — в любом случае необходимо будет провести дополнительное обследование. Если повышенный лейкоцитоз 10-11 проявляется однократно — это еще не повод бежать к гематологу, так как это может быть вполне нормальная реакция организма на перенесенную вирусную или бактериальную инфекцию. Но если в течение трех месяцев наблюдается лейкоцитоз выше 15, то это повод обратиться к гематологу. Мы рекомендуем наблюдать за показателями крови и сдавать анализы хотя бы раз в год, чтобы вовремя выявить сбой и начать лечение, если оно необходимо.
Можно ли говорить о том, что кто-то находится в зоне риска? Есть ли предрасположенность? Влияет ли экология?
Наследственность здесь не играет абсолютно никакой роли. Если у родителей был ХМЛ, то далеко не факт, что он будет у детей: наследственная теория пока не нашла подтверждения. То же самое касается всех остальных существующих теорий: вирусной, бактериальной.
Не так давно произошла ужасная история, когда больных лейкозом детей выселяли из квартир, потому что жители дома считали, будто рак может передаваться воздушно-капельным путем. Это, разумеется, не так: онкологические заболевания не передаются таким способом. Если бы онкологические болезни передавались воздушно-капельным путем, то я и другие врачи-онкологи уже, наверное, поумирали бы: своего первого онкологического пациента я увидел на третьем курсе, за 15 лет практики я повидал их тысячи и пока, к счастью, жив, здоров и не имею никакого онкологического диагноза.
После получения ионизирующего излучения риск действительно повышается: после Чернобыля, Хиросимы и Нагасаки отмечался всплеск развития острых лейкозов. Это подтвержденный факт, но наследственность на возникновение лейкозов никаким образом не влияет. Другие теории пока тоже не нашли подтверждения. Врачи, к сожалению, пока не выявили причину.
Можно сказать, что ХМЛ — это несчастный случай, как кирпич на голову?
Да, это именно так. Я сейчас сижу перед вами, а вы сидите за своими гаджетами, и внутри каждого организма прямо в это время происходит энное количество мутаций. Это случается, пока мы спим, едим, идем по улице. Пока наша иммунная система справляется с возникающими мутациями, все хорошо. Когда возникает сбой и система перестает справляться, начинает развиваться опухолевый процесс. В случае с гематологическими болезнями, для этого достаточно мутации одной клетки. И это действительно, как кирпич на голову. Хронический лейкоз возникает спонтанно, мы не можем его спрогнозировать.
Как строится лечение при ХМЛ?
В первой линии терапии назначается Иматиниб. Если до 1999-го года после постановки диагноза пациенты проживали 3-4 года, то сегодня можно говорить о 20-летней выживаемости. Пациенты с ХМЛ продолжают жить полноценной спокойной жизнью и умирают также, как их сверстники от сердечно-сосудистых заболеваний, сахарного диабета и так далее. Лечение Иматинибом происходит амбулаторно. Пациент получает препарат в аптеке, принимает дома и живет, в общем, как совершенно обычный человек. Помимо Иматиниба, существуют препараты второго и третьего поколения. И даже уже четвертого, они пока проходят клинические исследования.
Можно ли беременеть при ХМЛ?
При лечении новыми препаратами, которые проходят клинические исследования, необходимо применять контрацептивы, потому что мы пока не знаем, как эти новые лекарства могут повлиять на плод. В случае с уже хорошо известными, необходимо принимать решение совместно с лечащим врачом, гематологом и гинекологом, ведущим беременность. Например, у Екатерины Юрьевны Челышевой, которая работает в НМИЦ гематологии, огромный опыт и большой регистр пациенток с хроническим миелолейкозом, которые забеременели и родили здоровых детишек. Если ситуация позволяет безопасно отменить терапию на время зачатия и хотя бы первый триместр, необходим ежемесячный мониторинг. Если мы видим, что молекулярный ответ потерян, то по жизненно важным показаниям терапию придется вернуть.
Полная отмена происходит, к сожалению, не так быстро, как нам хотелось бы. В случае с ингибиторами тирозинкиназы первого поколения – чуть дольше. Со вторым поколением – чуть раньше: примерно от трех до пяти лет постоянного приема. Достигаем молекулярного ответа, отменяем терапию, и там — пожалуйста. Снимаем ограничения в плане беременности и вообще, в принципе, большинство ограничений. Это обычный выздоровевший человек, излеченный от онкологического заболевания. Беременеть – можно. Единственное, что требуется — постоянный мониторинг со стороны именно гематолога.
Лечение препаратами второго и последующих поколений позволяют сохранить репродуктивные функции, хотя раньше это казалось нонсенсом. Сейчас даже в рекомендациях по лечению онкологических заболеваний рекомендовано обсудить с пациентами их репродуктивные планы, и только после этого назначать препарат. Сегодня существуют препараты, которые не так сильно влияют на фертильность, и у женщины остается возможность забеременеть и выносить здорового ребенка. Сейчас сохранение репродуктивных функций является нормой и одной из целей при лечении больных с ХМЛ. Это ли не счастье?
Есть ли какие-то ограничения, которые накладывает ХМЛ или их нет? Какова жизнь при ХМЛ и после ХМЛ, если мы добиваемся полной ремиссии и прекращаем лечение препаратами?
Я так радужно говорю о том, что все победили, все выиграли, но чтобы этого добиться, необходимо тесное сотрудничество между лечащим врачом и самим пациентом. Какие-либо изменения в жизни необходимо обсуждать с лечащим врачом, нельзя принимать решения самостоятельно — только после консультации с лечащим врачом.
Единственное строгое ограничение, которое действительно существует, — это употребление грейпфрутового сока. Это категорически запрещено. Если упростить, грейпфрутовой сок влияет на усваиваемость препаратов с ингибиторами тирозинкиназы, и они становятся неэффективными: то есть, ты принимаешь лекарство, а оно не действует так, как должно. Также существует ряд препаратов, которые могут усиливать эффект препаратов или снижать его, поэтому перед началом лечения у гематолога необходимо сообщить о всех лекарствах, которые вы принимаете постоянно. Если длительность приема препаратов не превышает неделю, то это ни на что не влияет, но если терапию назначают на постоянной основе, то может возникнуть конфликт. Особенно это касается гипотензивных препаратов для нормализации давления.
Если говорить о спорте, то можно постепенно возвращаться к нему после того, как всё — размеры селезенки, анализ крови, общее самочувствие — нормализуется. Умеренные физические нагрузки — это пожалуйста. Наши коллеги из США недавно провели исследования, которые доказали, что занятия йогой, дыхательные упражнения, цигун позитивно сказываются на качестве жизни пациентов с миелопролиферативными заболеваниями.
Можно ли ездить на море, проходить санаторно-курортное лечение?
Этот вопрос до конца неясен. Раньше каждый онкологический диагноз ставил крест на любой физиотерапии, любом санаторно-курортном лечении. Сейчас единственное, что я запрещаю всем, и не только своим пациентам, но и здоровым здоровым людям – избегать повышенного излучения солнечных лучей. В море купайтесь, сколько влезет, но от солнца следует закрываться. И мы сейчас говорим не только о тех, кто находится в ремиссии, но и о тех, кто находится на лечении, принимает медикаменты. Если чувствуете себя хорошо, анализ крови нормальный, то море — пожалуйста. Но вот активного солнца следует избегать — это пагубно сказывается на всех без исключения. Повышенное воздействие солнечных лучей, ультрафиолета повышает риск развития меланомы. Это доказано.
Можно ли полностью вылечить ХМЛ?
Хронический миелолейкоз — это заболевание, с которым можно жить, и мы этому учим. Существуют школы для диабетиков, школы для больных с артериальной гипертензией, а мы теперь проводим школы для больных с хроническим миелолейкозом: читаем лекции, консультируем больных, образовываем, чтобы они знали про болезнь больше, чем мы. При ХМЛ необходимо мониторить свое состояние и раз в полгода сдавать контрольные анализы. Сейчас проводятся общемировые исследования по поводу возможности полной отмены терапии. Примерно половине пациентов терапию отменяют. В другой половине случаев в течение первого полугода, к сожалению, приходится вернуться к терапии, потому что возникает рецидив. Все очень индивидуально.
Хронический Миелоидный лейкоз( ХМЛ) | Детская больница «Сафра»
- Детская больница Сафра > Детский центр онкогематологии > Хронический Миелоидный лейкоз
Профессор Амос Торен
Специализация:
Гематология Онкогематология
Ведущий врач онкогематолог в Израиле. Заведующий гемато-онкологическим отделением детской больницы Сафра.
Стволовые клетки (Stem cells) — это клетки-предшественники, из которых в костном мозге образуются все клетки крови. Хронический миелоидный лейкоз является, по сути, раком стволовых клеток костного мозга. При хроническом миелоидном лейкозе процесс созревания клеток в костном мозге нарушен, и стволовые клетки подвержены бесконтрольному делению. Это заболевание редко встречается у детей, им чаще болеют взрослые. На его долю приходится менее 3% всех детских лейкозов и менее 10% всех случаев ХМЛ.
Большинство пациентов с хроническим миелоидным лейкозом являются носителями мутации в одной хромосоме, т.н. «филадельфийская хромосома». Несмотря на то, что речь идет о хромозомальном дефекте, данное заболевание не является генетическим и не передается по наследству. Для хронического миелоидного лейкоза характерно медленное течение болезни. Выделяют три стадии заболевания – в зависимости от количества незрелых клеток крови (такие клетки называют бластными) в костном мозге и в периферической крови и от наличия клинических симптомов.
О центре гематоонкологии детской больницы Сафра
Хроническая(стабильная) стадия
На этой стадии, как правило, ставится диагноз. Болезни свойственно медленное течение, состояние пациента остается стабильным в среднем на протяжении 4-5 лет. В костном мозге и в периферической крови содержание бластных клеток не превышает 5%.
Для этой стадии характерны лишь немногочисленные симптомы, и пациент может поддерживать обычный образ жизни. Большинству пациентов не требуются госпитализации, лечение можно получать в домашних условиях.
Ускоренная стадияСледующей стадией заболевания является ускоренная, в течение которой возрастает темп развития болезни. В крови и в костном мозге наблюдается 6-30% бластных клеток. На этой стадии появляются такие симптомы, как анемия, сильная утомляемость, кровотечения, подверженность инфекционным заболеваниям. Пациенту в этой стадии болезни необходимы госпитализации для получения более интенсивного лечения.
Бластная стадияЧерез несколько месяцев после наступления ускоренной стадии, болезнь, как правило, вступает в бластную фазу. Эта стадия по своему течению напоминает острый миелобластный лейкоз. Для этого периода характерно крайне высокое содержание бластных клеток в крови и в костном мозге (более 30%). У некоторых пациентов бластная стадия наступает сразу же за хронической. В бластной стадии у пациента может наступить т.н. «бластный криз», для которого характерны сильная утомляемость, увеличение селезенки, высокая температура.
РемиссияСтадия ремиссии у пациентов определяется как результат лечения, при котором уровень бластных клеток в крови и костном мозге снижается до нормального. «Молекулярная ремиссия» — состояние, при котором самые точные методы диагностики, такие как PCR, устанавливают, что в клетках больше не содержится филадельфийская хромосома. Если после периода ремиссии уровень бластных клеток начинает расти, это свидетельствует о рецидиве болезни.
Наши видеоотзывы
Причины развития хронического миелоидного лейкоза
Точные причины возникновения хронического миелоидного лейкоза неизвестны.
У большинства пациентов с этим диагнозом наблюдается специфическая хромозомальная аномалия, т.н. «филадельфийская хромосома». Но несмотря на то, что речь идет о хромозомальном дефекте, заболевание не является генетическим и не передается по наследству.
К факторам риска относятся воздействие бензола (вещества, широко применяющегося при производстве резины) и высоких доз радиации.
Диагностика хронического миелоидного лейкоза
Большинству пациентов диагноз ставится случайно, на основании результатов анализа крови. В анализе крови пациентов с хроническим миелоидным лейкозом отмечается резко увеличенное количество молодых лейкоцитов. Если результаты анализа крови вызывают подозрение на лейкоз, необходимо выполнить биопсию костного мозга.
Биопсия костного мозга
Это очень важный метод исследования, позволяющий диагностировать лейкоз. По результатам биопсии костного мозга будет подобрано максимально соответствующе лечение.
Небольшое количество костного мозга на анализ берется из задней части тазовой кости или из грудины. Затем образец исследуется под микроскопом, чтобы выявить присутствие злокачественных лейкоцитов. Тип лейкоза определяется по типу патологически измененных лейкоцитов.
Забор образца костного мозга на анализ осуществляется посредством введения полой иглы через кожу в кость. В случае необходимости на анализ (биопсию) берется также кусочек самой кости. Процедура проводится под местной анестезией. Процедура может сопровождаться болью или дискомфортом, для уменьшения, которых применяются соответствующие лекарства.
Филадельфийская хромосома
У большинства пациентов с хроническим миелоидным лейкозом наблюдается хромозомальная аномалия, названная «филадельфийской хромосомой». Наличие филадельфийской хромосомы можно выявить в ходе лабораторного обследования.
Хромосома – это молекула ДНК (DNA), несущая генетическую информацию и присутствующая в каждой клетке человеческого тела. В ходе процесса деления клетки происходит дефрагментация хромосом. Образование филадельфийской хромосомы возникает по ошибке, когда часть хромосомы 9 (ген ABL) присоединяется к хромосоме 22 (гену BCR). В результате этого аномального процесса возникает новый ген, который называется BCR-ABL. Хромосома названа филадельфийской в честь города, в котором она была впервые обнаружена.
Новый ген вызывает синтез нового белка, приводящего к формированию злокачественных клеток крови в костном мозге. Иными словами, несмотря на присутствие хромозомальной аномалии, болезнь не имеет генетической природы и не наследуется.
PCR, Polymerase Chain Reaction (ПЦР, полимеразная цепная реакция)
Данный анализ используется для обнаружения филадельфийской хромосомы. Для анализа используется метод, называемый полимеразной цепной реакцией. Преимуществом этого метода является его высокая чувствительность.
Дополнительными методами диагностики являются рентгенография грудной клетки и компьютерная томография (CT). Они позволяют выявить наличие лимфатических узлов, в которых находятся злокачественные клетки.
Рентгенография грудной клетки
Целью этого обследования является диагностика распространения заболевания и выявление увеличенных лимфатических узлов в грудной клетке. Кроме того, при помощи рентгеновского снимка можно определить, нормально ли функционируют сердце и легкие.
Методы лечения хронического миелоидного лейкоза в больнице Сафра
Лечение болезни определяется ее стадией, возрастом пациента и его состоянием здоровья. Основным препаратом для лечения хронической стадии является гливек. На ускоренной и бластной стадиях назначается т.н. «коктейль» — химиотерапевтические препараты, вводимые внутривенно.
Гливек (иманитиб)
На хронической стадии болезни пациентам обычно назначается препарат под названием Гливек (Glivec). Его действие направлено против белка, чей синтез обусловлен геном BCR-ABL. Препарат блокирует этот белок, присутствующий в злокачественных клетках. Как следствие, раковые клетки теряют способность функционировать. Вместо них начинают развиваться обычные клетки крови. Лекарственная форма Гливека – капсулы.
Если лечение Гливеком эффективно, наступает полная ремиссия. При неэффективности лечения молодым пациентам показана трансплантация костного мозга или стволовых клеток.
Интерферон альфа-2
Интерферон – белок, вырабатывающийся в организме человека. Он является частью иммунной системы и помогает бороться с возбудителями инфекций. В настоящее время интерферон можно получить лабораторным путем.
Интерферон альфа-2 вводится подкожно, трижды в неделю. Большинство пациентов обучаются делать инъекции самостоятельно, в домашних условиях. Зачастую интерферон назначается параллельно с курсом химиотерапии.
Побочные действия интерферона: симптомы, схожие с симптомами гриппа (повышение температуры, слабость, головная боль, боли в мышцах, озноб). Интенсивность симптомов ослабевает в течение курса лечения.
Химиотерапия
Химиотерапия – общее название для группы химических веществ, обладающих цитотоксическим действием (от лат. «цитос» — клетка, «токсикум» — яд). Химиотерапия включает в себя комбинацию препаратов, способных проникать во все части человеческого тела и разрушать раковые клетки.
В хронической стадии пациентам обычно назначается препарат в форме капсул под названием гидроксиуреа. Прием препарата производится ежедневно, доза зависит от числа бластных клеток в анализе крови. Побочные эффекты незначительны.
В бластной стадии назначается комплекс химиотерапевтических средств («коктейль»). Как правило, такое лечение длится, пока не будет найден подходящий донор для пересадки стволовых клеток или костного мозга.
Пересадка костного мозга
Из-за того, что химиотерапевтические препараты разрушают клетки костного мозга, пересадка является по-настоящему спасительным средством для пациента. Целью трансплантации костного мозга является внедрение в организм здоровых клеток костного мозга параллельно с лечением высокими дозами химиотерапевтических средств (тем самым повышается вероятность уничтожения раковых клеток и полного выздоровления).
Пересадка стволовых клеток
Стволовыми называют клетки, на ранних стадиях развития, еще не превратившиеся в лейкоциты, эритроциты или тромбоциты. Стволовые клетки в наши дни получают из периферической крови при помощи специального прибора, позволяющего рассортировать клетки разных типов. В таком приборе кровь центрифугируется с большой скоростью и разделяется на составные элементы. Процесс длится 3-4 часа.
Стволовые клетки отбираются и замораживаются до процедуры пересадки. Если трансплантация прошла успешно, стволовые клетки приживутся в организме реципиента, пройдут процесс созревания, и из них впоследствии образуются все виды клеток крови: лейкоциты, эритроциты и тромбоциты. Пересадка клеток от донора называется аллогенной трансплантацией, пересадка клеток самого пациента (как правило, стволовых) – аутологичной трансплантацией.
Аллогенная трансплантация (от совместимого донора)
При аллогенной трансплантации источником клеток костного мозга или стволовых клеток является донор, чьи клетки подобыли признаны подходящими для пересадки после анализа на тканевую совместимость. В некоторых случаях донором может стать родственник пациента, но в принципе можно использовать клетки постороннего человека, если они успешно прошли проверку на совместимость.
Перед процедурой трансплантации необходимо полностью уничтожить все злокачественные клетки в костном мозге пациента. Для этого назначаются цитотоксичные препараты в высоких дозах и радиотерапия (облучение всего организма). Затем трансплантат вводится в организм пациента через внутривенную инфузию.
Процесс приживания трансплантированных клеток занимает несколько недель. Все это время иммунная система пациента функционирует на крайне низком уровне, поэтому в этот период нужно тщательно оберегать больного от инфекций. По этой причине после процедуры пересадки пациент находится в изоляторе, пока в его анализе крови не будет отмечен рост числа лейкоцитов. Такой рост является симптомом восстановления иммунной системы, приживания трансплантата и возобновления процесса кроветворения.
В течение нескольких месяцев после процедуры пересадки важно оставаться под медицинским наблюдением, чтобы в случае необходимости вовремя распознать состояние, называемое «трансплантат против хозяина». Это состояние, при котором клетки пересаженного костного мозга атакуют ткани организма пациента. Оно может возникнуть в течение 6 месяцев после процедуры трансплантации. Реакция «трансплантат против хозяина» может сопровождаться симптомами различной степени тяжести — от легких (понос, сыпь) до тяжелых (печеночная недостаточность). Для лечения этого состояния назначаются соответствующие лекарства. Возникновение реакции «трансплантат против хозяина» не означает, что трансплантация прошла неудачно.
Аутологичная трансплантация
При этой процедуре донором стволовых клеток является сам пациент, находящийся в периоде ремиссии.
Кровь забирается из вены пациента на одной руке, проходит через прибор, отделяющий стволовые клетки, и возвращается в тело через вену другой руки.
Прогноз
При своевременном обращении за медицинской помощью к специалистам гематологам прогноз заболевания весьма позитивен. По данным опубликованным в журнале New England Journal of Medicine процент пятилетней выживаемости составляет 89%.
Хронический миелолейкоз — справочник болезней — ЗдоровьеИнфо
Цель лечения хронического миелоидного лейкоза – удаление всех патологических клеток, содержащих BCR-ABL ген, который является причиной избыточного образования клеток крови. В большинстве случаев невозможно устранить все лейкозные клетки, но можно добиться долгосрочной ремиссии заболевания.
Таргетные препараты
Таргетные препараты воздействуют на специфические молекулярные механизмы роста и деления злокачественных клеток. «Мишенью» препаратов, использующихся для лечения хронического миелоидного лейкоза, является белок, кодируемый геном BCR-ABL, – тирозинкиназа. Таргетные препараты, блокирующие действие тирозинкиназы:
- Иматиниб (Гливек)
- Дазатиниб (Спрайсел)
- Нилотиниб (Тасигна)
- Бозутиниб (Бозулиф)
- Омаксетин (Синрибо)
Таргетные препараты являются в большинстве случаев препаратами первой линии. Если ответа на лечение одним таргетным препаратом не наступает, врач может назначить другой препарат или иные виды лечения. Побочными эффектами являются отеки, тошнота, мышечные судороги, сыпь на коже, слабость, диарея.
Врачи не установили, когда прекращение приема таргетных препаратов безопасно, поэтому большинство пациентов продолжает принимать их, даже когда по результатам анализов крови обнаруживается стойкая ремиссия.
Трансплантация костного мозга
Трансплантация костного мозга дает единственный шанс на окончательное излечение хронического миелогенного лейкоза, однако она остается методом резерва для пациентов, которым не помогли другие виды лечения, поскольку связана с высоким риском развития серьезных осложнений. При трансплантации используются высокие дозы химиотерапевтических препаратов для уничтожения собственного костного мозга пациента. Затем клетки крови от донора или ваши собственный, заранее заготовленные, вводятся внутривенно.
Химиотерапия
Химиотерапию обычно сочетают с другими видами лечения. Обычно химиотерапевтические препараты для лечения хронического миелоидного лейкоза принимают внутрь в виде таблеток. Побочные эффекты зависят от конкретного препарата.
Биологическая терапия
Биологическая терапия предполагает вовлечение иммунной системы в борьбу с онкологическим заболеванием. Для этого используются препараты интерферонов – синтетические аналоги веществ, вырабатывающихся иммунной системой организма. Интерфероны могут помочь замедлить размножение лейкозных клеток. Интерфероны показаны в тех случаях, когда другие методы лечения не работают или пациент не может принимать препараты, например, в связи с беременностью. Побочные эффекты интерферонов включают слабость, лихорадку, гриппоподобные симптомы и потерю веса.
Клинические исследования
В клинических испытаниях изучаются новейшие методы лечения заболеваний или новые способы использования существующих методов лечения. Участие в клинических испытаниях может дать вам возможность попробовать последнюю лечение, но не может гарантировать излечение. Поговорите со своим врачом о том, какие клинические испытания доступны для вас. Обсудите «за» и «против» участия в клинических исследованиях.
Образ жизни и народные средства
Многим людям приходится жить с хроническим миелоидным лейкозом в течение многих лет. Многим придется продолжать лечение иматинибом неопределенный срок. Иногда вы будете чувствовать себя больным, даже если не выглядите таковым. Иногда вы будете уставать от своего заболевания. Приведенные здесь советы помогут вам настроиться на лучшее и справиться с заболеванием:
- Обсудите с врачом возможные побочные эффекты заболевания. Мощные препараты для лечения лейкоза могут вызывать различные побочные эффекты, но вы не обязательно должны терпеть это. С побочными эффектами зачастую можно справиться с помощью других лекарственных препаратов.
- Не прекращать лечение самостоятельно. Если у вас возникли какие-либо побочные эффекты, такие как сыпь на коже или выраженная слабость, не прекращайте лечение без консультации со специалистом. Также не прекращайте принимать свои лекарства, если вы чувствуете себя лучше, и думаете, что заболевание излечено. Если вы прекратите принимать лекарства, ваше заболевание может быстро и неожиданно вернуться, даже если вы находитесь состоянии ремиссии.
- Обратитесь за помощью, если вам трудно справляться с заболеванием. Хроническое заболевание является источником стресса и эмоциональных перегрузок. Расскажите своему врачу о ваших чувствах. Попросите направление к психотерапевту или другому специалисту, с которым вы можете поговорить.
Альтернативная медицина
Ни один из методов альтернативной медицины не может вылечить хронический миелоидный лейкоз, но они могут помочь вам справляться со стрессом и побочными эффектами лечения. Обсудите с врачом такие методы, как:
- Акупунктура
- Ароматерапия
- Массаж
- Медитация
- Техники релаксации
Хронический лейкоз у взрослых
Лейкоз (лейкемия) является злокачественным заболеванием лейкоцитов (белых кровяных телец). Он возникает в костном мозге и затем поражает кровь, лимфатические узлы, селезенку, печень, центральную нервную систему (ЦНС) и другие органы. Лейкоз может развиваться как у взрослых, так и детей.
Лейкоз подразделяется на многие типы и подтипы, которые имеют свои особенности клинического течения, лечения и прогноза (исхода).
Для лучшего понимания различных типов лейкоза необходимо иметь основные представления о кровеносной и лимфатической системах.
Костный мозг расположен внутри костей. В нем образуются различные клетки крови.
Ранние (молодые, или незрелые) клетки крови носят название стволовых. Эти клетки созревают и превращаются в эритроциты (красные кровяные тельца), лейкоциты и тромбоциты.
Эритроциты переносят кислород из легких в другие ткани и организма. Они же выводят углекислый газ – продукт жизнедеятельности клеток. Уменьшение числа эритроцитов (анемия) приводит к слабости, одышке и повышенной утомляемости.
Лейкоциты помогают в борьбе против вирусов и бактерий. Различают несколько типов и подтипов лейкоцитов, каждый из которых играет особую роль в защите против инфекций.
Выделяют три основных типа лейкоцитов: гранулоциты, моноциты и лимфоциты.
Тромбоциты предотвращают кровотечения при порезах и ушибах.
Лимфатическая система включает в себя лимфатические сосуды, лимфатические узлы и лимфу.
Лимфатические сосуды напоминают вены, но переносят не кровь, а лимфу – прозрачную жидкость, содержащую тканевую жидкость, продукты жизнедеятельности организма и клетки иммунной системы.
Лимфатические узлы располагаются вдоль лимфатических сосудов и накапливают в себе клетки иммунной системы. При воспалении и некоторых других заболеваниях они могут увеличиваться в размерах.
Типы лейкозов
Различают:
острый и хронический лейкозы
лимфоцитарный (лимфобластный) и миелоидный лейкозы
При остром лейкозе болезнь быстро прогрессирует, и хотя клетки растут быстро, они не способны к созреванию.
При хроническом лейкозе опухолевые клетки напоминают нормальные, но отличаются от них. Они живут слишком долго и мешают образованию некоторых видов лейкоцитов.
Лимфоцитарный и миелоидный лейкозы получили свое название в соответствии с клетками, из которых они возникли.
| Острый лимфоцитарный лейкоз (ОЛЛ) (лимфобластный) | Острый миелоидный лейкоз (ОМЛ) (нелимфоцитарный, ОНЛЛ) |
| Встречается чаще у детей, чем у взрослых и составляет более 50% лейкозов детей. | Возникает у детей и взрослых, составляя менее половины всех случаев лейкозов детского возраста. |
| Хронический лимфоцитарный лейкоз (ХЛЛ) | Хронический миелоидный лейкоз (ХМЛ) |
| Поражает взрослых и встречается в 2 раза чаще ХМЛ. | Выявляется преимущественно у взрослых и очень редко у детей и встречается в 2 раза реже ХЛЛ. |
Как часто встречается хронический лейкоз у взрослых?
Хронический лимфоцитарный лейкоз (лимфолейкоз) – наиболее распространенный вид лейкоза в странах Европы и Северной Америки. На его долю приходится 30% среди всех лейкозов.
Ежегодная заболеваемость ХЛЛ в этих странах составляет 3-3,5 на 100 тыс. населения, а среди лиц старше 65 лет – до 20 на 100 тыс.населения.
Около 70% пациентов заболевают между 50 и 70 годами. Средний возраст к началу заболевания составляет 55 лет. Только менее 10% заболевают в возрасте моложе 40 лет.
Мужчины болеют в 2 раза чаще женщин.
Хронический миелоидный лейкоз составляет около 20% среди всех лейкозов. В странах Европы и Северной Америки по частоте распространения ХМЛ занимает 3 место после острых лейкозов и ХЛЛ. Ежегодная заболеваемость составляет 1-1,5 на 100 тыс. населения во всех странах и остается практически стабильной на протяжении последних 50 лет.
Мужчины заболевают несколько чаще женщин, составляя 55-60% больных. Половина пациентов заболевают в возрасте 30-50 лет, чаще всего между 30-40 годами. У детей типичный ХМЛ встречается редко, составляя не более 1-2% случаев детских лейкозов.
Причины возникновения хронического лейкоза и возможность его предотвращения
В настоящее время известны некоторые факторы риска, связанные с развитиемразвитием хронического лейкоза. Так, воздействие высоких доз радиации при взрыве атомной бомбы или аварии на атомном реакторе повышает риск хронического миелоидного лейкоза, но не хронического лимфоцитарного лейкоза.
Длительный контакт с гербицидами или пестицидами среди сельских жителей может повысить риск возникновения хронического лимфоцитарного лейкоза.
Высоковольтные линии передач, возможно, являются фактором риска развития лейкоза.
У большинства больных лейкозом не выявлены факторы риска, поэтому не существует способов предотвращения этого заболевания. Исключение составляет курение, которое повышает риск возникновения лейкоза.
Диагностика хронического лейкоза
В настоящее время еще не разработаны методы раннего выявления хронического лейкоза. При появлении у необычных симптомов необходимо срочно обратиться к врачу.
У 50% больных хроническим лейкозом отсутствуют какие-либо симптомы в момент выявления заболевания. У этих пациентов заболевание диагностируется по данным анализа крови, выполненного по другому поводу.
Общие симптомы хронического лейкоза могут включать повышенную утомляемость, слабость, потерю веса, повышение температуры и боли в костях. Большинство из этих симптомов связаны со снижением количества клклеток крови.
Анемия (малокровие) возникает в результате уменьшение количества эритроцитов, что приводит к одышке, повышенной утомляемости и бледности кожи.
Снижение числа нормальных лейкоцитов повышает риск инфекционных заболеваний. У больных лейкозом количество лейкоцитов может быть значительно повышено, однако эти опухолевые клетки не защищают от инфекции.
Уменьшение числа тромбоцитов сопровождается кровоизлияниями, кровотечениями из носа и десен.
Распространение лейкоза из костного мозга в другие органы и центральную нервную систему может привести к головной боли, слабости, судорогам, рвоте, нарушению зрения.
Лейкоз может сопровождаться увеличением лимфатических узлов, печени и селезенки.
Методы диагностики
Анализ крови. По количеству клеток крови и их виду под микроскопом можно заподозрить лейкоз. У большинства больных хроническим лейкозом имеется повышенное количество лейкоцитов, снижение числа эритроцитов и тромбоцитов.
Биохимический анализ крови помогает уточнить функцию почек и состав крови.
Исследование костного мозга дает возможность установить диагноз лейкоза и оценить эффективность лечения.
Спинно-мозговая пункция позволяет выявить опухолевые клетки в спинно-мозговой жидкости и провести лечение путем введения химиопрепаратов.
С целью уточнения типа лейкоза используются специальные методы исследования: цитохимия, проточная цитометрия, иммуноцитохимия, цитогенетика и молекулярно-генетическое исследование.
Рентгенологические исследования грудной клетки и костей позволяют выявить поражение лимфатических узлов средостения, костей и суставов.
Компьютерная томография (КТ) дает возможность обнаружить поражение лимфатических узлов в грудной полости и животе.
Магнитно-резонансная томография (МРТ) особенно показана при исследовании головного и спинного мозга.
Ультразвуковое исследование (УЗИ) позволяет отличить опухолевые и кистозные образования, выявить поражение почек, печени и селезенки, лимфатических узлов.
Стадии хронического лейкоза
В зависимости от степени распространения заболевания при большинстве злокачественных опухолей определяется стадия – от 1 до 4.
Однако, лейкоз является системным заболеванием, при котором к моменту диагностики имеется поражение костного мозга и других органов, поэтому при лейкозе стадия не определяется.
Для оценки прогноза (исхода) заболевания учитываются другие характеристики, влияющие на выбор тактики лечения.
Лечение хронического лейкоза
Лечение больных хроническим лейкозом зависит от типа заболевания и прогностических факторов.
Лекарственный метод является основным при лечении хронического лейкоза.
Выбор тактики лечения больных ХЛЛ зависит как от распространенности опухолевого процесса, так и от наличия определенных симптомов. С учетом этих факторов, а также клеточных и хромосомных изменений, больные подразделяются на группы риска.
Группа низкого риска.
Прогноз (исход) заболевания у пациентов этой группы благоприятный. Средняя выживаемость составляет 20-25 лет. Обычно лечение не назначается, а рекомендуется тщательное наблюдение. Лишь в случае дальнейшего развития болезни или появления неприятных симптомов применяется лечение.
Группа промежуточного и высокого риска.
У больных при отсутствии симптомов от лечения можно временно воздержаться. При появлении признаков прогрессирования заболевания или новых симптомов может быть назначена терапия.
Химиоптерапия проводится, как правило, противоопухолевым препаратом хлорамбуцилом. При появлении выраженных побочных эффектов этот препарат может быть заменен на циклофосфамид. Иногда используются стероидные препараты (преднизон).
У некоторых больных применяют комбинированную химиотерапию с включением циклофосфамида, доксорубицина, винкристина.
Флюдарабин применяется обычно при рецидиве (возврате) заболевания после лечения комбинацией препаратов. У молодых больных этот препарат можно применять в самом начале лечения. При увеличении селезенки или лимфатических узлов возможно назначение лучевой терапии в низких дозах. В случае появления выраженных симптомов, связанных со значительным увеличением селезенки, выполняется удаление селезенки.
Больным с большим количеством лейкоцитов, нарушающим кровоток, до химиотерапии показан лейкаферез (удаление избытка лейкоцитов, включая опухолевые клетки). Эффект наступает быстро, но бывает временным.
В редких случаях применяется трансплантация стволовых клеток, однако эффективность данного метода еще не доказана.
Иногда ХЛЛ может трансформироваться (превращаться) в острый лейкоз или агрессивную неходжкинскую лимфому (лимфосаркому).
Лечение хронического миелоидного лейкоза (миелолейкоза) в зависимости от фазы заболевания.
Выбор тактики лечения больных с ХМЛ зависит от фазы заболевания (хроническая, акселерации, бластный криз), возраста больного, прогностических факторов и наличия подходящего донора.
Хроническая фаза.
Применение препарата гливек (иматиниб) приводит к достижению полного эффекта у 90% больных ХМЛ.
До этого использовалась химиотерапия высокими дозами препаратов в сочетании с тотальным облучением и трансплантацией стволовых клеток.
Фаза обострения.
Применение гливека может привести к достижению ремиссии (отсутствию признаков болезни), однако период улучшения длится недолго. Использование интерферона также не позволяет получать длительные ремиссии. У 20% больных отмечается положительный ответ на химиотерапию, но он длится не более 6 месяцев.
Приблизительно 15% больных в этой фазе ХМЛ живут в течение нескольких лет после трансплантации стволовых клеток. Эту процедуру лучше выполнять молодым больным после эффективной химиотерапии.
Бластный криз.
В этой фазе болезни опухолевые клетки напоминают таковые при остром миелоидном лейкозе (ОМЛ), причем они мало чувствительны к химиотерапии. Если же и достигается положительный эффект, то он бывает кратковременным. В этом случае возможно применение трансплантации стволовых клеток.
У некоторых больных опухолевые клетки напоминают клетки острого лимфобластного лейкоза (ОЛЛ), которые более чувствительны к химиотерапии. Поэтому использование винкристина, доксорубицина и преднизона может привести к ремиссии.
При поражении центральной нервной системы у больных ХМЛ применяется цитарабин, вводимый в спинномозговой канал, или облучение головного мозга.
Заболевания, связанные со зданиями — HML
БОЛЕЗНИ, СВЯЗАННЫЕ С ЗДАНИЕМ
(СИНДРОМ ЗДАНИЯ)
доктора Дональда А. Хендриксона, Ph.D. HML, Inc.
- Обычно сообщаемые симптомы:
- раздражение глаз
- сухость в горле
- головная боль
- усталость
- заложенность носовых пазух
- раздражение кожи
- одышка
- кашель
- головокружение
- тошнота
- лихорадка (эндотоксины)
- Обычные загрязнители
- Биологический
- Грибы (плесневые и дрожжевые)
- Состояние болезни:
- Аллергические реакции могут следовать за сенсибилизацией к определенным антигенам (споры грибов).Эти реакции являются наиболее часто встречающимися заболеваниями, связанными с синдромом больного здания. Это в первую очередь верхние дыхательные пути (нос и горло), поскольку споры грибов переносятся по воздуху.
- Определенные грибы выделяют токсичные вещества, например микотоксины. Эти токсины могут присутствовать в спорах грибов и вызывать реакцию в легких. Присутствие микотоксинов в легких может препятствовать клеточному иммунному ответу. Совсем недавно они были связаны с СВДС.
- Некоторые грибы могут вызывать инфекцию и расти на организме человека-хозяина.В первую очередь это связано с взломанным хостом. Примеры состояний, которые могут предрасполагать человека к микотической (грибковой) инфекции, включают:
- Использование антибактериальных антибиотиков, таких как тетрациклины, кортикостероиды, иммунодепрессанты или противоопухолевые препараты.
- Человек с ослабленным клеточным иммунитетом, таким как СПИД, гематологические злокачественные новообразования (лейкемия и лимфома) или пациенты с трансплантацией органов.
- Наследственная предрасположенность к развитию немедленной гиперчувствительности к таким заболеваниям, как аспергиллез.
- Повреждение эпителия (кожи) в результате ожогов, травм или мацерации.
- Предыдущие болезни, такие как туберкулез, саркодоз, эмфизема, муковисцидоз, диабетический ацидоз (сахарный диабет), гипергликемия, лейкопения и злокачественные новообразования
- Сигаретный дым
- Горячие точки грибкового заражения:
- Воздухозаборник HVAC возле птичьих гнезд.
- Застой конденсата ОВКВ в поддоне для сбора капель.
- Здания с кондиционированием воздуха, в которых окна закрыты круглый год.
- Затопление жилых помещений и конденсат на стене или в стене.
- Ковролин, который постоянно остается влажным, например, в коридорах, куда входят дети.
- Плоские крыши часто протекают, а потолочная черепица может служить отличной средой для роста грибков.
- Конструкции с бетонными полами и стенами могут обеспечивать необходимую влажность для роста грибка.
- Рост грибков может ускориться в летние месяцы, если система кондиционирования воздуха отключена.
- Меры по контролю влажности:
- Предотвращение образования конденсата на потолке, стене и полу.
- Удалите весь ковер, который может стать влажным и оставаться влажным.
- Частая чистка охлаждающих змеевиков и поддонов для сбора конденсата.
- Обеспечьте надлежащий дренаж поддонов для конденсата и дренажных линий.
- Достаточное осушение системы HVAC.
- Незамедлительно исследуйте все утечки или проблемы с водой и немедленно устраняйте их.
- Удалите и утилизируйте все поврежденные водой строительные материалы, такие как потолочная плитка и ковровое покрытие.
- Обеззараживайте все участки с видимым ростом грибков 10% раствором отбеливателя и повторите процедуру дважды с 30-минутным интервалом между нанесениями. Сполосните поверхности нехлорированной водой через два часа.
- Состояние болезни:
- Бактерии
- Legionella pneumophila: эти бактерии являются возбудителями болезни легионеров (пневмонии) и лихорадки Понтиак.Лихорадка Понтиак — это легкая форма, которая возникает у здоровых людей и характеризуется быстрым началом лихорадки, озноба, головных болей и миалгии. Кашель возникает примерно у 50% пациентов. Болезнь легионеров — тяжелая пневмония, которая может привести к летальному исходу. Легочные инфекции человека возникают в результате контакта с аэрозолями, такими как горячие ванны, кондиционеры, градирни и компост.
- Pseudomonas aerguinosa: Эти бактерии связаны с кондиционированием воздуха и могут вызывать уникальный синдром, характеризующийся везикулярной или пустулезной сыпью, недомоганием, усталостью и наружным отитом.У некоторых пациентов может развиться очень серьезная пневмония.
- Грамотрицательные бактериальные эндотоксины: эти токсины, связанные с клеточной стенкой, могут вызывать кашель, зуд в глазах, лихорадку и гипотонию.
- Пылевые клещи: аллергические реакции
- Пыльца: аллергические реакции
- Органические вещества, переносимые по воздуху
- Формальдегид: Строительные материалы, такие как изоляция из мочевиноформальдегидной пены и клееные текстильные материалы, прессованные текстильные материалы, ДСП, фанера из твердых пород дерева и древесноволокнистая плита средней плотности.Он вызывает сенсорное раздражение и является канцерогенным.
- Летучие органические соединения (VOC): они могут вызывать раздражение органов чувств и рак. Эти соединения могут быть связаны с ковровым покрытием, строительными материалами, мебелью, потребительскими товарами, чистящими средствами, оргтехникой, выхлопными газами двигателей внутреннего сгорания и табачным дымом.
Загрузите версию этого документа для печати.
элементов эндогенного ретровируса человека K (HML-2) в плазме людей с лимфомой и раком груди
РЕФЕРАТ
Активно реплицирующиеся эндогенные ретровирусы вошли в геном человека миллионы лет назад и стали стабильной частью унаследованного генетического материала.Впоследствии они приобрели множественные мутации, что привело к предположению, что эти вирусы больше не реплицируются. Однако было показано, что некоторые линии опухолевых клеток человека выделяют эндогенные ретровирусные частицы. Здесь мы показываем, что РНК из человеческого эндогенного ретровируса K (HERV-K) (HML-2), относительно недавно вошедшего в геном человека, может быть обнаружена в очень высоких титрах в плазме крови пациентов с лимфомами и раком груди, как измерено либо ПЦР с обратной транскриптазой, либо амплификация на основе последовательностей нуклеиновых кислот.Кроме того, эти титры резко падают при лечении рака. Мы также демонстрируем присутствие обратной транскриптазы и вирусной РНК во фракциях плазмы, которые содержат как незрелые, так и правильно процессированные Gag и белки оболочки HERV-K (HML-2). Наконец, с помощью иммуноэлектронной микроскопии мы показываем присутствие вирусоподобных частиц HERV-K (HML-2) в плазме пациентов с лимфомой. Взятые вместе, эти результаты демонстрируют, что элементы эндогенного ретровируса HERV-K (HML-2) могут быть обнаружены в крови современных людей с некоторыми видами рака.
В течение миллионов лет активно реплицирующиеся ретровирусы вошли в геном человека и в конечном итоге стали стабильной частью наследуемого генетического материала (3, 35, 43, 45). Эти вирусы называются эндогенными ретровирусами человека (HERV), и эндогенные ретровирусные элементы составляют примерно 8 процентов генома человека (3, 34, 45, 48). HERV существуют в геноме в провирусной форме и состоят из трех генов ( gag , pol и env ), фланкированных двумя длинными концевыми повторами (3, 44).После попадания в геном HERV впоследствии приобрели множественные мутации и делеции, что привело к предположению, что ни один из них не способен к репликации. Фактически, почти все провирусы, охарактеризованные до сих пор в геноме человека, оказались нефункциональными и фиксированными. Однако недавно было обнаружено, что некоторые из них содержат полиморфизмы у разных людей, что позволяет предположить, что они интегрировались в геном относительно недавно в истории человечества и могут все еще развиваться (4, 7, 8, 38, 40, 41, 55).
Эндогенный ретровирус HERV-K (HML-2) является самым недавним представителем генома человека, он вошел от 200000 до 5 миллионов лет назад (4, 55), а также является наиболее транскрипционно активным (29, 47, 49, 51, 54, 57, 59). За последние 2 года одна группа создала инфекционный клон HERV-K (HML-2) (23), а другая показала, что вирус может быть получен с использованием нескольких транскомплементарных плазмид (32). Таким образом, по крайней мере, в его реанимированной форме с исправленными мутациями для повторного введения открытых рамок считывания, HERV-K (HML-2) может реплицироваться.Ведутся споры о том, способен ли HERV-K (HML-2) к репликации у современных людей.
HERV-K (HML-2) связан с онкогенезом. Действительно, этот вирус впервые привлек внимание биологов из-за его сходства с вирусом опухоли молочной железы мышей (MMTV), вирусом, который вызывает опухоли молочной железы у мышей, реплицируется в лимфоцитах и имеет экзогенную фазу и эндогенную фазу (9, 37 ). В соответствии со сходством HERV-K (HML-2) с MMTV, HERV-K (HML-2) env , как было обнаружено, сверхэкспрессируется в ткани рака груди, где он также проявляет новые, альтернативно сплайсированные формы (24, 56, 57).Сверхэкспрессия HERV-K gag дополнительно наблюдалась в клетках периферической крови больных лейкемией (21). Также было показано, что HERV-K (HML-2) способен образовывать вирусные частицы в мегакариоцитах пациентов с эссенциальной тромбоцитемией и в клеточных линиях меланомы, рака груди и тератокарциномы, хотя не было продемонстрировано, что эти частицы являются инфекционные (10, 16, 36, 39, 42, 49).
Механизмы, с помощью которых HERV-K (HML-2) может оказаться онкогенным, если это вообще возможно, только недавно начали выясняться.В связи с этим HERV-K (HML-2), имеющий две формы, тип 1 и тип 2, может кодировать как минимум два предполагаемых онкопротеина (1, 2, 15, 20). Тип 1 кодирует недавно идентифицированный онкопротеин Np9, тогда как тип 2 кодирует вспомогательный белок Rec, который необходим для экспорта несплицированной РНК из ядра в цитоплазму, как и его аналоги вируса иммунодефицита человека типа 1 (ВИЧ-1) Rev и T- вирус клеточного лейкоза типа 1 Rex (38, 58). Было показано, что как Np9, так и Rec способны к клеточной трансформации при определенных обстоятельствах, а Rec может вызывать карциному in situ у мышей (1, 2, 6, 11, 15, 20, 25, 38).
Мы недавно сделали наблюдение, что РНК HERV-K (HML-2) может быть обнаружена в плазме ВИЧ-1-инфицированных пациентов (18, 19). Принимая во внимание это и факторы, указанные выше, мы исследовали, может ли РНК HERV-K (HML-2) также присутствовать в крови пациентов с лимфомой или раком груди. Мы сообщаем, что у этих пациентов действительно очень высокие титры вирусной РНК в крови, и эти титры резко падают, когда пациенты проходят лечение от лимфомы. Мы также демонстрируем, что люди с лимфомой, которые имеют высокие титры РНК HERV-K (HML-2), также обладают активностью обратной транскриптазы и вирусными белками Gag и Env в тех же фракциях плазмы, в которых обнаружена вирусная РНК.Наконец, с помощью электронной микроскопии (ЭМ) и окрашивания иммунным золотом мы впервые визуализировали присутствие HERV-K (HML-2) -подобных частиц в плазме людей (пациентов с лимфомой). Эти результаты показывают, что вирусные элементы HERV-K (HML-2) могут циркулировать в крови людей с лимфомой и раком груди.
МАТЕРИАЛЫ И МЕТОДЫ
Субъекты исследования. После получения информированного согласия у людей были получены образцы плазмы в соответствии с протоколами, одобренными экспертными советами Мичиганского университета и больницей Университета Северного берега.Испытуемые включали 18 здоровых людей и пациентов с ревматоидным артритом, раком груди, ВИЧ-инфекцией с диффузной крупноклеточной В-клеточной лимфомой, не связанной с ВИЧ диффузной большой В-клеточной лимфомой и ВИЧ-инфекцией с лимфомой Ходжкина.
Экстракция вирусной РНК. Для ПЦР с обратной транскриптазой (ОТ-ПЦР) плазму обрабатывали 200 ед. ДНКазой, не содержащей РНКаз (Roche Laboratories), в течение 2 часов. РНК экстрагировали из 140 мкл плазмы с использованием мининабора вирусной РНК QIAamp, следуя инструкциям производителя (Qiagen, Valencia, CA).Отсутствие загрязнения ДНК подтверждено методом ПЦР. Для амплификации на основе последовательности нуклеиновых кислот (NASBA) РНК экстрагировали с помощью метода экстракции NucliSENS easyMAG (Biomerieux, Франция) (17).
Синтез РНК-транскриптов in vitro и ОТ-ПЦР в реальном времени Синтез РНК-транскриптов для калибровки и ОТ-ПЦР в реальном времени выполняли, как описано ранее (18). Праймеры были разработаны для амплификации и количественного определения gag HERV-K (KgagRTF, 5′-AGC AGG TCA GGT GCC TGT AAC ATT-3 ‘; KgagRTR, 5′-TGG TGC CGT AGG ATT AAG TCT CCT-3’) и env tm HERV-K (KenvTMF, 5′-GCT GTA GCA GGA GTT GCA TTG-3 ‘; KenvTMR, 5′-TAA TCG ATG TAC TTC CAA TGG TC-3’).
NASBA.NASBA амплификацию выполняли, как описано ранее (17), с использованием праймеров, специфичных для HERV-K (HML-2) env (Ktype1F, 5′-AGA AAA GGG CCT CCA CGG AGA TG-3 ‘; Ktype1R , 5’-AAT TCT AAT ACG ACT CAC TAT AGG GAG AAG GCT CTC CCT AGG CAA ATA GGA-3 ‘; Ktype2F, 5′-AGA CAC CGC AAT CGA GCA CCG TTG A-3′; и Ktype2R, 5’-AAT TCT AAT ACG ACT CAC TAT AGG GAG AAG GAT CAA GGC TGC AAG CAG CAT ACT C-3 ‘) с молекулярными маяками, специфичными для вирусов типа 1 и 2, меченных флуорофором FAM (6-карбоксифлуоресцеин) или ROX (6-карбокси- X-родамин) на 5′-конце и тушитель (дабсил) на 3′-конце.Последовательности зонда были Ktype1P (5’-FAM-CGA TCG ACG GAG ATG GTA ACA CCA GTC ACA TGG ACG ATC G-3 ‘) и Ktype2P (5’-ROX-CGA TCG AAG TTG CCA TCC ACC AAG AAG GCA GAC GAT CG- РОКС-3 ′).
Градиенты йодиксанола и очистка от вирусных частиц. Один миллилитр каждого образца плазмы разбавляли 10 мл фосфатно-солевого буфера (PBS) и центрифугировали при 3000 об / мин в течение 10 минут. Супернатанты наносили на подушки с 20% йодиксанолом (среда с градиентом плотности Optiprep; Sigma, St. Louis, MO) и центрифугировали при 45000 × g в течение 2 часов.Гранулы ресуспендировали в 500 мкл PBS и накладывали на 50% раствор йодиксанола в 0,85% NaCl. Самоградиент был достигнут посредством ультрацентрифугирования в вертикальном роторе с фиксированным углом при 350 000 × g в течение 6 часов. Собирали фракции по 350 мкл, и их плотность рассчитывали путем измерения оптической плотности при 340 нм, а также считывания показателя преломления.
RT-анализы. Активность RT измеряли в 5 мкл каждой фракции с использованием набора для анализа EnzCheck RT (Invitrogen), как описано производителем.В качестве калибраторов использовали серийные разведения RT вируса мышиного лейкоза (Stratagene).
Вестерн-блоттинг. Белки осаждали из фракций смесью хлороформ-метанол, разделяли на 10% -ных гелях додецилсульфат натрия-полиакриламид и наносили на нитроцеллюлозные мембраны. Мембраны блокировали в 10% молоке в течение 1 ч и инкубировали с первичным анти-HERV-K Env (HERM-1811-5) или моноклональным антителом против HERV-K Gag (HERM-1841-5) (Austral Biologicals) для блокирования. решение. В качестве контроля неспецифической перекрестной реактивности блоты инкубировали с сывороткой мыши.Мембраны пять раз промывали PBS, содержащим 1% твин. Связанное первичное антитело затем детектировали с помощью вторичного козьего антимышиного антитела, конъюгированного с пероксидазой хрена, с использованием системы Super Signal West Pico (Pierce Chemical Co., Rockford, IL).
EM. Фракции плазмы, полученные с помощью градиентов йодиксанола, разбавляли в PBS, и частицы осаждали в количестве 250000 × г . Отрицательное окрашивание, обычная ЭМ и мечение частиц иммунным золотом проводили, как описано ранее (30).Вкратце, частицы абсорбировали на никелевых решетках размером 300 меш и блокировали в забуференном трис-солевом растворе с 1% бычьим сывороточным альбумином. Частицы инкубировали с первичным мышиным моноклональным анти-HERV-K Env (HERM-1811-5, разведенный 1:10 в блокирующем растворе) (Austral Biologicals) в течение 1 часа. Кроме того, другой набор сеток инкубировали с очищенным иммуноглобулином G (IgG) мыши в течение 1 ч для контроля перекрестной реактивности сыворотки мыши с белками плазмы. Сетки промывали пять раз и инкубировали с меченным золотом вторичным антителом против мышиных антител в течение 1 часа.В экспериментах, проведенных с частицами золота размером 10 нм, вторичные антитела поступали от Sigma (Сент-Луис, Миссури), а в экспериментах, проведенных с частицами золота размером 5 нм, вторичные антитела поступали от BB International (Мэдисон, Висконсин). Частицы фиксировали 2% глутаровым альдегидом, отрицательно окрашивали 2% уранилацетатом и визуализировали с помощью просвечивающего электронного микроскопа Philips CM-100 (Анн-Арбор, Мичиган) или CM-10 (Сиена), работающего при 80 кВ.
РЕЗУЛЬТАТЫ
Недавно мы сделали наблюдение, что РНК HERV-K (HML-2), но не РНК родственного HERV, HERV-H, может быть обнаружена в плазме ВИЧ-1-положительных пациентов с использованием количественной реальной метод RT-PCR для амплификации транскриптов gag и pol HERV-K (HML-2) (18, 19).В этих экспериментах плазму обрабатывали ДНКазой перед экстракцией РНК, чтобы попытаться устранить загрязняющую ДНК, которая могла вызвать ложноположительные результаты ОТ-ПЦР. Используя вырожденные праймеры, которые амплифицируют все 10 семейств HERV-K (от HML-1 до HML-10), присутствующих в геноме человека, мы обнаружили, что экспрессия только HML-2 и HML-3 была увеличена у пациентов с ВИЧ-1. РНК вирусов семейства HERV-H, которых в геноме человека насчитывается не менее 1000 копий, в отличие от ∼50 копий HERV-K (HML-2), в плазме не обнаружена (18, 19).Вывод о том, что титры РНК HERV-K в плазме значительно повышены у ВИЧ-1-инфицированных людей, теперь подтверждено по крайней мере двумя другими группами (26, 32). Поскольку HERV-K (HML-2) имеет большое сходство с MMTV, который вызывает опухоли молочной железы у грызунов и воспроизводится в лимфоцитах (9, 37), мы исследовали, повышаются ли титры HERV-K (HML-2) в плазме крови. людей с раком груди или лимфомой. Согласно измерениям с помощью того же количественного анализа RT-PCR в реальном времени для РНК HERV-K (HML-2) gag , контрольные люди обычно практически не имели доказательств gag в плазме (10 2 копий / мл в среднем), тогда как пациенты с лимфомами, связанными с ВИЧ или не с ВИЧ, имели очень высокие титры (до 10 10 копий РНК на мл, в среднем 10 7 копий / мл), а пациенты с раком груди также имели в плазме высокие титры gag РНК (рис.1А).
РИС. 1.титров РНК HERV-K (HML-2) в плазме крови пациентов и здоровых лиц. (A) Вирусную РНК выделяли из образцов плазмы, и нагрузку РНК HERV-K (HML-2) gag измеряли с помощью ОТ-ПЦР в реальном времени. (B и C) Нагрузки РНК env штаммов HERV-K (HML-2) типа 1 (B) и типа 2 (C) были количественно определены NASBA. Столбцы показывают логарифмическую медианную вирусную нагрузку РНК HERV-K (HML-2). Наблюдалась статистически значимая разница между средней нагрузкой РНК HERV-K (HML-2) у пациентов с лимфомой (тест t , P <0.0001) или рака груди (тест t , P <0,0001) и у здоровых людей.
Чтобы еще раз доказать, что высокие титры вирусной РНК HERV-K (HML-2) могут быть обнаружены в плазме пациентов с лимфомой и раком груди, мы использовали второй, независимый метод амплификации РНК, NASBA, который не требует термоциклирования и не влияет на загрязняющую ДНК, которая может присутствовать в плазме (см. рис. S1 в дополнительном материале). Кроме того, мы использовали этот метод для амплификации вирусной РНК env , а не gag , как использовалось в ОТ-ПЦР.Используя эту методологию, мы смогли обнаружить две разные формы HERV-K (HML-2), тип 1 и тип 2, которые отличаются фрагментом 292 п.н. в env , который присутствует в типе 2, но удален. в типе 1. Как видно на фиг. 1B, очень высокие титры РНК типа 1 env снова наблюдались у пациентов с раком груди и лимфомой, но не у нормальных контролей. Аналогичная картина наблюдалась с HERV-K типа 2 (HML-2), за исключением того, что здесь титры были значительно ниже или отсутствовали при лимфоме Ходжкина (рис.1С). Поэтому не только очень высокие титры РНК HERV-K (HML-2) в плазме пациентов с лимфомой, в отличие от здоровых людей, но и специфичность в отношении типа HERV-K (HML-2), обнаруженного в люди с различными типами лимфомы. У пациентов с лимфомой и раком молочной железы секвенирование РНК HERV-K (HML-2) подтвердило транскрипционную активацию последовательностей env как минимум из 16 различных полиморфных вирусов HERV-K (HML-2) типа 1 и 18 различных полиморфных вирусов HERV-K (HML-2) типа 1 ( данные не показаны).Поразительно, что когда пациенты получали лечение и их лимфома перешла в стадию ремиссии, титры HERV-K (HML-2) в большинстве случаев становились неопределяемыми (рис. 2). У двух пациентов, которые получили неполное лечение или получили лишь частичную ремиссию, титры упали, но все еще оставались значительно выше нормального диапазона.
РИС. 2.титров HERV-K (HML-2) в плазме у пациентов с ВИЧ-ассоциированной лимфомой во время диагностики и ремиссии. Плазма была доступна до и после лечения девяти пациентам (четыре с диффузной большой B-клеточной лимфомой, три с лимфомой Ходжкина, один с лимфомой Беркитта и один с лимфомой маргинальной зоны).Вирусную нагрузку HERV-K (HML-2) gag в плазме измеряли с помощью ОТ-ПЦР в реальном времени. Значение P было рассчитано с использованием теста t и сравнения средних нагрузок РНК HERV-K (HML-2) при диагностике и после ремиссии. Столбики показывают логарифмическую медианную вирусную нагрузку РНК HERV-K (HML-2) до и после лечения. Один пациент с диффузной большой B-клеточной лимфомой лечился только фоскарнетом, что привело к резкому уменьшению опухоли. Четверо других пациентов с диффузной крупноклеточной В-клеточной лимфомой лечились циклофосфамидом, адриамицином, винкристином и преднизоном.Один пациент с лимфомой Беркитта проходил курс лечения циклофосфамидом, винкристином, преднизоном и интратекальным метотрексатом. Единственного пациента с лимфомой маргинальной зоны лечили ритуксаном плюс циклофосфамид, адриамицин, винкристин и преднизон. Пациенты с болезнью Ходжкина получали курс адриамицина, блеомицина, велбана, преднизона и дакарбазина. У двух пациентов вирусная нагрузка не стала неопределяемой после лечения: один пациент с лимфомой Ходжкина завершил только три из шести курсов химиотерапии, а один пациент с лимфомой маргинальной зоны имел только частичную ремиссию.Остальные семь пациентов завершили терапию и достигли полной и стойкой ремиссии.
Получив доказательства с помощью двух независимых методов амплификации РНК (NASBA и RT-PCR), что элементы HERV-K (HML-2), вероятно, обнаруживаются в плазме пациентов с лимфомой, мы исследовали этот вопрос дополнительно с использованием дополнительных параметров. Мы изучили плазму трех ВИЧ-отрицательных пациентов с лимфомой с высокими титрами РНК HERV-K (HML-2), обнаруженных с помощью ОТ-ПЦР, и трех контрольных лиц без лимфомы (два здоровых молодых человека и один человек без лимфомы с панкреатит), у которых отсутствовали определяемые титры РНК HERV-K (HML-2).Образцы плазмы от этих людей сначала подвергали ультрацентрифугированию в градиенте йодиксанола, чтобы фракционировать плазму по плотности. Затем мы искали вирусную РНК gag и env с помощью ОТ-ПЦР, на предмет активности ОТ с использованием стандартного ферментативного анализа и белков Gag и Env с помощью вестерн-блоттинга в различных фракциях, полученных из градиентов йодиксанола. Белковый экстракт из клеточной линии NCCIT, продуцирующей частицы HERV-K (HML-2), использовали в качестве контроля для вестерн-блоттинга, поскольку этими клетками продуцируются как белки HERV-K (HML-2), Gag, так и Env (10).Как можно видеть на фиг. 3, вирусная РНК или вирусный белок и очень низкая активность ОТ не были обнаружены у трех контрольных индивидуумов, у которых не было обнаружено РНК в плазме с помощью ОТ-ПЦР. Напротив, у трех пациентов с лимфомой наблюдались активность RT, вирусные РНК gag и env и правильно обработанные вирусные белки Gag и Env, в каждом случае во фракциях с соответствующей плотностью (1,15-1,17 г / мл) для предполагаемого вируса HERV-K (HML-2) (22, 23, 50). Размеры белков Gag (30 кДа) и Env (55 кДа), обнаруженные с помощью вестерн-блоттинга у всех трех пациентов с лимфомой, соответствуют процессированному белку Gag и субъединице поверхности Env (SU), что указывает на то, что эти белки были правильно обработаны (10, 12, 13, 22, 23, 34).Это наблюдение предполагает, что некоторые частицы HERV-K (HML-2), обнаруженные в крови, могут быть зрелыми вирионами. Кроме того, поскольку расщепление белков Env и Gag вирусной протеазой необходимо для созревания вириона (50), присутствие процессированных Gag и Env указывает на то, что вирусная протеаза, вероятно, функциональна в этих условиях. У одного пациента с лимфомой (рис. 3C) была обнаружена не только полоса 30 кДа, соответствующая процессированному белку Gag, и полоса 55 кДа, представляющая обработанную субъединицу SU Env, но также полосу 80 кДа, соответствующую необработанному Env. (10, 12, 23).Это говорит о том, что незрелые и зрелые вирионы HERV-K могут сосуществовать в крови этого пациента.
РИС. 3.титров РНК HERV-K, белков и активности RT во фракциях из образцов плазмы здоровых людей и пациентов с лимфомой, не инфицированных ВИЧ. Образцы плазмы от трех пациентов с лимфомой (крупноклеточная лимфома [A и B] и лимфома из мантийных клеток [C]) и трех контрольных лиц (здоровые люди [D и E] и пациент с панкреатитом [F]) были фракционированы по плотности в градиентах йодиксанола.Плотность каждой фракции дана по оси x . Активность ОТ в каждой фракции, представленная светлыми полосами, дана по оси — в относительных флуоресцентных единицах. Титры (линии) РНК HERV-K (HML-2) gag и env оценивали с помощью ОТ-ПЦР в реальном времени. Вирусные белки HERV-K (HML-2) обнаруживали вестерн-блоттингом белковых экстрактов из каждой фракции. Лизаты клеток из линии клеток NCCIT, продуцирующей частицы HERV-K (HML-2), использовали в качестве положительного контроля (первая полоса вестерн-блоттинга на каждой панели).Полоса, представляющая обработанный Env, находится на уровне 55 кДа, а полоса, соответствующая необработанному Env, — на уровне 80 кДа.
Обычно очень сложно обнаружить патогенные вирусные частицы в крови пациентов с помощью ЭМ; например, это никогда не было успешным с пациентами, инфицированными ВИЧ-1. Однако некоторые РНК-вирусы, обнаруженные в крови с очень высокими титрами, такие как вирус гепатита С, могут быть обнаружены непосредственно в крови с помощью ЭМ (30). Поскольку некоторые из наших пациентов с лимфомой имели титры РНК HERV-K (HML-2) до 10 10 копий / мл, мы искали доказательства наличия вирусных частиц во фракционированной плазме пациентов с лимфомой.Действительно, мы смогли обнаружить вирусные частицы во фракции (плотность ~ 1,16 г / мл), содержащей вирусную РНК и белки HERV-K (HML-2) (рис. 4A-C), а также заметные шипы, характерные для ретровирусной оболочки. можно увидеть в некоторых частицах (например, на фиг. 4A). Затем мы провели иммуно-ЭМ с использованием антитела против белка SU Env HERV-K (HML-2) (фиг. 4D-M). Несмотря на сложность сохранения вирионов от сдвига оболочки в результате ультрацентрифугирования в градиентах, таких как сахароза (30), с использованием градиентов йодиксанола мы смогли обнаружить кластеры меченых золотом вирусных частиц с помощью анти-HERV-K (HML- 2) Моноклональные антитела мыши Env.Некоторые частицы имели конденсированные ядра и шипы, симметрично распределенные вокруг вирусной мембраны, что свидетельствует о зрелости вирусов. Подобного кластеризации частиц золота не наблюдалось в вирусных препаратах, зондированных очищенным контрольным мышиным IgG-антителом и детектированных с помощью вторичного антитела, меченного золотом (фиг. 4N-O). Эти результаты ЭМ, подтвержденные в двух независимых лабораториях (Анн-Арбор, штат Мичиган, и Сиена, Италия), демонстрируют, что вирусные частицы, некоторые зрелые и некоторые незрелые, обнаруженные в крови пациентов с лимфомой, действительно являются HERV-K (HML-2 ).Таким образом, многочисленные доказательства, полученные в наших лабораториях, предполагают присутствие элементов HERV-K (HML-2) в плазме современных людей, больных раком.
РИС. 4. В плазме больных лимфомой обнаруженочастиц HERV-K (HML-2). Вирусные частицы, обнаруженные во фракции плазмы при плотности 1,16 г / мл, были визуализированы с помощью ЭМ. (От A до C) частицы были обнаружены у всех пациентов с лимфомой. При большом увеличении одна частица (A) показывает зрелую морфологию с уплотненным ядром и выступами.Две частицы (B и C) показывают шипы Env, но ядро не полностью конденсировано, что указывает на то, что эти вирионы, вероятно, еще не полностью созрели. (D к M) Иммуно-ЭМ изображения частиц, меченных антителом, специфичным к HERV-K Env, и вторичным антителом, связанным с 5 (D к K) или 10-нм частицами золота (L и M). Все обнаруженные вирусные частицы имеют размер от 90 до 100 нм, как и ожидалось для HERV-K (HML-2). Некоторые частицы (G, I, J, K и L) имели конденсированные ядра и шипы, симметрично распределенные вокруг вирусной мембраны, что указывает на зрелые вирусы.(N и O) Не наблюдали кластеризации золотых частиц в отрицательном контроле, в котором те же препараты были помечены очищенным мышиным IgG-антителом и детектированы с помощью вторичного антитела, меченного золотом (частицы размером 5 нм).
ОБСУЖДЕНИЕ
Вирусоподобные частицы, генерируемые тканями млекопитающих, часто обнаруживают, что они происходят от эндогенных ретровирусных провирусов. Ткани мыши генерируют такие вирусоподобные частицы, происходящие от эндогенного ретровируса, как в патологических, так и в нормальных условиях, в том числе в развивающемся эмбрионе (31, 46, 60).Помимо мышей, наличие эндогенных ретровирусов и ретровирусных частиц было связано с раком у нескольких других животных, включая человека. Недавно Tarlinton et al. изолировал новый ретровирус от коал, названный KoRV. Этот вирус был выделен из коал, у которых развились лимфомы. Авторы показали, что KoRV — это новый эндогенный ретровирус коалы, который в настоящее время находится в переходной стадии между экзогенной и эндогенной фазами. Кроме того, KoRV обнаруживается в высоких титрах в крови некоторых коал, что демонстрирует ОТ-ПЦР в реальном времени (52, 53).Интересно, что у этих коал существует сильная связь между вирусной нагрузкой в плазме, оцениваемой по уровням РНК, и развитием лейкемии / лимфомы (51). Вирусоподобные частицы HERV-K (HML-2) ранее были обнаружены в клеточных линиях тератокарциномы, меланомы и рака груди человека (10, 42, 49). Здесь мы впервые демонстрируем, что РНК HERV-K (HML-2) может быть обнаружена в крови пациентов с лимфомой, а также у пациентов с раком груди. Кроме того, у этих пациентов наблюдаются чрезвычайно высокие титры РНК HERV-K (HML-2) в плазме, и эти титры резко падают при успешном лечении лимфомы.По аналогии с MMTV, вероятно, что опухолевые клетки молочной железы или лимфоцитов являются основным источником продукции частиц HERV-K (HML-2), количество которых, по-видимому, резко снижается в плазме после того, как опухолевая нагрузка уменьшается на химиотерапия. Однако продолжающиеся эксперименты в нашей лаборатории направлены на то, чтобы прояснить, что это действительно так.
Следует предупредить, что то, что мы определяем как РНК плазмы HERV-K (HML-2), вероятно, может быть вирусной ДНК, которая высвобождается в ответ на повышенную клеточную пролиферацию и обмен, наблюдаемый при злокачественных новообразованиях (27, 28).Однако несколько факторов предполагают, что это не так. Во-первых, мы не обнаружили амплификации РНК HERV-K (HML-2), когда RT не добавляли в реакционные смеси (ссылка 19 и данные не показаны). Во-вторых, ОТ-ПЦР выполняются в присутствии ДНКазы, и, что, возможно, более важно, мы получили очень похожие результаты как с ОТ-ПЦР, так и с NASBA, последняя представляет собой метод амплификации РНК, который не требует термоциклирования и не мешает с наличием свободной ДНК. Кроме того, даже преднамеренное заражение реакций NASBA не приводило к амплификации ДНК (см.рис.S1 в дополнительном материале). Таким образом, хотя полностью исключить контаминацию ДНК невозможно, эти соображения, а также присутствие вирусных частиц и белков в плазме этих пациентов позволяют предположить, что это, скорее всего, HERV-K (HML-2). РНК, а не ДНК, которую мы обнаруживаем в этих исследованиях.
В дополнение к РНК HERV-K (HML-2), мы также представили доказательства, свидетельствующие о наличии других вирусных элементов в плазме пациентов с лимфомой. Во-первых, когда плазму разделяют градиентами йодиксанола, фракции, соответствующие плотности ретровируса, содержат активность ОТ, HERV-K (HML-2) gag и РНК env , а также белки Gag и Env, тогда как ОТ активность, вирусная РНК или вирусные белки наблюдаются в плазме контрольных лиц.Кроме того, вероятно, потому, что титры вирусоподобных частиц настолько высоки, мы смогли визуализировать HERV-K (HML-2) -подобные частицы в плазме пациентов с лимфомой. Окрашивание иммуноголдом продемонстрировало, что эти частицы действительно весьма вероятно являются HERV-K (HML-2), как предполагают результаты вестерн-блоттинга, RT-PCR и NASBA. Насколько нам известно, это первая демонстрация того, что, как и в случае с супернатантами линий злокачественных клеток человека, частицы HERV-K (HML-2) можно найти в сыворотках реальных больных раком.Хотя присутствие этих вирусных элементов коррелирует с заболеванием, еще предстоит выяснить, играет ли HERV-K (HML-2) активную проонкогенную роль. Однако, если эти вирусные элементы в плазме в конечном итоге окажутся из действительно инфекционных вирусных частиц (см. Обсуждение ниже), нацеливание на HERV-K (HML-2) с помощью антиретровирусных соединений может в конечном итоге стать терапевтической стратегией у пациентов с лимфомой или раком груди. . Таким образом, наши результаты могут повлиять как на понимание вирусного онкогенеза, так и на методы лечения важных злокачественных новообразований.
Независимо от того, играет ли репликация HERV-K (HML-2) роль в патогенезе рака или лимфомы молочной железы, похоже, что в соответствии с данными о коалах (52, 53), вирус HERV-K (HML-2) нагрузки могут оказаться важным новым биомаркером этих заболеваний. Во-первых, в то время как некоторые биомаркеры, используемые в клинической практике, показывают изменения в диапазоне одной логарифмической единицы, титры РНК HERV-K (HML-2) у пациентов заметно отличаются от контрольной: у нормальных людей титры составляют 10 2 копий / мл в среднем, тогда как у пациентов с лимфомой титры могут достигать 10 10 копий / мл.Кроме того, хотя специфичность этих результатов потребует значительно более тщательного исследования, прежде чем будут сделаны выводы, похоже, что существуют различия внутри групп рака, которые основаны не только на общем титре. Например, пациенты с болезнью Ходжкина имеют очень высокие титры HERV-K (HML-2) типа 1, но незначительные титры HERV-K (HML-2) типа 2 (рис. 1B и C). Наконец, мы обнаружили, что при успешном лечении пациентов от лимфомы (рис. 2) титры РНК HERV-K (HML-2) в крови возвращаются к низким или даже неопределяемым уровням.Таким образом, титры HERV-K (HML-2) потенциально могут стать крайне необходимым биомаркером этого важного рака. Однако необходимо подчеркнуть, что необходимо провести дополнительную работу, прежде чем будет установлена истинная клиническая ценность HERV-K (HML-2) в качестве биомаркера.
Эндогенные ретровирусные элементы составляют примерно 8 процентов генома человека (33, 45), и обычно считается, что они утратили способность к репликации из-за приобретения нескольких мутаций. Кроме того, в геноме человека наблюдается нехватка полных функциональных элементов [тех, которые непрерывно кодируют функциональные копии всех генов HERV-K (HML-2)].Две группы недавно показали, что реанимированные версии HERV-K (HML-2), сделанные из клонированных конструкций, в которых были исправлены мутации, способны к репликации (23, 34). Эти элегантные эксперименты демонстрируют, что HERV-K (HML-2) действительно мог реплицироваться в прошлом, но они напрямую не решают, может ли HERV-K (HML-2) все еще реплицироваться у современных людей. Интересно, что по крайней мере один полноразмерный HERV-K с неповрежденными открытыми рамками считывания, HERV-K 113, был обнаружен примерно у 15-30 процентов людей, прошедших тестирование, и генетический анализ показывает, что это очень недавнее добавление в геном человека (14, 55).Это побудило авторов предположить, что HERV-K 113 является кандидатом на активную репликацию у современных людей, но три группы в настоящее время представили доказательства того, что HERV-K113 сам по себе, вероятно, является дефектным, по крайней мере, в анализах клеточных культур (5, 13, 22). ). Белшоу и его коллеги показали, что HERV-K (HML-2) подвергался непрерывному очищающему отбору, открытие, которое они интерпретируют как предположение, что распространение этого семейства почти полностью связано с повторным инфицированием зародышевой линии (7, 8). В дальнейшем считалось, что сохранение гена env поддерживает эту идею, поскольку это предполагает необходимость постоянного повторного заражения в жизненном цикле этих вирусных элементов.Наконец, по крайней мере, восемь элементов из семейства HERV-K (HML-2), по-видимому, полиморфны в отношении их присутствия в человеческой популяции, что указывает на то, что они были вставлены в геном человека после последнего общего предка людей и шимпанзе. (7, 8, 38, 40, 41). Таким образом, хотя большинство исследователей сегодня считают, что HERV-K (HML-2) больше не способен к репликации у современных людей, некоторые доказательства обратного существуют. Наше открытие РНК HERV-K (HML-2), активности RT, процессированных вирусных белков и того, что кажется зрелыми вирусными частицами в крови больных раком, поднимает вопрос о том, может ли активная репликация HERV-K (HML-2) имеют место у этих пациентов при некоторых обстоятельствах.Однако для доказательства этого потребуется передача современного вируса в лаборатории.
БЛАГОДАРНОСТИ
Мы благодарим Рино Раппуоли, Джона Доннелли, Джона Морана, Стива Гоффа и Джозефа Пагано за их вдумчивые комментарии к работе; Донна Гшвенд за подготовку рукописи; Дотти Соренсон за помощь с электронно-микроскопическими исследованиями; и Джудит Эстес и Кэтрин Якоби за набор пациентов.
Работа выполнена при поддержке щедрого гранта M.H.K. от организации «Обеспокоенные родители для исследований в области СПИДа» (05-5089), при этом дополнительное финансирование поступило от учеников средней школы Рослин, Рослин, штат Нью-Йорк. D.F.H. при поддержке Благотворительного фонда модной обуви Нью-Йорка / QVC представляет обувь на распродаже. S.D.G. был поддержан грантом Мичиганского института клинических исследований и медицинских исследований. D.M.M. был поддержан грантом R01 AI062248 от Национальных институтов здравоохранения и получил премию Клинического ученого Фонда Берроуза Велкома в области трансляционных исследований.
Сноски
- Получено 21 марта 2008 г.
- Принято 9 июля 2008 г.
- Авторское право © Американское общество микробиологии, 2008 г.
ССЫЛКИ
- 1.8 9 903 Sauter, E. Krautkraemer, E. Meese, A. Kleiman, B. Best, K. Roemer и N. Mueller-Lantzsch. 2002. Новый ген эндогенного ретровируса К человека, экспрессируемый в трансформированных клетках. Clin. Cancer Res.8 : 1800-1807.
- 2.↵
Армбруестер, В., М. Заутер, К. Ремер, Б. Бест, С. Хан, А. Нти, А. Шмид, С. Филипп, А. Мюллер и Н. Мюллер-Ланцш. 2004. Белок Np9 эндогенного ретровируса К человека взаимодействует с лигандом numb-белка X. J. Virol.78 : 10310-10319.
- 3.↵
Bannert, N., and R. Kurth. 2004. Ретроэлементы и геном человека: новые взгляды на старые отношения. Proc. Natl. Акад. Sci.USA101 : 14572-14579.
- 4.↵
Барбулеску, М., Г. Тернер, М. Симан, А. Дейнард, К. Кидд и Дж. Ленц. 1999. Многие провирусы человеческого эндогенного ретровируса К (HERV-K) уникальны для человека. Curr. Биол.9 : 861-868.
- 5.↵
Беймфорде, Н., К. Ханке, И. Аммар, Р. Курт и Н. Баннерт. 2008. Молекулярное клонирование и функциональная характеристика человеческого эндогенного ретровируса K113. Вирусология 371 : 216-225.
- 6.↵
Белансио, В. П., Д. Дж. Хеджес и П. Дейнингер. 2008. Не-LTR ретротранспозоны млекопитающих: к лучшему или к худшему, в болезни и в состоянии здоровья. Genome Res.18 : 343-358.
- 7.↵
Белшоу, Р., А. Л. А. Доусон, Дж. Вулвен-Аллен, Дж. Реддинг, А. Берт и М. Тристем. 2005. Общегеномный скрининг выявляет высокие уровни инсерционного полиморфизма в семействе эндогенных ретровирусов человека HERV-K (HML2): последствия для современной активности.J. Virol.79 : 12507-12514.
- 8.↵
Belshaw, R., V. Pereira, A. Katzourakis, G. Talbot, J. Paces, A. Burt, and M. Tristem. 2004. Длительная реинфекция генома человека эндогенными ретровирусами. Proc. Natl. Акад. Sci. USA101 : 4894-4899.
- 9.↵
Бхадра, С., М. М. Лозано и Дж. П. Дадли. 2005. Превращение вируса опухоли молочной железы мышей в лимфомагенный вирус. J. Virol.79 : 12592-12596.
- 10.↵
Бьеда, К., А. Хоффманн и К. Боллер. 2001. Фенотипическая гетерогенность человеческих эндогенных ретровирусных частиц, продуцируемых клеточными линиями тератокарциномы. J. Gen. Virol. 82 : 591-596.
- 11.↵
Boese, A., M. Sauter, U. Galli, B. Best, H. Herbst, J. Mayer, E. Kremmer, K. Roemer и N. Mueller-Lantzsch. 2000. Эндогенный ретровирусный белок человека cORF поддерживает трансформацию клеток и связан с белком цинкового пальца промиелоцитарного лейкоза.Онкоген19 : 4328-4336.
- 12.↵
Boller, K., H. Konig, M. Sauter, N. Mueller-Lantzsch, R. Löwer, J. Löwer и R. Kurth. 1993. Доказательства того, что HERV-K является эндогенной ретровирусной последовательностью, которая кодирует ретровирус HTDV, происходящий от тератокарциномы человека. Вирусология 196 : 349-353.
- 13.↵
Боллер, К., К. Шёнфельд, С. Лишер, Н. Фишер, А. Хоффманн, Р. Курт и Р. Р. Тёньес. 2008 г.Эндогенный ретровирус человека HERV-K113 способен продуцировать интактные вирусные частицы. J. Gen. Virol. 89, : , 567-572.
- 14.↵
Burmeister, T., A. D. Ebert, W. Pritze, C. Loddenkemper, S. Schwartz, and E. Thiel. 2004. Инсерционные полиморфизмы эндогенных ретровирусов HERV-K113 и HERV-K115 у пациентов с раком груди и контрольной группы соответствующего возраста. AIDS Res. Гм. Ретровирусы20 : 1223-1229.
- 15.↵
Бюшер, К., S. Hahn, M. Hofmann, U. Trefzer, M. Ozel, W. Sterry, J. Löwer, R. Löwer, R. Kurth и J. Denner. 2006. Экспрессия трансмембранной оболочки эндогенного ретровируса-К человека, белков Rec и Np9 в клеточных линиях меланомы. Melanoma Res.16 : 223-234.
- 16.↵
Büscher, K., U. Trefzer, M. Hofmann, W. Sterry, R. Kurth, and J. Denner. 2005. Экспрессия эндогенного ретровируса К человека в меланомах и клеточных линиях меланомы. Cancer Res.65 : 4172-4180.
- 17.↵
Калиендо, А. М., Дж. Ингерсолл, А. М. Фокс-Канале, С. Паргман, Т. Байтвуд, М. К. Хайден, Дж. У. Бремер и Н. С. Лурайн. 2007. Оценка разработанных лабораторией тестов ПЦР в реальном времени с использованием специфичных для аналитов реагентов для количественной оценки цитомегаловируса. J. Clin. Microbiol.45 : 1723-1727.
- 18.↵
Контрерас-Галиндо, Р., М. Гонсалес, С. Альмодовар, С. Гонсалес-Рамирес, Э. Лоренцо и Ю. Ямамура. 2006. Новая ОТ-ПЦР в реальном времени для количественного определения РНК-нагрузки эндогенных ретровирусов типа К (HERV-K) человека в образцах плазмы: повышение титров РНК HERV-K у пациентов с ВИЧ-1, получавших не супрессивные схемы ВААРТ. J. Virol. Методы 136 : 51-57.
- 19.↵
Контрерас-Галиндо, Р., М. Х. Каплан, Д. М. Марковиц, Э. Лоренцо и Ю. Ямамура. 2006. Обнаружение вирусной РНК HERV-K (HML-2) в плазме людей, инфицированных ВИЧ типа 1. AIDS Res. Гм.Ретровирусы 22 : 979-984.
- 20.↵
Denne, M., M. Sauter, V. Armbruester, J. D. Licht, K. Roemer и N. Mueller-Lantzsch. 2007. Физические и функциональные взаимодействия белков человеческого эндогенного ретровируса Np9 и rec с белком цинкового пальца промиелоцитарного лейкоза. J. Virol. 81 : 5607-5616.
- 21.↵
Depil, S., C. Roche, P. Dussart, and L. Prin. 2002. Экспрессия человеческого эндогенного ретровируса HERV-K в клетках крови больных лейкемией.Лейкемия 16 : 254-259.
- 22.↵
Деванье, М., С. Блез и Т. Хайдманн. 2005. Идентификация функционального белка оболочки из семейства HERV-K эндогенных ретровирусов человека. J. Virol.79 : 15573-15577.
- 23.↵
Деванье, М., Ф. Харпер, А. Ришо, К. Летцельтер, Д. Рибет, Г. Пьерон и Т. Хайдманн. 2006. Идентификация инфекционного предшественника многокопийных эндогенных ретроэлементов HERV-K человека.Genome Res.16 : 1548-1556.
- 24.↵
Эйтади, Х. Д., Дж. Х. Мартин, Дж. Джуниинг, Д. А. Роден, М. Лахири, П. Уоррен, П. Г. Мюррей и П. Н. Нельсон. 2005. Новая система мультиплексной ОТ-ПЦР обнаруживает человеческий эндогенный ретровирус-К при раке груди. Arch. Virol.150 : 177-184.
- 25.↵
Галли, У. М., М. Заутер, Б. Лехер, С. Маурер, Х. Хербст, К. Ремер и Н. Мюллер-Ланцш. 2005. Эндогенный ретровирус человека rec препятствует развитию зародышевых клеток у мышей и может вызвать карциному in situ, предшествующее поражение опухолей зародышевых клеток.Онкоген24 : 3223-3228.
- 26.↵
Garrison, KE, RB Jones, DA Meiklejohn, N. Anwar, LC Ndhlovu, JM Chapman, AL Erickson, A. Agrawal, G. Spotts, FM Hecht, S. Rakoff-Nahoum, Дж. Ленц, М.А. Островски и Д.Ф. Никсон. 2007. Т-клеточные реакции на эндогенные ретровирусы человека при ВИЧ-1-инфекции. PloS Pathog.3 : e165.
- 27.↵
Джакона, М. Б., Г. К. Рубен, К. А. Ичковски, Т.Б. Роос, Д. М. Портер и Г. Д. Соренсон. 1998. Бесклеточная ДНК в плазме крови человека: измерения длины у пациентов с раком поджелудочной железы и здоровых людей. Поджелудочная железа17 : 89-97.
- 28.↵
Яр, С., Х. Хентце, С. Энглиш, Д. Хардт, Ф. О. Факельмайер, Р. Д. Хеш и Р. Книпперс. 2001. Фрагменты ДНК в плазме крови больных раком: количественное определение и доказательства их происхождения из апоптотических и некротических клеток. Cancer Res.61 : 1659-1665.
- 29.↵
Джонстон, Дж., К. Сильва, Дж. Холден, К. Уоррен, А. Кларк и К. Пауэр. 2001. Активация и дифференцировка моноцитов усиливают экспрессию эндогенного ретровируса человека: последствия для воспалительных заболеваний мозга. Анна. Neurol.50 : 434-442.
- 30.↵
Kaito, M., S. Watanabe, K. Tsukiyama-Kohara, K. Yamaguchi, Y. Kobayashi, M. Konishi, M. Yokoi, S. Ishida, S. Suzuki, and М.Кохара. 1994. Частица вируса гепатита С обнаружена методом иммуноэлектронной микроскопии. J. Gen. Virol.75 : 1755-1760.
- 31.↵
Кигами Д., Н. Минами, Х. Такаяма и Х. Имаи. 2003. MuERV-L — один из самых ранних транскрибируемых генов одноклеточных эмбрионов мыши. Биол. Репродукция 68 : 651-654.
- 32.↵
Laderoute, M. P., A. Giulivi, L. Larocque, D. Bellfoy, Y. Hou, H. X. Wu, K. Fowke, J.Ву и Ф. Митома. 2007. Репликативная активность человеческого эндогенного ретровируса K102 (HERV-K102) при ВИЧ-виремии. AIDS21 : 2417-2424.
- 33.↵
Лендер, Э. С., Р. Х. Уотерстон, Дж. Салстон и Ф. С. Коллинз. 2001. Первоначальное секвенирование и анализ генома человека. Nature409 : 860-921.
- 34.↵
Lee, Y., and P. D. Bieneasz. 2007. Воссоздание инфекционного эндогенного ретровируса человека.PLoS Pathog.3 : e10.
- 35.↵
Löwer, R., J. Löwer, and R. Kurth. 1996. Вирусы в каждом из нас: характеристики и биологическое значение последовательностей эндогенных ретровирусов человека. Proc. Natl. Акад. Sci. USA93 : 5177-5184.
- 36.↵
Löwer, R., K. Boller, B. Hasenmaier, C. Korbmacher, N. Mueller-Lantzsch, J. Löwer, and R. Kurth. 1993. Идентификация эндогенных ретровирусов человека со сложной экспрессией мРНК и образованием частиц.Proc. Natl. Акад. Sci. USA90 : 4480-4484.
- 37.↵
Мацузава, А., Х. Накано, Ю. Йошимото и К. Саяма. 1995. Биология вируса опухоли молочной железы мышей (MMTV). Cancer Lett.90 : 3-11.
- 38.↵
Mayer, J., S. Ehlhardt, M. Seifert, M. Sauter, N. Mueller-Lantzsch, Y. Mehraein, K. D. Zang, and E. Meese. 2004. 2004. Провирусы эндогенного ретровируса HERV-K (HML-2) человека с кодирующей способностью Rec-белка и транскрипционной активностью.Вирусология 322 : 190-198.
- 39.↵
Морган Д. и Бродские И. 2004. Частицы эндогенного ретровируса человека (HERV-K) в мегакариоцитах, культивируемых из стволовых клеток периферической крови эссенциальной тромбоцитемии. Exp. Hematol.32 : 520-525.
- 40.↵
Мойес, Д., А. Мартин, С. Соцер, Н. Темпертон, Дж. Уортингтон, Д. Гриффитс и П. Венейблс. 2005. Распространение эндогенных ретровирусов HERV-K113 и HERV-K115 в условиях здоровья и болезней.Genomics86 : 337-341.
- 41.↵
Мойес Д., Д. Дж. Гриффитс и П. Дж. Венейблс. 2007. Инсерционные полиморфизмы: новая жизнь эндогенных ретровирусов при болезнях человека. Тенденции Genet.23 : 326-333.
- 42.↵
Muster, T., A. Waltenberger, A. Grassauer, S. Hirschl, P. Caucig, I. Romirer, D. Födinger, H. Seppele, O. Schanab, C. Magin -Лахманн, Р. Лёвер, Б. Янсен, Х. Пехамбергер и К.Вольф. 2003. Эндогенный ретровирус, полученный из клеток меланомы человека. Cancer Res.63 : 8735-8741.
- 43.↵
Нельсон, П., П. Карнеги, Дж. Мартин, Э. Давари, П. Хули, Д. Роден, С. Роуленд-Джонс, П. Уоррен, Дж. Эстли и П. Мюррей. 2003. Демистифицированные эндогенные ретровирусы человека. Мол. Патол. 56 : 11-18.
- 44.↵
Оно, М., Т, Ясунага. Т. Мията и Х. Ушикубо. 1986 г.Нуклеотидная последовательность генома эндогенного ретровируса человека, связанная с геномом вируса опухоли молочной железы мыши. J. Virol. 60, : , 589-598.
- 45.↵
Paces, J., A. Pavlicek и V. Paces. 2002. HERVd: База данных эндогенных ретровирусов человека. Nucleic Acids Res.30 : 205-206.
- 46.↵
Ribet, D., S. Louvet-Vallee, F. Harper, N. de Parseval, M. Dewannieux, O. Heidmann, G. Pierron, B. Maro и T.Хайдманн. 2008. Мышиный эндогенный ретровирус MuERV-L является предшественником «орфанных» эпсилон-вирусоподобных частиц ранних эмбрионов мыши. J. Virol. 82 : 1622-1625.
- 47.↵
Руда В. М., Акопов С. Б., Трубецкой Д. О., Мануйлов Н. Л., Ветчинова А. С., Завалова Л. Л., Николаев Л. Г., Свердлов Е. Д.. 2004. Тканевая специфичность энхансерной и промоторной активностей HERV-K (HML-2) LTR. Virus Res.104 : 11-16.
- 48.↵
Райан, Ф. П. 2004. Эндогенные ретровирусы человека в здоровье и болезни: симбиотическая перспектива. J. R. Soc. Med.97 : 560-565.
- 49.↵
Seifarth, W., C. Baust, A. Murr, H. Skladny, F. Krieg-Schneider, J. Blusch, T. Werner, R. Hehlmann, and C. Leib- Mosch. 1998. Провирусная структура, хромосомное расположение и экспрессия HERV-K-T47D, нового человеческого эндогенного ретровируса, полученного из частиц T47D. J. Virol.72 : 8384-8391.
- 50.↵
Симпсон, Г. Р., К. Пейшенс, Р. Лёвер, Р. Р. Тёньес, Х. Д. Мур, Р. А. Вайс и М. Т. Бойд. 1996. Последовательности, родственные эндогенному D-типу (HERV-K), упакованы в ретровирусные частицы в плаценте и обладают открытыми рамками считывания для обратной транскриптазы. Вирусология. 222 : 451-456.
- 51.↵
Сугимото, Дж., Н. Мацуура, Ю. Киндзё, Н. Такасу, Т. Ода и Ю. Джинно. 2001. Транскрипционно активные гены HERV-K: идентификация, выделение и хромосомное картирование.Genomics72 : 137-144.
- 52.↵
Тарлинтон Р., Дж. Меерс и П. Р. Янг. 2006. Ретровирусное вторжение в геном коалы. Nature442 : 79-81.
- 53.↵
Тарлинтон Р., Дж. Меерс, Дж. Хэнгер и П. Янг. 2005. ПЦР с обратной транскриптазой в реальном времени для эндогенного ретровируса коалы выявляет связь между вирусной нагрузкой в плазме и опухолевыми заболеваниями у коал. J. Gen. Virol. 86, : , 783-787.
- 54.↵
Tönjes, RR, R. Löwer, K. Boller, J. Denner, B. Hasenmaier, H. Kirsch, H. König, C. Korbmacher, C. Limbach, R. Lugert, Р. К. Фелпс, Дж. Шерер, К. Телен, Дж. Лёвер и Р. Курт. 1996. HERV-K: биологически наиболее активное семейство эндогенных ретровирусов человека. J. Acquir. Иммунодефицит. Syndr. Гм. Ретровирол.13 (Дополнение 1) : S261-S267.
- 55.↵
Тернер, Г., М. Барбулеску, М. Су, М. Йенсен-Симан, К.Кидд и Дж. Ленц. 2001. Инсерционный полиморфизм полноразмерных эндогенных ретровирусов у человека. Curr. Биол.11 : 1531-1535.
- 56.↵
Ван-Йоханнинг, Ф., А. Фрост, Б. Цзянь, Л. Эпп, Д. Лу и Г. Йоханнинг. 2003. Количественное определение экспрессии гена env HERV-K и сплайсинга при раке груди человека. Онкоген22 : 1528-1535.
- 57.↵
Ван-Йоханнинг, Ф., А. Р. Фрост, Г. Л. Йоханнинг, М.Б. Хазаэли, А. Ф. Лобульо, Д. Р. Шоу и Т. В. Стронг. 2001. Экспрессия транскриптов оболочки эндогенного ретровируса К человека при раке груди человека. Clin. Cancer Res.7 : 1553-1560.
- 58.↵
Янг, Дж., Х. П. Богерд, С. Пенг, Х. Виганд, Р. Труант и Б. Р. Каллен. 1999. Древнее семейство эндогенных ретровирусов человека кодирует функциональный гомолог белка HIV-1 Rev. Proc. Natl. Акад. Sci. USA96 : 13404-13408.
- 59.↵
Йи, Дж. М., Х. М. Ким и Х. С. Ким. 2001. Молекулярное клонирование и филогенетический анализ элементов длинных концевых повторов человеческого эндогенного ретровируса HERV-K в различных раковых клетках. Мол. Cells12 : 137-141.
- 60.↵
Yotsuyanagi, Y., and D. Szollosi. 1980. Развитие эмбриона и внутрицистернальные частицы у мышей. Биол. Cell39 : 201-204.
Экспрессия эндогенных ретровирусов человека-K (HML-2) коррелирует с прогнозом и прогрессом гепатоцеллюлярной карциномы
Предпосылки .Была указана связь между человеческими эндогенными ретровирусами-K (HERV-K) (HML-2) и заболеваниями человека, включая различные виды рака. Однако функция HERV-K (HML-2) в прогрессировании гепатоцеллюлярной карциномы (ГЦК) все еще остается в значительной степени неясной. Методы . Мы выявили экспрессию HERV-K (HML-2) в 84 тканях с ГЦК и прилегающих неопухолевых тканях с помощью количественной ПЦР в реальном времени (qRT-PCR) и проанализировали ее корреляцию с клиническими параметрами. Результат .Уровень HEVR-K был значительно увеличен при ГЦК по сравнению с соседними нормальными тканями (), что, как было доказано, в значительной степени связано с циррозом (), дифференцировкой опухоли () и стадией TNM (). Более того, высокая экспрессия HERV-K (HML-2) имела более низкую общую выживаемость, чем пациенты с более низкой экспрессией, согласно анализу выживаемости Каплана-Мейера (). Многомерный регрессионный анализ Кокса показал, что уровень HERV-K (HML-2) был независимым прогностическим фактором для общей выживаемости пациентов с ГЦК.Кривые рабочих характеристик приемника (ROC) продемонстрировали диагностическую точность экспрессии HERV-K (HML-2) при HCC (AUC = 0,729, чувствительность 74,7% и специфичность 67,8%). Выводы . Наши результаты показали, что повышенная регуляция HERV-K (HML-2) у пациентов с HCC была в значительной степени связана с прогрессированием рака и плохим исходом, что указывает на то, что HERV-K (HML-2) может быть новым кандидатом в прогностический биомаркер для HCC.
1. Введение
Гепатоцеллюлярная карцинома (ГЦК) занимает шестое место среди наиболее распространенных злокачественных опухолей и третье место среди причин смертности от рака во всем мире [1].Развитие ГЦК — многоступенчатый процесс, включающий накопление генетических и эпигенетических мутаций регуляторных генов, вызывающих аберрантную экспрессию онкогенов и гена-супрессора опухоли. Массовые исследования выявили большое количество молекулярных биомаркеров, которые можно использовать для оценки состояния пациента в различных клинических условиях, включая оценку риска заболевания, скрининг скрытого первичного рака, различение доброкачественных и злокачественных новообразований или одного типа злокачественного новообразования от другого, определение прогноза и прогнозирование для пациентов, у которых был диагностирован рак, мониторинг статуса заболевания, обнаружение рецидива и определение ответа или прогрессирования терапии [2].Следовательно, идентификация связанных новых молекулярных биомаркеров ГЦК может предоставить новые методы диагностики и лечения этого злокачественного новообразования.
Эндогенные ретровирусы человека (HERV) составляют более 8% генома человека [3]. HERV существуют как остатки ДНК инфекции, которая произошла в клетках зародышевой линии древнего человека, распространяется как ретротранспозоны в геноме, а позднее как возбудители инфекций и, наконец, передаются по наследству через поколения людей [4]. Эти HERV считаются в основном неинфекционными, дефектными по репликации и ретровирусными остатками, передающимися в виде стабильных менделевских генов.С момента открытия в 1980-х годах HERV были связаны с аутоиммунными заболеваниями и раком [5, 6]. Недавно были обнаружены мРНК HERV, белки HERV и даже частицы HERV при заболеваниях человека, особенно при раке. В отличие от многих других семейств HERV, которые имеют дефектные последовательности, семейство HERV-K (HML-2, вирус опухоли молочной железы человека мыши-2) представляет собой наиболее интактные ретровирусные гены, причем некоторые из них имеют открытые и интактные рамки считывания для вирусных белков [7]. Семейство HERV-K транскрипционно активны в некоторых раковых тканях человека [8, 9].Однако потенциальная роль HERV-K при ГЦК не оценивалась.
Мы стремились оценить уровень экспрессии HERV-K (HML-2) у пациентов с ГЦК и проанализировать его клиническую значимость с помощью количественной полимеразной цепной реакции в реальном времени (qRT-PCR), а также определить его потенциал в качестве биомаркера. для прогнозирования степени тяжести и прогноза ГЦК в этом исследовании.
2. Материалы и методы
2.1. Сбор образцов тканей и клинические характеристики
В этом исследовании приняли участие 84 пациента (78 мужчин и 6 женщин, средний возраст), которым был поставлен диагноз ГЦК и которые перенесли операцию в период с 2012 по 2016 годы.Никто из них не получал предоперационную химиотерапию или лучевую терапию. Парные образцы тканей (опухоль и прилегающие нормальные ткани), гистологически подтвержденные опытными патологами больницы Чжуннань Уханьского университета, были собраны у пациентов после информирования о согласии. В течение 30 минут после операции образцы свежих тканей замораживали и хранили при -80 ° C в растворе для стабилизации РНК RNAlater® (Invitrogen, CA, USA) до использования. Были собраны клинические данные и данные последующего наблюдения. Шестое издание системы классификации метастазов в опухолевые узлы (TNM), опубликованной Международным союзом против рака, было использовано для определения стадии опухоли при ГЦК.
2.2. Экстракция РНК и обратная транскрипция
Образцы ткани по 100 мг использовали для экстракции РНК с помощью реагента Trizol (Invitrogen, CA, USA) в соответствии с инструкциями производителя. Экстрагированную РНК элюировали 40 мкл л воды, свободной от РНКазы. Концентрация и чистота РНК определялись количественно с помощью NanoDrop ND2000 (Thermo, CA, USA). 500 нг ДНК-стертой РНК подвергали обратной транскрипции в конечном объеме 10 мкл в соответствии с протоколом набора реагентов PrimeScript RT (TaKaRa, Далянь, Китай): 37 ° C в течение 15 минут и 85 ° C в течение 15 секунд, а затем хранением при 4 ° C.
2.3. Количественный анализ полимеразной цепной реакции в реальном времени (qRT-PCR)
Для qRT-PCR 2 мкл л разбавленных продуктов обратной транскрипции смешивали с 10 мкл л SYBR® Green в мастер-миксе для ПЦР в реальном времени (Toyobo, Осака, Япония), 1 мкм л прямого праймера (10 мкм M), 1 мкм л обратного праймера (10 мкм M) и 6 мкм л воды, свободной от РНКазы, в конечном объеме 20 мк л. Все реакции проводили по следующему протоколу: один цикл при 95 ° C в течение 3 минут и 40 циклов при 95 ° C в течение 15 секунд, 61 ° C в течение 3 секунд и 72 ° C в течение 30 секунд на Система реального времени CFX96 ™ (Bio-Rad, Калифорния, США).В конце реакции анализировали кривую амплификации и кривую плавления. Наличие единственного пика в анализе кривой плавления применяли для подтверждения специфичности амплификации ПЦР. Экспрессию целевой РНК нормализовали к экспрессии 18S РНК. Используемые праймеры qPCR HERV-K представляют собой прямые, 5′-ATTGGCAACACCGTATTCTGCT -3 ‘; обратный, 5’- CAGTCAAAATATGGACGGATGGT -3 ‘[10]. Праймеры 18S РНК были следующими: прямой: 5’-CAGCCACCCGAGATTGAGCA -3 ‘и обратный: 5′-TAGTAGCGACGGGCGGTGTG -3’.Относительную экспрессию HERV-K рассчитывали методом сравнительного порога цикла (Ct) ().
2.4. Статистический анализ
SPSS версии 17.0 (SPSS, Inc., Чикаго, Иллинойс, США) и GraphPad Prism 5.0 (GraphPad Software, Ла-Хойя, Калифорния, США) применяли для завершения статистического анализа. Для проверки нормальности распределения применялся критерий Шапиро-Уилка. Нормально распределенные числовые переменные были представлены как среднее значение ± стандартное отклонение (SD) и оценены с помощью критерия Стьюдента, в то время как ненормально распределенные переменные были проанализированы с помощью дисперсионного анализа Краскела-Уоллиса.Категориальные переменные анализировали с помощью критерия хи-квадрат. Тест Каплана-Мейера использовался для оценки влияния уровня HERV-K на прогноз общей выживаемости в случаях ГЦК, а логранговый тест применялся для анализа статистических различий между разными группами. Модель пропорциональных рисков Кокса была оценена с помощью многомерного анализа, который содержал переменные с помощью одномерного анализа. Кривая рабочей характеристики приемника (ROC) и площадь под кривой ROC (AUC) были разработаны для оценки диагностической ценности.Для всех анализов статистически значимым считался (два хвоста). Статистическая значимость была присвоена () или ().
3. Результаты
3.1. HERV-K (HML-2) был повышен в образцах тканей HCC
Относительная экспрессия HERV-K (HML-2) была обнаружена и проанализирована в 84 парных клинических тканях HCC и прилегающих нормальных тканях печени. Мы обнаружили, что уровень экспрессии HEVR-K был значительно увеличен при ГЦК по сравнению с соседними нормальными тканями (Таблица 1, Рисунок 1 (a)).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Данные являются средними ± стандартное отклонение. и . Парный -тест использовался для анализа различий между ГЦК и прилежащей доброкачественной печенью. К остальным данным были применены независимые тесты. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.2. Корреляция между HEVR-K и патологическими особенностями HCC
Связь HERV-K с клиническими особенностями 84 пациентов с HCC была оценена, как показано в таблице 1 ().Мы обнаружили значительную корреляцию между HERV-K и некоторыми патологическими данными, такими как дифференциация, стадия TNM и цирроз печени (рис. 1 (b)). Однако ни пол, ни возраст, ни размер опухоли, ни опухолевые узлы, ни другая клиническая патологическая информация существенно не различались с высоко экспрессируемым HERV-K (Таблица 1).
3.3. Высокая экспрессия HERV-K предсказывает плохой прогноз у пациентов с HCC
Эта когорта из 84 пациентов с HCC была разделена на группу с низкой экспрессией (<5,96,) и группу с высокой экспрессией (≥5.96,) в соответствии с нормализованным медианным уровнем HERV-K (медиана = 5,96). Корреляция между экспрессией HERV-K и общей выживаемостью пациентов с ГЦК была исследована с помощью анализа Каплана-Мейера и лог-рангового теста. Как показано на рисунке 2, пациенты с ГЦК с более высокой экспрессией HERV-K имели тенденцию к более короткой общей выживаемости, чем пациенты с более низкой экспрессией HERV-K (низкий HERV-K, медиана: не определена; высокий HERV-K, медиана = 23; HR = 3,017, 95% ДИ = 1,563–5,820 и логранговый тест :). Одномерный анализ показал, что стадия опухоли (III ~ IV по сравнению с I ~ II) и уровень экспрессии HEVR-K (низкий по сравнению с высоким) были значительно связаны с общей выживаемостью пациентов с HCC (Таблица 2).Многофакторный анализ с использованием модели пропорциональных рисков Кокса также показал, что размер опухоли, стадия опухоли и экспрессия HERV-K были независимыми благоприятными прогностическими факторами ГЦК (Таблица 2).
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| считалось статистически значимым; АЛТ: аланинаминотрансфераза; AST: аспартатаминотрансфераза; AFP: α -фетопротеин; TNM: опухоль-узел-метастаз. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.4. Диагностическая ценность HERV-K в HCC
Кривая рабочих характеристик приемника (ROC) была проведена для анализа диагностической точности экспрессии HERV-K.Площадь под кривой ROC () показала, что HERV-K может служить новым биомаркером в диагностике ГЦК (AUC = 0,729, 95% ДИ: 0,652–0,805, чувствительность 74,7%, специфичность 67,8%). Более того, уровень экспрессии HERV-K также может иметь высокую специфичность при скрининге цирроза печени (специфичность 100%) и высокую чувствительность (чувствительность 74,6%) при определении степени дифференцировки для HCC. Между тем, кривая ROC показала, что HEVR-K обеспечивает чувствительность 61,8% и специфичность 69% при разделении стадии TNM (рис. 3).
4. Обсуждение
ГЦР имеет характер незаметного патогенеза, быстрого прогресса, плохого прогноза и высокой смертности, что приводит к инвазивности опухоли, частому внутрипеченочному распространению и внепеченочным метастазам, а также частым рецидивам после резекции [11]. Из-за отсутствия эффективных средств клинической диагностики на ранней стадии только 30–40% пациентов с ГЦК могут быть кандидатами на потенциально излечивающую резекцию, при которой 5–9% общей 5-летней выживаемости могут улучшиться до 69% [12, 13].На поиск идеального биомаркера ГЦК были потрачены десятилетия [14]. Было показано, что многочисленные биомаркеры, выделенные из опухолевых тканей или плазмы, играют жизненно важную роль в прогнозировании канцерогенеза, метастазирования и прогноза ГЦК. Альфа-фетальный белок (AFP) был одним из традиционных биомаркеров для клинической диагностики ГЦК или мониторинга рецидива [15, 16]. Однако специфичность AFP недостаточно высока для того, чтобы выявление часто сообщалось о плохом при ранней диагностике или прогнозировании метастазирования ГЦК [17].С целью повышения диагностической точности и эффективности лечения ГЦК очень важно изучить новые действующие биомаркеры опухолей и выявить механизм канцерогенеза.
Эндогенные ретровирусы человека являются наследственными реликтами зародышевой линии на протяжении всего процесса эволюции. Как и все другие ретровирусы, HERV имеют геномную структуру: 5’LTR-gag, pro, pol и env-3’LTR. Длинные концевые повторы (LTR) играют роль специфицирующих сигналов промотора, энхансера и полиаденилирования, которые вирусы вставляют свои генетические последовательности в геномы хозяина.Без селективного давления на хозяина для поддержания вирусных ДНК или их компонентов в неизменном состоянии комбинация мутаций последовательностей, делеций и ошибок сдвига рамки считывания в течение эволюционного времени привела к потере части целых геномных сегментов, что вызывает гомологичную рекомбинацию между два LTR, которые генерируют одиночные LTR [18]. В большинстве случаев HEVR являются дефектными из-за множественных терминирующих кодонов и делеций, тогда как HERV-K (HML-2) представляет собой наиболее интактный ERV в геноме человека, поскольку он поддерживает открытые и полные рамки считывания.
Большинство членов семейства HERV в значительной степени репрессируются в большинстве клеток при нормальных условиях, таких как эпигенетическое молчание, включая HERV-K [19]. Накопленные мутации в интегрированных провирусах сыграли роль в противодействии активности элементов HML-2 [20, 21]. Кроме того, метилирование ДНК и гистонов или деацетилирование гистонов являются жизненно важными механизмами для молчания HERV-K [22]. Белки связывающего домена Methyl-CpG могут репрессировать транскрипционную активность HERV-K (HML-2) [23, 24]. Действие малых РНК, таких как микроРНК и Piwi-взаимодействующие РНК (piRNAs), может быть другой причиной избирательной экспрессии HEVR-K [25].
Несмотря на упомянутые выше механизмы, HERV продемонстрировали свой патогенный потенциал как в качестве генов / генных продуктов, так и в качестве (более или менее активных) ретровирусов при различных заболеваниях человека, включая аутоиммунные расстройства, неврологические, инфекционные заболевания и рак [26]. По сравнению со здоровыми тканями, была исследована более высокая экспрессия HERV-K при злокачественных заболеваниях, таких как меланомы [27], рак яичников [28], рак груди [29], рак простаты [30], тератокарцинома [31].Курение или ультрафиолет C могут быть факторами риска, которые могут влиять на экспрессию HERV-K [32, 33]. Глобальное гипометилирование и региональное гиперметилирование — общие механизмы аберрантной экспрессии гена. Потеря метилирования HERV-K была обнаружена у бузины, что может указывать на глобальное гипометилирование или потеря метилирования в масштабе всего генома может вызвать повышенную регуляцию HERV-K [34]. Повышенная активность HERV-K также оценивалась с несколькими факторами транскрипции.Fuchs et al. сообщили, что транскрипция HERV-K опосредуется факторами транскрипции Sp1 и Sp3, которые активируются во время окислительного стресса и вызывают генную регуляцию, контролирующую множественные клеточные процессы, такие как повреждение ДНК, ремоделирование и пролиферация хроматина, дифференцировка и апоптоз клетки [35]. . Длинный концевой повтор (LTR) HERV-K играет роль независимого от TATA и инициаторного элемента промотора, который имеет вариабельный сайт старта транскрипции и содержит четыре участка с высоким содержанием G, играющих роль областей связывания, свободных от нуклеосом для Sp1 и Sp3. [35].Повышенная экспрессия HERV-K связана со злокачественными новообразованиями, особенно с гормонально-ассоциированным раком. Это может свидетельствовать о том, что HERV-K чувствителен к стимуляции гормонами. Экспрессия HERV-K и высвобождение частиц были впервые обнаружены при раке регулируемых андрогенами тканей, таких как опухоли зародышевых клеток (GCT) [36]. Фактически, LTR HERV-K имеют тенденцию получать по крайней мере один предполагаемый сайт связывания для рецептора андрогена, почти на 800 п.н. выше сайта начала транскрипции [37]. Однако необходимы дополнительные исследования, чтобы раскрыть скрытый механизм этого явления.
HERV-K можно разделить на два типа: тип 1 имеет делецию 292 п.н., ведущую к экспрессии аномального ядерного белка 9 кДа, названного Np9, вместо белка Rec 14 кДа, экспрессируемого типом 2 [38]. Хотя любой из этих двух белков взаимодействует с различными клеточными белками, что приводит к усилению экспрессии HERV, белок Rec может быть усилен андрогенной стимуляцией и независимо активировать каскад андрогенных рецепторов [39, 40]. Человеческий небольшой глутамин-богатый тетратрикопептидный повторяющийся белок (hSGT) и тестикулярный белок цинковых пальцев (TZFP) являются регуляторами, которые регулируют неактивный, но индуцибельный AR в цитоплазме [39, 40].В сочетании с Rec, hSGT заметно снижает количество необходимого лиганда для активации AR и подавления AR-индуцированной трансактивации, опосредованной TZFP, что приводит к увеличению провирусов HERV-K [37, 39]. Другой клеточный фактор, белок промиелоцитарного лейкоза цинкового пальца (PLZF), взаимодействующий с Np9 и Rec, нарушает связывание с c-myc, что приводит к неограниченной активности c-myc, что, в свою очередь, может приводить к канцерогенным процессам в тканях зародышевых клеток [41 , 42].
Недавно было проведено несколько исследований, направленных на раскрытие молекулярных путей, лежащих в основе аберрантной экспрессии HERV-K при злокачественных новообразованиях.Было подтверждено, что уровень HERV-K связан со статусом путей MEK-ERK и p16INK4A-CDK4 в клетках меланомы [43]. Повышенный уровень белка Np9, который кодируется HERV-K типа 1, способствовал росту лейкозных клеток in vitro и in vivo не только за счет активации путей ERK, AKT и Notch2, но также за счет активации β -катенина, необходимого для выживания лейкемии стволовые клетки [44]. При раке молочной железы человека сверхэкспрессия HERV-K специфически увеличивает Ras-индуцированную активацию ERK, что предполагает, что онкогенная активность белка Ras распространяется за счет активации белка HERV-K Env [45].Хотя роль, которую этот активированный HERV-K будет играть в HCC и лежащих в основе сигнальных путях, все еще неизвестна, мы предполагаем, что HERV-K может быть связан с трансформацией и туморогенезом HCC через сигнальные пути Ras из-за обнаружения активированных Ras / Путь Raf / MAPK при ГЦК [46]. Конечно, эта гипотеза будет полностью проверена в нашей следующей работе.
Чтобы напрямую оценить потенциальную роль HERV-K в возникновении и прогрессе ГЦК, был проведен сложный эксперимент и строгий анализ.В настоящем исследовании мы подтвердили, что экспрессия HERV-K значительно повышается в тканях HCC по сравнению с соседними нормальными тканями печени. Кроме того, что интересно, мы обнаружили корреляцию между нерегулярным уровнем экспрессии HERV-K и клинико-патологическими параметрами при ГЦК. Уровень HERV-K сильно коррелировал с циррозом, гистологической степенью и стадией опухоли у пациентов с ГЦК. Более того, мы продемонстрировали, что пациенты с более высоким уровнем HERV-K, как правило, имели более низкую общую выживаемость, чем пациенты с более низким уровнем экспрессии.Примечательно, что помимо стадии TNM, экспрессия HERV-K была независимым благоприятным прогностическим фактором для выживаемости пациентов с помощью многомерного регрессионного анализа Кокса. Это предоставило доказательства того, что повышенная регуляция HERV-K при ГЦК может способствовать усилению злокачественного фенотипа и ухудшению прогностического фенотипа. Затем кривые ROC подтвердили диагностическую ценность HERV-K, так как HEVR-K имел лучшую диагностическую ценность для дифференциации пациентов с HCC от контроля.
Несмотря на небольшой размер выборки, наше исследование было первым, которое предоставило понимание нерегулярной экспрессии HERV-K при ГЦК и взаимосвязи между клиническими особенностями пациентов с ГЦК.Мы подтвердили, что HERV-K может быть хорошим кандидатом биомаркера для диагностики ГЦК. По-видимому, необходимы дополнительные исследования для изучения механизма HERV-K при ГЦК человека, которые могут пролить новый свет на открытие антигена, ассоциированного с опухолью, и дальнейшую разработку новых методов лечения ГЦК.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Авторы хотели бы поблагодарить профессора Feng Wang-Johanning (Центр рака и метаболизма, SRI International, Отдел биологических наук, Менло-Парк, Калифорния 94025, США) за конструктивное руководство.
Болезнь HML | SGD
Помощь при болезняхАннотации болезней состоят из трех обязательных компонентов: генный продукт, термин из Онтология болезней (DO) контролирует словарный запас и код доказательства. SGD предоставляет вручную отобранные аннотации DO, полученные из литература.
0 Условия использования DO.
Курируется вручную
Аннотации DO, созданные вручную, отражают наши лучшие понимание ассоциации болезни для этого генного продукта.Аннотации, созданные вручную, присваиваются кураторами SGD на основе опубликованных статей, когда в наличии, либо кураторским заявлением при необходимости. Кураторы периодически просматривают все аннотации болезней, подобранные вручную для обеспечения точности и полноты.
Увеличьте общее количество строк, отображаемых на этой странице, используя раскрывающееся меню, расположенное под таблицей, или используйте страницу прокрутите в правом верхнем углу таблицы, чтобы просмотреть страницы таблицы; используйте стрелки справа от заголовка столбца отсортировать по этому столбцу; отфильтруйте таблицу, используя поле «Фильтр» в верхней части таблицы.
| Идентификатор доказательства | Анализировать ID | Джин | Систематическое название гена | Термин онтологии болезней | Термин онтологии болезней ID | Квалификация | Доказательства | Метод | Источник | Назначено | Номер ссылки |
|---|
Аннотации для HML отсутствуют.
Высокая пропускная способность
Аннотации DO из высокопроизводительных экспериментов на основе множества крупномасштабных высокопроизводительных экспериментов, в том числе полногеномные эксперименты. Многие из этих аннотаций сделаны на основе аннотаций DO (или сопоставления с аннотациями DO), назначенные авторами, а не кураторами SGD. Пока SGD кураторы читают эти публикации и часто работают в тесном сотрудничестве с авторами, чтобы включить информации, каждая отдельная аннотация не обязательно может быть просмотрена куратором.
Увеличьте общее количество строк, отображаемых на этой странице, используя раскрывающееся меню, расположенное под таблицей, или используйте страницу прокрутите в правом верхнем углу таблицы, чтобы просмотреть страницы таблицы; используйте стрелки справа от заголовка столбца отсортировать по этому столбцу; отфильтруйте таблицу, используя поле «Фильтр» в верхней части таблицы.
| Идентификатор доказательства | Анализировать ID | Джин | Систематическое название гена | Термин онтологии болезней | Термин онтологии болезней ID | Квалификация | Доказательства | Метод | Источник | Назначено | Номер ссылки |
|---|
Нет высокопроизводительных аннотаций для HML.
Вычислительный
Вычислительные аннотации DO: предсказания. Эти аннотации НЕ проверяются куратором. В настоящее время все вычислительные аннотации DO для S. cerevisiae назначаются внешним источник (например, Альянс геномных ресурсов (Альянс).
Увеличьте общее количество строк, отображаемых на этой странице, используя раскрывающееся меню, расположенное под таблицей, или используйте страницу прокрутите в правом верхнем углу таблицы, чтобы просмотреть страницы таблицы; используйте стрелки справа от заголовка столбца отсортировать по этому столбцу; отфильтруйте таблицу, используя поле «Фильтр» в верхней части таблицы.
| Идентификатор доказательства | Анализировать ID | Джин | Систематическое название гена | Термин онтологии болезней | Термин онтологии болезней ID | Квалификация | Доказательства | Метод | Источник | Назначено | Номер ссылки |
|---|
Нет вычислительных аннотаций для HML.
Общие аннотации
На этой диаграмме показаны вручную отобранные и высокопроизводительные термины DO (оранжевые кружки), общие для данного гена (черные круг), гены других дрожжей (синие кружки) и гены человека (голубые кружки).
Повышение вирусной нагрузки эндогенного ретровируса HERV-K (HML-2) при активном ревматоидном артрите
Hintergrund: Die der Pathogenese von Morbus Parkinson (PD, болезнь Паркинсона) zugrunde liegenden Mechanismen sind heutend nur unvolldensta.Insbesondere ist unklar, durch welche ursächlichen Faktoren Parkinson ausgelöst wird. Bei der HIV-Infektion treten bei vielen Patienten Neurologische Störungen auf (ВИЧ-ассоциированные неврологические расстройства, HAND), die in der klinischen Symptomatik und der Lokalisation der betroffenen Gehirnareale dem Morbus Parkinson ähneln. Möglicherweise könnte eine Fehlregulation der Immunantwort eine Rolle als Auslöser beider Erkrankungen spielen. In dieser Arbeit wurde die Autoimmunantwort von PD- und HAND-Patienten und gesunden Kontrollen gegen verschiedene gehirnhomogenate untersucht, die während der Parkinsonerkrankung in unterschiedlichem Ausmaß geschädigt werden.Das Autoimmun-Signal имеет количественный и значительный аутоантигенный идентификатор. Метододен: In dieser Arbeit wurde ein Western-Blot-basiertes Verfahren zum Nachweis von Autoantikörpern gegen Gehirngewebe entwickelt. Dieses Verfahren Würde Optimierung мит нах Plasmaproben фон gesunden Kontrollen, PD-Patienten унд Patienten мит ВИЧ-Infektion insbesondere в Einer Gruppe фон 40 Паркинсона-Patienten (Durchschnittsalter 65 Jahre, 45% Weiblich) UND 40 alters- унд geschlechtsgemachten Kontrollen (Durchschnittsalter 62 Jahre, 50% weiblich) angewendet und die humorale Autoimmunität gegen verschiedene Gehirnareale untersucht.Dazu wurden die verschiedenen Areale (дорсалер Motornucleus des Glossopharynx- und Vagusnervs (dm), Substantia nigra (SN), передний медиатор, временный мезокортекс (MC), сенсорные ассоциации высокого порядка — и передние фельдеровские сенсоры (HC), первые oder Felder-сенсоры (HC) , Primäre Sensorische und Motorische Felder (FC)) von post mortem Gehirnen homogenisiert, auf SDS-Gradienten-Gelen elektrophoretisch aufgetrennt und auf Nitrocellulose geblottet. Die Membranen wurden mit den Plasmen inkubiert und gebundene Autoantikörper immmunologisch Detektiert.Die Signale wurden qualitativ und количественный ausgewertet. Mit Hilfe einer zweidimensionalen Elektrophorese und anschließender Immunfärbung wurden prominente Autoantigene durch Massenspektroskopie identifiziert. Ergebnisse: Mit dem in dieser Arbeit entwickelten Assay lässt sich die humorale Autoimmunantwort gegen Gehirngewebe semiquantitativ bestimmen. In allen untersuchten Proben konnten verschiedene Autoantikörper gegen unterschiedliche Antigene nachgewiesen werden. Der Gesamt-IgG-Gehalt der Plasmen unterscheidet sich weder zwischen PD-Patienten und gesunden Kontrollen, noch zwischen Männern und Frauen signifikant.Weibliche PD-Patienten zeigen Signifikant stärkere Signale gegen dm als männliche (p = 0,02, U-тест Манна-Уитни), der wiederum in jedem Patienten — unabhängig vom Geschlecht — von den untersuchten Hirnmunäirdlebris signif (p <0,0001, Friedman-ANOVA). В jedem Hirnareal wurden drei Banden besonders häufig erkannt (45, 40 и 37 кДа), jede davon am stärksten im dm (p <0,0001, Friedman-ANOVA). Die Einzelanalysen der Signalintensitäten zeigt, dass PD-Patienten signifikant weniger Autoreaktivität gegen die 45 kDa-Bande in der SN (p = 0.056), im MC (p = 0,0277) и im FC (p = 0,0188) zeigen, als Kontrollen. Weitere Analysen zeigen, dass männliche PD-Patienten hochsignifikant weniger das 45 kDa-Protein im SN (p <0,0001), MC (p = 0,0042) и FC (p = 0,0088) erkennen als Kontrollen, wohingegen bei den weiblichen Kontroll- und PD- Plasmen kein Unterschied festzustellen war. Ein weiteres Protein bei 160 kDa wird signifikant unterschiedlich stark in allen Gehirnarealen erkannt (p <0,0001, Friedman-ANOVA), wobei die stärkste Immunreaktivität gegen FC besteht.Basierend auf dem Nachweis der 45 kDa-Bande aus der SN ergibt sich eine Коэффициент шансов для Merkmal Parkinson von 3,38 (CI 1,11 - 10,30). Bei Männern ist diese Odds Ratio sogar 53,12 (CI 2,79 - 1012), bei Frauen 0,44 (CI 0,09 - 2,09). Die Sensitivität dieses Тесты должны соответствовать Männern bei 1 (CI 0,84 - 1), die Spezifität bei 4,41 (0,31 - 0,78). Die negativ prädiktiven Werte liegen in allen Gruppen über 99,15%. Die Identifizierung der Proteine mittels Massenspektroskopie ergab, dass es sich bei den 37-45 kDa Banden um Isoformen oder posttranslational modifizierte Formen des GFAP (глиальный фибриллярный кислый белок), einem Bestandteil von Neurofilamenten v.а. в Astrozyten handelt. Außerdem wurde Fructose-Bisphosphate Aldolase A und Aspartat-Aminotransferase (митохондриальная изоформа 1 Vorläufer), beides Proteine des Kohlenhydrat-Stoffwechsels und der Glykolyse, als weitere Proteine mit ebenfalls 45 kDaiz. Благодаря определению белка с молекулярной массой 160 кДа, связанной с дигидропиримидиназой-родственным белком 2, происходит обнаружение GFAP через Bildung des Zytoskeletts beteiligt. Обсуждение: Autoantikörper gegen Gehirnantigene sind ein Physiologisches Phänomen, das unabhängig von dem Vorliegen einer nerologischen Erkrankung besteht.Gehirnareale, die bei Parkinson besonders stark geschädigt werden, werden von dieser humoralen Аутоиммунный зверобойный болотный вид. Eine vorübergehende Permeabilisierung der Blut-Hirn-Schranke durch Infektion oder Trauma könnte den Zutritt der Autoantikörper zum Gehirn erlauben und so autoreaktive Prozesse in Gang setzen und zum Untergang dopaminerger Neuronen. Bei den identifizierten Proteinen handelt es sich um grundlegende Bestandteile eukaryotischer Zellen, был die Hypothese eines Art Beseitigungsmechanismus der Autoantikörper und damit die Aufgabe der Aufrechterhaltung der Homöostase darstel.Bei männlichen PD Patienten wird die 45 kDa Bande Signifikant weniger stark von Auto-IgGs erkannt; dieser Mechanismus könnte somit in den männlichen PD-Patienten vermindert sein. Als Folge wäre die Ablagerung von Zelltrümmern im Gehirn vorstellbar, die dann auch langfristig eine Angriffsfläche für Autoimmunprozesse mit dem Verlust dopaminerger Neuronen bieten könnte.
(PDF) Эндогенный ретровирус человека K (HML-2) в состоянии здоровья и болезней
fmicb-11-01690 16 июля 2020 г. Время: 19:29 # 11
Xue et al.Болезни, вызывающие HERV-K (HML-2)
Гарсон, Дж. А., Ашер, Л., Аль-Чалаби, А., Хаггетт, Дж., Дэй, Э. Ф. и Маккормик,
А. Л. (2019). Количественный анализ транскриптов человеческого эндогенного ретровируса-К
в посмертной премоторной коре головного мозга не подтвердил повышенную экспрессию
РНК HERV-K при боковом амиотрофическом склерозе. Acta Neuropathol. Commun.
7:45. DOI: 10.1186 / s40478-019-0698-692
Giebler, M., Staege, M. S., Blauschmidt, S., Ohm, L.I., Kraus, M., Würl, P., et al.
(2018). Повышенная экспрессия HERV-K при саркоме мягких тканей связана с
ухудшением безрецидивной выживаемости. Передний. Microbiol. 9: 211. DOI: 10.3389 / fonc.2013.
00211
Гиорд Р. и Тристем М. (2003). Эволюция, распространение и разнообразие
эндогенных ретровирусов. Гены вирусов 26, 291–315.
Геринг В., Рибарска Т. и Шульц В. А. (2011). Селективные изменения экспрессии ретроэлементов
при раке простаты человека.Канцерогенез 32, 1484–
1492. doi: 10.1093 / carcin / bgr181
Goering, W., Schmitt, K., Dostert, M., Schaal, H., Deenen, R., Mayer, J., et al. . (2015).
Активность человеческого эндогенного ретровируса HERV-K (HML-2) при раке предстательной железы составляет
, в котором преобладают несколько локусов. Простата 75, 1958–1971. doi: 10.1002 / pros.23095
Гогвадзе Е., Стукачева Е., Буздин А. и Свердлов Е. (2009). Специфическая для человека модуляция транскрипционной активности
, обеспечиваемая вставками эндогенного ретровируса
.J. Virol. 83, 6098–6105. DOI: 10.1128 / jvi.00123-09
Göke, J., Lu, X., Chan, Y.-S., Ng, H.-H., Ly, L.-H., Sachs, F., и другие. (2015).
Динамическая транскрипция отдельных классов эндогенных ретровирусных элементов
маркирует определенные популяции ранних эмбриональных клеток человека. Cell Stem Cell 16,
135–141. DOI: 10.1016 / j.stem.2015.01.005
Голан, М., Хизи, А., Ресау, Дж. Х., Яал-Хахошен, Н., Райхман, Х., Кейдар, И.,
et al. (2008). Обратная транскриптаза эндогенного ретровируса человека (HERV-K) как
является прогностическим маркером рака груди.Неоплазия 10, 521–522.
Гриффитс, Д. Дж. (2001). Эндогенные ретровирусы в последовательности генома человека.
Genome Biol. 2: reviews1017.
Grow, E. J., Flynn, R.A., Chavez, S. L., Bayless, N. L., Wossidlo, M., Wesche,
,D. J., et al. (2015). Внутренняя реактивация ретровирусов у человека до имплантации
эмбрионов и плюрипотентных клеток. Nature 522, 221–225. DOI: 10.1038 / nature14308
Hahn, S., Ugurel, S., Hanschmann, K.-M., Strobel, H., Tondera, C., Schadendorf,
D., et al. (2008). Серологический ответ на эндогенный ретровирус человека K
у пациентов с меланомой коррелирует с вероятностью выживания. AIDS Res. Гм.
Ретровирус. 24, 717–723. DOI: 10.1089 / aid.2007.0286
Ханке, К., Чудак, К., Курт, Р., и Баннерт, Н. (2013). Белок Rec
HERV-K (HML-2) усиливает активность рецептора андрогенов за счет связывания с человеческим малым богатым глутамином тетратрикопептидным повторяющимся белком (hSGT)
.Int. J.
Cancer 132, 556–567. doi: 10.1002 / ijc.27693
Hao, Z., Lv, D., Ge, Y., Shi, J., Weijers, D., Yu, G., et al. (2020). Ридеограмма: отрисовка
графики SVG для визуализации и сопоставления данных всего генома на идиограммах. PeerJ
Вычисл. Sci. 6: e251. DOI: 10.7717 / peerjcs.251
Хилдич, Л., Матадин, Р., Голдстоун, Д. К., Розенталь, П. Б., Тейлор, И. А. и
Стой, Дж. П. (2011). Упорядоченная сборка капсидного белка
вируса лейкемии мышей на липидных нанотрубках направляет специфическое связывание фактором рестрикции Fv1.Proc.
Нац. Акад. Sci. США 108: 5771. DOI: 10.1073 / pnas.1100118108
Хон, О., Ханке, К., и Баннерт, Н. (2013). HERV-K (HML-2), лучшее
сохраненное семейство HERV: эндогенизация, экспрессия и влияние на здоровье и болезнь
. Передний. Онкол. 3: 246. DOI: 10.3389 / fonc.2013.00246
Хуанг, Г., Ли, З., Ван, X., Ван, Ю., и Донг, Дж. (2013). Человеческий эндогенный ретровирусный К-элемент
кодирует фузогенную активность в клетках меланомы.
J. Канцероген. 12: 5. DOI: 10.4103 / 1477-3163.109032
Хьюз, Дж. Ф., и Коэн, Дж. М. (2004). Человеческий эндогенный ретровирус K solo-
Образование LTR и инсерционный полиморфизм: значение для эволюции вируса человека и
. Proc. Natl. Акад. Sci. США 101, 1668–1672. DOI: 10.1073 / pnas.
0307885100
Januszkiewicz-Lewandowska, D., Nowicka, K., Rembowska, J., Fichna, M.,
?? urawek, M., Derwich, K., et al. (2013). Экспрессия гена Env
эндогенного ретровируса-k человека и эндогенного ретровируса-w человека в детском возрасте
клеток острого лейкоза.Acta Haematol. 129, 232–237. DOI: 10.1159 / 000345407
Джерн, П., и Кон, Дж. М. (2008). Влияние ретровирусов на функцию генома хозяина.
Анну. Преподобный Жене. 42, 709–732. DOI: 10.1146 / annurev.genet.42.110807.0
Джерн П., Спербер Г. О. и Бломберг Дж. (2005). Использование эндогенных ретровирусных последовательностей
(ERV) и структурных маркеров для ретровирусного филогенетического вывода
и таксономии. Ретровирология 2:50.
Джа, А. Р., Никсон, Д.Ф., Розенберг, М. Г., Мартин, Дж. Н., Дикс, С. Г., Хадсон,
,Р. Р. и др. (2011). Эндогенный ретровирус K106 человека (HERV-K106) был
заразным после появления людей современного анатомического типа. PLoS One
6: e20234. DOI: 10.1371 / journal.pone.0020234
Johanning, G. L., Malouf, G. G., Zheng, X., Esteva, F. J., Weinstein, J. N., Wang-
Johanning, F., et al. (2017). Экспрессия человеческого эндогенного ретровируса-K
сильно связана с базальным фенотипом рака молочной железы.Sci. Реп.
7: 41960.
Джонс, Р. Б., Гаррисон, К. Э., Муджиб, С., Михайлович, В., Аидарус, Н., Хантер, Д. В.,
et al. (2012). HERV-K-специфические Т-клетки устраняют различные первичные изоляты ВИЧ-1/2 и SIV
. J. Clin. Вкладывать деньги. 122, 4473–4489. DOI: 10.1172 / JCI64560
Кахио, Т., Тао, Х., Шинмура, К., Ямада, Х., Мори, Х., Фунаи, К. и др. (2013).
Исследование идентификации и ассоциации с раком легкого для новой инсерции
полиморфизмов эндогенного ретровируса человека.Канцерогенез 34, 2531–
2538. doi: 10.1093 / carcin / bgt253
Каплан, М. Х., Камински, М., Эстес, Дж. М., Гитлин, С. Д., Зан, Дж., Элдер, Дж. Т. и др.
(2019). Структурные вариации центромерных эндогенных ретровирусов в популяциях людей
и их влияние на кожную Т-клеточную лимфому, синдром Сезари,
и ВИЧ-инфекцию. BMC Med. Геном. 12:58. DOI: 10.1186 / s12920-019-0505-
508
Карамитрос, Т., Херст, Т., Марчи, Э., Карамичали Э., Георгопулу У., Ментис,
А. и др. (2018). Интеграция человеческого эндогенного ретровируса-K HML-2
в RASGRF2 связана со злоупотреблением наркотиками внутривенно и модулирует транскрипцию
в модели клеточной линии. Proc. Natl. Акад. Sci. США 115: 10434. DOI:
10.1073 / pnas.1811940115
Карими, А., Эсмайли, Н., Ранджкеш, М., и Золфагари, М.А. (2019). Экспрессия
эндогенных ретровирусов человека у пациентов с Pemphigus vulgaris.Мол. Биол. Реп.
46, 6181–6186. DOI: 10.1007 / s11033-019-05053-5056
Кассиотис, Г., и Стоу, Дж. П. (2017). Создание добродетели необходимости: плейотропная роль эндогенных ретровирусов человека в развитии рака. Филос. Пер. R. Soc. B Biol.
Sci. 372: 20160277. DOI: 10.1098 / rstb.2016.0277
Кауфманн, С., Заутер, М., Шмитт, М., Баумерт, Б., Бест, Б., Бозе, А. и др.
(2010). Эндогенный ретровирусный белок человека Rec взаимодействует с тестикулярным белком цинкового пальца
и рецептором андрогена.J. Gen. Virol. 91, 1494–1502. doi:
10.1099 / vir.0.014241-14240
Ходосевич К., Лебедев Ю. и Свердлов Е. (2002). Эндогенные ретровирусы
,и эволюция человека. Междунар. J. Genom. 3, 494–498.
Клейман, А., Сенюта, Н., Трякин, А., Заутер, М., Карселадзе, А., Тюландин, С., и др.
(2004). HERV-K (HML-2) антитела GAG / ENV как индикатор терапевтического эффекта
у пациентов с опухолями половых клеток. Int. J. Cancer 110, 459–461. DOI: 10.1002 / ijc.
11649
Краус Б., Фишер К., Бюхнер С. М., Вельс В. С., Лёвер Р., Слива К. и др. (2013).
Вакцинация, направленная против эндогенного ретровируса-К оболочки человека
Белокподавляет рост опухоли в мышиной модельной системе. PLoS One 8: e72756.
doi: 10.1371 / journal.pone.0072756
Краймер У., Шульц В. А., Кох А., Нигиш Г. и Геринг В. (2013). HERV-
K и метилирование ДНК LINE-1 и реэкспрессия при уротелиальной карциноме.
Перед. Онкол. 3: 255. DOI: 10.3389 / fonc.2013.00255
Крон, Б., Кёльмель, К. Ф., Хенц, Б. М., и Гранж, Дж. М. (2005). Защита от меланомы
путем вакцинации бациллой Кальметта-Герена (БЦЖ) и / или осповакцинией:
эпидемиологическая гипотеза о природе фактора риска меланомы и
иммунологический контроль. Евро. J. Cancer 41, 104–117. DOI: 10.1016 / j.ejca.2004.
08.010
Кшишталовска-Вавжиняк, М., Останек, М., Clark, J., Binczak-Kuleta, A.,
Ostanek, L., Kaczmarczyk, M., et al. (2011). Распространение эндогенного ретровируса К-113 человека
при аутоиммунных заболеваниях в Польше.
Ревматология 50, 1310–1314. DOI: 10.1093 / ревматология / ker022
Küry, P., Nath, A., Créange, A., Dolei, A., Marche, P., Gold, J., et al. (2018).
Эндогенные ретровирусы человека при неврологических заболеваниях. Тенденции Мол. Med. 24,
379–394. DOI: 10.1016 / j.molmed.2018.02.007
Ли, Э., Искоу, Р., Янг, Л., Гоккумен, О., Хасли, П., Лукетт, Л. Дж., И др. (2012).
Пейзаж соматической ретротранспозиции при раке человека. Наука 337: 967.
DOI: 10.1126 / science.1222077
Лемэтр, К., Цанг, Дж., Биро, К., Хайдманн, Т., и Деваннье, М. (2017). Ген эндогенного ретровируса человека
, который может способствовать онкогенезу
путем активации пути ERK и индукции миграции и инвазии.ПЛоС
Патог. 13: e1006451. DOI: 10.1371 / journal.pone.1006451
Леунг, Д. К., и Лоринц, М. К. (2012). Подавление эндогенных ретровирусов:
когда и почему преобладают гистоновые метки? Trends Biochem. Sci. 37, 127–
133. doi: 10.1016 / j.tibs.2011.11.006
Границы микробиологии | www.frontiersin.org 11 июля 2020 г. | Том 11 | Статья 1690
Эндогенный ретровирус К человека (HML-2) в медицине и болезнях., Frontiers in Microbiology
Эндогенные ретровирусы человека (HERV) происходят от экзогенных ретровирусных инфекций в эволюции приматов и составляют около 8% генома человека.В течение долгого времени они считались молчаливыми пассажирами в наших геномах, однако реактивация HERV была связана с опухолями и аутоиммунными заболеваниями, особенно с семейством HERV-K (HML-2), новейшими интеграционными группами с наименьшим количеством мутации и наиболее биологически активны для кодирования функциональных ретровирусных белков и образования ретровирусоподобных частиц. Все больше исследований направлено на определение потенциальной роли HERV-K (HML-2) в патогенности. Хотя до сих пор нет доказательств того, что HERV-K (HML-2) является прямой причиной заболеваний, аберрантные профили экспрессии транскриптов HERV-K (HML-2) и их регуляторная функция по отношению к проксимальным генам-хозяевам были идентифицированы в разных болезни.В этом обзоре мы суммировали достижения между HERV-K (HML-2) и заболеваниями, чтобы обеспечить основу для дальнейших исследований причинно-следственной связи между HERV-K (HML-2) и заболеваниями. Мы рекомендовали уделять больше внимания полиморфным интегрированным локусам HERV-K (HML-2), которые могут быть генетическими причинными факторами и быть связаны с межиндивидуальными различиями в онкогенезе и аутоиммунных заболеваниях.
中文 翻译 :
人类 内 源性 逆转录 病毒 K (HML-2) 与 健康 和 疾病 的 关系。
内 源性 逆转录 病毒 (HERV) 源自 灵长类 动物 进化 过程 中 的 外 源性 逆转录 的 8。 被 认为 是 我们 中 沉默 , , HERV 的 重新 激活 与 肿瘤 和 自身 免疫性 有关 , 尤其 HERV-K (HML-2) 家族 , 这 是 最近 整合 的 组 数量 最少。 突变 的 编码 功能 性 逆转录蛋白 并 产生 逆转录 病毒 颗粒。 越来越 的 研究 致力于 确定 HERV-K (HML-2) 在 致病 性 中 的 潜在 作用。 证据 HERV-K (HML-2) 是疾病 的 直接 原因 , HERV-K (HML-2) 转录 本 的 异常 表达 谱 及其 对 的 的 调控 功能 在 不同 疾病 中 得到。 在 这篇 综述 中 , 总结 HERV-K ( HML-2) 疾病 之间 的 进展 , 为 进一步 研究 HERV-K (HML-2) 与 疾病 之间 的 因果 关系 提供 了。 建议 注意 多态性 整合 HERV-K (HML- 2) 座 是 遗传 的 致病 因素 , 并且 与 个体 间 肿瘤 发生 疾病 的 差异 有关。
.
 Появляются тяжесть и боли в левом подреберье, особенно после ходьбы. Почти у половины больных могут развиться инфаркты селезенки, проявляющиеся острыми болями в левом подреберье.
Появляются тяжесть и боли в левом подреберье, особенно после ходьбы. Почти у половины больных могут развиться инфаркты селезенки, проявляющиеся острыми болями в левом подреберье.