Новые факты о нервных клетках
Выражение «нервные клетки не восстанавливаются» — не более чем миф, и последние научные данные его опровергают.
Крылатое выражение «нервные клетки не восстанавливаются» все с детства воспринимают как непреложную истину. Однако эта аксиома — не более чем миф, и новые научные данные его опровергают.
Факт №1: Гибель нервных клеток в нас изначально запрограммирована.
Ежедневно в организме человека гибнут десятки тысяч нервных клеток. В год мозг может терять 1% и более от общего их количества. И это «запрограммировано» самой природой.
Если посмотреть на низших животных, например – на круглых червей, то у них никакой гибели нервных клеток нет в принципе. Как имеет аскарида 162 нейрона в «молодости», так с ними же и умирает. Похожая картина и у других червей, и у многих моллюсков, даже у насекомых. Количество и расположение нервных клеток у них жёстко задано генетически. А особи с «неправильной» нервной системой чаще всего не выживают. Однако жёсткие ограничения в устройстве нервной системы не дают подобным животным возможности обучаться и менять поведение.
Человек, в
отличие от низших животных, рождается с огромным «избытком»
нейронов. Это запрограммировано изначально: природа закладывает в
наш мозг гигантский резерв. Все клетки мозга довольно случайно
образуют множество связей, но закрепляются из них только те,
которые используются в процессе обучения. Эти нейроны получают
«точки опоры» — связи с другими нейронами. А затем организм
проводит жёсткий отбор: умерщвление нейронов, не образовавших
достаточного количества связей.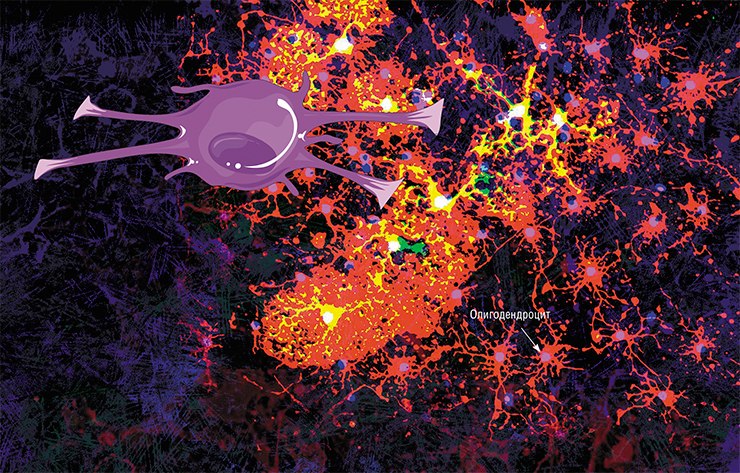
Факт №2: Наиболее интенсивно нейроны гибнут у детей
70% нейронов, заложенных еще при эмбриогенезе, гибнут ещё до рождения ребёнка. И это нормально – именно в детском возрасте способность к обучению должна быть максимальна, а потому и мозг должен обладать самыми значительными резервами. Резервами, которые прямо в ходе обучения апробируются и сокращаются по мере возможности, чтобы снизить нагрузку на весь организм. Иными словами, можно сказать, что избыточное количество клеток нервной системы – необходимое условие для обучения и то, что обеспечивает многообразие возможных вариантов развития человека – то есть нашу индивидуальность.
Смысл пластичности в том, что функции погибших нервных клеток берут на себя их оставшиеся в живых „коллеги“, которые увеличиваются в размерах и формируют новые связи, компенсируя утраченные функции. Одна живая нервная клетка может заменить девять погибших.
В зрелом возрасте процесс гибели клеток продолжается, но уже не
так сильно. Однако, если не нагружать мозг новой информацией, то
он будет оттачивать старые навыки, сокращая количество нервных
клеток, необходимых для их реализации. Клеток будет становиться
меньше, а связей у них с другими клетками – больше.
У пожилого человека нейронов в мозгу существенно меньше, чем у младенца или молодого человека. Однако соображать он может намного быстрее, не говоря уж о том, что знает существенно больше. Всё это – благодаря отлично простроенной в процессе обучения архитектуре связей между нейронами.
А вот в старости, если нет обучения, то мозг человека, как и весь организм, начинает программу свёртывания – то есть старения, приводящего к смерти. И чем меньше показатели востребованности у разных систем организма, то есть чем меньше физическая и интеллектуальная нагрузка, чем меньше человек двигается и общается с другими людьми – тем процесс быстрее. Вот почему требуется постоянно осваивать новую информацию.
Факт №3: Нервные клетки восстанавливаются – причем генерируются в трех местах человеческого организма
Новые нервные клетки не появляются в ходе деления, как это происходит в других органах и тканях организма, а образуются в ходе нейрогенеза, который наиболее активен во время внутриутробного развития. Нейрогенез начинается с деления предшественников нейронов — нейронных стволовых клеток, которые затем мигрируют, дифференцируются и образуют полностью функционирующий нейрон.
|
|
Нейрон — особенная клетка, у неё
имеются отростки: длинные называются аксонами, а короткие
разветвлённые —дендритами. |
Впервые сообщение об образовании новых нервных клеток во
взрослом организме млекопитающих появилось ещё в 1962 году. Но
тогда результаты работы Джозефа Олтмана, опубликованные в журнале
Science, не были восприняты всерьёз, и признание нейрогенеза
отложилось почти на двадцать лет. С тех пор неоспоримые
доказательства существования этого процесса во взрослом организме
были получены для певчих птиц, грызунов, амфибий и некоторых
других животных. И только в 1998 году нейробиологам во главе с
Питером Эрикссоном и Фредом Гейгом удалось
продемонстрировать образование новых нейронов в гиппокампе
человека и доказать существование нейрогенеза в головном мозге
взрослых людей. Сейчас исследование нейрогенеза является одним из
самых приоритетных направлений в нейробиологии. Учёные и медики
видят в нём большой потенциал для лечения дегенеративных
заболеваний нервной системы, таких как болезнь Альцгеймера или
болезнь Паркинсона.
Изначально считалось, что нейрогенез в головном мозге взрослых млекопитающих локализован в двух областях, которые связаны с памятью (гиппокамп) и обонянием (обонятельные луковицы). Однако исследования последних лет показали, что на протяжении периода полового созревания мозг млекопитающих наращивает количество этих клеток также в миндалине и во взаимосвязанных с ней областях, играющих важную роль в восприятии социальных ориентиров и адаптации особи к «взрослой жизни». Причем растет не только число нейронов, но и клеток нейроглии – вспомогательных клеток нервной ткани.
Факт №4: Стволовые нейрональные клетки мигрируют в организме
Так же, как у птиц и низших позвоночных, у млекопитающих нейрональные стволовые клетки располагаются поблизости от боковых желудочков мозга. Их перерождение в нейроны идёт очень интенсивно. Так, у взрослых крыс за месяц из стволовых клеток образуется около 250 000 нейронов, замещая 3% всех нейронов гиппокампа. Продолжительность жизни таких нейронов очень высока — до 112 дней. Более того, стволовые нейрональные клетки мигрируют! И в среднем преодолевают путь длиной около 2 см. И если они попадают в обонятельную луковицу, то превращаются там в нейроны.
Также стволовые клетки можно извлечь из мозга
и пересадить в другой участок нервной системы,
где они превратятся в нейроны. Недавно
проведённые исследования показали, что новые нейроны
во взрослом мозге могут образовываться не только
из нейрональных стволовых клеток, но из стволовых
клеток крови. Однако последние не превращаются в нейроны,
а сливаются с ними, образуя двуядерные клетки. Затем
„старое“ ядро нейрона разрушается, а его замещает „новое“
ядро стволовой клетки крови.
Затем
„старое“ ядро нейрона разрушается, а его замещает „новое“
ядро стволовой клетки крови.
Факт №5: Нервные клетки неспособны гибнуть от стресса, они просто тормозят свою деятельность и отдыхают
При стрессе клетки гибнут не от избыточного напряжения. Нейроны вообще не способны погибнуть от перегрузки — они просто тормозят свою деятельность и отдыхают. Нейроны гибнут от возникающего недостатка питательных веществ, особенно витаминов и из-за нарушения кровоснабжения тканей, приводящих к интоксикации продуктами жизнедеятельности и гипоксии, употреблении разнообразных лекарств, крепкого кофе и чая, наркотиков, табака и алкоголя, значительных физических нагрузках, и инфекционных болезнях. А сберечь их очень просто. Достаточно постоянно учиться чему-то новому, а также развивать уверенность в себе и крепкие эмоциональные связи с близкими людьми.
Правда ли, что нервные клетки умирают во время стресса? Как и почему это происходит?
Здесь следует отметить тот факт, что нервные клетки гибнут постоянно, каждый день мы теряем некоторое количество нейронов, и это биологически запрограммированный процесс. Каждый нейрон имеет аксон и большое количество дендритов, по средством которых он связывается с другими нейронами и образует сеть, выполняющую определенную функцию, другими словами количество связей — показатель активности, если у какого-то нейрона их нет, значит, он не участвует в процессе обработки информации и передачи сигналов, а следовательно просто так расходует энергию, от таких и можно избавляться.
Так же следует сказать и о том, что уже давно опровергли утверждение «нервные клетки не восстанавливаются», и что наша нервная система статична и неспособна к регенерации, нейроны очень даже восстанавливаются. В головном мозге есть определенные зоны(субвентрикулярная зона и субгранулярная зона) в которых проходит процесс нейрогенеза(образования новых клеток), часть из них умирает, а часть образует новые синаптические связи и включается в общий процесс. Сейчас этот вопрос изучается еще более активно, для того чтобы можно было стимулировать нейрогенез извне, с целью лечения различных нейродегенеративных заболеваний.
В головном мозге есть определенные зоны(субвентрикулярная зона и субгранулярная зона) в которых проходит процесс нейрогенеза(образования новых клеток), часть из них умирает, а часть образует новые синаптические связи и включается в общий процесс. Сейчас этот вопрос изучается еще более активно, для того чтобы можно было стимулировать нейрогенез извне, с целью лечения различных нейродегенеративных заболеваний.
Вернемся к изначальному вопросу, стресс — понятие очень расплывчатое. Для организма в принципе любое воздействие — стресс, потому что любая информация, воспринимаемая нами, закономерно приводит к возбуждению определенных нейронов и, соответственно, к выработке нейромедиаторов, гормонов и так далее. Но есть так же такое понятие как «дистресс», это, если можно так выразиться, сверхпороговый раздражитель, который приводит к чрезмерной активации различных областей мозга и систем организма. Гормоном стресса закономерно считается кортизол, так же при стрессе повышается и уровень норадреналина, адреналина, в головном мозге повышается количество глутамата(активирующего медиатора), и снижается уровень ГАМК(тормозного медиатора, отвечающего в том числе и за способность головного мозга восстанавливаться до состояния покоя). Повышение глутамата — закономерная реакция на стресс, повышенное его количество приводит нервную систему в состояние гипервозбуждения, для того чтобы можно было реагировать на стрессовую ситуацию как можно быстрее, принимать какие-либо решения или действия. Но при хроническом стрессе это будет принимать по большей части негативные последствия, постоянно повышенная возбужденность, снижение количества ГАМК — приведет к перевозбуждению нейронов, непосредственно от этого они не погибнут, они просто «выключатся» из работы и снизят свою активность. Но хронический стресс в долгосрочной перспективе может нарушить не только механизм передачи сигнала между нейронами и биохимию нейромедиаторов, но и метаболические процессы организма.
И как раз из-за этих нарушений нейроны и могут погибнуть, при стрессе нарушается обмен глюкозы в организме, кислородный обмен, липидный обмен, повышается артериальное давление(что может сыграть злую шутку у пожилых людей, с ослабленными сосудами, на которых уже к тому же образовалось немало атеросклеротических бляшек, что в теории(и на практике) может привести вообще к инсульту, а это массовый геноцид нервных клеток), кратковременное повышение активности щитовидной железы, сменяется стойким угнетением ее функции, что в свою очередь замыкает порочный круг, т. к. основная область действия гормонов щитовидной железы — это обмен веществ и выработка энергии.
к. основная область действия гормонов щитовидной железы — это обмен веществ и выработка энергии.
В конечном итоге можно сказать, что нейроны при хроническом стрессе могут погибнуть вследствие возникающего недостатка питательных веществ, витаминов, из-за кислородного голодания, связанного в том числе и с нарушением кровоснабжения тканей головного мозга, из-за интоксикации различными продуктами жизнедеятельности, например при стрессе повышается уровень кетоновых тел, которые в свою очередь весьма токсичны для организма.
Напоследок, биохимические и метаболические нарушения я описал не в полной мере, т.к. я не учел еще целую кучу различных факторов, например при стрессе может наблюдаться бессонница, либо может развиться депрессия, и эти состояния лишь усугубят ситуацию, в перспективе они, вместо со стрессом, могут привести уже и к соматическим(со стороны органов и систем) патологиям. Плюс и изменения гормонального фона я так же описал не полностью, изменяется и обмен цитокинов, других нейромедиаторов и гормонов, которым тоже отведена определенная роль в организме, и нарушение их обмена и функции приводит к различным проблемам.
Все это справедливо для действительно сильного стресса, сохраняющегося на протяжении длительного времени, при котором еще и сам человек не заинтересован в том, чтобы себе помочь, не идет к врачу, а наоборот начинает, к примеру, употреблять алкоголь, а это, к слову, очень(!) сильно ухудшает прогноз и еще больше нарушает работу организма и центральной нервной системы в частности.
Что ускоряет гибель нервных клеток и ведет к потере памяти, выяснили ученые из России
Стресс влияет на болезни мозга
Фото: GLOBAL LOOK PRESS
Российские ученые сделали открытие мирового масштаба. Они выяснили, что воспалительные процессы в определенных участках мозга вызывают стресс и нервное напряжение. Именно их влияние ускоряет гибель нервных клеток и ведет к потере памяти.
Открытие сделали специалисты Института высшей нервной деятельности и нейрофизиологии РАН в Москве. Исследуя механизмы нейродегенерации в гиппокампе, они провели опыты на лабораторных мышах, проследив, что происходит в их мозге, если создать им условия непредсказуемого и постоянного стресса (для чего тех заставляли жить в большой зашумленности, время от времени помещали в узкие и тесные клетки, подвергали ударам тока).
Исследуя механизмы нейродегенерации в гиппокампе, они провели опыты на лабораторных мышах, проследив, что происходит в их мозге, если создать им условия непредсказуемого и постоянного стресса (для чего тех заставляли жить в большой зашумленности, время от времени помещали в узкие и тесные клетки, подвергали ударам тока).
При этом ученые с помощью специальных датчиков фиксировали сигналы, поступающие из гиппокампа грызунов.
В итоге эксперимент показал, что во время такой стрессовой обстановки в гиппокампе мышей накапливался гормон стресса — кортикостероид. Он вызывает воспалительные процессы в мозге. В частности, отмирают нервные клетки, ухудшается память, начинаются воспалительные процессы.
Причем эти процессы необратимы. Даже когда стрессовая ситуация прекращается, воспаление остается и иногда даже продолжает развиваться. Последствия этого, как отмечают ученые, могут быть достаточно печальными.
Таким образом, ученые доказали тесную связь между стрессом и заболеваниями мозга.
Эксперимент принято решение продолжить: «Если мы будем знать, как именно гибнут нейроны, мы сможем разработать способы их защиты. Наша цель — понять, почему гиппокамп среди десятков других отделов мозга является самым чувствительным к разным формам стресса», — объясняет один из авторов открытия Наталия Гуляева.
Пока же медики могут только повторить уже старый как мир совет: сохраняйте самообладание и старайтесь избегать нервных ситуаций.
“Переживание хронического стресса проявляется сначала в виде невроза, а потом могут патологические состояния могут перерасти в гипертонию, инфаркт и инсульт. Поскольку в результате действия хронического стресса в первую очередь страдает гиппокамп, могут развиваться деменция и эмоциональные нарушения».
КСТАТИ
Ровно год назад ученые из Гарвардского университета в ходе масштабного исследования доказали, что человек, который испытывает частый стресс на работе, подвергается повышенному риску развития ряда опасных заболеваний и даже преждевременной смерти. Точно так же, как пассивные курильщики.
Точно так же, как пассивные курильщики.
И еще один момент. Домашние дела — уборка, стирка, мытье посуды, уход за детьми — именно эти вещи вызывают в нашем организме стресс гораздо чаще, чем работа. Оказывается, в офисе мы более расслаблены, оценены коллегами и спокойны. Особенно сильно подвержены стрессу дома женщины, ведь именно они чаще выполняют домашние дела и ухаживают за детьми
НА ЗАМЕТКУ
Британские социологи составили список из 10 главных причин, которые вызывают стресс у жителей городов. Оказалось, что почти половину опрошенных (46 процентов) сводит с ума невозможность нормально выспаться! Еще среди названных стресс-факторов были: долгие поиски парковки, потеря важных документов, севшая батарейка телефона, потерянные ключи, ситуации, в которых ты выглядишь глупо. Все участники опроса признавались, что раздражители подстерегают каждый день! В лидеры стресс-причин вышли: пустой рулончик туалетной бумаги (он вызывает раздражение у 30 процентов) и забытые деньги, когда ты приходишь в банк оплачивать счета (25 процентов).
Говорят, что нервные клетки не восстанавливаются. Ученые смогли это сделать — и говорят о перспективах лечения глаукомы | Громадское телевидение
Группа ученых из Великобритании, США и Швеции смогла восстановить поврежденный зрительный нерв, взятый у мышей. Ключевую роль в этом процессе сыграл белок протрудин. Это открытие теперь может помочь в лечении глаукомы — группы заболеваний глаз, связанных с повышением внутриглазного давления и повреждением зрительного нерва.
Известное утверждение о том, что нервные клетки не восстанавливаются, на самом деле имеет под собой научную основу. Зрелые нервные клетки — нейроны — практически теряют способность к регенерации. Это касается прежде всего центральной нервной системы — головного и спинного мозга.
Именно из-за слишком медленной регенерации поражения нервной системы достаточно тяжелые для людей: они могут привести к обездвиживанию частей тела, параличу и даже отказу жизненно важных органов. Впрочем, исследования последних лет показали, что существуют способы стимулировать такое восстановление клеток.
Впрочем, исследования последних лет показали, что существуют способы стимулировать такое восстановление клеток.
В 2012 году исследователи смогли частично регенерировать ганглиозные клетки мышей — это слой нейронов сетчатки, который воспринимает информацию от фоторецепторов глаза и передает ее дальше в мозг. А четыре года спустя ученым удалось не только восстановить эти клетки, но и показать, что они соединились с правильным участком головного мозга.
Группа исследователей под руководством Ричарда Ивы, Кита Мартина и Джеймса Фосета из Кембриджского университета решила проверить, в чем заключается различие между незрелыми нервными клетками, которые способны достаточно легко регенерироваться, и зрелыми, которые такого свойства уже не имеют. Разгадка — в белке протрудине.
Свое исследование авторы провели на лпбораторних мышах
Протрудин — это белок, который играет важную роль в устойчивости незрелых нервных клеток к физическим повреждениям. Когда нейрон становится зрелым, производство этого белка в аксонах (нервных отростках) клетки почти прекращается. Следовательно, для восстановления поврежденной нервной клетки нужно просто простимулировать производство в ней протрудина.
Для стимулирования производства протрудина исследователи использовали экспериментальную технику генотерапии, суть которой заключается в изменении генома клетки с целью устранения нежелательных или достижения желаемых мутаций. Так авторы изменили клетки зрительного нерва мышей, которые поместили в чашку Петри и аксоны которых отрезали лазером — и в результате выработки протрудина те возобновились.
После этого исследователи воссоздали эксперимент на мышах. С помощью инъекции в глаза зрительные нервы животных «запрограммировали» на выработку протрудина, после чего их повредили. Через несколько недель у мышей, которым делали инъекцию, осталось больше неповрежденных нервных клеток, чем у контрольной группы.
В конце концов, ученые взяли сетчатку глаза одной из мышей, получивших протрудиновую инъекцию, и поместили ее в чашку Петри. Как правило, в течение трех дней после изъятия сетчатки погибает примерно половина ее нейронов — тут же почти ни одна клетка не оказалась поврежденной.
Как правило, в течение трех дней после изъятия сетчатки погибает примерно половина ее нейронов — тут же почти ни одна клетка не оказалась поврежденной.
Сравнение нервного отростка клетки, «запрограммированной» на выработку протрудина (нижняя строка) и нет (верхняя строка). Красная стрелка показывает место повреждения аксона лазером, по горизонтали отражено состояние нейрона в течение определенного времени
Фото:Petrova et al. / Nature Communications
Авторам удалось показать роль белка протрудина в восстановлении нейронов зрительного нерва. Пока они не берутся утверждать, можно ли так восстановить зрение — тем более, что генотерапия пока является экспериментальной методикой лечения. Впрочем, считают, что потенциально их способ позволит эффективно лечить глаукому — группу заболеваний глаза, которые приводят к потере зрения из-за повреждения зрительного нерва.
Теперь авторы планируют исследовать, имеет ли протрудин такой же эффект и на человеческие нейроны сетчатки. А в своей будущей работе они хотят попробовать регенерировать нейроны спинного мозга.
читайте также
НЕРВНЫЕ КЛЕТКИ ВОССТАНАВЛИВАЮТСЯ | Наука и жизнь
Крылатое выражение «Нервные клетки не восстанавливаются» все с детства воспринимают как непреложную истину. Однако эта аксиома — не более чем миф, и новые научные данные его опровергают.Схематическое изображение нервной клетки, или нейрона, которая состоит из тела с ядром, одного аксона и нескольких дендритов.
Нейроны отличаются друг от друга по размеру, разветвленности дендритов и длине аксонов.
Понятие ‘глии’ включает все клетки нервной ткани, не являющиеся нейронами.
Нейроны генетически запрограммированы на миграцию в тот или иной отдел нервной системы, где с помощью отростков они устанавливают связи с другими нервными клетками.
Погибшие нервные клетки уничтожаются макрофагами, попадающими в нервную систему из крови.
Этапы образования нервной трубки в зародыше человека.
‹
›
Природа закладывает в развивающийся мозг очень высокий запас прочности: при эмбриогенезе образуется большой избыток нейронов. Почти 70% из них гибнут еще до рождения ребенка. Человеческий мозг продолжает терять нейроны и после рождения, на протяжении всей жизни. Такая гибель клеток генетически запрограммирована. Конечно же погибают не только нейроны, но и другие клетки организма. Только все остальные ткани обладают высокой регенерационной способностью, то есть их клетки делятся, замещая погибшие. Наиболее активно процесс регенерации идет в клетках эпителия и кроветворных органах (красный костный мозг). Но есть клетки, в которых гены, отвечающие за размножение делением, заблокированы. Помимо нейронов к таким клеткам относятся клетки сердечной мышцы. Как же люди умудряются сохранить интеллект до весьма преклонных лет, если нервные клетки погибают и не обновляются?
Одно из возможных объяснений: в нервной системе одновременно «работают» не все, а только 10% нейронов. Этот факт часто приводится в популярной и даже научной литературе. Мне неоднократно приходилось обсуждать данное утверждение со своими отечественными и зарубежными коллегами. И никто из них не понимает, откуда взялась такая цифра. Любая клетка одновременно и живет и «работает». В каждом нейроне все время происходят обменные процессы, синтезируются белки, генерируются и передаются нервные импульсы. Поэтому, оставив гипотезу об «отдыхающих» нейронах, обратимся к одному из свойств нервной системы, а именно — к ее исключительной пластичности.
Смысл пластичности в том, что функции погибших нервных клеток берут на себя их оставшиеся в живых «коллеги», которые увеличиваются в размерах и формируют новые связи, компенсируя утраченные функции. Высокую, но не беспредельную эффективность подобной компенсации можно проиллюстрировать на примере болезни Паркинсона, при которой происходит постепенное отмирание нейронов. Оказывается, пока в головном мозге не погибнет около 90% нейронов, клинические симптомы заболевания (дрожание конечностей, ограничение подвижности, неустойчивая походка, слабоумие) не проявляются, то есть человек выглядит практически здоровым.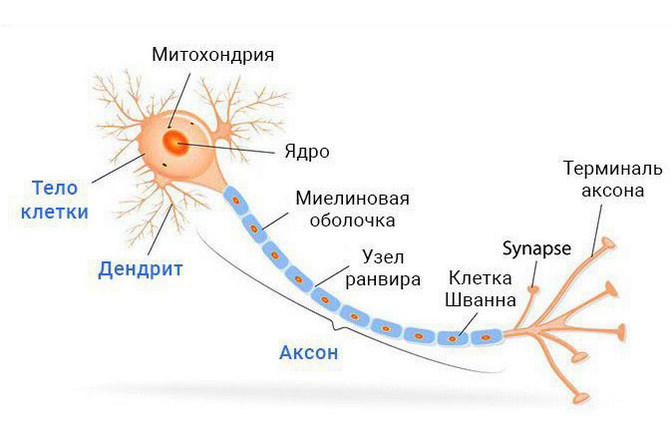 Значит, одна живая нервная клетка может заменить девять погибших.
Значит, одна живая нервная клетка может заменить девять погибших.
Но пластичность нервной системы — не единственный механизм, позволяющий сохранить интеллект до глубокой старости. У природы имеется и запасной вариант — возникновение новых нервных клеток в головном мозге взрослых млекопитающих, или нейрогенез.
Первое сообщение о нейрогенезе появилось в 1962 году в престижном научном журнале «Science». Статья называлась «Формируются ли новые нейроны в мозге взрослых млекопитающих?». Ее автор, профессор Жозеф Олтман из Университета Пердью (США) с помощью электрического тока разрушил одну из структур мозга крысы (латеральное коленчатое тело) и ввел туда радиоактивное вещество, проникающее во вновь возникающие клетки. Через несколько месяцев ученый обнаружил новые радиоактивные нейроны в таламусе (участок переднего мозга) и коре головного мозга. В течение последующих семи лет Олтман опубликовал еще несколько работ, доказывающих существование нейрогенеза в мозге взрослых млекопитающих. Однако тогда, в 1960-е годы, его работы вызывали у нейробиологов лишь скепсис, их развития не последовало.
И только спустя двадцать лет нейрогенез был вновь «открыт», но уже в головном мозге птиц. Многие исследователи певчих птиц обращали внимание на то, что в течение каждого брачного сезона самец канарейки Serinus canaria исполняет песню с новыми «коленами». Причем новые трели он не перенимает у собратьев, поскольку песни обновлялись и в условиях изоляции. Ученые стали детально изучать главный вокальный центр птиц, расположенный в специальном отделе головного мозга, и обнаружили, что в конце брачного сезона (у канареек он приходится на август и январь) значительная часть нейронов вокального центра погибала, — вероятно, из-за избыточной функциональной нагрузки. В середине 1980-х годов профессору Фернандо Ноттебуму из Рокфеллеровского университета (США) удалось показать, что у взрослых самцов канареек процесс нейрогенеза происходит в вокальном центре постоянно, но количество образующихся нейронов подвержено сезонным колебаниям. Пик нейрогенеза у канареек приходится на октябрь и март, то есть через два месяца после брачных сезонов. Вот почему «фонотека» песен самца канарейки регулярно обновляется.
Пик нейрогенеза у канареек приходится на октябрь и март, то есть через два месяца после брачных сезонов. Вот почему «фонотека» песен самца канарейки регулярно обновляется.
В конце 1980-х годов нейрогенез был также обнаружен у взрослых амфибий в лаборатории ленинградского ученого профессора А. Л. Поленова.
Откуда берутся новые нейроны, если нервные клетки не делятся? Источником новых нейронов и у птиц, и у амфибий оказались нейрональные стволовые клетки стенки желудочков мозга. Во время развития зародыша именно из этих клеток образуются клетки нервной системы: нейроны и клетки глии. Но не все стволовые клетки превращаются в клетки нервной системы — часть из них «затаивается» и ждет своего часа.
Как было показано, новые нейроны появляются из стволовых клеток взрослого организма и у низших позвоночных. Однако потребовалось почти пятнадцать лет, чтобы доказать, что аналогичный процесс происходит и в нервной системе млекопитающих.
Развитие нейробиологии в начале 1990-х годов привело к обнаружению «новорожденных» нейронов в головном мозге взрослых крыс и мышей. Их находили большей частью в эволюционно древних отделах головного мозга: обонятельных луковицах и коре гиппокампа, которые отвечают главным образом за эмоциональное поведение, реакцию на стресс и регуляцию половых функций млекопитающих.
Так же, как у птиц и низших позвоночных, у млекопитающих нейрональные стволовые клетки располагаются поблизости от боковых желудочков мозга. Их перерождение в нейроны идет очень интенсивно. У взрослых крыс за месяц из стволовых клеток образуется около 250 000 нейронов, замещая 3% всех нейронов гиппокампа. Продолжительность жизни таких нейронов очень высока — до 112 дней. Стволовые нейрональные клетки преодолевают длинный путь (около 2 см). Они также способны мигрировать в обонятельную луковицу, превращаясь там в нейроны.
Обонятельные луковицы головного мозга млекопитающих отвечают за восприятие и первичную обработку различных запахов, включая и распознавание феромонов — веществ, которые по своему химическому составу близки к половым гормонам. Сексуальное поведение у грызунов регулируется в первую очередь выработкой феромонов. Гиппокамп же расположен под полушариями мозга. Функции этой сложноорганизованной структуры связаны с формированием краткосрочной памяти, реализацией некоторых эмоций и участием в формировании полового поведения. Наличие у крыс постоянного нейрогенеза в обонятельной луковице и гиппокампе объясняется тем, что у грызунов эти структуры несут основную функциональную нагрузку. Поэтому нервные клетки в них часто гибнут, а значит, их необходимо обновлять.
Сексуальное поведение у грызунов регулируется в первую очередь выработкой феромонов. Гиппокамп же расположен под полушариями мозга. Функции этой сложноорганизованной структуры связаны с формированием краткосрочной памяти, реализацией некоторых эмоций и участием в формировании полового поведения. Наличие у крыс постоянного нейрогенеза в обонятельной луковице и гиппокампе объясняется тем, что у грызунов эти структуры несут основную функциональную нагрузку. Поэтому нервные клетки в них часто гибнут, а значит, их необходимо обновлять.
Для того чтобы понять, какие условия влияют на нейрогенез в гиппокампе и обонятельной луковице, профессор Гейдж из Университета Салка (США) построил миниатюрный город. Мыши там играли, занимались физкультурой, отыскивали выходы из лабиринтов. Оказалось, что у «городских» мышей новые нейроны возникали в гораздо большем количестве, чем у их пассивных сородичей, погрязших в рутинной жизни в виварии.
Cтволовые клетки можно извлечь из мозга и пересадить в другой участок нервной системы, где они превратятся в нейроны. Профессор Гейдж с коллегами провел несколько подобных экспериментов, наиболее впечатляющим среди которых был следующий. Участок мозговой ткани, содержащий стволовые клетки, пересадили в разрушенную сетчатку глаза крысы. (Светочувствительная внутренняя стенка глаза имеет «нервное» происхождение: состоит из видоизмененных нейронов — палочек и колбочек. Когда светочувствительный слой разрушается, наступает слепота.) Пересаженные стволовые клетки мозга превратились в нейроны сетчатки, их отростки достигли зрительного нерва, и крыса прозрела! Причем при пересадке стволовых клеток мозга в неповрежденный глаз никаких превращений с ними не происходило . Вероятно, при повреждении сетчатки глаза вырабатываются какие-то вещества (например, так называемые факторы роста), которые стимулируют нейрогенез. Однако точный механизм этого явления до сих пор не ясен.
Перед учеными встала задача показать, что нейрогенез идет не только у грызунов, но и у человека. Для этого исследователи под руководством профессора Гейджа недавно выполнили сенсационную работу. В одной из американских онкологических клиник группа больных, имеющих неизлечимые злокачественные новообразования, принимала химиотерапевтический препарат бромдиоксиуридин. У этого вещества есть важное свойство — способность накапливаться в делящихся клетках различных органов и тканей. Бромдиоксиуридин включается в ДНК материнской клетки и сохраняется в дочерних клетках после деления материнской. Патологоанатомическое исследование показало, что нейроны, содержащие бромдиоксиуридин, обнаруживаются практически во всех отделах мозга, включая кору больших полушарий. Значит, эти нейроны были новыми клетками, возникшими при делении стволовых клеток. Находка безоговорочно подтвердила, что процесс нейрогенеза происходит и у взрослых людей. Но если у грызунов нейрогенез идет только в гиппокампе, то у человека, вероятно, он может захватывать более обширные зоны головного мозга, включая кору больших полушарий. Недавно проведенные исследования показали, что новые нейроны во взрослом мозге могут образовываться не только из нейрональных стволовых, но из стволовых клеток крови. Открытие этого феномена вызвало в научном мире эйфорию. Однако публикация в журнале «Nature» за октябрь 2003 года во многом остудила восторженные умы. Оказалось, что стволовые клетки крови действительно проникают в мозг, но они не превращаются в нейроны, а сливаются с ними, образуя двуядерные клетки. Затем «старое» ядро нейрона разрушается, а его замещает «новое» ядро стволовой клетки крови. В организме крысы стволовые клетки крови в основном сливаются с гигантскими клетками мозжечка — клетками Пуркинье, правда, происходит это довольно редко: во всем мозжечке можно обнаружить лишь несколько слившихся клеток. Более интенсивное слияние нейронов происходит в печени и сердечной мышце. Пока совершенно непонятно, какой в этом физиологический смысл. Одна из гипотез заключается в том, что стволовые клетки крови несут с собой новый генетический материал, который, попадая в «старую» клетку мозжечка, продлевает ей жизнь.
Для этого исследователи под руководством профессора Гейджа недавно выполнили сенсационную работу. В одной из американских онкологических клиник группа больных, имеющих неизлечимые злокачественные новообразования, принимала химиотерапевтический препарат бромдиоксиуридин. У этого вещества есть важное свойство — способность накапливаться в делящихся клетках различных органов и тканей. Бромдиоксиуридин включается в ДНК материнской клетки и сохраняется в дочерних клетках после деления материнской. Патологоанатомическое исследование показало, что нейроны, содержащие бромдиоксиуридин, обнаруживаются практически во всех отделах мозга, включая кору больших полушарий. Значит, эти нейроны были новыми клетками, возникшими при делении стволовых клеток. Находка безоговорочно подтвердила, что процесс нейрогенеза происходит и у взрослых людей. Но если у грызунов нейрогенез идет только в гиппокампе, то у человека, вероятно, он может захватывать более обширные зоны головного мозга, включая кору больших полушарий. Недавно проведенные исследования показали, что новые нейроны во взрослом мозге могут образовываться не только из нейрональных стволовых, но из стволовых клеток крови. Открытие этого феномена вызвало в научном мире эйфорию. Однако публикация в журнале «Nature» за октябрь 2003 года во многом остудила восторженные умы. Оказалось, что стволовые клетки крови действительно проникают в мозг, но они не превращаются в нейроны, а сливаются с ними, образуя двуядерные клетки. Затем «старое» ядро нейрона разрушается, а его замещает «новое» ядро стволовой клетки крови. В организме крысы стволовые клетки крови в основном сливаются с гигантскими клетками мозжечка — клетками Пуркинье, правда, происходит это довольно редко: во всем мозжечке можно обнаружить лишь несколько слившихся клеток. Более интенсивное слияние нейронов происходит в печени и сердечной мышце. Пока совершенно непонятно, какой в этом физиологический смысл. Одна из гипотез заключается в том, что стволовые клетки крови несут с собой новый генетический материал, который, попадая в «старую» клетку мозжечка, продлевает ей жизнь.
Итак, новые нейроны могут возникать из стволовых клеток даже в мозге взрослого человека. Этот феномен уже достаточно широко применяется для лечения различных нейродегенеративных заболеваний (заболеваний, сопровождающихся гибелью нейронов головного мозга). Препараты стволовых клеток для трансплантации получают двумя способами. Первый — это использование нейрональных стволовых клеток, которые и у эмбриона, и у взрослого человека располагаются вокруг желудочков головного мозга. Второй подход — использование эмбриональных стволовых клеток. Эти клетки располагаются во внутренней клеточной массе на ранней стадии формирования зародыша. Они способны превращаться практически в любые клетки организма. Наибольшая сложность в работе с эмбриональными клетками — заставить их трансформироваться в нейроны. Новые технологии позволяют сделать это.
В некоторых лечебных учреждениях в США уже сформированы «библиотеки» нейрональных стволовых клеток, полученных из зародышевой ткани, и проводятся их пересадки пациентам. Первые попытки трансплантации дают положительные результаты, хотя на сегодняшний день врачи не могут разрешить основную проблему подобных пересадок: безудержное размножение стволовых клеток в 30-40% случаев приводит к образованию злокачественных опухолей. Пока не найдено подхода к предотвращению подобного побочного эффекта. Но, несмотря на это, трансплантация стволовых клеток, несомненно, будет одним из главных подходов в терапии таких нейродегенеративных заболеваний, как болезни Альцгеймера и Паркинсона, ставших бичом развитых стран.
«Наука и жизнь» о стволовых клетках:
Белоконева О., канд. хим. наук. Запрет для нервных клеток. — 2001, № 8.
Белоконева О., канд. хим. наук. Праматерь всех клеток. — 2001, № 10.
Смирнов В., акад. РАМН, член-корр. РАН. Восстановительная терапия будущего. — 2001, № 8.
Умри, нейрон. Ученые предположили, что гибель нервных клеток может идти нам на пользу
Война всех против всех
Многоклеточный организм часто сравнивают с государством: отдельные особи-клетки заключили общественный договор, чтобы равномерно распределять ресурсы и эффективно защищаться от врагов. Поэтому клетки строго соблюдают основные законы: не размножаться, если рядом нет свободного места; не есть больше, чем требуется; выделять вещества (факторы роста), поддерживающие жизнь соседей. Считается, что до рукоприкладства у добросовестных клеток дело не доходит — для этого есть специальные стражи порядка, клетки иммунитета, которые единственные имеют право стрелять на поражение.
Поэтому клетки строго соблюдают основные законы: не размножаться, если рядом нет свободного места; не есть больше, чем требуется; выделять вещества (факторы роста), поддерживающие жизнь соседей. Считается, что до рукоприкладства у добросовестных клеток дело не доходит — для этого есть специальные стражи порядка, клетки иммунитета, которые единственные имеют право стрелять на поражение.
Однако в 70-х годах испанские ученые, изучавшие развитие мушки дрозофилы, обнаружили, что не все так ладно в клеточном государстве. Ученых интересовал ген minute, кодирующий один из рибосомных белков. Мутации в одной из копий гена сильно замедляют синтез белка, а клетки с мутациями в обеих копиях нежизнеспособны. Ученые обнаружили, что сами по себе клетки — частичные мутанты — развиваются нормально, но если их смешать со здоровыми клетками, то они не выдерживают конкуренции и исчезают из популяции. Этот феномен назвали клеточной конкуренцией (cell competition).
Клеточная конкуренция не похожа на классическую дарвиновскую борьбу за существование. Победители в естественном отборе просто оставляют больше потомков, чем проигравшие.
Клеточная конкуренция же еще суровее — здесь побежденного могут просто уничтожить на месте, не дожидаясь, пока его потомки растворятся в популяции победителей.
За 40 с лишним лет ученым удалось поймать на месте преступления множество типов клеток: не только в мухах, но и в млекопитающих, не только зародышевые, но и взрослые, относящиеся к самым разным тканям. Судя по всему, это некоторый универсальный механизм клеточного взаимодействия. И то, что кажется нам цивилизованным сообществом, на деле оборачивается подковерной войной всех против всех.
Клеточный триатлон
Мы до сих пор не знаем наверняка, чем именно меряются клетки в ходе соревнования. Судя по мутациям, которые заставляют их чаще выигрывать или проигрывать, можно предположить, что состязаться они могут в трех дисциплинах.
Плодовитость. Чем клетка активнее размножается, тем больше шансов на победу. Впрочем, сам по себе рост не всегда приводит к уничтожению соседей. Вероятно, дело в каком-то параметре, связанном с ростом, — например, скорости синтеза белка или обмена веществ.
Ораторское искусство, или активность сигнальных путей. Большинство сигнальных белков, участвующих в развитии (BMP, WNT и др.), дают клеткам преимущество в соревновании: чем их больше, тем лучше клетки выживают. Однако не очень понятно, как отделить этот «демагогический» параметр от общей интенсивности обмена веществ.
Внешний вид клетки, а точнее — ее полярность. Это что-то вроде конкурса красоты: клетки правильной, аккуратной формы, с четко выраженными полюсами, выживают, а неаккуратные клеточные «кляксы» гибнут. Но, в отличие от модельных стандартов, форма клеток напрямую связана с их жизнеспособностью: полярность свидетельствует о четкой организации цитоскелета и распределении органелл по клетке, а расплывчатая форма часто связана с излишней подвижностью и опухолевой трансформацией.
Плодовитость. Чем клетка активнее размножается, тем больше шансов на победу. Впрочем, сам по себе рост не всегда приводит к уничтожению соседей. Вероятно, дело в каком-то параметре, связанном с ростом, — например, скорости синтеза белка или обмена веществ.
Ораторское искусство, или активность сигнальных путей. Большинство сигнальных белков, участвующих в развитии (BMP, WNT и др.), дают клеткам преимущество в соревновании: чем их больше, тем лучше клетки выживают. Однако не очень понятно, как отделить этот «демагогический» параметр от общей интенсивности обмена веществ.
Внешний вид клетки, а точнее — ее полярность. Это что-то вроде конкурса красоты: клетки правильной, аккуратной формы, с четко выраженными полюсами, выживают, а неаккуратные клеточные «кляксы» гибнут. Но, в отличие от модельных стандартов, форма клеток напрямую связана с их жизнеспособностью: полярность свидетельствует о четкой организации цитоскелета и распределении органелл по клетке, а расплывчатая форма часто связана с излишней подвижностью и опухолевой трансформацией.
Но, в отличие от модельных стандартов, форма клеток напрямую связана с их жизнеспособностью: полярность свидетельствует о четкой организации цитоскелета и распределении органелл по клетке, а расплывчатая форма часто связана с излишней подвижностью и опухолевой трансформацией.
Возможно, в разных типах тканей клетки соревнуются по разным параметрам, а где-то — и по всем трем сразу. Единственное, что мы знаем наверняка, — состязаются только клетки одного типа, на другие группы эта борьба не распространяется. Грубо говоря, нервные клетки воюют с нервными, а клетки крови в ходе этого никак не страдают. Поэтому мутации, губящие клетку в нервной ткани, могли бы оказаться, наоборот, преимуществом в мышечной.
Нет у нас и однозначной картины того, как именно клетки подставляют подножки своим коллегам. Вероятно, в конкретных случаях работают разные механизмы, а общий список подлостей выглядит так.
Захватить всю еду. Более активные клетки могут поглощать больше ресурсов и факторов роста, оставив соседей ни с чем.
Выслать в ссылку. При скоплении клеток в ткани победители механически выдавливают побежденных из строя или «затаптывают» до смерти (в прямом смысле слова — под давлением победителей в побежденных клетках начинается апоптоз).
Без церемоний сожрать. Этим способом часто пользуются беспринципные раковые клетки, обволакивая неудачливых соседей и постепенно поглощая их целиком.
Блэкджек по-крупному. Клетки выставляют на свою поверхность белки, которые распознают их соседи. Один такой белок дрозофилы называетcя FLOWER — это кальциевый канал, который существует в нескольких изоформах. От соотношения изоформ у соседних клеток зависит их судьба: если у тебя больше Flowerubi, чем у соседа, то ты победил и живешь. А если больше FlowerLose-A и FlowerLose-B, то это проигрыш и апоптоз.

Захватить всю еду. Более активные клетки могут поглощать больше ресурсов и факторов роста, оставив соседей ни с чем.
Выслать в ссылку. При скоплении клеток в ткани победители механически выдавливают побежденных из строя или «затаптывают» до смерти (в прямом смысле слова — под давлением победителей в побежденных клетках начинается апоптоз).
Без церемоний сожрать. Этим способом часто пользуются беспринципные раковые клетки, обволакивая неудачливых соседей и постепенно поглощая их целиком.
Блэкджек по-крупному. Клетки выставляют на свою поверхность белки, которые распознают их соседи. Один такой белок дрозофилы называетcя FLOWER — это кальциевый канал, который существует в нескольких изоформах. От соотношения изоформ у соседних клеток зависит их судьба: если у тебя больше Flowerubi, чем у соседа, то ты победил и живешь. А если больше FlowerLose-A и FlowerLose-B, то это проигрыш и апоптоз.
И вновь продолжается бой
Несмотря на кажущуюся жестокость, клеточная конкуренция — неизбежный элемент большинства процессов в тканях. Например, в ходе развития зародыша полезно уничтожить клетки с низким уровнем обмена веществ или опасными мутациями. Зародыши часто бывают мозаичны, то есть отдельные клетки отличаются друг от друга, например количеством хромосом (это называют анеуплоидией). В таких случаях лучше избавиться от них в самом начале, чем ждать, пока из них вырастет плохо работающий орган, и из-за этого умереть.
Во взрослом организме клеточная конкуренция позволяет избавиться от сломанных или внезапно мутировавших клеток, то есть мешает тканям стареть. Новые клетки, ближайшие потомки стволовых клеток, например, в тимусе мышей, оказываются более жизнеспособными и постепенно вытесняют старые, тем самым обновляя ткань тимуса.
То же самое происходит и при регенерации: если подсадить в ткань новые клетки, они будут не только заращивать дырки, но и добивать старые.
Но есть и ситуации, в которых клеточная конкуренция играет не столь однозначную роль, и это опухоли. С одной стороны, сам механизм соревнования позволяет законопослушным соседям по-тихому уничтожить мутантные клетки на ранних стадиях превращения в раковые, когда иммунная система до них еще не добралась. Если этот процесс нарушить, как происходит, например, у мышей при ожирении, то опухоли развиваются чаще. С другой стороны, если опухолевая клетка окажется быстрее (например, если первую мутацию в ней соседи не заметили, а потом появилась вторая, более агрессивная), то она сама может оказаться агрессором и развязать войну с окружающими, расчищая для себя место или просто выдавливая их из ткани.
Падающего подтолкни
В поисках новых случаев клеточной конкуренции ученые, теперь уже португальские, добрались наконец до мозга. Они работали с дрозофилами, которые экспрессировали человеческий бета-амилоид — белок, накапливающийся в нервной ткани при болезни Альцгеймера. Обычно скопление бета-амилоидов приводит к нейродегенерации, но точный механизм гибели клеток пока не ясен. Ученые предположили: возможно, и здесь замешана клеточная конкуренция? Если так, то больные нервные клетки погибают от «рук» своих более здоровых соседей, а значит, весь процесс скорее благоприятен для мозга, чем вреден.
В начале эксперимента больные Альцгеймером мушки чувствовали себя неважно: они теряли долгосрочную память и испытывали проблемы с координацией. В то же время в их мозге шла ожесточенная битва: клеточные клоны, экспрессировавшие бета-амилоид, кроме этого несли на себе «неудачливые» белки FlowerLose-B и azot (вторая «черная метка» для соревнующихся клеток) и часто умирали. Когда же производство этих белков заблокировали, гибель нейронов в мозге прекратилась. Видимо, там действительно разворачивалась клеточная конкуренция.
Однако попытки разнять дерущихся и предотвратить их гибель закончились печально. У мух с заблокированным белком azot нейродегенерация лишь усилилась, а количество вакуолей в нейронах (признак дегенерации) выросло на 57%. Когда же вдобавок к этому ученые запретили в клетках апоптоз полностью, то нервная система начала разрушаться еще быстрее. Спасти больных Альцгеймером мушек удалось только с помощью дополнительной, третьей копии гена azot: клетки начали соревноваться еще агрессивнее, «слабые» — умирать еще чаще, однако нейродегенерация в целом при этом замедлилась. Восстановились заодно память, способность к поведению и двигательные способности.
У мух с заблокированным белком azot нейродегенерация лишь усилилась, а количество вакуолей в нейронах (признак дегенерации) выросло на 57%. Когда же вдобавок к этому ученые запретили в клетках апоптоз полностью, то нервная система начала разрушаться еще быстрее. Спасти больных Альцгеймером мушек удалось только с помощью дополнительной, третьей копии гена azot: клетки начали соревноваться еще агрессивнее, «слабые» — умирать еще чаще, однако нейродегенерация в целом при этом замедлилась. Восстановились заодно память, способность к поведению и двигательные способности.
Неожиданный поворот сюжета, обнаруженный в мозге дрозофилы, ставит нас перед вопросом: как быть теперь с людьми?
Если удастся доказать, что в мозге, например, мыши, больной Альцгеймером, также разыгрывается битва между поврежденными и здоровыми нейронами, нам придется признать, что гибель нервных клеток скорее полезна, чем вредна. В то же время лекарства, которые сейчас рассматривают в качестве кандидатов в борцы с нейродегенерацией, напротив, апоптоз блокируют. Значит ли это, что нам придется радикально изменить стратегию и начать добивать нейроны вместо того, чтобы спасать?
Полина Лосева
Метастазы в головном мозге — Brainlab
Запись текста документального фильма
Brain Metastases: A Documentary
Механизм развития и перспективные методы лечения
Что такое метастазы в головном мозге?
Дэвид Эндрюс, врач: Рак. Страшнейшая болезнь. Ужасный недуг, лекарство от которого еще не найдено. Однако сегодня мы, бесспорно, находимся на одной из самых динамичных и многообещающих стадий поисков его лечения.
Бренда Винченц-Смит: Я чувствовала, что с моей правой грудью что-то не так. Оказалось, что у меня рак молочной железы. Я перенесла семь месяцев химиотерапии, мастэктомию, облучение. Наконец все признаки болезни исчезли. Онколог предложил мне пройти сканирование мозга, потому что я не делала этого с самой постановки диагноза, когда мне делали ПЭТ. У меня нашли три опухоли.
У меня нашли три опухоли.
Дуайт Херон, врач: Метастазы в головном мозге — это скопление раковых клеток, которые мигрировали из другой части тела, где они появились изначально. Из-за них возникают сильные отеки. Отеки и давление на мозг вызывают неврологические симптомы и могут привести к смерти, если их должным образом не лечить.
Бренда Винченц-Смит: Моя первая мысль была: «Ну ладно, и что дальше? Каким будет качество моей жизни?» На самом деле, я уже была готова к смерти.
Вероника Чанг, врач: Это приводит в ужас. Пациенты боятся, что скоро умрут. Они боятся лечения, которое мы можем им предложить.
Дуглас Кондзиолка, врач: Несколько лет назад мы провели исследование. Я попытался спрогнозировать, как долго проживет каждый из моих пациентов. Мы поделились этими данными с 17 самыми уважаемыми врачами в мире. Это было удивительно. Оказалось, что врачи не в состоянии определить, кто победит болезнь, несмотря ни на что, а для кого борьба будет безуспешной. Возможно, мы не так уж хорошо можем предсказать, сколько времени отведено людям.
Вероника Чанг, врач: Мы обязательно найдем лекарство от рака, но пока этого не произошло, мы хотим, чтобы люди могли жить с раком, а не доживать свои дни.
Дуайт Херон, врач: Благодаря радиохирургии мы можем лечить даже самые глубокие и труднодоступные опухоли, почти не нанося вреда организму. Лечение настолько точное, что не имеет значительных побочных эффектов.
Дуглас Кондзиолка, врач: Это произвело революцию в нейрохирургии и радиационной онкологии. До этого приходилось выбирать между открытой хирургией и облучением всей головы и нельзя было облучать только образования.
Дэвид Эндрюс, врач: Преимущество радиохирургии заключается в том, что, фокусируя облучение, мы ограждаем окружающие структуры мозга от радиационного поражения.
Дуглас Кондзиолка, врач: Пациенты удивляют нас. Они живут дольше, они побеждают болезнь. Мы наблюдаем случаи выздоровления, которые не наблюдали никогда раньше.
Дэвид Эндрюс, врач: Мы можем с высокой долей уверенности утверждать, что удалим раковую опухоль в мозге и вернем вас к вашей обычной жизни.
Как и почему возникают метастазы в головном мозге?
Дэвид Роберж, врач: Есть разные виды опухолей головного мозга. Выделяют первичный рак мозга, то есть опухоль, изначально развившуюся в мозге, что на самом деле редкость. Также есть метастатический рак мозга, который встречается в пять раз чаще. Особенностью раковой опухоли является ее способность распространяться по всему телу. Так, опухоль может образоваться в молочной железе, по достижении определенного размера мутировать, в результате ее клетка может отделиться и попасть в кровь, а затем в мозг. Она укореняется там и образует другие опухоли. Это и есть метастазирование.
Орин Блох, врач: Мозг защищен от возбудителей инфекций, токсинов и других веществ, которые могут присутствовать в крови, гематоэнцефалическим барьером. Рак способен проникать сквозь этот барьер, и у некоторых видов рака механизм проникновения лучше, чем у других. Так, большинство наблюдаемых нами метастатических опухолей возникают из-за рака легких, рака молочной железы, меланомы и рака яичка. Если удалить одну из таких метастатических опухолей из мозга хирургическим путем и посмотреть на нее под микроскопом, она будет похожа на рак из первоисточника. Например, метастазы рака молочной железы выглядят как патологическая ткань молочной железы, а не ткань мозга. Эти клетки создают шарообразное скопление, которое является раком, но не является частью мозга. Они как плохие соседи, так сказать.
Дуглас Кондзиолка, врач: Наша цель — обнаруживать подобные опухоли как можно раньше, потому что по мере их роста шансы на успех лечения снижаются. Обычно при использовании радиохирургии риск дальнейшего развития опухоли головного мозга снижается примерно на 85 %. Но как довести этот показатель до 95 %, 98 %, 99 %? Для этого важно как можно раньше выявлять опухоли, а значит, периодически нужно проводить сканирование мозга.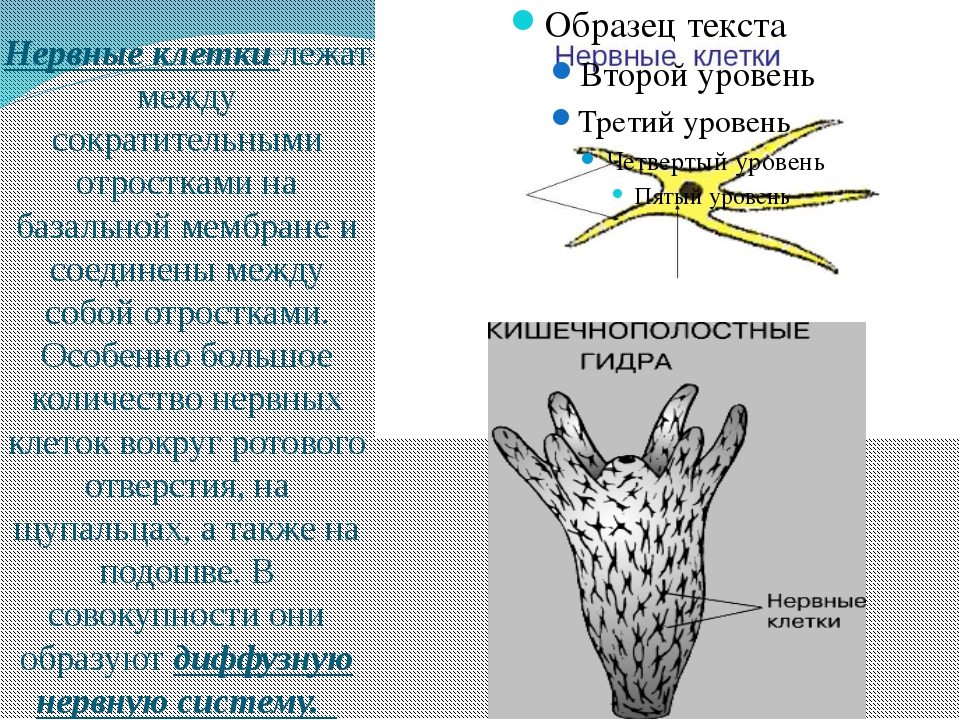 Если пропустить момент образования опухоли, она вырастет, и это порой вызывает неврологические симптомы, которых можно было бы избежать.
Если пропустить момент образования опухоли, она вырастет, и это порой вызывает неврологические симптомы, которых можно было бы избежать.
Каковы возможные варианты лечения?
Химиотерапия
Орин Блох, врач: Обычно, когда у вас диагностируют метастатический рак или рак, распространяющийся по всему телу, вам назначают системную химиотерапию, при которой используемый препарат должен убивать раковые клетки во всем теле. Но такой препарат не попадает в мозг из-за гематоэнцефалического барьера.
Дэвид Эндрюс, врач: Противораковый препарат должен иметь сильный эффект, но так как сквозь гематоэнцефалический барьер проникает только небольшая его часть, химиотерапия существенно затрудняется.
Орин Блох, врач: Поэтому опухоли в мозге необходимо лечить как образования, полностью отделенные от опухолей в других частях тела.
Дэвид Эндрюс, врач: Таким образом, инструменты, доступные для лечения метастазов в мозге, — это облучение и хирургия.
Дуглас Кондзиолка, врач: В отдельных случаях выполняется оценка и тестирование разных протоколов исследований и медикаментозного лечения. Мы надеемся, что любое полученное медикаментозное лечение приносит пользу организму, особенно в аспекте предотвращения появления опухолей в будущем.
Лучевая терапия всего головного мозга
Дуайт Херон, врач: Облучение всего головного мозга полностью соответствует своему названию. Мы облучаем весь мозг радиацией.
Дэвид Роберж, врач: Методика традиционной радиотерапии неизменна уже много лет: каждый день дается небольшая доза радиации, и это повторяется пять дней в неделю в течение семи или восьми недель. При этом многие здоровые клетки получают такую же дозу радиации, как и раковые, но здоровые клетки быстрее восстанавливаются между процедурами облучения. Если вы проходите процедуру сегодня, а следующую через 24 часа, здоровые клетки восстановятся быстрее, чем раковые.
Эрик Чанг, врач: К сожалению, если пациенту диагностировали метастазы в головном мозге, многие из этих опухолей не обнаруживаются с помощью МРТ или других доступных методов лучевой диагностики. И они могут увеличиваться. Некоторые называют это «эффектом одуванчика». Когда вы дуете на одуванчик, все семена разлетаются. Так же происходит и с первичным раком в организме: у раковых клеток есть возможность распространиться и прорасти в разных областях головного мозга. Лучевая терапия всего головного мозга используется для того, чтобы удалить не только видимые метастазы, но и микроскопические, которых пока не видно.
Дэвид Роберж, врач: Облучение начали применять почти 100 лет назад, и это был очень важный шаг в лечении рака. Для некоторых людей это оптимальная терапия, но у нее много побочных эффектов. Почти все пациенты чувствуют утомление, иногда даже изнеможение. У них выпадают волосы. Может возникнуть воспаление уха, и иногда это приводит к потере слуха. Иногда облучение вызывает тошноту. Но больше всего пациентов и врачей беспокоит то, что облучение может повлиять на память, концентрацию внимания и другие функции мозга.
Орин Блох, врач: Лучевая терапия всего головного мозга оказывает разрушительное воздействие на когнитивные функции. Мы воздействуем на области, где формируются новые воспоминания, гиппокамп, а также все взаимосвязи между различными частями мозга, которые критически важны для памяти и мыслительной деятельности более высокого уровня. Нельзя подвергать такой объем тканей мозга токсическому воздействию радиации и ожидать, что последствий не будет. Поэтому в поисках метода лечения рака или, по крайней мере, его долговременного подавления, позволяющего продлить жизнь пациентов на многие годы, нам нужно задуматься, каким будет качество их жизни. А качество жизни начинается здесь.
Стереотаксическая радиохирургия
Дуайт Херон, врач: Благодаря современным технологиям визуализации, которые позволяют увидеть самые крошечные опухоли внутри мозга, мы можем избежать облучения всего головного мозга и лечить эти опухоли с помощью радиохирургии.
Говард Чандлер, врач: Стереотаксическая радиохирургия — это метод точной доставки облучения в конкретную точку внутри головы.
Дуайт Херон, врач: Принцип заключается в том, что вы разрушаете опухоли внутри тела с точностью лезвия ножа. Опухоль уничтожается глубоко внутри тела, почти как если ее вырезать, только используется неинвазивный способ.
Дэвид Роберж, врач: Радиохирургические устройства обычно имеют точность до миллиметра. И с той же точностью мы можем обнаружить местоположение опухоли на МРТ- или КТ-снимке, так что эта точность вполне близка к необходимой.
Говард Чандлер, врач: Это оборудование использует несколько пучков излучения, которые сходятся в одной точке. Я говорю пациентам, что это очень похоже на увеличительное стекло и листок. Если поместить листок под солнечные лучи, он не загорится сам по себе, но если взять линзу и направить малую дозу солнечной энергии в одну точку, она прожжет в листке дыру. Примерно так работает оборудование стереотаксической радиохирургии.
Дэвид Роберж, врач: Излучение поступает со всех направлений и фокусируется в одной точке. Но область вокруг этой точки почти не облучается, и поражается именно опухоль.
Дэвид Эндрюс, врач: Метастазы — одни из немногих очагов поражения в головном мозге, которые можно полностью устранить с помощью облучения. Огромное преимущество радиохирургии заключается в том, что она позволяет не прерывать системного лечения, в то время как пациент, проходящий лучевую терапию всего мозга, должен приостановить стандартное лечение.
Какие бывают типы стереотаксической радиохирургии?
Гамма-нож
Дуглас Кондзиолка, врач: Гамма-нож — первая стационарная специализированная радиохирургическая система.
Вероника Чанг, врач: Облучение гамма-ножом — это однодневная процедура.
Дуглас Кондзиолка, врач: Они приходят в больницу рано утром. Мы даем им немного успокоительного. Мы очищаем кожу, и я ввожу небольшое количество местного анестетика в лоб и затылок перед тем, как установить то, что я называю направляющим устройством стереотаксической рамы. Это похоже на кольцо с маленькими штырями, которые мы прикрепляем к голове в онемевших зонах. Пациент находится в нем во время процедуры. Направляющее устройство стереотаксической рамы предотвращает движения головой. Второе, что делает рама, — это фактически создает GPS-устройство для головы, чтобы мы знали местонахождение опухоли внутри мозга с математической точки зрения: точные координаты в трехмерном пространстве.
Дуайт Херон, врач: В гамма-ноже 192 источника, и все они сфокусированы в одной точке пространства.
Дуглас Кондзиолка, врач: Каждое из облучающих устройств по-разному создает подобный конформный план неправильной формы. В гамма-ноже используются так называемые изоцентры или порции радиации. Каждая порция похожа на шар. Чтобы получить неправильную форму, можно сделать серию шаров, которые математически объединяются в трех измерениях для создания нужной формы. После этого группа выбирает дозу радиации, которая лучше всего подходит для данной опухоли в данном месте у данного пациента. При этом необходимо учитывать множество факторов: проводилось ли облучение ранее, размер опухоли, ее местоположение, есть ли другие варианты лечения на случай, если этот не сработает, есть ли риски и как ими можно управлять.
Вероника Чанг, врач: После завершения процедуры мы снимаем головную раму, накладываем повязки на места, где были установлены штифты, перебинтовываем голову и пациент почти сразу идет домой.
Линейные ускорители
Дэвид Эндрюс, врач: Для стереотаксического облучения также используются линейные ускорители. Используемые в них ускоренные электроны сталкиваются с мишенью из тяжелого металла, в результате чего образуются фотоны высокой энергии.
Джеймс Робар, доктор наук: Когда они замедляются, они испускают рентгеновское излучение, но не такое, которое используется, например, для флюорографии. Это излучение почти в 100 раз сильнее. Такое рентгеновское излучение предназначено для уничтожения раковых клеток. Появление линейных ускорителей открыло доступ к огромному числу новых методов лечения. Мы смогли направлять радиационные пучки под разными углами и перекрывать их. Нам даже не нужно подавать все пучки одновременно. Биологический эффект облучения аддитивен, даже если подавать эти пучки последовательно. И это довольно быстро. Подача всей серии пучков и полной дозы облучения занимает от 15 минут до получаса.
В чем разница между безрамным облучением и процедурой с использованием рамы?
Орин Блох, врач: Преимущество радиохирургии с использованием рамы состоит в том, что пациент жестко зафиксирован на столе. Благодаря этому гарантируется неподвижность пациента, а определить мишень можно с высокой точностью. В безрамной радиохирургии используются термопластические маски, которые изготавливают индивидуально для каждого пациента. Для этого пластик нагревают, придают ему форму и после этого охлаждают, чтобы он стал жестким. Как и рама, маска удерживает пациента на столе, но все же допускает микродвижения на один-два миллиметра. Это намного удобнее, чем жесткая фиксация на столе, но потенциально может привести к ошибкам.
Тимоти Зольберг, доктор наук: Существуют безрамные технологии, позволяющие отслеживать поверхность тела пациента и на основе этих данных триангулировать находящуюся внутри тела мишень, которую невозможно увидеть.
Джеймс Робар, доктор наук: Технологии оптического отслеживания поверхности тела хорошо подходят для лечения рака некоторых локализаций, например в молочной железе. При лечении опухолей мозга пространственная точность важнее, чем при лечении любой другой части тела. На чувствительность отслеживания может влиять даже цвет кожи. Кроме того, кожа может сдвинуться, деформироваться, растянуться. В этом главное ограничение метода сопоставления поверхностей. Чтобы компенсировать ограниченную точность сопоставления поверхностей, можно добавить вокруг облучаемой опухоли дополнительный зазор. Мы стремимся сделать эти зазоры как можно меньше, поскольку такое расширение мишени означает намеренное облучение здоровой ткани мозга. К примеру, возьмем вторичные метастазы в мозге по 15 мм в диаметре. Если добавить зазор, который составляет всего 2 мм, мы практически удвоим объем опухоли, который нужно облучить. Чего бы нам действительно хотелось, так это иметь средства для более наглядного мониторинга фактического расположения опухоли.
Тимоти Зольберг, доктор наук: Благодаря безрамной технологии под контролем визуализации, например с помощью ExacTrac, можно в режиме реального времени увидеть, куда направлен пучок. Таким образом, можно постоянно следить за пациентом. Если он по какой-то причине начал двигаться, кашлять или вздрогнул, вы это заметите и сможете скорректировать процедуру.
Орин Блох, врач: Если к термопластической маске добавить визуализацию и корректировку микродвижений, можно достигнуть того же уровня точности, что и при использовании рамы. Это можно сделать с помощью такой системы, как ExacTrac. В ней используется встроенная рентгеновская визуализация и роботизированное перемещение стола, которые позволяют производить небольшие корректировки положения пациента с учетом любого его движения.
Говард Чандлер, врач: Исходя из моего опыта лечения сотен пациентов с использованием как рамы, так и безрамных технологий, безрамная иммобилизация более удобна и для пациента, и для специалиста. Для пациентов это значит, что не нужно терпеть болезненную анестезию и принимать успокоительное, не нужно терпеть дискомфорт от ношения рамы в течение всего дня лечения. Они обездвижены, только когда находятся на столе во время облучения.
Дэвид Роберж, врач: Не имеет значения, проводится ли одна процедура, три или пять. Можно достигать такой же точности и выполнять любое количество процедур, лучше всего подходящее для пациента и лечения его опухоли.
Технология CyberKnife
Дуайт Херон, врач: CyberKnife — это небольшой роботизированный линейный ускоритель, который позволяет проводить лучевую терапию с дозой гораздо меньшей мощности. Он работает по узловой схеме и поэтому перемещается из одного положения в следующее и так далее. Без лишних перемещений. Зачастую это позволяет создавать качественно схожие планы облучения. То есть, если необходимо доставить дозу в 18 греев в небольшую опухоль, то будь это гамма-нож, система Novalis или система CyberKnife — подойдет любая. Принципиальное различие в способе распределения дозы и ее доставки. И также в скорости. Продолжительность процедуры исключительно важна. Как и система Novalis, CyberKnife использует стереоскопическую визуализацию, которая позволяет визуализировать пациента и контролировать его правильное положение на протяжении всего курса облучения.
Многолепестковый коллиматор
Говард Чандлер, врач: Следующим шагом в развитии технологий формирования пучка являются микромноголепестковые коллиматоры. В основе этой технологии лежит факт, что не все опухоли имеют правильную круглую форму. Круговой пучок идеально подходит для сферической мишени, но если представить, например, хот-дог, то он будет круглой формы в одной проекции, но вытянутой в другой.
Джеймс Робар, доктор наук: Многолепестковый коллиматор позволяет подстраивать эти формы в зависимости от проекции опухоли. Мы не можем использовать магниты для управления рентгеновским излучением или использовать линзы, например оптические. Нам нужно просто заблокировать области, куда не должны попадать рентгеновские лучи, и создать отверстие, куда они должны проходить.
Говард Чандлер, врач: В микромноголепестковых коллиматорах несколько лепестков закрывают часть пучка, чтобы он по форме точно соответствовал опухоли. Контур пучка точно совпадает с краем опухоли на данной проекции. И все это производится во время процедуры, пока пучок движется по дуге облучения вокруг опухоли.
Джеймс Робар, доктор наук: Если управление лепестками осуществляется динамически, можно менять интенсивность излучения, испускаемого линейным ускорителем.
Говард Чандлер, врач: Я считаю, что разработка микромноголепесткового коллиматора — самый большой успех в радиохирургии в мое время. Он позволяет более точно и стабильно доставлять дозу непосредственно в мишень, что снижает облучение здоровых тканей мозга вокруг опухоли.
Облучение нескольких метастазов
Дэвид Эндрюс, врач: Пусть даже пациенту назначено 36 часов радиохирургии, не важно. Благодаря поразительным технологиям линейных ускорителей мы можем выполнить облучение десяти метастазов в кратчайшие сроки — всего за полчаса.
Тимоти Зольберг, доктор наук: Применяемый сегодня метод лечения множественных метастазов заключается в том, чтобы облучать один метастаз за другим, и, безусловно, можно так и делать. С помощью гамма-ножа это традиционно делается на линейном ускорителе. Облучается метастаз за метастазом, и процедура занимает 15–20 минут для каждого. Если у пациента 12 метастазов, приходится облучать его в течение трех, а то и четырех часов.
Дэвид Роберж, врач: Это не так актуально, когда речь идет о двух или трех опухолях. Но если необходимо облучить 10 или 15 опухолей, крайне неудобно облучать их по одной за раз. Гораздо проще использовать технологию, с помощью которой можно облучить все сразу.
Тимоти Зольберг, доктор наук: Исторически сложилось, что планирование облучения выполняется вручную и зависит от знаний и опыта физика, сидящего за компьютером. Все делается вручную, шаг за шагом, пока не получается план. Не самый лучший план, поскольку вы знаете, что могли бы потратить немного больше времени и получить лучший результат. Но этот план клинически приемлем, и нет причин его переделывать, поскольку есть компьютеры, которые оптимизируют его автоматически.
Джеймс Робар, доктор наук: Новые подходы позволяют облучать все метастазы с использованием единого изоцентра. Одним из таких методов является дуговая терапия с объемной модуляцией. Поворачивая гантри линейного ускорителя, можно создавать отверстия очень сложной формы для облучения сразу всех метастазов. В зависимости от ориентации микромноголепесткового коллиматора может быть сложно создать две отдельные апертуры без создания между ними области, которую облучать нежелательно.
Новое программное обеспечение для облучения множественных метастазов
Джеймс Робар, доктор наук: Набирает популярность еще один метод, в котором используется иной подход для выбора групп метастазов в головном мозге и их облучения за один поворот гантри. Допустим, у пациента семь метастазов в головном мозге. Данный алгоритм оценивает эти метастазы и решает, что три из семи можно облучить с использованием одной дуги гантри, а затем для второго поворота гантри алгоритм может выбрать оставшиеся четыре метастаза. Такое решение будет принято, чтобы подвергнуть облучению как можно меньший объем здоровой ткани мозга.
Почему иногда необходимо проводить несколько сеансов радиохирургии?
Дуайт Херон, врач: Все чаще мы сталкиваемся с более сложными во всех отношениях и более крупными опухолями, а также опухолями, которые расположены очень близко к критическим структурам, таким как перекрест зрительных нервов, ствол головного мозга или один из основных черепно-мозговых нервов. Использовать одну фракцию было бы нежелательно, это было бы чревато слишком серьезными побочными эффектами. И сегодня благодаря современным технологиям, переставляемым рамам, визуализационному контролю и возможности регулировать интенсивность пучка радиации мы можем доставлять эффективную дозу облучения, разбивая ее на более мелкие фракции. Это называется «гипофракционирование». Например, для самых маленьких опухолей можно подать 21 или 24 грея. И это доза излучения в одной фракции. Но для опухоли размером три сантиметра мы используем гораздо более низкую дозу — 16 греев. Звучит странно, ведь в большой опухоли больше клеток, которые нужно уничтожить. Тогда почему мы используем более низкую дозу? Дело в том, что, если мы попытаемся подать 24 греев на трехсантиметровую опухоль, побочные эффекты, а именно отек и некроз, то есть омертвение тканей мозга, будут чрезвычайно тяжелыми.
Дэвид Роберж, врач: В промежутках между процедурами здоровая ткань мозга может восстанавливаться. Между процедурами некоторые участки опухоли, которые были более устойчивы к радиации, например потому, что получали недостаточно кислорода, могут получить больше кислорода и стать более чувствительными к облучению.
Дуайт Херон, врач: Всем клеткам в организме нужен кислород, а клеткам опухоли требуется еще больше кислорода, потому что они очень быстро растут. Фактически их рост может опережать кровоснабжение. И когда они опережают кровоснабжение, их называют гипоксическими. В центре опухоли мало кислорода. Именно поэтому эффективнее подавать меньшую дозу радиации, но в нескольких фракциях. От этого опухоль уменьшается, и та часть, которая была гипоксической, получает больше крови. По мере дальнейшего сокращения ее кровоснабжение увеличивается, поэтому облучение становится более эффективным. Становится больше кислорода, а значит, и больше свободных радикалов для уничтожения раковых клеток. В результате эффективность лечения повышается.
Дэвид Роберж, врач: Для некоторых крупных опухолей, возможно, будет эффективнее проводить три или пять процедур вместо одной. К тому же, если есть система, которая позволяет ничего не прикручивать к голове пациента, выбор оптимального варианта облучения опухоли становится шире. Если это три процедуры, мы сделаем три облучения. Если одна процедура, мы сделаем одно облучение. Качество и точность будут одинаковыми.
Почему лучевая терапия всего головного мозга до сих пор применяется?
Эрик Чанг, врач: Практика лучевой терапии всего головного мозга очень прочно укоренилась в сознании многих онкологов-радиологов, и это неизменно уже очень много лет.
Дэвид Эндрюс, врач: Лучевая терапия без фокусирования наносит ущерб окружающей ткани.
Дуайт Херон, врач: Зачем продолжать использовать технологии и метод облучения, которые приводят к развитию серьезных, долгосрочных, необратимых побочных эффектов, таких как потеря памяти и деменция, когда тщательно продуманный клинический подход в радиохирургии в сочетании с внимательным последующим наблюдением позволяет получить идентичные результаты. Мне кажется вопиющим, что страховые компании отказывают в хороших методах лечения. Одной из причин, почему лучевая терапия всего головного мозга так популярна, является то, что даже в центрах с необходимыми специалистами и возможностями для проведения радиохирургии пациенты получают отказ.
Эрик Чанг, врач: Если начать лечение пациента с радиохирургии, это не значит, что дополнительные методы лечения исключаются. Лучевую терапию всего головного мозга можно провести позже, если это будет необходимо. Я считаю, что лучевая терапия всего головного мозга всегда будет занимать определенное место в лечении метастатических заболеваний мозга, но я также думаю, что популярность этого метода будет постепенно сходить на нет из-за пациентов с более сложными случаями метастазирования.
Что я могу сделать как пациент для поддержания наилучшего качества жизни?
Дэвид Роберж, врач: Если назначить пациенту радиохирургическое лечение и не наблюдать его после процедуры, вероятность образования новых метастазов в мозге, к сожалению, составляет примерно 50/50. И если не наблюдать пациентов, то единственными причинами для повторной встречи будут ухудшение их состояния и поступление в реанимацию. Но если приглашать их на прием каждые несколько месяцев и делать МРТ, вы можете обнаружить новые метастазы, пока их размер не превышает нескольких миллиметров. Вы можете удалить их до того, как они станут представлять проблему. Зачастую пациентов даже с прогрессирующим раком и метастазированием в головном мозге можно спасти, если контролировать ситуацию, выявлять метастазы и облучать их, пока они малы.
Дуглас Кондзиолка, врач: Фактически на этом этапе мониторинг рака схож с ведением хронических заболеваний, для которых необходимо периодически сдавать анализы. Как и для поддержания здоровья других органов, ПЭТ-сканирование, периодические КТ-сканирования нужны и для головного мозга.
Орин Блох, врач: Если вы заметили пару сорняков в саду, вы можете пойти и вырвать эти сорняки либо перекопать весь газон. Но могут остаться два или три сорняка, которых вы не заметили. Если они вырастут, вы можете просто вырвать их позже.
Почему иногда необходимо хирургическое лечение?
Орин Блох, врач: Конечно, пациенты хотели бы избежать операции. Перспектива, что вам вскроют черепную коробку и будут копаться в вашем мозге, очень пугает.
Дуглас Кондзиолка, врач: Если опухоль большая и имеет клинические проявления, вызывая невыносимые головные боли, частые судороги или проблемы с равновесием, и ее расположение подходит для хирургического удаления, может быть показано удаление этой опухоли оперативным путем, чтобы уменьшить давление на мозг. Многие пациенты благодарны за такое решение. Когда я объясняю, что это самый быстрый способ улучшить их самочувствие, их это радует. Вот когда мы задумываемся об операции: когда это отвечает нуждам пациента.
Орин Блох, врач: Как только мы удаляем опухоль, отек начинает спадать, поэтому после удаления метастазов в головном мозге пациентам становится лучше уже на следующий день после операции. Мы используем минимально инвазивный способ: делаем небольшие краниотомии непосредственно над местом вмешательства. В современных условиях для этого мы используем технологию, называемую интраоперационной нейронавигацией. С ее помощью мы можем рассчитать кратчайшее расстояние от поверхности черепа до опухоли и сделать наименьшее отверстие из возможных.
Почему иногда нужны и хирургические операции, и радиохирургия?
Орин Блох, врач: При хирургическом вмешательстве невозможно гарантировать 100%-ное удаление опухоли. Порой, даже если мы удалили все, что можно увидеть на МРТ, мы знаем, что остались микроскопические клетки. Данные ясно показывают, что результаты лечения улучшаются, если в области, где была удалена опухоль, провести радиохирургию. Облучение радиацией до хирургической операции — это очень любопытная идея, которая начинает вызывать все больший интерес. Концепция заключается в том, что, если облучить опухоль радиацией до того, как сделать операцию, облучение начнет убивать клетки опухоли. Поэтому когда мы приступаем к операции по удалению опухоли, большая ее часть уже мертва, а клетки, которые попадают в ткани во время операции, уже не смогут распространиться и образовать новые опухоли. Когда облучение радиацией выполняется до операции, гораздо проще очертить контуры опухоли и точно понять, где граница между нею и здоровой тканью мозга.
Как выбрать самое лучшее и самое подходящее отделение терапии?
Тимоти Зольберг, доктор наук: Радиохирургия — это все еще новое направление. Двадцать лет — довольно небольшой срок. Стандарты медицинского обслуживания включают довольно много доступных процедур.
Дэвид Роберж, врач: Радиохирургия весьма быстро развивается. И это палка о двух концах, поскольку радиохирургию, особенно метастазов в мозге, теперь можно пройти в сравнительно небольших клиниках со стандартным оборудованием для лучевой терапии. Но качество лечения в таких условиях может существенно отличаться от качества лечения в крупных учреждениях, в которых есть устройства, предназначенные для радиохирургии. Для пациента и даже для меня сложно с порога определить, насколько такие клиники квалифицированы для радиохирургии.
Тимоти Зольберг, доктор наук: Честно говоря, нет никаких гарантий, что не будет проблем. Novalis Certified — единственная в мире программа, которая предполагает наличие независимой группы специалистов. Они могут прийти, посмотреть на вашу практику и подтвердить, что вы выполняете стереотаксическую радиохирургию на высоком уровне с клинической точки зрения, с технической точки зрения, с точки зрения физики и гарантируете качество всех своих услуг. Это очень важный показатель.
Как будет развиваться лечение метастатического рака головного мозга в будущем?
Элизабет Уилсон, CEO: В вопросах лечения метастатического рака и метастазов в головном мозге в частности мы только в начале пути. Ценность этого фильма заключается в том, что к его созданию привлекается Американская ассоциация онкологии головного мозга. Он служит нашей миссии. Если люди поймут, что у них достаточно времени для осознания своей опухоли, осознания своего диагноза, достаточно времени для того, чтобы изучить возможные варианты лечения, то улучшится и ход лечения, и его результат. Я думаю, это и есть путь реализации миссии нашей организации.
Орин Блох, врач: Если лечение токсично и приведет к снижению когнитивных способностей, пациенты не смогут наслаждаться годами жизни, которые мы подарим им с помощью новых методов лечения. Поэтому в современных условиях при лечении больных раком необходимо учитывать и качество жизни, которую им предстоит прожить.
Вероника Чанг, врач: Мы хотим, чтобы люди продолжали жить, работать и делать все, что для них важно.
Дуайт Херон, врач: Радиохирургия является неотъемлемой частью новейших методик лечения рака.
Бренда Винченц-Смит: Знаете, я больше не думаю о смерти. Правда. Я считаю, это показатель.
Дэвид Эндрюс, врач: Если мы можем продлить жизнь пациента хоть ненадолго, он сможет воспользоваться возможностями лечения, которые станут доступны в будущем. Возможностями, которых не было, например, еще три года назад. Это дает пациентам реальную надежду.
Орин Блох, врач: Технологии достигли уровня, когда мы можем улучшать самочувствие пациентов и зачастую даже излечивать интракраниальные заболевания. Большинство пациентов с раком, у которых нашли метастазы в головном мозге, осознают, что окончательный прогноз зависит от того, что происходит с раком в остальных частях тела. Будущее для этих людей действительно светлое, потому что наши системные методы лечения постоянно совершенствуются, а процент выживания намного выше, чем когда-либо в прошлом. Я считаю, что в будущем рак перестанет считаться смертельной болезнью и станет просто хроническим заболеванием.
Brain Basics: The Life and Death of a Neuron
Запросить бесплатную брошюру
Введение
Архитектура нейрона
Рождение
Миграция
Дифференциация
Смерть
Надежда через исследования
Введение
До недавнего времени большинство нейробиологов считало, что мы родились со всеми нейронами, которые когда-либо могли иметь. В детстве мы могли бы создавать новые нейроны, которые помогают строить проводящие пути, называемые нейронными цепями, которые действуют как информационные магистрали между различными областями мозга.Но ученые полагали, что после создания нейронной цепи добавление любых новых нейронов нарушит поток информации и отключит систему связи мозга.
В 1962 году ученый Джозеф Альтман бросил вызов этому убеждению, когда увидел доказательства нейрогенеза (рождения нейронов) в области мозга взрослой крысы, называемой гиппокампом. Позже он сообщил, что новорожденные нейроны мигрировали из места своего рождения в гиппокампе в другие части мозга. В 1979 году другой ученый, Майкл Каплан, подтвердил открытия Альтмана в мозге крысы, а в 1983 году он обнаружил нервные клетки-предшественники в переднем мозге взрослой обезьяны.
Эти открытия о нейрогенезе во взрослом мозге удивили других исследователей, которые не думали, что они могут быть правдой для людей. Но в начале 1980-х годов ученый, пытающийся понять, как птицы учатся петь, предложил нейробиологам еще раз взглянуть на нейрогенез во взрослом мозге и начать понимать, как это может иметь смысл. В серии экспериментов Фернандо Ноттебом и его исследовательская группа показали, что количество нейронов в переднем мозге самцов канареек резко увеличилось во время брачного сезона.Это было то же время, когда птицам приходилось разучивать новые песни, чтобы привлечь самок.
Почему эти птичьи мозги добавили нейроны в такой критический момент в обучении? Ноттебом полагал, что это произошло потому, что свежие нейроны помогли сохранить новые паттерны песен в нейронных цепях переднего мозга, области мозга, которая контролирует сложное поведение. Эти новые нейроны сделали возможным обучение. Ноттебом считал, что если птицы создают новые нейроны, чтобы помогать им запоминать и учиться, это может сделать и мозг млекопитающих.
Другие ученые полагали, что эти результаты не могут быть применены к млекопитающим, но Элизабет Гулд позже нашла доказательства наличия новорожденных нейронов в отдельной области мозга у обезьян, а Фред Гейдж и Питер Эрикссон показали, что мозг взрослого человека производит новые нейроны в аналогичной области. .
Для некоторых нейробиологов нейрогенез в мозге взрослого человека все еще остается недоказанной теорией. Но другие думают, что данные открывают интригующие возможности относительно роли нейронов, генерируемых взрослыми, в обучении и памяти.
Нейрон Архитектура нейронаЦентральная нервная система (включая головной и спинной мозг) состоит из двух основных типов клеток: нейронов (1) и глии (4) и (6). В некоторых частях мозга глии больше, чем нейронов, но нейроны являются ключевыми игроками в мозге.
Нейроны — посланники информации. Они используют электрические импульсы и химические сигналы для передачи информации между различными областями мозга, а также между мозгом и остальной нервной системой.Все, что мы думаем, чувствуем и делаем, было бы невозможно без работы нейронов и их поддерживающих клеток, глиальных клеток, называемых астроцитами (4) и олигодендроцитами (6).
Нейроны состоят из трех основных частей: тела клетки и двух расширений, называемых аксоном (5) и дендритом (3). Внутри тела клетки находится ядро (2), которое контролирует деятельность клетки и содержит генетический материал клетки. Аксон похож на длинный хвост и передает сообщения от клетки. Дендриты выглядят как ветви дерева и получают сообщения для ячейки.Нейроны общаются друг с другом, посылая химические вещества, называемые нейротрансмиттерами, через крошечное пространство, называемое синапсом, между аксонами и дендритами соседних нейронов.
Архитектура нейрона.Есть три класса нейронов:
- Сенсорные нейроны несут информацию от органов чувств (например, глаз и ушей) в мозг.
- Моторные нейроны контролируют произвольную мышечную активность, такую как речь, и передают сообщения от нервных клеток мозга к мышцам.
- Все остальные нейроны называются интернейронами .
Ученые считают, что нейроны — это самые разнообразные клетки в организме. Внутри этих трех классов нейронов есть сотни различных типов, каждый из которых обладает определенной способностью передавать сообщения.
То, как эти нейроны общаются друг с другом, устанавливая связи, делает каждого из нас уникальным в том, как мы думаем, чувствуем и действуем.
РождениеСтепень образования новых нейронов в головном мозге является спорным вопросом среди нейробиологов.Хотя большинство нейронов уже присутствует в нашем мозгу к моменту нашего рождения, есть доказательства, подтверждающие, что нейрогенез (научное слово, обозначающее рождение нейронов) — это процесс, продолжающийся всю жизнь.
Нейроны рождаются в областях мозга, богатых концентрациями нервных клеток-предшественников (также называемых нервными стволовыми клетками). Эти клетки могут генерировать большую часть, если не все, нейронов и глии, обнаруженных в головном мозге.
Нейробиологи наблюдали, как нервные клетки-предшественники ведут себя в лаборатории.Хотя это может быть не совсем то, как эти клетки ведут себя, когда они находятся в мозгу, это дает нам информацию о том, как они могли бы себя вести, находясь в окружающей среде мозга.
Наука о стволовых клетках все еще очень нова и может измениться с дополнительными открытиями, но исследователи узнали достаточно, чтобы описать, как нервные стволовые клетки генерируют другие клетки мозга. Они называют это происхождением стволовых клеток, и оно в принципе похоже на генеалогическое древо.
Нервные стволовые клетки увеличиваются за счет деления на две части и образования либо двух новых стволовых клеток, либо двух ранних клеток-предшественников, либо по одной каждой из них.
Когда стволовая клетка делится, чтобы произвести другую стволовую клетку, говорят, что она самообновляется. Эта новая клетка может производить больше стволовых клеток.
Говорят, что когда стволовая клетка делится с образованием ранней клетки-предшественника, она дифференцируется. Дифференциация означает, что новая клетка более специализирована по форме и функциям. Ранняя клетка-предшественник не обладает потенциалом стволовой клетки для образования множества различных типов клеток. Он может создавать клетки только своей особой линии.
Ранние клетки-предшественники могут самообновляться или идти двумя путями.Один тип дает начало астроцитам. Другой тип в конечном итоге будет производить нейроны или олигодендроциты.
МиграцияПосле рождения нейрон должен отправиться в то место в мозге, где он будет выполнять свою работу.
Как нейрон узнает, куда идти? Что ему помогает?
Ученые обнаружили, что нейроны используют как минимум два разных способа передвижения:
- Некоторые нейроны мигрируют по длинным клеточным волокнам, называемым радиальной глией.Эти волокна простираются от внутренних слоев к внешним слоям мозга. Нейроны скользят по волокнам, пока не достигнут пункта назначения.
- Нейроны также путешествуют с помощью химических сигналов. Ученые обнаружили на поверхности нейронов особые молекулы — молекулы адгезии — которые связываются с аналогичными молекулами на близлежащих глиальных клетках или нервных аксонах. Эти химические сигналы направляют нейрон к его окончательному местоположению.
Не все нейроны успешно проходят свой путь. Ученые считают, что до места назначения доходит только треть.Некоторые клетки погибают в процессе развития нейронов.
Некоторые нейроны выживают во время трипа, но оказываются там, где их не должно быть. Мутации в генах, контролирующих миграцию, создают области нейронов неправильной формы или неправильной формы, которые могут вызывать такие расстройства, как детская эпилепсия. Некоторые исследователи подозревают, что шизофрения и дислексия, связанная с нарушением обучаемости, частично являются результатом неправильного управления нейронами.
Некоторые нейроны мигрируют, перемещаясь вдоль расширений (радиальной глии), пока не достигнут своего конечного пункта назначения. ДифференциацияКак только нейрон достигает места назначения, он должен начать работать. Этот последний этап дифференцировки — наименее изученная часть нейрогенеза.
Нейроны отвечают за транспортировку и поглощение нейротрансмиттеров — химических веществ, которые передают информацию между клетками мозга.
В зависимости от своего местоположения нейрон может выполнять работу сенсорного нейрона, двигательного нейрона или интернейрона, посылая и получая определенные нейротрансмиттеры.
В развивающемся мозге нейрон зависит от молекулярных сигналов от других клеток, таких как астроциты, для определения его формы и местоположения, типа передатчика, который он производит, и от того, с какими другими нейронами он будет соединяться. Эти только что рожденные клетки устанавливают нейронные цепи — или информационные пути, соединяющие нейрон с нейроном, — которые будут действовать на протяжении всей взрослой жизни.
Но в мозге взрослого человека нейронные цепи уже развиты, и нейроны должны найти способ приспособиться к ним.По мере того, как новый нейрон осваивается, он начинает выглядеть как окружающие клетки. Он развивает аксон и дендриты и начинает общаться со своими соседями.
Стволовые клетки дифференцируются, чтобы производить нервные клетки разных типов. СмертьХотя нейроны — самые длинные живые клетки в организме, большое их количество погибает во время миграции и дифференцировки.
Жизнь некоторых нейронов может меняться ненормально. Некоторые заболевания головного мозга являются результатом неестественной смерти нейронов.
— При болезни Паркинсона нейроны, вырабатывающие нейромедиатор дофамин, отмирают в базальных ганглиях, области мозга, контролирующей движения тела. Это затрудняет начало движения.
— При болезни Гентингтона генетическая мутация вызывает избыточное производство нейротрансмиттера, называемого глутаматом, который убивает нейроны в базальных ганглиях. В результате люди бесконтрольно скручиваются и корчатся.
— При болезни Альцгеймера необычные белки накапливаются в нейронах неокортекса и гиппокампа и вокруг них, частях мозга, которые контролируют память.Когда эти нейроны умирают, люди теряют способность помнить и выполнять повседневные задачи. Физическое повреждение мозга и других частей центральной нервной системы также может убивать или выводить из строя нейроны.
— Удары в мозг или повреждение, вызванное инсультом, могут полностью убить нейроны или медленно лишить их кислорода и питательных веществ, необходимых для выживания.
— Повреждение спинного мозга может нарушить связь между мозгом и мышцами, когда нейроны теряют связь с аксонами, расположенными ниже места повреждения.Эти нейроны могут еще жить, но они теряют способность общаться.
Один из методов гибели клеток — это высвобождение избыточного глутамата. Макрофаги (зеленые) поедают умирающие нейроны, чтобы очистить от мусора. Надежда через исследованияУченые надеются, что, узнав больше о жизни и смерти нейронов, они смогут разработать новые методы лечения и, возможно, даже лекарства от болезней мозга и расстройств, которые влияют на жизни миллионов американцев.
Последние исследования показывают, что нервные стволовые клетки могут генерировать множество, если не все, нейронов различных типов, обнаруженных в головном мозге и нервной системе. Изучение того, как превращать эти стволовые клетки в нейроны в лаборатории в определенные типы нейронов, могло бы произвести свежий запас клеток мозга, чтобы заменить те, которые умерли или были повреждены.
Также могут быть созданы методы лечения, использующие факторы роста и другие сигнальные механизмы внутри мозга, которые говорят клеткам-предшественникам создавать новые нейроны.Это позволило бы восстанавливать, изменять и обновлять мозг изнутри.
Для получения информации о других неврологических расстройствах или исследовательских программах, финансируемых Национальным институтом неврологических расстройств и инсульта, свяжитесь с Институтом мозговых ресурсов и информационной сети (BRAIN) по телефону:
BRAIN
P.O. Box 5801
Bethesda, MD 20824
(800) 352-9424
www.ninds.nih.gov
Верх
Подготовлено:
Офис по связям с общественностью
Национальный институт неврологических расстройств и инсульта
Национальные институты здравоохранения
Bethesda, MD 20892
NINDS, связанные со здоровьем, предоставляются только в информационных целях и не обязательно представляют собой одобрение или официальную позицию Национального института неврологических расстройств и инсульта или любого другого федерального агентства.Консультации по лечению или уходу за отдельным пациентом следует получать после консультации с врачом, который обследовал этого пациента или знаком с историей болезни этого пациента.
Вся информация, подготовленная NINDS, находится в открытом доступе и может свободно копироваться. Благодарность NINDS или NIH приветствуется.
Почему ваш мозг не заживает, как кожа? · Границы для молодых умов
Абстрактные
Кожные раны, такие как царапины и порезы, могут быть болезненными, но обычно они заживают безупречно.В худшем случае у вас может остаться шрам. Напротив, когда мозг травмируется, мы часто остаемся инвалидами, которые остаются с нами на всю оставшуюся жизнь. Что такого особенного в мозге и как он восстанавливается? Клетки мозга сталкиваются с уникальными проблемами, когда они получают травмы, например, в результате сотрясения мозга или инсульта. И чтобы справиться с этими проблемами, у мозга есть гениальная стратегия борьбы с травмами.
Мозг очень уязвим
Ваш головной мозг и спинной мозг вместе образуют то, что мы называем центральной нервной системой.Глядя на скелет, задавались ли вы когда-нибудь вопросом, почему головной и спинной мозг — единственные органы в нашем теле, заключенные в кости? Правда, легкие и сердце тоже хорошо защищены грудной клеткой. Но когда вы смотрите на череп, это, по сути, костяная коробка с несколькими отверстиями, позволяющими нервным окончаниям выходить из мозга. Нервная система уникальна по сравнению со многими другими органами тем, что она не расширяется и не сокращается, как сердце, легкие и кишечник. Поскольку нет серьезных движений, это нормально, если центральная нервная система полностью покрыта костью.Почему центральная нервная система так хорошо защищена? Ответ прост: потому что он сверхчувствительный и очень уязвимый.
Как вы думаете, какой орган вашего тела вы травмируете чаще всего? Наверное, твоя кожа. Вспомните случай, когда вы упали, ваша кожа разорвалась и какое-то время у вас была рана, похожая на царапину или порез. Если эта травма произошла некоторое время назад, скорее всего, вы даже больше не увидите пятна на коже. Или, может быть, вы видите шрам, но в основном ваша кожа могла восстанавливаться почти идеально.К сожалению, головной и спинной мозг принципиально разные. Если ваш мозг получит травму, некоторые повреждения могут сохраняться на протяжении всей оставшейся жизни.
Почему мозг не может восстановить себя так, как ваша кожа?
Нервные клетки не обновляются сами по себе
Клетки вашей кожи продолжают делиться, они умирают и рождают новые клетки постоянно, даже если вы не ранены. После травмы кожа образует множество новых клеток и использует их для лечения вашей раны. Тем не менее, нервные клетки в вашем мозгу, также называемые нейронами , не обновляются.Они вообще не делятся. Из этого правила очень мало исключений — только два особых места в мозге могут дать рождение новым нейронам. Однако по большей части мозг не может восполнить мертвые нейроны. Это особенно беспокоит, потому что нейроны — очень чувствительные клетки и умирают по разным причинам. Когда вы ударяетесь головой и получаете сотрясение мозга , нейроны погибают. Когда происходит сбой в кровоснабжении мозга, также называемый инсультом , нейроны умирают. Нейроны также умирают, когда сталкиваются с изменениями в своих собственных функциях, что происходит при так называемых нейродегенеративных заболеваниях , таких как болезнь Паркинсона и болезнь Альцгеймера.
Вот и хорошие новости. Поскольку потеря нейронов обычно носит постоянный характер, ученые работают над двумя важными стратегиями, чтобы помочь мозгу после травмы. Один из способов — защитить нервную систему сразу после повреждения. Это может быть инсульт, серьезное сотрясение мозга или любой вид травмы. Если мы сможем каким-то образом ограничить количество нейронов, которые умирают рано после травмы, то мы сведем ущерб к минимуму. Чтобы помочь в восстановлении после травмы, после того, как повреждение было нанесено, некоторые ученые пытаются использовать стволовые клетки в качестве лечения потери нейронов в головном мозге. 1 Эти стволовые клетки представляют собой молодые и незрелые клетки, которые еще не превратились в «профессиональные» клетки. Они могут превратиться в новые нейроны, если ученые обработают их специальными молекулами. Это немного похоже на учеников начальной школы, которые еще не являются врачами или водопроводчиками, но при правильном обучении имеют возможность стать любым профессионалом в будущем. Самая большая проблема при замене мертвых нейронов стволовыми клетками состоит в том, чтобы эти новые нейроны правильно интегрировались или вписывались в существующие сети мозга.Новые нейроны не могут просто зависать в мозгу, они нужны нам, чтобы формировать связи с другими клетками и выполнять ту работу, которую выполняют все нейроны: обрабатывать сигналы.
Нервные клетки не могут отрастить поврежденные части
Глядя на структуру нейрона, вы заметите, что у него есть тело клетки и несколько плеч, которые он использует для соединения и общения с другими нейронами (рис. 1, слева). Действительно длинная рука, которая посылает сигналы другим нейронам, называется аксон , а аксоны могут быть очень длинными.Если аксон повреждается на пути к другой клетке, поврежденная часть аксона погибнет (рис. 1, справа), в то время как сам нейрон может выжить с культей вместо руки. Проблема в том, что нейроны центральной нервной системы с трудом отращивают аксоны из культи. Почему у клеток кожи нет этой проблемы? Клетки кожи намного проще по строению. А поскольку они могут рождать совершенно новые клетки, они не сталкиваются с проблемой ремонта частей своих клеток.
- Рисунок 1
- Слева: структура клетки мозга.Обратите внимание на ветвистые руки, которые отходят от тела клетки (верхний левый угол). Эти руки принимают входящие сигналы. Действительно длинная рука, которая простирается в нижний правый угол, называется аксоном, который посылает сигналы принимающей клетке. Аксон окружен миелиновой оболочкой (темно-фиолетовой), которая помогает сигналам быстрее перемещаться по аксону к принимающей клетке. Справа: при повреждении аксона его концевая часть отмирает и оставляет культю аксона. Куни с трудом отрастают после травмы.
Итак, почему у поврежденных нейронов возникают проблемы с отрастанием аксонов?
Во-первых, им нужна мотивация.Есть специальные молекулы, которые помогают активировать рост нейронов. Когда нейроны активны, образуется больше этих мотивирующих молекул. Итак, если ваш мозг будет активным, ваши нейроны с большей вероятностью будут расти. Это верно как после травмы, так и в здоровом мозге.
Во-вторых, аксоны сталкиваются с враждебной средой, которая полна молекулярных «стоп-сигналов», которые сигнализируют аксонам «запрет на проникновение». Некоторые знаки остановки являются частью оболочки или покрытия вокруг соседних аксонов, называемой миелиновой оболочкой (рис. 1, слева).Некоторые знаки остановки являются частью шрама, который образуется как защитная стена вокруг травмы, чтобы предотвратить распространение ущерба. Эти шрамы образованы клетками мозга, называемыми астроцитами (звездчатые клетки из-за их звездообразного вида). Астроциты, образующие рубцы, просто пытаются помочь, но они также выделяют в окружающую среду химическое вещество, которое затрудняет рост аксонов (рис. 2).
- Рисунок 2
- Растущие аксоны (зеленые в правом верхнем и нижнем левом углах), ищущие новые клетки-мишени для соединения, испытывают трудности в условиях травмы.Отчасти это происходит из-за звездообразных опорных клеток (астроцитов, выделенных желтым цветом), которые выделяют химические вещества (красный цвет). Эти химические вещества останавливают рост аксонов.
Но есть и хорошие новости. Ученые работают над стратегиями стимулирования роста поврежденных нейронов с помощью специальных молекул роста и устранения признаков остановки для аксонов, чтобы сделать среду повреждения более благоприятной для роста нервных клеток [1].
Иммунный ответ головного мозга отличается от кожного
Иммунный ответ играет важную роль в любом виде восстановления после травмы.В поврежденной коже иммунные клетки устремятся к месту повреждения из крови и помогут резидентным иммунным клеткам очистить от мусора мертвые клетки. Как только очистка завершена, иммунные клетки умирают и прекращают борьбу. В мозгу также есть специализированные резидентные иммунные клетки, которые активируются, когда чувствуют опасность или повреждение. Распространенная проблема мозга заключается в том, что активированные иммунные клетки часто не знают, когда прекратить борьбу. Если они будут продолжать выделять токсичные химические вещества в течение длительного времени, они могут причинить больше вреда, чем пользы, убивая здоровые нейроны.Вот почему ученые пытаются понять, что включает и выключает иммунные клетки мозга, и пытаются выяснить, как они могут изменить реакцию этих иммунных клеток, чтобы клетки могли быть полезными, а не вредными [2].
Как же тогда мозг восстанавливается?
Узнав об ограничениях нейронов по сравнению с клетками кожи, вы можете быть разочарованы тем, что такой важный орган, как мозг, кажется, не готов к разрушительным событиям. На самом деле у центральной нервной системы есть гениальная стратегия самовосстановления, которая полностью отличается от стратегии, используемой другими органами.Мозг никогда не будет таким, каким был до повреждения, но он постарается компенсировать свои потери. Нейроны мозга могут изменять свои связи друг с другом. Этот процесс называется , пластичность , и он помогает мозгу адаптироваться к потере нейронов. Забудьте на мгновение об умирающих клетках, ответственность за пластичность полностью лежит на выживших клетках. Как это работает?
Поскольку основная задача нейрона — посылать сигнал, нейроны очень хорошо воспринимают «свободную недвижимость» или другие нейроны, с которыми они могут соединяться.Помимо выращивания новых плеч для соединения с новыми клетками, нейроны также могут изменять силу существующих связей с другими нейронами (рис. 3). Они могут либо усилить такие связи, либо ослабить их, что приведет к совершенно новой сети связей в мозгу. Эта пластичность обусловлена и направляется деятельностью, которую мы выполняем. После инсульта или черепно-мозговой травмы пациенты обычно в определенной степени поправляются при помощи какой-либо физиотерапии. Улучшение связано не столько с ростом новых нейронов, как вы узнали выше, сколько потому, что эти пациенты продолжают стимулировать пластичность и, следовательно, строят новые связи между выжившими нейронами в своем мозгу!
- Рисунок 3
- В ответ на травму клетка мозга может адаптироваться за счет роста новых рук (ветвь аксона с зеленым фоном), а также за счет увеличения или уменьшения силы существующих связей (соединение между аксоном и принимающей клеткой с зеленым фоном в правом нижнем углу).
К сожалению, пластичность как ремонтный механизм имеет свои пределы. Пластичность полностью зависит от выживших клеток, поэтому чем больше выживших клеток, тем лучше. Если кто-то получает серьезную черепно-мозговую травму или сильный инсульт, в результате которого погибает значительное количество мозговых клеток, остается меньше выживших нейронов, способных к пластичности, чем после легкого сотрясения мозга. Чем больше ячеек доступно для пластичности, тем больше пластичность может быть. Вот почему тяжелые травмы центральной нервной системы обычно приводят к длительной инвалидности.И потому, что последствия этих тяжелых травм настолько плачевные, ученые прилагают все усилия, чтобы попытаться защитить нейроны от смерти, чтобы заменить утраченные клетки с помощью стволовых клеток, чтобы помочь травмированным нейроны растут, и стимулировать пластичность.
Глоссарий
Спинной мозг : ↑ Часть центральной нервной системы, которая находится в позвоночнике, костная структура вдоль спины. Спинной мозг в основном отвечает за улавливание всех видов ощущений от вашего тела и отправку их в мозг для обработки, а также за отправку команд движения от мозга к вашим рукам и ногам.
Нейроны : ↑ Нервные клетки в головном мозге, которые получают сигналы от других нервных клеток, обрабатывают их, а затем посылают новые сигналы различным нервным клеткам. Эта сеть связанных нейронов является основой всей работы, которую выполняет центральная нервная система, поэтому вы можете думать, двигаться и чувствовать вещи.
Сотрясение мозга : ↑ Сотрясение мозга происходит, когда вы сильно ударяетесь головой и ваш мозг ударяется о череп. Если у вас сильное сотрясение мозга, вы можете видеть звезды перед глазами, вы можете не помнить, какой сегодня день, и вас может подташнивать.
Инсульт : ↑ Инсульт случается, когда нарушается кровоснабжение той или иной области мозга. Нервные клетки в этой области быстро отмирают, если они перестают получать из крови такие важные вещества, как сахар и кислород.
Нейродегенеративные заболевания : ↑ Заболевание, при котором нейроны отмирают (или дегенерируют, что означает, что они умирают), потому что они не могут справиться с проблемами, с которыми сталкиваются. Большинство этих проблем представляют собой сложные химические процессы.
Стволовые клетки : ↑ Незрелые клетки, которые еще не превратились в «профессиональные» клетки кожи, нервные клетки или любые другие клетки вашего тела. Они обладают способностью развиваться в любую клетку вашего тела, и их будущая «профессия» определяется тем, с какими молекулами они сталкиваются по мере созревания. Они могут развиться в любую профессиональную клетку, включая нейроны, когда ученые обрабатывают их определенными молекулами.
Миелиновая оболочка : ↑ Жировая оболочка, которая покрывает аксоны, заставляя сигналы проходить по аксонам как можно быстрее.Например, эти ножны позволяют быстро реагировать, когда вы причиняете себе вред, например, отводите руку от прикосновения к горячей плите.
Astrocytes : ↑ Преобразуется в «звездчатые клетки» из-за звездообразной формы этих клеток. Астроциты — это поддерживающие клетки мозга, которые сильно отличаются от нейронов. Они поддерживают нейроны разными способами, например, удерживая вредные молекулы.
Иммунный ответ : ↑ Реакция вашего организма на травму.Иммунный ответ будет посылать специализированные клетки, некоторые из области повреждения, а некоторые из кровотока, чтобы помочь очистить и восстановить.
Пластичность : ↑ Способность нервных клеток изменять свои связи с другими нервными клетками. Пластичность — это процесс создания нейронов новыми ответвлениями для соединения с другими нейронами или просто ослабления или усиления существующей связи с другой нервной клеткой.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Сноска
[1] ↑ http://www.eurostemcell.org/commentanalysis/stem-cell-therapies-and-neurological-disorders-brain-what-truth
Список литературы
[1] ↑ Сильвер, Дж., Шваб, М. Э. и Попович, П. Г. 2015. Регенеративная недостаточность центральной нервной системы: роль олигодендроцитов, астроцитов и микроглии. Харб Холодного источника. Перспектива. Биол. 7 (3): a020602. DOI: 10.1101 / cshperspect.a020602
[2] ↑ Лоан, Д.Дж. И Кумар А. 2015. Микроглия в головном мозге ЧМТ: хорошие, плохие и нерегулируемые. Exp. Neurol. 275 (Pt 3): 316–27. DOI: 10.1016 / j.expneurol.2015.08.018
Что происходит, когда нервные клетки перестают работать? Полный отказ мозга — ScienceDaily
Инсульт — это лишь один из примеров нарушения связи между нервными клетками. Микро-сбои в работе мозга также возникают при таких состояниях, как депрессия и слабоумие. В большинстве случаев утраченная емкость через некоторое время вернется.Тем не менее, косвенный ущерб часто остается, так что функциональные возможности могут быть восстановлены только путем длительного лечения — если вообще возможно. По этой причине исследователи из Университета Фридриха Александра в Эрлангене-Нюрнберге (FAU) изучают, что происходит во время таких фаз поломки, и ищут возможные способы предотвращения повреждений и ускорения процессов заживления. Их результаты были недавно опубликованы в известном журнале Scientific Reports .
Исследовательская группа, возглавляемая Яной Врош из кафедры психиатрии и психотерапии FAU, обнаружила, что в нервных клетках произошли значительные изменения, в то время как коммуникационные пути были заблокированы.Нейронные сети повторно подключаются в такие периоды бездействия и становятся сверхчувствительными. Если мы представим себе, что нормальные пути коммуникации — это автомагистрали, когда они заблокированы, в мозгу возникает форма дорожного хаоса, когда информация перенаправляется в неорганизованном виде по тому, что можно назвать переулками и второстепенными маршрутами. Повсюду генерируются дополнительные синапсы, и они начинают работать. Когда сигнал восстанавливается, ранее скоординированные информационные маршруты больше не существуют, и, как и в случае с ребенком, соответствующие функции необходимо изучать с нуля.Поскольку они не получают нормальных сигналов во время фазы сбоя мозга, нервные клетки также становятся более чувствительными в попытке найти недостающий входной сигнал. Как только сигналы вернутся, это означает, что они могут остро отреагировать.
Мерцание нервных клеток при окрашивании
Визуализация микроскопически мельчайших связей между нервными клетками — серьезная техническая задача. Доступные в настоящее время традиционные микроскопические методы, такие как электронная микроскопия, всегда требуют предварительной обработки нервных клеток, подлежащих исследованию.Однако это приводит к гибели нервных клеток, так что изменения, происходящие в клетках, не наблюдаются. Чтобы обойти эту проблему, Врош и ее команда разработали процесс высокоскоростной микроскопии вместе со специальным статистическим компьютерным программным обеспечением, которое позволяет визуализировать коммуникационные сети живых нейронов. Сначала делается видео ячеек, при этом изображение снимается каждые 36 миллисекунд. Для окрашивания клеток используется специальный краситель, чтобы гарантировать, что отдельные клетки мерцают всякий раз, когда они получают сигнал.Впоследствии программное обеспечение распознает эти ячейки на видеоизображениях и обнаруживает информационные пути, по которым сигналы передаются от ячейки к ячейке.
Затем нервные клетки подвергаются воздействию тетродотоксина яда иглобрюха, чтобы имитировать блокировку каналов связи, которая возникает при заболеваниях. Вызвав фазы разрыва связи различной продолжительности, исследователи удаляют токсин из клеток и определяют, как сети нервных клеток изменились во время воздействия.«Благодаря этой концепции мы, наконец, смогли обнаружить, что происходит, когда связь блокируется», — объясняет Врош. «Теперь мы можем попытаться разработать лекарства, которые помогут предотвратить эти разрушительные изменения». В будущих проектах исследовательская группа планирует изучить точный механизм действия антидепрессантов на сети нервных клеток и намеревается найти новые подходы к созданию более эффективных лекарств.
История Источник:
Материалы предоставлены Университетом Эрлангена-Нюрнберга . Примечание. Содержимое можно редактировать по стилю и длине.
нейронов могут пережить тела, которые их содержат
Большая часть вашего тела моложе вас. Клеткам верхнего слоя кожи около двух недель, и они скоро умрут. Вашим самым старым эритроцитам около четырех месяцев. Клетки вашей печени будут жить от 10 до 17 месяцев, прежде чем будут заменены. Во всех ваших органах производятся и разрушаются клетки. У них есть срок годности.
В вашем мозгу другая история. Новые нейроны образуются всего в двух частях мозга — гиппокампе, участвующем в памяти и навигации, и обонятельной луковице, участвующей в обонянии (и то только до 18-месячного возраста). Кроме того, ваши нейроны так же стары, как и вы, и прослужат вам всю оставшуюся жизнь. Не делятся, текучести нет.
Но имеют ли нейроны максимальную продолжительность жизни, как клетки кожи, крови или печени? Да, очевидно, они умирают, когда ты умираешь, но что, если ты продолжишь жить? Это не надуманный вопрос в то время, когда медицинские и технологические достижения обещают продлить нашу жизнь далеко за пределы их обычных границ.Достигнем ли мы точки, когда наши нейроны откажутся раньше нашего тела?
Лоренцо Маграсси, нейрохирург из Университета Павии, думает, что нет. Недавно он трансплантировал нейронные клетки из эмбрионов мыши в развивающийся мозг долгоживущих крыс. Эти клетки превратились в нейроны, похожие на нейроны мыши… но с продолжительностью жизни крысы. Они выживали до 36 месяцев, что примерно в два раза дольше, чем обычно в мозге родных мышей.
«Нейроны не имеют фиксированной продолжительности жизни», — говорит Маграсси.«Они могут выжить вечно. Они умирают в теле, в котором они находятся. Если вы поместите их в более долгоживущее тело, они будут жить столько, сколько им позволяет новое тело. Это увеличивает нашу надежду на то, что увеличение продолжительности жизни не обязательно приведет к истощению нейронов в мозге ».
Маграсси работал с генетически модифицированными эмбрионами мышей, все клетки которых производят светящийся зеленый белок, и их можно было легко отследить. Из этих эмбрионов он удалил предшественники клеток мозга и трансплантировал их эмбрионам крысы.В их новых хозяевах зеленое свечение этих чужеродных клеток выдавало их присутствие и присутствие любого из их потомков.
Пересаженные клетки выжили примерно у трети крыс. Они произвели много типов зрелых клеток мозга, в том числе несколько классов нейронов и поддерживающих клеток, называемых глиями. Нейроны соединились со своими крысиными аналогами, оставаясь верными мышиному происхождению с точки зрения размера и формы.
Однако их продолжительность жизни резко возросла. Маграсси сосредоточился на клетках Пуркинье — классе крупных, густых, много ветвящихся нейронов, которые участвуют в управлении движениями.Эти клетки самопроизвольно погибают в процессе старения как у людей, так и у грызунов. Но в то время как их мыши-доноры живут около 18 месяцев, самое большее 26, пересаженные клетки Пуркинье живут столько же, сколько и их новые крысы-хозяева — около 30 месяцев, самое большее 36 месяцев. Их максимальная продолжительность жизни увеличилась на 38 процентов. Их ветви со временем истончались, но они не умирали.
Для перспективы, хотя некоторые исключительные мыши живут очень долго, нет никакого искусственного способа продлить жизнь всей мыши на 38 процентов — кроме хороших диет, медикаментозного лечения или генной инженерии.
Диана Вудрафф-Пак, нейробиолог из Темплского университета, безусловно, впечатлена. «Нейроны Пуркинье являются наиболее уязвимыми из нейронов и одним из немногих типов, которые теряются при нормальном старении», — говорит она. «Продлить жизнь нейронов Пуркинье мыши замечательно».
Но Джудит Кампизи, изучающая старение в Институте Бака в Калифорнии, результаты исследования не удивили. «Идея о том, что организм умирает, когда умирают его клетки, не является основной мыслью в исследованиях старения», — говорит она.«Если вы возьмете нейрон у мыши и поместите его в слона, вы действительно ожидаете, что этот нейрон проживет 2,5 года?» Она думает, что нет. «Большинство людей умирают с неповрежденными нейронами. Если вы доживете до 123 лет, вы умрете с большей частью клеток, с которыми родились ».
Но Маграсси говорит, что идея о том, что увеличение продолжительности жизни приведет к обеднению нейронов мозга, была «распространенным мнением до недавнего времени». И доказательства обратного — например, тот факт, что у очень старых людей все еще есть большинство их нейронов — были косвенными.Его эксперименты дают более прямое подтверждение того, что нейроны не имеют фиксированной продолжительности жизни, установленной их генами. Вместо этого их среда определяет, когда они умирают.
Маграсси не думает, что мозг крысы обеспечивает что-то особенное, чего не хватает мозгу мыши. У обоих грызунов действуют одни и те же белки, но, предположительно, задействованы в разных ритмах. (И Вудрафф-Пак подозревает, что собственная глия крыс поддерживает нейроны Пуркинье мыши и продлевает их жизнь.)
Сейчас команда исследует пересаженные клетки, чтобы понять, почему они живут дольше у крыс. «Если мы узнаем, какой фактор или факторы ответственны, мы можем надеяться использовать их при тех заболеваниях, когда нейроны начинают умирать намного раньше», — говорит Маграсси. «Конечно, впереди еще долгий путь».
Артикул: Magrassi, Leto & Rossi. 2013. Продолжительность жизни нейронов не связана с продолжительностью жизни организма. PNAS http://dx.doi.org/10.1073/pnas.1217505110
Подробнее о круговороте клеток:
Повреждения нервов — Нейрохирургическая клиника Роли
Найдите эффективное лечение травм нервов в нейрохирургической клинике Роли
Нервная система представляет собой сложную совокупность нервных клеток (нейронов), которая действует как электрическая проводка тела, передавая сигналы между всеми частями тела.Он состоит из головного и спинного мозга и органов, передающих информацию (органы чувств), а также всех нейронов тела.
Нервная система подразделяется на две группы:
- Центральная нервная система : включает головной и спинной мозг и действует как центр управления, где обрабатывается информация и принимаются решения.
- Периферическая нервная система : сюда входят все нейроны за пределами центральной нервной системы.Некоторые несут информацию от него (мотонейроны), а другие несут информацию (сенсорные нейроны). Эти нейроны контролируют ощущения, движения и координацию движений.
Что такое травмы нервов?
Нейроны хрупкие и могут быть повреждены при надавливании, растяжении или разрезании. Повреждение нейрона может остановить сигналы, передаваемые в мозг и из него, что приведет к неправильной работе мышц или потере чувствительности в травмированной области. Травмы нервов могут повлиять на головной, спинной и периферические нервы.
Что такое травмы головного мозга?
Травмы головного мозга или повреждение головного мозга могут возникать в результате широкого спектра травм, болезней и других состояний. Они также могут возникать, если мозг испытывает недостаток кислорода в течение длительного периода времени. Травмы головного мозга могут привести к долгосрочным осложнениям в различных типах функционирования, и многим людям, которые их испытывают, требуется помощь при выполнении обычных физических нагрузок. Травмы головного мозга обычно делятся на следующие категории:
- Приобретенные травмы головного мозга (ABI): Любой тип повреждения головного мозга после рождения, включая черепно-мозговые травмы.Причины ЛПИ включают отравление, опухоли, сердечные приступы, инсульт, удушение, удушье, неврологические расстройства, инфекции и злоупотребление наркотиками.
- Черепно-мозговые травмы (ЧМТ): Вызваны внешней силой, например, ударом по голове, который заставляет мозг перемещаться внутри черепа и повреждает мозг. Причины ЧМТ включают автомобильные аварии, спортивные травмы, физическое насилие и падения.
В зависимости от типа и тяжести черепно-мозговой травмы может развиться широкий спектр когнитивных, перцептивных, физических или поведенческих и эмоциональных симптомов.Если заметны какие-либо серьезные изменения в любой из этих областей, это может быть связано с черепно-мозговой травмой и должно быть оценено медицинским работником.
Что такое травмы спинного мозга?
Травма спинного мозга — это любое повреждение или травма любой части самого спинного мозга или нервов внутри него, которые прерывают поток информации от головного мозга к другим частям тела. Это может вызвать необратимые изменения ощущений, силы и других функций.
Чем выше повреждение спинного мозга, тем больше дисфункции.Травма на более высоком уровне пуповины повлияет на руки, ноги, кисти, туловище, ноги и тазовые органы, в то время как травма на более низком уровне затронет только ноги, тазовые органы и туловище. В зависимости от степени тяжести травма спинного мозга классифицируется как полная или неполная. Полная травма означает, что почти все движения и ощущения ниже уровня травмы теряются или прерываются, в то время как неполная травма означает, что некоторые движения остаются. Тяжелые травмы могут привести к параличу всех четырех конечностей (паралич нижних конечностей или тетраплегия) или только нижних конечностей (паралич нижних конечностей).
Несчастные случаи, падения и спортивные травмы могут вызвать прямое повреждение спинномозговых нервов, в то время как другие состояния, такие как стеноз позвоночника, защемление нервов и боли в межпозвоночном диске, также могут вызывать эти проблемы.
Симптомы поражения нервов спинного мозга включают:
- Потеря движения
- Потеря чувствительности
- Потеря контроля над мочевым пузырем или кишечником
- Повышенные рефлексы
- Изменения половой функции
- Ощущение боли или покалывания
- Затрудненное дыхание, кашель или откашливание
Что такое травмы периферических нервов?
Периферические нервы хрупкие и могут быть легко повреждены.Когда они повреждены, это может повлиять на способность мозга взаимодействовать с мышцами и органами и может привести к потере двигательной функции, сенсорной функции или того и другого. Повреждение периферических нервов также может привести к периферической невропатии, что является общим термином для обозначения нарушения работы этих нервов.
Повреждения периферических нервов могут быть результатом таких заболеваний, как диабетические нервные расстройства; может развиться через такие инфекции, как синдром Гийена-Барре; может возникнуть в результате сдавления нерва, например, синдрома запястного канала; или развиться в результате травмы, такой как травма плечевого сплетения.Некоторые люди рождаются с заболеваниями периферических нервов.
Симптомы часто начинаются постепенно, а затем ухудшаются и включают:
- Онемение
- Покалывание или жжение
- Боль
- Слабость мышц
- Чувствительность к прикосновению в руках, ногах, плечах или кистях
Очень важно быстро получить медицинскую помощь при повреждении периферического нерва, поскольку эти нервные ткани обычно поддаются восстановлению.
Как диагностируют травмы нервов?
Если вы испытываете какие-либо из вышеперечисленных симптомов и подозреваете, что у вас может быть повреждение нерва, специалисты нейрохирургической клиники Роли помогут диагностировать ваше состояние и определить правильный курс лечения.
Ваша оценка будет включать полную историю болезни, физический и неврологический осмотр и, в зависимости от ваших симптомов, возможно, рентгенографическое исследование, такое как магнитно-резонансная томография (МРТ), компьютерная томография (CAT) или позитронно-эмиссионная томография (ПЭТ). .
Как лечат травмы нервов?
После того, как ваш диагноз будет поставлен, мы вместе с вами выберем лучший способ лечения вашей травмы или состояния. При определенных проблемах с нервной системой хирургическое лечение может быть самым быстрым решением вашей проблемы.
В нейрохирургической клинике Роли мы предлагаем некоторые хирургические процедуры при повреждении нервов центральной и периферической нервной системы:
- Расцепитель запястного канала
- Декомпрессия локтевого нерва
- Ламинэктомия
Назначить встречу
Наши нейрохирурги нейрохирургической клиники Роли имеют большой опыт лечения нервных травм. Чтобы встретиться с одним из наших специалистов по травмам нервов, запишитесь на прием сегодня.
Что происходит, когда нервные клетки перестают работать?
Резюме: в новом исследовании изучается, что происходит во время микропереработок нейронных коммуникаций, и рассматриваются возможные методы предотвращения долгосрочного ущерба.
Источник: FAU.
Инсульт — это лишь один пример состояния, при котором нарушается связь между нервными клетками. Микро-сбои в работе мозга также возникают при таких состояниях, как депрессия и слабоумие. В большинстве случаев утраченная емкость через некоторое время вернется.Тем не менее, косвенный ущерб часто остается, так что функциональные возможности могут быть восстановлены только путем длительного лечения — если вообще возможно. По этой причине исследователи из Университета Фридриха Александра в Эрлангене-Нюрнберге (FAU) изучают, что происходит во время таких фаз поломки, и ищут возможные способы предотвращения повреждений и ускорения процессов заживления. Их результаты были недавно опубликованы в Scientific Reports.
Исследовательская группа, возглавляемая Яной Врош из кафедры психиатрии и психотерапии FAU, обнаружила, что в нервных клетках произошли значительные изменения, в то время как коммуникационные пути были заблокированы.Нейронные сети повторно подключаются в такие периоды бездействия и становятся сверхчувствительными. Если мы представим себе, что нормальные пути коммуникации — это автомагистрали, когда они заблокированы, в мозгу возникает форма дорожного хаоса, когда информация перенаправляется в неорганизованном виде по тому, что можно назвать переулками и второстепенными маршрутами. Повсюду генерируются дополнительные синапсы, и они начинают работать. Когда сигнал восстанавливается, ранее скоординированные информационные маршруты больше не существуют, и, как и в случае с ребенком, соответствующие функции необходимо изучать с нуля.Поскольку они не получают нормальных сигналов во время фазы сбоя мозга, нервные клетки также становятся более чувствительными в попытке найти недостающий входной сигнал. Как только сигналы вернутся, это означает, что они могут остро отреагировать.
Нервные клетки мерцают при окрашивании
Визуализация микроскопически мельчайших связей между нервными клетками является серьезной технической проблемой. Доступные в настоящее время традиционные микроскопические методы, такие как электронная микроскопия, всегда требуют предварительной обработки нервных клеток, подлежащих исследованию.Однако это приводит к гибели нервных клеток, так что изменения, происходящие в клетках, не наблюдаются. Чтобы обойти эту проблему, Врош и ее команда разработали процесс высокоскоростной микроскопии вместе со специальным статистическим компьютерным программным обеспечением, которое позволяет визуализировать коммуникационные сети живых нейронов. Сначала делается видео ячеек, при этом изображение снимается каждые 36 миллисекунд. Для окрашивания клеток используется специальный краситель, чтобы гарантировать, что отдельные клетки мерцают всякий раз, когда они получают сигнал.Впоследствии программное обеспечение распознает эти ячейки на видеоизображениях и обнаруживает информационные пути, по которым сигналы передаются от ячейки к ячейке.
Визуализация микроскопически мельчайших связей между нервными клетками — серьезная техническая задача. Изображение NeuroscienceNews.com находится в открытом доступе.Затем нервные клетки подвергаются воздействию тетродотоксина яда иглобрюха, чтобы имитировать блокировку каналов связи, которая возникает при заболеваниях. Вызвав фазы разрыва связи различной продолжительности, исследователи удаляют токсин из клеток и определяют, как сети нервных клеток изменились во время воздействия.«Благодаря этой концепции мы, наконец, смогли обнаружить, что происходит, когда связь блокируется», — объясняет Врош. «Теперь мы можем попытаться разработать лекарства, которые помогут предотвратить эти разрушительные изменения». В будущих проектах исследовательская группа планирует изучить точный способ действия антидепрессантов на сети нервных клеток и намеревается найти новые подходы к созданию более эффективных наркотики.
Об этой статье исследования нейробиологии
Источник: FAU
Источник изображения: NeuroscienceNews.com изображение находится в общественном достоянии.
Оригинальное исследование: Исследование с полным открытым доступом для «Перепрограммирования нейронных сетей во время синаптического молчания», проведенное Яной Катариной Врош, Вики фон Эйнем, Катариной Брейнингер, Марком Дальманнсом, Андреасом Майером, Йоханнесом Корнхубером и Тейей Вольфганг Громер в журнале Scientific Reports . Опубликовано в Интернете 15 сентября 2017 г. doi: 10.1038 / s41598-017-11729-5
Цитируйте эту статью NeuroscienceNews.com
[cbtabs] [cbtab title = ”MLA”] FAU «Что происходит, когда нервные клетки перестают работать ?.NeuroscienceNews. NeuroscienceNews, 27 сентября 2017 г.
Abstract
См. также
Перепрограммирование нейронных сетей во время синаптического молчания
Анализ связности нейронных сетей на основе данных функциональной визуализации мозга позволил по-новому взглянуть на схемы мозга, благодаря которым функциональные и эффективные сети становятся предметом интереса для понимания сложных неврологических и психических расстройств. Однако анализ сетевых изменений, основанный на активности отдельных нейронов, затруднен из-за отсутствия подходящих значимых и воспроизводимых методологий.Здесь мы использовали визуализацию кальция, статистический анализ времени всплеска и мощную классификационную модель для реконструкции эффективных сетей первичных нейронов гиппокампа крысы in vitro. Этот метод позволяет рассчитывать параметры сети, такие как вероятность распространения, длина пути и поведение кластеризации, путем измерения синаптической активности на уровне отдельной ячейки, что обеспечивает более полное понимание того, как изменения в отдельных синапсах транслируются на всю популяцию нейроны. Мы демонстрируем, что наша методология может обнаруживать известные эффекты нейрональной неактивности, вызванной лекарствами, и может использоваться для исследования обширных процессов перенастройки, влияющих на паттерны связи в масштабах всей популяции после периодов индуцированной нейрональной неактивности.
«Перестройка нейронных сетей во время синаптического молчания» Яна Катарина Врош, Вики фон Эйнем, Катарина Брейнингер, Марк Дальманнс, Андреас Майер, Йоханнес Корнхубер и Тея Вольфганг Громер в журнале Scientific Reports . Опубликовано в Интернете 15 сентября 2017 г. doi: 10.1038 / s41598-017-11729-5
Не стесняйтесь поделиться этими новостями нейробиологии.
Детские неврологии — клетки нервной системы
Типы нейронов (нервных клеток)
Человеческое тело состоит из триллионов клеток.Клетки нервной система, называемая нервными клетками или нейронами , специализируется на переносить «сообщения» с помощью электрохимического процесса. Человеческий мозг имеет примерно 86 миллиардов нейронов. Чтобы узнать, как нейроны передают сообщения, прочитать о потенциале действия.
Нейроны бывают разных форм и размеров. Одни из самых маленьких нейроны имеют клеточные тела шириной всего 4 микрона. Несколько из самые большие нейроны имеют клеточные тела шириной 100 микрон. (Помните что 1 микрон равен одной тысячной миллиметра!).
Нейроны похожи на другие клетки тела, потому что:
- Нейроны окружены клеточной мембраной.
- Нейроны имеют ядро, содержащее гены.
- Нейроны содержат цитоплазму, митохондрии и другие органеллы.
- Нейроны выполняют основные клеточные процессы, такие как белок синтез и производство энергии.
Однако нейроны отличаются от других клеток тела, потому что:
- Нейроны имеют специализированные части клетки, называемые дендритами и аксонов .Дендриты передают электрические сигналы к тело клетки и аксоны забирают информацию от тела клетки.
- Нейроны общаются друг с другом посредством электрохимического процесс.
- Нейроны содержат некоторые специализированные структуры (например, синапсы) и химические вещества (например, нейромедиаторы).
Нейрон
Один из способов классификации нейронов — это количество расширений, которые простираются от тела клетки нейрона (сомы).
Биполярные нейроны имеют два отростка
выходящие из тела клетки (примеры: клетки сетчатки,
клетки обонятельного эпителия).
Псевдоуниполярные клетки (пример: дорсальные
клетки корневых ганглиев). На самом деле эти клетки имеют 2 аксона, а не
аксон и дендрит. Один аксон проходит по центру к спинному мозгу,
другой аксон простирается к коже или мышце.
Мультиполярные нейроны имеют множество отростков, которые простираются от
тело клетки. Однако каждый нейрон имеет только один аксон (примеры: спинномозговая
мотонейроны, пирамидные нейроны, клетки Пуркинье).
Нейроны также можно классифицировать по направлению, которое они посылают. Информация.
- Сенсорные (или афферентные) нейроны: отправить информация от сенсорных рецепторов (например, кожи, глаз, носа, языка, уши) НАПРАВЛЕНИЕ центральной нервной системы.
- Двигательные (или эфферентные) нейроны: отправить информацию прочь от центральной нервной системы к мышцам или железы.
- Интернейроны: отправляют информацию между сенсорными нейроны и мотонейроны. Большинство интернейронов расположено в центральной нервная система.
Загляните в Галерею нейронов, чтобы увидеть картинки реальных нейронов или «Тротуар» Клетки »для просмотра фотографий нейронов на ул.
Есть несколько различий между аксонами и дендриты:
| Аксоны | Дендриты |
|
|
Что внутри нейрона? В нейроне много того же органелл , таких как митохондрии, цитоплазма и ядро, как и другие клетки тела.
- Ядро — содержит генетический материал (хромосомы), включая информацию для развития клеток и синтеза белки, необходимые для поддержания и выживания клеток. Покрыт мембрана.
- Nucleolus — производит необходимые рибосомы для трансляции генетической информации в белки
- Nissl Bodies — используемые группы рибосом для синтеза белка.
- Эндоплазматический ретикулум (ЭР) — система трубы для транспортировки материалов внутри цитоплазмы.Может иметь рибосомы (грубая ER) или без рибосом (гладкий ER). В случае рибосом ER важен для синтез белка.
- Аппарат Гольджи — мембраносвязанный структура важна для упаковки пептидов и белков (включая нейротрансмиттеры) в пузырьки.
- Микрофиламенты / нейротрубочки — система транспорт материалов внутри нейрона и может использоваться для структурных поддерживать.
- Митохондрии — производят энергию для подпитки клеточной деятельности.
Знаете ли вы? | Нейроны — самые старые и длинные клетки в организме! У вас есть много одних и тех же нейронов на всю жизнь. Хотя другие клетки умирают и заменены, многие нейроны никогда не заменяются, когда они умирают. На самом деле ты в старом возрасте у вас меньше нейронов, чем в молодом. На с другой стороны, данные, опубликованные в ноябре 1998 г., показывают, что в одном область мозга (гиппокамп), новые нейроны МОЖЕТ расти у взрослых людей. Нейроны могут быть довольно большими — в некоторых нейронах, например, в кортикоспинальном нейроны (от моторной коры до спинного мозга) или первичные афферентные нейроны (нейроны, которые простираются от кожи до спинного мозга и до ствол мозга), может достигать нескольких футов в длину! С Днем Рождения аппарата Гольджи, 121 st ! В 1898 году знаменитый нейроанатом Камилло Гольджи сообщил о своем открытии ленточного аппарат внутри нейронов мозжечка. Эта структура теперь носит его называют как «Аппарат Гольджи».» |
Авторские права © 1996-2019, Эрик Х. Чадлер. Все права Зарезервированный.
.
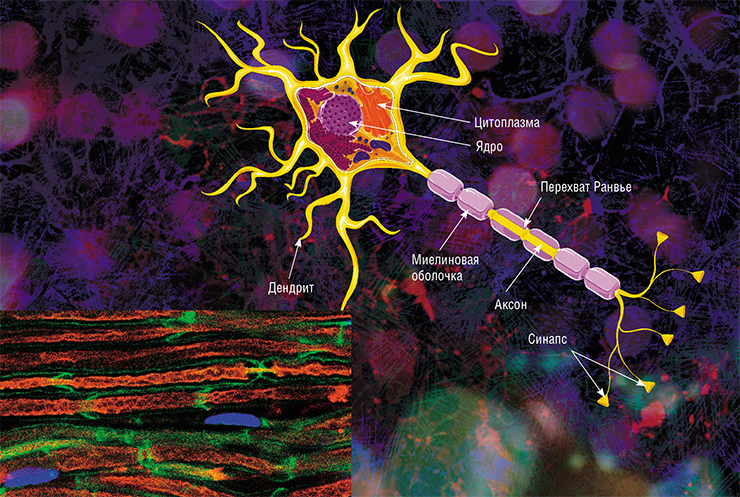 Нейроны генерируют нервные
импульсы, передавая их соседним нервным клеткам. Средний
диаметр тела нейрона составляет около 0,01 мм, а общее
количество нейронов в головном мозге достигает 100
миллиардов. Если тела всех нейронов головного мозга
выстроить в одну линию, то её длина составит 1000
километров.
Нейроны генерируют нервные
импульсы, передавая их соседним нервным клеткам. Средний
диаметр тела нейрона составляет около 0,01 мм, а общее
количество нейронов в головном мозге достигает 100
миллиардов. Если тела всех нейронов головного мозга
выстроить в одну линию, то её длина составит 1000
километров.