Сопроводительная и симптоматическая терапия: Антиэметическая терапия
Рекомендации ESMO по профилактике тошноты и рвоты, обусловленной проведением химиотерапии
Антихолинергические средства
Антигистаминные средства
Психотропные средства: нейролептики и транквилизаторы
Производные бутирофенона
Замещенные бензамины
Производные бензодиазепина
Глюкокортикоиды
Каннабиноиды
5НТ-3 антагонисты
Список литературы
Лечение тошноты и рвоты при химиотерапии
Насущная проблема химиотерапии злокачественных опухолей – предотвращение тошноты и рвоты. В качестве обоснования, в большинстве своем, опираются на существенное ухудшение качества жизни. И верно, любой из нас хоть раз в жизни испытал продолжительную тошноту – это крайне мучительно. Первый эпизод рвоты в такой ситуации воспринимался как благо, потому как после нее на некоторое время тошнота отступала.
Гиповолемия как последствие рвоты не только ухудшает сердечную деятельность, но может стать причиной смерти. Известно, что частота венозных тромбозов у онкологических больных достигает 40-50% [31]. Цитостатики повреждают эндотелий, создавая предпосылки для образования тромбов [35]. Сочетание химиотерапии с тамоксифеном существенно усугубляет риск тромботических осложнений [36]. На таком весьма неблагоприятном фоне изменение реологических свойств крови в результате вводно-электролитных нарушений, вызываемых рвотой в совокупности с вынужденной малоподвижностью из-за слабости, может привести к клинической манифестации тромбоза: ТЭЛА, инфаркту миокарда, острой сердечной недостаточности или фатальной аритмии.
К сожалению, не существует статистики случаев смерти, «пусковым механизмом» которых стала рвота. Хотя каждый врач может вспомнить случай из своей практики. Но причиной тошноты и рвоты у онкологических больных бывает не только специфическое лечение, лекарственное или лучевое, в терминальной стадии довольно часто эметогенная реакция сопутствует интоксикации. И рвота возникает не только при наполнении желудка, но и при колебаниях психоэмоционального состояния, когда больного, например, не устраивает недостаточно быстрое реагирование окружающих на его просьбы или воспоминание о пище [34].
Синтез 5НТ-3 блокаторов принес облегчение не только пациентам, но и врачам. Постепенно из-за более низкой по сравнению с 5НТ-3 блокаторами эффективностью другие противорвотные «получили отставку», и со временем схемы антиэметической терапии были утрачены. Тем не менее, контроль острой рвоты с помощью антисеротониновых препаратов осуществляется у 78-86% больных, тошноты – у 44-58% [21,23,25].
Существует, пусть небольшое, число пациентов, резистентных к анти- серотониновым препаратам; они страдают, и их жизнь подвержена реальной опасности. Больной в терминальной стадии в домашних условиях из-за особенностей организации российской медицинской помощи не имеет возможности получать полноценную парентеральную противорвотную терапию.
Полный антиэметогенный эффект, как критерий оценки, предполагает отсутствие рвоты в течение 24 часов после последнего введения противорвотного, и возможна слабая тошнота [29]. Если эпизод рвоты возник через 25 или 26 часов, формально данный случай будет считаться весьма успешным по степени контроля, но существование больного в этом отрезке времени успешным назвать нельзя. Частичный эффект – один эпизод рвоты за 24 часа или тошнота различной степени. Но один эпизод рвоты может оставить неизгладимые впечатления на всю оставшуюся жизнь, сформировав устойчивую психогенную предварительную рвоту. Поэтому онкологу необходимо использовать весь спектр существующих и неоправданно забытых противорвотных средств.
Если эпизод рвоты возник через 25 или 26 часов, формально данный случай будет считаться весьма успешным по степени контроля, но существование больного в этом отрезке времени успешным назвать нельзя. Частичный эффект – один эпизод рвоты за 24 часа или тошнота различной степени. Но один эпизод рвоты может оставить неизгладимые впечатления на всю оставшуюся жизнь, сформировав устойчивую психогенную предварительную рвоту. Поэтому онкологу необходимо использовать весь спектр существующих и неоправданно забытых противорвотных средств.
За акт рвоты отвечают два функционально различных центра продолговатого мозга: рвотный центр в дорсальной части ретикулярной формации и хеморецепторная триггерная зона в самом заднем поле ромбовидной ямки на дне четвертого желудочка [43]. Главная роль принадлежит рвотному центру, который обеспечивает координированную активность скелетных мышц и гладкомышечных органов во время рвоты. Рвотный центр получает информацию от ЖКТ, верхних отделов ствола мозга и корковых центров, вестибулярного аппарата и хеморецепторных триггерных зон.
Существует, по меньшей мере, два механизма рвоты и тошноты: центральный и периферический. Метаболиты цитостатиков, выделяясь с желчью, раздражают энтерохроматофинные клетки кишечника [1]. Продуцируемый клетками серотонин возбуждает соответствующие рецепторы блуждающего нерва. Импульс идет в триггерную зону area postrema продолговатого мозга и далее в рвотный центр. Это периферический механизм. Центральный – когда выделенный энтерохроматофинными клетками кишечника и переносимый кровью серотонин непосредственно раздражает триггерную зону IV желудочка, и далее сигналы передаются в рвотный центр.
Новое – хорошо забытое старое; практика показала, что без реализации этого принципа невозможно квалифицированно и успешно лечить тошноту и рвоту у онкологических больных. Таблица 1 представляет классификацию современных лекарственных препаратов, оказывающих антиэметогенное действие.
Таблица 1. Классификация противорвотных средств.
| Фармакологическая группа | Механизм действия | Препараты и максимальные суточные дозы |
|---|---|---|
| Антихолинергические | Блокада М-холинергических рецепторов | Атропин 3 мг Платифиллин 30 мг |
| Антигистаминные | Блокада Н-1 рецепторов гистамина | Димедрол 150 мг Пипольфен (дипразин) 500 мг |
| Нейролептики: | ||
1. производные фенотиазина производные фенотиазина | Блокада М-холинергических, Н-1 рецепторов гистамина и дофамина | Аминазин 250 мг Пропазин 2 мг |
| 2. производные бутирофенона | Блокада дофаминовых рецепторов | Галоперидол 100 мг Дроперидол 20 мг |
| 3. замещенные бензамины | Антагонисты дофаминовых рецепторов | Метаклопрамид 0,5 мг/кг Домперидон (мотилиум) 60 мг Диметпрамид 100 мг |
| Кортикостероиды | Подавление энкефалинов и простагландинов | Дексаметазон 15 мг (р.о.) 80 мг (в/в, в/м) |
| Производные бензодиазепина | Снижение возбудимости коры головного мозга посредством связывания с БД-1,2 рецепторами | Лоразепам 20 мг Сибазон 60 мг |
| Антисеротониновые | Блокада 5НТ-3 рецепторов | Трописетрон 10 мг Ондансетрон 32 мг Гранисетрон 9 мг |
| Каннабиоиды | Угнетение триггерных зон продолговатого мозга | Набилон ТНС Дронабинол |
Мещерякова Н. Г.
Г.
Цитостатическая противоопухолевая терапия
Призвана воздействовать на те клетки в организме, которые делятся наиболее быстро. Прежде всего это относится к опухолевым клеткам. Химиопрепараты могут назначаться по одному (монотерапия) или в комбинации (полихимиотерапия).
Наиболее часто противоопухолевые цитостатики назначаются внутривенно или внутрь, однако в ряде случаев может потребоваться введение лекарств в спинномозговой канал, либо в плевральную или брюшную полости. Иногда эффективность внутривенного введения повышает длительность введения химиопрепарата (до 48 и даже 96 часов).
Как проводится химиотерапия
Практически всегда химиотерапия проводится курсами (циклами), предполагая перерыв для восстановления нормальных тканей и функций организма (помимо опухолевых клеток, в процессе лечения могут повреждаться другие активно делящиеся клетки – в первую очередь клетки крови, волосяных фолликулов, клетки слизистых оболочек.
В последние годы успехи молекулярной биологии позволили для лечения ряда злокачественных новообразований создать препараты так называемой таргетной, или направленной терапии, с конкретной мишенью приложения, отличающей опухолевую клетку от нормальной.
Препараты таргетной терапии
В большинстве случаев препараты таргетной терапии сочетаются с обычными цитостатиками, повышая эффективность лечения, но иногда используются самостоятельно. Наиболее часто мишенью служат рецепторы на поверхности клеток опухоли или питающих ее сосудов (так действуют моноклональные антитела и ингибиторы тирозин-киназ), но мишенью могут быть и последующие этамы передачи пролиферативного сигнала).
Значительное число опухолевых заболеваний лечится не только химиопрепаратами, но и гормонами. Как правило, гормональные препараты принимаются внутрь и лечение осуществляется длительно. Иногда гормональное лечение требует хирургических вмешательств с целью исключить влияние тех или иных гормонов, вырабатывающихся в организме (удаление яичников или яичек).
Реже для лечения злокачественных новообразований используется иммунотерапия (как правило, цитокины интерферон альфа или интерлейкин-2). Обычно эти препараты используются в случаях, когда ограничены возможности химио- и гормонотерапии.
Бисфосфонаты
В арсенале онкологов существует также группа препаратов, избирательно действующих на костную ткань – бисфосфонаты. Предохраняя кость от разрушения опухолью, эти лекарства уменьшают боль и снижают частоту осложнений (прежде всего патологических переломов).
Кроме того, в арсенале онкологов существует целый ряд препаратов поддерживающей терапии для предотвращения либо лечения осложнений, связанных с химиотерапией. Как правило, такое лечение не носит «универсального» характера и присоединяется к противоопухолевой терапии по мере развития осложнений.
Исключение представляет, главным образом, противорвотная (антиэметическая) терапия, назначаемая перед химиотерапией, исходя из данных о возможности тошноты и рвоты при каждой конкретной схеме лечения.
По мере исчерпания возможностей противоопухолевого лечения (а на поздних стадиях болезни это обычно химиотерапия) возрастает значение паллиативной помощи и симптоматического лекарственного лечения как ее компонента.
В настоящее время медицина располагает большим количеством препаратов, позволяющих эффективно бороться с наиболее мучительными симптомами опухолевой болезни, включая болевой.
Антиэметическая терапия раннего токсикоза у беременных с врожденными пороками сердца
Mayhall EA, Gray R, Lopes V, Matteson KA 2015. Comparison of antiemetics for nausea and vomiting of pregnancy in an emergency department setting. Am J Emerg Med. 33: 882—886. http://dx.doi.org/10.1016/j.ajem.2015.03.032; PMid:25921968
Danielsson B, Wikner BN, Kallen B, Danielsson B. 2014. Use of ondansetron during pregnancy and congenital malformations in the infant. Reprod Toxicol. 50: 134—137. http://dx.doi.org/10.1016/j.reprotox.2014.10.017; PMid:25450422
Ebrahimi N, Maltepe C, Einarson A. 2010. Optimal management of nausea and vomiting of pregnancy. Int J Womens Health. 2: 241—248. http://dx.doi.org/10.2147/IJWH.S6794; PMid:21151729 PMCid:PMC2990891
Lee NM, Saha S. 2011. Nausea and vomiting of pregnancy. Gastroenterol Clin North Am. 40: 309—334. http://dx.doi.org/10.1016/j.gtc.2011.03.009; PMid:21601782 PMCid:PMC3676933
2011. Nausea and vomiting of pregnancy. Gastroenterol Clin North Am. 40: 309—334. http://dx.doi.org/10.1016/j.gtc.2011.03.009; PMid:21601782 PMCid:PMC3676933
Mitchell AA, Gilboa SM, Werler MM et al. 2011. National Birth Defects Prevention Study. Medication use during pregnancy, with particular focus on prescription drugs: 1976—2008. Am J Obstet Gynecol. 205: 51.e1—8. http://dx.doi.org/10.1016/j.ajog.2011.02.029; PMid:21514558 PMCid:PMC3793635
Anderka M, Mitchell AA, Louik C et al. 2012. National Birth Defects Prevention Study. Medications used to treat nausea and vomiting of pregnancy and risk of selected birth defects. Birth Defects Res A Clin Mol Teratol. 94: 22—30. http://dx.doi.org/10.1002/bdra.22865; PMid:22102545 PMCid:PMC3299087
Nausea and vomiting of pregnancy: Educational Series on Women’s Health. American Professors in Gynecology and Obstetrics. 2015.
Pasternak B, Svanstrom H, Hviid A. 2013. Ondansetron in pregnancy and risk of adverse fetal outcomes. N Engl J Med. 368: 814—823. http://dx.doi.org/10.1056/NEJMoa1211035; PMid:23445092
2013. Ondansetron in pregnancy and risk of adverse fetal outcomes. N Engl J Med. 368: 814—823. http://dx.doi.org/10.1056/NEJMoa1211035; PMid:23445092
Practice Bulletin: nausea and vomiting of pregnancy. American College of Obstetricians and Gynecologist. Obstet Gynecol. 2004. 103: 803—814. http://dx.doi.org/10.1097/00006250-200404000-00045; PMid:15051578
Einarson A, Maltepe C, Navioz Y et al. 2004. The safety of ondansetron for nausea and vomiting of pregnancy: A prospective comparative study. BJOG. 111: 940—943. http://dx.doi.org/10.1111/j.1471-0528.2004.00236.x; PMid:15327608
Анестезиологическое обеспечение циторедуктивных операций с применением гипертермической внутрибрюшинной химиотерапии у больных раком яичника | Мориков
1. Аксель Е. М., Виноградова Н. Н. Статистика злокачественных новообразований женских репродуктивных органов // Онкогинекология. ‒ 2018. ‒ № 3. ‒ С. 64‒78.
‒ 2018. ‒ № 3. ‒ С. 64‒78.
2. Смешной И. А., Пасечник И. Н., Скобелев Е. И. и др. Оптимизация инфузионной терапии в плановой абдоминальной хирургии // Общая реаниматология. ‒ 2018. ‒ Т. 14, № 5. ‒ С. 4‒15.
3. Химиоперфузионное лечение злокачественных опухолей. Руководство для врачей / под ред. Беляева А. М., Леонтьева О. В., Рогачева М. В. ‒ СПб.: СпецЛит, 2018. ‒ 286 с.
4. Хороненко В. Э., Шеметова М. М., Дрожжина О. В. и др. Анестезиологическое обеспечение и интенсивная терапия при проведении гипертермической интраоперационной внутрибрюшной химиотерапии у больных раком желудка. Обзор литературы и собственный клинический опыт // Анестезиология и реаниматология. ‒ 2015. ‒ Т. 60, № 1. ‒ С. 50‒54.
5. Шелехов А. В., Дворниченко В. В., Радостев С. И. и др. Опыт применения технологии циторедуктивной хирургии с методом интраоперационной интраперитонеальной гипертермической химиотерапии в лечении больных распространенным раком яичников // Сибирский онкологический журнал. ‒ 2018. ‒ Т. 17, № 3. ‒ С. 58‒63.
Шелехов А. В., Дворниченко В. В., Радостев С. И. и др. Опыт применения технологии циторедуктивной хирургии с методом интраоперационной интраперитонеальной гипертермической химиотерапии в лечении больных распространенным раком яичников // Сибирский онкологический журнал. ‒ 2018. ‒ Т. 17, № 3. ‒ С. 58‒63.
6. Bakrin N., Classe J. M., Pomel C. et al. Hyperthermic intraperitoneal chemotherapy (HIPEC) in ovarian cancer // J. Visc. Surg. ‒ 2014. ‒ Vol. 151, № 5. ‒ P. 347‒353.
7. Cata J. P., Zavala A. M., Van Meter A. et al. Identification of risk factors associated with postoperative acute kidney injury after cytoreductive surgery with hyperthermic intraperitoneal chemotherapy: a retrospective study // Intern. J. Hyperthermia. ‒ 2018. ‒ Vol. 34, № 5. ‒ P. 538‒544.
8. Colantonio L., Claroni C., Fabrizi L. et al. A randomized trial of goal direct vs standart fluid therapy in cytoreductive surgery with hiperthermic intraperitoneal chemotherapy // J. Gastrointest. Surg. ‒ 2015. ‒ № 19. ‒ P. 722.
Colantonio L., Claroni C., Fabrizi L. et al. A randomized trial of goal direct vs standart fluid therapy in cytoreductive surgery with hiperthermic intraperitoneal chemotherapy // J. Gastrointest. Surg. ‒ 2015. ‒ № 19. ‒ P. 722.
9. De Brito Poveda V., Clark A. M., Galvão C. M. A systematic review on the effectiveness of prewarming to prevent perioperative hypothermia // J. Clin. Nurs. ‒ 2013. ‒ Vol. 22, № 7‒8. ‒ P. 906‒918.
10. Esteve-Perez N., Ferrer-Robles A., Gomez-Romero G. et al. Goal-directed therapy in cytoreductive surgery with hyperthermic intraperitoneal chemotherapy: a prospective observational study // Clin. Transl. Oncol. ‒ 2018. ‒ https://doi.org/10/1007/s12094-018-1944- (First Online: 14 September 2018).
11. Iavazzo C., Spiliotis J. Hyperthermic intraperitoneal chemotherapy (HIPEC) for ovarian cancer: a «useless intraoperative fever» or the next hot voice in the surgical management of the «silent killer»? // Arch. Gynecol. Obstet. ‒ 2018. ‒ Vol. 298, № 4. ‒ P. 673‒674.
Gynecol. Obstet. ‒ 2018. ‒ Vol. 298, № 4. ‒ P. 673‒674.
12. I-Lin E. S., Shulyn C. C., Hwei Ching G. T. et al. Acute kidney injury in ovarian cancer patients undergoing cytoreductive surgery and hyperthermic intra-peritoneal chemotherapy // Intern. J. Hyperthermia. ‒ 2017. ‒ Vol. 33, № 6. ‒ P. 690‒695.
13. Morales-Soriano R., Esteve-Perez N., Segura-Sampedro J. J. et al. Spanish Group of Peritoneal Malignancy Surface (GECOP). Current practice in cytoreductive surgery and HIPEG for metastatic peritoneal disease: Spanish multicentric survey // Eur. J. Surg. Oncology. ‒ 2018. ‒ Vol. 44, Issue 2. ‒ P. 228‒236.
14. Raspe C., Fletcher L., Schneider R. et al. Best practice for perioperative management of patients with cytoreductive surgery and HIPEG // Eur. J. Surg. Oncology. ‒ 2017. ‒ Vol. 43, Issue 6. ‒ P. 1013‒1027. https://doi.org/10.1016/j.ejso.2016.19.008
J. Surg. Oncology. ‒ 2017. ‒ Vol. 43, Issue 6. ‒ P. 1013‒1027. https://doi.org/10.1016/j.ejso.2016.19.008
15. Sugarbaker P. H. Evolution of cytoreductive surgery and perioperative intraperitoneal chemotherapy for peritoneal carcinomatosis: are there treatment alternatives? // Am. J. Surg. ‒ 2011. ‒ Vol. 201. ‒ P. 157–159.
Образовательная конференция «Поддерживающая терапия в онкологии»
Дата завершения: 6 декабря 2013г.
Информация:
Место проведения: Уфа, конференц-зал Республиканского клинического онкологического диспансера(Республика Башкортостан, г. Уфа, пр. Октября, д. 73/1)Начало в 10.00.
Уфа, пр. Октября, д. 73/1)Начало в 10.00.
Организаторы: ГБУЗ Республиканский клинический онкологический диспансер, Общество онкологов-химиотерапевтов.
Председатели: д.м.н. Сакаева Д.Д. (Уфа), проф. Манзюк Л.В. (Москва), проф. Ларионова В.Б. (Москва)
ПРОГРАММА
| 10:00-10:15 | Открытие |
| 10:00-10:0510:05-10:1010:10-10:15 | д.м.н. Сакаева Д.Д. (Уфа)проф. Манзюк Л.В.проф. Ларионова В.Б. |
| 10:15-10:55 | I сессия: Анемии в онкологии |
| 10:15-10:40 | Анемии в онкологии. Рекомендации RUSSCO-ROHSд.м.н. Сакаева Д.Д. (Уфа) |
| 10:40-10:55 | Вопросы и ответы. Разбор клинических случаевд.м.н. Сакаева Д.Д. (Уфа) |
| 10:55-11:05 | Перерыв |
| 11:05-11:45 | II сессия: Гепатотоксичность в онкологии. Возможности лечения Возможности лечения |
| 11:05-11:30 | Возможности патогенетической терапии лекарственных поражений печени в онкологии. Рекомендации RUSSCOпроф. Ларионова В.Б. (Москва) |
| 11:30-11:45 | Вопросы и ответы. Разбор клинических случаевпроф. Ларионова В.Б. (Москва) |
| 11:45-11:55 | Перерыв |
| 11:55-12:35 | III сессия: Метастазы в кости скелета. Профилактика костных осложнений |
| 11:55-12:20 | Ингибитор RANK-лиганда и бисфосфонаты в онкологии. Рекомендации RUSSCOпроф. Манзюк Л.В. (Москва) |
| 12:20-12:35 | Вопросы и ответы. Разбор клинических случаевпроф. Манзюк Л.В. (Москва) |
| 12:35-12:45 | Перерыв |
| 12:45-13:45 | IV сессия: Антиэметическая терапия на фоне лекарственной и лучевой терапии, рекомендации RUSSCO. Рекомендации RUSSCO по профилактике фебрильной нейтропении |
| 12:45-13:10 | Современные возможности антиэметической терапии на фоне лекарственной и лучевой терапии. Рекомендации RUSSCOк.м.н. Кононенко И.Б. (Москва) Рекомендации RUSSCOк.м.н. Кононенко И.Б. (Москва) |
| 13:10-13:35 | Практические рекомендации по назначению Г-КСФ с целью профилактики развития фебрильной нейтропениик.м.н. Снеговой А.В. (Москва) |
| 13:35-13:45 | Вопросы и ответы |
| 13:45-14:45 | Перерыв. Обед |
| 14:45-15:25 | V сессия: Нутритивная поддержка в онкологии |
| 14:45-15:10 | Синдром анорексии-кахексии в онкологии. Рекомендации RUSSCO по нутритивной поддержкек.м.н. Снеговой А.В. (Москва) |
| 15:10-15:25 | Вопросы и ответы. Разбор клинических случаевк.м.н. Снеговой А.В. (Москва) |
| 15:25-16:00 | VI сессия: Осложнения таргетной терапии. Профилактика кожной токсичности |
| 15:25-15:50 | Токсичность на фоне таргетной терапии. Рекомендации RUSSCOд.м.н. Сакаева Д.Д.(Уфа) |
| 15:50-16:00 | Вопросы и ответы |
| 16:00 | Закрытие семинара |
Регистрация
Предварительная регистрация не требуется. Регистрация осуществляется на месте.
Регистрация осуществляется на месте.
Источник: http://www.rosoncoweb.ru/
Применение препарата Ингарон в онкологии
ИФН-гамма играет ключевую роль в противоопухолевом иммунитете и защите организма от патогенных микроорганизмов и вирусов. ИФН-гамма повышает экспрессию антигенов главного комплекса гистосовместимости I и II класса на поверхности опухолевых клеток, наличие которых на опухолевых клетках необходимо для развития специфического противоопухолевого иммунного ответа. ИФН-гамма оказывает прямое антипролиферативное действие на опухолевые клетки, индуцируя их гибель.
Противоопухолевое действие ИФН-гамма связано также с его способностью активировать клетки иммунной системы,убивающие опухолевые и поврежденные вирусами лимфоциты, естественные киллеры (ЕК-клетки), цитотоксические Т-лимфоцитаты и макрофаги. Он также обладает выраженными антиангиогенными свойствами, препятствуя развитию сосудов в опухоли и таким образом также способствуя ее разрушению.
Проведенные клинические исследования показали, что Ингарон® оказывает иммуномодулирующее действие у больных меланомой, раком шейки матки и раком молочной железы: нормализует количество Т-лимфоцитов (СD3+ клеток) в периферической крови, в том числе, активированных лимфоцитов (CD38+, CD71+, CD25+ и HLA-DR+ клеток). Препарат приводит к нормализации как повышенного, так и пониженного количества ЕК-клеток (CD16+), одновременно повышая их цитотоксический противоопухолевый потенциал.
Схема лечения больных диссеминированной меланомой
I-я неделя лечения: Ингарон® в дозе 500 тыс. ME внутримышечно или подкожно ежедневно в течение 5 дней, а при наличии внутрикожных метастазов дополнительно внутриопухолевое введение препарата Ингарон® в дозе 250 тыс. ME ежедневно в течение 5 дней.
II-я неделя лечения: химиотерапия + стандартная антиэметическая терапия.
III- IV — V недели: Ингарон® в дозе 500 тыс. ME внутримышечно или подкожно через день. Перерыв между курсами составляет 5 недель. Начало следующего курса — с ежедневного введения препарата Ингарон® системно и в опухоль.
Начало следующего курса — с ежедневного введения препарата Ингарон® системно и в опухоль.
Рекомендации: При тромбоцитопении менее 80*10³/мкл введение препарата Ингарон® прекратить до повышения числа тромбоцитов не менее 100*10³/мкл.
Схема лечения больных местно-распространенным или диссеминированным раком молочной железы
1-я неделя лечения: Ингарон® в дозе 500 тыс. MEвнутримышечно или подкожно ежедневно в течение 5 дней, а при наличии внутрикожных метастазов или первичной опухоли дополнительно внутриопухолевое введение препарата Ингарон® в дозе 250 тыс. MEежедневно в течение 5 дней.
И-я неделя лечения: химиотерапия + стандартная антиэметическая терапия.
Ill- IV недели лечения: Ингарон® в дозе 500 тыс. MEвнутримышечно или подкожно через день.
Перерыв между курсами составляет 3 недели. Начало следующего курса — с ежедневного введения препарата Ингарон® системно и в опухоль.
Рекомендации: При местно-распространенном процессе после двух или трех курсов необходима консультация хирурга для определения возможности оперативного лечения. В послеоперационном периоде — проведение адъювантной химиотерапии и эндокринотерапии.
В послеоперационном периоде — проведение адъювантной химиотерапии и эндокринотерапии.
Схема лечения больных плоскоклеточным раком шейки матки.
1-я неделя лечения: Ингарон® в дозе 500 000 ME внутримышечно или подкожно через день (3 инъекции), дополнительно внутриопухолевое введение препарата Ингарон® в дозе 250 000 ME ежедневно в течение 5 дней.
II-я неделя лечения: химиотерапия + стандартная антиэметическая терапия.
Провести 3 курса, перерыв между курсами составляет 3 недели. Через 3 недели после последнего курса химио-иммунотерапии выполняется операция.
Рекомендации: Продолжение лечения будет планироваться в зависимости от лечебного эффекта по результатам послеоперационного гистологического исследования. При невозможности выполнения хирургического этапа лечения после трех курсов химио-иммунотерапии, продолжить химио-иммунотерапию в том же режиме до б курсов. Если опухоль признается резектабельной, выполняется хирургический этап лечения. При невозможности выполнения хирургического этапа лечения после б курсов вследствие недостаточного эффекта, проводится химиолучевое лечение.
При невозможности выполнения хирургического этапа лечения после б курсов вследствие недостаточного эффекта, проводится химиолучевое лечение.
Схема лечения больных местно-распространенным и метастатическим раком почки.
После хирургического удаления основного процесса Ингарон® в дозе 500 000 ME внутримышечно или подкожно через день (10 инъекций), потом перерыв 10 — 12 дней, далее курс повторяется в том же режиме. Всего 3 курса иммунотерапии.
Рекомендации: Динамический контроль переносимости и гематологической токсичности препарата.
Toxicity of trabectedin-based combinations in the treatment of different malignant tumors | Cherkasova
Antitumor activity of trabectedin as a monotherapy in different solid tumors (soft tissue sarcoma, ovarian cancer, breast cancer, melanoma) contributed to research trabectedin-based drug combinations. Phase I trials were searching for optimal dose and schedule of administration trabectedin and trabectedin-based combinations. This review considers aspects of clinical applications and toxic profile of trabectedin alone and combinations, including a rare adverse event – rhabdomyolysis and data of own experience.
This review considers aspects of clinical applications and toxic profile of trabectedin alone and combinations, including a rare adverse event – rhabdomyolysis and data of own experience.
Одним из перспективных достижений лекарственного лечения злокачественных опухолей последних лет стало открытие трабектедина. Трабектедин (Йонделис, ET-743, эктеинасцидин) представляет собой алкалоид природного (морского) происхождения, впервые выделенный из Карибского оболочечника (Ecteinascidia turbinate) и в настоящее время получаемый путем химического синтеза. Препарат обладает сложным механизмом действия, направленным на подавление транскрипции генов и взаимодействие с системой репарации нуклеотидов, связанных с транскрипцией, что приводит к нарушению клеточного цикла. Молекула трабектедина связывается с малой бороздкой ДНК и алкилирует Гуанин в N2-положении, в то время как большинство алкилирующих агентов связывают Гуанин в положении N7 или O6 большой бороздки. Это изгибает ДНК в направлении большой бороздки, нарушая связывание с ней разных белков репарации [1]. Этот механизм объясняет противоопухолевое действие препарата. Трабектедин активно метаболизируется в печени. При клинически значимых концентрациях происходит окисление, осуществляемое в основном через изоформу CYP3А4 системы цитохрома Р-450, но нельзя исключить и вклад других ферментов в его метаболизм (уридин-дифосфоглюкуронозил-трансферазы и глутатион-S-трансферазы). При нарушении функции печени клиренс трабектедина может снижаться с соответствующим повышением концентрации препарата в плазме крови. Напротив, нарушение функции почек существенно не влияет на фармакокинетику и метаболизм препарата. Трабектедин показал выраженную противоопухолевую активность как in vitro, так и in vivo при различных солидных опухолях, включая саркомы мягких тканей (СМТ), рак яичника (РЯ), рак молочной железы (РМЖ) и меланому [2, 3]. В Российской Федерации трабектедин одобрен к применению в терапии распространенных СМТ, резистентных к ифосфамиду и доксорубицину, либо при непереносимости данных препаратов, а также в комбинации с пегилированным липосомальным доксорубицином (ПЛД) в терапии РЯ, рецидивирующего после платиносодержащих режимов.
Это изгибает ДНК в направлении большой бороздки, нарушая связывание с ней разных белков репарации [1]. Этот механизм объясняет противоопухолевое действие препарата. Трабектедин активно метаболизируется в печени. При клинически значимых концентрациях происходит окисление, осуществляемое в основном через изоформу CYP3А4 системы цитохрома Р-450, но нельзя исключить и вклад других ферментов в его метаболизм (уридин-дифосфоглюкуронозил-трансферазы и глутатион-S-трансферазы). При нарушении функции печени клиренс трабектедина может снижаться с соответствующим повышением концентрации препарата в плазме крови. Напротив, нарушение функции почек существенно не влияет на фармакокинетику и метаболизм препарата. Трабектедин показал выраженную противоопухолевую активность как in vitro, так и in vivo при различных солидных опухолях, включая саркомы мягких тканей (СМТ), рак яичника (РЯ), рак молочной железы (РМЖ) и меланому [2, 3]. В Российской Федерации трабектедин одобрен к применению в терапии распространенных СМТ, резистентных к ифосфамиду и доксорубицину, либо при непереносимости данных препаратов, а также в комбинации с пегилированным липосомальным доксорубицином (ПЛД) в терапии РЯ, рецидивирующего после платиносодержащих режимов. В настоящей статье будут рассмотрены аспекты клинического применения и токсичности трабектедина и его комбинаций в терапии различных злокачественных новообразований (ЗНО). Анализ 19 клинических исследований II фазы, проведенных с февраля 1999 по апрель 2008 г. с включением 1132 пациентов, показал сравнительные данные разных дозовых режимов препарата и, соответственно, разный профиль токсичности. Исследования были проведены в Северной Америке, Израиле, Австралии и странах Европы [4]. Остановимся подробно на исследованиях, посвященных изучению трабектедина в контексте рецидивов эпителиального РЯ. В исследовании I фазы при сравнении времени инфузии препарата было показано, что 60-минутная инфузия трабектедина ассоциировалась с выраженной гепатотоксичностью, а также тошнотой, рвотой и астенией. Пролонгирование инфузии до 24 ч вызывало меньшую печеночную и гастроинтестинальную токсичность, но с большей миелосупрессией. Оптимальным являлся 3-часовой режим введения препарата, обладающий приемлемым профилем токсичности [5].
В настоящей статье будут рассмотрены аспекты клинического применения и токсичности трабектедина и его комбинаций в терапии различных злокачественных новообразований (ЗНО). Анализ 19 клинических исследований II фазы, проведенных с февраля 1999 по апрель 2008 г. с включением 1132 пациентов, показал сравнительные данные разных дозовых режимов препарата и, соответственно, разный профиль токсичности. Исследования были проведены в Северной Америке, Израиле, Австралии и странах Европы [4]. Остановимся подробно на исследованиях, посвященных изучению трабектедина в контексте рецидивов эпителиального РЯ. В исследовании I фазы при сравнении времени инфузии препарата было показано, что 60-минутная инфузия трабектедина ассоциировалась с выраженной гепатотоксичностью, а также тошнотой, рвотой и астенией. Пролонгирование инфузии до 24 ч вызывало меньшую печеночную и гастроинтестинальную токсичность, но с большей миелосупрессией. Оптимальным являлся 3-часовой режим введения препарата, обладающий приемлемым профилем токсичности [5]. S.McMeekin и соавт. провели сравнительный анализ 3 исследований II фазы, включающих 294 пациента и демонстрирующих различные режимы введения препарата. Трабектедин в дозе 1,3 мг/м2 (А) вводился в течение 3 ч, в дозе 1,5 мг/м2 – в течение 24-часовой инфузии (В) 21-дневного цикла и в дозе 0,58 мг/м2 – в виде еженедельных инфузий (С) в 1, 8 и 15-й дни 28-дневного цикла. Наиболее частыми побочными явлениями всех степеней в группе А были астения и рвота: 38 и 16% случаев соответственно. Среди гематологической токсичности 3–4-й степени отмечались нейтропения у 21% и повышение аланинаминотрансферазы (АЛТ) у 32% больных. В группе В астения и рвота составили 35 и 27% соответственно; нейтропения – 28% и повышение АЛТ – 26%. В группе С преобладала астения у 63% больных, рвота – у 21%, повышение АЛТ; нейтропения 3–4-й степени отмечалась только у 3 и 1% больных соответственно [6]. В исследование C.Sessa и соавт. были включены 59 пациенток – 29 пациенток с платиночувствительными и 30 с платинорезистентными рецидивами РЯ (из них 7 – платинорефрактерные).
S.McMeekin и соавт. провели сравнительный анализ 3 исследований II фазы, включающих 294 пациента и демонстрирующих различные режимы введения препарата. Трабектедин в дозе 1,3 мг/м2 (А) вводился в течение 3 ч, в дозе 1,5 мг/м2 – в течение 24-часовой инфузии (В) 21-дневного цикла и в дозе 0,58 мг/м2 – в виде еженедельных инфузий (С) в 1, 8 и 15-й дни 28-дневного цикла. Наиболее частыми побочными явлениями всех степеней в группе А были астения и рвота: 38 и 16% случаев соответственно. Среди гематологической токсичности 3–4-й степени отмечались нейтропения у 21% и повышение аланинаминотрансферазы (АЛТ) у 32% больных. В группе В астения и рвота составили 35 и 27% соответственно; нейтропения – 28% и повышение АЛТ – 26%. В группе С преобладала астения у 63% больных, рвота – у 21%, повышение АЛТ; нейтропения 3–4-й степени отмечалась только у 3 и 1% больных соответственно [6]. В исследование C.Sessa и соавт. были включены 59 пациенток – 29 пациенток с платиночувствительными и 30 с платинорезистентными рецидивами РЯ (из них 7 – платинорефрактерные). Исходно доза трабектедина составляла 1,65 мг/м2 с дальнейшей последовательной редукцией до 1,5 и 13 мг/м2. Токсичность являлась дозозависимой. Наиболее частые нежелательные явления (НЯ) при использовании стартовой дозы препарата были представлены повышением трансаминаз и астенией 3–4-й степени у 83% больных, повышением билирубина 1–2-й степени у 50% больных. При дозе трабектедина 1,5 мг/м2 повышение трансаминаз и астения 3–4-й степени зарегистрированы в 42%, повышение билирубина 1–2-й степени – в 4% случаев. При минимальной дозе трабектедина 1,3 мг/м2 выявлена следующая токсичность 3–4-й степени: повышение трансаминаз у 17% больных, астения – у 7%; повышение билирубина 1–2-й степени у 12% больных. Другими НЯ были тошнота/рвота более 2-й степени, несмотря на адекватную антиэметическую терапию, у 50% больных при использовании дозы трабектедина 1,65 мг/м2; 58 и 15% при применении препарата в дозе 1,5 и 1,3 мг/м2 соответственно. Глубокая нейтропения 3–4-й степени отмечалась у 67% пациентов, получавших трабектедин в дозе 1,65 мг/м2 (в 1% случаев фебрильная нейтропения), у 33% – при дозе 1,5 мг/м2 и у 12% больных – при дозе 1,3 мг/м2.
Исходно доза трабектедина составляла 1,65 мг/м2 с дальнейшей последовательной редукцией до 1,5 и 13 мг/м2. Токсичность являлась дозозависимой. Наиболее частые нежелательные явления (НЯ) при использовании стартовой дозы препарата были представлены повышением трансаминаз и астенией 3–4-й степени у 83% больных, повышением билирубина 1–2-й степени у 50% больных. При дозе трабектедина 1,5 мг/м2 повышение трансаминаз и астения 3–4-й степени зарегистрированы в 42%, повышение билирубина 1–2-й степени – в 4% случаев. При минимальной дозе трабектедина 1,3 мг/м2 выявлена следующая токсичность 3–4-й степени: повышение трансаминаз у 17% больных, астения – у 7%; повышение билирубина 1–2-й степени у 12% больных. Другими НЯ были тошнота/рвота более 2-й степени, несмотря на адекватную антиэметическую терапию, у 50% больных при использовании дозы трабектедина 1,65 мг/м2; 58 и 15% при применении препарата в дозе 1,5 и 1,3 мг/м2 соответственно. Глубокая нейтропения 3–4-й степени отмечалась у 67% пациентов, получавших трабектедин в дозе 1,65 мг/м2 (в 1% случаев фебрильная нейтропения), у 33% – при дозе 1,5 мг/м2 и у 12% больных – при дозе 1,3 мг/м2. Медиана длительности нейтропении 4-й степени составила 3 дня. Глубокая тромбоцитопения наблюдалась у 3 пациентов, и в одном случае имел место септический тромбоз в сочетании с нейтропенией 4-й степени [7]. В исследовании C.Кrasner и соавт., включающем 147 пациентов, инфузия трабектедина производилась в дозе 0,58 мг/м2 в течение 3 ч. Среди побочных эффектов 3–4-й степени отмечались повышение трансаминаз у 15% больных, нейтропения – у 8%, астения и тошнота/рвота – у 5%, тромбоцитопения – у 3% больных [8]. J. Del Campo и соавт. изучали трабектедин в двух режимах: в дозе 1,5 мг/м2 (24-часовая инфузия) и в дозе 1,3 мг/м2 в виде 3-часовой инфузии. В исследование были включены 107 пациентов с равноценным распределением по группам. Наиболее выраженными побочными эффектами 3–4-й степени в первом «рукаве» исследования являлись транзиторное повышение трансаминаз и нейтропения (по 55% случаев), тошнота/рвота – в 24%, астения – в 15% случаев по сравнению со вторым «рукавом», в котором повышение трансаминаз составило 59%, нейтропения – 37%, тошнота/рвота – 15% и астения – 10% случаев (табл.
Медиана длительности нейтропении 4-й степени составила 3 дня. Глубокая тромбоцитопения наблюдалась у 3 пациентов, и в одном случае имел место септический тромбоз в сочетании с нейтропенией 4-й степени [7]. В исследовании C.Кrasner и соавт., включающем 147 пациентов, инфузия трабектедина производилась в дозе 0,58 мг/м2 в течение 3 ч. Среди побочных эффектов 3–4-й степени отмечались повышение трансаминаз у 15% больных, нейтропения – у 8%, астения и тошнота/рвота – у 5%, тромбоцитопения – у 3% больных [8]. J. Del Campo и соавт. изучали трабектедин в двух режимах: в дозе 1,5 мг/м2 (24-часовая инфузия) и в дозе 1,3 мг/м2 в виде 3-часовой инфузии. В исследование были включены 107 пациентов с равноценным распределением по группам. Наиболее выраженными побочными эффектами 3–4-й степени в первом «рукаве» исследования являлись транзиторное повышение трансаминаз и нейтропения (по 55% случаев), тошнота/рвота – в 24%, астения – в 15% случаев по сравнению со вторым «рукавом», в котором повышение трансаминаз составило 59%, нейтропения – 37%, тошнота/рвота – 15% и астения – 10% случаев (табл. 1) [9]. Токсичность трабектедина являлась дозозависимой; относительно благоприятный профиль зафиксирован при дозе 0,58 мг/м2, вводимой еженедельно; токсичность возрастала соответственно увеличению доза препарата. Следует отметить, что во всех исследованиях не наблюдалось алопеции – не самой грозной, но наиболее психологически тяжело переносимой больными побочной реакции. Явления нейропатии также не характерны для трабектедина. В подавляющем большинстве случаев трабектедин вводился через центральный венозный катетер с целью профилактики возможных местных реакций. По данным C.Sessa, локальные реакции при инфузии препарата посредством периферического венозного доступа (болезненная эритема по ходу вен с исходом в склеротический флебит) имели место в 19% случаев [7]. В литературе опубликованы исследования преимущественно I фазы, изучающие комбинации трабектедина с различными цитостатиками в терапии распространенных ЗНО. Имеются доклинические данные о синергизме действия трабектедина и цисплатина, основанные на механизме действия обоих препаратов, направленных на нарушение процессов репарации ДНК [10].
1) [9]. Токсичность трабектедина являлась дозозависимой; относительно благоприятный профиль зафиксирован при дозе 0,58 мг/м2, вводимой еженедельно; токсичность возрастала соответственно увеличению доза препарата. Следует отметить, что во всех исследованиях не наблюдалось алопеции – не самой грозной, но наиболее психологически тяжело переносимой больными побочной реакции. Явления нейропатии также не характерны для трабектедина. В подавляющем большинстве случаев трабектедин вводился через центральный венозный катетер с целью профилактики возможных местных реакций. По данным C.Sessa, локальные реакции при инфузии препарата посредством периферического венозного доступа (болезненная эритема по ходу вен с исходом в склеротический флебит) имели место в 19% случаев [7]. В литературе опубликованы исследования преимущественно I фазы, изучающие комбинации трабектедина с различными цитостатиками в терапии распространенных ЗНО. Имеются доклинические данные о синергизме действия трабектедина и цисплатина, основанные на механизме действия обоих препаратов, направленных на нарушение процессов репарации ДНК [10]. В исследование C.Sessa данная комбинация изучалась на группе больных, ранее получавших лечение по поводу РЯ и немелкоклеточного рака легкого. Цисплатин (40 мг/м2) и трабектедин в начальной дозе 0,1 мг/м2 вводились в 1 и 8-й дни 21-дневного цикла с эскалацией дозы трабектедина до 0,6 мг/м2 [10]. Дозолимитирующей токсичностью являлась стойкая нейтропения, сохранявшаяся у некоторых больных в пределах 3-й степени до 35-го дня. В другом поисковом исследовании C.Sessa 4 больных получали цисплатин в стандартной дозе 75 мг/м2 в сочетании с трабектедином в дозе 0,75 мг/м2 в 1-й день 21-дневного цикла. Однако выраженная токсичность (у 2 из 4 пациентов – нейтропения 4-й степени более 7 дней и неукротимая рвота 3–4-й степени) диктовала необходимость редукции дозы трабектедина до 0,6 мг/м2. Но и в редуцированной дозе наиболее частыми НЯ оставались астения, тошнота/рвота, повышение трансаминаз, а также нейтропения и тромбоцитопения 3–4-й степени [11]. В небольшом исследовании I фазы, выполненном с включением 44 больных с рецидивами РЯ и СМТ, изучалась комбинация трабектедина 0,5–1,2 мг/м2 с карбоплатином АUС-4-5 [12].
В исследование C.Sessa данная комбинация изучалась на группе больных, ранее получавших лечение по поводу РЯ и немелкоклеточного рака легкого. Цисплатин (40 мг/м2) и трабектедин в начальной дозе 0,1 мг/м2 вводились в 1 и 8-й дни 21-дневного цикла с эскалацией дозы трабектедина до 0,6 мг/м2 [10]. Дозолимитирующей токсичностью являлась стойкая нейтропения, сохранявшаяся у некоторых больных в пределах 3-й степени до 35-го дня. В другом поисковом исследовании C.Sessa 4 больных получали цисплатин в стандартной дозе 75 мг/м2 в сочетании с трабектедином в дозе 0,75 мг/м2 в 1-й день 21-дневного цикла. Однако выраженная токсичность (у 2 из 4 пациентов – нейтропения 4-й степени более 7 дней и неукротимая рвота 3–4-й степени) диктовала необходимость редукции дозы трабектедина до 0,6 мг/м2. Но и в редуцированной дозе наиболее частыми НЯ оставались астения, тошнота/рвота, повышение трансаминаз, а также нейтропения и тромбоцитопения 3–4-й степени [11]. В небольшом исследовании I фазы, выполненном с включением 44 больных с рецидивами РЯ и СМТ, изучалась комбинация трабектедина 0,5–1,2 мг/м2 с карбоплатином АUС-4-5 [12]. Кумулятивная гематологическая токсичность была представлена у всех пациентов и имела дозолимитирующий характер. Развитие глубокой анемии в ряде случаев требовало гемотрансфузий. Толерантная доза для трабектедина составила 0,8 мг/м2 и карбоплатина АИС-4. Однако, несмотря на то что в данной группе дозолимитирующий токсичности отмечено не было, в 28,6% случаев имела место отсрочка проведения очередного цикла лечения, в связи с чем рекомендован 4-недельный интервал введения. Также, учитывая доклинические данные о синергизме трабектедина с капецитабином, в исследовании L.Gore и соавт. изучалась данная комбинация у 30 больных с различными ЗНО. Режим обладал адекватной переносимостью, и рекомендованные дозы составили 0,9 мг/м2 для трабектедина и 1600 мг/м2 для капецитабина. Наиболее частыми НЯ 3–4-й степени явились диарея в 23% случаев, нейтропения – в 20%, тошнота и ладонно-подошвенный синдром – в 16,6% и рвота – в 13% случаев [13]. В исследовании W.Messersmith была представлена комбинация трабектедина в начальной дозе 0,3 мг/м2 (с планируемой эскалацией последовательно до 0,4, 0,475, 0,535 и 0,58 мг/м2) и гемцитабина в начальной дозе 800 мг/м2 (с планируемой эскалацией до 1000 мг/м2).
Кумулятивная гематологическая токсичность была представлена у всех пациентов и имела дозолимитирующий характер. Развитие глубокой анемии в ряде случаев требовало гемотрансфузий. Толерантная доза для трабектедина составила 0,8 мг/м2 и карбоплатина АИС-4. Однако, несмотря на то что в данной группе дозолимитирующий токсичности отмечено не было, в 28,6% случаев имела место отсрочка проведения очередного цикла лечения, в связи с чем рекомендован 4-недельный интервал введения. Также, учитывая доклинические данные о синергизме трабектедина с капецитабином, в исследовании L.Gore и соавт. изучалась данная комбинация у 30 больных с различными ЗНО. Режим обладал адекватной переносимостью, и рекомендованные дозы составили 0,9 мг/м2 для трабектедина и 1600 мг/м2 для капецитабина. Наиболее частыми НЯ 3–4-й степени явились диарея в 23% случаев, нейтропения – в 20%, тошнота и ладонно-подошвенный синдром – в 16,6% и рвота – в 13% случаев [13]. В исследовании W.Messersmith была представлена комбинация трабектедина в начальной дозе 0,3 мг/м2 (с планируемой эскалацией последовательно до 0,4, 0,475, 0,535 и 0,58 мг/м2) и гемцитабина в начальной дозе 800 мг/м2 (с планируемой эскалацией до 1000 мг/м2). Оба препарата вводились в 1, 8 и 15-й дни 21-дневного цикла. Исследование, включающее 15 пациентов с различными ЗНО, было прекращено досрочно в связи с гепатотоксичностью (повышение трансаминаз 3–4-й степени у 33% больных). Рекомендованные дозы препаратов для дальнейшего изучения составили: трабектедин 0,4 мг/м2 и гемцитабин 1000 мг/м2 [14]. В исследовании S.Sessa изучалась комбинация трабектедина и доксорубицина у 38 больных РМЖ и СМТ. Максимально переносимые дозы составили 60 мг/м2 для доксорубицина и 0,6–0,8 мг/м2 для трабектедина (с рекомендуемой дозой 0,7 мг/м2). Дозолимитирующая токсичность была представлена фебрильной нейтропенией и астенией, также отмечались повышение трансаминаз, тошнота/рвота и стоматит [15]. B.Monk и соавт. изучали комбинацию трабектедина (1,1 мг/м2) и доцетаксела (60 мг/м2) с профилактическим введением гранулоцитарного колониестимулирующего фактора (Г-КСФ) у 71 пациентки с рецидивирующим РЯ. Основные побочные явления 3–4-й степени отмечались в виде нейтропении у 28,2% больных, гастроинтестинальной токсичности (тошнота, рвота, анорексия, повышение трансаминаз) – у 14%, а также болевого синдрома – у 8,4% больных [16].
Оба препарата вводились в 1, 8 и 15-й дни 21-дневного цикла. Исследование, включающее 15 пациентов с различными ЗНО, было прекращено досрочно в связи с гепатотоксичностью (повышение трансаминаз 3–4-й степени у 33% больных). Рекомендованные дозы препаратов для дальнейшего изучения составили: трабектедин 0,4 мг/м2 и гемцитабин 1000 мг/м2 [14]. В исследовании S.Sessa изучалась комбинация трабектедина и доксорубицина у 38 больных РМЖ и СМТ. Максимально переносимые дозы составили 60 мг/м2 для доксорубицина и 0,6–0,8 мг/м2 для трабектедина (с рекомендуемой дозой 0,7 мг/м2). Дозолимитирующая токсичность была представлена фебрильной нейтропенией и астенией, также отмечались повышение трансаминаз, тошнота/рвота и стоматит [15]. B.Monk и соавт. изучали комбинацию трабектедина (1,1 мг/м2) и доцетаксела (60 мг/м2) с профилактическим введением гранулоцитарного колониестимулирующего фактора (Г-КСФ) у 71 пациентки с рецидивирующим РЯ. Основные побочные явления 3–4-й степени отмечались в виде нейтропении у 28,2% больных, гастроинтестинальной токсичности (тошнота, рвота, анорексия, повышение трансаминаз) – у 14%, а также болевого синдрома – у 8,4% больных [16]. В другом исследовании, посвященном изучению комбинации трабектедина и таксанов, проведенном K.Papadopoulos и соавт., паклитаксел вводился с эскалацией дозы от 80 до 120 мг/м2 путем 1-часовой инфузии в 1-й день 14-дневного цикла и трабектедин в дозе 0,525–0,775 мг/м2 в виде 3-часовой инфузии во 2-й день 14-дневного цикла у 29 больных. Дозозависимой токсичностью явилась нейтропения, в связи с чем рекомендованные дозы препаратов составили 120 мг/м2 и 0,65 мг/м2 соответственно. Наиболее частые побочные явления включали в себя тошноту/рвоту в 51 и 24% случаев соответственно, нейтропению – в 24% случаев, повышение трансаминаз – в 23%, миалгию – в 24% и алопецию – в 20% случаев [17]. Вероятно, наиболее изученным комбинированным режимом химиотерапии (ХТ) с включением трабектедина по праву может считаться комбинация последнего с ПЛД. Широко известное международное многоцентровое рандомизированное исследование III фазы OVA-301, включающее 672 больных с рецидивами эпителиального РЯ, доказало преимущество комбинации трабектедина в дозе 1,1 мг/м2 и ПЛД в дозе 30 мг/м2 по сравнению с ПЛД 50 мг/м2 в монорежиме [18–20].
В другом исследовании, посвященном изучению комбинации трабектедина и таксанов, проведенном K.Papadopoulos и соавт., паклитаксел вводился с эскалацией дозы от 80 до 120 мг/м2 путем 1-часовой инфузии в 1-й день 14-дневного цикла и трабектедин в дозе 0,525–0,775 мг/м2 в виде 3-часовой инфузии во 2-й день 14-дневного цикла у 29 больных. Дозозависимой токсичностью явилась нейтропения, в связи с чем рекомендованные дозы препаратов составили 120 мг/м2 и 0,65 мг/м2 соответственно. Наиболее частые побочные явления включали в себя тошноту/рвоту в 51 и 24% случаев соответственно, нейтропению – в 24% случаев, повышение трансаминаз – в 23%, миалгию – в 24% и алопецию – в 20% случаев [17]. Вероятно, наиболее изученным комбинированным режимом химиотерапии (ХТ) с включением трабектедина по праву может считаться комбинация последнего с ПЛД. Широко известное международное многоцентровое рандомизированное исследование III фазы OVA-301, включающее 672 больных с рецидивами эпителиального РЯ, доказало преимущество комбинации трабектедина в дозе 1,1 мг/м2 и ПЛД в дозе 30 мг/м2 по сравнению с ПЛД 50 мг/м2 в монорежиме [18–20]. Спектр токсичности комбинированного режима отличался большей миелосупрессией, эметогенностью и гепатотоксичностью при меньшем проценте случаев мукозитов и ладонно-подошвенного синдрома. Так, в экспериментальной группе НЯ 3–4-й степени являлись нейтропения у 62,7% пациентов (фебрильная нейтропения – у 6,9%), повышение трансаминаз – у 38,1%, тромбоцитопения и анемия – у 18,3 и 12,3% больных соответственно, тошнота/рвота – у 8,7 и 10,2% соответственно, астения – в 6% случаев, липополисахариды (ЛПС) и мукозиты – в 3,9 и 2,1% случаев. В контрольной группе токсичность 3–4-й степени была представлена следующими побочными явлениями: нейтропения – в 22,4% (фебрильная – в 2,1%) случаев, ЛПС и мукозиты – в 19,7 и 5,8% случаев соответственно, анемия и тромбоцитопения – у 4,8 и 2,4% больных соответственно, астения – у 2,7% больных, тошнота/рвота – у 2,4 и 2,1% пациентов, астения – у 2,7%. Повышение трансаминаз 3–4-й степени наблюдалось лишь в 0,9% случаев. Алопеция отмечалась с одинаковой частотой в 2 (12 и 13%) группах и, вероятно, была связана с ПЛД (табл.
Спектр токсичности комбинированного режима отличался большей миелосупрессией, эметогенностью и гепатотоксичностью при меньшем проценте случаев мукозитов и ладонно-подошвенного синдрома. Так, в экспериментальной группе НЯ 3–4-й степени являлись нейтропения у 62,7% пациентов (фебрильная нейтропения – у 6,9%), повышение трансаминаз – у 38,1%, тромбоцитопения и анемия – у 18,3 и 12,3% больных соответственно, тошнота/рвота – у 8,7 и 10,2% соответственно, астения – в 6% случаев, липополисахариды (ЛПС) и мукозиты – в 3,9 и 2,1% случаев. В контрольной группе токсичность 3–4-й степени была представлена следующими побочными явлениями: нейтропения – в 22,4% (фебрильная – в 2,1%) случаев, ЛПС и мукозиты – в 19,7 и 5,8% случаев соответственно, анемия и тромбоцитопения – у 4,8 и 2,4% больных соответственно, астения – у 2,7% больных, тошнота/рвота – у 2,4 и 2,1% пациентов, астения – у 2,7%. Повышение трансаминаз 3–4-й степени наблюдалось лишь в 0,9% случаев. Алопеция отмечалась с одинаковой частотой в 2 (12 и 13%) группах и, вероятно, была связана с ПЛД (табл.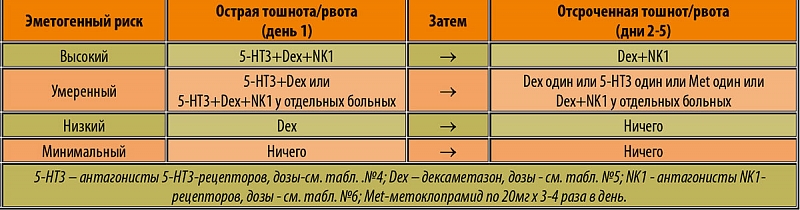 2). Следует отдельно остановиться на наиболее тяжелом, хотя и редком осложнении трабектедина – рабдомиолизе. Рабдомиолиз представляет собой разрушение поперечно-полосатой мускулатуры, вследствие чего происходит выброс продуктов распада мышечной ткани (в частности, миоглобина) в кровеносное русло, что в конечном итоге приводит к развитию острой почечной недостаточности (ОПН) [21, 25]. Рабдомиолиз может иметь множество причин – синдром длительного раздавливания, повышенная мышечная активность, гипоксия, инфекции, метаболические и электролитные нарушения, заболевания соединительной ткани, токсины и лекарственные вещества. Клиническая картина рабдомиолиза достаточно хорошо известна и включает в себя мышечные симптомы (боль, мышечная слабость, контрактуры) и общие симптомы (недомогание, слабость, лихорадка, тошнота и рвота). Результатом рабдомиолиза могут быть жизнеугрожающая почечная и полиорганная недостаточность с гиповолемией, гиперкалиемией, метаболическим ацидозом, синдромом диссеминированного внутрисосудистого свертывания, вторичными аритмиями и острой сердечной недостаточностью [22–24].
2). Следует отдельно остановиться на наиболее тяжелом, хотя и редком осложнении трабектедина – рабдомиолизе. Рабдомиолиз представляет собой разрушение поперечно-полосатой мускулатуры, вследствие чего происходит выброс продуктов распада мышечной ткани (в частности, миоглобина) в кровеносное русло, что в конечном итоге приводит к развитию острой почечной недостаточности (ОПН) [21, 25]. Рабдомиолиз может иметь множество причин – синдром длительного раздавливания, повышенная мышечная активность, гипоксия, инфекции, метаболические и электролитные нарушения, заболевания соединительной ткани, токсины и лекарственные вещества. Клиническая картина рабдомиолиза достаточно хорошо известна и включает в себя мышечные симптомы (боль, мышечная слабость, контрактуры) и общие симптомы (недомогание, слабость, лихорадка, тошнота и рвота). Результатом рабдомиолиза могут быть жизнеугрожающая почечная и полиорганная недостаточность с гиповолемией, гиперкалиемией, метаболическим ацидозом, синдромом диссеминированного внутрисосудистого свертывания, вторичными аритмиями и острой сердечной недостаточностью [22–24]. Наиболее чувствительными биохимическими маркерами являются повышение уровня креатинфосфокиназы (КФК) более чем в 10 раз от верхней границы нормы и повышение уровня креатинина. F.Grosso и соавт. провели анализ более чем 10 тыс. пациентов с различными ЗНО за период с апреля 1996 по сентябрь 2010 г. [21]. В результате были выделены 2 группы – развернутая картина рабдомиолиза и клинически значимое повышение уровня КФК при отсутствии ОПН. Факторы риска развития этих осложнений продолжают изучаться, но в контексте применения трабектедина имеется предположение об изменении кинетики препарата. Так, среди 10841 пациента, получавших лечение, рабдомиолиз был выявлен у 75 (0,7%) больных; 1/2 (45,3%) пациентов имели возможные факторы риска, такие как фоновые заболевания печени, потенциально способные изменить метаболизм препарата, а также сопутствующая терапия препаратами, самостоятельно вызывающими рабдомиолиз (например, статинами) и ингибиторами CYP3A4. В большинстве случаев рабдомиолиз возникал после 2-го цикла терапии трабектедином, что было зарегистрировано у 43 из 75 (57,3%) больных.
Наиболее чувствительными биохимическими маркерами являются повышение уровня креатинфосфокиназы (КФК) более чем в 10 раз от верхней границы нормы и повышение уровня креатинина. F.Grosso и соавт. провели анализ более чем 10 тыс. пациентов с различными ЗНО за период с апреля 1996 по сентябрь 2010 г. [21]. В результате были выделены 2 группы – развернутая картина рабдомиолиза и клинически значимое повышение уровня КФК при отсутствии ОПН. Факторы риска развития этих осложнений продолжают изучаться, но в контексте применения трабектедина имеется предположение об изменении кинетики препарата. Так, среди 10841 пациента, получавших лечение, рабдомиолиз был выявлен у 75 (0,7%) больных; 1/2 (45,3%) пациентов имели возможные факторы риска, такие как фоновые заболевания печени, потенциально способные изменить метаболизм препарата, а также сопутствующая терапия препаратами, самостоятельно вызывающими рабдомиолиз (например, статинами) и ингибиторами CYP3A4. В большинстве случаев рабдомиолиз возникал после 2-го цикла терапии трабектедином, что было зарегистрировано у 43 из 75 (57,3%) больных. Используемая доза препарата была равна 1,5 мг/м2 у больных СМТ и 1,1 мг/м2 – у больных РЯ. Как правило, рабдомиолиз сочетался с нейтропенией и повышением трансаминаз всех степеней в 70,7 и 66,7% случаев соответственно. Прогноз этого осложнения зависит прежде всего от ранней диагностики и своевременно начатого лечения. Рабдомиолиз имел фатальные последствия в 31 случае, что составило 0,3% от общего числа больных (10841). Гемодиализ проводился 12 (38,7%) пациентам. Время от манифестации симптомов до начала симптоматической терапии представлено не было [21, 22]. Клинически значимое повышение уровня КФК без признаков ОПН было выявлено в 48 (0,4%) случаях, из которых в 27 (46,6%) наблюдениях в течение первых 3 циклов лечения. При этом все пациенты имели нормальную почечную функцию, а мышечные симптомы наблюдались только у 13 (27,1%) больных. Прогноз в целом оставался благоприятным, в 70,7% случаев уровень КФК нормализовался к моменту анализа, показаний к гемодиализу не было. В заключение можно отметить, что рабдомиолиз и клинически значимое повышение уровня КФК без признаков ОПН является нечастым осложнением терапии трабектедином.
Используемая доза препарата была равна 1,5 мг/м2 у больных СМТ и 1,1 мг/м2 – у больных РЯ. Как правило, рабдомиолиз сочетался с нейтропенией и повышением трансаминаз всех степеней в 70,7 и 66,7% случаев соответственно. Прогноз этого осложнения зависит прежде всего от ранней диагностики и своевременно начатого лечения. Рабдомиолиз имел фатальные последствия в 31 случае, что составило 0,3% от общего числа больных (10841). Гемодиализ проводился 12 (38,7%) пациентам. Время от манифестации симптомов до начала симптоматической терапии представлено не было [21, 22]. Клинически значимое повышение уровня КФК без признаков ОПН было выявлено в 48 (0,4%) случаях, из которых в 27 (46,6%) наблюдениях в течение первых 3 циклов лечения. При этом все пациенты имели нормальную почечную функцию, а мышечные симптомы наблюдались только у 13 (27,1%) больных. Прогноз в целом оставался благоприятным, в 70,7% случаев уровень КФК нормализовался к моменту анализа, показаний к гемодиализу не было. В заключение можно отметить, что рабдомиолиз и клинически значимое повышение уровня КФК без признаков ОПН является нечастым осложнением терапии трабектедином. Но, учитывая отсутствие достоверных факторов риска развития рабдомиолиза, есть версия об этом явлении как о реакции типа идиосинкразии. В связи с этим необходимо тщательное наблюдение больного, особенно в течение первых 3 циклов ХТ. Премедикация кортикостероидами, коррекция дозы трабектедина в зависимости от степени миелосупрессии, гепатотоксичности и уровня КФК способствуют снижению риска развития рабдомиолиза и включены в рекомендации по применению препарата [21]. В отделении химиотерапии ФГБУ РОНЦ им. Н.Н.Блохина РАМН с декабря 2011 г. по настоящее время проводится исследование в рамках I–II фазы по применению трабектедина у больных с платиночувствительными рецидивами РЯ. Материалы и методы В настоящий момент в исследование включены 60 больных с платиночувствительными рецидивами РЯ, рандомизированных на 2 группы терапии: 30 больных в группе трабектедина 1,1–0,7 мг/м2 + цисплатин 75 мг/м2 и 30 больных в группе трабектедина 1,1–0,7 мг/м2 + доксорубицин 30 мг/м2. Трабектедин вводился путем 3-часовой инфузии, в 2 группах применялась стандартная антиэметическая терапия и премедикация кортикостероидами.
Но, учитывая отсутствие достоверных факторов риска развития рабдомиолиза, есть версия об этом явлении как о реакции типа идиосинкразии. В связи с этим необходимо тщательное наблюдение больного, особенно в течение первых 3 циклов ХТ. Премедикация кортикостероидами, коррекция дозы трабектедина в зависимости от степени миелосупрессии, гепатотоксичности и уровня КФК способствуют снижению риска развития рабдомиолиза и включены в рекомендации по применению препарата [21]. В отделении химиотерапии ФГБУ РОНЦ им. Н.Н.Блохина РАМН с декабря 2011 г. по настоящее время проводится исследование в рамках I–II фазы по применению трабектедина у больных с платиночувствительными рецидивами РЯ. Материалы и методы В настоящий момент в исследование включены 60 больных с платиночувствительными рецидивами РЯ, рандомизированных на 2 группы терапии: 30 больных в группе трабектедина 1,1–0,7 мг/м2 + цисплатин 75 мг/м2 и 30 больных в группе трабектедина 1,1–0,7 мг/м2 + доксорубицин 30 мг/м2. Трабектедин вводился путем 3-часовой инфузии, в 2 группах применялась стандартная антиэметическая терапия и премедикация кортикостероидами. Критерии включения: возраст старше 18 лет, ECOG 0–1, сохранные почечная, печеночная функции и функция костного мозга. Оценка эффекта лечения осуществлялась каждые 2 курса терапии в соответствии с критериями RECIST 1.0, оценка токсичности по критериям NCI CTCAE, версия 3.0 (табл. 3). Результаты исследования Нами представлены предварительные результаты по эффективности и токсичности комбинаций на основе трабектедина у больных с рецидивами РЯ, чувствительных к препаратам платины. В 1-й группе проведено 144 цикла ХТ. На основании данных литературы стартовая доза трабектедина составила 1,1 мг/м2, а цисплатина – 75 мг/м2. Однако выраженная токсичность комбинации диктовала необходимость редукции дозы трабектедина. Путем ступенчатой редукции дозы препарата нами выявлен оптимальный дозовый режим введения: доза трабектедина 0,7 мг/м2 и цисплатина – 75 мг/м2. При применении комбинации с указанными дозами зарегистрированы следующие НЯ: в спектре негематологической токсичности преобладала астения преимущественно 1–2-й степени у 91,7% больных; астения 3-й степени была отмечена у 4,2% больных (случаев астении 4-й степени зарегистрировано не было).
Критерии включения: возраст старше 18 лет, ECOG 0–1, сохранные почечная, печеночная функции и функция костного мозга. Оценка эффекта лечения осуществлялась каждые 2 курса терапии в соответствии с критериями RECIST 1.0, оценка токсичности по критериям NCI CTCAE, версия 3.0 (табл. 3). Результаты исследования Нами представлены предварительные результаты по эффективности и токсичности комбинаций на основе трабектедина у больных с рецидивами РЯ, чувствительных к препаратам платины. В 1-й группе проведено 144 цикла ХТ. На основании данных литературы стартовая доза трабектедина составила 1,1 мг/м2, а цисплатина – 75 мг/м2. Однако выраженная токсичность комбинации диктовала необходимость редукции дозы трабектедина. Путем ступенчатой редукции дозы препарата нами выявлен оптимальный дозовый режим введения: доза трабектедина 0,7 мг/м2 и цисплатина – 75 мг/м2. При применении комбинации с указанными дозами зарегистрированы следующие НЯ: в спектре негематологической токсичности преобладала астения преимущественно 1–2-й степени у 91,7% больных; астения 3-й степени была отмечена у 4,2% больных (случаев астении 4-й степени зарегистрировано не было). Тошнота и рвота 1–2-й степени наблюдались у 83,3 и 26,4% больных соответственно; тошнота и рвота 3–4-й степени на фоне адекватной антиэметической терапии отмечались значительно реже – у 2,8 и 7% больных соответственно. Преобладающим типом гематологической токсичности была анемия преимущественно 1–2-й степени – у 68,1% пациентов (анемия 3–4-й степени составила 11,1%) и тромбоцитопения 1–2-й степени – у 58,9% больных (3–4-й степени – у 9,7% больных). Нейтропения отмечалась реже, но преобладала 3–4-я степень токсичности (в 53,5% случаев; фебрильная нейтропения составила 2,8%). Умеренная нейтропения 1–2-й степени зарегистрирована у 31,9% больных. Гепатотоксичность в виде повышения уровня трансаминаз 1–2-й и 3–4-й степени встречалась у 30,5 и 7,7% пациентов соответственно. Нефротоксичность наблюдалась сравнительно редко и проявлялась транзиторным повышением уровня креатинина в пределах 1-й степени у 13,2% больных и, вероятно, была связана с цисплатином. Цисплатин был отменен у 3 пациентов в связи с развитием аллергической реакции немедленного типа.
Тошнота и рвота 1–2-й степени наблюдались у 83,3 и 26,4% больных соответственно; тошнота и рвота 3–4-й степени на фоне адекватной антиэметической терапии отмечались значительно реже – у 2,8 и 7% больных соответственно. Преобладающим типом гематологической токсичности была анемия преимущественно 1–2-й степени – у 68,1% пациентов (анемия 3–4-й степени составила 11,1%) и тромбоцитопения 1–2-й степени – у 58,9% больных (3–4-й степени – у 9,7% больных). Нейтропения отмечалась реже, но преобладала 3–4-я степень токсичности (в 53,5% случаев; фебрильная нейтропения составила 2,8%). Умеренная нейтропения 1–2-й степени зарегистрирована у 31,9% больных. Гепатотоксичность в виде повышения уровня трансаминаз 1–2-й и 3–4-й степени встречалась у 30,5 и 7,7% пациентов соответственно. Нефротоксичность наблюдалась сравнительно редко и проявлялась транзиторным повышением уровня креатинина в пределах 1-й степени у 13,2% больных и, вероятно, была связана с цисплатином. Цисплатин был отменен у 3 пациентов в связи с развитием аллергической реакции немедленного типа. Попытка замены цисплатина на карбоплатин (в дозе АИС-6) повлекла за собой развитие длительной панцитопении (во всех 3 случаях применялась терапия эритропоэтинами и Г-КСФ, в 2 случаях – гемотрансфузии), что в целом совпадает с данными литературы о выраженной гематологической токсичности данной комбинации [12]. Во 2-й группе было проведено 128 циклов ХТ. Начальная доза трабектедина также составила 1,1 мг/м2 и также была ступенчато редуцирована до 0,7 мг/м2 в связи с токсичностью. Доза доксорубицина составила 30 мг/м2. В спектре НЯ доминировала астения преимущественно 1–2-й степени у 92,2% больных, астения 3-й степени наблюдалась у 1,6% больных (случаев астении 4-й степени зарегистрировано не было). Тошнота/рвота 1–2-й степени составила 73,4 и 19,6% соответственно, тошноты 3–4-й степени выявлено не было; у 1 больного отмечалась рвота 3-й степени несмотря на антиэметическую терапию. Гематологическая токсичность была представлена преимущественно анемией 1–2-й степени в 50% случаев, при этом анемии 3–4-й степени отмечено не было.
Попытка замены цисплатина на карбоплатин (в дозе АИС-6) повлекла за собой развитие длительной панцитопении (во всех 3 случаях применялась терапия эритропоэтинами и Г-КСФ, в 2 случаях – гемотрансфузии), что в целом совпадает с данными литературы о выраженной гематологической токсичности данной комбинации [12]. Во 2-й группе было проведено 128 циклов ХТ. Начальная доза трабектедина также составила 1,1 мг/м2 и также была ступенчато редуцирована до 0,7 мг/м2 в связи с токсичностью. Доза доксорубицина составила 30 мг/м2. В спектре НЯ доминировала астения преимущественно 1–2-й степени у 92,2% больных, астения 3-й степени наблюдалась у 1,6% больных (случаев астении 4-й степени зарегистрировано не было). Тошнота/рвота 1–2-й степени составила 73,4 и 19,6% соответственно, тошноты 3–4-й степени выявлено не было; у 1 больного отмечалась рвота 3-й степени несмотря на антиэметическую терапию. Гематологическая токсичность была представлена преимущественно анемией 1–2-й степени в 50% случаев, при этом анемии 3–4-й степени отмечено не было. Нейтропения 1–2-й и 3–4-й степени наблюдалась в 33,5 и 32,8% случаев соответственно; фебрильная нейтропения составила 1,6%. Тромбоцитопения отмечалась реже, в пределах 1–2-й степени встречалась в 21,8% и 3–4-й степени – в 1,6% случаев. Повышение трансаминаз преимущественно 1–2-й степени зарегистрировано у 53,2% больных и 3–4-й степени – у 2,3%. Транзиторное повышение креатинина в пределах 1-й степени наблюдалось в 4,7% случаев. Нейротоксичность в виде сенсорной полинейропатии 1–2-й степени была выявлена в группе цисплатина у 4,9% больных и в группе доксорубицина – у 1,6% больных. Во всех случаях это НЯ имелось исходно как следствие ХТ 1-й линии с использованием препаратов платины и таксанов. Среди спектра побочных явлений в 1-й группе не было отмечено алопеции, зарегистрированной у 13,3% больных во 2-й группе и, вероятно, связанной с доксорубицином. Подъем КФК в пределах двух норм (1-я степень) отмечался в 2 группах в равном соотношении – 3,5 и 3,9% в 1 и 2-й группе соответственно; у всех больных сохранялась адекватная почечная функция и отсутствовали мышечные симптомы, специального лечения не требовалось.
Нейтропения 1–2-й и 3–4-й степени наблюдалась в 33,5 и 32,8% случаев соответственно; фебрильная нейтропения составила 1,6%. Тромбоцитопения отмечалась реже, в пределах 1–2-й степени встречалась в 21,8% и 3–4-й степени – в 1,6% случаев. Повышение трансаминаз преимущественно 1–2-й степени зарегистрировано у 53,2% больных и 3–4-й степени – у 2,3%. Транзиторное повышение креатинина в пределах 1-й степени наблюдалось в 4,7% случаев. Нейротоксичность в виде сенсорной полинейропатии 1–2-й степени была выявлена в группе цисплатина у 4,9% больных и в группе доксорубицина – у 1,6% больных. Во всех случаях это НЯ имелось исходно как следствие ХТ 1-й линии с использованием препаратов платины и таксанов. Среди спектра побочных явлений в 1-й группе не было отмечено алопеции, зарегистрированной у 13,3% больных во 2-й группе и, вероятно, связанной с доксорубицином. Подъем КФК в пределах двух норм (1-я степень) отмечался в 2 группах в равном соотношении – 3,5 и 3,9% в 1 и 2-й группе соответственно; у всех больных сохранялась адекватная почечная функция и отсутствовали мышечные симптомы, специального лечения не требовалось. Случаев рабдомиолиза в нашем исследовании отмечено не было (табл. 4). Отдельно необходимо отметить локальную токсичность трабектедина, а именно постинфузионные флебиты. В нашем исследовании данное осложнение отмечалось достаточно часто: в 1-й группе – в 14,6%, во 2-й группе – в 25,8% случаев. Эти данные позволяют сделать вывод о том, что, несмотря на то что 3-часовая инфузия препарата разрешена посредством периферического венозного доступа, катетеризация центральных вен предпочтительнее. Обсуждение По результатам нашего пилотного исследования токсичность трабектединсодержащих комбинаций сопоставима с литературными данными. Основными НЯ были зарегистрированы астения преимущественно 1–2-й степени, равно выраженная в 2 группах терапии, тошнота/рвота, закономерно более выраженная в группе с цисплатином с учетом высокого эметогенного потенциала последнего. Гемотологическая токсичность представлена угнетением в разной мере всех ростков гемопоэза, также с преимуществом и более глубокой степенью выраженности в сочетании трабектедина с препаратами платины.
Случаев рабдомиолиза в нашем исследовании отмечено не было (табл. 4). Отдельно необходимо отметить локальную токсичность трабектедина, а именно постинфузионные флебиты. В нашем исследовании данное осложнение отмечалось достаточно часто: в 1-й группе – в 14,6%, во 2-й группе – в 25,8% случаев. Эти данные позволяют сделать вывод о том, что, несмотря на то что 3-часовая инфузия препарата разрешена посредством периферического венозного доступа, катетеризация центральных вен предпочтительнее. Обсуждение По результатам нашего пилотного исследования токсичность трабектединсодержащих комбинаций сопоставима с литературными данными. Основными НЯ были зарегистрированы астения преимущественно 1–2-й степени, равно выраженная в 2 группах терапии, тошнота/рвота, закономерно более выраженная в группе с цисплатином с учетом высокого эметогенного потенциала последнего. Гемотологическая токсичность представлена угнетением в разной мере всех ростков гемопоэза, также с преимуществом и более глубокой степенью выраженности в сочетании трабектедина с препаратами платины. Гепатотоксичность отмечалась чаще в группе с доксорубицином, была представлена в основном транзиторным подъемом трансаминаз и, как правило, не превышала м2 1–2-й степени. Также в группе с антрациклинами чаще отмечались постинфузионные флебиты, что закономерно связано с местнораздражающим действием обоих препаратов. Случаев рабдомиолиза зарегистрировано не было, а подъем КФК в пределах 1-й степени без признаков ОПН наблюдался с равной невысокой частотой в 2 группах. Однако необходимо дальнейшее изучение режимов, мониторирование токсичности и оценка эффекта на больших группах больных. В настоящий момент исследование продолжается. Заключение В эпоху развития ХТ ведется непрерывный поиск новых лекарственных препаратов и режимов лечения больных с различными ЗНО. Суммируя данные разных исследований, можно сделать вывод, что трабектедин является перспективным препаратом в арсенале современной ХТ и, безусловно, займет должное место в терапии солидных опухолей. Однако довольно выраженный профиль токсичности диктует необходимость дальнейшего изучения препарата, исследования дозовых режимов при комбинированном назначении и разработки методик сопроводительной терапии для его успешного применения.
Гепатотоксичность отмечалась чаще в группе с доксорубицином, была представлена в основном транзиторным подъемом трансаминаз и, как правило, не превышала м2 1–2-й степени. Также в группе с антрациклинами чаще отмечались постинфузионные флебиты, что закономерно связано с местнораздражающим действием обоих препаратов. Случаев рабдомиолиза зарегистрировано не было, а подъем КФК в пределах 1-й степени без признаков ОПН наблюдался с равной невысокой частотой в 2 группах. Однако необходимо дальнейшее изучение режимов, мониторирование токсичности и оценка эффекта на больших группах больных. В настоящий момент исследование продолжается. Заключение В эпоху развития ХТ ведется непрерывный поиск новых лекарственных препаратов и режимов лечения больных с различными ЗНО. Суммируя данные разных исследований, можно сделать вывод, что трабектедин является перспективным препаратом в арсенале современной ХТ и, безусловно, займет должное место в терапии солидных опухолей. Однако довольно выраженный профиль токсичности диктует необходимость дальнейшего изучения препарата, исследования дозовых режимов при комбинированном назначении и разработки методик сопроводительной терапии для его успешного применения.
- David-Cordonnier M.H, Gajate C, Olmea O et al. DNA and non — DNA targets in the mechanism of action of the antitumor drug trabectedin. Chem Biol 2005; 12: 1201–10.
- Valoti G, Nicoletti M.I, Pellegrino A et al. Ecteinascidin-743, a new marine natural product with potent antitumor activity on human ovarian carcinoma xenografts. Clin Cancer Res 1998; 4: 1977–83.
- Hendriks H.R, Fiebig H.H, Giavazzi R et al. High antitumor activity of ET743 against human tumor xenografts from melanoma, non — small — cell lung and ovarian cancer. Ann Oncol 1999; 10: 1233–40.
- Cesne A, Yovine A, Blay J.Y et al. A retrospective pooled analysis of trabectedin safety in 1,132 patients with solid tumors treated in phase II clinical trials. Invest New Drugs 2012; 30: 1193–202.
- Twelves C, Hoekman K, Bowman A et al.
 Phase I and pharmacokinetic study of Yondelis (ecteinascidin-743, ET-743) administreted as on infusion over 1h or 3h every 21 days in patients with solid tumors. Eur J Cancer 2003; 39: 1842–51.
Phase I and pharmacokinetic study of Yondelis (ecteinascidin-743, ET-743) administreted as on infusion over 1h or 3h every 21 days in patients with solid tumors. Eur J Cancer 2003; 39: 1842–51. - Mc Meekin S, del Campo J.M, Colombo N et al. Trabectedin in relapsed advanced ovarian cancer (ROC): A pooled analysis of three phase II studies. ASCO Meeting Abstr 2007; 25 (Suppl. 18): 5579.
- Sessa C, de Braud F, Perotti A et al. Trabectedin for women with ovarian carcinoma after treatment with platinum and taxanes fails. J Clin Oncol 2005; 20: 1867–74.
- Krasner C.N, Mc Meekin D.S, Chan S et al. A Phase II study of trabectedin single agent in patients with recurrent ovarian cancer previously treated with platinum — based regimens. Br J Cancer 2007; 97 (12): 1618–24.
- Campo Del J.M, Roszak A, Bidzinski M et al. Phase II randomized study of trabectedin given as 2 different every 3 weeks dose schedules (1,5 mg/m2 24h or 1,3 mg/m2 3h) to patients with relapsed, platinum — sensitive, advanced ovarian cancer.
 Ann Oncol 2009; 20: 1794–802.
Ann Oncol 2009; 20: 1794–802. - Sessa C, Cresta S, Noberasco C et al. Phase I clinical and pharmacokinetic study of trabectedin and cisplatin in solid tumors. Eur J Cancer 2009; 45: 2116–22.
- Sessa C, Gallerani E, Conte Del G et al. Phase I dose — finding study of trabectedin (T) in combination with cisplatin (C) in patients (pts) with advanced solid tumors. J Clin Oncol 29: 2011 (Suppl; abstr. 2517).
- Vidal L, Garcia-Martin M, Tan S et al. Phase I combination study of trabectedin and carboplatin in patients with advanced solid tumors. Ann Oncol 2010; 15 (Suppl. 3): 102–1.
- Gore L, Rivera E, Lavalee K et al. Phase I combination study of trabectedin (T) and capecitabine (C) in patients with advanced malignancies. J Clin Oncol 2006; 24 (Suppl. 18S): 2079.
- Messersmith W.A, Jimeno A, Ettinger D et al. Phase I trial of weekly trabectedin (ET-743) and gemcitabine in patients with advanced solid tumors.
 Cancer Chemoter Pharmacol 2008; 63: 181–8.
Cancer Chemoter Pharmacol 2008; 63: 181–8. - Sessa C, Perotti A, Noberasco C et al. Phase I clinical and pharmacokinetic study of trabectedin and doxorubicin in advanced soft tissue sarcoma and breast cancer. Eur J Cancer 2009; 45 (7): 1153–61.
- Monk B.J, Sill M, Walker J.L et al. Activity of docetaxel plus trabectedin in reccurent or persistent ovarian and primary peritoneal cancer: A phase II study of the Gynecologic Oncology Group (GOG). J Clin Oncol 2010; 28 (Suppl. 15): 5046.
- Papadopoulos K.P, Chu Q, Patnaik A et al. Phase I pharmacokinetics (PK) study of sequential paclitaxel and trabectedin every 2 weeks in patients with advanced solid tumors. J Clin Oncol 2006. ASCO Ann Meeting Proceedings (part I) 2006; 24 (18): 2029.
- Poveda A, Kaye S.B, Herzog T et al. Correlation RNA expression of DNA repair genes with clinical outcomes of advanced ovarian cancer (OC) pts treated with pegylated liposomal doxorubicin (PLD) vs trabectedin (T) + PLD in the ET-743-OVA-301 clinical trial.
 Eur J Cancer Suppl 2009; 7: 451.
Eur J Cancer Suppl 2009; 7: 451. - Romero I, Colombo N, Kaye S.B et al. Tolerability of long — term use of trabectedin (Tr) in combination with pegylated liposomal doxorubicin (PLD) in patients (pts) with relapsed ovarian cancer (ROC). J Clin Oncol 2010; 28: 15. Abstr. 5121.
- Monk B.J, Dalton H, Benjamin I et al. Trabectedin as a new chemotherapy option in the treatment of relapsed platinum sensitive ovarian cancer. Curr Pharm Des 2012; 18 (25): 3754–69.
- Grosso F, D´Incalci M, Cartoafa M et al. A comprehensive safety analysis confirms rhabdomyolysis as an uncommon adverse reaction in patients treated with trabectedin. Cancer Chemother Pharmacol 2012; 69 (6): 1557–65.
- Chatzizisis Y.S, Misirli G, Hatzitolios A.I et al. The syndrome of rhabdomyolysis: complications and treatment. Eur J Intern Med 2008; 19: 568–74.
- Khan F.Y. Rhabdomyolysis: a review of the literature.
 Neth J Med 2009; 67: 272–83.
Neth J Med 2009; 67: 272–83. - Cesne Le A, Yovine A, Blay J.Y et al. A retrospective pooled analysis of trabectedin safety in 1,132 patients with solid tumors treated in phase II clinical trials. Invest New Drugs 2012; 30: 1193–202.
- Cervellin G, Comelii I, Lippi G. Rhabdomyolysis: historical background, clinical, diagnostic and therapeutic features. Clin Chem Lab Med 2010; 48 (6): 749–56.
Cited-By
Article Metrics
Refbacks
- There are currently no refbacks.
Противорвотная терапия при тошноте и рвоте в отделении неотложной помощи
Реферат
Справочная информация: Противорвотные средства являются одними из наиболее часто назначаемых лекарств в отделениях неотложной помощи (ED). Тем не менее, не существует общепринятых научно обоснованных рекомендаций по оптимизации использования этих препаратов от тошноты или рвоты в этих условиях. Цель: цель этой статьи — кратко рассмотреть доказательства, подтверждающие использование противорвотных средств для лечения тошноты или рвоты у взрослых в отделении неотложной помощи, и предоставить рекомендации, помогающие направлять терапию.Обсуждение. Изученные противорвотные средства включают дроперидол, прометазин, прохлорперазин, метоклопрамид и ондансетрон. В прошлом широко применялся дроперидол, он более эффективен, чем прохлорперазин или метоклопрамид, но из-за предупреждения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США относительно возможности удлинения интервала QT при применении этого препарата его использование ограничено в трудно поддающихся лечению случаях. Прометазин обладает более сильным седативным действием, чем другие препараты сравнения, а также может вызывать повреждение сосудов при внутривенном введении.Это может быть подходящим вариантом, когда желательна седация. Пациенты, принимающие прохлорперазин или метоклопрамид, должны находиться под наблюдением на предмет акатизии, которая может развиться в любое время в течение 48 часов после приема.
Цель: цель этой статьи — кратко рассмотреть доказательства, подтверждающие использование противорвотных средств для лечения тошноты или рвоты у взрослых в отделении неотложной помощи, и предоставить рекомендации, помогающие направлять терапию.Обсуждение. Изученные противорвотные средства включают дроперидол, прометазин, прохлорперазин, метоклопрамид и ондансетрон. В прошлом широко применялся дроперидол, он более эффективен, чем прохлорперазин или метоклопрамид, но из-за предупреждения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США относительно возможности удлинения интервала QT при применении этого препарата его использование ограничено в трудно поддающихся лечению случаях. Прометазин обладает более сильным седативным действием, чем другие препараты сравнения, а также может вызывать повреждение сосудов при внутривенном введении.Это может быть подходящим вариантом, когда желательна седация. Пациенты, принимающие прохлорперазин или метоклопрамид, должны находиться под наблюдением на предмет акатизии, которая может развиться в любое время в течение 48 часов после приема. Уменьшение скорости инфузии может снизить частоту возникновения этого побочного эффекта, и этот эффект можно лечить с помощью внутривенного введения дифенгидрамина. Ондансетрон так же эффективен, как прометазин, и не вызывает седативного эффекта или акатизии. Заключение. Основываясь на безопасности и эффективности ондансетрона, он может использоваться в качестве средства первой линии для облегчения тошноты или рвоты для большинства групп пациентов в отделении неотложной помощи.
Уменьшение скорости инфузии может снизить частоту возникновения этого побочного эффекта, и этот эффект можно лечить с помощью внутривенного введения дифенгидрамина. Ондансетрон так же эффективен, как прометазин, и не вызывает седативного эффекта или акатизии. Заключение. Основываясь на безопасности и эффективности ондансетрона, он может использоваться в качестве средства первой линии для облегчения тошноты или рвоты для большинства групп пациентов в отделении неотложной помощи.
Ключевые слова
противорвотные
терапии
тошнота
рвота
неотложная помощь
Рекомендуемые статьиЦитирующие статьи (0)
Полный текстCopyright © 2010 Elsevier Inc. Все права защищены.
Рекомендуемые статьи
Цитирующие статьи
Рандомизированное открытое исследование противорвотной терапии на основе рекомендаций по сравнению с монотерапией противорвотными средствами у пациентов с распространенным раком и тошнотой, не связанной с противоопухолевым лечением | BMC Cancer
Дизайн исследования
Это открытое рандомизированное контролируемое исследование с параллельными группами было проведено Объединением клинических исследований паллиативной помощи (PaCCSC) в 11 центрах по всей Австралии.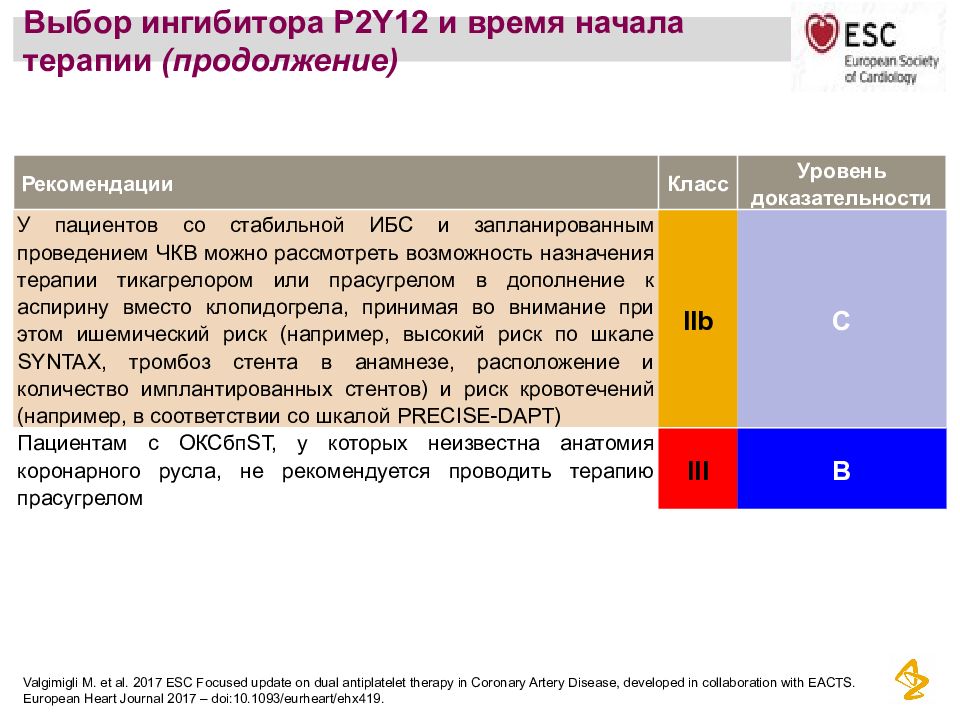 Исследование было одобрено комитетами по этике исследований на людях, охватывающими все учреждения (больница Альфреда (ведущая Виктория), Хантер Новая Англия (ведущая роль Нового Южного Уэльса), Служба охраны здоровья матери, Южная Аделаида, Центр здоровья и ухода за пожилыми людьми Сент-Винсента и Технологический университет Квинсленда).
Исследование было одобрено комитетами по этике исследований на людях, охватывающими все учреждения (больница Альфреда (ведущая Виктория), Хантер Новая Англия (ведущая роль Нового Южного Уэльса), Служба охраны здоровья матери, Южная Аделаида, Центр здоровья и ухода за пожилыми людьми Сент-Винсента и Технологический университет Квинсленда).
Пациенты
Участники старше 18 лет имели диагноз рака и тошноты со средним баллом ≥3 по 11 баллам (0–10) NRS. В настоящее время они не получали противорвотные средства или получали несоответствующие противорвотные средства (как определено в руководствах по противорвотным средствам).
Пациенты были исключены, если они: имели краткосрочную ятрогенную или обратимую причину тошноты, для которой имелись доказательства высокого уровня, что было показано конкретное противорвотное средство или вмешательство (например, повышенное внутричерепное давление или острая тошнота, вызванная химиолучевой терапией) пройти любую процедуру, которая может вызвать тошноту за два дня до или во время периода исследования, иметь определенные противопоказания к любому из исследуемых препаратов, изменение дозы глюкокортикоидов в течение 48 часов или плохое состояние здоровья (что могло бы сделал участника неспособным выполнить требования исследования).
Вмешательства
Следователи прошли формальную подготовку по различным механизмам тошноты и рвоты и способам определения первопричины. Были зарегистрированы все потенциальные причины и, если возможно, определен доминирующий механизм.
Расписания рандомизации были созданы на компьютере для каждого сайта в независимом центральном реестре. Расписания для каждого сайта были распределены в соотношении 1: 1 случайным образом распределенными блоками по два или четыре. Расписания, хранящиеся в центральном реестре, были отправлены на каждый объект в непрозрачных запечатанных конвертах, пронумерованных по порядку.Получив уведомление о подходящем пациенте, координатор исследования в каждом учреждении открывал следующий пронумерованный конверт, назначал пациента группе лечения по рекомендациям или отдельной группе лечения и уведомлял исследовательский персонал и лечащих врачей о распределении группы лечения. Невозможно было провести слепое лечение из-за количества используемых лекарств и сложности увеличения дозы.
Те, кто был отнесен к группе лечения по руководству, получали противорвотную терапию на основе руководящих принципов клинической практики (CPG), основанных на этиологии, разработанных на основе систематического обзора эффективности противорвотных средств у пациентов с далеко зашедшим раком, проведенного Glare et al.[9]. CPG были обновлены и изменены на основе консенсуса с использованием экспертной группы после обзора последней литературы. В CPG (таблица 1) указаны общие механизмы тошноты (категории A-G), и для каждого механизма рекомендуется лечение первой линии с последующими курсами лечения поэтапно каждые 24 часа, если тошнота остается неконтролируемой. Для нескольких факторов, способствующих, исследователи были проинструктированы лечить в соответствии с основным или доминирующим фактором. CPG были адаптированы для включения рекомендуемых вариантов лечения для пациентов, у которых не удалось определить основную причину (категория H).Пероральный путь был предпочтительным для всех исследуемых лекарств, но парентеральный путь был разрешен для тех, кто не мог принимать пероральные препараты.
Участники, отнесенные к группе с одним агентом, получали галоперидол (1,0 мг / 24 ч) перорально или парентерально (подкожно или внутривенно). У пациентов с неконтролируемой тошнотой дозу постепенно увеличивали каждые 24 часа до 2 мг, а затем до максимума 3 мг / 24 часа.
Метоклопрамид 10 мг был обозначен как спасательное противорвотное средство, которое следует вводить каждые 4 часа по мере необходимости (prn), за исключением тех групп, где метоклопрамид уже вводился 4 часа, и в этом случае использовался галоперидол (0,5 мг каждые 6 часов). для прорыва.
Пациенты, которые не соответствовали определению ответа через 24 часа, переходили к противорвотной терапии второй и третьей линии в соответствии с CPG. Пациенты, которые соответствовали определению ответа через 24 часа, оставались на той же схеме противорвотных средств.Через 72 часа участники, чья тошнота была под контролем, продолжали принимать эффективные лекарства и дозу. Пациенты с рефрактерной тошнотой (окончательный балл ≥ 3/10) лечились по усмотрению лечащего врача.
Пациенты с рефрактерной тошнотой (окончательный балл ≥ 3/10) лечились по усмотрению лечащего врача.
Оценка результатов
Оценка тяжести тошноты и дистресса проводилась ежедневно. Другими показателями были: работоспособность [13], тяжесть симптомов [14], качество жизни [15], сопутствующие заболевания [16] и токсичность [17, 18].
Ответ был определен как уменьшение средней тошноты по крайней мере на 2 балла и балла <3 за среднюю тошноту за предшествующие 24 часа, измеренного через 72 часа по 11-балльной шкале числовых оценок (NRS).
Первичным критерием оценки был ответ через 72 часа (конец 3 дня). Вторичные исходы, измеренные через 72 часа, включали: средний, лучший и худший баллы по тошноте, тошноту, количество пациентов, получавших лечение на каждом уровне дозы, введенные дозы экстренной помощи, эпизоды рвоты, общее впечатление об изменениях и побочные эффекты.
Статистический анализ
Первичная гипотеза об отсутствии разницы в скорости ответа через 72 часа была проверена с использованием критериев хи-квадрат различий между обработками. Предполагая, что уровень ответа составляет 75% в группе рекомендаций и 50% в группе с одним агентом, минимум 150 участников (75 на группу), завершивших 72 часа лечения, было сочтено достаточным для выявления абсолютной и клинически значимой разницы в частоте ответа. 25% между одним агентом и терапией по рекомендациям, с мощностью 90%, предполагая двустороннюю ошибку 1-го типа в 5% и простую схему случайной выборки.
Предполагая, что уровень ответа составляет 75% в группе рекомендаций и 50% в группе с одним агентом, минимум 150 участников (75 на группу), завершивших 72 часа лечения, было сочтено достаточным для выявления абсолютной и клинически значимой разницы в частоте ответа. 25% между одним агентом и терапией по рекомендациям, с мощностью 90%, предполагая двустороннюю ошибку 1-го типа в 5% и простую схему случайной выборки.
В анализе первичного намерения лечиться (ITT) рандомизированные пациенты, выбывшие по любой причине, были классифицированы как «не отвечающие на лечение».Вторичный анализ проводился как анализ « по протоколу » пациентов, завершивших 72-часовой курс лечения. Описательная статистика была получена на основе демографических и клинических характеристик пациента. Анализ хи-квадрат использовался для обнаружения любых различий между группами лечения на исходном уровне.
При вторичном поперечном анализе каждая конечная точка рассматривалась отдельно. Регрессионное моделирование оценок тошноты с течением времени и влияния вмешательства на эти тенденции проводилось в предположении « случайное отсутствие данных » с применением подхода линейных смешанных моделей для корректировки возможных искажений и обеспечения того, чтобы люди с отсутствующими данными с течением времени могли быть включены, насколько позволяют их данные. Результаты выражаются в виде уровней распространенности, медианы и диапазона, среднего и стандартного отклонения, в зависимости от типа данных и анализа.
Результаты выражаются в виде уровней распространенности, медианы и диапазона, среднего и стандартного отклонения, в зависимости от типа данных и анализа.
Какие противорвотные средства для какой терапии?
Тошнота и рвота, вызванные химиотерапией (CINV), остаются важным и распространенным фактором токсичности лечения рака. В недавних пересмотрах рекомендаций химиотерапевтические агенты классифицировались по четырем категориям риска рвоты без использования профилактических средств: высокий (> 90%), умеренный (30-90%), низкий (10-30%) и минимальный (<10%). %).Доступные в настоящее время противорвотные средства, включая кортикостероиды, антагонисты рецепторов 5-гидрокситриптамина (HT) 3 и антагонисты нейрокинина (NK) -1, используются отдельно или в комбинации в зависимости от уровня рвотного потенциала в качестве профилактики развития CINV в остром периоде. (до 24 часов после химиотерапии) и отсроченный период (до 5 дней после лечения). Новые агенты, в том числе антагонист рецептора 5-HT3 второго поколения палоносетрон (Aloxi) и антагонист NK-1 апрепитант (Emend), обладают дополнительным клиническим преимуществом при высоко- и умеренно рвотной терапии. Однако отсроченная тошнота и рвота по-прежнему часто возникают у многих пациентов и влияют на качество жизни. Другие классы агентов, включая бензодиазепины и каннабиноиды, обладают потенциалом для дополнительной защиты. Чтобы удовлетворить эту значительную неудовлетворенную потребность онкологических больных, необходимо продолжать исследования с новыми лекарствами и их комбинациями.
Однако отсроченная тошнота и рвота по-прежнему часто возникают у многих пациентов и влияют на качество жизни. Другие классы агентов, включая бензодиазепины и каннабиноиды, обладают потенциалом для дополнительной защиты. Чтобы удовлетворить эту значительную неудовлетворенную потребность онкологических больных, необходимо продолжать исследования с новыми лекарствами и их комбинациями.
Тошнота и рвота, вызванные химиотерапией рака (CINV), являются одними из наиболее распространенных и неприятных побочных эффектов лечения рака.[1] Возможно, разработка эффективных режимов комбинированной химиотерапии, способных продлить жизнь и излечить пациентов, не могла продолжаться до параллельной разработки эффективных стратегий профилактики и лечения CINV. Действительно, я хорошо помню молодых пациентов с раком яичек в начале 1980-х, которые крайне неохотно продолжали лечение высокими дозами цисплатина после одного цикла, проведенного без эффективной противорвотной терапии. К счастью, благодаря достижениям в разработке противорвотных средств такая ситуация сегодня становится крайне редкой.
Этот обзор будет посвящен обновленной классификации рвотного потенциала доступных химиотерапевтических агентов и текущим рекомендациям по профилактике и лечению CINV, основанным на данных недавних клинических испытаний.
Физиология рвоты
Центральным в развитии современной противорвотной терапии было понимание физиологии рвотной реакции. Рвота является естественным защитным механизмом от проглатывания токсичных веществ и возникает в результате сигналов, запускаемых проводящими путями как в головном, так и в желудочно-кишечном тракте.Триггерная зона хеморецепторов (CTZ) в стволе мозга активируется ядовитыми стимулами и, в свою очередь, стимулирует центр рвоты в продолговатом мозге. Центр рвоты посылает сигналы о слюноотделении, изменении дыхания, сокращениях глотки, желудочно-кишечного тракта и брюшной полости, что приводит к рвоте. Энтерохромаффинные клетки желудочно-кишечного тракта содержат рецепторы, которые могут запускать афферентный блуждающий нерв, чтобы стимулировать CTZ и инициировать процесс рвоты. [2]
[2]
В этот физиологически сложный процесс вовлечены несколько нейромедиаторов.Наиболее важными нейрорецепторами являются рецепторы 5-гидрокситриптамина (HT) 3 или серотонина, рецепторы дофамина и рецептор нейрокинина (NK) -1, но другие включают рецепторы гистамина, эндорфинов, ацетилхолина, каннабиноидов и гамма-аминомасляной кислоты. (ГАМК). Обычно в случае рвоты участвуют несколько рецепторов [3]. Антагонисты одного или нескольких из этих рецепторов составляют основу фармакологического контроля рвоты. [4]
Классификация CINV
CINV можно разделить на четыре общие категории: острая, отсроченная, упреждающая и прорывная.Острый CINV определяется как тошнота и / или рвота, возникающие в первые 24 часа после проведения химиотерапии. Отсроченный CINV произвольно определяется как происходящий через первые 24 часа и до 120 часов после химиотерапии. [5] Упреждающий CINV — это усвоенная или условная реакция, которая возникает у пациентов, у которых во время предыдущей химиотерапии плохо контролировались тошнота и рвота. Предупреждающий CINV был зарегистрирован у 18–57% пациентов [6] и обычно лучше реагирует на изменение поведения или нефармакологические подходы.
Предупреждающий CINV был зарегистрирован у 18–57% пациентов [6] и обычно лучше реагирует на изменение поведения или нефармакологические подходы.
Первичная и вторичная профилактика каждого из этих типов CINV снижает риск событий. Однако у некоторых пациентов развивается обострение CINV, определяемое как эпизоды, возникающие, несмотря на соответствующее профилактическое применение противорвотных средств. Рвотный вирус CINV обычно решается за счет использования противорвотных средств других классов, кроме тех, которые используются во время профилактической фазы.
Классификация химиотерапевтических агентов по эметогенному риску
Значительный прогресс в определении риска CINV по агенту был достигнут в 1997 году, когда Hesketh et al разработали схему классификации, разделяющую химиотерапевтические агенты на пять уровней в соответствии с процентом пациентов, испытывающих острую рвоту без профилактическая противорвотная терапия в клинических испытаниях: уровень 1 (<10%), уровень 2 (10-30%), уровень 3 (30-60%), уровень 4 (60-90%) и уровень 5 (> 90%). [7] Эта система была обновлена Грюнбергом и его коллегами в 2005 году путем разделения уровней на четыре категории риска:> 90%, 30% -90%, 10% -30% и <10%. [8] У пациентов, получающих комбинированную химиотерапию, лекарство самого высокого уровня определяет риск. Кроме того, была предоставлена отдельная классификация для пероральных средств.
[7] Эта система была обновлена Грюнбергом и его коллегами в 2005 году путем разделения уровней на четыре категории риска:> 90%, 30% -90%, 10% -30% и <10%. [8] У пациентов, получающих комбинированную химиотерапию, лекарство самого высокого уровня определяет риск. Кроме того, была предоставлена отдельная классификация для пероральных средств.
ТАБЛИЦА 1
Эметогенный риск, связанный с внутривенно вводимыми противоопухолевыми препаратами
В 2006 году Американское общество клинической онкологии (ASCO) опубликовало пересмотр своих руководств по противорвотным препаратам, основанных на фактических данных, — первое обновление их рекомендаций с 1999 года.[9] Рекомендации Национальной комплексной онкологической сети (NCCN), ежегодно обновляемые в соответствии с согласованными стандартами, классифицируют возбудителей очень аналогично рекомендациям ASCO. [10] Пересмотренные в 2006 г. рвотные риски для противоопухолевых препаратов представлены в таблице 1. К агентам в группе наивысшего риска относятся многие препараты, которые больше не используются регулярно в текущих схемах химиотерапии, но содержат цисплатин и дакарбазин.
Группа умеренного риска (риск рвоты> 30–90%) включает многие из широко используемых лекарств для лечения рака, включая карбоплатин, оксалиплатин (элоксатин), циклофосфамид, доксорубицин, эпирубицин (Ellence) и иринотекан (камптозар).Считается, что препараты с низким рвотным риском (10-30%) включают таксаны, этопозид и биопрепараты, такие как трастузумаб (Герцептин) и цетуксимаб (Эрбитукс). Некоторые противоопухолевые препараты, такие как класс алкалоидов барвинка или бевацизумаб (Авастин), связаны с минимальным риском рвоты без профилактики (<10%). Клиницисты должны знать о последних изменениях в рекомендациях ASCO 2006 г., например, паклитаксел и гемцитабин (Гемзар) реклассифицируются как препараты с низким, а не с минимальным риском, в то время как другие (например, винкристин, флударабин) были изменены с низкого до минимального риска. .
Известно, что помимо типа химиотерапевтического агента, специфические для пациента факторы риска увеличивают вероятность развития CINV. К ним относятся возраст <50 лет, легкое употребление алкоголя в анамнезе, рвота, связанная с предыдущей химиотерапией, тошнота или рвота во время беременности, укачивание в анамнезе и крайнее беспокойство. [11] Пол также играет роль, поскольку женщины чаще подвержены риску заражения вирусом иммунодефицита человека, чем мужчины. Полный анамнез пациента помогает выявить исторические факторы риска, которые могут повлиять на уровень рвотного риска и изменить назначенную противорвотную терапию.
К ним относятся возраст <50 лет, легкое употребление алкоголя в анамнезе, рвота, связанная с предыдущей химиотерапией, тошнота или рвота во время беременности, укачивание в анамнезе и крайнее беспокойство. [11] Пол также играет роль, поскольку женщины чаще подвержены риску заражения вирусом иммунодефицита человека, чем мужчины. Полный анамнез пациента помогает выявить исторические факторы риска, которые могут повлиять на уровень рвотного риска и изменить назначенную противорвотную терапию.
Фармакологическое лечение CINV
В настоящее время для профилактики и лечения CINV используются пять классов фармакологических агентов: антагонисты дофамина, кортикостероиды, антагонисты серотонина, антагонисты нейрокинина и каннабиноиды. Ранние испытания оценивали антидофаминергические средства, такие как фенотиазины и высокие дозы метоклопрамида, которые, как оказалось, обладали ограниченной эффективностью или высокой токсичностью [12]. Текущие руководства рекомендуют лечить пациентов с помощью противорвотных схем, обеспечивающих наивысший терапевтический индекс. На практике это означает комбинацию антагониста рецептора 5-HT3, кортикостероидов и антагониста NK-1.
На практике это означает комбинацию антагониста рецептора 5-HT3, кортикостероидов и антагониста NK-1.
Антагонисты рецепторов 5-HT3
Антагонисты рецепторов 5-HT3 первого поколения включают ондансетрон (Зофран), доласетрон (Анземет), гранисетрон (Китрил) и трописетрон (недоступны в США). Хотя химическая структура и фармакологические характеристики у этих препаратов различаются, они имеют эквивалентные профили эффективности и безопасности и могут использоваться взаимозаменяемо — выводы, подкрепленные доказательствами категории 1 и тремя наборами руководств по лечению от ASCO, NCCN и Многонациональной ассоциации поддерживающей терапии в США. Рак (MASCC).[9,10,13]
Множественные клинические испытания подтверждают эти рекомендации. Например, двойное слепое рандомизированное исследование сравнивало внутривенное введение доласетрона с внутривенным ондансетроном для предотвращения CINV после химиотерапии на основе цисплатина. Это исследование продемонстрировало сопоставимую эффективность и безопасность однократной дозы доласетрона по сравнению с однократной дозой 32 мг ондансетрона [14] после высокоэметогенной химиотерапии. Точно так же однократная доза гранисетрона внутривенно показала эффективность, аналогичную эффективности трех доз ондансетрона, у ранее не получавших химиотерапию пациентов, получавших высокие дозы цисплатина в дозах> 60 мг / м 2 .[15]
Точно так же однократная доза гранисетрона внутривенно показала эффективность, аналогичную эффективности трех доз ондансетрона, у ранее не получавших химиотерапию пациентов, получавших высокие дозы цисплатина в дозах> 60 мг / м 2 .[15]
Было показано, что антагонисты рецепторов 5-HT3 первого поколения обладают очень хорошей абсорбцией GI, что привело к тестированию пероральных составов на эффективность. В многоцентровом рандомизированном двойном слепом исследовании приняли участие более 1000 пациентов, которым была назначена высокоэметогенная химиотерапия на основе цисплатина, которые получали либо 2 мг гранисетрона перорально, либо 32 мг ондансетрона внутривенно перед назначением химиотерапии. Активность была сопоставимой между двумя группами: 54,7% пациентов, получавших гранисетрон, и 58 пациентов.3% пациентов, получавших ондансетрон, достигли полного контроля рвоты. [16] Аналогичным образом, однократная доза перорального гранисетрона была показана в другом крупном исследовании умеренно рвотной химиотерапии как эквивалентное внутривенному введению ондансетрона в этой ситуации. Полный ответ, определяемый как отсутствие рвоты или отсутствие необходимости в каких-либо передовых лекарствах, был достигнут у 59,4% пациентов, получавших гранисетрон, по сравнению с 58% пациентов, получавших ондансетрон [17].
Полный ответ, определяемый как отсутствие рвоты или отсутствие необходимости в каких-либо передовых лекарствах, был достигнут у 59,4% пациентов, получавших гранисетрон, по сравнению с 58% пациентов, получавших ондансетрон [17].
Профиль токсичности антагонистов рецептора 5-HT3 невелик. Наиболее частая токсичность включает головную боль у 10-15% пациентов и запор у 10-15%.Редкие побочные реакции включают беспокойство, головокружение, диарею и утомляемость. Индивидуальные реакции могут варьироваться от одного агента к другому. Таким образом, если у пациента возникает головная боль при приеме одного антагониста рецептора 5-HT3, переключение на другой агент часто устраняет эту токсичность, сохраняя при этом эффективность.
Недавно были описаны потенциальные различия в метаболизме этих агентов, основанные на фармакогенетических вариациях в системе цитохрома P450. CYP2D6 участвует в метаболизме всех антагонистов рецепторов 5-HT3, кроме гранисетрона.[18] В интригующем исследовании, которое включало генотипирование CYP2D6 у пациентов, получавших ондансетрон или трописетрон, исследователи смогли разделить пациентов на три клинические группы: слабые метаболизаторы CYP2D6 с самой низкой частотой CINV, интенсивные метаболизаторы с промежуточной частотой CINV. , и сверхбыстрые метаболизаторы с самой высокой частотой CINV после рвотной химиотерапии. [19] Из доступных антагонистов рецепторов 5-HT3 гранисетрон не метаболизируется исключительно через CYP2D6.Вместо этого этот препарат метаболизируется подтипами CYP3A и ферментом CYP1A1. Хотя определение фармакокинетического профиля пациента еще не является стандартной клинической практикой, оно может оказаться полезным при выборе противорвотных средств.
, и сверхбыстрые метаболизаторы с самой высокой частотой CINV после рвотной химиотерапии. [19] Из доступных антагонистов рецепторов 5-HT3 гранисетрон не метаболизируется исключительно через CYP2D6.Вместо этого этот препарат метаболизируется подтипами CYP3A и ферментом CYP1A1. Хотя определение фармакокинетического профиля пациента еще не является стандартной клинической практикой, оно может оказаться полезным при выборе противорвотных средств.
Хотя антагонисты рецепторов 5-HT3 первого поколения явились крупным клиническим достижением в профилактике против CINV, тошнота и рвота остаются серьезными проблемами для многих пациентов, получающих противорвотную терапию. [20,21] Палоносетрон (Aloxi), новый рецептор 5-HT3. антагонист с фармакокинетическими свойствами, которые отличаются от других агентов этого класса, был одобрен Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) в 2003 году, что сделало его первым новым лекарством от CINV за десятилетие. Палоносетрон имеет в 100 раз большую аффинность связывания с рецептором серотонина 3-го типа, а его период полураспада, составляющий примерно 40 часов, значительно больше, чем у других антагонистов рецептора 5-HT3.
Палоносетрон имеет в 100 раз большую аффинность связывания с рецептором серотонина 3-го типа, а его период полураспада, составляющий примерно 40 часов, значительно больше, чем у других антагонистов рецептора 5-HT3.
РИСУНОК 1
Палоносетрон и антагонисты рецепторов 5-HT3
В ходе прямых испытаний палоносетрон сравнивали с 32 мг ондансетрона или 100 мг доласетрона. 0,25 мг внутривенно обеспечили статистически значимое улучшение полного ответа по сравнению с любым из двух других агентов.Палоносетрон сохранял свое превосходство в течение периода задержки CINV на 120 часов после введения химиотерапии. Общий полный ответ в течение 5-дневного периода наблюдался у 57,7% пациентов, получавших палоносетрон, по сравнению с 42,0% пациентов, получавших ондансетрон / доласетрон (рис. 1) [24].
В другом исследовании фазы III сравнивали палоносетрон, ондансетрон и дексаметазон после высокоэметогенной химиотерапии. [25] Палоносетрон плюс дексаметазон давали полный ответ 40,7% по сравнению с 25.2% для ондансетрона плюс дексаметазон в течение 5-дневного периода после химиотерапии. Палоносетрон одобрен для профилактики острой и отсроченной CINV после умеренно рвотной химиотерапии и для профилактики острой CINV, связанной с высокоэметогенной химиотерапией. Из-за длительного периода полувыведения палоносетрон не показан для многодневного использования в многодневных режимах химиотерапии.
В исследовании фазы II оценивали комбинацию палоносетрона (0,25 мг внутривенно) и дексаметазона (8 мг перорально) в день 1 перед получением умеренно рвотной химиотерапии.В этом небольшом исследовании полный ответ в течение первых 24 часов составил 84,4%; в течение всего 120-часового периода оценки у 59% был полный ответ, у 77% не было эпизодов рвоты, а 66% не нуждались в спасательных препаратах [26].
Антагонисты нейрокинина-1
Был представлен новый класс агентов для CINV с апрепитантом (Emend), новым антагонистом NK-1, одобренным в 2003 году. Этот агент блокирует рецептор нейрокинина и, таким образом, усиливает активность антагонистов рецептора 5-HT3 с дополнительным механизмом действия.[27,28] Апрепитант, добавленный к ондансетрону и дексаметазону, обеспечивал более высокую степень защиты от острой и отсроченной CINV, чем только ондансетрон и дексаметазон после химиотерапии высокими дозами цисплатина, с полной степенью ответа 72,7% против 52,3% в дни с 1 по 5. [29]
РИСУНОК 2
Добавление апрепитанта к антагонисту 5-HT3 рецепторов / дексаметазону
Рандомизированное двойное слепое плацебо-контролируемое исследование у пациентов с раком груди, получавших антрациклин и циклофосфамид, оценивало использование ондансетрона (8 мг перорально 2 раза в сутки) дексаметазон (20 мг два раза в день) в день 1 по сравнению с такой же комбинацией ондансетрона и дексаметазона плюс апрепитант (125 мг в день 1) с последующим введением дополнительных доз апрепитанта (80 мг) на 2 и 3 дни.[30] В целом, частота полного ответа в течение дней с 1 по 5 была выше для группы, содержащей апрепитант — 51% против 42% ( P = 0,015, см. Рисунок 2). Недавний комбинированный анализ, в котором рассматривались более 1000 пациентов, получающих высокие дозы цисплатина, показал, что апрепитант улучшает контроль CINV по-разному у женщин и, следовательно, может свести на нет неблагоприятный прогностический эффект женского пола. [31]
Апрепитант сам по себе или в комбинации с дексаметазоном не контролирует острую рвоту, а также антагонисты рецепторов 5-HT3 и дексаметазон.[32] Однако апрепитант, по-видимому, сохраняет свои преимущества при использовании в нескольких циклах химиотерапии на основе цисплатина. Апрепитант метаболизируется с помощью фермента CYP3A4, поэтому следует рассмотреть возможность корректировки дозы других распространенных лекарств, использующих этот путь, особенно дексаметазона и варфарина.
Доступность новых противорвотных средств привела к фазе II испытания комбинации палоносетрона, дексаметазона и апрепитанта у пациентов, получающих химиотерапию с умеренным и сильным рвотным действием.[33] Пациенты получали апрепитант (125 мг перорально) за 1 час до химиотерапии в день 1, затем палоносетрон (0,25 мг внутривенно) и дексаметазон (12 мг перорально) за полчаса до химиотерапии. На 2 и 3 дни пациенты получали апрепитант (80 мг перорально) и дексаметазон (8 мг перорально). Анализ намерения лечить продемонстрировал частоту полного ответа 88% в течение первых 24 часов и общую частоту полного ответа 78% в течение 5 дней. Надеемся, что эти обнадеживающие результаты будут подтверждены в других исследованиях.
Каннабиноиды и другие противорвотные средства
Другие классы агентов, по-видимому, обладают активностью в предотвращении CINV.Оланзапин (зипрекса), антипсихотический тиенобензодиазепин, оценивался в последовательных исследованиях фазы I / II. [34,35] Режим перорального приема оланзапина в дозе 5 мг на 2-й и 1-й дни, оланзапин в дозе 10 мг с добавлением в / в гранисетрон и дексаметазон. в день 1, затем дексаметазон и оланзапин в дозе 10 мг перорально в дни 2–4. Частота полного ответа у 30 пациентов, получавших умеренно или сильно рвотную химиотерапию, составила 100% в остром периоде и 80% в отсроченном периоде. Не было отмечено серьезных токсических эффектов, и эта комбинация оказалась эффективной в течение нескольких циклов.
Возрождается интерес к использованию каннабиноидов в CINV. Отчасти это связано с расширением знаний об эндогенных каннабиноидах и их рецепторах. Рецептор CB-1, член большого семейства рецепторов, связанных с G-белками, обнаруживается в больших количествах в базальных ганглиях, мозжечке, стволе мозга и гипоталамусе. Второй подтип рецептора, CB-2, был идентифицирован преимущественно в клетках иммунной системы. Рецепторы CB-1 и CB-2 активируются THC, составляющей, наиболее ответственной за фармакологическую активность марихуаны.[36] Были идентифицированы природные эндогенные лиганды для обоих каннабиноидных рецепторов, а также пути передачи сигналов, а также синтетические и метаболические пути для этих комплексов лиганд-рецептор. Модели на животных подтверждают роль эндоканнабиноидов в контроле рвоты.
Два фармацевтических каннабиноида были одобрены в США для профилактики и лечения CINV: дронабинол (маринол) и набилон (цезамет). Фармакокинетика обоих препаратов схожа, хотя набилон имеет меньше метаболитов и большую продолжительность действия, что позволяет реже принимать его дважды в день.[37]
Клинические испытания дронабинола и набилона в основном проводились в эпоху до появления антагонистов рецепторов 5-HT3. Систематический обзор имеющихся исследований по оценке использования каннабиноидов для контроля CINV был опубликован в 2001 году [38]. В большинстве этих исследований сравнивали дронабинол и набилон с прохлорперазином, метоклопрамидом, домперидоном или плацебо в химиотерапии с умеренным и сильным рвотным действием в течение первых 24 часов после лечения. Во всех исследованиях каннабиноиды были более эффективными, чем активные компараторы и плацебо, при этом для лечения требовалось 6.От 4 до 8,0 для достижения полного контроля тошноты и рвоты по сравнению с активным компаратором.
Интересно, что пациенты в большей степени предпочитали каннабиноид активным препаратам сравнения или плацебо. Однако у каннабиноидов были выявлены значительные психотропные побочные эффекты. Некоторые из этих побочных эффектов были потенциально полезными, например, чувство эйфории, повышенной чувствительности, сонливости или седативного эффекта, в то время как некоторые вызывали беспокойство или вред, например головокружение, дисфория или даже галлюцинации или паранойя у небольшой части пациентов.Следует отметить, что в этих исследованиях использовались относительно высокие дозы дронабинола.
Удивительно, но не было хорошо контролируемых исследований каннабиноидов в эпоху комбинированной противорвотной терапии с антагонистами рецепторов 5-HT3 плюс дексаметазон. Учитывая значительное количество пациентов с отсроченным CINV и неудовлетворенную потребность в дополнительных эффективных агентах в этой обстановке, возможность для дальнейших исследований очевидна.
Профилактика и лечение отсроченной CINV
СПРАВОЧНОЕ РУКОВОДСТВО
Терапевтические агенты
, упомянутые в этой статье
Апрепитант (Emend)
Цетуксисмаб (Авастин)
Цетуксимрон97 (Эрплаза) Анцемет)
Домперидон
Эпирубицин (Элленс)
Этопозид
Флударабин
Гемцитабин (Гемзар)
Гранисетрон (Китрил)
Иринотекан (Камптозар)
Метоклопрамид
Набилон (Цезаметинрон)
Зондранзетаплан (Цезаметинрон)
Зондранзетона
Паклитаксел
Палоносетрон (Алокси)
Прохлорперазин
Трастузумаб (Герцептин)
Трописетрон
Винкристин
Варфарин
Торговые наименования указаны в скобках только в том случае, если лекарство не является генерируемым и продается не более чем с двумя товарными знаками или зарегистрированными продуктами.В скобках также могут быть включены более знакомые альтернативные общие обозначения.
Среди медицинских работников сохраняется мнение, что пациенты достигают хорошего контроля CINV как в остром, так и в отдаленном периоде после рвотной химиотерапии. Опросы пациентов указывают на несоответствие между мнением врача и реальностью. [39]
В проспективном исследовании, посвященном отсроченному CINV, недавно описанному Hickock et al [21], 704 ранее не получавших химиотерапии пациентов, получавших режим химиотерапии на основе антрациклина, лечились пероральным антагонистом рецептора 5-HT3 плюс дексаметазон в первый день с последующим приемом дексаметазона. на 2 день.Затем они были рандомизированы для приема перорального антагониста рецептора 5-HT3 на 2–5 дни по сравнению с прохлорперазином на 2–5 дни по фиксированному графику по сравнению с прохлорперазином по мере необходимости после внезапной тошноты и рвоты. Антагонисты рецептора 5-HT3 показали себя не лучше, чем прохлорперазин в снижении отсроченного CINV, и на самом деле большему количеству пациентов, получавших антагонисты рецептора 5-HT3, требовались препараты экстренной помощи (45%), чем пациентам в группах прохлорперазина (27-30%; P ) = 0,002). Больше случаев рвоты произошло в отсроченном периоде (34%), чем в остром периоде (19%; P <.01). В целом 75% пациентов испытали тошноту в течение отсроченного периода.
В недавнем исследовании оценивалось качество жизни пациентов (QOL), о чем сообщалось проспективно с использованием проверенного инструмента — опросника функционального индекса жизни — рвоты (FLIE) до и на 6 день после умеренно рвотной химиотерапии или сильно рвотной химиотерапии. Почти все пациенты получали лечение в соответствии со стандартизованными рекомендациями, включая антагонист рецептора 5-HT3 и дексаметазон. Несмотря на профилактическое лечение, отсроченная тошнота возникла у 54.3% пациентов и отсроченная рвота — у 32,5%. Исследователи обнаружили небольшую разницу в отсроченной тошноте между уровнями рвотного риска. Пациенты сообщали о большем влиянии тошноты на качество жизни на повседневную жизнь, чем от рвоты. В целом, почти каждый второй пациент пострадал от воздействия на качество жизни в течение отсроченного периода. Значительная часть пациентов, не испытывающих острой тошноты или рвоты, почувствовала влияние на качество своей жизни в течение отсроченного периода. Эти результаты согласуются с наблюдением, что антагонисты рецептора 5-HT3 [41] и антагонисты NK-1 [30] менее эффективны в предотвращении тошноты, чем рвота.
В другом недавнем исследовании изучалось влияние CINV и QOL в 10 онкологических клиниках. [42] Во время цикла 1 только у 33% не было ни острой, ни отсроченной CINV; 59% пациентов сообщили о задержке CINV, примерно у половины из них наблюдались острые и отсроченные симптомы, а у половины — только CINV с задержкой. Как острый, так и отсроченный CINV оказали значительное влияние на качество жизни и повседневное функционирование, при этом пациенты, испытывавшие симптомы в течение обоих периодов, демонстрировали большее ухудшение их повседневного функционирования.Более того, ежедневные функциональные уровни были значительно ниже, когда у пациента была острая или отложенная CINV в предыдущем цикле, даже когда острая / отложенная CINV контролировалась в текущем цикле. Эти результаты предполагают, что влияние CINV на функционирование и качество жизни пациента является кумулятивным и постоянным.
В недавнем метаанализе рассматривалась польза антагонистов рецептора 5-HT3 в предотвращении отсроченной рвоты после химиотерапии. [43] В пяти испытаниях сравнивали монотерапию антагонистом 5-HT3 рецептора с плацебо, а в других пяти исследованиях с участием 2240 пациентов сравнивали антагонист 5-HT3 рецептора плюс дексаметазон с одним дексаметазоном.Абсолютное снижение риска для антагонистов рецептора 5-HT3 составило 8,2%, при этом количество, необходимое для лечения, составляло 74 дозы, чтобы защитить одного пациента от отсроченной рвоты. Для дексаметазона плюс антагонист рецептора 5-HT3 абсолютное снижение риска составило всего 2,6% (95% доверительный интервал = от -0,6% до 5,8%), и для защиты одного пациента потребовалось бы 423 дозы антагониста рецептора 5-HT3.
Обилие доказательств позволяет предположить, что антагонисты рецептора 5-HT3, по-видимому, обладают небольшим защитным эффектом в условиях отсроченного CINV и, безусловно, мало добавляют к дексаметазону.Пероральный антагонист рецептора 5-HT3 не следует назначать после приема палоносетрона, учитывая длительный период полувыведения палоносетрона и потенциальную дополнительную токсичность без каких-либо доказательств увеличения активности комбинированных антагонистов рецептора 5-HT3.
Текущие руководящие принципы
ТАБЛИЦА 2
Режимы лекарств для предотвращения рвоты, вызванной химиотерапией, по категориям рвотного риска
Профилактические противорвотные схемы руководствуются максимальным рвотным потенциалом химиотерапевтических схем и разделены на режимы профилактики и прорывные схемы лечения.Эти превентивные стратегии недавно были обновлены как ASCO, так и NCCN (Таблица 2). Важным пересмотром классификации является отнесение комбинаций антрациклинов и циклофосфамида к категории высокоэметогенного риска. Высокоэметогенная химиотерапия должна сопровождаться комбинацией из трех препаратов антагониста рецептора 5-HT3, дексаметазона и апрепитанта с последующим введением дексаметазона и апрепитанта на 2-й и 3-й дни.
ТАБЛИЦА 3
Амбулаторное прорывное лечение
V
Для умеренно рвотной химиотерапии пациенты должны получить режим с двумя лекарствами: антагонист 5-HT3 рецепторов плюс дексаметазон в день 1 с последующим введением только дексаметазона или антагониста 5-HT3 рецепторов для отсроченного CINV.Для схем с низким рвотным потенциалом рекомендуется использовать только дексаметазон, в то время как минимальный риск рвоты не должен побуждать к рутинной профилактической терапии. Стратегии лечения прорывного CINV представлены в таблице 3.Практические рекомендации
Нынешняя эра доказательной медицины подчеркнула необходимость в практических рекомендациях, которые стандартизируют, упрощают и делают более эффективным подход к общим клиническим сценариям. Действительно, демонстрационные проекты Центров Medicare и Medicaid Services (CMS) на 2005 и 2006 годы включали вопросы, в которых оценивалась степень оценки тошноты и рвоты при каждом лечении и степень соблюдения рекомендаций при назначении химиотерапии.Несмотря на повышенную осведомленность, оценка и лечение симптоматики в большинстве случаев не стандартизированы.
Соблюдение рекомендаций по противорвотному лечению может значительно улучшить результаты лечения. В одном исследовании после корректировки прогностических переменных для отсроченного CINV соблюдение рекомендаций привело к уменьшению доли пациентов, сообщающих об этих симптомах (55% против 75%; P = 0,02) [44]. Однако даже при соблюдении рекомендаций у половины всех пациентов, получавших антагонист рецептора 5-HT3 первого поколения, все еще наблюдался отсроченный CINV.Аналогичные результаты наблюдались в европейской популяции: соблюдение рекомендаций снизило CINV и рвоту; однако симптомы все еще присутствовали в половине всех курсов терапии даже при тщательном соблюдении рекомендаций [45].
Эти результаты указывают на постоянную потребность в более эффективном лечении CINV. За последние два десятилетия был достигнут большой прогресс в предотвращении этого распространенного побочного эффекта, и, будем надеяться, новые клинические испытания будут сосредоточены на стратегиях дальнейшего снижения заболеваемости, связанной с тошнотой и рвотой, вызванными химиотерапией.
Раскрытие финансовой информации: Д-р Шварцберг является членом бюро докладчиков MGI Pharma and Merck.
Ссылки:
Ссылки:
1. Ричардсон Дж., Маркс Г., Левин А. Влияние симптомов заболевания и побочных эффектов лечения на соблюдение режима лечения рака. J Clin Oncol 6: 1746-1752, 1988.
2. Крейг Дж., Пауэлл Б.: Управление тошнотой и рвотой в клинической онкологии. Am J Med Sci 293: 34-44, 1987.
3. Siegel L, Longo D: Контроль рвоты, вызванной химиотерапией. Ann Intern Med 95: 352-359, 1981.
4. Dodds LJ: Контроль тошноты и рвоты, вызванных химиотерапией рака. J Clin Hosp Pharm 10: 143-166, 1985.
5. Крис М., Гралла Р., Кларк Р. и др. Частота, течение и тяжесть отсроченной тошноты и рвоты после введения высоких доз цисплатина. Дж. Клин Онкол 3: 1379-1384, 1985.
6. Jacobsen PB, Redd WH: Развитие и лечение упреждающей тошноты и рвоты, связанных с химиотерапией. Cancer Invest 6: 329-336, 1988.
7. Хескет П., Крис М., Грюнберг С. и др.: Предложение по классификации острой рвотной активности химиотерапии рака. J Clin Oncol 15: 103-109, 1997.
8. Грюнберг С., Особа Д., Хескет П. и др.: Оценка новых противорвотных средств и определение рвотной активности противоопухолевых средств — обновление. Support Care Cancer 13: 80-84, 2005.
9. Kris M, Hesketh P, Somerfield M, et al: Руководство Американского общества клинической онкологии по противорвотным средствам в онкологии: обновление 2006 г. J Clin Oncol 24: 2932-2947, 2006.
10. Национальная всеобъемлющая онкологическая сеть: Antiemesis. Руководство NCCN по клинической практике в онкологии v.1.2007. Доступно на www.nccn.org. Проверено 1 июня 2007 г.
11. Американское общество фармацевтов систем здравоохранения: терапевтические рекомендации ASHP по фармакологическому лечению тошноты и рвоты у взрослых и детей, получающих химиотерапию или лучевую терапию или подвергающихся хирургическому вмешательству. Am J Health Syst Pharm 56: 729-764, 1999.
12. Grunberg S: достижения в лечении тошноты и рвоты, вызванных химиотерапевтическими режимами, не содержащими цисплатин. Кровь Ред. 3: 216-221, 1989.
13. Гралла Р., Ройла Ф., Тонато М. и др.: Конференция консенсуса по противорвотной терапии. Многонациональная ассоциация поддерживающей терапии при раке. Перуджа, Италия; 29-31 марта 2004 г.
14. Hesketh P, Navari R, Grote T, et al: Двойное слепое рандомизированное сравнение противорвотной эффективности внутривенного мезилата доласетрона и внутривенного ондансетрона в профилактике острой рвоты, вызванной цисплатином, у больные раком. J Clin Oncol 14: 2242-2249, 1996.
15. Навари Р., Гандара Д., Хескет П. и др.: Сравнительное клиническое испытание гранисетрона и ондансетрона в профилактике рвоты, вызванной цисплатином. J Clin Oncol 13: 1242-1248, 1995.
16. Gralla R, Navari R, Hesketh P, et al: Однократный пероральный гранисетрон обладает противорвотной эффективностью, эквивалентной внутривенному ондансетрону при высокоэметогенной химиотерапии на основе цисплатина . Дж. Клин Онкол 16: 1568-1573, 1998.
17. Перес Э., Хескет П., Сандбах Дж и др.: Сравнение однократного перорального гранисетрона и внутривенного ондансетрона в профилактике тошноты и рвоты, вызванных умеренно рвотной химиотерапией: многоцентровое двойное слепое рандомизированное параллельное исследование. J Clin Oncol 16: 754-760, 1998.
18. Бернард С., Невилл К., Нгуен А. и др.: Межэтнические различия в генетических полиморфизмах CYP2D6 в популяции США: Клинические последствия. Онколог 11: 126-135, 2006.
19. Kaiser R, Sezer O, Papies A, et al: Индивидуальная для пациента противорвотная терапия антагонистами рецепторов 5-гидрокситриптамина типа 3 в соответствии с генотипами цитохрома P-450 2D6. J Clin Oncol 20: 2805-2811, 2002.
20. Хикок Дж., Роско Дж., Морроу Дж. И др .: Тошнота и рвота остаются серьезными проблемами химиотерапии, несмотря на профилактику с помощью противорвотных средств 5-гидрокситриптамина-3: A Рочестерский университет Рочестерского центра онкологии им. Джеймса П. Уилмота. Общественная программа клинической онкологии. Исследование 360 больных раком, пролеченных в общине. Cancer 97: 2880-2886, 2003.
21. Hickok J, Roscoe J, Morrow G, et al: Антагонисты 5-гидрокситриптаминовых рецепторов по сравнению с прохлорперазином для контроля отсроченной тошноты, вызванной доксорубицином: рандомизированное контролируемое исследование URCC CCOP . Lancet Oncol 6: 765-772, 2006.
22. Gralla R, Lichinitser M, Van Der Vegt S, et al: Palonosetron улучшает профилактику тошноты и рвоты, вызванной химиотерапией, после умеренно рвотной химиотерапии: результаты двойного действия. слепое рандомизированное исследование III фазы, сравнивающее разовые дозы палоносетрона и ондансетрона. Ann Oncol 14: 1570-1577, 2003.
23. Eisenberg P, Figueroa-Vadillo J, Zamora R, et al: 99-04 Palonosetron Study Group. Улучшенная профилактика умеренно рвотной тошноты и рвоты, вызванной химиотерапией, с помощью палоносетрона, фармакологически нового антагониста рецепторов 5-HT3: результаты фазы III испытания однократной дозы по сравнению с доласетроном. Cancer 98: 2473-2482, 2003.
24. Rubenstein EB, Gralla RJ, Eisenberg P, et al: Palonosetron (PALO) по сравнению с ондансетроном (OND) или доласетроном (DOL) для предотвращения острой и отсроченной химиотерапии. индуцированная тошнота и рвота (CINV): объединенные результаты двух исследований фазы III (аннотация 2932). Proc Am Soc Clin Oncol 22: 729, 2003.
25. Aapro M, Grunberg S, Manikhas G, et al: Фаза III, двойное слепое, рандомизированное испытание палоносетрона по сравнению с ондансетроном для предотвращения химиотерапии. вызванная тошнотой и рвотой после сильной рвотной химиотерапии. Ann Oncol 17: 1441-1449, 2006.
26. Хайденберг Дж., Гроте Т., Йи Л. и др.: Инфузия палоносетрона плюс дексаметазон для предотвращения тошноты и рвоты, вызванных химиотерапией. J Support Oncol 4: 467-471, 2006.
27. Navari R: Роль антагонистов рецептора нейрокинина-1 в рвоте, вызванной химиотерапией: Резюме клинических испытаний. Cancer Invest 22: 56576, 2004.
28. Массаро А., Ленц К.: Апрепитант: новое противорвотное средство от тошноты и рвоты, вызванных химиотерапией. Ann Pharmacother 39: 77-85, 2005.
29. Hesketh P, Grunberg S, Gralla R, et al: Aprepitant Protocol 052 Study Group. Пероральный антагонист нейрокинина-1 апрепитант для профилактики тошноты и рвоты, вызванных химиотерапией: многонациональное рандомизированное двойное слепое плацебо-контролируемое исследование с участием пациентов, получающих высокие дозы цисплатина — группа исследования протокола Aprepitant 052. J Clin Oncol 21: 4112-4119, 2003.
30. Варр Д., Хескет П., Гралла Р. и др.: Эффективность и переносимость апрепитанта для предотвращения тошноты и рвоты, вызванных химиотерапией, у пациентов с грудью. рак после умеренно рвотной химиотерапии. J Clin Oncol 23: 2822-2830, 2005.
31. Hesketh P, Grunberg S, Herrstedt J, et al: Объединенные данные двух фаз III испытаний апрепитанта антагониста NK1 плюс антагониста 5HT3 вызвали тошноту и рвота: влияние пола на реакцию на лечение. Support Cancer Care 14; 354-360, 2006.
32. Навари Р., провинция П: Новые лекарства от рвоты, вызванной химиотерапией. Expert Opin Emerg Drugs 11: 137-151, 2006.
33. Grote T., Hajdenberg J, Catmell A и др.: Комбинированная терапия от тошноты и рвоты, вызванной химиотерапией, у пациентов, получающих умеренно рвотную химиотерапию: палоносетрон, дексаметазон, и апрепитант. J Support Oncol 4: 403-408, 2006.
34. Passik S, Navari R, Jung S и др.: Фаза I испытания оланзапина (Zyprexa) для предотвращения отсроченной рвоты у онкологических больных: A Hoosier Групповое онкологическое исследование. Cancer Invest 22: 383-388, 2004.
35. Navari R, Einhorn L, Passik S, et al: Испытание фазы II оланзапина для предотвращения тошноты и рвоты, вызванных химиотерапией: исследование Hoosier Oncology Group . Support Care Cancer 13: 529-534, 2005.
36. Мартин Б., Уайли Дж .: Механизм действия каннабиноидов: как это может привести к лечению кахексии, рвоты и боли. J Support Oncol 2: 305-316, 2004.
37. Дэвис М., Майда В., Даенинк П. и др.: Возникающая роль каннабиноидных нейромодуляторов в управлении симптомами. Support Care Cancer 15: 63-71, 2007.
38. Трамер М., Кэрролл Д., Кэмпбелл Ф. и др.: Каннабиноиды для контроля тошноты и рвоты, вызванной химиотерапией: количественный систематический обзор. BMJ 323: 1-8, 2001.
39. Грюнберг С., Деусон Р., Маврос П. и др.: Частота возникновения тошноты и рвоты, вызванных химиотерапией, после применения современных противорвотных средств. Cancer 100: 2261-2268, 2004.
40. Bloechl-Daum B, Deuson R, Mavros P, et al: Отсроченная тошнота и рвота продолжают снижать качество жизни пациентов после высоко или умеренно рвотной химиотерапии, несмотря на противорвотное лечение . J Clin Oncol 24: 4472-4478, 2006.
41. Herrstedt J: Риск-польза противорвотных средств в профилактике и лечении тошноты и рвоты, вызванных химиотерапией. Expert Opin Drug Saf 3: 231-248, 2004.
42. Cohen L, de Moor CA, Eisenberg P, et al: Тошнота и рвота, вызванные химиотерапией: частота и влияние на качество жизни пациентов в онкологических учреждениях по месту жительства . Support Cancer Care 15: 497-503, 2007.
43. Geling O, Eichler H: Следует ли вводить антагонисты рецептора 5-гидрокситриптамина-3 через 24 часа после химиотерапии для предотвращения отсроченной рвоты? Систематическая переоценка клинических данных и стоимости лекарств. J Clin Oncol 23: 1289-1294, 2005.
44. de Moor C, Cohen L, Eisenberg P, et al: Соблюдение онкологами рекомендаций по противорвотным средствам (AEG) и исходы пациентов (pts), получающих рвотные средства химиотерапия (ХТ) (аннотация 2924). Proc Am Soc Clin Oncol 22: 727, 2003.
45. Инбе-Хеффингер А., Элкен Б., Бернард Р. и др .: Влияние отсроченной тошноты и рвоты, вызванной химиотерапией, на пациентов, использование ресурсов здравоохранения и расходы в онкологических центрах Германии. Ann Oncol 15: 526-536, 2004.
Практический выбор противорвотных средств — Американский семейный врач
1. Гэдсби Р. Болезнь и симптомы беременности: ответы на ваши вопросы. Проф Уход Мать Ребёнок . 1994; 4: 16–7 ….
2. Гэдсби Р., Барни-Адсхед А.М., Джаггер К. Проспективное исследование тошноты и рвоты во время беременности [опечатка опубликована в Br J Gen Pract 1993; 43: 325]. Br J Gen Pract .1993; 43: 245–8.
3. Хорнби П.Дж. Центральная нервная система, связанная с рвотой. Am J Med . 2001; 111 (доп. 8А): 106С – 12С.
4. Маккуэйд KR. Пищеварительный тракт. В: Tierney LM, ed. Текущая медицинская диагностика и лечение, 2003. 42-е изд. Нью-Йорк: Lange Medical Books / McGraw-Hill, 2003: 573–5.
5. Pasricha PJ. Прокинетические средства, противорвотные средства и средства, применяемые при синдроме раздраженного кишечника. В: Goodman LS, Hardman JG, Limbird LE, Gilman AG. Гудман и Гилман Фармакологические основы терапии.10-е изд. Нью-Йорк: Макгроу-Хилл, 2001: 1021–36.
6. Бэйб К.С. младший, Серафин В.Е. Гистамин, брадикинин и их антагонисты. В: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Goodman AG, ред. Гудман и Гилман Фармакологические основы терапии. 10-е изд. Нью-Йорк: Макгроу-Хилл, 2001: 587–91.
7. Красная книга по наркотикам за 2003 год. Монтваль, Нью-Джерси: Медицинская экономика, 2003.
8. Baldessarini RJ. Лекарства и лечение психических расстройств. В: Hardman JG, Limbird LE, Molinoff PB, Ruddon RW, Goodman AG, ред.Гудман и Гилман Фармакологические основы терапии. 9 изд. Нью-Йорк: Макгроу-Хилл, 1996: 414–7.
9. Ган Т.Дж., Белый ПФ, Скудери ЧП, Watcha MF, Ковач А. Предупреждение FDA «черный ящик» относительно использования дроперидола при послеоперационной тошноте и рвоте: оправдано ли это ?. [Письмо] Анестезиология . 2002; 97: 287
10. Henzi I, Сондреггер Дж., Tramer MR. Эффективность, доза-реакция и побочные эффекты дроперидола для предотвращения послеоперационной тошноты и рвоты. Кан Дж Анаэст . 2000; 47: 537–51.
11. Терапевтические рекомендации ASHP по фармакологическому лечению тошноты и рвоты у взрослых и детей, получающих химиотерапию или лучевую терапию или подвергающихся хирургическому вмешательству. Am J Health Syst Pharm . 1999; 56: 729–64.
12. Факты о лекарствах и сравнения 2003. 57-е изд. Сент-Луис: факты и сравнения, 2003.
13. De Ponti F, Полуцци Э, Кавалли А, Реканатини М, Монтанаро Н.Безопасность неантиаритмических препаратов, удлиняющих интервал QT или вызывающих torsade de pointes: обзор. Сейф с лекарствами . 2002; 25: 263–86.
14. Куигли Е.М., Хаслер В.Л., Parkman HP. Технический обзор AGA по тошноте и рвоте. Гастроэнтерология . 2001; 120: 263–86.
15. Ричмана П.Б., Аллегра J, Эскин Б, Доран Дж, Reischel U, Кайафас C, и другие. Рандомизированное клиническое испытание для оценки эффективности внутримышечного дроперидола для лечения острой мигрени. Am J Emerg Med . 2002; 20: 39–42.
16. Матчар Д. Б., Янг В. Б., Розенберг Дж. Х., Петрзак М. П., Зильберштейн С. Д., Липтон Р. Б. и др. Основанные на фактах рекомендации по лечению мигренозной головной боли в учреждениях первичной медико-санитарной помощи: фармакологическое лечение острых приступов. По состоянию на 12 декабря 2003 г., по адресу: www.aan.com/professionals/practice/pdfs/gl0087.pdf.
17. Джуэлл Д, Молодой Г. Вмешательства при тошноте и рвоте на ранних сроках беременности. Кокрановская база данных Syst Rev .2003 (4): CD000145.
18. Салливан, Калифорния, Джонсон, Калифорния, Плотва H, Мартин Р.В., Стюарт Д.К., Моррисон JC. Пилотное исследование внутривенного введения ондансетрона при гиперемезисе беременных. Am J Obstet Gynecol . 1996; 175: 1565–8.
19. Safari HR, Фассетт MJ, Саутер IC, Алсулман О.М., Goodwin TM. Эффективность метилпреднизолона в лечении гиперемезиса беременных: рандомизированное двойное слепое контролируемое исследование. Am J Obstet Gynecol . 1998. 179: 921–4.
20. Техасский университет в Остине, Школа медсестер, программа практикующих семейных медсестер. Оценка и лечение тошноты и рвоты на ранних сроках беременности (менее или равно 20 неделе беременности). Остин, Техас: Техасский университет в Остине, Школа медсестер, 2002 г. По состоянию на 22 января 2004 г., по адресу: http://www.guideline.gov/summary/summary.aspx?doc_id=3228.
21. Вутяванич Т., Крайсарин Т, Руангсри Р.Имбирь от тошноты и рвоты при беременности: рандомизированное плацебо-контролируемое исследование с двойной маской. Акушерский гинекол . 2001; 97: 577–82.
22. Практический параметр: лечение острого гастроэнтерита у детей раннего возраста. Американская академия педиатрии, Временный комитет по улучшению качества, Подкомитет по острому гастроэнтериту. Педиатрия . 1996. 97: 424–35.
23. Рамсук С, Саагун-Карреон I, Козинец ЦА, Моро-Сазерленд Д.Рандомизированное клиническое испытание по сравнению перорального ондансетрона с плацебо у детей с рвотой в результате острого гастроэнтерита. Энн Эмерг Мед . 2002; 39: 397–403.
24. Ривз Дж. Дж., Шеннон М.В., Fleisher GR. Ондансетрон уменьшает рвоту, связанную с острым гастроэнтеритом: рандомизированное контролируемое исследование. Педиатрия . 2002; 109: e62
25. Tramer MR. Рациональный подход к контролю послеоперационной тошноты и рвоты: данные систематических обзоров.Часть I. Эффективность и вред противорвотных вмешательств и методические вопросы. Acta Anaesthesiol Scand . 2001; 45: 4–13.
26. Watcha MF, Смит И. Анализ экономической эффективности противорвотной терапии в амбулаторной хирургии. Дж Клин Анест . 1994; 6: 370–7.
27. Henzi I, Уолдер Б, Tramer MR. Дексаметазон для профилактики послеоперационной тошноты и рвоты: количественный систематический обзор. Анест Анальг .2000; 90: 186–94.
28. Watcha MF. Послеоперационная тошнота и рвота. Анестезиол Clin North Am . 2002; 20: 709–22.
Противорвотная терапия (Материалы)
Рвотный рефлекс — это сложный механизм, который может запускаться периферически из желудочно-кишечного тракта, глотки, триггерной зоны хеморецепторов (CRTZ) и вестибулярной системы или центрально в рвотном центре в головном мозге. Прямое раздражение глотки может вызвать рвоту, хотя у животных это относительно нечастая причина.Рвота может быть инициирована из ЖКТ из-за раздражения, воспаления или вздутия желудка или кишечника и обычно опосредуется рецепторами серотонина (5HT3), которые затем прогрессируют через CRTZ или ядро единственного тракта в головном мозге. Ядро единственного тракта содержит рецепторы энкефалина, гистамина (h2), мускариновой кислоты (M1), вещества P (нейрокинина NK-1) и 5HT3. Триггерная зона хеморецептора может также инициировать рвотный рефлекс из-за переносимых с кровью лекарств или токсинов (например, рвота, вызванная морфином у собак), которая опосредуется рецепторами опиатов, 5HT3, дофамина (D2) и M1, NK1 и норэпинефрина (α-2) .Укачивание или вестибулярное заболевание могут стимулировать рвотный рефлекс главным образом за счет гистамина (h2) и мускариновых рецепторов. Рвотный центр координирует рвотный рефлекс и содержит высокие концентрации рецепторов 5HT1 и α-2. Сложная природа и множественные пути, которые могут стимулировать рвотный рефлекс, могут сбивать с толку, но предлагают множество целей для симптоматического лечения рвоты, но ни одно лечение не будет высокоэффективным для всех причин рвоты. Также важно повторить, что противорвотные средства лечат симптом, а не заболевание, поэтому необходимо приложить все усилия для постановки первичного диагноза, поскольку некоторые основные заболевания могут оказаться фатальными, если их не лечить.
Антигистаминные препараты
Антигистаминные препараты обычно используются при рвоте, связанной с вестибулярной стимуляцией, такой как укачивание или вестибулярное заболевание. Большинство антигистаминных препаратов также обладают слабым антихолинергическим действием, поэтому они обычно противопоказаны при глаукоме и сердечно-сосудистых заболеваниях. Дифенгидрамин (Бенадрил), дименгидринат (Драмамин) и гидроксизин использовались для лечения вестибулярной рвоты. Эффективность антигистаминных препаратов для лечения вестибулярной рвоты у кошек ниже, чем у собак, и, возможно, не является оптимальным выбором для кошек.
Антихолинергические средства
Аминопентамид (Центрин) является типичным антимускариновым средством, используемым при рвоте в ветеринарии. Эффективность аминопентамида по существу ограничивается вестибулярной рвотой. Аминопентамид имеет низкую эффективность при других причинах рвоты. Побочные эффекты холинолитиков (уменьшение опорожнения желудка, кишечная непроходимость) часто противопоказаны из-за многих причин рвоты. Другие побочные эффекты включают ксеростомию, задержку мочи, повышение внутриглазного давления, запор и возбуждение у кошек.Клиническая ценность этого класса лекарств в качестве противорвотных средств минимальна.
Фенотиазины
Фенотиазины являются эффективными противорвотными средствами благодаря их активности в качестве антагонистов D2. Однако большинство фенотиазинов обладают слабым антигистаминным и холинолитическим действием, что может способствовать их эффективности. Фенотиазины также являются антагонистами α-1, что приводит к расширению сосудов и их гипотензивным эффектам. В результате фенотиазины обычно противопоказаны гипотензивным или сильно обезвоженным животным.Обычным побочным эффектом фенотиазинов является седативный эффект, который используется в качестве показания для ацепромазина. Хотя широко известно, что фенотиазины противопоказаны при эпилепсии, существует минимальное количество данных, подтверждающих это утверждение. Хроническое введение фенотиазинов может привести к дискинезии (симптомы болезни Паркинсона) из-за их действия в качестве антагонистов D2. Фенотиазины выводятся в первую очередь за счет метаболизма в печени. Фенотиазины обычно считаются эффективными при вестибулярной, желудочно-кишечной и рвоте, вызванной CRTZ.Фенотиазины менее эффективны в профилактике и лечении рвоты, вызванной химиотерапией, чем маропитант или ондансетрон.
Хлорпромазин (0,5 мг / кг подкожно каждые 6-8 ч), вероятно, является наиболее часто используемым фенотиазином в качестве противорвотного средства. Ацепромазин также является эффективным противорвотным средством, но оказывает более сильное седативное действие, чем хлорпромазин. Прометазин (фенерган) обладает выраженными антигистаминными эффектами в дополнение к его эффектам антагониста D2 (меньше, чем хлорпромазин), и обладает меньшим седативным действием, чем другие фенотиазины.Прометазин вводили собакам перорально в дозе 0,2-0,5 мг / кг каждые 6-8 лет в качестве противорвотного средства и обычно применяют для профилактики укачивания. Однако пероральная биодоступность у собак составляет всего ~ 9%, поэтому может не иметь высокой эффективности.
Метоклопрамид
Метоклопрамид — противорвотное средство широкого спектра действия, которое проявляет действие как антагонист D2, а также за счет прокинетических эффектов. Высокие дозы метоклопрамида также вызывают эффекты антагонистов 5HT3, но побочные эффекты, такие как возбуждение и спазмы / колики в животе, более вероятны.Метоклопрамид также увеличивает высвобождение альдостерона и пролактина. Сообщалось, что периферический отек является побочным эффектом у людей и эпизодически возникал у животных, что, вероятно, связано с его влиянием на высвобождение альдостерона. Повышенное высвобождение альдостерона может обострить основное или ранее существовавшее сердечно-сосудистое заболевание и потенциально привести к отеку легких. Хроническое введение может также вызвать лактацию или гинекомастию из-за повышенного высвобождения пролактина. Из-за его способности вызывать возбуждение ЦНС использование метоклопрамида у пациентов, предрасположенных к судорогам (т.е. эпилептикам) вообще противопоказан. Из-за прокинетических эффектов метоклопрамида его нельзя назначать животным с непроходимостью ЖКТ или инородным телом.
Метоклопрамид быстро метаболизируется в печени с коротким периодом полувыведения ~ 2 часа. Биодоступность при пероральном введении у собак составляет ~ 50%. Метоклопрамид можно вводить собакам и кошкам внутривенно, внутримышечно, перорально в дозе 0,2–0,5 мг / кг каждые 6–8 часов, причем перорально вводят более высокий предел диапазона доз. Метоклопрамид также можно вводить в виде внутривенной инфузии с постоянной скоростью до 2 мг / кг / сут.Метоклопрамид в высоких дозах, 1 мг / кг, используемый в основном для предотвращения рвоты, вызванной химиотерапией, вызывает эффекты антагонистов 5HT3 (аналогично ондансетрону, см. Ниже), но с появлением генерического ондансетрона применение высоких доз метоклопрамида уменьшилось.
Антагонисты серотонина (5HT3)
Антагонисты серотонина (5HT3) являются высокоэффективными противорвотными средствами при желудочно-кишечном тракте, химиотерапии, послеоперационной тошноте, тошноте и рвоте, вызванных беременностью (у людей).Маропитант (см. Ниже) был более эффективен при контроле рвоты, вызванной ипекакой, у собак, но клиническая значимость этого различия не известна. Препараты не эффективны при укачивании, тогда как маропитант эффективен. Ондансетрон (0,1-0,2 мг / кг каждые 6-12 ч в виде медленной внутривенной инъекции или 0,5 мг / кг для внутривенной химиотерапии) является прототипом препарата в этом классе и в настоящее время является жизнеспособным выбором в ветеринарии из-за низкой стоимости дженериков. . Гранисетрон и доласетрон также относятся к одному классу лекарств, но являются дорогостоящими.Биодоступность гранисетрона и доласетрона при пероральном приеме выше, чем у ондансетрона, и может оказаться эффективным, но стоимость ограничивает их использование у ветеринарных пациентов. Ондансетрон в первую очередь выводится из метаболизма в печени. Период полувыведения короткий, но противорвотный эффект сохраняется дольше, чем концентрация препарата. Продолжительность противорвотного действия у собак составляет от 6 до 12 часов. Биодоступность при пероральном введении у собак очень низкая (<10%), поэтому, вероятно, пероральный прием неэффективен.Хотя на этикетке указано, что его не следует вводить подкожно из-за низкого pH (3,5), его вводили людям в виде подкожной инфузии. До тех пор, пока не будут проведены исследования безопасности, эффективности и фармакокинетики на собаках, рутинное применение ондансетрона подкожно не рекомендуется. Побочные эффекты онданстрона ограничены из-за его высокой рецепторной специфичности, но у людей наблюдаются головные боли, головокружение, запоры и диарея. Сообщалось об изменениях электрокардиграфии у людей, но сердечно-сосудистые заболевания не считаются противопоказанием.
Maropitant
Maropitant относится к новейшему классу противорвотных средств — антагонистов нейрокинина (NK-1). Вещество P — нейромедиатор, связанный с рецепторами NK-1. Мароптитант — высокоэффективное противорвотное средство от рвоты, вызванной желудочно-кишечными заболеваниями, химиотерапией и укачиванием. Маропитант имеет период полувыведения около 6 часов, метаболизируется печеночными механизмами и имеет 30% биодоступность при пероральном приеме. Маропитант имеет дозозависимый метаболизм (увеличение дозы приводит к увеличению периода полувыведения) и рекомендуется для краткосрочного применения.Побочные эффекты включали снижение массы тела, снижение веса печени и яичек, слабость, вялость, снижение аппетита, умеренную нейтропению, снижение частоты сердечных сокращений и удлинение интервалов QT в испытаниях на токсичность. Маропитант также проявляет эффекты как блокатор кальциевых каналов (например, дилтиазем) и как блокатор калиевых каналов (например, соталол), что объясняет его сердечные побочные эффекты. Сердечно-сосудистые исследования у здоровых молодых гончих не привели к какой-либо кардиотоксичности, но одновременное применение с блокаторами кальциевых каналов, бета-блокаторами и блокаторами калиевых каналов следует проводить с осторожностью.Никаких исследований не изучали безопасность маропитанта на собаках с сердечно-сосудистыми заболеваниями. Следует с осторожностью применять у животных с сердечно-сосудистыми заболеваниями или заболеваниями печени. Маропитант предназначен для применения у собак в возрасте старше 16 недель, поэтому для большинства собак применение при парвовирусном гастроэнтерите нецелесообразно. Maropitant приводил к большей частоте подавления костного мозга (по сравнению с плацебо) у щенков в возрасте 11 недель.
Доза маропитанта при острой рвоте составляет 2 мг / кг перорально каждые 24 часа на срок до 5 дней и 8 мг / кг перорально каждые 24 часа на срок до 2 дней при укачивании.Маропитант также доступен в виде раствора для инъекций, 1 мг / кг подкожно каждые 24 часа на срок до 5 дней. Боль, седативный эффект, атаксия и брадикардия были зарегистрированы как побочные эффекты.
Маропитант не предназначен для применения у кошек, но его вводили кошкам в дозе 0,5–1 мг / кг подкожно. В предварительных исследованиях безопасности ЗДОРОВЫМ кошкам вводились дозы до 5-кратной рекомендуемой один раз в день, что не привело к побочным эффектам. Однако исследования безопасности на животных, пораженных болезнью, не проводились.Следует избегать применения маропитанта или применять его с осторожностью кошкам, которые в настоящее время получают бета-блокаторы (атенолол, пропранолол, соталол и др.), Дилтиазем или амлодипин.
Заявление об ограничении ответственности: информация является точной, насколько известно автору. Однако рекомендации меняются по мере появления новых данных и возможны ошибки. Автор рекомендует дважды проверять точность всей информации, включая дозировки.
Более низкая доза оланзапина плюс триплетная противорвотная терапия может уменьшить тошноту и рвоту, вызванные химиотерапией
добавление 5 мг оланзапина к тройной противорвотной комбинированной терапии значительно увеличили частоту полного ответа (CR) на противорвотную терапию в отсроченной фазе у пациентов, получавших цисплатин, согласно результатам рандомизированное исследование фазы 3.Эти данные были опубликованы в журнале Lancet Oncology . 1
антипсихотический агент оланзапин, как ранее было показано, значительно снизить частоту тошноты и рвоты у пациентов, получавших сильное рвотное средство химиотерапия (например, цисплатин; комбинация антрациклина / циклофосфамида терапия) при добавлении к тройной противорвотной комбинированной терапии, состоящей из серотонина (5-HT 3 ) антагонист рецептора, нейрокинин 1 (NK 1 ) антагонист и дексаметазон. 2 В частности, оланзапин был Показано, что он эффективен в уменьшении отсроченной тошноты и рвоты, которые возникают 24 до 120 часов после введения химиотерапии, и исторически контролировать труднее, чем острую тошноту и рвоту, возникающие внутри в первый день после начала рвотной химиотерапии.
Вкл. На основе исследований оланзапина в этой ситуации добавление 10 мг оланзапина триплетной комбинированной терапии было включено в руководящие принципы противорвотных средств от Американское общество клинической онкологии для пациентов, получающих высокоэффективное рвотная химиотерапия с оговоркой в некоторых руководствах, что доза снижение уровня оланзапина может быть необходимо пациентам, которые испытывают чрезмерное седация, а также пожилые пациенты.
Продолжить чтение
В это двойное слепое плацебо-контролируемое исследование фазы 3, которое проводилось в 26 больниц в Японии, 710 пациентов, получающих цисплатин (в дозе 50 мг / м) 2 или выше) были случайным образом распределены в соотношении 1: 1 для приема 5 мг оланзапин или плацебо перорально после ужина в дни с 1 по 4 в комбинации с триплетной терапией (например, палоносетрон, апрепитант, дексаметазон) как профилактика тошноты и рвоты, вызванных химиотерапией.
Все зачисленные пациенты наблюдались в течение 120 часов, а также заполняли ежедневные дневники это включало количество и время эпизодов рвоты, а также тяжесть и время появления тошноты и дневной сонливости.Первичная конечная точка исследования была доля пациентов, не испытывающих рвоты или рвоты (т.е. CR) в отсроченная фаза со вторичными конечными точками, включая частоту полного ответа в остром периоде (0-24 часа) и общие фазы (0-120 часов), а также доля пациенты в CR, испытывающие только легкую тошноту (т.е. полный контроль) или не испытывающие тошнота (т.е. полный контроль) и побочные эффекты.
Ключ Результаты исследования включали следующее:
- CR ставки (рвота) в отсроченной фазе 79% (группа оланзапина) по сравнению с 66% (плацебо). рука; П <.0001)
- Ставки CR (рвота) в острой фазе 95% (группа оланзапина) по сравнению с 89% (группа плацебо; P = 0,0021)
- Частота полного ответа (рвота) в течение всего периода 78% (группа оланзапина) по сравнению с 64% (плацебо). рука; P <.0001)
- Полный контроль частота в отсроченной фазе 78% (группа оланзапина) по сравнению с 64% (группа плацебо; P <0,0001)
- Полный контроль частота в острой фазе 76% (группа оланзапина) по сравнению с 61% (группа плацебо; P <.0001)
- Нет разницы в частота дневной сонливости между двумя группами исследования
- Связанные с лечением запор 3 степени (1 пациент) и сонливость (1 пациента) в группе оланзапина
Ограничением исследования, упомянутым авторами исследования, было исключение пациентов, получавших комбинацию антрациклина и циклофосфамид, еще один высокоэметогенный режим химиотерапии, который часто используется при лечении больных раком груди.
В своих заключительных комментариях исследователи заявил, что «оланзапин 5 мг в сочетании с апрепитантом, палоносетроном и дексаметазоном могут стать новым стандартом. вариант противорвотной терапии у пациентов, получающих химиотерапию на основе цисплатина.”
Частично на основе исследований фазы 2 оценка дозы оланзапина 5 мг в этой обстановке, рекомендации по борьбе с рвотой из Национальной комплексной онкологической сети (NCCN) в настоящее время рекомендуют использование от 5 до 10 мг оланзапина в сочетании с триплетной комбинированной терапией для пациентов, получавших высокоэметогенную химиотерапию. 3
Список литературы
1. Хашимото Х., Абэ М., Токуяма О. и др. Оланзапин 5 мг плюс стандартная противорвотная терапия для профилактики тошноты и рвоты, вызванной химиотерапией (J-FORCE): многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3 [опубликовано в Интернете 11 декабря 2019 г.]. Ланцет Онкол . DOI: 10.1016 / S1470-2045 (19) 30678-3
2. Navari RM, Qin R, Ruddy KJ, et al. Оланзапин для профилактики тошноты и рвоты, вызванных химиотерапией. N Engl J Med. 2016; 375: 131-142.
3. Руководство по борьбе с рвотой Национальной комплексной онкологической сети (NCCN). V1.2019. https://www.nccn.org/professionals/physician_gls/pdf/antiemesis.pdf. Обновлено: 29 февраля 2019 г. Проверено 16 января 2019 г.
Ароматерапия против перорального ондансетрона для противорвотной терапии среди взрослых пациентов отделения неотложной помощи — REBEL EM
3 декабря 2020
Ароматерапия против перорального ондансетрона для противорвотной терапии среди взрослых пациентов отделения неотложной помощи
Написано Марк Рамзи REBEL EM Медицинская категория: Брюшной полости и желудочно-кишечного тракта Справочная информация:Тошнота и / или рвота — основные жалобы, на которые ежегодно приходится более 4 миллионов посещений отделений неотложной помощи (ED). 1 Многочисленные исследования показали, что ароматерапия в виде «подготовительных» подушечек изопропилового спирта эффективна при послеоперационной тошноте и рвоте. 2,3 В частности, в ED одно рандомизированное контролируемое исследование показало облегчение тошноты с помощью ингаляционного изопропилового спирта по сравнению с плацебо. 4 Авторы этого исследования решили сделать еще один шаг вперед в этом плацебо-контролируемом рандомизированном контрольном исследовании, сравнив ароматерапию с пероральным ондансетроном у пациентов с ЭД с тошнотой и рвотой
Статья: April MD, et al.Ароматерапия по сравнению с пероральным ондансетроном для противорвотной терапии среди взрослых пациентов отделения неотложной помощи: рандомизированное контролируемое исследование. Ann Emerg Med. 2018 PMID: 29463461
Клинический вопрос:- Чем ароматерапия с использованием изопропилового спирта по сравнению с пероральным ондансетроном в качестве противорвотной терапии среди взрослых пациентов отделения неотложной помощи, не нуждающихся в немедленном внутривенном доступе?
- Одноцентровое плацебо-контролируемое слепое рандомизированное контрольное исследование в одной городской академической больнице третичного уровня
- Медперсонал уведомлял исследователей, когда потенциальные объекты исследования поступали на сортировку с тошнотой или рвотой в качестве основной жалобы
- Субъекты были рандомизированы в одну из следующих трех групп:
- Группа 1: Ингаляционный изопропиловый спирт и 4 мг ондансетрона перорально
- Группа 2: Ингаляционный изопропиловый спирт и пероральное плацебо
- Группа 3: ингаляционный солевой раствор плацебо и 4 мг перорального ондансетрона
- Пациентам было рекомендовано делать глубокие носовые ингаляции исследуемых препаратов так часто, как это требуется для достижения облегчения состояния носа
- Данные собирались через 10, 20, 30 и 60 минут после приема лекарств, а затем ежечасно, пока лечащие врачи не приняли решение об их удалении.
- Для обеспечения слепоты упаковки всех подушечек были закрыты, и испытуемые открывали свои собственные исследуемые лекарства.
- Если не хотят или не могут, исследователи открывали подушечку на расстоянии вытянутой руки, чтобы не уловить запах подушечки.
- Исследователи также проинструктировали пациентов избегать описания запаха прокладок им или последующим поставщикам во время визита в отделение неотложной помощи.
- Участие в исследовании не помешало субъектам получать обычную помощь, и субъекты могли получать спасительную противорвотную терапию в любое время
- Взрослые пациенты ≥ 18 лет
- Основная жалоба на тошноту или рвоту
- Тошнота, о которой сообщают сами пациенты, степень тяжести 3 или выше по вербальной числовой шкале реакции (от 0 до 10)
- Изменение психического статуса, препятствующее подписанию информированного согласия
- Невозможность вдохнуть через нос (т.е.Ринит)
- Известная история удлинения QT-сегмента
- Клиническое подозрение на серотониновый синдром
- Беременные
- Недавний прием лекарств, противопоказанных приему алкоголя (например, дисульфрам, цефоперазон, метронидазол)
- Известная аллергия на изопропиловый спирт или ондансетрон
- По усмотрению лечащего врача
- Пациенты, которым были установлены капельницы или которые получали противорвотную терапию в порядке сортировки (включая ароматерапию)
Первичный
- Изменение тошноты от исходного уровня до 30 минут после вмешательства, описанное с помощью визуальной аналоговой шкалы (ВАШ) от 0 до 100 мм
Вторичный
- Изменение оценки боли по ВАШ от исходного уровня до 30 минут после вмешательства
- Рвота во время пребывания в ЭД
- Получение спасательных противорвотных препаратов во время пребывания в больнице
- Поступление в больницу
- ED продолжительность пребывания
- 208 пациентов прошли скрининг на предмет включения в исследование, 61 субъект не соответствовал всем критериям включения и исключения, а 25 отказались от участия
- Из оставшихся 122 пациентов двое выбыли, оставив остальных для рандомизации следующим образом:
- 40 в группе 1: ароматерапия + пероральный ондансетрон
- 40 в группе 2: ароматерапия + пероральное плацебо
- 40 в группе 3: ингаляционное плацебо + пероральный ондансетрон
- Исходные характеристики были сопоставимы во всех трех группах, однако в группе 2 было меньше женщин
- По сравнению с ингаляционным плацебо, обе группы ингаляционного изопропилового спирта испытали более низкие средние значения тошноты по ВАШ
- Группы, подвергавшиеся воздействию ингаляционного изопропилового спирта, имели более высокие баллы удовлетворенности на момент обращения (чем меньше число, тем больше удовлетворение)
- У субъектов, получавших ингаляционный изопропиловый спирт, наблюдалось большее уменьшение боли по сравнению с плацебо
- Ни один субъект не получал спасательные противорвотные средства до измерения первичного результата
- Первое исследование по сравнению ингаляционной ароматерапии с использованием изопропилового спирта не только с плацебо, но и с ондансетроном
- Помогает ответить на клинически значимый вопрос о вариантах противорвотной терапии
- Набор медсестер для сортировки пациентов до того, как они получат доступ к внутривенному вводу или какой-либо терапии
- Внедрил сложную стратегию ослепления и измерил эффективность их ослепления, опросив субъектов, поставщиков медицинских услуг и исследователей, было ли исследуемое лекарство, полученное субъектом, лечением или плацебо
- Проведена спасательная противорвотная терапия пациентам всех групп
- Исследователи опросили субъектов об их общей удовлетворенности полученным лечением
- Включены другие вторичные исходы, представляющие интерес для врачей неотложной помощи, такие как продолжительность пребывания в отделении неотложной помощи, получение экстренной противорвотной терапии и госпитализация
- Малый размер выборки
- Более здоровая популяция пациентов, у которых не было доступа для внутривенных вливаний, что ограничивает возможность обобщения до пациентов с более тяжелой тошнотой
- Зачисление было удобной выборкой, что могло привести к смещению выборки
- Выполняется в одном городском академическом центре, что ограничивает внешнюю действительность в других учреждениях
- Исключение беременных — это упущенная возможность для большой группы населения с этой частой основной жалобой
- Ароматерапия сравнивалась только с одной пероральной противорвотной терапией
- 30 минут в качестве измерения первичного результата могло быть недостаточно для того, чтобы ондансетрон подействовал
- баллов по ВАШ для измерения тошноты и уменьшения боли субъективны
- Это исследование чрезвычайно ценно и меняет практику, поскольку в нем используется простой и недорогой агент с часто встречающейся главной жалобой.Если применяется при сортировке, немедленный внутривенный доступ не всегда может быть необходим
- Кроме того, это может обеспечить более быстрое облегчение, чем пероральные препараты, и, таким образом, привести к большему удовлетворению пациентов. Хотя это и анекдотично, я лично использовал ингаляционную ароматерапию в течение довольно долгого времени и обычно вижу облегчение в течение нескольких секунд или минут у пациентов, которые активно рвут
- Сравнение ароматерапии с пероральными противорвотными средствами и обнаружение, что она приводит к большему облегчению тошноты, чем только противорвотные средства, означает, что ее можно использовать в качестве еще одного инструмента у пациентов, которые не поддаются обычно применяемой стандартной терапии.
- Важно отметить, что авторы сравнили вдыхание изопропилового спирта только с одним другим противорвотным средством.В будущих исследованиях следует рассмотреть возможность сравнения этих методов лечения, чтобы определить, какая комбинация наиболее эффективна
- Авторы признают, что использование баллов по ВАШ является субъективным и важным для исходов, ориентированных на пациента. К сожалению, это лучшее, что у нас есть при измерении неопределенных переменных, таких как тошнота и боль. Помимо учета процента пациентов, которых рвало во время пребывания в отделении неотложной помощи, авторы, хотя это и трудно сделать, должны были записать фактическое количество случаев рвоты у пациентов
- Результаты этого исследования дополняют предыдущую литературу, показывающую улучшение уменьшения тошноты при вдыхании изопропилового спирта по сравнению с плацебо у пациентов отделения неотложной помощи 4
- Авторы обосновали свое использование 30-минутной отметки времени тем, что многие врачи рассмотрели бы альтернативный препарат, если бы у пациента продолжались симптомы
- В этом исследовании недооценивается оставшийся уход за пациентом.Более быстрое облегчение тошноты и рвоты могло произойти в результате введения жидкости и лечения первопричины (например, головной боли, ИМП, электролитных нарушений)
Выводы авторов:
- У пациентов с ЭД с острой тошнотой, не требующих немедленного внутривенного доступа, ароматерапия с ондансетроном или без него обеспечивает большее облегчение тошноты, чем пероральный ондансетрон только перорально
- Ингаляционный изопропиловый спирт — это простое, быстрое и недорогое средство, которое можно комбинировать с пероральными средствами и использовать в качестве противорвотного средства у взрослых пациентов отделения неотложной помощи.Немедленное облегчение тошноты и рвоты также может улучшить удовлетворенность пациента и предотвратить установку внутривенного катетера. При применении результатов этого исследования к беременным пациентам, детям и тем, у кого сильная тошнота и рвота, необходимы дополнительные исследования
- Прокладки с изопропиловым спиртом для ингаляции — это простое и недорогое средство, которое следует добавить в качестве еще одного средства, среди других противорвотных средств, при лечении взрослых пациентов отделения неотложной помощи с тошнотой и рвотой
Дополнительные мысли по этой теме:
СПРАВОЧНИК:
- April MD, et al.Ароматерапия по сравнению с пероральным ондансетроном для противорвотной терапии среди взрослых пациентов отделения неотложной помощи: рандомизированное контролируемое исследование. Ann Emerg Med. 2018 PMID: 29463461
- Hines S, et al. Ароматерапия для лечения послеоперационной тошноты и рвоты. Кокрановская база данных Syst Rev.2012, 18 апреля; PMID: 22513952
- Teran L, et al. Эффективность ингаляционного изопропилового спирта по сравнению с гранисетроном для профилактики послеоперационной тошноты и рвоты. AANA J. 2007 декабрь; PMID: 18179001
- Beadle KL, et al.Назальные ингаляции изопропиловым спиртом при тошноте в отделении неотложной помощи: рандомизированное контролируемое исследование. Ann Emerg Med. 2016 июл; PMID: 26679977
Сообщение Рецензент: Salim R. Rezaie, MD (Twitter: @srreziae)
Цитируйте эту статью как: Марк Рамзи, «Ароматерапия против перорального ондансетрона для противорвотной терапии среди взрослых пациентов отделения неотложной помощи», блог REBEL EM, 3 декабря 2020 г. Доступно по адресу: https://rebelem.com/aromatherapy-vs-oral -ондансетрон-для-противорвотной-терапии-среди-взрослых-пациентов отделения неотложной помощи /.
 Phase I and pharmacokinetic study of Yondelis (ecteinascidin-743, ET-743) administreted as on infusion over 1h or 3h every 21 days in patients with solid tumors. Eur J Cancer 2003; 39: 1842–51.
Phase I and pharmacokinetic study of Yondelis (ecteinascidin-743, ET-743) administreted as on infusion over 1h or 3h every 21 days in patients with solid tumors. Eur J Cancer 2003; 39: 1842–51. Ann Oncol 2009; 20: 1794–802.
Ann Oncol 2009; 20: 1794–802. Cancer Chemoter Pharmacol 2008; 63: 181–8.
Cancer Chemoter Pharmacol 2008; 63: 181–8. Eur J Cancer Suppl 2009; 7: 451.
Eur J Cancer Suppl 2009; 7: 451. Neth J Med 2009; 67: 272–83.
Neth J Med 2009; 67: 272–83.