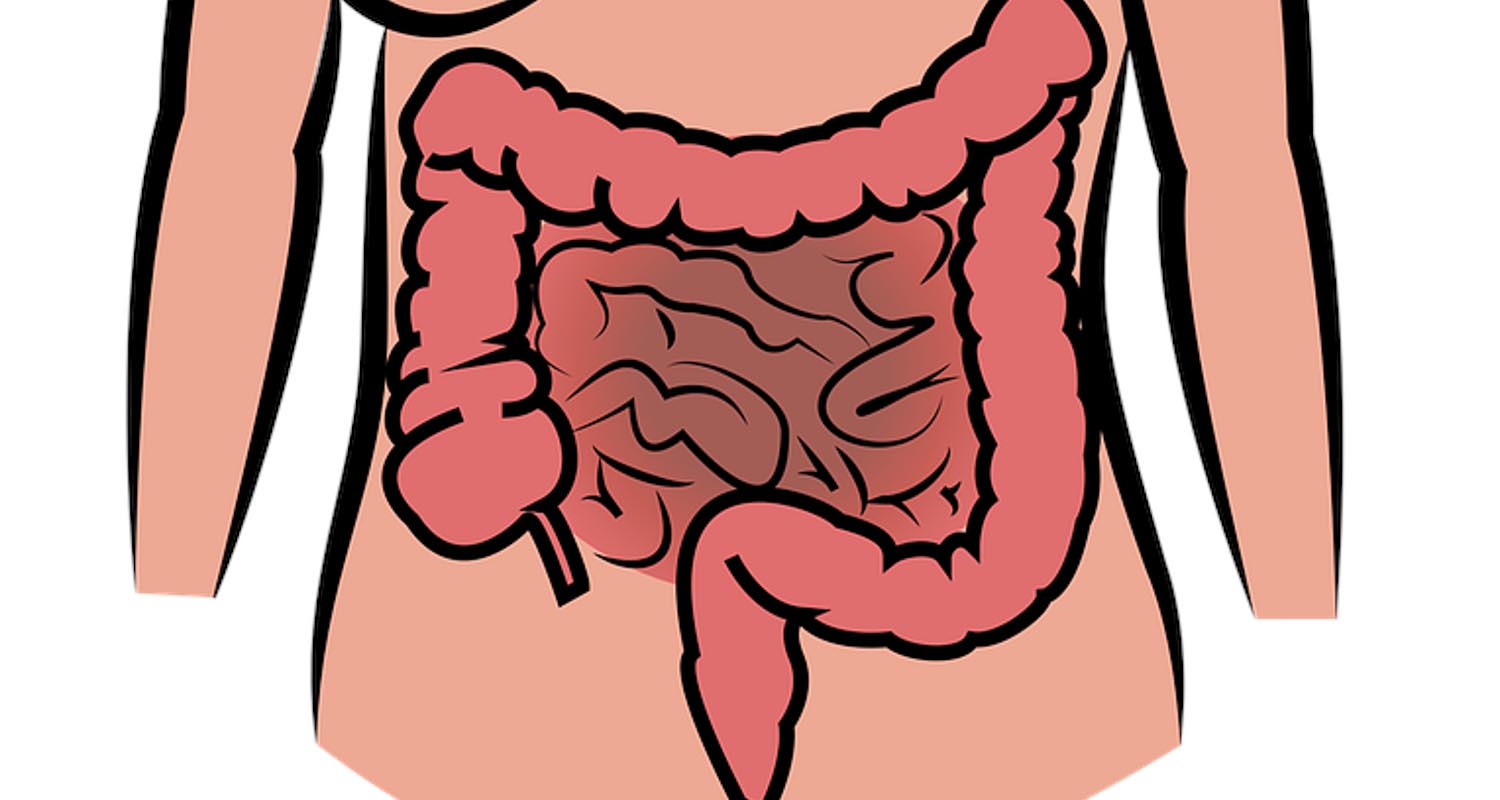
Рак толстой кишки: описание заболевания
Быстрый переходКолоректальный рак – это рак толстой кишки, которая является конечной частью желудочно-кишечного тракта и включает в себя ободочную, сигмовидную и прямую кишку.
Большинство случаев рака толстой кишки начинается с небольших доброкачественных опухолей, которые называются аденоматозные полипы и аденомы. Со временем некоторые из этих полипов могут перерождаться в злокачественную опухоль и становиться раком толстой кишки.
Полипы могут не вызывать симптомов, либо симптомы малозаметны. По этой причине врачи рекомендуют проводить регулярные скрининговые тесты для предотвращения рака толстой кишки, путем выявления и удаления полипов до того, как они превратятся в рак.
Какие симптомы у рака толстой кишки?
Признаки рака толстой кишки включают в себя:
- Изменения в привычной работе кишечника, включая диарею или запор, изменение консистенции стула, которые длятся более четырех недель.

- Выделение крови или примесь крови в стуле.
- Постоянный дискомфорт в животе, такой как вздутие живота, боли переменного характера.
- Чувство не полного опорожнения кишечника.
- Общая слабость, быстрая утомляемость.
- Необъяснимая потеря веса.
На ранних стадиях рака толстой кишки многие люди не испытывают симптомов. Когда появляются симптомы, они обычно изменяются в зависимости от размера опухоли и ее локализации в толстом кишечнике.
Когда необходимо обратиться к врачу?
Если вы заметили какие-либо симптомы рака толстой кишки, такие как примесь крови в стуле или постоянный дискомфорт в кишечника, не стесняйтесь записаться на прием к врачу.
В клинике Рассвет работает мультидисциплинарная команда высококвалифицированных специалистов – гастроэнтерологов, терапевтов, диетологов, к которым вы можете обратиться за помощью.
Врач сначала изучит более распространенные причины этих признаков и симптомов, а при выявлении опухолевого процесса направит на консультацию к врачу-онкологу клиники Рассвет.
Также вы можете узнать, когда следует начать скрининг рака толстой кишки. Как правило, его рекомендуется начинать в возрасте после 50 лет. Но ваш врач может порекомендовать более частое или раннее обследование, если у вас есть факторы риска.
Каковы причины возникновения рака толстой кишки?
В большинстве случаев окончательно не установлено, что именно вызывает рак толстой кишки. Врачи знают, что он возникает тогда, когда у здоровых клеток толстой кишки возникают ошибки в их генетическом коде – ДНК.
Здоровые клетки растут и делятся таким образом, чтобы поддерживать нормальное функционирование организма. Но когда ДНК-клетки повреждается и клетка становится раковой, она продолжают делиться, даже если новые клетки не нужны. Иммунная система в норме выявляет и уничтожает такие клетки, но со временем раковые клетки приобретают способность «ускользать» от иммунной системы. Так образуется злокачественная опухоль.
Со временем количество раковых клеток растет, они проникают в близлежащие ткани и разрушают их.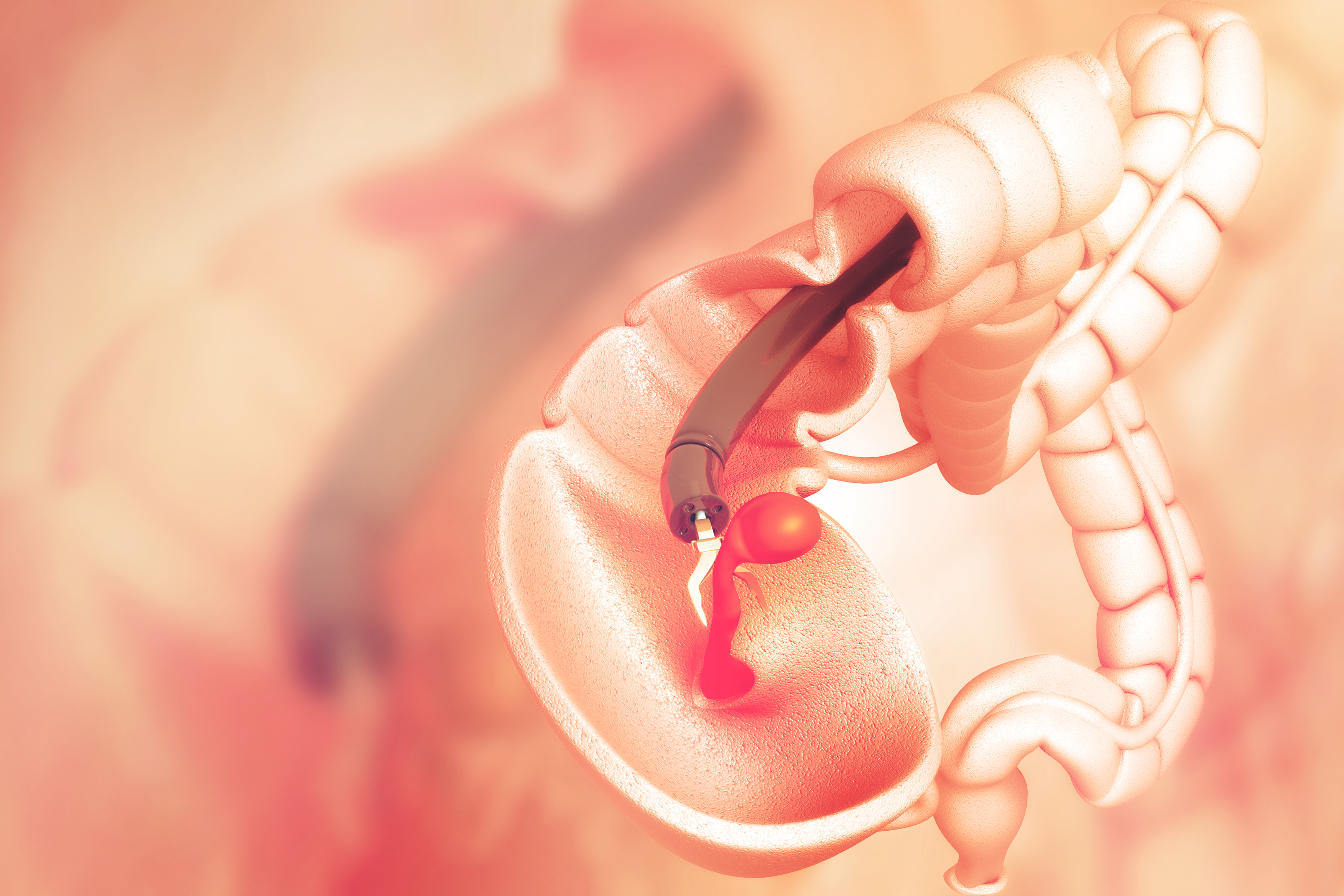 Также раковые клетки могут перемещаться в другие части тела. Это называется метастазирование.
Также раковые клетки могут перемещаться в другие части тела. Это называется метастазирование.
Наследственный рак толстой кишки
Унаследованные мутации генов, повышающие риск развития рака толстой кишки, могут передаваться в семье, но эти наследственные изменения в генах связаны лишь с небольшим процентом случаев рака толстой кишки.
Унаследованные мутации генов не всегда обязательно приводят к раку, но могут значительно повысить риск заболевания.
Наиболее распространенными наследственными онкологическими синдромами, связанными с раком толстой кишки, являются:
- Семейный аденоматозный полипоз (Familial adenomatous polyposis, FAP). FAP – это редкое заболевание, которое приводит к образованию тысяч полипов в слизистой оболочки толстой и прямой кишки. При этом заболевании у пациента имеется почти 100%-ная вероятность развития рака толстой кишки к 40 летнему возрасту.
- Наследственный рак толстой кишки без полипоза (Hereditary nonpolyposis colorectal cancer, HNPCC), также называемый синдромом Линча.

Пациенты с синдромом Линча имеют 50-70%-ный риск заболевания раком толстой кишки в течение жизни.
FAP, синдром Линча и другие, более редкие, наследственные онкологические синдромы толстой кишки могут быть обнаружены с помощью генетического тестирования. Если вас беспокоит история заболевания раком толстой кишки в вашей семье, и вы хотите выяснить, насколько высок риск заболеть раком толстой кишки, запишитесь на консультацию онколога клиники Рассвет.
Врач определит необходимую программу обследования для определения степени риска и расскажет о методах профилактики рака в вашем случае.
Связь между питанием и повышенным риском развития рака толстой кишки
Исследования больших групп людей показали связь между типичным «западным» рационом питания и повышенным риском рака толстой кишки. Типичный «западный» рацион питания отличается высоким содержанием жиров и малым содержание клетчатки.
Когда люди переезжают из районов, где принята диета с низким содержанием жиров и высоким содержанием клетчатки в районы с типичной «западной» диетой, риск развития рака толстой кишки у них значительно возрастает. Это объясняется влиянием диеты с высоким содержанием жира и низким содержанием клетчатки на бактерий, которые в норме живут в толстой кишке, и поддержанием хронического воспаления, способствующего возникновению рака. В настоящее время эта тема является предметом активных исследований.
Также риск развития рака толстой кишки увеличивает повышенное употребление красного мяса и продуктов мясной переработки.
Какие существуют факторы риска рака толстой кишки?
Факторы, которые могут увеличить риск развития рака толстой кишки, включают в себя:
- Пожилой возраст.
 В подавляющем большинстве случаев рак толстой кишки возникает у лиц старше 50 лет. Данное заболевание может встречаться и у молодых людей, но гораздо реже.
В подавляющем большинстве случаев рак толстой кишки возникает у лиц старше 50 лет. Данное заболевание может встречаться и у молодых людей, но гораздо реже. - Афроамериканская раса. Афроамериканцы имеют больший риск заболевания раком толстой кишки, чем представители других рас.
- Рак толстой кишки в анамнезе. Если у вас уже был рак толстой кишки или аденоматозный полип, то вы имеете повышенный риск развития рака толстой кишки в будущем.
- Воспалительные заболевания кишечника. Хронические воспалительные заболевания толстой кишки, такие как язвенный колит или болезнь Крона, могут повысить риск развития рака толстой кишки.
- Наследственные синдромы. Генетические синдромы, передающиеся из поколения в поколение, могут повысить риск заболевания раком толстой кишки. Эти синдромы включают семейный аденоматозный полипоз и наследственный рак толстой кишки без полипоза, который также известен как синдром Линча.
- Семейная история рака толстой кишки.

- Диета с низким содержанием клетчатки и высоким содержанием жиров.
- Малоподвижный образ жизни. У лиц с низкой физической активностью повышен риск развития рака толстой кишки. Регулярная физическая активность может снизить риск его развития.
- Сахарный диабет. Люди с диабетом и резистентностью к инсулину имеют повышенный риск развития рака толстой кишки.
- Ожирение. Люди с ожирением имеют повышенный риск развития онкологии толстой кишки и риск смерти от нее по сравнению с людьми, чей вес находится в норме.
- Курение. Курящие люди имеют повышенный риск развития рака толстой кишки.
- Алкоголь. Чрезмерное употребление алкоголя повышает риск развития этого онкологического заболевания.
- Лучевая терапия. Лица, прошедшие лучевую терапию на область живота или область таза по поводу лечения другой онкологии, имеют повышенный риск развития рака толстой кишки.

Профилактика рака толстой кишки. Скрининг
Важнейшее место в профилактике рака толстой кишки занимает скрининг.
Врачи рекомендуют определенные скрининговые тесты здоровым людям без признаков или симптомов болезни для выявления рака толстой кишки на ранней стадии.
Обнаружение рака толстой кишки на самой ранней стадии дает наибольшие шансы на излечение. Было показано, что скрининг снижает риск смерти от этого заболевания.
В соответствии с рекомендациями Американского онкологического сообщества, следует начинать регулярный скрининг рака толстой кишки в возрасте 45–50 лет. Это можно сделать либо с помощью теста на скрытую кровь в кале, либо с помощью осмотра толстой кишки при эндоскопической процедуре – колоноскопии или нижних ее отделов — ректосигмоидоскопии. Также возможно проведение КТ–колонографии – это исследование с помощью компьютерной томографии.
Людям с хорошим здоровьем следует проводить регулярное обследование на рак толстой кишки до достижения 75-летнего возраста.
Для людей в возрасте 76-85 лет решение о прохождении скрининга принимается индивидуально, совместно с врачом, и должно основываться на предпочтениях, ожидаемой продолжительности жизни, общем состоянии здоровья и истории предыдущих скрининговых обследований.
Людям старше 85 лет проведение скрининга рака толстой кишки не рекомендовано.
Различают следующие виды скрининга рака толстой кишки:
- Колоноскопия. Обычно проводится 1 раз в 10 лет при отсутствии признаков патологии.
- КТ-колонография. Проводится каждые 5 лет.
Еще одной скрининговой опцией является ежегодный анализ кала на скрытую кровь в комбинации с ректосигмоидоскопией раз в 5 лет.
Каждый из методов имеет свои преимущества и недостатки. Проконсультируйтесь с врачом, и вместе вы сможете решить, какие анализы подходят именно вам. Если для скрининга используется колоноскопия, полипы могут быть удалены во время процедуры, прежде чем они превратятся в рак.
Самое главное – пройти скрининг. В клинике Рассвет вы можете получить консультацию онколога о видах обследований для скрининга рака толстой кишки и решить, какой метод подойдет именно вам.
Людям с повышенным риском развития колоректального рака может быть предписана индивидуальная программа, так как может понадобиться начать скрининг до 45 лет, чаще проходить его и/или проходить специальные тесты.
Риск рака толстой кишки повышен, если:
- Имеется семейная история рака толстой кишки или некоторых типов полипов.
- Лечение рака толстой кишки или некоторых типов полипов в пролом.
- Имеются воспалительные болезни кишечника (язвенный колит или болезнь Крона).
- Известнен семейный анамнез наследственного колоректального рака, такого как семейный аденоматоз (FAP) или синдром Линча.
- Ранее проводилась лучевая терапия на область живота или области таза по поводу лечения другого рака.

- В семье один или несколько членов, больных раком толстой кишки.
- Люди, у которых во время колоноскопии были удалены определенные типы полипов.
Если вы имеете повышенный риск рака толстой кишки, вы можете проконсультироваться у специалистов клиники Рассвет, получить индивидуальную программу скрининга, которая необходима в вашем случае.
Советы врачей клиники Рассвет по изменению образа жизни для снижения риска заболевания раком толстой кишки
Вы можете предпринять шаги для снижения риска развития рака толстой кишки, внося изменения в вашу повседневную жизнь. Для этого необходимо:
- Есть разнообразные фрукты, овощи и цельные зерна. Фрукты, овощи и цельные зерна содержат витамины, минералы, клетчатку и антиоксиданты, которые могут играют важную роль в профилактике рака. Выбирайте разнообразные фрукты и овощи, чтобы получать различные витамины и питательные вещества.
- Употребляйте алкоголь умеренно, или не пейте вообщее.
 Если вы употребляете спиртное, ограничивайте количество выпиваемого вами алкоголя не более чем одним напитком в день для женщин и двумя — для мужчин.
Если вы употребляете спиртное, ограничивайте количество выпиваемого вами алкоголя не более чем одним напитком в день для женщин и двумя — для мужчин. - Откажитесь от курения. Бросить курить самостоятельно может быть очень сложно, вы можете обратиться к врачам клиники Рассвет. Вам предоставят практические советы и информацию о существующих медикаментах, позволяющих облегчить отказ от курения.
- Будьте физически активны как можно больше дней в неделе. Постарайтесь выполнять физические упражнения не менее 30 минут как можно чаще. Если вы были неактивны, начинайте постепенно и наращивайте время до 30 минут.
- Поддерживайте нормальный вес. Для поддержания веса сочетайте здоровое питание с ежедневными физическими упражнениями. Если вам необходимо сбросить вес, в клинике Рассвет вы можете получить консультацию диетолога о здоровых способах достижения вашей цели. Стремитесь к медленному похудению, увеличивая количество выполняемых упражнений и уменьшая количество потребляемых калорий.

Диагностика рака толстой кишки
Если ваши симптомы указывают на то, что у вас может быть рак толстой кишки, вам необходимо провести дополнительное обследование. Для этого используют следующие процедуры:
Эндоскопическая диагностика:
1. Колоноскопия. При колоноскопии используется специальный инструмент (колоноскоп), представляющий длинную, гибкую и тонкую трубку, совмещенную с видеокамерой и монитором. Тем самым врач осуществляет осмотр слизистой оболочки всей толстой кишки.
При обнаружении подозрительной ткани или полипов, он проводит через колоноскоп хирургические инструменты и выполняет забор образцов ткани (биопсии) или выполняет удаление полипов. В клинике Рассвет процедура проходит под общей анестезией, что позволяет сделать ее безболезненной и избежать дискомфорта при исследовании.
Биопсия ткани крайне важна, так ткань подвергается современной патоморфологической диагностике, с проведением гистологического, иммуногистохимического и молекулярно–генетического исследования, это позволяет не только поставить диагноз, но и правильно назначить лечение.
После того как установлен диагноз «рак толстой кишки», назначаются обследования, позволяющие определить степень его распространенности. Правильное определение степени распространенности опухолевого процесса (стадии) необходимо для подбора наиболее подходящего протокола лечения.
Эти обследования включают визуализирующие процедуры, такие как компьютерная томография органов брюшной полости и грудной клетки.
2. Магнито-резонансная томография органов малого таза. Окончательный объем обследования устанавливает врач, исходя из жалоб и клинической картины заболевания.
3. Также проводятся клинические анализы крови. Анализ крови не может определить рак толстой кишки. Но врач способен проверить вашу кровь на предмет выявления признаков нарушений общего состояния здоровья.
Проводится анализ крови на наличие в ней онкомаркеров — химических веществ, иногда вырабатываемых клетками рака толстой кишки (карциноэмбриональный антиген СА19-9 или СЕА). Отслеживаемый в динамике уровень онкомаркера, также может помочь врачу оценить прогноз болезни и понять, реагирует ли ваш рак на лечение.
Отслеживаемый в динамике уровень онкомаркера, также может помочь врачу оценить прогноз болезни и понять, реагирует ли ваш рак на лечение.
В некоторых случаях стадия распространенности опухоли может быть определена только после операции по удалению рака толстой кишки.
Стадии рака толстой кишки
Существует 4 стадии протекания данного заболевания:
- I стадия. Рак распространяется в пределах стенки толстого кишечника, но не распространяется за ее стенку или прямую кишку.
- II стадия. Рак прорастает через всю толщу стенки толстой кишки и может прорастать на соседние ткани, но не распространяется на соседние лимфатические узлы.
- III стадия. Рак распространяется на близлежащие лимфатические узлы, но не поражает другие части организма.
- IV стадия. Рак распространяется на отдаленные органы, такие как, например, печень или легкие.
Как лечить рак толстой кишки
В лечении рака толстой кишки, как и при большинстве остальных злокачественных опухолей, применяются хирургическое вмешательство, химиотерапия, лучевая терапия и их комбинации.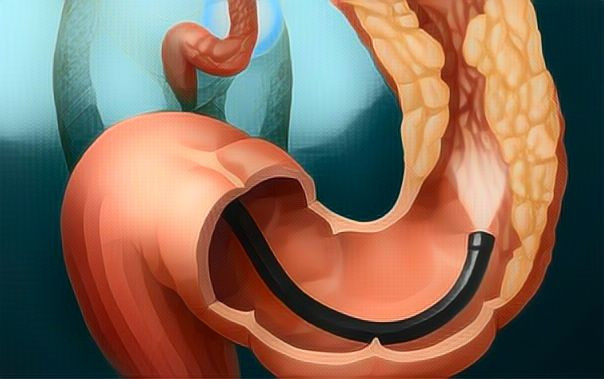 Необходимость и последовательность каждого их этих этапов определяется с учетом распространенности процесса, а также состояния пациента и выявленных сопутствующих заболеваний.
Необходимость и последовательность каждого их этих этапов определяется с учетом распространенности процесса, а также состояния пациента и выявленных сопутствующих заболеваний.
В клинике Рассвет для лечения злокачественных опухолей толстой кишки применяется тактика мультидисциплинарного подхода с обсуждением сложных случаем на консилиуме с привлечением хирурга, химиотерапевта и радиотерапевта.
В клинике Рассвет есть все необходимое для проведения химиотерапии при раке толстой кишки по российским и западным протоколам, а также сопроводительной терапии. При необходимости осуществляется маршрутизация пациента на другие методы лечения.
Автор:
Рак прямой кишки — лечение, операция по удалению онкологии прямой кишки в СПб
Процесс сопровождается метастазированием и может протекать в 4 стадии. Данная патология требует ранней постановки диагноза, так как это повышает шансы на эффективное лечение. Немного чаще болеют пациенты мужского пола. Риск болезни повышается после возраста 45 лет, а возрастная группа 70-75 лет подвергается самой высокой опасности в плане данной патологии.
Немного чаще болеют пациенты мужского пола. Риск болезни повышается после возраста 45 лет, а возрастная группа 70-75 лет подвергается самой высокой опасности в плане данной патологии.
Почему возникает рак прямой кишки?
Нет единственной причины, которая сопряжена с возникновением онкологического процесса в прямой кишке. Ученые выделяют два основных фактора риска: особенности питания и наследственная склонность. Также, на возникновение рака прямой кишки влияют другие причины. Рассмотрим их подробнее.
Особенности питания, которые повышают риск возникновения колоректального рака:
- преобладание жиров животного происхождения в питании или их высокое количество;
- низкое содержание растительной клетчатки в рационе;
- употребление большего количества пищи, чем требуется организму;
- злоупотребление алкоголем.
От вредного воздействия канцерогенных веществ слизистую кишечника защищают продукты, богатые клетчаткой, с низким содержанием насыщенных жиров и трансжиров. Полезными также являются продукты, которые содержат кальций, витамин D и С.
Полезными также являются продукты, которые содержат кальций, витамин D и С.
Наследственная склонность к заболеванию доказана целым рядом исследований, в которых ученые изучали семейный анамнез пациентов с различными формами колоректального рака. Особенно прослеживается связь генетических мутаций с формированием полипоза и наследственного неполипозного рака.
На молекулярном уровне эта связь объясняется мутациями в комплексе генов. Наиболее часто поражаются гены MLh2и MSh3. Это важно для того, чтобы, в случае обнаружения данной мутации у пациента, проверку прошла вся семья. Если человек входит в группу риска, лучше время от времени проходить скрининг с целью обнаружения процесса на ранних стадиях.
Остальные причины развития болезни включают в себя следующие факторы:
- наличие аденом, полипов, доброкачественных новообразований прямой кишки;
- хронический колит;
- болезнь Крона;
- воздействие канцерогенов;
- дефицит иммунной системы;
- хронические инфекционные процессы;
- поражение организма вирусом папилломы человека;
- наличие онкологического процесса в тканях молочной железы или половых органов у женщин;
Причины рака действуют на организм комплексно, особенно возрастает риск заболевания при действии нескольких факторов или при их длительном влиянии на организм.
Стоит обратить внимание на полипы, так как рак прямой кишки часто формируется на месте их возникновения. Это первоначально доброкачественное новообразование, которое может приобрести злокачественный характер со временем.
Как распознать заболевание?
Как и в случае других онкологических процессов, коварство рака прямой кишки заключается в том, что ранние стадии протекают бессимптомно. А ведь на данном этапе возможно полное выздоровление, так как опухоль еще не проросла в мышечный слой кишечной стенки и не распространяет метастазы.
Чуть позже начинается появление симптомов, среди которых следует выделить:
- появление крови в стуле;
- выделение слизи из заднего прохода;
- нарушается стул — он может стать нерегулярным, запоры сменяются диареей;
- болезненность в животе и в зоне заднего прохода;
- беспричинное снижение веса;
- слабость;
- признаки анемии — учащение сердцебиения, одышка, бледность кожных покровов, сонливость и вялость;
- появляются болезненные позывы к дефекации.

Многие пациенты недооценивают некоторые симптомы такого рода и не решаются поговорить о них с врачом. И зря, ведь это отражает функционирование организма. Опытный специалист всегда деликатно уточнит наличие тех или иных симптомов и не пропустит ключевые признаки болезни.
На той стадии, которая не сопровождается симптомами, единственным методом диагностики является профилактическая колоноскопия. Это стоит помнить пациентам старше 45-50 лет, а также тем, кто входит в группу риска.
Стадии развития колоректального рака
Стадийность заболевания зависит от распространения опухоли относительно стенок кишечника. Это влияет на симптоматику и прогноз по выздоровлению.
- 1 стадия характеризуется тем, что опухоль не проникает за пределы стенки кишечника. Соответственно, жалобы практически отсутствуют. Может наблюдаться незначительное появление слизистых выделений вместе с калом. Эта стадия легко поддается лечению, так как лимфатические узлы не вовлечены в процесс и отсутствуют метастазы.
- 2 стадия процесса — это прорастание опухолью всех слоев толстого кишечника и возможное вовлечение в процесс клетчатки, которая окружает прямую кишку. Метастазы еще не распространены. Симптоматика становится разнообразнее: появляется дискомфорт в области прямой кишки, который некоторые пациенты описывают, как ощущение инородного тела. Тревожат неприятные ощущения в нижней части живота, появляются более обильные примеси в стуле, среди которых слизь, кровь.
- 3 стадия может совпадает с нарушением проходимости прямой кишки, настолько большой в размерах становится опухоль и/или появляются метастазы в лимфатических узлах вокруг прямой кишки. Злокачественные ткани прорастают в окружающие участки, поражают клетчатку, соседние органы и лимфатические узлы. Пациенты могут отмечатьухудшение состояния, появление диспепсических расстройств: урчания в животе, вздутия, ненастоящих позывов к дефекации. Тревожат спазмы, боль, вкрапления крови в стуле, появляются запоры и диареи. Общее состояние также становится тяжелым: пациент жалуется на слабость, бледность, снижение аппетита и работоспособности.
- 4 стадия — пик распространения опухоли. Она может прекратить работу кишечника и (нарушает) работы соседних органов. Наблюдается метастазирование в отдаленных лимфатических узлах, а также в печени, легких, желудке, костях. Из наиболее тяжелых симптомов — кишечная непроходимость, задержка стула и газов, рвота. Беспокоит болезненность в животе, а также в тех органах, которые поражены вторичной опухолью. Зачастую возникаетболезненное истощение, может наблюдаться нарушение работы центральной нервной системы.
Для классификации стадии процесса используется система TNM. Обозначение T говорит о размерах опухоли и её отношении к окружающим тканям. N — это регионарные лимфоузлы, в которые распространяется процесс. M — это обозначение метастазов, их количество и распространение. Это общепринятая классификация, которая используется во всем мире.
Осложнения заболевания
- воспалительные процессы в окружающих тканях;
- прорастание опухоли в соседние органы;
- обтурационная непроходимость кишки;
- кровотечение из опухоли.
Рассмотрим подробнее эти состояния.
Опухоль из прямой кишки может перфорировать стенку и расти в ткани мочеточников, мочевого пузыря, женских половых органов, простаты. Это приводит к нарушению их работы и появлению соответствующих симптомов.
Непроходимость кишечника чаще всего возникает, если опухоль расположена над ампулой кишки или в аноректальном отделе. В зависимости от стадии процесса, развивается полная или частичная непроходимость кишечника.
Кровотечение чаще всего наблюдается при распаде опухоли. Это осложнение характерно для экзофитного роста новообразования. Если в зоне распада опухоли проходят кровеносные сосуды, они также разрушаются и происходит потеря крови. Это приводит к анемии у пациента. Кровотечение открывается в задний проход, наблюдается выделение алой или темной крови. Большая кровопотеря отражается в слабости, головокружении. Человек становится бледным, беспокоит шум в ушах, учащается пульс и дыхание, возможны потери сознания.
Прорастание опухоли в мочевой пузырь сопровождается изменениями мочи. Она становится мутной, могут появляться каловые примеси, возникает воспалительный процесс в тканях органа. Пациента беспокоит боль, жжение, ощущение неполного опорожнения мочевого пузыря. Характерным симптомом является вытекание мочи из заднего прохода.
У женщин может наблюдаться формирование кишечно-влагалищных свищей. Из влагалища выделяются газы, каловые массы, выделения слизистого характера с мутным цветом и неприятным запахом.
Важно отметить, что все эти осложнения сопровождают поздние стадии патологии.
Диагностика рака прямой кишки
Особое место в диагностике рака прямой кишки занимает скрининг. Это раннее выявление рака на тех стадиях, когда болезнь не беспокоит пациента. Скрининговые методы:
- пальцевое исследование прямой кишки;
- анализ кала на скрытую кровь;
- эндоскопические методики.
Обратите внимание, что пальцевым методом можно своевременно обнаружить около 70% карцином. А около 4-5% условно здорового населения дает положительный результат на гемокульт-тест, который реагирует на периодические кровотечения рака прямой кишки.
Из эндоскопических методов используется колоноскопия. Этот метод позволяет диагностировать не только рак, но и предраковые состояния.
Подтверждение диагноза возможно только после проведения биопсии. Для этого на анализ берется фрагмент опухолевой ткани, который направляется на гистологический анализ.
Также, назначается ряд исследований, которые определяют распространенность опухолевого роста:
- УЗИ через брюшную стенку и трансректальное УЗИ;
- КТ;
- МРТ.
На основе точной диагностики возможно назначение эффективного лечения. Лечащему врачу важно знать локализацию, распространение опухоли, наличие метастазов и их местоположение.
Современные методы лечения колоректального рака
Среди современных методов лечения рака выделяют хирургический метод, химиотерапию и лучевую терапию. Также, на современном этапе применяются биологические и иммунные препараты.
- Лучевая терапия применяется, если до операции врач обнаружил, что в процесс вовлечены все три слоя кишечной стенки, присутствуют метастазы в лимфоузлах. Радиотерапия показана до операции, как один из этапов подготовки к хирургическому вмешательству.
- Комбинация химиотерапии и лучевого воздействия применяется при местном распространении рака, при поражении лимфоузлов, при прорастании опухолью фасции кишечника (когда опухоль неподвижна относительно таза).
Конкретный вид и последовательность лечения определяется на основе клинических, гистологических, инструментальных исследований. Лечение рака должно быть комплексным. Оно подразумевает поддержку организма во время химиотерапии и лучевого воздействия, качественное послеоперационное лечение.
Оперативная тактика
- 1. Если позволяет размер опухоли, вмешательство проводится эндоскопически. Этот вид вмешательства возможен, если рост опухоли затрагивает только слизистый и подслизистый слои.
- 2. Современный метод лечения — трансанальная эндомикрохирургия. Она позволяет максимально сохранить стенки кишечника и характеризуется максимально комфортным послеоперационным периодом.
- 3. Если опухоль достигла мышечного слоя — удаляется весь участок кишечника, который вовлечен в процесс. Также удаляется окружающая клетчатка, лимфоузлы. Может применяться открытая или лапароскопическая методика.
Чаще всего, локализация опухоли затрудняет сохранение естественного заднего прохода и требует формирования колостомы. Современные хирурги максимально ориентированы на сохранение функциональности органа, поэтому могут сформировать профилактическую колостому, которая снижает риск инфекционных осложнений и воспалительных процессов в области швов. При благоприятном прогнозе колостома закрывается в течение нескольких месяцев после оперативного вмешательства.
Комбинированные оперативные вмешательства требуются, если в процесс вовлечено несколько органов. Отдаленные метастазы требуют поочередного удаления.
Профилактика и прогноз жизни
Даже самое качественное лечение не исключает того, что в организме останутся раковые клетки. Они настолько малы, что их сложно определить с помощью диагностики. Тем не менее, они таят в себе опасность и могут обернуться рецидивом.
Чем раньше диагностировать рецидив, тем легче он поддается лечению. Поэтому, даже после операции и курса терапии, пациенту следует проходить диагностику. После рака прямой кишки могут вновь возникать полипы, которые, со временем озлокачествляются. Важно диагностировать этот процесс и провести лечение до того, как процесс станет неконтролируемым.
Первые два года после лечения — время наибольшего риска в плане рецидивирования болезни. Мониторинг новых случаев болезни должен быть особенно интенсивным в это время.
Желательно проходить осмотр у врача каждые полгода в течение первых 2 лет и раз в год в течение 3-го, 4-го и 5-го года после операции. Согласно исследованиям, после 5 лет от момента лечения резко снижается риск рецидивирования.
В консультацию входит физикальный осмотр, анализ на измерение опухолевого маркера, колоноскопия, рентген грудной клетки, КТ, УЗИ.
Профилактика рака прямой кишки включает в себя следующие меры:
- сбалансированное питание с высоким содержанием клетчатки;
- профилактическая колоноскопия для раннего обнаружения полипов, хронического воспаления;
- избегание стрессов, полноценный сон и нормальная физическая активность;
- поддержание обмена веществ в норме;
- профилактика инфицирования ВПЧ;
- необходимо минимизировать воздействие канцерогенов;
- поддержание и укрепление иммунной системы.
Как получить лечение в клинике?
Для жителей России доступно бесплатное лечение в нашей клинике. Созданы все условия для качественной диагностики состояния пациента, его лечения и восстановления.
Чтобы попасть в клинику на лечение колоректального рака необходимо записаться на прием к врачу. После проведенных методов диагностики и определения степени и стадии заболевания врач назначает комбинацию методов лечения.
Рак толстой, прямой кишки и тонкого кишечника
Рак толстой, прямой кишки и тонкого кишечника
Колоректальный рак (толстой и прямой кишки)
Под колоректальным раком, или раком прямой кишки, понимают совокупность злокачественных опухолей, которые возникают в области толстой и прямой кишок. Рак кишечника опасен метастазами (в тяжелых стадиях), которые по кровотоку и лимфотоку переносятся не только в соседние органы, но могут попасть и в легкие и головной мозг.
В свою очередь толстая и прямая кишка представляют собой отделы пищеварительной системы, или желудочно-кишечного тракта. Как правило, длина толстой кишки составляет от 1,5 до 2 м, а прямой кишки, которая расположена непосредственно перед заднепроходным отверстием (анусом), — 12-15 см.
В России колоректальный рак является третьей по распространенности злокачественной опухолью. Рак тонкого кишечника встречается гораздо реже — в 2% случаев онкологии ЖКТ.
Симптомы при раке тонкого кишечника
Онкология кишечника характеризуется разнообразными и неспецифическими симптомами. К ним можно отнести:
- утомляемость,
- слабость,
- одышку,
- изменение ритма дефекаций,
- появление узкого лентовидного стула,
- запоры или поносы,
- выделение со стулом ярко-красной или темной крови,
- похудание,
- боли в животе,
- спазмы кишечника или вздутие живота.
Подобные симптомы рака кишечника — характерные признаки для массы других заболеваний, например синдрома раздраженного кишечника (спастический колит), неспецифического язвенного колита, болезни Крона, дивертикулита, язвенной болезни желудка, и имитируют рак толстой кишки или рак тонкого кишечника. Только медицинская диагностика позволит выявить действительное заболевание, поэтому не следует затягивать визит к врачу и строить самостоятельные прогнозы.
С момента возникновения рака толстой кишки до появления его симптомов может пройти несколько лет. Признаки рака кишечника зависят от точной локализации опухоли в кишечнике.
Симптомы при раке толстого кишечника и прямой кишки
Правые отделы толстого кишечника весьма вместительны. В силу этого симптомы рака кишечника правых отделов толстой кишки нередко возникают при уже довольно больших размерах новообразования.
Обычно опухоли с правосторонним расположением вызывают железодефицитную анемию, которая связана с медленной кровопотерей в течение длительного периода времени. Подобная анемия вызывает симптомы, как: слабость, утомляемость и одышка.
Левые отделы толстого кишечника по сравнению с правыми более узкие. Следовательно, злокачественные поражения левых отделов чаще сопровождаются частичной или полной обструкцией (нарушением проходимости) кишечника. Этот симптом может говорить о раке толстой кишки. Даже при частичной непроходимости следует немедленно обратиться за диагностикой.
При раке толстой кишки с частичной обструкцией наблюдаются симптомы: запоры, появление узкого (лентовидного) кала, поносы, боли в животе, нередко по типу спазмов, вздутие живота. Выделение с калом ярко-красной крови может указывать на новообразование, расположенное в левых отделах толстого кишечника или в области прямой кишки. Помните, что все вышеперечисленные симптомы могут конечно не являться признаками рака кишечника, но это однозначный повод для обращения за медицинской помощью и тщательной диагностике.
)). Данный способ проведения лучевой терапии снижает риски развития долгосрочных, хронических осложнений со стороны толстого кишечника — повышает прогноз выживаемости.
Рак прямой кишки
Среди многочисленных злокачественных новообразований значительное место занимает РАК ПРЯМОЙ КИШКИ, ему принадлежит 4-6% всех онкозаболеваний. По данным всемирной организации здравоохранения, ежегодно в мире регистрируется 510 000 новых случаев рака толстой кишки, из которых рак прямой кишки составляет не меньше 30-40% .
Наиболее часто рак прямой кишки наблюдается в возрасте 40-60 лет, однако он может возникать и в более молодом возрасте. Женщины и мужчины заболевают с одинаковой частотой. Во всем мире отмечается рост заболеваемости раком прямой кишки, наиболее выраженный в экономически развитых странах. Для Беларуси эта проблема весьма актуальна.
Что представляет собой рак прямой кишки и каковы причины его возникновения?
Рак прямой кишки – злокачественная опухоль, источником которой служат клетки, выстилающие прямую кишку.
Как и для большинства локализаций злокачественных опухолей, причины возникновения рака прямой кишки точно не известны. В то же время на злокачественные образования в прямой кишке влияют:
- Характер питания – влияет на скорость продвижения каловых масс, их объем, содержание, бактериальную флору и периодичность стула. Специально проведенные исследования показали, что «западный» тип диеты, в которой преобладают большое количество свежих фруктов и высококалорийных жиров, легкоусвояемых продуктов, приводит к замедлению продвижения содержимого по кишечнику. При этом вещества, вызывающие опухоль, которые могут входить в состав пищи или вырабатываться кишечником, длительно воздействуют на стенку прямой кишки. Возникающие при этом дисбактериоз, нарушение работы печени часто сопровождают рак прямой кишки.
- Наследственный фактор – имеют значение опухоли и полипы толстой кишки у родственников, а также ранее перенесенный рак молочной железы и матки у женщин.
- Склонны к заболеванию раком прямой кишки тучные люди, ведущие малоподвижный образ жизни, употребляющие большое количество жирного мяса.
- Принято считать, что рак прямой кишки начинается как доброкачественный полип. Полипы постепенно увеличиваются в размерах и могут переходить в рак. Причем, если одиночные полипы не очень опасны, то диффузный (равномерно распределенный, рассеянный) полипоз приводит к развитию рака практически в 100% случаев. Опасны в плане развития рака прямой кишки ворсинчатые опухоли. До 90% из них могут переходить в рак.
- Возраст – более чем 90% пациентов имеют возраст старше 40 лет. После этого возраста риск заболеть раком прямой кишки удваивается каждые 10 лет.
Симптомы болезни
Раковые опухоли прямой кишки характеризуются медленным ростом и постепенным появлением клинических симптомов.
Первыми симптомами рака прямой кишки являются прожилки крови в кале и отсутствие чувства удовлетворения после дефекации (опорожнения кишечника). Боль в животе и похудание сопровождают более запущенные случаи. К сожалению, большинство полипов симптомов не имеют.
Диагностика и лечение болезни
Существует несколько методов обнаружения рака прямой кишки, это:
- пальцевое обследование прямой кишки;
- тест кала на скрытую кровь;
- сигмо- или колоноскопия;
- ирригоскопия (метод рентгенологического исследования с контрастным веществом) и др.
Основным методом лечения рака прямой кишки является хирургический. В зависимости от расположения опухоли и ее размеров выполняют 4 основные операции:
- внутрибрюшную резекцию прямой кишки – это удаление пораженной опухолью кишки с последующим сшиванием концов пересеченной кишки.
- Операцию Гартмана — опухоль удаляют, «верхний» конейц кишки выводят в виде колостомы, а «нижний» — зашивают, (колостома – наружный толстокишечный свищ, который выводится на передне-боковую стенку брюшной полости).
- Брюшно-анальную резекцию прямой кишки – пораженную опухолью кишку удаляют, а «верхний» конец кишки протягивают внутрь «нижнего», ждут, пока они не срастутся, а потом отсекают избыток протянутой в задний проход кишки.
- Экстирпацию прямой кишки – прямая кишка удаляется полностью вместе с задним проходом и формируется колостома.
80-90% пациентов, обратившихся на раннем этапе, возвращаются к нормальной жизни. Благодаря современным технологиям, колостомия при раннем раке прямой кишки необходимо только в 5% случаев.
Меры профилактики и защиты
Для уменьшения риска развития рака прямой кишки необходимо придерживаться следующих рекомендаций.
- Если у вас есть родственники первого порядка (родители, братья или сестры), болеющие раком прямой кишки, необходимо пройти обследование на рак прямой кишки в 40 лет.
- Проходить регулярное обследование с 50 лет.
- Заниматься спортом и поддерживать нормальный вес.
- Есть больше овощей, фруктов и других продуктов, богатых клетчаткой, соблюдать почасовой режим питания (3-4 раза в сутки).
- Избегать жирной пищи.
- Не курить и употреблять алкоголь в умеренных количествах, предпочтительно в виде сухого или полусухого вина.
- Следить за регулярной функцией кишечника.
- Бороться с хроническими запорами.
- Нельзя пользоваться после дефекации газетной бумагой – типографская краска неблагоприятно воздействует на слизистую.
- Желательно подмываться после опорожнения кишечника. Эту полезную привычку следует прививать и детям.
- Не оставлять без внимания такие заболевания, как хронический колит, трещины заднего прохода, полипы в толстой кишке.
- Обязательно прийти к врачу при появлении слизи или крови в кале, чувства дискомфорта или боли в заднем проходе, частых позывов на низ.
Помните! Раннее обращение к врачу, своевременное, в начальных стадиях лечение любых опухолей, в том числе злокачественных, дает хороший результат.
Колоректальный рак — Клиника колопроктологии СПБ НИИ им. И.И. Джанелидзе
В большинстве развитых стран рак толстой и прямой кишок (колоректальный рак) — вторая ведущая причина смерти от рака и второй по распространенности вид рака .
Частота развития колоректального рака начинает повышаться в возрастной группе пациентов 40 лет и достигает пика между 60 и 75 годами. Рак прямой кишки чаще встречается у мужчин, рак толстой кишки — у женщин. Примерно 5% больных раком толстой или прямой кишок имеют одновременно несколько злокачественных опухолей колоректальной зоны.
Рак толстой кишки обычно начинается как припухлость на поверхности cлизистой оболочки толстой кишки или полипа. По мере роста могут быть поражены близлежащие лимфатические узлы, а опухоль начинает вторгаться в кишечную стенку. Поскольку кровь из кишечной стенки поступает к печени, вскоре после распространения на близлежащие лимфатические узлы рак толстой кишки обычно метастазирует и в печень.
Симптомы
Колоректальный рак растет достаточно медленно, и прежде чем появляются достаточно отчетливые симптомы, проходит длительное время. Симптомы его зависят от вида, расположения и распространенности злокачественной опухоли. Опухоль в восходящей ободочной кишке бывает таких больших размеров, что врач может прощупать ее через брюшную стенку. Тем не менее утомляемость и слабость вследствие тяжелой анемии иногда являются единственными симптомами.
Восходящая ободочная кишка имеет большой диаметр и тонкие стенки. Поскольку ее содержимое жидкое, непроходимость развивается лишь в поздних стадиях заболевания.
Нисходящая ободочная кишка имеет меньший диаметр и более толстую стенку, каловые массы в ее просвете почти твердые. Опухоль этой части толстой кишки обычно растет по ее окружности, вызывая чередование запоров и поносов. Поскольку нисходящая ободочная кишка более узкая и имеет толстые стенки, рак этой локализации рано приводит к развитию непроходимости. Человек может обратиться к врачу из-за запора и сильных болей в животе. В кале иногда обнаруживаются прожилки или примесь крови, но часто видимая кровь отсутствует; чтобы ее определить, необходимо лабораторное исследование.
Все злокачественные опухоли, как правило, кровоточат; кровотечение обычно скудное. Наиболее распространенным первым симптомом при колоректальном раке является кровотечение во время дефекации. Врачи рассматривают возможность рака при любом кровотечении из прямой кишки, даже если известно, что у человека геморрой или дивертикулез.
При колоректальном раке акт дефекации болезненен; характерно чувство неполного опорожнения прямой кишки. Сидеть бывает больно. Однако, если опухоль не распространяется на ткани вне прямой кишки, пациент обычно не чувствует боли, непосредственно связанной с ее развитием.
Причины
Шанс развития колоректального рака более высок, если в семье кто-либо им болел; известны случаи семейного полипоза или подобной болезни; если человек страдает неспецифическим язвенным колитом или болезнью Крона шанс появления опухоли также высок.
Риск связан с возрастом человека и давностью заболевания.
Рацион играет определенную роль в развитии рака толстой кишки. Во всем мире самому высокому риску подвержены люди, которые живут в городах и рацион которых типичен для развитых западных стран. Такой рацион характеризуется низким содержанием растительных волокон и высоким содержанием животных белков, жиров и легкоусваиваемых углеводов, например сахара.
Риск, вероятно, можно уменьшить, если ввести в рацион больше кальция, витамина D и овощей, таких как капуста, морковь, свекла.
Прием аспирина через день также, по-видимому, уменьшает риск возникновения рака толстой кишки, но такой вид лечения нельзя рекомендовать без веских оснований.
Диагностика
Раннему обнаружению колоректального рака способствует регулярное обследование для выявления скрытой формы заболевания. Анализ кала на присутствие микроскопических количеств крови недорог и прост. Чтобы результаты анализа были точными, в течение 3 дней перед его сдачей человеку необходимо избегать мяса и употреблять пищу с высоким содержанием растительных волокон. Если эта проба для выявления скрытой формы заболевания указывает на вероятность рака, необходимо дальнейшее обследование.
Перед эндоскопией кишечник освобождают, часто с использованием сильных слабительных средств и нескольких клизм. Около 65% колоректальных злокачественных опухолей выявляют с помощью ректороманоскопа. Если обнаружен полип, который может быть злокачественным, требуется исследование всей толстой кишки с помощью колоноскопии. Некоторые опухоли, которые выглядят злокачественными, можно удалить, используя хирургические инструменты, проведенные через колоноскоп; другие удаляют во время полостной операции.
Обнаружить колоректальный рак позволяет исследование крови. Уровень карциноэмбрионального антигена в крови высокий у 70% пациентов с такой опухолью. Высокое содержание карциноэмбрионального антигена перед операцией может снизиться после удаления опухоли. Если так и происходит, целесообразны последующие проверки. Повышение количества карциноэмбрионального антигена предполагает рецидив рака. Два других антигена, СА 19-9 и СА 125, подобны карциноэмбриональному антигену, и их содержание также можно проверить с этой целью.
Список методов диагностик: ирригоскопия, ректороманоскопия, колоноскопия, пробы на скрытую кровь, биопсия слизистой, онкомаркеры крови
Лечение
Основа лечения колоректального рака — хирургическое удаление большого сегмента пораженного кишечника и сопутствующих лимфатических узлов. Примерно 70% больных с колоректальным раком можно сделать операцию; некоторым больным из тех 30%, которые не могут перенести операцию из-за ослабленного состояния, иногда удаляют опухоль путем электрокоагуляции. Эта процедура уменьшает симптомы и продлевает жизнь, но к сожалению не приводит к полному излечению.
В большинстве случаев рака толстой кишки пораженный сегмент кишечника удаляют хирургическим путем, и остающиеся концы соединяют. При раке прямой кишки вид операции зависит от того, как далеко от анального отверстия расположена опухоль и как глубоко она врастает в стенку кишки. После полного удаления прямой кишки и заднего прохода у человека остается постоянная колостома (созданное хирургически сообщение между кишкой и брюшной стенкой).
После колостомии содержимое толстой кишки выводится через брюшную стенку в калоприемник. Если возможно, удаляют только часть прямой кишки, после чего остается культя прямой кишки и неповрежденный задний проход. Затем ректальную культю присоединяют к концу толстой кишки.
Лучевая терапия после хирургического удаления видимой злокачественной опухоли прямой кишки помогает подавить рост оставшихся опухолевых клеток, уменьшает вероятность рецидива и увеличивает вероятность выживания. При раке прямой кишки и поражении от одного до четырех лимфатических узлов в большинстве случаев назначается сочетание облучения и химиотерапии. Если поражено больше четырех лимфатических узлов, то такое лечение менее эффективно.
Если колоректальный рак распространенный, имеются отдаленные метастазы и маловероятно, что с помощью операции удастся радикально помочь, химиотерапия препаратами флуороурацилом (фторурацилом) и левамизолом (декарисом) после операции может продлить жизнь человека, но тоже редко приводит к излечению. Если колоректальный рак распространился настолько, что всю опухоль невозможно удалить, выполняют операцию с целью уменьшить степень кишечной непроходимости — это позволяет облегчить состояние больного. Однако время жизни обычно составляет только около 7 месяцев.
Когда рак распространился лишь на печень, средства для химиотерапии можно вводить непосредственно в артерию, снабжающую печень. Маленький насос хирургически вводят под кожу или надевают внешний насос на пояс, что позволяет человеку передвигаться во время лечения. Хотя такое лечение дорого, оно может дать больший эффект, чем обычная химиотерапия; однако оно требует дальнейшего исследования. Если рак распространился за пределы печени, этот подход к лечению не имеет преимуществ.
Если колоректальная злокачественная опухоль была полностью удалена во время операции, эксперты в большинстве случаев рекомендуют проводить 2-5 ежегодных обследований кишечника с помощью колоноскопии. Если при таких обследованиях в течение первого года не обнаруживают опухоли, то последующие осмотры обычно делают каждые 2-3 года.
Методы лечения: хирургическое вмешательство, лекарственная терапия, химиотерапия, лучевая терапия
Когда необходимо обратиться к врачу:
Лица старше 60 лет должны раз в год сдавать анализ кала на скрытую кровь.
При повышенной утомляемости, бледности, одышке.
При запорах или поносах.
При болях в животе.
При наличии крови или слизи в кале.
При выделении алой крови из прямой кишки.
Когда вызвать скорую:
При боли в животе, вздутии живота, асимметрии живота, отсутствии отхождения стула и газов (признаки непроходимости кишечника)
Профилактика рака прямой кишки — Профилактика заболеваний и ЗОЖ — Бюджетное учреждение Ханты-Мансийского автономного округа — Югры
Рак прямой кишки – злокачественная образование конечного отдела толстой кишки, занимает первое место среди онкологических заболеваний толстого кишечника, около 70% случаев. Рак прямой кишки, чаще возникает у мужчин и риск его развития повышается с возрастом. И связано это с возрастными изменениями в эпителиальных клетках кишечника. Большинство случаев рака прямой кишки диагностируется на поздних стадиях, хотя сама прямая кишка доступна к множеству исследований, самым доступным из которых является пальцевой ректальный осмотр. Связано это с тем, что пациенты стесняются обращаться к врачу с этой интимной проблемой.
Причины рака прямой кишки
Отмечается прямая зависимость развития рака прямой кишки от особенностей пищевого поведения. Болезнь чаще встречается у людей, употребляющих жирную, жаренную и острую пищу, со скудным содержанием растительной клетчаткой. Кроме этого большое количество мясных блюд в рационе питания способствует возникновению злокачественных образований в толстой кишке.
Важными факторами, повышающими риск развития рака толстого кишечника, являются хронические воспалительные заболевания: болезнь Крона, неспецифический язвенный колит, врожденные патологии (семейный полипоз, ферментные недостаточности). Полипы толстого кишечника являются самым распространенным предраковых заболеванием, а семейный полипоз, самым малигнизирующимся. Наследственный фактор также играет не последнюю роль в заболеваемости раком прямой кишки.
Симптомы рака прямой кишки
На ранних стадиях рак прямой кишки протекает бессимптомно, что значительно затрудняет диагностирование и своевременное выявление опухоли.
Самые распространенные симптомы рака прямой кишки: нарушение дефекации (запоры или поносы), кровотечение из заднего прохода, примесь крови в кале, снижение массы тела, ноющие боли в низу живота, «ленточный» стул.
Диагностика рака прямой кишки
На сегодняшний день существуют онкомаркеры на рак толстого кишечника, самым доступным из которых является иммунохимическое исследование кала на скрытую кровь. Важно понимать, что положительный тест на скрытую кровь автоматически не означает наличие рака кишечника у исследуемого пациента, а только предполагает наличие злокачественного или предракового заболевания и возможно о воспалительных заболеваниях толстого кишечника. Основным методом диагностики рака толстого кишечника являются инструментальные методы исследования, такие как: ректороманоскопия (обследуется внутренняя стенка прямой и сигмовидной кишки), колоноскопия (эндоскопическое исследование всей толстой кишки), ирригоскопия (рентгенографическое исследование толстой кишки с контрастным веществом).
Эндоскопические методики позволяют подробно изучить состояние слизистой оболочки кишечной стенки, имеющиеся опухолевые образования, произвести биопсию для последующего гистологического и цитологического исследования. Диагностика рака прямой кишки производится только на сновании обнаружения раковых клеток при цитологическом исследовании биоптата.
Профилактика рака прямой кишки
Профилактические меры злокачественных новообразований толстой кишки включают регулярное обследование лиц, входящих в группу риска (люди старше 50 лет, больные с хроническими заболеваниями толстой кишки). Особое внимание уделяется пациентам с полипами толстой кишки.
В скрининговые мероприятия входят: ежегодный анализ кала на скрытую кровь, сигмоидоскопия каждые 5 лет, каждые 10 лет – колоноскопия.
Лица, страдающие семейным полипозом, подлежат обследованию каждые 2-3 года. Общие меры профилактики рака прямой кишки включают активный образ жизни, правильное сбалансированное питание, богатое растительной клетчаткой без перегруженности животными жирами, отказ от курения и злоупотребления алкогольными напитками, своевременное выявление и лечение заболеваний, провоцирующих развитие злокачественных опухолей.
Вторичная профилактика рака прямой кишки заключается в предотвращении болезни путем раннего обнаружения патологии, в результате чего увеличиваются шансы на успешное излечение. Диспансерное наблюдение с регулярными осмотрами рекомендовано лицам, которые находятся в группе риска. К ним относятся пациенты с полипами и полипозом, проктитами, язвами, трещинами, свищами и др. Конечно, при появлении первых симптомов следует незамедлительно отправляться к врачу. Во время регулярного профилактического осмотра можно обнаружить опухоль, когда о ее появлении пациент даже не догадывается.
При пальцевом ректальном исследовании диагностируется около 40% случаев болезни. После проведения ректороманоскопии подтверждается до 95% всех диагнозов. Следует помнить, что при вовремя начатом лечении прогноз весьма благоприятный. Благодаря раннему выявлению болезни лечение удается начать на ранней стадии болезни. В таком случае существует возможность проведения сфинктеросохраняющей операции, при которой в дальнейшем акт дефекации по-прежнему будет физиологичным.
Подготовил:
заведующий ОПСМСП – 5 Чернобай Владимир Григорьевич
симптомы, признаки, профилактика и лечение злокачественной опухоли кишечника
Рак кишечника – патологический процесс развития злокачественной опухоли, образовавшейся в эпителиальной ткани тонкого или толстого кишечника. При ее формировании нормальные клетки эпителия трансформируются в атипичные, склонные к быстрому, неконтролируемому делению. В 99% случаев заболевание развивается в толстом кишечнике и называется колоректальным раком. По распространенности в возрастной группе от 45 лет и старше оно занимает второе место.
Симптомы
При раке кишечника первые симптомы, как правило, незначительны, и многие пациенты не обращают на них внимания. Следует обязательно посетить гастроэнтеролога или проктолога при появлении:
- чередования запоров и диареи без существенных изменений в рационе питания;
- постоянного дискомфорта – вздутия живота, периодически ощущаемых болей;
- при дефекации – ощущения неполного завершения процесса;
- частых позывов к дефекации, нередко болезненных;
- снижения работоспособности, постоянной усталости;
- анемии;
- беспричинной потери веса.
С течением времени перечисленные проявления усиливаются, к ним присоединяются более выраженные симптомы рака кишечника:
- затрудненная дефекация, сопровождающаяся болью схваткообразного характера;
- лентообразные или слишком тонкие каловые массы, часто с примесью крови;
- длительная изжога, кислая отрыжка, горький привкус во рту;
- периодическая тошнота и рвота;
- острые боли в области живота, сопровождающиеся повышением температуры;
- болезненное мочеиспускание, примесь крови в моче.
Причины и факторы риска
До сих пор точно не установлен механизм развития онкологии кишечника. Однако факторы, повышающие вероятность заболевания, изучены достаточно хорошо. Среди них:
- унаследованная предрасположенность;
- наличие полипов в кишечнике;
- хронические заболевания воспалительного характера – болезнь Крона, язвенный колит, дивертикулез, хроническая непроходимость;
- несбалансированное питание с чрезмерным количеством красного мяса, копченостей, острых приправ, жирной и жареной пищи;
- воздействие ионизированного излучения, канцерогенных соединений;
- ожирение, малоподвижный образ жизни;
- возраст старше 45 лет.
Стадии
При появлении признаков рака кишечника важно определить стадию заболевания, так как от этого напрямую зависит выбор стратегии лечения. Различают четыре основных, к которым нередко добавляют так называемую нулевую стадию – этап, на котором в кишечнике появляются доброкачественные новообразования (полипы) или хронические воспаления с эрозией слизистой оболочки. Эти состояния часто становятся предраковыми.
- Опухоль по размерам не превышает 2 см и располагается в пределах слизистой оболочки. Лимфоузлы не поражены.
- Размеры опухоли увеличиваются до 5 см, злокачественная ткань распространяется в подслизистый слой. Поражены два-три регионарных лимфоузла, метастазов нет.
- Новообразование разрастается до 10 см, проникает в мышечный слой кишечной стенки, но за пределы органа не выходит. Возможно частичное или полное перекрытие кишечного просвета. Поражены практически все регионарные лимфоузлы, обнаруживаются метастазы в расположенных рядом органах.
- Опухоль разрастается более 10 см, прорастает сквозь все слои стенки кишечника и проникает в соседние ткани. Начинается распад раковой ткани с распространением раковых клеток по всему организму – в отдаленные лимфоузлы и органы. Наличие отдаленных метастазов – основной признак четвертой стадии, независимо от размеров раковой опухоли.
Диагностика
Лабораторная и инструментальная диагностика рака кишечника включает следующие процедуры:
-
биохимический анализ крови для выявления уровня билирубина, АЛТ, АСТ;
- анализ на онокомаркеры;
-
колоноскопия – исследование внутренних стенок толстого кишечника при помощи эндоскопа с биопсией ткани обнаруженных новообразований;
-
ирригоскопия – рентгеновское исследование кишечника, выполняемое с рентгеноконтрастным веществом, для выявления деформированных участков, сужений;
-
УЗИ брюшной полости для выявления метастазов в других органах;
-
КТ брюшной полости, необходимое для определения размеров опухоли, ее распространенности и точной локализации.
Кроме того, может возникнуть необходимость в дополнительных исследованиях органов грудной клетки, печени, головного мозга и других органов при подозрении на метастазирование в них.
Внимание!
Вы можете бесплатно получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (высокотехнологичной медицинской помощи).
Чтобы узнать подробности, позвоните, пожалуйста, по телефону +7 (495) 775-73-60 , или можете прочитать более подробно здесь…
Лечение
Тактика лечения опухоли кишечника, симптомы которой описаны выше, для каждого пациента определяются индивидуально в зависимости от стадии болезни, возраста и общего состояния пациента, локализации патологического образования и других факторов. Как правило, онкологи используют комбинацию нескольких методов для достижения результата наиболее щадящим путем.
-
Хирургия. На ранних стадиях хирург удаляет участок кишечника, пораженный болезнью, а образцы удаленной ткани отправляет на гистологический анализ. Край удаленной ткани не должен содержать злокачественно измененных клеток, иначе вмешательство приходится повторить. При неоперабельной опухоли, перекрывающей просвет кишечника, выполняют паллиативное вмешательство – формируют колостому (отверстие для отхождения каловых масс) или устанавливают стент для расширения просвета.
-
Химиотерапия. Сильнодействующие препараты назначают перед операцией для сокращения размеров злокачественной ткани, после вмешательства – для предупреждения рецидивов. При неоперабельной опухоли химиопрепараты увеличивают продолжительность жизни больного и снижают неблагоприятную симптоматику.
-
Лучевая терапия. Часто ионизированное излучение сочетают с химиопрепаратами для достижения наибольшей результативности процедур.
-
Таргетная терапия. Препараты, нацеленные на определенные типы белка, назначают для блокирования роста и деления клеток. Их назначают на поздних стадиях для уменьшения роста опухоли, чтобы продлить срок жизни пациента.
-
Иммунотерапия. Новое направление в онкологии использует собственную иммунную систему организма для борьбы с опухолью. Препараты разблокируют иммунные клетки, тем самым стимулируя их атаковать злокачественные клетки.
Прогнозы
Пятилетний прогноз выживаемости при раке кишечника составляет:
- на первой стадии болезни – до 95%;
- на второй стадии –до 90%;
- на третьей стадии – от 55 до 70%
- на четвертой стадии – около 30%.
Профилактика
Основные меры профилактики рака кишечника заключаются в соблюдении правил здорового питания, своевременном лечении воспалительных заболеваний, уменьшения стрессов. Людям после 45 лет необходимо ежегодно проходить скрининговое обследование, чтобы исключить бессимптомное развитие опухоли.
Реабилитация
Восстановление после операции по удалению опухоли – это длительный и сложный процесс, который пациенту необходимо пройти, чтобы вернуться к обычной жизни. Его основой является специальная диета при раке кишечника, соблюдать которую больному придется до конца жизни. Особенно сложно тем, у кого сформирована колостома для вывода каловых масс. Принять такой образ жизни помогают специалисты-психологи.
Диагностика и лечение рака кишечника в Москве
Если у вас появились симптомы рака кишечника, для проведения диагностики и последующего лечения онкозаболевания обратитесь в клинику «Медицина». Здесь вас ожидают:
- высококвалифицированные специалисты – онкологи, гастроэнтерологи, хирурги, рентгенологи;
- современное диагностическое оборудование последнего поколения;
- превосходно оснащенная лаборатория, выполняющая все виды анализов;
- комфортабельное стационарное отделение.
Позвоните, чтобы узнать больше по интересующей вас проблеме и записаться на прием.
Вопросы и ответы
Как распознать рак кишечника?
Начальные симптомы рака кишечника похожи на ряд других, менее опасных заболеваний, поэтому больные часто не обращают на них внимания. Если у вас без видимой причины:
- пропал аппетит, появилось отвращение к мясным блюдам;
- периодически побаливает живот;
- постоянно ощущается дискомфорт в животе, усилилось газообразование;
- начались длительные запоры, чередующиеся с приступами поноса;
это означает, что следует как можно скорее обратиться к гастроэнтерологу или проктологу для обследования.
Лечится ли рак кишечника?
Больные с опухолью кишечника подлежат лечению на любой стадии рака. Шансы на полное избавление от злокачественной патологии сохраняются даже в самых запущенных случаях.
Рак кишечника с метастазами: сколько живут больные?
Без медицинской помощи срок жизни больного с метастазами в другие органы составляет 6-11 месяцев, в зависимости от скорости развития вторичных опухолей. При прохождении курса лечения процент пятилетней выживаемости у пациентов с метастазами составляет 30-45%, т.е. не менее тридцати человек из ста проживают более пяти лет после операции.
Внимание!
Вы можете бесплатно вылечить это заболевание и получить медицинскую помощь в АО «Медицина» (клиника академика Ройтберга) по программе Государственных гарантий ОМС (Обязательного медицинского страхования) и ВМП (выскокотехнологичной медицинской помощи).
Чтобы узнать подробности, позвоните, пожалуйста, по телефону +7(495) 775-73-60, или на странице ВМП по ОМС
Список источников
- Цуканов А.С., Шелыгин Ю.А., Ачкасов С.И., Фролов С.А., Кашников В.Н., Кузьминов А.М., Пикунов Д.Ю., Шубин В.П. Принципы диагностики и персонифицированного лечения наследственных форм колоректального рака. Вестник Российской академии медицинских наук. — 2019
- Ассоциация онкологов России. Практические рекомендации по лекарственному лечению больных раком ободочной кишки. — 2014
- В.В. Мартынюк. Рак ободочной кишки (заболеваемость, смертность, факторы риска, скрининг).Санкт-Петербургская медицинская академия последипломного образования. — 2000
Лечение рака тонкой кишки (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны на понятном нетехническом языке. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI является частью Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении рака тонкой кишки.Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациента была взята из версии для медицинских работников, которая регулярно пересматривается и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и более эффективные способы помощи больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно. Тем не менее, пользователю будет разрешено написать предложение, например: «В сводке информации о раке PDQ NCI о профилактике рака груди указываются риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment.PDQ Лечение рака тонкой кишки. Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/small-intestine/patient/small-intestine-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389461]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца.Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этих сводках, не должна использоваться для принятия решений о страховом возмещении. Более подробную информацию о страховании можно найти на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Подробнее о том, как связаться с нами или получить помощь при раке.gov можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Первичная злокачественная опухоль тонкой кишки
ВВЕДЕНИЕ
Первичные злокачественные опухоли тонкой кишки легко диагностируются неправильно из-за низкой заболеваемости, неспецифических клинических проявлений и ограниченности методов обследования. Большинство случаев на момент постановки диагноза уже находятся в запущенной стадии, поэтому терапевтический результат очень плох.Для лучшего понимания клинических характеристик злокачественной опухоли тонкой кишки был проведен анализ факторов, влияющих на диагностику, лечение и прогноз, в 75 случаях, диагнозы которых были подтверждены патологическим исследованием с 1964 по август. 1995 г. в нашей больнице, с целью улучшения их ранней диагностики, своевременного лечения и терапевтического эффекта.
МАТЕРИАЛЫ И МЕТОДЫ
Общие данные
В эту группу вошли 75 больных, 42 мужчины и 33 женщины.Начальный возраст варьировал от 4 до 75 лет, в среднем 47 лет. Течение болезни составляло от 1 до 99 месяцев, в среднем 47 месяцев.
Патологический тип и место расположения опухоли
Диагноз 75 случаев подтвержден патологическим обследованием, 26 случаев лейомиосаркомы, 25 аденокарцином, 20 злокачественных лимфом и 4 других злокачественных новообразования. Опухоли располагались в двенадцатиперстной, тощей и подвздошной кишках в 18, 28 и 29 случаях соответственно (таблица).
Таблица 1
Патологические типы и распространение
| Тип новообразований | Число по регионам | ||||
| Двенадцатиперстная кишка | Jejunum | Подвздошная кишка | Подвздошная кишка|||
| Лейомиосаркома | 5 | 14 | |||
| Аденокарцинома | 10 | 9 | 6 | 25 | |
| Злокачественная лимфома | 2 | 4 | 14 | ||
| Злокачественная фиброзная гистиоцитома | 1 | 1 | 2 | ||
| Злокачественность нейрофибромы | 1 | 1 | |||
| Злокачественность фибромы | 1 | 1 | |||
| Всего | 18 | 28 | 29 | 75 | |
Клинические проявления
Клинические проявления этих злокачественных опухолей представлены в таблице.
Таблица 2
| Симптом | Боль в животе | Масса в животе | Истощение | Кишечная непроходимость | Мелена | Острый перитонит | Лихорадка | Анемия | |
| Номер | 45 | 43 | 18 | 11 | 6 | 5 | 5 | 4 | 3 |
| % | 60 | 57.3 | 24 | 14,7 | 8 | 6,7 | 6,7 | 5,3 | 5 |
Предоперационная диагностика
Перед диагностической лапаротомией в 33 случаях был диагностирован рак кишечника, в 25 случаях — образование в брюшной полости, и 17 случаев были ошибочно диагностированы как другие заболевания, такие как перфорация кишечника, острый перитонит, опухоль яичников, рак толстой кишки, инвагинация подвздошной кишки и слепой кишки и т. д.
Дополнительные исследования
В 10 случаях аномальный CEA (карциноэмбриональный антиген) не был обнаружен.У двадцати трех из 26 пациентов с помощью УЗИ B-типа было обнаружено новообразование в брюшной полости. КТ (компьютерная томография) показала четкую демонстрацию опухоли на пораженном участке и структурах вокруг него в 20 случаях. Из 13 случаев, прошедших рентгенографию бариевой муки, в 11 была диагностирована опухоль кишечника с точностью 84,6%. Из 7 случаев опухоли двенадцатиперстной кишки 6 были диагностированы как опухоль двенадцатиперстной кишки при фиброскопии, что было подтверждено патологическим исследованием. Бариевая клизма была проведена в 18 случаях, у 8 из них была обнаружена опухоль в подвздошной кишке.
Методы лечения
Хирургическое лечение было основным методом лечения этой группы больных. Тридцать семь пациентов получили радикальную резекцию, 21 паллиативную резекцию и 10 операций шунтирования, 3 исследовательской лапаротомии и 3 прямой биопсии. Летальность операции составила 1,4%. В четырех случаях хирургическая операция не проводилась. 27 пациентов получили адъювантную химиотерапию. Обычно использовали 5-фторурацил (5-FU), митомицин (MMC), циклофосфамид е (CTX) и адриамицин (ADM).
РЕЗУЛЬТАТЫ
Выживаемость рассчитывалась с помощью таблицы продолжительности жизни, а компьютерная модель многомерного анализа СОХ использовалась для анализа выживаемости.
Данные наблюдения
Продолжительность наблюдения составила от 1 года до 30 лет, частота наблюдения составила 94,2%. Одно-, трех- и пятилетняя выживаемость из 71 прооперированного случая составила 70,7%, 49,9% и 35,1% соответственно (таблицы и).
Таблица 3
Выживаемость в зависимости от типа операции
| Тип операции | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Радикальная резекция | 37 | 87.5 | 68,7 | 48,1 |
| Паллиативная резекция | 21 | 57,9 | 33,8 | 24,1 |
| Облегчение симптомов и диагностическая операция | 13 | 42,9 | 21,4 | 0,0 |
Таблица 4
Выживаемость по патологическому типу
| Патологический тип | n | Выживаемость (%) | |||||||
| 1 год | 3 года | 5 лет | |||||||
| Аденокарцинома | 25 | 53.9 | 27,9 | 14,0 | |||||
| Лейомиосаркома | 26 | 95,8 | 82,1 | 57,5 | |||||
| Злокачественная лимфома | 20 | 48,6 | 39,7 | 23,8 | |||||
| Расположение опухоли | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Двенадцатиперстная кишка | 17 | 69.2 | 38,5 | 0,0 |
| Jejunum | 27 | 81,8 | 59,6 | 50,4 |
| Подвздошная кишка | 27 | 51,1 | 29,2 | 17,5 |
Факторы анализа прогноза компьютерная модель многомерного анализа ЦОГ
С помощью модели многомерного анализа ЦОГ был проведен анализ следующих факторов, которые могут повлиять на прогноз, таких как пол пациента, возраст, клиническое течение, гистологический тип, локализация опухоли, размер опухоли, общий тип, метастаз в лимфатические узлы. , метастазирование в печень, инвазия в соседние органы, тип операции и химиотерапия.Критическое значение альфа было 0,05. Статистические результаты показали, что возраст пациента, гистологический тип, место опухоли и тип операции оказали значительное влияние на выживаемость. Но химиотерапия не оказала существенного влияния на прогноз.
ОБСУЖДЕНИЕ
Общее рассмотрение
Заболеваемость первичной злокачественной опухолью тонкой кишки очень низкая, составляя 1–3,6% всех злокачественных новообразований желудочно-кишечного тракта и 0,2–0,3% всего тела [1, 2]. С 1964 по 1995 год в нашу больницу поступило 75 больных первичной злокачественной опухолью тонкой кишки, из них около 1.4% из 4427 случаев злокачественного новообразования всего желудочно-кишечного тракта за тот же период. В Китае лейомиосаркома, аденокарцинома и злокачественная лимфома составляют большую часть злокачественных новообразований тонкого кишечника, но карциноид встречается редко. Однако в других странах наиболее часто встречающиеся злокачественные новообразования тонкой кишки — это аденокарцинома и карциноид, злокачественная лимфома и лейомиокарцинома [3].
Связь между патологией и местом опухоли. Наиболее частыми участками лейомиосаркомы являются тощая кишка, подвздошная кишка и двенадцатиперстная кишка.Аденокарцинома чаще всего поражает двенадцатиперстную кишку, тощую кишку и подвздошную кишку, а при злокачественной лимфоме муравьев — подвздошная кишка и тощая кишка и находится ниже в двенадцатиперстной кишке [3]. Частота распространения опухолей в этой группе случаев соответствует данным, указанным в литературе (таблица).
Распространение опухоли в тонком кишечнике. Аденокарцинома составляет около 50-66% опухолей двенадцатиперстной кишки (55,6% в этой группе), за ней следуют злокачественная лимфома и лейомиосаркома. В тощей кишке чаще всего встречается лейомиосаркома (50% в этой группе), за ней следуют аденокарцинома и злокачественная лимфома.Но в подвздошной кишке злокачественная лимфома составляет около половины всех злокачественных новообразований (48,3% в этой группе), за ней следуют аденокарцинома и лейомиосаркома.
Многие ученые считают, что низкая частота злокачественных опухолей в тонком кишечнике связана со следующими факторами: (1) Щелочность в просвете тонкого кишечника не способствует росту опухоли. (2) Быстрая перистальтика тонкой кишки рекомендуется для минимизации времени воздействия на слизистую оболочку потенциальных канцерогенов из пищи, а содержание жидкости в просвете может разбавить канцерогены, что приведет к снижению канцерогенности.(3) Отсутствие внутрипросветной бактериальной флоры, очевидно, снижает количество канцерогенных агентов, и эти бактерии необходимы в процессе метаболизма. (4) Высокая концентрация IgA, продуцируемого в основном в лимфоидной ткани тонкого кишечника, защищает от онкогенеза за счет нейтрализации вируса и потенциальных канцерогенных агентов. (5) Т-лимфоциты с сильным иммунитетом, составляющие большинство лимфоцитов, собирающих лимфатические узлы тонкого кишечника, обладают сильной способностью и специфическими характеристиками для защиты от роста опухоли.(6) Бензопиренгидроксилаза присутствует в больших количествах в слизистой оболочке тонкой кишки и может выводить токсины из канцерогенов [1].
Диагноз
Первичная злокачественная опухоль тонкой кишки легко диагностируется неправильно из-за ее низкой заболеваемости, расплывчатых и неспецифических клинических проявлений и ограниченных методов диагностики. Частота ошибочных диагнозов в литературных отчетах составляет 40–80% [4], а в нашей группе — 56%. Мы считаем, что следующие моменты являются ключевыми для повышения точности диагностики и уменьшения частоты ошибочной диагностики.
Лучше разбираться в первичной злокачественной опухоли тонкой кишки. В клинике следует с особой осторожностью относиться к заболеванию: неизвестная боль в животе, образование в брюшной полости, мелена и непроходимость, особенно при пальпации новообразования в брюшной полости.
Рентгенография бариевой муки — рутинный метод выявления первичных злокачественных опухолей тонкой кишки, диагностическая точность которого может достигать 50% [2,5]. Мы считаем, что пациентам с подозрением на опухоль в тонкой кишке по возможности следует проводить рентгенографию бариевой муки.В нашей исследуемой группе диагноз был установлен по рентгенограмме бариевой муки в 11 из 13 случаев с точностью 84,6%. Рентгенография с контрастированием воздуха и бария, при которой большое количество бария и воздуха вводится в просвет двенадцатиперстной кишки через желудочный зонд, предлагается выполнять для визуализации сегмента за сегментом тонкой кишки, чтобы повысить точность диагностики. Дистальная подвздошная кишка обычно плохо визуализируется в сериях исследований верхних отделов желудочно-кишечного тракта, но это может быть продемонстрировано с помощью бариевой клизмы, при которой контрастный материал из толстой кишки возвращается в дистальный отдел тонкой кишки через илеоцекальный клапан.Комбинация рентгенографии с бариевой мукой и бариевой клизмы может дать положительный результат в 50-80%.
Гибкое эндоскопическое обследование и прямая биопсия — самые надежные методы постановки диагноза, особенно на ранней стадии заболевания. Это также полезно и надежно для диагностики опухолей двенадцатиперстной кишки. В нашей исследуемой группе диагноз был установлен в 6 из 7 случаев при гибком эндоскопическом исследовании и подтвержден патологическим исследованием. За рубежом гибкая эндоскопия тонкой кишки использовалась в клинике в 1969 году.Но он развивался очень медленно из-за технических трудностей при установке и больших страданий пациентов [5].
Компьютерная томография (КТ) может хорошо продемонстрировать пораженную опухолью область и структуры вокруг нее. Кроме того, компьютерная томография может определить наличие локальных или отдаленных метастазов. КТ является эффективным методом, особенно для тех, чей диагноз не может быть подтвержден рентгенографией с барием желудочно-кишечного тракта [6].
Лечение
Хирургическая резекция на сегодняшний день является наиболее эффективным методом лечения злокачественной опухоли тонкой кишки.Если диагноз установлен, радикальная резекция должна быть выполнена как можно раньше, что требует как минимум сегментарной резекции 10 см пораженной области, включая удаление соответствующей брыжейки и ее лимфатических узлов [7]. Сообщалось, что 5-летняя выживаемость после радикальной резекции составляет 25–54% [1,8], что согласуется с данными (48,1%) в нашем исследовании. При раке двенадцатиперстной кишки по возможности следует провести операцию Уипплса. Опухоль в дистальном отделе подвздошной кишки лечится правой гемиколонэктомией.Паллиативная резекция опухоли имеет определенную ценность, и от нее нельзя легко отказываться. Его 5-летняя выживаемость составляет 0-25% по данным литературы [1], а в нашем исследовании — 24,1%. Операция шунтирования может временно облегчить симптомы, но не может продлить жизнь пациента. Повторная исследовательская резекция должна быть выполнена при рецидиве, если это возможно [9,10].
Необходима адъювантная послеоперационная химиотерапия злокачественной лимфомы. Неоперабельную злокачественную лимфому тонкой кишки следует лечить в основном химиотерапией, чтобы облегчить симптомы и продлить жизнь.Обычный режим химиотерапии — CHOP (CTX + VCR + ADM + преднизон). Лейомиосаркома тонкого кишечника частично чувствительна к химиотерапевтическим средствам. При обширной лейомиосаркоме предоперационная комбинированная химиотерапия ADM и CTX может минимизировать размер опухоли и повысить скорость резекции. Химиотерапия не влияет на аденокарциному тонкого кишечника из-за нечувствительности к химиотерапевтическим средствам. В нашем исследовании 27 пациентов прошли курс химиотерапии, но ни послеоперационная адъювантная, ни паллиативная химиотерапия не эффективны для продления выживаемости, что, возможно, связано с поздней стадией заболевания.
Факторы прогноза
Сообщалось, что прогностическими факторами первичной злокачественной опухоли тонкой кишки являются, в основном, тип операции, гистологический тип, место расположения опухоли и размер опухоли [1,7], и каждый из них был проанализирован с помощью моновариантного анализа. До сих пор в мире не было сообщений о прогностических факторах, изучаемых с помощью модели многомерного анализа. В нашем исследовании с помощью компьютерной модели многомерного анализа СОХ было проанализировано 12 факторов, включая пол пациента, возраст, клиническое течение, гистологический тип, локализацию опухоли, размер опухоли, общий тип, метастазирование лимфатических узлов, метастаз живого r, инвазию в соседние органы, операцию. типа, и химиотерапия.Результаты показали, что значимыми прогностическими факторами были гистологический тип, тип операции, возраст пациента и локализация опухоли, ни размер опухоли, ни химиотерапия не оказали значительного влияния на прогноз.
Первичная злокачественная опухоль тонкой кишки
ВВЕДЕНИЕ
Первичные злокачественные опухоли тонкой кишки легко диагностируются неправильно из-за низкой заболеваемости, неспецифических клинических проявлений и ограниченности методов обследования. Большинство случаев на момент постановки диагноза уже находятся в запущенной стадии, поэтому терапевтический результат очень плох.Для лучшего понимания клинических характеристик злокачественной опухоли тонкой кишки был проведен анализ факторов, влияющих на диагностику, лечение и прогноз, в 75 случаях, диагнозы которых были подтверждены патологическим исследованием с 1964 по август. 1995 г. в нашей больнице, с целью улучшения их ранней диагностики, своевременного лечения и терапевтического эффекта.
МАТЕРИАЛЫ И МЕТОДЫ
Общие данные
В эту группу вошли 75 больных, 42 мужчины и 33 женщины.Начальный возраст варьировал от 4 до 75 лет, в среднем 47 лет. Течение болезни составляло от 1 до 99 месяцев, в среднем 47 месяцев.
Патологический тип и место расположения опухоли
Диагноз 75 случаев подтвержден патологическим обследованием, 26 случаев лейомиосаркомы, 25 аденокарцином, 20 злокачественных лимфом и 4 других злокачественных новообразования. Опухоли располагались в двенадцатиперстной, тощей и подвздошной кишках в 18, 28 и 29 случаях соответственно (таблица).
Таблица 1
Патологические типы и распространение
| Тип новообразований | Число по регионам | ||||
| Двенадцатиперстная кишка | Jejunum | Подвздошная кишка | Подвздошная кишка|||
| Лейомиосаркома | 5 | 14 | |||
| Аденокарцинома | 10 | 9 | 6 | 25 | |
| Злокачественная лимфома | 2 | 4 | 14 | ||
| Злокачественная фиброзная гистиоцитома | 1 | 1 | 2 | ||
| Злокачественность нейрофибромы | 1 | 1 | |||
| Злокачественность фибромы | 1 | 1 | |||
| Всего | 18 | 28 | 29 | 75 | |
Клинические проявления
Клинические проявления этих злокачественных опухолей представлены в таблице.
Таблица 2
| Симптом | Боль в животе | Масса в животе | Истощение | Кишечная непроходимость | Мелена | Острый перитонит | Лихорадка | Анемия | |
| Номер | 45 | 43 | 18 | 11 | 6 | 5 | 5 | 4 | 3 |
| % | 60 | 57.3 | 24 | 14,7 | 8 | 6,7 | 6,7 | 5,3 | 5 |
Предоперационная диагностика
Перед диагностической лапаротомией в 33 случаях был диагностирован рак кишечника, в 25 случаях — образование в брюшной полости, и 17 случаев были ошибочно диагностированы как другие заболевания, такие как перфорация кишечника, острый перитонит, опухоль яичников, рак толстой кишки, инвагинация подвздошной кишки и слепой кишки и т. д.
Дополнительные исследования
В 10 случаях аномальный CEA (карциноэмбриональный антиген) не был обнаружен.У двадцати трех из 26 пациентов с помощью УЗИ B-типа было обнаружено новообразование в брюшной полости. КТ (компьютерная томография) показала четкую демонстрацию опухоли на пораженном участке и структурах вокруг него в 20 случаях. Из 13 случаев, прошедших рентгенографию бариевой муки, в 11 была диагностирована опухоль кишечника с точностью 84,6%. Из 7 случаев опухоли двенадцатиперстной кишки 6 были диагностированы как опухоль двенадцатиперстной кишки при фиброскопии, что было подтверждено патологическим исследованием. Бариевая клизма была проведена в 18 случаях, у 8 из них была обнаружена опухоль в подвздошной кишке.
Методы лечения
Хирургическое лечение было основным методом лечения этой группы больных. Тридцать семь пациентов получили радикальную резекцию, 21 паллиативную резекцию и 10 операций шунтирования, 3 исследовательской лапаротомии и 3 прямой биопсии. Летальность операции составила 1,4%. В четырех случаях хирургическая операция не проводилась. 27 пациентов получили адъювантную химиотерапию. Обычно использовали 5-фторурацил (5-FU), митомицин (MMC), циклофосфамид е (CTX) и адриамицин (ADM).
РЕЗУЛЬТАТЫ
Выживаемость рассчитывалась с помощью таблицы продолжительности жизни, а компьютерная модель многомерного анализа СОХ использовалась для анализа выживаемости.
Данные наблюдения
Продолжительность наблюдения составила от 1 года до 30 лет, частота наблюдения составила 94,2%. Одно-, трех- и пятилетняя выживаемость из 71 прооперированного случая составила 70,7%, 49,9% и 35,1% соответственно (таблицы и).
Таблица 3
Выживаемость в зависимости от типа операции
| Тип операции | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Радикальная резекция | 37 | 87.5 | 68,7 | 48,1 |
| Паллиативная резекция | 21 | 57,9 | 33,8 | 24,1 |
| Облегчение симптомов и диагностическая операция | 13 | 42,9 | 21,4 | 0,0 |
Таблица 4
Выживаемость по патологическому типу
| Патологический тип | n | Выживаемость (%) | |||||||
| 1 год | 3 года | 5 лет | |||||||
| Аденокарцинома | 25 | 53.9 | 27,9 | 14,0 | |||||
| Лейомиосаркома | 26 | 95,8 | 82,1 | 57,5 | |||||
| Злокачественная лимфома | 20 | 48,6 | 39,7 | 23,8 | |||||
| Расположение опухоли | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Двенадцатиперстная кишка | 17 | 69.2 | 38,5 | 0,0 |
| Jejunum | 27 | 81,8 | 59,6 | 50,4 |
| Подвздошная кишка | 27 | 51,1 | 29,2 | 17,5 |
Факторы анализа прогноза компьютерная модель многомерного анализа ЦОГ
С помощью модели многомерного анализа ЦОГ был проведен анализ следующих факторов, которые могут повлиять на прогноз, таких как пол пациента, возраст, клиническое течение, гистологический тип, локализация опухоли, размер опухоли, общий тип, метастаз в лимфатические узлы. , метастазирование в печень, инвазия в соседние органы, тип операции и химиотерапия.Критическое значение альфа было 0,05. Статистические результаты показали, что возраст пациента, гистологический тип, место опухоли и тип операции оказали значительное влияние на выживаемость. Но химиотерапия не оказала существенного влияния на прогноз.
ОБСУЖДЕНИЕ
Общее рассмотрение
Заболеваемость первичной злокачественной опухолью тонкой кишки очень низкая, составляя 1–3,6% всех злокачественных новообразований желудочно-кишечного тракта и 0,2–0,3% всего тела [1, 2]. С 1964 по 1995 год в нашу больницу поступило 75 больных первичной злокачественной опухолью тонкой кишки, из них около 1.4% из 4427 случаев злокачественного новообразования всего желудочно-кишечного тракта за тот же период. В Китае лейомиосаркома, аденокарцинома и злокачественная лимфома составляют большую часть злокачественных новообразований тонкого кишечника, но карциноид встречается редко. Однако в других странах наиболее часто встречающиеся злокачественные новообразования тонкой кишки — это аденокарцинома и карциноид, злокачественная лимфома и лейомиокарцинома [3].
Связь между патологией и местом опухоли. Наиболее частыми участками лейомиосаркомы являются тощая кишка, подвздошная кишка и двенадцатиперстная кишка.Аденокарцинома чаще всего поражает двенадцатиперстную кишку, тощую кишку и подвздошную кишку, а при злокачественной лимфоме муравьев — подвздошная кишка и тощая кишка и находится ниже в двенадцатиперстной кишке [3]. Частота распространения опухолей в этой группе случаев соответствует данным, указанным в литературе (таблица).
Распространение опухоли в тонком кишечнике. Аденокарцинома составляет около 50-66% опухолей двенадцатиперстной кишки (55,6% в этой группе), за ней следуют злокачественная лимфома и лейомиосаркома. В тощей кишке чаще всего встречается лейомиосаркома (50% в этой группе), за ней следуют аденокарцинома и злокачественная лимфома.Но в подвздошной кишке злокачественная лимфома составляет около половины всех злокачественных новообразований (48,3% в этой группе), за ней следуют аденокарцинома и лейомиосаркома.
Многие ученые считают, что низкая частота злокачественных опухолей в тонком кишечнике связана со следующими факторами: (1) Щелочность в просвете тонкого кишечника не способствует росту опухоли. (2) Быстрая перистальтика тонкой кишки рекомендуется для минимизации времени воздействия на слизистую оболочку потенциальных канцерогенов из пищи, а содержание жидкости в просвете может разбавить канцерогены, что приведет к снижению канцерогенности.(3) Отсутствие внутрипросветной бактериальной флоры, очевидно, снижает количество канцерогенных агентов, и эти бактерии необходимы в процессе метаболизма. (4) Высокая концентрация IgA, продуцируемого в основном в лимфоидной ткани тонкого кишечника, защищает от онкогенеза за счет нейтрализации вируса и потенциальных канцерогенных агентов. (5) Т-лимфоциты с сильным иммунитетом, составляющие большинство лимфоцитов, собирающих лимфатические узлы тонкого кишечника, обладают сильной способностью и специфическими характеристиками для защиты от роста опухоли.(6) Бензопиренгидроксилаза присутствует в больших количествах в слизистой оболочке тонкой кишки и может выводить токсины из канцерогенов [1].
Диагноз
Первичная злокачественная опухоль тонкой кишки легко диагностируется неправильно из-за ее низкой заболеваемости, расплывчатых и неспецифических клинических проявлений и ограниченных методов диагностики. Частота ошибочных диагнозов в литературных отчетах составляет 40–80% [4], а в нашей группе — 56%. Мы считаем, что следующие моменты являются ключевыми для повышения точности диагностики и уменьшения частоты ошибочной диагностики.
Лучше разбираться в первичной злокачественной опухоли тонкой кишки. В клинике следует с особой осторожностью относиться к заболеванию: неизвестная боль в животе, образование в брюшной полости, мелена и непроходимость, особенно при пальпации новообразования в брюшной полости.
Рентгенография бариевой муки — рутинный метод выявления первичных злокачественных опухолей тонкой кишки, диагностическая точность которого может достигать 50% [2,5]. Мы считаем, что пациентам с подозрением на опухоль в тонкой кишке по возможности следует проводить рентгенографию бариевой муки.В нашей исследуемой группе диагноз был установлен по рентгенограмме бариевой муки в 11 из 13 случаев с точностью 84,6%. Рентгенография с контрастированием воздуха и бария, при которой большое количество бария и воздуха вводится в просвет двенадцатиперстной кишки через желудочный зонд, предлагается выполнять для визуализации сегмента за сегментом тонкой кишки, чтобы повысить точность диагностики. Дистальная подвздошная кишка обычно плохо визуализируется в сериях исследований верхних отделов желудочно-кишечного тракта, но это может быть продемонстрировано с помощью бариевой клизмы, при которой контрастный материал из толстой кишки возвращается в дистальный отдел тонкой кишки через илеоцекальный клапан.Комбинация рентгенографии с бариевой мукой и бариевой клизмы может дать положительный результат в 50-80%.
Гибкое эндоскопическое обследование и прямая биопсия — самые надежные методы постановки диагноза, особенно на ранней стадии заболевания. Это также полезно и надежно для диагностики опухолей двенадцатиперстной кишки. В нашей исследуемой группе диагноз был установлен в 6 из 7 случаев при гибком эндоскопическом исследовании и подтвержден патологическим исследованием. За рубежом гибкая эндоскопия тонкой кишки использовалась в клинике в 1969 году.Но он развивался очень медленно из-за технических трудностей при установке и больших страданий пациентов [5].
Компьютерная томография (КТ) может хорошо продемонстрировать пораженную опухолью область и структуры вокруг нее. Кроме того, компьютерная томография может определить наличие локальных или отдаленных метастазов. КТ является эффективным методом, особенно для тех, чей диагноз не может быть подтвержден рентгенографией с барием желудочно-кишечного тракта [6].
Лечение
Хирургическая резекция на сегодняшний день является наиболее эффективным методом лечения злокачественной опухоли тонкой кишки.Если диагноз установлен, радикальная резекция должна быть выполнена как можно раньше, что требует как минимум сегментарной резекции 10 см пораженной области, включая удаление соответствующей брыжейки и ее лимфатических узлов [7]. Сообщалось, что 5-летняя выживаемость после радикальной резекции составляет 25–54% [1,8], что согласуется с данными (48,1%) в нашем исследовании. При раке двенадцатиперстной кишки по возможности следует провести операцию Уипплса. Опухоль в дистальном отделе подвздошной кишки лечится правой гемиколонэктомией.Паллиативная резекция опухоли имеет определенную ценность, и от нее нельзя легко отказываться. Его 5-летняя выживаемость составляет 0-25% по данным литературы [1], а в нашем исследовании — 24,1%. Операция шунтирования может временно облегчить симптомы, но не может продлить жизнь пациента. Повторная исследовательская резекция должна быть выполнена при рецидиве, если это возможно [9,10].
Необходима адъювантная послеоперационная химиотерапия злокачественной лимфомы. Неоперабельную злокачественную лимфому тонкой кишки следует лечить в основном химиотерапией, чтобы облегчить симптомы и продлить жизнь.Обычный режим химиотерапии — CHOP (CTX + VCR + ADM + преднизон). Лейомиосаркома тонкого кишечника частично чувствительна к химиотерапевтическим средствам. При обширной лейомиосаркоме предоперационная комбинированная химиотерапия ADM и CTX может минимизировать размер опухоли и повысить скорость резекции. Химиотерапия не влияет на аденокарциному тонкого кишечника из-за нечувствительности к химиотерапевтическим средствам. В нашем исследовании 27 пациентов прошли курс химиотерапии, но ни послеоперационная адъювантная, ни паллиативная химиотерапия не эффективны для продления выживаемости, что, возможно, связано с поздней стадией заболевания.
Факторы прогноза
Сообщалось, что прогностическими факторами первичной злокачественной опухоли тонкой кишки являются, в основном, тип операции, гистологический тип, место расположения опухоли и размер опухоли [1,7], и каждый из них был проанализирован с помощью моновариантного анализа. До сих пор в мире не было сообщений о прогностических факторах, изучаемых с помощью модели многомерного анализа. В нашем исследовании с помощью компьютерной модели многомерного анализа СОХ было проанализировано 12 факторов, включая пол пациента, возраст, клиническое течение, гистологический тип, локализацию опухоли, размер опухоли, общий тип, метастазирование лимфатических узлов, метастаз живого r, инвазию в соседние органы, операцию. типа, и химиотерапия.Результаты показали, что значимыми прогностическими факторами были гистологический тип, тип операции, возраст пациента и локализация опухоли, ни размер опухоли, ни химиотерапия не оказали значительного влияния на прогноз.
Первичная злокачественная опухоль тонкой кишки
ВВЕДЕНИЕ
Первичные злокачественные опухоли тонкой кишки легко диагностируются неправильно из-за низкой заболеваемости, неспецифических клинических проявлений и ограниченности методов обследования. Большинство случаев на момент постановки диагноза уже находятся в запущенной стадии, поэтому терапевтический результат очень плох.Для лучшего понимания клинических характеристик злокачественной опухоли тонкой кишки был проведен анализ факторов, влияющих на диагностику, лечение и прогноз, в 75 случаях, диагнозы которых были подтверждены патологическим исследованием с 1964 по август. 1995 г. в нашей больнице, с целью улучшения их ранней диагностики, своевременного лечения и терапевтического эффекта.
МАТЕРИАЛЫ И МЕТОДЫ
Общие данные
В эту группу вошли 75 больных, 42 мужчины и 33 женщины.Начальный возраст варьировал от 4 до 75 лет, в среднем 47 лет. Течение болезни составляло от 1 до 99 месяцев, в среднем 47 месяцев.
Патологический тип и место расположения опухоли
Диагноз 75 случаев подтвержден патологическим обследованием, 26 случаев лейомиосаркомы, 25 аденокарцином, 20 злокачественных лимфом и 4 других злокачественных новообразования. Опухоли располагались в двенадцатиперстной, тощей и подвздошной кишках в 18, 28 и 29 случаях соответственно (таблица).
Таблица 1
Патологические типы и распространение
| Тип новообразований | Число по регионам | ||||
| Двенадцатиперстная кишка | Jejunum | Подвздошная кишка | Подвздошная кишка|||
| Лейомиосаркома | 5 | 14 | |||
| Аденокарцинома | 10 | 9 | 6 | 25 | |
| Злокачественная лимфома | 2 | 4 | 14 | ||
| Злокачественная фиброзная гистиоцитома | 1 | 1 | 2 | ||
| Злокачественность нейрофибромы | 1 | 1 | |||
| Злокачественность фибромы | 1 | 1 | |||
| Всего | 18 | 28 | 29 | 75 | |
Клинические проявления
Клинические проявления этих злокачественных опухолей представлены в таблице.
Таблица 2
| Симптом | Боль в животе | Масса в животе | Истощение | Кишечная непроходимость | Мелена | Острый перитонит | Лихорадка | Анемия | |
| Номер | 45 | 43 | 18 | 11 | 6 | 5 | 5 | 4 | 3 |
| % | 60 | 57.3 | 24 | 14,7 | 8 | 6,7 | 6,7 | 5,3 | 5 |
Предоперационная диагностика
Перед диагностической лапаротомией в 33 случаях был диагностирован рак кишечника, в 25 случаях — образование в брюшной полости, и 17 случаев были ошибочно диагностированы как другие заболевания, такие как перфорация кишечника, острый перитонит, опухоль яичников, рак толстой кишки, инвагинация подвздошной кишки и слепой кишки и т. д.
Дополнительные исследования
В 10 случаях аномальный CEA (карциноэмбриональный антиген) не был обнаружен.У двадцати трех из 26 пациентов с помощью УЗИ B-типа было обнаружено новообразование в брюшной полости. КТ (компьютерная томография) показала четкую демонстрацию опухоли на пораженном участке и структурах вокруг него в 20 случаях. Из 13 случаев, прошедших рентгенографию бариевой муки, в 11 была диагностирована опухоль кишечника с точностью 84,6%. Из 7 случаев опухоли двенадцатиперстной кишки 6 были диагностированы как опухоль двенадцатиперстной кишки при фиброскопии, что было подтверждено патологическим исследованием. Бариевая клизма была проведена в 18 случаях, у 8 из них была обнаружена опухоль в подвздошной кишке.
Методы лечения
Хирургическое лечение было основным методом лечения этой группы больных. Тридцать семь пациентов получили радикальную резекцию, 21 паллиативную резекцию и 10 операций шунтирования, 3 исследовательской лапаротомии и 3 прямой биопсии. Летальность операции составила 1,4%. В четырех случаях хирургическая операция не проводилась. 27 пациентов получили адъювантную химиотерапию. Обычно использовали 5-фторурацил (5-FU), митомицин (MMC), циклофосфамид е (CTX) и адриамицин (ADM).
РЕЗУЛЬТАТЫ
Выживаемость рассчитывалась с помощью таблицы продолжительности жизни, а компьютерная модель многомерного анализа СОХ использовалась для анализа выживаемости.
Данные наблюдения
Продолжительность наблюдения составила от 1 года до 30 лет, частота наблюдения составила 94,2%. Одно-, трех- и пятилетняя выживаемость из 71 прооперированного случая составила 70,7%, 49,9% и 35,1% соответственно (таблицы и).
Таблица 3
Выживаемость в зависимости от типа операции
| Тип операции | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Радикальная резекция | 37 | 87.5 | 68,7 | 48,1 |
| Паллиативная резекция | 21 | 57,9 | 33,8 | 24,1 |
| Облегчение симптомов и диагностическая операция | 13 | 42,9 | 21,4 | 0,0 |
Таблица 4
Выживаемость по патологическому типу
| Патологический тип | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Аденокарцинома | 25 | 53.9 | 27,9 | 14,0 |
| Лейомиосаркома | 26 | 95,8 | 82,1 | 57,5 |
| Злокачественная лимфома | 20 | 48,6 | 39,7 | 23,8 |
| Расположение опухоли | n | Выживаемость (%) | ||
| 1 год | 3 года | 5 лет | ||
| Двенадцатиперстная кишка | 17 | 69.2 | 38,5 | 0,0 |
| Jejunum | 27 | 81,8 | 59,6 | 50,4 |
| Подвздошная кишка | 27 | 51,1 | 29,2 | 17,5 |
Факторы анализа прогноза компьютерная модель многомерного анализа ЦОГ
С помощью модели многомерного анализа ЦОГ был проведен анализ следующих факторов, которые могут повлиять на прогноз, таких как пол пациента, возраст, клиническое течение, гистологический тип, локализация опухоли, размер опухоли, общий тип, метастаз в лимфатические узлы. , метастазирование в печень, инвазия в соседние органы, тип операции и химиотерапия.Критическое значение альфа было 0,05. Статистические результаты показали, что возраст пациента, гистологический тип, место опухоли и тип операции оказали значительное влияние на выживаемость. Но химиотерапия не оказала существенного влияния на прогноз.
ОБСУЖДЕНИЕ
Общее рассмотрение
Заболеваемость первичной злокачественной опухолью тонкой кишки очень низкая, составляя 1–3,6% всех злокачественных новообразований желудочно-кишечного тракта и 0,2–0,3% всего тела [1, 2]. С 1964 по 1995 год в нашу больницу поступило 75 больных первичной злокачественной опухолью тонкой кишки, из них около 1.4% из 4427 случаев злокачественного новообразования всего желудочно-кишечного тракта за тот же период. В Китае лейомиосаркома, аденокарцинома и злокачественная лимфома составляют большую часть злокачественных новообразований тонкого кишечника, но карциноид встречается редко. Однако в других странах наиболее часто встречающиеся злокачественные новообразования тонкой кишки — это аденокарцинома и карциноид, злокачественная лимфома и лейомиокарцинома [3].
Связь между патологией и местом опухоли. Наиболее частыми участками лейомиосаркомы являются тощая кишка, подвздошная кишка и двенадцатиперстная кишка.Аденокарцинома чаще всего поражает двенадцатиперстную кишку, тощую кишку и подвздошную кишку, а при злокачественной лимфоме муравьев — подвздошная кишка и тощая кишка и находится ниже в двенадцатиперстной кишке [3]. Частота распространения опухолей в этой группе случаев соответствует данным, указанным в литературе (таблица).
Распространение опухоли в тонком кишечнике. Аденокарцинома составляет около 50-66% опухолей двенадцатиперстной кишки (55,6% в этой группе), за ней следуют злокачественная лимфома и лейомиосаркома. В тощей кишке чаще всего встречается лейомиосаркома (50% в этой группе), за ней следуют аденокарцинома и злокачественная лимфома.Но в подвздошной кишке злокачественная лимфома составляет около половины всех злокачественных новообразований (48,3% в этой группе), за ней следуют аденокарцинома и лейомиосаркома.
Многие ученые считают, что низкая частота злокачественных опухолей в тонком кишечнике связана со следующими факторами: (1) Щелочность в просвете тонкого кишечника не способствует росту опухоли. (2) Быстрая перистальтика тонкой кишки рекомендуется для минимизации времени воздействия на слизистую оболочку потенциальных канцерогенов из пищи, а содержание жидкости в просвете может разбавить канцерогены, что приведет к снижению канцерогенности.(3) Отсутствие внутрипросветной бактериальной флоры, очевидно, снижает количество канцерогенных агентов, и эти бактерии необходимы в процессе метаболизма. (4) Высокая концентрация IgA, продуцируемого в основном в лимфоидной ткани тонкого кишечника, защищает от онкогенеза за счет нейтрализации вируса и потенциальных канцерогенных агентов. (5) Т-лимфоциты с сильным иммунитетом, составляющие большинство лимфоцитов, собирающих лимфатические узлы тонкого кишечника, обладают сильной способностью и специфическими характеристиками для защиты от роста опухоли.(6) Бензопиренгидроксилаза присутствует в больших количествах в слизистой оболочке тонкой кишки и может выводить токсины из канцерогенов [1].
Диагноз
Первичная злокачественная опухоль тонкой кишки легко диагностируется неправильно из-за ее низкой заболеваемости, расплывчатых и неспецифических клинических проявлений и ограниченных методов диагностики. Частота ошибочных диагнозов в литературных отчетах составляет 40–80% [4], а в нашей группе — 56%. Мы считаем, что следующие моменты являются ключевыми для повышения точности диагностики и уменьшения частоты ошибочной диагностики.
Лучше разбираться в первичной злокачественной опухоли тонкой кишки. В клинике следует с особой осторожностью относиться к заболеванию: неизвестная боль в животе, образование в брюшной полости, мелена и непроходимость, особенно при пальпации новообразования в брюшной полости.
Рентгенография бариевой муки — рутинный метод выявления первичных злокачественных опухолей тонкой кишки, диагностическая точность которого может достигать 50% [2,5]. Мы считаем, что пациентам с подозрением на опухоль в тонкой кишке по возможности следует проводить рентгенографию бариевой муки.В нашей исследуемой группе диагноз был установлен по рентгенограмме бариевой муки в 11 из 13 случаев с точностью 84,6%. Рентгенография с контрастированием воздуха и бария, при которой большое количество бария и воздуха вводится в просвет двенадцатиперстной кишки через желудочный зонд, предлагается выполнять для визуализации сегмента за сегментом тонкой кишки, чтобы повысить точность диагностики. Дистальная подвздошная кишка обычно плохо визуализируется в сериях исследований верхних отделов желудочно-кишечного тракта, но это может быть продемонстрировано с помощью бариевой клизмы, при которой контрастный материал из толстой кишки возвращается в дистальный отдел тонкой кишки через илеоцекальный клапан.Комбинация рентгенографии с бариевой мукой и бариевой клизмы может дать положительный результат в 50-80%.
Гибкое эндоскопическое обследование и прямая биопсия — самые надежные методы постановки диагноза, особенно на ранней стадии заболевания. Это также полезно и надежно для диагностики опухолей двенадцатиперстной кишки. В нашей исследуемой группе диагноз был установлен в 6 из 7 случаев при гибком эндоскопическом исследовании и подтвержден патологическим исследованием. За рубежом гибкая эндоскопия тонкой кишки использовалась в клинике в 1969 году.Но он развивался очень медленно из-за технических трудностей при установке и больших страданий пациентов [5].
Компьютерная томография (КТ) может хорошо продемонстрировать пораженную опухолью область и структуры вокруг нее. Кроме того, компьютерная томография может определить наличие локальных или отдаленных метастазов. КТ является эффективным методом, особенно для тех, чей диагноз не может быть подтвержден рентгенографией с барием желудочно-кишечного тракта [6].
Лечение
Хирургическая резекция на сегодняшний день является наиболее эффективным методом лечения злокачественной опухоли тонкой кишки.Если диагноз установлен, радикальная резекция должна быть выполнена как можно раньше, что требует как минимум сегментарной резекции 10 см пораженной области, включая удаление соответствующей брыжейки и ее лимфатических узлов [7]. Сообщалось, что 5-летняя выживаемость после радикальной резекции составляет 25–54% [1,8], что согласуется с данными (48,1%) в нашем исследовании. При раке двенадцатиперстной кишки по возможности следует провести операцию Уипплса. Опухоль в дистальном отделе подвздошной кишки лечится правой гемиколонэктомией.Паллиативная резекция опухоли имеет определенную ценность, и от нее нельзя легко отказываться. Его 5-летняя выживаемость составляет 0-25% по данным литературы [1], а в нашем исследовании — 24,1%. Операция шунтирования может временно облегчить симптомы, но не может продлить жизнь пациента. Повторная исследовательская резекция должна быть выполнена при рецидиве, если это возможно [9,10].
Необходима адъювантная послеоперационная химиотерапия злокачественной лимфомы. Неоперабельную злокачественную лимфому тонкой кишки следует лечить в основном химиотерапией, чтобы облегчить симптомы и продлить жизнь.Обычный режим химиотерапии — CHOP (CTX + VCR + ADM + преднизон). Лейомиосаркома тонкого кишечника частично чувствительна к химиотерапевтическим средствам. При обширной лейомиосаркоме предоперационная комбинированная химиотерапия ADM и CTX может минимизировать размер опухоли и повысить скорость резекции. Химиотерапия не влияет на аденокарциному тонкого кишечника из-за нечувствительности к химиотерапевтическим средствам. В нашем исследовании 27 пациентов прошли курс химиотерапии, но ни послеоперационная адъювантная, ни паллиативная химиотерапия не эффективны для продления выживаемости, что, возможно, связано с поздней стадией заболевания.
Факторы прогноза
Сообщалось, что прогностическими факторами первичной злокачественной опухоли тонкой кишки являются, в основном, тип операции, гистологический тип, место расположения опухоли и размер опухоли [1,7], и каждый из них был проанализирован с помощью моновариантного анализа. До сих пор в мире не было сообщений о прогностических факторах, изучаемых с помощью модели многомерного анализа. В нашем исследовании с помощью компьютерной модели многомерного анализа СОХ было проанализировано 12 факторов, включая пол пациента, возраст, клиническое течение, гистологический тип, локализацию опухоли, размер опухоли, общий тип, метастазирование лимфатических узлов, метастаз живого r, инвазию в соседние органы, операцию. типа, и химиотерапия.Результаты показали, что значимыми прогностическими факторами были гистологический тип, тип операции, возраст пациента и локализация опухоли, ни размер опухоли, ни химиотерапия не оказали значительного влияния на прогноз.
Обзор гистопатологии, мультидетекторной КТ и МРТ
Резюме
Новообразования тонкого кишечника, включая аденокарциному, карциноидную опухоль, лимфому и стромальные опухоли желудочно-кишечного тракта, составляют небольшой процент рака желудочно-кишечного тракта, но среди тех, у кого по сравнению с ними самый плохой прогноз с другими злокачественными новообразованиями ЖКТ.Неясные клинические сценарии и сложная радиологическая диагностика часто задерживают лечение, что отрицательно сказывается на выживаемости пациентов. Недавно мультидетекторная КТ (МДКТ) и МРТ были внедрены в качестве возможных и точных диагностических методов для выявления и определения стадии новообразований тонкой кишки. Эти методы постепенно заменяют обычную бариевую рентгенографию как предпочтительный инструмент. Однако технические и физиологические проблемы, присущие визуализации тонкой кишки, требуют знания протоколов подготовки пациентов и сканирования.Адекватные знания гистопатологии и естественной эволюции новообразований тонкой кишки также важны для дифференциальной диагностики. Целью данной статьи является обзор протоколов МДКТ и МРТ для оценки опухолей тонкой кишки и предоставление краткого, но исчерпывающего руководства по наиболее важным функциям визуализации, относящимся к гистопатологии.
Тонкая кишка (SI) составляет 75% длины и 90% поверхности слизистой оболочки пищеварительного тракта; однако из-за некоторых уникальных физиологических особенностей (быстрое прохождение, содержание щелочей, секреция IgA и лимфоидная ткань) на него приходится всего 2–6% всех новообразований желудочно-кишечного тракта (ЖКТ) [1,2].Данные программы эпидемиологии и конечных результатов эпидемиологического надзора США (SEER) с 2002 по 2006 год [3] показывают, что скорректированный по возрасту уровень заболеваемости злокачественными опухолями составляет 1,9 на 100 000 мужчин и женщин в год при скорректированном по возрасту уровне смертности 0,4. на 100 000 мужчин и женщин в год. Помимо неясного желудочно-кишечного кровотечения, пациенты могут предъявлять неспецифические жалобы, такие как боль в животе (60%), анемия (50%), тошнота и рвота (50%), потеря веса (40%), диарея (30%) и кишечная непроходимость (30%) [4].Однако многие пациенты могут оставаться бессимптомными до поздних стадий заболевания. Новообразования SI также трудно идентифицировать при диагностической визуализации, и в результате часто возникают задержки в диагностике. Maglinte и др. [5] подсчитали, что, хотя задержки в диагностике менее 2 месяцев были обычным явлением из-за того, что пациент не сообщал о симптомах, длительные задержки имели место в результате того, что врач не назначил соответствующие обследования (> 8 месяцев) и / или потому, что рентгенолог не смог поставить правильный диагноз (примерно 12 месяцев).К сожалению, последствием поздней диагностики является плохой прогноз [3]. Пятилетняя выживаемость колеблется от 0–28% для аденокарциномы, 14–30% для лимфомы и 60% для карциноидных опухолей.
До недавнего времени энтероклиз с барием считался наиболее точным радиологическим методом для выявления злокачественных новообразований тонкой кишки [6]. Однако этот метод требует дуоденальной интубации и прямой инъекции бария и метилцеллюлозы в просвет кишечника, требует много времени и плохо переносится пациентами.Кроме того, бариевый энтероклич ограничен в своей способности точно отображать настенные и внешние масштабы заболевания [6]. Альтернативой бариевому энтероклизу для визуализации SI являются мультидетекторная компьютерная томография (MDCT) и МРТ. Оба метода имеют хороший потенциал для ранней диагностики как воспалительных, так и неопластических состояний. Цели этого обзора — представить протоколы MDCT и MRI для визуализации SI, описать типичные особенности визуализации общих новообразований SI и сопоставить рентгенологические данные с конкретными гистопатологическими характеристиками.
Гистопатология и результаты визуализации
Аденокарцинома
Аденокарцинома является наиболее частой первичной злокачественной опухолью SI и составляет 40% случаев рака (). Преобладающая локализация аденокарциномы — двенадцатиперстная кишка и проксимальный отдел тощей кишки, при этом заболеваемость снижается в дистальном направлении [31]. Исключением является болезнь Крона, при которой большинство аденокарцином возникает в подвздошной кишке. Аденокарциномы могут быть полиповидными, инфильтрирующими или стенозирующими [32]. Аденокарциномы двенадцатиперстной кишки обычно имеют полиповидную или выпуклую форму ().И наоборот, поражения тощей или подвздошной кишки имеют тенденцию быть более крупными, кольцевидными, суживающими опухолями с периферическим поражением стенки кишечника; на момент постановки диагноза большинство из них демонстрируют полное париетальное проникновение и вовлечение серозной поверхности [33] (). Повышенная частота аденокарциномы тонкой кишки была описана у пациентов, страдающих семейным аденоматозным полипозом (в основном периампулярным) и синдромом Линча. Карциномы тонкой кишки похожи на свои аналоги в толстой кишке, но с большей долей низкодифференцированных опухолей с железистыми, плоскоклеточными и недифференцированными нейроэндокринными компонентами [34].
Аденокарцинома. (а) Фотография резецированной и открытой двенадцатиперстной кишки, сделанная 67-летним мужчиной с меленой, показывает вегетативное поражение 2,0 см, происходящее из слизистой оболочки, окружающей дуоденальный сосочек. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) поражения показывает неопластическую инфильтрацию (звездочка) эпителия слизистой оболочки и собственной мышечной ткани.
Таблица 1
Эпидемиология и демография новообразований тонкой кишки
| Гистология | Заболеваемость в год | соотношение m / f | Факторы риска | 5-летняя выживаемость |
| Аденокаркома | Всего = 0.4 на 100 000 | W m / f = 1,5 | Болезнь Крона, | 26,6–39% |
| Wm = 30,8% | B m / f = 1,2 | целиакия, | ||
| Wf = 32,7% | семейный аденоматоз | |||
| Bm = 37,2% | полипоз, | |||
| Bf = 45,5% | Дивертикул Меккеля | |||
| Карциноид | 68 = 0,4 на 100 000 | Вт м / ж = 1.4 | MEN1 | 60–76,5% |
| Wm = 36,0% | B m / f = 1,6 | |||
| Wf = 39,2% | ||||
| Bm = 43,9% | ||||
| Bf = 39,7% | ||||
| Лимфома | Всего = 0,3 на 100 000 | Вт м / ж = 1,9 | ВЭБ, СПИД (В-клетка) | 8–25% |
| Wm = 22,9% | В м / f = 2,3 | Целиакия (Т-лимфоциты) | ||
| Bm = 11.4% | Химиотерапия | |||
| Wf = 17,9% | ||||
| Bf = 7,3% | ||||
| GIST | В целом = 0,2 на 100 000 | W m / f = 1,4 | Нет | 45–55% |
| Wm = 10,3% | B m / f = 1,4 | |||
| Bm = 7,4% | ||||
| Wf = 10,2% | ||||
| Bf = 7,5% | ||||
| Метастазы | Серия вскрытия: | Рак легкого | Конечная стадия заболевания, резекция одиночных очагов может продлить выживание | |
| Рак легкого (12%) | Меланома | |||
| Рак груди (16%) | Рак груди | |||
| Меланома (42%) |
Таблица 2
Сводка типичных и атипичных результатов визуализации новообразований тонкой кишки
9006 2При визуализации карциномы двенадцатиперстной кишки часто выглядят как полиповидные, четко очерченные поражения [35,36] (и), хотя рак высокой степени злокачественности может проявлять более агрессивное поведение.Центральные язвы могут присутствовать в 10% случаев. Аденокарциномы тощей кишки и подвздошной кишки обычно проявляются в виде кольцевого сужения с резким концентрическим или нерегулярным стенозом «выступающего края» (), что может привести к частичной или полной обструкции [17,22]. После внутривенного введения контрастного вещества обычно наблюдается умеренное неоднородное усиление [14]. Внепросветная инфильтрация может проявляться в виде скопления жира на MDCT и гиперинтенсивности слоев наружной стенки и жира на T 2 взвешенных последовательностях MR с подавлением жира.Аденокарцинома подвздошной кишки может имитировать болезнь Крона по своим клиническим и рентгенологическим характеристикам; однако, по нашему опыту, отсутствие значительного нагрубания сосуда прямой кишки (признак «гребешок» при болезни Крона) и наличие одного очагового поражения, а не нескольких «пропускаемых» участков утолщения стенки могут быть полезными критериями для подозрения злокачественность (). Вторичные лимфаденопатии могут присутствовать на момент постановки диагноза и должны быть дифференцированы от более крупных узлов, которые возникают при лимфоматозном поражении брыжейки.
Аденокарцинома. Тот же пациент, что и. (а) Магнитно-резонансная холангиопанкреатография (MRCP) демонстрирует обструкцию главного протока поджелудочной железы и общего желчного протока с потерей сигнала на сосочке двенадцатиперстной кишки (стрелка), застоем и расширением печеночных желчных протоков. (b) Подавленные жиром аксиальные последовательности T 1 испорченного градиентного эхо (SPGRE), полученные после внутривенного введения контрастного вещества и водного растяжения двенадцатиперстной кишки, позволили идентифицировать гиперваскулярное выпячивание из сосочка (звездочка).(c) Многодетекторная КТ, выполненная после стентирования желчных протоков, подтверждает наличие поражения (звездочка), которое можно четко дифференцировать от паренхимы поджелудочной железы, исключая, в то же время, инфильтрацию перивисцеральной жировой ткани.
Аденокарцинома. Мужчина 49 лет с меленой и эндоскопическим диагнозом новообразования двенадцатиперстной кишки. Высокий внутрипросветный сигнал, достигнутый на (а) МРТ-визуализации с истинной прецессией (true-FISP) после растяжения воды в двенадцатиперстной кишке, позволяет идентифицировать полиповидное поражение (стрелка) с толстой ножкой и дольчатыми профилями, обращенными к двенадцатиперстной кишке. сосочек.Контур наружных слоев стенки сохраняется, за исключением глубокой внепросветной инфильтрации. (b) В этом случае слабый градиент затухания и меньшее расширение просвета, достигаемое на мультидетекторной компьютерной томографии, препятствуют точному очерчиванию очага поражения (стрелка).
Аденокарцинома. 89-летний мужчина с похуданием, болями в животе и меленой поступил в отделение неотложной помощи. Мультидетекторные КТ-изображения, полученные после перорального введения контрастного вещества с низкой концентрацией, демонстрируют эксцентрическое и частично стенозирующее утолщение стенки с вовлечением одной из проксимальных петель тощей кишки (стрелки).Поражение выходит за пределы стенки, инфильтрируя перивисцеральный жир. Также визуализируются множественные перитонеальные имплантаты (стрелки), перигепатический асцит (черная стрелка) и некоторые сантиметровые лимфаденопатии (звездочка).
Аденокарцинома. 66-летний мужчина с похуданием, меленой и неполной колоноскопией. Мультидетекторные КТ-изображения демонстрируют большую массу, происходящую из последней петли подвздошной кишки ((а) стрелки), инфильтрирующей илеоцекальный клапан. Поражение распространяется на перивисцеральный жир и инфильтрирует брюшину ((b) стрелки).Также можно идентифицировать небольшие метастазы в печень ((b) звездочка) и некротические лимфаденопатии ((c) звездочка).
Карциноидные опухоли
Карциноид является вторым по частоте злокачественным новообразованием, составляющим примерно 20-25% всех поражений SI, хотя недавно сообщалось, что его частота увеличивается до 35%. Эти опухоли возникают из энтерохромаффинных клеток, расположенных в криптах Либеркюн, и продуцируют серотонин и другие гистаминоподобные вещества [37]. Карциноидные опухоли чаще встречаются в подвздошной кишке (большинство в пределах 60 см от илеоцекального клапана), чем в тощей кишке или двенадцатиперстной кишке, и на момент постановки диагноза поражения могут быть множественными и / или метастатическими (печень и легкие).Прогноз обычно отрицательно зависит от возраста пациента и размера опухоли. Макроскопически карциноид представляет собой интрамуральную или слизистую массу, которая может проникать в брыжейку, вызывая сильную десмопластическую реакцию, которая приводит к кальцификации, скручиванию жира и, в конечном итоге, перегибу сегментов кишечника (), часто с кишечной непроходимостью [38]. Гистологически опухоли напоминают аденокарциномы, но с менее агрессивным развитием. Поражения SI демонстрируют сильную аргентафиновую реакцию, и иммуногистохимическое окрашивание (хромогранин, нейронспецифическая энолаза, синаптофизин) является обязательным для подтверждения гистологической классификации ().
Карциноидная опухоль. (а) Фотография резецированной и открытой петли тощей кишки (справа) и брыжейки (слева) от 57-летней женщины с диареей, покраснением и болью в животе показывает округлое поражение 1,5 см, исходящее из стенки тощей кишки. без сглаживания слизистой оболочки и скручивания брыжейки, заканчивающейся бляшкообразной зоной десмопластической реакции. (b) Микрофотография с малым увеличением (увеличение × 4; окраска гематоксилином-эозином) поражения показывает неопластическое вовлечение подслизистого слоя в значительной степени с трансмуральным расширением (стрелки).Неопластические изменения поверхностного эпителия отсутствуют. (c) Окраска антител к кромогранину подтверждает диагноз карциноидной опухоли (звездочка).
При диагностической визуализации карциноид обычно выглядит как париетальный узел с резким усилением контраста в артериальной фазе [14,17,22] (). Поскольку большинство поражений на момент обследования имеют небольшой размер (<2 см), необходимо добиться оптимального растяжения просвета кишечника, чтобы правильно идентифицировать узелки. При неулучшенном МРТ карциноидные опухоли обычно выглядят как изоинтенсивные по отношению к мышцам на взвешенных изображениях T 1 и изо- или умеренно гиперинтенсивные по отношению к мышцам на T 2 взвешенных изображениях [39].В некоторых случаях невозможно идентифицировать дискретную массу, и в таких случаях опухоль обычно развивается как очаговое утолщение стенки петли кишечника. Наиболее характерной особенностью карциноидных опухолей является интенсивная десмопластическая реакция в брыжейке, вызванная внепариетальной инфильтрацией [14,40]. И МДКТ, и МРТ могут показать нечеткое образование мягких тканей с неровными краями и инфильтративным характером, связанным с мезентериальным фиброзом (). До 70% случаев эти брыжеечные образования содержат кальцификаты, которые правильно идентифицируются только при МДКТ [14].Более того, кальцификации брыжейки можно использовать для дифференциации фиброза, вызванного карциноидами, от других состояний, таких как фиброматоз брыжейки, при которых осаждение кальция встречается редко [41]. Брыжеечный сосуд может быть вовлечен в результате прямой оболочки опухоли или десмопластической реакции. Сужение или нагрубание прямой кишки, а также секреторные выделения () могут происходить из-за действия гормонов, выделяемых новообразованием. Особое внимание следует уделять выявлению синхронных локализаций в SI и возможному присутствию гиперваскулярных метастазов в печени.Альтернативные методы диагностики, такие как сканирование рецепторов соматостастина или позитронно-эмиссионная томография (ПЭТ) с C 11 -гидрокситритофаном, могут быть приемлемым вариантом при подозрении на карциноид в отсутствие подтверждающих обычных данных поперечной визуализации.
Карциноидная опухоль. Тот же пациент, что и. (а) Коронарное истинное быстрое изображение со стабильной прецессией (истинное FISP) изображение демонстрирует небольшой дефект наполнения (стрелка) в первой петле тощей кишки; также могут быть визуализированы некоторые поражения печени.(b) Мультидетекторное КТ-изображение, полученное у одного и того же пациента в артериальной фазе, показывает небольшое внутрипросветное усиливающее поражение (стрелка) и массовое десмопластическое изменение брыжейки (острие стрелки) с точечными кальцификациями (звездочка). (c) Портально-венозное сканирование также показывает множественные гиперваскулярные метастазы в печени (звездочка).
Карциноидная опухоль. 50-летний мужчина с множественными поражениями печени, выявленными при обычном ультразвуковом сканировании от неизвестного первичного рака. (а) Многодетекторные КТ-изображения, полученные в портально-венозной фазе, демонстрируют усиление поражения подвздошной кишки (стрелка) с массоформирующей десмопластической реакцией в брыжейке (звездочка), заметное поражение брыжейки хорошо визуализируется на аксиальных изображениях ((b) наконечники стрелок).
Атипичная карциноидная опухоль. 46-летняя женщина с хронической диареей, гиперемией, сердечной аритмией и высоким уровнем 5-HIAA в моче. (а) Мультидетекторные КТ-изображения демонстрируют периферическое утолщение последней петли подвздошной кишки с сохранением слоев наружной стенки, (б) некоторые неровности слизистой оболочки могут быть идентифицированы на ретроградном изображении с виртуальной эндоскопической реконструкции. (c) Каудальные срезы показывают заметное растяжение жидкости петель подвздошной и тощей кишки из-за секреторных выделений, вызванных карциноидами.
Лимфома
Третье по частоте новообразование — неходжкинская лимфома (10–15% случаев). Это новообразование чаще встречается у пациентов с глютеновой болезнью и у пациентов с синдромом приобретенного иммунодефицита (СПИД) и особенно распространено в развивающихся странах. Ранние поражения могут проявляться в виде бляшек на слизистой оболочке, в то время как продвинутые, инфильтрирующие поражения вызывают полное утолщение стенок и изъязвление слизистой оболочки. Другие поражения могут проявляться в виде полипоидных масс, выступающих в просвет.Поражение наружного слоя кишечной стенки часто приводит к широкой инфильтрации собственной мышечной ткани и кишечного сплетения, вызывая нарушение моторики и вторичную обструкцию [42] (). Более того, отсутствие поддержки стромы в более крупных поражениях может определять ишемию, некроз и перфорацию стенки. Атипичные лимфоидные клетки заселяют поверхностный эпителий, впоследствии замещая подслизистую основу и даже мышечную стенку в запущенных случаях (). Большинство SI-лимфом представляют собой поражения B-клеточного типа, в то время как небольшой процент представляют собой T-клеточные лимфомы, равномерно распределенные между поражениями низкой и высокой степени [43].
Неходжкинская В-клеточная лимфома. (а) Фотография резецированных петель подвздошной кишки и брыжейки, сделанная 53-летним мужчиной с болью в животе и окклюзией тонкой кишки, показывает объемную некротическую лимфаденопатию (стрелка) и обширную аморфную неопластическую инфильтрацию стенок подвздошной кишки и брыжейки (звездочка) . (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилин-эозином) демонстрирует стирание слизистой оболочки инфильтратом лимфоидных клеток (звездочка) и прилегающей нормальной слизистой оболочкой кишечника.(c) Микрофотография с большим увеличением (увеличение × 400; окраска гематоксилин-эозином) демонстрирует, что крупные В-клетки инфильтрируют железистые крипты.
Вследствие протеиформных аспектов этого новообразования лимфома тонкой кишки имеет широкий спектр радиологических проявлений. Описаны по крайней мере четыре основных паттерна лимфоматозного поражения SI [14,44]. Наиболее распространенный тип изменения (50% случаев) представлен инфильтративным поражением на всю толщину с разрушением нормальных складок слизистой оболочки (), которое может затрагивать мышечный слой, блокируя перистальтику и вызывая аневризматическое расширение петель кишечника.Аденокарциному обычно следует рассматривать для дифференциальной диагностики, хотя это поражение обычно проявляется без аневризматического расширения кишечника [14]. Лимфома также может присутствовать в виде мультифокальных узелков на нескольких участках вдоль SI (требующих дифференциации от карциноидной опухоли) или в виде единичного массообразующего поражения, которое может вызывать инвагинацию или непроходимость (). В качестве альтернативы была описана экзофитная саркомоподобная форма. После введения контрастного вещества лимфома демонстрирует однородное легкое усиление.Описаны некрозы или свищи соседних петель кишечника, в основном в экзофитной форме [45], с повышенным риском перфорации во время химиотерапии. Сателлитные лимфаденопатии обычно имеют большие размеры (), больше, чем при других новообразованиях, и могут использоваться как дифференциальный признак [14].
Лимфома. 72-летняя женщина с ранее леченной неходжкинской B-клеточной лимфомой. (а) Аксиальное T 2 взвешенное изображение турбо спинового эха демонстрирует диффузное утолщение стенки одной из последних петель подвздошной кишки (стрелка).Также определяется сигнальное изменение костного мозга правой подвздошной кости (звездочка). (b) T 1 взвешенных изображений без и (c) с жировым насыщением подтверждают результаты (стрелки), что позволяет исключить заочное заболевание. Наличие инфильтрации костного мозга хорошо обозначено (звездочкой) наряду с диффузным усилением периоста после введения гадолиния.
Лимфома. Тот же пациент, что и. Мультидетекторные КТ-изображения демонстрируют периферическое утолщение (а) проксимального отдела тощей кишки с неровностями слизистой оболочки (стрелка) и сохранением слоев наружной стенки ((b) стрелка), вдоль брыжеечных сосудов идентифицируются объемные лимфаденопатии (звездочка).
Опухоли стромы желудочно-кишечного тракта
Опухоль стромальных клеток желудочно-кишечного тракта (GIST) является четвертой по распространенности злокачественной опухолью SI, на которую приходится менее 10% случаев. ГИСО развиваются из интерстициальных клеток Кахаля в сплетении Ауэрбаха [46]. Грубо говоря, ГИСО выглядят как округлые, четко очерченные образования, возникающие из мышечного слоя и часто развивающиеся экзофитически или интралюминально, они могут представлять собой изъязвления слизистой оболочки. Размер поражения может варьироваться от нескольких миллиметров до более 30 см.Более крупные поражения часто представляют собой центральный некроз и кровотечение (). Гистологически GIST можно разделить на веретеновидные и эпителиоидные разновидности. Клеточная экспрессия c-kit (CD117), трансмембранного белкового рецептора с внутриклеточным доменом тирозинкиназы, типична для GIST (85–95% случаев) и может быть продемонстрирована с помощью иммуногистохимического окрашивания [47] (). Эпителиоидные c-kit-отрицательные ГИСО обычно показывают раннее поражение лимфоузлов и имеют худший прогноз. Число митотических фигур на поле высокого увеличения (HPF) обычно принимается как эмпирический порог для прогнозирования поведения поражения: 1–5 митозов на 10 HPF предполагают потенциальное злокачественное новообразование, в то время как более 5 митозов на 10 HPF указывают на злокачественность. [48].ГИСО встречаются почти в любом месте SI, хотя злокачественные новообразования возникают в основном в дистальном отделе подвздошной кишки. GIST могут быть классифицированы как:
Желудочно-кишечная стромальная опухоль (GIST). (а) Фотография резецированной и открытой экзофитной массы, происходящей из петли тощей кишки (не показана) у 79-летней женщины, у которой был дискомфорт в животе, показывает четко выраженное внутреннее ядро (звездочка), окруженное более крупной твердой тканью с некротизированной и геморрагические изменения. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) внутреннего ядра (звездочка) показывает вовлечение всех подслизистых слоев без инфильтрации эпителия слизистой оболочки.(c) Окраска антител к CD-117 подтверждает диагноз GIST (звездочка).
подслизистый слой: гладкий, округло-овальный дефект наполнения просвета SI;
субсерозный: внешние или экзоцентрические образования, которые смещают соседние петли кишечника;
внутрипросветные: гиперваскулярные поражения часто коррелируют с кровотечением и изъязвлением.
Другие рентгенологические данные, которые могут указывать на злокачественную форму, включают неправильную форму с низким затуханием и внутренним некрозом на MDCT [49,50] () и гиперинтенсивность на T 2 МРТ, показывающую центральный некроз [16,51 ].Прямое распространение на соседние петли кишечника, сосудистую оболочку и метастазы являются обычным явлением для злокачественных образований (). Нейрофибромы тонкой кишки похожи на доброкачественные ГИСО и могут быть в равной степени гиперваскулярными. У пациентов с приобретенным иммунодефицитом следует отличать множественные ГИСО от кишечной саркомы Капоши [52]. И МДКТ, и МРТ важны для оценки ответа на лечение.
Субсерозная стромальная опухоль желудочно-кишечного тракта низкой степени злокачественности (GIST). Тот же пациент, что и. (а) Мультидетекторные КТ-изображения демонстрируют большое поражение (стрелка) с четко определенными краями, исходящими от брыжеечной стороны одной из последних петель подвздошной кишки, перигепатический асцит подтвержден (черная стрелка).(b) Сагиттальная реконструкция четко демонстрирует преобладающее экстрапросветное распространение поражения, также выявляя множественные некротические очаги внутри поражения (звездочка).
Внутрипросветная стромальная опухоль желудочно-кишечного тракта высокой степени злокачественности (GIST). 73-летняя женщина с ранее удаленной ГИСО и недавней кишечной непроходимостью. (a) Корональное изображение T 2 взвешенных полуфурье-снимков однократного турбо спинового эхо-сигнала демонстрирует концентрическое утолщение стенки на месте предыдущей резекции (стрелка) с дилатацией верхней петли кишечника (черная стрелка).Также идентифицированы множественные кишечные и перитонеальные имплантаты ((b) звездочка). (c) Насыщенные жирами T 1 взвешенное изображение испорченного градиентного эхо, полученное после внутривенного введения гадолиния, показывает гиперваскулярные поражения печени (стрелки) и имплантаты брюшины малого таза ((d) звездочка).
Метастазы
Хотя метастазы являются наименее распространенными злокачественными новообразованиями SI, тонкий кишечник остается основным местом метастазирования в желудочно-кишечном тракте. В то время как GIST, аденокарцинома и карциноидные опухоли часто дают метастазы в SI, наиболее частыми экстраабдоминальными причинами метастазов SI являются меланома [53], рак легких [54], груди и щитовидной железы [55].Обычно макроскопические признаки, такие как мультифокальность, отсутствие изъязвлений и преобладающий внешний компонент, могут указывать на метастатическое заболевание (). Гистологически метастазы обычно бывают подслизистыми или субсерозными, и их легко отличить от первичных опухолей; тем не менее, иммуногистохимия также может помочь дифференцировать первичный рак от метастазов (). Метастатическое распространение в тонкую кишку обычно выглядит как гладкое, круглое или полиповидное образование с «целевым» аспектом язвенного поражения, которое может привести к инвагинации или окклюзии [22,56] ().Метастазы в тонкую кишку также могут возникать в виде экстрамуральных узелков после внутрибрюшинного посева, особенно при первичных муцинозных опухолях (яичники, аппендикс и толстая кишка). Увеличение толщины стенки кишечника с инфильтрацией брыжеечного жира (сальниковой корки) является классическим рентгенологическим признаком внутрибрюшинного посева на МДКТ и МРТ [57]. Поскольку радиологический диагноз метастазов не является диагностическим для первичной опухоли, компьютерная томография всего тела может быть полезной для выявления первичного очага.
Метастазы. (а) Фотография резецированных петель подвздошной кишки и экзофитных масс, исходящих из стенки кишечника, у 68-летней женщины с предыдущим диагнозом кожной меланомы, у которой была окклюзия тонкой кишки. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) показывает неопластическую инфильтрацию наружных слоев стенки кишечника (звездочка) с интактным эпителием слизистой оболочки (наконечник стрелки). (c) Микрофотография с большим увеличением (увеличение × 400; окраска гематоксилин-эозином) демонстрирует пролиферацию круглых анапластических клеток, вовлекающих собственную мышечную мышцу (стрелки).
Метастазы (меланома). Тот же пациент, что и. (a) Многодетекторные КТ-изображения демонстрируют большое поражение (стрелка) с плохо очерченными дольчатыми краями, развивающееся из слоев внутренней стенки подвздошной петли, в то время как поражение развивается как большая масса с некротическим ядром ((b, c) наконечники стрел ) кишечник не закупорен из-за преобладающей заочной вегетативной формы опухоли.
Заключение
Поскольку первичные и вторичные новообразования тонкой кишки встречаются редко, проявляются неспецифическими симптомами и имеют небольшой размер на ранней стадии, они по-прежнему представляют собой диагностическую проблему для радиологов.Использование современных МДКТ и МРТ с соответствующим применением адаптированных протоколов сканирования и пониманием визуализационных признаков каждого патологического объекта по сравнению с естественной историей опухоли и микроскопической гистологией может оказать значительную помощь в повседневной жизни. режим работы радиологов ЖКТ.
Обзор гистопатологии, мультидетекторной КТ и МРТ
Резюме
Новообразования тонкого кишечника, включая аденокарциному, карциноидную опухоль, лимфому и стромальные опухоли желудочно-кишечного тракта, составляют небольшой процент рака желудочно-кишечного тракта, но среди тех, у кого по сравнению с ними самый плохой прогноз с другими злокачественными новообразованиями ЖКТ.Неясные клинические сценарии и сложная радиологическая диагностика часто задерживают лечение, что отрицательно сказывается на выживаемости пациентов. Недавно мультидетекторная КТ (МДКТ) и МРТ были внедрены в качестве возможных и точных диагностических методов для выявления и определения стадии новообразований тонкой кишки. Эти методы постепенно заменяют обычную бариевую рентгенографию как предпочтительный инструмент. Однако технические и физиологические проблемы, присущие визуализации тонкой кишки, требуют знания протоколов подготовки пациентов и сканирования.Адекватные знания гистопатологии и естественной эволюции новообразований тонкой кишки также важны для дифференциальной диагностики. Целью данной статьи является обзор протоколов МДКТ и МРТ для оценки опухолей тонкой кишки и предоставление краткого, но исчерпывающего руководства по наиболее важным функциям визуализации, относящимся к гистопатологии.
Тонкая кишка (SI) составляет 75% длины и 90% поверхности слизистой оболочки пищеварительного тракта; однако из-за некоторых уникальных физиологических особенностей (быстрое прохождение, содержание щелочей, секреция IgA и лимфоидная ткань) на него приходится всего 2–6% всех новообразований желудочно-кишечного тракта (ЖКТ) [1,2].Данные программы эпидемиологии и конечных результатов эпидемиологического надзора США (SEER) с 2002 по 2006 год [3] показывают, что скорректированный по возрасту уровень заболеваемости злокачественными опухолями составляет 1,9 на 100 000 мужчин и женщин в год при скорректированном по возрасту уровне смертности 0,4. на 100 000 мужчин и женщин в год. Помимо неясного желудочно-кишечного кровотечения, пациенты могут предъявлять неспецифические жалобы, такие как боль в животе (60%), анемия (50%), тошнота и рвота (50%), потеря веса (40%), диарея (30%) и кишечная непроходимость (30%) [4].Однако многие пациенты могут оставаться бессимптомными до поздних стадий заболевания. Новообразования SI также трудно идентифицировать при диагностической визуализации, и в результате часто возникают задержки в диагностике. Maglinte и др. [5] подсчитали, что, хотя задержки в диагностике менее 2 месяцев были обычным явлением из-за того, что пациент не сообщал о симптомах, длительные задержки имели место в результате того, что врач не назначил соответствующие обследования (> 8 месяцев) и / или потому, что рентгенолог не смог поставить правильный диагноз (примерно 12 месяцев).К сожалению, последствием поздней диагностики является плохой прогноз [3]. Пятилетняя выживаемость колеблется от 0–28% для аденокарциномы, 14–30% для лимфомы и 60% для карциноидных опухолей.
До недавнего времени энтероклиз с барием считался наиболее точным радиологическим методом для выявления злокачественных новообразований тонкой кишки [6]. Однако этот метод требует дуоденальной интубации и прямой инъекции бария и метилцеллюлозы в просвет кишечника, требует много времени и плохо переносится пациентами.Кроме того, бариевый энтероклич ограничен в своей способности точно отображать настенные и внешние масштабы заболевания [6]. Альтернативой бариевому энтероклизу для визуализации SI являются мультидетекторная компьютерная томография (MDCT) и МРТ. Оба метода имеют хороший потенциал для ранней диагностики как воспалительных, так и неопластических состояний. Цели этого обзора — представить протоколы MDCT и MRI для визуализации SI, описать типичные особенности визуализации общих новообразований SI и сопоставить рентгенологические данные с конкретными гистопатологическими характеристиками.
Гистопатология и результаты визуализации
Аденокарцинома
Аденокарцинома является наиболее частой первичной злокачественной опухолью SI и составляет 40% случаев рака (). Преобладающая локализация аденокарциномы — двенадцатиперстная кишка и проксимальный отдел тощей кишки, при этом заболеваемость снижается в дистальном направлении [31]. Исключением является болезнь Крона, при которой большинство аденокарцином возникает в подвздошной кишке. Аденокарциномы могут быть полиповидными, инфильтрирующими или стенозирующими [32]. Аденокарциномы двенадцатиперстной кишки обычно имеют полиповидную или выпуклую форму ().И наоборот, поражения тощей или подвздошной кишки имеют тенденцию быть более крупными, кольцевидными, суживающими опухолями с периферическим поражением стенки кишечника; на момент постановки диагноза большинство из них демонстрируют полное париетальное проникновение и вовлечение серозной поверхности [33] (). Повышенная частота аденокарциномы тонкой кишки была описана у пациентов, страдающих семейным аденоматозным полипозом (в основном периампулярным) и синдромом Линча. Карциномы тонкой кишки похожи на свои аналоги в толстой кишке, но с большей долей низкодифференцированных опухолей с железистыми, плоскоклеточными и недифференцированными нейроэндокринными компонентами [34].
Аденокарцинома. (а) Фотография резецированной и открытой двенадцатиперстной кишки, сделанная 67-летним мужчиной с меленой, показывает вегетативное поражение 2,0 см, происходящее из слизистой оболочки, окружающей дуоденальный сосочек. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) поражения показывает неопластическую инфильтрацию (звездочка) эпителия слизистой оболочки и собственной мышечной ткани.
Таблица 1
Эпидемиология и демография новообразований тонкой кишки
| Гистология | Заболеваемость в год | соотношение m / f | Факторы риска | 5-летняя выживаемость |
| Аденокаркома | Всего = 0.4 на 100 000 | W m / f = 1,5 | Болезнь Крона, | 26,6–39% |
| Wm = 30,8% | B m / f = 1,2 | целиакия, | ||
| Wf = 32,7% | семейный аденоматоз | |||
| Bm = 37,2% | полипоз, | |||
| Bf = 45,5% | Дивертикул Меккеля | |||
| Карциноид | 68 = 0,4 на 100 000 | Вт м / ж = 1.4 | MEN1 | 60–76,5% |
| Wm = 36,0% | B m / f = 1,6 | |||
| Wf = 39,2% | ||||
| Bm = 43,9% | ||||
| Bf = 39,7% | ||||
| Лимфома | Всего = 0,3 на 100 000 | Вт м / ж = 1,9 | ВЭБ, СПИД (В-клетка) | 8–25% |
| Wm = 22,9% | В м / f = 2,3 | Целиакия (Т-лимфоциты) | ||
| Bm = 11.4% | Химиотерапия | |||
| Wf = 17,9% | ||||
| Bf = 7,3% | ||||
| GIST | В целом = 0,2 на 100 000 | W m / f = 1,4 | Нет | 45–55% |
| Wm = 10,3% | B m / f = 1,4 | |||
| Bm = 7,4% | ||||
| Wf = 10,2% | ||||
| Bf = 7,5% | ||||
| Метастазы | Серия вскрытия: | Рак легкого | Конечная стадия заболевания, резекция одиночных очагов может продлить выживание | |
| Рак легкого (12%) | Меланома | |||
| Рак груди (16%) | Рак груди | |||
| Меланома (42%) |
Таблица 2
Сводка типичных и атипичных результатов визуализации новообразований тонкой кишки
9006 2При визуализации карциномы двенадцатиперстной кишки часто выглядят как полиповидные, четко очерченные поражения [35,36] (и), хотя рак высокой степени злокачественности может проявлять более агрессивное поведение.Центральные язвы могут присутствовать в 10% случаев. Аденокарциномы тощей кишки и подвздошной кишки обычно проявляются в виде кольцевого сужения с резким концентрическим или нерегулярным стенозом «выступающего края» (), что может привести к частичной или полной обструкции [17,22]. После внутривенного введения контрастного вещества обычно наблюдается умеренное неоднородное усиление [14]. Внепросветная инфильтрация может проявляться в виде скопления жира на MDCT и гиперинтенсивности слоев наружной стенки и жира на T 2 взвешенных последовательностях MR с подавлением жира.Аденокарцинома подвздошной кишки может имитировать болезнь Крона по своим клиническим и рентгенологическим характеристикам; однако, по нашему опыту, отсутствие значительного нагрубания сосуда прямой кишки (признак «гребешок» при болезни Крона) и наличие одного очагового поражения, а не нескольких «пропускаемых» участков утолщения стенки могут быть полезными критериями для подозрения злокачественность (). Вторичные лимфаденопатии могут присутствовать на момент постановки диагноза и должны быть дифференцированы от более крупных узлов, которые возникают при лимфоматозном поражении брыжейки.
Аденокарцинома. Тот же пациент, что и. (а) Магнитно-резонансная холангиопанкреатография (MRCP) демонстрирует обструкцию главного протока поджелудочной железы и общего желчного протока с потерей сигнала на сосочке двенадцатиперстной кишки (стрелка), застоем и расширением печеночных желчных протоков. (b) Подавленные жиром аксиальные последовательности T 1 испорченного градиентного эхо (SPGRE), полученные после внутривенного введения контрастного вещества и водного растяжения двенадцатиперстной кишки, позволили идентифицировать гиперваскулярное выпячивание из сосочка (звездочка).(c) Многодетекторная КТ, выполненная после стентирования желчных протоков, подтверждает наличие поражения (звездочка), которое можно четко дифференцировать от паренхимы поджелудочной железы, исключая, в то же время, инфильтрацию перивисцеральной жировой ткани.
Аденокарцинома. Мужчина 49 лет с меленой и эндоскопическим диагнозом новообразования двенадцатиперстной кишки. Высокий внутрипросветный сигнал, достигнутый на (а) МРТ-визуализации с истинной прецессией (true-FISP) после растяжения воды в двенадцатиперстной кишке, позволяет идентифицировать полиповидное поражение (стрелка) с толстой ножкой и дольчатыми профилями, обращенными к двенадцатиперстной кишке. сосочек.Контур наружных слоев стенки сохраняется, за исключением глубокой внепросветной инфильтрации. (b) В этом случае слабый градиент затухания и меньшее расширение просвета, достигаемое на мультидетекторной компьютерной томографии, препятствуют точному очерчиванию очага поражения (стрелка).
Аденокарцинома. 89-летний мужчина с похуданием, болями в животе и меленой поступил в отделение неотложной помощи. Мультидетекторные КТ-изображения, полученные после перорального введения контрастного вещества с низкой концентрацией, демонстрируют эксцентрическое и частично стенозирующее утолщение стенки с вовлечением одной из проксимальных петель тощей кишки (стрелки).Поражение выходит за пределы стенки, инфильтрируя перивисцеральный жир. Также визуализируются множественные перитонеальные имплантаты (стрелки), перигепатический асцит (черная стрелка) и некоторые сантиметровые лимфаденопатии (звездочка).
Аденокарцинома. 66-летний мужчина с похуданием, меленой и неполной колоноскопией. Мультидетекторные КТ-изображения демонстрируют большую массу, происходящую из последней петли подвздошной кишки ((а) стрелки), инфильтрирующей илеоцекальный клапан. Поражение распространяется на перивисцеральный жир и инфильтрирует брюшину ((b) стрелки).Также можно идентифицировать небольшие метастазы в печень ((b) звездочка) и некротические лимфаденопатии ((c) звездочка).
Карциноидные опухоли
Карциноид является вторым по частоте злокачественным новообразованием, составляющим примерно 20-25% всех поражений SI, хотя недавно сообщалось, что его частота увеличивается до 35%. Эти опухоли возникают из энтерохромаффинных клеток, расположенных в криптах Либеркюн, и продуцируют серотонин и другие гистаминоподобные вещества [37]. Карциноидные опухоли чаще встречаются в подвздошной кишке (большинство в пределах 60 см от илеоцекального клапана), чем в тощей кишке или двенадцатиперстной кишке, и на момент постановки диагноза поражения могут быть множественными и / или метастатическими (печень и легкие).Прогноз обычно отрицательно зависит от возраста пациента и размера опухоли. Макроскопически карциноид представляет собой интрамуральную или слизистую массу, которая может проникать в брыжейку, вызывая сильную десмопластическую реакцию, которая приводит к кальцификации, скручиванию жира и, в конечном итоге, перегибу сегментов кишечника (), часто с кишечной непроходимостью [38]. Гистологически опухоли напоминают аденокарциномы, но с менее агрессивным развитием. Поражения SI демонстрируют сильную аргентафиновую реакцию, и иммуногистохимическое окрашивание (хромогранин, нейронспецифическая энолаза, синаптофизин) является обязательным для подтверждения гистологической классификации ().
Карциноидная опухоль. (а) Фотография резецированной и открытой петли тощей кишки (справа) и брыжейки (слева) от 57-летней женщины с диареей, покраснением и болью в животе показывает округлое поражение 1,5 см, исходящее из стенки тощей кишки. без сглаживания слизистой оболочки и скручивания брыжейки, заканчивающейся бляшкообразной зоной десмопластической реакции. (b) Микрофотография с малым увеличением (увеличение × 4; окраска гематоксилином-эозином) поражения показывает неопластическое вовлечение подслизистого слоя в значительной степени с трансмуральным расширением (стрелки).Неопластические изменения поверхностного эпителия отсутствуют. (c) Окраска антител к кромогранину подтверждает диагноз карциноидной опухоли (звездочка).
При диагностической визуализации карциноид обычно выглядит как париетальный узел с резким усилением контраста в артериальной фазе [14,17,22] (). Поскольку большинство поражений на момент обследования имеют небольшой размер (<2 см), необходимо добиться оптимального растяжения просвета кишечника, чтобы правильно идентифицировать узелки. При неулучшенном МРТ карциноидные опухоли обычно выглядят как изоинтенсивные по отношению к мышцам на взвешенных изображениях T 1 и изо- или умеренно гиперинтенсивные по отношению к мышцам на T 2 взвешенных изображениях [39].В некоторых случаях невозможно идентифицировать дискретную массу, и в таких случаях опухоль обычно развивается как очаговое утолщение стенки петли кишечника. Наиболее характерной особенностью карциноидных опухолей является интенсивная десмопластическая реакция в брыжейке, вызванная внепариетальной инфильтрацией [14,40]. И МДКТ, и МРТ могут показать нечеткое образование мягких тканей с неровными краями и инфильтративным характером, связанным с мезентериальным фиброзом (). До 70% случаев эти брыжеечные образования содержат кальцификаты, которые правильно идентифицируются только при МДКТ [14].Более того, кальцификации брыжейки можно использовать для дифференциации фиброза, вызванного карциноидами, от других состояний, таких как фиброматоз брыжейки, при которых осаждение кальция встречается редко [41]. Брыжеечный сосуд может быть вовлечен в результате прямой оболочки опухоли или десмопластической реакции. Сужение или нагрубание прямой кишки, а также секреторные выделения () могут происходить из-за действия гормонов, выделяемых новообразованием. Особое внимание следует уделять выявлению синхронных локализаций в SI и возможному присутствию гиперваскулярных метастазов в печени.Альтернативные методы диагностики, такие как сканирование рецепторов соматостастина или позитронно-эмиссионная томография (ПЭТ) с C 11 -гидрокситритофаном, могут быть приемлемым вариантом при подозрении на карциноид в отсутствие подтверждающих обычных данных поперечной визуализации.
Карциноидная опухоль. Тот же пациент, что и. (а) Коронарное истинное быстрое изображение со стабильной прецессией (истинное FISP) изображение демонстрирует небольшой дефект наполнения (стрелка) в первой петле тощей кишки; также могут быть визуализированы некоторые поражения печени.(b) Мультидетекторное КТ-изображение, полученное у одного и того же пациента в артериальной фазе, показывает небольшое внутрипросветное усиливающее поражение (стрелка) и массовое десмопластическое изменение брыжейки (острие стрелки) с точечными кальцификациями (звездочка). (c) Портально-венозное сканирование также показывает множественные гиперваскулярные метастазы в печени (звездочка).
Карциноидная опухоль. 50-летний мужчина с множественными поражениями печени, выявленными при обычном ультразвуковом сканировании от неизвестного первичного рака. (а) Многодетекторные КТ-изображения, полученные в портально-венозной фазе, демонстрируют усиление поражения подвздошной кишки (стрелка) с массоформирующей десмопластической реакцией в брыжейке (звездочка), заметное поражение брыжейки хорошо визуализируется на аксиальных изображениях ((b) наконечники стрелок).
Атипичная карциноидная опухоль. 46-летняя женщина с хронической диареей, гиперемией, сердечной аритмией и высоким уровнем 5-HIAA в моче. (а) Мультидетекторные КТ-изображения демонстрируют периферическое утолщение последней петли подвздошной кишки с сохранением слоев наружной стенки, (б) некоторые неровности слизистой оболочки могут быть идентифицированы на ретроградном изображении с виртуальной эндоскопической реконструкции. (c) Каудальные срезы показывают заметное растяжение жидкости петель подвздошной и тощей кишки из-за секреторных выделений, вызванных карциноидами.
Лимфома
Третье по частоте новообразование — неходжкинская лимфома (10–15% случаев). Это новообразование чаще встречается у пациентов с глютеновой болезнью и у пациентов с синдромом приобретенного иммунодефицита (СПИД) и особенно распространено в развивающихся странах. Ранние поражения могут проявляться в виде бляшек на слизистой оболочке, в то время как продвинутые, инфильтрирующие поражения вызывают полное утолщение стенок и изъязвление слизистой оболочки. Другие поражения могут проявляться в виде полипоидных масс, выступающих в просвет.Поражение наружного слоя кишечной стенки часто приводит к широкой инфильтрации собственной мышечной ткани и кишечного сплетения, вызывая нарушение моторики и вторичную обструкцию [42] (). Более того, отсутствие поддержки стромы в более крупных поражениях может определять ишемию, некроз и перфорацию стенки. Атипичные лимфоидные клетки заселяют поверхностный эпителий, впоследствии замещая подслизистую основу и даже мышечную стенку в запущенных случаях (). Большинство SI-лимфом представляют собой поражения B-клеточного типа, в то время как небольшой процент представляют собой T-клеточные лимфомы, равномерно распределенные между поражениями низкой и высокой степени [43].
Неходжкинская В-клеточная лимфома. (а) Фотография резецированных петель подвздошной кишки и брыжейки, сделанная 53-летним мужчиной с болью в животе и окклюзией тонкой кишки, показывает объемную некротическую лимфаденопатию (стрелка) и обширную аморфную неопластическую инфильтрацию стенок подвздошной кишки и брыжейки (звездочка) . (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилин-эозином) демонстрирует стирание слизистой оболочки инфильтратом лимфоидных клеток (звездочка) и прилегающей нормальной слизистой оболочкой кишечника.(c) Микрофотография с большим увеличением (увеличение × 400; окраска гематоксилин-эозином) демонстрирует, что крупные В-клетки инфильтрируют железистые крипты.
Вследствие протеиформных аспектов этого новообразования лимфома тонкой кишки имеет широкий спектр радиологических проявлений. Описаны по крайней мере четыре основных паттерна лимфоматозного поражения SI [14,44]. Наиболее распространенный тип изменения (50% случаев) представлен инфильтративным поражением на всю толщину с разрушением нормальных складок слизистой оболочки (), которое может затрагивать мышечный слой, блокируя перистальтику и вызывая аневризматическое расширение петель кишечника.Аденокарциному обычно следует рассматривать для дифференциальной диагностики, хотя это поражение обычно проявляется без аневризматического расширения кишечника [14]. Лимфома также может присутствовать в виде мультифокальных узелков на нескольких участках вдоль SI (требующих дифференциации от карциноидной опухоли) или в виде единичного массообразующего поражения, которое может вызывать инвагинацию или непроходимость (). В качестве альтернативы была описана экзофитная саркомоподобная форма. После введения контрастного вещества лимфома демонстрирует однородное легкое усиление.Описаны некрозы или свищи соседних петель кишечника, в основном в экзофитной форме [45], с повышенным риском перфорации во время химиотерапии. Сателлитные лимфаденопатии обычно имеют большие размеры (), больше, чем при других новообразованиях, и могут использоваться как дифференциальный признак [14].
Лимфома. 72-летняя женщина с ранее леченной неходжкинской B-клеточной лимфомой. (а) Аксиальное T 2 взвешенное изображение турбо спинового эха демонстрирует диффузное утолщение стенки одной из последних петель подвздошной кишки (стрелка).Также определяется сигнальное изменение костного мозга правой подвздошной кости (звездочка). (b) T 1 взвешенных изображений без и (c) с жировым насыщением подтверждают результаты (стрелки), что позволяет исключить заочное заболевание. Наличие инфильтрации костного мозга хорошо обозначено (звездочкой) наряду с диффузным усилением периоста после введения гадолиния.
Лимфома. Тот же пациент, что и. Мультидетекторные КТ-изображения демонстрируют периферическое утолщение (а) проксимального отдела тощей кишки с неровностями слизистой оболочки (стрелка) и сохранением слоев наружной стенки ((b) стрелка), вдоль брыжеечных сосудов идентифицируются объемные лимфаденопатии (звездочка).
Опухоли стромы желудочно-кишечного тракта
Опухоль стромальных клеток желудочно-кишечного тракта (GIST) является четвертой по распространенности злокачественной опухолью SI, на которую приходится менее 10% случаев. ГИСО развиваются из интерстициальных клеток Кахаля в сплетении Ауэрбаха [46]. Грубо говоря, ГИСО выглядят как округлые, четко очерченные образования, возникающие из мышечного слоя и часто развивающиеся экзофитически или интралюминально, они могут представлять собой изъязвления слизистой оболочки. Размер поражения может варьироваться от нескольких миллиметров до более 30 см.Более крупные поражения часто представляют собой центральный некроз и кровотечение (). Гистологически GIST можно разделить на веретеновидные и эпителиоидные разновидности. Клеточная экспрессия c-kit (CD117), трансмембранного белкового рецептора с внутриклеточным доменом тирозинкиназы, типична для GIST (85–95% случаев) и может быть продемонстрирована с помощью иммуногистохимического окрашивания [47] (). Эпителиоидные c-kit-отрицательные ГИСО обычно показывают раннее поражение лимфоузлов и имеют худший прогноз. Число митотических фигур на поле высокого увеличения (HPF) обычно принимается как эмпирический порог для прогнозирования поведения поражения: 1–5 митозов на 10 HPF предполагают потенциальное злокачественное новообразование, в то время как более 5 митозов на 10 HPF указывают на злокачественность. [48].ГИСО встречаются почти в любом месте SI, хотя злокачественные новообразования возникают в основном в дистальном отделе подвздошной кишки. GIST могут быть классифицированы как:
Желудочно-кишечная стромальная опухоль (GIST). (а) Фотография резецированной и открытой экзофитной массы, происходящей из петли тощей кишки (не показана) у 79-летней женщины, у которой был дискомфорт в животе, показывает четко выраженное внутреннее ядро (звездочка), окруженное более крупной твердой тканью с некротизированной и геморрагические изменения. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) внутреннего ядра (звездочка) показывает вовлечение всех подслизистых слоев без инфильтрации эпителия слизистой оболочки.(c) Окраска антител к CD-117 подтверждает диагноз GIST (звездочка).
подслизистый слой: гладкий, округло-овальный дефект наполнения просвета SI;
субсерозный: внешние или экзоцентрические образования, которые смещают соседние петли кишечника;
внутрипросветные: гиперваскулярные поражения часто коррелируют с кровотечением и изъязвлением.
Другие рентгенологические данные, которые могут указывать на злокачественную форму, включают неправильную форму с низким затуханием и внутренним некрозом на MDCT [49,50] () и гиперинтенсивность на T 2 МРТ, показывающую центральный некроз [16,51 ].Прямое распространение на соседние петли кишечника, сосудистую оболочку и метастазы являются обычным явлением для злокачественных образований (). Нейрофибромы тонкой кишки похожи на доброкачественные ГИСО и могут быть в равной степени гиперваскулярными. У пациентов с приобретенным иммунодефицитом следует отличать множественные ГИСО от кишечной саркомы Капоши [52]. И МДКТ, и МРТ важны для оценки ответа на лечение.
Субсерозная стромальная опухоль желудочно-кишечного тракта низкой степени злокачественности (GIST). Тот же пациент, что и. (а) Мультидетекторные КТ-изображения демонстрируют большое поражение (стрелка) с четко определенными краями, исходящими от брыжеечной стороны одной из последних петель подвздошной кишки, перигепатический асцит подтвержден (черная стрелка).(b) Сагиттальная реконструкция четко демонстрирует преобладающее экстрапросветное распространение поражения, также выявляя множественные некротические очаги внутри поражения (звездочка).
Внутрипросветная стромальная опухоль желудочно-кишечного тракта высокой степени злокачественности (GIST). 73-летняя женщина с ранее удаленной ГИСО и недавней кишечной непроходимостью. (a) Корональное изображение T 2 взвешенных полуфурье-снимков однократного турбо спинового эхо-сигнала демонстрирует концентрическое утолщение стенки на месте предыдущей резекции (стрелка) с дилатацией верхней петли кишечника (черная стрелка).Также идентифицированы множественные кишечные и перитонеальные имплантаты ((b) звездочка). (c) Насыщенные жирами T 1 взвешенное изображение испорченного градиентного эхо, полученное после внутривенного введения гадолиния, показывает гиперваскулярные поражения печени (стрелки) и имплантаты брюшины малого таза ((d) звездочка).
Метастазы
Хотя метастазы являются наименее распространенными злокачественными новообразованиями SI, тонкий кишечник остается основным местом метастазирования в желудочно-кишечном тракте. В то время как GIST, аденокарцинома и карциноидные опухоли часто дают метастазы в SI, наиболее частыми экстраабдоминальными причинами метастазов SI являются меланома [53], рак легких [54], груди и щитовидной железы [55].Обычно макроскопические признаки, такие как мультифокальность, отсутствие изъязвлений и преобладающий внешний компонент, могут указывать на метастатическое заболевание (). Гистологически метастазы обычно бывают подслизистыми или субсерозными, и их легко отличить от первичных опухолей; тем не менее, иммуногистохимия также может помочь дифференцировать первичный рак от метастазов (). Метастатическое распространение в тонкую кишку обычно выглядит как гладкое, круглое или полиповидное образование с «целевым» аспектом язвенного поражения, которое может привести к инвагинации или окклюзии [22,56] ().Метастазы в тонкую кишку также могут возникать в виде экстрамуральных узелков после внутрибрюшинного посева, особенно при первичных муцинозных опухолях (яичники, аппендикс и толстая кишка). Увеличение толщины стенки кишечника с инфильтрацией брыжеечного жира (сальниковой корки) является классическим рентгенологическим признаком внутрибрюшинного посева на МДКТ и МРТ [57]. Поскольку радиологический диагноз метастазов не является диагностическим для первичной опухоли, компьютерная томография всего тела может быть полезной для выявления первичного очага.
Метастазы. (а) Фотография резецированных петель подвздошной кишки и экзофитных масс, исходящих из стенки кишечника, у 68-летней женщины с предыдущим диагнозом кожной меланомы, у которой была окклюзия тонкой кишки. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) показывает неопластическую инфильтрацию наружных слоев стенки кишечника (звездочка) с интактным эпителием слизистой оболочки (наконечник стрелки). (c) Микрофотография с большим увеличением (увеличение × 400; окраска гематоксилин-эозином) демонстрирует пролиферацию круглых анапластических клеток, вовлекающих собственную мышечную мышцу (стрелки).
Метастазы (меланома). Тот же пациент, что и. (a) Многодетекторные КТ-изображения демонстрируют большое поражение (стрелка) с плохо очерченными дольчатыми краями, развивающееся из слоев внутренней стенки подвздошной петли, в то время как поражение развивается как большая масса с некротическим ядром ((b, c) наконечники стрел ) кишечник не закупорен из-за преобладающей заочной вегетативной формы опухоли.
Заключение
Поскольку первичные и вторичные новообразования тонкой кишки встречаются редко, проявляются неспецифическими симптомами и имеют небольшой размер на ранней стадии, они по-прежнему представляют собой диагностическую проблему для радиологов.Использование современных МДКТ и МРТ с соответствующим применением адаптированных протоколов сканирования и пониманием визуализационных признаков каждого патологического объекта по сравнению с естественной историей опухоли и микроскопической гистологией может оказать значительную помощь в повседневной жизни. режим работы радиологов ЖКТ.
Обзор гистопатологии, мультидетекторной КТ и МРТ
Резюме
Новообразования тонкого кишечника, включая аденокарциному, карциноидную опухоль, лимфому и стромальные опухоли желудочно-кишечного тракта, составляют небольшой процент рака желудочно-кишечного тракта, но среди тех, у кого по сравнению с ними самый плохой прогноз с другими злокачественными новообразованиями ЖКТ.Неясные клинические сценарии и сложная радиологическая диагностика часто задерживают лечение, что отрицательно сказывается на выживаемости пациентов. Недавно мультидетекторная КТ (МДКТ) и МРТ были внедрены в качестве возможных и точных диагностических методов для выявления и определения стадии новообразований тонкой кишки. Эти методы постепенно заменяют обычную бариевую рентгенографию как предпочтительный инструмент. Однако технические и физиологические проблемы, присущие визуализации тонкой кишки, требуют знания протоколов подготовки пациентов и сканирования.Адекватные знания гистопатологии и естественной эволюции новообразований тонкой кишки также важны для дифференциальной диагностики. Целью данной статьи является обзор протоколов МДКТ и МРТ для оценки опухолей тонкой кишки и предоставление краткого, но исчерпывающего руководства по наиболее важным функциям визуализации, относящимся к гистопатологии.
Тонкая кишка (SI) составляет 75% длины и 90% поверхности слизистой оболочки пищеварительного тракта; однако из-за некоторых уникальных физиологических особенностей (быстрое прохождение, содержание щелочей, секреция IgA и лимфоидная ткань) на него приходится всего 2–6% всех новообразований желудочно-кишечного тракта (ЖКТ) [1,2].Данные программы эпидемиологии и конечных результатов эпидемиологического надзора США (SEER) с 2002 по 2006 год [3] показывают, что скорректированный по возрасту уровень заболеваемости злокачественными опухолями составляет 1,9 на 100 000 мужчин и женщин в год при скорректированном по возрасту уровне смертности 0,4. на 100 000 мужчин и женщин в год. Помимо неясного желудочно-кишечного кровотечения, пациенты могут предъявлять неспецифические жалобы, такие как боль в животе (60%), анемия (50%), тошнота и рвота (50%), потеря веса (40%), диарея (30%) и кишечная непроходимость (30%) [4].Однако многие пациенты могут оставаться бессимптомными до поздних стадий заболевания. Новообразования SI также трудно идентифицировать при диагностической визуализации, и в результате часто возникают задержки в диагностике. Maglinte и др. [5] подсчитали, что, хотя задержки в диагностике менее 2 месяцев были обычным явлением из-за того, что пациент не сообщал о симптомах, длительные задержки имели место в результате того, что врач не назначил соответствующие обследования (> 8 месяцев) и / или потому, что рентгенолог не смог поставить правильный диагноз (примерно 12 месяцев).К сожалению, последствием поздней диагностики является плохой прогноз [3]. Пятилетняя выживаемость колеблется от 0–28% для аденокарциномы, 14–30% для лимфомы и 60% для карциноидных опухолей.
До недавнего времени энтероклиз с барием считался наиболее точным радиологическим методом для выявления злокачественных новообразований тонкой кишки [6]. Однако этот метод требует дуоденальной интубации и прямой инъекции бария и метилцеллюлозы в просвет кишечника, требует много времени и плохо переносится пациентами.Кроме того, бариевый энтероклич ограничен в своей способности точно отображать настенные и внешние масштабы заболевания [6]. Альтернативой бариевому энтероклизу для визуализации SI являются мультидетекторная компьютерная томография (MDCT) и МРТ. Оба метода имеют хороший потенциал для ранней диагностики как воспалительных, так и неопластических состояний. Цели этого обзора — представить протоколы MDCT и MRI для визуализации SI, описать типичные особенности визуализации общих новообразований SI и сопоставить рентгенологические данные с конкретными гистопатологическими характеристиками.
Гистопатология и результаты визуализации
Аденокарцинома
Аденокарцинома является наиболее частой первичной злокачественной опухолью SI и составляет 40% случаев рака (). Преобладающая локализация аденокарциномы — двенадцатиперстная кишка и проксимальный отдел тощей кишки, при этом заболеваемость снижается в дистальном направлении [31]. Исключением является болезнь Крона, при которой большинство аденокарцином возникает в подвздошной кишке. Аденокарциномы могут быть полиповидными, инфильтрирующими или стенозирующими [32]. Аденокарциномы двенадцатиперстной кишки обычно имеют полиповидную или выпуклую форму ().И наоборот, поражения тощей или подвздошной кишки имеют тенденцию быть более крупными, кольцевидными, суживающими опухолями с периферическим поражением стенки кишечника; на момент постановки диагноза большинство из них демонстрируют полное париетальное проникновение и вовлечение серозной поверхности [33] (). Повышенная частота аденокарциномы тонкой кишки была описана у пациентов, страдающих семейным аденоматозным полипозом (в основном периампулярным) и синдромом Линча. Карциномы тонкой кишки похожи на свои аналоги в толстой кишке, но с большей долей низкодифференцированных опухолей с железистыми, плоскоклеточными и недифференцированными нейроэндокринными компонентами [34].
Аденокарцинома. (а) Фотография резецированной и открытой двенадцатиперстной кишки, сделанная 67-летним мужчиной с меленой, показывает вегетативное поражение 2,0 см, происходящее из слизистой оболочки, окружающей дуоденальный сосочек. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) поражения показывает неопластическую инфильтрацию (звездочка) эпителия слизистой оболочки и собственной мышечной ткани.
Таблица 1
Эпидемиология и демография новообразований тонкой кишки
| Гистология | Заболеваемость в год | соотношение m / f | Факторы риска | 5-летняя выживаемость |
| Аденокаркома | Всего = 0.4 на 100 000 | W m / f = 1,5 | Болезнь Крона, | 26,6–39% |
| Wm = 30,8% | B m / f = 1,2 | целиакия, | ||
| Wf = 32,7% | семейный аденоматоз | |||
| Bm = 37,2% | полипоз, | |||
| Bf = 45,5% | Дивертикул Меккеля | |||
| Карциноид | 68 = 0,4 на 100 000 | Вт м / ж = 1.4 | MEN1 | 60–76,5% |
| Wm = 36,0% | B m / f = 1,6 | |||
| Wf = 39,2% | ||||
| Bm = 43,9% | ||||
| Bf = 39,7% | ||||
| Лимфома | Всего = 0,3 на 100 000 | Вт м / ж = 1,9 | ВЭБ, СПИД (В-клетка) | 8–25% |
| Wm = 22,9% | В м / f = 2,3 | Целиакия (Т-лимфоциты) | ||
| Bm = 11.4% | Химиотерапия | |||
| Wf = 17,9% | ||||
| Bf = 7,3% | ||||
| GIST | В целом = 0,2 на 100 000 | W m / f = 1,4 | Нет | 45–55% |
| Wm = 10,3% | B m / f = 1,4 | |||
| Bm = 7,4% | ||||
| Wf = 10,2% | ||||
| Bf = 7,5% | ||||
| Метастазы | Серия вскрытия: | Рак легкого | Конечная стадия заболевания, резекция одиночных очагов может продлить выживание | |
| Рак легкого (12%) | Меланома | |||
| Рак груди (16%) | Рак груди | |||
| Меланома (42%) |
Таблица 2
Сводка типичных и атипичных результатов визуализации новообразований тонкой кишки
9006 2При визуализации карциномы двенадцатиперстной кишки часто выглядят как полиповидные, четко очерченные поражения [35,36] (и), хотя рак высокой степени злокачественности может проявлять более агрессивное поведение.Центральные язвы могут присутствовать в 10% случаев. Аденокарциномы тощей кишки и подвздошной кишки обычно проявляются в виде кольцевого сужения с резким концентрическим или нерегулярным стенозом «выступающего края» (), что может привести к частичной или полной обструкции [17,22]. После внутривенного введения контрастного вещества обычно наблюдается умеренное неоднородное усиление [14]. Внепросветная инфильтрация может проявляться в виде скопления жира на MDCT и гиперинтенсивности слоев наружной стенки и жира на T 2 взвешенных последовательностях MR с подавлением жира.Аденокарцинома подвздошной кишки может имитировать болезнь Крона по своим клиническим и рентгенологическим характеристикам; однако, по нашему опыту, отсутствие значительного нагрубания сосуда прямой кишки (признак «гребешок» при болезни Крона) и наличие одного очагового поражения, а не нескольких «пропускаемых» участков утолщения стенки могут быть полезными критериями для подозрения злокачественность (). Вторичные лимфаденопатии могут присутствовать на момент постановки диагноза и должны быть дифференцированы от более крупных узлов, которые возникают при лимфоматозном поражении брыжейки.
Аденокарцинома. Тот же пациент, что и. (а) Магнитно-резонансная холангиопанкреатография (MRCP) демонстрирует обструкцию главного протока поджелудочной железы и общего желчного протока с потерей сигнала на сосочке двенадцатиперстной кишки (стрелка), застоем и расширением печеночных желчных протоков. (b) Подавленные жиром аксиальные последовательности T 1 испорченного градиентного эхо (SPGRE), полученные после внутривенного введения контрастного вещества и водного растяжения двенадцатиперстной кишки, позволили идентифицировать гиперваскулярное выпячивание из сосочка (звездочка).(c) Многодетекторная КТ, выполненная после стентирования желчных протоков, подтверждает наличие поражения (звездочка), которое можно четко дифференцировать от паренхимы поджелудочной железы, исключая, в то же время, инфильтрацию перивисцеральной жировой ткани.
Аденокарцинома. Мужчина 49 лет с меленой и эндоскопическим диагнозом новообразования двенадцатиперстной кишки. Высокий внутрипросветный сигнал, достигнутый на (а) МРТ-визуализации с истинной прецессией (true-FISP) после растяжения воды в двенадцатиперстной кишке, позволяет идентифицировать полиповидное поражение (стрелка) с толстой ножкой и дольчатыми профилями, обращенными к двенадцатиперстной кишке. сосочек.Контур наружных слоев стенки сохраняется, за исключением глубокой внепросветной инфильтрации. (b) В этом случае слабый градиент затухания и меньшее расширение просвета, достигаемое на мультидетекторной компьютерной томографии, препятствуют точному очерчиванию очага поражения (стрелка).
Аденокарцинома. 89-летний мужчина с похуданием, болями в животе и меленой поступил в отделение неотложной помощи. Мультидетекторные КТ-изображения, полученные после перорального введения контрастного вещества с низкой концентрацией, демонстрируют эксцентрическое и частично стенозирующее утолщение стенки с вовлечением одной из проксимальных петель тощей кишки (стрелки).Поражение выходит за пределы стенки, инфильтрируя перивисцеральный жир. Также визуализируются множественные перитонеальные имплантаты (стрелки), перигепатический асцит (черная стрелка) и некоторые сантиметровые лимфаденопатии (звездочка).
Аденокарцинома. 66-летний мужчина с похуданием, меленой и неполной колоноскопией. Мультидетекторные КТ-изображения демонстрируют большую массу, происходящую из последней петли подвздошной кишки ((а) стрелки), инфильтрирующей илеоцекальный клапан. Поражение распространяется на перивисцеральный жир и инфильтрирует брюшину ((b) стрелки).Также можно идентифицировать небольшие метастазы в печень ((b) звездочка) и некротические лимфаденопатии ((c) звездочка).
Карциноидные опухоли
Карциноид является вторым по частоте злокачественным новообразованием, составляющим примерно 20-25% всех поражений SI, хотя недавно сообщалось, что его частота увеличивается до 35%. Эти опухоли возникают из энтерохромаффинных клеток, расположенных в криптах Либеркюн, и продуцируют серотонин и другие гистаминоподобные вещества [37]. Карциноидные опухоли чаще встречаются в подвздошной кишке (большинство в пределах 60 см от илеоцекального клапана), чем в тощей кишке или двенадцатиперстной кишке, и на момент постановки диагноза поражения могут быть множественными и / или метастатическими (печень и легкие).Прогноз обычно отрицательно зависит от возраста пациента и размера опухоли. Макроскопически карциноид представляет собой интрамуральную или слизистую массу, которая может проникать в брыжейку, вызывая сильную десмопластическую реакцию, которая приводит к кальцификации, скручиванию жира и, в конечном итоге, перегибу сегментов кишечника (), часто с кишечной непроходимостью [38]. Гистологически опухоли напоминают аденокарциномы, но с менее агрессивным развитием. Поражения SI демонстрируют сильную аргентафиновую реакцию, и иммуногистохимическое окрашивание (хромогранин, нейронспецифическая энолаза, синаптофизин) является обязательным для подтверждения гистологической классификации ().
Карциноидная опухоль. (а) Фотография резецированной и открытой петли тощей кишки (справа) и брыжейки (слева) от 57-летней женщины с диареей, покраснением и болью в животе показывает округлое поражение 1,5 см, исходящее из стенки тощей кишки. без сглаживания слизистой оболочки и скручивания брыжейки, заканчивающейся бляшкообразной зоной десмопластической реакции. (b) Микрофотография с малым увеличением (увеличение × 4; окраска гематоксилином-эозином) поражения показывает неопластическое вовлечение подслизистого слоя в значительной степени с трансмуральным расширением (стрелки).Неопластические изменения поверхностного эпителия отсутствуют. (c) Окраска антител к кромогранину подтверждает диагноз карциноидной опухоли (звездочка).
При диагностической визуализации карциноид обычно выглядит как париетальный узел с резким усилением контраста в артериальной фазе [14,17,22] (). Поскольку большинство поражений на момент обследования имеют небольшой размер (<2 см), необходимо добиться оптимального растяжения просвета кишечника, чтобы правильно идентифицировать узелки. При неулучшенном МРТ карциноидные опухоли обычно выглядят как изоинтенсивные по отношению к мышцам на взвешенных изображениях T 1 и изо- или умеренно гиперинтенсивные по отношению к мышцам на T 2 взвешенных изображениях [39].В некоторых случаях невозможно идентифицировать дискретную массу, и в таких случаях опухоль обычно развивается как очаговое утолщение стенки петли кишечника. Наиболее характерной особенностью карциноидных опухолей является интенсивная десмопластическая реакция в брыжейке, вызванная внепариетальной инфильтрацией [14,40]. И МДКТ, и МРТ могут показать нечеткое образование мягких тканей с неровными краями и инфильтративным характером, связанным с мезентериальным фиброзом (). До 70% случаев эти брыжеечные образования содержат кальцификаты, которые правильно идентифицируются только при МДКТ [14].Более того, кальцификации брыжейки можно использовать для дифференциации фиброза, вызванного карциноидами, от других состояний, таких как фиброматоз брыжейки, при которых осаждение кальция встречается редко [41]. Брыжеечный сосуд может быть вовлечен в результате прямой оболочки опухоли или десмопластической реакции. Сужение или нагрубание прямой кишки, а также секреторные выделения () могут происходить из-за действия гормонов, выделяемых новообразованием. Особое внимание следует уделять выявлению синхронных локализаций в SI и возможному присутствию гиперваскулярных метастазов в печени.Альтернативные методы диагностики, такие как сканирование рецепторов соматостастина или позитронно-эмиссионная томография (ПЭТ) с C 11 -гидрокситритофаном, могут быть приемлемым вариантом при подозрении на карциноид в отсутствие подтверждающих обычных данных поперечной визуализации.
Карциноидная опухоль. Тот же пациент, что и. (а) Коронарное истинное быстрое изображение со стабильной прецессией (истинное FISP) изображение демонстрирует небольшой дефект наполнения (стрелка) в первой петле тощей кишки; также могут быть визуализированы некоторые поражения печени.(b) Мультидетекторное КТ-изображение, полученное у одного и того же пациента в артериальной фазе, показывает небольшое внутрипросветное усиливающее поражение (стрелка) и массовое десмопластическое изменение брыжейки (острие стрелки) с точечными кальцификациями (звездочка). (c) Портально-венозное сканирование также показывает множественные гиперваскулярные метастазы в печени (звездочка).
Карциноидная опухоль. 50-летний мужчина с множественными поражениями печени, выявленными при обычном ультразвуковом сканировании от неизвестного первичного рака. (а) Многодетекторные КТ-изображения, полученные в портально-венозной фазе, демонстрируют усиление поражения подвздошной кишки (стрелка) с массоформирующей десмопластической реакцией в брыжейке (звездочка), заметное поражение брыжейки хорошо визуализируется на аксиальных изображениях ((b) наконечники стрелок).
Атипичная карциноидная опухоль. 46-летняя женщина с хронической диареей, гиперемией, сердечной аритмией и высоким уровнем 5-HIAA в моче. (а) Мультидетекторные КТ-изображения демонстрируют периферическое утолщение последней петли подвздошной кишки с сохранением слоев наружной стенки, (б) некоторые неровности слизистой оболочки могут быть идентифицированы на ретроградном изображении с виртуальной эндоскопической реконструкции. (c) Каудальные срезы показывают заметное растяжение жидкости петель подвздошной и тощей кишки из-за секреторных выделений, вызванных карциноидами.
Лимфома
Третье по частоте новообразование — неходжкинская лимфома (10–15% случаев). Это новообразование чаще встречается у пациентов с глютеновой болезнью и у пациентов с синдромом приобретенного иммунодефицита (СПИД) и особенно распространено в развивающихся странах. Ранние поражения могут проявляться в виде бляшек на слизистой оболочке, в то время как продвинутые, инфильтрирующие поражения вызывают полное утолщение стенок и изъязвление слизистой оболочки. Другие поражения могут проявляться в виде полипоидных масс, выступающих в просвет.Поражение наружного слоя кишечной стенки часто приводит к широкой инфильтрации собственной мышечной ткани и кишечного сплетения, вызывая нарушение моторики и вторичную обструкцию [42] (). Более того, отсутствие поддержки стромы в более крупных поражениях может определять ишемию, некроз и перфорацию стенки. Атипичные лимфоидные клетки заселяют поверхностный эпителий, впоследствии замещая подслизистую основу и даже мышечную стенку в запущенных случаях (). Большинство SI-лимфом представляют собой поражения B-клеточного типа, в то время как небольшой процент представляют собой T-клеточные лимфомы, равномерно распределенные между поражениями низкой и высокой степени [43].
Неходжкинская В-клеточная лимфома. (а) Фотография резецированных петель подвздошной кишки и брыжейки, сделанная 53-летним мужчиной с болью в животе и окклюзией тонкой кишки, показывает объемную некротическую лимфаденопатию (стрелка) и обширную аморфную неопластическую инфильтрацию стенок подвздошной кишки и брыжейки (звездочка) . (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилин-эозином) демонстрирует стирание слизистой оболочки инфильтратом лимфоидных клеток (звездочка) и прилегающей нормальной слизистой оболочкой кишечника.(c) Микрофотография с большим увеличением (увеличение × 400; окраска гематоксилин-эозином) демонстрирует, что крупные В-клетки инфильтрируют железистые крипты.
Вследствие протеиформных аспектов этого новообразования лимфома тонкой кишки имеет широкий спектр радиологических проявлений. Описаны по крайней мере четыре основных паттерна лимфоматозного поражения SI [14,44]. Наиболее распространенный тип изменения (50% случаев) представлен инфильтративным поражением на всю толщину с разрушением нормальных складок слизистой оболочки (), которое может затрагивать мышечный слой, блокируя перистальтику и вызывая аневризматическое расширение петель кишечника.Аденокарциному обычно следует рассматривать для дифференциальной диагностики, хотя это поражение обычно проявляется без аневризматического расширения кишечника [14]. Лимфома также может присутствовать в виде мультифокальных узелков на нескольких участках вдоль SI (требующих дифференциации от карциноидной опухоли) или в виде единичного массообразующего поражения, которое может вызывать инвагинацию или непроходимость (). В качестве альтернативы была описана экзофитная саркомоподобная форма. После введения контрастного вещества лимфома демонстрирует однородное легкое усиление.Описаны некрозы или свищи соседних петель кишечника, в основном в экзофитной форме [45], с повышенным риском перфорации во время химиотерапии. Сателлитные лимфаденопатии обычно имеют большие размеры (), больше, чем при других новообразованиях, и могут использоваться как дифференциальный признак [14].
Лимфома. 72-летняя женщина с ранее леченной неходжкинской B-клеточной лимфомой. (а) Аксиальное T 2 взвешенное изображение турбо спинового эха демонстрирует диффузное утолщение стенки одной из последних петель подвздошной кишки (стрелка).Также определяется сигнальное изменение костного мозга правой подвздошной кости (звездочка). (b) T 1 взвешенных изображений без и (c) с жировым насыщением подтверждают результаты (стрелки), что позволяет исключить заочное заболевание. Наличие инфильтрации костного мозга хорошо обозначено (звездочкой) наряду с диффузным усилением периоста после введения гадолиния.
Лимфома. Тот же пациент, что и. Мультидетекторные КТ-изображения демонстрируют периферическое утолщение (а) проксимального отдела тощей кишки с неровностями слизистой оболочки (стрелка) и сохранением слоев наружной стенки ((b) стрелка), вдоль брыжеечных сосудов идентифицируются объемные лимфаденопатии (звездочка).
Опухоли стромы желудочно-кишечного тракта
Опухоль стромальных клеток желудочно-кишечного тракта (GIST) является четвертой по распространенности злокачественной опухолью SI, на которую приходится менее 10% случаев. ГИСО развиваются из интерстициальных клеток Кахаля в сплетении Ауэрбаха [46]. Грубо говоря, ГИСО выглядят как округлые, четко очерченные образования, возникающие из мышечного слоя и часто развивающиеся экзофитически или интралюминально, они могут представлять собой изъязвления слизистой оболочки. Размер поражения может варьироваться от нескольких миллиметров до более 30 см.Более крупные поражения часто представляют собой центральный некроз и кровотечение (). Гистологически GIST можно разделить на веретеновидные и эпителиоидные разновидности. Клеточная экспрессия c-kit (CD117), трансмембранного белкового рецептора с внутриклеточным доменом тирозинкиназы, типична для GIST (85–95% случаев) и может быть продемонстрирована с помощью иммуногистохимического окрашивания [47] (). Эпителиоидные c-kit-отрицательные ГИСО обычно показывают раннее поражение лимфоузлов и имеют худший прогноз. Число митотических фигур на поле высокого увеличения (HPF) обычно принимается как эмпирический порог для прогнозирования поведения поражения: 1–5 митозов на 10 HPF предполагают потенциальное злокачественное новообразование, в то время как более 5 митозов на 10 HPF указывают на злокачественность. [48].ГИСО встречаются почти в любом месте SI, хотя злокачественные новообразования возникают в основном в дистальном отделе подвздошной кишки. GIST могут быть классифицированы как:
Желудочно-кишечная стромальная опухоль (GIST). (а) Фотография резецированной и открытой экзофитной массы, происходящей из петли тощей кишки (не показана) у 79-летней женщины, у которой был дискомфорт в животе, показывает четко выраженное внутреннее ядро (звездочка), окруженное более крупной твердой тканью с некротизированной и геморрагические изменения. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) внутреннего ядра (звездочка) показывает вовлечение всех подслизистых слоев без инфильтрации эпителия слизистой оболочки.(c) Окраска антител к CD-117 подтверждает диагноз GIST (звездочка).
подслизистый слой: гладкий, округло-овальный дефект наполнения просвета SI;
субсерозный: внешние или экзоцентрические образования, которые смещают соседние петли кишечника;
внутрипросветные: гиперваскулярные поражения часто коррелируют с кровотечением и изъязвлением.
Другие рентгенологические данные, которые могут указывать на злокачественную форму, включают неправильную форму с низким затуханием и внутренним некрозом на MDCT [49,50] () и гиперинтенсивность на T 2 МРТ, показывающую центральный некроз [16,51 ].Прямое распространение на соседние петли кишечника, сосудистую оболочку и метастазы являются обычным явлением для злокачественных образований (). Нейрофибромы тонкой кишки похожи на доброкачественные ГИСО и могут быть в равной степени гиперваскулярными. У пациентов с приобретенным иммунодефицитом следует отличать множественные ГИСО от кишечной саркомы Капоши [52]. И МДКТ, и МРТ важны для оценки ответа на лечение.
Субсерозная стромальная опухоль желудочно-кишечного тракта низкой степени злокачественности (GIST). Тот же пациент, что и. (а) Мультидетекторные КТ-изображения демонстрируют большое поражение (стрелка) с четко определенными краями, исходящими от брыжеечной стороны одной из последних петель подвздошной кишки, перигепатический асцит подтвержден (черная стрелка).(b) Сагиттальная реконструкция четко демонстрирует преобладающее экстрапросветное распространение поражения, также выявляя множественные некротические очаги внутри поражения (звездочка).
Внутрипросветная стромальная опухоль желудочно-кишечного тракта высокой степени злокачественности (GIST). 73-летняя женщина с ранее удаленной ГИСО и недавней кишечной непроходимостью. (a) Корональное изображение T 2 взвешенных полуфурье-снимков однократного турбо спинового эхо-сигнала демонстрирует концентрическое утолщение стенки на месте предыдущей резекции (стрелка) с дилатацией верхней петли кишечника (черная стрелка).Также идентифицированы множественные кишечные и перитонеальные имплантаты ((b) звездочка). (c) Насыщенные жирами T 1 взвешенное изображение испорченного градиентного эхо, полученное после внутривенного введения гадолиния, показывает гиперваскулярные поражения печени (стрелки) и имплантаты брюшины малого таза ((d) звездочка).
Метастазы
Хотя метастазы являются наименее распространенными злокачественными новообразованиями SI, тонкий кишечник остается основным местом метастазирования в желудочно-кишечном тракте. В то время как GIST, аденокарцинома и карциноидные опухоли часто дают метастазы в SI, наиболее частыми экстраабдоминальными причинами метастазов SI являются меланома [53], рак легких [54], груди и щитовидной железы [55].Обычно макроскопические признаки, такие как мультифокальность, отсутствие изъязвлений и преобладающий внешний компонент, могут указывать на метастатическое заболевание (). Гистологически метастазы обычно бывают подслизистыми или субсерозными, и их легко отличить от первичных опухолей; тем не менее, иммуногистохимия также может помочь дифференцировать первичный рак от метастазов (). Метастатическое распространение в тонкую кишку обычно выглядит как гладкое, круглое или полиповидное образование с «целевым» аспектом язвенного поражения, которое может привести к инвагинации или окклюзии [22,56] ().Метастазы в тонкую кишку также могут возникать в виде экстрамуральных узелков после внутрибрюшинного посева, особенно при первичных муцинозных опухолях (яичники, аппендикс и толстая кишка). Увеличение толщины стенки кишечника с инфильтрацией брыжеечного жира (сальниковой корки) является классическим рентгенологическим признаком внутрибрюшинного посева на МДКТ и МРТ [57]. Поскольку радиологический диагноз метастазов не является диагностическим для первичной опухоли, компьютерная томография всего тела может быть полезной для выявления первичного очага.
Метастазы. (а) Фотография резецированных петель подвздошной кишки и экзофитных масс, исходящих из стенки кишечника, у 68-летней женщины с предыдущим диагнозом кожной меланомы, у которой была окклюзия тонкой кишки. (b) Микрофотография с низким увеличением (увеличение × 4; окраска гематоксилином-эозином) показывает неопластическую инфильтрацию наружных слоев стенки кишечника (звездочка) с интактным эпителием слизистой оболочки (наконечник стрелки). (c) Микрофотография с большим увеличением (увеличение × 400; окраска гематоксилин-эозином) демонстрирует пролиферацию круглых анапластических клеток, вовлекающих собственную мышечную мышцу (стрелки).
Метастазы (меланома). Тот же пациент, что и. (a) Многодетекторные КТ-изображения демонстрируют большое поражение (стрелка) с плохо очерченными дольчатыми краями, развивающееся из слоев внутренней стенки подвздошной петли, в то время как поражение развивается как большая масса с некротическим ядром ((b, c) наконечники стрел ) кишечник не закупорен из-за преобладающей заочной вегетативной формы опухоли.
Заключение
Поскольку первичные и вторичные новообразования тонкой кишки встречаются редко, проявляются неспецифическими симптомами и имеют небольшой размер на ранней стадии, они по-прежнему представляют собой диагностическую проблему для радиологов.Использование современных МДКТ и МРТ с соответствующим применением адаптированных протоколов сканирования и пониманием визуализационных признаков каждого патологического объекта по сравнению с естественной историей опухоли и микроскопической гистологией может оказать значительную помощь в повседневной жизни.


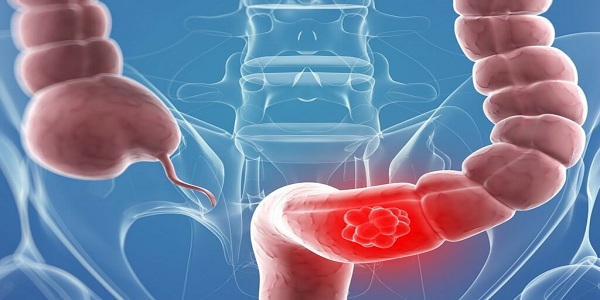
 В подавляющем большинстве случаев рак толстой кишки возникает у лиц старше 50 лет. Данное заболевание может встречаться и у молодых людей, но гораздо реже.
В подавляющем большинстве случаев рак толстой кишки возникает у лиц старше 50 лет. Данное заболевание может встречаться и у молодых людей, но гораздо реже.

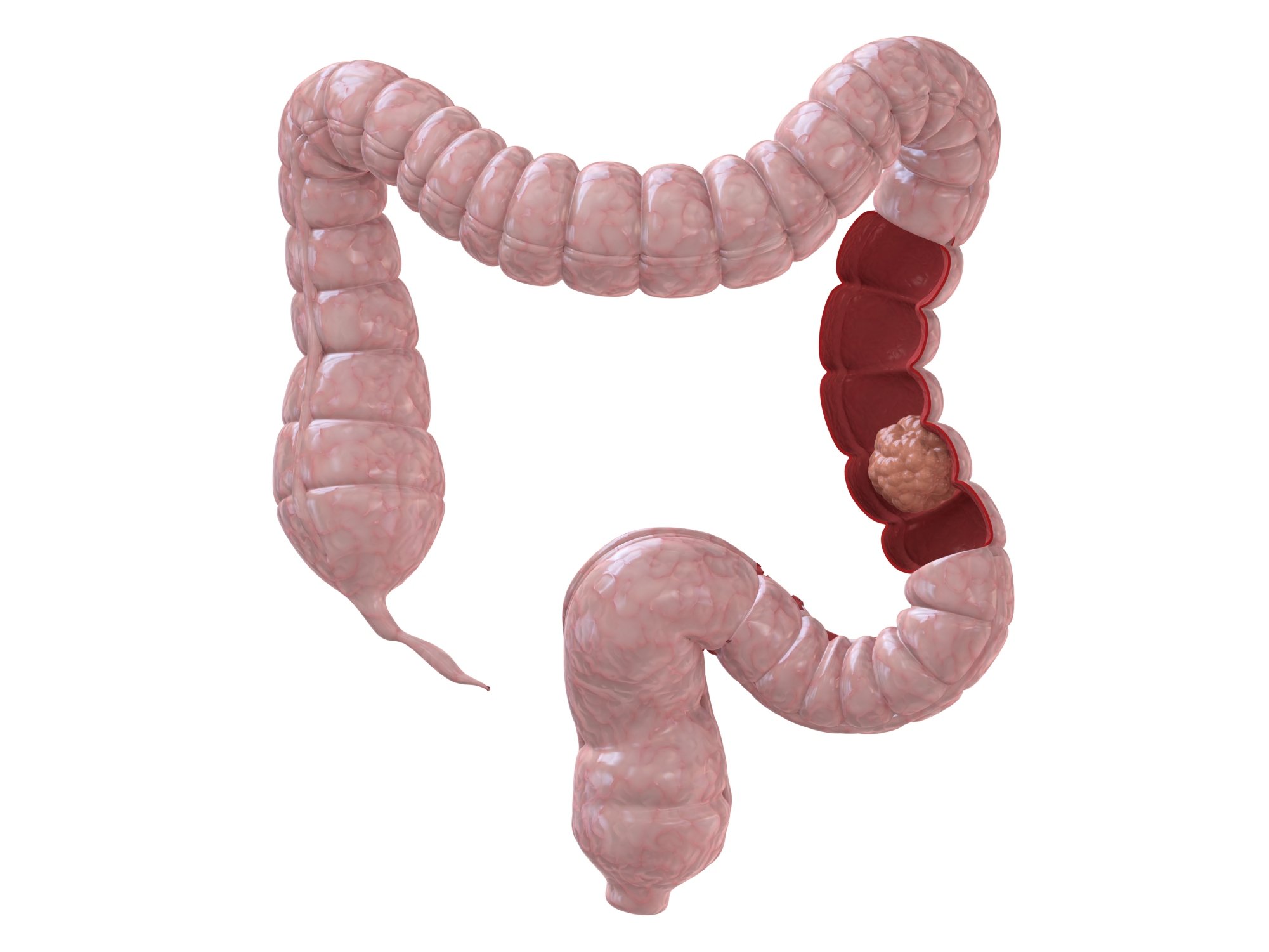
 Если вы употребляете спиртное, ограничивайте количество выпиваемого вами алкоголя не более чем одним напитком в день для женщин и двумя — для мужчин.
Если вы употребляете спиртное, ограничивайте количество выпиваемого вами алкоголя не более чем одним напитком в день для женщин и двумя — для мужчин.