| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
: 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 >> [543]
: 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 >> [543] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Росздравнадзор уведомил о несоответствии трех препаратов установленным требованиям
Аптекам следует проверить наличие трех препаратов, к которым у регулятора возникли вопросы, и принять меры, ограничивающие их дальнейшее обращение, следует из писем Росздравнадзора от 20 января.
Препараты «Триметазидин», «Эссенциале® Н» и «Алмагель®» оказались в поле зрения Росздравнадзора. Территориальным органам поручено обеспечить контроль за выявлением и изъятием из обращения перечисленных препаратов, говорится в письмах федеральной службы, которые опубликованы на сайте ведомства.
В соответствии с письмом № 01и-67/21 изымаются из обращения лекарственные препараты «Триметазидин, таблетки, покрытые пленочной оболочкой, 20 мг № 30» серий 131018, 141018 и «Триметазидин, таблетки, покрытые пленочной оболочкой, 20 мг № 60» серий 151118, 161118, 171118, 181118 производства ЗАО «АЛСИ Фарма» (Россия). Причиной «забраковки» указано несоответствие их состава требованиям нормативной документации.
Решение об изъятии принято также в отношении препарата «Эссенциале® Н, раствор для введения 250 мг/5 мл 5 мл, ампулы (5), пачки картонные» серии 1У7290А производства «Фамар Хелс Кэа Сервисиз Мадрид, С.А.У.» (Испания). По информации представителя производителя компании АО «Санофи Россия», указанная серия гепатопротектора выпускалась для реализации на территории Республики Узбекистан и Грузии и в Россию не завозилась.
Нарушения в маркировке послужили основанием для прекращения обращения двух серий антацидного препарата «Алмагель®, суспензия для приема внутрь 170 мл, флаконы (1), пачки картонные/в комплекте с ложкой мерной/» производства «Балканфарма – Троян АД» (Болгария): серии 121019 и серии 101019. Владельцами партий в письме указаны склады в Свердловской области ООО «ФК Гранд Капитал Екатеринбург» и ООО «Магнит Фарма», которым необходимо уничтожить недоброкачественную продукцию. В соответствии с предписанием Росздравнадзора ООО «Тева» необходимо отчитаться о результатах расследования данного факта.
Таблетки на выброс
Росздравнадзор оценил качество лекарств на российском рынке
Росздравнадзор оценил качество лекарств на российском рынке
Росздравнадзор опубликовал рейтинг фармпроизводителей, к качеству продукции которых в первой половине 2015 года поступило наибольшее количество нареканий. Больше всего забракованных серий препаратов — у ОАО «Муромский приборостроительный завод». Эксперты утверждают, что из-за выборочности проверок объем некачественной продукции на рынке вдвое превышает выявляемый Росздравнадзором. Они полагают, что этот показатель может еще вырасти после возможной легализации параллельного импорта лекарств.
Эксперты утверждают, что из-за выборочности проверок объем некачественной продукции на рынке вдвое превышает выявляемый Росздравнадзором. Они полагают, что этот показатель может еще вырасти после возможной легализации параллельного импорта лекарств.
В отечественной части рейтинга Росздравнадзора — 14 предприятий, в зарубежной — 9. На первом месте среди российских компаний, на чьи препараты жаловались чаще всего,— ОАО «Муромский приборостроительный завод». У этого производителя по результатам проверки было забраковано 29 серий препаратов двух торговых наименований. На втором месте — ООО «Озон» (14 серий, 2 наименования), на третьем — ОАО «Тверская фармацевтическая фабрика» (11 и 4).
Наибольшее число претензий помимо несоответствия стандартам упаковки и объема действующего вещества вызывали подлинность препаратов и некорректность маркировки. Среди параметров, не соблюдаемых производителями,— растворимость, наличие в препарате посторонних примесей, неправильно указанная масса таблеток. Примерно те же претензии — и к иностранным производителям. Их рейтинг возглавила болгарская компания «Софарма», у которой ведомство забраковало 13 серий препаратов одного торгового наименования. «Тройку» составили также польская компания «Польфарма С.А.» (11 серий одного наименования) и Северная китайская фармацевтическая корпорация Лтд (9 серий, четыре наименования).
Примерно те же претензии — и к иностранным производителям. Их рейтинг возглавила болгарская компания «Софарма», у которой ведомство забраковало 13 серий препаратов одного торгового наименования. «Тройку» составили также польская компания «Польфарма С.А.» (11 серий одного наименования) и Северная китайская фармацевтическая корпорация Лтд (9 серий, четыре наименования).
Многие производители фигурировали в аналогичном рейтинге ведомства в 2014 году. «Из года в год в списки ведомства попадают одни и те же компании, что свидетельствует о неэффективности системы контроля качества»,— сказал «Ъ» глава Центра социальной экономики Давид Мелик-Гусейнов. По его словам, объем некачественной продукции на рынке превышает выявленный Росздравнадзором примерно в два раза. Эксперт отмечает, что система контроля качества в коммерческом сегменте рынка предполагает, что ведомство проводит проверку характеристик серии продукции выборочно или уже по заявлению самого потребителя или рапорта врача. Тотальные проверки, проводившиеся в советское время и в 1990-е годы, прекратились из-за увеличения общего объема продукции и недостаточности финансирования контролеров.
Гендиректор DSM Group Сергей Шуляк отмечает, что Росздравнадзор может чаще проверять производителей, в чьей продукции уже был обнаружен брак, может даже поставить их производство на постоянный контроль, однако на этом полномочия ведомства заканчиваются. «Когда ведомство обнаруживает бракованную серию лекарств, ее просто отзывают, а производителю даже не выписывают штраф»,— говорит он.
По словам Давида Мелик-Гусейнова, уменьшить объем некачественных препаратов мог бы полный перевод российских производителей на стандарты производства GMP, GDP, GPP. По ним фарминдустрия работает в Евросоюзе — производители, аптеки и дистрибуторы лекарств проходят проверку соответствия выданному сертификату качества раз в год.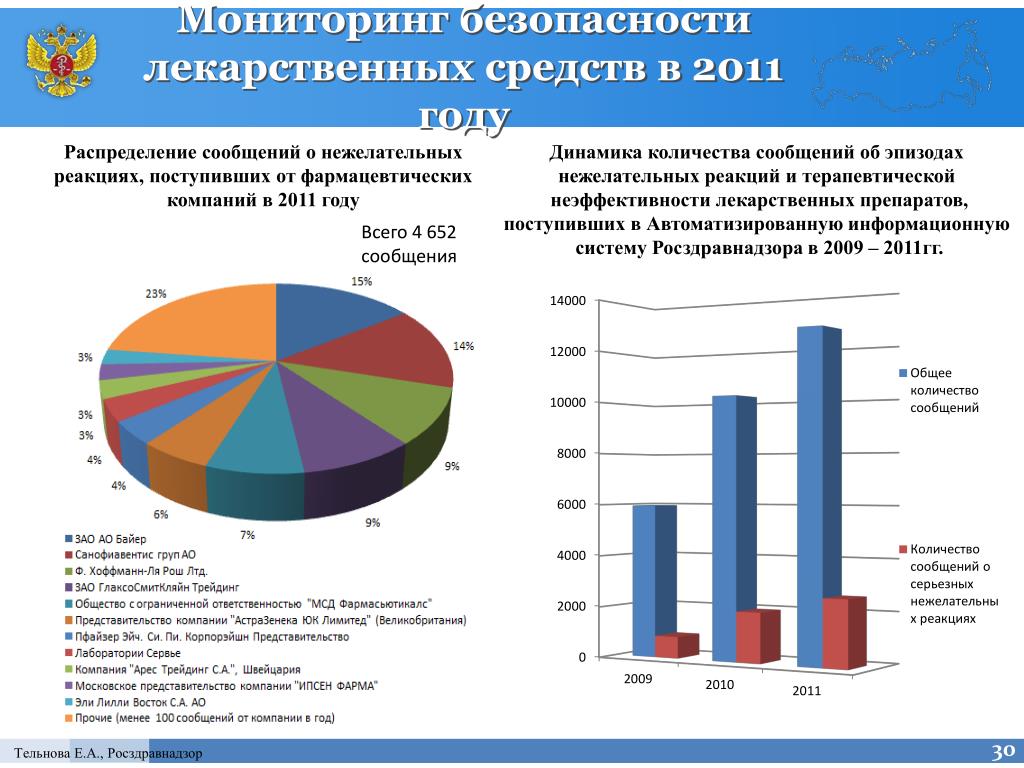 В России, напомним, полный переход производителей на эти стандарты должен закончиться к 2016 году. Часть из них работает в соответствии с требованиями сертификатов уже сейчас, что снижает объем некачественной продукции.
В России, напомним, полный переход производителей на эти стандарты должен закончиться к 2016 году. Часть из них работает в соответствии с требованиями сертификатов уже сейчас, что снижает объем некачественной продукции.
Впрочем, как отмечает господин Шуляк, доля брака на рынке может существенно возрасти в случае легализации параллельного импорта препаратов — когда их смогут ввозить любые компании, а не только официальные дистрибуторы. В мае этого года премьер-министр Дмитрий Медведев поддержал предложение о введении параллельного импорта, отметив, что это может повысить конкуренцию на рынке лекарств и снизить цену на них. «Но если препараты начнут импортировать неофициальные поставщики, отследить цепочку их перемещения от производителя до аптеки и соответственно контролировать их качество будет невозможно»,— полагает Сергей Шуляк. По его мнению, предполагаемого снижения цен на лекарства не произойдет, так как их все равно потребуется переупаковывать в России. Доля же некачественной и контрафактной продукции (пока составляющая в РФ менее 1% рынка) возрастет, считает эксперт.
Анастасия Мануйлова
Источник: Газета КоммерсантЪ
В 2007 г. было забраковано почти 3,6% серий лекарственных средств
Федеральная служба по надзору в сфере здравоохранения и социального развития (Росздравнадзор) РФ подвела итоги деятельности по контролю качества лекарственных средств за 2007 г. Как сообщает пресс-служба ведомства, в рамках предварительного государственного контроля в 2007 г. была проведена экспертиза качества 2 тыс. 567 серий лекарственных средств, из них забраковано 3,58%, или 92 серии лекарств. В том числе специалисты признали недоброкачественными 60 серий (19 наименований лекарств) отечественного производства и 32 серии (23 наименований) лекарств зарубежного происхождения.
По результатам экспертизы качества 2 тыс. 653 серий 1 тыс. 090 наименований лекарственных средств в рамках выборочного контроля в 2007 г. выявлено и изъято из обращения 18 торговых наименований 31 серий недоброкачественных лекарственных средств.
Как отметили в Росздравнадзоре, внедрение в практику работы административного регламента по организации проведения экспертизы качества, эффективности и безопасности лекарственных средств, позволило осуществлять планирование контрольных мероприятий на основе объективной информации о фактически поступивших в обращение лекарствах. В 2007г. на повторный выборочный государственный контроль качества было направлено 403 серии лекарственных средств. Как оказалось, организации-производители ответственны за 15,8% от общего количества брака, выявляемого в обращении (в 2006г. этот показатель составлял 13%). В большинстве же случаев (70,8%) снижение качества происходит в процессе транспортировки и хранения (брак поставщика). По сравнению с 2006г. этот показатель увеличился на 16,8%, что свидетельствует о том, что на предприятиях оптовой торговли вопросам обеспечения качества лекарственных средств уделяется недостаточно внимания.
В 2007г. на повторный выборочный государственный контроль качества было направлено 403 серии лекарственных средств. Как оказалось, организации-производители ответственны за 15,8% от общего количества брака, выявляемого в обращении (в 2006г. этот показатель составлял 13%). В большинстве же случаев (70,8%) снижение качества происходит в процессе транспортировки и хранения (брак поставщика). По сравнению с 2006г. этот показатель увеличился на 16,8%, что свидетельствует о том, что на предприятиях оптовой торговли вопросам обеспечения качества лекарственных средств уделяется недостаточно внимания.
Положительным моментом в Росздравнадзоре назвали снижение количества ошибок экспертных организаций при проведении оценки качества лекарственных средств — с 13% в 2006г. до 9,3% в 2007г.
Подводя итоги года, в Росздравнадзоре отметили также, что в 2007г. было выявлено и изъято из обращения 58 наименований фальсифицированных лекарственных средств. При этом доля подделок зарубежных лекарственных средств по сравнению с 2006г. увеличилась на 7% и составила 94% от общего числа серий, признанных фальсифицированными. 6% случаев составили подделки российских препаратов (в 2006г. — 1%).
увеличилась на 7% и составила 94% от общего числа серий, признанных фальсифицированными. 6% случаев составили подделки российских препаратов (в 2006г. — 1%).
Росздравнадзор разберется в ситуации с небезопасным препаратом от язвы
https://ria.ru/20190930/1559268983.html
Росздравнадзор разберется в ситуации с небезопасным препаратом от язвы
Росздравнадзор разберется в ситуации с небезопасным препаратом от язвы
Росздравнадзор в связи с получением информации об опасности субстанции ранитидин гидрохлорид, на основе которой производят лекарство от язвенной болезни… РИА Новости, 03.03.2020
2019-09-30T11:26
2019-09-30T11:26
2020-03-03T16:29
россия
здоровье — общество
федеральная служба по надзору в сфере здравоохранения (росздравнадзор)
германия
литва
общество
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn21. img.ria.ru/images/154954/30/1549543049_0:149:3072:1877_1920x0_80_0_0_a461c1d48c262f8125e4cb91ba5034fd.jpg
img.ria.ru/images/154954/30/1549543049_0:149:3072:1877_1920x0_80_0_0_a461c1d48c262f8125e4cb91ba5034fd.jpg
МОСКВА, 30 сен — РИА Новости. Росздравнадзор в связи с получением информации об опасности субстанции ранитидин гидрохлорид, на основе которой производят лекарство от язвенной болезни желудка, просит производителей и импортеров до 2 октября предоставить информацию о принятых решениях в отношении препаратов, следует из информационного письма, опубликованного на сайте ведомства.Ранее агентство Sputnik сообщило, что в Литве запретили продажу лекарств, содержащих активное вещество ранитидина гидрохлорид, решение было принято из-за наличия в нем примеси N-нитрозодиметиламина (NDMA), который является канцерогеном, влияющим на печень. Европейский директорат по качеству лекарственных средств для здравоохранения (EDQM) 23 сентября 2019 года приостановил действие сертификата на ранитидина гидрохлорид. На фоне этого лекарство отозвали в Германии, Швейцарии, Финляндии, Хорватии, Чехии, Венгрии, Дании, Канаде, Италии, Испании, Польше, Португалии, Словении и Сингапуре. Ранитидин — это лекарство, используемое для снижения высокого уровня желудочной кислоты при лечении кратковременных проблем с желудком (без рецепта) и в профилактике и лечении язв (по рецепту).В ноябре прошлого года СМИ сообщили, что в регионах России идет закупка потенциально опасных таблеток, провоцирующих развитие раковых заболеваний, на основе субстанции валсартан, содержащих примесь N-нитрозодиметиламина. Позднее Росздравнадзор заявил, что после решения Европейского агентства по лекарственным средствам об отзыве данных препаратов ведомство определило производителей подобных лекарств и направило в их адрес запросы. В результате производители приняли решение изъять из обращения 561 серию готовых лекарств.
Ранитидин — это лекарство, используемое для снижения высокого уровня желудочной кислоты при лечении кратковременных проблем с желудком (без рецепта) и в профилактике и лечении язв (по рецепту).В ноябре прошлого года СМИ сообщили, что в регионах России идет закупка потенциально опасных таблеток, провоцирующих развитие раковых заболеваний, на основе субстанции валсартан, содержащих примесь N-нитрозодиметиламина. Позднее Росздравнадзор заявил, что после решения Европейского агентства по лекарственным средствам об отзыве данных препаратов ведомство определило производителей подобных лекарств и направило в их адрес запросы. В результате производители приняли решение изъять из обращения 561 серию готовых лекарств.
https://ria.ru/20190731/1557031968.html
https://ria.ru/20190621/1555777344.html
россия
германия
литва
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2019
РИА Новости
internet-group@rian.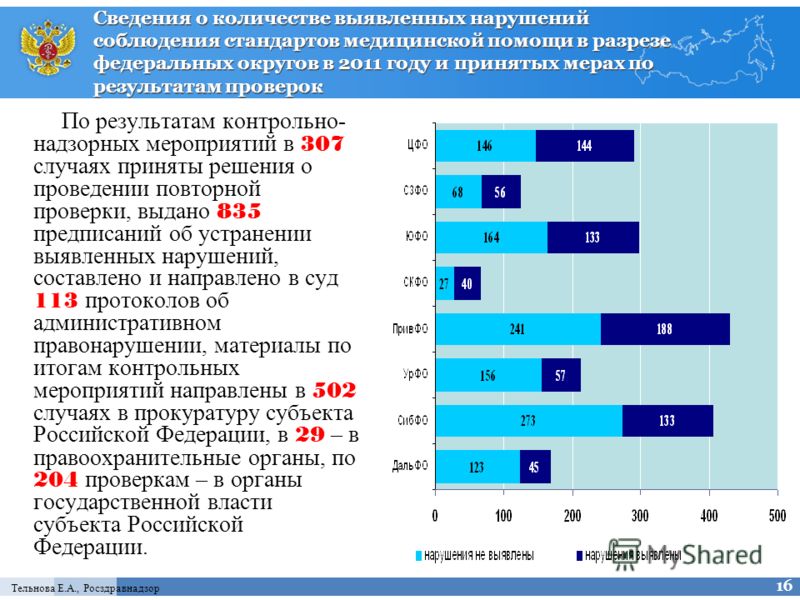 ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/154954/30/1549543049_108:0:2839:2048_1920x0_80_0_0_3326f7cd4fe772d8c0f184fd89f76850.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
россия, здоровье — общество, федеральная служба по надзору в сфере здравоохранения (росздравнадзор), германия, литва, общество
Росздравнадзор обнародовал рейтинг производителей некачественных лекарств
26 января 2015
Росздравнадзор опубликовал традиционный анти-рейтинг производителей лекарств, к которым было больше всего претензий в 2014 году. По количеству забракованных средств российские производители вновь обошли зарубежных коллег — в два раза.
По количеству забракованных средств российские производители вновь обошли зарубежных коллег — в два раза.
У отечественных производителей Росздравнадзор забраковал 195 серий и 68 торговых наименований препаратов. Это почти вдвое меньше, чем у их иностранных коллег — за 2014 ведомство выявило 96 серий и 33 торговых наименования некачественных импортных препаратов.
Среди отечественных фармпроизводителей по количеству забракованных серий препаратов лидирует ООО «АСФАРМА», у которого 24 серии двух препаратов не соответствовали норме по 4 показателям — «микробиологическая чистота», «средняя масса таблеток», «pH» и «распадаемость». Кстати, это предприятие входило в первые строчки анти-рейтинга и в 2013 году. Также в тройку лидеров-2014 вошли ОАО «Синтез» (забракована 21 серия) и ОАО «Уралбиофарм» (20 серий). Кроме этих производителей, в «черный» список надзорного ведомства попали ООО «ЮжФарм» (18 серий), ОАО НПК «ЭСКОМ» (17 серий), ОАО «Ирбитский ХФЗ» (17 серий), ЗАО «Медисорб» (16 серий), ООО «Озон» (15 серий), ООО «Гиппократ» (11 серий), ОАО «Татхимфарм-препараты» (10 серий), ЗАО «АЛСИ Фарма» (10 серий), ОАО «Дальхимфарм» (8 серий) и ОАО «Самарамедпром» (8 серий).
Наибольшее количество торговых наименований некачественных лекарств зафиксировано у ОАО НПК «ЭСКОМ» — 11 препаратов. У двух российских производителей — ООО «ЮжФарм» и тот же ОАО НПК «ЭСКОМ» среди несоответствующих показателей отмечена «подлинность». Практически ко всем участникам анти-рейтинга у Росздравнадзора возникли претензии по упаковке и описанию продукции. Это может говорить как о фальсификации лекарства, так и о нарушениях при производстве.
Среди зарубежных фармпроизводителей больше всего некачественной продукции зарегистрировано у индийской компании «Эльфа Лабораториз» (забраковано 18 серий двух препаратов). Еще одна индийская фирма — «Шрея Лайф Сайенсиз Пвт.Лтд» оказалась на 8 месте списка — у нее забраковали 4 серии трех препаратов. Среди несоответствующих показателей у обеих компаний фигурируют в том числе «подлинность», «количественное определение», «механические включения» и «посторонние примеси».
Среди недобросовестных китайских фармпроизводителей — «Шаньдун Шэнлу Фармасьютикал Ко. Лтд» (забраковано 10 серий), «Янчжоу №3 Фармасьютикал Ко.Лтд» (5 серий) и «Си Эс Пи Си Оуи Фармасьютикал Ко. Лтд» (4 серии). В анти-рейтинг вошли две польские компании — фармацевтический завод «Польфарма» АО (4 серии) и «ГлаксоСмит Кляйн Фармасьютикалз С.А.» (4 серии). Претензии у Росздравнадзора возникли также к производителям из Франции — «Мерк Сантэ с.а.с» (14 серий пяти препаратов), Германии — «Мукос Эмульсионс ГмбХ» (5 серий одного торгового наименования) и Словении — «Лек д.д.» (5 серий двух препаратов).
Лтд» (забраковано 10 серий), «Янчжоу №3 Фармасьютикал Ко.Лтд» (5 серий) и «Си Эс Пи Си Оуи Фармасьютикал Ко. Лтд» (4 серии). В анти-рейтинг вошли две польские компании — фармацевтический завод «Польфарма» АО (4 серии) и «ГлаксоСмит Кляйн Фармасьютикалз С.А.» (4 серии). Претензии у Росздравнадзора возникли также к производителям из Франции — «Мерк Сантэ с.а.с» (14 серий пяти препаратов), Германии — «Мукос Эмульсионс ГмбХ» (5 серий одного торгового наименования) и Словении — «Лек д.д.» (5 серий двух препаратов).
В этом же списке оказались и наши ближайшие соседи — белорусы и украинцы. ОАО «Борисовский завод медицинских препаратов» (Республика Беларусь) занял 2-е место с 18 сериями забракованных лекарств. У него же и наибольшее в этом списке количество несоответствующих норме показателей, в том числе «подлинность». РУП «Белмед-препараты» (Республика Беларусь) занял 12-е место в анти-рейтинге — у него забраковали 3 серии лекарств по показателям «упаковка» и «маркировка». Замыкает список украинский производитель — ООО «Опытный Завод ГНЦЛС» — у него Росздравнадзор забраковал 3 серии лекарств по показателям «описание» и «упаковка».
Замыкает список украинский производитель — ООО «Опытный Завод ГНЦЛС» — у него Росздравнадзор забраковал 3 серии лекарств по показателям «описание» и «упаковка».
Подробнее с анти-рейтингом можно ознакомиться здесь.
Источник: Доктор Питер
Росздравнадзор озабочен низким контролем качества продукции на отечественных фармпредприятиях
На заседании обсуждались вопросы обеспечения и контроля качества лекарственных средств на производстве, итоги надзорной деятельности Федеральной службы в этой сфере за 2008 год и первый квартал 2009 года. В заседании приняли участие представители более 120 фармацевтических предприятий, ассоциаций и общественных профессиональных объединений.В своем вступительном слове профессор Юргель кратко рассказал о ситуации, сложившейся в отрасли. Он отметил, что на многих фармацевтических предприятиях отмечается критическая ситуация в вопросах обеспечения качества лекарственных средств и фармацевтических субстанций. Контроль качества остается на очень низком уровне, и поступающая в Росздравнадзор информация оптимизма не вызывает.
 Следствием этой ситуации стал вопиющий случай, связанный с грубыми нарушениями организации производства препарата «Милдронат, раствор для инъекций» на ЗАО «ФармФирма «Сотекс», который привел к развитию серьезных негативных реакций у пациентов, в том числе со смертельными исходами. Кроме того, отмечается увеличение количества тяжелых побочных реакций на применение лекарственных препаратов.
Следствием этой ситуации стал вопиющий случай, связанный с грубыми нарушениями организации производства препарата «Милдронат, раствор для инъекций» на ЗАО «ФармФирма «Сотекс», который привел к развитию серьезных негативных реакций у пациентов, в том числе со смертельными исходами. Кроме того, отмечается увеличение количества тяжелых побочных реакций на применение лекарственных препаратов.Николай Юргель призвал представителей фармацевтической промышленности к конструктивному диалогу для совместного решения проблем обеспечения качества лекарственных средств. «Вопросы организации контроля качества лекарств чрезвычайно важны, поскольку осложнения от применения лекарственных препаратов являются одной из 10 ведущих причин смертности в различных странах. Мы планируем в течение ближайших двух лет создать эффективную современную систему контроля качества, охватывающую всю территорию России и гармонизированную с международными требованиями. Наши совместные действия должны быть направлены на создание эффективных отношений в части обеспечения населения качественными, и безопасными лекарственными средствами», — подчеркнул руководитель Росздравнадзора.

Начальник Управления организации государственного контроля обращения медицинской продукции и средств реабилитации инвалидов Росздравнадзора Валентина Косенко озвучила итоги работы ведомства по контролю качества лекарственных средств на производстве. В 70% случаев проведенных проверок составлены протоколы об административных правонарушениях за грубые нарушения лицензионных требований и условий. Входной контроль проводится не по всем показателям нормативно-правовой документации, не осуществляется аудит поставщиков фармацевтических субстанций, маршрутные карты не содержат всей информации о ходе производства серии, не ведется учет печатных материалов, производственный процесс осуществляется с отклонением от утвержденных регламентов.
До 3,5% лекарственных средств, представляемых организациями-производителями и импортерами на предварительный государственный контроль, забраковываются, что свидетельствует об отсутствии должной системы контроля качества на производстве и необходимого квалифицированного персонала.
 На этапе предварительного контроля были забракованы лекарственные средства 20 отечественных предприятий и 10 зарубежных компаний. Показатели несоответствия практически одинаковы для препаратов как отечественного, так и зарубежного производства.
На этапе предварительного контроля были забракованы лекарственные средства 20 отечественных предприятий и 10 зарубежных компаний. Показатели несоответствия практически одинаковы для препаратов как отечественного, так и зарубежного производства.Выделены основные причины несоответствия качества выпускаемой продукции предъявляемым требованиям: отсутствие аудита поставщиков и производителей активных фармацевтических субстанций, неэффективность системы проверки подлинности происхождения закупаемых субстанций, отсутствие должного объема работ по валидации методик, вводимых в стандарты качества на выпускаемые лекарственные средства.
Объем выборочного контроля был увеличен в среднем на 45% по сравнению с уровнем 2007 г. Установлено, что в обращение поступают лекарственные средства, несоответствующие требованиям, в т.ч. по критическим показателям. В 2008 г. отмечено уменьшение в 2 раза, по сравнению с 2007 г., количества лекарственных средств, поступающих на повторный выборочный контроль.
 Это можно расценивать, как признание производителями брака.
Это можно расценивать, как признание производителями брака.Особую озабоченность вызывает выявление значительного числа недоброкачественных и фальсифицированных фармацевтических субстанций, из которых производились лекарственные средства. В 2008 г. было забраковано 4 серии 3 наименований отечественных фармацевтических субстанций и 6 серий 6 наименований фармацевтических субстанций зарубежного производства.
Выявлено и изъято из обращения 37 торговых наименований 81 серии фальсифицированных лекарственных препаратов, 6 наименований 187 серий фальсифицированных фармацевтических субстанций и 1190 серий готовых лекарственных средств, произведенных из данных субстанций. В числе отечественных предприятий-производителей лекарственных средств, отзывавших продукцию: ОАО «Биосинтез», ОАО «Биохимик», ОАО «Ирбитский химико-фармацевтический завод», ОАО «Мосхимфармпрепараты им. Семашко», ОАО «Марбиофарм», ООО «Озон», ЗАО «ПФК «Обновление», ОАО «Тюменский ХФЗ», ОАО «Уралбиофарм», ОАО «Фармстандарт» и др.

Несмотря на то, что на рынке присутствуют зарегистрированные субстанции хорошего качества, производители продолжают использовать так называемые «серые» незарегистрированные.
По результатам мониторинга качества лекарственных средств в 2008 г. Росздравнадзором приняты решения об изъятии из обращения 1074 серий 406 торговых названий недоброкачественных лекарственных средств (среди них 653 серии 229 названий отечественных препаратов и 421 серия 177 названий — зарубежных).
В ходе заседания руководство Росздравнадзора ответило на многочисленные вопросы фармацевтических организаций и ассоциаций, а также приняло к рассмотрению ряд предложений.
По результатам совместной работы будет составлено информационное письмо руководителям субъектов Российской Федерации, в котором будут отражены все озвученные данные и даны рекомендации по оптимизации работы систем обеспечения и контроля качества на производствах. Осенью 2009 года запланировано провести очередное совещание, на котором будут оценены результаты принятых мер по повышению контроля качества лекарственных средств.

Рейтинг отечественных производителей лекарственных средств по объему забракованной продукции за период с 01.01.2009 по 31.03.2009.
Новый порядок ввоза медицинских изделий для их дальнейшей регистрации
Автор: Lidings Law Firm, 19 октября 2020 г.С 1 января 2021 года вступает в силу новый порядок ввоза медицинских изделий для их дальнейшей регистрации в России 1 .
По новому порядку Росздравназор выдает разрешение на ввоз медицинского изделия для его дальнейшей регистрации в электронном виде.Такое разрешение действительно в течение 1 года и позволяет заявителю один раз ввозить медицинское устройство.
Разрешение выдается при подаче заявки в электронном виде на имя производителя медицинского изделия или его представителя в России. Заявление можно подать с помощью соответствующего сервиса на официальном сайте Росздравнадзора. Копии договоров о соответствующих исследованиях (исследованиях) присылаются вместе с заявлением. Количество образцов медицинского изделия определяется заявителем по рекомендации компаний, проводящих исследования, в зависимости от класса потенциального риска и объема ожидаемых испытаний (исследований).
Росздравнадзор в течение 5 рабочих дней принимает решение о выдаче разрешения на ввоз или отказе в его выдаче. Решение Росздравнадзора должно быть опубликовано на официальном сайте в течение 2 рабочих дней.
Процедура вводит исчерпывающий перечень оснований для отказа в выдаче разрешения. Например, отказ может быть вызван непредоставлением или неполным предоставлением Росздравнадзору запрошенной информации и документации, ограничениями на импорт или неуказанными побочными эффектами в инструкции по продукту.
По заявлению заявителя разрешение может быть аннулировано.
Программное обеспечение как медицинское устройство не требует такого разрешения на импорт.
В отличие от предыдущей процедуры 2 новая позволяет срок действия разрешения на импорт в течение 1 года вместо 6 месяцев и больше оснований для отказа в выдаче разрешения.
_____
1 Постановление Минздрава России от 30.06.2020 № 661н, зарегистрированное Минюстом РФ за №60070 от 28 сентября 2020 г.
2 Постановление Минздрава России № 7н от 15 июня 2012 г., зарегистрировано Минюстом РФ за № 25013 от 15 июля 2012 г.
Индия отвергает масштабные испытания российской вакцины против COVID-19
Последнее обновление 08 окт, 2020, 16:00
Регулирующий орган Индии отказался разрешить крупномасштабное клиническое испытание российской вакцины Sputnik V от COVID-19.
Это решение стало неудачей для страны, возглавляемой Владимиром Путиным, которая в августе в ускоренном порядке дала разрешение на то, чтобы предоставить своим гражданам, а также гражданам других стран, способ борьбы с продолжающейся пандемией.
Вот и все.
Доктор.
 Предложение Reddy’s Laboratories отклонено
Предложение Reddy’s Laboratories отклоненоНесколько недель назад индийская лаборатория Dr. Reddy’s Laboratories и Российский фонд прямых инвестиций (РФПИ) заключили договор об испытаниях и поставках вакцины Sputnik V COVID-19 населению Индии.
Однако, когда лаборатория подала заявку на проведение крупномасштабного клинического исследования вакцины на людях, Центральная организация по контролю за стандартами на лекарственные средства (CDSCO) отказалась принять это предложение.
Почему предложение было отклонено?
Группа экспертов CDSCO проинформировала Dr. Reddy’s Laboratories, что не может дать разрешение на проведение крупномасштабных испытаний, поскольку данные о безопасности и иммуногенности Sputnik V на ранней стадии доступны из небольших исследований, проведенных на иностранном населении.
Он посоветовал лаборатории сначала рассмотреть возможность проведения небольшого клинического исследования вместо того, чтобы сразу переходить к большому исследованию фазы 3.
Вот что сказала экспертная комиссия
«После подробного обсуждения комитет рекомендовал фирме следовать нормативным требованиям и провести в стране испытания фазы 2/3 с надлежащим мониторингом гуморального и клеточно-опосредованного иммунного ответа», — говорится в сообщении комитета.
Нет сообщений от вовлеченных сторон
Пока что ни лаборатория Dr. Reddy’s, ни РФПИ не прокомментировали этот вопрос.
Ранее лаборатория заявляла, что проведет 3-ю фазу испытаний, чтобы продемонстрировать безопасность и эффективность Sputnik V для населения Индии и сделать около 100 миллионов доз доступными для местного населения, начиная с конца этого года.
Теперь, когда испытания сегментированы, это может занять больше времени.
Спутник V был одобрен досрочно в августе
г.Разработанный НИИ эпидемиологии и микробиологии имени Гамалеи при поддержке РФПИ, Sputnik V был зарегистрирован 11 августа, и Путин заявил, что прививка формирует устойчивый иммунитет, а одной из его дочерей уже была сделана прививка.
Однако, поскольку одобрение было дано после двухмесячных испытаний и отсутствия общедоступных данных, многие утверждали, что Россия, возможно, срезала необходимые углы, рискуя безопасностью людей.
Тем не менее, Россия продвигает производство, распространение
Несмотря на вопросы, Россия продолжает внутреннее производство и распространение Sputnik V.
Компания начала производство в августе и уже выпустила первую партию шота в гражданский оборот после необходимых проверок качества в лабораториях Росздравнадзора.
Страна также выразила готовность сотрудничать с Индией для увеличения своего производства.
Принятие результатов клинических исследований, проведенных в России, для регистрации в Европейском Союзе и США
Клинические исследования, в том числе многонациональные и многоцентровые, проводятся в Российской Федерации с начала 90-х годов ХХ века, и это было вовлечением России в международную клиническую практику. пробный рынок, который способствовал развитию, совершенствованию и гармонизации нормативных и этических требований к проведению таких испытаний в стране.За относительно короткий период по сравнению с другими странами (менее 20 лет) Российская Федерация сменила несколько «поколений» регламентов и руководств по клиническим исследованиям. Надлежащая клиническая практика (GCP) была принята в качестве национального стандарта (ГОСТ) в России в 2006 году и является почти дословным переводом соответствующего руководства Международной конференции по гармонизации (ICH). В 2010 году вступил в силу Федеральный закон ФЗ-61 «Об обращении лекарственных средств», который с многочисленными поправками, внесенными в период с 2010 по 2016 год, постепенно гармонизировал стандарт подачи и проведения клинических исследований, а также регистрации новых лекарственных средств с международными стандартами.
С 2011 г. (вскоре после начала действия ФЗ-61) Научный центр экспертизы медицинских изделий при Минздраве России приступил к разработке и публикации рекомендаций для отрасли и собственных экспертов по проведению и экспертизе доклинических и клинических испытаний лекарственных средств. лекарства, которые в значительной степени основывались на руководящих принципах ICH, научных руководствах Европейского агентства по лекарственным средствам (EMEA) и руководствах Управления по контролю за продуктами и лекарствами (FDA). Уточнены и дополнены руководства по надлежащей клинической практике, утвержденные приказом Минздрава России.Наконец, к концу 2016 года вступит в силу длинный список нормативных актов Евразийского экономического союза, в том числе касающихся клинических исследований, которые еще больше гармонизируют процедуры регистрации и контроля обращения лекарственных средств в России и ЕС / США.
Более того, активное сотрудничество регулирующих органов ЕС и США с Минздравом России в области регистрации лекарственных средств и фармаконадзора продолжается не менее 10 последних лет. В рамках диалога между ЕС и Россией в 2007 году была создана подгруппа по фармацевтическим препаратам.С тех пор эта группа активно вовлекает регион EMEA в дискуссии, связанные с научно-техническими вопросами регистрации и обращения лекарственных средств. Меморандум о взаимопонимании был снова продлен между Фармакопейной конвенцией США (USP) и Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор) Российской Федерации в октябре 2015 года, что укрепило сотрудничество в области регулирования фармакопейных требований и надлежащей лабораторной практики в России и США. Практически сразу после этого был подписан аналогичный меморандум между FDA и Росздравнадзором в области клинических исследований и регистрации лекарственных средств.Эксперты Росздравнадзора регулярно посещают USP и FDA, чтобы участвовать в обучении и повышать свои навыки, что также способствует дальнейшему сближению понимания проведения клинических исследований регулирующими органами обеих стран.
Таким образом, в Российской Федерации удалось разработать прочную (но постоянно развивающуюся) систему контроля за разработкой и проведением доклинических и клинических испытаний фармацевтических препаратов, а эксперты Минздрава России иногда даже строже по сравнению со своими коллегами в EMEA и FDA, буквально соблюдая национальные и международные правила и рекомендации по клиническим исследованиям.Например, до недавнего времени к лекарствам для перорального приема без системной абсорбции российские эксперты относились только как к лекарствам, которые, соответственно, предполагали определенный объем данных доклинических и клинических исследований, в то время как стандарты EMEA допускают регистрацию некоторых лекарств этого типа как медицинских изделий, что предполагает меньшую клинические и доклинические данные. Анализ отклонений или комментариев Минздрава России к протоколам клинических исследований, утвержденных одновременно в других странах региона, показал, что российские эксперты проводят тщательный анализ текста протокола и требуют строгого соблюдения этических и нормативных стандартов.Постоянно увеличивающееся количество проверок клинических исследований Росздравнадзором обеспечивает высокое качество данных, и последнее подтверждается результатами многочисленных нормативных проверок, проведенных EMEA и FDA — процент проверок без серьезных результатов в России самый высокий по сравнению с другими странами в область, край.
Соответственно, за последние 10 лет несколько западных фармацевтических компаний начали все более широко использовать данные клинических исследований, проведенных в Российской Федерации, как для новых, так и для генерических препаратов.Широко известно, что такие новые лекарства, как Tykerb (GSK), Ixempra (BMS) и Mircera (Roche) были зарегистрированы в ЕС и США по результатам исследований, в которых участвовало население России. Новартис зарегистрировал Gilenya в Российской Федерации раньше, чем в любой другой стране, включая США и ЕС, на основании регистрационного досье, содержащего результаты клинического исследования финголимода в ходе клинического исследования с участием российских пациентов с рассеянным склерозом.
Регистрационное досье Abraxane® (дженерик паклитаксела), которое в настоящее время зарегистрировано в ЕС и США, содержит значительную часть данных из России — половина испытаний фазы I проводилась исключительно в Российской Федерации, а доля пациентов из России и Украины достигла 80%. опорное исследование III фазы (следует отметить, что российские клинические центры составили только 25% от всех активных центров в этом исследовании).
Результаты клинических исследований, проведенных в России, используются не только международными фармацевтическими компаниями. Российская компания «Р-Фарм» после консультаций с FDA в 2015 г. получила одобрение на широкомасштабную программу клинических испытаний олокизумаба (моноклональные антитела для лечения ревматоидного артрита) в Российской Федерации и США с преобладанием населения России. все клинические испытания этой программы.
Таким образом, недавний опыт ясно показывает, что результаты клинических исследований, проведенных в Российской Федерации или с участием российских пациентов, рассматриваются и принимаются регулирующими органами ЕС и США.Более того, высокое качество данных и доступность различных групп пациентов в более чем 1000 исследовательских центрах делают Россию весьма привлекательной для промышленности.
Zynex получает разрешение Росздравнадзора на продажу устройства для восстановления инсульта Neuromove (TM) и устройства для электротерапии NexWave (TM) в России
LONE TREE, CO — (Marketwired — 6 февраля 2014 г.) — Zynex, Inc. (OTCQB: ZYXI), поставщик и разработчик неинвазивных медицинских устройств для электротерапии, реабилитации после инсульта и неврологической диагностики, объявил сегодня о том, что Федеральная служба по надзору в сфере здравоохранения России (Росздравнадзор) дала разрешение на продажу своего устройства для восстановления после инсульта NeuroMove ™ и Аппарат электротерапии NexWave ™.
NexWave ™ — это лечебное устройство для электротерапии, способное обеспечивать три режима стимуляции; традиционная ЧЭНС, интерференционная и нервно-мышечная электростимуляция. Комбинированные методы NexWave ™ обеспечивают широкий спектр терапии боли и восстановления мышц с помощью одного устройства.
Устройство NeuroMove ™ увеличивает функциональные возможности многих жертв инсульта, обучая здоровые части мозга компенсировать поврежденные участки. NeuroMove ™, который значительно более чувствителен, чем большинство диагностического оборудования, контролирует мышечную активность и выбирает сигналы из мозга, указывающие, что пациент пытается двигать определенную мышцу.Затем он вводит фактическое движение посредством электростимуляции. В конце концов связь между мозгом и мышцами часто может быть восстановлена. NeuroMove ™ также можно использовать для лечения травм спинного мозга.
Zynex
Zynex (основана в 1996 г.), работает в пяти основных бизнес-сегментах; Zynex Medical, Zynex NeuroDiagnostics, Zynex Monitoring Solutions, Zynex International и Zynex Billing and Consulting. Zynex Medical разрабатывает, производит, продает и продает медицинские устройства электротерапии собственной конструкции для электротерапии, используемые для обезболивания и реабилитации.Линия продуктов Zynex Medical полностью разработана, одобрена FDA и продается по всему миру. Zynex NeuroDiagnostics продает запатентованное компанией устройство NeuroMove, предназначенное для помощи пациентам с инсультом и травмами спинного мозга, и в настоящее время расширяется на рынки устройств неврологической диагностики ЭМГ, ЭЭГ, режима сна, слуховой и нервной проводимости посредством разработки и приобретения продуктов. Компания Zynex Monitoring Solutions, которая в настоящее время находится на стадии разработки, была создана для разработки и продажи медицинских устройств для неинвазивного кардиологического мониторинга.Zynex International занимается поддержкой продаж и маркетинга продукции Zynex по всему миру через сеть медицинских дистрибьюторов. Подразделение Zynex Billing and Consulting предоставляет медицинские услуги по выставлению счетов и консультационные услуги для офисов и больниц. Для получения дополнительной информации посетите: www.ir-site.com/zynex .
Заявление Safe Harbor
Некоторые заявления в этом выпуске носят прогнозный характер и, как таковые, связаны с многочисленными рисками и неопределенностями.Фактические результаты могут значительно отличаться от результатов, выраженных или подразумеваемых в таких заявлениях. Факторы, которые могут привести к тому, что фактические результаты будут существенно отличаться от прогнозных заявлений, включают, помимо прочего, необходимость получения дополнительного капитала для развития нашего бизнеса, нашу способность привлекать дополнительных торговых представителей, успех таких дополнительных торговых представителей. , необходимость получения разрешения FDA и маркировки CE для новых продуктов, принятие новых продуктов, а также существующих продуктов врачами и больницами, более крупные конкуренты с большими финансовыми ресурсами, необходимость идти в ногу с технологическими изменениями, наша зависимость от возмещения от страховых компаний для продуктов, продаваемых или сдаваемых в аренду нашим клиентам, принятие наших продуктов поставщиками медицинского страхования, наша зависимость от сторонних производителей в отношении производства наших товаров вовремя и в соответствии с нашими спецификациями, реализация нашей стратегии продаж, включая сильные прямые продажи, неопределенный исход рассматриваемого существенного судебного разбирательства и другие риски, описанные в наших документах с t Комиссия по ценным бумагам и биржам, включая раздел «Факторы риска» нашего Годового отчета по форме 10-K за год, закончившийся 31 декабря 2012 года.
14.08.2012 вступил в силу приказ Минздрава России от 14.08.2012 г. 7н от 15.06.2012, которым введен новый порядок ввоза образцов медицинского изделия с целью его регистрации в Минздраве. Приказом министерства введено специальное разрешение на ввоз образцов медицинского изделия, выданное Федеральной службой по надзору в сфере здравоохранения (Росздравнадзор).Он действителен в течение 6 месяцев и подлежит одноразовому использованию. До 14.10.2012 ввоз образцов медицинских изделий в Россию происходил без специального разрешения или документа. Для получения разрешения на ввоз необходимы следующие документы (информация): Разрешение выдается производителю или его представителю в течение 5 дней с момента получения запроса на выпуск. Заявка на получение разрешения на импорт может быть отклонена по следующим причинам: На сайте Росздравнадзора размещена база данных, доступная в режиме онлайн, со всеми выданными разрешениями на ввоз. |
Положения о медицинских изделиях в России — Курсы
«Живи так, как будто ты умрешь завтра. Учись так, как будто ты будешь жить вечно».
Махатма Ганди
«Посвятите себя обучению на протяжении всей жизни.Самый ценный актив, который у вас когда-либо был, — это ваш ум и то, что вы в него вкладываете «.
Брайан Трейси
«Ум — это не сосуд, который нужно наполнить, но огонь, который нужно зажечь».
Плутарх
«Я все время учусь.Надгробие будет моим дипломом «.
Эрта Китт
«Я твердо верю, что самообразование — единственный вид образования».
Исаак Азимов
«Вы не можете открыть книгу, не изучив что-то.»
Конфуций
«Мудрость приходит не от возраста, а от образования и обучения».
Антон Чехов
«Способность учиться — это дар; способность учиться — это навык; готовность учиться — это выбор.»
Брайан Герберт
«Вы не научитесь ходить, следуя правилам. Вы учитесь, делая и падая».
Ричард Брэнсон
«Обучение — это опыт.Все остальное — просто информация «.
Альберт Эйнштейн
«У меня было шесть честных людей. Они научили меня всему, что я знал. Их звали: Где, Что, Когда, Почему, Как и Кто».
Редьярд Киплинг
«Узнай все, что можешь, в любое время и у любого, кого можешь.Всегда будет время, когда вы будете благодарны за это ».
Сара Колдуэлл
«Задача образования — заменить пустой ум открытым».
Малькольм Форбс
«Я всегда делаю то, что не могу, чтобы научиться это делать.»
Пабло Пикассо
«Скажи мне, и я забуду. Научи меня, и я запомню. Вовлеките меня, и я узнаю».
Бенджамин Франклин
«В обучении прекрасно то, что никто не может отнять его у вас.»
Би Би Кинг
«Образование — это не изучение фактов, а тренировка ума».
Альберт Эйнштейн
«Вам еще предстоит многому научиться.»
Йода
«Жить легко с закрытыми глазами, не понимая всего, что ты видишь».
Джон Леннон и Пол Маккартни
«Человек, хотя и мудрый, никогда не должен стесняться учиться большему, и он должен изменить свой разум.»
Софокл
«Весь мир — моя школа, и все человечество — мой учитель».
Джордж Уитмен
«Обучение только демонстрирует, что это возможно.Обучение делает это возможным «.
Пауло Коэльо
«Знание говорит, но мудрость слушает».
Джими Хендрикс
«Ошибки велики, чем больше я делаю, тем умнее становлюсь.»
Р. Бакминстер Фуллер
«Вы ничего не поймете, пока не узнаете больше, чем одним способом».
Марвин Мински
«У золота есть цена, но обучение бесценно.»
Китайская пословица
«Мне потребовалась вся жизнь, чтобы научиться тому, во что не играть».
Диззи Гиллеспи
«Любой, кто перестает учиться, стар, будь то двадцать или восемьдесят лет.Любой, кто продолжает учиться, остается молодым «.
Генри Форд
«Обучение никогда не истощает ум».
Леонардо да Винчи
«Это искусство образованного ума — уметь поддерживать мысль, не принимая ее.»
Аристотель
«Корни образования горьки, а плод сладок».
Аристотель
«Неважно, насколько медленно вы идете, пока вы не останавливаетесь.»
Конфуций
«Наука — это организованное знание. Мудрость — это организованная жизнь».
Уилл Дюрант,
«Я был обязан быть трудолюбивым.Тот, кто столь же трудолюбив, добьется успеха одинаково хорошо «.
Иоганн Себастьян Бах
«Образование — это движение от тьмы к свету».
Аллан Блум
«Образование — это прогрессивное открытие нашего собственного невежества.»
Уилл Дюрант,
«Самое благородное удовольствие — это радость понимания».
Леонардо да Винчи
«Для максимальной отдачи вложите кошелек себе в голову.»
Бенджамин Франклин
«Образование — это разжигание пламени, а не наполнение сосуда».
Сократ
«Зажги тьму.»
Боб Марли
«Обучение — это сокровище, которое повсюду будет следовать за своим владельцем».
Китайская пословица
«Каждый раз, когда человек проводит новый эксперимент, он всегда узнает больше.Он не может научиться меньшему «.
Р. Бакминстер Фуллер
«Настоящее обучение приходит, когда утихает дух соревнования».
Джидду Кришнамурти
«Образование — это ключ к открытию мира, пропуск к свободе.»
Опра Уинфри
«Вы никогда не можете быть слишком одеты или слишком образованы».
Оскар Уайльд
«Воспитание — это не наполнение ведра, а разжигание огня.»
W.B. Йейтс
«Я все еще учусь.»
Микеланджело, 87 лет
«Учась, вы будете учить, а в обучении вы будете учиться.»
Фил Коллинз
«Мы то, что делаем постоянно. Следовательно, совершенство — это не действие, а привычка».
Аристотель
«Мы рождены не для того, чтобы быть совершенными, но чтобы учиться и размышлять о недостатках»
Принцесса Рамирес
«Образование — это не подготовка; образование — это сама жизнь.»
Джон Дьюи
Разрешение на выпуск партии вакцины Sputnik V для гражданского использования может быть получено на следующей неделе — Общество и культура
МОСКВА, 3 сентября. / ТАСС /. Гамалея НИИ эпидемиологии и микробиологии Минздрава России может получить разрешение на выпуск на следующей неделе партии новой вакцины Sputnik V против нового коронавируса для гражданского использования, сообщил заместитель директора института по исследованиям, член-корреспондент Об этом в пятницу сообщил РАН Денис Логунов.
«Его экспертиза должна начаться в течение нескольких дней. Также в течение нескольких дней мы должны получить разрешение. Существует определенная процедура разрешения партии для использования в гражданских целях. Она должна пройти проверку качества медицинской службы Росздравнадзора. В течение нескольких дней, в период с сентября. 10 и 13, мы должны получить разрешение на выпуск партии вакцины для гражданского использования. Соответственно, с этого момента начнется вакцинация населения », — сказал он в эфире круглосуточного новостного телеканала« Россия-24 ». .
Распространение вакцины будет осуществляться Министерством здравоохранения. Ранее министр здравоохранения Михаил Мурашко заявлял, что на нынешнем этапе под гражданским использованием подразумевается вакцинация людей из групп риска, таких как медики и учителя. Эта процедура будет проводиться одновременно с пострегистрационным клиническим исследованием.
«Регистрация вакцины позволяет вакцинировать все население, но на первом месте будут группы высокого риска. По остальным нет ограничений, но Минздрав поставил задачу защитить группы риска в первую очередь. «, — сказал Логунов.
«Платформа [на которой была разработана вакцина против коронавируса] хорошо изучена не только нами, но и во всем мире. Она зарегистрирована в Китае, ЕС и США. Обширная доказательная база вакцины безопасность была основным предварительным условием для ее условной регистрации. Что позволяет условная регистрация? Она позволяет сразу же защитить группы риска, не тратя два, три, четыре или пять лет на тестирование вакцины на добровольцах, в течение которых многие люди в Группы высокого риска могут умереть или пострадать.Это постановление позволяет приступить к защите населения. Вот что это значит «, — сказал Логунов.
11 августа Россия первой в мире зарегистрировала вакцину против коронавируса — Sputnik V. Вакцина создана в Институте Гамалеи и прошла клинические испытания в июне-июле. Он основан на платформе, которая уже использовалась для создания ряда других вакцин. 15 августа Минздрав сообщил, что производство вакцины запущено.
Позже директор Института эпидемиологии и микробиологии им. Гамалеи Александр Гинцбург сообщил ТАСС, что вакцинация добровольцев в рамках пострегистрационных тестов начнется в начале сентября. Всего будет задействовано 40 000 человек. Десяти тысячам из них будет введено плацебо.
.