Цитомегаловирус
Цитомегаловирус (ЦМВ) — это род вирусов группы герпесвирусов.
Вирус имеет сродство к тканям слюнных желез, что зачастую позволяет находить и локализовывать его именно там. Данный вирус, как и все вирусы герпеса, имеет свойство постоянно находиться (персистировать) в организме человека при однократном заражении, однако сам по себе он не сильно заразен, поскольку для этого требуются частые и тесные контакты с носителем.
Заражение происходит:
- воздушно-капельным путем, а также через слюну при поцелуях;
- половым путем — при контакте со спермой и слизистой матки;
- при переливании крови;
- при родах и во время пребывания ребенка в утробе в процессе беременности;
- через молоко матери при грудном кормлении ребенка.
Клинические проявления
 При этом проявляются: повышение температуры тела, признаки общей интоксикации, слабость, ознобы, головные боли, боли в мышцах, явления бронхита. Впоследствии под действием вируса происходит перестройка иммунной системы организма, готовящейся к отражению атаки. Однако в случае нехватки сил организма острая фаза переходит в более спокойную форму, когда зачастую проявляются сосудисто-вегетативные расстройства, а также поражения внутренних органов. В данном случае возможны три проявления заболевания:
При этом проявляются: повышение температуры тела, признаки общей интоксикации, слабость, ознобы, головные боли, боли в мышцах, явления бронхита. Впоследствии под действием вируса происходит перестройка иммунной системы организма, готовящейся к отражению атаки. Однако в случае нехватки сил организма острая фаза переходит в более спокойную форму, когда зачастую проявляются сосудисто-вегетативные расстройства, а также поражения внутренних органов. В данном случае возможны три проявления заболевания:- ОРВИ (острая респираторная вирусная инфекция) — в данном случае представлены все симптомы ОРВИ (слабость, общее недомогание, быстрая утомляемость, немного повышенная температура тела, головные боли, насморк, увеличение и воспаление слюнных желез, белесоватые налеты на языке и деснах; иногда возможно наличие воспаленных миндалин;
- генерализованная форма — поражение ЦМВ внутренних органов (воспаление печеночной ткани, надпочечников, почек, селезенки, поджелудочной железы).

- поражение органов мочеполовой/мочевыводящей системы — проявляется в виде неспецифического и периодического воспаления. При этом, как и в случае бронхита и пневмонии, воспаления плохо поддаются лечению традиционными для данного локального заболевания антибиотиками.
Также в случае заражения беременной женщины возможна патология плода, когда плод заражается поступившим в кровь извне ЦМВ, что приводит к невынашиванию плода (одна из наиболее частых причин). Также возможна активизация латентной формы вируса, заражающего плод через кровь матери. Заражение приводит либо к гибели ребенка в утробе/после родов, либо к поражению нервной системы и головного мозга, что проявляется в различных психологических и физических заболеваниях.
Также возможна активизация латентной формы вируса, заражающего плод через кровь матери. Заражение приводит либо к гибели ребенка в утробе/после родов, либо к поражению нервной системы и головного мозга, что проявляется в различных психологических и физических заболеваниях.
Лечение
Лечение вируса имеет общий характер, когда требуется укрепление иммунной системы человека для противостояния развитию заболевания даже в случае заражения. Также лечение антибиотиками сопутствующих заболеваний в комплексе с противовирусной и общеукрепляющей терапией позволяет излечиться или вывести вирус в латентную (неактивную) форму, когда деятельность вируса контролируется иммунной системой человека.
Правильно подобранное лечение современными препаратами, а также лечение сопутствующих заболеваний антибиотиками и иммуномодуляторами, в комплексе с общеукрепляющей (здоровый образ жизни, обязательные прогулки, витаминотерапия и т.
Cytomegalovirus, IgG
Антитела класса IgG к цитомегаловирусу – специфические иммуноглобулины, вырабатывающиеся в организме человека в период выраженных клинических проявлений цитомегаловирусной инфекции и являющиеся серологическим маркером этого заболевания, а также перенесенной в прошлом цитомегаловирусной инфекции.
Синонимы русские
Антитела класса IgG к цитомегаловирусу (ЦМВ).
Синонимы английские
Anti-CMV-IgG, CMV Antibody, IgG.
Метод исследования
Электрохемилюминесцентный иммуноанализ (ECLIA).
Единицы измерения
Ед/мл (единица на миллилитр).
Какой биоматериал можно использовать для исследования?
Венозную, капиллярную кровь.
Как правильно подготовиться к исследованию?
Не курить в течение 30 минут до исследования.
Общая информация об исследовании
Цитомегаловирус (ЦМВ) относится к семейству вирусов герпеса. Так же, как и другие представители этой группы, он может сохраняться у человека всю жизнь. У здоровых людей с нормальным иммунитетом первичная инфекция протекает без осложнений (и часто бессимптомно). Однако цитомегаловирус опасен при беременности (для ребенка) и при иммунодефиците.
Цитомегаловирусом можно заразиться через различные биологические жидкости: слюну, мочу, сперму, кровь. Кроме того, он передается от матери к ребенку (во время беременности, родов или при кормлении).
Как правило, цитомегаловирусная инфекция протекает бессимптомно. Иногда заболевание напоминает инфекционный мононуклеоз: повышается температура, болит горло, увеличиваются лимфатические узлы. В дальнейшем вирус сохраняется внутри клеток в неактивном состоянии, но если организм окажется ослаблен, то он снова начнет размножаться.
Для женщины важно знать, была ли она заражена ЦМВ в прошлом, потому что именно это определяет, есть ли риск осложнений при беременности. Если раньше она уже была инфицирована, то риск минимален. Во время беременности может обостриться старая инфекция, однако такая форма обычно не вызывает тяжелых последствий.
Если раньше она уже была инфицирована, то риск минимален. Во время беременности может обостриться старая инфекция, однако такая форма обычно не вызывает тяжелых последствий.
Если у женщины еще не было ЦМВ, значит, она входит в группу риска и ей следует уделять особое внимание профилактике ЦМВ. Для ребенка опасна именно инфекция, которой мать заразилась первый раз во время беременности.
При первичной инфекции у беременной женщины вирус часто попадает и в организм ребенка. Это еще не означает, что он заболеет. Как правило, заражение ЦМВ протекает бессимптомно. Однако примерно в 10 % случаев оно приводит к врождённым патологиям: микроцефалии, церебральной кальцификации, сыпи и увеличению селезенки и печени. Это часто сопровождается снижением интеллекта и глухотой, возможен даже летальный исход.
Таким образом, для будущей матери важно знать, была ли она в прошлом заражена ЦМВ. Если да, то риск осложнений из-за возможного ЦМВ становится незначительным. Если же нет – нужно проявлять особую осторожность во время беременности:
- избегать незащищенного секса,
- не контактировать со слюной другого человека (не целоваться, не использовать общую посуду, зубные щетки и пр.
 ),
), - соблюдать правила гигиены при играх с детьми (мыть руки, если на них попадает слюна или моча),
- сдавать анализ на ЦМВ при признаках общего недомогания.
Кроме того, цитомегаловирус представляет опасность при ослаблении иммунной системы (например, из-за иммунодепрессантов или ВИЧ). При СПИДе ЦМВ протекает в тяжелой форме и является частой причиной смерти больных.
Основные симптомы цитомегаловирусной инфекции:
- воспаление сетчатки (которое может приводить к слепоте),
- колит (воспаление толстой кишки),
- эзофагит (воспаление пищевода),
- неврологические расстройства (энцефалит и др.).
Выработка антител – это один из способов борьбы с вирусной инфекцией. Существует несколько классов антител (IgG, IgM, IgA и др.).
Антитела класса G (IgG) присутствуют в крови в наибольшем количестве (по сравнению с другими типами иммуноглобулинов). При первичной инфекции их уровень возрастает в первые недели после заражения и затем может оставаться высоким годами.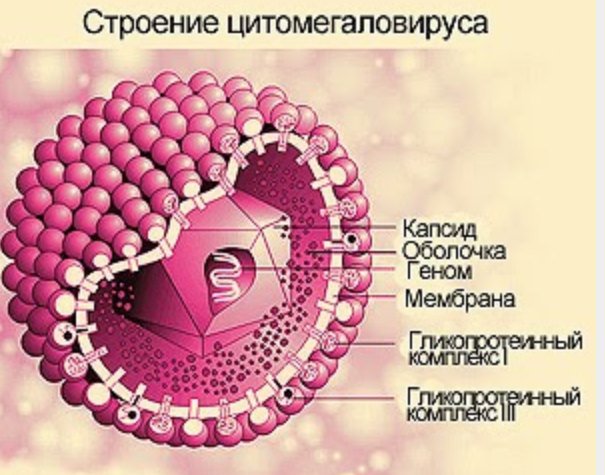
Кроме количества, часто определяется еще и авидность IgG – прочность, с которой антитело связывается с антигеном. Чем выше авидность, тем прочнее и быстрее антитела связывают вирусные белки. Когда человек впервые заражается ЦМВ, его антитела IgG обладают низкой авидностью, потом (через три месяца) она становится высокой. По авидности IgG судят о том, как давно произошло первоначальное заражение ЦМВ.
Для чего используется исследование?
- Чтобы установить, был ли человек в прошлом инфицирован ЦМВ.
- Для диагностики цитомегаловирусной инфекции.
- Чтобы установить возбудителя заболевания, которое похоже на цитомегаловирусную инфекцию.
Когда назначается исследование?
- Во время беременности (или при ее планировании) – для оценки риска осложнений (проверочное исследование), при симптомах цитомегаловирусной инфекции, при нарушениях у плода по результатам УЗИ.
- При симптомах цитомегаловирусной инфекции у людей с ослабленным иммунитетом.

- При симптомах мононуклеоза (если тесты не выявили вирус Эпштейна – Барр).
Что означают результаты?
Референсные значения
Концентрация: 0 — 0,5 Ед/мл.
Результат: отрицательный.
Отрицательный результат при беременности
- Женщина раньше не была инфицирована ЦМВ – есть риск приобрести первичную ЦМВ-инфекцию. Однако если с момента заражения прошло не больше 2-3 недель, то IgG могли еще не появиться. Чтобы исключить этот вариант, нужно сдать анализ повторно через 2 недели.
Положительный результат до беременности
- Женщина уже была инфицирована ЦМВ в прошлом – риск осложнений минимален.
Положительный результат во время беременности
- Нельзя сделать однозначный вывод. Возможно, ЦМВ попал в организм до беременности. Но не исключено, что женщина заразилась недавно, в начале беременности (за несколько недель до теста). Такой вариант представляет опасность для ребенка.
 Для точного диагноза нужны результаты других анализов (см. таблицу).
Для точного диагноза нужны результаты других анализов (см. таблицу).
При попытке установить возбудителя неизвестного заболевания единичный тест на IgG дает мало информации. Нужно учитывать результаты всех анализов.
Результаты тестов в разных ситуациях
|
|
Первичная инфекция |
Обострение давней инфекции |
ЦМВ в латентном состоянии (человек был инфицирован в прошлом) |
Человек не заражен ЦМВ |
|
Результаты тестов |
IgG: первые 1-2 недели отсутствуют, потом их количество увеличивается. IgM: есть (высокий уровень). Авидность IgG: низкая. |
IgG: есть (количество увеличивается). IgM: есть (невысокий уровень). Авидность IgG: высокая. |
IgG: присутствуют на постоянном уровне. IgM: обычно нет. Авидность IgG: высокая.
|
IgG: нет. IgM: нет. |
Важные замечания
- Иногда нужно узнать, заражен ли цитомегаловирусом сам новорождённый ребенок. Однако анализ на IgG в данном случае неинформативен. IgG могут проникать через плацентарный барьер, поэтому, если антитела есть у матери, то они же будут присутствовать и у ребенка.
- Что такое реинфекция? В природе существует несколько разновидностей ЦМВ, так что возможна ситуация, когда человек, уже инфицированный одним типом вируса, заражается еще раз другим.

Также рекомендуется
Кто назначает исследование?
Врач общей практики, терапевт, инфекционист, гинеколог.
Литература
- Adler S. P. Screening for cytomegalovirus during Pregnancy. Infect Dis Obstet Gynecol. 2011:1-9.
- Goldman’s Cecil Medicine. 24th ed. Goldman L, Schafer A.I., eds. Saunders Elsevier; 2011.
- Lazzarotto T. et al. Why is cytomegalovirus the most frequent cause of congenital infection? Expert Rev Anti Infect Ther. 2011; 9(10): 841-843.
Cytomegalovirus, ДНК, количественно [реал-тайм ПЦР]
Исследование, направленное на обнаружение генетического материала (ДНК) возбудителя цитомегаловирусной инфекции, Cytomegalovirus, методом полимеразной цепной реакции в режиме реального времени.
Синонимы русские
Цитомегаловирус; ЦМВ; ДНК [полимеразная цепная реакция в режиме реального времени]; количественный анализ.
Синонимы английские
Cytomegalovirus; CMV; DNA [polymerase chain reaction, real-time PCR]; quantitative.
Метод исследования
Полимеразная цепная реакция в режиме реального времени
Какой биоматериал можно использовать для исследования?
Амниотическая жидкость, бронхоальвеолярный лаваж, венозная кровь, ликвор, мазок из зева (ротоглотки), первая порция утренней мочи, слюна, биоптат (биоптат лёгких, печени, ЖКТ).
Общая информация об исследовании
Цитомегаловирус (Cytomegalovirus) относится к семейству герпес-вирусов человека, рода Cytomegalovirus, и является возбудителем цитомегаловирусной инфекции. Цитомегаловирусная инфекция (ЦМВИ) – это широко распространенная инфекция человека, характеризующаяся легким, бессимптомным течением у людей в обычных условиях и с нормально функционирующей иммунной системой. Особое клиническое значение она приобретает у лиц с патологией иммунной системы, иммунодефицитными состояниями и у беременных женщин из-за риска внутриутробного инфицирования плода.
По данным различных исследований, носительство цитомегаловирусной инфекции выявляется у 60-90 % взрослого населения. ЦМВИ также входит в группу TORCH-инфекций (перевод первых букв латинских токсоплазмы — Toxoplasma, краснухи — Rubella, цитомегаловируса — Cytomegalovirus, герпеса — Herpes), — являющихся потенциально опасными для развития плода и вызывающими тяжелые поражения органов у новорождённых детей. Цитомегаловирус является ведущей причиной врождённых инфекций во всем мире и обнаруживается у 0,2-2,2 % новорождённых. У 10 % таких детей развиваются клинические признаки заболевания с рождения, у части в течение первых десяти лет жизни.
Цитомегаловирус является ДНКсодержащим вирусом, обладающим способностью к медленному распространению в культуре инфицированных клеток и приводящим к их изменению и увеличению размера (цитомегалии). Источником инфекции является человек, выделяющий вирус через различные биологические жидкости. К ним относятся кровь, слюна, моча, грудное молоко, цервикальный и вагинальный секрет, семенная жидкость, ликвор, содержимое желудочно-кишечного тракта и прочие секреты. Инфекция передается воздушно-капельным, контактным, половым путем, в результате переливания крови от инфицированного донора. Возможно также заражение при трансплантации органов и вертикальный путь передачи, от инфицированной женщины к ребенку во время беременности или родов. Длительность инкубационного периода заболевания часто установить невозможно, так как большинство клинических случаев не распознается и протекает в латентной, бессимптомной, форме. Также следует отметить, что для ЦМВИ характерна длительная персистенция возбудителя в организме человека. Это приводит к тому, что множество людей является носителями этого вида инфекции на протяжении долгих лет и, возможно, всей жизни. При ослаблении иммунной системы может отмечаться тяжелое течение заболевания.
Инфекция передается воздушно-капельным, контактным, половым путем, в результате переливания крови от инфицированного донора. Возможно также заражение при трансплантации органов и вертикальный путь передачи, от инфицированной женщины к ребенку во время беременности или родов. Длительность инкубационного периода заболевания часто установить невозможно, так как большинство клинических случаев не распознается и протекает в латентной, бессимптомной, форме. Также следует отметить, что для ЦМВИ характерна длительная персистенция возбудителя в организме человека. Это приводит к тому, что множество людей является носителями этого вида инфекции на протяжении долгих лет и, возможно, всей жизни. При ослаблении иммунной системы может отмечаться тяжелое течение заболевания.
Различают приобретенную и врождённую формы ЦМВИ. Приобретенная форма инфекции протекает в виде острого локализованного процесса, схожего по клинической симптоматике с острой респираторной вирусной инфекцией или инфекционным мононуклеозом. Отмечается повышение температуры тела, слабость, общее недомогание, боль в горле, миалгии, увеличение шейных лимфатических узлов. В редких случаях отмечаются осложнения в виде артралгий, артритов, пневмонии, цитомегаловирусного гепатита.
Отмечается повышение температуры тела, слабость, общее недомогание, боль в горле, миалгии, увеличение шейных лимфатических узлов. В редких случаях отмечаются осложнения в виде артралгий, артритов, пневмонии, цитомегаловирусного гепатита.
У детей до трех месяцев жизни, а также у лиц с патологией иммунной системы (иммунодефицитными состояниями, ВИЧ-инфекцией, после трансплантации органов, лечения иммуносупрессивными препаратами, при злокачественных заболеваниях) ЦМВИ может протекать в тяжелой форме с развитием серьезных осложнений. При этом развиваются тяжелые поражения легких, почек, печени, желудочно-кишечного тракта, нервной системы с развитием вирусного энцефалита.
Врождённая форма ЦМВИ возникает в результате трансплацентарной передачи инфекции от матери плоду при инфицировании женщины на ранних сроках беременности, особенно при первичном инфицировании. Последнее очень опасно в связи с тем, что предполагает отсутствие у женщины предварительного иммунитета к цитомегаловирусу и, следовательно, незащищенность здоровья ребенка. При этом развивается острая врождённая ЦМВИ, приводящая к самопроизвольному аборту или гибели эмбриона. При поражении плода на более поздних сроках беременности развивается геморрагический синдром с кровоизлияниями в кожу, внутренние органы, головной мозг. Отмечается энцефаломаляция, церебральная кальцификация, увеличение селезёнки, печени, гепатит. Возможно также заражение ребенка во время родов при прохождении родовых путей. При хронической врождённой ЦМВИ возникает фиброз внутренних органов и пороки развития: гидроцефалия, микроцефалия, увеит, слепота, пороки сердца, нейросенсорная потеря слуха и другие неврологические нарушения. Отмечается отставание и в неврологическом и психическом развитии.
При этом развивается острая врождённая ЦМВИ, приводящая к самопроизвольному аборту или гибели эмбриона. При поражении плода на более поздних сроках беременности развивается геморрагический синдром с кровоизлияниями в кожу, внутренние органы, головной мозг. Отмечается энцефаломаляция, церебральная кальцификация, увеличение селезёнки, печени, гепатит. Возможно также заражение ребенка во время родов при прохождении родовых путей. При хронической врождённой ЦМВИ возникает фиброз внутренних органов и пороки развития: гидроцефалия, микроцефалия, увеит, слепота, пороки сердца, нейросенсорная потеря слуха и другие неврологические нарушения. Отмечается отставание и в неврологическом и психическом развитии.
В связи с тем что клиническая диагностика ЦМВИ в большинстве случаев затруднена, лабораторная диагностика очень важна. Современным методом диагностики ЦМВИ является полимеразная цепная реакция в режиме реального времени. Это метод молекулярной диагностики, позволяющий выявлять генетический материал возбудителя на ранних этапах заболевания.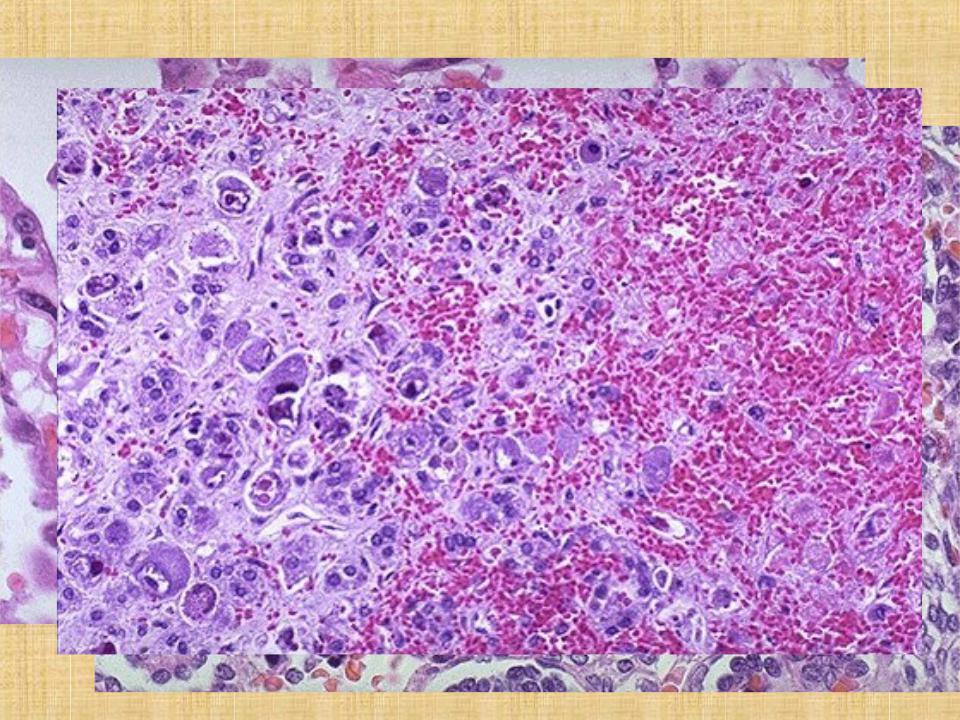 Он характеризуется высокими показателями диагностической чувствительности и специфичности, быстротой получения конечного результата и доступностью. Особенностью метода является возможность выявлять ДНК (дезоксирибонуклеиновую кислоту) цитомегаловируса даже при малом содержании её в исследуемом биологическом материале. Метод основан на многократном увеличении числа копий специфичного для данного возбудителя участка ДНК. Он позволяет определять ДНК цитомегаловируса в случае подозрения на острую, текущую ЦМВИ у детей и взрослых, у людей с патологией иммунной системы, у беременных женщин. Преимуществом метода является возможность его использования для диагностики заболевания на ранних стадиях, при латентной и персистирующих формах инфекции. Возможно проведение исследования в биоматериале, взятом у новорождённых детей в случае подозрения на врождённую форму ЦМВИ или при инфицировании матери. Используется для дифференциальной диагностики инфекции, вызванной цитомегаловирусом, и других вирусных инфекций.
Он характеризуется высокими показателями диагностической чувствительности и специфичности, быстротой получения конечного результата и доступностью. Особенностью метода является возможность выявлять ДНК (дезоксирибонуклеиновую кислоту) цитомегаловируса даже при малом содержании её в исследуемом биологическом материале. Метод основан на многократном увеличении числа копий специфичного для данного возбудителя участка ДНК. Он позволяет определять ДНК цитомегаловируса в случае подозрения на острую, текущую ЦМВИ у детей и взрослых, у людей с патологией иммунной системы, у беременных женщин. Преимуществом метода является возможность его использования для диагностики заболевания на ранних стадиях, при латентной и персистирующих формах инфекции. Возможно проведение исследования в биоматериале, взятом у новорождённых детей в случае подозрения на врождённую форму ЦМВИ или при инфицировании матери. Используется для дифференциальной диагностики инфекции, вызванной цитомегаловирусом, и других вирусных инфекций. Рекомендуется также для оценки эффективности проводимой терапии.
Рекомендуется также для оценки эффективности проводимой терапии.
Для чего используется исследование?
- Для подтверждения ЦМВИ.
- Для диагностики острой или текущей ЦМВИ.
- Для диагностики первичной инфекции и/или активной формы ЦМВИ в период реактивации (обострения) персистентной инфекции.
- Для диагностики латентной формы ЦМВИ.
- Для диагностики персистентной формы ЦМВИ.
Когда назначается исследование?
- При подозрении на ЦМВИ и ее клинических проявлениях.
- При подозрении на латентную и персистентную формы ЦМВИ.
- При клинических проявлениях ЦМВИ у лиц с иммунодефицитными состояниями, ВИЧ-инфекцией, после трансплантации органов, лечения иммуносупрессивными препаратами, при злокачественных заболеваниях.
- При поражении легких, желудочно-кишечного тракта, нервной системы, почек, печени предположительно цитомегаловирусной этиологии.

- При атипичном течении заболеваний бронхо-легочной системы у детей, при пневмонии.
- Во время беременности (при симптомах заболевания, при подозрении на нарушения развития плода, для скрининга ЦМВИ).
- Женщинам при патологии беременности: невынашивание беременности, замершая беременность, самопроизвольные аборты, гибель эмбриона.
- Обследование плода при инфицировании беременной женщины во время беременности, признаках внутриутробной инфекции.
- Новорождённым детям: если его мать перенесла первичную цитомегаловирусную инфекцию во время беременности; если у ребенка есть симптомы врождённой инфекции: анемия, геморрагия, гепатит, микроцефалия, увеличение селезенки и/или печени, нарушение слуха, зрения, пороки сердца, неврологические нарушения (задержка умственного развития, конвульсии).
- При оценке контроля проведенного лечения против ЦМВИ.
Что означают результаты?
Референсные значения: не обнаружено.
Причины повышения:
- инфицирование цитомегаловирусом;
- острая, текущая, персистентная, латентная формы ЦМВИ.
Причины понижения:
- отсутствие инфицирования цитомегаловирусом.
Важные замечания
- Диагностика ЦМВИ является комплексной и основана на сочетании анамнестических, клинических данных и результатах лабораторных исследований.
- Метод ПЦР в режиме реального времени позволяет выявлять части и молекулу ДНК цитомегаловируса при любых формах ЦМВИ. Преимуществом метода является возможность его использования для диагностики заболевания на ранних стадиях, при латентной и персистирующих формах инфекции. Важно отметить, что с помощью данного метода невозможно проводить дифференциальную диагностику форм ЦМВИ, так как генетический материал вируса может быть обнаружен и при латентной форме инфекции.
Также рекомендуется
[07-016] Cytomegalovirus предранний белок IEA, IgM, IgG
[07-017] Cytomegalovirus, IgG
[07-018] Cytomegalovirus, IgM
[09-003] Cytomegalovirus, ДНК [реал-тайм ПЦР]
[40-129] Антитела к Cytomegalovirus (IgG) с определением авидности
Кто назначает исследование?
Терапевт, врач общей практики, инфекционист, акушер-гинеколог, неонатолог, педиатр, уролог, хирург.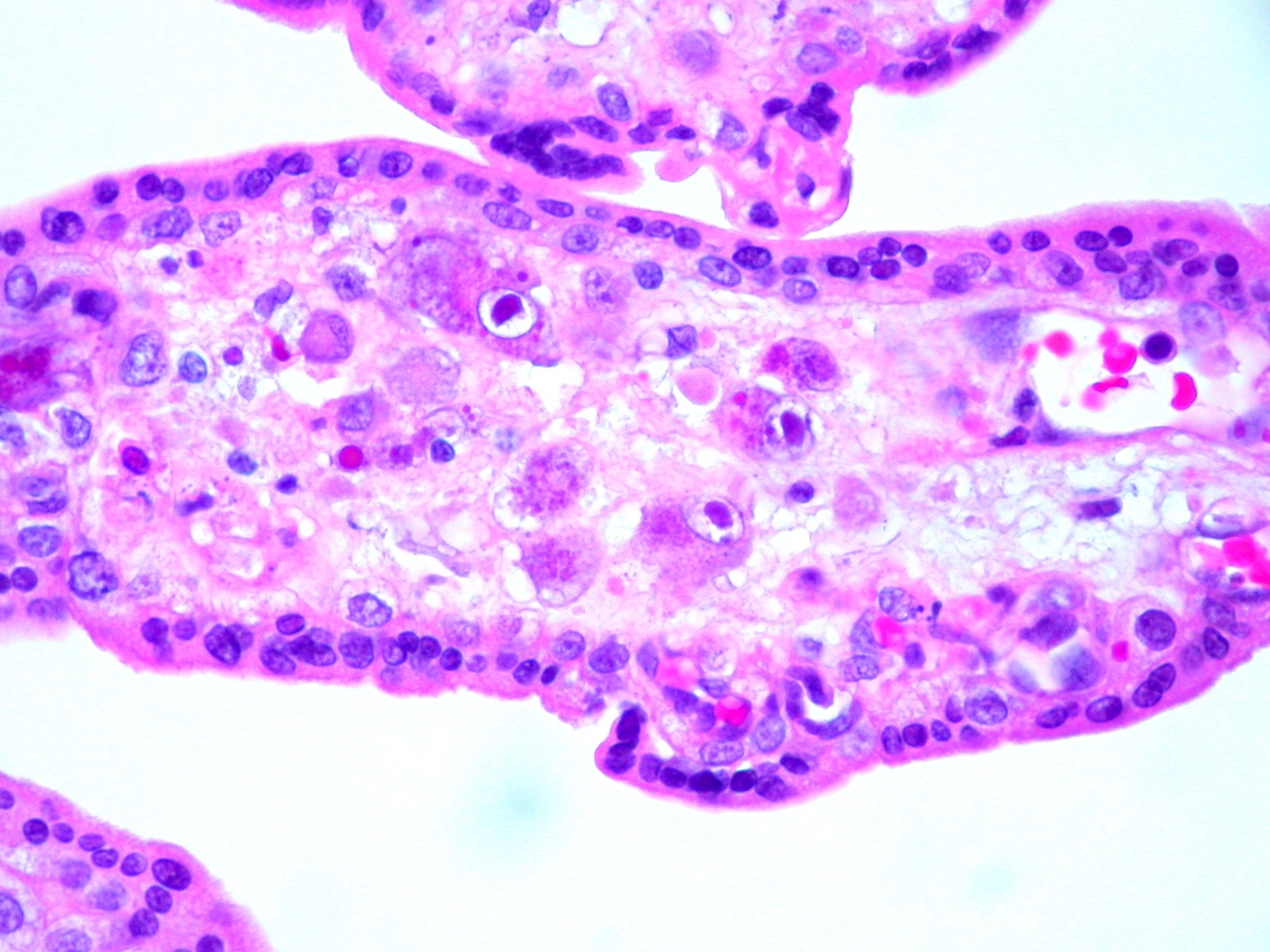
Литература
- Wang L, Xu X, Zhang H, Qian J, Zhu J. Dried blood spots PCR assays to screen congenital cytomegalovirus infection: a meta-analysis / Virol J. 2015 Apr 14;12:60.
- Liu Z, Zhang P, Tang S, He X, Zhang R, Wang X, Yuan Z, Tan J, Peng B, Liu E, Fu Z, Zou L. Urine real-time polymerase chain reaction detection for children virus pneumonia with acute human cytomegalovirus infection / BMC Infect Dis. 2014 May 8;14:245.
- Ross SA, Ahmed A, Palmer AL, Michaels MG, Sánchez PJ, Bernstein DI, Tolan RW Jr, Novak Z, Chowdhury N, Fowler KB, Boppana SB; National Institute on Deafness and Other Communication Disorders CHIMES Study. Detection of congenital cytomegalovirus infection by real-time polymerase chain reaction analysis of saliva or urine specimens / J Infect Dis. 2014 Nov 1;210(9):1415-8.
- Gaytant M A, Steegers E A P, Semmekrot B A, Merkus H M M W, Galama J M D. Congenital cytomegalovirus infection: Review of the epidemiology and outcome.
 Obstet Gynecol Surv 2002; 57: 245-256.
Obstet Gynecol Surv 2002; 57: 245-256.
ЦМВ-инфекция, одна из «поцелуйных» болезней
Цитомегаловирусная инфекция – это заболевание, передающееся половым путем, через слюну, материнское молоко, при беременности (от матери к ребенку), через общую мочалку, полотенце, посуду и т.д. К концу жизни инфицированными этим вирусом оказывается практически сто процентов людей. В большинстве случаев он никак себя не проявляет, но при снижении иммунитета активируется и вызывает болезнь. Вирус может начать действовать в любой части организма, поэтому четкой симптоматики у инфекции нет.
Искоренить вирус нельзя, можно лишь уменьшить его активность. Особенно внимательно к этому вирусу и к его поведению в организме нужно относиться женщинам беременным или планирующим зачать ребенка, поскольку цитомегаловирусная инфекция может вызвать повреждение плода.
Что это такое?
В старые добрые времена ее величали «поцелуйной болезнью», потому как думали, что она передается вместе со слюной. Нынешние медики доказали, что это не совсем так. Возбудитель болезни может находиться не только в слюне, но и в крови, моче, фекалиях, семенной жидкости, секрете шейки матки и материнском молоке. Разумеется, и поцелуя в губы достаточно, чтобы подхватить инфекцию от носителя вируса. Однако того же результата можно добиться, если заняться с ним сексом, выпить из его чашки или поесть из его тарелки, воспользоваться его носовым платком, полотенцем или мочалкой. Кроме того, цитомегаловирусом можно заразиться при переливании крови и пересадке органов, даже в животе у матери будущий ребенок от него не застрахован.
Нынешние медики доказали, что это не совсем так. Возбудитель болезни может находиться не только в слюне, но и в крови, моче, фекалиях, семенной жидкости, секрете шейки матки и материнском молоке. Разумеется, и поцелуя в губы достаточно, чтобы подхватить инфекцию от носителя вируса. Однако того же результата можно добиться, если заняться с ним сексом, выпить из его чашки или поесть из его тарелки, воспользоваться его носовым платком, полотенцем или мочалкой. Кроме того, цитомегаловирусом можно заразиться при переливании крови и пересадке органов, даже в животе у матери будущий ребенок от него не застрахован.
Неутешительные цифры : к 1 году заражен каждый пятый, к 35 годам — 40 процентов населения, а к 50 — все сто. Цитомегаловирусная инфекция считается одним из самых распространенных инфекционных заболеваний.
Возбудитель болезни — Cytomegalovirus hominis — вирус из того же семейства, что и вирус герпеса.
Цитомегаловирус — капризный и привередливый, жить и размножаться он может лишь в очень благоприятных условиях и в определенных клетках. Если ему «что-то не нравится», он ведет себя тихо, зараженный человек пока не болен, он просто является носителем вируса. Но как только организм ослабевает, возбудитель инфекции начинает действовать.
Если ему «что-то не нравится», он ведет себя тихо, зараженный человек пока не болен, он просто является носителем вируса. Но как только организм ослабевает, возбудитель инфекции начинает действовать.
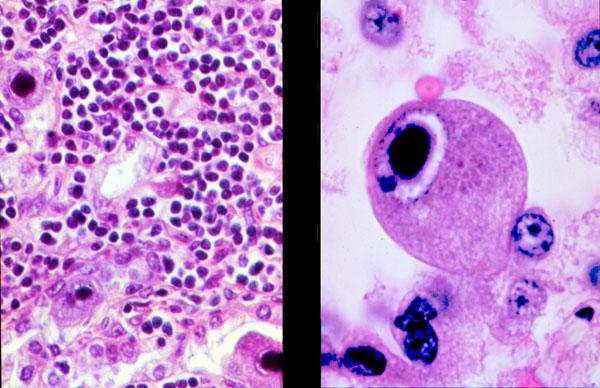
В переводе в греческого цитомегалия — болезнь, при которой «клетки становятся большими». Под влиянием цитомегаловируса клетки теряют способность делиться и одновременно сильно разбухают. Под микроскопом они становятся похожи на глаза совы.
Что происходит?
Оказавшись в клетках человека, цитомегаловирус остается в них навсегда. Независимо от того, каким путем произошло заражение, проявления болезни всегда будут примерно одинаковы. А точнее, никаких проявлений не будет. У большинства инфицированных болезнь протекает в скрытой форме.
Для того чтобы цитомегаловирус активизировался, необходимо снижение иммунитета. Иногда хватает банального авитаминоза, но чаще нужно что-нибудь экстраординарное. Например, СПИД) или прием особых лекарств, понижающих иммунитет (чаще всего они применяются для лечения онкологических заболеваний).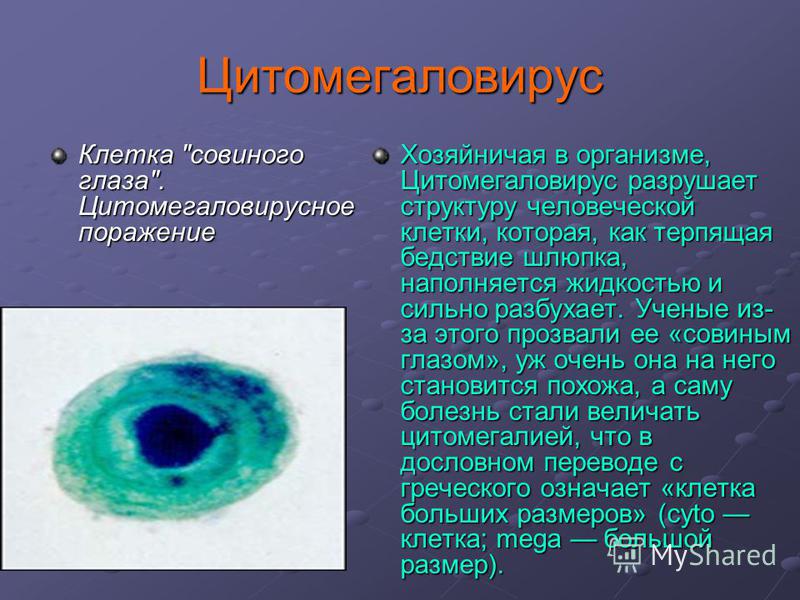
Если цитомегаловирус повреждает слизистые оболочки носа, появляется насморк. При повреждении внутренних органов появляется слабость, поносы-запоры и другие неясные признаки, с которыми, как правило, к врачу не ходят. Тем более, что они через несколько дней сами собой исчезают.
Бывает, что цитомегаловирус поселяется на мочеполовых органах. И тогда у женщин воспаляется матка (эндометрит), шейка матки (цервицит), влагалище (вагинит) и т.п. У мужчин инфекция мочеполовых органов обычно протекает бессимптомно.
Заражение цитомегаловирусом представляет опасность для беременных женщин, поскольку инфекция может передаться развивающемуся эмбриону. Впрочем, если женщина заразилась давно, и инфекция не обостряется, вероятность того, что вирус покалечит будущего ребенка, чрезвычайно низкая. Но при заражении во время беременности, эта вероятность возрастает.
Диагностика и лечение
Самому заподозрить у себя цитомегаловирусную инфекцию практически невозможно. Из всех существующих заболеваний эта болезнь больше всего похожа на банальное ОРЗ. Так же повышается температура, течет из носа и болит горло. Могут увеличиться лимфатические узлы, селезенка и печень. Правда, в отличие от ОРЗ цитомегаловирусная инфекция длится дольше: 1 — 1,5 месяца.
Так же повышается температура, течет из носа и болит горло. Могут увеличиться лимфатические узлы, селезенка и печень. Правда, в отличие от ОРЗ цитомегаловирусная инфекция длится дольше: 1 — 1,5 месяца.
В некоторых случаях единственным признаком болезни является воспаление слюнных желез, в них цитомегаловирус чувствует себя комфортнее всего.
Поставить диагноз «цитомегаловирусная инфекция» может врач-дерматовенеролог. Для этого он вам назначит специальные исследования, которые помогут обнаружить вирус. В образцах крови, слюны, спермы, отделяемого из шейки матки и влагалища, околоплодных вод (при беременности) под микроскопом ищут гигантские клетки или выявляют вирус с помощью ПЦР (ДНК-диагностики). Еще один метод исследования — иммунный: выявление вируса в крови по реакции иммунной системы.
Анализ на цитомегаловирус необходимо делать женщинам, желающим забеременеть.
Цитомегаловирусная инфекция неизлечима. Однако существуют лекарства, позволяющие контролировать количество вируса в организме, сдерживать его развитие. Больным повышают иммунитет и назначают специальные противовирусные препараты.
Больным повышают иммунитет и назначают специальные противовирусные препараты.
Эти же мероприятия проводятся при обнаружении цитомегаловируса у беременной или собирающейся забеременеть женщины на протяжении всего периода вынашивания ребёнка и лактации. Используется весь комплекс препаратов, повышающих иммунитет, а также применяются подавляющие размножение вируса препараты интерферона. Инфицированная беременная женщина должна с интервалом 10-12 дней сдавать анализы. Также следует постоянно следить за состоянием эмбриона.
Тщательно подобранная мощная терапия и строгое выполнение рекомендаций врача позволяют значительно снизить риск передачи инфекции ребёнку, который впрямую зависит от активности вируса в организме матери.
Цитомегаловирусная инфекция. Симптомы и диагностика.
Цитомегаловирусная инфекция (цитомегалия) — распространенное инфекционное заболевание, которое может долго не проявляться либо вызвать поражение внутренних органов и центральной нервной системы. Распространение цитомегаловируса может происходить через сперму, слюну, кровь, грудное молоко. Поэтому инфицирование возможно при любом тесном контакте: при поцелуе и во время полового акта, а также в быту при использовании одной посуды, зубной щетки и предметов гигиены. Заражение происходит при длительном контакте с инфицированным человеком. Возможна передача цитомегаловируса при переливании инфицированной крови или трансплантации инфицированного органа. Ребенок может заразиться от матери через плаценту во время беременности, во время родов или через грудное молоко.
Распространение цитомегаловируса может происходить через сперму, слюну, кровь, грудное молоко. Поэтому инфицирование возможно при любом тесном контакте: при поцелуе и во время полового акта, а также в быту при использовании одной посуды, зубной щетки и предметов гигиены. Заражение происходит при длительном контакте с инфицированным человеком. Возможна передача цитомегаловируса при переливании инфицированной крови или трансплантации инфицированного органа. Ребенок может заразиться от матери через плаценту во время беременности, во время родов или через грудное молоко.
Проявления
Цитомегаловирус, попав в организм, остается в нем навсегда. Обычно вирус бездействует, находится в неактивном состоянии и может длительное время никак себя не проявлять. Если по каким-либо причинам произошел сбой иммунной системы, тогда вирус активизируется и развивается цитомегалия разной степени тяжести. Тяжелая форма заболевания возникает у ВИЧ-инфицированных, у больных СПИДом, при химиотерапии у онкобольных, а также у перенесших трансплантацию органов. Во время беременности, когда отмечается снижение иммунитета, цитомегаловирус начинает активно размножаться, проникать через плаценту и поражать плод.
Во время беременности, когда отмечается снижение иммунитета, цитомегаловирус начинает активно размножаться, проникать через плаценту и поражать плод.
У большинства людей цитомегалия протекает без каких-либо симптомов либо отмечаются признаки схожие с ОРЗ: повышенная температура, озноб, увеличение лимфатических узлов, головная боль, слабость, плохое самочувствие. Если заражение вирусом произошло при переливании крови, тогда спустя 2-4 недели наблюдается длительное повышение температуры, возможно развитие гепатита и желтухи, появление сыпи. При тяжелой форме заболевания вирус вызывает поражение целого ряда органов и может привести к развитию слепоты, энцефалита, язвы кишечника или пищевода, поражению легких и головного мозга, которые могут привести к смерти.
У беременных
Наиболее опасен вирус для беременных женщин, которые заразились во время беременности. Инфицирование в первом триместре беременности может вызвать выкидыш или смерть ребенка. У младенцев с врожденной цитомегалией отмечаются увеличенные размеры печени, селезенки, пониженный гемоглобин, желтуха. Для данных детей характерна задержка психического развития, церебральный паралич, эпилепсия, слепота, поражение слуха.
У младенцев с врожденной цитомегалией отмечаются увеличенные размеры печени, селезенки, пониженный гемоглобин, желтуха. Для данных детей характерна задержка психического развития, церебральный паралич, эпилепсия, слепота, поражение слуха.
Где сдать анализы
Медицинская лаборатория «Синэво» рекомендует пройти обследование на цитомегаловирус при подозрениях на половые инфекции, при длительных воспалительных заболеваниях, а также при планировании беременности.
Для диагностики заражения организма цитомегавирусной инфекцией, оценки риска возникновения острой стадии заболевания предлагаем:
- анализ крови на антитела к цитомегаловирусу IgG и анализ крови на антитела к цитомегаловирусу IgM;
- ДНК-диагностика вируса в мазке и ДНК-диагностика вируса в крови.
Помните, что своевременное обследование на цитомегаловирусную инфекцию позволит избежать серьезных последствий, а также предотвратить инфицирование близких.
Сдать анализ на антитела IgG к цитомегаловирусу, ЦМВ
Метод определения
Иммуноферментный анализ (ИФА).
Исследуемый материал Сыворотка крови
Доступен выезд на дом
Онлайн-регистрацияСинонимы: Антитела класса G к цитомегаловирусу; АТ-ЦМВ-IgG.
Anti-CMV-IgG; CMV Antibody, IgG.
Краткая характеристика определяемого аналита Антитела класса G к цитомегаловирусу (Anti-CMV-IgG)
В ответ на внедрение в организм цитомегаловируса (ЦМВ) развивается иммунная перестройка организма. Инкубационный период колеблется от 15 дней до 3 месяцев. При данной инфекции имеет место нестерильный иммунитет (то есть не наблюдается полной элиминации вируса). Иммунитет при цитомегаловирусной инфекции (ЦМВИ) нестойкий, медленный. Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию. Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция – это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3-5 лет жизни, беременные – чаще во 2 и 3 триместрах), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т. п.).
Возможна реинфекция экзогенным вирусом или реактивация латентной инфекции. Вследствие длительного персистирования в организме вирус действует на все звенья иммунной системы больного. Защитная реакция организма проявляется, прежде всего, в виде образования специфических антител классов IgM и IgG к ЦМВ. Антитела класса IgG к цитомегаловирусу (CMV, ЦМВ) указывают на текущую или имевшую место в прошлом цитомегаловирусную инфекцию. Особенности инфекции. Цитомегаловирусная (ЦМВ) инфекция – это широко распространённое вирусное поражение организма, которое относится к так называемым оппортунистическим инфекциям, протекающим обычно латентно. Клинические проявления наблюдаются на фоне физиологических иммунодефицитных состояний (дети первых 3-5 лет жизни, беременные – чаще во 2 и 3 триместрах), а также у лиц с врождёнными или приобретёнными иммунодефицитами (ВИЧ-инфекция, применение иммунодепрессантов, онкогематологические заболевания, облучение, диабет и т. п.).
Цитомегаловирус – вирус семейства герпес-вирусов. Так же, как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5-6 лет, взрослые 16-30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путём от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра.
Так же, как и другие представители семейства, после инфицирования сохраняется в организме практически пожизненно. Устойчив во влажной среде. Группу риска составляют дети 5-6 лет, взрослые 16-30 лет, а также лица, практикующие анальный секс. Дети восприимчивы к передаче инфекции воздушно-капельным путём от родителей и других детей с латентными формами инфекции. Для взрослых более характерен половой путь передачи. Вирус содержится в сперме и других биологических жидкостях. Вертикальная передача инфекции (от матери к плоду) происходит трансплацентарно и в процессе родов. ЦМВ-инфекция характеризуется разнообразием клинических проявлений, но при полноценном иммунитете протекает клинически бессимптомно. В редких случаях развивается картина инфекционного мононуклеоза (около 10% всех случаев инфекционного мононуклеоза), клинически не отличимого от мононуклеоза, вызванного вирусом Эпштейн-Барра.
Репликация вируса происходит в тканях ретикуло-эндотелиальной системы, эпителии урогенитального тракта, печени, слизистой дыхательных путей и пищеварительного тракта.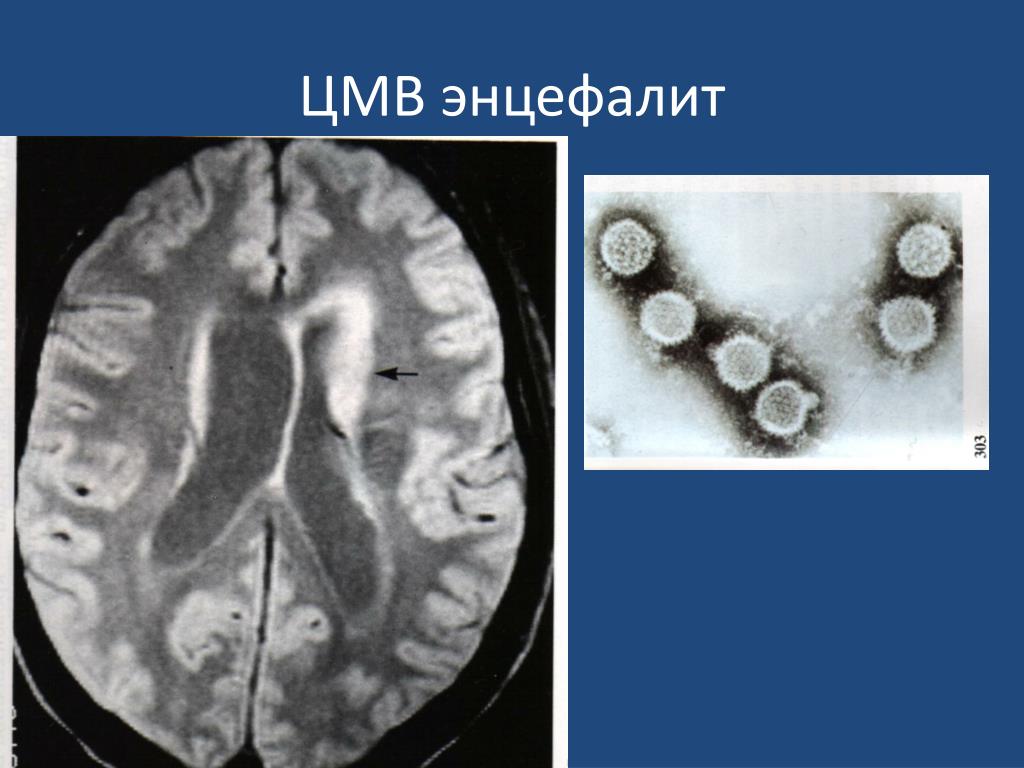 При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. Возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
При снижении иммунитета после трансплантации органов, терапии иммуносупрессорами, ВИЧ-инфекции, а также у новорожденных, ЦМВ представляет серьезную угрозу, так как заболевание может затрагивать любой орган. Возможно развитие гепатита, пневмонии, эзофагита, гастрита, колита, ретинита, диффузной энцефалопатии, лихорадки, лейкопении. Заболевание может заканчиваться летально.
Цитомегаловирусная инфекция у беременных, обследование при беременности
При первичном инфицировании беременной цитомегаловирусом (в 35-50% случаев) или реактивации инфекции в период беременности (в 8-10% случаев) развивается внутриутробная инфекция. При развитии внутриутробной инфекции на сроке до 10 недель есть риск возникновения пороков развития, возможно самопроизвольное прерывание беременности. При инфицировании на 11-28 неделе возникают задержка внутриутробного развития, гипо- или дисплазии внутренних органов. Если инфицирование происходит на более позднем сроке, поражение может быть генерализованным, захватывать определённый орган (например, фетальный гепатит) или проявляться после рождения (гипертензионно-гидроцефальный синдром, нарушения слуха, интерстициальный пневмонит и т.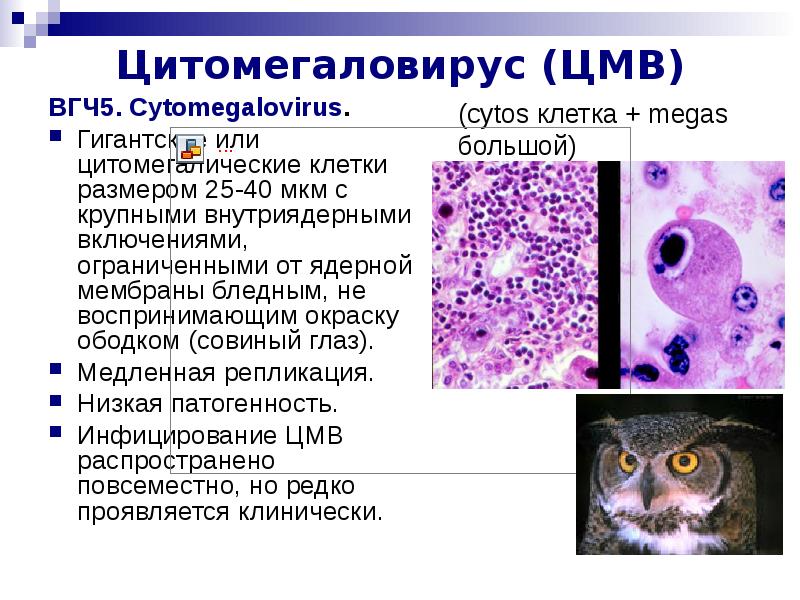 д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса. На сегодняшний момент вакцина против цитомегаловируса не разработана. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма. Полностью излечить это заболевание невозможно: нельзя удалить цитомегаловирус из организма. Но если своевременно, при малейшем подозрении на инфицирование этим вирусом, обратиться к врачу, произвести необходимые анализы, то можно долгие годы удерживать инфекцию в «спящем» состоянии. Это обеспечит нормальное вынашивание беременности и роды здорового ребёнка.
д.). Проявления инфекции также зависят от иммунитета матери, вирулентности и локализации вируса. На сегодняшний момент вакцина против цитомегаловируса не разработана. Медикаментозная терапия позволяет увеличить период ремиссии и воздействовать на рецидив инфекции, но не позволяет элиминировать вирус из организма. Полностью излечить это заболевание невозможно: нельзя удалить цитомегаловирус из организма. Но если своевременно, при малейшем подозрении на инфицирование этим вирусом, обратиться к врачу, произвести необходимые анализы, то можно долгие годы удерживать инфекцию в «спящем» состоянии. Это обеспечит нормальное вынашивание беременности и роды здорового ребёнка.
Особое значение лабораторная диагностика цитомегаловирусной инфекции имеет у следующих категорий обследуемых:
| Категория | Причины |
| Женщины, при подготовке к беременности | 1.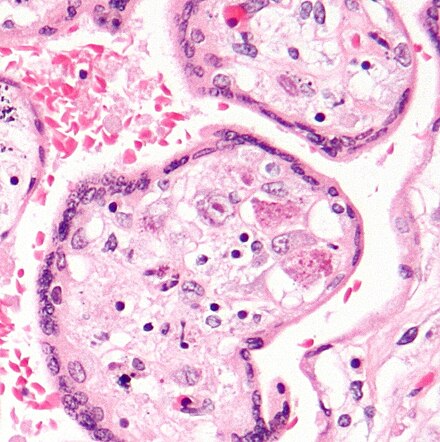 Латентное течение заболевания Латентное течение заболевания
2. Сложность дифференциальной диагностики первичного инфицирования и рецидива инфекции при обследовании во время беременности 3. Тяжёлые последствия внутриутробной инфекции у новорожденных |
| Беременные женщины | Тяжёлые последствия внутриутробной инфекции у новорожденных |
| Иммунодефицитные состояния | Генерализованные формы |
Последовательное многократное определение уровня IgG-антител у новорожденных позволяет отличить врождённое заражение (постоянный уровень) от неонатального (нарастание титров). Если титр IgG антител при повторном (через две недели) анализе не увеличивается, то причин для тревоги нет, если титр IgG растёт, следует рассмотреть вопрос об аборте.
С какой целью определяют Антитела класса G к цитомегаловирусу (Anti-CMV-IgG)
Антитела класса IgG к цитомегаловирусу – специфические иммуноглобулины, вырабатываемые в организме человека в период выраженных клинических проявлений цитомегаловирусной инфекции и являющиеся серологическим маркером этого заболевания, а также перенесенной в прошлом цитомегаловирусной инфекции.
Важно! CMV-инфекция входит в группу TORCH-инфекций (название образовано начальными буквами в латинских наименованиях – Toxoplasma, Rubella, Cytomegalovirus, Herpes), считающихся потенциально опасными для развития ребёнка.
В идеальном случае проконсультироваться с врачом и пройти лабораторное обследование на TORCH-инфекции женщине нужно за 2-3 месяца до планируемой беременности, поскольку в этом случае будет возможность предпринять соответствующие лечебные или профилактические меры, а также при необходимости в будущем сравнить полученные результаты исследований до беременности с результатами обследований во время беременности.
Что такое ЦМВ? Вирус, о котором вы никогда не слышали
Автор: Women’s Care Florida Staff
Знакомы с цитомегаловирусом (sy-toe-MEG-a-low-vy-rus)? Большинство людей нет. Тем не менее, ЦМВ — распространенный вирус. Кроме того, ежегодно от него страдают тысячи людей всех возрастов.
Что такое ЦМВ?
В соответствии с Центры по контролю и профилактике заболеваний:
- 50–80% взрослых инфицированы к 40 годам.
- Каждый третий ребенок инфицирован к пятилетнему возрасту
- Один из 150 детей рождается с врожденным ЦМВ
Узнал бы я, если бы он у меня был?
Не обязательно. Если вы никогда не слышали о вирус цитомегалии, ты не один. Национальный фонд CMV говорит, что только 9% женщин имеют. При таком высоком уровне заражения это число может показаться невероятно низким. Многие люди не знают об этом вирусе, потому что он относительно безвреден для здоровых детей и взрослых.
Симптомы и исходы
Для людей со здоровой иммунной системой вирус цитомегалии редко вызывает проблемы. Симптомы легкого заболевания включают жар, боль в горле, усталость, мышечные боли и опухшие железы. Многие принимают это за простуду или грипп. Однако, как только человек заражается, он остается в организме навсегда. Более того, он может реактивироваться и повторно заражаться различными штаммами вируса.
Для людей с ослабленной или ослабленной иммунной системой это может быть намного серьезнее. Cитомегаловирус может проявляться как болезнь, похожая на мононуклеоз. Он также может поражать определенные органы, такие как глаза, печень и желудок. В этих случаях симптомы могут включать лихорадку, пневмонию, изменения поведения, судороги, а также нарушение зрения или слепоту, а также другие важные признаки.
Не меньшее беспокойство вызывает влияние врожденного ЦМВ, как его называют, когда он заражает ребенка до рождения, на младенцев. Хотя исходы зависят от ребенка, врожденный ЦМВ может иметь стойкие и печальные результаты, включая потерю слуха, умственную отсталость, микроцефалию, церебральный паралич и проблемы с питанием.
Как избежать передачи и заражения
Поскольку ЦМВ очень легко заразиться, врачи во всем мире подчеркивают важность профилактики посредством осведомленности. Мы можем распространять его разными способами, включая сексуальный контакт и прямой контакт с биологическими жидкостями, включая слюну, мочу, слезы или грудное молоко. ЦМВ также может передаваться от матери ребенку во время беременности и от донора пациенту через трансплантированные органы и переливания крови.
ЦМВ также может передаваться от матери ребенку во время беременности и от донора пациенту через трансплантированные органы и переливания крови.
Далее вам нужно знать, что хорошая гигиена — лучшая профилактика. Тщательное и частое мытье рук, избегание совместного использования посуды или чашки, а также использование презервативов во время секса — все это помогает уменьшить распространение инфекции. Вы можете прочитать больше советов по профилактике на сайте клиники Мэйо.
Диагностика
Если у вас проявились симптомы ЦМВ или вы планируете забеременеть, простой анализ крови может определить ваше воздействие и риск. Чтобы запланировать тест, обратитесь к врачу в Women’s Care Florida.
Цитомегаловирус: симптомы, лечение и типы
Цитомегаловирус — распространенный вирус герпеса. Многие люди не знают, что у них это есть, потому что у них может не быть симптомов.
Но вирус, который остается в организме в спящем состоянии, может вызывать осложнения во время беременности и у людей с ослабленной иммунной системой.
Вирус распространяется через жидкости организма, и беременный человек может передать его еще не родившемуся ребенку.
Также известный как HCMV, CMV или человеческий герпесвирус 5 (HHV-5), цитомегаловирус является наиболее часто передающимся вирусом развивающемуся плоду.
По оценкам Центров по контролю и профилактике заболеваний (CDC), более 50% взрослого населения США заразились вирусом к 40 годам. Он одинаково влияет на мужчин и женщин в любом возрасте и независимо от этнической принадлежности.
Симптомы зависят от типа ЦМВ.
Приобретенный ЦМВ
У большинства людей с приобретенным ЦМВ нет заметных симптомов, но если симптомы все же появляются, они могут включать:
Симптомы обычно проходят через 2 недели.
Рецидивирующий ЦМВ
Симптомы рецидивирующего ЦМВ различаются в зависимости от того, какие органы поразил вирус. Скорее всего, будут поражены глаза, легкие или пищеварительная система.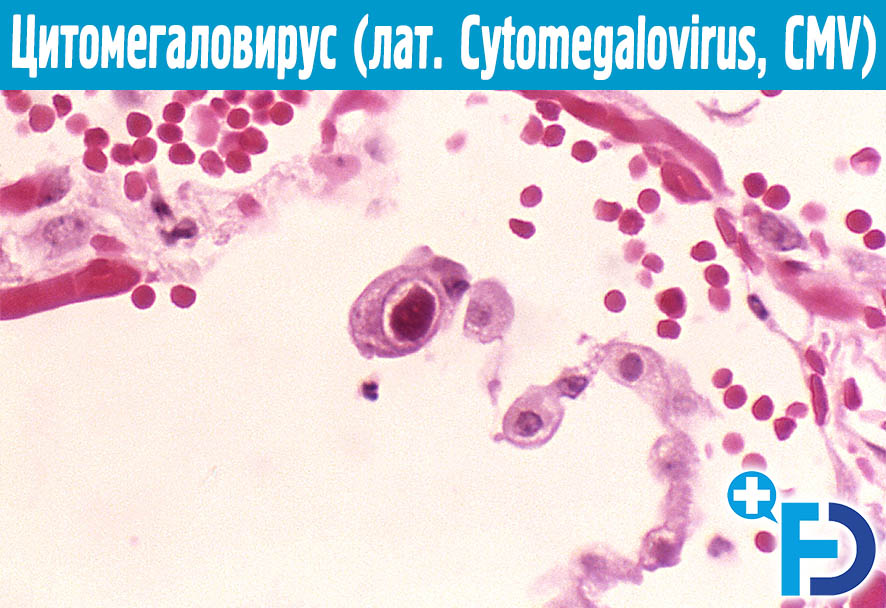
Симптомы могут включать:
- лихорадку
- диарею, язвы желудочно-кишечного тракта и желудочно-кишечное кровотечение
- одышку
- пневмонию с гипоксемией или низким содержанием кислорода в крови
- язвы во рту, которые могут быть большими
- проблемы со зрением, включая плавающие пятна, слепые пятна и помутнение зрения
- гепатит или воспаление печени с продолжительной лихорадкой
- энцефалит или воспаление мозга, ведущее к изменениям поведения, судорогам и даже коме.
Человеку с ослабленной иммунной системой, у которого наблюдается любой из этих симптомов, следует обратиться за медицинской помощью.
Врожденный ЦМВ
По данным Национального фонда ЦМВ, около 90% детей, рожденных с ЦМВ, не имеют симптомов, но у 10–15% из них разовьется потеря слуха, как правило, в течение первых 6 месяцев жизни. По степени тяжести потеря слуха варьируется от легкой до полной.
У половины этих детей вирус поражает только одно ухо, но у остальных будет потеря слуха на оба уха. Потеря слуха на оба уха может в дальнейшем привести к более высокому риску возникновения проблем с речью и общением.
Потеря слуха на оба уха может в дальнейшем привести к более высокому риску возникновения проблем с речью и общением.
Если есть симптомы врожденного ЦМВ при рождении, они могут включать:
- желтуху
- пневмонию
- пятна под кожей
- фиолетовые пятна на коже, сыпь или и то и другое
- увеличение печени
- увеличение селезенки
- низкая масса тела при рождении
- судороги
Некоторые из этих симптомов поддаются лечению.
ЦМВ влияет на мозг примерно 75% детей, рожденных с врожденным ЦМВ.Это может привести к проблемам в дальнейшей жизни.
Условия, с которыми они могут столкнуться, включают:
- аутизм
- потеря центрального зрения, рубцевание сетчатки и увеит или отек и раздражение глаза
- когнитивные трудности и трудности обучения
- глухота или частичная потеря слуха
- эпилепсия
- нарушение зрения
- проблемы с координацией движений
- припадки
- маленькая голова
Ученые ищут вакцину против ЦМВ, но пока нет лекарства.
Люди с приобретенным ЦМВ, впервые заразившиеся вирусом, могут использовать безрецептурные (OTC) обезболивающие, такие как тайленол (ацетаминофен), ибупрофен или аспирин, для облегчения симптомов и должны пить много жидкости.
Люди с врожденным или рецидивирующим ЦМВ могут использовать противовирусные препараты, такие как ганцикловир, для замедления распространения вируса.
Эти лекарства могут иметь побочные эффекты. При обширном поражении органа может потребоваться госпитализация.
Новорожденным, возможно, придется оставаться в больнице до тех пор, пока их органы не вернутся в норму.
Профилактика
Следующие меры предосторожности могут помочь снизить риск заражения ЦМВ:
- Регулярно мойте руки водой с мылом.
- Избегайте целования маленького ребенка, в том числе контакта со слезами и слюной.
- Избегайте совместного использования стаканов и кухонных принадлежностей, например, передачи напитков.
- Тщательно утилизируйте подгузники, бумажные носовые платки и подобные предметы.

- Используйте презерватив, чтобы предотвратить распространение ЦМВ через вагинальные жидкости и сперму.
CDC призывает родителей и опекунов детей с ЦМВ обращаться за лечением как можно раньше, независимо от того, принимают ли они лекарства или посещают все приемы для получения услуг, таких как проверка слуха.
Существует три основных типа ЦМВ-инфекции: приобретенная, рецидивирующая и врожденная.
- Приобретенный, или первичный, CMV — это когда человек впервые заражается вирусом.
- Рецидив CMV — это когда у человека уже есть вирус.Вирус находится в спящем состоянии, а затем становится активным из-за слабой иммунной системы.
- Врожденный ЦМВ — это когда человек заражается вирусом во время беременности и передает его плоду.
ЦМВ, как правило, не представляет проблемы, за исключением случаев, когда он поражает будущего ребенка или человека со слабой иммунной системой, например, недавно перенесшего трансплантат или человека с ВИЧ.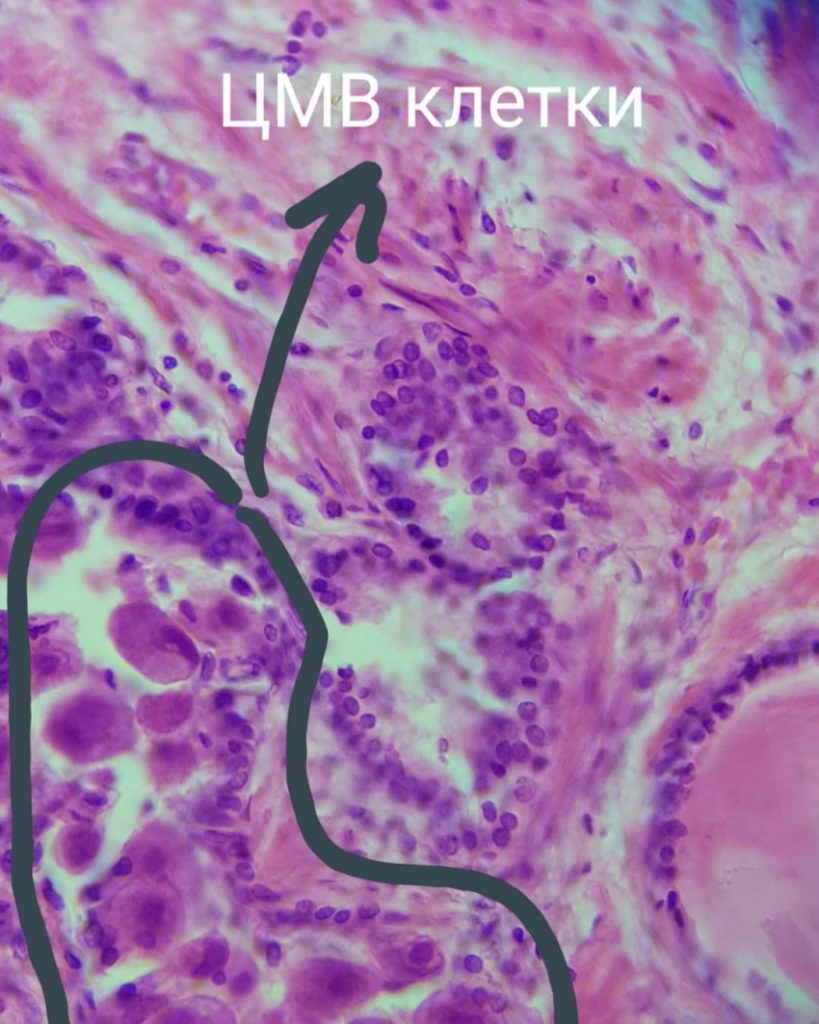
Если человек с ВИЧ заразится ЦМВ, это может привести к органной недостаточности, повреждению глаз и слепоте. В последние годы улучшение противовирусных препаратов снизило риск.
Людям, перенесшим трансплантацию органов и костного мозга, необходимо принимать иммунодепрессанты, чтобы ослабить их иммунную систему, чтобы их тела не отторгали новые органы. Спящий ЦМВ может стать активным у этих людей и привести к повреждению органов.
Реципиенты трансплантата могут получать противовирусные препараты в качестве меры предосторожности против ЦМВ.
Беременный человек может передать вирус плоду. Это называется врожденной ЦМВ.
По данным CDC, около 1 из 200 детей рождается с этим вирусом.
У большинства этих младенцев не будет никаких признаков или симптомов, но около 20% из них будут иметь симптомы или долгосрочные осложнения со здоровьем, включая трудности с обучением.
Симптомы могут быть серьезными, и они включают потерю зрения и слуха, небольшой размер головы, слабость, трудности с использованием мышц, проблемы с координацией и судороги.
Приобретенный цитомегаловирус может передаваться между людьми через жидкости организма, такие как слюна, сперма, кровь, моча, вагинальные жидкости и грудное молоко.
Человек также может заразиться вирусом, прикоснувшись к поверхности, на которой находится вирус, а затем прикоснувшись к внутренней части носа или рта.
Большинство людей заражаются вирусом в детстве, в детских садах, яслях и других местах, где дети вступают в тесный контакт друг с другом. Однако к этому возрасту иммунная система ребенка может нормально справиться с инфекцией.
Рецидив ЦМВ может возникать у людей с ослабленной иммунной системой из-за ВИЧ, трансплантации органов, химиотерапии или приема пероральных стероидов в течение более 3 месяцев.
Врожденный ЦМВ обычно возникает, когда женщина впервые заражается ЦМВ во время беременности или незадолго до зачатия.
Иногда неактивный ЦМВ может рецидивировать во время беременности, особенно если у человека ослаблена иммунная система.
Анализ крови может обнаружить антитела, которые вырабатывает организм, когда иммунная система реагирует на присутствие ЦМВ.
Беременная женщина имеет минимальный риск того, что реактивация ЦМВ может повлиять на ее развивающегося ребенка.Если врач подозревает, что у беременной есть ЦМВ, он может предложить амниоцентез. Это включает в себя извлечение образца амниотической жидкости, чтобы выяснить, присутствует ли вирус.
Если врач подозревает врожденный ЦМВ, он проверит ребенка в течение первых 3 недель жизни. Тестирование позже 3 недель не будет окончательным для врожденного ЦМВ, потому что ребенок мог заразиться вирусом после рождения.
Любой человек с ослабленной иммунной системой должен пройти тест, даже если вирус неактивен.Регулярный мониторинг осложнений ЦМВ будет включать тестирование на проблемы со зрением и слухом.
Здоровые люди редко серьезно заболевают ЦМВ.
Однако у людей с ослабленной иммунной системой может развиться ЦМВ-мононуклеоз, состояние, при котором слишком много белых кровяных телец с одним ядром.
Симптомы включают боль в горле, опухшие железы, опухшие миндалины, усталость и тошноту. Это может вызвать воспаление печени или гепатит, а также увеличение селезенки.
ЦМВ-мононуклеоз похож на классический мононуклеоз, вызываемый вирусом Эпштейна-Барра. (EBV). Мононуклеоз EBV также известен как гландулярная лихорадка.
К другим осложнениям ЦМВ относятся:
- желудочно-кишечные проблемы, включая диарею, лихорадку, боль в животе, воспаление толстой кишки и кровь в кале
- проблемы с функцией печени
- осложнения центральной нервной системы (ЦНС), такие как энцефалит или воспаление головного мозга
- пневмонит или воспаление легочной ткани.
Цитомегаловирус: симптомы, лечение и типы
Цитомегаловирус — распространенный вирус герпеса. Многие люди не знают, что у них это есть, потому что у них может не быть симптомов.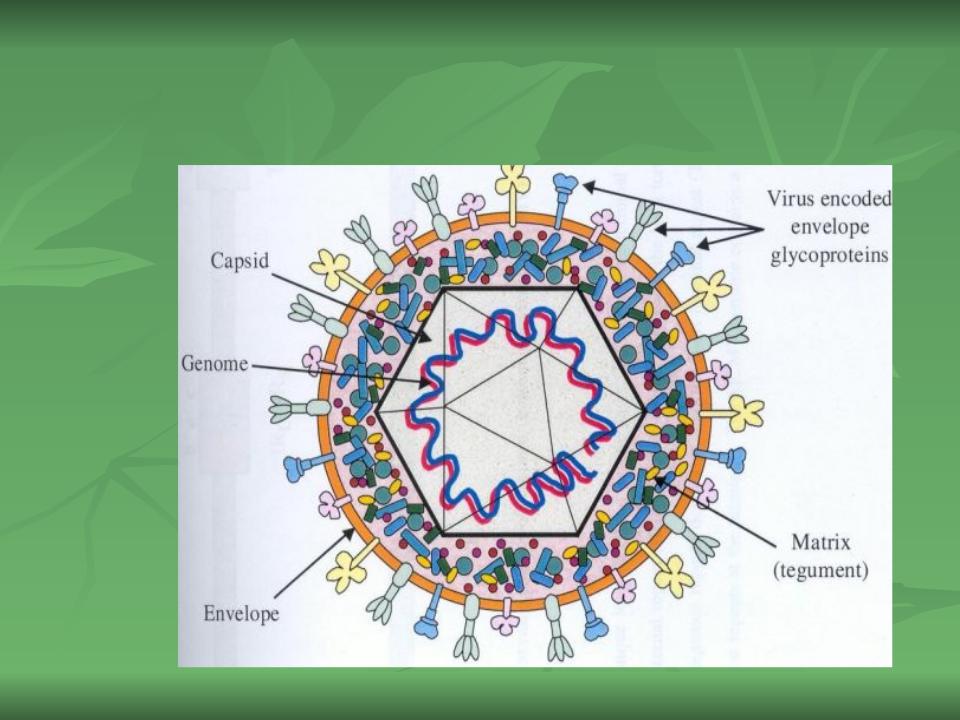
Но вирус, который остается в организме в спящем состоянии, может вызывать осложнения во время беременности и у людей с ослабленной иммунной системой.
Вирус распространяется через жидкости организма, и беременный человек может передать его еще не родившемуся ребенку.
Также известный как HCMV, CMV или человеческий герпесвирус 5 (HHV-5), цитомегаловирус является наиболее часто передающимся вирусом развивающемуся плоду.
По оценкам Центров по контролю и профилактике заболеваний (CDC), более 50% взрослого населения США заразились вирусом к 40 годам. Он одинаково влияет на мужчин и женщин в любом возрасте и независимо от этнической принадлежности.
Симптомы зависят от типа ЦМВ.
Приобретенный ЦМВ
У большинства людей с приобретенным ЦМВ нет заметных симптомов, но если симптомы все же появляются, они могут включать:
Симптомы обычно проходят через 2 недели.
Рецидивирующий ЦМВ
Симптомы рецидивирующего ЦМВ различаются в зависимости от того, какие органы поразил вирус. Скорее всего, будут поражены глаза, легкие или пищеварительная система.
Скорее всего, будут поражены глаза, легкие или пищеварительная система.
Симптомы могут включать:
- лихорадку
- диарею, язвы желудочно-кишечного тракта и желудочно-кишечное кровотечение
- одышку
- пневмонию с гипоксемией или низким содержанием кислорода в крови
- язвы во рту, которые могут быть большими
- проблемы со зрением, включая плавающие пятна, слепые пятна и помутнение зрения
- гепатит или воспаление печени с продолжительной лихорадкой
- энцефалит или воспаление мозга, ведущее к изменениям поведения, судорогам и даже коме.
Человеку с ослабленной иммунной системой, у которого наблюдается любой из этих симптомов, следует обратиться за медицинской помощью.
Врожденный ЦМВ
По данным Национального фонда ЦМВ, около 90% детей, рожденных с ЦМВ, не имеют симптомов, но у 10–15% из них разовьется потеря слуха, как правило, в течение первых 6 месяцев жизни. По степени тяжести потеря слуха варьируется от легкой до полной.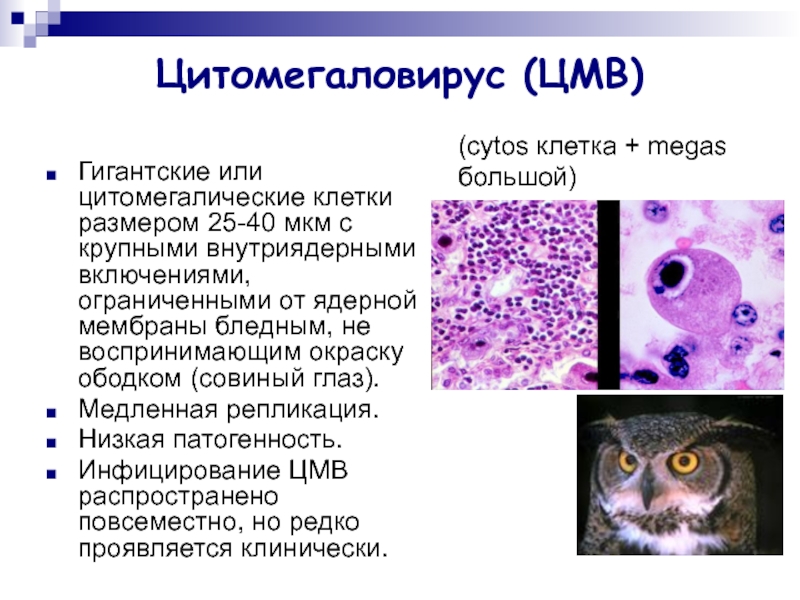
У половины этих детей вирус поражает только одно ухо, но у остальных будет потеря слуха на оба уха.Потеря слуха на оба уха может в дальнейшем привести к более высокому риску возникновения проблем с речью и общением.
Если есть симптомы врожденного ЦМВ при рождении, они могут включать:
- желтуху
- пневмонию
- пятна под кожей
- фиолетовые пятна на коже, сыпь или и то и другое
- увеличение печени
- увеличение селезенки
- низкая масса тела при рождении
- судороги
Некоторые из этих симптомов поддаются лечению.
ЦМВ влияет на мозг примерно 75% детей, рожденных с врожденным ЦМВ.Это может привести к проблемам в дальнейшей жизни.
Условия, с которыми они могут столкнуться, включают:
- аутизм
- потеря центрального зрения, рубцевание сетчатки и увеит или отек и раздражение глаза
- когнитивные трудности и трудности обучения
- глухота или частичная потеря слуха
- эпилепсия
- нарушение зрения
- проблемы с координацией движений
- припадки
- маленькая голова
Ученые ищут вакцину против ЦМВ, но пока нет лекарства.
Люди с приобретенным ЦМВ, впервые заразившиеся вирусом, могут использовать безрецептурные (OTC) обезболивающие, такие как тайленол (ацетаминофен), ибупрофен или аспирин, для облегчения симптомов и должны пить много жидкости.
Люди с врожденным или рецидивирующим ЦМВ могут использовать противовирусные препараты, такие как ганцикловир, для замедления распространения вируса.
Эти лекарства могут иметь побочные эффекты. При обширном поражении органа может потребоваться госпитализация.
Новорожденным, возможно, придется оставаться в больнице до тех пор, пока их органы не вернутся в норму.
Профилактика
Следующие меры предосторожности могут помочь снизить риск заражения ЦМВ:
- Регулярно мойте руки водой с мылом.
- Избегайте целования маленького ребенка, в том числе контакта со слезами и слюной.
- Избегайте совместного использования стаканов и кухонных принадлежностей, например, передачи напитков.
- Тщательно утилизируйте подгузники, бумажные носовые платки и подобные предметы.

- Используйте презерватив, чтобы предотвратить распространение ЦМВ через вагинальные жидкости и сперму.
CDC призывает родителей и опекунов детей с ЦМВ обращаться за лечением как можно раньше, независимо от того, принимают ли они лекарства или посещают все приемы для получения услуг, таких как проверка слуха.
Существует три основных типа ЦМВ-инфекции: приобретенная, рецидивирующая и врожденная.
- Приобретенный, или первичный, CMV — это когда человек впервые заражается вирусом.
- Рецидив CMV — это когда у человека уже есть вирус.Вирус находится в спящем состоянии, а затем становится активным из-за слабой иммунной системы.
- Врожденный ЦМВ — это когда человек заражается вирусом во время беременности и передает его плоду.
ЦМВ, как правило, не представляет проблемы, за исключением случаев, когда он поражает будущего ребенка или человека со слабой иммунной системой, например, недавно перенесшего трансплантат или человека с ВИЧ.
Если человек с ВИЧ заразится ЦМВ, это может привести к органной недостаточности, повреждению глаз и слепоте. В последние годы улучшение противовирусных препаратов снизило риск.
Людям, перенесшим трансплантацию органов и костного мозга, необходимо принимать иммунодепрессанты, чтобы ослабить их иммунную систему, чтобы их тела не отторгали новые органы. Спящий ЦМВ может стать активным у этих людей и привести к повреждению органов.
Реципиенты трансплантата могут получать противовирусные препараты в качестве меры предосторожности против ЦМВ.
Беременный человек может передать вирус плоду. Это называется врожденной ЦМВ.
По данным CDC, около 1 из 200 детей рождается с этим вирусом.
У большинства этих младенцев не будет никаких признаков или симптомов, но около 20% из них будут иметь симптомы или долгосрочные осложнения со здоровьем, включая трудности с обучением.
Симптомы могут быть серьезными, и они включают потерю зрения и слуха, небольшой размер головы, слабость, трудности с использованием мышц, проблемы с координацией и судороги.
Приобретенный цитомегаловирус может передаваться между людьми через жидкости организма, такие как слюна, сперма, кровь, моча, вагинальные жидкости и грудное молоко.
Человек также может заразиться вирусом, прикоснувшись к поверхности, на которой находится вирус, а затем прикоснувшись к внутренней части носа или рта.
Большинство людей заражаются вирусом в детстве, в детских садах, яслях и других местах, где дети вступают в тесный контакт друг с другом. Однако к этому возрасту иммунная система ребенка может нормально справиться с инфекцией.
Рецидив ЦМВ может возникать у людей с ослабленной иммунной системой из-за ВИЧ, трансплантации органов, химиотерапии или приема пероральных стероидов в течение более 3 месяцев.
Врожденный ЦМВ обычно возникает, когда женщина впервые заражается ЦМВ во время беременности или незадолго до зачатия.
Иногда неактивный ЦМВ может рецидивировать во время беременности, особенно если у человека ослаблена иммунная система.
Анализ крови может обнаружить антитела, которые вырабатывает организм, когда иммунная система реагирует на присутствие ЦМВ.
Беременная женщина имеет минимальный риск того, что реактивация ЦМВ может повлиять на ее развивающегося ребенка.Если врач подозревает, что у беременной есть ЦМВ, он может предложить амниоцентез. Это включает в себя извлечение образца амниотической жидкости, чтобы выяснить, присутствует ли вирус.
Если врач подозревает врожденный ЦМВ, он проверит ребенка в течение первых 3 недель жизни. Тестирование позже 3 недель не будет окончательным для врожденного ЦМВ, потому что ребенок мог заразиться вирусом после рождения.
Любой человек с ослабленной иммунной системой должен пройти тест, даже если вирус неактивен.Регулярный мониторинг осложнений ЦМВ будет включать тестирование на проблемы со зрением и слухом.
Здоровые люди редко серьезно заболевают ЦМВ.
Однако у людей с ослабленной иммунной системой может развиться ЦМВ-мононуклеоз, состояние, при котором слишком много белых кровяных телец с одним ядром.
Симптомы включают боль в горле, опухшие железы, опухшие миндалины, усталость и тошноту. Это может вызвать воспаление печени или гепатит, а также увеличение селезенки.
ЦМВ-мононуклеоз похож на классический мононуклеоз, вызываемый вирусом Эпштейна-Барра. (EBV). Мононуклеоз EBV также известен как гландулярная лихорадка.
К другим осложнениям ЦМВ относятся:
- желудочно-кишечные проблемы, включая диарею, лихорадку, боль в животе, воспаление толстой кишки и кровь в кале
- проблемы с функцией печени
- осложнения центральной нервной системы (ЦНС), такие как энцефалит или воспаление головного мозга
- пневмонит или воспаление легочной ткани.
Цитомегаловирус: симптомы, лечение и типы
Цитомегаловирус — распространенный вирус герпеса. Многие люди не знают, что у них это есть, потому что у них может не быть симптомов.
Но вирус, который остается в организме в спящем состоянии, может вызывать осложнения во время беременности и у людей с ослабленной иммунной системой.
Вирус распространяется через жидкости организма, и беременный человек может передать его еще не родившемуся ребенку.
Также известный как HCMV, CMV или человеческий герпесвирус 5 (HHV-5), цитомегаловирус является наиболее часто передающимся вирусом развивающемуся плоду.
По оценкам Центров по контролю и профилактике заболеваний (CDC), более 50% взрослого населения США заразились вирусом к 40 годам. Он одинаково влияет на мужчин и женщин в любом возрасте и независимо от этнической принадлежности.
Симптомы зависят от типа ЦМВ.
Приобретенный ЦМВ
У большинства людей с приобретенным ЦМВ нет заметных симптомов, но если симптомы все же появляются, они могут включать:
Симптомы обычно проходят через 2 недели.
Рецидивирующий ЦМВ
Симптомы рецидивирующего ЦМВ различаются в зависимости от того, какие органы поразил вирус. Скорее всего, будут поражены глаза, легкие или пищеварительная система.
Скорее всего, будут поражены глаза, легкие или пищеварительная система.
Симптомы могут включать:
- лихорадку
- диарею, язвы желудочно-кишечного тракта и желудочно-кишечное кровотечение
- одышку
- пневмонию с гипоксемией или низким содержанием кислорода в крови
- язвы во рту, которые могут быть большими
- проблемы со зрением, включая плавающие пятна, слепые пятна и помутнение зрения
- гепатит или воспаление печени с продолжительной лихорадкой
- энцефалит или воспаление мозга, ведущее к изменениям поведения, судорогам и даже коме.
Человеку с ослабленной иммунной системой, у которого наблюдается любой из этих симптомов, следует обратиться за медицинской помощью.
Врожденный ЦМВ
По данным Национального фонда ЦМВ, около 90% детей, рожденных с ЦМВ, не имеют симптомов, но у 10–15% из них разовьется потеря слуха, как правило, в течение первых 6 месяцев жизни. По степени тяжести потеря слуха варьируется от легкой до полной.
У половины этих детей вирус поражает только одно ухо, но у остальных будет потеря слуха на оба уха.Потеря слуха на оба уха может в дальнейшем привести к более высокому риску возникновения проблем с речью и общением.
Если есть симптомы врожденного ЦМВ при рождении, они могут включать:
- желтуху
- пневмонию
- пятна под кожей
- фиолетовые пятна на коже, сыпь или и то и другое
- увеличение печени
- увеличение селезенки
- низкая масса тела при рождении
- судороги
Некоторые из этих симптомов поддаются лечению.
ЦМВ влияет на мозг примерно 75% детей, рожденных с врожденным ЦМВ.Это может привести к проблемам в дальнейшей жизни.
Условия, с которыми они могут столкнуться, включают:
- аутизм
- потеря центрального зрения, рубцевание сетчатки и увеит или отек и раздражение глаза
- когнитивные трудности и трудности обучения
- глухота или частичная потеря слуха
- эпилепсия
- нарушение зрения
- проблемы с координацией движений
- припадки
- маленькая голова
Ученые ищут вакцину против ЦМВ, но пока нет лекарства.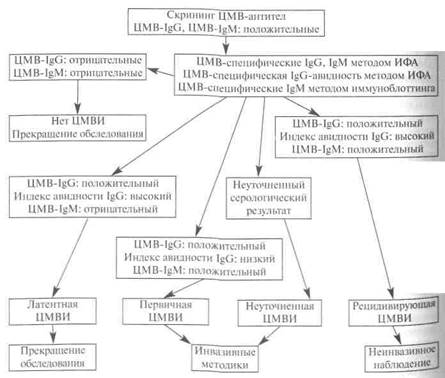
Люди с приобретенным ЦМВ, впервые заразившиеся вирусом, могут использовать безрецептурные (OTC) обезболивающие, такие как тайленол (ацетаминофен), ибупрофен или аспирин, для облегчения симптомов и должны пить много жидкости.
Люди с врожденным или рецидивирующим ЦМВ могут использовать противовирусные препараты, такие как ганцикловир, для замедления распространения вируса.
Эти лекарства могут иметь побочные эффекты. При обширном поражении органа может потребоваться госпитализация.
Новорожденным, возможно, придется оставаться в больнице до тех пор, пока их органы не вернутся в норму.
Профилактика
Следующие меры предосторожности могут помочь снизить риск заражения ЦМВ:
- Регулярно мойте руки водой с мылом.
- Избегайте целования маленького ребенка, в том числе контакта со слезами и слюной.
- Избегайте совместного использования стаканов и кухонных принадлежностей, например, передачи напитков.
- Тщательно утилизируйте подгузники, бумажные носовые платки и подобные предметы.

- Используйте презерватив, чтобы предотвратить распространение ЦМВ через вагинальные жидкости и сперму.
CDC призывает родителей и опекунов детей с ЦМВ обращаться за лечением как можно раньше, независимо от того, принимают ли они лекарства или посещают все приемы для получения услуг, таких как проверка слуха.
Существует три основных типа ЦМВ-инфекции: приобретенная, рецидивирующая и врожденная.
- Приобретенный, или первичный, CMV — это когда человек впервые заражается вирусом.
- Рецидив CMV — это когда у человека уже есть вирус.Вирус находится в спящем состоянии, а затем становится активным из-за слабой иммунной системы.
- Врожденный ЦМВ — это когда человек заражается вирусом во время беременности и передает его плоду.
ЦМВ, как правило, не представляет проблемы, за исключением случаев, когда он поражает будущего ребенка или человека со слабой иммунной системой, например, недавно перенесшего трансплантат или человека с ВИЧ.
Если человек с ВИЧ заразится ЦМВ, это может привести к органной недостаточности, повреждению глаз и слепоте. В последние годы улучшение противовирусных препаратов снизило риск.
Людям, перенесшим трансплантацию органов и костного мозга, необходимо принимать иммунодепрессанты, чтобы ослабить их иммунную систему, чтобы их тела не отторгали новые органы. Спящий ЦМВ может стать активным у этих людей и привести к повреждению органов.
Реципиенты трансплантата могут получать противовирусные препараты в качестве меры предосторожности против ЦМВ.
Беременный человек может передать вирус плоду. Это называется врожденной ЦМВ.
По данным CDC, около 1 из 200 детей рождается с этим вирусом.
У большинства этих младенцев не будет никаких признаков или симптомов, но около 20% из них будут иметь симптомы или долгосрочные осложнения со здоровьем, включая трудности с обучением.
Симптомы могут быть серьезными, и они включают потерю зрения и слуха, небольшой размер головы, слабость, трудности с использованием мышц, проблемы с координацией и судороги.
Приобретенный цитомегаловирус может передаваться между людьми через жидкости организма, такие как слюна, сперма, кровь, моча, вагинальные жидкости и грудное молоко.
Человек также может заразиться вирусом, прикоснувшись к поверхности, на которой находится вирус, а затем прикоснувшись к внутренней части носа или рта.
Большинство людей заражаются вирусом в детстве, в детских садах, яслях и других местах, где дети вступают в тесный контакт друг с другом. Однако к этому возрасту иммунная система ребенка может нормально справиться с инфекцией.
Рецидив ЦМВ может возникать у людей с ослабленной иммунной системой из-за ВИЧ, трансплантации органов, химиотерапии или приема пероральных стероидов в течение более 3 месяцев.
Врожденный ЦМВ обычно возникает, когда женщина впервые заражается ЦМВ во время беременности или незадолго до зачатия.
Иногда неактивный ЦМВ может рецидивировать во время беременности, особенно если у человека ослаблена иммунная система.
Анализ крови может обнаружить антитела, которые вырабатывает организм, когда иммунная система реагирует на присутствие ЦМВ.
Беременная женщина имеет минимальный риск того, что реактивация ЦМВ может повлиять на ее развивающегося ребенка.Если врач подозревает, что у беременной есть ЦМВ, он может предложить амниоцентез. Это включает в себя извлечение образца амниотической жидкости, чтобы выяснить, присутствует ли вирус.
Если врач подозревает врожденный ЦМВ, он проверит ребенка в течение первых 3 недель жизни. Тестирование позже 3 недель не будет окончательным для врожденного ЦМВ, потому что ребенок мог заразиться вирусом после рождения.
Любой человек с ослабленной иммунной системой должен пройти тест, даже если вирус неактивен.Регулярный мониторинг осложнений ЦМВ будет включать тестирование на проблемы со зрением и слухом.
Здоровые люди редко серьезно заболевают ЦМВ.
Однако у людей с ослабленной иммунной системой может развиться ЦМВ-мононуклеоз, состояние, при котором слишком много белых кровяных телец с одним ядром.
Симптомы включают боль в горле, опухшие железы, опухшие миндалины, усталость и тошноту. Это может вызвать воспаление печени или гепатит, а также увеличение селезенки.
ЦМВ-мононуклеоз похож на классический мононуклеоз, вызываемый вирусом Эпштейна-Барра. (EBV). Мононуклеоз EBV также известен как гландулярная лихорадка.
К другим осложнениям ЦМВ относятся:
- желудочно-кишечные проблемы, включая диарею, лихорадку, боль в животе, воспаление толстой кишки и кровь в кале
- проблемы с функцией печени
- осложнения центральной нервной системы (ЦНС), такие как энцефалит или воспаление головного мозга
- пневмонит или воспаление легочной ткани.
Цитомегаловирус: симптомы, лечение и типы
Цитомегаловирус — распространенный вирус герпеса. Многие люди не знают, что у них это есть, потому что у них может не быть симптомов.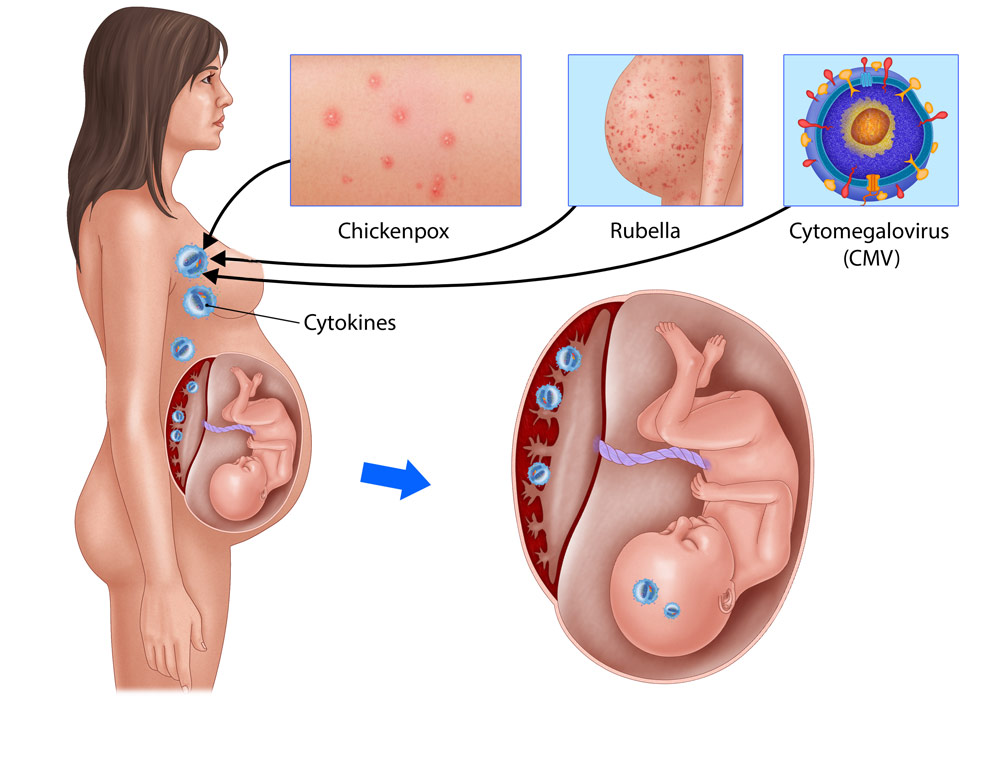
Но вирус, который остается в организме в спящем состоянии, может вызывать осложнения во время беременности и у людей с ослабленной иммунной системой.
Вирус распространяется через жидкости организма, и беременный человек может передать его еще не родившемуся ребенку.
Также известный как HCMV, CMV или человеческий герпесвирус 5 (HHV-5), цитомегаловирус является наиболее часто передающимся вирусом развивающемуся плоду.
По оценкам Центров по контролю и профилактике заболеваний (CDC), более 50% взрослого населения США заразились вирусом к 40 годам. Он одинаково влияет на мужчин и женщин в любом возрасте и независимо от этнической принадлежности.
Симптомы зависят от типа ЦМВ.
Приобретенный ЦМВ
У большинства людей с приобретенным ЦМВ нет заметных симптомов, но если симптомы все же появляются, они могут включать:
Симптомы обычно проходят через 2 недели.
Рецидивирующий ЦМВ
Симптомы рецидивирующего ЦМВ различаются в зависимости от того, какие органы поразил вирус. Скорее всего, будут поражены глаза, легкие или пищеварительная система.
Скорее всего, будут поражены глаза, легкие или пищеварительная система.
Симптомы могут включать:
- лихорадку
- диарею, язвы желудочно-кишечного тракта и желудочно-кишечное кровотечение
- одышку
- пневмонию с гипоксемией или низким содержанием кислорода в крови
- язвы во рту, которые могут быть большими
- проблемы со зрением, включая плавающие пятна, слепые пятна и помутнение зрения
- гепатит или воспаление печени с продолжительной лихорадкой
- энцефалит или воспаление мозга, ведущее к изменениям поведения, судорогам и даже коме.
Человеку с ослабленной иммунной системой, у которого наблюдается любой из этих симптомов, следует обратиться за медицинской помощью.
Врожденный ЦМВ
По данным Национального фонда ЦМВ, около 90% детей, рожденных с ЦМВ, не имеют симптомов, но у 10–15% из них разовьется потеря слуха, как правило, в течение первых 6 месяцев жизни. По степени тяжести потеря слуха варьируется от легкой до полной.
У половины этих детей вирус поражает только одно ухо, но у остальных будет потеря слуха на оба уха.Потеря слуха на оба уха может в дальнейшем привести к более высокому риску возникновения проблем с речью и общением.
Если есть симптомы врожденного ЦМВ при рождении, они могут включать:
- желтуху
- пневмонию
- пятна под кожей
- фиолетовые пятна на коже, сыпь или и то и другое
- увеличение печени
- увеличение селезенки
- низкая масса тела при рождении
- судороги
Некоторые из этих симптомов поддаются лечению.
ЦМВ влияет на мозг примерно 75% детей, рожденных с врожденным ЦМВ.Это может привести к проблемам в дальнейшей жизни.
Условия, с которыми они могут столкнуться, включают:
- аутизм
- потеря центрального зрения, рубцевание сетчатки и увеит или отек и раздражение глаза
- когнитивные трудности и трудности обучения
- глухота или частичная потеря слуха
- эпилепсия
- нарушение зрения
- проблемы с координацией движений
- припадки
- маленькая голова
Ученые ищут вакцину против ЦМВ, но пока нет лекарства.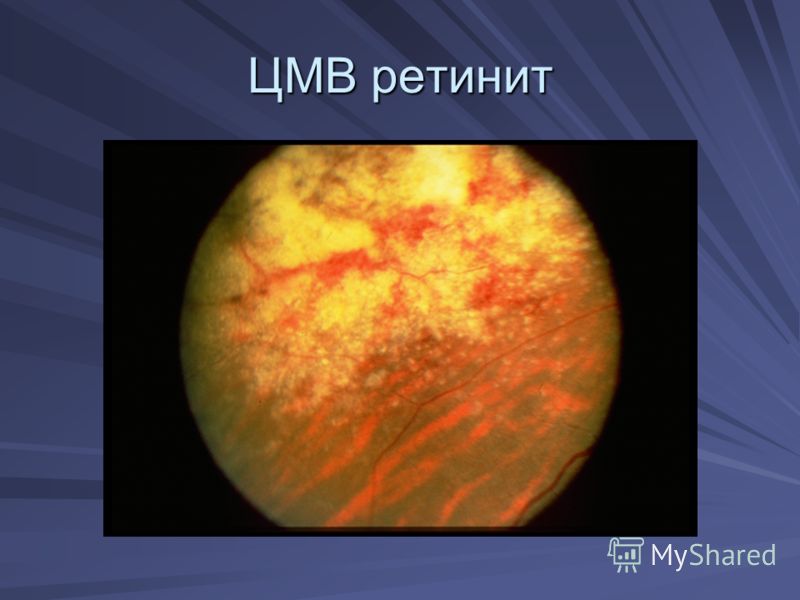
Люди с приобретенным ЦМВ, впервые заразившиеся вирусом, могут использовать безрецептурные (OTC) обезболивающие, такие как тайленол (ацетаминофен), ибупрофен или аспирин, для облегчения симптомов и должны пить много жидкости.
Люди с врожденным или рецидивирующим ЦМВ могут использовать противовирусные препараты, такие как ганцикловир, для замедления распространения вируса.
Эти лекарства могут иметь побочные эффекты. При обширном поражении органа может потребоваться госпитализация.
Новорожденным, возможно, придется оставаться в больнице до тех пор, пока их органы не вернутся в норму.
Профилактика
Следующие меры предосторожности могут помочь снизить риск заражения ЦМВ:
- Регулярно мойте руки водой с мылом.
- Избегайте целования маленького ребенка, в том числе контакта со слезами и слюной.
- Избегайте совместного использования стаканов и кухонных принадлежностей, например, передачи напитков.
- Тщательно утилизируйте подгузники, бумажные носовые платки и подобные предметы.

- Используйте презерватив, чтобы предотвратить распространение ЦМВ через вагинальные жидкости и сперму.
CDC призывает родителей и опекунов детей с ЦМВ обращаться за лечением как можно раньше, независимо от того, принимают ли они лекарства или посещают все приемы для получения услуг, таких как проверка слуха.
Существует три основных типа ЦМВ-инфекции: приобретенная, рецидивирующая и врожденная.
- Приобретенный, или первичный, CMV — это когда человек впервые заражается вирусом.
- Рецидив CMV — это когда у человека уже есть вирус.Вирус находится в спящем состоянии, а затем становится активным из-за слабой иммунной системы.
- Врожденный ЦМВ — это когда человек заражается вирусом во время беременности и передает его плоду.
ЦМВ, как правило, не представляет проблемы, за исключением случаев, когда он поражает будущего ребенка или человека со слабой иммунной системой, например, недавно перенесшего трансплантат или человека с ВИЧ.
Если человек с ВИЧ заразится ЦМВ, это может привести к органной недостаточности, повреждению глаз и слепоте. В последние годы улучшение противовирусных препаратов снизило риск.
Людям, перенесшим трансплантацию органов и костного мозга, необходимо принимать иммунодепрессанты, чтобы ослабить их иммунную систему, чтобы их тела не отторгали новые органы. Спящий ЦМВ может стать активным у этих людей и привести к повреждению органов.
Реципиенты трансплантата могут получать противовирусные препараты в качестве меры предосторожности против ЦМВ.
Беременный человек может передать вирус плоду. Это называется врожденной ЦМВ.
По данным CDC, около 1 из 200 детей рождается с этим вирусом.
У большинства этих младенцев не будет никаких признаков или симптомов, но около 20% из них будут иметь симптомы или долгосрочные осложнения со здоровьем, включая трудности с обучением.
Симптомы могут быть серьезными, и они включают потерю зрения и слуха, небольшой размер головы, слабость, трудности с использованием мышц, проблемы с координацией и судороги.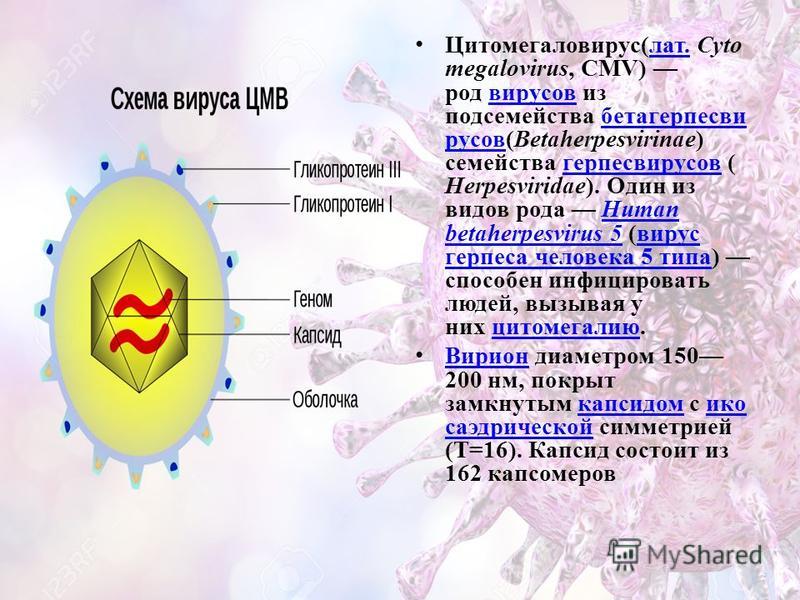
Приобретенный цитомегаловирус может передаваться между людьми через жидкости организма, такие как слюна, сперма, кровь, моча, вагинальные жидкости и грудное молоко.
Человек также может заразиться вирусом, прикоснувшись к поверхности, на которой находится вирус, а затем прикоснувшись к внутренней части носа или рта.
Большинство людей заражаются вирусом в детстве, в детских садах, яслях и других местах, где дети вступают в тесный контакт друг с другом. Однако к этому возрасту иммунная система ребенка может нормально справиться с инфекцией.
Рецидив ЦМВ может возникать у людей с ослабленной иммунной системой из-за ВИЧ, трансплантации органов, химиотерапии или приема пероральных стероидов в течение более 3 месяцев.
Врожденный ЦМВ обычно возникает, когда женщина впервые заражается ЦМВ во время беременности или незадолго до зачатия.
Иногда неактивный ЦМВ может рецидивировать во время беременности, особенно если у человека ослаблена иммунная система.
Анализ крови может обнаружить антитела, которые вырабатывает организм, когда иммунная система реагирует на присутствие ЦМВ.
Беременная женщина имеет минимальный риск того, что реактивация ЦМВ может повлиять на ее развивающегося ребенка.Если врач подозревает, что у беременной есть ЦМВ, он может предложить амниоцентез. Это включает в себя извлечение образца амниотической жидкости, чтобы выяснить, присутствует ли вирус.
Если врач подозревает врожденный ЦМВ, он проверит ребенка в течение первых 3 недель жизни. Тестирование позже 3 недель не будет окончательным для врожденного ЦМВ, потому что ребенок мог заразиться вирусом после рождения.
Любой человек с ослабленной иммунной системой должен пройти тест, даже если вирус неактивен.Регулярный мониторинг осложнений ЦМВ будет включать тестирование на проблемы со зрением и слухом.
Здоровые люди редко серьезно заболевают ЦМВ.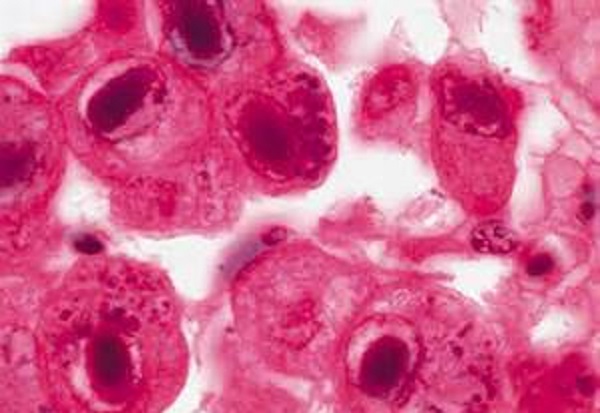
Однако у людей с ослабленной иммунной системой может развиться ЦМВ-мононуклеоз, состояние, при котором слишком много белых кровяных телец с одним ядром.
Симптомы включают боль в горле, опухшие железы, опухшие миндалины, усталость и тошноту. Это может вызвать воспаление печени или гепатит, а также увеличение селезенки.
ЦМВ-мононуклеоз похож на классический мононуклеоз, вызываемый вирусом Эпштейна-Барра. (EBV). Мононуклеоз EBV также известен как гландулярная лихорадка.
К другим осложнениям ЦМВ относятся:
- желудочно-кишечные проблемы, включая диарею, лихорадку, боль в животе, воспаление толстой кишки и кровь в кале
- проблемы с функцией печени
- осложнения центральной нервной системы (ЦНС), такие как энцефалит или воспаление головного мозга
- пневмонит или воспаление легочной ткани.
Цитомегаловирус человека — обзор
Клинические признаки и патология
Инфекция HCMV у иммунокомпетентного хозяина обычно клинически не протекает. Небольшой процент мононуклеоза возникает из-за HCMV, который обычно менее серьезен, чем вызванный вирусом Эпштейна-Барра. Тяжелое или системное заболевание HCMV, поражающее один или несколько органов, встречается только у хозяев с ослабленным иммунитетом и, как известно, выявляет основной иммунодефицит у людей с ранее нераспознанным иммунодефицитом.
Небольшой процент мононуклеоза возникает из-за HCMV, который обычно менее серьезен, чем вызванный вирусом Эпштейна-Барра. Тяжелое или системное заболевание HCMV, поражающее один или несколько органов, встречается только у хозяев с ослабленным иммунитетом и, как известно, выявляет основной иммунодефицит у людей с ранее нераспознанным иммунодефицитом.
Врожденное заболевание является отличительной чертой патогенеза HCMV и следует за трансплацентарной передачей к плоду в любое время во время беременности и представляет особый риск для женщины с первичной инфекцией. Врожденное заболевание остается наиболее серьезной проблемой для здоровья и здоровья населения, вызывающей гепатит В, и его трудно идентифицировать, поскольку первичная инфекция обычно протекает бессимптомно. Значительно более низкая частота врожденных заболеваний после рецидивов по сравнению с первичной материнской инфекцией во время беременности является ключевым доказательством того, что всеобщая вакцинация принесет пользу населению.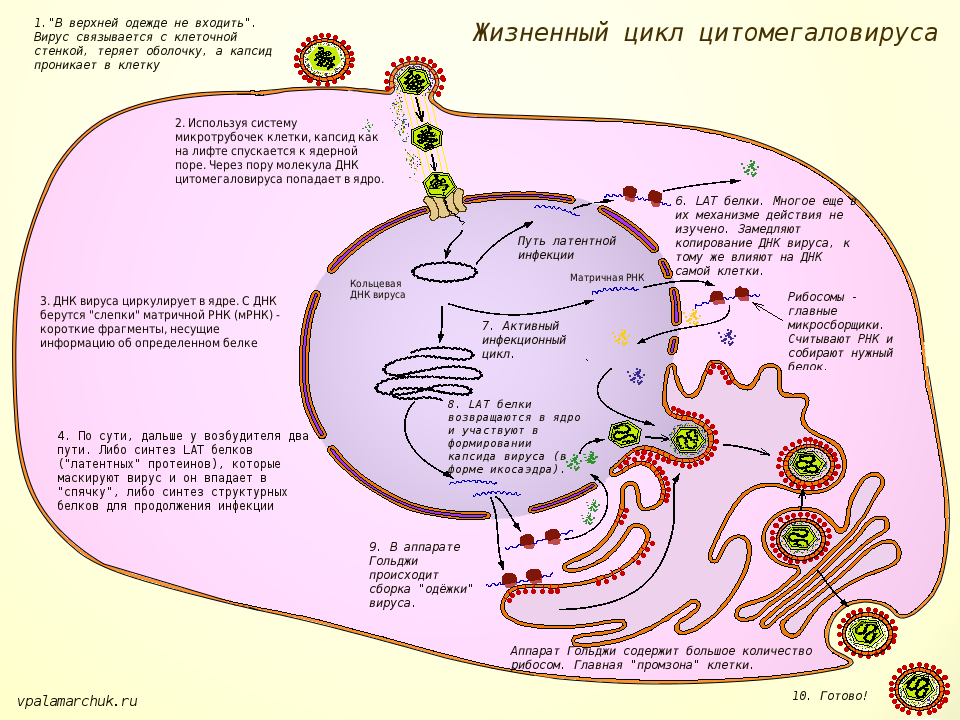 Кроме того, первичная инфекция в более раннем гестационном возрасте чаще всего проявляется как заболевание у новорожденного. Заболевание HCMV, выявленное при рождении, часто отражает повреждение нейронов (потеря слуха, ретинит, неврит зрительного нерва, микроцефалия или энцефалопатия), а также повреждение ретикулоэндотелиальной системы (гепатомегалия, спленомегалия, петехии или желтуха). Недоношенность и слабый внутриутробный рост являются обычным явлением среди новорожденных с симптоматической врожденной инфекцией HCMV. Хотя у большинства инфицированных новорожденных отсутствуют симптомы при рождении, у некоторых все еще развиваются осложнения, особенно нейросенсорная потеря слуха, в течение первых нескольких лет жизни.Большинство новорожденных с врожденной инфекцией HCMV, даже серьезно пострадавшие при рождении, выживают; врожденная инфекция HCMV сказывается на слухе, зрении и умственных способностях.
Кроме того, первичная инфекция в более раннем гестационном возрасте чаще всего проявляется как заболевание у новорожденного. Заболевание HCMV, выявленное при рождении, часто отражает повреждение нейронов (потеря слуха, ретинит, неврит зрительного нерва, микроцефалия или энцефалопатия), а также повреждение ретикулоэндотелиальной системы (гепатомегалия, спленомегалия, петехии или желтуха). Недоношенность и слабый внутриутробный рост являются обычным явлением среди новорожденных с симптоматической врожденной инфекцией HCMV. Хотя у большинства инфицированных новорожденных отсутствуют симптомы при рождении, у некоторых все еще развиваются осложнения, особенно нейросенсорная потеря слуха, в течение первых нескольких лет жизни.Большинство новорожденных с врожденной инфекцией HCMV, даже серьезно пострадавшие при рождении, выживают; врожденная инфекция HCMV сказывается на слухе, зрении и умственных способностях.
Недоношенные дети с очень низкой массой тела при рождении, заразившиеся HCMV во время родов или послеродового периода (через грудное молоко или переливание крови), могут развить системное заболевание, отличное от обычных врожденных заболеваний. Факторы риска включают очень низкий вес при рождении, воздействие нескольких единиц крови и рождение от серонегативной матери (отсутствие пассивного иммунитета).Заболевание, связанное с переливанием крови, HCMV у новорожденных контролируется с помощью серонегативных (или обедненных лейкоцитами) продуктов крови. Вопрос о том, следует ли предотвращать передачу HCMV от материнского молока недоношенному новорожденному с очень низкой массой тела при рождении, остается предметом споров.
Факторы риска включают очень низкий вес при рождении, воздействие нескольких единиц крови и рождение от серонегативной матери (отсутствие пассивного иммунитета).Заболевание, связанное с переливанием крови, HCMV у новорожденных контролируется с помощью серонегативных (или обедненных лейкоцитами) продуктов крови. Вопрос о том, следует ли предотвращать передачу HCMV от материнского молока недоношенному новорожденному с очень низкой массой тела при рождении, остается предметом споров.
HCMV стал одним из наиболее распространенных условно-патогенных микроорганизмов по мере роста трансплантации аллотрансплантата и распространения эпидемии СПИДа. Все реципиенты аллотрансплантата твердых органов и гемопоэтических клеток получают сильную посттрансплантационную иммуносупрессивную терапию, и пациенты со СПИДом прогрессируют до дефицита Т-лимфоцитов, который дает возможность HCMV воспроизводиться до высоких уровней и вызывать заболевание.Активное заражение возникает в результате первичного заражения наивных людей, повторного заражения дополнительными штаммами вируса и реактивации латентного вируса. Этот аспект патогенеза заболевания сложен, потому что выделение HCMV и виремия являются обычными явлениями при нарушении клеточного иммунитета, даже если HCMV отсутствует. Клинически бессимптомная инфекция HCMV может преобладать даже при противовирусной профилактике и может прогрессировать только до заболевания, поскольку иммунный надзор, опосредованный Т-клетками, становится серьезно нарушенным, как это происходит у пациентов со СПИДом с очень низким числом Т-лимфоцитов CD4.
Этот аспект патогенеза заболевания сложен, потому что выделение HCMV и виремия являются обычными явлениями при нарушении клеточного иммунитета, даже если HCMV отсутствует. Клинически бессимптомная инфекция HCMV может преобладать даже при противовирусной профилактике и может прогрессировать только до заболевания, поскольку иммунный надзор, опосредованный Т-клетками, становится серьезно нарушенным, как это происходит у пациентов со СПИДом с очень низким числом Т-лимфоцитов CD4.
Клинические проявления болезни у пациентов с трансплантацией солидных органов включают системное лихорадочное заболевание (ЦМВ-синдром с недомоганием, артралгией и сыпью; нейтропения, тромбоцитопения и повышенные ферменты печени), а также прямое или косвенное воздействие на определенные органы. Риск этого заболевания был снижен, но не устранен упреждающей терапией или профилактикой противовирусными препаратами. Клиническое обнаружение инфекции с использованием анализов на вирусные антигены или нуклеиновые кислоты без необходимости культивирования вируса успешно снизило частоту острого заболевания HCMV в первые несколько недель после трансплантации. Превентивная терапия оказалась полезной для других пациентов с высоким риском, таких как трансплантация аллогенной крови и костного мозга (гемопоэтических клеток), где более поздние проявления заболевания и косвенные эффекты стали более заметными. Обнаружение антигенов HCMV (обычно антигенемия pp65) или нуклеиновых кислот (обычно обнаружение вирусной ДНК в плазме или лейкоцитах с помощью ПЦР) в крови используется для вовлечения этого вируса в заболевание. У реципиентов трансплантата твердых органов может развиться пневмонит, вызванный HCMV, или поражения желудочно-кишечного тракта, гепатит, ретинит, панкреатит, миокардит и, в редких случаях, энцефалит или периферическая невропатия, тогда как у реципиентов трансплантата гемопоэтических клеток может развиться пневмонит HCMV или желудочно-кишечные заболевания.Установление этиологической роли HCMV требует обнаружения вируса в пораженной ткани или бронхоальвеолярного лаважа или количественного определения HCMV в крови или плазме. Основные косвенные эффекты HCMV, особенно при трансплантации твердых органов, включают отторжение аллотрансплантата, осложнения сосудистых заболеваний и повышенный риск условно-патогенных грибковых и бактериальных инфекций.
Превентивная терапия оказалась полезной для других пациентов с высоким риском, таких как трансплантация аллогенной крови и костного мозга (гемопоэтических клеток), где более поздние проявления заболевания и косвенные эффекты стали более заметными. Обнаружение антигенов HCMV (обычно антигенемия pp65) или нуклеиновых кислот (обычно обнаружение вирусной ДНК в плазме или лейкоцитах с помощью ПЦР) в крови используется для вовлечения этого вируса в заболевание. У реципиентов трансплантата твердых органов может развиться пневмонит, вызванный HCMV, или поражения желудочно-кишечного тракта, гепатит, ретинит, панкреатит, миокардит и, в редких случаях, энцефалит или периферическая невропатия, тогда как у реципиентов трансплантата гемопоэтических клеток может развиться пневмонит HCMV или желудочно-кишечные заболевания.Установление этиологической роли HCMV требует обнаружения вируса в пораженной ткани или бронхоальвеолярного лаважа или количественного определения HCMV в крови или плазме. Основные косвенные эффекты HCMV, особенно при трансплантации твердых органов, включают отторжение аллотрансплантата, осложнения сосудистых заболеваний и повышенный риск условно-патогенных грибковых и бактериальных инфекций.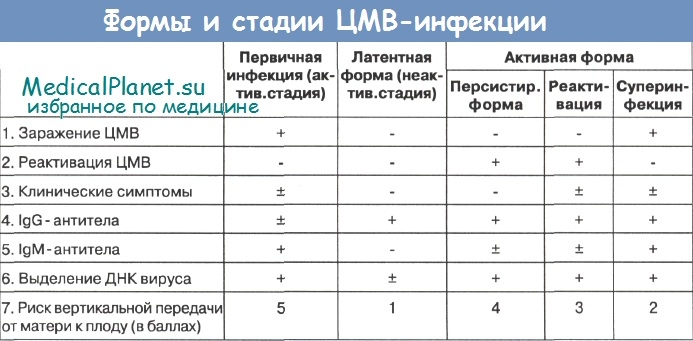 Первичная инфекция с наибольшей вероятностью приведет к заболеванию, когда наивный реципиент получит орган от серопозитивного донора по HCMV, хотя конкретный орган и режим иммуносупрессии также влияют на результат.
Первичная инфекция с наибольшей вероятностью приведет к заболеванию, когда наивный реципиент получит орган от серопозитивного донора по HCMV, хотя конкретный орган и режим иммуносупрессии также влияют на результат.
Несмотря на то, что противовирусная профилактика оказалась очень эффективной в предотвращении заболевания HCMV у реципиентов трансплантата солидных органов, заболевание HCMV с поздним началом может сопровождаться профилактикой у 5% пациентов. Профилактическое или упреждающее противовирусное лечение реципиентов трансплантата гемопоэтических клеток снижает заболеваемость HCMV в течение первых 3–4 месяцев примерно до 5%; однако заболевание с поздним началом, обычно более чем через 100 дней после трансплантации, остается проблемой. Во всех клинических условиях трансплантации HCMV ассоциировался с последствиями хронического заболевания, которые профилактика и превентивная терапия полностью не устраняли.У нетрансплантированного индивидуума HCMV был подозреваемым кофактором атеросклеротического заболевания сосудов и аутоиммунного васкулита.
Высокоактивная антиретровирусная терапия (ВААРТ) снижает заболеваемость HCMV-ретинитом и желудочно-кишечными заболеваниями у пациентов со СПИДом за счет восстановления или сохранения клеточной иммунной функции, хотя HCMV остается значительным риском для людей, инфицированных вирусом иммунодефицита человека (ВИЧ), когда CD4 T- количество клеток падает до низкого уровня.
В настоящее время в США одобрены четыре противовирусных агента для лечения HCMV: ганцикловир, валганцикловир, цидофовир и фоскарнет, причем в большинстве случаев в первую очередь выбирают ганцикловир для внутривенного введения и пролекарство валганцикловир для перорального введения.Эти два варианта также являются обычным выбором для профилактики и упреждающей терапии. Все препараты против HCMV обладают потенциально значительной токсичностью и ограничены для использования у пациентов с инвалидностью или опасным для жизни риском заболевания. Таким образом, дополнительные препараты находятся в стадии разработки. Продолжительное использование любого исследуемого или лицензированного препарата может привести к отбору резистентного вируса, но циркуляция устойчивых к лекарственным средствам мутантов среди населения не наблюдается.
Продолжительное использование любого исследуемого или лицензированного препарата может привести к отбору резистентного вируса, но циркуляция устойчивых к лекарственным средствам мутантов среди населения не наблюдается.
Границы | Системная вирусология и цитомегаловирус человека: использование высокопроизводительных подходов для выявления новых взаимодействий между хозяином и вирусом во время литической инфекции
Введение
Цитомегаловирус человека (HCMV) — это широко распространенный патоген человека, принадлежащий к подсемейству β-герпесвирусов.Он имеет самый большой ДНК-геном среди герпесвирусов человека с парами ~ 235 т.п.н. и кодирует по меньшей мере 173 аннотированных гена на основе штамма с низким числом пассажей Merlin, текущего эталонного штамма для HCMV дикого типа (Dunn et al., 2003; Fields et al., 2007; Sijmons et al., 2014; Marti-Carreras and Maes, 2019). HCMV может инфицировать широкий спектр типов клеток, включая эндотелиальные и эпителиальные клетки, клетки фибробластов и клетки, происходящие от миелоидных клонов (Rice et al. , 1984; Sinzger et al., 2008). Он имеет относительно длинный цикл литической репликации, который может занять до 72 часов, чтобы начать высвобождение инфекционных вирионов во внеклеточный компартмент (Landolfo et al., 2003). Латентная инфекция на протяжении всей жизни может быть установлена в примитивных резидентных в костном мозге гематопоэтических стволовых клетках CD34 + и миелоидных клетках-предшественниках CD33 +, которые сохраняют латентный вирусный геном, поскольку они дифференцируются в моноциты CD14 + периферической крови и миелоидные дендритные клетки (mDC) (Collins-McMillen et al. ., 2018; Arcangeletti et al., 2016; Stern et al., 2019). Реактивация латентного вирусного генома происходит, когда латентно инфицированные клетки достигают терминальной дифференцировки в mDC и макрофаги, что сопровождается ремоделированием хроматина главного немедленного-раннего промотора HCMV (Reeves et al., 2005). Другие факторы, такие как аллогенная стимуляция и провоспалительные цитокины, такие как интерферон гамма (IFN-γ), также вовлечены в процесс созревания миелоидных клеток и реактивацию латентно инфицированных клеток (Stern et al.
, 1984; Sinzger et al., 2008). Он имеет относительно длинный цикл литической репликации, который может занять до 72 часов, чтобы начать высвобождение инфекционных вирионов во внеклеточный компартмент (Landolfo et al., 2003). Латентная инфекция на протяжении всей жизни может быть установлена в примитивных резидентных в костном мозге гематопоэтических стволовых клетках CD34 + и миелоидных клетках-предшественниках CD33 +, которые сохраняют латентный вирусный геном, поскольку они дифференцируются в моноциты CD14 + периферической крови и миелоидные дендритные клетки (mDC) (Collins-McMillen et al. ., 2018; Arcangeletti et al., 2016; Stern et al., 2019). Реактивация латентного вирусного генома происходит, когда латентно инфицированные клетки достигают терминальной дифференцировки в mDC и макрофаги, что сопровождается ремоделированием хроматина главного немедленного-раннего промотора HCMV (Reeves et al., 2005). Другие факторы, такие как аллогенная стимуляция и провоспалительные цитокины, такие как интерферон гамма (IFN-γ), также вовлечены в процесс созревания миелоидных клеток и реактивацию латентно инфицированных клеток (Stern et al.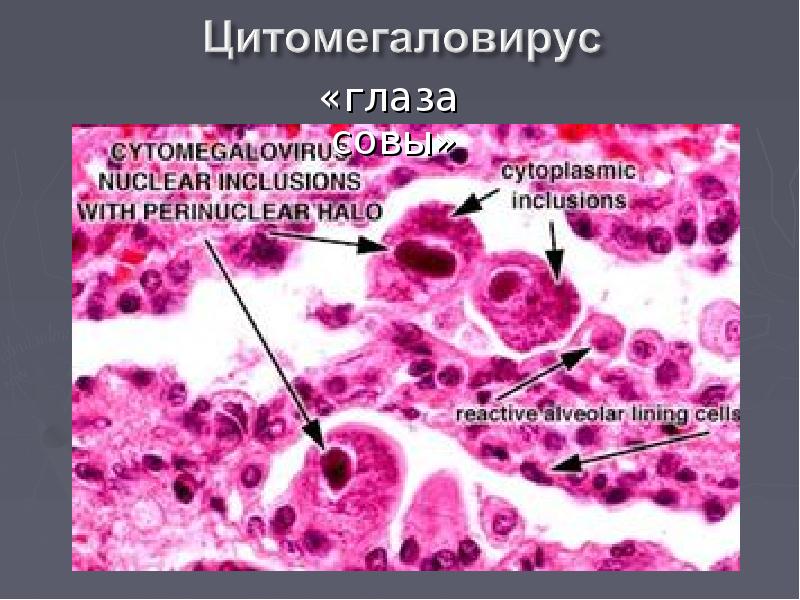 , 2019).
, 2019).
Вирусы являются облигатными внутриклеточными патогенами, которые полагаются на механизмы клетки-хозяина для инфильтрации, репликации в клетки-мишени и выхода из них. HCMV имеет сложные взаимодействия с различными факторами хозяина, и взаимодействия хозяина с вирусом различаются между пермиссивными типами клеток, а также между литическими и латентными стадиями вирусной инфекции.Характеристика изменений в экспрессии РНК хозяина и протеомах при инфицировании может помочь проанализировать эти сложные взаимодействия хозяина с вирусом, поскольку вирус, вероятно, будет индуцировать факторы хозяина, необходимые для эффективной репликации вируса, и подавлять факторы, которые в противном случае ингибировали бы репликацию вируса. Изучение того, как вирус взаимодействует с хозяином, может способствовать лучшему пониманию биологии вируса, а также функций факторов хозяина. Более того, факторы хозяина, которые определены как критические для репликации вируса, могут быть нацелены на низкомолекулярные ингибиторы, что приводит к потенциально новым противовирусным препаратам против HCMV.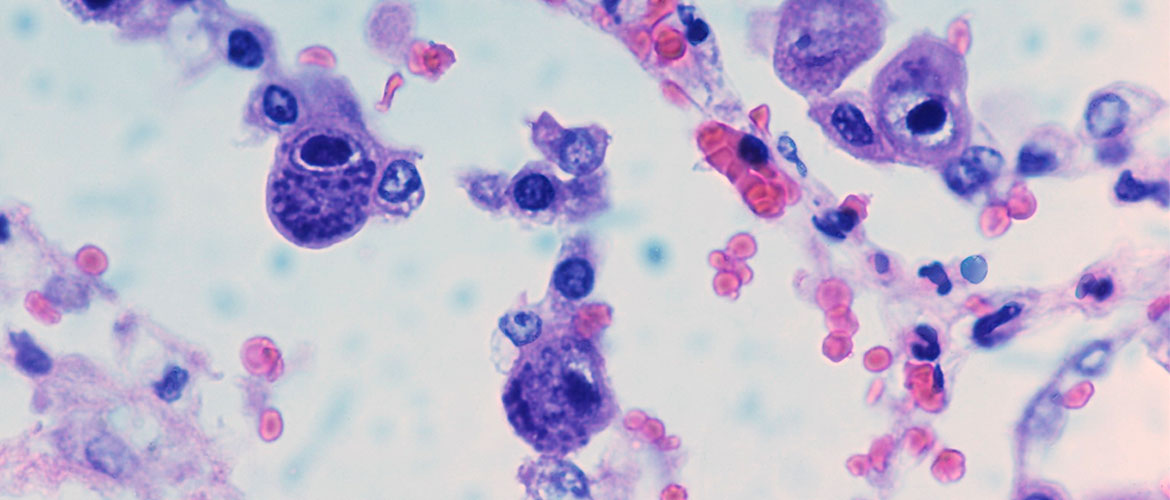
Исследования с высокой пропускной способностью — мощные инструменты для систематического изучения взаимодействий хост-вирус. Есть много стратегий для анализа сложных взаимодействий между вирусом и клетками-хозяевами. Секвенирование РНК и масс-спектрометрия позволяют отслеживать временную и пространственную экспрессию вирусных факторов и факторов хозяина в ходе инфекции, впоследствии обнаруживая механизм вирусных манипуляций с механизмами хозяина и факторами хозяина, важными для репликации вируса (Weekes et al., 2014 ; Жан Бельтран и др., 2016). Кроме того, экспрессия генов-хозяев может систематически подавляться с помощью РНК-индуцированного комплекса молчания (RISC) или нарушаться с помощью технологии кластеризации коротких палиндромных повторов с регулярными интервалами (CRISPR) (Polachek et al., 2016; McCormick et al., 2018) . Результирующие эффекты истощения или нарушения репликации отдельных генов могут быть исследованы с использованием репортерной системы, такой как люминесценция, белок с усиленной зеленой флуоресценцией (eGFP) или иммунофлуоресцентное окрашивание вирусных белков. Наконец, вместо подавления экспрессии генов, гены-хозяева, такие как гены, стимулированные интерфероном (ISG), могут быть сверхэкспрессированы с использованием массивов лентивирусных библиотек, и могут быть идентифицированы факторы рестрикции хозяина против вируса (Schoggins et al., 2011).
Наконец, вместо подавления экспрессии генов, гены-хозяева, такие как гены, стимулированные интерфероном (ISG), могут быть сверхэкспрессированы с использованием массивов лентивирусных библиотек, и могут быть идентифицированы факторы рестрикции хозяина против вируса (Schoggins et al., 2011).
Ранее в 2014 году был опубликован подробный обзор, в котором обсуждалось, как HCMV управляет метаболизмом хозяина и экспрессией генов с помощью секвенирования РНК (RNA-seq), протеомики и высокопроизводительных скрининговых РНКи (Cohen and Stern-Ginossar, 2014). Однако исследования с использованием высокопроизводительных или систематических подходов внесли большой вклад в наше понимание биологии HCMV, как в литическом, так и в латентном аспектах, за последние 5 лет.Таким образом, в этом обзоре мы суммируем результаты высокопроизводительных исследований HCMV с упором на литическую инфекцию с 2014 года по настоящее время. Обзор будет состоять из двух основных частей: (i) как вирус изменяет клеточную РНК и экспрессию белка и (ii) как изменения в клетках-хозяевах влияют на репликацию вируса.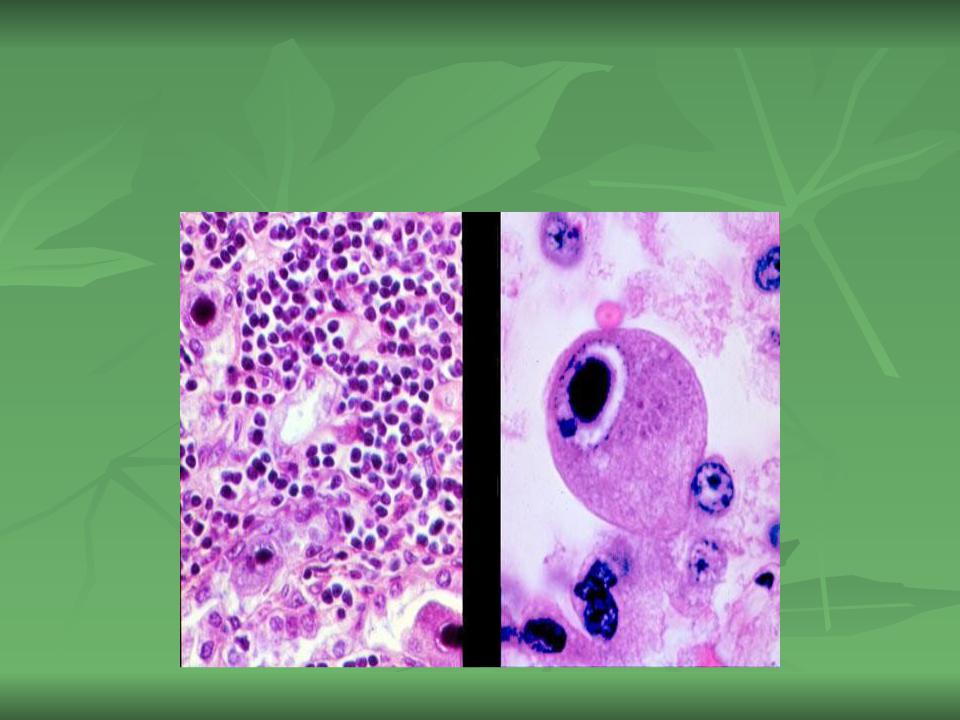
Глобальный анализ индуцированных HCMV изменений экспрессии генов-хозяев с помощью RNA-SEQ и протеомики
При инфицировании HCMV вызывает глобальные изменения в экспрессии белка-хозяина для преодоления врожденной иммунной защиты хозяина и отклонения нормальных клеточных процессов от хозяина к вирусу для облегчения эффективной репликации вируса.Эти изменения могут наблюдаться на уровнях РНК, где вирусные белки напрямую взаимодействуют с ДНК или хроматином хозяина или опосредованно, увеличивая или уменьшая экспрессию специфического гена хозяина, тем самым создавая среду, способствующую эффективной репликации и распространению. Однако транскрипты мРНК подвержены посттранскрипционной регуляции и деградации, а уровни транскриптов и белков не всегда коррелируют. Таким образом, анализ изменений уровней белка при заражении может показать, соответствуют ли изменения уровня мРНК изменениям уровней белка и имеют ли изменения в экспрессии белка роли и функции в репликации HCMV.
Исследования последовательностей РНК у HCMV
РНК-секвенирование (RNA-seq) произвело революцию в нашей способности контролировать уровни экспрессии генов в масштабе всего генома. Такие методы, как очистка поли-A-транскриптов или истощение рибосомной РНК (рРНК), повысили чувствительность и точность RNA-seq (Zhao et al., 2018). Помимо использования RNA-seq для количественного определения уровней РНК, были разработаны новые стратегии для исследования посттранскрипционных событий, включая альтернативный сплайсинг (AS) и альтернативное расщепление и полиаденилирование (APA), поскольку эти события определяют кодирующие потенциалы транскриптов мРНК и регулируют экспрессия гена.AS — это строго регулируемый процесс, который генерирует несколько изоформ мРНК с использованием различных комбинаций сайтов сплайсинга и экзонов. Несколько классов паттернов сплайсинга включают пропуск экзонов, выбор альтернативных 5′-сайтов сплайсинга и удержание интронов (Movassat et al., 2016). Между тем, APA включает использование альтернативных поли (A) сайтов, расположенных во внутренних интронах или экзонах, для образования множества изоформ мРНК.
Такие методы, как очистка поли-A-транскриптов или истощение рибосомной РНК (рРНК), повысили чувствительность и точность RNA-seq (Zhao et al., 2018). Помимо использования RNA-seq для количественного определения уровней РНК, были разработаны новые стратегии для исследования посттранскрипционных событий, включая альтернативный сплайсинг (AS) и альтернативное расщепление и полиаденилирование (APA), поскольку эти события определяют кодирующие потенциалы транскриптов мРНК и регулируют экспрессия гена.AS — это строго регулируемый процесс, который генерирует несколько изоформ мРНК с использованием различных комбинаций сайтов сплайсинга и экзонов. Несколько классов паттернов сплайсинга включают пропуск экзонов, выбор альтернативных 5′-сайтов сплайсинга и удержание интронов (Movassat et al., 2016). Между тем, APA включает использование альтернативных поли (A) сайтов, расположенных во внутренних интронах или экзонах, для образования множества изоформ мРНК.
Полиаденилирование — это двухстадийный процесс, включающий специфическое эндонуклеолитическое расщепление и полимеризацию аденозинового хвоста, длина которого зависит от хозяина и часто составляет около 200 остатков у высших эукариот (Lutz and Moreira, 2011). Поли (A) хвосты находятся на 3′-конце почти каждого транскрипта мРНК эукариот, и конкретный сайт поли (A) выбирается в зависимости от силы сигнала поли (A) и окружающих цис- -элементов (Millevoi and Vagner , 2010; Fu, Ares, 2014). APA также может встречаться в 3′-нетранслируемых областях (3’UTR), что приводит к транскрипции с различной длиной 3’UTR, что, как предполагается, влияет на стабильность, локализацию, транспорт и трансляцию мРНК (Movassat et al., 2016) .
Поли (A) хвосты находятся на 3′-конце почти каждого транскрипта мРНК эукариот, и конкретный сайт поли (A) выбирается в зависимости от силы сигнала поли (A) и окружающих цис- -элементов (Millevoi and Vagner , 2010; Fu, Ares, 2014). APA также может встречаться в 3′-нетранслируемых областях (3’UTR), что приводит к транскрипции с различной длиной 3’UTR, что, как предполагается, влияет на стабильность, локализацию, транспорт и трансляцию мРНК (Movassat et al., 2016) .
AS был идентифицирован примерно в 95% генов человека, а APA — примерно в 70% генов человека (Pan et al., 2008; Derti et al., 2012). AS и APA могут влиять на многие клеточные процессы, включая стабильность РНК, трансляцию, нацеливание miRNA, развитие и болезнь (Lutz and Moreira, 2011). RNA-seq использовался для изучения того, как AS и APA изменяют транскриптомы хозяина на посттранскрипционном уровне после заражения HCMV. Batra et al. (2016) оценили паттерны экспрессии мРНК в трех пермиссивных типах клеток HCMV, используя чувствительные к сплайсингу микроматрицы Affymetrix и поли-A-выбранную РНК-seq.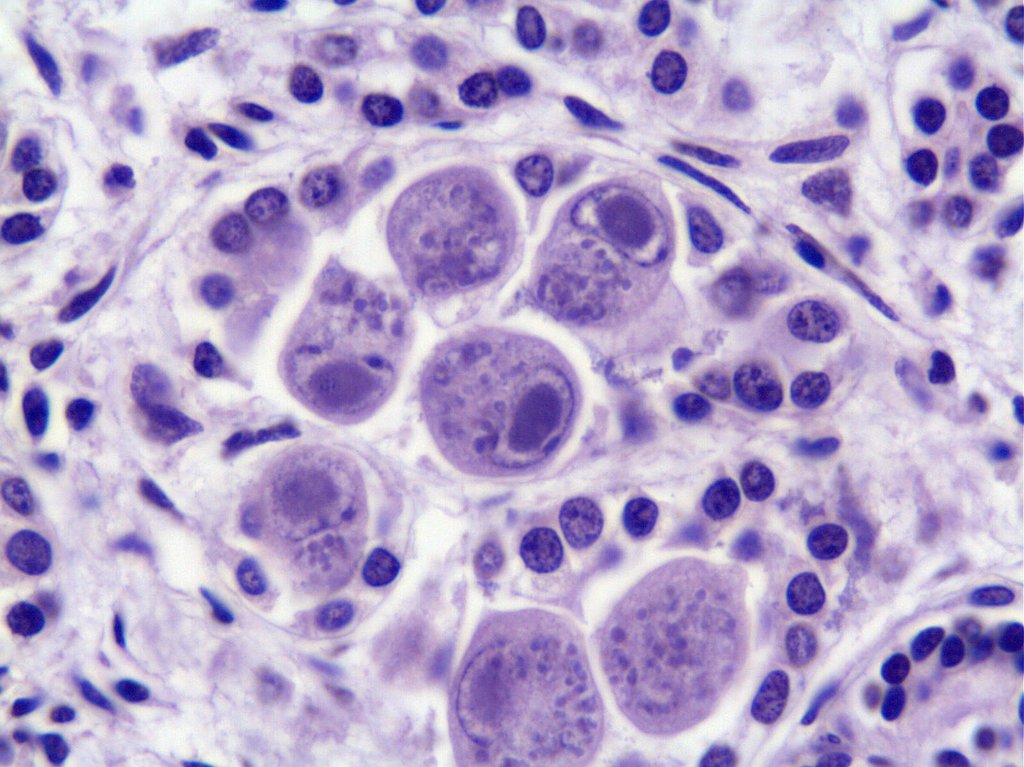 РНК экстрагировали из первичных фибробластных клеток крайней плоти человека (HFF), эндотелиальных клеток аорты (EC) и клеток-предшественников нервных клеток (NPC), полученных из эмбриональных стволовых клеток человека, через 48 и 96 часов после инфицирования (HPI) штаммом HCMV TB40 / E. . Изменения в APA и AS привели к более чем 2000 изменениям транскриптов хозяина после заражения HCMV. Используя алгоритм смеси изоформ (MISO), было обнаружено, что большинство событий APA приводило к укорочению 3’UTR после инфицирования во всех трех тестируемых типах клеток, при этом 3’UTR укорачивались до 5 килобаз (кб) при 96 HPI. .Чтобы оценить регуляцию APA в 3’UTR, анализ RNA-seq выявил резкую повышающую регуляцию уровней мРНК белка 1, связывающего элемент полиаденилирования цитоплазмы (CPEB1), что соответствует повышенной экспрессии белка. Истощение CPEB1 малой интерферирующей РНК (siRNA) во время инфекции частично или полностью обращало вспять 41% изменений APA в инфицированных HFF, в то время как избыточная экспрессия CPEB1 привела к значительному сдвигу в сторону использования проксимальных поли (A) сайтов в генах, которые, как было установлено, были затронуты во время инфекционное заболевание.
РНК экстрагировали из первичных фибробластных клеток крайней плоти человека (HFF), эндотелиальных клеток аорты (EC) и клеток-предшественников нервных клеток (NPC), полученных из эмбриональных стволовых клеток человека, через 48 и 96 часов после инфицирования (HPI) штаммом HCMV TB40 / E. . Изменения в APA и AS привели к более чем 2000 изменениям транскриптов хозяина после заражения HCMV. Используя алгоритм смеси изоформ (MISO), было обнаружено, что большинство событий APA приводило к укорочению 3’UTR после инфицирования во всех трех тестируемых типах клеток, при этом 3’UTR укорачивались до 5 килобаз (кб) при 96 HPI. .Чтобы оценить регуляцию APA в 3’UTR, анализ RNA-seq выявил резкую повышающую регуляцию уровней мРНК белка 1, связывающего элемент полиаденилирования цитоплазмы (CPEB1), что соответствует повышенной экспрессии белка. Истощение CPEB1 малой интерферирующей РНК (siRNA) во время инфекции частично или полностью обращало вспять 41% изменений APA в инфицированных HFF, в то время как избыточная экспрессия CPEB1 привела к значительному сдвигу в сторону использования проксимальных поли (A) сайтов в генах, которые, как было установлено, были затронуты во время инфекционное заболевание. Кроме того, истощение CPEB1 также укорачивает поли (A) хвосты в генах HCMV, таких как UL18 и UL99, и снижает продуктивную инфекцию HCMV в HFF, хотя величина снижения была более значительной при 96 HPI (примерно в 10 раз) и титре восстановлено частично на 144 HPI. Это исследование демонстрирует силу систематических подходов к пониманию того, как вирусы могут управлять уровнями экспрессии генов в глобальном масштабе.
Кроме того, истощение CPEB1 также укорачивает поли (A) хвосты в генах HCMV, таких как UL18 и UL99, и снижает продуктивную инфекцию HCMV в HFF, хотя величина снижения была более значительной при 96 HPI (примерно в 10 раз) и титре восстановлено частично на 144 HPI. Это исследование демонстрирует силу систематических подходов к пониманию того, как вирусы могут управлять уровнями экспрессии генов в глобальном масштабе.
Протеомические исследования HCMV
Уровни мРНК не всегда соответствуют уровням белка из-за различных факторов, включая посттранскрипционную модификацию, стабильность мРНК и регуляцию микроРНК (Valencia-Sanchez et al., 2006; Нахтергаэле и Он, 2017; Nouaille et al., 2017; Mauger et al., 2019). Следовательно, измерение уровней белка во время инфекции может обеспечить более прямую функциональную связь между вирусом и хозяином (Koussounadis et al., 2015; Liu et al., 2016). Основополагающее количественное протеомное исследование точной временной экспрессии белков плазматической мембраны и внутриклеточных белков было проведено Weekes et al. (2014). Тандемные массовые метки (TMT) были использованы для количественной оценки 1184 белков клеточной поверхности и 7 491 клеточных белков от 10 временных точек в HFF.Было обнаружено, что некоторые поверхностные клетки и клеточные белки в пути передачи сигналов интерферона (IFN) подавляются штаммом Merlin HCMV, включая Jak1, STAT2 и IRF9. Совсем недавно аналогичная стратегия была адаптирована для сосредоточения на белках-хозяевах с функцией врожденного иммунитета, которые активно разрушаются протеасомой или лизосомой во время ранней стадии инфекции HCMV (Nightingale et al., 2018). Используя ингибитор протеасом MG132 или лейпептин, ингибитор функции лизосом, HFF инфицировали штаммом Merlin и анализировали при 12, 18 и 24 HPI с помощью масс-спектрометрии MS3.Восемь тысяч шестьсот семьдесят восемь белков оценивали между инфицированными клетками, обработанными протеасомным или лизосомным ингибитором или без него. В целом 131 белок, включая E3-убиквитинлигазу ANAPC1 и фактор рестрикции HCMV Sp100, был спасен применением MG132 в пределах 24 HPI, при этом 46 белков были спасены при 12 HPI.
(2014). Тандемные массовые метки (TMT) были использованы для количественной оценки 1184 белков клеточной поверхности и 7 491 клеточных белков от 10 временных точек в HFF.Было обнаружено, что некоторые поверхностные клетки и клеточные белки в пути передачи сигналов интерферона (IFN) подавляются штаммом Merlin HCMV, включая Jak1, STAT2 и IRF9. Совсем недавно аналогичная стратегия была адаптирована для сосредоточения на белках-хозяевах с функцией врожденного иммунитета, которые активно разрушаются протеасомой или лизосомой во время ранней стадии инфекции HCMV (Nightingale et al., 2018). Используя ингибитор протеасом MG132 или лейпептин, ингибитор функции лизосом, HFF инфицировали штаммом Merlin и анализировали при 12, 18 и 24 HPI с помощью масс-спектрометрии MS3.Восемь тысяч шестьсот семьдесят восемь белков оценивали между инфицированными клетками, обработанными протеасомным или лизосомным ингибитором или без него. В целом 131 белок, включая E3-убиквитинлигазу ANAPC1 и фактор рестрикции HCMV Sp100, был спасен применением MG132 в пределах 24 HPI, при этом 46 белков были спасены при 12 HPI.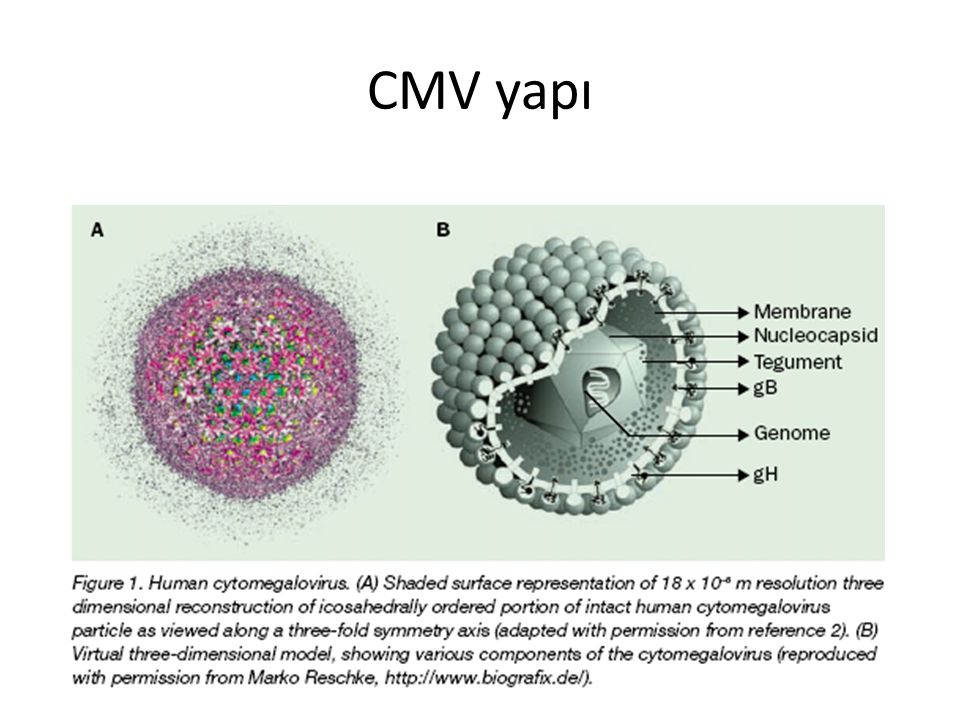 Между тем, 28 белков, включая E3-лигазу NEDD4, были спасены с помощью лейпептина. Пятьдесят процентов белков, спасенных лейпептином, также были спасены MG132.Для решения проблемы стабильности и обмена белка во время инфекции HCMV использовалось несмещенное импульсное мечение стабильных изотопов аминокислотами в культуре клеток (pSILAC) с химической меткой TMT. По сравнению с традиционным подходом pSILAC, комбинация pSILAC с TMT обеспечивает лучшую временную эффективность в масс-спектрометрии и более высокую точность измерения каждого белка в любой момент времени. Мультиплексный подход pSILAC / TMT включает мечение клеток «средним» лизином ( 2 H 4 L-лизин; Lys4), обеспечивая клетки «тяжелым» лизином ( 13 C 6 15 N 2 L-лизин; Lys8) во время заражения для идентификации вновь синтезированных пептидов и маркировки пептидов с помощью TMT для масс-спектрометрии.Результаты pSILAC показали, что 24 из 46 белков, восстановленных при 12 HPI с помощью MG132, демонстрировали повышенную деградацию в инфицированных HCMV клетках по сравнению с имитацией инфекции, в то время как 12 белков не проявляли нестабильности или деградации.
Между тем, 28 белков, включая E3-лигазу NEDD4, были спасены с помощью лейпептина. Пятьдесят процентов белков, спасенных лейпептином, также были спасены MG132.Для решения проблемы стабильности и обмена белка во время инфекции HCMV использовалось несмещенное импульсное мечение стабильных изотопов аминокислотами в культуре клеток (pSILAC) с химической меткой TMT. По сравнению с традиционным подходом pSILAC, комбинация pSILAC с TMT обеспечивает лучшую временную эффективность в масс-спектрометрии и более высокую точность измерения каждого белка в любой момент времени. Мультиплексный подход pSILAC / TMT включает мечение клеток «средним» лизином ( 2 H 4 L-лизин; Lys4), обеспечивая клетки «тяжелым» лизином ( 13 C 6 15 N 2 L-лизин; Lys8) во время заражения для идентификации вновь синтезированных пептидов и маркировки пептидов с помощью TMT для масс-спектрометрии.Результаты pSILAC показали, что 24 из 46 белков, восстановленных при 12 HPI с помощью MG132, демонстрировали повышенную деградацию в инфицированных HCMV клетках по сравнению с имитацией инфекции, в то время как 12 белков не проявляли нестабильности или деградации. Некоторые из этих белков имели чрезвычайно высокую скорость оборота, что затрудняло наблюдение разницы между ложной инфекцией и инфекцией HCMV (например, TXNIP), тогда как некоторые из этих белков также были спасены путем применения MG132 во время фиктивной инфекции (например, PHLDA1). Таким образом, белки, которые были спасены с помощью MG132, но не проявляли нестабильности с помощью pSILAC, могут все еще деградировать, и посттранскрипционная и посттрансляционная регуляции могут работать в комбинации для регулирования экспрессии генов.Кроме того, был проведен анализ РНК-seq для идентификации белков, экспрессия которых определялась в первую очередь посттранскрипционной регуляцией, а не транскрипцией мРНК. Было показано, что несколько кандидатов имеют повышенную регуляцию транскрипции, но понижающую регуляцию экспрессии белка, включая фактор рестрикции HCMV Sp100, убиквитинлигазу E3 ANAPC1 и подобный геликазе фактор транскрипции HLTF. Авторы далее охарактеризовали HLTF, о котором ранее не сообщалось, что он нацелен на протеасомную деградацию с помощью HCMV, и обнаружили, что UL145 необходим и достаточен для деградации HLTF.
Некоторые из этих белков имели чрезвычайно высокую скорость оборота, что затрудняло наблюдение разницы между ложной инфекцией и инфекцией HCMV (например, TXNIP), тогда как некоторые из этих белков также были спасены путем применения MG132 во время фиктивной инфекции (например, PHLDA1). Таким образом, белки, которые были спасены с помощью MG132, но не проявляли нестабильности с помощью pSILAC, могут все еще деградировать, и посттранскрипционная и посттрансляционная регуляции могут работать в комбинации для регулирования экспрессии генов.Кроме того, был проведен анализ РНК-seq для идентификации белков, экспрессия которых определялась в первую очередь посттранскрипционной регуляцией, а не транскрипцией мРНК. Было показано, что несколько кандидатов имеют повышенную регуляцию транскрипции, но понижающую регуляцию экспрессии белка, включая фактор рестрикции HCMV Sp100, убиквитинлигазу E3 ANAPC1 и подобный геликазе фактор транскрипции HLTF. Авторы далее охарактеризовали HLTF, о котором ранее не сообщалось, что он нацелен на протеасомную деградацию с помощью HCMV, и обнаружили, что UL145 необходим и достаточен для деградации HLTF. Также было обнаружено, что UL145 рекрутирует лигазный комплекс Cullin 4 (CUL4) E3 для нацеливания HLTF на протеасомную деградацию. Наконец, было показано, что HLTF действует как фактор рестрикции, аналогичный Sp100, на ранней стадии репликации вируса.
Также было обнаружено, что UL145 рекрутирует лигазный комплекс Cullin 4 (CUL4) E3 для нацеливания HLTF на протеасомную деградацию. Наконец, было показано, что HLTF действует как фактор рестрикции, аналогичный Sp100, на ранней стадии репликации вируса.
Другое протеомное исследование, проведенное Jean Beltran et al. (2016) исследовали как временные, так и пространственные изменения экспрессии клеточного белка во время инфекции HCMV, используя субклеточное фракционирование и масс-спектрометрию на основе TMT. Цикл инфицирования HCMV был разделен на пять временных точек (24, 48, 72, 96 и 120 HPI) и шесть пространственных фракций с помощью ультрацентрифугирования в градиенте плотности.Исследование показало, что почти 4000 белков-хозяев в HFF подверглись субклеточной реорганизации во время инфекции HCMV, а лизосомы во время инфекции были преобразованы в две отдельные субпопуляции. Авторы проследили за одним из совпадений, миозином XVIIIA (MYO18A), и показали, что MYO18A перемещается из плазматической мембраны в лизосомы во время инфекции. Нокдаун MYO18A с помощью siRNA также показал умеренное снижение репликации вируса, измеренное с помощью IE1-положительных инфекционных единиц. MYO18A участвует в ретроградном токе актина в клеточных ламеллах и переносе пузырьков.Таким образом, была предложена модель, предполагающая, что MYO18A перемещается из плазматической мембраны в компартмент сборки вируса, чтобы связывать загруженные вирусом везикулы и моторные белки. Эта же группа дополнительно исследовала глобальные изменения в биогенезе пероксисом во время инфекции HCMV, используя целевую количественную протеомику (Jean Beltran et al., 2018). Шестьдесят пероксисомальных белков, которые были найдены подходящими для количественной оценки с помощью масс-спектрометрии в HFF, были проанализированы при 0, 6, 24, 48, 72 и 120 HPI с штаммом HCMV AD169 с использованием анализа параллельного мониторинга реакции высокого разрешения для высокого разрешения и высокой точности масс.В целом, содержание большинства пероксисомальных белков (52 из 60) увеличилось с 24 HPI.
Нокдаун MYO18A с помощью siRNA также показал умеренное снижение репликации вируса, измеренное с помощью IE1-положительных инфекционных единиц. MYO18A участвует в ретроградном токе актина в клеточных ламеллах и переносе пузырьков.Таким образом, была предложена модель, предполагающая, что MYO18A перемещается из плазматической мембраны в компартмент сборки вируса, чтобы связывать загруженные вирусом везикулы и моторные белки. Эта же группа дополнительно исследовала глобальные изменения в биогенезе пероксисом во время инфекции HCMV, используя целевую количественную протеомику (Jean Beltran et al., 2018). Шестьдесят пероксисомальных белков, которые были найдены подходящими для количественной оценки с помощью масс-спектрометрии в HFF, были проанализированы при 0, 6, 24, 48, 72 и 120 HPI с штаммом HCMV AD169 с использованием анализа параллельного мониторинга реакции высокого разрешения для высокого разрешения и высокой точности масс.В целом, содержание большинства пероксисомальных белков (52 из 60) увеличилось с 24 HPI. Авторы впоследствии показали, что для индукции экспрессии пероксисомальных белков не требуется экспрессия поздних генов, а биогенез пероксисом необходим для эффективной репликации HCMV.
Авторы впоследствии показали, что для индукции экспрессии пероксисомальных белков не требуется экспрессия поздних генов, а биогенез пероксисом необходим для эффективной репликации HCMV.
В дополнение к исследованиям, изучающим глобальные изменения протеомов, исследование Arend et al. сосредоточили внимание на изменениях активности и уровня экспрессии киназ-хозяев с использованием масс-спектрометрии с мультиплексным ингибитором киназ (MIB-MS) (Arend et al., 2017). Используя гранулы, содержащие иммобилизованные ингибиторы панкиназы для захвата киназы, исследование выявило временные изменения в комплементе протеинкиназ хозяина (то есть киноме) во время инфекции HCMV. Лабораторно адаптированный штамм AD169 и клинический релевантный штамм TB40 / E использовали для инфицирования клеток фибробластов MRC-5, чтобы сравнить изменения в киноме, вызванные двумя разными штаммами. Интересно, что и AD169, и TB40 / E модифицируют кином хозяина сходным образом. Результаты показали, что 53 киназы, включая циклин-зависимые киназы (например,g. , CDK1, CDK7) и липидкиназы (например, PIK3C3, PI4K2B) имели повышенную экспрессию во время инфекции. Между тем, 51 киназа, такая как рецептор тромбоцитарного фактора роста альфа и бета (PDGFRα и PDGFRβ) и рецепторы 1 и 2 трансформирующего фактора роста (TGFBR1 и TGFBR2), снизили экспрессию после инфекции. Исследование подтвердило важность ранее описанных сигнальных путей AMPK, mTOR и ERK / MAPK во время инфекции HCMV, а также идентификацию киназ рецепторов эфрина (Eph) как новых путей, на которые влияет HCMV.Основываясь на данных профилирования кинома MIB-MS, авторы протестировали 13 ингибиторов киназ, которые в настоящее время используются или проходят клинические испытания, на предмет их способности подавлять инфекцию HCMV. Вирус AD169, экспрессирующий белок pp28, слитый с GFP на его С-конце (pp28-GFP), использовали для мониторинга уровня вирусной инфекции после лечения лекарственным средством. Было обнаружено, что четыре ингибитора значительно снижали экспрессию pp28-GFP. Это OTSSP167 [нацеливание на киназу лейциновой молнии материнского эмбриона (MELK)], динациклиб (нацеливание на CDK1, 2, 5 и 9), OTX015 (нацеливание на бромодомен-содержащие белки BRD2, 3 и 4) и LY2603618 [нацеливание на киназу контрольной точки 1 (ЧЕК1)].
, CDK1, CDK7) и липидкиназы (например, PIK3C3, PI4K2B) имели повышенную экспрессию во время инфекции. Между тем, 51 киназа, такая как рецептор тромбоцитарного фактора роста альфа и бета (PDGFRα и PDGFRβ) и рецепторы 1 и 2 трансформирующего фактора роста (TGFBR1 и TGFBR2), снизили экспрессию после инфекции. Исследование подтвердило важность ранее описанных сигнальных путей AMPK, mTOR и ERK / MAPK во время инфекции HCMV, а также идентификацию киназ рецепторов эфрина (Eph) как новых путей, на которые влияет HCMV.Основываясь на данных профилирования кинома MIB-MS, авторы протестировали 13 ингибиторов киназ, которые в настоящее время используются или проходят клинические испытания, на предмет их способности подавлять инфекцию HCMV. Вирус AD169, экспрессирующий белок pp28, слитый с GFP на его С-конце (pp28-GFP), использовали для мониторинга уровня вирусной инфекции после лечения лекарственным средством. Было обнаружено, что четыре ингибитора значительно снижали экспрессию pp28-GFP. Это OTSSP167 [нацеливание на киназу лейциновой молнии материнского эмбриона (MELK)], динациклиб (нацеливание на CDK1, 2, 5 и 9), OTX015 (нацеливание на бромодомен-содержащие белки BRD2, 3 и 4) и LY2603618 [нацеливание на киназу контрольной точки 1 (ЧЕК1)]. Подробная характеристика была проведена на OTSSP167, и было показано, что вирусная инфекция уменьшилась на 1 log после лечения лекарством. Это исследование демонстрирует возможность выявления противовирусных мишеней с помощью профилирования кинома.
Подробная характеристика была проведена на OTSSP167, и было показано, что вирусная инфекция уменьшилась на 1 log после лечения лекарством. Это исследование демонстрирует возможность выявления противовирусных мишеней с помощью профилирования кинома.
Систематическая идентификация новых взаимодействий хозяина и вируса с использованием интерференции РНК и CRISPR / CAS9
Глобальный анализ уровней РНК и белка во время инфекции HCMV может помочь понять, как вирус влияет на экспрессию клеточных генов, а также как клетки реагируют на инфекцию.Однако некоторые факторы хозяина могут не иметь дифференциальной экспрессии до и после заражения, но их функции важны для эффективной репликации вируса. С развитием РНК-интерференции (РНКи) с использованием малой интерферирующей РНК (миРНК) и короткой шпилечной РНК (шРНК) экспрессия факторов хозяина может быть систематически подавлена, и можно исследовать влияние истощения отдельных генов на репликацию вируса. Кроме того, недавно разработанная и усовершенствованная технология редактирования генома CRISPR позволяет вносить мутации в гены-мишени и нарушать экспрессию белков факторов хозяина, которые важны для репликации вируса.
siRNA обычно выполняется в виде массивов, где каждая лунка микропланшета содержит уникальный реагент RNAi, нацеленный на один ген. С другой стороны, скрининг shRNA часто выполняется как объединенный скрининг, где все реагенты RNAi объединяются вместе и случайным образом вводятся в клетки, где shRNA могут быть обнаружены секвенированием следующего поколения (NGS) или микрочипом штрих-кода после фенотипического отбора. Высокопроизводительные скрининги РНКи в значительной степени способствовали нашему пониманию базовой биологии клетки, а также сложных взаимодействий хозяина и вируса, которые могут привести к разработке новых терапевтических средств.
Исследования siRNA в HCMV
миРНК представляют собой дуплексы регуляторных РНК, обычно длиной 21–23 нуклеотида, с выступами из 2 нуклеотидов на 3′-концах. Они связываются с комплементарными транскриптами мРНК, вызывая деградацию (Rao et al., 2009). siRNAs обычно имеют одну мишень мРНК, а направляющая цепь siRNA включается в РНК-индуцированный комплекс молчания (RISC), который использует направляющую последовательность для распознавания транскрипта-мишени для деградации (Lam et al. , 2015). Из-за своей простоты и специфичности миРНК была адаптирована для высокопроизводительных скрининговых исследований для проведения систематических исследований потери функции с целью выявления генов, важных для нормальных клеточных функций или репликации вирусов.
, 2015). Из-за своей простоты и специфичности миРНК была адаптирована для высокопроизводительных скрининговых исследований для проведения систематических исследований потери функции с целью выявления генов, важных для нормальных клеточных функций или репликации вирусов.
Важными аспектами, которые следует учитывать при попытке высокопроизводительного скрининга вирусной siRNA, является то, будет ли выбранный считывание генерировать широкий динамический диапазон и точно отражать репликацию вируса и, в конечном итоге, производство вируса. Динамический диапазон экрана описывает отношение сигнал / шум. Если выбранный показатель репликации вируса генерирует максимальный сигнал в 2 раза выше фона, чувствительность экрана будет низкой, так как максимально возможный фенотип будет снижен в 2 раза.Напротив, экран, который генерирует 100-кратный динамический диапазон, предоставляет гораздо больше возможностей для определения фенотипических эффектов и увеличивает чувствительность экрана. Кроме того, если показания не точно отражают репликацию вируса и, возможно, более важное измерение, производство вируса, уровень ложного обнаружения будет значительно выше. При обычном скрининге siRNA часто используются репортерные конструкции, включенные в вирусный геном, для генерации сигнала, отражающего репликацию вируса.Хотя этот подход позволяет быстро, эффективно и в реальном времени измерять сигнал, любые воздействия на репликацию вируса смещены в сторону ранних событий, таких как вход и репликация генома, и могут быть менее эффективными при измерении поздних событий, таких как сборка и выход. Ранее мы показали, что измерение репликации вируса, основанное на экспрессии кассеты флуоресценции, включенной только в геном вируса, было плохим предиктором воздействия на поздние аспекты репликации вируса (McCormick et al., 2018).Более того, основание считывания непосредственно на флуоресцентном репортере может привести к идентификации генов, которые имеют прямое влияние на флуоресцентный сигнал, а не через ингибирование или стимулирование репликации вируса.
При обычном скрининге siRNA часто используются репортерные конструкции, включенные в вирусный геном, для генерации сигнала, отражающего репликацию вируса.Хотя этот подход позволяет быстро, эффективно и в реальном времени измерять сигнал, любые воздействия на репликацию вируса смещены в сторону ранних событий, таких как вход и репликация генома, и могут быть менее эффективными при измерении поздних событий, таких как сборка и выход. Ранее мы показали, что измерение репликации вируса, основанное на экспрессии кассеты флуоресценции, включенной только в геном вируса, было плохим предиктором воздействия на поздние аспекты репликации вируса (McCormick et al., 2018).Более того, основание считывания непосредственно на флуоресцентном репортере может привести к идентификации генов, которые имеют прямое влияние на флуоресцентный сигнал, а не через ингибирование или стимулирование репликации вируса.
Другой аспект, который следует учитывать, — это возможность нецелевых эффектов, когда наблюдаемый фенотип вызван ингибированием гена, отличного от намеченной мишени. Использование объединенных миРНК уменьшило проблемы нецелевых эффектов. Используя от трех до четырех независимых siRNA, которые нацелены на разные области транскрипта, можно снизить концентрацию каждой siRNA, тем самым уменьшая риск нецелевых эффектов, при одновременном генерировании синергической активности RNAi, повышая эффективность и специфичность нокдауна.Однако тщательная проверка все еще требуется для любого потенциального попадания, и объединенные миРНК могут быть деконволютированы во время валидации попаданий, а отдельные миРНК исследованы для подтверждения специфичности нокдауна.
Использование объединенных миРНК уменьшило проблемы нецелевых эффектов. Используя от трех до четырех независимых siRNA, которые нацелены на разные области транскрипта, можно снизить концентрацию каждой siRNA, тем самым уменьшая риск нецелевых эффектов, при одновременном генерировании синергической активности RNAi, повышая эффективность и специфичность нокдауна.Однако тщательная проверка все еще требуется для любого потенциального попадания, и объединенные миРНК могут быть деконволютированы во время валидации попаданий, а отдельные миРНК исследованы для подтверждения специфичности нокдауна.
В этом разделе мы описываем ряд скринингов siRNA HCMV, в которых использовались альтернативные подходы для измерения репликации вируса, что позволяет улучшить измерение ранних и поздних аспектов репликации вируса HCMV.
Polachek et al. (2016) провели скрининг миРНК, чтобы определить роль клеточных киназ и фосфатаз в репликации HMCV.В этом исследовании 789 человеческих киназ и фосфатаз были нацелены на HFF с использованием пулов siRNA и лабораторного штамма HCMV AD169. Иммунофлуоресцентное окрашивание вирусного антигена рр28 (кодируемого UL99) при 72 HPI использовали в качестве индикатора уровня репликации вируса. Высокопроизводительная конфокальная микроскопия с высоким содержанием микроскопа ImageXpress Micro была использована для количественной оценки уровня экспрессии pp28, что позволяет получать изображения в системах микропланшетов. Поскольку pp28 является поздним геном, визуализация этого белка будет более точно отражать все стадии репликации вируса.Результаты показали, что 25 миРНК оказали усиливающее действие на репликацию HCMV с оценкой Z выше 1, тогда как 30 миРНК оказали ингибирующее действие с оценкой Z ниже -1. Z -score описывает, на сколько стандартных отклонений данное измерение находится выше или ниже среднего для генеральной совокупности (Curtis et al., 2016). Было обнаружено, что только 4 пула миРНК, нацеленных на фосфатидилинозитол-3-киназу класса II альфа (PI3K-C2A), кластер дифференцировки 4 (CD4), компонент экзосомы 10 (EXOSC10) и протеинкиназу 4 с дефицитом лизина WNK (WNK4), обладают сильным ингибирующим действием ( Z — баллы ниже -2) при репликации HCMV.
Иммунофлуоресцентное окрашивание вирусного антигена рр28 (кодируемого UL99) при 72 HPI использовали в качестве индикатора уровня репликации вируса. Высокопроизводительная конфокальная микроскопия с высоким содержанием микроскопа ImageXpress Micro была использована для количественной оценки уровня экспрессии pp28, что позволяет получать изображения в системах микропланшетов. Поскольку pp28 является поздним геном, визуализация этого белка будет более точно отражать все стадии репликации вируса.Результаты показали, что 25 миРНК оказали усиливающее действие на репликацию HCMV с оценкой Z выше 1, тогда как 30 миРНК оказали ингибирующее действие с оценкой Z ниже -1. Z -score описывает, на сколько стандартных отклонений данное измерение находится выше или ниже среднего для генеральной совокупности (Curtis et al., 2016). Было обнаружено, что только 4 пула миРНК, нацеленных на фосфатидилинозитол-3-киназу класса II альфа (PI3K-C2A), кластер дифференцировки 4 (CD4), компонент экзосомы 10 (EXOSC10) и протеинкиназу 4 с дефицитом лизина WNK (WNK4), обладают сильным ингибирующим действием ( Z — баллы ниже -2) при репликации HCMV. Однако было обнаружено, что CD4 и WNK4 не экспрессируются в HFF, инфицированных HCMV; таким образом, они были исключены из дальнейшего анализа. PI3K-C2A был дополнительно охарактеризован, поскольку он ранее не был связан с репликацией HCMV во время исследования. Семейство PI3K важно почти для всех аспектов клеточной биологии, действуя почти на все клеточные мембраны, регулируя широкий спектр передачи сигналов, мембранного переноса и метаболических процессов (Jean and Kiger, 2014). Авторы продемонстрировали, что все 4 миРНК из пула миРНК против PI3K-C2A значительно снижают количество pp28-положительных клеток; однако анализ вестерн-блоттинга показал, что нокдаун PI3K-C2A приводил к умеренному снижению pp28.Таким образом, было высказано предположение, что истощение PI3K-C2A с большей вероятностью влияет на продукцию вирусных или клеточных факторов, важных для продуктивной репликации, а не на экспрессию pp28. Используя электронную микроскопию, авторы также показали, что нокдаун PI3K-C2A ведет к накоплению капсидов, которые подверглись вторичной оболочке, но не высвобождаются из клетки.
Однако было обнаружено, что CD4 и WNK4 не экспрессируются в HFF, инфицированных HCMV; таким образом, они были исключены из дальнейшего анализа. PI3K-C2A был дополнительно охарактеризован, поскольку он ранее не был связан с репликацией HCMV во время исследования. Семейство PI3K важно почти для всех аспектов клеточной биологии, действуя почти на все клеточные мембраны, регулируя широкий спектр передачи сигналов, мембранного переноса и метаболических процессов (Jean and Kiger, 2014). Авторы продемонстрировали, что все 4 миРНК из пула миРНК против PI3K-C2A значительно снижают количество pp28-положительных клеток; однако анализ вестерн-блоттинга показал, что нокдаун PI3K-C2A приводил к умеренному снижению pp28.Таким образом, было высказано предположение, что истощение PI3K-C2A с большей вероятностью влияет на продукцию вирусных или клеточных факторов, важных для продуктивной репликации, а не на экспрессию pp28. Используя электронную микроскопию, авторы также показали, что нокдаун PI3K-C2A ведет к накоплению капсидов, которые подверглись вторичной оболочке, но не высвобождаются из клетки. Интересно, что как PI3K класса I, так и класса III, как было показано, участвуют во внутриклеточной передаче сигналов и вторичной оболочке во время инфекции HCMV, соответственно, таким образом, идентификация PI3K класса II как важного фактора хозяина для репликации HCMV иллюстрирует участие всех трех классы PI3K в репликации HCMV и функциональные различия между классами одного и того же семейства белков (Johnson et al., 2001; Шарон-Фрилинг и Шенк, 2014).
Интересно, что как PI3K класса I, так и класса III, как было показано, участвуют во внутриклеточной передаче сигналов и вторичной оболочке во время инфекции HCMV, соответственно, таким образом, идентификация PI3K класса II как важного фактора хозяина для репликации HCMV иллюстрирует участие всех трех классы PI3K в репликации HCMV и функциональные различия между классами одного и того же семейства белков (Johnson et al., 2001; Шарон-Фрилинг и Шенк, 2014).
Вирус, экспрессирующий репортер флуоресценции, также может использоваться в качестве косвенного индикатора инфекции и репликации. Например, GFP-экспрессирующий вирус TB40 / E (TB40 / E-GFP) был разработан путем вставки кассеты GFP, управляемой промотором SV40, во внутригенную область между TRS1 и US34 (Umashankar et al., 2011). Использование вируса, экспрессирующего GFP, может значительно сократить время измерения уровня заражения, если экспрессия GFP представляет или коррелирует с репликацией вируса.Обычно скрининг миРНК выполняли в одном цикле репликации, где клетки трансфицировали миРНК, инфицировали вирусом, и экспрессию вирусного гена или измеряли копии вирусного генома как показатель репликации вируса.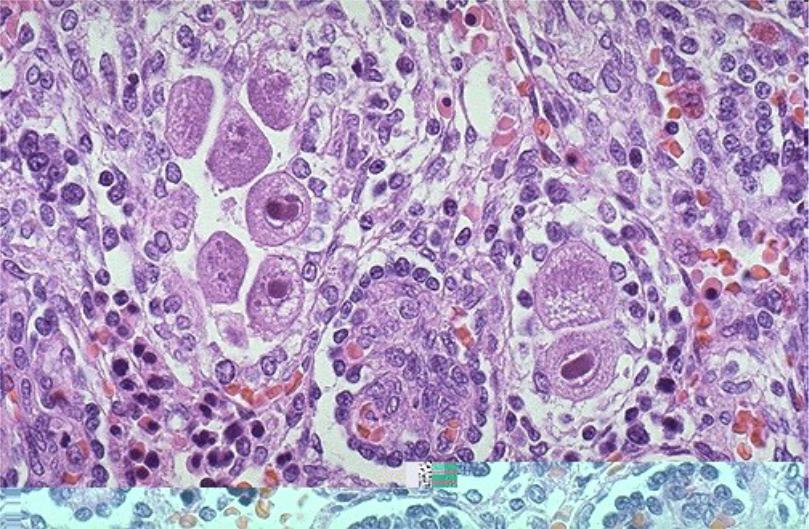 Однако при таком подходе можно упустить факторы хозяина, которые участвуют на более поздних стадиях жизненного цикла вируса, такие как сборка и выход вириона. Подход, состоящий в сборе супернатанта после первого раунда репликации и анализе супернатанта на инфекционные вирионы на клетках, может решить эту проблему.Вышеупомянутый вирус TB40 / E-GFP был использован в скрининге siRNA средней производительности, проведенном в нашей лаборатории, с использованием библиотеки 160 генов-хозяев, участвующих в организации мембраны (Lin et al., 2017; McCormick et al., 2018). Считывание GFP является прямым показателем заражения, но только косвенным показателем производства вируса. В отличие от обычных одноэтапных экранов, в этом исследовании использовался двухэтапный подход. Это включает сбор супернатанта в конце первичного скрининга репликации через 7 дней после инфицирования (DPI) и перенос супернатанта в свежие нетрансфицированные клетки для измерения продукции инфекционного потомства вируса путем экспрессии GFP.
Однако при таком подходе можно упустить факторы хозяина, которые участвуют на более поздних стадиях жизненного цикла вируса, такие как сборка и выход вириона. Подход, состоящий в сборе супернатанта после первого раунда репликации и анализе супернатанта на инфекционные вирионы на клетках, может решить эту проблему.Вышеупомянутый вирус TB40 / E-GFP был использован в скрининге siRNA средней производительности, проведенном в нашей лаборатории, с использованием библиотеки 160 генов-хозяев, участвующих в организации мембраны (Lin et al., 2017; McCormick et al., 2018). Считывание GFP является прямым показателем заражения, но только косвенным показателем производства вируса. В отличие от обычных одноэтапных экранов, в этом исследовании использовался двухэтапный подход. Это включает сбор супернатанта в конце первичного скрининга репликации через 7 дней после инфицирования (DPI) и перенос супернатанта в свежие нетрансфицированные клетки для измерения продукции инфекционного потомства вируса путем экспрессии GFP.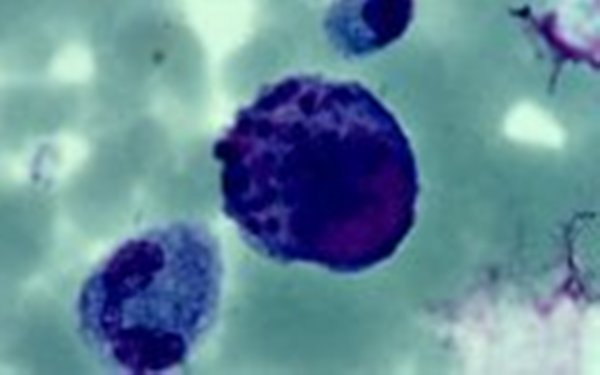 Этот подход независимо измеряет репликацию и продукцию вируса с использованием считывания GFP, которое можно измерить с помощью цитометрии планшета. Мы показали поразительное отсутствие корреляции между результатами первичной репликации и скрининга вирусной продукции. Например, нокдаун некоторых кандидатов снижает уровень экспрессии GFP при первичной репликации, но не влияет на уровень потомства инфекционного вируса. Некоторые из этих факторов могут участвовать в регуляции экспрессии GFP вместо репликации HCMV.Между тем, нокдаун других кандидатов имел ограниченное влияние на первичную репликацию, но производство вируса было существенно подавлено. Эти факторы представляли бы ложноотрицательных кандидатов на обычных пошаговых экранах. Этот анализ выявил преимущества двухэтапного подхода к скринингу в выявлении факторов хозяина, участвующих как в ранних (например, вхождение и ранняя экспрессия генов), так и в поздних (например, поздняя экспрессия генов и сборка / выход вириона) стадии жизненного цикла вируса.
Этот подход независимо измеряет репликацию и продукцию вируса с использованием считывания GFP, которое можно измерить с помощью цитометрии планшета. Мы показали поразительное отсутствие корреляции между результатами первичной репликации и скрининга вирусной продукции. Например, нокдаун некоторых кандидатов снижает уровень экспрессии GFP при первичной репликации, но не влияет на уровень потомства инфекционного вируса. Некоторые из этих факторов могут участвовать в регуляции экспрессии GFP вместо репликации HCMV.Между тем, нокдаун других кандидатов имел ограниченное влияние на первичную репликацию, но производство вируса было существенно подавлено. Эти факторы представляли бы ложноотрицательных кандидатов на обычных пошаговых экранах. Этот анализ выявил преимущества двухэтапного подхода к скринингу в выявлении факторов хозяина, участвующих как в ранних (например, вхождение и ранняя экспрессия генов), так и в поздних (например, поздняя экспрессия генов и сборка / выход вириона) стадии жизненного цикла вируса. Скрининг успешно идентифицировал валозин-содержащий белок, VCP, в качестве важного фактора хозяина для первичной репликации HCMV (Lin et al., 2017). VCP является членом семейства гексамерных ААА-АТФаз и играет роль в передаче сигналов, опосредованной убиквитином, путем ремоделирования целевых белков, которые часто разрушаются протеасомами. Было обнаружено, что VCP участвует в регуляции экспрессии двух основных вирусных предранних генов, IE1 и IE2, а нокдаун VCP приводит к потере экспрессии IE2 и последующей потере экспрессии ранних и поздних генов. Было также показано, что VCP колокализуется с компартментами репликации вируса в ядре, и было показано, что низкомолекулярный ингибитор VCP, NMS-873, является мощным противовирусным вирусом HCMV.Тот же самый скрининг также выявил новые факторы хозяина, участвующие в сборке и выходе вируса, включая ERC1, RAB4B, COPA и COPB2 (McCormick et al., 2018). Нокдаун этих кандидатов привел к небольшому снижению первичной репликации или отсутствию его вообще, но значительно снизил производство вируса.
Скрининг успешно идентифицировал валозин-содержащий белок, VCP, в качестве важного фактора хозяина для первичной репликации HCMV (Lin et al., 2017). VCP является членом семейства гексамерных ААА-АТФаз и играет роль в передаче сигналов, опосредованной убиквитином, путем ремоделирования целевых белков, которые часто разрушаются протеасомами. Было обнаружено, что VCP участвует в регуляции экспрессии двух основных вирусных предранних генов, IE1 и IE2, а нокдаун VCP приводит к потере экспрессии IE2 и последующей потере экспрессии ранних и поздних генов. Было также показано, что VCP колокализуется с компартментами репликации вируса в ядре, и было показано, что низкомолекулярный ингибитор VCP, NMS-873, является мощным противовирусным вирусом HCMV.Тот же самый скрининг также выявил новые факторы хозяина, участвующие в сборке и выходе вируса, включая ERC1, RAB4B, COPA и COPB2 (McCormick et al., 2018). Нокдаун этих кандидатов привел к небольшому снижению первичной репликации или отсутствию его вообще, но значительно снизил производство вируса. Дальнейшие исследования характеристик показали различные функции этих четырех генов-хозяев в регуляции экспрессии вирусных генов, амплификации ДНК, сборки и выхода.
Дальнейшие исследования характеристик показали различные функции этих четырех генов-хозяев в регуляции экспрессии вирусных генов, амплификации ДНК, сборки и выхода.
Совсем недавно мы сообщили о высокопроизводительном скрининге siRNA с использованием библиотеки, нацеленной на 6,881 ген-хозяин, которые считаются лекарственными и обладают высоким терапевтическим потенциалом (Lee et al., 2019). Используя нормальные клетки дермальных фибробластов человека (NHDF, аналогичные HFF) и TB40 / E-GFP, скрининг выявил 47 провирусных и 68 противовирусных факторов, участвующих в широком спектре клеточных функций, таких как регуляция транскрипции медиаторным комплексом и протеасомная деградация. Было показано, что аспарагинсинтетаза (ASNS) является провирусным фактором HCMV, о котором ранее не сообщалось. Было обнаружено, что нокдаун ASNS ингибирует репликацию HCMV на ранней стадии, и дальнейшие анализы с помощью вестерн-блоттинга показали, что экспрессия IE2 ингибируется в клетках с истощенным ASNS. Существует ряд исследований, демонстрирующих, что аминокислоты действуют не только в биосинтезе белка; вместо этого они участвуют в ряде клеточных путей, включая клеточный цикл, апоптоз и трансляцию белков (Gong and Basilico, 1990; Kimball and Jefferson, 2006; Jewell et al., 2013; Meijer et al., 2015). Основная функция ASNS состоит в том, чтобы производить несущественную аминокислоту аспарагин через глутамин и аспартат АТФ-зависимым образом. Было показано, что аспарагин влияет на клеточный цикл, поскольку снижение внутриклеточных уровней аспарагина вызывает остановку клеточного цикла в фазе G1 (Gong and Basilico, 1990).Однако, поскольку HCMV вызывает остановку клеточного цикла в фазе G1 / S, индукция остановки клеточного цикла из-за истощения аспарагина не объясняет раннее ингибирование репликации вируса. Также было показано, что аспарагин регулирует поглощение аминокислот в раковых клетках и косвенно, как фактор обмена аминокислот, регулирует путь mTOR, который контролирует синтез белка (Krall et al.
Существует ряд исследований, демонстрирующих, что аминокислоты действуют не только в биосинтезе белка; вместо этого они участвуют в ряде клеточных путей, включая клеточный цикл, апоптоз и трансляцию белков (Gong and Basilico, 1990; Kimball and Jefferson, 2006; Jewell et al., 2013; Meijer et al., 2015). Основная функция ASNS состоит в том, чтобы производить несущественную аминокислоту аспарагин через глутамин и аспартат АТФ-зависимым образом. Было показано, что аспарагин влияет на клеточный цикл, поскольку снижение внутриклеточных уровней аспарагина вызывает остановку клеточного цикла в фазе G1 (Gong and Basilico, 1990).Однако, поскольку HCMV вызывает остановку клеточного цикла в фазе G1 / S, индукция остановки клеточного цикла из-за истощения аспарагина не объясняет раннее ингибирование репликации вируса. Также было показано, что аспарагин регулирует поглощение аминокислот в раковых клетках и косвенно, как фактор обмена аминокислот, регулирует путь mTOR, который контролирует синтез белка (Krall et al. , 2016). Ранее серия исследований показала, что HCMV поддерживает активацию mTOR во время депривации незаменимых аминокислот посредством связывания и антагонизма главного супрессора mTOR, комплекса субъединиц туберозного склероза 2 (TSC2), вирусным белком UL38 (Moorman et al., 2008; Terhune et al., 2010; Клиппингер и др., 2011; Родригес-Санчес и др., 2019). Как и в случае депривации незаменимых аминокислот, активность mTOR, измеряемая по фосфорилированию киназы S6, также поддерживалась вирусом после нокдауна ASNS. Кроме того, нокдаун ASNS не повлиял на репликацию вируса другого герпесвируса человека, вируса простого герпеса-1 (HSV-1) или вируса гриппа A, что свидетельствует о том, что клетки с истощенным ASNS все еще способны продолжать синтез белка и поддерживать репликацию вируса.Эти данные предполагают, что может существовать неизвестный путь, регулируемый внутриклеточными уровнями аспарагина, влияющими на репликацию HCMV. Чтобы продемонстрировать, что эффект нокдауна ASNS обусловлен снижением уровня аспарагина, мы продемонстрировали, что репликация вируса полностью восстанавливается путем добавления экзогенного аспарагина во время инфекции в клетках с истощенным ASNS.
, 2016). Ранее серия исследований показала, что HCMV поддерживает активацию mTOR во время депривации незаменимых аминокислот посредством связывания и антагонизма главного супрессора mTOR, комплекса субъединиц туберозного склероза 2 (TSC2), вирусным белком UL38 (Moorman et al., 2008; Terhune et al., 2010; Клиппингер и др., 2011; Родригес-Санчес и др., 2019). Как и в случае депривации незаменимых аминокислот, активность mTOR, измеряемая по фосфорилированию киназы S6, также поддерживалась вирусом после нокдауна ASNS. Кроме того, нокдаун ASNS не повлиял на репликацию вируса другого герпесвируса человека, вируса простого герпеса-1 (HSV-1) или вируса гриппа A, что свидетельствует о том, что клетки с истощенным ASNS все еще способны продолжать синтез белка и поддерживать репликацию вируса.Эти данные предполагают, что может существовать неизвестный путь, регулируемый внутриклеточными уровнями аспарагина, влияющими на репликацию HCMV. Чтобы продемонстрировать, что эффект нокдауна ASNS обусловлен снижением уровня аспарагина, мы продемонстрировали, что репликация вируса полностью восстанавливается путем добавления экзогенного аспарагина во время инфекции в клетках с истощенным ASNS. Примечательно, что при истощении ASNS репликация вируса может быть полностью устранена путем введения экзогенного аспарагина в течение 7 дней после заражения. Это говорит о том, что в клетках с истощением ASNS HCMV может проникать в клетку и экспрессировать IE1, но не IE2; таким образом, вирус остается в клетке в состоянии покоя, но сохраняет способность к полной репликации через несколько дней после первоначального заражения и требует только аспарагина для возобновления своей репликации.
Примечательно, что при истощении ASNS репликация вируса может быть полностью устранена путем введения экзогенного аспарагина в течение 7 дней после заражения. Это говорит о том, что в клетках с истощением ASNS HCMV может проникать в клетку и экспрессировать IE1, но не IE2; таким образом, вирус остается в клетке в состоянии покоя, но сохраняет способность к полной репликации через несколько дней после первоначального заражения и требует только аспарагина для возобновления своей репликации.
Существуют исследования раковых клеток, показывающие необходимость аспарагина для клеточной адаптации во время голодания по глутамину и для биосинтеза нуклеотидов (Zhang et al., 2014; Zhu et al., 2017). Кроме того, аспарагиназа, фермент, который превращает аспарагин в аспартат и аммиак, использовался для лечения рака, включая острый лимфобластный лейкоз, острый миелоидный лейкоз и неходжкинскую лимфому (Hettmer et al., 2015; Bu et al., 2016; Egler et al. др., 2016). Однако в некоторых случаях рака сообщается о резистентности к аспарагиназе, и было предложено использование ингибиторов ASNS, которые в настоящее время находятся в процессе разработки (Gutierrez et al.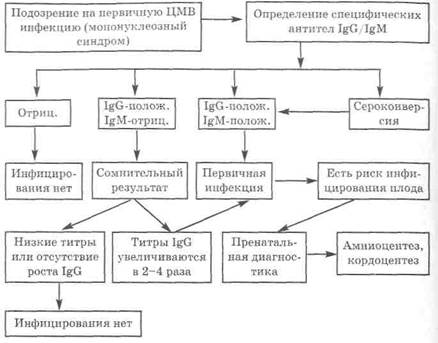 , 2006). Следовательно, существует возможность перепрофилировать противораковые препараты для лечения HCMV на основе аналогичной зависимости от аспарагина между раком и HCMV, или, возможно, простое диетическое ограничение у пациентов с высоким риском инфекции HCMV может предотвратить распространение вируса. Способность «возобновлять» репликацию вируса путем добавления экзогенного аспарагина в клетки с истощенным ASNS также предполагает потенциальное влияние уровней аспарагина и экспрессии ASNS на установление и поддержание латентного периода HCMV.На данном этапе неясно, почему HCMV требует аспарагина для эффективной репликации, в то время как другие герпесвирусы, такие как HSV-1, этого не делают.
, 2006). Следовательно, существует возможность перепрофилировать противораковые препараты для лечения HCMV на основе аналогичной зависимости от аспарагина между раком и HCMV, или, возможно, простое диетическое ограничение у пациентов с высоким риском инфекции HCMV может предотвратить распространение вируса. Способность «возобновлять» репликацию вируса путем добавления экзогенного аспарагина в клетки с истощенным ASNS также предполагает потенциальное влияние уровней аспарагина и экспрессии ASNS на установление и поддержание латентного периода HCMV.На данном этапе неясно, почему HCMV требует аспарагина для эффективной репликации, в то время как другие герпесвирусы, такие как HSV-1, этого не делают.
Еще один способ измерения вирусной инфекции с помощью высокопроизводительного скрининга siRNA — количественное определение уровней ключевых вирусных транскриптов с помощью RNA-seq или количественной полимеразной цепной реакции с обратной транскрипцией (RT-qPCR) (Song et al., 2019). Недавно было сообщено о высокопроизводительном скрининге siRNA, в котором изучалась роль клеточных факторов процессинга РНК в иммунной регуляции во время литической инфекции HCMV.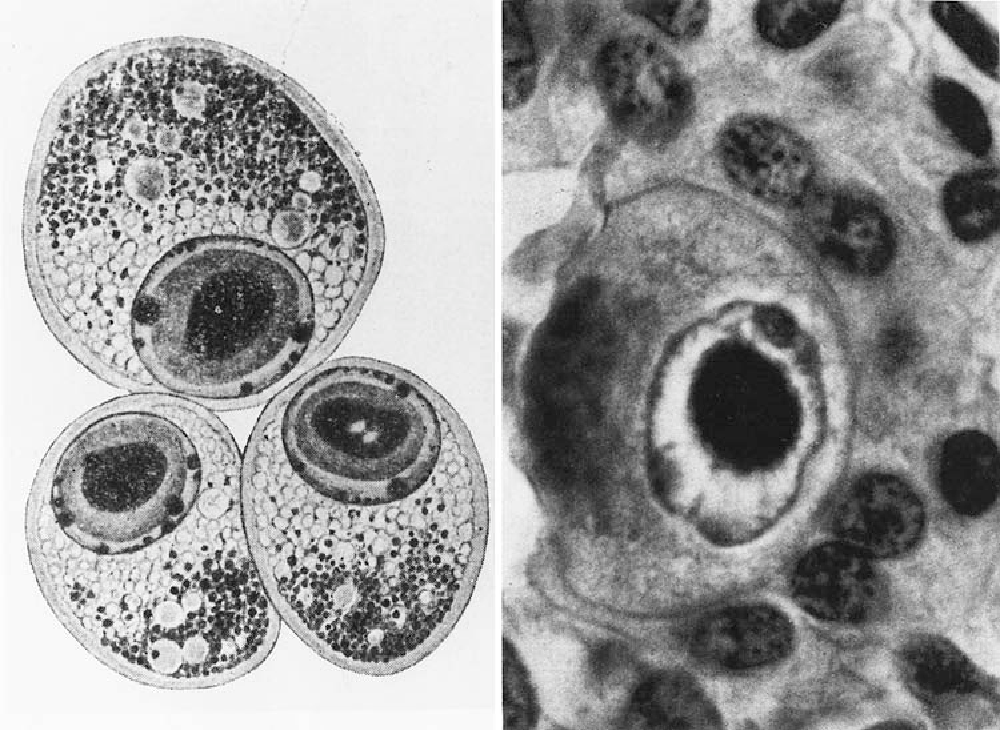 Ориентируясь на 687 генов, участвующих в процессинге клеточной РНК, включая РНК-связывающие белки и рибонуклеазы, с использованием объединенных миРНК (4 миРНК на ген), клетки HFF инфицировали штаммом Toledo с низкими пассажами HCMV, и эффективность заражения определяли количественно путем измерения уровней мРНК IE1 ( немедленный-ранний), UL44 (ранний) и UL99 (поздний) гены на 48 HPI (Song et al., 2019). Нокдаун 36 генов показал как минимум 3-кратное снижение уровней мРНК экспрессии вирусного позднего гена UL99. Авторы проследили за одним из кандидатов, РНК-связывающим белком Roquin, кодируемым геном RC3h2, и показали, что экспрессия Roquin индуцируется HCMV и необходима для эффективной продуктивной инфекции.Роквин играет важную роль как во врожденной, так и в адаптивной иммунной системе и способствует распаду мРНК транскриптов, играя роль в иммунитете (Athanasopoulos et al., 2016). Анализ последовательности РНК, проведенный на инфицированных HCMV и ложно инфицированных клетках Roquin, истощенных, выявил повышенную продукцию провоспалительных цитокинов, таких как интерлейкин-6 (IL-6) и IL-1B.
Ориентируясь на 687 генов, участвующих в процессинге клеточной РНК, включая РНК-связывающие белки и рибонуклеазы, с использованием объединенных миРНК (4 миРНК на ген), клетки HFF инфицировали штаммом Toledo с низкими пассажами HCMV, и эффективность заражения определяли количественно путем измерения уровней мРНК IE1 ( немедленный-ранний), UL44 (ранний) и UL99 (поздний) гены на 48 HPI (Song et al., 2019). Нокдаун 36 генов показал как минимум 3-кратное снижение уровней мРНК экспрессии вирусного позднего гена UL99. Авторы проследили за одним из кандидатов, РНК-связывающим белком Roquin, кодируемым геном RC3h2, и показали, что экспрессия Roquin индуцируется HCMV и необходима для эффективной продуктивной инфекции.Роквин играет важную роль как во врожденной, так и в адаптивной иммунной системе и способствует распаду мРНК транскриптов, играя роль в иммунитете (Athanasopoulos et al., 2016). Анализ последовательности РНК, проведенный на инфицированных HCMV и ложно инфицированных клетках Roquin, истощенных, выявил повышенную продукцию провоспалительных цитокинов, таких как интерлейкин-6 (IL-6) и IL-1B. Однако повышенная продукция провоспалительных цитокинов, хемокинов, интерферонов (IFN) и генов, стимулированных интерфероном (ISG) была более резкой в инфицированных клетках, при этом уровни цитокинов индуцировались более чем в 200 раз при 72 HPI.IFN и ISG показали сильную индукцию при 24 HPI в клетках, истощенных по Рокину. Последовательный анализ перекрестно-сшивающей иммунопреципитации (CLIP) был проведен для идентификации последовательностей мРНК, на которые нацелен Roquin во время инфекции HCMV, и обнаружено обогащение ранее известных мишеней Roquin, таких как провоспалительный цитокин IL-6 и хемокин CXCL2, а также новых мишеней, включая dickkopf, ингибитор 1 сигнального пути WNT (DKK1) и белок, связывающий фактор регуляции интерферона 2 (IRF2BPL). Мишени мРНК, идентифицированные в анализе CLIP-seq, также были обнаружены обогащенными клетками, истощенными Roquin, что позволяет предположить, что Roquin избирательно нацелен на эти гены для подавления во время инфекции HCMV.Наконец, для определения конкретных мишеней Roquin, участвующих в экспрессии гена HCMV, для нокдауна siRNA были отобраны 109 генов, которые показали повышенную экспрессию при истощении запасов Roquin, наряду с истощением Roquin и инфекцией, мониторинг которых проводился путем количественной оценки уровня мРНК позднего гена UL146 HCMV.
Однако повышенная продукция провоспалительных цитокинов, хемокинов, интерферонов (IFN) и генов, стимулированных интерфероном (ISG) была более резкой в инфицированных клетках, при этом уровни цитокинов индуцировались более чем в 200 раз при 72 HPI.IFN и ISG показали сильную индукцию при 24 HPI в клетках, истощенных по Рокину. Последовательный анализ перекрестно-сшивающей иммунопреципитации (CLIP) был проведен для идентификации последовательностей мРНК, на которые нацелен Roquin во время инфекции HCMV, и обнаружено обогащение ранее известных мишеней Roquin, таких как провоспалительный цитокин IL-6 и хемокин CXCL2, а также новых мишеней, включая dickkopf, ингибитор 1 сигнального пути WNT (DKK1) и белок, связывающий фактор регуляции интерферона 2 (IRF2BPL). Мишени мРНК, идентифицированные в анализе CLIP-seq, также были обнаружены обогащенными клетками, истощенными Roquin, что позволяет предположить, что Roquin избирательно нацелен на эти гены для подавления во время инфекции HCMV.Наконец, для определения конкретных мишеней Roquin, участвующих в экспрессии гена HCMV, для нокдауна siRNA были отобраны 109 генов, которые показали повышенную экспрессию при истощении запасов Roquin, наряду с истощением Roquin и инфекцией, мониторинг которых проводился путем количественной оценки уровня мРНК позднего гена UL146 HCMV.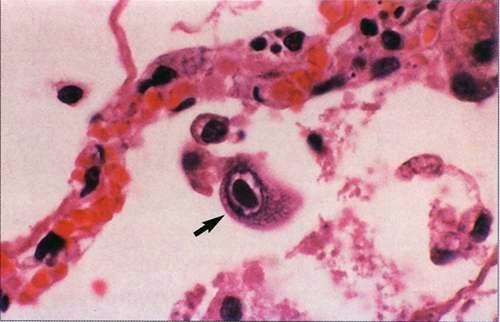 После нокдауна инфицированных HCMV клеток Roquin, истощенных, ANKRD52, CDK6, CFL2 и IRF1 показали восстановление> 50% экспрессии гена UL146. Авторы предположили, что Roquin может подавлять экспрессию ANKRD52, чтобы ингибировать клеточную miRNA-зависимую регуляцию, которая может участвовать во врожденных противовирусных ответах.Более того, подавление CDK6 и CFL2 с помощью Roquin может установить клеточную среду, контролируя клеточный цикл и цитоскелет, соответственно. Поскольку IRF1 является хорошо изученным активатором транскрипции различных цитокинов, его роль в качестве мишени для Roquin во время репликации HCMV была дополнительно изучена. Был сделан вывод, что опосредованное Roquin подавление IRF1 важно для репликации HCMV, опосредуя уровни цитокинов.
После нокдауна инфицированных HCMV клеток Roquin, истощенных, ANKRD52, CDK6, CFL2 и IRF1 показали восстановление> 50% экспрессии гена UL146. Авторы предположили, что Roquin может подавлять экспрессию ANKRD52, чтобы ингибировать клеточную miRNA-зависимую регуляцию, которая может участвовать во врожденных противовирусных ответах.Более того, подавление CDK6 и CFL2 с помощью Roquin может установить клеточную среду, контролируя клеточный цикл и цитоскелет, соответственно. Поскольку IRF1 является хорошо изученным активатором транскрипции различных цитокинов, его роль в качестве мишени для Roquin во время репликации HCMV была дополнительно изучена. Был сделан вывод, что опосредованное Roquin подавление IRF1 важно для репликации HCMV, опосредуя уровни цитокинов.
shRNA Исследования HCMV
В дополнение к скринингу siRNA с нокдауном индивидуального гена в форматах микролуночных планшетов, крупномасштабные объединенные библиотеки лентивирусных векторов экспрессии shRNA обеспечивают еще одно приложение для идентификации взаимодействий хозяина и вируса. shRNAs имеют длину около 80 нуклеотидов со структурой стержень-петля, подобной pre-miRNA (Fennell et al., 2014). Перед включением в RISC они требуют обработки белком Dicer. В отличие от миРНК, которые обычно трансфицируются в клетки как дуплексные РНК, кшРНК обычно конструируют в лентивирусные векторы и интегрируют в геномную ДНК для более длительной и стабильной экспрессии.
shRNAs имеют длину около 80 нуклеотидов со структурой стержень-петля, подобной pre-miRNA (Fennell et al., 2014). Перед включением в RISC они требуют обработки белком Dicer. В отличие от миРНК, которые обычно трансфицируются в клетки как дуплексные РНК, кшРНК обычно конструируют в лентивирусные векторы и интегрируют в геномную ДНК для более длительной и стабильной экспрессии.
Высокопроизводительный скрининг shRNA использовали для идентификации факторов хозяина, участвующих в опосредованной HCMV US11 деградации HLA класса I через путь деградации белка, ассоциированного с эндоплазматическим ретикулумом (ERAD).Была создана библиотека shRNA с высоким охватом, состоящая примерно из 55000 последовательностей (около 30 отдельных shRNA на ген), нацеленных на все известные гены, кодирующие человеческие белки (van de Weijer et al., 2014). Каждый лентивирусный вектор shRNA экспрессирует mCherry. Использовали линию моноцитарных клеток U937, коэкспрессирующую HCMV US11 и химерные молекулы HLA-A2 с меченным на N-конце eGFP и Myc-эпитопом. Используя химерные молекулы HLA-A2 в качестве индикатора опосредованной US11 деградации, уровень экспрессии молекулы HLA класса I можно контролировать, измеряя сигнал GFP на поверхности клетки с помощью проточной цитометрии или используя специфические антитела к Myc.До трансдукции shRNA было подтверждено, что экспрессия HCMV US11 значительно снижает экспрессию GFP из химерных молекул HLA-A2. После трансдукции shRNA клетки были отсортированы с помощью сигнала GFP в популяции GFP-bright и GFP-dim, а популяция GFP-bright дополнительно сортируется по чистоте путем отбора mCherry-позитивных клеток (клеток, трансдуцированных вектором shRNA лентивируса) и GFP-светлых клеток. . Около 2,8 миллиона mCherry-позитивных GFP-светлых клеток на экран были отобраны для глубокого секвенирования вместе со 115 миллионами mCherry-позитивных GFP-тусклых клеток в качестве контроля.Считается, что GFP-светлые популяции нарушили опосредованное US11 подавление HLA класса I. Было выполнено два независимых скрининга, и перекрывающиеся гены в 100 лучших из двух скринингов включают субъединицы коатомера (например, COPA и COPB2) и субъединицы протеасомы (например, PSMD1 и PSMC2).
Используя химерные молекулы HLA-A2 в качестве индикатора опосредованной US11 деградации, уровень экспрессии молекулы HLA класса I можно контролировать, измеряя сигнал GFP на поверхности клетки с помощью проточной цитометрии или используя специфические антитела к Myc.До трансдукции shRNA было подтверждено, что экспрессия HCMV US11 значительно снижает экспрессию GFP из химерных молекул HLA-A2. После трансдукции shRNA клетки были отсортированы с помощью сигнала GFP в популяции GFP-bright и GFP-dim, а популяция GFP-bright дополнительно сортируется по чистоте путем отбора mCherry-позитивных клеток (клеток, трансдуцированных вектором shRNA лентивируса) и GFP-светлых клеток. . Около 2,8 миллиона mCherry-позитивных GFP-светлых клеток на экран были отобраны для глубокого секвенирования вместе со 115 миллионами mCherry-позитивных GFP-тусклых клеток в качестве контроля.Считается, что GFP-светлые популяции нарушили опосредованное US11 подавление HLA класса I. Было выполнено два независимых скрининга, и перекрывающиеся гены в 100 лучших из двух скринингов включают субъединицы коатомера (например, COPA и COPB2) и субъединицы протеасомы (например, PSMD1 и PSMC2). VCP также был идентифицирован как явный хит, и этот ген был идентифицирован в нашем скрининге siRNA средней производительности (Lin et al., 2017). Некоторые белки, участвующие в пути убиквитина, были идентифицированы в популяциях GFP-bright, но не отвечали строгим критериям отсечения, включая убиквитин B, убиквитин C, убиквитин-активирующий фермент E1 (UAE1) и E2-конъюгирующий фермент UBE2J2.Авторы сосредоточились на трансмембранном белке 129 (TMEM129) и показали, что TMEM129 является новой убиквитинлигазой E3 и важен для подавления HLA класса I, опосредованного HCMV US11. Авторы также продемонстрировали участие UBE2J2, E2 убиквитин-конъюгированного фермента, в опосредованном US11 подавлении HLA класса I с использованием shRNA и методов CRISPR / Cas9. Несколько лет спустя те же исследовательские группы дополнительно изучили свое исследование и выполнили CRISPR / Cas9-скрининг для выявления E2-убиквитин-конъюгированных ферментов, которые участвуют в регуляции опосредованного HCMV US2-опосредованного подавления HLA класса I.
VCP также был идентифицирован как явный хит, и этот ген был идентифицирован в нашем скрининге siRNA средней производительности (Lin et al., 2017). Некоторые белки, участвующие в пути убиквитина, были идентифицированы в популяциях GFP-bright, но не отвечали строгим критериям отсечения, включая убиквитин B, убиквитин C, убиквитин-активирующий фермент E1 (UAE1) и E2-конъюгирующий фермент UBE2J2.Авторы сосредоточились на трансмембранном белке 129 (TMEM129) и показали, что TMEM129 является новой убиквитинлигазой E3 и важен для подавления HLA класса I, опосредованного HCMV US11. Авторы также продемонстрировали участие UBE2J2, E2 убиквитин-конъюгированного фермента, в опосредованном US11 подавлении HLA класса I с использованием shRNA и методов CRISPR / Cas9. Несколько лет спустя те же исследовательские группы дополнительно изучили свое исследование и выполнили CRISPR / Cas9-скрининг для выявления E2-убиквитин-конъюгированных ферментов, которые участвуют в регуляции опосредованного HCMV US2-опосредованного подавления HLA класса I. Тридцать шесть известных человеческих ферментов E2 были нацелены, и было создано 112 одиночных направляющих РНК (sgRNA) (van de Weijer et al., 2017). Ту же моноцитарную клеточную линию U937, экспрессирующую молекулу HLA-A2 с N-концевой меткой eGFP, использовали для обнаружения экспрессии HLA класса I, опосредованной HCMV US2. Была использована стратегия, аналогичная скринингу shRNA, и UBE2G2 и UBE2D3 были идентифицированы как важные факторы для подавления опосредованной US2 HLA класса I, поскольку sgRNAs, нацеленные на эти два белка, приводили к повышенной экспрессии молекул HLA-A2, меченных GFP.Однако sgRNAs, нацеленные на UBE2J2, приводили к дальнейшему подавлению экспрессии HLA-A2, предполагая, что UBE2J2 противодействует подавлению HLA класса I с помощью US2 во время инфекции HCMV. Интересно, что UBE2J2 также был идентифицирован при скрининге shRNA, но он показал противоположные функции для US11-опосредованной и US2-опосредованной деградации HLA класса I. К сожалению, объяснение этого не было дано в последнем отчете; однако возможно, что UBE2J2 участвует в регуляции деградации HLA класса I между двумя вирусными белками по неизвестному механизму.
Тридцать шесть известных человеческих ферментов E2 были нацелены, и было создано 112 одиночных направляющих РНК (sgRNA) (van de Weijer et al., 2017). Ту же моноцитарную клеточную линию U937, экспрессирующую молекулу HLA-A2 с N-концевой меткой eGFP, использовали для обнаружения экспрессии HLA класса I, опосредованной HCMV US2. Была использована стратегия, аналогичная скринингу shRNA, и UBE2G2 и UBE2D3 были идентифицированы как важные факторы для подавления опосредованной US2 HLA класса I, поскольку sgRNAs, нацеленные на эти два белка, приводили к повышенной экспрессии молекул HLA-A2, меченных GFP.Однако sgRNAs, нацеленные на UBE2J2, приводили к дальнейшему подавлению экспрессии HLA-A2, предполагая, что UBE2J2 противодействует подавлению HLA класса I с помощью US2 во время инфекции HCMV. Интересно, что UBE2J2 также был идентифицирован при скрининге shRNA, но он показал противоположные функции для US11-опосредованной и US2-опосредованной деградации HLA класса I. К сожалению, объяснение этого не было дано в последнем отчете; однако возможно, что UBE2J2 участвует в регуляции деградации HLA класса I между двумя вирусными белками по неизвестному механизму.
Исследования CRISPR / Cas9 в HCMV
Клеточная РНКи была основной системой для высокопроизводительного возмущения генов, но некоторые проблемы и ограничения сохраняются, включая токсичность и нецелевые эффекты (Mashalidis et al., 2013; Jadhav, 2014). Нецелевые эффекты миРНК являются обычным явлением и могут возникать, когда непреднамеренные транскрипты заглушаются миРНК за счет частичной комплементарности последовательностей или когда цепи-пассажира миРНК загружаются в RISC (Jackson and Linsley, 2010; Lam et al., 2015). siRNA и / или их носители для доставки также могут запускать воспалительный ответ через активацию Toll-подобных рецепторов (TLR), вызывая непрямое ингибирование репликации вируса. Однако объединение нескольких siRNAs с одним и тем же транскриптом-мишенью может помочь уменьшить сайленсинг вне мишени из-за конкуренции между siRNAs в пуле (Kittler et al., 2007).
В отличие от РНКи, технология CRISPR / Cas9 напрямую нацелена на ДНК для полного нокаута гена и была адаптирована для высокопроизводительных скринингов, поскольку она преодолевает некоторые ограничения скрининга РНКи, включая неполное подавление целевых генов и эффекты вне мишени (Пикар-Оливер и Герсбах , 2019). CRISPR / Cas9 позволяет специфические манипуляции с геномами на основе экспрессии модифицированного белка Cas9 и одиночных направляющих РНК (sgRNA). По своей природе CRISPR представляет собой прокариотический иммунный ответ на вторжение ДНК, таких как бактериофаги и транспозоны. Специализированные эндонуклеазы, называемые белками Cas, используют CRISPR РНК (crRNA) для распознавания и расщепления целевой последовательности. В зависимости от белков Cas ДНК может быть разрезана на одной цепи или расщеплена на обеих цепях. Белок Cas9 был впервые обнаружен в Streptococcus pyogenes и перепрограммирован для редактирования генома в клетках млекопитающих (Pickar-Oliver and Gersbach, 2019).Cas9, содержащий два различных нуклеазных домена, RuvC и HNH, обычно расщепляет каждую цепь каждым нуклеазным доменом, создавая двухцепочечный разрыв ДНК (DSB), который восстанавливается либо путем гомологически направленной репарации (HDR), либо негомологичным концевым соединением ( NHEJ) путь. Восстановление NHEJ более распространено, потому что эффективность HDR зависит от концентрации гомологичной ДНК-матрицы во время репарации, длины гомологии и активности эндогенной системы репарации (Lin et al., 2014; Маруяма и др., 2015). Из-за склонности к ошибкам пути репарации NHEJ часто вводятся мутации путем вставки или делеции в целевой сайт, что впоследствии приводит к потенциальному сдвигу рамки считывания и преждевременным стоп-кодонам ниже.
CRISPR / Cas9 позволяет специфические манипуляции с геномами на основе экспрессии модифицированного белка Cas9 и одиночных направляющих РНК (sgRNA). По своей природе CRISPR представляет собой прокариотический иммунный ответ на вторжение ДНК, таких как бактериофаги и транспозоны. Специализированные эндонуклеазы, называемые белками Cas, используют CRISPR РНК (crRNA) для распознавания и расщепления целевой последовательности. В зависимости от белков Cas ДНК может быть разрезана на одной цепи или расщеплена на обеих цепях. Белок Cas9 был впервые обнаружен в Streptococcus pyogenes и перепрограммирован для редактирования генома в клетках млекопитающих (Pickar-Oliver and Gersbach, 2019).Cas9, содержащий два различных нуклеазных домена, RuvC и HNH, обычно расщепляет каждую цепь каждым нуклеазным доменом, создавая двухцепочечный разрыв ДНК (DSB), который восстанавливается либо путем гомологически направленной репарации (HDR), либо негомологичным концевым соединением ( NHEJ) путь. Восстановление NHEJ более распространено, потому что эффективность HDR зависит от концентрации гомологичной ДНК-матрицы во время репарации, длины гомологии и активности эндогенной системы репарации (Lin et al., 2014; Маруяма и др., 2015). Из-за склонности к ошибкам пути репарации NHEJ часто вводятся мутации путем вставки или делеции в целевой сайт, что впоследствии приводит к потенциальному сдвигу рамки считывания и преждевременным стоп-кодонам ниже.
Библиотека CRISPR для нокаута по всему геному человека (GeCKO) использовалась в скрининге для определения факторов хозяина, необходимых для репликации HCMV. Библиотека нацелена на 19 050 генов человека с более чем 120000 последовательностей sgRNA (Wu et al., 2018). Два штамма HCMV, которые экспрессируют только вирусный тримерный гликопротеиновый комплекс (gH / gL / gO), AD169 со вставкой сдвига рамки считывания в UL131A и Merlin с нонсенс-мутацией в UL128, были использованы для заражения HFF.Выжившие после заражения клетки собирали для анализа последовательности обогащения sgRNA, и sgRNA, нацеленные на рецептор тромбоцитарного фактора роста альфа (PDGFRα), были обогащены в клетках, инфицированных обоими тримерными вирусами. Было показано, что иммуноглобулиноподобный домен 3 PDGFRα, но не киназный домен, необходим для проникновения HCMV через тримерный комплекс. Однако фибробластные клетки с нокаутом PDGFRα остаются чувствительными к HCMV, который размножается в эпителиальных клетках, экспрессирующих пентамерный комплекс (gH / gL / pUL128-pUL130-pUL131A).
Недавний скрининг CRISPR / Cas9 выявил член семейства обонятельных рецепторов, OR14I1, как важный рецептор для прикрепления, проникновения и инфицирования эпителиальных клеток пентамерным комплексом, экспрессирующим HCMV (Xiaofei et al., 2019). Используя одну и ту же библиотеку GeCKO человека (19 050 генов человека, 6 sgRNA на ген), было проведено два параллельных скрининга любой линии 19 пигментных эпителиальных клеток сетчатки взрослого человека (ARPE-19), инфицированных эпителиально-тропным TB40 / E (экспрессирующим оба тримерных gH / gL / gO и петамерные комплексы gH / gL / pUL128-pUL130-pUL131A) или клетки фибробластов эмбрионального легкого человека (HEL), инфицированные фибробласт-тропным AD169 (экспрессирующие только тримерные комплексы gH / gL / gO).После нокаута CRISPR клетки неоднократно подвергались инфекции HCMV в течение 3 месяцев при MOI, равном 5. Когда 95% соответствующих клеток умирали, выжившие клетки размножались и подвергались второму циклу инфицирования. Выжившие клетки с sgRNA-индуцированной устойчивостью к HCMV были подвергнуты секвенированию следующего поколения для идентификации обогащенных sgRNA. Было обнаружено, что sgRNA против OR14I1 или PDGFRα обогащены пентамарным комплексом, экспрессирующим инфицированные TB40 / E клетки. Однако только sgRNA против PDGFRα были обогащены тримерным комплексом, экспрессирующим клетки фибробластов, инфицированных AD169, что позволяет предположить, что OR14I1 не требуется для входа через тримерные комплексы.OR14I1 представляет собой рецептор, связанный с G-белком, принадлежащий к семейству обонятельных рецепторов, которые традиционно считаются хемосенсорами для обоняния. Однако ранее было продемонстрировано, что инфекционные агенты используют рецепторы, связанные с обонянием, для передачи и заражения, такие как мышиный CMV (MCMV) (Farrell et al., 2016). Поэтому любопытно, что для проникновения HCMV также требуется обонятельный рецептор. С помощью анализа мембранной флотации и иммуноблотов было показано, что TB40 / E, который экспрессирует как тримерные, так и пентамерные комплексы, требует как OR14I1, так и PDGFRα для оптимального связывания с эпителиальными клетками.Предполагается, что OR14I1 имеет 4 пептидных участка, экспонированных на поверхности клетки, и было обнаружено, что первый участок, аминокислота 1-26, обладает способностью взаимодействовать с пентамерным комплексом, тем самым ограничивая связывание и репликацию TB40 / E в эпителиальных клетках . Авторы также продемонстрировали, что OR14I1 необходим для активации пути передачи сигналов аденилатциклазы (AC) / протеинкиназы A, и комбинация связывания OR14I1 и активности AC необходима для входа TB40 / E.
CRISPR / Cas9 предлагает полный нокаут гена путем введения мутаций в сайты-мишени вместо подавления экспрессии гена путем индукции деградации мРНК или нарушения трансляции.Скрининг потери функции CRISPR / Cas9 можно проводить с использованием sgRNA против экзонов, некодирующих областей или мотивов факторов транскрипции (Pickar-Oliver and Gersbach, 2019). Есть несколько факторов, которые могут повлиять на эффективность экрана CRISPR / Cas9, в том числе обрезание вне цели, частота и эффективность HDR по сравнению с NHEJ и активность Cas9 (Lino et al., 2018). Однако одной из основных проблем двух скринингов, обсуждаемых в этом обзоре, является смещение в сторону обогащения sgRNAs, нацеленных на поверхностные рецепторы для проникновения вируса.Хотя важность PDGFRα для тримерного комплекса, экспрессирующего вход HCMV, была успешно подтверждена, и OR14I1 был идентифицирован как новый рецептор для пентамерного комплекса, экспрессирующего HCMV, обогащение sgRNAs против других клеточных факторов, которые могут участвовать в экспрессии вирусных генов или других процессах, менее существенно. . Существуют потенциальные способы обойти предвзятость публикуемого в настоящее время CRISPR. Например, вместо использования объединенных лентивирусных векторов и анализов выживаемости можно использовать системы микропланшетов с высокой пропускной способностью, подобные скринингу siRNA, с каждой лункой, содержащей sgRNA, нацеленные на один и тот же ген.Кроме того, сортировка флуоресцентно активированных клеток (FACS) также может быть адаптирована для измерения вирусной инфекции и сортировки клеток на основе уровня репликации вируса перед секвенированием для обогащения sgRNA. Кроме того, в будущем будет приносить прибыль секвенирование отдельных клеток после скрининга CRISPR, поскольку оно помогает анализировать клеточные различия с более высоким разрешением и понимать, как отдельные клетки реагируют на инфекцию. Адаптация других высокопроизводительных методов, таких как автоматизация работы с жидкостью для распределения и сбора жидкости в микропланшетах и микроскопия с высоким содержанием, а также усовершенствование дизайна библиотек sgRNA может привести к новому поколению экранов CRISPR / Cas9 с более высокими показателями идентификации попаданий.
Исследования miRNA в HCMV
Более косвенный, но потенциально мощный подход к идентификации новых взаимодействий хозяин-вирус заключается в обнаружении мишеней miRNA. Герпесвирусы экспрессируют свои собственные вирусные miRNA, которые могут быть нацелены как на вирусные, так и на клеточные транскрипты. Вирусы также модулируют экспрессию клеточных miRNA, тем самым косвенно влияя на экспрессию генов хозяина. Идентифицируя мишени вирусных miRNA, можно обнаружить новые факторы хозяина, важные для репликации вируса; по сути, использование вируса для указания, какие гены-хозяева важны для его цикла репликации.
miRNAs изначально транскрибируются как длинная первичная miRNA (pri-miRNA) с одной или несколькими последовательностями, которые могут гибридизоваться и образовывать шпилечные структуры (Fennell et al., 2014). При-миРНК процессируется РНКазой Drosha / Pasha в ядре с образованием пре-миРНК, которые имеют индивидуальные структуры шпильки типа стержень-петля. Пре-миРНК экспортируются в цитоплазму, где они процессируются белком Dicer с образованием коротких двухцепочечных siRNA-подобных дуплексов miRNA, которые имеют длину 19-25 нуклеотидов (Tomari and Zamore, 2005; Lam et al., 2015). Одноцепочечная зрелая миРНК затем включается в комплекс РНК-индуцированного сайленсинга (RISC), который использует последовательность миРНК в качестве ориентира для распознавания комплементарных транскриптов мРНК и расщепляет мРНК через белок Argonaute, который находится внутри RISC. miRNAs модулируют экспрессию генов в первую очередь посредством нацеливания на 3′-нетранслируемую область (3’UTR) генов и часто имеют несколько мишеней за счет частичной комплементарности (Fennell et al., 2014).
Ранее наша лаборатория выполнила систематический анализ иммунопреципитации RISC (RISC-IP) для выявления факторов хозяина, на которые нацелены миРНК, кодируемые HCMV (Pavelin et al., 2013). Путем опускания RISC с использованием антитела, специфичного к аргонауте 2 (AGO2) и анализа транскриптов мРНК с помощью микроматрицы, ATP6V0C, вакуолярный АТФазный комплекс, участвующий в подкислении эндосомных компартментов, был идентифицирован как новая мишень для вирусного mir-US25-1. Интересно, что дальнейшие исследования характеристик с использованием siRNA против ATP6V0C показали, что истощение ATP6V0C привело к почти полной потере продукции инфекционного вируса, предполагая, что HCMV нацелен на критический фактор хозяина, необходимый для продуктивной репликации вируса.Также было обнаружено, что ATP6V0C необходим для образования компартмента сборки вириона (VAC) во время инфекции HCMV (Pavelin et al., 2017). В настоящее время все еще не совсем понятно, почему HCMV нацелен на ATP6V0C. Мы предположили, что это может быть связано с установлением латентного периода или уклонения от иммунитета, поскольку закисление эндосом необходимо для эффективной презентации антигена MHC класса II, но механизм еще предстоит установить.
Впоследствии сшивание аргонавтом и иммунопреципитация с последующим высокопроизводительным скринингом (AGO-CLIP-seq, также известный как Ago HITS-CLIP) были выполнены в HFF, инфицированных штаммом HCMV Towne long , для выявления сайтов взаимодействия миРНК-мишени ( Kim et al., 2015). По сравнению с анализом RISC-IP, AGO-CLIP-seq включает УФ-перекрестное связывание РНК с белками аргонавта (AGO) и секвенирование мРНК и малых РНК. Кроме того, вместо AGO2-специфического антитела использовали пан-AGO-специфическое моноклональное антитело; таким образом, результаты будут выявить miRNA, ассоциированные со всеми белками AGO, а не специфические взаимодействия с AGO2. У млекопитающих имеется четыре белка AGO, но только AGO2 является каталитически активным и может разрушать транскрипты-мишени (Meister, 2013).AGO-CLIP-seq идентифицировал 3909 человеческих мишеней вирусных miRNA (HTV) из данных, собранных на 24, 48 и 72 HPI, и эти группы целевых генов содержат кластеры пиков с более высоким обогащением в инфицированных образцах, чем в неинфицированных образцах. Тридцать кандидатов с высокой степенью достоверности были отобраны для проверки с помощью количественной ПЦР в реальном времени (qRT-PCR), чтобы изучить кратное уменьшение экспрессии мРНК после трансфекции с направлением вирусных miRNA в HFF. Через 48 часов после трансфекции 26 из 30 были значительно подавлены.Уровни мРНК большинства из этих мишеней были восстановлены или заметно выше при инфицировании мутантными вирусами по miRNA. Авторы сосредоточились на двух путях, на которые нацелены вирусные miRNA: клеточный цикл / апоптоз / аутофагия и передача сигналов интерферона JAK / STAT, и подтвердили свои результаты с использованием имитаторов вирусной miRNA и анализов репортера люциферазы для 3’UTR целевых мРНК. Наконец, мишени miRNA человека также были исследованы с использованием того же набора данных, и было обнаружено, что повышенная экспрессия miRNA человека обычно приводит к снижению общей экспрессии мРНК мишеней; однако снижение экспрессии miRNA человека не увеличивает общую экспрессию мРНК.Эти эксперименты помогают проанализировать сложные miRNA-опосредованные манипуляции с хозяином во время литической инфекции HCMV.
Заключительные замечания и направления на будущее
Системная вирусология, включающая высокопроизводительное молекулярное профилирование и биоинформатику, высветила сложность взаимодействий вирус-хозяин и способствовала нашему пониманию того, как работает HCMV, новых клеточных функций и потенциальных новых мишеней для лекарств (Law et al., 2013). Экраны, обсуждаемые в этом обзоре, сведены в Таблицу 1.Подтвержденные кандидаты на каждом экране показаны на рисунке 1, где каждый цвет показывает тип экранов, на которых был идентифицирован кандидат.
Таблица 1 . Резюме высокопроизводительных исследований.
Рисунок 1 . Факторы-хозяева, выявленные в высокопроизводительных исследованиях, и их роль в инфицировании HCMV. Жизненный цикл HCMV представлен на рисунке, и кандидаты, идентифицированные в каждом типе высокопроизводительных исследований, показаны в их приблизительном функциональном расположении.Кандидаты, идентифицированные в каждом типе высокопроизводительных исследований, окрашены в: красный (RNA-seq), синий (протеомика), зеленый (siRNA), фиолетовый (shRNA), коричневый (CRISPR), розовый (miRNA).
Благодаря достижениям в области секвенирования, масс-спектрометрии и редактирования генома высокопроизводительные исследования становятся более эффективными и точными в идентификации взаимодействий хозяин-вирус. Несмотря на открытие новых факторов-хозяев, важных для репликации вируса, точные функции и роли этих факторов еще предстоит полностью выяснить.Потенциал этих факторов в качестве противовирусных мишеней также потребует обширных исследований in vivo , прежде чем переходить к клиническим испытаниям. Разработка противовирусных препаратов, ориентированных на хозяина, будет иметь более низкие темпы появления устойчивых к лекарствам вирусов, тем самым обеспечивая лучший вариант для лечения. Однако токсичность лекарственного средства для хозяина является серьезной проблемой, которую необходимо преодолеть большинству новых противовирусных препаратов, поскольку для нормального функционирования клеток требуются некоторые факторы хозяина.
Интеграция различных высокопроизводительных подходов, от RNA-seq до протеомики и фенотипических скринингов, представляет собой привлекательную будущую цель системных подходов в исследованиях HCMV, а также в системных исследованиях в целом.С улучшением анализа путей, интегрированные системные подходы могут привести к значительному прогрессу в нашем понимании базовой биологии вирусов, клеточной биологии и открытию новых противовирусных методов лечения.
Авторские взносы
C-HL написал рукопись. Все авторы внесли свой вклад в доработку рукописи, прочитали и одобрили представленную версию.
Финансирование
Этот проект финансировался MRC (MR / N001796 / 1), BBSRC (BBS / E / D / 20002172) и стипендией директора по развитию карьеры от Университета Эдинбурга.Финансирование публикации было покрыто Фондом открытого доступа RCUK.
Конфликт интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим доктора Элеонору Гонт за критическую оценку этой рукописи.
Сокращения
3’UTR, 3′-нетранслируемые области; AGO2, Argonaute 2; AGO-CLIP-seq, сшивание аргонавтом и иммунопреципитация; AMPK, 5′-AMP-активированная протеинкиназа; ANAPC1, субъединица 1 комплекса, стимулирующего анафазу; ANKRD52, домен 52 анкириновых повторов; APA, альтернативное расщепление и полиаденилирование; ARPE-19, линия 19 пигментных эпителиальных клеток сетчатки взрослых; AS — Альтернативная сварка; ASNS, аспарагинсинтетаза; ATP6V0C, АТФаза H +, транспортирующая субъединицу C V0; BRD2, белок 2, содержащий бромодомен; CD4, кластер дифференцировки 4; CDK6, циклинзависимая киназа 6; CFL2, Cofilin 2; CHEK1, киназа контрольной точки 1; CLIP-seq, перекрестное связывание с иммунопреципитацией-секвенированием; COPA, субъединица альфа-белкового комплекса коатомера; COPB2, субъединица бета 2 белкового комплекса коатомера; CPEB1, белок 1, связывающий элемент цитоплазматического полиаденилирования; CRISPR, Кластерные короткие палиндромные повторы с регулярными интервалами; crRNA, CRISPR РНК; CUL4, Cullin 4; CXCL2, хемокиновый (мотив C-X-C) лиганд 2; DKK1, ингибитор 1 пути передачи сигнала Dickkopf WNT; DPI, дни после заражения; DSB, двухниточный разрыв; ЭК — эндотелиальные клетки; eGFP, усиленный зеленый флуоресцентный белок; ERAD, деградация белков, связанная с эндоплазматическим ретикулумом; ERC1, ELKS / RAB6-взаимодействующий член семейства CAST 1; ERK / MAPK, Киназа, регулируемая внеклеточными сигналами / митоген-активируемая протеинкиназа; EXOSC10, компонент экзосомы 10; FACS, Флуоресцентная сортировка активированных клеток; GeCKO, нокаут CRISPR по всему геному; HCMV, цитомегаловирус человека; HDR, гомологически направленный ремонт; HEL, эмбриональные клетки фибробластов легких человека; HFFs, клетки фибробластов крайней плоти человека; HLTF, фактор транскрипции, подобный геликазе; HPI, часы после заражения; HSV-1, вирус простого герпеса 1; HTVs, человеческие мишени вирусных миРНК; IFN-, Интерферон-; ИЛ-, Интерлейкин-; IRF1, фактор регуляции интерферона 1; IRF2BPL, белок, связывающий фактор 2, регулирующий интерферон; IRF9, фактор регуляции интерферона 9; ISG, гены, стимулированные интерфероном; Jak1, киназа Януса 1; kb, килобазис; mDC, миелоидные дендритные клетки; MELK, киназа лейциновой молнии материнского эмбриона; miRNA, МикроРНК; мРНК, информационная РНК; mTOR, мишень рапамицина у млекопитающих; MYO18A, миозин XVIIIA; NEDD4, экспрессируемый нейронными клетками-предшественниками белок 4, подавленный в процессе развития; NGS, секвенирование нового поколения; NHDF, нормальные фибробластные клетки кожи человека; NHEJ, Негомологичное соединение концов; NPC, нейральные клетки-предшественники; OR14I1, член 1 подсемейства I семейства 14 обонятельных рецепторов; PDGFRα, рецептор фактора роста тромбоцитов альфа; PHLDA1, член 1 семейства A гомологии плэкстрина; PI3K-C2A, фосфатидилинозитол-3-киназа, класс 2, альфа; PI4K2B, фосфатидилинозитол-4-киназа типа 2-бета; PIK3C3, каталитическая субъединица фосфатидилинозитол-3-киназы типа 3; pri-miRNA, первичная миРНК; pSILAC, Импульсное мечение стабильных изотопов аминокислотами в культуре клеток; PSMC2, субъединица 26S протеасомы, АТФаза 2; PSMD1, субъединица 26S протеасомы, не являющаяся АТФазой 1; RAB4B, Ras-родственный GTP-связывающий белок 4B; RISC, РНК-индуцированный комплекс сайленсинга; RISC-IP, РНК-индуцированный комплекс сайленсинга-иммунопреципитация; РНКи, РНК-интерференция; RNA-seq, РНК-секвенирование; рРНК, рибосомная РНК; RT-qPCR, количественная полимеразная цепная реакция с обратной транскрипцией; sgRNA, однонаправленная РНК; shRNA, короткая шпильочная РНК; миРНК, малая интерферирующая РНК; STAT2, преобразователь сигналов и активатор транскрипции 2; TGFBR1, бета-рецептор 1 трансформирующего фактора роста; TLR, Toll-подобные рецепторы; TMEM129, трансмембранный белок 129; TMT, тандемные массовые метки; TSC2, субъединица 2 комплекса туберозного склероза; TXNIP, белок, взаимодействующий с тиоредоксином; UAE1, убиквитин-активирующий фермент E1; UBE2J2, убиквитин-конъюгированный фермент E2 J2; ВАК, монтажный отсек Вириона; VCP, белок, содержащий валозин; WNK4, протеинкиназа с дефицитом лизина WNK 4.
Список литературы
Арканджелетти, М. К., Василе Симоне, Р., Родигиеро, И., Де Конто, Ф., Медичи, М. К., Маккари, К., и др. (2016). Реактивация цитомегаловируса человека с латентного периода: проверка «переключателя» модели in vitro . Virol. J . 13: 179. DOI: 10.1186 / s12985-016-0634-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Аренд, К. К., Ленарчич, Э. М., Винсент, Х. А., Рашид, Н., Лазер, Э., Макдональд, И. М. и др.(2017). Профилирование киномов позволяет выявить мишени для новых противовирусных препаратов от цитомегаловируса человека (HCMV). Протеомика клеток Mol 16, S263 – S276. DOI: 10.1074 / mcp.M116.065375
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Афанасопулос В., Рамискаль Р. Р. и Винуеса К. Г. (2016). Сигнальные пути ROQUIN при врожденном и адаптивном иммунитете. Eur. J. Immunol . 46, 1082–1090. DOI: 10.1002 / eji.201545956
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Баллард, Р.А., Дрю, В. Л., Хафнагл, К. Г., и Ридель, П. А. (1979). Приобретенная цитомегаловирусная инфекция у недоношенных детей. Am. J. Dis. Детский . 133, 482–485. DOI: 10.1001 / archpedi.1979.02130050026005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Батра, Р., Старк, Т. Дж., Кларк, Э., Белзил, Дж. П., Уилер, Э. К., Йи, Б. А. и др. (2016). РНК-связывающий белок CPEB1 ремоделирует ландшафты РНК хозяина и вируса. Нат. Struct. Мол. Биол . 23, 1101–1110.DOI: 10.1038 / nsmb.3310
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бруминент, Дж., И Разонабл, Р. Р. (2014). Управление цитомегаловирусной инфекцией и заболеванием у реципиентов трансплантата печени. Мир J. Hepatol . 6, 370–383. DOI: 10.4254 / wjh.v6.i6.370
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бу, С., Юань, Ф., Вэй, X., Инь, К., Ли, Ю., Ми, Р. и др. (2016). Схема на основе L-аспарагиназы в качестве лечения первой линии для недавно диагностированной экстранодальной лимфомы из естественных киллеров носа / Т-лимфоцитов. Exp. Ther. Мед . 11, 2437–2445. DOI: 10.3892 / etm.2016.3249
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Клиппингер, А. Дж., Магуайр, Т. Г., и Алвин, Дж. К. (2011). Цитомегаловирусная инфекция человека поддерживает активность mTOR и его перинуклеарную локализацию во время аминокислотной депривации. Дж. Вирол . 85, 9369–9376. DOI: 10.1128 / JVI.05102-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коэн Ю., Стерн-Гиноссар Н.(2014). Манипулирование путями хозяина цитомегаловирусом человека: выводы из полногеномных исследований. Семин. Иммунопатол . 36, 651–658. DOI: 10.1007 / s00281-014-0443-7
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коллинз-Макмиллен, Д., Бюлер, Дж., Пеппенелли, М., и Гудрам, Ф. Молекулярные детерминанты и регуляция латентности и реактивации цитомегаловируса человека. Вирусы . (2018) 10: 444. DOI: 10.3390 / v10080444.
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дерти, А., Гарретт-Энгеле, П., Масисаак, К. Д., Стивенс, Р. К., Шрирам, С., Чен, Р. и др. (2012). Количественный атлас полиаденилирования у пяти млекопитающих. Genome Res . 22, 1173–1183. DOI: 10.1101 / gr.132563.111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dunn, W., Chou, C., Li, H., Hai, R., Patterson, D., Stolc, V., et al. (2003). Функциональное профилирование генома цитомегаловируса человека. Proc. Natl. Акад. Sci. США . 100, 14223–14228. DOI: 10.1073 / пнас.2334032100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Эглер Р. А., Ахуджа С. П. и Матлоуб Ю. (2016). L-аспарагиназа в лечении пациентов с острым лимфобластным лейкозом. J. Pharmacol. Фармако . 7, 62–71. DOI: 10.4103 / 0976-500X.184769
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фаррелл, Х. Э., Лоулер, К., Тан, С. С., Макдональд, К., Брюс, К., Мах, М. и др. (2016). Мышиный цитомегаловирус использует обоняние для проникновения в новых хозяев. мБио 7, e00251 – e00216. DOI: 10.1128 / mBio.00251-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феннелл, М., Сян, К., Хван, А., Чен, К., Хуанг, К. Х., Чен, К. С. и др. (2014). Влияние технологий, управляемых РНК, на идентификацию и деконволюцию целей. J. Biomol. Экран 19, 1327–1337. DOI: 10.1177 / 1087057114548414
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Филдс, Б.Н., Книп, Д.М., и Хоули, П. М. (2007). Вирусология Филдса . Филадельфия, Пенсильвания; Лондон: Уолтерс Клувер / Липпинкотт Уильямс и Уилкинс.
Google Scholar
Филдс, Б. Н., Книп, Д. М., и Хоули, П. М. (2013). Областная вирусология . Филадельфия, Пенсильвания: Wolters Kluwer Health / Lippincott Williams & Wilkins.
Google Scholar
Гонг, С.С., и Базилико, К. (1990). Чувствительная к температуре мутация млекопитающих, влияющая на прогрессирование G1, возникает в результате замены одной аминокислоты в аспарагинсинтетазе. Nucl. Кислоты Res . 18, 3509–3513. DOI: 10.1093 / nar / 18.12.3509
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гриффит, Д. М., Льюис, С., Росси, А. Г., Ренни, Дж., Солсбери, Л., Мерривезер, Дж. Л. и др. (2016). Системное воспаление после критического заболевания: связь с физическим выздоровлением и изучением потенциальных механизмов. Грудь . 71, 820–829. DOI: 10.1136 / thoraxjnl-2015-208114
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гутьеррес, Дж.А., Пан, Ю. X., Короньяк, Л., Хиратаке, Дж., Килберг, М. С., и Ричардс, Н. Г. (2006). Ингибитор аспарагинсинтетазы человека подавляет пролиферацию устойчивой к L-аспарагиназе линии клеток лейкемии. Chem. Биол . 13, 1339–1347. DOI: 10.1016 / j.chembiol.2006.10.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Hettmer, S., Schinzel, A.C., Tchessalova, D., Schneider, M., Parker, C.L., Bronson, R.T., et al. (2015). Функциональный геномный скрининг показывает зависимость от аспарагина как метаболическую уязвимость при саркоме. Элиф 4: e09436. DOI: 10.7554 / eLife.09436.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джексон, А. Л., и Линсли, П. С. (2010). Распознавание и предотвращение нецелевых эффектов siRNA для идентификации мишеней и терапевтического применения. Нат. Rev. Drug Discov . 9, 57–67. DOI: 10.1038 / nrd3010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Жан Бельтран, П. М., Кук, К. К., Хашимото, Ю., Голицын, К., Мюррей, Л.А., Витек, О., и др. (2018). Биогенез пероксисом, индуцированный инфекцией, представляет собой метаболическую стратегию репликации вируса герпеса. Клеточный микроб-хозяин 24, 526–541 e527. DOI: 10.1016 / j.chom.2018.09.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Жан Бельтран, П. М., Матиас, Р. А., и Криста, И. М. (2016). Портрет протеома человеческих органелл в пространстве и времени во время цитомегаловирусной инфекции. Cell Syst . 3, 361–373, e366.DOI: 10.1016 / j.cels.2016.08.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джергович, М., Контрерас, Н. А., Николич-Цугич, Дж. (2019). Влияние ЦМВ на иммунное старение: факты и вымысел. Med. Microbiol. Иммунол . 208, 263–269. DOI: 10.1007 / s00430-019-00605-w
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Джонсон, Р. А., Ван, X., Ма, X. Л., Хыонг, С. М., и Хуанг, Э. С. (2001). Человеческий цитомегаловирус активирует путь фосфатидилинозитол-3-киназы (PI3-K): ингибирование активности PI3-K подавляет репликацию вируса и вирус-индуцированную передачу сигналов. Дж. Вирол . 75, 6022–6032. DOI: 10.1128 / JVI.75.13.6022-6032.2001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ким, С., Со, Д., Ким, Д., Хонг, Ю., Чанг, Х., Бэк, Д., и др. (2015). Временной ландшафт перекрестного взаимодействия между хозяином и вирусом, опосредованным микроРНК, во время продуктивной цитомегаловирусной инфекции человека. Клеточный микроб-хозяин 17, 838–851. DOI: 10.1016 / j.chom.2015.05.014
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кимбалл, С.Р., и Джефферсон, Л. С. (2006). Сигнальные пути и молекулярные механизмы, с помощью которых аминокислоты с разветвленной цепью опосредуют трансляционный контроль синтеза белка. J. Nutr. 136, 227С-231С. DOI: 10.1093 / jn / 136.1.227S
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Киттлер Р., Сурендранат В., Хенингер А. К., Слабицки М., Тайс М., Путц Г. и др. (2007). Общегеномные ресурсы коротких интерферирующих РНК, приготовленных с помощью эндорибонуклеазы, для конкретных исследований потери функции. Нат. Методы 4, 337–344. DOI: 10.1038 / nmeth2025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кусунадис А., Лэнгдон С. П., Ум И. Х., Харрисон Д. Дж. И Смит В. А. (2015). Взаимосвязь между дифференциально экспрессируемой мРНК и корреляциями мРНК-белок в модельной системе ксенотрансплантата. Sci. Реп. 5: 10775. DOI: 10.1038 / srep10775
CrossRef Полный текст | Google Scholar
Ковальский, С., Арнон, Р., Посада, Р.(2013). Профилактика цитомегаловируса после трансплантации солидных органов: обзор литературы. Pediatr. Пересадка . 17, 499–509. DOI: 10.1111 / petr.12118
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кралл А. С., Сюй С., Гребер Т. Г., Браас Д. и Кристофк Х. Р. (2016). Аспарагин способствует пролиферации раковых клеток за счет использования в качестве фактора обмена аминокислот. Нат. Коммуна . 7: 11457. DOI: 10.1038 / ncomms11457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лам, Дж.К. В., Чоу, М. Ю. Т., Чжан, Ю., и Люн, С. В. С. (2015). миРНК против миРНК в качестве терапевтического средства для подавления гена. Мол. Ther. Nucl. Кислоты 908 34. 4: e252. DOI: 10.1038 / mtna.2015.23
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ло, Г. Л., Корт, М. Дж., Бенеке, А. Г., и Катце, М. Г. (2013). Системная вирусология: ориентированные на хозяина подходы к вирусному патогенезу и нацеливанию лекарств. Нат. Ред. Microbiol . 11, 455–466. DOI: 10.1038 / nrmicro3036
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ли, К.Х., Гриффитс, С., Дигард, П., Фам, Н., Ауэр, М., Хаас, Дж. И др. (2019). Недостаток аспарагина вызывает обратимое подавление репликации острой репликации вируса цитомегаловируса человека. MBio 10: e01651-19. DOI: 10.1128 / mBio.01651-19
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лин, С., Стал, Б. Т., Алла, Р. К., и Дудна, Дж. А. (2014). Улучшенная гомологически управляемая инженерия генома человека за счет контролируемого времени доставки CRISPR / Cas9. Элиф 3: e04766.DOI: 10.7554 / eLife.04766
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лин, Ю. Т., Прендергаст, Дж., И Грей, Ф. (2017). Убиквитин-зависимая сегрегаза хозяина VCP / p97 необходима для начала репликации цитомегаловируса человека. PLoS Патог . 13: e1006329. DOI: 10.1371 / journal.ppat.1006329
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лино, К. А., Харпер, Дж. К., Карни, Дж. П., и Тимлин, Дж. А. (2018). Доставка CRISPR: обзор проблем и подходов. Доставка лекарств . 25, 1234–1257. DOI: 10.1080 / 10717544.2018.1474964
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лутц, К. С., Морейра, А. (2011). Альтернативное полиаденилирование мРНК у эукариот: эффективный регулятор экспрессии генов. Wiley Interdiscip. Rev. RNA 2, 22–31. DOI: 10.1002 / wrna.47
CrossRef Полный текст | Google Scholar
Марти-Каррерас, Дж., И Маес, П. (2019). Геномика и транскриптомика цитомегаловируса человека через призму секвенирования следующего поколения: пересмотр и будущие задачи. Гены вирусов 55, 138–164. DOI: 10.1007 / s11262-018-1627-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маруяма Т., Дуган С. К., Труттманн М. К., Билате А. М., Инграм Дж. Р. и Плоег Х. Л. (2015). Повышение эффективности точного редактирования генома с помощью CRISPR-Cas9 за счет ингибирования негомологичного соединения концов. Нат. Биотехнология . 33, 538–542. DOI: 10.1038 / NBT.3190
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Машалидис, Э.Х., Следз, П., Ланг, С., и Абелл, К. (2013). Трехэтапный каскад биофизического скрининга для обнаружения лекарств на основе фрагментов. Нат. Протокол . 8, 2309–2324. DOI: 10.1038 / nprot.2013.130
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маугер, Д. М., Кабрал, Б. Дж., Пресняк, В., Су, С. В., Рид, Д. В., Гудман, Б. и др. (2019). Структура мРНК регулирует экспрессию белка за счет изменения функционального периода полужизни. Proc. Natl. Акад. Sci. США .116, 24075–24083. DOI: 10.1073 / pnas.1
2116PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маккормик, Д., Лин, Ю. Т., и Грей, Ф. (2018). Идентификация факторов хозяина, вовлеченных в репликацию, сборку и выход цитомегаловируса человека, с использованием двухэтапного скрининга малой интерферирующей РНК. MBio 9: e00716-18. DOI: 10.1128 / mBio.00716-18
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мейер, А. Дж., Лорин, С., Бломмаарт, Э.Ф. и Кодоньо П. (2015). Регулирование аутофагии с помощью аминокислот и MTOR-зависимой передачи сигнала. Аминокислоты 47, 2037–2063. DOI: 10.1007 / s00726-014-1765-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мурман, Н. Дж., Криста, И. М., Терхун, С. С., Рут, М. П., Чайт, Б. Т., и Шенк, Т. (2008). Белок цитомегаловируса человека UL38 ингибирует стрессовые реакции клетки-хозяина, противодействуя белковому комплексу туберозного склероза. Клеточный микроб-хозяин 3, 253–262.DOI: 10.1016 / j.chom.2008.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мовассат, М., Крабб, Т. Л., Буш, А., Яо, К. Г., Рейнольдс, Д. Дж., Ши, Ю. С. и др. (2016). Сочетание альтернативного полиаденилирования и альтернативного сплайсинга ограничено концевыми интронами. РНК Биол . 13, 646–655. DOI: 10.1080 / 15476286.2016.1191727
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Найтингейл, К., Лин, К. М., Равенхилл, Б.J., Davies, C., Nobre, L., Fielding, C.A., et al. (2018). Анализ высокой четкости стабильности белка хозяина во время цитомегаловирусной инфекции человека позволяет выявить противовирусные факторы и механизмы уклонения от вируса. Клеточный микроб-хозяин 24, 447–460 e411. DOI: 10.1016 / j.chom.2018.07.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нуай С., Мондей С., Фину А. Л., Мулис К., Гирбаль Л. и Кокаин-Буске М. (2017). На стабильность мРНК влияет ее концентрация: потенциальный физический механизм регулирования экспрессии генов. Nucl. Кислоты Res . 45, 11711–11724. DOI: 10.1093 / nar / gkx781
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пан, К., Шай, О., Ли, Л. Дж., Фрей, Б. Дж., И Бленкоу, Б. Дж. (2008). Глубокое исследование сложности альтернативного сплайсинга в человеческом транскриптоме с помощью высокопроизводительного секвенирования. Нат. Genet . 40, 1413–1415. DOI: 10,1038 / нг. 259
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Павелин, Дж., Маккормик, Д., Чивеш, С., Рамачандран, С., Лин, Ю. Т., и Грей, Ф. (2017). Клеточная v-АТФаза необходима для образования компартмента сборки вириона при цитомегаловирусной инфекции человека. Открыть Биол . 7: 160298. DOI: 10.1098 / rsob.160298
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Павелин, Дж., Рейнольдс, Н., Чивеш, С., Ву, Г., Тирибасси, Р., и Грей, Ф. (2013). Систематический анализ микроРНК определяет ATP6V0C как важный фактор-хозяин для репликации цитомегаловируса человека. PLoS Патог . 9: e1003820. DOI: 10.1371 / journal.ppat.1003820
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пикар-Оливер А. и Герсбах К. А. (2019). Новое поколение технологий и приложений CRISPR-Cas. Нат. Преподобный Мол. Ячейка Биол . 20, 490–507. DOI: 10.1038 / s41580-019-0131-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Полачек, В. С., Мошриф, Х. Ф., Франти, М., Коэн, Д. М., Срину, В.Б., Странг Б. Л. (2016). Высокопроизводительный скрининг малых интерферирующих РНК позволяет идентифицировать фосфатидилинозитол-3-киназу класса II альфа как важную для продуцирования вирионов цитомегаловируса человека. Дж. Вирол . 90, 8360–8371. DOI: 10.1128 / JVI.01134-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рао Д. Д., Сензер Н., Клири М. А. и Немунайтис Дж. (2009). Сравнительная оценка нецелевых эффектов миРНК и шРНК: что замедляет клиническое развитие. Cancer Gene Ther . 16, 807–809. DOI: 10.1038 / cgt.2009.53
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ривз, М. Б., Макари, П. А., Ленер, П. Дж., Сиссонс, Дж. Г., и Синклер, Дж. Х. (2005). Латентность, ремоделирование хроматина и реактивация цитомегаловируса человека в дендритных клетках здоровых носителей. Proc. Natl. Акад. Sci. США . 102, 4140–4145. DOI: 10.1073 / pnas.0408994102
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Райс, Г.П., Шриер Р. Д. и Олдстон М. Б. (1984). Цитомегаловирус поражает лимфоциты и моноциты человека: экспрессия вируса ограничена продуктами генов немедленного происхождения. Proc. Natl. Акад. Sci. США . 81, 6134–6138. DOI: 10.1073 / pnas.81.19.6134
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Родригес-Санчес, И., Шафер, X. Л., Монаган, М., и Мунгер, Дж. (2019). Белок цитомегаловируса человека UL38 управляет mTOR-независимым перепрограммированием метаболического потока путем ингибирования TSC2. PLoS Патог . 15: e1007569. DOI: 10.1371 / journal.ppat.1007569
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Schoggins, J. W., Wilson, S. J., Panis, M., Murphy, M. Y., Jones, C. T., Bieniasz, P., et al. (2011). Разнообразные генные продукты являются эффекторами противовирусного ответа интерферона типа I. Природа 472, 481–485. DOI: 10.1038 / nature09907
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шарон-Фрилинг, Р., и Шенк, Т. (2014). Индуцированный цитомегаловирусом человека pUL37x1 поток кальция активирует PKCalpha, вызывая изменение формы клеток и накопление цитоплазматических везикул. Proc. Natl. Акад. Sci. США . 111, E1140–1148. DOI: 10.1073 / pnas.1402515111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Sijmons, S., Van Ranst, M., and Maes, P. (2014). Геномные и функциональные характеристики цитомегаловируса человека, выявленные с помощью секвенирования следующего поколения. Вирусы 6, 1049–1072.DOI: 10.3390 / v6031049
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сонг, Дж., Ли, С., Чо, Д. Ю., Ли, С., Ким, Х., Ю, Н. и др. (2019). Человеческий цитомегаловирус индуцирует и использует Roquin для противодействия IRF1-опосредованному антивирусному состоянию. Proc. Natl. Акад. Sci. США . 116, 18619–18628. DOI: 10.1073 / pnas.1
4116PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стерн, Л., Холерс, Б., Авдик, С., Готтлиб, Д., Abendroth, A., Blyth, E., et al. (2019). Латентный период цитомегаловируса человека и реактивация у реципиентов аллогенных гемопоэтических стволовых клеток. Фронт. Микробиол . 10: 1186. DOI: 10.3389 / fmicb.2019.01186
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Terhune, S. S., Moorman, N. J., Cristea, I. M., Savaryn, J. P., Cuevas-Bennett, C., Rout, M. P., et al. (2010). Белок цитомегаловируса человека UL29 / 28 взаимодействует с компонентами комплекса NuRD, которые способствуют накоплению ранней РНК. PLoS Патог . 6: e1000965. DOI: 10.1371 / journal.ppat.1000965
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Umashankar, M., Petrucelli, A., Cicchini, L., Caposio, P., Kreklywich, C.N., Rak, M., et al. (2011). Новый локус цитомегаловируса человека модулирует исходы инфекции, специфичные для клеточного типа. PLoS Патог . 7: e1002444. DOI: 10.1371 / journal.ppat.1002444
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валенсия-Санчес, М.А., Лю Дж., Хэннон Дж. Дж. И Паркер Р. (2006). Контроль трансляции и деградации мРНК с помощью миРНК и миРНК. Гены Дев . 20, 515–524. DOI: 10.1101 / gad.1399806
PubMed Аннотация | CrossRef Полный текст | Google Scholar
van de Weijer, M. L., Bassik, M. C., Luteijn, R. D., Voorburg, C. M., Lohuis, M. A., Kremmer, E., et al. (2014). Скрининг shRNA с высоким охватом идентифицирует TMEM129 как лигазу E3, участвующую в ER-ассоциированной деградации белка. Нат.Коммуна . 5: 3832. DOI: 10.1038 / ncomms4832
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван де Вейер, М. Л., Шурен, А. Б. С., ван ден Бумен, Д. Дж. Х., Малдер, А., Клаас, Ф. Х. Дж., Ленер, П. Дж. И др. (2017). Множественные ферменты, конъюгирующие с убиквитином E2, регулируют подавление иммунорецепторов, опосредованное US2 цитомегаловирусом человека. J. Cell Sci . 130, 2883–2892. DOI: 10.1242 / jcs.206839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уикс, М.П., Томасек, П., Хаттлин, Э. Л., Филдинг, К. А., Нусинов, Д., Стэнтон, Р. Дж. И др. (2014). Количественная временная виромика: подход к исследованию взаимодействия хозяина-патогена. Cell 157, 1460–1472. DOI: 10.1016 / j.cell.2014.04.028
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву К., Оберштейн А., Ван В. и Шенк Т. (2018). Роль рецептора PDGF-альфа во время проникновения цитомегаловируса человека в фибробласты. Proc. Natl. Акад. Sci. U.S.A. 115, E9889 – E9898. DOI: 10.1073 / pnas.1806305115
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сяофэй, Э., Меранер, П., Лу, П., Перрейра, Дж. М., Акер, А. М., Макдугалл, В. М. и др. (2019). OR14I1 является рецептором пентамерного комплекса цитомегаловируса человека и определяет тропизм вирусных эпителиальных клеток. Proc. Natl. Акад. Sci. США . 116, 7043–7052. DOI: 10.1073 / pnas.1814850116
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжан, Дж., Fan, J., Venneti, S., Cross, J. R., Takagi, T., Bhinder, B., et al. (2014). Аспарагин играет важную роль в регулировании клеточной адаптации к истощению запасов глутамина. Мол. Ячейка . 56, 205–218. DOI: 10.1016 / j.molcel.2014.08.018
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, С., Чжан, Ю., Гамини, Р., Чжан, Б., и фон Шак, Д. (2018). Оценка двух основных подходов RNA-seq для количественной оценки генов при клиническом секвенировании РНК: выбор полиА + против истощения рРНК. Научная репутация . 8: 4781. DOI: 10.1038 / s41598-018-23226-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Zhu, Y., Li, T., Ramos da Silva, S., Lee, J. J., Lu, C., Eoh, H., et al. (2017). Критическая роль глутамина и гамма-азота аспарагина в биосинтезе нуклеотидов в раковых клетках, захваченных онкогенным вирусом. MBio 8: e01179-17. DOI: 10.1128 / mBio.01179-17
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Цитомегаловирус человека — больше не просто ДНК-вирус
Цитомегаловирус человека (HCMV) классифицируется как ДНК-вирус герпеса.Недавнее исследование показало, что вирион HCMV содержит не только ДНК, но и четыре вида мРНК, что указывает на то, что этот вирус более сложный, чем считалось ранее.
ЦИТОМЕГАЛОВИРУС ЧЕЛОВЕКА (HCMV) — самый крупный из известных герпесвирусов с геномом более 235 т.п.н. и более чем 200 потенциальными открытыми рамками считывания. 1 . Это широко распространенный условно-патогенный микроорганизм, не вызывающий явных клинических проявлений у здоровых людей.С другой стороны, это основная причина связанных с вирусами врожденных дефектов, включая умственную отсталость и глухоту. Он вызывает тяжелые и смертельные заболевания у лиц с ослабленным иммунитетом, таких как реципиенты трансплантатов органов и пациенты со СПИДом, а также ассоциируется с атеросклерозом и коронарным рестенозом.
Когда HCMV заражает клетку, вирусный капсид транспортируется в ядро, где вирусная ДНК высвобождается и транскрибируется аппаратом клетки-хозяина (рис. 1). Обычно считалось, что все вновь синтезированные вирусные белки кодируются геномом вирусной ДНК 2 .Однако в недавнем выпуске Science Бреснахан и Шенк продемонстрировали, что в дополнение к вирусной ДНК частицы вируса HCMV также переносят мРНК в клетку-хозяин 3 . Используя технологию массива генов, они идентифицировали четыре кодируемых вирусом мРНК, которые присутствуют в высокоочищенных вирионах HCMV. Эти мРНК доставляются в цитоплазму клетки, когда вирусная оболочка сливается с плазматической мембраной в начале инфекции. Четыре мРНК остаются в цитоплазме, где они транслируются в белки в отсутствие продуктов генов, кодируемых вирусной ДНК.Одна из мРНК, UL21.5, кодирует белок, содержащий лидерную последовательность, которая локализует ее в сети Гольджи, но функция (и) мРНК или их продуктов неизвестна.
Рис. 1. Литический жизненный цикл HCMV.1 , Связывание гликопротеинов gB и gH HCMV с клеточными рецепторами активирует клеточные факторы транскрипции, такие как NF-κB и Sp1. 2 . Затем вирус проникает в клетку, высвобождая вирусную ДНК, белки вириона и транскрипты мРНК вириона в цитоплазму, где транслируются мРНК вириона.Вирусная ДНК и некоторые вирусные белки транспортируются в ядро. 3 , В ядре вирусные и клеточные гены экспрессируются с помощью активированных факторов транскрипции, и вирусная ДНК реплицируется. 4 , Вирусная ДНК, вирусные и клеточные белки, а также транскрипты вирионов упаковываются в вирион с помощью еще не установленного механизма. Во время выхода вириона из клетки формируется оболочка вириона и высвобождается инфекционная вирусная частица.
Гены HCMV классифицируются как непосредственно ранние, ранние или поздние, в зависимости от времени и условий их экспрессии. Бреснахан и Шенк обнаружили, что кодируемые вирусом мРНК транскрибируются с одного раннего гена (UL106-109), двух ранних генов (TRL / IRL2-5 и TRL / IRL7) и одного позднего гена (UL21.5) (ссылка 3). . Эти мРНК транскрибируются с вирусной ДНК и накапливаются до самых высоких уровней на поздних этапах инфицирования, когда вирионы собираются. Связь этих мРНК HCMV с вирионом специфична, так как четыре вирусных транскрипта были единственными, которые, как было обнаружено, связаны с вирионом.
Общая структура вирусной частицы HCMV аналогична структуре других герпесвирусов. Самый внешний слой — это двухслойная липидная оболочка, которая содержит гликопротеины, кодируемые клетками и вирусами. В основе частицы лежит вирусная ДНК, окруженная икосаэдрическим капсидом. Между капсидом и оболочкой находится аморфный слой, называемый тегументом. Именно в этой области тегумента, скорее всего, находятся мРНК, описанные Bresnahan и Shenk 3 .
Тегумент вириона HCMV также содержит много белков. К ним относятся ДНК-полимераза, протеинкиназа 4 и клеточный фермент топоизомераза II (необходимый для репликации вирусной ДНК) 5 . Рецептор Fc для человеческого иммуноглобулина G расположен внутри тегумента вместе с серин / треониновой протеинфосфатазой PP1 и производной из клетки-хозяина фосфатазой PP2A (ссылка 6). Продукты вирусных генов UL82, UL69 и UL83 (ссылки 7, 8) также присутствуют в тегументе. Эти белки высвобождаются в цитоплазму после вирусной инфекции и необходимы для репликации вируса и вирус-индуцированного патогенеза.Например, считается, что ДНК-полимераза и топоизомераза II усиливают репликацию вирусной ДНК. Продукт гена UL82, pp71 (гомолог VP-16 HSV), усиливает экспрессию главного немедленного раннего промотора, тогда как продукт гена UL69 препятствует переходу покоящихся клеток в фазу S после стимуляции сывороткой в определенных типах клеток. Однако мРНК, описанные Bresnahan и Shenk 3 , вероятно, кодируют белки, которые необходимы для вирусной функции на ранних стадиях инфекции, до того, как вирусный геном станет транскрипционно активным.
Кодируемые вирусом гликопротеины, расположенные в оболочке вириона, также вызывают значительные клеточные изменения, когда они связываются с рецепторами своих клеток-хозяев. Факторы клеточной транскрипции, такие как NF-κB и Sp1, активируются при абсорбции вируса (рис. 1). Это, в свою очередь, активирует экспрессию нижележащих вирусных генов, а также синтез клеточных макромолекул 9 . Кроме того, связывание HCMV с моноцитами человека индуцирует экспрессию иммунорегуляторных генов и стимулирует синтез клеточных цитокинов 10 , что указывает на то, что абсорбция вируса может изменять метаболизм клеток, даже если инфекция непродуктивна.Таким образом, инфекционный вирион не просто вводит вирусную ДНК в ядро инфицированных клеток, но также вызывает множество клеточных изменений, которые могут создать среду, благоприятную для репликации вируса. Эти опосредованные вирионом изменения могут побудить клетку-хозяина перейти в активное метаболическое состояние, которое приводит к пролиферации клеток, если инфекция непродуктивна.
Статья Бреснахана и Шенка поднимает много интересных вопросов. Эти мРНК специально упакованы, и если да, то как? Возможно, что они образуют комплексы с другими белками тегумента и локализуются внутри вириона.Альтернативно, поскольку эти мРНК присутствуют на очень высоких уровнях во время сборки вириона, они могут неспецифично поглощаться тегументом. Также будет интересно определить функцию этих мРНК. МРНК могут иметь функцию, не кодирующую белок, играя структурную роль в сборке и организации белков тегумента. Альтернативно, мРНК или их продукты могут способствовать экспрессии генома вирусной ДНК или транспортировке структур капсид-тегумент к ядерной поре 2,3 .На эти вопросы можно ответить, проанализировав мутантные вирусы, не обладающие этими мРНК.
Различные типы герпесвирусов имеют много общих структурных, биологических и биохимических свойств. Их гены сильно гомологичны и даже колинеарны, и все вирионы герпеса содержат слой тегумента. Другие герпесвирусы также могут упаковывать подобные типы мРНК в свои вирионы. Определение вирусов, содержащих и ДНК, и РНК, повлияет на классификацию семейства герпесвирусов. Обнаружение функции, которую сами мРНК вириона или их белковые продукты играют в патогенезе HCMV, будет представлять большой интерес для вирусологов и может привести к новым мишеням для лечения герпесвирусных инфекций.
Ссылки
- 1
Mocarski, E.S. in Fields Virology , 3-е изд. Vol. 2 (ред. Филдс, Б.Н.) 2447–2492 (Липпинкотт-Ревен, Филадельфия, 1996).
Google ученый
- 2
Ройзман Б. Новое определение вирусологии. Наука 288 , 2327–2328 (2000).
CAS Статья Google ученый
- 3
Bresnahan, W.А. и Шенк Т. Подмножество вирусных транскриптов, упакованных в частицы цитомегаловируса человека. Наука 288 , 2373–2376 (2000).
CAS Статья Google ученый
- 4
Mar, E.-C. и другие. Активность ДНК-полимеразы и протеинкиназы, связанной с цитомегаловирусом человека. J. Gen. Virol. 57 , 149–156 (1981).
CAS Статья Google ученый
- 5
Бенсон, Дж.Д. и Хуанг, Э.-С. Цитомегаловирус человека индуцирует экспрессию клеточной топоизомеразы II. J. Virol. 64 , 9–15 (1990).
CAS Google ученый
- 6
Michelson, S. et al. Человеческий цитомегаловирус несет серин / треониновые протеинфосфатазы PP1 и полученный из клетки-хозяина pp2A. J. Virol. 70 , 1415–1423 (1996).
CAS Google ученый
- 7
Лю Б.И Стински, М.Ф. Цитомегаловирус человека содержит белок тегумента, который усиливает транскрипцию с промоторов с вышестоящими цис-действующими элементами ATF и AP-1. J. Virol. 66 , 4434–4444 (1992).
CAS Google ученый
- 8
Hayashi, M.L. и другие. Белок UL69 цитомегаловируса человека необходим для эффективного накопления инфицированных клеток в фазе G1 клеточного цикла. Proc. Natl. Акад. Sci.США 97 , 2692–2696 (2000).
CAS Статья Google ученый
- 9
Юрочуко А.Д. и др. Гликопротеиновые лиганды цитомегаловируса человека UL55 (gB) и UL75 (gH) инициируют быструю активацию Sp1 и NF-kB во время инфекции. J. Virol. 71 , 5051–5059 (1997).
Google ученый
- 10
Юрочко А.Д. и Хуанг Э.-S. Связывание цитомегаловируса человека с моноцитом человека индуцирует экспрессию иммунорегуляторного гена. J. Immunol. 162 , 4806–4816 (1999).
CAS Google ученый
Скачать ссылки
Информация об авторе
Принадлежности
Кафедра медицины и Линебергер, Комплексный онкологический центр, Университет Северной Каролины в Чапел-Хилл, Чапел-Хилл, 27599, Северная Каролина
Eng-Shang Huang & Robert А.Джонсон
Об этой статье
Цитируйте эту статью
Хуанг, Э.С., Джонсон, Р. Цитомегаловирус человека — больше не просто ДНК-вирус. Nat Med 6, 863–864 (2000). https://doi.org/10.1038/78612
Ссылка для скачивания
Дополнительная литература
Плазмацитоидные дендритные клетки человека приобретают фагоцитарную способность за счет лигирования TLR9 в присутствии растворимых факторов, продуцируемых почечными эпителиальными клетками
- Юрьен М.Рубен
- , Джина Стелла Гарсия-Ромо
- , Эйтан Бреман
- , Сандра ван дер Коой
- , Анке Редекер
- , Рамон Аренс
- и Сес ван Кутен
Kidney International (2018)
Электрофизиологические исследования трансгенных мышей со сверхэкспрессией KCNJ8 с мутацией S422L в кардиомиоцитах
- Ясухиро Ватанабе
- , Акио Мацумото
- , Такаши Мики
- , Сусуму Сейно
- , Наохико Анзай
- и Харуаки Накая
Журнал фармакологических наук (2017)
МикроРНК цитомегаловируса человека переносятся вирионами и плотными телами и доставляются к клеткам-мишеням.
- Абдул-Алим Мохаммад
- , Хелена Коста
- , Наталья Ландазури
- , Вен-Онн Луи
- , Кьелл Халтенби
- , Афсар Рахбар
- , Кун-Чу Яйв
0 и Сесилия Содерберг-9002 Сесилия Содерберг
Журнал общей вирусологии (2017)Трансген Osterix-Cre вызывает дефект развития черепно-лицевой кости
- Ли Ван
- , Юджи Мишина
- и Фей Лю
Calcified Tissue International (2015)
Гликопротеин вируса везикулярного стоматита и вирус венесуэльского энцефалита гликопротеина псевдотипные лентивирусные векторы, дифференцированно передающие эндотелий роговицы, трабекулярную сеть и фоторецепторы человека
- Дэниел М.


 ),
),
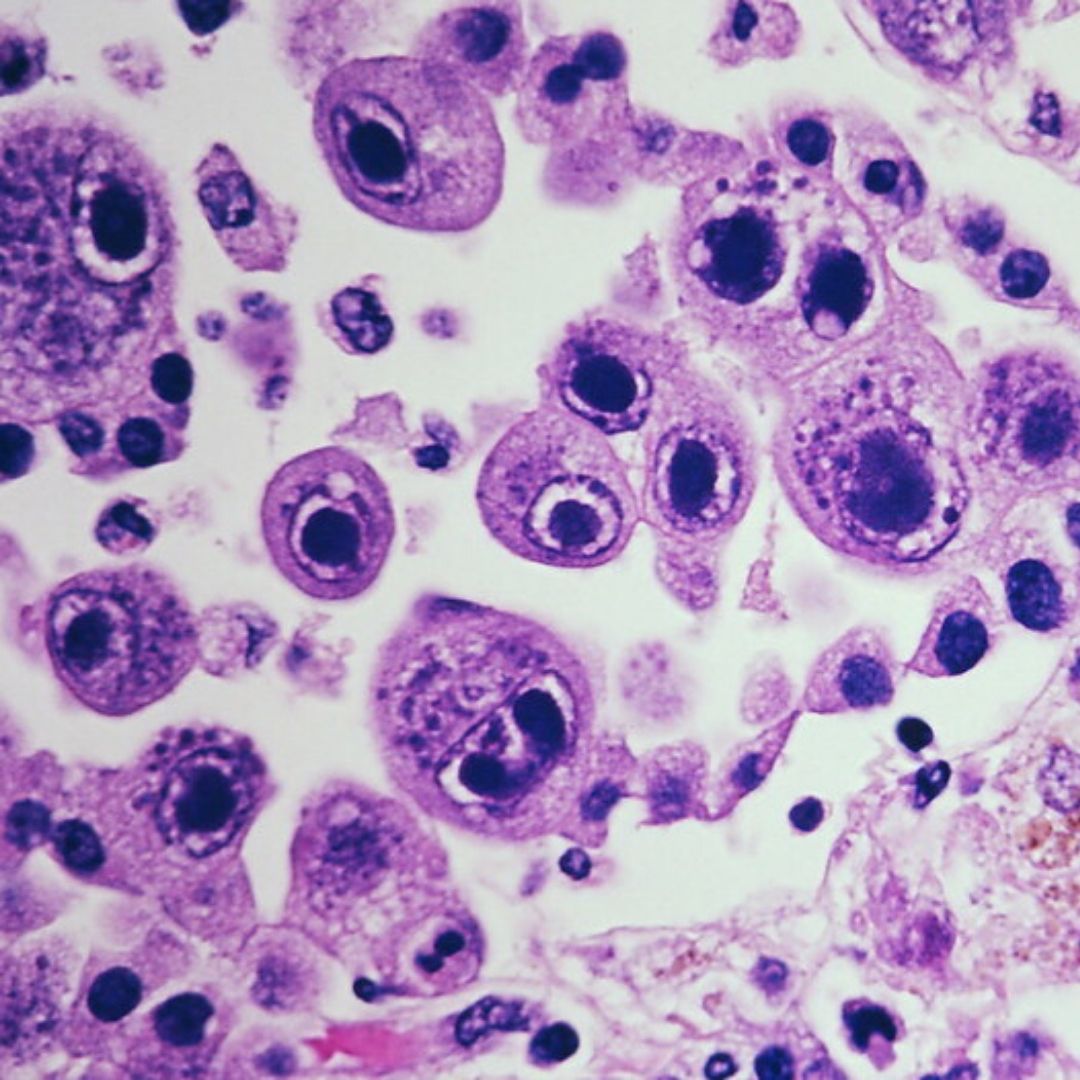 Для точного диагноза нужны результаты других анализов (см. таблицу).
Для точного диагноза нужны результаты других анализов (см. таблицу).


 Obstet Gynecol Surv 2002; 57: 245-256.
Obstet Gynecol Surv 2002; 57: 245-256.