Генетическая информация поставляется в виде рибонуклеопротеинового комплекса, в котором РНК тесно связана с нуклеопротеином. РНК-геном вируса кодирует пять генов, порядок которого высоко консервативен. Эти гены кодируют нуклеопротеиды (N), фосфопротеин (Р), матрицу белка (М), гликопротеин (G) и вирусные РНК-полимеразы (L) — совместно с Р-белком
(фосфопротеином) L-белок обеспечивает транскрипцию и репликацию генома. Полные последовательности генома в пределах от 11615 до 11966 нуклеотидов в длину.
N-белок в виде чехла покрывает вирусную РНК и защищает ее от действия клеточной протеазы.
Белок М (матриксный белок) располагается с внутренней стороны суперкапсидной оболочки. Он участвует в заключительной стадии сборки дочерних вирионов и обеспечивает стягивание рибонуклеопротеина в цилиндр. Белок М
принимает участие в завершающей стадии морфогенеза вируса в зараженной клетке.
Гликопротеин G входит в состав суперкапсидной оболочки вириона и
образует на его поверхности шипы длиной 5-10 нм и диаметром 3 нм. Он участвует в адсорбции вириона на клеточной поверхности, проникновении и эндоцитозе вируса в клетку. Качественный состав белковой части молекулы варьирует в зависимости от вирулентности вируса. Например, в более вирулентном варианте аргинин замещается глутамином и изолейцином. Играет ведущую роль в процессах адсорбции на поверхности чувствительных клеток. G-белок является протективным антигеном, т.е. индуцирует образование вируснейтрализующих антител, которые блокируют адгезию вируса. Он также обладает гемагглютинирующими свойствами.
Вирион, прикрепляясь белком G к рецепторам чувствительной клетки, проникает в нее путем эндоцитоза, а не вследствие слияния суперкапсида с ее мембраной (у рабдовирусов нет белка, ответственного за этот процесс). Внутри клетки вирус обнаруживается в эндосомах, где при кислых значениях рН меняется конформация его G-белка, делая его чувствительным к клеточным протеазам.
Схема строения вируса бешенства представлена на рисунке 1.
Рис. 1. Строение вируса бешенства.
Все транскрипции и репликации событий происходят в цитоплазме внутри тельца Бабеша — Негри. Диаметр составляет 2—10 мкм.
ВБ имеет спиральную симметрию, так что его инфекционные частицы имеют практически цилиндрическую форму. Они характеризуются чрезвычайно широким спектром поражения, начиная от растений и заканчивая насекомыми и млекопитающими; вирус, которым может заразиться человек, чаще имеет кубическую симметрию и принимает формы, аппроксимирующие правильные многогранники.
Вирус бешенства имеет форму пули с длиной около 180 нм и поперечный разрез диаметром около 75 нм. Один конец закруглён или имеет коническую форму, а другой конец имеет плоскую или вогнутую форму. Содержит в себе липопротеины, состоящие из гликопротеина G. Шипы не покрывают плоский конец вириона (вирусной частицы). Под оболочкой имеется мембрана или матрица (М) слоя белка, который имеет возможность инвагинации на плоском конце. Ядро вириона состоит из спирально расположенных рибонуклеопротеидов.
Рис. 2. Электронная микрофотография ВБ.
В центре вириона располагается геном. Геном вируса бешенства представлен одноцепочечной несегментированной молекулой минус-РНК. Схема строения генома и кодируемые им белки представлена на рисунке 3.
Рис. 3. Геном вируса бешенства и кодируемые им белки.
Этапы репродукции вируса бешенства
Репродукция вирусов семейства Rhabdoviridae происходит в цитоплазме клетки-хозяина.
Рис. 4. Схема репродукции рабдовирусов.
1. Адсорбция вируса на клетках-мишенях (нейроциты).
Рабдовирусы связываются с рецепторами клетки-хозяина при помощи гликопротеинов G суперкапсида. (Цифра 1 на рисунке 4.)
Такими рецепторами могут быть никотиновый ацетилхолиновый рецептор (н-холинорецептор), молекула адгезии клеток нервной ткани (NCAM), клатрин и рецептор фактора роста нервов (NGER).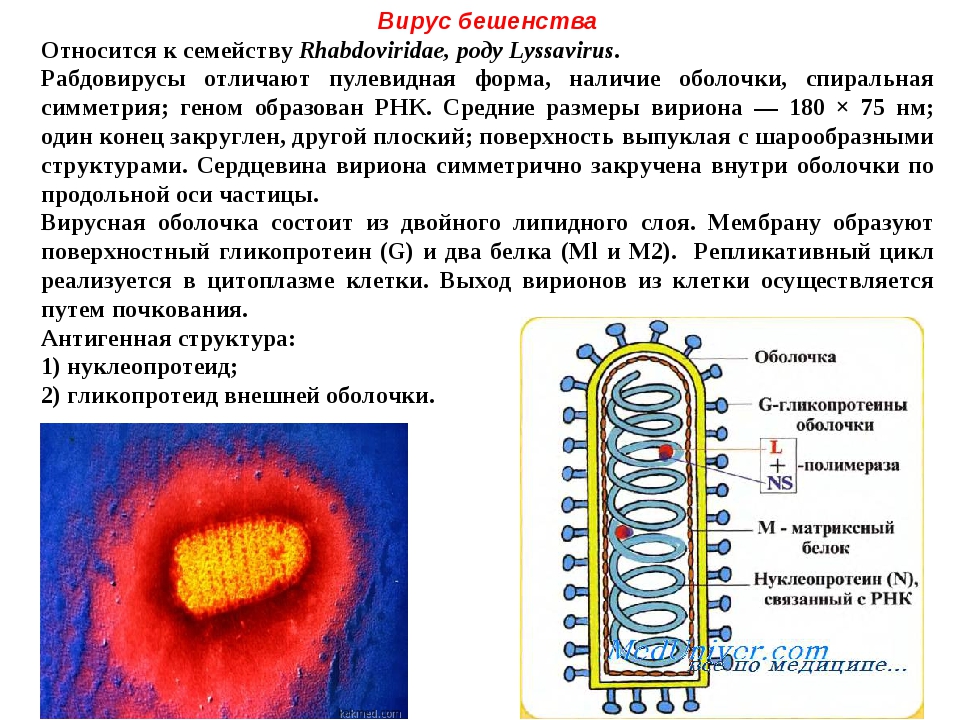
2. Проникновение вируса в клетку по типу эндоцитоза.
После связывания вируса с клеточным рецептором вирионы проникают в клетки посредством рецептор-опосредованного эндоцитоза, то есть в результате образования покрытых оболочкой крупных эндосом (цитоплазматических везикул), содержащих вирусные частицы.
3. Депротеинизация в вакуоли клетки.
Внутри везикул происходит снижение рН среды и конформационное изменение гликопротеина G, что приводит к слиянию оболочки вириона с мембраной везикулы и высвобождению рибонуклеопротеина вириона в цитоплазму клетки (цифра 2 на рисунке 4).
После высвобождения в цитоплазму клетки рибонуклеопротеиновый комплекс переходит из скрученной формы в релаксированную и становится способным к транскрипции.
4.Транскрипция (синтез иРНК для трансляции вирусных белков и плюс-РНК- матрицы для репликации генома).
5.Трансляция (синтез структурных белков вириона и ферментов для репликации). В цитоплазме клетки-хозяина с помощью РНК-зависимой РНК-полимеразы (3 на рис.
4), синтезируется неполные (4 на рис. 4) плюс — нити РНК (пять индивидуальных иРНК для синтеза вирусных белков) и полные (6 на рис. 4) плюс — нити РНК, являющиеся матрицей для синтеза геномной РНК. Во время трансляции иРНК рибосомами (5 на рис. 4) клетки-хозяина синтезируются вирусные белки.
Гликопротеин G гликолизируется в эндоплазматическом ретикулуме, а затем окончательно преобразуется в комплексе Гольджи и включается в плазмолемму клетки-хозяина (8 на рис. 4). Матриксный белок (М-белок) сразу после синтеза встраивается в плазмалемму с внутренней цитоплазматической стороны билипидного слоя. Включение матриксного белка М в плазмалемму является сигналом к формированию вириона.
6.Репликация вирусного генома (минус-РНК).
7.Сборка вириона.
8.Выход вируса из клетки по типу почкования (9 на рис. 4).
Сердцевина вируса, состоящая из РНК, N-, Р- и L-белков, собирается в виде отдельной структуры в цитоплазме. Одновременно происходит модификация клеточной мембраны: с внутренней стороны клеточной мембраны располагается белок М, а снаружи в клеточную мембрану встраивается белок G. Через модифицированную клеточную мембрану происходит почкование дочерних вирионов.
Одновременно происходит модификация клеточной мембраны: с внутренней стороны клеточной мембраны располагается белок М, а снаружи в клеточную мембрану встраивается белок G. Через модифицированную клеточную мембрану происходит почкование дочерних вирионов.
Почкование зрелых вирионов — сложный процесс, для которого необходимы ассоциированный с мембраной G-белок, М-белок и рибонуклеопротеиновые частицы. Все они собираются на определенном участке мембраны. Ключевую роль в сборке и почковании играет М-белок. Он связывает рибонуклеопротеин и оболочку, кроме того, способен вызывать сворачивание удлиненных рибонуклеопротеиновых частиц с образованием той уплотненной конфигурации, которая присутствует в вирионах.
Рис. 5. Схема жизненного цикла вируса бешенства.
Смертоносный кусь
Статья на конкурс «био/мол/текст»: Бешенство — от слова «бес», и хоть это заболевание никакого отношения к чему-то сверхъестественному не имеет, со стороны больной выглядит в лучших традициях фильмов ужасов. Что вызывает столь характерные симптомы? Почему стоит избегать общения с дикими животными? И самое главное: как не пополнить ряды безнадежно больных?
Эта работа опубликована в номинации «Свободная тема» конкурса «био/мол/текст»-2018.
Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
Спонсором приза зрительских симпатий выступил медико-генетический центр Genotek.
Стоит начать с истории
От глиняных табличек до современности
Первые упоминания о болезни от укуса собак, весьма напоминающей бешенство, встречаются на клинописных глиняных табличках Древней Месопотамии в третьем тысячелетии до н.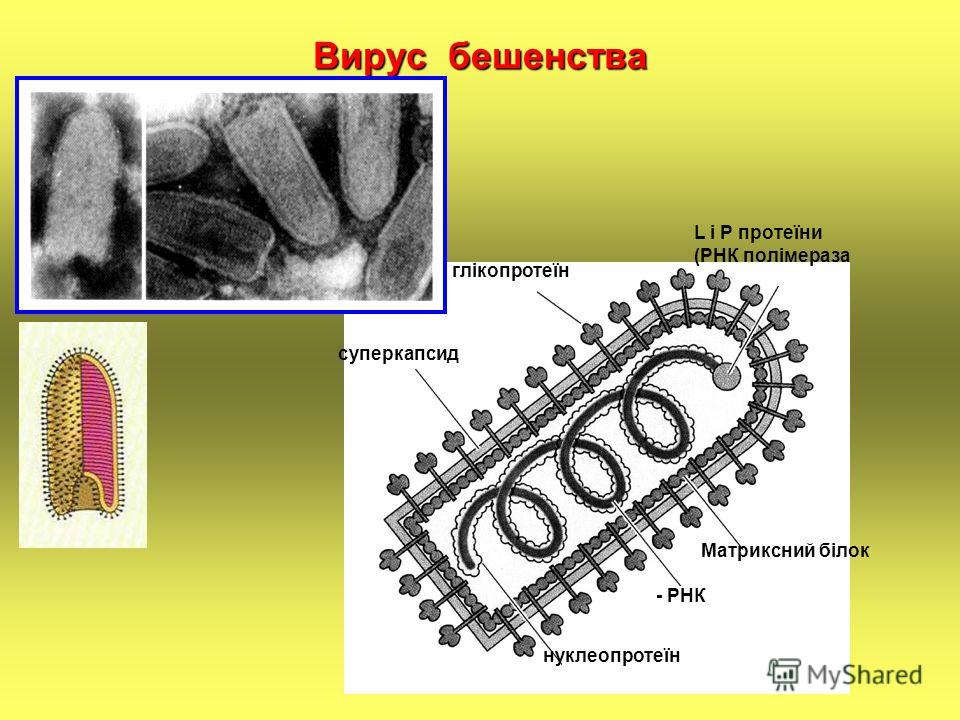 э. [1].
э. [1].
Древнегреческий философ Демокрит описал бешенство собак в V веке до н.э., то же сделал и Аристотель, однако он считал, что человек бешенством не болеет. Корнелий Цельс, древнеримский ученый, в I веке н.э. все же заметил аналогичное заболевание у людей и назвал его водобоязнью [2].
Начиная с XIII века у нас появляются сведения о крупных эпизоотиях бешенства на территории Европы. Вероятно, они вспыхивали и на других континентах, так как это заболевание в современном мире распространено практически повсеместно.
И если вы думаете, что это все было давно, и сейчас вирус не представляет никакой опасности, вы крупно ошибаетесь: согласно данным ВОЗ 2007 года, он ежегодно уносил жизни 55 тысяч человек по всему миру [3]. Это около 151 смерти в день! Такой постоянно высокий показатель говорит о человеческой уязвимости, эпизоотии вспыхивают каждый год, что ставит под опасность жизнь каждого человека. На данный момент случаи заражения бешенством носят регулярный характер в более чем 150 странах мира, в том числе и в России [4] (рис. 1 и 2).
Рисунок 1. Оценка риска заражения бешенством в мире
Рисунок 2. Неблагополучные по бешенству регионы России, данные 2014 года подпись
Давайте знакомиться,
Neuroiyctes rabidЧто ты такое?
Бешенство (rabies, hydrofobia) — особо опасная вирусная инфекция теплокровных животных, в том числе и человека, она выбирает самое «вкусное» — центральную нервную систему (ЦНС). При отсутствии своевременного лечения это заболевание приводит к летальному исходу.
Вирус бешенства входит в отдельное семейство РНК-содержащих вирусов — Rhabdoviridae. Интересно, что такое название оно получило от греческого корня rabdos — «палочка» (рис. 3), так как все рабдовирусы имеют пулевидную или палочковидную форму [5].
Рисунок 3. Маленькие «пули» опасного вируса бешенства видны нам с помощью сканирующего микроскопа
Смертоносная пуля длиной 180 нм и шириной 75–80 нм [6] имеет двухслойную липидную оболочку, которая довольно сильно по строению напоминает привычную нам мембрану клеток. На своей поверхности вирион имеет шипы длиной 10 нм и шириной 3 нм. Упорядоченное расположение шипов на мембране обеспечивает особый гликопротеид, далее мы будет к нему возвращаться еще несколько раз, запомните его, товарищи.
На своей поверхности вирион имеет шипы длиной 10 нм и шириной 3 нм. Упорядоченное расположение шипов на мембране обеспечивает особый гликопротеид, далее мы будет к нему возвращаться еще несколько раз, запомните его, товарищи.
Под прочной оболочкой внутри вируса залегает одна молекула РНК, свернутая в спираль, она мало похожа на привычные нам РНК клеток и вообще не способна к инфицированию. Но она имеет важное значение для жизни хитрого вируса, поскольку несет в себе минус-цепь РНК или, как её еще называют, рибонуклеопротеид (РНП), который послужит матрицей для синтеза вирусной РНК (вРНК) по правилу комплементарности, как только попадет в клетку-хозяина.
«Сердце» вируса, его генетическая информация
РНК вируса бешенства довольно небольшая и содержит всего 5 генов, кодирующих необходимые белки. Чтобы лучше понимать, что необходимо Neuroiyctes rabid для существования, нам вместе с тобой, уважаемый читатель, стоит лучше разобраться в этом вопросе.
Итак, мы знаем, что у цепи РНК есть два конца: 5′ (место присоединения остатка фосфорной кислоты) и 3′ (место присоединения рибозы).
Начиная с 3′ гены вируса бешенства расположены так:
- Ген нуклеокапсидного белка N, окружающего цепь РНК.
- Ген белка NSV — одного из компонентов вирусной транскриптазы, входящего в состав капсида.
- Ген, кодирующий матриксный белок M, выстилающий липидную мембрану с внутренней стороны.
- Ген белка G — внешнего гликопротеида вирусного суперкапсида (оболочки, покрывающей капсид с внешней стороны и содержащей шипы), который отвечает за адсорбцию и внедрение вируса в клетку, обладает антигенными и иммуногенными свойствами (антитела именно к этому гликопротеиду нейтрализуют вирус бешенства).
- Ген белка L — высокомолекулярного компонента вирусной транскриптазы [5] (рис.4).
Рисунок 4. Схематичное изображение РНК вируса бешенства, белки, синтезируемые на определенных участках, и их функции
Когда все необходимые белки синтезируются в клетке-хозяине, то белки G и M будут располагаться с двух сторон от оболочки вируса, а N, NSV и L прилегать к минус-цепи РНК (рис. 5).
5).
Рисунок 5. Схематичное строение вируса бешенства
Разные рабдовирусы обладают различной степенью устойчивости к неблагоприятным факторам внешней среды. Если говорить о вирусе бешенства, он очень слабенький: неустойчив к воздействию ультрафиолета, высушиванию, нагреванию. При 100 градусах Цельсия вирус может выдержать 2 минуты, а при 60 градусах Цельсия — 5 минут. Это очень мало [7]. Для сравнения: для инактивации возбудителя сибирской язвы необходимо применять автоклавирование при температуре выше 110 градусов Цельсия в течение 40 минут. Вирус бешенства к тому же неустойчив к жирорастворителям, трипсину, а также растворам лизола, хлорамина и фенола [5]. Это значит, что при воздействии на него данных факторов, его защитная оболочка разрушается, а генетическая информация под воздействием ферментов «рассыпается» на нуклеотиды.
Вы правда думаете, что вирус бешенства один?
На самом деле различают несколько диких и один культивированный штаммы вируса бешенства. Первые циркулируют в природе, имеют длительный инкубационный период, чаще образуют специфические тельца, локализуются в нервных клетках, слюнных железах и роговице глаза. К ним относят [7]:
- вирус классического бешенства — RABV;
- вирус рукокрылых Лагос — LBV;
- вирус Дювенхейдж — DUVV;
- лиссавирусы европейских рукокрылых EBLV-1 и EBLV-2;
- лиссавирус австралийских рукокрылых — ABLV;
- вирус Мокола — MOKV.
Культивированный (фиксированный) вирус впервые выделил Луи Пастер в 1885 году путем длительного заражения лабораторных кроликов дикой формой вируса, которая мутировала и приобрела определенные, выгодные для нас, качества. Например, она опасна только для лабораторных животных, на которых ее выводили, имеет очень короткий инкубационный период, не образует специфических телец и поражает только ЦНС. Организм человека она не убивает, но заставляет иммунную систему вырабатывать антитела, которые могут защитить и от других, более опасных, штаммов вируса бешенства.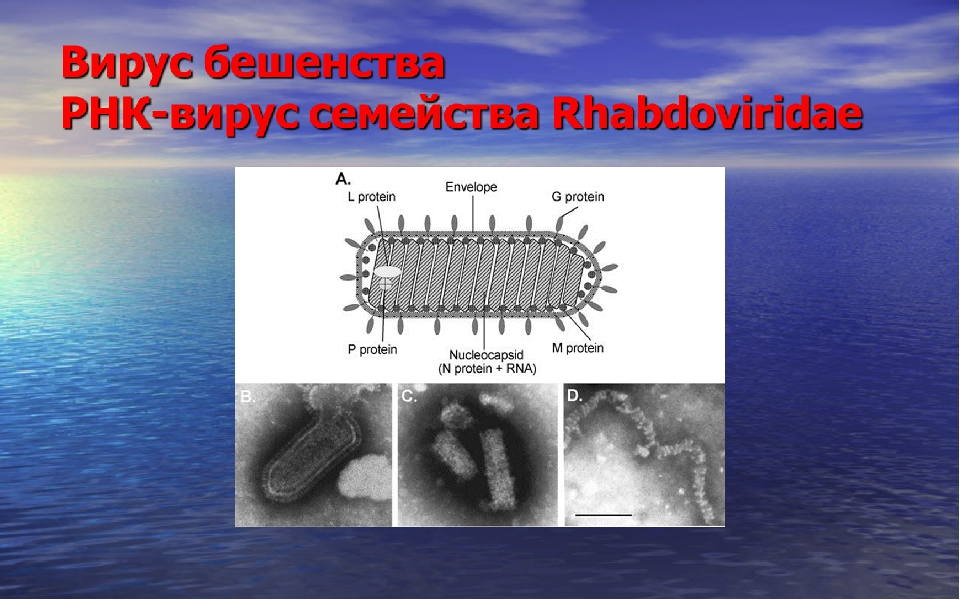 Стоит ли говорить, что люди с радостью стали использовать взвесь мозга больных животных в качестве вакцины и успешно практиковали такой метод до сравнительно недавнего времени [5].
Стоит ли говорить, что люди с радостью стали использовать взвесь мозга больных животных в качестве вакцины и успешно практиковали такой метод до сравнительно недавнего времени [5].
Как у вируса появляются дети?
Чтобы создать подобные себе копии, вирусу бешенства, как и любому другому клеточному паразиту, для начала нужно попасть в организм хозяина и найти интересующую его клетку. Мы уже знаем, что излюбленным местом для его размножения является нервная ткань, в особенности — ЦНС. После попадания с зараженной слюной в ткани, шипастый негодяй проводит в мышечной ткани нового хозяина до нескольких дней, затем адсорбируется на нервные окончания с помощью уже известного гликопротеида G и проникает в нервную клетку путем эндоцитоза (рис. 6).
Рисунок 6. Схематичное изображение жизненного цикла вируса бешенства. RNA = РНК.
Дальнейшая скорость протекания жизненного цикла вируса зависит от места попадания в организм: чем дальше от ЦНС, тем дольше вирус будет распространяться по аксонам, ведь скорость его передвижения составляет примерно 3 мм/ч.
Проникнув в клетку, вирус бешенства сливается с мембраной лизосомы, и его внутреннее содержимое высвобождается. Затем в ход идет вирионная транскриптаза, которая обусловливает считывание информации с минус-РНК, и синтез на ней, как на матрице, вРНК. Далее все идет по стандартной схеме биосинтеза белка: к кодонам вРНК по правилу комплементарности пристраиваются антикодоны тРНК, последние перемещаются к рибосомам, где в дальнейшем синтезируются вирусспецифические белки, с которыми мы уже знакомы. вРНК связывается с N, L и NSV в нуклеокапсид, который подходит к назначенному месту, где уже в плазмалемму (клеточную мембрану) клетки-хозяина успешно встроились M и G. Затем генетическая информация и прилежащие белки обволакиваются мембраной, и путем эндоцитоза в области дендритов (отростков нервных клеток) выходят новые вирионы.
Вирус бешенства, по сравнению со многими другими рабдовирусами, довольно медленно «размножается» в клетках хозяина, этот процесс может занимать несколько суток.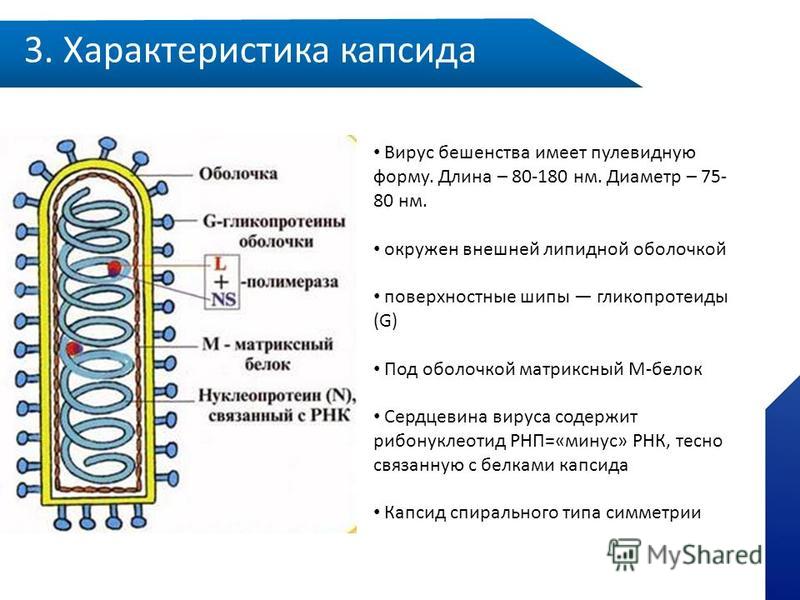 Для примера, вирусу везикулярного стоматита для этих целей требуется несколько часов. Предполагается, что скорость размножения различных вирусов зависит от уровня активности вирионной транскриптазы [8].
Для примера, вирусу везикулярного стоматита для этих целей требуется несколько часов. Предполагается, что скорость размножения различных вирусов зависит от уровня активности вирионной транскриптазы [8].
Кроме того, вирус бешенства может блокировать биосинтез нормальных белков клетки [5] и повышать экспрессию и выделение цитокинов (клеточных медиаторов) в близлежащих, незараженных клетках, что, вероятно, способствует развитию энцефалита [9].
Когда меры предосторожности не сработали
«Хьюстон, у нас проблемы!»
Я искренне надеюсь, что вам никогда в жизни не понадобится несколько следующих абзацев, но с моей стороны было бы преступно упустить это.
Итак, если вас все же покусал или облизал зверь (рис. 6), лучше не надеяться на лучшее, а экстренно применять необходимые меры. Для начала хорошенько промойте место укуса водой с мылом, а затем прижгите спиртовым раствором йода. Если вы вдруг врач-эпидемиолог, спешащий на работу, или обычный смертный, в руках у которого почему-то есть антирабический иммуноглобулин, то это как раз то время, когда стоит его применить по назначению. Сходить к врачу все равно придется, но шансы на выживание у вас резко возрастут.
Если вы хотите, чтобы больше никто не пострадал (а я уверена, что хотите), то вызовите бравую бригаду СББЖ (станции по борьбе с болезнями животных), они усыпят животное и доставят его в лабораторию целиком или только голову, иногда могут достать головной мозг и законсервировать его 50-процентным глицерином, если поездка обещает быть достаточно долгой. Трупный материал упаковывают в плотный полиэтиленовый мешок, а мозг в банку с пробкой, которую к тому же заливают парафином, а потом все это дополнительно помещают в водонепроницаемую тару, чтобы полностью себя обезопасить.
На СББЖ материал с подозрением на бешенство без очереди и всякого промедления исследуют смелые ветеринары, ведь в данном случае речь может идти о сохранении жизни укушенного человека. Работая с, вероятно, зараженным мозгом, надевают две пары перчаток, защитные очки на глаза и шесть марлевых повязок, прикрывающих нос и рот, все манипуляции проводят в стерильных условиях [10].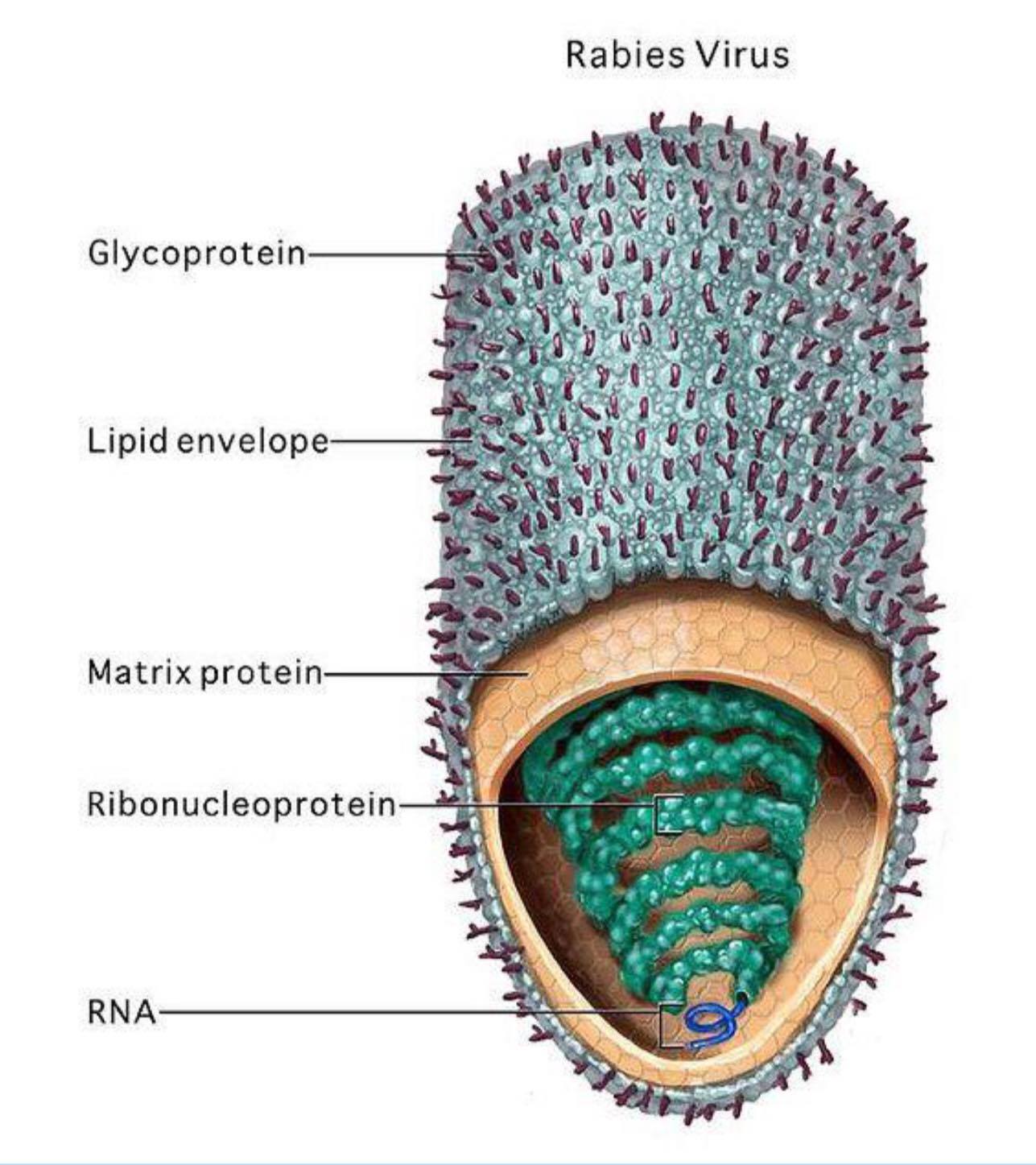 Представляете, как все серьезно?
Представляете, как все серьезно?
Сколько времени в запасе?
Скорость течения болезни может сильно варьировать: инкубационный период длится от 10 до 90 дней и более, но обычно около месяца. Быстрее всего он проходит при попадании вируса в области лица и головы, причем для этого не обязательно, чтобы вас за щечки покусала собака с пеной у рта, ведь проникновение вируса в организм возможно не только через повреждение кожных покровов, но и через слизистые оболочки.
Как только вирус попал в рану или на слизистую, он не спешит оттуда уходить и только через 1–4 дня проникает в нервную ткань. Конечно, ему не терпится скорее попасть в ЦНС и вызвать смертельный энцефалит, но ведь тело хозяина имеет еще парочку пригодных мест, интересующих вирус бешенства, а именно: слюнные железы и роговица глаза. Проникновение в первые из перечисленных имеет принципиальное значение для передачи вируса новым хозяевам.
Не придал значения и умер
В развитии заболевания выделяют три стадии: начальную (она идет сразу после инкубационного периода), возбуждения и параличей [11], [12]. В любом случае, не советую вам ждать ни одну из них. Когда появятся симптомы, будет уже слишком поздно, ведь излечение возможно только во время инкубационного периода. Впрочем, существует гипотеза, согласно которой бешенство можно вылечить путем ингибирования пептидов вируса непосредственно в зараженном организме [13], так что, вероятно, через несколько лет данная проблема будет решена, но пока что будем читать и бояться.
1. Начальная стадия.
Появляются беспокойство и страх, тошнота, головокружение, зуд и покраснение в области укуса. Длится от 1 до 3 дней.
2. Стадия возбуждения.
Возбуждение, судороги гортани и глотки, водобоязнь, агрессивность, галлюцинации. Именно в этот период появляются наиболее привычные симптомы бешенства. Из-за невозможности глотать слюну, она взбивается в пену и валит изо рта. Есть даже предположение, что водобоязнь провоцирует животное разбрасывать слюну, так как даже вид жидкости вызывает болезненные спазмы глотки. Домашние животные, которые обычно не отходят от дома дальше, чем на один километр, беспокойно бегают, превращаются в бродяг и стремятся напасть на все, что движется (или даже не движется), что, конечно, способствует распространению заболевания. Дикие животные теряют страх перед человеческими поселениями и выходят из леса, чаще всего, кусая домашних животных, реже — человека. Иногда может наблюдаться, наоборот, излишняя ласковость зараженных животных, их стремление поскорее облизать вас, что на самом деле еще более опасно, так как вызывает меньше подозрений.
Домашние животные, которые обычно не отходят от дома дальше, чем на один километр, беспокойно бегают, превращаются в бродяг и стремятся напасть на все, что движется (или даже не движется), что, конечно, способствует распространению заболевания. Дикие животные теряют страх перед человеческими поселениями и выходят из леса, чаще всего, кусая домашних животных, реже — человека. Иногда может наблюдаться, наоборот, излишняя ласковость зараженных животных, их стремление поскорее облизать вас, что на самом деле еще более опасно, так как вызывает меньше подозрений.
Также существует исследование, которое дает нам объяснение подобных изменений в поведении. Дело в том, что гликопротеид G, содержащийся на поверхности вируса бешенства, умеет «выключать» никотиновые ацетилхолиновые рецепторы, находящиеся в центральной нервной системе. Ацетилхолин в норме передает сигнал от мозга к мышцам, заставляя их расслабляться. Из-за того, что при бешенстве он перестает восприниматься специальными рецепторами, уровень двигательной активности зараженных организмов повышается [13].
3. Стадия параличей.
Через 5–7 дней после начала появления симптомов смерть наступает от паралича дыхательной или сердечной мускулатуры, так как нервная система перестает посылать им сигналы о необходимых сокращениях.
Когда очень хочется жить. Лечение
Так как бешенство особо опасное заболевание, его лечение представляет собой скорее попытку вызвать искусственный активный иммунитет у предполагаемых больных. Удивительно, что пастеровские методы вакцинации применялись вплоть до XX века, а в сознании граждан навсегда закрепилась фраза «не гладь кошечку, а то будут ставить 40 уколов в живот». Такое количество инъекций обусловлено использованием взвеси мозга зараженных овец, так называемой вакцины Ферми.
Современные же вакцины имеют ряд неоспоримых преимуществ [14]:
- Их выращивают не в живых существах, а в культурах клеток эмбрионов птиц, что делает процесс создания вакцины более контролируемым и гуманным.

- Они более безопасны, так как почти не вызывают побочных эффектов.
- Они экономичнее. Объем для успешной вакцинации нужен меньший, а хранить такие вакцины можно дольше.
Сплошные плюсы! Более того, в настоящее время используют препарат, состоящий не из цельных вирусных частиц, а из гликопротеина вируса бешенства (того самого G), который обладает высокой иммуногенностью. В этом случае количество необходимых инъекций снижается до шести, а в некоторых случаях даже до трех. Активный иммунитет к бешенству достигается последовательностью инъекций ослабленного вируса и может не снижаться от одного года до трех лет [3].
Если вирус попал в область головы и шеи, то, как я уже говорила, он развивается очень быстро, поэтому людям вводят готовый специфический иммуноглобулин, который создает пассивный иммунитет, что несколько продлевает инкубационный период и несколько отдаляет момент гибели зараженного. Антирабический иммуноглобулин получают из 10-процентной сыворотки крови зараженных бешенством лошадей [15].
Просто о сложном. Лабораторная диагностика
А что если не бешенство?
Конечно, у каждого укушенного и облизанного возникают мысли: «Этот котик был точно привит, никакого бешенства и быть не может». Так что я хочу рассказать о том, как ставят диагноз и почему в нем не надо сомневаться.
В лаборатории СББЖ проводится четырехступенчатый анализ материалов, которые были добыты от того животного, которое на вас напало. Принято придерживаться данной последовательности методов лабораторной диагностики:
1. Гистологический метод для обнаружения телец Бабеша—Негри.
В зараженных клетках можно обнаружить специфические включения, так называемые тельца Бабеша—Негри, которые могут быть размером до 25 мкм, а значит, они хорошо видны в световой микроскоп. Их точная функция до сих пор не ясна.
Из головного мозга животного с левой и правой сторон берут материал на гистологические срезы или мазки. Вирус бешенства локализуется в определенных частях головного мозга, таких как Аммонов рог (гиппокамп), мозжечок, кора полушарий и продолговатый мозг (рис. 7). Суммарно получается восемь гистопрепаратов. Мазки или срезы подвергаются окраске по Селлерсу (тельца получаются розово-красного цвета (рис. 8)) или Муромцеву (окраска телец фиолетовая с темно-синими включениями (рис. 9)).
Вирус бешенства локализуется в определенных частях головного мозга, таких как Аммонов рог (гиппокамп), мозжечок, кора полушарий и продолговатый мозг (рис. 7). Суммарно получается восемь гистопрепаратов. Мазки или срезы подвергаются окраске по Селлерсу (тельца получаются розово-красного цвета (рис. 8)) или Муромцеву (окраска телец фиолетовая с темно-синими включениями (рис. 9)).
Рисунок 7. Места локализации телец Бабеша—Негри в головном мозге: гиппокамп, продолговатый мозг, мозжечок, кора полушарий
Рисунок 8. Тельца Бабеша—Негри насыщенного розового цвета, окраска по Селлерсу
Рисунок 9. Тельца Бабеша—Негри темно-фиолетового цвета, окраска по Муромцеву
Обнаружение телец Бабеша—Негри является бесспорным доказательством заражения животного бешенством, однако у некоторых здоровых животных, например, кошек или собак, умерших в результате укуса ядовитой змеи или электрического тока, в головном мозге могут присутствовать включения, похожие на искомые тельца. Кроме того, тельца Бабеша—Негри обнаруживаются у больных животных только в 65–85%. Так что, если их нет, материал обязательно проверяют в дополнительных тестах.
2. Реакция иммунофлюоресценции (РИФ).
Незаменимый и очень точный метод (в 99% случаев результаты совпадают с результатами биопробы). Для него используют те же мазки или срезы, что и для гистологии.
Этот и следующий методы основаны на том, что антитело всегда находит свой антиген. Так как мы знаем антитела (иммуноглобулины) против вируса бешенства, то можем использовать их для обнаружения его антигенов.
Антирабический флюоресцирующий иммуноглобулин вводят в пробу, фиксируют препарат ацетоном, охлажденным до 10 градусов Цельсия, не менее четырех часов. Затем через люминесцентный микроскоп оценивают интенсивность свечения комплекса антиген—антитело, который выглядит как зеленые или желто-зеленые гранулы и часто находится вне клеток (рис. 10) [16].
Рисунок 10. РИФ-положительная окраска FITC-меченными моноклональными антителами, увеличение 100×
Данный метод дает возможность исследовать не только мозг, но и другие органы животного, а именно роговицу и слюнные железы, что может помочь при постановке диагноза.
3. Реакция диффузной преципитации в геле (РДП).
Этот метод применяют при работе с неконсервированным материалом. Он основан на диффузии антигенов и антител в 1–1,5-процентном агарозном геле. В этом геле специально создаются лунки, куда помещают измельченные части мозга, подверженные заражению, и специфические иммуноглобулины. При наличии 1–3 линий преципитации (соединения) между лунками с антигеном и иммуноглобулином тест считается положительным, а животное больным бешенством с вероятностью 45–70%.
4. Биопроба.
Даже если телец Бабеша–Негри не найдено, а РИФ и РДП показали отрицательный результат, все еще нельзя точно сказать, что животное не больно. На помощь приходит метод биопробы, так как он считается наиболее эффективным.
Итак, лабораторным животным (чаще мышам-сосункам или сирийским хомякам) прямо в мозг вводят ткань предполагаемого зараженного животного. И хоть результатов нужно ждать не менее четырех дней, метод поражает своей простотой и эффективностью: появились симптомы — материал был получен от больного животного, нет — скорее всего, оно было здорово.
Но есть два «но», которые носят названия «лисицы» и «скунсы». В мозге особей этих видов, павших от бешенства, обнаружено вещество, которое ингибирует инфекционность вируса. Биопроба с таким материалом будет отрицательна вне зависимости от того, заражено животное или нет.
Есть и другие лабораторные методы выявления бешенства, но они либо трудновыполнимы, либо еще не вошли в постоянное использование из-за низкой эффективности [10], [17].
Профилактика бешенства вчера и сегодня
Вы что, хотите убивать лисичек?
Итак, бешенство — опасно, оно может убить небольшой город и это во времена, когда уже существует доступная и действенная вакцина. Что мы делаем не так?
Что мы делаем не так?
Для начала нужно понять, как избежать распространения вируса. Самое основное — ликвидация городских и диких очагов. По данным ВОЗ, 99% заражений бешенством происходит именно от укусов домашних или уличных городских животных. Многие страны проводят успешные иммунизацию и учет бродячих животных, что блокирует передачу вируса. В России же наблюдается повсеместное увеличение их числа, из-за чего 420–470 тыс. человек обращается с укусами в поликлиники ежегодно [18]!
Однако не стоит забывать, что дикие бешеные животные теряют осторожность и подходят вплотную к поселениям, а значит, тоже представляют опасность для человека. В нашем регионе основным переносчиком являются лисицы [19].
Наверняка вы помните о таком явлении, как популяционные волны — колебания численности живых организмов. Так вот, чем выше численность популяции диких животных, тем больше вероятность вспышек бешенства среди них, а отстрел дает лишь временный и весьма сомнительный результат. Что делать? Ряд стран уже применяет методику скармливании оральных антирабических вакцин диким животным. Успешные опыты проводят в США с 1976 года [20]. Достаточно раз в год размещать приманку с вакциной в местах обитания диких зверей, чтобы они её съели и не болели бешенством. И лисы живы, и люди целы. Однако такую программу лучше не начинать, если она планируется на срок менее чем шесть лет, не будет крупномасштабной или спланированной [21].
Также не стоит забывать и о сельскохозяйственных животных — они зачастую становятся жертвами бешенных некрупных плотоядных, таких как кошки, летучие мыши и многие другие. Вспышки бешенства на агропромышленных предприятиях очень тяжело остановить, так что профилактика бешенства должна носить регулярный, а не экстренный характер [22].
Кроме того, существуют рекомендации по доконтактной вакцинации людей, проживающих в местах с частыми эпизоотиями бешенства [3].
О будущем
В наше время идет настоящая борьба за то, чтобы бешенство стало отголоском прошлого и больше не несло за собой столько потерь. ВОЗ, Всемирная организация здравоохранения животных (МБЭ), Продовольственная и сельскохозяйственная организация ООН (ФАО) и Глобальный альянс по борьбе против бешенства (ГАББ) учредили партнерство «Объединенные против бешенства» (United against rabies), целью которого является полностью устранить случаи заражения этим заболеванием к 2030 году. United against rabies выдвигает два основных направления работы: информирование населения, регулярная и доступная вакцинация людей и животных [4]. Вероятно, даже мы с вами застанем момент, когда бешенство будет полностью искоренено.
ВОЗ, Всемирная организация здравоохранения животных (МБЭ), Продовольственная и сельскохозяйственная организация ООН (ФАО) и Глобальный альянс по борьбе против бешенства (ГАББ) учредили партнерство «Объединенные против бешенства» (United against rabies), целью которого является полностью устранить случаи заражения этим заболеванием к 2030 году. United against rabies выдвигает два основных направления работы: информирование населения, регулярная и доступная вакцинация людей и животных [4]. Вероятно, даже мы с вами застанем момент, когда бешенство будет полностью искоренено.
Изложение личных надежд
Не так давно человечество отошло от пастеровских методов вакцинации против бешенства. Мы стремимся на Марс, но не можем спастись от чего-то столь небольшого, как вирусы, а пули длиной 180 нм уносят больше жизней, чем боевые снаряды… Иронично, не правда ли? Однако я всей душой верю, что даже просвещение аудитории посредством сведения ключевых моментов в небольшую статью, может сыграть решающую роль в спасении чьей-то жизни. Надеюсь, в скором времени положение людей в борьбе с вирусами на арене жизни изменится в нашу пользу, а пока что ждем, надеемся и не трогаем диких животных.
- Петрова Н.П. Медицина эпохи древнего мира. Гомель: ГГМУ, 2009;
- Нуратинов Р.А. (2011). Краткая характеристика нозоареала бешенства. Юг России: экология, развитие. 4, 176–180;
- Еженедельный эпидемиологический бюллетень. (2007). Сайт ВОЗ;
- Бешенство. (2018). Сайт ВОЗ;
- Коротяев А.И. и Бабичев С.А. Медицинская микробиология, иммунология и вирусология. СПб: «СпецЛит», 2010. — 760 с.;
- Барышников П.И. Ветеринарная вирусология: учебное пособие. Барнаул: Изд-во АГАУ, 2006. — 113 с.;
- Заволока А.А. и Заволока Ан.А. (2013). О бешенстве. VetPharma. 4, 24–31;
- Страйер Л.
 Биохимия (в 3-х томах, том № 3). М.: «Мир», 1985. — 400 с.;
Биохимия (в 3-х томах, том № 3). М.: «Мир», 1985. — 400 с.; - Gerard J Nuovo, Dulcelena L DeFaria, Juan G Chanona-Vilchi, Yilan Zhang. (2005). Molecular detection of rabies encephalitis and correlation with cytokine expression. Mod Pathol. 18, 62-67;
- Шевченко А.А., Шевченко Л.В., Черных О.Ю., Шевкопляс В.Н. Лабораторная диагностика инфекционных болезней животных. Краснодар: КубГАУ, 2009. — 584 с.;
- Иванов В.А., Хисматуллина Н.А, Чернов А.Н., Гулюкин А.М. Бешенство: этиология, эпизоотология, диагностика: учебно-методическое пособие в иллюстрациях. М.: «Колос», 2010. — 54 с.;
- WHO expert consultation on rabies: first report. (2004). Сайт ВОЗ;
- Karsten Hueffer, Shailesh Khatri, Shane Rideout, Michael B. Harris, Roger L. Papke, et. al.. (2017). Rabies virus modifies host behaviour through a snake-toxin like region of its glycoprotein that inhibits neurotransmitter receptors in the CNS. Sci Rep. 7;
- Буркова В.В., Высеканцев И.П., Лаврик А.А. (2014). Сохранность инфекционной активности промышленных штаммов вируса бешенства, хранившихся при различных температурах. Живые и биокосные системы. 9;
- Государственная фармакопея СССР. М.: «Медицина», 1968;
- Носик Н.Н. и Стаханова В.М. (2000). Лабораторная диагностика вирусных инфекций. Клиническая микробиология и антимикробная терапия. 2, 70–78;
- Назаров Н.А., Михайлина Н.М., Рыбаков С.С., Метлин А.Е., Чепуркин А.В., Молодкин А.В. и др. (2005). Разработка твердофазного непрямого сэндвич-варианта иммуноферментного анализа диагностики бешенства животных. Труды федерального центра охраны здоровья животных. 125–132;
- Мовсесянц А.А. (2011). Бешенство: особенности современной эпизоотической и эпидемиологической ситуации в России.
 Эпидемиология и вакцинопрофилактика. 5, 4–5;
Эпидемиология и вакцинопрофилактика. 5, 4–5; - Макаров В.В., Джупина С.И., Ведерников В.А., Заводских А.В., Ромашкин С.Б., Афонин В.Н. (2002). Бешенство животных разных видов в современных условиях — эпизоотологический образец и клиническая характеристика. Ветеринарная патология. 1, 65–71;
- Франц И. и Крит А. Биологические методы борьбы с вредителями. М.: «Колос», 1984. — 352 с.;
- Метлин А.Е, Чернышова Е.В, Рыбаков С.С. (2009). Бешенство животных: эпизоотология, меры борьбы и перспективы. Ветеринария Кубани. 6, 2–4;
- Ведерников В.А., Балдина И.В., Шабейкин А.А., Гулюкин А.М., Харкевич А.А., Шабейкина М.В. (2005). Бешенство животных в Российской Федерации. Вакцинация. 1, 15–19.
Биомолекула
Биология
«Сухая» биология
Антропология
Бионика
Биофизика
Вирусология
Вопросы пола
ГМО
Генетика
Иммунология
Микробиология
Нейробиология
Носимые технологии
Психогенетика
Синтетическая биология
Старение
Структурная биология
Цитология
Эволюционная биология
Экология
Эмбриология
Эпигенетика
Этология
Биомолекулы
GPCR
Активные формы кислорода
Амилоиды
Биомембраны
Гормоны растений
ДНК
Ионные каналы
Мобильные генетические элементы
Внеклеточный матрикс
Нейромедиаторы
РНК
Рецепторы
Хроматин
Биотехнологии
CRISPR/CAS
GWAS
Генная инженерия
ДНК-микрочипы
Драг-дизайн
Квантовые точки
Нано(био)технологии
Оптогенетика
РНК-интерференция
Секвенирование ДНК
Тканевая инженерия
Флуоресценция
Детям
Личность
Нобелевские лауреаты
Медицина
SARS-CoV-2
Проект «Биомолекулы» и Forbes
Аллергия
Антибиотики
Атеросклероз
Аутоиммунитет
Боль
ВИЧ/СПИД
Вакцины
Вирус Зика
Вирус Эбола
Генная терапия
Грипп
Депрессия
Дерматология
Диагностика
Здравоохранение
Нейродегенерация
Никотин
Онкологические заболевания
Персонализированная медицина
Питание
Сон
Стволовые клетки
Фармакология
Эпилепсия
Места
Наглядно о ненаглядном
Видео
Инфографика
Комикс
Мультфильм
ОколоНауки
Итоги года
Карьера
Мнения
Наука из первых рук
Образование
Своя работа
Процессы
Анабиоз
Апоптоз
Аутофагия
Биодеградация
Метаболизм
Фотосинтез
Спорт
Биомолекула
Биология
«Сухая» биология
Антропология
Бионика
Биофизика
Вирусология
Вопросы пола
ГМО
Генетика
Иммунология
Микробиология
Нейробиология
Носимые технологии
Психогенетика
Синтетическая биология
Старение
Структурная биология
Цитология
Эволюционная биология
Экология
Эмбриология
Эпигенетика
Этология
Биомолекулы
GPCR
Активные формы кислорода
Амилоиды
Биомембраны
Гормоны растений
ДНК
Ионные каналы
Мобильные генетические элементы
Внеклеточный матрикс
Нейромедиаторы
РНК
Рецепторы
Хроматин
Биотехнологии
CRISPR/CAS
GWAS
Генная инженерия
ДНК-микрочипы
Драг-дизайн
Квантовые точки
Нано(био)технологии
Оптогенетика
РНК-интерференция
Секвенирование ДНК
Тканевая инженерия
Флуоресценция
Детям
Личность
Нобелевские лауреаты
Медицина
SARS-CoV-2
Проект «Биомолекулы» и Forbes
Аллергия
Антибиотики
Атеросклероз
Аутоиммунитет
Боль
ВИЧ/СПИД
Вакцины
Вирус Зика
Вирус Эбола
Генная терапия
Грипп
Депрессия
Дерматология
Диагностика
Здравоохранение
Нейродегенерация
Никотин
Онкологические заболевания
Персонализированная медицина
Питание
Сон
Стволовые клетки
Фармакология
Эпилепсия
Места
Наглядно о ненаглядном
Видео
Инфографика
Комикс
Мультфильм
ОколоНауки
Итоги года
Карьера
Мнения
Наука из первых рук
Образование
Своя работа
Процессы
Анабиоз
Апоптоз
Аутофагия
Биодеградация
Метаболизм
Фотосинтез
Спорт
Биомолекула
Биология
«Сухая» биология
Антропология
Бионика
Биофизика
Вирусология
Вопросы пола
ГМО
Генетика
Иммунология
Микробиология
Нейробиология
Носимые технологии
Психогенетика
Синтетическая биология
Старение
Структурная биология
Цитология
Эволюционная биология
Экология
Эмбриология
Эпигенетика
Этология
Биомолекулы
GPCR
Активные формы кислорода
Амилоиды
Биомембраны
Гормоны растений
ДНК
Ионные каналы
Мобильные генетические элементы
Внеклеточный матрикс
Нейромедиаторы
РНК
Рецепторы
Хроматин
Биотехнологии
CRISPR/CAS
GWAS
Генная инженерия
ДНК-микрочипы
Драг-дизайн
Квантовые точки
Нано(био)технологии
Оптогенетика
РНК-интерференция
Секвенирование ДНК
Тканевая инженерия
Флуоресценция
Детям
Личность
Нобелевские лауреаты
Медицина
SARS-CoV-2
Проект «Биомолекулы» и Forbes
Аллергия
Антибиотики
Атеросклероз
Аутоиммунитет
Боль
ВИЧ/СПИД
Вакцины
Вирус Зика
Вирус Эбола
Генная терапия
Грипп
Депрессия
Дерматология
Диагностика
Здравоохранение
Нейродегенерация
Никотин
Онкологические заболевания
Персонализированная медицина
Питание
Сон
Стволовые клетки
Фармакология
Эпилепсия
Места
Наглядно о ненаглядном
Видео
Инфографика
Комикс
Мультфильм
ОколоНауки
Итоги года
Карьера
Мнения
Наука из первых рук
Образование
Своя работа
Процессы
Анабиоз
Апоптоз
Аутофагия
Биодеградация
Метаболизм
Фотосинтез
Спорт
Вирус бешенства — Справочник химика 21
Лучше всего изучен спиральный РНК-содержащий вирус табачной мозаики (разд.
 Г.2)я. Более сложное строение имеют вирусы, у которых вирионы напоминают по форме пулю примером может служить вирус бешенства — его диаметр равен 65—90 нм, а длина— 120—500 нм. Нуклеопротеид внутри частицы у таких вирусов уложен в виде спирали. [c.289]
Г.2)я. Более сложное строение имеют вирусы, у которых вирионы напоминают по форме пулю примером может служить вирус бешенства — его диаметр равен 65—90 нм, а длина— 120—500 нм. Нуклеопротеид внутри частицы у таких вирусов уложен в виде спирали. [c.289]Л. Пастеру удалось избавить человечество еще от одной страшной болезни — бешенства. Вирус бешенства, попадая в организм, медленно развивается в клетках мозга. Л. Пастер приготовлял вытяжки из высушенных тканей мозга кроликов, зараженных этим вирусом, и использовал полученные препараты в качестве защитной прививки. Высушивание ослабляло вирус, но не препятствовало образованию антител, т. е. сохраняло антигенную активность. Однако химизм процессов иммунизации оставался совершенно неизвестным, и бактериологи нуждались в активной поддержке химиков. В начале XX в. химик и врач П. Эрлих утвердил основы химиотерапии, поставив задачей отыскание соединений, которые убивали бы клетки бактерий, не затрагивая клет- [c.180]
Гликопротеин 50 вируса псевдобешенства Гликопротеин вируса бешенства Антиген респираторно-синцитиального вируса [c.145]
Вирус бешенства Энцефалит [c.229]
Вирусам — как облигатным паразитам — присуща еще и весьма высокая специфичность применительно к организмам-хозяевам (вирусы бактерий, грибов, растений, животных) и, даже тканям (вирусы бешенства и полиомиелита — в отношении нервной ткани, вирус оспы — в отношении кожи, аденовирусы — в отношении железистой ткани) [c.289]
Гамма-глобулин антирабический представляет собой 10% раствор гамма-глобулиновой фракции сыворотки крови лошадей, содержащей антитела к вирусу бешенства. [c.329]
Вакцина представляет собой лиофильно высушенную 5% суспензию ткани мозга овец или кроликов, зараженных фиксированным вирусом бешенства. Вирус инактивируют фенолом в концентрации 1%. [c.725]
Предшественник гликопротеина G вируса бешенства [c.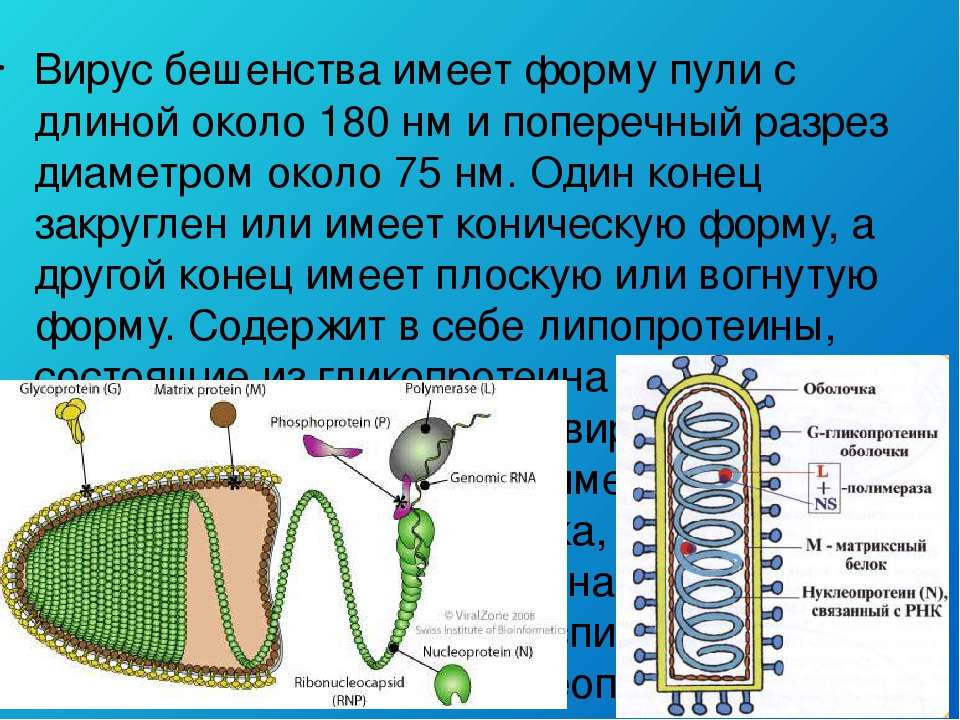 161]
161]
Принято считать, что такие симптомы простуды, как насморк или кашель, — это досадные следствия активности вирусов. В некоторых случаях, однако, представляется более вероятным, что вирус намеренно выработал их, чтобы обеспечить себе перемещение от одного хозяина к другому. Вирус не удовлетворяется тем, что его выдыхают в воздух он заставляет нас чихать или кашлять, залпом разбрасывая вокруг вирусные частицы. Вирус бешенства передается со слюной, когда одно животное кусает другое. У собак один из симптомов этой болезни состоит в том, что обычно смирные и дружелюбные животные становятся свирепыми кусаками со свисающей из пасти пеной. Кроме того, в отличие от нормальных собак, которые обычно не отходят от дома дальше чем на 1-1,5 километров, бешеные собаки превращаются в беспокойных бродяг, разнося вирус на большие расстояния. Высказывалось даже предположение, что хорошо известный симптом водобоязни побуждает собаку стряхивать с морды влажную пену, а вместе с ней и вирус. Я не располагаю прямыми данными о том, что болезни, передаваемые половым путем, повышают половое влечение, но мне представляется небезынтересным изучить этот вопрос. По крайней мере одно вещество, считающееся средством, вызывающим половое возбуждение, шпанская мушка, оказывает свое действие, вызывая зуд, а как известно, заставлять людей чесаться — это именно то, что вирусы отлично умеют делать. [c.190]
С вирусом бешенства, обязательно должен быть вакцинирован и иметь в крови защитный титр противовирусных антител, заданный нормами Всемирной организации здравоохранения [7]. Кроме того, в настоящей главе особое внимание уделено очистке рабдовирусов растений, поскольку эта процедура встречается с значительными трудностями. [c.113]
Для выделения, например, вируса бешенства 1 мл суспензии клеток ВНК-21 смешивают с 0,25 мл суспензии мозговой ткани во флаконе типа Т-25 смесь инкубируют несколько минут при комнатной температуре. [c. 122]
122]
Вирус бешенства относится к РНК-содержащим вирусам рода Lyssavirus, семейства Rhabdovindae. При бешенстве поражается центральная нервная система, поэтому диагностика заболевания ос-нована на обнаружении в ткани мозга телец Бабеша—Негри (в области гиппокампа), вирусного антигена или самого вируса. При исследовании животного, нанесшего укус, определяют наличие вируса или вирусного антигена в ткани слюнной железы с помощью РИФ и биологической пробы. [c.306]
Для подтверждения диагноза мозг заболевших мышей исследуют на наличие телец Бабеша—Негри или антигена вируса бешенства в РИФ. Идентификацию проводят с помощью PH на мышах. [c.307]
В работе с животными должны учитываться все инфекционные заболевания, которые могут сказаться на результатах экспериментов При этом необходимо иметь в виду и тот факт, что отдельные возбудители инфекционных заболеваний могут передаваться от человека к животным и наоборот К их числу относятся вирусы бешенства, лимфоцитарного хориоменингита, шигеллы, некоторые бруцеллы (Bru ella ams), сальмонеллы, микобактерии туберкулеза, токсоплазмы (Toxoplazma gondii), дизентерийная амеба [c.285]
По способам культивирования особое место занимает вирус бешенства. Его репродукцию осуществляют на мозговой ткани целостных организмов, используя для этого кроликов, крыс, овец. А. Пастер в 80-е годы XIX века выделил от больной собаки вирус бешенства, и после ряда его пассажей через мозг кроликов он добился того, что вирус приобрел свойства вызывать заболевание у данных животных после определенного и постоянного инкубационного периода (4-6 дней). Такой вирус, в отличие от вируса «уличного» бешенства, получил название Virus fixe (фиксированный вирус). Его-то и применяют для получения вакцин. [c.548]
В целях профилактики бешенства используют сухие антира-бические вакцины Ферми и МИВП. Первую из них готовят из мозга овец возраста до 1 года, вторую — из мозга сосунков белых крыс (возраст 4-8 суток) после заражения тех и других фиксированным вирусом бешенства. Подобные вакцины представляют собой суспензии мозговых тканей, содержащих указанный вирус. В сухом виде вакцины выпускают в форме таблеток беловато-серого цвета, которые суспендируют в прилагаемом растворителе (дистиллированная вода) и сразу же вводят подкожно. Хранение разведенных вакцин впрок запрещается. [c.548]
Подобные вакцины представляют собой суспензии мозговых тканей, содержащих указанный вирус. В сухом виде вакцины выпускают в форме таблеток беловато-серого цвета, которые суспендируют в прилагаемом растворителе (дистиллированная вода) и сразу же вводят подкожно. Хранение разведенных вакцин впрок запрещается. [c.548]
Неправильное применение пестицидов, так же как и широко разбросанные для борьбы с мышами отравленные зерна (по предписанию зооциды должны вноситься глубоко в мышиные норы), могут привести к уничтожению пригодной для охоты дичи. Борьба с пашенными полевками путем обработки полей препаратами энд-рина также приводит к досадным потерям дичи [447]. Эти препараты вычеркнуты из списка официально допущенных [112]. Однако сообщение о том, что кролики становятся настоящим бедствием в результате гибели многих лисиц после поедания ими отравленных птиц и мышей [170], не соответствует истинному положению вещей, как это видно из сообщения Британского министерства сельского хозяйства 1300 найденных мертвых лисиц погибло от вируса бешенства [32]. Исследования 384 экземпляров падали, проведенные в 1950—1954 гг. Институтом гигиены животных Фрайбургского университета, показали, что у 4,4% из них можно было предположить отравления, которые, однако, не удалось доказать, и лишь 2,6% случаев отравления были установлены [447]. Гибель дичи как следствие применения пестицидов стала после исключения ранее применявшихся токсичных средств (эндрин, арсенат кальция) и проведения разъяснительной работы с потребителями средств защиты растений [791] настолько редкой, что, можно сказать, она принадлежит истории. [c.28]
Очистка осуществлялась также удалением азотнокислых или других примесей из раствора вируса без одновременного поглощения его ионитом. Ингибитор гемолизина для вируса свинки (по всей вероятности ионы Са ) сорбировался сульфоионитом [57]. Некоторые нейротропические вирусы (японского энцефалита, восточного конского энцефалита, вирус бешенства) очищались адсорбцией в колонке на карбоксильном ионите — амберлите ХЕ64, 140— 180 меш в Ка форме — от азотсодержащих материалов из их суспензий [59]. Для изучения вирусов иониты были буферированы до разных значений pH между 6,8 и 8,8 и стерилизовались. После пропускания 1 объема суспензии через 2 объема ионита отмечалась разная степень очистки с удалением до ЭЗ /о азота. [c.622]
В последние годы проведены многочисленные опыты по применению пероральной вакцинации против различных вирусов. Примером может служить вакцинация с питьевой водой кур для защиты их от куриной оспы и классической чумы птиц. Обсуждается возможность массовой вакцинации лис, являющихся основными резерваторами вируса бешенства в Европе распространение бешенства удавалось приостановить, когда прививками было охвачено не менее 75% популяции этих животных. Успешные опыты по применению приманок с живой вакциной бешенства проводятся в США уже с 1976 г. [c.216]
Наиболее широко используемый метод концентрирования рабдовирусов — осаждение высокоскоростным центрифугированием (естественно, для этого в лаборатории должна быть ультрацентрифуга с подходящим ротором). Коэффициент седиментации стандартных инфекционных частиц ВВС и вируса бешенства составляет около 600S длина ДИЧ на 1/3—3/4 меньше длины стандартных вирионов, и соответственно они имеют меньшие коэффициенты седиментации [25]. В большинстве лабораторий для выделения вируса из инфицированных тканей осветленную содержащую вирус культуральную жидкость в ламинарном боксе переносят в плотно закрывающиеся центрифужные пробирки или стаканы большого объема (250 мл) от соответствующего углового или бакет-ротора, например центрифуги Spin o (Be kman) и др. [c.124]
Константа седиментации крупного фрагмента РНК приблизительно равна 408, а вес общей РНК нерасщеп-ленной частицы лежит между З-Ю и 7-10 Д. Интерпретация сложной структуры соединенных между собой спиралей этого вируса схематически изображена на фиг. 37. К этому же классу, возможно, относится и вирус бешенства [228]. [c.149]
Поскольку интенсивность изучения вирусов постоянно нарастает благодаря непрерывному совершенствованию биохимических и иммунологических методов, очевидная уникальность антигенной изменчивости вируса гриппа и его кажущаяся гипермутабельность могут быть подвергнуты сомнению. Недавно получены доказательства того, что вирус бешенства [68], полиовирус [86] и другие РНК-содержащие вирусы [39] претерпевают различные антигенные изменения. Тем не менее только нри гриппе непрерывное появление мутантов отчетливо влияет на эпидемиологию болезни. [c.12]
Раскрытие иммунохимических основ аллергического энцефалита и близких к нему болезней — рассеянного склероза и энцефалита, возникающего иногда после вакцинации против вируса бешенства, — заставляет исследователей с возрастающим вниманием относиться к данным об иммунохимических процессах при других психонейрологических болезнях. Выше уже упоминались предположения о возможной роли этих процессов в патогенезе эпилепсии. Разнообразные спектры антител к мозгоспецифическим белкам и ряд изменений иммуно-компетентных клеток регистрируются при шизофрении, депрессиях и др. Очевидной представляется важность накопления и [c.436]
Тема 35. ВИРУСОЛОГИЧЕСКАЯ И СЕРОЛОГИЧЕСКАЯ ДИАГНОСТИКА НЕЙРОИНФЕКЦИЙ, ВЫЗВАННЫХ ПИКОРНАВИРУСАМИ, ФЛАВИВИРУСАМИ, ВИРУСАМИ БЕШЕНСТВА И ЛИМФОЦИТАРНОГО ХОРИОМЕНИНГИТА [c.240]
Сухая актирабическая вакцина Ферми. Изготовляется из мозга овец в возрасте до 1 года, зараженных вирусом бешенства, и вьшускается в сухом виде. Антирабические вакцины вводят лицам, укушенным больными или подозрительными на бешенство животными. Прививки проводят по специальной инструкции. Антирабические вакцины обладают высокой эффектив- [c.245]
Цикл размножения некоторых рабдовирусов, например ВВС, короткий и составляет несколько часов, других же, например вируса бешенства, — более длинный и составляет несколько суток. Точно неизвестно, почему одни вирусы размножаются более эффективно, чем другие, хотя предполагают, что эффективность размножения определяется уровнем активности вири-онной транскриптазы. [c.114]
Некоторые штаммы вируса бешенства тоже образуют четкие бляшки на монослое клеток хомячка ER в настоящее время эта линия клеток широко используется для размножения и титрования вируса бешенства и других вирусов [17]. Метод бляшек с использованием клеток ER особенно чувствителен при титровании стандартного штамма вируса бешенства VS, При работе этим методом используют монослойные культуры, выращиваемые в шестилуночных планшетах (диаметр лунки составляет 35 мм). [c.117]
Описаны различные модификации метода бляшек с использованием суспензии клеток в агарозе или агарового покрытия [16, 18]. Один из этих методов разработан для медленно размножающегося вируса бешенства [19]. Сублиния клеток ЗНК-21 (клон 13S) была адаптирована к росту в суспензионной культуре в присутствии агарозы в течение 1,5—2 нед [20] (эти клетки способны расти как в монослое, так и в суспензионной культуре на среде МЕМ-10). Клетки, хранящиеся в жидком азоте, сначала выращивают в виде монослоя, а затем пассируют путем регулярной трипсинизации. Размороженные клетки проходят около 30 пассажей. После этого их способность давать бляшки может нарушиться. [c.118]
Рабдовирусы млекопитающих, принадлежащие к родам Vesi ulovirus и Lissavirus, размножаются в мозге взрослых мышей и крыс после интрацеребрального заражения и могут быть выделены из природного материала после одного пассажа через мозг животных. Однако более чувствительной системой для выявления и размножения этих рабдовирусов являются мыши-сосунки [23]. В зависимости от продолжительности инкубационного периода длительность пассажа в мозге мышей может составлять от 7 до 18 сут, а в случае медленно размножающегося вируса бешенства и больше. Для ВВС инкубационный период, как правило, намного короче (2 сут). Вирус обнаруживают методом иммунофлуоресцеиции. [c.122]
Лишь столетие спустя уже Пастером был сформулирован фундаментальный принцип вакцинации для создания напряженного иммунитета против высоковирулентных микроорганизмов можно применять препараты из тех же микробов, но с ослабленной путем определенного воздействия вирулентностью. Используя в соответствии с этим высушенный спинной мозг кролика, зараженного вирусом бешенства, и прогретые культуры бацилл сибирской язвы, Пастер создал по сути дела прототипы современных вакцин. В то же время созданная Дженнером вакцина животного происхождения, содержащая вирус коровьей оспы (гетерологичная), не получила впоследствии как метод какого-либо продолжения. [c.361]
Внимание! Вирус бешенства в г. Мытищи!
ВНИМАНИЕ, БЕШЕНСТВО !
Государственная ветеринарная служба информирует
о выявлении 26.10.2020 года на территории города Мытищи случая заболевания бешенством у енотовидной собаки.
Дикое животное было подобрано на обочине дороги
в Ярославской области и привезено в город Мытищи.
Бешенство — болезнь животных и людей, вызываемая вирусом и представляющая смертельную опасность, поэтому так важно оценивать все риски, связанные с этим заболеванием.
Переносчиками бешенства являются все без исключения теплокровные животные. Основную опасность для Московской и прилегающих областей представляют лисы, еноты и мышевидные грызуны. Вирус достаточно долго сохраняется в погибших животных, поэтому никогда не подпускайте своих питомцев к ним и избегайте контактов с дикой фауной в лесу и на трассах.
Как происходит заражение? Бешенство передается только контактным путем. Заражение происходит через слюну больных животных, главным образом при укусах, а также через ссадины, царапины, ослюнения кожных покровов, слизистую оболочку глаз, ротовой и носовой полостей, а также при соприкосновении с каким-либо предметом или одеждой, загрязненными слюной бешенного животного. Можно заразиться и при снятии шкур животного.
Поэтому если ваш питомец постоянно находится в домашних условиях, заболеть бешенством он не может. Заражаются в основном не привитые животные, вывозимые на дачу, на отдых и свободно гуляющие по территории дачного участка и окрестностей. Если вы считаете, что животные за забором защищены полностью, это не верно. Всегда имеется возможность проникновения на участок грызунов, безнадзорных кошек и мелких лесных плотоядных.
Обязательно (если животное не привито) до выезда на дачу или на природу вакцинируйте ваших питомцев от бешенства — это гарантированная защита для вас и ваших домашних любимцев.
Классические симптомы бешенства: агрессия, переходящая в угнетение, слюнотечение, водобоязнь, светобоязнь, «отвисание» нижней челюсти, параличи глотки, гортани и задних конечностей.
У собак бешенство может протекать в буйной или тихой (паралитической) форме. В первом случае для собак характерно проявление беспокойства, желание укрыться в темном месте, снижение аппетита, поедание несъедобных предметов (камни, палки), хриплый лай, слюнотечение, агрессивность. Собака бросается на животных и людей, включая хозяина, и кусает их. Далее появляются судороги, развиваются параличи и животное погибает. При тихой форме бешенства развиваются параличи глотки и нижней челюсти, животное неспособно принимать корм, язык свисает, идет беспрерывное слюнотечение, отмечается слабость конечностей, далее наступает общий паралич и смерть. Агрессивности нет.
У кошек симптомы во многом схожи, но в период буйства они агрессивнее собак, с особой злостью нападают на собак и человека, и их нападение почти всегда заканчиваются укусом.
Больные дикие животные, как правило, теряют страх перед человеком, приходят в населенные пункты и на дачные участки, охотно идут на контакт, проявляют излишнее дружелюбие, но при этом могут нападать на людей и животных. Такое нехарактерное поведение один из признаков бешенства.
Помните: добрых лис, барсуков, енотов не бывает и, если на ваш дачный участок пришло животное из леса, не подходите к нему сами и не допускайте своих домашних питомцев.
Что делать, если вы пострадали от укуса животного? Немедленно тщательно промойте рану с мылом, чтобы смыть слюну животного, и сразу обратитесь за медицинской помощью в ближайший травмотологический пункт или другое медицинское учреждение для проведения курса антирабических прививок. От скорости обращения зависит эффективность оказанной вам помощи. Вопреки распространенному мнению о 40 уколах против бешенства, сейчас вводится всего
6 доз вакцины: в день обращения и на 3-7-14-28-90 дни после укуса.
Что делать, если ваше животное укусило человека? Обязательно сообщите пострадавшему свой адрес, телефон, а животное доставьте в государственную ветеринарную лечебницу для осмотра. В соответствии с ветеринарными правилами животных, нанесших укусы, карантинируют в течение 10 дней под наблюдением государственного ветеринарного врача. Если за этот период у них не проявляются признаки болезни, то считается, что в момент укуса у них в слюне вируса бешенства не было. Если животное, находясь на карантине, погибло, лабораторные исследования и вскрытие животного проводятся в государственной ветеринарной лаборатории.
Помните: Бешенство вылечить нельзя, можно только предупредить!
Владельцы животных должны неукоснительно соблюдать правила содержания животных, помня, что несут ответственность за их поведение и судьбу, а также безопасность окружающих людей. Своевременная вакцинация животных защитит их, а значит и Вас от опасности смертельного заболевания.
Государственной ветеринарной службой в течение года проводится профилактическая вакцинация домашних животных и оральная иммунизация диких плотоядных против бешенства.
Вакцинация животных против бешенства вакцинами отечественного производится бесплатно.
По вопросам болезней и профилактики животных, вакцинации против бешенства и регистрации домашних любимцев Вы можете узнать в Мытищинской ветеринарной станции:
Московская обл., г.о. Мытищи, Олимпийский проспект, владение 43 А, строение 1 тел. 8-903-538-82-59, режим работы с 9 до 18 ежедневно, амбулаторный прием работает круглосуточно.
Что такое бешенство? | Бешенство
Бешенство — это предотвратимое вирусное заболевание, которое чаще всего передается через укус бешеного животного. Вирус бешенства поражает центральную нервную систему млекопитающих, вызывая в конечном итоге болезнь мозга и смерть. Подавляющее большинство случаев бешенства, о которых ежегодно сообщается в Центры по контролю и профилактике заболеваний (CDC), происходит у диких животных, таких как летучие мыши, еноты, скунсы и лисы, хотя бешенством может заразиться любое млекопитающее.
Вирус бешенства
Вирус бешенства относится к отряду Mononegavirales, вирусов с несегментированными геномами с отрицательной цепью РНК.Внутри этой группы вирусы с отчетливой «пулевидной» формой классифицируются в семействе Rhabdoviridae, которое включает по крайней мере три рода вирусов животных: Lyssavirus, Ephemerovirus и Vesiculovirus. Род Lyssavirus включает вирус бешенства, вирус летучих мышей Лагоса, вирус Мокола, вирус Дювенхаге, вирус европейских летучих мышей 1 и 2 и вирус австралийских летучих мышей.
Структура
Рабдовирусы имеют длину примерно 180 нм и ширину 75 нм. Геном бешенства кодирует пять белков: нуклеопротеин (N), фосфопротеин (P), матричный белок (M), гликопротеин (G) и полимеразу (L).Все рабдовирусы имеют два основных структурных компонента: спиральное ядро рибонуклеопротеина (RNP) и окружающую оболочку. В РНП геномная РНК плотно заключена в нуклеопротеин. Два других вирусных белка, фосфопротеин и большой белок (L-белок или полимераза) связаны с РНП.
Гликопротеин образует приблизительно 400 тримерных шипов, которые плотно прилегают к поверхности вируса. Белок М связан как с оболочкой, так и с РНП и может быть центральным белком сборки рабдовируса.Основная структура и состав вируса бешенства показаны на продольной диаграмме ниже.
Бешенство — это РНК-вирус. Геном кодирует 5 белков, обозначенных как N, P, M, G и L. Порядок и относительный размер генов в геноме показаны на рисунке ниже. Расположение этих белков и генома РНК определяют структуру вируса бешенства.
Реплика
Слияние оболочки вируса бешенства с мембраной клетки-хозяина (адсорбция) инициирует процесс заражения.Может быть вовлечено взаимодействие G-белка и специфических рецепторов клеточной поверхности.
После адсорбции вирус проникает в клетку-хозяин и попадает в цитоплазму. Вирионы собираются в большие эндосомы (цитоплазматические пузырьки). Вирусные мембраны сливаются с эндосомальными мембранами, вызывая высвобождение вирусных РНП в цитоплазму (снятие покрытия). Поскольку лиссавирусы имеют линейный геном одноцепочечной рибонуклеиновой кислоты (РНК), информационные РНК (мРНК) должны быть транскрибированы, чтобы разрешить репликацию вируса.
Кодируемая вирусом полимераза (ген L) транскрибирует геномную цепь РНК бешенства в лидерную РНК и пять кэпированных и полиаденилированных мРНК, которые транслируются в белки. Трансляция, которая включает синтез белков N, P, M, G и L, происходит на свободных рибосомах в цитоплазме. Хотя синтез G-белка инициируется на свободных рибосомах, завершение синтеза и гликозилирование (процессинг гликопротеина) происходит в эндоплазматическом ретикулуме (ER) и аппарате Гольджи.Внутриклеточное соотношение лидерной РНК и N-белка регулирует переход от транскрипции к репликации. Когда этот переключатель активируется, начинается репликация вирусного генома. Первым этапом репликации вируса является синтез полноразмерных копий (положительных цепей) вирусного генома. Когда происходит переключение на репликацию, транскрипция РНК становится «безостановочной» и стоп-кодоны игнорируются. Вирусная полимераза входит в единственный сайт на 3’-конце генома и продолжает синтезировать полноразмерные копии генома.Эти положительные цепи РНК бешенства служат матрицей для синтеза полноразмерных отрицательных цепей вирусного генома.
В процессе сборки комплекс N-P-L инкапсулирует геномную РНК с отрицательной цепью, чтобы сформировать ядро РНП, а белок М образует капсулу или матрицу вокруг РНП. Комплекс RNP-M мигрирует в область плазматической мембраны, содержащую гликопротеиновые вставки, и M-белок инициирует свертывание. Комплекс M-RNP связывается с гликопротеином и завершенными вирусными зачатками из плазматической мембраны.В центральной нервной системе (ЦНС) происходит преимущественное почкование вируса из плазматических мембран. И наоборот, вирус в слюнных железах распространяется преимущественно через клеточную мембрану в просвет ацинара. Распространение вируса в слюнную железу и вызываемое вирусом агрессивное кусание животного-хозяина увеличивают шансы вирусной инфекции нового хозяина.
Вирус бешенства — Обзор | Примечания к микробам
Главная »Вирусология» Вирус бешенства — обзор
Последнее обновление 4 февраля 2021 года Сагаром Ариалом
Структура вируса бешенства- Вирус представляет собой оболочечные частицы в форме палочек размером 75 × 180 нм.
- Зрелый вирион выглядит либо как частицы пулевидной формы с одним закругленным и одним плоским концом, либо как бацилловидные частицы.
- Частицы окружены мембранной липидной оболочкой.
- Плотность плавучести частиц в CsCl составляет около 1,19 г / см3.
- Наружная поверхность вириона покрыта выступающими шипами длиной 10 нм.
- Пепломеры (шипы) состоят из тримеров вирусного гликопротеина.
- Внутри оболочки находится рибонуклеокапсид, который включает одноцепочечный геном с отрицательной РНК (12 т.п.н., молекулярная масса 4.6 * 10ˆ6).
- Геном кодирует пять белков, обозначенных как гликопротеин (G), нуклеопротеин (N), фосфопротеин (P), матричный белок (M) и белок большой полимеразы (L).
- Геном вируса бешенства состоит примерно из 12000 нуклеотидов.
- Это одноцепочечная РНК, линейная, несегментированная, с отрицательным смыслом.
- Геномная РНК кодирует пять различных вирусных белков: нуклеопротеин (N), фосфопротеин (P), матричный белок (M), гликопротеин (G) и белок большой полимеразы (L).
- Ядро вирусного рибонуклеопротеина (РНП) состоит из вирусной РНК, инкапсидированной белками N и связанной с белками P и L.
- Другие вирусные белки, M и G, участвуют в структуре вириона и прикреплении к клеточным рецепторам соответственно.
- Межгенная область (G-L) имеет длину приблизительно 450 нуклеотидов и, по-видимому, не кодирует какие-либо полипептиды.
- Бешенство у человека обычно передается от укуса инфицированного животного.
- Домашняя собака ( Canis knownis ) является наиболее важным переносчиком, хотя бешенство летучих мышей продолжает вызывать инфекцию среди людей на большей части территории Центральной и Южной Америки.
- Вирус все еще остается эндемическим в большей части развивающегося мира, где большинство (99%) случаев смерти людей от бешенства происходит, главным образом в Африке и Азии, хотя проводятся широкомасштабные кампании вакцинации собак и наземных животных. популяции диких животных снизили заболеваемость по всему миру.
- Всемирная организация здравоохранения (ВОЗ) оценивает ежегодное количество смертей в 55 000 человек в результате заражения людей вирусом бешенства, хотя это, вероятно, сильно занижено.
- Укус зараженного бешеного животного
- Контакт слюны с поврежденной кожей или слизистой оболочкой
- Пересадка роговицы
- Инфекция распространяется через укус зараженного бешеного животного.
- Значительное взаимодействие G-белка и рецепторов ацетилхолина периферической нервной системы свидетельствует о прикреплении вируса.
- Затем вирус попадает в центральную нервную систему через механизм, называемый эндоцитозом.
- Внутри эндосомы снижается pH, что вызывает конформационные изменения в G-белке, что способствует слиянию вирусной мембраны с эндосомальной мембраной, что приводит к высвобождению вирусного нуклеокапсида.
- Геном одноцепочечной РНК транскрибируется в положительную смысловую мРНК с помощью связанной с вирионом РНК-полимеразы.
- Моноцистронные мРНК кодируют пять белков вириона: нуклеокапсид (N), белки полимеразы (L, P), матрикс (M) и гликопротеин (G).
- Хотя синтез G-белка инициируется на свободных рибосомах, завершение синтеза и гликозилирование (процессинг гликопротеина) происходит в эндоплазматическом ретикулуме (ER) и аппарате Гольджи.
- Геномная РНП представляет собой матрицу для комплементарной РНК с положительным смыслом, которая отвечает за образование дочерней РНК с отрицательным смыслом.
- В процессе сборки комплекс N-P-L инкапсулирует геномную РНК с отрицательной цепью для формирования ядра РНП, а белок М образует капсулу или матрицу вокруг РНП.
- Комплекс RNP-M мигрирует в область плазматической мембраны, содержащую гликопротеиновые вставки, и M-белок инициирует свертывание.
- Комплекс M-RNP связывается с гликопротеином и завершенными вирусными зачатками из плазматической мембраны.
- Белок вирусной матрицы образует слой на внутренней стороне оболочки, тогда как вирусный гликопротеин находится на внешнем слое и образует шипы.
- После заражения инфекционной слюной при укусе вирус может сохраняться и размножаться в мышечной ткани, прежде чем перейти в периферическую нервную ткань через нервно-мышечные соединения.
- Нейротропсим — это главная особенность, связанная с репликацией вируса, находящаяся исключительно в нейронах.
- Значительное взаимодействие G-белка и рецептора ацетилхолина свидетельствует о прикреплении вируса.
- После проникновения в периферический нерв вирус движется центростремительно внутри аксонов к ЦНС посредством транспортировки ретроградным потоком аксонов.
- Инкубационный период зависит от расстояния между местом укуса и ЦНС.
- Помимо этого, это также зависит от возраста хозяина, иммунного статуса хозяина, вирусного штамма и количества инокуляции.
- В ЦНС размножение вируса происходит в сером веществе и распространяется в эндоневрии шванновских клеток.
- Распространению вируса может способствовать перемещение от клетки к стыку клетки.
- После периода размножения он распространяется в ткани и органы через эфферентные нейроны.
- Заболевание — острый молниеносный энцефалит со смертельным исходом.
- Инкубационный период у людей обычно составляет 1–3 месяца, но может составлять всего 1 неделю или более года.
- Клинический спектр можно разделить на три фазы: короткая продромальная фаза, острая неврологическая фаза и кома.
- Продромальный период продолжительностью 2–10 дней может проявляться одним из следующих неспецифических симптомов: недомоганием, анорексией, головной болью, светобоязнью, тошнотой и рвотой, болью в горле и лихорадкой.
- Во время острой неврологической фазы, которая длится 2–7 дней, у пациентов проявляются признаки дисфункции нервной системы, такие как нервозность, опасения, галлюцинации и странное поведение.
- Кроме того, наблюдается общая гиперактивность симпатической нервной системы, включая слезотечение, расширение зрачков, повышенное слюноотделение и потоотделение.
- Гидрофобия (боязнь воды) или аэрофобия (боязнь ветра) проявляется у многих пациентов.
- Глотание вызывает болезненный спазм мышц горла.
- Неврологическая фаза сопровождается судорожными припадками или комой и смертью.
- Основная причина смерти — остановка сердца и дыхания.
- Течение болезни более медленное, некоторые пациенты выживают 30 дней.
- Однако выздоровление и выживание крайне редки.
Препарат: слюна, биопсия роговицы, ткани мозга, биопсия кожи шеи
Гистопатология
- Обнаружение тел Негри методом окрашивания Продавца, который включает использование основного фуксина и метиленового синего.
- Тельца Негри пурпурно-розовые, резко очерченные, более или менее сферические, диаметром 2–10 мкм, и они имеют характерную внутреннюю структуру с базофильными гранулами в эозинофильном матриксе.
Обнаружение антигена
- Ткани, инфицированные вирусом бешенства, в настоящее время идентифицируются наиболее быстро и точно с помощью иммунофлуоресценции или окрашивания иммунопероксидазой с использованием моноклональных антител против бешенства.
Обнаружение антител
- Антитела развиваются медленно у инфицированных людей или животных во время прогрессирования заболевания, но сразу после вакцинации клеточными вакцинами.
- Сывороточные антитела к бешенству могут быть обнаружены с помощью тестов иммунофлуоресценции или нейтрализации.
Изоляция вируса
- Доступную ткань инокулируют внутримозговым мышам-сосункам.
- Заражение мышей приводит к энцефалиту и смерти.
- Центральную нервную систему привитого животного исследуют на тельца Негри и антиген бешенства.
- Однако изоляция вируса занимает слишком много времени, чтобы ее можно было использовать при принятии решения о вакцинации.
Молекулярный метод
- Тестирование полимеразной цепной реакции с обратной транскрипцией можно использовать для амплификации частей генома вируса бешенства из фиксированной или нефиксированной ткани мозга или слюны.
- Секвенирование амплифицированных продуктов с использованием амплификации на основе нуклеиновых кислот может позволить идентифицировать штамм заражающего вируса.
- Нет успешного лечения в клинической практике.
- Это включает профилактику до и после контакта.
- Предэкспозиционная профилактика проводится лицам, входящим в группу риска, в том числе ветеринарам, специалистам по уходу за животными, лабораторным работникам.
- Вакцина линии диплоидных клеток человека (HDCV) вводится двумя дозами с интервалом в 4 недели.
- Постконтактная профилактика включает
- Осмотр животных в течение 10 дней на наличие симптомов, после чего их умерщвляют.
- Обработка ран путем хирургического удаления мусора и очистки раны водой с мылом и соединениями четвертичного аммония.
- Пассивная иммунизация с использованием иммуноглобулина человека против бешенства (HRIG), полученного от иммунизированных лиц и инфильтрированного в месте раны или введенного внутримышечно как можно скорее после заражения бешенством.
- Активная иммунизация современными вакцинами для культивирования тканей состоит из серии из четырех доз, вводимых внутримышечно в дельтовидную область, по 1 мл каждая, в течение 2-недельного периода (дни 0, 3, 7 и 14).
- Для людей с иммуносупрессией рекомендованная серия постконтактной профилактики включает пять доз вакцины, вводимых в дни 0, 3, 7, 14 и 30.
- Для правильного лечения настоятельно рекомендуется использовать как активную, так и пассивную иммунизацию.
Матричный белок вируса бешенства отвечает за сборку и образование бутонов пулевидных частиц и взаимодействует с трансмембранным гликопротеином Spike G
РЕФЕРАТ
Чтобы выяснить функции белка матрицы рабдовируса (M), мы определили локализацию M в вируса бешенства (RV) и проанализировали свойства М-дефицитного мутанта RV.Мы предоставляем доказательства того, что М полностью покрывает спираль рибонуклеопротеина (РНП) и сохраняет ее в конденсированной форме. Как было определено в экспериментах по совместной седиментации, не только комплекс M-RNP, но и только M, как было обнаружено, специфически взаимодействуют с гликопротеином G. В отличие от этого взаимодействия G с нуклеопротеином N или RNP без M не наблюдалось. В отсутствие M инфекционные частицы были в основном связаны с клетками, и выход внеклеточного инфекционного вируса был снижен в целых 500000 раз, демонстрируя решающую роль M в почковании вируса.Супернатанты от клеток, инфицированных M-дефицитным RV, не содержали типичных пулевидных частиц рабдовируса, а вместо этого содержали длинные палочковидные вирионы, демонстрирующие серьезное нарушение процесса образования вируса. Комплементация с белком М, экспрессируемым из плазмид, спасала образование рабдовируса. Эти результаты демонстрируют ключевую роль M-белка в конденсации и нацеливании RNP на плазматическую мембрану, а также во включении G-белка в почкующиеся вирионы.
Матричные (M) белки вирусов с РНК с отрицательной цепью составляют основные структурные компоненты вируса и, как полагают, необходимы для сборки и образования почки вируса.Что касается рабдовирусов, первое понимание функции белка М было получено путем лечения вируса везикулярного стоматита (VSV) неионным детергентом и анализа интактных комплексов нуклеокапсид-M VSV. Изолированные субвирусные структуры, получившие название скелетов, напоминали интактные вирионы, несмотря на их увеличенную длину и меньший диаметр (3, 22). Эти результаты предполагают, что функция сборки вируса обусловлена способностью M связывать и, вероятно, конденсировать нуклеокапсид (см. Ссылку 14).Что наиболее важно, скелетоподобные структуры также наблюдались возле плазматических мембран VSV-инфицированных клеток, показывая, что эти структуры представляют собой промежуточное звено между голым нуклеокапсидом и зрелыми вирионами (24). Было также показано, что VSV M связывается с плазматической мембраной даже в отсутствие других вирусных белков, и такой ассоциированный с мембраной M также способен связываться с нуклеокапсидом VSV in vitro (4, 5). Эти свойства белка М делают вероятным, что М функционирует в процессе сборки и почкования вируса, действуя как мост между нуклеокапсидом и плазматической мембраной.
В вирусе гриппа матричный белок (M1), как предполагается, окружает нуклеокапсид (26), и было высказано предположение, что M1 взаимодействует с мембраной и, возможно, также с белками-шипами. Напротив, было предположено, что белок М VSV находится внутри спирали нуклеокапсида и доступен для контакта с липидным бислоем только на крайних концах (1). Это контрастирует с более общепринятым мнением, что M ответственен за конденсацию нуклеокапсида извне и что он локализован между клубком нуклеокапсида и мембраной (33).Как для VSV, так и для вируса гриппа из-за отсутствия четкой маркировки антителами не было получено убедительных данных о локализации M.
Организация генома и структура вириона вируса бешенства (RV), прототипа рода Lyssavirus в семействе Rhabdoviridae , очень похожи на таковые у VSV. В обоих вирусах несегментированная РНК с отрицательной цепью вместе с нуклеопротеином (N), фосфопротеином (P) и полимеразой (L) образует спиральный рибонуклеопротеиновый комплекс (RNP).В вирионе РНП окружен липидным бислоем, содержащим единственный трансмембранный гликопротеин шипа (G) и, якобы, матричный белок (M). Хотя центральная роль M белков несегментированных вирусов РНК с отрицательной цепью в процессе сборки и образования почкования вируса кажется очевидной, прямых экспериментальных доказательств их функций предоставлено не было. Это произошло главным образом из-за отсутствия систем, которые позволяли бы прямые генетические манипуляции с несегментированными геномами вирусов с отрицательной цепью РНК.Эти технические трудности были преодолены путем разработки систем обратной генетики, позволяющих извлекать вирусы из кДНК, как впервые было описано для RV (31), которые в настоящее время используются для создания несегментированных мутантов вируса РНК с отрицательной цепью (см. Ссылку 9). .
Недавно мы показали, что частицы в форме рабдовируса без шипов высвобождаются из клеток, инфицированных G-дефицитным мутантом, хотя и с 30-кратной эффективностью (21). Это продемонстрировало, что РНП, связанные с М-белком, могут быть обернуты мембраной и зачатком на поверхности клетки.Для VSV было показано, что M способен индуцировать образование везикул в отсутствие других белков VSV (13, 15), что указывает на то, что M-белок способен отщеплять мембраны автономно. Было показано, что помимо белка M, белки G рабдовируса вносят вклад в эффективность бутонов и даже способны мобилизовать РНК или РНП (21, 25). Следовательно, высокоэффективное почкование рабдовирусов достигается за счет согласованного действия как шипов, так и ядер.
Другая роль белка М в образовании вириона — его участие в морфогенезе вириона.Было показано, что сферические частицы высвобождались из клеток, инфицированных термочувствительным М-мутантом VSV при недопустимой температуре (16). Кроме того, участие M в определении образования сферических или нитевидных частиц было задокументировано для вирусов гриппа (34), предполагая ключевую роль белка M в морфогенезе вириона.
Сообщается, что помимо их роли в сборке и почковании вирусов, белки М рабдовирусов, вирусов гриппа и парамиксовирусов ингибируют транскрипцию вирусов (2, 6, 12, 18, 35, 37).Субгеномные мРНК этих групп вирусов транскрибируются с РНП, которые также служат матрицами для репликации полноразмерных РНК. В тесте транскрипции in vitro с изолированными РНП и М-белком VSV было показано, что активность ингибирования транскрипции М-белка обусловлена реассоциацией М-белка с ядрами РНП (2).
В этом отчете, основанном на биохимических исследованиях и подходах обратной генетики, мы показываем локализацию белка M в зрелом RV и описываем свойства мутанта RV, лишенного всего M-гена.Результаты демонстрируют, что М лежит между липидным бислоем и спиралью РНП и что в отсутствие белка М процесс сборки и почкования вируса серьезно нарушается. Электронная микроскопия показала плохое выделение только стержневидных частиц или круглых везикулярных структур, но не пулевидных вирусов. Последующая экспрессия M-белка из плазмидной ДНК в клетках, инфицированных M-дефицитным мутантом, спасла высокие титры инфекционности и привела к высвобождению типичных пулевидных частиц, демонстрируя, что белок RV M ответственен за образование вирионов с пулевидным нравится морфология.Кроме того, мы предоставляем доказательства прямого взаимодействия G-белка с M.
МАТЕРИАЛЫ И МЕТОДЫ
Обработка вирионов моющими средствами и иммуноэлектронная микроскопия. Примерно 10 6 и 10 7 клеток BSR были инфицированы SAD L16 и SAD ΔM соответственно, при множественности инфицирования (MOI) 1. Примерно 5 × 10 8 вирионов SAD L16 обрабатывали либо 0,05% Triton X-100, либо 20 мМ октилглюкозидом в течение 15 мин при комнатной температуре. Обработанные моющим средством или необработанные контрольные образцы фиксировали 0.5% глутаральдегид в течение 30 минут при 4 ° C и очищенный центрифугированием через 20% сахарозу на 60% сахарозной подушке в роторе Beckman SW41 при 27000 об / мин в течение 90 минут. Затем интерфазу собирали путем бокового прокола. Покрытые углеродом никелевые сетки наносили в течение 7 минут на каплю вирусной суспензии и четыре раза промывали фосфатно-солевым буфером (PBS), содержащим 0,5% бычьего сывороточного альбумина. Образцы инкубировали в течение 45 мин с моноклональным антителом против RV G (MAb) E543 (27), моноспецифической поликлональной кроличьей сывороткой против M (S66) или кроличьей сывороткой, полученной против очищенного RNP RV (S50), распознающей RV N и P-белки (21).Иммуноокрашивание проводили путем инкубации образцов с козьими антимышиными или козьими антителами против кроличьего иммуноглобулина G (Biocell, Кардифф, Великобритания), связанными с частицами золота размером 10 нм. После промывания PBS и дистиллированной воды образцы отрицательно окрашивали 1% уранилацетатом (без буфера) и исследовали в электронном микроскопе Zeiss 109. Микрофотографии сделаны при инструментальном увеличении × 50 000 на пленке Agfa Scientia 23D56.
Конструирование клона кДНК. Чтобы удалить всю кодирующую белок М область из генома RV, следующие манипуляции были выполнены с полноразмерным клоном кДНК pSAD L16 (31), который имеет аутентичную последовательность штамма RV SAD. В19 (7).Сначала был создан субклон pSKpm24, содержащий фрагмент Eco RI- Xho I размером 2,7 т.п.н. pSAD L16, представляющий нуклеотиды SAD B19 с 1112 по 3823. Путем переваривания pSKpm24 с помощью Pfl MI и Xba I, последующего заполнения ферментом Кленова и повторного лигирования фрагмент кДНК, содержащий нуклеотиды с 2435 по 3176 SAD B19, был удален. Затем выделяли фрагмент Bst BI модифицированного pSKpm24 (положения SAD B19 с 1498 по 3739) и использовали для замены соответствующего фрагмента pSAD L16, чтобы получить pSAD ΔM.
Восстановление M-дефицитной RV. Эксперименты по трансфекции проводили, как описано ранее (10). Приблизительно 10 6 клеток BSR были инфицированы рекомбинантным вирусом осповакцины vTF7-3 (11), а затем трансфицированы смесью плазмид, содержащей 5 мкг pT7T-N, 2,5 мкг pT7T-P, 2,5 мкг pT7T-L, 2 мкг pT7T-M и 4 мкг pSAD ΔM с использованием набора для трансфекции млекопитающих Stratagene (протокол CaPO 4 ). Выделение трансфектантного вируса и удаление вируса коровьей оспы проводили, как описано ранее (31).Для пассажа SAD ΔM, который требовал для эффективности комплементации с белком М, клетки инкубировали с осветленным супернатантом, инфицировали vTF7-3 и трансфицировали 2 мкг pT7T-M, как описано выше. Для обнаружения репликации RV инфицированные клетки фиксировали 80% ацетоном и окрашивали конъюгатом, содержащим смесь MAb, направленную на белок RV N (Centocor). Запасы фенотипически дополненного SAD ΔM получали после семи или восьми серийных пассажей. Инфекционные титры RV и M-дополненного SAD ΔM определяли путем серийных 10-кратных разведений и окрашивания инфицированных очагов или синцитий N-конъюгатом.В случае неполного SAD ΔM неразбавленный супернатант использовали для инфицирования клеток, а флуоресцентные синцитии подсчитывали через 24 часа после инфицирования.
Анализ РНК и ОТ-ПЦР. Суммарную РНК, выделенную из инфицированных клеток, подвергали электрофорезу на денатурирующих гелях и анализировали с помощью Нозерн-гибридизации, как описано ранее (8). Фрагменты кДНК гена N или M RV метили с помощью ник-трансляции (набор для ник-трансляции Amersham) с помощью 32 P. ПЦР с обратной транскрипцией (ОТ-ПЦР) выполняли на 1 мкг общей РНК из инфицированных клеток.Обратная транскрипция с помощью обратной транскриптазы вируса миелобластоза птиц была примирована специфическим для гена RV P олигонуклеотидом, NS1P (5′-GTCGAATCCGACAAGCTG-3 ‘; нуклеотиды SAD B19 с 2345 по 2362). Амплификацию ДНК проводили с использованием праймера NS1P и специфичного для гена G праймера, G4M (5’-GGGTACAAACAGGACAGC-3 ‘; нуклеотиды SAD B19 с 3329 по 3346), или праймера, специфичного для гена M, M4M (5′-TTGCAATCCGACGAACTC-3’ ). Продукты ПЦР, полученные в результате 30 циклов (денатурация в течение 30 секунд при 94 ° C, отжиг в течение 60 секунд при 45 ° C и элонгация в течение 120 секунд при 72 ° C), анализировали на 1% агарозных гелях и использовали непосредственно для секвенирования.
Метаболическое мечение и иммунопреципитация белков. Для поверхностной иммунопреципитации приблизительно 10 6 клеток BSR были инфицированы рекомбинантными RV с MOI 1. Через 16 часов инфицирования клетки метили 100 мкКи [ 35 S] метионин (1365 Ки / ммоль; ICN) в течение 3 часов. Меченые клетки затем инкубировали с MAb, направленным на белок RV G, в течение 45 минут при 4 ° C. Экстракцию антигена и иммунопреципитацию проводили, как описано ранее (21). Иммунопреципитированные белки анализировали электрофорезом в полиакриламидном геле с додецилсульфатом натрия и количественно оценивали с помощью фосфорного сканера (Fuji BAS1500).
Центрифугирование в градиенте сахарозы и анализ белков. Для анализа бесклеточных вирионов приблизительно 10 6 и 10 7 клеток были инфицированы SAD L16 и SAD ΔM, соответственно, при MOI, равном 1. Для скоростного центрифугирования супернатанты собирали через 2 дня после заражения и наносили слоями на градиенты от 5 до 25% сахарозы, приготовленные в буфере TEN (10 мМ Трис [pH 7,4], 50 мМ NaCl, 1 мМ EDTA). Градиенты центрифугировали при 31 500 об / мин в роторе SW41 в течение 30 мин. Для анализа белкового состава ассоциированных с клетками инфекционных частиц равные количества инфицированных клеток пять раз промывали PBS и собирали соскабливанием монослоя в буфере TEN, pH 7.4. Клетки разрушали обработкой ультразвуком в течение 10 с при 100 Вт с помощью Sonifier B12 (Branson Sonic Power Company), и лизаты осветляли центрифугированием при 5000 × g в течение 5 минут при 4 ° C. Для изопикнического центрифугирования осветленные клеточные лизаты или супернатанты, содержащие высвобожденные частицы, наслаивали на 10-70% непрерывных градиентов сахарозы и центрифугировали в роторе SW41 при 35000 об / мин в течение 18 часов. Были собраны равные количества 12 фракций, и аликвоты из каждой фракции были использованы для определения показателя преломления и титра инфекционных частиц путем разбавления конечной точки.Белки вируса из фракций градиента разделяли электрофорезом в полиакриламидном геле додецилсульфата натрия, переносили на нитроцеллюлозные мембраны и инкубировали со смесью кроличьей сыворотки, направленной против белков RV, как описано ранее (21). Белки визуализировали после инкубации с конъюгированным с пероксидазой козьим антикроличьим иммуноглобулином G (Dianova) с использованием набора для детекции вестерн-блоттинга ECL (Amersham) (1-минутная инкубация) и экспонирования на рентгеновских пленках (Biomax MR; Kodak).
РЕЗУЛЬТАТЫ
RV M располагается под липидным бислоем и окружает RNP.Виртуальная догма о том, что матричные белки лежат в основе липидного бислоя вируса, недавно была оспорена результатами, полученными при электронно-микроскопических исследованиях VSV, прототипа рабдовируса. Было высказано предположение, что VSV M находится внутри спирали RNP и что только часть M, которая выступает из концов RNP, способна контактировать с липидным бислоем (1). Для определения локализации M в вирионах RV супернатанты из культур инфицированных клеток собирали через 24 часа после заражения, обрабатывали детергентом и фиксировали глутаральдегидом.Затем вирионы очищали с использованием градиентов сахарозы. Электронно-микроскопическое исследование необработанных контрольных образцов, которые инкубировали с моноспецифической анти-М поликлональной кроличьей сывороткой, не показало маркировки на внешней поверхности, подтверждая, что М-белок не выступает через вирусную мембрану (рис. 1А). Обработка вирионов 0,05% Triton X-100 удаляла липидный бислой вместе с поверхностным трансмембранным гликопротеином и приводила к субвирусным структурам той же длины, что и интактный ПЖ, но с меньшим диаметром (от 50 до 60 нм), чем у интактного ПЖ (от 90 до 100 нм). ) (Рисунок.1). Подобные структуры VSV, обработанные октилглюкозидом, были названы скелетами (3), и мы также используем этот термин для субвирусных структур RV, полученных после обработки Triton X-100. Формы наблюдаемых структур варьировались от интактных скелетов с остаточными липидными бислоями (Fig. 1B) до частично разобранных, в которых RNP выходили за пределы скелета (Fig. 1D). Эта неоднородность помогла нам определить расположение вирусных белков в различных структурах. При использовании анти-G MAb не было обнаружено золотого мечения скелетов, за исключением областей, где липидный бислой не был полностью удален (рис.1Б). Для анализа локализации М-белка в субвирусной структуре обработанные частицы метили моноспецифической анти-М-сывороткой и исследовали с помощью электронной микроскопии. Интенсивное маркирование интактных скелетов наблюдалось в областях, полностью лишенных мембран, демонстрируя, что RV M лежит под липидным бислоем и покрывает нуклеокапсид (Fig. 1C). В частично разобранных каркасах маркировка M не была обнаружена на развернутых RNP, за исключением распутывающихся концов каркасов (не показаны).Инкубация таких частично разобранных скелетов с кроличьей сывороткой, полученной против очищенного RNP, привела к интенсивному мечению размотанного нуклеокапсида, но на поверхности неповрежденного скелета не наблюдалось мечения золотом (рис. 1D). Очевидно, белок RV M покрывает всю поверхность конденсированных РНП. Даже после удаления мембраны белок М связывается с нуклеокапсидом и поддерживает его в компактной форме. При частичном удалении M катушка RNP освобождается на одном или обоих концах каркаса (рис.1D). Интенсивная обработка детергентом привела к полной разборке структуры скелета (не показана), демонстрируя, что белок М придает определенную форму за счет поддержания конденсации спирали RNP.
Рис. 1. БелокRV M расположен между липидным бислоем и спиралью RNP. Вирионы, обработанные Triton X-100 (от B до D), и необработанные контрольные образцы (A) очищали, как описано в разделе «Материалы и методы», и анализировали с помощью электронной микроскопии. Отсутствие анти-M-мечения на внешних мембранах необработанных вирионов (диаметром от 90 до 100 нм) (A) и интенсивное анти-M-мечение на поверхности спирали RNP или скелетов (диаметром от 50 до 60 нм) Вирионы, обработанные детергентом (C), демонстрируют, что M окружает спираль RNP.Только области, где липидный бислой не был полностью удален (от 60 до 70 нм в диаметре), слабо помечены анти-G MAb (B). В частично разобранном скелете (D) только развернутый нуклеокапсид, а не поверхность скелета, помечен сывороткой против РНП. Бар, 100 нм.
Получение M-дефицитного мутанта RV. Анализ генно-инженерных вирусов, которые полностью лишены определенного гена и способности транс дополнять основные функции, оказался полезным при исследовании роли вирусных белков.Чтобы обратиться к функциям белка M RV в образовании вириона, мы сконструировали кДНК, в которой была удалена вся последовательность гена M RV (положения SAD B19 с 2435 по 3176) (фиг. 2). Чтобы спасти модифицированную кДНК в вирус, мы использовали ранее описанную систему (31), в которой транскрипты РНК-полимеразы Т7, соответствующие РНК антигенома RV, собраны в транскрипционно активные RNP в клетках, которые экспрессируют белки N, P и L. Неудивительно, что было невозможно восстановить инфекционные М-дефицитные вирионы с использованием стандартного протокола, что указывает на серьезное нарушение образования вируса в отсутствие М-белка.Поэтому мы дополнили дефекты во время экспериментов по восстановлению экспрессией белка М. Помимо плазмид, кодирующих белки N, P и L RV, и антигенома М-дефицитного мутанта (SAD ΔM), культуры клеток трансфицировали pT7T-M, кодирующим белок SAD B19 M (10). После инкубации в течение 2 дней присутствие вируса определяли с помощью прямой иммунофлуоресценции с анти-N конъюгатом. Запасы бесклеточного фенотипически комплементарного SAD ΔM получали после семи или восьми пассажей в клетках, временно экспрессирующих белок M RV из трансфицированных плазмид.Затем рекомбинантный вирус осповакцины vTF7-3, экспрессирующий РНК-полимеразу Т7, удаляли из полученного супернатанта фильтрованием.
Рис. 2.Организация М-дефицитного генома RV. Показаны полный геном RV с его пятью открытыми рамками считывания (вверху), детализированная область цистрона M (посередине) и область, охватывающая делецию (внизу). Стрелки и столбцы представляют собой сигналы начала и остановки транскрипции соответственно. В SAD ΔM весь цистрон M (нуклеотиды L16 SAD от 2435 до 3176) был удален путем делеции, начинающейся в нетранслируемой области гена P и заканчивающейся рядом с сигналом остановки транскрипции гена M.
Чтобы сначала подтвердить отсутствие гена M в SAD ΔM, общую РНК выделяли из клеток, инфицированных фенотипически комплементарными вирионами SAD ΔM, и проводили ОТ-ПЦР. При использовании специфичного для гена P праймера NS1P и специфичного для G-гена праймера G4M фрагменты ДНК размером ∼990 и ∼250 п.н. были получены из геномов SAD L16 и SAD ΔM, соответственно (не показаны). Разница в размерах ~ 740 п.н. соответствовала делеции, введенной в кДНК. Кроме того, с использованием праймера NS1P и праймера, специфичного к гену M, M4M, из генома SAD L16 был получен фрагмент ДНК размером ~ 600 п.н., но продукт из генома SAD ΔM не был обнаружен.Идентичность рекомбинантного вируса SAD ΔM дополнительно подтверждали секвенированием продуктов ПЦР и Нозерн-блоттингом общей РНК из клеток, инфицированных SAD ΔM или SAD L16. С зондом, охватывающим всю кодирующую область гена RV M, гибридизация SAD ΔM РНК не наблюдалась в Нозерн-блоттинге, что еще раз подтверждает отсутствие гена M (не показано). Как было определено с помощью фосфорного сканера, примерно в два раза больше мРНК N воспроизводимо присутствовало в SAD ΔM-инфицированных клетках, чем в SAD-L16-инфицированных клетках, что может частично отражать ослабление транскрипционной активности белка рабдовируса M (2, 6, 12 ).
SAD ΔM индуцирует повышенное слияние клеток. Для исследования характеристик роста SAD ΔM в отсутствие белка RV M клетки инфицировали фенотипически комплементарными вирионами SAD ΔM при MOI 1 и исследовали с помощью иммунофлуоресценции в разное время после заражения. . Интересно, что клетки, инфицированные SAD ΔM, показали заметную активность слияния клеток с клетками уже через 24 часа после инфицирования. Напротив, клетки, инфицированные параллельно с SAD L16, не изменились даже до 72 часов заражения.Чтобы проанализировать этот неожиданный эффект SAD ΔM, инфицирование проводили при более низком MOI (0,005), и как живые, так и фиксированные клетки исследовали на морфологические изменения и экспрессию вирусного белка. Как показано на фиг. 3A, через 48 ч после инфицирования наблюдали повышенное слияние клеток с клетками в клетках, инфицированных SAD ΔM. Слитые клетки начали отделяться от монослоя и плавать в супернатанте через 72 часа после инфицирования. Напротив, клетки, инфицированные вирусом дикого типа, не показали значительных изменений даже через 72 часа заражения.
Рис. 3.SAD ΔM вызывает повышенное слияние клетки с клеткой и гибель клеток. (A) После заражения культур с MOI 0,005 живые клетки исследовали под микроскопом на морфологические изменения в указанные моменты времени. Слияние клеток обнаруживается в SAD ΔM-инфицированных клетках через 48 часов, а через 72 часа после инфицирования присутствуют большие синцитии. (B) В клетках, инфицированных параллельно, распространение инфекции контролировали в указанные моменты времени с помощью прямой иммунофлуоресценции с конъюгатом, направленным против белка N RV.Вторичное инфицирование клеток, о чем свидетельствует появление флуоресцирующих гранул, практически отсутствует в SAD ΔM. Через 48 ч экспрессия SAD ΔM N обнаруживается в больших синцитиях.
Для сравнения распространения SAD ΔM и SAD L16, культуры инфицированных клеток фиксировали ацетоном и исследовали методом прямой иммунофлуоресценции с анти-N конъюгатом (фиг. 3B). В культурах, инкубированных с SAD L16, первичная инфекция единичных клеток распространилась на соседние клетки в течение 24 часов, о чем свидетельствует появление небольших флуоресцентных гранул.Через 48 часов после инфицирования наблюдали большие очаги приблизительно от 50 до 100 флуоресцирующих клеток, а через 72 часа инфицировали весь клеточный монослой. Напротив, типичные маленькие флуоресцентные гранулы ранней инфекции RV полностью отсутствовали через 24 часа после инфицирования в культурах, инкубированных с SAD ΔM. Через 48 часов после инфицирования было обнаружено, что клетки, экспрессирующие белок RV N, сливаются с соседними клетками и образуют большие многоядерные синцитии, что не является характерным свойством для стандартной инфекции RV.Через 72 часа эти синцитии начинают распадаться на мелкие кусочки и либо остаются на монослое, либо плавают в супернатанте (рис. 3).
G-белок накапливается до высоких уровней на поверхности клеток, инфицированных вирусом SAD ΔM. Предыдущие результаты, полученные с G-дефицитным мутантом RV, показали, что инфицирование клеток супернатантным вирусом и распространение RV от клетки к клетке полностью зависят от присутствие G-белка (21). Поскольку скорость внутриклеточного транспорта и накопления G-белка на поверхности клетки может влиять на характеристики роста RV, клетки, инфицированные SAD ΔM и SAD L16, анализировали на количество G-белка, экспрессируемого на клеточной поверхности.После 16 часов инфицирования клетки метили 100 мкКи [ 35 S] метионина в течение 3 часов, инкубировали с анти-G MAb и анализировали поверхностным иммунопреципитацией (фиг.4). Согласно количественной оценке с помощью фосфорного визуализатора, общее количество G-белка в клетках, инфицированных SAD ΔM, было только на 3% больше, чем в клетках, инфицированных SAD L16. Однако количество G-белка, присутствующего на поверхности инфицированных клеток, было в 2,6 раза больше для клеток, инфицированных SAD ΔM. G клеточной поверхности составлял 13 и 33% от общего содержания G для SAD L16 и SAD ΔM, соответственно.Поскольку G является единственным белком RV, который обладает активностью слияния, повышенное накопление G-белка на клеточной поверхности может быть ответственным за усиленное слияние клеток в SAD ΔM-инфицированных клетках.
Рис. 4.Анализ экспрессии G белков на клеточной поверхности. Приблизительно 10 6 клеток BSR были инфицированы при MOI, равном 1, и через 16 часов были помечены 100 мкКи [ 35 S] метионина в течение 3 часов. Анти-G MAb инкубировали с живыми клетками для связывания G-белков, экспрессируемых на поверхности клетки, или с клеточными лизатами, содержащими общий G-белок.Количественное определение с помощью Phoshorimager показало, что уровень G-белка в 2,6 раза выше на поверхности клеток, инфицированных SAD ΔM.
M является движущей силой в сборке и почковании вируса. Характерная картина распространения, наблюдаемая для SAD ΔM в культуре клеток, и высокий уровень накопления G-белка на поверхности клеток, инфицированных SAD ΔM, указывают на дефект в сборке вируса. и процесс бутонизации. Для определения эффективности образования и высвобождения вируса некомплементарные клетки инфицировали при MOI, равном 1, фенотипически комплементарными вирионами SAD ΔM.Супернатанты, а также клеточные экстракты титровали через 24, 48 и 72 часа после заражения. По сравнению с таковым для SAD L16, общее количество инфекционного SAD ΔM, включая как ассоциированный с клеткой, так и внеклеточный вирус, было снижено примерно в 600 раз через 24 часа и 10000 через 48 часов после заражения (Таблица 1). Когда сравнивали только титры внеклеточного инфекционного вируса, выход снижался в 5 × 10 5 раз. В соответствии с этим было обнаружено, что 98% инфекционных частиц SAD ΔM связаны с клетками, по сравнению с менее чем 10% для вируса дикого типа через 48 часов после инфицирования.Это указывает на серьезные дефекты сборки вируса и механизма почкования в отсутствие M белка (Table1).
Таблица 1.Титры высвобожденных и связанных с клетками RV
Физические характеристики инфекционных частиц SAD ΔM. Для анализа скорости оседания инфекционных частиц супернатанты от клеток, инфицированных SAD ΔM, наслаивали на 5-25% непрерывную сахарозу. градиент и центрифугировали при 31 500 об / мин в роторе SW41 в течение 30 мин. Двенадцать равных фракций были собраны из градиента, и инфекционность отдельных фракций была определена разбавлением конечной точки.Для RV дикого типа пик инфекционности был во фракциях 9 и 10 (нумерация ведется сверху вниз градиента), тогда как для SAD ΔM большинство инфекционных частиц было обнаружено в двух различных пиках, охватывающих фракции 7 и 8 и фракция 11. Этот результат показал, что размер частиц ΔM SAD значительно отличается от размера RV дикого типа. Для определения плотности инфекционных частиц SAD ΔM образцы осаждали до равновесия на непрерывных градиентах сахарозы от 10 до 70% и определяли инфекционность 12 равных фракций, как описано выше.Плотность фракций, содержащих большую часть инфекционных SAD ΔM и SAD L16, составила 1,17 и 1,16 г / см 3 соответственно.
RV M взаимодействует с G. Предполагается, что взаимодействие между G и M и / или N необходимо для эффективного почкования рабдовирусов (17, 21). Однако прямых доказательств в поддержку этой центральной догмы было мало. Таким образом, ожидалось, что анализ мутанта ΔM SAD даст ключ к пониманию того, взаимодействует ли G с M, N или RNP.Поскольку большинство инфекционных частиц SAD ΔM связаны с клетками, мы проанализировали белковый состав и инфекционность связанных с клетками частиц после равновесного центрифугирования на градиентах сахарозы. Общие клеточные лизаты получали, как описано в разделе «Материалы и методы», наслаивали на градиент сахарозы от 10 до 70% и фракционировали, как описано выше. Расположение вирусных белков определяли с помощью вестерн-блоттинга, а также определяли инфекционность и показатели преломления отдельных фракций. Большинство клеточно-ассоциированных инфекционных вирионов SAD L16 локализовано во фракции 6 (2 × 10 6 / мл), которая также содержит наибольшее количество вирусных белков (рис.5). Инфекционность связанного с клетками SAD ΔM также достигла пика во фракции 6 (1,5 × 10 3 / мл), плотность которой составляет 1,14 г / см 3 . Другой пик белка в обоих градиентах, в котором детектировался в основном N, был локализован во фракции 9 для SAD L16 и во фракциях 9 и 10 для SAD ΔM. Плотность 1,21 г / см 3 для фракции 9 в обоих градиентах идентична плотности RNP RV, полученной после обработки очищенных вирионов детергентом (21).
Рис. 5.Белковый состав ассоциированных с клетками вирионов SAD L16 и SAD ΔM.Клеточные экстракты приблизительно из 10 6 инфицированных клеток получали, как описано в разделе «Материалы и методы», и очищали центрифугированием в градиенте от 10 до 70% сахарозы. Двенадцать равных градиентных фракций (пронумерованных сверху вниз) анализировали вестерн-блоттингом на наличие вирусных белков. Плотность сахарозы определяли по показателю преломления каждой фракции. Для обоих препаратов пик инфекционности присутствовал во фракции 6, которая имеет плотность 1,14 г / см 3 .
Поразительное различие между двумя градиентами было в пропорциях белка N, локализованного в двух пиках (рис. 5). Хотя белок N во фракциях 5 и 6, где G также колокализуется, в градиенте SAD L16 составляет 36% от общего белка N, только 6% белка SAD ΔM N локализовано в соответствующих фракциях. Отсутствие совместной локализации SAD ΔM RNP с G-белком указывает на то, что только те RNP, которые заключены в M-белок, способны специфически взаимодействовать с spike-белком.Чтобы исследовать, может ли M по отдельности взаимодействовать с G или необходимо ли образование комплекса M-RNP, мы экспрессировали белки M, N и G RV либо по отдельности, либо в комбинациях и проанализировали клеточные лизаты путем осаждения на градиентах сахарозы. Когда белок M экспрессировался в отсутствие других вирусных белков, около 10% M оставалось в пределах трех верхних фракций градиента, тогда как более 90% перемещалось в нижнюю часть градиента и достигало пика во фракциях 6 и 7 (рис. 6). Когда G экспрессировался отдельно, большая часть G была локализована во фракциях от 3 до 5.Наиболее интересно то, что когда M и G были коэкспрессированы, локализация M оставалась неизменной, но G следовала за M и колокализовалась с ней на протяжении всего градиента, за исключением вершины. Напротив, характер распределения G оставался неизменным, когда он коэкспрессировался с белком N, что позволяет предположить отсутствие прямого взаимодействия G-N. Эти результаты показали, что M способен взаимодействовать с G даже в отсутствие других вирусных компонентов, а также в форме комплекса M-RNP (рис. 5). Очевидно, взаимодействие между G и комплексом RNP-M является критическим для эффективного отпочкования вирионов инфекционного потомства.
Рис. 6.RV M взаимодействует с G. Примерно 10 6 клеток BSR сначала инфицировали vTF7-3, а затем трансфицировали 5 мкг плазмидной ДНК. После 16 ч инфицирования клеточные лизаты были приготовлены, центрифугированы до равновесия и проанализированы, как описано для фиг. 5. (A) Градиенты плотности клеток, экспрессирующих G, N или M белок по отдельности; (B) клетки, коэкспрессирующие белки G и N или белки G и M. Когда белки G и M коэкспрессируются, белок G совпадает с белком M (нумерация ведется сверху вниз по градиенту).
M придает ПЖ пулевидную форму. Как показано выше, инфекционные частицы, продуцируемые в SAD ΔM-инфицированных клетках, во многих отношениях отличаются от ПЖ дикого типа. Для анализа морфологии инфекционных частиц, высвобождаемых в отсутствие белка М, образцы супернатанта фиксировали 0,5% глутаровым альдегидом и очищали в градиенте сахарозы. Образцы инкубировали с MAb, направленным против белка G RV, окрашивали вторичным антителом, связанным с коллоидным золотом, и исследовали с помощью иммуноэлектронной микроскопии.Хотя контрольные образцы, полученные параллельно из клеток, инфицированных SAD L16, содержали почти исключительно типичные частицы пулевидной формы, нам неоднократно не удавалось обнаружить даже одну частицу пулевидной формы в образцах, приготовленных из клеток, инфицированных SAD ΔM. Вместо этого последние образцы содержали либо уникальные длинные стержневидные частицы меньшего диаметра, либо округлые везикулярные структуры (рис. 7A-C). Длинные палочковидные частицы, которые были обнаружены исключительно в супернатантах клеток, инфицированных SAD ΔM, сильно различались по размеру: от 500 до 1000 нм на 50 нм, по сравнению с 200-300 нм на 95 нм для RV дикого типа.Оба типа частиц были помечены анти-G MAb, что показало, что они содержат на своей поверхности белок G-шип. Из-за высокого накопления G-белка на поверхности клеток, инфицированных SAD ΔM, частицы могли неспецифически приобрести G-белок. Были также предприняты попытки визуализировать вирионы SAD ΔM, отпочковывающиеся с поверхности инфицированных вирусом клеток, путем изучения тонких срезов в электронном микроскопе. Однако нам не удалось обнаружить какие-либо вирусоподобные отростки частиц на плазматической мембране, дополнительно подтверждая, что в отсутствие M, только RNP не компетентны к отпочкованию даже на G-содержащих мембранах.
Рис. 7.Морфология частиц, высвобождаемых из клеток, инфицированных SAD ΔM. SAD ΔM выращивали в отсутствие белка M RV (от A до C) или в клетках, которые экспрессируют белок M RV из трансфицированных плазмид (D). Очищенные супернатанты приблизительно от 10 7 клеток BSR, инфицированных SAD ΔM, иммуноокрашивали с помощью MAb, специфичных для белка G RV, и анализировали с помощью электронной микроскопии. В отсутствие белка RV M были обнаружены либо длинные палочковидные частицы (A и B), либо круглые везикулярные структуры (C), но не были обнаружены частицы в форме пули.После экспрессии белка RV M большинство частиц имело типичную пулевидную морфологию рабдовируса (D). Бар, 100 нм.
Чтобы подтвердить возможность исправления наблюдаемых дефектов в процессе сборки и почкования мутанта SAD ΔM RV, мы дополнили дефицит M экспрессией белка M RV в инфицированных клетках. Полученный супернатант анализировали на инфекционность путем разбавления до конечной точки и на морфологию частиц с помощью электронной микроскопии, как описано выше. После комплементации SAD ΔM выход инфекционных частиц через 24 часа после трансфекции увеличился примерно в 10000 раз, с 10 2 / мл (SAD ΔM) до 10 6 / мл (SAD ΔM плюс M), таким образом достигнув 1% от максимальные титры SAD L16.Это указывает на облегчение основных дефектов с помощью белка М, представленного в trans . Более того, увеличение титра в супернатанте сопровождалось образованием типичных частиц пулевидной формы (фиг. 7D). Хотя круглые везикулярные структуры все еще присутствовали в меньшем количестве, длинные палочковидные частицы практически отсутствовали в супернатантах после комплементации с белком М из трансфицированных плазмид. Взятые вместе, эти результаты показывают абсолютную потребность в белке рабдовируса М для эффективной сборки и образования почки вируса, а также для пулевидной морфологии.
ОБСУЖДЕНИЕ
Считается, что в пути сборки вирусов РНК с отрицательной цепью этапы, следующие за инкапсидацией генома РНК нуклеопротеином и, наконец, приводящие к почкованию зрелых вирусных частиц, включают матричный (M) белок. Однако знания о биологических функциях M белка ограничиваются в основном свойствами связывания с мембраной или нуклеокапсидом (рассмотрено в ссылке 14), и более прямых доказательств того, что M белок действительно выполняет сборку вируса и почкование, не было.Недавно сообщалось, что M-белок VSV, прототипа рабдовируса, локализован внутри RNP-спирали (1), что ставит под сомнение общее представление о том, как M-белки вносят вклад в сборку вируса. В этой работе мы показываем локализацию M-белка в вирионах RV и описываем рекомбинантный мутантный RV, в котором отсутствует весь M-ген. Характеристика этого не содержащего хелперного вируса мутанта с дефицитом М дала более глубокое понимание роли белка М на различных стадиях образования вируса, включая сборку вирусного белка, морфогенез и высвобождение зрелых вирионов.
Чтобы определить локализацию белка M в зрелом RV, чтобы понять, как он проявляет свое действие на различных стадиях образования вириона, мембраны зрелых вирионов были отслоены с использованием неионного детергента. После мечения полученных субвирусных структур иммунным золотом на поверхности неповрежденного спиралевидного нуклеокапсида, так называемого скелета, наблюдали интенсивное мечение анти-M золотом. Напротив, метка анти-RNP была связана только с развернутыми RNP, идущими от скелетов, а не на поверхности интактных скелетов.Как интенсивное мечение интактных скелетов M, так и их недоступность для антител N и P указывают на то, что клубок RNP полностью покрыт M-белком. Удаление белка M из скелетов, по-видимому, приводит к раскручиванию RNP, которое затем может быть помечено антителами против RNP. Таким образом, слой белка М, окружающий скелеты, отвечает за сохранение RNP в конденсированной форме. Таким образом, целостность и форма скелета правого желудочка определяются конденсирующим эффектом М-белка.
Открытие, что RV M лежит под липидным бислоем и окружает RNP, противоречит результатам, опубликованным для VSV (1). Было высказано предположение, что М-белок VSV находится только внутри спирали нуклеокапсида и может взаимодействовать с мембраной только на крайних концах. Отсутствие маркировки анти-M на поверхности скелетов VSV может быть связано с конформационными различиями между VSV M внутри спиралей RNP и VSV M, которые могут окружать RNP, так что эпитопы последнего, возможно, были недоступны для используемых антител.В качестве альтернативы, белок М вне спирали РНП может быть быстро удален в используемых условиях, в то время как белок внутри может быть более устойчивым и достаточным для сохранения конденсированных скелетов. Однако нельзя исключить существенное различие в структурной организации двух рабдовирусов (см. Ниже). Фактически, в отличие от случая для RV, мы также могли наблюдать центральные структуры, напоминающие описанный сигарный сердечник (1) в частично развернутых RNP VSV (не показаны).
Чтобы выяснить важность белка M RV в образовании вирионов, мы создали мутант SAD ΔM RV, в котором отсутствует весь ген M.Способ распространения SAD ΔM в культуре клеток значительно отличался от такового для RV дикого типа. Клетки, инфицированные SAD ΔM, показали повышенное слияние клеток и повышенную гибель клеток, в отличие от нецитопатического типа роста RV дикого типа в культуре клеток. Когда инфицирование проводилось при низкой MOI (0,005), образование гигантских многоядерных клеток было более очевидным. Такие синцитии достигают максимального размера через 48 ч после заражения, а затем начинают распадаться. Хотя RV является скорее нецитопатогенным вирусом, более высокое накопление G-белка RV в инфицированных клетках было связано с усилением цитопатических эффектов в фибробластах и индуцированным RV апоптозом в лимфоцитах (23, 36).Таким образом, более высокий уровень экспрессии G-белка в 2,6 раза на поверхности клеток, инфицированных SAD ΔM, по сравнению с SAD L16, может объяснить усиление слияния клеток и цитопатических эффектов, наблюдаемых в культурах, инфицированных SAD ΔM. Кроме того, накопление высокого уровня G на поверхности клеток, инфицированных SAD ΔM, убедительно свидетельствует о низком уровне истощения поверхностного G за счет почкующихся вирионов.
Обнаружение того, что общее количество инфекционных частиц ΔM SAD было уменьшено до 10 000 раз, а количество бесклеточных частиц уменьшилось в 5 × 10 5 раз, выявило серьезные дефекты в процессе образования вирусов. если М-протеин отсутствует.Как показано центрифугированием в градиенте плотности ассоциированных с клетками инфекционных частиц, средний пик в градиенте SAD L16 составлял 36% от общего RNP, по сравнению только с 6% от соответствующего SAD ΔM RNP (рис. 5). Фракция 6 в обоих градиентах содержала большинство инфекционных частиц и, предположительно, большинство конденсированных ядер RNP-M в градиенте SAD L16. Было продемонстрировано, что такие конденсированные ядра RV RNP-M способны отрастать на поверхности клетки и созревать в частицы без шипов (21).Таким образом, значительное снижение образования инфекционных частиц SAD ΔM происходит, главным образом, из-за отсутствия ядер RNP-M, которые могут представлять минимальную субвирусную структуру, способную к почкованию. Предположительно, конденсированные RNPs, т.е. RNPs, окруженные M белком, уже принимают скелетоподобную структуру внутриклеточно и не требуется большого изменения формы во время окутывания и отпочкования. Таким образом, способ, которым РНП вирусов с отрицательной цепью РНК конденсируются с помощью их М-белков, может быть основой морфологической изменчивости и эффективности высвобождения вириона.
Интересно, что более 98% инфекционных частиц SAD ΔM были связаны с клетками, по сравнению с менее чем 10% для SAD L16. Это говорит о том, что промежуточные соединения сборки, обнаруженные во фракции 6 SAD ΔM-инфицированных клеток, не были компетентны для обволакивания плазматической мембраной. Высвободившиеся инфекционные частицы SAD ΔM, хотя и гетерогенные по размеру, имеют плотность, аналогичную плотности RV дикого типа, что указывает на то, что они также состоят из окруженных RNP, но в неконденсированной форме.Такие неконденсированные RNP могут быть заключены в G-содержащие мембраны и выпущены в супернатант. Поскольку было показано, что белки G рабдовируса автономно мобилизуют даже неродственные РНК или РНП (21, 25), этот процесс высвобождения частиц ΔM SAD не представляет собой нормальный механизм почкования вируса. Мы предполагаем, что длинные стержнеобразные частицы содержат неконденсированные RNP и составляют все свободные инфекционные частицы SAD ΔM. Однако мы не можем исключить возможность того, что некоторые из круглых везикул, содержащих G-белок, также могут содержать РНП-подобные структуры, поскольку наблюдались частицы как с электронно-плотным содержимым, так и без него (рис.7C). Однако полное отсутствие пулевидных частиц в супернатантах SAD ΔM-инфицированных клеток показывает абсолютную потребность в М-белке для характерной морфологии рабдовируса. Кроме того, после временной экспрессии белка RV M в клетках, инфицированных SAD ΔM, большинство высвобожденных частиц имело типичную морфологию пулевидной формы. Титр в супернатанте также увеличился в 10 000 раз, что ясно показывает центральную роль белков рабдовируса М как в морфогенезе вируса, так и в процессе почкования.
Было продемонстрировано, что для эффективного отпочкования RV необходимо согласованное действие как ядра (т. Е. RNPs, окруженного M-белком), так и spike-белка (21). Кроме того, было показано, что цитоплазматический хвост RV G содержит сигнал для управления эффективным включением не только G, но и химерных белков с чужеродными трансмембранными доменами и эктодоменами в оболочки почкующихся вирионов (19-21). Эти данные свидетельствуют о том, что цитоплазматический хвост RV G специфически взаимодействует с одним или несколькими внутренними вирусными белками, облегчая как сортировку поверхностных белков в вирусные оболочки, так и эффективное почкование.Настоящие результаты показывают, что М является единственным внутренним вирусным белком, с которым цитоплазматический хвост G может взаимодействовать. Скелет нуклеокапсида ПЖ полностью покрыт М, что делает его недоступным для антител и, вероятно, также для цитоплазматического хвоста G. Отсутствие совместной локализации M-less RNPs и G белка в градиентах ΔM SAD дополнительно подтверждает идею о том, что цитоплазматические хвосты G взаимодействуют исключительно с RV M, локализованным между мембраной и нуклеокапсидом. Это дополнительно подтверждается обнаружением совместной локализации между M-RNP и G в RV дикого типа (рис.5), а также совместного оседания M и G в отсутствие какого-либо другого вирусного белка (рис. 6). Очевидно, что взаимодействие между G и комплексом RNP опосредуется слоем M, что обеспечивает эффективное высвобождение вирионов инфекционного потомства.
В отличие от RV, близкородственный VSV, по-видимому, использует неспецифический способ включения белка G VSV (28) или гетерологичных поверхностных белков (29, 32) в оболочку. Например, было обнаружено, что человеческий трансмембранный белок CD4 встраивается в оболочку вируса с той же эффективностью, что и химерный CD4, содержащий трансмембранный и цитоплазматический домены VSV G (29, 32).В отличие от VSV, белки CD4 и человеческого хемокинового рецептора CXCR4 эффективно включались в производную от RV оболочку только при наличии аутологичного G-хвоста (20, 30). Мы показали здесь, что белок M RV взаимодействует с G и, таким образом, отвечает за рекрутирование белка G в вирус. Сейчас мы идентифицируем остатки цитоплазматического хвоста, ответственные за это взаимодействие (неопубликованные данные). Прямое взаимодействие VSV M и VSV G однозначно пока не показано (4, 17).Если рассматривать локализацию VSV M как RV-подобную, убедительные различия во включении спайкового белка VSV и RV можно объяснить менее строгим и более слабым взаимодействием между M и G. RNP, как недавно было предложено (1), должно быть постулировано фундаментальным различием в механизмах сборки RV и VSV. В такой ситуации взаимодействия M-G, возможно, не будут иметь значения, и это может быть отражено наблюдаемым неселективным включением поверхностных белков VSV.Только часть белка M, выступающая из концов RNPs, могла бы оставаться способной контактировать с G-содержащими мембранами. Более того, локализация M белка в VSV внутри спирали RNP потребует существенно модифицированной модели того, как достигается эффективное почкование.
БЛАГОДАРНОСТИ
Мы благодарим K. Kegreiss, V. Schlatt и K. Mildner за их безупречную техническую помощь и W. Kramer за фотографические работы.
Работа поддержана грантом BEO / 0311171 от Bundesministerium für Forschung und Technologie.
СНОСКИ
- Получено 10 июня 1998 г.
- Принято 18 сентября 1998 г.
- Авторские права © 1999 Американское общество микробиологов
Прогнозируемая 3D-модель тримеров гликопротеина вируса бешенства
RABVG эктодомен гомотример, а тримеры часто называют шипами. Они несут ответственность за прикрепление вируса через взаимодействие с никотиновыми рецепторами ацетилхолина, молекулой адгезии нервных клеток (NCAM) и рецептором нейротрофина p75 (p75NTR).Это делает их значимыми в вирусном патогенезе. Антигенная структура тримеров и мономеров значительно различается. Поверхности, богатые гидрофобными аминокислотами, важны для стабилизации тримеров, в которой С-конец эктодомена играет важную роль; Чтобы понять эти взаимодействия между G-белками, было проведено механистическое исследование их функций с помощью молекулярной модели G-белка в его тримерной форме. Это подтвердило его трехмерное соответствие. Молекулярное моделирование G-белка было выполнено сервером I-TASSER и оценено с помощью графика Рахамандрана и получена программа ERRAT 84.64% и 89,9% остатков в благоприятных регионах и общий коэффициент качества соответственно. Моделирование молекулярной динамики проводилось на тримере RABVG при 310 К. Из этих теоретических исследований мы извлекли значения RMSD для атомов C α для оценки стабильности. Получена предварительная модель G-белка вируса бешенства, стабильного при 12 нс, с молекулярной динамикой.
1. Введение
Бешенство — это заболевание со 100% летальным исходом, вызываемое вирусом бешенства (RABV), поражающим центральную нервную систему [1].Вирус бешенства принадлежит к отряду Mononegavirales, классифицированному в семействе Rhabdoviridae, которое включает по крайней мере три рода: Lyssavirus , Ephemerovirus и Vesiculovirus . Род Lyssavirus включает вирус бешенства. Вирусный геном состоит из одноцепочечной несегментированной РНК с отрицательной цепью, которая кодирует пять белков: нуклеопротеин, матричный белок, фосфопротеин, гликопротеин и вирус-зависимую РНК-полимеразу [2, 3].
Гликопротеин (RABVG) вируса бешенства состоит из четырех доменов: сигнального пептида (SP), эктодомена (ED), трансмембранного (TM) и цитоплазматического домена (CD) [4, 5].RABVG имеет вес 65 кДа и 524 аминокислоты. Это связано с наличием его сигнального пептида (SP), который расположен на N-конце. Он охватывает 19 остатков. SP отвечает за закрепление белка на мембране аппарата ER-Golgi (AP). Это способствует последующему транспорту растущего белка к мембране до того, как он отщепится от N-конца в AP [6, 7].
RABVG в каждом пике закреплен в плазматической мембране и липидной оболочке трансмембранным доменом из 22 аминокислот от 439 до 461 остатка [8].С-конец с последними 44 аминокислотами является цитоплазматическим доменом. Он распространяется в цитоплазму инфицированной клетки, где взаимодействует с М для завершения сборки вируса [9].
С другой стороны, эктодомен RABVG представляет собой гомотример, содержащий трансмембранный домен. Каждый мономер состоит из 439 остатков, и тримеры обычно называют шипами. Эти шипы ответственны за прикрепление вируса через взаимодействие с никотиновыми рецепторами ацетилхолина, молекулой адгезии нервных клеток (NCAM) и рецептором нейротрофина p75 (p75NTR).Это делает их актуальными для вирусного патогенеза [10–15]. Кроме того, эти рецепторы ответственны за слияние вирусной оболочки с клеточной мембраной, вызванное низким pH [16]. Это способствует транссинаптическому распространению вируса в центральную нервную систему. Они также могут действовать как мишени для хелперных и цитотоксических Т-клеток.
C-конец RABVG содержит 44 аминокислотных цитоплазматических домена, которые взаимодействуют с матриксным белком для завершения сборки вируса [9].
Белок RABVG индуцирует иммунный ответ благодаря своим множественным антигенным доменам.Следовательно, RABVG вносит основной вклад в патогенность RABV [17]. Антигенная структура тримеров и мономеров значительно различается. Сообщалось, что поверхности, богатые гидрофобными аминокислотами, важны для стабилизации тримеров, в которой С-конец эктодомена играет важную роль [18].
2. Материалы и методы
2.1. Анализ последовательностей, моделирование и стереохимический анализ
Это исследование было разработано для прогнозирования трехмерной модели белка RABVG в рамках алгоритма итеративного уточнения сборки потоков, реализованного в I-TASSER [19].Это было выполнено, потому что экспериментальная трехмерная структура белка RABVG не была доступна в Protein Data Bank (PDB) (http://www.rcsb.org). Различные физико-химические параметры анализа первичной структуры были рассчитаны с помощью онлайн-инструмента ProtParam [20]. Вторичную структуру белка рассчитывали с помощью серверов J-PRED [21]. Инструмент DiANNA [22] использовался для проверки классификации системы и дисульфидной связности. Эти знания могут быть полезны для понимания вторичной структуры белка, поскольку мостики дисульфидных связей важны для стабилизации белковой складки.Трансмембранную топологию RABVG проверяли с помощью TMHMM [23], MEMSAT3 и MEMSAT-SVM [24].
Наконец, 3D модель RABVG была сгенерирована с помощью онлайн-сервера I-TASSER [25]. Это сгенерировало 3D-модели вместе с их оценкой достоверности (-score). После создания 3D-модели был выполнен структурный и стереохимический анализ с использованием различных инструментов оценки и проверки. График Psi / Phi Ramachandran был получен с помощью PROCHECK [26]. Это помогло в оценке строения позвоночника.График Рамачандрана использовали для проверки остатков не-Gly в запрещенных областях. Структурное качество модели было гарантировано с использованием -скорингов, которые указывают на общее качество модели и подтверждают, что предсказанная структура находится в пределах диапазона оценок, найденных в нативных белках. Веб-инструмент ProSA [27] использовался для определения -счетов. Кроме того, сгенерированная модель была представлена в базе данных моделей белков (PMDB) (https://bioinformatics.cineca.it/PMDB/) с идентификатором PMDB PM0079619.
Имея в руках структуру мономера, мы попытались заставить тример взаимодействовать с исследованиями стыковки белок-белок, чтобы предсказать белковый комплекс, образующийся при взаимодействии белок-белок. В этих исследованиях стыковки использовался сервер ClusPro [28–31], который является первой полностью автоматизированной веб-программой для стыковки белков. Он был одним из лучших в раундах 1–12 CAPRI (Критическая оценка прогнозируемых взаимодействий) — эксперименте в масштабе всего сообщества, посвященном стыковке белков [28].
Мы использовали сервер PDBsum Generate [32], чтобы понять взаимодействие между пятью субъединицами CRP и их сборку.Этот сервер помогает нам анализировать интерфейсы между подразделениями и суммирует взаимодействия через любой выбранный интерфейс. Этот сервер также предоставляет информацию об остатках, которые фактически взаимодействуют через интерфейс.
2.2. Моделирование молекулярной динамики
В этих МД моделирования использовался NAMD 2.6 (наноразмерная молекулярная динамика) [33] путем применения силового поля CHARMM27 для липидов и белков [34]. Это первое нейтрализовало модельный тример RABVG с 24 ионами натрия вместе с моделью TIP3P для водяного бокса, содержащего 58 566 молекул воды.Минимизация структурной энергии была выполнена с использованием 10 000 шагов. Использовались алгоритмы с несколькими шагами по времени с шагом интегрирования 2 фс. Различные взаимодействия были рассчитаны за 1, 2 и 4 временных шага для ковалентных связей, а также короткодействующие несвязанные взаимодействия и дальнодействующие электростатические силы, соответственно. Для каждых десяти временных шагов несвязанные взаимодействия имели расстояние списка пар 13,5 Å. Ван-дер-Ваальсовы и электростатические взаимодействия были определены как взаимодействия между короткодействующими несвязанными взаимодействиями между частицами в пределах 12 Å.Функция сглаживания использовалась для ван-дер-ваальсовых взаимодействий 10 Å. Моделирование проводилось на уравновешенной системе в течение 80 нс при постоянном давлении и температуре 1 атм и 310 К соответственно. Для последующих упражнений использовалась структура с наименьшей энергией и сходящимся среднеквадратичным отклонением. Окончательная структура была проанализирована с помощью CARMA [35] и визуализирована с помощью программы VMD [36] с использованием 100 кадров.
3. Результаты
3.1. Структурное описание 3D-модели RABVG
Это исследование было инициировано для проведения исследований по анализу последовательности на основе структуры на RABVG.Последовательность белка получали с использованием доступа AGN94258.1 из белка NCBI. Анализ первичной структуры показал, что белок RABVG имел молекулярную массу 58487,3 Дальтон и теоретическую изоэлектрическую точку (pI) 7,83. Индекс нестабильности (II) составляет 38,05. Это классифицирует белок как стабильный. Отрицательное общее среднее значение гидропатичности (GRAVY) показывает значение -0,173, что указывает на то, что белок был гидрофильным согласно другим сообщениям [37].
Анализ последовательности и вторичной структуры RABVG показал, что он имеет 6 β -листов, 7 бета-шпилек, 3 бета-выступа, 21 нить, 5 α -спиралей, 10 взаимодействий спираль-спираль, 38 бета-витков и 10 γ — витки.Вторичные структурные особенности показаны на Рисунке 1. Дисульфидные связи, предсказанные DiANNA, показаны в Таблице 1.
| ||||||||||||||||||||||||
Дисульфидная связность прогнозировалась в пределах 1–8, 2–7, 3–12, 5–11, 6–10, 9–19, 13–17, 14–18 и 15–16.Программы TMHMM, MEMSAT3 и MEMSAT-SVM идентифицируют трансмембранную область между аминокислотами 460 и 480. С-конец, возможно, находится в цитоплазме. N-конец, включающий 19 аминокислот из сигнального пептида, расположен во внеклеточной области (рис. 2).
Знание трехмерной структуры RABVG очень важно для понимания взаимодействий, функций и локализации их важных сайтов. Модель не была получена по гомологии, потому что идентичность была низкой (23%) с кристаллами 2J6J и 2CMZ; для близкородственных белковых последовательностей с идентичностью выше 40% выравнивание почти всегда правильное.Области с низким локальным сходством последовательностей становятся обычным явлением, когда общая идентичность последовательностей ниже 40% [38, 39]. В этом смысле трехмерная структура RABVG была предсказана с использованием онлайн-сервера I-TASSER (http://zhanglab.ccmb.med.umich.edu/I-TASSER/) и наилучшей предсказанной структуры с максимальной оценкой достоверности (- оценка -2,18) был выбран (мономер на рисунке 3) для проведения исследований стыковки белок-белок с использованием сервера Cluspro (http://cluspro.bu.edu/) для получения тримерного комплекса для визуализации взаимодействий белков (рисунок 3).
Центральный домен тримеризации вносит значительный вклад в структурную стабильность тримера G-белка из-за образования 6 альфа-спиралей. Различные конформации (мономер, димер и тример) белка G зависят от pH, несколько кислотных остатков (Glu286, Glu293, Glu294, Glu405 и Glu408) сближаются в связке из шести спиралей после слияния, что позволяет предположить, что кислотные остатки остатки играют роль молекулярных переключателей в своих депротонированных формах, и это д. дестабилизировать центральный пучок из шести спиралей и, таким образом, позволять рефолдингу G обратно к его префузионной конформации, подобной VSV G белку [40].
Эти остатки обеспечивают правильную активацию G и гарантируют, что стабильность 6-ти цепочечных спиралей должна строго регулироваться, поскольку как его дестабилизация, так и сверхстабилизация пагубны для вируса.
Гликопротеин рабдовируса является мишенью нейтрализующих антител; его антигенность и антигенные сайты G были широко изучены у VSV и RABV [41]. Антигенный сайт II RABVG расположен между положениями 34 и 42 и положениями 198 и 200.Эти пептиды, вероятно, связаны дисульфидным мостиком и удерживаются вместе в третичной структуре G-антигенного сайта III, который простирается от аминокислот 330 до 338. Этот сайт связан с вирулентностью [42].
Они описали различные области белка G, которые играют важную роль в слиянии мембран для интернализации вируса; обычно считалось, что область между аминокислотами 118 и 139 представляет собой пептид внутреннего слияния для VSV G. Однако другие исследования продемонстрировали, что аминокислоты 395–418 оказывают значительное влияние на слияние, а дополнительные исследования идентифицировали область 145–164, названную p2 -подобный пептид, как центральный домен, способствующий слиянию мембран, опосредованному гликопротеином G [43].Стабильность и сохранение этих областей важны в структуре G-белка для интернализации вируса.
Структурная организация G очень похожа на структуру VSV G. Это сходство простирается от N-концевой части, по крайней мере, до конца спирали G домена II. Он включает как домен PH, так и домен слияния (109 остатков домена слияния), а также домен тримеризации и выявляет четкую структурную гомологию между двумя белками.
G имеет совершенно иную структурную организацию, чем описанные до сих пор вирусные слитые белки как класса I, так и класса II.Полипептидная цепь G складывается в четыре отдельных домена (рис. 3): латеральный домен, богатый β листом наверху молекулы (домен I), центральный, в основном α -спиральный домен, который участвует в тримеризация вершины молекулы (домен II), шейный домен, который имеет характерную складку доменов гомологии плекстрина (PH) (домен III), и удлиненный домен слияния, образующий тримерный стержень молекулы (домен IV). С-концевая часть G соответствует AA с 411 по 422 в VSV и с 410 по 455 в RAVBG [44].
Верхний латеральный домен I содержит около 90 остатков в двух сегментах (от 1 до 17 и от 310 до 383 для VSV и от 1 до 17 и от 311 до 383 для RABV). Домен II состоит из трех сегментов (от 18 до 35, от 259 до 309 и от 384 до 405 для VSV и 18–35, от 269 до 310 и от 384 до 409 для RABV). Домен III вставлен в домен II. Он состоит из двух сегментов (от 36 до 50 и от 181 до 258 для VSV и RABV) и имеет складку домена PH. Домен IV (от 51 до 180 для VSV и RABV) вставлен в петлю домена PH [44].
Эти остатки обеспечивают правильную активацию G и показывают, что стабильность 6-цепочечных спиралей жестко регулируется, поскольку как его дестабилизация, так и сверхстабилизация вредны для вируса.
Число остатков, участвующих во взаимодействиях остаток-остаток, и модель взаимодействий между каждым мономером, обозначенным AB, BC и CA, показаны на рисунке 4. Модель, изображенная на рисунке 4, показывает, что водородные связи и другие несвязанные взаимодействия являются отвечает за взаимодействия между мономерами с образованием тримерного комплекса.
Эта модель тримера показывает количество взаимодействий через два интерфейса, а также детали индивидуальных взаимодействий остаток-остаток через эти интерфейсы (рис. 5).
Анализ взаимодействий в трехмерной структуре был получен сервером PDBsum; для этих водородных связей и других несвязанных дисульфидных мостиков CYS между двумя боковыми цепями или образования амидной связи (–CO – NH–) между боковыми цепями Lys и дикарбоновой аминокислоты (Glu или Asp) рассматривались.Трехмерная структура представляет электростатические взаимодействия между Glu 293 в цепи A с Lys 297 в цепи B, Glu 300 цепи A с Lys 313 цепи C, Lys 297 цепи A с Glu 300 цепи C, Lys 148 в цепи B с Glu129 на цепи C и Lys298 на 25 цепи C с Glu 286 и 293 на цепи B. Они стабилизируют структуру (фиг. 6).
Качество и надежность структуры RABVG были проверены с использованием -score и графика Рамачандрана. Стереохимическое качество 3D-структуры RABVG было проверено с помощью графика Рамачандрана путем анализа остатка двугранного угла остова за остатком.Результат показал, что 89,9% остатков находились в благоприятной области (Рисунок 7).
Общее качество модели можно проверить с помощью ProsA -score, который используется для проверки, находится ли входная структура в диапазоне оценок, обычно встречающихся для нативных белков аналогичного размера [27]. Оценка белка составила -5,54. Надежность модели была дополнительно проверена ERRAT [45], который анализирует статистику несвязанных взаимодействий между различными типами атомов и строит график зависимости значения функции ошибок от положения скользящего окна из 9 остатков, рассчитанного путем сравнения со статистикой из высокоточных структур. .Результаты ERRAT показали общее качество модели 84,648 (рис. 8). -Оценки, график Рамачандрана и результаты ERRAT подтвердили, что качество модели тримера RABVG подходит для будущих теоретических исследований.
Моделирование молекулярной динамики (МД) было выполнено на тримере RABVG при 310 К. Из этих теоретических исследований мы извлекли значения RMSD для атомов C α . Это говорит о том, что система достигла структурной устойчивости и целостности моделирования. Величина RMSD (7 Å) указывает на то, что тример RABVG стабилизируется при 12 нс и остается неизменным до конца моделирования (Рисунок 9).
С другой стороны, остатки, которые мы использовали в среднеквадратических колебаниях (RMSF), идентифицируют области, ответственные за колебания во время моделирования MD. Области с более высокими колебаниями соответствуют остаткам бета-петли-бета цепей и участкам поворота. С меньшими флуктуациями относятся области α -спиралей. При МД-моделировании структурной раскрутки не наблюдалось. При 310 К значения RMSF изменяются от 3 до 15 Å, полученные от 12000 до 7500 кадров; RMSF подобны для всех цепей, кроме остатков Ala87 с Thr100, Pro136 с Thr147, Phe173 с Asn201 и Ser422 с остатками Val435 цепи C (фиг.9).
Области с наибольшими колебаниями не были описаны как важные области для поддержания структурной стабильности тримера G-белка. Это не вызывает значительных изменений в основных областях связывания тримеров.
В остатках 125–131 конформационное изменение цепи C после 10 нс было обнаружено и стабильно от 40 нс до 80 нс, когда молекулярно-динамический конец завершается (рис. 10).
Во время молекулярно-динамического моделирования структура G-белка оставалась стабильной через 12 нс.Он поддерживал связанный тример и сохранял ключевые взаимодействия для поддержания стабильности структуры.
4. Выводы
Молекулярное моделирование G-белка было выполнено сервером I-TASSER и оценено с помощью графика Рахамандрана, и программа ERRAT получила 84,64% и 89,9% остатков в благоприятных областях и общий коэффициент качества, соответственно. .
Взаимодействия между остатками с 274 по 293 напрямую связаны со структурой гликопротеина до и после слияния.Эти взаимодействия важны для поддержания этих структур.
Это важно для структурной стабильности тримера G-белка. Это может быть хорошей мишенью для противовирусных соединений, потому что такие модификации могут изменить спиральную конформацию и нанести вред вирусу.
Колебания, происходящие во время молекулярной динамики, не влияют на стабильность структуры тримера G-белка. Структурная стабильность белка G была получена с помощью молекулярно-динамического анализа при 12 нс.
Конкурирующие интересы
Авторы заявляют, что у них нет конкурирующих интересов.
Благодарности
Авторы выражают благодарность COFAA-IPN.
Антигены вируса бешенства — Creative Diagnostics
Вирус бешенства (RABV) — нейротропный, оболочечный одноцепочечный РНК-вирус. Он принадлежит к семейству Rhabdoviridae , роду Lyssavirus . RABV-инфекция вызывает бешенство у людей и других животных.Бешенство вызывает воспаление мозга у людей и других млекопитающих. Ранние симптомы бешенства включают жар и покалывание в месте воздействия, за которыми следуют один или несколько симптомов, таких как боязнь воды, резкие движения, спутанность сознания, неконтролируемое возбуждение, неспособность двигать частями тела и потеря сознания. После появления симптомов уровень смертности составляет почти 100%. Ежегодно он вызывает от 24 000 до 60 000 смертей во всем мире. RABV имеет широкий спектр естественных хозяев, а также многие другие рабдовирусы.Сообщается, что многие виды млекопитающих инфицированы RABV в дикой природе, например, люди, собаки, кошки, и т.д. . В лаборатории было обнаружено, что культуры клеток млекопитающих, птиц, рептилий и насекомых также могут быть инфицированы RABV.
Рис.1 Частицы RABV под электронной микроскопией
Геном RABV представляет собой одноцепочечную РНК с отрицательным смыслом длиной около 12 тыс. Нуклеотидов. Он кодирует пять вирусных белков, включая нуклеопротеин (N), фосфопротеин (P), матричный белок (M), гликопротеин (G) и полимеразу (L).Вирион RABV имеет два основных структурных компонента, включая оболочку и спиральное ядро рибонуклеопротеина (RNP), которое такое же, как и у всех других рабдовирусов. Геном RABV плотно упакован нуклеопротеином в RNP. Фосфопротеин и полимераза также связаны с РНП. Считается, что матричный белок является центральной молекулой для сборки частиц RABV, а также связан с оболочкой RABV. Форма частицы RABV похожа на пулю с размером около 180 нм и диаметром поперечного сечения около 75 нм.Один конец вириона вогнутый, а другой конический.
Рис.2 Жизненный цикл RABV.
RABV попадает в клетки-хозяева через эндосомный транспортный путь. Низкий pH внутри эндосомы способствует слиянию мембран и, таким образом, позволяет вирусному геному попасть в цитозоль. Затем транскрипция вирусного генома выполняется полимеразой P-L и регулируется белком М вместе с цис-действующими последовательностями вирусного генома. Белок М также играет важную роль в репликации геномной РНК.Эти новые РНК с отрицательным смыслом и белок N затем собираются в новые РНП, чтобы сформировать новый вирус.
Благодаря самым передовым методам и многолетнему опыту в области производства антигенов, Creative Diagnostics теперь может предоставлять различные виды белков и антигенов вируса бешенства (RABV) с высоким качеством и по более низкой цене как для академических, так и для промышленных приложений, включая гликопротеин вируса бешенства, Матричный белок вируса бешенства, нуклеопротеин вируса бешенства, и т. Д. .Добро пожаловать, чтобы связаться с нами для получения более подробной информации.
Твиттер Facebook
Морфология, рост, характеристики и устойчивость
В этой статье мы обсудим следующее: — 1. Морфология вируса бешенства 2. Характеристики роста вируса бешенства 3. Устойчивость.
Морфология вируса бешенства:Вирус бешенства (рис. 14.12) имеет форму пули, размером 180 x 75 нм, с одним концом закругленным или коническим, а другим плоским или вогнутым.Геном, который находится в центральном ядре, является несегментированной, линейной, одноцепочечной РНК с отрицательным смыслом, 10-12 килобаз, заключенной в спирально намотанный нуклеокапсид.
РНК-зависимый фермент РНК-полимераза, который необходим для инициации репликации вируса, заключен внутри вируса в ассоциации с рибонуклеопротеиновым ядром. Последний окружен вирусной мембраной (матриксным белком), которая может быть инвагинирована на конце плоскости.
Вирусная мембрана, в свою очередь, окружена липопротеиновой оболочкой, которая несет шишки, похожие на шипы, состоящие из гликопротеина G.Шипы не покрывают плоский конец вируса и могут быть высвобождены из оболочки обработкой липидными растворителями или детергентами.
Характеристики роста вируса бешенства:Свежевыделенный вирус бешенства от естественных инфекций человека или животных называется уличным вирусом. Это приводит к смертельному энцефалиту у экспериментальных животных в лабораторных условиях после длительного и изменчивого периода инокуляции от 1 до 12 недель. Тельца Негри (внутрицитоплазматические тельца включения) можно наблюдать в мозге привитых лабораторных животных, погибших от уличной вирусной инфекции.
После нескольких серийных внутримозговых пассажей у кролика вирус претерпевает определенные изменения и становится так называемым фиксированным вирусом. Последний более нейротропен, хотя и менее заразен другими путями.
После внутримозгового заражения вирус вызывает смертельный энцефалит после короткого фиксированного инкубационного периода, составляющего около недели. Тела Негри обычно обнаруживаются в мозгу животных при заражении фиксированным вирусом. Фиксированный вирус вызывает скорее паралитические, чем яростные симптомы, и используется для производства вакцин.
Вирус бешенства можно культивировать на куриных эмбрионах. Вирус обычно инокулируется в желточный мешок эмбриона. Серийное размножение на куриных эмбрионах привело к разработке ослабленных вакцинных штаммов, таких как Flury и Kelev. Красители, адаптированные для утиного яйца, дают высокий выход вируса и используются для приготовления инактивированных вакцин.
Несколько первичных и непрерывных клеточных культур (например, фибробласта куриного эмбриона, почка детеныша хомячка, нейробластома мыши, диплоидные фибробласты легких человека, клетки почек обезьяны Vero с минимальным цитоплазматическим действием) используются для выращивания вируса бешенства.Фиксированные штаммы вируса, выращенные в диплоидных либробластах легких человека, куриных эмбрионах и культурах клеток почек обезьяны Vero, используются для производства вакцины.
Устойчивость к вирусу бешенства:Вирус бешенства чувствителен к спирту и липидным растворителям (например, эфиру, хлороформ, ацетон), препаратам йода, соединениям четвертичного аммония, мылу и детергентам.
Его можно инактивировать фенолом, формалином, бета-пропиолактоном, солнечным светом, ультрафиолетовым облучением и нагреванием при 50 ° C в течение одного часа или 60 ° C в течение 5 минут.Вирус умирает при комнатной температуре, но может выжить в течение нескольких недель при стабилизации 50% глицерином. Он может оставаться стабильным в течение нескольких дней при 0–4 ° C и может храниться при –70 ° C или лиофилизацией (сублимационная сушка).

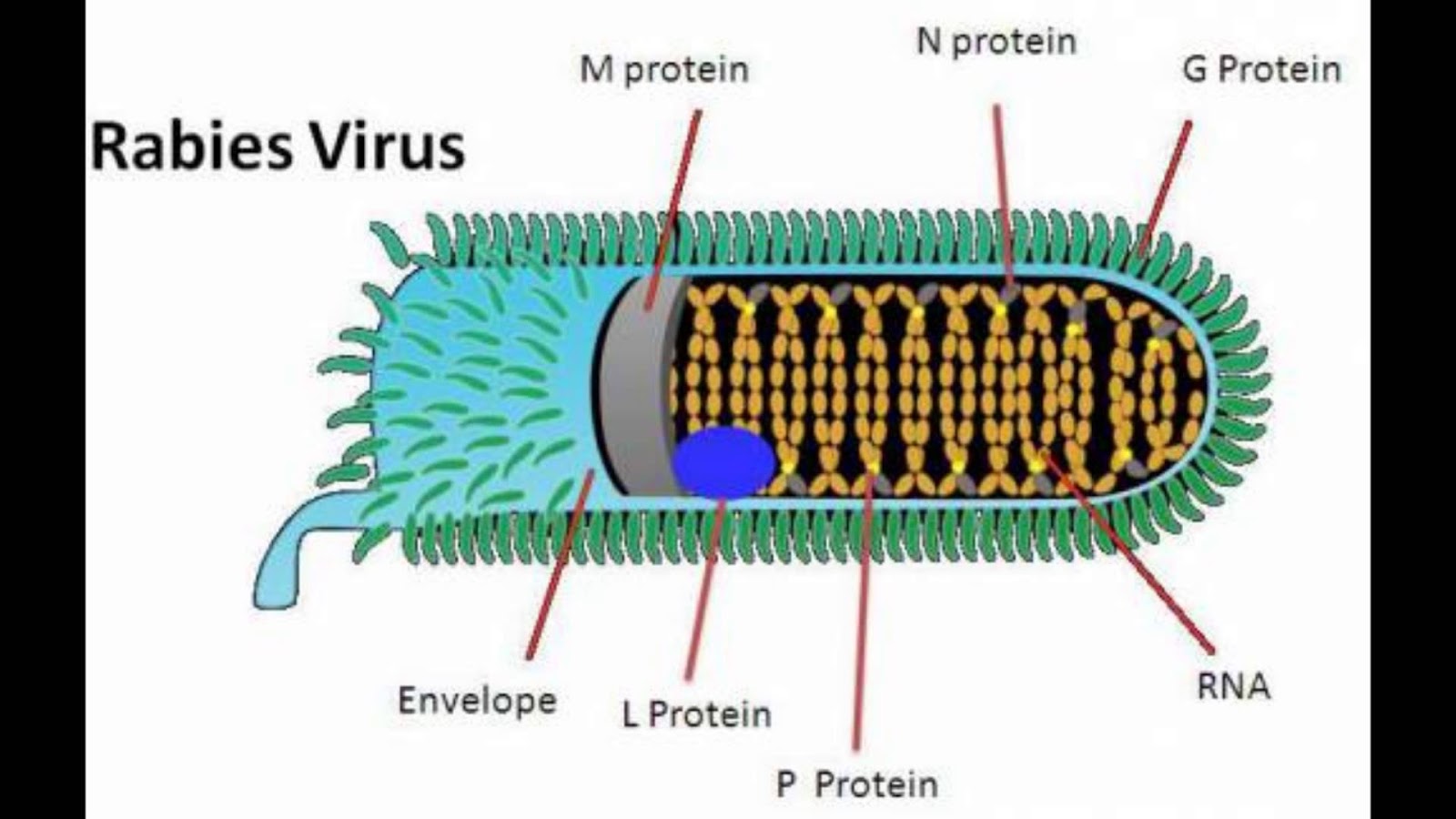
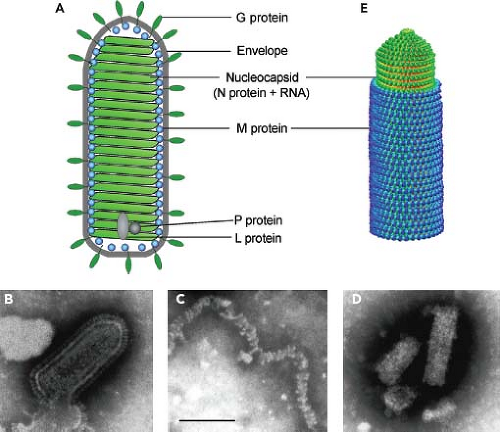 Биохимия (в 3-х томах, том № 3). М.: «Мир», 1985. — 400 с.;
Биохимия (в 3-х томах, том № 3). М.: «Мир», 1985. — 400 с.;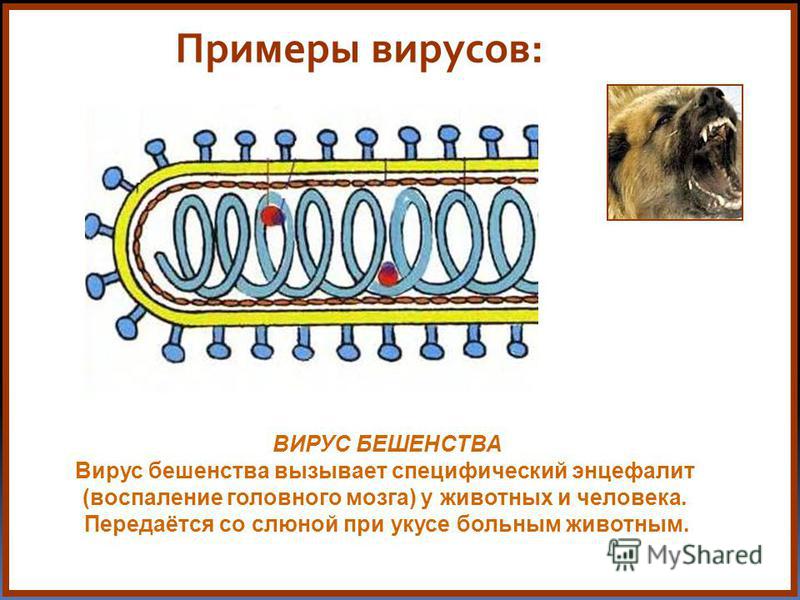 Эпидемиология и вакцинопрофилактика. 5, 4–5;
Эпидемиология и вакцинопрофилактика. 5, 4–5;