Органы кроветворения и иммунной защиты (часть 1)
Слушать (7 122 Кб):
Часть первая – общая характеристика, классификация; красный костный мозг
К системе органов кроветворения и иммунной защиты относят красный костный мозг, тимус (вилочковая железа), селезенку, лимфатические узлы, а также лимфатические узелки в составе слизистых оболочек (например, пищеварительного тракта — миндалины, лимфатические узелки кишечника, и других органов). Это совокупность органов, поддерживающих гомеостаз системы крови и иммунокомпетентных клеток.
Различают центральные и периферические органы кроветворения и иммунной защиты.
К центральным органам кроветворения и иммунной защиты у человека относятся красный костный мозг и тимус. В красном костном мозге образуются эритроциты, тромбоциты, гранулоциты и предшественники лимфоцитов. Тимус — центральный орган лимфопоэза.
В периферических кроветворных органах (селезенка, лимфатические узлы, гемолимфатические узлы) происходят размножение приносимых сюда из центральных органов Т- и В-лимфоцитов и специализация их под влиянием антигенов в эффекторные клетки, осуществляющие иммунную защиту, и клетки памяти (КП).
Органы кроветворения функционируют содружественно и обеспечивают поддержание морфологического состава крови и иммунного гомеостаза в организме. Координация и регуляция деятельности всех органов кроветворения осуществляются посредством гуморальных и нервных факторов организма, а также внутриорганных влияний, обусловленных микроокружением.
Несмотря на различия в специализации органов гемопоэза, все они имеют сходные структурно-функциональные признаки. В основе большинства их лежит
Костный мозг
Костный мозг (medulla osseum, bone marrow) — центральный кроветворный орган, в котором находится самоподдерживающаяся популяция стволовых кроветворных клеток (СКК) и образуются клетки как миелоидного, так и лимфоидного ряда.
Развитие
Костный мозг у человека появляется впервые на 2-м месяце внутриутробного периода в ключице эмбриона, затем на 3-4 -м месяце он образуется в развивающихся плоских костях, а также в трубчатых костях конечностей — лопатках, тазовых костях, затылочной кости, ребрах, грудине, костях основания черепа и позвонках, а в начале 4-го месяца развивается также в трубчатых костях конечностей. До 11-й недели это остеобластический костный мозг, который выполняет остеогенную функцию. В данный период костный мозг накапливает стволовые клетки, а клетки стромы с остеогенными потенциями создают микросреду, необходимую для дифференцировки стволовых кроветворных клеток. У 12—14-недельного эмбриона человека происходят развитие и дифференцировка вокруг кровеносных сосудов гемопоэтических клеток.
У зародыша 36 нед развития в костном мозге диафиза трубчатых костей обнаруживаются жировые клетки. Одновременно появляются очаги кроветворения в эпифизах.
Строение
Во взрослом организме человека различают красный и желтый костный мозг.
Красный костный мозг
Красный костный мозг (medulla ossium rubra) является кроветворной частью костного мозга. Он заполняет губчатое вещество плоских и трубчатых костей и во взрослом организме составляет в среднем около 4 – 5% общей массы тела.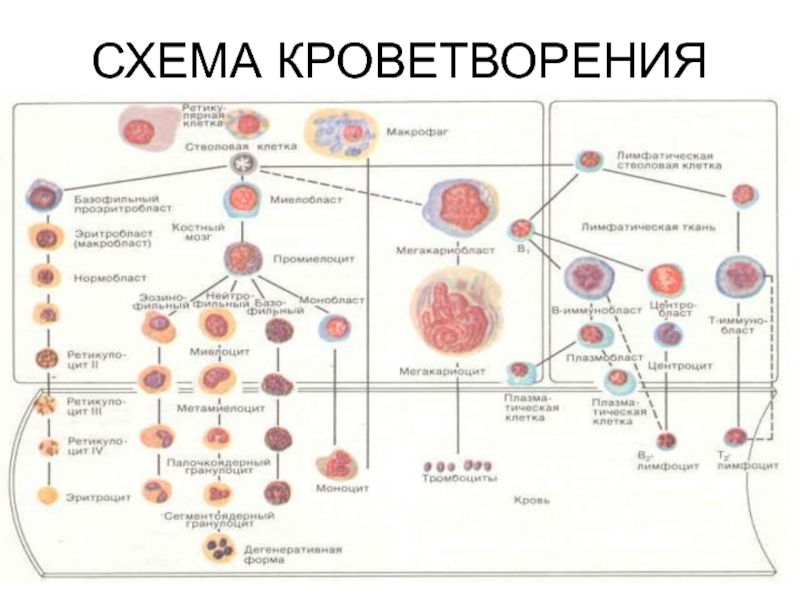
Ретикулярные клетки
Остеогенными клетками называют стволовые клетки опорных тканей, остеобласты и их предшественники. Остеогенные клетки входят в состав эндоста и могут быть в костномозговых полостях. Остеогенные клетки также способны вырабатывать ростовые факторы, индуцировать родоначальные гемопоэтические клетки в местах своего расположения к пролиферации и дифференцировке. Наиболее интенсивно кроветворение происходит вблизи эндоста, где концентрация стволовых клеток примерно в 3 раза больше, чем в центре костномозговой полости.
Остеогенные клетки входят в состав эндоста и могут быть в костномозговых полостях. Остеогенные клетки также способны вырабатывать ростовые факторы, индуцировать родоначальные гемопоэтические клетки в местах своего расположения к пролиферации и дифференцировке. Наиболее интенсивно кроветворение происходит вблизи эндоста, где концентрация стволовых клеток примерно в 3 раза больше, чем в центре костномозговой полости.
Адипоциты (жировые клетки) являются постоянными элементами костного мозга.
Адвентициальные клетки сопровождают кровеносные сосуды и покрывают более 50% наружной поверхности синусоидных капилляров. Под влиянием гемопоэтинов (эритропоэтин) и других факторов они способны сокращаться, что способствует миграции клеток в кровоток.
Эндотелиальные клетки сосудов костного мозга принимают участие в организации стромы и процессов кроветворения, синтезируют коллаген IV типа, гемопоэтины. Эндотелиоциты, образующие стенки синусоидных капилляров, непосредственно контактируют с гемопоэтическими и стромальными клетками благодаря прерывистой базальной мембране.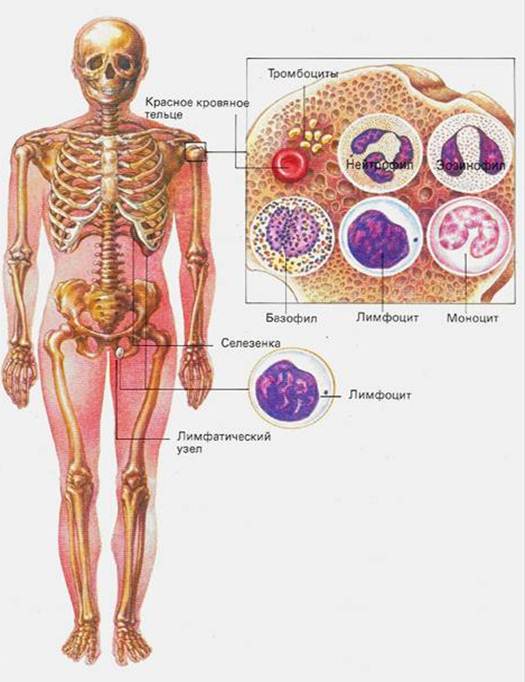
Макрофаги в костном мозге представлены неоднородными по структуре и функциональным свойствам клетками, но всегда богатыми лизосомами и фагосомами. Некоторые из популяций макрофагов секретируют ряд биологически активных веществ (эритропоэтин, колониестимулирующие факторы, интерлейкины, простагландины, интерферон и др.). Макрофаги при помощи своих отростков, проникающих через стенки синусов, улавливают из кровотока железосодержащее соединение (трансферрин) и далее передают его развивающимся эритроидным клеткам для построения геминовой части гемоглобина.
Межклеточное вещество — В костном мозге это вещество содержит коллаген II, III и IV типа, гликопротеины, протеогликаны и др.
Гемопоэтические клетки или кроветворные диффероны составляют паренхиму красного костного мозга.
Рассмотрим подребнее образование эритроцитов, гранулоцитов и тромбоцитов в красном костном мозге.
Эритроцитопоэз
Эритропоэз у млекопитающих и человека протекает в костном мозге в особых морфофункциональных ассоциациях, получивших название эритробластических островков.
Эритробластический островок состоит из макрофага, окруженного эритроидными клетками.
Эритроидные клетки развиваются из колониеобразующей эритроидной клетки (КОЕ-Э), вступившей в контакт с макрофагом костного мозга. КОЕэ и образующиеся из нее клетки — от проэритробласта до ретикулоцита — удерживаются в контакте с макрофагом его рецепторами — сиалоадгезинами.
Макрофаги служат своего рода «кормильцами» для эритробластов, способствуют накоплению в непосредственной близости от эритробластов и поступлению в них эритропоэтина, витаминов кроветворения (витамина D3), молекул ферритина. Макрофаги островков фагоцитируют ядра, вытолкнутые эритробластами при их созревании и способны повторно присоединять КОЕэ и формировать вокруг себя новый очаг эритропоэза.
Макрофаги островков фагоцитируют ядра, вытолкнутые эритробластами при их созревании и способны повторно присоединять КОЕэ и формировать вокруг себя новый очаг эритропоэза.
По мере созревания эритробласты отделяются от островков и после удаления ядра (энуклеации) проникают через стенку венозных синусов в кровоток.
Гранулоцитопоэз
Гранулоцитопоэтические клетки также образуют островки, главным образом по периферии костномозговой полости. Незрелые клетки гранулоцитарных рядов окружены протеогликанами. В процессе созревания гранулоциты депонируются в красном костном мозге, где их насчитывается примерно в 3 раза больше, чем эритроцитов, и в 20 раз больше, чем гранулоцитов в периферической крови.
Тромбоцитопоэз
«Гиганты красного костного мозга дают карликов крови» — Мегакариобласты и мегакариоциты располагаются в тесном контакте с синусами так, что периферическая часть их цитоплазмы проникает в просвет сосуда через поры. Отделение фрагментов цитоплазмы в виде тромбоцитов (кровяных пластинок) происходит непосредственно в кровяное русло.
Отделение фрагментов цитоплазмы в виде тромбоцитов (кровяных пластинок) происходит непосредственно в кровяное русло.
Лимфоцитопоэз и моноцитопоэз
Среди островков клеток миелоидного ряда встречаются небольшие скопления костномозговых лимфоцитов и моноцитов, которые окружают кровеносный сосуд.
В обычных физиологических условиях через стенку синусов костного мозга проникают лишь созревшие форменные элементы крови. Миелоциты и эритробласты попадают в кровь только при патологических состояниях организма. Причины такой избирательной проницаемости стенки сосудов остаются недостаточно ясными, но факт проникновения незрелых клеток в кровяное русло всегда служит верным признаком расстройства костномозгового кроветворения.
Желтый костный мозг
Желтый костный мозг (medulla ossium flava) у взрослых находится в диафизах трубчатых костей. В его составе находятся многочисленные жировые клетки (адипоциты).
Благодаря наличию в жировых клетках пигментов типа липохромов костный мозг в диафизах имеет желтый цвет, что и определяет его название. В обычных условиях желтый костный мозг не осуществляет кроветворной функции, но в случае больших кровопотерь или при некоторых патологических состояниях организма в нем появляются очаги миелопоэза за счет дифференцировки приносимых сюда с кровью стволовых и полустволовых клеток крови.
В обычных условиях желтый костный мозг не осуществляет кроветворной функции, но в случае больших кровопотерь или при некоторых патологических состояниях организма в нем появляются очаги миелопоэза за счет дифференцировки приносимых сюда с кровью стволовых и полустволовых клеток крови.
Резкой границы между желтым и красным костным мозгом не существует. Небольшое количество адипоцитов постоянно встречается и в красном костном мозге. Соотношение желтого и красного костного мозга может меняться в зависимости от возраста, условий питания, нервных, эндокринных и других факторов.
Васкуляризация. Иннервация. Возрастные изменения. Регенерация.
Васкуляризация. Костный мозг снабжается кровью посредством сосудов, проникающих через надкостницу в специальные отверстия в компактном веществе кости. Войдя в костный мозг, артерии разветвляются на восходящую и нисходящую ветви, от которых радиально отходят артериолы. Сначала они переходят в узкие капилляры (2—4 мкм), а затем в области эндоста продолжаются в широкие тонкостенные с щелевидными порами синусы (диаметром 10—14 мкм).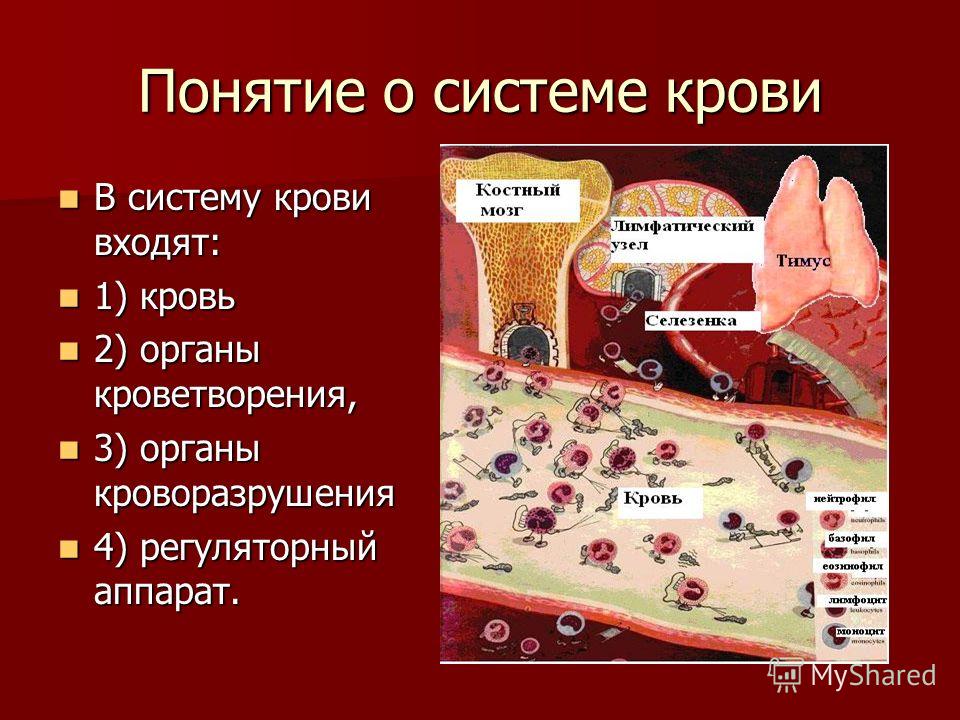 Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиальном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере контакта с костной тканью кровь обогащается минеральными солями и регуляторами кроветворения.
Из синусов кровь собирается в центральную венулу. Постоянное зияние синусов и наличие щелей в эндотелиальном пласте обусловливаются тем, что в синусах гидростатическое давление несколько повышено, так как диаметр выносящей вены меньше по сравнению с диаметром артерии. К базальной мембране с наружной стороны прилежат адвентициальные клетки, которые, однако, не образуют сплошного слоя, что создает благоприятные условия для миграции клеток костного мозга в кровь. Меньшая часть крови проходит со стороны периоста в каналы остеонов, а затем в эндост и синус. По мере контакта с костной тканью кровь обогащается минеральными солями и регуляторами кроветворения.
Кровеносные сосуды составляют половину (50%) массы костного мозга, из них 30% приходится на синусы. В костном мозге разных костей человека артерии имеют толстую среднюю и адвентициальную оболочки, многочисленные тонкостенные вены, причем артерии и вены редко идут вместе, чаще врозь.
Капилляры бывают двух типов: узкие 6—20 мкм и широкие синусоидные (или синусы) диаметром 200—500 мкм.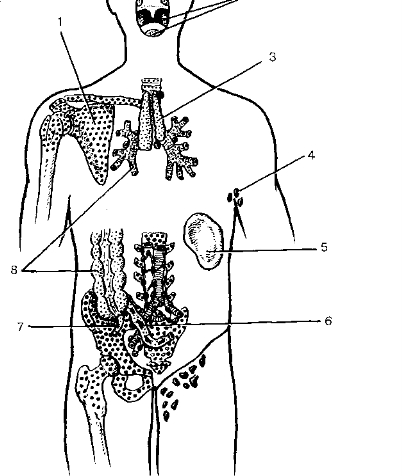 Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране.
Узкие капилляры выполняют трофическую функцию, широкие являются местом дозревания эритроцитов и выхода в кровоток разных клеток крови. Капилляры выстланы эндотелиоцитами, лежащими на прерывистой базальной мембране.
Иннервация. В иннервации участвуют нервы сосудистых сплетений, нервы мышц и специальные нервные проводники к костному мозгу. Нервы проникают в костный мозг вместе с кровеносными сосудами через костные каналы. Далее покидают их и продолжаются как самостоятельные веточки в паренхиме в пределах ячеек губчатого вещества кости. Они ветвятся на тонкие волоконца, которые либо вновь вступают в контакт с костномозговыми сосудами и оканчиваются на их стенках, либо заканчиваются свободно среди клеток костного мозга.
Возрастные изменения. Красный костный мозг в детском возрасте заполняет эпифизы и диафизы трубчатых костей и находится в губчатом веществе плоских костей. Примерно в 12—18 лет красный костный мозг в диафизах замещается желтым. В старческом возрасте костный мозг (желтый и красный) приобретает слизистую консистенцию и тогда называется желатинозным костным мозгом.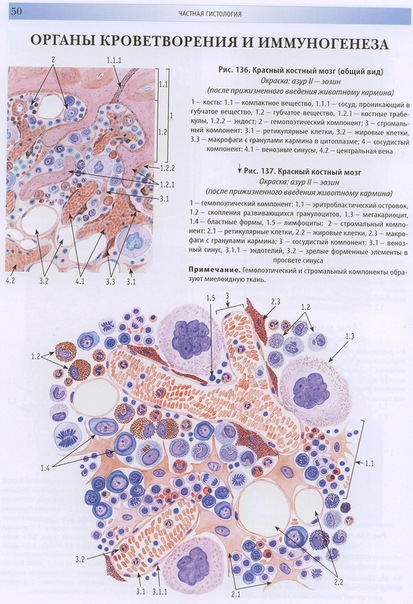 Следует отметить, что этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Следует отметить, что этот вид костного мозга может встречаться и в более раннем возрасте, например при развитии костей черепа и лица.
Регенерация. Красный костный мозг обладает высокой физиологической и репаративной регенерационной способностью. Источником образования гемопоэтических клеток являются стволовые клетки, находящиеся в тесном взаимодействии с ретикулярной стромальной тканью. Скорость регенерации костного мозга в значительной мере связана с микроокружением и специальными ростстимулирующими факторами гемопоэза.
Некоторые термины из практической медицины:
- миелограмма (миело- + греч. gramma запись) — выраженный в форме таблицы или диаграммы результат микроскопии мазка пунктата костного мозга, отражающий качественный и количественный состав ядросодержащих клеток миелоидной ткани.;
- миелоидная реакция (миело- + греч. —eides подобный) — появление в периферической крови малодифференцированных клеток, относящихся к грануло- и эритропоэтическому ряду; наблюдается при метастазах злокачественной опухоли в костный мозг, а также при сепсисе, туберкулезе и некоторых других болезнях;
- остеомиелит (osteomyelitis; остео- + греч.
 myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
Органы кроветворения и иммунной защиты
К органам кроветворения и иммунной защиты относятся: красный костный мозг, тимус (вилочковая железа), лимфатические узлы, селезенка, лимфатические фолликулы пищеварительного тракта и дыхательных путей, гемолимфатические узлы. Из них первых два принято считать центральными, остальные – периферическими органами кроветворения.
Функция центральных органов связана с
образованием всех видов форменных
элементов крови и создание условий для
антигеннезависимого развития лимфоцитов.
В периферических органах иммуногенеза
осуществляется антигензависимая
специализация приносимых из центральных
органов Т- и В-лимфоцитов в эффекторные
клетки, обеспечивающих иммунологическую
защиту. В органах кроветворения
депонируется кровь и лимфа,
обеспечивается их очищение от инородных
частиц, бактерий и остатков погибших
клеток. Кроме того, здесь происходит
элиминация клеток крови, завершающих
свой жизненный цикл. Органы кроветворения
функционируют содружественно, поддерживая
гомеостаз крови и иммунологический
гомеостаз. Строму органов кроветворения,
за исключением тимуса, образует
ретикулярная ткань, создающая
микроокружение для созревающих форменных
элементов крови. В тимусе строма
представлена эпителиальной тканью.
В органах кроветворения
депонируется кровь и лимфа,
обеспечивается их очищение от инородных
частиц, бактерий и остатков погибших
клеток. Кроме того, здесь происходит
элиминация клеток крови, завершающих
свой жизненный цикл. Органы кроветворения
функционируют содружественно, поддерживая
гомеостаз крови и иммунологический
гомеостаз. Строму органов кроветворения,
за исключением тимуса, образует
ретикулярная ткань, создающая
микроокружение для созревающих форменных
элементов крови. В тимусе строма
представлена эпителиальной тканью.
Красный костный мозг (medulla ossium rubra)
Красный костный мозг – центральный
орган кроветворения, в котором
находится самоподдерживающаяся
популяция стволовых кроветворных
клеток, осуществляется размножение
и дифференцировка клеток миелоидного
и лимфоидного рядов: эритроцитов,
тромбоцитов, гранулоцитов, моноцитов,
и предшественников Т- и В-лимфоцитов. У
взрослого человека красный костный
мозг располагается в эпифизах
трубчатых костей и в губчатом веществе
плоских костей, имеет полужидкую
консистенцию темно- красного цвета. Общая масса красного мозга составляет
4-5% от массы организма
Общая масса красного мозга составляет
4-5% от массы организма
Развитие. Костный мозг у человека закладывается на втором месяце эмбрионального развития в ключице эмбриона. На 3-м месяце он образуется в плоских костях, ребрах, грудине, а на 4-м месяце в трубчатых костях. На 5-7 месяце красный костный мозг функционирует как основной кроветворный орган. В возрасте 12-18 лет красный костный мозг в диафизах трубчатых костей замещается на желтый. В его состав входят многочисленные жировые клетки (адипоциты). В норме он не несет функции гемопоэза. Однако в условиях большой кровопотери в нем могут появляться очаги миелоидного кроветворения. В пожилом возрасте красный и желтый костный мозг приобретает слизистую консистенцию и называется желатинозным костным мозгом.
Строение. Трабекулы губчатых костей образуют опору для ретикулярной ткани, которая служит стромой для гемопоэтических клеток- стволовых, полустволовых, дифферонов эритроцитарного, тромбоцитарного, гранулоцитарного, моноцитарного и лимфоцитарного рядов (рис. 12-1). Ретикулярная ткань образует микроокружение для развивающихся клеток крови, ее клетки секретируют компоненты основного вещества- гликозаминогликаны, преколлаген и др.. Постоянными элементами костного мозга являются жировые клетки и макрофаги. Последние богаты лизосомами, секретируют ряд биологически активных веществ (эритропоэтины, интерлейкины, простогландины и др.). Макрофаги благодаря своим отросткам, проникающим через стенку синусов, улавливают из кровотока железосодержащие соединения, необходимые эритроидным клеткам для синтеза геминовой части гемоглобина. Для гемопоэтических клеток, образующих паренхиму органа, является характерным образование островков, в которых располагаются клетки того или другого гистогенетического ряда. Процессы пролиферации и созревания клеток крови наиболее интенсивно проходят вблизи эндооста.
Васкуляризация. В кровоснабжении костного мозга принимают участие артерии, питающие кость. Артерии, проникшие в костномозговую полость, делятся на дистальную и проксимальную ветви. Отходящие от них артериолы переходят в капилляры, последние подразделяются на истинные и синусоидные. В синусоидные капилляры переходит только часть истинных. Истинные капилляры имеют сплошной эндотелиальный слой, базальную мембрану и перициты, выполняют трофическую функцию.
Рис. 12-1. Красный костный мозг.
1. Ретикулярная клетка.
2. Мегакариоцит.
3. Развивающиеся клетки крови.
4. Синусоидный капилляр.
5. Адипоцит.
(По И. В. Алмазаву, Л. С. Сутулову).
Синусоидные капилляры располагаются преимущественно вблизи эндооста и выполняют функцию селекции зрелых клеток крови в кровоток. Диаметр синусоидных капилляров составляет 100-500 мкм. Выстилающий их эндотелий обладает выраженной фагоцитарной активностью, имеют фенестры. Базальная мембрана прерывистая или отсутствует. С эндотелием тесно связаны многочисленные макрофаги. Синусоидные капилляры переходят в венулы.
Иннервация. В иннервации костного мозга участвуют нервы сосудистых сплетений и мышц. Нервы проникают в костный мозг вместе с кровеносными сосудами через каналы кости, ветвятся и оканчиваются свободно среди клеток костного мозга.
Регенерация. Красный костный мозг отличается высокой физиологической и репаративной регенераторной способностью.
Анатомия органов кроветворения
Многие не представляют, откуда берётся кровь, что такое иммунитет и где он, собственно, находится. Реклама говорит нам, что иммунитет находится в кишечнике, но это не совсем верно. Чтобы развеять подобные заблуждения, а также чтобы дать вам, уважаемые читатели, чёткую и ясную картину того, как выглядит система органов кроветворения, я и задумал цикл статей про основы гематологии.
Важная оговорка: каждый компонент кроветворной системы я буду описывать очень упрощённо. Эта статья не является пособием для занятий по анатомии, она не подходит для подготовки к зачетам. Я старался писать в научно-популярном формате для примерного знакомства с кроветворной системой.
Что такое кроветворная система?
Наша кровь состоит из форменных элементов и плазмы. Плазма — это жидкая часть крови, она состоит из воды (более 95%) и сухого остатка (белки, витамины, углеводы, липопротеидные комплексы, неорганические вещества). К форменным элементам крови относят эритроциты, тромбоциты и лейкоциты.
Кроветворная система — это система органов, в которых создаются и созревают форменные элементы крови. Механизм образования белков плазмы или поддержания необходимого количества воды в плазме рассматривается за пределами кроветворной системы.
Кроветворную систему также иногда называют иммунной системой и это весьма верно, ведь главные клетки нашего иммунитета — лейкоциты — создаются в кроветворной системе. Особенно часто это название встречается в учебниках по гистологии.
Классификация кроветворной системы
Кроветворная система делится на центральную и периферическую. К центральной кроветворной системе относят красный костный мозг и тимус. К периферической кроветворной системе относят селезёнку, лимфатические узлы и скопления лимфатической ткани — миндалины, аппендикс, Пейеровы бляшки, лимфатическую ткань на стенке бронхов.
Органы кроветворения (центральные)
Красный костный мозг
Прежде всего, давайте договоримся: красный костный мозг не имеет никакого отношения к головному мозгу или к спинному мозгу. Этот орган называется мозгом потому, что он является центром кроветворения, то есть самым главным компонентом кроветворной системы.
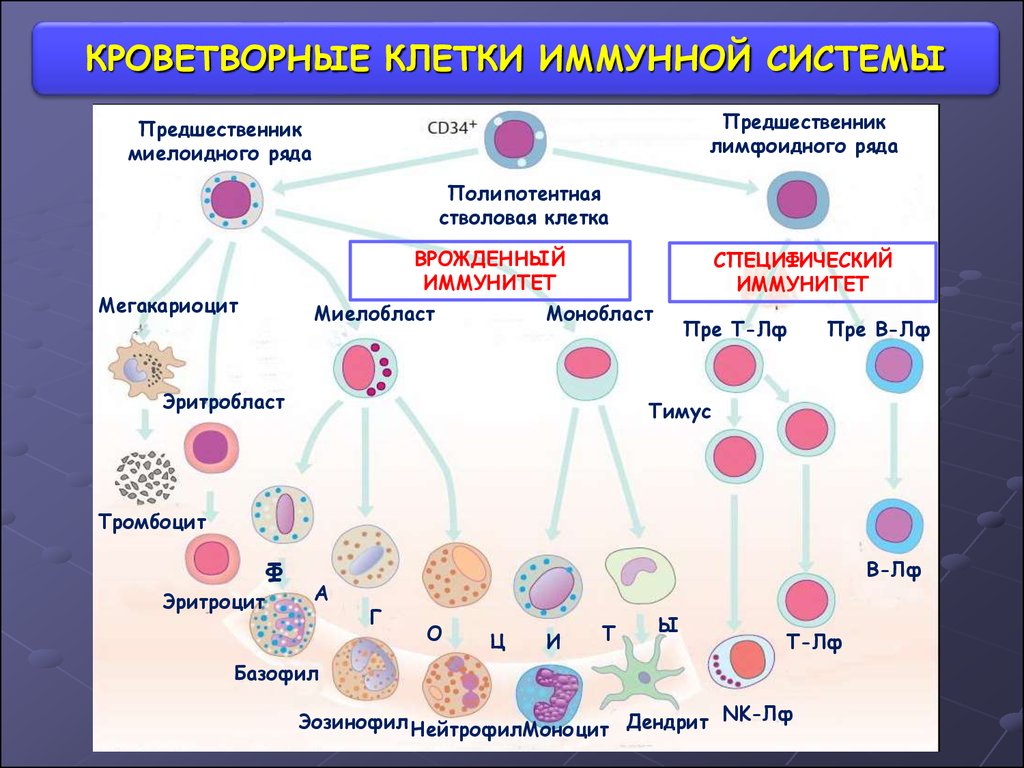
Красный костный мозг (medulla ossium rubra) — это скопление клеток крови и их предшественников разной степени зрелости. Красный костный мозг — это множество стволовых клеток, то есть совершенно незрелых, из которых может получится любая клетка. Также в красном костном мозге имеются более зрелые клетки-предшественники форменных элементов крови.
Вы наверняка видели множество картинок, подобных этой:
Это — типичная схема кроветворения. В самом верху таблицы вы видите одну клетку — это стволовая клетка. Особенность стволовой клетки в том, что она может превратиться в любую кроветворную клетку. Её ещё называют «полипатентная», от латинских слов «поли» — «много» и «потенция» — «возможность». Следующая ступень, вторая — выбор между лимфатическим ростком и миелоцитарным ростком. Далее клетка будет становится всё более зрелой, и в конце (самая нижняя строчка) мы получим готовый форменный элемент крови — эритроцит, тромбоцит или лейкоцит.
Так вот, представьте, что таких клеток, как стволовая клетка в верхней части схемы, очень много. И клеток, в которые они дифференцируются (вторая и следующие ступени) тоже очень много. Все эти клетки разной степени зрелости (кроме Т-лимфоцитов, они отправляются в тимус), которые собраны в одном месте. Это и есть красный костный мозг.
Возьмём обычную плоскую кость, например, грудину (sternum), я её обозначил цифрой 1. Распилим её поперёк и в центре разреза (2) мы увидим тёмно-малиновую мякоть — это и будет красный костный мозг, в котором находятся стволовые клетки и все их дозревающие потомки.
Посмотрите на отличную иллюстрацию из гистологического атласа В.Г. Елисеева. Это красный костный мозг под микроскопом. Не точь-в-точь с реальным изображением, но здесь очень наглядно показана структура. По сути, мы видим табличку, которую мы рассматривали парой абзацев выше, только в естественных условиях.
Гистологический препарат красного костного мозга примечателен разнообразием клеток. Здесь находится много клеток разной степени зрелости, разной формы и размера. Давайте рассмотрим иллюстрацию препарата красного костного мозга поподробнее:
- Зрелый эритроцит;
- Мегакариоцит. Огромная незрелая клетка, которая дозреет до тромбоцита;
- Лимфобласт. Предшественник зрелого лимфоцита, 4-й уровень зрелости. Обратите внимание на очень крупное ядро — это очень характерно для всех незрелых клеток;
- Базофильный метамиелоцит. Клетка 5-го уровня зрелости (то есть 5-я строчка в кроветворной таблице). Всего уровней зрелости 6, так что ей остался один шаг до зрелого базофила.
Макроскопически красный костный мозг — это тёмно-красная полужидкая масса.
Красный костный мозг находится, преимущественно, в плоских костях. Прежде всего, это таз (pelvis), грудина и череп (cranium), точнее, кости черепа. Красный костный мозг располагается ещё и в эпифизах трубчатых костей, но там его значительно меньше.
На этой картинке красным цветом выделены те участки костей, внутри которых содержится красный костный мозг.
Внутри кости располагаются синусы — небольшие углубления, через которые свежеприготовленные зрелые форменные элементы крови попадают в общий кровоток. В нормальном, здоровом организме через эти синусы проходят только зрелые эритроциты, тромбоциты и лейкоциты.
Тимус
Многие люди не знают, где находится тимус и что это вообще такое. Давайте попробуем разобраться.
Тимус, или вилочковая железа (thymus) является вторым центральным органом кроветворения. Помните, мы говорили, что все клетки крови зреют в красном костном мозге? Здесь есть небольшое исключение. Последние 3 стадии развития Т-лимфоцитов проходят в тимусе, собственно отсюда и буква «Т» в их названии. B-лимфоциты зреют в красном костном мозге до стадии готовности.
Итак,незрелые T-лимфоциты отправляются на «обучение» в тимус. Обучение заключается в том, что лимфоциты становятся способны распознавать и атаковать чужеродные организмы (бактерии, вирусы, раковые клетки). Также лимфоцит в тимусе учится отличать ткани собственного организма от чужеродных. Лимфоциты, которые принимают собственные органы за чужеродные, уничтожаются макрофагами здесь же, в тимусе. Это предохраняет нас от аутоиммунных заболеваний.
Удивительная особенность тимуса — этот орган раньше всех начинает стареть. Пик развития тимуса приходится на 3-5 лет. В этом возрасте тимус очень крупный, он имеет минимальное количество жировой ткани. Практически вся масса тимуса приходится на кроветворную ткань. Вот как располагается тимус (выделен зелёным) у 8-месячного ребёнка:
К подростковому возрасту годам тимус уже заметно уменьшается, это называется инволюцией тимуса. Тимус 15-летнего молодого человека (тимус выделен зелёным, лёгкие для сравнения размеров выделены красным) выглядит так:
Дело не только в изменении размеров. Значительно сильнее изменяется структура тимуса — кроветворная, ретикулярная и эпителиальная ткани превращаются в жировую ткань. У пожилых людей в тимусе остаётся всего лишь 1-3 % процента кроветворной ткани, всё остальное представляет собой уже очень небольшой комочек жировой ткани.
Теперь рассмотрим топографию тимуса. Вилочковая железа располагается в средостении (mediastinum). Средостение — это пространство в грудной полости между лёгкими (pulmones). Наверняка анатомы и хирурги будут сейчас кидать в меня тухлыми помидорами, потому что академически, конечно же, средостение — это пространство между правой и левой плевральными полостями. Но поскольку плевра покрывает каждое лёгкое, мы будем понимать под этим термином именно пространство между лёгкими.
Тимус выглядит как несимметричный железистый орган серо-розового цвета, который слегка расширен у основания и сужен в районе верхушки. Тимус покрывает оболочка из соединительной ткани. Как я уже говорил, у взрослых людей тимус замещается жировой тканью, и постепенно он меняет структуру и приобретает тёмно-жёлтый оттенок. Тимус состоит из двух долей — правой (lobus dexter) и левой (lobus sinister). .
Если мы разрежем тимус вдоль, мы увидим, что эта же соединительная ткань разделяет его доли на более мелкие дольки. В каждой дольке имеется внешняя часть — кора (cortex thymi) и внутренняя часть — мозговое вещество (medulla thymi).
Вы можете увидеть эти составные части, если рассмотрите препарат тимуса под микроскопом в малом увеличении:
Всё очень просто:
- Перегородка, которая делит орган на дольки. Состоит из плотной соединительной ткани и отходит от капсулы;
- Корковое вещество, то есть кора тимуса. Она более тёмная, потому что она очень плотно заселена Т-лимфоцитами;
- Мозговое вещество, оно обычно располагается в центре дольки.
Когда мы проецируем границы органа на скелет, это называется скелетотопия. Как же показать тимус на скелете? Запомните главный ориентир — рукоятку грудины (manubrium sterni). Если вы забыли, где это находится, обязательно загляните сюда. У взрослого человека 20-40 лет тимус располагается именно за рукояткой грудины. Если мы говорим о ребёнке 2-5 лет, его тимус значительно крупнее, его нижняя граница будет доходить до хряща третьего ребра или спуститься ещё ниже.
Теперь давайте обозначим и голотопию тимуса. Голотопия — это когда мы показываем и описываем расположение органа на целом теле человека. Тимус находится вот здесь:
Лексический минимум
В каждой статье я публикую небольшую подборку терминов, которые я использовал. Это будет полезно тем, кто решил не останавливаться на моих уроках по латинскому языку и продолжает расширять свой словарный запас. Я рекомендую выписывать каждый термин в тетрадь и подписывать перевод (который вы найдёте в самой статье, то есть в тексте выше).
- Medulla ossium rubra;
- Sternum;
- Pelvis;
- Thymus;
- Mediastinum;
- Pulmones;
- Lobus dexter;
- Lobus sinister;
- Cortex thymi;
- Medulla thymi;
- Manubrium sterni.
ПОХОЖИЕ ПОСТЫ
Примерный план изучения дисциплины
План лекций и лабораторных занятий лечебного факультета
Весенний семестр.
Темы лекций.
- Введение в предмет. Методы исследования в гистологии. Цитология.
- Цитология: плазмолемма, органеллы, включения.
- Цитология: ядро, клеточный цикл, апоптоз.
- Основные этапы эмбрионального развития. Источники развития тканей.
- Общие принципы организации тканей.
- Эпителиальные ткани
- Эпителиальные ткани. Железы
- Ткани внутренней среды, кровь.
- Кроветворные ткани.
- Клеточные основы иммунных реакций.
- Волокнистые соединительные ткани.
- Скелетные ткани.
- Мышечные ткани.
- Нервные ткани.
- Органы нервной системы.
- Органы чувств.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
Темы лабораторных занятий.
- Методы исследования в гистологии. Цитология.
- Цитология
- Основные этапы эмбрионального развития.
- Эпителиальные ткани.
- Контрольное занятие.
- Диагностическое занятие.
- Кровь. Кроветворные ткани.
- Волокнистые соединительные ткани.
- Хрящевые и костные ткани.
- Мышечные ткани.
- Нервные ткани.
- Контрольное занятие.
- Компьютерный контроль.
- Диагностическое занятие.
- Органы нервной системы.
- Органы чувств.
- Диагностическое занятие.
- Зачетное занятие.
Осенний семестр
Темы лекций.
- Органы эндокринной системы
- Органы эндокринной системы
- Кожа.
- Производные кожи.
- Слизистые оболочки.
- Пищеварительная система: органы ротовой полости.
- Пищеварительная система: пищевод, желудок, кишечник
- Пищеварительная система: крупные железы.
- Органы дыхательной системы.
- Органы выделительной системы.
- Принцип развития и строения половых систем.
- Органы мужской половой системы.
- Органы мужской половой системы.
- Органы женской половой системы.
- Органы женской половой системы.
- Эмбриогенез человека.
- Эмбриогенез человека.
- Заключительная лекция.
Темы лабораторных занятий.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
- Органы эндокринной системы.
- Контрольное занятие. Кожа.
- Диагностическое занятие.
- Органы пищеварительного тракта: ротовая полость.
- Органы пищеварительного тракта: пищевод, желудок, кишечник.
- Органы пищеварительного тракта: печень, поджелудочная железа.
- Контрольное занятие.
- Диагностическое занятие.
- Органы дыхательной системы.
- Органы выделительной системы.
- Органы мужской половой системы.
- Органы женской половой системы.
- Эмбриогенез человека.
- Компьютерный контроль.
- Контрольное занятие.
- Диагностическое занятие.
- Зачетная неделя.
План лекций и лабораторных занятий для студентов факультета спортивной медицины
Весенний семестр.
Темы лекций.
- Введение в предмет. Методы исследования в гистологии. Цитология.
- Цитология: плазмолемма, органеллы, включения.
- Цитология: ядро, клеточный цикл, апоптоз.
- Основные этапы эмбрионального развития. Источники развития тканей.
- Общие принципы организации тканей.
- Эпителиальные ткани
- Эпителиальные ткани. Железы
- Ткани внутренней среды, кровь.
- Кроветворные ткани.
- Клеточные основы иммунных реакций.
- Волокнистые соединительные ткани.
- Скелетные ткани.
- Мышечные ткани.
- Нервные ткани.
- Органы нервной системы.
- Органы чувств.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
Темы лабораторных занятий.
- Методы исследования в гистологии. Цитология.
- Цитология
- Основные этапы эмбрионального развития.
- Эпителиальные ткани.
- Контрольное занятие.
- Диагностическое занятие.
- Кровь. Кроветворные ткани.
- Волокнистые соединительные ткани.
- Хрящевые и костные ткани.
- Мышечные ткани.
- Нервные ткани.
- Контрольное занятие.
- Компьютерный контроль.
- Диагностическое занятие.
- Органы нервной системы.
- Органы чувств.
- Диагностическое занятие.
- Зачетное занятие.
Осенний семестр.
Темы лекций.
- Органы эндокринной системы
- Органы эндокринной системы
- Кожа. Производные кожи.
- Слизистые оболочки.
- Пищеварительная система: органы ротовой полости.
- Пищеварительная система: пищевод, желудок,
- Пищеварительная система: крупные железы.
- Органы дыхательной системы.
- Органы выделительной системы.
- Принцип развития и строения половых систем.
- Органы мужской половой системы.
- Органы женской половой системы.
- Органы женской половой системы.
- Эмбриогенез человека.
- Эмбриогенез человека.
- Заключительная лекция.
Темы лекций по профильным разделам.
Органы опорно–двигательного аппарата: гистофизиология мышечной системы
Органы опорно–двигательного аппарата: гистофизиология костно–суставной системы
Гистофизиология опорно–двигательного аппарата при спортивных нагрузках
Темы лабораторных занятий.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
- Органы эндокринной системы.
- Контрольное занятие. Кожа.
- Диагностическое занятие.
- Органы опорно–двигательного аппарата: гистофизиология мышечной системы.
- Органы опорно–двигательного аппарата: гистофизиология костно–суставной системы
- Гистофизиология опорно–двигательного аппарата при спортивных нагрузках
- Компьютерный контроль
- Диагностическое занятие.
- Органы пищеварительной системы.
- Органы дыхательной системы.
- Органы выделительной системы.
- Органы мужской половой системы.
- Органы женской половой системы.
- Эмбриогенез человека.
- Компьютерный контроль.
- Контрольное занятие.
- Диагностическое занятие.
- Зачетная неделя.
План лекций и лабораторных занятий педиатрического факультета
Весенний семестр.
Темы лекций.
- Введение в предмет. Методы исследования в гистологии. Цитология.
- Цитология: плазмолемма, органеллы, включения.
- Цитология: ядро, клеточный цикл, апоптоз.
- Основные этапы эмбрионального развития. Источники развития тканей.
- Общие принципы организации тканей.
- Эпителиальные ткани
- Эпителиальные ткани. Железы
- Ткани внутренней среды, кровь.
- Кроветворные ткани.
- Клеточные основы иммунных реакций.
- Волокнистые соединительные ткани.
- Скелетные ткани.
- Мышечные ткани.
- Нервные ткани.
- Органы нервной системы.
- Органы чувств.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
Темы лабораторных занятий.
- Методы исследования в гистологии. Цитология.
- Цитология
- Основные этапы эмбрионального развития.
- Эпителиальные ткани.
- Контрольное занятие.
- Диагностическое занятие.
- Кровь. Кроветворные ткани.
- Волокнистые соединительные ткани.
- Хрящевые и костные ткани.
- Мышечные ткани.
- Нервные ткани.
- Контрольное занятие.
- Компьютерный контроль.
- Диагностическое занятие.
- Органы нервной системы.
- Органы чувств.
- Диагностическое занятие.
- Зачетное занятие.
Осенний семестр.
Темы лекций.
- Органы эндокринной системы
- Органы эндокринной системы
- Кожа.
- Производные кожи.
- Слизистые оболочки.
- Пищеварительная система: органы ротовой полости.
- Пищеварительная система: пищевод, желудок, кишечник
- Пищеварительная система: крупные железы.
- Органы дыхательной системы.
- Органы выделительной системы.
- Принцип развития и строения половых систем.
- Органы мужской половой системы.
- Органы мужской половой системы.
- Органы женской половой системы.
- Органы женской половой системы.
- Эмбриогенез человека.
- Эмбриогенез человека.
- Заключительная лекция.
Темы лабораторных занятий.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
- Органы эндокринной системы.
- Контрольное занятие. Кожа.
- Диагностическое занятие.
- Органы пищеварительного тракта: ротовая полость.
- Органы пищеварительного тракта: пищевод, желудок, кишечник.
- Органы пищеварительного тракта: печень, поджелудочная железа.
- Контрольное занятие.
- Диагностическое занятие.
- Органы дыхательной системы.
- Органы выделительной системы.
- Органы мужской половой системы.
- Органы женской половой системы.
- Эмбриогенез человека.
- Компьютерный контроль.
- Контрольное занятие.
- Диагностическое занятие.
- Зачетная неделя.
План лекций и лабораторных занятий для студентов стоматологического факультета
Весенний семестр.
Темы лекций.
- Введение в предмет. Цитология.
- Ранний эмбриогенез. Источники развития тканей.
- Общие принципы организации тканей. Эпителиальные ткани. Железы.
- Ткани внутренней среды. Кровь. Кроветворные ткани. Клеточные основы иммунных реакций.
- Волокнистые соединительные ткани.
- Скелетные ткани.
- Мышечные ткани. Нервная ткань.
- Органы нервной системы. Органы чувств.
- Органы сердечно–сосудистой системы. Органы кроветворения и иммуногенеза.
- Органы эндокринной системы.
Темы лабораторных занятий.
- Введение в предмет. Методы исследования в гистологии.
- Цитология
- Основные этапы эмбрионального развития.
- Эпителиальные ткани.
- Контрольное занятие.
- Диагностическое занятие.
- Кровь. Кроветворные ткани.
- Волокнистые соединительные ткани.
- Хрящевые и костные ткани.
- Мышечные ткани.
- Нервные ткани.
- Контрольное занятие
- Компьютерный контроль.
- Диагностическое занятие.
- Органы нервной системы.
- Органы чувств.
- Контрольное занятие.
- Диагностическое занятие.
- Зачетное занятие.
Осенний семестр.
Темы лекций.
- Кожа и ее производные. Общие принципы строения слизистых оболочек.
- Слизистые оболочки полости рта. Слюнные железы.
- Зуб–строение. Пародонт.
- Развитие органов полости рта.
- Пищеварительная система: пищевод, желудок, кишечник.
- Пищеварительная система: печень, поджелудочная железа
- Органы дыхательной системы. Органы выделительной системы.
- Органы половых систем.
- Эмбриогенез человека.
Темы лабораторных занятий.
- Органы сердечно–сосудистой системы.
- Органы кроветворения и иммуногенеза.
- Органы эндокринной системы.
- Контрольное занятие. Кожа.
- Диагностическое занятие.
- Слизистая оболочка полости рта. Слюнные железы.
- Крупные железы ротовой полости. Зуб–строение. Пародонт.
- Развитие органов полости рта.
- Компьютерный контроль.
- Диагностическое занятие.
- Органы пищеварительной системы: пищевод, желудок кишечник.
- Органы пищеварительной системы: печень, поджелудочная железа.
- Органы дыхательной системы.
- Органы выделительной системы.
- Органы половых систем.
- Эмбриогенез человека.
- Компьютерный контроль
- Контрольное занятие.
- Диагностическое занятие.
- Зачетная неделя.
Карта сайта
Страница не найдена. Возможно, карта сайта Вам поможет.
- Главная
-
Университет
- Об университете
- Структура
- Нормативные документы и процедуры
- Лечебная деятельность
- Международное сотрудничество
-
Пресс-центр
- Новости
- Анонсы
- События
- Объявления и поздравления
- Online конференции
-
Фотоальбом
- Республиканский субботник-2021
- Семинар «Человек внутри себя»
- Международный конкурс «Здоровый образ жизни глазами разных поколений»
- Вручение нагрудного знака «Жена пограничника»
- Встреча с представителями медуниверситета г. Люблина
- Королева Студенчества ГрГМУ — 2021
- День открытых дверей-2021
- Управление личными финансами (встреча с представителями «БПС-Сбербанк»)
- Весенний «Мелотрек»
- Праздничный концерт к 8 Марта
- Диалоговая площадка с председателем Гродненского облисполкома
- Расширенное заседание совета университета
- Гродно — Молодежная столица Республики Беларусь-2021
- Торжественное собрание, приуроченное к Дню защитника Отечества
- Вручение свидетельства действительного члена Белорусской торгово-промышленной палаты
- Новогодний ScienceQuiz
- Финал IV Турнира трех вузов ScienseQuiz
- Областной этап конкурса «Студент года-2020″
- Семинар дистанционного обучения для сотрудников университетов из Беларуси «Обеспечение качества медицинского образования и образования в области общественного здоровья и здравоохранения»
- Студент года — 2020
- День Знаний — 2020
- Церемония награждения лауреатов Премии Правительства в области качества
- Военная присяга
- Выпускной лечебного факультета-2020
- Выпускной медико-психологического факультета-2020
- Выпускной педиатрического факультета-2020
- Выпускной факультета иностранных учащихся-2020
- Распределение — 2020
- Стоп коронавирус!
- Навстречу весне — 2020
- Профориентация — 18-я Международная специализированная выставка «Образование и карьера»
- Спартакиада среди сотрудников «Здоровье-2020″
- Конференция «Актуальные проблемы медицины»
- Открытие общежития №4
- Встреча Президента Беларуси со студентами и преподавателями медвузов
- Новогодний утренник в ГрГМУ
- XIX Республиканская студенческая конференция «Язык. Общество. Медицина»
- Alma mater – любовь с первого курса
- Актуальные вопросы коморбидности сердечно-сосудистых и костно-мышечных заболеваний в амбулаторной практике
- Областной этап «Студент года-2019″
- Финал Science Qiuz
- Конференция «Актуальные проблемы психологии личности и социального взаимодействия»
- Посвящение в студенты ФИУ
- День Матери
- День открытых дверей — 2019
- Визит в Азербайджанский медицинский университет
- Семинар-тренинг с международным участием «Современные аспекты сестринского образования»
- Осенний легкоатлетический кросс — 2019
- 40 лет педиатрическому факультету
- День Знаний — 2019
- Посвящение в первокурсники
- Акция к Всемирному дню предотвращения суицида
- Турслет-2019
- Договор о создании филиала кафедры общей хирургии на базе Брестской областной больницы
- День Независимости
- Конференция «Современные технологии диагностики, терапии и реабилитации в пульмонологии»
- Выпускной медико-диагностического, педиатрического факультетов и факультета иностранных учащихся — 2019
- Выпускной медико-психологического факультета — 2019
- Выпускной лечебного факультета — 2019
- В добрый путь, выпускники!
- Распределение по профилям субординатуры
- Государственные экзамены
- Интеллектуальная игра «Что? Где? Когда?»
- Мистер и Мисс факультета иностранных учащихся-2019
- День Победы
- IV Республиканская студенческая военно-научная конференция «Этих дней не смолкнет слава»
- Республиканский гражданско-патриотический марафон «Вместе — за сильную и процветающую Беларусь!»
- Литературно-художественный марафон «На хвалях спадчыны маёй»
- День открытых дверей-2019
- Их имена останутся в наших сердцах
- Областной этап конкурса «Королева Весна — 2019″
- Королева Весна ГрГМУ — 2019
- Профориентация «Абитуриент – 2019» (г. Барановичи)
- Мероприятие «Карьера начинается с образования!» (г. Лида)
- Итоговое распределение выпускников — 2019
- «Навстречу весне — 2019″
- Торжественная церемония, посвященная Дню защитника Отечества
- Торжественное собрание к Дню защитника Отечества — 2019
- Мистер ГрГМУ — 2019
- Предварительное распределение выпускников 2019 года
- Митинг-реквием у памятника воинам-интернационалистам
- Профориентация «Образование и карьера» (г.Минск)
- Итоговая коллегия главного управления здравоохранения Гродненского областного исполнительного комитета
- Спартакиада «Здоровье — 2019»
- Итоговая научно-практическая конференция «Актуальные проблемы медицины».
- Расширенное заседание Совета университета.
- Научно-практическая конференция «Симуляционные технологии обучения в подготовке медицинских работников: актуальность, проблемные вопросы внедрения и перспективы»
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- XVI съезд хирургов Республики Беларусь
- Итоговая практика
- Конкурс «Студент года-2018»
- Совет университета
- 1-й съезд Евразийской Аритмологической Ассоциации (14.09.2018 г.)
- 1-й съезд Евразийской Аритмологической Ассоциации (13.09.2018 г.)
- День знаний
- День независимости Республики Беларусь
- Церемония награждения победителей конкурса на соискание Премии СНГ
- День герба и флага Республики Беларусь
- «Стань донором – подари возможность жить»
- VIII Международный межвузовский фестиваль современного танца «Сделай шаг вперед»
- Конкурс грации и артистического мастерства «Королева Весна ГрГМУ – 2018»
- Окончательное распределение выпускников 2018 года
- Митинг-реквием, приуроченный к 75-летию хатынской трагедии
- Областное совещание «Итоги работы терапевтической и кардиологической служб Гродненской области за 2017 год и задачи на 2018 год»
- Конкурсное шоу-представление «Мистер ГрГМУ-2018»
- Предварительное распределение выпускников 2018 года
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- II Съезд учёных Республики Беларусь
- Круглый стол факультета иностранных учащихся
- «Молодежь мира: самобытность, солидарность, сотрудничество»
- Заседание выездной сессии Гродненского областного Совета депутатов
- Областной этап республиканского конкурса «Студент года-2017»
- Встреча с председателем РОО «Белая Русь» Александром Михайловичем Радьковым
- Конференция «Актуальные вопросы инфекционной патологии», 27.10.2017
- XIX Всемирный фестиваль студентов и молодежи
- Республиканская научно-практическая конференция «II Гродненские аритмологические чтения»
- Областная научно-практическая конференция «V Гродненские гастроэнтерологические чтения»
- Праздник, посвящённый 889-летию города Гродно
- Круглый стол на тему «Место и роль РОО «Белая Русь» в политической системе Республики Беларусь» (22.09.2017)
- ГрГМУ и Университет медицины и фармации (г.Тыргу-Муреш, Румыния) подписали Соглашение о сотрудничестве
- 1 сентября — День знаний
- Итоговая практика на кафедре военной и экстремальной медицины
- Квалификационный экзамен у врачей-интернов
- Встреча с Комиссией по присуждению Премии Правительства Республики Беларусь
- Научно-практическая конференция «Амбулаторная терапия и хирургия заболеваний ЛОР-органов и сопряженной патологии других органов и систем»
- День государственного флага и герба
- 9 мая
- Республиканская научно-практическая конференция с международным участием «V белорусско-польская дерматологическая конференция: дерматология без границ»
- «Стань донором – подари возможность жить»
- «Круглый стол» Постоянной комиссии Совета Республики Беларусь Национального собрания Республики Беларусь по образованию, науке, культуре и социальному развитию
- Весенний кубок КВН «Юмор–это наука»
- Мисс ГрГМУ-2017
- Распределение 2017 года
- Общегородской профориентационный день для учащихся гимназий, лицеев и школ
- Праздничный концерт, посвященный Дню 8 марта
- Конкурсное шоу-представление «Мистер ГрГМУ–2017»
- «Масленица-2017»
- Торжественное собрание и паздничный концерт, посвященный Дню защитника Отечества
- Лекция профессора, д.м.н. О.О. Руммо
- Итоговая научно-практическая конференция «Актуальные проблемы медицины»
- Меморандум о сотрудничестве между областной организацией Белорусского общества Красного Креста и региональной организацией Красного Креста китайской провинции Хэнань
- Визит делегации МГЭУ им. А.Д. Сахарова БГУ в ГрГМУ
- «Студент года-2016»
- Визит Чрезвычайного и Полномочного Посла Королевства Швеция в Республике Беларусь господина Мартина Оберга в ГрГМУ
- Конкурс первокурсников «Аlma mater – любовь с первого курса»
- День матери в ГрГМУ
- Итоговая практика-2016
- День знаний
- Визит китайской делегации в ГрГМУ
- Визит иностранной делегации из Вроцлавского медицинского университета (Республика Польша)
- Торжественное мероприятие, посвященное профессиональному празднику – Дню медицинского работника
- Визит ректора ГрГМУ Виктора Александровича Снежицкого в Индию
- Республиканская университетская суббота-2016
- Республиканская акция «Беларусь против табака»
- Встреча с поэтессой Яниной Бокий
- 9 мая — День Победы
- Митинг, посвященный Дню Государственного герба и Государственного флага Республики Беларусь
- Областная межвузовская студенческая научно-практическая конференция «1941 год: трагедия, героизм, память»
- «Цветы Великой Победы»
- Концерт народного ансамбля польской песни и танца «Хабры»
- Суботнiк ў Мураванцы
- «Мисс ГрГМУ-2016»
- Визит академика РАМН, профессора Разумова Александра Николаевича в УО «ГрГМУ»
- Визит иностранной делегации из Медицинского совета Мальдивской Республики
- «Кубок ректора Гродненского государственного медицинского университета по дзюдо»
- «Кубок Дружбы-2016» по мини-футболу среди мужских и женских команд медицинских учреждений образования Республики Беларусь
- Распределение выпускников 2016 года
- Визит Министра обороны Республики Беларусь на военную кафедру ГрГМУ
- Визит Первого секретаря Посольства Израиля Анны Кейнан и директора Израильского культурного центра при Посольстве Израиля Рей Кейнан
- Визит иностранной делегации из провинции Ганьсу Китайской Народной Республики в ГрГМУ
- Состоялось открытие фотовыставки «По следам Библии»
- «Кубок декана» медико-диагностического факультета по скалолазанию
- Мистер ГрГМУ-2016
- Приём Первого секретаря Посольства Израиля Анны Кейнан в ГрГМУ
- Спартакиада «Здоровье» УО «ГрГМУ» среди сотрудников 2015-2016 учебного года
- Визит Посла Республики Индия в УО «ГрГМУ»
- Торжественное собрание и концерт, посвященный Дню защитника Отечества
- Митинг-реквием, посвященный Дню памяти воинов-интернационалистов
- Итоговое заседание коллегии главного управления идеологической работы, культуры и по делам молодежи Гродненского облисполкома
- Итоговая научно-практическая конференция Гродненского государственного медицинского университета
- Новогодний концерт
- Открытие профессорского консультативного центра
- Концерт-акция «Молодёжь против СПИДа»
- «Студент года-2015»
- Открытые лекции профессора, академика НАН Беларуси Островского Юрия Петровича
- «Аlma mater – любовь с первого курса»
- Открытая лекция Регионального директора ВОЗ госпожи Жужанны Якаб
- «Открытый Кубок по велоориентированию РЦФВиС»
- Совместное заседание Советов университетов г. Гродно
- Встреча с Министром здравоохранения Республики Беларусь В.И. Жарко
- День города
- Дебаты «Врач — выбор жизни»
- День города
- Праздничный концерт «Для вас, первокурсники!»
- Акция «Наш год – наш выбор»
- День знаний
- Открытое зачисление абитуриентов в УО «Гродненский государственный медицинский университет»
- Принятие военной присяги студентами ГрГМУ
- День Независимости Республики Беларусь
- Вручение дипломов выпускникам 2015 года
- Республиканская олимпиада студентов по педиатрии
- Открытие памятного знака в честь погибших защитников
- 9 мая
- «Вторая белорусско-польская дерматологическая конференция: дерматология без границ»
- Мистер университет
- Мисс универитет
- КВН
- Гродненский государственный медицинский университет
- Чествование наших ветеранов
- 1 Мая
- Cовместный субботник
- Наши издания
- Медицинский календарь
- Университет в СМИ
- Видео-презентации
- Общественные объединения
- Комиссия по противодействию коррупции
- Образовательная деятельность
- Абитуриентам
- Студентам
- Выпускникам
- Слайдер
- Последние обновления
- Баннеры
- Иностранному гражданину
- Научная деятельность
- Поиск
Кроветворная система — это… Что такое Кроветворная система?
- Кроветворная система
Кроветво́рная система — система органов организма, отвечающих за постоянство состава крови. Поскольку в организме непрерывно разрушаются форменные элементы (напр., тромбоциты распадаются примерно через неделю), основной функцией кроветворных органов является постоянное пополнение клеточных элементов крови — кроветворение или Гемопоэз (лат. haemopoiesis). Основными компонентами кроветворной системы являются костный мозг, лимфатические узлы и селезёнка.
В костном мозге происходит образование эритроцитов, разных форм лейкоцитов и тромбоцитов.
Лимфатические узлы участвуют в процессах кроветворения, вырабатывая лимфоциты, плазматические клетки.
Селезёнка состоит из так наз. красной и белой пульпы. Красная пульпа заполнена форменными элементами крови, в основном эритроцитами; белая пульпа образована лимфоидной тканью, в которой вырабатываются лимфоциты. Помимо кроветворной функции, селезёнка осуществляет захват из тока крови повреждённых эритроцитов, микроорганизмов и других чуждых организму элементов, попавших в кровь; в ней вырабатываются антитела.
См. также
Категории:- Кровь
- Органы кроветворения и иммунной системы
Wikimedia Foundation. 2010.
- Преподобномученик
- Фонтаны Москвы
Смотреть что такое «Кроветворная система» в других словарях:
ЛИМФАТИЧЕСКАЯ СИСТЕМА — (ЖЕЛЕЗЫ, СОСУДЫ), система щелей, каналов, сосудов и специальных образований (лимфатич. желез) по ходу их, отводящих из тканей т. н. лимфу (см.). Понятие Л. с. включает в себя также нек рые образования из аденоидной ткани (см.). Сюда принадлежат… … Большая медицинская энциклопедия
Небидо — Действующее вещество ›› Тестостерон* (Testosterone*) Латинское название Nebido АТХ: ›› G03BA03 Тестостерон Фармакологическая группа: Андрогены, антиандрогены Нозологическая классификация (МКБ 10) ›› E23.0 Гипопитуитаризм ›› E29 Дисфункция яичек… … Словарь медицинских препаратов
ЛЕЙКЕМИЯ — ЛЕЙКЕМИЯ, (leukaemia; Virchow, 1845), системное заболевание кроветворного аппарата, имеющее в основе гиперпластическое разрастание лимфаденоидной или мие лоидной ткани или рет. энд. ткани и сопровождающееся увеличением в крови количества белых… … Большая медицинская энциклопедия
Шко́льный во́зраст — период жизни с 6 7 до 17 18 лет. Условно выделяют младший Ш. в. (до 11 лет) и старший Ш. в. (с 12 лет), который обычно называют подростковым возрастом, или периодом полового созревания. В связи с индивидуальными колебаниями сроков полового… … Медицинская энциклопедия
Я́сельный во́зраст — период развития ребенка от 4 нед. до 3 лет. Условно подразделяется на младший ясельный, или грудной, возраст от 4 нед. до 1 года (см. Грудной ребенок (Грудной ребёнок)) и старший ясельный, или преддошкольный, от 1 года до 3 лет. Я. в.… … Медицинская энциклопедия
Циклоспорин ГЕКСАЛ — Действующее вещество ›› Циклоспорин* (Ciclosporin*) Латинское название Ciclosporin HEXAL АТХ: ›› L04AD01 Циклоспорин Фармакологическая группа: Иммунодепрессанты Нозологическая классификация (МКБ 10) ›› h30 Иридоциклит ›› L20 Атопический дерматит… … Словарь медицинских препаратов
Дошко́льный во́зраст — период развития ребенка от 3 до 6 7 лет. В эти годы происходят дальнейшее физическое развитие и совершенствование интеллектуальных возможностей ребенка. Рост и масса тела. Рост детей в Д. в. увеличивается неравномерно вначале до 4 6 см в год, а… … Медицинская энциклопедия
Тизерцин — Действующее вещество ›› Левомепромазин* (Levomepromazine*) Латинское название Tisercin АТХ: ›› N05AA02 Левомепромазин Фармакологическая группа: Нейролептики Нозологическая классификация (МКБ 10) ›› F20 Шизофрения ›› F29 Неорганический психоз… … Словарь медицинских препаратов
Биологическое действие ионизирующих излучений — изменения, вызываемые в жизнедеятельности и структуре живых организмов при воздействии коротковолновых электромагнитных волн (рентгеновского излучения и гамма излучения (См. Гамма излучение)) или потоков заряженных частиц (альфа частиц… … Большая советская энциклопедия
Анкотил — Действующее вещество ›› Флуцитозин* (Flucytosine*) Латинское название Ancotil АТХ: ›› J02AX01 Флуцитозин Фармакологическая группа: Противогрибковые средства Нозологическая классификация (МКБ 10) ›› B37.7 Кандидозная септицемия ›› B43.9 Хромомикоз … Словарь медицинских препаратов
Обзор онкологических заболеваний крови
ЗЛОКАЧЕСТВЕННЫЕ ЗАБОЛЕАНИЯ КРОВИОпухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний.
Предлагаем Вашему вниманию краткий, но очень подробный обзор онкологических заболеваний кроветворной системы.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиала ФГБУ «НМИЦ радиологии» Минздрава России.
Филиалы и отделения, где лечат злокачественные заболеания кровиМНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Злокачественные заболевания крови (современное обозначение: опухоли кроветворной и лимфоидной тканей ,онкогематологические заболевания , устаревшее название – гемобластозы , в бытовом понимании —рак крови ) – эти понятия объединяют различные по своим клиническим и биологическим свойствам, прогнозу и подходам к лечению заболевания, общим для которых является происхождение из той или иной клетки крови, находящейся на том или ином этапе развития. Иными словами, в организме здорового человека клетки-родоначальницы кроветворения непрерывно образуются новые клетки крови, такой процесс образования, развития и созревания клеток крови — лейкоцитов, эритроцитов, тромбоцитов носит название гемопоэз.
Каждая новая клетка проходит строго определенные этапы своего развития, результатом которых является изменение ее внешнего вида и свойств. Если на каком-либо этапе в силу разных повреждающих причин происходит «замирание» одной единственной клетки (=блок дифференцировки), а затем эта клетка начнет деление и новые клетки будут также лишены возможности дальнейшего развития, то исходом этого процесса будет накопление не завершивших все необходимые этапы дифференцировки клеток (=опухолевого клона), что собственно и будет обозначать начало гемобластоза. Интересно, что злокачественные клетки крови в той или иной мере сохраняют морфологические, иммунологические свойства и «биологическое поведение» своих нормальных аналогов.
Существующие классификационные системы опухолей лимфоидной и кроветворной тканей основываются на детальной иммуноморфологической характеристике опухоли, подкрепленной в ряде случаев дополнительной информацией о генетической и молекулярной ее структуре.
Иммунофенотипирование при лейкозе или лимфоме– необходимый диагностический этап при остром лейкозе или лимфоме. Это комплексная характеристика типа клеток. С использованием иммунологических методов возможно выявление особых структур, антигенов, на поверхности клетки (как правило, белковых молекул, так называемых CD (claster differentiation), кластер дифференцировки). Комплекс данных антигенов составляет иммунологический фенотип (иммунофенотип) на основании которого каждая клетка может быть отнесена к определенному классу: негемопоэтическая, гемопоэтическая, миелоидная, лимфоидная, T-клетка, В-клетка, клетка-предшественник. В соответствии с иммунофенотипом определяется иммунологический вариант заболевания, что является принципиальным для выбора правильной терапии на этапе диагноза.
Цитогенетический метод исследования кровив настоящее время входит в перечень необходимых диагностических мероприятий при большинстве онкогематологических заболеваний. Данный метод позволяет:
• Провести точную диагностику большинства опухолевых заболеваний системы крови.
• Определить прогноз заболевания.
• Использовать таргетную (точечную, прицельную терапию) при обнаружении определенных цитогенетических перестроек.
В основе развития онкогематологических заболеваний лежат перестройки (поломки) генетического материала в клетках кроветворной и лимфоидной тканей. Эти события приводят к трансформации нормальных кроветворных клеток в опухолевые. Они не затрагивают другие клетки организма (в т.ч. половые клетки). По этой причине онкогематологические заболевания, за редким исключением, не передаются по наследству. Хромосомные перестройки можно обнаружить при помощи стандартного цитогенетического исследования или более чувствительного метода – интерфазного анализа с использованием зондов (маркеров) к конкретным участкам хромосом (метод FISH). В ряде случаев цитогенетические изменения могут происходить на субмикроскопическом уровне (т.к называемые точечные мутации). Такие изменения возможно детектировать только с помощью ультратонких высокочувствительных методов молекулярного исследования (метод ПЦР- полимеразная цепная реакция).
Чем продиктована необходимость проведения молекулярно-цитогенетических исследований у онкогематологических больных? В настоящее время хорошо изучен ряд цитогенетических изменений, являющихся уникальными специфическими маркерами для различных вариантов опухолевых заболеваний системы крови. Их обнаружение является достоверным критерием диагноза. Яркими примерами могут служить транслокация t(9:22) или филадельфийская хромосома, присутствующая во всех случаях хронического миелолейкоза; транслокация t(15;17) — при остром промиелоцитарном лейкозе, транслокация t(8;14) – при лимфоме Беркитта. Кроме того, расшифровка цитогенетических событий привела к созданию таргетных препаратов, которые в отличие от химиопрепаратов обладают селективным действием на опухолевые клетки. Так, использование иматиниба при обнаружении филадельфийской хромосомы кардинально изменило прогноз хронического миелолейкоза.
В ходе больших международных исследований было обнаружено различное течение онкогематологических заболеваний в зависимости от обнаружения тех или иных хромосомных перестроек или мутаций генов. Известны изменения, ассоциированные с благоприятным, промежуточным или неблагоприятным агрессивным течением заболевания. Таким образом, молекулярно-цитогенетические характеристики являются предикторами прогноза. На этой основе при различных онкогематологических заболеваниях на ряду с другими признаками разрабатываются программы терапии разной интенсивности (риск-адаптированная терапия).
Среди опухолей кроветворной и лимфоидной тканей различают лимфомы и лейкозы. Исторически сложилось разделение лимфоидных опухолей (лимфом) на лимфому Ходжкина и неходжкинские лимфомы. Неходжкинские лимфомы в зависимости от клеточной линии подразделяются на В-клеточные, Т- и NK-клеточные опухоли. На сегодняшний день на основании морфоиммунологических и генетических характеристик выделяется несколько десятков видов неходжкинских лимфом, для многих из которых созданы обособленные терапевтические программы. Лейкозы представляют собой разнородную группу заболеваний, делятся на острые и хронические в зависимости от субстрата опухоли: при острых лейкозах основная масса клеточного субстрата представлена незрелыми клетками (бластами ), при этом блок дифференцировки происходит очень рано, на этапе клеток-родоначальниц кроветворения, в отличие от хронических лейкозов, где опухолевые клетки представлены зрелыми и созревающими элементами. Также принципиально важным является деление лейкозов на миелоидные и лимфоидные, что возможно только при проведении качественного морфо- цитохимического, иммунофенотипического и молекулярно-генетического исследований клеток крови еще до начала лечения.
Опухоли кроветворной и лимфоидной тканей составляют приблизительно 8% от всех злокачественных новообразований, и все вместе входят в число 6 самых частых видов злокачественных заболеваний. Уровень смертности при этом значительно снизился в последнее два десятилетии, что является следствием появления новых высоко эффективных программ лечения.
Филиалы и отделения Центра, в которых лечат злокачественные заболевания кроветворной системыФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
8 (494) 150 11 22
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови. Это происходит в системе кроветворения, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, кроветворение — это процесс, посредством которого организм производит клетки крови. Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Краткие сведения о кроветворении:
Кровь состоит из более чем 10 различных типов клеток.Каждый из этих типов клеток попадает в одну из трех широких категорий:
1. Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : они поддерживают иммунную систему. Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : Помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : они помогают крови свертываться.
Текущие исследования подтверждают теорию кроветворения, называемую монофилетической теорией.Эта теория гласит, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом. На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит в основном в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами. Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма.Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента клеток крови.
Лейкоциты имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты.Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы кроветворения, продолжаются научные дебаты о том, как формируются стволовые клетки, которые играют роль в кроветворении.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда кроветворение следует двумя разными путями.
Трехлинейный гемопоэз означает производство трех типов клеток крови: тромбоцитов, красных кровяных телец и белых кровяных телец. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется. На каждом этапе процесса клетки-предшественники становятся более организованными:
эритроцитов и тромбоцитов
- эритроцитов : клетки CMP изменяются пять раз, прежде чем окончательно становятся эритроцитами, также известными как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три разных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых проходит свой путь в процессе кроветворения. Все белые кровяные тельца изначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь кроветворения продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые общими лимфоидными предшественниками, которые затем становятся лимфобластами. Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут поражать здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак лейкоцитов, такой как лейкемия и лимфома, может изменять количество лейкоцитов в кровотоке. Опухоли в кроветворной ткани, вырабатывающей клетки крови, например, в костном мозге, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить производство клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность.Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей. Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови.Это происходит в системе кроветворения, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, кроветворение — это процесс, посредством которого организм производит клетки крови. Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Краткие сведения о кроветворении:
Кровь состоит из более чем 10 различных типов клеток. Каждый из этих типов клеток попадает в одну из трех широких категорий:
1.Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : они поддерживают иммунную систему. Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : Помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : они помогают крови свертываться.
Текущие исследования подтверждают теорию кроветворения, называемую монофилетической теорией. Эта теория гласит, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом.На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит в основном в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами.Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента клеток крови.
Лейкоциты имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы кроветворения, продолжаются научные дебаты о том, как формируются стволовые клетки, которые играют роль в кроветворении.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда кроветворение следует двумя разными путями.
Трехлинейный гемопоэз означает производство трех типов клеток крови: тромбоцитов, красных кровяных телец и белых кровяных телец. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется.На каждом этапе процесса клетки-предшественники становятся более организованными:
эритроцитов и тромбоцитов
- эритроцитов : клетки CMP изменяются пять раз, прежде чем окончательно становятся эритроцитами, также известными как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три разных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых проходит свой путь в процессе кроветворения.Все белые кровяные тельца изначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь кроветворения продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые общими лимфоидными предшественниками, которые затем становятся лимфобластами.Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут поражать здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак лейкоцитов, такой как лейкемия и лимфома, может изменять количество лейкоцитов в кровотоке. Опухоли в кроветворной ткани, вырабатывающей клетки крови, например, в костном мозге, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить производство клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность. Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей.Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови. Это происходит в системе кроветворения, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, кроветворение — это процесс, посредством которого организм производит клетки крови.Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Краткие сведения о кроветворении:
Кровь состоит из более чем 10 различных типов клеток. Каждый из этих типов клеток попадает в одну из трех широких категорий:
1. Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : они поддерживают иммунную систему.Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : Помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : они помогают крови свертываться.
Текущие исследования подтверждают теорию кроветворения, называемую монофилетической теорией. Эта теория гласит, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом.На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит в основном в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами.Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента клеток крови.
Лейкоциты имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы кроветворения, продолжаются научные дебаты о том, как формируются стволовые клетки, которые играют роль в кроветворении.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда кроветворение следует двумя разными путями.
Трехлинейный гемопоэз означает производство трех типов клеток крови: тромбоцитов, красных кровяных телец и белых кровяных телец. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется.На каждом этапе процесса клетки-предшественники становятся более организованными:
эритроцитов и тромбоцитов
- эритроцитов : клетки CMP изменяются пять раз, прежде чем окончательно становятся эритроцитами, также известными как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три разных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых проходит свой путь в процессе кроветворения.Все белые кровяные тельца изначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь кроветворения продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые общими лимфоидными предшественниками, которые затем становятся лимфобластами.Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут поражать здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак лейкоцитов, такой как лейкемия и лимфома, может изменять количество лейкоцитов в кровотоке. Опухоли в кроветворной ткани, вырабатывающей клетки крови, например, в костном мозге, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить производство клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность. Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей.Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови. Это происходит в системе кроветворения, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, кроветворение — это процесс, посредством которого организм производит клетки крови.Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Краткие сведения о кроветворении:
Кровь состоит из более чем 10 различных типов клеток. Каждый из этих типов клеток попадает в одну из трех широких категорий:
1. Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : они поддерживают иммунную систему.Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : Помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : они помогают крови свертываться.
Текущие исследования подтверждают теорию кроветворения, называемую монофилетической теорией. Эта теория гласит, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом.На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит в основном в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами.Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента клеток крови.
Лейкоциты имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы кроветворения, продолжаются научные дебаты о том, как формируются стволовые клетки, которые играют роль в кроветворении.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда кроветворение следует двумя разными путями.
Трехлинейный гемопоэз означает производство трех типов клеток крови: тромбоцитов, красных кровяных телец и белых кровяных телец. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется.На каждом этапе процесса клетки-предшественники становятся более организованными:
эритроцитов и тромбоцитов
- эритроцитов : клетки CMP изменяются пять раз, прежде чем окончательно становятся эритроцитами, также известными как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три разных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых проходит свой путь в процессе кроветворения.Все белые кровяные тельца изначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь кроветворения продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые общими лимфоидными предшественниками, которые затем становятся лимфобластами.Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут поражать здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак лейкоцитов, такой как лейкемия и лимфома, может изменять количество лейкоцитов в кровотоке. Опухоли в кроветворной ткани, вырабатывающей клетки крови, например, в костном мозге, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить производство клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность. Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей.Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
Определение, где это происходит, процесс и типы
Гематопоэз — это производство всех клеточных компонентов крови и плазмы крови. Это происходит в системе кроветворения, которая включает органы и ткани, такие как костный мозг, печень и селезенку.
Проще говоря, кроветворение — это процесс, посредством которого организм производит клетки крови.Он начинается на ранней стадии развития эмбриона, задолго до рождения, и продолжается на протяжении всей жизни человека.
Краткие сведения о кроветворении:
Кровь состоит из более чем 10 различных типов клеток. Каждый из этих типов клеток попадает в одну из трех широких категорий:
1. Красные кровяные тельца (эритроциты) : они переносят кислород и гемоглобин по всему телу.
2. Лейкоциты (лейкоциты) : они поддерживают иммунную систему.Существует несколько различных типов лейкоцитов:
- Лимфоциты : включая Т-клетки и В-клетки, которые помогают бороться с некоторыми вирусами и опухолями.
- Нейтрофилы : Помогают бороться с бактериальными и грибковыми инфекциями.
- Эозинофилы : они играют роль в воспалительной реакции и помогают бороться с некоторыми паразитами.
- Базофилы : они высвобождают гистамины, необходимые для воспалительной реакции.
- Макрофаги : они поглощают и переваривают мусор, включая бактерии.
3. Тромбоциты (тромбоциты) : они помогают крови свертываться.
Текущие исследования подтверждают теорию кроветворения, называемую монофилетической теорией. Эта теория гласит, что один тип стволовых клеток производит все типы клеток крови.
Кроветворение происходит во многих местах:
Кроветворение в эмбрионе
Кроветворение в эмбрионе, которое иногда называют примитивным кроветворением, продуцирует только красные кровяные тельца, которые могут обеспечивать развивающиеся органы кислородом.На этой стадии развития желточный мешок, который питает эмбрион до полного развития плаценты, контролирует кроветворение.
По мере того, как эмбрион продолжает развиваться, процесс кроветворения перемещается в печень, селезенку и костный мозг и начинает продуцировать другие типы клеток крови.
У взрослых кроветворение эритроцитов и тромбоцитов происходит в основном в костном мозге. У младенцев и детей он также может продолжаться в селезенке и печени.
Лимфатическая система, в частности селезенка, лимфатические узлы и тимус, вырабатывает белые кровяные тельца, называемые лимфоцитами.Ткани печени, селезенки, лимфатических узлов и некоторых других органов производят другой тип белых кровяных телец, называемых моноцитами.
Процесс кроветворения
Скорость кроветворения зависит от потребностей организма. Организм постоянно производит новые клетки крови, чтобы заменить старые. Ежедневно необходимо заменять около 1 процента клеток крови.
Лейкоциты имеют самую короткую продолжительность жизни, иногда от нескольких часов до нескольких дней, в то время как эритроциты могут длиться до 120 дней или около того.
Процесс кроветворения начинается с неспециализированных стволовых клеток. Эта стволовая клетка размножается, и некоторые из этих новых клеток трансформируются в клетки-предшественники. Это клетки, которым суждено стать определенным типом клеток крови, но они еще не полностью развиты. Однако эти незрелые клетки вскоре делятся и созревают на компоненты крови, такие как красные и белые кровяные тельца или тромбоциты.
Хотя исследователи понимают основы кроветворения, продолжаются научные дебаты о том, как формируются стволовые клетки, которые играют роль в кроветворении.
Каждый тип кровяных клеток проходит несколько разный путь кроветворения. Все начинаются со стволовых клеток, называемых мультипотентными гемопоэтическими стволовыми клетками (HSC). Отсюда кроветворение следует двумя разными путями.
Трехлинейный гемопоэз означает производство трех типов клеток крови: тромбоцитов, красных кровяных телец и белых кровяных телец. Каждая из этих клеток начинается с трансформации HSC в клетки, называемые общими миелоидными предшественниками (CMP).
После этого процесс немного меняется.На каждом этапе процесса клетки-предшественники становятся более организованными:
эритроцитов и тромбоцитов
- эритроцитов : клетки CMP изменяются пять раз, прежде чем окончательно становятся эритроцитами, также известными как эритроциты.
- Тромбоциты : клетки CMP трансформируются в три разных типа клеток, прежде чем стать тромбоцитами.
Белые кровяные тельца
Существует несколько типов белых кровяных телец, каждый из которых проходит свой путь в процессе кроветворения.Все белые кровяные тельца изначально трансформируются из клеток CMP в миобласты. После этого процесс выглядит следующим образом:
- Прежде чем стать нейтрофилом, эозинофилом или базофилом, миобласт проходит еще четыре стадии развития.
- Чтобы стать макрофагом, миобласт должен трансформироваться еще три раза.
Второй путь кроветворения продуцирует Т- и В-клетки.
Т-клетки и В-клетки
Для производства лимфоцитов МНС трансформируются в клетки, называемые общими лимфоидными предшественниками, которые затем становятся лимфобластами.Лимфобласты дифференцируются в борющиеся с инфекцией Т-клетки и В-клетки. Некоторые В-клетки дифференцируются в плазматические клетки после контакта с инфекцией.
Некоторые заболевания крови могут поражать здоровые клетки крови в крови, даже если происходит кроветворение.
Например, рак лейкоцитов, такой как лейкемия и лимфома, может изменять количество лейкоцитов в кровотоке. Опухоли в кроветворной ткани, вырабатывающей клетки крови, например, в костном мозге, могут влиять на количество клеток крови.
Процесс старения может увеличить количество жира в костном мозге. Это увеличение жира может затруднить производство клеток крови костным мозгом. Если организм нуждается в дополнительных клетках крови из-за болезни, костный мозг не может опередить эту потребность. Это может вызвать анемию, которая возникает, когда в крови не хватает гемоглобина из красных кровяных телец.
Гематопоэз — это постоянный процесс, в результате которого образуется огромное количество клеток. Оценки различаются, и точное количество ячеек зависит от индивидуальных потребностей.Но в обычный день организм может производить 200 миллиардов эритроцитов, 10 миллионов лейкоцитов и 400 миллиардов тромбоцитов.
5. Кроветворные стволовые клетки | stemcells.nih.gov
Обладая более чем 50-летним опытом изучения кроветворных стволовых клеток, называемых гемопоэтическими стволовыми клетками, ученые выработали достаточное понимание, чтобы фактически использовать их в качестве терапии. В настоящее время ни один другой тип стволовых клеток, взрослых, эмбриональных или эмбриональных, не достиг такого статуса.В настоящее время трансплантаты гемопоэтических стволовых клеток обычно используются для лечения пациентов с онкологическими заболеваниями и другими заболеваниями крови и иммунной системы. Недавно исследователи наблюдали в исследованиях на животных, что гемопоэтические стволовые клетки, по-видимому, способны образовывать другие виды клеток, такие как мышцы, кровеносные сосуды и кости. Если это применимо к клеткам человека, возможно, в конечном итоге станет возможным использовать гемопоэтические стволовые клетки для замены более широкого набора клеток и тканей, чем считалось ранее. Несмотря на обширный опыт работы с гемопоэтическими стволовыми клетками, ученые сталкиваются с серьезными препятствиями в расширении их использования, помимо замены крови и иммунных клеток.Во-первых, гемопоэтические стволовые клетки не могут пролиферировать (реплицироваться) и дифференцироваться (специализироваться на других типах клеток) in vitro (в пробирке или культуральной чашке). Во-вторых, у ученых пока нет точного метода отличия стволовых клеток от других клеток, полученных из крови или костного мозга. Пока ученые не преодолеют эти технические препятствия, они считают, что маловероятно, что гемопоэтические стволовые клетки будут применяться в качестве заместительной клеточной терапии при таких заболеваниях, как диабет, болезнь Паркинсона, травмы спинного мозга и многих других. ВведениеКлетки крови отвечают за постоянное поддержание и иммунную защиту каждого типа клеток тела. Эта неустанная и жестокая работа требует, чтобы клетки крови, наряду с клетками кожи, обладали наибольшей способностью к самообновлению по сравнению с любой тканью взрослого человека. Стволовые клетки, которые образуют кровь и иммунные клетки, известны как гемопоэтические стволовые клетки (ГСК). В конечном итоге они несут ответственность за постоянное обновление крови — производство миллиардов новых клеток крови каждый день.Врачи и фундаментальные исследователи знают и используют этот факт более 50 лет при лечении многих заболеваний. Первые доказательства и определение кроветворных стволовых клеток были получены в результате исследований людей, подвергшихся смертельным дозам радиации в 1945 году. Вскоре последовали фундаментальные исследования. После дублирования лучевой болезни у мышей ученые обнаружили, что могут спасти мышей от смерти с помощью трансплантации костного мозга от здоровых животных-доноров. В начале 1960-х Тилль и Маккалок начали анализ костного мозга, чтобы выяснить, какие компоненты отвечают за регенерацию крови [56].Они определили, что остается двумя отличительными чертами HSC: он может обновляться и производить клетки, дающие начало всем различным типам клеток крови (см. Главу 4. Стволовые клетки взрослого). Что такое гемопоэтическая стволовая клетка?Гематопоэтическая стволовая клетка — это клетка, выделенная из крови или костного мозга, которая может обновляться, может дифференцироваться в различные специализированные клетки, может мобилизоваться из костного мозга в циркулирующую кровь и может подвергаться запрограммированной гибели клеток, называемой апоптозом — a. процесс самоуничтожения вредных или ненужных клеток. Основным направлением фундаментальных исследований HSC с 1960-х гг. Было выявление и характеристика этих стволовых клеток. Поскольку HSC выглядят и ведут себя в культуре как обычные белые кровяные тельца, это было сложной задачей, и это затрудняет их идентификацию по морфологии (размеру и форме). Даже сегодня ученые должны полагаться на белки клеточной поверхности, которые лишь приблизительно служат маркерами лейкоцитов. Идентификация и характеристика свойств HSC началась с исследований на мышах, которые заложили основу для исследований на людях.Проблема огромна, поскольку считается, что примерно 1 из каждых 10 000–15 000 клеток костного мозга является стволовой клеткой. В кровотоке это соотношение составляет 1 на 100 000 клеток крови. С этой целью ученые начали разрабатывать тесты для доказательства самообновления и пластичности HSC. «Золотой стандарт» доказательства того, что клетка, полученная из костного мозга мыши, действительно является HSC, все еще основан на том же доказательстве, описанном выше и использованном на мышах много лет назад. То есть клетки вводятся мыши, получившей дозу облучения, достаточную для уничтожения ее собственных кроветворных клеток.Если мышь выздоравливает и снова появляются все типы клеток крови (несущие генетический маркер от животного-донора), считается, что трансплантированные клетки содержат стволовые клетки. Эти исследования показали, что существует два типа HSC. Если клетки костного мозга пересаженной мыши, в свою очередь, можно трансплантировать другой смертельно облученной мыши и восстановить ее кроветворную систему в течение нескольких месяцев, они считаются стволовыми клетками длительного хранения, способными к самообновлению.Другие клетки костного мозга могут немедленно регенерировать все различные типы клеток крови, но при нормальных обстоятельствах не могут обновляться в течение длительного времени, и их называют краткосрочными клетками-предшественниками или клетками-предшественниками. Клетки-предшественники или клетки-предшественники — это относительно незрелые клетки, которые являются предшественниками полностью дифференцированной клетки того же типа ткани. Они способны к пролиферации, но обладают ограниченной способностью дифференцироваться в более чем один тип клеток, как это делают HSC.Например, клетки-предшественники крови могут производить только эритроциты (см. Рисунок 5.1. Дифференциация гемопоэтических и стромальных стволовых клеток). Рисунок 5.1. Дифференциация гемопоэтических и стромальных стволовых клеток. (© 2001 Тереза Уинслоу, Лидия Кибюк) Харрисон и др. пишут, что краткосрочные клетки-предшественники крови у мыши могут восстанавливать кроветворение в течение трех-четырех месяцев [36]. Долговечность краткосрочных стволовых клеток для человека точно не установлена.Настоящая стволовая клетка, способная к самообновлению, должна быть способна обновляться на протяжении всей жизни организма. Именно эти долгосрочно реплицирующиеся HSC наиболее важны для разработки клеточной терапии на основе HSC. К сожалению, на сегодняшний день исследователи не могут отличить долгосрочные клетки от краткосрочных, когда они удаляются из кровотока или костного мозга. Основная проблема анализов, используемых для идентификации стволовых клеток с длительным сроком действия и клеток-предшественников с коротким сроком действия, заключается в том, что они сложны, дороги, требуют много времени и не могут быть выполнены на людях.В настоящее время доступно несколько анализов, которые проверяют способность клеток в культуре образовывать примитивные и долговечные колонии клеток, но эти тесты не принимаются в качестве доказательства того, что клетка является стволовой клеткой с длительным сроком существования. Некоторые генетически измененные мыши могут получать трансплантированные человеческие HSC для проверки самообновления клеток и гематопоэтических возможностей в течение жизни мыши, но актуальность этого теста для клеток человека, которые могут жить десятилетиями, остается под вопросом. Сложность анализов HSC способствовала возникновению двух взаимоисключающих исследовательских проблем: окончательная идентификация HSC и обеспечение его размножения или увеличения его количества в чашке для культивирования.Более быстрый прогресс в исследованиях по характеристике и использованию HSC был бы возможен, если бы их можно было легко выращивать в лаборатории. И наоборот, прогресс в определении условий роста, подходящих для HSC, и в получении клеток для размножения был бы более быстрым, если бы ученые могли надежно и легко идентифицировать истинные HSC. Можно ли использовать клеточные маркеры для идентификации гемопоэтических стволовых клеток?У HSC есть проблема с идентификацией. Во-первых, редко встречаются те, которые обладают способностью к долгосрочному воспроизведению.Во-вторых, существует несколько типов стволовых клеток. И, в-третьих, стволовые клетки похожи на многие другие клетки крови или костного мозга. Итак, как исследователи находят желаемые популяции клеток? Самый распространенный подход — это маркеры, которые появляются на поверхности клеток. (Более подробное обсуждение см. В Приложении E.i. Маркеры: как исследователи используют их для идентификации стволовых клеток?) Это полезные, но не идеальные инструменты для исследовательской лаборатории. В 1988 году, пытаясь разработать надежные средства идентификации этих клеток, Ирвинг Вайсман и его сотрудники сосредоточили внимание на наборе белковых маркеров на поверхности клеток крови мышей, которые были связаны с повышенной вероятностью того, что эта клетка является долговременной. HSC [50].Четыре года спустя лаборатория предложила сопоставимый набор маркеров для стволовых клеток человека [3]. Вайсман предлагает маркеры, представленные в таблице 5.1, в качестве ближайших маркеров для HSC мыши и человека [62].
Такие клеточные маркеры могут быть помечены моноклональными антителами, несущими флуоресцентную метку, и выделены из костного мозга с помощью сортировки клеток с активацией флуоресценции (FACS). Группы клеток, отсортированные таким образом по поверхностным маркерам, неоднородны и включают некоторые клетки, которые являются истинными, долгосрочными самообновляющимися стволовыми клетками, некоторые более краткосрочные предшественники и некоторые не стволовые клетки.Группа Вайсмана показала, что всего пять генетически помеченных клеток, введенных вместе с большими дозами стволовых клеток смертельно облученным мышам, могут закрепиться и произвести помеченные донорские клетки во всех линиях клеток крови на протяжении всей жизни мыши. Одна меченая клетка могла продуцировать все клоны в течение целых семи недель, и 30 очищенных клеток было достаточно для спасения мышей и полного репопуляции костного мозга без дополнительных доз резервных клеток для спасения мышей [49]. Несмотря на эти усилия, исследователи по-прежнему расходятся во мнениях относительно наиболее стабильно экспрессируемого набора маркеров HSC [27, 32].Конни Ивз из Университета Британской Колумбии говорит, что ни один из маркеров не привязан к уникальным функциям стволовых клеток или действительно определяет стволовые клетки [14]. «Практически все известные мне маркеры непостоянны», — говорит она. Совсем недавно Дайан Краузе и ее коллеги из Йельского университета, Нью-Йоркского университета и Университета Джона Хопкинса использовали новую технику, чтобы сосредоточиться на одной клетке, способной воссоздать все клоны клеток крови облученной мыши [27]. После маркировки клеток костного мозга мышей-доноров нетоксичным красителем они вводили клетки самкам мышей-реципиентов, получивших смертельную дозу радиации.В течение следующих двух дней некоторые из инъецированных клеток мигрировали или попали в костный мозг реципиентов и не делились; при трансплантации второй группе облученных самок мышей в конечном итоге оказалось, что они представляют собой концентрированный пул самообновляющихся стволовых клеток. Клетки также восстановили производство крови. По оценкам ученых, их метод сконцентрировал стволовые клетки длительного хранения в 500–1000 раз по сравнению с костным мозгом. Каковы источники гемопоэтических стволовых клеток?Костный мозгКлассическим источником гемопоэтических стволовых клеток (ГСК) является костный мозг.Более 40 лет врачи выполняли трансплантацию костного мозга, обезболивая донора стволовых клеток, прокалывая кость — обычно бедренную кость — и извлекая клетки костного мозга с помощью шприца. Примерно 1 из 100 000 клеток в костном мозге представляет собой стволовую кроветворную стволовую клетку с длительным сроком существования; другие присутствующие клетки включают стромальные клетки, стромальные стволовые клетки, клетки-предшественники крови, а также зрелые и созревающие лейкоциты и эритроциты. Периферическая кровьКак источник HSC для лечения, извлечение костного мозга непосредственно из кости быстро уходит в прошлое.Для клинической трансплантации HSC человека врачи теперь предпочитают собирать донорские клетки из периферической циркулирующей крови. В течение десятилетий было известно, что небольшое количество стволовых клеток и клеток-предшественников циркулирует в кровотоке, но за последние 10 лет исследователи обнаружили, что они могут заставить клетки мигрировать из костного мозга в кровь в больших количествах, вводя донору цитокин, такой как фактор, стимулирующий колонии гранулоцитов (GCSF). Донору вводят GCSF за несколько дней до сбора клеток.Чтобы собрать клетки, врачи вставляют внутривенную трубку в вену донора и пропускают его кровь через систему фильтрации, которая вытягивает лейкоциты CD34 + и возвращает эритроциты донору. Из собранных клеток от 5 до 20 процентов будут истинными HSC. Таким образом, когда исследователи-медики обычно ссылаются на «стволовые клетки», собираемые периферией, это что-то вроде неправильного названия. Как и в случае костного мозга, клетки CD34 + представляют собой смесь стволовых клеток, клеток-предшественников и лейкоцитов разной степени зрелости. За последние три года большинство аутологичных (где донор и реципиент — одно и то же лицо) и аллогенных (где донор и реципиент — разные люди) трансплантатов «костного мозга» на самом деле представляли собой лейкоциты, взятые из периферического кровообращения, а не Костный мозг. Ричард Чайлдс, внутренний исследователь в NIH, говорит, что периферический сбор клеток легче для донора — с минимальной болью, без анестезии и без госпитализации — но также дает лучшие клетки для трансплантации [6].Чайлдс указывает на доказательства того, что пациенты, получающие клетки, полученные из периферических клеток, имеют более высокие показатели выживаемости, чем реципиенты костного мозга. Клетки, собранные с периферии, содержат в два раза больше HSC, чем стволовые клетки, взятые из костного мозга, и приживаются быстрее. Это означает, что пациенты могут восстанавливать лейкоциты, тромбоциты, а также их иммунную защиту и защиту от свертывания крови на несколько дней быстрее, чем при трансплантации костного мозга. Ученые из Стэнфорда сообщают, что высокоочищенные мобилизованные периферические клетки, которые имеют поверхностные маркеры CD34 + и Thy-1 + , приживаются быстро и без осложнений у пациентов с раком груди, получающих аутологичную трансплантацию клеток после интенсивной химиотерапии [41]. Пуповинная кровьВ конце 1980-х — начале 1990-х годов врачи начали осознавать, что кровь из пуповины и плаценты человека является богатым источником HSC. Эта ткань поддерживает развивающийся плод во время беременности, рождается вместе с ребенком и обычно выбрасывается. С момента первой успешной трансплантации пуповинной крови детям с анемией Фанкони сбор и терапевтическое использование этих клеток быстро расширились. Программа плацентарной крови Нью-Йоркского центра крови, поддерживаемая NIH, является крупнейшим U.S. общественный банк пуповинной крови, и в настоящее время имеется 13 000 донорских средств, доступных для трансплантации маленьким пациентам, нуждающимся в HSC. С момента начала сбора пуповинной крови в 1992 году центр предоставил пациентам тысячи единиц пуповинной крови. Реципиенты пуповинной крови — обычно дети — в настоящее время живут более восьми лет, полагаясь на HSC после трансплантации пуповинной крови [31, 57]. В настоящее время проводится значительное количество исследований пуповинной крови для поиска способов увеличения количества HSC и сравнения биологических свойств пуповинной крови со стволовыми клетками костного мозга взрослых.Были предположения, что пуповинная кровь содержит стволовые клетки, которые обладают способностью к развитию клеток нескольких зародышевых листков (мультипотентные) или даже всех зародышевых листков, например энтодермы, эктодермы и мезодермы (плюрипотентные). На сегодняшний день нет опубликованных научных доказательств, подтверждающих это утверждение. Хотя пуповинная кровь представляет собой ценный ресурс для HSC, данные исследований не окончательно показали качественные различия в дифференцированных клетках, продуцируемых между этим источником HSC и периферической кровью и костным мозгом. Система кроветворения плодаВажным источником HSC в исследованиях, но не в клиническом использовании, являются развивающиеся кроветворные ткани эмбриональных животных. Кроветворные клетки появляются на ранних стадиях развития всех позвоночных. Наиболее широко изучаемая на мышах продукция HSC волнообразно распространяется через развивающийся эмбрион и плод. Начиная примерно с 7-го дня жизни эмбриона мыши, о самой ранней гемопоэтической активности свидетельствует появление кровяных островков в желточном мешке (см. Приложение A.Ранняя разработка). Это оспаривается, но некоторые ученые утверждают, что производство крови из желточного мешка является временным и будет генерировать некоторые клетки крови для эмбриона, но, вероятно, не большую часть HSCs для взрослого животного [12, 26, 44]. Согласно этому предложенному сценарию, большинство стволовых клеток, которые будут обнаружены в костном мозге и кровообращении взрослого человека, происходят из клеток, которые появляются несколько позже и в другом месте. Эта другая волна продукции гемопоэтических стволовых клеток происходит в AGM — области, где начинают развиваться аорта, гонады и почки плода (мезонефрос).Клетки, которые дают начало HSC в AGM, также могут давать начало эндотелиальным клеткам, выстилающим кровеносные сосуды. [13]. Эти HSCs возникают примерно на 10-11 день у эмбриона мыши (4-6 недель у человека), делятся и в течение нескольких дней мигрируют в печень [11]. HSC в печени продолжают делиться и мигрировать, распространяясь на селезенку, тимус и — примерно во время рождения — в костный мозг. В то время как все больше исследований HSC плода проводится на мышах и других животных, информации о HSC плода и эмбриона человека гораздо меньше.Европейские ученые, в том числе Куломбель, По и его коллеги, впервые описали гематопоэтических предшественников в человеческих эмбрионах всего несколько лет назад [20, 53]. Совсем недавно Галлахер и другие сообщили об обнаружении HSC, циркулирующих в крови абортированных плодов человека на сроке от 12 до 18 недель [16, 28, 54], которые были богаты HSC. Эти циркулирующие клетки имели другие маркеры, чем клетки из печени плода, костного мозга плода или пуповинной крови. Эмбриональные стволовые клетки и эмбриональные зародышевые клеткиВ 1985 году было показано, что из эмбриональных стволовых клеток мыши можно получить предшественники многих различных клеток крови [9].Перкинс смог получить все основные клоны клеток-предшественников из эмбриоидных телец мыши, даже без добавления гемопоэтических факторов роста [45]. Эмбриональные стволовые клетки мыши в культуре при правильных факторах роста могут генерировать большинство, если не все, различные типы клеток крови [19], но никто еще не достиг «золотого стандарта» доказательства того, что они могут производить в долгосрочной перспективе. HSC из этих источников, а именно путем получения клеток, которые можно трансплантировать смертельно облученным мышам для восстановления долговременного гемопоэза [32]. Картина для эмбриональных стволовых и половых клеток человека еще менее ясна. Ученые из лаборатории Джеймса Томсона сообщили в 1999 году, что им удалось направить человеческие эмбриональные стволовые клетки, которые теперь можно культивировать в лаборатории, на производство клеток-предшественников крови [23]. Израильские ученые сообщили, что они заставили человеческие ES-клетки производить кроветворные клетки, о чем свидетельствует их производство белка крови, гамма-глобина [21]. Клеточные линии, полученные из зародышевых эмбриональных клеток человека (культивируемые клетки, полученные первоначально из клеток эмбриона, которые в конечном итоге дадут начало яйцеклетке или сперматозоиду), которые культивируются при определенных условиях, будут продуцировать клетки CD34 + [47].Клетки, продуцирующие кровь, полученные из человеческих ES и клеток эмбрионального зародыша (EG), не были тщательно проверены на долгосрочное самообновление или способность давать начало всем различным клеткам крови. Какими бы отрывочными ни были данные о кроветворной способности ES- и EG-клеток человека, эксперты по крови заинтригованы их клиническим потенциалом и их способностью ответить на основные вопросы по обновлению и дифференцировке HSCs [19]. Конни Ивз, которая провела сравнение HSC из печени плода, пуповинной крови и взрослого костного мозга, ожидает, что клетки, полученные из эмбриональных тканей, будут иметь некоторые интересные особенности.Она говорит, что активно делящиеся кроветворные клетки из культуры ES-клеток — если они похожи на другие делящиеся клетки — сами по себе не приживутся или не спасут кроветворение у животного, костный мозг которого был разрушен. Однако они могут сыграть решающую роль в создании большого количества HSC, выращенных в лаборатории. Есть признаки того, что делящиеся клетки также легче поддаются генным манипуляциям, чем взрослые HSC. Eaves ожидает, что HSCs, происходящие из источников ранних эмбрионов, будут с точки зрения развития более «пластичными», чем более поздние HSCs, и более способными к самообновлению [14]. Чем отличаются ГСК из разных источников?Ученые в лаборатории и клинике начинают измерять различия между HSC из разных источников. В целом, они обнаружили, что HSC, взятые из тканей на более ранних стадиях развития, обладают большей способностью к самовоспроизведению, демонстрируют различные хоминг и поверхностные характеристики и с меньшей вероятностью отторгаются иммунной системой, что делает их потенциально более полезными для терапевтической трансплантации. . Популяции стволовых клеток костного мозга,00Когда HSC перемещаются из ранних участков развивающегося плода в свой взрослый «дом» в костном мозге? Европейские ученые обнаружили, что относительное количество клеток CD34 + в коллекциях пуповинной крови снижалось с возрастом беременности, но экспрессия молекул клеточной адгезии на этих клетках увеличивалась. Авторы полагают, что эти изменения отражают подготовку клеток к перемещению — от хоминга в печени плода к хомингу в костном мозге [52]. Дело в том, является спорным, но документ Чен и др. предоставляет доказательства того, что по крайней мере у некоторых линий мышей HSC от старых мышей менее способны к репопуляции костного мозга после трансплантации, чем клетки от молодых взрослых мышей [5]. Клетки эмбриональных мышей на 50–100 процентов лучше репопуляции костного мозга, чем клетки молодых взрослых мышей. Специфический потенциал репопуляции костного мозга, по-видимому, зависит от штамма, но ученые обнаружили, что этот потенциал снижается с возрастом для обоих штаммов.Другие ученые не обнаруживают уменьшения, а иногда и увеличения количества HSC с возрастом [51]. Из-за сложности идентификации стволовых клеток с длительным сроком существования остается трудным количественно оценить изменения в количестве HSC с возрастом человека. Эффективность трансплантации взрослых стволовых клеток пуповинной крови по сравнению со стволовыми клетками пуповинной кровиПрактическое и важное различие между HSC, полученными от взрослых доноров, и из пуповинной крови просто количественное. Врачи редко могут извлечь более нескольких миллионов HSC из плаценты и пуповины — слишком мало, чтобы использовать их в трансплантате для взрослого, который в идеале получил бы от 7 до 10 миллионов клеток CD34 + на килограмм веса тела, но часто подходит для трансплантата ребенку [33, 48]. Леонард Зон говорит, что HSC из пуповинной крови с меньшей вероятностью вызовут осложнение трансплантации, называемое болезнью «трансплантат против хозяина», при которой лейкоциты донора атакуют ткани реципиента [65]. В недавнем обзоре трансплантации пуповинной крови Лафлин приводит доказательства того, что пуповинная кровь вызывает меньшую реакцию «трансплантат против хозяина» [31]. Лафлин пишет, что еще предстоит определить, действительно ли HSC пуповинной крови живут дольше у реципиента трансплантата. В лабораторных тестах и тестах на мышах, сравнивающих клетки CD34 + из пуповины человека с клетками CD34 + , полученными из костного мозга взрослых, исследователи обнаружили, что пуповинная кровь обладает большей способностью к пролиферации [24]. Белые кровяные тельца из пуповинной крови лучше приживались в мышиной модели, которая была генетически изменена, чтобы переносить человеческие клетки, чем их взрослые аналоги. Эффективность трансплантации периферических стволовых клеток костного мозга по сравнению со стволовыми клетками костного мозгаПомимо того, что их гораздо легче собирать, белые кровяные тельца, полученные периферическими методами, имеют и другие преимущества перед костным мозгом.В обзоре Катлера и Антина говорится, что периферически собранные клетки приживаются быстрее, но с большей вероятностью вызывают реакцию «трансплантат против хозяина» [8]. В поисках наиболее восприимчивых HSC для генной терапии Орлик и его коллеги обнаружили, что мышиные HSC, мобилизованные с помощью цитокинов, с большей вероятностью захватывают гены вирусного вектора, чем немобилизованные HSC костного мозга [43]. Что делают гемопоэтические стволовые клетки и какие факторы участвуют в этой деятельности?Как указывалось ранее, HSC в костном мозге имеет четыре действия в своем репертуаре: 1) он может обновляться, 2) он может дифференцироваться, 3) он может мобилизоваться из костного мозга в кровообращение (или наоборот), или 4 ) он может подвергнуться запрограммированной гибели клеток или апоптозу.Понимание того, как, когда, где, что и почему из этого простого репертуара позволит исследователям манипулировать и использовать HSC для восстановления тканей и органов. Самообновление гемопоэтических стволовых клетокУченым приходилось нелегко в попытках выращивать — или даже поддерживать — настоящие стволовые клетки в культуре. Это важная цель, поскольку культуры HSC, которые могут сохранять свои характерные свойства самообновления и отсутствия дифференцировки, могут обеспечивать неограниченный источник клеток для терапевтической трансплантации и исследования.Когда костный мозг или клетки крови наблюдаются в культуре, часто наблюдается значительное увеличение количества клеток. Обычно это отражает увеличение дифференцировки клеток в клетки-предшественники, которые могут давать начало различным линиям клеток крови, но не могут обновляться. Истинные стволовые клетки медленно делятся и замещаются в костном мозге взрослого человека. Новые инструменты для анализа экспрессии генов теперь позволят ученым изучать изменения активности теломеразы и теломер в процессе развития.Теломеры — это участки ДНК, расположенные на концах хромосом, которые удлиняются ферментом теломеразой. Теломеразная активность необходима для пролиферации клеток, и с возрастом активность снижается, что приводит к укорочению теломер. Ученые предполагают, что снижение обновления стволовых клеток будет связано с уменьшением длины теломер и активности теломеразы. Активность теломеразы в гемопоэтических клетках связана с потенциалом самообновления [40]. Поскольку самообновляющиеся разделения редки, их трудно вызвать в культуре и трудно доказать, у ученых нет окончательного ответа на животрепещущий вопрос: что ставит — или, возможно, удерживает — HSC в режиме самообновляющегося разделения? HSC, введенные пациенту или мыши с анемией, или той, чьи HSC были подавлены или убиты, будут возвращаться в костный мозг и подвергаться активному делению, чтобы пополнить все различные типы клеток крови и дать дополнительные самообновляющиеся HSC.Но как именно это происходит, остается загадкой, которую ученые пытаются решить, манипулируя культурами HSC в лаборатории. Два недавних примера прогресса в исследованиях культивирования HSCs мышей представлены Ema и соавторами и Audet с коллегами [2, 15]. Ema et al. обнаружили, что два цитокина — фактор стволовых клеток и тромбопоэтин — эффективно индуцировали неравное первое деление клеток, при котором одна дочерняя клетка давала начало репопуляции клеток с потенциалом самообновления.Audet et al. обнаружили, что активация сигнальной молекулы gp130 имеет решающее значение для выживания и пролиферации мышиных HSCs в культуре. Работа со специфическими цитокинами и сигнальными молекулами основывается на нескольких более ранних исследованиях, демонстрирующих умеренное увеличение количества стволовых клеток, которые можно на короткое время индуцировать в культуре. Например, Ван Зант и его коллеги использовали культивирование с непрерывной перфузией и биореакторы в попытке увеличить количество HSC человека в отдельных образцах пуповинной крови, инкубированных в течение одной-двух недель [58].Они получили 20-кратное увеличение «клеток, инициирующих длительную культуру». Больше подсказок о том, как увеличить количество стволовых клеток, можно получить, глядя на других животных и на разных стадиях развития. На ранних стадиях развития — например, в печени плода — HSCs могут подвергаться более активному клеточному делению, чтобы увеличить их количество, но в более позднем возрасте они делятся гораздо реже [30, 42]. Выращивая HSC из 10- и 11-дневных эмбрионов мыши, Элейн Дзержак из Университета Эразмус в Нидерландах обнаружила, что она может получить 15-кратное увеличение HSC в течение первых 2 или 3 дней после удаления AGM из эмбрионов [38 ].Дзержак признает, что это резко отличается от всего, что наблюдается со взрослыми стволовыми клетками, и предполагает, что это различие имеет практическое значение. Она подозревает, что это увеличение является не столько реакцией на то, что происходит в культуре, но, скорее, представляет собой импульс развития этой специфической эмбриональной ткани. То есть это неизбежное следствие делений, вызванных конкретным эмбриональным микроокружением. Через пять дней количество HSCs находится на плато и может сохраняться до месяца.Дзежак говорит, что ключ к пониманию того, как взрослые HSCs могут быть расширены и манипулировать ими для клинических целей, очень хорошо может быть найден путем определения клеточного состава и сложных молекулярных сигналов в области AGM во время развития [13]. В другом подходе Lemischka и соавторы смогли поддерживать мышиные HSC в течение четырех-семи недель, когда они выращивались на клональной линии клеток (AFT024), происходящей из стромы, другого основного клеточного компонента костного мозга [39].Никто не знает, какие именно факторы, секретируемые стромальными клетками, поддерживают стволовые клетки. Он говорит, что продолжающееся клонирование генов быстро сводится к новым молекулам из стромальных клеток, которые могут «разговаривать» со стволовыми клетками и убеждать их оставаться стволовыми клетками, то есть продолжать делиться, а не дифференцироваться. Если стромальные факторы являются ключом к самообновлению стволовых клеток, исследование поддержания стромальных клеток может быть важным предварительным условием. В 1999 году исследователи из Osiris Therapeutics и Университета Джона Хопкинса сообщили о культивировании и увеличении количества мезенхимальных стволовых клеток, которые производят стромальную среду [46].В то время как культивируемые HSC стремятся дифференцироваться и не могут сохранить примитивные, самообновляющиеся клетки, количество мезенхимальных стволовых клеток может быть увеличено, и они все еще сохраняют свою способность генерировать полный репертуар потомков. Дифференциация HSC на компоненты крови и иммунной системыПроизводство дифференцированных лейкоцитов и эритроцитов — настоящая работа HSC и клеток-предшественников. M.C. Макки подсчитал, что в процессе производства зрелой циркулирующей кровяной клетки исходная гемопоэтическая стволовая клетка подвергнется от 17 до 19.5 делений, «что дает чистое усиление от ~ 170 000 до ~ 720 000» [35]. Посредством серии тщательных исследований культивируемых клеток — часто клеток с мутациями, обнаруживаемыми у больных лейкемией, или клеток, которые были генетически изменены, — исследователи обнаружили множество ключевых факторов роста и цитокинов, которые побуждают клетки-предшественники образовывать различные типы клеток крови. Эти факторы сложным образом взаимодействуют друг с другом, создавая систему точного генетического контроля и координации производства клеток крови. Миграция гемопоэтических стволовых клеток в костный мозг и ткани и из нихУченые знают, что большую часть времени HSC живут в тесной связи со стромой костного мозга у взрослых (см. Главу 4. Стволовые клетки взрослого). Но HSC также могут быть обнаружены в селезенке, в периферическом кровообращении и других тканях. Связь с промежутками костного мозга важна как для приживления трансплантированных клеток, так и для поддержания стволовых клеток как самообновляющейся популяции.Связь со стромой также важна для упорядоченной пролиферации, дифференцировки и созревания клеток крови [63]. Вайсман говорит, что HSCs, по-видимому, совершают короткие набеги из костного мозга в ткани, а затем ныряют в костный мозг [62]. В настоящее время ученые не понимают, почему и как HSC покидают костный мозг или возвращаются в него [59]. Ученые обнаружили, что HSC, которые были мобилизованы в периферическое кровообращение, в основном являются неделящимися клетками [64]. Они сообщают, что адгезионные молекулы на строме играют роль в мобилизации, прикреплении к строме и в передаче сигналов, которые регулируют самообновление HSC и дифференцировку предшественников [61]. Апоптоз и регуляция популяций гемопоэтических стволовых клетокКоличество клеток крови в костном мозге и крови регулируется генетическими и молекулярными механизмами. Как гемопоэтические стволовые клетки знают, когда прекратить размножаться? Апоптоз — это процесс запрограммированной гибели клеток, который приводит к самоуничтожению клеток, когда они не нужны или вредны. Если в организме слишком мало HSC, делится больше клеток и увеличивается их количество. Если бы животному вводили избыточные стволовые клетки, они просто не делились бы или подверглись апоптозу и были бы уничтожены [62].Избыточное количество стволовых клеток в трансплантате HSC на самом деле, кажется, увеличивает вероятность и скорость приживления, хотя, похоже, нет точной идентификации механизма для этого эмпирического наблюдения. Конкретные сигналы, запускающие апоптоз в HSC, пока неизвестны. Одним из возможных сигналов апоптоза может быть отсутствие сигналов жизнеобеспечения от стромы костного мозга. Майкл Ван и другие обнаружили, что когда они использовали антитела для нарушения адгезии HSC к строме через VLA-4 / VCAM-1, клетки были предрасположены к апоптозу [61]. Понимание сил, действующих в апоптозе HSC, важно для сохранения или увеличения их количества в культуре. Например, без факторов роста, поступающих в среду или через сыворотку или другие питающие слои клеток, HSC подвергаются апоптозу. Домен и Вайсман обнаружили, что стволовые клетки должны получать два сигнала фактора роста, чтобы продолжить жизнь и избежать апоптоза: один — через белок BCL-2, другой — из стального фактора, который сам по себе побуждает HSC производить клетки-предшественники, но не производить самообновление [10]. Каково клиническое применение гемопоэтических стволовых клеток?Лейкемия и лимфомаСреди первых клинических применений HSC было лечение рака крови — лейкемии и лимфомы, которые возникают в результате неконтролируемой пролиферации лейкоцитов. В этих приложениях собственные раковые кроветворные клетки пациента были уничтожены с помощью радиации или химиотерапии, затем заменены трансплантатом костного мозга или, как это делается сейчас, трансплантатом HSC, собранных из периферического кровообращения подходящего донора.Подходящим донором обычно является сестра или брат пациента, унаследовавшего аналогичные человеческие лейкоцитарные антигены (HLA) на поверхности своих клеток. Рак крови включает острый лимфобластный лейкоз, острый миелобластный лейкоз, хронический миелогенный лейкоз (ХМЛ), болезнь Ходжкина, множественную миелому и неходжкинскую лимфому. Томас и Клифт описывают историю лечения хронического миелоидного лейкоза по мере перехода от в значительной степени неэффективной химиотерапии к умеренно успешному использованию цитокина, интерферона, к трансплантатам костного мозга — сначала у однояйцевых близнецов, затем у братьев и сестер, соответствующих HLA [55]. .Хотя вскоре после трансплантации существовал значительный риск смерти пациента либо от инфекции, либо от болезни «трансплантат против хозяина», впервые многие пациенты пережили эту непосредственную проблему и имели время выживания, измеряемое годами или даже десятилетиями, а не месяцами. Авторы пишут: «За 20 лет трансплантация костного мозга способствовала превращению ХМЛ [хронического миелогенного лейкоза] из смертельного заболевания в заболевание, которое часто поддается лечению. В то же время, опыт, приобретенный в этой обстановке, улучшил наши понимание многих проблем, связанных с трансплантацией.Теперь ясно, что заболеваемость и смертность не являются неизбежными последствиями аллогенной трансплантации, [и] что аллогенный эффект может добавить антилейкемической силы схем кондиционирования… » В недавнем развитии исследователи CML продвинули свои знания о регуляции кроветворения на один шаг дальше. 10 мая 2001 г. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов одобрило Гливек ™ (мезилат иматиниба), новый рационально разработанный пероральный препарат для лечения ХМЛ. Новый препарат специально нацелен на мутантный белок, продуцируемый в раковых клетках ХМЛ, который саботирует клеточные сигналы, контролирующие упорядоченное деление клеток-предшественников.Подавляя этот белок, новый препарат отключает злокачественную гиперпродукцию лейкоцитов, поэтому врачам не нужно прибегать к трансплантации костного мозга. В настоящее время неизвестно, обеспечит ли новый препарат стойкую ремиссию или продлит жизнь пациентам с ХМЛ. Наследственные заболевания кровиЕще одно применение аллогенных трансплантатов костного мозга — лечение наследственных заболеваний крови, таких как различные типы наследственной анемии (неспособность продуцировать клетки крови) и врожденные нарушения обмена веществ (генетические нарушения, характеризующиеся дефектами ключевых ферментов, которые необходимы для выработки основного тела компоненты или разрушают химические побочные продукты).Заболевания крови включают апластическую анемию, бета-талассемию, синдром Блэкфана-Даймонда, лейкодистрофию глобоидных клеток, серповидно-клеточную анемию, тяжелый комбинированный иммунодефицит, Х-связанный лимфопролиферативный синдром и синдром Вискотта-Олдрича. Врожденные нарушения метаболизма, которые лечат с помощью трансплантации костного мозга, включают: синдром Хантера, синдром Гурлера, синдром Леша-Найхана и остеопетроз. Поскольку трансплантация костного мозга сопряжена со значительным риском смерти, обычно это крайняя мера лечения смертельных заболеваний. Спасение гемопоэтических стволовых клеток при химиотерапии ракаХимиотерапия, направленная на быстрое деление раковых клеток, неизбежно поражает другую цель — быстро делящиеся кроветворные клетки. Врачи могут сделать больным раком трансплантацию аутологичных стволовых клеток, чтобы заменить клетки, разрушенные химиотерапией. Они делают это, мобилизуя HSC и собирая их из периферической крови. Клетки сохраняются, пока пациент проходит интенсивную химиотерапию или лучевую терапию для уничтожения раковых клеток.После того, как лекарства вымываются из организма пациента, пациенту делают переливание его или ее сохраненных HSC. Поскольку пациенты получают обратно свои собственные клетки, нет никаких шансов на иммунное несоответствие или болезнь трансплантат против хозяина. Одна из проблем, связанных с использованием аутологичных трансплантатов HSC в терапии рака, заключалась в том, что раковые клетки иногда случайно собираются и повторно вводятся обратно пациенту вместе со стволовыми клетками. Одна группа исследователей обнаружила, что они могут предотвратить повторное внедрение раковых клеток, очищая клетки и сохраняя только те клетки, которые являются CD34 + , Thy-1 + [41]. Лечение рака «трансплантат против опухоли»Одно из самых захватывающих новых применений трансплантации HSC заставляет клетки работать, атакуя неизлечимые опухоли. Группа исследователей из программы интрамуральных исследований NIH недавно описала этот подход к лечению метастатического рака почки [7]. У чуть менее половины из 38 пациентов, прошедших курс лечения, опухоли уменьшились. Протокол исследования в настоящее время распространяется на лечение других солидных опухолей, которые не поддаются стандартной терапии, включая рак легких, простаты, яичников, толстой кишки, пищевода, печени и поджелудочной железы. Это экспериментальное лечение основано на трансплантации аллогенных стволовых клеток от HLA-совместимого брата или сестры, HSC которого собираются периферически. Собственная иммунная система пациента подавляется, но не разрушается полностью. Донорские клетки переливаются пациенту, и в течение следующих трех месяцев врачи внимательно следят за иммунными клетками пациента, используя дактилоскопию ДНК, чтобы следить за приживлением донорских клеток и повторным ростом собственных клеток крови пациента. Они также должны разумно подавлять иммунную систему пациента по мере необходимости, чтобы удерживать его / ее Т-клетки от атаки трансплантата и уменьшать реакцию «трансплантат против хозяина». Исследование Joshi et al. показывает, что пуповинная кровь и периферические HSC человека проявляют противоопухолевую активность в пробирке против лейкозных клеток и клеток рака груди [22]. Привитые к мышиной модели, которая переносит клетки человека, HSC атакуют лейкоз человека и клетки рака груди. Хотя в необработанной пуповинной крови отсутствуют естественные лимфоциты-киллеры (NK), способные убивать опухолевые клетки, исследователи обнаружили, что, по крайней мере, в пробирке и у мышей они могут значительно повысить активность и количество этих клеток с помощью цитокинов IL-15 [22, 34]. Другие применения гемопоэтических стволовых клетокВ настоящее время ведутся существенные фундаментальные и ограниченные клинические исследования по экспериментальному использованию HSC для лечения других заболеваний. Среди основных применений — аутоиммунные заболевания, такие как диабет, ревматоидный артрит и системная красная волчанка. Здесь иммунная система организма поворачивается к разрушению тканей тела. Проводятся экспериментальные подходы, аналогичные тем, которые использовались выше для лечения рака, чтобы увидеть, можно ли восстановить или перепрограммировать иммунную систему.Более подробное обсуждение этого приложения представлено в главе 6. Аутоиммунные заболевания и перспективы лечения на основе стволовых клеток. Использование HSC в качестве средства доставки генов для восстановления поврежденных клеток — еще одно исследуемое применение. Использование HSC для генной терапии подробно обсуждается в главе 11. Использование генетически модифицированных стволовых клеток в экспериментальной генной терапии. Пластичность гемопоэтических стволовых клетокНесколько недавних сообщений показывают, что ученые смогли заставить костный мозг или HSC дифференцироваться в другие типы тканей, такие как клетки мозга, мышц и печени.Эти концепции и экспериментальные данные, подтверждающие эту концепцию, обсуждаются в главе 4. Стволовая клетка взрослого человека. Исследования на мышиной модели показывают, что клетки из трансплантатов костного мозга или выбранных HSC могут быть домом для поврежденных скелетных и сердечных мышц или печени и регенерировать эти ткани [4, 29]. Одним из недавних достижений стало изучение мышечной дистрофии, генетического заболевания, которое возникает у молодых людей и приводит к прогрессирующей слабости скелетных мышц. Биттнер и его коллеги использовали мышей MDX, генетически модифицированных мышей с дефектами мышечных клеток, аналогичными дефектам мышечной дистрофии человека.Костный мозг мышей-самцов, не являющихся самцами mdx, трансплантировали самкам мышей mdx с хроническим повреждением мышц; Через 70 дней исследователи обнаружили, что ядра самцов поселились в клетках скелетных и сердечных мышц. Демонстрация Lagasse с коллегами восстановления печени очищенными HSC также является обнадеживающим признаком того, что HSC могут иметь потенциал для интеграции и роста в некоторых тканях, не связанных с кровью. Эти ученые смертельно облучили самок мышей, у которых было необычное генетическое заболевание печени, которое можно было остановить с помощью лекарства.Мышам сделали трансплантаты генетически маркированных очищенных HSC от мышей-самцов, у которых не было заболевания печени. Трансплантатам дали возможность прижиться в течение нескольких месяцев, пока мыши принимали лекарство, защищающее печень. Затем лекарство было удалено, что привело к ухудшению состояния печени и испытанию, чтобы увидеть, будут ли задействованы клетки из трансплантата и спасут ли печень. Ученые обнаружили, что трансплантация всего 50 клеток приводит к обильному росту заметных донорских клеток печени у самок мышей. Недавно Краузе показал на мышах, что одна выбранная донорская гемопоэтическая стволовая клетка может делать больше, чем просто повторно заселять костный мозг и гематопоэтическую систему реципиента [27]. Эти исследователи также обнаружили эпителиальные клетки, полученные от доноров, в легких, кишечнике и коже мышей-реципиентов. Это говорит о том, что HSC могли расти в других тканях в ответ на инфекцию или повреждение от облучения, которое получили мыши. У людей наблюдения за мужскими клетками печени у пациентов женского пола, получивших трансплантаты костного мозга от мужчин, и у пациентов мужского пола, которым была проведена трансплантация печени от доноров женского пола, также предполагают возможность того, что некоторые клетки костного мозга обладают способностью интегрироваться в печень и образуют гепатоциты [1]. Каковы препятствия на пути разработки новых и улучшенных методов лечения с использованием гемопоэтических стволовых клеток?Увеличение количества гемопоэтических стволовых клетокКлинические исследователи сталкиваются с той же фундаментальной проблемой, что и базовые исследователи, — ограниченная способность к росту и увеличению количества HSC человека. Клиницисты неоднократно видели, что большее количество клеток в трансплантатах стволовых клеток имеет больше шансов на выживание у пациента, чем меньшее количество клеток.Ограниченное количество клеток, доступных при трансплантации плаценты и пуповинной крови, в настоящее время означает, что банки пуповинной крови полезны для детей, но не для взрослых пациентов. Исследователи полагают, что основной причиной неспособности HSC приживаться является болезнь «хозяин против трансплантата», а более крупные трансплантаты позволяют по крайней мере некоторым донорским клеткам избежать первоначальных волн атаки со стороны остаточной или подавленной иммунной системы пациента [6]. Способность увеличивать количество человеческих HSC in vivo или in vitro , несомненно, станет огромным стимулом для всех текущих и будущих медицинских применений трансплантации HSC. Как только стволовые клетки и их потомство можно будет размножить в культуре, генные терапевты и эксперты по крови смогут объединить свои таланты для выращивания неограниченного количества стволовых клеток «универсальных доноров», а также предшественников и определенных типов красных и белых кровяных телец. Если бы клетки были сконструированы так, чтобы не содержать маркеров, вызывающих отторжение, их можно было бы перелить любому реципиенту для лечения любого из заболеваний, которые сейчас лечатся костным мозгом, периферической, пуповинной или другой переливаемой кровью.Если генная терапия и исследования пластичности HSCs будут успешными, клетки также можно будет выращивать для восстановления других тканей и лечения нарушений, не связанных с кровью [32]. Несколько исследовательских групп в США, Канаде и за рубежом пытались найти ключевой фактор или факторы для увеличения производства HSC. Типичные подходы включают сравнение генов, экспрессируемых в примитивных HSC, с клетками-предшественниками; сравнение генов активно делящихся HSC плода с HSC взрослых; генетический скрининг гематопоэтических мутировавших рыбок данио; изучение генов с нарушенной регуляцией в раковых кроветворных клетках; анализ факторов стромы или фидерного слоя, которые, по-видимому, усиливают деление HSC; и анализ факторов, способствующих хождению и прикреплению к строме.Многообещающие факторы-кандидаты были опробованы по отдельности и в комбинации, и исследователи утверждают, что теперь они могут увеличить количество стволовых клеток с длительным сроком существования в 20 раз, хотя и ненадолго, в культуре. Специфические анализы, которые используют исследователи, чтобы доказать, что их увеличившиеся клетки являются стволовыми, различаются, что затрудняет сравнение утверждений различных исследовательских групп. На сегодняшний день существует лишь небольшая возможность расширять истинные, долгосрочные, самообновляющиеся человеческие HSCs. Однако легче увеличить количество клеток-предшественников.Kobari et al., Например, могут увеличивать количество клеток-предшественников для гранулоцитов и макрофагов в 278 раз в культуре [25]. Некоторые исследователи сейчас оценивают, является ли такое сравнительно небольшое увеличение количества HSC клинически полезным. В настоящее время увеличение количества клеток не является устойчивым в течение периодов, превышающих несколько месяцев, и выход слишком низок для массового производства. Кроме того, полученные клетки часто не характеризуются строго. Остается множество других вопросов — от того, насколько хорошо размноженные клетки могут быть изменены для генной терапии, до их потенциальной продолжительности жизни, иммуногенности, способности правильно жить дома и восприимчивости к раковой трансформации.Glimm et al. [17] подчеркивают некоторые из этих проблем, например, своим подтверждением того, что человеческие стволовые клетки теряют способность повторно заселять костный мозг по мере того, как они входят и продвигаются по клеточному циклу, как мышиные стволовые клетки, которые были стимулированы к делению, теряют свою трансплантационную способность [18]. ]. Наблюдения за обратной зависимостью между скоростью деления клеток-предшественников и продолжительностью жизни у линий мышей вызывают дополнительную озабоченность тем, что уловки культивирования или отбор клеток, которые быстро расширяются, могут обречь клетки на короткую жизнь. С прагматической точки зрения некоторые ученые говорят, что, возможно, нет необходимости в возможности вызвать истинное долгосрочное разделение HSC в лаборатории. Если они могут манипулировать предшественниками и уговаривать их делиться по команде, поглощать гены и дифференцироваться в ключевые клетки крови и другие ткани, этого может быть достаточно для достижения клинических целей. Этого может быть достаточно для усиления HSC или субпопуляций гемопоэтических клеток в организме путем химического воздействия на костный мозг для доставки пока еще неуловимых факторов для омоложения деления клеток. Перехитрить иммунную систему при атаках хозяина, трансплантата и патогеновВ настоящее время риски трансплантации костного мозга — отторжение трансплантата, болезнь «хозяин против трансплантата» и инфекция в период до того, как HSC прижились и возобновили полноценное производство клеток крови, — ограничивают их использование пациентами с серьезными или смертельными заболеваниями. Аллогенные трансплантаты должны поступать от доноров, которые по HLA близки пациенту (см. Главу 6. Аутоиммунные заболевания и перспективы лечения на основе стволовых клеток).Если бы врачи могли точно манипулировать иммунными реакциями и защищать пациентов от патогенов до того, как их трансплантаты начнут функционировать, трансплантаты HSC можно было бы распространить на менее больных пациентов и пациентов, для которых соответствие HLA было не таким близким, как должно быть сейчас. Врачи могут безнаказанно использовать трансплантаты при генной терапии, аутоиммунных заболеваниях, лечении ВИЧ / СПИДа и предварительной подготовке пациентов к пересадке крупного органа. Ученые сосредоточили внимание на субпопуляциях Т-клеток, которые могут вызывать или подавлять потенциально смертельное отторжение хозяина против трансплантата и болезнь трансплантат против хозяина у реципиентов аллогенных трансплантатов.Т-клетки в трансплантате — это палка о двух концах. Они борются с инфекциями и помогают закрепиться трансплантату, но они также могут вызывать болезнь трансплантат против хозяина. Выявление субпопуляций Т-клеток, ответственных за вредные и полезные эффекты — в трансплантате, но также и в остаточных клетках, выживших или возвращающихся в хозяине, — может позволить клиницистам сделать трансплантаты более безопасными и усилить эффекты трансплантата против опухоли [48]. Понимание представления антигенов иммунной системе и здоровых и нездоровых реакций иммунной системы на эти антигены, а также созревание и запрограммированная гибель Т-клеток имеет решающее значение. Подход исследователей из Стэнфорда — очистка периферической крови — также может помочь устранить клетки, вызывающие болезнь трансплантат против хозяина. Трансплантаты на мышиных моделях подтверждают идею о том, что очищенные HSC, очищенные от зрелых лимфоцитов, легко приживаются и предотвращают реакцию «трансплантат против хозяина» [60]. Знание ключевых клеточных участников аутоиммунных заболеваний, иммунной трансплантации и отторжения трансплантата также может позволить ученым разработать более мягкие «минитрансплантаты».«Вместо того, чтобы стирать и заменять всю гематопоэтическую систему пациента, они могли бы заменить только неисправные компоненты набором клеток, специально адаптированных к потребностям пациента. В настоящее время клиницисты экспериментируют с удалением Т-клеток из трансплантатов при некоторых заболеваниях, например, таким образом, уменьшение реакции «трансплантат против хозяина». Исследователи также экспериментируют с возможностью вывести из строя иммунную систему пациента, но не вырубить ее.Сублетального удара по кроветворным клеткам пациента перед аллогенной трансплантацией может быть достаточно, чтобы дать трансплантату возможность поселиться в костном мозге. Клетки заменяют некоторые или все исходные стволовые клетки пациента, часто превращая их кровь в смесь донорских и исходных клеток. Для некоторых пациентов этого набора клеток будет достаточно для достижения целей лечения, но без того, чтобы подвергнуть их серьезным побочным эффектам и опасностям инфицирования самых мощных препаратов, используемых для полного разрушения их кроветворных систем [37]. Понимание дифференцирующей среды и пластичности развитияВ какой-то момент эмбрионального развития все клетки пластичны или достаточно гибки в процессе развития, чтобы превращаться в различные ткани. Что именно в клетке или эмбриональной среде заставляет клетки расти в один орган, а не в другой? Может ли быть эмбриологическая подоплека кажущейся пластичности взрослых клеток? Исследователи предположили, что многие ткани, которые демонстрируют пластичность, прилегают друг к другу после гаструляции в листе мезодермальной ткани, которая будет формировать кровь — мышцы, кровеносные сосуды, почки, мезенхима и хорда.Пластичность может отражать происхождение из мезодермы, а не быть фиксированным признаком гемопоэтических клеток. Одна лаборатория сейчас изучает соседство эмбриональных клеток и то, как развивающийся эмбрион принимает решение создать одну ткань вместо другой, а также является ли это решение обратимым [65]. In vivo исследования пластичности костного мозга или очищенных стволовых клеток, вводимых мышам, находятся в зачаточном состоянии. Даже если последующие исследования подтверждают и более точно характеризуют и количественно определяют потенциал пластичности HSC у мышей, нет никакой гарантии, что это произойдет или может быть индуцировано у людей. РезюмеОснованное на полувековых исследованиях, изучение гемопоэтических стволовых клеток сегодня является одной из самых захватывающих и быстро развивающихся дисциплин в биомедицине. Революционные открытия как в лаборатории, так и в клинике резко расширили использование и поставку жизненно важных стволовых клеток. Тем не менее, еще более многообещающие применения находятся на горизонте, и нынешняя неспособность ученых вырастить HSC вне тела может задержать или помешать прогрессу в этих новых методах лечения.Новые методы лечения включают терапию «трансплантат против опухоли» при неизлечимых в настоящее время формах рака, аутологичные трансплантаты при аутоиммунных заболеваниях, а также генную терапию и восстановление тканей для множества других проблем. Техники, клетки и знания, которыми сейчас обладают исследователи, недостаточны для полной реализации перспектив терапии на основе HSC. Ключевые проблемы для раскрытия потенциала гемопоэтических стволовых клеток будут заключаться в поиске способов безопасного и эффективного увеличения количества трансплантируемых человеческих HSC in vitro, или in vivo. Также будет важно лучше понять основы того, как работают иммунные клетки — в борьбе с инфекциями, вызывая отторжение трансплантата и при реакции «трансплантат против хозяина», а также овладеть основами дифференцировки HSC. Сопутствующие достижения в методах генной терапии и понимание клеточной пластичности могут сделать HSC одним из самых мощных инструментов для лечения. Список литературы
Глава 4 | Содержание | Глава 6 Историческое содержание: 17 июня 2001 г. | ||||||||||||||||||
Геномная и функциональная целостность кроветворной системы требует толерантности к окислительным повреждениям ДНК | Кровь
Истирание тканей во время старения связано с накоплением окислительных и других эндогенных повреждений ДНК в ядерном геноме долговременных стволовых клеток и клеток-предшественников. 5,17,18 Однако точный характер этих повреждений, их биологическое воздействие, механистическая основа их цитотоксичности и пути, участвующие в плейотропных ответах на эти повреждения, в значительной степени остаются неизученными. 3 Влияние АФК на геномную целостность долгоживущих HSC сдерживается гипоксической средой (ниша стволовых клеток) и состоянием метаболического покоя, в котором используется гликолиз, а не окислительное дыхание. 37,43,44 Это говорит о том, что воздействие АФК на HSC отрицательно влияет на их функцию.В самом деле, стареющие HSCs обнаруживают ответы на повреждение ДНК, хотя существуют разногласия относительно природы лежащих в основе повреждений и индуцируются ли повреждения во время покоя 45 или во время пролиферации. 46 В последнее время ассоциированный со старением распад HSCs приписывают стрессу репликации, возникающему в результате снижения экспрессии минихромосомной поддерживающей геликазы. 47,48 Здесь мы используем мышей Rev1 , чтобы продемонстрировать, что репликационный стресс при искажающих спираль окислительных повреждениях ДНК в ядерном геноме связан с функциональным и геномным истощением кроветворной системы (рисунки 1, 3 и 5; дополнительные Рисунок 4).Гемопоэтические фенотипы мышей Rev1 синергетически усугубляются, когда дополнительно нарушается ggNER (в результате нарушения Xpc ; Фигуры 2-4 и дополнительные Фигуры 2-5). Эти данные показывают, что ggNER и TLS совместно сохраняют геномную и функциональную целостность гематопоэтической системы посредством, соответственно, репарации эндогенных искажающих спираль повреждений ДНК и подавления репликационного стресса в этих повреждениях (Рисунок 6). Наблюдение за тем, что потеря HSC происходит во время онтогенеза и не зависит от тканевого контекста (как в пренатальной печени, так и в постнатальной кости), дополнительно подтверждает, что эти фенотипы являются клеточно-автономными.
Митохондриальная дисфункция вызывает истощение кроветворной системы, 49,50 и зависимая от повреждения геномной ДНК связь между ядром и митохондриями, приводящая к истощению митохондрий, связана с патологиями, связанными со старением. 38 , 51,52 Хотя Rev1 не обнаружен в митохондриях, 53 жизнеспособный Rev1Xpc и, в некоторой степени, также Rev1 клетки костного мозга развивают митохондриальную дисфункцию, что позволяет предположить, что стресс репликации ядер влияет на активность митохондрий.В печени Rev1 и культивируемых фибробластах митохондриальная дисфункция связана с повышенной активностью поли (АДФ) рибозо-полимеразы 1 (PARP1), возможно, при разрывах оцДНК. Это предположительно приводит к истощению субстрата PARP1 и важного митохондриального кофактора, NAD + (NBF, JA Durhuus, CE Regnell, M. Angleys, C. Desler, M. Hasan-Olive, A. Martin-Pardillos, AT-S ., K. Thomsen, M. Laauritzen, VA Bohr, NdW, Bergensen, LH, and LJR, представлены в августе 2017 г.).Похожий механизм вызывает митохондриальную дисфункцию в клетках с дефектом минорного, транскрипционно-связанного, подпути NER. 54 Мы предполагаем, что усиление стресса репликации генома, вызванное производством АФК дисфункциональными митохондриями, ускоряет коллапс кроветворной системы Rev1Xpc (рис. 6F). Тем не менее, прямые доказательства этой гипотезы отсутствуют, и мы не можем формально исключить, что дисфункция митохондрий отражает, а не является источником распада костного мозга Rev1Xpc .
Распад кроветворной системы мышей Rev1, и, в большей степени, Rev1Xpc может представлять собой резко ускоренное старение кроветворения. Гемопоэтические фенотипы мышей с единичным дефицитом Rev1 и , а также обнаружение того, что Xpc или Rev1 одиночные клетки с дефицитом — уже проявляют умеренную чувствительность к УФ-свету (дополнительный рисунок 2B), подчеркивают, что ggNER и TLS не могут либо восстанавливают, либо обходят, соответственно, все искажающие спираль нуклеотидные повреждения.Таким образом, мы предполагаем, что фенотипы костного мозга Rev1 и Rev1Xpc представляют собой обостренные фенотипы, которые вносят вклад в физиологическое функциональное истощение HSCs в стареющем костном мозге. 1,15 Кроме того, эндогенные альдегиды с небольшой цепью были идентифицированы как угроза целостности кроветворной системы. 55,56 Следовательно, несколько типов нереплицированных эндогенных повреждений ДНК параллельно могут участвовать в связанном со старением функциональном снижении кроветворной системы.Замены нуклеотидов и неэффективная репарация ДНК сильно коррелируют со старением, гематопоэтическими и другими злокачественными новообразованиями. 6,16,57-61 Поскольку Rev1-опосредованный TLS поврежденных нуклеотидов, включая нуклеотиды, аддуктирующие перекисное окисление липидов, является высоко мутагенным (рис. 5B 9 ), мы предполагаем, что накопление таких мутаций является платой за защита кроветворной системы от эндогенных искажающих спираль окислительных нуклеотидных повреждений с помощью склонного к ошибкам TLS.Наконец, будущие исследования могут также затронуть вопрос о том, сохраняется ли Rev1-опосредованный TLS и, возможно, обеспечивает ли механизм выживания лейкозных клеток и, следовательно, представляет собой потенциальную терапевтическую мишень.

 myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;
myelos костный мозг + ит; син.: костоеда — устар., паностит) — воспаление костного мозга, обычно распространяющееся на компактное и губчатое вещество кости и надкостницу;