Лабораторная диагностика заболеваний печени
Дата публикации: .
Врач лабораторной диагностики
(заведующий клинико-
диагностической лабораторией)
Лавицкая Т.В.
Печень играет важную роль в обмене белков, углеводов, липидов. Клетки печени метаболизируют, детоксицируют и экскретируют экзо — и эндогенные вещества. Важной функцией печени является синтез белков плазмы. В печени также синтезируется желчные кислоты, необходимые для переваривания и всасывания жиров. Гликолиз, цикл Кребса, синтез и распад аминокислот, реакции окислительного фосфорилирования – все эти процессы представлены в гепатоцитах, богатых митохондриями. В печени представлены 2 основных типа клеток: гепатоциты или паренхиматозные клетки, составляющие около 60% всей клеточной массы, и Купферовы клетки, входящие в состав ретикуло-эндотелиальной системы и составляющие 30% от всех клеток печени.
Функции печени
- Обмен углеводов.
- Обмен аминокислот и белков.
- Обмен липидов.
- Обмен желчных кислот.
- Конъюгация и детоксикация.
Лабораторные тесты диагностики заболеваний печени
Под тестами оценки функций печени обычно подразумеваются измерения компонентов крови, свидетельствующих о наличии и типе поражения печени. В повседневной клинической практике для этого используется определение уровня билирубина, активности ферментов (трансаминаз и щелочной фосфатазы) в образцах сыворотки. Определение концентрации сывороточного альбумина также может быть одним из показателей заболеваний печени. Эти биохимические определения могут помочь в дифференциации следующих состояний:
- Обструкция билиарного тракта.
- Острое гепатоцеллюлярное повреждение.
- Хронические заболевания печени.
Концентрация общего билирубина сыворотки и активность сывороточной фосфатазы свидетельствует о холестазе, блокаде оттока желчи.
Концентрация альбумина сыворотки является одним из существенных показателей синтетической способности печени, хотя на уровень альбумина влияют и многие другие факторы.
Клинические и биохимические синдромы
Болезни печени сопровождаются рядом лабораторных синдромов. При анализе результатов биохимического исследования у больных с заболеваниями печени целесообразно выделять четыре лабораторных синдрома, каждый из которых в известной степени соответствует определенным морфологическим и функциональным изменениям в органе: цитолитический синдром, мезенхимально-воспалительный синдром, холестатический синдром (синдомхолестаза), синдром малой печеночно-клеточной недостаточности, Обычно в каждом конкретном случае заболевания имеет место сочетание нескольких биохимических синдромов.
Синдром нарушения целостности гепатоцитов (синдром цитолиза или цитолитический синдром). Характеризуется повышением в плазме крови активности индикаторных ферментов – АсАТ (аспартатаминотрансферазы), АлАТ (аланинаминотрансферазы), ЛДГ (лактатдегидрогеназы) и ее изоферментов – ЛДГ4 и ЛДГ3; специфических печеночных ферментов: фруктозо-1-фосфатальдолазы, сорбитдегидрогеназы, а также концентрации ферритина, сывороточного железа, витамина В12 и билирубина главным образом за счет повышения прямой фракции.
В оценке степени выраженности патологического процесса основное значение придается активности АлАТ и АсАТ. Повышение их уровня в сыворотке крови менее чем в 5 раз по сравнению с верхней границей нормы рассматривается как умеренная, от 5 до 10 раз – как средняя степень и свыше 10 раз – как высокая степень выраженности.
Морфологической основой этого синдрома являются гидропическая и ацидофильная дистрофия и некроз гепатоцитов с повреждением и повышением проницаемости клеточных мембран.
Синдром холестаза (экскреторно-билиарный синдром, холестатический синдром – нарушение экскреторной функции печени). Сопровождается повышением уровня в сыворотке крови ЩФ (щелочная фосфатаза), ЛАП (лейцинаминопептидаза), ГГТФ, холестерина, Р-липопротеинов, конъюгированной фракции билирубина, желчных кислот, фосфолипидов, снижается экскреция бромсульфалеина (вофавердина) и радиофармакологических препаратов.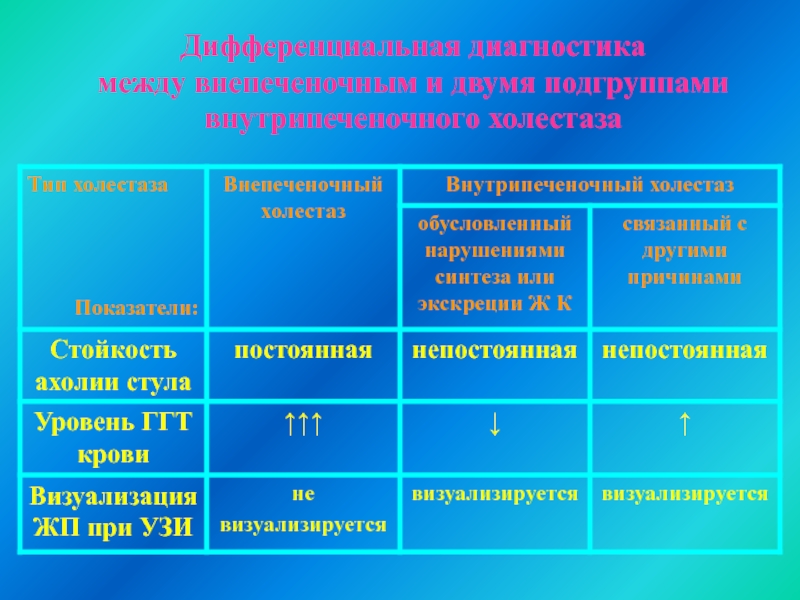 Морфологической основой внутриклеточного холестаза являются ультраструктурные изменения гепатоцита – гиперплазия гладкой цитоплазматической сети, изменения билиарного полюса гепатоцита, накопление компонентов желчи в гепатоците, которые нередко сочетаются с цитолизом гепатоцитов. При внутрипеченочномхолестазе выявляют накопление желчи в желчных ходах, а при внепеченочном – расширение междольковых желчных протоков.
Морфологической основой внутриклеточного холестаза являются ультраструктурные изменения гепатоцита – гиперплазия гладкой цитоплазматической сети, изменения билиарного полюса гепатоцита, накопление компонентов желчи в гепатоците, которые нередко сочетаются с цитолизом гепатоцитов. При внутрипеченочномхолестазе выявляют накопление желчи в желчных ходах, а при внепеченочном – расширение междольковых желчных протоков.
Синдром печеночно-клеточной недостаточности (синдром синтетической недостаточности). Проявляется уменьшением содержания в сыворотке крови общего белка и особенно альбумина, трансферрина, холестерина, II, V, VII факторов свертывания крови, холинэстеразы, альфа-липопротеинов, но в то же время повышением билирубина за счет неконъюгированной фракции. Морфологическим субстратом синдрома являются выраженные дистрофические изменения гепатоцитов и/или значительное уменьшение функционирующей паренхимы печени вследствие ее некротических изменений.
Нарушенная функция гепатоцитов может приводить к нарушению синтеза альбумина, что наблюдается при хронических заболеваниях печени. Наиболее выраженные гипоальбуминемии выявляются при портальном циррозе, жировой дистрофии печени.
Мезенхимально-воспалительный синдром. Характеризуется гипергамма-глобулинемией, повышением показателей белково-осадочных проб, увеличением СОЭ, появлением в крови продуктов деградации соединительной ткани (С-реактивный белок, серомукоид и др.). Наблюдаются изменения показателей клеточных и гуморальных иммунных реакций: появляются антитела к субклеточным фракциям гепатоцита, ревматоидный фактор, антимитохондриальные и антиядерные антитела, изменения количества и функциональной активности Т — и В-лимфоцитов, а также повышение уровня иммуноглобулинов.
При морфологических исследованиях печени характерна активация и пролиферация лимфоидных и ретикулогистиоцитарных клеток, усиление фиброгенеза, формирование активных септ с некрозами гепатоцитов, внутрипеченочная миграция лейкоцитов, васкулиты.
|
Синдром цитолиза (цитолитический синдром или синдром нарушения целостности гепатоцитов) |
↑ АсАТ, АлАТ, ЛДГ и ее изоферментов – ЛДГ4 и ЛДГ3, фруктозо-1-фосфатальдолазы, сорбит-дегидрогеназы, а концентрации ферритина, сывороточного железа, витамина В12 и билирубина за счет повышения прямой фракции |
|
Синдром холестаза (экскреторно-билиарный синдром, холестатический синдром |
↑ ЩФ, ЛАП, ГГТФ, холестерина, Р-липопротеинов, конъюгированной фракции билирубина, желчных кислот, фосфолипидов |
|
Синдром печеночно-клеточной недостаточности (синдром синтетической недостаточности) |
↓ общего белка (особенно альбумина), трансферрина, холестерина, II, V, VII факторов свертывания крови, холинэстеразы, альфа-липопротеинов ↑ билирубина за счет неконъюгированной фракции |
|
Мезенхимально-воспалительный синдром |
↑ СОЭ, появление в крови С-реактивного белка, ревматоидного фактора, антител к субклеточным фракциям гепатоцита, антимитохондриальных и антиядерных антител, изменение количества и функциональной активности Т — и В-лимфоцитов, повышение уровня иммуноглобулинов. |
Энзимодиагностика заболеваний печени
Печень продуцирует большое число ферментов, поступающих непосредственно в кровь. При поражениях печени количество одних ферментов в сыворотке крови понижается, а других – повышается.
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы.
Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль, например ферменты, участвующие в процессе свертывания крови (протромбиназа), холинэстераза. При поражении печени их синтез снижается, и активность этих ферментов падает.
При поражении печени их синтез снижается, и активность этих ферментов падает.
Индикаторные ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Одни из них находятся в цитозоле клеток (ЛДГ, АлАТ, АсАТ), другие – в митохондриях (ГДГ, АсАТ) и т. д.
При поражении печени ферменты из клеток вымываются в кровь, и активность их возрастает. Наибольшее диагностическое значение имеет определение активности АлАТ и АсАТ. Активность трансаминаз в сыворотке крови: АсАТ – 5-40 Е/л, АлАТ – 5-43 Е/л. При остром паренхиматозном гепатите АлАТ увеличивается в 20-30, а иногда в 100 раз и более. Несколько меньше повышается активность АсАТ.
Экскреторные ферменты синтезируются главным образом в печени (щелочная фосфатаза). В физиологических условиях эти ферменты в основном выделяются с желчью. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность их в плазме крови повышается.
Щелочная фосфатаза.
Увеличение активности щелочной фосфатазы (ЩФ) при заболеваниях печени является результатом увеличенного синтеза фермента клетками, расположенными в желчных канальцах, обычно в ответ на холестаз, который может быть интра — и внепеченочным. Холестаз, даже непродолжительный, приводит к увеличенной активности фермента, по крайней мере, вдвое превышающий нормальный уровень. Высокая активность ЩФ может также наблюдаться при инфильтративных заболеваниях печени (например, опухолях). Это также характерно для цирроза.
Печень не является единственным источником активности ЩФ. Умеренные количества ЩФ представлены в костях, тонком кишечнике, плаценте, почках.
Лактатдегидрогеназа.
Уровень ЛДГ часто возрастает при гепатоцеллюлярной дисфункции, хотя на практике определение активности этого фермента редко используют в диагностике заболеваний печени из-за низкой специфичности показателя (фермент широко распространен в организме).
γ-глутамилтранспептидаза.
γ-глутамилтранспептидаза (ГГТП) – это микросомальный фермент, широко представленный в тканях, особенно таких, как печень и почечные канальцы.
Активность γ-глутамилтранспептидазы в плазме резко повышается (иногда более, чем в 50 раз) при холестазе и является показателем печеночной недостаточности. Увеличение активности ГГТП наблюдается также у лиц, употребляющих алкоголь, даже в отсутствии явной патологии печени. При остром поражении печени изменение активности ГГТП параллельны изменениям активности трансаминаз.
Глутаматдегидрогеназа катализирует превращение глутаминовой кислоты в альфа-кетоглутаровую и аммиак; фермент сосредоточен в митохондриях клеток, преимущественно в гепатоцитах. Он также обнаружен в незначительном количестве в нервной ткани, скелетных мышцах, миокарде и молочной железе.
Глутаматдегидрогеназа — один из органоспецифических ферментов, определяется в сыворотке крови при заболеваниях печени.
Поскольку фермент является митохондриальным, то степень повышения его активности отражает глубину цитолиза при заболеваниях печени, по её уровню можно судить о тяжести патологического процесса.
Сорбитолдегидрогеназа – органоспецифический фермент печени, катализирующий обратимое превращение сорбитола во фруктозу с участием НАД в качестве кофермента. Фермент локализован в цитоплазме гепатоцитов. Сывороточная активность энзима повышается при вирусных гепатитах. Как правило повышение активности СДГ наблюдается в дожелтушный период вирусного гепатита, предшествует увеличению активности других (ферментов, отражающих поражение печени. Однако высокие цифры активности СДГ выявляются в разгар болезни, иными словами, тест уступает по чувствительности другим органоспецифический ферментам и определению активности аминотрансфераз. Кроме того, активность СДГ нормализуется быстрее, чем активность аминотрансфераз, что также является недостатком теста. Другие заболевания печени (токсические гепатиты, циррозы, гипоксические поражения печени) сопровождаются незначительным увеличением активности энзима.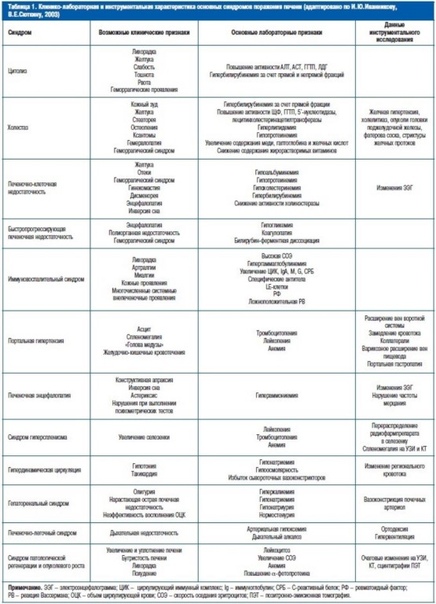
Внутрипеченочный холестаз при болезнях печени: от диагноза до лечения | #06/99
| При длительно существующем холестазе нарушается липидный обмен, в результате чего на коже образуются ксантомы и ксантелазмы |
Внутрипеченочный холестаз (ВХ) может развиваться на уровне гепатоцитов или внутрипеченочных желчных протоков. Соответственно этому выделяют ВХ, обусловленный поражением гепатоцитов и каналикул, и ВХ, связанный с поражением протоков.
Этиология и патогенез ВХ многообразны. Гепатоцеллюлярный и каналикулярный холестазы могут быть обусловлены вирусным, алкогольным, лекарственным, токсическим поражением печени, застойной сердечной недостаточностью, эндогенными метаболическими нарушениями (холестаз беременных, при муковисцидозе, при альфа-1-антитрипсиновой недостаточности и др.). Экстралобулярный (дуктулярный) холестаз характерен для первичного билиарного цирроза печени и первичного склерозирующего холангита, этиология которых неизвестна, а также для некоторых других заболеваний с известными причинами, например, для вторичного склерозирующего холангита.
При гепатоцеллюлярном и каналикулярном холестазах преимущественно поражаются транспортные системы мембран, а для экстралобулярного холестаза характерно повреждение эпителия желчных протоков. Для ВХ характерно поступление в кровь, а следовательно, и в ткани, различных компонентов желчи, преимущественно желчных кислот, и их дефицит или отсутствие в просвете двенадцатиперстной кишки и других отделах кишечника. При холестазе избыточная концентрация компонентов желчи в печени и тканях организма вызывает печеночные и системные патологические процессы, обусловливающие соответствующие клинические и лабораторные проявления болезни.
В основе формирования клинических симптомов лежат три фактора:
— избыточное поступление желчи в кровь и ткани;
— уменьшение количества или отсутствие желчи в кишечнике;
— воздействие компонентов желчи и ее токсических метаболитов на печеночные клетки и канальцы.
- Клиническая картина
Характерными симптомами холестаза, в том числе ВХ, являются: кожный зуд, желтуха, ксантомы, ксантелазмы, ахоличный стул, моча темно-коричневого цвета. Выраженность симптомов ВХ зависит от основного заболевания, нарушения экскреторной функции гепатоцитов и печеночно-клеточной недостаточности.
Кожный зуд обычно предшествует появлению желтухи.
При ВХ присоединяются симптомы, связанные с недостатком желчи в просвете кишечника и нарушением всасывания жиров (стеаторея, похудение, дефицит жирорастворимых витаминов).
При длительно существующем холестазе закономерно выявляются: дефицит витамина Д (оссалгии, проксимальная миопатия, остеопороз, иногда остеомаляция), витамина Е (мышечная слабость, мозжечковая атаксия), витамина К(геморрагический синдром, гипопротромбинемия), витамина А (“куриная слепота”, гиперкератоз кожи, ксерофтальмия, кератомаляция). При формировании билиарного цирроза печени присоединяются признаки билиарной гипертензии (упорный метеоризм, асцит, спленомегалия) и печеночно-клеточной недостаточности (потеря массы тела, атрофия мышц, гипоальбуминемия и др.). К характерным лабораторным признакам ВХ относят: увеличение в крови щелочной фосфатазы (ЩФ) и гамма-глютаминтранспептидазы (ГГТП) до трех и более норм, а также повышение в крови холестерина (свыше полутора норм), желчных кислот (до полутора норм и выше) и некоторых других маркеров (лейцинаминопептидазы и др.), имеющих определенное диагностическое значение.
Уровень трансаминаз обычно повышен, но, как правило, он ниже уровней ферментов холестаза и только при быстро прогрессирующем холестазе уровень АсАТ и АлАТ резко возрастает, особенно при внепеченочном обструктивном синдроме.
Важным, но необязательным лабораторным признаком ВХ является повышение уровня конъюгированного билирубина, холестерина и его производных.
К симптомам, связанным с задержкой липидов в организме, относят ксантомы на коже, во внутренних органах, в том числе на оболочках нервных стволов с проявлениями полинейропатии.
Прежде чем диагностировать болезни, при которых проявляются ВХ, необходимо исключить внепеченочный холестаз, который также может длительно протекать под маской ВХ.
Внепеченочный холестаз имеет следующие характерные признаки: надстенотическое расширение протоков, выявляемое на УЗИ, и блокада протоков (холедохолитиаз, стриктура и др.), выявляемая при эндоскопической ретроградной холангиографии (ЭРХГ).
| Внутрипеченочный холестаз (ВХ) характеризуется уменьшением тока желчи и ее поступления в двенадцатиперстную кишку при отсутствии механического повреждения и обструкции внепеченочного билиарного тракта. ВХ обусловлен либо нарушением механизмов образования и транспорта желчи на уровне гепатоцитов, либо повреждением внутрипеченочных протоков, либо их сочетанием |
ВХ на уровне гепатоцитов, каналикулов и даже экстралобулярных желчных протоков, по существу, клинически неразличимы, поскольку внутрипеченочный билиарный тракт представляет собой непрерывную систему, и поэтому любой патологический процесс на уровне печени, в том числе поражающий гепатоциты, может сопровождаться холестазом. Гепатоцеллюлярный холестаз развивается как при острых, так и при хронических гепатитах вирусной, алкогольной, лекарственной и токсической этиологии, при циррозе печени, а также при невоспалительных заболеваниях печени (амилоидоз, саркоидоз и др.).
- Исследования, подтверждающие ВХ
- ВХ при первичном билиарном циррозе (ПБЦ):
- Повышение уровня ЩФ до пяти и более норм. Печеночное происхождение ЩФ подтверждается одновременным повышением ГГТ, особенно в ранней стадии.
- Содержание АлАТ и АсАТ повышается в меньшей степени, чем ЩФ и ГГТП.
- Уровень сывороточного альбумина остается нормальным до развития поздней стадии цирроза печени.
- Высокий уровень антимитохондриальных антител М2.

- Закономерное увеличение Ig M и холестерина в сыворотке крови.
- Гистологическое исследование биоптата печени выявляет признаки холестаза. Септальный фиброз, гистиолимфоцитарные инфильтраты.
Пролиферация звездчатых ретикулоэндотелиоцитов и их трансформация в фибробласты.
- Первичный склерозирующий холангит:
- Лабораторные и клинические признаки холестаза.
- Отсутствие антимитохондриальных антител.
- УЗИ позволяет исключить другие признаки холестаза.
- При ЭРХГ — сужение внутрипеченочных протоков в виде “четок”.
- Ректосигмоскопия с прицельной биопсией из прямой кишки для установления возможной связи с язвенным колитом.
Таблица 1. Патогенетические подходы к медикаментозной терапии ВХ
| Механизмы холестаза | Этиология | Препараты первого выбора |
| Снижение проницаемости базолатеральной и/или каналикулярной мембраны | Алкогольные или лекарственные поражения печени, беременность | В основном гептал |
| Ингибирование K+-Na+-АТФазы и других мембранных переносчиков | Лекарственные поражения печени, бактериальные поражения печени | В основном гептал |
| Разрушение цитоскелета гепатоцитов, нарушение везикулярного транспорта компонентов желчи | Гепатиты вирусные, лекарственные, алкогольные, циррозы печени, бактериальные инфекции (холангиты), доброкачественный возвратный холестаз | В основном гептал (возможно, фенобарбитал) |
| Нарушение формирования мицелл желчи, обусловленное изменением состава желчных кислот | Болезни кишечника, обусловленные избыточным бактериальным ростом и дисбактериозом, парентеральное питание, синдром Целлвегера | Урсодезоксихолевая кислота (УДХК), рифампицин, фенобарбитал |
| Нарушение целостности каналикул (мембран, микрофиламентов, клеточных соединений) | Лекарства, оральные контрацептивы, бактериальные инфекции, болезнь Бейлера | Гептал |
| Нарушение целостности эпителия протоков и их проходимости | ПБЦ, ПСХ, вторичный склерозирующий холангит, состояние после пересадки печени, идеопатическая дуктопения, билиарная атрезия | УДХК или рифампицин в сочетании с гепталом |
- ВХ беременных:
- Лабораторные и клинические признаки холестаза (типичные отклонения от нормы).

- Клинический анализ крови: нейтрофильный лейкоцитоз, макроцитарная и гемолитическая анемия, увеличение СОЭ.
- Биохимические исследования: увеличение в крови амилазы и мочевой кислоты.
Независимо от этиологии и нозологии ВХ, постоянное присутствие в избыточном количестве желчи в гепатоцитах и каналикулах приводит к некрозу гепатоцитов и развитию печеночно-клеточной недостаточности. Если холестаз наблюдается в течение трех–пяти лет, то формируется цирроз печени с развитием асцита, отеков и печеночной энцефалопатии. Тяжесть и выраженность клинических симптомов и при ВХ чрезвычайно вариабельны. Но почти всегда процесс прогрессирует, если не устраняется причина, обусловившая его развитие, — например, лекарство, алкоголь, вирус, бактерии и т. д.
- Медикаментозное лечение
В лечении используются любые лекарственные средства, влияющие на этиологию и патогенез болезни, если это возможно; также предпринимаются попытки оказать медикаментозное влияние на отдельные симптомы, например, устранить дефицит витаминов, улучшить процессы пищеварения и всасывания и т. д. Однако у каждого конкретного больного надо применять только патогенетически обоснованную лекарственную терапию.
- Краткая характеристика некоторых препаратов, используемых при ВХ
1. Адеметионин-1,4-бутандисульфонат (S-адеметионин, гептал) — биологическое вещество, входящее в состав тканей и жидких сред организма и участвующее в реакциях трансметилирования. Обладает антидепрессивной и гепатопротективной активностью.
В течение двух-трех недель целесообразно применять ежедневно внутривенно или внутримышечно по 5-10 мл (400-800 мг), а в дальнейшем принимать внутрь по 400 мг (одна таблетка) два–четыре раза в день натощак.
Курс лечения. При остром ВХ полтора — два месяца, при хроническом — с учетом эффективности.
2. Урсодезоксихолевая кислота (УДХК) — обладает разносторонним позитивным действием на гепатобилиарную систему при ВХ и желчекаменной болезни. УДХК абсорбируется в прямой кишке. При систематическом приеме внутрь (10 мг/кг в сутки) она включается в энтерогепатическую циркуляцию, обеспечивая нормализацию желчеобразовательной и выделительной функций печени. Чаще применяется препарат урсофальк, назначаемый при ВХ внутрь по 250 мг два-три раза в день на длительный период. Возможно сочетание с гепталом.
3. Рифампицин (рифадин, рифарен и др.) — в основе его позитивного действия при ВХ лежит индукция микросомальных ферментов печени. Препарат вызывает ряд побочных эффектов (тошнота, рвота, диарея, головная боль и др.)
Эффект от применения препаратов, используемых при ВХ, как правило, больными оценивается по тому, как они влияют на зуд (его выраженность обычно уменьшается через несколько дней, но исчезает зуд лишь через один-два месяца от начала лечения. Врачами эффект оценивается, кроме того, по клиническим и лабораторным показателям (уровни ЩФ, ГГТП, холестерина и др.).
О патофизиологии холестаза
Как известно, желчь представляет собой изоосмотическую жидкость, состоящую из воды, электролитов, органических веществ (желчных кислот и солей, холестерина, коньюгированного билирубина, цитокинов, эйкозаноидов и других веществ) и металлов, в частности меди. Общее количество выделяемой печенью желчи в сутки составляет в среднем 600 мл. Основными же органическими компонентами желчи являются желчные кислоты, которые поступают из двух источников:
- первичные желчные кислоты (холевая и хенодезоксихолевая) синтезируются из холестерина в гепатоцитах;
- вторичные желчные кислоты (дезоксихолевая, литохолевая) образуются из первичных желчных кислот в кишечнике под действием бактерий, колонизирующих преимущественно начальные отделы толстого кишечника.
 В печени и кишечнике могут образовываться и третичные желчные кислоты (сульфолитохолевая, урсодезоксихолевая), которые, так же как и вторичные, участвуют в энтерогепатической циркуляции.
В печени и кишечнике могут образовываться и третичные желчные кислоты (сульфолитохолевая, урсодезоксихолевая), которые, так же как и вторичные, участвуют в энтерогепатической циркуляции.
Формирование желчи проходит в три этапа: 1) захват из крови ее компонентов на уровне базолатеральной мембраны; 2) метаболизм, а также синтез новых составляющих и их транспорт в цитоплазме гепатоцитов; 3) выделение их через каналикулярную (билиарную) мембрану в желчные каналикулы.
В физиологических условиях транспорт желчных кислот из плазмы в гепатоцит осуществляется благодаря наличию в составе базолатеральных мембран K+-Na+-АТФазы. Внутриклеточный транспорт желчных кислот от базолатеральной мембраны до каналикулярной мембраны гепатоцита осуществляется цитозольными протеинами.
Выделение компонентов желчи из цитоплазмы гепатоцитов в просвет каналикулов против градиента концентрации осуществляют АТФ-зависимые транспортные белки, которые синтезируются в гепатоцитах наряду со щелочной фосфатазой (ЩФ). В результате функционирования этих транспортных систем в каналикулы поступают желчные кислоты и их соли, а также ряд осмотически активных веществ (глютатион, бикарбонаты), обеспечивающих поступление воды в каналикулы по осмотическому градиенту из синусоидов. Ток желчи во всей системе протоков зависит от темпов образования желчи. Из каналикулов желчь через вставочные канальцы Геринга поступает в желчные протоки, которые, соединяясь между собой, образуют интралобулярные, а затем и общий желчный проток. Эпителий протоков секретирует бикарбонаты и воду, формируя тем самым окончательный состав желчи, поступающей по внепеченочному желчному протоку (холедоху) в двенадцатиперстную кишку.
Дифференциальная диагностика и этиопатогенетическое лечение синдрома холестаза у новорожденных детей
На правах рукописи
Иванова Айна Владимировна
ДИФФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА И ЭТИОПАТОГЕНЕТИЧЕСКОЕ ЛЕЧЕНИЕ СИНДРОМА ХОЛЕСТАЗА У НОВОРОЖДЕННЫХ ДЕТЕЙ.
14.00.09. — Педиатрия
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата медицинских наук.
Москва 1999 г.
Работа выполнена в Российском Государственном Медицинском Университете
Научный руководитель: Академик РАМН, доктор
медицинских наук, профессор В. А. Таболин Научный консультант:
Доктор медицинских наук, профессор Ю.Г. Мухина Официальные оппоненты:
Доктор медицинских наук, профессор М.С. Ефимов
Доктор медицинских наук, профессор Л.И. Ильенко
Ведущее учреждение: НИИ Педиатрии Научного центра здоровья детей РАМН.
Защита состоится «_» _1999 г. в _ часов на заседаю
Диссертационного совета Д 084.14.02 при Российском Государственно Медицинском Университете по адресу: 117513, г. Москва, ул. Островитянова, 1
С диссертацией можно ознакомиться в библиотеке университета.
Автореферат разослан «_»_1999 г.
Ученый секретарь Диссертационного совета
кандидат медицинских наук, доцент Л.В. Сапелкинг
АКТУАЛЬНОСТЬ ТЕМЫ.
Гепатология раннего возраста является одним из перспективных направлений современной педиатрии (Нисевич Н.И, Учайкин Ю.Ф, 1994 г, Соринсон С.Н, 1997.). В последние годы отмечается увеличение частоты развития холестаза в периоде новорожденности (Таболин В.А, 1996 г.). До недавнего времени большинство таких случаев расценивалось как проявление идиопатического неонатального гепатита. В начале 80 годов профессором F. Balistrery и соавторами было введено понятие физиологического холестаза новорожденных. Основной предпосылкой для развития холестаза в периоде новорожденности является более высокий уровень синтеза желчных кислот, превышающий в 50-80 раз таковой в более поздние возрастные периоды (Панченко А.И, 1979 г.), а также образование преимущественно атипичных желчных кислот, которые встречаются у взрослых только при развитии у них синдрома холестаза Наряду с усиленным синтезом желчи у новорожденных отмечается незрелость всех этапов печеночно-кишечной циркуляции желчных кислот и, прежде всего незрелость экскреторных механизмов. Все это предрасполагает к нарушению экскреторной функции гепатобилиарной системы в неонатальном периоде.
Все это предрасполагает к нарушению экскреторной функции гепатобилиарной системы в неонатальном периоде.
Синдром холестаза у новорожденных детей может быть как проявлением внутриутробного или постнатального поражения печени, так и осложнением тяжелой внепеченочной перинатальной патологии В последнем случае холестаз имеет транзиторный характер (Emmanuel Jacguemin, Panayotis, Lykavieris et al, 1998 г.).
В настоящее время отмечается тенденция к увеличению частоты транзиторного холестаза, что может быть связано с более широким использованием в неонатологии методов интенсивной терапии (Шабалов Н.П, 1996 г, Brown DC, Halliday HL, McClure G., 1991 г.). Вместе с тем, с каждым годом увеличивается перечень внутриутробных и постнатальных заболеваний гепатобилиарной системы, которые проявляются также
холестазом в периоде новорожденности (Bernard О., 1998 г.). Все эт затрудняет дифференциальный диагноз неонатального синдрома холестаза.
Последовательное исключение всех известных причин холестаза требует проведения большого количества лабораторных и инструментальных исследований и, следовательно, сопряжено со значительными временными и материальными затратами. В свою очередь прогноз многих заболеваний зависит от своевременности установления диагноза и сроков начала этиопатогенетического лечения (Подымова С.Д, 1993 г.). Все это является важной предпосылкой для создания алгоритма дифференциальной диагностики, позволяющего систематизировать многочисленные заболевания и уменьшить спектр диагностических исследований,, необходимых для установления диагноза.
Кроме того, остаются мало изученными вопросы этиологии, особенностей клинических и лабораторных проявлений транзиторного нарушения экскреторной функции гепатобилиарной системы в этом возрасте. ЦЕЛЬ РАБОТЫ.
Выявить клинико-лабораторные особенности транзиторного нарушения экскреторной функции гепатобилиарной системы и холестаза при различных заболеваниях у новорожденных и детей первых месяцев жизни, обосновать принципы этиопатогенетического лечения. ЗАДА ЧИ ИССЛЕДОВАНИЯ:
ЗАДА ЧИ ИССЛЕДОВАНИЯ:
1. Выявить клинико-лабораторные особенности транзиторного нарушения экскреторной функции гепатобилиарной системы и факторы, способствующие его развитию у новорожденных детей.
2. Определить клинико-лабораторные особенности холестаза у новорожденных детей с заболеваниями гепатобилиарной системы.
3. Разработать алгоритм дифференциальной диагностики заболеваний, сопровождающихся развитием синдрома холестаза в периоде новорожденности.
4. Оценить дифференциально диагностическое значение флуоресцентного метода определения общей и эффективной концентрации альбумина у новорожденных детей с различными нарушениями экскреторной функции печени.
5. Обосновать принципы этиопатогенетического лечения синдрома холестаза у детей первых месяцев жизни.
НА УЧНАЯ НОВИЗНА.
Впервые систематизированы факторы, способствующие развитию транзиторного синдрома холестаза у новорожденных детей.
Изучены клинико-лабораторные особенности транзиторного нарушения экскреторной функции гепатобилиарной системы и холестаза при различных заболеваниях.
Впервые выявлены кардинальные признаки и разработан алгоритм, позволяющий проводить дифференциальную диагностику синдрома холестаза у новорожденных и детей первых месяцев жизни.
Впервые продемонстрирована возможность использования флуоресцентного метода определения общей и эффективной концентрации альбумина сыворотки крови для дифференциальной диагностики между транзиторным нарушением экскреторной функции гепатобилиарной системы и холестазом при различных заболеваниях. ПРАКТИЧЕСКАЯ ЗНА ЧИМОСТЬ:
Установлена роль отдельных перинатальных патологических и ятрогенных факторов в формировании транзиторного синдрома холестаза.
Разработан алгоритм дифференциальной диагностики, позволяющий ограничить спектр диагностических исследований и в максимально короткие сроки установить диагноз.
Обсонована целесообразность использования общей и эффективной концентрации альбумина с целью определения тяжести нарушений функционального состояния печени и дифференциального диагноза между
транзиторным нарушением экскреторной функции гепатобилиарной системы и холестазом при различных заболеваниях. Уисточника, в том числе Л ¥ отечественных и .¿¿¡.¿иностранных. Текст диссертации изложен на ■/£ листах машинописного текста, иллюстрирован ЗО таблицами, // рисунками и схемой.
Уисточника, в том числе Л ¥ отечественных и .¿¿¡.¿иностранных. Текст диссертации изложен на ■/£ листах машинописного текста, иллюстрирован ЗО таблицами, // рисунками и схемой.
МЛ ТЕРН АЛЫ II МЕТОДЫ ИССЛЕДОВАНИЯ.
Обследование 114 новорожденных и детей первых месяцев жизни проводилось в период с сентября 1996 г. по март 1999 г. Исследование осуществлялось в условиях отделений: реанимации и патологии новорожденных ДКБ №13, а также отделения катамнеза КДЦ ДКБ № 13 им. Н.Ф. Филатова (главный врач — Г.И. Лукин).
Структура патологических состояний, проявляющихся синдромом холестаза у наблюдаемых нами детей представлена в таблице 1
Таблица 1.
Структура патологических состояний, проявляющихся синдромом
холестаза у наблюдаемых детей
ПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ: N
• Транзиторный синдром холестаза 78
• Инфекционный гепатит 12
• Атрезия внепеченочных желчных протоков 10
• Галактоземия 5
• Синдром Алажиля 3
• Киста общего желчного протока 2
• Болезнь Байлера 2
• Желчные пробки общего желчного протока 1
• Нарушение синтеза желчных кислот, вследствие ферментопатии 1
Всего: 114
Синдром холестаза устанавливался на основании следующих клинических и лабораторных показателей: желту хи с зеленоватым оттенком, увеличения размеров печени, ахолии сту ла, насыщенного или темного цвета мочи, увеличения прямой фракции билирубина, ферментов — ЩФ и у-ГТ, холестерина, р-ЛПД, желчных кислот, показателей липидного спектра сыворотки крови и кала. При УЗИ отмечалось увеличение размеров печени, повышение ее эхогенности, различных изменений со стороны желчного пузыря. С целью уточнения этиологического фактора проводилось
обследование больных на ТСЖСН-инфекции, включающее маркеры вирусного гепатита В и С, ИЛУ и ВИЧ, определение уровня галактозы и а-1-антитрипсина крови, спектр аминокислот крови и мочи, офтальмологическое исследование и консультация генетика. По показаниям осуществлялась биопсия печени, фиброгастродуоденоскопия с 25% липидограмма
По показаниям осуществлялась биопсия печени, фиброгастродуоденоскопия с 25% липидограмма
крови и кала, ЭХО-КГ, рентгенологическое исследование позвоночника. Объем проведенных исследований представлен в таблице 2.
Таблица 2.
Объем исследований, проведенных новорожденным и детям первых месяцев жизни с синдромом холестаза:
Методы исследования: N %
1. Сбор анамнеза. ‘ 114 100
2. Осмотр. 114 100
3. Биохимический анализ крови 114 100
4. Спектр желчных кислот сыворотки крови 40 35
5. Липидограмма крови и кала. 40 35
6. Обследование на ТОЯСН-инфекции, включающее HЪSAg, анти-НСУ, ИЛУ 114 100
7. Определение уровня а-1-ангигрипсина 50 44
8. Определение галактозы сыворотки крови 30 26
9. Аминокислотный спектр сыворотки крови и мочи. 20 18
10. Микроэкологическое исследование 83 73
11. УЗИ печени и желчевыводящих протоков 114 100
12. Фиброгастродуоденоскопия с 25% МйБ04 22 19
13. Рентгенологическое исследование позвоночника 11 10
14. ЭХО-КГ 55 48
15. Биопсия печени 14 12
16. Консультация генетика 114 100
17. Консультация Окулиста. 114 100
18. Определение общей и эффективной концентрации альбумина сыворотки крови. 60 53
При осмотре детей учитывались: динамика общего состояния, течения основного заболевания, клинические проявления холестаза и других
патологических синдромов, а также возрастные сроки их появления и разрешения, данные лабораторных и инструментальных методов исследования.
Помимо указанных в таблице лабораторно-инструменталъных исследований детям также проводился общий анализ крови, мочи, протромбиновый индекс, оценивалось кислотно-щелочное состояние, электролитный состав крови, ЭКГ, НСГ, R-графия грудной клетки. По показаниям — общий и микробиологический анализ ликвора и другие.
Определение содержания общей (ОКА) и эффективной (ЭКА) концентрации альбумина проводилось флюоресцентным методом с использованием флуоресцентного зонда К-35. На основании последних двух показателей рассчитывалась резервная способность альбумина (РСА = ЭКА/ОКА х 100%) и индекс токсичности (Т = ОКА/ЭКА — 1 ).
На основании последних двух показателей рассчитывалась резервная способность альбумина (РСА = ЭКА/ОКА х 100%) и индекс токсичности (Т = ОКА/ЭКА — 1 ).
Статистическая обработка полученных результатов проводилась методом вариационной статистики и корреляционно-регрессионного анализа на персональном IBM-совместимом компьютере при помощи программы Microsoft Excel 97 (Windows 98). Вычислялись средняя арифметическая (М), ошибка средней (ш), стандартное отклонение (sd), t-критерий Стьюдента при известном числе наблюдений (п), коэффициент корреляции г. РЕЗУЛЬ ТА ТЫ ИССЛЕДОВАНИЯ И ИХ ОБСУЖДЕНИЕ.
Первый этап работы был посвящен анализу клинико-анамнестических показателей, динамическому наблюдению и обследованию новорожденных детей с транзнторным нарушением экскреторной функции гепатобилиарной системы с целью выявления клинико-лабораторных особенностей транзиторного холестаза и факторов, способствующих его развитию.
Транзиторный характер нарушения экскреторной функции печени и желчевыводящих путей устанавлен 78 новорожденным детям путем исключения известных в настоящее время заболеваний, проявляющихся
холестазом. Ретроспективно у всех больных отмечался обратимый характер данных нарушений.
В клинической картине у этих больных преобладали: желтуха с зеленоватым оттенком, увеличение печени до 4-7 см (в среднем 4,2+1,1 см) из под края реберной дуги по срединно-ключичной линии, насыщенный или темный цвет мочи. Периодически возникающая ахолия стула выявлена у 39 пациентов (50%). Основные лабораторные показатели холестаза представлены в таблице 3.
Таблица 3.
Основные лабораторные показатели у детей с транзиторным холестазом.
Показатели: Результат: N . %
Прямой билирубин,% (норма-до 10) 52+21 78 100
ЩФ, Е/л (норма — до 150) 706,3+339 78 100
ИТ, Е/л (норма — до 250) 375+254 78 100
Холестерин, ммоль/л (норма 1,6-3,0) 6,4+3,3 64 83
Р-ЛПД, г/л (норма 1,5-3,5) 6,6+3,2 53 68
УЗИ печени и желчевыводящей системы проводилось 74 новорожденным (95%). Выявлено различной степени выраженности увеличение вертикального размера печени и повышение ее эхогенности. Желчный пузырь у всех больных визуализировался в типичном месте.
Выявлено различной степени выраженности увеличение вертикального размера печени и повышение ее эхогенности. Желчный пузырь у всех больных визуализировался в типичном месте.
На основании динамического наблюдения и комплексного обследования данной группы детей нами была выявлена тяжелая перинатальная патология и ряд ятрогенных факторов, отрицательно влияющих на организм плода и новорожденного в анте-, ингра- и неонатальном периодах (таблица 4).
Таблица 4.
Частота выявления перинатальной патологии и ятрогенных факторов у новорожденных детей с транзиторным холестазом в анте-, шпра- и неонатальном периодах
Факторы: Частота
1.Нарушение внутриутробного развития:
Внутриутробная гипотрофия 0,25
Недоношенность 0,69
2.Перинатальная патология:
Асфиксия 0,87
Гемолитическая анемия (в т.ч. Гемолитическая болезнь 0,84
новорожденных)
Бактериальные инфекции новорожденного 1,0
Гипербилирубинемия 1,0
Сердечно-сосудистая недостаточность 1,0
З.Ятрогенные факторы:
Заменное переливание крови 0,3
Повторные прямые переливания крови 0,12
Повторное переливание эритромассы 0,61
Антибактериальная терапия 1,0
Полное парентеральное питание 0,97
Катетеризация вены пуповины -Тромбофлебит пупочной вены 0,96 0,13
В нашем исследовании развитие транзиторного холестаза чаще отмечалось у недоношенных новорожденных, перенесших асфиксию. У всех детей отмечались бактериальные инфекции, гипербилирубинемия, сердечнососудистая недостаточность, у большинства — гемолитическая анемия. Среди ятрогенных факторов наибольшее значение имели повторные переливания препаратов крови, массивная антибактериальная терапия, полное парентеральное питание, катетеризация вены пуповины.
Нами выявлена зависимость степени выраженности и продолжительности холестаза от течения основных патологических состояний перинатального периода и действия ятрогенных факторов. Наблюдалось достоверно более длительное течение пневмонии.
Наблюдалось достоверно более длительное течение пневмонии.
гипребилирубинемии, сохранение симптомов сердечно-сосудистой недостаточности и тяжелого общего состояния у детей с достоверно более продолжительным синдромом холестаза (рисунок 1).
Рисунок 1.
Длительность тяжелого состояния и средняя продолжительность отдельных патологических состояний у детей 1 и 2 групп.
25-
20-
15-
10
5-
£|
1 Ш
I — ‘ЙП
Ш
II’
1
* <
1 €1
К (
ж®
|| |Г щ
Значительные различия также выявлены в суммарном количестве гемотрансфузий (эршроцитарной массы, заменного переливания крови и прямого переливания крови). Больным второй группы гемотрансфузии проводись чаще, чем детям 1 группы (р<0,01).
Была установлена сильная прямая корреляционная зависимость между длительностью холестаза и гестацнонным возрастом ребенка (г=+0,83;Р<0,05), а также отягощенным анамнезом матерей (г=+0,82;Р<0,05). Степень выраженности и длительность синдрома холестаза прямо зависела от тяжести и продолжительности основного заболевания (г=+0,9;Р<0.05). Длительность нарушений экскреторной функции гепатобилиарной системы
10
зависела от степени выраженности асфиксии (1=0,78;Р<0,05), анемии (г=+0,76;Р<0,05), длительности гипербилирубинемни (г=0,85;Р<0,05) и пневмонии (г=0,92;р<0,05), которая у большинства больных являлась основным клиническим диагнозом.
Также обнаружена зависимость степени выраженности холестаза от количества операций заменного переливания крови (г=0,83;Р<0,05), переливаний эритроцитарной массы (г=0,78;Р<0,05) и прямых переливаний крови (г=0,68;Р<0,05).
У всех больных установлена сильная прямая зависимость холестаза от длительности тяжелого общего состояния ребенка, которое в свою очередь можно считать суммарным показателем, отражающим сочетанное действие различных факторов анте-, интра- и постнатального периодов.
Полученные данные позволяют предположить, что формирование транзиторного холестаза является следствием сочетанного влияния различных факторов на организм плода и новорожденного в анте-, интра и постнаталыюм периодах. Особенностью транзиторного нарушения экскреторной функции гепатобилиарной системы является прямая его зависимость от степени выраженности и длительности основного заболевания, а также ятрогенных факторов.
Второй этап работы был посвящен анализу клинико-анамнестических показателей, динамическому наблюдению и обследованию 36 новорожденных и детей первых месяцев жизни с различными заболеваниями гепатобилиарной системы. Разрабатывался алгоритм дифференциальной диагностики заболеваний, сопровождающихся развитием синдрома холестаза.
Наблюдаемые нами дети разделены на 2 группы. В 1 группе пациентов диагностированы заболевания, проявляющиеся внепеченочным холестазом, во 2 группе — внутрипеченочным.
В клинической картине у больных 1 и 2 групп отмечалась желтуха, увеличение размеров печени до 3-7см, темная моча. Принципиальным различием между этими группами явилась стойкость ахолии стула. У больных 1 группы отмечался постоянно обесцвеченный стул, тогда как у детей 2 группы ахолия стула имела непостоянный характер.
При УЗИ у пациентов 1 группы желчный пузырь не визуализировался, тогда как у детей 2 группы желчный пузырь определялся в типичном месте.
Основные биохимические показатели холсстаза у детей 1 и 2 группы представлены в таблице 5.
Таблица 5.
Биохимические показатели синдрома холестаза у детей 1 и 2 группы.
Показатели 1 группа 2 группа
(п=13) (п=21)
Прямой билирубин, % (норма до 10%) 61+19 54+11
ГЦФ, Е/л (норма до 644) 2260+850 2048+1200
у-ГТ, Е/л (норма до 177) 1511+580* 708+207*
Холестерин, ммоль/л (норма 1,8-4,9) 11,2+6,8** 8,9+3,2**
Р-ЛПД, г/л (норма 1,4-4,5) 7,7+2,9 6,8+2,8
* -Р<0,01, ** — Р<0,05.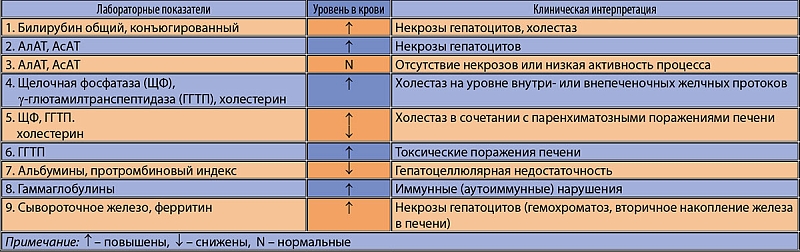
Как следует из результатов, представленных в таблице, у больных 1
группы выявлены достоверно более высокие значениями ГТТ и холестерина
сыворотки крови.
Вместе с тем, важно отметить, что у 3 пациентов 2 группы значения
ГТТ (30,6+10 Е/л) и холестерина (2,7+1,5 ммоль/л) оставались в пределах
нормы, тогда как другие клинические и лабораторные показатели были
повышены. Объяснением этого служат следующие литературные данные.
Фермент ГТТ является мембрана-связанным, локализующимся
преимущественно в эпителиальных клетках внутрипеченочных желчных
протоков (Prieto J, Rodes J, Shafritz D., 1992). Основным стимулом для его
выделения служат желчные кислоты и, следовательно, заболевания при
12
которых желчные кислоты не поступают во внутрипеченочную систему, не будут сопровождаться повышением уровня данного фермента. Таким образом, диссоциация между значениями 11 1 и другими маркерами холестаза может отражать нарушение синтеза желчных кислот или их экскреции через канальцевую мембрану гепатоцита.
Все вышеизложенное явилось основанием для выделения 3 больных с низкими значениями фермента ГТТ из 2 группы в отдельную подгрупп}’ -внутрипеченчного холестаза, обусловленного нарушением синтеза или экскреции желчных кислот. В свою очередь дети 2 группы, значения ГТТ у которых были повышенными, были отнесены к подгруппе пациентов с внутрипеченочным холестазом, не связанным с нарушениями синтеза или экскреции желчных кислот.
На основании анализа клинико-лабораторных и инструментальных показателей нами разработан алгоритм дифференциальной диагностики заболеваний, проявляющихся синдромом холестаза у новорожденных и детей первых месяцев жизни (приложение 1).
Начальный этап дифференциального диагноза (в приложении обозначен цифрой 1) включает оценку трех показателей: стойкости ахолии стула, уровня ГТТ сыворотки крови и визуализации желчного пузыря при УЗИ. Сочетание этих показателей позволяет определить групп}’ заболеваний и, следовательно, уменьшить объем исследований, необходимых для установления диагноза.
Сочетание этих показателей позволяет определить групп}’ заболеваний и, следовательно, уменьшить объем исследований, необходимых для установления диагноза.
На следующем этапе (в приложении обозначен цифрой 2) проводится дифференциальная диагностика между заболеваниями конкретной группы.
Для дифференциальной диагностики между заболеваниями, проявляющимися внепеченочным холестазом требуется УЗ-исследование, при котором наряду с отсутствием визуализации желчного пузыря могут быть выявлены изменения, характерные для кисты общего желчного протока,
желчнокаменной болезни, «желчных пробок» общего желчного протока и атрезии внепеченочных желчных протоков.
Дифференциальная диагностика между заболеваниями, проявляющимися внутрипеченочньш холестазом, обусловленным нарушениями синтеза или экскреции желчных кислот включает исследование спектра желчных кислот сыворотки крови и желчи. Значительное повышение, преимущественно первичных желчных кислот в сыворотке крови при их отсутствии или следовых концентрациях в желчи, свидетельствует о нарушении их экскреции. Следовые концентрации желчных кислот и в сыворотке крови и в желчи при повышении промежуточных продуктов их синтеза в сыворотке крови, отражают нарушение синтеза желчных кислот. Патологические изменения со стороны ЦНС и мочевыделительной системы, а также повышенное содержание длинноцепочечных (>Сг2) жирных кислот, играют решающую роль при пероксисомальной недостаточности и не встречаются при нарушении синтеза желчных кислот, вследствие ферменгопатий. Учитывая наследственный характер представленных заболеваний, их подтверждением могут быть также результаты молекулярно-генетического тестирования специфического локуса.
Большинство заболеваний, проявляющихся внутрипеченочньш холестазом, не связанным с нарушениями синтеза или экскреции желчных кислот имеет характерный симптомокомплекс, часто включающий сочетанное изменение со стороны нескольких органов и систем, играющий решающее значение в их диагностике. В свою очередь дополнительные методы исследования, необходимые для подтверждения диагноза, целесообразно проводить исходя из имеющихся клинических проявлений. Описание основных методов исследования, необходимых для подтверждения заболеваний данной группы представлены в диссертации.
В свою очередь дополнительные методы исследования, необходимые для подтверждения диагноза, целесообразно проводить исходя из имеющихся клинических проявлений. Описание основных методов исследования, необходимых для подтверждения заболеваний данной группы представлены в диссертации.
В случае выявления внутрипеченочного холестаза, не связанного с нарушениями синтеза или экскреции желчных кислот, у новорожденных детей следует иметь ввиду, что с высокой вероятностью это состояние может быть осложнением тяжелой перинатальной патологии и/или иметь ятрогенное происхождение
Учитывая недостаточную информативность рутинных лабораторных и клинических методов для постановки диагноза транзиторного холестаза на начальных этапах его развития, нами предпринята попытка использовать для этой цели флуоресцентный метод определения общей (ОКА) и эффективной (ЭКА) концентрации сывороточного альбумина. Проведена оценка дифференциально-диагностического значения ОКА и ЭКА, а также расчетных показателей — индекса токсичности (ИТ=ОКА/ЭКА-1) и резервной способности альбумина (РСА=ЭКА/ОКАхЮО%).
Выявлены достоверные различия между этими показателями у детей с транзиторным холестазом и холестазом, связанным с заболеваниями гепатобилиарной системы (рисунок 2).
Рисунок 2.
Показатели ОКА, ЭКА, РСА и ИТ у детей с транзиторным холестазом (1 группа) и заболеваниями гепатобилиарной системы (2 группа).
Полученные данные свидетельствуют о том, что флуоресцентный метод определения ОКА и ЭКА, может быть использован для проведения дифференциального диагноза между транзиторным холестазом и различными заболеваниями печени.
Исходя из накопленного нами опыта, были сформулированы основные принципы этиопатогенетического лечения больных с синдромом холестаза (таблиц 6).
Таблица 6.
Принципы этиопатогенетического лечения синдрома холестаза у новорожденных и детей первых месяцев жизни.
1. Тратиторный холестаз:
> Адекватное лечение основного заболевания,
> Исключение/или ограничение гепатотоксичных лекарств и препаратов крови
> Максимально раннее начало энтерального питания.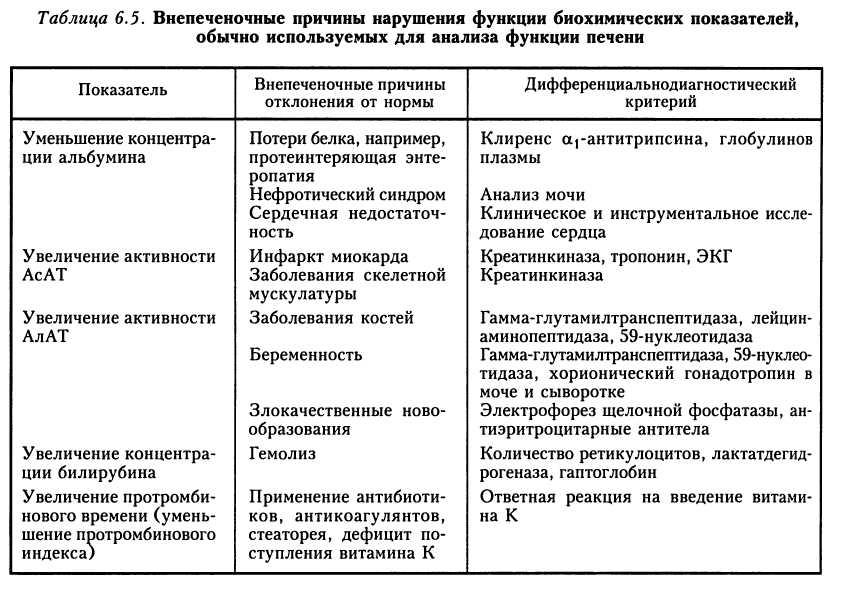
2. Внепеченочный холестаз:
> Оперативное лечение и, в том числе операция по Касаи.
3. Внутрипеченочный холестаз,
— обусловленный нарушениями синтеза или экскреции желчных кислот:
> Препараты первичных желчных кислот — холевой или хенодезоксихолевой при нарушении синтеза желчных кислот.
— не связанный с нарушениями синтеза или экскреции желчных кислот:
> Противоинфекционная терапия при выявлении инфекционного фактора
_с-
> Гормональная терапия при выявлении эндокринных нарушений
> Безгалактозная диета при галактоземии
Во всех случаях неэффективности консервативных и оперативных методов лечения показано проведение ортотопической трансплантации печени, которая за последние годы нашла широкое применение в различных странах мира. Родственная пересадка печени является высокоэффективным радикальным методом лечения таких больных.
Было также установлено, что вне зависимости от этиологического фактора, всем детям с длительно сохраняющимся синдромом холестаза, показано проведение симптоматической терапии, направленной на профилактику и лечение осложнений. Среди последних наиболее часто развивается синдром мальабсорбции, способствующий нарушению роста и
17
развития ребенка и состояния, связанные с дефицитом жирорастворимых витаминов. Основной причиной смерти таких больных служит желудочно-кишечное кровотечение, связанное с дефицитом витамина К. Однако его можно предотвратить путем назначения препарата витамина К (викасола).
Симптоматическое лечение включает ‘назначение диеты, богатой белком, содержащей коротко- и среднецепочечные триглицерыды, желчегонных препаратов, жирорастворимых витаминов (витамины А, Д, Е и К. По показанием применяются мочегонные (верошпирон, фуросемид) и препараты, уменьшающие кожный зуд (холестерамин, фенобарбитал, рифампицин).
Учитывая важность желчегонной терапии, нами проведено изучение эффективности препарата сернокислой магнезии у новорожденных детей с транзиторным нарушением экскреторной функции гепатобилиарной системы. Патофизиологической основой синдрома холестаза является изменение коллоидных свойств желчи, повышение ее вязкости и уменьшение текучести. Это в свою очередь является предпосылкой для назначения желчегонных препаратов. Среди последних, учитывая морфофункциональные особенности гепатобилиарной системы у новорожденных детей, целесообразно отдавать предпочтение холекинетикам. К этой группе относится препарат сернокислой магнезии, об эффективности которой существуют противоречивые данные. В процессе наблюдения за детьми выявлено, что у новорожденных, получавших препарат сернокислой магнезии клинико- лабораторные показатели синдрома холестаза купировались достоверно раныпе(Р=0,05).
Патофизиологической основой синдрома холестаза является изменение коллоидных свойств желчи, повышение ее вязкости и уменьшение текучести. Это в свою очередь является предпосылкой для назначения желчегонных препаратов. Среди последних, учитывая морфофункциональные особенности гепатобилиарной системы у новорожденных детей, целесообразно отдавать предпочтение холекинетикам. К этой группе относится препарат сернокислой магнезии, об эффективности которой существуют противоречивые данные. В процессе наблюдения за детьми выявлено, что у новорожденных, получавших препарат сернокислой магнезии клинико- лабораторные показатели синдрома холестаза купировались достоверно раныпе(Р=0,05).
У детей основной группы отмечалось значительно более быстрое уменьшение размеров печени, нормализация ЩФ, у-ГТ и холестерина по-сравнению с контрольной. Наряду с показателями холестаза, у пациентов основной группы было показано достоверно более раннее снижение уровня билирубина и более быстрая нормализация трансаминаз (рисунок 3).
PllCVHOK 3
Длительность повышения ЩФ, ГГТ, холестерина, билирубина, АЛТ и ACT у детей основной (1) и контрольной (2) групп.
ЩФ ГГТ холестерин билиоубин АЛТ ACT
Полученные данные свидетельствуют об эффективности препарата сернокислой магнезии и позволяют рекомендовать его использование у новорожденных детей с транзиторным нарушением экскреторной функции гепатобилиарной системы. Кроме того, данный препарат может быть использован и при других заболеваниях печени, проявляющихся холестазом. Исключение составляет атрезия внепеченочных желчных протоков, при которой прием любых желчегонных препаратов противопоказан.
ВЫВОДЫ:
1. У новорожденных и детей первых месяцев жизни синдром холестаза может быть следствием как внутриутробного или постнатального поражения печени, так и отражать транзиторное нарушение гепатобилиарной системы.
2. Развитие транзиторного синдрома холестаза отмечается на фоне различных заболеваний перинатального периода и является следствием одновременного действия ряда патологических и ятрогенных факторов
анте-, интра- и постнатального периодов. Транзиторный холесгаз имссг прямую зависимость от степени выраженности и длительности основного заболевания, а также действия ятрогенных факторов.
Транзиторный холесгаз имссг прямую зависимость от степени выраженности и длительности основного заболевания, а также действия ятрогенных факторов.
3. Критериями заболеваний, проявляющихся внепеченочным холестазом служат постоянная ахолия стула, повышение уровня ГТТ сыворотки крови и отсутствие визуализации желчного пузыря при ультразвуковом исследовании.
4. Клинико- лабораторными критериями заболеваний, проявляющихся внутрипеченочным холестазом, обусловленным нарушениями синтеза или экскреции желчных кислот является непостоянная ахолия стула, низкий уровень ГТТ сыворотки крови и визуализация желчного пузыря при ультразвуковом исследовании.
5. Клинико-лабораторными критериями заболеваний, проявляющихся внутрипеченочным холестазом, не связанным с нарушениями синтеза или экскреции желчных кислот является непостоянная ахолия стула, повышение уровня ГТТ сыворотки крови и визуализация желчного пузыря при ультразвуковом исследовании.
6. Общая концентрация альбумина (ОКА), эффективная концентрация альбумина (ЭКА), а также их производные — резервная способность альбумина (РСА) и индекс токсичности (ИТ) могут быть использованы для проведения дифференциального диагноза между транзиторным холестазом и различными заболеваниями печени.
7. Терапия транзиторного холестаза включает адекватное лечение основного заболевания, максимально раннее начало энтерального питания, исключение/или ограничение гепатотоксичных лекарств и препаратов крови. Важным компонентом терапии служит лечебная диета, богатая белком, содержащая коротко- и среднецепочечные жирные кислоты, использование сернокислой магнезии и жирорастворимых витаминов.
ПРАКТИЧЕСКИЕ РЕКОМЕНДАЦИИ.
1. Выявление анте-, интра- и постнатальных факторов, способствующих нарушена экскреторной функции гепатобилиарной системы, зависимость этого нарушения от тяжести и продолжительности основного заболевания, позволяют предположить возможность развития синдрома холестаза, транзиторного характера.
2. Алгоритм дифференциальной диагностики заболеваний, сопровождающихся развитием синдрома холестаза у новорожденных и детей первых месяцев, включает 2 этапа. Первым принципиальным этапом, с которого целесообразно начинать обследование больного, служит оценка сочетания 3 показателей: стойкости ахолии стула, уровня 111 сыворотки крови и визуализации желчного пузыря при УЗИ.
3. При проведении дифференциального диагноза между транзиторным холестазом и заболеваниями печени, проявляющимися внутрипеченочным холестазом, не связанным с нарушениями синтеза или экскреции желчных кислот, следует использовать показатели ОКА и ЭКА, определенные флуоресцентным методом.
4. У новорожденных детей с синдромом холестаза следует начинать проведение энтерального питания в максимально ранние сроки, исключать/или ограничивать прием гепатотоксичных лекарств и препаратов крови.
5. Больным с транзиторным холестазом, а также с заболеваниями печени, сопровождающимися внутрипеченочным холестазом показано назначение 5% сернокислой магнезии в дозе 5 мл х 2-3 раза в день.
СПИСОК ОПУБЛИКОВАННЫХ РАБОТ ПО ТЕМЕ ДИССЕРТАЦИИ:
1. Дифференциальная диагностика заболеваний печени, проявляющихся внутрипеченочным холестазом у детей раннего возраста. // Российский журнал Гастроентерологии, гепатологии, Колонопроктологии №5, том. 8, стр. 188. Материалы IV Российской Гастроентерологической Недели, 1420 ноября 1998 г., Москва, (соавт. Добрецов Г.Е., Грызунов Ю.А, Мухина Ю.Г, Дегтярев Д.Н).
2. Дифференциальный диагноз наследственных заболеваний гепатобилиарной системы, сопровождающихся синдромом холестаза у новорожденных и детей раннего возраста. II Материалы конференции «Актуальные проблемы диагностики, лечения и профилактики наследственных заболеваний у детей». Москва 1998, стр. 60. (соавт. Таболин В.А, Мухина Ю.Г, Дегтярев Д.Н, Лукина Л.И).
3. Диагностическое и прогностическое значение показателей ОКА и ЭКА у новорожденных детей с синдромом холестаза. // Книга 2 «Альбумин сыворотки крови в клинической медицине» под редакцией Ю.А. Грызунова, Г.Е. Добрецова «ГЭОТАР» Москва 1998, стр. 328-333. (соавт. Мухина Ю.Г, Дегтярев Д.Н).
// Книга 2 «Альбумин сыворотки крови в клинической медицине» под редакцией Ю.А. Грызунова, Г.Е. Добрецова «ГЭОТАР» Москва 1998, стр. 328-333. (соавт. Мухина Ю.Г, Дегтярев Д.Н).
4. Двадцать один случай тяжелого холестаза у новорожденных, не связанного с врожденными аномалиями желчевыводащих путей и вирусным гепатитом. Сборник. Нижний Новгород, 1997 г. (соавт. В.А.Таболин, Ю.Г.Мухина, Д.Н.Дегтярев).
5. Изучение свойств альбумина новорожденных методом тушения флуоресценции. // Книга 2 «Альбумин сыворотки крови в клинической медицине» под редакцией Ю.А. Грызунова, Г.Е. Добрецова «ГЭОТАР» Москва 1998, стр. 333-336 (соавт. Смолина Н.В, Грызунов Ю.А, Дегтярев Д.Н).
6. Особенности метаболизма и печеночно-кншечной циркуляции желчных кислот у плода и новорожденного. // Педиатрия №3, 1997, стр.89-94. (соавт. Таболин В.А, Володин Н.Н, Мухина Ю.Г).
7. Обоснование принципов симптоматического лечения холестаза у детей первых месяцев жизни. // VI Российский национальный конгресс «Человек и лекарство» 19-23 апреля 1999 г. Москва, стр. 207. (соавт. Мухина Ю.Г, Таболин В.Л).
8. Принципы дифференциальной диагностики и лечения синдрома холестаза у новорожденных и детей первых месяцев жизни. // Сборник работ участников V конференции «Актуальные проблемы абдоминальной патологии у детей». Москва 25-26 марта 1998, стр. 23-36. (соавт. Таболин В.А, Мухина Ю.Г, Корнева Т.И, Дьяконова Г.В).
9. Синдром холестаза у новорожденных детей. // Материалы 1 Конгресса педиатров России «Болезни органов пищеварения у детей. Питание здорового и больного ребенка». Москва — Нижний Новгород, 28-30 мая 1996 г. стр. 48. (соавт. Таболин В.А, Кыштымов М.В, Дегтярев Д.Н).
10. .Синдром Криглера-Найара. // Российский вестник перинатологии и педиатрии, № 4, 1998 г. стр. 44-48 (соавт. Володин Н.Н, Дегтярев Д.Н, Сигова Ю.А).
11. Случай успешного использования фототерапии с целью предупреждения билирубиновой энцефалопатии у ребенка с синдромом Криглера-Найара 1 типа. // Материалы 11 съезда РАСПМ «Перинатальная неврология». Москва 25-26 сентября 1997 г.-стр. 179 (соавт. Дегтярев ДН, Жизневский Б.Л.)
// Материалы 11 съезда РАСПМ «Перинатальная неврология». Москва 25-26 сентября 1997 г.-стр. 179 (соавт. Дегтярев ДН, Жизневский Б.Л.)
12. Факторы, способствующие развитию синдрома холестаза у детей в экологически неблагоприятных условиях. // Конгресс педиатров России. «Экологические и гигиенические проблемы педиатрии». Москва 27-28 октября 1998. стр. 40. (соавт. Мухина Ю.Г, Кургашова Е.К).
АЛГОРИТМ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ СИНДРОМ
Сш
Постоянная ахолия стула, Т ГГТ, отсутствие визуализации желчного пузыря при УЗИ Непостоянная ахоли визуализация желчногс
1
Внепеченочный холестаз Впутрнпечеиочш обусловленный нарушен экскреции желт
Т
1 .Атрезия внепеченочных желчных протоков -На ограниченном участке -На всем протяжении с развитием фиброзного процесса
2.Киста общего желчного протока
3.Желчные пробки общего желчного протока.
4.Желчнокаменная болезнь
1 .Нарушение синтеза желчи 1.1 .Ферментопатаи -ТНСА — синдром -Дефицит Д4-3-оксистеу -Дефицит З-Р-гидрокси-дегидрогеназы/томе;-1.2.Пероксисомальная педсх -Структурные нарушен!
(синдром Цельвейге -Функциональные нар\и
2. Нарушение экскреции же -Прогрессирующий сем внугрипеченочный хо -1 тип (болезнь Ба -11 тип -Рецидивирующий в нут холестаз
ГГТ — гаммаглугаминтрансфераза, УЗИ — ультразвуковое исследование, ТНСА -
Приложение
ТАЗА У НОВОРОЖДЕННЫХ И ДЕТЕЙ ПЕРВЫХ МЕСЯЦЕВ ЖИЗНИ.
[естаза
ггт,
эи УЗИ
аз,
еза или
дуктазы Д
:ои
ксисом
ют
ный
1 .Инфекщгоиные факторы -В1фусы (гепатит) -Бактерии (гепатит) -Простейшие (гепатит)
2.Эндокринные нар\тпения -Гипогапуитаризм -Гипотиреоз
3.Моногенные нарушения -Дефицит а-1 -антитрипсина -Галактоземия -Тирозинемия
-Неонатальпый гемохроматоз (первичный) -Синдром Алажиля
-Несширомальная форма гипоплазии внугрипеченочных желчных протоков
4. Хромосомные нарушения -Трисомия 13, 17 или 18 хромосом
Хромосомные нарушения -Трисомия 13, 17 или 18 хромосом
5.Полное парентеральное питшше
6.Токсическое действие лекарственных препаратов
7. Идиопатический неонатальный гепатит
8.ТРАНЗИТОРНЫЙ СИНДРОМ ХОЛЕСТАЗА
— ишдром тетрогидрохолевой кислоты.
анализы крови для обследования печени и желчного пузыря
АЛТ (аланинаминотрансфераза) и АСТ (аспартатаминотрансфераза)
Это ферменты, содержащиеся в печени, а также других органах и тканях нашего организма. В норме оба фермента присутствуют в сыворотке крови, и их активность не превышает 40 ед./л. Повышение АЛТ и АСТ в анализе крови происходит при любых повреждениях клеток печени, гепатоцитов, вызванных заболеваниями и поражением печени.
Белки сыворотки
Альбумин, фибриноген, гаптоглобин и бетта-глуболины, синтезируются клетками печени, гепатоцитами, гамма-глобулины производят лимфоциты и плазматические клетки печени. При большинстве заболеваний печени уровень альбумина и других белков печени в сыворотке крови снижается, а уровень глобулинов наоборот повышается. Уровень альбумина ниже нормы и уровень глобулинов выше нормы может указывать на хроническое и прогрессирующее заболевание печени.
Коагулограмма
Это комплексное исследование гомеостаза, которое позволяет оценить состояние свертывающей и других систем крови. В печени синтезируются практически все факторы свертывания крови, кроме того удаляет она эти факторы из кровотока и участвует в растворении тромбов. При отклонении от нормы показателей входящих в коагулограмму, можно предположить нарушение синтеза свертывающих факторов в печени вследствие повреждения и гибели гепатоцитов при инфекционных заболеваниях печени, циррозе, хроническом гепатите, острой печеночной недостаточности и других заболеваниях.
ГГТ (гамма-глутамилтрансфераза)
Это фермент, который содержится в печени, поджелудочной железе и почках. Повышается при заболеваниях печени и поджелудочной железы, значительно повышается при алкогольном поражении печени;
ЩФ (щелочная фосфатаза)
Это фермент, производимый в печени и желчных путях, костной ткани и кишечнике. Повышение этого фермента возможно при нарушении проходимости внутри- и внепеченочных желчных путей и инфильтративных заболеваниях печени, при которых вещества, например жиры, или чужеродные клетки, например, метастазы проникают в клетки печени. Билирубин
Повышение этого фермента возможно при нарушении проходимости внутри- и внепеченочных желчных путей и инфильтративных заболеваниях печени, при которых вещества, например жиры, или чужеродные клетки, например, метастазы проникают в клетки печени. Билирубин
Это желчный пигмент, который является одним из самых главных составляющих желчи и образуется в результате распада гемоглобина и других компонентов крови, образовавшийся билирубин удаляется из кровотока печенью и выводится с желчью. Повышение уровня билирубина в крови сигнализирует о снижении способности печени выводить билирубин из организма и нарушении оттока желчи, встречается при острых и хронических заболеваниях печени, хроническом холецистите, закупорке желчных протоков и других заболеваниях.
Холестерин
Это органическое соединение, которое содержится в клеточных мембранах всех животных организмов и используется для синтеза желчных кислот, гормонов и витамина D. Примерно 50% холестерина производится печенью, часть поступает с пищей, остальное вырабатывают другие клетки нашего организма. Снижение уровня холестерина в крови может сигнализировать о снижении способности печени его производить , встречается при циррозе печени, злокачественных заболеваниях печени и других заболеваниях. Повышение уровня холестерина может сопровождать нарушение оттока желчи по внутри- и внепеченочным желчным путям.
Кому и зачем назначается биохимия?
Биохимические показатели крови назначают врачом после осмотра пациента если
- необходимо пройти профилактический осмотр;
- есть жалобы на горький привкус во рту, боли и тяжесть в правом подреберье, тошноту, быструю утомляемость;
- обнаружено пожелтение кожи и белков глаз и наличие отеков;
- у близких родственников есть заболевания печени и желчного пузыря;
- есть необходимость постоянно принимать гепатотоксические лекарства.
Лабораторная диагностика заболеваний печени
11. 07.2019
07.2019
• Вирусные гепатиты – воспалительные заболевания печени с парентеральным (гепатиты В и С) и энтеральным (гепатиты А и Е) путями передачи. Гепатит А хронической формы не имеет, гепатиты В и С хронизируются (при этом увеличивается риск развития рака печени и цирроза)
• Алкогольную болезнь печени – хроническое заболевание печени, развивающееся у лиц, склонных к злоупотреблению алкоголем. Однако далеко не у всех пациентов, страдающих алкоголизмом, развивается эта болезнь
• Лекарственные поражения печени – многие лекарственные препараты при длительном применении вызывают повреждение печени. Одним из самых токсичных препаратов для печени является парацетамол
• Цирроз печени – конечная стадия заболеваний печени. При циррозе медикаментозная терапия малоэффективна.
• Неалкогольную жировую болезнь печени – развивается у лиц с предрасположенностью к этому заболеванию, а также у пациентов, страдающих сахарным диабетом и хроническим панкреатитом. Определенную роль играет неправильное питание с преобладанием в рационе животных жиров
• Опухоли печени – гепатоцеллюлярную карциному (злокачественная опухоль печени), аденому (доброкачественная опухоль), гемангиому (сосудистая опухоль)
Менее частно встречаются такие заболевания печени, как:
• Аутоиммунный гепатит – как и другие аутоиммунные заболевания, чаще встречается у женщин репродуктивного возраста
• Паразитарные заболевания печени (эхинококкоз) – эхинококк образует кисты в печени, легких и в головном мозге
• Болезнь Вильсона-Коновалова – наследственное заболевание, обусловленное нарушением обмена меди в организме. Медь накапливается во многих органах, в том числе и в печени, вызывая цирроз
• Гемохроматоз – избыточное отложение железа во многих органах. Избыток железа, также, как и меди, токсичен для организма. Существуют как наследственные, так и не связанные с генетическим фактором формы заболевания
• Дефицит альфа-1-антитрипсина — антитрипсин подавляет активность многих ферментов, в частности, ферментов поджелудочной железы и легких
• Сосудистые заболевания печени (синдром Бадда-Киари-тромбоз печеночной вены) – тромбоз печеночной вены возникает при закупорке этой вены тромбом, при этом развивается ишемия клеток печени
Диагностику и лечение болезней печени осуществляют терапевт, гастроэнтеролог, гепатолог.

Для диагностики заболеваний печени исследуют следующие основные лабораторные показатели:
АСТ (аспартатаминотрансфераза)
АСТ – фермент, высокая активность которого характерна для печени, скелетных мышц и миокарда. Важное диагностическое значение имеет коэффициент де Ритиса. Этот коэффициент представляет собой отношение АСТ/АЛТ. В норме коэффициент де Ритиса равен 1,33. При заболеваниях печени коэффициент 1,33. В клинической практике нашло широкое применение одновременное определение активности АЛТ и АСТ, поскольку в этом случае помимо коэффициента де Ритиса возможно более точно определить активность патологического процесса.
Каковы же основные причины повышения активности АСТ?
Чрезмерно высокая активность АСТ (более чем в 10 раз больше нормы) обычно вызвана вирусными инфекциями. Также она может значительно увеличиваться в результате приема лекарств или иных веществ, которые являются токсичными для печени, а также из-за болезней, замедляющих приток крови к печени (ишемии).
При хроническом гепатите активность АСТ обычно превышает норму не более чем в 4 раза. Она колеблется между нормальной и несколько повышенной, поэтому часто для выяснения степени заболевания и назначается анализ. Такие заболевания, как непроходимость желчных путей, цирроз и некоторые виды рака печени способствуют умеренному повышению АСТ. После перенесенного инфаркта и при повреждении мышц активность АСТ также может повышаться, обычно намного больше АЛТ.
При большинстве заболеваний печени активность АЛТ в крови выше активности АСТ, так что соотношение АСТ/АЛТ будет низким. Однако существует несколько исключений: алкогольный гепатит, цирроз и повреждение мышц.
.
АЛТ (аланинаминотрансфераза)
АЛТ – фермент, достигающий наибольшей концентрации в печени. В меньшем количестве АЛТ присутствует в скелетной и сердечной мускулатуре, поджелудочной железе и легких. При заболеваниях печени в первую очередь изменяется концентрация АЛТ по сравнению с АСТ. АЛТ является более чувствительным тестом ранней диагностики острого гепатита, чем АСТ.
 При остром вирусном гепатите АЛТ и АСТ повышаются за 10 -15 дней до появления желтухи при гепатите А, и за много недель – при гепатите В. Активность АЛТ достигает максимума на 2-3-й неделе острого гепатита В.
При остром вирусном гепатите АЛТ и АСТ повышаются за 10 -15 дней до появления желтухи при гепатите А, и за много недель – при гепатите В. Активность АЛТ достигает максимума на 2-3-й неделе острого гепатита В.ГГТ (гамма-глутамилтрансфераза)
ГГТ – фермент, наибольшая активность которого наблюдается в печени, желчных протоках, поджелудочной железе и почках.
Причины повышения активности ГГТ в сыворотке крови:
• Алкогольное и лекарственное поражение печени
• Инфекционное поражение печени
Активность ГГТ в крови повышается при как при внепеченочном, так при внутрипеченочном холестазе (застое желчи). При холестазе активность ГГТ повышается в 5-30 раз по сравнению в верхней границей нормы.
ГГТ особенно чувствительна к влиянию на печень длительного потребления алкоголя. Уровень ГГТ в крови напрямую коррелирует с количеством употребляемого алкоголя. Прекращение приема алкоголя снижает активность этого фермента на 50% в течение 10 дней. Исследование уровня ГГТ в динамике особенно ценно для контроля лечения алкоголизма.
Щелочная фосфатаза (ЩФ)
Выделяют общую щелочную фосфатазу (ее часто называют печеночной), а также ее фракции – костную и кишечную ЩФ.
Наиболее типичной причиной повышения уровня щелочной фосфатазы в крови является синдром холестаза.
К основным причинам развития холестаза относят:
1. Причины внепеченочной обструкции желчных протоков:
• Закупорка протока камнем
• Послеоперационные стриктуры
2. Причины сужения внутрипеченочных протоков:
• Первичный билиарный цирроз печени
3. Нарушение транспорта желчи на уровне мелких протоков:
• Применение некоторых гепатотоксичных лекарственных препаратов
Также активность щелочной фосфатазы возрастает при:
• Повышенном метаболизме в костной ткани и при заболеваниях костей. Однако, уровень ЩФ может превышать норму и при отсутствии патологии, в частности, у детей и подростков в период интенсивного роста и развития костной ткани.
• При заболеваниях кишечника – болезни Крона, бактериальных кишечных инфекциях.
Билирубин
Билирубин – представляет собой желчный пигмент. Выделяют прямую и непрямую фракции билирубина. Суммарно они составляют общий билирубин.
Увеличение содержания билирубина в крови может быть обусловлено следующими причинами:
• Увеличение интенсивности гемолиза эритроцитов – возрастает уровень непрямого билирубина
• Поражение печени с нарушением выделения билирубина
• Нарушение оттока желчи в кишечник
• Недостаток ферментов, осуществляющих конъюгирование (связывание с глюкуроновой кислотой) билирубина – уровень билирубина возрастает за счет непрямой фракции
• Нарушение секреции прямого (конъюгированного) билирубина в желчь
Желтушная окраска кожи появляется при достижении концентрации 30-35 мкмоль/л общего билирубина в крови. Опасность значительно более высоких концентраций билирубина заключается в развитии поражения центральной нервной системы – развития билирубиновой энцефалопатии (ядерной желтухи).
Cуществует явление при котором уровень прямого билирубина повышен, а уровень аминотрансфераз в норме – билирубин-аминотрансферазная диссоциация. Это явление наблюдается при подпеченочной желтухе со стабильной желчной гипертезией.
Лаборатория Диалайн предлагает комплексную программу лабораторного обследования печени:
• ЛК.08. Здоровая печень. Базовый комплекс
• КБ2 • ALAT (аланинаминотрансфераза)
• КБ3 • ASAT (аспартатаминотрансфераза)
• КБ10 • Билирубин общий
• КБ11 • Билирубин прямой
• КБ12 • ГГТ (гамма-глутамилтрансфераза)
• КБ36 • Фосфатаза щелочная
Результаты анализов не являются диагнозом. Диагноз ставит врач (терапевт, гастроэнтеролог, гепатолог) с учетом данных клинической картины, анамнеза, а также данных инстументальных методов исследования.
Возникли вопросы?
Заполните форму обратной связи, наши менеджеры свяжутся с вами!
Возможности коррекции лекарственной печеночной токсичности при лечении больных с опухолями системы крови | Ларионова
1. Ивашкин В.Т., Барановский А.Ю., Райхельсон К.Л. и др. Лекарственные поражения печени (клинические рекомендации для врачей). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(1):85–115. DOI: 10.22416/1382-4376-2019-29-1101-131.
Ивашкин В.Т., Барановский А.Ю., Райхельсон К.Л. и др. Лекарственные поражения печени (клинические рекомендации для врачей). Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2019;29(1):85–115. DOI: 10.22416/1382-4376-2019-29-1101-131.
2. Azad A., Chang P., Deepika D. et al. Real world experience of drug induced liver injury in patients undergoing chemotherapy. J Clin Gastroenterol Hepatol 2018;2(3):18. DOI: 10.21767/2575-7733.1000047.
3. Groeneweg M., Quero J.C., De Bruijn I. и др. Хроническая печеночная недостаточность. Влияние субклинической печеночной энцефалопатии на качество жизни. МБГ 2000;(3).
4. Andrade R.J., Aithal G.P., Björnsson E.S. et al. EASL Clinical Practice Guidelines: drug-induced liver injury. J Hepatol 2019;70(6):1222–61. DOI: 10.1016/j.jhep.2019.02.014.
5. Ricart A.D. Drug-induced liver injury in oncology. Annal Oncol 2017;28(8):2013–20. DOI: 10.1093/annonc/mdx158.
6. Лазебник Л.Б., Голованова Е.В., Хлынова О.В. и др. Лекарственные поражения печени (ЛПП) у взрослых. Экспериментальная и клиническая гастроэнтерология 2020;174(2):29–54. DOI: 10.31146/1682-8658-ecg-174-2-29-54.
7. Lindros K.D. Zonation of cytochrome P-450 expression. Drug metabolism and toxicity in liver. Gen Pharmacol 1997;28(2):191–6. DOI: 10.1016/s0306-3623(96)00183-8.
8. Горожанская Э.Г., Ларионова В.Б., Зубрихина Г.Н. и др. Роль глутатионзависимых пероксидаз в регуляции утилизации липопероксидов в злокачественных опухолях. Биохимия 2001;66(2):273–8.
Биохимия 2001;66(2):273–8.
9. Wang L., Gloves J., Hepburn M., Bowen D. Glutathione-S-transferase enzyme expression in hematopoietic cell lins implies a differential protective role for TI, and AI isoenzymes in erythroid and for MI in lymphoid lineages. Haematologica 2000;85(6):573–9.
10. Франциянц Е.М., Сидоренко Ю.С., Розенко Л.Я. Перекисное окисление липидов в патогенезе опухолевой болезни. Ростов-на-Дону: Издательство Ростовского университета, 1995. 176 с.
11. Патофизиология фиброгенеза и стратегия антифиброзной терапии при хронических заболеваниях печени. Доступно по: http://www.gastroportal.ru (дата обращения 17.02.2016).
12. Malhi H., Gores G.J. Cellular and molecular mechanisms of liver injury. Gastroenterology 2008;134(6):1641–54. DOI: 10.1053/j.gastro.2008.03.002.
13. Gitlin N. Subclinical portal-systemic encephalopathy. Am J Gastroenterol 1988;83(1):8–11.
14. Glutathione metabolism and phisiological functions. Ed.: J. Vina. Boston, 1990. 378 p.
15. Kazis L.E. Health outcome assessments in medicine: history, applications and new directions. Adv Intern Med 1991;36:109–30.
16. Райхельсон К.Л., Кондрашина Э.А. Адеметионин в лечении повышенной утомляемости/слабости при заболеваниях печени: систематический обзор. Терапевтический архив 2019;91(2):8–142. DOI: 10.26442/00403660.2019.02.000130.
17. Никитин И.Г., Сторожаков Г.И., Буеверов А.О. Лекарственные поражения печени. В кн.: Болезни печени и желчевыводящих путей. Под ред. В.Т. Ивашкина. М.: М-Вести, 2005. С. 217–223.
Никитин И.Г., Сторожаков Г.И., Буеверов А.О. Лекарственные поражения печени. В кн.: Болезни печени и желчевыводящих путей. Под ред. В.Т. Ивашкина. М.: М-Вести, 2005. С. 217–223.
18. Сassaval R.J., Lancaster D.J. Hypersensitivity syndrome associated with azithromycin. Am J Med 2001;110(4):330–1. DOI: 10.1016/s0002-9343(00)00724-5.
19. Lee W. Drug-induced hepatotoxicity. N Engl J Med 2003;349(5):474–85. DOI: 10.1056/NEJMra021844.
20. Anstee Q.M., Wright M., Goldin R., Thursz M.R. Parenchymal extinction: coagulation and hepatic fibrogenesis. Clin Liver Dis 2009;13(1):117–26. DOI: 10.1016/j.cld.2008.09.013.
21. Казюлин А.Н., Вельшер Л.З., Королева И.А. Проблемы гепатотоксичности при проведении химиотерапии онкологических заболеваний и методы ее коррекции. Фарматека 2010;(17):82–90.
22. Desmet V., Gerber M., Hoofnagle J.H. и др. Классификация хронического гепатита: диагностика, определение степени тяжести и стадии течения. Российский журнал гастроэнтерологии, гепатологии, колопроктологии 1995;5(2):38.
23. Anstee Q.M., Daly A.K., Day C.P. Genetics of alcoholic and nonalcoholic fatty liver disease. Semin Liver Dis 2011;31(2):128–46. DOI: 10.1055/s-0031-1276643.
24. Plauth M., Cabre E., Riggio O. et al. ESPEN guidelines on enteral nutrition: liver disease. Clin Nutr 2006;25(2):285–94. DOI: 10.1016/j.clnu.2006.01.018.
25. Lieber C.S. S-adenosyl-L-methionine: its role in the treatment of liver disorders.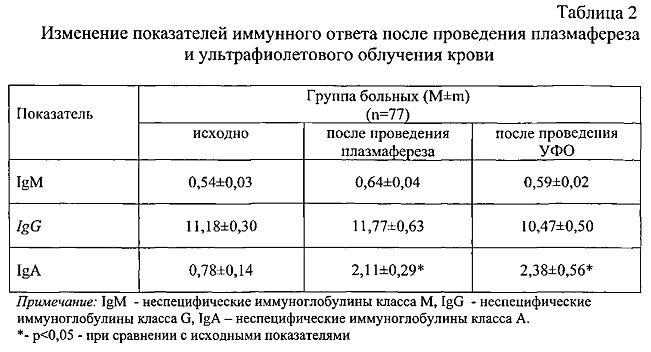 Am J Clin Nutr 2002;76(5):1183S–7S. DOI: 10.1093/ajcn/76/5.1183S.
Am J Clin Nutr 2002;76(5):1183S–7S. DOI: 10.1093/ajcn/76/5.1183S.
26. Vincenzi B., Russo A., Terenzio A. et al. The use of SAMe in chemotherapy-indised liver injury. Crit Rev Oncol Hematol 2018;130:70–7. DOI: 10.1016/j.critrevonc.2018.06.019.
27. Lu S.C. S-adenosylmethionine. Int J Biochem Cell Biol 2000;32(4):391–5. DOI: 10.1016/s1357-2725(99)00139-9.
28. Kuntz E., Kuntz H. D. Hepatology. Principles and practice. Heidelberg: Springer-Verlag Berlin, 2006. Pp. 542–562.
29. Hultgvist M., Hegbrant J., Nilsson-Thorell C. еt al. Plasma concentrations of vitamin C, vitamin E ahd/or malondialdehyde is markers of oxygen free radical production during hemodialysis. Clin Nephrol 1997;47(1):37–46.
30. Martinez-Chantar M.L., GarsiaTrevijano E.R., Latasa M.U. et al. Importance of a deficiency in S-adenosylL-methionine syntesis in the pathogenesis of the liver injury. Am J Clin Nutr 2002;76(5):1177S–82S. DOI: 10.1093/ajcn/76/5.1177S.
31. Song Z., Barve S., Chen T. et al. S-adenosylmethionine (AdoMet) modulates endotoxin stimulated interleukin-10 production in monocytes. Am J Physiol Gastrointest Liver Physiol 2003;284(6):G949–55. DOI: 10.1152/ajpgi.00426.2002.
32. Friedel H.A., Goa K.L., Benfield P. S-adenosyl-L-methionine. A review of its pharmacological properties and therapeutic potential in liver dysfunction and affective disorders in relation to its physiological role in cell metabolism. Drugs 1989;38(3):389–416. DOI: 10.2165/00003495-198938030-00004.
33. Vendemiale G., Altomare E., Trizio T. et al. Effects of oral S-adenosyl-L-methionine on hepatic glutathione in patients with liver disease. Scand J Gastroenterol 1989;24(4):407–15. DOI: 10.3109/00365528909093067.
34. Bottiglieri T., Chary T.K., Laundy M. et al. Transmethylation in depression. Ala J Med Sci 1988;25(3):296–301.
35. Santini D., Vincenzi B., Massacesi C. et al. S-adenosylmethionine (AdoMet) supplementation for treatment of chemotherapy-induced liver injury. Anticancer Res 2003;23(6D):5173–9.
36. Грек О.Р., Мишенина С.В., Пупышев А.Б. Протективное действие энтеросгеля на лизосомы печени крыс при введении комплекса цитостатических препаратов. Бюллетень экспериментальной биологии и медицины 2002;134(10):413–7.
37. Молодых О.П., Лушникова Е.Л., Клинникова М.Г., Непомнящих Л.М. Структурная реорганизация печени крыс при цитотоксическом действии доксорубицина. Бюллетень экспериментальной биологии и медицины 2006;141(5):579–85.
38. Ramadori G., Cameron S. Effects of systemic chemotherapy on the liver. Ann Hepatol 2010;9(2):133–43.
39. Uchyama M., Mihara M. Determination of malonaldehyde precursor in tissues by thiobarbituric acid test. Anal Biochem 1978;86(1):271–8. DOI: 10.1016/0003-2697(78)90342-1.
40. Голиков П.П., Николаева Н.Ю. Метод определения нитрита/нитрата (NOх ) в сыворотке крови. Биомедицинская химия 2004;50(1):79–85.
41. Porstmann T., Wietschke R., Jahn S. et al. A rapid and sensitive enzyme immunoassay for Cu/Zn superoxide dismutase with polyclonal and monoclonal antibodies. Clin Chim Acta 1988;171(1):1–10. DOI: 10.1016/0009-8981(88)90285-9.
42. Tietze F. Enzymic method for quantitative determination of nanogram amounts of total and oxidized glutathione; applications to mammalian blood and other tissues. Anal Biochem 1969;27(3):502–22. DOI: 10.1016/0003-2697(69)90064-5.
43. Habig W., Jakoby W. Assays for differentiation of glutathione S-transferases. Methods Enzymol 1981;77:398–405. DOI: 10.1016/s0076-6879(81)77053-8.
44. Куркумов И.А. Лекарственное поражение печени при лечении онкогематологических заболеваний. Клиническая онкогематология. Фундаментальные исследования и клиническая практика 2010;3(1):60–7.
45. Богуш Т.А., Богуш Е.А., Дурнов Л.А., Сыркин А.Б. Снижение токсичности и повышение эффективности противоопухолевой химиотерапии путем коррекции активности монооксигеназ печени: от эксперимента – в клинику. Вестник РАМН 2002;(1):37–42.
46. Pessaux P. Chemotherapy’s hepatotoxicity: what is the impact on surgery? J Chir (Paris) 2010;147(1):7–11. DOI: 10.1016/S0021-7697(10)70002-8.
47. Rubbia-Brandt L. Hepatic lesions induced by systemic chemotherapy for digestive cancer. Ann Pathol 2010;30(6):421–5. DOI: 10.1016/j.annpat.2010.09.008.
48. Bak M., Czerniak M. , KicinskaKrogulska M. et al. Toxic liver injuries – a current view on pathogenesis. Part I. Med Pr 2011;62(1):47–55.
, KicinskaKrogulska M. et al. Toxic liver injuries – a current view on pathogenesis. Part I. Med Pr 2011;62(1):47–55.
49. Микуляк Н.И., Кинзирская Ю.А. Экспериментальное изучение показателей перекисного окисления липидов при воздействии доксорубицина и мексидола. Вестник Волгоградского государственного медицинского университета 2011;(1):101–3.
50. Непомнящих Г.И., Дюбанова Г.А., Непомнящих Д.Л. и др. Универсальные структурные маркеры гепатотоксического воздействия лекарственных препаратов. Бюллетень Сибирского отделения Российской академии медицинских наук 2008;(6):86–92.
51. Stankiewicz A., Skrzydlewska E., Makieła M. Effects of amifostine on liver oxidative stress caused by cyclophosphamide administration to rats. Drug Metabol Drug Interact 2002;19(2):67–82. DOI: 10.1515/dmdi.2002.19.2.67.
52. Меньщикова Е.Б., Ланкин В.З., Зенков Н.К. и др. Окислительный стресс: прооксиданты и антиоксиданты. М.: Слово, 2006. 556 с.
53. Jaeschke H. Reactive oxygen and mechanisms of inflammatory liver injury: present concepts. J Gastroenterol Hepatol 2011:26(Suppl 1):173–9. DOI: 10.1111/j.1440-1746.2010.06592.x.
54. McDonnell M.E., Braverman L.E., Patel K.P. et al. Drug – related hepatotoxicity. N Engl J Med 2006;354(20):2191–3. DOI: 10.1056/NEJMc060733.
55. Mato J.M., Corrales F.J., Lu S.C., Avila M.A. S-adenosylmethionine; a control switch that regulates liver function. FASEB J 2002;16(l):15–26. DOI: 10.1096/fj.01-0401rev.
56. Зубрихина Г.Н., Горожанская Э.Г., Добровольская М.М., Матвеева И.И. Оксид азота и супероксиддисмутаза при интенсивной химиотерапии онкологических больных. Вестник интенсивной терапии 2007;(2):14–8.
Зубрихина Г.Н., Горожанская Э.Г., Добровольская М.М., Матвеева И.И. Оксид азота и супероксиддисмутаза при интенсивной химиотерапии онкологических больных. Вестник интенсивной терапии 2007;(2):14–8.
57. Протоколы клинических рекомендаций поддерживающей терапии в онкологии. Общество специалистов поддерживающей терапии в онкологии (RASSC). Под ред. М.И. Давыдова. 2-е издание, переработанное и дополненное. М.: АБВ-пресс, 2018. 224 c.
Нарушения функции печени у больных хроническим некалькулезным холециститом и их коррекция | Ефремова
1. Бурдина, Е. Г. Билиарный сладж: диагностика, критерии оценки, прогноз / Е. Г. Бурдина [и др.] // Кремлевская медицина. Клинический вестник. — 2013. — № 3. — с. 103-109.
2. Галиев Ш. З., Амиров Н. Б., Баранова О. А. и др. Нарушение сократительной функции желчного пузыря как фактор развития рефлюкс-гастрита при заболеваниях желчевыводящей системы. // Современные проблемы науки и образования. — 2016. — № 2. — С. 88.
3. Грищенко Е. Б. Роль гепатопротекторов в терапии заболеваний печени / Е. Б. Грищенко, М. И. Щекина // Фарматека. — 2014. — № 14. — с. 76-79.
4. Ажулай Г. С., Секарева Е. В., Червинцев В. М., Михайлова Е. С. Гастроэзофагеальная рефлюксная болезнь, ассоциированная с дуоденогастроэзофагеальным рефлюксом, у больных с билиарной патологией: особенности течения и микробного биоценоза эзофагогастродуоденальной зоны. // Терапевтический архив. — 2014. — № 2. — С. 17-22.
5. Кнышова В. В. Взаимосвязь метаболических нарушений и функционального состояния печени при хроническом некаль-кулезном холецистите. / В. В. Кнышова, Л. В. Веремчук, А. И. Шейкина // Вестник новых медицинских технологий. — 2011. — Т. XVIII. — № 3. — с. 36.
/ В. В. Кнышова, Л. В. Веремчук, А. И. Шейкина // Вестник новых медицинских технологий. — 2011. — Т. XVIII. — № 3. — с. 36.
6. Минушкин О. Н., Масловский Л. В. Диагностика и лечение функциональных расстройств билиарного тракта. Российский медицинский журнал. — 2010. — № 18 (5). — с. 277-282.
7. Общая заболеваемость взрослого населения России в 2015 году. Статистические материалы. Часть IV. Москва, 2016 [электронный доступ]: https://www.rosminzdrav.ru/ministry/61/22/stranitsa-979/statisticheskaya-informatsiya-minzdrava-rossii.
8. Подымова, С. А. Адеметионин: фармакологические эффекты и клиническое применение препарата / С. А. Подымова // Российский медицинский журнал. Болезни органов пищеварения. — 2010. — Т. 18. — № 13. — с. 800-805.
9. Хронические заболевания желчевыводящих путей: дисфункция расстройств, хронический холецистит, желчнокаменная болезнь: учебно-методическое пособие / Сост. и редактор Т. В. Маринич, А. В. Борсуков — Смоленск, 2004-25с.
10. Циммерман Я. С. Хронический холецистит и его клинические «маски»: диагностика и лечение / Я. С. Циммерман. — П.: Пермская государственная медицинская академия имени академика Е. А. Вагнера Минздравсоцразвития РФ, 2006. — 75с.
Лабораторные исследования, исследования изображений, процедуры
Автор
Хишам Назер, MBBCh, FRCP, DTM & H Профессор педиатрии, консультант по детской гастроэнтерологии, гепатологии и клиническому питанию, Медицинский факультет Университета Иордании, Иордания
Хишам Назер, MBBCh, FRCP, DTM & H является членом следующих медицинских общества: Американская ассоциация врачей-лидеров, Королевский колледж педиатрии и детского здоровья, Королевский колледж хирургов в Ирландии, Королевское общество тропической медицины и гигиены, Королевский колледж врачей и хирургов Соединенного Королевства
Раскрытие информации: не раскрывать.
Специальная редакционная коллегия
Мэри Л. Виндл, PharmD Адъюнкт-профессор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Главный редактор
Кармен Каффари, доктор медицины Доцент кафедры педиатрии, отделение гастроэнтерологии / питания, Медицинская школа университета Джона Хопкинса
Кармен Каффари, доктор медицины, является членом следующих медицинских обществ: Американского колледжа гастроэнтерологии, Американской гастроэнтерологической ассоциации, Североамериканское общество детской гастроэнтерологии, гепатологии и питания, Королевский колледж врачей и хирургов Канады
Раскрытие информации: Получены гонорары от лабораторий Прометея за выступления и обучение; Получал гонорары от Abbott Nutritionals за выступления и преподавание.для: Abbott Nutritional, Abbvie, спикеры.
Дополнительные участники
Джаянт Деодхар, доктор медицины Адъюнкт-профессор педиатрии, Медицинский колледж Би Джей, Индия; Почетный консультант отделения педиатрии и неонатологии, Мемориальная больница короля Эдуарда, Индия
Раскрытие информации: нечего раскрывать.
Лабораторные исследования, процедуры, другие тесты
Амброс-Рудольф CM. Дерматозы беременности — ключи к диагностике, риску для плода и терапии. Энн Дерматол . 2011 23 августа (3): 265-75. [Медлайн]. [Полный текст].
Pan C, Perumalswami PV. Заболевания печени, связанные с беременностью. Клиническая Печень Дис . 2011 15 февраля (1): 199-208. [Медлайн].
Джоши Д., Джеймс А., Квалья А., Вестбрук Р. Х., Хенеган, Массачусетс. Заболевание печени при беременности. Ланцет . 13 февраля 2010 г. 375 (9714): 594-605. [Медлайн].
Х., Хенеган, Массачусетс. Заболевание печени при беременности. Ланцет . 13 февраля 2010 г. 375 (9714): 594-605. [Медлайн].
Рейес Х, Саймон Фр. Внутрипеченочный холестаз беременных: заболевание, связанное с эстрогенами. Семян Печень Дис . 1993 13 августа (3): 289-301. [Медлайн].
Поупон Р. Внутрипеченочный холестаз беременных: от постели к скамье и к постели. Печень Инт . 2005 июн. 25 (3): 467-8. [Медлайн].
Dixon PH, Weerasekera N, Linton KJ, et al. Гетерозиготная миссенс-мутация MDR3, связанная с внутрипеченочным холестазом беременных: доказательства нарушения в транспортировке белков. Хум Мол Генет . 2000 1 мая.9 (8): 1209-17. [Медлайн].
Schneider G, Paus TC, Kullak-Ublick GA, Meier PJ, Wienker TF, Lang T. Связь между новой мутацией сайта сплайсинга в гене ABCB4 MDR3 и внутрипеченочным холестазом беременности. Гепатология . 2007 Январь 45 (1): 150-8. [Медлайн].
Keitel V, Vogt C, Häussinger D, Kubitz R. Комбинированные мутации белков канальцевых транспортеров вызывают тяжелый внутрипеченочный холестаз беременных. Гастроэнтерология .2006 август 131 (2): 624-9. [Медлайн].
Флореани А., Кардери И., Патерностер Д., Соардо Г., Аззароли Ф., Эспозито В. и др. Внутрипеченочный холестаз беременных: три новые мутации гена MDR3. Алимент Фармакол Тер . 2006 г., 1 июня, 23 (11): 1649-53. [Медлайн].
Jacquemin E, De Vree JM, Cresteil D, Sokal EM, Sturm E, Dumont M. Широкий спектр дефицита множественной лекарственной устойчивости 3: от холестаза новорожденных до цирроза взрослых. Гастроэнтерология . 2001 Май. 120 (6): 1448-58. [Медлайн].
Hardikar W, Kansal S, Oude Elferink RP, Angus P. Внутрипеченочный холестаз при беременности: когда следует искать дальше ?. Мир Дж. Гастроэнтерол . 2009 7 марта. 15 (9): 1126-9. [Медлайн]. [Полный текст].
Ли НМ, Брэди CW. Заболевание печени при беременности. Мир Дж. Гастроэнтерол . 2009 28 февраля, 15 (8): 897-906. [Медлайн]. [Полный текст].
Гонсалес М.С., Рейес Х., Аррезе М., Фигероа Д., Лорка Б., Андресен М. и др.Внутрипеченочный холестаз беременности при беременности двойней. Дж. Гепатол . 1989 июл.9 (1): 84-90. [Медлайн].
Reyes H, Báez ME, González MC, Hernández I, Palma J, Ribalta J. Уровни селена, цинка и меди в плазме крови при внутрипеченочном холестазе при беременности, при нормальной беременности и у здоровых людей в Чили. Дж. Гепатол . 2000 апр. 32 (4): 542-9. [Медлайн].
Lammert F, Marschall HU, Glantz A, Matern S. Внутрипеченочный холестаз беременности: молекулярный патогенез, диагностика и лечение. Дж. Гепатол . 2000 Декабрь 33 (6): 1012-21. [Медлайн].
Hay JE. Заболевание печени при беременности. Гепатология . 2008 Март, 47 (3): 1067-76. [Медлайн].
Tribe RM, Dann AT, Kenyon AP, Seed P, Shennan AH, Mallet A. Продольные профили 15 желчных кислот сыворотки у пациенток с внутрипеченочным холестазом беременных. Ам Дж Гастроэнтерол . 2010 Март 105 (3): 585-95. [Медлайн].
Sinakos E, Lindor KD.Профили желчных кислот при внутрипеченочном холестазе беременных: это решение загадки внутрипеченочного холестаза беременных? Ам Дж Гастроэнтерол . 2010 Март 105 (3): 596-8. [Медлайн].
Abu-Hayyeh S, Ovadia C, Lieu T, Jensen DD, et al. Прогностический и механистический потенциал сульфатов прогестерона при внутрипеченочном холестазе беременности и зуде беременных. Гепатология . 2015, 1 октября. [Medline].
Reyes H, Gonzalez MC, Ribalta J, Aburto H, Matus C, Schramm G и др.Распространенность внутрипеченочного холестаза у беременных в Чили. Энн Интерн Мед. 1978 апр. 88 (4): 487-93. [Медлайн].
Laifer SA, Stiller RJ, Siddiqui DS, Dunston-Boone G, Whetham JC. Урсодезоксихолевая кислота для лечения внутрипеченочного холестаза при беременности. J Matern Fetal Med . 2001 Апрель 10 (2): 131-5. [Медлайн].
Lee RH, Goodwin TM, Greenspoon J, Incerpi M. Распространенность внутрипеченочного холестаза при беременности в преимущественно латинском населении Лос-Анджелеса. Дж Перинатол . 2006 Сентябрь 26 (9): 527-32. [Медлайн].
Pusl T, Beuers U. Внутрипеченочный холестаз при беременности. Орфанет Дж. Редкий Диск . 2007 29 мая. 2:26. [Медлайн].
Рейес Х. Обзор: внутрипеченочный холестаз. Загадочное заболевание беременности. Дж Гастроэнтерол Гепатол . 1997 марта 12 (3): 211-6. [Медлайн].
Патак Б., Шейбани Л., Ли Р. Холестаз беременности. Акушерская гинекологическая клиника North Am .2010 июн. 37 (2): 269-82. [Медлайн].
Mays JK. Активное ведение внутрипеченочного холестаза при беременности. Curr Opin Акушерский гинекол . 2010 Апрель 22 (2): 100-3. [Медлайн].
Pata O, Vardareli E, Ozcan A, Serteser M, Unsal I, Saruç M. Внутрипеченочный холестаз беременности: корреляция преждевременных родов с желчными кислотами. Турок Дж. Гастроэнтерол . 2011 Декабрь 22 (6): 602-5. [Медлайн].
Грач М., Варгас Дж., Каугей А., Баккетти П., Розенталь П., Булл Л.Исходы плода при беременности, осложненной внутрипеченочным холестазом, в когорте Северной Калифорнии. PLoS Один . 2012. 7 (3): e28343. [Медлайн]. [Полный текст].
Балиутавичене Д., Зубрувене Н., Залинкявичюс Р. Исход беременности при внутрипеченочном холестазе беременности. Int J Gynaecol Obstet . 2011 Март 112 (3): 250-1. [Медлайн].
Floreani A, Gervasi MT. Новые взгляды на внутрипеченочный холестаз беременности. Клиническая Печень Дис . 2016 20 февраля (1): 177-89. [Медлайн].
Favre N, Abergel A, Blanc P, Sapin V, Roszyk L, Gallot D. Необычное проявление тяжелого внутрипеченочного холестаза беременности, ведущего к гибели плода. Акушерский гинекол . 2009 август 114 (2, часть 2): 491-3. [Медлайн].
Уильямсон С., Мираголи М., Шейх Абдул Кадир С. и др. Передача сигналов желчной кислоты в тканях плода: значение для внутрипеченочного холестаза беременности. Dig Dis . 2011. 29 (1): 58-61. [Медлайн].
Strehlow SL, Pathak B, Goodwin TM, Perez BM, Ebrahimi M, Lee RH. Интервал механического PR у плодов женщин с внутрипеченочным холестазом беременности. Ам Дж. Обстет Гинекол . 2010 ноябрь 203 (5): 455.e1-5. [Медлайн].
Wang C, Chen X, Zhou SF, Li X. Нарушение функции надпочечников плода при внутрипеченочном холестазе беременности. Медицинский Мониторинг . 2011 Май. 17 (5): CR265-71.[Медлайн].
Рид Р., Айви К.Дж., Ренкорет Р.Х., Стори Б. Осложнения акушерского холестаза у плода. Br Med J . 1976, 10 апреля. 1 (6014): 870-2. [Медлайн].
Фиск Н.М., Стори Г.Н. Исход плода при акушерском холестазе. Br J Obstet Gynaecol . 1988 ноябрь 95 (11): 1137-43. [Медлайн].
Уильямсон С., Хелмс Л. М., Гулис Д. Г. и др. Клинические исходы в серии случаев акушерского холестаза, выявленные группой поддержки пациентов. БЖОГ . 2004. 111: 676-681.
Сури В., Джайн Р., Аггарвал Н., Чавла Ю.К., Кохли К.К. Полезность мониторинга плода при внутрипеченочном холестазе беременности: проспективное исследование. Арочный гинекол акушерский . 2012 декабрь 286 (6): 1419-24. [Медлайн].
Ce H, Rr S, S G, Kk F, A H, Mercado R. Primum Non Nocere: Как активное ведение стало методом лечения внутрипеченочного холестаза беременности. Ам Дж. Обстет Гинекол .2014 г., 1 апреля [Medline].
Geenes V, Chappell LC, Seed PT, Steer PJ, Knight M, Williamson C. Связь тяжелого внутрипеченочного холестаза беременности с неблагоприятными исходами беременности: проспективное популяционное исследование методом случай-контроль. Гепатология . 2014 Апрель 59 (4): 1482-91. [Медлайн].
Chen J, Deng W, Wang J, Shao Y, Ou M, Ding M. Первичные желчные кислоты как потенциальные биомаркеры для клинической оценки внутрипеченочного холестаза при беременности. Int J Gynaecol Obstet . 2013 июл.122 (1): 5-8. [Медлайн].
Glantz A, Marschall HU, Mattsson LA. Внутрипеченочный холестаз беременности: взаимосвязь между уровнем желчной кислоты и частотой осложнений у плода. Гепатология . 2004 Август 40 (2): 467-74. [Медлайн].
Кавакита Т., Парих Л.И., Рэмси П.С., Хуанг С.С., Зеймо А., Фернандес М. и др. Предикторы неблагоприятных исходов новорожденных при внутрипеченочном холестазе беременности. Ам Дж. Обстет Гинекол . 2015 Октябрь 213 (4): 570.e1-8. [Медлайн].
Маллалли Б.А., Хансен В.Ф. Внутрипеченочный холестаз беременности: обзор литературы. Наблюдение за акушерством и гинекологом . 2002 Январь 57 (1): 47-52. [Медлайн].
Brites D, Rodrigues CM, Oliveira N, Cardoso M, Graça LM. Коррекция профиля желчных кислот в сыворотке крови матери при терапии урсодезоксихолевой кислотой при холестазе беременных. Дж. Гепатол . 1998 Янв.28 (1): 91-8. [Медлайн].
Borum ML. Заболевания печени и желчевыводящих путей у женщин. Мед Клин Норт Ам . 1998, январь 82 (1): 51-75. [Медлайн].
Knox TA, Olans LB. Заболевание печени при беременности. N Engl J Med . 1996 22 августа. 335 (8): 569-76. [Медлайн].
Пальма Дж., Рейес Х., Рибалта Дж., Эрнандес И., Сандовал Л., Альмуна Р. и др. Урсодезоксихолевая кислота в лечении холестаза беременных: рандомизированное двойное слепое исследование, контролируемое плацебо. Дж. Гепатол . 1997 27 декабря (6): 1022-8. [Медлайн].
Heikkinen J, Mäentausta O, Ylöstalo P, Jänne O. Уровни желчных кислот в сыворотке крови при внутрипеченочном холестазе беременных во время лечения фенобарбиталом или холестирамином. евро J Obstet Gynecol Reprod Biol . 1982 г., 14 (3): 153-62. [Медлайн].
Ли НМ, Брэди CW. Заболевание печени при беременности. Мир Дж. Гастроэнтерол . 2009 28 февраля, 15 (8): 897-906. [Медлайн].[Полный текст].
Davies MH, da Silva RC, Jones SR, Weaver JB, Elias E. Смертность плода, связанная с холестазом беременности, и потенциальная польза от терапии урсодезоксихолевой кислотой. Кишечник . 1995 Октябрь 37 (4): 580-4. [Медлайн].
Кремер А.Е., Болье Р., Диксон П.Х., Гинес В., Чемберс Дж., Толенаарс Д. и др. Активность аутотаксина имеет высокую точность для диагностики внутрипеченочного холестаза при беременности. Дж. Гепатол . 2015 апр.62 (4): 897-904. [Медлайн].
Barrett JM, Salyer SL, Boehm FH. Нестрессовый тест: оценка 1000 пациентов. Ам Дж. Обстет Гинекол . 1981, 15 сентября. 141 (2): 153-7. [Медлайн].
Martinez E, Rodriguez N, Lisonim et al. Продажи bilares Plasmaticas maternos y perfel biofisico del feto en la eolestasia gravidaric. Ред. Чил Обстет Гинеколь . 1987. 52: 137-141.
Циммерман П., Коскинен Дж., Вааламо П. и др.Допплерография пупочной артерии при беременности, осложненной внутрипеченочным холестазом. J Перинатальная медицина . 1991. 19: 351-355.
Rioseco AJ, Иванкович MB, Manzur A, Hamed F, Kato SR, Parer JT. Внутрипеченочный холестаз беременности: ретроспективное исследование перинатального исхода случай-контроль. Ам Дж. Обстет Гинекол . 1994 Mar.170 (3): 890-5. [Медлайн].
CA Herrera, TA Manuck, GJ Stoddard, MW Varner, S. Esplin, EA Clark, et al.Перинатальные исходы, связанные с внутрипеченочным холестазом беременности. Журнал медицины матери, плода и новорожденных . 05 июня 2017. [Полный текст].
К. С. Кохари, Р. Кэрролл, С. Капогна, А. Дитчик, Н. Фокс, Л. А. Феррара. Результат после внедрения современной стратегии лечения внутрипеченочного холестаза беременных. Журнал медицины матери, плода и новорожденных . 2 августа 2016. 30 (11): 1342-1346.
Furrer R, Winter K, Schäffer L, Zimmermann R, Burkhardt T, Haslinger C.Послеродовая потеря крови у женщин, леченных по поводу внутрипеченочного холестаза беременности. Акушерский гинекол . 2016 ноябрь 128 (5): 1048-1052. [Медлайн].
Шен И, Чжоу Дж, Чжан С., Ван XL, Цзя Ю.Л., Хе С. и др. Нужно ли проводить фармакологические вмешательства при внутрипеченочном холестазе беременности? Байесовский сетевой метаанализ. Клинические исследования лекарственных средств . 24 октября 2018 г. [Medline].
Rust C, Sauter GH, Oswald M, Büttner J, Kullak-Ublick GA, Paumgartner G.Влияние холестирамина на структуру и синтез желчных кислот при введении урсодезоксихолевой кислоты человеку. евро J Clin Invest . 2000, 30 февраля (2): 135-9. [Медлайн].
Sadler LC, Lane M, North R. Сильное внутричерепное кровоизлияние у плода во время лечения холестирамином от внутрипеченочного холестаза беременных. Br J Obstet Gynaecol . 1995 Февраль 102 (2): 169-70. [Медлайн].
Ribalta J, Reyes H, Gonzalez MC, Iglesias J, Arrese M, Poniachik J, et al.S-аденозил-L-метионин в лечении пациентов с внутрипеченочным холестазом беременности: рандомизированное двойное слепое плацебо-контролируемое исследование с отрицательными результатами. Гепатология . 1991 июн. 13 (6): 1084-9. [Медлайн].
Лаатикайнен Т. Влияние холестирамина и фенобарбитала на зуд и уровни желчных кислот в сыворотке крови при холестазе беременных. Ам Дж. Обстет Гинекол . 1978, 1 ноября. 132 (5): 501-6. [Медлайн].
Hirvioja ML, Tuimala R, Vuori J.Лечение внутрипеченочного холестаза беременных дексаметазоном. Br J Obstet Gynaecol . 1992 Февраль 99 (2): 109-11. [Медлайн].
Beuers U, Boyer JL, Paumgartner G. Урсодезоксихолевая кислота при холестазе: потенциальные механизмы действия и терапевтические применения. Гепатология . 1998 Декабрь 28 (6): 1449-53. [Медлайн].
Кретович Э., Макинтайр HD. Внутрипеченочный холестаз беременных, усиливающийся после приема дексаметазона. Aust N Z J Obstet Gynaecol . 1994 Май. 34 (2): 211-3. [Медлайн].
Azzaroli F, Turco L, Lisotti A, Calvanese C, Mazzella G. Фармакологическое лечение внутрипеченочного холестаза при беременности. Курр Клин Фармакол . 2011 Февраль 6 (1): 12-7. [Медлайн].
Chappell LC, Gurung V, Seed PT, Chambers J, Williamson C, Thornton JG. Урсодезоксихолевая кислота по сравнению с плацебо и ранние роды по сравнению с выжидательной тактикой у женщин с внутрипеченочным холестазом беременности: полуфакторное рандомизированное клиническое исследование. BMJ . 2012 г., 13 июня. 344: e3799. [Медлайн]. [Полный текст].
Кэри Э.Дж., Линдор К.Д. Современная фармакотерапия холестатической болезни печени. Экспертное мнение Фармаколог . 2012 г., 13 (17): 2473-84. [Медлайн].
Beuers U. Обзор лекарств: механизм и участки действия урсодезоксихолевой кислоты при холестазе. Нат Клин Практик Гастроэнтерол Гепатол . 2006. 3: 318-328.
Glantz A, Marschall HU, Lammert F, Mattsson LA.Внутрипеченочный холестаз беременных: рандомизированное контролируемое исследование, сравнивающее дексаметазон и урсодезоксихолевую кислоту. Гепатология . 2005 декабрь 42 (6): 1399-405. [Медлайн].
Пальма Дж., Рейес Х., Рибальта Дж., Иглесиас Дж., Гонсалес М.С., Эрнандес И. и др. Эффекты урсодезоксихолевой кислоты у пациенток с внутрипеченочным холестазом беременности. Гепатология . 1992 июн. 15 (6): 1043-7. [Медлайн].
Meng LJ, Reyes H, Palma J, Hernandez I, Ribalta J, Sjövall J.Влияние урсодезоксихолевой кислоты на конъюгированные желчные кислоты и метаболиты прогестерона в сыворотке и моче пациентов с внутрипеченочным холестазом беременных. Дж. Гепатол . 1997 Dec. 27 (6): 1029-40. [Медлайн].
Пальма Дж., Рейес Х., Рибалта Дж., Эрнандес И., Сандовал Л., Альмуна Р. и др. Урсодезоксихолевая кислота в лечении холестаза беременных: рандомизированное двойное слепое исследование, контролируемое плацебо. Дж. Гепатол . 1997 27 декабря (6): 1022-8.[Медлайн].
Diaferia A, Nicastri PL, Tartagni M, Loizzi P, Iacovizzi C, Di Leo A. Терапия урсодезоксихолевой кислотой у беременных с холестазом. Int J Gynaecol Obstet . 1996 Февраль 52 (2): 133-40. [Медлайн].
Zapata R, Sandoval L, Palma J, et al. Урсодезоксихолевая кислота в лечении внутрипеченочного холестаза беременных. 12-летний опыт работы. Печень Инт . 2005 июн. 25 (3): 548-54. [Медлайн].
Bacq Y, Sentilhes L, Reyes HB, Glantz A, Kondrackiene J, Binder T и др.Эффективность урсодезоксихолевой кислоты при лечении внутрипеченочного холестаза беременности: метаанализ. Гастроэнтерология . 2012 г. 11 августа [Medline].
Mölsä A, Turunen K, Mattila KJ, Sumanen M. Излишняя путаница в планировании семьи после внутрипеченочного холестаза беременности. Контрацепция . 2012 декабрь 86 (6): 639-44. [Медлайн].
Hämäläinen ST, Turunen K, Mattila KJ, Sumanen M. Внутрипеченочный холестаз беременности и связанные с ним причины смерти: когортное исследование с последующим наблюдением 27-46 лет. BMC Женское Здоровье . 19 июня 2018 г. 18 (1): 98. [Медлайн].
Bacq Y. Заболевания печени, присущие только беременным: обновление за 2010 год. Клин Рес Гепатол Гастроэнтерол . 2011 марта, 35 (3): 182-93. [Медлайн].
Лабораторные исследования печени и желчного пузыря — заболевания печени и желчевыводящих путей
Билирубин, пигмент желчи, вырабатывается при расщеплении гемовых белков, в основном гемовой составляющей гемоглобина в стареющих красных кровяных тельцах.Неконъюгированный (свободный) билирубин не растворяется в воде и, следовательно, не выводится с мочой; большая часть неконъюгированного билирубина связана с альбумином в плазме. Билирубин соединяется в печени с глюкуроновой кислотой с образованием более водорастворимого диглюкуронида билирубина. Затем конъюгированный билирубин выводится через желчные пути в двенадцатиперстную кишку, где он метаболизируется до уробилиногенов (некоторые из которых реабсорбируются и повторно выделяются с желчью), а затем в уробилины оранжевого цвета (большая часть которых выводится с калом).Эти желчные пигменты придают стулу типичный цвет.
Гипербилирубинемия возникает в результате одного или нескольких из следующих событий:
Повышение продукции билирубина
Пониженное поглощение печенью или конъюгация
Пониженное выделение желчевыводящих путей (см. Желтуха)
Обычно общий билирубин в основном неконъюгированный, со значениями <1.2 мг / дл (<20 мкмоль / л). Фракционирование измеряет долю конъюгированного билирубина (т. Е. Прямого, так называемого, потому что он измеряется напрямую, без использования растворителей). Фракционирование наиболее полезно для оценки желтухи новорожденных и для оценки повышенного билирубина, когда другие результаты печеночных тестов в норме, что позволяет предположить, что дисфункция гепатобилиарной системы не является причиной.
Неконъюгированная гипербилирубинемия (фракция непрямого билирубина> 85%) отражает повышенное производство билирубина (например, при гемолизе) или нарушение поглощения печенью или конъюгации (например, при синдроме Гилберта).Такое повышение уровня неконъюгированного билирубина обычно <5 раз от нормы (до <6 мг / дл [<100 микромоль / л]), если нет сопутствующего поражения печени.
Конъюгированная гипербилирубинемия (доля прямого билирубина> 50%) возникает в результате снижения образования или выведения желчи (холестаза). Когда он связан с другими аномалиями печеночных тестов, высокий уровень билирубина в сыворотке указывает на дисфункцию гепатоцеллюлярных и / или желчных путей. Билирубин в сыворотке несколько нечувствителен к нарушению функции печени.Однако развитие тяжелой гипербилирубинемии при первичном билиарном холангите (также называемом первичным билиарным циррозом), первичном склерозирующем холангите, алкогольном гепатите и острой печеночной недостаточности предполагает плохой прогноз.
Билирубинурия отражает присутствие конъюгированного билирубина в моче; билирубин попадает в мочу, потому что его уровень в крови заметно повышен, что указывает на тяжелое заболевание. Неконъюгированный билирубин нерастворим в воде и связан с альбумином, поэтому не может выводиться с мочой.Билирубинурию можно обнаружить у постели больного с помощью коммерческих тест-полосок для анализа мочи при остром вирусном гепатите или других гепатобилиарных заболеваниях, даже до появления желтухи. Однако диагностическая точность таких анализов мочи ограничена. Результаты могут быть ложноотрицательными, если образец мочи хранился долгое время, был проглочен витамин С или моча содержит нитраты (например, из-за инфекций мочевыводящих путей). Точно так же увеличение уробилиногена не является ни специфичным, ни чувствительным.
Диагностика— ICP Care
Диагностика внутрипеченочного холестаза при беременности может быть сложной задачей.ВЧД — это диагноз исключения, а это означает, что необходимо исключить другие причины нарушения функции печени и холестаза, прежде чем можно будет поставить диагноз ВЧД. Врачи будут проверять такие заболевания, как вирусный гепатит, обструкции или стриктуры желчевыводящих путей, аутоиммунный гепатит, среди прочего, для выявления ВЧД. Однако, независимо от причины повышенного содержания желчных кислот, необходимо соблюдать курс лечения, снижающий риск для беременности. Важно сохранять положительный результат и проявлять терпение при прохождении нескольких тестов или панелей.
Желчные кислоты сыворотки
В настоящее время наиболее чувствительным тестом для выявления внутрипеченочного холестаза беременных является анализ крови для измерения уровня желчных кислот. Его часто называют общими желчными кислотами, солями желчных кислот или солями желчных кислот. Исследования показывают, что повышенный уровень желчных кислот может быть связан с риском для будущего ребенка.
Желчные кислоты более 10 мкмоль / л указывают на ВЧД. Многие врачи не ставят диагноз без повышенного содержания желчных кислот, но некоторые врачи и специалисты могут ставить диагноз только на основании симптомов, соответствующих заболеванию, или только на основании повышенной функции печени.Некоторые врачи, не являющиеся специалистами, могут быть не знакомы с анализом желчной кислоты, поэтому может потребоваться запросить его по имени. В большинстве случаев получение результатов теста на желчную кислоту занимает 5-10 дней, поскольку он обрабатывается только в нескольких специализированных лабораториях и должен быть отправлен. Это следует учитывать в случаях, когда у вас развился внутрипеченочный холестаз на поздних сроках беременности.
Одно крупное исследование населения Швеции показало, что желчные кислоты более 40 мкмоль / л представляют больший риск преждевременных родов, респираторных заболеваний и окрашивания мекония.Другие исследования в той же области также обнаружили корреляцию между более высоким уровнем желчной кислоты и респираторными проблемами.
Крупное исследование американской популяции показало, что умеренный внутрипеченочный холестаз беременных (определяемый для целей исследования как желчные кислоты 20-40 мкмоль / л) имел такой же риск эмбриональных осложнений, как и тяжелый внутрипеченочный холестаз беременности (более 40 мкмоль / л), но частота осложнений в обеих группах при лечении была очень низкой.
Желчные кислоты не считаются причиной зуда при внутрипеченочном холестазе беременных.Доказано, что уровень желчной кислоты плохо коррелирует с интенсивностью зуда, который испытывает человек. Зуд хорошо коррелирует с уровнем другого химического вещества, который повышается во время ICP, но не может быть проверен в типичных лабораторных условиях (это химическое вещество известно как LPA или лизофосфатидная кислота). Из-за этого желчные кислоты могут оставаться в норме в течение недель или даже месяцев после начала зуда. Если ваши первоначальные тесты кажутся нормальными, но вы продолжаете испытывать симптомы, вам следует проходить повторное тестирование каждую неделю или две недели, пока симптомы сохраняются.
Просмотр референсных диапазонов Quest Laboratories для анализа крови на общую желчную кислоту.
Две основные лаборатории США коды анализа крови и ссылки на их веб-сайты ниже.
Quest Diagnostics and Lab Corp.
Пожалуйста, посетите страницу диагностического тестирования для получения дополнительной информации.
Функциональные тесты печени (или полная метаболическая панель)
Приблизительно 60% женщин с внутрипеченочным холестазом беременных имеют повышенные функции печени во время беременности.Панель нормальной функции печени не исключает нарушения, однако результаты теста возвращаются в течение нескольких часов, а не дней, что может более оперативно предоставить вашему врачу информацию. Когда функции печени повышены, они могут быть повышены до повышения уровня желчных кислот, после повышения уровня желчных кислот или одновременно. В этом наборе тестов проанализировано много элементов. В отношении внутрипеченочного холестаза при беременности важно отметить следующее.
- ALT (аланинаминотрансфераза) является наиболее чувствительной функцией печени для помощи в диагностике внутрипеченочного холестаза беременности, за которой следует AST (аспартатаминотрансфераза).Повышение одного или обоих из них может указывать на то, что у вас ВЧД. Некоторые врачи ставят диагноз, основываясь исключительно на повышении уровня этих ферментов печени, оба из которых вырабатываются при повреждении клеток печени.
- Повышение уровня ALP / ALK (щелочной фосфатазы) само по себе не является признаком внутрипеченочного холестаза при беременности. Этот печеночный фермент менее специфичен для печени и является побочным продуктом образования костей, а также вырабатывается плацентой. Повышение уровня этого фермента во время беременности — это нормально.
- Билирубин повышен в небольшом меньшинстве случаев (по оценкам, менее 10%). Повышенный билирубин также может вызвать желтуху. Когда билирубин повышен, он, как правило, повышен незначительно.
- GGT (гамма-глутамилтрансфераза) редко повышается
- Другие тесты, включенные в панель функции печени или полного метаболизма, не являются специфическими для внутрипеченочного холестаза беременности, но если они отклоняются от нормы, обсудите со своим врачом, на что это может указывать.
Посмотрите пример результатов и контрольных диапазонов для анализа крови на функцию печени.
Понимание необычной природы внутрипеченочного холестаза при беременности
Поскольку внутрипеченочный холестаз при беременности является редким заболеванием (в Соединенных Штатах редкое заболевание определяется как заболевание, поражающее менее 200000 американцев в любой момент времени, в то время как ВЧД, по оценкам, поражает примерно 6000 американцев в год), некоторые врачи могут не иметь практическое знание болезни. Ваш врач может не знать о заболевании, а если он или она знает, возможно, он мало знает о нем или может даже иметь неправильные представления о состоянии, или может быть не в состоянии определить диагноз интрагептического холестаза беременности.
Когда-то считалось, что внутрипеченочный холестаз беременных — это состояние, не представляющее опасности для ребенка, и некоторые до сих пор считают его таковым. Возможно, вам придется взять с собой на прием образовательные материалы, чтобы помочь вашему врачу узнать больше (учебные брошюры и информация о поставщиках услуг). Распечатайте эти материалы и поделитесь ими со своим врачом, вместо того, чтобы упоминать, что вы нашли информацию в Интернете. Учитывая, что это настолько необычно, ваш врач может сначала не убедиться, что у вас может быть заболевание.Будьте готовы к скептицизму и поймите, что пока ваш врач хочет провести надлежащие анализы, это не важно.
Если ваш врач не хочет больше узнавать об этом заболевании или если он или она не желает проводить тест на желчные кислоты, то, возможно, пришло время обратиться за помощью к другому специалисту.
Работа по распространению осведомленности о внутрипеченочном холестазе беременности
Может быть неприятно, что ваш врач может не знать о ВЧД, но многие организации работают над распространением информации о ВЧД.Мы чтим каждого ребенка, погибшего в результате ДЦП, и поддерживаем матерей, переживших эту трагическую утрату.
Мы с энтузиазмом относимся к расширению прав и возможностей каждой женщины с ДЦП, чтобы у нее были ресурсы, необходимые для пропаганды надлежащего тестирования, приема лекарств и ранних родов, чтобы спасти жизнь своего ребенка.
Узнайте больше об усилиях ICP Care по распространению информации или пожертвованиям.
Холестаз | eClinpath
Цитологические свидетельства холестаза
Холестаз можно определить как остановку или подавление оттока желчи.
Есть несколько лабораторных маркеров холестаза. Это:
- «Холестастические» или «индуцибельные» ферменты щелочная фосфатаза (ALP) и γ-глутамилтрансфераза (GGT). Они связаны с клеточными мембранами эпителиальных клеток желчных путей и в первую очередь служат индикаторами холестаза. Однако ЩФ недостаточно специфичен для этой цели, поскольку на его активность может влиять множество других факторов, включая индукцию, вторичную по отношению к кортикостероидам у собак.GGT более специфичен в целом и более чувствителен в некоторых случаях.
- Билирубин , особенно конъюгированный билирубин: в тяжелых случаях холестаз приводит к увеличению концентрации прямого билирубина в крови, который попадает в мочу, что приводит к билирубинурии. ALP и GGT обычно имеют более высокую чувствительность к холестазу по сравнению с уровнем только билирубина в сыворотке. Например, локализованный холестаз может увеличивать концентрацию ЩФ и ГГТ без повышения уровня билирубина в сыворотке или моче.Холестаз приведет к вторичному повреждению печени (желчные кислоты обладают эмульгирующим действием на клеточные мембраны), что приведет к увеличению утечки ферментов в печень, а также к увеличению непрямого билирубина.
- Билирубинурия ; У всех видов животных, кроме собак и хорьков, билирубинурия в моче является аномальной, возникает из-за повышенного прямого билирубина в крови и указывает на холестаз. Небольшие количества билирубина (конъюгированного или прямого билирубина) можно увидеть в концентрированной моче собак и хорьков, но избыточная билирубинурия по-прежнему является ненормальной для последних.
- Другие аномалии могут наблюдаться у холестатических животных, но обычно не используются в качестве маркеров холестаза (слишком неспецифические), например гиперхолестеринемия, повышение концентрации желчных кислот (см. ниже раздел лабораторной диагностики).
Виды холестаза
Поток желчи зависит от активного транспорта желчных кислот через переносчики белка в канальцы, создавая осмотический градиент. и проходимость желчных путей от канальцев до того места, где общий желчный проток входит в кишечник.Следовательно, холестаз может быть связан либо со структурной обструкцией, либо с «функциональным» дефектом (влияющим на функцию переносчиков желчных кислот или осмотический градиент) оттока желчи. Холестаз вызывает серьезные изменения в гепатоцитах, в том числе негерметичные внутриклеточные промежутки (через которые желчь и ее составляющие могут просачиваться или «срыгивать» обратно в кровь) и подавление или обратное развитие белковых переносчиков (что также вызывает регургитацию и снижение поглощения органических соединений, таких как билирубин). и желчные соли).
Структурный холестаз
Структурный холестаз — физическое препятствие оттоку желчи. Он может быть внутрипеченочным или внепеченочным:
- Внутрипеченочная непроходимость , сдавливающая желчные каналы:
- Гепатоцеллюлярное набухание — например, липидоз печени, тяжелая кортикостероидная гепатопатия у собак
- Тяжелые клеточные инфильтраты (воспалительные или опухолевые), особенно вокруг воротной области и желчного дерева
- Солидные опухоли — первичные по отношению к печени (e.грамм. холангиокарцинома) или метастатическая
- Фиброз желчевыводящей системы — ответ на хроническое воспаление
- Холелиты, паразиты (например, Fasciola hepatica )
- Застой желчи в канальцах (например, сильное обезвоживание у кошек)
- Внепеченочные обструкции , влияющие на внепеченочную билиарную систему:
- Опухоли — например, поджелудочная железа, желчные пути, двенадцатиперстная кишка
- Воспаление, например панкреатит
- Фиброз — e.грамм. вторичный по отношению к хроническому рецидивирующему панкреатиту
- Холелиты
- Слизистая оболочка желчного пузыря
«Функциональный» холестаз
Так называемый «функциональный» холестаз связан с дефектами транспортеров, необходимых для активного транспорта желчных кислот в канальцы, хотя недавние данные показывают, что даже при структурных проблемах холестаз является результатом подавления транспортеров. Они зависят от АТФ, и выведение является лимитирующим этапом метаболизма билирубина. E.грамм. Na / K АТФаза. Функциональный холестаз может возникать, если лекарства, гормоны, цитокины, эндотоксины или избыток свободных жирных кислот (токсичность жирных кислот) мешают переносчикам гепатоцитов, ответственным за экскрецию билирубина (MRP2).
Переносчики гепатоцитов
ТранспортерыСчитается, что изменения в транспортерах гепатоцитов являются основными факторами, опосредующими гепатоцеллюлярный холестаз. Некоторые переносчики присутствуют на холангиоцитах, хотя в настоящее время о них мало что известно (например,грамм. захват солей желчных кислот из желчи происходит через апикальный или просветный натрий-зависимый переносчик солей желчи; экскреция в кровь через белок 3, связанный с множественной лекарственной устойчивостью, на холангиоцитах может играть роль в возвращении солей желчных кислот в системный кровоток во время холестаза).
Поглощение синусоидальной или базолатеральной мембраной (из крови)
Следующие транспортеры расположены в синусоидальном или базолатеральном аспекте гепатоцитов крови и забирают вещества из крови в гепатоциты.
- Котранспортер таурохолата натрия (Ntcp): транспортер, опосредованный натрийзависимым носителем, поглощает конъюгированные желчные кислоты (> 80% таурохолата) с натрием и меньше (<50%) неконъюгированных желчных кислот (например, холата). Движущая сила, необходимая для этого транспортера, обеспечивается базолатеральной (синусоидальной) Na / K-АТФазой. Лекарства и гормоны могут влиять на эту Na / K-АТФазу и уменьшать отток желчи (что приводит к холестазу). Липополисахарид и воспалительные цитокины, такие как TNFα и IL-1, могут подавлять экспрессию Ntcp и Na / K АТФазы более чем на 90 и 50% соответственно, что приводит к «функциональному» холестазу при сепсисе.Перевязка желчных протоков также снижает эти переносчики.
- Органические анион-транспортирующие полипептиды семейства (OATP): они отвечают за опосредованное натрий-носителем поглощение неконъюгированных желчных кислот, бромсульфалеина (BSP; краситель, используемый в тестах функции печени), конъюгированного (и, возможно, неконъюгированного) билирубина и органических анионы. Активность этого переносчика подавляется перевязкой желчных протоков и цитокинами («функциональный» холестаз сепсиса). Функция этих переносчиков включает обмен анионов с бикарбонатом и восстановленным глутатионом (высокие внутриклеточные концентрации восстановленного глутатиона стимулируют захват ОАТФ), а некоторые могут работать в противоположном направлении при высоких внутриклеточных концентрациях некоторых белков (служащих для избавления от потенциально опасных соединений. , при необходимости), т.е. отвечает за регургитацию желчных кислот и «конъюгированного билирубина» обратно в кровь при холестазе.
- Белки 3 и 4, связанные с множественной лекарственной устойчивостью (MRP3, MRP4): они участвуют в оттоке желчных кислот из гепатоцитов в кровь (регургитация) и являются защитным механизмом против накопления желчных кислот внутриклеточно, поскольку они токсичны. (эмульгировать мембраны). MRP-3 обычно экспрессируется в низких концентрациях, но индуцируется при определенных условиях, таких как наследственные дефекты канальцевых транспортных белков (синдром Дубина Джонсона) или билиарный цирроз печени у людей.MRP-4 участвует в секреции восстановленного глутатиона (GSH) и моноанионных солей желчных кислот.
- Другие переносчики : Неконъюгированный билирубин и жирные кислоты поглощаются пока еще неизвестными переносчиками (семейство ОАТФ может частично участвовать в захвате неконъюгированного билирубина). Поглощение жирных кислот зависит от натрийзависимых механизмов.
Существуют и другие механизмы переноса, например пассивная ионная диффузия. Некоторые неконъюгированные желчные кислоты захватываются этим механизмом.
Выведение в канальцы (желчь)
Образование и отток желчи в значительной степени обусловлены экскрецией солей желчных кислот, которые осмотически активны и создают градиент концентрации, за которым следует вода, позволяя выводить жидкую желчь (так называемый поток, зависимый от желчных солей). Секреция желчных кислот связана с выведением электролитов, натрия, хлорида и калия. Также существует не зависящий от солей желчных солей поток желчи, который стимулируется бикарбонатно-хлоридным обменником, который активно переносит бикарбонат в желчь в обмен на поглощение хлоридов.Последний обменник также обнаружен в холангиоцитах. Неконъюгированные соли желчных кислот, такие как урсодезоксихолат (который используется для лечения некоторых холестатических состояний), способствуют зависимому от солей желчных потоку через стимуляцию этого переносчика.
Активное выведение соединений в желчевыводящие каналы является этапом, ограничивающим скорость образования желчи. Выведение осуществляется следующими АТФ-зависимыми переносчиками, которые, в отличие от некоторых синусоидальных переносчиков, работают только в одном направлении (то есть выведение растворенных веществ в желчь, а не наоборот).
- Насос для отвода желчных солей (BSEP): Этот натрий-независимый транспортер выводит соли желчных кислот и является основной силой, обеспечивающей отток желчи, зависящий от солей желчных кислот.
- Белок 2, связанный с множественной лекарственной устойчивостью (MRP2): Он транспортирует конъюгированный билирубин и конъюгированные соли желчных кислот в желчь и способствует независимому от солей желчи оттоку желчи. Это также переносчик, который выделяет органические кислоты, не являющиеся желчными кислотами, например BSP. Этот переносчик отсутствует при синдроме Дубина-Джонсона у людей и подавляется цитокинами и обструкцией желчных протоков.
- Ген множественной лекарственной устойчивости-1 (MDR1, P-гликопротеин): переносит инородные вещества (лекарства), органические катионы и цитотоксины в желчь.
Дефекты в этих транспортерах возникают в следующих ситуациях:
- Перевязка желчных протоков (внепеченочный холестаз): накопление солей желчных кислот повреждает гепатоциты, поэтому были разработаны защитные механизмы для уменьшения поглощения желчных солей за счет подавления Ntcp, основного транспортера захвата желчных солей на синусоидальной поверхности.К сожалению, один из транспортеров солей желчных кислот (и билирубина) на канальцевой мембране также заметно подавляется, предотвращая выведение накапливающихся солей желчных кислот. Семейство ОАТФ также уменьшается, что способствует гипербилирубинемии.
- Эндотоксины и воспалительные цитокины : Они влияют на натрий-зависимое поглощение желчных солей (Ntcp, обменник натрия / калия), а также на желчный солевой (BSEP) и независимый (MRP2) поток желчи. Бикарбонат / хлоридный обменник также страдает, ухудшая дефекты независимого от солей желчных водотоков.Это приводит к так называемому «функциональному» холестазу, который может не стимулировать заметное увеличение индуцируемых или «холестатических» ферментов, ЩФ и ГГТ (которые повышаются до высоких уровней при внепеченочном холестазе).
Лабораторная диагностика
Следующие лабораторные данные помогают определить наличие холестаза у животного:
- Гипербилирубинемия (больше конъюгированных, чем неконъюгированных)
- Билирубинурия : Конъюгированный (прямой) билирубин растворим в воде и быстро появляется в моче (избыточный для УЗИ у собак, вероятно, у хорьков, и ненормальный у других видов, независимо от УЗИ).
- Часто непропорционально увеличивается индуктивность ферментов утечки (ALP и GGT будут выше, чем ALT и AST)
- Обратите внимание, что воспалительные заболевания (такие как хронический / хронический активный гепатит) могут вызывать клеточное повреждение и сопутствующий холестаз из-за отека и / / фиброза. Паттерны ферментов при этих заболеваниях могут быть весьма неоднородными.
- Аномальное всасывание витамина К , ведущее к нарушениям гемостаза: всасывание жирорастворимых витаминов зависит от эмульгирования жиров желчными кислотами в кишечнике.Уменьшение оттока желчи приводит к снижению всасывания этих жирорастворимых витаминов, особенно витамина К. Витамин К необходим для активации факторов свертывания крови II, VII, IX и X и ингибиторов, протеина С и протеина S. ПВ (может быть затронуто до АЧТВ из-за короткого периода полувыведения FVII) и / или АЧТВ или низкой активности FVII: C. Может не наблюдаться клинического кровотечения.
- Гиперхолестеринемия : Считается, что это происходит из-за:
- Пониженный клиренс холестерина с желчью
- Повышенное производство липопротеинов, богатых холестерином:
- Холестатические заболевания связаны с производством аберрантного липопротеина (называемого липопротеином X).Исследования показали, что этот липопротеин играет роль во вмешательстве в петли отрицательной регуляторной обратной связи, которые обычно снижают синтез холестерина при высоких клеточных уровнях.
- Снижение клиренса липопротеинов
Наблюдения в Корнельском университете показывают, что более высокие концентрации холестерина наблюдаются при внепеченочном холестазе по сравнению с внутрипеченочным холестазом.
- Повышение концентрации желчных кислот : Содержание желчных кислот в сыворотке будет повышаться при холестазе, поэтому этот тест обычно используется в качестве индикатора функции печени при отсутствии холестаза (и, как правило, его не следует проводить у животных с признаками холестаза).
Внутрипеченочный холестаз — обзор
2.09.3.3.2 Холестаз, вызванный эндотоксинами
Внутрипеченочный холестаз является осложнением внепеченочных бактериальных инфекций. Липополисахарид (ЛПС), также называемый эндотоксином, является компонентом внешней клеточной стенки грамотрицательных бактерий, проникающих в печень через циркулирующую портальную кровь. ЛПС подавляет отток желчи и экскрецию органических анионов с желчью и в конечном итоге может привести к холестатическому повреждению печени. Уменьшение оттока желчи происходит в течение 6–12 ч после воздействия на грызунов однократной дозы ЛПС.Из-за быстрого снижения оттока желчи после LPS, одно правдоподобное объяснение состоит в том, что воздействие LPS приводит к измененной регуляции транспортеров, участвующих в желчном потоке, зависимом от соли желчи (Ntcp, Bsep) и не зависящем от соли желчи (Mrp2). Резкое снижение экспрессии и / или функции этих переносчиков может объяснять холестаз, индуцированный ЛПС. Ntcp снижается в везикулах базолатеральной плазматической мембраны, выделенных от крыс, получавших ЛПС, что свидетельствует о нарушении функции поглощения желчных кислот (Arab et al., 2009; Donner et al., 2007; Ли и др., 2000а; Болдер и др., 1997; Moseley et al., 1996). Экспрессия мРНК Ntcp начинает снижаться в печени крыс в течение 2 часов после воздействия LPS (Green et al., 1996), а к 16 часам уровни мРНК Ntcp и белка снижаются до 10% от контрольных крыс (Cherrington et al., 2004; Geier et al., 2003b; Lee et al., 2000a; Trauner et al., 1998). Подобное снижение мРНК Ntcp наблюдается у мышей после обработки LPS (Lickteig et al., 2007b). Кроме того, инкубация срезов печени человека с ЛПС in vitro снижает белок NTCP (Elferink et al., 2004).
Помимо нарушения базолатерального транспорта желчных кислот, отток таурохолата и таурохенодезоксихолата из везикул плазматической мембраны канальцев уменьшается в печени с эндотоксемией (Bolder et al., 1997; Moseley et al., 1996). Подавление мРНК и белка Bsep является вероятной причиной более низкой экскреции таурохолата с желчью после лечения ЛПС (Arab et al., 2009; Donner et al., 2007; Cherrington et al., 2004; Hojo et al., 2003; Lee et al., al., 2000a; Lickteig et al., 2007b; Vos et al., 1998). Обработанные LPS срезы печени человека обнаруживают сходным образом сниженный белок BSEP в отсутствие изменений в экспрессии мРНК, предполагая, что его подавление происходит посттранскрипционно у людей (Elferink et al. 2004).
Обработка ЛПС заметно снижает выведение с желчью не только желчных кислот, но и органических анионов немилосодержащих кислот. Снижение экспрессии мРНК и белка Mrp2 в печени грызунов, получавших LPS, отражается в снижении экскреции с желчью субстратов Mrp2, BSP и сульфолитохолилтаурина (Arab et al., 2009; Lickteig et al., 2007b; Черрингтон и др., 2004; Гейер и др., 2003b; Ходжо и др., 2003; Ли и др., 2000а; Вос и др., 1998; Bolder et al., 1997). Исследование временного курса, проведенное Kubitz et al. (1999) продемонстрировали, что у крыс Wistar выведение BSP с желчью нарушается уже через 3 ч после LPS. Этот функциональный дефицит предшествует снижению мРНК Mrp2, наблюдаемому через 12 часов. Несоответствие между мРНК и транспортной функцией происходит из-за быстрого извлечения белка Mrp2 из канальцевой мембраны в субапикальные пузырьки вскоре после лечения LPS.Хотя большая часть белка Mrp2 колокализуется с канальцевым белком плотного соединения zona occludins-1, окрашивание Mrp2 нечеткое и широкое и через 6 часов появляется в виде точек (Kubitz et al., 1999; Zinchuk et al., 2005). Перераспределение некоторых белков Mrp2 на базолатеральную поверхность может происходить через 48 ч после LPS (Zinchuk et al., 2005). Субапикальное окрашивание белка Mrp2 после LPS также наблюдается в срезах печени крыс (Elferink et al., 2004). Окрашивание MRP2 в срезах печени человека также снижается в ответ на LPS, но остается локализованным в канальце без заметного перераспределения на другие участки мембраны.Это говорит о том, что существуют межвидовые различия в регуляции и переносе белков в ответ на ЛПС. Кроме того, введение димерумовой кислоты, антиоксиданта, до индукции холестаза с помощью лечения LPS противодействует субклеточному распределению Mrp2, снижению скорости потока желчи и желчной экскреции GSH (Yano et al., 2010). Это исследование предполагает, что индуцированное LPS кратковременное быстрое извлечение Mrp2 с поверхности канальцев является результатом LPS-индуцированного окислительного стресса, в то время как долгосрочная регуляция транскрипции Mrp2 с помощью LPS, по-видимому, не зависит от внутриклеточного окислительно-восстановительного статуса (Yano et al. al., 2010). Тот же антиоксидант, димерумовая кислота, также отменяет повторное появление Mrp2 в срезах печени человека, инкубированных с LPS (Sekine et al., 2010). Радиксин является доминирующим белком из эзрин-радиксин-моэзин, семейства белков, сшивающих актиновые филаменты цитоскелета (F-актин) с интегральными мембранными белками. Эта функция регулируется статусом С-концевого фосфорилирования радиксина посредством перехода между активной (С-концевой фосфорилированный) и неактивной (С-концевой дефосфорилированный) формами (Ishikawa et al., 2001). У мышей, лишенных радиксина, развивается конъюгированная гипербилирубинемия из-за нарушения локализации Mrp2 на канальцевой поверхности гепатоцитов (Kikuchi et al., 2002). Параллельно с этим после лечения ЛПС уменьшается канальцевая локализация радиксина. В частности, общее количество активного радиксина (его фосфорилированная форма) и доля, коиммунопреципитирующая с Mrp2, снижается во время холестаза за счет LPS (Saeki et al., 2011). Это было предложено как посттранскрипционный регуляторный механизм функции Mrp2 во время холестаза.
Снижение экскреции органических анионов с желчью во время эндотоксемии также может быть результатом нарушения поглощения на базолатеральной поверхности. Поглощение BSP в везикулы базолатеральной плазматической мембраны крыс, получавших LPS, снижено (Bolder et al., 1997). BSP является субстратом Oatp 1a4 мыши и OATP1B1 / 1B3 человека (Seithel et al., 2007; van Montfoort et al., 2002). Как и ожидалось, обработка LPS снижает экспрессию мРНК Oatp1a1, 1a4 и 1b2 мыши и крысы (Donner et al., 2007; Lickteig et al., 2007b; Li and Klaassen, 2004; Cherrington et al., 2004; Гейер и др., 2003b; Hartmann et al., 2002). Сходным образом Oat2 мыши и Oat3 крысы снижаются после LPS (Lickteig et al., 2007b; Cherrington et al., 2004).
Аналогичным образом сообщалось об уменьшении мРНК и белка NTCP, BSEP OATP2 и снижении только белка MRP2 при неизменной экспрессии мРНК в биоптатах печени у пациентов с желтушным холестатом, вызванным воспалением (Zollner et al., 2001). Кроме того, у этих пациентов не сообщалось об изменениях экспрессии MRP3, MDR1, MDR3.
ЛПС активирует макрофаги, связывая толл-подобный рецептор 4 и CD14, что приводит к высвобождению медиаторов воспаления, которые стимулируют различные реакции в гепатоцитах. Решающая роль воспаления в опосредовании регуляции гепатобилиарных транспортеров после воздействия ЛПС была установлена в исследованиях, в которых дексаметазон давали крысам, получавшим ЛПС. Дексаметазон — сильнодействующее противовоспалительное и иммунодепрессивное средство, блокирующее высвобождение цитокинов. Дексаметазон восстанавливает экспрессию мРНК Oatp1a1, Oatp1a4, Ntcp, Bsep и Mrp2 в печени крыс с эндотоксемией (Cherrington et al., 2004; Кубиц и др., 1999). Введение IL-6 снижает уровни мРНК Ntcp, Oatp1, Mrp2, MRP3 и Bsep в печени крыс (Siewert et al., 2004). Те же авторы показали, что эти изменения в экспрессии мРНК не наблюдаются у мышей IL-6 KO. Эти находки дают начальные ключи к разгадке сигнальных путей, управляющих LPS-опосредованной регуляцией транспортеров захвата и оттока. Недавно исследования с использованием мышей с нокаутом лимфоцитов T, B или T / B продемонстрировали, что обработка LPS подавляет экспрессию мРНК Bsep и Oct1 в печени, и что это снижение экспрессии генов отменяется потерей T, но не B-клеток (Bodeman et al., 2013). Кроме того, те же самые авторы описали, что отсутствие Т-клеток увеличивает экспрессию мРНК Mrp2, тогда как дефицит В-клеток ослабляет снижение экспрессии мРНК Oatp1a4 у мышей, получавших LPS. На Oatp1a1, Oatp1b2, Ntcp и Mrp3 в значительной степени не влиял дефицит Т- или В-клеток. Что касается медиаторов воспаления в этих моделях мышей, то дефицит лимфоцитов изменяет базальный и воспалительный IL-6, но не влияет на экспрессию мРНК TNF-a или IL-1b (Bodeman et al., 2013).
Гипертермия рассматривается как возможное вмешательство для лечения внутрипеченочного холестаза.Bolder et al. (2006, 2002) сообщили, что нагревание мышей в течение 2 часов перед инъекцией LPS предотвращает снижение оттока желчи и экскреции желчных кислот с желчью. Кроме того, более высокая температура тела частично восстанавливает выведение BSP (Bolder et al. 2006, 2002). Тепловой стресс частично или полностью подавляет снижение белков Bsep, Ntcp и Mrp2, вызванное LPS. Снижению уровней мРНК Mrp2 также препятствует тепловой стресс. Напротив, тепловой стресс не защищает от снижения мРНК Ntcp и Bsep.Поддержание экспрессии белков Ntcp и Bsep, вероятно, связано с индукцией белков теплового шока 25 и 70. В частности, Bsep и белок теплового шока 70 были коиммунопреципитированы из печени крыс, получавших LPS, что позволяет предположить, что за это отвечает опосредованная шаперонами защита Bsep для предотвращения его подавления (Bolder et al., 2006).
Экспрессия и функция печеночного Pgp снижаются во время острого введения LPS, при этом сообщается о значительном снижении Mdr1a, Mdr1b, Mdr2 и Spgp (Hartmann et al., 2005, 2001). Те же авторы также продемонстрировали, что введение IL-6 или IL-1β снижает экспрессию всех этих переносчиков, тогда как введение TNF-α вызывает небольшое увеличение мРНК Mdr1b и подавление экспрессии мРНК Mdr1a, Mdr2 и Spgp (Hartmann et al. ., 2001). Снижение экспрессии Pgp с помощью LPS было связано с функциональным дефицитом, о чем свидетельствует снижение экскреции с желчью доксорубицина (Hartmann et al., 2005) и Rhodamine 123 (Tomita et al., 2010), двух типичных субстратов для этого транспортера.
Интернет-научных публикаций
История болезни
11-летний мальчик, первый ребенок своих здоровых не кровных родителей, обратился к нам с жалобами на зуд, желтуху, темную мочу и периодический бледный стул. Не было в анамнезе лихорадочного заболевания / приема лекарств или семейного анамнеза заболеваний печени. Год назад у него был аналогичный эпизод желтухи, который длился один месяц, в течение которого он получил симптоматическое лечение.Функциональные тесты печени, проведенные во время этого предыдущего эпизода, показали конъюгированную гипербилирубинемию и повышенный уровень щелочной фосфатазы (900 МЕ). Между эпизодами у ребенка не было симптомов. Он был здоров, нормальный рост и развитие. При осмотре у ребенка появилась желтуха, явный зуд, без бледности, отеков стопы и признаков авитаминоза. Признаков печеночной недостаточности не было. Печень просто пальпируется в правом подреберье с размахом 11 см. Селезенка не пальпируется. Остальная часть системного обследования не внесла вклад.Исследования показали, что гемоглобин составляет 12,1 г / дл при нормальном общем и дифференциальном подсчете. Общий билирубин составлял 19,53 мг% с прямым компонентом 14,06 мг%. Щелочная фосфатаза была повышена до 769 МЕ. Ферменты печени, включая АЛТ, АСТ и гамма-глутамилтранспептидазу (GGT: 8 Ед / л), были в пределах нормы. Общий белок сыворотки крови, соотношение альбуминов и глобулинов также были в норме. Протромбиновое время было увеличено, но реагировало на витамин К. Ультрасонография брюшной полости показала нормальную эхотекстуру печени. MRCP (магнитно-резонансная холангиопанкреатограмма) была нормальной.Вирусные маркеры гепатита A, B и C были отрицательными, а церулоплазмин сыворотки (20 мг / дл) был в пределах нормы. Принимая во внимание клинические и биохимические данные, была рассмотрена возможность рецидивирующего холестаза, и была выполнена биопсия печени. Биопсия показала сохранившуюся лобулярную архитектуру с выраженным холестазом внутри гепатоцитов с легкими воспалительными клеточными инфильтратами (рис. 1).
Рисунок 1
Рисунок 1: Биопсия печени, показывающая дольки печени с внутрипеченочным холестазом и инфильтратами воспалительных клеток
Диагноз BRIC поставлен на основании клинико-лабораторных показателей.Пациент лечился симптоматически, и в течение 4 недель ему стало лучше, показатели функции печени нормализовались. Через 1 год у ребенка не было симптомов.
Обсуждение
BRIC был описан Summerskill и Walshe в 1959 году как повторяющиеся эпизоды желтухи и зуда. ( 1 ) Это менее тяжелая форма наследственных синдромов холестаза. BRIC-1 и 2 — это доброкачественная рецидивирующая форма FIC-1 и 2 (семейный внутрипеченочный холестаз).Существует три формы BRIC со схожим фенотипом. BRIC-1 и BRIC-2 передаются как аутосомно-рецессивные заболевания. BRIC-1 / PFIC-1 (PFIC-прогрессирующий семейный внутрипеченочный холестаз) из-за мутаций аминофосфолипидной флиппазы ATP8B1, расположенной на хромосоме 18q21 ( 3 ). BRIC-2 / PFIC-2 из-за мутаций в насосе экспорта солей желчных кислот BSEP / ABCB11, расположенном на хромосоме 2q24 ( 4 ). Третья форма, не связанная ни с 18q21, ни с 2q24, существует и передается как аутосомно-доминантное заболевание ( 5 ).BRIC проявляется в раннем возрасте, холестазу предшествует сильный кожный зуд, недомогание, вялость, изредка появляется эритематозная сыпь. Продолжительность холестаза составляет от 2 до 24 недель ( 1 ), но описаны более длительные приступы и прогрессирование до ПСВС-1. Интенсивность и продолжительность промежуточных периодов непредсказуемо меняются до спонтанного разрешения ( 2 ). Между приступами больные здоровы. Сопутствующие симптомы включают анорексию, потерю веса, рвоту, усталость, темную мочу и бледный стул.Физикальное обследование обычно без особенностей. Признаком заболевания является холестаз — повышенный билирубин, желчные кислоты и щелочная фосфатаза — при нормальном G-GT. Функциональные пробы печени между приступами в норме ( 6 ). Гистологически — канальцевый холестаз, некоторая степень портального гепатита и фиброза. Диагноз был основан на следующих диагностических критериях для BRIC: а) По крайней мере, два эпизода желтухи, разделенные перерывом без симптомов, продолжающимся от нескольких месяцев до лет.(б) Лабораторные значения соответствуют внутрипеченочному холестазу. (c) Тяжелый зуд, вторичный по отношению к холестазу. (d) Гистология печени, демонстрирующая центрилобулярный холестаз. (e) Нормальные внутрипеченочные и внепеченочные желчные протоки, подтвержденные холангиографией. (f) Отсутствие факторов, которые, как известно, связаны с холестазом (например, лекарства, беременность) ( 7 ). BRIC-1 иногда связаны с внепеченочными проявлениями, такими как диарея, мальабсорбция желчных кислот, панкреатит и нефролитиаз, что можно объяснить широкой экспрессией FIC1 в этих тканях.( 8 ) BRIC-2, по-видимому, связан с риском развития желчных камней. BRIC не всегда так доброкачественен, иногда он может прогрессировать до ПСВС и более позднего цирроза. ( 9 ) Возвращение аппетита часто является первым признаком разрешения, за которым следует кожный зуд. Желтуха постепенно уменьшается, а затем проходит. ( 7 )
Неизвестно какое-либо конкретное лечение, которое могло бы предотвратить или ограничить продолжительность приступов. Таким образом, ключом к лечению является облегчение сильного зуда и других симптомов до тех пор, пока приступы не исчезнут спонтанно.Неизлечимый зуд плохо реагирует на антигистаминные препараты, холестирамин, урсодезоксихолевую кислоту ( 10 ) или S-аденозилметионин и рифампицин. ( 11 ) Плазмаферез / MARS (система рециркуляции молекулярных адсорбентов) следует рассматривать в трудноустойчивых случаях. Отведение желчных путей не очень убедительно. Трансплантация печени может быть показана при неизлечимом зуде, в частности, когда BRIC прогрессирует до ПСВХ.
Переписка на
Доктор.Арулпракаш. Сюжет. №: 119 А, Первая главная дорога, Второй перекресток, расширение Лакшми нагар, Порур, Ченнаи: 600116. Тамилнаду Индия Телефон: 09962033234 Эл. Почта: [email protected]
Список литературы
1. Summerskill WHJ, Walsh JM. Доброкачественная рецидивирующая внутрипеченочная механическая желтуха. Ланцет, 1959; 1: 686-90.2. Аль Дрис К., аль Забен А., аль Амин А., Абдулла А. Доброкачественный рецидивирующий внутрипеченочный холестаз у саудовского ребенка. Ann of Trop Paediatr, 1999; 19: 215-7.



 В печени и кишечнике могут образовываться и третичные желчные кислоты (сульфолитохолевая, урсодезоксихолевая), которые, так же как и вторичные, участвуют в энтерогепатической циркуляции.
В печени и кишечнике могут образовываться и третичные желчные кислоты (сульфолитохолевая, урсодезоксихолевая), которые, так же как и вторичные, участвуют в энтерогепатической циркуляции.