Минздрав утвердил новые правила регистрации медицинских изделий — Российская газета
Разрешение Росздравнадзора на госрегистрацию медизделий при ввозе их в Россию с нового года можно будет оформить только в электронном виде, на сайте ведомства в тестовом режиме запущен специальный сервис, через который уже можно подать заявление. Новые правила утвердил минздрав.
В них говорится, что с 1 января 2021 года разрешение Росздравнадзора потребуется на все ввозимые медизделия, кроме программного обеспечения. Получить его должны в том числе те производители, которые зарегистрированы на территории России, но выпускают товар за границей. Теперь в течение пяти рабочих дней с момента обращения оно поступит в личный кабинет заявителя на Едином портале госуслуг, подписанное усиленной электронной подписью ведомства. Срок действия документа увеличен до одного года (ранее он выдавался на 6 месяцев), однако по-прежнему им предоставляется право только однократного ввоза медизделия на территорию страны для государственной регистрации. В течение двух дней после оформления сведения о нем также появятся в Реестре выданных разрешений в автоматизированной информационной системе Росздравнадзора, где размещению подлежит только открытая часть информации, которая не охраняется законом о коммерческой тайне. Помимо этого в реестр вносятся уведомления об отказе, причем перечень оснований увеличился в два раза. К ним относятся — предоставление неполных или недостоверных сведений о производителе и самом медизделии, ограничение на импорт ввозимого в страну товара, сведения о нежелательных или побочных эффектах, не указанных в инструкции, неправильно заполненное заявление. Отказ придет и в том случае, если на территории России товар не считается медизделием. До конца этого года электронный формат заявления — рекомендуемый. Сам электронный сервис для его подачи размещен на сайте Росздравнадзора в разделе «Электронные сервисы», подраздел «Регистрация медицинских изделий» и «Ввоз медицинских изделий». Услуга останется бесплатной.
Услуга останется бесплатной.
Какие реестры Росздравнадзора необходимо использовать в работе и где их найти
Проверяем легальность лекарств
Наиболее востребованными в повседневной практике аптекарей стали сервисы по проверке качества лекарственных препаратов и медицинских изделий.
В конце 2019 года изменились правила поступления лекарств в гражданский оборот. Вместо привычных деклараций и сертификатов качество препаратов стали подтверждать непосредственно в Росздравнадзоре. Лекарства могут легально обращаться на рынке с момента появления данных о конкретных сериях в одном из реестров:
- «Сведения о лекарственных средствах, вводимых в гражданский оборот в Российской Федерации»1 — для лекарственных препаратов;
- «Реестр разрешений на ввод в гражданский оборот иммунобиологических лекарственных препаратов»2 — для иммунобиологических препаратов.
Мониторим брак
Решения по качеству и обращению аптечных товаров Росздравнадзор принимает в форме писем, которые размещает в одноименных разделах своего сайта.
Информация о забраковке лекарств аккумулируется в специальном сервисе «Поиск изъятых из обращения лекарственных средств», попасть на который можно по ссылке https://roszdravnadzor.gov.ru/services/lssearch. Используя простой поиск, можно по названию, серии или производителю провести ревизию аптечного ассортимента на наличие запрещенных к продаже препаратов.
Для оптимизации работы можно воспользоваться расширенным поиском, который позволяет искать по нескольким критериям одновременно. Например, вводить названия, серии и производителей только тех товаров, которые есть в аптеке. Поля для ввода дат позволяют получить данные о приостановке или изъятии недоброкачественных, фальсифицированных или контрафактных лекарств за конкретный период. Сервис также позволяет выгружать базу данных в удобном табличном формате. В умелых руках программистов такая база может быть легко интегрирована в аптечную систему и упростит сотрудникам процессы по отслеживанию брака.
Проверка качества препаратов не ограничивается только решениями о браке. Используя сервис «Поиск писем по контролю качества лекарственных средств», аптекари могут получать оперативную информацию об изменениях дизайнов упаковок препаратов, о результатах экспертизы отдельных серий лекарств в ходе выборочного контроля, другую важную информацию об их обращении.
Для поиска запрещенных к обращению медицинских изделий предусмотрен электронный ресурс «Информационные письма о медицинских изделиях» (https://roszdravnadzor.gov.ru/services/unreg). С помощью данного сервиса фармработники могут своевременно выявить и переместить в карантин незарегистрированные, недоброкачественные, фальсифицированные и контрафактные медизделия.
Осуществляем фармаконадзор
Помимо качества аптечной продукции фармацевты и провизоры должны уделять внимание вопросам безопасности лекарств и медицинских изделий. Обязанность по осуществлению фармаконадзора в отношении указанных групп аптечных товаров предусмотрена ФЗ № 323 «Об основах охраны здоровья граждан» и ФЗ № 61 «Об обращении лекарственных средств».
С новыми данными по безопасности шприцев, тонометров и прочих медизделий аптечные работники могут ознакомиться в разделе сайта «Информационные письма о медицинских изделиях». Данные о побочных реакциях на лекарственные препараты служба публикует в специальном подразделе «Мониторинг эффективности и безопасности лекарственных препаратов»
Знания о безопасности медицинских товаров можно и нужно использовать при аптечном консультировании покупателей.
Часто аптеки становятся своеобразным «входным» окном для коммуникации с пациентами в вопросах эффективности лекарств. Правилами фармаконадзора предполагается, что аптеки должны не только ретранслировать медработникам и фармпроизводителям жалобы, поступающие от пациентов на действие препаратов, но и самостоятельно фиксировать в учетной системе Росздравнадзора или направлять карты-извещения в службу. Для передачи данных нужно пройти несложную регистрацию в автоматизированной системе «Фармаконадзор»
Разрешительные сервисы
В прошлом году Росздравнадзор продолжил диджитализацию разрешительных сервисов. В первую очередь нововведения касаются вопросов дистанционной торговли лекарствами. Заявление по государственной услуге «Разрешение на дистанционную торговлю лекарственными препаратами» можно подать на официальном сайте Росздравнадзора в разделе «Электронные сервисы» (https://roszdravnadzor.gov.ru/services). Принятые территориальными органами разрешения публикуются в «Реестре выданных разрешений на дистанционную торговлю лекарственными препаратами»
С переходом на реестровую модель лицензирования возрастает значение «Единого реестра лицензий». С нового года лицензирующие органы перестали выдавать бумажные лицензии, заменив их внесением сведений в единый реестр. От корректности внесенных в реестр данных зависит их интеграция с системой мониторинга движения лекарственных препаратов (ФГИС МДЛП). Также с помощью данного ресурса нужно будет проверять актуальность фармлицензии у дистрибьютора.
Без использования в повседневной практике «Государственного реестра медицинских изделий и организаций (индивидуальных предпринимателей), осуществляющих производство и изготовление медицинских изделий»
Особое внимание необходимо уделять подразделу «Наименование медицинского изделия» реестровой записи о конкретном товаре. Отсутствие конкретного вида медизделия в данном реестре при контроле рассматривается как нарушение, а сам товар признается незарегистрированным медизделием.
Ресурсы для контроля
Информационное обеспечение сайта позволяет значительно упростить подготовку к проверочным мероприятиям надзорного органа.
В разделе «Контроль и надзор»7 размещаются актуальные планы по ежегодному контролю субъектов фармацевтического рынка.
Реформа контрольно-надзорной деятельности изменила подходы к формированию планов проверок. Попадание той или иной аптеки в план зависит от присвоенной ей категории риска, рассчитать который можно самостоятельно с помощью электронного калькулятора8, а затем проверить в реестре9.
Также на сайте публикуется «Перечень нормативных правовых актов (их отдельных положений)»
____________________
1 https://roszdravnadzor.gov.ru/services/turnover.
2 https://roszdravnadzor.gov.ru/services/imblp.
3 https://roszdravnadzor.gov.ru/drugs/monitpringlp.
4 https://roszdravnadzor.gov.ru/services/npr_ais.
5 https://roszdravnadzor.gov.ru/services/ods.
6 https://roszdravnadzor.gov.ru/services/misearch.
7 https://roszdravnadzor.gov.ru/control.
8 https://roszdravnadzor.gov.ru/services/calculator.
9 https://roszdravnadzor.gov.ru/services/rom_reestr.
10 https://roszdravnadzor.gov.ru/services/prevention.
Росздравнадзор подготовил Памятку по приемке лекарств по новым правилам
Лекарственные препараты, поступающие в гражданский оборот после 29 ноября 2019 года, не сопровождаются документами, содержащими сведения о зарегистрированных декларациях о соответствии и выданных сертификатах соответствия.
Росздравнадзор подготовил Памятку по приемке лекарственных препаратов в связи с вступлением в действие с 29 ноября 2019 года нового порядка ввода лекарственных препаратов в гражданский оборот. С этого времени серии (партии) лекарственных препаратов, поступающих в гражданский оборот, не будут сопровождаться документами, содержащими сведения о зарегистрированных декларациях о соответствии и выданных сертификатах соответствия.
Поставка лекарств (за исключением иммунобиологических лекарственных препаратов: вакцин, сывороток, иммуноглобулинов, токсинов и антитоксинов) может сопровождаться следующими документами:
– паспортом (сертификатом) производителя о соответствии серии (партии) лекарственного препарата требованиям нормативной документации;
– подтверждением уполномоченного лица производителя лекарственных средств (для препаратов, произведенных на отечественных производственных площадках) или ответственного лица организации, осуществляющей ввоз лекарственного препарата в Российскую Федерацию и уполномоченной иностранным производителем лекарственных средств, соответствия ввозимого лекарственного препарата требованиям, установленным при его государственной регистрации.
Поставка иммунобиологических лекарственных препаратов (вакцин, сывороток, иммуноглобулинов, токсинов и анатоксинов) может сопровождаться копией разрешения Росздравнадзора на ввод в гражданский оборот, заверенной электронной цифровой подписью.
Законность нахождения серии (партии) лекарственного препарата проверяется через официальный сайт Росздравнадзора www.roszdravnadzor.ru. Для этого на сайте ведомства необходимо перейти в раздел «Лекарственные средства» и в рубрике «Электронные сервисы» найти сервис: «Сведения о ЛС, поступивших в гражданский оборот в РФ». Поиск возможен по нескольким реквизитам, включая торговое наименование, номер серии, производитель, страна производства. Сведения о разрешениях Росздравнадзора на ввод в гражданский оборот серии (партии) иммунобиологического лекарственного препарата также размещаются на сайте Росздравнадзора в рубрике «Электронные сервисы»/ «Сведения о ЛС, поступивших в гражданский оборот в РФ».
Источник: https://pharmvestnik.ru/content/news/Roszdravnadzor-podgotovil-pamyatku-po-priemke-lekarstv-po-novym-pravilam.html
Письмо Росздравнадзора от 28.11.2019 № 01И-2906/19 . Таможенные документы
Федеральная служба по надзору в сфере здравоохранения в связи с принятием постановления Правительства Российской Федерации от 26 ноября 2019 года N 1510 «О порядке ввода в гражданский оборот лекарственных препаратов для медицинского применения» направляет разъяснения по вопросам ввода в гражданский оборот лекарственных препаратов для медицинского применения.
М.А.Мурашко
Приложение
к письму Росздравнадзора
от 28.11.2019 N 01И-2906/19
О ВВОДЕ В ГРАЖДАНСКИЙ ОБОРОТ
ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ
В СВЯЗИ С ВСТУПЛЕНИЕМ В ДЕЙСТВИЕ С 29 НОЯБРЯ 2019 ГОДА
ФЕДЕРАЛЬНОГО ЗАКОНА ОТ 28 НОЯБРЯ 2018 Г. N 449-ФЗ
«О ВНЕСЕНИИ ИЗМЕНЕНИЙ В ОТДЕЛЬНЫЕ ЗАКОНОДАТЕЛЬНЫЕ АКТЫ
РОССИЙСКОЙ ФЕДЕРАЦИИ ПО ВОПРОСУ ВВОДА В ГРАЖДАНСКИЙ
ОБОРОТ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ»
Процедура ввода в гражданский оборот лекарственных средств в соответствии с требованиями Федерального закона от 28. 11.2018 N 449-ФЗ вводится в действие с 29 ноября 2019 года.
11.2018 N 449-ФЗ вводится в действие с 29 ноября 2019 года.
Начиная с этой даты, не требуется получения сертификатов соответствия и регистрации деклараций о соответствии.
В целях реализации действия Федерального закона от 29 ноября 2018 г. N 449-ФЗ «О внесении изменений в отдельные законодательные акты Российской Федерации по вопросу ввода в гражданский оборот лекарственных препаратов для медицинского применения» принято постановление Правительства Российской Федерации от 26 ноября 2019 года N 1510 «О порядке ввода в гражданский оборот лекарственных препаратов для медицинского применения».
Указанным постановлением утверждены:
Правила предоставления документов и сведений о лекарственных препаратах для медицинского применения, вводимых в гражданский оборот;
Правила выдачи протокола испытаний о соответствии первых трех серий или партий лекарственного препарата для медицинского применения (за исключением иммунобиологического лекарственного препарата), впервые произведенного в Российской Федерации или впервые ввозимого в Российскую Федерацию, показателям качества, предусмотренным нормативной документацией;
Правила выдачи разрешения на ввод в гражданский оборот серии или партии иммунобиологического лекарственного препарата, выдачи заключения о соответствии серии или партии иммунобиологического лекарственного препарата требованиям, установленным при его государственной регистрации;
Правила принятия решения о прекращении гражданского оборота серии или партии лекарственного препарата для медицинского применения.
Все серии (партии) лекарственных препаратов, в отношении которых сведения не введены в АИС Росздравнадзора до 29.11.2019, должны проходить процедуру ввода в гражданский оборот в соответствии с Федеральным законом от 28.11.2018 N 449-ФЗ и постановлением Правительства Российской Федерации от 26 ноября 2019 года N 1510.
Ввод в гражданский оборот лекарственных препаратов осуществляется после внесения сведений в АИС Росздравнадзора.
С 29 ноября 2019 года организации, осуществляющие производство лекарственных препаратов в Российской Федерации или ввоз лекарственных препаратов в Российскую Федерацию, вносят сведения в личный кабинет внешнего информационного ресурса АИС Росздравнадзора.
Если у заявителя уже есть личный кабинет в АИС Росздравнадзора, то дополнительной регистрации НЕ ТРЕБУЕТСЯ.
Внимание!
Для фармацевтических субстанций сохраняется ввод данных в объеме, предусмотренном приказом Росздравнадзора от 07.08.2015 N 5539.
Для лекарственных препаратов (за исключением иммунобиологических лекарственных препаратов) вход в систему Росздравнадзора осуществляется по ссылке на сайте Росздравнадзора: http://roszdravnadzor.ru/services/vk_ais.
Для получения разрешения на ввод в гражданский оборот иммунобиологического лекарственного препарата необходимо заполнить электронную форму подачи заявления на получение государственной услуги с использованием Единой системы идентификации и аутентификации (ЕСИА), размещенную в Личном кабинете на главной странице официального сайта Росздравнадзора: http://www.roszdravnadzor.ru/
1. Порядок ввода сведений в АИС Росздравнадзора для всех
лекарственных препаратов, кроме лекарственных препаратов,
впервые произведенных в Российской Федерации или впервые ввезенных
в Российскую Федерацию, и иммунобиологических лекарственных
препаратов (вакцин, сывороток, иммуноглобулинов, токсинов
и антитоксинов, аллергенов)
Перед вводом в гражданский оборот лекарственных препаратов осуществляется внесение сведений в АИС Росздравнадзора.
Для внесения сведений в АИС Росздравнадзора необходимо воспользоваться своей учетной записью в автоматизированной системе «Выборочный контроль». При отсутствии учетной записи следует в системе зарегистрироваться.
Описание работы с автоматизированной системой «Выборочный контроль» и переход к данной системе расположены на сайте Росздравнадзора в разделе «Электронные сервисы», сервис «Автоматизированная система «Выборочный контроль».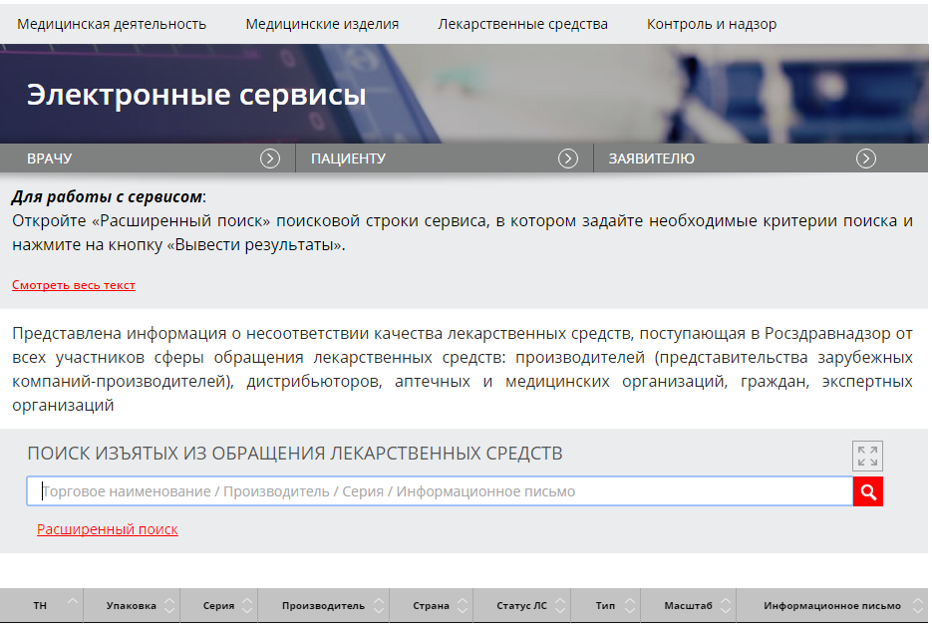
После регистрации в системе будет доступна форма внесения сведений о выпущенном лекарственном препарате с составом сведений, определенных Федеральным законом от 28.11.2018 N 449-ФЗ.
Ссылка на раздел сайта Росздравнадзора:
http://roszdravnadzor.ru/services/vk_ais
В перечень документов и сведений, предоставляемых заявителем, входят:
— сведения, позволяющие идентифицировать серию или партию лекарственного препарата, включающие помимо данных о лекарственном препарате сведения о производственных площадках, а также о фармацевтических субстанциях, из которой была произведена данная серия или партия лекарственного препарата.
Внимание!
Для обеспечения взаимодействия АИС Росздравнадзора с федеральной государственной информационной системой мониторинга движения лекарственных препаратов для медицинского применения необходимо при внесении сведений в АИС Росздравнадзора указывать 14-значный GTIN. В случае его отсутствия необходимо получить GTIN в Ассоциации автоматической идентификации GS1 (сайт: http://www.gs1ru.org) до 1 января 2020 года.
Производители перед вводом в гражданский оборот серии или партии лекарственного препарата представляют в АИС Росздравнадзора через личный кабинет для каждой серии или каждой партии лекарственного препарата:
— документ производителя, подтверждающий качество лекарственного препарата;
— подтверждение уполномоченного лица производителя соответствия лекарственного препарата требованиям, установленным при его государственной регистрации.
Импортеры перед вводом в гражданский оборот лекарственного препарата представляют в АИС Росздравнадзора через личный кабинет для каждой серии или каждой партии лекарственного препарата:
— сертификат производителя лекарственного средства, удостоверяющий соответствие ввозимого лекарственного препарата требованиям фармакопейной статьи, а в случае отсутствия фармакопейной статьи требованиям нормативной документации;
— подтверждение представителя импортера, уполномоченного иностранным производителем лекарственных средств, соответствия ввозимого лекарственного препарата требованиям, установленным при его государственной регистрации.
Внимание!
Внесение сведений в ручном режиме НЕВОЗМОЖНО. В случае отсутствия сведений в государственном реестре лекарственных средств, их неполноты, либо наличия ошибок, следует обращаться в техническую поддержку Росздравнадзора по адресу: rzn_support@ppr.ru.
2. Порядок ввода сведений в АИС Росздравнадзора
для впервые производимых в Российской Федерации
или впервые ввозимых в Российскую Федерацию
лекарственных препаратов
Впервые производимыми или впервые ввозимыми считаются лекарственные препараты, получившие регистрационные удостоверения после 28 ноября 2019 года.
Для внесения сведений о впервые производимых или впервые ввозимых лекарственных препаратах в АИС Росздравнадзора необходимо воспользоваться своей учетной записью в автоматизированной системе «Выборочный контроль». При отсутствии учетной записи следует зарегистрироваться в системе.
Описание работы с системой и переход к системе расположены на сайте Росздравнадзора в разделе «Сервисы», сервис «Автоматизированная система «Выборочный контроль» http://roszdravnadzor.ru/services/vk_ais.
После регистрации в системе будет доступна форма внесения сведений о выпущенном лекарственном препарате с составом сведений, определенных Федеральным законом от 28.11.2018 N 449-ФЗ.
В АИС Росздравнадзора в соответствии с частью 4 статьи 52.1 Федерального закона от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» предусмотрен функционал внесения протоколов испытаний на первые три серии (партии) лекарственного препарата, впервые произведенного в Российской Федерации или впервые ввозимого в Российскую Федерацию (для внесения протоколов после ввода сведений о лекарственном препарате необходимо перейти во вкладку «Протокол испытаний для новых лекарственных препаратов по 3 сериям»).
В связи с тем, что контроль впервые ввозимого препарата могут осуществлять несколько дистрибьюторов, предусмотрена возможность прикрепления протоколов в количестве более трех. Обязательным является проведение испытаний трех серий любым из дистрибьюторов, ввозящих препарат.
Обязательным является проведение испытаний трех серий любым из дистрибьюторов, ввозящих препарат.
В соответствии с частью 4 статьи 52.1 Федерального закона от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств» при вводе в гражданский оборот первых трех серий (партий) лекарственного препарата, впервые производимого или впервые ввозимого в Российскую Федерацию, предоставляется протокол испытаний о соответствии показателям качества, предусмотренным нормативной документацией, полученный в ФГБУ «НЦЭСМП» Минздрава России или ФГБУ «ИМЦЭУАОСМП» Росздравнадзора.
Перечень филиалов ФГБУ «ИМЦЭУАОСМП» Росздравнадзора с контактными данными размещен на официальном сайте ФГБУ «ИМЦЭУАОСМП» Росздравнадзора www.fgu.ru.
Внимание!
До внесения протокола испытаний на серию препарата, имеющего регистрационное удостоверение, датированное после 28 ноября 2019 года, сведения о данной серии (партии) лекарственного препарата будут находиться в статусе «Ожидание протокола». Статус «Опубликовано» появится только после прикрепления соответствующего протокола.
Статус «Ожидание протокола» означает, что решение по вводу в ГО для серии (партии) ЛП не принято. Статус «Опубликовано» подтверждает внесение сведений в систему.
3. Порядок ввода сведений в АИС Росздравнадзора
для иммунобиологических лекарственных препаратов
(вакцин, сывороток, иммуноглобулинов, токсинов
и антитоксинов, аллергенов) и контроль иммунобиологических
лекарственных препаратов (далее — ИЛП)
Ввод в гражданский оборот ИЛП осуществляется после получения разрешения Росздравнадзора на ввод в гражданский оборот серии (партии) иммунобиологического лекарственного препарата.
Внимание!
Для подачи заявления на получение разрешения Росздравнадзора на ввод в гражданский оборот серии (партии) ИЛП юридическому лицу необходима регистрация на портале Госуслуг, наличие усиленной квалифицированной электронной подписи.
Используя логин и пароль Единой системы идентификации и аутентификации (ЕСИА) портала Госуслуг, заявитель — юридическое лицо (производитель или организация, осуществляющая ввоз ИЛП) входит в «ЛИЧНЫЙ КАБИНЕТ», расположенный в правом верхнем углу страницы сайта Росздравнадзора (http://roszdravnadzor. ru).
ru).
После авторизации и получения доступа к АИС заявителем (производителем или организацией, осуществляющей ввоз ИЛП) заполняется форма заявления, включающая сведения о ИЛП, прикрепляется заключение, которое выдано федеральным учреждением (ФГБУ «ИМЦЭУАОСМП» Росздравнадзора или ФГБУ «НЦЭСМП» Минздрава России), с прилагаемым к нему протоколом испытаний (файлы размещаются в виде отсканированных документов в формате pdf).
Заявление поступает на рассмотрение в Росздравнадзор.
Разрешение Росздравнадзора на ввод в гражданский оборот серии (партии) ИЛП или отказ в выдаче разрешения размещается в личном кабинете и публикуется в открытом доступе на сайте Росздравнадзора в разделе «Сервисы»/»Реестр разрешений Росздравнадзора на ввод в гражданский оборот серии (партии) ИЛП» в форме реестра с возможностью распечатки.
Форма разрешения на ввод в гражданский оборот в Российской Федерации серии или партии произведенного в Российской Федерации или ввозимого в Российскую Федерацию иммунобиологического лекарственного препарата и форма заключения о соответствии серии или партии иммунобиологического лекарственного препарата требованиям, установленным при его государственной регистрации, утверждаются приказом Росздравнадзора.
4. Представление в Росздравнадзор протокола испытаний,
проведенных в аккредитованной в соответствии с законодательством
Российской Федерации об аккредитации в национальной системе
аккредитации испытательной лаборатории (центре), на одну серию
лекарственного препарата конкретного производителя каждого
торгового наименования (с учетом лекарственной формы и дозировки),
поступившего в течение календарного года в гражданский
оборот, подтверждающего соответствие лекарственного
препарата требованиям нормативной документации
Частью 5 статьи 52.1 Федерального закона от 12.04.2010 N 61-ФЗ установлено, что ежегодно не позднее 1 февраля производители лекарственных средств или организации, осуществляющие ввоз лекарственных препаратов в Российскую Федерацию, представляют в федеральный орган исполнительной власти, осуществляющий функции по контролю и надзору в сфере здравоохранения, протокол испытаний поступившего в течение года в гражданский оборот лекарственного препарата конкретного производителя (на одну серию каждого торгового наименования с учетом лекарственной формы и дозировки), проводимых аккредитованными в соответствии с законодательством Российской Федерации об аккредитации в национальной системе аккредитации испытательными лабораториями (центрами).
Протоколы испытаний предоставляются в течение года на любую серию торгового наименования лекарственного препарата конкретного производителя с учетом лекарственной формы и дозировки, полученные в течение календарного года, в любой лаборатории, аккредитованной в национальной системе аккредитации, в том числе полученные в рамках выборочного контроля качества или федерального государственного надзора в сфере обращения лекарственных средств.
Предоставляются только протоколы испытаний лекарственных препаратов, проведенных по всем показателям нормативной документации.
Например:
В течение 2019 года организация произвела (ввезла) 100 серий препарата одного торгового наименования в 1 дозировке. Следовательно, необходимо провести испытания качества в аккредитованной лаборатории 1 любой серии из ввезенных за год.
Внимание!
Не требуется дополнительного предоставления протоколов при получении изменений в регистрационное досье на препарат, вступившие в действие течение календарного года.
В связи с вступлением в действие Федерального закона от 28.11.2018 N 449-ФЗ с 29.11.2019 до 1 февраля 2020 года в АИС Росздравнадзора должны быть представлены протоколы только на препараты, введенные в гражданский оборот с 29.11.2019 по 31.12.2019 включительно. При этом можно использовать любой протокол на серии, поступившие в гражданский оборот в 2019 году.
В личном кабинете заявителя предусмотрена вкладка «Протокол испытаний на одну серию в год» для ввода протокола испытаний на одну серию торгового наименования лекарственного препарата конкретного производителя (с учетом дозировки и формы выпуска) в год, предусмотренного частью 5 статьи 52.1 Федерального закона от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств».
В личном кабинете заявителя будет сформирован отчет по протоколам на одну серию в отношении лекарственных препаратов, введенных заявителем в гражданский оборот в течение текущего года.
Внимание!
После 1 февраля года, следующего за текущим, внесение дополнительных сведений будет возможным, но все препараты, на которые в установленное время не поступили протоколы испытаний, будут подкрашены красным цветом.
5. Требования к уполномоченному представителю дистрибьютора
В настоящее время Правилами надлежащей дистрибьюторской практики, утвержденными Решением Совета Евразийской экономической комиссии от 03.11.2016 N 80, установлено требование о наличии в организации, осуществляющей оптовую торговлю лекарственными средствами, системы качества.
Руководством организации назначается ответственное лицо, наделенное полномочиями и обязанностями для обеспечения внедрения и поддержания в актуальном состоянии системы качества.
В соответствии с Распоряжением Коллегии Евразийской экономической комиссии от 06.08.2019 N 136, уполномоченное иностранным изготовителем лицо — выступающее заявителем при оценке соответствия серийно выпускаемой продукции путем оформления доверенности или заключения договора в соответствии с законодательством государств — членов Евразийского экономического союза.
Таким образом, в рамках Федерального закона от 28.11.2018 N 449-ФЗ ответственность уполномоченного представителя дистрибьютора за качество ввозимых лекарственных препаратов должна оформляться в соответствующем договоре или доверенности от иностранного держателя регистрационного удостоверения, производителя.
В настоящее время отсутствуют требования к образованию и стажу работы указанного представителя дистрибьютора. Однако, из характера проводимых им работ и налагаемой ответственности, он должен обладать необходимой информацией и быть осведомленным по вопросам качества лекарственных препаратов и требований, предъявляемых к документации по качеству.
При наличии в договоре с иностранным производителем пунктов, определяющих ответственность дистрибьютора за принятие претензий по поставляемым товарам, приказом по организации может быть назначено лицо, ответственное за комплекс установленных мероприятий по приемке товара и подтверждение его качества.
Импортер может быть уполномочен посредством типовой доверенности или в соглашении по качеству с производителем, которое является неотъемлемой частью основного договора.
Иностранный производитель лекарственного препарата может уполномочить непосредственно конкретного представителя импортера (физическое лицо) или организацию, осуществляющую ввоз лекарственного препарата в России, а руководитель импортера локально выдает доверенность своему сотруднику.
Внимание!
При внесении сведений о лекарственных препаратах, поступающих в гражданский оборот, предусмотрено введение информации об уполномоченном (ответственном) лице производителя/импортера с внесением личных контактных данных и прикреплением документа, подтверждающего его полномочия. Данная информация будет автоматически отражаться при последующем вводе сведений. В случае изменения информации, необходимо внесение изменений в АИС Росздравнадзора.
6. Документы, подтверждающие качество
лекарственных препаратов, ввезенных на территорию
Российской Федерации
Особое внимание следует уделить вопросам соответствия сертификатов качества зарубежного производителя, поставляемых лекарственных препаратов, требованиям, установленным в Российской Федерации.
Важно соблюдение требований статьи 47 Федерального закона от 12.04.2010 N 61-ФЗ «Об обращении лекарственных средств»:
«В Российскую Федерацию можно ввозить лекарственные средства, качество которых подтверждено сертификатом производителя лекарственных средств, удостоверяющим соответствие ввозимых лекарственных средств требованиям фармакопейных статей либо в случае их отсутствия нормативной документации или нормативного документа.».
При отсутствии в сертификате производителя ряда показателей, отсутствующих в фармакопейных требованиях других стран, следует предусмотреть прохождение испытаний по данным показателям в российских испытательных лабораториях, аккредитованных в национальной системе аккредитации.
Подтверждение соответствия качества лекарственного препарата по любому показателю может осуществляться только в лаборатории, аккредитованной в установленном порядке.
Внимание!
В систему вводятся сертификаты на русском языке (переводы, заверенные в соответствии с внутренней системой документации), а также отсканированные оригиналы сертификатов зарубежного производителя.
Система ввода информации предусматривает возможность прикрепления нескольких файлов.
7. Подтверждение соответствия ввозимого лекарственного
препарата требованиям, установленным при его государственной
регистрации, уполномоченным лицом производителя лекарственных
средств или представителем организации, осуществляющей ввоз
лекарственного препарата в Российскую Федерацию и
уполномоченной иностранным производителем лекарственных
средств (далее — Подтверждение)
Предусмотренное частью 2 статьи 52.1 Федерального закона от 12.04.2010 N 61-ФЗ подтверждение должно содержать информацию, необходимую и достаточную для идентификации данной серии (партии) лекарственного препарата, а также для организации, при необходимости, испытаний качества образцов серии или партии данного лекарственного препарата требованиям нормативной документации, на основании которой данный лекарственный препарат был произведен и выпущен в гражданский оборот.
Рекомендуемый перечень информации, содержащейся в подтверждении, приводится ниже:
| Торговое наименование | |
| Международное непатентованное наименование (группировочное или химическое) | |
| Лекарственная форма | |
| Дозировка | |
| Форма выпуска | |
| Номер серии (партии) | |
| Объем серии (партии) | |
| Дата выпуска | |
| Годен до | |
| Наименование и адрес производителя (с указанием стадий производства) | |
| Номер и дата регистрационного удостоверения | |
| Номер нормативной документации | |
| Наименование и адрес держателя регистрационного удостоверения |
Помимо информации о лекарственном препарате подтверждение должно содержать информацию, позволяющую идентифицировать Уполномоченное лицо производителя (ФИО, номер и дата приказа Минздрава России об аттестации) или ответственное лицо дистрибьютора и его полномочия (ФИО, номер и дата доверенности либо другого документа, определяющего его полномочия).
Номер подтверждения формируется произвольно согласно стандартной операционной процедуре, утвержденной в организации.
Номер подтверждения должен однозначно идентифицировать выданное подтверждение.
Внимание!
Росздравнадзор рекомендует производителям и дистрибьюторам заранее провести ряд мероприятий:
— провести анализ нормативной документации с целью выявления вопросов, требующих решений до проведения испытаний;
— проработать вопрос обеспечения необходимыми стандартными образцами и/или расходными материалами,
— определить необходимость проведения трансфера методик;
— определиться с выбором испытательной лаборатории, в которой предполагается проведение испытаний качества лекарственных препаратов.
Заранее проведенные мероприятия позволят в максимально короткие сроки ввести лекарственный препарат в гражданский оборот.
8. Ответственность за непредставление документов и сведений
В соответствии с частью 8 статьи 52.1 Федерального закона от 12 апреля 2010 года N 61-ФЗ «Об обращении лекарственных средств» производители лекарственных средств и организации, осуществляющие ввоз лекарственных препаратов в Российскую Федерацию, несут ответственность в соответствии с законодательством Российской Федерации (статья 19.7.8 Кодекса Российской Федерации об административных правонарушениях от 30.12.2001 N 195-ФЗ) за непредставление или несвоевременное представление документов и сведений, предусмотренных частями 1, 2, 4, 5 и 6 статьи 52.1.
Постановлением Правительства Российской Федерации от 26 ноября 2019 года N 1510 «О порядке ввода в гражданский оборот лекарственных препаратов для медицинского применения» установлены правила принятия решения о прекращении гражданского оборота серии или партии лекарственного препарата для медицинского применения, документы и сведения о которых не представлены в Федеральную службу по надзору в сфере здравоохранения, либо серии или партии иммунобиологического лекарственного препарата, не имеющего разрешения на ввод в гражданский оборот, выданного Федеральной службой по надзору в сфере здравоохранения в установленном порядке.
Росздравнадзор закрыл в Москве косметологический кабинет, где лечил врач с поддельным дипломом — Агентство городских новостей «Москва»
Росздравнадзор закрыл в Москве косметологический кабинет, где лечил врач с поддельным дипломом
08.04 18:39
Теги: Врачи , Росздравнадзор , Нарушения , Лицензия , Косметология
В Москве закрыт нелегальный косметологический кабинет, где врач с поддельным дипломом лечил пациентов незарегистрированными препаратами. Об этом сообщили в пресс-службе Федеральной службы по надзору в сфере здравоохранения (Росздравнадзор).
«В территориальный орган Росздравнадзора по Москве и Московской области поступила жалоба гражданина на деятельность ООО «Галерея красоты «Царская цирюльня» на Кочновском проезде, где врачом-косметологом оказывались некачественные услуги. В ходе контрольно-надзорных мероприятий сотрудниками Росздравнадзора было установлено, что медицинская деятельность по профилю «Косметология» оказывается в учреждении без соответствующей лицензии. Кроме того, в косметологическом кабинете пациентов принимала доктор с поддельным дипломом о высшем образовании, которая использовала в работе незарегистрированные лекарственные препараты и медицинские изделия, запрещенные на территории РФ», — говорится в сообщении.
По результатом проверки Росздравнадзором составлен в отношении ООО «Галерея красоты «Царская цирюльня» акт об административном правонарушении.
«Материалы надзорных мероприятий переданы в Следственный комитет Российской Федерации по городу Москве, лекарственные средства и медицинские изделия изъяты, на косметологический кабинет наложен арест, помещение опечатано», — заключили в ведомстве.
Рубрика: Общество , Происшествия
Ссылка на материал: https://www. mskagency.ru/materials/3103235
mskagency.ru/materials/3103235
Обязательная маркировка товаров 2020 — 2021 — официальный сайт Честный ЗНАК
Аналог онлайн-кассы. Необходим в местах, где выводятся из оборота бесплатные ЛП.
Руководство пользователя для регистратора выбытия 1.0
Руководство пользователя для регистратора выбытия 2.0
Руководство пользователя для регистратора выбытия 3.0
Для организаций, участвующих в программе высокозатратных нозологий, заявка на регистратор выбытия доступна для заполнения в личном кабинете системы мониторинга оборота лекарственных препаратов с 1 июля 2019 года (согласно ППРФ № 1557 от 14.12.18). Для остальных участников оборота сроки подачи заявок будут определены отдельными нормативными актами.
Инструкция по оформлению заявки на регистратор выбытия
Регистраторы выбытия выдаются:
1) Медицинским организациям, а также всем организациям, имеющим медицинскую лицензию — в соответствии с количеством мест осуществления деятельности по оказанию медицинской помощи.
Кроме:- медицинских организации, подведомственных Минобороны России;
- кабинетов врачебной помощи (медицинские кабинеты), расположенных в дошкольных образовательных организациях, общеобразовательных организациях, иных организациях, и являющиеся структурными подразделениями медицинской организации;
- обособленных структурных подразделений медицинских организаций, получающих лекарственные препараты, предназначенные для оказания медицинской помощи, из головной медицинской организации.

2) Аптекам, осуществляющим выдачу лекарственных препаратов по программе высокозатратных нозологий — по списку мест осуществления деятельности, задействованных в данной программе, согласованному Росздравнадзором.
3) Аптекам, осуществляющим отпуск лекарственных препаратов по льготе или по частичной льготе.
Кроме:- аптечных организаций (аптеки, аптечные пункты, аптечные киоски), осуществляющих только розничную торговлю лекарственными препаратами.
Согласно п. 51 ППРФ1556 от 14.12.2018, оснащение будет производиться на основании типовой, утвержденной Министерством промышленности и торговли РФ формы договора.
Типовая форма договора по предоставлению регистратора выбытия
При автономном использовании регистратора выбытия (РВ) требуется только подключение к сети Интернет. Дополнительного программного обеспечения или оборудования не требуется.
При подключении РВ к компьютеру используется подключение к сети интернет, установленное на данном компьютере. Если на компьютере установлена информационная система (товаро-учетная система или ИС Вашей организации), умеющая управлять РВ (настроена интеграция методами API), то возможно использование сторонних 2D сканеров.
Если РВ подключен в локальную вычислительную сеть организации и не находится непосредственно на рабочем месте сотрудника, регистрирующего вывод ЛП из оборота, подключение к нему и его использование возможно с любого компьютера в локальной сети организации. При этом использование встроенного сканера кодов маркировки невозможно и такие рабочие места должны быть оснащены сканерами 2D-штрихкодов. Также возможно использование серийно выпускаемых терминалов сбора данных с последующей передачей информации в РВ. Данное использование РВ невозможно без установки на рабочих местах пользователей информационной системы, управляющей работой РВ.
Также возможно использование серийно выпускаемых терминалов сбора данных с последующей передачей информации в РВ. Данное использование РВ невозможно без установки на рабочих местах пользователей информационной системы, управляющей работой РВ.
Информация о результатах попытки вывода из оборота ЛП через РВ недоступна на самом РВ, ее можно увидеть только на компьютере, имеющем прямое подключение к МДЛП через личный кабинет участника оборота или в информационной системе участника оборота, интегрированной с ИС МДЛП и загружающей оттуда сведения.
Регистратор можно перепривязать на другое место деятельности, например, если текущее место деятельности закрылось, но у организации имеется другое.
Для осуществления перепривязки, обратитесь в службу поддержки support@crpt.ru и предоставьте следующие данные:
- Причина перепривязки
- Идентификатор и адрес места деятельности, к которому привязан РВ на текущий момент
- Идентификатор и адрес места деятельности, на которое необходимо перепривязать РВ
- Серийный номер РВ
- Контактное лицо и номер телефона
Алгоритм использования регистратора выбытия (РВ) для медицинских организаций:
При работе РВ в автономном режиме (РВ подключен к сети интернет, интеграция с информационными системами не используется):
1. Сотрудник медицинской организации получает или создает документ-основание для регистрации вывода из оборота. Это может быть требование-накладная, акт списания при использовании для оказания медицинской помощи или любой другой документ в соответствии с внутренней учетной политикой участника оборота.
Это может быть требование-накладная, акт списания при использовании для оказания медицинской помощи или любой другой документ в соответствии с внутренней учетной политикой участника оборота.
2. Входит в меню «Регистрация выбытия — Автономный режим — Прочее» (для РВ 1.0 и 2.0) или «Выбытие — Начать выбытие — Новый документ» (для РВ 3.0) и вводит реквизиты документа основания.
3. Подбирает упаковки лекарственных препаратов (ЛП) в соответствии с документом-основанием и сканирует коды маркировки (КМ). При сканировании КМ РВ выводит на экран результат локальной проверки кода маркировки, GTIN и серийный номер ЛП.
4. Завершив подбор ЛП, сотрудник выбирает действие «Завершить» (для РВ 1.0 и 2.0) или «Выбытие» (для РВ 3.0).
Если используется информационная система (ИС), интегрированная с ФГИС МДЛП и РВ, реквизиты документов основания вводятся в ИС и сканируются КМ с помощью сканера. Выбытие осуществляется через интерфейс ИС.
При использовании РВ создается документ на выбытие, выбирается тип выбытия (для мед применения или льготный рецепт), сканируются выбываемые лекарственные препараты. Затем сформированный документ отправляется на выбытие и РВ формирует и передает в ИС МДЛП схему 10531 (при выборе типа для мед применения) или 10521 (при выборе типа льготный рецепт).
Установка сторонних мобильных приложений на регистраторы выбытия не предусмотрена.Согласно пункту договора на предоставление регистратора выбытия 2.5.2. Г «Участник не имеет права без письменного согласия Оператора осуществлять вмешательство в программную и аппаратную часть Оборудования, вскрытие корпуса Оборудования, нарушение целостности разъёмов, интерфейсных кабелей, подключение к Оборудованию каких-либо устройств кроме тех, для подключения к которым Оборудование непосредственно предназначено».
Регистратор выбытия (далее — РВ) предназначен для отправки в ИС МДЛП информации о выводе лекарственных препаратов из оборота при отпуске лекарств без оплаты получателем и при отпуске ЛП в медицинских и иных организациях с мед. лицензией для оказания медицинской помощи.
РВ НЕ предназначен для отправки в сведений о приемке товара, операциям внутреннего перемещения и другим логистическим операциям.
Также РВ НЕ предназначен для отправки сведений по операциям вывода из оборота ЛП, если они не заканчиваются применением ЛП (передача на уничтожение, списание в ходе инвентаризации и т.п.) и по продаже ЛП с частичной льготой (в этом случае должна использоваться контрольно-кассовая техника — ККТ).
РВ может использоваться для проверки информации по упаковкам ЛП, имеющейся в ИС МДЛП и для автоматизации работы с маркированными ЛП в информационной системе мед. организации или аптеки. Такие функции предусмотрены в РВ, но их использование необязательно.
Для решения данного вопроса необходимо составить обращение оператору ЦРПТ:
— написав письмо на электронную почту службы технической поддержки: support@crpt.ru
— зарегистрированные в ИС МДЛП участники оборота для создания обращений в службу технической поддержки могут использовать портал https://support.crpt.ru, на котором можно посмотреть статус работы с созданными обращениями и получить другую полезную информацию.
В обращении необходимо указать:
1. Описание поломки
2. Полный адрес места деятельности
3. Серийный номер РВ
4. Контактное лицо
5. Номер телефона для связи
6. Фото ошибки / дефекта
Возможность смены модели регистратора выбытия на другую (1. 0 / 2.0 / 3.0) не предусмотрена.
0 / 2.0 / 3.0) не предусмотрена.
Регистратор выбытия не относится к измерительным приборам, поэтому метрологическую проверку производить не требуется.
РВ — являются мобильными устройствами и предполагают использование по типу соединения:
— Ethernet (только модели 1.0 и 3.0, для модели 2.0 в комплекте идет роутер MicroTic)
— GSM Modem (только модель 3.0, модем приобретается участником самостоятельно, в комплект не входит)
— WI-FI (все модели)
— Sim-карта (только модель 1.0)
Тип подключения определяется участником самостоятельно, исходя из процессов и технических возможностей, используемых при обороте ЛП на стороне участника оборота товаров.
Закупка ЛП в розницу в аптеке:
Организации обладающие лицензией на розничную торговлю ЛП могут осуществлять отпуск ЛП только физ. лицам.
Для продажи ЛП юридическим лицам в целях дальнейшего предоставления услуги, аптека должна обладать лицензией на оптовую продажу ЛП и производить реализацию ЛП в рамках отгрузки от одного юр. лица другому.
Соответственно частные организации с медицинской лицензией в целях предоставления услуги обязаны закупать ЛП через юр. лицо, а не в рамках розничной продажи.
ФАС России от 19.09.2017 N ИА/64899/17 «О необходимости наличия у участников закупки лекарственных препаратов лицензии на оптовую торговлю лекарственными препаратами»
https://legalacts. ru/doc/pismo-fas-rossii-ot-19092017-n-ia6489917-o-neobkhodimosti/
ru/doc/pismo-fas-rossii-ot-19092017-n-ia6489917-o-neobkhodimosti/
Федеральный закон от 12.04.2010 N 61-ФЗ (ред. от 02.08.2019)
В ИС МДЛП необходимо передавать сведения о приемке / перемещении / выбытии.
Приемка ЛП: возможно получение ЛП по прямому акцептированию и обратному.
При прямом акцептировании сначала поставщик передает сведения по 415 схеме, затем получатель подтверждает приемку по 701 схеме.
При обратном акцептировании сначала получатель отправляет 416 схему, затем поставщик подтверждает по 701. При этом поставщик должен добавить получателя в доверенные контрагенты.
Перемещение ЛП: при наличии нескольких мест деятельности и перемещении ЛП между ними, необходимо передавать данные по 431 схеме.
Выбытие ЛП: производится через регистратор выбытия (предоставляется бесплатно всем организациям с медицинской лицензией) перед использованием ЛП.
Выбывать ЛП через кассу при оказании платных услуг не требуется, при этом по желанию можно просто указывать в чеке SGTIN использованного ЛП.
На момент получения регистратора выбытия (РВ) в личном кабинете на вкладке «Договоры» должен быть акт приема-передачи (по одному акту на каждый РВ).
В акте приема-передачи указан адрес места деятельности и серийный номер регистратора выбытия.
На коробке с РВ имеется наклейка, с серийными номерами РВ и модуля безопасности.
Серийные номера РВ 3.0 начинаются с символов IZM, серийные номера РВ 1.0 и 2.0 состоят полностью из цифр.
Сопоставив серийные номера на коробках с РВ с серийными номерами из актов приема-передачи можно определить, к какому адресу места деятельности привязан данный РВ.
Также серийные номера можно посмотреть в меню самого РВ. Подробную инструкцию по нахождению данной информации можно найти в руководстве пользователя РВ.
На усмотрение участника оборота оставлен вопрос определения места вывода из оборота в медицинских организациях — при отпуске в отделение в больничной аптеке или в отделении при выдаче со склада отделения.
1.Получатель ЛП предоставляет сотруднику (первостольнику) льготный рецепт.
2.Сотрудник подбирает препараты в соответствии с полученным рецептом, при этом сканирует коды маркировки на них. Важно: отсканирована должна быть каждая упаковка. При повторном сканировании упаковки РВ не добавит ее в список для вывода из оборота, а сообщит пользователю об ошибочном сканировании.
3.Сотрудник вводит дату, серию и номер рецепта (на РВ или в программе, которая умеет управлять РВ) и выбирает действие «Зарегистрировать выбытие». После индикации на РВ, что запрос отправлен, отдает ЛП получателю. Важно: ожидать ответ ФГИС МДЛП о результатах попытки вывода ЛП из оборота в момент отпуска ЛП не нужно. Для минимизации вероятности нарушений в сфере оборота ЛП желательно проверить возможность вывода из оборота всех упаковок ЛП до того, как они могут быть выданы получателю. Это не обязательно делать при приемке товара, это не следует делать при отпуске товара, это может быть сделано в любой момент времени, начиная с приемки товара и до момента подбора ЛП с целью отпуска получателю.
Взаимодействие будет осуществляться по открытому API.
Алгоритмы взаимодействия, а так же методы API описаны в документе «Выдержка из технической спецификации на поставку регистратора выбытия» по ссылке.
РВ предназначен только для выбытия ЛП, с помощью него нельзя принимать товар.
Сканер необходим для приемки лекарственных препаратов в организации. Единственным критерием к нему является умение считывать Data-matrix код.
Если же в вашей организации очень небольшой оборот товара (менее 10 упаковок в день), для внесения сведений о приёмке в ИС МДЛП можно пользоваться человекочитаемой информацией на упаковке лекарственного препарата — вносить её в систему вручную.
Согласно договору, регистратор выбытия предоставляется на безвозмездной основе. Арендная стоимость не предусмотрена. Залоговая стоимость оборудования указана в акте приема-передачи. Вопрос постановки на балансовый учет находится в компетенции отдела бухгалтерии Вашей организации. Все необходимые документы можно скачать в личном кабинете с оттисками электронных подписей.
При использовании РВ, в ИС МДЛП автоматически отправляется документ 10531 или 10521, в зависимости от типа выбытия (мед. применение или льготный рецепт), загружать вручную более ничего не требуется.
При осуществлении тестового выбытия в ИС МДЛП отправляется документ 20521 — подключение регистратора выбытия.
Согласно договору, пункт 7. 7: Оператор вправе потребовать от Участника возвратить Оператору Оборудование, в случае если Оборудование не используется Участником в течение 6 месяцев подряд.
7: Оператор вправе потребовать от Участника возвратить Оператору Оборудование, в случае если Оборудование не используется Участником в течение 6 месяцев подряд.
В связи с переносом срока начала обязательной маркировки, время между получением регистратора выбытия и началом обязательной маркировки не будет учитываться при подсчете времени по пункту 7.7 договора.
Регистратор выбытия настроен на промышленный контур ИС МДЛП. Настройка РВ на тестовый контур «Песочница» не реализована. К реализации не планируется.
Выбытие можно произвести только вторичной упаковки. Если вторичная упаковка вложена в третичную, необходимо SSCC распаковать, предварительно получив из ИС МДЛП содержимое SSCC.
1. При подключении к компьютеру:
Регистратор выбытия может быть подключен к персональному компьютеру сотрудника, регистрирующего вывод из оборота лекарственных препаратов. В этом случае:
— РВ использует подключение к сети интернет, установленное на данном компьютере.
— РВ может использовать как встроенный в него сканер кодов маркировки, так и подключенный к этому же компьютеру сканер 2D-штрихкодов стороннего производителя (например, стационарного типа), если на компьютере установлена информационная система, умеющая управлять РВ.
2. При подключении к локальной вычислительной сети организации:
Если РВ подключен в сеть организации и не находится непосредственно на рабочем месте сотрудника, регистрирующего вывод ЛП из оборота, подключение к нему и его использование возможно с любого компьютера в локальной сети организации. При этом использование встроенного сканера кодов маркировки невозможно и такие рабочие места должны быть оснащены сканерами 2D-штрихкодов. Также возможно использование серийно выпускаемых терминалов сбора данных с последующей передачей информации в РВ.
При этом использование встроенного сканера кодов маркировки невозможно и такие рабочие места должны быть оснащены сканерами 2D-штрихкодов. Также возможно использование серийно выпускаемых терминалов сбора данных с последующей передачей информации в РВ.
Данное использование РВ невозможно без установки на рабочих местах пользователей информационной системы, управляющей работой РВ.
3. Автономное использование РВ:
При отсутствии подключения РВ к информационной системе участника оборота, РВ может отправлять данные о выводе ЛП из оборота через любое подключение к Интернет. В этом случае:
— дополнительные сведения, необходимые для регистрации вывода ЛП из оборота (кроме содержащихся в коде маркировки), например, дату льготного рецепта или документа-основания, необходимо будет ввести с клавиатуры РВ;
— необходимо помнить, что отсутствие в ИС МДЛП сведений о приемке ЛП участником оборота приведет к ошибке при попытке вывода этих ЛП у этого участника оборота и может служить сигналом о нарушении правил оборота маркированных ЛП.
4. Если в организации используется облачное решение для автоматизации учета лекарств:
В ряде регионов РФ реализованные облачные решения для ведения учета ЛП в государственных медицинских организациях. Возможно использование подобных решений по автоматизации в крупных аптечных сетях или сетях медицинских организаций. В этом случае возможна установка РВ в центре обработки данных. При этом оснащение рабочих мест сканерами 2D-штрихкодов должно выполняться за счет участника оборота.
Оборудование — регистратор выбытия, доставляется до участника в подготовленном, проверенном и готовом к эксплуатации состоянии.
Подключение к локальной сети учреждения, а также интеграция устройства с программным обеспечением участника, производится участником самостоятельно.
В комплекте с регистратором выбытия прикладываются необходимые инструкции.
Также инструкции в электронном виде можно скачать на сайте Честный ЗНАК, в разделе «Регистраторы выбытия».
Для корректной работы и обновления ПО РВ КМ необходима точная настройка внутренних часов реального времени. Настройка часов производится по сигналам ГНСС ГЛОНАСС. Для настройки требуется, чтобы РВКМ имел связь как минимум с тремя спутниками ГЛОНАСС. В случае, если в течение суток, связи со спутниками не было, РВ блокируется до тех пор, пока связь не будет установлена. Других блокировок (более длительной или окончательной) по этой причине не предусмотрено.
Все инструкции по интеграции находятся на сайте.
Согласно пункту 2.3.3 Договора по предоставлению регистратора выбытия лекарственных препаратов субъектам обращения лекарственных средств на безвозмездной основе:
Участник принимает на себя следующие обязательства:
Осуществлять действия по подключению оборудования к своему программно-аппаратному комплексу согласно требованиям, установленным инструкцией по эксплуатации оборудования и иной технической документацией, размещенной на официальном сайте Оператора в информационно-телекоммуникационной сети «Интернет» (далее — Сайт Оператора, Правила), а также самостоятельно осуществлять интеграцию оборудования со своим программно-аппаратным комплексом.
Если Вы используете программного обеспечение, предоставляемое другой организацией, рекомендуется обратиться в данную организацию.
Перед началом работы с регистратором выбытия 1.0 / 2.0, необходимо произвести обновление прошивки согласно инструкции пользователя.
Если данного информационного окна не появилось «обновление OC», необходимо открыть меню настройки => об устройстве => обновление системы => обновить. Также после активации приложения «клиент оператора», необходимо зайти настройки => обновление прошивки платы МБ, дождаться окончания обновления ПО.
Инструкцию по настройке можно найти в руководстве пользователя, на 11 странице, раздел «Подключение к Wi-Fi».
Нажмите кнопку «F1», далее кнопкой стрелкой спуститесь до пункта «Выход» и нажмите кнопку «Ent».
Кнопкой «Esc» можно выйти только до ввода PIN кода.
Клавишей F1 можно менять раскладку между 3 режимами: русская, английская, цифры.
При необходимости ввести заглавные буквы требуется несколько раз нажимать на кнопку с соответствующими буквами — после строчных букв последуют заглавные.
 Авторизация не пройдена».
Авторизация не пройдена».Выполните обновление прошивки регистратора выбытия:
1. Выйти из приложения «Клиент оператора» (нажать F1, пролистать появившееся меню вниз и выбрать «Выход».
2. Открыть меню с приложениями (кнопка внизу экрана в виде круга с 6 точками).
3. Открыть приложение «Обновление системы».
4. Нажать «Обновить».
Появление уведомления «Срок МБ истёк» возможно. Необходимо выключить/включить РВ. Все устройства приходят активированными и дополнительных манипуляций по активации не требуют.
Рекомендуется убедиться, что встроенный сканер 2D не заклеен защитной пленкой. Если имеется защитная пленка, то необходимо её удалить.
Сканируемый лекарственный препарат желательно размещать не далее, чем на расстоянии 10-15 см от луча лазера сканера. Сканер следует направлять немного под углом относительно DataMatrix. При поиске оптимального положения можете перемещать сканер вверх и вниз относительно кода маркировки.
Если произвести сканирование кода маркировки вне предназначенных для этого меню, ничего не произойдет.
Для проверки кода маркировки в приложении клиент оператора необходимо выбрать «Проверка КМ» и когда появится надпись «Отсканируйте 2D штрих код» выполнить сканирование на кнопку «SCAN».
Для тестового выбытия необходимо перейти в меню «Диагностика — Тестовое выбытие» и когда появится надпись «Просканируйте штрихкод нажав кнопку SCAN» выполнить сканирование на кнопку «SCAN».
Аналогичный алгоритм сканирования при формировании выбытия по льготному рецепту или для мед. применения.
применения.
Устройство активировано. Кратковременное появление надписи «Активация РВ» до ввода Пин-кода возможно.
Выполните выключение и включение регистратора выбытия (РВ): зажать кнопку выключения, затем выбрать «Отключить питание», затем включить устройство зажав кнопку включения (внизу слева для РВ 2.0 / внизу посередине для РВ 1.0 ).
Если после включения устройства и ввода пин-кода ошибка повторилась, подождите 10-15 секунд и введите пин-код повторно. Если ошибка осталась после перезагрузки и двух попыток ввода пин-кода — сообщите об этом, указав какие действия Вы уже произвели, в службу поддержки support@crpt.ru.
Регистратор выбытия 1.0 и 2.0 не поддерживает работу через прокси сервер.
Для упрощения старта работы с регистраторами выбытия (РВ) для участников оборота, РВ активируются перед доставкой. Перед началом работы с РВ, Вам достаточно включить РВ, установить связь со спутниками и произвести тестовое выбытие.
 0 и 2.0.
0 и 2.0.Для проверки успешности отправки данных с регистратора выбытия (РВ) можно выполнить тестовое выбытие кода маркировки (КМ): в приложении «Клиент оператора» вызвать боковое меню (кнопка F1 для РВ 1.0 или провести из левого края экрана вправо для РВ 2.0), выбрать «Диагностика» — «Тестовое выбытие».
При переходе в режим тестового выбытия предлагается отсканировать тестовый КМ, который можно увидеть в «Паспорте» на используемый экземпляр РВ КМ. При корректно выполненных настройках на экране будет отображено уведомление: тестовое выбытие успешно зарегистрировано.
Значком в виде ключа отображается VPN соединение. Оно необходимо, если требуется с РВ подключиться к защищённой (VPN) сети организации.
При необходимости увеличить объем внутренней памяти, можно установить съемный внешний носитель — микро-SD. Слот для микро-SD расположен в отсеке АКБ, поэтому первоначально необходимо открыть крышку отсека АКБ, извлечь аккумулятор и отсоединить кабель. Правильная установка карты в слот изображено в отсеке АКБ. Микро-SD устанавливается в верхнюю часть смежного разъема (более углубленный разъем), сим-карта — в нижнюю. Сим-карту/микро-SD необходимо медленно вставлять в соответствующий слот до щелчка. Микро-SD считается «установленной» (подключенной), когда устройство распознает карту и откроет к ней доступ.
Необходимый IP адрес и порт для подключения можно найти в меню регистратора выбытия, после его подключения к сети. Приложение клиент оператора — Диагностика — Диагностика составных модулей — Сетевой режим.
Приложение клиент оператора — Диагностика — Диагностика составных модулей — Сетевой режим.
Выключите и включите устройство и повторите поиск спутников. Следите за уровнем сигнала / шума в приложении «Клиент оператора», меню «Диагностика — Диагностика составных модулей — Модуль ГНСС». Для получения актуальной информации на текущий момент необходимо периодически возвращаться в предыдущее меню и снова заходить в «Диагностика составных модулей».
В регистратор выбытия 1.0 можно вставить свою SIM-карту. Для установки SIM-карты необходимо открыть крышку отсека АКБ, извлечь аккумулятор и отсоединить кабель. Правильная установка карты в слот изображена в отсеке АКБ. Микро-SD устанавливается в верхнюю часть смежного разъема (более углубленный разъем), SIM-карта — в нижнюю. SIM-карту/микро-SD необходимо медленно вставлять в соответствующий слот до щелчка. Обращаем Ваше внимание, что ООО «Оператор-ЦРПТ» не несет ответственность за работоспособность устанавливаемых SIM-карт. По вопросам работы SIM-карты необходимо обращаться к поставщику SIM-карты. Выбор поставщика услуг по SIM-картам не регламентируется Оператором ЦРПТ и осуществляется участником оборота товаров самостоятельно.
Если регистратор выбытия (РВ) выводит сообщение о доступности обновления, то необходимо обновить РВ.
Подробная инструкция по обновлению имеется в руководстве пользователя в разделе «Обновление ОС»:
РВ 1. 0 (желтая кнопка)
0 (желтая кнопка)
РВ 2.0 (красная кнопка)
Красный символ означает, что регистратор не подключен к сети. Нужно попробовать подключить регистратор к каналу, который точно имеет доступ к сети. Дополнительно необходимо проверить не настроен ли регистратор для статического подключения в случае, если подключение динамическое (сервис => настройки => настройка сети => конфигурация ethernet => способ настройки («авто» для динамического соединения, «ручной» для статического). Также можно воспользоваться подключением по WiFi.
Необходимый IP адрес для подключения можно найти в меню регистратора выбытия, после его подключения к сети. Главное меню — Информация — строка «IP». Порт по умолчанию — 8080.
Поиск устройством спутников может занимать до 30 минут.
Перезагрузите устройство и повторите поиск спутников. Следите за уровнем сигнала CNR в меню «Сервис — Проверка РВ — Спутники».
а. Выберите пункт меню «Сервис» и нажмите зеленую клавишу .
б. В меню «Сервис» выберите пункт меню «Настройки» и нажмите зеленую клавишу .
в. В меню «Настройки» выберите пункт меню «Управление интерфейсами» и
нажмите зеленую клавишу.
г. В меню «Настройки сети» выберите пункт меню «Настройки сети» и нажмите зеленую
клавишу .
д. С помощью клавиш курсора «вверх», «вниз» выберите интерфейс WI-FI и нажмите зеленую клавишу.
е. На появившееся приглашение сохранить настройки ответе «Да», нажав зеленую клавишу.
ж. После возврата в меню «Настройка сети» выберите пункт «Конфигурация WIFI».
з. В самой верхней строчке окна выберите, в зависимости от настроек вашей сети, способ получения IP-адреса «Авто (DHCP)» или «Ручной» (выбор нужного значения в поле осуществляется центральной белой кнопкой).
и. В случае выбора «Авто (DHCP)» никакие другие настройки в окне менять не нужно, в противном случае необходимо заполнить все оставшиеся поля( «IP адрес», «Маска подсети», «Адрес шлюза», «Адрес DNS»).
к. Сохраните настройки, нажав зеленую клавишу и подтвердив сохранение.
л. После возврата в меню «Настройка сети» выберите пункт «Выбор сети WI-FI».
м. В появившемся окне заполните поля «Ввод SSID» и «Ввод пароля». Если сеть является скрытой необходимо выбрать пункт «Скрытая». Просмотреть список доступных сетей и выбрать нужную можно выбрав пункт-кнопку «Выбрать SSID».
н. Нажмите зеленую клавишу , чтобы подключиться к выбранной сети WI-FI.
о. После успешного подключения РВКМ к сети WI-FI в панели состояния появится значок подключения. Зелёный цвет этого значка обозначает, что РВКМ успешно подключился к СЭ.
Уровень приема сигнала Wi-fi на регистраторе выбытия определяется цветовой индикацией значка на дисплее устройства. Если цвет зеленый то прием сигнала отличный,если желтого цвета то средний (данный цвет индикатора не несет в себе критичности для отправки сведений с РВ), если индикатор красного цвета то рекомендуем осуществить проверку подключения.
РВ предоставляются Оператором ЦРПТ по заявкам участников оборота бесплатно.
Инструкция по формированию заявок
Связь регистратора выбытия со спутниками нужна только раз в сутки для синхронизации времени и контроля соответствия места выбытия лекарственного препарата фактическому. Для выполнения выбытия лекарственных препаратов связь со спутником не нужна.
Для получения сигнала достаточно нескольких минут, после чего регистратор может работать без связи еще 24 часа.
Внизу экрана должно быть сообщение от браузера «Эта веб-страница пытается запустить надстройку Модуль внешнего интерфейса усовершенствованной Э… издателя CRYPTO-PRO», справа от этого сообщения имеется кнопка «Разрешить». Нажмите, пожалуйста, кнопку «Разрешить» и попробуйте повторно подписать соглашение.
Адрес предоставления регистратора выбытия соответствует адресу места осуществления деятельности организации. Соответственно, если у Вашей организации несколько мест осуществления деятельности, то согласно лицензии на медицинскую деятельность, необходимо подать несколько заявок на предоставление регистратора выбытия — для каждого места осуществления деятельности организации.
Поле корреспондентского счета является обязательным для заполнения, потому что договор по форме Минпромторга предполагает заполнение реквизитов.
Согласно Постановлению Правительства Российской Федерации от 31.12.2019 № 1954 «О внесении изменений в постановление Правительства Российской Федерации от 14 декабря 2018 г. № 1556»», заявку (в электронной форме) на получение регистратора выбытия необходимо подать в срок до 15 февраля 2020 г. либо в течение 7 календарных дней со дня регистрации в МДЛП.
Срок начала обязательной маркировки перенесен на 01.07.2020 (кроме категории 7ВЗН), но промаркированные лекарственные препараты уже могут поступать в оборот.
Рекомендуем Вам подать анкету на предоставление регистратора выбытия (РВ) в максимально сжатые сроки, это позволит заблаговременно получить РВ и отработать Ваши бизнес процессы.
Если используется браузер Internet Explorer 11:
Для устранения ошибки необходимо изменить настройки безопасности браузера Internet Explorer .
Нажмите на кнопки в виде шестеренки в верхней правой части браузера (или сочетание клавиш Alt + x) и выберите пункт «Свойства браузера».
Перейдите на вкладку «Безопасность», в раздел «Интернет».
Установите уровень безопасности «средний» или «выше среднего». После этого необходимо перезапустить браузер.
После этого необходимо перезапустить браузер.
Если после выполнения вышеописанных рекомендаций ошибка останется, воспользуйтесь, пожалуйста, браузером Google Chrome или Яндекс браузером последней версии.
Плагин КриптоПро для Google Chrome или Яндекс браузера можно установить, открыв ссылку в этих браузерах.
Если используется другой браузер:
Загрузка вкладки «Договоры» в виде пустой белой страницы связана с медленным интернет соединением или блокировкой загружаемых данных.
Для устранения данной ошибки попробуйте произвести следующие действия:
1. Очистить КЭШ и куки браузера
2. Отключить антивирус
3. Отключить плагины антивирусов в браузере
4. Отключить плагины VPN в браузере
5. Отключить блокировщики рекламы в браузере
Для устранения ошибки «Не удается построить цепочку сертификатов для доверенного корневого центра» необходимо установить корневой сертификат удостоверяющего центра и корневой сертификат головного удостоверяющего центра.
Необходимо подать заново анкету с лицензией на медицинскую деятельность.
Типовая форма договора на оснащение регистратором выбытия утверждена Приказом Министерства промышленности и торговли российской Федерации № 2973 от 13.08.2019 г.
Изменение типовой формы договора не предусмотрено.
Если руководитель организации действует на основании приказа или устава, то при заполнении анкеты на РВ, можно выбрать «учредительный документ». Выбор данного варианта не будет считаться ошибкой.
На одно место осуществления деятельности (МД) предполагается выдача одного регистратора выбытия (РВ).
Если на одном МД производится выбытие множества лекарственных препаратов (ЛП), используются разные товароучётные системы, то необходимо подключить РВ к сети организации. При этом устройство сможет по сети получать информацию из разных источников и регистрировать выбытие ЛП.
Если в несколько лицензий внесён один и тот же адрес, например, по которому производится бесплатная выдача лекарств, как по рецептам, так и для мед. применения, то это будет считаться одним местом деятельности. Для осуществления выбытия лекарств РВ так же можно будет подключить к сети организации.
Скачать и просмотреть договор можно в личном кабинете на вкладке «Профиль — Анкеты и договоры — Договоры». После подписания со стороны ООО «ЦРПТ» (статус «Подписан сторонами») в конце документа будут присутствовать оттиски электронных подписей.
Также с типовой формой договора можно ознакомиться по ссылке.
Акт выполненных работ из приложения № 5 к типовой форме договора по предоставлении регистратора выбытия оформляется в случае произведения ремонта регистратора выбытия.
Если у организации только лицевой счет в комитете финансов, то в поле «Наименование банка» необходимо заполнить: «л/с №хххххх в Комитете финансов» (вместо хххххх необходимо указать номер лицевого счета).
При этом поля «БИК», «Корреспондентский счет» и «Расчетный счет» заполняются нулями.
При отсутствии у ИП банковского счета, поля «БИК», «Наименование банка», «Корреспондентский счет» и «Расчетный счет» заполняются нулями.
Согласно договору по форме МинПромТорга, товарной накладной к РВ нет. Акт приема-передачи отображается в личном кабинете.
При заполнении анкеты на РВ В в графах «контакты руководителя организации», «контакты ответственного сотрудника», «контакты лиц, обеспечивающих доступ к месту установки» необходимо указать номер телефона и через запятую — имя контактного лица.
В случае возникновения ошибки «Отказано в доступе» при подписании документов на вкладке «Договоры» в браузере Internet Explorer, воспользуйтесь, пожалуйста, другим браузером, например, Google Chrome или Яндекс браузер.
В Договоре по предоставлению регистратора выбытия, приложения представлены как не заполненный образец типовой формы. Они формируются (заполняются) и подписываются как отдельный документ.
Заявка на предоставление регистратора выбытия (приложение 1) формируется на основании отправленных Вами анкет на РВ.
Акт приема-передачи (приложение 2) необходимо подписывать при получении регистратора выбытия.
Для устранения ошибки «Цепочка сертификатов обработана, но обработка прервана на корневом сертификате, у которого отсутствует отношение доверия с поставщиком доверия» необходимо установить корневой сертификат удостоверяющего центра и корневой сертификат головного удостоверяющего центра.
РВ предоставляются Оператором ЦРПТ по заявкам участников оборота бесплатно. В акте приема-передачи прописана залоговая сумма в случае утери оборудования (РВ).
В акте приема-передачи прописана залоговая сумма в случае утери оборудования (РВ).
При получении РВ платить залоговую сумму не требуется.
Если отсутствует корреспондентский счёт, данное поле необходимо заполнить нулями.
Согласно пункту 2.1.1 Договора по предоставлению регистратора выбытия, оборудование предоставляется в течении 30 календарных дней с момента подписания участником заявки на предоставление регистратора выбытия (приложение № 1 к Договору).
Для устранения ошибки «Не установлен корневой сертификат» необходимо установить корневой сертификат удостоверяющего центра и корневой сертификат головного удостоверяющего центра.
Для заполнения анкеты на РВ требуется предварительно добавить место деятельности с действующей фарм/мед лицензией на вкладке «Профиль — Адреса — Места деятельности».
После добавления адреса на вкладке «Профиль — Анкеты и договоры — Заполнение анкет на РВ», должна появиться строка с информацией о МД и в правой части этой строки будет кнопка «Плюс».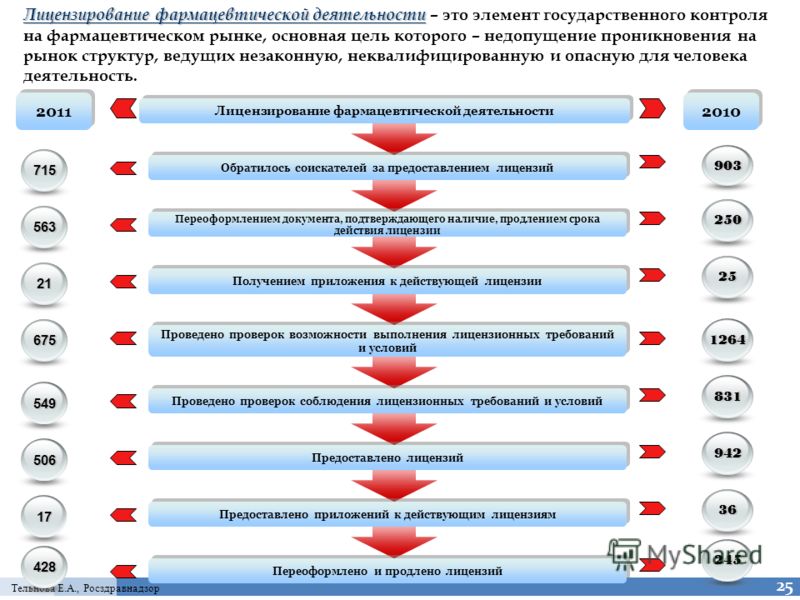 При нажатии на эту кнопку откроется окно заполнения анкеты.
При нажатии на эту кнопку откроется окно заполнения анкеты.
Подробную инструкцию по добавлению места деятельности можно найти в руководстве пользователя, раздел 4.5 (страница 75)
Руководство пользователя можно найти по ссылке.
В поле «IT служба» необходимо выбрать либо «Очная» — если в организации есть в штате сотрудник IT (например, системный администратор), либо «Заочная» — если нет сотрудника и организация использует сторонние услуги.
При отсутствии штатного сотрудника службы IT в полях «Время работы ИТ поддержки «с», «Время работы ИТ поддержки «по», «Дни недели работы ИТ поддержки» и «Контакты ответственного сотрудника ИТ поддержки» заполняются данные Вашего сотрудника, который будет получать и подключать РВ.
Необходимо указывать усредненное количество всех лекарственных препаратов, выводимых из оборота за сутки.
Нужно указывать количество окон, в которых производится выдача ЛП. Если из одного окна, то необходимо указать одно окно.
Необходимо указать полное наименование, версию программы и номер релиза, а также место развёртывания программы (на локальном рабочем месте, сетевое размещение, облачная реализация).
Если товаро-учетная система не используется, написать «не используется».
При заполнении граф с контактами необходимо указать номер телефона и имя контактного лица, например: «+11111111111, Имя».
1. Проверить актуальность прошивки программного обеспечения.
2. При попытке синхронизации внутри помещения устройство следует размещать в непосредственной близости к окну, при этом избегать северной стороны здания.
3. Синхронизация со спутниками происходит значительно быстрее при его регулярном использовании, и поиска спутников в одно и тоже время суток.
4. Синхронизация проходит значительно быстрее на открытом воздухе даже при наличии городской застройки.
5. Сроки синхронизации могут увеличиваться при наличии в непосредственной близости индустриальных и промышленных шумов (заводы, производства и другие предприятия, порождающие электромагнитные помехи).
Для отслеживания доступности спутников на РВ следует запустить приложение «Клиент оператора», вызвать информационное меню, проведя по экрану слева направо (или нажать F1, если экран не сенсорный), выбрать «Диагностика — Диагностика составных модулей». В строке «Модуль ГНСС» будет отображаться информация по поиску спутников. Для получения актуальной информации на текущий момент необходимо периодически возвращаться в предыдущее меню и снова заходить в «Диагностика составных модулей». Если на улице сигнал остается равным 0, выключите и включите РВ.
 Что делать?
Что делать?1. Проверить актуальность прошивки программного обеспечения.
2. При попытке синхронизации внутри помещения устройство следует размещать в непосредственной близости к окну, при этом избегать северной стороны здания.
3. Синхронизация со спутниками происходит значительно быстрее при его регулярном использовании, и поиска спутников в одно и тоже время суток.
4. Синхронизация проходит значительно быстрее на открытом воздухе даже при наличии городской застройки.
5. Сроки синхронизации могут увеличиваться при наличии в непосредственной близости индустриальных и промышленных шумов (заводы, производства и другие предприятия, порождающие электромагнитные помехи).
Для отслеживания доступности спутников на РВ следует зайти в «Сервис», «Проверка РВ», «Спутники». В данном меню будет отображаться информация по поиску спутников.
Росздравнадзор закрыл нелегальный косметологический кабинет в Москве, где пациентов лечили запрещенными лекарствами
03:11 09 Апреля | Разные новости
03:09 09 Апреля | Здоровье
03:07 09 Апреля | Разные новости
03:06 09 Апреля | Разные новости
23:52 08 Апреля | Власть
23:51 08 Апреля | Разные новости
23:50 08 Апреля | Пензенская область
23:49 08 Апреля | Разные новости
21:19 08 Апреля | Экономика
21:18 08 Апреля | Власть
21:16 08 Апреля | Экономика
21:03 08 Апреля | Власть
20:28 08 Апреля | Разные новости
20:27 08 Апреля | Разные новости
20:25 08 Апреля | Разные новости
20:24 08 Апреля | Разные новости
20:20 08 Апреля | Власть
20:19 08 Апреля | Разные новости
20:17 08 Апреля | Власть
20:15 08 Апреля | Власть
20:11 08 Апреля | Власть
20:09 08 Апреля | Власть
19:59 08 Апреля | Смоленская область
19:40 08 Апреля | Москва
19:38 08 Апреля | Разные новости
19:33 08 Апреля | Мир
19:18 08 Апреля | Мир
19:18 08 Апреля | Мир
19:00 08 Апреля | Разные новости
18:56 08 Апреля | Москва
18:54 08 Апреля | Красноярский край
18:47 08 Апреля | Ульяновская область
18:37 08 Апреля | Москва
18:18 08 Апреля | Севастополь
18:17 08 Апреля | Санкт-Петербург
18:13 08 Апреля | Свердловская область
17:59 08 Апреля | Республика Марий Эл
17:57 08 Апреля | Разные новости
17:55 08 Апреля | Разные новости
17:52 08 Апреля | Ульяновская область
17:50 08 Апреля | Разные новости
17:47 08 Апреля | Смоленская область
17:44 08 Апреля | Санкт-Петербург
17:42 08 Апреля | Московская область
17:39 08 Апреля | Нижегородская область
17:28 08 Апреля | Крым
17:26 08 Апреля | Крым
17:24 08 Апреля | Разные новости
17:23 08 Апреля | Москва
17:15 08 Апреля | Саратовская область
17:06 08 Апреля | Разные новости
16:56 08 Апреля | Московская область
16:54 08 Апреля | Разные новости
16:53 08 Апреля | Разные новости
16:52 08 Апреля | Разные новости
16:40 08 Апреля | Санкт-Петербург
16:33 08 Апреля | Разные новости
16:30 08 Апреля | Экономика
16:28 08 Апреля | Россия
16:27 08 Апреля | Россия
16:27 08 Апреля | Россия
16:14 08 Апреля | Россия
16:13 08 Апреля | Разные новости
16:12 08 Апреля | Ставропольский край
15:21 08 Апреля | Оренбургская область
15:18 08 Апреля | Разные новости
15:13 08 Апреля | Санкт-Петербург
15:10 08 Апреля | Разные новости
15:07 08 Апреля | Россия
15:07 08 Апреля | Москва
15:05 08 Апреля | Власть
15:03 08 Апреля | Свердловская область
14:58 08 Апреля | Саратовская область
14:56 08 Апреля | Экономика
14:52 08 Апреля | Россия
14:36 08 Апреля | Саратовская область
14:23 08 Апреля | Самарская область
14:22 08 Апреля | Удмуртская Республика
14:17 08 Апреля | Краснодарский край
14:16 08 Апреля | Разные новости
14:16 08 Апреля | Краснодарский край
14:15 08 Апреля | Разные новости
14:13 08 Апреля | Разные новости
14:11 08 Апреля | Саратовская область
14:09 08 Апреля | Самарская область
14:08 08 Апреля | Оренбургская область
14:06 08 Апреля | Разные новости
13:59 08 Апреля | Самарская область
13:58 08 Апреля | Разные новости
13:57 08 Апреля | Разные новости
13:57 08 Апреля | Пензенская область
13:55 08 Апреля | Пензенская область
13:52 08 Апреля | Ульяновская область
13:47 08 Апреля | Разные новости
13:44 08 Апреля | Краснодарский край
13:21 08 Апреля | Разные новости
13:15 08 Апреля | Разные новости
13:11 08 Апреля | Власть
13:10 08 Апреля | Свердловская область
13:09 08 Апреля | Разные новости
Федеральная служба по надзору в сфере здравоохранения :: На главную
Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) создана Указом Президента Российской Федерации от 9 марта 2004 г. № 314 «О системе и структуре федеральной исполнительной власти». Органы »и является федеральным органом исполнительной власти, осуществляющим контроль и надзор за системой здравоохранения.
№ 314 «О системе и структуре федеральной исполнительной власти». Органы »и является федеральным органом исполнительной власти, осуществляющим контроль и надзор за системой здравоохранения.
Росздравнадзор подчиняется Министерству здравоохранения Российской Федерации и руководствуется Конституцией Российской Федерации, федеральными конституционными законами, федеральными законами, актами Президента Российской Федерации и Правительства Российской Федерации, международными соглашениями, актами Министерства здравоохранения. Российской Федерации и Положения, изложенного в Постановлении от 30 июня 2004 г. № 323 «О Федеральной службе по надзору в сфере здравоохранения».
Федеральная служба по надзору в сфере здравоохранения действует напрямую или через свои региональные отделения в сотрудничестве с другими федеральными органами, органами государственной исполнительной власти, органами местного самоуправления, общественными объединениями и другими учреждениями.
В настоящее время в структуру Федеральной службы по надзору в сфере здравоохранения входят центральный головной аппарат (9 управлений), 80 региональных управлений в субъектах Российской Федерации, 1 межрегиональное управление и 3 федеральных государственных бюджетных учреждения.
Росздравнадзор осуществляет следующие полномочия:
1. Государственный контроль и надзор:
— обращение медицинских изделий;
— качество и безопасность врачебной практики при проведении проверок и аудитов;
— оборот лекарственных средств
— ценообразование на лекарственные средства, включенные в перечень жизненно необходимых и важнейших лекарственных средств;
— Выполнение региональных программ модернизации здравоохранения Российской Федерации и мероприятий по модернизации учреждений здравоохранения и государственных учреждений, осуществляющих внедрение и модернизацию информационных систем здравоохранения в субъектах Российской Федерации;
— Достоверность первичной статистики, представленной медицинскими учреждениями и индивидуальными медицинскими предпринимателями.
2. Контроль и надзор со стороны органов государственной власти субъекта Российской Федерации по ежегодным выплатам лицам, удостоенным звания «Почетный донор России». Росздравнадзор отвечает за выявление нарушений и возбуждение уголовного дела в отношении местных должностных лиц, виновных в неисполнении делегированных полномочий.
3. Федеральная служба по надзору в сфере здравоохранения выполняет следующие функции:
— мониторинг списка жизненно необходимых и важнейших лекарственных средств и цен на них;
— мониторинг безопасности медицинских изделий, регистрация побочных эффектов и нежелательных реакций, а также фактов и обстоятельств, связанных с обращением зарегистрированных медицинских изделий, которые могут представлять опасность для жизни и здоровья людей.
4. Лицензирование отдельных видов деятельности в пределах компетенции Службы.
5. Федеральная служба по надзору в сфере здравоохранения:
— разрешения на транзит через территорию Российской Федерации сверхсильных веществ, не являющихся прекурсорами наркотических средств и психотропных веществ;
— разрешения на ввоз медицинских изделий в РФ для государственной регистрации;
— сертификат на ввоз (вывоз) наркотических средств, психотропных веществ и их прекурсоров;
— сертификаты специалиста лицам с иностранным медицинским или фармацевтическим образованием.
6. Государственная регистрация медицинских изделий осуществляется Федеральной службой по надзору в сфере здравоохранения.
7. Федеральная служба по надзору в сфере здравоохранения ведет государственный реестр изделий медицинского назначения и организаций, производящих изделия медицинского назначения;
8. Служба публикует информацию о решениях, принятых по результатам мониторинга безопасности лекарственных средств;
9. Федеральная служба по надзору в сфере здравоохранения проводит проверки учреждений здравоохранения;
10. Федеральная служба по надзору в сфере здравоохранения имеет часы приема, обеспечивает своевременное и полное рассмотрение обращений граждан;
Федеральная служба по надзору в сфере здравоохранения имеет часы приема, обеспечивает своевременное и полное рассмотрение обращений граждан;
11. Федеральная служба по надзору в сфере здравоохранения выполняет иные функции, предусмотренные Положением о Росздравнадзоре, а также функции, предусмотренные федеральными законами, нормативными правовыми актами Президента Российской Федерации или Правительства Российской Федерации.
Российских регуляторных тенденций в фармацевтической отрасли в связи с COVID-19
Общие государственные ограничения, связанные с COVID, и их влияние
В России введены общеправительственные ограничения на введение карантинного режима в связи с COVID.Ограничения включают закрытие сухопутных границ, отмену регулярных и чартерных международных рейсов, что неизбежно привело к увеличению сроков доставки лекарств и медицинских изделий из-за рубежа.
Другая мера — предоставить местным властям право ограничивать свободу передвижения и, следовательно, свободу торговли, если они сочтут это необходимым. В Москве и некоторых других регионах России введен режим повышенной готовности. Кроме того, президент России объявил, что пять недель (с 28 марта 2020 года до конца апреля 2020 года) не будут работать в России.
После объявления о нем возникла неуверенность в том, смогут ли предприятия по производству и продаже лекарств продолжать свою деятельность. Вопрос прояснился после того, как производство и продажа лекарств стали считаться частью деятельности по поддержанию жизни. Это означает, что, несмотря на введенные карантинные меры и объявленные нерабочие недели, деятельность фармацевтической отрасли не заморожена. Аптеки тоже остались открытыми.
Специальные правительственные меры, направленные на фармацевтическую промышленность
Закон, предоставляющий Правительству РФ право устанавливать максимальные отпускные цены
26 марта 2020 года был принят закон, дающий Правительству РФ право устанавливать максимальные отпускные цены, оптовые и розничные надбавки на лекарства и медицинские изделия.
Правительство РФ будет регулировать цены в случае:
- существует угроза распространения болезни, представляющей угрозу для окружающих,
- в ходе мониторинга цен выявлено необоснованное повышение цен в нескольких регионах более чем на 30 процентов за 30 дней,
- или в экстренных случаях.
Такие ограничения могут длиться не более 90 дней.
Ранее максимальные отпускные цены, оптовые и розничные надбавки можно было устанавливать только для препаратов, включенных в Перечень жизненно необходимых и основных лекарственных средств, и только для некоторых видов медицинских изделий.
Порядок установления таких предельных отпускных цен, оптовых и розничных надбавок определяется Правительством Российской Федерации.
Стимулом для принятия этого закона стало повышение цен на защитные маски и респираторы в нескольких аптеках в марте 2020 года. Цель поправок — ограничить рост цен на лекарства и медицинские устройства первой необходимости в ситуации пандемии.
Интернет-продажа безрецептурных препаратов
Распоряжение Президента РФ №187 от 17 марта 2020 года и Федеральный закон от 3 апреля 2020 года № 105-ФЗ были приняты с целью легализации продажи безрецептурных препаратов через Интернет.
Для продажи лекарств, отпускаемых без рецепта, в аптеке должно быть:
- лицензия на фармацевтическую деятельность,
- специальное разрешение Росздравнадзора (то есть Федеральной службы по надзору в сфере здравоохранения).
Порядок получения указанного разрешения Росздравнадзора еще не установлен.
Однако из-за отсутствия детального регулирования многие проблемы фармацевтической промышленности в отношении онлайн-продажи лекарств остаются нерешенными, в том числе (1) кто может доставить лекарства покупателю (например, если это курьер со специальным медицинским образованием или любое лицо ), (2) если территория доставки будет ограничена территорией, на которой работает лицензированная аптека, и (3) как обеспечить соблюдение и защиту прав потребителей и контроль качества в отношении лекарств, продаваемых через Интернет.
Ужесточение административной и уголовной ответственности за продажу контрафактных и некачественных лекарственных средств
Установлена административная и уголовная ответственность за продажу, в том числе онлайн-продажу 1) фальсифицированных, поддельных, дефектных или незарегистрированных лекарств или 2) фальсифицированных, поддельных или неисправных медицинских изделий, или 3) фальсифицированных пищевых добавок (биологически активных добавок, содержащих фармацевтические субстанции, не заявленные во время государственной регистрации) ужесточен Федеральным законом от 28.07.2012 г.89 от 1 апреля 2020 г. (п. 3 ст. 6.33 КоАП РФ, п. 1.1 ст. 238.1 УК РФ).
Усиленная ответственность включает административный штраф в размере до 6 000 000 российских рублей (примерно 81 000 долларов США) или административное приостановление деятельности на срок до 90 дней. Уголовная ответственность предусмотрена в виде штрафа, лишения свободы до шести лет или принудительных работ до пяти лет с лишением права занимать определенные должности или заниматься определенной деятельностью на срок до трех лет.
Такая более строгая административная и уголовная ответственность предусмотрена для снижения рисков, связанных с недавно введенным разрешением на продажу безрецептурных лекарств через Интернет.
Нулевая ставка импортной пошлины на товары, предотвращающие распространение COVID-19
Решение Совета Комиссии Евразийского экономического союза (ЕАЭС) об освобождении от ввозных таможенных пошлин ввозимых товаров для предотвращения распространения COVID-19 было принято 16 марта 2020 года.
Это решение распространяется в первую очередь на средства индивидуальной защиты, дезинфицирующие средства, диагностические реагенты, отдельные виды медицинского оборудования и материалов. Товары для борьбы с COVID-19, защиты и лечения населения будут импортироваться без уплаты импортных таможенных пошлин на основании целевого назначения, подтвержденного национальными компетентными органами здравоохранения.
Решение распространяется на товары, ввезенные на таможенную территорию ЕАЭС в период с 16 марта 2020 года, и будет действовать до 30 сентября 2020 года.
Упрощенная процедура регистрации медицинских изделий
Распоряжением Правительства РФ от 18 марта 2020 г. № 299 установлена упрощенная процедура получения регистрационного удостоверения (т. Е. Государственной регистрации) на ряд изделий медицинского назначения.
Упрощенная процедура распространяется на регистрацию различных видов медицинской формы (защитная одежда, пальто), масок, перчаток, бахил и респираторов. Упрощенная процедура позволяет получить регистрационное удостоверение без предоставления результатов каких-либо испытаний и тестов.Если Росздравнадзор (т. Е. Государственный орган, выдающий регистрационное удостоверение для медицинских изделий) не направит запрос, регистрационное удостоверение будет выдано в течение 5 рабочих дней после получения необходимых документов.
В то же время соискатель регистрационного удостоверения должен пройти технические испытания, токсикологические исследования и клинические испытания медицинских изделий, в отношении которых регистрационное удостоверение было получено по упрощенной процедуре после получения регистрационного удостоверения.Таким образом, результаты указанных испытаний и испытаний должны быть предоставлены в Росздравнадзор в течение 150 рабочих дней после получения разрешения на продажу. Росздравнадзор проводит экспертизу качества, эффективности и безопасности медицинского изделия на основании полученных результатов и подтверждает или аннулирует соответствующее регистрационное удостоверение.
Упрощенная процедура регистрации (государственной регистрации) установлена на 36 видов медицинских изделий, в том числе медицинские маски и респираторы.
Упрощенная процедура регистрации лекарственных средств
Постановлением Правительства РФ № 441 от 3 апреля 2020 года установлен особый порядок получения регистрационного удостоверения (т.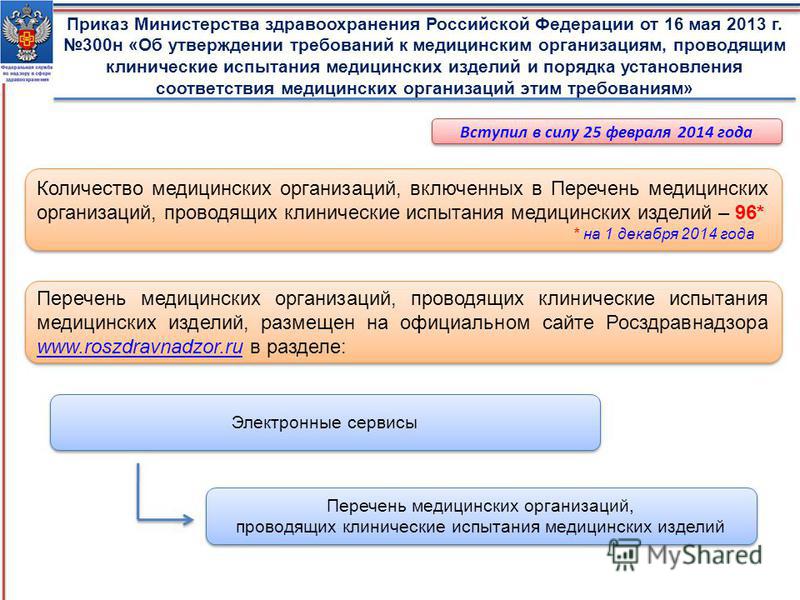 Е. Государственной регистрации) лекарственных средств, предназначенных для использования в условиях войны, чрезвычайных ситуаций, профилактики и лечения заболеваний, вызывающих опасность для окружающих, заболевания и травмы в результате воздействия неблагоприятных химических, биологических и радиационных факторов, которые развиваются, среди прочего, на основании указаний определенных государственных органов.
Е. Государственной регистрации) лекарственных средств, предназначенных для использования в условиях войны, чрезвычайных ситуаций, профилактики и лечения заболеваний, вызывающих опасность для окружающих, заболевания и травмы в результате воздействия неблагоприятных химических, биологических и радиационных факторов, которые развиваются, среди прочего, на основании указаний определенных государственных органов.
Заявление на получение регистрационного удостоверения и дополнительные документы могут быть предоставлены в электронном виде в Минздрав России. Более того, исследования по оценке риска и пользы для лекарственного средства могут проводиться по упрощенной процедуре.
Постановление Правительства РФ действует до 31 декабря 2020 года.
Без НДС на основные медицинские изделия
Основные медицинские изделия (например, средства индивидуальной защиты), ввезенные на территорию Российской Федерации в рамках борьбы с распространением COVID-19, освобождены от налога на добавленную стоимость (ссылка).
Изменения в гос.закупках
До 31 декабря 2020 года включительно Правительство Российской Федерации может установить дополнительные случаи государственных закупок у одного поставщика, а также определить соответствующий порядок (Ссылка).
Законодательные инициативы, связанные с телемедициной
Поскольку самоизоляция практикуется во многих регионах России, в настоящее время существует большой спрос на онлайн-услуги здравоохранения.
Стоит отметить, что официально телемедицинские услуги начали развиваться в России в 2018 году, когда Федеральным законом от 25.07.2012 г.242 от 29 июля 2017 года («Закон о телемедицине»). Закон «О телемедицине» предоставил медицинским организациям (получившим лицензию на фармацевтическую деятельность) право предоставлять ряд медицинских услуг в режиме онлайн, в частности, проводить консультации и контролировать состояние здоровья пациента. Однако Закон о телемедицине не позволяет диагностировать пациентов только на основе онлайн-общения.
Однако Закон о телемедицине не позволяет диагностировать пациентов только на основе онлайн-общения.
Распространение COVID-19 вызвало ряд инициатив по расширению области телемедицины.Прежде всего, предоставление медицинской организации возможности поставить диагноз пациентам и назначить лечение. Соответствующий законопроект был внесен в Госдуму в марте 2020 года и уже прошел первое чтение. Также принимается множество организационных мер по продвижению телемедицины в России. В частности, в 2018 году власти Москвы запустили пилотный проект по использованию телемедицины в 2 поликлиниках и организовали телемедицину для пациентов, которые лечатся с коронавирусной инфекцией на дому.Также несколько дней назад власти Ханты-Мансийского автономного округа России запустили пилотный проект по использованию телемедицины для лечения пациентов с хроническими заболеваниями.
Однако проблемы, связанные с телемедициной (например, безопасностью персональных данных), остаются, и практика покажет, как они будут решаться.
Поскольку ситуация в России стремительно развивается и новые законы и постановления принимаются почти каждый день, мы настоятельно рекомендуем внимательно следить за ситуацией.По вашему запросу мы будем рады предоставить более подробную информацию о мерах, принимаемых Российской Федерацией в ответ на вспышку COVID-19, и ответить на конкретные вопросы.
Авторы Наталья Гуляева, Александра Бахтиозина, Наталья Спицына и Наталья Спиридонова
В настоящее время в Российской Федерации действуют два свода правил фармаконадзора. Местным регулирующим органом, отвечающим за фармаконадзор, является Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор) и Федеральное государственное бюджетное учреждение под названием Центр мониторинга и клинико-экономической экспертизы при Росздравнадзоре.
Местные требования регулируются Федеральным законом № 61 «Об обращении лекарственных средств» и Приказом Росздравнадзора № 1071 «Об утверждении процедур фармаконадзора».
Россия также теперь является частью Евразийского экономического союза (ЕАЭС) и будет следовать нормам, установленным Евразийской экономической комиссией. Государствами-членами ЕАЭС являются Российская Федерация, Республика Беларусь, Республика Казахстан, Республика Армения и Кыргызская Республика.
3 ноября 2016 г.87 Евразийская экономическая комиссия ратифицировала «Правила надлежащей практики фармаконадзора в Евразийском экономическом союзе».
Фармаконадзор в России и ЕАЭС осуществляется посредством сотрудничества между всеми вовлеченными сторонами (например, держателями регистрационных удостоверений (MAH), CRO, врачами, пациентами, регулирующими органами). Информация также получена из периодических отчетов по безопасности и в ходе проверок.
План управления рисками должен быть подготовлен для каждого продукта MAH. Аудиты системы фармаконадзора должны планироваться УЗН.Квалифицированное лицо, ответственное за фармаконадзор (QPPV), должно быть назначено в странах ЕАЭС. QPPV должен пройти обучение по системе фармаконадзора соответствующего MAH.
Надлежащая практика фармаконадзора (GVP) в ЕАЭС использует принципы фармаконадзора, которые соответствуют европейским принципам, а местный российский Приказ 1071 гармонизирует GVP в ЕАЭС с местным законодательством.
Наталья Саламова — директор по развитию бизнеса Smooth Drug Development.Наталья работает в отрасли с 2010 года, имея опыт работы в международных и местных CRO, а также в Комитете по здравоохранению Бундестага Германии. Smooth Drug Development — это CRO полного цикла, предоставляющая полный спектр клинических исследований в России и странах СНГ.
Эта статья была перепечатана из тома 24, выпуска 06, из The CenterWatch Monthly , ведущего отраслевого издания, обеспечивающего серьезное, авторитетное деловое и финансовое освещение пространства клинических исследований.В разделе «Действия» представлены короткие столбцы, посвященные практическим советам или практическим рекомендациям специалистов по клиническим исследованиям. Чтобы отправить задание, напишите по адресу editorial@centerwatch.com. Подписка >>
Чтобы отправить задание, напишите по адресу editorial@centerwatch.com. Подписка >>
Дистанционная торговля лекарствами — как она развивается в России
В соответствии с данными изменениями аптекам запрещена продажа через Интернет:
- лекарств, отпускаемых по рецепту;
- наркотических и психотропных средств;
- спиртосодержащих лекарственных средств с объемной долей этилового спирта более 25%.
Все остальные лекарства, не подпадающие под запрет, можно приобрести через Интернет и заказать с доставкой на дом.
Для розничной онлайн-продажи лекарственных средств аптечным организациям необходимо получить специальное разрешение, так как только лица, имеющие лицензию на фармацевтическую деятельность и разрешение Росздравнадзора, будут иметь право осуществлять удаленную торговлю лекарственными средствами. Получение разрешения занимает до 5 рабочих дней со дня поступления в Росздравнадзор заявления и необходимых документов.Реестр выданных разрешений будет размещен на сайте агентства. В случае нарушений со стороны аптечной организации и в ряде других случаев разрешение может быть отозвано.
В соответствии с поправками к Закону об обращении лекарственных средств удаленная продажа рецептурных препаратов также может быть разрешена во время эпидемий. В связи с распространением коронавирусной инфекции у правительства есть дополнительные полномочия в этом отношении. Пользоваться ими он сможет до 31 декабря 2020 года включительно.Однако в любом случае удаленная реализация наркотических и психотропных средств, а также спиртосодержащих препаратов с объемной долей этилового спирта более 25% будет невозможна.
16 мая 2020 года Правительство Российской Федерации постановлением № 697 утвердило Правила выдачи разрешений на удаленную розничную продажу лекарственных средств, их реализацию и доставку гражданам («Правила»).
Согласно Правилам прием заказов на ЛС для удаленной продажи может осуществляться через сайт, мобильное приложение, по телефону службы заказа / справочной службы, либо через другое структурное подразделение организации.
Правила определяют требования к аптечной организации, чтобы иметь возможность продавать лекарства гражданам удаленно. В частности, организация должна иметь: соответствующую фармацевтическую лицензию на год и более, не менее десяти мест фармацевтической деятельности в РФ, соответствующее оборудование (места) для хранения заказов, веб-сайт / мобильное приложение, собственную курьерскую службу или договор со службой доставки, обеспечивающей надлежащий температурный режим для лекарств, а также электронная платежная система и / или мобильные терминалы, позволяющие оплачивать товары по месту оказания услуги.
В процессе своей деятельности аптеки будут обязаны регистрировать удаленные заказы и доставку лекарств, а также вводить информацию об оплаченных (отпускаемых) и полученных покупателем лекарствах в систему мониторинга лекарственных средств.
Доставленный заказ может быть принят покупателем, а в его отсутствие — другим лицом, которое сможет предъявить квитанцию или другой документ, подтверждающий заключение контракта, оплату заказа или выполнение его доставки. .
Помимо прочего, Правила регулируют обязанности аптечного предприятия при приеме заказов, момент заключения договора с покупателем, требования к упаковке лекарственных средств при доставке, порядок их доставки, обязанности покупателя при получении. порядок и другие вопросы.
За нарушение Правил компаниями их сайты будут заблокированы, если владельцы сайта не удалят их сами.
Федеральный закон89-ФЗ от 1 апреля 2020 года устанавливает административную ответственность за продажу контрафактных лекарств в Интернете. Штрафы за нарушение для должностных лиц и индивидуальных предпринимателей составят от 150 000 до 600 000 рублей, для юридических лиц — от 2 до 6 миллионов рублей.
Для юридических лиц и индивидуальных предпринимателей может быть назначено дополнительное наказание в виде административного приостановления их деятельности на срок до 90 суток.
Федеральным законом от 01. 04.2020 № 95-ФЗ установлена уголовная ответственность за те же деяния, совершенные в особо крупном размере, то есть когда стоимость лекарственных средств превышает 100 000 рублей.Меры уголовной ответственности включают принудительные работы до 5 лет с возможным лишением права занимать определенные должности на срок до 3 лет или лишение свободы до 6 лет со штрафом до 2,5 млн рублей с возможным лишением свободы. право занимать определенные должности до 4 лет.
04.2020 № 95-ФЗ установлена уголовная ответственность за те же деяния, совершенные в особо крупном размере, то есть когда стоимость лекарственных средств превышает 100 000 рублей.Меры уголовной ответственности включают принудительные работы до 5 лет с возможным лишением права занимать определенные должности на срок до 3 лет или лишение свободы до 6 лет со штрафом до 2,5 млн рублей с возможным лишением свободы. право занимать определенные должности до 4 лет.
Мы будем следить за законодательными изменениями по этим вопросам и сообщать вам о принятии нового законодательства в сфере онлайн-торговли наркотиками.
Statandocs — Интернет-мероприятия Advantix Pharma
Statandocs была основана в 2016 году группой экспертов в области клинических и доклинических исследований.Основной целью основателей компании на тот момент было помочь фармацевтической отрасли в подготовке качественных клинических и регистрационных досье на лекарства. С самого начала своей деятельности специалисты Statandocs оказывали консультационные услуги по оптимальной стратегии разработки лекарств, услуги по написанию медицинских документов — от концепции до протокола и других важных документов клинического исследования, статистическое сопровождение от обоснования размера выборки до создания отчета о результатах клинического исследования. результаты исследования, оформление досье в едином техническом документе (CTD) в соответствии с требованиями местного законодательства Российской Федерации и в формате CTD в соответствии с законодательством Евразийского экономического союза (ЕАЭС).
КВАЛИФИКАЦИЯ СОТРУДНИКОВ
Принимая во внимание стремительные изменения нормативной базы как на национальном, так и на международном уровне, сотрудники компании постоянно проходят обучение на обучающих семинарах и курсах повышения квалификации в ФГБУ «Научный центр экспертизы лекарственных средств» Минздрава России. РФ, ФГБУ «ВНИИИМТ» Росздравнадзора, ФГБУ «Национальный институт качества» Росздравнадзора (ранее ФГБУ ЦМИКЭЭ Росздравнадзора), ФГУ СИД и ГП. Эффективная и максимально полезная работа для наших клиентов невозможна без понимания насущных проблем, с которыми ежедневно сталкиваются фармацевтические компании, без обмена опытом с коллегами и представителями регулятора в процессе реального общения. Поэтому владельцы направлений бизнеса компании ежегодно участвуют в ключевых отраслевых конференциях и конгрессах, таких как RegLek, PharmMedOverview, Circulation of medical devices, Международный конгресс по клиническим испытаниям медицинских устройств (CTMD), Международный форум Института Адама Смита «Клиническая медицина». Исследования в России »Азиатского фармацевтического форума, и последние два года в качестве приглашенных спикеров и организаторов мастер-классов, неизменно вызывающих интерес делегатов.
Эффективная и максимально полезная работа для наших клиентов невозможна без понимания насущных проблем, с которыми ежедневно сталкиваются фармацевтические компании, без обмена опытом с коллегами и представителями регулятора в процессе реального общения. Поэтому владельцы направлений бизнеса компании ежегодно участвуют в ключевых отраслевых конференциях и конгрессах, таких как RegLek, PharmMedOverview, Circulation of medical devices, Международный конгресс по клиническим испытаниям медицинских устройств (CTMD), Международный форум Института Адама Смита «Клиническая медицина». Исследования в России »Азиатского фармацевтического форума, и последние два года в качестве приглашенных спикеров и организаторов мастер-классов, неизменно вызывающих интерес делегатов.
ДЕЯТЕЛЬНОСТЬ
Активное участие Statandocs в жизни отрасли напрямую связано с развитием компании и появлением новых направлений деятельности. Так, с вступлением в силу Правил надлежащей практики фармаконадзора ЕАЭС и приказов национального регулятора, основанных на этих правилах, с 2017 года растет спрос на подготовку качественных документов для системы фармаконадзора. : периодический отчет об обновлении безопасности (PSUR), отчет об обновлении безопасности (DSUR), план управления рисками (RMP), главный файл системы фармаконадзора.Сегодня сотрудники компании сертифицированные специалисты по фармаконадзору, подготовленные ими документы соответствуют строгим требованиям специалистов Росздравнадзора и в большинстве случаев принимаются без комментариев с первой подачи. Благодаря очень серьезному отношению к информационной безопасности в компании работают высококвалифицированные специалисты в области IT-технологий. При участии экспертов ИТ-отдела и специалистов отдела управления данными мы внедрили собственные электронные сервисы CRF и IWRS, обеспечиваем разработку баз данных, ввод и проверку данных, формирование уточняющих запросов, бесперебойную работу базы данных, содержащие информацию о десятках тысяч пациентов. Statandocs — одна из первых компаний, предлагающих услугу по подготовке электронного CTD (eCTD) в соответствии с требованиями ЕАЭС. Подготовленные eCTD прошли валидацию и приняты регулирующими органами Российской Федерации и Республики Казахстан. В 2019 году был запущен сервис по написанию SmPC, листовки-вкладыша и проведения пользовательского тестирования листовки-вкладыша, в частности, было проведено более 10 пользовательских тестов с использованием телекоммуникационных технологий в период действия ограничительных мер в связи с пандемией новая коронавирусная инфекция COVID-19.
Statandocs — одна из первых компаний, предлагающих услугу по подготовке электронного CTD (eCTD) в соответствии с требованиями ЕАЭС. Подготовленные eCTD прошли валидацию и приняты регулирующими органами Российской Федерации и Республики Казахстан. В 2019 году был запущен сервис по написанию SmPC, листовки-вкладыша и проведения пользовательского тестирования листовки-вкладыша, в частности, было проведено более 10 пользовательских тестов с использованием телекоммуникационных технологий в период действия ограничительных мер в связи с пандемией новая коронавирусная инфекция COVID-19.
НАШ ОПЫТ
За 4 года работы сотрудниками Statandocs выполнено более 900 проектов. Накоплен огромный опыт в области написания научных и нормативных медицинских документов, экспертизы доклинических и клинических досье, в том числе с подготовкой юридически значимых заключений; 6 программ развития, включая разработку оригинальных молекул, сопровождались нами от первых исследований на людях до регистрации. Высокая квалификация специалистов Statandocs признана экспертами регулирующих органов Российской Федерации и ЕАЭС, что подтверждается включением в рабочую группу, которая готовит методические рекомендации по статистическим аспектам клинических исследований.Ведущие специалисты Statandocs проводят тренинги и семинары, а также вебинары по всем направлениям деятельности компании. Наши сотрудники принимали участие в качестве приглашенных лекторов в сертификационных образовательных циклах по экспертизе и регистрации лекарственных средств, надлежащей клинической практике, организованных ФГБУ «Научный центр экспертизы лекарственных средств», а также в разработке и проведении курса » Документы клинических исследований лекарственных средств »на базе Первого МГМУ им. И.М. Сеченова с выдачей сертификатов государственного образца.
Хирургическая система SenhanceTransEnterix одобрена в России
TransEnterix Inc., компания, занимающаяся медицинским оборудованием, которая переводит в цифровую форму интерфейс между хирургом и пациентом для улучшения малоинвазивной хирургии, объявила, что хирургическая система Senhance получила регистрационный сертификат Росздравнадзора. Орган по надзору за медицинским оборудованием, разрешающий его продажу и использование на всей территории Российской Федерации.
Орган по надзору за медицинским оборудованием, разрешающий его продажу и использование на всей территории Российской Федерации. «Разрешение российских регулирующих органов является важной вехой для TransEnterix, и это недостаточно обслуживаемый рынок роботизированной хирургии», — сказал Энтони Фернандо, президент и генеральный директор TransEnterix.«За последние 10 лет в России быстро выросли знания и опыт малоинвазивной хирургии, но роботизированная хирургия остается крайне ограниченной в регионе из-за высокой стоимости процедуры и успеха лапароскопических доступов. Senhance помогает решить эти проблемы с усыновлением. Ранее мы работали с BOWA над запуском четырех программ Senhance в регионе Содружества Независимых Государств (СНГ) и надеемся на сотрудничество, чтобы использовать этот недавний успех для выхода на крупнейший рынок СНГ.”
TransEnterix является партнером компании BOWA-electronic GmbH & Co. KG (BOWA), расположенной в Германии, с целью коммерциализации хирургической системы Senhance в регионе СНГ в течение последних трех лет. Компания BOWA вместе со 100% дочерней компанией ООО «БОВА Евразия» имеет устойчивое коммерческое присутствие и поддержку в этом регионе. Они хорошо оснащены для стимулирования продаж медицинского оборудования и оказания послепродажной поддержки больницам в регионе СНГ, включая Россию, в отношении собственного дополнительного портфеля хирургических устройств Senhance и BOWA.
Хирургическая система Senhance — первая и единственная цифровая лапароскопическая платформа, разработанная для поддержания стандартов минимально инвазивной лапароскопической хирургии, обеспечивая при этом цифровые преимущества, такие как тактильная обратная связь, роботизированная точность, удобная эргономика, усовершенствованные инструменты, включая 3-миллиметровые микролапароскопические инструменты, управление камерой с датчиком зрения и многоразовые стандартные инструменты, позволяющие снизить затраты на одну процедуру, как при традиционной лапароскопии.
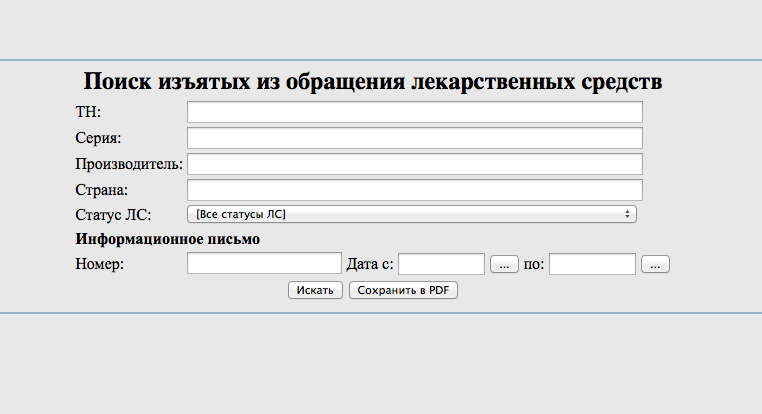 TransEnterix также недавно запустила первую систему машинного зрения в роботизированной хирургии в США.Эта первая в своем роде возможность расширенного интеллекта обеспечивается новым интеллектуальным хирургическим блоком хирургической системы Senhance. В настоящее время не все функции доступны на всех рынках.
TransEnterix также недавно запустила первую систему машинного зрения в роботизированной хирургии в США.Эта первая в своем роде возможность расширенного интеллекта обеспечивается новым интеллектуальным хирургическим блоком хирургической системы Senhance. В настоящее время не все функции доступны на всех рынках. Управление качеством
Данные о безопасности и качестве пациентов лежат в основе всего, что мы делаем. Команда качества Medical Technologies гарантирует, что наши процессы будут надежными, а данные о пациентах будут полными и точными.
Команда Medical Technologies понимает, что эффективная система менеджмента качества позволяет минимизировать ряд потенциальных рисков.Наша компания уделяет большое внимание качеству.
Medical Technologies признана многими спонсорами лидером в области обеспечения качества и соблюдения нормативных требований. Для обеспечения качества мы разработали собственные системы управления качеством медицинских технологий. Все объекты в сети «Медицинские технологии» работают в единой Системе управления качеством.
Мы постоянно работаем с CRO и фармацевтическими компаниями над обновлением наших операционных процедур, обеспечивая непрерывный цикл улучшений процессов, который обеспечивает соответствие нормативным, этическим и ICH GCP требованиям и ожиданиям клиентов.
Видение качества медицинских технологий заключается в постоянном достижении высших стандартов качества для обеспечения высочайшего качества обслуживания клиентов и пациентов.
Система менеджмента качества включает:
- Видение качества
- Организационная структура компании
- Стандартные рабочие процедуры, политики, шаблоны и стандартные формы
- Контроль качества и контроля качества
- Обучение персонала
- Оценка эффективности
Все Документы QMS компании хранятся в электронной системе LMS, что позволяет всем сотрудникам иметь онлайн-доступ к документам в любое время.