Рак желудка
Вам поставили диагноз: рак желудка?Наверняка вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать».
Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни. Мы поможем вам справиться с болезнью и будем идти с Вами рука об руку через все этапы вашего лечения.
Предлагаем Вашему вниманию краткий, но очень подробный обзор рака желудка.
Его подготовили высоко квалифицированные специалисты торакоабдоминального отделения МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России..
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
ВведениеАнатомия органа
Желудок – орган пищеварения, относится к верхним отделам пищеварительного тракта. Представляет собой полый мышечный орган, располагается между пищеводом и двенадцатиперстной кишкой, в верхнем этаже брюшной полости, занимая преимущественно срединное положение. Объем и размеры желудка варьируют в зависимости от его наполнения. Пустой желудок длиной 18-20см, объем – около 400мл, при наполнении желудка объем его может возрастать до 4л.
 Вдоль большой и малой кривизны располагаются сосуды (артерии, вены, лимфатические сосуды) и нервные волокна, обеспечивающие питание стенки желудка и регулировку его работы. Вокруг сосудисто-нервных пучков имеется жировая клетчатка, содержащая лимфатические узлы, через которые осуществляется отток лимфы из органа. К передней поверхности желудка прилежит левая доля печени, к задней – поджелудочная железа.
Вдоль большой и малой кривизны располагаются сосуды (артерии, вены, лимфатические сосуды) и нервные волокна, обеспечивающие питание стенки желудка и регулировку его работы. Вокруг сосудисто-нервных пучков имеется жировая клетчатка, содержащая лимфатические узлы, через которые осуществляется отток лимфы из органа. К передней поверхности желудка прилежит левая доля печени, к задней – поджелудочная железа.Желудок, как было сказано выше, участвует в переваривании пищи. Это происходит благодаря наличию большого количества желез желудка, которые вырабатывают желудочный сок. Желудочный сок, в свою очередь, с помощью пищеварительных ферментов расщепляет белки и частично жиры. За счёт наличия мышц в стенке желудок перемешивает пищу и желудочный сок, образуя химус — жидкую кашицу, которая проходит дальше, в двенадцатиперстную кишку.
Основная функция желудка – накопление пищевой массы, ее механическая и химическая (с помощью желудочного сока) обработка и продвижение в двенадцатиперстную кишку. Кроме того, желудочный сок содержит соляную кислоту, выполняющую и защитную (бактерицидную) функцию, а также слизистая оболочка желудка выделяет ряд специфических факторов и биологически активных веществ, которые регулируют дальнейшее пищеварение. В процессе желудочного пищеварения всасываются вода, соли, глюкоза.
Рак желудка – это злокачественная опухоль, развивающаяся из клеток внутренней слизистой оболочки желудка. По локализации выделяют опухоли верхних (проксимальных, близких к пищеводу) отделов желудка, средних отделов (тела) желудка и нижних (дистальных, ближе к двенадцатиперстной кишке) отделов, опухоль может распространяться на два и более отдела и приобретать тотальное распространение.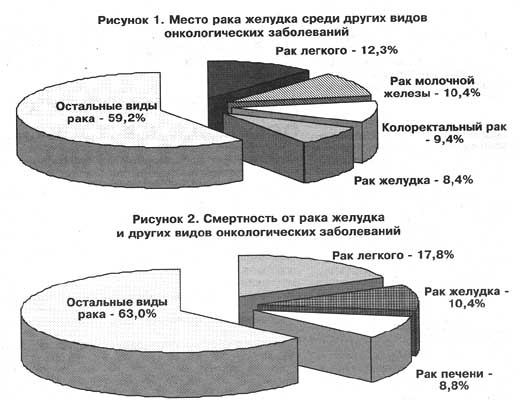
Рак желудка, как и другие злокачественные опухоли, имеет способность прорастать в толщу стенки органа и врастать в прилежащие органы и структуры, а также давать отсевы в ближайшие к органу лимфатические узлы (регионарные метастазы). Рак желудка может распространяться вдоль пищеварительной трубки на пищевод, двенадцатиперстную кишку, а также прорастать в поджелудочную железу, печень, переднюю брюшную стенку, поперечно-ободочную кишку и ее брыжейку. Опухолевые клетки могут переноситься с током крови в другие органы (печень, легкие, кости и др) и давать рост новых очагов (отдаленные метастазы), а также при прорастании наружной оболочки – рассеиваться по брюшной полости и формировать множественные очаги на брюшине (перитонеальная диссеминация).
В мире рак желудка занимает 5 место в структуре онкологической заболеваемости и 2 место в структуре смертности от онкологических заболеваний. Поскольку это заболевание имеет высокий показатель смертности (более 700 000 в год), оно является вторым в структуре онкологической смертности после рака лёгкого.
По строению опухоли желудка могут очень сильно различаться. Строение клеток опухоли определяет ее «гистологический» тип.
Аденокарцинома
Этот вид формируется в железистом эпителии желудка. Аденокарцинома, в свою очередь, подразделяется на высоко-(G1), умеренно-(G2), низко- (G3) и недифференцированную(G4). Чем меньше в опухолевой клетке остается черт «нормальной» клетки (предшественницы), тем ниже степень ее дифференцировки (G1->G4). Одной из наиболее агрессивных разновидностей аденокарцином является перстневидноклеточный рак желудка.
Плоскоклеточный рак
Самый нераспространенный тип опухоли.
Железисто-плоскоклеточный рак
Опухоль, в которой сочетаются элементы аденокарциномы и плоскоклеточного рака.
Нейроэндокринная карцинома (включая мелкоклеточный рак желудка)
Редкая высоко злокачественная форма рака желудка, которую можно диагностировать при помощи иммуногистохимического исследования. Отличается высоким потенциалом к метастазированию.
Недифференцированный рак
Помимо раковых опухолей в желудке могут встречаться карциноиды – опухоли из клеток диффузной нейроэндокринной системы, расположенных в желудке. Карциноиды представляют собой полиповидные опухоли, часто множественные, и отличаются более доброкачественным течением по сравнению с аденокарциномами.
Также есть классификация, которую активно используют врачи-онкологи, занимающиеся опухолями желудка. В данной классификации есть всего 2 варианта: рак желудка кишечного типа и диффузного.
Рак желудка кишечного типа сходен по строению с опухолями кишечника (откуда и берет свое название) и представлен отчетливыми железистыми структурами, состоящими из цилиндрического эпителия. Часто причинами развития рака желудка кишечного типа являются факторы окружающей среды, а именно питания и образа жизни, о которых мы поговорим позже. Также значительную роль в возникновении данного типа рака желудка играет бактерия H.pylori.
В отличие от рака желудка кишечного типа, для диффузного типа не характерна стадийность поражения слизистой оболочки желудка. В то же время, при этой форме чаще появляется не один, а несколько очагов опухолевого поражения одновременно. Для рака желудка диффузного типа характерно более агрессивное и быстрое течение болезни, а значит методы лечения этой формы также более агрессивны.

Как все злокачественные новообразования, в развитии рака желудка выделяют 4 стадии:
• Первой стадии процесса соответствует распространенность опухоли не глубже мышечного слоя, возможно наличие МТС в 1-2 регионарных лимфоузлах.
• Вторая стадия характеризуется глубиной инвазии до серозного слоя, но без МТС в регионарных лимфоузлах, либо наличие регионарных МТС с небольшой инвазией опухоли.
• Третья стадия определяется глубокой инвазией и наличием МТС в регионарных лимофузлах.
На ранних стадиях развития рака желудка специфических клиническим симптомов, как правило, не бывает. Пациентов беспокоят ощущение общего дискомфорта в верхнем этаже брюшной полости, чаще всего связанного с сопутствующими заболеваниями желудочно-кишечного тракта (хронический панкреатит, холецистит, колит), либо с фоновыми воспалительными изменениями в слизистой оболочке желудка. Болевые ощущения в желудке появляются при наличии изъязвления или воспаления с вовлечением глубоких слоев стенки желудка, где имеются нервные окончания, способные воспринять боль. Изъязвление в слизистой оболочке желудка – локальное разрушение слизистой оболочки желудка до глубоких слоев (подслизистого, мышечного), может вызывать болевые ощущения в верхних отделах живота, дискомфорт и тошноту, а в редких случаях вызывать желудочные кровотечения.
Болевые ощущения в желудке появляются при наличии изъязвления или воспаления с вовлечением глубоких слоев стенки желудка, где имеются нервные окончания, способные воспринять боль. Изъязвление в слизистой оболочке желудка – локальное разрушение слизистой оболочки желудка до глубоких слоев (подслизистого, мышечного), может вызывать болевые ощущения в верхних отделах живота, дискомфорт и тошноту, а в редких случаях вызывать желудочные кровотечения.
Выявление рака желудка на ранних стадиях происходит, как правило, при выполнении эндоскопического исследования либо по поводу неясных ощущений в животе, либо при профилактических осмотрах.
Научные данные свидетельствуют о том, что с момента появления первой раковой клетки до достижении опухолью размером 2 мм в пределах слизистой оболочки проходит от 2 до 7 лет (в зависимости от индивидуального темпа роста опухоли). Ранняя стадия рака желудка занимает период длительностью не менее 5 лет. Следовательно, выявление рака желудка на ранней, излечимой стадии, можно считать основным благоприятным прогностическим фактором в лечении рака желудка.
В Японии, где заболеваемость раком желудка чрезвычайно высока, существует государственная национальная программа, направленная на раннее выявление и лечение рака желудка (т.н. скрининг рака желудка). Она заключается в обязательном проведении гастроскопии всем гражданам, а при наличии факторов риска и фоновых заболеваний – регулярное проведение эндоскопического исследования.
При достижении опухолью определенных размеров можно выделить условно ряд симптомов:
-дискомфорт в верхних отделах брюшной полости, чувство тяжести, невозможность принять обычный объем пищи;
-боли в верхних отделах живота или разлитого характера, умеренной интенсивности, связанные или не связанные с приемом пищи, боли натощак;
-наличие анемии без явных причин также может быть следствием опухолевого процесса в желудке и является показанием к проведению гастроскопии;
— тошнота, эпизодическая рвота съеденной пищей. При сужении опухолью выходного отдела желудка отмечается застой пищи, при присоединении гнилостной флоры появляется специфический запах изо рта, появляется обильная рвота дурно-пахнущим содержимым, накапливающимся в желудке в течение нескольких суток;
-рвота с кровью, черный жидкий стул, резкая слабость и понижение артериального давления свидетельствуют о желудочном кровотечении, причиной которого может быть опухоль желудка;
-затруднение прохождения пищи (дисфагия) развивается при распространении опухоли желудка на пищеводно-желудочный переход и пищевод;
-похудание, слабость могут быть следствие нарушения питания (при сужении просвета желудка) либо свидетельствовать о далеко зашедшем процессе с развитием отдаленных метастазов;
-иногда заболевание впервые проявляется увеличением лимфоузлов надключичной области слева, реже – на шее, либо выявлением на УЗИ малого таза увеличенных, метастатически измененных яичников;
-у молодых пациентов манифестация заболевания может быть сразу в виде появления асцита и кишечной непроходимости вследствие перитонеального канцероматоза.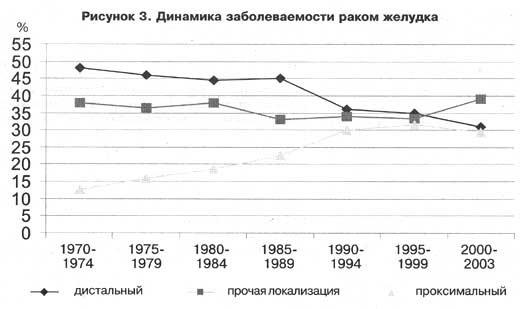
Наличие факторов риска не означает, что рак желудка обязательно вас коснется. Стоит сказать, что отсутствие каких-либо факторов риска тоже не означает, что вы защищены от развития опухолей, ведь возникновение их связано с более сложными механизмами и возможными изменениями в генах.
Факторы риска настолько многообразны, что проще будет разделить их на группы:
1. Пищевые факторы (повышенное потребление поваренной соли; диета с высоким содержанием мясных продуктов, приготовленных с использованием соли, копчения, консервантов; пищевые нитраты и нитрозосодержащие компоненты).
2. Инфекционные факторы (инфекцию Helicobacter pylori и вирус Epstein-Barr)
3. Факторы внешней среды и образа жизни (курение табака, ожирение, профессиональные вредности, в т.ч. угольная пыль, лако-красочные работы, производство резины и метталургия)
4. Наследственные факторы (наличие у кровного родственника рака желудка и/или мутации гена CDh2)
Наследственные факторы (наличие у кровного родственника рака желудка и/или мутации гена CDh2)
Строго наследственными формами рака желудка в настоящее время считаются три генетических синдрома:
Наследственный рак желудка диффузного типа
При наличии данного синдрома вероятность развития рака желудка в течение жизни превышает 80%. Средний возраст возникновения опухоли составляет 38 лет. Одной из наиболее вероятных генетических основ данного синдрома является мутация в гене CDh2.
Согласно международным рекомендациям 2015 г. НРЖДТ можно заподозрить при наличии одного из следующих критериев:
1. если имеется как минимум два случая рака желудка в семье, среди которых хотя бы один диффузный;
2. если диффузный рак желудка возник у пациента в возрасте до 40 лет;
3. если имеется сочетание диффузного рака желудка и долькового рака молочной железы у одной больной или у близких родственников, при возникновении любой из этих опухолей в возрасте до 50 лет. Данная форма наследственного рака желудка характеризуется ранним началом заболевания и агрессивным течением.
Данная форма наследственного рака желудка характеризуется ранним началом заболевания и агрессивным течением.
Синдром GAPPS (от англ. — gastric adenocarcinoma & proximal polyposis of the stomach)
Обусловлен развитием полипоза желез в верхней части желудка.
Синдром фамильного рака желудка кишечного типа.
О наличии синдрома фамильного рака желудка кишечного типа у пациента с отягощенным семейным анамнезом следует задуматься при выявлении кишечного типа опухоли и отсутствии полипов в желудке.
Первичная диагностика рака желудка включает в себя:
• Осмотр врачом, выявление семейного анамнеза, факторов риска рака желудка.
• Эзофагогастродуоденоскопия (ЭГДС) выполняют специальным инструментом – гибким эндоскопом, представляющим собой тонкий гибкий шланг с подсветкой и видеокамерой на конце, который вводят через рот в просвет пищевода, желудка и двенадцатиперстной кишки.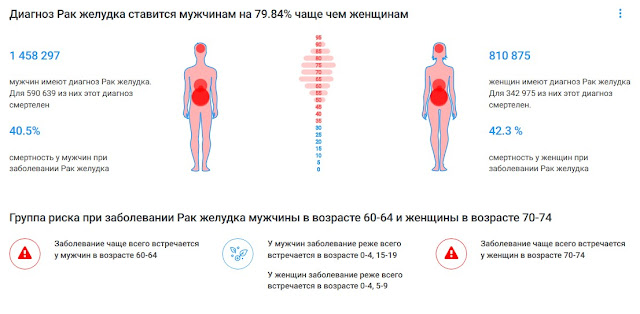 Этот метод позволяет прицельно рассмотреть все отделы пищевода, желудка, двенадцатиперстной кишки, в том числе при сильном увеличении, с применением различных дополнительных методик для выявления очагов измененной слизистой оболочки и забора материала для биопсии и гистологического/цитологического исследований. Существуют специальные методы окрашивания, прижизненной биопсии, осмотра в специальных режимах, позволяющих сразу заподозрить злокачественное заболевание. Эндоскопическое ультразвуковое исследование позволяет уточнить глубину инвазии опухоли в стенку желудка, рассмотреть ближайшие регионарные лимфатические узлы. В некоторых ситуациях эндоскопию выполняют под наркозом.
Этот метод позволяет прицельно рассмотреть все отделы пищевода, желудка, двенадцатиперстной кишки, в том числе при сильном увеличении, с применением различных дополнительных методик для выявления очагов измененной слизистой оболочки и забора материала для биопсии и гистологического/цитологического исследований. Существуют специальные методы окрашивания, прижизненной биопсии, осмотра в специальных режимах, позволяющих сразу заподозрить злокачественное заболевание. Эндоскопическое ультразвуковое исследование позволяет уточнить глубину инвазии опухоли в стенку желудка, рассмотреть ближайшие регионарные лимфатические узлы. В некоторых ситуациях эндоскопию выполняют под наркозом.
• Гистологическое или цитологическое исследование под микроскопом взятых кусочков опухоли (биопсия) позволяет подтвердить диагноз злокачественной опухоли, определить ее гистологический тип, выявить предраковые изменения слизистой оболочки желудка.
Уточняющая диагностика проводится с целью уточнения распространенности опухолевого процесса, наличие метастазов, и соответственно для определения стадии опухоли, включает в себя:
• Рентгенография пищевода и желудка с введением контраста (сульфата бария). Стандартная методика, заключающаяся в том, что больному предлагают выпить контраст, одновременно производя рентгеновские снимки. Метод позволяет выявить опухоль в желудке, места опухолевого сужения, нарушение эвакуации содержимого из желудка, уменьшение просвета желудка при диффузном раке.
Стандартная методика, заключающаяся в том, что больному предлагают выпить контраст, одновременно производя рентгеновские снимки. Метод позволяет выявить опухоль в желудке, места опухолевого сужения, нарушение эвакуации содержимого из желудка, уменьшение просвета желудка при диффузном раке.
• Ультразвуковое исследование (УЗИ) органов брюшной полости, забрюшинного пространства, лимфатических узлов шеи, над- и подключичных зон, малого таза. Позволяет обнаружить метастазы в печени, лимфатических узлах, малом тазу, яичниках, выявить наличие свободной жидкости в брюшной полости. В ряде наблюдений при соблюдении методики удается визуализировать опухоль непосредственно в желудке, выявить прорастание ее в соседние органы и структуры, рассмотреть регионарные лимфоузлы.
• Мультиспиральная компьютерная томография (компьютерная томография, КТ, СКТ, МСКТ), в том числе с внутривенным введением контраста, позволяет получить изображения органов грудной и брюшной полостей в виде поперечных срезов. С помощью компьютерной томографии определяют глубину прорастания опухолью стенки пищевода, расположение опухоли по отношению к окружающим органам и их вовлечение, наличие метастазов в легких, печени, лимфатических узлах.
С помощью компьютерной томографии определяют глубину прорастания опухолью стенки пищевода, расположение опухоли по отношению к окружающим органам и их вовлечение, наличие метастазов в легких, печени, лимфатических узлах.
• Диагностическая лапароскопия (исследование брюшной полости через проколы под общим наркозом) проводится для определения стадии заболевания и выявления метастазов на париетальной и висцеральной брюшине (перитонеальная диссеминация), не видимых при УЗИ и КТ. Тем самым лапароскопия сводит до минимума число эксплоративных (диагностических) лапаротомий.
Выбор метода лечения при раке желудка, как и при любом другом онкологическом заболевании, зависит от стадии процесса и общего состояния пациента на момент установления диагноза. Распространенность опухолевого процесса оценивается на основании данных обследования. Оценивают локализацию опухоли, глубину прорастания стенки желудка, вовлечение соседних органов, наличие метастазов в лимфатических узлах и отдаленных метастазов. Общее состояние пациента играет значительную роль в выборе метода лечения. Учитывается возраст, сопутствующие заболевания (сердечно-сосудистые, органов дыхания, печени, почек), лабораторные показатели (анализы крови, мочи), дефицит массы тела (недостаточность питания) и др. При тяжелом общем состоянии, у пожилых людей предпочтение отдают нехирургическим методам лечения. В некоторых случаях перед началом специального лечения требуется особая терапевтическая подготовка в условиях стационара.
Общее состояние пациента играет значительную роль в выборе метода лечения. Учитывается возраст, сопутствующие заболевания (сердечно-сосудистые, органов дыхания, печени, почек), лабораторные показатели (анализы крови, мочи), дефицит массы тела (недостаточность питания) и др. При тяжелом общем состоянии, у пожилых людей предпочтение отдают нехирургическим методам лечения. В некоторых случаях перед началом специального лечения требуется особая терапевтическая подготовка в условиях стационара.
План лечения каждого больного обсуждается на консилиуме с участием хирурга-онколога, химиотерапевта и радиотерапевта.
В зависимости от ситуации возможны следующие варианты лечения больных раком желудка:
1. Эндоскопическое лечение
Эндоскопическое лечение проводят при начальных формах рака (раннем раке), когда опухоль представляет собой небольшой очаг в пределах слизистой оболочки желудка. Операцию проводят через эндоскоп, удаляя фрагмент слизистой оболочки в пределах здоровой слизистой оболочки.
2. Хирургическое лечение
Основным методом лечения локализованного инвазивного рака желудка без отдаленных метастазов является радикальное хирургическое лечение. Оно заключается в тотальном (полном) или субтотальном удалении желудка. В зависимости от расположения опухоли выполняют дистальную субтотальную, либо проксимальную субтотальную резекции желудка с оставлением около ¼ органа. Такой объем требуется для максимального радикализма операции и предупреждения возобновления опухолевого роста (рецидива рака), т.к. опухолевые клетки могут распространяться вдоль стенки желудка на участки, неизмененные при осмотре. Одновременно удаляют лимфатические узлы желудка, так как в них могут быть метастазы. При распространении опухоли на пищевод производится резекция пищевода на 4-5см выше видимого опухолевого края. Удаленную часть желудка замещают петлями тонкой кишки. Существуют различные варианты реконструкции пищеварительного тракта после удаления желудка, позволяющие компенсировать утраченные функции. Прорастание опухоли в поджелудочную железу, печень, толстую кишку диктует необходимость выполнения комбинированной операции с резекцией вовлеченных в опухолевый процесс органов. Однако при прорастании жизненно важных структур, как правило магистральных сосудов, процесс признается неудалимым, операция завершается пробной лапаротомией и назначаются другие, альтернативные методы лечения.
3. Химиотерапия
Химиотерапия представляет собой вариант лечения, при котором химиопрепарат действует на быстроделящиеся клетки, тем самым вызывая их гибель. Есть три основных варианта проведения химиотерапии пациентам, которым планируется проведение хирургического вмешательства: перед операцией (так называемая неоадъювантная), после операции (адъювантная химиотерапия), а также периоперационная химиотерапия, когда химиопрепарат назначается как до операции, так и после нее.
Больным с местнораспространенным нерезектабельным процессом и/или наличии отдаленных метастазов, при хороших функциональных показателях, назначается химиотерапия в лечебном режиме. Применяются препараты фторпиримидинового ряда (капецитабин, 5-фторурацил), платины (цисплатин, оксалиплатин), таксаны, иринотеканы. Возможно применение таргетного препарата (трастузумаба) при наличии положительной экспрессии рецептора фактора роста HER2/NEU. Для определения чувствительности к трастузумабу (герцептину) необходимо исследовать эту экспрессию в кусочках опухоли путем иммуногистохимического исследования.
При выборе режима лекарственной терапии необходимо учитывать общее состояние больного, количество и тяжесть сопутствующих заболеваний, токсический профиль режимов, а также HER2-статус опухоли;
• при гиперэкспрессии / амплификации HER2 / neu в опухоли (ИГХ3+ или ИГХ2+ / FISH+) в состав первой линии лечения показано включение трастузумаба.
• трехкомпонентные режимы химиотерапии могут быть назначены сохранным больным в удовлетворительном общем состоянии, без нарушения функции внутренних органов, обязательным условием является возможность еженедельного мониторинга побочных эффектов и своевременное назначение сопроводительной терапии;
• необходимо соблюдение рекомендованных доз, режимов и продолжительности введения препаратов, составляющих комбинацию, с необходимой коррекцией их в процессе лечения;
• предпочтительно инфузионное, а не струйное назначение 5-фторурацила; эквивалентом инфузионному введению 5-фторурацила является прием таблетированной формы — капецитабина; цисплатин и оксалиплатин являются взаимозаменяемыми препаратами, выбор препарата осуществляется на основе токсического профиля;
• у больных с низким функциональным статусом или отягощенным сопутствующими заболеваниями средней тяжести возможно начало лечения с монохимиотерапии с последующим применением комбинированных режимов после улучшении общего состояния;
• при крайне низком функциональном статусе больного, наличии тяжелых сопутствующих заболеваний больным показана симптоматическая терапия
Побочные эффекты химиотерапии индивидуальны и зависят от препарата и используемой дозы, и могут включать утомляемость, тошноту и рвоту, выпадение волос, снижение аппетита и диарею. Все побочные эффекты проходят после завершения лечения.
4. Паллиативное лечение
Больным с отдаленными метастазами назначают паллиативное лечение, которое направлено на облегчение тягостных симптомов болезни. Первоочередная задача паллиативного лечения — устранение дисфагии (непроходимости пищевода и желудка). С этой целью в зону опухолевого сужения с помощью эндоскопа ставят саморасправляющийся стент – специальное устройство, которое расширяет просвет пищевода и не дает опухоли его сдавить. При стенозе выходного отдела желудка проводится попытка установки стента, при невозможности – формирование обходного желудочно-кишечного соустья.
В качестве самостоятельного метода лечения первичной опухоли желудка не продемонстрировала своей эффективности и в настоящее время продолжаются исследования в данной области. На сегодняшний день лучевая терапия используется в сочетании с химиотерапией для повышения ее эффективности.
Осложнения противоопухолевого лечения и их коррекцияНаиболее частое осложнение химиотерапии – это угнетение миелопоэза — роста и размножения различных фракций лейкоцитов с развитием лейкопении (низкого уровня в крови общего числа лейкоцитов) и нейтропении (снижение уровня относительного и абсолютного числа нейтрофильных лейкоцитов), как наиболее интенсивно делящихся и чувствительных к повреждающему действию цитотоксических препаратов. Использование колоние-стимулирующих факторов (лейкостим, филграстим и др.) позволяет существенно снизить число опасных для жизни инфекционных осложнений, возникающих при нейтропении.
Не менее часто встречается осложнение в виде тошноты и рвоты – субъективно тягостные для больных токсические проявления, связанные с разрушением клеток слизистой тонкой кишки с выбросом серотонина в кровоток, активацией волокон блуждающего нерва и воздействием на особую область в головном мозге, ответственную за рефлексы тошноты и рвоты. Для купирования этих явлений наибольшей эффективностью обладает противорвотные препараты группы антагонистов рецепторов серотонина (трописетрон, ондансетрон и др.).
Диарея достаточно часто сопровождает проведение химиотерапии. Она является следствием повреждения быстро делящихся клеток слизистой оболочки тонкой и толстой кишки, что провоцирует транссудацию жидкости в просвет кишки с последующим многократным водянистым стулом. Потери жидкости восполняются по возможности обильным питьем, при необходимости возможно проведение инфузионной терапии.
Анемия также является частым осложнением химиотерапии, применяются препараты железа, в т.ч. внутривенные формы, а также при рефрактерной анемии целесообразно назначение препаратов – стимуляторов эритропоэза (препараты эритропоэтина альфа- и бета-).
Ладонно-подошвенный синдром – дермато-нейропатия, возникающая на коже дистальных отделов конечностей. Для борьбы с эти осложнением применяются сложносоставные кремы и мази на основе масел и растительных экстрактов, облегчающие эти симптомы (крем Mapisal, Элима).
Алопеция — проявление токсического повреждения придатков кожи при использовании некоторых противоопухолевых препаратов. Это осложнение возникает в результате подавления пролиферации эпителия волосяных фолликулов. Алопеция обратима, однако является тяжелой психической травмой. Она закономерно сопровождает химиотерапию доксорубицином, эпирубицином, этопозидом, таксанами, иринотеканом, цисплатином и отмечается у 10-30% больных. Полное восстановление волосяного покрова головы происходит через 3-6 мес. после окончания медикаментозного лечения.
В ситуации, когда выявленная опухоль желудка распространилась за пределы органа в виде множественных очагов на брюшине (канцероматоз), операцию на желудке не выполняют за исключением тех случаев, когда имеются угрожающие жизни осложнения опухоли (кровотечение, перфорация). Стандартным вариантом лечения в подобной ситуации является системная химиотерапия (лекарственное лечение), однако, ее эффективность на сегодняшний день недостаточно высокая из-за того, что противоопухолевые лекарства плохо проникают в брюшинную полость.
Возможным решением данной проблемы является проведение внутрибрюшной химиотерапии. Например, методика гипертермической внутрибрюшной химиотерапии (HIPEC) показала высокую эффективность при поражениях брюшины, обусловленных такими онкологическими заболеваниями как псевдомиксома, мезотелиома, рак червеобразного отростка и толстой кишки. К сожалению, при раке желудка, эффективность внутрибрюшной химиотерапии оказалась не столь высока, поэтому данный метод применяется для профилактики канцероматоза, а также при наличии единичных очагов болезни на брюшине.
В настоящее время разработана новая методика внутрибрюшной химиотерапии, которая заключается в распылении аэрозоля химиопрепаратов под давлением во время лапароскопии (PIPAC). В отличие от обычного введения растворов химиопрепаратов в брюшную полость, распыление аэрозоля под давлением приводит к более глубокому проникновению лекарств вглубь опухолевой ткани, что увеличивает повреждающий эффект для опухоли. Результаты применения данной методики в Германии оказались обнадеживающими. У большинства больных с опухолями желудка отмечено улучшение или стабилизация опухолевого процесса.
Наибольшее значение имеет реабилитация после радикального хирургического лечения, т.к. операции носят обширный характер и зачастую пациенту предстоит продолжение противоопухолевого лечения (послеоперационная химиотерапия).
Непосредственно после операции пациент переводится в палату отделения интенсивной терапии и реанимации, где в течение 12-24 часов осуществляется наблюдение, перевязки и реабилитация. С первых суток назначается голод, а питание проводится с помощью внутривенных инфузий.
У некоторых пациентов во время операции устанавливается тонкий зонд, заведенный за зону швов, в послеоперационном периоде питание начинается сразу после операции – вводятся растворы солей, глюкозы, а затем питательные смеси. С разрешения лечащего врача рекомендуется полоскание рта и питье чистой воды небольшими глотками.
Во время операции устанавливается катетер в мочевой пузырь для отвода мочи и контроля диуреза. Мочевой катетер удаляется на 2-3 сутки, после чего пациент должен самостоятельно помочиться. Если возникают затруднения, необходимо сообщить об этом врачу.
Необходимо знать, что боли в операционной ране неизбежны, в связи с этим проводится плановое поликомпонентное обезболивание, в том числе посредством эпидуральной анестезии, однако если боль начинает усиливаться, необходимо сразу дать знать об этом врачу, т.к. предупредить сильную боль значительно легче, чем купировать развившийся выраженный болевой синдром.
С целью ранней реабилитации и профилактики нарушений дренажной функции трахеи и бронхов с развитием воспалительных явлений дыхательных путей, а также более быстрого и устойчивого появления перистальтики рекомендуются лечебная, в том числе дыхательная гимнастика в постели с первого послеоперационного дня, и ранняя вертикализация: постепенное присаживание, вставание и хождение с поддержкой. Также полезно выполнять движения кистями и стопами, сгибание в локтевых и коленных суставах, нерезкое покашливание.
Дыхательная гимнастика необходима для профилактики развития пневмонии, рекомендуется проводить серии глубоких, но не резких, вдохов и выдохов, иногда с этой целью рекомендуется упражнение с побудительным спирометром. При необходимости проводится респираторная терапия с ингаляциями противовоспалительных, бронхолитических и муколитических средств.
Питание через рот начинается при наличии устойчивой работы кишечника (хорошо выслушиваемая перистальтика и отхождение газов), что происходит в среднем на 4-5-6 сутки после операции, и отсутствии подозрений на развитие хирургических осложнений. Иногда для стимуляции перистальтики используются специальные медикаментозные средства (прозерин, убретид), а также лечебные клизмы с гипертоническим раствором соли. В это время пациент должен быть полностью активизирован, самостоятельно передвигаться и обслуживать себя. Компрессионные чулки необходимо носить постоянно, особенно ночью, допускается снять их в дневное время на 1-2 часа, затем снова надеть в положении лежа.
С 4-5 суток после операции начинается питание согласно диете №0 с добавлением питательных смесей. В рацион входят мясной бульон, сырые яйца, кефир, компот (преимущественно из сухофруктов, содержащий большое количество калия, необходимого для нормализации перистальтики кишечника), кисель, морс, минеральная негазированная вода. Питание проводится дробно, небольшими порциями (50-70 грамм) 8–12 раз в сутки. Пища не должна быть горячей. Мясной бульон – дается только жидкая часть (без мяса, крупы и т.д.), должен быть достаточно постным и ненасыщенным. Бульон и сырые яйца можно подсолить по вкусу. Через 2-3 дня стол расширяется, но при этом требования к дробности питания и температуре пищи не меняются. Расширение происходит за счет жидких протертых каш из рисовой, гречневой крупы, геркулеса, сваренных на мясном бульоне или на воде с молоком в соотношении 1:1, возможно добавление 10 – 20 грамм сливочного масла. Рекомендуются перетертые (перекрученные) в виде филе отварная рыба и отварное мясо (обязательно освободить от сухожилий, фасций, костей, кожи), паровые котлеты, хорошо разваренные крупы. Свежий хлеб категорически не рекомендуется, так как может вызвать излишнее брожение и газообразование, рекомендуется подсушенный белый хлеб. Яйца можно принимать не только в сыром виде, но и сваренные всмятку, либо в виде парового омлета. Возможен прием кисломолочных продуктов (кефир, сметана, мягкий творог). Цельное молоко не рекомендуется, так как для усвоения в кишечнике требуется его предварительное створаживание, что после операций на желудке часто попросту невозможно, а после операций на других отделах желудочно-кишечного тракта нарушено.
Разрешаются фрукты в сыром виде, желе или муссов. Из фруктов можно те, которые не вызывают излишнего газообразования и брожения: бананы, яблоки кисло-сладких сортов (без кожуры), цитрусовые, гранаты. Однозначно не рекомендуются виноград, дыня, арбуз, груши. Рекомендуются тушеные овощи в виде пюре или рагу (но без белокочанной капусты), соленья и квашенья (не маринады!!!), а свежие овощи не ранее, чем через 2-3 недели. Щадящая диета сохраняется на протяжении 1,5 – 2 месяцев после операции и после выписки из стационара. После указанного срока диету можно расширять самостоятельно, но продукты, плохо подходящие, принимать не следует, а повторить попытку (пробу) через месяц. К 6–12 месяцу после операции возможно вернуться к своему прежнему дооперационному типу питания (за некоторыми исключениями, например, цельного молока и легкоусваиваемой глюкозы, которые в большинстве случаев плохо переносятся и в отдаленном послеоперационном периоде), однако исключают сильные стимуляторы желчеотделения и секреции поджелудочной железы, а также продукты и блюда, способные вызвать демпинг-синдром (сладкие жидкие молочные каши, сладкое молоко, сладкий чай, горячий жирный суп и др.). Все блюда готовят в вареном виде или на пару, протертыми. Особое внимание больной должен уделять значению медленного приема пищи с тщательным пережевыванием ее. Питание должно происходить в вертикальном положении (сидя или стоя), после приема пищи рекомендуется некоторое время не ложиться, а посидеть или походить.
Для улучшения переваривания и усвоения пищи в первые недели после операции с приемом пищи целесообразен прием препаратов – ферментов поджелудочной железы (Панкреатин) до нормализации стула, далее постепенно отменить; для профилактики кишечных расстройств, связанных с приемом антибактериальных препаратов, рекомендован прием препаратов-пробиотиков.
Спать рекомендуется с приподнятой верхней половиной кровати, особенно в первые 5-7 суток после операции, а при развитии рефлюксных явлений в позднем послеоперационном периоде – постоянно (положение Фаулера).
При болях, повышении температуры тела возможен прием Кетопрофена 50 мг или лорноксикама 8 мг (разово, не регулярно!) внутрь или внутримышечно, при необходимости длительного приема обезболивающих средств необходимо проконсультироваться с врачом и пройти обследование. Рекомендован прием поливитаминных препаратов (ревит, ундевит, компливит, олиговит, витрум, центрум и др.) курсами по 1 мес.
После гастрэктомии в те или иные сроки (до 12-24мес) в 100% случаев развивается В12-дефицитная анемия, что является следствием отсутствия фактора Касла — специального вещества, вырабатываемого слизистой оболочкой желудка и способствующего всасыванию витамина В12, поэтому рекомендуется проводить профилактику – введение препарата В12 внтуримышечно либо ежемесячно 1,0мл, либо ежегодно курс по 1,0мл в/м в течение 7-10 дней. Также при снижении уровня гемоглобина вследствие дефицита железа рекомендован прием препараты железа (мальтофер, сорбифер-дурулес) принимать согласно аннотации до нормализации уровня гемоглобина крови (под контролем анализов).
По возвращении домой через 2-3 дня можно снять компрессионные чулки. Необходимо принять теплый душ, помыться с мылом и мочалкой, но принимать ванну категорически не рекомендуется. В бане не париться. Физиотерапия, избыточная инсоляция не рекомендована. В течение первых 3-6 мес. следует ограничить тяжелые физические нагрузки (до 3-х кг) при сохранении достаточной физической активности, выполнять лечебно-физкультурный комплекс, дыхательную гимнастику, совершать прогулки на свежем воздухе. Нахождение в вертикальном положении (не ложиться) не менее 8 часов в сутки, пищу принимать только в вертикальном положении.
Пациенты, перенесшие резекцию желудка, нуждаются в динамическом наблюдении.
Нередким последствием этой операции является рефлюкс-эзофагит — воспаление пищевода вследствие заброса содержимого тощей кишки в пищевод, раздражения последнего панкреатическим соком и желчью. Рефлюкс наступает чаще после приема жирной пищи, молока, фруктов и выражается в чувстве острой боли и жжения за грудиной и в подложечной области.
Профилактика этих неблагоприятных последствий возможна. Она требует строгого соблюдения предписанного больному режима питания и диеты, а при появлении жалоб необходимо обратится к врачу и пройти обследование. Если существенных жалоб нет, рекомендовано обследование каждые 3 месяца после операции в течение первого года, далее – 1 раз в 6 месяцев (1-2 года), далее 1 раз в год либо при появлении жалоб.
Прогноз заболевания зависит от стадии болезни на момент установки диагноза и правильности проведенного лечения. При начальных формах рака и своевременно начатом лечении шансы на выздоровление высокие. При раке желудка I стадии пятилетняя выживаемость составляет 95%, из них 70% полностью выздоравливают. У пациентов с раком желудка II стадии пятилетняя выживаемость составляет 56%, из них у половины больных наблюдается излечение. На момент диагностики I-II стадию имеют от 34 до 58% в зависимости от региона.
При больших опухолях без отдаленных метастазов излечение возможно, но его успех зависит от множества условий, среди которых важнейшее — это техническое оснащение и опыт клиники, проводящей сложное комбинированное лечение. У пациентов с раком желудка III стадии пятилетняя выживаемость в среднем составляет 38%, из них около 26% полностью выздоравливают. У пациентов с раком желудка стадии IIIB-C пятилетняя выживаемость составляет лишь 15 %, из них выздоравливают лишь 10 %.При запущенных формах опухоли прогноз неблагоприятный. У пациентов с раком желудка IV стадии пятилетняя выживаемость обычно не превышает 5%, а 10-летняя выживаемость наблюдается крайне редко.
Таким образом, в большинстве случаев рак желудка выявляется на запущенных стадиях (III, IV) и является уже распространённым, в этом случае общая 5-летняя выживаемость составляет лишь 15 %. Если человек прожил первые 5 лет, то дальнейшая выживаемость повышается — 10-летняя выживаемость составляет 11 %, что лишь на 4 % ниже 5-летней выживаемости.
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Рак желудка можно лечить:
В отделении торакоабдоминальной хирургии МНИОИ имени П.А. Герцена – филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделением – к.м.н. Владимир Михайлович Хомяков.
Контакты: (495) 150 11 22
В отделении лучевого и хирургического лечения заболеваний абдоминальной области МРНЦ имени А.Ф. Цыба — филиала ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделением — к.м.н. Леонид Олегович Петров
Контакты: (484) 399-30-08
Статистика онкологических заболеваний в России у мужчин и женщин разных возрастных групп
В последнее время количество онкологических заболеваний возросло. Зачастую только упоминание диагноза «рак» сопровождается паническим страхом за себя или здоровье и жизнь своих близких. Однако, стратегия поведения, которую диктует страх, абсолютно неверна, при столкновении с онкологическими заболеваниями. Следует напротив, как можно больше узнавать об этой теме, так как это может помочь спасти жизнь и здоровье!
Ниже представлена структура заболеваемости злокачественными новообразованиями в России. Ведущими локализациями в общей (оба пола) структуре заболеваемости злокачественными новообразованиями населения России являются:
- Рак кожи (12,6%, с меланомой – 14,0%)
- Рак молочной железы (11,1%)
- Рак трахеи, рак бронхов, рак легких (10,7%)
- Рак желудка (7,3%)
- Рак ободочной кишки (6,5%)
- Рак предстательной железы (5,1%)
- Рак прямой кишки, рак ректосигмоидного соединения и рак ануса (4,9%)
- Рак лимфатической и кроветворной ткани (4,7%)
- Рак тела матки (3,8%)
- Рак почки (3,8%)
- Рак поджелудочной железы (2,9%)
- Рак шейки матки (2,8%)
- Рак мочевого пузыря (2,6%)
- Рак яичников (2,5%)
Первые места в структуре заболеваемости злокачественными новообразованиями мужского населения России распределены следующим образом:
- Опухоли трахеи, бронхов, легкого (18,9%)
- Опухоли предстательной железы (11,9%)
- Опухоли кожи (10,1%, с меланомой – 11,5%)
- Опухоли желудка (9,1%)
- Опухоли ободочной кишки (5,8%)
- Значителен удельный вес злокачественных новообразований прямой кишки, ректосигмоидного соединения, ануса (5,2%)
- Опухоли лимфатической и кроветворной ткани (5,0%)
- Опухоли мочевого пузыря (4,5%)
- Опухоли почки (4,5%)
- Опухоли поджелудочной железы (3,1%)
- Опухоли гортани (2,6%)
- Значимую по удельному весу группу у мужчин формируют злокачественные опухоли органов мочеполовой системы, составляя 21,7% всех злокачественных новообразований
Первые места в структуре заболеваемости злокачественными новообразованиями женского населения России распределены следующим образом:
- Злокачественные опухоли молочной железы (20,4%) являются ведущей онкологической патологией у женского населения
- Нвообразования кожи (14,7%, с меланомой – 16,6%)
- Новообразования тела матки (7,4%)
- Новообразования ободочной кишки (7,0%)
- Новообразования желудка (5,8%)
- Новообразования шейки матки (5,3%)
- Новообразования прямой кишки, ректосигмоидного соединения, ануса (4,7%)
- Новообразования яичника (4,6%)
- Новообразования лимфатической и кроветворной ткани (4,4%)
- Новообразования трахеи, бронхов, легкого (3,8%)
Максимальное число заболеваний приходится на возрастную группу 70-74 года:
- У мужчин − 18,2%
- У женщин — 16,3%
Данная статистика позволяет четче представлять наиболее распространённые онкозаболевания среди различных возрастных групп у мужчин и женщин. А это, в свою очередь, дает информацию для принятия решения о прохождении скрининговых или диагностических программ, онко-чекапов. Беспечность в отношении некоторых симптомов просто недопустима, а уверенность в состоянии Вашего здоровья и здоровья Ваших близких – обоснованная жизненная необходимость.
Онкологические заболевания в 2020 году: 19,3 млн новых случаев и 10 млн летальных исходов
Число людей, выживших спустя пять лет после того, как им поставили диагноз, тоже растет – их теперь 50,6 млн. На десять наиболее распространенных видов рака приходится 60 процентов новых случаев и 70 процентов летальных исходов. Рак груди у женщин занимает первое место в списке наиболее часто встречающихся видов рака, на втором месте рак легких, на третьем – рак прямой кишки, затем следуют рак простаты и рак желудка.
Самым смертельным для мужчин признан рак легких — на это заболевание приходится 18 процентов всех летальных исходов среди представителей мужского пола. Вторым в списке самых опасных для жизни мужчины онкологических заболеваний стоит рак простаты. Женщины чаще всего умирают от рака груди, рака легких и рака прямой кишки.
По оценкам ученых, к 2040 году число ежегодных новых случаев онкологических заболеваний возрастет на 47 процентов и достигнет 28,4 млн. Подавляющая часть этой статистики приходится на страны с низким и средним индексом развития человеческого потенциала. Во многих из них также значительно возрастут показатели факторов риска, влияющих на заболеваемость, таких как курение, нездоровое питание, ожирение и малоподвижный образ жизни.
«На заболеваемость раком и смертность от него будут влиять изменения структуры населения и условий жизни людей, а также уровень способности систем здравоохранения контролировать ситуацию», — считает специалист Агентства д-р Фредди Брей.
Рак груди – самый распространенный вид рака
В 2020 году на рак молочной железы пришелся каждый восьмой новый случай рака в мире и каждый четвертый — среди женщин: это заболевание диагностировали у 2,3 млн человек, 685 тысяч от него скончались.
На показатели заболеваемости раком молочной железы также влияют социально-культурные факторы, например, женщины все позже рожают первого ребенка и имеют все меньше детей. Это касается всех стран мира, но смертность от рака груди выше в странах с низким и средним индексом развития человеческого потенциала. Это объясняется прежде всего поздней диагностикой.
Специалисты полагают, что пришло время разработать новые рекомендации по раннему выявлению и лечению рака молочной железы, основываясь на данных последних исследований. С новой инициативой по этому заболеванию ВОЗ планирует выступить уже в следующем году.
Рак желудка
Попадая в желудок пища перемешивается с желудочным соком, который вырабатывается внутренним слоем желудка (слизистой оболочкой). Так начинается процесс пищеварения. Большинство случаев рака желудка возникает в слизистой оболочке. По мере прорастания опухоли в более глубокие слои желудка прогноз заболевания ухудшается.
Рак желудка обычно растет довольно медленно, иногда в течение многих лет. Ранние изменения в слизистой оболочке желудка редко сопровождаются симптомами и поэтому часто остаются незамеченными.
Рак желудка может распространяться различными путями. Он может прорастать стенку желудка и поражать вблизи расположенные органы или поражать лимфатические узлы и распространяться по лимфатической системе. Если рак распространяется, то прогноз становится хуже.
По мере распространения рака опухолевые клетки через кровоток попадают в печень, легкие и кости. При такой распространенности рака желудка излечить его уже невозможно.
Большинство видов рака желудка носит название аденокарцином. Но в желудке могут возникнуть и другие опухоли:
- Лимфомы — развиваются из элементов лимфоидной иммунной системы, которые расположены в стенках желудка.
- Стромальные опухоли — возникают из мышечной или соединительной тканей.
- Карциноидные опухоли — развиваются из гормонопродуцирующих клеток желудка. В большинстве случаев эти формы опухолей не распространяются на другие органы.
Лечение и исход этих более редких опухолей отличаются от аденокарциномы желудка.
Факторы риска рака желудка
Существуют факторы риска, наличие которых повышает риск возникновения рака. Но наличие факторов риска не означает обязательное развитие заболевания, а указывает лишь на повышенную вероятность возникновения рака.
Бактериальная инфекция. В последние годы большое внимание уделяется особой инфекции желудка — хеликобактериозу, вызываемому бактерией Helicobacter pylori, который является основной причиной рака желудка. Инфицированность населения хеликобактериозом составляет около 40%. Длительное существование этой инфекции может привести к воспалению и повреждению внутреннего слоя желудка (эпителия) и явиться причиной предопухолевых изменений. Эта инфекция связана также с некоторыми видами лимфом желудка. Однако у большинства людей с этой инфекцией рак желудка никогда не развивается.
Питание. Повышенный риск рака желудка отмечен у людей, употребляющих большое количество копченых продуктов, соленой рыбы и мяса, маринованных овощей и некоторых видов пищи, богатой крахмалом и бедной клетчаткой. С другой стороны, употребление продуктов из зерна грубого помола, свежих овощей и фруктов, содержащих провитамины А и витамин С, снижает риск рака желудка.
Табак и употребление алкоголя. Курение удваивает риск развития рака желудка. Связь между употреблением алкоголя и раком желудка точно не установлена.
Ранее перенесенные операции на желудке. Рак желудка чаще возникает у тех, кто перенес частичное удаление желудка по поводу других заболеваний, например, язвы.
Пол. Рак желудка в два раза чаще развивается у мужчин по сравнению с женщинами.
Этническая принадлежность. Частота рака желудка выше среди американцев латиноамериканского происхождения и афроамериканцев по сравнению с белыми американцами нелатиноамериканского происхождения. Наиболее высокая частота рака желудка обнаружена среди жителей азиатско-тихоокеанских островов.
Возраст. После 50 лет отмечается резкое возрастание частоты рака желудка.
Группа крови. По неизвестным причинам люди с группой крови А (II) имеют повышенный риск развития рака желудка.
Семейный анамнез рака желудка. Люди, у которых несколько близких родственников перенесли рак желудка, имеют повышенный риск развития такой же опухоли.
Полипы желудка. Полипы представляют собой грибовидные образования, исходящие из слизистой оболочки желудка. Большинство видов таких полипов не сопровождается повышенным риском рака желудка, однако некоторые виды полипов могут иногда превращаться в рак.
Место жительства. Место Вашего проживания может иметь большое значение. Японцы, проживающие в Японии, имеют очень высокий риск рака желудка. Если они переезжают в США, то через несколько лет риск снижается, но все же остается выше по сравнению с людьми, родившимися в США. Предполагают, что воздействие неблагоприятных факторов в ранний период жизни, оказывает влияние на высокий риск рака желудка в Японии. Неизвестно также, влияет ли только характер питания на этот риск.
Симптомы рака желудка
У больных раком желудка редко появляются симптомы на ранних стадиях заболевания. По этой причине рак желудка трудно диагностировать своевременно.
Симптомы рака желудка могут быть следующими:
- Необъяснимое похудание и отсутствие аппетита.
- Боль в области желудка.
- Неприятные ощущения (дискомфорт) в животе, часто выше пупка.
- Чувство переполнения желудка после принятия малого количества пищи.
- Изжога, нарушение пищеварения или симптомы, напоминающие язву.
- Тошнота.
- Рвота с кровью или без нее.
- Увеличение размеров живота
- Нарастающая бледность кожи.
Конечно, многие из этих симптомов могут быть вызваны другими заболеваниями, а не раком. Однако если возникли указанные симптомы и они продолжаются в течение длительного периода времени, необходимо срочно обратиться к врачу, особенно, если Вам за 50 лет и у Вас имеются факторы риска развития рака желудка.
Если у Вас есть причина подозревать рак желудка, то нужно немедленно обратиться к врачу, который, поговорив с Вами, проведет необходимое обследование. Врач обследует живот и проверит, нет ли там опухоли. Кроме того, он определит, не увеличена ли печень, что может означать ее поражение опухолевым процессом.
Затем будут проведены специальные методы обследования, которые позволят подтвердить или отвергнуть диагноз рака желудка. При подтверждении диагноза рака необходимо уточнить его распространение. Это осуществляется с помощью ряда методов.
Эндоскопия желудка. При этой процедуре после обезболивания тонкая гибкая трубка с осветителем (эндоскоп) вводится через рот и врач осматривает пищевод, желудок и начальный отдел тонкой кишки (12-перстную кишку). При наличии подозрительного участка берется маленький кусочек слизистой оболочки желудка (биопсия) для микроскопического исследования.
Контрастное исследование желудочно-кишечного тракта. Больному дается барий, который покрывает слизистую оболочку пищевода, желудка и начального отдела тонкой кишки и выполняются несколько рентгенограмм. После этого, если имеются показания, вводится через трубку воздух в желудок, чтобы барий распространился по слизистой оболочке тонким слоем. Такая методика дает возможность обнаружить даже очень незначительные изменения в желудке.
Ультразвуковое исследование (УЗИ). При этом методе используют звуковые волны для определения состояния внутренних органов. УЗИ иногда проводится в сочетании с введением специального зонда через нос или рот в желудок, что позволяет оценить распространенность опухоли внутри желудка и в окружающие ткани и лимфатические узлы.
Компьютерная томография (КТ). При этом методе применяется специальная рентгеновская техника, дающая возможность делать снимки под разными углами. Таким образом получается детальная информация об органах и тканях. Выясняется, насколько распространен рак желудка и какие органы (например, печень) поражены. С помощью этого метода можно выполнить прицельную биопсию подозрительного участка с последующим исследованием.
Позитронно-эмиссионная томография (ПЭТ). В вену больного вводится радиоактивная глюкоза. Она концентрируется в опухоли, а прибор сканнер обнаруживает зоны ее накопления. Метод позволяет выяснить распространение рака за пределы желудка и уточнить стадию заболевания.
Магнитно-резонансная томография (МРТ). Данный метод, как и КТ, позволяет исследовать организм послойно, но при этом вместо излучения используются мощные магниты.
Рентгенография грудной клетки дает возможность выявить поражение легких опухолевым процессом.
Лапароскопия. Тонкая гибкая трубка с маленькой видеокамерой (лапароскоп) вводится через небольшой разрез в брюшную полость. Таким способом можно оценить вероятность удаления опухоли и ее распространенность по брюшной полости. Кроме того, с помощью специального устройства можно взять кусочек ткани (биопсия) или жидкость для исследования.
Лабораторные исследования. Проводится полный анализ крови для выявления анемии (малокровия), а также исследуется кал на скрытую кровь.
Можно ли предотвратить рак желудка?
Несмотря на то, что мы не знаем точную причину возникновения рака желудка, тем не менее, многие случаи этого заболевания можно предотвратить. Замораживание пищевых продуктов, вместо соления, маринования и копчения, а также изменение характера питания, помогло снизить частоту рака желудка в течение последних 60 лет.
Диета с высоким содержанием свежих фруктов и овощей привела к снижению риска рака желудка. Рекомендуется употреблять свежие фрукты и овощи 5 раз в день наряду с продуктами из зерна грубого помола в виде хлеба, зерновых хлопьев, макаронных изделий, риса и бобов. Красное мясо, особенно жирное или переработанное, следует ограничить.
Табак и алкоголь могут повысить риск рака желудка. Мы рекомендуем ограничить употребление алкогольных напитков или отказаться от них вообще. Если Вы не курите, то и не начинайте. В случае если Вы уже курите, то постарайтесь бросить эту пагубную привычку.
В настоящее время еще не ясно, нужно ли лечить хроническую инфекцию, вызванную бактерией Helicobacter pylori, с целью профилактики рака желудка. Исследования в этой области продолжаются.
Скрининг рака желудка
Скрининг — это ранее активное выявление рака на ранней стадии, когда симптомы болезни еще отсутствуют. Основным методом скрининга рака желудка является выполнение регулярной (1-2 раза в год) гастроскопии, при которой выявляются предопухолевые состояния и маленькие опухоли, не сопровождающиеся симптомами.
Лечение рака желудка
В зависимости от стадии рака желудка существуют различные методы лечения. Выбор метода лечения зависит от многих факторов. Конечно, месторасположение и стадия опухоли являются важными факторами. К другим факторам относится возраст, общее состояние и личные пожелания.
Основными методами лечения рака желудка являются: операция, химиотерапия и облучение. Часто наилучшим подходом к лечению может быть применение двух и более методов. Главной целью лечения является полное избавление от болезни. В том случае, когда полное излечение невозможно, терапия направлена на облегчение симптомов болезни, таких как нарушение приема пищи, боль или кровотечение. Перед началом лечения важно уточнить цель предполагаемой терапии.
Оперативное лечение
В зависимости от вида рака желудка и стадии заболевания может быть выполнена операция с удалением опухоли вместе с частью желудка. По возможности хирург оставляет непораженную часть желудка.
В настоящий момент операция является единственным способом излечения рака желудка. При наличии 0, I, II или III стадий рака желудка, а также относительно удовлетворительного состояния, предпринимается попытка полного удаления опухоли.
Даже если рак к моменту лечения распространен и не может быть полностью удален, операция может помочь предотвратить кровотечение из опухоли или способствовать прохождению пищи через кишечник. Этот тип оперативного вмешательства называется паллиативным, т.е. выполняется с целью облегчения или предотвращения симптомов, а не с целью излечения рака.
Химиотерапия
Под химиотерапией подразумевается использование противоопухолевых препаратов для уничтожения опухолевых клеток. Обычно препараты назначаются внутривенно или внутрь, т.е. через рот. Как только препарат поступает в кровяное русло, он распространяется по всему организму. Химиотерапии применяется обычно для воздействия на распространенную опухоль.
Химиотерапия может быть основным методом лечения рака желудка, когда опухоль уже распространилась в отдаленные органы. Этот метод терапии применяется до или после операции. Опыт показал, что химиотерапия может облегчить симптомы у некоторых больных раком желудка, особенно в тех случаях, когда рак распространился в другие области тела. Имеются указания на то, что химиотерапия в сочетании с лучевой терапией может отсрочить рецидив (возврат) болезни и продлить жизнь больным с распространенным процессом.
Химиотерапевтические препараты не только уничтожают опухолевые клетки, но и могут повреждать нормальные клетки, что приводит к побочным эффектам. Эти побочные эффекты зависят от типа препаратов, их доз и длительности лечения. В процессе химиотерапии могут появиться следующие осложнения лечения:
- Повышенная утомляемость
- Тошнота и рвота
- Жидкий стул
- Потеря аппетита
- Облысение (волосы отрастают вновь после окончания лечения)
- Язвы во рту
- Повышенный риск инфекционных заболеваний в связи со снижением количества лейкоцитов (белых кровяных телец)
- Появление синяков или кровотечений.
- Одышка
Большинство из этих побочных эффектов проходят после окончания лечения. При появлении таких явлений сообщите об этом врачу или медицинской сестре, так как имеются способы борьбы с побочными эффектами химиотерапии.
Лучевая терапия
При этом методе используются лучи высоких энергий с целью уничтожения или сокращения опухоли. Облучение может быть наружным или с помощью радиоактивных материалов, вводимых непосредственно в опухолевую ткань (внутреннее или имплантационное облучение). При раке желудка обычно применяется наружное облучение.
После операции лучевая терапия может применяться для уничтожения мелких очагов опухоли, которые нельзя увидеть или удалить во время оперативного вмешательства. Полагают, что лучевая терапия, особенно в комбинации с химиотерапией, может отсрочить или предотвратить рецидив (возврат) рака после операции и может способствовать продлению жизни больным. Лучевая терапия может использоваться с целью облегчения симптомов, таких как боль, кровотечение и затруднение прохождения пищи.
Лучевая терапия рака желудка — сложная процедура, поэтому ее нужно проводить в отделениях с большим опытом лечения таких больных.
Из побочных эффектов лучевой терапии нужно отметить незначительные кожные реакции, тошноту, рвоту, жидкий стул или повышенную утомляемость. Эти симптомы обычно проходят через несколько недель после прекращения лечения. Облучение может усугубить побочные эффекты химиотерапии. При появлении таких явлений сообщите о них врачу, который знает, как Вам помочь.
Выживаемость больных раком желудка в зависимости от стадии заболевания.
5-летняя выживаемость означает процент больных, проживших, по меньшей мере, 5 лет после выявления рака. Конечно, больные могут прожить и значительно больше после установления диагноза. Общая выживаемость больных раком желудка колеблется в пределах 20%. Одной из наиболее важных причин такой низкой выживаемости является выявление рака в распространенных стадиях. Выживаемость хуже при расположении опухоли в верхних отделах желудка и лучше при ее локализации в нижних отделах. Пациенты, получающие лечение в настоящее время, могут иметь более благоприятный исход.
В то время как приведенные цифры отражают общую картину, нужно помнить, что ситуации в каждом отдельном случае особая и статистика не может точно предсказать, что случится с каждым больным. Спрашивайте у врача о Ваших шансах на выздоровление и о возможности длительного выживания. Врачи лучше других знают о Вашей ситуации.
ГКБ №31 — Хронический гастрит и рак желудка. Звенья одной цепи?
Согласно последним данным, рак желудка занимает 4 место в структуре смертности от злокачественных новообразований в мире. «Опережают желудок» по частоте смертей лишь рак легкого, молочной железы и печени. Ежегодно в мире от рака желудка умирают 9 из 100000 человек.
Что вызывает развитие злокачественных опухолей этого важного органа? Имеются ли ранние симптомы заболевания? Можно ли предотвратить развитие рака желудка?
Начнем с факторов риска. Безусловно имеет значение генетическая предрасположенность: если ближайшие родственники человека болели раком желудка, то вероятность заболевания значительно повышается. На генетическую составляющую приходится до 1/3 случаев заболеваемости раком желудка. У прямых родственников больных раком желудка риск заболеть возрастает в 6 раз.
Но, к счастью, одних только генов недостаточно для возникновения этого страшного заболевания. Значительную роль играют диетические факторы и факторы окружающей среды. Так, например, диета с избытком поваренной соли (соленая рыба, мясо, овощи, морепродукты), вызывает осмотическое повреждение эпителия желудка и способствует заселению слизистой оболочки желудка бактериями Н. Pylori, которые являются одним из главных канцерогенов для желудка. Высокое содержание в почве, воде, продуктах питания нитритов и нитратов (особенно много их в колбасах, копченых продуктах, овощах, подвергшихся химической обработке) приводит к тому, что в желудке они превращаются в нитрозамины, являющиеся сильными канцерогенами. Недостаток в продуктах питания витаминов (С, А, Е), антиоксидантов, курение, злоупотребление алкоголем также значительно повышают риск развития рака желудка.
НО! Одним из самых главных факторов, влияющих на образование злокачественной опухоли в желудке, является инфицирование человека бактерией Хеликобактер пилори (Helicobacter pylori).
В 1994 г. Международное агентство по изучению рака (“International Agency for Research on Cancer”) отнесла инфекцию Н.pylori к канцерогенам I класса («определенно доказанным»). Наличие инфекции H.pylori повышает риск развития рака желудка в 4-20 раз. У больных раком желудка инфекция Н.pylori обнаруживается в 60-90% случаев. К сожалению, наша страна относится к регионам с крайне высокой инфицированностью населения-до 75% жителей России являются носителями этой бактерии. Ее коварство заключается в том, что в большинстве случаев инфицирование не сопровождается какими бы то ни было симптомами и пациент годами, а зачастую и десятилетиями живет в казалось бы «мирном» содружестве с этим микроорганизмом, в то время как в желудке запускается каскад патологических изменений. Поначалу возникает поверхностное воспаление, затем-атрофический гастрит, далее-кишечная метаплазия,являющаяся уже предраковым заболеванием, затем дисплазия и рак. Известно, что хронический гастрит предшествует возникновению рака желудка в 73,5-85 % случаев. К счастью, процессы эти текут крайне медленно, занимают много лет и если вовремя провести обследование (эзофагогастродуоденоскопия с исследованием на H.pylori), застать болезнь на стадии гастрита, пройти курс антибактериальной терапии, направленной на уничтожение этой зловредной бактерии, то страшного заболевания можно избежать! Важно, что большинство людей заражаются бактерией в детстве (через плохо обработанную посуду, грязные руки, предметы обихода), а повторного заражения (после проведения лечения) у взрослых в 90% не происходит (имеет значение приобретенный иммунитет).
Конечно, проводить антибактериальную терапию 75% населения нашей огромной страны невозможно, да и не нужно, ведь рак желудка возникает далеко не у всех инфицированных, а только при совокупности «злых» факторов.
Поэтому существуют строгие показания для лечения H.pylori: врач настоятельно порекомендует провести лечение, если у Вас кроме самой H.pylori будут выявлены следующие заболевания или данные анамнеза:
- MALT-ома желудка
- Атрофический гастрит
- Язвенная болезнь желудка или двенадцатиперстной кишки
- Родственники в 1 колене болели или умерли от рака желудка
Кроме того, даже если никаких заболеваний еще не развилось, но пациент пожелает избавиться от бактерии – ему также проведут курс антибактериальной терапии.
Важно помнить о том, что зачастую гастрит, атрофия, кишечная метаплазия и даже ранний рак желудка не проявляются никакими симптомами, либо пациента могут беспокоить отрыжка, тошнота, боль в подложечной области, снижение аппетита, чувство переполнения и быстрого насыщения после еды. Очевидные симптомы рака желудка, такие как рвота съеденной накануне пищей, тухлая отрыжка, рвота с кровью, похудание, слабость, бледность появляются только на запущенных стадиях рака желудка, когда спасти человека значительно сложнее! Поэтому, в случае появления у Вас жалоб не тяните с визитом к врачу-гастроэнтерологу, а в возрасте старше 40 лет есть смысл пройти профилактическое обследование даже если Вас ничего не беспокоит.
Автор: Кайбышева Валерия Олеговна — врач гастроэнтеролог, кандидат медицинских наук.
Рак желудка на территории Дальневосточного федерального округа | Гордиенко
1. Злокачественные новообразования в России в 2017 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М., 2018. 250 с.
2. Плетнев В.В. Выявление предрасположенности к раку и методика его первичной профилактики. М., 2015. 160 с.
3. Swerdlow AJ, Harvey CE, Milne RL, Pottinger CA, Vachon CM, Rwilkens L, Winn D. The national cancer institute cohort consortium: An international pooling collaboration of 58 cohorts from 20 countries. Cancer Epidemiol Biomarkers Prev. 2018; 27(11):1307–19.
4. Мерабишвили В.М. Аналитическая эпидемиология рака желудка. Вопросы онкологии. 2013;59(5):565–70
5. Мерабишвили В.М. Динамика наблюдаемой и относительной выживаемости больных раком желудка. Вопросы онкологии. 2013;59(6):701–6.
6. Bray F, Ferlay J, Soerjomataram I, Siegel RL, Torre LA, Jemal A. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018;68:394–424.
7. Агаджанян Н.А., Уйба В.В., Куликова М.П., Кочеткова А.В. Актуальные проблемы адаптационной, экологической и восстановительной медицины. М.: Медика, 2006. 208 с.
8. Гордиенко В.П., Вахненко А.А. Возможные факторы социального риска онкологической патологии в отдельно взятом регионе. Сибирский медицинский журнал. 2012;115(8):86–9.
9. Гордиенко В.П., Вахненко А.А., Сапегина О.В., Ролько Е.М. Основные направления совершенствования медицинской помощи онкологическим больным в современных социально-экономических условиях отдельно взятого региона. Социальные аспекты здоровья населения. 2014;3:1–11.
10. Злокачественные новообразования в России в 2008 году (заболеваемость и смертность). Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М., 2009. 255 с.
11. Состояние онкологической помощи населению России в 2008 году. Под ред. В.И. Чиссова, В.В. Старинского, Г.В. Петровой. М., 2009. 192 с.
12. Состояние онкологической помощи населению России в 2017 году. Под ред. А.Д. Каприна, В.В. Старинского, Г.В. Петровой. М.: МНИОИ им. П.А.Герцена. 2018. 235 с. [Kaprin AD, Starinskiy VV, Petrova GV, eds. The state of oncologic care for the population of Russia in 2017. Moscow; 2018 (In Russ).]
13. Мерабишвили В.М. Индекс достоверности учета – важнейший критерий объективной оценки деятельности онкологической службы для всех локализаций злокачественных новообразований, независимо от уровня летальности больных. Вопросы онкологии. 2019;65(4):510–5.
14. Мерабишвили В.М. Онкологическая статистика (традиционные методы, новые информационные технологии). Руководство для врачей. Часть 1. СПб.: Коста, 2011. 221 с.
15. Балашов П.Ю., Старинский В.В., Александрова Л.М. Кадровые ресурсы онкологической службы России. Евразийский онкологический журнал. 2014;3(03):976.
Лечение рака желудка на 1,2,3,4 стадии: методы и современные подходы
Рак желудка — несомненно, опасное заболевание, имеющее невысокий процент полного излечения. Однако если следить за своим здоровьем, обращаться за помощью к врачам, а не шарлатанам, можно существенно повысить свои шансы на успешную борьбу с болезнью. Излечение от рака желудка или как минимум облегчение жизни возможно на любой стадии болезни, остается найти онкологов, способных оказать незамедлительную и действенную помощь.
Рак желудка — не приговор?
Согласно медицинским данным, рак желудка находится на четвертом месте по распространенности болезни и на втором — по смертности. Что же представляет собой данный тип онкологии? Этот вид рака характеризуется патологическими изменениями в эпителии слизистой оболочки желудка. Чаще всего он начинается бессимптомно, и только при появлении метастазов выявляются первые признаки болезни. Причем нередко на начальных этапах диагностики фиксируются другие заболевания ЖКТ. Отметим, что рак может развиться в любой части желудка, но чаще всего он поражает пилорический и антральный отделы.
Обратите внимание!
80–90% составляет выживаемость больных от рака желудка, если его обнаружили на нулевой или первой стадии. Вероятность выздоровления при раке желудка второй стадии близка к 60%. Пятилетняя выживаемость с раком желудка третьей степени наблюдается у 15–40% пациентов, при четвертой стадии — лишь у 5%.
Наибольшему риску заболевания подвержены люди в возрасте старше 40 лет. При этом крайне редки случаи, когда рак начинался у человека, перешедшего возрастной порог в 70 лет. Если смотреть на статистику, исходя из гендерной принадлежности заболевших, то мужчины в списки пациентов попадают в два раза чаще, чем женщины. Реже всего рак желудка проявляется у жителей Средней Азии, с годами сокращается заболеваемость в США и Западной Европе. А вот Япония, Чили, Исландия, Бразилия, Финляндия и Россия являются странами с наибольшим количеством страдающих данной патологией.
Лечение рака желудка до полного исчезновения болезни возможно при своевременном обращении к врачу и грамотном подходе к терапии.
Основные причины рака желудка:
- Чрезмерное употребление алкоголя.
- Неправильное питание. Так, в зоне риска находятся продукты с большим количеством нитратов, нитритов, животных жиров. Стоит тщательно относиться к выбору овощей, их хранению и приготовлению, поскольку именно овощи в рационе человека являются основным источником нитритов и нитратов. Соли азотной кислоты содержат также вяленая и копченая пища, некоторые сыры.
- Курение табака.
- Предраковые заболевания: полипы желудка, хроническая язва желудка, хронический гастрит, гипертрофический гастрит (болезнь Менетрие), пернициозная анемия.
- Доказана связь бактерии Helicobacter pylori с раком некардиального отдела желудка. У всех заболевших она была обнаружена. Эта бактерия вызывает гистологические изменения слизистой желудка — атрофию слизистой оболочки, кишечную метаплазию и дисплазию эпителия.
Важно!
Одним из факторов риска появления рака желудка является наследственная предрасположенность — если у кого-то в семье выявлено данное заболевание, то у всех остальных кровных родственников вероятность заболеть повышается на 20%. Другим провоцирующим фактором является работа с асбестом и никелем. Дефицит витаминов В12 и С — еще один негативный момент, который не стоит упускать из вида[1].
Несмотря на достаточно пессимистичную информацию и сложность диагностирования рака желудка, прогноз заболевания может быть положительным. При грамотном лечении онкологии на ранней стадии выздоровление наблюдается у 95% пациентов. Но, если запустить рак желудка до последней стадии, шансов уже не остается, однако при помощи специалистов можно продлить жизнь больного до года. Так что главное, что требуется от человека, особенно находящегося в зоне риска, — наблюдение за своим здоровьем и регулярное посещение врача. Обязательным обследованием для ранней диагностики рака желудка является гастроскопия. Ежегодное прохождение этой процедуры значительно увеличит шансы на своевременную диагностику и лечение, а значит — на полное выздоровление.
Типы онкологии желудка
Международная классификация ВОЗ разделяет рак желудка на две категории: ранний и распространенный. А для морфологической характеристики используется классификация, предложенная еще в 1926 году. Согласно ей выделяется четыре анатомических типа рака желудка:
- грибовидный и полиповидный рак. Он четко отграничен от здоровых тканей, имеет экзофитный рост;
- блюдцеобразный и чашевидный. У этого типа рака границы имеют ясные контуры, а также приподнятые края. Данная онкология является деструктивной фазой первого типа;
- язвенно-инфильтративный (язвенноподобный, изъязвляющийся). В этом случае раковая ткань от желудочной стенки четкими границами не отделена;
- диффузный. Для этого вида рака желудка характерно утолщение всей стенки органа. Весь желудок — от кардии до привратника — представляет собой толстостенную трубку.
В 1977 году ВОЗ предложила классифицировать рак желудка по гистологическому строению. В этом случае выделяются следующие разновидности опухолей:
- Аденокарцинома. Этот вид онкологии формируется в железистом эпителии желудка. Аденокарцинома подразделяется, в свою очередь, на высокодифференцированную (образуется высокий цилиндрический эпителий), умереннодифференцированную (более плоские кубические клетки) и малодифференцированную (выделяется с трудом).
- Плоскоклеточный рак. Самый нераспространенный тип опухоли. Появляется между слоями железистого эпителия желудка из плоских клеток, напоминающих кожу.
- Железистоплоскоклеточный рак. Опухоль, в которой есть черты плоскоклеточного рака и аденокарциномы. Данное онкозаболевание выявляется сложнее, и здесь требуется опытный высококвалифицированный врач, способный дифференцировать этот тип от сочетания опухолей и от больших очагов плоскоклеточной метаплазии.
- Недифференцированный рак. Опухоль, клетки которой имеют «рассыпной» характер роста. По размеру клетки могут быть мелкими либо крупными (мелко- или крупноклеточный рак, соответственно), а также полиморфными — в этом случае присутствуют все переходные формы клеток.
- Неклассифицируемый рак. Это злокачественное эпителиальное новообразование, развивающееся из многослойного плоского эпителия.
Степень выраженности и специфичности того или иного типа рака желудка постепенно возрастает, если болезнь не начать лечить. На более поздних стадиях следует говорить не только о раке желудка, но и о поражении метастазами соседних и отдаленных органов брюшной полости, лимфоузлов.
Стадии рака желудка
Опишем, как меняется характер заболевания в зависимости от его продолжительности. Врачи выделяют пять стадий течения рака желудка.
Стадия 0. Предраковая стадия, диагностика которой довольно затруднительна. На этом этапе появляется внутриэпителиальный рак, соответственно, обнаружить раковые, атипичные клетки возможно только во внутреннем поверхностном слое слизистой желудка.
Стадия 1. Это самая ранняя из стадий рака желудка. В слизистой оболочке появляется опухоль, которая может затронуть мышечный слой, а также проникнуть в единичные лимфатические узлы. Диагностирование рака желудка начальной стадии дает наибольший шанс на полное излечение. Как уже говорилось выше, около 95% пациентов, у которых болезнь обнаружили именно на первой или нулевой стадии, возвращаются после квалифицированной терапии к нормальной жизни.
Стадия 2. При раке желудка второй стадии опухоль прорастает во внешний слой стенки желудка, при этом возможно поражение до 15 лимфоузлов. Если диагностировать онкологию на данном этапе — вероятность прожить более пяти лет после курса лечения приближается к 50%.
Стадия 3. При раке желудка третьей стадии происходит значительное ухудшение состояния пациента. Опухоль распространяется на серозный и мышечный слои, а также затрагивает близлежащие органы: поперечную ободочную кишку, тонкий кишечник, печень, селезенку, почки и так далее. Лечение рака желудка на данной стадии дает шанс на пять и более лет жизни только для 15–40% больных.
Стадия 4. Опухоль охватывает органы, расположенные рядом с желудком, и отдаленные ткани организма. Около 5% больных после лечения рака желудка четвертой стадии с метастазами получают возможность прожить более пяти лет.
Выявление рака на ранних стадиях осложнено тем, что начинается он обычно бессимптомно. Далее могут возникать дискомфорт и боль в животе, тошнота, изжога, рвота, потеря аппетита, нарушения стула, в том числе кровь в фекалиях, потеря веса и высокая утомляемость. Добавим, что в России в большинстве случаев диагноз «рак желудка» ставится, когда болезнь достигла третьей и четвертой стадий — таких пациентов более 70%.
Диагностика
При раке желудка лечение будет максимально эффективным, если своевременно обнаружить болезнь. Чем раньше диагностировано онкозаболевание, тем выше процент возвращения к полноценной жизни после операции и комплексной терапии. Конечно же, важно довериться только опытным специалистам, которые владеют всеми современными методиками выявления, дифференциации и лечения именно рака желудка. При диагностике рака желудка используют следующие методы:
Гастроскопия. С помощью этого метода врачи могут тщательно осмотреть слизистую оболочку желудка, пищевода и двенадцатиперстной кишки, своевременно заметить опухоль, выяснить ее границы, а также взять образцы тканей для исследования. К концу эндоскопа прикреплена маленькая камера, с которой выводится четкое изображение на монитор непосредственно во время исследования. Метод позволяет диагностировать опухоль уже на нулевой и начальной стадиях.
Эндоскопическое ультразвуковое исследование. Эта процедура осуществляется с помощью небольшого ультразвукового устройства, прикрепляемого к эндоскопу. Оно помогает глубокому исследованию стенок желудка и пищевода. Такой способ с очень высокой точностью показывает границы опухоли.
Рентгеноскопическое исследование. С помощью введенного сульфата бария можно увидеть раковую нишу в зоне инфильтрации. Данный способ помогает конкретизировать границы и распространение опухоли. Кроме того, если произошло сужение желудка, врачи с помощью этой процедуры определят степень сужения. Это один из самых проверенных способов. Он особо эффективен при инфильтративных формах рака, не имеет большой лучевой нагрузки, а следовательно, безопасен для больного. Кроме того, с помощью рентгена можно увидеть функциональные возможности органов и заметить рецидивы опухоли.
Диагностическая лапароскопия под контролем УЗИ. Это операция, которая выполняется под наркозом. В ходе нее для осмотра органов брюшной полости через проколы в брюшной стенке вводится камера. Данный способ применяется, если случай неоднозначный, а также если необходимо выявить, проросла ли опухоль в близлежащие ткани, распространились ли метастазы в печень и брюшину.
Компьютерная томография. Метод дает возможность увидеть толщину стенки органа, а значит, определить стадию рака желудка. Наиболее эффективна томография с введением контрастного вещества, что помогает разглядеть опухолевый инфильтрат и нарушение эластичности стенок желудка.
Исследование ПЭТ/КТ — позитронно-эмиссионная томография, совмещенная с компьютерной томографией, считается самым современным методом диагностики рака. Незаменима в диагностике и дальнейшем контроле ракового заболевания. ПЭТ/КТ позволяет получить точную и детальную информацию о распространении опухоли и ее локализации посредством детальной визуализации патологических процессов. В соответствии с результатами исследования производится подбор дальнейшей схемы лечения.
Методы лечения рака желудка
На данный момент единственный способ радикального лечения рака желудка — это операция. Очень часто хирургическое вмешательство сочетается с химио- и лучевой терапией.
Хирургическое лечение
Существует несколько подвидов хирургического вмешательства при лечении рака желудка. Если у пациента наблюдаются экзофитные (с четкими границами) опухоли кардиального или антрального отдела желудка, то производится резекция, то есть удаление части органа. Резекция может быть проксимальная (удаление ближайшего к пищеводу отдела), дистальная (удаление выходного отдела). Лечение рака желудка начальной стадии возможно с помощью эндоскопической резекции слизистой, о чем мы уже говорили, описывая эндоскопию как метод диагностики заболевания.
Гастрэктомия — процедура удаления желудка целиком. По сути, доктор, проводящий операцию, «собирает» пациенту новый желудок, состоящий из петель тонкого кишечника. Онкология рака желудка требует такого лечения, если возникли опухоли тела желудка или его средней части. Этот метод наиболее эффективен на нулевой и первой стадиях рака желудка — его могут применять без дополнительных методов терапии. Далее же необходимо совмещение с химио- и лучевой терапией.
Химиотерапия
Медикаментозное лечение рака желудка назначают как до операции — для подготовки к ней, так и после — для ликвидации дальнейших негативных процессов. Задача химиотерапии — снизить риск образования метастазов, уменьшить размер опухоли. Химиотерапию используют при раке желудка второй стадии и последующих, а иногда и на начальном этапе заболевания. Современные методы позволили химиотерапии стать более эффективной, но по-прежнему без дополнительных методов лечения рак не победить. При неоперабельном раке четвертой стадии лечение методом химиотерапии позволяет приостановить процесс метастазирования и продлить жизнь пациента.
Таргетная терапия
Самое щадящее лечение рака желудка. При данной процедуре посредством приема лекарств в организм вводятся активные вещества, синтезированные для борьбы с раковыми клетками. Эти вещества хороши тем, что работают точечно, не оказывая влияния на здоровые ткани. Таргетная терапия может работать как самостоятельно, так и в связке с прочими способами лечения, и может применяться на любой стадии рака. Препараты таргетной терапии вводятся внутривенно с помощью капельниц.
Радиотерапия
Также часто применяемая процедура, которая работает исключительно в связке с хирургическим вмешательством и химиотерапией. С ее помощью минимизируется повреждение здоровых тканей, оказывается точечное воздействие на пораженные органы, снижается интенсивность болей при метастазах. Этот метод лечения применяется обычно после операции, чтобы «убить» оставшиеся раковые клетки или уменьшить очаги метастазов.
Паллиативное лечение
Это терапия, которая не позволяет вылечить пациента, но помогает создать для него максимально возможные благоприятные условия жизни. Обычно рак желудка четвертой стадии предполагает именно такое лечение. Паллиативная терапия предназначена для устранения симптомов, которые приносят больному мучения, — сильной боли, тошноты и рвоты, головокружения, кровотечения.
Если опухоли неудаляемые, то хирург может:
- провести гастростому — искусственный ввод пищевого канала в желудок через брюшную стенку, что позволит кормить больного и продлит ему жизнь;
- сформировать обходное соустье между петлями кишечника и самим желудком — таким образом создастся путь, по которому будет проходить пища, что также продлит жизнь пациента;
- прибегнуть к эндолюминальной лазеротерапии, то есть разрезать опухоль с помощью лазера, вводимого в процессе ФГДС; данный метод применяют, когда новообразование закрывает вход в желудок.
Итак, рак желудка является одним из самых распространенных заболеваний и обладает высоким процентом смертности. Его главная опасность в том, что на ранних стадиях болезнь трудно выявить, а на поздних — лечение лишь продлевает жизнь на несколько лет. Но не стоит впадать в отчаяние, услышав диагноз. Общая тенденция смертности идет на убыль во многих развитых странах. Необходимо сразу же обращаться к высококвалифицированным онкологам, уже обладающим успешным опытом в борьбе с болезнью.
Основные статистические данные о раке желудка (желудка)
Насколько распространен рак желудка?
По оценке Американского онкологического общества в отношении рака желудка (также известного как рак желудка) в США на 2021 год:
- Около 26 560 новых случаев рака желудка (16 160 у мужчин и 10400 у женщин)
- Около 11 180 случаев смерти от этого типа рака (6740 мужчин и 4440 женщин)
На рак желудка приходится около 1,5% всех новых онкологических заболеваний, диагностируемых в США каждый год.
Кто заболевает раком желудка?
Рак желудка чаще всего поражает пожилых людей. Средний возраст людей, когда им ставят диагноз, составляет 68 лет. Около 6 из каждых 10 человек, у которых ежегодно диагностируется рак желудка, — 65 лет и старше.
Пожизненный риск развития рака желудка выше у мужчин (примерно у 1 из 96), чем у женщин (примерно у 1 из 152). Но на риск каждого человека могут влиять многие другие факторы.
Динамика развития рака желудка
В США число новых случаев рака желудка снизилось примерно на 1.5% ежегодно в течение последних 10 лет.
На протяжении большей части начала 20 века рак желудка был основной причиной смерти от рака в Соединенных Штатах. но сегодня он находится в самом конце этого списка. Причины этого не совсем ясны, но два основных фактора считаются важными:
- Более широкое использование холодильников для хранения продуктов, что привело к тому, что люди стали есть меньше соленой и копченой пищи (известные факторы риска рака желудка).
- Снижение числа людей, инфицированных бактериями Helicobacter pylori ( H pylori ), которые считаются основной причиной рака желудка.
В то время как рак желудка стал менее распространенным в США, он все еще гораздо более распространен в некоторых других частях мира, особенно в Восточной Азии. Он остается одной из ведущих причин смертности от рака в мире.
Статистические данные о выживаемости при раке желудка см. В разделе «Показатели выживаемости при раке желудка».
Посетите Центр онкологической статистики Американского онкологического общества, чтобы получить более подробную статистику.
Рак желудка: Статистика | Cancer.Net
НА ЭТОЙ СТРАНИЦЕ: Вы найдете информацию о количестве людей, у которых ежегодно диагностируется рак желудка. Вы также прочтете общую информацию о том, как пережить болезнь. Помните, что выживаемость зависит от нескольких факторов. Используйте меню для просмотра других страниц.
В этом году примерно 26 560 человек (16 160 мужчин и 10 400 женщин) в США будут диагностированы с раком желудка.
По оценкам, в этом году от этой болезни погибнет 11 180 человек (6740 мужчин и 4440 женщин).
Рак желудка чаще всего встречается у пожилых людей. Около 60% людей, которым поставлен диагноз, старше 64 лет. Средний возраст постановки диагноза — 68 лет.
Заболеваемость раком желудка варьируется в разных частях мира. В Соединенных Штатах за последнее десятилетие уровень заболеваемости снижался на 1,5% ежегодно. Частично это снижение может быть связано с использованием антибиотиков для лечения инфекций.Эти лекарства могут убить H. pylori (см. «Факторы риска » ). Однако рак желудка по-прежнему остается одним из наиболее распространенных видов рака и одной из основных причин смерти от рака во всем мире.
5-летняя выживаемость показывает, какой процент людей живет не менее 5 лет после обнаружения рака. Процент означает, сколько из 100. 5-летняя выживаемость для людей с раком желудка составляет 32%. Эта статистика отражает тот факт, что 62% людей с раком желудка диагностируются после того, как рак уже распространился за пределы того места, где он возник.Если рак желудка обнаружен до того, как он распространился, 5-летняя выживаемость обычно выше, но зависит от стадии рака, обнаруженной во время операции.
Если рак диагностируется и лечится до того, как он распространился за пределы желудка, 5-летняя выживаемость составляет 70%. Если рак распространился на окружающие ткани или органы и / или региональные лимфатические узлы, 5-летняя выживаемость составляет 32%. Если рак распространился на отдаленную часть тела, 5-летняя выживаемость составляет 6%.
Важно помнить, что статистика выживаемости людей с раком желудка является приблизительной.Оценка основана на ежегодных данных, основанных на количестве людей с этим раком в Соединенных Штатах. Также каждые 5 лет специалисты измеряют статистику выживаемости. Таким образом, оценка может не отражать результаты более точной диагностики или лечения, доступного менее чем за 5 лет. Поговорите со своим врачом, если у вас есть какие-либо вопросы по поводу этой информации. Узнайте больше о статистике.
Статистические данные адаптированы из публикации Американского онкологического общества (ACS), Cancer Facts & Figures 2021, веб-сайта ACS и программы Национального института рака по надзору, эпидемиологии и конечным результатам (SEER) (источники по состоянию на февраль 2021 г. ).
Следующий раздел в этом руководстве — Медицинские иллюстрации . Предлагает рисунки частей тела, часто поражаемых раком желудка. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Статистика рака желудка | World Cancer Research Fund International
Рак желудка — четвертый по частоте вид рака у мужчин и седьмой по частоте у женщин.В 2018 году было зарегистрировано более 1 миллиона новых случаев заболевания. В таблицах ниже представлены 20 стран с самыми высокими показателями заболеваемости раком желудка в 2018 году.
Группа проекта «Постоянное обновление» пришла к выводу, что есть веские доказательства того, что увеличение ожирения и употребление алкогольных напитков и продуктов, консервированных солением, являются причинами рака желудка. Есть некоторые свидетельства того, что потребление обработанного мяса и мяса и рыбы, приготовленных на гриле или на гриле, а также низкое потребление фруктов может увеличить риск рака желудка.Есть некоторые свидетельства того, что потребление цитрусовых может снизить риск рака желудка.
> Прочтите обо всех доказательствах в нашем третьем экспертном отчете.
В таблицах используются нормированные по возрасту ставки. Это сводный показатель уровня заболеваемости, который имел бы население, если бы оно имело стандартную возрастную структуру. Стандартизация необходима при сравнении популяций, различающихся по возрасту, поскольку возраст оказывает сильное влияние на риск смерти от рака.
Заболеваемость раком желудка: у обоих полов
Самый высокий уровень заболеваемости раком желудка в 2018 году был в Южной Корее, за которой следует Монголия.
| Рейтинг | Страна | Стандартизованная по возрасту ставка на 100000 | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Южная Корея | 39,6 | ||||||||||
| 2 | Япония | 27,5 | ||||||||||
| 4 | Китай | 20.7 | ||||||||||
| 5 | Бутан | 19,4 | ||||||||||
| 6 | Киргизия | 18,6 | ||||||||||
| 7 | Чили | 17,8103 | 9011Беларусь | Перу | 16,1 | |||||||
| 10 | Вьетнам | 15,9 | ||||||||||
| 11 | Иран | 15,8 | ||||||||||
| 12 = | Казахстан | .7 | ||||||||||
| 12 = | Таджикистан | 15,7 | ||||||||||
| 14 | Кабо-Верде | 15,3 | ||||||||||
| 15 | Северная Корея | 14,7103 | Северная Корея | 14,7103 | 9011 | 9011 9011 9011|||||||
| 17 | Эквадор | 13,8 | ||||||||||
| 18 | Бруней | 13,6 | ||||||||||
| 19 | Коста-Рика | 13,4 | Литва3 |
Заболеваемость раком желудка у мужчин
Самый высокий уровень заболеваемости раком желудка у мужчин в 2018 г. был в Южной Корее, за которой следует Монголия.
| Рейтинг | Страна | Стандартизованная по возрасту ставка на 100000 | ||||
|---|---|---|---|---|---|---|
| 1 | Южная Корея | 57,8 | ||||
| 2 | Япония | 40,7 | ||||
| 4 | Китай | 29.5 | ||||
| 5 | Киргизия | 29,3 | ||||
| 6 | Чили | 26,9 | ||||
| 7 = | Беларусь | 25,1 | 9011 9011 9011 9011 901||||
| 9 | Казахстан | 24,7 | ||||
| 10 | Бутан | 24,2 | ||||
| 11 | Вьетнам | 23,3 | ||||
| Северная Корея1 | ||||||
| 13 | Иран | 21,6 | ||||
| 14 | Россия | 20,4 | ||||
| 15 | Таджикистан | 20,2 | Азербайджан | 19,8 | ||
| 18 | Французская Гвиана | 19,6 | ||||
| 19 | Перу | 19,3 | ||||
| 20 | Албания1 |
Заболеваемость раком желудка у женщин
Самый высокий уровень заболеваемости раком желудка у женщин в 2018 году был в Южной Корее, за которой следует Монголия.
| Рейтинг | Страна | Стандартизованная по возрасту ставка на 100000 | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Южная Корея | 23,5 | |||||||||||||
| 2 | 16,0 | ||||||||||||||
| 4 | Гватемала | 14.2 | |||||||||||||
| 5 | Бутан | 13,5 | |||||||||||||
| 6 | Перу | 13,4 | |||||||||||||
| 7 | Мали | 12,8103 | Эквадор | 12,2 | |||||||||||
| 10 | Таджикистан | 11,6 | |||||||||||||
| 11 | Беларусь | 10,8 | |||||||||||||
| 12 | Кыргызстан 10,1155 | ||||||||||||||
| 13 | Чили | 10,3 | |||||||||||||
| 14 | Вьетнам | 10,2 | |||||||||||||
| 15 | Бруней | 10,1 | 9011 9011 9011 | 9011 | 17 | Иран | 9,8 | ||||||||
| 18 = | Гондурас | 9,7 | |||||||||||||
| 18 = | Казахстан | 9,7 | |||||||||||||
| 20 9011b4 | Zim5 |
Данные, цитируемые на этих веб-страницах, получены из Глобальной онкологической обсерватории, принадлежащей Международному агентству по изучению рака (IARC), и используются с разрешения. Статистика заболеваемости за 2018 год — это прогнозы, рассчитанные на основе данных онкологического реестра, собранных до 2018 года. Полная информация о методах, используемых IARC, доступна здесь.
Источник: Брей Ф., Ферли Дж., Сурджоматарам И., Сигель Р.Л., Торре Л.А., Джемаль А. Глобальная статистика рака 2018 г .: оценки GLOBOCAN заболеваемости и смертности от 36 раковых заболеваний в 185 странах во всем мире.CA Cancer J Clin, в печати. Онлайн-база данных GLOBOCAN 2018 доступна по адресу http://gco.iarc.fr/ как часть Глобальной онкологической обсерватории МАИР.
Заболеваемость и смертность от рака желудка по возрастным группам, штат Нью-Йорк, кроме города Нью-Йорк, 2014-2018
Источник: Регистр рака штата Нью-Йорк
.| Возрастная группа | Заболеваемость | Смертность | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 0.0 | 0,0 | 0,0-0,1 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0,0-0,1 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0,0-0,2 | |
| 0,0 | 0,0 | 0,0-0,1 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0.0-0,2 | 0,0 | 0,0 | 0,0-0,1 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0,0-0,2 | |
| 0,2 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0,0-0,2 | 0,2 | 0,1 | 0,0-0,3 | 0,0 | 0,0 | 0,0-0,1 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0.0 | 0,0-0,2 | |
| 0,6 | 0,1 | 0,0-0,2 | 0,2 | 0,1 | 0,0-0,3 | 0,4 | 0,1 | 0,0-0,4 | 0,0 | 0,0 | 0,0-0,1 | 0,0 | 0,0 | 0,0-0,2 | 0,0 | 0,0 | 0,0-0,2 | |
| 2,0 | 0,3 | 0,1-0,5 | 1,2 | 0,3 | 0.1-0,6 | 0,8 | 0,2 | 0,1-0,5 | 0,2 | 0,0 | 0,0-0,1 | 0,2 | 0,0 | 0,0-0,3 | 0,0 | 0,0 | 0,0-0,2 | |
| 2,2 | 0,3 | 0,2-0,6 | 1,0 | 0,3 | 0,1-0,6 | 1,2 | 0,4 | 0,1-0,8 | 0,8 | 0,1 | 0,0-0,3 | 0,6 | 0.2 | 0,0-0,5 | 0,2 | 0,1 | 0,0-0,3 | |
| 8,2 | 1,2 | 0,9–1,7 | 4,2 | 1,3 | 0,8–1,9 | 4,0 | 1,2 | 0,8–1,9 | 2,8 | 0,4 | 0,2-0,7 | 1,0 | 0,3 | 0,1-0,7 | 1,8 | 0,6 | 0,3–1,1 | |
| 12,2 | 1,9 | 1.5-2,4 | 6,2 | 1,9 | 1,3–2,7 | 6,0 | 1,9 | 1,3–2,7 | 3,6 | 0,6 | 0,3-0,9 | 1,4 | 0,4 | 0,2-0,9 | 2,2 | 0,7 | 0,3–1,2 | |
| 24,4 | 3,8 | 3,1–4,5 | 12,2 | 3,8 | 2,9–4,9 | 12,2 | 3,7 | 2,9-4,8 | 6.4 | 1,0 | 0,7–1,4 | 3,2 | 1,0 | 0,6–1,6 | 3,2 | 1,0 | 0,6–1,6 | |
| 42,4 | 5,6 | 4,9-6,4 | 21,6 | 5,8 | 4,8-7,0 | 20,8 | 5,4 | 4,5-6,6 | 11,4 | 1,5 | 1,1–2,0 | 7,4 | 2,0 | 1,4–2,8 | 4,0 | 1,0 | 0.6-1,6 | |
| 72,2 | 8,7 | 7,8–9,6 | 43,2 | 10,6 | 9,2–12,1 | 29,0 | 6,8 | 5,7-8,0 | 20,0 | 2,4 | 1,9–2,9 | 12,2 | 3,0 | 2,3–3,8 | 7,8 | 1,8 | 1,3–2,5 | |
| 102,6 | 12,2 | 11,2-13,4 | 67,8 | 16,5 | 14.8-18,4 | 34,8 | 8,1 | 7,0-9,4 | 33,6 | 4,0 | 3,4–4,7 | 23,6 | 5,8 | 4,8-6,9 | 10,0 | 2,3 | 1,7–3,1 | |
| 118,6 | 16,3 | 15,0-17,7 | 80,2 | 22,6 | 20,5-25,0 | 38,4 | 10,3 | 8,9-11,8 | 40,0 | 5,5 | 4,8-6,3 | 28.0 | 7,9 | 6,7-9,3 | 12,0 | 3,2 | 2,4–4,1 | |
| 145,0 | 23,9 | 22,2-25,7 | 97,4 | 33,7 | 30,7–36,8 | 47,6 | 15,0 | 13,1-17,0 | 41,2 | 6,8 | 5,9-7,8 | 29,0 | 10,0 | 8,5-11,8 | 12,2 | 3,8 | 2,9–4,9 | |
| 149.8 | 33,5 | 31,1-35,9 | 97,4 | 47,2 | 43,1-51,5 | 52,4 | 21,7 | 19,2-24,5 | 47,4 | 10,6 | 9,3–12,0 | 29,6 | 14,3 | 12,1-16,8 | 17,8 | 7,4 | 5,9-9,1 | |
| 136,0 | 43,1 | 39,9–46,5 | 83,2 | 60,0 | 54,4-66,0 | 52.8 | 29,9 | 26,4-33,7 | 49,4 | 15,7 | 13,8-17,7 | 28,4 | 20,5 | 17,2-24,1 | 21,0 | 11,9 | 9,7-14,4 | |
| 103,6 | 44,3 | 40,5-48,2 | 62,0 | 64,3 | 57,4-71,9 | 41,6 | 30,2 | 26,2-34,6 | 46,2 | 19,7 | 17,3–22,5 | 26.6 | 27,6 | 23,1-32,7 | 19,6 | 14,2 | 11,6-17,3 | |
| 119,2 | 42,9 | 39,5-46,5 | 64,6 | 68,6 | 61,3-76,5 | 54,6 | 29,7 | 26,3–33,5 | 71,4 | 25,7 | 23,1–28,5 | 36,0 | 38,2 | 32,8-44,2 | 35,4 | 19,3 | 16,5-22,3 | |
Примечания
- Данные о заболеваемости предварительные, ноябрь 2020 г.
- Ставки указаны на 100 000 человек с доверительным интервалом 95%.
- Показатели, основанные на менее чем 4 случаях или смертельных исходах в год, нестабильны и должны использоваться с осторожностью.
Показатели, статистика и результаты выживших после рака желудка
В Центрах лечения рака Америки ® (CTCA) мы понимаем, что вы можете захотеть увидеть информацию о результатах выживаемости пациентов с отдаленным (также называемым метастатическим) раком желудка, которым был поставлен диагноз и / или, по крайней мере, первоначально частично лечиться в наших больницах, чтобы помочь вам и вашей семье решить, куда обратиться за лечением, в рамках многих других факторов, которые вы можете учитывать.Поэтому мы попросили независимого биостатиста проанализировать результаты выживаемости пациентов с CTCA ® .
Статистическая методология и ограничения
Квалификация независимых исследователей
В приведенной ниже таблице отражены коэффициенты выживаемости CTCA и SEER для пациентов с раком желудка с отдаленным (метастатическим) заболеванием, которые были диагностированы между 2000 и 2015 годами. Он включает оценки процента пациентов с раком желудка с отдаленным (метастатическим) заболеванием, которые выжили в течение шести месяцев до пяти лет после первоначального диагноза, как указано в базах данных CTCA и SEER.
- В этот анализ были включены пациенты с раком желудка из CTCA, у которых были первичные очаги опухоли (согласно кодам ICD-O-2 (1973+) от C160 до C169, были диагностированы с 2000 по 2015 год (включая 2000 и 2015 годы) и получили хотя бы часть начального курса лечения в CTCA. Все пациенты, включенные в анализ, считались аналитическими пациентами CTCA. В анализ были включены
- пациентов с раком желудка с отдаленным (метастатическим) заболеванием из базы данных SEER и пациенты с раком желудка с отдаленным (метастатическим) заболеванием из базы данных CTCA.Кроме того, из анализа были исключены пациенты, в медицинских записях которых отсутствовала какая-либо из следующих сведений:
- SEER Суммарные этапы
- Первичные очаги опухоли
- Гистологические типы рака
- Дата первичного диагноза
- Возраст при первоначальном диагнозе
- Пол
- Гонка
* Данные SEER представляют национальные результаты по большому количеству учреждений и были включены в иллюстративных целях.Они не предназначены для представления контролируемого исследования и / или идеального анализа данных CTCA и SEER из-за различий в размерах выборки в двух базах данных, клиническом состоянии (-ях) пролеченных пациентов и других факторах.
Выборка CTCA относительно небольшая, потому что в нее были включены только пациенты с метастатическим раком желудка, которые были первоначально диагностированы в CTCA и / или прошли, по крайней мере, часть своего первоначального курса лечения в CTCA. Эти факторы значительно уменьшили размер выборки CTCA, а это означает, что оценки, отраженные в диаграмме выживаемости, могут сильно варьироваться и не могут быть воспроизведены в будущем, когда у нас будет большая выборка CTCA для анализа.
Чтобы получить полное техническое объяснение методологии, использованной в анализе, и подробное описание включенных групп пациентов CTCA и SEER, щелкните здесь, чтобы просмотреть статистическую методологию, а для получения дополнительной информации о программе SEER перейдите на seer.cancer.gov .
Мы также хотим быть уверены, что вы понимаете, что рак — это сложное заболевание, и состояние здоровья каждого человека индивидуально; поэтому CTCA не делает заявлений ни об эффективности конкретных методов лечения, оказании помощи, ни о значении анализов CTCA и SEER.Не все больные раком, проходящие лечение в больнице CTCA, могут получить такие же результаты.
Узнайте больше о стадиях рака желудка
Следующая тема: Какие факты о раке желудка?
Статистика— Нет желудка для рака
Пятая
наиболее распространенный тип рака в мире
Более 1 миллиона
новых случая ежегодно во всем мире
Примерно 28000 случаев заболевания в США, по оценкам в 2020 г.
1 из 111
мужчины и женщины будут диагностированы в течение жизни
до 10%
случаев рака желудка имеют «семейное» происхождение
до 42%
пожизненный риск по наследственности
Синдром наследственного диффузного рака желудка (HDGC) увеличивает риск диффузного рака желудка (риск 42% к 80 годам) и лобулярного рака груди (риск 42-55% для женщин к 80 годам)
4%
5-летняя выживаемость пациентов с раком желудка IV стадии
Общая 5-летняя выживаемость — 29.3%
Второй
наиболее частая причина смерти от рака во всем мире
По оценкам, в 2020 году от рака желудка умрут 11000 американцев и 782000 человек во всем мире
1,8 миллиарда долларов
было потрачено на лечение больных раком желудка в США в 2014 г.
Но Национальный институт рака вложил всего 11,2 миллиона долларов в финансирование исследований рака желудка в 2013 году
Только 0,23%
бюджета Национального института рака на 2013 год было выделено на лечение рака желудка
Рак желудка получил наименьшее количество долларов на исследования NCI в 2013 году по сравнению с другими видами рака
Знаете ли вы?
- Рак желудка трудно обнаружить и обычно диагностируется на поздних стадиях
- Лечение H.pylori (распространенная бактериальная инфекция желудка) может снизить риск развития рака желудка
- Диета с высоким содержанием копченых, соленых и маринованных продуктов, употребление табака и ожирение могут увеличить риск рака желудка
- Люди, несущие мутации генов BRCA1 и BRCA2, которые увеличивают риск рака груди и яичников, также могут иметь повышенный риск развития рака желудка
- Рак желудка может быть наследственным, иногда вызванным мутацией гена (CDh2 — один из таких генов)
- Профилактическое полное удаление желудка (гастрэктомия) — это лечение пациентов с мутацией гена CDh2
- Рак желудка, дольчатой груди и толстой кишки — все риски для людей с мутацией гена CDh2
- Человек может жить нормальной жизнью без желудка
- Раннее выявление рака желудка — ключ к выживанию
- Вы можете помочь спасти жизни, рассказав о раке желудка
Список литературы
Какова глобальная заболеваемость раком желудка?
Всемирная организация здравоохранения.Рак. КТО. Доступно по адресу http://www.who.int/mediacentre/factsheets/fs297/en/. 12 сентября 2018 г .; Дата обращения: 22 февраля 2021 г.
Программа эпиднадзора, эпидемиологии и конечных результатов. Информационные бюллетени SEER Stat: рак желудка. Национальный институт рака. Доступно по адресу http://seer.cancer.gov/statfacts/html/stomach.html. Дата обращения: 22 февраля 2021 г.
Авиталь I, Стоядинович А., Пистерс П.В.Т., Келсен Д.П., Виллетт К.Г. Рак желудка. ДеВита В.Т., Лоуренс Т.С., Розенберг С.А. Рак ДеВиты, Хеллмана и Розенберга: принципы и практика онкологии . 10-е изд. Филадельфия, Пенсильвания: Уолтерс Клувер; 2015. 613-42.
[Рекомендации] Национальная комплексная онкологическая сеть. Руководство NCCN по клинической практике в онкологии: рак желудка. NCCN. Доступно на http://www.nccn.org/professionals/physician_gls/pdf/gastric.pdf. Версия 1.2021 — 9 февраля 2021 г .; Дата обращения: 22 февраля 2021 г.
Брей Ф, Ферлей Дж., Сурджоматарам I, Сигел Р.Л., Торре Л.А., Джемаль А.Глобальная статистика рака 2018: оценки GLOBOCAN заболеваемости и смертности во всем мире от 36 видов рака в 185 странах. CA Cancer J Clin . 2018 ноябрь 68 (6): 394-424. [Медлайн]. [Полный текст].
Macdonald JS, Smalley SR, Benedetti J, Hundahl SA, Estes NC, Stemmermann GN, et al. Химиолучевая терапия после хирургического вмешательства по сравнению с хирургическим вмешательством при аденокарциноме желудка или пищеводно-желудочного перехода. N Engl J Med . 2001, 6 сентября. 345 (10): 725-30.[Медлайн].
Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Периоперационная химиотерапия в сравнении с хирургическим вмешательством при резектабельном раке пищевода. N Engl J Med . 2006 июл 6. 355 (1): 11-20. [Медлайн].
Ooi CH, Иванова Т., Ву Дж., Ли М., Тан И.Б., Тао Дж. И др. Комбинации онкогенных путей прогнозируют клинический прогноз при раке желудка. PLoS Genet . 5 (10) октября 2009 г .: e1000676.[Медлайн]. [Полный текст].
Song H, Ekheden IG, Zheng Z, Ericsson J, Nyrén O, Ye W. Заболеваемость раком желудка среди пациентов с предраковыми поражениями желудка: наблюдательное когортное исследование в западной популяции с низким уровнем риска. BMJ . 2015 27 июля. 351: h4867. [Медлайн]. [Полный текст].
Американское онкологическое общество. Ключевые статистические данные о раке желудка. Американское онкологическое общество. Доступно по адресу http://www.cancer.org/cancer/stomachcancer/detailedguide/stomach-cancer-key-statistics.22 января 2021 г .; Дата обращения: 22 февраля 2021 г.
Arnold M, Park JY, Camargo MC, Lunet N, Forman D, Soerjomataram I. Становится ли рак желудка редким заболеванием? Глобальная оценка прогнозируемых тенденций заболеваемости до 2035 года. Кишечник . 2020 30 января. [Medline].
Гундерсон Л.Л., Сосин Х. Аденокарцинома желудка: области неудач в серии повторных операций (второй или симптоматический взгляд) клинико-патологическая корреляция и последствия для адъювантной терапии. Инт Дж. Радиат Онкол Биол Физ . 1982 8 января (1): 1-11. [Медлайн].
Корреа П. Модификация диеты и профилактика рака желудка. J Национальный институт рака, монография . 1992. 75-8. [Медлайн].
Buiatti E, Palli D, Decarli A, Amadori D, Avellini C, Bianchi S и др. Исследование «случай-контроль» рака желудка и диеты в Италии. Инт Дж. Рак . 1989 15 октября. 44 (4): 611-6. [Медлайн].
Steevens J, Schouten LJ, Goldbohm RA, van den Brandt PA.Потребление алкоголя, курение сигарет и риск подтипов рака пищевода и желудка: проспективное когортное исследование. Кишечник . 2010 Январь 59 (1): 39-48. [Медлайн].
González CA, Pera G, Agudo A, Palli D, Krogh V, Vineis P, et al. Курение и риск рака желудка в Европейском проспективном исследовании рака и питания (EPIC). Инт Дж. Рак . 20 ноября 2003 г. 107 (4): 629-34. [Медлайн].
Wu X, Zeng Z, Chen B, Yu J, Xue L, Hao Y, et al.Связь полиморфизмов генов интерлейкина-17A и интерлейкина-17F и риски рака желудка. Инт Дж. Рак . 2009 10 ноября. [Medline].
Рабочая группа МАИР по оценке канцерогенных рисков для людей, Schistosom. Том 61 монографий МАИР по оценке канцерогенных рисков для человека. Международное агентство по изучению рака, Лион, 1994. J Clin Oncol . 2004. 22: 2069.
Харрисон П.Терапия H.pylori снижает риск рака желудка у пациентов из группы высокого риска. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/924545. 30 января 2020 г .; Дата обращения: 5 февраля 2020 г.
Choi IJ, Kim CG, Lee JY, Kim YI, Kook MC, Park B, et al. Семейный анамнез рака желудка и Helicobacter pylori Лечение. N Engl J Med . 2020 30 января. 382 (5): 427-436. [Медлайн].
Cheung KS, Chan EW, Wong AYS, Chen L, Wong ICK, Leung WK.Долгосрочные ингибиторы протонной помпы и риск развития рака желудка после лечения Helicobacter pylori: популяционное исследование. Кишечник. Доступно по адресу http://gut.bmj.com/content/early/2017/09/18/gutjnl-2017-314605. 31 октября 2017 г .; Доступ: 1 ноября 2017 г.
Профилактика рака желудка (PDQ®) — Версия для специалистов в области здравоохранения. Национальный институт рака. Доступно по адресу http://www.cancer.gov/cancertopics/pdq/prevention/gastric/HealthProfessional. 21 сентября 2018 г .; Доступ: 27 февраля 2019 г.
Neugut AI, Hayek M, Howe G. Эпидемиология рака желудка. Семин Онкол . 1996, 23 июня (3): 281-91. [Медлайн].
Guilford P, Hopkins J, Harraway J, et al. Мутации зародышевой линии E-кадгерина при семейном раке желудка. Природа . 1998. 392: 402. [Медлайн].
Cardwell CR, Abnet CC, Cantwell MM, Murray LJ. Воздействие пероральных бисфосфонатов и риск рака пищевода. ЯМА .2010 г. 11 августа. 304 (6): 657-63. [Медлайн]. [Полный текст].
Филиппи Л., Д’Ариензо М., Скопинаро Ф., Сальватори Р., Баньи О. Полезность визуализации с двумя временными точками после газированной воды для визуализации фтордезоксиглюкозно-позитронно-эмиссионной визуализации перитонеального карциноматоза при раке толстой кишки. Биотерма для рака Радиофарм . 2013 28 января (1): 29-33. [Медлайн].
Брукс М. Новый подтип рака желудка реагирует на 5-ФУ. Медицинские новости Medscape .4 сентября 2013 г. [Полный текст].
Lei Z, Tan IB, Das K, et al. Идентификация молекулярных подтипов рака желудка с различными ответами на ингибиторы PI3-киназы и 5-фторурацил. Гастроэнтерология . 2013 Сентябрь 145 (3): 554-65. [Медлайн].
Тернер Э.С., Тернер Дж. Р. Расширение классификации Лорен: новый подтип рака желудка? [редакционная статья]. Гастроэнтерология . 2013 Сентябрь 145 (3): 505-8. [Медлайн].
Американский объединенный комитет по раку.Желудок. Amin MB, Edge S, Greene F, Byrd DR, Brookland RK и др., Под ред. AJCC Руководство по стадированию рака . 8-е изд. Нью-Йорк: Спрингер; 2017.
Наджам А.А., Яо Дж. К., Лензи Р. и др. Пластический линит часто встречается у женщин и в гистологиях низкодифференцированных и перстневых клеток: анализ 217 пациентов (аннотация). Proc Am Soc Clin Oncol . 2002. 21: 166a.
Шен К.Х., Ву К.В., Ло С.С. и др. Факторы коррелировали с количеством метастатических лимфатических узлов при раке желудка. Ам Дж. Гастроэнтерол . 1999, январь, 94 (1): 104-8. [Медлайн].
Lee SE, Ryu KW, Nam BH, Lee JH, Choi IJ, Kook MC и др. Прогностическое значение интраоперационно оцененного этапа хирургического вмешательства у больных раком желудка после радикальной резекции. Дж. Ам Колл Сург . 2009 Октябрь 209 (4): 461-7. [Медлайн].
Озкан С., Баркаускас Д.А., Рухаак Л.Р., Хавьер Торрес Дж., Кук С.Л., Ан Х и др. Гликановые признаки рака желудка в сыворотке крови. Cancer Prev Res (Phila) .2013 10 декабря [Medline].
Вакнин Ю. Исследователи обнаружили «гликановый отпечаток пальца» при раке желудка. Medscape [сериал онлайн]. Доступно на http://www.medscape.com/viewarticle/818637. 3 января 2014 г .; Доступ: 24 апреля 2018 г.
Bozzetti F, Marubini E, Bonfanti G, Miceli R, Piano C, Gennari L. Промежуточный итог по сравнению с тотальной гастрэктомией при раке желудка: пятилетняя выживаемость в многоцентровом рандомизированном итальянском исследовании. Итальянская группа по изучению опухолей желудочно-кишечного тракта. Энн Сург . 1999 августа 230 (2): 170-8. [Медлайн].
Bonenkamp JJ, Hermans J, Sasako M, van de Velde CJ, Welvaart K, Songun I, et al. ван де Вельде, CJ. Расширенная лимфодиссекция при раке желудка. N Engl J Med . 1999 25 марта. 340: 908. [Медлайн].
Hartgrink HH, van de Velde CJ, Putter H, Bonenkamp JJ, Klein Kranenbarg E, Songun I, et al. Расширенная лимфодиссекция при раке желудка: кому может быть полезно? Окончательные результаты рандомизированного голландского группового исследования рака желудка. Дж Клин Онкол . 2004, 1 июня, 22 (11): 2069-77. [Медлайн].
Degiuli M, Sasako M, Ponti A. Заболеваемость и смертность в рандомизированном клиническом исследовании итальянской группы по изучению рака желудка по сравнению с резекцией D1 и D2 при раке желудка. руб. J Surg . 2010 май. 97 (5): 643-9. [Медлайн].
Мемон М.А., Субраманья М.С., Хан С. и др. Мета-анализ D1 и D2 гастрэктомии при аденокарциноме желудка. Энн Сург . 2011 Май.253 (5): 900-11. [Медлайн].
Coccolini F, Nardi M, Montori G, Ceresoli M, Celotti A, Cascinu S и др. Неоадъювантная химиотерапия при распространенном раке желудка и пищевода-желудка. Метаанализ рандомизированных исследований. Инт Дж. Сургут . 2018 Март 51: 120-127. [Медлайн].
Sindelar WG, Kinsella TJ. Рандомизированное исследование резекции и интраоперационной лучевой терапии при местнораспространенном раке желудка. Proc Ann Знакомьтесь, Am Soc Clin Oncol .1987. 6: A357.
Moertel CG, Childs DS, Reitemeier RJ, et al. Комбинированная 5-фторурацил и лучевая терапия сверхвысоким напряжением местного неоперабельного рака желудочно-кишечного тракта. Ланцет . 1969 25 октября. 2 (7626): 865-7. [Медлайн].
Hallissey MT, Dunn JA, Ward LC, Allum WH. Второе испытание Британской группы рака желудка по адъювантной лучевой терапии или химиотерапии при резектабельном раке желудка: пятилетнее наблюдение. Ланцет .1994 28 мая. 343 (8909): 1309-12. [Медлайн].
Группа изучения опухолей желудочно-кишечного тракта. Понятие о местнораспространенном раке желудка. Влияние лечения на исход. Группа исследования опухолей желудочно-кишечного тракта. Рак . 1990 декабрь 1. 66 (11): 2324-30. [Медлайн].
Moertel CG, Childs DS, O’Fallon JR, et al. Комбинированный 5-фторурацил и лучевая терапия в качестве хирургического вспомогательного средства при плохом прогнозе карциномы желудка. Дж Клин Онкол .1984, ноябрь 2 (11): 1249-54. [Медлайн].
Smalley SR, Benedetti JK, Haller DG, Hundahl SA, Estes NC, Ajani JA, et al. Обновленный анализ проведенного SWOG межгруппового исследования 0116: исследование фазы III адъювантной радиохимиотерапии по сравнению с наблюдением после лечебной резекции рака желудка. Дж Клин Онкол . 2012 г. 1 июля. 30 (19): 2327-33. [Медлайн].
Earle CC, Maroun JA. Адъювантная химиотерапия после радикальной резекции рака желудка у пациентов неазиатского происхождения: пересмотр метаанализа рандомизированных исследований. евро J Рак . 1999 июл.35 (7): 1059-64. [Медлайн].
Bang YJ, Kim YW, Yang HK, et al. Адъювант капецитабин и оксалиплатин при раке желудка после гастрэктомии D2 (CLASSIC): открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 2012 28 января. 379 (9813): 315-21. [Медлайн].
Fuchs CS, Niedzwiecki D, Mamon HJ, Tepper JE, Ye X, Swanson RS и др. Адъювантная химиолучевая терапия эпирубицином, цисплатином и фторурацилом по сравнению с адъювантной химиолучевой терапией фторурацилом и лейковорином после лечебной резекции рака желудка: результаты исследования CALGB 80101 (Alliance). Дж Клин Онкол . 2017 10 ноября. 35 (32): 3671-3677. [Медлайн]. [Полный текст].
Нарахара Х., Коидзуми Т., Хара А и др. Рандомизированное исследование фазы III одного S-1 в сравнении с S-1 + цисплатином при лечении распространенного рака желудка. Дж Клин Онкол . Июнь 2007. 25: 201с.
Wagner AD, Syn NL, Moehler M, Grothe W., Yong WP, Tai BC, et al. Химиотерапия при распространенном раке желудка. Кокрановская база данных Syst Rev . 2017 29 августа.8: CD004064. [Медлайн].
Hartgrink HH, Jansen EP, van Grieken NC, van de Velde CJ. Рак желудка. Ланцет . 2009 8 августа. 374 (9688): 477-90. [Медлайн].
Ким Х. К., Чой Ай Джей, Ким К. Г., Осима А, Грин Дж. Э. Сигнатуры экспрессии генов для прогнозирования ответа рака желудка на цисплатин и фторурацил. Дж Клин Онкол . 2009/05. 27: [Полный текст].
Исидо К., Адзума М., Коидзуми В., Такеучи А., Сакурамото С., Ватанабе М. и др.Оценка прогностических факторов ответа на S-1 у пациентов с распространенным раком желудка II или III стадии, перенесших гастрэктомию. Фармакогенет Геномика . 2009 5 ноября. [Medline].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. FDA одобрило Cyramza для лечения рака желудка [пресс-релиз]. 21 апреля 2014 г. Доступно по адресу https://wayback.archive-it.org/7993/20170112023840/http://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm394107.htm. 21 апреля 2014 г .; Доступ: 24 апреля 2018 г.
Fuchs CS, Doi T, Jang RW, Muro K, Satoh T. и др. Безопасность и эффективность монотерапии пембролизумабом у пациентов с ранее леченным распространенным раком желудка и гастроэзофагеального перехода: клиническое испытание фазы 2 KEYNOTE-059. JAMA Онкол . 2018 15 марта. [Medline]. [Полный текст].
Камада Т., Тогаши Ю., Тай С., Ха Д., Сасаки А., Накамура Ю. и др. PD-1 + регуляторных Т-клеток, усиленных блокадой PD-1, способствует гиперпрогрессии рака. Proc Natl Acad Sci U S A . 14 мая 2019 г. 116 (20): 9999-10008. [Медлайн]. [Полный текст].
Bang YJ, Van Cutsem E, Feyereislova A, Chung HC, Shen L, Sawaki A, et al. Трастузумаб в сочетании с химиотерапией по сравнению с одной химиотерапией для лечения HER2-положительного распространенного рака желудка или желудочно-пищеводного перехода (ToGA): открытое рандомизированное контролируемое исследование фазы 3. Ланцет . 28 августа 2010 г. 376 (9742): 687-97. [Медлайн].
Шитара К., Банг Й.Дж., Иваса С., Сугимото Н. и др.Трастузумаб Дерустекан при ранее леченном HER2-положительном раке желудка. N Engl J Med . 2020 18 июня. 382 (25): 2419-2430. [Медлайн]. [Полный текст].
Ohtsu A, Shah MA, Van Cutsem E, Rha SY, Sawaki A, Park SR и др. Бевацизумаб в сочетании с химиотерапией в качестве терапии первой линии при распространенном раке желудка: рандомизированное, двойное слепое, плацебо-контролируемое исследование фазы III. Дж Клин Онкол . 2011 20 октября. 29 (30): 3968-76. [Медлайн]. [Полный текст].
Ван Катсем Э., де Хаас С., Канг Ю.К., Оцу А., Теббутт, Северная Каролина, Мин Сюй Дж. И др. Бевацизумаб в сочетании с химиотерапией в качестве терапии первой линии при распространенном раке желудка: оценка биомаркеров по результатам рандомизированного исследования III фазы AVAGAST. Дж Клин Онкол . 2012 июн 10, 30 (17): 2119-27. [Медлайн].
Шитара К., Дои Т., Дворкин М., Мансур В., Аркенау Х.Т., Прохарау А. и др. Сравнение трифлуридина / типирацила с плацебо у пациентов с метастатическим раком желудка (TAGS), ранее получавшим тяжелую терапию: рандомизированное двойное слепое плацебо-контролируемое исследование фазы 3. Ланцет Онкол . 2018 19 ноября (11): 1437-1448. [Медлайн].
Давенпорт Л. «Сдвиг парадигмы» при раке желудочного перехода с помощью ниволумаба. Медицинские новости Medscape. Доступно на https://www.medscape.com/viewarticle/937916. 23 сентября 2020 г .; Дата обращения: 10 октября 2020 г.
Ротвелл П.М., Фаукс Г.Р., Белч Дж.Ф., Огава Х., Варлоу С.П., Мид Т.В. Влияние ежедневного приема аспирина на долгосрочный риск смерти от рака: анализ данных отдельных пациентов из рандомизированных исследований. Ланцет . 7 декабря 2010 г .; Ранняя онлайн-публикация. [Полный текст].
Скрининг рака желудка (желудка) (PDQ®) Версия для медицинских специалистов. Национальный институт рака. Доступно по адресу http://www.cancer.gov/cancertopics/pdq/screening/gastric/HealthProfessional. 20 февраля 2020 г .; Дата обращения: 22 февраля 2021 г.
[Рекомендации] Динис-Рибейро М., Арейя М., де Фрис А.С. и др. Ведение предраковых состояний и поражений желудка (MAPS): рекомендации Европейского общества эндоскопии желудочно-кишечного тракта (ESGE), Европейской группы изучения хеликобактер (EHSG), Европейского общества патологов (ESP) и Sociedade Portuguesa de Endoscopia Digestiva (SPED). ). Эндоскопия . 2012 Январь 44 (1): 74-94. [Медлайн]. [Полный текст].
[Рекомендации] Chey WD, Wong BC, Комитет по параметрам практики Американского колледжа гастроэнтерологии. Руководство Американского колледжа гастроэнтерологии по лечению инфекции Helicobacter pylori. Ам Дж. Гастроэнтерол . 2007 августа 102 (8): 1808-25. [Медлайн]. [Полный текст].
[Руководство] Мальфертайнер П., Мегро Ф., О’Морайн, Калифорния, Атертон Дж., Аксон А. Т., Баццоли Ф. и др.Управление инфекцией Helicobacter pylori — Маастрихтский отчет IV / Флорентийский консенсусный доклад. Кишечник . 2012 май. 61 (5): 646-64. [Медлайн].
[Рекомендации] Fallone CA, Chiba N, van Zanten SV, Fischbach L, Gisbert JP, Hunt RH, et al. Торонтский консенсус по лечению инфекции Helicobacter pylori у взрослых. Гастроэнтерология . 2016 Июль 151 (1): 51-69.e14. [Медлайн]. [Полный текст].
[Рекомендации] Национальная комплексная онкологическая сеть.Руководство по клинической практике в онкологии: генетическая / семейная оценка высокого риска: колоректальный. NCCN. Доступно на https://www.nccn.org/professionals/physician_gls/pdf/genetics_colon.pdf. Версия 3.2019 — 13 декабря 2019 г .; Дата обращения: 24 февраля 2020 г.
[Рекомендации] Фитцджеральд Р.К., Хардвик Р., Хантсман Д., Карнейро Ф., Гилфорд П., Блэр В. и др. Наследственный диффузный рак желудка: обновленные согласованные руководящие принципы клинического ведения и направления будущих исследований. Дж Мед Генет .2010 июл. 47 (7): 436-44. [Медлайн]. [Полный текст].
[Рекомендации] van der Post RS, Vogelaar IP, Carneiro F, et al. Наследственный диффузный рак желудка: обновленные клинические рекомендации с акцентом на носителей мутации CDh2 в зародышевой линии. Дж Мед Генет . 2015 июн. 52 (6): 361-74. [Медлайн]. [Полный текст].
[Рекомендации] Джардиелло Ф.М., Аллен Дж. И., Аксилбунд Дж. Э., Боланд С. Р., Берк Калифорния, Берт Р. В. и др. Руководящие принципы по генетической оценке и лечению синдрома Линча: согласованное заявление Многосоциальной целевой группы США по колоректальному раку. Ам Дж. Гастроэнтерол . 2014 августа 109 (8): 1159-79. [Медлайн].
[Рекомендации] Смит ЕС, Верхей М., Аллум В., Каннингем Д., Сервантес А., Арнольд Д. и др. Рак желудка: Руководство ESMO по клинической практике по диагностике, лечению и последующему наблюдению. Энн Онкол . 2016, 27 сентября (приложение 5): v38-v49. [Медлайн]. [Полный текст].
[Рекомендации] Vasen HF, Blanco I, Aktan-Collan K, et al. Пересмотренное руководство по клиническому ведению синдрома Линча (HNPCC): рекомендации группы европейских экспертов.
