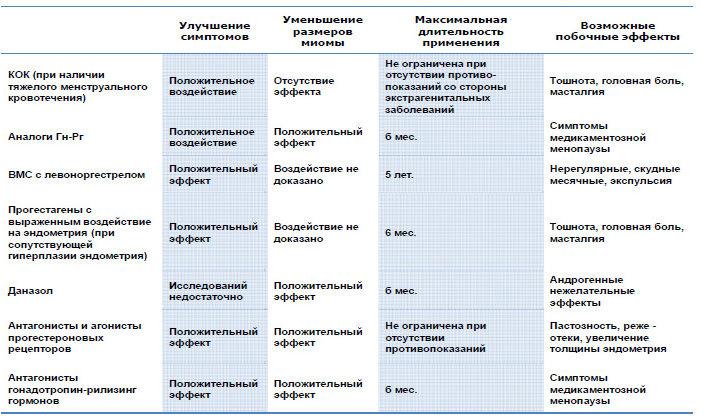
Антагонисты гонадотропин-рилизинг гормона в сравнении с агонистами ГнРГ у субфертильных пар при использовании вспомогательных репродуктивных технологий
Вопрос обзора
В этом обновленном Кокрейновском обзоре оценили эффективность и безопасность антагонистов ГнРГ, в сравнении с более широко используемыми агонистами ГнРГ (протокол с длительным курсом).
Актуальность:
Агонисты гонадотропин-рилизинг гормона (ГнРГ) обычно используют, чтобы предотвратить преждевременный выброс лютеинизирующего гормона (ЛГ), и тем самым увеличить вероятность рождения живого ребенка у женщин, которые подвергаются процедурам вспомогательных репродуктивных технологий (ВРТ), и, одновременно снизить риск развития таких осложнений, как синдром гиперстимуляции яичников (СГСЯ). Антагонисты гонадотропин-рилизинг гормона (ГнРГ) в настоящее время рассматривают в качестве потенциального средства достижения лучших исходов лечения, поскольку протокол является более гибким, и антагонисты могут более эффективно уменьшить риск развития СГСЯ, чем агонисты.
Характеристика исследований
Мы нашли 73 рандомизированных контролируемых испытания (с участием, в общей сложности, 12212 женщин, подвергающимся процедурам ВРТ), в которых сравнивали антагонист ГнРГ с агонистом ГнРГ. Доказательства актуальны по май 2015 года.
Основные результаты
Не было доказательств различий между группами в показателях живорождения (т.е. показателях после завершенного курса лечения). Доказательства позволяют предположить, что если шансы живорождения после применения агониста ГнРГ принять за 29%, то шансы живорождения после применения антагониста ГнРГ будут от 25% до 33%. Однако частота развития СГСЯ была значительно выше после применения агонистов ГнРГ. Доказательства позволяют предположить, что, если риск развития СГСЯ после применения агониста ГнРГ принять за 11%, тогда риск развития СГСЯ после применения антагониста ГнРГ будет между 6% и 9%.
Качество доказательств
Доказательства были среднего качества, как в отношении живорождения, так и в отношении СГСЯ. Основными ограничениями доказательств были возможность публикационного смещения в отношении живорождения (с учетом небольших по размеру исследований, в которых вероятно сообщали о благоприятных исходах при использовании антагонистов ГнРГ) и плохое представление методов исследования в отношении СГСЯ.
Протокол с антагонистами и агонистом ГнРГ в качестве триггера овуляции (т.н. короткий протокол).
Согласно последним исследованиям, короткие протоколы с антагонистами и агонистом ГнРГ в качестве триггера овуляции целесообразно проводить пациенткам, у которых подозревается чрезмерный ответ яичников на гормональную стимуляцию и высокий риск развития синдрома гиперстимуляции яичников (СГЯ).
Стимуляция в таком протоколе начинается на 2-5
д.ц., а средняя её продолжительность — 10-12 дней, в зависимости от
скорости роста фолликулов. Спонтанная овуляция невозможна, поскольку
обычно с 6-8 дня стимуляции подключаются препараты-антагонисты
ГнРГ (Цетротид, Оргалутран), целевое действие которых — подавление пика
ЛГ, являющегося предвестником овуляции.
Триггеры овуляции — препараты, стимулирующие выброс ЛГ и обеспечивающие финальное созревание ооцитов в фолликулах и их овуляцию.
Триггеры
овуляции вводят по достижении фолликулами размеров 18-20 мм и
используют во всех протоколах стимуляции, независимо от того, какие
препараты для стимуляции применялись.
Однако, достоверно известно, что введение чХГ является одним из основных факторов возникновения СГЯ.
Поэтому, агонисты ГнРГ (Диферелин, Декапетил), введённые однократно в недепонированной (ежедневной) форме, в дозе 0,2 мг, в качестве триггера овуляции стали реальным и практическим спасением для пациенток с высоким риском СГЯ. Агонист ГнРГ вызывает выброс эндогенного ЛГ и программирует овуляцию
также, как и чХГ.

Однако,
при использовании аногистов ГнРГ желтые тела функционируют существенно
хуже, чем при использовании препаратов чХГ. Соответственно, значительно
меньше шансов того, что беременность наступит.
Поскольку в
последнее время статистически подтверждено, что шансы получить
беременность в свежем протоколе и в крио-протоколе сравнялись, во многих
клиниках эмбрионы стали замораживать, если есть хотя бы малейший риск
развития СГЯ.
Таким образом сейчас агонист ГнРГ в качестве триггера
овуляции означает заморозку всех эмбрионов. Беременностей при этом
меньше не становится, а вероятность для пациентки попасть в реанимацию с
тяжёлой степенью СГЯ практически равна нулю. Такова эволюция ЭКО.
Самостоятельная овуляция происходит через 38-44 часа после инъекции триггера овуляции. Поэтому пункцию целесообразно производить через 36 часов после введения триггера.
Факторы риска развития СГЯ:
— Молодой возраст (< 35 лет).
— Низкий индекс массы тела – астенический тип телосложения.
— Синдром поликистозных яичников (СПКЯ) или мультифолликулярных яичников (МФЯ).
— Наличие аллергических реакций на препараты.
— Высокая активность эстрадиола в сыворотке крови.
— Увеличенное количество развивающихся фолликулов (более 20 фолликулов суммарно в обоих яичниках).
— Введение высоких или повторенных доз чХГ (Овитрель, Прегнил).
— Протокол стимуляции суперовуляции с агонистами Гн-РГ (т.н. длинный протокол).
— Наступление беременности (повышение уровня чХГ в сыворотке крови усугубляет СГЯ).
Рецепторные механизмы действия половых гормонов. Может ли рецептор работать без лиганда? | Бабичев
Среди эндокринологов считается общепринятым, что большая часть эффектов стероидных гормонов передается на клетку через их рецепторы, локализованные на внутриклеточных местах, главным образом на ядрах клеток, и эти механизмы интенсивно исследуются [1—3, 13, 21, 46, 49, 93].
Если это происходит, возникает вопрос, являются ли наблюдаемые явления в физиологии и поведении гормонально-зависимыми.
Иными словами, необходимо учитывать, какими механизмами осуществляется регуляция активирования рецепторов стероидных гормонов в организме в отсутствие гормонов.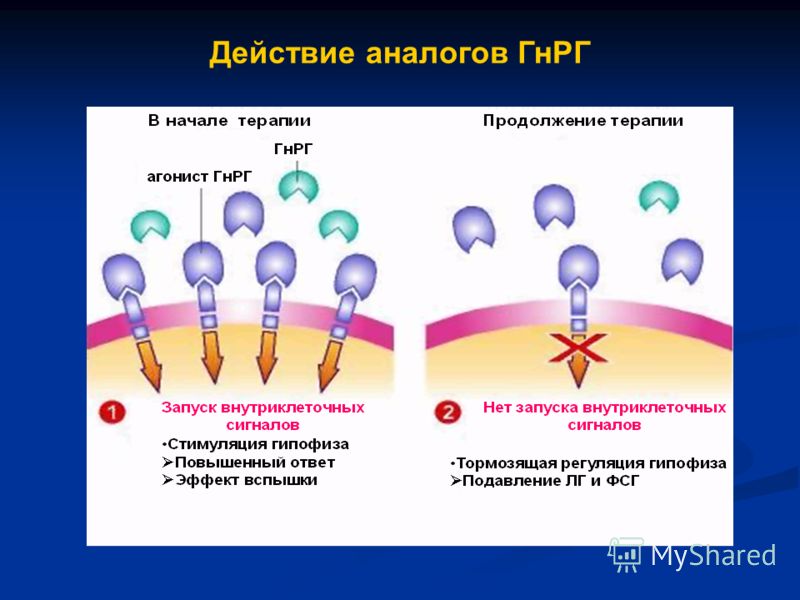 Конкретные опыты показывают, что определенный стероидный гормон необязательно должен присутствовать для того, чтобы клетка экспрессировала стероидный рецепторзависимый ответ. Имеются доказательства, что рецепторы активируются и в отсутствие лигандов в физиологических условиях.
Конкретные опыты показывают, что определенный стероидный гормон необязательно должен присутствовать для того, чтобы клетка экспрессировала стероидный рецепторзависимый ответ. Имеются доказательства, что рецепторы активируются и в отсутствие лигандов в физиологических условиях.
Стероидные рецепторы были интенсивно исследованы в 60—70-е годы XX века [13, 25, 63, 97]. Показано, что основным механизмом действия стероидов является связывание со свободными, высокоспецифичными внутриклеточными гормональными рецепторами, которое определяется как транскрипционное. Большая часть хорошо известных эстрогентранскрипционных действий у млекопитающих передается через классические эстрогенные рецепторы (ЭР) — ЭРа и ЭРр, которые часто выполняют медуляторную функцию, а также ЭРу, недавно обнаруженный в костях [49]. Эти рецепторы входят в группу суперсемейства ядерных рецепторов, вызывающих транскрипцию. Сюда входят также рецепторы стероидных гормонов, гормонов щитовидной железы, витамина D [70, 91].
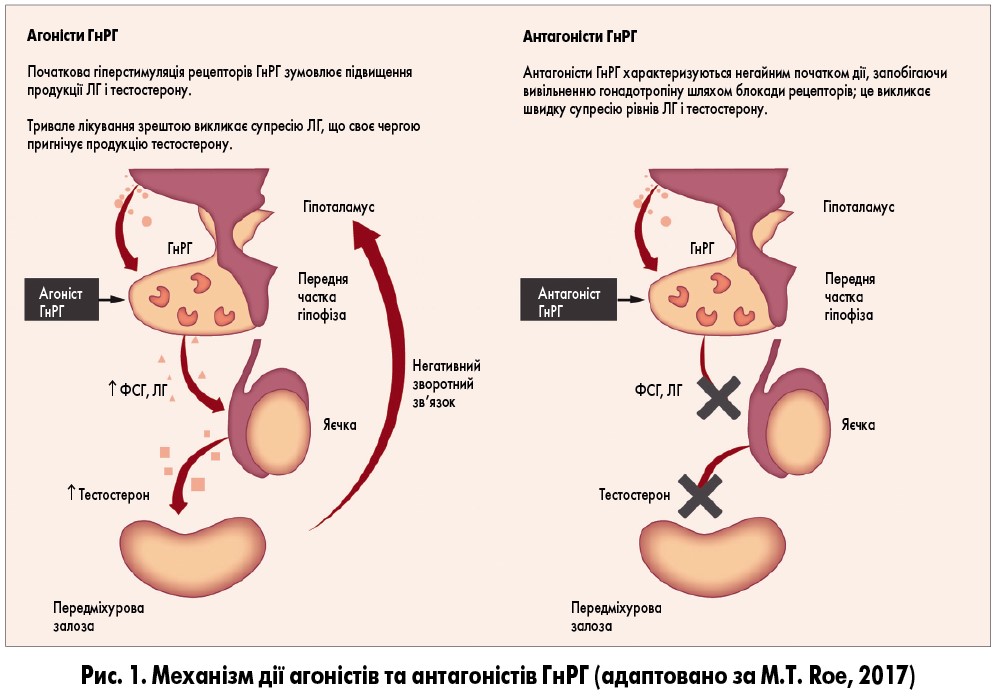
Некоторые эффекты эстрогенов не могут быть объяснены наличием ядерных ЭРа и ЭРр и предполагают существование дополнительных форм. Например, нельзя объяснить способность эстрогенов регулировать работу многих генов, не проявляющих свой эффект через ERE. Р. J. Kushner и со- авт. [57] показали, что ЭР не только связывают ERE в целевых генах для того, чтобы подключить коактиваторный комплекс коинтегративного белка р160, который передает стимуляцию транскрипции, но могут активировать транскрипцию через активационные белковые места, которые связывают Jun/Fos-транскрипционные факторы через активацию белка-1 (АР-1) [57]. Как объяснить механизмы, которые лежат в основе быстрых эффектов эстрогенов, проявляющиеся в секунды или минуты? Это несопоставимо с прямой транскрипционной модуляцией через классический внутриядерный рецепторный процесс, длительность которого значительно больше, чем секунды или минуты. Например, введение альдостерона вызывает экспрессию первого гена через час [16]. С другой стороны, быстрый эффект эстрогенов можно объяснить наличием мембранно-связанного эстрогенного рецептора (3Ps), который может связываться с факторами роста и таким путем косвенно ведет к регуляции генов и транскрипционных факторов.
Например, введение альдостерона вызывает экспрессию первого гена через час [16]. С другой стороны, быстрый эффект эстрогенов можно объяснить наличием мембранно-связанного эстрогенного рецептора (3Ps), который может связываться с факторами роста и таким путем косвенно ведет к регуляции генов и транскрипционных факторов.
Существование мембранно-связанных 3Ps было предметом обсуждения и дискуссий, начиная с 1977 г., когда R. Pietras и С. Szego [83] описали рецепторные места для эстрогенов на внешней поверхности изолированных эндометриальных клеток. В настоящее время уже выделены и охарактеризованы 3Ps в нервных и других целевых структурах [60, 86, 87]. Возможно, что как ядерные, так и мембраносвязанные 3Ps образуются в одних и тех же генах и в результате транскрипции. Однако такая точка зрения маловероятна, ввиду того что мембранно-связанные ЭР исследованы только на изолированных клетках, а не в физиологических условиях [101]. Чувствительность этих клеток к эстрадиолу характеризуется высоким коэффициентом эстрогенного связывания (кД 1,8 нМ).
Показано, что рецепторы плазменных мембран в нейронах локализованы главным образом в определенных кавернозоподобных плазменных мембранах микродомена — CLMs [50]. Они обнаружены также на плазменных мембранах большинства типов клеток, отличных от нейронов. В отличие от кавернозных CLM экспрессируют белок мембраны флотилии [18, 27, 31, 32] значительно быстрее, чем белок кавеолин, синтезирующийся в кавернах, экспрессия которых в мозге ограничивается астроцитами и микроглией. Кавернозоподобные микродомены, подобно кавернозным, обогащены холестерином, глюкозолипидами, сфингомиелином и липидоподобными белками и используются в сигнальной трансдукции и перемещении липиды— белки. Некоторые белки сконцентрированы в малых кавернах, например классические мембранные рецепторы эстрадиола а и р и их варианты [48]; рецептор тирозинкиназы, нейротропин, инсулин, эпидермальный фактор роста; слабосвязывающий нейротропиновый рецептор р75; hsp90; SRS семейства тирозинкиназы С; небольшой адаптивный белок She и Grb2; сигнальные трансдукторные молекулы, такие как члены МАРК-каскада (митогенак- тивирующей протеинкиназы), аденициклаза, про- теинкиназа А, протеинкиназа С и др. В целом можно предположить, что кавернозноподобные и кавернозные домены служат функциональными сигнальными молекулами компартментализации (отделения), модуляции и интеграции сигнальных событий на поверхности клеток [4, 77].
В целом можно предположить, что кавернозноподобные и кавернозные домены служат функциональными сигнальными молекулами компартментализации (отделения), модуляции и интеграции сигнальных событий на поверхности клеток [4, 77].
Новые мембранные рецепторы эстрадиола
Несмотря на имеющиеся доказательства того, что передающие ЭРа и ЭРр могут также вести себя как рецепторы мембран плазмы, есть доказательства существования новых мембранных рецепторов, которые не являются ни ЭРа, ни ЭРр [48, 50], ни G-белоксвязанными рецепторами [51—54, 73], не связаны с классическими ядерными ЭР, отличаются структурно и проявляют специфические свойства связывания, тирозиноподобную активность, как и рецептор ростового фактора [55].
Информация о наличии новых ЭР не является новой, и их идентификация основана главным образом, на функциональных ответах на эстрадиол, модуляции активности Са2+— и К+-каналов и активности различных трансдукторных путей. S. Das и соавт. [37] показали, что эффект катехолэстрогенов (4-гидроксиэстрадиол) на экспрессию лактоферрина матки не только передается потенциально новыми ЭР, но и что антиэстроген ICI 182, 780 блокирует этот эффект, но не в ЭРа нокаутированной ткани, после шока ЭР [44].
Стероидные гормоны также действуют как транскрипционные факторы и посредством взаимодействия с мембранными рецепторами — через изменение активности внутриклеточных сигнальных систем, и некоторые из этих мембранных рецепторов являются производными тех же генов, которые выполняют транскрипционные рецепторные факторы [48, 74, 77, 100].
Лигандонезависимая активация
Каждый рецептор стероидных гормонов часто имеет более чем одно название, например эстро- ген/эстрадиоловый рецептор, прогестин/прогесте- роновый рецептор. Это определяется связыванием и активацией каждого класса стероидных гормонов. Фактически ядерные рецепторы определяются как прогестин- и эстрогенные рецепторы суперсемейства транскрипционных факторов. Считается, что связывание стероидных гормонов является одним из многочисленных путей, благодаря которому эти стероидгормональные рецепторы активируются. В 1991 г. R. Power и соавт. [84] обнаружили, что овальбумин цыпленка является промоторным, прогестиновым и эстрогеновым рецептором и мог бы активироваться in vitro за счет активации допа- минрецептора. Процесс, благодаря которому допамин и другие соединения активируют рецепторы стероидных гормонов через вторичные мессенд- жерные пути, обозначают как лигандонезависимая активация.
Процесс, благодаря которому допамин и другие соединения активируют рецепторы стероидных гормонов через вторичные мессенд- жерные пути, обозначают как лигандонезависимая активация.
И прогестин-, и эстрогеновые рецепторы в различных типах клеток могут активироваться этими альтернативными, негормональными путями. В работах, выполненных в условиях in vitro и на периферических тканях, основное внимание было сфокусировано на активации эстрогенных рецепторов ростовыми факторами, такими как эпидермальный ростовой фактор и инсулиноподобный ростовой фактор (ИРФ-1). Однако лигандонезависимая активация является общей чертой рецепторов стероидных гормонов, и это доказано путем все возрастающего списка ростовых факторов, активирующих один или два вида рецепторов в различных типах клеток и тканей. Кроме факторов роста, в эту группу можно включить белковые и пептидные гормоны: инсулин [62], гонадотропин-рилизинг- гормон [38], агонисты нейтротрансмиттеров — Д1/ Д5-допаминергические агонисты [84] — и активаторы особых внутриклеточных сигнальных путей, таких, как протеинкиназа С [52, 80], протеинкина- за А [6, 89], митогенактивируемая протеинкиназа (МАРК) [55], фосфатидилинозитол-3-киназа [68], циклинзависимая киназа [30]. Важно отметить, что лигандонезависимая активация есть процесс, который наблюдается in vivo в физиологических условиях [8, 25, 33, 55, 66]. По-видимому, имеются различные молекулярные механизмы, благодаря которым происходит лигандонезависимая активация рецепторов стероидных гормонов. Например, фосфорилирование Seri 18 на ЭРа за счет МАРК ведет к увеличению транскрипционной активности [53]. Вероятно, фосфорилирование Ser236, который регулирует димеризацию рецептора, может также активировать некоторые из этих внутриклеточных сигнальных путей [35, 104, 108]. Более того, фосфорилирование активационной функции (АР-1) на ЭРр может пополнить коактиватор стероидного гормона—коактиватора-1 (SRC-1) — в рецепторе эстрогена [99]. Аналогично, транскрипционная активность прогестинового рецептора может быть увеличена путем активации коактиватора [11, 88] и снижения взаимодействия с ядерным корепрессо- ром.
Важно отметить, что лигандонезависимая активация есть процесс, который наблюдается in vivo в физиологических условиях [8, 25, 33, 55, 66]. По-видимому, имеются различные молекулярные механизмы, благодаря которым происходит лигандонезависимая активация рецепторов стероидных гормонов. Например, фосфорилирование Seri 18 на ЭРа за счет МАРК ведет к увеличению транскрипционной активности [53]. Вероятно, фосфорилирование Ser236, который регулирует димеризацию рецептора, может также активировать некоторые из этих внутриклеточных сигнальных путей [35, 104, 108]. Более того, фосфорилирование активационной функции (АР-1) на ЭРр может пополнить коактиватор стероидного гормона—коактиватора-1 (SRC-1) — в рецепторе эстрогена [99]. Аналогично, транскрипционная активность прогестинового рецептора может быть увеличена путем активации коактиватора [11, 88] и снижения взаимодействия с ядерным корепрессо- ром.
зз
Лигандонезависимая активация рецепторов прогестина в нервной ткани
У самок крыс и других грызунов сексуальная чувствительность формируется в ходе эстрального цикла за счет последовательного выделения эстрадиола вслед за прогестероном. При этом оба гормона влияют на специфические области мозга [49, 64, 65]. Аналогичным образом оптимальный уровень сексуальной чувствительности у овариэктоми- рованных крыс зависит от действия прогестерона после воздействия определенной концентрацией эстрадиола. При исследовании клеточных механизмов этой регуляции с использованием антагонистов прогестерона [24, 26, 64] показана абсолютная необходимость рецепторов прогестинов для прогестеронстимулированного полового поведения у грызунов. Повышение уровня прогестиновых рецепторов приводит к увеличению половой активности животных, тогда как их снижение в различных модификациях — к гипочувствительности или полному отсутствию реакции на прогестерон [18, 23]. Таким образом, имеется доказательная база того, что внутриклеточные рецепторы прогестинов играют важную роль в медиации поведенческих эффектов прогестерона.
При этом оба гормона влияют на специфические области мозга [49, 64, 65]. Аналогичным образом оптимальный уровень сексуальной чувствительности у овариэктоми- рованных крыс зависит от действия прогестерона после воздействия определенной концентрацией эстрадиола. При исследовании клеточных механизмов этой регуляции с использованием антагонистов прогестерона [24, 26, 64] показана абсолютная необходимость рецепторов прогестинов для прогестеронстимулированного полового поведения у грызунов. Повышение уровня прогестиновых рецепторов приводит к увеличению половой активности животных, тогда как их снижение в различных модификациях — к гипочувствительности или полному отсутствию реакции на прогестерон [18, 23]. Таким образом, имеется доказательная база того, что внутриклеточные рецепторы прогестинов играют важную роль в медиации поведенческих эффектов прогестерона.
Различные агонисты нейротрансмиттеров могут заменять влияние прогестерона в активации полового поведения, например, введение Д1, ДЗ специфических агонистов допаминового рецептора в структуре мозга вызывает активацию полового поведения у мышей, предварительно получавших Е [65, 94]. В основе этого эффекта лежит лигандонезависимая активация прогестиновых рецепторов. Разрушение гена прогестинового рецептора у мышей [66] блокирует стимулирующий эффект этого гормона или допаминового агониста и доказывает, что активация полового поведения за счет введения допамина включает лигандонезависимое увеличение прогестиновых рецепторов в структурах мозга. Аналогичный эффект гонадолиберина [17], простагландинов и оксида азота [66] также осуществляется через прогестин-рецепторно-зависимые механизмы, за счет их активации, с вовлечением в этот процесс протеинкиназы А и протеинкиназы G. Эффект многих физиологически активных соединений через вторичную систему мессенджеров на половое поведение впервые был показан Р. Whalen и соавт. [105], через циклическую ГМФ и цАМФ С. Beyer и соавт. [17]. В дальнейшем эти факты были подтверждены в отношении прогестиновых рецепторов в общем сигнальном пути [25]. Более того, дофамин и цАМФ также могут активировать прогестиновые рецепторы. Таким образом, формирование полового поведения осуществляется как за счет прогестерона, так и лигандонезависимой активации [9, 66].
В основе этого эффекта лежит лигандонезависимая активация прогестиновых рецепторов. Разрушение гена прогестинового рецептора у мышей [66] блокирует стимулирующий эффект этого гормона или допаминового агониста и доказывает, что активация полового поведения за счет введения допамина включает лигандонезависимое увеличение прогестиновых рецепторов в структурах мозга. Аналогичный эффект гонадолиберина [17], простагландинов и оксида азота [66] также осуществляется через прогестин-рецепторно-зависимые механизмы, за счет их активации, с вовлечением в этот процесс протеинкиназы А и протеинкиназы G. Эффект многих физиологически активных соединений через вторичную систему мессенджеров на половое поведение впервые был показан Р. Whalen и соавт. [105], через циклическую ГМФ и цАМФ С. Beyer и соавт. [17]. В дальнейшем эти факты были подтверждены в отношении прогестиновых рецепторов в общем сигнальном пути [25]. Более того, дофамин и цАМФ также могут активировать прогестиновые рецепторы. Таким образом, формирование полового поведения осуществляется как за счет прогестерона, так и лигандонезависимой активации [9, 66].
Лигандонезависимая активация прогестиновых рецепторов играет важную роль в регуляции женского полового поведения за счет афферентных путей в момент спаривания. Если же овариэктомиро- ванных крыс, получавших эстрадиол, подсаживали к самцам на 15 мин, а затем отсаживали, их половая активность была повышена в течение нескольких часов, т. е. ответ не зависит от секреции прогестерона яичниками или надпочечниками [3]. Обработка антагонистами прогестинов перед подсадкой к самцу полностью устраняет этот ответ [8]. Эти данные позволяют предположить, что внешняя стимуляция (например, спаривание) усиливает половое поведение за счет лигандонезависимой активации прогестиновых рецепторов. Более того, можно предположить, что, кроме активации нейротрансмиттерными агонистами, нейрональные прогестиновые рецепторы могут подвергаться лигандонезависимой активации физиологическими стимуляциями.
Интересно, что нейрональная экспрессия начального белка в ответ на генитальную стимуляцию также блокировалась антагонистами прогестерона [23, 47], позволяя тем самым предположить, что в некоторых нейронах, содержащих прогестиновые рецепторы, ответы непосредственных ранних генов на афферентный вход осуществляются за счет лигандонезависимой активации прогестиновых рецепторов.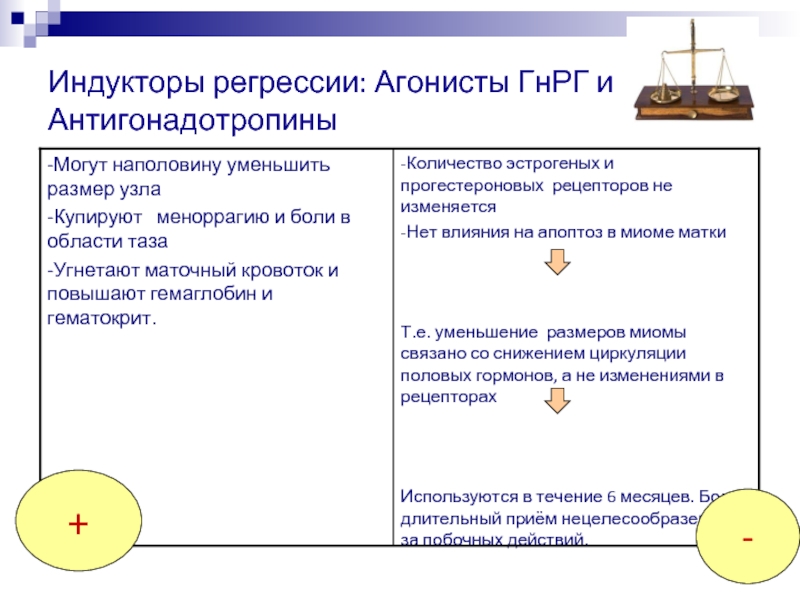
Лигандонезависимая активация нейрональных прогестиновых рецепторов отмечена не только во время стимуляции полового поведения, но и в период регуляции овуляции в ходе цикла у крыс и мышей [59]. Блокада прогестиновых рецепторов и ингибиция их синтеза в антеро- и перивентрику- лярных областях тормозят эффекты эстрадиола на секрецию гонадолиберина [29, 59]. В этом случае афферентная стимуляция, которая активирует прогестиновые рецепторы, предполагает эндогенную циркадную, нервную последовательность для пре- овуляторного выброса гонадотропинов.
В связи с этим следует обратить внимание на наличие синтеза стероидных гормонов в мозге. Хорошо известно о синтезе прогестерона в нервной системе [90], а также о вероятности синтеза рецепторов прогестинов и возможной регуляторной роли в этом процессе эстрогенов [71].
Лигандонезависимая активация эстрогенных рецепторов в нервной ткани не ограничивается рецепторами прогестинов. Во многих типах тканей и клеток, включая мозг, эстрогенные рецепторы могут активироваться лигандонезависимым путем. В опытах на трансгенных мышах показано, что пик трансгенной экспрессии следовал за повышенным выбросом эстрадиола в стадии проэструса в матке, яичниках, гипоталамусе и печени. В других тканях (кости и некоторые структуры мозга) эстроген-ре- цепторзависимую экспрессию наблюдали в период, предшествующий увеличенной секреции эстрогенов. Антагонисты эстрогенов блокировали как эстрогеннезависимые трансгенные ответы, так и ответы, наблюдаемые в отсутствие эстрадиола, тем самым позволяя допустить мысль о том, что активация трансгена является эстроген-рецепторзави- симой, но не эстрогензависимой [33]. Можно предположить, что рецепторы эстрогенов, в том числе и в мозге, активируются за счет других факторов, нежели эстрадиол, подтверждая мысль о том, что путь лигандонезависимой активации может вызвать активацию других рецепторов.
В опытах на трансгенных мышах показано, что пик трансгенной экспрессии следовал за повышенным выбросом эстрадиола в стадии проэструса в матке, яичниках, гипоталамусе и печени. В других тканях (кости и некоторые структуры мозга) эстроген-ре- цепторзависимую экспрессию наблюдали в период, предшествующий увеличенной секреции эстрогенов. Антагонисты эстрогенов блокировали как эстрогеннезависимые трансгенные ответы, так и ответы, наблюдаемые в отсутствие эстрадиола, тем самым позволяя допустить мысль о том, что активация трансгена является эстроген-рецепторзави- симой, но не эстрогензависимой [33]. Можно предположить, что рецепторы эстрогенов, в том числе и в мозге, активируются за счет других факторов, нежели эстрадиол, подтверждая мысль о том, что путь лигандонезависимой активации может вызвать активацию других рецепторов.
Существует и другая ситуация, при которой лигандонезависимая активация стероидных рецепторов может рассматриваться в системе взаимодействия между найротрансмиттерами и/или ростовыми факторами и внутриклеточными рецепторами стероидных гормонов [28]. В серии исследований L. Garcia-Segura и соавт. [45, 81] показана роль эстрогенов в регуляции концентрации рецепторов для инсулинового ростового фактора (ИРФ) в некоторых областях мозга и что оба вида эстрадиоловых рецепторов коэкспрессируются с ИРФ в нейронах и/или глии во многих областях мозга. Влияние ИРФ на нейрогенез блокировали введением антагонистов эстрогенов или олигонуклеотидами, которые вызывают потерю чувствительности эстрогенных рецепторов [39]. Аналогично, нейродегенерация гипоталамических нейронов введением каиновой кислоты может быть предотвращена введением ИРФ или эстрадиола, тем самым подтверждая мысль о том, что эстрогенные рецепторы являются передатчиками эффекта ИРФ и могут рассматриваться как часть лигандонезависимой активации [69]. Другой ростовой фактор — эпидермальный фактор роста (ЭРФ) — активирует половое поведение в отсутствие эстрогенов [5], хотя нужны еще дополнительные исследования, которые бы помогли связать активацию эстрогенных рецепторов в мозге с усилением сексуальной активности.
В серии исследований L. Garcia-Segura и соавт. [45, 81] показана роль эстрогенов в регуляции концентрации рецепторов для инсулинового ростового фактора (ИРФ) в некоторых областях мозга и что оба вида эстрадиоловых рецепторов коэкспрессируются с ИРФ в нейронах и/или глии во многих областях мозга. Влияние ИРФ на нейрогенез блокировали введением антагонистов эстрогенов или олигонуклеотидами, которые вызывают потерю чувствительности эстрогенных рецепторов [39]. Аналогично, нейродегенерация гипоталамических нейронов введением каиновой кислоты может быть предотвращена введением ИРФ или эстрадиола, тем самым подтверждая мысль о том, что эстрогенные рецепторы являются передатчиками эффекта ИРФ и могут рассматриваться как часть лигандонезависимой активации [69]. Другой ростовой фактор — эпидермальный фактор роста (ЭРФ) — активирует половое поведение в отсутствие эстрогенов [5], хотя нужны еще дополнительные исследования, которые бы помогли связать активацию эстрогенных рецепторов в мозге с усилением сексуальной активности.
Регуляция концентрации стероидных рецепторов за счет афферентных и эфферентных влияний
Известно, что отдельные нейротрансмиттеры и афферентные входы могут изменять концентрацию отдельных стероидов в различных областях мозга [25]. Например, норадренергические трансмиттеры регулируют концентрацию прогестинов, эстрогенов [23], а мускариновые рецепторы определяют концентрацию эстрогенных рецепторов [58]. Удаление обонятельных луковиц увеличивает концентрацию эстрогенных рецепторов в амигдале, перерезка некоторых афферентов в гипоталамусе увеличивает концентрацию эстрогеновых рецепторов в гипоталамусе. Изменение социальных условий влияет на количество рецепторов в преоптической области самок [34]. Подсадка помета матери увеличивает концентрацию эстрогенных рецепторов в некоторых нейроанатомических областях мозга [41]. Очень мало известно о клеточных механизмах, благодаря которым осуществляется регуляция рецепторов стероидных гормонов в каждой из этих ситуаций.
Имеются данные о том, что концентрация андрогенных рецепторов в некоторых спинальных мотонейронах зависит от активности эфферентной нервной системы, например, аксотомия или блокада аксонального транспорта в нейронах спинальных ядер — бульбокавернозис — снижает концентрацию андрогенных рецепторов в ядрах [3]. Вышеприведенные данные свидетельствуют о том, что в ряде ситуаций афферентные входы регулируют концентрацию нейрональных стероидных гормонов и подтверждают идею о влиянии нейротрансмиттеров на гормональную стероидную рецепцию [106].
Вышеприведенные данные свидетельствуют о том, что в ряде ситуаций афферентные входы регулируют концентрацию нейрональных стероидных гормонов и подтверждают идею о влиянии нейротрансмиттеров на гормональную стероидную рецепцию [106].
Передают ли рецепторы стероидных гормонов эффекты стероидных гормонов?
Тот факт, что во многих ситуациях нейротрансмиттеры и внешние стимулы регулируют концентрацию рецепторов стероидных гормонов и многие внутриклеточные сигнальные пути способны активировать рецепторы стероидных гормонов, позволяет предположить, что нейротрансмиттеры или внешние факторы стимулируют транскрипционную активность нейрональных стероидных гормонов в ряде физиологических ситуаций.
Является ли активация рецепторов к половым гормонам стимулирующим сигналом для выброса гормона во время овуляции у рефлекторно-овули- рующих животных, как необходим нейрональный сигнал для секреции гонадотропин-рилизинг-гор- мона у спонтанно-овулирующих животных [57, 75]? Имеет ли место активация рецепторов стероидных гормонов под влиянием различных нейротрансмиттеров дофамина [61], лежащая в основе гормоннезависимой индукции материнского поведения? Очень часто нейроэндокринный ответ связывают с рецепторами эстрогенов [61]. Является ли устойчивым андрогензависимое копуляторное поведение после кастрации? Устойчива ли лигандонезависимая активация рецепторов стероидных гормонов под влиянием социальных стимулов? Будут ли другие ответные реакции, например системные, в которых нейрональные эстроген- или прогестиновые рецепторы опосредуют эффекты эстрогенов или прогестинов, регулироваться или нейротрансмиттерами, или стимулами окружающей среды?
Является ли устойчивым андрогензависимое копуляторное поведение после кастрации? Устойчива ли лигандонезависимая активация рецепторов стероидных гормонов под влиянием социальных стимулов? Будут ли другие ответные реакции, например системные, в которых нейрональные эстроген- или прогестиновые рецепторы опосредуют эффекты эстрогенов или прогестинов, регулироваться или нейротрансмиттерами, или стимулами окружающей среды?
Возможное влияние рецепторов стероидных гормонов на расстройства половой системы (агрессивное поведение, депрессию и умственные способности) является ограниченной ситуацией, где мы можем рассматривать потенциальное влияние нейротрансмиттеров и других факторов на лиган- донезависимую стероидрецепторную активацию. Об этом свидетельствуют данные, когда введение ингибитора допамингидроксилазы увеличивает
концентрацию как прогестиновых, так и эстрогенных рецепторов [19, 20], связанных с ядрами клеток. Тесная связь рецепторов с ядрами может рассматриваться как аналог активации. Вначале этому трудно было поверить, так как этот факт отмечен без лиганда. Возможно, что повышенный уровень дофамина в гипоталамусе [21] является вторичным по отношению к торможению синтеза норэпинефрина и активирует рецепторы стероидных гормонов лигандонезависимым способом.
Вначале этому трудно было поверить, так как этот факт отмечен без лиганда. Возможно, что повышенный уровень дофамина в гипоталамусе [21] является вторичным по отношению к торможению синтеза норэпинефрина и активирует рецепторы стероидных гормонов лигандонезависимым способом.
В ближайшее время, когда исследователи будут думать о рецепторах стероидных гормонов как о транскрипционных регуляторах, которые работают только с лигандами, будут обнаружены новые трансмиттеры и стимуляторы окружающей среды, которые активируют их.
Возникает вопрос: если рецепторы стероидных гормонов активируются за счет циркулирующих гормонов, то почему они активируются за счет афферентных входов от нейротрансмиттеров и других факторов? Ответ таков: это может происходить как из адаптивной, так и из эволюционной перспективы. Адаптационный процесс имеет место в случае негормональных факторов-нейротрансмиттеров — для тонкой настройки и, возможно, в особых случаях, когда происходит экспрессия особых стероидных рецепторов, зависимых от нейрональных и поведенческих ответов, например при спаривании, когда у самцов повышается сексуальная чувствительность. Н. Escriva и соавт. [42] показали, что ядерные (транскрипционные факторы) рецепторы приобрели свои лигандосвязывающие способности в ходе эволюции. В этом нет ничего удивительного — рецепторы активируются множественными путями, и только один из них связывает родственный лиганд. Первыми у позвоночных обнаружены рецепторы к эстрогенам, а затем к прогестинам. Потеря чувствительности к антиэстрогенам (ICI), так же как и блокада транскрипции и трансляции, является особенностью влияния эстрогенов на мембранные рецепторы нервных и ненервных целевых тканей, которые не связываются с классическими ЭР [26]. Другие исследования подтверждают наличие новых, антиэстрогеннечувствительных мембранных ЭР при быстром и так называемом негеномном пути действия на мозг [22, 66]. Например, 17-эстрадиолвызванная потенциация каинатвыз- ванного тока может быть блокирована антиэстро- геном ICI 182.780 в изолированных гипокампаль- ных катехоламнергических нейронах как интактных, так и нокаутированных мышей (ERKO) [67].
Н. Escriva и соавт. [42] показали, что ядерные (транскрипционные факторы) рецепторы приобрели свои лигандосвязывающие способности в ходе эволюции. В этом нет ничего удивительного — рецепторы активируются множественными путями, и только один из них связывает родственный лиганд. Первыми у позвоночных обнаружены рецепторы к эстрогенам, а затем к прогестинам. Потеря чувствительности к антиэстрогенам (ICI), так же как и блокада транскрипции и трансляции, является особенностью влияния эстрогенов на мембранные рецепторы нервных и ненервных целевых тканей, которые не связываются с классическими ЭР [26]. Другие исследования подтверждают наличие новых, антиэстрогеннечувствительных мембранных ЭР при быстром и так называемом негеномном пути действия на мозг [22, 66]. Например, 17-эстрадиолвызванная потенциация каинатвыз- ванного тока может быть блокирована антиэстро- геном ICI 182.780 в изолированных гипокампаль- ных катехоламнергических нейронах как интактных, так и нокаутированных мышей (ERKO) [67]. Аналогично, высокосвязывающие эстрогенные места в р-клетках поджелудочной железы и 17а- и 17р-эстрадиолактивация семейства МАРК, нокаутированные рецепторы в неокортикальных эксплантатах не блокировались антиэстрогенным препаратом [22]. Возникает вопрос: неспособность блокировать антиэстрогенным препаратом — результат неспецифичного мембранного эффекта или особенность новых рецепторов плазмы? Более того, блокада антиэстрогенами не может быть универсальным ответом классических мембранных ЭР. Когда антиэстроген снижал экспрессию ЭРа в семенниках крыс и их эфферентных протоках, он не влиял на тестикулярные ЭРр [6]. С другой стороны, было показано, что эстрогенная активация цАМР и эстрогенопосредованная нейропротекция против р-амилоидной токсичности были полностью блокированы антиэстрогеном [17]. Можно предположить, что эти процессы осуществляются через ЭР-механизм и в обоих случаях клеточные линии были переданы через ЭРа и ЭРр, которые могли быть специфично блокированы антиэстрогенным препаратом.
Аналогично, высокосвязывающие эстрогенные места в р-клетках поджелудочной железы и 17а- и 17р-эстрадиолактивация семейства МАРК, нокаутированные рецепторы в неокортикальных эксплантатах не блокировались антиэстрогенным препаратом [22]. Возникает вопрос: неспособность блокировать антиэстрогенным препаратом — результат неспецифичного мембранного эффекта или особенность новых рецепторов плазмы? Более того, блокада антиэстрогенами не может быть универсальным ответом классических мембранных ЭР. Когда антиэстроген снижал экспрессию ЭРа в семенниках крыс и их эфферентных протоках, он не влиял на тестикулярные ЭРр [6]. С другой стороны, было показано, что эстрогенная активация цАМР и эстрогенопосредованная нейропротекция против р-амилоидной токсичности были полностью блокированы антиэстрогеном [17]. Можно предположить, что эти процессы осуществляются через ЭР-механизм и в обоих случаях клеточные линии были переданы через ЭРа и ЭРр, которые могли быть специфично блокированы антиэстрогенным препаратом.
Вновь обнаруженные рецепторы (ЭР-Х)
В дополнение к имеющемуся комплексу ЭР недавно был идентифицирован новый, уникальный плазменно-мембранно-связывающий родственный ЭР, который не является ни ЭРа, ни ЭРр. Он и был обозначен как ЭР-Х [96]. ЭР-Х участвует в регуляции онтогенеза и преобладает в чистых CLMs неокортикальной плазменной мембраны и у 7-дневных мышей линии aERKO [78].
Его недавно идентифицировали в неокортексе, гипоталамусе, мозжечке и легких у плодов обезьян. Мол. масса ЭР-Х 62—63 кД — у крыс, мышей и обезьян отличается от мол. массы ЭРа (67 кД) и ЭРр (54—60 и 64 кД). ЭР-Х с мол. массой 62 кД выявлены у неполовозрелых животных, тогда как ЭР-Х с мол. массой 64 кД — у взрослых. ЭР-Х связывает эстрадиол, меченный Н-3, с очень высоким сродством, но со связывающими свойствами и лигандной специфичностью, совершенно отличной от ЭРа. Однако ЭРа и ЭР-Х могут быть идентифицированы одними и теми же антителами к ЭРа LBD, хотя и в различной концентрации. .
ЭР-Х есть рецептор, который передает активность 17а- и 17р-эстрадиола на МАРК-нокаутиро- ванные неокортикальные эксплантаты в онтогенезе, тогда как ЭРа- и ЭРр-селективные лиганды не повышают активацию МАРК-нокаутированных. Несмотря на то что и 17а-, и 17р-эстрадиолы связывают ЭР-Х, 17а-эстрадиол, по-видимому, является эндогенным лигандом ЭР-Х и активирует систему МАРК-нокаутированных. Значительно более высокий уровень 17р-эстрадиола необходим для активации неокортекса. Многие характеристики ЭР-Х полностью отличаются от характеристик рецепторов аир. Например, ассоциация ЭР-Х с hsp90 является абсолютно необходимой для активации эстрадиолом системы МАРК-нокаут [92], и наоборот, связь с hsp90 необходимо сохранить ЭРа в неактивном состоянии [14, 82]. В исследованиях Jr. Setalo [92] показано, что ЭР-Х имеет черты G-npo- теинсвязанного рецептора. Все вышеприведенные данные позволяют предположить, что ЭР-Х не является альтернативным слайсинговым вариантом ЭРа и ЭРр, а может быть новым геном.
Несмотря на то что и 17а-, и 17р-эстрадиолы связывают ЭР-Х, 17а-эстрадиол, по-видимому, является эндогенным лигандом ЭР-Х и активирует систему МАРК-нокаутированных. Значительно более высокий уровень 17р-эстрадиола необходим для активации неокортекса. Многие характеристики ЭР-Х полностью отличаются от характеристик рецепторов аир. Например, ассоциация ЭР-Х с hsp90 является абсолютно необходимой для активации эстрадиолом системы МАРК-нокаут [92], и наоборот, связь с hsp90 необходимо сохранить ЭРа в неактивном состоянии [14, 82]. В исследованиях Jr. Setalo [92] показано, что ЭР-Х имеет черты G-npo- теинсвязанного рецептора. Все вышеприведенные данные позволяют предположить, что ЭР-Х не является альтернативным слайсинговым вариантом ЭРа и ЭРр, а может быть новым геном.
Другие мембранные эстрогенрецепторные белки
Другие родственные эстрогенсвязывающие белки были идентифицированы в мозге. Они включают идентификацию ЭР с мол. массой 112—116 кД в коре головного мозга взрослых особей, уровень которых меняется с возрастом или под действием гормональных препаратов, но какую они выполняют функцию, неизвестно [7].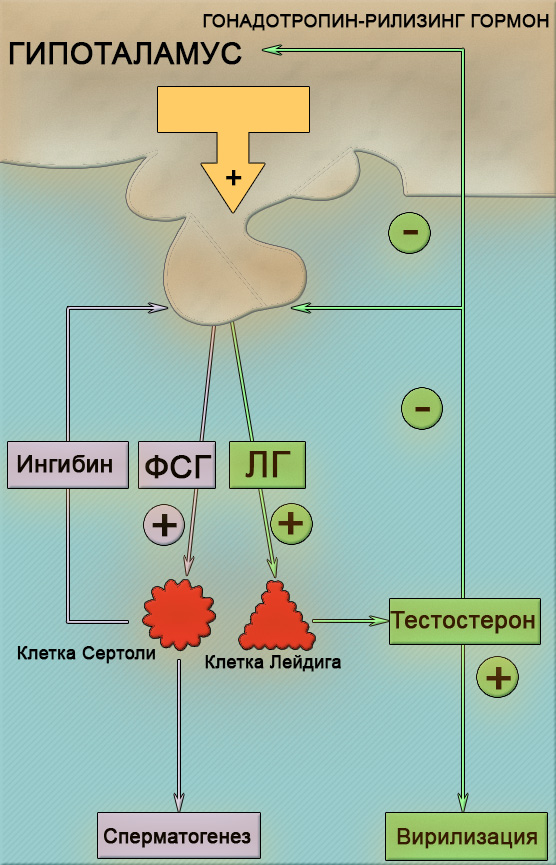 V. Ramirez и соавт. [85] идентифицировали три типа связывающих белков на мембране: 1) белок с мол. массой 37 кД с 100% гомологичностыо с глицеральдегид-3-фос- фатдегидрогеназой |51]; 2) белок с мол. массой 55 кД, идентифицированный как [3-тубулин, связывание которого полностью вытеснялось 17р-эстра- диолом в концентрации 10-7 М [85]; 3) белок с мол. массой 23 кД, идентифицированный как олигому- цинчувствительный белок [107]. Роль их в эстро- генмедиации неизвестна. Кроме того, был идентифицирован амилокислотный продукт с мол. массой 46 кД такой же длины, как ЭРа, в плазменной мембране, цитозоле, ядрах ненервных клеток [7] и, возможно, в мозге. Эти белки модулируют мембранопусковые эффекты эстрогенов, включая эндотелиальный синтез окиси азота более активно, чем ЭРа.
V. Ramirez и соавт. [85] идентифицировали три типа связывающих белков на мембране: 1) белок с мол. массой 37 кД с 100% гомологичностыо с глицеральдегид-3-фос- фатдегидрогеназой |51]; 2) белок с мол. массой 55 кД, идентифицированный как [3-тубулин, связывание которого полностью вытеснялось 17р-эстра- диолом в концентрации 10-7 М [85]; 3) белок с мол. массой 23 кД, идентифицированный как олигому- цинчувствительный белок [107]. Роль их в эстро- генмедиации неизвестна. Кроме того, был идентифицирован амилокислотный продукт с мол. массой 46 кД такой же длины, как ЭРа, в плазменной мембране, цитозоле, ядрах ненервных клеток [7] и, возможно, в мозге. Эти белки модулируют мембранопусковые эффекты эстрогенов, включая эндотелиальный синтез окиси азота более активно, чем ЭРа.
Недавно в мозге и других тканях был идентифицирован гетеродимергический эстрогенсвязываю- щий белок, названный как родственный ЭР (pER), с мол. массой 81—84 кД [97]. Он был локализован на плазменных и ядерных мембранах некоторых клеток. Он связывает 17р-эстрадиол, но не связывает другие натуральные стероиды, синтетические эстрогены или антиэстрогены. Иммунореактивно pER не определяются в репродуктивных органах, за исключением яичников, но определяются в мозге, мышцах, сосудах, сетчатке, опухолях молочной железы.
Он связывает 17р-эстрадиол, но не связывает другие натуральные стероиды, синтетические эстрогены или антиэстрогены. Иммунореактивно pER не определяются в репродуктивных органах, за исключением яичников, но определяются в мозге, мышцах, сосудах, сетчатке, опухолях молочной железы.
Световая микроскопия и структурная локализация мембранных рецепторов
Специфическое связывание эстрогенов в мембране плазмы мозга впервые было показано на мембране синапсов [23]. В дальнейшем, в многочисленных исследованиях на гиппокампе и гипоталамусе, были подтверждены плазменная и цитозольная локализация ЭРа иммунологически как в световом, так и в электронном микроскопировании [23, 72, 98, 102, 103]. ЭРа-меченые профили были обнаружены в неми ел инизиро ванных нейронах, аксональных терминалях, содержащих многочисленные небольшие синаптические везикулы, дендритные шипики и астроглиальные окончания. В дендритных шипиках основная часть ЭРа реактивности была обнаружена в цитоплазматических областях головки шипика и интерпретировалась как эстрадиоловые рецепторы а плазменной мембраны [23, 72, 98].
Заключение
Природа включения рецепторов в быстрое действие эстрогенов остается малоизученной. Возможно, имеются различные дополнительные мембранные рецепторы к эстрогенам в мозге, не связанные с ЭРа и ЭРр, аналогичные катехоламинер- гическим рецепторам р-клеток поджелудочной железы [74] и мембранным рецепторам спермы с мол. массой 29 кД [98]. Это связано с тем, что, помимо хорошо установленного организационного влияния и активационного действия на репродуктивную нейроэндокринную функцию, эстрогены проявляют разнообразное действие на познавательные функции, механизмы боли, тонкие двигательные функции, создание хорошего настроения, регуляцию температуры и сна. Эстрогены проявляют нейропротекторное действие при болезни Паркинсона и Альцгеймера, множественном склерозе, депрессии, шизофрении, инсульте.
Дополнительные мембранные рецепторы в нервных тканях могут варьировать в различных областях мозга, клеточных фенотипах [40], стадиях развития мозга. Возможно, придется пересмотреть взгляды на механизм действия эстрогенов в ходе онтогенеза в эстрогенчувствительных тканях, отличный от действия только через ЭРа и ЭРр.
1. Бабичев В. Н. // Успехи физиол. наук. — 2005. — Т. 36, № 1. — С. 54-67.
2. Розен В. Б., Смирнов А. Н. Рецепторы и стероидные гормоны. — М., 1981.
3. Shamma H. A., Arnold A. P. // Proc. Natl. Acad. Sci. USA. -1997. — Vol. 94. — P. 1521-1526.
4. Anderson R. G. // Annu. Rev. Biochem. — 1998. — Vol. 67. — P. 199-225.
5. Apostolakis E. M. et al. // Mol. Endocrinol. — 2000. — Vol. 14. — P. 1086-1098.
6. Aronica S. M. et al. // Mol. Endocrinol. — 1993. — Vol. 7. — P. 743-752.
Endocrinol. — 1993. — Vol. 7. — P. 743-752.
7. Asaithambi A., Mukherjee S., Thakur M. K. // Biochem. Biophys. Res. Commun. — 1997. — Vol. 231. — P. 683-685.
8. Auger A. P., Moffatt C. A., Blaustein J. D. // Endocrinology. — 1997. — Vol. 138. — P. 511-514.
9. Auger A. P., LaRiccia L. M., Moffatt C. A., Blaustein J. D. // Horm. Behav. — 2000. — Vol. 37. — P. 135-144.
10. Azcoitia I., Sierra A., Garcia-Segura L. M. // J. Neurosci. Res. -1999. — Vol. 58. — P. 815-822.
11. Bai W. L. et al. // J. Biol. Chem. — 1997. — Vol. 272. — P. 10457-10463.
12. Baldi E. et al. // Mol. Cell Endocrinol. — 2000. — Vol. 161. -P. 31-35.
Baldi E. et al. // Mol. Cell Endocrinol. — 2000. — Vol. 161. -P. 31-35.
13. Baulieu E. E. // J. A. M. A. — 1975. — Vol. 234. — P. 404- 409.
14. Beato M. // Cell. — 1989. — Vol. 56. — P. 335-344.
15. Behl С. // Nat. Rev. Neurosci. — 2002. — Vol. 3. — P. 433- 442.
16. Benten W. P. et al. // Endocrinology. — 2001. — Vol. 142. — P. 1669-1677.
17. Beyer C., Pawlak J., Karolczak M. // J. Neurochem. — 2003. -Vol. 87. — P. 545-550.
18. Bickel P. E. et al. // J. Biol. Chem. — 1997. — Vol. 272. — P. 13793-13802.
Chem. — 1997. — Vol. 272. — P. 13793-13802.
19. Blaustein J. D. // Neuroendocrinology. — 1986. — Vol. 42. — P. 44-50.
20. Blaustein J. D. //Brain Res. — 1986. — Vol. 325. — P. 89- 98.
21. Blaustein J. D., Braun T. J., McElroy J. F. // Neuroendocrinology. — 1986. — Vol. 43. — P. 143-149.
22. Blaustein J. D., Olster D. H. // Advances in Comparative and Environmental Physiology. Molecular and Cellular Bases of Social Behavior in Vertebrates / Ed. J. Balthazart. — Berlin, 1989.-Vol. 3.-P. 31-104.
23. Blaustein J. D. // Endocrinology. — 1992. — Vol. 31. — P. 1336-1342.
31. — P. 1336-1342.
24. Blaustein J. D., Greco B. // J. Neuroendocrinol. — 2002. — Vol. 14.-P. 109-115.
25. Blaustein J. D. // Endocrinology. — 2004. — Vol. 145, N 3. — P. 1075-1081.
26. Brown N. J., Braustein J. D. // Brain Res. — 1984. — Vol. 301. -P. 343-349.
27. Cameron P. L., Ruffin J. W., Bollag R. et al. // J. Neurosci. — 1997. — Vol. 17. — P. 9520-9535.
28. Cardona-Gomez G P., Mendez P., DonCarlos et al // J. Steroid Biochem. Mol. Biol. — 2003. — Vol. 83. — P. 211-217.
29. Chappell P. E., Levine J. E. // Endocrinology. — 2000. — Vol. 141. — P. 1477-1485.
Chappell P. E., Levine J. E. // Endocrinology. — 2000. — Vol. 141. — P. 1477-1485.
30. Cenni В., Picard D. // Trends Endocrinol. Metab. — 1999. — Vol. 10. — P. 41-46.
31. Chen D. S., Pace P. E, Combes R. C., Ali S. // Mol. Cell Biol. -1999. — Vol. 19. — P. 1002-1015.
32. Chu Н. P., Morales J. С, Etgen А. М. // J. Neuroendocrinol. -1999. — Vol. 11. — P. 107-113.
33. Ciana P. et al. // Nat. Med. — 2003. — Vol. 19. — P. 82-86.
34. Cohen-Parsons M., Carter С. S. // Physiol. Behav. — 1988. — Vol. 42. — P. 191-197.
35. Coleman K. M., Smith С. L. // Front Biosci. — 2001. — Vol. 6. — P. D1379-D1391.
Coleman K. M., Smith С. L. // Front Biosci. — 2001. — Vol. 6. — P. D1379-D1391.
36. Cowley S. M., Hoare S., Mosselman S., Parker M. G. // J. Biol. Chem.- 1997. -Vol. 272. — P. 19858-19862.
37. Das S. K. et al. // Proc. Natl. Acad. Sci USA. — 1997. — Vol. 94. — P. 12786-12791.
38. Demay F. et al. // Endocrinology. — 1001. — Vol. 142. — P. 3340-3347.
39. Duenas M., Torres-Aleman I., Naftolin F., Garcia-Segura L. M. // Neurosciene. — 1996. — Vol. 74. — P. 531-539.
40. Dupont S. et al. // Development. — 2000. — Vol. 127. — P. 4277-4291.
41. Ehret G., Buckenmaier J. // J. Physiol. — 1994. — Vol. 88. — P. 315-329.
Ehret G., Buckenmaier J. // J. Physiol. — 1994. — Vol. 88. — P. 315-329.
42. Escriva.H., Delaunay F., Laudet V. // Bioessays. — 2000. — Vol. 22. — P. 717′-727.
43. Evans R. M. // Science. — 1988. — Vol. 240. — P. 889-895.
44. Fitzpatrick J. L. et al. // J. Neurochem. — 2002. — Vol. 82. — P. 674-682.
45. Garcia-Segura L. M., Azcoitia I., Don Carlos L. L. // Progr. Neurobiol. — 2001. — Vol. 63. — P. 29-60.
46. Gorski J., Toft D., Shyamala G. et al. // Recent Prog. Horm. Res. — 1968. — Vol. 24. — P. 45-80.
47. Greengard P., Allen P. В., Nairm A. C. // Neuron. — 1999. — Vol. 23. — P. 435-447.
Greengard P., Allen P. В., Nairm A. C. // Neuron. — 1999. — Vol. 23. — P. 435-447.
48. Gu Q., Korach K. S., Moss R. L. // Endocrinology. — 1999. — Vol. 140. — P. 660-666.
49. Hawkins M. D. et al. // Proc. Natl. Acad. Sci. USA. — 2000. -Vol. 97. — P. 10751-10756.
50. Huang С. S. et al. // J. Biol. Chem. — 1999. — Vol. 274. — P. 36707-36714.
51. Joe /., Ramirez V. D. // Steroids. — 2001. — Vol. 66. — P. 529-538.
52. Joel P. В., Traish A. M., Lannigan D. А. // Mol. Endocrinol. -1995. — Vol. 9. — P. 1041-1052.
53. Kato S. et al. // Genes Cells. — 2000. — Vol. 5. — P. 593- 601.
Kato S. et al. // Genes Cells. — 2000. — Vol. 5. — P. 593- 601.
54. Kelly M. J., Levin E. R. // Trends Endocrinol. Metab. — 2001. -Vol. 12. — P. 152-156.
55. Klotz D. M. et al. // J. Biol. Chem. — 2002. — Vol. 277. — P. 8531-8537.
56. Kuiper G. G. et al. // Endocrinology. — 1997. — Vol. 138. — P. 863-870.
57. Kushner P. J. et al. // J. Steroid Biochem. Mol. Biol. — 2000. -Vol. 74. -P. 311-317.
58. Lauber A., Whalen R. E. f/ Brain Res. — 1988. — Vol. 443. — P. 21-26.
59. Levin E. R. // Steroids. — 2002. — Vol. 67. — P. 471-475.
Levin E. R. // Steroids. — 2002. — Vol. 67. — P. 471-475.
60. Lindberg M. K. et al. // Mol. Endocrinol. — 2003. — Vol. 17. -P. 203-208.
61. Lonstein J. S. et al. // Brai Res. — 2003. — Vol. 970. — P. 149-158.
62. Ma Z. Q. et al. // Mol. Endocrinol. — 1994. — Vol. 8. — P. 910-918.
63. McEwen B. S. // Recent Prog. Horm. Res. — 2002. — Vol. 57. -P. 357-384.
64. Manl S. К. et al. // Science. — 1994. — Vol. 265. — P. 1246- 1249.
65. Mani S. K. et al. // Proc. Natl. Acad. Sci. USA. — 1994. — Vol. 91. — P. 6468-6472.
Acad. Sci. USA. — 1994. — Vol. 91. — P. 6468-6472.
66. Mani S. K., Blaustein J. D., O’Malley B. W. //I Horm. Behav. -1997. — Vol. 31. — P. 244-255.
67. Manl S. K., O’Malley B. W. // Hormones. Brain and Behav Eds D. W. Pfaff et al. — Amsterdam, 2002. — Vol. 3. — . P. 643-682.
68. Martin M. B. et al. // Endocrinology. — 2000. — Vol. 141. — P. 4503-4511.
69. Mendes P., Azcoitia J., Garcia-Segura L. M. // Brain Res. Mol. -2003. — Vol. 112. — P. 170-176.
70. Mermelstein P. G., Becker J. В., Surmeier D. J. // J. Neurosci. -1996. — Vol. 16. — P. 595-604. 38
38
71. Micevych P. et al. // Neuroendocrinology. — 2003. — Vol. 78. -P. 29-35.
72. Milner T. A. et al. // J. Соmр. Neurol. 2001. — Vol. 429. — P. 355-371.
73. Moss R. L, Gu Q. //I Steroids. — 1999. — Vol. 64. — P. 14- 21.
74. Nodal A. et al. // Proc. Natl. Acad. Sci. USA. — 2000. — Vol. 97.-P. 11603-11608.
75. Malley B. W. // Steroids. — 1995. — Vol. 60. — P. 490- 498.
76. Oiu J. et al. // J. Neurosci. — 2003. — Vol. 23. — P. 9529- 9540.
77. Okamoto T. et al. // J. Biol. Chem. — 1998. — Vol. 273. — P. 5419-5422.
Okamoto T. et al. // J. Biol. Chem. — 1998. — Vol. 273. — P. 5419-5422.
78. Okivera C. A. et al. // Reprod. Biol. Endocrinol. — 2003. — Vol. 1. — P. 75.
79. Parker M. G. // Vitam. Horm. — 1995. — Vol. 23. — P. 267- 287.
80. Patrone С. et al. // Mol. Endocrinol. — 1996. — Vol. 10. — P. 499-507.
81. Perez-Martin M. et al. // Eur. J. Neurosci. — 2003. — Vol. 18. -P. 923-930.
82. Picard D. et al. // Nature. — 1990. — Vol. 348. — P. 1666- 1688.
83. Pietras R. J. , Szego С. М. // Nature. — 1977. — Vol. 265. — P. 69-72.
, Szego С. М. // Nature. — 1977. — Vol. 265. — P. 69-72.
84. Power R. F. et al. // Science. — 1991. — Vol. 254. — P. 1636-1639.
85. Ramirez V. D., Kipp J. L., Joe I. // Brain Res. Rev. — 2001. — Vol. 37. — P. 141-152.
86. Razandi M., Pedram A., Greene G. L., Levin E. R. // Mol. Endocrinol. — 1999. — Vol. 13. — P. 307-319.
87. Razandi M. et al. // Mol. Endocrinol. — 2002. — Vol. 16. — P. 100-115.
88. Rowan B. G, Garrison N., Weigel N. L, O’Malley B. W. // Mol. Cell. Biol. — 2000. — Vol. 20. — P. 8720-8730.
89. Schreihofer D. A., Resnick E. M., Lin V. Y, Shupnik M. A. // Endocrinology. — 2001. — Vol. 142. — P. 3361-3368.
Schreihofer D. A., Resnick E. M., Lin V. Y, Shupnik M. A. // Endocrinology. — 2001. — Vol. 142. — P. 3361-3368.
90. Schumacher M. et al. // J. Neurocytol. — 2000. — Vol. 29. — P. 307-326.
91. Segars J. H., Driggers P. H. // Trends Endocrinol. Metab. — 2002. — Vol. 13. — P. 349-354. ‘
92. Setalo Jr. G., Singh M., Guan X, Toran-Allerand C. D. // J. Neurobiol. — 2002. — Vol. 50. — P. 1-12.
93. Sherwin B. B. // Endocr. Rev. — 2003. — Vol. 24. — P. 133- 151.
94. Singh M. et al. // J. Neurosci. — 2000. — Vol.20. — P. 1694-1700.
95. Sukovich D. A., Mukherjee R., Menfeld P. A. // Mol. Cell. Biol. -1994. — Vol. 14. — P. 7134-7143.
Sukovich D. A., Mukherjee R., Menfeld P. A. // Mol. Cell. Biol. -1994. — Vol. 14. — P. 7134-7143.
96. Toran-Allerand C. D. et al. // J. Neurosci. — 2002. — Vol. 22. -P. 8391-8401.
97. Taran-Allerand С D. // Endocrinology. — 2004. — Vol. 145. -P. 1068-1074.
98. Towart L. A. et al. // J. Сотр. Neurol. — 2003. — Vol. 463. -P. 390-401.
99. Tremblay G. В., Tremblay A., Labrie F, Gugiere V. // Cancer Res. — 1998. — Vol. 58. — P. 877-881.
100. Vasudevan N., Kow L. M., Pfaff D. W. // Proc. Natl. Acad. Sci. USA. — 2001. — Vol. 98. — P. 12267-12271.
101. Wade С. В., Dorsa D. M. // Endocrinology. — 2003. — Vol. 144. — P. 832-838.
Wade С. В., Dorsa D. M. // Endocrinology. — 2003. — Vol. 144. — P. 832-838.
102. Watson C. S., Cambell С H., Gametchu B. //I Exp. Physiol. — 1999. — Vol. 84. — P. 1013-1022.
103. Watson С. S., Norflee A. M., Pappas T. S., Gametchu B. // Steroids. — 1999. — Vol. 64. — P. 5-13.
104. Weigel N. L, Zhang Y. X. // J. Mol. Med. — 1998. — Vol. 76. -P. 469-479.
105. Whalen R. E., Lauber A. N. // Neurosci. Biobehav. Rev. — 1986. — Vol. 10. — P. 47-53.
106. Yang L. Y, Arnold A. P. // Brain Res. — 2000. — Vol. 852. — P. 127-139.
107. Zheng J., Ramirez V. D. // J. Steroid Biochem. Mol. Biol. — 1999. — Vol. 68. — P. 65-75.
Zheng J., Ramirez V. D. // J. Steroid Biochem. Mol. Biol. — 1999. — Vol. 68. — P. 65-75.
108. Zwijsen R. M. L. et al. // Genes Dev. — 1998. — Vol. 12. — . P. 3488-3498.
Виды протоколов ЭКО | Полезное от клиники «Геном» в Ростове на Дону
Протокол ЭКО — это схема введения препаратов для стимуляции работы яичников в режиме сверх нормы, чтобы получить качественные яйцеклетки для оплодотворения. Это так называемая стимуляция суперовуляции.
Основными считаются ДВА вида протоколов ЭКО — короткий и длинный. Также, используются протоколы ЭКО с антагонистами.
Первый этап ЭКО определяет судьбу протокола. Если, в результате стимуляции суперовуляции, будут получены качественные яйцеклетки, то шанс на получение беременности в итоге программы ЭКО возрастает.Квалификация и опыт репродуктологов «Геном» позволяют разрабатывать индивидуальные схемы стимуляции суперовуляции, которые позволяют получить адекватный ответ яичников у женщин как «до», так и «после» 35 лет, а также у пациенток с низким фолликулярным запасом, при наличии таких заболеваниях как эндометриоз, миома матки, кисты яичников.
Основа любой схемы стимуляции суперовуляции – гонадотропины. Это препараты, которые содержат гормоны ФСГ (фолликулостимулирующий) или ЛГ (лютеинизирующий).
Некоторые содержат только один ФСГ — например, «Гонал» и «Пурегон», а некоторые — комбинации ЛГ и ФСГ, например, «Менопур». Для предупреждения преждевременной овуляции используют агонисты или антагонисты гонадотропин-рилизинг гормона (ГнРГ).Агонисты ГнРГ обладают схожим действием с ГнРГ. При ежедневном введении они раздражают гипофиз, вызывая чрезмерную выработку гормонов ЛГ и ФСГ. В результате, гипофиз прекращает вырабатывать собственные гормоны, наступает состояние, похожее на климакс.
 Это даёт врачу возможность полностью «руководить» дальнейшим процессом стимуляции.
Это даёт врачу возможность полностью «руководить» дальнейшим процессом стимуляции.Агонисты ГнРГ применяются иногда в качестве триггера овуляции – это снижает риск такого осложнения, как гиперстимуляция яичников.
Антагонисты ГнРГ действуют противоположно ГнРГ. Они подавляют секрецию гормонов гипофиза сильнее агонистов, но, при этом, активность гипофиза после прекращения их приема восстанавливается быстрее. Дополнительные преимущества антагонистов перед агонистами:— возможно сокращение длительности стимуляции на 1-2 дня,
— рост фолликулов происходит быстрее,
— требуется меньшая доза препаратов (снижается гормональная нагрузка),
— качество эмбрионов и, следовательно, шанс на имплантацию и наступление беременности выше.
Основные виды схем стимуляции (протоколов) ЭКО:
1) «Короткий» с агонистами ГнРГ
Короткий протокол оправдывает своё название тем, что проводится в одном менструальном цикле. Здесь меньше медикаментозная нагрузка на организм женщины и риск возникновения СГЯ, но есть вероятность спонтанной овуляции. Яйцеклетки созревают неравномерно, поэтому, их может быть недостаточно или они будут ненадлежащего качества.
Яйцеклетки созревают неравномерно, поэтому, их может быть недостаточно или они будут ненадлежащего качества.
2) «Длинный» с агонистами ГнРГ
Длинный протокол захватывает 2 цикла и может длиться до 50 дней. Начинается он с регулирующей фазы (обычно на 21 день цикла), в результате чего происходит полная остановка выработки собственных гормонов. Далее, вводятся искусственные гормоны по схеме, назначенной репродуктологом. При этом, процесс полностью «подвластен» специалисту, риск самопроизвольной овуляции сведён к нулю. В итоге, как правило, получают достаточное количество зрелых яйцеклеток.
При длинной схеме протокола ЭКО есть вероятность наступления синдрома гиперстимуляции яичников (СГЯ), но врачи «Геном» умеют прогнозировать ситуацию. Поэтому, все необходимые меры против возможных осложнений принимаются заранее.
Гиперстимуляция яичников является результатом роста большого количества фолликулов. Их стенки активно продуцируют эстрогены, избыточный уровень этих гормонов в крови приводит к соответствующим реакциям — сгущению крови, появлению жидкости в полостях (грудной, брюшной).3) Протоколы с антагонистами могут применяться для женщин разного возраста, при различных формах бесплодия. Репродуктологи отмечают, что частота наступления беременности в них выше, при этом гормональную нагрузку можно свести к минимуму. Поэтому, такие программы ЭКО применяются всё чаще.Лёгкая форма СГЯ, которая неизбежна в некоторых ситуациях, не нарушает общего состояния. Пациентка может ощущать дискомфорт в области живота, лёгкое недомогание. Эти симптомы достаточно быстро корректируется без каких либо серьёзных последствий для здоровья.
Репродуктология: от науки к практике.Как определить наилучший вариант лечения?
В апреле этого года в Киеве прошел Международный симпозиум по вопросам репродуктивной медицины «От науки к практике», организаторами которого выступили Министерство здравоохранения Украины, Буковинский государственный медицинский университет и Украинская ассоциация репродуктивной медицины (УАРМ).
Научный симпозиум «Как определить наилучший вариант лечения?» компании «Мерк Сероно» открыл вице-президент УАРМ В.Д. Зукин. Он обратился ко всем присутствующим с приветственным словом и отметил, что у отечественных специалистов есть прекрасная возможность ознакомиться с новейшими научными тенденциями и практическим опытом ведущих зарубежных ученых в области репродуктологии.
Профессор Рене Фридман, советник министра науки и здравоохранения Франции, руководитель отделения гинекологии, акушерства и репродуктивной медицины больницы Антуана Беклера выступил с докладом «Что мы знаем о фолликулогенезе?».
Как известно, фолликулогенезом называется этапное развитие фолликулов от примордиальных через стадии первичных и вторичных до третичных (преовуляторных) фолликулов, или граафовых пузырьков. Фолликулогенез возникает в период полового созревания и продолжается до наступления менопаузы.
В организме человека этот процесс начинается с того момента, когда несколько фолликулов выходят из резервного пула (инициация), а его кульминацией является формирование одного доминантного фолликула в каждом менструальном цикле (МЦ).
Фолликулогенез включает 4 фазы (рис. 1):
1. Инициацию.
2. Ранний рост фолликулов.
3. Селекцию из доступного пула фолликулов.
4. Созревание преовуляторного фолликула.
Для того чтобы новые растущие фолликулы достигли преантральной стадии (0,15 мм), требуется несколько месяцев. Еще через 70 дней преовуляторный фолликул достигает размера 2 мм.
Следует учитывать, что до момента, когда возникает потребность вмешательства в процессы фолликулогенеза (стимуляция яичников), проходит несколько месяцев. И до этого момента развивающиеся фолликулы имеют «свою историю».
Процессы инициации и раннего роста фолликулов
Ранний рост фолликула регулируется тонким взаимодействием между фолликулостимулирующим гормоном (ФСГ) и местными факторами, продуцируемыми клетками теки, гранулезной оболочки и ооцитом. На данный момент это является новейшим открытием. Щелевидные соединения (GAP junctions) между ооцитом и клетками гранулезы, которые образуются посредством двух коннексинов (Сх43 и Сх47), имеют фундаментальное значение в период базального фолликулярного роста. Если эти два соединения не экспрессируются в ооцитах, рост фолликулов замедляется и даже останавливается. Кроме влияния ооцита на клетки гранулезы и в меньшей степени теки, наблюдается и обратный процесс, а именно влияние факторов гранулезы на ооцит. Одним из таких факторов, ответственным за формирование примордиальных фолликулов и взаимодействие ооцита и клеток гранулезы, является так называемый kit-ligand (KL) – фактор роста стволовых клеток. Конечно же, немаловажным является наличие определенных рецепторов и антимюллерова гормона (АМГ). В последние годы также определена роль ооцита в процессах активации фолликулогенеза. Механизмы, которые отвечают за выход фолликулов из состояния покоя и определяют начало их роста и дифференцировки в фазе инициации, осуществляются посредством двух факторов ооцитов, таких как фактор роста и дифференцировки 9 (Growth differenciation factor, GDF-9) и морфогенетический протеин кости (Bone morphogenetic protein, ВMP 15).
На данный момент это является новейшим открытием. Щелевидные соединения (GAP junctions) между ооцитом и клетками гранулезы, которые образуются посредством двух коннексинов (Сх43 и Сх47), имеют фундаментальное значение в период базального фолликулярного роста. Если эти два соединения не экспрессируются в ооцитах, рост фолликулов замедляется и даже останавливается. Кроме влияния ооцита на клетки гранулезы и в меньшей степени теки, наблюдается и обратный процесс, а именно влияние факторов гранулезы на ооцит. Одним из таких факторов, ответственным за формирование примордиальных фолликулов и взаимодействие ооцита и клеток гранулезы, является так называемый kit-ligand (KL) – фактор роста стволовых клеток. Конечно же, немаловажным является наличие определенных рецепторов и антимюллерова гормона (АМГ). В последние годы также определена роль ооцита в процессах активации фолликулогенеза. Механизмы, которые отвечают за выход фолликулов из состояния покоя и определяют начало их роста и дифференцировки в фазе инициации, осуществляются посредством двух факторов ооцитов, таких как фактор роста и дифференцировки 9 (Growth differenciation factor, GDF-9) и морфогенетический протеин кости (Bone morphogenetic protein, ВMP 15). Так, мыши, мутантные по CDF-9 -/-, страдают гипергонадотропным гипогонадизмом. У гомозиготных овец с инактивированным ВMP 15 наблюдается бесплодие. При наличии врожденного блефарофимоза в сочетании с бесплодием была доказана недостаточность ВMP 15.
Так, мыши, мутантные по CDF-9 -/-, страдают гипергонадотропным гипогонадизмом. У гомозиготных овец с инактивированным ВMP 15 наблюдается бесплодие. При наличии врожденного блефарофимоза в сочетании с бесплодием была доказана недостаточность ВMP 15.
Тонкий механизм взаимодействия ооцита и окружающих клеток гранулезы в процессе фолликулогенеза был недавно описан. Прегранулезные клетки выделяют KL и фактор, ингибирующий лейкемию (Leukemia inhibitory factor, LIF), которые способствуют фолликулярному развитию ооцита. У человека ингибиция рецептора KL приводит к атрезии фолликула.
Кроме того, на сегодняшний день имеется достаточное количество данных о роли АМГ в процессе фолликулогенеза. Исследования in vitro показали, что АМГ блокирует выход примордиальных фолликулов из состояния покоя и является антагонистом факторов, стимулирующих этот процесс (KL и BMP 15). К ингибирующим факторам также относят транскрипционный фактор Foxo 3 и регуляторный белок фосфатидилинозитол-3-киназа (PTEN). При недостаточности/отсутствии вышеперечисленных субстанций у мышей развивается преждевременная недостаточность яичников. На начальной фазе фолликулогенеза в качестве ингибитора могут выступать также и андрогены.
При недостаточности/отсутствии вышеперечисленных субстанций у мышей развивается преждевременная недостаточность яичников. На начальной фазе фолликулогенеза в качестве ингибитора могут выступать также и андрогены.
Часто репродуктологи задаются вопросом: почему у молодых женщин, имеющих множество фолликулов, их созревание происходит по-разному? Суть в том, что существует определенный баланс между активирующими и деактивирующими этот процесс факторами. Иногда преобладают процессы торможения. Важнейшее значение имеет биосинтез эстрадиола из андрогенов в яичниках. В некоторых клинических случаях, для того чтобы улучшить изначально неудовлетворительную реакцию яичника на стимуляцию, в течение определенного периода времени можно использовать именно андрогены. Существует мнение, что на преантральной стадии развития фолликула процессы фолликулогенеза не зависят от влияния гонадотропинов. В то же время учеными доказано присутствие рецепторов лютеинизирующего гормона (ЛГ) и ФСГ уже на стадии преантрального фолликула, что ставит под сомнение предыдущее утверждение.
Известно, что при введении ФСГ в конце фолликулиновой фазы реакция яичников будет улучшаться, а в ходе развития фолликулов не возникнет атрезии ооцитов. В течение МЦ (особенно в ранней фолликулиновой фазе) вышедшие из состояния покоя фолликулы растут очень быстро, при этом в фолликулярной жидкости уже присутствует эстрадиол. Именно это предопределяет реакцию яичников на стимулирование при помощи ФСГ. В то же время синтез данного гормона на этот момент находится на низком уровне. В середине фолликулиновой фазы влияние эстрогена достаточно выражено, что обусловлено выработкой прогестерона под действием ЛГ. Синтез всех этих необходимых веществ в организме человека на данном этапе является крайне интересным и важным для анализа процессом.
Селекция фолликула
При отборе фолликулов руководствуются следующими критериями:
- диаметр фолликула равен 5-8 мм;
- быстрый рост фолликулов под влиянием ФСГ;
- наличие ароматазы P450 (участвует в процессах преобразования гормонов) в гранулезных клетках.

Также важнейшая роль в процессе селекции фолликула отводится инсулиноподобному фактору роста (Insulin-like growth factor, IGF).
У всех млекопитающих фолликулы выходят из состояния покоя и входят в фазу роста, созревания и селекции доминантного фолликула. Момент прекращения функционирования яичников генетически детерминирован и зависит от величины первоначального овариального резерва и от скорости атрезии фолликулов, которая регулируется соотношением про- и антиапоптотических факторов. При этом вследствие апоптоза основная масса фолликулов редуцируется путем атрезии, происходящей на всех стадиях их развития. Известно, что отсутствие такого проапоптического фактора как Bax protein повышает фертильность и уменьшает связанные с возрастом негативные изменения в организме мышей-самок. Применение сфингозина 1-фосфата обеспечивает сохранение фертильности у облученных мышей.
С возрастом у женщины наблюдается преобладание процессов апоптоза и соответственно снижение овариального резерва. При этом неизвестно, в какой именно момент начнет снижаться фертильность и когда она исчезнет вообще.
При этом неизвестно, в какой именно момент начнет снижаться фертильность и когда она исчезнет вообще.
Актуальной является информация о двух исследованиях, результаты которых, наверное, могут изменить будущее. Группа исследователей во главе с J.L. Tilly (2004, 2006, 2009) уже не первый год детально изучает процессы фолликулогеназа. Полученные результаты позволяют сделать вывод, что количество фолликулов не ограничено только теми, которые имеются у девочек при рождении. Ученые считают, что процессы обновления в яичниках происходят даже в подростковом возрасте. Так, было установлено, что в яичниках мышей молодого и репродуктивного возраста содержатся большие овоидные клетки, напоминающие фетальные герминогенные клетки, располагающиеся в поверхностном эпителиальном слое. Эти весомые данные свидетельствуют в пользу пролиферации герминогенных клеток и образования фолликулов в яичниках мышей и в постнатальном периоде. В следующем исследовании этой же группы авторов было доказано, что яичники взрослых самок мышей способны производить сотни ооцитов, несмотря на небольшой пул премейотических герминальных клеток. Авторы считают, что стволовые клетки красного костного мозга могут мигрировать в яичник и участвовать в постнатальном оогенезе. В выводах ученых высказано предположение, что полученные данные, возможно, в корне изменят наше представление о фолликулярном резерве, и в будущем появится реальная возможность отсрочить время наступления менопаузы и/или преждевременного истощения яичников.
Авторы считают, что стволовые клетки красного костного мозга могут мигрировать в яичник и участвовать в постнатальном оогенезе. В выводах ученых высказано предположение, что полученные данные, возможно, в корне изменят наше представление о фолликулярном резерве, и в будущем появится реальная возможность отсрочить время наступления менопаузы и/или преждевременного истощения яичников.
В марте этого года вышла публикация, в которой представлены результаты нового успешного эксперимента группы ученых под руководством профессора J.L. Tilly. В ходе исследования в лабораторных условиях из стволовых клеток, взятых из яичника молодой женщины, были выращены яйцеклетки. Авторы выделили стволовые клетки яичников благодаря специфическому белку DDX4, покрывающему их поверхность. Затем в течение двух недель in vitro из стволовых клеток развились ооциты, после чего незрелые яйцеклетки были пересажены в кортикальную оболочку яичника человека и вживлены под кожу живой мыши. Там ооциты созрели и превратились в зрелые яйцеклетки, которые, как утверждают исследователи, по своим функциональным характеристикам ничем не отличаются от производимых в женском организме естественным путем. Таким образом, было доказано, что в яичнике взрослой женщины присутствуют стволовые клетки, из которых могут вырабатываться ооциты in vitro.
Таким образом, было доказано, что в яичнике взрослой женщины присутствуют стволовые клетки, из которых могут вырабатываться ооциты in vitro.
Имеются также результаты исследования A.J. Hsueh et. аl. (2010), которые у специалистов вызывают много вопросов. В них указано, что дозревание яйцеклеток можно обеспечить путем активации дремлющих фолликулов. Это означает, что если «отключить» ингибицию спящих фолликулов, начнется их активация и рост. Если стимулируя неактивные фолликулы, удастся «дойти» до стадии созревания, это станет важнейшим этапом и научным направлением в будущем. Откроются новые репродуктивные перспективы для женщин в возрасте и тех, у кого наблюдается плохая реакция на стимуляцию яичников. Краткосрочная активация «спящих» фолликулов в условиях in vitro позволяет активировать стволовые клетки, что способствует преодолению бесплодия у женщин. Также данное открытие, безусловно, найдет свое применение у пациенток с онкопатологией и желающих пройти процедуру криоконсервации яичников.
В конце своего выступления профессор отметил, что несмотря на имеющиеся научные достижения фолликулогенез до сих пор остается для ученых не до конца изученной тайной, однако в свете последних открытий появляются удивительные и многообещающие перспективы.
Доклад «Индивидуализация протоколов стимуляции» представил профессор Карло Альвиги, Центр по лечению бесплодия Неаполитанского университета им. Фридриха II, Италия.
В начале выступления докладчик поблагодарил компанию «Мерк Сероно» за представившуюся возможность выступить перед украинскими коллегами, при этом отметив, что в докладе будут рассмотрены существующие на сегодняшний день подходы к индивидуализации протоколов овариальной стимуляции (ОС).
Выбор конкретного протокола проводится с учетом следующих факторов: демографических, антропометрических (возраст, индекс массы тела [ИМТ], расовая принадлежность), базального уровня гормонов (ФСГ, ЛГ, эстрадиол), уровня физического здоровья, длительности бесплодия, характера питания, данных о ранее проведенных циклах ЭКО. Работая в этой сфере более 20 лет, автор доклада пришел к выводу, что подбор протокола ОС является в основном эмпирическим. Пациенткам с подобными характеристиками назначают одинаковый (один из трех) базовый протокол. При этом в основном учитываются только вышеперечисленные факторы. Когда же речь идет об индивидуализации протокола, то необходимо учесть следующее. Сохранение достигнутого уровня наступления беременности или повышение этого показателя сегодня должно сопровождаться оптимальным показателем стоимость/эффективность. Также следует особое внимание уделить побочным эффектам, в т.ч. многоплодной беременности и риску развития синдрома гиперстимуляции яичников (СГСЯ), частоту которых мы стремимся снизить. Кроме того, существует такая проблема, как неадекватная реакция яичников на ОС, которую также необходимо решать с учетом показателя стоимость/эффективность. Все вышеперечисленное, на наш взгляд, и обусловливает необходимость индивидуализации протоколов ОС.
Работая в этой сфере более 20 лет, автор доклада пришел к выводу, что подбор протокола ОС является в основном эмпирическим. Пациенткам с подобными характеристиками назначают одинаковый (один из трех) базовый протокол. При этом в основном учитываются только вышеперечисленные факторы. Когда же речь идет об индивидуализации протокола, то необходимо учесть следующее. Сохранение достигнутого уровня наступления беременности или повышение этого показателя сегодня должно сопровождаться оптимальным показателем стоимость/эффективность. Также следует особое внимание уделить побочным эффектам, в т.ч. многоплодной беременности и риску развития синдрома гиперстимуляции яичников (СГСЯ), частоту которых мы стремимся снизить. Кроме того, существует такая проблема, как неадекватная реакция яичников на ОС, которую также необходимо решать с учетом показателя стоимость/эффективность. Все вышеперечисленное, на наш взгляд, и обусловливает необходимость индивидуализации протоколов ОС.
В последние годы для выполнения этой задачи проводилось множество исследований, возникли различные направления, о которых хотелось бы рассказать. Так, в настоящее время репродуктологи осведомлены о существовании достаточно нового поколения маркеров, таких как АМГ, подсчет антральных фолликулов (ПАФ), полиморфизм гонадотропинов, АМГ и их рецепторов. Исходя из этого, предпринимаются попытки разделения пациенток на отдельные группы.
Так, в настоящее время репродуктологи осведомлены о существовании достаточно нового поколения маркеров, таких как АМГ, подсчет антральных фолликулов (ПАФ), полиморфизм гонадотропинов, АМГ и их рецепторов. Исходя из этого, предпринимаются попытки разделения пациенток на отдельные группы.
Необходимо напомнить о том, что некоторые биомаркеры, включая АМГ, изначально использовались для определения вероятности наступления беременности у конкретной женщины или хорошей ответной реакции яичников на стимуляцию. В последние годы АМГ рассматривался в качестве одного из критериев при принятии решения о тактике ведения пациентки. Возникает вопрос: можно ли подобрать оптимальный протокол ОС, руководствуясь уровнем АМГ?
Именно такой подход использовали Nelson et al. (2009) в исследовании, проводившемся в двух репродуктивных центрах Италии (рис. 2). Ученые провели стратификацию пациенток по уровню АМГ на три группы: с нормальным, очень низким и высоким уровнем этого гормона. В первом центре всем женщинам независимо от уровня АМГ проводили стимуляцию яичников на основе стандартного протокола с использованием рекомбинантного ФСГ. Во втором центре у пациенток с нормальным уровнем АМГ использовали стандартный длинный протокол с агонистами гонадотропин-рилизинг гормона (ГнРГ), а лицам с низким и высоким уровнем АМГ назначали антагонисты ГнРГ.
Во втором центре у пациенток с нормальным уровнем АМГ использовали стандартный длинный протокол с агонистами гонадотропин-рилизинг гормона (ГнРГ), а лицам с низким и высоким уровнем АМГ назначали антагонисты ГнРГ.
Анализируя полученные результаты, ученые пришли к выводу, что возможно у пациенток с нормальным уровнем АМГ оптимальным в плане стоимость/эффективность является стандартный длительный протокол с малой или средней дозой ФСГ. Для женщин с низким или высоким значением АМГ наилучшим вариантом будет использование антагонистов ГнРГ в комбинации с ФСГ в низкой или средней дозе. Если лицам со сниженным овариальным резервом назначать ФСГ в низких дозах, то в комбинации с антагонистами ГнРГ существенно снизится частота прерывания протокола вследствие развития СГСЯ. Следует учесть, что с повышением дозы ФСГ не всегда улучшается результат. При назначении женщинам с высоким уровнем АМГ антагонистов ГнРГ в комбинации с ФСГ в относительно низкой дозе (125-150 МЕ) отмечено достоверное снижение уровня госпитализаций вследствие развития СГСЯ. Таким образом, данное исследование впервые показало, что уровень АМГ может быть использован в качестве одного из критериев для выбора протокола стимуляции, а не только для оценки прогноза.
Таким образом, данное исследование впервые показало, что уровень АМГ может быть использован в качестве одного из критериев для выбора протокола стимуляции, а не только для оценки прогноза.
Еще одним примером такого подхода, но уже с использованием другого биомаркера, является показатель ПАФ. Вначале ПАФ проводили для прогнозирования ответной реакции яичника на стимуляцию и для определения вероятности наступления беременности. ПАФ использовали в комплексе с такими показателями, как ФСГ, возраст матери, ИМТ (алгоритм CONsistency in r-FSH Starting dOses for individualized tReatmenT, CONSORT). Далее рассчитывали начальную дозу ФСГ (Olivennes F. et al., 2008). Авторы этого исследования пришли к следующему выводу. Если подбирать начальную дозу ФСГ, исходя из вышеперечисленных параметров, то можно ожидать хороших результатов (повышение частоты наступления беременности) при назначении ФСГ в более низких дозах, нежели предполагалось ранее. В этом контексте показатель ПАФ выступает как функциональный маркер резерва яичника и используется для того, чтобы определить начальную дозу ФСГ.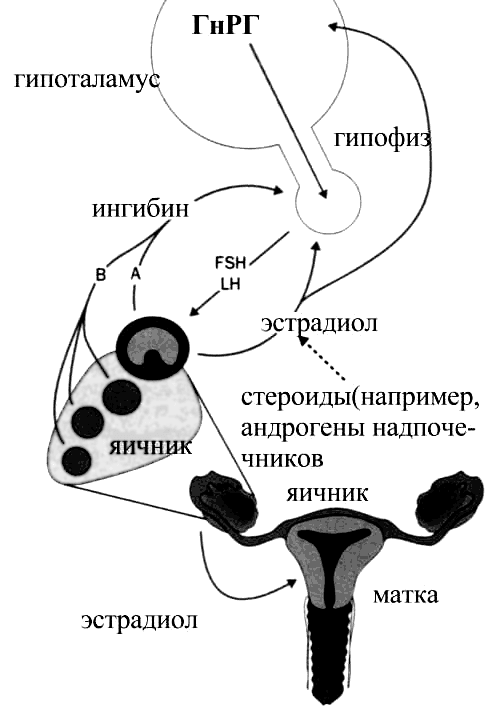 Таким образом, результаты этих двух исследований свидетельствуют о том, что при применении этих двух биомаркеров (АМГ и ПАФ) можно индивидуализировать протоколы ОС касательно улучшения показателя стоимость/эффективность.
Таким образом, результаты этих двух исследований свидетельствуют о том, что при применении этих двух биомаркеров (АМГ и ПАФ) можно индивидуализировать протоколы ОС касательно улучшения показателя стоимость/эффективность.
Обобщая вышеизложенное, отдельное внимание следует уделить особенностям фармакогеномного подхода. В течение последних лет было выдвинуто предположение о том, что некоторые генетические заболевания пациенток могут предопределять ответную реакцию яичника на введение экзогенного гонадотропина. Для подтверждения или отрицания данного предположения были проанализированы некоторые генетические маркеры (ген рецептора ФСГ (FSHR), АМГ и рецептора АМГ (AMH – AMHR2), метилентетрагидрофолатредуктазы (MTHFR), рецепторов эстрогенов (ER1, ER2), вариантного ЛГ (V-LH)) в контексте ответной реакции яичника на введение гонадотропинов.
Может ли определенный полиморфизм генов предопределять реакцию яичника на введение экзогенного гонадотропина? Хотелось бы подробнее остановиться на исследовании De Рlacidо et al. (2001), в котором изучали гипореактивность яичника на введение рекомбинантного ФСГ молодым женщинам с нормальным уровнем гонадотропинов. Однако при этом нужно четко понимать, что означает термин «недостаточная ответная реакция». Раньше в клинической практике при проведении контролированной ОС реакция считалась недостаточной или плохой, если количество полученных ооцитов было меньше 3-5 независимо от использованной дозы ФСГ. При этом в течение последних лет мы выделили конкретную группу пациенток с гипореактивностью яичника при введении ФСГ. На наш взгляд, это понятие отличное от так называемой плохой реакции. Как правило, пациентки с недостаточной реакцией яичника – молодые женщины с нормальным овариальным резервом и уровнем эндогенных гонадотропинов, АМГ и ПАФ. Однако при проведении стимуляции им требуется более высокая доза гонадотропина или более длительный протокол ОС, нежели предполагалось ранее. Потому мы считаем, что у них имеет место гипосенситивность к ФСГ, т.е. устойчивость яичника к воздействию экзогенного гонадотропина.
(2001), в котором изучали гипореактивность яичника на введение рекомбинантного ФСГ молодым женщинам с нормальным уровнем гонадотропинов. Однако при этом нужно четко понимать, что означает термин «недостаточная ответная реакция». Раньше в клинической практике при проведении контролированной ОС реакция считалась недостаточной или плохой, если количество полученных ооцитов было меньше 3-5 независимо от использованной дозы ФСГ. При этом в течение последних лет мы выделили конкретную группу пациенток с гипореактивностью яичника при введении ФСГ. На наш взгляд, это понятие отличное от так называемой плохой реакции. Как правило, пациентки с недостаточной реакцией яичника – молодые женщины с нормальным овариальным резервом и уровнем эндогенных гонадотропинов, АМГ и ПАФ. Однако при проведении стимуляции им требуется более высокая доза гонадотропина или более длительный протокол ОС, нежели предполагалось ранее. Потому мы считаем, что у них имеет место гипосенситивность к ФСГ, т.е. устойчивость яичника к воздействию экзогенного гонадотропина. Поэтому эти пациентки нуждаются в ином подходе. Прежде считалось, что у них просто имеет место замедленная реакция. Однако все зависит от характеристик фолликулов. В этой ситуации в начале стимуляции наблюдается замедленный рост фолликулов, а уровень эстрадиола не повышается, как ожидалось. Это вынуждает повышать начальную дозу ФСГ в ходе стимуляции. Например, если начинать с дозы ФСГ 150 МЕ у молодой женщины с нормальными показателями, то вероятно через 10-11 сут суммарная доза составит 1500 МЕ ФСГ. Однако иногда приходится повышать дозу и продлевать стимуляцию. В итоге для достижения результата пациентка получает ФСГ в дозе более 2000, а иногда 3000 МЕ.
Поэтому эти пациентки нуждаются в ином подходе. Прежде считалось, что у них просто имеет место замедленная реакция. Однако все зависит от характеристик фолликулов. В этой ситуации в начале стимуляции наблюдается замедленный рост фолликулов, а уровень эстрадиола не повышается, как ожидалось. Это вынуждает повышать начальную дозу ФСГ в ходе стимуляции. Например, если начинать с дозы ФСГ 150 МЕ у молодой женщины с нормальными показателями, то вероятно через 10-11 сут суммарная доза составит 1500 МЕ ФСГ. Однако иногда приходится повышать дозу и продлевать стимуляцию. В итоге для достижения результата пациентка получает ФСГ в дозе более 2000, а иногда 3000 МЕ.
Для объяснения подобного феномена были выдвинуты гипотезы о низком уровне (активности) эндогенного ЛГ и неадекватного ответа на введение ФСГ. Более детальный анализ показал, что если реакция яичника в ходе стимуляции понижена, то при дополнительном назначении ЛГ, как бы «в нагрузку», у многих из этих пациенток улучшается рост фолликулов (их количество не увеличивается). Поэтому добавление ЛГ в ходе стимуляции оказывает лучший эффект, нежели просто повышение дозы ФСГ. Все это позволяет сделать вывод о том, что у таких пациенток может быть недостаточным уровень собственного биоактивного ЛГ при том, что все базовые показатели гонадотропинов находятся в норме. Данный феномен можно объяснить следующим образом: у таких пациенток уровень собственного биоактивного ЛГ снижен, но на течении спонтанного (физиологического) МЦ это особым образом не сказывается. Однако в стрессовой ситуации (ОС), когда происходит рост множества фолликулов, собственного биоактивного ЛГ оказывается недостаточно.
Поэтому добавление ЛГ в ходе стимуляции оказывает лучший эффект, нежели просто повышение дозы ФСГ. Все это позволяет сделать вывод о том, что у таких пациенток может быть недостаточным уровень собственного биоактивного ЛГ при том, что все базовые показатели гонадотропинов находятся в норме. Данный феномен можно объяснить следующим образом: у таких пациенток уровень собственного биоактивного ЛГ снижен, но на течении спонтанного (физиологического) МЦ это особым образом не сказывается. Однако в стрессовой ситуации (ОС), когда происходит рост множества фолликулов, собственного биоактивного ЛГ оказывается недостаточно.
Сегодня доказано существование менее биологически активного варианта ЛГ – VbЛГ, который с высокой вероятностью ассоциируется со слабым ответом яичника на ФСГ в процессе стимуляции. Это обусловливает назначение ФСГ в более высоких дозах и более длительных протоколов стимуляции. В Италии распространенность такого полиморфизма составляет 13-14%, на севере Европы – до 30%. Состояние гетерозиготы по этому варианту связано с необходимостью повышения дозы ФСГ в протоколе ОС. Пациенткам, гомозиготным по этому варианту, требуются самые высокие дозы ФСГ. Таким образом, если заранее известно о наличии данного полиморфизма, следует начинать стимуляцию с изначально высокой дозы ФСГ и дополнять схему протокола введением ЛГ.
Состояние гетерозиготы по этому варианту связано с необходимостью повышения дозы ФСГ в протоколе ОС. Пациенткам, гомозиготным по этому варианту, требуются самые высокие дозы ФСГ. Таким образом, если заранее известно о наличии данного полиморфизма, следует начинать стимуляцию с изначально высокой дозы ФСГ и дополнять схему протокола введением ЛГ.
Существует еще одна ситуация, когда при проведении ОС требуется повышенная доза ФСГ. Это обусловлено полиморфизмом генов рецепторов ФСГ (генотип FSH-R: Ser680). Необходимо отметить, что данная мутация присутствует у 25% пациенток. В результате исследования было доказано, что такие женщины нуждаются в более высокой дозе ФСГ в ходе стимуляции (точно так же, как и при наличии VbЛГ).
В исследованиях P. Mayorga (2000), Sudo et al. (2002), Choi et al. (2004), Falconer et al. (2005) было продемонстрировано следующее. У пациенток с полиморфизмом генов рецепторов ФСГ показатель ПАФ чаще всего повышен. Выходит, что ориентируясь на данные ПАФ и не зная о наличии гипосенситивности к ФСГ (генотип FSH-R: Ser680), у каждой четвертой пациентки мы начинаем ОС с более низкой дозы ФСГ, а впоследствии вынуждены ее повышать, что чревато развитием СГСЯ. Если же предварительно обследовав женщину на наличие FSH-R: Ser680, мы проводим ОС с изначально более высокой дозой ФСГ (что более подходит в данном случае), то тем самым избежим риска развития СГСЯ. Таким образом, необходимо объединить всю имеющуюся информацию о пациентке, а именно: показатель ПАФ и уровень АМГ плюс дополнительно по возможности учитывать ее генетические характеристики. Это поможет скорректировать стартовую дозу или весь протокол ОС, исходя из общего набора данных.
Если же предварительно обследовав женщину на наличие FSH-R: Ser680, мы проводим ОС с изначально более высокой дозой ФСГ (что более подходит в данном случае), то тем самым избежим риска развития СГСЯ. Таким образом, необходимо объединить всю имеющуюся информацию о пациентке, а именно: показатель ПАФ и уровень АМГ плюс дополнительно по возможности учитывать ее генетические характеристики. Это поможет скорректировать стартовую дозу или весь протокол ОС, исходя из общего набора данных.
Следует обратить внимание еще на один аспект. Относительно индивидуализации протоколов ОС необходимо обязательно упомянуть о так называемой мягкой стимуляции.
В одном из центров репродуктологии на севере Италии Esther M. et al. (2007) провели следующее исследование, разделив пациенток на две группы. Участницам первой группы проводили стимуляцию яичников, используя стандартный протокол с рекомбинантным ФСГ в дозе 150 МЕ; в каждом цикле было перенесено по 2 эмбриона. Женщинам второй группы назначали ФСГ в той же дозе (150 МЕ) с переносом одного эмбриона. Им проводили мягкую стимуляцию, поскольку в отличие от пациенток первой группы назначали ФСГ на 5-е, а не на 1-е или 2-е сутки. Основная идея мягкой симуляции состоит в том, что необходимо подождать, пока в яичнике отбор фолликулов произойдет естественным образом, и уже потом стимулировать их. Следовательно, в рост идут лучшие фолликулы. Через год таких наблюдений было доказано, что частота наступления беременности у женщин в обеих группах не различалась. Заслуживает внимания также и то, что при мягком стимулировании число многоплодных беременностей намного снизилось, а вес детей при рождении был больше. В дополнение выяснилось, что при мягком стимулировании частота развития СГСЯ была ниже, чем при стандартном протоколе.
Им проводили мягкую стимуляцию, поскольку в отличие от пациенток первой группы назначали ФСГ на 5-е, а не на 1-е или 2-е сутки. Основная идея мягкой симуляции состоит в том, что необходимо подождать, пока в яичнике отбор фолликулов произойдет естественным образом, и уже потом стимулировать их. Следовательно, в рост идут лучшие фолликулы. Через год таких наблюдений было доказано, что частота наступления беременности у женщин в обеих группах не различалась. Заслуживает внимания также и то, что при мягком стимулировании число многоплодных беременностей намного снизилось, а вес детей при рождении был больше. В дополнение выяснилось, что при мягком стимулировании частота развития СГСЯ была ниже, чем при стандартном протоколе.
Вместе с тем данная методика имеет определенные недостатки. Пациентки, которым проводят мягкое стимулирование, суммарно проходят большее количество циклов стимуляции в год. Это просто иной подход, а главное состоит в том, чтобы сделать правильный выбор: получить большее количество ооцитов за один цикл стимуляции или провести больше циклов самой стимуляции. Что же лучше? По данным исследователей, проведение ОС сопровождалось определенным дискомфортом, без существенных различий по группам сравнения. Что же касается экономии, то уровень затрат при применении стандартных протоколов стимуляции ниже в сравнении с циклами мягкой стимуляции, поскольку последние нужно повторять большее число раз. Однако при сравнении расходов в пери- и неонатальный периоды ситуация оказалась в пользу мягкой стимуляции.
Что же лучше? По данным исследователей, проведение ОС сопровождалось определенным дискомфортом, без существенных различий по группам сравнения. Что же касается экономии, то уровень затрат при применении стандартных протоколов стимуляции ниже в сравнении с циклами мягкой стимуляции, поскольку последние нужно повторять большее число раз. Однако при сравнении расходов в пери- и неонатальный периоды ситуация оказалась в пользу мягкой стимуляции.
Между тем остается вопрос: всем ли можно проводить мягкую стимуляцию? По нашему мнению, такой вариант стимуляции подходит для женщин с нормальным показателем ПАФ, уровнем АМГ и др. Кроме того, существуют социальные, культурные, экономические и законодательные аспекты этого вопроса. Например, у пациентки есть необходимость многократного повтора цикла, и государство оплачивает 1, 2, максимум 3 цикла, дальше она платит сама. При таких условиях вряд ли можно предлагать мягкую стимуляцию. Необходимо использовать эти несколько оплаченных циклов так, чтобы получить большее количество ооцитов и, соответственно, эмбрионов. Даже с точки зрения психологии следует понимать, каким именно пациенткам подходит мягкая стимуляция. Вначале вроде все пациентки соглашаются повторить попытку 3-4 раза, несмотря на то что по каждому циклу вероятность беременности весьма невысока. Однако, как показывает практика, если после первого цикла результат является отрицательным, женщина просто покидает программу ВРТ, считая, что репродуктологи ей не смогли помочь. В такой ситуации многие пациентки выбывают из программы. Именно поэтому мягкая стимуляция – это вариант, хотя он подходит лишь определенной категории лиц.
Даже с точки зрения психологии следует понимать, каким именно пациенткам подходит мягкая стимуляция. Вначале вроде все пациентки соглашаются повторить попытку 3-4 раза, несмотря на то что по каждому циклу вероятность беременности весьма невысока. Однако, как показывает практика, если после первого цикла результат является отрицательным, женщина просто покидает программу ВРТ, считая, что репродуктологи ей не смогли помочь. В такой ситуации многие пациентки выбывают из программы. Именно поэтому мягкая стимуляция – это вариант, хотя он подходит лишь определенной категории лиц.
Далее симпозиум продолжил основатель и директор компании Reprogenetics Сантьяго Мунне докладом на тему «Геномика при селекции эмбрионов».
В начале своего выступления докладчик отметил, что большинство эмбрионов, получаемые в условиях in vitro, имеют хромосомные отклонения. Даже у морфологически неизмененных эмбрионов у более половины случаев (56%) обнаруживают хромосомные аномалии (рис. 3).
3).
В ходе недавно проведенного исследования эмбриологи дважды с определенным временным промежутком проводили эмбриоскопическое исследование, и согласно морфологическим критериям, выбирали наилучшие эмбрионы. Последующее выполнение сравнительной геномной гибридизации (array-Comparative Genomic Hybridization, aCGH) для оценки этих эмбрионов показало, что 60% бластоцист имели хромосомные аномалии. Через некоторое время при повторном проведении aCGH половина отобранных при эмбриоскопии бластоцист были анеуплоидными.
Чтобы наглядно показать значение предимплантационной генетической диагностики (ПГД) хромосомных отклонений для ЭКО, следует проанализировать данные Общества вспомогательных репродуктивных технологий (Society for assisted reproductive technologies, SART) за 2008 г. (табл. 1). Как видно из анализа, уровень имплантации у молодых пациенток до 35 лет составляет 32%, а у женщин 41-42 лет – всего 6%. С возрастом матери изменяется и уровень хромосомных аномалий у эмбрионов. У женщин до 35 лет их частота составляет 54%, а в возрасте 41-42 лет достигает 82%.
С возрастом матери изменяется и уровень хромосомных аномалий у эмбрионов. У женщин до 35 лет их частота составляет 54%, а в возрасте 41-42 лет достигает 82%.
Результаты ЭКО | Возраст матери, лет | ||||
< 35 | 35-37 | 38-40 | 41-42 | ||
| Продолжающаяся имплантация* без ПГД, % | 32 | 23 | 13 | 6 | |
| Аномальные эмбрионы (aCGH)**, % | 54 | 67 | 75 | 82 | |
| Имплантационные потери, не связанные с хромосомными аномалиями, % | 14 | 10 | 12 | 12 | |
| * Данные SART (2008), ** Данные компании Reprogenetics (2011) | |||||
В этом же исследовании были представлены следующие данные, на которые следует обратить внимание. Частота имплантационных потерь, не связанных с хромосомными аномалиями, у молодых женщин составила 14%, а у пациенток в возрасте 41-42 лет – 12%. Долгое время существовала следующая гипотеза: если в процессе ПГД исключить аномальные эмбрионы (≈50%), то уровень имплантации возрастет вдвое (Munne S. et al., 1993). В реальности же использование метода флюоресцентной гибридизации in situ (Fluorescence in situ hybridization, FISH) c проведением биопсии эмбриона на 3-й день развития оказалось не таким эффективным, как предполагалось. Результаты выполнения FISH с биопсией эмбриона на 3-й день у разных исследователей показали различную эффективность и не оправдали ожиданий. Ряд авторов объяснял это мозаицизмом и самокоррекцией эмбрионов. По мнению докладчика, основная причина таких различий – чисто техническая, обусловленная методикой проведения биопсии. Явления мозаицизма и самокоррекции эмбрионов не имеют существенного влияния. Учитывая результаты множества проведенных исследований, можно сделать вывод, что чем большее количество хромосом подвергается анализу, тем понятнее становится, что у каждого эмбриона есть хромосомные отклонения.
Частота имплантационных потерь, не связанных с хромосомными аномалиями, у молодых женщин составила 14%, а у пациенток в возрасте 41-42 лет – 12%. Долгое время существовала следующая гипотеза: если в процессе ПГД исключить аномальные эмбрионы (≈50%), то уровень имплантации возрастет вдвое (Munne S. et al., 1993). В реальности же использование метода флюоресцентной гибридизации in situ (Fluorescence in situ hybridization, FISH) c проведением биопсии эмбриона на 3-й день развития оказалось не таким эффективным, как предполагалось. Результаты выполнения FISH с биопсией эмбриона на 3-й день у разных исследователей показали различную эффективность и не оправдали ожиданий. Ряд авторов объяснял это мозаицизмом и самокоррекцией эмбрионов. По мнению докладчика, основная причина таких различий – чисто техническая, обусловленная методикой проведения биопсии. Явления мозаицизма и самокоррекции эмбрионов не имеют существенного влияния. Учитывая результаты множества проведенных исследований, можно сделать вывод, что чем большее количество хромосом подвергается анализу, тем понятнее становится, что у каждого эмбриона есть хромосомные отклонения. Было проведено сравнение эффективности выполнения FISH по 12 и 24 хромосомам. В исследовании на 24 образцах по сравнению с 12 было обнаружено на 50% больше аномалий. Однако аномальных эмбрионов при этом было идентифицировано только на 20% больше. Согласно статистике, на сегодняшний день частота ложных результатов при aCGH составляет 2%. Как отмечает докладчик, основная проблема, объясняющая неоправдавшиеся ожидания от ПГД, – это техника проведения эмбриональной биопсии. Частота ошибочных результатов при выполнении ПГД находится в прямой зависимости от конкретной лаборатории. Так, по данным Baart et al. (2004), уровень ошибок при проведении FISH достигал 50%, по данным Gleicher et al. (2009) – 15-20%. Согласно нашим данным (Munnе et al., 2002), уровень ошибочных результатов при проведении FISH-9 составляет 7,2%. Следует обратить внимание на то, что ложные результаты при выполнении ПГД методом aCGH были отмечены только в 1,8% случаев согласно результатам исследований Gutierrez-Mateo et al.
Было проведено сравнение эффективности выполнения FISH по 12 и 24 хромосомам. В исследовании на 24 образцах по сравнению с 12 было обнаружено на 50% больше аномалий. Однако аномальных эмбрионов при этом было идентифицировано только на 20% больше. Согласно статистике, на сегодняшний день частота ложных результатов при aCGH составляет 2%. Как отмечает докладчик, основная проблема, объясняющая неоправдавшиеся ожидания от ПГД, – это техника проведения эмбриональной биопсии. Частота ошибочных результатов при выполнении ПГД находится в прямой зависимости от конкретной лаборатории. Так, по данным Baart et al. (2004), уровень ошибок при проведении FISH достигал 50%, по данным Gleicher et al. (2009) – 15-20%. Согласно нашим данным (Munnе et al., 2002), уровень ошибочных результатов при проведении FISH-9 составляет 7,2%. Следует обратить внимание на то, что ложные результаты при выполнении ПГД методом aCGH были отмечены только в 1,8% случаев согласно результатам исследований Gutierrez-Mateo et al. (2011) и в 6% по данным Geraedts et al. (2011).
(2011) и в 6% по данным Geraedts et al. (2011).
При проведении ПГД исследование можно проводить на трех разных стадиях развития: биопсия полярного тельца, биопсия бластомера и трофоэктодермальная биопсия бластоцисты. При выполнении биопсии полярных телец с целью ПГД не диагностируются 30% постмейотических хромосомных аномалий. Кроме того, приходится анализировать в 3 раза больше клеток, чем при биопсии бластоцисты. Это существенно увеличивает временные и финансовые затраты.
При биопсии бластомера на 3-тьи сутки потенциал имплантации эмбриона снижается на 30-60%. В этой ситуации получаемая от проведения ПГД польза не всегда оправданна. Безусловно, во многом конечный результат определяется квалификацией специалиста, выполняющего исследование.
Впервые положительные результаты применения биопсии бластоцисты при ПГД были получены в 2010 г. (Schoolcraft et al.). По мнению докладчика, переход на биопсию бластоцисты полностью раскрывает весь потенциал методики ПГД. В сравнении с биопсией бластоцисты выполнение биопсии эмбриона на 3-тьи сутки показывает худшие результаты.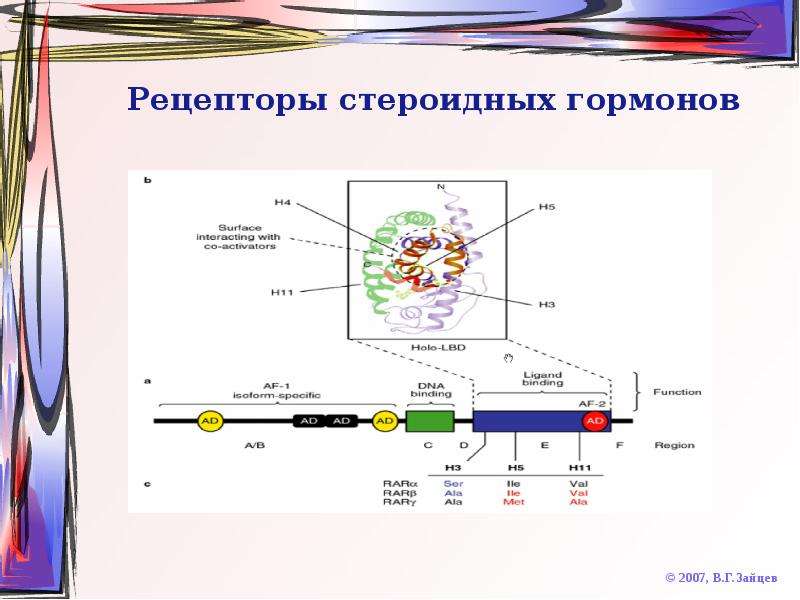 Так, исследования, проведенные Treff N.R. et al. (2011) по оценке имплантации в зависимости от проведения ПГД показали следующее. Уровень имплантации при биопсии эмбриона на 3-й день составил 31% в сравнении с 51% у эмбрионов, которым биопсия не проводилась. Частота имплантации эмбрионов, у которых данную процедуру выполняли на стадии бластоцисты, составила 52% и практически не отличалась от таковой у эмбрионов, которым исследование не проводили.
Так, исследования, проведенные Treff N.R. et al. (2011) по оценке имплантации в зависимости от проведения ПГД показали следующее. Уровень имплантации при биопсии эмбриона на 3-й день составил 31% в сравнении с 51% у эмбрионов, которым биопсия не проводилась. Частота имплантации эмбрионов, у которых данную процедуру выполняли на стадии бластоцисты, составила 52% и практически не отличалась от таковой у эмбрионов, которым исследование не проводили.
В США на сегодняшний день большинство центров переходит на биопсию бластоцисты с последующей диагностикой генетических нарушений методом aCGH. Преимущество этой методики состоит в скорости выполнения анализа, время проведения которого составляет менее 16 ч.
Сегодня имеются результаты проведения биопсии бластоцисты и переноса эмбриона на 6-е сутки. Данная методика продемонстрировала аналогичные или даже лучшие показатели в сравнении с классической. Как отмечает докладчик, постепенно проведение aCGH станет стандартом ПГД и в скором времени заменит некоторые процедуры пре- и постнатальной диагностики. Выполнение aCGH дает возможность определить анеуплоидию или транслокации всех 24-х хромосом менее чем за 16 ч, при этом не используется ДНК родителей.
Выполнение aCGH дает возможность определить анеуплоидию или транслокации всех 24-х хромосом менее чем за 16 ч, при этом не используется ДНК родителей.
В таблице 2 представлена частота хромосомных отклонений у эмбрионов в зависимости от их количества и возраста матери по результатам биопсии бластомера на 3-тьи сутки.
К-во 3-дневных эмбрионов | К-во пациенток с нормальными эмбрионами, % | ||||
Доноры яйцеклеток | < 35 | 35-39 | 40-42 | > 42 | |
1-4 | Нет данных | 69 | 57 | 43 | 25 |
5-7 | 100 | 93 | 85 | 60 | 25 |
8-10 | 99 | 96 | 93 | 72 | 53 |
> 10 | 100 | 100 | 97 | 83 | 91 |
Чем больше полученных эмбрионов, тем выше вероятность того, что они будут более высокого качества. Следует учитывать, что с возрастом матери уровень эуплоидии существенно снижается. При выполнении биопсии на 5-е сутки отмечаются значительно лучшие результаты (табл. 3). Таким образом, если провести несколько циклов, то можно получить 100% нормальных эмбрионов. Согласно данным многих репродуктивных центров, при ПГД с биопсией бластоцисты на 5-е сутки уровень имплантации достигает 60%, а ранее составлял 35%. Таким образом, в определенной степени удается нивелировать влияние возраста матери на успешность имплантации.
Следует учитывать, что с возрастом матери уровень эуплоидии существенно снижается. При выполнении биопсии на 5-е сутки отмечаются значительно лучшие результаты (табл. 3). Таким образом, если провести несколько циклов, то можно получить 100% нормальных эмбрионов. Согласно данным многих репродуктивных центров, при ПГД с биопсией бластоцисты на 5-е сутки уровень имплантации достигает 60%, а ранее составлял 35%. Таким образом, в определенной степени удается нивелировать влияние возраста матери на успешность имплантации.
К-во 5-дневных эмбрионов | К-во пациенток с нормальными эмбрионами, % | ||||
Доноры яйцеклеток | < 35 | 35-39 | 40-42 | > 42 | |
1-3 | 99 | 95 | 79 | 61 | 37 |
4-6 | 100 | 100 | 97 | 81 | 67 |
7-10 | 100 | 100 | 100 | 97 | 95 |
> 10 | 100 | 100 | 100 | 100 | 100 |
ПГД также рекомендована при эмбриобанкинге, привычном невынашивании беременности, определении транслокаций.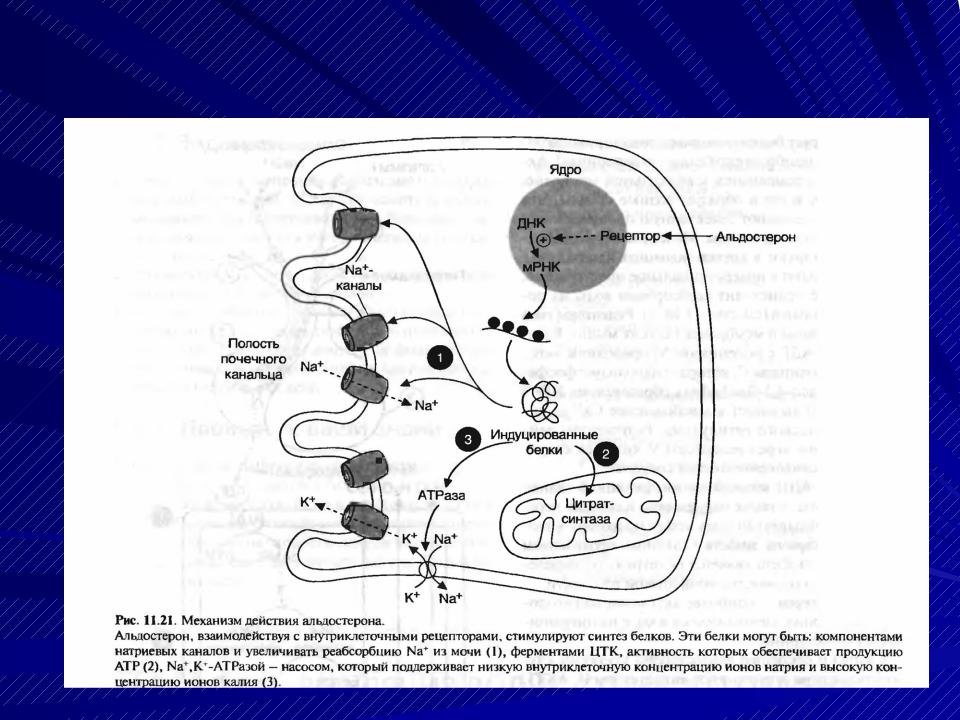 Кроме того, данный метод применяется для определения любых дефектов генов, хромосомных отклонений как у эмбриона, так и у будущих родителей на этапе преконцепционной подготовки.
Кроме того, данный метод применяется для определения любых дефектов генов, хромосомных отклонений как у эмбриона, так и у будущих родителей на этапе преконцепционной подготовки.
По окончании выступлений участники симпозиума задавили докладчикам вопросы, касающиеся проблем, освещаемых в лекциях, интересовались мнением и тактикой ведущих иностранных специалистов при ведении пациенток с сопутствующей бесплодию патологией, активно дискутировали и обменивались собственным опытом.
Подготовила Мария Арефьева
Галакторея — Эндокринные и метаболические нарушения
При макроаденомах обычно применяют агонисты дофамина или прибегают к хирургической операции, но только после тщательного исследования функции гипофиза и оценки возможности проведения лучевой терапии. Агонисты дофамина обычно являются начальной терапией выбора и уменьшают размер пролактин-секретирующей опухоли. Агонисты допамина не будут сокращать нефункционирующую опухоль, вызывающую компрессию гипофиза, хотя уровень пролактина будет снижаться. Если уровень пролактина снижается, а симптомы и признаки давления опухоли на соседние структуры исчезают, то никакого другого лечения не требуется. Однако обычно в случае крупных нефункционирующих опухолей необходимо применение дополнительного лечения, как правило, хирургического вмешательства. Операцию или лучевую терапию легче проводить, и они дают лучшие результаты, когда выполняются после уменьшения размеров опухоли под действием агонистов дофамина. Хотя лечение агонистами дофамина обычно требует длительного времени, пролактинсекретирующие опухоли могут исчезать либо спонтанно, либо, что вероятнее, под действием лекарственной терапии. Поэтому иногда агонисты дофамина удается отменять без рецидивирования опухоли или повторного повышения уровня пролактина. При микроаденомах ремиссия более вероятна, чем при макроаденомах. Ремиссия также более вероятна после беременности.
Если уровень пролактина снижается, а симптомы и признаки давления опухоли на соседние структуры исчезают, то никакого другого лечения не требуется. Однако обычно в случае крупных нефункционирующих опухолей необходимо применение дополнительного лечения, как правило, хирургического вмешательства. Операцию или лучевую терапию легче проводить, и они дают лучшие результаты, когда выполняются после уменьшения размеров опухоли под действием агонистов дофамина. Хотя лечение агонистами дофамина обычно требует длительного времени, пролактинсекретирующие опухоли могут исчезать либо спонтанно, либо, что вероятнее, под действием лекарственной терапии. Поэтому иногда агонисты дофамина удается отменять без рецидивирования опухоли или повторного повышения уровня пролактина. При микроаденомах ремиссия более вероятна, чем при макроаденомах. Ремиссия также более вероятна после беременности.
Целесообразно продолжать терапию дофамином на протяжении всей беременности, особенно если опухоль инвазивна или граничит с хиазмой зрительных нервов. Во время беременности около 30% макроаденом увеличиваются; если у пациенток имеются клинические признаки расширения опухоли (головные боли и/или сужение поля зрения), а увеличение опухоли подтверждается МРТ, то, вероятно, следует возобновить терапию дофамином. В инструкциях Общества эндокринологов (The Endocrine Society) рекомендуется использовать бромокриптин, но многие эксперты применяют каберголин, особенно если он использовался до беременности – нет никаких свидетельств неблагоприятных результатов ни для плода, ни для матери.
Во время беременности около 30% макроаденом увеличиваются; если у пациенток имеются клинические признаки расширения опухоли (головные боли и/или сужение поля зрения), а увеличение опухоли подтверждается МРТ, то, вероятно, следует возобновить терапию дофамином. В инструкциях Общества эндокринологов (The Endocrine Society) рекомендуется использовать бромокриптин, но многие эксперты применяют каберголин, особенно если он использовался до беременности – нет никаких свидетельств неблагоприятных результатов ни для плода, ни для матери.
Считается, что высокие дозы агонистов допамина, в частности каберголина и перголида, вызывали развитие пороков сердца у некоторых пациентов с болезнью Паркинсона. Увеличивают ли риск клапанных поражений сердца меньшие дозы агонистов допамина, применяемые при гиперпролактинемии, неясно, но такую возможность, равно как и необходимость эхокардиографического контроля, следует обсуждать с больными. Риск может быть уменьшен путем приема бромокриптина или хинаголида. Агонисты допамина, применяемые в тех же дозах, что и при гиперпролактинемии, также иногда вызывают поведенческие и психические изменения, характеризующиеся повышенной импульсивностью, а иногда и психозом, и это ограничивает возможность их назначение некоторым больным.
Агонисты допамина, применяемые в тех же дозах, что и при гиперпролактинемии, также иногда вызывают поведенческие и психические изменения, характеризующиеся повышенной импульсивностью, а иногда и психозом, и это ограничивает возможность их назначение некоторым больным.
Лучевую терапию применяют только при прогрессирующем заболевании, не поддающемся другим формам лечения. Через несколько лет после облучения гипофиза часто развивается гипопитуитаризм. Необходимо ежегодно на протяжении всей жизни проверять эндокринные функции и оценивать состояние турецкого седла.
Опасности и осложнения гормональной терапии рака простаты
Рак предстательной железы (РПЖ), частота которого составляет 26% от всех новообразований у мужчин, является наиболее распространенным раковым заболеванием и по уровню смертности занимает третье место, уступая раку легких и кишечника. С увеличением продолжительности жизни число больных РПЖ прогрессивно возрастает, а их средний возраст составляет 69 лет, что характерно для большинства раковых заболеваний.
На протяжении более 70 лет, т.е. с тех пор как C. Huggins et al. (1941) доказали возможность лечения метастатического РПЖ путем кастрации либо введения эстрогенов, антиандрогенная терапия повсеместно получила широкое распространение. Использование гормонального воздействия в настоящее время практикуется не только при диссеминированных формах РПЖ, но и в качестве дополнительного метода при проведении радикальной простатэктомии или лучевой терапии. Помимо лечения метастатических форм РПЖ, имеется еще многочисленный ряд показаний, при которых проводят системную андрогендепривационную терапию (АДТ). В частности, пациентам назначают неоадъювантное лечение с использованием антиандрогенов при биохимическом рецидиве, определяемом как новое повышение уровня простатспецифического антигена (ПСА) после ранее проведенной терапии с лечебной целью. Кроме того, приобретает популярность гормональная терапия (ГТ) как метод лечения локальных форм РПЖ. В одной из публикаций отмечено, что в США из 2 млн мужчин с данным диагнозом приблизительно 600 тыс. (30%) получают АДТ [1]. В связи с этим особо актуальной является оценка токсичности депривационной терапии во время и после ее применения.
(30%) получают АДТ [1]. В связи с этим особо актуальной является оценка токсичности депривационной терапии во время и после ее применения.
Нередко проведение гормонального лечения сопряжено с трудностями, обусловленными неоднородностью раковых клеток простаты. В некоторых опухолях присутствуют различные популяции с неодинаковыми морфологическими и функциональными характеристиками. Поэтому практическое значение имеет выявление случайных подпопуляций клеток с классическими видами аденокарциномы, соприкасающихся со смешанными клетками с нейроэндокринной дифференциацией. Архитектура клеток низкодифференцированного рака и таких, которые действительно представляют переход от простатической интраэпителиальной неоплазии к дифференцированному раку, отличается выраженным полиморфизмом. При этом трудно достичь одинаковой эффективности ГТ в отношении всей гаммы гетерогенных раковых клеток, тем более в условиях запущенного заболевания, в частности при наличии метастазов.
Эффект такого лечения направлен в первую очередь на то, чтобы лишить раковые клетки питательного субстрата, каковым является тестостерон или его более мощный метаболит – дигидротестостерон (ДГТ).
Участие андрогенов в регуляции роста РПЖ обеспечивается эндокринными и паракринными механизмами, в которых задействованы гипоталамус, гипофиз, яички и надпочечники (рис. 1, 2).
| Рис. 1. Функциональная схема гипоталамо-гипофизарной активности |
| Рис. 2. Продукция тестостерона под влиянием ЛГРГ и ЛГ |
В этой связи современные схемы лечения предусматривают воздействие на все звенья сложной гормональной цепи. Эндокринная ось начинается в гипоталамусе, где декапептидный лютеинизирующего гормона рилизинг-гормон (ЛГРГ), который является ключевым регулятором репродуктивного процесса, секретируется в пульсирующем режиме и переносится по гипоталамо-гипофизарному кровотоку к его первичному очагу действия в гипофизе. В нем синтезируются фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, последний из которых стимулирует клетки Лейдига, продуцирующие тестостерон.
В нем синтезируются фолликулостимулирующий (ФСГ) и лютеинизирующий (ЛГ) гормоны, последний из которых стимулирует клетки Лейдига, продуцирующие тестостерон.
Основная направленность ГТ состоит в подавлении продукции тестостерона клетками Лейдига в яичках. С этой целью используется как хирургическая кастрация, так и многочисленная группа медикаментозных средств, среди которых превалируют два класса – аналоги и антагонисты ЛГРГ и антиандрогены.
С самого начала применения АДТ при раке простаты стало очевидным, что вмешательство в сложную систему гормональной регуляции организма негативно влияет на многие его функции. Иными словами, как нет розы без шипов, так и не бывает лекарств без побочных эффектов. Оценивая любой из вариантов лечения с использованием андрогенной депривации, необходимо указать на возможность возникновения осложнений. В литературе имеется мало сведений об осложнениях и побочных эффектах длительного гормонального лечения метастатического РПЖ, на долю которого в Украине приходится до 80%.
ГТ замедляет прогрессирующий рост опухоли, предотвращает развитие тяжелых осложнений заболевания, эффективно уменьшает его клинические проявления. Как было отмечено ранее, основная лечебная цель АДТ – лишать опухолевые клетки питательного субстрата, каковым является тестостерон. Однако его подавление не проходит бесследно, поскольку этот гормон обеспечивает физиологическое функционирование важнейших систем организма (рис. 3).
| Рис. 3. Роль тестостерона в организме мужчины |
Следует сказать, что АДТ по частоте применения является вторым методом (после хирургической операции) лечения клинически местно распространенного РПЖ. В отношении же метастатического РПЖ андрогенная депривация является первостепенной и используется в целях:
- уменьшения опухолевой массы предстательной железы;
- эффективного снижения интенсивности или остановки метастазирования;
- минимизации риска смертельных осложнений РПЖ;
- паллиативной терапии симптомов заболевания у больных с прогрессирующим метастазированием.

Поскольку андрогены играют важнейшую роль в физиологической активности многих функций организма, гормональная депривация сопровождается возникновением множества побочных эффектов (схема).
| Схема. Осложнения вследствие АДТ |
Рассмотрим ряд наиболее частых неблагоприятных событий, возникающих при АДТ у пациентов с раком простаты. В литературе последних лет наиболее часто сообщается о повышении частоты осложнений и смертности, обусловленных сердечно-сосудистыми заболеваниями (ССЗ) [2-5]. Так, обсуждению этой актуальной проблемы и условий развития метаболического синдрома был посвящен ряд заседаний 26-го конгресса Европейской ассоциации урологов (2010).
О неблагоприятных последствиях и серьезных осложнениях при использовании эстрогенов известно давно. Мысль о том, что ГТ синэстролом с последующим развитием инфаркта миокарда унесла больше жизней, чем сам рак простаты, была подтверждена многими авторами. В одном из крупных исследований последних лет, которое включало 73 196 мужчин с диагнозом локализованного или локально-распространенного РПЖ, доказано значительное повышение риска ишемической болезни сердца, инфаркта миокарда и сахарного диабета 2-го типа у лиц, получавших аналоги ЛГРГ [2]. Отмечено, что у мужчин, получавших АДТ не менее года, риск нового ССЗ был на 20% выше в сравнении с теми, кто не подвергался воздействию антиандрогенной терапии в любом виде. Кроме того, показатели сердечно-сосудистой летальности статистически достоверно не отличаются в группах немедленной и отсроченной АДТ [6].
В одном из крупных исследований последних лет, которое включало 73 196 мужчин с диагнозом локализованного или локально-распространенного РПЖ, доказано значительное повышение риска ишемической болезни сердца, инфаркта миокарда и сахарного диабета 2-го типа у лиц, получавших аналоги ЛГРГ [2]. Отмечено, что у мужчин, получавших АДТ не менее года, риск нового ССЗ был на 20% выше в сравнении с теми, кто не подвергался воздействию антиандрогенной терапии в любом виде. Кроме того, показатели сердечно-сосудистой летальности статистически достоверно не отличаются в группах немедленной и отсроченной АДТ [6].
Имеются сообщения о том, что применение неоадъювантной или адъювантной АДТ связано с более высоким уровнем смертности от сердечно-сосудистой патологии [4]. В исследовании с участием 4890 пациентов с локализованным РПЖ, из которых 1015 – получали АДТ, зафиксирован 131 летальный исход от ССЗ. Более высокий риск смерти от кардиоваскулярной патологии наблюдался в популяции мужчин, подвергшихся радикальной простатэктомии с последующей ГТ.
Объединенный анализ результатов трех рандомизированных контролируемых исследований с участием 1372 пациентов с/без немедленной АДТ по поводу РПЖ высокой степени риска показал, что длительное проведение такого лечения статистически достоверно ассоциированно с более ранним возникновением инфаркта миокарда со смертельным исходом [7].
Имеющиеся литературные данные и многочисленные собственные наблюдения свидетельствуют, что даже кратковременный (до 6 мес) прием гормональных препаратов может быть связан с повышенной частотой сердечно-сосудистых осложнений. Однако не удается выявить минимальный показатель продолжительности воздействия АДТ, при котором могут возникнуть неблагоприятные события. В то же время любое увеличение длительности АДТ примерно на 25% повышает риск летального исхода от сердечно-сосудистой патологии.
При распространенных формах РПЖ применяют два варианта паллиативного лечения – медикаментозную кастрацию или хирургическую орхидэктомию. Для большинства пациентов более предпочтителен первый вариант с использованием агонистов ГнРГ. Наиболее популярны и широко применяемы препараты – золадекс, диферелин, элигард – эффективно подавляют сывороточный уровень тестостерона, что в свою очередь тормозит рост опухоли. В частности, при использовании гозерелина (золадекса) на протяжении 12 мес у 88% больных уровень тестостерона снижается до 50 нг/дл [8].
Наиболее популярны и широко применяемы препараты – золадекс, диферелин, элигард – эффективно подавляют сывороточный уровень тестостерона, что в свою очередь тормозит рост опухоли. В частности, при использовании гозерелина (золадекса) на протяжении 12 мес у 88% больных уровень тестостерона снижается до 50 нг/дл [8].
Однако первоначальным ответом на терапию агонистами ЛГРГ является временное повышение концентрации тестостерона, известное как тестостероновая «вспышка» или «цветение» опухоли, которое может привести к обострению симптомов и отрицательно повлиять на выживаемость. Препараты этой группы действуют путем связывания с рецепторами ГнРГ гипофиза, и первоначальной реакцией является стимуляция выброса ЛГ с немедленным повышением уровня тестостерона в сыворотке крови («вспышка»). Концентрация ЛГ может повышаться в 10 раз, а тестостерона – примерно в 2 раза, причем это становится очевидным на протяжении 2-3 дней после первой инъекции агониста и может продолжаться от 10 до 20 дней. В свою очередь повышение уровня тестостерона сопровождается повышением концентрации ПСА – маркера роста опухоли [9].
В свою очередь повышение уровня тестостерона сопровождается повышением концентрации ПСА – маркера роста опухоли [9].
Тестостероновые «вспышки», т.е. повышение содержания этого гормона с ниже до выше кастрационного уровня, регистрируют у 4-63% пациентов, получающих инъекции агониста ЛГРГ. В среднем частота «вспышки» составляет 11% и клинически менее распространена у больных локальным РПЖ. У многих пациентов с метастазами тестостероновая «вспышка» сопровождается как ухудшением клинических симптомов, так и внезапным летальным исходом. Причинами смерти являются сердечно-сосудистые события, компрессия спинного мозга, легочная эмболия и остановка дыхания. В период «вспышки» тестостерона опухоль простаты увеличивается, о чем свидетельствуют повышение уровня кислой фосфатазы, концентрации ПСА и ухудшение клинических симптомов.
Применение АДТ ассоциируется с высокой частотой возникновения таких осложнений, как потеря либидо и развитие импотенции. РПЖ наиболее часто диагностируют у пожилых мужчин в возрасте 60-80 лет, когда уже около 50% из них отмечают выраженное снижение эректильной способности.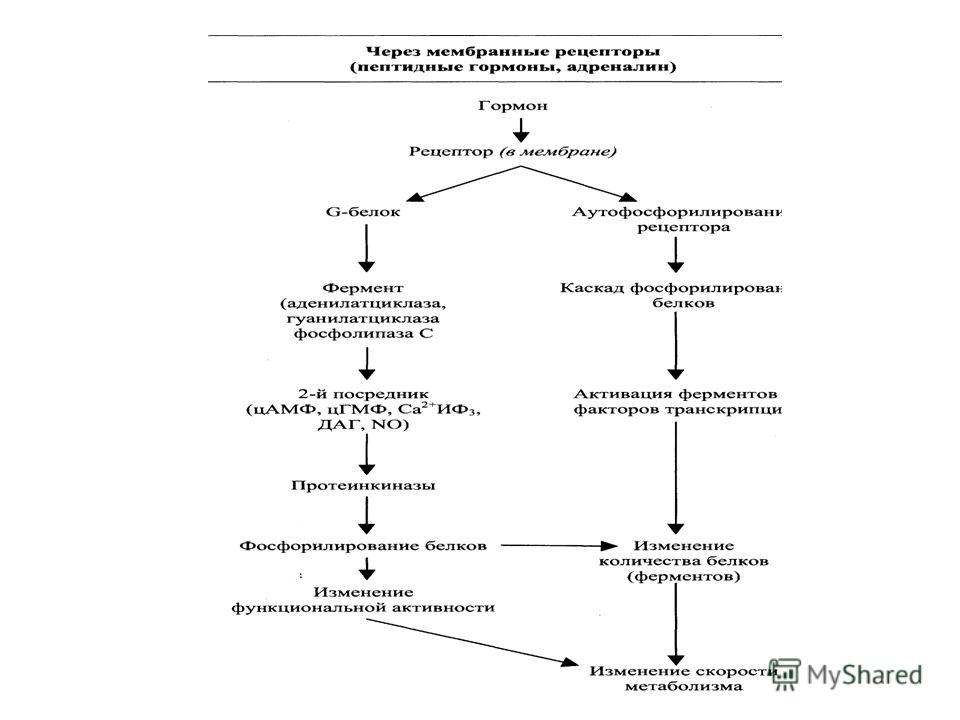 Учитывая данную ситуацию, необходимо предупреждать пациента, ведущего активную половую жизнь, что гормональное лечение может усугубить половую недостаточность.
Учитывая данную ситуацию, необходимо предупреждать пациента, ведущего активную половую жизнь, что гормональное лечение может усугубить половую недостаточность.
Хорошо известно, что сексуальная стабильность для представителей сильного пола является неотъемлемым достоинством и важным критерием качества жизни. Определенно можно утверждать, что нормальная половая функция для подавляющего большинства мужчин составляет смысл всей жизни. Неоднократно приходится убеждаться в том, что неурядицы и проблемы в сексуальной сфере иногда чреваты трагическими суицидальными исходами.
Ведущим звеном в развитии эректильной дисфункции при проведении АДТ является синдром недостаточности тестостерона. Поскольку антиандрогенная (медикаментозная) терапия приводит к снижению его концентрации до посткастрационного уровня, то наличие эректильной дисфункции представляется прямым следствием проводимого лечения.
На вопрос, является ли начало гормонального лечения РПЖ окончанием сексуальной активности, можно ответить положительно. К примеру, в исследовании Ch. J. Di Blasio et al. (2008) с участием 395 пациентов, которым проводили медикаментозную антиандрогенную терапию, лишь десять из них сообщили о нормальном либидо. Таким образом, сохранившаяся сексуальная жизнь при гормональном лечении является скорее исключением, чем правилом. В этом отношении использование бикалутамида в качестве монотерапии при локально распространенном РПЖ может быть оправданным. В адъювантном режиме прием касодекса в дозе 150 мг при местно распространенном РПЖ более предпочтителен, поскольку у таких пациентов сохраняется физическая активность, отсутствуют приливы жара, стабилизируется минеральная плотность костной ткани и отмечается низкая частота импотенции. Указанные преимущества обусловливают значительное снижение риска прогрессирования заболевания в среднем на 5,3 года [14].
К примеру, в исследовании Ch. J. Di Blasio et al. (2008) с участием 395 пациентов, которым проводили медикаментозную антиандрогенную терапию, лишь десять из них сообщили о нормальном либидо. Таким образом, сохранившаяся сексуальная жизнь при гормональном лечении является скорее исключением, чем правилом. В этом отношении использование бикалутамида в качестве монотерапии при локально распространенном РПЖ может быть оправданным. В адъювантном режиме прием касодекса в дозе 150 мг при местно распространенном РПЖ более предпочтителен, поскольку у таких пациентов сохраняется физическая активность, отсутствуют приливы жара, стабилизируется минеральная плотность костной ткани и отмечается низкая частота импотенции. Указанные преимущества обусловливают значительное снижение риска прогрессирования заболевания в среднем на 5,3 года [14].
Однако существует и другая сторона этой проблемы. Так, многим мужчинам можно помочь устранить или уменьшить проявления сексуальной недостаточности, если учитывать этот аспект при проведении антиандрогенной терапии. Причиной такого осложнения является непонимание пациентом особенностей течения сексуальных расстройств из-за табуирования этого интимного вопроса либо его нежелания обсуждать эту щекотливую тему. Число страдающих расстройствами эрекции значительно больше, чем упоминается в литературных источниках. Детальные клинические сведения должны охватывать этот важнейший аспект качества жизни, поскольку выраженность эректильной дисфункции зависит от индивидуальных особенностей больного, его предпочтений в выборе терапии.
Причиной такого осложнения является непонимание пациентом особенностей течения сексуальных расстройств из-за табуирования этого интимного вопроса либо его нежелания обсуждать эту щекотливую тему. Число страдающих расстройствами эрекции значительно больше, чем упоминается в литературных источниках. Детальные клинические сведения должны охватывать этот важнейший аспект качества жизни, поскольку выраженность эректильной дисфункции зависит от индивидуальных особенностей больного, его предпочтений в выборе терапии.
При успешном онкологическом лечении (уменьшение опухолевой массы, остановка метастазирования, редукция симптомов) значительно снижается уровень тестостерона, что оказывает высокую нагрузку на организм. Так, уменьшение мышечной массы, перераспределение жировой ткани, развитие метаболического синдрома с инсулинорезистентностью вызывают сахарный диабет. Кроме того, возможно развитие гинекомастии, усиление или появление сердечно-сосудистой симптоматики, которые в свою очередь приводят к самоизоляции, умеренным когнитивным расстройствам, депрессии и, наконец, к снижению сексуального влечения.
Лишь немногие мужчины при длительной АДТ сохраняют сексуальный интерес, что определяется их возрастом, сексуальной активностью до лечения, интеллектом, физическим состоянием, изначальным уровнем тестостерона и еще рядом других факторов. Тот факт, что у отдельных пациентов либидо остается нормальным, свидетельствует о том, что не все обусловлено низким уровнем тестостерона. Не последнюю роль в поддержании либидо играет женщина, ее умение оказать возбуждающее сексуальное воздействие. Поэтому среди условий, положительно влияющих на сохранение интимных отношений, следует выделить возраст пациента, привлекательность его партнерши, обоюдную нежность и гармонию супружеской пары, стремление снять напряженность в семейных отношениях.
На современном этапе развития медицины использование ряда ингибиторов фосфодиэстеразы 5-го типа (левитры, виагры, джантивы и др.) способствует поддержанию эрекции. По сведениям отдельных пациентов, важную вспомогательную роль играет импаза. Такие широко рекламируемые виды лечения эректильной дисфункции, как применение вакуумных устройств или имплантация протезов, у данной категории больных используются редко.
Следует отметить, что сохранение сексуальной активности при проведении гормональнодепривационной терапии должно быть важнейшей составляющей врачебной практики.
Среди осложнений антиандрогенного лечения РПЖ у пациентов нередко отмечается развитие гинекомастии – увеличение, уплотнение и болезненность грудных желез. Необходимо сказать, что данный побочный эффект часто встречается во время лечения как аналогами ЛГРГ, так и антиандрогенами. Прежде увеличение грудных желез было неизбежным при применении синэстрола, а поскольку отмечается тенденция к более широкому использованию АДТ, проблема гинекомастии становится все актуальнее.
Рис. 4. Свисающие грудные железы у мужчины после ГТ |
Гинекомастия у подвергшихся гормональному лечению больных оказывает выраженное негативное влияние на физическое и психологическое состояние; у многих снижается самооценка, отмечается психологическая стагнация. Качество жизни таких мужчин заметно снижается. Наряду с болезненностью возникает эмоциональное неприятие неожиданно возникшего факта, компрометирующего мужской образ. Появление гинекомастии у пациента с редуцированным качеством жизни из-за наличия РПЖ и проводимой ГТ значительно усугубляет уже произошедшие изменения в жизни (рис. 4).
Качество жизни таких мужчин заметно снижается. Наряду с болезненностью возникает эмоциональное неприятие неожиданно возникшего факта, компрометирующего мужской образ. Появление гинекомастии у пациента с редуцированным качеством жизни из-за наличия РПЖ и проводимой ГТ значительно усугубляет уже произошедшие изменения в жизни (рис. 4).
Важнейшим фактором в патогенезе развития гинекомастии является повышенный коэффициент соотношения эстрогены/андрогены. Клинически у пациентов с РПЖ гинекомастия часто развивается после АДТ путем орхидэктомии, фармакологической интервенции или системной терапии эстрогенами. Полагаем, что в развитии этого заболевания немаловажную роль играет гипогонадизм, который имеет высокую распространенность в популяции стареющих мужчин. B.E. Simon et al. (1973) предложили классификацию гинекомастии в зависимости от степени увеличения грудных желез [10].
- Тип 1 – незначительное увеличение грудных желез без выраженного свисания кожи.
- Тип 2а – умеренное увеличение грудных желез без чрезмерного свисания кожи.

- Тип 2б – выраженное увеличение грудных желез с незначительным свисанием кожи.
- Тип 3 – увеличение грудных желез с отвисанием кожи, напоминающее женскую грудь.
Эффективным в профилактике гинекомастии является дотерапевтическое облучение грудных желез в дозе 15-20 Гр на протяжении 1-3 сеансов.
Вместе с тем разработаны методы хирургического удаления грудных желез с последующей пластической реконструкцией [11].
При проведении ГТ уязвимой является костная система организма, поражения которой представлены остеопорозом и переломами. Кости с возрастом подвергаются выраженной резорбции, и этот процесс усиливается воздействием данного лечения. Поэтому на развитие остеопороза, кроме возрастных причин и гипогонадизма, выраженное влияние оказывает длительно проводимая обременительная ГТ. Так, использование аналогов ЛГРГ сопровождается относительным повышением частоты клинических переломов на 21-45% [12]. Чем продолжительнее лечение, тем выше риск возможных переломов. Кроме того, возраст и сопутствующая патология ассоциированны с более высокой частотой переломов у пациентов с РПЖ. При применении АДТ повышается степень обновления костной ткани и снижается ее минеральная плотность, что повышает риск переломов [13]. В период проведения такого лечения плотность костной ткани бедра и позвоночного столба снижается приблизительно на 3% ежегодно. Спустя 48 нед после ГТ минеральная плотность костной ткани поясничного отдела позвоночника уменьшается в среднем на 8,5% [15].
Кроме того, возраст и сопутствующая патология ассоциированны с более высокой частотой переломов у пациентов с РПЖ. При применении АДТ повышается степень обновления костной ткани и снижается ее минеральная плотность, что повышает риск переломов [13]. В период проведения такого лечения плотность костной ткани бедра и позвоночного столба снижается приблизительно на 3% ежегодно. Спустя 48 нед после ГТ минеральная плотность костной ткани поясничного отдела позвоночника уменьшается в среднем на 8,5% [15].
Неблагоприятные антиандрогенные последствия и возможности их лечения представляются важной проблемой, поскольку атрофия мышц, а также остеопороз с возможными вторичными проявлениями по типу костной боли и остеопоротических переломов являются значимыми осложнениями.
Предупредить или стабилизировать остеопороз у больных на фоне АДТ можно с помощью проведения комплексного лечения, которое включает:
- прием витамина D и препаратов кальция;
- отказ от курения, ограничение потребления алкоголя, поддержание нормального веса и выполнение регулярных физических упражнений;
- внутривенное введение бисфосфоната (золедроновой кислоты) в дозе 4 мг 1 раз в 3 мес; всего четыре капельных инъекции.

Предложенная схема лечения позволяет ингибировать остеокластическую резорбцию кости, что дает возможность упредить развитие данного заболевания у мужчин, а также снизить влияние множества факторов риска перелома костей.
Новым средством в профилактике остеопороза при проведении АДТ является прием препарата на основе моноклонального антитела – деносумаба. Он эффективно предотвращает возникновение скелетных осложнений, отсрочивая на 8-9 мес появление таких неблагоприятных последствий, как переломы, компрессия спинного мозга, операции и облучение.
Наиболее частыми осложнениями ГТ (40-80%) являются приливы жара. Изначальное утяжеление урологической симптоматики наблюдается при введении практически всех аналогов ЛГРГ, однако с различной интенсивностью и частотой. Приливы жара после лишения андрогенов являются результатом расстройств центральной регуляции гипоталамуса. В физиологических условиях за счет циркуляции андрогенов осуществляется центральный синтез эндорфинов с ингибирующим действием на основные центры терморегуляции. Последствия андрогенной супрессии проявляются в подавлении ингибирующих факторов, что ведет к гиперпродукции центральных адренергических субстанций (таких как норадреналин) и последующей стимуляции терморегулирующих центров.
Последствия андрогенной супрессии проявляются в подавлении ингибирующих факторов, что ведет к гиперпродукции центральных адренергических субстанций (таких как норадреналин) и последующей стимуляции терморегулирующих центров.
Новой субстанцией в лечении распространенного гормональнозависимого РПЖ является фирмагон (дегареликс) – антагонист ГнРГ. Рандомизированные исследования III фазы продемонстрировали преимущества дегареликса относительно скорости снижения уровня тестостерона до кастрационного (< 3 дней), показателя ПСА, а также отсутствие инициального повышения и колебаний концентрации андрогенов в процессе лечения по сравнению с агонистами ЛГРГ. Данные результаты позволяют судить о том, что терапия с использованием дегареликса способна отсрочить метастазирование в кости более чем на год в сравнении с агонистами ЛГРГ [16]. Риск ПСА-рецидива и смерти достоверно выше при применении лейпрорелина, чем дегареликса. При приеме последнего частота побочных явлений значительно ниже, нежели в группе агонистов, а отсутствие тестостероновых «вспышек», сопровождающихся приливами жара и усилением симптомов, ставит дегареликс в ряд предпочтительных антиандрогенных препаратов. Первым, хотя и ограниченным, опытом его клинических испытаний делятся российские урологи, отмечая его высокую безопасность и простоту применения [17].
Первым, хотя и ограниченным, опытом его клинических испытаний делятся российские урологи, отмечая его высокую безопасность и простоту применения [17].
Арсенал лекарственных средств для устранения осложнений ГТ РПЖ представлен в таблице.
Таблица. Профилактика и лечение наиболее частых побочных эффектов ГТ РПЖ
Основные побочные эффекты | Виды профилактики и/или лечения |
Эректильная дисфункция | Ингибиторы фосфодиэстеразы 5-го типа Интракавернозные инъекции Имплантаты в половой член |
Гинекомастия/гинекодиния | Облучение Мастэктомия Тамоксифен |
Мышечная слабость | Физические упражнения Сбалансированное питание |
Анемия | Трансфузия крови при симптоматической анемии |
Редукция толщины костей | Физические упражнения Кальций + витамин D Бисфосфонаты, деносумаб при остеопорозе |
Сердечно-сосудистые проявления | Активный контроль факторов риска и ранних симптомов, их лечение |
Результаты многочисленных клинических наблюдений доказывают, что использование комбинированной андрогенной блокады с включением в схемы лечения прежде всего аналогов ЛГРГ часто сопровождается рядом тяжелых и опасных для жизни осложнений.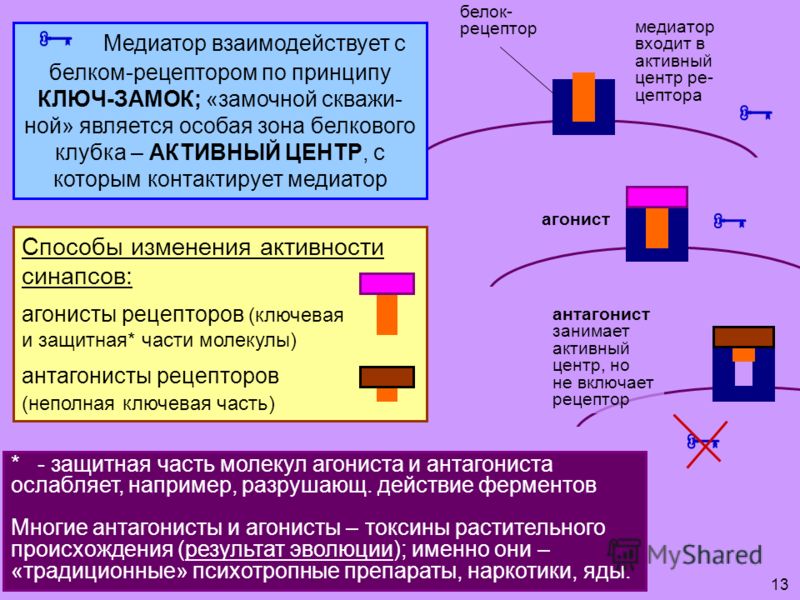 Более того, большинство данных свидетельствует о том, что такой вид комбинированной терапии демонстрирует всего лишь небольшое преимущество выживаемости при повышенной токсичности.
Более того, большинство данных свидетельствует о том, что такой вид комбинированной терапии демонстрирует всего лишь небольшое преимущество выживаемости при повышенной токсичности.
Рядом крупных рандомизированных исследований доказано, что снижение уровня тестостерона и тотальная блокада андрогенных рецепторов, а также комбинированная антигормональная терапия менее эффективны, чем монотерапия. Эти данные явились веским аргументом в пользу активного использования антиандрогенов (прежде всего бикалутамида), испытания которых проводились в 70-80-х годах прошлого столетия.
Таким образом, оптимальный выбор ГТ метастатического РПЖ должен основываться на средствах и методах, способных оказывать минимальные побочные эффекты, которые реально возможно корректировать.
Литература
1. Smith M.R. Androgen deprivation therapy for prostate cancer: new concept and concerns. Curr.Opin.Endocrinol.Diabetes Obes. 2007; 14: 247-254
2. Keating N. L., O’Malley A.J., Smith M.R. Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J.Clin.Oncol., 2006; 24: 4448-56
L., O’Malley A.J., Smith M.R. Diabetes and cardiovascular disease during androgen deprivation therapy for prostate cancer. J.Clin.Oncol., 2006; 24: 4448-56
3. Scugal C.S., Gore J.L., Kruski T.L. et al. Androgen deprivation therapy increases cardiovascular morbidity in men with prostate cancer. Cancer, 2007; 110: 1493-1500
4. Tsai H.K., D’Amico A.V., Sadetsky N. Androgen deprivation therapy for localized prostate cancer and the risk of cardiovascular mortality. J.Nat.Cancer Inst., 2007; 99: 1516-24
5. Isbarn H., Boccon-Gibod L., Carroll P.R. Androgen deprivation therapy for the treatment of prostate cancer. Consider both benefits and risks. Eur.Urol., 2009; 55: 62-75
6. Studer U.E., Whelan P. Albrecht W. Immediate or deferred androgen deprivation for patients with prostate cancer not suitable for local treatment with curative intent: EORTC Trial 30891. J.Clin.Oncol., 2006; 24: 1868-76
7. D’Amico A.V., Denham J.W., Crook J. Influence of androgen suppression therapy for prostate cancer on the frequency and timing of fatal myocardial infarctions. J.Clin.Oncol., 2007; 25: 2420-25
J.Clin.Oncol., 2007; 25: 2420-25
8. Аполихин О.И., Сивков А.В., Жернов А.А., Кешишев И.Г. Фармакоэкономическая оценка применения аналогов ЛГРГ при лечении рака предстательной железы в России: обоснование для льготного обеспечения. Клин. и эксперим. Урология, 2010, 3: 76-83
9. Van Poppel H., Nilsson S. Testosterone surge: rationale for gonadotropin-releasing hormone blockers? Urology. 2008; 71: 1001-1006
10. Simon B.E., Hoffman S., Kahn S. Classification and surgical correction of gynecomastia. Plast. Reconstr. Surg., 1973, 41: 378-383
11. Ryssell H., Germann G., Köllensperger E. Die plastisch chirurgische Therapie der Gynäkomastie nach antihormoneller Therapie bei Prostatakarzinom. Urologe, 2008; 47: 467-471
12. Smith M.R., Boyce S.P., Moyneur E. Risk of clinical fracture after gonadotropin-releasing hormone agonist therapy for prostate cancer. J.Urol., 2006; 175: 136-139
13. Daniell H.W., Dunn S.R., Ferguson D.W. Progressive osteoporosis during androgen deprivation therapy for prostate cancer. J.Urol., 2000; 163: 181-186
J.Urol., 2000; 163: 181-186
14. Iversen P., Johansson J.E., Lodding P. Bicalutamide (150mg) versus placebo as immediate therapy alone or as adjuvant to the therapy with curative intent for largely non-metastatic prostate cancer: 5.3-year median follow-up from the Scandinavian Prostate Cancer Group Study. J.Urol., 2004; 172: 1871-76
15. Sharifi N., Dahut W.L., Steinberg S.M. A retrospective study of the time to clinical endpoints for advanced prostate cancer. B.J.U.Int., 2005; 96(7): 985-9
16. Schröder F.N., Tombal B., Miller K., Boccon-Gibod L., Shore N.D. Changes in alkaline phosphatase levels in patients with prostate cancer receiving degarelix or leuprolide: results from a 12-month, comparative, phase III study. BJU. Int., 2010; 106: 182-187
17. Пушкарь Д.Ю., Бормотин А.В., Говоров А.В., Опыт применения препарата дегареликс в лечении больных раком предстательной железы. Онкоурология. Материалы VI Конгресса РООУ. Москва. 2011, стр. 129-150.
В начало статьи
Антагонисты ГнРГ — обзор
ЭКО естественного цикла
Этот минималистичный подход основан на использовании эндогенного ФСГ для стимуляции развития монофолликулов и запуска окончательного созревания ооцитов либо спонтанным выбросом ЛГ, либо введением ХГЧ. Ранние подходы, основанные на первом, требовали интенсивного мониторинга цикла, который ложился значительной нагрузкой как на пациентов, так и на клинику. Первая большая опубликованная серия также подчеркнула низкую эффективность этого подхода.Из 162 циклов лечения только 89 (55%) достигли переноса эмбрионов и только 9 (5,6% за начатый цикл) привели к живорождению (Zayed et al., 1997).
В ответ на эти неутешительные результаты, а также на логистические проблемы, связанные с мониторингом цикла таким образом, было предложение запустить окончательное созревание ооцитов путем введения инъекции ХГЧ, имитирующей всплеск ЛГ. Последующий обширный обзор, в котором анализировалась эффективность лечения нивкр в 20 исследованиях, опубликованных в период с 1989 по 2001 гг. И включавших 1800 циклов, показал, что скорость успешного восстановления ооцитов сильно различалась между исследованиями (30–96%) (Pelinck et al., 2002).
Ретроспективный обзор, сравнивающий результаты после спонтанного всплеска ЛГ или с использованием инъекции ХГЧ, показал умеренный предел преимущества после первого. В группе ЛГ (534 цикла) яйца собирали в 81% циклов, тогда как в группе ХГЧ (241 цикл) это было 76% (Lenton, 2007). Более того, рандомизированное клиническое исследование лечения внутриматочной инсеминации показало, что частота продолжающихся беременностей была значительно выше (23% против 11%) при спонтанных циклах по сравнению с циклами, запускаемыми ХГЧ (Kyrou et al., 2012).
Эти возможные различия необходимо сопоставить с неудобством мониторинга ЛГ два раза в день, и большинство клиник предпочитают запуск ХГЧ, поскольку он позволяет определить время извлечения ооцитов и удобен как для пациентов, так и для персонала клиники. Однако риск преждевременной овуляции остается проблемой, и это привело к развитию «модифицированных» естественных циклов. Они по-прежнему полагаются на эндогенный ФСГ для стимуляции роста одного фолликула, но, как и в режимах мягкой стимуляции, используют антагонисты ГнРГ для предотвращения преждевременного выброса ЛГ, тем самым уменьшая риск преждевременной овуляции и позволяя запускать экзогенный ХГЧ в удобное время таким образом значительно упрощается планирование извлечения ооцитов.В пилотном исследовании, в котором антагонисты ГнРГ вводились ежедневно с момента, когда ведущий фолликул достигал 12–14 мм, и одновременно вводились ежедневные дозы 150 МЕ чМГ для поддержания стимуляции фолликулов (Rongieres-Bertrand et al., 1999). Из 44 циклов у пациенток младше 37 лет 91% закончился извлечением ооцитов, 50% — переносом эмбрионов и было 5 (11,4%) продолжающихся беременностей. Эти результаты были сочтены достаточно обнадеживающими, чтобы этот новый протокол стал предпочтительным методом лечения для многих центров, предлагающих «естественный» цикл ЭКО.
В исследовании, сравнивающем результаты после модифицированного нивк и традиционного ЭКО у 134 пациенток в возрасте до 35 лет, 56% циклов нкИВФ привели к переносу эмбрионов в 15% случаев клинической беременности по сравнению с 45% после традиционной стимуляции (Phillips et al. , 2007). У пожилых пациентов (от 35 до 38 лет) соответствующие показатели были намного ниже — 3,7% по сравнению с 34% соответственно. Авторы пришли к выводу, что, хотя при использовании модифицированного нцИВФ частота отмены очень высока, это может быть компенсировано тем фактом, что мягкий вариант лечения менее сложен для пациентов, может повторяться каждый месяц и стоит меньше.Самая большая серия публикаций по модифицированному нцИВФ, опубликованная Pelinck et al. (2007) сообщили об итогах 1048 циклов на кумулятивной основе у пациентов, которым было предложено до 9 циклов лечения. Частота продолжающейся беременности за цикл составляла 7,9%, но в совокупности достигла 44,4%.
Хотя на сегодняшний день нет значимых исследований, сравнивающих немедикаментозный естественный цикл с протоколом «модифицированного» естественного цикла ЭКО на основе антагонистов ГнРГ, доступные данные показывают, что общий результат цикла аналогичен протоколам, в которых для запуска последнего используется только экзогенный ХГЧ. созревание ооцитов.Это может быть объяснено сообщениями об ограниченной способности антагонистов ГнРГ полностью предотвращать преждевременные выбросы ЛГ в контексте нестимулированных курсов с относительно низким уровнем стероидов. Действительно, было высказано предположение, что может потребоваться повышенная доза антагониста ГнРГ, чтобы полностью предотвратить возникновение всплесков ЛГ, и, учитывая относительно ограниченное предлагаемое преимущество, экономическая эффективность этого подхода обсуждается (Reyftman et al., 2007). В небольшом исследовании с участием восьми добровольцев, получавших трансдермальный E2 с ежедневным совместным лечением антагонистами GnRH или без него (Messinis et al., 2010), антагонисты ГнРГ были не в состоянии блокировать возникновение выброса ЛГ, вызванного надфизиологическими уровнями E2. Было высказано предположение, что антагонисты GnRH ведут себя по-разному во время стимуляции яичников и нестимулированных циклов с дополнительной ролью других эндокринных факторов, таких как предполагаемый фактор ослабления выброса гонадотропина (Messinis et al., 2010).
Систематический обзор эффективности ЭКО естественного цикла (Pelinck et al., 2002) суммировал результаты 20 исследований, включающих в общей сложности 1800 циклов нцЭКО.Этот обзор включал исследования, в которых ХГЧ был единственным лекарством, используемым для индукции созревания ооцитов, и где можно было рассчитать частоту продолжающихся беременностей на начатый цикл на основе опубликованных данных. Этот обзор пришел к выводу, что только 45,5% начатых циклов достигли переноса эмбриона, что привело к 7,2% продолжающейся беременности на начатый цикл. Тем не менее, наблюдались большие различия между исследованиями, и показатели переноса эмбрионов и продолжающейся беременности за начатый цикл колебались между 22% –80% и 0% –16%, соответственно.Авторы утверждали, что дальнейшие усовершенствования, такие как использование антагонистов GnRH для контроля всплесков ЛГ или NSAID для предотвращения преждевременной овуляции, могут еще больше повысить эффективность лечения ncIVF, но дополнительная ценность этих вмешательств еще предстоит продемонстрировать.
Совсем недавно Roesner et al. (2014) проанализировали 5-летний опыт своего центра в Германии, в котором использовался подход ЭКО естественного цикла, в котором для запуска окончательного созревания ооцитов вводился только ХГЧ, и сравнили его с опубликованными результатами 28 исследований нивФ, опубликованными в период с 1995 по 2012 год.Частота клинической беременности на перенос эмбриона широко варьировала от 10% до 56%; цифры согласуются с данными, полученными Pelinck et al. (10% –50%). В течение 10-летнего периода, который разделяет публикация этих двух обзоров литературы, не было заметного улучшения общей эффективности лечения ЭКО естественным циклом.
Общая низкая эффективность ЭКО естественного цикла может быть улучшена путем повторения последовательных попыток лечения. В ряде исследований сообщается о совокупных показателях успеха после (модифицированного) подхода естественного цикла.В более раннем исследовании в Великобритании сообщалось о 181 цикле, проведенном у 52 женщин с бесплодием (Nargund et al., 2001). Хотя уровень живорождений за цикл составлял всего 8,8%, по сообщениям, при выполнении четырех попыток лечения совокупный уровень живорождений составил 32%. В большом исследовании из Гронингена сообщается о совокупном исходе 1048 циклов модифицированного ЭКО естественного цикла (mncIVF), выполненных у 256 пациентов (Pelinck et al., 2007). Участникам в возрасте до 37 лет было предложено максимум 9 циклов, хотя в среднем 4.Была предпринята 1 попытка. Сообщалось о продолжающихся беременностях 7,9% за цикл, но совокупные показатели достигли 44,4%. Эти данные дополнительно подтверждают идею о том, что модифицированный нивк ЭКО может представлять собой ценную альтернативу лечению традиционной стимуляции яичников, когда результаты рассматриваются в течение всего курса лечения, а не цикла.
В недавно опубликованном 3-летнем когортном исследовании также сообщалось о совокупном успехе программы, основанной исключительно на нивктивном оплодотворении и минимальной стимуляции яичников (Bodri et al., 2014). Хотя эта когорта представляла собой смесь различных подходов к мягкому лечению, ЭКО естественным циклом по-прежнему составляло 57% всех попыток лечения. Общий кумулятивный коэффициент живорождения был благоприятным у молодых пациентов (65% и 60% у пациентов <35 и <38 лет соответственно), все еще приемлемым для среднего возраста (39% для пациентов в возрасте от 38 до 40 лет) и постепенно снижается у пациентов с бесплодием старше 40 лет. Более того, плато также было обнаружено после примерно четырех-шести циклов лечения.
Недавнее исследование, проведенное на основе регистров в США, дало более глубокое понимание эффективности лечения нвивФ в различных возрастных группах. В обзоре представлены данные обо всех 795 нестимулированных циклах ЭКО, которые были зарегистрированы в базе данных SART (Society for Assisted Reproductive Technologies) в течение 2006 и 2007 годов (Gordon et al., 2013). Тем не менее, среднее количество нестимулированных циклов на каждый центр отчетности было <10 в год и, следовательно, представляло лишь небольшую часть (1,5%) всех циклов лечения, проведенных в каждом центре.Ограниченный опыт и отобранная (с плохим прогнозом) популяция могли отрицательно повлиять на сообщаемые результаты. Действительно, многие клиники будут предлагать ЭКО естественного цикла в первую очередь пациентам с плохим прогнозом, пожилым пациентам с уменьшенным овариальным резервом и плохим качеством яйцеклеток, для которых стимулированное ЭКО не представляет особой ценности.
При хорошем прогнозе результаты лечения могут быть лучше. Авторы SART-анализа сообщили, что частота переноса эмбрионов и живорождений за начальный цикл у пациентов <35 лет составила 54% и 15%, соответственно, снизившись до 42% и 9% у пациентов в возрасте 38–40 лет и далее у пациентов. > 40 лет.Однако по сравнению со стимулированным ЭКО частота имплантации на эмбрион в целом была выше, что свидетельствует о некоторых преимуществах избежания супрафизиологических уровней эстрадиола, связанных со стимуляцией яичников. Взятые вместе, эти данные позволяют предположить, что нивкр следует рассматривать у более молодых пациентов (<38 лет), а не ограничивать его только пожилыми пациентами, у которых все другие варианты лечения оказались неэффективными.
Приведенные выше результаты, полученные из реестра США, были подтверждены недавним ретроспективным анализом 469 циклов ЭКО естественного цикла, выполненных у 164 плохо ответивших пациентов (Polyzos et al., 2012). По сравнению со стимулированными циклами, авторы обнаружили, что перенос эмбрионов и коэффициент живорождения были значительно снижены, и пришли к выводу, что ЭКО естественного цикла не приносит какой-либо существенной пользы для этой группы.
Продолжает встречаться ряд проблем, связанных с естественным циклом, и они суммированы в таблице 1.
Таблица 1. Проблемы естественного цикла ЭКО
| Проблемы | Возможные решения | Преимущества / недостатки |
|---|---|---|
| Неконтролируемый выброс ЛГ | Гибкое планирование | Очень сложно |
| Антагонисты ГнРГ | Дополнительные затраты, неэффективно? | |
| Кломифен в малых дозах | Эндометриальный эффект? | |
| Преждевременная овуляция | НПВП | Дешевый, эффективный |
| Пустой фолликул | Промывание фолликулов | Требуется много времени |
| Незрелый ооцит | Созревание in vitro | Низкая эффективность |
| Обязательный одиночный эмбрион перенос | Оптимизированная техника переноса эмбрионов под ультразвуковым контролем | Требуется обучение |
| Низкая эффективность за цикл | Повторяющиеся циклы | Риск выпадения |
| Выбор пациентов | Ограничивает доступ пациентов |
Адаптировано из Бодри, Д.(2017). ЭКО естественного цикла со спонтанным выбросом ЛГ. В: Chian, R.C. et al. (ред.) Развитие созревания in vitro ооцитов человека . Springer International Publishing AG.
Антагонисты ГнРГ — обзор
Экспериментальная медицинская терапия
Как и ингибиторы ЦОГ-2, ряд новых медицинских методов лечения теоретически перспективен для лечения боли и воспаления, связанных с эндометриозом. Антагонисты GnRH, которые вызывают немедленное подавление продукции гонадотропинов без начального эффекта «вспышки» суперагонистов GnRH, 270 могут быть полезными в этой ситуации. 271 Селективные модуляторы рецепторов эстрогена (SERM) также могут иметь теоретическую пользу. Из-за своей частичной агонистической активности в эндометрии тамоксифен может усугубить эндометриоз. 272 Хотя было показано, что ралоксифен снижает эндометриоз в моделях этого заболевания на мышах и резус, 273 предварительные клинические испытания неожиданно показали обострение этого SERM при болевых симптомах. 274 Ингибиторы ароматазы 137 , благодаря их влиянию на производство и действие эстрогенов, были предложены в качестве новых терапевтических средств при эндометриозе. 275 Ингибиторы ароматазы были предложены в качестве новых терапевтических средств при эндометриозе. 276 Принятие должно ждать более крупных клинических испытаний. Хотя рандомизированного контролируемого исследования нет, раннее открытое, нерандомизированное исследование, подтверждающее концепцию, предполагает пользу в лечении ректовагинального эндометриоза. 277 Эндометриоз в этом анатомическом месте также экспрессирует фермент ароматазу (рис. 26.9). 138
Модуляторы рецепторов прогестерона также были исследованы. 278 Ранние опыты с высокими и низкими дозами антипрогестинового мифепристона показали уменьшение боли в области таза без видимого регресса перитонеальных имплантатов. 279,280 Антиглюкокортикоидные эффекты этого класса соединений и их способность создавать гиперэстрогенную среду эндометрия, 281 , вероятно, ограничивают клиническую применимость. Интересные недавние исследования in vitro предполагают, что часть эффективности мифепристона может быть связана с его антиоксидантными свойствами. 282 Было показано, что лиганды для другого ядерного рецептора, рецептора, активируемого пролифератором пероксисом (PPAR) -γ, снижают секрецию RANTES и IL-8 и пролиферацию эндометриоидных стромальных клеток; ингибировать активацию и миграцию макрофагов в in vitro и мышиных моделях эндометриоза 283-285 ; и для уменьшения объема эндометриоидных поражений на моделях этого заболевания на крысах и бабуинах. 286-289
Терапевтические агенты, нацеленные на выработку и действие цитокинов, также исследуются как возможные клинические дополнения к лечению эндометриоза.На модели эндометриоза на крысах была показана эффективность имиквимода (агониста толл-подобных рецепторов), рекомбинантного человеческого INF-α-2b, лефлуномида, тиазолидиндиона и левамизола. 288,290-292 Введение тиазолидионов или рекомбинантного TNF-связывающего белка-1 или моноклонального антитела c5N против TNF-α ингибировало развитие эндометриоза у модели бабуина 293-295 и блокирование действия VEGF в эндометрии мыши может быть достигнуто с использованием растворимого VEGF-R1 (sflt-1). 296 Будущее применение тех же стратегий может быть полезно при клиническом эндометриозе.
Новый подход к лечению боли, связанной с глубоким ректовагинальным эндометриозом, был представлен 297 в проспективном самоконтролируемом исследовании 11 симптоматических пациентов с ректовагинальным эндометриозом. Использование внутриматочной спирали с высвобождением левоноргестрела в течение 12 месяцев привело к значительному уменьшению дисменореи, тазовой боли и глубокой диспареунии, а также было отмечено объективное разрешение размеров ректовагинальных эндометриоидных поражений при ультразвуковом исследовании. В другом исследовании было обнаружено аналогичное облегчение боли после 6 месяцев терапии при сравнении внутриматочной спирали левоноргестрела с ГнРГ. 298 Другие агенты, которые могут иметь некоторый потенциал, если будут подтверждены в более крупных клинических испытаниях, включают небиоразлагаемый противозачаточный имплантат этоногестрела, буфалин, BAY 11-7085 (растворимый ингибитор активации NK-κB), агонисты дофамина, экстракт коры французской морской сосны, ивейнинг, рапамицин, метформин, пероральный антагонист рилизинг-гормона гонадотропина, хорионические гонадотропины человека, доксициклин, мелатонин, генистеин, аторвастатин, трихостатин А и вагинальный даназол. 299-310
Накапливаются данные, позволяющие предположить, что лекарственные растительные препараты с противовоспалительными и болеутоляющими свойствами перспективны для лечения эндометриоза. 311 Хотя их безопасность формально не проверена, в целом считается, что эти добавки не нарушают овуляцию или оплодотворение и, следовательно, могут приниматься женщинами, пытающимися зачать ребенка. Лекарственные травы и их активные компоненты проявляют подавляющие цитокины, ингибирующие ЦОГ-2, антиоксидантные, седативные и обезболивающие свойства, которые, как ожидается, будут иметь благотворное действие при эндометриозе. Хотя контролируемые рандомизированные клинические испытания проводятся редко, фитотерапия с давними традициями безопасного использования (например,g., куркумин и его аналоги) обладают множеством полезных свойств и требуют более тщательной оценки (таблица 26.3). 312
(PDF) Прямые эффекты на яичники и аспекты безопасности агонистов и антагонистов ГнРГ
Накоплениепод действием высвобождающего гормона лютеинизирующего гормона (ЛГРГ) и
аналогов ЛГРГ в клетках гранулезы крысы in vitro. Эндокринология, 107, 17-23.Clayton, R.N. и Кэтт, К.Дж. (1980) Рецептор-связывающая способность аналогов рилизинг-гормона гонадотропина-
: анализ радиолиганд-рецепторного анализа.
Эндокринология, 106, 1154 ± 1159.
Clayton, R.N. and Huhtaniemi, I.T. (1982) Отсутствие гонадотропин-высвобождающих гормонов
рецепторов в ткани гонад человека. Природа, 299, 56-59.
Clayton, R.N., Harwood, J.P. and Catt, K.J. (1979) Выделяющий гонадотропин аналог гормона
связывается с лютеиновыми клетками и ингибирует выработку прогестерона
. Природа, 282, 90 ± 92.
Conn, P.M. и Кроули, В.Ф. (1991) Обзорная статья: Гонадотропин-высвобождающий гормон
и его аналоги.Новый англ. J. Med., 324, 93-103.
Корбин А. и Битти К.В. (1975) Посткоитальные контрацептивные и утеротрофические
эффекты высвобождающего гормона лютеинизирующего гормона. Endocr. Res. Commun.
2, 445 ± 458.
Корбин А. и Бекс Ф.Дж. (1981) Релизинг-гормон лютеинизирующего гормона
Агонистывызывают овуляцию у гипофизэктомированных крыс с проэстральной стадией: прямой эффект на яичники
. Life Sci., 29, 185 ± 192.
Декель, Н. и Шалги, Р. (1987) Оплодотворение in vitro ооцитов крысы, подвергающихся созреванию
в ответ на аналог GnRH.J. Reprod. Fertil., 80, 531 ±
535.
Dicker, D., Goldman, J.A., Vagman, I. et al. (1989) Исход беременности
после раннего контакта матери с агонистом гормона, высвобождающим лютеинизирующий гормон
(бусерелин). Гм. Репродукция, 4, 250 ± 251.
Diedrich, K., Diedrich, C., Santos, E. et al. (1994) Подавление выброса эндогенного лютеинизирующего гормона
антагонистом гонадотропин-высвобождающего гормона
Цетрореликсом во время стимуляции яичников.Гм. Репродукция,
9, 788 ± 791.
Ditkoff, E.C., Cassidenti, D.L., Paulson, R.J. и другие. (1991) Антагонист рилизинг-гормона гонадотропина
(Nal-Glu) резко блокирует выброс лютеинизирующего гормона
, но позволяет возобновить фолликулогенез у нормальных женщин
. Являюсь. J. Obstet. Гинекол., 165, 1811 — 1817.
Dodson, W.C., Hughes, C.L., Whitesides, D.B. и другие. (1987) Влияние
ацетата лейпролида на индукцию овуляции с участием гонадотропинов
человека в менопаузе при синдроме поликистозных яичников.J. Clin. Эндокринол.
Метаб., 65, 95 ± 100.
Dodson, W.C., Myers, T., Morton, P.C. и другие. (1988) Леупролида ацетат: сыворотка
и концентрации фолликулярной жидкости и влияние на оплодотворение человека,
рост эмбрионов и накопление прогестерона гранулезо-лютеиновых клеток в
vitro. Fertil. Стерил., 50, 612 ± 617.
Дроува, С.В., Горен, И., Лапланте, Э. и др. (1990) Эстрадиол модулирует активность
протеинкиназы С в гипофизе крысы in vivo и in vitro.
Эндокринология, 126, 536 ± 544.
Duijkers, I.J.M., Klipping, C., Willemsen, W.N.P. и другие. (1998) Фармакокинетика и фармакодинамика
многократных доз антагониста гонадотропин-высвобождающего гормона Цетрореликса
у здоровых
женщин-добровольцев (1998). Гм. Репродукция, 13, 2392 ± 2398.
Ekholm, C., Hillensjo
È
, T. and Isaksson, O. (1981) Гонадотропин, высвобождающий
агонистов гормона, стимулирует мейоз и овуляцию ооцитов у
гипофизэктомированных крыс.Эндокринология, 108, 2022-2024.
Экхольм К., Кларк М.Р., Магнуссон К. и др. (1982) Овуляция, индуцированная аналогом гонадотропин-рилизинг-гормона
у гипофизэктомированных крыс
, включает простагландины. Эндокринология, 110, 288 ± 290.
Элефант, Э., Биур, Б., Блумберг-Тик, Дж. И др. (1995) Введение агониста гонадотропин-рилизинг-гормона
во время беременности: наблюдение за
28 беременных, подвергшихся воздействию трипторелина. Fertil. Стерил., 63, 1111 ± 1113.
Fabbri, R., Porcu, E., Pession, A. et al. (1996) Влияние лейпрорелина на стероидогенез
клеток преовуляторной гранулезы человека in vitro. J. Assist.
Репродукция. Генет., 13, 287 ± 292.
Fraser, H.M., Sellar, R.E., Illingworth, P.J. et al. (1996) Экспрессия мРНК рецептора GnRH
путем гибридизации in-situ в гипофизе приматов и яичниках
. Мол. Гм. Репродукция, 2, 117-121.
Фредерик, Дж. Л., Хики, М. Дж., Фрэнсис, М. и другие. (1991) Эффект
ацетата лейпролида на стероидогенез клетками гранулезы и теки in vitro.
J. In vitro Fertil. Перенос эмбрионов, 8, 230 ± 234.
Frydman, R., Cornel, C., de Ziegler, D. et al. (1991) Предотвращение преждевременного повышения уровня лютеинизирующего гормона
и прогестерона с помощью антагониста гормона
, высвобождающего гонадотропин, Nal-Glu, при контролируемой гиперстимуляции яичников.
Fertil. Стерил., 56, 923 ± 927.
Фридман Р., Cornel, C., de Ziegler, D. et al. (1992) Спонтанные выбросы лютеинизирующего гормона
можно надежно предотвратить путем своевременного введения
антагониста гонадотропин-рилизинг-гормона (Nal-Gu) в течение поздней фолликулярной фазы
. Гм. Репродукция, 7, 930 ± 933.
Furger, C., Bourrie
Â
, N., Cedard, L. et al. (1996) Гонадотропин-высвобождающий гормон
и трипторелин ингибируют индуцированный фолликулостимулирующим гормоном ответ
в первичных культивируемых гранулезно-лютеиновых клетках человека.Мол. Гм.
Репродукция, 2, 259 ± 264.
Исследовательская группа с дозированием ганиреликса (1998) Двойное слепое рандомизированное исследование с окончанием дозирования
для оценки эффективности гонадотропин-высвобождающего
антагониста гормонаганиреликса (Org 37462) для предотвращения преждевременных
выброс лютеинизирующего гормона у женщин, подвергающихся стимуляции яичников
рекомбинантным фолликулостимулирующим гормоном (Пурегон
q
). Гм.
Репродукция, 13, 3023 ± 3031.
Gartner, B., Moreno, C., Marinaro, A. et al. (1997) Случайное воздействие
ежедневного введения аналога гонадотропин-рилизинг-гормона длительного действия
и беременность в цикле экстракорпорального оплодотворения. Гм.
Репродукция, 12, 2557 ± 2559.
Гази, Д.М., Кемманн, Э. и Хаммонд, Дж. М. (1991) Нормальная беременность
Исход после раннего воздействия на мать гонадотропин-рилизинг-гормона
агонист. J. Reprod. Мед., 36, 173 ± 174.
Жигере, В., Лефевр, Ф.-А. и Labrie, F. (1981). Андрогены уменьшают LHRH
насайтах связывания в клетках передней доли гипофиза крысы в культуре. Эндокринология, 108,
350 ± 352.
Gougeon, A., Lefe
Á
vre, B. and Testart, J. (1992) Влияние гонадотропин-
-агониста высвобождающего гормона и гонадотропинов на морфометрические
характеристики популяции мелких яичников. фолликулы
яванских макак (Macaca fascicularis).J. Reprod. Fertil., 95, 567 ±
575.
Gregory, H., Taylor, C.L. и Hopkins, C.R. (1982) Лютеинизирующий гормон
высвобождается из диссоциированных клеток гипофиза путем димеризации занятых рецепторов LHRH
. Природа, 300, 269 ± 271.
Guerrero, H.E., Stein, P., Asch, R.H. et al. (1993) Эффект агониста рилизинг-гормона гонадотропина
на рецепторы лютеинизирующего гормона и стероидогенез
в клетках яичников. Fertil. Стерил., 59, 803 ± 809.
Habibi, H.R., Van Der Kraak, G., Fraser, R. et al. (1989) Влияние аналога костистого
GnRH на стероидогенез заключенными в фолликулы ооцитами gold®sh,
in vitro. Gen. Comp. Эндокринол., 76, 95 ± 105.
Har-Toov, J., Brenner, S.H., Jaffa, A. et al. (1993) Беременность во время длительной терапии агонистами гонадотропин-рилизинг-гормона
, ассоциированной с клинической псевдоменопаузой
. Fertil. Стерил., 59, 446 ± 447.
Харвуд, Дж. П., Клейтон, Р. и Кэтт, К.Дж. (1980) Гонадотропин яичников —
рецепторов рилизинг-гормона. I. Свойства и ингибирование функции лютеиновых клеток
. Эндокринология, 107, 407 ± 413.
Hazum, E. и Keinan, D. (1985) Активация гонадотропин-рилизинг-гормона
опосредуется димеризацией занятых рецепторов. Biochem. Биофиз.
Рез. Commun., 133, 449 ± 456.
Герман А., Рон-Эл Р., Голан А. и др. (1990) Частота наступления беременности и гиперстимуляция яичников
после лютеинового оплодотворения хорионическим гонадотропином человека in vitro
, стимулированного аналогом гонадотропин-рилизинг-гормона и
менотропинами.Fertil. Стерил., 53, 92 ± 96.
Герман А., Рон-Эл Р., Голан А. и др. (1992) Нарушение функции желтого тела
и другие нежелательные результаты беременностей, связанные с непреднамеренным введением агониста гонадотропина
рилизинг-гормона длительного действия
. Гм. Репродукция, 7, 465-468.
Heyward, P.M. и Кларк, И.Дж. (1995) Временное действие эстрогена на кальциевые токи
и электрофизиологические реакции на рилизинг-гормон гонадотропина
в гонадотропах овец.Neuroendocrinology, 62, 543 ±
552.
Hillensjo
È
, T. and LeMaire, W.J. (1980) Гонадотропин-высвобождающий гормон
агонистов стимулируют мейотическое созревание
закрытых фолликулов ооцитов крыс. Природа, 287, 145 ± 146.Hillensjo
È
, T., LeMaire, W.J., Clark, M.R. et al. (1982a) Эффект
гонадотропин-рилизинг-гормона (GnRH) и агонистов GnRH на накопление
прогестерона, цАМФ и простагландина в изолированных
преовуляторных фолликулах крысы.Acta Endocrinol., 101, 603 ± 610.
Hillensjo
È
, T., Magnusson, C., Ekholm, C. et al. (1982b) Роль кумулюсных клеток
в созревании ооцитов. Adv. Exp. Med. Биол., 147, 175 ± 188.
Hsueh, A.J.W. и Эриксон, Г. Ф. (1979) Внегипофизарное действие гонадотропин-рилизинг гормона
: прямое ингибирование стероидогенеза в яичниках
. Наука, 204, 854 ± 855.
Hsueh, A.J.W. и Джонс, P.B.C. (1981) Внегипофизарные действия
гонадотропин-рилизинг-гормона.Endocr. Ред., 2, 437 ± 460.
Hsueh, A.J.W. и Ling, N.C. (1979) Эффект антагонистического аналога гонадотропин-рилизинг-гормона
на функцию клеток гранулезы яичника.
Life Sci., 25, 1223 ± 1230.
Hsueh, A.J.W., Wang, C. и Erickson, G.F. (1980) Прямое ингибирующее действие
гонадотропин-рилизинг гормона на фолликулостимулирующий гормон
индукция рецептора лютеинизирующего гормона и активность ароматазы в клетках гранулезы крыс
.Эндокринология, 106, 1697 ± 1705.
Hsueh, A.J.W., Adashi, E.Y., Tucker, E. et al. (1983) Относительные силы
516 R.M.J. Jansens et al.
Новые аспекты ADT при распространенном раке простаты и возрастающая роль антагонистов GnRH
Heidenreich A, Bastian PJ, Bellmunt J, Bolla M, Joniau S, Mason MD et al . Рекомендации по раку простаты. 2012; Доступно по адресу: http://www.uroweb.org/gls/pdf/08%20Prostate%20Cancer_LR%20March%2013th%202012.pdf. По состоянию на апрель 2012 г.
Национальные комплексные онкологические сети (NCCN) Clinical Practice Guidelines in Oncology ™. Рак простаты . Национальная всеобъемлющая онкологическая сеть: Форт Вашингтон, Пенсильвания, версия 2, 2012 г. Доступно по адресу: http://www.nccn.org/professionals/physician_gls/pdf/prostate.pdf. По состоянию на апрель 2012 г.
Payne H, Mason M. Андрогенная депривационная терапия в качестве адъювантной / неоадъювантной радиотерапии при локализованном и местно-распространенном раке простаты с высоким риском: последние разработки. Br J Cancer 2011; 105 : 1628–1634.
Артикул CAS PubMed PubMed Central Google ученый
Ли WR. Роль андрогенной депривации в сочетании с брахитерапией простаты. Урология 2002; 60 (3 приложение 1): 39–44.
Артикул Google ученый
Зиннер Н.Р., Бидаир М, Сентено А, Томера К.Сходная частота всплеска тестостерона после повторных инъекций гозерелина (золадекс) 3,6 мг и 10,8 мг: результаты рандомизированного открытого исследования. Урология 2004; 64 : 1177–1181.
Артикул Google ученый
Sharifi N, Gulley JL, Dahut WL. Обновленная информация о андрогенной депривационной терапии рака простаты. Endocr Relat Cancer 2010; 17 : R305 – R315.
Артикул CAS PubMed PubMed Central Google ученый
Damber J-E.Эндокринная терапия рака простаты. Acta Oncologica 2005; 44 : 605–609.
Артикул CAS Google ученый
Huhtaniemi I, White R, McArdle CA, Persson BE. Улучшат ли антагонисты ГнРГ лечение рака простаты? Trends Endocrinol Metab 2009; 20 : 43–50.
Артикул CAS Google ученый
Драдж-Коутс Л.Блокаторы ГнРГ: меняющаяся парадигма в лечении рака простаты. Int J Урологический сестринский уход 2009; 3 : 85–92.
Артикул Google ученый
Ван Поппель Х. Агонисты LHRH против антагонистов GnRH для лечения рака простаты. Бельгийский J Med Oncol 2010; 4 : 18–22.
Google ученый
Klotz L, Boccon-Gibod L, Shore ND, Andreou C, Persson BE, Cantor P et al .Эффективность и безопасность дегареликса: 12-месячное сравнительное рандомизированное открытое исследование фазы III в параллельных группах у пациентов с раком простаты. BJU Int 2008; 102 : 1531–1538.
Артикул CAS Google ученый
Van Poppel H, Tombal B, de la Rosette JL, Persson BE, Jensen JK, Kold Olesen T. Дегареликс: новый блокатор рецепторов гонадотропин-рилизинг-гормона (ГнРГ) — результат 1-летнего многоцентрового рандомизированного исследования фазы 2 по поиску доз при лечении рака простаты. евро Урол 2008 г .; 54 : 805–813.
Артикул CAS Google ученый
Belanger A, Brochu M, Cliche J. Уровни стероидных глюкуронидов в плазме у интактных и кастрированных мужчин с раком простаты. J Clin Endocrinol Metab 1986; 62 : 812–815.
Артикул CAS Google ученый
Tomic R. Функция гипофиза после орхиэктомии у пациентов, получавших или не получавших ранее лечение эстрогенами по поводу рака простаты. J Endocrinol Invest 1987; 10 : 479–482.
Артикул CAS Google ученый
Varenhorst E, Wallentin L, Carlström K. Влияние орхидэктомии, эстрогенов и ципротерона ацетата на концентрацию тестостерона, ЛГ и ФСГ в плазме у пациентов с карциномой простаты. Scand J Urol Nephrol 1982; 16 : 31–36.
Артикул CAS Google ученый
Andò S, Giacchetto C, Canonaco M, Aquila S, Valenti A, Beraldi E и др. .Влияние кастрации на уровни андростендиона, тестостерона и дигидротестостерона в плазме у взрослых самцов крыс. Horm Res 1986; 23 : 122–127.
Артикул Google ученый
Labrie F, Bélanger A, Luu-The V, Labrie C, Simard J, Cusan L et al . Агонисты гонадотропин-рилизинг-гормона в лечении рака простаты. Endocr Ред. 2005; 26 : 361–379.
Артикул CAS Google ученый
Bhasin S, Berman N, Swerdloff RS.Фолликулостимулирующий гормон (ФСГ) ускользает во время лечения хроническим агонистом гонадотропин-рилизинг-гормона (ГнРГ) и тестостероном. Дж. Андрол 1994; 15 : 386–391.
CAS PubMed Google ученый
Wong SL, Lau DT-W, Baughman SA, Menchaca D, Garnick MB. Фармакокинетика и фармакодинамика абареликса, антагониста гонадотропин-рилизинг гормона, после подкожной непрерывной инфузии у пациентов с раком простаты. Clin Pharmacol Ther 2003; 73 : 304–311.
Артикул CAS Google ученый
Гарник М.Б., Кэмпион М. Abarelix Depot, антагонист GnRH, v суперагонисты LHRH при раке простаты: дифференциальные эффекты на фолликулостимулирующий гормон. Учебная группа Abarelix Depot. Мол Урол 2000; 4 : 275.
CAS PubMed Google ученый
Малер С.Вспышка болезни — проблема? Cancer 1993; 72 : 3799–3802.
Артикул CAS Google ученый
Tombal B, Berges R. Оптимальный контроль тестостерона: подход на основе клинического случая современной андрогенной депривационной терапии. Eur Urol Suppl 2008; 7 : 15–21.
Артикул CAS Google ученый
Томбал Б.Соответствующая кастрация агонистами рилизинг-гормона лютеинизирующего гормона (ЛГРГ): каков оптимальный уровень тестостерона? Eur Urol Suppl 2005; 4 : 14–19.
Артикул CAS Google ученый
Morote J, Orsola A, Planas J, Trilla E, Raventos CX, Cecchini L и др. . Переопределение клинически значимых уровней кастрации у пациентов с раком простаты, получающих непрерывную терапию андрогенной депривацией. Дж Урол 2007; 178 : 1290–1295.
Артикул CAS Google ученый
Монгиат-Артус П., Тейяк П. Абареликс: первый антагонист гонадотропин-рилизинг-гормона для лечения рака простаты. Expert Opin Pharmacother 2004; 5 : 2171–2179.
Артикул CAS Google ученый
Perachino M, Cavalli V, Bravi F.Уровни тестостерона у пациентов с метастатическим раком простаты, получавших терапию лютеинизирующим гормон-рилизинг-гормоном: прогностическое значение? BJU Int 2010; 105 : 648–651.
Артикул CAS Google ученый
Малер С, Верхелст Дж, Чабан М, Денис Л. Значения пролактина и гонадотропина гипофиза и реакция на острую проблему высвобождения лютеинизирующего гормона (LHRH) у пациентов, проходящих длительное лечение депо аналогом LHRH. Cancer 1991; 67 : 557–559.
Артикул CAS Google ученый
Хан М.С., О’Брайен А. Оценка фармакокинетики и фармакодинамики лейпрорелина ацетата 3M-депо у пациентов с запущенной и метастатической карциномой простаты. Урол Инт 1998; 60 : 33–40.
Артикул CAS Google ученый
Huhtaniemi I, Venho P, Jacobi G, Rannikko S.Ответ уровней циркулирующих гонадтропинов на лечение агонистами GnRH при раке простаты. Дж. Андрол 1991; 12 : 46–53.
CAS PubMed Google ученый
Бен-Йозеф Э, Ян С. И, Джи ТХ, Бидарт Дж. М., Гард С. В., Чопра Д. П. и др. . Клетки гормонорезистентного рака предстательной железы экспрессируют функциональный рецептор фолликулостимулирующего гормона (ФСГР). J Urol 1999; 161 : 970–976.
Артикул CAS Google ученый
Хухтаниеми I. Канцерогены гонадотропины — критический обзор клинических и экспериментальных данных. Mol Cell Endocrinol 2010; 329 : 56–61.
Артикул CAS Google ученый
Раду А., Пишон С., Кампаро П., Антуан М., Аллори Y, Кувелар А. и др. . Экспрессия рецептора фолликулостимулирующего гормона в кровеносных сосудах опухоли. N Engl J Med 2010; 363 : 1621–1630.
Артикул CAS Google ученый
Mariani S, Salvatori L, Basciani S, Arizzi M, Franco G, Petrangeli E et al . Экспрессия и клеточная локализация рецептора фолликулостимулирующего гормона в нормальной простате человека, доброкачественной гиперплазии предстательной железы и раке простаты. Дж Урол 2006; 175 : 2072–2077.
Артикул CAS Google ученый
Портер А.Т., Бен-Йозеф Э.Гуморальные механизмы при раке простаты: роль ФСГ. Урол Онкол 2001; 6 : 131–138.
Артикул CAS Google ученый
Canon JG, Kraj B, Sloan G. Фолликулостимулирующий гормон способствует экспрессии RANK на моноцитах человека. Цитокин 2011; 53 : 141–144.
Артикул CAS Google ученый
Beer TM, Garzotto M, Eilers KM, Lemmon D, Wersinger EM.Ориентация на ФСГ при андроген-независимом раке простаты: абареликс при прогрессировании рака простаты после орхиэктомии. Урология 2004; 63 : 342–347.
Артикул Google ученый
Beer TM, Garzotto M, Eilers KM, Lemmon D. Фаза II исследования депо абареликса для андроген-независимого прогрессирования рака простаты во время терапии агонистами гонадотропин-рилизинг-гормона. Дж Урол 2003; 169 : 1738–1741.
Артикул CAS Google ученый
Пиво TM. Экспериментальное использование антагонистов ГнРГ в качестве гормональной терапии второй линии. Ред. Урол 2004; 6 (Дополнение 7): S33 – S38.
PubMed PubMed Central Google ученый
Дебрюйн Ф., Бхат Дж., Гарник МБ. Абареликс для инъекционной суспензии: первый в своем классе антагонист гонадотропин-рилизинг-гормона при раке простаты. Future Oncol 2006; 2 : 677–696.
Артикул CAS Google ученый
Специальная европейская фармацевтика. Пленаксис. Новый препарат от рака простаты. Доступно по адресу: http://www.specialityeuropeanpharma.com/sepproducts.html. По состоянию на ноябрь 2011 г.
Broqua P, Riviere PJ, Conn PM, Rivier JE, Aubert ML, Junien JL. Фармакологический профиль нового мощного антагониста гонадотропин-рилизинг-гормона длительного действия: дегареликса. J Pharmacol Exp Ther 2002; 301 : 95–102.
Артикул CAS Google ученый
Koechling W, Hjortkjaer R, Tankó LB. Дегареликс, новый антагонист ГнРГ, вызывает минимальное высвобождение гистамина по сравнению с цетрореликсом, абареликсом и ганиреликсом в модели ex vivo образцов кожи человека. Br J Clin Pharmacol 2010; 70 : 580–587.
Артикул CAS PubMed PubMed Central Google ученый
Gittelman M, Pommerville PJ, Persson BE, Jensen JK, Olsen TK.1-летнее открытое рандомизированное исследование фазы II по подбору доз дегареликса, нового блокатора рецепторов гонадотропин-рилизинг-гормона (GnRH), в лечении рака простаты в Северной Америке. Дж Урол 2008; 180 : 1986–1992.
Артикул CAS Google ученый
Kuhn JM, Billebaud T, Navratil H, Moulonguet A, Fiet J, Grise P et al . Профилактика преходящих побочных эффектов аналога гонадотропин-рилизинг гормона (бусерелина) при метастатической карциноме простаты путем введения антиандрогена (нилутамида). N Engl J Med 1989; 321 : 413–418.
Артикул CAS Google ученый
Андерсон Дж. Роль монотерапии антиандрогенами в лечении рака простаты. BJU Int 2003; 91 : 455–461.
Артикул CAS Google ученый
Томбал Б., Миллер К., Боккон-Гибод Л., Шрдер Ф., Шор Н., Кроуфорд ЭД и др. .Дополнительный анализ вторичной конечной точки частоты биохимических рецидивов в исследовании фазы 3 (CS21), сравнивающем дегареликс 80 мг с лейпролидом у пациентов с раком простаты, с разбивкой по исходным характеристикам. евро Урол 2010; 57 : 836–842.
Артикул CAS Google ученый
Шредер Ф.Х., Томбал Б., Миллер К., Боккон-Гибод Л., Шор Н.Д., Кроуфорд ЭД и др. . Изменения уровней щелочной фосфатазы у пациентов с раком простаты, получающих дегареликс или лейпролид: результаты 12-месячного сравнительного исследования III фазы. BJU Int 2010; 106 : 182–187.
Артикул CAS Google ученый
Кроуфорд Э.Д., Томбал Б., Миллер К., Боккон-Гибод Л., Шредер Ф., Шор № и др. . Расширенное исследование фазы III с переходом от лейпролида к дегареликсу в одной группе: сравнение агониста и антагониста гонадотропин-рилизинг-гормона на рак простаты. Дж Урол 2011; 186 : 889–897.
Артикул CAS Google ученый
Shore N, Moul J, Crawford ED, van der Meulen E, Olesen T., Persson B.Выживаемость без прогрессирования (ВБП) с простат-специфическим антигеном (ПСА): сравнение дегареликса и лейпролида у пациентов с раком простаты. J Clin Oncol 2011; 29 (доп. 7): 12.
Артикул Google ученый
Boccon-Gibod L, van der Meulen E, Persson B.E. Обновленная информация об использовании антагонистов гонадотропин-рилизинг-гормона при раке простаты. Ther Adv Urol 2011; 3 : 127–140.
Артикул CAS PubMed PubMed Central Google ученый
Ока Д., Сиба М., Араи Й, Накаяма М., Такаяма Х., Иноуэ Х. и др. . Кожные реакции на 3-месячную терапию агонистами лютеинизирующего гормона-рилизинг-гормона депо. JMAJ 2006; 49 : 48–54.
Google ученый
Crawford ED, Moul JW, Shaw ND, Oleson TK, Persson B.E.Переход от лейпролида к дегареликсу по сравнению с непрерывным лечением дегареликсом: влияние на долгосрочное регулирование простат-специфического антигена. Дж Урол 2010; 183 (доп.): E262, аннотация 670.
Google ученый
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). Сообщение FDA по безопасности лекарственных средств 10-20-2010. Доступно по адресу: http://www.fda.gov/Drugs/DrugSafety/ucm229986.htm. По состоянию на ноябрь 2011 г.
Levine GN, D’Amico AV, Berger P, Clark PE, Eckel RH, Keating NL et al .Андрогенная депривация при раке простаты и риске сердечно-сосудистых заболеваний: научный совет Американской кардиологической ассоциации, Американского онкологического общества и Американской урологической ассоциации: одобрен Американским обществом радиационной онкологии. Тираж 2010 г .; 121 : 833–840.
Артикул PubMed PubMed Central Google ученый
Китинг Н., О’Мэлли А.Дж., Смит М.Р. Диабет и сердечно-сосудистые заболевания во время терапии андрогенной депривации рака простаты. J Clin Oncol 2006; 24 : 4448–4456.
Артикул CAS Google ученый
Алибхай С.М., Дуонг-Хуа М., Сутрадхар Р., Флешнер Н.Э., Вард П., Чунг А.М. и др. . Влияние андрогенной депривации на сердечно-сосудистые заболевания и диабет. J Clin Oncol 2009; 27 : 3452–3458.
Артикул PubMed PubMed Central Google ученый
Смит М., Клотц Л., Перссон Б. Е., Олесен Т. К., Уайлд А. А..Сердечно-сосудистая безопасность дегареликса: результаты 12-месячного сравнительного рандомизированного открытого исследования фазы III параллельной группы у пациентов с раком простаты. Дж Урол 2010; 184 : 2313–2319.
Артикул CAS PubMed PubMed Central Google ученый
Smith MR, Klotz L, van der Meulen E, Colli E, Tankó L. Блокаторы гонадотропин-рилизинг-гормона и риск сердечно-сосудистых заболеваний: анализ проспективных клинических испытаний дегареликса. Дж Урол 2011; 186 : 1835–1842.
Артикул CAS PubMed PubMed Central Google ученый
Маклеод Д., Зиннер Н., Томера К., Глисон Д., Фотерингем Н., Кэмпион М и др. . Фаза 3, многоцентровое, открытое, рандомизированное исследование абареликса по сравнению с ацетатом лейпролида у мужчин с раком простаты. Урология 2001; 58 : 756–761.
Артикул CAS Google ученый
Трахтенберг Дж., Гиттлман М., Стейдл С., Барзелл В., Фридель В., Пессис Д. и др. .Фаза 3, многоцентровое открытое рандомизированное исследование абареликса в сравнении с лейпролидом плюс ежедневный прием антиандрогенов у мужчин с раком простаты. Дж Урол 2002; 167 : 1670–1674.
Артикул CAS Google ученый
Селваджи Ф., Кхо ГСС, Ван Канг П., Юнг Дж.Л., Шульман CC, Валлансьен G и др. . Сравнение депо абареликса (A-D) и гозерелина (G) плюс бикалутамид (B) при распространенном раке простаты: результаты многоцентрового открытого рандомизированного исследования фазы III. Eur Urol 2001; 39 (Дополнение 5): 78.
Google ученый
Koch M, Steidle C, Brosman S, Centeno A, Gaylis F, Campion M и др. . Открытое исследование абареликса у мужчин с симптоматическим раком простаты из группы риска лечения агонистами LHRH. Урология 2003; 62 : 877–882.
Артикул Google ученый
Гарник М.Б., Моттет Н.Новая парадигма лечения рака простаты: начальная терапия абареликсом для немедленного подавления тестостерона с последующим приемом агониста высвобождающего лютеинизирующего гормона гормона. BJU Int 2011. DOI: 10.1111 / j.1464-410X.2011.10708.x.
Oefelein MG, Feng A, Scolieri MJ, Ricchiutti D, Resnick MI. Переоценка определения кастрированных уровней тестостерона: значение для принятия клинических решений. Урология 2000; 56 : 1021–1024.
Артикул CAS Google ученый
Sharma OP, Weinbauer GF, Behre HM, Nieschlag E.Вызванное агонистом гонадотропин-рилизинг-гормона (ГнРГ) начальное повышение биоактивного ЛГ и тестостерона может быть снижено дозозависимым образом антагонистом ГнРГ у приматов, не являющихся человеком. Urol Res 1992; 20 : 317–321.
Артикул CAS Google ученый
Дэниэл Х.В., Данн С.Р., Фергюсон Д.В., Ломас Г., Ниази З., Стратте П.Т. Прогрессирующий остеопороз во время терапии андрогенной депривации рака простаты. Дж Урол 2000; 163 : 181–186.
Артикул CAS Google ученый
Шагинян В.Б., Куо Ю.Ф., Фриман Дж. Л., Гудвин Дж. С.. Риск перелома после андрогенной депривации при раке простаты. N Engl J Med 2005; 352 : 154–164.
Артикул CAS Google ученый
Oefelein MG, Ricchiuti V, Conrad W, Resnick MI.Переломы скелета отрицательно коррелируют с общей выживаемостью у мужчин с раком простаты. Дж Урол 2002; 168 : 1005–1007.
Артикул Google ученый
Смит М.Р., Финкельштейн Дж.С., Макговерн Ф.Дж., Зитман А.Л., Фаллон М.А., Шенфельд Д.А. и др. . Изменения в составе тела во время терапии андрогенной депривации рака простаты. J Clin Endocrinol Metab 2002; 87 : 599–603.
Артикул CAS Google ученый
Смит М.Р., Ли Х., Натан Д.М. Чувствительность к инсулину при комбинированной андрогенной блокаде при раке простаты. J Clin Endocrinol Metab 2006; 91 : 1305–1308.
Артикул CAS Google ученый
Шахани С., Брага-Басария М, Басария С. Андрогенная депривационная терапия при раке простаты и метаболическом риске атеросклероза. J Clin Endocrinol Metab 2008; 93 : 2042–2049.
Артикул CAS Google ученый
Яннуччи Дж., Манола Дж., Гарник МБ, Бхат Дж., Бабли Дж. Влияние андрогенной депривации на показатели липидов и глюкозы в сыворотке крови натощак. Дж Урол 2006; 176 : 520–525.
Артикул Google ученый
Nguyen PL, Je Y, Schutz FA, Hoffman KE, Hu JC, Parekh A et al .Связь терапии депривации андрогенов с сердечно-сосудистой смертью у пациентов с раком простаты: метаанализ рандомизированных исследований. JAMA 2011; 306 : 2359–2366.
Артикул CAS PubMed Google ученый
Northhouse LL, Mood DW, Schafenacker A, Montie JE, Sandler HM, Forman JD и др. . Рандомизированное клиническое испытание семейного вмешательства для пациентов с раком простаты и их супругов. Cancer 2007; 110 : 2809–2818.
Артикул Google ученый
Томбал Б. Целостный подход к терапии депривации андрогенов: лечение рака, не причиняя вреда пациенту. Урол Инт 2009 г .; 83 : 373–378.
Артикул Google ученый
Гроссманн М., Гамильтон Э.Дж., Гилфиллан С., Болтон Д., Джун Д.Л., Заяк Д.Д.Состояние костей и обмена веществ у пациентов с неметастатическим раком простаты, получающих терапию по депривации андрогенов. Med J Australia 2011; 194 : 301–306.
PubMed Google ученый
Ebeling PR. Клиническая практика. Остеопороз у мужчин. N Engl J Med 2008; 358 : 1474–1482.
Артикул CAS Google ученый
Diamond TH, Higano CS, Smith MR, Guise TA, Singer FR.Остеопороз у мужчин с карциномой простаты, получающих андроген-депривационную терапию: рекомендации по диагностике и методам лечения. Cancer 2004; 100 : 892–899.
Артикул Google ученый
Смит М.Р., Эгерди Б., Эрнандес Торис Н., Фельдман Р., Таммела Т.Л., Саад Ф и др. . Деносумаб у мужчин, получающих андроген-депривационную терапию рака простаты. N Engl J Med 2009; 361 : 745–755.
Артикул CAS PubMed PubMed Central Google ученый
Saylor PJ, Smith MR. Здоровье костей и рак простаты. Prostate Cancer Prostatic Dis 2010; 13 : 20–27.
Артикул CAS Google ученый
Saylor PJ, Smith MR. Метаболические осложнения андрогенной депривации рака простаты. Дж Урол 2009; 181 : 1998–2006.
Артикул CAS PubMed PubMed Central Google ученый
Tunn U. Текущее состояние терапии с интермиттирующей андрогенной депривацией (ДИА) рака простаты: внимание к ДИА. BJU Int 2007; 99 : 19–22.
Артикул CAS Google ученый
Gomella LG, Singh J, Lallas C, Trabulsi EJ. Гормональная терапия в лечении рака простаты: научно-обоснованные подходы. Ther Adv Urol 2010; 2 : 171–181.
Артикул CAS PubMed PubMed Central Google ученый
Abrahamsson PA. Потенциальные преимущества прерывистой терапии подавлением андрогенов при лечении рака простаты: систематический обзор литературы. евро Урол 2010; 57 : 49–59.
Артикул CAS Google ученый
Shaw GL, Wilson P, Cuzick J, Prowse DM, Goldenberg SL, Spry NA и др. .Международное исследование использования интермиттирующей гормональной терапии при лечении рака простаты: метаанализ 1446 пациентов. BJU Int 2007; 99 : 1056–1065.
Артикул CAS Google ученый
Tunn U. Может ли прерывистая гормональная терапия оправдать свои ожидания? Eur Urol Suppl 2008; 7 : 752–757.
Артикул Google ученый
Calais da Silva FE, Bono AV, Whelan P, Brausi M, Marques Queimadelos A, Martin JA et al .Прерывистая андрогенная депривация при местнораспространенном и метастатическом раке простаты: результаты рандомизированного исследования фазы 3 Южно-европейской Uroncological Group. евро Урол 2009 г .; 55 : 1269–1277.
Артикул CAS Google ученый
Klotz L, O’Callaghan CJ, Ding K, Dearnaley DP, Higano CS, Horwitz EM et al . Рандомизированное исследование фазы III, сравнивающее периодическое и непрерывное подавление андрогенов у пациентов с прогрессированием уровня ПСА после радикальной терапии: NCIC CTG PR.7 / SWOG JPR.7 / CTSU JPR.7 / UK Intercontinental Trial CRUKE / 01/013. J Clin Oncol 2011; 29 (Дополнение 7): 3.
Артикул Google ученый
В НИЦЕ. Рак простаты: диагностика и лечение, 2008 г. Доступно в Интернете по адресу: www.nice.org.uk/nicemedia/live/11924/39687/39687.pdf. По состоянию на ноябрь 2011 г.
Clarke NW, Marberger M. Движение: антагонисты ГнРГ — это новый путь вперед в гормональной терапии. евро Урол 2010; 57 : 534–537.
Артикул Google ученый
Уильямс С.Г., Дюшен Г.М., Миллар Дж.Л., Пратт Г.Р. Как уровень простатспецифического антигена до лечения, так и биохимическая неудача после лечения являются независимыми предикторами общей выживаемости после лучевой терапии рака простаты. Int J Radiat Oncol Biol Phys 2004; 60 : 1082–1087.
Артикул Google ученый
Хуссейн М., Танген С.М., Хигано С., Шелхаммер П.Ф., Фолкер Дж., Кроуфорд ЭД и др. .Абсолютное значение простат-специфического антигена после андрогенной депривации является сильным независимым предиктором выживаемости при новом метастатическом раке простаты: данные исследования Southwest Oncology Group Trial 9346 (INT-0162). J Clin Oncol 2006; 24 : 3984–3990.
Артикул Google ученый
Хуссейн М., Гольдман Б., Танген С., Хигано С.С., Петрилак Д.П., Уилдинг G и др. . Прогрессирование простат-специфического антигена позволяет прогнозировать общую выживаемость пациентов с метастатическим раком простаты: данные исследований Southwest Oncology Group 9346 (Intergroup Study 0162) и 9916. J Clin Oncol 2009; 27 : 2450–2456.
Артикул PubMed PubMed Central Google ученый
Herbst KL, Coviello AD, Page ST, Amory JK, Anawalt BD, Bremner WJ. Ацилин, антагонист гонадотропин-рилизинг-гормона, подавляет гонадотропины и тестостерон в течение 15 дней после однократного приема. J Clin Endocrinol Metab 2004; 89 : 5959–5965.
Артикул CAS Google ученый
Амори Дж. К., Леонард Т. В., Пейдж СТ, О’Тул Э, Маккенна М.Дж., Бремнер В.Дж.Пероральное введение ацилина антагониста гонадолиберина в форме таблеток, усиленных GIPET, резко подавляет уровень тестостерона в сыворотке у нормальных мужчин: фармакокинетика и фармакодинамика однократной дозы. Cancer Chemother Pharmacol 2009; 64 : 641–645.
Артикул CAS PubMed PubMed Central Google ученый
Рейтер. Ключевые события, Ardana plc: Ardana plc объявляет предварительные результаты фазы II повторной дозы тевереликса LA при раке простаты.2008. Доступно по адресу: http://www.reuters.com/article/2008/04/09/idUS59548+09-Apr-2008+RNS20080409. (Проверено в декабре 2011 г.).
Festuccia C, Dondi D, Piccolella M, Locatelli A, Gravina GL, Tombolini V и др. . Озареликс, антагонист ГнРГ четвертого поколения, индуцирует апоптоз в клетках рака предстательной железы, резистентных к гормонорезистентным андрогенным рецепторам, модулируя экспрессию и активность рецепторов смерти. Простата 2010; 70 : 1340–1349.
CAS PubMed Google ученый
Gonzalez-Barcena D, Vadillo-Buenfil M, Gomez-Orta F, Fuentes Garcia M, Cardenas-Cornejo I, Graef-Sanchez A et al .Ответы на антагонистический аналог LH-RH (SB-75, цетрореликс) у пациентов с доброкачественной гиперплазией предстательной железы и раком простаты. Prostate 1994; 24 : 84–92.
Артикул CAS Google ученый
Gonzalex-Barcena D, Cardenas-Cornejo I, Vadillo-Buenfil M, Comaru-Schally AM, Cortex-Moralex A, Schally AV и др. . Антагонист высвобождающего гормона лютеинизирующего гормона цетрореликс в качестве первичной монотерапии у пациентов с распространенным раком простаты и параплегией из-за метастатической инвазии спинного мозга. Урология 1995; 45 : 275–281.
Артикул Google ученый
Агонист ГнРГ против антагониста ГнРГ среди пациентов с распространенным раком простаты и ранее существовавшим сердечно-сосудистым заболеванием
Агонист ГнРГ против антагониста ГнРГ среди пациентов с распространенным раком простаты и ранее существовавшим сердечно-сосудистым заболеванием | Практика Мы обнаружили, что вы используете блокировку рекламы.
PracticeUpdate бесплатен для конечных пользователей, но мы полагаемся на рекламу для финансирования нашего сайта. Пожалуйста, подумайте о поддержке PracticeUpdate, добавив нас в белый список для блокировки рекламы.
Познакомьтесь с
Продвинутый рак простаты
Центр передового опыта
Заинтересованы в получении еженедельных обновлений о Центре передового опыта по лечению рака простаты?
Подпишитесь сейчас!
Войти на практикуОбновить
Только зарегистрированные пользователи имеют полный доступ к контенту PracticeUpdate.
Дополнительная литература
избранных
Сравнение только простаты с лучевой терапией всего таза при раке простаты высокого и очень высокого риска
Дж.Clin. Онкол · 12 февраля 2021 г.
обновлено
избранных
Оптимальное лечение мужчины с рецидивирующим раком простаты
Случаи · 11 февраля 2021 г.
история недели
Мутационный ландшафт метастатического чувствительного к кастрации рака простаты: пересмотр теории спектра
Eur Urol · 09 февраля 2021 г.
избранных
Sipuleucel-T с радием-223 или без него у мужчин с костно-метастатическим устойчивым к кастрации раком простаты
Clin.Рак Res · 8 февраля 2021 г.
избранных
ASCO GU 2021: Рекомендации Dr.Оливер Сартор
Освещение конференций · 07 февраля 2021 г.
избранных
ASCO GU 2021: Рекомендации Dr.Брайан Льюис
Освещение конференций · 06 февраля 2021 г.
история недели
Ультрагипофракционированная и традиционная фракционированная лучевая терапия при раке простаты
Ланцет Онкол · 2 февраля 2021 г.
избранных
Системная терапия неметастатического кастраторезистентного рака простаты
Опрос · 18 января 2021 г.
история недели
Эффективность энзалутамида плюс АДТ при метастатическом гормоночувствительном раке простаты по типу метастатического распространения
Дж Урол · 14 января 2021 г.
избранных
Иммунотерапия в лечении рака простаты
Опрос · 11 января 2021 г.
избранных
Пропорция мутации сдвига рамки опухоли предсказывает ответ на иммунотерапию при раке простаты с недостаточностью восстановления несоответствия
Онколог · 31 декабря 2020 г.
обновлено
Расширенный рак простаты Расширенный рак простатыColleague Insights
Влияние лечения агонистами ГнРГ на стероидогенез и фолликулогенез в яичниках циклических мышей | Журнал исследований яичников
Whitelaw PF, Eidne KA, Sellar R, Smyth CD, Hillier SG: Экспрессия рибонуклеиновой кислоты посредника рецептора гонадотропин-рилизинг-гормона в яичнике крысы. Эндокринология 1995, 136: 172–179. 10.1210 / en.136.1.172
CAS PubMed Google ученый
Jones PB, Conn PM, Marian J: Связывание агониста гонадотропин-рилизинг-гормона с клетками гранулезы яичника крысы. Науки о жизни 1980, 27: 2125–2132. 10.1016 / 0024-3205 (80)
-4
CAS Статья Google ученый
Peng C, Fan NC, Ligier M: Экспрессия и регуляция гонадотропин-рилизинг-гормона (GnRH) и рибонуклеиновых кислот-мессенджеров рецептора GnRH в гранулезно-лютеиновых клетках человека. Эндокринология 1994, 135: 1740–1746. 10.1210 / en.135.5.1740
CAS PubMed Google ученый
Минаретцис Д., Якубовски М., Мортола Дж. Ф. Экспрессия гена рецептора гонадотропин-рилизинг-гормона в яичниках человека и гранулезно-лютеиновых клетках. Журнал клинической эндокринологии и метаболизма 1995 г., 80: 430–434.
CAS Google ученый
Hillensjo T., LeMaire WJ: Агонисты гонадотропин-рилизинг-гормона стимулируют мейотическое созревание заключенных в фолликулы ооцитов крысы in vitro . Nature 1980, 287: 145–146. 10.1038 / 287145a0
CAS Статья PubMed Google ученый
Ekholm C, Hillensjo T., Isaksson O: Агонисты гонадотропин-рилизинг-гормона стимулируют мейоз и овуляцию ооцитов у гипофизэктомированных крыс. Эндокринология 1981, 108: 2022–2024. 10.1210 / эндо-108-5-2022
CAS Статья PubMed Google ученый
Hsueh AJ, Jones PB: Внегипофизарные действия гонадотропин-рилизинг-гормона. Endocrine Review 1981, 2: 437–461. 10.1210 / edrv-2-4-437
CAS Статья Google ученый
Parborell F, Irusta G, Vitale A, Gonzalez O, Pecci A, Tesone M: антид-антагонист гонадотропин-рилизинг-гормона ингибирует апоптоз преовуляторных фолликулярных клеток в яичнике крысы. Биология репродукции 2005, 72: 659–666. 10.1095 / биолрепрод.104.034454
CAS Статья PubMed Google ученый
Conn PM, Crowley WF: Гонадотропин-рилизинг-гормон и его аналоги. Annual Review of Medicine 1994, 45: 391–405.10.1146 / annurev.med.45.1.391
CAS Статья PubMed Google ученый
Кизель Л.А., Роди А., Греб Р.Р., Силаджи А. Клиническое использование аналогов гонадолиберина. Клиническая эндокринология 2002, 56: 677–687. 10.1046 / j.1365-2265.2002.01291.x
CAS Статья PubMed Google ученый
Миллар Р.П., Лу З.Л., Поусон А.Дж., Фланаган К.А., Морган К., Модсли С.Р .: Рецепторы гонадотропин-рилизинг-гормона. Endocrine Reviews 2004, 25: 235–275. 10.1210 / er.2003-0002
CAS Статья PubMed Google ученый
Блюменфельд З., Вольф М.В.: Аналоги ГнРГ и пероральные контрацептивы для сохранения фертильности у женщин во время химиотерапии. Обновление репродукции человека 2008 г., 14: 543–552. 10.1093 / humupd / dmn022
CAS Статья PubMed Google ученый
Janssens RMJ, Brus L, Cahill DJ, Huirne JAF, Schoemaker J, Lambalk CB: Прямые эффекты на яичники и аспекты безопасности агонистов и антагонистов GnRH. Обновление репродукции человека 2000, 6: 505–518. 10.1093 / humupd / 6.5.505
CAS Статья PubMed Google ученый
Отани Т., Маруо Т., Ашитака Ю.: Множественные ингибирующие эффекты агониста лютеинизирующего гормона высвобождающего гормона на ХГЧ-зависимый стероидогенез и на ФСГ-зависимые ответы в клетках яичников in vivo и in vitro . Endocrinology Jpn 1982, 29: 597–605.
CAS Статья Google ученый
Hsueh JP: Прямое ингибирующее действие GnRH на лютеиновый рецептор LH и стероидогенез у неполовозрелых самок крыс, подвергнутых hvpophvsectomized. Эндокринология 1980, 107: 1930–1936. 10.1210 / endo-107-6-1930
Артикул PubMed Google ученый
Leung PKC, Cheng CK: GnRH как аутокринный регулятор в яичниках человека.В Яичник . Издание 2-е издание. Под редакцией: Леунг PKC и Adashi EY. Калифорния: Elsevier Academic Press; 2004: 289–304.
Google ученый
Шривастава Р.К., Кришна А., Шридаран Р.: Развитие фолликулов, стероидогенез и секреция гонадотропина в ответ на длительное лечение агонистом гонадотропин-рилизинг-гормона у крыс. Эндокринологический журнал 1995, 146: 349–357. 10.1677 / joe.0,1460349
CAS Статья PubMed Google ученый
Meijs-Roelofs HMA, Osman P, Kramer P: Развитие фолликулов яичников, ведущее к первой овуляции, сопровождающее уровни гонадотропина, по данным исследования на крысах с односторонней овариэктомией. Эндокринологический журнал 1982, 92: 341–349. 10.1677 / joe.0.0
1
CAS Статья PubMed Google ученый
Сингх П., Кришна А., Цуцуи К.: Влияние гормона, ингибирующего гонадотропин, на фолликулогенез и стероидогенез циклических мышей. Фертильность и бесплодие , в печати.
Лоури О.Н., Роузбро, штат Нью-Джерси, Фарр А.Л .: Измерение белка с помощью реагента фолин-фенол. Журнал биологической химии 1951, 193: 265–275.
CAS PubMed Google ученый
Irusta G, Parborell F, Peluffo M, Manna PR, Golzalez-Calvar SI, Calandra R, Stocco DM, Tesone M: Стероидогенный острый регуляторный белок в фолликуле яичников крыс, стимулированных гонадотропином, регулируется гонадотропином. Выпускающий агонист гормона. Биология репродукции 2003, 68: 1577–1583. 10.1095 / биолрепрод.102.009944
CAS Статья PubMed Google ученый
Каспер РФ, Йен СС: Индукция лютеолиза у человека с помощью аналога пролонгированного действия фактора высвобождения лютеинизирующего гормона. Science 1979, 205: 408–410. 10.1126 / science.377491
CAS Статья PubMed Google ученый
Clayton RN, Harwood JP, Catt KJ: Аналог гонадотропин-рилизинг гормона связывается с лютеиновыми клетками и ингибирует выработку прогестерона. Nature 1979, 282: 90–92. 10.1038 / 282090a0
CAS Статья PubMed Google ученый
Hsueh AJ, Erickson GF: Внегипофизарное действие гонадотропин-рилизинг гормона: прямое ингибирование стероидогенеза яичников. Science 1979, 204: 854–855. 10.1126 / наука.375393
CAS Статья PubMed Google ученый
Деврой П., Маннаертс Б., Смитц Дж., Коллинг Х.И.Т .: Клинические результаты пилотного исследования эффективности рекомбинантного фолликулостимулирующего гормона человека (Org 32489) в сочетании с различными схемами агонистов гонадотропин-рилизинг-гормона. Рекомбинентный ФСГ (Пурегон): доклинический и клинический опыт 1996, 99–112.
Google ученый
Альбина Дж. С., Рейнольд Л. П., Редмер Д. А.: Влияние лечения и отмены гонадотропинов на рост фолликулов, пролиферацию клеток и атрезию у овец. Биология репродукции 1996, 55: 692–702.
Google ученый
Hsueh AJ, Billig H, Tsafriri A: Атрезия яичникового фолликула — гормонально контролируемый апоптотический процесс. Endocrine Reviews 1994, 15: 707–724.
CAS PubMed Google ученый
Taylor PD, Hillier SG, Fraser HM: эффекты лечения антагонистами GnRH на развитие фолликулов и ангиогенез в яичниках приматов. Эндокринологический журнал 2004, 183: 1–17. 10.1677 / joe.1.05685
CAS Статья PubMed Google ученый
Belchetz PE, Plant TM, Nakai Y, Keogh EJ, Knobil E: Гипофизические реакции на непрерывную и периодическую доставку гипопталамического гонадотропин-рилизинг-гормона. Science 1978, 202: 631–633. 10.1126 / science.100883
CAS Статья PubMed Google ученый
Кришна А., Шривастава Р.К., Шридаран Р.: Влияние кратковременного лечения агонистом гонадотропин-рилизинг-гормона на развитие фолликулов и секрецию гонадотропинов у крыс. Эндокринные исследования 1996, 22: 299–310. 10.3109 / 0743580960
14CAS Статья PubMed Google ученый
Fraser HM, Lunn SF, Harrison DJ, Kerr JB: Лютеиновая регрессия у приматов: различные формы гибели клеток во время естественного и антагониста гонадотропин-рилизинг-гормона или лютеолиза, индуцированного аналогом простагландина. Биология репродукции 1999, 61: 1468–1479. 10.1095 / биолрепрод61.6.1468
CAS Статья PubMed Google ученый
Karnitis VJ, Townson DH, Friedman CI, Danforth DR: Рекомбинантный человеческий фолликулостимулирующий гормон стимулирует множественный рост фолликулов, но минимальное производство эстрогена у обезьян, леченных антагонистами гонадотропин-рилизинг-гормона: изучение роли лютеинизирующего гормона в фолликулярное развитие и стероидогенез. Журнал клинической эндокринологии и метаболизма 1994, 79: 91–97. 10.1210 / jc.79.1.91
CAS PubMed Google ученый
Эриксон Г.Ф., Ли Д., Садрханлоо Р., Лю XJ, Шимасаки С., Линг Н.: Внегипофизарные действия гонадотропин-рилизинг-гормона: стимуляция инсулиноподобного белка-4, связывающего фактор роста, и атрезия. Эндокринология 1994, 134: 1365–1372. 10.1210 / en.134.3.1365
CAS PubMed Google ученый
Schirman-Hildesheim TD, Bar T, Ben-Aroya N, Koch Y: Дифференциальный гонадотропин-высвобождающий гормон (GnRH) и паттерны экспрессии рибонуклеиновой кислоты посланника рецептора GnRH в различных тканях самки крысы в течение эстрального цикла. Эндокринология 2005, 146: 3401–3408. 10.1210 / en.2005-0240
CAS Статья PubMed Google ученый
Сингх П., Кришна А., Сридаран Р., Цуцуи К.: Изменения GnRH I, брадикинина и их рецепторов и GnIH в яичнике Calotes versicolor во время репродуктивного цикла. Общая и сравнительная эндокринология 2008, 159: 158–169. 10.1016 / j.ygcen.2008.08.016
CAS Статья PubMed Google ученый
Schirman-Hildesheim TD, Gershon E, Litichever N, Galiani D, Ben-Aroya N, Deke N, Koch Y: Местное производство гонадотропных гормонов в яичнике крысы. Молекулярная и клеточная эндокринология 2008, 282: 32–38. 10.1016 / j.mce.2007.11.014
CAS Статья PubMed Google ученый
Драммонд А.Е., Бейли А.Дж., Финдли Дж.К .: Рецептор эстрогена-β яичников и экспрессия мРНК: влияние развития и эстрогена. Молекулярная и клеточная эндокринология 1999, 149: 153–161. 10.1016 / S0303-7207 (98) 00247-0
CAS Статья PubMed Google ученый
Hsueh AJ: Гормональная регуляция дифференцировки культивируемых клеток гранулезы яичника. Endocrine Reviews 1984, 5: 76–127. 10.1210 / edrv-5-1-76
CAS Статья PubMed Google ученый
Лутрадис Д., Блеца Р., Аравантинос Л., Каллианидис К., Михалас С., Психойос А: Преовуляторные эффекты антагониста прогестерона мифепристона (RU486) у мышей. Репродукция человека 1991, 6: 1238–1240.
CAS PubMed Google ученый
van der Schoot P: Влияние антагониста прогестерона RU486 на активность яичников у крыс. Эндокринология 1987, 121: 1375–1382. 10.1210 / эндо-121-4-1375
CAS Статья PubMed Google ученый
Лютеинизирующие и фолликулостимулирующие гормоны
Гонадотропины: лютеинизирующие и фолликулостимулирующие гормоны
Лютеинизирующий гормон (ЛГ) и фолликулостимулирующий гормон (ФСГ) называются гонадотропинами , потому что стимулируют гонады — у мужчин, семенников, а у женщин — яичников.Они не нужны для жизни, но необходимы для воспроизводства. Эти два гормона секретируются клетками передней доли гипофиза, которые называются гонадотрофами , . Большинство гонадотрофов секретируют только ЛГ или ФСГ, но некоторые, по-видимому, секретируют оба гормона.
Как описано для гормона, моделирующего щитовидную железу, ЛГ и ФСГ представляют собой большие гликопротеины, состоящие из альфа- и бета-субъединиц. Альфа-субъединица идентична во всех трех этих гормонах передней доли гипофиза, в то время как бета-субъединица уникальна и наделяет каждый гормон способностью связывать свой собственный рецептор.
Физиологические эффекты гонадотропинов
Физиологические эффекты гонадотропинов известны только в отношении яичников и семенников. Вместе они регулируют многие аспекты функции гонад как у мужчин, так и у женщин.
Лютеинизирующий гормон
У обоих полов ЛГ стимулирует секрецию половых стероидов гонадными железами. В семенниках ЛГ связывается с рецепторами клеток Лейдига, стимулируя синтез и секрецию тестостерона. Клетки Тека в яичнике отвечают на стимуляцию ЛГ секрецией тестостерона, который превращается в эстроген соседними клетками гранулезы.
У женщин овуляция зрелых фолликулов на яичнике индуцируется сильным всплеском секреции ЛГ, известным как преовуляторный выброс ЛГ . Остаточные клетки в овулировавших фолликулах пролиферируют с образованием желтых тел, которые секретируют стероидные гормоны прогестерон и эстрадиол. Прогестерон необходим для поддержания беременности, и у большинства млекопитающих ЛГ необходим для непрерывного развития и функционирования желтого тела. Название лютеинизирующий гормон происходит от этого эффекта, вызывающего лютеинизацию фолликулов яичников.
Фолликулостимулирующий гормон
Как следует из названия, ФСГ стимулирует созревание фолликулов яичников. Введение ФСГ людям и животным вызывает «суперовуляцию» или развитие большего, чем обычно, количества зрелых фолликулов и, следовательно, увеличения количества зрелых гамет.
ФСГ также важен для производства спермы. Он поддерживает функцию клеток Сертоли, которые, в свою очередь, поддерживают многие аспекты созревания сперматозоидов.
Контроль секреции гонадотропинов
Основным регулятором секреции ЛГ и ФСГ является гонадотропин-рилизинг-гормон (ГнРГ, также известный как ЛГ-рилизинг-гормон). GnRH — это пептид из десяти аминокислот, который синтезируется и секретируется нейронами гипоталамуса и связывается с рецепторами гонадотрофов.
Как показано на рисунке справа, гонадолиберин стимулирует секрецию ЛГ, который, в свою очередь, стимулирует секрецию половых стероидов тестостерона, эстрогена и прогестерона гонадными железами.В классической петле отрицательной обратной связи половые стероиды подавляют секрецию гонадолиберина, а также, по-видимому, оказывают прямое негативное воздействие на гонадотрофов.
Эта регуляторная петля приводит к пульсирующей секреции ЛГ и, в гораздо меньшей степени, ФСГ. Количество импульсов ГнРГ и ЛГ варьируется от нескольких в день до одного или более в час. У женщин частота пульса явно связана со стадией цикла.
Многие гормоны влияют на секрецию GnRH, и положительный и отрицательный контроль над GnRH и секрецией гонадотропинов на самом деле значительно сложнее, чем показано на рисунке.Например, гонады секретируют по крайней мере два дополнительных гормона — ингибин и активин, которые избирательно ингибируют и активируют секрецию ФСГ из гипофиза.
Болезни
Снижение секреции ЛГ или ФСГ может привести к нарушению функции гонад (гипогонадизм). Это состояние обычно проявляется у мужчин как нарушение производства нормального количества сперматозоидов. У самок обычно наблюдается прекращение репродуктивных циклов.
Повышенный уровень гонадотропинов в крови обычно отражает отсутствие отрицательной обратной связи по стероидам.Удаление гонад у самцов или самок, как это обычно делается у животных, приводит к стойкому повышению уровня ЛГ и ФСГ. У людей чрезмерная секреция ФСГ и / или ЛГ чаще всего является результатом гонадной недостаточности или опухолей гипофиза. Как правило, повышенные уровни гонадотропинов сами по себе не имеют биологического эффекта.
Фармакологические манипуляции с секрецией гонадотропинов
Нормальные паттерны секреции гонадотропинов абсолютно необходимы для воспроизводства, и вмешательство, в частности, в секрецию ЛГ — широко используемая стратегия контрацепции.Таблетки для перорального приема содержат прогестин (соединение, имитирующее прогестерон), обычно в сочетании с эстрогеном. Как обсуждалось выше, прогестерон и эстроген ингибируют секрецию ЛГ, и пероральные контрацептивы эффективны, потому что они подавляют выброс ЛГ, вызывающий овуляцию.
Другой путь подавления секреции гонадотропина — блокирование рецептора GnRH. Антагонисты рецепторов GnRH обладают сильным противозачаточным действием как у мужчин, так и у женщин, но не получили широкого распространения для этой цели.
Обновлено 2018 г. Присылайте комментарии по адресу [email protected]
Венгерский перевод этой страницы был создан Эланой Павлет и доступен в венгерском переводе
Украинский перевод этой страницы сделан Еленой Червоной и доступен в украинском переводе
.
 Квалификация и опыт репродуктологов «Геном» позволяют разрабатывать индивидуальные схемы стимуляции суперовуляции, которые позволяют получить адекватный ответ яичников у женщин как «до», так и «после» 35 лет, а также у пациенток с низким фолликулярным запасом, при наличии таких заболеваниях как эндометриоз, миома матки, кисты яичников.
Квалификация и опыт репродуктологов «Геном» позволяют разрабатывать индивидуальные схемы стимуляции суперовуляции, которые позволяют получить адекватный ответ яичников у женщин как «до», так и «после» 35 лет, а также у пациенток с низким фолликулярным запасом, при наличии таких заболеваниях как эндометриоз, миома матки, кисты яичников.  Лёгкая форма СГЯ, которая неизбежна в некоторых ситуациях, не нарушает общего состояния. Пациентка может ощущать дискомфорт в области живота, лёгкое недомогание. Эти симптомы достаточно быстро корректируется без каких либо серьёзных последствий для здоровья.
Лёгкая форма СГЯ, которая неизбежна в некоторых ситуациях, не нарушает общего состояния. Пациентка может ощущать дискомфорт в области живота, лёгкое недомогание. Эти симптомы достаточно быстро корректируется без каких либо серьёзных последствий для здоровья.