Препараты железа для парентерального применения входит в группу B03AC
Анатомо-Терапевтически-Химическая (АТХ) система классификации (ATC)
Название: Препараты железа для парентерального применения
| ФерМед |  №: ЛП-001882
от 16.12.12 №: ЛП-001882
от 16.12.12 |
В каких случаях педиатр должен назначать препараты железа парентерально? | Захарова
1. UNICEF, United Nations University, WHO. Iron deficiency anemia: assessment, prevention and control. A guide for programme managers [Электронный ресурс] / Geneva: World Health Organization; 2001 (WHO/NHD/01.3). 114 p. Режим доступа: http: //www.who.int/nutrition/publications/micronutrients/anaemia_iron_deficiency/WHO_NHD_01.3/en.
2. WHO. Guideline: intermittent iron supplementation in preschool and school-age children [Электронный ресурс] / Geneva: World Health Organization, 2011.Режим доступа: http: //apps.who.int/iris/bitstream/10665/44648/1/9789241502009_eng. pdf?ua=1.
pdf?ua=1.
4. Румянцев А.Г., Захарова И.Н., Чернов В.М., Тарасова И.С., Заплатников А.Л., Коровина Н.А., Боровик Т.Э., Звонкова Н.Г., Мачнева Е.Б., Пудриков К.А. Диагностика и лечение железодефицитной анемии у детей и подростков (пособие для врачей). Под ред. А.Г. Румянцева, И.Н. Захаровой. М.: Конти Принт, 2015. 76 с. / Rumyantsev A.G., Zakharova I.N., Chernov V.M., Tarasova I.S., Zaplatnikov A.L., Korovina N.A., Borovik T.E., Zvonkova N.G., Machneva E.B., Pudrikov K.A. Diagnostics and therapy of irondeficient anemia in children and teenagers (textbook for doctors). Ed. by A.G. Rumyantsev, I.N. Zakharova, M.: Konti Print, 2015. 76 p.
5. Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 190 с./Idelson L.I. Hypochromic anemias. M.: Meditsina, 1981. 190 p.
Идельсон Л. И. Гипохромные анемии. М.: Медицина, 1981. 190 с./Idelson L.I. Hypochromic anemias. M.: Meditsina, 1981. 190 p.
6. Всероссийский консенсус по диагностике и лечению целиакии у детей и взрослых. Принят на 42-й Научной сессии ЦНИИГ (2-3 марта 2016 г.). Consilium Medicum. Педиатрия. Приложение к журналу, 2016, 1: 6-19. / All-Russian Consensus on Diagnostics and Therapy of Celiac Disease in Children and Adults. Approved at the 42nd Scientific Session of Central Scientific and Research Institute of Gastroenterology (March 2-3, 2016). Consilium Medicum. Pediatria. Appendix to Journal, 2016, 1: 6-19.
7. Grasso P. Sarcoma after intramuscular iron injection. Br. Med. J., 1973, 2: 667.
8. Greenberg G. Sarcoma after intramuscular iron injection. Br. Med.
9. Auerbach M, Ballard H, Glaspy J et al. Clinical update: intravenous iron for anaemia. Lancet, 2007, 369: 1502-1504.
10. Регистр лекарственных средств России. РЛС -2000-2016 (Энциклопедия лекарств и товаров аптечного ассортимента). Режим доступа: http://www.rlsnet.ru/. / Register of Russia’s drugs. Drugs Register – 2000 – 2016 (Encyclopedia of Drugs and Goods of Pharmacy Assortment). Access regime: http://www.rlsnet.ru.
12. Lyseng-Williamson KA, Keating GM. Ferric carboxymaltose: a review of its use in iron-deficiency anaemia. Drugs, 2009, 69(6): 739-56.
Drugs, 2009, 69(6): 739-56.
ФЕРРОКСИД (Беларусь) | СООО «Лекфарм»
Ферроксид вводят внутримышечно.
Тщательно контролируют состояние пациентов на наличие реакций гиперчувствительности во время инъекции и после каждой инъекции Ферроксида. Инъекцию делают в присутствии квалифицированного персонала, обученного оказывать помощь при анафилактических реакциях, в условиях, обеспечивающих доступ к реанимационному оборудованию. Пациентов наблюдают в течение 30 минут после инъекции.
Доза для каждого пациента рассчитывается индивидуально в зависимости от степени дефицита железа по следующей формуле:
Общий дефицит железа (мг) = Масса тела (кг) x (Целевое значение гемоглобина – действительный уровень гемоглобина) (г/л) x 0,24 * + депонированное железо (мг)
где, *Коэффициент 0,24 = 0,0034 x 0,07 x 1 000 (содержание железа в гемоглобине ≈ 0,34%/Объем крови ≈ 7% от массы тела/Коэффициент 1 000 = пересчет из г в мг).
Для пациентов с массой тела менее 35 кг: целевое значение гемоглобина = 130 г/л; депонированное железо = 15 мг/кг массы тела.
Для пациентов с массой тела 35 кг и более: целевое значение гемоглобина = 150 г/л; депонированное железо = 500 мг.
число ампул Ферроксида на курс лечения = Общий дефицит железа/100 мг.
Общее число ампул Ферроксида (100 мг/2мл) на курс лечения:
| Масса тела (кг) | Hb 60 (г/л) | Hb 75 (г/л) | Hb 90 (г/л) | Hb 105 (г/л) | ||||
|---|---|---|---|---|---|---|---|---|
| мл | амп. | мл | амп. | мл | амп. | мл | амп. | |
| 5 | 3 | 1,5 | 3 | 1,5 | 3 | 1,5 | 2 | 1 |
| 10 | 6 | 3 | 6 | 3 | 5 | 2,5 | 4 | 2 |
| 15 | 10 | 5 | 9 | 7 | 3,5 | 6 | 3 | |
| 20 | 13 | 6,5 | 11 | 5,5 | 10 | 5 | 8 | 4 |
| 25 | 16 | 8 | 14 | 7 | 12 | 6 | 11 | 5,5 |
| 30 | 19 | 9,5 | 17 | 8,5 | 15 | 7,5 | 13 | 6,5 |
| 35 | 25 | 12,5 | 23 | 11,5 | 20 | 10 | 18 | 9 |
| 40 | 27 | 13,5 | 24 | 12 | 22 | 11 | 19 | 9,5 |
| 45 | 30 | 15 | 26 | 13 | 23 | 11,5 | 20 | 10 |
| 50 | 32 | 16 | 28 | 14 | 24 | 12 | 21 | 10,5 |
| 55 | 34 | 17 | 30 | 15 | 26 | 13 | 22 | 11 |
| 60 | 36 | 18 | 32 | 16 | 27 | 13,5 | 23 | 11,5 |
| 65 | 38 | 19 | 33 | 16,5 | 29 | 14,5 | 24 | 12 |
| 70 | 40 | 20 | 35 | 17,5 | 30 | 15 | 25 | 12,5 |
| 75 | 42 | 21 | 37 | 18,5 | 32 | 16 | 26 | 13 |
| 80 | 45 | 22,5 | 39 | 19,5 | 33 | 16,5 | 27 | 13,5 |
| 85 | 47 | 23,5 | 51 | 20,5 | 34 | 17 | 28 | 14 |
| 90 | 49 | 24,5 | 43 | 21,5 | 36 | 18 | 29 | 14,5 |
Если общая доза превышает максимальную суточную дозу, необходимо разделить введение Ферроксида на несколько раз.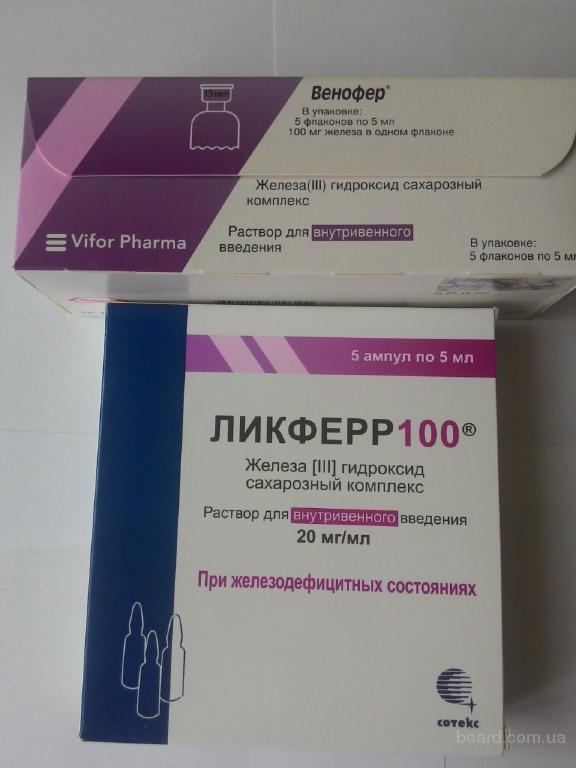 Если после 1-2 недель терапии не наблюдается нормализации гематологических параметров, необходимо пересмотреть поставленный диагноз.
Если после 1-2 недель терапии не наблюдается нормализации гематологических параметров, необходимо пересмотреть поставленный диагноз.
Стандартная дозировка:
Взрослые (включая пациентов пожилого возраста): 1-2 ампулы Ферроксида (100-200 мг железа) 2 или 3 раза в неделю в зависимости от уровня гемоглобина.
Дети (старше 4 месяцев): 0,06 мл Ферроксида /кг массы тела/день = 3 мг железа/кг массы тела/день 2 или 3 раза в неделю в зависимости от уровня гемоглобина.
Максимальная суточная доза:
Взрослые (включая пациентов пожилого возраста): 2 ампулы (4,0 мл = 200 мг железа).
Дети с массой тела до 5 кг: ¼ ампулы (0,5 мл = 25 мг железа)
Дети с массой тела от 5 до 10 кг: ½ ампулы (1,0 мл = 50 мг железа)
Дети с массой тела от 10 до 45 кг: 1 ампула (2,0 мл = 100 мг железа)
Особые группы пациентов
Пациентам с нарушениями функции печени парентеральное железо назначается с осторожностью.
Пациентам с нарушениями функции почек коррекция дозы Ферроксида не требуется.
Феррум Лек® | Сандоз в России
Препарат Феррум Лек® раствор предназначен только для внутримышечного введения. Препарат не должен вводиться в виде внутривенных инфузий или инъекций.
Препарат должен вводиться только специально обученным персоналом, умеющим распознавать и купировать признаки начинающегося анафилактического шока, в условиях доступности средств реанимации и возможности проведения комплекса противошоковых мероприятий.
Пациент должен наблюдаться по крайней мере в течение 30 минут после каждой инъекции с целью выявления признаков реакции гиперчувствительности.
Дозу препарата Феррум Лек® необходимо подбирать индивидуально в соответствии с общим дефицитом железа, который рассчитывается по следующей формуле:
Общее количество железа, которое должен получить пациент (в мг) = масса тела (кг) х (расчетный уровень гемоглобина (г/л) — реальный уровень гемоглобина (г/л)) х 0,24* + содержание депонированного железа (мг).
У пациентов с массой тела до 35 кг: расчетный уровень гемоглобина = 130 г/л и содержание депонированного железа = 15 мг/кг массы тела.
У пациентов с массой тела свыше 35 кг: расчетный уровень гемоглобина = 150 г/л и содержание депонированного железа = 500 мг.
*Фактор 0,24 = 0,0034 х 0,07 х 1000:
(содержание железа в гемоглобине = 0,34%; общий объем крови = 7% массы тела; фактор 1000 = перевод из г в мг/).
Пример:
Масса тела пациента: 70 кг
Реальная концентрация гемоглобина: 80 г/л
Общий дефицит железа = 70 х (150 — 80) х 0,24 + 500 = 1676 ̴ 1700 мг железа.
Общее количество ампул препарата Феррум Лек®, которое необходимо ввести = Общий дефицит железа (мг)/100 мг
Таблица: Расчет общего количества ампул препарата Феррум Лек®, которое необходимо ввести, в зависимости от реальной концентрации гемоглобина и массы тела
| Масса тела (кг) | Общее количество ампул Феррум Лек® для введения | |||
5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80 85 90 | Нb 60 г/л | Нb 75 г/л | Нb 90 г/л | Нb 105 г/л |
1. 5 53.0 5.0 6.5 8.0 9.5 12.5 13.5 15.0 16.0 17.0 18.0 19.0 20.0 21.0 22.5 23.5 24.5 | 1.5 3.0 4.5 5.5 7.0 8.5 11.5 12.0 13.0 14.0 15.0 16.0 16.5 17.5 18.5 19.5 20.5 21.5 | 1.5 2.5 3.5 5.0 6.0 7.5 10.0 11.0 11.5 12.0 13.0 13.5 14.5 15.0 16.0 16.5 17.0 18.0 | 1.0 2.0 3.0 4.0 5.5 6.5 9.0 9.5 10.0 10.5 11.0 11.5 12.0 12.5 13.0 13.5 14.0 14.5 | |
Если необходимая доза препарата Феррум Лек® превышает максимальную суточную дозу, введение препарата должно быть дробным (в течение нескольких дней).
Если спустя 1-2 недели после начала лечения гематологические параметры не меняются, следует провести дополнительное обследование с целью уточнения поставленного диагноза.
Расчет общей дозы для возмещения железа вследствие кровопотери
Необходимая доза препарата для компенсации железодефицита рассчитывается по формуле, приведенной ниже.
Если известно количество потерянной крови
Введение 200 мг железа внутримышечно (2 ампулы препарата Феррум Лек®) приводит к увеличению концентрации гемоглобина, которое эквивалентно 1 единице крови (400 мл крови с содержанием гемоглобина 150 г/л).
Общее количество железа, которое следует возместить (мг) = число потерянных единиц крови х 200, или необходимое число ампул препарата Феррум Лек® = число потерянных единиц крови х 2.
Если известен конечный уровень гемоглобина
Используйте следующую формулу, учитывая то, что депонированное железо возмещать не нужно.
Общее количество железа, которое должен получать пациент (в мг) = масса тела (кг) х (расчетный уровень гемоглобина (г/л) — реальный уровень гемоглобина (г/л)) х 0,24.
Пример:
Пациенту с массой тела 60 кг и дефицитом гемоглобина 10 г/л следует возместить 150 мг железа, что составляет 1 1/2 ампулы препарата Феррум Лек®.
Стандартные дозы
Детям: 0,06 мл/кг массы тела/сутки (3 мг железа/кг/сутки).
Взрослым: 1 — 2 ампулы препарата Феррум Лек® (100 — 200 мг железа), в зависимости от уровня гемоглобина.
Максимальные суточные дозы
Детям: 0,14 мл/кг массы тела в сутки (7 мг железа/кг/сутки).
Взрослым: 4 мл (2 ампулы препарата Феррум Лек®) в сутки.
Техника инъекции (см. рисунки)
Техника инъекции имеет решающее значение. В результате неправильного введения препарата могут возникнуть болевые ощущения и окрашивание кожи в месте инъекции. Описанная ниже техника вентро-ягодичной инъекции рекомендована вместо общепринятой – в верхний наружный квадрант большой ягодичной мышцы.
1. Длина иглы должна быть не менее 50 мм, а у пациентов с ожирением длина иглы должна составлять от 80 до 100 мм. Просвет иглы не должен быть слишком широким. Для детей, а также для взрослых с небольшой массой тела, иглы должны быть короче и тоньше. Для детей рекомендуют использовать иглу длиной 32 мм.
2. Место инъекции определяется следующим образом: по линии позвоночного столба на уровне, соответствующем пояснично-подвздошному сочленению зафиксируйте точку (точка А). Если пациент лежит на правом боку, расположите средний палец левой руки в точке А. Отставьте указательный палец от среднего так, чтобы он находился под линией подвздошного гребня (точка В). Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами является местом инъекции.
Если пациент лежит на правом боку, расположите средний палец левой руки в точке А. Отставьте указательный палец от среднего так, чтобы он находился под линией подвздошного гребня (точка В). Треугольник, располагающийся между проксимальными фалангами, средним и указательным пальцами является местом инъекции.
3. Инструменты дезинфицируют обычным методом. Прежде чем ввести иглу, сдвиньте кожу примерно на 2 см для того, чтобы хорошо закрыть канал прокола после извлечения иглы. Это предотвращает проникновение введенного раствора в подкожные ткани и окрашивание кожи.
4. Расположите иглу вертикально по отношению к поверхности кожи, под большим углом к точке подвздошного сочленения, чем к точке бедренного сустава.
5. После инъекции медленно извлеките иглу и прижимайте пальцем участок кожи, прилегающий к месту инъекции, примерно в течение одной минуты.
6. После инъекции пациенту необходимо подвигаться.
Препарат вводят по очереди в правую и левую ягодичные мышцы. Вскрытую ампулу необходимо использовать немедленно.
Вскрытую ампулу необходимо использовать немедленно.
Клинико-биохимические особенности некоторых комплексов железа для внутривенного введения | Абашин
1. Сельчук В.Ю., Чистяков С.С., Толокнов Б.О. и др. Железодефицитная анемия: современное состояние проблемы. Русский мед журн 2012;17:1–7.
2. Jahn M.R., Andreasen H.B., Fütterer S. et al. A comparative study of the physicochemical properties of iron isomaltoside 1000 (MonoFer®), a new intravenous iron preparation and its clinical implications. Euro J Pharm Biopharm 2011;78:480–91.
3. Crichton R.R., Danielson B.G., Geisser P. Iron therapy with special emphasis on intravenous administration, 3rd ed. Bremen: UNI-MED Verlag, Germany, 2005. P. 83.
4. Моисеев С.В. Железа карбоксимальтозат (Феринжект®) – новый внутривенный препарат для лечения железодефицитной анемии. Клин фармакол и терап 2012;21(2):2–7.
Моисеев С.В. Железа карбоксимальтозат (Феринжект®) – новый внутривенный препарат для лечения железодефицитной анемии. Клин фармакол и терап 2012;21(2):2–7.
5. Преображенская М.Е. Декстраны и декстраназы. Успехи биологической химии, т. 16. М., 1975. С. 214–235.
6. Bailie G.R., Clark J.A., Lane C.E., Lane P.L. Hypersensitivity reactions and deaths associated with intravenous iron preparations. Nephrol Dial Transplant 2005;20:1443–9. 7. Павлов А.Д., Моршакова Е.Ф., Румянцев А.Г. Эритропоэз, эритропоэтин, железо. Молекулярные и клинические аспекты. М.: ГЭОТАР-Медиа, 2011.
7. Richter A.W., Hedin H.I. Dextran hypersensitivity. Immunol Today 1982;3:132–8.
8. Ljungström K.G., Renck H. , Hedin H. et al. Hapten inhibition and dexrtan anaphylaxis Anesthesia 1988;3:729–33.
, Hedin H. et al. Hapten inhibition and dexrtan anaphylaxis Anesthesia 1988;3:729–33.
9. Neiser S., Wilhelm M., Schwarz K. et al. Assessment of dextran antigenicity of intravenous iron products by an immunodiffusion assay. Port J Nephrol Hypert 2011;25(3):219–24.
10. Инструкция по применению препарата КосмоФер®.
11. McCarthy J.T., Regnier C.E., Loebertmann C.L., Bergstralh E.J. Adverse events in chronic hemodialysis patients receiving intravenous iron dextran – a comparison of two products. Am J Nephrol 2000;20:455–62.
12. Fletes R. Lazarus J.M., Gage J., Chertow G.M. Suspected iron dextran-related adverse drug events in hemodialysis patients. Am J Kidney Dis 2001;37:743–9.
13. Chertow G.M., Mason P.D., Vaage-Nilsen O., Ahlmen J. On the relative safety of parenteral iron formulations. Nephrol Dialys Transplant 2004;19:1571–5.
14. Chertow G.M., Mason P.D., Vaage-Nilsen O., Ahlmen J. Update on adverse drug events associated with parenteral iron. Nephrol Dialys Transplant 2006;21:378–82.
15. Инструкция по медицинскому применению препарата Феринжект®.
16. Geisser Р. The pharmacology and safety profile of ferric carboxymaltose (Ferinject®): structure/reactivity relationships of iron preparations. Port J Nephrol Hypert 2009;23(1):11–6.
17. Инструкция по медицинскому применению препарата МоноФер®.
18. Richter W. Minimal molecular size of dextran required to elicit heterologous passive cutaneous anaphylaxis in guinea pigs. Int Arch Allergy 1972;43:252–68.
19. Messmer K. Risiken der Infusion kolloidaler Losungen. Infusionsther Transfusionsmed 1993;20:284–5.
20. Richter W., Hedin H., Ring J. et al. Anaphylaktoide Reaktionen nac Dextran. Allergologie 1980;3:51–8.
21. Allhoff T., Lenhart F.P. Schwere dextraninduzierte anaphaylaktische/ anaphylaktoide Reaktion (DIAR) trotz Haptenprophylaxe. Infusionsther Transfusion med 1993;20:301–6.
Аптека 18 Плюс
Венофер вводят только в/в (медленно капельно или струйно) или в венозный участок диализной системы. Не предназначен для в/м введения. Недопустимо одномоментное введение полной терапевтической дозы препарата.
Не предназначен для в/м введения. Недопустимо одномоментное введение полной терапевтической дозы препарата.
Перед введением первой терапевтической дозы необходимо назначить тест-дозу. Если в течение периода наблюдения возникли явления непереносимости, введение препарата следует немедленно прекратить. Перед вскрытием ампулы следует осмотреть ее на наличие возможного осадка и повреждений. Можно использовать только коричневый раствор без осадка.
Капельное введение: Венофер® предпочтительно вводить в ходе капельной инфузии для того, чтобы уменьшить риск выраженного снижения АД и опасность попадания раствора в околовенозное пространство. Непосредственно перед инфузией Венофер® следует развести 0.9% раствором натрия хлорида в соотношении 1:20, например, 1 мл (20 мг железа) в 20 мл 0.9% раствора натрия хлорида. Полученный раствор следует вводить со следующей скоростью: 100 мг железа — не менее, чем за 15 мин, 200 мг железа — в течение 30 мин, 300 мг железа — в течение 1.5 ч, 400 мг железа — в течение 2.5 ч, 500 мг железа — в течение 3.5 ч. Введение максимально переносимой разовой дозы, составляющей 7 мг железа/кг, следует производить в течение минимум 3.5 ч, независимо от общей дозы препарата.
Перед первым капельным введением терапевтической дозы препарата Венофер® необходимо ввести тест-дозу: 20 мг железа взрослым и детям с массой тела более 14 кг, и половину дневной дозы (1.5 мг железа/кг) детям, имеющим массу тела менее 14 кг, в течение 15 мин. При отсутствии нежелательных явлений, оставшуюся часть раствора следует вводить с рекомендованной скоростью.
Струйное введение: препарат Венофер® также можно вводить в виде неразведенного раствора в/в медленно, со скоростью (норма) 1 мл препарата Венофер® (20 мг железа) в мин, 5 мл препарата Венофер® (100 мг железа) следует вводить минимум за 5 мин. Максимальный объем препарата не должен превышать 10 мл препарата Венофер® (200 мг железа) за 1 инъекцию.
Перед первым струйным введением терапевтической дозы препарата Венофер® следует назначить тест-дозу: 1 мл препарата Венофер® (20 мг железа) взрослым и детям массой тела более 14 кг и половину дневной дозы (1.5 мг железа/кг) детям массой тела менее 14 кг в течение 1-2 мин. При отсутствии нежелательных явлений в течение последующих 15 мин наблюдения оставшуюся часть раствора следует вводить с рекомендованной скоростью. После инъекции больному рекомендуется на некоторое время зафиксировать руку в вытянутом положении.
Введение в диализную систему
Венофер® можно вводить непосредственно в венозный участок диализной системы, строго соблюдая правила, описанные для в/в инъекции.
Расчет дозы: доза рассчитывается индивидуально в соответствии с общим дефицитом железа в организме по формуле:
Общий дефицит железа (мг) = масса тела (кг) × [нормальный уровень Hb — уровень Hb больного] (г/л) × 0.24* + депонированное железо (мг).
Для больных массой тела менее 35 кг: нормальный уровень Hb=130 г/л, количество депонированного железа = 15 мг/кг массы тела.
Для больных массой тела более 35 кг: нормальный уровень Hb=150 г/л, количество депонированного железа = 500 мг.
*Коэффициент 0.24 = 0.0034×0.07×1000 (содержание железа в Hb=0.34%, объем крови = 7% от массы тела, коэффициент 1000 = перевод из «г» в «мг»).
Общий объем (мл) препарата Венофер®, который необходимо ввести = общий дефицит железа (мг)/20 мг/мл (таблицы 1 и 2).
Таблица 1.
| Масса тела (кг) | Кумулятивная терапевтическая доза препарата Венофер® для введения | |||
| Hb 60 г/л | Hb 75 г/л | |||
| мг Fe | мл | мг Fe | мл | |
| 5 | 160 | 8 | 140 | 7 |
| 10 | 320 | 16 | 280 | 14 |
| 15 | 480 | 24 | 420 | 21 |
| 20 | 640 | 32 | 560 | 28 |
| 25 | 800 | 40 | 700 | 35 |
| 30 | 960 | 48 | 840 | 42 |
| 35 | 1260 | 63 | 1140 | 57 |
| 40 | 1360 | 68 | 1220 | 61 |
| 45 | 1480 | 74 | 1320 | 66 |
| 50 | 1580 | 79 | 1400 | 70 |
| 55 | 1680 | 84 | 1500 | 75 |
| 60 | 1800 | 90 | 1580 | 79 |
| 65 | 1900 | 95 | 1680 | 84 |
| 70 | 2020 | 101 | 1760 | 88 |
| 75 | 2120 | 106 | 1860 | 93 |
| 80 | 2220 | 111 | 1940 | 97 |
| 85 | 2340 | 117 | 2040 | 102 |
| 90 | 2440 | 122 | 2120 | 106 |
Таблица 2.
| Масса тела (кг) | Кумулятивная терапевтическая доза препарата Венофер® для введения | |||
| Hb 90 г/л | Hb 105 г/л | |||
| мг Fe | мл | мг Fe | мл | |
| 5 | 120 | 6 | 100 | 5 |
| 10 | 240 | 12 | 220 | 11 |
| 15 | 380 | 19 | 320 | 16 |
| 20 | 500 | 25 | 420 | 21 |
| 25 | 620 | 31 | 520 | 26 |
| 30 | 740 | 37 | 640 | 32 |
| 35 | 1000 | 50 | 880 | 44 |
| 40 | 1080 | 54 | 940 | 47 |
| 45 | 1140 | 57 | 980 | 49 |
| 50 | 1220 | 61 | 1040 | 52 |
| 55 | 1300 | 65 | 1100 | 55 |
| 60 | 1360 | 68 | 1140 | 57 |
| 65 | 1440 | 72 | 1200 | 60 |
| 70 | 1500 | 75 | 1260 | 63 |
| 75 | 1580 | 79 | 1320 | 66 |
| 80 | 1660 | 83 | 1360 | 68 |
| 85 | 1720 | 86 | 1420 | 71 |
| 90 | 1800 | 90 | 1480 | 74 |
В случае, когда общая терапевтическая доза превышает максимальную допустимую разовую дозу, рекомендуется дробное введение препарата. Если спустя 1–2 нед. после начала лечения препаратом Венофер® не происходит улучшения гематологических показателей, необходимо пересмотреть первоначальный диагноз.
Расчет дозы для восполнения уровня железа после кровопотери или сдачи аутологичной крови
Доза препарата Венофер® рассчитывается по следующей формуле:
Если количество потерянной крови известно: в/в введение 200 мг железа (10 мл препарата Венофер®) приводит к такому же повышению концентрации Hb, как и переливание 1 единицы крови (=400 мл с концентрацией Hb=150 г/л).
Количество железа, которое необходимо восполнить (мг) = количество единиц потерянной крови × 200
или
Необходимый объем препарата Венофер® (мл) = количество единиц потерянной крови × 10.
При снижении уровня Hb: следует использовать предыдущую формулу при условии, что депо железа пополнять не требуется.
Количество железа (мг), которое нужно восполнить = масса тела (кг) × 0.24 × [нормальный уровень Hb — уровень Hb больного] (г/л).
Например: масса тела 60 кг, дефицит Hb = 10 г/л: необходимое количество железа составляет приблизительно 150 мг, а необходимый объем препарата Венофер® = 7.5 мл.
Стандартная доза
Взрослым и пациентам пожилого возраста назначают 5-10 мл препарата Венофер® (100-200 мг железа) 1-3 раза в неделю в зависимости от уровня гемоглобина.
Имеются лишь ограниченные данные о применении препарата у детей в возрасте до 3 лет. В случае необходимости рекомендуется вводить не более 0.15 мл препарата Венофер® (3 мг железа) на кг массы тела 1-3 раза в неделю в зависимости от уровня гемоглобина.
Максимальная переносимая разовая доза
Взрослым и пациентам пожилого возраста: для струйного введения — 10 мл препарата Венофер® (200 мг железа), продолжительность введения не менее 10 мин, для капельного введения в зависимости от показаний разовая доза может достигать 500 мг железа. Максимальная допустимая разовая доза составляет 7 мг/кг и вводится 1 раз в неделю, но она не должна превышать 500 мг железа. Время введения препарата и способ разведения, как указано выше.
Препараты железа окисного для парентерального введения
Препарат | Форма | Содержание | Состав |
| выпуска | элементарного |
|
|
| железа |
|
Жектофер | Раствор | 50 мг в 1 мл | Железосорби-толовый |
|
|
| комплекс с цитратом |
|
|
| в растворе декстрина |
Фербитол | Раствор | 50 мг в 1 мл | Железосорбит-оловый |
|
|
| комплекс |
Феррум Лек | Раствор | 50 мг в 2 мл | Комплекс с мальтозой |
Ферковен | Раствор | 20 мг в 1 мл | Железа сахарат и |
|
|
| кобальта глюконат |
Феррлецид | Раствор | 62,5 мг в 5 мл | Натрия- |
|
|
| железоглюконатный |
|
|
| комплекс |
ПРЕПАРАТЫ ЖЕЛЕЗА
•Применяют длительно до насыщения депо железа и исчезновения явлений анемии (3 — 6 мес ), поэтому необходим контроль за уровнем железа в крови
•Самочувствие больных при оптимальном лечении улучшается через 3-4 дня
Токсическое действие препаратов железа
При приеме внутрь:
•Снижение аппетита, боль в животе, тошнота, колики, диарея или запор (связывание сероводорода).
•Железо окрашивает зубы, кал, реже мочу в черный цвет, образуя сульфид железа (FeS) при реакции с сероводородом
•При окислении двухвалентного железа в трехвалентное образуются свободные радикалы с последующей модификацией мембранных липидов, ДНК и РНК
•У детей длительная терапия может вызывать рахит, так как нарушается ассимиляция
Токсическое действие препаратов железа
При парентеральном введении:
•Ведение в мышцы вызывает боль
•Внутривенное ведение —могут возникать местные (спазм вен, флебиты, абсцессы ), и системные (головная боль, головокружение, тошнота, рвота, металлический вкус во рту, тахикардия, лихорадка, генерализованные лимфоаденопатии, крапивница, артралгии, боли в мышцах) реакции
•Анафилактический шок (1 случай на 1 млн инъекций)
Токсическое действие препаратов железа
Лечение
•Введение анальгетиков и атропина сульфата
•Дефероксамин (десферал) – производное гидроаксамовой кислоты, комплексообразователь :
Ампулы — 500 мг сухого препарата растворяют в 5 мл воды для инъекций и вводят в/мышечно
Или 5-10 г разводят водой для
Гипохромные анемии
применяют препарат кобальта коамид
по химической структуре представляет собой комплексное соединение кобальта
самидом никотиновой кислоты
кобальт стимулирует эритропоэз и способствует усвоению железа для образования гемоглобина
вводят подкожно
Гемостимулин (сухая кровь, железа закисного лактат, меди сульфат)
Макроцитарная (В12, фолиеводифецитная) | |
анемия Аддисона-Бирмера | |
• | В 1824 г. Томас Аддисон описал клинику макроцитарной анемии. |
• | В 1872 г. А.Бирмер предложил называть это заболевание |
| прогресирующей пернициозной анемией (лат. рerniciosus – |
| гибельный). |
• | В 1925 г. Джордж Уипл установил, что печень животных содержит |
| какие-то стимуляторы эритропоэза. |
• | 1929 г. Уильям Кастл предсказал участие внутреннего фактора в |
| всасывании внешнего антианемического фактора. |
• | В 1934 г. Д.Уипл, Джордж Майнот и Уильям Мерфи были удостоены |
| Нобелевской премии за открытие лечебного эффекта сырой |
| печени при макроцитарной анемии (200 г. в сутки). Далее |
| последовало создание препаратов-экстрактов из печени: |
| витогепата, серипара. |
• | Конец сороковых годов – Риккс, Смит и Паркер идентифицировали |
| внешний фактор Кастла как витамин В12 и выделили его в |
| кристаллической форме. |
• | Биохимик Дороти Кроуфут-Ходжкин установила химическую |
| структуру и механизм действия витамина В12. За эту работу в 1964 |
| г. была удостоена Нобелевской премии по химии. |
Фармакокинетика витамина В12
•в желудке и тонком кишечнике витамин В12 освобождается от белков пищи
•присоединяет внутренний фактор Кастла (гликопротеин) — образуется в париетальных (обкладочных) клетках желудка
•в норме биодоступность В12 достигает 80-90%, без фактора Кастла
– 0-30%.
•в тонком кишечнике комплекс витамин В12 + внутренний фактор Кастла связывается с белковым рецептором на энтероцитах и пиноцитозом доставляется в кровь
•для всасывания необходимы затраты энергии, присутствие желчи, ионы кальция, нейтральная среда (NaHCO3).
•транскобаламин II (β-глобулин) транспортирует витамин В12 в печень, костный мозг, селезенку (известен наследственный дефицит траскобаламина II)
•90% цианокобаламина депонировано в печени (1-10 мг). Используется ежедневно 0,5-8 мкг.
•Нормальная концентрация в плазме составляет 200-900 пг/мл; концентрация ниже 150 пг/мл – приводит к симптомам анемии
В12 в пище
Желудок
R-белок R+В12
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| R – В12 |
| |||
|
|
| Ферменты |
|
|
|
|
|
|
|
| ||||||||
|
| поджелудочной железы |
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
| |||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Кишечно-печеночный |
| В12 |
|
|
|
|
|
|
|
| |||||||||
|
|
|
| В12 |
| ||||||||||||||
водоворот |
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ВФК | ||||
Системный кровоток |
|
|
|
|
|
|
|
|
|
| |||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
| ТКI – В12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
| ТКII – В12 |
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| ВФК+В12 |
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
|
|
|
|
|
| Энтероцит |
|
|
|
|
|
|
| ||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
| В12 |
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
| ВФК – В12 |
|
|
|
| |||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
|
|
| ТКII – В12 |
|
|
|
|
|
|
|
|
|
|
|
| ||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||
Депо |
|
|
|
|
|
| ТКII |
|
|
|
|
|
|
|
|
| |||
|
|
|
|
|
|
|
|
|
|
|
| ||||||||
Портальный |
|
|
|
|
|
|
|
|
|
|
| ||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| |||||
|
|
|
|
|
|
|
|
|
|
|
|
|
| ||||||
|
|
| кровоток |
|
|
|
|
|
|
|
|
|
|
|
|
| |||
Всасывание витамина В12.
ВФК
Обкла- дочные клетки
Двенадцатиперстная и тощая кишки
Подвздошная кишка
Фармакодинамика цианокобаламина
В организме В-12 участвует в:
метаболизме нуклеиновых кислот
синтезе и регенерации миелина
в обмене жирных кислот и
нейтрализации токсичной метилмалоновой кислоты
Парентеральное железо
6.4: Парентеральное железо
Пероральное железо является предпочтительной и самой безопасной терапией первой линии для большинства пациентов с железодефицитной анемией, но многие пользователи испытывают побочные эффекты со стороны желудочно-кишечного тракта и плохо соблюдают режим лечения. У пациентов, получающих ЭСС, пероральная заместительная терапия железом часто оказывается недостаточной, а «функциональный дефицит железа» ограничивает ответ на лечение. Парентеральное введение железа вызывает более быстрые реакции и лучшее пополнение запасов железа в нескольких клинических условиях, но до недавнего времени его использование было ограничено значительным риском тяжелых, иногда летальных, аллергических реакций на доступные препараты (особенно высокомолекулярный декстран железа).Доступные в настоящее время препараты имеют очень низкую частоту серьезных реакций и вернули парентеральное введение железа в обычную практику. Общие показания к применению внутривенного железа включают:
- Железодефицитная анемия с непереносимостью перорального железа, особенно при воспалительном заболевании кишечника, или при неэффективности перорального приема железа.
- Для поддержки использования средств, стимулирующих эритропоэз (включая пациентов, находящихся на диализе почек).
- В качестве альтернативы переливанию крови, когда требуется быстрое повышение Hb (например,грамм. периоперационная анемия, тяжелая анемия на поздних сроках беременности или послеродовая анемия).
Несколько препаратов железа для парентерального введения в настоящее время лицензированы в Великобритании. Некоторые, такие как сахароза железа (Venofer ® ), вводятся до трех раз в неделю путем медленной внутривенной инъекции или короткой инфузии, и может потребоваться несколько недель лечения для введения полной замещающей дозы. Другие, такие как низкомолекулярные декстраны железа (Cosmofer ® ), можно вводить в виде однократной инфузии общей дозы в течение нескольких часов.Недавно представленные агенты, такие как карбоксимальтоза железа (Ferinject ® ) или изомальтозид железа (Monofer ® ), обладают преимуществом более быстрого введения больших замещающих доз (от 15 до 60 минут).
Новые препараты более дорогие, и клинический опыт все еще ограничен. Парентеральное введение железа противопоказано в первом триместре беременности. Доступность отдельных препаратов железа для парентерального введения варьируется в зависимости от больницы, и их следует использовать в соответствии с местными правилами и политиками.Подробная информация о дозах и способах приема доступна в индивидуальной сводке характеристик продукта и в Британском национальном фармакологическом справочнике (http://bnf.org/bnf).
Последнее обновление 02.04.2014
Парентеральное железо
| Определение (MSH) | Оксид железа (II, III) (Fe3O4). Это черная железная руда, которая образует непрозрачные кристаллы и обладает сильным магнетизмом. |
| Определение (NCI) | Суперпарамагнитная наночастица оксида железа, покрытая полусинтетическим углеводом с низким молекулярным весом, карбоксиметиловым эфиром полиглюкозного сорбита, с потенциальными антианемическими и визуализирующими свойствами. После внутривенного введения ферумокситол восполняет запасы железа с меньшим количеством побочных эффектов по сравнению с пероральным приемом железа.Кроме того, этот агент генерирует релаксацию T1, создавая магнитное поле и усиливая релаксацию T2, тем самым затемняя структуры, содержащие контрастные вещества, при магнитно-резонансной томографии (МРТ). Из-за небольшого размера частиц ферумокситол остается во внутрисосудистой сети в течение длительного периода и поэтому может использоваться в качестве агента для пула крови. |
| Определение (NCI_NCI-GLOSS) | Форма наночастиц железа, изготовленная в лаборатории, которая изучается для использования в заместительной терапии железом и в качестве контрастного вещества для магнитно-резонансной томографии.Контрастные вещества — это вещества, которые вводятся в организм и поглощаются определенными тканями, благодаря чему ткани легче увидеть при сканировании изображений. |
| Определение (PDQ) | Суперпарамагнитная наночастица оксида железа, покрытая полусинтетическим углеводом с низким молекулярным весом, карбоксиметиловым эфиром полиглюкозного сорбита, с потенциальными антианемическими и визуализирующими свойствами.После внутривенного введения ферумокситол восполняет запасы железа с меньшим количеством побочных эффектов по сравнению с пероральным приемом железа. Кроме того, этот агент генерирует релаксацию T1, создавая магнитное поле и усиливая релаксацию T2, тем самым затемняя структуры, содержащие контрастные вещества, при магнитно-резонансной томографии (МРТ). Из-за небольшого размера частиц ферумокситол остается во внутрисосудистой сети в течение длительного периода и поэтому может использоваться в качестве агента для пула крови. Проверьте «http://www.cancer.gov/Search/ClinicalTrialsLink.aspx? id = 377345 & idtype = 1 «активные клинические испытания или» http://www.cancer.gov/Search/ClinicalTrialsLink.aspx?id=377345&idtype=1&closed=1 «закрытые клинические испытания с использованием этого агента. (» http: // nciterms.nci.nih.gov:80/NCIBrowser/ConceptReport.jsp?dictionary=NCI_Thesaurus&code=C38138 «Тезаурус NCI) |
| Концепции | Индикатор, реагент или диагностическое средство ( T130 ) , Неорганические химические вещества ( T197 ) |
| MSH | D052203 |
| SnomedCT | 442951001, 442952008, 517 |
| Русский | ЖЕЛЕЗА (II, III) ОКСИД, ЖЕЛЕЗА (II), (III) ОКСИД, ЖЕЛЕЗА (II) (III) ОКСИД, ЖЕЛЕЗА (II, III) ОКСИД, ЖЕЛЕЗА (II) (III) ОКСИД, ЖЕЛЕЗА ЗАКИСЬ-ОКСИД , ЖЕЛЕЗА (II), (III) ОКСИД, МАГНЕТИТ, МАГНЕТИТ, ФЕРУМОКСИТОЛ, ФЕРУМОКСИТОЛ, FE3O4, ЖЕЛЕЗА ЗАКИСЬ-ОКИСЬ |
| Итальянский | Оссидо феррозо феррико, Оссидо феррозо феррико |
| шведский | Магнитит |
| Чешский | Оксид железато-железитовый, Оксид железнодорожный |
| финский | Раутаоксиди |
| Японский | 磁 鉄 鉱, マ グ ネ タ イ ト, 四 三 酸化 鉄, 黒 色 酸化 鉄, 磁性 酸化 鉄, 酸化 鉄 (III) 鉄 (II), 酸化 第一 鉄 第二 鉄 |
| Английский | Тетраоксид триирона, оксид черного железа, магнитная сажа, железная сажа, ферумокситол, нестехиометрический магнетит, ферумокситол, ферумокситол (субстанция), ферумокситол (продукт), ферумокситол, оксид железа (продукт), ферумокситол, оксид железа, оксид железа [химический / ингредиент], ферумоокситол оксид железа, оксид железа, C.I. 77499, оксид железа (II, III), ферумокситол, черный оксид железа, оксид железа, оксид железа, оксид железа, оксид железа, оксид железа |
| Испанский | ферумокситол (продукт), ферумокситол (сустансия), ферумокситол, оксидо феррозоферрико, ферумокситол, не переведено [оксид железа], оксидо де иерро негро |
| французский | Oxyde de fer noir, Férumoxytol, Oxyde ferrosoferrique |
| Польский | Магнетид, Ферумокситол, Фархем |
| Немецкий | Ферумокситол, Ферроферриоксид |
| Норвежский | Magnetitt |
| Португальский | Ферумокситол, оксидо феррозо-феррико, не переведено [оксид железа] |
Современная заместительная терапия железом: клинические и патофизиологические исследования
Camaschella C. Железодефицитная анемия. N Engl J Med. 2015; 372: 1832–43.
PubMed Статья Google Scholar
Кассебаум, штат Нью-Джерси, сотрудники GBDA. Глобальное бремя анемии. Hematol Oncol Clin North Am. 2016; 30: 247–308.
PubMed Статья Google Scholar
Стивенс Г.А., Финукейн М.М., Де-Регил Л.М. и др. Глобальные, региональные и национальные тенденции в концентрации гемоглобина и распространенности общей и тяжелой анемии у детей, беременных и небеременных женщин за 1995–2011 годы: систематический анализ репрезентативных данных для населения.Ланцет Glob Health. 2013; 1: e16–25.
PubMed PubMed Central Статья Google Scholar
Busti F, Campostrini N, Martinelli N, et al. Дефицит железа у пожилого населения, возвращенный в эпоху гепсидина. Front Pharmacol. 2014; 5: 83.
PubMed PubMed Central Статья CAS Google Scholar
Hershko C, Camaschella C. Как я лечу необъяснимую рефрактерную железодефицитную анемию.Кровь. 2014; 123: 326–33.
CAS PubMed Статья Google Scholar
Сами С.С., Аль-Араджи С.А., Рагунат К. Обзорная статья: ангиодисплазия желудочно-кишечного тракта — патогенез, диагностика и лечение. Алимент Pharmacol Ther. 2014; 39: 15–34.
CAS PubMed Статья Google Scholar
Лоскальцо Дж. От клинического наблюдения к механизму — синдром Хейде.N Engl J Med. 2012; 367: 1954–6.
CAS PubMed Статья Google Scholar
Sender R, Fuchs S, Milo R. Пересмотренные оценки количества человеческих и бактериальных клеток в организме. PLoS Biol. 2016; 14: e1002533.
PubMed PubMed Central Статья CAS Google Scholar
Каутц Л., Немет Э. Молекулярные связи между эритропоэзом и метаболизмом железа.Кровь. 2014; 124: 479–82.
CAS PubMed PubMed Central Статья Google Scholar
Пьетранджело А. Механизмы гепатотоксичности железа. J Hepatol. 2016; 65: 226–7.
PubMed Статья Google Scholar
Эндрюс, Северная Каролина. Ковка поля: золотой век биологии железа. Кровь. 2008; 112: 219–30.
CAS PubMed PubMed Central Статья Google Scholar
Park CH, Valore EV, Waring AJ и др. Гепсидин, мочевой антимикробный пептид, синтезируемый в печени. J Biol Chem. 2001; 276: 7806–10.
CAS PubMed Статья Google Scholar
Голубь C, Ильин G, Courselaud B и др. Новый ген, специфичный для печени мыши, кодирующий белок, гомологичный человеческому антимикробному пептиду гепсидину, сверхэкспрессируется во время перегрузки железом. J Biol Chem. 2001; 276: 7811–9.
CAS PubMed Статья Google Scholar
Николас Г., Беннун М., Дево И. и др. Отсутствие экспрессии гена гепсидина и тяжелая перегрузка тканями железом у мышей с нокаутом по вышестоящему стимулирующему фактору 2 (USF2). Proc Natl Acad Sci USA. 2001; 98: 8780–5.
CAS PubMed PubMed Central Статья Google Scholar
Abboud S, Haile DJ. Новый регулируемый железом белок млекопитающих, участвующий во внутриклеточном метаболизме железа. J Biol Chem. 2000; 275: 19906–12.
CAS PubMed Статья Google Scholar
Донован А., Браунли А., Чжоу Ю. и др. Позиционное клонирование ferroportin1 рыбок данио идентифицирует консервативного экспортера железа позвоночных. Природа. 2000; 403: 776–81.
CAS PubMed Статья Google Scholar
Макки А.Т., Марчиани П., Рольфс А. и др. Новый дуоденальный транспортер железа, регулируемый IREG1, участвует в базолатеральном переносе железа в кровоток. Mol Cell. 2000. 5: 299–309.
CAS PubMed Статья Google Scholar
Немет Э., Таттл М.С., Пауэлсон Дж. И др. Гепсидин регулирует отток клеточного железа, связываясь с ферропортином и индуцируя его интернализацию. Наука. 2004; 306: 2090–3.
CAS PubMed Статья Google Scholar
Ганц Т. Гепсидин и регулирование железа, 10 лет спустя. Кровь. 2011; 117: 4425–33.
CAS PubMed PubMed Central Статья Google Scholar
Джордан Дж. Б., Поппе Л., Ханиу М. и др. Еще раз о гепсидине, дисульфидных связях, динамике и структуре. J Biol Chem. 2009. 284: 24155–67.
CAS PubMed PubMed Central Статья Google Scholar
Лерер Р.И. Дефенсины приматов. Nat Rev Microbiol. 2004; 2: 727–38.
CAS PubMed Статья Google Scholar
Пьетранджело А.Генетика, генетическое тестирование и лечение гемохроматоза: 15 лет после гепсидина. Гастроэнтерология. 2015; 149 (1240–1251): e1244.
Google Scholar
Muckenthaler MU, Rivella S, Hentze MW и др. Красная дорожка метаболизма железа. Клетка. 2017; 168: 344–61.
CAS PubMed PubMed Central Статья Google Scholar
Ганц Т. Системный гомеостаз железа.Physiol Rev.2013; 93: 1721–41.
CAS PubMed Статья Google Scholar
Джирелли Д., Немет Э., Свинкелс Д.В. Гепсидин в диагностике нарушений железа. Кровь. 2016; 127: 2809–13.
CAS PubMed PubMed Central Статья Google Scholar
Андриопулос Б., Коррадини Е., Ся Й и др. BMP6 является ключевым эндогенным регулятором экспрессии гепсидина и метаболизма железа.Нат Жене. 2009. 41: 482–7.
CAS PubMed PubMed Central Статья Google Scholar
Piubelli C, Castagna A, Marchi G, et al. Выявление новых мутаций пропептида BMP6 у пациентов с перегрузкой железом. Am J Hematol. 2017; 92: 562–8.
CAS PubMed Статья Google Scholar
Canali S, Zumbrennen-Bullough KB, Core AB, et al.Эндотелиальные клетки продуцируют костный морфогенетический белок 6, необходимый для гомеостаза железа у мышей. Кровь. 2017; 129: 405–14.
CAS PubMed Статья Google Scholar
Ганц Т., Ольбина Г., Джирелли Д. и др. Иммуноанализ на гепсидин сыворотки крови человека. Кровь. 2008; 112: 4292–7.
CAS PubMed Статья Google Scholar
Bozzini C, Campostrini N, Trombini P, et al.Измерение уровней гепсидина в моче с помощью SELDI-TOF-MS при HFE-гемохроматозе. Blood Cells Mol Dis. 2008; 40: 347–52.
CAS PubMed Статья Google Scholar
Kautz L, Jung G, Valore EV, et al. Идентификация эритроферрона как эритроидного регулятора метаболизма железа. Нат Жене. 2014; 46: 678–84.
CAS PubMed PubMed Central Статья Google Scholar
Руссо Р., Андольфо И., Манна Ф. и др. Повышенные уровни ERFE-кодирующего FAM132B у пациентов с врожденной дизеритропоэтической анемией II типа. Кровь. 2016; 128: 1899–902.
CAS PubMed Статья Google Scholar
Ganz T, Jung G, Naeim A, et al. Иммуноанализ на эритроферрон сыворотки крови человека. Кровь. 2017; 130: 1243–6.
PubMed Статья Google Scholar
Verga Falzacappa MV, Vujic Spasic M, Kessler R, et al. STAT3 опосредует экспрессию гепсидина в печени и его воспалительную стимуляцию. Кровь. 2007; 109: 353–8.
PubMed Статья CAS Google Scholar
Шанмугам Н.К., Чен К., Чераил Б.Дж. Индуцированный комменсальными бактериями интерлейкин 1бета (ИЛ-1бета), секретируемый макрофагами, усиливает экспрессию гепсидина в гепатоцитах, активируя сигнальный путь костного морфогенетического белка.J Biol Chem. 2015; 290: 30637–47.
CAS PubMed PubMed Central Статья Google Scholar
Немет Э., Ривера С., Габаян В. и др. IL-6 опосредует гипоферремию воспаления, индуцируя синтез гормона, регулирующего железо, гепсидина. J Clin Invest. 2004. 113: 1271–6.
CAS PubMed PubMed Central Статья Google Scholar
Кемна Э., Пиккерс П., Немет Э. и др. Анализ динамики уровней гепсидина, сывороточного железа и плазменных цитокинов у людей, которым вводили ЛПС. Кровь. 2005; 106: 1864–6.
CAS PubMed Статья Google Scholar
Ганц Т. Железо в врожденном иммунитете: морите захватчиков голодом. Curr Opin Immunol. 2009; 21: 63–7.
CAS PubMed PubMed Central Статья Google Scholar
Арезес Дж., Юнг Дж., Габаян В. и др. Гепсидин-индуцированная гипоферемия является важным механизмом защиты хозяина от сидерофильной бактерии Vibrio vulnificus . Клеточный микроб-хозяин. 2015; 17: 47–57.
CAS PubMed PubMed Central Статья Google Scholar
Цзэн Ц., Чен Кью, Чжан К. и др. Печеночный гепсидин защищает от полимикробного сепсиса у мышей, регулируя статус железа хозяина. Анестезиология.2015; 122: 374–86.
CAS PubMed Статья Google Scholar
Weiss G, Goodnough LT. Анемия хронического заболевания. N Engl J Med. 2005; 352: 1011–23.
CAS PubMed Статья Google Scholar
Вайс Г. Анемия хронических заболеваний: новые инструменты диагностики и новые стратегии лечения. Semin Hematol. 2015; 52: 313–20.
PubMed Статья Google Scholar
Штокман Р. Лечение хлороза железом и некоторыми другими препаратами. Br Med J. 1893; 1: 942–4.
CAS PubMed PubMed Central Статья Google Scholar
Nissim JA. Внутривенное введение железа. Ланцет. 1947; 2: 49–51.
CAS PubMed Статья Google Scholar
Муньос М., Гомес-Рамирес С., Бессер М. и др. Современные заблуждения в диагностике и лечении дефицита железа.Переливание крови. 2017; 15: 422–37.
PubMed PubMed Central Google Scholar
Сантьяго П. Пероральные препараты железа и трехвалентного железа для лечения дефицита железа: клинический обзор. Научный мир J. 2012; 2012: 846824.
Артикул CAS Google Scholar
Bothwell TH, Pirzio-Biroli G, Finch CA. Поглощение железа. I. Факторы, влияющие на абсорбцию.J Lab Clin Med. 1958; 51: 24–36.
CAS PubMed Google Scholar
Гулек С., Андерсон Дж. Дж., Коллинз Дж. Ф. Механические и регуляторные аспекты всасывания железа в кишечнике. Am J Physiol Gastrointest Liver Physiol. 2014; 307: G397–409.
CAS PubMed PubMed Central Статья Google Scholar
Ауэрбах М., Адамсон Дж. У. Как мы диагностируем и лечим железодефицитную анемию.Am J Hematol. 2016; 91: 31–8.
PubMed Статья Google Scholar
Годдард А.Ф., Джеймс М.В., Макинтайр А.С. и др. Рекомендации по ведению железодефицитной анемии. Кишечник. 2011; 60: 1309–16.
CAS PubMed Статья Google Scholar
Peyrin-Biroulet L, Williet N, Cacoub P. Рекомендации по диагностике и лечению дефицита железа по показаниям: систематический обзор.Am J Clin Nutr. 2015; 102: 1585–94.
CAS PubMed Статья Google Scholar
Schrier SL. Итак, вы знаете, как лечить железодефицитную анемию. Кровь. 2015; 126: 1971.
CAS PubMed Статья Google Scholar
Циммерманн МБ, Харрелл РФ. Недостаток пищевого железа. Ланцет. 2007; 370: 511–20.
CAS PubMed Статья Google Scholar
Tondeur MC, Schauer CS, Christofides AL, et al. Определение абсорбции железа из микрокапсулированного фумарата железа с внутренней меткой (брызг) у младенцев с различным железом и гематологическим статусом с использованием метода двойных стабильных изотопов. Am J Clin Nutr. 2004; 80: 1436–44.
CAS PubMed Google Scholar
Hallberg L, Brune M, Rossander-Hulthen L. Есть ли физиологическая роль витамина C в усвоении железа? Ann N Y Acad Sci.1987. 498: 324–32.
CAS PubMed Статья Google Scholar
Канчело-Идальго М.Дж., Кастело-Бранко С., Паласиос С. и др. Переносимость различных пероральных добавок железа: систематический обзор. Curr Med Res Opin. 2013; 29: 291–303.
CAS PubMed Статья Google Scholar
Толкин З., Стечер Л., Мандер А.П. и др. Добавка сульфата железа вызывает значительные побочные эффекты со стороны желудочно-кишечного тракта у взрослых: систематический обзор и метаанализ.PLoS One. 2015; 10: e0117383.
PubMed PubMed Central Статья CAS Google Scholar
Кортман Г.А., Раффателлу М., Свинкелс Д.В. и др. Пищевое железо вывернуто наизнанку: кишечный стресс с точки зрения кишечных микробов. FEMS Microbiol Rev.2014; 38: 1202–34.
CAS PubMed Статья Google Scholar
Циммерманн М.Б., Чассар С., Ронер Ф. и др.Влияние обогащения железом на микробиоту кишечника у африканских детей: рандомизированное контролируемое исследование в Кот-д’Ивуаре. Am J Clin Nutr. 2010; 92: 1406–15.
CAS PubMed Статья Google Scholar
Паганини Д., Циммерманн МБ. Влияние обогащения и добавок железа на микробиом кишечника и диарею у младенцев и детей: обзор. Am J Clin Nutr 2017. http://doi.org/10.3945/ajcn.117.156067
Джегги Т., Кортман Г.А., Моретти Д. и др. Обогащение железом отрицательно влияет на микробиом кишечника, увеличивает количество патогенов и вызывает воспаление кишечника у кенийских младенцев. Кишечник. 2015; 64: 731–42.
CAS PubMed Статья Google Scholar
Sazawal S, Black RE, Ramsan M, et al. Влияние обычных профилактических добавок с железом и фолиевой кислотой на госпитализацию и смертность детей дошкольного возраста в условиях высокой передачи малярии: рандомизированное плацебо-контролируемое исследование на уровне общины.Ланцет. 2006; 367: 133–43.
CAS PubMed Статья Google Scholar
Злоткин С., Ньютон С., Эймоне А.М. и др. Влияние обогащения железом на заболеваемость малярией у младенцев и детей младшего возраста в Гане: рандомизированное исследование. ДЖАМА. 2013; 310: 938–47.
CAS PubMed Статья Google Scholar
Finberg KE, Heeney MM, Campagna DR, et al.Мутации в TMPRSS6 вызывают железо-рефрактерную железодефицитную анемию (IRIDA). Нат Жене. 2008; 40: 569–71.
CAS PubMed PubMed Central Статья Google Scholar
Де Фалько Л., Сильвестри Л., Канненгессер С. и др. Функциональное и клиническое влияние новых вариантов TMPRSS6 у пациентов с железорезистентной железодефицитной анемией и исследования генотипа-фенотипа. Hum Mutat. 2014; 35: 1321–9.
PubMed Google Scholar
Донкер А.Е., Raymakers RA, Vlasveld LT и др. Практические рекомендации по диагностике и лечению микроцитарных анемий, вызванных генетическими нарушениями метаболизма железа или синтеза гема. Кровь. 2014; 123: 3873–86.
CAS PubMed Статья Google Scholar
van Santen S, van Dongen-Lases EC, de Vegt F, et al. Параметры содержания гепсидина и гемоглобина в диагностике дефицита железа у больных ревматоидным артритом с анемией.Ревматоидный артрит. 2011; 63: 3672–80.
PubMed Статья CAS Google Scholar
Бергамаски Г., Ди Сабатино А., Альбертини Р. и др. Сывороточный гепсидин при воспалительных заболеваниях кишечника: биологическое и клиническое значение. Воспаление кишечника. 2013; 19: 2166–72.
PubMed Статья Google Scholar
Дик С.А., Эпельман С. Хроническая сердечная недостаточность и воспаление: что мы на самом деле знаем? Circ Res.2016; 119: 159–76.
CAS PubMed Статья Google Scholar
Jankowska EA, Rozentryt P, Witkowska A, et al. Дефицит железа: опасный признак у пациентов с систолической хронической сердечной недостаточностью. Eur Heart J. 2010; 31: 1872–80.
CAS PubMed Статья Google Scholar
von Haehling S, Jankowska EA, van Veldhuisen DJ, et al. Дефицит железа и сердечно-сосудистые заболевания.Nat Rev Cardiol. 2015; 12: 659–69.
Артикул CAS Google Scholar
Haas JD. Brownlie Tt. Дефицит железа и снижение работоспособности: критический обзор исследования для определения причинно-следственной связи. J Nutr. 2001; 131: 676S – 88S (обсуждение 688S – 690S) .
CAS PubMed Google Scholar
Оконко Д.О., Мандал А.К., Миссурис К.Г. и др.Нарушение гомеостаза железа при хронической сердечной недостаточности: распространенность, предикторы и связь с анемией, переносимостью физических нагрузок и выживаемость. J Am Coll Cardiol. 2011; 58: 1241–51.
CAS PubMed Статья Google Scholar
Анкер С.Д., Комин Колет Дж., Филиппатос Дж. И др. Карбоксимальтоза железа у пациентов с сердечной недостаточностью и дефицитом железа. N Engl J Med. 2009; 361: 2436–48.
CAS PubMed Статья Google Scholar
Ponikowski P, van Veldhuisen DJ, Comin-Colet J, et al. Благоприятные эффекты длительного внутривенного введения железа с карбоксимальтозой железа у пациентов с симптоматической сердечной недостаточностью и железодефицитным клинком. Eur Heart J. 2015; 36: 657–68.
CAS PubMed Статья Google Scholar
Льюис Г.Д., Малхотра Р., Эрнандес А.Ф. и др. Влияние перорального восполнения запасов железа на переносимость физической нагрузки у пациентов с сердечной недостаточностью со сниженной фракцией выброса и дефицитом железа: рандомизированное клиническое испытание IRONOUT HF.ДЖАМА. 2017; 317: 1958–66.
CAS PubMed PubMed Central Статья Google Scholar
Стинсма Д.П., Сасу Б.Дж., Слоан Д.А. и др. Уровни гепсидина в сыворотке позволяют прогнозировать ответ на внутривенное введение железа и дарбэпоэтина при анемии, связанной с химиотерапией. Кровь. 2015; 125: 3669–71.
CAS PubMed Статья Google Scholar
Брегман Д.Б., Моррис Д., Кох Т.А. и др.Уровни гепсидина позволяют прогнозировать отсутствие реакции на пероральную терапию железом у пациентов с железодефицитной анемией. Am J Hematol. 2013; 88: 97–101.
CAS PubMed Статья Google Scholar
Крут Дж. Дж., Ван Херваарден А. Э., Тьялсма Х. и др. Второй круговой алгоритм для методов плазменного гепсидина: первые шаги к гармонизации. Am J Hematol. 2012; 87: 977–83.
CAS PubMed Статья Google Scholar
Прентис А.М., Доэрти С.П., Абрамс С.А. и др. Гепсидин является основным предиктором инкорпорации железа в эритроцитах у африканских детей с анемией. Кровь. 2012; 119: 1922–8.
CAS PubMed PubMed Central Статья Google Scholar
Moretti D, Goede JS, Zeder C, et al. Пероральные добавки железа повышают уровень гепсидина и снижают абсорбцию железа при приеме ежедневных или двукратных доз у молодых женщин с дефицитом железа. Кровь. 2015; 126: 1981–9.
CAS PubMed Статья Google Scholar
Стоффель Н.Ю., Черкамонди К.И., Бриттенхэм Дж. И др. Абсорбция железа из пероральных добавок железа, вводимых в последовательные или альтернативные дни, и в виде однократных утренних доз по сравнению с раздельным приемом дважды в день у истощенных по железу женщин: два открытых рандомизированных контролируемых исследования. Lancet Haematol. 2017; 4: e524–33.
PubMed Статья Google Scholar
Шриер С.Л., Ауэрбах М. Лечение дефицита железа у взрослых. Вольтерс Клувер: UpToDate; 2017.
Google Scholar
Fabiano A, Brilli E, Fogli S, et al. Всасывание железа сукросомным (R) изучали на моделях in vitro и ex vivo. Eur J Pharm Sci. 2017; 111: 425–31.
PubMed Статья CAS Google Scholar
Перейра Д.И., Мерглер Б.И., Фариа Н. и др.Получение клетками Caco-2 пищевого железа (III) запускает эндоцитарный путь наночастиц. PLoS One. 2013; 8: e81250.
PubMed PubMed Central Статья Google Scholar
Ян М.Р., Наврот Т., Футтерер С. и др. Наночастицы оксида / гидроксида железа с отрицательно заряженной оболочкой демонстрируют повышенное поглощение клетками Caco-2. Mol Pharm. 2012; 9: 1628–37.
CAS PubMed Статья Google Scholar
Пизани А., Риччио Э., Саббатини М. и др. Эффект перорального липосомального железа по сравнению с внутривенным железом для лечения железодефицитной анемии у пациентов с ХБП: рандомизированное исследование. Пересадка нефрола Dial. 2015; 30: 645–52.
CAS PubMed Статья Google Scholar
Валенти Л., Месса П., Пелуси С. и др. Уровни гепсидина у пациентов, находящихся на хроническом гемодиализе: критическая оценка. Clin Chem Lab Med. 2014; 52: 613–9.
CAS PubMed Статья Google Scholar
Ли С.В., Ким Дж. М., Лим Х. Дж. И др. Сывороточный гепсидин может быть новым уремическим токсином, что может быть связано с резистентностью к эритропоэтину. Научный отчет 2017; 7: 4260.
PubMed PubMed Central Статья Google Scholar
Римон Э., Каганский Н, Каганский М и др. Мы даем слишком много железа? У восьмидесятилетних детей эффективна терапия низкими дозами железа. Am J Med. 2005; 118: 1142–7.
CAS PubMed Статья Google Scholar
Hilty FM, Арнольд М., Хилбе М. и др. Железо из наночастиц, содержащих железо и цинк, обладает высокой биодоступностью для крыс без накопления в тканях. Nat Nanotechnol. 2010; 5: 374–80.
CAS PubMed Статья Google Scholar
Хосни К.М., Банджар З.М., Харири А.Х. и др. Твердые липидные наночастицы, содержащие железо, для преодоления препятствий при лечении железодефицитной анемии. Drug Des Devel Ther. 2015; 9: 313–20.
PubMed PubMed Central Статья Google Scholar
Latunde-Dada GO, Pereira DI, Tempest B и др. Миметик ферритина в виде наночастиц хорошо усваивается клетками двенадцатиперстной кишки HuTu 80, и его абсорбция у мышей регулируется железом организма. J Nutr. 2014; 144: 1896–902.
CAS PubMed PubMed Central Статья Google Scholar
Занелла Д., Босси Э., Горнати Р. и др. Наночастицы оксида железа могут проникать через плазматические мембраны. Научный доклад 2017; 7: 11413.
PubMed PubMed Central Статья Google Scholar
Heath CW, Strauss MB, Castle WB. Количественные аспекты дефицита железа при гипохромной анемии: (парентеральное введение железа). J Clin Invest. 1932; 11: 1293–312.
CAS PubMed PubMed Central Статья Google Scholar
Бэрд И.М., Подмор Д.А. Внутримышечная терапия железом при железодефицитной анемии. Ланцет. 1954; 267: 942–6.
CAS PubMed Статья Google Scholar
Марчасин С, Валлерстайн РО. Лечение железодефицитной анемии декстраном железа внутривенно. Кровь. 1964; 23: 354–8.
CAS PubMed Google Scholar
Hamstra RD, Block MH, Schocket AL. Внутривенное введение декстрана железа в клинической медицине. ДЖАМА. 1980; 243: 1726–31.
CAS PubMed Статья Google Scholar
Чертов Г.М., Мейсон П.Д., Вааге-Нильсен О. и др.Обновленная информация о побочных эффектах лекарственных препаратов, связанных с парентеральным введением железа. Пересадка нефрола Dial. 2006; 21: 378–82.
CAS PubMed Статья Google Scholar
Ауэрбах М., Баллард Х. Клиническое использование внутривенного железа: введение, эффективность и безопасность. Образовательная программа Hematol Am Soc Hematol. 2010; 2010: 338–47.
Google Scholar
Funk F, Ryle P, Canclini C, et al.Новое поколение внутривенного железа: химия, фармакология и токсикология карбоксимальтозы трехвалентного железа. Arzneimittelforschung. 2010; 60: 345–53.
CAS PubMed Google Scholar
Fishbane S. Обзор вопросов, связанных с железом и инфекциями. Am J Kidney Dis. 1999; 34: S47–52.
CAS PubMed Статья Google Scholar
Рэмптон Д., Фолкерсен Дж., Фишбейн С. и др.Реакции гиперчувствительности на внутривенное введение железа: руководство по минимизации риска и управлению. Haematologica. 2014; 99: 1671–6.
CAS PubMed PubMed Central Статья Google Scholar
Burns DL, Pomposelli JJ. Токсичность парентеральной терапии декстраном железа. Kidney Int Suppl. 1999; 69: S119–24.
CAS PubMed Статья Google Scholar
Новей Х.С., Пал М., Хайдик И. и др. Иммунологические исследования анафилаксии на декстран железа у пациентов, находящихся на диализе почек. Энн Аллергия. 1994; 72: 224–8.
CAS PubMed Google Scholar
Szebeni J, Fishbane S, Hedenus M, et al. Повышенная чувствительность к внутривенному железу: классификация, терминология, механизмы и лечение. Br J Pharmacol. 2015; 172: 5025–36.
CAS PubMed PubMed Central Статья Google Scholar
Авни Т., Бибер А., Гроссман А. и др. Безопасность внутривенных препаратов железа: систематический обзор и метаанализ. Mayo Clin Proc. 2015; 90: 12–23.
PubMed Статья CAS Google Scholar
Болтон-Мэггс PH, Коэн Х. Серьезные опасности переливания крови (SHOT) гемонадзор и прогресс улучшают безопасность переливания. Br J Haematol. 2013; 163: 303–14.
PubMed PubMed Central Статья Google Scholar
Ganzoni AM. Нарушения синтеза гемоглобина (без дефицита железа). Schweiz Med Wochenschr. 1975; 105: 1081–7.
CAS PubMed Google Scholar
Calvet X, Ruiz MA, Dosal A, et al. Анализ минимизации затрат отдает предпочтение внутривенному введению карбоксимальтозы трехвалентного железа по сравнению с сахарозой трехвалентного железа для амбулаторного лечения тяжелой недостаточности железа. PLoS One. 2012; 7: e45604.
CAS PubMed PubMed Central Статья Google Scholar
Auerbach M, Deloughery T. Однократное внутривенное введение железа при дефиците железа: новая парадигма. Образовательная программа Hematol Am Soc Hematol. 2016; 2016: 57–66.
Google Scholar
Нгуен К.Л., Мориарти Дж.М., Плотник А.Н. и др. МР-ангиография с усилением ферумокситола для картирования сосудистого доступа перед транскатетерной заменой аортального клапана у пациентов с почечной недостаточностью: шаг к индивидуальной помощи пациента. Радиология. 2017: 162899. http: // doi.org / 10.1148 / radiol.2017162899
Neiser S, Rentsch D, Dippon U, et al. Физико-химические свойства препаратов железа нового поколения IV ферумокситола, изомальтозида железа 1000 и карбоксимальтозы железа. Биометаллы. 2015; 28: 615–35.
CAS PubMed Статья Google Scholar
Китинг GM. Карбоксимальтоза железа: обзор его использования при дефиците железа. Наркотики. 2015; 75: 101–27.
CAS PubMed Статья Google Scholar
Bregman DB, Goodnough LT. Опыт применения карбоксимальтозы железа внутривенно у пациентов с железодефицитной анемией. Ther Adv Hematol. 2014; 5: 48–60.
CAS PubMed PubMed Central Статья Google Scholar
Вольф М., Кох Т.А., Брегман ДБ. Влияние железодефицитной анемии и ее лечения на фактор роста фибробластов 23 и гомеостаз фосфатов у женщин.J Bone Miner Res. 2013; 28: 1793–803.
CAS PubMed Статья Google Scholar
Courbebaisse M, Lanske B. Биология фактора роста фибробластов 23: от физиологии к патологии. Cold Spring Harb Perspect Med 2017. http://doi.org/10.1101/cshperspect.a031260
Macdougall IC. Внутривенная терапия железом у недиализных пациентов с ХБП. Пересадка нефрола Dial. 2014; 29: 717–20.
PubMed Статья Google Scholar
Евстатиев Р., Марто П., Икбал Т. и др. FERGIcor, рандомизированное контролируемое исследование карбоксимальтозы железа при железодефицитной анемии при воспалительном заболевании кишечника. Гастроэнтерология. 2011; 141 (846–853): e841–2.
Google Scholar
Кульнигг С., Стойнов С., Симаненков В. и др. Новый препарат железа для внутривенного введения для лечения анемии при воспалительном заболевании кишечника: рандомизированное контролируемое исследование карбоксимальтозы железа (FERINJECT).Am J Gastroenterol. 2008; 103: 1182–92.
CAS PubMed Статья Google Scholar
Van Wyck DB, Mangione A, Morrison J, et al. Внутривенная инъекция карбоксимальтозы железа в больших дозах при железодефицитной анемии при тяжелом маточном кровотечении: рандомизированное контролируемое исследование. Переливание. 2009. 49: 2719–28.
PubMed Статья CAS Google Scholar
Van Wyck DB, Martens MG, Seid MH и др. Внутривенное введение карбоксимальтозы трехвалентного железа в сравнении с пероральным приемом железа при лечении послеродовой анемии: рандомизированное контролируемое исследование. Obstet Gynecol. 2007; 110: 267–78.
PubMed Статья Google Scholar
Брейманн С., Глига Ф., Беженариу С. и др. Сравнительная эффективность и безопасность внутривенного введения карбоксимальтозы железа в лечении послеродовой железодефицитной анемии. Int J Gynaecol Obstet.2008; 101: 67–73.
CAS PubMed Статья Google Scholar
van Veldhuisen DJ, Ponikowski P, van der Meer P, et al. Влияние карбоксимальтозы железа на физическую работоспособность у пациентов с хронической сердечной недостаточностью и дефицитом железа. Тираж. 2017; 136: 1374–83.
PubMed PubMed Central Статья CAS Google Scholar
Пониковски П., Вурс А.А., Анкер С.Д. и др.Рекомендации ESC по диагностике и лечению острой и хронической сердечной недостаточности: целевая группа по диагностике и лечению острой и хронической сердечной недостаточности Европейского общества кардиологов (ESC) Разработано при особом участии Ассоциации сердечной недостаточности (HFA) ESC. Eur Heart J. 2016; 37: 2129–200.
PubMed Статья Google Scholar
Янси К.В., Джессап М., Бозкурт Б. и др. ACC / AHA / HFSA сфокусировано на обновлении рекомендаций ACCF / AHA по лечению сердечной недостаточности 2013 года: отчет Американского колледжа кардиологов / Американской кардиологической ассоциации по клиническим практическим рекомендациям и Американского общества сердечной недостаточности.J Am Coll Cardiol. 2017; 70: 776–803.
PubMed Статья Google Scholar
Ezekowitz JA, O’Meara E, McDonald MA, et al. Комплексное обновление рекомендаций Канадского сердечно-сосудистого общества по лечению сердечной недостаточности. Может J Cardiol. 2017; 33: 1342–433.
PubMed Статья Google Scholar
Филиппатос Г., Фармакис Д., Колет Дж. С. и др.Внутривенное введение карбоксимальтозы железа (III) железодефицитным пациентам с хронической сердечной недостаточностью с анемией и без нее: субанализ исследования FAIR-HF. Eur J Heart Fail. 2013; 15: 1267–76.
CAS PubMed PubMed Central Статья Google Scholar
Drakesmith H, Nemeth E, Ganz T. Выравнивание ферропортина. Cell Metab. 2015; 22: 777–87.
CAS PubMed PubMed Central Статья Google Scholar
Сабелли М., Монтози Дж., Гарути С. и др. Биология макрофагов ферропортина человека и основы ферропортиновой болезни. Гепатология. 2017; 65: 1512–25.
CAS PubMed PubMed Central Статья Google Scholar
Джирелли Д., Марки Дж., Бусти Ф. Железозаместительная терапия: вступление в новую эру без заблуждений, но необходимы дополнительные исследования. Переливание крови. 2017; 15: 379–81.
PubMed PubMed Central Google Scholar
Cloonan SM, Mumby S, Adcock IM, et al. «Железный» фактор перегрузки железом и дефицита железа при хронической обструктивной болезни легких. Am J Respir Crit Care Med. 2017; 196: 1103–12.
PubMed Статья Google Scholar
Внутривенная терапия добавками железа — ScienceDirect
Внутривенные инфузии железа превратились из малоэффективного и опасного вмешательства в безопасный краеугольный камень в лечении дефицита железа.Современные составы железа представляют собой композитные наночастицы, состоящие из оксигидроксидов железа и углеводов. Декстран железа, дерисомальтоза железа (ранее известная как изомальтозид железа 1000), карбоксимальтоза железа, феррумокситол, сахароза железа и глюконат натрия трехвалентного железа могут вводиться в различных дозах и позволяют корректировать общий дефицит железа однократными или повторными дозами в течение 1-2 недель в зависимости от конкретная формулировка. Все препараты железа связаны с риском тяжелых инфузионных реакций. В недавних проспективных клинических исследованиях риск развития инфузионных реакций от умеренной до тяжелой степени был сопоставим для всех современных препаратов, поражающих <1% пациентов.
Следовательно, внутривенная терапия железом предназначена для пациентов с железодефицитной анемией с непереносимостью или отсутствием реакции на пероральное введение железа. Согласно европейской маркировке лекарств, внутривенное введение железа также может быть предпочтительным, когда требуется быстрая коррекция дефицита железа. У пациентов с воспалением дефицит железа также следует подозревать как причину анемии, когда насыщение трансферрина низкое, поскольку ферритин сыворотки может быть ложно нормальным. Основная цель лечения в.в. железо — это улучшение качества жизни, суррогатным маркером которого является гемоглобин.
Возникающим осложнением, поражающим 50–74% пациентов, получавших карбоксимальтозу железа в проспективных клинических исследованиях, является гипофосфатемия — или, точнее, синдром 6H (гиперфосфатурическая гипофосфатемия, вызванная высоким фактором роста фибробластов 23, вызывающим гиповитаминоз D, гипокальциемию и вторичный гиперпаратизм). Эти биохимические изменения могут вызвать серьезные и потенциально необратимые клинические осложнения, такие как боль в костях, остеомаляция и переломы. Индивидуальный подбор подходящей терапии железом и оценка ответа на лечение являются обязательными для безопасного достижения улучшенного результата с помощью внутривенной терапии железом.
Клиническое применение железа для внутривенного введения: введение, эффективность и безопасность | Гематология, Образовательная программа ASH
В этом разделе рассматриваются история, фармакология, введение, эффективность и токсичность внутривенного железа. Внутривенное введение железа дает преимущества перед пероральным приемом железа для лечения железодефицитной анемии при широком диапазоне болезненных состояний, связанных с абсолютным и функциональным дефицитом железа. Однако остаются опасения по поводу острых профилей безопасности доступных препаратов и возможности долгосрочной токсичности при их повторном применении.Доступно семь препаратов железа для внутривенного введения. Существует множество заблуждений относительно относительной токсичности различных составов. Обсуждаются сходства и различия. Восполнение запасов железа связано с неблагоприятными исходами при инфекциях. Рассматривается взаимосвязь, если таковая имеется, между внутривенным введением железа и инфекциями. Выделены потенциальные преимущества инфузии общей дозы (TDI), полного восстановления за один прием. Представлена новая парадигма заместительной терапии железом при железодефицитной анемии.
Железо используется для лечения анемии более 300 лет. В обзоре лечения хлороза в 1893 году Стокман приписывает первое применение перорального железа Сиденхему в 1681 году. что пероральная терапия железом стала стандартным лечением того, что сейчас известно как железодефицитная анемия (ЖДА).Однако пероральный прием железа не является идеальным лечением, поскольку желудочно-кишечная токсичность встречается у> 35–59% пациентов, 3,4 и длительный курс необходим для устранения анемии и пополнения запасов. Несоблюдение предписанного курса перорального приема железа является обычным явлением, и даже у приверженных ему пациентов плохая кишечная абсорбция не может компенсировать потребность в железе при продолжающихся кровопотерях.
Хотя внутривенное введение железа способно обойти все эти проблемы, сохраняются опасения по поводу острых профилей безопасности доступных продуктов и потенциального долгосрочного вреда от повторного введения железа.Хотя любое внутривенное введение железа может вызывать острые тяжелые реакции, частота и тяжесть реакций ниже, чем могут оценить врачи, 5 , а дозы, обычно вводимые в клинической практике, недостаточны для того, чтобы привести к повреждению паренхиматозного органа. Точно так же опасения по поводу внутривенной терапии железом, потенциально повышающей риск инфекций и сердечно-сосудистых заболеваний, не были подтверждены в проспективных исследованиях или клинических испытаниях и остаются в значительной степени недоказанными гипотезами. В этой статье будут рассмотрены способы применения, показания и профили безопасности доступных внутривенных препаратов железа в развитых странах.Тем не менее, целесообразно проанализировать историю инъекционного железа, чтобы лучше понять нынешнее нежелание применять рутинную терапию препаратами железа внутривенно.
Парентеральное железо впервые было введено в начале 20-х гг. -х гг. г. г. 6 г. (рис. 1). Растворы гидроксида железа вводили подкожно и внутримышечно пациентам с гипохромной анемией, и наблюдаемые приросты гемоглобина были пропорциональны количеству введенного железа.Отсутствие углеводной оболочки привело к немедленному высвобождению железа и серьезным токсическим реакциям, которые привели к тому, что использование этой терапии было рекомендовано только в чрезвычайных обстоятельствах.
Рисунок 1.
Всего зарегистрированных серьезных НЯ на миллион доз 100 мг. Изменено с разрешения Chertow et al. 19
Рисунок 1.
Всего зарегистрированных серьезных нежелательных явлений на миллион доз 100 мг.Изменено с разрешения Chertow et al. 19
В 1947 году Nissim 7 ввел сахарид железа для внутривенной инъекции и пришел к выводу, что эта форма железа более безопасна и больше подходит для парентерального введения. В 1954 году Бэрд и Подмор 8 представили Имферон (высокомолекулярный декстран железа [HMW ID], Fisons plc, Homes Chapel England, Ипсвич, Великобритания; продаваемый Merrill Pharmaceuticals в США) для внутримышечного (IM) и внутривенного применения. .Декстран покрывает ядро оксида железа, уменьшая высвобождение свободного железа во время инфузии, что объясняет низкую частоту побочных реакций. Биодоступность железа происходит за счет поглощения частиц декстрана железа ретикулоэндотелиальной системой с последующей деградацией. Наблюдались быстрые гематологические реакции с низкой частотой побочных эффектов. Однако у пациентов могут развиваться или иметься предварительно сформированные антидекстрановые антитела, и, в частности, более крупные молекулы декстрана могут вызывать анафилаксию, как описано при введении HMW ID.Несмотря на то, что эти реакции относительно редки, эти реакции побуждали избегать парентерального введения железа, за исключением случаев, когда наблюдались экстремальные клинические условия и другие варианты недоступны. HMW ID был единственным препаратом для парентерального введения железа, доступным до 1990-х годов.
Хотя опубликованные в мировой литературе статьи 9,10 подтверждают полезность внутривенного введения железа в лечении ЖДА, только в 1980 г. появилось первое проспективное исследование клинического использования внутривенного железа в США. 11 Четыреста семьдесят один пациент с ЖДА получил внутривенное введение железа в различных дозах. Все пациенты ответили на лечение, но у трех из них были выявлены «анафилактоидные» реакции с симптомами и признаками, включая остановку дыхания, гипотензию, пурпуру, цианоз, одышку, обморок, хрипы и крапивницу. В сериале не было смертей. Авторы пришли к выводу, что внутривенное введение железа следует применять для тех состояний, при которых нельзя использовать пероральное железо. HMW ID оставался в фармакопее и был второстепенным продуктом до появления в 1989 году рекомбинантного человеческого эритропоэтина (эпоэтина альфа), первого агента, стимулирующего эритропоэз (ESA).
Эпоэтин впервые был использован для лечения анемии у пациентов, находящихся на диализе почек. Хотя большинство пациентов ответили на эпоэтин, некоторые — нет. 12 Было найдено несколько объяснений субоптимального ответа, но обычно было показано, что неудача связана с абсолютным или функциональным дефицитом железа, поскольку введение железа внутривенно восстанавливает реакцию. 13 Функциональный дефицит железа (железо-ограниченный эритропоэз) рассматривается в другом месте этого занятия.Впоследствии парентеральная терапия железом стала важным дополнением к получению и поддержанию адекватных уровней гемоглобина у пациентов с терминальной стадией почечной недостаточности и другими болезненными состояниями.
Хотя относительно редко, наблюдались тяжелые реакции острой гиперчувствительности на HMW ID. Во вкладыше к упаковке было помещено предупреждение о черном ящике, и требовалась пробная доза. В 1991 году зараженная партия привела к отзыву продукта во всем мире.По счастливой случайности, в то же время низкомолекулярный декстран железа (LMW ID) (INFeD, Schein Pharmaceuticals, теперь Watson Pharmaceuticals, Inc, Морристаун, Нью-Джерси) завершал регистрационные испытания в Соединенных Штатах и выпущен для клинического использования в 1992 году. blueprinting, Фисонс определил, что этот продукт содержал декстран с более низкой молекулярной массой и меньшей вариабельностью боковых цепей. Первоначальная форма HMW ID была снята с американского рынка в 1991 году, а его производство прекратилось в 1992 году.Использование ESA и LMW ID было обычным явлением у пациентов на диализе и еще больше увеличилось в 1997 году с принятием руководящих принципов по клинической практике, продвигающих рутинное использование обоих агентов для достижения целевого уровня гемоглобина от 11 до 12 г / дл.
В 1996 году еще один HMW ID (Dexferrum, American Regent Pharmaceuticals, Ширли, штат Нью-Йорк) был одобрен Управлением по контролю за продуктами и лекарствами (FDA), хотя LMW ID сохранил большую часть рынка диализа.Оба декстрана железа требовали тестовой дозы и имели предупреждения о черном ящике.
В 1999 году глюконат железа (FG) (Ferrlecit, Schein, затем Watson Pharmaceuticals, теперь Sanofi-Aventis), после того как он был доступен в Европе в течение многих лет, был представлен на американском рынке как более безопасная альтернатива декстрану железа. Исторический обзор использования ФГ в Европе и декстранов железа в США не выявил смертей, связанных с ФГ, но по крайней мере 31 смерть от декстрана железа, и пришел к выводу, что ФГ более безопасен из-за отсутствия декстрановой оболочки. 14 Двойное слепое плацебо-контролируемое перекрестное исследование однократного введения ФГ у 2338 гемодиализных пациентов выявило только одну серьезную аллергическую реакцию без летального исхода. 15,16 Они также сообщили, что у пациентов, ранее чувствительных к декстрану железа, реакции на ФГ были необычными, но также в 7 раз чаще, чем у пациентов без предшествующей чувствительности к железу. 16 Практически все 2338 пациентов ранее получали декстраны железа. В ноябре 2000 г. сахароза железа (IS) (Venofer, America Regent Pharmaceuticals) была одобрена в США.Он также давно используется в Европе, не имеет декстранового покрытия и, как сообщается, имеет профиль безопасности, аналогичный FG. 17 Предупреждения о черном ящике не появляются на вкладышах в упаковке FG или IS, и тестовая доза не рекомендуется. Впоследствии FG и IS в значительной степени заменили использование декстранов железа у диализных пациентов в США.
В ретроспективном обзоре более 30 миллионов доз железа внутривенно Chertow et al 18 показали, что воздействие HMW ID было связано со значительно более высоким риском нежелательных явлений (AE) по сравнению с LMW ID (Рисунок 2 18 ).В ходе последующего анализа авторы пришли к выводу, что НЯ были относительно низкими в целом, с более низкими показателями среди LMW ID, FG и IS. 19 Однако два небольших проспективных исследования и один метаанализ, сравнивающие эффективность и безопасность LMW ID с IS, не показали никакой разницы. 20–22
Рисунок 2.
Всего сообщалось о серьезных побочных эффектах на миллион доз 100 мг декстрана железа.
Рисунок 2.
Всего сообщили о серьезных побочных эффектах на миллион доз 100 мг декстрана железа.
За последние 18 месяцев было выпущено три новых соединения железа для внутривенного введения для лечения пациентов с анемией или хронической болезнью почек (ХБП). Два в настоящее время одобрены для использования в Европе (карбоксимальтоза железа [FC], Ferrinject, ViforPharma, Санкт-Галлен, Швейцария, и изомальтозид железа [II], Monofer, Pharmacosmos, Holbaek, Дания) и один в США (ферумокситол, Feraheme , AMAG Pharmaceuticals, Inc, Лексингтон, Массачусетс).Все три соединения обещают предложить полную замещающую дозу железа за 15 минут или меньше.
Самые ранние препараты железа были связаны с неприемлемой острой токсичностью в результате высвобождения биоактивного свободного железа. Сегодня все препараты железа для внутривенного введения представляют собой комплексы или коллоиды железо-углевод, основанные на небольших сфероидальных железо-углеводных частицах. Каждая частица состоит из ядра, сделанного из оксигидроксигелевого железа, окруженного оболочкой из углеводов, которая стабилизирует гель, замедляет высвобождение железа и удерживает полученные частицы в коллоидной суспензии. 23 Все одобренные в настоящее время утюги для внутривенного введения имеют такую структуру, но отличаются друг от друга размером ядра, а также характером и плотностью окружающего углевода. Характеристики семи соединений железа показаны в таблице 1. Сильные стороны комплекса железа влияют на фармакокинетические характеристики утюгов для внутривенного введения, имеющих отношение к терапевтическому применению. Скорость высвобождения биоактивного железа обратно пропорциональна силе комплекса — чем сильнее комплекс, тем медленнее высвобождение железа. 24 Токсикологическое значение зависимости размера комплекса от времени высвобождения заключается в том, что более сильные комплексы имеют более низкий потенциал насыщения трансферрина с последующей токсичностью свободного железа по сравнению с более слабыми комплексами. 25
После инъекции все разные препараты разделяют схожую метаболическую судьбу. Комплексы железо-углевод смешиваются с плазмой и фагоцитируются в ретикулоэндотелиальной системе, при этом углеводная оболочка разрушается, а железо хранится в виде ферритина или транспортируется из клетки с помощью единственного известного белка, экспортирующего железо, ферропортина.Экспортируемое железо связывается с внеклеточным связывающим белком, трансферрином, который доставляет железо к рецепторам трансферрина на поверхности предшественников эритроидов, поддерживая гемоглобинизацию.
IM-маршрут считается более безопасной альтернативой IV. Никакие опубликованные данные не подтверждают этот вывод, поскольку частота нежелательных явлений схожа при обоих способах введения. Кроме того, внутримышечные инъекции болезненны, вызывают необратимое изменение цвета кожи и связаны с ягодичными саркомами. 26,27 Следует отказаться от внутримышечных инъекций. 5
Введение любого из доступных препаратов может быть связано с острой стесненностью в груди и спине без сопутствующей гипотензии, хрипов, стридора или периорбитального отека. В случае декстранов железа это обычно наблюдается после введения тестовой дозы. 5 Это нечастое событие редко повторяется при повторном вызове. Эти явления более вероятны у пациентов с аллергическим диатезом. 28 Важно не слишком остро реагировать на эти незначительные НЯ. У пациентов с повышенным риском развития НЯ предварительное лечение кортикостероидами может быть полезным. 29
В обзоре терапии LMW ID у пациентов с дефицитом железа и нормальной функцией почек, у которых была непереносимость перорального приема железа, Barton et al. 3 предположили, что предварительная обработка антигистаминными препаратами была ответственна за большинство предполагаемых реакций на декстран железа.Поскольку нет опубликованных доказательств того, что антигистаминные препараты полезны для уменьшения реакций острой гиперчувствительности к внутривенному введению железа, рекомендуется не проводить предварительное лечение в обычном порядке.
В нескольких публикациях упоминались проблемы безопасности этого препарата. 18,19,30–35 В течение короткого периода в 1997 году, когда LMW ID стал недоступен, HMW ID был единственным доступным препаратом.За этот период количество спонтанных сообщений в FDA о побочных эффектах, связанных с внутривенным введением железа, увеличилось в 11 раз (получено автором через Freedom of Information). Многочисленные публикации предостерегали от использования HMW ID. 30 Национальная комплексная онкологическая сеть 31 и журнал медсестер Американского общества нефрологии 32 запретили его использование. Он был удален из формуляров всех больниц Администрации ветеранов США и их протекторатов и недоступен в Европе.Несмотря на это, некоторые больничные фармацевты продолжают рассматривать все продукты с декстраном железа как равные, а многие врачи не знают о различиях между двумя декстранами железа. Центры услуг Medicare и Medicaid в настоящее время присваивают идентичные J-коды для выставления счетов, что еще больше сбивает с толку лиц, назначающих лекарства.
В 2002 г. Мамула и др. 33 опубликовали свой опыт инфузии общей дозы (TDI) у детей с воспалительным заболеванием кишечника и сообщили о 9-кратном увеличении частоты НЯ с HMW ID по сравнению с LMW ID.В обзоре предполагаемых НЯ декстрана железа Fletes et al 34 отметили, что НЯ были в 8,1 раза более вероятны при HMW ID, и пришли к выводу, что серьезные НЯ, связанные с внутривенным введением декстрана железа, были редкими и, по-видимому, зависели от конкретной рецептуры препарата. В / в декстран железа. Аналогичные результаты наблюдались McCarthy et al. 35 в исследовании, посвященном НЯ у пациентов на хроническом гемодиализе, получавших декстран железа внутривенно. В первом исследовании, продемонстрировавшем пользу внутривенного введения железа в синергизме с ЭСС при лечении анемии, вызванной химиотерапией, 81 из 157 пациентов получали декстран железа в виде болюса или ТДИ.Из 79 пациентов, получивших LMW ID, значимых НЯ не наблюдалось, тогда как у одного из двух пациентов, получивших HMW ID, в течение короткого периода, когда LMW ID не было доступно, развился анафилаксия. 36 Через четыре месяца после выздоровления этот пациент получил LMW ID без осложнений, как и ранее опубликованный опыт. 32,33 В недавнем исследовании 25 пациентов с синдромом беспокойных ног, получавших 1000 мг HMW ID в течение нескольких часов, Ondo 37 сообщил о высокой скорости улучшения симптомов; однако у двух пациентов развилась анафилаксия.Однако в публикации ретроспективного анализа 48 059 диализных пациентов, из которых 20 213 не получали железо, из базы данных Gambril US Healthcare, Уолтерс и Ван Вик 38 обнаружили, что пациенты, получившие HMW ID, с большей вероятностью не испытают тяжелую болезнь. AE, чем те, кто получил LMW ID.
Недавно FDA выпустило предупреждение, чтобы отметить «различия в химических характеристиках и клинических эффектах препаратов декстрана железа, чтобы минимизировать потенциальную путаницу между доступными продуктами в формуляре».Увеличение числа зарегистрированных серьезных НЯ с HMW ID предполагает, что при рассмотрении этого препарата следует проявлять осторожность.
Учитывая текущее состояние знаний, это предпочтительный состав декстрана железа. В отличие от солей железа, FG и IS, этот состав можно вводить в виде болюса внутривенно или TDI (одобренный метод введения в Европе, но не в Соединенных Штатах). Eschbach et al., , 12, были первыми, кто продемонстрировал преимущество декстрана железа в усилении ответа на эритропоэтин у пациентов с анемией ХБП, находящихся на диализе.Впоследствии было показано, что заметное снижение дозировки ESA может быть достигнуто при добавлении декстрана железа. 39
После выпуска LMW ID в 1991 г. для лечения диализной анемии, он стал стандартом для дополнения ESA. Первоначальный обзор безопасности был опубликован в 1996 году. Авторы пришли к выводу, что НЯ с LMW ID были редкими, и только история аллергии предсказывала очень редкие НЯ. 28 Кроме того, TDI особенно полезен при оказании помощи пациентам, находящимся на поддерживающем перитонеальном диализе или гемодиализе на дому, которым в противном случае потребовалось бы частое посещение амбулаторных учреждений для завершения терапии. 40 Этот метод введения пациентам, находящимся на гемодиализе, сравнивался с болюсным в многоцентровом рандомизированном открытом исследовании и показал его одинаковую безопасность и эффективность при значительной экономии средств. 41
Недавно мы представили данные о 226 инфузиях 1 грамма LMW ID в течение 1 часа у 187 последовательных, неотобранных пациентов с дефицитом железа и без недавнего внутривенного введения железа (Таблица 2).Только два пациента получили премедикацию — метилпреднизолон — из-за аллергического анамнеза. Существенной токсичности не наблюдалось (таблица 3). Все пациенты, у которых развилась крапивница, кроме одного, получили полную дозу. 42
Таблица 2.диагнозов у 187 пациентов, получавших 1 грамм внутривенного LMWID в течение 1 часа lang = FR
Таблица 3.Неблагоприятные события после 1 грамма внутривенного введения LMW ID в течение 1 часа
Гипофосфатемия (сывороточный фосфат <2 мг / дл) наблюдалась после введения IS и FC. Мы исследовали до- и постинфузионные уровни фосфатов после LMW ID и не обнаружили изменений при медиане наблюдения в течение 2 недель (среднее изменение от исходного уровня фосфатов составило 0,0 мг / дл (95% ДИ, от -0,1 до 0,2; P ). = 0,537) (Таблица 4).
Таблица 4.Уровни фосфатов до и после инфузии в соответствии с LMW ID
Пациентам с раком или заболеванием почек, требующим еженедельных или более частых посещений, короткие инфузии любого из доступных препаратов, за возможным исключением HMW ID, могут проводиться без значительного риска. Однако, если большие дозы железа вводятся внутривенно в амбулаторных условиях, предпочтительным методом является TDI. Этот метод особенно полезен в следующих клинических ситуациях: домашний перитонеальный диализ или гемодиализ, дефицит железа из-за беременности, менометроррагия, хирургическая кровопотеря, операция обходного желудочного анастомоза, наследственные геморрагические телеангиэктазии (Osler-Weber-Rendu), ангиодисплазия, вызванная другими причинами, воспалительные процессы. заболевания кишечника (ВЗК), синдромы мальабсорбции и у тех пациентов с неосложненным дефицитом железа, которые не соблюдают или не переносят пероральное введение железа.Этот метод введения особенно полезен Свидетелям Иеговы, которые отказываются от всех препаратов крови.
После утверждения для использования у пациентов, находящихся на гемодиализе в 2002 году, FG (и позже IS) быстро заменили декстран железа в качестве предпочтительного препарата железа для внутривенного введения. Были введены миллионы доз, причем НЯ почти всегда были незначительными реакциями на инфузию. Хотя сообщалось о НЯ при применении всех в / в утюжков, НЯ с этим составом, когда избегают высоких доз, встречаются редко. 15,16 Введение FG было показано для снижения потребности в ЭСС у гемодиализных пациентов с повышенным уровнем ферритина, 43 для улучшения анемии без ЭСС у железодефицитных пациентов с ХБП, 44 и для коррекции анемии у диализных пациентов с высоким уровнем ферритина. сывороточный ферритин и низкое насыщение трансферрина. 45
Хотя максимальная рекомендуемая доза ФГ составляет 125 мг в виде болюса или короткой инфузии, сообщается, что 250 мг безопасно вводить в течение 1 часа. 46 Более высокие дозы связаны с вазоактивными реакциями, включая гипотонию, острое начало диареи и отек конечностей, и поэтому их следует избегать. Если не вводить дозы, превышающие рекомендуемые, значительные НЯ с ФГ возникают нечасто.
Безусловно, самый большой опыт в опубликованной литературе связан с этой формулировкой. В 1994 г. Aronoff et al. 47 продемонстрировали безопасность заместительных и поддерживающих схем ИИ у пациентов, находящихся на гемодиализе.Эти данные были подтверждены Charytan et al., 48 , которые показали безопасность ИИ у гемодиализных пациентов, в том числе у пациентов с непереносимостью других парентеральных препаратов железа. В рандомизированном контролируемом исследовании по сравнению внутривенного введения ИИ с пероральным приемом железа у пациентов с анемией и недиализно-зависимой ХБП Van Wyck et al. 49 показали, что ИИ в дозе 1000 мг в разделенных дозах более эффективен, чем пероральный прием железа. В исследовании пациентов с анемией и ХБП с отсутствием гемосидерина костного мозга и высоким уровнем ферритина в сыворотке крови Gotloib et al 50 показали, что внутривенное введение ИС с ЭСС и без них привело к повышению уровня гемоглобина и достижению целевого гемоглобина 12 г / г. дл.
Было показано, чтоIS улучшает реакцию гемоглобина при лечении анемии у пациентов с ВЗК, когда пероральное железо потенциально опасно для кишечного эпителия. 51,52 FG, LMW ID и FC также оказались полезными для этих пациентов. 53 В обзоре эффективности и безопасности внутривенного введения ИИ в качестве альтернативы переливанию крови в хирургии авторы пришли к выводу, что внутривенное введение ИС было безопасным, ускоряло выздоровление от анемии и уменьшало потребность в переливании крови. 54 Внутривенное введение ИС было показано в обсервационных исследованиях для снижения потребности в переливании крови при замене суставов, кардиохирургии и хирургии колоректального рака. Сводка данных по внутривенному введению железа в хирургии представлена в таблице 5. Эти данные рассмотрены в недавней публикации. 55
Таблица 5.Исследования внутривенного введения железа в хирургии
IS можно безопасно вводить в виде 2-минутного болюса или в виде короткой инфузии в дозах до 300 мг, но более высокие дозы запрещены. 56 .При введении более высоких доз, даже при продолжительности инфузии в течение 2 часов, наблюдаются гипотония, тошнота и боли в пояснице. 57 Если не вводить более высокие дозы, чем рекомендованные, значительные НЯ возникают нечасто.
Этот препарат железа для внутривенного введения был первым из новых препаратов, одобренных для более быстрого введения больших доз. ФК можно вводить в виде инфузии по 500-1500 мг за 15 минут; однако в настоящее время утверждены только дозы до 1000 мг.Тестовая доза не требуется. FC одобрен в Европе, Азии и Австралии.
В январе 2010 г. Anker et al. 58 опубликовали свой опыт применения болюсов FC 200 мг у пациентов с фракцией выброса левого желудочка 45% или меньше. Они пришли к выводу, что лечение IV ФК у пациентов с хронической сердечной недостаточностью и дефицитом железа, с анемией или без нее, улучшает симптомы, функциональные возможности и качество жизни с приемлемым профилем побочных эффектов.
В проспективном исследовании 200 пациентов с ВЗК, получавших ФК в виде инфузии 1000 мг за 15 минут, Кульнигг и др. 59 пришли к выводу, что ФК безопасен и не уступает пероральному сульфату железа при лечении пациентов с дефицитом железа, что привело к быстрое повышение гемоглобина и пополнение запасов железа. В недавно опубликованном клиническом исследовании Covic et al. 60 изучали 163 гемодиализных пациентов с ЖДА, которые получали болюсы FC от 100 до 200 мг в день диализа, и пришли к выводу, что препарат хорошо переносится и эффективен в коррекции гемоглобина. уровни и склады железа.
В исследовании 477 женщин с ЖДА, рандомизированных для приема ≤1000 мг ФК в течение 15 минут или перорального приема сульфата железа, Ван Вик и др. 61 показали улучшение реакции гемоглобина, физических функций и утомляемости по сравнению с пероральным приемом железа. Существенной токсичности не наблюдалось.
Однако в феврале 2008 г. FDA не утвердило FC для распространения в Соединенных Штатах из-за необъяснимой гипофосфатемии после инфузии пациентам с ХБП, увеличения числа неблагоприятных сердечных событий и дисбаланса показателей смертности в группе лечения по сравнению с с рычагом управления.Ожидаются результаты текущих и достаточно мощных испытаний безопасности этого агента.
Этот состав был одобрен FDA в июне 2009 г. для заместительной терапии железом у пациентов с ЖДА и ХБП. Тестовая доза не требуется. Этот продукт уникален тем, что его можно вводить в виде относительно большой дозы (510 мг, эксклюзивный размер флакона) менее чем за 20 секунд. Нет данных о более высоких дозах. Опубликованный профиль безопасности соответствует LMW ID, FG и IS.
В исследовании 230 пациентов, из которых 116 получали ферумокситол и 114 перорально железо, Provenzano и др. Пришли к выводу, что две быстрые (17 секунд) инъекции 510 мг ферумокситола, введенные в течение 1 недели, привели к большему увеличению гемоглобина по сравнению с пероральное железо с сопоставимой переносимостью. Никаких значительных НЯ не наблюдалось. 62 В перекрестном исследовании с участием 750 пациентов с ЖДА и ХБП, не находящихся на диализе, Singh et al. 63 вводили 510 мг ферумокситола или плацебо за 17 секунд дважды за 1 неделю 711 пациентам или плацебо 713 пациентам.Одно значимое НЯ (анафилаксия) наблюдалось в группе лечения у пациента с историей множественной лекарственной аллергии. Пациент выздоровел. Авторы пришли к выводу, что ферумокситол хорошо переносится и имеет профиль безопасности, аналогичный плацебо, у пациентов с анемией и ХБП.
Ферумокситол может способствовать замещению железа, если профиль безопасности остается неизменным в других группах пациентов. В настоящее время он не одобрен в Европе.Мы с нетерпением ждем дополнительных данных о безопасности и дозировке этого нового агента на постмаркетинговом рынке у пациентов с анемией при ХБП, а также в других клинических условиях.
Нет никаких проспективных данных о отдаленных результатах при использовании внутривенного железа. Самый большой опыт использования внутривенного железа получен в нефрологическом сообществе, при этом большая часть опубликованных данных поступает из исследований на диализных пациентах. Наиболее всесторонняя работа по этому вопросу была проведена Kalantar-Zadeh et al., 65 , которые исследовали зависящие от времени связи между внутривенным введением железа и смертностью от всех причин и сердечно-сосудистой смертности у пациентов на поддерживающем гемодиализе.Были проанализированы проспективно собранные данные (2001–2003 гг.) Из исторической когорты из более чем 58 000 пациентов, представляющих практически все диализные клиники DaVita в США. Исследователи сообщили, что после обширной зависящей от времени и многовариантной корректировки для смеси случаев, введения внутривенных доз железа и эритропоэтина и суррогатов нутритивного статуса и воспаления самый низкий риск смерти от всех причин и сердечно-сосудистых заболеваний был связан со следующими параметрами железа: сывороткой уровни ферритина от 200 до 1200 нг / мл, насыщение трансферрина от 30% до 50% и уровни сывороточного железа от 60 до 120 мкг / мл.Они также обнаружили, что по сравнению с теми, кто не получал внутривенное введение железа, поддерживающие дозы до 400 мг в месяц были связаны с улучшением выживаемости. 65
В ретроспективном анализе смертности от всех причин в когорте из 32 566 пациентов, находящихся на гемодиализе с 1996 г. по середину 1998 г., Feldman et al. 66 не обнаружили неблагоприятного воздействия на 2-летнюю выживаемость при дозах до 1000 мг в течение 6 лет. -месячный период, но повышенная смертность при дозах от 1000 до 1800 мг.Однако, используя многомерные модели для учета изменяющихся во времени показателей заболеваемости и введения железа, авторы не обнаружили статистически значимой связи между любым уровнем введения железа и смертностью. В результате этого наблюдения они пришли к выводу, что ранее наблюдаемые связи между введением железа и более высокой смертностью могут быть искажены, и предоставили осторожную поддержку безопасности разумного введения кумулятивных доз железа> 1000 мг в течение 6-месячного периода, если это необходимо для поддержания целевые гемоглобины у пациентов, находящихся на гемодиализе
Beguin et al. 67 опубликовали единственное онкологическое исследование, посвященное изучению отдаленных результатов после в / в введения железа.Авторы изучили 127 пациентов с трансплантацией аутологичных стволовых клеток с анемией и лимфопролиферативными злокачественными новообразованиями, получавших дарбепоэтин с внутривенным введением железа или без него. На сроке> 1500 дней аналогичные результаты наблюдались для обеих групп. 67
Железо является прооксидантом, важным питательным веществом для многих бактерий, и у лабораторных животных было показано, что оно обостряет сепсис. В то время как исследования на людях показали временное увеличение маркеров окислительного стресса при применении всех форм железа, вводимого внутривенно, о каких-либо клинических отрицательных результатах, связанных с увеличением этих маркеров, никогда не сообщалось. 68
Восполнение запасов железа пероральным приемом железа связано с неблагоприятными исходами при некоторых инфекциях. В исследовании 137 сомалийских кочевников с дефицитом железа, 67 из которых получали плацебо, а 71 — пероральное железо, Мюррей и др. 69 отметили семь эпизодов инфекции в группе плацебо и 36 в группе, получавшей железо. Хотя внутривенное введение железа теоретически считается причиной увеличения числа инфекций. 70,71 Hoen et al. 72 проспективно обследовали 985 диализных пациентов, получающих внутривенное введение железа в рамках режима диализ-ассоциированной анемии, и обнаружили, что, хотя центральные венозные катетеры, история бактериемии, артериовенозных трансплантатов и иммуносупрессии были связаны с повышенного риска инфекций, уровня ферритина и общей дозы в / в введения железа не было. Кроме того, в исследовании Anker у пациентов с сердечной недостаточностью (группа относительно высокого риска), в том числе примерно 40% с ХБП в 6-месячном плацебо-контролируемом исследовании, отмечалось улучшение качества жизни и функционального статуса без увеличения числа инфекций. . 58 Текущее состояние литературы, касающейся приема железа и риска инфицирования, не позволяет делать однозначных выводов. Риск, если таковой имеется, внутривенного введения железа, вызывающего инфекцию и связанную с этим заболеваемость и смертность, вероятно, очень мал. Клиницисты должны сопоставить эту информацию с хорошо известными преимуществами эффективного лечения железом и коррекции анемии, включая снижение заболеваемости и улучшение качества жизни.
Учитывая продемонстрированную безопасность и эффективность внутривенного введения железа при широком спектре заболеваний, связанных с ЖДА, следует пересмотреть существующую парадигму, согласно которой пероральное железо является терапией первой линии.Кроме того, внутривенное введение железа является предпочтительным методом замещения железа в качестве дополнения к ЭСС у пациентов с диализной и недиализной ХБП, у пациентов с ВЗК и у онкологических пациентов, получающих ЭСС по поводу анемии, вызванной химиотерапией. Внутривенное введение железа можно вводить в виде нескольких болюсов IS, FG, FC (только для Европы), II (только для Европы) или LMW ID до тех пор, пока не будет достигнута желаемая доза: две быстрые инъекции ферумокситола (только для США) от 2 до 3 дней. отдельно или TDI LMW ID (обычно 1 грамм) примерно за 1 час (одобрено только в Европе).В Европе ТДИ FC (1000 мг) и II (20 мг / кг) разрешены для приема за 15 минут. Премедикации следует избегать, если в анамнезе нет гиперчувствительности. В нашей практике мы обычно вводим 1000 мг LMW ID в 250 мл физиологического раствора в течение 1 часа без премедикации. Пробная доза от 10 до 25 мг вводится в течение 3-5 минут. Если острой реакции не наблюдается, оставшийся раствор настаивают в течение 1 часа. Тем, у кого в анамнезе была лекарственная аллергия, аллергический диатез или воспалительный артрит в анамнезе, когда было показано, что как парентеральное, так и пероральное железо усугубляет симптомы, перед тестовой дозой вводят 125 мг метилпреднизолона.
Хотя безопасность внутривенного введения железа была продемонстрирована в исследованиях с участием тысяч пациентов с многочисленными клиническими проявлениями, связанными с дефицитом железа, проблемы безопасности все еще существуют. Все препараты железа могут вызвать гиперчувствительность или другие реакции, некоторые из которых будут тяжелыми. За исключением ретроспективных обзоров спонтанно сообщаемых событий, сравнительная частота реакций остается неизвестной. Однако до тех пор, пока реальная частота НЯ не будет известна более точно, можно рассмотреть возможность отказа от HMW ID на основании преобладающего количества опубликованных данных.Общепринятое определение НЯ должно быть продвинуто и принято FDA, чтобы можно было рассчитать типы событий. Отчетность в центральное агентство должна быть обязательной, а данные должны регулярно проверяться. Пока не станут доступны надежные сравнительные данные, один продукт не может и не должен считаться лучшим с точки зрения профиля безопасности. Как гематологи, мы должны знакомиться с частотой, клиническим характером и значением реакций на существующие препараты. Как специалисты по болезням крови, мы обязаны лучше познакомиться с этой важной терапией наиболее распространенной анемии, с которой мы сталкиваемся.
[97] Внутривенное (IV) железо при тяжелой недостаточности железа
Немия поражает около одной трети людей; Наиболее частой причиной является дефицит железа (Fe). 1 В Канаде (2009-11 гг.) Дефицит ферритина в сыворотке <15 мкг / л, по оценкам, поражал 13% женщин в возрасте 12-19 лет и 9% женщин в возрасте 20-49 лет. 2 Эта оценка, вероятно, занижена, поскольку ограничение по ферритину является произвольным и исключает жителей резерваций коренных народов, где питание часто хуже, чем в остальной части Канады.Железо необходимо для транспорта кислорода гемоглобином (Hb), а также для энергетического метаболизма, включая митохондриальную цепь переноса электронов. Дефицит без анемии может вызывать неспецифические симптомы (например, утомляемость, нарушение концентрации внимания, слабость) и признаки (например, выпадение волос, изменения ногтей и слизистых оболочек), но на удивление мало доказательств того, является ли лечение полезным. 3,4,5 Выявление причины всегда важно. Лечение пероральным железом и / или диетой обычно несложно, хотя абсорбируется лишь малая часть поступившего внутрь элементарного железа. 6,7
Однако иногда железо необходимо вводить парентерально. Внутривенное введение железа может спасти пациентов, которые не могут переносить или усваивать пероральное железо или быстро теряют кровь. Примеры включают обильные менструации, целиакию, обходной желудочный анастомоз, воспалительное заболевание кишечника и желудочно-кишечное кровотечение. Когда восполнение запасов железа необходимо срочно, внутривенное введение экономит время, переливание крови и деньги и используется недостаточно. 8,9 В этом письме не обсуждаются разногласия по поводу внутривенного введения железа пациентам, находящимся на гемодиализе. 10
3 случая иллюстрируют правильное использование
- Меноррагия: студентка университета 20 лет страдала одышкой из-за анемии, вызванной хронической менструальной кровопотерей. Ее частота сердечных сокращений в состоянии покоя составляла 126, Hb 70 г / л (120-155), средний объем клеток (MCV) 55 мкг (82-98), ферритин 2 мкг / л (10-150). Она собиралась поехать за границу и получила 1 г декстрана железа внутривенно в течение 4 часов вместо эритроцитов. В течение 24 дней ее гемоглобин составил 117 г / л, MCV 71 мкг / л, ферритин 28 мкг / л.Ее симптомы исчезли, и ее меноррагия была устранена.
- Хроническое кровотечение из верхних отделов ЖКТ и недоедание: Бездомный мужчина 56 лет страдал шизофренией и алкоголизмом. Он был госпитализирован после рвоты кровью и потерял сознание на улице. Его исходный гемоглобин составлял 36 г / л, MCV 78 мкг / л, ферритин 20 мкг / л. При эндоскопии была пролечена большая язва желудка, и он получил 3 единицы эритроцитов. В картах скорой помощи выявлена хроническая железодефицитная анемия в течение как минимум 7 лет. Во время госпитализации ему в течение 2 дней вводили 2 г декстрана железа внутривенно.Два месяца спустя его гемоглобин повысился до 123 г / л, а MCV — до 95 фл.
- Хроническое кровотечение из нижних отделов ЖКТ и ограниченное всасывание железа: У мальчика 14 лет с тяжелым язвенным колитом ежедневный кровянистый стул. Сопутствующая целиакия ограничивает всасывание железа из вегетарианской диеты. Его гемоглобин составлял 44 г / л, (MCV) 58 мкл, а ферритин плазмы <1 мкг / л. Тестовая доза декстрана железа вызвала хрипы, боли в спине и животе, но после 25 мг дифенгидрамина внутривенно он переносил 600 мг сахарозы железа. Семь недель спустя его гемоглобин составлял 120 г / л, а MCV 79 фл.Дополнительное количество сахарозы железа компенсировало продолжающееся кровотечение из нижних отделов ЖКТ, и его Hb достиг пика 143 г / л с ферритином 89 мкг / л.
Показания и дозировка
Тяжелый дефицит железа плюс неспособность переносить или усваивать пероральное железо является основным показанием. В условиях продолжающейся кровопотери или срочного хирургического вмешательства внутривенное введение железа лечит анемию намного быстрее, чем пероральное железо. В организме хорошо питающихся людей содержится около 4-5 граммов элементарного железа, половина из которых циркулирует в эритроцитах. Остальное хранится в костном мозге, печени и селезенке.Взрослым пациентам с глубоким дефицитом железа требуется не менее 1 грамма элементарного железа для пополнения запасов в организме. Для коррекции анемии требуется еще 200 мг на 10 г / л прироста гемоглобина. Удобство пополнения запасов железа зависит от политики больницы в отношении администрации, включая наличие предварительно распечатанных заказов. 11
Преимущества
Мета-анализ сообщает об умеренном увеличении гемоглобина и сокращении трансфузий для внутривенного (и перорального) железа, но не вызывает убедительного вреда. 12-14 Скромные преимущества объясняются испытаниями, в которых участвовали пациенты с относительно умеренным дефицитом железа или с хроническими состояниями, ограничивающими кроветворение.
Хармс
Ранние препараты декстрана железа вызывали частую анафилаксию и некоторые смертельные случаи. Хотя сейчас это случается редко, монографии предупреждают о возможной анафилаксии и против использования во время активной инфекции, а для использования декстрана железа требуется присутствие врача во время приема тестовой дозы. В течение 2013-2015 гг. Европейское агентство по лекарственным средствам потребовало усиленных предупреждений о смертельной анафилаксии для всех препаратов железа для парентерального введения. 15 Министерство здравоохранения Канады и FDA США ужесточили предупреждения о ферумокситоле, который официально противопоказан людям с любой лекарственной аллергией. 16 Последующее снижение использования привело к прекращению доступности ферумокситола в Канаде в январе 2016 года.
Невозможно установить сравнительную безопасность декстранового железа по сравнению с недекстрановым железом, поскольку рандомизированные контролируемые клинические испытания (РКИ) слишком малы для надежного сравнения редких серьезных нежелательных явлений. включая смерть. РКИ, сравнивающие глюконат железа, сахарозу железа или ферумокситол, не установили различий в частоте анафилаксии. 17
Наблюдательные исследования не продемонстрировали убедительного общего преимущества в отношении безопасности какого-либо продукта. 18,19 Новый ретроспективный анализ FDA 688 183 реципиентов без диализа в США, получавших внутривенное введение железа в период 2003-2013 гг. (Декстран, сахароза, глюконат или ферумокситол), выявил 274 случая анафилаксии при первом воздействии и еще 170 эпизодов при повторных дозах. . Вероятность анафилактической реакции при восполнении 1000 мг Fe была наименьшей с сахарозой железа (21: 100 000) и наибольшей с декстраном железа (82: 100 000). 20 Однако количество смертей в тот же день, что и вливание железа, не различались между препаратами (см. Таблицу 2).Приблизительная частота смертности в численном отношении предпочтительнее декстрана железа (4: 100 000), чем сахарозы железа (7-9: 100 000), глюконата железа (6-12: 100 000) или ферумокситола (7: 100 000). 21 У диализных пациентов частота смертельных или опасных для жизни побочных эффектов от декстрана железа была оценена FDA в пределах от 2 до 300 на миллион воздействий. 22 Риск причинения вреда при переливании эритроцитов схож по частоте. 23
Неаллергическая токсичность включает местные реакции на настой, отсроченные боли в мышцах и суставах, преходящую гипотензию и лихорадку.Обычно это самоограничение.
О долгосрочной токсичности ничего не известно. Повышенный риск инфицирования после в / в введения железа не установлен.
Повышает ли безопасность премедикация или внутримышечная инъекция?
Премедикация не требуется и, как известно, предотвращает опасную гиперчувствительность. Дифенгидрамин внутривенно 25 мг предсказуемо вызывает седативный эффект. 24 Внутримышечная инъекция железа не безопаснее, но имеет недостатки, заключающиеся в местной боли и отсроченном улучшении.
Составы для парентерального введения железа
В таблице 1 показаны продукты, доступные в Канаде по состоянию на февраль 2016 г., и их утвержденные показания. 25 Хотя официально для инфузии полной дозы не утверждены, препараты железа широко используются в Канаде для быстрого восполнения запасов железа.
IV предпочтительнее внутримышечного (IM) введения, потому что внутримышечные инъекции болезненны и абсорбция неполная.
Выводы
- Внутривенное введение железа приносит ощутимую пользу соответствующим образом отобранным людям с хроническим тяжелым дефицитом железа.
- Редкие, но потенциально смертельные реакции происходят со всеми продуктами железа, вводимыми внутривенно.Это требует введения в условиях, когда доступно немедленное лечение, включая адреналин.
- Ни один препарат не является более безопасным, чем другие. Внутривенное введение железа предпочтительнее, чем внутримышечное введение.
Таблица 1: Продукты из железа для внутривенного введения, доступные в Канаде, и их утвержденные показания
| Товар (торговая марка) | Утвержденные показания | Частота гиперчувствительности, указанная в монографии * | Концентрация | Цена за 100 мг Fe ** |
|---|---|---|---|---|
| декстран железа (Dexiron) | Недостаток железа при пероральном недостаточном количестве железа | оценка не предоставлена | 50 мг / мл | $ 27.50 |
| глюконат натрия и железа (Феррлецит) | железодефицитная анемия гемодиализа | 3,3 на миллион до не менее 6 промилле | 12,5 мг / мл | $ 44.29 |
| железо-сахароза (Венофер) | железодефицитная анемия при ХБП | 23 на миллион | 20 мг / мл | $ 38,15 |
* эти цифры нельзя сравнивать напрямую, так как они частично основаны на спонтанных отчетах ADR.
** Больница Ванкувера и аптека Центра медицинских наук, январь 2016 г.
Таблица 2: Показатели смертности в день введения железа после инцидента IV среди населения, не получающего диализ *
| IV Утюг 2003-2013 | # Deaths | # Новые пользователи | Уровень заболеваемости на 100000 человек (95% ДИ) |
|---|---|---|---|
| Декстран железа | 10 | 247 500 | 4,0 (1,9, 7.4) |
| Глюконат железа | 11 | 94 400 | 11,7 (5,8, 20,8) |
| Железная сахароза | 19 | 264 166 | 7,2 (4,3, 11,2) |
| 2010-2013 Декстран железа | 3 | 77 935 | 3,8 (0,8, 11,2) |
| Глюконат железа | 2 | 34 029 | 5.9 (0,7, 21,2) |
| Железная сахароза | 12 | 134 836 | 8,9 (4,6, 15,5) |
| Ферумокситол | 6 | 82,117 | 7,3 (2,7, 15,9) |
* Предоставлено доктором Канлин Ван, FDA США, личное сообщение, январь 2016 г.
Черновик этого терапевтического письма был представлен на рассмотрение 70 экспертам и врачам первичного звена с целью исправления любых неточностей и обеспечения краткости и актуальности информации для клиницистов.
Therapeutics Initiative финансируется Министерством здравоохранения Британской Колумбии через грант Университета Британской Колумбии. Therapeutics Initiative предоставляет научно обоснованные советы по лекарственной терапии и не несет ответственности за формулирование или принятие решений провинциальной политики в отношении лекарственных средств.
Список литературы
- Kassebaum NJ, Jasrasaria R, Naghavi M et al. Систематический анализ глобального бремени анемии с 1990 по 2010 гг. Кровь. 2014; 123 (5): 615-24. DOI: 10.1182 / кровь-2013-06-508325.
- Cooper M, Greene-Finestone, L, Lowell H et al. Железная обеспеченность канадцев. Отчеты о состоянии здравоохранения Статистического управления Канады. 23 (4), ноябрь 2012 г. http://www.statcan.gc.ca/pub/82-003-x/2012004/article/11742-eng.htm
- Pratt JJ, Khan KS. Неанемический дефицит железа — заболевание, требующее распознавания диагноза: систематический обзор. Наша гематология J 2015; DOI: 10.1111 / ejh.12645.
- Фаврат Б., Бальк К., Брейманн С. и др. Оценка однократной дозы карбоксимальтозы железа (III) у утомленных женщин с дефицитом железа — ПРЕДПОЧТИТЕ рандомизированное плацебо-контролируемое исследование.PLoS ONE [Электронный ресурс] 2014; 9 (4): e94217. DOI: 10.1371 / journal.pone.0094217.
- Авни Т., Лейбовичи Л., Гафтер-Гвили А. Добавки железа для лечения хронической сердечной недостаточности и дефицита железа: систематический обзор и метаанализ. Eur J Heart Fail 2012; 14 (4): 423-9. DOI: 10.1093 / eurjhf / hfs017.
- г. до н.э. Консультативный комитет по руководствам и протоколам. Дефицит железа — исследование и управление. BC Guidelines.ca 15 июня 2010 г. http://www2.gov.bc.ca/gov/content/health/practitioner-professionalresources/bc-guidelines/iron-deficiency
- Камашелла К.Железодефицитная анемия. N Engl J Med 2015; 372 (19): 1832-43. DOI: 10.1056 / NEJMra1401038.
- Ауэрбах М., Адамсон Дж., Бирчер А. и др. Доказательства безопасности внутривенного введения железа важнее предположений. Haematologica, май 2015 г .; 100 (5): e214-5. DOI: 10.3324 / haematol.2014.121004.
- Каллум Дж., Лин И, Химмель В., Киллиан М. и Хелман А. IV. Железо для лечения анемии в неотложной медицине. Подкаст «Скорая медицинская помощь». Эпизод 65; Май 2015 г. http://emergencymedicinecases.com/iv-iron-foranemia-in-emergency-medicine/
- Charytan DM, Pai AB, Chan CT et al.Соображения и проблемы при определении оптимального использования железа при гемодиализе. J Am Soc Nephron 2015; 26 (6): 1238-47. DOI: 10.1681 / ASN.20140
- .
- Саннибрук Центр медицинских наук. Назначения врача: Внутривенное введение железа (Венофер, Ферахема) в амбулаторных условиях. PR 50006; 2015, 18 февраля. Http://emergencymedicinecases.com/wpcontent/uploads/filebase/pdf/IV_Iron_Outpatient_Orders_Form_PR50006.pdf
- Gurusamy KS, Nagendran M, Broadhurst JF et al. Терапия железом у взрослых с анемией без хронической болезни почек (обзор).Кокрановская библиотека, 2014 г., выпуск 12. Артикул: CD010640. DOI: 10.1002 / 14651858.CD010640.pub2.
- Авни Т., Бибер А., Гроссман А. и др. Безопасность внутривенных препаратов железа: систематический обзор и метаанализ. Mayo Clin Proc 2015; 90 (1): 12-23. DOI: 10.1016 / j.mayocp.2014.10.007.
- Litton E, Xiao J, Ho KM. Безопасность и эффективность внутривенной терапии железом в снижении потребности в аллогенном переливании крови: систематический обзор и метаанализ рандомизированных клинических испытаний.BMJ 2013; 347: f4822. DOI: 10.1136 / bmj.f4822.
- Европейское агентство по лекарственным средствам. Отчет об оценке: железосодержащие препараты для внутривенного (в / в) введения. 2013; www.ema.europa.eu/docs/en_GB/document_library/Referrals_document/IV_iron_31/WC500150771.pdf
- Министерство здравоохранения Канады. Письмо уважаемого специалиста в области здравоохранения: Министерство здравоохранения Канады одобрило важную информацию о безопасности препарата FERAHEME (ферумокситол). Важная информация по безопасности RA-42607, 21 ноября 2014 г. http://healthycanadians.gc.ca/recall-alertrappel-avis/hc-sc/2014/42607a-eng.php
FDA. Информация о безопасности лекарств: FDA усиливает предупреждения и изменяет инструкции по назначению, чтобы снизить риск серьезных аллергических реакций на лекарство от анемии Feraheme (ферумокситол). MedWatch 30 марта 2015 г. http://www.fda.gov/Drugs/DrugSafety/ucm440138.htm - Macdougall IC, Strauss WE, McLaughlin J et al. Рандомизированное сравнение ферумокситола и сахарозы железа для лечения железодефицитной анемии у пациентов с ХБП. Clin J Am Soc Nephron 2014; 9 (4): 704-12. DOI: 10.2215 / CJN.05320513.
- Brookhart, MA, Freburger JK, Ellis AR et al. Сравнительная краткосрочная безопасность глюконата натрия и железа с сахарозой у пациентов, находящихся на гемодиализе. Am J. Kidney Dis. 2016; 67 (1): 119-27. DOI: 10.1053 / j.ajkd.2015.07.026.
- Эйри М., Мандаям С., Митани А.А. и др. Сравнительные результаты преобладающего использования ферумокситола на уровне учреждения по сравнению с другими внутривенными препаратами железа у пациентов, находящихся на гемодиализе. Трансплантация циферблата нефрона 2015; 30 (12): 2068-75. DOI: 10.1093 / ndt / gfv305.
- Ван С., Грэхем Д. Д., Кейн Р. С. и др. Сравнительный риск анафилактических реакций, связанных с внутривенными препаратами железа. ДЖАМА. 2015; 314 (19): 2062-8. DOI: 10.1001 / jama.2015.15572.
- Wang, C. FDA США. Личное сообщение, январь 2016 г. См. Таблицу 2 в html-версии настоящего Письма.
- Wysowski DK, Swartz L, Borders-Hemphill BV и др. Использование препаратов железа для парентерального введения и серьезные реакции анафилактического типа. Am J Hematol 2010; 85 (9): 650-4. DOI: 10.1002 / ajh.21794.
- Callum JL, Lin Y, Pinkerton PH et al. Bloody Easy 3: Переливание крови, альтернативы крови и реакции на переливание. Руководство по трансфузионной медицине (третье издание). Региональная координационная сеть по крови Онтарио, 2011 г. http://transfusionontario.org/en/cmdownloads/categories/bloody_easy/
- Barton JC, Barton EH, Bertoli LF et al. Внутривенная терапия декстраном железа у пациентов с дефицитом железа и нормальной функцией почек, которые не реагировали на пероральные добавки железа или не переносили их.Am J Med. 2000; 109 (1): 27-32.
- База данных по лекарственным препаратам Министерства здравоохранения Канады. Монографии по продукту:
— Декстран железа (Дексирон): http://webprod5.hc-sc.gc.ca/dpd-bdpp/itemiteme.do?pm-mp=00018869
— Глюконат натрия и железа (Феррлецит): http: / /webprod5.hc-sc.gc.ca/dpdbdpp/item-iteme.do?pm-mp=00019077
— Сахароза железа (Venofer): http://webprod5.hc-sc.gc.ca/dpd-bdpp/ itemiteme.do?pm-mp=00018889
Парентеральное введение железа при предоперационной железодефицитной анемии: безопасный выбор?
Женщина 70 лет направлена хирургом-ортопедом для предоперационного обследования. для двустороннего тотального эндопротезирования бедра через четыре недели.Ее история болезни положительный результат на остеоартрит, хорошо контролируемую гипертензию и удаленную грудную клетку in situ рак после лампэктомии и после лучевой терапии без активного рецидива. Ее мать была Деменция Альцгеймера. Она не курит и иногда употребляет алкоголь (30 унций красное вино в неделю). В прошлом она принимала 25 мг гидрохлоротиазида в день. 10 лет. В течение последних шести месяцев она принимала 500 мг напроксена два раза в день и 650 мг парацетамола четыре раза в день при боли в бедре.
Пациент может подняться на один лестничный пролет, если боль хорошо контролируется и отрицает боль в груди, одышка, сердцебиение, головокружение, бледность, потоотделение, обморок или цианоз.
Ее физикальное обследование имеет значение для нормальных показателей жизнедеятельности, минимальной конъюнктивы. бледность и снижение двустороннего сгибания и отведения бедра.В остальном это ничем не примечательно.
Лабораторные результаты показали уровень гемоглобина 9,9 г / дл, гематокрит 30% красный клетки крови и количество тромбоцитов 400 к / мкл. Ее основная метаболическая панель, анализ мочи, панель функции печени и профиль коагуляции были нормальными.
При дальнейшем обсуждении пациент не сообщает об отсутствии мелены, гематохезии, ректоррагии, гематемезис, боль в животе, гематурия, ночное потоотделение и лимфаденопатия или похудание.У нее нет диареи и отрицает непереносимость глютена. Она сохранила в основном вегетарианская диета в течение последнего года, чтобы похудеть из-за остеоартрита.
Учитывая, что пациенту предстоит двусторонняя замена тазобедренного сустава, ожидается, что она потеряет не менее 2–3 г / дл гемоглобина; ей грозит переливание аллогенной крови если уровень опускается ниже 7 г / дл. Пациенту сообщили об этом риске и попросили кровь. хранилище для «аутотрансфузии».”
Следуя нашим институциональным рекомендациям по предоперационной оценке анемии, далее были проведены исследования, чтобы определить этиологию анемии и возможность необходимо откорректировать перед операцией (см. Таблицу 1).
Результаты соответствовали железодефицитной анемии, и пациент был начат на пероральные добавки железа — диетические и фармакологические — из 325 мг сульфата железа три раза в день.Образец кала был отрицательным на скрытую кровь.
Учитывая близость хирургического вмешательства, было рекомендовано парентеральное введение железа пополнить запасы железа пациента. Схема приема 200 мг сахарозы железа внутривенно через день по пять доз (общая доза 1 г). Через десять дней после последнего доза железа внутривенно, ее гемоглобин составлял 12,5 г / дл, а ее гематокрит составлял 36%.Она продолжила принимал пероральные добавки железа и перенес операцию без осложнений, без необходимости переливания аллогенной крови.
После операции пациент направлен на дополнительное обследование на дефицит железа. ее лечащим врачом; оценка показала только эрозивный гастрит с нормальным биопсия двенадцатиперстной кишки, отрицательная серология целиакии и нормальная колоноскопия.Диетическое обучение касательно богатой железом пищи.
Какое значение имеет периоперационная анемия?
Анемия является серьезным фактором риска смертности, заболеваемости и неблагоприятных исходов хирургического лечения. пациенты. В последнее десятилетие его менеджмент отошел от аллогенной крови. переливание. Сообщаемые данные о распространенности анемии в этой стране сильно различаются. популяция (от 5% до 76%), которая зависит от множества факторов, таких как состояние пациента сопутствующие заболевания, хирургическая процедура и связанная с ней кровопотеря, а также прерывание значения гемоглобина.Кроме того, частота анемии увеличивается с возрастом пациента. и выше у женщин, чем у мужчин ( 1 1. Shander A, Knight K, Thurer R, et al. Распространенность и исходы анемии в хирургии: систематический обзор литературы. Am J Med . 2004 ; 116 (Дополнение 7A): 58S-69S., 2 2. Кумар А. Периоперационное ведение анемии: пределы переливания крови и альтернативы Это. Cleve Clin J Med . 2009; 76 (Приложение 4): S112-8. , 3 3. Уилсон А., Ю. Х. Т., Гудно Л. Т. и др. Распространенность и исходы анемии при ревматоидном артрите: систематический обзор литература. Am J Med. 2004; 116 (Дополнение 7A): 50S-7S. ).
В периоперационном периоде предоперационные значения гемоглобина коррелируют с риск смерти через 30 дней после операции; низкий уровень гемоглобина имеет наиболее значительный влияние на пациентов с сердечно-сосудистыми заболеваниями ( 4 4. Карсон Дж. Л., Дафф А., Позес Р. М. и др. Влияние анемии и сердечно-сосудистых заболеваний на хирургическую смертность и заболеваемость. Ланцет. 1996; 348: 1055-60. ). Кроме того, даже легкая анемия независимо связана с повышенным сопутствующим заболеванием. события (сердечные приступы, пневмония, уросепсис, венозная тромбоэмболия, послеоперационные делирий и т. д.) через 30 дней после операции ( 5 5. Musallam KM, Tamim HM, Richards T, et al. Предоперационная анемия и послеоперационные исходы в несердечной хирургии: ретроспектива когортное исследование. Ланцет. 2011; 378: 1396-407. ).
Какова роль программы контроля крови в периоперационном периоде?
Переливание крови для коррекции анемии в настоящее время считается признаком плохих результатов в медицине по нескольким причинам.В текущем состоянии уменьшающегося пула доноров, произвольное использование крови препятствует эффективному распределению ресурсов. Это связано с серьезные осложнения (например, острое повреждение легких, связанное с переливанием крови, иммуномодуляция, перегрузка кровообращения, связанная с переливанием крови), и это связано со значительными затратами с процессом хранения крови. Кроме того, недавние исследования показали, что ограничивающие кровь подход связан с улучшенными результатами у пациентов с хирургическим вмешательством на бедре ( 6 6. Carson JL, Terrin ML, Noveck H, et al. Либеральное или ограничительное переливание крови пациентам из группы высокого риска после операции на бедре. N Engl J Med. 2011; 365: 2453-62. ).
Ожидается, что медицинские центры с большим объемом хирургических операций будут проводить более тщательную и экономный подход к использованию крови и пересмотр их текущего периоперационного практики переливания. Это запустило агрессивную программу управления кровью, чтобы минимизировать периоперационную утилизацию крови.Кроме того, Совместная комиссия недавно одобрил меры по надлежащему лечению крови ( 7 7. The Joint Commission. Руководство по внедрению Совместной комиссии по контролю качества крови пациентов меры 2011. По состоянию на 3 января 2012 г., ).
Управление кровью — это ориентированный на пациента стандарт помощи, в котором стратегии и методы используются для уменьшения, исключения или оптимизации переливаний крови с целью улучшения результатов лечения пациентов.Это обеспечивает безопасное и эффективное использование множества ресурсов, задействованных в сложном процессе. компонентной терапии крови. Его цели — перевод доказательств в клиническую практику. Практика минимизации использования крови, обеспечение согласованности между разными врачами практиковать поведение и проводить предоперационное лечение, ориентированное на этиологию анемия как «лучшая практика» для плановых хирургических пациентов.Периоперационный управление кровью находится на стыке безопасности пациентов и использования ресурсов и системная интеграция с последующим улучшением общего качества обслуживания ( 8 8. Bierbaum BE, Callaghan JJ, Galante O, et al. Анализ управления кровью у пациентов, перенесших тотальное эндопротезирование тазобедренного или коленного сустава. J Bone Joint Surg Am .1999; 81: 2-10 ., 9 9. Boucher BA, Hannon TJ. Управление кровью: учебник для врачей. Фармакотерапия . 2007; 27 (10): 1394-411. , 10 10. Патель М., Аурон М., Бенитес-Сантана С.М. и др. Предоперационное управление кровью — путь к бескровной хирургии. Больница Medicine 2011, Даллас, 10–13 мая 2011 г. J Hosp Med . 2011; 6 (Приложение 2): S124. ).
Как подойти к периоперационной железодефицитной анемии?
В этом случае мы знаем, что анемия пациента связана с дефицитом железа, потому что у нее низкий уровень железа, низкое насыщение трансферрина и низкий уровень ферритина; Кроме того у нее фолиевая кислота и витамин В 12 магазина в норме.Дефицит железа можно измерить путем оценки запасов железа как а также эритропоэз ( 11 11. Clark SF. Железодефицитная анемия: диагностика и лечение. Curr Opin Gastroenterol .2009; 25: 122-8. , 12 12. Gasche C, Berstad A, Befrits R, et al., Руководство по диагностике и лечению дефицита железа и анемии при воспалительных процессах. заболевания кишечника. Воспаление кишечника .2007; 13: 1545-53. , 13 13. Goodnough LT, Shander A, Spivak JL, et al. Выявление, оценка и лечение анемии у планового хирургического пациента. Анест Аналг . 2005; 101: 1858-61. ).
Хранилище железа оценивается по:
- уровней железа,
- общая железосвязывающая способность,
- насыщения трансферрина и
- ферритин.
Оценка эритропоэза:
- гемоглобин / гематокрит,
- средний размер эритроцитов / количество гемоглобина на эритроцит,
- распределения эритроцитов и
- ретикулоцитов.
Показания к лечению предоперационной анемии зависят от тяжести анемии, а также ожидаемая хирургическая кровопотеря.Например, если у пациента в настоящее время уровень гемоглобина 9 г / дл и ожидается потеря от 500 до 1000 мл крови, повышается вероятность падения гемоглобина до критических значений (<7 г / дл), где показано переливание. В этой группе пациентов гемоглобин должен быть оптимизированным, увеличив его на 2–3 г / дл перед операцией, чтобы компенсировать ожидаемый послеоперационное падение и попытка предотвратить критический порог переливания.
На основании многочисленных исследований хирургической популяции и пациентов с хронической почечной недостаточностью. неэффективность, текущие рекомендуемые пороговые значения для парентерального введения препаратов железа насыщение трансферрина менее 20% и ферритина менее 100 нг / мл; тем не мение, у пациентов с хроническим заболеванием почек пороговые значения для продолжения парентерального введения железа добавка — насыщение трансферрина менее 50% и ферритина менее 800 нг / мл ( 14 14. Ауэрбах М., Койн Д., Баллард Х. Внутривенное введение железа: от анафемы к стандарту лечения. Am J Hematol . 2008; 83: 5808. ).
Как определить сосуществование анемии хронического заболевания и дефицита железа?
До недавнего времени у нас не было практических исследований для определения сосуществования анемии. хронических заболеваний и железодефицитной анемии. Анализ растворимого рецептора трансферрина (sTfR) теперь является чрезвычайно ценным инструментом в этой ситуации, когда уровни sTfR будут повышаться при дефиците железа и при уровнях ферритина и трансферрина. изменяются при наличии воспаления ( 15 15. Skikne BS. Рецептор трансферрина сыворотки. Am J Hematol . 2008; 83: 872-5. , 16, 16. Джайн С., Нараян С., Чандра Дж. И др. Оценка показателей сывороточного рецептора трансферрина и ферритина sTfR при диагностике и дифференцировать железодефицитную анемию от анемии хронического заболевания. Indian J Pediatr. 2010; 77 (2): 179-83. ).
В клинике Кливленда референсный диапазон STfR равен 1.От 9 до 4,4 мг / л; его ссылка интервалы не установлены для беременных, пациенток до 18 лет. возраста, а также недавних или частых доноров крови.
Достаточна ли биодоступность перорального железа для оптимизации пациентов?
Хотя пероральная заместительная терапия железом является допустимым терапевтическим выбором, она очень неэффективна. учитывая его беспорядочное поглощение GI.Например, у пациентов с хроническими соматическими заболеваниями. такие как уремия, несколько факторов ухудшают энтеральную биодоступность железа, такие как избыточный бактериальный рост, хроническое желудочно-кишечное кровотечение, дисфункция тромбоцитов, использование антиагрегантов, частая флеботомия, протеинурия и повышенная утилизация железа (использование эритропоэтин-стимулирующих агенты). Кроме того, другие факторы могут ухудшить всасывание железа, например, глютеновая болезнь, распространенность которых увеличивается при более высоком индексе обнаружения ( 17 17. MacDougall IC. Добавки железа для пациента с хронической болезнью почек (ND-CKD), не получающей диализ: перорально или внутривенно? Curr Med Res Opin . 2010; 26 (2): 473-82. , 18, 18. Годдард А.Ф., Джеймс М.В., Макинтайр А.С. и др. Руководство по ведению железодефицитной анемии. Кишечник . 2011 Октябрь; 60 (10): 1309-16. ).
Безопасно ли внутривенное введение железа? Какие доказательства подтверждают его использование?
Было проведено множество исследований у хирургических пациентов, в том числе кардиологических, гинекологических, ортопедическая и колоректальная хирургия.Большинство из них являются обсервационными исследованиями, и есть несколько рандомизированные контролируемые испытания. В среднем, введение внутривенной дозы железа составляет 1000 мг повышает уровень гемоглобина примерно на 2,0 г / дл и даже устраняет анемию. до 58% случаев. Скорость переливания крови снижается на 66%, а инфекция на 55% ( 19 19. Муньос М., Кампос А., Гарсия-Эрсе Дж. и др. Внутривенное введение железа в хирургии колоректального рака. Семин Гематол . 2006; 43: S36-8. , 20 20. Муньос М., Брейманн С., Гарсия-Эрсе Дж. Эффективность и безопасность внутривенной терапии железом в качестве альтернативы / дополнения к аллогенной переливание крови. Vox Sang . 2008; 94: 172-83. , 21, 21. Муньос М., Гомес-Рамирес С., Гарсия-Эрсе Дж. И др. Внутривенное введение железа при воспалительном заболевании кишечника. World J Gastroenterol . 2009; 15 (37): 4666-74. , 22 22. Муньос М., Гарсия-Эрсе Дж., Диес-Лобо А.И. и др. Полезность внутривенного введения сахарозы железа для коррекции предоперационная анемия у крупных хирургических больных. Med Clin (Barc) . 2009; 132 (8): 303-6. , 23 23. García-Erce JA, et al. Posibilidades de tratamiento de la anemia perioperatoria en cirugía ortopédica y reumatología. Анемия . 2009; 2: 17-27. ).
Пероральное и парентеральное введение железа сравнивалось у гинекологических пациентов. а у пациентов, которые получали сахарозу железа внутривенно, уровень гемоглобина повышался до 3,0 г / дл через четыре недели по сравнению с 0,8 г / дл у пациентов, принимавших пероральное железо. Кроме того, в группе внутривенного введения железа целевой гемоглобин был достигнут у 76% пациентов по сравнению с только с 11.5% пациентов, принимающих пероральное железо ( 24 24. Kim YH, Chung HH, Kang SB, et al. Безопасность и полезность внутривенного введения сахарозы железа в ведении предоперационной анемия у пациентов с меноррагией: фаза IV, открытая, проспективная, рандомизированная изучение. Acta Haematol . 2009; 121 (1): 37-41. , 25, 25. Бибер Э.Дж. Что вы можете сделать для оптимизации сохранения крови в практике акушерской гинекологии. Управление OBG. 2010; 22 (2): 28-38. ).
Сеть по развитию альтернатив переливанию крови (NATA), европейская организация сосредоточен на управлении кровью, предлагает использовать предоперационное внутривенное введение железа у пациентов с ферритин менее 100 нг / мл, насыщение трансферрина менее 20% или ожидаемая кровь потеря более 1500 мл. Предел отсечки, позволяющий избежать дальнейшего внутривенного введения железа, — это когда уровни ферритина выше 300 нг / мл и насыщение трансферрина выше 50%, или когда острая инфекция ( 26 26. Берис П., Муньос М., Гарсия-Эрсе Дж. И др. Периоперационное ведение анемии: консенсусное заявление о роли внутривенного железа. Br J Anaesth. 2008; 100: 599-604. ).
Безопасны ли препараты железа для внутривенного введения?
Введение железа требует его включения в углеводный щит, который может стабилизировать его и способствовать его абсорбции и включению в ретикулоэндотелиальный система.Первоначальные препараты железа для внутривенного введения, которые были изготовлены с использованием высокомолекулярных препаратов. декстран, были связаны с предполагаемыми анафилактическими реакциями; это отложило широкое распространение использовали до недавнего времени ( 27 27. Ganzoni AM. Внутривенное железо-декстран: терапевтические и экспериментальные возможности. Schweiz Med Wochenschr . 1970; 100: 301-3. ).
Разработка новых препаратов железа без декстрана для внутривенного введения за последние 20 лет повышенное использование парентерального железа.Наиболее распространенными в настоящее время препаратами являются трехвалентное железо. глюконат и сахароза железа. Пациенты, у которых наблюдались реакции на глюконат железа, имеют не было повышения уровня триптазы, что исключает анафилактическую реакцию ( 28 28. Silverstein SB, Rodgers GM. Варианты парентеральной терапии железом. Am J Hematol . 2004; 76: 74-8. ).
Наиболее часто используемые препараты представлены в таблице 2.
Наиболее частыми побочными реакциями, связанными с новыми парентеральными препаратами, являются: связанные с синдромом транзиторной утечки капилляров (тошнота, гипотензия, тахикардия, грудная клетка) боль, одышка и отек). Однако эти реакции зависят от дозы и редко происходят при дозировке парентерального железа, отпускаемой в настоящее время (глюконат железа, 125 мг / сут; сахароза железа, 200 мг / сут).
С 2001 по 2003 годы FDA задокументировало 30 миллионов доз внутривенного введения железа. Одиннадцать человек кто получил дозу, умерли, и было зарегистрировано 1141 побочных эффектов (большинство обычно реакции анафилактоидного типа, которые обычно зависят от дозы). Оценка побочного действия заключается в следующем ( 14 14. Auerbach M, Coyne D, Ballard H. Внутривенное железо: от анафемы к стандарту лечения. Am J Hematol . 2008; 83: 5808. , 31, 31. Чертов Г.М., Мейсон П.Д., Вааге-Нильсен О. и др. Обновленная информация о побочных эффектах лекарственных препаратов, связанных с парентеральным введением железа. Циферблат нефрола . 2006; 21 (2): 378-82. ):
- железо сахароза, 0,6 на миллион доз
- глюконат железа, 0,9 на миллион доз
- низкомолекулярный декстран, 3.3 на миллион доз
- высокомолекулярный декстран, 11,3 на миллион доз
Каков экономический эффект от внутривенного введения железа по сравнению с переливанием крови?
В целом, когда мы вычисляем дефицит железа у среднего пациента с гемоглобином примерно от 10 до 11 г / дл, дефицит железа составляет примерно от 1 до 1,5 г. Это Обоснование приема целого грамма железа перед операцией, что обычно повышает гемоглобин примерно на 2 г / дл.
Исходя из этой дозы, стоимость внутривенного введения железа по сравнению с кровью (с 1 г железа) составляет:
- декстран железа, примерно 377 долл. США / г
- глюконат железа, примерно 688 долл. США / г
- железо-сахароза, примерно 688 долл. / Г
- переливание крови, приблизительно 761 ± 294 долл. США за единицу (приблизительно 250 мг железа на единицу) × 4 = 3044 $ / г
Кроме того, стоимость упакованных эритроцитов должна включать весь банк крови. менеджмент, квалифицированный сестринский уход и дополнительные услуги ( 32 32. Шандер А., Хофманн А., Озава С. Затраты на переливание крови хирургическим пациентам в четырех больницах, основанные на деятельности. Переливание крови . 2010; 50: 753-65. ).
Каков протокол предоперационного контроля крови и парентерального использования железа?
В клинике Кливленда рассматриваются пациенты с любым из следующих критериев: идеально подходит для направления в программу:
- подозреваемая или известная анемия (гемоглобин <12 г / дл)
- высокая ожидаемая кровопотеря в зависимости от характера операции
- Требование нескольких единиц переливания крови во время недавних операций
- отказ от переливания крови (e.г., по религиозным убеждениям)
Приветствуется раннее направление к специалисту, чтобы дать достаточно времени для планирования лечения и последующего наблюдения. вверх. В среднем это должно быть три-четыре недели. Приказ о направлении на кровь управление доступно через компьютеризированный ввод приказов врача (CPOE) в электронном медицинская карта. Идеальная обработка должна включать любой субстрат, который можно заменить, такой как:
- железо и общая железосвязывающая способность,
- ферритин,
- количество ретикулоцитов (для сравнения после замены),
- фолиевой кислоты в сыворотке (у пациентов старше 60 лет) и
- витамин B 12 (у пациентов старше 60 лет)
Впоследствии эти лабораторные тесты, специфичные для анемии, пересматриваются и назначается конкретное вмешательство. преследуется, что обычно включает:
- 1.замена железа, витамина B 12 или фолиевой кислоты;
- 2. Использование средств, стимулирующих эритропоэз, в основном у пациентов с нормальными запасами железа. которые отказываются от переливания из-за религиозных убеждений или запланированы на бедро или колено замена; а также
- 3. Просвещение относительно источников железа и важности полноценного питания.
Планирование введения парентерального железа или средств, стимулирующих эритропоэз ориентирован на пациента и подчеркивает важность системной интеграции обширная система здравоохранения. В зависимости от географических предпочтений пациента он или она получает парентеральное железо в центре управления кровью, который может быть выделенным клиника управления, диализное отделение или гематологический кабинет.Пациенты заполняют лечение и беспрепятственный переход обратно для последующих анализов ( 10 10. Патель М., Аурон М., Бенитес-Сантана С.М. и др. Предоперационное управление кровью — прокладывая путь к бескровной хирургии. Больница Medicine 2011, Даллас, 10–13 мая 2011 г. J Hosp Med . 2011; 6 (Приложение 2): S124. ).
Процесс внутривенной замены железа, наиболее распространенная процедура, которую мы выполняем, составляет:
- 1.Пациенты направляются к программе контроля крови хирургом и утюгом. Недостаток выявляется при выполнении лабораторных исследований, упомянутых ранее.
- 2. Врач, проверяющий лабораторные работы и подтверждающий наличие железодефицитной анемии, ставит заказ в CPOE. Обычно для амбулаторных пациентов в нашей системе используется формула железа. сахароза, 200 мг внутривенно через день, всего пять доз (для введения всего 1 грамм).
- 3. Как правило, повторный гемоглобин получается через одну неделю — 10 дней после последней дозы утюг. Обычно эта процедура дает среднее увеличение гемоглобина на 2 г / дл.
- 4. Врач первичной медико-санитарной помощи уведомлен о необходимости дальнейшего обследования при железодефицитной анемии. после завершения операции.
Является ли аутотрансфузия полностью безопасной процедурой?
Срок годности перелитой крови напрямую влияет на клинические исходы.Хотя в настоящее время FDA разрешает хранить кровь не более 42 дней, исследование сердца хирургические пациенты, которым переливали во время операции, обнаружили, что те, кто получил кровь, хранившаяся более 14 дней, имела значительно более высокие показатели сепсиса, продолжительного интубация, почечная недостаточность, госпитальная летальность и однолетняя смертность в сравнении с теми, кому кровь хранилась не более 14 дней ( 33 33. Кох К.Г., Ли Л., Сесслер Д.И. и др. Продолжительность хранения эритроцитов и осложнения после кардиохирургических операций. N Engl J Med. 2008; 358: 1229-39. ).
Различия в результатах в зависимости от возраста крови обычно связывают с так называемыми «Дефект хранения»: более старая кровь теряет такие компоненты, как 2,3-DPG и аденозин. дифосфат, красные кровяные тельца теряют деформируемость и накапливаются цитокины и также встречается свободный гемоглобин ( 2 2. Кумар А. Периоперационное ведение анемии: пределы переливания крови и альтернативы Это. Cleve Clin J Med . 2009; 76 (Приложение 4): S112-8. ).
Доктор Аурон — госпиталист в клинике Кливленда в Огайо. Доктор Кумар — руководитель отделение больничной медицины в больнице Хартфорд в Коннектикуте. У них нет раскрытие конфликта интересов.Приведенная здесь информация ни в коем случае не должна использоваться в качестве заменяет клиническую оценку и не представляет официальную позицию ACP.
Ссылки
1. Шандер А., Найт К., Тюрер Р. и др. Распространенность и исходы анемии в хирургии: систематический обзор литературы. Am J Med .2004; 116 (Дополнение 7А): 58С-69С.
2. Кумар А. Периоперационное ведение анемии: пределы переливания крови и альтернативы Это. Cleve Clin J Med . 2009; 76 (Приложение 4): S112-8.
3. Уилсон А., Ю. Х.Т., Гудноу Л.Т. и др. Распространенность и исходы анемии при ревматоидном артрите: систематический обзор литература. Am J Med. 2004; 116 (Дополнение 7A): 50S-7S.
4. Карсон Дж. Л., Дафф А., Позес Р. М. и др. Влияние анемии и сердечно-сосудистых заболеваний на хирургическую смертность и заболеваемость. Ланцет. 1996; 348: 1055-60.
5. Мусаллам К.М., Тамим Х.М., Ричардс Т. и др. Предоперационная анемия и послеоперационные исходы в несердечной хирургии: ретроспектива когортное исследование. Ланцет. 2011; 378: 1396-407.
6. Carson JL, Terrin ML, Noveck H, et al. Либеральное или ограничительное переливание крови пациентам из группы высокого риска после операции на бедре. N Engl J Med. 2011; 365: 2453-62.
7. Совместная комиссия. Руководство по внедрению системы управления кровью пациентов Совместной комиссии меры 2011.Доступ 3 января 2012 г.
8. Bierbaum BE, Callaghan JJ, Galante O, et al. Анализ управления кровью у пациентов, перенесших тотальное эндопротезирование тазобедренного или коленного сустава. J Bone Joint Surg Am . 1999; 81: 2-10.
9. Boucher BA, Hannon TJ. Управление кровью: учебник для врачей. Фармакотерапия . 2007; 27 (10): 1394-411.
10. Патель М., Аурон М., Бенитес-Сантана С.М. и др. Предоперационное управление кровью — путь к бескровной хирургии. Больница Medicine 2011, Даллас, 10–13 мая 2011 г. J Hosp Med . 2011; 6 (Приложение 2): S124.
11. Clark SF. Железодефицитная анемия: диагностика и лечение. Curr Opin Gastroenterol . 2009; 25: 122-8.
12. Гаше С., Берстад А., Бефритс Р. и др. Рекомендации по диагностике и лечению дефицита железа и анемии при воспалительных заболевания кишечника. Воспаление кишечника . 2007; 13: 1545-53.
13. Goodnough LT, Shander A, Spivak JL, et al. Выявление, оценка и лечение анемии у планового хирургического пациента. Анест Аналг . 2005; 101: 1858-61.
14. Ауэрбах М., Койн Д., Баллард Х. Внутривенное введение железа: от анафемы к стандарту лечения. Am J Hematol . 2008; 83: 5808.
15. Skikne BS. Рецептор трансферрина сыворотки. Am J Hematol . 2008; 83: 872-5.
16. Джайн С., Нараян С., Чандра Дж. И др. Оценка показателей сывороточного рецептора трансферрина и ферритина sTfR при диагностике и дифференцировать железодефицитную анемию от анемии хронического заболевания. Indian J Pediatr. 2010; 77 (2): 179-83.
17. MacDougall IC. Добавки железа для пациента с хронической болезнью почек (ND-CKD), не получающей диализ: перорально или внутривенно? Curr Med Res Opin . 2010; 26 (2): 473-82.
18. Годдард А.Ф., Джеймс М.В., Макинтайр А.С. и др. Руководство по ведению железодефицитной анемии. Кишечник . 2011 Октябрь; 60 (10): 1309-16.
19. Муньос М., Кампос А., Гарсия-Эрсе Дж. И др. Внутривенное введение железа в хирургии колоректального рака. Семин Гематол . 2006; 43: S36-8.
20. Muñoz M, Breymann C, García-Erce J. Эффективность и безопасность внутривенной терапии железом в качестве альтернативы / дополнения к аллогенной переливание крови. Vox Sang . 2008; 94: 172-83.
21. Муньос М., Гомес-Рамирес С., Гарсия-Эрсе Дж. И др. Внутривенное введение железа при воспалительном заболевании кишечника. World J Gastroenterol . 2009; 15 (37): 4666-74.
22. Муньос М., Гарсия-Эрсе Дж., Диес-Лобо А.И. и др. Полезность внутривенного введения сахарозы железа для коррекции предоперационная анемия у крупных хирургических больных. Med Clin (Barc) . 2009; 132 (8): 303-6.
23. García-Erce JA, et al. Posibilidades de tratamiento de la anemia perioperatoria en cirugía ortopédica y reumatología. Анемия . 2009; 2: 17-27.
24. Kim YH, Chung HH, Kang SB, et al. Безопасность и полезность внутривенного введения сахарозы железа в предоперационном ведении анемия у пациентов с меноррагией: фаза IV, открытая, проспективная, рандомизированная изучение. Acta Haematol . 2009; 121 (1): 37-41.
25. Бибер EJ. Что вы можете сделать для оптимизации сохранения крови в практике акушерской гинекологии. Управление OBG. 2010; 22 (2): 28-38.
26. Берис П., Муньос М., Гарсия-Эрсе Дж. И др. Периоперационное ведение анемии: консенсусное заявление о роли внутривенного железа. Br J Anaesth. 2008; 100: 599-604.
27. Ганзони AM. Внутривенное введение декстрана железа: терапевтические и экспериментальные возможности. Schweiz Med Wochenschr . 1970; 100: 301-3.
28. Сильверштейн С.Б., Роджерс Г.М. Варианты парентеральной терапии железом. Am J Hematol . 2004; 76: 74-8.
29. Информация о назначении Feraheme ™.Доступ 3 января 2012 г.
30. Сравнение и дозирование препаратов железа для инъекций. Доступ 3 января 2012 г.
31. Чертов Г.М., Мейсон П.Д., Вааге-Нильсен О. и др. Обновленная информация о побочных эффектах лекарственных препаратов, связанных с парентеральным введением железа. Циферблат нефрола . 2006; 21 (2): 378-82.
32. Шандер А., Хофманн А., Одзава С. Затраты на переливание крови хирургическим пациентам в четырех больницах, основанные на деятельности.
