Применение гравитационного плазмафереза у новорожденных
И.И. Афуков, И.О. Цветков, П.Е. Бирюков, А.Д. Кулаев, Н.В. Елисеева
ГБУЗ «Детская городская клиническая больница № 13 им. Н.Ф. Филатова ДЗМ», г. Москва
ГБОУ ВПО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, г. Москва
Трансфузиология №2, 2015
Резюме
В статье показана возможность применения терапевтического гравитационного плазмафереза на аппарате «SpectraOptia». После выполнения данной процедуры не отмечалось снижения показателей лимфоцитов, тромбоцитов, эритроцитов. Гравитационный плазмаферез может проводится у новорожденных и недоношенных детей при возможности установки катетера необходимого диаметра.
Ключевые слова: гравитационный плазмаферез, фильтрационный плазмаферез, гипербилирубинемия, гемолитическая болезнь новорожденных.
Введение
Методы эфферентной терапии делятся на две группы: сорбционные, при которых происходит поглощение циркулирующих в крови веществ и последующее их удаление, и методы удаления патологических веществ вместе с плазмой.
1) гемолитическая болезнь новорожденных с быстрым и высоким приростом билирубина и трансаминаз;
2) сепсис и другие инфекционно-воспалительные заболевания;
3) респираторный дистресс-синдром;
4) последствия внутриутробной гипоксии и асфиксии;
5) синдром аспирации меконием;
6) бронхолегочная дисплазия.
У новорожденных детей наиболее распространенным методом эфферентной терапии является шприцевой мембранный плазмаферез. Этот метод был описан еще в 1996 г. в методических рекомендациях МЗ России и позволяет проводить ПФ у недоношенных с массой тела от 700 г. Мембрана имеет минимальный объем собственного заполнения (не более 15 мл), и этот способ может быть использован без каких-либо аппаратов, с помощью лишь одного шприца, по одноигольной методике. Также применяется дискретный плазмаферез, который осуществлялся путем забора крови с дальнейшим ее центрифугированием, возвращением пациенту форменных элементов крови и удалением плазмы. Этот метод весьма утомительный и продолжительный (до 4–6 часов). Предпочтение отдается мембранному ПФ, так как при дискретном ПФ отмечается значительное снижение лейкоцитов, лимфоцитов, тромбоцитов и эритроцитов и практически всегда требуется гемотрансфузия. Есть данные о проведении плазмафереза и иных методов детоксикации при эндогенной интоксикации, а также гипербилирубинемии у новорожденных с помощью роликовых насосов при скорости забора крови 4–5 мл/мин и скорости фильтрации 1,3 мл/мин.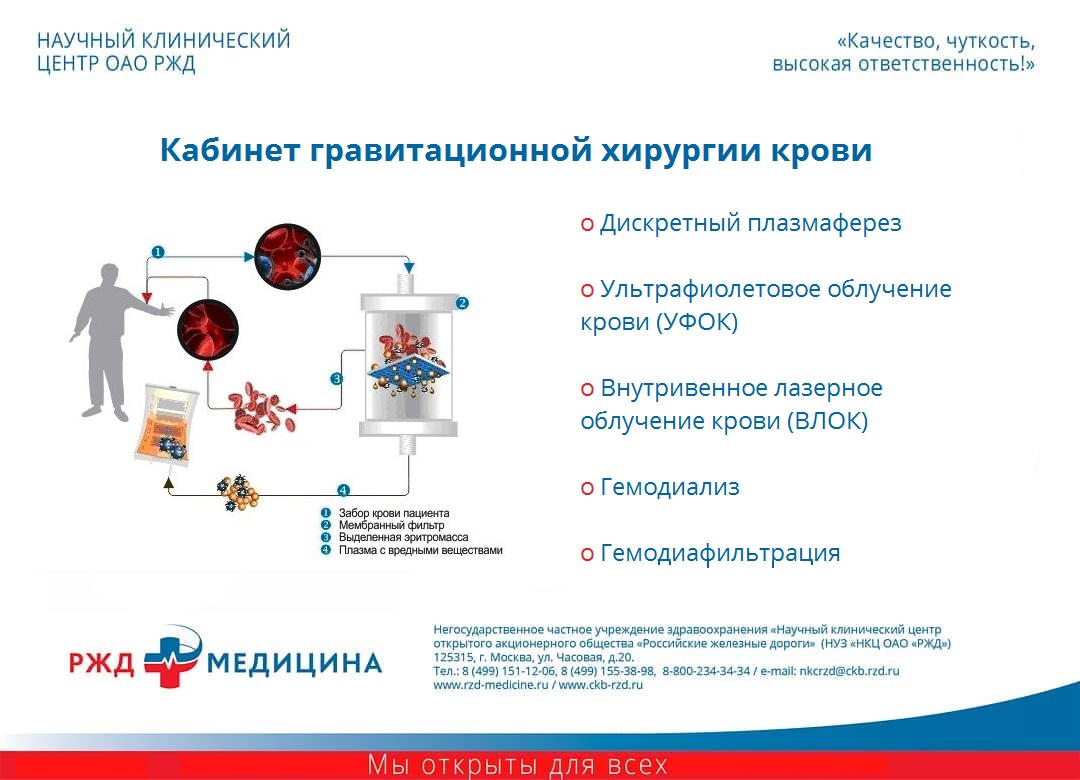
1) низкая масса тела;
2) малый объем циркулирующей крови;
3) чувствительность гемодинамики к дефициту объема циркулирующей крови;
4) малый диаметр сосудов;
5) значительный объем заполнения контура аппарата;
6) высокие скорости перфузии, не рассчитанные на катетеры малых диаметров.
В отечественной литературе мы не нашли данных о применении гравитационного ПФ у новорожденных на аппарате «SpectraOptia» (США).
Целью исследования явилась оценка эффективности применения гравитационного ПФ у новорожденных с гипербилирубинемией.
Материалы и методы
Исследование проведено у 2 новорожденных массой тела 3200 и 2500 г с гипербилирубинемией на фоне гемолитической болезни новорожденных. Первый ребенок дышал самостоятельно, второй ребенок находился на ИВЛ из-за дыхательной недостаточности на фоне основного заболевания. Всего было проведено 2 процедуры терапевтического ПФ. Для проведения про- цедуры использовали аппарат «SpectraOptia» (США). Сосудистый доступ – двухпросветный катетер 4 Fr, установленный в бедренную вену. Скорость забора крови была 3–5 мл/мин, скорость удаления плазмы – 1–2 мл/мин. Восполнение одногруппной свежезамороженной плазмой. В качестве ан- тикоагулянта использовался цитрат натрия. В течение каждой процедуры была произведена замена 0,5–0,75 объема циркулирующей плазмы. Оценку эффективности ПФ проводили по динамике снижения уровня билирубина, клинического состояния.
Первый ребенок дышал самостоятельно, второй ребенок находился на ИВЛ из-за дыхательной недостаточности на фоне основного заболевания. Всего было проведено 2 процедуры терапевтического ПФ. Для проведения про- цедуры использовали аппарат «SpectraOptia» (США). Сосудистый доступ – двухпросветный катетер 4 Fr, установленный в бедренную вену. Скорость забора крови была 3–5 мл/мин, скорость удаления плазмы – 1–2 мл/мин. Восполнение одногруппной свежезамороженной плазмой. В качестве ан- тикоагулянта использовался цитрат натрия. В течение каждой процедуры была произведена замена 0,5–0,75 объема циркулирующей плазмы. Оценку эффективности ПФ проводили по динамике снижения уровня билирубина, клинического состояния.
Результаты
Перед ПФ – 407 и 382 мкмоль/л.
Через 1 час – 245 и 198 мкмоль/л.
Через 6 часов – 200 и 174 мкмоль/л.
Через 12 часов – 133 и 118 мкмоль/л.
Во время проведения процедуры осложнений не отмечалось.
Выводы
Таким образом, первый опыт применения терапевтического гравитационного ПФ на аппарате «SpectraOptia» показал его эффективность и безопасность. После выполнения данной процедуры не отмечалось снижения показателей лимфоцитов, тромбоцитов, эритроцитов. Применение одноразового контура без необходимости частого забора крови, ее центрифугирования в другом аппарате и затем последующего ее возврата значительно снижает риск инфицирования пациента. Гравитационный ПФ может проводиться у новорожденных и недоношенных детей при возможности установки катетера необходимого диаметра. Отрицательным моментом является высокая стоимость аппарата и расходного материала.
Литература
1. Воинов В.А. Эфферентная терапия. Мембранный плазмаферез. – 5-е изд., испр. и доп. – М.: Новости, 2010. – 368 с.
2. Калинин Н.
3. Межирова Н.М., Данилова В.В., Овчаренко С.С., Штыкер С.Ю. Сравнительная оценка эффективности активных методов детоксикации у новорожденных // Актуальные проблемы транспортной медицины. – 2010. – № 3. – С. 142–144.
4. Дудукалов С.Г. Применение дискретного и мембранного плазмафереза в комплекс- ной терапии новорожденных детей с синдромом эндогенной интоксикации: автореф. дис. канд. мед. наук. – Хабаровск, 2010. – 23 с.
5. Вьюгов М.А., Воинов В.А., Майоров В.М., Пирогова О.П. Эфферентная терапия резус- конфликтной беременности и гемолитической болезни плода и новорожденного // Эффе- рентная и физико-химическая медицина. – 2012. – № 3. – С. 38–41.
6. Bambauer R., Jutzler G.A., Philippi H., Jesberger H.J. et al. Hemofiltration and plasmapheresis in premature infants and newborns // Artif. Organs. – 1988. – Vol. 12, № 1. – Р. 20–26.
7. Bunchman T.E. Plasmapheresis and renal replacement therapy in children // Curr.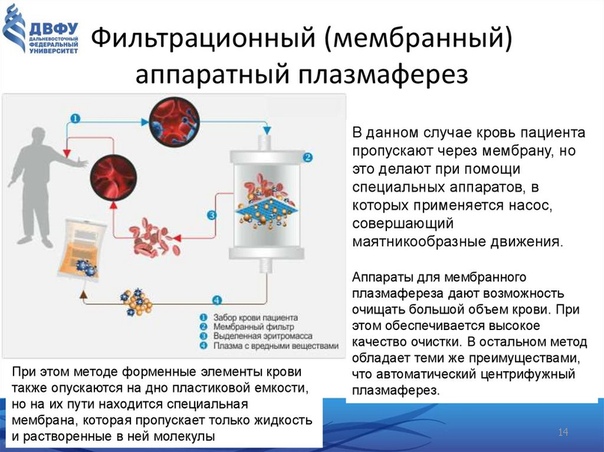 Opin. Pediatr. – 2002. – Vol. 14. – Р. 310–314.
Opin. Pediatr. – 2002. – Vol. 14. – Р. 310–314.
8. Bambauer R., el-Saadi R., Graf N., Jesberger H.J. et al. Plasmapheresis in newborns with hyperbilirubinemia // Artif. Organs. – 1992. – Vol. 16, № 5. – Р. 472–476.
9. South M., Butt W. Treatment of neonatal hyperbilirubinaemia by plasmapheresis // Intensive Care Med. – 1992. – Vol. 18, № 6. – Р. 373–374.
Отделение гемосорбции и гравитационной хирургии крови
Гемосорбция
Принцип действия гемосорбции основан на способности токсических веществ адсорбироваться на поверхности активированного угля. Адсорбироваться могут только среднемолекулярные вещества, имеющие заряд (+ или — ). К ним относятся: бактериальные токсины, живые или погибшие микробные тела, продукты тканевого распада, медиаторы воспаления и комплекс биологически активных веществ (продукты калликреин-кининового каскада, гистамина, серотонина, продукты перекисного окисления липидов, лизосомальные энзимы и т.
После проведения гемосорбции можно наблюдать значительное снижение концентрации патологических продуктов. Однако, через несколько часов их содержание в крови приближается к исходному. Это связано с тем, что в сосудистое русло поступают вещества, находящиеся в тканях (клетках и межклеточном пространстве). Последующие процедуры гемосорбции или способствуют удалению и этих веществ, что приводит к более полной санации внутренней среды организма, выздоровлению или длительной ремиссии (отсутствии проявлений болезни) при хронических заболеваниях, а так же снижает риск развития осложнений.
Плазмаферез
Сущность — удаление части плазмы крови. Молекулы некоторых метаболитов и патологических веществ имеют незаряженную “замкнутую” структуру и электрически инертны. Это иммунные комплексы, аутоантитела, иммуноглобулины, некоторые виды аллергенов, димиелинизирующие вещества, атерогенные факторы (холестерин, липопротеиды, жирные кислоты), различные патологические метаболиты. Они не вступают в контакт с активированным углем и не могут быть выведены из организма при помощи гемосорбции.
Выведение таких веществ может быть осуществлено при проведении плазмафереза, когда полностью удаляется какая-то часть плазмы крови вместе со всеми находящимися там патологическими продуктами. К помощи плазмафереза прибегают для уменьшения в плазме концентрации белков, липидов, гормонов, токсинов, антигенов, антител, иммунных комплексов. Показания к проведению плазмафереза постоянно расширяются. В отличие от гемосорбции, плазмаферез носит более универсальный характер, при нем удаляются все патологические продукты, независимо от наличия и величины электростатического заряда их молекул.
Так же, как при гемосорбции, после сеанса плазмафереза можно наблюдать значительное снижение концентрации патологических продуктов, однако уже через несколько часов содержание их в крови приближается к исходному уровню. Это говорит о том, что в сосудистое русло поступили вещества, находившиеся до того в тканях (клетках и межклеточном пространстве). Последующие сеансы плазмафереза способствуют удалению и этих веществ, что приводит к более полноценной санации всей внутренней среды, учитывая, что основная часть вредных продуктов находится во внесосудистых пространствах. Таким образом, могут быть удалены из организма и длительно находящиеся там ксенобиотики, поступившие из окружающей среды, естественные и патологические метаболиты. Иммуномодулирующее действие плазмафереза заключается в том, что организм, реагируя на потерю с плазмой иммунных компонентов, начинает синтезировать новые, как правило, более функционально активные.
Удаляемый объём плазмы восполняется плазмозамещающими растворами, альбумином или донорской плазмой. В последнем случае, особенно когда удалённая плазма полностью замещается донорской, операция носит название плазмообмен. При любом из методов после удаления плазмы сгущённая клеточная масса крови разводится изотоническим раствором натрия хлорида или иным плазмозаменителем и возвращается пациенту. Одномоментный забор 600 — 800 мл. плазмы в лечебных целях безопасен при возмещении потерянного объема кристаллоидными растворами (глюкозой или физиологическим раствором) и не требует введения белковых плазмозаменителей. Такая «мягкая» методика плазмафереза представляется более предпочтительной.
В последнем случае, особенно когда удалённая плазма полностью замещается донорской, операция носит название плазмообмен. При любом из методов после удаления плазмы сгущённая клеточная масса крови разводится изотоническим раствором натрия хлорида или иным плазмозаменителем и возвращается пациенту. Одномоментный забор 600 — 800 мл. плазмы в лечебных целях безопасен при возмещении потерянного объема кристаллоидными растворами (глюкозой или физиологическим раствором) и не требует введения белковых плазмозаменителей. Такая «мягкая» методика плазмафереза представляется более предпочтительной.
Для полноценной санации внутренней среды обычно требуется 3-5 сеансов плазмафереза, за которые удаляется в общей сложности 1-1,5 ОЦП (объема циркулирующей плазмы). Интервалы между процедурами составляют 2-3 дня. Процесс же накопления патологических ингредиентов, более постепенный, занимает месяцы, а то и годы. Поэтому, если не ликвидированы этиологические факторы заболеваний, то, на примере аутоиммунных («иммунокомплексных») болезней, проводя повторные курсы плазмафереза два раза в год можно удерживать пациентов на достаточно управляемом уровне ремиссии, своевременно предупреждая кризы тяжёлых обострений.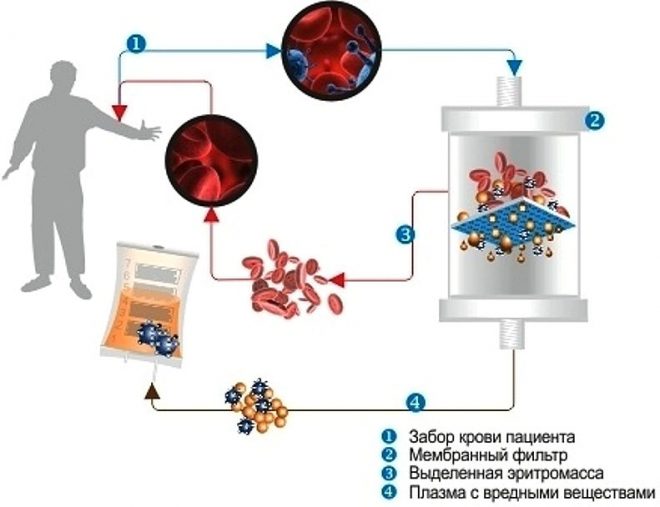
Фотогемокоррекция
Сущность — ультрафиолетовое (АУФОК) или лазерное (АЛОК) облучение крови. Удаление патологических продуктов внутренней среды является только первым шагом детоксикации. Вторым — является ликвидация вторичных последствий нарушений гомеостаза — восстановление естественных защитных систем, главным образом, иммунитета. Основой экстракорпоральных методов иммунокоррекции является квантовая терапия — облучение крови ультрафиолетовыми или лазерными лучами. Практически каждая операция плазмафереза (как и гемосорбции) должна сопровождаться квантовой иммунокоррекцией. С другой стороны, практически во всех случаях, когда квантовая терапия предпринимается с целью иммунокоррекции, бессмысленно её проведение без параллельной эфферентной терапии. Несмотря на использование разных источников оптического излучения (ультрафиолетового, лазерного — зелёного, красного, инфракрасного спектра), между ними нет принципиальных различий по механизмам воздействия, а, главное, по клиническим эффектам. Активный радикал («синклетный кислород»), образуемый при облучении крови, помимо бактерицидного эффекта, обладает способностью доокисления недоокисленных токсичных веществ в крови и облегчает процесс детоксикации (т.е. моделирует антитоксическую функцию печени).
Активный радикал («синклетный кислород»), образуемый при облучении крови, помимо бактерицидного эффекта, обладает способностью доокисления недоокисленных токсичных веществ в крови и облегчает процесс детоксикации (т.е. моделирует антитоксическую функцию печени).
АУФОК основано на использовании квантов, то есть малых доз ультрафиолетового излучении с целью лечения, профилактики и реабилитации пациентов. При этом используются естественные, близкие к природным факторы ультрафиолетового воздействия, оказывающие благотворное влияние на процессы жизнедеятельности клетки, органа, системы. Малые мощности энергетического воздействия, применяемые в квантовой медицине, абсолютно безопасны. Метод позволяет перевести возникший аномальный процесс, то есть болезнь, в устойчивое стабильное состояние, состояние здоровья. Объясняется это тем, что квантовое воздействие запускает скрытые резервные адаптационные возможности организма, как на уровне отдельной клетки, так и всей биологической системы в целом, резко повышая иммунитет и мобилизуя защитные силы организма на активное сопротивление возникшим отклонениям в функционировании.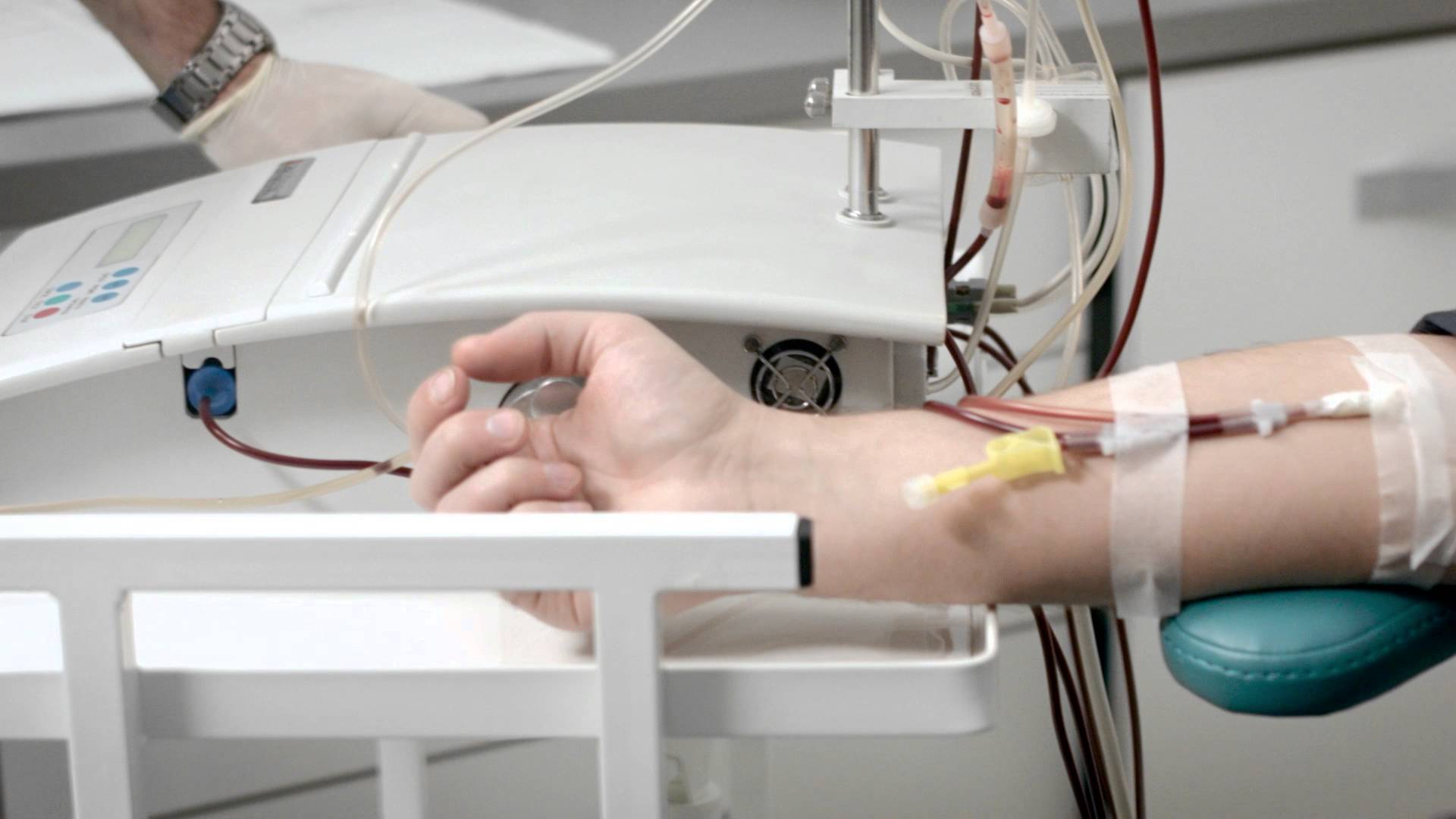
Целесообразность применения УФОК основано на стимуляции иммунитета, улучшении микроциркуляции и гемореологии, кислородно-транспортной функции крови и тканевого дыхания, активации антиоксидантной системы, что в суммарном итоге обеспечивает противовоспалительный и детоксикационный эффект. В ГКБ №52 процедуры проводятся на аппарате «Изольда», используются только одноразовые системы.
Гравитационная хирургия крови
Гравитационная хирургия крови — один из методов экстракорпоральной очистки крови, применяемый при патологических состояниях и заболеваниях связанных с выраженным скоплением в крови токсических продуктов. Кровь — это внутренняя среда организма, обеспечивающая жизнь человека. С током крови во все органы разносится кислород и необходимые питательные вещества, а из тканей удаляется углекислый газ. В норме в организме постоянно происходит выведение элементов обмена, однако этот процесс может быть нарушен при патологии печени, почек, селезенки, легких, а также при дефектах фагоцитарной системы и избытке продуктов, подлежащих удалению.
Процесс очищения крови бывает крайне необходим при иммунокомплексной патологии, при массивных ожогах, когда в кровоток поступают токсические вещества, при острых инфекциях или лучевой болезни.
По способу очищения крови от токсических продуктов, может быть выделено 3 основные методики:
- 1.гемодиализ — мембранное очищение крови;
- 2.гемосорбция — прохождение крови через сорбенты;
- 3.плазмаферез — метод центрифугирования и осаждения крови.
Расслоение крови на компоненты — это направление, которое получило название гравитационная хирургия крови в 1978 году. Наиболее распространенным методом является плазмаферез, в процессе которого происходит изъятие жидкой части крови — плазмы. Другим весьма важным этапом считается замещение удаленной плазмы донорской или введение дополнительных компонентов крови.
В настоящее время существует несколько методов разделения крови на компоненты под воздействием сил гравитации. Простейший из них — отстаивание крови во флаконах, когда через 2-3 часа после оседания образуется 2 слоя: верхний — плазма и нижний — клетки крови. Метод ручного плазмафереза, применяемый при заболеваниях крови, состоит в удалении плазмы и возвращении в кровоток клеток крови. С 1963 г. очистку крови стали проводить при помощи прерывистого плазмафереза с использованием пластиковых контейнеров. В 60-е годы 20 века в США создали сепаратор крови, и начиная с того времени широкое распространение получил машинный плазмаферез, когда разделение крови осуществляется в процессе ее центрифугирования в чаше-роторе. Это позволяет расслоить кровь на плазму и ее клеточные элементы — тромбоциты, лейкоциты и эритроциты, с удалением значительного объема плазмы, до 3-4 литров за сеанс.
Простейший из них — отстаивание крови во флаконах, когда через 2-3 часа после оседания образуется 2 слоя: верхний — плазма и нижний — клетки крови. Метод ручного плазмафереза, применяемый при заболеваниях крови, состоит в удалении плазмы и возвращении в кровоток клеток крови. С 1963 г. очистку крови стали проводить при помощи прерывистого плазмафереза с использованием пластиковых контейнеров. В 60-е годы 20 века в США создали сепаратор крови, и начиная с того времени широкое распространение получил машинный плазмаферез, когда разделение крови осуществляется в процессе ее центрифугирования в чаше-роторе. Это позволяет расслоить кровь на плазму и ее клеточные элементы — тромбоциты, лейкоциты и эритроциты, с удалением значительного объема плазмы, до 3-4 литров за сеанс.
Механизм лечебного плазмафереза помогает осуществлять выведение из кровотока вместе с плазмой токсических элементов, таких как: бактериальные токсины, продукты распада тканей, разрушающие клетки крови, клетки-киллеры. После плазмафереза улучшается микроциркуляция крови во внутренних органах, устраняются застойные явления, нормализуется дыхание тканей, происходит разжижение крови. Сегодня определен список из 50 болезней, для которых необходим плазмаферез, как неспецифический метод терапии, предполагающий детоксикацию, реокоррекцию и иммунокоррекцию с целью повышения эффективности лечения в комплексе с другими мероприятиями.
После плазмафереза улучшается микроциркуляция крови во внутренних органах, устраняются застойные явления, нормализуется дыхание тканей, происходит разжижение крови. Сегодня определен список из 50 болезней, для которых необходим плазмаферез, как неспецифический метод терапии, предполагающий детоксикацию, реокоррекцию и иммунокоррекцию с целью повышения эффективности лечения в комплексе с другими мероприятиями.
Лазеротерапия — лечебное применение оптического излучения, источником которого является лазер. Это класс приборов, в конструкции которых использованы принципы усиления оптического излучения при помощи индуцированного испускания квантов (LASER — Light Amplification by Stimulated Emission of Radiation — усиление света с помощью вынужденного излучения).
Лазерное излучение проникает в ткани на различную глубину, что зависит, от длины волны и от поглощающих свойств тканей. Под действием энергии лазерного излучения повышаются окислительно-восстанопительные процессы в тканях, повышается потребление тканями кислорода, стимулируются трофические и регенераторные процессы. Улучшаются процессы кровоснабжения тканей, повышается клеточный иммунитет. Лазерное излучение оказывает бактериостатическое действие, усиливает процессы регенерации костной ткани, оказывает противовоспалительное, рассасывающее действие. Лазеротерапия активизирует кровоснабжение головного мозга, ускоряет регенерацию нерва, улучшает трофику хрящевой ткани, снижает свертываемость крови, оказывает болеутоляющее, гипотензивное действие. Активация этих комплексов стимулирует синтез белков и нуклеиновых кислот, гликолиз, липолиз и окислительное фосфорилирование клеток. Сочетанная активация пластических процессов и накопление макроэргов приводит к усилению потребления кислорода и увеличению внутриклеточного окисления органических веществ, т.е. усиливает трофику облучаемых тканей. В облученных тканях происходят фазовые изменения локального кровотока и увеличение транскапиллярной проницаемости эндотелия сосудов микроциркуляторного русла. При лазерном облучении пограничных с очагом воспаления тканей или краев раны происходит стимуляция фибробластов и формирование грануляционной ткани. Уменьшение импульсной активности нервных окончаний С-афферентов приводит к снижению болевой чувствительности (за счет периферического афферентного блока), а также возбудимости проводящих нервных волокон кожи. При продолжительном воздействии лазерного излучения активируется нейроплазматический ток, что приводит к восстановлению возбудимости нервных проводников. Лазерное излучение усиливает деятельность иммунокомпетентных органов и систем и приводит к активации клеточного и гуморального иммунитета.
Улучшаются процессы кровоснабжения тканей, повышается клеточный иммунитет. Лазерное излучение оказывает бактериостатическое действие, усиливает процессы регенерации костной ткани, оказывает противовоспалительное, рассасывающее действие. Лазеротерапия активизирует кровоснабжение головного мозга, ускоряет регенерацию нерва, улучшает трофику хрящевой ткани, снижает свертываемость крови, оказывает болеутоляющее, гипотензивное действие. Активация этих комплексов стимулирует синтез белков и нуклеиновых кислот, гликолиз, липолиз и окислительное фосфорилирование клеток. Сочетанная активация пластических процессов и накопление макроэргов приводит к усилению потребления кислорода и увеличению внутриклеточного окисления органических веществ, т.е. усиливает трофику облучаемых тканей. В облученных тканях происходят фазовые изменения локального кровотока и увеличение транскапиллярной проницаемости эндотелия сосудов микроциркуляторного русла. При лазерном облучении пограничных с очагом воспаления тканей или краев раны происходит стимуляция фибробластов и формирование грануляционной ткани. Уменьшение импульсной активности нервных окончаний С-афферентов приводит к снижению болевой чувствительности (за счет периферического афферентного блока), а также возбудимости проводящих нервных волокон кожи. При продолжительном воздействии лазерного излучения активируется нейроплазматический ток, что приводит к восстановлению возбудимости нервных проводников. Лазерное излучение усиливает деятельность иммунокомпетентных органов и систем и приводит к активации клеточного и гуморального иммунитета.
УФОК – ультрафиолетовое облучение крови, метод гемокоррекции, заключающийся в экстра- или интракорпоральном воздействии на кровь квантами оптического излучения ультрафиолетовой части спектра. Работа над созданием искусственных методов протезирования дезинтоксикационной функции организма привела к развитию целого направления в современной медицине — эфферентологии (от латинского efferens — выводить). В последние десятилетия оформился и быстро развивается один из перспективных разделов эфферентной медицины — фотогемотерапия (квантовая терапия, физиогемотерапия, фотомодификация крови). Весомый вклад в развитие этого направления внесло внедрение в лечебную практику УФОК.
В настоящее время УФОК получило широкое признание благодаря относительной простоте, безопасности, экономичности, многообразию положительных функциональных сдвигов, индуцированных в организме, отсутствию побочных явлений, высокой терапевтической эффективности.
Механизм действия облучённой крови на человека сложен и многообразен. До сих пор нет единой теории о влиянии УФИ на организм человека. Филатов А.Н. (1937) считал, что в механизме действия ультрафиолетового облучения крови необходимо учитывать два фактора: во-первых, кровопускание и во-вторых, обратное переливание крови после облучения УФИ . Это предположение нашло своё доказательство в последующих экспериментальных и клинических работах. По мнению некоторых исследователей, умеренное кровопускание является мощным стимулятором эритробластической и миелоидной функций костного мозга, повышает активность гипофизарно-надпочечниковой системы, сопротивляемость организма в ответ на остро развившуюся гипоксию, и тем самым улучшает общее состояние больных.
УФОК обеспечивает следующие лечебные эффекты:
- бактерицидный;
- противовоспалительный;
- улучшение микроциркуляции;
- повышение кислородной емкости крови и улучшение оксигенации органов и тканей;
- нормализация и стимуляция регенераторных и обменных процессов;
- иммунокорригирующий;
- стимуляция гемопоэза и регенерации, улучшение функциональных свойств эритроцитов.
Городская клиническая больница №31 — Кабинет гравитационной хирургии крови (Плазмаферез, УФО)
Заведующий отделением врач высшей квалификационной категории
Павел Владимирович Бойцов
Отделение экстракорпоральных методов очищения крови (ЭМОК) было создано в нашей больнице в 1991 году. В 2005 году отделение реорганизовано в кабинет гравитационной хирургии крови (КГХК). За это время проведено более 30 000 сеансов лечебного плазмафереза, свыше 35 000 сеансов ультрафиолетового (УФО) и лазерного облучения крови.
Плазмаферез – наиболее известный метод очищения крови, при котором из организма пациента удаляется плазма, содержащая токсические вещества и продукты нарушенного обмена веществ. Современный плазмаферез проводится с применением специальных сепараторов и центрифуг, в которых кровь разделяется на плазму и клеточную массу. Плазму удаляют, а клетки крови вместе с замещающими удаленную плазму растворами возвращают в кровоток пациента. Одна процедура плазмафереза занимает 1,5-2 часа. Курс лечения, в зависимости от заболевания и состояния пациента, состоит из 5 – 10 процедур.
Наилучшие результаты применения плазмафереза получены при лечении аллергических состояний, ишемической болезни сердца (ИБС), гипертонической болезни, стенокардии, нарушениях липидного обмена, синдроме хронической усталости.
Плазмаферез показал себя одним из ведущих методов лечения таких заболеваний, как:
- ревматоидный полиартрит;
- подагра;
- нефрит;
- аутоиммунный гепатит;
- миокардит;
- неспецифический язвенный колит;
- астматический бронхит и бронхиальная астма;
- псориаз;
- нейродермит.
Плазмаферез с успехом применяется в неврологической практике при лечении рассеянного склероза, сосудисто-мозговой недостаточности, энцефалопатии.
Ультрафиолетовое облучение крови (УФО) является методом фотогемокоррекции. УФО применяется в комплексном лечении фурункулеза, рожистого воспаления, герпетической инфекции, в том числе опоясывающего лишая, и других инфекционных заболеваний с целью повышения иммунитета.
Периодическое проведение курсов очищения организма методами эфферентной терапии позволяет значительно улучшить качество и увеличить продолжительность активной жизни.
Курсы лечения плазмаферезом возможно проводить как в стационаре, так и в амбулаторных условиях.
Запись на консультацию осуществляется по телефонам:
(812) 24-600-57;
+7-901-328-11-28.
ГРАВИТАЦИОННАЯ ХИРУРГИЯ КРОВИ (ЭКСТРАКОРПОРАЛЬНАЯ ГЕМОКОРРЕКЦИЯ)
ГРАВИТАЦИОННАЯ ХИРУРГИЯ КРОВИ (ЭКСТРАКОРПОРАЛЬНАЯ ГЕМОКОРРЕКЦИЯ)
Экстракорпоральная гемокоррекция (гравитационная хирургия крови) –направление в медицине, объединившее группу современных методов лечения ряда серьезных заболеваний (сердечно-сосудистых, аутоиммунных и др.). Они основаны на удалении из крови веществ, способствующих поддержанию и развитию болезни, и придании самой крови дополнительных лечебных свойств. Сегодня в развитых странах мира используется более 30 различных экстракорпоральных методов лечения заболеваний.
ПРЕИМУЩЕСТВА ПРОВЕДЕНИЯ ЭКСТРАКОРПОРАЛЬНОЙ ГЕМОКОРРЕКЦИИ В НАШЕЙ КЛИНИКЕ:
Правильное использование методов гравитационной хирургии крови улучшает течение заболевания и прогноз в большинстве случаев. Мы готовы помочь Вам даже в тех случаях, когда результаты лечения в других лечебных учреждениях оказались неутешительными. Строгое соблюдение нашими специалистами международных протоколов диагностики и лечения позволяют рассчитывать на положительный результат даже в самых тяжелых случаях. Об этом свидетельствует 25-летний опыт нашей работы.
Мы используем комплексный подход к лечению заболеваний и профилактике обострений. Во многих случаях это определяется соблюдением диеты, правильно подобранной лекарственной терапией, периодическим наблюдением за течением заболевания и своевременной коррекцией лечебных мероприятий.
КАК ПРОВОДИТСЯ ЛЕЧЕНИЕ:
На первом этапе наши специалисты детально ознакомятся с историей Вашего заболевания, чтобы уточнить диагноз и при необходимости провести дополнительные исследования. В трудных случаях привлекаются ведущие специалисты нашей клиники. Затем Вам составят индивидуальные программы комплексного лечения.
В клинике используются современные технологии экстракорпоральной гемокоррекции, что позволяет минимизировать или полностью устранить неприятные ощущения.
После «подключения» к аппаратам Вы можете читать, вести телефонные разговоры, беседовать с медицинским персоналом. Длительность таких операций (процедур) колеблется от 1,5 до 2 часов, после непродолжительного отдыха Вы можете заниматься любыми привычными для себя делами (работать, управлять автотранспортом, заниматься спортом).
В заключение курса экстракорпоральной гемокоррекции, пациентам при необходимости назначается медикаментозная терапия после консультации специалистами соответствующего профиля.
ПЛАЗМАФЕРЕЗ
Плазмаферез — современный эффективный метод лечения, незаменимый, а иногда и единственно эффективный при лечении аллергических состояний, интоксикаций различного генеза, легочной, неврологической, кардиологической, эндокринной, дерматологической, печеночной и др. патологий. Суть метода состоит в удалении плазмы, в которой содержатся токсические и метаболические компоненты — носители причин болезней. По сравнению с другими методами экстракорпорального очищения крови, плазмаферез оказывает наименьшее повреждающее действие на клетки крови, удовлетворительно переносится больными.
ПОКАЗАНИЯ К ПЛАЗМАФЕРЕЗУ
• Наличие в крови патологических веществ, отличающихся по своим свойствам от нормальных (антитела, иммунные комплексы, токсины).
• Высокое содержание в крови нормальных компонентов (иммуноглобулины, фибриноген, триглицериды, холестерин, билирубин, факторы свертывания и др.).
• Необходимость проведения реокоррекции
Плазмаферез входит в комплексное лечение заболеваний:
• системная красная волчанка
• васкулит
• пузырчатка АВ0-несовместимая трансплантация костного мозга
• ингибиторы к факторам свертывания
• наследственная гиперхолестеринемия
• парапротеинемическая полинейропатия
• миеломная болезнь
• болезнь Вальденстрема (быстропрогрессирующий нефрит)
• ювенильный ревматоидный артрит
• системная склеродермия
• ревматоидный артрит
• апластическая анемия
• аутоиммунная гемолитическая анемия
• иммунная тромбоцитопения
• рефрактерность к трансфузиям тромбоцитов и эритроцитов
• аутоиммунный тиреоидит
• дерматомиозит
• отдельные формы псориаза
• бронхиальная астма
• идеопатический фиброзирующий альвеолит.
ПРОТИВОПОКАЗАНИЯ К ПЛАЗМАФЕРЕЗУ
• Острый геморрагический инсульт
• Тромбоцитопения с количеством тромбоцитов менее 40 тыс.
• Макрогематурия
• Любые язвенно-эрозивные заболевания, связанные с угрозой кровотечения
• Иммунодефицит
• Гипопротеинемия с общим белком менее 50 г/л
• Коллапс
• Недостаточность кровообращения III степени
• Аллергические реакции на все плазмозамещающие растворы
• Возраст более 70 лет
• Сопутствующие психические заболевания с неконтролируемым поведением
• Нарушения в анализе крови
ПРОВЕДЕНИЕ ПЛАЗМАФЕРЕЗА
Плазмаферез — безопасная процедура, проводится в нашей клинике опытными специалистами. При плазмаферезе происходит разделение крови на клеточную массу и плазму. Плазма удаляется, а клетки крови вместе с плазмозамещающими растворами возвращаются в кровоток пациента. Пациент подключается к аппарату через одну из периферических вен, посредством иглы, соединенной с магистралью.
Весь процесс выделения плазмы и возврата клеток выполняется автоматически, безопасно, так как используются только стерильные наборы одноразовых материалов. Для венозного доступа пунктируется одна вена. Длительность процедуры составляет 1,0-2 часа.
Количество операций (сеансов) плазмафереза на курс лечения определяется индивидуально, зависит особенностей клинического случая, в среднем — от 2 до 3. После завершения сеанса на место пункции накладывается давящая повязка, которую следует сохранять 3-4 часа.
СТОИМОСТЬ ПРОЦЕДУР
Стоимость процедуры в кабинете гравитационной хирургии крови Вы можете узнать в разделе ПРЕЙСКУРАНТ.
Получить дополнительную информацию об этих медицинских технологиях и записаться на консультацию можно по тел.: (843) 231-20-91; 231-20-90, либо по адресу: Республика Татарстан, г. Казань, Оренбургский тракт, д.138, Консультативная поликлиника ГАУЗ «РКБ МЗ РТ», отделение платных услуг.
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ УЧРЕЖДЕНИЕ ЗДРАВООХРАНЕНИЯ ТВЕРСКОЙ ОБЛАСТИ «ОБЛАСТНАЯ КЛИНИЧЕСКАЯ БОЛЬНИЦА»
Что такое плазмаферез?
Дискретный плазмаферезявляется экстракорпоральной процедурой, производимой, в основном для очищения крови от токсичных веществ. Суть процедуры достаточно проста: извлекаемая из пациента кровь помещается в гемо-контейнер, в котором разделяется на плазму и форменные элементы – эритроциты, лейкоциты и тромбоциты. Затем кровяные клетки возвращаются в организм, а плазма только утилизируется Чтобы вернуть больному объем крови, равный взятому, недостаток плазмы восполняют физиологическим раствором или другой жидкостью, если того требует лечение болезни. Таким образом, кровь очищается от всех токсинов, растворенных в плазме, и не теряет свои функциональные клетки.
Плазмаферез позволяет избавить организм от накопившихся или выделяющихся токсинов, в том числе аллергенов, антигенов, медиаторных возбудителей воспаления и так далее. Но как метод лечения плазмаферез имеет и свои достоинства, и свои недостатки.
- При некоторых заболеваниях этот метод незаменим – при остром отравлении, например, заражении крови, дисфункции печени, когда кровь попросту не очищается, и так далее.
- Процедура улучшает состав крови и удаляет не только продукты метаболизма, но и гормоны, медиаторы, антигены, антитела и так далее. Это один из лучших методов для подавления тяжелых аллергических реакций.
- Кровь становится менее вязкой, кровообращение усиливается, обеспечивая питание и кислород всем тканям организма.
- Побочные эффекты минимальны, осложнения крайне редки.
- При заборе крови жидкость из окружающих тканей устремляется к сосудам, чтобы восполнить недостаток объема. Тем самым процедура решает и проблему отеков самого разного рода.
Показания для проведения
Применяют плазмаферез достаточно широко.
- Никаких ограничений по возрасту и полу не существует: даже самым маленьким пациентам назначают плазмаферез, если того требует состояние ребенка.
- В пожилом возрасте эта процедура зачастую является куда более эффективным средством при лечении недугов, особенно кожных.
- Плазмаферез применяют и при беременности, в основном для профилактики аутоиммунных заболеваний, в особенности конфликта резус-факторов, а также при фетоплацентарной недостаточности.
Для процедуры существуют абсолютные и относительные показания. В первом случае отказ от плазмообмена может привести к летальному исходу. К таковым назначениям относится:
- эритролейкоз;
- серповидно-клеточная анемия;
- тромбо- и лейкоцитоз;
- миастения;
- отравление любого рода;
- наследственная гиперхолестеринемия;
- болезнь Руфуса, синдром Гийена-Барре и так далее.
Относительными показаниями являются:
- атеросклероз;
- гнойно-септические осложнения;
- болезни ЖКТ;
- сердечно-сосудистые недуги;
- аллергические реакции разного плана, в том числе и кожные.
В дерматологии плазмаферез назначают при:
- псориазе,
- пузырчатке,
- герпесе,
- атопическом дерматите,
- поллинозе,
- фурункулезе и так далее.
Процедура позволяет в максимально сжатые сроки избавиться от главного провоцирующего фактора – аллергена, антител и так далее. Конечно, 1 сеанс дела не исправит: средний курс при дерматологических заболеваниях составляет 5–7 процедур, хотя эффект, особенно при аллергических дерматитах, появляется уже после 2 сеансов.
Очистка крови настолько положительно влияет на состояние кожи, что в некоторых случаях позиционируется как косметологическая процедура для омолаживания организма. Это не соответствует истине.
Отделение гравитационной хирургии крови — Национальный центр Медицины РС(Я), Республиканская больница №1
заведующий Унаров Максим Владимирович, раб. телефон 39-51-29
Отделение гравитационной хирургии крови (ОГХК) ПДЦ ГАУ РС (Я) РБ№1-НЦМ. Открыто 1 марта 1999 года.
ОГХК ПДЦ осуществляет экстракорпоральные методы детоксикации (гравитационные, мембранные, перитонеальные), иммуннокоррекцию методом ультрафиолетового и лазерного облучения крови, гемосорбционные методы детоксикации.
ОГХК ПДЦ оказывает специализированную экстренную медицинскую помощь больным с острой почечной недостаточностью, токсикологическим больным и больным нуждающимся в интенсивной детоксикационной терапии в отделениях ОАРИТ КЦ, ОАРИТ ПДЦ, ОАРИТ АГ ПНЦ, ОАРИТ ПНЦ (ОПН, синдром полиорганной недостаточности, сепсис, панкреонекроз, отек мозга, отек легких, гипергидратационный синдром, ДВС синдром и т.д).
Оказывает плановую заместительную почечную терапию детям с терминальной стадией хронической почечной недостаточности.
Оказывает плановую и экстренную помощь пациентам с печеночной недостаточностью, подготовке к трансплантации печени.
Оказывает плановую и экстренную медицинскую помощь гравитационными методами терапии (плазмаферез, плазмообмен), иммунокоррекцию световыми методами облучения крови пациентам всех структурных подразделений ГАУ РС (Я) РБ№1-НЦМ нуждающихся в данном виде терапии.
Отделение оснащено современными аппаратами для заместительной почечной терапии «искусственная почка» последнего поколения, мобильными аппаратами для проведения продолженных методов гемодиализа, гемофильтрации и мембранного плазмафереза для проведения процедур непосредственно у постели больного в отделениях интенсивной терапии, аппаратом для экстракорпоральной поддержки печени, системой подготовки ультрачистой воды, аппаратами для приготовления диализирующих растворов, центрифугами для проведения плазмафереза, внутрисосудистыми облучателями лазерного и ультрафиолетового света.
В отделении работают высококвалифицированные врачи, прошедшие подготовку по экстракорпоральным видам лечения.
Заведующий отделением Унаров Максим Владимирович, врач трансфузиолог высшей категории, отличник здравоохранения РС (Я), отличник здравоохранения РФ. Раб телефон: 39-51-29
Врачи отделения:
Иванов Михаил Михайлович, врач анестезиолог высшей категории, отличник здравоохранения РС(Я)
Бугай Александр Николаевич врач анестезиолог- реаниматолог
Коммунарова Ольга Петровна врач анестезиолог- реаниматолог
Коконова Елена Евгеньевна врач анестезиолог-реаниматолог
Тихонова Инна Алексеевна врач трансфузиолог
В отделении работает профессиональный коллектив медицинских сестер по специальности медицинская сестра-анестезистка
Старшая медицинская сестра Егорова Елена Константиновна
Техническое и инженерное обеспечение осуществляют специалисты технического центра прикрепленные к отделению гравитационной хирургии крови в главе с инженером высшей категории Корниловым Павлом Ильичом.
Как работает плазменный обмен для облегчения симптомов GBS и MG
«При некоторых заболеваниях массовое удаление патологических веществ не объясняет всех результатов, связанных с использованием TPE, и, следовательно, TPE, по-видимому, имеет дополнительные терапевтические эффекты». 1
Среднее максимальное снижение после одного курса * плазмафереза составило: 2
IgA
69.1%
IgM
79,1%
IgG
73,4%
(подклассы 1-4)
* Пациенты прошли в среднем 6 (от 5 до 27) процедур TPE во время исследования.
Иммуномодулирующая роль терапевтического плазмообмена в периферических Нервная система и нервно-мышечные заболевания
Жан-Марк Леже, Луис Кероль, Мазен М Димаки
Не все плазмообменники одинаковы
Spectra Optia использует удельный вес для разделения компонентов крови.Центрифугирование по сравнению с мембранными методами обеспечивает более эффективное разделение, что может существенно повлиять на впечатления пациентов.
Поскольку центробежный терапевтический плазмообмен (cTPE) более эффективен, чем мембранный терапевтический плазмообмен (mTPE), он удаляет в 1,5–3 раза больше плазмы на единицу обработанного объема цельной крови, что позволяет сократить время процедуры и / или снизить скорость потока цельной крови по желанию.
Spectra Optia использует различия в удельном весе и скорости оседания клеток крови и плазмы для разделения определенных компонентов крови.При центрифугировании в непрерывном потоке кровь непрерывно добавляется в центрифугу; клетки крови отделяются от плазмы, смешиваются с замещающей жидкостью и возвращаются пациенту.
ОТКАЗ ОТ ОТВЕТСТВЕННОСТИ: Этот рисунок предназначен для общего представления процедуры афереза и поэтому не охватывает все этапы. За подробным описанием обращайтесь в Terumo BCT.
- Автоматически контролирует жидкости, используемые в процедуре, что позволяет поддерживать баланс жидкости
- Может проводиться в стационаре или амбулаторно
- Среднее время процедуры составляет 1 час 45 минут (на основе проанализированных данных более 40 000 процедур)
- Подходит для небольших пациентов и обеспечивает комфорт и безопасность пациента
- Обеспечивает доступ к периферическим венам с помощью одной или двух игл
- Возможны другие варианты венозного доступа
Узнать больше Данные нескольких исследований показывают, что 64.3 процента 3 –94,6 процента 4 из
процедур афереза могут быть выполнены с использованием периферийного доступа. 5
У некоторых пациентов периферический доступ может быть невозможен. 6,7
Эти термины часто ошибочно используются как синонимы.
Вот их отличия: 8 ПЛАЗМАФЕРЕЗ:
относится только к удалению плазмы.
ПЛАЗМЕННЫЙ ОБМЕН, ТЕРАПЕВТИЧЕСКИЙ ПЛАЗМЕННЫЙ ОБМЕН (TPE) И ПЛЕКС:
относятся как к удалению, так и к замене плазмы
Информация по безопасности при аферезе
Противопоказания
Лейкоцитаферез противопоказан при остром миелоидном лейкозе FAB M3 (острый промиелоцитарный лейкоз) из-за сопутствующей диссеминированной внутрисосудистой коагуляции. 1,2 Другие противопоказания для использования системы Spectra Optia ограничиваются теми, которые связаны с инфузией растворов и замещающих жидкостей, как того требует процедура афереза, и противопоказаниями, связанными со всеми типами автоматизированных систем афереза.Нежелательные явления процедур афереза могут включать
Беспокойство, головная боль, головокружение, парестезия пальцев и / или лица, лихорадка, озноб, гематома, гипервентиляция, тошнота и рвота, обмороки (обмороки), крапивница, гипотензия, аллергические реакции, инфекции, гемолиз, тромбоз у пациента и устройства, гипокальциемия , гипокалиемия, тромбоцитопения, гипоальбуминемия, анемия, коагулопатия, утомляемость, гипомагниемия, гипогаммаглобулинемия, неблагоприятная тканевая реакция, отказ устройства / одноразового набора, воздушная эмболия, кровопотеря / анемия, электрический шок, дисбаланс жидкости и недостаточное разделение компонентов крови.Реакции на продукты крови, перелитые во время процедур, могут включать
Гемолитическая трансфузионная реакция, иммуноопосредованная деструкция тромбоцитов, лихорадка, аллергические реакции, анафилаксия, острое повреждение легких, связанное с переливанием крови (TRALI), аллоиммунизация, посттрансфузионная пурпура (PTP), связанная с трансфузией реакция трансплантат против хозяина (TA-GVHD), перегрузка кровообращения, переохлаждение, метаболические осложнения и передача инфекционных заболеваний и бактерий. 3,4Только для рецепта
- Операторы должны быть знакомы с инструкциями по эксплуатации системы
- Процедуры должны выполняться квалифицированным медицинским персоналом.
1 Vahdat L, Maslak P, Miller WH Jr, et al.Ранняя смертность и синдром ретиноевой кислоты при остром промиелоцитарном лейкозе: влияние лейкоцитоза, низкодозной химиотерапии, изоформы PMN / RAR-альфа и экспрессии CD13 у пациентов, получавших ретиноевую кислоту all-trans . Кровь . 1994; 84 (11): 3843-3849.
2 Дэвер Н., Кантарджиан Х., Маркучи Дж. И др. Клиническая характеристика и исходы у пациентов с острым промиелотическим лейкозом и гиперлейкоцитозом. Br J Haematol . 2015; 168 (5): 646-653.
3 AABB. Информационный проспект по использованию человеческой крови и компонентов крови. Bethesda, MD: AABB; 2017.
4 Европейское управление качества лекарств и здравоохранения (EDQM). Руководство по приготовлению, использованию и обеспечению качества компонентов крови. 19-е издание.Страсбург, Франция: EDQM Совет Европы; 2017 г.
1 Ривз Х, Винтерс Дж. Механизмы действия плазмообмена. Br J Haematol . 2014; 164 (3): 342-351.2 Guptill JT, Juel VC, Massey JM и др. Влияние терапевтического плазмафереза на иммуноглобулины при миастении. Аутоиммунитет . 2016; 49 (7): 472-479.
3 Mortzell Henriksson M, Newman E, Witt V и др.Нежелательные явления при аферезе: обновление данных реестра WAA. Трансфузия Apher Sci . 2016; 54 (1): 2-15.
4 Носуорти Дж. Х., Шумак К. Х., Вандервурт МК. Длительное использование антекубитальных вен для плазмафереза. Переливание крови . 1989; 29 (7): 610-613.
5 Путенсен Д., Леверетт Д., Патель Б., Ривера Дж. Не используется ли периферический доступ для процедур афереза в клинической практике? Единый центр. Дж Клин Апер . 2017; 32 (6): 553-559.
6 Стегмайр Б., Викдаль А. Доступ в терапевтическом аферезе. Циферблат Тер Афера . 2003; 7 (2): 209-214.
7 Schonermarck U, Bosch T. Сосудистый доступ для афереза у пациентов интенсивной терапии. Циферблат Тер Афера . 2003; 7 (2): 215-220.
8 Оценка плазмафереза. Неврология .1996; 47 (3): 840-843.
(PDF) Центробежный и мембранный терапевтический плазмообмен — мини-обзор
Центробежный и мембранный терапевтический плазмаферез
109
ЕВРОПЕЙСКАЯ ОНКОЛОГИЯ И ГЕМАТОЛОГИЯ
повысило понимание их технических и процедурных характеристик
.11–13 Большинство технических переменных отдают предпочтение системе Spectra
Optia cTPE по сравнению с системами mTPE, с низким риском свертывания крови
и очевидными преимуществами, наблюдаемыми в PRE и времени процедуры.В системах mTPE,
, более низкий PRE часто в некоторой степени компенсируется (хотя и не полностью)
за счет использования более высоких скоростей потока, что имеет дополнительный недостаток, заключающийся в том, что
является выбором типа венозного доступа, более конкретно периферического доступа, становится
. ограничено.
Как cTPE, так и mTPE процедуры в целом безопасны и хорошо переносятся,
, хотя более низкие показатели побочных эффектов были зарегистрированы с системами cTPE в
— всестороннем анализе данных из реестра Всемирной ассоциации афереза
.27 Потеря тромбоцитов с помощью системы Spectra Optia оказалась на
аналогичной или уменьшенной по сравнению с системами mTPE. Устройства mTPE
в целом больше связаны с использованием гепарина, в то время как системы cTPE
в основном работают с цитратом в качестве антикоагулянта. Однако цитрат
часто в большом количестве присутствует в замещающей жидкости во время процедур
обоих типов устройств. В результате гипокальциемия наблюдалась как побочное явление
во время процедур cTPE и mTPE.
В настоящее время в опубликованной литературе из
недостаточно данных, чтобы сделать надежные выводы об эффективности удаления
медиаторов болезней или других молекул с помощью любого типа системы.
Действительно, хотя в некоторых публикациях упоминается, что существуют различия,
, особенно для белков с более высокой молекулярной массой, данные ограничены, и
требуют дальнейших исследований.
Региональные различия в использовании любого типа системы показывают
, что другие факторы, такие как историческое использование и затраты на возмещение,
могут влиять на решения по лечению TPE.41 Кроме того, необходимость выполнения
других типов процедур на объекте, где требуется система TPE
, также может влиять на тип выбранной системы TPE. Поскольку
снижает частоту возникновения событий свертывания крови, разумно предположить, что
, что cTPE снизило бы одноразовые затраты по сравнению с системами
mTPE. Аналогичным образом, сокращение времени процедуры и снижение частоты нежелательных явлений на
также могут снизить стоимость лечения
в долгосрочной перспективе.В заключение, есть несколько причин
, чтобы предложить использование систем cTPE или mTPE на основе различий
, описанных здесь. q
1. Carter CE, Benador NM. Терапевтический плазмаферез для лечения детских болезней почек
в 2013 году. Pediatr Nephrol.
2014; 29: 35–50.
2. Ламберт С., Герике М., Смит Р. и др. Скорость экстракции плазмы и эффективность сбора
во время терапевтического плазмообмена с
Spectra Optia по сравнению с Haemonetics MCS +.
J Clin Apher. 2011; 26: 17–22.
3. Патон Э., Болдуин И.К. Плазмообмен в отделении интенсивной терапии:
ретроспективный аудит 10 лет. Aust Crit Care. 2014; 27: 139–44.
4. Пьюзи С.Д., Леви Дж. Б.. Плазмаферез при иммунологической болезни почек
. Blood Purif. 2012; 33: 190–8.
5. Тан Х. К., Харт Г. Плазменная фильтрация. Ann Acad Med Singapore.
2005; 34: 615–24.
6. Йокояма Х., Вада Т., Чжан В. и др. Достижения афереза
Терапия гломерулярных заболеваний.Clin Exp Nephrol.
2007; 11: 122–7.
7. Мадоре Ф. Плазмаферез. Технические аспекты и показания.
Crit Care Clin. 2002; 18: 375–92.
8. Линенбергер М.Л., Цена TH. Использование клеточного и плазменного афереза
у пациентов в критическом состоянии: часть 1: технические и физиологические аспекты
. J Intensive Care Med. 2005. 20: 18–27.
9. Okafor C, Ward DM, Mokrzycki MH, et al. Введение и обзор терапевтического афереза
и.Дж. Клин Афер. 2010; 25: 240–9.
10. Палата DM. Обычные методы афереза: обзор. J Clin
Apher. 2011; 26: 230–8.
11. Kes P, Janssens ME, Basic-Jukic N, et al. Рандомизированное перекрестное исследование
, сравнивающее мембранные и центробежные
терапевтические процедуры плазмафереза. Переливание.
2016; 56: 3065–72.
12. Puppe B, Kingdon EJ. Мембранный и центробежный терапевтический
плазмаферез: практические трудности антикоагуляции экстракорпорального контура
.Clin Kidney J. 2014; 7: 201–5.
13. Hafer C, Golla P, Gericke M, et al. Мембрана против терапевтического плазмафереза
на центрифуге: рандомизированное проспективное перекрестное исследование
. Int Urol Nephrol. 2016; 48: 133–8.
14. Cid J, Molina JM, Mustieles MJ, et al. Сравнение процедур обмена плазмы
с использованием трех систем афереза.
Переливание. 2015; 55: 1001–7.
15. Hequet O, Stocco V, Assari S, et al. Сравнение эффективности обмена плазмой
между Spectra Optia и COBE
системами афереза Spectra при повторных процедурах с учетом вариабельности
и с использованием конкретных статистических моделей.Transfus Apher
Sci. 2014; 51: 47–53.
16. Tormey CA, Peddinghaus ME, Erickson M, et al.
Повышенная эффективность удаления плазмы для терапевтического плазмафереза
с использованием новой платформы афереза.
Переливание. 2010; 50: 471–7.
17. Ким Д.К., Ким С., Чон Ш. и др. Терапевтический плазмообмен
с использованием сепаратора клеток Spectra Optia по сравнению с COBE
Spectra. Ann Lab Med. 2015; 35: 506–9.
18.Дуглас К.В., МакГарви М., Робертсон С. и др. Первоначальный опыт
одноцентрового обмена плазмой на аппарате
Spectra Optia Cell Separator: 106 последовательных процедур
Optia по сравнению со 114 последовательными процедурами COBE
Spectra на той же группе пациентов. Дж. Клин Афер.
2008; 23: 17–8.
19. Роксби Д., Фоул А., Сумисон Д. и др. Предварительный опыт использования
системы афереза Spectra Optia для терапевтических процедур плазмафереза
.Дж. Клин Афер. 2008; 23: 18–9.
20. Ким С., Ли К., Ли Э, Ким Хо. P586. Сравнение эффективности удаления плазмы с помощью двух инструментов для афереза
во время терапевтического плазмафереза
, связанного с трансплантацией почки.
Vox Sanguinis. 2013; 105 (Приложение 1): 260.
21. Шмидт Дж. Дж., Аспер Ф., Эйнеке Г. и др. Обмен терапевтической плазмы
в центре третичной медицинской помощи: 185 пациентов, прошедших курс лечения 912
— годичный ретроспективный анализ.BMC Nephrol.
2018; 19: 12.
22. Schwartz J, Padmanabhan A, Aqui N, et al. Руководство по использованию терапевтического афереза
в клинической практике — доказательства — подход, основанный на
от Писательского комитета Американского общества афереза
: седьмой специальный выпуск. Дж. Клин Афер.
2016; 31: 149–62.
23. Basic-Jukic N, Kes P, Glavas-Boras S, et al. Осложнения
терапевтического плазмафереза: опыт 4 857
процедур.Ther Apher Dial 2005; 9: 391–5.
24. Bramlage CP, Schroder K, Bramlage P, et al. Предикторы
осложнений терапевтического плазмафереза. Дж. Клин Афер.
2009; 24: 225–31.
25. Куриэль Д., Вайнштейн Р. Осложнения терапевтического обмена плазмой
Обмен: недавняя оценка. Дж. Клин Афер. 1994; 9: 1–5.
26. Кипров Д.Д., Голден П, Роэ Р. и др. Нежелательные реакции, связанные с мобильным терапевтическим аферезом
: анализ 17 940
процедур.Дж. Клин Афер. 2001; 16: 130–3.
27. Mortzell Henriksson M, Newman E, Witt V, et al. Нежелательные явления
при аферезе: обновление данных реестра WAA. Transfus
Apher Sci. 2016; 54: 2–15.
28. Lemaire A, Parquet N, Galicier L, et al. Плазмообмен в отделении интенсивной терапии
: Технические аспекты и осложнения.
J Clin Apher. 2017; 32: 405–12.
29. Бурноуф Т., Эбер М., Кинц Д. и др. Оценка активации комплемента
во время процедуры мембранного плазмафереза
.Дж. Клин Афер. 2004; 19: 142–147.
30. Рейманн П.М., Мейсон П.Д. Плазмаферез: техника и
осложнений. Intensive Care Med. 1990; 16: 3–10.
31. Джанг И.К., Херстинг М.Дж. Когда гепарины способствуют тромбозу:
обзор гепарин-индуцированной тромбоцитопении. Тираж.
2005; 111: 2671–83.
32. Брунетта Гавранич Б., Басич-Юкич Н., Премузич В. и др. Мембранный
терапевтический плазмаферез с гепарином и без него
антикоагулянт.Дж. Клин Афер. 2017; 32: 479–85.
33. Палата DM, Mehta RL. Экстракорпоральное ведение
пациентов с острой почечной недостаточностью с высоким риском кровотечения. Kidney Int Suppl.
1993; 41: S237–44.
34. Сиглер К., Ли Дж., Сриватс П. Региональная цитратная антикоагуляция
с замещением кальция в педиатрическом аферезе. Дж. Клин Афер.
2018; 33: 274–7.
35. Вайнштейн Р. Основные принципы лечебного кровообмена.
В: Mcleod B, Szczepiorkowski Z, Weinstein R, Winters J (ред.),
Аферез: принципы и практика (3-е издание). Bethesda,
Мэриленд: AABB Press, 2010: 259–94.
36. Betz C, Buettner S, Geiger H, et al. Региональная цитратная
антикоагуляция в терапевтическом плазмафере со свежей
замороженной плазмой — модифицированный протокол. Int J Artif Organs.
2013; 36: 803–11.
37. Гашти К.Н., Андреоли Д.К., Патель Д. Терапевтический мембранный обмен
плазмаферез (mTPE): технический и клинический опыт.
J Clin Apher. 2018; 33: 38–45.
38. Muchtar E, Magen H, Gertz MA. Как лечить криоглобулинемию.
Кровь. 2017; 129: 289–98.
39. Siami GA, Siami FS. Мембранный плазмаферез в США
: обзор за последние 20 лет.
Тер Афер. 2001; 5: 315–20.
40. Балинт Б., Тодорович-Балинт М., Остойич Г. и др. Немедленный эффект от плазмообмена
при лечении тяжелой гипертриглицеридемии
с использованием Spectra Optia по сравнению с COBE Spectra.
Vox Sanguinis. 2013; 105: 256.
41. Мальческий П.С., Коо А.П., Скибинский В.И. и др. Технологии афереза
и клиническое применение: Международный регистр афереза
за 2007 год. Ther Apher Dial. 2010; 14: 52–73.
Принципы разделения: показания и терапевтические цели для плазмообмена
Введение
Терапевтический плазмообмен (ТПЭ) входит в список экстракорпоральных методов лечения, в управлении которыми нефрологи часто считаются экспертами.Ожидается, что TPE станет логичным терапевтическим вариантом для рассмотрения в болезненном состоянии, при котором патогенез связан с конкретным токсичным биологическим веществом, имеющим относительно высокую молекулярную массу (> 15000 D), медленную скорость образования и распределение в внутрисосудистое пространство (таблица 1) (1). В отличие от гемодиализа или гемофильтрации, при которых многие вещества с более низкой или средней молекулярной массой нацелены на удаление, мишень с TPE обычно является единственным компонентом плазмы (рис. 1) (2).
Таблица 1.Характеристики идеальной молекулы-мишени для терапевтического плазмафереза
Рисунок 1.Эффективность экстракорпоральной терапии в зависимости от размера целевых веществ. Указаны молекулярные массы (в килодальтонах). Коэффициенты просеивания (рассчитанные как отношение концентраций растворенных веществ между фильтратом и кровью мембраны для больших молекул) по существу равны единице для белков с молекулярной массой от альбумина до B-липопротеина (2400000 D) и потенциально до криоглобулины (900 000 Д).На верхнем уровне характерны исключение тромбоцитов (1-2 мкм) и отторжение белков с очень высокой молекулярной массой (3 000 000 D) (2). VitB12, витамин B 12 .
Существует два принципиально разных технологических подхода к плазмообмену: разделение с помощью центробежных сил и разделение с помощью фильтрующего мембранного аппарата. Они работают на разных физических принципах, но каждый из них способен эффективно фракционировать содержимое плазмы из цельной крови (3) и обеспечивать замену плазмой или альбумином.Большинство доказательств клинических испытаний безопасности и эффективности TPE было впоследствии получено из исследований с использованием технологии разделения центрифугированием. Тем не менее предполагается, что мембранное разделение имеет аналогичную эффективность в большинстве условий (4). Операционные различия между центрифугированием и мембранной фильтрацией, двумя основными технологиями, используемыми для достижения TPE, приведены в таблице 2. Центробежный аферез отделяет плазму от клеточных компонентов на основе плотности, тогда как мембранный аферез основан на размере молекул.Чтобы нефролог мог применить процедуру TPE, необходимо понимать методы удаления вещества как с помощью процедур, так и с точки зрения кинетики.
Таблица 2.Операционные различия между центрифугированием и процедурами мембранного афереза
Текущие показания к TPE
Последние рекомендации Американского общества афереза (ASFA), опубликованные в 2010 г. и обновленные в 2013 г., включают постоянно растущий список показаний категории I. TPE, при котором терапевтический аферез считается терапией первой линии, отдельно или в сочетании с другой терапией (5,6).Показания категории I ASFA для заболеваний почек из самых последних руководств приведены в Таблице 3.
Таблица 3.Показания почечного обмена ASFA I для терапевтического плазмафереза
Принципы центробежного разделения
Центробежные проточные устройства чаще всего обеспечивают непрерывный поток из пациента к центрифуге (рис. 2А). Антикоагулянт, обычно цитрат, добавляется перед центрифугированием, за которым следует возврат остальных компонентов крови с соответствующей замещающей жидкостью (обычно альбумином или плазмой), так что образуется непрерывный экстракорпоральный контур потока (7).Функциональным блоком является сама центрифуга, которая вращается с типичной скоростью 2000–2500 об / мин для разделения содержимого антикоагулированной крови в зависимости от плотности или удельного веса различных компонентов крови. Неселективное удаление плазмы достигается за счет наслоения плазмы около оси вращения, рядом с которой находится лейкоцитарная пленка, состоящая из тромбоцитов, лимфоцитов, моноцитов и гранулоцитов в том порядке, который простирается от оси вращения с эритроцитами, образующими самый внешний слой. (8).Эффективность разделения различных компонентов крови зависит от размеров центрифуги и переменной скорости (оборотов в минуту) центрифуги, которая создает гравитационные силы, а также от времени пребывания, которое представляет собой количество времени, в течение которого кровь проводит в центрифуге.
Рисунок 2.Технологические подходы к лечебному плазмообмену. Сравнение процедур разделения плазмы на центрифуге (A) и на мембране (B).
Принципы мембранного разделения
Хотя они не могут выполнять цитаферез (удаление клеток), мембранные сепараторы плазмы более напоминают процедуру непрерывного диализа, выполняемую в режиме изолированной ультрафильтрации (рис. 2В).Плазмообмен отделяет и удаляет плазму с ее патогенным (ыми) веществом (ями) с одновременным замещением жидкости, обычно включающим альбумин или плазму. Основными факторами в эффективности устройства для удаления растворенных веществ в мембранных сепараторах плазмы являются скорость фильтрации плазмы и факторы, присущие мембране. Чтобы избежать засорения фильтра внутри сепаратора, фильтрующая фракция ограничивается 30–35% плазмы. В результате для достижения желаемого плазменного клиренса потребуется обработать 3–4-кратный расчетный объем крови (9).Мембранный плазмообмен, как это обычно делается, является неселективным, удаляя все составляющие плазмы, как патологические, так и полезные компоненты плазмы. Внутренние свойства мембраны включают размер и распределение пор. Коэффициенты просеивания (рассчитанные как отношение концентраций растворенных веществ между фильтратом и кровью мембраны для больших молекул) равны единице для белков с молекулярной массой в диапазоне от альбумина (67000) до B-липопротеина (2400000) и потенциально выше к криоглобулинам (900 000).На эффективность может дополнительно влиять in vivo такие факторы, как отложение формованных элементов, свертывание волокон, адсорбция белка и концентрационная поляризация, наслоение отклоненных растворенных веществ белка на внутренней поверхности мембраны, что дополнительно снижает саму фильтрацию (2,3). .
Молекулярные мишени
Интенсивный плазмообмен используется при лечении заболеваний, патогенез которых связан с патогенными патогенными аутоантителами в крови (10), парапротеинами, белками, не относящимися к Ig, комплексами антиген-антитело, аллоантителами, эндогенными токсинами, экзогенными ядами , или в некоторых случаях неопознанные токсичные компоненты плазмы (11).Способность достигать и поддерживать пониженные концентрации целевых молекул при частом лечении плазмой была продемонстрирована для ограниченного числа болезненных состояний. Клинические реакции чаще оценивались в отсутствие измерения изменений концентрации патогенных молекул-мишеней.
Основными факторами, определяющими удаление целевых веществ в TPE, являются объем распределения, t 1/2 и возможность отскока целевого вещества до повышенных уровней в сосудистом пространстве после процедуры.Увеличение объема плазмы, обменяемой во время одной процедуры TPE, приводит к уменьшению отдачи из-за удаления фиксированной доли (65–70%) существующего вещества и снижения уровня плазмы замещающей жидкостью, используемой для TPE. Следовательно, процентное снижение концентрации в плазме, ожидаемое во время обмена плазмой, уменьшается по мере удаления большего общего объема плазмы: замена первого объема плазмы (приблизительно 3 л у человека весом 70 кг с нормальным уровнем гематокрита) удалит 63%, следующий единичный объем плазмы 23%, а третий объем плазмы только 9% (рисунок 3) (1,2,9,12,13).Кроме того, если коэффициент рассева ниже единицы, удаление становится менее эффективным. На чистое сокращение будет влиять перераспределение из внесосудистых во внутрисосудистые отделы, скорость синтеза и объемы распределения, приближающиеся, а затем превышающие расчетный объем плазмы (2). Плазма t 1/2 молекулярной мишени влияет на скорость восстановления концентрации в плазме после процедуры TPE. Быстрый рост уровней молекулы с коротким t 1/2 потребует более частого TPE.Кроме того, перенос молекул-мишеней продолжается между межклеточным, интерстициальным и внутрисосудистым пространством. Эти взаимодействия между компартментами, аналогичные модели с двумя пулами для небольших растворенных веществ, схематически представлены на рисунке 4.
Рисунок 3.Кинетика целевой молекулы во время терапевтического обмена плазмой. (A) Теоретическая взаимосвязь между увеличением объема плазмы, обмениваемой по сравнению с объемом плазмы пациента во время процедуры TPE, и процентным снижением концентрации целевой молекулы в идеализированных условиях.(B) Аналогичный рисунок, показывающий удаление целевой молекулы от начала (черные кружки) до конца каждой из трех процедур TPE (белые кружки), теперь с учетом таких факторов, как биосинтез, катаболизм и компартментальное равновесие. По материалам Kaplan (1) и Samtleben et al . (2). ТПЭ, лечебный плазмаферез.
Рис. 4.Схематическая диаграмма, показывающая взаимосвязь между внутренним компартментальным и внешним распределением целевых молекул во время процедуры терапевтического плазмообмена.
Эти зазоры и компартментные характеристики, которые будут определять количество и частоту требуемых TPE, в конечном итоге относятся к характеристикам молекулярной мишени, связанной с заболеванием. Если антитело имеет длинный t 1/2 , уровни в отсутствие удаления будут сохраняться, несмотря на прекращение эндогенной продукции. т 1/2 за 5 дней означает, что фракционный оборот IgM составит 19% в день, так что, когда производство остановлено, исчезновение происходит довольно быстро.Для IgG t 1/2 из 22 дней дает только 7% оборота в день и более длинную кривую исчезновения (13). С помощью TPE патогенные молекулы IgM могут быть эффективно истощены: поскольку IgM имеет большой размер (приблизительно 970 000 D) и находится на 90% внутрисосудисто, клиренс будет эффективно достигнут одним или двумя обменами плазмы (11) с минимальным восстановлением уровня сыворотки. Однако большинство заболеваний, опосредованных аутоантителами, связано с выработкой IgG, молекулы размером примерно в одну восьмую размера и находящейся на 30–45% во внесосудистом пространстве.При таком большом объеме плазмы при идентичных обстоятельствах потребуется несколько обменов плазмой для удаления Ig из кровотока и интерстициального пространства и для достижения значимого клиренса (9). Например, для процессов, опосредованных IgG, ожидается, что шесть TPE снизят уровни циркулирующих IgG до одной пятой или одной шестой от исходного уровня.
Растущий список состояний с патогенными аутоантителами, идентифицированных современной молекулярной биологией, варьируется от миастении (по сравнению с рецептором ацетилхолина) и варианта Миллера-Фишера острого синдрома Гийена-Барре (антитела к ганглиозиду GQ1b) до аутоиммунной дилатационной кардиомиопатии ( антитела к адренорецептору B-1) и криоглобулинемии, связанной с гепатитом C (ревматоидный фактор, антитела IgM к IgG).Подавляющее большинство почечных показаний к TPE связано с удалением Ig. Значимое истощение более мелких и короткоживущих компонентов, таких как моноклональные свободные легкие цепи или даже более мелкие и более короткоживущие вещества, такие как свободные легкие цепи и фрагменты комплемента, было труднее продемонстрировать.
Терапевтические мишени в болезненных состояниях
Хотя процедура TPE является относительно простой и механической, ее эффективность при различных состояниях остается переменной, даже если было идентифицировано большее количество потенциальных медиаторов патогенных заболеваний.Примеры патогенных молекул-мишеней для TPE при заболевании почек перечислены в таблице 4. Антитела, специфичные к гепарину и фактору 4 тромбоцитов, являются отличительным признаком гепарин-индуцированной тромбоцитопении. TPE может эффективно снижать титры антител к гепарин-индуцированной тромбоцитопении, измеренные с помощью ELISA на фактор 4-поливинилсульфат тромбоцитов или агрегации тромбоцитов, индуцированной гепарином, до низких или отрицательных уровней. Однако рекомендации ASFA находятся на уровне 2C, что является слабой рекомендацией с низким или очень низким качеством доказательств, поскольку данные ограничены небольшим количеством серий случаев и отчетов (5).Антигеном-мишенью при неврологическом синдроме оптического нейромиелита (NMO) теперь считается водный канал аквапорина 4 (14). Сывороточные антитела связываются с мягкой мозговой оболочкой микрососудов центральной нервной системы и пространствами Вирхова-Робина. В результате иммунная система разрушает миелин в зрительном нерве и спинном мозге. TPE уменьшает воспаление во время приступов неврита. Антитело может быть отличительным биомаркером NMO по сравнению с рассеянным склерозом и другими состояниями. Однако только 21 из 37 пациентов имели антитела к NMO в одной серии (15).В других условиях, таких как идиопатическая дилатационная кардиомиопатия, при которой аутоантитела к миокардиальным антигенам присутствуют у большинства пациентов, неоднородность результатов клинических исследований может быть связана с используемыми анализами аутоантител.
Таблица 4.Примеры патогенных молекул-мишеней для TPE при заболевании почек
Такая же вариабельность применима к показаниям почек для форм GN, индуцированных TPE аутоантителами, которые, по-видимому, не получают одинакового преимущества от TPE (4). Например, в настоящее время плазмаферез не показан при первичной идиопатической мембранозной гломерулопатии, недавно описанной в связи с антителами, реактивными к рецепторам фосфолипазы А2 М-типа на отростках подоцитов, хроническом состоянии с медленным и непрерывным болезненным процессом.Эффективность процедуры также может варьироваться в зависимости от активности заболевания, особенно при заболевании антигломерулярной базальной мембраны (GBM) или быстро прогрессирующем GN. Обоснование TPE при нефропатии IgA заключается в удалении циркулирующих патогенных молекул IgA или иммунных комплексов; несмотря на исследования, демонстрирующие, что TPE может снижать уровни обоих, клиническая польза, по-видимому, ограничивается ранним острым заболеванием и не может остановить прогрессирование заболевания (5). При заболеваниях отложений, таких как амилоидоз, удаление моноклональных легких цепей Ig (амилоидоз легких цепей амилоида) или β 2 -микроглобулина (амилоидоз, связанный с диализом) может быть неадекватным, учитывая хронический характер лежащего в основе процесса отложения.Во многих случаях уменьшение количества патогенных молекул может привести к клинической ремиссии только в том случае, если основной процесс перепроизводства также замедлен.
Анти-GBM-антитела
Синдром Гудпасчера — это органоспецифическое аутоиммунное заболевание, опосредованное анти-GBM-антителами (16). Заболевание, направленное против GBM, остается прототипом почечных показаний для TPE. Подстрекательский фактор неизвестен. Почти у всех пациентов в крови обнаруживаются антитела против GBM. Хотя повышение титра антител против GBM не установлено как прогностический фактор для почечных исходов, в одном исследовании они достоверно коррелировали с серьезностью морфологических изменений при биопсии почек (17).
При синдроме Гудпасчера анти-GBM представляют собой антитела, направленные против области α3-домена коллагена типа IV в почках и легких (18–21). В экспериментах по пассивному переносу было показано, что аутоантитела против GBM являются патогенными. Происходит линейное отложение антител против GBM, а пассивный перенос на модели приматов индуцирует GN (22). Сообщалось о иммунореактивности циркулирующих аутоантител Goodpasture к нескольким доменам NC 1 коллагена IV (20), возможно, вызванной конформационными изменениями в четвертичной структуре неколлагенового домена.У большинства пациентов с заболеванием против GBM в крови обнаруживаются антитела IgG, в первую очередь IgG1. В недавнем отчете о целевых антигенах при заболевании все 57 пациентов имели естественные антитела против GBM, хотя были некоторые различия в целевых антигенах (23). Антитела против GBM, обнаруживаемые с помощью ELISA, обычно находятся в диапазоне 30–120 Ед / мл (19). Недавний одноцентровый отчет о 221 пациенте, пролеченном более 10 лет, показал, что сывороточные уровни анти-GBM антител были независимым предиктором смерти пациента (23).
ASFA классифицирует заболевание против GBM как показание категории I для TPE. по доказательствам от низкого до очень низкого качества для диффузного альвеолярного кровоизлияния и категории IA, сильная рекомендация, основанная на доказательствах высокого качества, для независимости от диализа (5). Успешное лечение пар анти-GBM GN удаление патогенных аутоантител из кровотока с подавлением дальнейшей продукции аутоантител. Раннее проведение плазмафереза имеет важное значение, поскольку повреждение клубочков становится необратимым, когда пациент становится зависимым от диализа.Титры антител быстро снижаются при плазмообмене и иммуносупрессии. В часто цитируемом небольшом рандомизированном клиническом исследовании антитела против GBM исчезали примерно в два раза быстрее, чем в контрольной группе (24). Исследование показало тенденцию к лучшему результату в группе плазмафереза; однако его небольшой размер ( n = 20) и несколько более высокий уровень функции почек на момент включения в группу плазмафереза затрудняют интерпретацию. Ограниченные данные свидетельствуют о корреляции между уровнем антител против GBM и серьезностью морфологических изменений в почках (17,24).Неопределяемые уровни антител являются целью терапии TPE при заболевании против GBM. TPE обеспечивает быстрое снижение уровня антител против GBM (4). В крупнейшем одноцентровом отчете комбинация плазмафереза с кортикостероидами и циклофосфамидом оказала благоприятное влияние на почечные исходы и результаты лечения пациентов по сравнению с лечением без плазмафереза (24). Титры анти-GBM антител следует регулярно контролировать, а аферез следует прекращать, если они не обнаруживаются, обычно после 10–14 процедур.
Тромботическая тромбоцитопеническая пурпура
«Идиопатическая» приобретенная форма тромботической тромбоцитопенической пурпуры (ТТП) считается аутоиммунным состоянием, вызванным образованием ингибирующих аутоантител (обычно IgG) против ADAMTS13 (дезинтегрин-подобного типа и металлопротеина). 1 motifs-13) протеаза (25–30). ADAMTS13 представляет собой vWf-расщепляющую металлопротеиназу, активность которой недостаточна либо из-за врожденной генетической мутации, либо из-за приобретенного аутоиммунного состояния при TTP (25,28,29).Низкая активность этой протеазы приводит к образованию больших мультимеров vWF, которые способствуют агрегации тромбоцитов в ответ на внутрисосудистое напряжение сдвига и формируют критический очаг образования микротромбов в артериолах (31). Относительно большое (102 пациента) рандомизированное контролируемое клиническое исследование показало превосходство ТПЭ над инфузией только плазмы при лечении ТТП (30). В этом случае мишенью являются ингибирующие аутоантитела IgG против протеазы ADAMTS13. Дополнительным преимуществом TPE, выполняемого с использованием свежезамороженной плазмы, а не замены альбумина, является возможность вводить большие объемы плазмы, содержащей дефицитный фермент ADAMTS-13 (30).В редких случаях ТТП из-за генетического отсутствия ADAMTS-13 и отсутствия ингибитора одной плазмы может быть достаточно для лечения.
Rapidly Progressive GN
TPE в настоящее время зарекомендовал себя как эффективная терапия для ANCA-положительного быстро прогрессирующего GN у пациентов с тяжелой почечной недостаточностью (креатинин сыворотки> 5,7 мг / дл) или диализной зависимостью, а также у пациентов с диффузным альвеолярным кровотечением, с нет преимущества по сравнению с одной только иммуносупрессией у пациентов с легкой формой заболевания (5). Однако все клинические испытания включали как слабиммунный (связанный с ANCA), так и иммунный комплексный GN.Нет клинических исследований, в которых сообщалось бы только о пациентах с идиопатическим иммунным комплексом GN. Часто цитируемое крупное рандомизированное клиническое исследование иммунокомплексного нефрита, вызванного СКВ, не показало никакой пользы от добавления TPE к стандартному режиму стероид / циклофосфамид (32). ANCA имеет высокую молекулярную массу, низкий объем распределения, низкую скорость оборота и длинную t 1/2 и может быть патогенным для слабоиммунных GN. В исследовании MEPEX, проведенном Европейской группой по изучению васкулита, рандомизация в группу плазмообменной терапии снизила риск диализной зависимости через 1 год (33).
Миеломная нефропатия
Множественная миелома и макроглобулинемия Вальденстрема представляют собой злокачественные заболевания плазматических клеток, характеризующиеся продуцированием моноклональных Ig клонами В-лимфоцитов. Избыточное производство моноклональных типов Ig следует параллельно за концентрацией типов Ig в сыворотке: IgG примерно в 65%, IgA в 20% и сами легкие цепи в 15%. Очищенный нативный человеческий IgG имеет молекулярную массу 160 кДа по сравнению с гораздо большей молекулярной массой IgM (970 кДа).Для миеломной нефропатии характерно высокое количество циркулирующих свободных легких цепей Ig, κ или λ (31). При миеломе легких цепей избыточная продукция и доставка в просвет малых легких цепей (22 кДа для цепей κ, 44 кДа для цепей λ) сверх тяжелых цепей приводит к эндоцитозу отфильтрованных легких цепей проксимальными канальцевыми клетками с последующим внутриклеточным катаболизмом. Чрезмерная фильтрация легких цепей подавляет этот катаболический механизм, что приводит к внутриклеточному воспалительному каскаду (34).Реже при пролиферации лимфоцитов и плазматических клеток образуется пентамерный моноклональный белок IgM, характерный для макроглобулинемии Вальденстрема. Восемьдесят пять процентов белков IgM находятся во внутрисосудистом компартменте. У большинства пациентов в моче могут быть легкие цепи Бенс-Джонса, но на более низком уровне, чем при миеломе, и классической гипертонической нефропатии не возникает.
Недавние руководящие принципы ASFA дают рекомендацию степени 2B (слабая рекомендация) для миеломной гипертонической нефропатии в сочетании с химиотерапией на основе пяти рандомизированных клинических испытаний, особенно при высокой нагрузке на легкие цепи (экскреция> 10 г / 24 ч) ( 5).Хотя у легких цепей отсутствуют критерии для молекул-мишеней, эффективно удаляемых TPE (, например, большой молекулярный вес, внутрисосудистое расположение, низкая скорость обмена), TPE является наиболее эффективным доступным способом быстрого удаления большого количества легких цепей (35). TPE, удаляя циркулирующие легкие цепи, снижает их фильтруемую нагрузку, потенциально уменьшая повреждение почек. Тем не менее, клиническая польза TPE остается спорной. Часто цитируемое исследование 1988 г. пришло к выводу, что с помощью TPE удалось удалить большое количество белков Бенс-Джонса и, в сочетании с химиотерапией, улучшить функцию почек и долгосрочное выживание (35).Протеинурия Бенс-Джонса значительно снизилась. Тем не менее, исследование подверглось критике из-за сравнения групп гемодиализа и перитонеального диализа с чрезвычайно высокой двухмесячной смертностью в последних. В крупном рандомизированном клиническом исследовании не удалось продемонстрировать преимущества TPE, но биопсия почки не была критерием включения (гипертоническая нефропатия документировалась редко), и измерения свободных легких цепей не включались (36). Недавнее клиническое испытание показало, что снижение уровней свободных легких цепей на 50% (достигнутое примерно у двух третей участников) было эффективным в обращении вспять почечной недостаточности при одновременном повышении выживаемости (37).Зависимость почечного ответа от уровня легкой цепи наблюдалась только у пациентов с гипертонической нефропатией. Недавний анализ показал, что превосходное удаление легких цепей может быть достигнуто с использованием гемодиализной мембраны с «высоким отсечением», еще не доступной в США (38).
Синдром гипервязкости — редкое, но тяжелое заболевание, наиболее часто встречающееся при макроглобулинемии Вальденстрема, характеризующееся выработкой моноклональных молекул IgM. В одном недавнем отчете однократное лечение плазмаферезом эффективно снизило уровни IgM на 46% и вязкость сыворотки на 45%, с обращением вспять связанной с гипервязкостью ретинопатии и параметров гемодинамики сетчатки (39).
Криоглобулинемия
Криоглобулины состоят из аномальных гамма-глобулинов и компонентов комплемента с молекулярной массой примерно 200 кДа с необычным свойством преципитации в сыворотке или плазме при охлаждении и повторного растворения в тепле. При иммунологическом анализе наиболее распространенная форма включает поликлональные Ig, обычно IgM или IgA, обладающие активностью ревматоидного фактора и обычно вызываемые хроническими вирусными инфекциями, такими как гепатит C или ВИЧ. Осложнения могут включать синдром повышенной вязкости.Пегилированный IFN-α и рибавирин в настоящее время считаются стандартом лечения гепатита C, основной причины смешанной криоглобулинемии (40). Добавление TPE позволяет эффективно удалять криоглобулины, а также может улучшить растворимость иммунных комплексов за счет изменения соотношения антиген-антитело (41). Он наиболее подходит для пациентов с активной криоглобулинемией от умеренной до тяжелой, включая мембранопролиферативный ГН, невропатию, артралгии или язвенные пурпурные поражения (42). Серии случаев и отчеты, но не рандомизированные испытания, подтверждают использование TPE при криоглобулинемии, выполняемой с подогретыми линиями и замещающими жидкостями для предотвращения выпадения осадков (4,43).
Рецидивирующий ФСГС
Недавно исследователи идентифицировали растворимый рецептор урокиназы в плазме пациентов с рецидивирующим ФСГС, способный вызывать выраженную альбуминурию при инкубации с изолированными клубочками крысы (38,39). Это может быть причиной протеинурии через механизм, который включает липидзависимую активацию интегрина α5β3 (44,45). Одним из факторов риска рецидива является повышенная проницаемость, обнаруженная с помощью анализа in vitro (44,46). Фактор представляет собой небольшой белок с одним или несколькими сайтами гликирования с кажущейся молекулярной массой примерно 50 кДа (44).Галактозная аффинная хроматография выявила кардиотропиноподобный цитокин-1, присутствующий в кровотоке в 100 раз больше нормы у пациентов с рецидивирующим ФСГС в активной фракции. Претрансплантационный TPE может быть эффективным в предотвращении или отсрочке рецидива ФСГС у пациентов с высоким риском (44,47). Нерандомизированные клинические испытания и серии случаев показывают, что удаление фактора TPE связано с частичной или полной ремиссией нефротического синдрома при рецидивирующем заболевании (44,46,48).
Гемолитико-уремический синдром
Нет убедительных доказательств того, что TPE в целом приносит пользу пациентам с диареей-ассоциированным гемолитико-уремическим синдромом (ГУС), хотя некоторые пациенты во время недавней европейской вспышки ответили (49).Напротив, TPE был терапией первой линии для атипичного HUS (5), хотя и без проспективных исследований. В настоящее время известно, что растущий список генетических мутаций и полиморфизмов предрасполагает к атипичному ГУС, чаще всего с участием регуляторов или активаторов комплемента, включая фактор комплемента H, фактор комплемента I и белки мембранных кофакторов (50). Последние руководящие принципы рекомендуют TPE для удаления циркулирующих регуляторных компонентов комплемента или аутоантител при замене дефицитных факторов свежезамороженной плазмой, причем самая строгая рекомендация — для людей с аутоантителами к фактору H (51).
Трансплантация почки
Использование плазмафереза при трансплантации почек обычно осуществляется в одном из двух сценариев; ( 1 ) использование как часть протокола перед трансплантацией для снижения иммунологического риска отторжения почечного аллотрансплантата («десенсибилизация» анти-HLA-антител или трансплантация несовместимой по группе крови ABO), что, следовательно, расширяет доступ к трансплантации почек; и ( 2 ) использование в качестве частичного лечения опосредованного антителами отторжения после трансплантации (52).Пациенты с ESRD, у которых есть антитела с высокой пан-реактивностью или специфические для донора антитела, проходят десенсибилизацию — сложный лечебный режим, при котором удаляются специфические для донора антитела и подавляется выработка новых антител, чтобы снизить иммунологический риск и сделать трансплантацию более безопасной (52–58). Острое гуморальное отторжение почечных аллотрансплантатов вызывается аллоантителами, которые вызывают повреждение почек в перитубулярных капиллярах, что приводит к повреждению эндотелия, потере проходимости капилляров, ишемии и пролиферации миофибробластов.TPE используется как часть лечения острого гуморального отторжения (52).
Из-за условий лечения и операционных особенностей, присущих экстракорпоральному ТПЭ, понимание целевых молекул и кинетики их удаления с помощью процедуры очень важно для нефролога. Центробежное и мембранное разделение позволяет достичь плазменного обмена с помощью контрастной технологии. Несмотря на то, что выявляется все больше целевых молекул, имеющих патофизиологическое значение для болезней человека, количественная методология в большинстве случаев еще не применяется.В отличие от уремического синдрома, при котором накапливается множество молекул различного размера и требуется их удаление путем диализа, состояния, обычно лечатся с помощью TPE, включают единственного доминирующего медиатора заболевания. Применение таких понятий, как «адекватность», знакомых нефрологу, необходимо оценить, чтобы лучше понять клинические исходы TPE.
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или уточнить у системного администратора.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
| Dublin Core | Элементы метаданных PKP | Метаданные для этого документа | |
| 1. | Название | Название документа | Гравитационная терапия и медицинский плазмаферез в комплексной терапии облитерирующего атеросклероза артерий нижних конечностей |
| 2. | Создатель | ФИО автора, место работы, страна | Э. С. Лопухов; |
| 3. | Субъект | Дисциплины | |
| 3. | Субъект | Ключевое слово (а) | хроническая ишемия нижней конечности; медицинский плазмаферез; гравитационная терапия |
| 4. | Описание | Абстрактные | Изучены результаты лечения 186 больных с хронической ишемией нижних конечностей атеросклерозом. Пациенты были разделены на три группы. Использование лечебного плазмафереза и гравитационной терапии в комплексной терапии позволяет улучшить результаты терапии и нормализовать большинство исследованных результатов антиоксидантного статуса, липидного спектра и регионарного кровотока в нижних конечностях. |
| 5. | Издатель | Организационное агентство, местонахождение | Эко-вектор |
| 6. | Автор | Спонсор (ы) | |
| 7. | Дата | (ДД-ММ-ГГГГ) | 15.03.2014 |
| 8. | Тип | Статус и жанр | Рецензируемая статья |
| 8. | Тип | Тип | Оригинальная Артикул |
| 9. | Формат | Формат файла | |
| 10. | Идентификатор | Унифицированный идентификатор ресурса | https://journals.eco-vector.com/2410-3764/article/view/24556 |
| 10. | Идентификатор | Цифровой идентификатор объекта (DOI) | 10.17816 / 2072-2354.2014.0.1-2.165-168 |
| 11. | Источник | Заголовок; т., нет. (год) | Аспирантский Вестник Поволжья; Том 14, № 1-2 (2014) |
| 12. | Язык | Английский = en | ru |
| 13. | Отношение | Supp. Файлы | |
| 14. | Покрытие | Геопространственное положение, хронологический период, исследовательская выборка (пол, возраст и др.) | |
| 15. | Права | Авторские права и разрешения | Copyright (c) 2014 Лопухов Е.S. Эта работа находится под международной лицензией Creative Commons Attribution 4.0. |
Оценка активации комплемента во время процедур мембранного плазмафереза - Тайбэйский медицинский университет
TY — JOUR
T1 — Оценка активации комплемента во время процедур мембранного плазмафереза
AU — Burnouf, Thierry
AU — Eber, Michel
AU — Kientz, Daniel
AU — Cazenave, Jean Pierre
AU — Burkhardt, Thomas
PY — 2004
Y1 — 2004
N2 — Предыдущие исследования показали, что процедуры плазмафереза с использованием разделительной мембраны могут активировать дополняет систему и высвобождает анафилатоксины.Это исследование определяет содержание C3a / C3ades Arg и C5a / C5ades Arg в донорской плазме, полученной с помощью новой процедуры Haemonetics® Filter Core (FC), и сравнивает его с Baxter Autopheresis C® (Auto-C). FC выполняет последовательное центрифугирование крови и фильтрацию плазмы на микропористой полиэфирсульфоновой мембране, в то время как Auto-C удаляет клетки крови путем одновременной гравитации и фильтрации на вращающейся нейлоновой мембране. Одна группа из 34 доноров пожертвовала на FC и две группы из 30 и 10 доноров на Auto-C.Аликвоты плазмы отбирали из единиц плазмы в течение 30 минут после окончания процедур сбора, замораживали при температуре <-30 ° C и оценивали на C3a и C5a в различные моменты времени хранения. Среднее значение C3a / C3ades Arg в плазме FC (N = 34) составило 1151 (диапазон: 526-2991), 1092 (диапазон: 349-3498) и 507 (диапазон: 307-815) нг / мл во время сбора и после 6 и 12 месяцев хранения соответственно. Соответствующий CSa / C5ades Arg составил 26,6 (диапазон 4,9–74), 18,9 (9,5–42,6) и 30,9 (диапазон: 10,7–62,3) нг / мл. Среднее значение C3a / C3ades Arg было выше в Auto-C (P <0.001): 4724 нг / мл (N = 10; диапазон: 2400-7 360) и> 4 149 нг / мл (N = 30; 2408-> 6430) после 3 и 18 месяцев хранения соответственно. Среднее значение C5a / C5ades Arg составило 32,1 нг / мл (N = 30; диапазон: 10,6-57,2) после 18 месяцев хранения. Активация комплемента в плазме FC кажется ограниченной по сравнению с Auto-C, что предполагает лучшую биосовместимость этого устройства для сбора и / или благоприятное влияние используемой технологии последовательного центрифугирования / фильтрации клеток. Необходимы дальнейшие исследования для объяснения различий в активации комплемента между процедурами афереза и для оценки клинического воздействия, если таковое имеется.
AB — Предыдущие исследования показали, что процедуры плазмафереза с использованием разделительной мембраны могут активировать систему комплемента и высвобождать анафилатоксины. Это исследование определяет содержание C3a / C3ades Arg и C5a / C5ades Arg в донорской плазме, полученной с помощью новой процедуры Haemonetics® Filter Core (FC), и сравнивает его с Baxter Autopheresis C® (Auto-C). FC выполняет последовательное центрифугирование крови и фильтрацию плазмы на микропористой полиэфирсульфоновой мембране, в то время как Auto-C удаляет клетки крови путем одновременной гравитации и фильтрации на вращающейся нейлоновой мембране.Одна группа из 34 доноров пожертвовала на FC и две группы из 30 и 10 доноров на Auto-C. Аликвоты плазмы отбирали из единиц плазмы в течение 30 минут после окончания процедур сбора, замораживали при температуре <-30 ° C и оценивали на C3a и C5a в различные моменты времени хранения. Среднее значение C3a / C3ades Arg в плазме FC (N = 34) составило 1151 (диапазон: 526-2991), 1092 (диапазон: 349-3498) и 507 (диапазон: 307-815) нг / мл во время сбора и после 6 и 12 месяцев хранения соответственно. Соответствующий CSa / C5ades Arg был 26.6 (диапазон 4,9-74), 18,9 (9,5-42,6) и 30,9 (диапазон: 10,7-62,3) нг / мл. Среднее значение C3a / C3ades Arg было выше в Auto-C (P <0,001): 4,724 нг / мл (N = 10; диапазон: 2,400-7,360) и> 4,149 нг / мл (N = 30; 2408-> 6,430) через 3 и 18 месяцев хранения соответственно. Среднее значение C5a / C5ades Arg составило 32,1 нг / мл (N = 30; диапазон: 10,6-57,2) после 18 месяцев хранения. Активация комплемента в плазме FC кажется ограниченной по сравнению с Auto-C, что предполагает лучшую биосовместимость этого устройства для сбора и / или благоприятное влияние используемой технологии последовательного центрифугирования / фильтрации клеток.Необходимы дальнейшие исследования для объяснения различий в активации комплемента между процедурами афереза и для оценки клинического воздействия, если таковое имеется.
кВт — Аферез
кВт — C3a
кВт — C5a
кВт — Дополнение
кВт — Плазма
UR — http://www.scopus.com/inward/record.url?scp=634ID422975
UR — http://www.scopus.com/inward/citedby.url?scp=6344229753&partnerID=8YFLogxK
U2 — 10.1002 / jca.20019
DO — 10.1002 / jca. 20019
M3 — Артикул
C2 — 15493055
AN — SCOPUS: 6344229753
VL — 19
SP — 142
EP — 147 J
Journal ofClinical
JF — Журнал клинического афереза
SN — 0733-2459
IS — 3
ER —
Плазменный обмен малых объемов (SVPE) для пациентов с синдромом Гийена-Барре (GBS) — Просмотр полного текста
Дизайн исследования :
В этом исследовании безопасности и технико-экономического обоснования 20 пациентов с GBS будут включены в SVPE в соответствии с критериями протокола.Клинометрические измерения (частота сердечных сокращений, артериальное давление, температура, сатурация кислорода (SpO2), неврологическое обследование) наряду с документированием инфекции, связанной с центральной линией кровотока (CLABSI) и других осложнений, связанных с центральным венозным катетером (CV), будут проводиться ежедневно и в течение всего периода. курс СВПЭ до 2-го дня вывода катетера ЦВ по заданному протоколу. Установленный или сильно подозреваемый CLABSI и тромбоз глубоких вен (ТГВ), связанный с центральным венозным катетером, будут отслеживаться для получения определенного результата, чтобы определить частоту тяжелых побочных эффектов, связанных с CLABSI, до выписки пациента из больницы.Неврологический исход будет задокументирован в соответствии с несколькими шкалами оценки инвалидности на протяжении всего SVPE до выписки и до четырех недель с момента включения пациентов GBS. Кроме того, безопасность SVPE у пациентов с СГБ будет сравниваться с фоновым риском осложнений путем определения частоты осложнений у пациентов без СГБ, получавших катетер CV в том же отделении интенсивной терапии (ICU) в течение того же периода с использованием тот же протокол наблюдения, что и у пациентов с СГБ, получавших СВПЭ.
Комплект СВПЭ:
КомплектSVPE будет подготовлен с одним набором для переливания крови и двумя наборами для инфузии физиологического раствора, соединенными с трехканальным устройством. На другом конце набор для переливания крови будет соединен с мешком для крови, один набор для инфузии физиологического раствора соединен с 1 литром физиологического раствора, смешанным с 2500 единицами нефракционированного гепарина, и один набор для инфузии физиологического раствора соединен с 500 мл раствора гексаэтилкрахмала. . Все трубки должны быть освобождены от воздуха столбиком жидкости из соответствующего мешка.Затем к центральному венозному катетеру присоединяют трехканальный канал.
Процедура СВП для пациентов с СГБ:
После подготовки набора SVPE цельная кровь пациента будет забираться из центрального венозного катетера в соответствии с массой тела (7 мл / кг) в каждом сеансе в мешке для переливания крови с силой гравитации, помещая мешок для крови ниже уровня кончика центрального венозного катетера.
Столбик крови в наборе для переливания и в центральном венозном катетере будет очищен физиологическим раствором смешанного гепарина, предварительно введенным через боковой канал.Пакет с кровью будет подвешен рядом с пациентом на подставке для солевого раствора без перерыва для разделения плазмы и клеток крови, что в конечном итоге займет 2,5 часа под действием силы тяжести. Клетки крови будут введены обратно пациенту, а плазма будет удалена и заменена свежезамороженной плазмой (СЗП) и коллоидным раствором попеременно в равном объеме через боковой канал. Один пакет с кровью будет использоваться каждый день на 6 сеансов. В начале каждого сеанса в мешок для крови берется 70 мл раствора гепарина из физиологического раствора, смешанного с гепарином, в качестве антикоагулянта.Шесть сеансов будут проводиться ежедневно в течение 8 дней подряд. Всего за восемь дней будет проведено 48 сеансов. Эти шесть сеансов плазмообмена небольшого объема в день у взрослого пациента будут удалять примерно 1200 мл плазмы в день, и в конечном итоге будет удалено 9600 мл плазмы всего за 48 сеансов. Все соединительные порты и трехканальные каналы центрального венозного катетера, мешка для крови и мешка с физиологическим раствором дезинфицируются с использованием 70% спирта, затем сушатся на воздухе перед забором крови или (раз) соединением.Эти процедуры выполняются в асептических условиях. Утвержденные на международном уровне рекомендации по профилактике инфекций кровотока через центральный венозный катетер соблюдаются на протяжении всего периода процедуры SVPE. Общее активное вмешательство в работу пациента в каждом сеансе будет составлять 30 минут, а общее ежедневное активное вмешательство в работу пациента будет составлять три часа с ежедневным графиком в 8:00, 11:00, 14:00, 17:00, 20:00 и 23:00. Замена плазмы будет производиться поочередно с использованием свежезамороженной плазмы и коллоидного раствора (гексаэтилкрахмал).
Антикоагулянтная терапия:
Нагрузочный подкожный низкомолекулярный гепарин (1,5 мг / кг) будет введен по крайней мере за два часа до начала СВПЭ. После этого ежедневная поддерживающая доза подкожного низкомолекулярного гепарина (1,5 мг / кг) будет продолжаться в течение восьми дней или до завершения SVPE.
Показания к антитромбоцитарной терапии:
Пациенты с чрезмерной тенденцией к свертыванию, несмотря на прием низкомолекулярного гепарина, будут подвергнуты оценке активации тромбоцитов.Если время кровотечения сокращается более чем на 50% от исходного уровня для конкретного пациента с СГБ, исследователи вводят антитромбоцитарные препараты. Ударная пероральная доза аспирина (500 мг) и клопидогреля (600 мг) будет дана как минимум за два часа до следующего сеанса СВПЭ. После этого ежедневная поддерживающая доза перорального аспирина (150 мг) и клопидогреля (75 мг) вместе с подкожным низкомолекулярным гепарином (1,5 мг / кг) будет продолжаться в течение восьми дней или до завершения SVPE.
Документация по процедуре СВПЭ:
Для определения безопасности СВПЭ, шесть ежедневных сеансов СВПЭ будут задокументированы с точки зрения продолжительности и количества плазмы, удаляемой в каждом сеансе, типа и объема используемой замещающей жидкости и свежезамороженной плазмы, а также любых неудобств, мешающих сеансам СВПЭ. временно или постоянно.Любые трудности, мешающие СВПЭ, которых в настоящее время нельзя предвидеть, будут дословно задокументированы.
Документация гемодинамических параметров и вегетативных нарушений:
На протяжении всей процедуры, гемодинамический статус, включая артериальное давление, частоту сердечных сокращений, любую сердечную аритмию, сатурацию кислородом (%) в периферической крови, потребление и выделение жидкости, будет контролироваться ежедневно в соответствии со стандартной практикой у всех пациентов ОИТ. Свертываемость крови будет контролироваться по протромбиновому времени (PT) и времени кровотечения (BT) через день.Вегетативные параметры будут регистрироваться ежедневно в зависимости от наличия высокого или низкого артериального давления, увеличения или уменьшения частоты пульса, ортостатической гипотензии, сердечной аритмии, дисфункции мочевого пузыря и желудочно-кишечного тракта, аномалий зрачков, необычного потоотделения или повышенного слюноотделения.
Документация о заражении:
Признаки инфекций, включая гипертермию, лейкоцитоз в периферической крови, С-реактивный белок и признаки очаговых инфекций, такие как положительный результат крови, аспирата горла / трахеи или посева мочи на патогенные организмы и т. Д.будут задокументированы в соответствии с протоколом в соответствии с соответствующими стандартными формами истории болезни для конкретных госпитальных инфекций (HAI). Клинические и лабораторные данные о HAI, особенно CLABSI, будут контролироваться и изучаться в любое время во время процедуры SVPE до второго дня удаления центрального венозного катетера. Определенный или сильно подозреваемый CLABSI будет отслеживаться до выписки, чтобы задокументировать окончательную судьбу.
Документация по HAI и осложнениям:
Инфекция считается HAI, если все элементы центра по контролю и профилактике заболеваний / Национальной сети безопасности здравоохранения (CDC / NHSN) — специфический критерий инфекции — все присутствуют на третий календарный день госпитализации или после него.Любая инфекция до третьего календарного дня госпитализации будет считаться инфекцией, присутствующей при госпитализации, за исключением случая CLABSI; что может произойти даже на второй день после введения центрального венозного катетера. CLABSI, первичный и вторичный сепсис с инфекциями кровотока и тяжелый сепсис будут в центре внимания при документации инфекции. Все пациенты, отвечающие критериям включения в обследование CLABSI, будут находиться под наблюдением с момента поступления в отделение интенсивной терапии. Пневмония, связанная с аппаратом искусственной вентиляции легких, и инфекция мочевыводящих путей, связанная с катетером, также будут контролироваться с использованием установленных рекомендаций, чтобы иметь более конкретную частоту CLABSI и связанных с ним осложнений.Соответствующие клинические данные, изображения, образцы для биохимического и микроскопического исследования и посева будут задокументированы в определенные моменты времени, определенные в соответствии с конкретным контрольным списком HAI. Осложнения, связанные с устройством, включают окклюзию центрального венозного катетера, кровотечение и тромбоз глубоких вен. Все эти показатели запаса прочности будут определены в соответствии с определениями конкретных руководящих указаний.
Используйте противомикробные препараты:
Любая инфекция будет соответственно лечиться противомикробными препаратами.Выбор антибиотиков (перорально или внутривенно) будет зависеть от места заражения, конкретных выделенных организмов и / или тяжести инфекции, что отражается на клинических и лабораторных характеристиках системного воспалительного ответа (повышенное количество лейкоцитов (WBC) (> 11000 / c мм крови), C-реактивный белок (> 40 мг / л) или положительная культура патогенных организмов) и выбор делается после консультации микробиолога. Соответствующие более низкие поколения антибиотиков для прогнозируемой локально-специфической инфекции будут вводиться сначала, если необходимо, прежде чем рассматривать последующие более высокие поколения, пока не будет доступен отчет о чувствительности посева.
Показания к отмене плазмафереза:
- Развитие тяжелого или неизлечимого сопутствующего соматического заболевания
- Гипотония (снижение систолического артериального давления на 30 мм рт. Ст. Или систолическое артериальное давление <90 или среднее артериальное давление (САД) <65 мм рт. Ст.) После начала лечения
Показания к возобновлению плазмафереза:
- Возвращение артериального давления к исходному или систолического артериального давления> 90 или MAP <65.
- После лечения анафилактической реакции после инфузии СЗП или физиологического раствора.
Показания к замене центрального венозного катетера (ЦВК) на другое место:
1. CLABSI или инфекция в месте введения катетера, связанная с CVC, диагностирована или строго подозревается в соответствии с протоколом.
Показания к замене проволочного проводника центрального венозного катетера (ЦВК) в то же место:
1. Полная окклюзия ЦВК, несмотря на введение антикоагулянтов или тромболитиков при отсутствии признаков CLABSI
Показания к переливанию крови:
1.Анемия с концентрацией гемоглобина ниже 7 г / дл во время и после процедуры SVPE.
Когда остановить испытание (правило остановки):
Для целей технико-экономического обоснования: в отношении процедуры SVPE будет установлен прогнозируемый коэффициент успеха 75%. Если более чем в 5 из 20 процедур SVPE нарушается протокол, процедура будет считаться невыполнимой, и модификация процедуры SVPE будет рассмотрена до любой дальнейшей переоценки измененной процедуры на предмет выполнимости наряду с безопасностью.
В целях безопасности: предварительное распределение вероятности успеха в отношении серьезных побочных эффектов (SAE) будет установлено как 75%. Исследователи будут рассматривать тяжелый сепсис из-за CLABSI и венозный тромбоз, связанный с использованием CVC в качестве SAE. Если> 5 пациентов имели SAE при завершении SVPE или до него у 20 пациентов с GBS; исследование будет остановлено. В противном случае впоследствии будет запланировано РКИ для оценки неврологической эффективности процедуры SVPE.
Базовая документация и первичный отбор:
Полный анализ крови, включая гемоглобин в г / л, общее и дифференциальное количество лейкоцитов и тромбоцитов, скорость оседания эритроцитов (СОЭ), С-реактивный белок, протромбиновое время, креатинин сыворотки, билирубин сыворотки и глутамино-пировиноградная трансаминаза сыворотки (SGPT). документально подтвержден как исходный статус для пациентов с СГБ с СВПЭ вместе со скринингом на гепатиты B, C и ВИЧ.
Документация на антитела против ганглиозидов:
Концентрация анти-ганглиозидных антител (GM1 и GD1A) в сыворотке будет измеряться в начале и в конце SVPE для наблюдения за тенденцией изменения титров в сыворотке пациентов с GBS.
Документация в конце СВПЭ:
На второй день после удаления центральной венозной линии будет проведена повторная оценка исходной документации. К ним относятся полный анализ крови, включая гемоглобин в г / л, общее и дифференциальное количество лейкоцитов и тромбоцитов и СОЭ, С-реактивный белок, протромбиновое время, креатинин сыворотки, билирубин сыворотки и SGPT.
Оценка неврологической функции:
Неврологическое обследование будет выполнено, чтобы увидеть клиническую тенденцию моторных, сенсорных и вегетативных параметров до, во время процедуры и впоследствии при последующем наблюдении за пациентами до четырех недель.
Оценка двигательной функции:
Различные шкалы клинической оценки будут использоваться для отслеживания изменений двигательной функции. Это оценка инвалидности GBS, суммарная оценка Совета по медицинским исследованиям (MRC), оценка MRC, построенная по Рашу, общая шкала ограничения невропатии (ONLS), общая оценка по шкале Раша (R-ODS).
Сенсорная функция:
Соматические и гностические ощущения в конечностях будут исследованы с обеих сторон. Соматические ощущения будут оцениваться путем изучения тонких и грубых прикосновений и болевых ощущений в определенных дерматомных областях, а гностические ощущения будут оцениваться по положению и ощущению вибрации.
Автономная функция:
Вегетативные параметры будут задокументированы в соответствии с наличием высокого или низкого кровяного давления, повышенной или пониженной частоты пульса, сердечной аритмии, дисфункции мочевого пузыря и желудочно-кишечного тракта, аномалий зрачков, необычного потоотделения, повышенного слюноотделения и аномального роста волос.
