Опыт применения рамуцирумаба в комбинации с паклитакселом во второй линии терапии метастатического рака желудка
Цель исследования – изучить эффективность и безопасность рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии.Материал и методы. Пациенты получали рамуцирумаб 8 мг/кг внутривенно один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1, 8 и 15-й дни 28-дневного цикла. Терапия в данном режиме продолжалась до прогрессирования заболевания или непереносимости препаратов.
Результаты. Как показали промежуточные результаты применения рамуцирумаба во второй линии терапии у больных метастатическим раком желудка, у одного пациента достигнут объективный ответ на терапию в виде частичного регрессирования, еще у десяти – стабилизация. Медиана выживаемости без прогрессирования и общей выживаемости не достигнута, поскольку большинство пациентов продолжают получать терапию, причем двое из них свыше восьми месяцев.

Заключение. Комбинация рамуцирумаба и паклитаксела характеризуется высокой эффективностью, приемлемым профилем токсичности и потенциально ассоциируется с высокой общей выживаемостью у пациентов с метастатическим раком желудка, прогрессирующим на фоне первой линии терапии.
Таблица 1. Исходные характеристики пациентов и их опухолей
Рисунок. Гистологические препараты опухоли желудка у пациента (А – до лечения рамуцирумабом и паклитакселом при 20-кратном увеличении, Б – до лечения при 40-кратном увеличении, В – после 20 недель лечения)
Таблица 2. Оценка токсичности
Введение
Рак желудка в структуре заболеваемости занимает четвертое место среди злокачественных новообразований у мужчин (7,9%) и пятое место у женщин (5,2%), но в структуре смертности прочно удерживает вторую позицию (10,3%).![]() У большинства пациентов (69,6%) на момент постановки диагноза имеет место поздняя стадия (III или IV) заболевания, когда методы лечения существенно ограничены. У 45% больных с локальной формой рака желудка, выявленной при первичной диагностике, в течение пяти лет диагностируются метастазы. У 85% пациентов регионарная форма прогрессирует и переходит в метастатическую [1, 2].
У большинства пациентов (69,6%) на момент постановки диагноза имеет место поздняя стадия (III или IV) заболевания, когда методы лечения существенно ограничены. У 45% больных с локальной формой рака желудка, выявленной при первичной диагностике, в течение пяти лет диагностируются метастазы. У 85% пациентов регионарная форма прогрессирует и переходит в метастатическую [1, 2].
В отсутствие противоопухолевого лечения продолжительность жизни больных диссеминированным раком желудка колеблется от трех до пяти месяцев.
Целесообразность и эффективность лекарственной терапии при диссеминированном раке желудка, подтвержденные в рандомизированных исследованиях II–III фаз, сегодня не вызывают сомнения. По сравнению с оптимальной симптоматической терапией химиотерапия достоверно увеличивает продолжительность жизни больных.
Перечень противоопухолевых препаратов, эффективных при раке желудка, включает фторпиримидины как для перорального, так и для парентерального использования, производные платины, таксаны, антрациклины, ингибиторы топоизомеразы I, а также препараты таргетной терапии. Эффективность каждого препарата в монорежиме не превышает 30%. Увеличение эффективности лекарственной терапии связано с использованием комбинированных, достаточно токсичных режимов химиотерапии (DCXF, TOFL, FOLFORINOX и др.). Химиотерапия первой линии диссеминированного рака желудка носит паллиативный характер. Эффект отмечается у 35–40% больных с медианой общей выживаемости от восьми до десяти месяцев [3].
Эффективность каждого препарата в монорежиме не превышает 30%. Увеличение эффективности лекарственной терапии связано с использованием комбинированных, достаточно токсичных режимов химиотерапии (DCXF, TOFL, FOLFORINOX и др.). Химиотерапия первой линии диссеминированного рака желудка носит паллиативный характер. Эффект отмечается у 35–40% больных с медианой общей выживаемости от восьми до десяти месяцев [3].
В настоящее время накоплены данные о молекулярно-генетических изменениях при раке желудка (экспрессия PDGF-альфа, HER2, TGF-бета, EGFR, c-met и др.), что позволяет рассчитывать на эффективность таргетной терапии.
HER2 – рецептор EGF гиперэкспрессирован у 13–22% больных раком желудка, чаще при кишечном типе рака. При НER2-позитивном раке желудка общий эффект от химиотерапии повышается на 12% при добавлении трастузумаба, а медиана выживаемости увеличивается до 13,8 месяца (в контрольной группе – 11,3 месяца). Иная ситуация при раке желудка с HER2-негативным статусом (78–87%).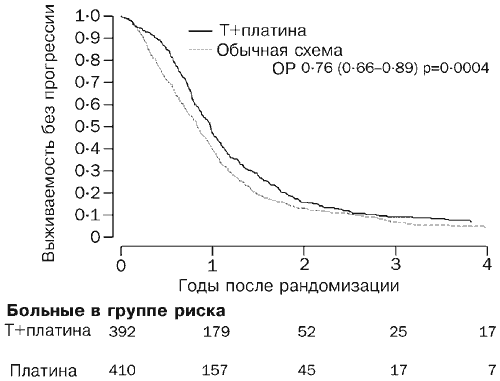
В настоящее время режимы второй линии не зарегистрированы. Актуальной остается проблема разработки новых таргетных системных препаратов для повышения эффективности лечения на поздних стадиях заболевания [4].
Пациентам со статусом 0–2 по шкале ECOG (Eastern Cooperative Oncology Group – Восточная объединенная группа онкологов), не отягощенным тяжелыми сопутствующими заболеваниями, рекомендована химиотерапия второй линии. Сравнение таксанов и иринотекана во второй линии химиотерапии показало их сопоставимую эффективность.
Рамуцирумаб – первый биологический препарат, который применяли в режиме монотерапии. В исследовании REGARD рамуцирумаб увеличивал медиану выживаемости у пациентов с поздними стадиями аденокарциномы желудка и прогрессированием заболевания после первой линии химиотерапии [5].![]() Комбинация рамуцирумаба с паклитакселом, статистически значимо увеличивающая общую выживаемость по сравнению с режимом плацебо в комбинации с паклитакселом (исследование RAINBOW), может быть использована в качестве нового стандартного режима второй линии лечения при раке желудка поздних стадий [6].
Комбинация рамуцирумаба с паклитакселом, статистически значимо увеличивающая общую выживаемость по сравнению с режимом плацебо в комбинации с паклитакселом (исследование RAINBOW), может быть использована в качестве нового стандартного режима второй линии лечения при раке желудка поздних стадий [6].
Материал и методы исследования
Исследование было выполнено на базе Областного онкологического диспансера г. Иркутска. Набор пациентов проводился с 1 июня 2016 г. до 31 января 2017 г. в рамках Всероссийской программы безвозмездной передачи препарата рамуцирумаб для оказания помощи больным раком желудка поздних стадий с прогрессированием заболевания на фоне или после предшествующей химиотерапии на основе производных платины и/или фторпиримидинов по жизненным показаниям.
Главными критериями включения в исследование стали возраст старше 18 лет, гистологически подтвержденный метастатический рак желудка, прогрессирование заболевания после первой линии химиотерапии, состояние на момент исследования по ECOG 0–1, лабораторные показатели без клинически значимых отклонений от нормы.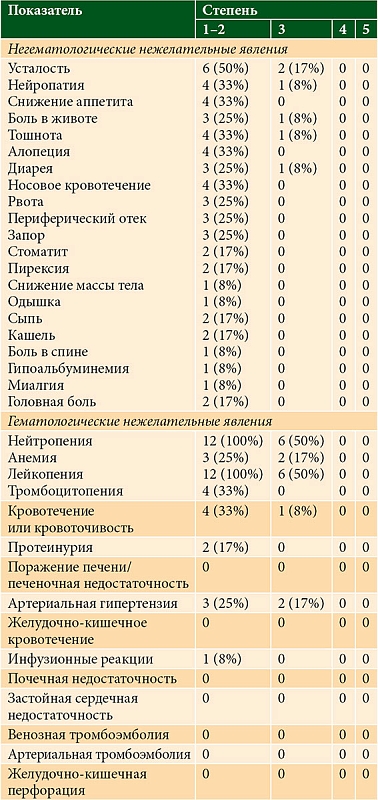
Все участники исследования подписали информированное согласие.
Индивидуальные планы лечения были подготовлены на общем мультидисциплинарном консилиуме диспансера и одобрены Министерством здравоохранения Российской Федерации.
Больные получали лечение по схеме: рамуцирумаб 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1, 8 и 15-й дни 28-дневного цикла. Лечение проводилось на фоне профилактической противорвотной и десенсибилизирующей терапии, инфузионной поддержки.
Объективный ответ оценивали на основании данных мультиспиральной компьютерной томографии с внутривенным контрастированием согласно критериям RECIST v.1.1 и данным эзофагогастроскопии с биопсией (фото в формате DICOM, определение лечебного патоморфоза в биопсийном материале). При анализе токсичности использовали критерии СТС AE v. 4. Определялись выживаемость без прогрессирования (время от регистрации до документального подтверждения прогрессирования) и общая выживаемость (время от регистрации до даты смерти от любой причины). Функцию выживаемости описывали методом Каплана – Майера.
Результаты
В исследование с 1 июня 2016 г. по 31 января 2017 г. было включено 12 пациентов. В ходе проспективного анализа промежуточных результатов применения рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии подтверждены эффективность и безопасность данной схемы лечения в наблюдаемой популяции. Одна пациентка прекратила терапию спустя десять недель от ее начала из-за ухудшения общего состояния. На контрольном обследовании по критериям RECIST констатировано прогрессирование заболевания. Больная умерла через две недели после обследования. У 11 пациентов на контрольном обследовании после двух месяцев терапии зарегистрирована стабилизация заболевания. Эти пациенты продолжили лечение.
по 31 января 2017 г. было включено 12 пациентов. В ходе проспективного анализа промежуточных результатов применения рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии подтверждены эффективность и безопасность данной схемы лечения в наблюдаемой популяции. Одна пациентка прекратила терапию спустя десять недель от ее начала из-за ухудшения общего состояния. На контрольном обследовании по критериям RECIST констатировано прогрессирование заболевания. Больная умерла через две недели после обследования. У 11 пациентов на контрольном обследовании после двух месяцев терапии зарегистрирована стабилизация заболевания. Эти пациенты продолжили лечение.
Среди пациентов в возрасте от 32 до 68 лет (средний возраст – 50 лет) было восемь (67%) женщин и четверо (33%) мужчин. Во всех случаях при гистологическом исследовании выявлена аденокарцинома (G1 – 8%, G2 – 50%, G3 – 42%). Очаги, измеряемые по критериям RECIST v. 1.1, присутствовали у шести (50%) больных. У шести (50%) пациентов выявлены только неизмеряемые очаги. Время до прогрессирования заболевания на фоне первой линии терапии у девяти (75%) пациентов составило менее шести месяцев, у троих (25%) более полугода. Наличие мутации HER2/neu не выявлено. Общее состояние всех больных расценивалось как удовлетворительное – ECOG 0–1. У 11 (92%) пациентов число органов метастазирования не превышало двух. У большинства больных (92%), участвовавших в исследовании, диагностированы перитонеальные метастазы. Асцит обнаружен у пяти (42%) пациентов. В анамнезе перенесли гастрэктомию трое (25%). Девять (75%) пациентов не были оперированы (табл. 1).
У шести (50%) пациентов выявлены только неизмеряемые очаги. Время до прогрессирования заболевания на фоне первой линии терапии у девяти (75%) пациентов составило менее шести месяцев, у троих (25%) более полугода. Наличие мутации HER2/neu не выявлено. Общее состояние всех больных расценивалось как удовлетворительное – ECOG 0–1. У 11 (92%) пациентов число органов метастазирования не превышало двух. У большинства больных (92%), участвовавших в исследовании, диагностированы перитонеальные метастазы. Асцит обнаружен у пяти (42%) пациентов. В анамнезе перенесли гастрэктомию трое (25%). Девять (75%) пациентов не были оперированы (табл. 1).
Больные получили от шести до 16 введений рамуцирумаба и от девяти до 24 введений паклитаксела (12–32 недели лечения, в среднем 22 недели). Пять введений рамуцирумаба с последующим контрольным обследованием получили все участники исследования. Десять (83%) пациентов продолжают получать терапию в прежнем объеме без коррекции доз препаратов с соблюдением режима введения. По результатам компьютерной томографии и эзофагогастродуоденоскопии у одного пациента зафиксировано прогрессирование опухоли после пяти введений рамуцирумаба (десять недель терапии). 11 пациентов продолжили получать терапию в режиме: рамуцирумаб 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1, 8 и 15-й дни 28-дневного цикла.
По результатам компьютерной томографии и эзофагогастродуоденоскопии у одного пациента зафиксировано прогрессирование опухоли после пяти введений рамуцирумаба (десять недель терапии). 11 пациентов продолжили получать терапию в режиме: рамуцирумаб 8 мг/кг в виде внутривенной инфузии в течение 60 минут один раз в две недели в комбинации с паклитакселом 80 мг/м2 внутривенно в 1, 8 и 15-й дни 28-дневного цикла.
Объективный ответ на терапию, по данным мультиспиральной компьютерной томографии в соответствии с критериями RECIST v. 1.1 и эзофагогастродуоденоскопии, зарегистрирован у 11 пациентов. Частичное регрессирование достигнуто после 20 недель лечения рамуцирумабом и паклитакселом у одного (8%) больного. Еще у десяти (83%) наблюдалась стабилизация. У одного (8%) пациента при первом контрольном обследовании после десяти недель терапии отмечалось прогрессирование. Выживаемость без прогрессирования у одного (8%) пациента составила шесть месяцев, рост опухоли констатирован после 13 введений рамуцирумаба. Случаев полного регрессирования опухоли не установлено. Частичное регрессирование опухоли заключалась в выраженном улучшении эндоскопической картины первичной опухоли по результатам эзофагогастродуоденоскопии и патоморфозе опухоли 4-й степени в биопсийном материале (рисунок). Динамики по перитонеальным метастазам не наблюдалось.
Случаев полного регрессирования опухоли не установлено. Частичное регрессирование опухоли заключалась в выраженном улучшении эндоскопической картины первичной опухоли по результатам эзофагогастродуоденоскопии и патоморфозе опухоли 4-й степени в биопсийном материале (рисунок). Динамики по перитонеальным метастазам не наблюдалось.
Медиана выживаемости без прогрессирования и медиана общей выживаемости не были достигнуты, поскольку большинство пациентов продолжают участвовать в исследовании. На сегодняшний день можно констатировать, что у десяти (83%) пациентов, продолжающих получать терапию, контроль над опухолью сохраняется. У двоих (17%) продолжительность терапии превысила восемь месяцев.
Одна пациентка умерла после 12 недель от начала терапии вследствие прогрессирования основного заболевания. Случаев гематологической и негематологической токсичности не зарегистрировано. Чаще имела место гематологическая токсичность. Нейтропения 1–2-й степени зафиксирована у 12 (100%) пациентов, что обусловлено применением паклитаксела. У трех (25%) больных наблюдалось развитие артериальной гипертензии, у четырех (33%) – носовые кровотечения, у двух (17%) – протеинурия. Полный спектр токсичности представлен в табл. 2.
У трех (25%) больных наблюдалось развитие артериальной гипертензии, у четырех (33%) – носовые кровотечения, у двух (17%) – протеинурия. Полный спектр токсичности представлен в табл. 2.
Обсуждение
Согласно промежуточным результатам, показатели выживаемости без прогрессирования и общей выживаемости значительно превысили результаты, которые обычно имеют место при проведении стандартной терапии второй линии метастатического рака желудка. Несмотря на использование разных комбинаций, объективные ответы не превысили 20–25%, медиана продолжительности жизни – пять-шесть месяцев (от начала второй линии химиотерапии) [7]. Аналогичные результаты были получены при использовании паклитаксела в монорежиме или в комбинации с другими препаратами [8–13]. Еженедельное применение паклитаксела (60–80 мг/м2) характеризовалось меньшей токсичностью (нейтропения 3–4-й степени в 16–32% случаев) при одинаковом количестве объективных ответов (8–27%) по сравнению со стандартным трехнедельным режимом в серии японских исследований [9, 10]. На фоне применения паклитаксела в комбинации с цисплатином отмечалась высокая частота нейтропении 3–4-й степени (до 34%) и периферической нейропатии 2–3-й степени (до 38%) [12, 13].
На фоне применения паклитаксела в комбинации с цисплатином отмечалась высокая частота нейтропении 3–4-й степени (до 34%) и периферической нейропатии 2–3-й степени (до 38%) [12, 13].
По сравнению с другими нозологиями терапия рака желудка несколько отставала в плане внедрения в клиническую практику таргетных препаратов. Тем не менее сегодня рак желудка является одним из заболеваний, при которых испытывают новые варианты персонализированного лечения. В последнее время появляется все больше обнадеживающих результатов, связанных с лечением этой агрессивной и рефрактерной к стандартной химиотерапии опухоли [14]. Неудовлетворительные результаты исследования бевацизумаба не перечеркнули дальнейший интерес к изучению антиангиогенной терапии при раке желудка. Следующим препаратом этой серии стал рамуцирумаб, представляющий собой антагонист фактора роста эндотелия сосудов, который связывает рецептор VEGFR-2 и блокирует лиганды рецептора VEGF-A, VEGF-C и VEGF-D.
По сравнению с плацебо монотерапия рамуцирумабом статистически значимо улучшала показатели общей выживаемости в исследовании REGARD.![]() Рамуцирумаб статистически значимо увеличивал общую выживаемость у пациентов с аденокарциномой желудка или желудочно-пищеводного соединения поздних стадий и прогрессированием заболевания после первой линии химиотерапии. Препарат снижал риск смерти от любой причины и риск прогрессирования заболевания вдвое. Преимущество рамуцирумаба по показателю выживаемости сохранялось практически во всех исследуемых группах. Влияние на общую выживаемость было несколько ниже у женщин, но расчетные значения выживаемости без прогрессирования заболевания у них были в пользу рамуцирумаба. После анализа влияния потенциальных расхождений в исходных характеристиках между лечебными группами преимущество рамуцирумаба по показателям общей выживаемости и выживаемости без прогрессирования заболевания после корректировки по другим прогностическим факторам оставалось неизменным. В данной популяции пациентов рамуцирумаб показал хорошую переносимость. При этом большинство нежелательных явлений отмечалось с одинаковой частотой в группах рамуцирумаба и плацебо.
Рамуцирумаб статистически значимо увеличивал общую выживаемость у пациентов с аденокарциномой желудка или желудочно-пищеводного соединения поздних стадий и прогрессированием заболевания после первой линии химиотерапии. Препарат снижал риск смерти от любой причины и риск прогрессирования заболевания вдвое. Преимущество рамуцирумаба по показателю выживаемости сохранялось практически во всех исследуемых группах. Влияние на общую выживаемость было несколько ниже у женщин, но расчетные значения выживаемости без прогрессирования заболевания у них были в пользу рамуцирумаба. После анализа влияния потенциальных расхождений в исходных характеристиках между лечебными группами преимущество рамуцирумаба по показателям общей выживаемости и выживаемости без прогрессирования заболевания после корректировки по другим прогностическим факторам оставалось неизменным. В данной популяции пациентов рамуцирумаб показал хорошую переносимость. При этом большинство нежелательных явлений отмечалось с одинаковой частотой в группах рамуцирумаба и плацебо. Гипертензия (нежелательное явление, ассоциируемое с большинством антиангиогенных препаратов) чаще отмечалась в группе рамуцирумаба, но гипертензия 3-й степени наблюдалась лишь у единичных пациентов, получавших рамуцирумаб. Данные о качестве жизни, согласно оценке пациентов, были скудными, однако эффект рамуцирумаба был не хуже эффекта плацебо. Кроме того, время до ухудшения оценки общего состояния оказалось статистически значимо более продолжительным у тех, кто получал рамуцирумаб [5]. Впоследствии положительными оказались результаты исследования фазы III по добавлению рамуцирумаба к паклитакселу во второй линии терапии рака желудка. Все это послужило основанием для регистрации в 2014 г. препарата для лечения больных метастатическим раком желудка [4, 15].
Гипертензия (нежелательное явление, ассоциируемое с большинством антиангиогенных препаратов) чаще отмечалась в группе рамуцирумаба, но гипертензия 3-й степени наблюдалась лишь у единичных пациентов, получавших рамуцирумаб. Данные о качестве жизни, согласно оценке пациентов, были скудными, однако эффект рамуцирумаба был не хуже эффекта плацебо. Кроме того, время до ухудшения оценки общего состояния оказалось статистически значимо более продолжительным у тех, кто получал рамуцирумаб [5]. Впоследствии положительными оказались результаты исследования фазы III по добавлению рамуцирумаба к паклитакселу во второй линии терапии рака желудка. Все это послужило основанием для регистрации в 2014 г. препарата для лечения больных метастатическим раком желудка [4, 15].
Рамуцирумаб в комбинации с еженедельным паклитакселом в отличие от других таргетных препаратов с антиангиогенным действием достоверно увеличивал число объективных ответов.
В клиническом исследовании III фазы RAINBOW эффективность и безопасность рамуцирумаба и паклитаксела сравнивали с таковыми паклитаксела и плацебо.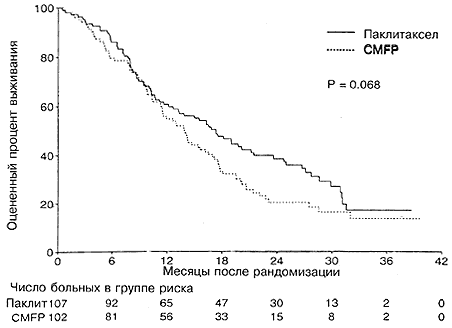 Добавление к терапии паклитакселом рамуцирумаба позволило добиться увеличения показателя средней выживаемости пациентов до 9,6 месяца. У больных, получавших паклитаксел и плацебо, средняя выживаемость составила 7,4 месяца. Кроме того, на фоне терапии рамуцирумабом и паклитакселом риск прогрессирования заболевания или смерти снизился на 37% (по сравнению с использованием паклитаксела и плацебо), выживаемость без прогрессирования увеличилась на 52% [6].
Добавление к терапии паклитакселом рамуцирумаба позволило добиться увеличения показателя средней выживаемости пациентов до 9,6 месяца. У больных, получавших паклитаксел и плацебо, средняя выживаемость составила 7,4 месяца. Кроме того, на фоне терапии рамуцирумабом и паклитакселом риск прогрессирования заболевания или смерти снизился на 37% (по сравнению с использованием паклитаксела и плацебо), выживаемость без прогрессирования увеличилась на 52% [6].
В настоящее время планируется исследование фазы III RAINFALL по применению рамуцирумаба в первой линии терапии рака желудка.
При выборе и проведении второй линии терапии метастатического рака желудка следует учитывать, что заболевание на этой стадии неизлечимо. Именно поэтому основными задачами лечения являются увеличение продолжительности жизни больных, улучшение ее качества (облегчение симптомов заболевания, профилактика и лечение осложнений терапии), сбалансированность терапевтического эффекта (в том числе выживаемости) и качества жизни.
Полученные нами данные о переносимости комбинации рамуцирумаба и паклитаксела согласуются с данными исследования RAINBOW и свидетельствуют о хорошем профиле безопасности препаратов [6]. Планируется продолжить данное исследование. Это позволит получить более полные и подробные результаты применения рамуцирумаба и паклитаксела у больных неоперабельным распространенным раком желудка во второй линии терапии.
Заключение
На основании полученных данных можно сделать вывод, что рамуцирумаб является важной составляющей лечения при аденокарциноме желудка или желудочно-пищеводного соединения поздних стадий у пациентов с прогрессированием заболевания после химиотерапии первой линии. Показано, что по механизму действия и профилю токсичности рамуцирумаб существенно отличается от стандартных режимов химиотерапии при аденокарциноме пищевода и желудка.
Полученные результаты подтверждают роль сигнальной активности VEGFR-2 как важной терапевтической мишени при аденокарциноме желудка или желудочно-пищеводного соединения поздних стадий [5].
Результаты химиотерапии первой линии метастатического рака шейки матки комбинацией цисплатина и пеметрекседа
Новости онкологии
14.10.2014
Результаты химиотерапии первой линии метастатического рака шейки матки комбинацией цисплатина и пеметрекседа
Тюляндин Сергей Алексеевич
Заслуженный деятель науки РФ, главный научный сотрудник
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России,
председатель Российского общества клинической онкологии (RUSSCO),
профессор, доктор медицинских наук,
Москва
Метастатический рак шейки матки, особенно возникший после ранее проведенного химиолучевого лечения первично локализованной опухоли, является малочувствительной к химиотерапии опухолью. За последние годы произошло лишь одно изменение в лечение рака шейки матки на этом этапе развития болезни – комбинация цисплатина и паклитаксела признана наиболее эффективной и сменила ранее широко использованную комбинацию препаратов платины и фторпиримидинов. Попытки улучшить результаты комбинции цисплатина и паклитаксела за счет использования с цисплатином гемцитабина, винорельбина или топотекана оказались неудачными [1]. Улучшение результатов комбинации цисплатина и паклитасела произошло при добавлении бевацизума [2].
Попытки улучшить результаты комбинции цисплатина и паклитаксела за счет использования с цисплатином гемцитабина, винорельбина или топотекана оказались неудачными [1]. Улучшение результатов комбинации цисплатина и паклитасела произошло при добавлении бевацизума [2].
Авторитетная американская кооперированная онкогинекологическая группа (GOG) сообщила результаты II фазы исследования комбинации цисплатина и пеметрекседа у больных с первично метастатическим раком шейки матки или с прогрессированием после ранее проведенного оперативного и/или химиолучевого лечения [3]. Больные получали цисплатин в дозе 50 мг/м2 и пеметрексед 500 мг/м2 каждые 3 недели до прогрессирования заболевания или развития серьезной токсичности.
Всего в исследование было включено 55 больных, анализ результатов проведен у 54 из них. Средний возраст больных составил 46 лет. Морфологически опухоль была представлена аденокарциномой и плоскоклеточным раком у 11 и 43 пациенток соответственно. Ранее лучевая терапия была проведена у 35 (77%) больных, из них у 27 больных совместно с химиотерапией. Режим обладал хорошей переносимостью, что позволило 26% больных получить более 9 курсов лечения. Наиболее частой токсичностью 3-4 степени была нейтропения (35%) и метаболитические нарушения (28%). Частота объективных эффектов составила 31% (1 полный и 16 частичных), медиана времени до прогрессирования и общая выживаемость составили 5,7 мес. и 12,3 мес. Все эффекты наблюдались в очагах, ранее не подвергавшихся облучению. Объективный эффект зарегистрирован у 3 (27%) больных с аденокарциномой и у 14 (33%) с плоскоклеточным раком. Частота объективного эффекта у больных, не получавших ранее химиотерапию, составила 37% и 27% у тех, кто получал цисплатин в составе химиолучевой терапии.
Ранее лучевая терапия была проведена у 35 (77%) больных, из них у 27 больных совместно с химиотерапией. Режим обладал хорошей переносимостью, что позволило 26% больных получить более 9 курсов лечения. Наиболее частой токсичностью 3-4 степени была нейтропения (35%) и метаболитические нарушения (28%). Частота объективных эффектов составила 31% (1 полный и 16 частичных), медиана времени до прогрессирования и общая выживаемость составили 5,7 мес. и 12,3 мес. Все эффекты наблюдались в очагах, ранее не подвергавшихся облучению. Объективный эффект зарегистрирован у 3 (27%) больных с аденокарциномой и у 14 (33%) с плоскоклеточным раком. Частота объективного эффекта у больных, не получавших ранее химиотерапию, составила 37% и 27% у тех, кто получал цисплатин в составе химиолучевой терапии.
Таблица 1. Результаты химиотерапии первой линии у больных метастатическим раком шейки матки.
| Комбинация | Частота объективного эффекта | Время до прогрессирования | Продолжительность жизни |
|---|---|---|---|
| GOG 204 [1] | |||
| Цисплатин+паклитаксел | 29% | 6 мес. | 13 мес. |
| Цисплатин+винорельбин | 26% | 4 мес. | 10 мес. |
| Цисплатин+гемцитабин | 22% | 5 мес. | 10 мес. |
| Цисплатин+топотекан | 23% | 5 мес. | 10 мес. |
| GOG 240 [2] | |||
| Цисплатин+паклитаксел или топотекан+паклитаксел | 36% | 5,9 мес. | 13,3 мес. |
| Цисплатин+паклитаксел+бевацизумаб | 48% | 8,2 мес. | 17 мес. |
| GOG 0076GG [3] | |||
| Цисплатин+пеметрексед | 31% | 5,7 мес. | 12,3 мес. |
Результаты проведенного исследования свидетельствуют, что комбинация цисплатина и пеметрекседа может служить одной из опций при проведении химиотерапии первой линии у больных с метастатическим раком шейки матки. Учитывая низкую токсичность комбинации, она может использоваться у больных с прогрессированием после ранее проведенной химиолучевой терапии. Именно у этих больных мы наблюдаем максимальную частоту побочных проявлений. Принимая во внимание известный синергизм пеметрекседа и бевацизумаба, оправданным выглядит использование их комбинации совместно с цисплатином для проведения первой линии и последующей поддерживающей терапии.
Учитывая низкую токсичность комбинации, она может использоваться у больных с прогрессированием после ранее проведенной химиолучевой терапии. Именно у этих больных мы наблюдаем максимальную частоту побочных проявлений. Принимая во внимание известный синергизм пеметрекседа и бевацизумаба, оправданным выглядит использование их комбинации совместно с цисплатином для проведения первой линии и последующей поддерживающей терапии.
Ключевые слова: рак шейки матки, химиотерапия первой линии, пеметрексед.
Литература:
- Miller SD, Blessing JA, Pham HQ, et al. Pemetrexed and cisplatin for the treatment of advanced, persistent, or recurrent carcinoma of the cervix: a limited access phase II trial of the Gynecologic Oncology Group. J. Clin. Oncol. 2014, 32: 2744-2749.
- Monk BJ, Sill MW, McMeekin DS, et al. Phase III trial pf four cisplatin-containing doublet combinations in stage IVb, recurrent, or persistent cervical carcinoma: a Gynecologic Oncology Group study.
 J. Clin. Oncol. 2009, 27:4649-4655.
J. Clin. Oncol. 2009, 27:4649-4655. - Trwari KS, Sill MW, Long HJ, et al. Improved survival with bevacisumab in advanced cervical cancer. N. Engl. J. Med. 2014, 370:734-743.
Актуальные аспекты применения карбоплатинав современной химиотерапии солидных опухолей
Опубликовано в журнале
«Эффективная фармакотерапия в онкологии,
гематологии и радиологии» №2/2010
А.Ю. Мащелуева, М.Е. Абрамов
Российский онкологический научный центр им. Н.Н. Блохина
В настоящее время в современной онкологии используется широкий спектр противоопухолевых препаратов. Одним из наиболее важных и часто применяемых является карбоплатин.
История открытия и развития препаратов платины начинается в 1969 году, когда американский химик Розенберг, работая с опущенными в жидкость платиновыми электродами, увидел, что находящиеся в жидкости микроорганизмы перестали делиться. Он сделал анализ и понял, что там образовалась платиновая соль, давно известное химическое соединение платины. Так появилась идея развития новых противоопухолевых препаратов на основе платины, которая получила возможность особо бурного развития в последние 20 лет, когда были созданы различные производные платины: цисплатин, циклоплатам, карбоплатин, оксалиплатин. Все эти препараты широко применяются в настоящее время в составе схем химиотерапии различных нозологий.
Он сделал анализ и понял, что там образовалась платиновая соль, давно известное химическое соединение платины. Так появилась идея развития новых противоопухолевых препаратов на основе платины, которая получила возможность особо бурного развития в последние 20 лет, когда были созданы различные производные платины: цисплатин, циклоплатам, карбоплатин, оксалиплатин. Все эти препараты широко применяются в настоящее время в составе схем химиотерапии различных нозологий.
Препараты платины имеют схожий механизм действия, основанный на образовании ковалентных связей с ДНК клеток, преимущественно с атомом азота в седьмом положении гуанина и аденина. Одна молекула карбоплатина соединяется с двумя нуклеотидами, образуя сшивку, обычно в пределах одной цепи ДНК (90%), реже – между цепями (5%). Это приводит к нарушению синтеза и функций ДНК. Цитотоксичность карбоплатина также обусловлена со связыванием с белками ядра и цитоплазмы. Действие не зависит от периода клеточного цикла [1].
Из наиболее часто встречаемых побочных эффектов можно отметить следующие. Со стороны органов желудочно-кишечного тракта – тошнота, рвота, боль в животе. Со стороны нервной системы и органов чувств возможные осложнения – периферическая полинейропатия, астения, судорожный синдром. Однако по сравнению с цисплатином нейротоксичность карбоплатина выражена в гораздо меньшей степени и встречается в 1-6% случаев. Со стороны сердечно-сосудистой системы и органов гемопоэза – миелосупрессия (наиболее часто отмечается тромбоцитопения, реже – лейкопения, нейтропения, анемия). Со стороны органов дыхания – одышка, бронхоспазм, кашель. Со стороны органов мочеполовой системы – нарушение функции почек. Со стороны кожных покровов – в редких случаях возможно развитие алопеции и аллергической реакции в виде зуда и крапивницы. Со стороны обмена веществ встречаются гипомагниемия, гипокальциемия, изменение концентрации натрия, гипокалиемия, повышение активности щелочной фосфатазы, уровня АсАТ, креатинина, общего билирубина, снижение клиренса креатинина.
До недавнего времени стандартом химиотерапии рака яичников являлась схема цисплатин + циклофосфан, но по результатам дальнейших исследований было установлено, что комбинация таксанов и цисплатина превосходит ее за счет увеличения частоты объективного эффекта (c 64% до 77%), медианы времени до прогрессирования (13 и 18 мес.) и общей выживаемости (24 и 38 мес.) соответственно [2].
Следующим этапом явилась замена цисплатина на карбоплатин ввиду выраженной нефро- и нейротоксичности, а также эметогенности первого. При сравнительном анализе было показано, что применение карбоплатина в сочетании с таксанами не ухудшало результатов лечения, но при этом наблюдалось снижение частоты и интенсивности токсических побочных эффектов [3,4].
Равная эффективность карбоплатина и цисплатина при лечении эпителиальных опухолей яичников была подтверждена в нескольких рандомизированных исследованиях, таких как Alberts (342 больных), Ten Bokkel (339 больных), Edmondson (103 больных).
Вышеизложенные факты привели к тому, что в настоящее время «золотым стандартом» лекарственного лечения рака яичников стало применение таксола и карбоплатина.
Расчет дозы карбоплатина с использованием формулы Калверта (AUC 5-7) позволяет проводить лечение с минимальной токсичностью и наибольшей эффективностью [5,6].
Возвращаясь к теме научного мониторирования применения препаратов и внедрения их в практику, нельзя не отметить, что после установления таксанов и карбоплатина в виде оптимального режима терапии рака яичников в лечении этой патологии наступило некоторое затишье, которое было нарушено исследованием GOG 182, целью которого представлялось улучшение результатов химиотерапии первой линии с помощью добавления в комбинацию паклитаксела и карбоплатина третьего препарата. Однако по-прежнему неизменной составляющей схем оставался карбоплатин.
Всего в исследование были включены 4312 больных эпителиальным раком яичников III-IV стадий после выполнения циторедуктивной операции. Схема исследования представлена в таблице 1.
Схема исследования представлена в таблице 1.
Таблица 1. Исследование GOG 182. Режимы химиотерапии.
| Группа 1 (контрольная) | Карбоплатин AUC × 6 Паклитаксел 175 мг/м2 3 часа каждые 3 недели × 8 курсов |
| Группа 2 | Карбоплатин AUC × 5 1 день Паклитаксел 175 мг/м2 3 часа 1 день Гемцитабин 800 мг/м2 1 и 8 дни каждые 3 недели × 8 курсов |
| Группа 3 | Карбоплатин AUC × 5 Паклитаксел 175 мг/м2 3 часа Доксил 30 мг/м2 каждые 3 недели × 8 курсов |
| Группа 4 | Карбоплатин AUC × 5 3 день Топотекан 1.5 мг/м2 1-3 дни каждые 3 недели 4 курса затем Карбоплатин AUC × 6 Паклитаксел 175 мг/м2 3 часа каждые 3 недели × 4 курса |
| Группа 5 | Карбоплатин AUC × 6 8 день Гемцитабин 1000 мг/м2 1 и 8 дни каждые 3 недели × 4 курса затем Карбоплатин AUC × 6 Паклитаксел 175 мг/м2 3 часа каждые 3 недели × 4 курса |
Однако в ходе исследования было показано, что добавление третьего препарата не улучшало результатов лечения и значительно усиливало гематологическую токсичность [7].
Таблица 2. Предварительные результаты исследования GOG 182.
| Группа 1 | Группа 2 | Группа 3 | Группа 4 | Группа 5 | |
|---|---|---|---|---|---|
| Время до прогрессирования | 16.1 мес. | 16.4 мес. | 16.4 мес. | 15.3 мес. | 14.4 мес. |
| Продолжительность жизни | 40.0 мес. | 40.4 мес. | 40.8 мес. | 39.1 мес. | 40.2 мес. |
| Нейтропения 4 ст. | 59 | 74 | 69 | 57 | 56 |
| Тромбоцитопения 3-4 ст. | 22 | 64 | 38 | 36 | 58 |
К такому же выводу пришли итальянские исследователи, которые в рандомизированном исследовании сравнили эффективность и токсичность комбинации карбоплатина и паклитаксела с комбинацией топотекан, карбоплатин и паклитаксел. Добавление топотекана не привело к удлинению времени до прогрессирования, но увеличило гематологическую токсичность терапии [8].
В Греции было проведено исследование, в котором добавляли доксорубицин к комбинации цисплатина и паклитаксела. Контрольная группа получала паклитаксел и карбоплатин. Медиана продолжительности составила 44 и 37 месяцев соответственно, разница статистически недостоверна. Что касается токсичности, наблюдалось увеличение степени и длительности нейтропений. Таким образом, был сделан вывод о том, что тройная комбинация не приводит к существенному улучшению результатов терапии больных опухолями яичника по сравнению со стандартной [9].
Следующим шагом на пути к усовершенствованию результатов химиотерапии рака яичников явились попытки добавления к стандарту «карбоплатин + паклитаксел» бевацизумаба – антитела к VEGF, ингибирующего ангиогенез сосудов опухоли. Так, в исследовании Cannistra et al. бевацизумаб в дозе 15 мг/кг в/в 1 раз в 3 недели назначался больным с прогрессированием после лечения топотеканом и липосомальным доксорубицином. В исследование было включено 44 пациентки, из которых у 7 (16%) отмечен объективный эффект от назначения препарата. У 5 (11%) больных отмечена острая перфорация кишечника, еще у 4 (9%) – артериальная тромбоэмболия [10].
У 5 (11%) больных отмечена острая перфорация кишечника, еще у 4 (9%) – артериальная тромбоэмболия [10].
Эти данные свидетельствуют об эффективности такой тройной комбинации, однако описанные серьезные нежелательные побочные эффекты существенно ограничивают возможность добавления бевацизумаба к терапии больных, ранее не получавших лечения. В связи с этим практически окончательно установлена ведущая роль комбинации карбоплатина и таксанов в терапии первой линии рака яичников.
Несомненно, принципиально важным применение препаратов платины, и в том числе Карбоплатина-Эбеве, остается при лечении рака яичников. Но что касается более широкого обсуждения вопроса использования карбоплатина, возможно рассмотреть его применение в лечении других видов онкопатологий. В частности, достаточно хорошие результаты получены при изучении комбинаций карбоплатина с другими препаратами в терапии немелколкеточного рака легкого.
Комбинация производных платины и таксанов в настоящее время признана стандартом терапии первой линии немелкоклеточного рака легкого. Если рассматривать вопрос о выборе конкретного производного платины, обычно применяется в комбинации с таксанами цисплатин. Однако при проведении анализа результатов лечения 1489 больных, получавших химиотерапию с включением цисплатина, и 1479 больных, получавших карбоплатин, был сделан вывод, что больным диссеминированным НМРЛ возможно назначение как цисплатина, так и карбоплатина. Частота объективного эффекта была достоверно выше в группе цисплатина – 30% и 24% соответственно. Одновременно с этим лучшая непосредственная эффективность цисплатина не привела к увеличению продолжительности жизни по сравнению с карбоплатином. При назначении цисплатина у больных чаще наблюдали тошноту, рвоту и признаки нефротоксичности, в то время как при назначении карбоплатина единственным частым проявлением токсичности была тромбоцитопения. Таким образом, можно сделать вывод о том, что включение в схему терапии диссеминированного НМРЛ карбоплатина не ухудшает отдаленные результаты, но обладает лучшей переносимостью, не оказывая отрицательного влияния тем самым на качество жизни пациентов [11,12].
Если рассматривать вопрос о выборе конкретного производного платины, обычно применяется в комбинации с таксанами цисплатин. Однако при проведении анализа результатов лечения 1489 больных, получавших химиотерапию с включением цисплатина, и 1479 больных, получавших карбоплатин, был сделан вывод, что больным диссеминированным НМРЛ возможно назначение как цисплатина, так и карбоплатина. Частота объективного эффекта была достоверно выше в группе цисплатина – 30% и 24% соответственно. Одновременно с этим лучшая непосредственная эффективность цисплатина не привела к увеличению продолжительности жизни по сравнению с карбоплатином. При назначении цисплатина у больных чаще наблюдали тошноту, рвоту и признаки нефротоксичности, в то время как при назначении карбоплатина единственным частым проявлением токсичности была тромбоцитопения. Таким образом, можно сделать вывод о том, что включение в схему терапии диссеминированного НМРЛ карбоплатина не ухудшает отдаленные результаты, но обладает лучшей переносимостью, не оказывая отрицательного влияния тем самым на качество жизни пациентов [11,12].
В другом исследовании, проведенном Eleni M. Karapanagiotou et al., обсуждалась комбинация карбоплатина и пеметрекседа в адъювантном лечении резектабельных больных со стадией IB, II и IIIA немелкоклеточного рака легкого после хирургического лечения. Был выбран следующий режим: карбоплатин AUC 5 и пеметрексед дни 1 и 14 с общей длительностью цикла 28 дней. Результатом такого исследования явилось наличие времени до прогрессирования, равного 26 месяцам, с умеренной, вполне управляемой токсичностью. На основании этого был сделан вывод, что комбинация карбоплатина и пеметрекседа не уступает в эффективности другим режимам, но имеет меньшую токсичность, что способствует более широкому внедрению ее в практику [13].
Нельзя не отметить важность и актуальность обсуждения вопроса применения карбоплатина в терапии рака молочной железы. В ряде исследований было показано, что добавление карбоплатина к терапии трастузумабом и паклитакселом в первой линии Her-2-положительного диссеминированного рака молочной железы имеет большую эффективность по сравнению с комбинацией трастузумаба и паклитаксела. При сравнении двух заданных режимов частота объективных ответов составила 53% в группе трастузумаб + паклитаксел и 62% в группе трастузумаб + паклитаксел + карбоплатин соответственно [14].
При сравнении двух заданных режимов частота объективных ответов составила 53% в группе трастузумаб + паклитаксел и 62% в группе трастузумаб + паклитаксел + карбоплатин соответственно [14].
Отдельного внимания в современной практике заслуживает тройной негативный рак молочной железы (ER, PR, HER2-отрицательный). Для этих пациентов единственным возможным вариантом лечения остается применение только химиотерапии. В настоящее время в литературе накоплены данные о том, что тройной негативный рак молочной железы имеет высокую чувствительность к платиновым агентам. Так, на ASCO 2007 были доложены результаты применения комбинации таксаны+карбоплатин у больных с исходно имевшимися метастазами, а также рецидивами тройного негативного рака молочной железы. 57% больных имели частичный эффект терапии. Среднее время до прогрессирования опухоли составило 16 недель (диапазон от 4 до 28 нед.). Эти данные предварительно свидетельствовали об эффективности карбоплатин-содержащих режимов химиотерапии в лечении тройного негативного рака молочной железы [15].
Достаточно хорошие результаты также показал еженедельный режим неоадъювантной химиотерапии рака молочной железы с включением Карбоплатина-Эбеве при невозможности применения антрациклинов [16].
Интересным можно назвать пилотное исследование по применению карбоплатина в комбинации с навельбином и интерлейкином-2 (IL-2). Известно, что меланома является опухолью, характеризующейся низкой чувствительностью к химиотерапии, а пациенты с распространенной метастатической болезнью имеют плохой прогноз. Существуют данные о том, что некоторую эффективность в лечении диссеминированной меланомы показали препараты платины и винкаалкалоиды. Интерлейкин-2, предполагалось, увеличивает чувствительность опухоли к химиотерапии. Двадцать два пациента были включены в исследование, 11 из которых имели диссеминированную меланому кожи, 6 – меланому радужной оболочки глаза и 3 – метастазы меланомы без выявленного первичного очага. В результате лечения карбоплатином, винорельбином и интерлейкином-2 1 пациент имел частичный эффект, 9 пациентов имели стабилизацию болезни в среднем 6 месяцев (диапазон от 3. 0 до 8.6 месяцев). Среднее время до прогрессирования у всех пациентов было равно 1.8 месяца (диапазон 0.7-8.6 мес.), а медиана выживаемости составила 7.2 месяца (диапазон от 1.4 до 42.0 мес.). Токсичность была умеренной, вполне управляемой и проявлялась в основном миелосупрессией. Таким образом, был сделан вывод о том, что применение карбоплатина в сочетании с винорельбином и интерлейкином-2 может быть рассмотрено в качестве химиотерапии 2 линии у пациентов с прогрессированием после лечения дакарбазином [17].
0 до 8.6 месяцев). Среднее время до прогрессирования у всех пациентов было равно 1.8 месяца (диапазон 0.7-8.6 мес.), а медиана выживаемости составила 7.2 месяца (диапазон от 1.4 до 42.0 мес.). Токсичность была умеренной, вполне управляемой и проявлялась в основном миелосупрессией. Таким образом, был сделан вывод о том, что применение карбоплатина в сочетании с винорельбином и интерлейкином-2 может быть рассмотрено в качестве химиотерапии 2 линии у пациентов с прогрессированием после лечения дакарбазином [17].
Эффективность применения карбоплатина в монотерапии была также показана в исследовании Krege et al. по лечению семиномы стадии IIA/B. В исследование было включено 108 больных с указанными стадиями заболевания. Все пациенты ранее не получали лечения по поводу семиномы. Лечение проводилось карбоплатином в дозе AUC 7 мг мин./мл каждые 4 недели в течение трех циклов при стадии IIA (n=51) или четырех циклов при стадии IIB (n=57). Пациенты, остаточная опухоль у которых была бы после лечения более 3 см, по плану должны были подвергнуться хирургическому лечению. В результате полный эффект был зарегистрирован у 88 (81%) пациентов, у 17(16%) – частичная регрессия, 2 (2%) пациента имели стабилизацию болезни, в одном случае было зарегистрировано прогрессирование. Что касается токсичности, основным видом была гематологическая токсичность III-IV степени, развитие тошноты и рвоты было отмечено лишь в 10% случаев. Несмотря на то, что при наблюдении в среднем в течение 28 месяцев у 13% больных отмечено прогрессирование заболевания (все больные имели частичный эффект при проведении терапии карбоплатином, в последующем рецидив был отмечен в забрюшинных лимфатических узлах), применение карбоплатина было признано достаточно эффективным и безопасным [18].
В результате полный эффект был зарегистрирован у 88 (81%) пациентов, у 17(16%) – частичная регрессия, 2 (2%) пациента имели стабилизацию болезни, в одном случае было зарегистрировано прогрессирование. Что касается токсичности, основным видом была гематологическая токсичность III-IV степени, развитие тошноты и рвоты было отмечено лишь в 10% случаев. Несмотря на то, что при наблюдении в среднем в течение 28 месяцев у 13% больных отмечено прогрессирование заболевания (все больные имели частичный эффект при проведении терапии карбоплатином, в последующем рецидив был отмечен в забрюшинных лимфатических узлах), применение карбоплатина было признано достаточно эффективным и безопасным [18].
Хорошее соотношение эффективности и, так сказать, приемлемой токсичности карбоплатина в сочетании с гемцитабином было продемонстрировано в многоцентровом исследовании II фазы, в которое было включено 50 больных с местно-распространенным или метастатическим раком поджелудочной железы. Режим лечения заключался во введении гемцитабина 800 мг/м2 в 1 и 8 дни и карбоплатина AUC 4 в 8 день каждого трехнедельного цикла. В среднем больные получили 6 циклов лечения. Из 35 пациентов, у которых был получен ответ на лечение, 8 (17%) имели частичный эффект, 15 (32%) и 12 (25%) имели стабилизацию и прогрессирование соответственно. При этом медиана времени до прогрессирования составила 4.4 месяца, медиана общей выживаемости – 7.4 месяца, однолетняя выживаемость составила 28%. Токсичность режима была незначительной и предсказуемой (8% анемии, 6% нейтропении и 13% тромбоцитопении). Однако необходимо отметить, что клинический эффект был выражен значительно уже после 2 циклов лечения и проявлялся в снижении интенсивности болевого синдрома и, как следствие, уменьшении количества болеутоляющих препаратов, а также в увеличении массы тела. Учитывая изложенные результаты, можно сделать вывод о целесообразности и эффективности применения карбоплатина, в том числе и Карбоплатина-Эбеве, в комбинации с гемцитабином для лечения пациентов с местно-распространенным и метастатическим раком поджелудочной железы.
Режим лечения заключался во введении гемцитабина 800 мг/м2 в 1 и 8 дни и карбоплатина AUC 4 в 8 день каждого трехнедельного цикла. В среднем больные получили 6 циклов лечения. Из 35 пациентов, у которых был получен ответ на лечение, 8 (17%) имели частичный эффект, 15 (32%) и 12 (25%) имели стабилизацию и прогрессирование соответственно. При этом медиана времени до прогрессирования составила 4.4 месяца, медиана общей выживаемости – 7.4 месяца, однолетняя выживаемость составила 28%. Токсичность режима была незначительной и предсказуемой (8% анемии, 6% нейтропении и 13% тромбоцитопении). Однако необходимо отметить, что клинический эффект был выражен значительно уже после 2 циклов лечения и проявлялся в снижении интенсивности болевого синдрома и, как следствие, уменьшении количества болеутоляющих препаратов, а также в увеличении массы тела. Учитывая изложенные результаты, можно сделать вывод о целесообразности и эффективности применения карбоплатина, в том числе и Карбоплатина-Эбеве, в комбинации с гемцитабином для лечения пациентов с местно-распространенным и метастатическим раком поджелудочной железы. При этом снова стоит отметить, что описанный режим имеет приемлемый профиль токсичности, что, в свою очередь, также имеет принципиальное значение для дальнейшего использования его в практике [19]. Достаточно высокую эффективность и хорошую переносимость также демонстрирует карбоплатин в сочетании с паклитакселом в лечении больных раком пищевода [20], в той же комбинации при лечении карциносаркомы матки [21], в сочетании с ралтитрекседом в терапии метастатического плоскоклеточного рака головы и шеи [22].
При этом снова стоит отметить, что описанный режим имеет приемлемый профиль токсичности, что, в свою очередь, также имеет принципиальное значение для дальнейшего использования его в практике [19]. Достаточно высокую эффективность и хорошую переносимость также демонстрирует карбоплатин в сочетании с паклитакселом в лечении больных раком пищевода [20], в той же комбинации при лечении карциносаркомы матки [21], в сочетании с ралтитрекседом в терапии метастатического плоскоклеточного рака головы и шеи [22].
В онкоофтальмологической практике хорошо зарекомендовал себя карбоплатин в лечении ретинобластомы [23].
Таким образом, подводя итог вышесказанному, необходимо сделать вывод о том, что опыт применения карбоплатина, как зарубежный, так и отечественный, достаточно велик, описанные моменты являются лишь некоторыми примерами успешных клинических испытаний. В дополнение можно сказать, что карбоплатин, в том числе и Карбоплатин-Эбеве, как представитель «семейства» препаратов платины, в настоящее время широко и успешно применяется для лечения различных онкопатологий.![]() Продолжаются исследования по включению карбоплатина в состав новых комбинаций.
Продолжаются исследования по включению карбоплатина в состав новых комбинаций.
Список литературы
- E. Chu, Vincent T. DeVita, Jr. Chemotherapy drug manual. 2007 by Jones and Bartlett Publishers.
- McGuire WP, Hoskins WJ, Brady MF et al. Cyclophosphamide and cisplatin compared with paclitaxel and cisplatin in patients with stage III and IV ovarian Cancer. N Engl J Med. 1996; 334: 1-6.
- Ozols, RF, Bundy BN, Fowler J et al. Randomized phase III study of cisplatin/paclitaxel versus carboplatin/paclitaxel in optimal stage III epithelial ovarian cancer: a Gynecologic Oncology Group Trial (GOG 158). In: Program and abstracts of the American Society of Clinical Oncology 35th Annual Meeting; May 15-18, 1999; Atlanta, Georgia. Abstract 1373.
- Lokich J, Anderson N. Carboplatin versus cisplatin in solid tumors: An analysis of the literature. Ann. Onc., Jan 1998; 9: 13-21.
- Alberts DS, Green S, Hannigan EV et al. J Clin Oncol, 1992, 10: 716-720.

- Swenerton K, Jeffrey J, Stuart G et al. J Clin Oncol, 1992, 10: 718-722.
- Bookman MA. GOG0182-ICON5: 5-arm phase III randomized trial of paclitaxel (P) and carboplatin (C) vs combinations with gemcitabine (G), PEG-lipososomal doxorubicin (D), or topotecan (T) in patients (pts) with advanced-stage epithelial ovarian (EOC) or primary peritoneal (PPC) carcinoma. Proc Am Soc Clin Oncol. 2006; 24:256s. Abstract 5002.
- Scarfone G, Scambia G, Raspagliesi F et al. A multicenter, randomized, phase III study comparing paclitaxel/carboplatin (PC) versus topotecan/paclitaxel/carboplatin (TPC) in patients with stage III (residual tumor > 1 cm after primary surgery) and IV ovarian cancer (OC). Proc Am Soc Clin Oncol. 2006; 24:256s. Abstract 5003.
- Aravantinos G, Fountzilas G, Kalofonos HP. Carboplatin and paclitaxel versus cisplatin, paclitaxel and doxorubicin for frontline chemotherapy of advanced ovarian carcinoma (AOC): A Hellenic Cooperative Oncology Group Study.
 Proc Am Soc Clin Oncol. 2006; 24:274s. Abstract 5074.
Proc Am Soc Clin Oncol. 2006; 24:274s. Abstract 5074. - Cannistra SA, Matulonis U, Penson R et al. Bevacizumab in patients with advanced platinum-resistant ovarian cancer. Proc Am Soc Clin Oncol. 2006; 24:257s. Abstract 5006.
- Ardizzoni A, Tiseo M, Boni L et al. CISCA (cisplatin vs. carboplatin) meta-analysis: an individual patient data meta-analysis comparing cisplatin versus carboplatin-based chemotherapy in first-line treatment of advanced non-small cell lung cancer. Proc Am Soc Clin Oncol. 2006; 24:366s. Abstract 7011.
- Treat JA, Gonin R, Socinski MA, Edelman MJ et al. A randomized, phase III multicenter trial of gemcitabine in combination with carboplatin or paclitaxel versus paclitaxel plus carboplatin in patients with advanced or metastatic non-small-cell lung cancer. Ann. Onc., Mar 2010; 21: 540-547.
- Eleni M. Karapanagiotou, Paraskevi G. Boura et al. Carboplatin-Pemetrexed Adjuvant Chemotherapy in Resected Non-small Cell Lung Cancer (NSCLC): A Phase II Study.
 Anticancer Res, Oct 2009; 29: 4297-4301.
Anticancer Res, Oct 2009; 29: 4297-4301. - Edith A. Perez. Carboplatin in Combination Therapy for Metastatic Breast Cancer. Oncologist, Sep 2004; 9: 518-527.-
- Chia JW, Ang P, See H, Wong Z, Soh L, Yap Y, Wong N. Triple-negative metastatic/recurrent breast cancer: Treatment with paclitaxel/carboplatin combination chemotherapy. ASCO Meeting Abstracts, Jun 2007; 25: 1086.
- Chen XS, Nie XQ, Chen CM, Wu JY, Wu J, Lu JS, Shao ZM, Shen ZZ, Shen KW. Weekly paclitaxel plus carboplatin is an effective nonanthracycline-containing regimen as neoadjuvant chemotherapy for breast cancer. Ann. Onc., May 2010; 21: 961-967.
- Vuoristo MS, Vihinen P, Skytta T, Tyynela K, Kellokumpu-Lehtinen P. Carboplatin and Vinorelbine Combined with Subcutaneous Interleukin-2 in Metastatic Melanoma with Poor Prognosis. Anticancer Res, May 2009; 29: 1755-1759.
- Krege S, Boergermann C, Baschek R, Hinke A, Pottek T, Kliesch S, Dieckmann K.-P., Albers P, Knutzen B, Weinknecht S, Schmoll H.
 -J., Beyer J, Ruebben H. Single agent carboplatin for CS IIA/B testicular seminoma. A phase II study of the German Testicular Cancer Study Group (GTCSG). Ann. Onc., Feb 2006; 17: 276-280.
-J., Beyer J, Ruebben H. Single agent carboplatin for CS IIA/B testicular seminoma. A phase II study of the German Testicular Cancer Study Group (GTCSG). Ann. Onc., Feb 2006; 17: 276-280. - Xiros N, Papacostas P, Economopoulos T, Samelis G, Efstathiou E, Kastritis E, Kalofonos H, Onyenadum A, Skarlos D, Bamias A, Gogas H, Bafaloukos D, Samantas E, Kosmidis P. Carboplatin plus gemcitabine in patients with inoperable or metastatic pancreatic cancer: a phase II multicenter study by the Hellenic Cooperative Oncology Group. Ann. Onc., May 2005; 16: 773-779.
- El-Rayes BF, Shields A, Zalupski M, Heilbrun LK, Jain V, Terry D, Ferris A, Philip PA. A phase II study of carboplatin and paclitaxel in esophageal cancer. Ann. Onc., Jun 2004; 15: 960-965.
- Powell MA, Filiaci VL, Rose PG, Mannel RS, Hanjani P, DeGeest K, Miller BE, Susumu N, Ueland FR. Phase II Evaluation of Paclitaxel and Carboplatin in the Treatment of Carcinosarcoma of the Uterus: A Gynecologic Oncology Group Study.
 J. Clin. Oncol., Jun 2010; 28: 2727-2731.
J. Clin. Oncol., Jun 2010; 28: 2727-2731. - Galetta D, Giotta F et al. Carboplatin in Combination with Raltitrexed in Recurrent and Metastatic Head and Neck Squamous Cell Carcinoma: A Multicentre Phase II Study of the Gruppo Oncologico Dell’Italia Meridionale (G.O.I.M.). Anticancer Res, Nov 2005; 25: 4445-4449.
- Leng T, Cebulla CM, Schefler AC, Murray TG. Focal periocular carboplatin chemotherapy avoids systemic chemotherapy for unilateral, progressive retinoblastoma. Retina, Apr 2010; 30(4 Suppl): S66-8.
Опубликован обзор эволюции терапии Her2 позитивного рака молочной железы
Her2 позитивный рак молочной железы 20 лет назад считался плохо поддающимся лечению. В настоящее время большинство пациенток с подобным диагнозом может быть вылечено. Об эволюции терапии этого вида рака содержательно рассказывает заведующий отделением химиотерапии Даниил Львович Строяковский.
Рак молочной железы – это несколько различных заболеваний, объединенных общей локализацией первичной опухоли.
Одним из наиболее распространенных и изученных вариантов является Her2 позитивный вариант. Он составляет 18-20% от всего рака молочной железы. Например: если в г. Москве в год заболевает РМЖ ~ 7000 женщин, то значит Her2 позитивных среди них ~ 1250 женщин. Причем, наиболее часто данный вариант опухоли встречается у женщин младше 50 лет (но может быть в любом возрасте).
По данным одного из Американских регистров если разделить женщин с РМЖ по возрасту, то 45% — женщины младше 50 лет, 29% — женщины от 50 до 60 лет, 26% старше 60 лет. Среди женщин старше 50 лет у более чем 75% опухоль гормонопозитивная (ER+, PR+/-). Соответственно младше 50 лет, существенно чаще встречается Her2 позитивный, гормононегативный вариант и трижды-негативный варианты. Это наиболее агрессивные подтипы.
Среди Her2 позитивного рака молочной железы у ~ 40% Эстрогеновые и Прогестероновые рецепторы отрицательные (ER-, PR-), соответственно у 60% опухоль гормонопозитивная (и Her2 позитивная).
Таким образом, есть 2 подтипа Her2 позитивного рака: люминальный В, Her2 позитивный (ER+, PR+/-, Her2 положительный) и нелюминальный Her2 позитивный (ER-, PR, Her2 положительный).
Что такое Her2 позитивность?
На 17 хромосоме есть участок ДНК, который кодирует наличие рецептора Her2 на поверхности клеток. Этот рецептор существует в норме на поверхности большинства эпителиальных клеток. При раке молочной железы, у части пациенток (~18%), на 17 хромосоме, данный участок ДНК начинает повторяться многократно (амплификация), то есть вместо 1 гена Her2 на каждой из 2-х хромосом (от папы и мамы), этих генов становится очень много. Соответственно происходит многократно бОльшая частота считывания этого гена, и это приводит к тому, что количество рецепторов Her2 на поверхности опухолевых клеток становится многократно больше, чем в норме (гиперэкпрессия). Эти рецепторы, как «антенны» торчат из мембраны опухолевых клеток, и начинают слипаться с другими такими «антеннами» (Her2), также могут слипаться с соседними другими «антеннами» Her1, Her3, Her4. Это приводит к генерации сигнала внутрь ядра опухолевой клетки – «плодись и метастазируй».
Это приводит к генерации сигнала внутрь ядра опухолевой клетки – «плодись и метастазируй».
Чтобы определить, если ли Her2 гиперэкпрессия на поверхности опухолевых клеток проводят исследование: иммуногистохимия (ИГХ)
Могут быть 4 варианта иммуногистохимического проявления Her2 на поверхности опухолевых клеток: варианты ответов
У большинства Her2 позитивных опухолей, с помощью ИГХ удается сразу установить Her2 позитивность, то есть ответ Her2 3+.
Но, у около 10% пациенток ИГХ экспрессия не дотягивает для HER2 3+, и врач получает ответ Her2 2+. В этом случае выполняется исследование FISH (флуоресцентная ин ситу гибридизация). Но даже в этом случае, не всегда удается до конца точно установить Her2 статус, так как иногда повтора гена бывает мало (амплификация низкой степени). Иногда опухоль неоднородная, то есть в части опухолевых клеток есть выраженная амплификация гена Her2, а в части ее нет. Это сложные случаи для трактовки. Поэтому каждые 3-5 лет происходят уточнения и дополнения к руководству по трактовке Her2 позитивности. Надо сказать, что заложенная ошибка метода (в очень качественной лаборатории) составляет в районе 5%, то есть, если в г. Москве 7000 женщинам проводится ИГХ исследование, для уточнения биологического типа рака молочной железы в год, ошибка существует как минимум у 350 женщин в ту или иную сторону.
Это сложные случаи для трактовки. Поэтому каждые 3-5 лет происходят уточнения и дополнения к руководству по трактовке Her2 позитивности. Надо сказать, что заложенная ошибка метода (в очень качественной лаборатории) составляет в районе 5%, то есть, если в г. Москве 7000 женщинам проводится ИГХ исследование, для уточнения биологического типа рака молочной железы в год, ошибка существует как минимум у 350 женщин в ту или иную сторону.
Хуже, когда Her2 позитивная опухоль была определена, как Her2 негативная – это означает, что пациентка не получает должного лечения. Если же Her2 негативная опухоль диагностирована как Her2 позитивная, то в этом случае женщина получает избыточное таргетное лечение, но так как токсичность данного лечения в целом мала, на мой взгляд от этого меньше вреда. На самом деле, частота ошибок в рутинном определении Her2 статуса намного больше, чем 5% (сколько я не знаю), поэтому так важно, чтобы Онкопатологические лаборатории были, по настоящему, высококачественные.
Эта форма опухоли – Her2 позитивный рак молочной железы важна тем, что еще 15-20 лет назад считалась наиболее агрессивной и летальной, среди всех вариантов РМЖ. Однако в настоящее время, благодаря интеграции таргетной терапии, стала самой курабильной (излечимой).
Основные таргетные препараты для Her2 позитивного РМЖ:
1. Трастузумаб — моноклональное антитело к рецептору Her2 на поверхности опухолевых клеток
2. Лапатиниб (малая молекула) – внутриклеточный ингибитор Her2 рецептора. Her2 как бы прошивает насквозь мембрану опухолевой клетки и у него есть внутриклеточная часть
3. Пертузумаб — моноклональное антитело к поверхности рецептора Her2, но присоединяется в другой точке чем Трастузумаб и мешает склеиванию рецепторов семейства Her (Her1, Her2, Her3, Her4). Пертузумаб эффективен только с Трастузумабом или Трастузумаб-Эмтанзином
4. Трастузумаб-Эмтанзин — это сложная молекула: Трастузумаб соединен с очень сильным цитостатиком. Опухолевая клетка, пытаясь избавится от Трастузумаба, как бы его «съедает» погружает часть мембраны с ним внутрь себя в виде вакуоли, затем разрушает эту вакуоль, и тут освободившийся сильный цитостатик разрушает опухолевую клетку изнутри – этакий «Троянский конь».
Опухолевая клетка, пытаясь избавится от Трастузумаба, как бы его «съедает» погружает часть мембраны с ним внутрь себя в виде вакуоли, затем разрушает эту вакуоль, и тут освободившийся сильный цитостатик разрушает опухолевую клетку изнутри – этакий «Троянский конь».
История создания препаратов анти-Her2 направленности существует около 25 лет. В 1998 году в США был зарегистрирован препарат Трастузумаб в комбинации с химиотерапией в качестве 1-ой линии лечения метастатического рака молочной железы (то есть паллиативное противоопухолевое лечение женщин с впервые выявленными метастазами).
Было проведено клиническое исследование: пациенток с впервые выявленными метастазами Her2 позитивного РМЖ делили на 2 группы: половина получала химиотерапию (или Доксорубицин-содержащую или Паклитаксел- содержащую), половина такую же химиотерапию + Трастузумаб. Средняя продолжительность жизни (Общая Выживаемость (ОВ)) составила в контрольной группе 20 месяцев (чуть более 1,5 лет), а группе с Трастузумабом 25 месяцев (более 2-х лет). На тот момент, результаты этого исследования выглядели значительным, но все-таки эволюционным шагом в лечении метастатического рака молочной железы. Разница в продолжительности жизни в 5 месяцев была не очень впечатляющая, но удалось впервые перешагнуть 2 года в средней продолжительности жизни в этой когорте пациенток. В реальной клинической практике, всего 20 лет назад половина женщин с метастазами Her2 позитивного рака молочной железы умирали в районе полутора лет. В основном метастазы поражали печень, легкие, кости.
На тот момент, результаты этого исследования выглядели значительным, но все-таки эволюционным шагом в лечении метастатического рака молочной железы. Разница в продолжительности жизни в 5 месяцев была не очень впечатляющая, но удалось впервые перешагнуть 2 года в средней продолжительности жизни в этой когорте пациенток. В реальной клинической практике, всего 20 лет назад половина женщин с метастазами Her2 позитивного рака молочной железы умирали в районе полутора лет. В основном метастазы поражали печень, легкие, кости.
У женщин с гормонопозитивным и Her2 позитивным РМЖ гормонотерапия была не эффективна, и только химиотерапия давала короткий эффект. Причем в странах Запада, пациенткам были доступны помимо Доксорубицина, также Таксаны (Паклитаксел и Доцетаксел с середины 90х годов, затем Капецитабин, Винорелбин, Платина, Гемцитабин). В нашей стране, в то время мы могли использовать только Доксорубицин и Циклофосфан, а также другие «старые» цитостатики. Таксанов, Капецитабина, Винорелбина, Гемцитабина практически не было, тем более Трастузумаба (его стоимость на 1 цикл терапии была в районе 3000$). Соответственно картина течения болезни была удручающая для большинства пациенток.
Таксанов, Капецитабина, Винорелбина, Гемцитабина практически не было, тем более Трастузумаба (его стоимость на 1 цикл терапии была в районе 3000$). Соответственно картина течения болезни была удручающая для большинства пациенток.
Революционным и поворотным моментом лечения Her2 позитивного рака молочной железы явилось 15 мая 2005 года, когда на конференции ASCO в Орландо были доложены результаты исследований адъювантной терапии Her2 позитивного рака молочной железы.
Адъювантная терапия – это терапия, которая применяется после хирургического лечения (операция по удалению первичной опухоли: или Мастэктомия, или Радикальная секторальная резекция), для снижения риска прогрессирования заболевания, у больных I, II, III стадиями (в основном с II и III стадиями). Хорошо известно, что на момент операции, когда стадия рака не IVя, у большинства пациенток имеются микрометастазы, которые могут быть, где угодно. Эти микрометастазы никак себя не проявляют и их невозможно определить никакими методами (УЗИ, Рентген, КТ, МРТ, ПЭТ-КТ, скенирование, анализы крови и т. д.). Но из этих микрометастазов, в последствии, разовьются макрометастазы, которые и переведут болезнь в неизлечимую фазу. При наличии отдаленных метастазов, неважно, которые были выявлены сразу (в дебюте заболевания) или после радикальной операции, на сегодня болезнь (метастатический рак молочной железы) считается не излечимой. Поэтому задача адъювантной терапии — убить микрометастазы (где бы они не находились) и тем самым излечить как можно больше пациенток. Минусом адъювантной (профилактической) терапии является тот факт, что, когда ее проводишь, ты не знаешь: кому конкретно она помогает. Это лечение не самого пациента, а его риска. Тем не менее адъювантная лекарственная терапия локальных форм рака молочной железы (I-III стадий) является одним из самых необходимых этапов лечения. Важно разумно и правильно объяснить риски, потенциальную пользу и возможные осложнения лечения. Очень важно выбрать научно обоснованную и наиболее эффективную программу, с наименьшим токсическим профилем.
д.). Но из этих микрометастазов, в последствии, разовьются макрометастазы, которые и переведут болезнь в неизлечимую фазу. При наличии отдаленных метастазов, неважно, которые были выявлены сразу (в дебюте заболевания) или после радикальной операции, на сегодня болезнь (метастатический рак молочной железы) считается не излечимой. Поэтому задача адъювантной терапии — убить микрометастазы (где бы они не находились) и тем самым излечить как можно больше пациенток. Минусом адъювантной (профилактической) терапии является тот факт, что, когда ее проводишь, ты не знаешь: кому конкретно она помогает. Это лечение не самого пациента, а его риска. Тем не менее адъювантная лекарственная терапия локальных форм рака молочной железы (I-III стадий) является одним из самых необходимых этапов лечения. Важно разумно и правильно объяснить риски, потенциальную пользу и возможные осложнения лечения. Очень важно выбрать научно обоснованную и наиболее эффективную программу, с наименьшим токсическим профилем.
Итак, 15 мая 2005 года на конференции ASCO в Орландо были доложены 2 Late Breaking Abstracts: результат Европейского исследования HERA (в котором, в том числе принимали участие и Российские исследователи) и объединенный анализ 2-х Американских исследований, посвященных добавлению Трастузумаба к адъювантной химиотерапии при I-III стадиях Her2 позитивного РМЖ.
Я прекрасно помню этот день, предварительные результаты были засекречены, была только информация, что исследования прошли успешно. В зале, где проходил доклад было вероятно несколько десятков тысяч человек (подобного количества я больше ни разу не видел) – это отражает огромную роль рака молочной железы, среди онкологических заболеваний. Врачи со всего мира очень плотно стояли друг рядом с другом и была фантастическая тишина, боялись пропустить хоть одно слово. Я тоже был в зале, вместе с русскими коллегами, мы слушали затаив дыхание. Результаты оказались ярче, чем все наши самые оптимистические предположения. В исследовании HERA, где контингент пациенток был несколько менее запущен (было больше I и II стадий) добавление Трастузумаба привело к уменьшению числа прогрессирующих в первые 3 года в половину. Но самое больше впечатление произвели объединенные результаты 2-х американских исследований (в основном II и III стадии), где к антрациклин и паклитаксел- содержащему режиму химиотерапии (на тот момент уже стандарт в США, мы еще и близко не могли так делать), был добавлен Трастузумаб. В 2-х исследованиях участвовали 3351 женщина. В группе без Трастузумаба в ближайшие 4 года после операции прогрессирование наблюдалось в среднем у 33% пациенток, тогда как в группе с Трастузумабом прогрессирование было только у 15%. Риск смерти от рака молочной железы снизился с 14% до 8%.
В 2-х исследованиях участвовали 3351 женщина. В группе без Трастузумаба в ближайшие 4 года после операции прогрессирование наблюдалось в среднем у 33% пациенток, тогда как в группе с Трастузумабом прогрессирование было только у 15%. Риск смерти от рака молочной железы снизился с 14% до 8%.
Если перевести это в понятные цифры, то арифметика следующая: возьмем 100 женщин с Her2 позитивным раком молочной железы с II или III стадией, после радикальной операции. Среди 100 женщин, которым будет проведена адъювантная химиотерапия Доксорубицин и Циклофосфан, затем Паклитаксел, у 33 из них проявятся метастазы рака молочной железы (и этих женщин вылечить уже не возможно, их лечение паллиативное) и 14 из них уже погибнет от этой формы рака. Если этим же женщинам, к той же самой терапии добавить Трастузумаб 1 год, то через 4 года метастазы разовьются только 15 из них, и погибнет от рака 8 женщин.
Результаты исследований адъювантной терапии Her2 позитивного рака молочной железы, кардинально изменили действующую практику, в контексте профилактического лечения. Тогда (в мае 2005 года) мы стояли в восхищении с одной стороны, и удручены с другой стороны – потому что Трастузумаб был нам недоступен (он был в стране, но его стоимость была фактически запретительной для применения). Ситуацию удалось изменить, только на рубеже 2009-11 годов. С 2012 года, в Москве практически все пациентки с Her2 позитивным раком уже были обеспечены Трастузумабом. К этому времени, также удалось полностью обеспечить всех нуждающих пациенток Таксанами, благодаря выходу генериков Паклитаксела на наш рынок.
Тогда (в мае 2005 года) мы стояли в восхищении с одной стороны, и удручены с другой стороны – потому что Трастузумаб был нам недоступен (он был в стране, но его стоимость была фактически запретительной для применения). Ситуацию удалось изменить, только на рубеже 2009-11 годов. С 2012 года, в Москве практически все пациентки с Her2 позитивным раком уже были обеспечены Трастузумабом. К этому времени, также удалось полностью обеспечить всех нуждающих пациенток Таксанами, благодаря выходу генериков Паклитаксела на наш рынок.
Следующим этапом использования таргетной терапии при Her2 позитивном РМЖ стало его применение в плане неоадъювантной терапии.
Неоадъювантная терапия – это терапия при локальных стадиях (I-III), которая проводится перед операцией. Основной целью данной терапии является оценить эффективность лекарственного лечения непосредственно на первичную опухоль и метастазы в локорегионарные лимфоузлы, постараться ее уменьшить. В некоторых случаях это позволит сделать органосохранную операцию.![]() При агрессивных подтипах рака молочной железы (Her2 позитивном и Трижды-негативном) на неоадъювантной химиотерапии у значительной части пациенток удается добиться полного морфологического регресса опухоли (полный лечебный патоморфоз – рCR). Полный лечебный патоморфоз оцениваться по результатам гистологического исследования, после удаления первичной опухоли и подмышечных л/у. Если рCR достигнут, то это является суррогатом элиминации микрометастазов рака у подавляющего числа пациенток. У тех же, у кого не удалось добиться pCR – это значит, что имеется относительно высокая вероятность сохранения микрометастазов, из которых, через какое-то время, вырастут метастазы и уже болезнь нельзя будет вылечить (или почти нельзя вылечить).
При агрессивных подтипах рака молочной железы (Her2 позитивном и Трижды-негативном) на неоадъювантной химиотерапии у значительной части пациенток удается добиться полного морфологического регресса опухоли (полный лечебный патоморфоз – рCR). Полный лечебный патоморфоз оцениваться по результатам гистологического исследования, после удаления первичной опухоли и подмышечных л/у. Если рCR достигнут, то это является суррогатом элиминации микрометастазов рака у подавляющего числа пациенток. У тех же, у кого не удалось добиться pCR – это значит, что имеется относительно высокая вероятность сохранения микрометастазов, из которых, через какое-то время, вырастут метастазы и уже болезнь нельзя будет вылечить (или почти нельзя вылечить).
Отсутствие рCR – ведет к необходимости разработки стратегии послеоперационной терапии, которая снизит риск прогрессирования. Критерием pCR является отсутствие опухолевых клеток (за исключение возможного наличия клеток рака in situ) в области, где ранее находилась первичная опухоль и в подмышечных л/у (ypT0(or in situ)ypN0).
При Her2 позитивном подтипе, у больных с II и III стадией рака неоадъювантная терапия стала основным подходом к лечению за последние 10 лет.
Вариантами химиотерапии являются: антрациклин + таксан-содержащие схемы (например: 4 Доцетаксел 75/3 недели или 12 Паклитаксел 80/ежененедельно, затем 4 АС (FAC, FEC, EC) или Доцетаксел 75 + Карбоплатин AUC6 каждые 3 недели — 6 циклов). К этой терапии должен быть добавлен Трастузумаб (как минимум).
Достижение полного лечебного патоморфоза (pCR) выражается в повышении выживаемости без прогрессирования (EFS — event free survival или DFS disease free survival). Выживаемость без прогрессирования отражает тенденцию к повышению общей выживаемости (OS – overall survival).
Таким образом, основная цель неоадъювантной терапии – достижение pCR.
Вероятность достижения pCR у больных c Her2+, которые получают только химиотерапию – без Трастузумаба или иных вариантов таргетной терапии следующая (метаанализ Cortazar – это очень большой анализ клинических исследований в области неоадъювантной терапии РМЖ):
Гормонопозитивные (HR+) ~ 18,3% (15-21%)
Гормононегативные (HR-) ~ 30,2% (26-34%)
Вероятность достижения pCR у больных с Her2+, которые получают химиотерапию + Трастузумаб (Метаанализ Cortazar):
Гормонопозитивные (HR+) ~ 30,9% (26-36%)
Гормононегативные (HR-) ~ 50,3% (45–55%)
Таким образом, добавление Трастузумаба к стандартной неоадъювантной химиотерапии повышает вероятность достижения pCR в среднем на 60%.
Например: исследование HANNAH. В этом исследовании все пациентки с II и III стадиями Her2 позитивного рака молочной железы получили одинаковую химиотерапию и таргетную терапию (половина в/в Трастузумаб, половина подкожный Трастузумаб). По сути, у всех почти 600 пациенток была одинаковая терапия, разница была лишь в варианте введения таргетного препарата (внутривенно или подкожно). Схема лечения: 4Доцетаксел 75/кв.м. + Трастузумаб каждые 3 недели, затем 4 F(500)E(75)C(500) + Трастузумаб, каждые 3 недели, затем операция, затем Трастузумаб еще 10 введений +/- адъювантная лучевая терапия (если есть повышенный риск локального рецидива) + гормонотерапия (у гормонопозитивных (HR+)). Дизайн данного исследования стал эталонным для дальнейших исследований по неоадъювантной терапии Her2 позитивного РМЖ с препаратами биоаналогами Трастузумаба. 591 оцененная пациентка.
Из данных исследования HANNAH следует, что достижение полного лечебного патоморфоза pCR приводит 20% разнице в 3-х летней бессобытийной выживаемости (EFS) и приблизительно 27% разнице в 6-ти летней бессобытийной выживаемости (EFS). Имеется 10% разница в 6-ти летней общей выживаемости (OS): то есть достижение рCR снижает риск смерти у каждой десятой пациентки за 6 лет.
Пациентки с гормонозависимым раком (HR+), Her2 позитивным имеют меньшую вероятность достижения рCR почти в 2 раза: 23,5% против 45,3%.
Но, если pCR был достигнут — бессобытийная выживаемость лучше, чем у HR- на 9-10%. Если pCR не был достигнут, то при HR+ 3-х и 6-ти летняя выживаемость лучше, чем у HR- на 11 и 13% соответственно.
С 3-го до 6-го года риск прогрессирования у тех, у кого был достигнут pCR составляет 5-6% за 3 года (то есть около 2% в год).
С 3-го до 6-го года риск прогрессирования у тех, у кого не был достигнут рCR составляет 11-13% за 3 года (то есть около 4% в год).
Выводы:
- полностью подтверждается необходимость достижения pCR как суррогата длительного ответа.
- вероятность pCR выше у HR- негативных пациенток
- у пациенток с гормонопозитивным (HR+) и Her2 позитивным РМЖ, 3-х и 6-ти летняя EFS выше. Применение адъювантной гормонотерапии и меньшая биологическая агрессивность улучшает результаты.
Следующий этап: Двойная Her2 блокада (Трастузумаб + Пертузумаб) приводит еще большему повышению вероятности pCR и, как следствие, повышает вероятность бессобытийной выживаемости (EFS).
Исследование KRISTINE III Фазы.
В этом исследовании пациентки с II и III стадиями HER позитивного РМЖ были рандомизированы в 2 группы по 220 пациенток:
- 1 группа: ТСНР (Доцетаксел 75/кв.м + Карбоплатин AUC 6 + Трастузумаб (стандартная доза 6 мг/кг веса, 1-ое введение 8 мг/кг веса) + Пертузумаб (стандартная доза – 420 мг, 1-ое введение 840 мг), каждые 3 недели 6 циклов. Затем операция. Затем Трастузумаб + Пертузумаб до 1 года суммарно (12 циклов). Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования.
- 2 группа: 6 циклов TD-M1 (Трастузумаб-Эмтанзин) + Р (Пертузумаб). Затем операция, затем ещё 12 циклов Трастузумаб -Эмтанзин + Пертузумаб, каждые 3 недели. Гормонотерапия у гормонопозитивных и лучевая терапия если есть факторы риска локального прогрессирования. Аббревиатура группы (TD-M1 – P).
pCR в группе ТСНР был достигнут у 55% пациенток, HR- 73%, HR+ 44%.
pCR в группе T-DM1+P был достигнут у 44% пациенток, HR- 54%, HR+ 35%.
В группе T-DM1+P: 6% пациенток спрогрессировали до операции, в основном с HER2 гетерогенной опухолью, в группе ТСНР никто не прогрессировал на фоне неоадъювантной терапии (удивительный непосредственный результат).
Лучшая группа: ТСНР 221 пациентка
3 летняя EFS на всю группу 94%
3 летняя IDFS (этот показатель близок к EFS) в группе pCR 97,5%
3 летняя IDFS (близок к EFS) в группе non pCR 84%
Выживаемость:
Итак, варианты неоадъювантной терапии и их эффективность в 2-х таблицах:
Следует отметить, что те пациентки, которые получают адъювантную терапию с III стадией, и те, кто получают неоадъювантную терапию при III стадии – это не одинаковые пациентки. Пациентки, с III стадией, которых можно прооперировать радикально – это с клинически (с)T3N1 по местному статусу – «начальная» IIIА стадия. Эти пациентки 90-е и 2000-е годы рассматривались, как первично-операбильные по первичной опухоли. Тогда, как пациентки с III В и III С стадиями (сN2-3 или все варианты сТ4) всегда рассматривались как первично неоперабильные. Эти пациентки практически не включались в адъювантные исследования. Эти пациентки практически всегда начинали лечение с предоперационной химиотерапии (неоадъювантной).
Соответственно в группе с неоадъювантной терапией всегда результаты несколько хуже, чем с адъювантной терапией, независимо от той терапии, которые пациентки получают. Даже если терапия одинаковая. Например, в 2-х американских исследованиях адъювантной терапии 3-х летняя выживаемость без прогрессирования (DFS) с Антрациклины + Таксаны + Трастузумабом – 87%. При использовании точно такой же терапии в неоадъюванте (Антрациклины + Таксаны + Трастузумаб) – 3-х летняя выживаемость без прогрессирования – 75% (на всю группу, независимо от pCR). Просто – это разные по распространенности опухоли.
Как быть с пациентками, у которых при применении неоадъювантной терапии не был достигнут полный лечебный патоморфоз (pCR). Прогноз данных пациенток существенно хуже – так как у многих из них сохраняются микрометастазы, которые в дальнейшем дадут макрометастазы.
Исследование KATНERINЕ:
В это исследование были включены, пациентки, которые получали неоадъювантную терапию с Трастузумабом, по поводу Her2 позитивного рака молочной железы с I-III стадиями, и у которых не был достигнут pCR на неоадъювантной фазе лечения. Пациентки были разделены на 2 группы: стандартная группа – Трастузумаб 14 циклов и экспериментальная Трастузумаб-Эмтанзин 14 циклов.
По результатам данного исследования, основной параметр данного исследования отражающий эффективность – invasive disease free survival (выживаемость без инвазивного прогрессирования – параметр близкий к event free survival — EFS) составил 88,3% к 3-м годам в группе Трастузумаб-Эмтанзин, в сравнении с 77% в группе Трастузумаба. В переводе на русский это означает, что в группе с Трастузумабом, у тех, у кого не имеется pCR к 3-м годам развиваются проблемы возврата рака молочной железы у 23% (почти ¼), тогда как при применении Трастузумаб-Эмтанзина возврат рака молочной железы в той или иной форме наблюдается только 11,7%. То есть в половину меньше!!!
В силу короткого периода наблюдения пока не имеется существенной разницы в общей выживаемости (OS), но это лишь вопрос времени. Явная тенденция к разнице в общей выживаемости имеется – нумерическое число смертей больше в контрольной группе.
Таким образом, на сегодня можно сделать вывод о том, что пациенткам, у которых не удалось достичь pCR на фоне неоадъювантной терапии, имеется четкая стратегия как улучшить результаты их лечения – фактически уполовинить риск прогрессирования в случае использования Трастузумаб-Эмтанзина. Но здесь надо не забывать, что у части пациенток опухоль гетерогенная и остаточная опухоль может оказаться Her2 негативной, поэтому необходимо проводить ретестирование остаточной опухоли и использовать Трастузумаб-Эмтанзин только у тех, у кого сохраняется Her2 позитивность. У тех, у кого после неоадъювантной химиотаргетной терапии выжил только Her2 негативный клон опухоли — Трастузумаб-Эмтанзин назначать не стоит. На мой взгляд может быть оставлен Трастузумаб, и проводится стандартный вариант адъювантного лечения, как у Her2 негативных пациенток – эта проблема должна решаться индивидуально.
Теперь о том, какая наиболее эффективная адъювантная терапия у пациенток с совсем ранними опухолями Her2 позитивными. К совсем ранним относятся опухоли менее 2-х см, без метастазов в лимфатические узлы. Сюда также можно отнести пациенток с опухолями чуть больше 2-х см (но обязательно меньше 3см), которые оказались такого размера при патологической послеоперационной оценке рТ. То есть – это опухоли рТ1аbcN0М0 и рТ2(чуть больше 2см)N0М0. Независимо от гормононально-рецепторного статуса. Большинство подобных пациенток на первом этапе оперируются. Им выполняется или Радикальная Секторальная Резекция или Радикальная Мастэктомия. После операции подавляющее большинство из них нуждается в адъювантной терапии.
Оптимальный вариант адъювантной терапии – проведение химиотаргетной терапии по схеме: Паклитаксел 80 мг/кв.м еженедельно + Трастузумаб (еженедельно или 1 раз в 3 недели), затем адъювантная терапия Трастузумаб суммарно 1 год.
Основанием для данной терапии является исследование APT. В данное исследование – были включены 410 пациенток в основном с опухолями менее 2-х см (в исследование было включено только 36 пациенток с опухолями чуть более 2-х см, но менее 3 см) при отсутствии метастазов регионарные лимфоузлы (мог быть 1 микрометастаз в 1 лимфатический узел). Пациентки в данном исследовании получали только 1 вариант терапии: Паклитаксел 12 циклов еженедельно + Трастузумаб, затем Трастузумаб суммарно 1 год. Интересно, что более 2/3 пациенток – были с гормонопозитивными опухолями. Этот интересный факт говорит о том, что гормонопозитивные и Her2 позитивные опухоли растут медленнее и больше шансов их поймать в I ой стадии, тогда гормононегативные и Her2 позитивные опухоли более агрессивны и чаще всего диагностируются по II-III стадиях.
При 7-ми летнем наблюдении за пациентками получены следующие результаты: только 4-х пациенток развились отдаленные метастазы, у 5-ти пациенток локорегионарное прогрессирование (чаще всего можно повторно получить ремиссию болезни), у 6-ти женщин развился рак другой молочной железы (или с той же стороны если была выполнена секторальная резекция) и зафиксировано 8 смертей от других причин (естественную смерть никто еще не отменил). И это на 410 пациенток!!! Фантастический результат. Таким образом 7-ми летняя DFS (выживаемость без прогрессирования) составила в группе гормонопозитивных пациенток 94,6%, в группе гормононегативных 90,7%.
Вряд ли подобные отдаленные результаты возможно улучшить!!!
Теперь вернемся к метастатическому раку молочной железы. После регистрации Трастузумаба (в 1998 году) в качестве моноклонального антитела допонительного к химиотерапии при метастатическом раке молочной железы начались длительные исследования по оценке эффективности различных химиопрепаратов в комбинации с ним. Эти исследования шли приблизительно 10 лет. К середине 2000 годов стало понятно, что оптимальным партнером к Трастузумабу являются Таксаны (Паклитаксел или Доцетаксел), а также Винорелбин, в качестве 1-ой линии терапии. Комбинация с Доксорубицином (или Доксорубицин + Циклофосфамид) также показала свою высокую эффективность, по оказалась кардиотоксичной и поэтому не применяется. Причем стало понятно, что один химиопрепарат (или Доцетаксел, или Паклитаксел, или Винорелбин) в комбинации с Трастузумабом не уступают по эффективности комбинированной химиотерапии (Например Доцетаксел + Карбоплатин), но по токсичности имеют преимущество. Поэтому комбинация Доцетаксел + Трастузумаб каждые 3 недели, или Паклитаксел (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) или Винорелбин (еженедельно) + Трастузумаб (еженедельно или 1 раз в 3 недели) стали основными схемами 1-ой линии терапии. Обычно проводят 6-9 циклов химиотерапии (5-8 месяц) с Трастузумабом и затем отменяется химиотерапия и продолжается терапия Трастузумабом до прогрессирования или токсичности (которая встречается очень редко). При этом пациенткам с одновременно гормонозависимым вариантом опухоли может быть назначена «поддерживающая» гормонотерапия ингибитором ароматазы (Анастрозол или Летрозол), если женщина в менопаузе (если нет, то стоит перевести в менопаузу).
Результатами данного подхода стало – около 1 года (12 мес) медиана времени до прогрессирования (mPFS) и средняя продолжительность жизни (mOS) в районе 3-х лет (36 месяцев). В эру до Трастузумаба медиана продолжительности жизни была в районе 1,5 лет. То есть Трастузумаб, дополнительно к химиотерапии добавил еще 1,5 года к средней продолжительности жизни. Надо сказать, что это произошло и потому, что пациентки при прогрессировании на Трастузумабе, продолжали получать Трастузумаб с другими химиопрепаратами, или комбинацию Капецитабин + Лапатиниб, или в дальнейшем Трастузумаб- Эмтанзин. Конечно, использование последующих эффективных линий терапии привело к увеличению средней продолжительности жизни. Но, в вместе с тем, влияние 1-ой линии терапии трудно переоценить, так как именно эффективная первая линия терапия дает максимальную прибавку.
На рубеже 2000 годов было начато исследование по оценке эффективности двойной блокады в сравнении с Трастузумабом с химиотерапией при метастатическом раке молочной железы. Ключевое исследование: Cleopatra. Вот дизайн исследования:
По сути, отличием в группах было – добавление Пертузумаба в одной из 2-х групп. Вторая группа получала плацебо. Никто – не пациент, не лечащий врач не знали: полностью «слепое» исследование, чтобы невозможно было фальсифицировать результаты.
В 2012 году исследование впервые было доложено, оно достигло своей Первичной Конечной Точки – увеличение Выживаемости без Прогрессирования (mPFS) с 12 месяцев в группе Доцетаксел + Трастузумаб + Плацебо до 18 месяцев в группе Доцетаксел + Трастузумаб + Пертузумаб. То есть, если пациентка получала тройную комбинацию в среднем прогрессирование наступало через 1,5 года от начала терапии. Это очень сильные данные по увеличению эффективности непосредственного лечения. Но самым главным результатом явилось увеличение Общей Выживаемости (mOS), которое было доложено в 2015 году. Медиана Общей Выживаемости увеличилась с 40,8 мес до 57,1 мес, в группе с Пертузумабом. То есть, среднее увеличение продолжительности жизни оказалось практически 17 месяцев благодаря добавлению Пертузумаба в 1-ой линии терапии. Интересно, что обычно в позитивных (в сторону экспериментальной терапии) клинических исследованиях 1-ой линии в онкологии мы имеем следующую картину: дельта (разница) mPFS практически всегда больше, чем дельта mOS. Это и понятно, так как последующие линии терапии, которые проводятся пациентам всегда разные и в том числе с применением того препарата, которого не было в 1-ой линии (в группе контроля) (так называемый crossover). То есть разница обычно сглаживается. Роль одного лекарства добавленного в 1-ой линии к стандартному набору всегда очень трудно разглядеть – много факторов наслаивается. Обычный пример: добавление Бевацизумаба к терапии метастатического рака молочной железы: препарат очевидно увеличивает эффективность 1 и 2 линии терапии (mPFS), но из-за «crossover» разница в mOS всегда оказывалась статистически недостоверной. Из-за этого в США ограничили применение Бевацизумаба при метастатическом раке молочной железы и во многих рекомендациях Бевацизумаб при РМЖ отсутствует (лично я с этим категорически не согласен).
Увеличение mOS на большУю дельту в сравнении с mPFS мы сегодня наблюдаем только в препаратах иммунотерапевтической направленности. В этих исследованиях появляется группа пациентов, которые благодаря данной терапии не прогрессируют совсем и живут очень долго (фактически излечены) и их доля существенная чтобы поднять кривые выживаемости. В исследовании Cleopatra фактически мы получили такую же картину. Кривые выживаемости:
Что мы видим в этом исследовании, что в группе с Пертузумабом и Трастузумабом к 8 годам от начала исследования не прогрессировало практически 25% пациенток, тогда в как в группе с только Трастузумабом не прогрессировало к 8 годам 19% пациенток. Разница в 6% к 8 годам в Выживаемости без прогрессирования привела к тому, что 8-лет 37% женщин живы в комбинированной группе по сравнению с 23% в группе только Трастузумаба. Очень красноречивые данные. Кривые выживаемости очень похожи на кривые выживаемости, которые мы видим при применении иммунотерапии. Мы видим, что те пациентки, которые прожили 5 лет без прогрессирования от начала получения 1-ой линии терапии – фактически не прогрессируют в дальнейшем совсем. Причем похожая картина кривых Выживаемости без Прогрессирования наблюдается и в группе с только Трастузумабом, только в комбинированной группе таких пациенток существенно больше.
Сегодня можно с уверенностью говорить, что метастатический Her2 позитивный рак молочной железы перестал относится к числу неизлечимых заболеваний. Получается, что применении Химиотерапии (на основе Таксанов) + Трастузумаб + Пертузумаб мы можем вылечить ¼ пациенток!!!
Причем наибольшие шансы у тех пациенток, у кого биологически опухоль была инфильтрирована лимфоцитами (так называемые TILs – tumor-infiltrating lymphocytes).
Это кривые выживаемости без прогрессирования в зависимости от терапии (Пертузумаб vs Плацебо) и в зависимости от наличия/отсутствия TILs:
Это кривые общей выживаемости в зависимости от терапии (Пертузумаб vs Плацебо) и в зависимости от наличия/отсутствия TILs:
На графиках отчетливо видно, что пациентки у которых имеются TILs в опухоли, через 3 года от начала лечения практически не прогрессируют – и таких пациенток около 40%, если им применялся Трастузумаб и Пертузумаб. Тогда как без Пертузумаба болезнь течет хуже, независимо от наличия/отсутствия TILs. При отсутствии TILs при добавлении Пертузумаба эффективность тоже выше, но не так ярко, как у больных с TILs.
Что такое TILs – это Т-лимфоциты, которые инфильтрируют опухоль (по какой-то причине), но не могут сами ее убить. Наличие TILs в опухоли является критерием благоприятного прогноза ответа на терапию (особенно при РМЖ). Вероятно, Т-лимфоциты помогают лекарственной терапии уничтожить опухоль. Имеющиеся данные, на мой взгляд, говорят нам о том, что Трастузумаб и, особенно, комбинация Трастузумаб + Пертузумаб являются Иммунотерапевтической комбинацией в первую очередь. И именно благодаря этому удается полностью уничтожить микрометастазы у большинства женщин, и макрометастазы — как минимум у 25%.
Таким образом, я считаю, что для Her2 – позитивного РМЖ должны использоваться следующие варианты лечения:
1. I стадия. Операция на первом этапе, затем применение адъювантной терапии: 12 циклов Паклитаксел 80 мг/кв.м 1 день + Трастузумаб 1,4,7,10 недели, затем каждые 3 недели 1 год суммарно. При гормонопозитивных вариантах, в адъюванте применение гормонотерапии ингибиторы ароматазы (Анастрозол или Летрозол), не менее 5 лет.
2. II и III стадии. Проведение неоадъювантной химиотаргетной терапии на первом этапе по схеме ТСНР: Доцетаксел 75 мг/кв.м + Карбоплатин AUC6 + Трастузумаб 6 мг/кг веса (1-ое введение 8 мг/кг веса) + Пертузумаб 420 мг (840 мг 1-ое введение) каждые 3 недели 6 циклов. Затем операция, затем адъювантная терапия Трастузумаб до 1 года. Адъювантная гормонотерапия у гормонопозитивных пациенток – ингибиторы ароматазы не менее 5 лет. В случае отсутствия полного лечебного патоморфоза (pCR), ретестирование опухоли и при сохранении Her2 3+ проведение адъювантной терапии препаратом Трастузумаб-Эмтанзин 14 циклов каждые 3 недели. При отсутствии Her2 позитивности в остаточной опухоли – альтернативная адъювантная терапия, которая должна рассматриваться индивидуально.
3. Бывают ситуации, когда хирурги шли на I стадию, но по результатам гистологического послеоперационного лечения, без проведения неоадъювантной химиотаргетной терапии, стадия заболевания оказалась существенно больше, например III стадия (по пораженным подмышечным лимфоузлам). В этом случае, должна быть использована такая схема адъювантной химиотаргетной терапии, которая была бы применена, в случае если бы знали о стадии заболевания сначала (до операции). Например, 6 курсов ТСНР затем Трастузумаб + Пертузумаб 1 год. Но таких пациенток должно становиться все меньше и меньше, так как на сегодня все имеющиеся методы обследований позволяют у большинства пациенток установить стадию заболевания до начала лечения. Данные ситуации должны решиться индивидуально квалифицированным онкологом.
4. Метастатический рак молочной железы: Доцетаксел 75 мг/кв.м 1 раз в 3 недели или Паклитаксел 80 мг/кв.м еженедельно + Трастузумаб + Пертузумаб в стандартных дозах. 18-24 недели химиотерапии, затем поддерживающая терапия Трастузумаб + Пертузумаб +/- гормонотерапия у гормонопозитивных пациенток (Ингибиторы ароматазы), до прогрессирования. При этом прогрессирование не наступит у минимум 24%. Как долго продолжать лечение, у тех, кто не прогрессирует годы, пока не ясно. Определение TILs не обязательно, так как это носит не предиктивный, а прогностический характер. Но если эта информация будет у врача, то вероятно она не будет лишней.
Заключение: Her2 позитивный рак молочной железы на сегодня является практически излечимым заболеванием. Мы можем вылечить подавляющее большинство пациенток с I-III стадиям ~ 90% при применении наиболее эффективных схем диагностики и лечения.
И мы можем вылечить (не побоюсь этого слова) 25% пациенток с метастатическим Her2 позитивным раком. Остальным мы можем значительно продлить жизнь, на многие годы, в том случае если будем использовать наиболее эффективные подходы к лечению.
Химиотерапия при раке легких | Клиника Рассвет
Системная терапия немелкоклеточного рака легкого (НМРЛ)
Системная терапия — это использование лекарственных средств для уничтожения раковых клеток. С током крови препараты распространяются по всему телу и воздействуют на раковые клетки. Обычно при системной терапии вводятся растворы в вену или используются таблетки и капсулы.
Типы системной терапии для лечения НМРЛ включают в себя:
- химиотерапию;
- таргетную терапию;
- иммунотерапию.
Человек может получать один вид системной терапии или комбинацию препаратов. Также системная терапия может дополнять такие виды лечения, как хирургия и/или лучевая терапия.
Химиотерапия
Химиотерапия — это использование лекарств для уничтожения опухолей, как правило, путем предотвращения роста, деления и образования новых раковых клеток. Доказано, что химиотерапия улучшает как продолжительность, так и качество жизни людей с раком легкого на всех стадиях.
Режим химиотерапии (или график) обычно состоит из определенного количества циклов, проводимых в течение определенного периода времени. От типа рака легкого, такого как аденокарцинома или плоскоклеточный рак, зависит, какие препараты могут использоваться для химиотерапии.
Химиотерапия перед облучением или операцией может помочь людям с раком легкого, уменьшив объем опухоли настолько, что ее будет легче удалить хирургическим путем. Химиотерапия, которая проводится перед лучевой терапией, может уничтожать скрытые раковые клетки, что повышает эффективность облучения.
Есть основания полагать, что для пациентов с НМРЛ, у которых опухоль может быть удалена хирургическим путем, химиотерапия после операции, известная как «адъювантная терапия», способствует предотвращению рецидива рака. Особенно это касается пациентов с II и III стадиями заболевания.
Для пациентов с III стадией рака легкого в случаях, когда опухоль не может быть удалена хирургическим путем, обычно рекомендуется химиотерапия в сочетании с лучевой терапией. На IV стадии рака легкого химиотерапия, как правило, является основным методом лечения. У пациентов с IV стадией лучевая терапия используется только для паллиативного лечения симптомов.
Обычно для лечения рака легкого используют комбинацию 2-3 препаратов (полихимиотерапия) либо 1 препарат (монохимиотерапия).
Препараты используемые для лечения НМРК:
- карбоплатин или цисплатин;
- доцетаксел;
- гемцитабин;
- наб-паклитаксел;
- паклитаксел;
- пеметрексед;
- винорельбин.
Если схема лечения не приносит желаемого эффекта или через некоторое время рак легкого возвращается, назначается вторая линия химиотерапии.
Химиотерапия может повреждать и здоровые клетки организма, включая клетки крови, кожи и нервные клетки. Побочные эффекты химиотерапии зависят от индивидуальных особенностей пациента и применяемой дозы. Они могут включать усталость, нарушение кроветворения, увеличение риска инфекционных процессов, появление язв в полости рта, тошноту и рвоту, потерю аппетита, диарею, онемение и покалывание в руках и ногах, а также потерю волос.
В клинике Рассвет для облегчения побочных эффектов химиотерапии доктор-онколог дополнительно назначает лекарственные средства. Введение гормонов и КСФ используются для предотвращения нарушения кроветворения. Проявления тошноты и рвоты также можно избежать с помощью специальных препаратов. Эти побочные эффекты обычно исчезают после завершения лечения.
На консультации онколога вы сможете больше узнать о профилактике тошноты, рвоты, и других побочных эффектов, вызванных химиопрепаратами.
Таргетная терапия
Одним из наиболее интересных достижений в лечении рака легкого является внедрение таргетных препаратов.
Таргетная терапия — это лечение, направленное на конкретные гены, белки или рецепторы опухолевой клетки, способствующие росту и выживанию рака. Этот вид лечения блокирует рост и распространение раковых клеток, ограничивая повреждение здоровых клеток.
Не все опухоли имеют одинаковые цели для таргетных препаратов. Чтобы найти наиболее эффективное лечение, необходимо провести тесты для определения генов, белков и других факторов опухоли. Это помогает подобрать наиболее эффективное лечение каждому пациенту, когда это возможно.
Таргетная терапия рака легкого включает в себя следующие препараты.
Эрлотиниб. Применяется для лечения НМРЛ. Препарат блокирует определенный тип рецепторов на поверхности клеток — рецептор эпидермального фактора роста (EGFR). EGFR может стимулировать рост и распространение раковых клеток. Клетки рака легкого, которые имеют мутацию EGFR, с большей вероятностью будут реагировать на лечение эрлотинибом, чем на химиотерапию. Для пациентов, прошедших химиотерапию и нуждающихся в поддерживающем лечении, эрлотиниб также может применяться даже без присутствия мутации.
Афатиниб. Одобрен как первая линия терапии метастатического НМРЛ у пациентов с теми же мутациями генов EGFR, что и у пациентов, которым может быть назначен эрлотиниб.
Гефитиниб. Одобрен как первая линия терапии для лечения пациентов с НМРЛ, опухоли которых содержат специфические типы мутаций генов EGFR.
Бевацизумаб. Как и нормальные ткани, опухоли нуждаются в кровоснабжении, чтобы выжить. Кровеносные сосуды растут несколькими способами. Одним из способов является наличие вещества, называемого фактором роста эндотелия сосудов (VEGF). Это вещество стимулирует кровеносные сосуды к проникновению в опухоль и обеспечивает опухолевые клетки кислородом, минералами и другими питательными веществами. Когда опухоль распространяются по всему телу, они высвобождают VEGF для создания новых кровеносных сосудов. Бевацизумаб, через останавку VEGF, блокирует рост новых кровеносных сосудов (поскольку нормальные ткани имеют сформировавшееся кровоснабжение, препарат на них не влияет). Было доказано, что в сочетании с химиотерапией бевацизумаб улучшает выживаемость пациентов с определенными типами НМРЛ, такими как аденокарцинома и крупноклеточная карцинома.
Кризотиниб. Препарат, который доказал свою эффективность у пациентов с прогрессирующим НМРЛ при наличии мутацией гена ALK. Кризотиниб работает, блокируя АЛК и останавливая рост опухоли.
Церитиниб. Препарат одобрен для пациентов с метастатическим ALK-положительным раком легкого, которые не переносят кризотиниб, или рак у них продолжает расти во время лечения кризотинибом.
Поскольку гены раковых клеток могут эволюционировать, некоторые опухоли могут проявлять устойчивость к таргетному лечению. Лекарственные средства для решения этих проблем в настоящее время изучаются в рамках клинических испытаний.
Онкологи клиники Рассвет постоянно посещают важнейшие научные конференции и съезды, а также регулярно обновляют и углубляют свои знания современных клинических рекомендаций. Это позволяет назначать нашим пациентам современное лечение с наибольшей эффективностью при наименьших побочных эффектах.
Иммунотерапия
В качестве метода лечения некоторых видов рака легкого иммунотерапия используется относительно недавно. Хотя любое лечение рака может вызывать побочные эффекты, иммунотерапия, как правило, хорошо переносится; отчасти это связано с ее механизмом действия.
Иммунная система постоянно работает, чтобы сохранить наше здоровье. Она распознает такие опасности, как инфекции, вирусы и рост раковых клеток, и борется с ними. Иммунотерапия использует собственную иммунную систему человека для лечения рака.
В марте 2015 года FDA одобрило иммунотерапию ниволумабом для лечения метастатического плоскоклеточного НМРЛ при неэффективности предыдущего лечения. Ниволумаб работает, вмешиваясь в молекулярный «тормоз», известный как PD-1, который предотвращает поражение опухоли иммунной системой организма.
В 2016 году FDA одобрило новый иммунный препарат пембролизумаб для лечения распространенного НМРЛ в качестве первой линии терапии. Его терапевтическая активность аналогична терапевтической активности ниволумаба. Пациентам проводится анализ на наличие белка PDL-1 и, если он выявляется в достаточном количестве, это является критерием для назначения упомянутых препаратов.
Системная терапия мелкоклеточного рака легкого
Для пациентов с мелкоклеточным раком легкого, независимо от стадии, химиотерапия является неотъемлемой частью лечения. В зависимости от стадии рака также может применяться лучевая терапия.
Для людей с ограниченной распространенностью мелкоклеточного рака легкого рекомендуется комбинированная химиотерапия плюс лучевая терапия, проводимая одновременно. Наиболее часто применяемым методом первичной химиотерапии является этопозид плюс цисплатин, схема известная как EP.
Для пациентов с распространенным мелкоклеточным раком легкого стандартным лечением является только химиотерапия с использованием схемы EP. Тем не менее, другой подходящий режим химиотерапии — карбоплатин плюс иринотекан.
Лучевая терапия на область головного мозга может использоваться до или после химиотерапии у пациентов с метастатическим поражением головного мозга.
Полезно знать
Расчет стоимости
Химиотерапия при раке легких — цена курса в центре онкологии СМ-Клиники, СПб
Особенности химиотерапии при раке легкого
Химиотерапия при раке легких направлена на снижение работоспособности раковых клеток, остановку роста опухоли. Благодаря токсическому воздействию злокачественное образование перестает развиваться и уменьшается в размере.
В большинстве случаев химиотерапия назначается как одна из составляющих комплексного лечения. Химию комбинируют с операцией по удалению опухоли и с радиоактивным облучением. Часто сочетают и с таргетной терапией – инновационным методом борьбы с онкологией, при котором уникальные препараты разрушают раковые клетки и при этом почти не влияют на здоровые ткани.
На 1 и 2 стадиях рака легкого химиотерапия назначается после операции и позволяет предотвратить рецидив заболевания. На 3 стадии, а также в случаях, когда новообразование неоперабельно, химия сочетается с радиотерапией. Курсы химиотерапии при раке легких с метастазами на 3-4 стадиях позволяют уничтожить раковые очаги во всем организме. При этом на 4 стадии лечение химиопрепаратами используется как основной метод паллиативного лечения симптомов.
Терапия состоит из нескольких курсов с перерывами между интенсивным введением препаратов для восстановления организма. Перерывы могут составлять от 1 до 6 недель. Стоимость курса химиотерапии зависит от его продолжительности и выбранных препаратов.
Обычно препараты вводятся внутривенно. В редких случаях используется пероральный прием в виде таблеток либо инъекционное введение подкожно, внутримышечно или непосредственно в опухоль.
Выбор препаратов зависит от вида рака. Для мелкоклеточного и не мелкоклеточного используются разные лекарства и схемы – чаще всего «Доцетаксел», «Паклитаксел», «Доксорубицин», «Циклофосфамид», «Ивинкристин», «Этопозид», Митомиицин», «Цисплатин» и др. Специальные схемы регламентируют комбинацию химиопрепаратов для достижения максимальной эффективности.
Побочные эффекты
Химиопрепараты повреждают не только раковые, но и здоровые клетки. Поэтому такое лечение вызывает ряд побочных эффектов, самыми распространенными среди которых являются:
- постоянная усталость;
- тошнота, рвота;
- поражение слизистой рта;
- потеря аппетита;
- диарея;
- потеря волос и повреждение кожных покровов.
Преимущества химиотерапии в «СМ-Клиника»
Лечение онкологии легкого в «СМ-Клиника» обладает рядом преимуществ:
- возможность лечения амбулаторно без госпитализации или в комфортном стационаре;
- составление индивидуальной программы лечения в соответствии с международными и российскими протоколами;
- использование современных препаратов последнего поколения с минимальными побочными эффектами;
- оперативная коррекция плана лечения с учетом результатов анализов для повышения эффективности выбранной схемы;
- назначение поддерживающей терапии, которая снижает побочные эффекты химиотерапии.
Звоните по телефону и записывайтесь на прием к онкологам в нашу клинику в Санкт-Петербурге. Определить, сколько будет стоить химиотерапия при раке легких в каждом конкретном случае, можно только после диагностики и разработки терапевтической схемы.
ICON: предпочтение — монотерапии рака яичников
Рак яичников — заболевание, на ранних стадиях протекающее с неясной симптоматикой или вовсе бессимптомно, зачастую диагностируется лишь на поздних стадиях и поэтому характеризуется низкой выживаемостью. В последние годы был проведен ряд исследований, в ходе которых доказано, что комбинированная терапия с помощью цисплатина и паклитаксела у больных раком яичников является более эффективной.
В журнале «The Lancet» (2002, August 17th, 360) были опубликованы результаты широкомасштабного международного исследования ICON (International Collaboration Ovarian Neoplasm Group), которое проводилось с 1995 до начала 2001 г. и охватило более 2 тыс. пациенток из восьми стран. Изучали терапевтическую эффективность и профиль безопасности трех режимов терапии: цисплатин + паклитаксел, циклофосфамид + доксорубицин + цисплатин и монотерапия карбоплатином. Отмечено, что выживаемость больных была приблизительно одинакова; лечение 1300 пациенток оказалось безуспешным. Продолжительность жизни больных, после комбинированной терапии с использованием паклитаксела и карбоплатина, в среднем на 1 мес превышала таковую у пациенток после монотерапии карбоплатином. Но у последних были менее выражены осложнения химиотерапии — неврологические расстройства, лихорадка и выпадение волос.
«Из трех вышеуказанных режимов химиотерапии следует отдать предпочтение монотерапии карбоплатином из-за более высокого профиля безопасности», — говорится в резюме исследования ICON. Его результаты ставят под сомнение целесообразность применения паклитаксела в качестве препарата первой линии при терапии рака яичников, в то время как монотерапия карбоплатином «представляется перспективным направлением». Необходимо учитывать, что побочные эффекты химиотерапии существенно влияют на выживаемость в тех случаях, когда антиканцероматозный эффект различных режимов терапии приблизительно одинаков.
Ученые подчеркивают, что результаты ICON не нивелируют роль паклитаксела (Таксол) для лечения больных раком яичников, однако «оптимальной схемой» следует считать монотерапию карбоплатином (Параплатин). Оба препарата поставляет на рынок компания «Bristol-Myers Squibb», которая поддерживала проведение исследования.
По материалам www.reuters.comrel=»nofollow»>
Паклитаксел (Таксол) | Рак груди сейчас
1. Что такое паклитаксел?
2. Когда назначают паклитаксел?
3. Перед началом приема паклитаксела
4. Как вводится паклитаксел?
5. Побочные эффекты паклитаксела
6. Аллергическая реакция
7. Сгустки крови
8. Секс, контрацепция и беременность
9. Путешествия и вакцинация
10. Дополнительная поддержка
1. Что такое паклитаксел?
Паклитаксел — химиотерапевтический препарат. Химиотерапия — это лечение, при котором раковые клетки уничтожаются с помощью противораковых препаратов.
Паклитаксел — это небрендовое название препарата, но вы можете услышать, что он называется одним из его торговых наименований, например, таксолом.
Некоторым людям назначают препарат наб-паклитаксел (Abraxane). Это может быть, если у вас аллергическая реакция на паклитаксел.
2. Когда назначают паклитаксел?
Первичный рак груди
Паклитаксел используется для лечения людей с первичным раком груди (рак, который не распространился за пределы груди или лимфатических узлов под мышкой) в сочетании с другими лекарствами.
Он также может быть назначен в рамках клинических испытаний при первичном раке груди.
До операции
Паклитаксел можно назначить перед операцией, чтобы уменьшить рак груди большего размера. Это может означать, что операция по сохранению груди является вариантом, а не мастэктомией. Или его можно назначить перед операцией, чтобы замедлить рост быстрорастущего рака груди и снизить вероятность его распространения на другие части тела.
Когда химиотерапия проводится перед операцией, это называется первичной или неоадъювантной химиотерапией.
После операции
Паклитаксел назначают после операции, чтобы снизить риск рецидива рака груди в будущем. Обычно это начинается в течение нескольких недель после операции.
Если вы собираетесь пройти лучевую терапию, вы обычно сначала завершаете курс паклитаксела.
Когда химиотерапия назначается после операции, это называется адъювантной терапией.
Распространившийся рак груди
Паклитаксел также используется отдельно или с другими химиотерапевтическими или противораковыми препаратами для лечения рака груди, имеющего:
- Распространяется на ткани и лимфатические узлы вокруг груди, шеи и под грудиной (известный как регионарный рецидив или местнораспространенный рак груди)
- Распространяется на другие части тела (вторичный рак груди)
3.Перед началом приема паклитаксела
Перед началом лечения в большинстве больниц проводится информационный сеанс химиотерапии.
На этом приеме медсестра обсудит, как и когда будет назначена ваша химиотерапия и как можно справиться с побочными эффектами.
У вас могут быть анализы крови, а у некоторых людей может быть ЭКГ (электрокардиограмма), простой тест, который проверяет ваш сердечный ритм.
Также будут измерены ваш рост и вес. Это необходимо, чтобы подобрать для вас правильную дозу химиотерапии.
Вам будут предоставлены контактные номера телефонов, чтобы вы знали, к кому обращаться, если у вас возникнут какие-либо вопросы или проблемы.
4. Как вводится паклитаксел?
Паклитаксел вводится в вену (внутривенно). Обычно это будет капля, также называемая настоем, в руку или руку. Другие внутривенные методы могут использоваться в зависимости от таких факторов, как то, насколько легко химиотерапевтам найти подходящие вены, и ваших предпочтений.
Вы можете прочитать о различных способах проведения химиотерапии на нашей странице химиотерапии.
Паклитаксел можно вводить один раз в две недели в течение двух часов (так называемый ускоренный или плотный прием дозы). Или его можно вводить еженедельно в более низких дозах в течение одного часа.
Интервал между каждым циклом лечения дает вашему организму время на восстановление и может варьироваться в зависимости от того, нормализовалось ли количество клеток крови между каждым циклом.
Вам назначат паклитаксел амбулаторно.
Перед каждой дозой вам будут вводить лекарство, чтобы уменьшить вероятность любой возможной аллергической реакции.
Как долго я буду принимать паклитаксел?
При первичном раке груди обычно назначают от трех до шести циклов лечения.
При местнораспространенном и вторичном раке груди количество циклов зависит от человека.
5. Побочные эффекты паклитаксела
Как и любое лечение, паклитаксел может вызывать побочные эффекты. Все по-разному реагируют на лекарства, и у некоторых людей побочных эффектов больше, чем у других. С этими побочными эффектами обычно можно справиться, и описанные здесь не повлияют на всех.
Если вас беспокоят какие-либо побочные эффекты, независимо от того, перечислены ли они здесь, как можно скорее поговорите со своей медсестрой по химиотерапии или онкологом (онкологом).
Если вам вводят другие химиотерапевтические или противораковые препараты с паклитакселом, у вас могут возникнуть дополнительные побочные эффекты от этих препаратов.
Общие побочные эффекты
Воздействие на кровь
Паклитаксел может временно влиять на количество здоровых клеток крови в организме.
На протяжении всего курса лечения вам нужно будет регулярно сдавать анализы крови, чтобы проверять свой анализ крови. Если количество клеток крови слишком низкое, ваш следующий курс лечения может быть отложен или доза химиотерапии уменьшена.
Риск заражения
Когда количество лейкоцитов падает ниже определенного уровня, это называется нейтропенией. Недостаток лейкоцитов может увеличить риск заражения. Количество лейкоцитов обычно возвращается к норме до того, как наступит срок следующего курса химиотерапии.
Ваша лечащая бригада может дать вам инструкции, которым следует следовать при сообщении о признаках инфекции, но обычно вам следует немедленно связаться с вашей больницей, если вы испытываете одно из следующих событий:
- У вас высокая температура (выше 37,5 ° C) или низкая температура (ниже 36 ° C), или что-то еще, что вам посоветовала ваша химиотерапевтическая бригада
- Вы внезапно почувствовали недомогание даже при нормальной температуре
- У вас есть какие-либо симптомы инфекции, например, боль в горле, кашель, потребность в частом мочеиспускании или ощущение холода и дрожи
Перед началом химиотерапии ваша лечащая бригада должна предоставить вам круглосуточный контактный номер или рассказать, как получить неотложную помощь.Вам могут понадобиться антибиотики. Иногда ваш врач может порекомендовать инъекции препаратов, называемых факторами роста. Это помогает организму производить больше лейкоцитов, что снижает риск заражения.
Анемия
Слишком мало эритроцитов называется анемией. Если вы чувствуете особую усталость, одышку или головокружение, сообщите об этом врачу.
Ушиб и кровотечение
У вас могут появиться синяки, кровотечение из носа или десны, когда вы чистите зубы.Сообщите врачу, если у вас возникнут какие-либо из этих симптомов.
Выпадение волос
Паклитаксел вызывает выпадение волос. Большинство людей теряют все волосы, включая брови, ресницы и волосы на теле.
Вы можете начать терять волосы примерно через две недели после первой процедуры, но это может произойти и раньше. Выпадение волос обычно происходит постепенно, но может произойти очень быстро, возможно, за пару дней.
Охлаждение кожи головы может предотвратить потерю некоторых или всех волос на голове.Это подразумевает ношение холодной шапочки до, во время и в течение одного-двух часов после лечения химиотерапевтическими препаратами. Насколько хорошо работает холодный колпачок, зависит от используемых лекарств и доз, и он подходит не всем.
Выпадение волос должно быть временным, и в большинстве случаев ваши волосы начнут расти снова через несколько недель после окончания лечения.
Постоянное облысение — это неполный отрастание волос через шесть или более месяцев после завершения лечения. В настоящее время нет определенных доказательств того, насколько часто это происходит.
Если при принятии решения о лечении вас беспокоит выпадение волос, поговорите со своей лечащей бригадой.
Узнайте больше о выпадении волос, охлаждении кожи головы и уходе за волосами.
Онемение и покалывание в руках или ногах
Люди, принимающие паклитаксел, могут испытывать боль, онемение или покалывание в руках и ногах. Это связано с действием паклитаксела на нервы и известно как периферическая невропатия.
Если у вас есть покалывание или онемение (например, трудности с нажатием кнопок или трудности с ощущением разницы между горячей и холодной водой кончиками пальцев) или потеря равновесия, сообщите об этом своей терапевтической бригаде, чтобы они могли отслеживать ваши симптомы.
Болезненные мышцы и суставы
Ваши мышцы или суставы могут болеть или становиться болезненными через два-три дня после лечения. Обычно это проходит через несколько дней или неделю, но у некоторых людей может длиться немного дольше.
Это может быть очень болезненно, и вам может потребоваться прием обезболивающих или противовоспалительных препаратов, таких как ибупрофен. Рекомендуется иметь некоторые из них перед началом лечения на случай, если они вам понадобятся. Имейте в виду, что обезболивающие, такие как парацетамол или ибупрофен, могут маскировать признаки инфекции.
Прежде чем использовать противовоспалительное обезболивающее, спросите своего врача о правильной дозе, как долго вы должны его использовать и о любых возможных побочных эффектах, особенно если у вас язва желудка или астма.
Тошнота и рвота
Вы можете почувствовать тошноту (тошноту), хотя обычно она легкая, и большинство людей на самом деле не болеет (рвота).
Через несколько часов после лечения вы можете почувствовать недомогание. Перед каждым курсом химиотерапии вам будут вводить лекарство от болезней в таблетках или в вену.Вы также можете взять с собой домой несколько таблеток от болезней.
Если вас беспокоят тошнота и рвота, сообщите об этом кому-нибудь из вашей терапевтической бригады.
Обратитесь в больницу, если у вас сильная рвота и вы не можете пить жидкость без рвоты, даже если это происходит в выходные или ночью.
Кожные реакции
На любом участке тела может появиться сыпь или кожа может обесцветиться. Это может быть покраснение и зуд, или вы можете почувствовать покраснение. Ваш врач может прописать лекарство, чтобы помочь.
Если у вас есть кожные реакции, сообщите об этом своей лечащей бригаде, когда увидите их в следующий раз, чтобы они могли отслеживать симптомы.
У некоторых людей наблюдается кожная реакция, называемая синдромом ладони-стопы, часто называемым ладонно-подошвенным синдромом. Обычно он поражает ладони рук и подошвы ног, но у вас могут быть симптомы и в других областях, например, на коже на коленях или локтях.
Боль во рту
Ваш рот может болеть и образовываться небольшие язвы. Обычно вам дают жидкость для полоскания рта, чтобы снизить риск развития воспаления во рту.
Во время лечения очень важно ухаживать за полостью рта, в том числе за зубами и деснами. Если вы заразились инфекцией ротовой полости, ваш специалист или медсестра-химиотерапевт посоветуют вам различные жидкости для полоскания рта или подходящие лекарства.
Перед началом химиотерапии рекомендуется посетить стоматолога для проверки. Если вам нужна стоматологическая работа, поговорите со своей лечащей бригадой о том, когда это лучше всего.
Диарея и запор
У вас может быть диарея или запор.Ваша химиотерапевтическая бригада может назначить лекарство, чтобы контролировать его, и предоставит вам информацию о диете.
Обратитесь в свою химиотерапевтическую бригаду, если у вас четыре или более эпизода диареи в течение 24 часов.
Сильная усталость
Усталость, связанная с раком, — это сильная усталость, которая не проходит с отдыхом или сном. Это очень распространенный побочный эффект лечения рака груди, который может повлиять на вас физически и эмоционально.
Если вам кажется, что вы устали, сообщите об этом своему терапевту или лечащей бригаде.Они могут оценить вас и посоветовать, как управлять вашим уровнем энергии.
Узнайте больше об усталости.
Влияние на вашу концентрацию
Некоторые люди считают, что лечение влияет на их способность концентрироваться и делает их более забывчивыми.
Иногда это называют «химиотерапией» или «химиотерапией», но ваша лечащая бригада может назвать это когнитивным нарушением. Обычно он улучшается со временем после завершения лечения.
Низкое артериальное давление
Пока вы принимаете паклитаксел, вам будут регулярно проверять артериальное давление.Сообщите своему врачу или медсестре, если вы чувствуете головокружение или головокружение.
Менее частые побочные эффекты
Реакция ногтей
Паклитаксел может вызывать изменения внешнего вида ногтей на пальцах рук и ног. Это может быть изменение цвета или текстуры ногтей, например образование гребней. Ногти могут стать более ломкими и потрескаться. Иногда ноготь может оторваться от ногтевого ложа и выпасть, но ногти будут снова расти.
Поскольку во время химиотерапии у вас повышается риск заражения, сообщайте лечащей бригаде о любых признаках инфекции, таких как покраснение, жар, отек или боль в ногтях рук и ног или под ними.
Реакция в месте укола
Боль, покраснение, изменение цвета или припухлость могут возникнуть в месте введения иглы или в любом месте вдоль вены.
Немедленно сообщите медсестре по химиотерапии, если во время введения препарата у вас возникнет боль, покалывание или жжение вокруг канюли (небольшой пластиковой трубки).
Если паклитаксел вытекает из вены, в которую он вводится (так называемая экстравазация), он может повредить окружающие ткани.
Через несколько недель вы можете заметить болезненность, потемнение и затвердение вокруг места введения иглы.Со временем это должно исчезнуть.
Влияние на фертильность
Точно неизвестно, какое влияние паклитаксел оказывает на фертильность. Однако любые эффекты также будут зависеть от других химиотерапевтических препаратов, которые вы принимаете в то же время или принимали в прошлом, а также от вашего возраста.
У некоторых женщин прекращаются менструации (аменорея) во время химиотерапии, хотя это может быть временным.
У женщин в возрасте около 40 лет и старше вероятность возобновления менструации после завершения химиотерапии ниже, чем у женщин моложе этого возраста.
Если вы беспокоитесь о своей фертильности, поговорите со своим лечащим врачом до начала лечения.
Узнайте больше о том, как лечение рака груди может повлиять на фертильность.
Воздействие на печень
Паклитаксел может повлиять на работу вашей печени. Это временно, и ваша функция печени обычно возвращается в норму после прекращения лечения.
Вы вряд ли заметите какие-либо симптомы. Вам будут регулярно сдавать анализы крови, чтобы контролировать функцию печени на протяжении всего курса лечения.
Редкие побочные эффекты паклитаксела
Изменения ЧСС
Паклитаксел может изменять частоту сердечных сокращений, поэтому во время лечения за вами будут тщательно следить за этим.
Если происходят изменения в вашей частоте сердечных сокращений, это обычно легко лечится, и вам не придется прекращать лечение.
Это не то же самое, что аллергическая реакция на паклитаксел.
Воздействие на легкие
Это может включать рубцы или воспаление легочной ткани.
Это редкий побочный эффект, но если вы почувствуете одышку или у вас появится сухой кашель во время или в течение нескольких недель после лечения, сообщите об этом своей лечащей бригаде.
6. Аллергическая реакция
Перед началом лечения вам дадут лекарства, в том числе стероиды, для снижения риска аллергической реакции. Их принимают в виде таблеток или вводят внутривенно.
Если у вас есть аллергическая реакция на паклитаксел, она, вероятно, произойдет в течение первых нескольких минут после лечения.Это более вероятно при первом или втором приеме препарата.
Реакция может варьироваться от легкой до тяжелой, хотя тяжелые реакции встречаются редко.
Во время лечения за вами будут внимательно наблюдать, чтобы можно было немедленно устранить любую реакцию.
Симптомы аллергической реакции включают:
- Промывка
- Сыпь на коже
- Зуд
- Боль в спине
- Одышка
- Обморок
- Лихорадка или озноб
Если у вас возникнет тяжелая реакция, лечение будет немедленно прекращено.Вам могут не назначать паклитаксел снова или его могут назначать с дополнительными лекарствами для предотвращения другой реакции, а паклитаксел можно вводить более медленно.
7. Сгустки крови
Люди с раком груди имеют более высокий риск образования тромбов. Их риск выше из-за самого рака и некоторых методов лечения рака груди. Если рак распространился на другие части тела (вторичный рак груди), это также увеличивает риск.
Наличие паклитаксела увеличивает риск образования тромбов, таких как тромбоз глубоких вен (ТГВ).
Люди с ТГВ подвержены риску развития тромбоэмболии легочной артерии (ТЭЛА). Это когда часть сгустка крови отрывается и попадает в легкие.
Сгустки крови могут быть опасными, но поддаются лечению, поэтому важно как можно скорее сообщать о симптомах.
Если вы испытываете какие-либо из следующих симптомов, немедленно обратитесь в местное отделение неотложной помощи, терапевта или терапевтическую бригаду:
- Боль, покраснение / изменение цвета, жар и отек голени или бедра
- Отек, покраснение или болезненность в месте введения центральной линии для проведения химиотерапии, например, в руке, в области груди или в области шеи
- Одышка
- Боль или стеснение в груди
- Необъяснимый кашель или кашель с кровью
Узнайте больше о тромбах.
8. Секс, контрацепция и беременность
Вам не рекомендуется беременеть во время лечения, поскольку паклитаксел может нанести вред развивающемуся ребенку. Если у вас не было менопаузы, поговорите со своей командой о наиболее подходящем для вас методе контрацепции. Забеременеть все еще возможно, даже если менструация станет нерегулярной или прекратится.
Вы все еще можете заниматься сексом во время лечения. Считается, что химиотерапевтические препараты не могут проникать во влагалищные жидкости или сперму, но это нельзя полностью исключить, поскольку химиотерапевтические препараты могут попадать в кровь и некоторые другие жидкости организма.
Большинство больничных специалистов советуют использовать барьерные методы контрацепции, такие как презервативы, во время лечения и в течение нескольких дней после проведения химиотерапии.
Узнайте больше о том, как рак груди и его лечение могут повлиять на секс и близость, и прочтите наши советы о том, как справиться с этими изменениями.
9. Поездки и вакцинация
Если вы планируете отпуск или вам нужно поехать за границу, сначала проконсультируйтесь с лечащей бригадой.
Вам не следует вводить какие-либо живые вакцины во время химиотерапии.Живые вакцины включают эпидемический паротит, корь, краснуху (краснуху), полиомиелит, БЦЖ (туберкулез), опоясывающий лишай и желтую лихорадку.
Живые вакцины содержат небольшое количество живых вирусов или бактерий. Если у вас ослабленная иммунная система, что может случиться во время химиотерапии, они могут быть вредными.
Безопасно получать эти вакцины через шесть месяцев после окончания химиотерапии. Перед вакцинацией поговорите со своим терапевтом или лечащей бригадой.
Если кому-то, с кем вы тесно общаетесь, нужна живая вакцина, поговорите со своей терапевтической бригадой или терапевтом.Они могут посоветовать, какие меры предосторожности вам могут потребоваться в зависимости от вакцинации.
Вакцинация против коронавируса (Covid-19)
Людям, проходящим химиотерапию, рекомендуется поговорить со своей лечащей бригадой перед вакцинацией от коронавируса (Covid-19).
Узнайте больше о вакцине от коронавируса.
Вакцинация от гриппа
Любой человек, подверженный риску ослабленной иммунной системы и, следовательно, более подверженный инфекциям, должен иметь вакцину от гриппа. Сюда входят люди, проходящие или уже проходящие химиотерапию.
Вакцина против гриппа не является живой вакциной, поэтому не содержит активных вирусов. Поговорите со своим химиотерапевтом или медсестрой, занимающейся грудным вскармливанием, о том, когда лучше всего делать прививку от гриппа.
10. Дополнительная поддержка
Ваша бригада химиотерапевтов и медсестра, занимающаяся грудным вскармливанием, ответят на любые ваши вопросы. Вы также можете позвонить нам по бесплатному телефону 0808 800 6000 для получения информации и поддержки.
На нашем онлайн-форуме вы можете найти людей, проходящих лечение одновременно с вами, в ежемесячных обсуждениях химиотерапии.
Паклитаксел (Таксол) | Информация о раке
Паклитаксел — химиотерапевтический препарат. Это лечение многих различных видов рака. Его еще называют таксолом.
Как действует паклитаксел
Паклитаксел останавливает раковые клетки от разделения на две новые клетки. Это блокирует рост рака.
Как это у вас
Обычно вы принимаете паклитаксел в виде циклов лечения. У вас может быть это отдельно или с другими химиотерапевтическими препаратами.
У вас есть паклитаксел в виде капель в кровоток (внутривенно). Каждая процедура занимает 1 час, 3 часа или 24 часа.
В ваш кровоток
Вы получаете лечение через тонкую короткую трубку (канюлю), которая вводится в вену на руке каждый раз, когда вы проходите лечение.
Или вы можете пройти курс лечения по длинной очереди: по центральной линии, по линии PICC или по переносной телефонной линии.Это длинные пластиковые трубки, по которым лекарство попадает в большую вену на груди. Трубка остается на месте на протяжении всего курса лечения.
Во время лечения
Вы можете принимать паклитаксел каждую неделю или каждые 2 или 3 недели.
Тесты
У вас есть анализы крови до и во время лечения. Они проверяют уровень ваших кровяных телец и других веществ в крови. Они также проверяют, насколько хорошо работают ваша печень и почки.
Побочные эффекты
Мы не перечислили все побочные эффекты. Очень маловероятно, что у вас появятся все эти побочные эффекты, но некоторые из них могут появиться у вас одновременно.
Частота и тяжесть побочных эффектов может варьироваться от человека к человеку. Они также зависят от того, какие другие методы лечения вы проходите. Например, ваши побочные эффекты могут быть хуже, если вы также принимаете другие лекарства или лучевую терапию.
Когда связываться с вашей командой
Ваш врач, медсестра или фармацевт рассмотрят возможные побочные эффекты.Они будут внимательно следить за вами во время лечения и проверять, как вы приходите на прием. Как можно скорее позвоните в службу поддержки, если:
- у вас серьезные побочные эффекты
- ваши побочные эффекты не улучшаются
- ваши побочные эффекты ухудшаются
Раннее лечение может помочь лучше справиться с побочными эффектами.
Немедленно обратитесь к врачу или медсестре, если у вас есть признаки инфекции, включая температуру выше 37,5 ° C или ниже 36 ° C.
Общие побочные эффекты
Эти побочные эффекты наблюдаются более чем у 10 из 100 человек (10%). У вас может быть один или несколько из них. В их числе:
Риск заражения
Повышенный риск заражения инфекцией связан с падением лейкоцитов. Симптомы включают изменение температуры, боли в мышцах, головные боли, ощущение холода и дрожи, а также общее недомогание. У вас могут быть другие симптомы в зависимости от того, где находится инфекция.
Инфекции иногда могут быть опасными для жизни.Если вы подозреваете, что у вас инфекция, вам следует срочно связаться с вашим советником.
Одышка и бледность
Вы можете задыхаться и выглядеть бледным из-за падения красных кровяных телец. Это называется анемией.
Синяки и кровотечение
Это связано с падением количества тромбоцитов в крови. Эти клетки крови помогают крови свертываться, когда мы порезаемся. После чистки зубов у вас может появиться кровотечение из носа или десен. Или у вас может быть много крошечных красных пятен или синяков на руках или ногах (известных как петехии).
Аллергическая реакция
У вас может возникнуть легкая аллергическая реакция во время или вскоре после лечения. Это может быть сыпь, зуд или покраснение лица.
Обычно вам будут давать лекарства непосредственно перед лечением, чтобы предотвратить или снизить риск аллергической реакции.
Онемение и покалывание в руках и ногах
Онемение или покалывание в пальцах рук или ног часто носит временный характер и может исчезнуть после завершения лечения. Сообщите врачу, если вам трудно ходить или выполнять утомительные задачи, например, застегивать пуговицы.
Низкое артериальное давление (гипотония)
Сообщите своему врачу или медсестре, если вы чувствуете головокружение или головокружение. У вас регулярно проверяют артериальное давление.
Диарея
Обратитесь на свою консультационную линию, если у вас диарея, например, если у вас было 4 или более жидких водянистых стула за 24 часа. Или если вы не можете пить, чтобы восполнить потерю жидкости. Или если это продолжается более 3 дней.
Ваш врач может дать вам лекарство от диареи, чтобы взять с собой домой после лечения.Ешьте меньше клетчатки, избегайте сырых фруктов, фруктовых соков, злаков и овощей и пейте много, чтобы восполнить потерю жидкости.
Чувство или недомогание
Чувство или недомогание обычно хорошо контролируется лекарствами от болезней. Избегать жирной или жареной пищи, есть небольшими порциями и закусками, пить много воды и расслабляться.
Важно принимать лекарства от болезней в соответствии с предписаниями, даже если вы не чувствуете себя плохо. Заболевание легче предотвратить, чем лечить, когда оно началось.
Боль во рту
Язвы и язвы во рту могут быть болезненными. Следите за чистотой рта и зубов; пить много жидкости; избегайте кислых продуктов, таких как апельсины, лимоны и грейпфруты; жуйте жевательную резинку, чтобы поддерживать рот влажным, и сообщите врачу или медсестре, если у вас есть язвы.
Выпадение волос
Вы можете потерять все волосы. Это касается ресниц, бровей, подмышек, ног, а иногда и лобковых волос. Ваши волосы обычно отрастают снова после завершения лечения, но, скорее всего, станут мягче.Он может снова отрасти другого цвета или стать более курчавым, чем раньше.
Боль в мышцах и суставах
Вы можете почувствовать некоторую боль в мышцах и суставах. Поговорите со своим врачом или медсестрой о том, какие обезболивающие вы можете принять, чтобы помочь с этим.
Случайные побочные эффекты
Эти побочные эффекты возникают у 1–10 из 100 человек (от 1 до 10%). У вас может быть один или несколько из них. В их числе:
- медленное сердцебиение
- изменения ногтей и кожи — обычно они незначительны и возвращаются к норме после окончания лечения
- боль, отек, покраснение в месте инъекции
- изменения в работе печени — обычно легкие и бессимптомные. t вызывают симптомы
Редкие побочные эффекты
Эти побочные эффекты возникают менее чем у 1 из 100 человек (1%).У вас может быть один или несколько из них. В их числе:
- аллергическая реакция, требующая лечения, признаки включают изменение кровяного давления, одышку, крапивницу, боль, учащенное сердцебиение, озноб
- изменения в сердце, включая сердечный приступ
- воспаление кровеносных сосудов
- высокое кровяное давление
- сгустки крови, которые могут быть опасными для жизни; Признаками являются боль, отек и покраснение в месте скопления. Ощущение одышки может быть признаком тромба в легком.
- изменения в легочной ткани, которые могут вызвать кашель и одышку. В редких случаях это может быть опасно для жизни.
Если у вас есть какие-либо симптомы этих побочных эффектов, немедленно обратитесь к врачу или по консультационной линии.
Как справиться с побочными эффектами
У нас есть дополнительная информация о побочных эффектах и советы, как с ними бороться.
Что еще я должен знать?
Лекарства, продукты питания и напитки прочие
Лекарства от рака могут взаимодействовать с некоторыми другими лекарствами и растительными продуктами.Сообщите своему врачу или фармацевту о любых лекарствах, которые вы принимаете. Сюда входят витамины, травяные добавки и лекарства, отпускаемые без рецепта.
Спирт
Некоторые марки этого препарата содержат алкоголь (равный половине стакана вина или половине пинты пива) и могут вызвать у вас сонливость или головокружение, особенно если вы выпили алкоголь. Не управляйте механизмами и не садитесь за руль, если чувствуете сонливость.
Потеря плодородия
Возможно, вы не сможете забеременеть или стать отцом ребенка после лечения этим препаратом.Поговорите со своим врачом перед началом лечения, если вы думаете, что можете иметь ребенка в будущем.
Мужчины могут хранить сперму до начала лечения. А женщины могут хранить яйцеклетки или ткань яичников. Но эти услуги доступны не во всех больницах, поэтому вам нужно будет спросить об этом своего врача.
Беременность и контрацепция
Неизвестно, может ли лечение нанести вред ребенку, развивающемуся в утробе матери. Во время лечения важно не забеременеть и не стать отцом.
Поговорите со своим врачом или медсестрой об эффективных противозачаточных средствах, которые можно использовать во время лечения. Спросите, как долго вам следует использовать его до начала лечения и после его окончания.
Лечение других заболеваний
Всегда сообщайте другим врачам, медсестрам, фармацевтам или стоматологам, что вы проходите это лечение, если вам нужно лечение от чего-либо еще, включая проблемы с зубами.
Грудное вскармливание
Не кормите грудью во время этого лечения, поскольку препарат может попасть в грудное молоко.
Иммунизация
Не делайте иммунизацию живыми вакцинами во время лечения и в течение 12 месяцев после него. Продолжительность зависит от вашего лечения. Спросите своего врача или фармацевта, как долго вам следует избегать вакцинации живыми вакцинами.
В Великобритании живые вакцины включают краснуху, эпидемический паротит, корь, БЦЖ, желтую лихорадку и вакцину против опоясывающего лишая (Zostavax).
Вы можете:
- есть другие вакцины, но они могут не дать вам такой же защиты, как обычно
- иметь вакцину от гриппа (в виде инъекции)
Контакт с другими людьми, которым сделали прививки — Вы можете контактировать с другими людьми, которым были сделаны инъекции живых вакцин.Избегайте тесного контакта с людьми, которым недавно были сделаны пероральные живые вакцины (пероральные вакцины), такие как пероральная вакцина против брюшного тифа.
Если ваша иммунная система сильно ослаблена, вам следует избегать контактов с детьми, которым была сделана вакцина против гриппа в виде назального спрея. Это в течение 2 недель после вакцинации.
Младенцы получают живую ротавирусную вакцину. Вирус находится в помете ребенка около 2 недель и может вызвать у вас заболевание, если у вас низкий иммунитет. Если можете, попросите кого-нибудь поменять подгузники в это время.Если это невозможно, хорошо вымойте руки после смены подгузника.
Подробнее об этом лечении
Для получения дополнительной информации об этом лечении перейдите на веб-сайт Электронного Компендиума лекарств (eMC).
Вы можете сообщать о любых побочных эффектах в Управление по контролю за качеством лекарственных средств (MHRA) в рамках их схемы желтых карточек.
iWantGreatCare позволяет пациентам оставлять отзывы о своем опыте приема того или иного препарата.Отзывы поступают от отдельных пациентов. Это не информация и не медицинский совет от Cancer Research UK.
FDA предоставило приоритетный обзор схемы перорального приема паклитаксела при метастатическом раке молочной железы
01 сентября 2020
1 мин чтения
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
FDA предоставило приоритетный обзор пероральным паклитакселу и энцекидару для лечения метастатического рака молочной железы.
Рандомизированное исследование фазы 3 сравнивало комбинацию перорального паклитаксела и энцекидара (Athenex) — нового, высокоспецифичного, мощного ингибитора помпы P-гликопротеина, который увеличивает абсорбцию перорального паклитаксела — с внутривенным введением паклитаксела среди женщин с метастатическим раком груди.
Источник: Adobe Stock.Как ранее сообщал Healio, пероральный режим значительно улучшил общую скорость ответа по сравнению с внутривенным введением паклитаксела и, по-видимому, ассоциировался с более низким уровнем нейропатии.
Ожидается, что FDA примет решение по заявке на новый препарат для этой схемы к 28 февраля.
«Мы продолжаем завершать наши коммерческие приготовления, чтобы обеспечить успешный запуск перорального паклитаксела, если он будет одобрен», — говорится в опубликованном компанией пресс-релизе Джонсон Лау, MBBS, MD, FRCP, , председатель и главный исполнительный директор Athenex.«Мы рассматриваем пероральный паклитаксел как потенциально важную альтернативу внутривенным инфузиям, особенно во время текущей пандемии, поскольку он может позволить [больным раком] принимать пероральные химиотерапевтические препараты дома».
ДОБАВИТЬ ТЕМУ В ОПОВЕЩЕНИЯ ПО ЭЛЕКТРОННОЙ ПОЧТЕ
Получать электронное письмо, когда новые статьи публикуются на
Укажите свой адрес электронной почты, чтобы получать сообщения о публикации новых статей.Подписаться Нам не удалось обработать ваш запрос. Пожалуйста, повторите попытку позже. Если у вас по-прежнему возникает эта проблема, обратитесь по адресу [email protected].Вернуться в Healio
1 | Чен В., Чжэн Р., Бааде PD, Чжан С., Цзэн H, Bray F, Jemal A, Yu XQ и He J: Статистика рака в Китае, 2015 г.CA Cancer J Clin. 66: 115–132. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
2 | Сигел Р.Л., Миллер К.Д. и Джемал А: Рак. статистика, 2016. CA Cancer J Clin. 66: 7–30. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
3 | Секереш Т. и Новотны Л.: Новые цели и препараты в химиотерапии рака. Med Princ Pract. 11: 117–125. 2002 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
4 | Ву Э.С., Одуйебо Т., Кобб Л.П., Чолакиан Д., Kong X, Fader AN, Levinson KL, Tanner EJ III, Stone RL, Пиотровски А и др.: Лимфопения и ее связь с выживаемостью у пациентов. при местнораспространенном раке шейки матки.Gynecol Oncol. 140: 76–82. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
5 | Сидерис С, Аун Ф, Занати М, Мартинес NC, Latifyan S, Awada A и Gil T: эффективность еженедельного приема паклитаксела лечение в виде химиотерапии с одним агентом лечение цисплатином при уротелиальном раке мочевого пузыря. Мол Клин Онкол. 4: 1063–1067. 2016.PubMed / NCBI |
6 | Dilruba S и Kalayda GV: на основе платины наркотики: прошлое, настоящее и будущее.Cancer Chemother Pharmacol. 77: 1103–1124. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
7 | Пан Х, Чжан Х, Сун Х, Чжан Дж, Ян М. и Чжан Х .: Ингибирование аутофагии способствует индуцированию 5-фторураци апоптоз путем стимуляции образования АФК в немелкоклеточном легком человека раковые клетки A549. PLoS One. 8: e5667. Просмотр статьи: Google Scholar: PubMed / NCBI |
8 | Эмади А., Джонс Р. Дж. И Бродский Р. А.: Циклофосфамид и рак: Золотая годовщина.Нат Рев Клин Онкол. 6: 638–647. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
9 | Ванхофер Ю, Харстрик А, Ахтеррат З, Cao S, Seeber S и Rustum YM: Иринотекан в лечении колоректальный рак: клинический обзор. J Clin Oncol. 19: 1501–1518. 2001. Просмотр статьи: Google Scholar: PubMed / NCBI |
10 | Сюй Т, Цинь Л, Чжу З., Ван Х, Лю И, Фань Y, Чжун С., Ван Х, Чжан Х, Ся Л. и др.: MicroRNA-31 функционирует как супрессор опухолей и увеличивает чувствительность к митомицину-C в уротелиальный рак мочевого пузыря, нацеленный на интегрин α5.Oncotarget. 7: 27445–27457. 2016.PubMed / NCBI |
11 | Пэ ИДжей, Юн И, Юн Ти Джей и Ли ХД: Доставка миРНК и химиотерапевтического препарата под контролем ультразвука с помощью с использованием микропузырьковых комплексов: оценки in vitro и in vivo в модель рака простаты. Корейский J Radiol. 17: 497–508. 2016 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
12 | Чжоу Ц., Е М, Лу И, Чжан Х, Чен Цюй, Хуан S и Su S: куркумин улучшает противоопухолевый эффект митомицина С. подавляя экспрессию ABCG2 при раке молочной железы, подобном стволовым клеткам клетки.PLoS One. 10: e01366942015. Просмотр статьи: Google Scholar: PubMed / NCBI |
13 | Вэй З, Лян Л, Цзюньсонг Л, Жуй Ц., Шуай Ц., Гуанлин К., Шицай Х., Цзексинг В., Цзинь В., Сянмин С. и др.: влияние инсулина на химиотерапевтическую чувствительность к 5-фторурацилу в клеточных линиях рака желудка SGC7901, MKN45 и MKN28. J Exp Clin Cancer Res. 34: 642015. Просмотр статьи: Google Scholar: PubMed / NCBI |
14 | Талекар М., Оуян К., Гольдберг М.С. и Амиджи ММ: Совместное действие ПКМ-2 и МЛУ-1 повышает чувствительность к множественной лекарственной устойчивости. клетки рака яичников к паклитакселу на мышиной модели яичников рак.Mol Cancer Ther. 14: 1521–1531. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
15 | Кенисер Дж., Спирс М., Литтл Н., Тейлор К. Дж., Ляо Л., Каннингем, Калифорния, Ламброс М., Маккей А., Яо С., Рейс-Филхо Дж. И др. al: Молекулярная характеристика устойчивых к изогенному таксану клеток линии определяют новые движущие силы лекарственной устойчивости. BMC Рак. 14: 762–772. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
16 | Мартин А.Дж., Альфонсо П.Г., Руперес А.Б. и Хименес М.М.: Наб-паклитаксел плюс гемцитабин в качестве препарата первой линии паллиативная химиотерапия у пациента с метастатическим поражением поджелудочной железы. рак со статусом эффективности Восточной кооперативной онкологической группы из 2.Oncol Lett. 12: 727–730. 2016.PubMed / NCBI |
17 | Эбара С., Кобаяси Ю., Сасаки К., Араки М., Сугимото М., Вада К., Фуджио К., Такамото А., Ватанабе Т., Янаи Х и др. al: Случай метастатического урахального рака, включая нейроэндокринный компонент, обработанный гемцитабином, цисплатином и паклитакселом комбинированная химиотерапия. Acta Med Okayama. 70: 223–227. 2016.PubMed / NCBI |
18 | Kalaghchi B, Abdi R, Amouzegar-Hashemi F, Эсмати Э. и Алихаси А: одновременное химиолучевое лечение с еженедельным паклитаксел и цисплатин при местнораспространенном раке шейки матки.Азиатский Pac J Cancer Prev. 17: 287–291. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
19 | Йилмаз А., Альп Э., Онен Х.И. и Меневсе С. Снижение экспрессии мРНК BCL2 и CCND1 при раке шейки матки человека Клетки HeLa обрабатывали комбинацией эверолимуса и паклитаксела. Contemp Oncol (Познань). 20: 28–32. 2016.PubMed / NCBI |
20 | Trendowski M, Christen TD, Acquafondata C и Fondy TP: Эффекты конгенеров цитохалазина, агенты, направленные на микротрубочки, и доксорубицин отдельно или в комбинация против клеточных линий карциномы яичников человека in vitro.BMC Рак. 15: 632–645. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
21 | ван дер Нолл Р., Маркетти С., Стигс Н., Beijnen JH, Mergui-Roelvink MW, Harms E, Rehorst H, Sonke GS и Schellens JH: Долгосрочная безопасность и противоопухолевое действие олапариба монотерапия после комбинации карбоплатина и паклитаксела в пациенты с запущенным раком груди, яичников или маточной трубы. Br J Рак. 113: 396–402. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
22 | Хуан Л., Чен С., Ян В., Сюй Б., Хуан Т., Ян Х, Чжэн Х, Ван И, Сонг Э, Чжан Дж и др.: Эффективность и анализ безопасности схемы на основе трастузумаба и паклитаксела плюс карбоплатин или эпирубицин в качестве неоадъювантной терапии на клинической стадии II – III, HER2-положительные пациенты с раком молочной железы: фаза A 2, открытое, многоцентровое, рандомизированное исследование.Oncotarget. 6: 18683–18692. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
23 | Сяо Б, Си Х, Хан МК, Вьеннуа Э, Чжан М и Merlin D: совместная доставка камптотецина и куркумина катионными полимерные наночастицы для синергетической комбинации рака толстой кишки химиотерапия. J Mater Chem B Mater Biol Med. 3: 7724–7733. 2015 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
24 | Цуда Н, Ватари Х и Ушидзима К.: Химиотерапия и молекулярная таргетная терапия при рецидиве шейки матки рак.Chin J Cancer Res. 28: 241–253. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
25 | Schwab CL, английский DP, Roque DM и Santin AD: Таксаны: их влияние на гинекологические злокачественные новообразования. Противоопухолевый Наркотики. 25: 522–535. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
26 | Вани М.С. и Хорвиц С.Б.: Природа как замечательный химик: личная история открытия и разработка Taxol.Противораковые препараты. 25: 482–487. 2014 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
27 | Уивер Б.А.: Как убивает таксол / паклитаксел раковые клетки. Mol Biol Cell. 25: 2677–2681. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
28 | Чжан Д., Ян Р, Ван С. и Дун З .: Паклитаксел: новое применение старого препарата. Drug Des Devel Ther. 8: 279–284. 2014.PubMed / NCBI |
29 | Такашима С., Киёто С., Такахаши М., Хара F, Aogi K, Ohsumi S, Mukai R и Fujita Y: клинический опыт применения паклитаксел, связанный с альбумином в виде наночастиц, новый таксановый противоопухолевый препарат агент, и лечение нежелательных явлений у женщин с грудью рак.Oncol Lett. 9: 1822–1826. 2015.PubMed / NCBI |
30 | Chen NC, Chyau CC, Lee YJ, Tseng HC и Chou FP: Продвижение митотической катастрофы через активацию PTEN посредством паклитаксел с добавкой водного экстракта шелковицы в мочевом пузыре раковые клетки. Научный доклад 6: 204172016. Просмотр статьи: Google Scholar: PubMed / NCBI |
31 | Чжун Ц.Ф., Тан В., Ван С.П., Цян В.А. и Ван Ю.Т .: Антипролиферативная активность и индуцированная остановка клеточного цикла эводиамином на чувствительные к паклитакселу и устойчивые к паклитакселу яичники человека раковые клетки.Sci Rep.5: 164152015. Просмотр статьи: Google Scholar: PubMed / NCBI |
32 | Лю К., Цан С., Ма И и Чиао Дж. У.: Синергетический эффект паклитаксела и эпигенетического агента фенэтил изотиоцианат на ингибирование роста, остановку клеточного цикла и апоптоз в клетках рака груди. Cancer Cell Int. 13: 102013. Просмотр статьи: Google Scholar: PubMed / NCBI |
33 | Такатори Э., Сёдзи Т., Кумагаи С., Савай Т., Куросе А и Сугияма Т: агенты платины, паклитаксел и иринотекан эффективен при светлоклеточном раке яичника? ДНК повреждение, обнаруженное с помощью γh3AX, вызванное противораковыми агентами.J Яичники Res. 5: 162012. Просмотр статьи: Google Scholar: PubMed / NCBI |
34 | Хариса Г.И., Ибрагим М.Ф., Аланази Ф. и Шазлы Г.А.: Конструирование эритроцитов как нового носителя адресная доставка противоопухолевого препарата паклитаксела. Сауди Фарм Дж. 22: 223–230. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
35 | Wu ZH, Lu MK, Hu LY и Li X: празиквантел синергетически повышает эффективность паклитаксела в подавлении раковых клеток рост.PLoS One. 7: e517212012. Просмотр статьи: Google Scholar: PubMed / NCBI |
36 | Ли СМ, Лу И, Чен Дж, Костелло Т.А., Нараянан Р., Далтон М.Н., Снайдер Л.М., Ан С., Ли В., Миллер Д.Д. и др.: Пероральные биодоступные антагонисты тубулина для резистентных к паклитакселу рак. Pharm Res. 29: 3053–3063. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
37 | Остендорп Р.Л., пряжка Т, Ламберт Г., Гарриге Дж. С., Бейнен Дж. Х., Шелленс Дж. Х. и ван Теллинген О. Паклитаксел в самоэмульгирующихся формах: пероральный Исследование биодоступности на мышах.Инвестируйте в новые лекарства. 29: 768–776. 2010 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
38 | Borst P и Schinkel AH: P-гликопротеин ABCB1: крупный игрок в сфере обращения с наркотиками млекопитающими. J Clin Invest. 123: 4131–4133. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
39 | Sui H, Fan ZZ и Li Q: сигнал пути трансдукции и механизмы транскрипции ABCB1 / Pgp-опосредованная множественная лекарственная устойчивость в раковых клетках человека.J Int Med Res. 40: 426–435. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
40 | Ким Х, Пак Дж. Э., Ли Дж. Э. и Ким Дж. Х .: А рецептор-2 лейкотриена B4 связан с устойчивостью к паклитакселу в клетках рака молочной железы MCF-7 / DOX. Br J Рак. 109: 351–359. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
41 | Ран X, Ян Дж., Лю Ц., Чжоу П., Сяо Л. и Чжан К. MiR-218 ингибирует опосредованную HMGB1 аутофагию в эндометрии клетки карциномы во время химиотерапии.Int J Clin Exp Pathol. 8: 6617–6626. 2015.PubMed / NCBI |
42 | Ян Х, Айер АК, Сингх А, Чой Э, Хорничек FJ, Amiji MM и Duan Z: загруженная миРНК MDR1 на основе гиалуроновой кислоты Системы наночастиц, нацеленных на CD44, обходят устойчивость к паклитакселу при раке яичников. Научный доклад 5: 850 . Просмотр статьи: Google Scholar: PubMed / NCBI |
43 | Ян Х, Айер А.К., Сингх А., Милан Л., Чой Э, Хорничек Ф. Дж., Амиджи М. М. и Дуан З .: Кластер дифференциации 44 нацеленные наночастицы на основе гиалуроновой кислоты для миРНК MDR1 доставка для преодоления лекарственной устойчивости при раке яичников.Pharm Res. 32: 2097–2109. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
44 | Мао К., Лю Ф, Лю Х, Хури Ф. Р., Маркус А. И., Ли М. и Чжоу В. Повторная экспрессия LKB1 в мутантных по LKB1 клетках EKVX. приводит к устойчивости к паклитакселу за счет активации MDR1 выражение. Рак легких. 88: 131–138. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
45 | Чен С.Ю., Ху С.С., Донг Ц., Цай Дж. Х., Чжан В.П., Sun JY, Wang TT, Xie J, He HR, Xing JF и др.: Создание линия клеток рака молочной железы, устойчивого к паклитакселу, и модели голых мышей, и лежащие в основе механизмы множественной лекарственной устойчивости in vitro и in vitro. естественным образом.Азиатский Pac J Cancer Prev. 14: 6135–6140. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
46 | Януховский Р, Войтович К, Суйка-Кордовска П., Анджеевская М. и Забель М.: экспрессия гена MDR анализ шести линий клеток рака яичников, устойчивых к лекарствам. БиоМед Res Int. 2013: 2417632013. Просмотр статьи: Google Scholar: PubMed / NCBI |
47 | Ву Джи, Цинь XQ, Го Джи Джей, Ли Тай и Чен Джи: Активация AKT / ERK связана с клеткой рака желудка устойчивость к паклитакселу.Int J Clin Exp Pathol. 7: 1449–1458. 2014.PubMed / NCBI |
48 | Jeong JY, Kim KS, Moon JS, Song JA, Choi SH, Ким KI, Kim TH и An HJ: целенаправленное ингибирование фосфатидила инозитол-3-киназа p110β, но не p110α, усиливает апоптоз и чувствительность к паклитакселу при химиорезистентном раке яичников. Апоптоз. 18: 509–520. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
49 | Лю З., Чжу Дж., Гетценберг Р.Х. и Велтри Р.В.: Повышенная регуляция киназных путей PI3K / Akt и MAP связана с с резистентностью к лекарственным средствам, направленным на микротрубочки, при раке простаты.J Cell Biochem. 116: 1341–1349. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
50 | Мэй М, Се Д, Чжан И, Цзинь Дж, Ю Ф, Ли И, Дай Дж и Чен Икс: новый 2α, 5α, 10β, 14β-тетраацетокси-4 (20), производное 11-таксадиена (SIA) преодолевает устойчивость к паклитакселу путем ингибирования передачи сигналов MAPK и увеличение накопления паклитаксела в клетках рака молочной железы. PLoS Один. 9: e1043172014. Просмотр статьи: Google Scholar: PubMed / NCBI |
51 | Чжоу М., Фань Ц. и Тиан Н .: Эффекты куркумин на профиль экспрессии генов клеток L-02.Biomed Rep. 3: 519–526. 2015.PubMed / NCBI |
52 | Чжан И, Лян Д., Донг Л, Гэ Х, Сюй Ф, Чен W, Dai Y, Li H, Zou P, Yang S и др.: Противовоспалительные эффекты новые аналоги куркумина при экспериментальном остром повреждении легких. Респир Res. 16: 432015. Просмотр статьи: Google Scholar: PubMed / NCBI |
53 | Fan Z, Yao J, Li Y, Hu X, Shao H и Tian X: Противовоспалительное и антиоксидантное действие куркумина при острых заболеваниях. Повреждение легкого в модели реперфузии ишемии кишечника на грызунах путем ингибирование пути NF-κB.Int J Clin Exp Pathol. 8: 3451–3459. 2015.PubMed / NCBI |
54 | Феррейра В.Х., Назли А., Диззелл С.Е., Мюллер K и Kaushic C: противовоспалительное действие куркумина. защищает эпителиальный барьер слизистой оболочки половых органов от разрушения и блокирует репликацию ВИЧ-1 и ВПГ-2. PLoS One. 10: e0124 15. Просмотр статьи: Google Scholar: PubMed / NCBI |
55 | Роблес-Эскажеда Э, Дас У, Ортега, Нью-Мексико, Парра К., Франсия Дж., Диммок-младший, Варела-Рамирес А. и Агилера Р. Дж.: Роман куркуминоподобный диенон вызывает апоптоз в трижды отрицательной груди раковые клетки.Сотовый Онкол (Дордр). 39: 265–277. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
56 | Park W, Amin AR, Chen ZG и Shin DM: новинка перспективы куркумина в профилактике рака. Рак Назад Res (Фила). 6: 387–400. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
57 | Чжоу Х., Биверс К.С. и Хуанг С. цели куркумина. Curr Drug Targets. 12: 332–347.2011 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
58 | Филип М., Роули Д.А. и Шрайбер Х .: Воспаление как промотор опухоли в индукции рака. Семин Рак Биол. 14: 433–439. 2004. Просмотр статьи: Google Scholar: PubMed / NCBI |
59 | Цао Ф, Лю Т., Сюй И, Сюй Д и Фэн С. Куркумин подавляет пролиферацию клеток и способствует апоптозу в клетка остеокластомы человека посредством передачи сигналов MMP-9, NF-κB и JNK пути.Int J Clin Exp Pathol. 8: 6037–6045. 2015.PubMed / NCBI |
60 | Бансал СС, Гоэль М., Акил Ф., Вадханам М.В. и Gupta RC: передовые системы доставки куркумина для лечения рака химиопрофилактика. Рак Prev Res (Phila). 4: 1158–1171. 2011 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
61 | Гуань Ф, Дин И, Чжан И, Чжоу И, Ли М и Ван С: Куркумин подавляет распространение и миграцию MDA-MB-231 клетки рака молочной железы через Akt, зависимые от аутофагии деградация.PLoS One. 11: e01465532016. Просмотр статьи: Google Scholar: PubMed / NCBI |
62 | Collett GP и Campbell FC: куркумин индуцирует зависимый от N-концевой киназы c-jun апоптоз в HCT116 человека раковые клетки толстой кишки. Канцерогенез. 25: 2183–2189. 2004. Просмотр статьи: Google Scholar: PubMed / NCBI |
63 | Ли Икс, Лу И, Джин И, Сон Дж. К., Ли Ш. и Чанг Х.В.: Куркумин подавляет активацию иммуноглобулина. е-опосредованные тучные клетки и пассивная системная анафилаксия у мышей путем снижение уровня эйкозаноидов и гистамина в сыворотке.Биомол Тер (Сеул). 22: 27–34. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
64 | Лю Д и Чен З: эффект куркумина на клетки рака груди. J Рак груди. 16: 133–137. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
65 | Астути П.Д., Утами Э., Нуграхани А.В. и Суджади С: Генистеин отменяет задержку G2, вызванную куркумином в p53 дефицитные клетки T47D.Дару. 20: 822012. Просмотр статьи: Google Scholar: PubMed / NCBI |
66 | Чэн Ц., Цзяо Дж. Т., Цянь И, Го XY, Хуан Дж., Дай МС, Чжан Л., Дин ХР, Цзун Д. и Шао Дж. Ф .: Куркумин индуцирует G2 / M останавливает и запускает апоптоз через передачу сигналов FoxO1 у человека U87. клетки глиомы. Mol Med Rep. 13: 3763–3770. 2016.PubMed / NCBI |
67 | Eom DW, Lee JH, Kim YJ, Hwang GS, Kim SN, Квак Дж. Х., Чеон Дж. Дж., Ким К. Х., Джанг Х. Дж., Хэм Дж. И др.: Synergistic влияние куркумина на противоопухолевые препараты, вызванные эпигаллокатехин галлатом действие на клетки рака предстательной железы PC3.BMB Rep. 48: 461–466. 2015 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
68 | Сяо Дж, Чу Й, Ху К., Ван Дж, Хуан Ю, Цзян C, Liang G и Li X: Синтез и биологический анализ нового аналог куркумина для повышения противоопухолевой активности в клетках HepG 2. Oncol Rep. 23: 1435–1441. 2010.PubMed / NCBI |
69 | Чжан И, Цзян Х, Пэн К., Чен С, Фу Л, Ван З., Фэн Дж., Лю З., Чжан Х., Лян Дж. И др .: Открытие и оценка новых противовоспалительных производных натуральных биоактивный куркумин.Drug Des Devel Ther. 8: 2161–2171. 2014.PubMed / NCBI |
70 | Чжан И, Чжао Ц., Хэ В, Ван З, Фанг Ц., Сяо Б., Лю З., Лян Дж. И Ян С.: открытие и оценка асимметричные монокарбонильные аналоги куркумина как противовоспалительные агенты. Drug Des Devel Ther. 8: 373–382. 2014.PubMed / NCBI |
71 | Оливера А., Мур Т.В., Ху Ф., Браун А.П., Солнце А, Лиотта Д.К., Снайдер Дж. П., Юн Й, Шим Х, Маркус А. И. и др.: Ингибирование сигнального пути NF-κB аналогом куркумина, 3,5-Бис (2-пиридинилметилиден) -4-пиперидон (EF31): Противовоспалительные и противораковые свойства.Int Immunopharmacol. 12: 368–377. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
72 | Торре Л.А., Брей Ф., Сигель Р.Л., Ферли Дж., Lortet-Tieulent J и Jemal A: Глобальная статистика рака, 2012. CA Рак J Clin. 65: 87–108. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
73 | Balanda M, Quiero A, Vergara N, Espinoza Дж., Мартин Х.С., Рохас Дж. И Рамирес Э.: Распространенность человеческого папилломавирусная инфекция среди женщин с раком шейки матки скрининг в Чили, 2014–2015 гг.Мед Микробиол Иммунол (Берл). 205: 585–594. 2016. Просмотр статьи: Google Scholar |
74 | Бава С.В., Пулиаппадамба В.Т., Дипти А., Наир A, Карунагаран Д. и Анто Р.Дж.: Повышение чувствительности к таксол-индуцированной апоптоз куркумином включает подавление ядерной фактор-каппаВ и серин / треонинкиназа Akt и независимо от полимеризации тубулина. J Biol Chem. 280: 6301–6308. 2005. Просмотр статьи: Google Scholar: PubMed / NCBI |
75 | Бава SV, Sreekanth CN, Туласидасан AKT, Анто Н.П., Чериян В.Т., Пулияпадамба В.Т., Менон С.Г., Равичандран С.Д. и Anto RJ: Akt находится выше по течению, а MAPK находятся ниже по течению от NF-κB в паклитаксел-индуцированные сигнальные события выживания, которые подавляется куркумином, способствуя их синергизму.Int J Biochem Cell Biol. 43: 331–341. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI |
76 | Sreekanth CN, Bava SV, Sreekumar E и Anto RJ: Молекулярные доказательства хемосенсибилизирующей эффективности липосомальный куркумин в химиотерапии паклитакселом на мышиных моделях рак шейки матки. Онкоген. 30: 3139–3152. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI |
77 | Данг Ю.П., Юань XY, Тянь Р., Ли Д.Г. и Лю В. Куркумин улучшает апоптоз, вызванный паклитакселом, у ВПЧ-положительных клетки рака шейки матки человека через путь NF-κB-p53-caspase-3.Exp Ther Med. 9: 1470–1476. 2015.PubMed / NCBI |
78 | Punfa W, Suzuki S, Pitchakarn P, Yodkeeree S, Naiki T, Takahashi S и Limtrakul P: PLGA, содержащий куркумин наночастицы, конъюгированные с антителом против P-гликопротеина, преодолеть множественную лекарственную устойчивость. Азиатский Pac J Cancer Prev. 15: 9249–9258. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
79 | Faião-Flores F, Suarez JAQ, Pardi PC и Мария Д.А.: ДМ-1, натрий 4- (5- (4-гидрокси-3-метоксифенил) -3-оксопента-1,4-диенил) -2-метоксифенолят: Аналог куркумина с синергическим действием в сочетании с паклитаксел в лечении рака груди.Tumor Biol. 33: 775–785. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
80 | Банерджи М., Сингх П. и Панда Д.: куркумин подавляет динамическую нестабильность микротрубочек, активирует митотическая контрольная точка и индуцирует апоптоз в клетках MCF-7. FEBS J. 277: 3437–3448. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI |
81 | Чжань И, Чен И, Лю Р, Чжан Х и Чжан Y: Усиление активности паклитаксела куркумином в груди человека. раковые клетки путем модуляции апоптоза и ингибирования передачи сигналов EGFR.Arch Pharm Res. 37: 1086–1095. 2014. Просмотр статьи: Google Scholar: PubMed / NCBI |
82 | Бозтас А.О., Каракузу О, Галанте Г., Угур З., Коджабас Ф., Алтунтас Ч.З., Язайдин А.О .: Синергетическое взаимодействие паклитаксел и куркумин с полимерным комплексообразованием циклодекстрина в раковые клетки человека. Mol Pharm. 10: 2676–2683. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
83 | Тадакапалли Р., Аафрин А., Аукунуру Дж., Хабибуддин М. и Джогала С. Подготовка и характеристика Наночастицы ПЭГ-альбумин-куркумин, предназначенные для лечения рака груди.Индийский J Pharm Sci. 78: 65–72. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
84 | Ройт М., Мукерджи С., Саркар Р. и Бисвас J: Куркумин сенсибилизирует химиотерапевтические препараты за счет модуляции PKC, теломераза, NF-kappaB и HDAC при раке груди. Ther Deliv. 2: 1275–1293. 2011. Просмотр статьи: Google Scholar: PubMed / NCBI |
85 | Аггарвал BB, Шисодиа С, Такада Y, Banerjee S, Newman RA, Bueso-Ramos CE и Price JE: куркумин подавляет индуцированный паклитакселом путь ядерного фактора-каппаВ в клетки рака молочной железы и подавляет метастазирование в легкие груди человека рак у голых мышей.Clin Cancer Res. 11: 7490–7498. 2005 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
86 | Кан Х. Дж., Ли Ш., Прайс Дж. Э. и Ким Л. С.: Куркумин подавляет индуцированный паклитакселом ядерный фактор-каппаВ в клеток рака молочной железы и усиливает эффект ингибирования роста паклитаксел на модели голых мышей с раком груди. Грудь J. 15: 223–229. 2009. Просмотр статьи: Google Scholar: PubMed / NCBI |
87 | Ван Дж, Ван Ф, Ли Ф, Чжан В, Шэнь Й, Zhou D и Guo S: многофункциональный поли (куркумин) наномедицин для двухмодальная нацеленная доставка, внутриклеточное ответное высвобождение, двойное лекарственное лечение и визуализация рака с множественной лекарственной устойчивостью клетки.J Mater Chem B Mater Biol Med. 4: 2954–2962. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
88 | Ганта С., Девалапалли Х. и Амиджи М.: Куркумин повышает биодоступность при приеме внутрь и повышает противоопухолевое терапевтическое действие. эффективность паклитаксела при введении в наноэмульсии формулировка. J Pharm Sci. 99: 4630–4641. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI |
89 | Иннама А, Джексон Л., Ашер В., фургон Шалквик Г., Уоррен А., Кейтли А., Хэй Д., Бали А., Соутер Н. и Хан Р: Выражение и эффекты модуляции калия K2P каналы TREK-1 (KCNK2) и TREK-2 (KCNK10) у нормального человека яичников и эпителиальный рак яичников.Clin Transl Oncol. 15: 910–918. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
90 | Дэн С., Сюй Дж., Ли Р и Чжоу Q: подавляющие эффект нагруженных куркумином твердых липидных наночастиц в сочетании с паклитаксел на линии клеток рака яичников человека НО-8910. Китай Аптека. 24: 1756–1759. 2013. http://en.cnki.com.cn/Article_en/CJFDTOTAL-ZGYA201319013.htm |
91 | Abouzeid AH, Patel NR, Sarisozen C и Торчилин В.П. Полимерные мицеллы, нацеленные на трансферрин, совместно загружены с куркумином и паклитакселом: эффективное уничтожение устойчивые к паклитакселу раковые клетки.Pharm Res. 31: 1938–1945. 2014 г. Просмотр статьи: Google Scholar: PubMed / NCBI |
92 | Лю З., Чжу Й., Ли З.Й. и Нин С.К .: Оценка эффективности комбинации паклитаксела с куркумином в раковых клетках яичников. Oncol Lett. 12: 3944–3948. 2016.PubMed / NCBI |
93 | Кар Р., Шарма К., Сен С., Джайн С. К., Гупта С. Д. и Сингх Н. Ответ первичной культуры рака яичников человека. клетки к химиотерапии: индивидуальная терапия in vitro.J Рак Res Ther. 12: 1050–1055. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
94 | Галия А., Калоджеро А.Е., Кондорелли Р., Fraggetta F, La Corte A, Ridolfo F, Bosco P, Castiglione R и Салеми М: экспрессия белка PARP-1 в мультиформной глиобластоме. Евро J Histochem. 56: e. Просмотр статьи: Google Scholar: PubMed / NCBI |
95 | Хоссейн М., Баник Н.Л. и Рэй С.К .: Синергетические противораковые механизмы куркумина и паклитаксела для подавление роста стволовых клеток опухоли головного мозга человека и LN18 и Клетки U138MG.Neurochem Int. 61: 1102–1113. 2012. Просмотр статьи: Google Scholar: PubMed / NCBI |
96 | Манджу С., Шарма С.П. и Шринивасан К. Целевое совместное введение труднорастворимого паклитаксела и куркумин в раковые клетки с помощью поверхностно-модифицированного магнитного наночастицы. J Mater Chem. 21: 15708–15717. 2011. Просмотр статьи: Google Scholar |
97 | Цуй И, Чжан М, Цзэн Ф, Цзинь Х, Сюй Кью и Хуан И .: Магнитные наночастицы PLGA с двойным нацеливанием для доставки кода паклитаксела и куркумина для терапии опухолей головного мозга.ACS Appl Mater Интерфейсы. 8: 32159–32169. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
98 | Камат А.М., Сетхи Дж. И Аггарвал ББ: Куркумин усиливает апоптотические эффекты химиотерапевтических препаратов. агентов и цитокинов за счет подавления ядерной генные продукты, регулируемые фактором-каппаВ и ядерным фактором-каппаВ в IFN-альфа-чувствительный и IFN-альфа-устойчивый рак мочевого пузыря человека клетки. Mol Cancer Ther. 6: 1022–1030. 2007. Просмотр статьи: Google Scholar: PubMed / NCBI |
99 | Чжао Х, Ю Х, Ци Р, Шан Ф и Су З: Подавляющее действие куркумина в сочетании с паклитакселом на Модель ксенотрансплантата рака простаты.Сяндай Шэнву Исюэ Цзиньчжань. 10: 823–827. 2010. (на китайском языке). |
100 | Wand D, Qi R, Zhao H и Yu X: эффекты куркумин в сочетании с паклитакселом на вторжение и старение клетки карциномы предстательной железы человека PC3. Сяндай Шэнву Исюэ Цзиньчжань. 12: 6239–6241. 2012. (на китайском языке). |
101 | Хуанг Ю.Т., Хуан Д.М., Чуэ С.К., Тэн С.М. и Guh JH: ацетат Alisol B, тритерпен из Alismatis rhizoma, индуцирует ядерную транслокацию Bax и апоптоз у человека гормонорезистентные клетки рака простаты PC-3.Cancer Lett. 231: 270–278. 2006. Просмотр статьи: Google Scholar: PubMed / NCBI |
102 | Томас С.Л., Чжун Д., Чжоу В., Малик С., Лиотта Д., Снайдер Дж. П., Хамель Е. и Джаннакаку П.: EF24, роман аналог куркумина, разрушает цитоскелет микротрубочек и ингибирует HIF-1. Клеточный цикл. 7: 2409–2417. 2008. Просмотр статьи: Google Scholar: PubMed / NCBI |
103 | Матур А., Абд Эльмагид З.Й., Лю Х, Косточка М.Л., Чжан Х., Абдель-Магид А.Б. и Мондал Д. Подрыв ER-стресс в отношении апоптоза при совместном воздействии нелфинавира и куркумина увеличивает эффективность доцетаксела при кастрационно-резистентном раке простаты клетки.PLoS One. 9: e10310 . Просмотр статьи: Google Scholar: PubMed / NCBI |
104 | Ян Дж. Д. и Робертс Л. Р.: Гепатоцеллюлярный карцинома: глобальный взгляд. Нат Рев Гастроэнтерол Гепатол. 7: 448–458. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI |
105 | Вэй К.Р., Ю Икс, Чжэн Р.С., Пэн ХБ, Чжан С.В., Ji MF, Liang ZH, Ou ZX и Chen WQ: Заболеваемость и смертность от рак печени в Китае, 2010 г.Подбородок Дж. Рак. 33: 388–394. 2014.PubMed / NCBI |
106 | Байам Дж., Ренц Дж. И Миллис Дж. М.: Печень трансплантация при гепатоцеллюлярной карциноме. Гепатобилиарная хирургия Nutr. 2: 22–30. 2013. PubMed / NCBI |
107 | Чжоу М., Ли З, Хань Зи и Тянь Н: Сенсибилизация паклитакселом, усиленная куркумином, включает: подавление ядерного фактора-κB и Lin28 в клетках Hep3B. J Recept Signal Transduct Res.35: 618–625. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
108 | О’Дей Э, Ле MTN, Имаи С., Тан С.М., Киршнер R, Arthanari H, Hofmann O, Wagner G и Lieberman J: Связывание РНК белок Lin28 распознает и ремоделирует g-квартеты в микроРНК (миРНК) и мРНК, которые он регулирует. J Biol Chem. 290: 17909–17922. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
109 | Дубей А.К., Гупта У и Джайн С. Эпидемиология рака легких и подходы к его прогнозированию: систематический обзор и анализ.Подбородок Дж. Рак. 35: 71–83. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
110 | Мутоосами К., Абубакар И.Б., Бай Р.Г., Лох Х.С. и Manickam S: чрезвычайно высокая совместная загрузка куркумина и паклитаксел на функционализированный полимером восстановленный оксид графена для высокоэффективное синергетическое противоопухолевое лечение. Научный представитель 6: 328082016. Просмотр статьи: Google Scholar: PubMed / NCBI |
111 | Су GM, Дэйви М.В. и Дэйви Р.А.: Введение широкая лекарственная устойчивость в клетках мелкоклеточного рака легкого и его аннулирование паклитакселом.Int J Cancer. 76: 702–708. 1998. Просмотр статьи: Google Scholar: PubMed / NCBI |
112 | Диллон Н., Аггарвал Б. Б., Ньюман Р. А., Вольф RA, Kunnumakkara AB, Abbruzzese JL, Ng CS, Badmaev V и Kurzrock R: Фаза II исследования куркумина у пациентов с прогрессирующей панкреатической болезнью. рак. Clin Cancer Res. 14: 4491–4499. 2008. Просмотр статьи: Google Scholar: PubMed / NCBI |
113 | Эпельбаум Р., Шаффер М., Визель Б., Бадмаев В. и Bar-Sela G: куркумин и гемцитабин у пациентов с рак поджелудочной железы.Nutr Cancer. 62: 1137–1141. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI |
114 | Ирвинг Г.Р., Ивуджи, CO, Морган Б., Берри Д.П., Стюард В.П., Томас А., Браун К. и Хауэллс Л.М.: сочетание куркумина (C3-комплекс, Sabinsa) со стандартной химиотерапией FOLFOX в пациенты с неоперабельным колоректальным раком (CUFOX): протокол исследования для рандомизированного контрольного исследования. Испытания. 16: 1102015. Просмотр статьи: Google Scholar: PubMed / NCBI |
115 | Байет-Роберт М., Квятковски Ф., Leheurteur M, Gachon F, Planchat E, Abrial C, Mouret-Reynier MA, Durando X, Barthomeuf C и Chollet P: испытание фазы I повышения дозы доцетаксел плюс куркумин у пациентов с прогрессирующими и метастатическими рак молочной железы.Cancer Biol Ther. 9: 8–14. 2010. Просмотр статьи: Google Scholar: PubMed / NCBI |
116 | Mahammedi H, Planchat E, Pouget M, Durando X, Curé H, Guy L, Van-Praagh I, Savareux L, Atger M, Bayet-Robert M и др.: Новая комбинация доцетаксела, преднизона и куркумина в пациенты с устойчивым к кастрации раком простаты: пилотная фаза II этюд. Онкология. 90: 69–78. 2016. Просмотр статьи: Google Scholar: PubMed / NCBI |
117 | Канаи М, Оцука Й, Оцука К., Сато М, Нисимура Т., Мори Ю., Кавагути М., Хатано Е., Кодама Ю., Мацумото С., и др.: Исследование фазы I, посвященное изучению безопасности и фармакокинетика куркумина с высокой биодоступностью (теракурмин) в онкологические больные.Cancer Chemother Pharmacol. 71: 1521–1530. 2013. Просмотр статьи: Google Scholar: PubMed / NCBI |
118 | Сторка А, Вцелар Б, Кликович У, Гуя Г, Weisshaar S, Aschauer S, Bolger G, Helson L и Wolzt M: Безопасность, переносимость и фармакокинетика липосомального куркумина у здоровых люди. Int J Clin Pharmacol Ther. 53: 54–65. 2015. Просмотр статьи: Google Scholar: PubMed / NCBI |
Монотерапия наб-паклитакселом как лечение пациентов с метастатическим раком молочной железы в повседневной клинической практике
Реферат
Цель: сравнить результаты лечения с использованием наб-паклитаксела в рутинной клинической практике с данными, полученными в ходе клинических испытаний.Пациенты и методы. Был проведен ретроспективный обзор всех 36 пациентов с метастатическим раком молочной железы, получавших наб-паклитаксел. Наб-паклитаксел вводили еженедельно и обычно начинали с 150 мг / м 2 . Результаты. Тринадцать (36,1%) пациентов получали наб-паклитаксел в качестве терапии первой линии, семь (19,4%) — в качестве второй линии и 16 — в качестве терапии третьей или дальнейшей линии. В целом частота ответа составила 9,7%, показатель контроля заболевания — 64,5%, медиана выживаемости без прогрессирования — 7,5 месяцев и медиана общей выживаемости 14.2 месяца. Наиболее частыми негематологическими токсическими эффектами 3 степени и выше были утомляемость (27,8%), одышка, сыпь и арталгия (все 5,6%). У шести (16,7%) пациентов развилась периферическая нейропатия 2 степени и выше. Частота нейтропении 3 степени и выше составила 41,7% без фебрильной нейтропении. Заключение: Согласно нашему опыту еженедельное введение наб-паклитаксела является эффективным и переносимым, с результатами, по крайней мере, сравнимыми с результатами проспективных клинических испытаний.
Таксаны эффективны при лечении метастатического рака молочной железы (МБК) (1).Тем не менее, растворители, необходимые из-за гидрофобности этих агентов, вызывают критическую токсичность и снижают эффективность обычных таксанов (2-5). Премедикация кортикостероидами является обязательной, но вызывает дополнительные побочные эффекты. Кроме того, доцетаксел и паклитаксел в настоящее время широко используются в (новых) адъювантах. Таким образом, большинство пациентов будут подвергаться воздействию любого из этих двух таксанов, если у них разовьются метастазы.
Nab -паклитаксел представляет собой уникальный состав паклитаксела, прикрепленного к связанным с альбумином наночастицам.Система доставки лекарств в виде наночастиц устраняет необходимость в токсичных растворителях, таких как кремофор. В результате, nab -паклитаксел не требует премедикации во избежание реакций гиперчувствительности. Важно отметить, что nab -паклитаксел демонстрирует линейную фармакокинетику, что обеспечивает дозозависимую противоопухолевую активность в отличие от паклитаксела и доцетаксела на основе растворителей (6). Кроме того, связывание с альбумином облегчает прохождение лекарственного средства из кровотока через эндотелий кровеносных сосудов в подлежащую опухолевую ткань за счет использования физиологических транспортных свойств альбумина.Комплекс альбумин-лекарство связывается с рецептором гликопротеина (GP) -60 на эндотелиальных клетках, последовательно активируя кавеолин-1, что приводит к трансцитозу интактных наночастиц через клеточную мембрану (7-10). Его связывание с секретируемым гликопротеином белком, кислым и богатым цистеином (SPARC), может способствовать пери- и внутриопухолевому накоплению паклитаксела (11). В клинических испытаниях лечение nab -паклитакселом привело к отличным клиническим исходам у пациентов с МБК первой линии и предварительно полученным антрациклином, а также к значительной эффективности у пациентов с МБК, резистентным к таксанам, после интенсивной предварительной обработки.
В основном исследовании фазы III 460 пациентов с МБК (~ 40% первая линия, ~ 80% предварительно получавшие антрациклин) были рандомизированы для лечения либо nab -паклитаксел в дозе 260 мг / м 2 , либо на основе растворителя. паклитаксел в дозе 175 мг / м 2 в день 1 каждые три недели (12). Лечение nab -паклитакселом привело к значительно более высокой общей частоте ответа (ЧОО: 33% против 19%, p = 0,001) и значительно более длительному среднему времени до прогрессирования (ВДП) (23.0 против 16,9 недель; отношение рисков (HR) = 0,75, p = 0,006) по сравнению с лечением паклитакселом на основе растворителя. Наблюдалась численная разница в средней общей выживаемости (ОВ) (65,0 против 55,7 недель), которая не достигла статистической значимости. У пациентов, получавших терапию второй или последующей линии, медиана ВДП (20,9 против 16,1 недель; HR = 0,73, p = 0,02) и медиана ОВ были значительно увеличены на nab -паклитаксел (56.4 против 46,7 недель; HR = 0,73, p = 0,024) (12). Nab -паклитаксел приводил к значительно более низкому уровню нейтропении. Сенсорная нейропатия 3 степени была выше для nab -паклитаксела по сравнению с обычным паклитакселом (10% против 2%), но ее можно было лечить с помощью снижения дозы и прерывания, и ее можно было лечить быстрее по сравнению с нейропатией, получавшей обычный паклитаксел (медиана = 22 против 79 дней соответственно) (12).
В двух контролируемых клинических испытаниях оценивали монотерапию МВС nab -паклитакселом по недельному графику.В рандомизированном исследовании фазы II 302 пациента первой линии были рандомизированы в четыре группы лечения: nab -паклитаксел в дозе 300 мг / м 2 в день 1 q3w ; еженедельно при 100 мг / м 2 или 150 мг / м 2 в дни 1, 8, 15 q4w соответственно; или доцетаксел в дозе 100 мг / м 2 в день 1 каждые 3 недели (13). Nab -паклитаксел в дозе 100 и 150 мг / м 2 еженедельно приводил к более высокой ЧОО, чем доцетаксел (45%, 49% против 35%, соответственно), по оценке независимого радиолога, без достижения статистической значимости .Уровень контроля заболевания (DCR) по оценке независимого обзора был значительно выше для nab -паклитаксела при 100 ( p = 0,009) и 150 мг / м 2 ( p = 0,017) по сравнению с доцетакселом. (75% и 80% против 58% соответственно). Лечение nab -паклитаксел в дозе 150 мг / м 2 еженедельно привело к значительно более длительной медианной выживаемости без прогрессирования (ВБП) по сравнению с доцетакселом в оценке независимого радиолога (12.9 против 7,5 месяцев; HR 0,495, p = 0,0065) (13). В окончательном анализе выживаемости nab -паклитаксел в дозе 150 мг / м 2 еженедельно привел к средней ОВ 33,8 месяца по сравнению с 22,2 месяцами для nab -паклитаксела в дозе 100 мг / м 2 еженедельно, 27,7 месяцев для nab -паклитаксела в дозе 300 мг / м 2 каждые три недели и 26,6 месяцев для доцетаксела в дозе 100 мг / м 2 каждые три недели. Статистическая значимость была достигнута при сравнении nab -паклитаксела в дозе 150 мг / м 2 с nab -паклитакселом в дозе 100 мг / м 2 ( p = 0.008) (14). Для доцетаксела сообщалось о более высоком уровне утомляемости 3 или 4 степени, нейтропении и фебрильной нейтропении. Частота сенсорной нейропатии была одинаковой во всех группах. Время до улучшения до степени 2 или менее было короче для всех групп nab -паклитаксел, со средним значением 20 дней для 150 мг / м 2 еженедельно по сравнению со средним значением 41 день для доцетаксела (13 , 14).
Пациенты, у которых в среднем было три (диапазон 0-14) предшествующих химиотерапевтических терапий по поводу метастатического заболевания, в исследовании фазы II лечили nab -паклитаксел в дозе 100 мг / м. когорта при 125 мг / м 2 (n = 75) в дни 1, 8 и 15 каждые четыре недели.ЧОО составляла 14% и 16%, ДКР — 26% и 37%, медиана ВБП 3 и 3,5 месяца и медиана ОС 9,2 и 9,1 месяца соответственно. Не было разницы в выживаемости между пациентами, достигшими стабильного заболевания (SD) ≥16 недель, и пациентами с подтвержденным ответом. В целом, nab -паклитаксел переносился хорошо. У девяти пациентов (8%) в когорте 2 100 мг / м и у 14 (19%) в когорте 125 мг / м 2 развилась сенсорная нейропатия 3 степени. Пациенты, у которых развилась ограничивающая лечение периферическая нейропатия, могли быть возобновлены с пониженной дозы nab -паклитаксела после задержки в одну-две недели (15).
Это обычное дело, что контролируемые клинические испытания обеспечивают высочайший уровень доказательности. Тем не менее, он также неоспоримо, что клинические испытания склонны к предвзятости выбора и не всегда отражают клиническую реальность. Использование nab -паклитаксела для лечения МБК все еще не распространено в немецкой клинической практике, несмотря на его рекомендации в немецких руководствах по лечению (16). В нашем учреждении nab -паклитаксел был интегрирован в рутинное лечение MBC. Мы хотели определить, как результаты нашего лечения сравниваются с данными, полученными в контролируемых клинических испытаниях.
Таблица I.Характеристики пациентов.
Пациенты и методы
Мы провели ретроспективный обзор всех пациентов с MBC, которые начали лечение nab -паклитаксел в нашем учреждении с 24 января 2011 г. по 25 сентября 2012 г.
Наб-паклитаксел назначался в виде монотерапии и обычно начинался с дозы 150 мг / м. 2 . Трем пациентам, подвергавшимся тяжелому предварительному лечению, была начата более низкая доза: у одного пациента была начальная доза 120 мг / м 2 , а у двух других пациентов начальная доза составляла 100 мг / м 2 .В случае токсичности 3 и более степени или нейротоксичности 2 и более доза была снижена на ~ 20%, что соответствует в основном 120 мг / м 2 (уровень 1), 100 мг / м 2 (уровень -2) и 80 мг / м 2 (уровень -3). Пациенты получали nab -паклитаксел еженедельно в течение трех недель из четырех.
Согласно рекомендациям нашего Центра, ответ обычно оценивался после каждого второго цикла. Использовалась описательная статистика. обобщить характеристики пациента и опухоли.ЧОО определялась как полный или частичный ответ (ПО + ЧО) в соответствии с критериями оценки ответа при солидных опухолях (RECIST) версии 1.1 (17). DCR был определен как CR плюс PR плюс SD в соответствии с критериями RECIST. ВБП определяли как интервал между первой дозой nab -паклитаксела и временем прогрессирования заболевания или смерти. ОС была определена как интервал между первой дозой nab -паклитаксела и смертью. ВБП и ОВ оценивались с использованием цензуры по методу Каплана-Мейера для пациентов, у которых на момент последнего наблюдения не было зарегистрированного события.У всех пациентов был проведен анализ ОВ. Анализ PFS проводился только для пациентов, у которых был оценен ответ опухоли.
Таблица II.Лечение наб-паклитакселом.
Таблица III.Сводка данных по эффективности.
Результаты
Характеристика пациентов. Мы идентифицировали 36 пациентов с MBC, которые начали лечение nab -паклитаксел в период с января 2011 года по сентябрь 2012 года. Медиана наблюдения составила 194 (диапазон 17-464) дня. Характеристики пациентов и опухолей суммированы в Таблице I и отражают типичную популяцию пациентов с МБК, наблюдаемых в нашей клинической практике.Их средний возраст составлял 65 лет. Более половины пациентов ранее получали (нео-) адъювантную цитотоксическую терапию, примерно одна треть получала таксаны в качестве (нео-) адъювантной терапии. В целом у 83,3% были висцеральные метастазы, у 58,3% — метастазы в кости.
Лечение. Подробная информация о лечении nab -паклитакселом представлена в таблице II. Тринадцать (36,1%) пациентов получали nab -паклитаксел в качестве лечения первой линии. Большинство пациентов (91,7%) начали с nab -паклитаксела в дозе 150 мг / м 2 .Среднее количество введенных циклов составляло 4 (диапазон = 1-11) и уменьшалось с увеличением количества линий лечения. Доза nab -паклитаксела была отсрочена у 18 (50%) пациентов и снижена у 20 (55,6%) пациентов.
Эффективность. Данные по эффективности сведены в Таблицу III. CR не наблюдалось. Общий ответ наблюдался у трех (9,7%) пациентов. DCR, определяемый как CR, PR и SD, составил 64,5%. При среднем сроке наблюдения 194 дня болезнь у 15 пациентов прогрессировала, а восемь пациентов умерли.В целом, медиана PFS составила 7,5 месяцев, а медиана OS 14,2 месяца. На рисунках 1 и 2 показаны графики Каплана-Мейера для ВБП и ОВ для всей популяции в соответствии с линиями лечения. Медиана PFS и медиана OS еще не были достигнуты у пациентов, получавших nab -паклитаксел в качестве терапии первой линии.
Токсичность. Всего была введена 451 доза nab -паклитаксела. Распространенность токсичности 3 степени или выше суммирована в Таблице IV. Токсичности 5 степени не было.Гематологической токсичности 4 степени не было. Наиболее частыми негематологическими токсическими эффектами были утомляемость, одышка, сыпь и арталгия. Был один пациент с нейтропенией 4 степени; У 14 (38,9%) пациентов была нейтропения 3 степени. Случаев фебрильной нейтропении зарегистрировано не было. Пациенты не получали первичной профилактики.
Рисунок 1.Выживаемость без прогрессирования.
В целом у шести (16,7%) пациентов развилась периферическая нейропатия 2 степени или выше. Периферической невропатии 4 степени не было.Только у одного (2,8%) пациента развилась периферическая нейропатия 3 степени, которая привела к прекращению лечения nab -паклитакселом. Этот пациент получил nab -паклитаксел в качестве терапии четвертой линии и получил доцетаксел в качестве адъюванта и винорелбин в качестве терапии второй линии. У пяти пациентов была периферическая нейропатия 2 степени. Двое из них получали nab -паклитаксел в качестве терапии первой линии, один — в качестве второй, один — в качестве четвертой и один — в качестве терапии шестой линии. У этих пяти пациентов токсичность купировалась снижением дозы nab -паклитаксела и не являлась причиной прекращения лечения.
Таблица IV.Неблагоприятные события.
Фигура 2.Общая выживаемость.
Обсуждение
Сложно сравнить результаты контролируемых клинических испытаний с результатами лечения в повседневной клинической практике. Во-первых, популяции пациентов почти наверняка будут различаться. Пациенты в нашей когорте были более чем на 10 лет старше, со средним возрастом 65 лет по сравнению со средним возрастом 53 лет (15) и 54 года (13) в проспективных исследованиях, оценивающих nab -паклитаксел в MBC в еженедельное расписание.Пропорция 17% наших пациентов имела статус работоспособности 2 по сравнению с 6% (13) и 5% (15) в проспективных клинических испытаниях. Наиболее важно то, что в клинических испытаниях в качестве обязательного критерия включения использовалось измеримое заболевание (12, 13, 15). Конечно, это отличается в когорте пациентов от клинической практики. В то время как, например, у 6% пациентов в основном исследовании nab -паклитаксел имелись костные метастазы (12), это имело место у 58% наших пациентов. Оценка ответа у этих пациентов часто бывает затруднена или невозможна, поскольку болезнь в большинстве случаев не поддается измерению.Таким образом, врачи в нашей клинической практике использовали скорее прагматичный подход и классифицировали ответ как SD, если не было признаков прогрессирования метастазов в кости. Это может быть одним из объяснений низкой частоты PR даже у пациентов, получавших первую линию в нашей когорте, по сравнению с частотой, указанной в клинических испытаниях. Тот факт, что лечение пациентов в рутинной клинической практике не связано со строгим протоколом, как в клиническом исследовании, который определяет временные интервалы для оценки ответа и подтверждения ответа опухоли, а также ретроспективный характер нашего исследования, возможно, также способствовал этому. разница.Глядя на DCR , т. Е. , включая пациентов с SD, результаты из нашей когорты на самом деле хорошо сравниваются с результатами, полученными в исследованиях: 82% в первой линии против 75% (13) и 45% во второй линии или более или 57,1% в третьей линии или более, по сравнению с данными Blum et al. у пациентов со средним показателем из трех предшествующих линий терапии 26% (100 мг / м 2 ) и 37% (125 мг / м 2 ) (15).
В когорте пациентов, получавших лечение первой линии, медиана PFS и медиана OS еще не достигнуты.Рассматривая пациентов с двумя или более, или тремя или более линиями лечения, медиана PFS (7,5 и 3,1 месяца) и OS (11,2 месяца) были по крайней мере сопоставимы с данными Blum et al. то есть 3 (100 мг / м 2 ) и 3,5 месяца (125 мг / м 2 ) и 9,2 и 9,1 месяца соответственно (15).
В целом, nab -паклитаксел переносился хорошо. Утомляемость была наиболее частым нежелательным явлением 3 и более степени (27,8%). Однако практически невозможно отделить утомляемость как следствие цитотоксического лечения от утомляемости как симптома основного злокачественного метастатического заболевания.Интересно, что несмотря на то, что наша группа пациентов подвергалась тяжелому предварительному лечению, периферическая нейропатия встречалась реже, чем сообщалось в контролируемых клинических испытаниях. Частота периферической нейропатии 2 степени или выше в нашей когорте составила 16,7%, и только у одного пациента (2,8%) была нейропатия 3 степени. Это выгодно отличается от показателей невропатии 3 и 4 степени, составляющих 26% и 22%, соответственно, в группе 150 мг / м 2 в исследовании первой линии, описанном Gradishar et al. (14) и до 25% и 17% (100 мг / м 2 ) и 51% и 19% (125 мг / м 2 ), соответственно, в Blum et al. испытание (15). Кто-то может возразить, что нежелательные явления и особенно нейропатия, вероятно, будут более тщательно отражены в клинических испытаниях, чем в рутинных клинических исследованиях, и поэтому сравнивать частоту нецелесообразно. Однако мы считаем, что это не относится к нашему Центру. Осведомленность об этой критической токсичности высока в нашем Центре из-за сообщений о случаях периферической невропатии в клинических испытаниях с таксанами, в частности с nab -паклитакселом. Таким образом, пациенты информируются о риске развития периферической невропатии, и лечащие врачи, а также медсестры учитывают эту токсичность во время консультаций с пациентами.При возникновении периферической невропатии 2 степени или более были приняты немедленные меры в виде снижения дозы. За исключением пациента с нейротоксичностью 3 степени, лечение было продолжено, и периферическая невропатия не была причиной прекращения лечения nab -паклитакселом.
Среднее количество циклов, проведенных в нашей когорте у пациентов с двумя или более линиями терапии, было несколько ниже, чем в исследовании Blum et al. со средним количеством циклов 5.3 для дозы 2 100 мг / м и 4,7 для дозы 125 мг / м 2 (15). Среднее количество циклов, назначенных пациентам первой линии в нашей когорте, было 5, что явно ниже, чем медиана из 10 циклов, описанных для группы 150 мг / м 2 nab -паклитаксел в Gradishar et al. испытание (14). Как сообщалось в исследовании Gradishar et al. (14) нам пришлось снизить начальную дозу nab -паклитаксела практически у каждого второго пациента, а в нашей когорте примерно каждому второму пациенту требовалась отсрочка введения дозы.Все это, возможно, способствовало результатам эффективности в терапии первой линии, а также более благоприятному профилю переносимости в отношении периферической невропатии, по нашему опыту.
При паллиативном лечении пациентов с МБК эффективность и переносимость должны быть сбалансированы с учетом индивидуальных особенностей пациента. В наших руках еженедельный nab -паклитаксел с начальной дозой 150 мг / м 2 был эффективным и переносимым лечением в рутинной клинической практике, с которым можно было работать в первой и второй линиях.У пациентов с MBC, прошедших интенсивное предварительное лечение, следует рассмотреть более низкую начальную дозу, что может привести к более высокому воздействию препарата и более высокой эффективности. Конечно, следует признать методологические ограничения ретроспективного обзора карт. Но в целом наши результаты кажутся, по крайней мере, сопоставимыми с результатами проспективных контролируемых клинических испытаний. В частности, частота периферической нейропатии была ниже, чем сообщалось в соответствующих клинических испытаниях, и эффективно контролировалась снижением дозы.
Сноски
Раскрытие информации
Это исследование было поддержано Celgene Corporation, Summit, NJ, USA. При подготовке этой рукописи авторы получили редакционную поддержку от доктора Сюзанн Хелл при финансовой поддержке Celgene Corporation. Авторы несут полную ответственность за все содержание и редакционные решения по этой рукописи.
- Получено 7 мая 2013 г.
- Исправление получено 23 мая 2013 г.
- Принято 27 мая 2013 г.
- Copyright © 2013 Международный институт противоопухолевых исследований (д-р Джон Г. Делинассиос), Все права защищены
Прогресс в исследованиях паклитаксела и иммунотерапии опухолей | Письма о клеточной и молекулярной биологии
Паклитаксел (торговое название Taxol) представляет собой трициклическое дитерпеноидное соединение, которое естественным образом образуется в коре и иглах Taxus brevifolia . Его молекулярная формула C 47 H 51 NO 14 , а его химическая структура показана на рис.1. Благодаря своему уникальному противоопухолевому механизму, он уже является одним из самых успешных и широко используемых природных противораковых препаратов [1]. В отличие от других тубулин-связывающих противоопухолевых препаратов, которые предотвращают сборку тубулина в микротрубочки, паклитаксел способствует сборке тубулина в микротрубочки и предотвращает диссоциацию микротрубочек, блокируя развитие клеточного цикла, предотвращая митоз и подавляя рост раковых клеток [2] . Он также используется при ишемической болезни сердца, кожных заболеваниях, фиброзе почек и печени, воспалении и регенерации аксонов, а клинические испытания проводятся при дегенеративных заболеваниях головного мозга [3].
Рис. 1Химическая структура паклитаксела
После серии клинических испытаний Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило паклитаксел для лечения распространенного рака яичников в 1992 году [4]. С тех пор паклитаксел широко используется для лечения рака груди, колоректального рака и плоскоклеточного рака мочевого пузыря. Кроме того, он использовался при лечении таких заболеваний, как рак головы и шеи, мелкоклеточный и немелкоклеточный рак легких (НМРЛ) и СПИД [5].
Паклитаксел был первоначально выделен из T. brevifolia . Однако из-за относительно низкой концентрации паклитаксела, присутствующего в растении, паклитаксел чрезвычайно дорог [6, 7]. Таким образом, было разработано несколько других способов получения паклитаксела, включая искусственное культивирование T. brevifolia , химический синтез или полусинтез лекарства и биотехнологический синтез. Экстракция паклитаксела, в частности, из генетически модифицированных эндофитных грибов оказалась эффективным способом получения лекарственного средства.
Противораковый механизм паклитаксела
В 1979 году сообщалось, что паклитаксел способствует сборке микротрубочек, структур, которые состоят из повторяющихся субъединиц, состоящих из гетеродимеров α / β-тубулина. Паклитаксел снижает критическую концентрацию собранных субъединиц тубулина и увеличивает процент собранных субъединиц тубулина [2]. Во время профазы микротрубочки образуют веретено, тянущее хромосомы к полюсам. На более поздних стадиях они деполимеризуются, и структура веретена растворяется.Как воздействие низких температур, так и воздействие ионов кальция вызывают деполимеризацию микротрубочек. Паклитаксел связывается с микротрубочками и стабилизирует их, а связанные с паклитакселом микротрубочки сопротивляются деполимеризации даже при обработке при низких температурах или ионами кальция. Таким образом, лечение паклитакселом способствует полимеризации тубулина и блокирует прогрессирование митоза [8, 9].
Источник паклитаксела
Искусственное выращивание
растений TaxusБольшие количества паклитаксела используются как в клинических, так и в фундаментальных исследованиях.Однако у некоторых видов Taxus практически отсутствует паклитаксел, и чрезмерное использование этих растений может нарушить естественный экологический баланс, в котором они существуют. Для уменьшения воздействия на экосистемы использовались методы искусственного выращивания. Более того, в китайских провинциях Юньнань и Сычуань были предприняты большие усилия по посадке Taxus chinensis , который был признан полезным источником этого препарата. На сегодняшний день насчитывается более 150 плантаций T. chinensis .Это гарантирует стабильную популяцию растений, из которых можно экстрагировать несколько активных фармацевтических ингредиентов, включая паклитаксел [10]. Это один из наиболее эффективных способов получения паклитаксела. Однако чрезмерная зависимость от эпигенетических факторов и факторов окружающей среды и медленная скорость роста растений Taxus являются проблемами, которые все еще вызывают беспокойство.
Химический синтез паклитаксела
Химический синтез
В 1994 году Холтон и его сотрудники успешно синтезировали паклитаксел [11].Однако паклитаксел имеет сложную молекулярную структуру, и его синтез очень сложен; в общей сложности процесс состоит из 25–40 шагов. Более того, коммерческое производство паклитаксела пока нецелесообразно, поскольку условия реакции чрезвычайно трудно контролировать, образуются большие количества токсичных продуктов, а стоимость производства чрезвычайно высока.
Химический полусинтез
В 1988 г. было сообщено о первом использовании химического полусинтеза для синтеза паклитаксела из 10-деацетилбаккатина III (10-DAB) [12].Паклитаксел получают путем химического полусинтеза путем превращения аналогов или предшественников, обнаруженных в растениях Taxus , таких как 10-деацетилбаккатин и баккатин III, в паклитаксел. Это может быть сделано с помощью асимметричного пути эпоксидирования, асимметричной реакции двойного гидроксилирования, хиральной вспомогательной стратегии, реакции Дильса – Альдера или енолиминовой конденсации, среди других методов [13, 14]. Асимметричное гидроксилирование — это химическая реакция, в которой олефин превращается в вицинальный диол в присутствии четырехокиси рутения с хиральным хининовым лигандом.Эта реакция обычно требует каталитического количества лимонной кислоты с феррицианидом калия или N-метилморфолина, а также реакции регенерации N-оксида. Этот метод снижает уровень токсичных выбросов, образующихся при синтезе паклитаксела, и снижает цену.
Taxus культура тканиКоличества паклитаксела, обнаруженные в разных частях растений, органов и тканей Taxus , сильно различаются; Таким образом, эксплантаты Taxus были целенаправленно культивированы.В 1989 г. впервые успешно культивировали T. brevifolia . Через 2 года культур T. brevifolia дали 1–3 мг / л паклитаксела на экстракцию [15]. С тех пор было обнаружено, что многие другие виды Taxus хорошо растут, в том числе T. baccata , T. yunnanensis , T. cuspidate , T. chinensis , T. canadensis и T. . globosa . Селекция с высокопродуктивными клеточными линиями с использованием двухэтапных систем культивирования, оптимизация источников углеводов, использование стратегий предварительного кормления и использование индукторов грибковой культуры (например,(например, экстракты грибов плюс салициловая кислота, ванадилсульфат, хитозан, сквален и метилжасмонат) — все это эффективные средства для увеличения выхода паклитаксела [16, 17].
Культура клеток Taxus имеет много преимуществ. Культуры, в отличие от дикорастущих растений, не подвержены влиянию погоды, времени года и загрязнения окружающей среды. Культивирование клеток Taxus также позволяет непрерывно производить паклитаксел идентичной чистоты, а культуры являются возобновляемыми, экологически безопасными и независимыми от источника.Культивирование клеток Taxus — хороший способ получить паклитаксел, особенно в сочетании с методами метаболической и генной инженерии, которые увеличивают урожай. Однако существует несколько трудностей, связанных с культивированием клеток Taxus . Культивированию могут препятствовать медленный рост клеток, образование факторов стресса, трудности индукции, агрегация клеток, повышенная чувствительность клеток к сдвигу, высокие затраты и нестабильные урожаи. Врожденно недифференцированные камбиальные меристематические клетки (CMCs) обходят многие проблемы, связанные с традиционными дедифференцированными клетками (DDC).Чтобы обойти стадию дедифференцировки, Ли выделил и культивировал КМЦ, которые в сумме продуцировали 264 мг паклитаксела на кг клеток, 74% из которых секретировалось непосредственно в среду [18, 19]. Эти клетки могут обеспечить рентабельную и экологически безопасную платформу для устойчивого производства множества важных натуральных растительных продуктов.
Производство паклитаксела с использованием эндофитных грибов
Исследование продукции паклитаксела эндофитными грибами
В 1993 году Стирл и Штробель выделили Taxomyces andreanae , эндофитный гриб, из T.chinensis и подтверждено масс-спектрометрией, хроматографией и иммунохимией, что он продуцирует паклитаксел. Они экстрагировали паклитаксел в искусственных условиях культивирования in vitro, но выход был очень низким (24–50 мкг / л) [20]. В 2003 году Чен также выделил штаммы эндофитных грибов из внутренней коры и ветвей T. yunnanensis . Путем анализа 52 штаммов эндофитных грибов методом тонкослойной хроматографии и высокоэффективной жидкостной хроматографии было обнаружено, что 19 штаммов могут продуцировать таксол и таксан [21].Технология биосинтеза эндофитных грибов открыла новую ветвь мирового рынка паклитаксела, который, как считается, оценивается в миллиарды долларов, когда концентрация паклитаксела, экстрагированного из эндофитных грибов, увеличилась до 846 мкг / л [22].
Имеются некоторые свидетельства того, что эндофитные грибы могут синтезировать паклитаксел или аналоги паклитаксела и что путь микробного синтеза паклитаксела в эндофитных грибах значительно отличается от пути биосинтеза паклитаксела в Taxus .Из-за своей сложности путь микробного синтеза остается неясным, и некоторые этапы этого пути отличаются от известного пути синтеза. Хейнинг и соавторы обнаружили, что невозможно продемонстрировать независимый синтез таксанов ни у одного эндофитного гриба, включая первый опубликованный эндофитный гриб T. andreanae [23]. Кусари и соавторы заявили, что необходимы дальнейшие исследования производства паклитаксела с использованием биотехнологии эндофитных грибов [24]. В связи с этим использование эндофитных грибов для производства паклитаксела остается спорным вопросом.
Способы увеличения продукции паклитаксела эндофитными грибами
Генетические свойства эндофитных грибов могут быть изменены физическими, химическими или аэрокосмическими методами, а также сложным мутагенезом. Слияние протопластов — это технология, с помощью которой интегрируются растительные клетки с отдаленными филогенетическими отношениями, и этот метод можно использовать для достижения гибридизации клеток на большие расстояния и расширения диапазона рекомбинации генетического материала. Это мощный инструмент для модификации генетического материала и, как таковой, он играет важную роль в генетической селекции микробов.Благодаря неполярным мембранам протопласты микробных клеток легче сливаются, позволяя целым цитоплазмам и ядрам сливаться друг с другом, оставляя генетический материал нетронутым, что позволяет производить гибриды. Комбинация методов слияния мутаций и протопластов эффективна для увеличения количества паклитаксела, продуцируемого эндофитными грибами [25].
Биотехнологический скрининг высокопродуктивных штаммов грибов широко используется для увеличения урожайности мицелиальных грибов.Это ценный инструмент для идентификации полезного генетического материала и подходящих методов трансформации грибов, особенно эндофитных грибов. Достижения в технологии рекомбинации ДНК привели к обновлению исходной схемы метаболического пути, а успешная экспрессия генов микробного пути синтеза паклитаксела стала прорывом в повышении выхода паклитаксела. Идентификация и клонирование ключевых ферментных генов микробного пути синтеза паклитаксела, определение подходящих векторов и методы генной инженерии для изучения экспрессии экзогенных генов — все это способствовало увеличению выхода паклитаксела, продуцируемого эндофитными грибами.
Путь биосинтеза паклитаксела
Путь биосинтеза паклитаксела включает по меньшей мере 19 этапов. В последние годы ученые добились значительного прогресса в характеристике каждого шага [16]. Биосинтез паклитаксела включает реакцию между изопентенилпирофосфатными единицами (IPP) и диметилаллилпирофосфатом (DMAPP), которые получают из мевалонатного (MVA) пути и 2-C-метилэритритол-4-фосфатного (MEP) пути соответственно. [26]. В присутствии таксадиен-синтазы (TS) геранилгеранилпирофосфат (GGPP) циклизуется с образованием таксонов-4 (5), 11 (12) -диенов.Путь биосинтеза включает ферменты из нескольких разных классов, которые расположены в нескольких разных клеточных компартментах, включая пластиду, эндоплазматический ретикулум и цитозоль. Проводятся модификации, такие как ацилирование и кетонирование баккатина. Затем добавляются функциональные группы боковой цепи, что приводит к полному синтезу паклитаксела [27]. Путь синтеза представлен на рис. 2.
Рис. 2Путь биосинтеза паклитаксела
Часть пути биосинтеза паклитаксела была перенесена в системы гетерологической экспрессии, такие как Saccharomyces cerevisiae , Escherichia coli , , и некоторые растения.Изомераза IPP, GGPP-синтаза и TS были сверхэкспрессированы в E. coli для синтеза таксадиена, а уровень продукции таксадиена из культивируемых клеток был зарегистрирован до 1,3 мг / л [28]. В S. cerevisiae был установлен ранний путь от первичного метаболизма до таксол-5α-ацетокси-10β-спирта. Теперь многомерный модульный подход к E. coli используется для получения самых высоких выходов паклитаксела. Этот подход разделяет метаболический путь паклитаксела на два модуля; в первом IPP образуется из гетерогенных вышележащих MEP, а во втором образуются терпеноиды.Наивысшая зарегистрированная концентрация паклитаксела, экстрагированного из E. coli , составила 570 мг / л, и это было достигнуто за счет оптимизации экспрессии таксанов P450, комбинирования различных кросс-редуктаз и модификации N-концов различных ферментов [29].
Многие ферменты участвуют в пути биосинтеза. Генетическая и метаболическая инженерия может быть использована для производства этих ферментов и получения более высоких выходов паклитаксела на клеточном и молекулярном уровнях. Из-за своей сложности этот путь недостаточно изучен, и необходимы дальнейшие исследования, чтобы полностью охарактеризовать и описать его.
Паклитаксел и иммунотерапия опухолей
Иммунотерапия опухолей
Иммунотерапия опухолей вызывает иммунный ответ на опухоли за счет повышения иммунитета организма. В последнее время были достигнуты успехи в нашем понимании возможных применений классических лекарств в иммунотерапии опухолей. Многие исследования показали, что паклитаксел напрямую убивает опухолевые клетки и регулирует различные иммунные клетки, такие как эффекторные Т-клетки, дендритные клетки (ДК), естественные киллеры (NK), регуляторные Т-клетки (Т-рег) и макрофаги [30].Другие химиотерапевтические препараты обладают аналогичными иммуномодулирующими свойствами, например белиностат [31], доксорубицин [32], блеомицин [33] и бортезомиб [34]. Иммунотерапия опухолей работает через несколько механизмов: (1) способствуя пролиферации и активации Т-клеток; (2) за счет увеличения активности В-клеток и увеличения выработки антител; (3) за счет увеличения количества NK-клеток, выработки активных веществ и способности представлять антигены; и (4) улучшая кроветворную функцию организма.
Паклитаксел и иммунные клетки
Химиотерапия карбоплатином и паклитакселом (CP) используется в качестве режима химиотерапии второй линии и обычно используется для лечения меланомы. Карбоплатин подавляет Т-клеточную ингибирующую молекулу рецептор-лиганд 2 запрограммированной смерти (PD-L2), которая экспрессируется DC и клетками меланомы для усиления активации Т-клеток [35]. Кроме того, паклитаксел снижает количество Treg, способствует продукции цитокина интерлейкина-10 (IL-10), трансформирует фактор роста-бета с помощью Treg и стимулирует DC-опосредованную презентацию антигена.Исследование показало, что вакцина DC с импульсным пептидом в сочетании с терапией CP (DCCP) более эффективна, чем схемы, содержащие дакарбазин [36]. Низкие, нетоксичные дозы паклитаксела препятствуют тому, чтобы предшественники DC становились функционально толерантными. Более того, есть данные, свидетельствующие о том, что малотоксичные дозы паклитаксела ингибируют ДК и поддерживают ответ на стимуляцию ДК и липополисахаридами [37]. Эксперименты с миеломой на мышах показали, что инъекция паклитаксела индуцирует опухолеспецифические цитотоксические Т-лимфоцитарные реакции и продлевает иммунитет опухоли.Рецептор CD95, индуцирующий апоптоз (APO-1 / Fas), играет ключевую роль в апоптозе и активируется с увеличением RT25 [38].
Системную иммунологическую активность измеряли с помощью мультиплексного анализа и проточной цитометрии, и ответ положительно коррелировал с более высокой инфильтрацией опухоли CD3 + (оценка иммунизации). Это характеризуется ранее существовавшим системным воспалительным состоянием, при котором наблюдается увеличение как выбранных хемокинов, так и развитая дифференцировка B-клеток, оба из которых связаны с плохим прогнозом [39].Адоптивная клеточная иммунотерапия (с использованием DC и цитокин-индуцированных клеток-киллеров [CIK]) представляет собой стратегию лечения рака, при которой перфузируются сами опухолевые клетки или клетки-киллеры аллогенных опухолей. Клетки CIK обладают многими свойствами иммунных клеток. Например, неосновной комплекс гистосовместимости NK-клеток и сильная противоопухолевая активность Т-лимфоцитов наделяют эти клетки преимуществами быстрой пролиферации, высокой активности уничтожения и широкого спектра уничтожения опухолей, а также небольшими побочными эффектами на кроветворение костного мозга.Взаимодействие между DC и клетками CIK оказывает взаимный стимулирующий эффект [40].
Паклитаксел подавляет митоз клеток и является препаратом первой линии химиотерапии. Химиотерапия паклитакселом может увеличить скорость апоптоза в опухолевых клетках, высвободить опухолевые антигены и усилить фагоцитоз антигенпрезентирующих клеток (APC). APC активируются для высвобождения большего количества провоспалительных цитокинов, тем самым способствуя перекрестной презентации APC с опухолевыми антигенами. Иммунотерапия DC используется для инъекции собственных иммунных клеток пациента обратно пациенту после активации, модификации и пролиферации in vitro, тем самым вызывая специфический или неспецифический иммунный ответ, убивая опухолевые клетки.ДК представляют собой класс гетерогенных клеток, которые играют важную регулирующую роль в клеточном и гуморальном иммунитете. Эти клетки обладают высокой убивающей активностью и составляют 1–5% лимфоцитов периферической крови человека. Клинически подтверждено, что обширная амплификация DC приводит к значительному уничтожению опухолей и уничтожению вирусов.
Было показано, что паклитаксел ингибирует функцию Treg и обращает вспять иммунный ускользание опухолей. Адоптивная иммунотерапия CIK или DC-CIK может убивать опухолевые клетки.Следовательно, паклитаксел в сочетании с иммунотерапией может повысить эффективность лечения. Клинически комбинированная терапия паклитакселом использовалась для лечения рака груди, НМРЛ, рака яичников и других злокачественных опухолей. Клинические исследования с использованием паклитаксела-карбоплатина-бевацизумаба для лечения рака легких находятся на стадии IIIB или стадии IV [41]. Одно исследование было направлено на оценку эффективности и токсичности липосомального паклитаксела и карбоплатина в сочетании с лучевой терапией при местнораспространенной плоскоклеточной карциноме легкого (LSCC) [42].
При раке человека тирозинкиназы семейства рецепторов эпидермального фактора роста (EGFR) часто мутируют [43]. Ингибиторы тирозинкиназы (TKI) EGFR использовались в качестве стандартной терапии первой линии для пациентов с распространенным НМРЛ, но развитие вторичной резистентности привело к неэффективности лечения [44]. Паклитаксел нерастворим в воде (менее 0,03 мг / мл), из-за чего разработка препарата была приостановлена более чем на десятилетие [45]. Молекулярно-таргетная терапия стала привлекательным противоопухолевым подходом.Было показано, что липосомальный паклитаксел и карбоплатин в сочетании с лучевой терапией оказывают значительное противоопухолевое действие на LSCC и контролируемую токсичность. Эти результаты показывают, что химиолучевая терапия на основе липосомального паклитаксела является безопасным лечением локально распространенного LSCC, особенно при аллергических заболеваниях. Исследования комбинации ингибитора нацеливания EGFR T790 M AZD929 и паклитаксела при лечении рака легких показали, что эти два препарата обладают сильным синергическим действием как в клеточных культурах, так и in vivo, без дополнительной токсичности [46,47,48,49] .Марк и его коллеги продемонстрировали, что связанный с альбумином паклитаксел является безопасным и эффективным терапевтическим агентом при НМРЛ [50, 51]. Julide и соавторы сравнили два таксана при лечении НМРЛ второй линии и обнаружили, что между ними не было значительной разницы в выживаемости, ответе на лечение или побочных эффектах [52].
Исследования молекулярной биологии показали, что ингибитор NF-каппа-B (IKB-α / NF-κB / Bcl-2) и пути EGFR / Akt работают синергетически. Чтобы исследовать эффективность и безопасность комбинации бевацизумаба с ХП при лечении распространенного НМРЛ [53,54,55], комбинацию ХП и бевацизумаба можно сравнить с одним ПК.Однако эта комбинация может привести к более высокому профилю токсичности. Таким образом, прежде чем принимать решение о лечении, следует учитывать преимущества и риски. Об этом пока мало что известно, поскольку иммунотерапия все еще находится на стадии исследований. Иммунный эффект лечения онкологических больных не является однозначным, и «период окна» иммунотерапии в сочетании с химиотерапией также остается неясным. В одном исследовании изучали иммуногенность CP-индуцированного апоптоза в клетках рака яичников, иммунологические аспекты химиотерапии рака яичников у пациентов и ответ цитотоксических Т-лимфоцитов (CTL) опухолевых антигенов на CD8 (+) Т-клетки в фазе окна [56 ].Паклитаксел действует, препятствуя нормальным разрывам микротрубочек во время деления клеток. Соотношение CD3 + Т-клеток, CD4 + Т-клеток и CD4 + клеток в клетках S1, S2 и S3B существенно не изменилось с соотношением клеток CD0 +. Отношение продукции IFN-γ в клетках S2 и Tc1 и отношение клеток TC1 к клеткам TC2 увеличивалось в S2 после обработки. Исследование также показало, что CD4 + CD45 RO + и CD8 + CD45 Ro + Т-клетки памяти были значительно увеличены в S2 по сравнению с CD0.
Увеличение количества Т-клеток памяти может предоставить возможность для развития долговременной иммунной памяти и защиты от рецидивов и метастазов после химиотерапии у пациентов с раком яичников.Опухоли активно привлекают и побуждают Tregs блокировать врожденную и адаптивную иммунную инициацию, ее эффекты и реакцию памяти. Паклитаксел и карбоплатин обладают высокой иммуногенностью и вызывают апоптоз в раковых клетках яичников. Иммунитет пациентов с запущенным раком яичников нарушен. После химиотерапии иммунная система рекомбинирует, что дает уникальную возможность использовать терапевтические вмешательства, которые модулируют реактивность опухолей к их антигенам. В химиотерапевтическом цикле ХП у пациентов с распространенным раком яичников 12–14-й день после химиотерапии может быть идеальным временем для проведения иммунотерапии.
Резюме и перспективы
Паклитаксел — самый мощный натуральный продукт, доступный для лечения рака. Сегодня химический полусинтез и искусственное выращивание тиса являются основными источниками паклитаксела. Увеличение производства паклитаксела является насущной необходимостью, и необходимы всесторонние исследования в различных дисциплинах. Хотя полный химический синтез является очень эффективным способом получения паклитаксела, сложный путь синтеза паклитаксела и высокая стоимость препятствуют его промышленному производству.Культура растительных клеток — более перспективный и устойчивый способ производства паклитаксела, но стоимость производства еще выше, а урожайность менее предсказуема. Хотя было обнаружено, что эндофитные грибы имеют большие перспективы для продукции паклитаксела, путь биосинтеза паклитаксела все еще неясен, и выход невысокий.
С развитием технологии биосинтеза возможно, что микробные клетки будут использоваться для производства паклитаксела в будущем. В этом случае необходимо использовать различные методы разведения.В настоящее время существует множество исследований, в которых подробно рассматривается использование мутагенеза для получения высокопродуктивных штаммов, продуцирующих паклитаксел. Также задействованы методы молекулярного разведения и селекции с регуляцией метаболизма. Необходимы дополнительные исследования, чтобы четко охарактеризовать биосинтетический путь паклитаксела в микроорганизмах. Паклитаксел может влиять на результат иммунотерапии с помощью различных механизмов воздействия на иммунные клетки, а также играет роль иммуномодулятора. Однако иммунный процесс опухоли сложен, и рак трудно вылечить.Функция паклитаксела при иммунотерапии опухолей требует дальнейшего изучения.
Гемцитабин и паклитаксел при метастатическом раке молочной железы: обзор
Гемцитабин (Гемзар) и паклитаксел являются активными препаратами при лечении метастатического рака молочной железы. Данные клинических испытаний фазы I показали, что комбинация гемцитабина и паклитаксела безопасна для пациентов с раком груди. В последующих исследованиях фазы II и III были предпочтительны две схемы приема / введения: гемцитабин в дни 1 и 8 плюс таксан в день 1 каждые 3 недели; или гемцитабин плюс таксан в дни 1 и 14 каждые 4 недели.В исследованиях фазы II 114 из 221 пациента (52%) ответили на терапию гемцитабином / паклитакселом. Частота ответа была ниже среди пациентов, которые ранее получали химиотерапию по поводу метастатического заболевания (частота ответа: 45%, вторая линия и 70%, первая линия). Токсичность схем гемцитабина / паклитаксела в целом была низкой, с несколькими случаями нейтропении или негематологической токсичности. Результаты рандомизированного регистрационного испытания фазы III показывают явное преимущество гемцитабина плюс паклитаксел перед одним паклитакселом во времени до прогрессирования заболевания, объективного ответа и общей выживаемости.Комбинации триплетов, в которых антрациклин добавляется к гемцитабину / паклитакселу, изучаются при метастатических и неоадъювантных условиях.
P Пациенты с метастатическим раком молочной железы, получающие комбинированную химиотерапию, улучшили безрецидивную и общую выживаемость [1-5], а у некоторых наблюдаются длительные ремиссии [6]. В настоящее время пациенты с ранним раком груди обычно получают адъювантную терапию, которая включает антрациклины в случаях высокого риска рецидива [7]. Хотя кумулятивной токсичности, связанной с антрациклином, часто можно избежать, сильные биологические [8] и клинические [9-11] данные показывают, что пациенты с метастатическим заболеванием, ранее получавшие антрациклины на более ранних стадиях заболевания, имеют худший прогноз и меньшие шансы на пользу от антрациклинов. содержащие схемы, чем пациенты, не получавшие химиотерапиюСледовательно, при распространенном раке молочной железы необходимы альтернативные химиотерапевтические методы, в том числе комбинации таксанов с новыми агентами, такими как гемцитабин (Гемзар). Таксаны, как отдельные агенты, так и в сочетании с другими лекарствами, стали стандартной терапией первой линии для пациентов, заболевание которых прогрессирует после химиотерапии антрациклинами. Было показано, что комбинация паклитаксела и доксорубицина менее активна у пациентов, которые ранее получали адъювантное лечение антрациклином.[11] Существует очевидная потребность в активных комбинациях, которые не включают антрациклины в этой популяции. Обращение к комбинированной терапии Гемцитабин — аналог пролекарства цитозинарабинозида, обладающий активностью в отношении широкого спектра опухолей. Цитотоксичность этого агента связана с клеточным накоплением гемцитабинтрифосфата (dFdCTP), вызывающего остановку фаз G0 / G1 и S в клетках солидных опухолей человека [12]. Частота ответа на монотерапию гемцитабином составляет от 15% до 46% у пациентов с раком молочной железы [13] с минимальной токсичностью даже у пациентов, подвергшихся предварительному лечению.[14] Паклитаксел стабилизирует микротрубочки, блокируя эукариотические клетки в митотической фазе G2 / M. [15] Было показано, что паклитаксел при назначении еженедельно или каждые 3 недели является одним из наиболее активных методов лечения рака груди. [16,17] В рандомизированных клинических исследованиях паклитаксел был равен по эффективности CMFP (циклофосфамиду [цитоксан, Neosar], метотрексат, фторурацил [5-FU], преднизон) у пациентов с распространенным раком груди. [18] В рандомизированных исследованиях с участием пациентов, ранее не получавших антрациклины, результаты применения паклитаксела в сочетании с антрациклинами были эквивалентны [19] или превосходили [3] результаты, полученные при использовании стандартного циклофосфамида, доксорубицина и 5-ФУ.Использование гемцитабина в сочетании с паклитакселом особенно привлекательно, поскольку у этих препаратов разные механизмы действия и неперекрывающаяся токсичность. In vivo паклитаксел увеличивает накопление dFdCTP. [20] В клеточных линиях немелкоклеточного рака легкого паклитаксел, вводимый непосредственно перед гемцитабином, значительно увеличивал накопление dFdCTP, включение гемцитабина в РНК и индекс апоптоза [21]. В модели на мышах наибольшая задержка роста опухоли была получена при введении паклитаксела в дни 1 и 15 с гемцитабином каждые 3 дня.[22] В дополнение к хорошо установленным графикам на 1-й и 8-й дни, комбинация паклитаксел / гемцитабин также оценивалась в исследовании фазы I с использованием графика каждые 2 недели. [23] Паклитаксел вводили в течение 3 часов, затем гемцитабин в течение 30-60 минут. Ограничивающими дозу токсичностями были нейтропения и повышение уровня аланинтрансаминазы (SGPT). Дозы, рекомендованные для исследований фазы II каждые две недели, составляли 150 мг / м 2 для паклитаксела плюс 3000 мг / м 2 для гемцитабина. Фаза II испытаний гемцитабина с паклитакселом В шести испытаниях фазы II изучалась комбинация гемцитабина с паклитакселом.Дозы, режимы и частота ответа приведены в таблице 1. Три испытания были проведены у пациентов, получавших лечение первой линии по поводу метастатического рака молочной железы, и три испытания включали терапию второй или третьей линии. График введения был каждые 3 недели и каждые 2 недели (раз в две недели) в трех испытаниях каждое. Общая частота ответа варьировала от 40% до 71%, при этом самые высокие показатели наблюдались в исследованиях пациентов, ранее не получавших химиотерапию (ответы суммированы в таблице 2).
Комбинация в целом хорошо переносилась, особенно на первой линии.В исследовании Sanchez-Rovira et al [24] по оценке гемцитабина / паклитаксела второй или третьей линии, 15% пациентов имели гематологическую токсичность 3 или 4 степени, а 34% нуждались в гранулоцитарном колониестимулирующем факторе (G-CSF [Neupogen ]) служба поддержки. Murad et al [25] наблюдали нейтропению 3 или 4 степени у 35% пациентов, нейтропеническую лихорадку у 7% и невропатию у 7%. Colomer et al [26] наблюдали нейтропению 4 степени у 17% пациентов. Негематологическая токсичность встречалась менее чем в 5% случаев, за исключением повышенного уровня ферментов печени (8%).Предварительные отчеты Delfino et al, Vici et al и Genot et al, представленные на ежегодном собрании Американского общества клинической онкологии (ASCO) в 2002 году, показали управляемую токсичность. [27-30] Коломер и др. Также отметили, что пациенты с повышенным уровнем токсичности уровни циркулирующего внеклеточного домена HER2 (ECD) имели более низкий ответ на терапию (83% против 42%, P = 0,02). Это открытие подтвердило результаты более раннего исследования [26,31] и является основой для последующего клинического исследования фазы II гемцитабина и паклитаксела плюс трастузумаб (герцептин) у пациентов с HER2 ECD-положительным статусом.Кроме того, интересные фармакогеномические исследования проводятся у пациентов с первичным раком молочной железы, получающих неоадъювантное лечение комбинацией гемцитабин / паклитаксел. [32]
Испытание фазы III гемцитабина и паклитаксела Ранние результаты рандомизированного сравнения Гемцитабин / паклитаксел по сравнению с одним паклитакселом были опубликованы в абстрактной форме. [33,34] В этом исследовании сравнивали комбинацию с паклитакселом у 529 пациентов с метастатическим раком молочной железы, которые ранее лечились антрациклином, но не получали химиотерапию на поздних стадиях заболевания.Целями исследования были общая выживаемость, выживаемость без прогрессирования, общая скорость ответа, качество жизни, облегчение боли, токсичность и время до прогрессирования заболевания (основная промежуточная цель анализа). Дизайн исследования показан на рисунке 1. Результаты многоцентрового исследования JHQG, представленного О’Шонесси на ежегодном собрании ASCO в 2003 г., отдали предпочтение комбинации гемцитабин / паклитаксел (n = 267) по сравнению с паклитакселом (n = 262) [33]. Среднее время до прогрессирования составляло 5,4 месяца (95% ДИ = 4,6-6,1 мес) для гемцитабина / паклитаксела и 3.5 месяцев (95% ДИ = 2,9-4,0 мес) для паклитаксела ( P = 0,0013). Отношение рисков отсутствия прогрессирования через 6 месяцев составило 0,734 (95% ДИ = 0,607-0,889; P = 0,0015) с повышенной вероятностью ~ 50% для комбинации. Выживаемость без прогрессирования заболевания была значительно лучше при приеме гемцитабина / паклитаксела ( P = 0,0021). Общая частота ответа составила 39,3% (95% ДИ = 33,5–45,2%) для гемцитабина / паклитаксела и 25,6% (95% ДИ = 20,3–30,9%) для паклитаксела ( P =.0007). Кроме того, комбинация была связана с тенденцией к количественному улучшению уровня анальгетика, облегчения боли и общего качества жизни ( P = NS). Гематологическая токсичность 4 степени (по общим критериям токсичности) была более выражена при приеме гемцитабина / паклитаксела, чем при приеме паклитаксела (17,2% против 6,6% нейтропении, 1,1% против 0,4% анемии, 0,4% против 0% тромбоцитопении, 0,4% против 0% фебрильной нейтропении). . Негематологическая токсичность была управляемой в обеих группах. На каждую руку приходилась одна токсическая смерть.Выводы этого исследования заключались в том, что гемцитабин плюс паклитаксел продемонстрировал значительные преимущества в эффективности по сравнению с одним паклитакселом у пациентов с метастатическим раком молочной железы, а токсичность была ожидаемой и управляемой. Во время ежегодного собрания ASCO в 2004 г. Albain et al [34] представили первоначальный отчет об общей выживаемости для этого исследования. Отношение рисков для общей выживаемости (HR) составило 0,775, что значимо в пользу комбинации гемцитабин плюс паклитаксел ( P = 0,018). Также сообщалось о статистически значимом преимуществе гемцитабина плюс паклитаксел перед паклитакселом (18.5 месяцев против 15,8 месяцев, HR = 0,775, P ( = 0,018). Годовая выживаемость была значительно увеличена в группе гемцитабина / паклитаксела (70,7% против 60,9%; P = 0,019), и HR в пользу комбинации сохранялся (регрессия Кокса) даже после поправки на исходные ковариаты: 0,740 ( P = 0,006). Тридцать восемь процентов пациентов, получавших гемцитабин плюс паклитаксел, прекратили терапию из-за прогрессирования заболевания, по сравнению с 55% в группе паклитаксела, а терапия завершилась из-за побочных эффектов в 6 случаях.7% пациентов, получавших гемцитабин плюс паклитаксел, по сравнению с 5,0% пациентов, получавших паклитаксел. Таким образом, преимущество выживаемости, о котором сообщалось в этом исследовании, окончательно установило роль гемцитабина в лечении метастатического рака молочной железы. Триплетные комбинации гемцитабина и паклитаксела плюс антрациклин Добавление антрациклина к комбинации гемцитабин / паклитаксел у пациентов с метастатическим раком молочной железы было изучено в исследованиях фазы II с превосходной степенью ответа 90.2% в неоадъювантном исследовании, опубликованном на Европейской конференции по раку молочной железы в 2004 г. Gennari et al [35], и 80% достигнуты Sanchez-Rovira и коллегами при метастазировании [36] и несколько большей токсичности, чем наблюдаемая при использовании гемцитабина / паклитаксела. В многоцентровом итальянском исследовании Gennari et al. Из 41 пациента, завершивших курс лечения гемцитабином / эпирубицином [Ellence] / паклитакселом и перенесших операцию, у 6 (14,6%) был полный патологический ответ; три были понижены до отрицательных подмышечных узлов.[35] Хотя результаты рандомизированного сравнения GET (гемцитабин / эпирубицин / паклитаксел) и FEC (5-FU / эпирубицин / циклофосфамид), представленные на ежегодном собрании ASCO в 2002 году, не показали терапевтического преимущества GET при прогрессировании груди. рак [37], эти триплетные комбинации исследуются в условиях неоадъювантной терапии, и сообщается о впечатляющих показателях ответа. [38] Дальнейшие исследования других исследователей, ожидаемые в ближайшем будущем, предоставят дополнительную информацию об использовании гемцитабина и таксанов с другими химиотерапевтическими агентами и без них у пациентов с метастатическим раком груди. Заключение Гемцитабин и паклитаксел обладают активностью против метастатического рака молочной железы, с низкой токсичностью при режимах гемцитабин / паклитаксел. Данные фазы III показывают явное преимущество гемцитабина плюс паклитаксел перед одним паклитакселом по таким параметрам, как время до прогрессирования заболевания, общая выживаемость и объективный ответ. Более того, триплетные комбинации с добавлением антрациклина к гемцитабину / паклитакселу изучаются при метастатических и неоадъювантных условиях.
Раскрытие информации:
Автор не имеет значительных финансовых интересов или каких-либо иных отношений с производителями каких-либо продуктов или поставщиками каких-либо услуг, упомянутых в этой статье.
Ссылки:
1. Harris JR, Marrow M, Bonadonna G: Cancer of the груди, в Devita Jr VT, Hellman S, Rosenberg SA (eds): Cancer: Principles and Practice of Oncology, 4th ed, pp. 1264-1332. Philadelphia, Lippincott, 1993.
2. Ackland SP, Anton A, Btreitbach GP, et al: Интенсивная химиотерапия на основе эпирубицина превосходит интенсивную внутривенную терапию циклофосфамидом, метотрексатом и фторурацилом при метастатическом раке молочной железы: рандомизированный многонациональное исследование.J Clin Oncol 19: 943-953, 2001.
3. Jassem J, Piernkowski T, Pluzanska A, et al: Доксорубицин и паклитаксел в сравнении с фторурацилом, доксорубицином и циклофосфамидом в качестве терапии первой линии для женщин с метастатическим раком молочной железы: Заключительный этап результаты рандомизированного многоцентрового исследования III фазы. J Clin Oncol 19: 1707-1715, 2001.
4. Nabholtz JM, Riva A: Комбинации таксана / антрациклина: установка нового стандарта в лечении рака груди. Онколог 6 (приложение 3): 5-12, 2001.
5. A’Hern RP, Smith IE, Ebbs SR: Химиотерапия и выживаемость при распространенном раке груди: включение доксорубицина в схемы типа Купера. Br J Cancer 67: 801-805, 1993.
6. Rahman ZU, Frye DK, Smith TL, et al: Результаты и долгосрочное наблюдение за 1581 пациентом с метастатической карциномой молочной железы, получавшим стандартную дозу химиотерапии, содержащей доксорубицин. : Ссылка. Cancer 85: 104-111, 1999.
7. Levine MN, Bramwell VH, Pritchard KI, et al: Рандомизированное испытание интенсивной химиотерапии циклофосфамидом, эпирубицином и фторурацилом в сравнении с циклофосфамидом, метотрексатом и фторурацилом у женщин в пременопаузе. -положительный рак груди.Группа клинических испытаний Национального института рака Канады. J Clin Oncol 16: 2651-2658, 1998.
8. Lönn U, Lönn S, Nilsson B и др.: Более высокая частота амплификации гена у пациентов с раком груди, получавших адъювантную химиотерапию. Cancer 77: 107-112, 1996.
9. Venturini M, Bruzzi P, Del Mastro L, et al: Влияние адъювантной химиотерапии с антрациклинами или без них на активность и эффективность циклофосфамида первой линии, эпидоксорубицина и фторурацила. у пациентов с метастатическим раком груди.J Clin Oncol 14: 764-773, 1996.
10. Pierga JY, Asselain B, Jouve M и др.: Влияние адъювантной химиотерапии на исход у пациентов с метастатической карциномой молочной железы, получавших химиотерапию, содержащую доксорубицин первой линии. Cancer 91: 1079-1089, 2001.
11. Lluch A, Ojeda B, Colomer R, et al: Доксорубицин и паклитаксел при распространенной карциноме молочной железы: важность предшествующей адъювантной терапии антрациклинами. Cancer 89: 2169-2175, 2000.
12. Kaye SB: Новые антиметаболиты в химиотерапии рака и их клиническое влияние.Br J Cancer 78 (Suppl 3): 1-7, 1998.
13. Seidman AD: Возрастающая роль гемцитабина в лечении рака груди. Oncology 60: 189-198, 2001.
14. Spielmann M, Llombart-Cussac A, Kalla S., et al: Гемцитабин в виде единственного агента активен при ранее леченном метастатическом раке молочной железы. Oncology 60: 303-307, 2001.
15. Rowinsky EK: Разработка и клиническое применение класса таксанов химиотерапевтических агентов против микротрубочек. Анну Рев Мед 48: 353-374, 1997.
16. Nabholtz JM, Gelmon K, Bontenbal M, et al: Многоцентровое рандомизированное сравнительное исследование двух доз паклитаксела у пациентов с метастатическим раком молочной железы. J Clin Oncol 14: 1858-1867, 1996.
17. Seidman AD, Hudis CA, Albanell J и др.: Плотная терапия с еженедельными 1-часовыми инфузиями паклитаксела при лечении метастатического рака молочной железы. J Clin Oncol 16: 3353-3361, 1998.
18. Bishop JF, Dewar J, Toner G, et al: рандомизированное исследование паклитаксела по сравнению с циклофосфамидом / метотрексатом / 5-фторурацилом / преднизоном у ранее нелеченных пациентов с развитой грудью. рак: предварительные результаты.Группа по расследованию таксолов, Австралия / Новая Зеландия. Semin Oncol 24 (Suppl 17): 5-9, 1998.
19. Biganzoli L, Cufer T, Bruning P, et al: Доксорубицин и паклитаксел в сравнении с доксорубицином и циклофосфамидом в качестве химиотерапии первой линии при метастатическом раке молочной железы: The European Организация по исследованию и лечению рака 10961 Многоцентровое исследование фазы III. J Clin Oncol 20: 3114-3121, 2002.
20. Kroep JR, Giaccone G, Tolis C, et al: Последовательно-зависимый эффект паклитаксела на метаболизм гемцитабина в отношении клеточного цикла и цитотоксичности в немелкоклеточном легком. линии раковых клеток.Br J Cancer 83: 1069-1076, 2000.
21. Kroep JR, Giaccone G, Voorn DA и др.: Гемцитабин и паклитаксел: фармакокинетические и фармакодинамические взаимодействия у пациентов с немелкоклеточным раком легкого. J Clin Oncol 17: 2190-2197, 1999.
22. Cividalli A, Mauro F, Livdi E и др.: Токсичность и эффективность комбинированного лечения гемцитабином / паклитакселом при аденокарциноме мышей, зависящая от графика. J Cancer Res Clin Oncol 126: 461-467, 2000.
23. Rothenberg ML, Sharma A, Weiis JR и др.: Испытание фазы I паклитаксела и гемцитабина, вводимых каждые две недели пациентам с рефрактерными солидными опухолями.Ann Oncol 9: 133-138, 1998.
24. Санчес-Ровира П., Медина Дж. Б., Мохедано Н. и др.: Результаты исследования фазы II гемцитабина в комбинации с паклитакселом при метастатическом раке молочной железы (аннотация). Ann Oncol 9 (Suppl 4): A77P, 1998.
25. Murad AM, Guimaraes RC, Aragao BC, et al: Испытание фазы II использования паклитаксела и гемцитабина в качестве лечебного средства при метастатическом раке молочной железы. Am J Clin Oncol 24: 264-268, 2001.
26. Colomer R, Llombart-Cussac A, Lluch A, et al. Каждые две недели паклитаксел плюс гемцитабин при распространенном раке груди: испытание фазы II и прогностическая ценность внеклеточного домена HER2. (ECD).Ann Oncol 15: 201-206, 2004.
27. Delfino C, Caccia GM, Riva Gonzales L, et al: Гемцитабин плюс паклитаксел, вводимый в качестве химиотерапии первой линии для пациентов с распространенным раком груди (ABC) (аннотация 2025) . Proc Am Soc Clin Oncol 21: 53b, 2002.
28. Vici P, Foggi P, Capomolla E, et al: Раз в две недели паклитаксел / гемцитабин (P / G) в качестве лечебного средства у пациентов с раком груди (pts): предварительные результаты (аннотация 2054). Proc Am Soc Clin Oncol 21: 61b, 2002.
29. Genot J-Y, Tubiana-Hulin M, Tubiana-Mathieu N, et al: Гемцитабин и паклитаксел при метастатическом раке молочной железы: исследование фазы II в условиях первой линии (аннотация 2002). Proc Am Soc Clin Oncol 21: 48b, 2002.
30. Delfino C, Caccia G, Gonzales LR, et al: Гемцитабин плюс паклитаксел в качестве химиотерапии первой линии для пациентов с распространенным раком груди. Oncology 66: 18-23, 2004.
31. Colomer R, Montero S, Lluch A, et al: Циркулирующий внеклеточный домен HER2 и устойчивость к химиотерапии при распространенном раке молочной железы.Clin Cancer Res 6: 2356-2362, 2000.
32. Llombart-Cussac A, Moreno-Bueno G, Ruiz A, et al: Профилирование экспрессии генов для прогнозирования ответа на неоадъювантный паклитаксел и гемцитабин при раке молочной железы (BC ): Предварительные результаты исследования фазы II (аннотация 580). Proc Am Soc Clin Oncol 23:22, 2004.
33. O’Shaughnessy J, Nag S, Calderillo-Ruiz G, et al: Гемцитабин плюс паклитаксел (GT) по сравнению с паклитакселом (T) в качестве лечения первой линии от антрациклина. предварительно пролеченный метастатический рак груди (MBC): промежуточные результаты глобального исследования фазы III (аннотация 25).Proc Am Soc Clin Oncol 22: 7, 2003.
34. Albain KS, Nag S, Calderillo-Ruiz G, et al: Глобальное исследование III фазы гемцитабина плюс паклитаксела (GT) по сравнению с паклитакселом (T) в качестве передовой терапии. для метастатического рака молочной железы (MBC): первый отчет об общей выживаемости (аннотация 510). Proc Am Soc Clin Oncol 23: 5, 2004.
35. Gennari A, Santoro A, Bottini A, et al: гемцитабин / эпирубицин / паклитаксел (GET) в качестве первичной химиотерапии при операбельном раке груди II-IIIA стадии: окончательные результаты многоцентрового итальянского исследования (аннотация 64).Proc Eur Breast Cancer Conf 2004.
36. Sanchez-Rovira P, Jaen A, Gonzalez E, et al: Испытание фазы II гемцитабина / доксорубицина / паклитаксела, вводимого каждые две недели пациентам с метастатическим раком молочной железы. Clin Breast Cancer 1: 226-232, 2000.
37. Zielinski C, Beslija S, Mrsic-Krmpotic Z, et al: Гемцитабин / эпирубицин / паклитаксел против 5-фторурацила / эпирубицина / циклофосфамида в качестве лечения первой линии в метастатических препаратах.

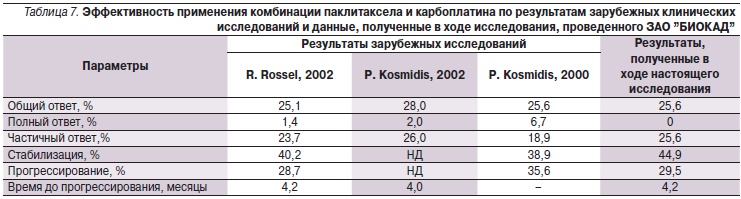 J. Clin. Oncol. 2009, 27:4649-4655.
J. Clin. Oncol. 2009, 27:4649-4655.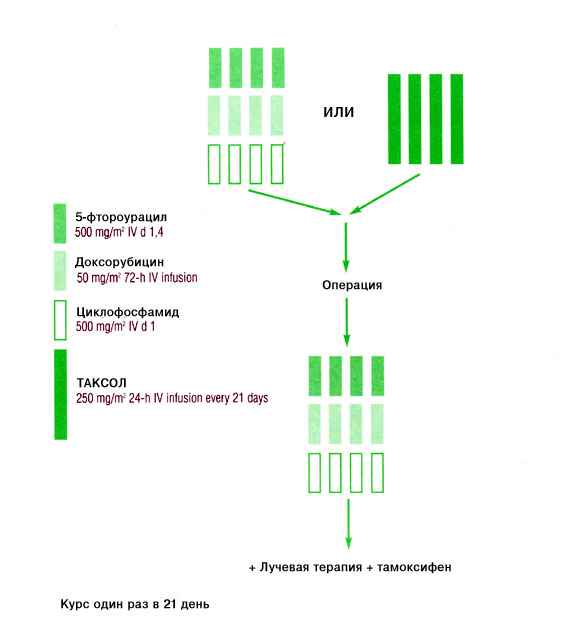
 Proc Am Soc Clin Oncol. 2006; 24:274s. Abstract 5074.
Proc Am Soc Clin Oncol. 2006; 24:274s. Abstract 5074. Anticancer Res, Oct 2009; 29: 4297-4301.
Anticancer Res, Oct 2009; 29: 4297-4301. -J., Beyer J, Ruebben H. Single agent carboplatin for CS IIA/B testicular seminoma. A phase II study of the German Testicular Cancer Study Group (GTCSG). Ann. Onc., Feb 2006; 17: 276-280.
-J., Beyer J, Ruebben H. Single agent carboplatin for CS IIA/B testicular seminoma. A phase II study of the German Testicular Cancer Study Group (GTCSG). Ann. Onc., Feb 2006; 17: 276-280. J. Clin. Oncol., Jun 2010; 28: 2727-2731.
J. Clin. Oncol., Jun 2010; 28: 2727-2731.