Редактирование человеческого эмбриона очень рискованно – Наука – Коммерсантъ
Эксперименты, в которых для модификации человеческих эмбрионов используется инструмент редактирования генов CRISPR-Cas9, показали, что эта операция ведет к нежелательным последствиям не только в самом месте редактирования ДНК, но и в его окрестностях.
Три исследования на эту тему опубликованы в июне на сервере препринтов bioRxiv, то есть рецензирования они еще не прошли. Но, взятые вместе, они дают представление о том, что риски редактирования человеческих эмбрионов при помощи «генетических ножниц» CRISPR-Cas9 недооцениваются. Предыдущие эксперименты уже показали, как «ножницы» могут незаметно вносить изменения в отдаленные от места воздействия локусы ДНК, а теперь выясняется, что под угрозой и ближайшие окрестности точки вмешательства, да и сама она.
Небезопасность метода, вероятно, станет в очередной раз причиной жарких дебатов: стоит ли вообще рисковать, редактируя геномы человеческого эмбриона, того, что будут побеждены некоторые генетические болезни.
«Если сравнить редактирование эмбрионов человека в репродуктивных целях с космическим полетом, то данные этих трех исследований придется сравнить со взрывом ракеты-носителя на стартовом столе»,— говорит Федор Урнов, один из ведущих специалистов по CRISPR-Cas9, сотрудник Калифорнийского университета в Беркли. Он не принимал участия ни в одном из трех исследований.
Первые опыты с CRISPR-Cas9-редактированием человеческих эмбрионов были проведены еще в 2015 году, с тех пор несколько групп ученых во всем мире регулярно пытаются внести изменения в человеческую ДНК. Работы их строго регламентированы.
Упомянутые три исследования обращают внимание не на сам процесс CRISPR-Cas9-редактирования, а на то, как ДНК эмбриона ведет себя после редактирования, как она восстанавливается, объясняет биолог, специалист по репродуктивным механизмам Мэри Герберт из Университета Ньюкасла, Великобритания. По ее мнению, прежде чем всерьез приступать к редактированию человеческого генома, надо составить точную карту изменений, которые вносятся CRISPR-Cas9-редактированием в ДНК.
По ее мнению, прежде чем всерьез приступать к редактированию человеческого генома, надо составить точную карту изменений, которые вносятся CRISPR-Cas9-редактированием в ДНК.
Другая группа во главе с исследователем стволовых клеток Дитером Эгли из Колумбийского университета в Нью-Йорке изучала эмбрионы, в которые мужская гамета привнесла мутацию в гене EYS. Ученые пытались с помощью CRISPR-Cas9 исправить эту мутацию, но около половины эмбрионов, как показало тестирование, потеряло большие сегменты хромосомы, а иногда и всю хромосому, в которой расположен EYS.
И третья группа, возглавляемая биологом-репродуктологом Шухратом Миталиповым из Орегонского медицинского университета в Портленде, изучала эмбрионы, полученные с использованием сперматозоидов с мутацией, которая вызывает заболевание сердца. Ученые также нашли признаки того, что редактирование затронуло большие области той хромосомы, где содержался мутировавший ген.
Все три группы редактировали геномы эмбрионов исключительно с научными целями, никто не имел в виду их развитие в плод.
Изменения стали следствием восстановления ДНК, а это необходимая часть процедуры CRISPR-Cas9-редактирования. Изменения в ДНК случаются во время этого восстановления: чаще всего разрез затягивается с ошибкой, может возникать перетасовка букв генома, а еще часть хромосомы может просто исчезнуть при ремонте.
В предыдущих работах других ученых было показано, что CRISPR-редактирование может вызывать значительные нежелательные эффекты в отдаленных от места воздействия частях хромосомы.
По материалам статьи https://www.nature.com/articles/d41586-020-01906-4
Анатолий Кривов
Можно ли создавать генетически модифицированных детей?
Автор фото, Getty Images
Підпис до фото,Начнут ли ученые, достигшие успеха в генной терапии, создавать генетически модифицированных людей?
Люди научились создавать растения, животных и даже — наши собственные гены. Но до сих пор вмешательство в генетический код будущих людей традиционно оставалось «за красной линией».
А сегодня ученый из Китая утверждает, что ему удалось создать первых генетически модифицированных младенцев. Этический аспект его работы уже раскритиковали.
Этический аспект его работы уже раскритиковали.
Однако почему ученым нельзя вмешиваться в генетику, если они хотят бороться с заболеваниями?
Люди-ГМО
Профессор Хэ Цзянькуй удалил ключевой белок с ДНК эмбрионов сестер-близнецов. Это означает, что они будут иметь врожденный иммунитет к ВИЧ.
По словам профессора, работу над белком CCR5 он вел втайне от шэньчжэньских Южного университета науки и технологий, учреждения, в котором работает.
В его исследованиях приняли участие восемь пар. В каждой паре был ВИЧ-положительный отец и ВИЧ-отрицательная мать.
Эти близнецы уже родились. Профессор Хэ сообщил, что уже есть вторая беременность на ранней стадии с генетически отредактированным эмбрионом.
Доказательств своего научного достижения ученый пока не предоставил. А родной университет планирует расследовать его деятельность в связи с нарушением академических норм.
И если результаты подтвердятся, этот эксперимент станет поворотным пунктом в науке — и одновременно поднимет непростые вопросы морально-этического характера.
Следующие поколения
«Редактирование гена зародышевой линии» (именно так называется модификации ДНК эмбриона, который может развиться у человека) дает надежду на то, что можно исправить генные мутации и предотвращать болезни, чтобы их не передавали дальше.
Автор фото, Getty Images
Підпис до фото,Редактирование ДНК эмбриона означает, что изменение может быть передано будущим поколениям
Но эта практика порождает этическую дилемму: вмешательство в генетический код поколений. Теперь уже речь идет о ДНК не одного человека, а потенциально многих людей.
Во многих странах эта практика категорически запрещена, а инструменты редактирования генов разрешено использовать только в нерепродуктивных клетках взрослых.
Например, в Великобритании ученым разрешено выполнять опыты с редактированием генов на списанных ЭКО-эмбрионах, но доводить их до состояния плода запрещено.
В Соединенных Штатах директивы в этом более свободны. В Японии продолжаются обсуждения, но речь в них лишь об опытах.
В Японии продолжаются обсуждения, но речь в них лишь об опытах.
Правительство Китая приказало провести расследование, чтобы выяснить, не нарушил ли профессор Хэ законодательство, подсадив генетически модифицированные эмбрионы матери.
По мнению заместителя министра науки и технологий Китая, нарушение все же имело место. В интервью государственным СМИ Cюй Нанпине сообщил, что он был «шокирован» и что эксперимент профессора Хэ запрещен китайским законодательством.
Подобно другим странам, Китай позволяет проводить опыты с эмбриональными стволовыми клетками человека in vitro в течение 14 дней максимум, добавил замминистра.
«Предотвратить страдания«
Впрочем, профессор Хэ гордится тем, что внес изменения в ДНК сестер-близнецов, ведь это (по его утверждению) защитит их от заболевания ВИЧ, если они когда-нибудь будут контактировать с этим вирусом.
Автор фото, Getty Images
Підпис до фото,Профессор Хэ защищал свою работу
Но на том этапе эмбрионы были здоровыми. Профессор Хэ вмешался в процесс, который может иметь непредсказуемые последствия, и многие сомневаются в целесообразности этого решения.
Профессор Хэ вмешался в процесс, который может иметь непредсказуемые последствия, и многие сомневаются в целесообразности этого решения.
Профессор Джулиан Савулеску, эксперт по этике (Оксфордский университет) объяснил BBC: «В результате эксперимента нормальные здоровые дети подверглись риску, который несет в себе изменения генов, тогда как реальная польза от этого кажется сомнительной».
Другие утверждают, что сегодня ВИЧ можно легко контролировать — благодаря лечению вирусную нагрузку в крови можно свести к уровням неопределенного.
Некоторые ученые обеспокоены удалением гена из организмов близнецов, ведь это может обернуться уязвимостью к другим болезням, таких как лихорадка Западного Нила и грипп.
«Само по себе изменение генов — это эксперимент. Оно до сих пор ассоциируется с нецелевыми мутациями, которые могут привести к генетическим проблемам в начале жизни и позже, в том числе и создают риск возникновения рака», — пояснил профессор Савулеску.
Автор фото, Getty Images
Підпис до фото,Ученые предупредили, что мутации могут переродиться в другие проблемы, например, рак
Доктор Ялда Ямшиди, эксперт по генетике человека в лондонском Университете Сент-Джордж, рассказала: «У нас очень мало информации о долгосрочных последствиях. Большинство людей согласятся: проводить эксперименты на людях, чтобы сделать их неуязвимыми к болезни, которой можно избежать, только ради обогащения наших знаний — с морально-этической точки зрения неприемлемо».
Дизайнерские младенцы
Некоторые ученые обеспокоены возможным злоупотреблением этой технологией в евгенике для создания генетической дискриминации.
Но профессор Хэ утверждает, что главное в его работе — создание детей, которые не будут болеть, а не дизайнерских младенцев с глазами желаемого цвета или высоким IQ.
«Я понимаю, что мою работу можно воспринимать неоднозначно. Но убежден, что семьям нужна эта технология, и ради них я готов вытерпеть критику», — сказал он.
Однако, возможно, китайский ученый — не единственный. В этом году в Британии провели расследование биоэтических аспектов изменения генов человека. Согласно его выводам, такая практика «допустима с точки зрения морали».
В то же время изменение генома «не должно увеличивать неравенство, дискриминацию или разделение в обществе», говорится в выводах следствия.
«Революция»
Автор фото, Getty Images
Підпис до фото,Доказано, что модификация генов предотвращает генетическую недостаточность печени у эмбрионов мышей
О технологии CRISPR, которая осуществляет редактирование генов, впервые стало известно в 2012 гоуа. С тех пор многих интересует вопрос, скоро ли мы увидим генетически модифицированных людей.
В CRISPR используются «молекулярные ножницы», которые меняют специфические участки ДНК — вырезают их, заменяют или корректируют.
Открытие CRISPR осуществило «революцию» в этой области, ведь впервые в истории переписывать и редактировать генетический код стало так легко.
В начале 2018 года ученые в США, применив эту технологию, сумели предотвратить генетическую печеночную недостаточность у мышей.
Этот способ лечения доказал свою действенность у грызунов после рождения. Исследователи из Детской больницы Филадельфии показали, что это изменение они могут осуществить еще до рождения мышей — отредактировав их гены.
Но они предупреждают: «любой перенос» этой работы на людей создаст «существенные трудности».
Ученые имеют в виду, что потенциальные последствия таких действий выходят за пределы новаторства в науке.
Это потребует от нас прийти к согласию, решив очень сложные этические дилеммы.
Ученые впервые устранили дефект в геноме зародыша человека — Российская газета
Эту работу ученых США, Китая и Южной Кореи уже называют прорывом в генетике. Эксперимент открывает возможность на ранней стадии развития человеческого эмбриона исправлять полученные им по наследству генетические поломки.
И вот впервые редактирование генома прошло успешно. Эксперимент проводила группа ученых под руководством Шухрата Миталипова, уроженца Алма-Аты, который с 1995 года живет и работает в США. В эксперименте с эмбрионом ученый применил молекулярный редактор CRISPR/Cas9, с помощью которого можно вносить исправления в различные гены. В данном случае ремонтировался дефектный ген, который является причиной серьезной наследственной болезни — гипертрофической кардиомиопатии (ГКМ). Она встречается у каждого из 500 человек и считается неизлечимой, может стать причиной остановки сердца внешне здоровых людей. В чем же суть этого эксперимента?
— В лаборатории яйцеклетки здоровых женщин-доноров оплодотворяли спермой мужчины-донора, больного ГКМ, — сказал корреспонденту «РГ» профессор Сколтеха и Университета Ратгерса (США), заведующий лабораториями Института молекулярной генетики РАН и Института биологии гена РАН Константин Северинов.
Конечно, это не 100 процентный результат, но достижение очень серьезное. Авторы утверждают, что представляют, как можно существенно повысить этот показатель. Также они намерены изучить, насколько такая технология применима для исправления других генов, ответственных за различные наследственные болезни. Данное исследование дает надежду многим семейным парам с дефектами в генах иметь здоровое потомство.
Данное исследование дает надежду многим семейным парам с дефектами в генах иметь здоровое потомство.
Справка «РГ»
Чтобы вылечить генетическую болезнь, нужно исправить генетическую информацию, вызванную мутацией. К примеру, гемофилия, от которой страдал царевич Алексей Романов, вызвана изменением всего одной буквы ДНК, а всего в нашем геноме их 6 миллиардов. Надо найти только одну «опечатку» и исправить ее в заданном месте, не изменив ничего больше. Именно это делает молекулярный «скальпель» CRISPR/Cas9. Он ищет мутацию и «вырезает» ее из ДНК, а на ее место вставляет здоровую копию из парной хромосомы.
Важно отметить, что у больных ГКМ в двойной спирали ДНК повреждена только одна копия гена, что позволяет копировать здоровый ген и вставлять эту копию на место удаленного. Но есть немало наследственных болезней, когда повреждены обе копии, и тут придется применять другие варианты редактирования.
Будем править? В России разразился спор о праве вмешиваться в геном эмбрионов человека
 Ученые готовят заявку в Минздрав на то, чтобы тот разрешил им попытаться отредактировать эмбрион будущего ребенка родителей с наследственной глухотой. Их оппоненты во главе с Куцевым готовят встречное заявление в министерство, где предлагают объявить на эксперименты по редактированию генома эмбрионов человека мораторий — до тех пор, пока не появятся соответствующие нормативно-правовые документы.
Ученые готовят заявку в Минздрав на то, чтобы тот разрешил им попытаться отредактировать эмбрион будущего ребенка родителей с наследственной глухотой. Их оппоненты во главе с Куцевым готовят встречное заявление в министерство, где предлагают объявить на эксперименты по редактированию генома эмбрионов человека мораторий — до тех пор, пока не появятся соответствующие нормативно-правовые документы.«В Штатах [заявку Ребрикова] даже не приняли бы, — говорит биолог Федор Урнов. — Кроме того, законодательные органы США только что ввели в жизнь закон, согласно которому запрещено проводить геноредактирование зародыша».
На эту тему
Урнов — один из признанных мировых лидеров в области технологий редактирования генома. Выпускник биологического факультета МГУ, он много лет работает в США, где активно занимается модификацией генома живых организмов (включая и клетки людей) как в лаборатории, так и в клинической практике. Среди его регалий, в частности, разработка самого точного из ныне существующих инструментов редактирования генома человека — ZFN, или «цинковых пальцев»: в лабораториях им на смену сейчас пришла в разы более дешевая и простая система CRISPR/Cas, с которой работает и Ребриков, и генетики в Медико-генетическом научном центре (Куцев — его директор), да и подопечные Урнова в Беркли.
Изобретение CRISPR/Cas сильно снизило порог входа в профессию «геноредактора». В разы увеличилось число исследований в области генетического редактирования, а новые, менее подготовленные в инфраструктурном плане (сюда входят не только специалисты, но и лаборатории, логистические цепочки, законодательство и т.д.) страны включились в биотехнологическую гонку.
Стало ясно, что вот она, возможность не только догнать, но и перегнать Запад.
Победой тут должно стать успешное клиническое испытание технологии — избавление человека от той или иной наследственной болезни путем редактирования его генома.
Еще большим престижем было бы излечить какую-то наследственную болезнь «начисто», то есть сделав так, чтобы и у потомков пациента она уже не могла проявиться. Серия операций — и мир больше никогда не вспомнит о муковисцидозе или малокровии.
Медики против ученых
«Медицинского смысла здесь нет, а опасность есть, — говорит Сергей Куцев, возглавивший протест врачей-генетиков против экспериментов Ребрикова. — Так зачем же этим заниматься? У нас было заседание ученого совета. На нем были врачи-генетики, доктора наук, профессора, они принимали десятки тысяч пациентов с наследственными заболеваниями. Я спрашиваю, в вашей практике была какая-то такая ситуация, когда вообще ничего нельзя сделать в плане профилактики наследственных заболеваний и только редактировать эмбрион? Такую ситуацию никто не вспомнил».
— Так зачем же этим заниматься? У нас было заседание ученого совета. На нем были врачи-генетики, доктора наук, профессора, они принимали десятки тысяч пациентов с наследственными заболеваниями. Я спрашиваю, в вашей практике была какая-то такая ситуация, когда вообще ничего нельзя сделать в плане профилактики наследственных заболеваний и только редактировать эмбрион? Такую ситуацию никто не вспомнил».
Современные репродуктивные технологии позволяют диагностировать генетические заболевания на самом раннем этапе. Диагностировать и отобрать для экстракорпорального оплодотворения тот эмбрион, у которого патогенной мутации нет. Или проанализировать геном эмбриона на ранней стадии беременности и в случае обнаружения каких-то генетических поломок в нем предложить родителям решать, прерывать беременность или нет. И никаких дополнительных рисков, связанных с редактированием.
По словам Урнова, в сообществе западных медиков и ученых, которые занимаются наследственными заболеваниями и технологиями редактирования генома, встречаются две позиции. Первая — и ее, по оценкам ученого, придерживается где-то треть — гласит, что редактировать эмбрионы человека надо запретить. Вторая, более популярная точка зрения, такова: на клинические испытания технологии пока необходимо объявить полный мораторий. И только если «будут ситуации, когда с медицинской точки зрения это обосновано, то тогда это разрешить, если мы можем себя убедить в том, что это безопасно, этично и вреда не принесет».
Первая — и ее, по оценкам ученого, придерживается где-то треть — гласит, что редактировать эмбрионы человека надо запретить. Вторая, более популярная точка зрения, такова: на клинические испытания технологии пока необходимо объявить полный мораторий. И только если «будут ситуации, когда с медицинской точки зрения это обосновано, то тогда это разрешить, если мы можем себя убедить в том, что это безопасно, этично и вреда не принесет».
«Я подозреваю, что в российском научном сообществе в целом настроение более пермиссивное [по отношению к клиническим испытаниям редактирования генома эмбриона человека], чем в западном, — говорит биолог Константин Северинов из Сколтеха. — Просто потому что это на уровне кузькину мать показать, шапку сорвать и об землю… Мечта объегорить всех этих англосаксов и показать, что мы можем это делать, а они нет, у нас у всех присутствует подспудно».
На эту тему
Сам Ребриков отказался комментировать свою позицию по этому вопросу после того, как Куцев выступил с призывом к Минздраву ввести мораторий. Однако еще в июле, говоря с порталом ТАСС «Чердак» о своих планах, признавал, что выбранные им и его командой цели для редактирования — ВИЧ, наследственная глухота, слепота, карликовость — действительно не являются чем-то несовместимым с жизнью и потому безальтернативной медицинской необходимости в редактировании генома эмбрионов нет. Но в более серьезных случаях речи о редактировании эмбрионов тоже не может быть: такие люди не заводят семьи.
Однако еще в июле, говоря с порталом ТАСС «Чердак» о своих планах, признавал, что выбранные им и его командой цели для редактирования — ВИЧ, наследственная глухота, слепота, карликовость — действительно не являются чем-то несовместимым с жизнью и потому безальтернативной медицинской необходимости в редактировании генома эмбрионов нет. Но в более серьезных случаях речи о редактировании эмбрионов тоже не может быть: такие люди не заводят семьи.
Кроме того, возможны случаи, в которых все оплодотворенные яйцеклетки будут носителями дефектного гена, хотя если верить Куцеву, такого в его медицинской практике и практике его коллег никогда не случалось. В такой ситуации преимплантационная диагностика помочь не сможет, единственной доступной мерой будет редактирование.
Сам вопрос о редактировании тогда же, в июле, Ребриков считал вопросом не о технологии, а о регуляции, причем его риторика апеллировала к вопросу о лидерстве в биотехнологической гонке: «Либо [регулятор] скажет да, давайте сделаем такой эксперимент — и перенести эмбрион в матку матери мы готовы хоть завтра, — сказал тогда он. — Либо скажет: давайте еще 100500 проверок. Либо нет, жесткое нет. Мы подумали, что Россия не будет лидером в этой области».
— Либо скажет: давайте еще 100500 проверок. Либо нет, жесткое нет. Мы подумали, что Россия не будет лидером в этой области».
Почему нельзя отмолчаться
Северинов крайне негативно оценивает возможные последствия от разрешения редактирования генома эмбрионов в России. Ученый при этом тоже занимается научными исследованиями, связанными с системой CRISPR/Cas.
Биолог называет призыв Куцева разумным и своевременным: «В России инфраструктурная часть научных исследований в области наук о жизни не готова к тому, чтобы такого рода эксперименты проводить на людях и гарантировать, что никаких последствий не будет, — считает Северинов. — Если дать этому волю, то мы придем в ту же дурацкую ситуацию, как было со стволовыми клетками. Лет десять назад все кому не лень потчевали всех стволовыми клетками с помощью процедур, безопасность и эффективность которых была не доказана. В СМИ можно найти немало примеров известных людей, которые пострадали из-за таких процедур, некоторые, возможно, из-за этого и умерли. Ну зачем повторять все это дело с «криспрами», рискуя создать долгосрочные проблемы для всего метода, безусловно, очень перспективного? Только для того, чтобы кто-то мог отрапортовать начальству о своем успехе?»
Ну зачем повторять все это дело с «криспрами», рискуя создать долгосрочные проблемы для всего метода, безусловно, очень перспективного? Только для того, чтобы кто-то мог отрапортовать начальству о своем успехе?»
На эту тему
Куцев — председатель этического комитета при Минздраве. Однако, по его словам, он не уверен, что заявка Ребрикова будет проходить через этот орган министерства.
«Есть этический комитет, а есть этический совет. И не факт, что нам [эту заявку] подадут, ее могут подать в этический совет. А во-вторых, извините, я очень надеюсь на разумность членов этического комитета, но вообще-то это коллегиальный орган. А единого мнения нет, — признает Куцев. — Потому что есть такая фраза, которая мне совершенно не нравится: «Науку остановить нельзя». Но кто же ее просит останавливать? Мы же говорим о клиническом применении».
Именно поэтому, по словам генетика, он не стал дожидаться, пока Ребриков подаст документы в Минздрав, и публично призвал остановить эксперименты. Кроме того, Куцева подстегнула готовность Ребрикова обсуждать свои эксперименты с прессой.
Кроме того, Куцева подстегнула готовность Ребрикова обсуждать свои эксперименты с прессой.
«Мы уже не сможем сказать о том, что мы не слышали ничего, что мы ничего не знали и этот биолог российский сделал все это тайно, — поясняет свое недовольство публичностью Ребрикова Куцев. — Тут ответственность, она распределена этим биологом на все общество. И общество, которое молчит, оно получит потом результат, который будет потом осужден на всех уровнях и во всех странах как эксперимент на людях, и мы тут уже не сможем отмолчаться».
- Пора меняться. Российское государство заинтересовалось редактированием генома эмбрионов человека
- Правительство РФ запланировало создание 30 видов ГМ-организмов к 2027 году
Свое предложение Куцев формулирует так: запретить клиническое применение технологий редактирования генома эмбрионов и наложить мораторий на эксперименты до тех пор, пока не появится детальное законодательство в этой области. А оно, по его словам, готовится.
Первая попытка
26 ноября 2018 года в Гонконге открылся Международный саммит по вопросам редактирования генома человека, организованный совместными усилиями Национальной академии наук США, британского Королевского общества и Гонконгской академии наук. Среди приглашенных участников были, без особенного преувеличения, все лидирующие геноредакторы планеты — люди, профессионально связанные с применением генной терапии и развитием ее инструментов. На саммите предполагалось обсуждать крайне волнующую и одновременно болезненную тему — как именно должен решаться вопрос о готовности технологии и общества к редактированию эмбрионов людей?
Взвешенной дискуссии, на которую рассчитывали организаторы, однако, не вышло. Первые в истории человечества генно-модифицированные дети к этому моменту уже родились. Об этом стало известно за день до открытия саммита. Родились они в Китае, Академия наук которого за несколько месяцев до начала мероприятия вышла из состава его организаторов.
На эту тему
Героем — со знаком минус — саммита стал Цзянькуй Хэ, мало кому известный молекулярный биолог, получивший образование в США и затем вернувшийся на родину руководить лабораторией в Южном университете науки и технологий (Шэньчжэнь). Ученый, действовавший на свой страх и риск, как было объявлено потом, отредактировал несколько эмбрионов, чтобы внести в ген CCR5 специфическую мутацию delta32. Ее носители неуязвимы для ВИЧ-инфекции.
Дальше был скандал. Хэ осудило практически все научное и медицинское сообщество, китайские власти начали расследование, которое закончилось заявлением о том, что ученый и его коллеги нарушили китайское законодательство (важный нюанс: никаких определенных санкций за это нарушение законодательство не предусматривало). Хэ поставили в вину то, что он нарушил правила получения информированного согласия на эксперимент, то, что работал тайком и что никакой медицинской необходимости в том, чтобы редактировать эмбрионы, не было.
«Мне, как одному из первопроходцев геноредактирования, это было эмоционально очень трудно, — вспоминает Урнов, который был первым, кому позвонил журналист, раскопавший данные об эксперименте Хэ. — Потому что всем ученым хочется, чтобы то, что ты сделал, принесло пользу человечеству. Мы вроде пытаемся вылечить генные заболевания, а тут какой-то геноредактор ни с того ни с сего вроде бы сделал нокаут (то есть «выбил» целевой ген — прим. ТАСС), и во-первых, сделал его плохо! А во-вторых, [в этом] не было никакой медицинской необходимости. Это просто хулиганство. Никаким другим словом, кроме как хулиганство, я не могу это назвать».
— Потому что всем ученым хочется, чтобы то, что ты сделал, принесло пользу человечеству. Мы вроде пытаемся вылечить генные заболевания, а тут какой-то геноредактор ни с того ни с сего вроде бы сделал нокаут (то есть «выбил» целевой ген — прим. ТАСС), и во-первых, сделал его плохо! А во-вторых, [в этом] не было никакой медицинской необходимости. Это просто хулиганство. Никаким другим словом, кроме как хулиганство, я не могу это назвать».
«Как врач, я подумал о бессмысленности происходящего, — вспоминает о том дне Куцев. — Понятно, что редактирование гена CCR5 может, во-первых, не привести к желаемому результату: ВИЧ-инфицирование происходит не только в связи с наличием рецепторов CCR5, это понятно всем. А затем пришло и понимание, что абсолютно нет никаких гарантий, что это редактирование не привело к побочным эффектам. К нецелевому редактированию».
Что останавливает науку
Никто из участников саммита тогда не знал, что за несколько месяцев до того в российском журнале «Вестник РГМУ» вышла статья, описывающая эксперименты группы Ребрикова над 16 зиготами человека, непригодными для ЭКО. При помощи системы CRISPR/Cas9 ученые попытались добиться пропажи 32 нуклеотидов в гене CCR5 этих эмбрионов, то есть добиться того же результата, к которому стремилась группа Хэ. Как значится в статье, восемь из 16 зигот дожили до стадии бластоциты, и в пяти из них эмбрионы оказались отредактированы на 100%.
При помощи системы CRISPR/Cas9 ученые попытались добиться пропажи 32 нуклеотидов в гене CCR5 этих эмбрионов, то есть добиться того же результата, к которому стремилась группа Хэ. Как значится в статье, восемь из 16 зигот дожили до стадии бластоциты, и в пяти из них эмбрионы оказались отредактированы на 100%.
«Когда я увидел статью [Ребрикова], — говорит Урнов, — [то] сразу ему написал. Он ответил связно и немедленно. Но то, что он показал… сказать, что у меня есть чисто технические вопросы о том, а реально ли все это, — это мягко сказано. Экстраординарные заявления требуют экстраординарных подтверждений. Если речь о том, что он может исправить мутацию в зародыше без мозаицизма и без ненацеленных мутаций и сделать это воспроизводимо, то есть на сотнях зародышей, то давайте посмотрим на эти данные. Я этих данных не видел».
Сейчас Ребриков, имея на руках данные эксперимента на 16 зиготах, из которых выжила половина, и чуть больше половины из этой половины оказалась, кажется, отредактирована успешно, заявляет о том, что нашел испытуемых для совсем другого эксперимента — уже не по привитию неуязвимости к ВИЧ, а излечению тугоухости. Как и в случае со внесением мутации CCR5Δ32, это задача, требующая отредактировать один ген. У обоих родителей, которых нашел Ребриков, «сломан» ген GJB2: в нем есть мутация, из-за которой у ее носителей возникают проблемы со слухом. Ее-то и предполагается исправлять.
Как и в случае со внесением мутации CCR5Δ32, это задача, требующая отредактировать один ген. У обоих родителей, которых нашел Ребриков, «сломан» ген GJB2: в нем есть мутация, из-за которой у ее носителей возникают проблемы со слухом. Ее-то и предполагается исправлять.
Между китайским и российским экспериментами есть разница. Хэ просто пытался «сломать», нокаутировать фрагмент гена CCR5 в ДНК эмбриона, чтобы получить мутацию CCR5Δ32. В эксперименте Ребрикова в эмбрион помимо самой системы CRISPR/Cas, нацеленной на нужный ген, вводилась «заплатка» с вариантом гена CCR5Δ32. Это было нужно для того, чтобы система репарации клетки, восстанавливая разрез на ДНК, сделанный редактором, руководствовалась шаблоном, который ей подсунули, и воссоздала на месте разреза нужный ученым вариант гена. Та же схема, по-видимому, будет использоваться и в случае с переписыванием гена GJB2.
Ребриков не просто «ломает», а исправляет гены. Это процедура сложнее технически.
«Ребята, вы хотите отредактировать ребенка методом исправления мутаций. А можно результаты посмотреть? — вопрошает Урнов. — Эта техническая проблема пока не решена. Вышла ровно одна статья в Nature, которая это показала, но никто этого результата больше получить не смог. Когда я смотрю на результаты, на которые [Ребриков] ссылается, я не понимаю, решена эта проблема [в его эксперименте] или нет».
А можно результаты посмотреть? — вопрошает Урнов. — Эта техническая проблема пока не решена. Вышла ровно одна статья в Nature, которая это показала, но никто этого результата больше получить не смог. Когда я смотрю на результаты, на которые [Ребриков] ссылается, я не понимаю, решена эта проблема [в его эксперименте] или нет».
Статья, которую упоминает Урнов, — это работа еще одного авторитетного американского ученого (и тоже российского происхождения) Шухрата Миталипова, в которой тот описывает свою попытку заменить ген MYBPC3, который отвечает за синтез белка, критически важный для формирования сердечной мышцы. Миталипов также столкнулся с проблемой недостаточной точности технологии: у него успех редактирования зародыша достиг 72,4%: из 58 зародышей с мутацией удалось получить 42 здоровых эмбриона.
На эту тему
«То, что Миталипов показывает, биологически невозможно, — не церемонится, однако, с именитым коллегой Урнов. — Я в лаборатории Миталипова не стоял, когда он это делал, поэтому скептицизмом я покрыт с ног до головы. Но и Миталипов, и Хэ сделали достаточное количество молекулярных анализов, которых в «Вестнике» Денис не показал. Обвинять его в недостатке знаний или навыков я никогда не стану. Я уверен, что эти результаты есть. Я уверен, что он все это сделал. Просто я их не видел».
Но и Миталипов, и Хэ сделали достаточное количество молекулярных анализов, которых в «Вестнике» Денис не показал. Обвинять его в недостатке знаний или навыков я никогда не стану. Я уверен, что эти результаты есть. Я уверен, что он все это сделал. Просто я их не видел».
Вторая проблема связана уже не с тем, что у Ребрикова и его команды слишком мало данных, чтобы другие ученые могли поверить в безопасность их технологии. Вторая проблема — фундаментальная для всей области, и из-за нее есть основания не доверять эффективности работы любой системы редактирования генома в эмбрионах.
«Берется яйцеклетка, берется сперматозоид, получается зародыш, одноклеточный. В него иголкой заносится редактор. И этот геноредактор начинает бегать по клетке, находит нужный ген и этот ген исправляет, — описывает механизм процедуры Урнов. — Вот в чем техническая тонкость: зародыш начинает делиться. Эксперименты показали, что геноредактор, он не то что отредактировал то, что нужно, и все, спасибо, до свидания, пошел отдыхать. Он свою работу продолжает. На стадии двух клеток, четырех и даже восьми. Результатом этого является то, что этот зародыш, пока еще состоящий всего из восьми клеток, он генетически неоднороден. Есть клетки отредактированные, а есть нет — этот феномен называется мозаицизм. Как эту проблему решить, не знает никто. Ни один геноредактор на планете Земля — нас сколько, 10, 20 тыс. человек? — ни одной матери в глаза не посмотрит и не скажет: «Знаете, Анна Ивановна, мы тут вам зародыш отредактировали, он лишен мозаицизма, у него все в порядке». Это невозможно сказать. Нет сейчас технологий, которые бы могли позволить сделать это заявление».
Он свою работу продолжает. На стадии двух клеток, четырех и даже восьми. Результатом этого является то, что этот зародыш, пока еще состоящий всего из восьми клеток, он генетически неоднороден. Есть клетки отредактированные, а есть нет — этот феномен называется мозаицизм. Как эту проблему решить, не знает никто. Ни один геноредактор на планете Земля — нас сколько, 10, 20 тыс. человек? — ни одной матери в глаза не посмотрит и не скажет: «Знаете, Анна Ивановна, мы тут вам зародыш отредактировали, он лишен мозаицизма, у него все в порядке». Это невозможно сказать. Нет сейчас технологий, которые бы могли позволить сделать это заявление».
Например, насколько можно судить по крайне фрагментарным сведениям о результатах эксперимента Хэ, одна из родившихся девочек мозаична. А значит, она уязвима для ВИЧ — в ее теле есть клетки, в которых «защитная» мутация не появилась, и в них вирус может пробраться. Хотя, конечно, проверить это можно, только заразив ее вирусом, чего делать ни один здравомыслящий не то что врач, а вообще человек не будет.
Третья проблема — это риски нецелевого редактирования. Кроме того, что мы не можем гарантировать, что редактор успеет отработать во всех делящихся клетках зародыша, мы также не можем гарантировать и того, что он не отработает только по своей цели. И даже если другие правки в ДНК эмбриона придутся на «мусорную» часть генома, предсказать, каков будет эффект на здоровье будущего ребенка, невозможно. Мы до сих пор крайне мало знаем о том, какие варианты и каких генов связаны с функционированием организма человека.
«Если мы считаем, что геном человека расшифрован, то это неправда. Мы не все знаем о том геноме, который мы расшифровали. Следовательно, проанализировать, произошло что-то неблагоприятное в геноме или не произошло, мы не можем», — говорит Куцев. И заключает из этого: «Что бы ни случилось у ребенка в его жизни, меня спросят, может это состояние быть результатом того, что он подвергся редактированию? Я на все ситуации могу сказать «не исключено», — разводит руками генетик. — Вот будет он часто болеть ОРВИ, связано ли это? Возможно, связано».
— Вот будет он часто болеть ОРВИ, связано ли это? Возможно, связано».
Как найти ошибку
Отправить в эмбрион CRISPR/Cas, нацеленный на определенный участок генома, просто. Но после этого надо еще и проверить, сработала редактура или нет. А это уже намного более сложная процедура.
«Для того чтобы гарантировать, что никаких нет нецелевых эффектов, — а это самое главное! — нужно иметь возможность быстро, эффективно и точно делать фактически de novo секвенирование отдельных клеток (то есть прочтение их генома — прим. ТАСС), выделенных из зародышей на очень ранней стадии, — объясняет Константин Северинов. — При этом нужно гарантировать, что такого рода процедура изъятия клеток для секвенирования не повредит эмбриону».
Когда вы не собираетесь подсаживать отредактированный эмбрион матери, вы, конечно, можете позволить себе секвенировать все его клетки и внимательно изучить, везде ли прошло редактирование и везде ли вам удалось избежать нецелевых мутаций. Но в ходе секвенирования клетка гибнет. Соответственно, если вы работаете с эмбрионом, который затем должен развиться в ребенка, целиком его в секвенатор отправить у вас не получится. Как много предварительных экспериментов вам нужно провести, дабы быть уверенным, что когда вы смотрите на результаты секвенирования одной из сотен клеток бластоцисты, все остальные, не изученные вами, выглядят точно так же? И что изъятие этой клетки не повредило всем остальным? А если добавить к этому то, что точность секвенирования также неидеальна?
Но в ходе секвенирования клетка гибнет. Соответственно, если вы работаете с эмбрионом, который затем должен развиться в ребенка, целиком его в секвенатор отправить у вас не получится. Как много предварительных экспериментов вам нужно провести, дабы быть уверенным, что когда вы смотрите на результаты секвенирования одной из сотен клеток бластоцисты, все остальные, не изученные вами, выглядят точно так же? И что изъятие этой клетки не повредило всем остальным? А если добавить к этому то, что точность секвенирования также неидеальна?
«Вот родится ребенок через девять месяцев. У него будут все части: руки, ноги, голова, уши, нос, — загибает пальцы Урнов. — А что если была одна неотредактированная клетка, и именно из нее возникнут органы слуха? И что мы будем делать? Извиняться перед родителями? Это хулиганство, это не наука. Поэтому я, как геноредактор, чисто технически — если забыть про этику, забыть про медицину, забыть про Минздрав, — пока эти проблемы не решены, я не понимаю, о чем может быть разговор. Возможно, у него есть какие-то данные, которые, я надеюсь, в Минздраве тщательно изучат, и он сможет убедить Минздрав, что он эти проблемы решил. Я уверен, что есть в Минздраве опытные генетики, геноредакторы, молекулярные биологи, которые эти данные посмотрят».
Возможно, у него есть какие-то данные, которые, я надеюсь, в Минздраве тщательно изучат, и он сможет убедить Минздрав, что он эти проблемы решил. Я уверен, что есть в Минздраве опытные генетики, геноредакторы, молекулярные биологи, которые эти данные посмотрят».
Зачем шум
Тем, что в США или Европе подобные эксперименты запрещены, собственно, и объясняется то, что первые генно-модифицированные дети родились в Китае, а по поводу вторых сейчас начинают спорить в России. При иных условиях «отцом» ГМ-детей мог бы давно стать тот же Урнов. Но тот к подобной славе не стремится.
«Я в 2015 году, когда только начались все эти разговоры, в Nature написал длинную статью под названием «Нельзя редактировать генофонд человека», — рассказывает он. — Так что я за мораторий руками, ногами, словами, делами. Не то чтобы Запад населен реакционерами, которые кричат «не пущать!», все с точностью до наоборот. Редактирование соматическое (то есть редактирование взрослых людей, эффект от которого уже не передастся всем последующим поколениям — прим. ТАСС) цветет пышным цветом. Я им занимаюсь, им занимаются сотни человек, десятки биотехнологических компаний, даже крупные фармацевтические типа «Новартиса» или «Пфайзера», у которых рыночная капитализация по $150–200 млрд, это серьезные люди. Россия в этом отношении может быть первопроходцем, но неплохо было бы первопроходить и не упасть под лед, пробирая эту стезю».
ТАСС) цветет пышным цветом. Я им занимаюсь, им занимаются сотни человек, десятки биотехнологических компаний, даже крупные фармацевтические типа «Новартиса» или «Пфайзера», у которых рыночная капитализация по $150–200 млрд, это серьезные люди. Россия в этом отношении может быть первопроходцем, но неплохо было бы первопроходить и не упасть под лед, пробирая эту стезю».
В том, что оружием победы человечества над наследственными заболеваниями станут технологии редактирования генома, мало кто в профессиональном сообществе сегодня сомневается. Признает это и Сергей Куцев, протестующий против попытки Ребрикова отредактировать геном нерожденного ребенка родителей с тугоухостью. Экспериментами по соматическому редактированию генома человека системой CRISPR/Cas для лечения наследственных болезней занимаются и в МГНЦ.
«Против прогресса никто не возражает, — говорит генетик. — Наука наукой, но клиника здесь при чем? Уберите руки от клиники, у вас нет диплома врача. У вас нет сертификата врача, у вас никаких навыков работы с пациентами».
Куцев отдельно подчеркивает, что он и его коллеги готовы проконсультировать семьи, которые согласились на участие в эксперименте Ребрикова, и призывает всех тех, кто имеет диплом врача, не вовлекаться в подобные эксперименты.
«Речь идет о клиническом применении непроверенных методов, — продолжает Куцев. — Это недопустимо. Я очень боюсь, что это будет сделано независимо от мнения общественности».
«У общества должна быть некоторая позиция на эту тему, — вторит Куцеву Северинов. — И выработана она должна быть не столько и не только непосредственно техническими специалистами, а широкой общественностью, которая должна включать философов, религиозных деятелей, этиков, юристов. Должна быть дискуссия, обсуждение, а не что-то на уровне того, что Денис зайдет к [министру здравоохранения Веронике] Скворцовой и она ему даст отмашку. Тем более что фактически нет никакой уверенности, что информированное согласие этими парами, которые он нашел, может быть дано. Непонятно, что в этом случае информированное согласие имеет в виду, потому что он не может им на самом деле рассказать, какие могут быть последствия. Чем быстрее будет выработан консенсус и закреплен в законодательстве, тем лучше. Иначе очень скоро в газетах и метро появятся соответствующие предложения от частных клиник. Платежеспособный, но неинформированный — спрос на такие услуги точно будет».
Чем быстрее будет выработан консенсус и закреплен в законодательстве, тем лучше. Иначе очень скоро в газетах и метро появятся соответствующие предложения от частных клиник. Платежеспособный, но неинформированный — спрос на такие услуги точно будет».
Николай Янковский, директор Института общей генетики РАН, знакомый с противостоянием Ребрикова и Куцева, в беседе с ТАСС воздержался от того, чтобы высказаться за или против моратория. Но не стал отрицать необходимости провести где-то черту.
«Есть научные вопросы, а есть те, которые требуют регуляции. Надо определиться, что здесь требует регуляции и в каких случаях имеет право человек определить, что он сам решит за себя, а где государство должно накладывать ограничения на то, что человек может решить про себя, — сказал ученый. — Эти вопросы надо различать. А то у нас обсуждение идет с точки зрения того, чего бы нам запретить или разрешить. И что вообще очень многие вопросы человек должен иметь право решить сам, это как-то не упоминается. Ребриков говорит о том, что должны быть вещи, которые человек решает сам про себя, он должен иметь на это право. Как это право будет ограничено государством, это пусть государство решит. Но лишать человека права решать за себя не надо».
Ребриков говорит о том, что должны быть вещи, которые человек решает сам про себя, он должен иметь на это право. Как это право будет ограничено государством, это пусть государство решит. Но лишать человека права решать за себя не надо».
Иван Шунин
Первое в мире редактирование генома эмбриона
Актуальность
В США ученые из Oregon Health and Science University во главе с Шухратом Миталиповым впервые выполнили успешное редактирование эмбрионального генома с помощью техники CRISPR.
И хотя на настоящий момент эмбрионы прожили лишь несколько дней и никто не знает, возможно ли имплантировать эмбрион в матку, ученые совершили настоящий прорыв в науке.
Необходимо отметить, что китайские исследователи ранее опубликовали 3 отчета о редактировании генома эмбриона, однако в них говорилось, что CRISPR вызывает ошибки и задуманные ими изменения ДНК не произошли во всех эмбриональных клетках. Такой эффект называется мозаицизмом, и по мнению исследователей, его развитие желает небезопасным создание нового организма
Однако Миталипов и коллеги доказали, что мозаицизма и отклонения от таргетного эффекта возможно избежать, если ошибки CRISPR известны.
На пути к редактировано генома
- Некоторые ученые говорят, что большое число человеческих эмбрионов, используемых при экстракорпоральном оплодотворении (ЭКО), были созданы в экспериментах при помощи донорской спермы мужчин-носителей мутаций наследственных заболеваний. Эмбрионы на данной стадии развития представляют собой скопление очень маленьких клеток, невидимых глазу.
- При этом, в случае первого успешного редактирования человеческого генома, невозможно определить, какие именно гены были выбраны для редактирования. По словам исследователей, это доказательство тому, что редактирование действительно работает. Шухрат Миталипов отмечает, что таким образом, им удалось достоверно снизить частоту мозаицизма. При этом ученые не считают, что это положит началу клиническим исследованиям, но это значительный шаг вперед.
Группа под руководством Шухрата Миталипова, кажется, смогла преодолеть ранние трудности и ввести CRISPR в яйцеклетку в то же самое время, когда производится оплодотворение при помощи спермы.
- Похожая концепция лежит в основе исследований Tony Perry (Bath University). Ученый успешно отредактировал ген мыши, ответственный за масть, что позволило изменить цвет потомства с ожидаемого коричневого на белый. Отчет по исследованию был частично опубликован в конце 2014 года. Тогда ученый говорил, что такая техника может быть однажды примешан для редактирования человеческого генома.
В США любые попытки превратить отредактированный эмбрион для ЭКО в ребенка были запрещены Конгрессом. Несмотря на такие барьеры, создание человека с отредактированным геномом возможно в любой момент в странах, где отсутствуют правовые ограничения на этот счет.
Источник: Steve Connor. MIT Technology Review. July 26, 2017.
Редактура продолжается — Блоги — Эхо Москвы, 21.05.2021
Два года назад мировое научное сообщество активно обсуждало намерение российского генетика Дениса Ребрикова отредактировать человеческий эмбрион с целью вылечить будущего ребенка от наследственной глухоты. Тогда Ребриков уже набирал в свой эксперимент испытуемых, хотя изо всех доказательств эффективности своей процедуры имел только публикацию об экспериментах над дефектными эмбрионами, где редактировал другой ген. Сегодня его команда на московской конференции по геномному секвенированию и редактированию впервые отчиталась о ходе работы над «глухим» проектом. Мы изучили презентацию с конференции и поговорили с докладчиком, Андреем Кривым, научным сотрудником лаборатории геномного редактирования Центра акушерства, гинекологии и перинатологии имени Кулакова.
Тогда Ребриков уже набирал в свой эксперимент испытуемых, хотя изо всех доказательств эффективности своей процедуры имел только публикацию об экспериментах над дефектными эмбрионами, где редактировал другой ген. Сегодня его команда на московской конференции по геномному секвенированию и редактированию впервые отчиталась о ходе работы над «глухим» проектом. Мы изучили презентацию с конференции и поговорили с докладчиком, Андреем Кривым, научным сотрудником лаборатории геномного редактирования Центра акушерства, гинекологии и перинатологии имени Кулакова.
Заболевание, о котором идет речь — аутосомно-рецессивная несиндромальная глухота, вызвано мутацией в гене GJB2. Ген кодирует белок, который необходим для установления контактов между нейронами во внутреннем ухе. В его отсутствие колебания чувствительных волосков не приводят к генерации сигнала, который бы передавался дальше в мозг — так человек теряет способность обрабатывать звуковые сигналы. В России, по данным Ребрикова, носителем такой мутации (конкретно, выпадение одной буквы в начале гена — 35delG) является каждый тридцатый.
В России, по данным Ребрикова, носителем такой мутации (конкретно, выпадение одной буквы в начале гена — 35delG) является каждый тридцатый.
Однако в гетерозиготном состоянии — когда мутация в гене GJB2 есть только на одной из двух копий хромосомы — она не опасна. Серьезные нарушения слуха возникают при наличии мутации на обеих хромосомах, что возможно, когда ребенок рождается у двух носителей. Шанс возникновения такой пары родителей «в вакууме», казалось бы, невелик —однако в действительности они возникают намного чаще, потому что глухие люди общаются и создают семьи внутри своего сообщества. И если большинство наследственных заболеваний можно при желании «отловить» и элиминировать при ЭКО, так как родители скорее всего будут гетерозиготами по вредной мутации, в случае с двумя тугоухими родителями отобрать «дикий» по GJB2 эмбрион невозможно. Именно поэтому Денис Ребриков остановился на этой модели, посчитав ее этически оправданной.
В лаборатории Ребрикова, который заведует подразделением в Центре акушерства и гинекологии им. Кулакова, уже были неплохие наработки по работе с эмбрионами — в 2018 году ученые опубликовали результаты внесения в человеческую зиготу мутации в гене CCR5, защищающей своего обладателя от заражения ВИЧ. Тогда генетики сообщили, что пять из восьми отредактированных бластоцист содержат нужную мутацию. Внесение делеции в CCR5 — довольно хорошо изученная модель, которую отрабатывали еще даже до распространения CRISPR с другими генетическими редакторами. В частности, до экспериментов группы Ребрикова, ее пытались внести в эмбрионы китайские исследователи, а некоторые из них пошли так далеко, что даже получили отредактированных детей, — правда, не очень успешно (о последнем можно прочитать в материале «Исправленная редакция»).
Кулакова, уже были неплохие наработки по работе с эмбрионами — в 2018 году ученые опубликовали результаты внесения в человеческую зиготу мутации в гене CCR5, защищающей своего обладателя от заражения ВИЧ. Тогда генетики сообщили, что пять из восьми отредактированных бластоцист содержат нужную мутацию. Внесение делеции в CCR5 — довольно хорошо изученная модель, которую отрабатывали еще даже до распространения CRISPR с другими генетическими редакторами. В частности, до экспериментов группы Ребрикова, ее пытались внести в эмбрионы китайские исследователи, а некоторые из них пошли так далеко, что даже получили отредактированных детей, — правда, не очень успешно (о последнем можно прочитать в материале «Исправленная редакция»).
Полтора года назад, обсуждая исправление в человеческих эмбрионах мутации в гене GJB2, Денис Ребриков уверял, что система для этого уже практически готова, и что до ее испытаний остается буквально месяц, и он даже нашел пару, готовую родить отредактированного ребенка. Основные проблемы ожидались со стороны регуляторов (Минздрава), так как в отличие от Хэ, эксперимент планировалось провести строго официально. Видимо, ученые рассчитывали, что по аналогии с CCR5, особых проблем с самим редактированием быть не должно.
Основные проблемы ожидались со стороны регуляторов (Минздрава), так как в отличие от Хэ, эксперимент планировалось провести строго официально. Видимо, ученые рассчитывали, что по аналогии с CCR5, особых проблем с самим редактированием быть не должно.
Чтобы внести правку в геном эмбриона при помощи системы CRISPR/Cas, вам нужно подобрать эффективную направляющую (гидовую) РНК против искомого гена, смешать с ферментом Cas9 и матрицей для устранения мутации. После введения вышеописанной смеси в зиготу РНК-гид должен «подвезти» к целевому гену Cas9, чтобы тот разрезал в этом месте двойную спираль ДНК. Затем в дело должна вступить уже система репарации клетки — а чтобы она залатала дырку в геноме нужным нам образом, используется «заплатка», матрица с генетическим материалом, который вы хотите подставить вместо целевого фрагмента. На выходе остается исправленная хромосома и здоровый эмбрион. Так это выглядит в теории.
А какие там проблемы?
На практике очень многое может пойти не так:
РНК-гид может связаться не с тем местом и на хромосоме появится незапланированная (офф-таргетная) мутация;
система репарации не обратит внимания на матрицу, и на месте разреза возникнет какая-нибудь другая мутация в результате неспецифического «зашивания» свободных концов ДНК;
пока система редактирования будет работать, эмбрион будет делиться.
 Возможен сценарий, при котором в какой-то клетке исправится только одна копия хромосомы, а вторая останется не отредактированной, и из-за этого не все клетки эмбриона будут нести в себе нужные нам изменения (мозаицизм).
Возможен сценарий, при котором в какой-то клетке исправится только одна копия хромосомы, а вторая останется не отредактированной, и из-за этого не все клетки эмбриона будут нести в себе нужные нам изменения (мозаицизм).
Чтобы перейти от экспериментов к пересадке отредактированного зародыша в утробу матери, нужно быть уверенным в том, что ничего из вышеперечисленного не случилось. Проверить же это можно только секвенированием, в ходе которого клетка уничтожается. Если отправлять на секвенирование весь зародыш, ни о какой трансплантации речи быть уже не может. Можно извлечь из зародыша несколько клеток (желательно как можно меньше, ведь из них строится весь организм будущего человека) и секвенировать их. Но чтобы довериться результатам такого анализа, нужно перед этим убедительно показать, что секвенирование отдельных клеток эмбриона надежно предсказывает состояние всех остальных. Для этого нужно в пилотных экспериментах выделить ДНК из всего эмбриона и отсеквенировать отредактированный участок.
Пока что никто не создал полностью застрахованной ото всех перечисленных казусов CRISPR-системы. Поэтому редактирование эмбрионов человека в большинстве стран до сих пор запрещено. В России этот вопрос до сих пор остается в «серой зоне» законодательства, хотя осенью 2019 года Минздрав отдельно комментировал инициативу Ребрикова по переходу к экспериментам с пересадкой зародышей матерям, заявив, что выдавать разрешение на подобное «преждевременно» и сослался при этом на то, что полностью солидарен с ВОЗ, позиция которого строго «против».
Кроме того, в последнее время у генетиков, которые работают с CRISPR/Cas, появилась новая забота. Оказалось, что разрезы, вносимые Cas9, могут приводить к выпадению больших участков одной из копий хромосом. В результате при анализе ДНК читается только оставшаяся копия и возникает ложное впечатление, что клетки гомозиготны по этому локусу (по этой причине это событие называют потерей гетерозиготности). К примеру, в одной из свежих статей в PNAS вероятность перестройки в одном из редактируемых локусов оценили в 16 процентов.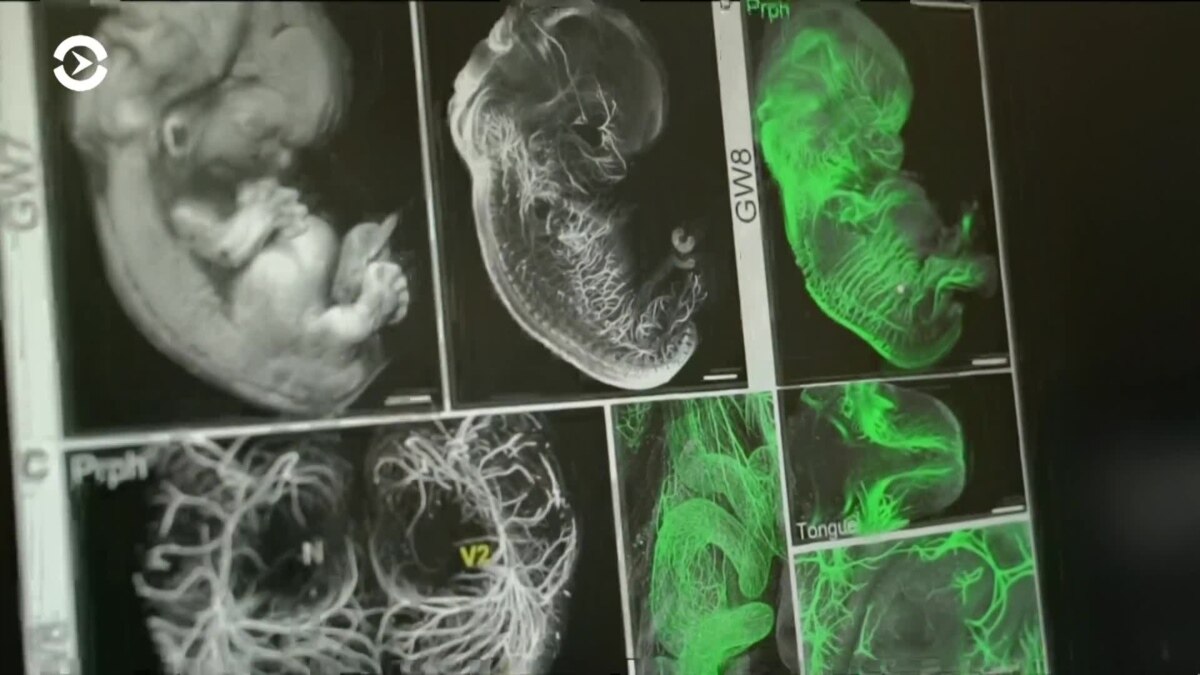 Дело здесь не в точности нуклеазы — ведь пропажа происходит в нужном месте, а с особенностью работы белков репарации, которые в некоторых случаях уничтожают ДНК вокруг разреза, чтобы потом синтезировать ее заново. Чтобы учесть потерю гетерозиготности, необходимо развивать альтернативные методы анализа генома, такие как анализ количества копий генов.
Дело здесь не в точности нуклеазы — ведь пропажа происходит в нужном месте, а с особенностью работы белков репарации, которые в некоторых случаях уничтожают ДНК вокруг разреза, чтобы потом синтезировать ее заново. Чтобы учесть потерю гетерозиготности, необходимо развивать альтернативные методы анализа генома, такие как анализ количества копий генов.
Попытка #1: CCR5
В 2018 году, команда Ребрикова, работая над внесением в ген CCR5 мутации del32, добилась следующего:
Целевая замена в геноме произошла с эффективностью 60 процентов (пять из восьми эмбрионов были гомозиготны по мутации), и только два из восьми успешно отредактированных эмбрионов оказались мозаиками. То есть системы репарации использовали матрицу очень эффективно, хотя это скорее исключение из правила — эффективность репарации по этому механизму у мышей оценивается в 5-20 процентов, а в клетках человека и того меньше, и скорее всего, сильно зависит от гена — его последовательности ДНК и уровня активности.
 В статье 2017 года группа Шухрата Миталипова, которая тоже занималась редактированием эмбрионов методом CRISPR/Cas, отчиталась, что по хотя целевому гену они попали в 42 из 58 случаев, ДНК-заплатка для гена MYBPC3 у них не сработала.
В статье 2017 года группа Шухрата Миталипова, которая тоже занималась редактированием эмбрионов методом CRISPR/Cas, отчиталась, что по хотя целевому гену они попали в 42 из 58 случаев, ДНК-заплатка для гена MYBPC3 у них не сработала.О наличии нецелевых мутаций в статье вообще ничего не говорилось — хотя ученые отмечали, что их они собираются в будущем искать их с использованием высокопроизводительных систем секвенирования ДНК, путем сравнения с геномами родителей. Все необходимые мощности для этого у ученых имелись.
Поэтому, когда группа Ребрикова сменила цель с CCR5 на GJB2, ей, во-первых, предстояло разобраться с вопросами, которые задавали к их предыдущей работе, а кроме того учесть еще и всплывшую проблему с потерей гетерозиготности.
Попытка #2: GJB2
Проект начался с подбора направляющей РНК и проверки ее на клетках соединительной ткани. Правда, об исправлении мутации 35delG пока речи не идет: у ученых даже нет подходящего материала для экспериментов. Вместо этого они пока пытаются сделать из «слышащих» клеток «тугоухие», то есть внести в ген GJB2 мутацию 35delG.
Вместо этого они пока пытаются сделать из «слышащих» клеток «тугоухие», то есть внести в ген GJB2 мутацию 35delG.
На этом этапе генетикам удалось подобрать РНК-гид, который приводил бы к разрезанию GJB2 с эффективностью, близкой к 100 процентам. С ним ученые перешли к эксперименту на зиготах. Как и в предыдущем эксперименте, ученые здесь работали с триплоидными эмбрионами — нежизнеспособными зародышами с тремя ядрами, которые возникают в ходе процедур ЭКО.
Через пять дней после введения в зиготу редактирующего коктейля получившиеся бластоцисты отправляли на генетический анализ. Планировалось не только смотреть наличие мутации в GJB2, но и секвенировать возможные места офф-таргетов, смотреть наличие хромосомных перестроек и проверять большие участки вокруг места разреза, чтобы засечь потерю гетерозиготности. А для проверки мозаичности эмбрионов планировалось сравнить результаты секвенирования нескольких клеток эмбриона с данными по целой бластоцисте.
Как уточнил Кривой, в настоящее время усилия команды сосредоточены именно на развитии методов генетического анализа эмбрионов. В докладе он представил результаты так называемого CNV-анализа (copy number variation), который после секвенирования генома по представленности сигналов разных его областей позволяет оценить количество копий участков размером больше 50 нуклеотидов. Таким образом можно отследить делеции, которые встречаются только на одной хромосоме из двух.
В докладе он представил результаты так называемого CNV-анализа (copy number variation), который после секвенирования генома по представленности сигналов разных его областей позволяет оценить количество копий участков размером больше 50 нуклеотидов. Таким образом можно отследить делеции, которые встречаются только на одной хромосоме из двух.
- Согласно первым результатам редактирования, внести изменения в ген GJB2 действительно можно довольно эффективно. Анализ нескольких эмбрионов показал, что небольшие делеции, соответствующие событию неспецифичного зашивания разреза, присутствуют как в отобранных клетках, так и в целой бластоцисте. Варианта гена дикого типа найдено не было, что указывает на отсутствие мозаичности.
Предоставлен Андреем Кривым
- А вот заставить системы репарации использовать ДНК-заплатку пока не удалось — эффективность встройки оказалась крайне низкой.

- CNV-анализ показал наличие куда большей проблемы — во всех эмбрионах пропала или одна копия 13-й хромосомы, или значительный ее фрагмент, содержащий ген GJB2. По словам Кривого, это связано с неудачно подобранной концентрацией компонентов коктейля в первом эксперименте, и во втором раунде редактирования этого удалось избежать. Тем не менее, этот факт показывает, что опасения экспертов по поводу неотработанности технологии возникают не на пустом месте.
Предоставлен Андреем Кривым
- Проверки на офф-таргеты в новых экспериментах так же, как и при работе с CCR5, пока не проводилось.
Итого
После переключения с гена CCR5 на GJB2 дела у группы Ребрикова пока идут хуже:
Добиться эффективного встраивания ДНК-заплатки пока не удалось, хотя в прошлом проекте этот механизм работал хорошо;
возникла проблема с потерей 13-й хромосомы;
проблему нецелевого редактирования ученые пока обходят молчанием.

Кривой говорит, что дальше группа будет заниматься подбором новых условий, менять концентрацию и химически модифицировать ДНК-заплатку, чтобы добиться увеличения эффективности ее встройки, а также займется анализом ДНК на офф-таргеты.
Если в прошлом проекте с CCR5 команда работала с известной моделью (причем, явно недостаточно проверяла полученные эмбрионы на предмет мутаций, чтобы говорить об успехе), редактировать ген GJB2 человека пока никто, кроме российских ученых, еще не пробовал (правда, в прошлом году китайцы вставили целый мутантный GJB2 человека в свинью).
По сути, команда еще в самом начале пути к терапевтическому редактированию глухоты, признается собеседник N + 1. Срок доведения системы до ума и проверку безопасности он оценивает в два года.
Впрочем, похоже, что торопиться им некуда — по словам Дениса Ребрикова, в настоящее время желающих отредактировать ребенка прямо сейчас у них нет, как нет и мутантных по GJB2 донорских яйцеклеток. Однако, нельзя сказать, что ученые работают впустую, — освоение тонкостей редактирования генома и полногеномного анализа ДНК, исследование «подводных камней» технологии никак нельзя назвать пустой тратой времени.
Однако, нельзя сказать, что ученые работают впустую, — освоение тонкостей редактирования генома и полногеномного анализа ДНК, исследование «подводных камней» технологии никак нельзя назвать пустой тратой времени.
Оригинал
Читайте также:
Метод австралийских аборигенов оказался эффективнее «дворца памяти»
Окаменелости из пещеры Сварткранс оказались древнейшими останками парантропа в ЮАР
Употребление даже небольших доз алкоголя связали с уменьшением объема серого вещества
почему в 2018 году человечество так боится редактировать гены людей?
До сих пор в мире официально не существует законов, которые бы запрещали генетическое редактирование человеческого эмбриона с возможностью дальнейших родов. В правилах американского агентства FDA нет прямого запрета на проведение такого эксперимента, однако в них есть пункт о том, что регулятор запрещает введение любого биологического продукта в человека без специального одобрения.
Правительство России не запрещает генную инженерию, более того, недавно президент Владимир Путин распорядился в течение трех месяцев разработать научно-техническую программу генетических технологий на 2019–2027 годы. В рамках этой программы откроют лаборатории по развитию технологии генетического редактирования.
Китайские власти официально заявили о недопущении геномного редактирования только после инцидента с Хэ. Заместитель министра здравоохранения Китая Ху Наньпин в начале декабря отметил, что подобные эксперименты «чрезвычайно отвратительны» и являются «грубым нарушением врачебной практики». «Модификация генов человеческих эмбрионов полностью запрещена в Китае», — подчеркнул замглавы минздрава Китая.
При этом неизвестно, является ли эксперимент Цзянькуя Хэ уникальным и проходят ли в других странах аналогичные медицинские проекты. Многие медицинские аналитики уже высказались о том, что такая реакция научного сообщества на китайских детей может еще больше загнать генетиков в подполье.
Китайские дети-CRISPR
В конце ноября 2018 года китайский ученый Цзянькуй Хэ заявил, что использовал технологию редактирования генов для изменения эмбрионов двух девочек. Конечная цель эксперимента — устранение возможности заражения ВИЧ. По словам Хэ, он применил метод геномного редактирования CRISPR/Cas9 — отредактировал 16 эмбрионов из 22. 11 из них использовались в попытках забеременеть. В итоге один эксперимент закончился родами двойняшек, дальше свои опыты Хэ не продолжает, чтобы убедиться в безопасности своих опытов. При этом ходят слухи, что, возможно, генетику удалось добиться появления еще одной беременной отредактированными эмбрионами женщины.
Сразу после публикации в Associated Press выяснилось, что Южный университет науки и технологий в Шэньчжэне, в котором преподавал Хэ, отправил его в неоплачиваемый отпуск еще в начале февраля 2018 года; представители больницы, где проводились роды, — Shenzhen HarMoniCare Women’s and Children’s Hospitas — заявили, что ничего не знают об этой истории, а сам ученый подал заявку на проведение эксперимента в китайский научный регулятор только в начале ноября — практически через год после его старта.
До сих пор публикация в Associated Press является единственным подтверждением проведения этого эксперимента. Однако известнейший профессор генетики Федор Урнов в интервью Nature заявил, что получил от Хэ документы, описывающие ход эксперимента, и рассмотрел их. «Данные, которые я рассмотрел, согласуются с тем фактом, что редактирование действительно было. Чтобы это проверить, нужно самостоятельно изучить их ДНК, — говорит он. — В настоящий момент нет яркой медицинской необходимости в редактировании генов ДНК», — добавил ученый.
Очевидно, Хэ проводил свой эксперимент в подполье, более того, он не предупредил участниц опытов о том, что занимается геномной инженерией, — только рассказал им об исследовании новых методов борьбы с ВИЧ (о всех методах борьбы с вирусом иммунодефицита вы можете почитать в нашем большом материале). Сейчас Хэ находится под следствием своего университета и экспертного совета по медицинской этике города Шэньчжэнь.
Сейчас Хэ находится под следствием своего университета и экспертного совета по медицинской этике города Шэньчжэнь.
Что такое CRISPR
Технология геномного редактирования CRISPR/Cas9 потенциально может уничтожить тысячи наследственных заболеваний, которые ранее считались неизлечимыми. У технологии есть и обратная сторона — с ее помощью, пока только теоретически, можно улучшать людей. Если говорить о лечении, то CRISPR/Cas9 позволят, в первую очередь, вылечить довольно простые моногенные заболевания — муковисцидоз, гемофилию или бета-талассемию.
Главное отличие инструмента генного редактирования CRISPR/Cas9 от других, достаточно долго существующих способов — это возможность направленного изменения ДНК. Раньше биоинженеры меняли конструкцию клетки практически рандомно. Было невозможно предсказать, на какое именно место встанет новая последовательность, также предыдущие инструменты не позволяли изменить уже существующие недостатки в ДНК — только добавлять к организму новые свойства.
CRISPR/Cas9 позволяют точечно влиять на последовательность ДНК и даже менять сломанный ген на правильный. Для этого специальный фермент нуклеаза вносит разрыв в нужное в геноме место, после чего включается система репарации — внутренние механизмы клетки по восстановлению генома. При этом клетка не просто стягивается — это приведет к потере нескольких букв в последовательности и появлению мутаций, поэтому она ищет в качестве образца нужную последовательность в соседних геномах. Согласно технологии, клетка должна найти ее в ферментах, которые внедрили в организм генетики, для того, чтобы взять ее и самостоятельно внедрить в себя.
Многие ученые раскритиковали Хэ за его подход к геномному редактированию. Один из создателей технологии редактирования генома CRISPR/Cas Фэн Чжан заявил, что необходимо ввести глобальный мораторий на имплантацию отредактированных эмбрионов и рождение таких детей. Джойс Харпер, занимающаяся изучением женского и репродуктивного здоровья в университетском колледже Лондона, заявила, что эксперимент Хэ — «преждевременный, опасный и безответственный». «Этот эксперимент может повлечь за собой риски редактирования генов без какой-либо реальной пользы», — также заявила Джулиан Савулеску, директор Центра практической этики Оксфорда Уэхиби в Оксфордском университете.
«Этот эксперимент может повлечь за собой риски редактирования генов без какой-либо реальной пользы», — также заявила Джулиан Савулеску, директор Центра практической этики Оксфорда Уэхиби в Оксфордском университете.
По сути, научное сообщество критиковало Хэ из-за того, что он пытался создать людей с отредактированными генами без явной медицинской выгоды. Помимо неэтичности эксперимента, многие ученые раскритиковали китайского генетика за то, что дети не были подвержены непосредственному риску заражения ВИЧ, а значит, не нуждались в генной инженерии. Более того, для проверки работоспособности такой ДНК-последовательности в дальнейшем их придется заразить вирусом иммунодефицита.
CRISPR-клиники
В результате скандала журналисты и правозащитники по всему миру начали анализировать возможность появления CRISPR-клиник в ближайшее время в разных странах. Биолог из Медицинской школы Дэвиса при Калифорнийском университете Пол Кнофлер в недавнем материале в Stat утверждал, что скоро человечество увидит новые клиники, связанные с генным редактированием. В качестве аналогичного примера он привел американские клиники, использующие стволовые клетки в своей деятельности несмотря на то, что FDA запрещает их использование. Медики насчитывают до тысячи таких клиник только на территории США.
Биолог из Медицинской школы Дэвиса при Калифорнийском университете Пол Кнофлер в недавнем материале в Stat утверждал, что скоро человечество увидит новые клиники, связанные с генным редактированием. В качестве аналогичного примера он привел американские клиники, использующие стволовые клетки в своей деятельности несмотря на то, что FDA запрещает их использование. Медики насчитывают до тысячи таких клиник только на территории США.
По словам профессора юриспруденции в Стэнфорде Хэнка Грили, процессы, связанные с CRISPR, изменятся в том случае, если какая-нибудь крупная фармацевтическая компания начнет работать с этой сферой и решить изменить общественное мнение. Десятки лет геномное редактирование является лишь футуристичным (и не очень этичным) прогнозом, однако для смены парадигмы этого тренда необходимо провести лишь несколько ярких маркетинговых кампаний под лозунгом «Мы изменим ваших детей». После этого к истории примкнут правозащитники, а также социологи, проводящие опросы под заголовком «Считаете ли вы, что родители имеют право убирать возможные наследственные заболевания у своих будущих детей».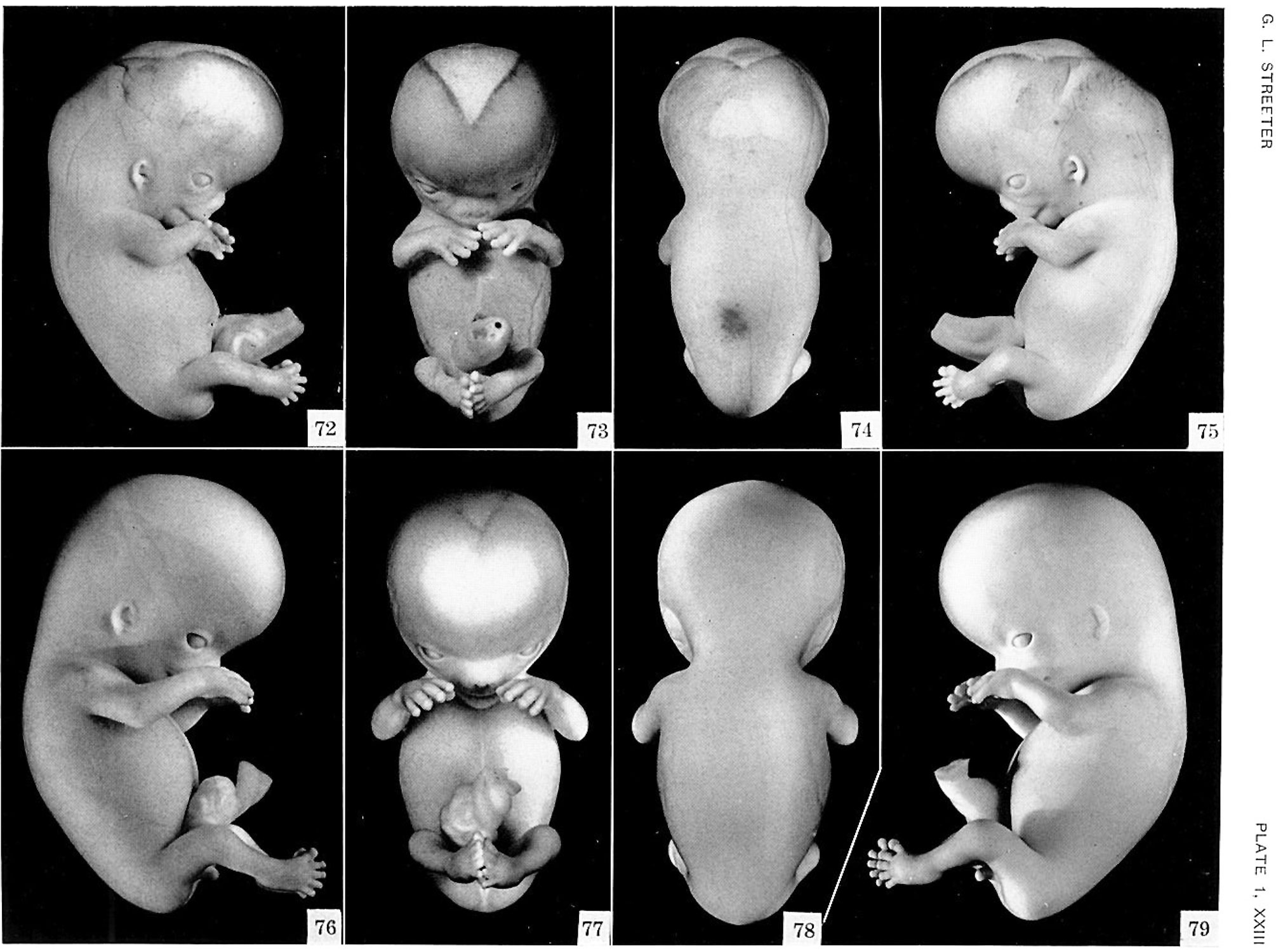
С другой стороны, добавил Грили, чем сложнее технология, тем меньше шансов, что какая-то компания будет ей незаконно заниматься. Для появления незаконной CRISPR-клиники ее руководству нужно найти первоклассных эндокринологов, эмбриологов и молекулярных биологов, желающих нарушить закон. Даже несмотря на то, что в медицине достаточно людей, эксплуатирующих отчаяние пациентов — это слишком крупные инвестиции для небольшой компании.
Генетически отредактированные люди давно среди нас, просто мы этого не замечаем
Вокруг скандала с китайским ученым почему-то мало кто говорит, что в Великобритании ученые под надзором правительства и правозащитников достаточно давно занимается редактированием генов у эмбрионов. Кроме того, еще с 1990-х годов генетики исследовали митохондриальную заместительную терапию для замены дефектной митохондриальной ДНК в яйцеклетках женщин. В итоге в 2016 году на свет появился ребенок, который может считать своими родителями трех человек.
Постоянные новости о том, что медики, используя CRISPR, исцелили то или иное заболевание, становятся привычными. Недавно ученым удалось вылечить слепоту и миодистрофию (пока только у мышей), а одному мальчику, страдающему от редкого заболевания, пересадили квадратный метр генетически отредактированной кожи. Новая кожа, заменившая 80% старой, пораженной болезнью, была выращена из 3 кв. см, которые подвергли воздействию модифицированного вируса. Часто говорят о возможном будущем CRISPR в сфере борьбы с раком. В начале января началось первое в США клиническое испытание технологии генного редактирования CRISPR для лечения рака. В исследовании приняли участие 18 пациентов, борющихся с тремя видами рака — множественной миеломой, саркомой и меланомой.
Недавно ученым удалось вылечить слепоту и миодистрофию (пока только у мышей), а одному мальчику, страдающему от редкого заболевания, пересадили квадратный метр генетически отредактированной кожи. Новая кожа, заменившая 80% старой, пораженной болезнью, была выращена из 3 кв. см, которые подвергли воздействию модифицированного вируса. Часто говорят о возможном будущем CRISPR в сфере борьбы с раком. В начале января началось первое в США клиническое испытание технологии генного редактирования CRISPR для лечения рака. В исследовании приняли участие 18 пациентов, борющихся с тремя видами рака — множественной миеломой, саркомой и меланомой.
Научный журналист Карл Зиммер в интервью для New York Times отметил, что сейчас всему научному миру нужны полноценные дебаты о плюсах и минусах CRISPR вместо реакционного запрета, который уже предложили представители Всемирной организации здравоохранения.
Китай достаточно давно считается возможным лидером CRISPR-будущего, поскольку в стране намного выше порог толерантности к подобным экспериментам. В марте 2018 года в больнице города Ханчжоу, расположенной неподалеку от Шанхая, планировали начать лечение рака пищевода с помощью генного редактирования иммунных клеток. Обсуждение технологии в наблюдательном совете больницы заняло всего один день, а одобрение национальных регулирующих органов не потребовалось. К сожалению, пока неизвестно, чем закончился этот эксперимент.
Недавно заведующий лабораторией геномной инженерии Павел Волчков в интервью изданию «Такие дела» рассказывал об эксперименте Sangamo Therapeutics с генами американца Тимоти Брауна, излечившегося от СПИДа из-за мутации в гене ССR5-delta32 в гене CCR5. Однако оказалось, что смертельный исход от подобного вмешательства составлял 1 к 35 — что является слишком большим показателем в медицине. Несмотря на это, российские ученые планируют заняться редактированием генома у живого человека уже через четыре года. Об этом недавно говорила в интервью РИА «Новости» ведущий научный сотрудник лаборатории мутагенеза ФГБНУ «Медико-генетический научный центр», кандидат медицинских наук Светлана Смирнихина.
Об этом недавно говорила в интервью РИА «Новости» ведущий научный сотрудник лаборатории мутагенеза ФГБНУ «Медико-генетический научный центр», кандидат медицинских наук Светлана Смирнихина.
Применение CRISPR не в медицине
Технологии CRISPR могут применяться не только в медицинских целях, но и в совсем иных направлениях. Управление перспективных исследовательских проектов Министерства обороны США (DARPA) вложило $100 млн в разработку генетического оружия. Пока управление намерено бороться генетическим оружием с малярийными комарами, грызунами и другими видам животных, несущими угрозу человеку и окружающей среде. Тогда ряд экспертов ООН выступил против решения со стороны американского правительства, поскольку у таких инструментов существует множество непредсказуемых последствий. «Можно уничтожить вирус или даже всю популяцию комаров, но это может оказать негативное экологическое воздействие на виды, которые от них зависят. Больше всего меня волнует, что, несмотря на наши добрые намерения, мы делаем нечто необратимое с природой, не просчитав полностью, как эта технология сработает», — говорилось в заявлении одного из экспертов ООН.
Компания Monsanto планирует использовать CRISPR, чтобы вывести новые сорта растений, более урожайные и устойчивые к экстремальным условиями среды. Возможно, именно эта технология поможет накормить растущее население нагревающейся Земли. Сельское хозяйство будущего станет использовать и генную модификацию животных. Например, в Китае уже создали свиней с пониженным содержанием жира, заменив часть их генов генами мышей.
Генное редактирование на дому
Различные энтузиасты уже популяризируют генетическое редактирование для обычных людей. Стартап Genspace за $400 предлагает любому желающему пройти курс генного инженера в настоящей лаборатории, меняя ген пивных дрожжей. Студенты получают доступ ко всему необходимому оборудованию и наставникам, которые смогут объяснить принципы работы технологии.
По словам одной из основательниц лаборатории Элен Йоргенсен, работа над редактированием генома дрожжей помогает лучше понять, как использовать технологию CRISPR, и когда этого делать не нужно. Например, правила организации не допускают работы с возбудителями инфекций, а в целях безопасности посетителям запрещено выносить из лаборатории полученные ими генно-модифицированные организмы и потенциально опасные химические вещества.
Фото: Genspace Биохакер Джошуа Зайнер, имеющий кандидатскую степень по биохимии Чикагского университета, утверждает, что он является первым человеком, пытающимся модифицировать свой собственный геном с помощью инновационной технологии редактирования генов, известной как CRISPR. По словам Зайнера, он начал экспериментировать с CRISPR в своем гараже летом 2016 года.:max_bytes(150000):strip_icc()/Fetus-56a9466b5f9b58b7d0f9d80f.jpg) В качестве эксперимента вводил себе флуоресцентный ген, который заставляет медуз светиться. Сам от этого светиться не начал, но биопсия показала, что новый ген есть в его клетках.
В качестве эксперимента вводил себе флуоресцентный ген, который заставляет медуз светиться. Сам от этого светиться не начал, но биопсия показала, что новый ген есть в его клетках.
Недавно Зайнер выступил на конференции SynBioBeta в Сан-Франциско с докладом «Пошаговое руководство по генетическому изменению себя с помощью CRISPR», в котором много рассказывал о своем стартапе Odin. Компания Зайнера занимается продажей комплекта «Измени свои гены сам» за $20, однако FDA запретило распространение этого продукта, назвав его мошенническим. Теперь биохакер предлагает клиентам покупать инструменты для генного редактирования растений и животных.
Редактирование гена CRISPR в человеческих эмбрионах вызывает хромосомный хаос
Редактирование человеческих эмбрионов вызывает споры Фото: Паскаль Гётгелюк / Библиотека научных фотографий
Набор экспериментов, в которых используется инструмент редактирования генов CRISPR – Cas9 для модификации человеческих эмбрионов, показал, как этот процесс может вносить большие, нежелательные изменения в геном на целевом сайте или рядом с ним.
Исследования были опубликованы в этом месяце на сервере препринтов bioRxiv и еще не прошли экспертную оценку 1 , 2 , 3 .Но вместе взятые, они дают ученым возможность хорошо взглянуть на то, что, по мнению некоторых, является недооцененным риском редактирования CRISPR – Cas9. Предыдущие эксперименты показали, что инструмент может производить «нецелевые» генные мутации далеко от целевого сайта, но близлежащие изменения, выявленные в последних исследованиях, могут быть пропущены стандартными методами оценки.
«Воздействие на цель более важно, и его будет намного труднее устранить», — говорит Гаэтан Берджио, генетик из Австралийского национального университета в Канберре.
Эти соображения безопасности, вероятно, послужат основой для продолжающихся дебатов о том, следует ли ученым редактировать человеческие эмбрионы для предотвращения генетических заболеваний — процесс, который является спорным, поскольку он создает постоянное изменение генома, которое может передаваться из поколения в поколение.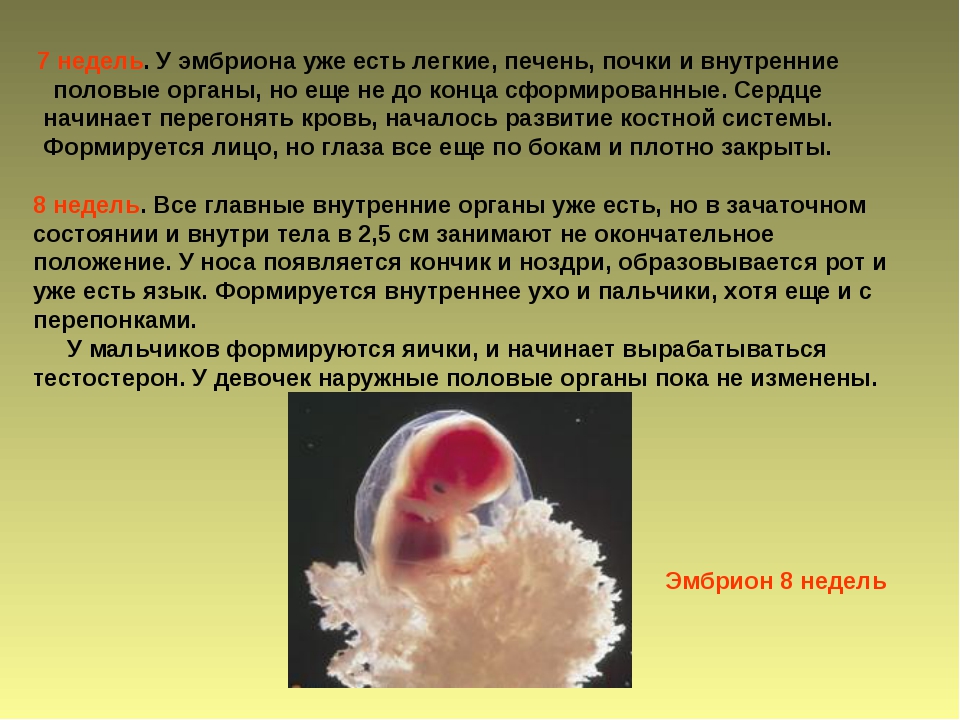 «Если бы редактирование человеческого эмбриона в репродуктивных целях или редактирование зародышевой линии было космическим полетом, то новые данные эквивалентны взрыву ракеты на стартовой площадке перед взлетом», — говорит Федор Урнов, изучающий редактирование генома в Калифорнийском университете. Беркли, но не участвовал ни в одном из последних исследований.
«Если бы редактирование человеческого эмбриона в репродуктивных целях или редактирование зародышевой линии было космическим полетом, то новые данные эквивалентны взрыву ракеты на стартовой площадке перед взлетом», — говорит Федор Урнов, изучающий редактирование генома в Калифорнийском университете. Беркли, но не участвовал ни в одном из последних исследований.
Нежелательные эффекты
Исследователи провели первые эксперименты с использованием CRISPR для редактирования человеческих эмбрионов в 2015 году. С тех пор несколько команд по всему миру начали исследовать этот процесс, направленный на точное редактирование генов. Но такие исследования все еще редки и, как правило, строго регулируются.
Последнее исследование подчеркивает, насколько мало известно о том, как человеческие эмбрионы восстанавливают ДНК, разрезанную инструментами редактирования генома — ключевой шаг в редактировании CRISPR – Cas9, говорит биолог-репродуктолог Мэри Герберт из Университета Ньюкасла, Великобритания. «Нам нужна базовая дорожная карта того, что там происходит, прежде чем мы начнем работать с ней с помощью ферментов, расщепляющих ДНК», — говорит она.
«Нам нужна базовая дорожная карта того, что там происходит, прежде чем мы начнем работать с ней с помощью ферментов, расщепляющих ДНК», — говорит она.
Первый препринт был размещен в Интернете 5 июня биологом Кэти Ниакан из Института Фрэнсиса Крика в Лондоне и ее коллегами. В этом исследовании 1 исследователи использовали CRISPR – Cas9 для создания мутаций в гене POU5F1 , который важен для эмбрионального развития. Из 18 геном-отредактированных эмбрионов около 22% содержали нежелательные изменения, затрагивающие большие участки ДНК, окружающие POU5F1 .Они включали перестройки ДНК и большие делеции нескольких тысяч букв ДНК — намного больше, чем обычно предполагали исследователи, использующие этот подход.
Другая группа, возглавляемая биологом по стволовым клеткам Дитером Эгли из Колумбийского университета в Нью-Йорке, изучала эмбрионы, созданные из сперматозоидов, несущих вызывающую слепоту мутацию в гене под названием EYS 2 . Команда использовала CRISPR – Cas9, чтобы попытаться исправить эту мутацию, но около половины протестированных эмбрионов потеряли большие сегменты хромосомы, а иногда и всю хромосому, на которой расположен EYS .
Команда использовала CRISPR – Cas9, чтобы попытаться исправить эту мутацию, но около половины протестированных эмбрионов потеряли большие сегменты хромосомы, а иногда и всю хромосому, на которой расположен EYS .
И третья группа, возглавляемая репродуктивным биологом Шухратом Миталиповым из Орегонского университета здоровья и науки в Портленде, изучала эмбрионы, полученные с использованием сперматозоидов с мутацией, вызывающей сердечное заболевание 3 . Эта команда также обнаружила признаки того, что редактирование затронуло большие участки хромосомы, содержащие мутировавший ген.
Во всех исследованиях исследователи использовали эмбрионы только в научных целях, а не для зачатия. Ведущие авторы трех препринтов отказались обсуждать детали своей работы с командой новостей Nature , пока статьи не будут опубликованы в рецензируемых журналах.
Непредсказуемый ремонт
Изменения являются результатом процессов репарации ДНК, задействованных инструментами редактирования генома. CRISPR-Cas9 использует небольшую цепь РНК для направления фермента Cas9 к сайту в геноме с аналогичной последовательностью. Затем фермент разрезает обе нити ДНК в этом месте, и системы репарации клетки устраняют разрыв.
CRISPR-Cas9 использует небольшую цепь РНК для направления фермента Cas9 к сайту в геноме с аналогичной последовательностью. Затем фермент разрезает обе нити ДНК в этом месте, и системы репарации клетки устраняют разрыв.
Редактирование происходит во время этого ремонта: чаще всего клетка закрывает разрез с помощью подверженного ошибкам механизма, который может вставлять или удалять небольшое количество букв ДНК.Если исследователи предоставят шаблон ДНК, клетка может иногда использовать эту последовательность для исправления разреза, что приводит к настоящей перезаписи. Но сломанная ДНК также может вызвать перетасование или потерю большой области хромосомы.
Предыдущая работа с использованием CRISPR на эмбрионах мыши и других видах человеческих клеток уже продемонстрировала, что редактирование хромосом может вызывать большие нежелательные эффекты 4 , 5 . Но было важно продемонстрировать работу и на человеческих эмбрионах, говорит Урнов, потому что разные типы клеток могут по-разному реагировать на редактирование генома.
Такие перестановки могут быть пропущены во многих экспериментах, которые обычно ищут другие нежелательные изменения, такие как изменения одной буквы ДНК или небольшие вставки или удаления только нескольких букв. Однако в последних исследованиях специально искали большие делеции и хромосомные перестройки рядом с целевым сайтом. «Это то, к чему все мы в научном сообществе с самого начала будем относиться более серьезно, чем мы уже сделали», — говорит Урнов. «Это не разовая случайность.”
Генетические изменения
Три исследования предложили разные объяснения того, как возникли изменения ДНК. Команды Эгли и Ниакана объясняют большую часть изменений, наблюдаемых в их эмбрионах, крупными делециями и перестройками. Группа Миталипова вместо этого заявила, что до 40% обнаруженных ею изменений были вызваны феноменом, называемым конверсией генов, при котором процессы восстановления ДНК копируют последовательность из одной хромосомы в паре, чтобы излечить другую.
Миталипов и его коллеги сообщили об аналогичных результатах в 2017 г. 6 , но некоторые исследователи скептически относились к тому, что частые преобразования генов могут происходить у эмбрионов.Они отметили, что материнские и отцовские хромосомы не находятся рядом друг с другом в то время, когда постулируется преобразование гена, и что анализы, которые команда использовала для выявления конверсий генов, могли выявить другие хромосомные изменения, включая делеции 4 , 7 .
6 , но некоторые исследователи скептически относились к тому, что частые преобразования генов могут происходить у эмбрионов.Они отметили, что материнские и отцовские хромосомы не находятся рядом друг с другом в то время, когда постулируется преобразование гена, и что анализы, которые команда использовала для выявления конверсий генов, могли выявить другие хромосомные изменения, включая делеции 4 , 7 .
Эгли и его коллеги непосредственно проверили конверсии генов в своем последнем препринте и не смогли их найти, и Берджио указывает, что анализы, использованные в препринте Миталипова, аналогичны тем, которые команда использовала в 2017 году.Одна из возможностей заключается в том, что разрывы ДНК заживают по-разному в разных местах хромосомы, говорит Джин-Су Ким, генетик из Сеульского национального университета и соавтор препринта Миталипова.
комиссионных карт узкий путь для редактирования человеческих эмбрионов | Наука
Хэ Цзянькуй шокировал мир, когда описал имплантацию отредактированных эмбрионов, которая привела к рождению девочек-близнецов, Лулу и Наны.
Автор: Джон Коэн
Ни один из недавних биомедицинских экспериментов не вызвал большего потрясения, чем создание Хэ Цзянькуя первых генно-отредактированных младенцев в 2018 году, которое многие считали опасным, неэтичным и недоношенным, и которое привело к его заключению в тюрьму в Китае. Теперь международный комитет пришел к выводу, что методы редактирования генов, несмотря на существенные улучшения, все еще далеки от того, чтобы безопасно вводить наследственные модификации ДНК в человеческие эмбрионы.
Но они могут быть однажды, в редких случаях, добавляет группа экспертов, призывая к формированию глобального научного органа, который будет рассматривать предложения по так называемому «наследуемому редактированию генома человека» (HHGE) и пытаться повлиять на решение стран разрешить его использование. Группа, которая сегодня выпустила один из самых подробных отчетов по этой теме, очень подробно описывает генетические ситуации, которые HHGE может решить, и строгий надзор, который клиницисты должны встретить в будущем, прежде чем снова создавать людей с модифицированной ДНК, которую они может передаваться потомству.
Группа, которая сегодня выпустила один из самых подробных отчетов по этой теме, очень подробно описывает генетические ситуации, которые HHGE может решить, и строгий надзор, который клиницисты должны встретить в будущем, прежде чем снова создавать людей с модифицированной ДНК, которую они может передаваться потомству.
В течение более 1 года Международная комиссия по клиническому использованию редактирования генома зародышевой линии человека изучала научную литературу по CRISPR и другим способам модификации ДНК, проводила публичные собрания и вебинары, а также консультировалась с учеными, врачами, специалистами по этике и группами пациентов. 18 членов комиссии — которые приехали из 10 стран и, как отмечается в отчете, включают «экспертов в области науки, медицины, генетики, этики, психологии, регулирования и права» — согласились с предыдущими группами, которые пришли к выводу, что никто не должен следовать В ближайшее время он пойдет по стопам.CRISPR — редактор генома, который Он использовал, и его усовершенствованные версии — они пришли к выводу, что все еще не может «эффективно и надежно» вносить точные изменения, не вызывая «нежелательных изменений в человеческих эмбрионах».
В отчете подчеркивается, что он фокусируется на «начальном клиническом использовании» HHGE, и говорится, что эту область необходимо тщательно контролировать и часто переоценивать. «В наших знаниях много пробелов, и необходимы дальнейшие исследования», — заявила сегодня на брифинге Кей Дэвис, генетик из Оксфордского университета, которая была сопредседателем комиссии.
Организованная Королевским обществом Великобритании и отделениями науки и медицины Национальной академии наук, инженерии и медицины США, комиссия ставила своей целью описать «ответственный путь клинической трансляции», который мог бы переместить редактирование генома из лаборатории в вспомогательное -репродуктивные вмешательства при болезнях человека. В отчете в значительной степени избегаются сложные социальные и этические последствия создания генетически отредактированных младенцев. Но он углубляется в управление этой проблемой, в частности, призывает к созданию Международной научной консультативной группы для оценки предлагаемого использования HHGE, предоставления регулярных обновлений о связанных технологиях и обзора клинических результатов в случае рождения отредактированного эмбриона, имплантированного матери. Он также рекомендует создать международный механизм, с помощью которого клиницист или исследователь мог бы сообщать о планах или использовании HHGE, которые, по их мнению, касаются — по сути, горячая линия для информаторов.
Он также рекомендует создать международный механизм, с помощью которого клиницист или исследователь мог бы сообщать о планах или использовании HHGE, которые, по их мнению, касаются — по сути, горячая линия для информаторов.
Набег комиссии на подобные вопросы обеспокоил некоторых. «Отчет выходит за рамки его научной компетенции», — заявила Сара Норкросс, директор Progress Educational Trust, благотворительной организации, занимающейся помощью людям с бесплодием или генетическими заболеваниями, в заявлении, опубликованном U.K. Научный медиацентр. «Всемирная организация здравоохранения (ВОЗ) все еще обсуждает вопросы управления редактированием генома и не должна чувствовать себя ограниченной рекомендациями этого отчета по управлению, если она считает целесообразным отклониться от них».
Комиссия по редактированию генома классифицировала потенциальные применения HHGE, создав шестиуровневую иерархию, которая варьируется от наиболее до наименее убедительных причин для риска. По их словам, использование HHGE, которое легче всего оправдать, поможет тем редким парам, у которых даже при экстракорпоральном оплодотворении (ЭКО) и скрининге эмбрионов мало или совсем нет шансов иметь ребенка, не унаследовавшего генетическое заболевание. — например, болезнь Хантингтона, муковисцидоз, бета-талассемия, — которые вызывают «тяжелую заболеваемость или преждевременную смерть».В отчете подчеркивается, что таких ситуаций немного и они очень редки. У людей есть две копии большинства генов, одна унаследована от матери, а другая — от отца. Что касается так называемого рецессивного расстройства, такого как кистозный фиброз, в Соединенных Штатах может быть одна или две пары, которые обе являются «гомозиготными» по этой мутации — то есть в их унаследованной паре гена — и произведут пораженного ребенка. При доминантных расстройствах, таких как Хантингтон, ребенок должен унаследовать только один мутировавший ген для развития болезни, поэтому один гомозиготный родитель, что также является редкостью, неизбежно передаст болезнь всем эмбрионам.
По их словам, использование HHGE, которое легче всего оправдать, поможет тем редким парам, у которых даже при экстракорпоральном оплодотворении (ЭКО) и скрининге эмбрионов мало или совсем нет шансов иметь ребенка, не унаследовавшего генетическое заболевание. — например, болезнь Хантингтона, муковисцидоз, бета-талассемия, — которые вызывают «тяжелую заболеваемость или преждевременную смерть».В отчете подчеркивается, что таких ситуаций немного и они очень редки. У людей есть две копии большинства генов, одна унаследована от матери, а другая — от отца. Что касается так называемого рецессивного расстройства, такого как кистозный фиброз, в Соединенных Штатах может быть одна или две пары, которые обе являются «гомозиготными» по этой мутации — то есть в их унаследованной паре гена — и произведут пораженного ребенка. При доминантных расстройствах, таких как Хантингтон, ребенок должен унаследовать только один мутировавший ген для развития болезни, поэтому один гомозиготный родитель, что также является редкостью, неизбежно передаст болезнь всем эмбрионам.
Если HHGE разрешен, — заявила группа, — любое редактирование эмбриона должно только «специально изменить одну последовательность ДНК на конкретную желаемую последовательность», которая является общей для «соответствующей популяции». Это означает, что простейшая, наиболее часто используемая форма CRISPR, которая может парализовать гены, но не исправляет их, никогда не должна использоваться в эмбрионах; Например, в спорном эксперименте Хэ он попытался отключить ген и сделать клетки ребенка устойчивыми к ВИЧ-инфекции.
«Я приветствую отчет комиссии, который продолжает углублять продолжающийся глобальный разговор о науке редактирования зародышевой линии», — говорит Альта Чаро, специалист по биоэтике из Университета Висконсина, Мэдисон, которая является частью комитета, организованного ВОЗ, исследует, как лучше всего управлять этой противоречивой ареной.
Химик из Гарвардского университета Дэвид Лю, который первым разработал усовершенствованные технологии редактирования генома, заимствованные из инструментария CRISPR, описывает отчет как «продуманный, сбалансированный и четко определенный». Но у него все еще есть опасения по поводу того, следует ли когда-либо разрешать HHGE. «Я по-прежнему с трудом могу представить себе правдоподобные ситуации, в которых редактирование клинической зародышевой линии обеспечивает путь вперед для удовлетворения неудовлетворенных медицинских потребностей, которые не могут быть удовлетворены другими способами», — говорит Лю. Он и другие подчеркивают, что доимплантационное генетическое тестирование (ПГТ), которое обычно используют клиники ЭКО, могло бы избежать необходимости редактирования большинства человеческих эмбрионов.Во всех случаях, кроме самых редких, это позволит парам выбирать и затем имплантировать эмбрионы, у которых нет вызывающих болезнь мутаций, переносимых родителями.
Но у него все еще есть опасения по поводу того, следует ли когда-либо разрешать HHGE. «Я по-прежнему с трудом могу представить себе правдоподобные ситуации, в которых редактирование клинической зародышевой линии обеспечивает путь вперед для удовлетворения неудовлетворенных медицинских потребностей, которые не могут быть удовлетворены другими способами», — говорит Лю. Он и другие подчеркивают, что доимплантационное генетическое тестирование (ПГТ), которое обычно используют клиники ЭКО, могло бы избежать необходимости редактирования большинства человеческих эмбрионов.Во всех случаях, кроме самых редких, это позволит парам выбирать и затем имплантировать эмбрионы, у которых нет вызывающих болезнь мутаций, переносимых родителями.
Однако есть пары, у которых высока вероятность того, что PGT не сможет родить здорового ребенка, и это единственное исключение из второй категории в отчете. Третья категория использования HHGE — это генетические заболевания, которые имеют менее серьезные последствия и также могут быть исправлены или вылечены, например, глухота, для которой теперь есть кохлеарные имплантаты.
После разоблачения Хе в 2018 году Денис Ребриков, специалист по секвенированию ДНК из Российского национального исследовательского медицинского университета им. Пирогова, реализовал проект по исправлению мутации глухоты в парах, каждая из которых имеет аномальный ген. Ребриков, который еще не удовлетворен тем, что может безопасно редактировать человеческий эмбрион и поэтому не добивался одобрения России для продвижения вперед, говорит, что случаи, в отношении которых комиссия разрешила бы HHGE, настолько редки, что одобрение комиссии бессмысленно. «В этой формулировке это принципиальный запрет на редактирование генома эмбриона», — говорит Ребриков.
Norcross разделяет эту критику, называя критерии отчета для редактирования человеческого эмбриона «слишком узкими».
Заболевания, вызываемые несколькими генами, представляют четвертую категорию использования HHGE. Пятое, и самое табу в глазах группы, будет включать генетические улучшения детей, делающие их устойчивыми к ВИЧ, лучшими в спорте, более высокими, умными или даже способными противостоять радиационному облучению, возникающему во время длительных космических полетов.
Основная опасность редактирования человеческих эмбрионов заключается в том, что непреднамеренные «нецелевые» изменения ДНК произойдут и не будут обнаружены до имплантации эмбриона.Панель подробно исследует возможное решение: редактирование стволовых клеток, которые производят человеческую сперму или яйцеклетки, перед использованием этих гамет для ЭКО. «Это будет иметь серьезные последствия для безопасности, поскольку вопросы точности редактирования на цели и предотвращения событий, не соответствующих цели, могут быть в значительной степени решены до того, как любая гамета будет рассмотрена для использования при создании эмбриона», — отмечается в отчете.
Федор Урнов, исследователь CRISPR из Калифорнийского университета в Беркли, говорит, что отчет подтверждает широко распространенное мнение о том, что редактирование человеческих эмбрионов в лучшем случае имеет лишь нишевое оправдание.«Тщательные рекомендации, изложенные в этом отчете, показывают, что список проблем, которые можно решить с помощью такого редактирования, на самом деле довольно невелик», — говорит Урнов. «В сообществе редакторов генов ни для кого не секрет, что репродуктивное редактирование человека — это решение в поисках проблемы».
«В сообществе редакторов генов ни для кого не секрет, что репродуктивное редактирование человека — это решение в поисках проблемы».
первых человеческих эмбрионов, отредактированных в США
При изменении кода ДНК человеческих эмбрионов цель ученых — показать, что они могут искоренить или исправить гены, вызывающие наследственные заболевания, такие как бета-талассемия в крови.Этот процесс называют «инженерией зародышевой линии», потому что любой генетически модифицированный ребенок затем передал бы изменения последующим поколениям через свои собственные половые клетки — яйцеклетку и сперму.
Некоторые критики говорят, что эксперименты с зародышевыми линиями могут открыть шлюзы в дивный новый мир «дизайнерских младенцев», созданных с использованием генетических усовершенствований — перспектива, против которой категорически возражают ряд религиозных организаций, групп гражданского общества и биотехнологических компаний.
В прошлом году разведывательное сообщество США назвало CRISPR потенциальным «оружием массового уничтожения».
OHSU / Кристина Вентц-Графф
Полученный по Skype, Миталипов отказался комментировать результаты, которые, по его словам, ожидают публикации. Но другие ученые подтвердили редактирование эмбрионов с помощью CRISPR. «Насколько я знаю, это будет первое исследование, опубликованное в США», — говорит Джун Ву, сотрудник Института Солка в Ла-Хойя, Калифорния, который принимал участие в проекте.
Лучшая техника
В более ранних китайских публикациях, хотя и ограниченных по объему, было обнаружено, что CRISPR вызывает ошибки редактирования и что желаемые изменения ДНК принимаются не всеми клетками эмбриона, а только некоторыми. Этот эффект, названный мозаицизмом, придал вес аргументам о том, что редактирование зародышевой линии было бы небезопасным способом создания человека.
Но, как говорят, Миталипов и его коллеги убедительно показали, что можно избежать как мозаицизма, так и «нецелевых» эффектов, как известны ошибки CRISPR.
Человек, знакомый с исследованием, говорит, что «многие десятки» человеческих эмбрионов ЭКО были созданы для эксперимента с использованием донорской спермы мужчин, несущих унаследованные мутации болезни. Эмбрионы на этой стадии представляют собой крошечные скопления клеток, невидимые невооруженным глазом. MIT Technology Review не смог определить, какие гены болезни были выбраны для редактирования.
«Это принципиальное доказательство того, что это может работать. Они значительно снизили мозаичность. Я не думаю, что это начало клинических испытаний, но они продвинулись дальше, чем кто-либо прежде », — сказал ученый, знакомый с проектом.
Группа Миталипова, похоже, преодолела предыдущие трудности, «забравшись раньше» и введя CRISPR в яйцеклетки одновременно с оплодотворением спермой.
Эта концепция аналогична концепции, испытанной на мышах Тони Перри из Университета Бата. Перри успешно отредактировал ген мыши для окраски шерсти, изменив мех потомства с ожидаемого коричневого на белый.
В некоторой степени пророчески, в статье Перри об исследовании, опубликованной в конце 2014 года, говорится: «Этот или аналогичный подход может однажды позволить таргетировать или редактировать геном человека на очень ранней стадии разработки.”
Генетическое улучшение
Миталипов родился в Казахстане, когда он был частью бывшего Советского Союза. В течение многих лет он раздвигал научные границы. В 2007 году он представил первых в мире клонированных обезьян. Затем, в 2013 году, он создал человеческие эмбрионы путем клонирования как способ создания стволовых клеток, ориентированных на пациента.
Переход его команды к редактированию эмбрионов совпадает с февральским отчетом Национальной академии наук США, который, по общему мнению, дает зеленый свет лабораторным исследованиям модификации зародышевой линии.
В отчете также предлагалась квалифицированная поддержка использования CRISPR для создания генно-отредактированных младенцев, но только в том случае, если он был использован для устранения серьезных заболеваний.
Консультативный комитет провел красную черту в отношении генетических улучшений, таких как более высокий интеллект. «Редактирование генома для улучшения черт или способностей, выходящих за рамки обычного здоровья, вызывает опасения по поводу того, могут ли преимущества перевешивать риски, и по поводу справедливости, если это доступно только некоторым людям», — сказала Альта Чаро, сопредседатель исследовательского комитета НАН и профессор права и биоэтика в Университете Висконсин-Мэдисон.
В США любые попытки превратить отредактированный эмбрион ЭКО в ребенка были заблокированы Конгрессом, который добавил формулировку в законопроект о финансировании Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США, запрещающий одобрять клинические испытания этой концепции.
Несмотря на такие препятствия, создание генетически отредактированного человека может быть предпринято в любой момент, в том числе в клиниках ЭКО, действующих в странах, где нет таких юридических ограничений.
Стив Коннор — независимый журналист из США.K.
Группа излагает рекомендации для CRISPR-редактируемых человеческих эмбрионов
В четверг (3 сентября) Международная комиссия по клиническому использованию редактирования генома зародышевой линии человека выпустила отчет, в котором анализируются имеющиеся исследования и определяется этическое использование редактирования генов. на человеческих эмбрионах. Этот 225-страничный документ предлагает дорожную карту для испытаний и правил, необходимых для разработки технологии, и в конечном итоге делает вывод о том, что технология еще недостаточно надежна для использования на людях.Любая страна, которая позволит своим ученым делать это в будущем, должна ограничить свою деятельность тяжелыми моногенными заболеваниями.
Комиссия, состоящая из десятков ученых со всего мира, была сформирована после того, как китайский генетик Хэ Цзянькуй в 2018 году заявил, что использовал CRISPR-Cas9 на наборе близнецов и третьего ребенка, чтобы сделать их устойчивыми к ВИЧ. Хотя законность редактирования еще не определена, утверждения Хэ были встречены международным осуждением и приговором к трем годам тюремного заключения за незаконную медицинскую практику.
Хотя законность редактирования еще не определена, утверждения Хэ были встречены международным осуждением и приговором к трем годам тюремного заключения за незаконную медицинскую практику.
Соматическое редактирование генов вводит измененную ДНК в некоторые клетки организма после развития в качестве средства лечения генетических заболеваний. Редактирование зародышевой линии манипулирует ДНК на самых ранних стадиях эмбрионального развития, затрагивает все типы тканей и позволяет организму затем передавать эти изменения своему потомству. Вместо того, чтобы лечить болезнь, редактирование зародышевой линии теоретически могло бы устранить ее не только из организма, но и полностью, что сделало бы ее привлекательной в контексте наследственных генетических заболеваний.
Хотя манипулирование геномами с помощью CRISPR стало обычным явлением в генетических лабораториях по всему миру, комиссия заявляет, что в настоящее время «результаты редактирования генома в зиготах человека невозможно контролировать» и могут иметь непредвиденные последствия.
«Это подчеркивает то, что на самом деле, я думаю, известно большинству исследователей, которые думают об этом: в настоящее время нельзя использовать редактирование зародышевой линии в клинических целях», — сказала Дженнифер Дудна, генетик из Калифорнийского университета в Беркли, не был членом комиссии, сообщает STAT .«Причина в том, что технология находится на слишком ранней стадии развития, и мы недостаточно хорошо понимаем, как она работает в человеческих эмбрионах».
Как только можно будет безопасно внести эти изменения, сообщает комиссия, страны могли бы принять политику, разрешающую эту технологию только в тех случаях, когда единственный ген ответственен за заболевание, например серповидноклеточную анемию, кистозный фиброз или Тея-Сакса. .
«Мы думаем, что планка должна быть высокой, и это уместно», — говорит Ричард Лифтон, сопредседатель комиссии The Guardian .«Если вы собираетесь создавать людей, вы хотите знать, что можете надежно вносить нужные изменения. Если вы не можете сделать это надежно, не создавая непредвиденных эффектов, вам не следует идти [вперед] ».
Если вы не можете сделать это надежно, не создавая непредвиденных эффектов, вам не следует идти [вперед] ».
Редактирование генов CRISPR вызывает хаос в ДНК человеческих эмбрионов
Способность технологии редактирования генов CRISPR безопасно модифицировать человеческие эмбрионы была поставлена под сомнение после того, как в нескольких недавних статьях были описаны серьезные нарушения ДНК у эмбрионов, подвергшихся редактированию.
Каждая из трех статей, опубликованных в этом месяце без рецензирования на сервере препринтов bioRxiv , предназначалась для редактирования только одного гена. Но результаты показали крупномасштабные, непреднамеренные делеции и перестройки ДНК в областях, окружающих целевую последовательность. Хотя прошлые исследования показали, что редактирование генов может привести к мутациям вдали от целевой области, эти исследования вместо этого привлекают внимание к более локализованным повреждениям с участием более крупных последовательностей ДНК, которые могут быть упущены из виду при традиционных проверках безопасности, сообщает Nature .
Эти исследования были предназначены только для исследовательских целей, то есть эмбрионы были уничтожены после окончания эксперимента. Но в ответ на свои выводы многие исследователи высказывают возражения против дальнейшего редактирования. Сама область все еще борется с последствиями рождения девочек-близнецов в результате весьма противоречивых экспериментов CRISPR, проведенных Хэ Цзянькуй в Южном университете науки и технологий в Китае в 2018 году.
«Это не приукрашивает», Федор Урнов, генетик и исследователь CRISPR из Калифорнийского университета в Беркли, который не участвовал в исследовании, рассказывает OneZero .«Это запретительный судебный приказ для всех редакторов генома, чтобы не допускать редактирования эмбрионов на дневном свету».
В первом исследовании, опубликованном 5 июня, исследователи из Института Фрэнсиса Крика использовали CRISPR для удаления гена POU5F1 — важного фактора эмбрионального развития и плюрипотентности стволовых клеток — у 18 эмбрионов. Когда они проанализировали влияние делеции на геном, они неожиданно обнаружили, что восемь из этих эмбрионов содержали дополнительные аномалии, четыре из которых включали существенные перестройки ДНК и делеции нескольких тысяч пар оснований.
Когда они проанализировали влияние делеции на геном, они неожиданно обнаружили, что восемь из этих эмбрионов содержали дополнительные аномалии, четыре из которых включали существенные перестройки ДНК и делеции нескольких тысяч пар оснований.
Вторая группа из Колумбийского университета попыталась модифицировать эмбрионы с помощью вызывающей слепоту мутации в гене EYS , наиболее распространенном гене, участвующем в возникновении дегенеративного состояния глаз, называемого пигментным ретинитом. Но в дополнение к ожидаемым изменениям 18 июня они сообщили, что почти половина из 23 эмбрионов также потеряли большие участки хромосомы, на которых расположен EYS . В самых крайних случаях хромосома полностью исчезла.
Наконец, исследование, опубликованное 20 июня исследователями из Орегонского университета здравоохранения и науки, также сосредоточено на исправлении мутации в гене MYBPC3 , который, как известно, вызывает сердечное заболевание.Хотя им удалось устранить повреждения почти у половины из 86 эмбрионов — в дополнение к их новаторской работе в 2017 году –, авторы также сообщили о серьезных нарушениях в хромосоме, содержащей ген.
Взятые вместе, эти три исследования подчеркивают контраст между эффектами, не соответствующими целевому объекту, которые возникают, когда инструменты CRISPR редактируют где-то непреднамеренно, и целевыми изменениями, при которых изменения правильно локализованы, но имеют некоторые непредвиденные последствия. В каждом случае попадание в цель было неожиданным.
«Это означает, что вы не просто изменяете ген, который хотите изменить, но вы затрагиваете настолько большую часть ДНК вокруг гена, который пытаетесь редактировать, что вы можете непреднамеренно влиять на другие гены и вызывать проблемы », — говорит Киран Мусунуру, кардиолог из Пенсильванского университета, который не принимал участия ни в одном из исследований, OneZero .
Эти проблемы также показывают, насколько мало известно о том, как организм естественным образом восстанавливает молекулярные разрезы в геноме, сделанные с помощью технологии CRISPR, сообщает Nature .Вместо того, чтобы аккуратно лечить недавно расщепленные концы ДНК, подвергнутые редактированию, механизм иногда может быть неисправным, что приводит к деградации или повреждению ДНК.
Обращаясь к Nature , Урнов говорит, что эти попадания в цель требуют внимания исследователей, идущих вперед. «Это то, что все мы, в научном сообществе, сразу же начнем воспринимать более серьезно, чем мы уже сделали. Это не разовая случайность ».
Исследованиевыявляет ловушку для коррекции мутаций в человеческих эмбрионах с помощью CRISPR
В статье, опубликованной сегодня в журнале Cell, ученые описывают неожиданные, нежелательные последствия редактирования генов в человеческих эмбрионах с помощью CRISPR, системы редактирования генома.
Исследование, наиболее подробный на сегодняшний день анализ CRISPR на человеческих эмбрионах, показывает, что применение технологии редактирования генов для восстановления гена, вызывающего слепоту, на ранней стадии развития человеческого эмбриона часто приводит к удалению всей хромосомы или ее большой части.
«Наше исследование показывает, что CRISPR / Cas9 еще не готов к клиническому использованию для исправления мутаций на данном этапе развития человека», — говорит старший автор исследования Дитер Эгли, доцент кафедры клеточной биологии развития кафедры педиатрии Колумбийского университета Вагелос. Колледж врачей и хирургов.
Колледж врачей и хирургов.
CRISPR в человеческих эмбрионах
Система редактирования генома под названием CRISPR / Cas9 произвела революцию в молекулярной биологии в последние годы, и ее первооткрыватели были удостоены Нобелевской премии по химии этого года. Система позволяет ученым вносить точные изменения в геномы культивируемых клеток, живых тканей и эмбрионов животных.
О первом применении CRISPR на человеческих эмбрионах было сообщено в 2015 году. Затем, в 2018 году, Хэ Цзянькуй заявил, что провел процедуру на паре двойных эмбрионов, что вызвало бурю осуждения со стороны ученых и правительственных чиновников во всем мире.
CRISPR может привести к хромосомным аномалиям
В новой статье Эгли и его коллеги протестировали влияние редактирования генома CRISPR / Cas9 на человеческие эмбрионы на ранних стадиях, несущие мутацию в гене EYS (гомолог с закрытыми глазами), который вызывает наследственную слепоту.
«Из предыдущих исследований дифференцированных клеток человека и мышей мы знаем, что разрыв ДНК приводит в основном к двум результатам: точному восстановлению или небольшим локальным изменениям. В гене EYS эти изменения могут дать функциональный ген, хотя это не идеальное восстановление », — говорит Майкл Зуккаро, научный сотрудник Колледжа врачей и хирургов Вагелоса Колумбийского университета и соавтор статьи.
В гене EYS эти изменения могут дать функциональный ген, хотя это не идеальное восстановление », — говорит Майкл Зуккаро, научный сотрудник Колледжа врачей и хирургов Вагелоса Колумбийского университета и соавтор статьи.
Когда Зуккаро, Эгли и их коллеги изучили полные геномы модифицированных эмбрионов в этом исследовании, они пришли к другому результату. «Мы узнали, что в человеческих эмбриональных клетках одиночный разрыв ДНК может привести к третьему результату — потере всей хромосомы или иногда большого сегмента этой хромосомы, и эта потеря хромосомы очень часта», — говорит Зуккаро. .
В 2017 году в исследовании сообщалось об успешной коррекции мутации, вызывающей болезни сердца, у нормальных человеческих эмбрионов с помощью CRISPR.Исчерпывающие данные нового исследования предлагают иную интерпретацию этих результатов: вместо исправления хромосома, несущая мутацию, могла быть полностью потеряна.
«Если бы наши результаты были известны два года назад, я сомневаюсь, что кто-то предпринял бы попытку использовать CRISPR для редактирования гена в человеческом эмбрионе в клинике», — говорит Эгли. «Мы надеемся, что эти предостерегающие открытия должны воспрепятствовать преждевременному клиническому применению этой важной технологии, но также могут помочь в проведении ответственных исследований для достижения максимально безопасного и эффективного использования.”
«Мы надеемся, что эти предостерегающие открытия должны воспрепятствовать преждевременному клиническому применению этой важной технологии, но также могут помочь в проведении ответственных исследований для достижения максимально безопасного и эффективного использования.”
Дорожная карта для редактирования генов человеческого эмбриона — не зеленый свет
По этой причине авторы отчета точно указывают, сколько и какие нецелевые эффекты могут быть приемлемыми. Они устанавливают этот порог не выше средней скорости новых мутаций, которые спонтанно приобретает эмбрион. Репликация ДНК несовершенна, и большинство людей рождаются с несколькими десятками мутаций, которых нет ни в одном из геномов их биологических родителей. Авторы пришли к выводу, что редактирование генов не должно приводить к большему количеству генетических вариаций, чем это происходит в природе, а типы изменений следует тщательно изучать в лаборатории, чтобы убедиться, что они не приводят к неблагоприятным результатам.
Проблема, однако, в том, что в настоящее время нет хороших методов для оценки нецелевых эффектов у эмбрионов. Для этого необходимо собрать большое количество ДНК, что можно сделать, только пожертвовав несколько клеток эмбриона для генетического секвенирования. Эти методы не только ненадежны, но и вредят жизнеспособности эмбриона, что снижает вероятность беременности. Могут потребоваться годы для разработки более эффективных методов оценки, говорит член комиссии Хаойи Ван, репродуктивный биолог из Института зоологии и Института стволовых клеток и регенерации Китайской академии наук.«От редактирования генома до секвенирования генома одного эмбриона, есть еще много пробелов, которые необходимо заполнить», — сказал Ван журналистам на брифинге для прессы в четверг.
Комиссия была более узко сфокусирована на устранении такого рода научных пробелов, в то время как другие органы, такие как ВОЗ, будут более широко смотреть на то, как общества могут принять решение о редактировании зародышевой линии человека и как правительства будут регулировать технологию. «Разработка этических рамок не может быть связана только с автономией, конфиденциальностью и справедливостью», — говорит член комиссии Барта Мария Кнопперс, которая руководит Центром геномики и политики и работает на кафедре канадских исследований в области права и медицины в Университете Макгилла в Монреале.«Для меня научное качество и безопасность являются первостепенными этическими соображениями; они не второстепенные, — говорит она. «Я думаю, что этот отчет отражает акцент на правильном понимании этих аспектов».
«Разработка этических рамок не может быть связана только с автономией, конфиденциальностью и справедливостью», — говорит член комиссии Барта Мария Кнопперс, которая руководит Центром геномики и политики и работает на кафедре канадских исследований в области права и медицины в Университете Макгилла в Монреале.«Для меня научное качество и безопасность являются первостепенными этическими соображениями; они не второстепенные, — говорит она. «Я думаю, что этот отчет отражает акцент на правильном понимании этих аспектов».
Очерчивание границ между хорошей и плохой наукой особенно важно для предотвращения причинения чрезмерного вреда любым, кто намерен действовать вне установленных нормативных рамок, говорит Дана Кэрролл, член комиссии и профессор биохимии Медицинской школы Университета штата Юта.«Эти стандарты должны быть настолько высокими, потому что фактическое начало беременности с измененным эмбрионом приведет нас на территорию, с которой у нас практически нет опыта», — говорит он.
Кэрролл, чья лаборатория стала пионером некоторых из самых ранних работ с редакторами генома старшего (до Crispr) поколений, присутствовал в аудитории на саммите в Гонконге в ноябре 2018 года, напряженно наблюдая, как Хэ Цзянькуй представил данные, описывающие свои эксперименты по созданию первые в мире дети Crispr’d. Но эти данные никогда не публиковались.И что немаловажно, говорит Кэрролл, никакая дополнительная информация о статусе детей никогда не становилась достоянием общественности. Таким образом, хотя Цзянькуй открыл дверь для других исследователей, он не оставил много возможностей для лучшего понимания того, что происходит, когда вы вставляете Crispr в человеческий эмбрион, а затем вставляете этот эмбрион в человеческую матку.
«Мы слышали грохот, что люди ждут своего часа, готовые продолжить», — говорит Кэрролл, имея в виду других исследователей, намеревающихся запустить свои собственные эксперименты с детьми Crispr.«Поэтому мы хотели убедиться, что когда они это сделают, стандарты, которым они должны соответствовать в отношении безопасности, эффективности и специфичности, будут ясны».

 Возможен сценарий, при котором в какой-то клетке исправится только одна копия хромосомы, а вторая останется не отредактированной, и из-за этого не все клетки эмбриона будут нести в себе нужные нам изменения (мозаицизм).
Возможен сценарий, при котором в какой-то клетке исправится только одна копия хромосомы, а вторая останется не отредактированной, и из-за этого не все клетки эмбриона будут нести в себе нужные нам изменения (мозаицизм). В статье 2017 года группа Шухрата Миталипова, которая тоже занималась редактированием эмбрионов методом CRISPR/Cas, отчиталась, что по хотя целевому гену они попали в 42 из 58 случаев, ДНК-заплатка для гена MYBPC3 у них не сработала.
В статье 2017 года группа Шухрата Миталипова, которая тоже занималась редактированием эмбрионов методом CRISPR/Cas, отчиталась, что по хотя целевому гену они попали в 42 из 58 случаев, ДНК-заплатка для гена MYBPC3 у них не сработала.