Острый миелоидный лейкоз | Фонд «Подари жизнь»
Суть болезни
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови, обычно предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обуславливает основные симптомы заболевания.
Как известно, различные клетки крови развиваются по-разному и имеют разных предшественников – то есть относятся к различным линиям кроветворения (см. схему в статье «Кроветворение»). Линия кроветворения, приводящая к появлению лимфоцитов, называется лимфоидной; остальные же лейкоциты и другие клетки крови относятся к миелоидной линии. Соответственно, различают лейкозы из клеток-предшественников лимфоцитов (такие лейкозы называют лимфобластными, лимфоцитарными или просто лимфолейкозами) и из предшественников других клеток (такие лейкозы называют миелобластными, миелоидными или просто миелолейкозами).
Острый миелоидный лейкоз (ОМЛ, острый миелобластный лейкоз, острый миелолейкоз, острый нелимфобластный лейкоз) – заболевание, сравнительно редко встречающееся у детей, однако с возрастом частота его возрастает. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «миелоидный» означает, как указано выше, что незрелые клетки, составляющие основу болезни, принадлежат к так называемой миелоидной линии кроветворения. Эти клетки – как правило, миелобласты и их потомки, но возможно также присутствие других видов бластных клеток.
В рамках франко-американско-британской морфологической классификации (ФАБ, FAB) выделяют 8 основных вариантов ОМЛ.
* М0 (ОМЛ с минимальной дифференцировкой): <5% всех случаев ОМЛ
* М1 (ОМЛ без созревания): 15-20%
* М2 (ОМЛ с признаками созревания): 20-30%
* М3 (Острый промиелоцитарный лейкоз): 10-15%
* М4 (Острый миеломоноцитарный лейкоз): 20-25%
* М5 (Острый моноцитарный лейкоз): 5-10%
* М6 (Острый эритроидный лейкоз): <5%
* М7 (Острый мегакариоцитарный лейкоз): 3-10%
Некоторые очень редкие разновидности ОМЛ не включены в этот список.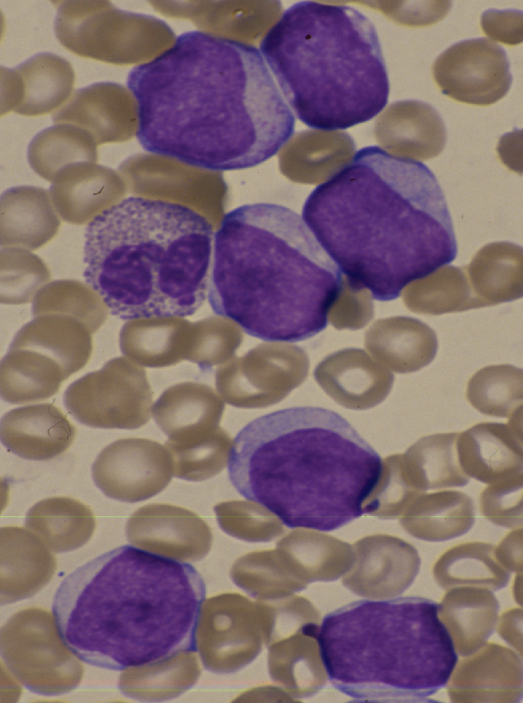 Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
Варианты ОМЛ с М3 по М7, имеющие собственные названия и некоторые специфические особенности, более подробно рассмотрены в отдельных разделах нашего справочника.
Частота встречаемости, факторы риска
ОМЛ составляет у детей около 15% всех случаев онкологических заболеваний кроветворной системы, то есть встречается у них заметно реже, чем острый лимфобластный лейкоз. Среди детей до 14 лет частота ОМЛ составляет приблизительно 0.6-0.8 случаев на 100 тысяч человек в год, однако в возрасте после 40-45 лет происходит резкий подъем заболеваемости. Большинство больных ОМЛ – пожилые люди. В отличие от острого лимфобластного лейкоза, наиболее характерного для детского возраста, при ОМЛ дети составляют всего 10% больных.
В большинстве случаев ОМЛ невозможно назвать непосредственную причину заболевания. Однако некоторые факторы повышают вероятность возникновения ОМЛ: воздействие ряда химических препаратов, ионизирующей радиации (в том числе в ходе предшествующего лечения других онкозаболеваний), иногда – случаи заболевания ОМЛ среди ближайших родственников, что говорит об определенной роли генетической предрасположенности.
Развитию ОМЛ могут предшествовать некоторые заболевания кроветворной системы, такие как миелодиспластический синдром. Тогда говорят о вторичном лейкозе. Наконец, риск ОМЛ повышен при определенных генетически обусловленных аномалиях, включая синдром Дауна, анемию Фанкони и некоторые другие состояния.
Признаки и симптомы
 Может возникнуть поражение слизистых оболочек рта и желудочно-кишечного тракта, припухлость десен. Нередко повышена температура тела, встречаются боли в костях. Иногда возникают опухоли из лейкемических клеток вне костного мозга –
Может возникнуть поражение слизистых оболочек рта и желудочно-кишечного тракта, припухлость десен. Нередко повышена температура тела, встречаются боли в костях. Иногда возникают опухоли из лейкемических клеток вне костного мозга – Так как большинство симптомов может быть связаны и с другими заболеваниями и не специфично для ОМЛ, перед началом лечения необходимо уточнение диагноза на основании лабораторных методов, которое в срочном порядке производится в больничных условиях.
Диагностика
При ОМЛ возникают изменения в обычном клиническом анализе крови: недостаток эритроцитов и тромбоцитов, чаще всего избыток лейкоцитов, причем многие из них представлены незрелыми формами. Но надежно поставить диагноз можно только при исследовании образца костного мозга. Согласно критериям Всемирной организации здравоохранения, диагноз ОМЛ ставится, если содержание миелобластов в костном мозге не менее 20% (согласно франко-американо-британской классифиции FAB, пороговым значением является 30%).
Для лечения и оценки прогноза заболевания важно не только подтвердить диагноз «лейкоз», но и различать острый лимфобластный лейкоз и ОМЛ, разграничивать лейкоз и миелодиспластический синдром, а также определять конкретный вариант ОМЛ (см. выше). Для этой цели применяется не только морфологическое исследование клеток (микроскопическое исследование специальным образом окрашенных препаратов), но и цитохимический анализ, а также иммунофенотипирование (изучение белков-антигенов на поверхности клеток). Цитогенетические исследования применяются для обнаружения хромосомных перестроек – так называемых транслокаций, имеющих большое значение для определения варианта болезни и прогноза.
Точная диагностика ОМЛ и его вариантов иногда представляет собой сложную задачу, требующую участия высококвалифицированных гематологов и гемопатологов в диагностическом процессе.
Как и при остром лимфобластном лейкозе, результаты диагностических исследований при ОМЛ используются для отнесения пациента к той или иной группе риска. Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии может понадобиться трансплантация костного мозга.
Это необходимо для того, чтобы определить тактику лечения, оценить как вероятность ответа на химиотерапию, так и риск последующего рецидива. У пациентов, принадлежащим к группе низкого риска, больше шансов достичь долговременной ремиссии при стандартном химиотерапевтическом лечении, а при высоком риске для успеха терапии может понадобиться трансплантация костного мозга.
Группу риска определяют многие факторы. Перечислим некоторые из них:
- Возраст: у больных среднего и пожилого возраста прогноз в среднем хуже, чем у детей и молодых людей.
- Хромосомные изменения в лейкемических клетках. Так, транслокации t(15;17) или t(8;21) определяют у больных более низкий риск. В то же время, например, определенные изменения хромосом 5 и 7 связаны с ухудшением прогноза.
- Вариант лейкоза. Некоторые варианты ОМЛ (такие как М0, М6, М7) связаны с высоким риском, а некоторые, напротив, сравнительно хорошо поддаются современной терапии (ОМЛ М3).
- С более высоким риском связан вторичный лейкоз, возникший на фоне другого гематологического заболевания – такого как миелодиспластический синдром или анемия Фанкони, – или после прохождения лечения (химиотерапия, облучение) по поводу какой-либо злокачественной опухоли. Риск также резко повышается при рецидиве лейкоза.
Лечение
Главным методом лечения ОМЛ является химиотерапия. Как в случае острого лимфобластного лейкоза, лечение включает фазы индукции ремиссии и консолидации; иногда применяется также поддерживающая терапия.
Индукция ремиссии – интенсивная терапия, направленная на достижение ремиссии лейкоза. При большинстве вариантов ОМЛ индукция ремиссии производится при помощи интенсивной химиотерапии с использованием цитарабина (цитозара) и лекарств антрациклинового ряда (даунорубицин, идарубицин), иногда с добавлением других препаратов – например, этопозида или митоксантрона. Стандартом являются курсы «7+3», при которых больному в течение 7 дней вводят цитарабин, причем в течение трех дней – в сочетании с антрациклиновым препаратом.
Специфической особенностью терапии при остром промиелоцитарном лейкозе (ОМЛ М3) является использование лекарства ATRA (полностью транс-ретиноевая кислота, третиноин) или других лекарств с похожим действием.
Если в результате терапии индукции оказывается, что в костном мозге стало менее 5% бластных клеток и у пациента нет других проявлений болезни (в том числе признаков нейролейкемии), то констатируется достижение ремиссии.
В результате курсов индукции удается достичь ремиссии у подавляющего большинства пациентов. Однако достигнутая ремиссия не может быть стойкой без терапии консолидации, то есть закрепления ремиссии. В фазе консолидации уничтожаются остаточные количества аномальных бластных клеток во избежание рецидива заболевания. Важнейшим препаратом в фазе консолидации при лечении ОМЛ является цитарабин, часто в высоких дозах; в разных сочетаниях используются также даунорубицин, 6-меркаптопурин, ифосфамид, митоксантрон, этопозид и др.
На этапах индукции и консолидации внутривенное введение химиотерапевтических препаратов производится в условиях больничного стационара.
Поддерживающая терапия используется далеко не во всех случаях (в отличие от острого лимфобластного лейкоза), однако при варианте ОМЛ М3 она важна. Эта терапия менее интенсивна, чем терапия индукции и консолидации, и не требует пребывания в больнице.
Иногда при ОМЛ к терапии добавляются современные таргетные препараты. Например, при определенной генетической поломке в опухолевых клетках эффективен препарат сорафениб.
Нейролейкемия менее характерна для ОМЛ, чем для острого лимфобластного лейкоза. Чаще всего она встречается при вариантах ОМЛ М3, М4 и М5. Для ее лечения и профилактики могут использоваться цитарабин, метотрексат и глюкокортикостероиды, вводимые интратекально, посредством люмбальной пункции спинномозгового канала. Изредка может использоваться также облучение головы (краниальное облучение). У детей риск распространения лейкоза в центральную нервную систему выше, чем у взрослых, поэтому профилактическая химиотерапия для его предотвращения используется чаще.
Для снижения вероятности рецидива пациентам из группы высокого риска может быть показана трансплантация костного мозга. Показаниями к трансплантации могут служить, например,
- транслокации и другие цитогенетические изменения в лейкемических клетках, связанные с высоким риском,
- рецидив лейкоза,
- развитие ОМЛ на фоне миелодиспластического синдрома или другой болезни крови, а также после предшествующего лечения злокачественных опухолей.
Вероятность успеха трансплантации максимальна, если проводить ее после достижения первой ремиссии. У детей трансплантации производятся чаще, чем у взрослых, и в среднем более успешны. Постоянно ведется работа над совершенствованием режимов трансплантации.
В ходе интенсивной химиотерапии ОМЛ практически всегда в той или иной мере подавляется нормальное кроветворение. Поэтому многим больным ОМЛ необходимы переливания компонентов крови: тромбоцитов во избежание кровотечений и эритроцитов для лечения анемии. Переливания донорских лейкоцитов (гранулоцитов) нужны только в случаях тяжелых инфекционных осложнений.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения часто необходимы эффективные антибактериальные, противогрибковые и противовирусные лекарства для профилактики и терапии инфекционных осложнений. Опасность представляют как обычные, так и оппортунистические инфекции. В частности, серьезную проблему представляют такие грибковые инфекции, как кандидоз и аспергиллез.
Лечение ОМЛ накладывает ограничения на образ жизни больного. В ходе интенсивной химиотерапии необходимо соблюдать диету и строгие правила гигиены, а также минимизировать контакты с внешним миром во избежание инфекций. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Общая продолжительность лечения при различных формах ОМЛ составляет от нескольких месяцев до 2-3 лет.
Прогноз
Без лечения ОМЛ, как правило, приводит к гибели больного в течение нескольких месяцев, иногда даже нескольких недель. Однако при современном лечении многих можно спасти. Прогноз зависит от конкретной разновидности миелолейкоза, цитогенетических особенностей (т.е. хромосомной структуры лейкемических клеток), возраста, общего состояния больного и других факторов.
В настоящее время медицина способна излечить 60-70% детей, заболевших ОМЛ. В частности, постоянно улучшаются результаты трансплантации костного мозга. В среднем и пожилом возрасте, к сожалению, вероятность излечения намного ниже.
Следует отметить, что большинство пациентов с ОМЛ – это именно пожилые больные. По сравнению с молодыми они тяжелее переносят лечение и хуже на него отвечают. Лишь у меньшинства пациентов старше 60 лет удается достичь длительной ремиссии. Для остальных зачастую основным становится поддерживающее лечение (борьба с инфекциями, переливания компонентов крови, обезболивание) для некоторого продления жизни и улучшения ее качества.
Специализированное научно-практическое издания для ветеринарных врачей и студентов ветеринарных ВУЗов.
TogglerВыпуски журнала по годам
Контакты журналаvetpeterburg
Подпишись на новости Вы можете подписаться на нашу новостную рассылку.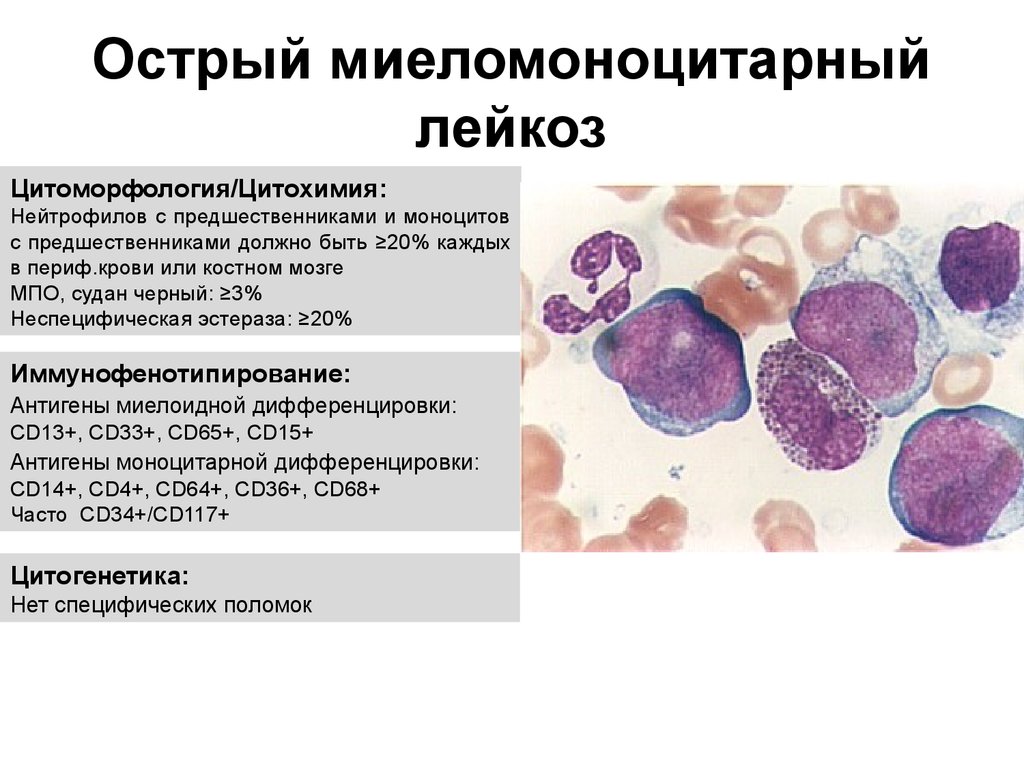
Для этого нужно заполнить форму, указав ваш почтовый e-mail.
Рассылка осуществляется не более 5-6 раз в год.
Администрация сайта никогда ни при каких обстоятельствах не разглашает и не передает другим лицам данные о пользователях сайта.
Покупка бумажной версии Чтобы приобрести бумажную версию журнала необходимо оформить заказ и оплатить его онлайн.
Доставка выполняется Почтой России.
Стоимость экземпляра журнала указанна с учетом доставки.
По вопросам рассылки в другие странны обращайтесь к заместителю главного редактора: [email protected].
Предзаказ Доставка для клиник
Для ветеринарных клиник г. Санкт-Петербурга и Лен. области.
Доставка производится курьером на адрес клиники в количестве одного экземпляра.
Для оформления доставки необходимо заполнить форму. Подписка на доставку оформляется один раз и действует до тех пор, пока представитель вашей организации не подаст заявку на отмену доставки.
Оформить доставку
Ошибка
Перейти на…
Перейти на…Системные требования для ЭУМКОбъявленияЭЛЕКТРОННЫЙ ЖУРНАЛТиповая программаУчебная программаТематический план Пояснительная запискаПоложение о рейтинговой оценке знанийКРИТЕРИИ ОЦЕНКИРасписание тестированияКалендарно-тематический план лекцийГрафик отработок и консультаций Расписание с изменениями от 09.04.2021Тема 1 Острый и хронический гломерулонефритТЕМА 2 Инфекция мочевых путей. Тубулоинтерстициальные болезни почекИнфекции мочевых путей (УСР, 2 ч.)Тест — Инфекции мочевых путейТЕМА 3 Нефротический синдром. Амилоидоз почек. Хроническая болезнь почек и хроническая почечная недостаточностьЛекция: Нефротический синдром. Амилоидоз почек. ХБП. УСР 2 ч. доц. Солодкова И.В.Лекция: Анемии (УСР 2 часа)Тест — АнемииТЕМА 4. Геморрагические диатезы. Гемолитические анемииТЕМА 5. Гемобластозы. Острые лейкозы. АгранулоцитозЛекция: Лейкозы (УСР 2 часа)Тест — ЛейкозыТЕМА 6. Хронические лейкозыТема 7. Полицитемия. Множественная миеломаТЕМА 1. Болезни костно-мышечной системы и соединительной ткани. Острая ревматическая лихорадка. Хроническая ревматическая болезнь сердца. Приобретенные пороки сердца. Пролабирование створок митрального клапана.ЛЕКЦИЯ ОРЛТЕСТ ОРЛ ЛЕКЦИЯ. Пороки сердцаТЕСТ 1. Пороки сердцаТЕСТ 2. Приобретенные пороки сердца.ЛЕКЦИЯ Пролапс митрального клапанаТЕМА 2. Болезни костно-мышечной системы и соединительной ткани. Заболевания суставов. Ревматоидный артрит. Остеоартрит. Подагра Лекция 1. Ревматоидный артрит (УСР, 2 ч)Тест — Ревматоидный артритТест — Остеоартрит, подаграТема 3. Болезни костно-мышечной системы и соединительной ткани. Системная красная волчанка. Системный склероз. Дерматомиозит/полимиозит Лекция Системные заболевания соединительной ткани (УСР, 2 ч)Тест — Системные заболевания соединительной ткани Тема 4. Болезни костно-мышечной системы и соединительной ткани. Системные васкулитыСистемные васкулиты (УСР, 2 ч)Тест — Системные васкулиты Тема 5. Заболевания толстого кишечника. Синдром раздраженного кишечника.Аутоиммунные заболевания кишечника (УСР, 2 ч.)Тест — Аутоиммунные заболевания кишечникаСиндром раздраженного кишечника«Воспалительные заболевания кишечника. Синдром раздраженного кишечника» ТЕМА 6. Болезни органов пищеварения Функциональные билиарные расстройства. Хронический панкреатит.Дискинезия желчевыводящих путейХронический панкреатит«Функциональные билиарные расстройства. Хронический панкреатит»Методические указания для студентов IX семестрМетодические указания для студентов X семестрОбщий анализ крови (для интерпретации)Стернальный пунктатБиохимический анализ кровиДиагностика аутоиммунных заболеванийФормулы расчета СКФИнтерпретация иммунологического тестаПример клинической ситуационной задачи 1Пример клинической ситуационной задачи 2Методические рекомендации для преподавателей 10 семТесты к экзаменуВопросы к экзамену (практика)ТЕСТЫПротоколы МЗ РБ по гастроэнтерологииКлинический протокол диагностики и лечения пациентов с нефрологическими заболеваниямиКлинический протокол диагностики и лечения пациентов с урологическими заболеваниямиАнемия хронического заболевания Учебник «Внутренние болезни» Т 1 под ред.
Геморрагические диатезы. Гемолитические анемииТЕМА 5. Гемобластозы. Острые лейкозы. АгранулоцитозЛекция: Лейкозы (УСР 2 часа)Тест — ЛейкозыТЕМА 6. Хронические лейкозыТема 7. Полицитемия. Множественная миеломаТЕМА 1. Болезни костно-мышечной системы и соединительной ткани. Острая ревматическая лихорадка. Хроническая ревматическая болезнь сердца. Приобретенные пороки сердца. Пролабирование створок митрального клапана.ЛЕКЦИЯ ОРЛТЕСТ ОРЛ ЛЕКЦИЯ. Пороки сердцаТЕСТ 1. Пороки сердцаТЕСТ 2. Приобретенные пороки сердца.ЛЕКЦИЯ Пролапс митрального клапанаТЕМА 2. Болезни костно-мышечной системы и соединительной ткани. Заболевания суставов. Ревматоидный артрит. Остеоартрит. Подагра Лекция 1. Ревматоидный артрит (УСР, 2 ч)Тест — Ревматоидный артритТест — Остеоартрит, подаграТема 3. Болезни костно-мышечной системы и соединительной ткани. Системная красная волчанка. Системный склероз. Дерматомиозит/полимиозит Лекция Системные заболевания соединительной ткани (УСР, 2 ч)Тест — Системные заболевания соединительной ткани Тема 4. Болезни костно-мышечной системы и соединительной ткани. Системные васкулитыСистемные васкулиты (УСР, 2 ч)Тест — Системные васкулиты Тема 5. Заболевания толстого кишечника. Синдром раздраженного кишечника.Аутоиммунные заболевания кишечника (УСР, 2 ч.)Тест — Аутоиммунные заболевания кишечникаСиндром раздраженного кишечника«Воспалительные заболевания кишечника. Синдром раздраженного кишечника» ТЕМА 6. Болезни органов пищеварения Функциональные билиарные расстройства. Хронический панкреатит.Дискинезия желчевыводящих путейХронический панкреатит«Функциональные билиарные расстройства. Хронический панкреатит»Методические указания для студентов IX семестрМетодические указания для студентов X семестрОбщий анализ крови (для интерпретации)Стернальный пунктатБиохимический анализ кровиДиагностика аутоиммунных заболеванийФормулы расчета СКФИнтерпретация иммунологического тестаПример клинической ситуационной задачи 1Пример клинической ситуационной задачи 2Методические рекомендации для преподавателей 10 семТесты к экзаменуВопросы к экзамену (практика)ТЕСТЫПротоколы МЗ РБ по гастроэнтерологииКлинический протокол диагностики и лечения пациентов с нефрологическими заболеваниямиКлинический протокол диагностики и лечения пациентов с урологическими заболеваниямиАнемия хронического заболевания Учебник «Внутренние болезни» Т 1 под ред. Моисеева В.С.Учебник Внутренние болезни Т 2 под ред Моисеева В.С.Список литературыУчебник «Внутренние болезни» Маколкин
Моисеева В.С.Учебник Внутренние болезни Т 2 под ред Моисеева В.С.Список литературыУчебник «Внутренние болезни» Маколкин
Лечение острого миелобластного лейкоза. Список клиник, рейтинг, отзывы, цены
Это неконтролируемая пролиферация (деление) аномально дифференцированных клеток-предшественниц миелоидного ряда. Появляется много незрелых клеток крови, которые вытесняют нормальные клетки.
Признаки лейкоза можно увидеть в клиническом анализе крови. Для подтверждения диагноза проводится биопсия костного мозга.
Для лечения заболевания используют системную и интратекальную (введение в спинномозговую жидкость) химиотерапию. Иногда применяют облучение, пересадку стволовых клеток, иммунную терапию.
Стоимость лечения острого миелобластного лейкоза зависит от схемы терапии, её продолжительности, использующихся медицинских манипуляций. Точные цены в разных клиниках за рубежом смотрите на сайте Booking Health.
Университетская клиника Людвига-Максимилиана, Хелиос Крефельд, Клиника современной биологической медицины Франкфурт-на-Майне.
О заболевании
Острый миелобластный лейкоз – это рак крови, который развивается в костном мозге. ОМЛ прогрессирует довольно быстро, а также метастазирует в лимфоузлы и центральную нервную систему. В некоторых случаях метастазы также могут поражать печень и селезенку.
ОМЛ возникает в миелоидных клетках, которые отвечают за образование эритроцитов и лейкоцитов. При трансформации миелоидных клеток в злокачественные их количество аномально увеличивается, а образование здоровых клеток крови блокируется. Такие аномальные клетки крови называют бластными клетками.
В странах СНГ ежегодно фиксируется несколько тысяч новых случаев ОМЛ. Чаще всего заболевание поражает людей в возрасте старше 45 лет, реже ОМЛ встречается у детей. Кроме того, недуг чаще поражает мужчин.
Точная причина возникновения ОМЛ до сих пор не установлена, но курение считается одним из главных риска факторов развития этого заболевания. Это объясняется тем, что при курении дым легко попадает в кровоток и поражает клетки крови. Кроме того, причиной заболевания может быть радиоактивное облучение или химиотерапия. Также ОМЛ могут вызывать определенные генетические нарушения в структуре крови, которые влияют на миелоидные клетки.
Это объясняется тем, что при курении дым легко попадает в кровоток и поражает клетки крови. Кроме того, причиной заболевания может быть радиоактивное облучение или химиотерапия. Также ОМЛ могут вызывать определенные генетические нарушения в структуре крови, которые влияют на миелоидные клетки.
Симптомы
- Патологическая усталость
- Потеря веса
- Головные боли
- Снижение аппетита
- Головокружение
- Предобморочное состояние
- Частые носовые кровотечения
- Длительно незаживающие раны и синяки
- Рвота
Диагностика
- Анализ крови, как правило, является первым исследованием при подозрении на ОМЛ. Он может выявить аномальное количество лейкоцитов и эритроцитов, а также исключить анемию или другие заболевания крови.
- Биопсия костного мозга используется для подтверждения диагноза и определения стадии ОМЛ. Также с помощью биопсии можно установить вид лейкоза, если диагноз острого миелобластного лейкоза еще не подтвердился.
- МРТ и КТ других органов назначаются при подозрении на метастазирование ОМЛ в легкие, печень и головной мозг.
Виды лечения
- Высокоинтенсивная индукционная химиотерапия считается главным методом лечения ОМЛ, так как хирургическое лечение при этом виде рака неэффективно. Существует несколько химиотерапевтических препаратов, предназначенных специально для лечения ОМЛ, которые успешно уничтожают большинство опухолевых клеток. Такое лечение особенно эффективно на начальных стадиях ОМЛ.
- Консолидация и поддерживающая терапия обычно проводятся после первого курса индукционной терапии. Их цель – уничтожить оставшиеся в организме бластные клетки, которые не удалось уничтожить с помощью индукционной терапии. Благодаря консолидации и поддерживающей терапии пациент входит в стойкую ремиссию.
- Лучевая терапия головного мозга применяется при метастазировании ОМЛ в головной мозг.
 В зависимости от стадии рака, больному проводится один или несколько курсов облучения.
В зависимости от стадии рака, больному проводится один или несколько курсов облучения. - Трансплантация стволовых клеток при необратимых изменениях в спинном мозге и отсутствии эффекта от химиотерапии. В такой ситуации больному пересаживают здоровые стволовые клетки от HLA-совместимого донора. Как правило, для такого вида лечения лучше всего подходят родственники или люди с похожей структурой ДНК.
Автор: Доктор Сергей Пащенко
прогноз жизни, клинические рекомендации и анализ крови
Острый миелобластный лейкоз (ОМЛ) – это злокачественный процесс в костном мозге, нарушающий функцию кроветворения. Заболевание поражает миелоидный росток. Здоровая клетка лейкоцит не созревает и выходит в кровоток в изменённом виде. Начинается неконтролируемое деление. Лейкоциты лишены способности защищать организм от микроорганизмов и инфекций. Угнетается производство эритроцитов и тромбоцитов. Начинает развиваться анемия и тромбоцитопения. Изменяется состав периферической крови.
Причины, провоцирующие развитие болезни, до конца не изучены. Учёные связывают ряд факторов с мутациями кроветворной системы, к примеру, наследственность, облучения или генетические аномалии.
Миелоидная лейкемия наиболее часто диагностируется у взрослых пациентов. Болезнь поражает людей после 50 лет. Пик развития рака приходится на 63 года. Миелоидному лейкозу больше подвержены пожилые мужчины. Среди молодого поколения одинаково страдают представители обоих полов.
У детей заболевание носит первичный характер. Ребёнок подвергается лейкозу при аномалиях в генетическом коде, при контакте матери с тяжёлыми отравляющими веществами (радиация, канцерогены) или если история болезней кровных родственников содержит онкологические патологии. Симптомы болезни как у взрослых.
В начале заболевания клиническая картина смазана. Постепенно больной замечает необычные изменения в состоянии. При остром течении болезни пациент отмечает симптомы самочувствия:
- Утомляемость;
- Одышка;
- Синяки и мелкие кровоподтеки;
- Кровоточивость слизистой ротовой полости;
- Инфекционные поражения организма, не поддающиеся классическому лечению и имеющие ярко выраженную симптоматику.

Для лейкозов терминальной стадии развития костный мозг лишается работоспособности, метастазы поражают органы и системы человеческого тела. Для этого характерны признаки:
- Значительное снижение веса;
- Бледность кожных покровов;
- Желудочно-кишечные и носовые кровотечения;
- Слабость;
- Боль и ломота в костях;
- Обмороки;
- Рвота с кровью;
- Чёрный стул;
- Боли в животе;
- Если поражается мочеполовая система, отмечается частичная или полная задержка мочи.
Лечением занимаются онкогематологи. Код по МКБ-10 миелолейкоза С92.
Классификация онкологической патологии
Нелимфобластный лейкоз представляет группа подвидов болезни. Для каждого вида шансы выживаемости и тактика лечения подбираются индивидуально.
Система ФАБ состоит из 9 разновидностей острого миелоидного лейкоза. Формы отличаются по типам предшественников лейкоцитов и степеням их зрелости. Клетки определяют при проведении микроскопического и цитогенетического исследования.
Клетки крови при тысячекратном увеличении
- Показатель М0 означает минимально-дифференцированную острую миелоидную лейкемию.
- М1 характеризует миелоцитарный лейкоз без созревания. В единичных бластах обнаруживаются азурофильные гранулы и палочки Ауэра.
- При М2 для лейкоза характерно созревание. Бласты преимущественно с палочками Ауэра и азурофильными гранулами.
- М3 обозначает острую форму промиелоцитарного рака крови. Клетки гипергранулированы. Палочки Ауэра присутствуют множественно.
- М4 представляет острый миеломонобластный онкологический процесс.
- При М4ео наблюдается миеломоноцитарная патология с повышенным уровнем эозинофилов в костном мозге.
- М5 определяет острый монобластный (-цитарный) лейкоз.
- М6 характеризует острые эритроидные заболевания крови.
- М7 означает мегакариобластную лейкемию.
- Подвид М8 представляет базофильное малокровие.
Исследования при лейкозах
Диагностика лейкозов заключается в изучении состава крови и костного мозга. Точный диагноз определяется только после забора биоптата из бедра или ребра для дальнейшего исследования.
Точный диагноз определяется только после забора биоптата из бедра или ребра для дальнейшего исследования.
Вначале проводят анализ крови. Наблюдаются отклонения в показателях лейкоцитов. Результат может быть представлен от 0,1*109/л до 10*100*109/л. Небольшие нарушения свидетельствуют о монобластной лейкемии или о эритромиелозе. В сыворотке крови не обнаруживаются базофилы. Скорость оседания эритроцитов (СОЭ) увеличена.
Эритроциты представлены низкими показателями. В крови преобладают бласты и клетки зернистого ряда. Отмечаются созревшие моноциты. Снижен уровень гемоглобина.
С помощью биохимического исследования определяется количество общего белка, билирубина, альбумина, мочевины и креатинина.
Для острого лейкоза первой фазы анализ крови может иметь следующую картину:
- Показатели общего белка – 78 ммоль/л.
- Общего билирубина – 14-17 ммоль/л.
- Прямого билирубина – 3,5-4,5 ммоль/л.
- Уровень креатинина – 108 мкмоль/л.
Благодаря цитохимическим показателям изучается активность ферментов, состав крови, костного мозга и других тканей организма.
Иммунологический тест является комплексным исследованием нарушений в работе иммунитета. Для анализа используют венозную кровь. Определяются иммунные клетки, их функции, активность и способность уничтожать бактерии.
Для выявления метастазов в миокарде используют электрокардиограмму и эхокардиографию.
Ультразвуковая диагностика выявляет отклонения во внутренних органах человека. Метод позволяет изучить печень, органы желудочно-кишечного тракта и мочеполовой системы, лимфатические узлы.
Вариант глобальной диагностики всех органов и систем представлен проведением магнитно-резонансной и компьютерной томографии. Методы послойно сканируют участки тела. Выявляются даже незначительные изменения в тканях.
Лечебная тактика
Лечение проводится в стационарных условиях, где снижается контакт с окружающим миром. Клинические рекомендации заключаются в проведении химиотерапии. Онкогематолог выбирает соответствующий протокол для каждого случая. При диагнозе «Острый миелобластный лейкоз» врачи подбирают комбинацию препаратов. Интенсивная химиотерапия помогает вылечиться и войти в стойкую ремиссию.
Онкогематолог выбирает соответствующий протокол для каждого случая. При диагнозе «Острый миелобластный лейкоз» врачи подбирают комбинацию препаратов. Интенсивная химиотерапия помогает вылечиться и войти в стойкую ремиссию.
Проведение процедуры химиотерапии
На первом этапе лечения назначенные препараты без разбора убивают здоровые и раковые клетки. Развиваются побочные явления:
- Тошнота;
- Рвота;
- Вялость;
- Язвенные поражения полости рта;
- Назальные кровотечения;
- Организм больного подвержен присоединению опасных инфекций.
На втором этапе назначают несколько курсов цитостатиков. Для уничтожения рака важен приём высокой дозы цитозин-арабинозида. Препарат препятствует созданию частиц, переносящих наследственную информацию. При печёночной и почечной недостаточностях или угнетении костного мозга приём препарата запрещен.
Для угнетения функций костного мозга и борьбы с опухолевыми клетками назначают Идарубицин.
Митоксантрон подавляет иммунитет и уничтожает опухоли.
Для достижения максимальной эффективности используют протоколы с тремя блоками постремиссионной химии.
Прогноз жизни на фоне химиопрепаратов значительно улучшается.
При поражении органов центральной нервной системы рекомендована лучевая терапия. Ионизирующее излучение вступает в реакцию с аномальными клетками, нарушает их структуру и провоцирует гибель.
Среди людей ходят истории об исцелении рака крови с помощью народной медицины. Однако ни один метод или препарат не показал 100% эффективности. Отказываясь от врачебного вмешательства, больной позволяет лейкозу стремительно развиваться и нарушать работу жизненно важных органов! Лечением может заниматься только квалифицированный врач онколог после проведения тщательной диагностики. Нетрадиционные методы обычно только усугубляют течение болезни.
Полное выздоровление наступает после пересадки костного мозга. Метод имеет нюансы и последствия:
- До начала проведения операции (вливание донорского материала через установленный в артерию катетер) больному уничтожают костный мозг с помощью ударных доз химиотерапии.

- При отсутствии иммунитета любые инфекции и болезни, к примеру, ОРЗ или царапина могут привести к летальному исходу.
- Трансплантируемый материал может не взаимодействовать с организмом пациента:
- В первом случае чужой костный мозг организм человека воспринимает за чужеродный и отторгает его. Нарушается работа всех органов. Иммунные клетки убивают все на своем пути. Однако при этом окончательно уничтожаются раковые клетки без возможности развиться снова. Иммуносупрессивная терапия помогает наладить нормальный кроветворный процесс.
- Организм пациента отвергает введенные стволовые клетки. Иммунитет не формируется. Выработка кровяных телец не начинается.
- При введении биоматериала развивается аллергия или анафилактический шок.
- Половина пациентов умирают в первый месяц после операции.
Пересадка костного мозга
Подходящий костный мозг трудно достать. Лучшими донорами являются однояйцевые близнецы, родные братья и сестры. Материал родителей подходит очень редко.
Стволовые клетки могут быть взяты у самого пациента в период ремиссии или у постороннего человека.
Прогнозы на жизнь
Шанс на полное выздоровление имеют 90% пациентов до 60 лет. Пожилой организм не справляется с раком и нагрузками при химиотерапии. Пациент до конца жизни использует паллиативное лечение. Пятилетняя выживаемость пожилых людей составляет 12-25%.
Шанс на выживаемость снижается при наличии сопутствующих онкологических проблем или заболеваний генетического типа (болезнь Дауна). Рецидив развивается в любой момент. Вторичное заболевание не поддаётся лечению.
Если больной в течение 5 лет не отмечал симптомы лейкоза и не обращался за помощью, его снимают с онкологического учёта и считают здоровым.
Специфическая профилактика лейкемии отсутствует.
Классификация острого миелоидного лейкоза
Острый лейкоз, такой как ОМЛ, классифицируется в соответствии с системой классификации FAB (франко-американско-британской). Согласно FAB, существует 5 подтипов ОМЛ:- Недифференцированный ОМЛ (М0) – в этой форме лейкоза клетки костного мозга не показывают значительных признаков дифференциации (зрелости, чтобы достичь различимых характеристик клеток).
- Миелобластный лейкоз (М1; с/без созревания клеток) – клетки костного мозга проявляют признаки гранулоцитарной дифференциации.
- Миелобластный лейкоз (вариант М2; с созреванием клеток) – созревание клеток костного мозга — на стадии промиелоцита (ранних гранулоцитов) или вне этой стадии; могут выявляться варьирующие количества созревающих гранулоцитов. Этот подтип часто ассоциирован со специфичными генетическими изменениями.
- Промиелоцитарный лейкоз (М3 или вариант М3 [M3V]) – это патологические ранние гранулоциты, находящиеся между миелобластами и миелоцитами в стадии развития и содержащие множество небольших частиц. Клеточные ядра могут различаться по размеру и форме. Этому типу лейкоза свойственны частые кровотечения, нарушения свертываемости крови, например, диссеминированное внутрисосудистое свертывание (ДВС). Эффективно лечение ретиноидами, препаратами с содержанием витамина А.
- Миеломоноцитарный лейкоз (М4 или вариант М4 – лейкоз с эозинофилией — [M4E]) – количества дифференцированных гранулоцитов и моноцитов в костном мозге и циркулирующей крови не постоянны. Доля моноцитов и промоноцитов (ранней формы моноцитов) в костном мозге превышает 20% всех ядросодержащих клеток. При лейкозе M4E в костном мозге также содержится некоторое количество патологических эозинофилов (двудольных гранулоцитов).
- Моноцитарный лейкоз (М5) – у этой формы лейкоза два подтипа. Первый вариант характеризуется слабо дифференцированными монобластами (незрелыми моноцитами) с похожим на кружево генетическим материалом.
 Второй вариант, дифференцированная форма, характеризуется высоким содержанием монобластов, промоноцитов и моноцитов. Соотношение моноцитов в кровотоке может быть выше, чем в костном мозге. Клетки лейкоза типа М5 могут проникать в кожу и десны, при этом варианте лейкоза прогноз хуже, чем при других.
Второй вариант, дифференцированная форма, характеризуется высоким содержанием монобластов, промоноцитов и моноцитов. Соотношение моноцитов в кровотоке может быть выше, чем в костном мозге. Клетки лейкоза типа М5 могут проникать в кожу и десны, при этом варианте лейкоза прогноз хуже, чем при других. - Эритролейкоз (М6) – этот тип лейкоза характеризуется патологическими клетками, из которых образуются эритроциты; они являются ядросодержащими, и их содержание в костном мозге составляет более половины клеток.
- Мегакриобластный лейкоз (М7) – бластные клетки при этом типе лейкоза похожи на незрелые мегакриоциты (гигантские клетки костного мозга) или лимфобласты (клетки, из которых образуются лимфоциты). Лейкоз типа М7 можно отличить по объемным фиброзным отложениям в костном мозге.
- Кроме того, у больных иногда развиваются изолированные опухоли миелобластов (ранних гранулоцитов). Примером этого служит изолированная гранулоцитарная саркома, или хлорома – злокачественная опухоль соединительной ткани. У больных при хлороме часто развивается ОМЛ, поэтому в таких случаях проводят лечение агрессивной ОМЛ-специфичной химиотерапевтической программой.
Лейкозы острый лейкоз
Определение. Острый лейкоз – миелопролиферативная опухоль, субстратом которой являются бласты, лишенные способности дифференцироваться в зрелые клетки крови.
МКБ10: С91.0 – Острый лимфобластный лейкоз.
С92.0 – Острый миелоидный лейкоз.
С93.0 – Острый моноцитарный лейкоз.
Этиология. Латентная
вирусная инфекция, предрасполагающая
наследственность, воздействие ионизирующей
радиации способны вызывать соматические
мутации в кроветворной ткани. Среди
мутантных полипотентных клеток, близких
к стволовой клетке, может сформироваться
клон нечувствительный к иммунорегуляторным
воздействиям. Из мутантного клона
формируется интенсивно пролиферирующая
и метастазирующая за пределы костного
мозга опухоль, состоящая из бластов
одного вида. Отличительной особенностью
опухолевых бластов является неспособность
к дальнейшей дифференциации в зрелые
клетки крови.
Из мутантного клона
формируется интенсивно пролиферирующая
и метастазирующая за пределы костного
мозга опухоль, состоящая из бластов
одного вида. Отличительной особенностью
опухолевых бластов является неспособность
к дальнейшей дифференциации в зрелые
клетки крови.
Патогенез. Важнейшим звеном патогенеза острого лейкоза является конкурентное метаболическое подавление аномальными бластами функциональной активности нормальной кроветворной ткани и вытеснение ее из костного мозга. В результате возникают апластическая анемия, агранулоцитоз, тромбоцитопения с характерными геморрагическим синдромом, тяжелыми инфекционными осложнениями вследствие глубоких нарушений во всех звеньях иммунитета, глубокими дистрофическими сдвигами в тканях внутренних органов.
Согласно классификации FAB (кооперативная группа гематологов Франции, Америки и Британии, 1990 г.) выделяют:
Острые лимфобластные лейкозы подразделяются на 3 типа:
L1 — острый микролимфобластный тип. Антигенные маркеры бластов соответствуют нулевым («ни Т, ни В») или тимусзависимым (Т) линиям лимфопоэза. Встречается главным образом у детей.
L2 — острый лимфобластный. Его с субстрат — типичные лимфобласты, антигенные маркеры которых такие же как и при L1 типе острого лейкоза. Чаще встречается у взрослых.
L3 — острый макролимфоцитарный и пролимфоцитарный лейкоз. Бласты имеют антигенные маркеры В-лимфоцитов, морфологически схожи с клетками лимфомы Беркитта. Этот тип встречается редко. Отличается очень плохим прогнозом.
Острые нелимфобластные (миелогенные) лейкозы делятся на 6 типов:
М0 — острый недифференцированный лейкоз.
М1 — острый миелобластный лейкоз без вызревания клеток.
М2 — острый миелобластный лейкоз с признаками вызревания клеток.

М3 — острый промиелоцитарный лейкоз.
М4 — острый миеломонобластный лейкоз.
М5 — острый монобластный лейкоз.
М6 — острый эритромиелоз.
Клиническая картина. В клиническом течении острых лейкозов выделяют следующие стадии:
Начальный период (первично-активная стадия).
В большинстве случаев начинается остро, часто в виде «гриппа». Внезапно повышается температура тела, появляются озноб, боли в горле, артралгии, резко выраженная общая слабость. Реже заболевание может впервые проявиться тромбоцитопенической пурпурой, рецидивирующими носовыми, маточными, желудочными кровотечениями. Иногда ОЛ начинается с постепенного ухудшения состояния больного, появления не выраженных артралгий, болей в костях, кровоточивости. В единичных случаях возможно бессимптомное начало заболевания.
У многих больных в начальный период ОЛ выявляется увеличение периферических лимфоузлов, умеренная спленомегалия.
Стадия развернутых клинико-гематологических проявлений (первая атака).
Характеризуется резким ухудшением общего состояния больных. Типичны жалобы на выраженную общую слабость, высокую лихорадку, боли в костях, в левом подреберье в области селезенки, кровоточивость. На этой стадии формируются клинические синдромы, типичные для ОЛ:
Гиперпластический (инфильтративный) синдром.
Увеличение лимфатических узлов и селезенки одно из самым типичных проявлений диссеминации лейкозной опухоли. Лейкозная инфильтрация нередко вызывает подкапсульные кровоизлияния, инфаркты, разрывы селезенки.
Печень и почки
также бывают увеличенными вследствие
лейкозной инфильтрации. Лейкозные
фильтраты в легких, плевре, медиастинальных
лимфоузлах проявляются симптомами
пневмонии, экссудативного плеврита.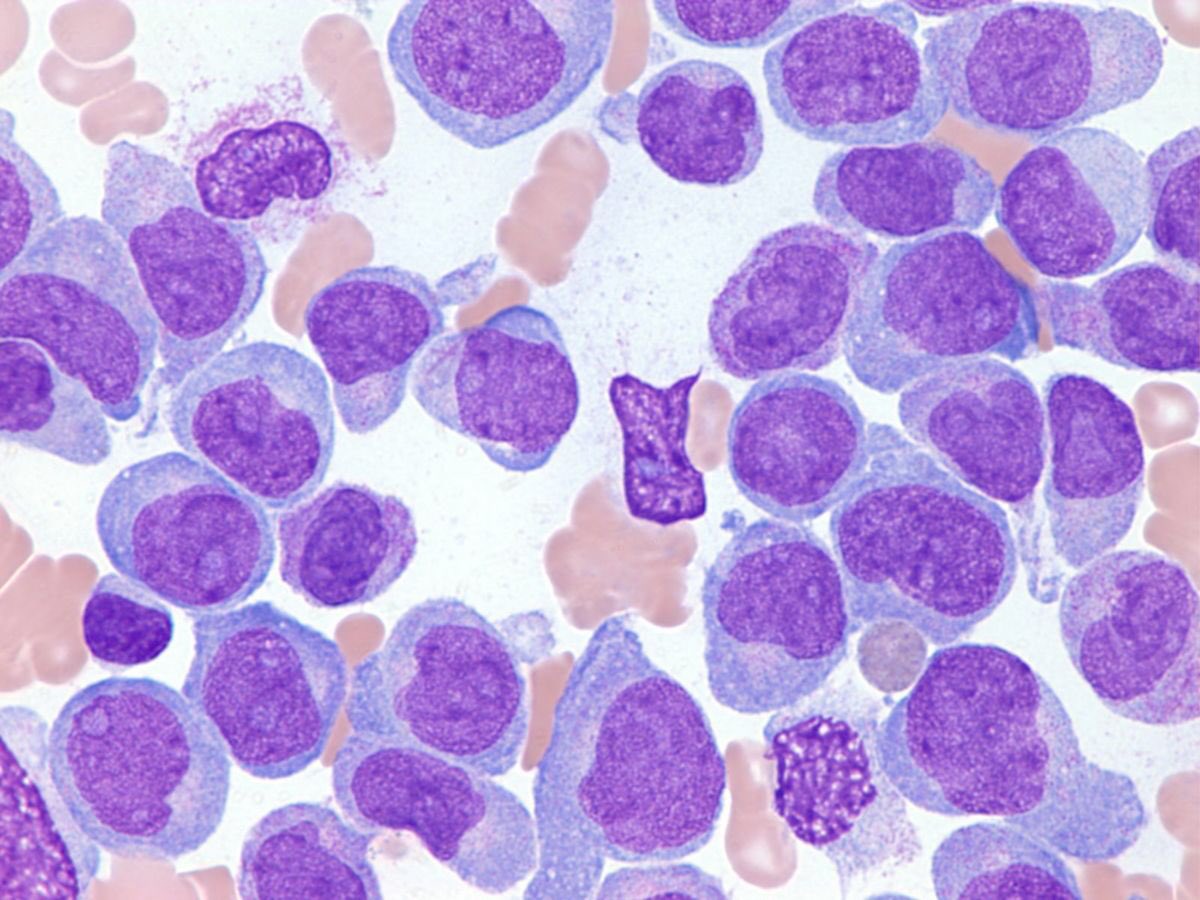
Лейкемическая инфильтрация десен с их набуханием, гиперемией, изъязвлениями обычное явление для острого моноцитарного лейкоза.
Локализованные опухолевые массы (лейкемиды) в коже, глазных яблоках, в других местах возникают при нелимфобластных (миелоидных) формах лейкоза на поздних стадиях заболевания. При некоторых миелобластных лейкозах лейкемиды могут иметь зеленоватый цвет («хлорома») из-за присутствия в бластных клетках опухоли миелопероксидазы.
Анемический синдром.
Лейкозная инфильтрация и метаболическое угнетение нормальных ростков костномозгового кроветворения приводят к возникновению апластической анемии. Обычно анемия нормохромная. При остром эритромиелозе она может иметь гиперхромный мегалобластоидный характер с умеренно выраженным гемолитическим компонентом. При выраженной спленомегалии может возникать гемолитическая анемия.
Геморрагический синдром.
Обусловлен тромбоцитопенией, ДВС-синдромом. Проявляется подкожными кровоизлияниями (тромбоцитопеническая пурпура), кровоточивостью десен, носовыми, маточными кровотечениями. Возможны желудочно-кишечные, легочные кровотечения, макрогематурия. Наряду с геморрагиями нередко возникают тромбофлебиты, тромбоэмболии, другие гиперкоагуляционные нарушения, обусловленные ДВС-синдромом. Это одно из характерных проявлений острого промиелоцитарного и миеломонобластного лейкозов.
Синдром иммунодефицита.
Формирование
иммунодефицитного состояния обусловлено
вытеснением лейкозными бластами
нормальных клонов иммунокомпетентных
клеток из костного мозга. Клинически
проявляется лихорадкой, нередко
гектического типа. Появляются очаги
хронической инфекции разной локализации.
Характерно возникновение язвенно-некротической
ангины, перитонзиллярных абсцессов,
некротического гингивита, стоматита,
пиодермии, параректальных абсцессов,
пневмонии, пиелонефрита. Генерализация
инфекции с развитием сепсиса, множественных
абсцессов в печени, почках, гемолитической
желтухи, ДВС-синдрома часто является
причиной смерти больного.
Генерализация
инфекции с развитием сепсиса, множественных
абсцессов в печени, почках, гемолитической
желтухи, ДВС-синдрома часто является
причиной смерти больного.
Синдром нейролейкемии.
Характеризуется метастатическим распространением очагов бластной пролиферации в мозговые оболочки, вещество головного мозга, структуры спинного мозга, нервные стволы. Проявляется менингиальными симптомами — головной болью, тошнотой, рвотой, нарушениями зрения, ригидностью затылочных мышц. Формирование крупных опухолевидных лейкозных инфильтратов в головном мозге сопровождается очаговой симптоматикой, параличами черепно-мозговых нервов.
Ремиссия, достигнутая в результате проводимого лечения.
Под влиянием проводимого лечения происходит угасание (неполная ремиссия) или даже полное исчезновение (полная ремиссия) всех клинических проявлений заболевания.
Рецидив (вторая и последующие атаки).
В результате продолжающихся мутаций возникает клон опухолевых бластов, способный «уклониться» от воздействия цитостатических препаратов, используемых для поддерживающего лечения. Возникает обострение заболевания с возвратом всех синдромов, типичных для стадии развернутых клинико-гематологических проявлений ОЛ.
Под влиянием противорецидивной терапии может вновь быть достигнута ремиссия. Оптимальная тактика лечения может привести к выздоровлению. При нечувствительности к проводимому лечению ОЛ переходит в терминальную стадию.
Выздоровление.
Больного считают выздоровевшим, если полная клиническая и гематологическая ремиссия сохраняется более 5 лет.
Терминальная стадия.
Характеризуется
недостаточностью или полным отсутствием
терапевтического контроля над разрастанием
и метастазированием лейкозного клона
опухоли.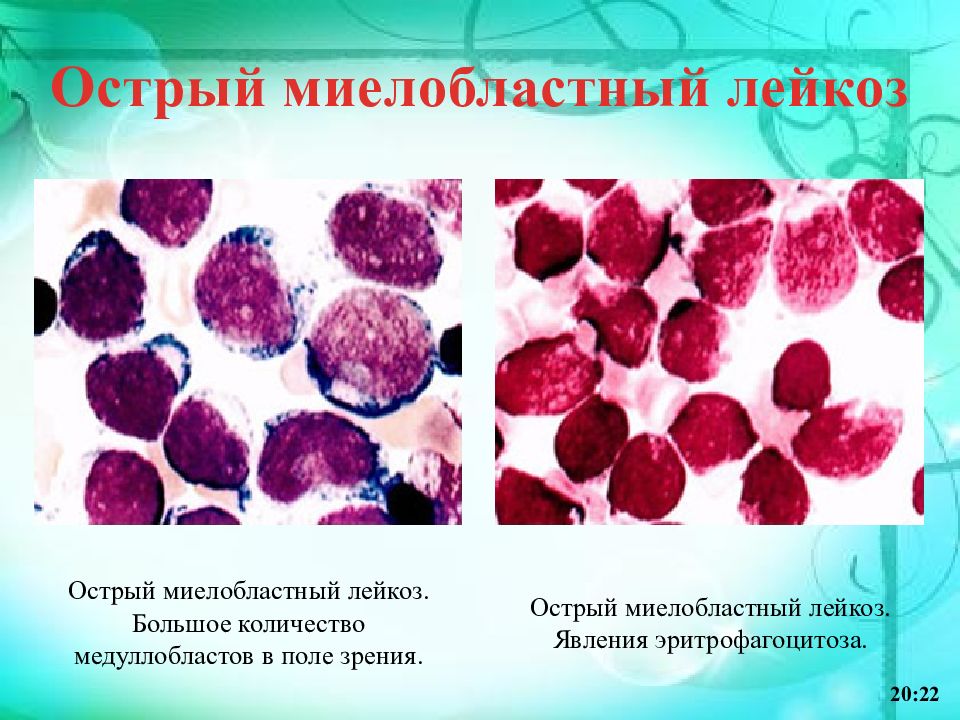 В результате диффузной
инфильтрации костного мозга, внутренних
органов лейкозными бластами тотально
подавляется система нормального
кроветворения, исчезает инфекционный
иммунитет, возникают глубокие нарушения
в системе гемостаза. Смерть наступает
от диссеминированных инфекционных
поражений, некупируемого кровотечения,
тяжелой интоксикации.
В результате диффузной
инфильтрации костного мозга, внутренних
органов лейкозными бластами тотально
подавляется система нормального
кроветворения, исчезает инфекционный
иммунитет, возникают глубокие нарушения
в системе гемостаза. Смерть наступает
от диссеминированных инфекционных
поражений, некупируемого кровотечения,
тяжелой интоксикации.
Клинические особенности морфологических типов острого лейкоза.
Острый недифференцированный лейкоз (М0). Встречается редко. Очень быстро прогрессирует с усугублением тяжелой апластической анемии, выраженного геморрагического синдрома. Ремиссии достигаются редко. Средняя продолжительность жизни менее 1 года.
Острый миелобластный лейкоз (М1-М2). Наиболее распространенный вариант острого нелимфобластного лейкоза. Чаще болеют взрослые. Отличается тяжелым, упорно прогрессирующим течением с выраженными анемическим, геморрагическим, иммунодепрессивным синдромами. Характерны язвенно-некротические поражения кожи, слизистых оболочек. Добиться ремиссии оказывается возможным у 60-80% больных. Средняя продолжительность жизни около 1 года.
Острый промиелоцитарный лейкоз (М3). Один из наиболее злокачественных вариантов. Характеризуется выраженным геморрагическим синдромом, который чаще всего и приводит больного к смерти. Бурные геморрагические проявления связывают с ДВС-синдромом, причиной которого является повышение тромбопластиновой активности лейкозных промиелоцитов. На их поверхности и в цитоплазме содержится в 10-15 раз больше тромбопластина чем у нормальных клеток. Своевременное лечение позволяет достичь ремиссии почти у каждого второго больного. Средняя продолжительность жизни достигает 2 лет.
Острый
миеломонобластный лейкоз (М4). Клиническая симптоматика этой формы
заболевания близка к острому миелобластному
лейкозу. Отличия заключаются в большей
склонности к некрозам. Чаще возникает
ДВС-синдром. У каждого десятого больного
имеет место нейролейкоз. Болезнь быстро
прогрессирует. Часто возникают тяжелые
инфекционные осложнения. Средняя
продолжительность жизни и частота
стойких ремиссий в два раза меньше чем
при остром миелобластном лейкозе.
У каждого десятого больного
имеет место нейролейкоз. Болезнь быстро
прогрессирует. Часто возникают тяжелые
инфекционные осложнения. Средняя
продолжительность жизни и частота
стойких ремиссий в два раза меньше чем
при остром миелобластном лейкозе.
Острый монобластный лейкоз (М5). Редкая форма. По клиническим проявлениям мало отличается от миеломонобластного лейкоза. Отличается большей склонностью к быстрому и упорному прогрессированию. Поэтому средняя продолжительность жизни больных с этой формой лейкоза еще меньше — около 9 месяцев.
Острый эритромиелоз (М6). Редкая формы. Отличительной особенностью этой формы является упорная, глубокая анемия. Анемия гиперхромная с явлениями нерезко выраженного гемолиза. В лейкозных эритробластах выявляются мегалобластоидные отклонения. Большинство случаев острого эритромиелоза резистентно к проводимой терапии. Продолжительность жизни больных редко превышает 7 месяцев.
Острый лимфобластный лейкоз (L1,L2,L3). Эта форма характеризуется умеренно прогрессирующим течением. Сопровождается увеличением периферических лимфоузлов, селезенки, печени. Геморрагический синдром, язвенно-некротические осложнения бывают редко. Продолжительность жизни при остром лимфобластном лейкозе от 1,5 до 3 лет.
Диагностика.
Общий анализ крови: уменьшение числа эритроцитов, лейкоцитов, тромбоцитов. Анемия чаще нормоцитарная, нормохромная, но у больных с острым эритромиелозом могут наблюдаться макроцитоз, появление в крови ядерных форм с признаками мегалобластоза. Мегалобластоподобные отклонения не исчезают при лечении цианкобаламином. Выявляются бластные клетки. Для лейкоцитарной формулы характерен феномен «лейкемического провала» — наличие бластов и зрелых форм лейкоцитов при отсутствии («провале») клеток промежуточных степеней дифференциации. Это свидетельствует о наличии одновременно двух линий размножающихся клеток.
 Одна
линия нормальная, завершающаяся зрелыми
клеточными формами. Другая линия —
опухолевый клон бластных клеток, не
способных к дальнейшей дифференциации.
В зависимости от содержания лейкоцитов
и количества бластных клеток в
периферической крови выделяют три
формы лейкоза: лейкемический — при
высоком, до 100*109/л
лейкоцитозе и большом количестве
бластов; сублейкемический, когда число
бластов незначительно превышает
нормальное содержание лейкоцитов в
крови; алейкемический — при отсутствии
бластов в периферической крови. В
последнем случае обычно отмечается
панцитопения — лейкопения, анемия,
тромбоцитопения.
Одна
линия нормальная, завершающаяся зрелыми
клеточными формами. Другая линия —
опухолевый клон бластных клеток, не
способных к дальнейшей дифференциации.
В зависимости от содержания лейкоцитов
и количества бластных клеток в
периферической крови выделяют три
формы лейкоза: лейкемический — при
высоком, до 100*109/л
лейкоцитозе и большом количестве
бластов; сублейкемический, когда число
бластов незначительно превышает
нормальное содержание лейкоцитов в
крови; алейкемический — при отсутствии
бластов в периферической крови. В
последнем случае обычно отмечается
панцитопения — лейкопения, анемия,
тромбоцитопения.Стернальный пунктат: В костном мозге нелеченных больных бласты составляют более 50% всех ядросодержащих клеток. Подавлены эритроцитарный, гранулоцитарный, мегакариоцитарный ростки. Выявляются признаки мегалобластного эритрогенеза.
Исследование спинномозговой жидкости: высокий цитоз, выявляются бластные клетки, повышено содержание белка.
Гистохимическое исследование бластов: определяется морфологический вариант нелимфобластного ОЛ.
Иммунотипирование лейкозных клеток: выявляется принадлежность лимфобластов к популяциям Т- или В-лимфоцитов, или к неопределенному (ни Т, ни В) типу.
Обоснование диагноза ОЛ.
Клинические проявления в виде анемического, геморрагического, иммунодефицитного синдромов, менингеальных явлений позволяют заподозрить заболевание и служат поводом для проведения стернальной пункции. Диагноз ОЛ основывается на обнаружении при стернальной пункции и/или трепанобиопсии крыла подвздошной кости бластной инфильтрации костного мозга.
Дифференциальный диагноз. Дифференциальный диагноз проводится в первую очередь с лейкемоидными реакциями, агранулоцитозом, апластическими анемиями.
При лейкемоидных
реакциях, возникающих у больных с
тяжелыми инфекционными заболеваниями,
злокачественными новообразованиями,
может возникнуть выраженный лейкоцитоз
со сдвигов формулы влево до появления
единичных бластов.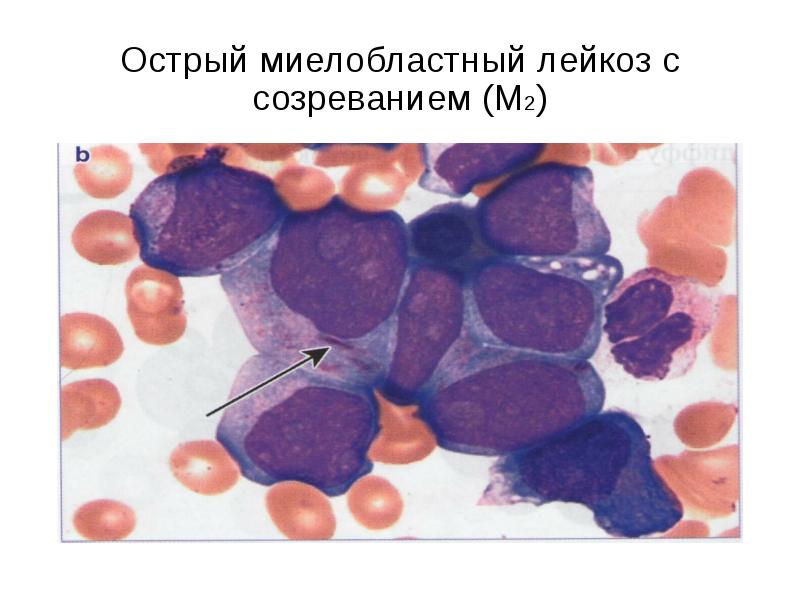 Однако, в отличие от
ОЛ при этих состояниях нет«лейкемического
провола» — отсутствия клеточных форм
промежуточной дифференциации между
бластом и зрелым лейкоцитом. Для
лейкемоидных реакций не типичны анемия
и тромбоцитопения. В костном мозге и в
периферической крови отсутствует
значительное повышение содержания
бластных клеток.
Однако, в отличие от
ОЛ при этих состояниях нет«лейкемического
провола» — отсутствия клеточных форм
промежуточной дифференциации между
бластом и зрелым лейкоцитом. Для
лейкемоидных реакций не типичны анемия
и тромбоцитопения. В костном мозге и в
периферической крови отсутствует
значительное повышение содержания
бластных клеток.
При выходе из агранулоцитоза, вызванного токсическими или иммунными факторами, в периферической крови появляются бластные клетки. Может возникнуть ситуация, когда в мазке будут видны единичные зрелые лейкоциты и бласты без промежуточных клеточных форм. Однако при динамическом исследовании мазков крови будет наблюдаться появление следующих за бластами промежуточных форм, чего никогда не наблюдается у больных ОЛ. При агранулоцитозе в отличие от ОЛ нет избыточного содержания бластных клеток в костном мозге.
В отличие от ОЛ для апластических анемий не характерно увеличение лимфатических узлов, селезенки. В противоположность ОЛ при апластических анемиях имеет место обеднение костного мозга, большое содержание в нем жировой ткани. В костном мозге резко снижено количество бластов, чего не бывает при ОЛ.
План обследования.
Общий анализ крови.
Стернальная пункция и/или трепанобиопсия крыла подвздошной кости.
Иммунотипирование популяционной (В или Т) принадлежности лейкозных лимфобластов.
Гистохимическое типирование бластов для определения морфологического варианта нелимфобластного лейкоза.
Лечение.
Применяются методы химиотерапии, и трансплантация костного мозга.
Химиотерапия острых лейкозов проводится следующими этапами:
Индукция ремиссии.
Консолидация ремиссии.
Поддерживающая терапия.

Профилактика нейролейкемии.
На 1 этапе (индукция ремиссии) наиболее эффективной программой медикаментозной терапии оказалась схема «7+3», с введением цитозара и рубомицина: Цитозар 100 мг/м2 в сутки внутривенно в течение 7 дней. Рубомицин 45 мг/м2 внутривенно в первые три дня недели.
На 2 этапе (консолидация ремиссии): При нелимфобластных лейкозах проводятся 2 курса химиотерапии по схеме «7+3».
На 3 этапе (поддерживающая терапия) в течение 5 лет больным нелимфобластным лейкозом непрерывно вводят препараты по схеме «5+2»: Цитозар 100 мг/м2 внутривенно каждые 12 часов в течение 5 дней. Тиогуанин 100 мг/м2 внутрь каждые 12 часов в течение 5 дней.
На 4 этапе (профилактика нейролейкоза) сразу после морфологической верификации диагноза острого лейкоза, затем спустя 2 недели от начала лечения и, далее, через каждые 2 недели до наступления ремиссии в спинномозговой канал вводят метотрексат в дозе 12,5 мг/м2. Химиотерапию комбинируют с локальным облучением головы. Суммарная доза 24 Гр. В фазу ремиссии метотрексат вводят эндолюмбально 1 раз в 3 месяца.
Пересадка костного мозга производится в фазе первой ремиссии острого нелимфобластного лейкоза и второй ремиссии острого лимфобластного лейкоза.
Перед аллогенной
трансплантацией костного мозга, тщательно
подобранного по антигенам гистосовместимости,
проводится химиотерапевтическая и
лучевая подготовка больного с целью
тотального уничтожения всех ростков
его собственного кроветворения.
Парентерально вводят сублетальные дозы
циклофосфана (60-120 мг/кг). Затем тотально
облучают все тело гамма-источником
дозой в 10 грей. У донора берут около 800
мл взвеси костного мозга путем
множественной аспирации из гребня
подвздошной кости. К взвеси добавляют
питательную среду, ее гепаринизируют,
фильтруют и переливают больному через
подключичный катетер.
Кроме аллогенной трансплантации, можно выполнить и аутологичную трансплантацию костного мозга. В период полной клинико-гематологической ремиссии у больного производится забор его собственного костного мозга из гребня подвздошной кости. Полученная взвесь костного мозга подвергается очистке от опухолевых клонов. Для этого она разделяется на сепараторе, где выделяются стволовые клетки, обрабатывается раствором 4-гидропероксициклофосфамидом или подвергается иммунологической обработке моноклональными антителами. Затем костный мозг замораживают. Проводят стандартную предварительную подготовку больного назначением высоких доз циклофосфамида и тотального облучения. Через 48 часов после этой процедуры размораживают костный мозг и возвращают его пациенту через подключичный катетер.
С целью лечения и профилактики инфекционных осложнений ОЛ назначают антибиотики широкого спектра действия, противогрибковые препараты. Парентерально вводят альфа-интерферон в дозе 50 млн. МЕ/сутки в течение недели.
При тяжело протекающем обострении осуществляют дезинтоксикационную терапию с парентеральным введением реополиглюкина. С этой же целью применяют плазмоферез, гемосорбцию.
Для купирования кровоточивости, вызванной тромбоцитопенией, проводят трансфузии тромбоцитов, полученных от доноров – близких родственников больного. Дефицит плазменных факторов свертывания, возникающий при ДВС-синдроме, купируют внутривенным струйным введением свежезамороженной плазмы.
Прогноз. При
естественном (без лечения) течении
острых лейкозов продолжительность
жизни больных не превышает 3 месяцев.
Химиотерапия позволяет достичь
продолжительности жизни 5 и более лет
у более чем 60% больных с лимфобластной
формой лейкоза. В первую очередь это
касается детей. При нелимфобластных
формах стойкая ремиссия достигается
труднее. Только 10-20% таких больных живут
больше 1 года. Лучшие результаты дает
трансплантация костного мозга. После
аллогенной пересадки костного мозга
ремиссия длительностью более 5 лет
наступает у 70% больных с лимфобластным,
и у 50-60% больных с нелимфобластным ОЛ. У
45% больных перенесших аутологичную
трансплантацию костного мозга также
возникает стойкая, многолетняя ремиссия.
Эти операции наиболее эффективны у
больных с острым нелимфобластным
лейкозом, у которых химиотерапия не
дает удовлетворительных результатов.
После
аллогенной пересадки костного мозга
ремиссия длительностью более 5 лет
наступает у 70% больных с лимфобластным,
и у 50-60% больных с нелимфобластным ОЛ. У
45% больных перенесших аутологичную
трансплантацию костного мозга также
возникает стойкая, многолетняя ремиссия.
Эти операции наиболее эффективны у
больных с острым нелимфобластным
лейкозом, у которых химиотерапия не
дает удовлетворительных результатов.
Подтипы острого миелоидного лейкоза (ОМЛ) и прогностические факторы
Для большинства видов рака очень важно определение стадии (степени) рака. Этап зависит от размера основной опухоли и того, насколько далеко распространился рак. Это может быть полезно для прогнозирования настроения человека и принятия решения о лечении.
Острый миелоидный лейкоз (ОМЛ), с другой стороны, обычно не приводит к образованию опухолей. Обычно он широко распространен в костном мозге, а в некоторых случаях распространился на другие органы, такие как печень и селезенка.Следовательно, ОМЛ не является стадийным, как большинство других видов рака. Прогноз для человека с ОМЛ зависит от другой информации, такой как подтип ОМЛ (определяемый лабораторными тестами), возраст пациента и результаты других лабораторных тестов.
Знание подтипа ОМЛ может быть очень важным, поскольку иногда оно влияет как на внешний вид пациента, так и на лучшее лечение. Например, подтип острого промиелоцитарного лейкоза (APL) часто лечится с помощью лекарств, отличных от тех, которые используются для других подтипов AML.Если вы не уверены, какой у вас подтип ОМЛ, спросите об этом своего врача и о том, как он может повлиять на ваше лечение.
Две из основных систем, которые использовались для классификации AML на подтипы, — это франко-американо-британская классификация (FAB) и более новая классификация Всемирной организации здравоохранения (ВОЗ).
Французско-американо-британская (FAB) классификация AML
В 1970-х годах группа французских, американских и британских экспертов по лейкемии разделила ОМЛ на подтипы, от M0 до M7, в зависимости от типа клеток, из которых развивается лейкоз, и степени их зрелости. Это было во многом основано на том, как лейкозные клетки выглядели под микроскопом после стандартного окрашивания.
Это было во многом основано на том, как лейкозные клетки выглядели под микроскопом после стандартного окрашивания.
FAB подтип | Имя |
M0 | Недифференцированный острый миелобластный лейкоз |
M1 | Острый миелобластный лейкоз с минимальным созреванием |
M2 | Острый миелобластный лейкоз с созреванием |
M3 | Острый промиелоцитарный лейкоз (ОПЛ) |
M4 | Острый миеломоноцитарный лейкоз |
M4 eos | Острый миеломоноцитарный лейкоз с эозинофилией |
M5 | Острый моноцитарный лейкоз |
M6 | Острый эритроидный лейкоз |
M7 | Острый мегакариобластный лейкоз |
Все подтипы от M0 до M5 начинаются с незрелых форм лейкоцитов.ОМЛ M6 начинается с очень незрелых форм эритроцитов, а ОМЛ M7 начинается с незрелых форм клеток, вырабатывающих тромбоциты.
Классификация AML по классификации Всемирной организации здравоохранения (ВОЗ)
Система классификации FAB может быть полезной, но она не учитывает многие факторы, которые, как сейчас известно, влияют на прогноз (перспективы). Система Всемирной организации здравоохранения (ВОЗ), последняя обновленная в 2016 году, включает некоторые из этих факторов, чтобы попытаться лучше классифицировать ПОД.
Система ВОЗ делит AML на несколько групп:
ОМЛ с определенными генетическими аномалиями (изменения генов или хромосом)
- ОМЛ с транслокацией между хромосомами 8 и 21 [t (8; 21)]
- AML с транслокацией или инверсией в хромосоме 16 [t (16; 16) или inv (16)]
- APL со слитым геном PML-RARA
- ОМЛ с транслокацией между хромосомами 9 и 11 [t (9; 11)]
- AML с транслокацией между хромосомами 6 и 9 [t (6: 9)]
- AML с транслокацией или инверсией хромосомы 3 [t (3; 3) или inv (3)]
- AML (мегакариобластный) с транслокацией между хромосомами 1 и 22 [t (1:22)]
- AML с гибридным геном BCR-ABL1 ( BCR-ABL ) *
- AML с мутированным геном NPM1
- AML с двуаллельными мутациями гена CEBPA (то есть мутациями в обеих копиях гена)
- AML с мутированным геном RUNX1 *
* Это все еще «временная сущность», то есть еще не ясно, достаточно ли доказательств того, что это уникальная группа.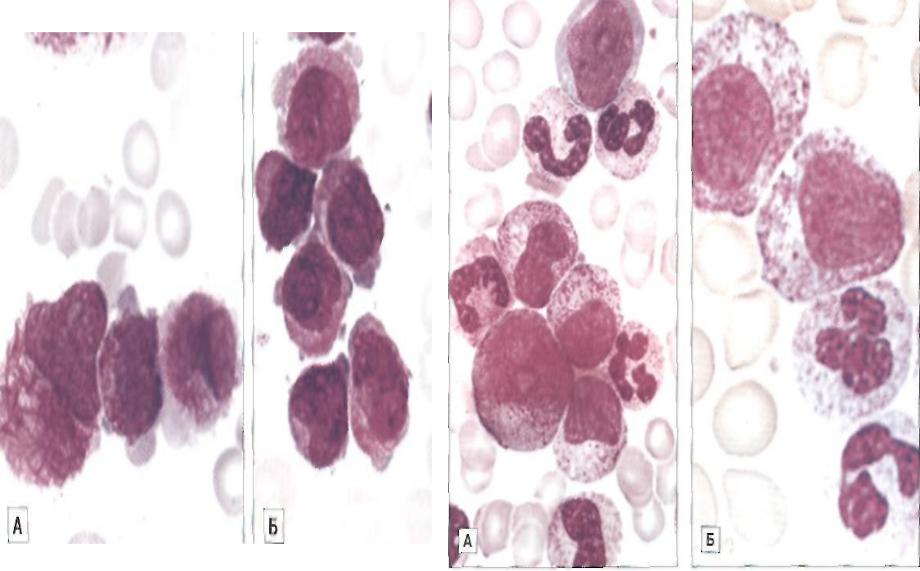
ОМЛ с изменениями, связанными с миелодисплазией
ОМЛ, связанный с предыдущей химиотерапией или лучевой терапией
AML, если иное не указано (Сюда входят случаи AML, которые не попадают ни в одну из вышеперечисленных групп, и аналогичны классификации FAB.)
- AML с минимальной дифференциацией (FAB M0)
- AML без созревания (FAB M1)
- AML с созреванием (FAB M2)
- Острый миеломоноцитарный лейкоз (FAB M4)
- Острый монобластный / моноцитарный лейкоз (FAB M5)
- Чистый эритроидный лейкоз (FAB M6)
- Острый мегакариобластный лейкоз (FAB M7)
- Острый базофильный лейкоз
- Острый панмиелез с фиброзом
Миелоидная саркома (также известная как гранулоцитарная саркома или хлорома)
Миелоидные пролиферации, связанные с синдромом Дауна
Недифференцированные и бифенотипические острые лейкозы не являются строго ОМЛ, но являются лейкозами, имеющими как лимфоцитарные, так и миелоидные особенности.Иногда их называют острыми лейкозами смешанного фенотипа (MPAL) .
Факторы прогноза для AML
Подтип AML может иметь важное значение для определения прогноза (перспективы) человека. Но другие факторы также могут повлиять на то, почему у одних пациентов с ОМЛ прогноз лучше, чем у других. Это так называемые прогностические факторы . Факторы прогноза помогают врачам определить риск рецидива лейкемии после лечения и, следовательно, необходимость более или менее интенсивного лечения.Некоторые из них включают:
Хромосомные (цитогенетические) аномалии
Клетки AML могут иметь много видов хромосомных изменений, некоторые из которых могут повлиять на прогноз человека. Перечисленные ниже являются одними из самых распространенных, но есть и многие другие.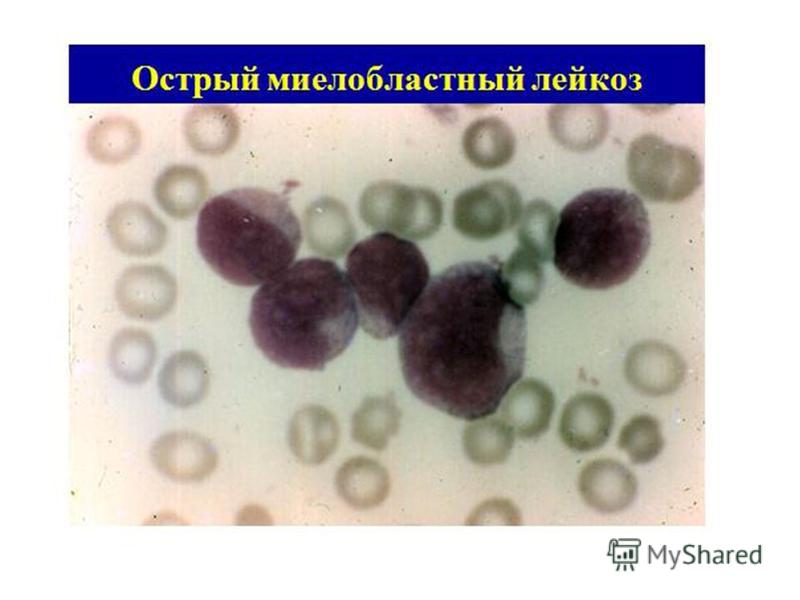 Не у всех лейкозов есть эти аномалии. Пациенты, у которых нет ни одного из этих признаков ОМЛ, обычно имеют прогноз между благоприятным и неблагоприятным.
Не у всех лейкозов есть эти аномалии. Пациенты, у которых нет ни одного из этих признаков ОМЛ, обычно имеют прогноз между благоприятным и неблагоприятным.
Благоприятные отклонения от нормы:
- Транслокация между хромосомами 8 и 21 (чаще всего наблюдается у пациентов с M2)
- Транслокация или инверсия хромосомы 16
- Транслокация между хромосомами 15 и 17 (чаще всего наблюдается у пациентов с M3)
Неблагоприятные отклонения от нормы:
- Делеция (потеря) части хромосомы 5 или 7
- Транслокация или инверсия хромосомы 3
- Транслокация между 6 и 9 хромосомами
- Транслокация между хромосомами 9 и 22
- Аномалии хромосомы 11 (в точке q23)
- Потеря хромосомы, поэтому у клетки есть только 1 копия вместо нормальных 2 (известная как моносомия)
- Сложные изменения (затрагивающие 3 и более хромосомы)
Генные мутации
Люди, лейкозные клетки которых имеют определенные генные мутации, могут иметь лучшее или худшее прогнозирование.
Например, люди с ОМЛ, у которых есть мутация в гене FLT3 , как правило, имеют худшие перспективы, хотя новые лекарства, нацеленные на клетки с этим аномальным геном, могут привести к лучшим результатам. Мутации в генах TP53 , RUNX1 и ASXL1 также связаны с худшими перспективами.
С другой стороны, люди, лейкозные клетки которых имеют изменения в гене NPM1 (и никаких других аномалий), по-видимому, имеют лучший прогноз, чем люди без этих изменений.Изменения в обеих копиях гена CEBPA также связаны с лучшим результатом.
Маркеры на лейкозные клетки
Если лейкозные клетки имеют белок CD34 и / или Р-гликопротеин (продукт гена MDR1 ) на своей поверхности, это связано с худшими перспективами.
Возраст
Как правило, люди старше 60 не справляются так хорошо, как молодые люди. Отчасти это может быть связано с тем, что у них с большей вероятностью будут неблагоприятные хромосомные аномалии.Иногда у них также есть другие заболевания, из-за которых им становится труднее выдерживать более интенсивные режимы химиотерапии.
Отчасти это может быть связано с тем, что у них с большей вероятностью будут неблагоприятные хромосомные аномалии.Иногда у них также есть другие заболевания, из-за которых им становится труднее выдерживать более интенсивные режимы химиотерапии.
Количество лейкоцитов
Высокое количество лейкоцитов (> 100 000 / мм 3 ) на момент постановки диагноза связано с худшим прогнозом.
Предыдущее заболевание крови, приведшее к ОМЛ
Наличие ранее перенесенного заболевания крови, такого как миелодиспластический синдром, связано с худшим прогнозом.
ОМЛ, связанный с лечением
ОМЛ, который развивается после лечения человека от другого рака, связан с худшим прогнозом.
Инфекция
Наличие системной (кровяной) инфекции при постановке диагноза связано с худшим прогнозом.
Лейкозные клетки центральной нервной системы
Лейкоз, который распространился на область вокруг головного и спинного мозга, трудно поддается лечению, поскольку большинство химиотерапевтических препаратов не достигают этой области.
Статус ОМЛ после лечения
Насколько хорошо (и как быстро) лейкоз поддается лечению, также влияет на долгосрочный прогноз.Лучшая первоначальная реакция была связана с лучшими долгосрочными результатами.
Ремиссия (полная ремиссия) обычно определяется как отсутствие признаков заболевания (NED) после лечения. Это означает, что в костном мозге содержится менее 5% бластных клеток, количество клеток крови в пределах нормы, и нет никаких признаков или симптомов лейкемии. Полная ремиссия молекулярная ремиссия означает отсутствие лейкозных клеток в костном мозге, даже при использовании очень чувствительных тестов, таких как ПЦР (полимеразная цепная реакция).
Минимальная остаточная болезнь (MRD) — это термин, используемый после лечения, когда лейкозные клетки не могут быть обнаружены в костном мозге с помощью стандартных тестов (таких как просмотр клеток под микроскопом), но более чувствительных тестов (таких как проточная цитометрия). или ПЦР) находят доказательства того, что в костном мозге все еще есть лейкозные клетки.
или ПЦР) находят доказательства того, что в костном мозге все еще есть лейкозные клетки.
Активное заболевание означает, что либо есть доказательства того, что лейкоз все еще присутствует во время лечения, либо что болезнь вернулась после лечения (рецидив).Для того чтобы у пациента случился рецидив, в его костном мозге должно быть более 5% бластных клеток.
AML (Острый миелогенный лейкоз без созревания) (M1)
Острый миелобластный лейкоз без созревания — FAB M1: AML-M1 определяется и характеризуется высоким процентом бластов в костном мозге без значительных доказательств созревания миелоида. Бласты составляют > 90% неэритроидных клеток. Миелоидная природа бластов демонстрируется положительностью MPO или SBB (> 3% бластов) и / или стержнями Ауэра.
Морфология
В некоторых случаях незрелые клетки имеют обильную, часто базофильную цитоплазму с различным количеством часто нечетких, иногда сливающихся гранул. Если таких незрелых клеток <10%, диагноз - M1, но если> 10%, диагноз становится
.| Типичная морфология взрыва AML-M1. |
Иммунофенотипирование
Используя точечный график зависимости CD45 от SSC, можно идентифицировать бласты (зеленая популяция ниже).Миелобласты M1 имеют умеренную экспрессию CD45 и SSC от низкого до умеренного. Обратите внимание, что эти бласты имеют немного более высокий SSC, чем лимфоциты (красная популяция ниже).
| Примерный график зависимости CD45 от SSC с контрольными точками идентифицирует миелобласты в случае AML-M1. |
Ниже приведены примеры гистограмм для случая AML M1.
Бласты M1 экспрессируют по крайней мере два из следующих миелоидных антигенов: CD13, CD33, CD117, MPO и / или HLA-DR. CD34 часто бывает положительным. Обычно нет экспрессии моноцитоидных маркеров CD11b или CD14. Лимфоидные антигены CD3, CD20, CD79a отсутствуют. CD7 может быть экспрессирован.
CD34 часто бывает положительным. Обычно нет экспрессии моноцитоидных маркеров CD11b или CD14. Лимфоидные антигены CD3, CD20, CD79a отсутствуют. CD7 может быть экспрессирован.
Другие соответствующие тесты
Cytochemistry : Относительно небольшое количество бластов (5-10%) являются MPO (миелопероксидазой) положительными. Для диагностики требуется минимум 3% положительных бластов на МПО. NSE и PAS обычно отрицательны.
Генетика : Хромосомные аномалии: t (9; 22) Филадельфийская хромосома, 8+, -5 и -7.
Диагностика потока
AML — M1 и AML-M2 изначально стратифицированы по морфологии (см. Выше). Бласты M1 должны экспрессировать по крайней мере два из следующих миелоидных антигенов: CD13, CD33, CD117, MPO и / или HLA-DR . MPO должно быть выражено на > 3% при взрыве.
Острый миелоидный лейкоз, M1: Биоинформатика болезней: Novus Biologicals
Разместите свое изображение, связанное с болезнями, чтобы оно было размещено!Социальные сети
Разместите свою учетную запись Twitter, связанную с острым миелоидным лейкозом, M1, чтобы быть избранным!Блоги
| Разместите свой блог об остром миелоидном лейкозе M1, чтобы быть избранным! |
События
| Разместите свое мероприятие по острому миелоидному лейкозу, M1, чтобы быть представленным! |
Видео
Отправьте свое видео об остром миелоидном лейкозе M1, чтобы оно было отмечено!Благотворительность
Отправьте свою благотворительную помощь по поводу острого миелоидного лейкоза, M1, чтобы быть представленным!
Острый миелоидный лейкоз — это клональное заболевание, вызванное злокачественной трансформацией самообновляющихся стволовых клеток или клеток-предшественников костного мозга. Это приводит к снижению скорости самоуничтожения и аберрантной дифференцировки, вызывая накопление этих миелоидных клеток в органах и костном мозге. В M1 наблюдается минимальное созревание клеток и прогноз средний для пациентов с AML. Развитие острого миелоидного лейкоза связано со многими синдромами предрасположенности, которые вызваны хромосомным дисбалансом, дефектами репарации ДНК, измененным синтезом белка и измененными рецепторами цитокинов или путями передачи сигнала.
Это приводит к снижению скорости самоуничтожения и аберрантной дифференцировки, вызывая накопление этих миелоидных клеток в органах и костном мозге. В M1 наблюдается минимальное созревание клеток и прогноз средний для пациентов с AML. Развитие острого миелоидного лейкоза связано со многими синдромами предрасположенности, которые вызваны хромосомным дисбалансом, дефектами репарации ДНК, измененным синтезом белка и измененными рецепторами цитокинов или путями передачи сигнала.Острый миелоидный лейкоз, M1 Bioinformatics Tool
Laverne — это удобный инструмент биоинформатики, помогающий облегчить научное исследование родственных генов, болезней и путей на основе совместного цитирования. Узнайте больше об остром миелоидном лейкозе M1 ниже! Для получения дополнительной информации о том, как использовать Laverne, прочтите Руководство.Лучшие исследовательские реактивы
У нас есть 3322 продукта для исследования острого миелоидного лейкоза, M1, которые можно применять для проточной цитометрии, вестерн-блоттинга, иммуноцитохимии / иммунофлюоресценции, иммуногистохимии из нашего каталога антител и наборов для ELISA.NBP2-52406 Мышь Моноклональная
Виды Человек
Приложения WB, ELISA, IHC
Кролик Поликлональный
Виды Человек, Мышь
Применения WB, ICC / IF, IHC
| 1 Обзор 3 Публикации | Добавить в корзину |
Мышь Моноклональная
Виды Человек
Приложения WB, Flow, IHC
Коза Поликлональная
Виды Человек, Мышь
Приложения WB, Simple Western, IHC
| 5 Обзоры 30 Публикации | Добавить в корзину |
Крыса Моноклональная
Виды Мышь, Крыса
Применения WB, ELISA, Flow
| 22 Публикации | Добавить в корзину |
Мышь Моноклональная
Виды Человек
Приложения WB, ELISA, Flow
| 26 Обзоры 477 Публикации | Добавить в корзину |
Коза Поликлональная
Виды Человек, Мышь
Приложения WB, Simple Western, Flow
| 11 Обзоры 31 Публикации | Добавить в корзину |
Мышь Monoclonal
Виды Человек, мышь, крыса
Приложения WB, Simple Western, Flow
| 7 Публикаций | Добавить в корзину |
Мышь Monoclonal
Виды Крыса
Приложения WB, Flow, ICC / IF
| 6 Публикаций | Добавить в корзину |
Мышь Моноклональная
Виды Человек
Приложения WB, IHC, IHC-P
| 2 публикации | Добавить в корзину |
Мышь Моноклональная
Виды Человек, Мышь
Приложения WB, Flow, ICC / IF
| 11 Публикаций | Добавить в корзину |
Кролик Моноклональный
Виды Человек, Мышь, Крыса
Применения WB, Flow, ICC / IF
Кролик Поликлональный
Виды Человек, Мышь
Приложения WB, Flow, ICC / IF
| 2 Обзоры 3 Публикации | Добавить в корзину |
Мышь Моноклональная
Виды Человек, Мышь
Приложения WB, Flow, ICC / IF
| 1 Обзор 23 Публикации | Добавить в корзину |
Крыса Моноклональная
Виды Мышь
Приложения Flow, IHC, IHC-Fr
| 4 Публикации | Добавить в корзину |
| 3 Обзоры 1 Публикация | Добавить в корзину |
Родственные гены
Острый миелоидный лейкоз, M1 был исследован против:Связанные пути
Острый миелоидный лейкоз, M1 был связан с:Связанные заболевания
Острый миелоидный лейкоз, M1 был изучен в отношении таких заболеваний, как:Связанные PTM
Острый миелоидный лейкоз, M1 был изучен в отношении посттрансляционных модификаций (ПТМ), включая:Альтернативные названия
Острый миелоидный лейкоз, M1 также известен как острый миелобластный лейкоз M1, острый миелобластный лейкоз без созревания, острый миелоцитарный лейкоз без созревания, острый миелоидный лейкоз без созревания, острый миелоидный лейкоз без созревания.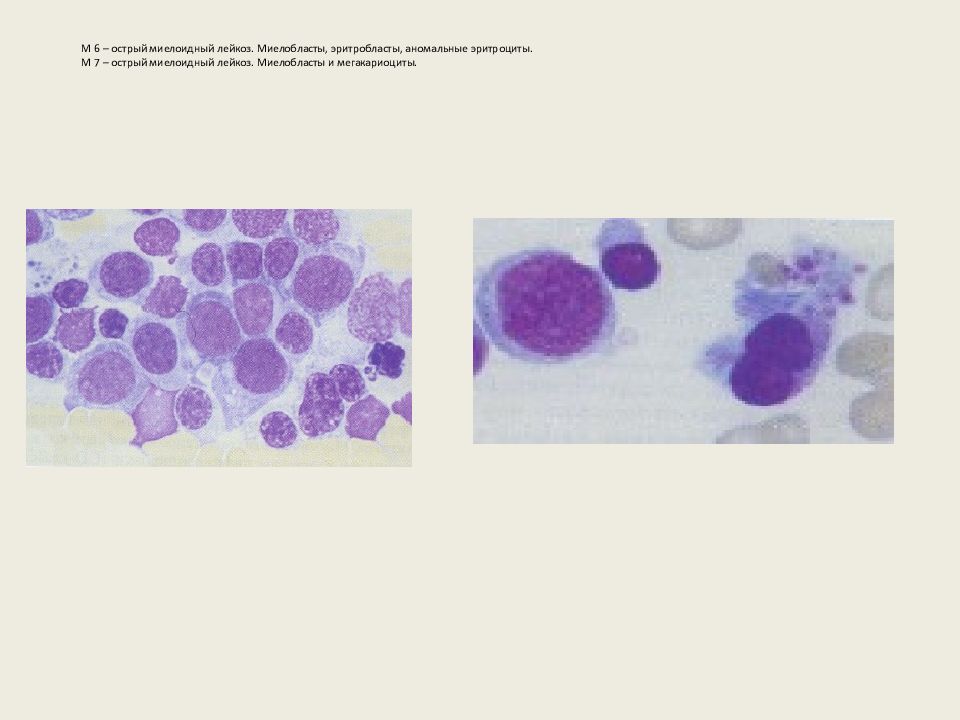
FAB и классификации острого миелоидного лейкоза ВОЗ
Автор
Карен Зайтер, доктор медицины Профессор, кафедра внутренней медицины, отделение онкологии / гематологии, Медицинский колледж Нью-Йорка
Карен Зайтер, доктор медицинских наук, является членом следующих медицинских обществ: Американская ассоциация исследований рака, Американский колледж врачей, Американское общество гематологов
Раскрытие информации: получено гонорар от Novartis за выступления и обучение; Получил гонорар от Novartis за выступление и преподавание; Получал гонорары от Celgene за выступления и преподавание.
Специальная редакционная коллегия
Jasmeet Anand, PharmD, RPh Адъюнкт-инструктор, Фармацевтический колледж Медицинского центра Университета Небраски; Главный редактор Medscape Drug Reference
Раскрытие информации: нечего раскрывать.
Christopher D Braden, DO гематолог / онколог, канцлер центра онкологии при больнице диакониссы; Медицинский директор амбулаторных инфузионных центров больницы диаконис; Председатель онкологического комитета госпиталя Дьяконесса
Кристофер Д. Брейден, доктор медицинских наук, является членом следующих медицинских обществ: Американское общество клинической онкологии, Американское общество гематологии
Раскрытие информации: не подлежит разглашению.
Главный редактор
Эммануэль Беса, доктор медицины Почетный профессор кафедры медицины, отделение гематологических злокачественных новообразований и трансплантации гемопоэтических стволовых клеток, Онкологический центр Киммела, Медицинский колледж Джефферсона Университета Томаса Джефферсона
Эммануэль Беса, доктор медицины, является членом следующих медицинских организаций: общества: Американская ассоциация по образованию в области рака, Американское общество клинической онкологии, Американский колледж клинической фармакологии, Американская федерация медицинских исследований, Американское общество гематологии, Нью-Йоркская академия наук
Раскрытие: Ничего не раскрывать.
Лейкемия — Острый миелоид — AML: Подтипы
НА ЭТОЙ СТРАНИЦЕ : Вы узнаете, как врачи описывают AML. Это называется подтипом. Используйте меню для просмотра других страниц.
Существуют разные способы классификации подтипов AML. Хотя все подтипы вызывают снижение нормального уровня клеток крови, разные типы ОМЛ связаны со специфическими симптомами и проблемами. Кроме того, каждый подтип может вести себя по-разному после лечения.
Морфология
AML сначала описывается его морфологией или тем, как раковые клетки выглядят под микроскопом.ОМЛ классифицируется по типу нормальных незрелых лейкоцитов, на которые он наиболее похож.
Большинство людей с ОМЛ имеют подтип, называемый миелоидным лейкозом, что означает, что рак находится в клетках, которые обычно производят нейтрофилы. У других пациентов есть тип AML, называемый монобластным или моноцитарным лейкозом. При моноцитарном лейкозе клетки выглядят как белые кровяные тельца, называемые моноцитами. Клетки лейкемии также могут быть смесью миелобластных и моноцитарных клеток.
Иногда кажется, что ОМЛ происходит из клеток, вырабатывающих эритроциты, называемых эритроидными, или тромбоцитами, называемых мегакариоцитами.
Острый промиелоцитарный лейкоз (ОПЛ) — это уникальный подтип ОМЛ, при котором раковая клетка перестает созревать, когда клетка находится на стадии, называемой стадией промиелоцитов или програнулоцитов. APL связан с транслокацией между хромосомами 15 и 17 [t (15; 17)].
Система классификации Всемирной организации здравоохранения (ВОЗ) включает следующие основные группы:
- ОМЛ с повторяющимися генетическими аномалиями, то есть со специфическими хромосомными изменениями
- ОМЛ с многолинейной дисплазией или аномалиями внешнего вида клеток крови
- ОМЛ, связанный с терапией, повреждающей клетки, также называемый миелоидным новообразованием, связанным с терапией
- AML, не отнесенный к другой категории
- Миелоидная саркома
- Миелоидные пролиферации, связанные с синдромом Дауна
- Недифференцированные или бифенотипические острые лейкозы
Французско-американо-британская классификация (FAB) — это более старая система описания AML, но она все еще широко используется и приводится ниже для справки.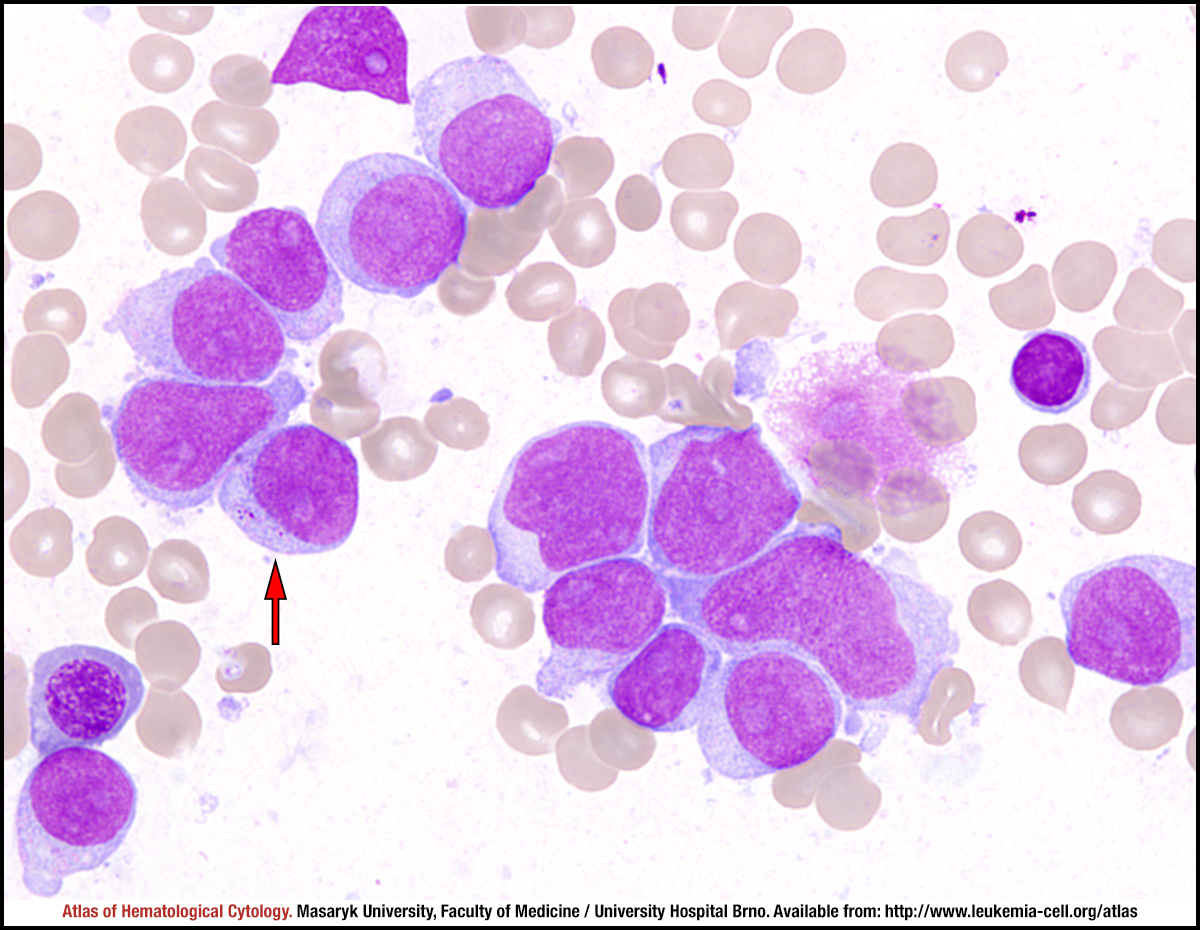
- M0: Миелобластический без дифференциации
- M1: Миелобластный с незначительным созреванием или без него
- M2: Миелобластика созревания
- M3: Промиелоцитарный
- M4: Миеломоноцитарный
- M4eo: Миеломоноцитарный с эозинофилами
- M5a: Моноцитарный без дифференциации (монобластный)
- M5b: Моноцитарный с дифференцировкой
- M6: Эритролейкемический
- M7: Мегакариоцитарный
Цитогенетика
AML также классифицируется по цитогенетическим или хромосомным изменениям, обнаруженным в лейкозных клетках.Определенные хромосомные изменения тесно связаны с морфологией клеток AML. Что еще более важно, хромосомные изменения помогают врачам определять лучшие варианты лечения, потому что эти изменения иногда могут предсказать, насколько хорошо будет работать интенсивное лечение. Хромосомные изменения обычно группируются в соответствии с вероятностью того, что лечение будет работать против подтипа AML.
Все хромосомы пронумерованы от 1 до 22. Половые хромосомы называются «X» или «Y». Буквы «p» и «q» относятся к «плечам» или конкретным участкам хромосомы.Некоторые из типов генетических изменений, обнаруженных при AML, включают:
Транслокация, означающая, что хромосома разрывается и присоединяется к другой хромосоме
Дополнительные копии хромосомы
Делеция хромосомы
Некоторые из наиболее распространенных хромосомных изменений сгруппированы следующим образом:
Благоприятно. Хромосомные изменения, связанные с более успешным лечением, включают аномалии хромосомы 16 на полосах p13 и q22 [t (16; 16) (p13; q22), inv (16) (p13q22)] и транслокацию между хромосомами 8 и 21 [t ( 8; 21)].
Средний. Изменения, связанные с менее благоприятным прогнозом, включают нормальные хромосомы, где изменений не обнаружено, и транслокацию между хромосомами 9 и 11 [t (9; 11)].
 Многие другие подтипы считаются частью этой группы, особенно с одним или несколькими специфическими молекулярными изменениями. Иногда дополнительные копии хромосомы 8 или трисомии 8 могут классифицироваться как промежуточный риск по сравнению с неблагоприятным (см. Ниже).
Многие другие подтипы считаются частью этой группы, особенно с одним или несколькими специфическими молекулярными изменениями. Иногда дополнительные копии хромосомы 8 или трисомии 8 могут классифицироваться как промежуточный риск по сравнению с неблагоприятным (см. Ниже).Неблагоприятно. Примеры хромосомных изменений, которые связаны с менее успешным лечением или с низкой вероятностью излечения AML, включают дополнительные копии хромосом 8 или 13 [например, трисомию 8 (+8)], делецию всех или части хромосом 5 или 7, сложные изменения на многих хромосомах и изменения на хромосоме 3 на полосе q26.
В целом, благоприятные изменения чаще встречаются у молодых пациентов, а неблагоприятные изменения — у людей старше 60 лет.Эффективность лечения по-прежнему сильно различается в каждой из этих групп. Лечение является успешным в долгосрочной перспективе для 50–60% пациентов моложе 60 лет с ОМЛ, который классифицируется как благоприятный, и менее 10% пациентов моложе 60 лет с ОМЛ, который классифицируется как неблагоприятный. Прогноз у пациентов старше 60 лет значительно хуже. Эффективность лечения также зависит от других факторов, включая количество лейкоцитов. Невозможно точно предсказать вероятность успешного лечения человека с ОМЛ.
Молекулярные изменения
Тестирование молекулярных изменений при постановке диагноза помогает определить варианты лечения пациента. Например, пациенты с изменениями в генах NPM1 или CEBPalpha имеют лучший долгосрочный результат, в то время как химиотерапия (см. Раздел «Варианты лечения») не работает также для пациентов с изменениями в гене FLT3 . Другие генетические изменения, связанные с прогнозом для людей с ОМЛ, включают:
RUNX1
ASX11
P53
IDh2 и IDh3
Рецидивирующий ОМЛ
Рецидивирующий или рецидивный ОМЛ — это рак, который вернулся после лечения.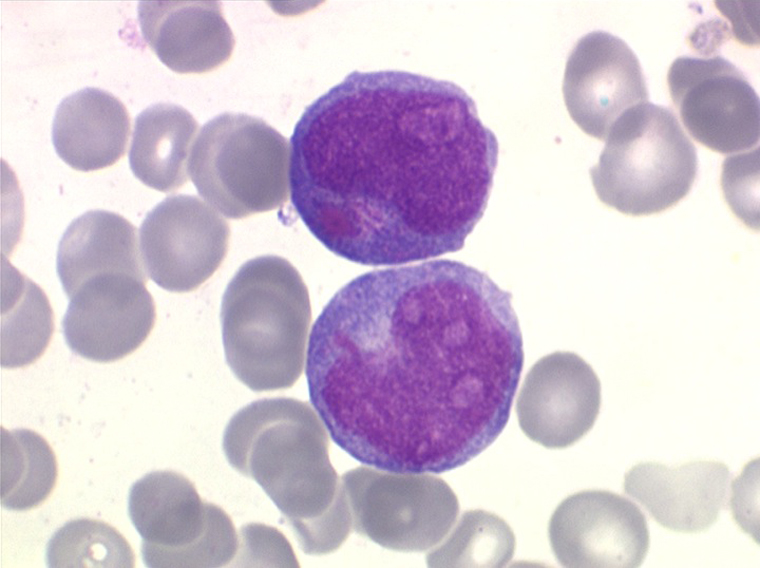 Если AML все же вернется, будет проведен еще один раунд тестов, чтобы узнать о степени повторения. Эти тесты и сканирование часто аналогичны тем, которые проводились во время первоначального диагноза.
Если AML все же вернется, будет проведен еще один раунд тестов, чтобы узнать о степени повторения. Эти тесты и сканирование часто аналогичны тем, которые проводились во время первоначального диагноза.
Информация о подтипе поможет врачу порекомендовать конкретный план лечения. Следующий раздел этого руководства — «Варианты лечения». Вы можете использовать меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Острый миелоидный лейкоз | Типы лейкемии
Острый миелоидный лейкоз (ОМЛ), также известный как острый миелогенный лейкоз, острый миелобластный лейкоз, острый гранулоцитарный лейкоз или острый нелимфоцитарный лейкоз, является быстрорастущей формой рака крови и костного мозга.
ОМЛ — наиболее распространенный тип острого лейкоза. Это происходит, когда костный мозг начинает производить бласты, клетки, которые еще не полностью созрели. Эти бласты обычно превращаются в белые кровяные тельца. Однако при ОМЛ эти клетки не развиваются и не могут предотвратить инфекции.
При ОМЛ костный мозг также может вырабатывать аномальные эритроциты и тромбоциты. Количество этих аномальных клеток быстро увеличивается, и аномальные (лейкозные) клетки начинают вытеснять нормальные лейкоциты, эритроциты и тромбоциты, которые необходимы организму.
Одним из основных отличий ОМЛ от других основных форм лейкемии является то, что он имеет восемь различных подтипов, которые основаны на клетке, из которой возник лейкоз. К типам острого миелолейкоза относятся:
- Миелобластический (M0) — по специальному анализу
- Миелобластический (M1) — без созревания
- Миелобластический (М2) — с созреванием
- Промиелоктик (M3)
- Миеломоноцитарный (M4)
- Моноцитарный (M5)
- Эритролейкоз (M6)
- Мегакариоцит (M7)
Симптомы острого миелоидного лейкоза
Поскольку AML производит аномальные клетки, которые вытесняют нормальные здоровые клетки, многие из его симптомов являются результатом низкого количества здоровых клеток крови в организме. Некоторые симптомы ОМЛ включают:
Некоторые симптомы ОМЛ включают:
- Частые инфекции и лихорадка : Работа белых кровяных телец — предотвращать инфекции и защищать наш организм от чужеродных микробов и бактерий. Поскольку ОМЛ снижает количество здоровых лейкоцитов, организм не так способен защищаться от чужеродных микробов и бактерий. Следовательно, у пациентов с ОМЛ может быть повышенная частота инфекций и лихорадок.
- Анемия : красные кровяные тельца переносят кислород по всему телу.Низкий уровень здоровых клеток крови, вызванный ОМЛ, может привести к чувству усталости и / или слабости, одышке и бледности.
- Легкое кровотечение или синяк : Тромбоциты останавливают кровотечение. Низкий уровень в крови может привести к легкому кровотечению или синякам. Это может привести к медленному заживлению порезов, длительному кровотечению из мелких порезов и синякам без ясной причины. Это также может привести к петехиям, крошечным красным пятнам под кожей.
- Боль в суставах и костях : Повышенное количество лейкозных клеток может вызывать боль в костях, суставах или и в том, и в другом.
Варианты лечения острого миелоидного лейкоза
Лечение ОМЛ может включать химиотерапию, лучевую терапию, трансплантацию стволовых клеток и / или таргетную терапию. Ваша интегрированная команда экспертов по лейкемии ответит на ваши вопросы и порекомендует варианты лечения, основанные на вашем уникальном диагнозе и потребностях.
Обычное химиотерапевтическое лечение ОМЛ начинается с индукционной химиотерапии, при которой используется комбинация лекарств для уничтожения как можно большего количества лейкозных клеток и нормализации показателей крови.Затем следует консолидирующая химиотерапия для уничтожения оставшихся лейкозных клеток, которые нельзя увидеть в крови или костном мозге.
Следующая тема: Что такое хронический лимфолейкоз?
Классификация острого миелоидного лейкоза
Лейкемии классифицируются по их острому и хроническому развитию, а также по происхождению лимфоидных или миелоидных клеток. Острый миелоидный лейкоз подразделяется на подтипы.
Острый миелоидный лейкоз подразделяется на подтипы.
Большинство видов рака и солидных опухолей классифицируются по типу клеток, агрессивности и склонности к распространению на другие органы.Однако классификации AML основаны на внешнем виде клеток и их генетической аномалии.
Системы классификации
Есть две основные системы, которые используются для классификации AML на подтипы. Одна из них — французско-американская британская (FAB) классификация, которая использовалась ранее и была заменена более новой классификацией Всемирной организации здравоохранения (ВОЗ).
Французско-американо-британская классификация (FAB)
Франко-американо-британская (FAB) классификация ОМЛ была разработана в 1970-х годах группой французских, американских и британских экспертов по лейкемии.
Они классифицировали AML на подтипы от M0 до M7. Это было основано на типе клетки, из которой развился лейкоз, и уровне зрелости клеток. Классификация FAB основывалась на появлении лейкозных клеток под микроскопом после стандартного окрашивания.
Согласно классификации FAB подтипы от M0 до M5 начинаются с предшественников лейкоцитов. M6 AML возникает в очень ранних формах эритроцитов, а M7 AML начинается в ранних формах клеток, которые образуют тромбоциты.
Классификация FAB также определяет различия симптомов. Например, неконтролируемое кровотечение наблюдается при подтипе M3 AML, также известном как острый промиелоцитарный лейкоз (APL). Подтипы также позволяют прогнозировать прогноз и определять наиболее подходящее лечение. Например, APL обычно реагирует на ретиноиды.
| FAB подтип | Имя | % взрослых больных ОМЛ | Прогноз по сравнению со средним для AML |
| M0 | Недифференцированный острый миелобластный | 5% | Хуже |
| M1 | Острый миелобластный лейкоз с минимальным созреванием | 15% | Среднее значение |
| м2 | Острый миелобластный лейкоз с созреванием | 25% | Лучше |
| м3 | Острый промиелоцитарный лейкоз (ОПЛ) | 10% | Лучшее |
| M4 | Острый миеломоноцитарный лейкоз | 20% | Среднее значение |
| M4 eos | Острый миеломоноцитарный лейкоз с эозинофилией | 5% | Лучше |
| M5 | Острый моноцитарный лейкоз | 10% | Среднее значение |
| M6 | Острый эритроидный лейкоз | 5% | Хуже |
| M7 | Острый мегакариобластный лейкоз | 5% | Хуже |
Классификация Всемирной организации здравоохранения (ВОЗ)
Наиболее используемой и современной классификацией AML является классификация Всемирной организации здравоохранения (ВОЗ). Система классификации FAB не учитывает несколько факторов, которые могут повлиять на прогноз лейкемии. Таким образом, ВОЗ предложила новую систему, которая включает некоторые из этих факторов для классификации AML.
Система классификации FAB не учитывает несколько факторов, которые могут повлиять на прогноз лейкемии. Таким образом, ВОЗ предложила новую систему, которая включает некоторые из этих факторов для классификации AML.
Система классификации ВОЗ делит AML на несколько широких групп. К ним относятся: —
- ОМЛ с генетическими отклонениями: —
- ОМЛ с транслокацией между 8 и 21 хромосомами
- ОМЛ с транслокацией или инверсией в хромосоме 16
- ОМЛ с изменениями в хромосоме 11
- APL (M3), который обычно имеет транслокацию между хромосомами 15 и 17
- AML с многолинейной дисплазией, означающей вовлечение более чем одного аномального типа миелоидных клеток
- ОМЛ, связанный с предыдущей химиотерапией или лучевой терапией
- AML неуточненный, в том числе те, которые не попадают ни в одну из вышеперечисленных групп.Это включает в себя:-
- Недифференцированный ОМЛ (M0)
- AML с минимальным созреванием (M1)
- AML с созреванием (M2)
- Острый миеломоноцитарный лейкоз (M4)
- Острый моноцитарный лейкоз (M5)
- Острый эритроидный лейкоз (M6)
- Острый мегакариобластный лейкоз (M7)
- Острый базофильный лейкоз
- Острый панмиелез с фиброзом
- Миелоидная саркома (также известная как гранулоцитарная саркома или хлорома)
Иногда ОЛЛ с миелоидными маркерами может быть включен в ОМЛ, называемый ОМЛ с лимфоидными маркерами, или лейкозами смешанного происхождения, или недифференцированными или бифенотипическими острыми лейкозами (как с лимфоцитарными, так и с миелоидными признаками).
Дополнительная литература
.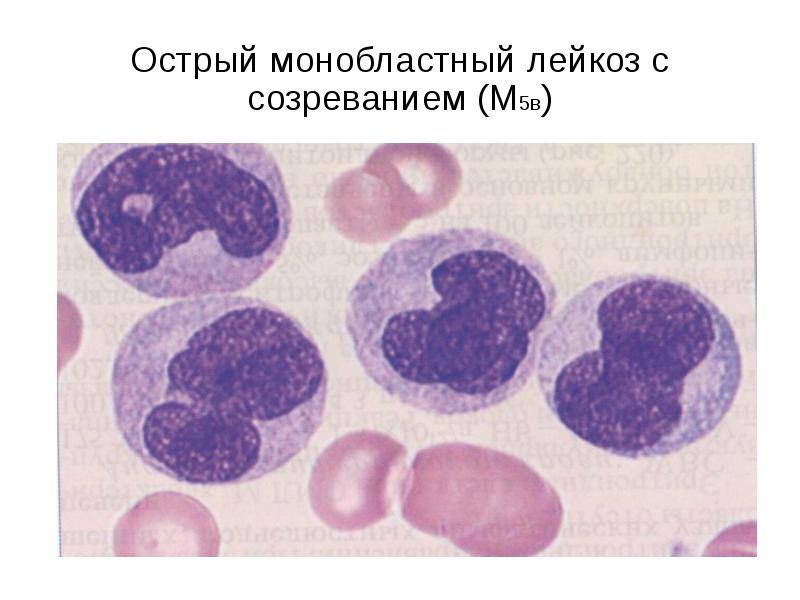

 В зависимости от стадии рака, больному проводится один или несколько курсов облучения.
В зависимости от стадии рака, больному проводится один или несколько курсов облучения.
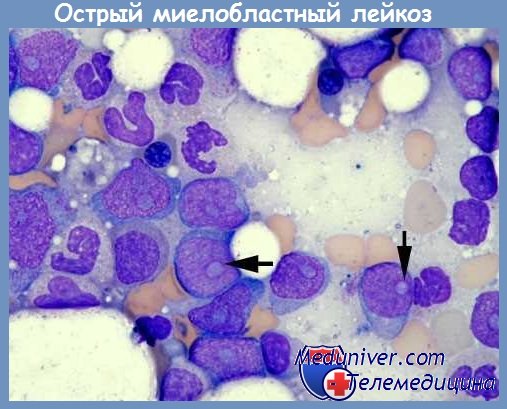
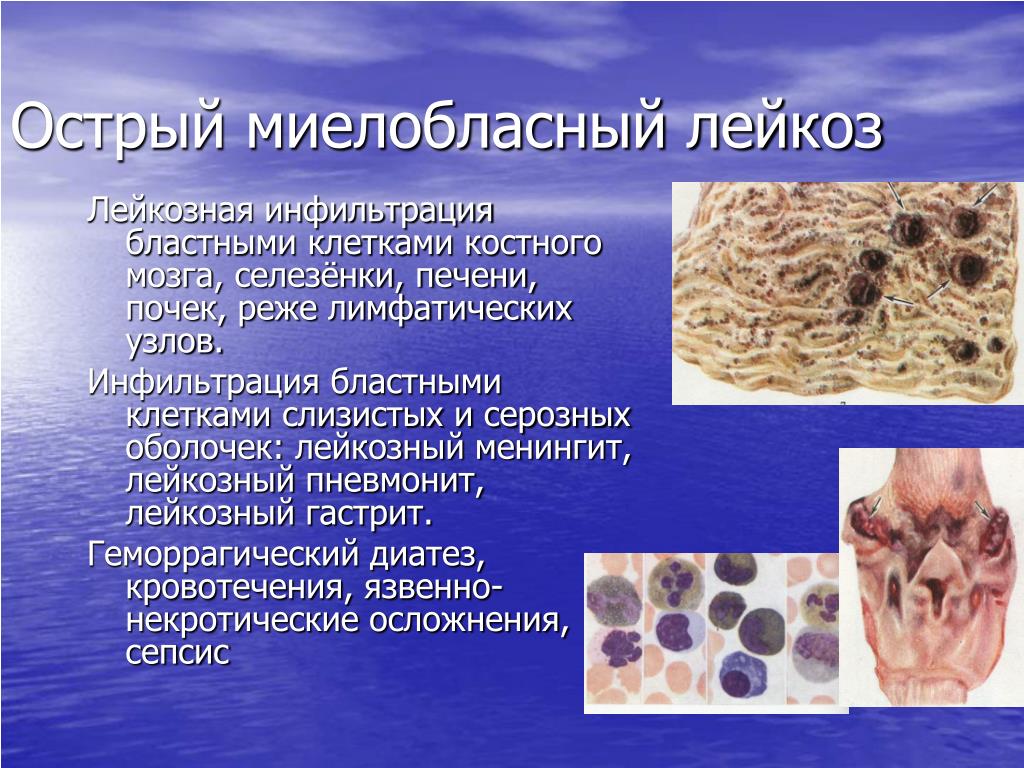 Второй вариант, дифференцированная форма, характеризуется высоким содержанием монобластов, промоноцитов и моноцитов. Соотношение моноцитов в кровотоке может быть выше, чем в костном мозге. Клетки лейкоза типа М5 могут проникать в кожу и десны, при этом варианте лейкоза прогноз хуже, чем при других.
Второй вариант, дифференцированная форма, характеризуется высоким содержанием монобластов, промоноцитов и моноцитов. Соотношение моноцитов в кровотоке может быть выше, чем в костном мозге. Клетки лейкоза типа М5 могут проникать в кожу и десны, при этом варианте лейкоза прогноз хуже, чем при других.
 Одна
линия нормальная, завершающаяся зрелыми
клеточными формами. Другая линия —
опухолевый клон бластных клеток, не
способных к дальнейшей дифференциации.
В зависимости от содержания лейкоцитов
и количества бластных клеток в
периферической крови выделяют три
формы лейкоза: лейкемический — при
высоком, до 100*109/л
лейкоцитозе и большом количестве
бластов; сублейкемический, когда число
бластов незначительно превышает
нормальное содержание лейкоцитов в
крови; алейкемический — при отсутствии
бластов в периферической крови. В
последнем случае обычно отмечается
панцитопения — лейкопения, анемия,
тромбоцитопения.
Одна
линия нормальная, завершающаяся зрелыми
клеточными формами. Другая линия —
опухолевый клон бластных клеток, не
способных к дальнейшей дифференциации.
В зависимости от содержания лейкоцитов
и количества бластных клеток в
периферической крови выделяют три
формы лейкоза: лейкемический — при
высоком, до 100*109/л
лейкоцитозе и большом количестве
бластов; сублейкемический, когда число
бластов незначительно превышает
нормальное содержание лейкоцитов в
крови; алейкемический — при отсутствии
бластов в периферической крови. В
последнем случае обычно отмечается
панцитопения — лейкопения, анемия,
тромбоцитопения.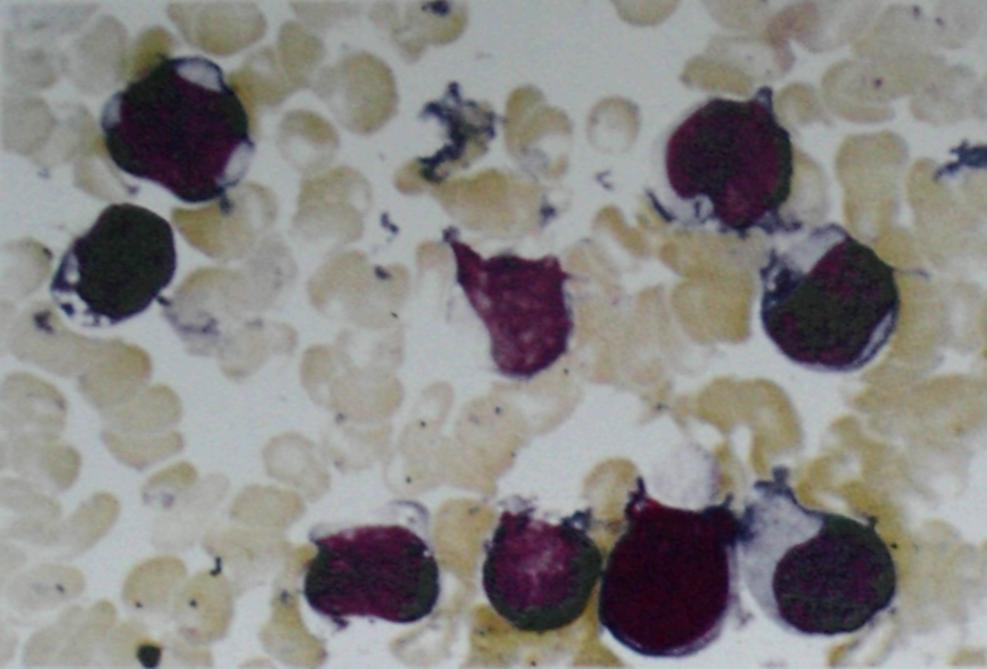
 Многие другие подтипы считаются частью этой группы, особенно с одним или несколькими специфическими молекулярными изменениями. Иногда дополнительные копии хромосомы 8 или трисомии 8 могут классифицироваться как промежуточный риск по сравнению с неблагоприятным (см. Ниже).
Многие другие подтипы считаются частью этой группы, особенно с одним или несколькими специфическими молекулярными изменениями. Иногда дополнительные копии хромосомы 8 или трисомии 8 могут классифицироваться как промежуточный риск по сравнению с неблагоприятным (см. Ниже).