связь между питанием и энергичностью, часть 1.
«Людям, которые страдают от избыточного веса и жалуются на дневную усталость и сонливость мы рекомендуем пройти тщательное исследование на предмет апноэ и других расстройств сна. Эти факторы могут присутствовать, а значит должны быть приняты во внимание», — рассказывает Фернандес Мендоса в интервью Yahoo Helth. Также, добавляет он, потеря веса при помощи диеты, физической активности и изменения поведенческих факторов (например, управление процессом приема пищи), «должно иметь наивысший приоритет для уменьшения массы тела и снижения дневной сонливости». Если вы полагаете, что ваша дневная сонливость вызвана депрессией, обязательно обратитесь к психологу или психиатру для постановки диагноза.
Выраженная сонливость днем, ожирение и инсулинорезистентность – частые «спутники» пациентов с синдромом обструктивного апноэ во сне. При этом, как свидетельствуют данные опубликованного в онлайн-версии журнала Thorax исследования, именно чрезмерная сонливость днем может быть маркером наличия у данных пациентов инсулинорезистентности, а значит – и сигналом для проведения более углубленного обследования. В данное исследование было включено 44 пациента с СОАС, у половины из которых имела место выраженная сонливость днем, отмечаемая как самими пациентами, так и зафиксированная объективными методами (тест MSLT). Инсулинорезистентность определяли по значению индекса НОМА; также у пациентов исследовали в динамике содержание в плазме крови триглицеридов, холестерина, кортизола, тиреотропного гормона, соматотропина и инсулиноподобного фактора роста I (IGF-I). Независимо от возраста и массы тела у пациентов с выраженной дневной сонливостью по сравнению с больными без таковой были выявлены достоверно более высокие плазменные концентрации глюкозы (p
В данное исследование было включено 44 пациента с СОАС, у половины из которых имела место выраженная сонливость днем, отмечаемая как самими пациентами, так и зафиксированная объективными методами (тест MSLT). Инсулинорезистентность определяли по значению индекса НОМА; также у пациентов исследовали в динамике содержание в плазме крови триглицеридов, холестерина, кортизола, тиреотропного гормона, соматотропина и инсулиноподобного фактора роста I (IGF-I). Независимо от возраста и массы тела у пациентов с выраженной дневной сонливостью по сравнению с больными без таковой были выявлены достоверно более высокие плазменные концентрации глюкозы (p
0>
Орексин и лептин влияют на ремоделирование костей. Как удалось выяснить команде ученых из университета Техасского юго-западного медицинского центра (UT Southwestern Medical Center), орексины, белковые нейромедиатры, которые провоцируют приступы дневной сонливости, также играют важную роль в формировании костей. Это значит, что полученные данные могут позволить разработать новые методы лечения остеопороза.
Орексины или гипокретины представляют собой особый вид протеина, который используется нервными клетками для связи с друг другом. Команда исследователей из Техаса, сотрудничая со своими коллегами в Японии, пришли к выводу, что, вследствие нехватки остеобластов, клеток, формирующих костную ткань у мышей с недостаточным количеством орексинов более тонкие и хрупкие кости, которые легко ломаются.
Поражая в первую очередь пожилых людей и женщин, остеопороз является чрезвычайно распространенной болезнью, которая нарушает костеобразование, и ежегодно становиться более 1,5 млн. переломов и смерти 40 тыс. людей. Более того оно негативно сказывается на работоспособности, психическом здоровье и качестве жизни в целом.
Как оказалось, орексины играют двойную роль: они как способствуют образованию костной ткани, так и препятствуют ему. Непосредственно в самом скелете они взаимодействуют с другим белком, орексиновым рецептором OX1R, который снижает уровень грелина, гормона отвечающего за чувство голода. Этот процесс замедляет производство новых остеобластов и, следовательно, препятствует формированию костных клеток. В то же время, в головном мозге орексины взаимодействуют с рецептором OX2R, что приводит к уменьшению уровней лептина, гормона, который способствуют разрушению костной ткани, что в итоге, является положительном фактором.
Этот процесс замедляет производство новых остеобластов и, следовательно, препятствует формированию костных клеток. В то же время, в головном мозге орексины взаимодействуют с рецептором OX2R, что приводит к уменьшению уровней лептина, гормона, который способствуют разрушению костной ткани, что в итоге, является положительном фактором.
Таким образом, профилактика и лечение остеопороза может быть достигнуты путем подавления активности OX1R или путем стимулирования OX2R. Нейропептидам удается регулировать формирование кости с помощью двух различных рецепторов, расположенных в двух разных тканях».
Активность OX2R в гипоталамусе оказалось доминантой. Поэтому, когда группа исследователей протестировала мышей, которые нуждались в обоих рецепторах, у них были очень хрупкие кости и не наблюдалось никакого роста. Подобным образом, когда они изучили мышей с высокими уровнями орексинов, их остеобласты находились в избытке и происходило активное костеобразование.
Мучает бессонница? ТОП-лист продуктов, которые смогут Вам помочь
Ученые провели исследование, чтобы выяснить, какие продукты помогают справиться с бессонницей.
Исследователи выявили, что от проблем со сном помогают продукты с большим содержанием мелатонина и триптофана.
Мелатонином называется гормон сна. И у него есть антипод – гормон орексин. Мелатонин обладает не только седативными (сонными), но и также антиоксидантными, омолаживающими свойствами, а кроме того, укрепляет иммунную систему и даже борется с раковыми клетками.
К счастью, содержание мелатонина в нашем организме можно, при необходимости повысить – с помощью определенных продуктов питания, в которых он содержится естественным путем.
Отв подготовил для вас ТОП-лист продуктов, содержащих мелатонин и триптофан и способствующих выработке серотонина.
Бананы. Стимулируют выработку серотонина и мелатонина, содержат калий, а также магний, способствующий стабилизации настроения и расслаблению мышц.
Вишня и черешня. Эти ягоды являются натуральным источником мелатонина – вещества, которое контролирует ваши внутренние часы и уравновешивает ваш сон. Эксперты рекомендуют за час перед сном съедать пригоршню этих ягод. Если вы хотите выспаться в самолете или поезде, берите всегда с собой вишни или черешню.
Эксперты рекомендуют за час перед сном съедать пригоршню этих ягод. Если вы хотите выспаться в самолете или поезде, берите всегда с собой вишни или черешню.
Молоко. Удачный союз триптофана и кальция, который помогает мозгу триптофан усваивать. Для многих детей теплое молоко с медом — идеальное снотворное. Так почему бы не брать с них пример? Кроме того, молоко воздействует также и на психику. Оно как бы погружает человека в полузабытые ощущения раннего детства, когда бутылочка молока олицетворяла собой покой и уют.
Мясо индейки, миндальные и кедровые орехи, цельнозерновой хлеб. Продукты — лидеры по содержанию триптофана. Небольшое количество глюкозы (в форме меда или варенья) поможет блокировать избытки орексина, мешающие нам отключиться и заснуть. Только не увлекайтесь! Большое количество сладкого воспринимается мозгом как сигнал к новому циклу активной деятельности.
Ромашковый чай. Ромашка недаром занимает первое место среди успокаивающих напитков.
Печеный картофель. Желудок не перегрузит небольшое количество печеного картофеля – он впитывает кислоты, мешающие выработке триптофана. Чтобы усилить успокоительный эффект, картофель можно размять в ложке теплого молока.
Овсяная каша на молоке с ложечкой меда. Окажет на организм успокаивающее воздействие и утолит чувство голода. Если сну мешают неприятности, депрессия, попробуйте добавить в вечернюю овсянку две чайные ложки семян льна. Семена льна богаты жирными кислотами омега-3, улучшающими настроение.
Луковый суп. В луке содержится особое успокаивающее вещество кверцетин, благодаря седативным свойствам которого лук использовался в качестве средства для борьбы с бессонницей еще в древнем Египте.
Эти продукты расслабляют напряженные мышцы, успокаивают нервную систему, стимулируют выработку навевающих сон гормонов – серотонина и мелатонина – и не отягощают желудок.
★ Орексин — нейромедиаторы .. Информация
1. Открытие и название.
(The opening and title)Группа Masashi Yanagisawa (Масаси Янагисава) и T. Sakurai (Сакураи) из Юго-Западного Медицинского центра Техасского университета в Далласе провели в 1998 г. поиск неизвестных гормонов, используя метод «обратной фармакологии». В нашем геноме есть о 100 — 150 последовательностей, предположительно кодирующий G-белок-связанные рецепторы клеток, роль которых в организме не выявлены рецепторы без известных лигандов, или «рецепторы-сироты». представление последовательностей в линиях клеток с помощью генной инженерии можно «отлавливать» с их помощью лигандов из экстрактов тканей. «Обратным фармакологическим» этот метод называется потому, что, в отличие от обычных исследований, уже не первый лиганд и рецептор. когда его обещают этот метод является менее надежным и более трудоемким, чем обычно.
Нашли два новых лиганда, и определяя, что они влияют на аппетит, это предположение было выдвинуто в самом начале, потому что латеральный гипоталамус тесно связан с регуляцией аппетита, они предложили для них название «орексины», происходит от греческого ορεξις аппетит.
Группа Luis de Lecea (Луис де Lecea) и Thomas Kilduff (Томас Кильдуфф) был открыт в том же году, два новых пептида для изоляции цепи мРНК в гипоталамусе, который они назвали «гипокретинами» из-за структурной схожести с гормоном секретин «гипо» — от гипоталамуса «кретин» — от секретин.
Консенсуса в отношении их имена в научных кругах до сих пор не достигнута: некоторые отвергают имя «орексины», указывая, что стимуляция аппетита не является их главной роли, к тому же он может быть косвенным, противники считают, что имя «гипокретин» еще более странно и менее информативно, тем более, что имена многих нейропептидов не отражает их основную функцию.
В то же время, вы должны знать, что ορεξις не самое точное слово в греческом языке для обозначения аппетит, его смысл более общий- «желание», «стремление», «страсть» более близкий перевод этого слова «аппетит» βουλεμια на греческом языке, из которого происходит название болезни булимия. в этом случае, как указывает один автор, он сказал в поддержку названия «орексин», как показывают последние исследования обнаружили важную роль орексина в мотивированное поведение reward circuit (вознаграждения схема).
Ученые на пути открытия «препарата бодрствования» | Новости | Известия
Миллионы сонных жителей городов, приводящих себя в чувства с помощью чашки утреннего кофе, возможно, скоро попробуют новое чудесное средство поддержания бодрости и работоспособности. Представьте: приняв таблетку после бессонных суток, у вас пропадает желание спать и вы снова готовы работать и бодрствовать, не прерываясь на сон. Заманчивая мысль продления жизни за счет воровства времени у сна может стать реальностью, а препарат, который обеспечивает это — сверхэффективным стимулятором будущего. Обезьяны в лабораториях американского города Дарпа уже попробовали этот стимулятор.
Небольшие обезьянки, которых бессердечные ученые в течение 30-36 часов в целях науки лишали сна, избавились от сонливости, получив дозу нейрогормона. Они почти мгновенно стали столь же активны и бодры, как их собратья, мирно дремавшие в соседней клетке. Этот чудесный гормон головного мозга, позволяющий ликвидировать эффект депривации сна, называется орексин-А.
Ученые предполагают, что на основе орексина-А можно создать препарат, который сможет без каких либо серьезных побочных эффектов заменить людям естественный сон. Однако первое практическое применение это открытие, скорее всего, найдет в терапии тяжелых нервных паталогий. На основе гормона ученые попытаются создать лекарство для лечения нарколепсии — серьезного заболевания, проявляющееся нарушениями сна. Больные нарколепсией испытывают непреодолимую дневную сонливость с приступами внезапного засыпания и катаплексии, то есть полной или частичной утраты мышечного тонуса.
«Данная терапия представляет собой абсолютно новый подход к повышению активности центральной нервной системы, а результаты последних экспериментов свидетельствуют об относительной безвредности этого метода», — отметил доктор Джером Сигел, профессор психиатрии из Калифорнийского университета в Лос-Анджелесе в статье Журнала Нейрологической Науки.
Орексин-А имеет все шансы стать основой препаратов, которые смогут продаваться как «заменители сна». Долгие годы люди использовали различные стимуляторы для борьбы со сном, однако они могут вызывать привыкания и часто имеют серьезные побочные эффекты, такие как повышение кровяного давления и перепады настроения. Вред здоровью, который за собой могут нести эти препараты, мешает их широкому применению.
Долгие годы люди использовали различные стимуляторы для борьбы со сном, однако они могут вызывать привыкания и часто имеют серьезные побочные эффекты, такие как повышение кровяного давления и перепады настроения. Вред здоровью, который за собой могут нести эти препараты, мешает их широкому применению.
Средство, помогающее человеку долгое время обходиться без сна, уже давно остается вожделенным «философским камнем» фармацевтики наряду с лекарством от рака и омолаживающими таблетками. «Таблетку для бодрости» очень хотели бы получить военные. Это позволит держать войска в постоянной боевой готовности. Во многих армиях мира уже сейчас пилотам разрешают принимать амфетамины для совершения дальних перелетов. Из военного бюджета финансируются разработки других стимуляторов — таких как модафинил и орексин-А.
В ходе эксперимента ученые поделили обезьян, не спавших более 30 часов подряд, на две группы, сообщает сайт k2kapital.com. Первой группе они ввели орексин-А, а второй группе — плацебо из физраствора.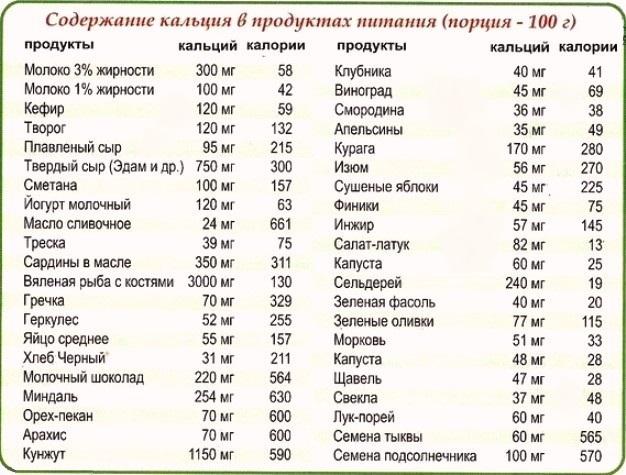 Затем ученые провели ряд стандартных когнитивных тестов. Те обезьяны, которые приняли орексин-А, выполнили все операции теста столь же успешно, как и выспавшиеся обезьяны, тогда как группа, принявшая физраствор, показала более слабые результаты.
Затем ученые провели ряд стандартных когнитивных тестов. Те обезьяны, которые приняли орексин-А, выполнили все операции теста столь же успешно, как и выспавшиеся обезьяны, тогда как группа, принявшая физраствор, показала более слабые результаты.
Результаты исследования, опубликованные в профильном Журнале Нейрологической Науки, также свидетельствуют о том, что орексин-А не только восстановил когнитивные способности обезьян. Мозг обезьян выглядел «проснувшимся» на снимках протонно-эмиссионного томографа.
По словам Сигела, уникальность орексина-А заключается в том, что фармакологический эффект лекарства оказывался только на обезьян, лишенных сна, никак не влияя на состояние бодрых животных. В связи с этим ученые считают, что этот нейрогормон действует «исключительно на обращение эффекта сонливости», не подвергая головной мозг другим воздействиям. Это свойство выгодно отличает это вещество от применяемых сейчас стимуляторов.
Такой продукт мог бы пользоваться колоссальным спросом во всем мире. Потребители могли бы обменять свои деньги на возможность не спать, одновременно сохраняя бодрость и не подвергая организм опасности. Широкое распространение и свободная продажа такого средства может иметь очень сильный социальный эффект, породив круглосуточное общество, способное обходиться без сна и сохранять работоспособность в течение всего времени суток.
Потребители могли бы обменять свои деньги на возможность не спать, одновременно сохраняя бодрость и не подвергая организм опасности. Широкое распространение и свободная продажа такого средства может иметь очень сильный социальный эффект, породив круглосуточное общество, способное обходиться без сна и сохранять работоспособность в течение всего времени суток.
Доктор Майкл Твери, директор Национального центра изучений нарушений сна, признал, что создание «таблетки для бодрости» представляет большой интерес, однако предупредил о возможных очень серьезных последствиях долгосрочного использования этого препарата, если не для центральной неровной системы, то для других систем организма. «Результаты последних исследований указывают на то, что недосыпание служит причиной повышение риска сердечно-сосудистых заболеваний и нарушения обмена веществ,» — сказал Твери.
Однако уже сейчас люди решают проблему нехватки времени для сна с помощью различных существующих и свободно продающихся стимуляторов. «Мы должны признать, что мы уже живем в обществе, где люди уже занимаются самолечением, принимая кофеин», — отметил Джером Сигел.
«Мы должны признать, что мы уже живем в обществе, где люди уже занимаются самолечением, принимая кофеин», — отметил Джером Сигел.
Он также отметил, что стимулятор модафинил (используется для лечения некоторых заболеваний, в том числе нарколепсии) применяется в таких препаратах как Provigil, Alertec, Modiodal, которые часто покупают здоровые люди для борьбы со сном вместо традиционной чашки кофе. «Имея эти и другие прецеденты, неясно, почему нельзя использовать орексин-А для временного избавления от сна», — сказал Сигел. «С другой стороны, надо быть идиотом, чтобы выступать за полную ликвидацию сна путем максимально продолжительного приема препарата».
Пока рано беспокоиться о том, что орексин-А появится в аптеках. В ближайшее время фармацевтические компании не смогут производить орексин-А в промышленных количествах, а его коммерческое применение и тем более свободная продажа займет не один год согласований, изучений и рассмотрений вопроса в регулирующих органах различных стран.
Тем не менее, рынок запрещенных препаратов, в том числе наркотических средств, существует и без одобрения регулирующих органов большинства стран, а некоторые страны, например Голландия, проводят более либеральную политику в отношении некоторых веществ, запрещенных в большинстве стран мира. На данный момент уже известно, что компании GlaxoSmithKline и Actelion работают над созданием снотворных лекарств на основе антогонистов рецепторов орексина, которые будут воздействовать на клетки мозга и вызывать обратный эффект, то есть сонливость. Не исключено, что в лабораториях фармацевтических компаний ведутся работы над созданием и препарата для бодрости.
Впрочем, очень маловероятно, что в ближайшие десятилетия орексин-А будет воспроизводиться в подпольных лабораториях в странах третьего мира для последующей нелегальной продажи в развитых странах, как это сейчас происходит, например, с героином. Синтезировать орексин-А достаточно сложно, тем более разработать экономичный способ массового производства препарата, поэтому можно почти с полной уверенностью сказать, что «таблетки для бодрости» из Таиланда или Колумбии не станут основой преступного бизнеса.
Какие продукты могут заменить снотворное?
Сон – важная часть человеческой жизни. Во сне человек проводит практически половину своей жизни, а некоторые и больше. Как сделать так, чтобы сон был по-настоящему здоровым и полноценным. Давай посмотрим, какие продукты помогут заменить снотворное.
За сон человека отвечает гормон мелатонин. У этого гормона есть противоположный гормон орексин, отвечающий за чувство голода и состояния бодрствования. Если будет нарушен баланс гормонов, нарушается полноценный и здоровый сон.
Мелатонин отвечает не только за здоровый сон, но и оказывает омолаживающее действие на весь организм, а также повышает иммунитет и устойчивость организма к образованию раковых опухолей.
Продукты для спокойного сна
Существует целый список продуктов, которые содержат мелатонин и триптофан (гормоны, которые отвечают за спокойный сон). Если у тебя проблемы со сном, лучше ешь натуральные продукты, а не синтетическими препаратами. Включай в вечернее меню следующие продукты:
Включай в вечернее меню следующие продукты:
Бананы – стимулируют выработку калия и магния. Эти вещества расслабляют мышцы и погружают в спокойный сон.
Черешня и вишня – натуральный источник мелатонина, который уравновешивает сон. Многие врачи советуют перед сном съедать несколько ягодок. Также эти ягоды помогают нормально заснуть в поезде и самолете.
Молоко – для многих людей теплое молоко с медом является чудодейственным снотворным. Кроме того, молоко прекрасно действует на психику человека, погружая его в воспоминания о детстве. Так что пей молоко и спи спокойно!
Мясо индейки, миндальные и кедровые орехи, цельнозерновой хлеб – это одни из самых полезных для сна продуктов, которые в большом количестве содержат триптофан. Перед сном полезно съедать горсть миндальных или кедровых орешков или сэндвич из цельнозерного хлеба с индейкой.
Чай из ромашки – оказывает успокаивающее действие на весь организм. Ромашка обладает снотворным эффектом, погружая человека в сон. При этом, тело и душа человека расслабляется и успокаивается.
Ромашка обладает снотворным эффектом, погружая человека в сон. При этом, тело и душа человека расслабляется и успокаивается.
Печеный картофель – впитывает кислоты, которые мешают вырабатывать триптофан. Лучшим эффектом будет совместить картофель и молоко. Так ты и поужинаешь плотно и уснешь спокойно.
Овсяная каша с медом – оказывает на организм успокаивающее действие, а также утоляет голод. Если по ночам тебя часто мучают кошмары, можно добавить в кашу пару ложек семян льна. В их составе содержатся омега-3 жирные кислоты, которые улучшают настроение и блокируют ночные кошмары.
Луковый суп – его использовали для борьбы с бессонницей еще в древнем Египте. Дело в том, что в луке содержится кверцетин – вещество, которое оказывает расслабляющее действие на весь организм.
Приведенные продукты расслабляют мышцы, успокаивают нервную систему и не отягощают желудок, что позволяет прекрасно заснуть.
Помни, что переедание на ночь, консервы, газировка, шоколад, кетчуп, острые и соленые блюда, а также всякие энергетики могут стать причиной бессонницы. Так что, ограничь употребление этих продуктов и будешь спать спокойно!
Так что, ограничь употребление этих продуктов и будешь спать спокойно!
10 продуктов, которые помогут уснуть
Иногда случается так, что мы долго не можем заснуть. Кто-то решает эту проблему, принимая успокоительные или снотворные лекарства, кто-то слушает медитативную музыку, но лишь немногие знают, что можно всего лишь съесть определенные продукты, которые помогут заснуть.
В некоторых продуктах содержатся вещества, которые снимают нервное напряжение, расслабляют мышцы и способствуют быстрому засыпанию и полноценному сну – это магний, серотонин, мелатонин, триптофан и другие.
Чтобы ваш сон был легким, а утро – бодрым, Вашему вниманию ТОП-10 продуктов, которые помогут уснуть.
Ромашковый чай
В ромашковом чае содержится большое количество натуральных седативных веществ. Это, прежде всего, апигенин, который позитивно влияет на центральную нервную систему человека, расслабляет и успокаивает нервы.
Ромашковый чай также поддерживает иммунную систему человека, снимает нервное напряжение, облегчает различного рода боли, способствует улучшению работы печени.
Успокаивающим и расслабляющим эффектом обладают многие травяные чаи, например: чай с жасмином, лавандой, чабрецом, мелиссой.
Мед
Мед благоприятно влияет на нервную систему, помогает снять напряжение и быстро заснуть. Натуральный пчелиный мед богат орексином – веществом, которое помогает избавиться от тревоги и быстро заснуть. Мед также легко усваивается нашим организмом благодаря содержанию глюкозы и фруктозы.
Мед содержит многие вещества, которые просто необходимы человеку для поддержания нормального функционирования его организма, – железо, кальций, медь, калий, магний, натрий, фосфор и другие.
Бананы
Бананы являются источником триптофана, который преобразуется в успокаивающее вещество меланин и «гормон счастья» – серотонин. Также в бананах содержится фосфор, который участвует в восстановлении нервной системы во время сна, и большое количество магния и калия, которые расслабляют мышцы и успокаивают нервы, что в свою очередь помогает быстрее заснуть.
Овсянка
Овсяная каша содержит в себе вещества, которые при постоянном употреблении успокаивающе воздействуют на нервную систему. В овсянке сочетаются углеводы и белки, способствующие вырабатыванию серотонина – «гормона счастья», который в свою очередь преобразуется в мелатонин, обладающий успокаивающим эффектом.
Это не только низкокалорийный продукт, богатый витаминами и микроэлементами, но и легкоусвояемый и сытный.
Морепродукты
Морепродукты содержат триптофан – аминокислоту, которая увеличивает количество природного седативного вещества – серотонина. К примеру, в лососе содержится вещества, необходимые для правильной работы нейромедиаторов, отвечающих за крепкий и здоровый сон.
Йод, который есть в морепродуктах и морской капусте, необходим для нормальной работы мозга и гормонального баланса. Употребление морепродуктов также сокращает риск сердечно-сосудистых заболеваний и помогает бороться с лишним весом. Морепродукты успокаивают нервную систему и повышают устойчивость к стрессам.
Вишневый сок
В вишне содержится больше мела тонина, чем в остальных продуктах натурального происхождения. Также уровень питательных веществ и антиоксидантов в вишневом соке гораздо выше, чем в других фруктовых соках. Вишневый сок обладает успокаивающим и противосудорожным действием, также полезен при низком уровне гемоглобина.
Молочные продукты
Большинство молочных продуктов содержат не только триптофан (который преобразуется в успокаивающее вещество меланин и «гормон счастья» серотонин), но и кальций – вещество, эффективное для стабилизации нервной системы при стрессе.
Молочные продукты успокаивают нервы, что в свою очередь помогает заснуть. Например, небольшая порция несладкого творога поможет быстрее заснуть, стакан теплого молока успокоит ваши нервы и вызовет легкую сонливость.
Орехи
Орехи содержат большое количество необходимых человеческому организму витаминов, минералов и микроэлементов.
Грецкие орехи помогают избавиться от последствий стресса и благоприятно влияют на работу сердечно-сосудистой системы. Миндаль содержит магний, который действует успокаивающе, расслабляет мышцы и улучшает сон.
Миндаль содержит магний, который действует успокаивающе, расслабляет мышцы и улучшает сон.
Мясо индейки
Мясо индейки считается самым богатым источником триптофана. В нём содержатся все необходимые человеку аминокислоты, железо, магний, фосфор, калий и разные витамины. Более того, мясо индейки низкокалорийное, но достаточно питательное.
Виноград
Виноград чрезвычайно полезен для нашего здоровья. Он содержит все необходимые для человеческого организма микро- и макроэлементы, минеральные соли, калий, а также мелатонин, который регулирует сон.
Самое главное, для того чтобы быстро и крепко уснуть, следует избегать перегрузки пищеварительной системы, а также отказаться от употребления перед сном алкоголя, кофе, жирной и острой пищи.
Врач лабораторной диагностики ЦДЛ
Новополоцкой городской больницы
Мясникова Н.М.
связь между питанием и энергичностью, часть 1. Записи блога
Орексин и висцеральное ожирение.

Исследователи из медицинского колледжа Пенн Стейт обнаружили, что причиной сонливости в течение дня является не недостаток ночного сна, а депрессия и лишний вес. Да, ожирение является основной причиной хронической сонливости. Именно понимание истинных причин дневной сонливости дает возможность утверждать, что эти симптомы характерны для 11-25 процентов населения Земли.
Новое исследование, проведенное при участии более 1300 человек, показало, что чем больший вес набирают люди, тем ярче выражается у них состояние сонливости в течение дня. Верно и обратное, чем быстрее люди сбрасывали избыточный вес, тем лучше становили показатели ночного сна — люди лучше высыпались, чувствовали прилив бодрости и в течение дня были более энергичными. Все исследования проводились в лаборатории сна, затем люди прошли медицинский осмотр и заполнили соответствующие анкеты о самочувствии. Исследования продолжались на протяжении семи с половиной лет. В промежутке между исследованиями с участниками проводились телефонные интервью, чтобы проверить состояние их здоровья в промежуточный период.
Также исследователи обнаружили, что нет жесткой связи между сонливостью, индексом массы тела и тем, сколько времени человек спал ночью. Другими словами, тучные люди чувствуют себя уставшими в течение всего дня, независимо от продолжительности ночного сна. По данным исследований можно утверждать, что сильная сонливость и повышенная утомляемость в течение дня вызвана жировыми клетками, особенно брюшным жиром, которые производят цитокины, соединения, способствующие дневной сонливости.
Люди, страдающие депрессией и нарушениями сна (много времени тратят на то чтобы заснуть или просыпаются по ночам), также имели повышенный риск расстройства нервной и гормональной системы, а также были подвержены сердечно-сосудистым заболеваниям. Это могло быть вызвано переизбытком гормонов стресса. «Результаты исследования надо иметь ввиду, при универсальном лечении чрезмерной дневной сонливости и при назначении дозы снотворного», — говорит ведущий специалист исследования Хулио Мендоса, д. м.н., из центра исследований сна Колледжа медицины Пенн Стейт.
м.н., из центра исследований сна Колледжа медицины Пенн Стейт.
«Людям, которые страдают от избыточного веса и жалуются на дневную усталость и сонливость мы рекомендуем пройти тщательное исследование на предмет апноэ и других расстройств сна. Эти факторы могут присутствовать, а значит должны быть приняты во внимание», — рассказывает Фернандес Мендоса в интервью Yahoo Helth. Также, добавляет он, потеря веса при помощи диеты, физической активности и изменения поведенческих факторов (например, управление процессом приема пищи), «должно иметь наивысший приоритет для уменьшения массы тела и снижения дневной сонливости». Если вы полагаете, что ваша дневная сонливость вызвана депрессией, обязательно обратитесь к психологу или психиатру для постановки диагноза.
Это первый шаг в избавлении от проблемы, говорит Фернандес Мендоса. «Многим людям с жалобами на дневную сонливость и подавленное состояние может потребоваться специфическое лечение для коррекции проблем со сном. Цель может быть достигнута благодаря когнитивно-поведенческому лечению бессонницы», — добавляет он. «Также следует обсудить проблему дневной сонливости с вашим терапевтом. По крайней мере, терапевт должен знать о наличии расстройства сна и поможет вам оценить и устранить причину вашего расстройства», — говорит Фернандес Мендоса. В любом случае, не следует пускать проблему на самотек.
«Также следует обсудить проблему дневной сонливости с вашим терапевтом. По крайней мере, терапевт должен знать о наличии расстройства сна и поможет вам оценить и устранить причину вашего расстройства», — говорит Фернандес Мендоса. В любом случае, не следует пускать проблему на самотек.
Дневная сонливость — маркер инсулинорезистентности.
Выраженная сонливость днем, ожирение и инсулинорезистентность — частые «спутники» пациентов с синдромом обструктивного апноэ во сне. При этом, как свидетельствуют данные опубликованного в онлайн-версии журнала Thorax исследования, именно чрезмерная сонливость днем может быть маркером наличия у данных пациентов инсулинорезистентности, а значит — и сигналом для проведения более углубленного обследования. В данное исследование было включено 44 пациента с СОАС, у половины из которых имела место выраженная сонливость днем, отмечаемая как самими пациентами, так и зафиксированная объективными методами (тест MSLT). Инсулинорезистентность определяли по значению индекса НОМА; также у пациентов исследовали в динамике содержание в плазме крови триглицеридов, холестерина, кортизола, тиреотропного гормона, соматотропина и инсулиноподобного фактора роста I (IGF-I). Независимо от возраста и массы тела у пациентов с выраженной дневной сонливостью по сравнению с больными без таковой были выявлены достоверно более высокие плазменные концентрации глюкозы (p<0 br=»» p=»»>
Независимо от возраста и массы тела у пациентов с выраженной дневной сонливостью по сравнению с больными без таковой были выявлены достоверно более высокие плазменные концентрации глюкозы (p<0 br=»» p=»»>
Остеопороз и орексин.
Орексин и лептин влияют на ремоделирование костей. Как удалось выяснить команде ученых из университета Техасского юго-западного медицинского центра (UT Southwestern Medical Center), орексины, белковые нейромедиатры, которые провоцируют приступы дневной сонливости, также играют важную роль в формировании костей. Это значит, что полученные данные могут позволить разработать новые методы лечения остеопороза.
Орексины или гипокретины представляют собой особый вид протеина, который используется нервными клетками для связи с друг другом. Команда исследователей из Техаса, сотрудничая со своими коллегами в Японии, пришли к выводу, что, вследствие нехватки остеобластов, клеток, формирующих костную ткань у мышей с недостаточным количеством орексинов более тонкие и хрупкие кости, которые легко ломаются.
Поражая в первую очередь пожилых людей и женщин, остеопороз является чрезвычайно распространенной болезнью, которая нарушает костеобразование, и ежегодно становиться более 1,5 млн. переломов и смерти 40 тыс. людей. Более того оно негативно сказывается на работоспособности, психическом здоровье и качестве жизни в целом.
Как оказалось, орексины играют двойную роль: они как способствуют образованию костной ткани, так и препятствуют ему. Непосредственно в самом скелете они взаимодействуют с другим белком, орексиновым рецептором OX1R, который снижает уровень грелина, гормона отвечающего за чувство голода. Этот процесс замедляет производство новых остеобластов и, следовательно, препятствует формированию костных клеток. В то же время, в головном мозге орексины взаимодействуют с рецептором OX2R, что приводит к уменьшению уровней лептина, гормона, который способствуют разрушению костной ткани, что в итоге, является положительном фактором.
Таким образом, профилактика и лечение остеопороза может быть достигнуты путем подавления активности OX1R или путем стимулирования OX2R. Нейропептидам удается регулировать формирование кости с помощью двух различных рецепторов, расположенных в двух разных тканях».
Нейропептидам удается регулировать формирование кости с помощью двух различных рецепторов, расположенных в двух разных тканях».
Активность OX2R в гипоталамусе оказалось доминантой. Поэтому, когда группа исследователей протестировала мышей, которые нуждались в обоих рецепторах, у них были очень хрупкие кости и не наблюдалось никакого роста. Подобным образом, когда они изучили мышей с высокими уровнями орексинов, их остеобласты находились в избытке и происходило активное костеобразование.
Орексинов: понимание их роли во сне
Заявление об отказе от ответственности: содержимое этой страницы не следует воспринимать как медицинский совет или использовать как рекомендацию для каких-либо конкретных лекарств. Всегда консультируйтесь с врачом перед приемом любого нового лекарства или изменением текущей дозировки.
Нервные клетки в организме, также называемые нейронами, общаются друг с другом через химические посредники, называемые нейротрансмиттерами. Нейротрансмиттеры контролируют практически все, что мы делаем, влияя на наши мысли и чувства и координируя наши действия.Один тип нейротрансмиттера называется нейропептидом.
Нейротрансмиттеры контролируют практически все, что мы делаем, влияя на наши мысли и чувства и координируя наши действия.Один тип нейротрансмиттера называется нейропептидом.
Орексины — это нейропептиды, вырабатываемые в части мозга, называемой гипоталамусом. Из миллиардов клеток головного мозга всего от 10 000 до 20 000 клеток вырабатывают орексин. Эти клетки производят два типа орексинов, называемых орексин-A и орексин-B.
Эти нейропептиды были открыты двумя группами примерно в одно время, поэтому в научном сообществе у них есть два взаимозаменяемых названия. Одна группа выбрала название орексин, происходящее от греческого «orexis», что означает аппетит.Другая группа назвала эти нейропептиды гипокретинами, потому что они были обнаружены в гипоталамусе. Таким образом, орексин-A и орексин-B часто называют гипокретином-1 и гипокретином-2.
Орексины в организме
Нейроны, производящие орексин, получают сигналы от тела, эмоций и окружающей среды, а затем выделяют орексины, которые влияют на всю центральную нервную систему. На самом деле, орексины, по-видимому, играют в организме такие разнообразные роли, что исследователи утверждают, что мы только начинаем понимать их важность.
На самом деле, орексины, по-видимому, играют в организме такие разнообразные роли, что исследователи утверждают, что мы только начинаем понимать их важность.
Считается, что орексины в первую очередь возбуждающие, что означает, что они заставляют другие нейроны становиться активными и начинают посылать свои собственные сигналы. Среди множества обнаруженных функций орексинов они, по-видимому, играют важную роль в сне, энергетическом обмене и настроении.
Недавнее исследование предложило гипотезу, которая пытается объяснить все, казалось бы, разнообразные роли орексинов в организме. Эта гипотеза предполагает, что орексины регулируют поведение во время физиологической потребности, воздействия угроз и возможностей для вознаграждения.
Понимание многих эффектов орексинов в организме очень интересно и ценно. Исследования в этой области расширяют наше понимание человеческого тела. Он также предлагает новые многообещающие способы лечения множества заболеваний, включая бессонницу, нарколепсию, депрессию и даже ожирение.
Сон и возбуждение
Предполагается, что основная роль орексинов — контролировать сон и возбуждение, а нейроны, выделяющие орексины, наиболее активны в течение дня. Чтобы не дать нам уснуть, эти нейропептиды стимулируют другие нейроны высвобождать нейротрансмиттеры, которые повышают бдительность, такие как дофамин, серотонин и норадреналин.
Без достаточного количества орексинов организму трудно бодрствовать и бодрствовать. У людей с диагнозом нарколепсия 1 типа наблюдается снижение количества нейронов, вырабатывающих орексины, на 85-95%. Эта потеря нейронов, продуцирующих орексин, приводит к симптомам нарколепсии, включая чрезмерную дневную сонливость, паралич сна, галлюцинации и катаплексию.
Хотя увеличение веса не является симптомом нарколепсии, люди с этим заболеванием чаще страдают избыточным весом. Исследования показывают, что связь между нарколепсией и увеличением веса может быть связана с ролью орексина в регуляции физической активности.
Стресс, физическая активность и ожирение
Орексины играют важную роль в реакции организма на стресс. Принимая сигналы из окружающей среды, нейроны, производящие орексин, реагируют на давление, возбуждая другие нейроны, которые увеличивают частоту сердечных сокращений и кровяное давление, помогая организму перейти из состояния покоя в состояние, когда оно готово реагировать и двигаться.
Принимая сигналы из окружающей среды, нейроны, производящие орексин, реагируют на давление, возбуждая другие нейроны, которые увеличивают частоту сердечных сокращений и кровяное давление, помогая организму перейти из состояния покоя в состояние, когда оно готово реагировать и двигаться.
При меньшем количестве химических сигналов для мотивации реакции недостаток орексинов связан с гиподинамией и ожирением.Исследования на животных показали, что мыши, которые теряют свои нейроны, вырабатывающие орексин, менее физически активны, имеют пониженный энергетический метаболизм и с большей вероятностью разовьются ожирение и диабет, даже когда они потребляют меньше калорий.
Настроение и память
Орексины также возбуждают нейроны, важные для регулирования настроения. Слишком высокая или слишком низкая активность орексина связана с депрессией и другими психическими заболеваниями, такими как тревожность, паническое расстройство, зависимости и посттравматическое стрессовое расстройство.
Эти нейропептиды также влияют на настроение благодаря своей функции в части мозга, называемой гиппокампом. Орексины стимулируют создание новых нейронов в гиппокампе, что важно для обучения, памяти и пространственных способностей. Без достаточного количества орексинов у людей могут развиться проблемы с обучением и памятью.
Снотворные препараты, нацеленные на орексины
Так как орексины стимулируют бодрствование, блокирование действия этих нейропептидов является одним из способов лечения некоторых нарушений сна.Двойные антагонисты рецепторов орексина (DORA) — это новый тип рецептурных снотворных, которые нацелены на систему орексина в организме. Эти лекарства действуют как антагонисты рецепторов орексина, что означает, что они блокируют действие орексинов в организме, уменьшают стремление бодрствовать и облегчают сон.
Два типа DORA в настоящее время одобрены Управлением по контролю за продуктами и лекарствами (FDA) для лечения бессонницы у взрослых: суворексант и лемборексант. Новые DORA все еще находятся в разработке.
Новые DORA все еще находятся в разработке.
DORA отличаются от других типов снотворных, поскольку влияют на разные системы организма. Безрецептурные снотворные, такие как дифенгидрамин и мелатонин, вызывают седативный эффект или помогают регулировать циркадный ритм организма. Снотворные средства, отпускаемые по рецепту, способствуют засыпанию другими способами, например, воздействуют на рецепторы ГАМК в головном мозге, и могут иметь нежелательные побочные эффекты, такие как проблемы с памятью, изменения поведения и даже галлюцинации.
Исследователи надеются, что, воздействуя на орексиновую систему организма, DORA может быть эффективным с меньшим количеством побочных эффектов.Фактически, оба DORA, одобренные FDA, улучшают качество сна у людей с бессонницей, и наиболее частым побочным эффектом, связанным с их использованием, является сонливость. Они также могут улучшить архитектуру сна и использовались для улучшения делирия у госпитализированных пациентов.
Хотя DORA предлагают новый многообещающий подход к лечению бессонницы, они подходят не всем.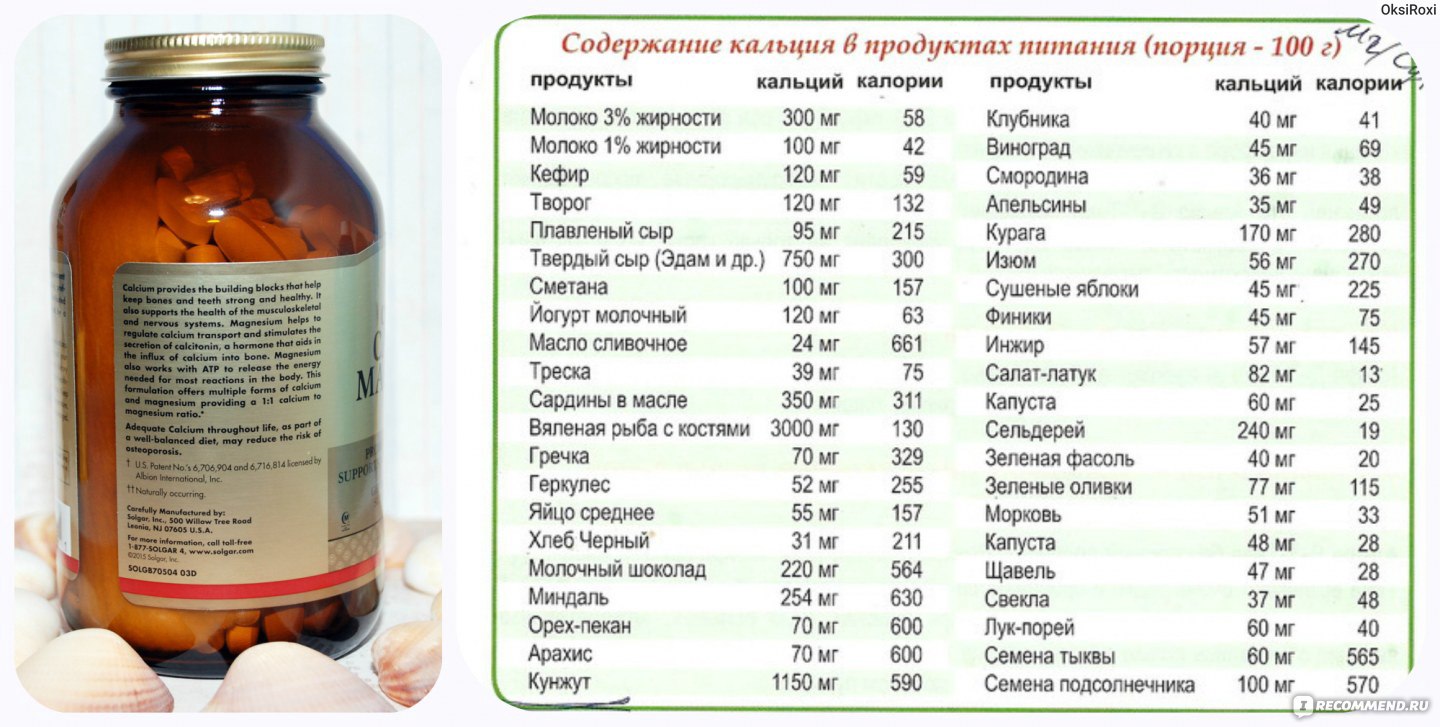 Прежде чем принимать какие-либо лекарства, обязательно проконсультируйтесь с врачом или специалистом по сну. Для многих людей, страдающих бессонницей и другими проблемами со сном, полезно сначала сосредоточиться на изменениях поведения, например на улучшении гигиены сна, прежде чем принимать лекарства.
Прежде чем принимать какие-либо лекарства, обязательно проконсультируйтесь с врачом или специалистом по сну. Для многих людей, страдающих бессонницей и другими проблемами со сном, полезно сначала сосредоточиться на изменениях поведения, например на улучшении гигиены сна, прежде чем принимать лекарства.
Ссылки
+14 источников- 1. Бурбах Дж. П. (2011). Что такое нейропептиды ?. Методы молекулярной биологии (Клифтон, Нью-Джерси), 789, 1–36. Https://doi.org/10.1007/978-1-61779-310-3_1
- 2. Блащик Ю. В. (2020). Снижение энергетического метаболизма при старении мозга — патогенез нейродегенеративных заболеваний. Метаболиты, 10 (11), 450. https://doi.org/10.3390/metabo10110450
- 3. Гудрик, С.(2015). Орексин или гипокретин ?. Ланцет. Неврология, 14 (3), 249. https://doi.org/10.1016/S1474-4422 (15) 70032-3
- 4. Сакураи, Т., Амемия, А., Исии, М., Мацузаки, И., Чемелли, Р.М., Танака, Х.
 , Уильямс, С.К., Ричардсон, Дж. А., Козловски, Г.П., Уилсон, С., Арч, Дж. Р., Бэкингем, Р. Э., Хейнс, А. К., Карр, С. А., Аннан, Р. С., Макналти, Д. Д., Лю, В. С., Террет, Дж. А., Эльшурбади, Н. А., Бергсма, Д. Д.,… Янагисава, М. (1998). Орексины и рецепторы орексина: семейство гипоталамических нейропептидов и рецепторов, связанных с G-белком, которые регулируют пищевое поведение.Ячейка, 92 (4), 573–585. Https://doi.org/10.1016/s0092-8674 (00) 80949-6
, Уильямс, С.К., Ричардсон, Дж. А., Козловски, Г.П., Уилсон, С., Арч, Дж. Р., Бэкингем, Р. Э., Хейнс, А. К., Карр, С. А., Аннан, Р. С., Макналти, Д. Д., Лю, В. С., Террет, Дж. А., Эльшурбади, Н. А., Бергсма, Д. Д.,… Янагисава, М. (1998). Орексины и рецепторы орексина: семейство гипоталамических нейропептидов и рецепторов, связанных с G-белком, которые регулируют пищевое поведение.Ячейка, 92 (4), 573–585. Https://doi.org/10.1016/s0092-8674 (00) 80949-6 - 5. de Lecea, L., Kilduff, TS, Peyron, C., Gao, X., Foye, PE, Danielson, PE, Fukuhara, C., Battenberg, EL, Gautvik, VT, Bartlett, FS, 2nd , Франкель, В. Н., ван ден Поль, А. Н., Блум, Ф. Е., Гаутвик, К. М., и Сатклифф, Дж. Г. (1998). Гипокретины: специфические для гипоталамуса пептиды с нейровозбуждающей активностью. Слушания Национальной академии наук Соединенных Штатов Америки, 95 (1), 322–327.https://doi.org/10.1073/pnas.95.1.322
- 6. Чиффи, С., Каротенуто, М., Монда, В., Валенцано, А., Виллано, И.
 , Преценцано, Ф., Тафури, Д., Салерно, М., Филиппи, Н., Нуччо , Ф., Руберто, М., Де Лука, В., Чиполлони, Л., Чибелли, Г., Моллика, М. П., Яконо, Д., Нигро, Э., Монда, М., Мессина, Г., & Мессина, А. (2017). Система орексинов: ключ к здоровой жизни. Границы физиологии, 8, 357. https://doi.org/10.3389/fphys.2017.00357
, Преценцано, Ф., Тафури, Д., Салерно, М., Филиппи, Н., Нуччо , Ф., Руберто, М., Де Лука, В., Чиполлони, Л., Чибелли, Г., Моллика, М. П., Яконо, Д., Нигро, Э., Монда, М., Мессина, Г., & Мессина, А. (2017). Система орексинов: ключ к здоровой жизни. Границы физиологии, 8, 357. https://doi.org/10.3389/fphys.2017.00357 - 7. Mahler, S.В., Мурман Д. Э., Смит Р. Дж., Джеймс М. Х. и Астон-Джонс Г. (2014). Мотивационная активация: объединяющая гипотеза о функции орексина / гипокретина. Природа нейробиологии, 17 (10), 1298–1303. https://doi.org/10.1038/nn.3810
- 8. Thannickal, T. C., Moore, R. Y., Nienhuis, R., Ramanathan, L., Gulyani, S., Aldrich, M., Cornford, M., & Siegel, J. M. (2000). Уменьшение количества нейронов гипокретина при нарколепсии человека. Нейрон, 27 (3), 469–474. https://doi.org/10.1016/s0896-6273(00)00058-1
- 9. Чабас, Д., Фулон, К., Гонсалес, Дж., Наср, М., Лион-Кан, О., Виллер, Дж. К., Деренн, Дж. П., и Арнульф, И. (2007).
 Расстройство пищевого поведения и обмена веществ у нарколептических больных. Сон, 30 (10), 1267–1273. Https://doi.org/10.1093/sleep/30.10.1267
Расстройство пищевого поведения и обмена веществ у нарколептических больных. Сон, 30 (10), 1267–1273. Https://doi.org/10.1093/sleep/30.10.1267 - 10. Граф, Л. А., и Бхатнагар, С. (2018). Орексины и стресс. Границы нейроэндокринологии, 51, 132–145. https://doi.org/10.1016/j.yfrne.2018.06.003
- 11. Цинк, А. Н., Перес-Лейтон, К. Э., и Котц, К.М. (2014). Система нейропептидов орексина: физическая активность и функция гипоталамуса на протяжении всего процесса старения. Границы системной нейробиологии, 8, 211. https://doi.org/10.3389/fnsys.2014.00211
- 12. Ноллет, М., и Леман, С. (2013). Роль орексина в патофизиологии депрессии: потенциал для фармакологического вмешательства. Препараты для ЦНС, 27 (6), 411–422. https://doi.org/10.1007/s40263-013-0064-z
- 13. Курияма А. и Табата Х. (2017).Суворексант для лечения первичной бессонницы: систематический обзор и метаанализ. Обзоры медицины сна, 35, 1–7. https://doi.org/10.1016/j.
 smrv.2016.09.004
smrv.2016.09.004 - 14. Скотт Л. Дж. (2020). Лемборексант: первое одобрение. Наркотики, 80 (4), 425–432. Https://doi.org/10.1007/s40265-020-01276-1
12 природных факторов, которые могут повысить уровень орексина и бодрствования
Орексин, также называемый гипокретином, — это нейромедиатор, регулирующий возбуждение, бодрствование и аппетит.Ученые подозревают, что нарколепсия вызвана нехваткой орексина в мозгу из-за разрушения клеток, которые его производят. Читайте дальше, чтобы узнать об этом нейротрансмиттере и факторах, которые могут его естественным образом увеличить.
Что такое орексин и почему он важен?Определение
В головном мозге содержится от 10 000 до 20 000 нейронов в гипоталамусе, но аксоны этих нейронов проходят по всему головному и спинному мозгу, где также есть рецепторы для орексина.
Наука предполагает, что нейроны орексина / гипокретина головного мозга стимулируют бодрствование , настороженность , прием пищи, поиск награды и здоровый баланс глюкозы [1].
Орексин — это не просто молекула в нашем организме. Некоторые ученые говорят, что всякий раз, когда мы устаем или утомлены, орексин подавляется [2].
Орексин — это не одна из многих систем, стимулирующих бодрствование. Считается, что это самый важный стимулятор бодрствования.Гистамин также участвует, но орексин активирует гистаминовую систему [2].
Исследователи подозревают, что в организме есть много гормонов и других систем, которые взаимодействуют с орексином.
Таким образом, орексиновая система играет центральную роль в продуктивном функционировании человека и хорошем настроении. Однако роль орексина была открыта относительно недавно. Необходимы более масштабные исследования на людях, чтобы лучше понять его влияние на здоровье [2].
Нарколепсия Существует два основных типа нарколепсии: тип 1 и тип 2.Измерение уровня орексина помогает диагностировать нарколепсию 1 типа [3].
Для диагностики нарколепсии 1 типа врачам необходимо следующее:
- Гиперсомния (крайняя сонливость)
- Катаплексия (эпизоды мышечной слабости в ответ на эмоциональные стимулы) и / или
- Концентрация орексина (гипокретина-1) в спинномозговой жидкости 110 пг / мл или менее
Точная причина нарколепсии до сих пор неизвестна. Недоказанные экспериментальные теории предполагают, что нарколепсия может быть результатом иммунного дисбаланса, в частности, повышенной иммунной системы Th3 у некоторых людей.Другое исследование обнаружило повышенный уровень TNF и IL-6 [5, 6].
Beyond Wakefulness
Ограниченные исследования показывают, что орексин также увеличивает метаболизм и температуру тела. Согласно этой теории, люди, которые чувствуют холода и усталость, могут, среди прочего, иметь низкий уровень орексина [7].
Орексин, по-видимому, также усиливает чувство голода за счет увеличения экспрессии нейропептида Y в дугообразном ядре гипоталамуса [8].
Модели на животных показывают, что низкие уровни орексина вызывают ожирение, даже когда потребляется меньше калорий.Это не было подтверждено на людях [9].
Согласно одной из гипотез, орексин является важным фактором, объясняющим, почему потребление сахара делает людей толстыми. Они утверждают, что это происходит потому, что люди чувствуют усталость после употребления сахара, поскольку он вызывает скачок уровня сахара в крови и падение орексина. Итак, вместо того, чтобы сжигать калории, люди ложатся спать. Хотя эта гипотеза правдоподобна, ее еще предстоит проверить [9].
Другая группа исследователей утверждала, что более высокий уровень орексина-А делает людей счастливее.Тем не менее, у них до сих пор нет надежных данных, поскольку эта теория в основном основана на том факте, что частота депрессии выше при нарколепсии.
Еще одно направление исследований показало, что орексин и его рецепторы могут уменьшаться с возрастом. Кроме того, орексин может привести к увеличению потребления кислорода людьми, потому что он может увеличить метаболизм. Будущие исследования еще не прояснили и не подтвердили все эти результаты [9, 10].
Будущие исследования еще не прояснили и не подтвердили все эти результаты [9, 10].
Когда обращаться к врачу
Если ваша цель — повысить уровень орексина, чтобы уменьшить вашу усталость или проблемы, связанные с крайним истощением, включая хроническую усталость или депрессию, важно поговорить с Ваш врач, особенно низкий уровень энергии значительно влияет на вашу повседневную жизнь.
Ваш врач должен диагностировать и лечить любые основные состояния, вызывающие ваши симптомы.
Меры предосторожности и ограничения
Помните, что существующие данные не предполагают, что низкий уровень орексина вызывает усталость или расстройства настроения.
Также нет точного способа измерения уровня орексина вне научных исследований и диагностики нарколепсии 1 типа. При нарколепсии медицинский работник должен взять у человека спинномозговую жидкость, что является инвазивной процедурой, предназначенной только для определенных случаев.
Сложные расстройства, такие как синдром хронической усталости, всегда связаны с множеством возможных факторов, включая химию мозга, окружающую среду, состояние здоровья и генетику, которые могут варьироваться от человека к человеку.
Кроме того, изменения в тонусе нервов и химии мозга люди не могут изменить самостоятельно с помощью перечисленных здесь подходов. Вместо этого факторы, упомянутые в этой статье, предназначены для повышения уровня энергии и поддержки общего психического здоровья и благополучия.Большинство из них подтверждено лишь ограниченными исследованиями на людях или животных.
Следовательно, , , вы можете попробовать стратегии, перечисленные ниже, если вы и ваш врач определите, что они могут быть подходящими . Прочтите предлагаемые нами подходы и обсудите их со своим врачом, прежде чем опробовать их. Это особенно важно, если вы планируете принимать какие-либо пищевые добавки.
Добавки не были одобрены FDA для медицинского использования и, как правило, не имеют достоверных клинических исследований. Правила устанавливают для них производственные стандарты, но не гарантируют их безопасность или эффективность.
Правила устанавливают для них производственные стандарты, но не гарантируют их безопасность или эффективность.
Наконец, имейте в виду, что ни одна из этих стратегий никогда не должна применяться вместо того, что рекомендует или предписывает ваш врач.
1) Устранение хронического воспаленияИсследования показывают связь между орексином и хроническим воспалением. Согласно последним научным данным, стойкое воспаление слабой степени также тесно связано с усталостью и низкой энергией клеток [11, 12].
Предполагается, что усиленное воспаление из-за цитокинов, таких как IL-1b и TNF, вызывает утомляемость из-за подавления нейронов орексина [13, 14, 15, 16].
Непосредственно перед началом нормального сна у крыс уровни TNF в ткани мозга были в 10 раз выше их дневного минимума. Однако это не было подтверждено на людях [17].
Если вы страдаете хроническим воспалением, обратитесь к врачу, чтобы решить основную проблему, вызывающую ваши симптомы.
Регулярные умеренные упражнения полезны для общего состояния здоровья.По опыту мы знаем, что это дает нам энергию, и некоторые ученые считают, что орексин может быть одной из причин.
Ограниченные исследования на людях подтверждают эту теорию: упражнения повышают уровень орексина в кровотоке человека [18].
Кроме того, физические упражнения, по-видимому, увеличивают содержание орексина в спинномозговой жидкости крыс, собак и кошек [18].
Исследователи полагают, что источник орексина может напрямую выделяться гипофизом в кровоток, вытекать из спинномозговой жидкости или вырабатываться кишечником или поджелудочной железой.Требуются дополнительные исследования [18].
Упражнения временно подкисляют нашу кровь (увеличивает лактат), что, как предполагается, увеличивает активность нейронов орексина [19].
Интересно, что орексин А может преодолевать гематоэнцефалический барьер. Теоретически, если он повышен в крови после упражнений, он также может быть повышен в мозге [20].
Яркий свет (например, от солнца) увеличивает содержание орексина, и исследования на животных показывают, что это вероятный механизм, с помощью которого он эффективен при депрессии и сезонном аффективном расстройстве (САР).Однако надлежащих данных о людях для подтверждения этого механизма все еще не хватает [21].
4) Ферментированные продуктыРаньше мы говорили о лактате как «резервном генераторе».
Лактат является важным источником энергии и вероятным регулятором системы орексинов. Ученые считают, что высвобождение лактата из астроцитов играет важную роль в балансировании активности мозга и энергоснабжения [22].
Согласно одной теории, снабжение нейронов орексина лактатом может помешать глюкозе блокировать нейроны орексина.Лактат может подавлять и повышать чувствительность этих нейронов орексина для будущего возбуждения. Однако это не было доказано на людях [1, 22].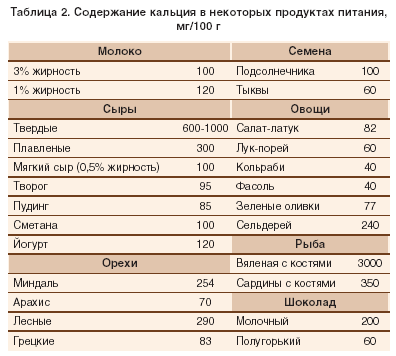
Одно исследование выдвинуло гипотезу, что нейроны орексина «видят» изменения глюкозы только тогда, когда уровни других энергетических молекул низкие, тогда как высокие уровни энергии могут мешать глюкозе регулировать клетки орексина [1].
Вот некоторые ферментированные продукты, которые, вероятно, содержат лактат:
- Комбуча
- Квашеная капуста
- Соленья
Чайный гриб содержит лактат, пируват, бутират, АТФ.Исследования изучают, есть ли в нем другие «связанные с энергией молекулы» в результате процесса ферментации. Как ни странно, многие люди говорят, что этот ферментированный восточный напиток освежает и заряжает их энергией [1].
Кроме того, некоторые пробиотики, такие как лактобациллы, производят лактат.
С другой стороны, различные минералы могут быть превращены в лактатные соли, такие как лактат кальция и лактат магния.
5) Белок Ежедневно получать достаточное количество здоровой белковой пищи — это хорошая идея. Предполагается, что различные аминокислоты влияют на передачу сигналов орексина, но клинических исследований для определения их влияния нет.
Предполагается, что различные аминокислоты влияют на передачу сигналов орексина, но клинических исследований для определения их влияния нет.
Исследователи полагают, что аминокислоты возбуждают нейроны орексина с помощью нескольких механизмов, хотя это еще не подтверждено на людях [23].
В ходе исследования на животных мышей с поврежденным мозгом получили аминокислоты с разветвленной цепью (BCAA), которые являются предшественниками синтеза глутамата. BCAA восстановили активацию нейронов орексина и уменьшили дефицит бодрствования у мышей с легкой травмой головного мозга.Человеческие данные отсутствуют [24].
В лаборатории заменимые аминокислоты оказались более эффективными в активации клеток орексина, чем незаменимые аминокислоты [23].
Одна теория утверждает, что аминокислоты могут блокировать подавление глюкозой орексина, потому что они сообщают нейронам, что вокруг достаточно энергии [23].
В клетках ученые упорядочили их так — от наиболее до наименее эффективных:
- Глицин
- Аспартат
- Цистеин (NAC)
- Аланин
- Серин
- Аспарагин
- Пролин
- Глютамин [23]
Однако у нас нет возможности узнать, как каждый из них влияет на активность орексина в сложных существах. Это не исследовалось.
Это не исследовалось.
Теоретически повышенная концентрация глюкозы может блокировать или подавлять активность нейронов орексина [1].
У лабораторных животных основным способом активации орексина является ограничение глюкозы [25].
Гипотеза состоит в том, что в условиях низкого потребления энергии, таких как голодание, может быть выгодно, чтобы проглоченная глюкоза подавляла чистый расход энергии, связанный с орексином, тем самым обеспечивая получение достаточного количества глюкозы для более фундаментальных процессов (таких как поддержание жизни мозга).
И наоборот, когда в мозгу много топлива (возможно, на это указывает высокий уровень пирувата и / или лактата), может быть мало преимуществ в сочетании колебаний глюкозы с активностью орексина, поскольку в этих условиях резкие изменения уровня глюкозы могут быть компенсируется другими энергетическими молекулами [1].
Кроме того, ученые считают, что нейроны орексина стимулируются падением уровня глюкозы [25].
Гипотетически люди, которые едят меньше или практикуют некоторую степень ограничения калорийности, могут иметь более высокий орексин, потому что их организм чувствует, что они не получают достаточно калорий, что активирует эту систему.Однако необходимы точные человеческие данные [9].
7) Поддержание здорового весаНекоторые исследователи считают, что потеря лишнего веса может помочь увеличить уровень орексина и энергии.
Это основано на теории, что лептин ингибирует орексин. Высокий уровень лептина характерен для избыточного веса, тогда как уровень лептина имеет тенденцию к снижению в результате потери веса [26].
Однако многие другие факторы также влияют на уровень и вес лептина, и точная роль орексина еще предстоит определить.
8) Волокно GLP-1 — это гормон кишечника, который может активировать / возбуждать нейроны орексина в гипоталамусе (что увеличивает количество орексина). Ученые считают, что это может быть полезно для того, чтобы мы чувствовали себя сытыми, что может заставить нас меньше есть и дополнительно активировать орексин.
Возможно, что GLP-1 действует как орексин и иногда работает вместо него, хотя это не было подтверждено на людях [27].
Резистентный крахмал может повышать уровень GLP-1, а также производить бутират.Еще он кислый. Гипотетически это может блокировать индуцированное глюкозой подавление орексина [28, 29, 1].
Как ни странно, люди говорят, что продукты или напитки с высоким содержанием бутирата (например, чайный гриб) повышают уровень энергии после обильной еды.
9) РазвлечениеИсследование, проведенное на собаках, показало, что веселье или игра способно повысить уровень орексина, в то время как тот же уровень физических упражнений не смог [30].
Исследование пришло к выводу, что двигательных и сердечно-сосудистых изменений может быть недостаточно для повышения уровня орексина, поэтому они выдвинули гипотезу, что эмоциональные аспекты дворовой игры объясняют наблюдаемое повышение уровня орексина [30].
Исследования еще не измерили влияние развлекательных мероприятий на орексин у людей.
Стимуляция блуждающего нерва, по данным ограниченных исследований, уменьшала дневной сон и быстрое движение глаз у пациентов с эпилепсией и черепно-мозговой травмой. Необходимы дополнительные клинические испытания, и до сих пор неизвестно, влияет ли стимуляция блуждающего нерва на передачу сигналов орексина [31].
У крыс, находящихся в коме после черепно-мозговой травмы, стимуляция блуждающего нерва способствовала восстановлению сознания [31].
Считалось, что эффекты отчасти опосредованы увеличением содержания орексина-А и его рецептора (OXR1) в префронтальной коре [31].
11) Зеленый чайБыло обнаружено, что кофеин активирует орексин, что неудивительно, учитывая, что это самый широко потребляемый стимулятор во всем мире. Он содержится как в кофе, так и в зеленом и черном чае, но в зеленом чае больше всего антиоксидантов из трех [32, 33].
12) Омега-3 Исследование показало, что у здоровых людей существует корреляция между омега-3 и орексином А (но не у нарколептиков) [34].
Следующие факторы являются теоретическими или анекдотическими. Они не подкреплены твердой наукой, а некоторые вообще не связаны с благополучием.
Например, мы не рекомендуем дыхание мешком и высокое потребление фруктозы, но думаем, что их интересно упомянуть в информационных целях.
Мы также настоятельно не рекомендуем использовать никотин по любым показаниям, кроме отказа от курения.Никотин вызывает сильную зависимость, и его вред перевешивает любые преимущества.
Кето-диеты и воздействие холода не вредны, если вы получили зеленый свет от вашего поставщика медицинских услуг.
Сумка для дыхания / CO
2CO 2 увеличивается после употребления углеводов. Если оставить в стороне профиль макронутриентов, CO 2 увеличивается после вдыхания в мешок [35].
Фруктоза
Исследования на животных показывают, что длительное употребление фруктозы (переедание) увеличивает орексин [36].
Кроме того, 25% потребляемой фруктозы превращается в лактат, который, как предполагается, обладает эффектом увеличения орексина [37].
Фруктоза, фруктаны и FOS могут также возбуждать нейроны орексина за счет увеличения GLP-1, тем самым потенциально увеличивая бодрствование [38, 39].
Сырой мед содержит фруктозу. Однако чрезмерное потребление фруктозы вредно для здоровья.
Воздействие холода
У крыс 30-минутное воздействие холода увеличивало экспрессию орексина [40].
Хотя влияние холодного душа на активность орексинов и состояние бодрствования не изучалось, многие люди выступают за этот традиционный метод охлаждения.
Однако, чтобы привыкнуть к полностью холодному душу, обычно требуется время. Некоторые говорят, что для начала хорошо окунуть лицо в холодную воду.
Однако не забудьте сначала проконсультироваться со своим врачом. Большинство врачей не рекомендуют принимать холодный душ людям с сердечными заболеваниями или людям из группы риска.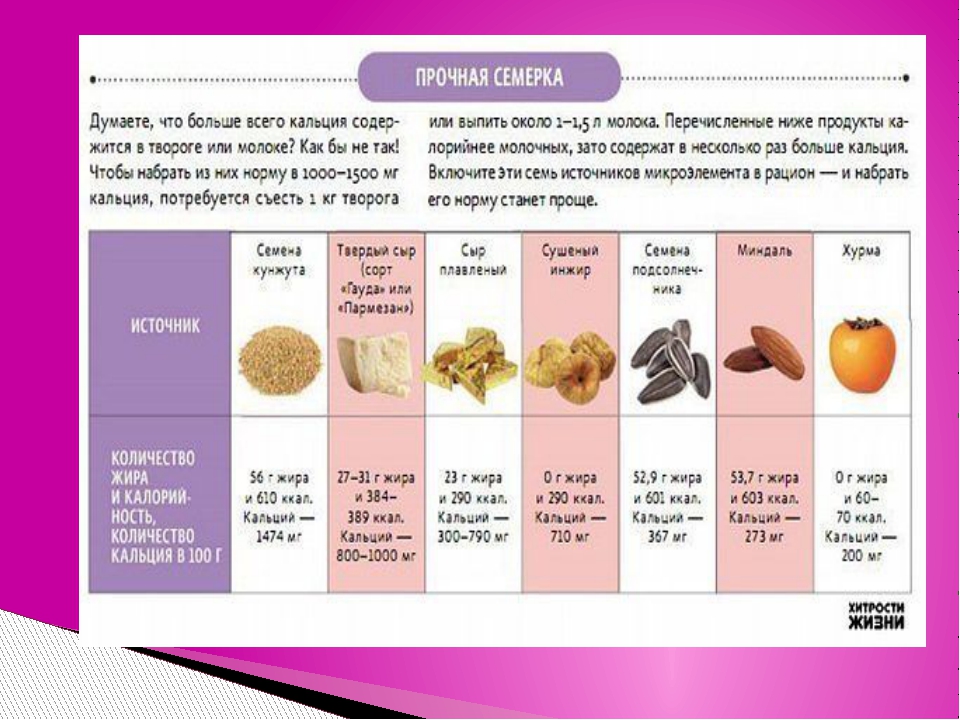 Это потому, что внезапное воздействие холода может сузить кровеносные сосуды, что может повысить частоту сердечных сокращений и кровяное давление.
Это потому, что внезапное воздействие холода может сузить кровеносные сосуды, что может повысить частоту сердечных сокращений и кровяное давление.
Keto Diet
Не было опубликовано никаких исследований, посвященных кетозу и орексину.
Тем не менее, некоторые люди утверждают, что кето-диета может стимулировать орексин, поскольку они субъективно чувствуют себя более бодрыми.
Сторонники кето говорят, что если они попадут в кетоз, уровень глюкозы, скорее всего, будет низким, что с большей вероятностью активирует орексин. Однако это не было доказано.
Во-вторых, защитники утверждают, что кетоны — это «энергетические молекулы», которые теоретически могут сигнализировать мозгу, что нет голода, который должен активировать орексин… теоретически. Считается, что это основная логика того, почему лактат якобы предотвращает подавление орексина.
В-третьих, кетоны кислые, поэтому люди говорят, что это также увеличивает количество орексина. Однако помните, что никакие человеческие данные не подтверждают их.
У животных кетоз увеличивает содержание грелина. Грелин активирует орексин [41]. Однако исследования на людях показывают, что кетоз не увеличивает уровень грелина [42].
Кетоз приводит к повышению у животных АТФ, который активирует орексин. Человеческие данные отсутствуют [43].
Форсколин
Хотя форсколин является популярным «стимулятором бодрствования», его влияние на сонливость и уровень орексина у людей не доказано.
Предполагается, что форсколин увеличивает циклический АМФ, в том числе в области, где находятся нейроны орексина. Теоретически это может активировать эти нейроны (долговременная потенциация) и увеличить бодрствование [44].
Орексин связывается с рецепторами орексина 1, чтобы стимулировать нейроны путем активации цАМФ [45].
Однако другое исследование не подтвердило этого [46].
Допамин
В ходе исследования изучалась способность агонистов дофамина активировать нейроны орексина у крыс.Исследование показало, что рецепторов D1 и D2 может быть достаточно для активации нейронов орексина [47].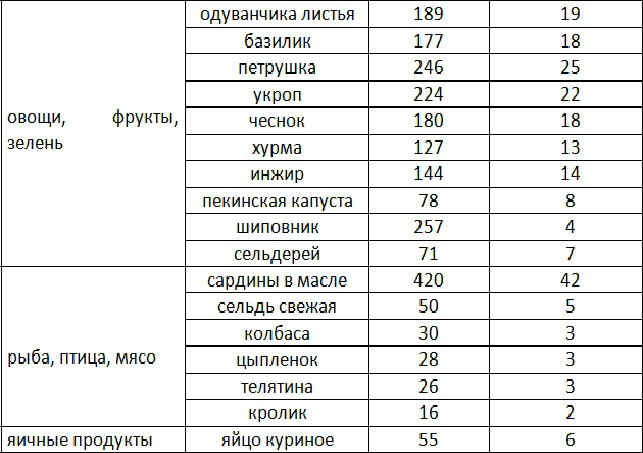
Однако, когда дофамин связывается с другими рецепторами, он может подавлять орексин (рецептор альфа-2). Итак, похоже, это зависит от рецепторов, и требуется гораздо больше исследований.
Мукуна, тирозин, родиола и SAM-e предположительно увеличивают дофамин, но их влияние на орексин неизвестно [48].
Исследовательские добавки
Эти данные не применимы к людям.
Никотин
Никотин вызывает привыкание, и его вред перевешивает любые преимущества.Единственным приемлемым показанием к его применению является терапия для прекращения курения.
Ученые считают, что никотин активирует нейроны орексина. Они исследуют, увеличивается ли он [53]:
- Орексин-A (в дорсомедиальном ядре гипоталамуса)
- Орексин B (в паравентрикулярном ядре)
- Рецепторы орексина [54, 55].
Никотин и орексин, похоже, возбуждают одни и те же синапсы пути возбуждения в префронтальной коре (таламокортикальной).Исследователи задаются вопросом, участвуют ли также пути орексина в зависимости [56].
Увеличение количества орексина кажется очень значительным в отношении никотиновой зависимости. Абстиненция вызывает повышение уровня орексина, побуждающего людей потреблять никотин [57, 58].
Галантамин
Галантамин — это лекарственное средство, которое изучалось для лечения болезни Альцгеймера. В США он доступен по рецепту врача.
Ученые утверждают, что он может увеличивать активность орексина косвенно, увеличивая рецептор или активируя никотиновые рецепторы, участвующие в орексине [никотиновый рецептор a4b2 — 59, 60].
Другие гормоны, нейротрансмиттеры и проводящие пути
В этом разделе обобщены научные данные о гормональных, клеточных и связанных с лекарствами факторах, которые могут повышать уровень орексина. Наша цель — обсудить результаты исследования.
Некоторые из перечисленных здесь веществ при ненадлежащем использовании могут нанести вред здоровью. Обязательно обсудите со своим врачом все ваши лекарства, добавки и результаты лабораторных исследований.
- Ацетилхолин [61] (может подавлять его одновременно с помощью другого механизма, но в основном, кажется, усиливает его)
- Норэпинефрин [62]
- Глутамат
- TRH [63]
- Эстрадиол и фитоэстроген [64, 65]
- DHEA [66]
- DHT [66]
- Грелин [41, 67]
- Окситоцин [68]
- Вазопрессин [68] — это гормон, который заставляет людей поглощать больше воды и уменьшать мочеиспускание.Животные проявляют повышенную активность при обезвоживании, поведение, которое повышает вероятность обнаружения новых источников воды. Когда мы испытываем жажду, мы бодрствуем, потому что высвобождается вазопрессин, который активирует орексин, и мы ищем воду [68].
- Нейротензин — это гормон, обнаруживаемый в основном в гипоталамусе, который регулирует пути лютеинизирующего гормона и дофамина. Он также снижает температуру тела и уровень боли, увеличивает нашу энергию (двигательную активность) и выполняет важные функции кишечника.

- CRH или гормон, высвобождающий кортикотропин, высвобождается гипоталамусом и активирует орексин. Он высвобождается в ответ на стресс. Некоторые ученые считают, что это может быть причиной того, что поначалу мы чувствуем себя более бодрыми при стрессе.
- CCK — это гормон кишечника, вызывающий тошноту, беспокойство и чувство насыщения. Тем не менее, это единственный гормон, идентифицированный, поэтому жир является активатором орексина, но также вызывает сон.
- Фолликулостимулирующий гормон — повышенный уровень рецептора орексина 1 в яичках [69]
- Кортизол (животный вариант) [70]
- Эндоморфин-2 [71]
- SIRT1 [72, 73, 74]
Многие нездоровые привычки могут нарушить энергетический баланс в организме.
Всегда полезно избегать нездорового поведения — например, недосыпания, курения, быстрого питания, переедания, сильного стресса и употребления слишком большого количества кофе или алкоголя — которые могут снизить уровень вашей энергии в долгосрочной перспективе. бегать и заставлять чувствовать себя измученным.
бегать и заставлять чувствовать себя измученным.
Старайтесь регулярно заниматься спортом, получать достаточно питательных веществ, спать и установить здоровый циркадный ритм.
Кроме того, ниже приведены некоторые факторы, которые могут ингибировать орексин у животных и клеток. Данные о человеке отсутствуют
Возможное снижение орексина- Голодание [75]
- TNF-альфа, IL-1 [76]
- Избыток глюкозы
- Алкоголь [77]
- LPS — вызывает потерю орексина нейроны от воспаления [78]
- Мелатонин [79]
- Лептин
- NPY — Хотя NPY стимулирует бодрствование, исследователи полагают, что он оказывает стимулирующее бодрствование и седативное действие, которое зависит от того, где он выделяется [80, 81]
- Пролактин [ 82]
- Опиоиды — могут подавлять активность нейронов орексина через мю-опиоидный рецептор [83]
- Аденозин (рецептор A1) [77]
- Серотонин (рецептор 5-HT1)
- Каннабиноиды — орексины могут играть роль в аддиктивных свойствах каннабиноидов (возможно, потому, что рецепторы CB1 усиливают рецепторы орексина 1, но необходимы дополнительные исследования) [84, 85, 86, 87]
- MSH [88]
- Хронический литий в высоких дозах
- Подщелачивание
- Noc iceptin
Некоторые исследования показывают, что орексин может играть роль в болезни Альцгеймера, увеличивая количество амилоидных бляшек. Было обнаружено, что механизм, с помощью которого пониженный уровень орексина уменьшает образование налета, связан с более длительным сном животных [89]. Ученые говорят, что это также подчеркивает важную роль сна для здоровья мозга, а не орексина как такового.
Было обнаружено, что механизм, с помощью которого пониженный уровень орексина уменьшает образование налета, связан с более длительным сном животных [89]. Ученые говорят, что это также подчеркивает важную роль сна для здоровья мозга, а не орексина как такового.
Слишком много орексина ночью может также привести к бессоннице, что неудивительно, поскольку орексин рассматривается как сигнал, способствующий пробуждению [90].
Орексин и зависимостьНедавняя наука предполагает, что многие из тех же систем в мозге, которые отвечают за голод, также ответственны за зависимость и стремление к удовольствиям.Орексин — одна из таких молекул, которая играет роль в обоих. Предполагается, что орексин играет роль в пищевой, наркотической и сексуальной зависимости [91].
В одном исследовании блокирование орексина снижает импульсивность, вызванную кокаином [92].
Слишком много орексина было связано с тревогой, паническими атаками и депрессией у животных [93].
Чтобы определить связь между орексином и зависимостью, необходимы исследования на людях.
Баланс орексинаСогласно одной экспериментальной гипотезе, слишком много или слишком мало орексина может вызвать эмоциональный дисбаланс.Это может означать, что важен баланс орексинов. Однако данные о людях все еще отсутствуют [94].
Система гипокретин / орексин
J R Soc Med. 2002 May; 95 (5): 227–230.
R S Howard
1 Отделение неврологии, отделение Lane Fox, больница Святого Томаса, Lambeth Palace Road, London SE1 7EH, UK
M K Sharief
1 Отделение неврологии, отделение Lane Fox, больница Святого Томаса, Ламбетский дворец Road, London SE1 7EH, UK
A J Williams
2 Центр расстройств сна, отделение Lane Fox, больница Святого Томаса, Ламбетский дворец Road, London SE1 7EH, UK
Отделение психиатрии, отделение Lane Fox, больница Святого Томаса, Ламбет Palace Road, London SE1 7EH, UK
1 Отделение неврологии, отделение Lane Fox, больница St Thomas ‘, Lambeth Palace Road, London SE1 7EH, UK
2 Центр расстройств сна, отделение Lane Fox, больница St Thomas ‘, Lambeth Palace Road, London SE1 7EH, UK
Copyright © 2002, Королевское медицинское общество. Эта статья цитировалась в других статьях в PMC.
Эта статья цитировалась в других статьях в PMC. Гипокретины (орексины) — недавно описанные нейропептиды гипоталамуса.
считается, что играет важную роль в регуляции сна и возбуждения
государства 1 . Их
Об открытии сообщили независимо две группы, использующие разные методы.
de Lecea et al.
al . 2 идентифицировано
прогормон пре-прогипокретин и его пептидные продукты гипокретин-1
(Hcrt-1) и гипокретин-2 (Hcrt-2) путем нуклеотидного секвенирования. Открытие
орексины, орексин-A (Orx-A) и орексин-B (Orx-B), почти
одновременно Сакураи и др.
al . 3 кто использовал
метод клонирования орфанных рецепторов. Термины орексин и гипокретин являются
синонимом, и в этой статье мы будем использовать гипокретин (Hcrt). Обнаружение, что
Уровни этих пептидов в спинномозговой жидкости (CSF) были аномальными у пациентов
с нарколепсией стимулировали исследования потенциальной роли этих
пептиды при заболеваниях человека. Мы представляем здесь обзор соответствующих
результаты исследований на животных и обзор опубликованных данных о людях. исследования, с особым акцентом на нарколепсию.Наконец, мы рассматриваем
возможные роли этих пептидов в неврологической и психиатрической
расстройства.
исследования, с особым акцентом на нарколепсию.Наконец, мы рассматриваем
возможные роли этих пептидов в неврологической и психиатрической
расстройства.
ИСТОРИЯ ВОПРОСА
Идентификация пептидов
В 1996 году был разработан набор нейропептидов, связанных с гормоном секретином. выделен из бокового гипоталамуса крысы с помощью процесса направленной метки ПЦР вычитание клонирование 4 . В клонирование гена этих пептидов от крысы и мыши, локализация тела клеток, продуцирующих пептиды, и описание некоторых из их эфферентных прогнозы были впервые представлены в 1977 5 , 6 .
Рецепторы
Рецепторы для этих нейропептидов (Hcrtr1 [Orxr1] и Hcrtr2 [Orxr2])
были идентифицированы как рецепторы, связанные с G-белком, и показаны у крыс
мозг, анализируя их мРНК, чтобы показать поразительный
Распределение 7 , 8 .
Рецептор Hcrtr1 имеет гораздо более высокое (от 100 до 1000 раз) сродство к Hcrt-1. чем для Hcrt-2. Рецептор Hcrtr2, по-видимому, имеет одинаковое сродство к обоим
нейропептиды. Отличительное распределение рецепторов привело к тому, что некоторые
авторы выдвинули гипотезу о специфической для сна роли рецептора Hcrtr1 и
более общая роль рецептора Hcrtr2.Рецепторы были нанесены на карту человека.
хромосома 1p33 и 6cen,
соответственно 5 , 7 , 8 , 9 .
чем для Hcrt-2. Рецептор Hcrtr2, по-видимому, имеет одинаковое сродство к обоим
нейропептиды. Отличительное распределение рецепторов привело к тому, что некоторые
авторы выдвинули гипотезу о специфической для сна роли рецептора Hcrtr1 и
более общая роль рецептора Hcrtr2.Рецепторы были нанесены на карту человека.
хромосома 1p33 и 6cen,
соответственно 5 , 7 , 8 , 9 .
Проекции гипокретиновой системы
Тела клеток, продуцирующих гипокретин, специфичны для гипоталамуса и
имеют широко распространенные анатомические проекции в центральной нервной системе
крыса с наиболее плотной внегипоталамической проекцией на норадренергический
locus coeruleus (LC) и меньшие выступы на базальные ганглии, таламический
области, ретикулярная формация мозгового вещества и ядро одиночной
тракт.Есть второстепенные выступы на корковые области, центральную и
переднее миндалевидное ядро и обонятельные
колба 4 , 10 , 11 . У людей локализация тел клеток, продуцирующих гипокретин, ограничена.
к дорсо-латеральному гипоталамусу с обширными плотными выростами на
голубое пятно (LC), ядра дорсального шва, миндалевидное тело, супрахиазматическое ядро,
базальный передний мозг, холинергический
ствол мозга 12 , 13 и спинной мозг () 14 .
У людей локализация тел клеток, продуцирующих гипокретин, ограничена.
к дорсо-латеральному гипоталамусу с обширными плотными выростами на
голубое пятно (LC), ядра дорсального шва, миндалевидное тело, супрахиазматическое ядро,
базальный передний мозг, холинергический
ствол мозга 12 , 13 и спинной мозг () 14 .
Проекции гипокретиновой (орексиновой) системы (А), холинергической нейроны, ретикулярная формация и спинной мозг; (B), в таламус и базальный ганглии; (C) к базальному переднему мозгу; (D), на миндалины и дофаминергические нейроны включая супрахиазматическое ядро; (E), к голубому пятну.
Нейрохимическое действие гипокретинов
Считается, что гипокретины действуют в первую очередь как возбуждающее средство.
нейротрансмиттеры 1 , 2 , 7 .Системное и внутрицеребровентрикулярное введение гипокретинов напрямую
стимулирует клетки норадренергической системы LC у крыс и обезьян,
предполагая роль гипокретинов в различных функциях центральной нервной системы
связанные с норадренергической иннервацией, включая бдительность, внимание,
обучение, и
память 15 . Их
действие на нейротрансмиссию серотонина, гистамина, ацетилхолина и дофамина
также считается возбуждающим и стимулирующим действием в отношении гамма-аминомасляной
кислота (ГАМК) и глутамат-опосредованная нейротрансмиссия
предлагается 16 , 17 .В частности, внутривенное введение Hcrt-1 крысам вызывает
дифференциальное высвобождение ГАМК и глутамата в гипокретин-плотной миндалине
по сравнению с мозжечком, предполагая, что модуляция этих
нейромедиаторы зависят от гипокретина
иннервация 18 .
Их
действие на нейротрансмиссию серотонина, гистамина, ацетилхолина и дофамина
также считается возбуждающим и стимулирующим действием в отношении гамма-аминомасляной
кислота (ГАМК) и глутамат-опосредованная нейротрансмиссия
предлагается 16 , 17 .В частности, внутривенное введение Hcrt-1 крысам вызывает
дифференциальное высвобождение ГАМК и глутамата в гипокретин-плотной миндалине
по сравнению с мозжечком, предполагая, что модуляция этих
нейромедиаторы зависят от гипокретина
иннервация 18 .
Функции гипокретина
Помимо их основной роли в контроле сна и
возбуждение 1 , 7 ,
гипокретины участвуют во многих функциях, включая кормление
и энергия
положение 3 , 16 , 19 , 20 , 21 ,
нейроэндокринный
положение 17 , 22 ,
желудочно-кишечный 23 и сердечно-сосудистые
система 24 управление,
регулирование водного баланса и модуляция
Боль 1 . Роль в
поведение также
постулированный 25 . В
клеточные тела, ответственные за синтез гипокретина, расположены в туберальном
часть гипоталамуса, так называемый центр питания. Наблюдение, что
Hcrt-1 увеличивает скорость метаболизма и доказывает, что индуцированный инсулином
гипогликемия активирует до одной трети гипокретинсодержащих
нейронов 21 привел
к предположению, что гипокретины являются посредниками энергии
метаболизм 26 . В
нейроэндокринные эффекты гипокретинов включают снижение плазменного
пролактин и гормон роста и повышение уровня кортикотропина
и кортизол, инсулин и лютеинизирующий
гормон 1 , 16 , 17 .Центральное введение гипокретинов увеличивает потребление воды,
стимулирует секрецию желудочного сока и улучшает работу кишечника
подвижность 1 , 23 .
Гипокретины повышают среднее артериальное давление и сердце.
скорость 7 .
Роль в
поведение также
постулированный 25 . В
клеточные тела, ответственные за синтез гипокретина, расположены в туберальном
часть гипоталамуса, так называемый центр питания. Наблюдение, что
Hcrt-1 увеличивает скорость метаболизма и доказывает, что индуцированный инсулином
гипогликемия активирует до одной трети гипокретинсодержащих
нейронов 21 привел
к предположению, что гипокретины являются посредниками энергии
метаболизм 26 . В
нейроэндокринные эффекты гипокретинов включают снижение плазменного
пролактин и гормон роста и повышение уровня кортикотропина
и кортизол, инсулин и лютеинизирующий
гормон 1 , 16 , 17 .Центральное введение гипокретинов увеличивает потребление воды,
стимулирует секрецию желудочного сока и улучшает работу кишечника
подвижность 1 , 23 .
Гипокретины повышают среднее артериальное давление и сердце.
скорость 7 . В
локализация длинных нисходящих аксонов, содержащих гипокретин, на
все уровни позвоночника
шнур 14 предлагает
роль в модуляции ощущений и боли. Сильная иннервация хвостового отдела
область крестцового канатика предполагает роль в регуляции обоих
симпатическая и парасимпатическая функции.
В
локализация длинных нисходящих аксонов, содержащих гипокретин, на
все уровни позвоночника
шнур 14 предлагает
роль в модуляции ощущений и боли. Сильная иннервация хвостового отдела
область крестцового канатика предполагает роль в регуляции обоих
симпатическая и парасимпатическая функции.
ГИПОКРЕТИН ПРИ НАРКОЛЕПСИИ
Нарколепсия — это первичное нарушение настороженности с предполагаемой распространенностью.
0,03-0,05%. Он может развиться в любом возрасте, но пик развития наступает в подростковом возрасте.
вторичный пик в четвертой декаде. Представляющий симптом обычно
чрезмерная дневная сонливость с непреодолимыми приступами сна в течение дня.
Другими симптомами этого синдрома являются катаплексия (короткие приступы мышечной
слабость или паралич, вызванные сильными эмоциями, такими как смех или
сюрприз), сонный паралич, который является симптомом из-за стойкости
атония сна с быстрым движением глаз (REM) при пробуждении и гипногогические галлюцинации
или похожие на сновидения образы, которые обычно возникают в начале сна. короткий
также могут возникать периоды автоматического поведения, отражающие кратковременные
вторжения сна («микросон») в сонливых
состояние 28 .
короткий
также могут возникать периоды автоматического поведения, отражающие кратковременные
вторжения сна («микросон») в сонливых
состояние 28 .
Исследования на животных
В 1999 г. Lin et al.
al . 29 продемонстрировали мутацию в гене рецептора гипокретина 2 у собак
нарколепсия. Последующее открытие, что у мышей, лишенных рецепторов гипокретина,
поведенческие остановки, похожие на симптомы нарколепсии-катаплексии, т. е.
прямые переходы от бодрствования к быстрому сну, предшествующее нарушение походки
и раскачивание во время остановки поведения
эпизоды 30 , 31 —led
к признанию потенциальной важности гипокретинов для сна,
возбуждение и активация.Модели нарколепсии на животных показывают некоторую вариабельность.
в дефекте, вызывающем нарколепсический синдром. В модели мыши
нарушение обоих типов путей рецептора гипокретина, Hcrtr1 и Hcrtr2,
необходимо произвести нарколептическое
выводы 30 , 31 , 32 , 33 тогда как в собачьей модели нарколепсии преобладающим дефектом является
Рецептор Hcrtr-2 29 . Внутривенное введение Hcrt-1 нарколептическим собакам (доберманам) снижает
катаплексия и нормализует сон и бодрствование
длительность 34 .
Внутривенное введение Hcrt-1 нарколептическим собакам (доберманам) снижает
катаплексия и нормализует сон и бодрствование
длительность 34 .
Гипокретин в спинномозговой жидкости
Было проведено несколько исследований гипокретина в спинномозговой жидкости человека. Опубликованный На данный момент работа проверена на наличие только Hcrt-1, а не Hcrt-2. CSF Уровни hcrt-1 у здоровых взрослых находятся в узком диапазоне (250-280 пг / мл) 35 . Недавний исследование показало отсутствие существенной разницы в уровнях гипокретина относительно пол или возраст, и пришел к выводу, что очень низкий или неопределяемый гипокретин в спинномозговой жидкости концентрации являются аномальным явлением при любом возраст 36 .
Первоначальное исследование Нишино и др.
al . 35 найдено
что у 7 из 9 пациентов с нарколепсией-катаплексией уровень неопределяемого
гипокретин в их спинномозговой жидкости. Из 2 пациентов с определяемым гипокретином один был
в пределах диапазона контроля, а другой поднял уровни. Оба эти пациента
были неотличимы от других пациентов с нарколепсией. Авторы
предположили, что у этих пациентов может быть дефект рецептора гипокретина, а
чем дефицит продукции гипокретина.Рипли и др.
al . 37 имеют
сообщили о неопределяемых уровнях гипокретина в спинномозговой жидкости у 32 из 36 пациентов.
проверено. В остальных 4-х уровни гипокретина были ниже контроля.
ассортимент.
Оба эти пациента
были неотличимы от других пациентов с нарколепсией. Авторы
предположили, что у этих пациентов может быть дефект рецептора гипокретина, а
чем дефицит продукции гипокретина.Рипли и др.
al . 37 имеют
сообщили о неопределяемых уровнях гипокретина в спинномозговой жидкости у 32 из 36 пациентов.
проверено. В остальных 4-х уровни гипокретина были ниже контроля.
ассортимент.
Было проведено два исследования, посвященных изучению клеток гипокретина после смерти в
мозг пациентов с
нарколепсия 12 , 13 .
Оба обнаружили поразительное сокращение примерно до 10% от нормального количества
гипокретиновые нейроны в нарколептическом мозге. В первоначальном
исследование 12 было
потеря клеток без глиоза и признаков воспаления.Однако в другом
исследование 13 было
свидетельство глиоза в области гипокретиновых клеток, подразумевая, что
дегенеративный процесс явился причиной потери клеток гипокретина при нарколепсии. Дополнительным подтверждением дегенеративной гипотезы является их открытие более высокого
количество астроцитов в гипоталамусе у больных нарколепсией, чем в
контроль. Отсутствие гипокретиновых нейронов можно объяснить механизмами
включая нейродегенерацию, задержку развития, снижение синтеза или
высвобождение гипокретинов или некоторая мутация в последовательности ДНК, кодирующей
гипокретин (хотя только 1 из 74 обследованных пациентов с нарколепсией показал
мутация 12 ).
Дополнительным подтверждением дегенеративной гипотезы является их открытие более высокого
количество астроцитов в гипоталамусе у больных нарколепсией, чем в
контроль. Отсутствие гипокретиновых нейронов можно объяснить механизмами
включая нейродегенерацию, задержку развития, снижение синтеза или
высвобождение гипокретинов или некоторая мутация в последовательности ДНК, кодирующей
гипокретин (хотя только 1 из 74 обследованных пациентов с нарколепсией показал
мутация 12 ).
ГИПОКРЕТИН ПРИ НЕВРОЛОГИЧЕСКИХ И ПСИХИАТРИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Роль гипокретина при других неврологических заболеваниях еще предстоит выяснить.
установлено. Недавний
исследование 38 обнаружило, что
Уровни гипокретина в спинномозговой жидкости существенно не различались между двумя группами, одна
с нейроиммунологическим заболеванием, а другой — с ненейроиммунологическим заболеванием.
болезнь и нормальный контроль. В ходе анализа подгрупп исследователи обнаружили
что 4 из 10 пациентов с синдромом Гийена-Барре имели
значительно более низкие уровни Hcrt-1, чем в контроле. Другая
исследование 37 имеет
продемонстрировали низкие уровни гипокретина в спинномозговой жидкости у пациентов с субарахноидальным
кровотечение, акустическая шваннома и травма головы — возможно, объяснение
повреждение и / или нарушение функции гипоталамуса.
Другая
исследование 37 имеет
продемонстрировали низкие уровни гипокретина в спинномозговой жидкости у пациентов с субарахноидальным
кровотечение, акустическая шваннома и травма головы — возможно, объяснение
повреждение и / или нарушение функции гипоталамуса.
Плотные гипокретиновые проекции на норадренергический, серотониновый,
дофаминергические, холинергические и ГАМК / глутамат области мозга предполагают
возможная роль в психиатрической и нейропсихиатрической
расстройства 39 , 40 .
Система гипокретина может иметь важное значение при аффективных расстройствах, таких как серьезные
депрессия и биполярное аффективное расстройство.Гипотеза моноаминов (биогенная
аминовая гипотеза) депрессии предполагает, что дисфункциональные или недостаточные
нейротрансмиссия норадреналина и / или серотонина лежит в основе симптомов
депрессия 41 , 42 , 43 .
В последнее время акцент сместился на возможную роль нейропептидов в
этиология и лечение
депрессия 44 , 45 , 46 , 47 , 48 , 49 . Предполагается, что гипокретиновая система участвует в депрессии.
нейроанатомические и фармакологические основы. Единственное известное вещество
иннервируют все соответствующие области мозга, вовлеченные в нейробиологию
депрессии гипокретин и возбуждающая иннервация LC и
область спинного шва, стимуляция дофамина и ацетилхолина и
Прогистаминергическое действие указывает на антидепрессивный эффект. Эти
терапевтические возможности еще предстоит выяснить с помощью соответствующих исследований.
Предполагается, что гипокретиновая система участвует в депрессии.
нейроанатомические и фармакологические основы. Единственное известное вещество
иннервируют все соответствующие области мозга, вовлеченные в нейробиологию
депрессии гипокретин и возбуждающая иннервация LC и
область спинного шва, стимуляция дофамина и ацетилхолина и
Прогистаминергическое действие указывает на антидепрессивный эффект. Эти
терапевтические возможности еще предстоит выяснить с помощью соответствующих исследований.
ЗАКЛЮЧЕНИЕ
Имеются убедительные доказательства того, что нарколепсия связана с аномалиями
нейротрансмиттерной системы гипокретина. Низкие или неопределяемые уровни
гипокретин обнаруживается у большинства пациентов, но у некоторых его уровень нормальный или повышенный.
Таким образом, было высказано предположение, что существует два варианта нарколепсии. В большинстве
у пациентов наблюдается дефицит гипокретина, но также может быть
форма с «резистентностью к гипокретину» из-за аномального гипокретина
рецепторная / пострецепторная динамика, приводящая к перепроизводству
гипокретин 9 , 50 . Система гипокретин / орексин может быть вовлечена в другие расстройства
сон, такой как первичная гиперсонница, бессонница и синдром Кляйне-Левина
синдром 10 , а
потенциальная роль в нарушениях сна, влияющих на старение
Население 7 , 28 , 41 , 51 , 52 .
Роль этих пептидов при других неврологических и психических расстройствах.
остается предполагаемым.
Система гипокретин / орексин может быть вовлечена в другие расстройства
сон, такой как первичная гиперсонница, бессонница и синдром Кляйне-Левина
синдром 10 , а
потенциальная роль в нарушениях сна, влияющих на старение
Население 7 , 28 , 41 , 51 , 52 .
Роль этих пептидов при других неврологических и психических расстройствах.
остается предполагаемым.
Список литературы
1.Sutcliffe JG, de Lecea L. Гипокретины: возбуждающие нейромодулирующие пептиды для нескольких гомеостатических систем, включая сон и кормление. J Neurosci Res 2000; 62: 161-8 [PubMed] [Google Scholar] 2. de Lecea L, Kilduff TS, Peyron C, и др. . Лицемеры: гипоталамус-специфические пептиды с нейровозбуждающей активностью. Proc Natl Acad Sci США 1998; 95: 322-7 [Бесплатная статья PMC] [PubMed] [Google Scholar] 3. Сакураи Т., Амемия А., Исии М., и др. . Орексины и орексин рецепторы: семейство гипоталамических нейропептидов и связанных с G-белком рецепторы, регулирующие пищевое поведение. Ячейка
1998; 92:
573-5 [PubMed] [Google Scholar] 4. Гаутвик К.М., де Лесеа Л., Гаутвик В.Т., и др. . Обзор
наиболее распространенные мРНК, специфичные для гипоталамуса, что определяется направленным тегом
Вычитание ПЦР. Proc Natl Acad Sci USA
1996; 93:
8733-8 [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Пейрон С. Распределение иммунореактивных нейронов и волокон для
предшественник гипоталамического нейропептида, родственный секретину. Soc
Neurosci Abstr
1997; 23:
2032 г. [Google Scholar] 6. Sutcliffe JG. Два новых гипоталамических пептида, связанных с секретином
происходит из одного предшественника нейропептида.Soc Neurosci
Abstr 1997; 23:
2032 год [Google Scholar] 7. Килдафф Т.С., Пейрон С. Система гипокретин / орексин-лиганд-рецептор:
последствия для сна и нарушений сна. ОЛОВА
2000; 23:
359–64 [PubMed] [Google Scholar] 8. Триведи П., Ю Х, Макнейл Диджей, Ван дер Плоег Л. Х., Гуан ХМ.
Распределение мРНК рецептора орексина в головном мозге крысы. FEBS
Lett 1998; 438:
71-5 [PubMed] [Google Scholar] 10.
Ячейка
1998; 92:
573-5 [PubMed] [Google Scholar] 4. Гаутвик К.М., де Лесеа Л., Гаутвик В.Т., и др. . Обзор
наиболее распространенные мРНК, специфичные для гипоталамуса, что определяется направленным тегом
Вычитание ПЦР. Proc Natl Acad Sci USA
1996; 93:
8733-8 [Бесплатная статья PMC] [PubMed] [Google Scholar] 5. Пейрон С. Распределение иммунореактивных нейронов и волокон для
предшественник гипоталамического нейропептида, родственный секретину. Soc
Neurosci Abstr
1997; 23:
2032 г. [Google Scholar] 6. Sutcliffe JG. Два новых гипоталамических пептида, связанных с секретином
происходит из одного предшественника нейропептида.Soc Neurosci
Abstr 1997; 23:
2032 год [Google Scholar] 7. Килдафф Т.С., Пейрон С. Система гипокретин / орексин-лиганд-рецептор:
последствия для сна и нарушений сна. ОЛОВА
2000; 23:
359–64 [PubMed] [Google Scholar] 8. Триведи П., Ю Х, Макнейл Диджей, Ван дер Плоег Л. Х., Гуан ХМ.
Распределение мРНК рецептора орексина в головном мозге крысы. FEBS
Lett 1998; 438:
71-5 [PubMed] [Google Scholar] 10. Миньо Э. Перспективы нарколепсии и гипокретина (орексина)
исследование. Сон Мед
2000; 1:
87-90 [PubMed] [Google Scholar] 11.Пейрон С., Тайге Д.К., Ван ден Поль А.Н., и др. . Нейроны
содержащий гипокретин (орексин), распространяется на несколько нейронных систем.
J Neurosci
1998; 23:
9996-10015 [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Пейрон С., Фарако Дж., Роджерс В., и др. . Мутация в футляре
раннего начала нарколепсии и общего отсутствия пептидов гипокретина в
нарколептический мозг человека. Нат Мед
2000; 6:
991-7 [PubMed] [Google Scholar] 13. Танникал Т.С., Мур Р.Й., Ниенхуис Р., и др. .Уменьшенное количество
гипокретиновых нейронов при нарколепсии человека. Нейрон
2000; 27:
469-74 [PubMed] [Google Scholar] 15. Хорват Т.Л., Пейрон С., Дайан С., и др. . Гипокретин (орексин)
активация и синаптическая иннервация голубого пятна норадренергического
система. J Comp Neurol
1999; 415:
145-59 [PubMed] [Google Scholar] 16.
Миньо Э. Перспективы нарколепсии и гипокретина (орексина)
исследование. Сон Мед
2000; 1:
87-90 [PubMed] [Google Scholar] 11.Пейрон С., Тайге Д.К., Ван ден Поль А.Н., и др. . Нейроны
содержащий гипокретин (орексин), распространяется на несколько нейронных систем.
J Neurosci
1998; 23:
9996-10015 [Бесплатная статья PMC] [PubMed] [Google Scholar] 12. Пейрон С., Фарако Дж., Роджерс В., и др. . Мутация в футляре
раннего начала нарколепсии и общего отсутствия пептидов гипокретина в
нарколептический мозг человека. Нат Мед
2000; 6:
991-7 [PubMed] [Google Scholar] 13. Танникал Т.С., Мур Р.Й., Ниенхуис Р., и др. .Уменьшенное количество
гипокретиновых нейронов при нарколепсии человека. Нейрон
2000; 27:
469-74 [PubMed] [Google Scholar] 15. Хорват Т.Л., Пейрон С., Дайан С., и др. . Гипокретин (орексин)
активация и синаптическая иннервация голубого пятна норадренергического
система. J Comp Neurol
1999; 415:
145-59 [PubMed] [Google Scholar] 16. Ида Т., Накахара К., Куроива Т., и др. . Оба кортикотропина
рилизинг-фактор и нейропептид Y участвуют в действии орексина
(гипокретин) от приема пищи крысами.Neurosci Lett
2000; 293:
119-22 [PubMed] [Google Scholar] 17. ван ден Поль А.Н., Гао ХБ, Обриетан К., Килдафф Т.С., Белоусов А.Б.
Пресинаптическое и постсинаптическое действие и модуляция нейроэндокринных нейронов
новым гипоталамическим пептидом, гипокретином / орексином. J
Neurosci 1998; 18:
7962-71 [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Джон Дж., Ву М.Ф., Кодана Т., Сигел Дж. М.. Гипокретин-1 (орексин-А)
вызывает изменения в высвобождении глутамата и ГАМК: in vivo исследование микродиализа [Аннотация]. Спать
2001; 24 (доп.):
A20 [Google Scholar] 19.Эдвардс С.М., Абуснана С., Сантер Д., Мерфи К.Г., Гатен М.А., Блум С.Р.
Влияние орексинов на прием пищи: сравнение с нейропептидом Y,
меланин-концентрирующий гормон и галанин. J
Эндокринол 1999; 160:
R7-12 [PubMed] [Google Scholar] 20.
Ида Т., Накахара К., Куроива Т., и др. . Оба кортикотропина
рилизинг-фактор и нейропептид Y участвуют в действии орексина
(гипокретин) от приема пищи крысами.Neurosci Lett
2000; 293:
119-22 [PubMed] [Google Scholar] 17. ван ден Поль А.Н., Гао ХБ, Обриетан К., Килдафф Т.С., Белоусов А.Б.
Пресинаптическое и постсинаптическое действие и модуляция нейроэндокринных нейронов
новым гипоталамическим пептидом, гипокретином / орексином. J
Neurosci 1998; 18:
7962-71 [Бесплатная статья PMC] [PubMed] [Google Scholar] 18. Джон Дж., Ву М.Ф., Кодана Т., Сигел Дж. М.. Гипокретин-1 (орексин-А)
вызывает изменения в высвобождении глутамата и ГАМК: in vivo исследование микродиализа [Аннотация]. Спать
2001; 24 (доп.):
A20 [Google Scholar] 19.Эдвардс С.М., Абуснана С., Сантер Д., Мерфи К.Г., Гатен М.А., Блум С.Р.
Влияние орексинов на прием пищи: сравнение с нейропептидом Y,
меланин-концентрирующий гормон и галанин. J
Эндокринол 1999; 160:
R7-12 [PubMed] [Google Scholar] 20. Хейнс А.С., Джексон Б., Оверенд П., и др. . Эффекты одиночного
и хроническое интрацеребровентрикулярное введение орексинов при кормлении
в крысе. Пептиды
1999; 20:
1099-105 [PubMed] [Google Scholar] 21. Моригути Т., Сакураи Т., Намбу Т., Янагисава М., Гото К.Нейроны
содержащие орексин в боковой гипоталамической области мозга взрослой крысы, являются
активируется инсулино-индуцированной острой гипогликемией. Неврологи
Lett 1999; 264:
101-4 [PubMed] [Google Scholar] 22. Куру М., Уэта Ю., Серино Р., и др. . Централизованно управляемый
орексин-гипокретин активирует ось HPA у крыс.
Нейроотчет
2000; 11:
1977-80 [PubMed] [Google Scholar] 23. Кирхгесснер А.Л., Лю М. Синтез орексинов и реакция в кишечнике.
Нейрон
1999; 24:
941-51 [PubMed] [Google Scholar] 24. Самсон В.К., Госнелл Б., Чанг Дж. К., Реш З. Т., Мерфи Т.К.Сердечно-сосудистые
регулирующие действия гипокретинов в головном мозге. Мозг
Res 1999; 831:
248-53 [PubMed] [Google Scholar] 25. Ида Т., Накахара К.
Хейнс А.С., Джексон Б., Оверенд П., и др. . Эффекты одиночного
и хроническое интрацеребровентрикулярное введение орексинов при кормлении
в крысе. Пептиды
1999; 20:
1099-105 [PubMed] [Google Scholar] 21. Моригути Т., Сакураи Т., Намбу Т., Янагисава М., Гото К.Нейроны
содержащие орексин в боковой гипоталамической области мозга взрослой крысы, являются
активируется инсулино-индуцированной острой гипогликемией. Неврологи
Lett 1999; 264:
101-4 [PubMed] [Google Scholar] 22. Куру М., Уэта Ю., Серино Р., и др. . Централизованно управляемый
орексин-гипокретин активирует ось HPA у крыс.
Нейроотчет
2000; 11:
1977-80 [PubMed] [Google Scholar] 23. Кирхгесснер А.Л., Лю М. Синтез орексинов и реакция в кишечнике.
Нейрон
1999; 24:
941-51 [PubMed] [Google Scholar] 24. Самсон В.К., Госнелл Б., Чанг Дж. К., Реш З. Т., Мерфи Т.К.Сердечно-сосудистые
регулирующие действия гипокретинов в головном мозге. Мозг
Res 1999; 831:
248-53 [PubMed] [Google Scholar] 25. Ида Т., Накахара К. , Катаяма Т., Мураками Н., Накадзато М. Эффект
боковая церебровентрикулярная инъекция возбуждающего аппетит
нейропептиды, орексин и нейропептид Y, на различные поведенческие
деятельность крыс. Brain Res
1999; 821:
526-9 [PubMed] [Google Scholar] 26. Chemelli RM, и др. . Метаболическая характеристика орексина
нокаутные мыши [Аннотация]. Спать
2001; 24 (доп.):
A21 [Google Scholar] 27.Самсон В.К., Реш ЗТ. История гипокретина / орексина. Тенденции
Эндокринол Метаб
2000; 11:
257-62 [PubMed] [Google Scholar] 28. Krahn LE, Black JL, Silber MH. Нарколепсия: новое понимание
непреодолимый сон. Mayo Clin Proc
2001; 76:
185-94 [PubMed] [Google Scholar] 29. Линь Л., Фарас Дж., Ли Р., и др. . Расстройство сна у собак
нарколепсия вызвана мутацией гена рецептора гипокретина (орексина) 2.
Ячейка
1999; 98:
365-76 [PubMed] [Google Scholar] 30. Chemelli RM, Willie JT, Sinton CM, и др. .Нарколепсия в
Мыши с нокаутом орексина: молекулярная генетика регуляции сна.
, Катаяма Т., Мураками Н., Накадзато М. Эффект
боковая церебровентрикулярная инъекция возбуждающего аппетит
нейропептиды, орексин и нейропептид Y, на различные поведенческие
деятельность крыс. Brain Res
1999; 821:
526-9 [PubMed] [Google Scholar] 26. Chemelli RM, и др. . Метаболическая характеристика орексина
нокаутные мыши [Аннотация]. Спать
2001; 24 (доп.):
A21 [Google Scholar] 27.Самсон В.К., Реш ЗТ. История гипокретина / орексина. Тенденции
Эндокринол Метаб
2000; 11:
257-62 [PubMed] [Google Scholar] 28. Krahn LE, Black JL, Silber MH. Нарколепсия: новое понимание
непреодолимый сон. Mayo Clin Proc
2001; 76:
185-94 [PubMed] [Google Scholar] 29. Линь Л., Фарас Дж., Ли Р., и др. . Расстройство сна у собак
нарколепсия вызвана мутацией гена рецептора гипокретина (орексина) 2.
Ячейка
1999; 98:
365-76 [PubMed] [Google Scholar] 30. Chemelli RM, Willie JT, Sinton CM, и др. .Нарколепсия в
Мыши с нокаутом орексина: молекулярная генетика регуляции сна. Ячейка
1999; 98:
437-51 [PubMed] [Google Scholar] 31. Кисануки Ю.Ю., Чемелли Р.М., Токита С., и др. . Поведенческие и
полисомнографическая характеристика рецептора орексина-1 и рецептора орексина-2
мыши с двойным нокаутом [Аннотация]. Спать
2001; 24 (доп.):
A22 [Google Scholar] 32. Кисануки Ю.Ю., Чемелли Р.М. Роль рецептора орексина типа 1 (OX1R)
в регуляции сна [Реферат]. Спать
2000; 23 (доп.):
A91 [Google Scholar] 33.Такита С., Чемелли Р.М., Вилли Дж. Т., Янагисава М. Поведенческие
характеристика мышей с нокаутом рецептора орексина-2 (OX2R) [Abstract].
Спать
2001; 24 (доп.):
A20 [Google Scholar] 34. Джон Дж., Ву М.Ф., Сигел Дж. М.. Системное введение гипокретина-1
снижает катаплексию и нормализует продолжительность сна и бодрствования при нарколепсии
собаки. Сон Res Online
2000; 3:
23-8 [PubMed] [Google Scholar] 35. Нишино С., Рипли Б., Оверим С., Ламмерс Г. Дж., Миньо Э. Гипокретин
(орексина) дефицит при нарколепсии человека. Ланцет
2000; 355:
39-40 [PubMed] [Google Scholar] 36.
Ячейка
1999; 98:
437-51 [PubMed] [Google Scholar] 31. Кисануки Ю.Ю., Чемелли Р.М., Токита С., и др. . Поведенческие и
полисомнографическая характеристика рецептора орексина-1 и рецептора орексина-2
мыши с двойным нокаутом [Аннотация]. Спать
2001; 24 (доп.):
A22 [Google Scholar] 32. Кисануки Ю.Ю., Чемелли Р.М. Роль рецептора орексина типа 1 (OX1R)
в регуляции сна [Реферат]. Спать
2000; 23 (доп.):
A91 [Google Scholar] 33.Такита С., Чемелли Р.М., Вилли Дж. Т., Янагисава М. Поведенческие
характеристика мышей с нокаутом рецептора орексина-2 (OX2R) [Abstract].
Спать
2001; 24 (доп.):
A20 [Google Scholar] 34. Джон Дж., Ву М.Ф., Сигел Дж. М.. Системное введение гипокретина-1
снижает катаплексию и нормализует продолжительность сна и бодрствования при нарколепсии
собаки. Сон Res Online
2000; 3:
23-8 [PubMed] [Google Scholar] 35. Нишино С., Рипли Б., Оверим С., Ламмерс Г. Дж., Миньо Э. Гипокретин
(орексина) дефицит при нарколепсии человека. Ланцет
2000; 355:
39-40 [PubMed] [Google Scholar] 36. Канбаяси Т., Яно Т., Исигуро Х., и др. . Гипокретин
(орексин) в спинномозговой жидкости поясничного отдела человека в разных возрастных группах [Аннотация].
Спать
2001; 24 (доп.):
A330 [PubMed] [Google Scholar] 37. Рипли Б., Оверим С., Фуджики Н., и др. . Гипокретин спинномозговой жидкости
уровни при различных неврологических состояниях: низкие уровни при нарколепсии и
Синдром Гийена-Барре [Аннотация]. Спать
2001; 24 (доп.):
A322 [Google Scholar] 38. Канбаяси Т., Исигуро Х., Яно Т., и др. . Гипокретин / орексин
низкие концентрации у пациентов с синдромом Гийена-Барре
[Абстрактные].Спать
2001; 24 (доп.):
A331-2 [Google Scholar] 39. Чарни Д.С. Моноаминовая дисфункция и патофизиология и
лечение депрессии. J Clin Психиатрия
1998; 59:
11–14 [PubMed] [Google Scholar] 40. van den Pol AN. Нарколепсия: нейродегенеративное заболевание
гипокретиновая система? Нейрон
2000; 27:
415-18 [PubMed] [Google Scholar] 41. Банни В.Е., Дэвис Дж. М.. Норадреналин при депрессивных реакциях.
Канбаяси Т., Яно Т., Исигуро Х., и др. . Гипокретин
(орексин) в спинномозговой жидкости поясничного отдела человека в разных возрастных группах [Аннотация].
Спать
2001; 24 (доп.):
A330 [PubMed] [Google Scholar] 37. Рипли Б., Оверим С., Фуджики Н., и др. . Гипокретин спинномозговой жидкости
уровни при различных неврологических состояниях: низкие уровни при нарколепсии и
Синдром Гийена-Барре [Аннотация]. Спать
2001; 24 (доп.):
A322 [Google Scholar] 38. Канбаяси Т., Исигуро Х., Яно Т., и др. . Гипокретин / орексин
низкие концентрации у пациентов с синдромом Гийена-Барре
[Абстрактные].Спать
2001; 24 (доп.):
A331-2 [Google Scholar] 39. Чарни Д.С. Моноаминовая дисфункция и патофизиология и
лечение депрессии. J Clin Психиатрия
1998; 59:
11–14 [PubMed] [Google Scholar] 40. van den Pol AN. Нарколепсия: нейродегенеративное заболевание
гипокретиновая система? Нейрон
2000; 27:
415-18 [PubMed] [Google Scholar] 41. Банни В.Е., Дэвис Дж. М.. Норадреналин при депрессивных реакциях. А
обзор. Arch Gen Psychiatry
1965; 13:
483-94 [PubMed] [Google Scholar] 42. Коппен А. Биохимия аффективных расстройств.Br J
Психиатрия 1967; 113:
1237-64 [PubMed] [Google Scholar] 43. Миллер Х.Л., Дельгадо П.Л., Саломон Р.М., и др. . Клинические и
биохимические эффекты истощения катехоламинов на индуцированные антидепрессантами
ремиссия депрессии. Arch Gen Psychiatry
1996; 53:
117-28 [PubMed] [Google Scholar] 44. Gold PW, Chrousos G, Kellner C, и др. . Психиатрическая
последствия фундаментальных и клинических исследований с высвобождением кортикотропина
фактор. Am J Psychiatry
1984; 141:
619-27 [PubMed] [Google Scholar] 45.Gold PW, Loriaux DL, Roy A, и др. . Ответы на
кортикотропин-рилизинг-гормон при гиперкортиколизме депрессии и
Болезнь Кушинга. Патофизиологические и диагностические значения. N
Engl J Med 1986; 314:
1329-35 [PubMed] [Google Scholar] 46. Holsboer F, Van Bardeleben U, Gerken A, Stalla GR, Muller OA.
Снижение уровня кортикотропина и нормальный ответ кортизола на человеческий
кортикотропин-рилизинг-фактор при депрессии.
А
обзор. Arch Gen Psychiatry
1965; 13:
483-94 [PubMed] [Google Scholar] 42. Коппен А. Биохимия аффективных расстройств.Br J
Психиатрия 1967; 113:
1237-64 [PubMed] [Google Scholar] 43. Миллер Х.Л., Дельгадо П.Л., Саломон Р.М., и др. . Клинические и
биохимические эффекты истощения катехоламинов на индуцированные антидепрессантами
ремиссия депрессии. Arch Gen Psychiatry
1996; 53:
117-28 [PubMed] [Google Scholar] 44. Gold PW, Chrousos G, Kellner C, и др. . Психиатрическая
последствия фундаментальных и клинических исследований с высвобождением кортикотропина
фактор. Am J Psychiatry
1984; 141:
619-27 [PubMed] [Google Scholar] 45.Gold PW, Loriaux DL, Roy A, и др. . Ответы на
кортикотропин-рилизинг-гормон при гиперкортиколизме депрессии и
Болезнь Кушинга. Патофизиологические и диагностические значения. N
Engl J Med 1986; 314:
1329-35 [PubMed] [Google Scholar] 46. Holsboer F, Van Bardeleben U, Gerken A, Stalla GR, Muller OA.
Снижение уровня кортикотропина и нормальный ответ кортизола на человеческий
кортикотропин-рилизинг-фактор при депрессии.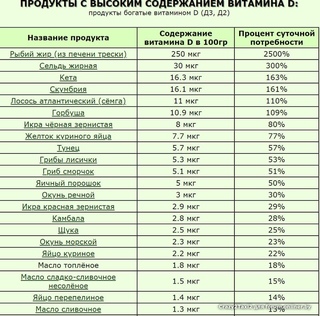 N Engl J
Мед 1984; 311:
1127 [PubMed] [Google Scholar] 47. Крамер М.С., Катлер Н., Файнер Дж., и др. .Отчетливый механизм
для антидепрессивной активности за счет блокады центральных рецепторов вещества P.
Наука
1998; 281:
1640-5 [PubMed] [Google Scholar] 48. Вонг М.Л., Личинио Дж. Исследования и подходы к лечению
депрессия. Nat Rev Neurosci
2001; 2:
343-51 [PubMed] [Google Scholar] 49. Зобель А.В., Никель Т, Кунцель М.Э., и др. . Эффекты
высокоаффинный антагонист рецептора 1 рилизинг-гормона кортикотропина R121919 в
большая депрессия: первые 20 пациентов прошли курс лечения. J Психиатр
Res 2000; 34:
171-81 [PubMed] [Google Scholar] 50.Мелберг А., Рипли Б., Линь Л., Хетта Дж., Миньо Е., Нишино С.
Дефицит гипокретина при семейной симптоматической нарколепсии. Анна
Neurol 2001; 49:
136-7 [PubMed] [Google Scholar] 51. Salin-Pascual RJ. Роль нейропептидов гипоталамуса
гипокретин / орексин в цикле сна-бодрствования. Isr Med Assoc
J 2001; 3:
144-6 [PubMed] [Google Scholar] 52.
N Engl J
Мед 1984; 311:
1127 [PubMed] [Google Scholar] 47. Крамер М.С., Катлер Н., Файнер Дж., и др. .Отчетливый механизм
для антидепрессивной активности за счет блокады центральных рецепторов вещества P.
Наука
1998; 281:
1640-5 [PubMed] [Google Scholar] 48. Вонг М.Л., Личинио Дж. Исследования и подходы к лечению
депрессия. Nat Rev Neurosci
2001; 2:
343-51 [PubMed] [Google Scholar] 49. Зобель А.В., Никель Т, Кунцель М.Э., и др. . Эффекты
высокоаффинный антагонист рецептора 1 рилизинг-гормона кортикотропина R121919 в
большая депрессия: первые 20 пациентов прошли курс лечения. J Психиатр
Res 2000; 34:
171-81 [PubMed] [Google Scholar] 50.Мелберг А., Рипли Б., Линь Л., Хетта Дж., Миньо Е., Нишино С.
Дефицит гипокретина при семейной симптоматической нарколепсии. Анна
Neurol 2001; 49:
136-7 [PubMed] [Google Scholar] 51. Salin-Pascual RJ. Роль нейропептидов гипоталамуса
гипокретин / орексин в цикле сна-бодрствования. Isr Med Assoc
J 2001; 3:
144-6 [PubMed] [Google Scholar] 52.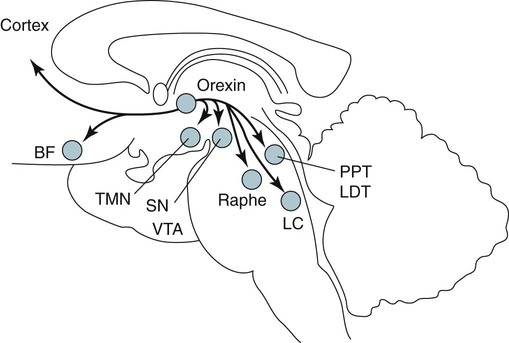 Скаммелл Т.Э., Эстабрук IV, Маккарти М.Т., и др. .
Области возбуждения гипоталамуса активируются во время индуцированного модафинилом
бодрствование. J Neurosci
2000; 20:
8620-8 [Бесплатная статья PMC] [PubMed] [Google Scholar]
Скаммелл Т.Э., Эстабрук IV, Маккарти М.Т., и др. .
Области возбуждения гипоталамуса активируются во время индуцированного модафинилом
бодрствование. J Neurosci
2000; 20:
8620-8 [Бесплатная статья PMC] [PubMed] [Google Scholar]Роль в чрезмерном потреблении продуктов питания и лекарств
Аннотация
Нейропептид орексин / гипокретин (OX), хотя в значительной степени транскрибируется в гипоталамусе, высвобождается по всему мозгу, чтобы воздействовать на сложное поведение.В первую очередь через сам гипоталамус OX гомеостатически регулирует адаптивное поведение, необходимое для выживания, включая прием пищи, регуляцию сна и бодрствования, совокупление и материнское поведение. Однако через экстрагипоталамические лимбические области мозга OX способствует поиску и потреблению полезных веществ, вызывающих злоупотребление, таких как вкусная еда, алкоголь, никотин и кокаин. Этот нейропептид, в свою очередь, стимулируется потреблением или воздействием этих веществ в раннем возрасте, образуя негомеостатическую петлю положительной обратной связи. Рецептор OX, участвующий в этом поведении, адаптивном поведении или поиске и приеме веществ, зависит от конкретной области мозга, которая способствует им. Таким образом, мы предполагаем, что, хотя основная функция ОХ заключается в поддержании возбуждения для выполнения адаптивного поведения, эта нейропептидная система легко кооперируется, вознаграждая веществами, которые вызывают положительную обратную связь, что в конечном итоге способствует злоупотреблению ими.
Рецептор OX, участвующий в этом поведении, адаптивном поведении или поиске и приеме веществ, зависит от конкретной области мозга, которая способствует им. Таким образом, мы предполагаем, что, хотя основная функция ОХ заключается в поддержании возбуждения для выполнения адаптивного поведения, эта нейропептидная система легко кооперируется, вознаграждая веществами, которые вызывают положительную обратную связь, что в конечном итоге способствует злоупотреблению ими.
Ключевые слова: сон-бодрствование, совокупление, материнское поведение, сахароза, жир, алкоголь, никотин, кокаин, поиск, потребление
1.Введение
В 1998 году нейропептид орексин / гипокретин (OX) был независимо идентифицирован двумя разными лабораториями, обе из которых предположили, что он играет важную роль в приеме пищи и энергетическом гомеостазе (de Lecea et al., 1998; Sakurai et al. ., 1998). Хотя было показано, что клеточные тела, которые транскрибируют этот нейропептид, в значительной степени ограничены гипоталамусом, который регулирует потребление пищи, эти нейроны также отправляют обширные проекции по всему мозгу, особенно в лимбическую систему (Peyron et al. , 1998; Триведи, Ю, Макнейл, Ван дер Плоег и Гуан, 1998). Многочисленные исследования за последние 20 лет продемонстрировали, что нейроны гипоталамуса OX и их проекции имеют более широкие функции, помимо гомеостатического приема пищи, контролируя ряд других адаптивных форм поведения, таких как регуляция сна и бодрствования, совокупление и материнское поведение. Особый интерес представляют дополнительные доказательства того, что OX способствует дисрегулируемому негомеостатическому потреблению, например, при злоупотреблении полезными веществами. Он стимулирует чрезмерное потребление вкусной сладкой и жирной пищи, алкоголя, никотина и кокаина среди других веществ, а во многих случаях, в свою очередь, стимулируется их потреблением в рамках цикла положительной обратной связи.Этому и посвящен настоящий обзор.
, 1998; Триведи, Ю, Макнейл, Ван дер Плоег и Гуан, 1998). Многочисленные исследования за последние 20 лет продемонстрировали, что нейроны гипоталамуса OX и их проекции имеют более широкие функции, помимо гомеостатического приема пищи, контролируя ряд других адаптивных форм поведения, таких как регуляция сна и бодрствования, совокупление и материнское поведение. Особый интерес представляют дополнительные доказательства того, что OX способствует дисрегулируемому негомеостатическому потреблению, например, при злоупотреблении полезными веществами. Он стимулирует чрезмерное потребление вкусной сладкой и жирной пищи, алкоголя, никотина и кокаина среди других веществ, а во многих случаях, в свою очередь, стимулируется их потреблением в рамках цикла положительной обратной связи.Этому и посвящен настоящий обзор.
2. Анатомия нейронов, экспрессирующих орексин / гипокретин
Первое описание ОХ было получено от de Lecea et al. (1998), которые идентифицировали ген, который они назвали гипокретином, учитывая его почти исключительную экспрессию в таламусе hypo и его аминокислотная последовательность аналогична кишечному гормону SE кретину . Эти авторы отметили, что этот ген-предшественник фактически кодирует два пептида, которые они назвали гипокретином 1 и гипокретином 2 (de Lecea et al., 1998). Вскоре после этого Сакураи и его коллеги (1998) идентифицировали тот же ген нейропептида из 130 аминокислот, который они назвали орексином после греческого слова, обозначающего аппетит, orexis , и отметили, что его последовательность хорошо сохраняется у крыс, мышей и люди. Эта группа также идентифицировала те же кодированные пептиды, орексин-A (OX-A), эквивалентный гипокретину 1 и состоящий из 33 аминокислот, и орексин-B (OX-B), эквивалентный гипокретину 2 и состоящий из 28 аминокислот, и они отметили, что два пептида идентичны по своей последовательности на 46% (Sakurai et al., 1998). Замечательной особенностью OX является то, что, несмотря на его ограниченную экспрессию в дискретном наборе преимущественно гипоталамических ядер, нейроны, экспрессирующие этот нейропептид, широко проецируются в области мозга, участвующие в питании, возбуждении и высвобождении гормонов (Peyron et al.
Эти авторы отметили, что этот ген-предшественник фактически кодирует два пептида, которые они назвали гипокретином 1 и гипокретином 2 (de Lecea et al., 1998). Вскоре после этого Сакураи и его коллеги (1998) идентифицировали тот же ген нейропептида из 130 аминокислот, который они назвали орексином после греческого слова, обозначающего аппетит, orexis , и отметили, что его последовательность хорошо сохраняется у крыс, мышей и люди. Эта группа также идентифицировала те же кодированные пептиды, орексин-A (OX-A), эквивалентный гипокретину 1 и состоящий из 33 аминокислот, и орексин-B (OX-B), эквивалентный гипокретину 2 и состоящий из 28 аминокислот, и они отметили, что два пептида идентичны по своей последовательности на 46% (Sakurai et al., 1998). Замечательной особенностью OX является то, что, несмотря на его ограниченную экспрессию в дискретном наборе преимущественно гипоталамических ядер, нейроны, экспрессирующие этот нейропептид, широко проецируются в области мозга, участвующие в питании, возбуждении и высвобождении гормонов (Peyron et al. , 1998; Tvedi et al. al., 1998), чтобы повлиять на множество моделей поведения. В этом разделе описывается анатомическое расположение нейронов OX, их эфферентные и афферентные проекции, а также нейрохимические свойства рецепторов OX.
, 1998; Tvedi et al. al., 1998), чтобы повлиять на множество моделей поведения. В этом разделе описывается анатомическое расположение нейронов OX, их эфферентные и афферентные проекции, а также нейрохимические свойства рецепторов OX.
2.1. Тела клеток
Нейроны, транскрибирующие OX, включают небольшой кластер нейронов, которые лежат преимущественно в гипоталамусе (Peyron et al., 1998; Sakurai et al., 1998). Субъядра, в которых они были описаны, несколько различаются в разных публикациях, в зависимости от анатомической терминологии, используемой в конкретной лаборатории. У крыс около половины из 6700 OX-экспрессирующих нейронов может быть обнаружено в перифорникальной области гипоталамуса, а остальные — в латеральном гипоталамусе, дорсомедиальном гипоталамусе и заднем гипоталамусе, а также в подталамусе (de Lecea et al. ., 1998; Modirrousta, Mainville, & Jones, 2005; Пейрон и др., 1998; Сакураи и др., 1998). Хотя это распределение нейронов OX значительно перекрывается с распределением другого орексигенного нейропептида, меланин-концентрирующего гормона, эти два нейропептида практически не обнаруживают совместной локализации в нейронах (Hakansson, de Lecea, Sutcliffe, Yanagisawa, & Meister, 1999). Нейроны, экспрессирующие орексин / гипокретин, были идентифицированы у множества позвоночных млекопитающих, включая крыс, мышей и людей (de Lecea et al., 1998; Sakurai et al., 1998), а также собак (Lin et al., 1999), овец (Archer, Findlay, Rhind, Mercer, & Adam, 2002), свиней (Dyer, Touchette, Carroll, Allee, & Matteri, 1999 ) и нечеловеческих приматов (Horvath, Diano, & van den Pol, 1999). Они также наблюдались у позвоночных, не являющихся млекопитающими, таких как рыбки данио, у которых нейроны OX лежат в ростральном гипоталамусе и преоптической области (Kaslin, Nystedt, Ostergard, Peitsaro, & Panula, 2004).
Нейроны, экспрессирующие орексин / гипокретин, были идентифицированы у множества позвоночных млекопитающих, включая крыс, мышей и людей (de Lecea et al., 1998; Sakurai et al., 1998), а также собак (Lin et al., 1999), овец (Archer, Findlay, Rhind, Mercer, & Adam, 2002), свиней (Dyer, Touchette, Carroll, Allee, & Matteri, 1999 ) и нечеловеческих приматов (Horvath, Diano, & van den Pol, 1999). Они также наблюдались у позвоночных, не являющихся млекопитающими, таких как рыбки данио, у которых нейроны OX лежат в ростральном гипоталамусе и преоптической области (Kaslin, Nystedt, Ostergard, Peitsaro, & Panula, 2004).
В отличие от гормона, концентрирующего меланин, ОХ совмещает локализацию с рядом других нейропептидов и нейротрансмиттеров.В частности, 94% нейронов OX также содержат опиоидный нейропептид динорфин (Chou et al., 2001), и и OX, и динорфин даже наблюдались в одних и тех же синаптических пузырьках (Muschamp et al., 2014). Также наблюдается значительная совместная локализация ОХ с глутаматом (Rosin, Weston, Sevigny, Stornetta, & Guyenet, 2003; Torrealba, Yanagisawa, & Saper, 2003) и пролактином (Risold, Griffond, Kilduff, Sutcliffe, & Fellmann, 1999). и более ограниченная совместная локализация с галанином (Hakansson et al., 1999), ноцицептин / орфанин FQ (Maolood & Meister, 2010), нейротензин (Furutani et al., 2013) и оксид азота (Cheng, Kuchiiwa, Gao, Kuchiiwa, & Nakagawa, 2003). Таким образом, высвобождение OX, вероятно, будет происходить одновременно с этими другими нейрохимическими веществами, которые могут действовать в разных временных масштабах и иметь различные эффекты от OX.
и более ограниченная совместная локализация с галанином (Hakansson et al., 1999), ноцицептин / орфанин FQ (Maolood & Meister, 2010), нейротензин (Furutani et al., 2013) и оксид азота (Cheng, Kuchiiwa, Gao, Kuchiiwa, & Nakagawa, 2003). Таким образом, высвобождение OX, вероятно, будет происходить одновременно с этими другими нейрохимическими веществами, которые могут действовать в разных временных масштабах и иметь различные эффекты от OX.
2.2. Рецепторы
Два рецептора для OX имеют разную аффинность связывания с пептидами OX. Рецептор орексина 1 (OX1R, также называемый рецептором гипокретина 1) в первую очередь взаимодействует с OX-A, требуя для полумаксимального ответа концентрация 30 нМ OX-A, но 2500 нМ OX-B (Sakurai et al., 1998). Это контрастирует с рецептором орексина 2 (OX2R, также называемым рецептором гипокретина 2), который почти одинаково взаимодействует с OX-A и OX-B, требуя для полумаксимального ответа концентрации 34 нМ OX-A и 60 нМ. нМ OX-B (Sakurai et al. , 1998). Таким образом, OX-A связывается как с OX1R, так и с OX2R с равным сродством, тогда как OX-B связывается почти исключительно с OX2R. Оба рецептора взаимодействуют с белками Gq, Gs и Gi (Magga et al., 2006; Tang et al., 2008) и наблюдались как пре-, так и постсинаптически (van den Pol, Gao, Obrietan, Kilduff, & Belousov , 1998).
, 1998). Таким образом, OX-A связывается как с OX1R, так и с OX2R с равным сродством, тогда как OX-B связывается почти исключительно с OX2R. Оба рецептора взаимодействуют с белками Gq, Gs и Gi (Magga et al., 2006; Tang et al., 2008) и наблюдались как пре-, так и постсинаптически (van den Pol, Gao, Obrietan, Kilduff, & Belousov , 1998).
2.3 Эфферентные проекции
Хотя пептиды OX широко распространяются через мозг, их проекции наиболее сильно сконцентрированы в различных лимбических областях, участвующих в возбуждении и эмоциях. Таким образом, аксоны OX особенно плотны в гипоталамусе, откуда они следуют как восходящими, так и нисходящими путями (Peyron et al., 1998). Самая тяжелая проекция ОХ направлена на голубое пятно, но аксоны также очень плотны во многих областях переднего мозга (ядро ложа концевой полоски, паравентрикулярный и центральный медиальный таламус и субталамус), задний мозг (черная субстанция, ядро единственного тракта). , периакведуктальный серый, дорсальный шов и шва мага, и ретикулярные ядра) и задний гипоталамус (Peyron et al. , 1998). Рецепторы OX также сильно экспрессируются в каждой из этих областей, где во многих случаях присутствует только один или другой рецептор. Например, локус голубого цвета и ядро ложа имеют тяжелую экспрессию генов OX1R, но не обнаруживают OX2R, подобно вентромедиальному ядру гипоталамуса, которое содержит OX1R, но не OX2R; Напротив, центральный медиальный таламус содержит OX2R, но не OX1R, а паравентрикулярное ядро гипоталамуса имеет плотную экспрессию OX2R, но не OX1R (Триведи и др., 1998). Ядра, содержащие оба рецептора на сходных уровнях, включают паравентрикулярный таламус, дорсальный шов и вентральную тегментальную область (Marcus et al., 2001; Tvedi et al., 1998). Примечательно, что области мозга, не связанные с возбуждением или эмоциями, содержат меньше волокон и рецепторов OX, если таковые вообще имеются, включая хвостатую скорлупу, претектальную область и глазодвигательное ядро (Peyron et al., 1998; Tvedi et al., 1998).
, 1998). Рецепторы OX также сильно экспрессируются в каждой из этих областей, где во многих случаях присутствует только один или другой рецептор. Например, локус голубого цвета и ядро ложа имеют тяжелую экспрессию генов OX1R, но не обнаруживают OX2R, подобно вентромедиальному ядру гипоталамуса, которое содержит OX1R, но не OX2R; Напротив, центральный медиальный таламус содержит OX2R, но не OX1R, а паравентрикулярное ядро гипоталамуса имеет плотную экспрессию OX2R, но не OX1R (Триведи и др., 1998). Ядра, содержащие оба рецептора на сходных уровнях, включают паравентрикулярный таламус, дорсальный шов и вентральную тегментальную область (Marcus et al., 2001; Tvedi et al., 1998). Примечательно, что области мозга, не связанные с возбуждением или эмоциями, содержат меньше волокон и рецепторов OX, если таковые вообще имеются, включая хвостатую скорлупу, претектальную область и глазодвигательное ядро (Peyron et al., 1998; Tvedi et al., 1998).
2.3. Афферентные входы
В соответствии с их проекциями на лимбические области мозга, участвующие в возбуждении и эмоциях, тела клеток OX также получают афферентный вход от областей мозга и нейрохимических веществ, участвующих в этих поведенческих функциях, причем связи часто являются взаимными. Самый тяжелый вход в нейроны ОХ поступает от боковой перегородки и медиальной преоптической области, а также от ядра ложа терминальной полоски и заднего гипоталамуса, на которые проецируются сами эти нейроны (K. Yoshida, McCormack, Espana, Crocker, & Scammell, 2006). . Кроме того, нейроны получают входные данные от выбранных ядер переднего мозга (инфралимбическая кора, поясная кора, прилежащее ядро и миндалевидное тело), заднего мозга (голубое пятно, вентральная тегментальная область, черная субстанция, периакведуктальный серый и дорсальный шов) и гипоталамуса ( супрахиазматическое ядро, передний гипоталамус, вентромедиальный гипоталамус и супраммиллярное ядро), но не из таких областей, как хвостатая скорлупа, соматосенсорная кора или грушевидная кора, которые не связаны с возбуждением и эмоциями (К.Йошида и др., 2006). В соответствии с этими разнообразными афферентами, нейроны OX, как было обнаружено, экспрессируют различные типы рецепторов, помимо своих собственных, OX1R (Backberg, Hervieu, Wilson, & Meister, 2002) и OX2R (Yamanaka, Tabuchi, Tsunematsu, Fukazawa, & Томинага, 2010).
Самый тяжелый вход в нейроны ОХ поступает от боковой перегородки и медиальной преоптической области, а также от ядра ложа терминальной полоски и заднего гипоталамуса, на которые проецируются сами эти нейроны (K. Yoshida, McCormack, Espana, Crocker, & Scammell, 2006). . Кроме того, нейроны получают входные данные от выбранных ядер переднего мозга (инфралимбическая кора, поясная кора, прилежащее ядро и миндалевидное тело), заднего мозга (голубое пятно, вентральная тегментальная область, черная субстанция, периакведуктальный серый и дорсальный шов) и гипоталамуса ( супрахиазматическое ядро, передний гипоталамус, вентромедиальный гипоталамус и супраммиллярное ядро), но не из таких областей, как хвостатая скорлупа, соматосенсорная кора или грушевидная кора, которые не связаны с возбуждением и эмоциями (К.Йошида и др., 2006). В соответствии с этими разнообразными афферентами, нейроны OX, как было обнаружено, экспрессируют различные типы рецепторов, помимо своих собственных, OX1R (Backberg, Hervieu, Wilson, & Meister, 2002) и OX2R (Yamanaka, Tabuchi, Tsunematsu, Fukazawa, & Томинага, 2010). Эти другие рецепторы включают рецепторы серотонина (Collin, Backberg, Onnestam, & Meister, 2002), ацетилхолина (Chou, Rotman, & Saper, 2004; Garcia et al., 2015), аденозина (Thakkar, Winston, & McCarley, 2002). , ГАМК (Backberg, Collin, Ovesjo, & Meister, 2003; Backberg, Ultenius, Fritschy, & Meister, 2004) и лептин (Hakansson et al., 1999), хотя редко дофамин (Bubser et al., 2005), а также нейропептиды, холецистокинин (Tsujino et al., 2005), фактор высвобождения кортикотропина (Winsky-Sommerer et al., 2004), нейротензин ( Furutani et al., 2013), нейропептид Y (Fu, Acuna-Goycolea, & van den Pol, 2004) и галанин-подобный пептид (Kageyama et al., 2006), а также мю-опиоидный рецептор (Y. Zhou и др., 2006). Вместе эти связи помещают OX в центр мотивации регулирования сети.
Эти другие рецепторы включают рецепторы серотонина (Collin, Backberg, Onnestam, & Meister, 2002), ацетилхолина (Chou, Rotman, & Saper, 2004; Garcia et al., 2015), аденозина (Thakkar, Winston, & McCarley, 2002). , ГАМК (Backberg, Collin, Ovesjo, & Meister, 2003; Backberg, Ultenius, Fritschy, & Meister, 2004) и лептин (Hakansson et al., 1999), хотя редко дофамин (Bubser et al., 2005), а также нейропептиды, холецистокинин (Tsujino et al., 2005), фактор высвобождения кортикотропина (Winsky-Sommerer et al., 2004), нейротензин ( Furutani et al., 2013), нейропептид Y (Fu, Acuna-Goycolea, & van den Pol, 2004) и галанин-подобный пептид (Kageyama et al., 2006), а также мю-опиоидный рецептор (Y. Zhou и др., 2006). Вместе эти связи помещают OX в центр мотивации регулирования сети.
3.Роль орексина / гипокретина в гомеостатическом кормлении и другом адаптивном поведении
Хотя OX изначально был известен своей ролью в приеме пищи и энергетическом гомеостазе, вскоре стало очевидно, что этот нейропептид участвует во множестве других форм поведения, многие из которых служат для стимулирования выживание. К ним относятся не только гомеостатический прием пищи, но и регулирование сна и бодрствования, брачное поведение и материнское поведение.
К ним относятся не только гомеостатический прием пищи, но и регулирование сна и бодрствования, брачное поведение и материнское поведение.
3.1. Гомеостатический прием пищи
Исследования предоставляют четкие доказательства того, что нейроны ОХ действуют, способствуя поведению поиска пищи, как это обычно происходит во время длительного голодания, ограниченного кормления и гипогликемии, причем активация этих нейронов снижается после употребления пищи.Сообщалось, что экспрессия генов и уровни пептидов ОХ в мозге повышаются после 48- или 72-часового голодания (Fujiki et al., 2001; Moriguchi, Sakurai, Nambu, Yanagisawa, & Goto, 1999; Sakurai et al., 1998). Аналогичным образом, в рамках парадигмы ограниченного питания нейроны OX более активны непосредственно перед запланированной доступностью пищи (Johnstone, Fong, & Ленг, 2006; Mieda et al., 2004), в то время как мыши, лишенные гена OX, демонстрируют снижение активности бодрствования и двигательной активности во время период ожидания еды (Akiyama et al.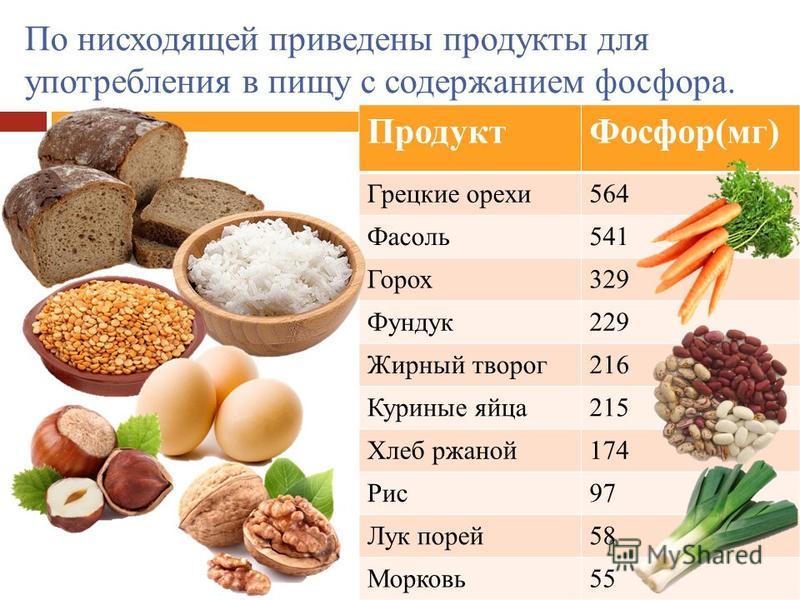 , 2004; Mieda et al., 2004). Уровни экспрессии генов и пептидов, а также активность нейронов OX также увеличиваются в состоянии гипогликемии (Bayer et al., 2000; Griffond, Risold, Jacquemard, Colard & Fellmann, 1999), что корректируется при повышении уровня глюкозы. восстанавливается при приеме пищи (Cai et al., 2001). Хотя гипергликемия, по-видимому, не влияет на уровни мРНК OX (Griffond et al., 1999), глюкоза на физиологических уровнях снижает возбуждение нейронов OX в зависимости от концентрации (Burdakov, Gerasimenko, & Verkhratsky, 2005).Это указывает на то, что в физиологических условиях нейроны OX активируются и транскрибируют нейропептид, когда уровни глюкозы низкие, например, при голодании или ограниченном питании, и они ингибируются, когда уровни глюкозы высоки.
, 2004; Mieda et al., 2004). Уровни экспрессии генов и пептидов, а также активность нейронов OX также увеличиваются в состоянии гипогликемии (Bayer et al., 2000; Griffond, Risold, Jacquemard, Colard & Fellmann, 1999), что корректируется при повышении уровня глюкозы. восстанавливается при приеме пищи (Cai et al., 2001). Хотя гипергликемия, по-видимому, не влияет на уровни мРНК OX (Griffond et al., 1999), глюкоза на физиологических уровнях снижает возбуждение нейронов OX в зависимости от концентрации (Burdakov, Gerasimenko, & Verkhratsky, 2005).Это указывает на то, что в физиологических условиях нейроны OX активируются и транскрибируют нейропептид, когда уровни глюкозы низкие, например, при голодании или ограниченном питании, и они ингибируются, когда уровни глюкозы высоки.
Роль OX в стимулировании приема стандартной пищи, по-видимому, связана с OX1R в первую очередь в областях гипоталамуса, где существуют нейроны OX, причем OX, вероятно, действует на эти нейроны, а также на другие локальные популяции нейронов.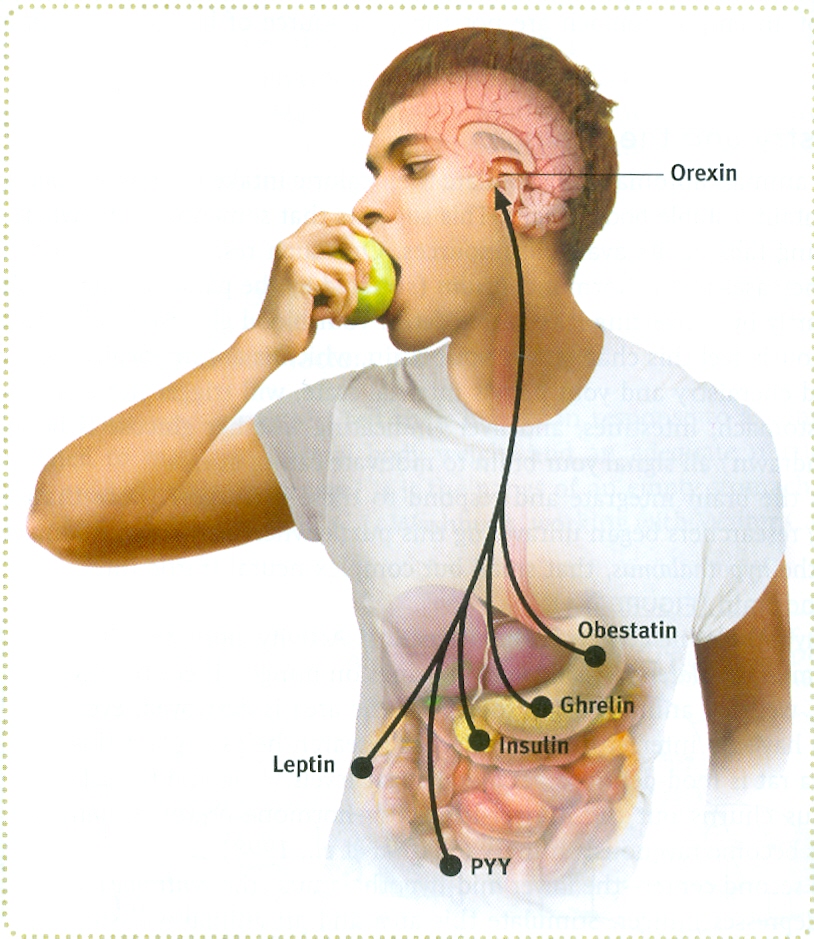 В частности, потребление лабораторной еды увеличивается за счет фармакогенетической активации нейронов OX и уменьшается за счет обширной абляции этих нейронов или периферической инъекции антагониста OX1R (Haynes et al., 2000; Инуцука и др., 2014). В ходе экспериментов с микроинъекциями было обнаружено, что эти эффекты OX в стимулировании приема пищи в значительной степени связаны с действием OX-A в тех же субрегионах гипоталамуса, где транскрибируется сам OX, а именно в перифорнийской области, латеральном гипоталамусе и дорсомедиальном гипоталамусе, с OX-B мало влияет на питание (Dube, Kalra, & Kalra, 1999; Sweet, Levine, Billington, & Kotz, 1999). Таким образом, эти действия OX-A, вероятно, опосредуются OX1R, которые расположены как на самих нейронах OX, так и на нейронах, экспрессирующих нейропептид, способствующий питанию, меланин-концентрирующий гормон (Backberg et al., 2002). Напротив, OX, вводимый в другие области мозга, включая вентромедиальный гипоталамус, преоптическую область, миндалевидное тело, вентральную тегментальную область или ядро единственного тракта, оказывает незначительное влияние на потребление пищи (Dube et al.
В частности, потребление лабораторной еды увеличивается за счет фармакогенетической активации нейронов OX и уменьшается за счет обширной абляции этих нейронов или периферической инъекции антагониста OX1R (Haynes et al., 2000; Инуцука и др., 2014). В ходе экспериментов с микроинъекциями было обнаружено, что эти эффекты OX в стимулировании приема пищи в значительной степени связаны с действием OX-A в тех же субрегионах гипоталамуса, где транскрибируется сам OX, а именно в перифорнийской области, латеральном гипоталамусе и дорсомедиальном гипоталамусе, с OX-B мало влияет на питание (Dube, Kalra, & Kalra, 1999; Sweet, Levine, Billington, & Kotz, 1999). Таким образом, эти действия OX-A, вероятно, опосредуются OX1R, которые расположены как на самих нейронах OX, так и на нейронах, экспрессирующих нейропептид, способствующий питанию, меланин-концентрирующий гормон (Backberg et al., 2002). Напротив, OX, вводимый в другие области мозга, включая вентромедиальный гипоталамус, преоптическую область, миндалевидное тело, вентральную тегментальную область или ядро единственного тракта, оказывает незначительное влияние на потребление пищи (Dube et al. , 1999; Sweet et al. , 1999). Таким образом, способствуя гомеостатическому приему пищи, OX, по-видимому, действует преимущественно на OX1R в дорсальной и латеральной областях гипоталамуса, где он может реагировать на физиологические сигналы, такие как падение уровня глюкозы, которое происходит, когда животным больше всего нужно искать и потреблять еда.
, 1999; Sweet et al. , 1999). Таким образом, способствуя гомеостатическому приему пищи, OX, по-видимому, действует преимущественно на OX1R в дорсальной и латеральной областях гипоталамуса, где он может реагировать на физиологические сигналы, такие как падение уровня глюкозы, которое происходит, когда животным больше всего нужно искать и потреблять еда.
3.2. Регламент сна и бодрствования
Кормление и пробуждение тесно связаны друг с другом. Во время голодания животные демонстрируют более короткие эпизоды сна, частота которых уменьшается с увеличением продолжительности депривации (Borbely, 1977; Dewasmes, Duchamp, & Minaire, 1989). Они также демонстрируют повышенную двигательную активность (Jones, Bellingham, & Ward, 1990; Mabry & Campbell, 1975; Moskowitz, 1959), что, возможно, отражает усиление кормового поведения. Подобно поиску пищи, OX прочно связан с поведением бодрствования в цикле сна-бодрствования, причем это поведение частично вызвано его высвобождением в голубом пятне. Эта связь была особенно отмечена в исследованиях нарколепсии, которая у собак вызвана нарушением OX2R (Lin et al., 1999), а у людей связана с почти неопределяемым количеством нейронов OX в головном мозге и уровнями OX в мозге. спинномозговая жидкость (Nishino, Ripley, Overeem, Lammers, & Mignot, 2000; Thannickal et al., 2000). Более того, нарколепсия облегчается интраназальным введением OX-A (Baier et al., 2011). В соответствии с этими данными, манипуляции с экспрессией эндогенного гена OX влияют на бодрствование и сон.Мыши, лишенные гена OX, демонстрируют нестабильность поведения, имея частые и быстрые переходы между периодами бодрствования и сна (Chemelli et al., 1999; Diniz Behn, Klerman, Mochizuki, Lin, & Scammell, 2010; Mochizuki et al., 2004), и у рыбок данио, сверхэкспрессирующих OX, наблюдается повышенное возбуждение и снижение начала и продолжительности периодов отдыха (Prober, Rihel, Onah, Sung, & Schier, 2006). В нормальных условиях возбуждение нейронов ОХ тесно связано с состоянием возбуждения, чаще всего происходит во время активного бодрствования и реже во время спокойного бодрствования, и оно отсутствует во время медленного сна, преходяще во время сна с быстрым движением глаз и увеличивается.
Эта связь была особенно отмечена в исследованиях нарколепсии, которая у собак вызвана нарушением OX2R (Lin et al., 1999), а у людей связана с почти неопределяемым количеством нейронов OX в головном мозге и уровнями OX в мозге. спинномозговая жидкость (Nishino, Ripley, Overeem, Lammers, & Mignot, 2000; Thannickal et al., 2000). Более того, нарколепсия облегчается интраназальным введением OX-A (Baier et al., 2011). В соответствии с этими данными, манипуляции с экспрессией эндогенного гена OX влияют на бодрствование и сон.Мыши, лишенные гена OX, демонстрируют нестабильность поведения, имея частые и быстрые переходы между периодами бодрствования и сна (Chemelli et al., 1999; Diniz Behn, Klerman, Mochizuki, Lin, & Scammell, 2010; Mochizuki et al., 2004), и у рыбок данио, сверхэкспрессирующих OX, наблюдается повышенное возбуждение и снижение начала и продолжительности периодов отдыха (Prober, Rihel, Onah, Sung, & Schier, 2006). В нормальных условиях возбуждение нейронов ОХ тесно связано с состоянием возбуждения, чаще всего происходит во время активного бодрствования и реже во время спокойного бодрствования, и оно отсутствует во время медленного сна, преходяще во время сна с быстрым движением глаз и увеличивается. опять же непосредственно перед пробуждением (Ли, Хассани и Джонс, 2005; Такахаши, Лин и Сакаи, 2008).Уровни пептида OX в гипоталамусе и таламусе также были выше во время бодрствования по сравнению со сном (Kiyashchenko et al., 2002; Y. Yoshida et al., 2001). Возможно, наиболее убедительным доказательством того, что активация ОХ способствует пробуждению, является открытие того факта, что оптогенетическая стимуляция нейронов ОХ увеличивает вероятность перехода от сна к бодрствованию (Adamantidis, Zhang, Aravanis, Deisseroth, & de Lecea, 2007), и это, по-видимому, в основном из-за изменений активности OX1R в голубом пятне (Carter et al., 2012; Hasegawa, Yanagisawa, Sakurai, & Mieda, 2014), где афференты OX являются наиболее плотными (Peyron et al., 1998). В совокупности эти исследования подтверждают, что OX через OX1R и OX2R стимулирует состояние возбуждения, которое способствует поиску пищи.
опять же непосредственно перед пробуждением (Ли, Хассани и Джонс, 2005; Такахаши, Лин и Сакаи, 2008).Уровни пептида OX в гипоталамусе и таламусе также были выше во время бодрствования по сравнению со сном (Kiyashchenko et al., 2002; Y. Yoshida et al., 2001). Возможно, наиболее убедительным доказательством того, что активация ОХ способствует пробуждению, является открытие того факта, что оптогенетическая стимуляция нейронов ОХ увеличивает вероятность перехода от сна к бодрствованию (Adamantidis, Zhang, Aravanis, Deisseroth, & de Lecea, 2007), и это, по-видимому, в основном из-за изменений активности OX1R в голубом пятне (Carter et al., 2012; Hasegawa, Yanagisawa, Sakurai, & Mieda, 2014), где афференты OX являются наиболее плотными (Peyron et al., 1998). В совокупности эти исследования подтверждают, что OX через OX1R и OX2R стимулирует состояние возбуждения, которое способствует поиску пищи.
3.3. Брачное поведение
Орексин / гипокретин также был связан с брачным поведением, при этом опубликованные исследования, изучающие самцов крыс, предполагают, что это происходит в основном через OX1R в медиальной преоптической области гипоталамуса. Нейроны, экспрессирующие OX, активируются во время копулятивного поведения (Muschamp, Dominguez, Sato, Shen, & Hull, 2007), а инъекция OX-A в медиальную преоптическую область увеличивает сексуальное возбуждение и производительность (Gulia, Mallick, & Kumar, 2003), в то время как системная блокада OX1R нарушает копулятивное поведение (Muschamp et al., 2007). Эти эффекты могут быть также частично связаны с влиянием на поощрительные или мотивационные аспекты такого поведения. Об этом свидетельствуют данные о том, что поражения нейронов ОХ предотвращают формирование условного предпочтения места для камеры, ранее связанной с сексуальным поведением (Di Sebastiano, Wilson-Perez, Lehman, & Coolen, 2011), и что волокна ОХ связаны с тирозингидроксилазой. положительные нейроны в вентральной тегментальной области, которые также демонстрируют повышенную активацию во время копуляции (Muschamp et al., 2007). Таким образом, спаривание — это еще одно поведение, связанное с возбуждением и выживанием, которое усиливается за счет активности OX, причем на само поведение влияет OX, действующий на OX1R в медиальной преоптической области гипоталамуса, и его вознаграждение, преимущественно связанное с OX в лимбической вентральной тегментальной области.
Нейроны, экспрессирующие OX, активируются во время копулятивного поведения (Muschamp, Dominguez, Sato, Shen, & Hull, 2007), а инъекция OX-A в медиальную преоптическую область увеличивает сексуальное возбуждение и производительность (Gulia, Mallick, & Kumar, 2003), в то время как системная блокада OX1R нарушает копулятивное поведение (Muschamp et al., 2007). Эти эффекты могут быть также частично связаны с влиянием на поощрительные или мотивационные аспекты такого поведения. Об этом свидетельствуют данные о том, что поражения нейронов ОХ предотвращают формирование условного предпочтения места для камеры, ранее связанной с сексуальным поведением (Di Sebastiano, Wilson-Perez, Lehman, & Coolen, 2011), и что волокна ОХ связаны с тирозингидроксилазой. положительные нейроны в вентральной тегментальной области, которые также демонстрируют повышенную активацию во время копуляции (Muschamp et al., 2007). Таким образом, спаривание — это еще одно поведение, связанное с возбуждением и выживанием, которое усиливается за счет активности OX, причем на само поведение влияет OX, действующий на OX1R в медиальной преоптической области гипоталамуса, и его вознаграждение, преимущественно связанное с OX в лимбической вентральной тегментальной области. .
.
3.4. Материнское поведение
Исследования также показывают, что OX усиливает материнское поведение, как и при спаривании, через OX1R в медиальной преоптической области гипоталамуса. Экспрессия генов OX повышена у беременных и кормящих самок крыс по сравнению с небеременными или нелактирующими крысами (Kanenishi et al., 2004; Sun, Narita, Murata, Honda, & Higuchi, 2003), а количество нейронов, экспрессирующих OX, также увеличивается во время лактации (Sun et al., 2003). В соответствии с этим инъекция OX-A в желудочки головного мозга или в медиальную преоптическую область, в частности, усиливает вылизывание и уход за детенышами, но не самими собой, в то время как инъекции антагониста OX1R в периферическую или медиальную преоптическую зону снижают это поведение (D’Anna & Gammie, 2006; Ривас, Тортероло, Феррейра и Бенедетто, 2016). Возможно, что увеличение OX в перинатальном периоде также влияет на другие поведения, наблюдаемые у матерей в это время, включая нарушение сна (Bei, Coo, & Trinder, 2015) и повышенное потребление калорий (Whichelow, 1975), которые в конечном итоге привязан к заботе о потомстве.
4. Роль орексина / гипокретина в негомеостатическом поступлении
В то время как адаптивное поведение обычно осуществляется гомеостатически, что предполагает отрицательную обратную связь, прием положительных веществ, вызываемых злоупотреблением, часто является негомеостатическим и включает петлю положительной обратной связи, которая способствует чрезмерному потреблению. Хотя механизмы, лежащие в основе этого адаптивного поведения и поведения чрезмерного потребления, могут казаться разными, известно, что эти поведения имеют общее функционирование посредством дофамина в оболочке прилежащего ядра.Уровни и выброс дофамина увеличиваются в ответ на адаптивное поведение, включая прием пищи (Martel & Fantino, 1996), состояние бодрствования (Lena et al., 2005), брачное поведение (Pfaus et al., 1990) и материнское поведение (Champagne et al., 2004), а также предшествующее этому поведению (Champagne et al., 2004), с допамином, по-видимому, способствующим их инициированию (Pisanu et al. , 2015). Аналогичным образом, накопительный уровень дофамина увеличивается за счет приема полезных веществ, включая вкусные продукты с высоким содержанием жира или сахара (Rada, Avena, Barson, Hoebel, & Leibowitz, 2012; Rada, Avena, & Hoebel, 2005; Sahr et al., 2008) и наркотиками, вызывающими злоупотребление, такими как алкоголь (Howard, Schier, Wetzel, Duvauchelle, & Gonzales, 2008), никотин (Cadoni & Di Chiara, 2000; Pontieri, Tanda, Orzi, & Di Chiara, 1996) и кокаин ( Pontieri, Tanda, & Di Chiara, 1995), и они также повышаются до начала приема (Cacciapaglia, Saddoris, Wightman, & Carelli, 2012; Doyon et al., 2003; Suto, Ecke, You, & Wise , 2010). Примечательно, что увеличение накопленного дофамина, вызванное приемом этих полезных веществ, значительно больше, чем увеличение, вызванное адаптивным поведением (Martel & Fantino, 1996), что позволяет предположить, что системы, управляющие этим поведением, различаются только по степени.Хотя OX похож на дофамин в том, что он играет важную роль в стимулировании как адаптивного поведения, так и негомеостатического потребления полезных веществ, примечательно, что OX действует через гипоталамус, оказывая свое влияние на гомеостатическое поведение, но действует через экстра- гипоталамические лимбические области, чтобы оказывать влияние на негомеостатическое поведение.
, 2015). Аналогичным образом, накопительный уровень дофамина увеличивается за счет приема полезных веществ, включая вкусные продукты с высоким содержанием жира или сахара (Rada, Avena, Barson, Hoebel, & Leibowitz, 2012; Rada, Avena, & Hoebel, 2005; Sahr et al., 2008) и наркотиками, вызывающими злоупотребление, такими как алкоголь (Howard, Schier, Wetzel, Duvauchelle, & Gonzales, 2008), никотин (Cadoni & Di Chiara, 2000; Pontieri, Tanda, Orzi, & Di Chiara, 1996) и кокаин ( Pontieri, Tanda, & Di Chiara, 1995), и они также повышаются до начала приема (Cacciapaglia, Saddoris, Wightman, & Carelli, 2012; Doyon et al., 2003; Suto, Ecke, You, & Wise , 2010). Примечательно, что увеличение накопленного дофамина, вызванное приемом этих полезных веществ, значительно больше, чем увеличение, вызванное адаптивным поведением (Martel & Fantino, 1996), что позволяет предположить, что системы, управляющие этим поведением, различаются только по степени.Хотя OX похож на дофамин в том, что он играет важную роль в стимулировании как адаптивного поведения, так и негомеостатического потребления полезных веществ, примечательно, что OX действует через гипоталамус, оказывая свое влияние на гомеостатическое поведение, но действует через экстра- гипоталамические лимбические области, чтобы оказывать влияние на негомеостатическое поведение. Таким образом, OX увеличивает потребление, готовность к работе, стремление к поведению и вознаграждение, получаемое от приема полезных веществ, действуя через прилежащее ядро, вентральную тегментальную область и паравентрикулярное ядро таламуса, где локальное применение OX приводит к повышенный внеклеточный уровень дофамина в прилежащей области (Choi et al., 2012; Короткова, Сергеева, Эрикссон, Хаас и Браун, 2003; Нарита и др., 2006; Патял, Ву и Боргланд, 2012 г.). Работая в основном за пределами гипоталамуса, чтобы повлиять на использование полезных веществ, роль OX в негомеостатическом поведении может фундаментально отличаться от роли гомеостатического поведения, направленного на выживание, способствуя чрезмерному потреблению, которое может привести к зависимости.
Таким образом, OX увеличивает потребление, готовность к работе, стремление к поведению и вознаграждение, получаемое от приема полезных веществ, действуя через прилежащее ядро, вентральную тегментальную область и паравентрикулярное ядро таламуса, где локальное применение OX приводит к повышенный внеклеточный уровень дофамина в прилежащей области (Choi et al., 2012; Короткова, Сергеева, Эрикссон, Хаас и Браун, 2003; Нарита и др., 2006; Патял, Ву и Боргланд, 2012 г.). Работая в основном за пределами гипоталамуса, чтобы повлиять на использование полезных веществ, роль OX в негомеостатическом поведении может фундаментально отличаться от роли гомеостатического поведения, направленного на выживание, способствуя чрезмерному потреблению, которое может привести к зависимости.
4.1. Роль орексина / гипокретина в переедании
Стимулируя потребление стандартной пищи для поддержания физиологического уровня глюкозы, ОХ действует гомеостатически.Это сильно отличается от роли OX в потреблении вкусных продуктов с высоким содержанием жира или сахара, поскольку обнаружено, что OX не только способствует их потреблению, но и значительно усиливается за счет их приема.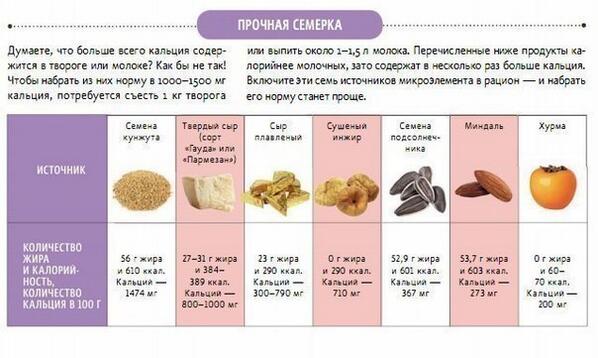 Это взаимодействие между OX и вкусной пищей отражает петлю положительной обратной связи, которая с более сильным сигналом OX, возникающим после каждого эпизода приема пищи, может способствовать чрезмерному потреблению жира и сахара.
Это взаимодействие между OX и вкусной пищей отражает петлю положительной обратной связи, которая с более сильным сигналом OX, возникающим после каждого эпизода приема пищи, может способствовать чрезмерному потреблению жира и сахара.
4.1.1. Влияние орексина / гипокретина на аспекты приема вкусной пищи
Подобно своей роли в контроле потребления стандартной пищи, эндогенный оксид кислорода, по-видимому, способствует потреблению вкусной пищи, прежде всего за счет своего воздействия на OX1R.Мыши, лишенные гена OX, по сравнению с мышами дикого типа, потребляют меньше сахарозы, когда она доступна ad libitum , даже с учетом различий в их двигательной активности (Matsuo et al., 2011). Роль OX1R в опосредовании приема вкусной пищи подтверждается данными о том, что системная инъекция антагониста OX1R, SB-334867, снижает оперантную реакцию как на сахарозу, так и на гранулы сахарина, в парадигме минимальной работы с фиксированным соотношением 1 ( Кейсон и Астон-Джонс, 2013a, 2013b, 2014). Этот антагонист также подавляет потребление сахарозы, сахарина и фруктозы, подобное перееданию, в рамках парадигмы питья в домашних условиях с прерывистым доступом (Alcaraz-Iborra, Carvajal, Lerma-Cabrera, Valor, & Cubero, 2014; Rorabaugh, Stratford, & Zahniser, 2014) и сокращает потребление диеты с высоким содержанием жиров как при ad libitum , так и при ограниченном доступе (Choi, Davis, Fitzgerald, & Benoit, 2010; Valdivia, Patrone, Reynaldo, & Perello, 2014; White et al. , 2005). Другие антагонисты OX1R аналогичным образом снижают потребление сладкой жирной пищи, независимо от того, соответствует ли она нормам питания ad libitum или периодическому доступу (Piccoli et al., 2012; Steiner, Sciarretta, Pasquali, & Jenck, 2013). Одно исследование антагониста OX2R, показывающее отсутствие эффекта системной инъекции JNJ-10397049 на потребление Nutella ® (Piccoli et al., 2012), подтверждает особую роль OX1R, но не OX2R в вкусной пище. потребление.
Этот антагонист также подавляет потребление сахарозы, сахарина и фруктозы, подобное перееданию, в рамках парадигмы питья в домашних условиях с прерывистым доступом (Alcaraz-Iborra, Carvajal, Lerma-Cabrera, Valor, & Cubero, 2014; Rorabaugh, Stratford, & Zahniser, 2014) и сокращает потребление диеты с высоким содержанием жиров как при ad libitum , так и при ограниченном доступе (Choi, Davis, Fitzgerald, & Benoit, 2010; Valdivia, Patrone, Reynaldo, & Perello, 2014; White et al. , 2005). Другие антагонисты OX1R аналогичным образом снижают потребление сладкой жирной пищи, независимо от того, соответствует ли она нормам питания ad libitum или периодическому доступу (Piccoli et al., 2012; Steiner, Sciarretta, Pasquali, & Jenck, 2013). Одно исследование антагониста OX2R, показывающее отсутствие эффекта системной инъекции JNJ-10397049 на потребление Nutella ® (Piccoli et al., 2012), подтверждает особую роль OX1R, но не OX2R в вкусной пище. потребление.
В отличие от первичной роли гипоталамуса в опосредовании воздействия ОКС на потребление стандартной пищи, центральная группа предполагает наличие нескольких внегипоталамических лимбических областей мозга, включая прилежащее ядро, вентральную тегментальную область и паравентрикулярное ядро таламуса исследования, связанные с инъекциями, для определения стимулирующего действия OX на прием вкусной пищи. Таким образом, OX-A увеличивает потребление M & Ms ® при введении в оболочку прилежащего ядра (Castro, Terry, & Berridge, 2016), раствора сахарозы и диеты с высоким содержанием жиров после инъекции в вентральную тегментальную область (Terrill et al. al., 2016), и раствора сахарозы после инъекции в паравентрикулярный таламус (Barson, Ho, & Leibowitz, 2015). Напротив, антагонист OX1R SB-334867 снижает потребление сахарозы при введении в вентральную область покрышки (Terrill et al., 2016), а нокдаун OX1R в паравентрикулярном таламусе подавляет потребление диеты с высоким содержанием жиров (Choi et al., 2012). О возможной дополнительной роли ядер гипоталамуса и заднего мозга в эффектах OX свидетельствуют данные о том, что потребление диеты с высоким содержанием жиров стимулируется инъекцией OX-A в третий желудочек в области гипоталамуса (Clegg, Air, Woods, & Seeley, 2002), а также четвертый желудочек (Kay, Parise, Lilly, & Williams, 2014) и дорсальный комплекс блуждающего нерва (Zheng, Patterson, & Berthoud, 2005).
Таким образом, OX-A увеличивает потребление M & Ms ® при введении в оболочку прилежащего ядра (Castro, Terry, & Berridge, 2016), раствора сахарозы и диеты с высоким содержанием жиров после инъекции в вентральную тегментальную область (Terrill et al. al., 2016), и раствора сахарозы после инъекции в паравентрикулярный таламус (Barson, Ho, & Leibowitz, 2015). Напротив, антагонист OX1R SB-334867 снижает потребление сахарозы при введении в вентральную область покрышки (Terrill et al., 2016), а нокдаун OX1R в паравентрикулярном таламусе подавляет потребление диеты с высоким содержанием жиров (Choi et al., 2012). О возможной дополнительной роли ядер гипоталамуса и заднего мозга в эффектах OX свидетельствуют данные о том, что потребление диеты с высоким содержанием жиров стимулируется инъекцией OX-A в третий желудочек в области гипоталамуса (Clegg, Air, Woods, & Seeley, 2002), а также четвертый желудочек (Kay, Parise, Lilly, & Williams, 2014) и дорсальный комплекс блуждающего нерва (Zheng, Patterson, & Berthoud, 2005). Таким образом, эти данные свидетельствуют о том, что гомеостатическое потребление вкусной пищи контролируется OX, действующим в гипоталамусе, в то время как негомеостатическое потребление контролируется OX в экстрагипоталамических лимбических областях мозга.
Таким образом, эти данные свидетельствуют о том, что гомеостатическое потребление вкусной пищи контролируется OX, действующим в гипоталамусе, в то время как негомеостатическое потребление контролируется OX в экстрагипоталамических лимбических областях мозга.
В дополнение к потреблению вкусной пищи, OX также увеличивает готовность человека работать для этой пищи, что измеряется с помощью задачи с прогрессивным соотношением, которая последовательно увеличивает количество оперантных реакций, необходимых для получения подкрепления, с точкой останова. требование, при котором отклик прекращается.Об участии эндогенного OX в выполнении этой задачи свидетельствуют данные о том, что желудочковая инъекция OX-A увеличивает точку разрыва для сахарозы (Choi et al., 2010; Kay et al., 2014), в то время как периферическая инъекция OX1R антагонист SB-334867 снижает точку разрыва для сахарозы (Cason & Aston-Jones, 2013b; Espana et al., 2010), диеты с высоким содержанием жиров (Borgland et al., 2009) и гранул сладкого жира (Choi et al.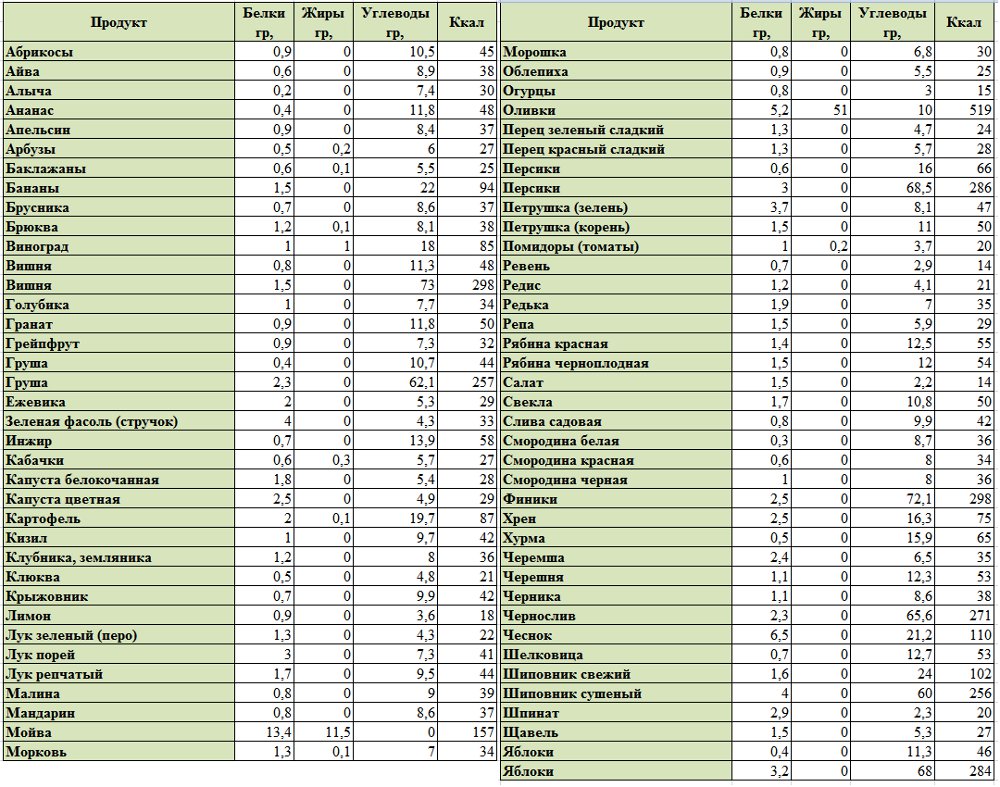 , 2010). Конкретный участок мозга, участвующий в этой реакции, еще предстоит идентифицировать, при этом OX-A в вентральной тегментальной области не может повлиять на точку останова для сахарозы (Terrill et al., 2016) и нокдаун OX1R в паравентрикулярном таламусе, не влияющий на точку останова для диеты с высоким содержанием жиров (Choi et al., 2012). Учитывая его тесную связь с мотивацией (Hamid et al., 2016), прилежащее ядро, вероятно, является областью мозга, которая опосредует влияние OX на готовность работать за вкусную пищу.
, 2010). Конкретный участок мозга, участвующий в этой реакции, еще предстоит идентифицировать, при этом OX-A в вентральной тегментальной области не может повлиять на точку останова для сахарозы (Terrill et al., 2016) и нокдаун OX1R в паравентрикулярном таламусе, не влияющий на точку останова для диеты с высоким содержанием жиров (Choi et al., 2012). Учитывая его тесную связь с мотивацией (Hamid et al., 2016), прилежащее ядро, вероятно, является областью мозга, которая опосредует влияние OX на готовность работать за вкусную пищу.
Возможность того, что OX также влияет на поиск вкусной пищи, измеряемая по восстановлению после исчезновения, предполагается в некоторых, но не во всех отчетах. Было показано, что антагонист OX1R SB-334867 в дозе 30 мг / кг ингибирует вызванное сигналом восстановление ответа на сахарозу или сахарин у самцов крыс (Cason & Aston-Jones, 2013a, 2013b).Этот эффект антагониста, однако, не проявляется у самок крыс (Cason & Aston-Jones, 2014), а также не наблюдается при более низкой дозе (10 мг / кг) у самцов крыс с индуцированным сигналом возобновлением употребления сгущенного молока. (Мартин-Фардон и Вайс, 2014a). Хотя результаты ясно показывают, что OX действует через OX1R, способствуя потреблению ряда вкусных продуктов и готовности работать с этими продуктами, возможность того, что он влияет на поиск этих продуктов, требует дальнейшего изучения.
(Мартин-Фардон и Вайс, 2014a). Хотя результаты ясно показывают, что OX действует через OX1R, способствуя потреблению ряда вкусных продуктов и готовности работать с этими продуктами, возможность того, что он влияет на поиск этих продуктов, требует дальнейшего изучения.
4.1.2. Влияние приема вкусной пищи на орексин / гипокретин
Было обнаружено, что помимо стимулирования приема вкусной пищи, сам эндогенный оксид кислорода очень чувствителен к потреблению вкусной пищи, при этом как экспрессия его генов, так и уровни пептидов зависят от времени . В то время как экспрессия OX первоначально снижается в течение первых 30 минут после потребления сахарозы или некалорийного сахарина по сравнению с водой (Alcaraz-Iborra et al., 2014), аналогично гомеостатическому ингибированию возбуждения нейронов OX, вызванному физиологическим подъемом в глюкозе (Бурдаков и др., 2005), дальнейшие измерения показывают, что уровни пептида OX впоследствии повышаются при приеме вкусной пищи. Они повышаются через час после употребления сахарина по сравнению с водой, до уровня выше, чем после стандартной лабораторной еды (Furudono, Ando, Yamamoto, Kobashi, & Yamamoto, 2006), а также через два-четыре часа после употребления в пищу сахарина. гранулы сахарозы по сравнению с кормом (Olszewski et al., 2009). Точно так же эндогенный OX стимулируется употреблением вкусных диет с высоким содержанием жира.Экспрессия генов OX повышается через два часа после приема пищи с высоким содержанием жиров по сравнению с приемом пищи с низким содержанием жира (Gaysinskaya, Karatayev, Chang, & Leibowitz, 2007), а мРНК OX и количество OX-A-иммунореактивных нейронов выше после трех недель ad libitum потребления диеты с высоким содержанием жиров (Park et al., 2004; Wortley, Chang, Davydova, & Leibowitz, 2003). Примечательно, что это повышение уровня мРНК и пептидов OX, наблюдаемое в течение первых трех недель доступа к диете с высоким содержанием жиров, больше не проявляется после восьми или двенадцати недель доступа (Cai et al., 1999; Нобунага и др., 2014; Xu, Wan, Tang, Wu, & Cai, 2008), что аналогично временной схеме приема пищи при диете с высоким содержанием жиров с гиперфагией, возникающей в течение первых нескольких недель доступа, но не позже (Honors, Hargrave, & Kinzig, 2012 ; Vasselli & Maggio, 1990; J.
гранулы сахарозы по сравнению с кормом (Olszewski et al., 2009). Точно так же эндогенный OX стимулируется употреблением вкусных диет с высоким содержанием жира.Экспрессия генов OX повышается через два часа после приема пищи с высоким содержанием жиров по сравнению с приемом пищи с низким содержанием жира (Gaysinskaya, Karatayev, Chang, & Leibowitz, 2007), а мРНК OX и количество OX-A-иммунореактивных нейронов выше после трех недель ad libitum потребления диеты с высоким содержанием жиров (Park et al., 2004; Wortley, Chang, Davydova, & Leibowitz, 2003). Примечательно, что это повышение уровня мРНК и пептидов OX, наблюдаемое в течение первых трех недель доступа к диете с высоким содержанием жиров, больше не проявляется после восьми или двенадцати недель доступа (Cai et al., 1999; Нобунага и др., 2014; Xu, Wan, Tang, Wu, & Cai, 2008), что аналогично временной схеме приема пищи при диете с высоким содержанием жиров с гиперфагией, возникающей в течение первых нескольких недель доступа, но не позже (Honors, Hargrave, & Kinzig, 2012 ; Vasselli & Maggio, 1990; J.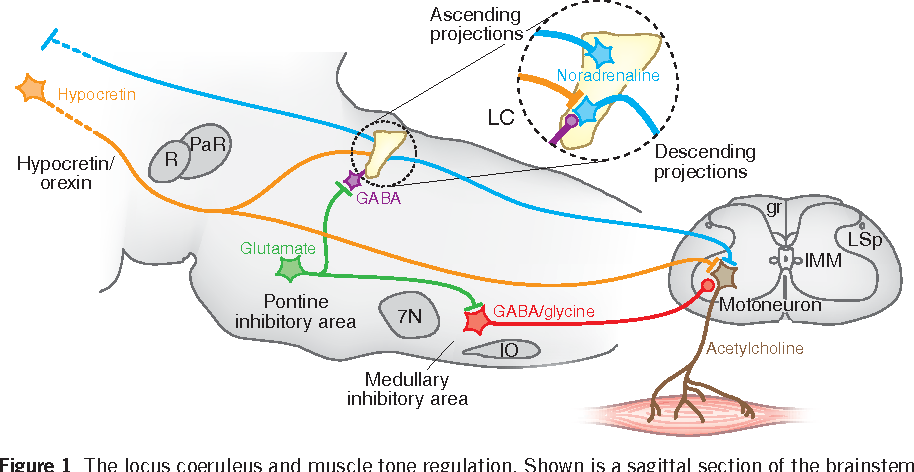 Wang et al., 1998). Эти данные о продуктах, богатых сахаром и жиром, подтверждают идею о том, что OX функционирует в петле положительной обратной связи с вкусной едой, при этом OX действует на OX1R, чтобы стимулировать и в конечном итоге увеличивать их потребление, что приводит к их чрезмерному потреблению.
Wang et al., 1998). Эти данные о продуктах, богатых сахаром и жиром, подтверждают идею о том, что OX функционирует в петле положительной обратной связи с вкусной едой, при этом OX действует на OX1R, чтобы стимулировать и в конечном итоге увеличивать их потребление, что приводит к их чрезмерному потреблению.
4.1.3. Влияние пренатального употребления вкусной пищи на орексин / гипокретин
Как и при приеме взрослыми, воздействие вкусной пищи во время пренатального периода может повлиять на экспрессию и уровни эндогенного ОХ. Крысы подвергали внутриутробному воздействию диеты с высоким содержанием жиров по сравнению со сбалансированной диетой показывают в подростковом и взрослом возрасте более высокую экспрессию генов и уровни пептидов OX (Chang, Gaysinskaya, Karatayev, & Leibowitz, 2008; Poon, Barson, Fagan, & Leibowitz , 2012). Это увеличение эндогенного ОХ у животных, подвергшихся пренатальному воздействию, сопровождается увеличением потребления калорий, потребляемых стандартной пищей, а также более высоким предпочтением диеты с высоким содержанием жиров (Chang et al. , 2008). Показано, что эндогенный оксид кислорода у взрослых способствует потреблению вкусной, богатой жирами диеты, и это открытие предполагает, что повышенное высвобождение оксида азота способствует чрезмерному потребительному поведению, наблюдаемому у животных, которым пренатально давалась эта вкусная еда.
, 2008). Показано, что эндогенный оксид кислорода у взрослых способствует потреблению вкусной, богатой жирами диеты, и это открытие предполагает, что повышенное высвобождение оксида азота способствует чрезмерному потребительному поведению, наблюдаемому у животных, которым пренатально давалась эта вкусная еда.
4.1.4. Клинические доказательства роли орексина / гипокретина в приеме вкусной пищи
Клинические исследования также связывают ОХ с нарушениями в приеме вкусной пищи, хотя взаимосвязь может быть не такой прямой, как наблюдаемая у животных.Данные свидетельствуют о том, что люди с нарколепсией, у которых отсутствует ОКС, значительно увеличивают потребление вкусной пищи. Они потребляют почти в четыре раза больше калорий, чем здоровые представители контрольной группы, когда ad libitum имеют доступ к закускам (van Holst et al., 2016), и они получают значительно больше калорий, чем контрольная группа по шкале переедания (Dimitrova et al., 2011) . Хотя эти результаты противоречат результатам, наблюдаемым у животных, которых обследуют в первую очередь после кратковременного и обратимого ингибирования OX1R, возможно, что повышенное потребление вкусной пищи у пациентов с нарколепсией отражает поведенческий паттерн, который чрезмерно компенсирует почти полную и хроническую потерю OX функция.
4.2. Роль орексина / гипокретина в употреблении алкоголя
Положительная обратная связь между OX и вкусной пищей также очевидна в отношении алкоголя. Поскольку алкоголь является наркотиком, вызывающим злоупотребление, а также пищей, содержащей калории (7 ккал / г в этаноле по сравнению с 9 ккал / г в жирах и 4 ккал / г в углеводах и белках), это вещество оказывает влияние на мозг. напоминают те, которые производятся как лекарствами, так и продуктами питания. Как и в случае с аппетитной пищей, OX способствует потреблению алкоголя животными, участвующими в фармакологически значимом употреблении алкоголя, при котором достигается уровень алкоголя в крови, достаточный для изменения их поведения, и это происходит в первую очередь через экстрагипоталамические лимбические области, где он также действует на повышают уровень дофамина в прилежащем ядре.Точно так же уровни OX повышаются при приеме алкоголя в зависимости от дозы и времени, чтобы способствовать дальнейшему потреблению. Таким образом, кислород и алкоголь, как и вкусная еда, по-видимому, взаимодействуют в рамках положительной обратной связи, способствуя чрезмерному потреблению веществ.
Таким образом, кислород и алкоголь, как и вкусная еда, по-видимому, взаимодействуют в рамках положительной обратной связи, способствуя чрезмерному потреблению веществ.
4.2.1. Влияние орексина / гипокретина на аспекты употребления алкоголя
В моделях доступа, которые вызывают фармакологически релевантное употребление алкоголя в домашней клетке, было обнаружено, что OX через OX1R и OX2R способствует потреблению алкоголя, действуя через ряд внегипоталамических лимбических расстройств. ядра.Эти модели высокого уровня употребления алкоголя предполагают периодический доступ к алкоголю в домашней клетке и приводят многих субъектов к чрезмерному употреблению алкоголя. Модели включают либо процедуру выбора из двух бутылок, которая обеспечивает круглосуточный доступ к воде плюс 10-20% алкоголя в течение 3 дней в неделю (Carnicella, Ron, & Barak, 2014), либо модель «пить в темноте», которая заменяет бутылка воды с бутылкой 20% спирта на 2–4 часа (Thiele, Crabbe, & Boehm, 2014). При использовании этих парадигм прерывистого доступа периферическое введение антагонистов OX1R SB-334867 и GSK1059865, как обнаружено, снижает потребление алкоголя и снижает его предпочтение как у крыс, так и у мышей (Lopez, Moorman, Aston-Jones, & Becker, 2016; Moorman & Aston-Jones, 2009; Olney, Navarro, & Thiele, 2015).Точно так же SB-334867 подавляет низкое потребление алкоголя, полученное при доступе к домашней клетке ad libitum (Anderson, Becker, Adams, Jesudason, & Rorick-Kehn, 2014). Напротив, системное введение антагониста OX2R LSN424100 снижает потребление алкоголя в больших количествах из парадигмы прерывистого доступа, но не влияет на потребление алкоголя в более низких дозах (Anderson et al., 2014), что указывает на то, что OX2R может быть задействован вместе с OX1R. только когда животные употребляют алкоголь в достаточно высоких дозах.Исследования с местными инъекциями предоставляют дополнительные доказательства того, что как OX1R, так и OX2R влияют на алкоголь в больших количествах, при этом OX1R действует в более широком диапазоне областей мозга.
При использовании этих парадигм прерывистого доступа периферическое введение антагонистов OX1R SB-334867 и GSK1059865, как обнаружено, снижает потребление алкоголя и снижает его предпочтение как у крыс, так и у мышей (Lopez, Moorman, Aston-Jones, & Becker, 2016; Moorman & Aston-Jones, 2009; Olney, Navarro, & Thiele, 2015).Точно так же SB-334867 подавляет низкое потребление алкоголя, полученное при доступе к домашней клетке ad libitum (Anderson, Becker, Adams, Jesudason, & Rorick-Kehn, 2014). Напротив, системное введение антагониста OX2R LSN424100 снижает потребление алкоголя в больших количествах из парадигмы прерывистого доступа, но не влияет на потребление алкоголя в более низких дозах (Anderson et al., 2014), что указывает на то, что OX2R может быть задействован вместе с OX1R. только когда животные употребляют алкоголь в достаточно высоких дозах.Исследования с местными инъекциями предоставляют дополнительные доказательства того, что как OX1R, так и OX2R влияют на алкоголь в больших количествах, при этом OX1R действует в более широком диапазоне областей мозга. Антагонисты OX1R сокращают потребление алкоголя в темноте при введении в оболочку прилежащего ядра, центральное ядро миндалины или вентральную тегментальную область (Lei et al., 2016; Olney, Navarro, & Thiele, 2017) и периодическое употребление алкоголя при инъекции в медиальную префронтальную кору, но не в переднюю часть коры островка и черную субстанцию (Lei et al., 2016; Srinivasan et al., 2012) или паравентрикулярный таламус (Barson et al., 2015). Это контрастирует с антагонистом OX2R TCS OX2 29, который снижает потребление алкоголя из двух бутылок при инъекции в паравентрикулярный таламус, где OX-B увеличивает его в большей степени, чем эквимолярная доза OX-A (Barson et al., 2015; Barson et al., 2017), но не влияет на питье в темноте при введении в раковину прилежащего ядра, центральное ядро миндалины или вентральную область покрышки (Lei et al., 2016; Olney et al., 2017). Эти данные подтверждают идею о том, что употребление алкоголя стимулируется OX1R во многих лимбических областях мозга, в то время как OX2R наиболее активен в паравентрикулярном таламусе, где он специально способствует употреблению алкоголя в больших количествах.
Антагонисты OX1R сокращают потребление алкоголя в темноте при введении в оболочку прилежащего ядра, центральное ядро миндалины или вентральную тегментальную область (Lei et al., 2016; Olney, Navarro, & Thiele, 2017) и периодическое употребление алкоголя при инъекции в медиальную префронтальную кору, но не в переднюю часть коры островка и черную субстанцию (Lei et al., 2016; Srinivasan et al., 2012) или паравентрикулярный таламус (Barson et al., 2015). Это контрастирует с антагонистом OX2R TCS OX2 29, который снижает потребление алкоголя из двух бутылок при инъекции в паравентрикулярный таламус, где OX-B увеличивает его в большей степени, чем эквимолярная доза OX-A (Barson et al., 2015; Barson et al., 2017), но не влияет на питье в темноте при введении в раковину прилежащего ядра, центральное ядро миндалины или вентральную область покрышки (Lei et al., 2016; Olney et al., 2017). Эти данные подтверждают идею о том, что употребление алкоголя стимулируется OX1R во многих лимбических областях мозга, в то время как OX2R наиболее активен в паравентрикулярном таламусе, где он специально способствует употреблению алкоголя в больших количествах. В гипоталамусе есть одно исследование низкоуровневого, ad libitum питья в домашней клетке, которое с инъекцией OX-A показывает, что этот пептид может также способствовать потреблению алкоголя через эту структуру (Schneider, Rada, Darby, Leibowitz, И Hoebel, 2007).Возможно, что OX в гипоталамусе способствует потреблению алкоголя из-за его калорийности, в отличие от экстрагипоталамических лимбических областей, где он способствует потреблению алкоголя из-за его фармакологических эффектов.
В гипоталамусе есть одно исследование низкоуровневого, ad libitum питья в домашней клетке, которое с инъекцией OX-A показывает, что этот пептид может также способствовать потреблению алкоголя через эту структуру (Schneider, Rada, Darby, Leibowitz, И Hoebel, 2007).Возможно, что OX в гипоталамусе способствует потреблению алкоголя из-за его калорийности, в отличие от экстрагипоталамических лимбических областей, где он способствует потреблению алкоголя из-за его фармакологических эффектов.
При использовании фиксированного соотношения 3 подкрепления в оперантной камере, также было обнаружено, что потребление алкоголя снижается антагонистами OX, нацеленными на любой из рецепторов. Таким образом, у различных линий крыс нажатие на рычаг для алкоголя ингибируется периферической инъекцией SB-334867 (Lawrence, Cowen, Yang, Chen, & Oldfield, 2006; Moorman, James, Kilroy, & Aston-Jones, 2017; Richards. и другие., 2008), двойной антагонист OX альморексант (Srinivasan et al., 2012) и антагонист OX2R JNJ-10397049 (Shoblock et al. , 2011). Однако, как и в случае питья в домашней клетке, эти антагонисты рецепторов, по-видимому, оказывают свое действие на различные области мозга. Об этом свидетельствует открытие, что оперантное самовведение алкоголя снижается инъекцией антагониста OX1R в оболочку прилежащего ядра (Lei et al., 2016), но антагонистом OX2R в сердцевине прилежащего ядра (Brown, Ху и Лоуренс, 2013).
, 2011). Однако, как и в случае питья в домашней клетке, эти антагонисты рецепторов, по-видимому, оказывают свое действие на различные области мозга. Об этом свидетельствует открытие, что оперантное самовведение алкоголя снижается инъекцией антагониста OX1R в оболочку прилежащего ядра (Lei et al., 2016), но антагонистом OX2R в сердцевине прилежащего ядра (Brown, Ху и Лоуренс, 2013).
Как и в случае с вкусной едой, OX увеличивает не только потребление алкоголя, но и индивидуальную готовность работать ради алкоголя, что измеряется точкой останова в задаче с прогрессивным соотношением. Исследования показали, что в этом эффекте участвуют оба подтипа рецепторов, и предполагают, что это может зависеть от пола. В частности, антагонист OX1R SB-334867 снижает точку останова для алкоголя у самцов, но не у самок крыс (Anderson et al., 2014; Jupp, Krivdic, Krstew, & Lawrence, 2011), тогда как антагонист OX2R LSN424100 снижает точку останова у самок крыс (Anderson и другие., 2014). Необходимы дальнейшие исследования, чтобы определить, отражает ли это различие полов в задействовании различных областей мозга во время приема алкоголя и задачи прогрессивного соотношения.
Стремление к алкоголю также поощряется OX в рамках нескольких парадигм восстановления и может быть опосредовано OX1R. Возобновление поиска алкоголя, вызванное сигналом, снижается или отменяется SB-334867 при системном введении (Lawrence et al., 2006; Martin-Fardon & Weiss, 2014b; Moorman et al., 2017) или локально в вентральную тегментальную область или медиальную часть. префронтальная кора (Brown et al., 2013). Это контрастирует с интрацеребровентрикулярной инъекцией антагониста OX2R TCS OX2 29, который не влияет на это поведение (Brown et al., 2013). Возможность того, что OX участвует в поиске алкоголя в условиях множественных рецидивов, подтверждается открытием, что системная инъекция антагониста OX1R также ингибирует вызванный стрессом йохимбин рецидив поиска алкоголя (Richards et al., 2008).
Несмотря на кажущуюся большую роль OX1R в большинстве аспектов употребления алкоголя, OX2R, по-видимому, является основным рецептором, участвующим в вознаграждении за употребление алкоголя. В парадигме условного предпочтения места, где мышей обучают ассоциировать отдельную камеру с алкоголем, вводимым экспериментатором, антагонист OX2R JNJ-10397049 ослабляет приобретение, выражение и восстановление обусловленного алкоголем предпочтения места (Shoblock et al., 2011). Это контрастирует с антагонистом OX1R SB-334867, который при той же дозе алкоголя, вводимого экспериментатором, не влияет на приобретение обусловленного алкоголем предпочтения места и блокирует выражение только слабого предпочтения места, но не умеренного или сильного. один (Voorhees & Cunningham, 2011).Это говорит о том, что вознаграждение после приема алкоголя в первую очередь опосредуется OX2R.
В парадигме условного предпочтения места, где мышей обучают ассоциировать отдельную камеру с алкоголем, вводимым экспериментатором, антагонист OX2R JNJ-10397049 ослабляет приобретение, выражение и восстановление обусловленного алкоголем предпочтения места (Shoblock et al., 2011). Это контрастирует с антагонистом OX1R SB-334867, который при той же дозе алкоголя, вводимого экспериментатором, не влияет на приобретение обусловленного алкоголем предпочтения места и блокирует выражение только слабого предпочтения места, но не умеренного или сильного. один (Voorhees & Cunningham, 2011).Это говорит о том, что вознаграждение после приема алкоголя в первую очередь опосредуется OX2R.
4.2.2. Влияние употребления алкоголя на орексин / гипокретин
Что касается потребления алкоголя, активность нейронов OX, экспрессия генов и уровни пептидов зависят от времени во многом так же, как и при приеме вкусной пищи. Активность OX-экспрессирующих нейронов повышается перед добровольным употреблением алкоголя, что согласуется с результатами исследований инъекций, предполагающих, что этот нейропептид инициирует и способствует потреблению алкоголя.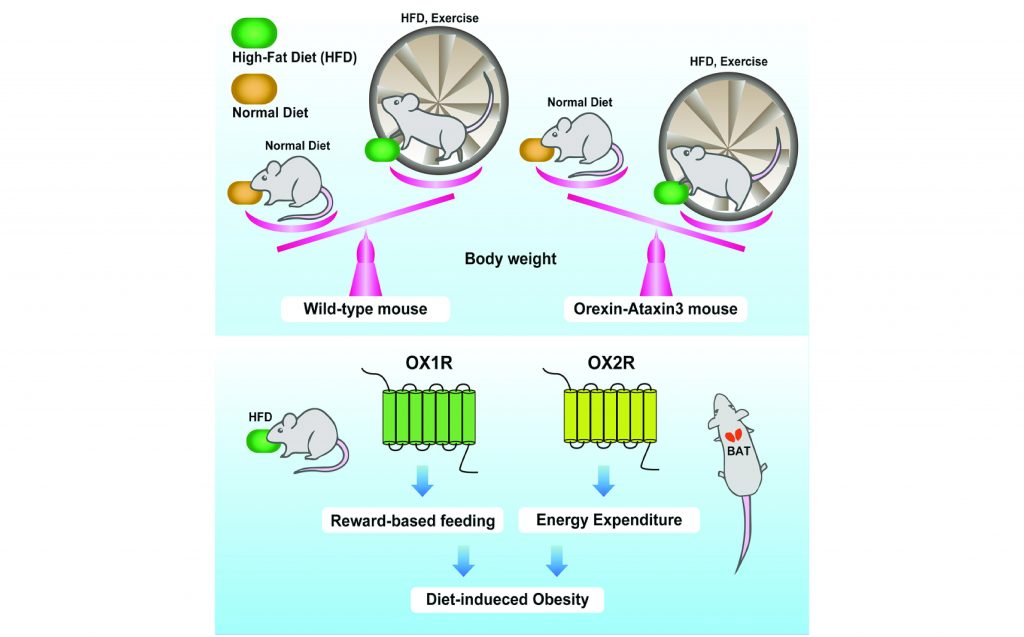 В частности, уровни c-Fos увеличиваются в нейронах OX в условиях, которые вызывают рецидив поиска алкоголя, включая представление пары алкогольных сигналов (Dayas, McGranahan, Martin-Fardon, & Weiss, 2008), временную инактивацию ядра. accumbens (Millan, Furlong, & McNally, 2010) и помещением в контекст, связанный с алкоголем (Moorman, James, Kilroy, & Aston-Jones, 2016). В ответ на прием алкоголя происходит изменение ОХ, которое меняется в зависимости от дозы и времени. В то время как активность OX подавляется острым алкоголем в очень высокой дозе, которая способствует засыпанию (Sharma, Sahota, & Thakkar, 2014), аналогично его ингибированию после физиологического повышения уровня глюкозы (Burdakov et al., 2005), экспрессия генов и уровни пептидов OX значительно увеличиваются при приеме алкоголя в более низких дозах (Morganstern et al., 2010). Точно так же в ответ на добровольное потребление экспрессия гена OX стимулируется в течение первых 30 минут после начала приема (Barson et al., 2015; Lawrence et al.
В частности, уровни c-Fos увеличиваются в нейронах OX в условиях, которые вызывают рецидив поиска алкоголя, включая представление пары алкогольных сигналов (Dayas, McGranahan, Martin-Fardon, & Weiss, 2008), временную инактивацию ядра. accumbens (Millan, Furlong, & McNally, 2010) и помещением в контекст, связанный с алкоголем (Moorman, James, Kilroy, & Aston-Jones, 2016). В ответ на прием алкоголя происходит изменение ОХ, которое меняется в зависимости от дозы и времени. В то время как активность OX подавляется острым алкоголем в очень высокой дозе, которая способствует засыпанию (Sharma, Sahota, & Thakkar, 2014), аналогично его ингибированию после физиологического повышения уровня глюкозы (Burdakov et al., 2005), экспрессия генов и уровни пептидов OX значительно увеличиваются при приеме алкоголя в более низких дозах (Morganstern et al., 2010). Точно так же в ответ на добровольное потребление экспрессия гена OX стимулируется в течение первых 30 минут после начала приема (Barson et al., 2015; Lawrence et al. , 2006; Sterling, Karatayev, Chang, Algava, & Leibowitz, 2015). ), но впоследствии не изменяется или снижается вместе с уровнями пептида OX в течение следующих нескольких часов (Morganstern et al., 2010; Olney et al., 2015, 2017). Этот зависящий от времени сдвиг в воздействии алкоголя на ОХ, стимуляция, за которой следует подавление, может помочь объяснить, почему люди участвуют в сеансах алкогольного запоя дискретной продолжительности (Carnicella et al., 2014), при этом употребление алкоголя продолжается до тех пор, пока в крови не будет алкоголя. уровни достаточно высоки, чтобы изменить поведение, а затем прекращаются до тех пор, пока уровень в крови значительно не снизится.
, 2006; Sterling, Karatayev, Chang, Algava, & Leibowitz, 2015). ), но впоследствии не изменяется или снижается вместе с уровнями пептида OX в течение следующих нескольких часов (Morganstern et al., 2010; Olney et al., 2015, 2017). Этот зависящий от времени сдвиг в воздействии алкоголя на ОХ, стимуляция, за которой следует подавление, может помочь объяснить, почему люди участвуют в сеансах алкогольного запоя дискретной продолжительности (Carnicella et al., 2014), при этом употребление алкоголя продолжается до тех пор, пока в крови не будет алкоголя. уровни достаточно высоки, чтобы изменить поведение, а затем прекращаются до тех пор, пока уровень в крови значительно не снизится.
4.2.3. Влияние пренатального воздействия алкоголя на орексин / гипокретин
Примечательно, что OX способствует фармакологически значимому употреблению алкоголя, и он эндогенно повышается у животных, подвергшихся пренатальному воздействию алкоголя.Пренатальное воздействие алкоголя от низкого до среднего уровня приводит к повышенному употреблению алкоголя у подростков и взрослых грызунов и даже у рыбок данио (Fabio, Macchione, Nizhnikov, & Pautassi, 2015; Nizhnikov, Popoola, & Cameron, 2016; Sterling, Chang, Karatayev , Chang, & Leibowitz, 2016). Примечательно, что такое воздействие алкоголя также стимулирует пролиферацию нейронов OX, что впоследствии приводит к увеличению их экспрессии и плотности генов (Chang, Karatayev, Liang, Barson, & Leibowitz, 2012; Sterling et al., 2016). Это говорит о том, что большее количество нейропептидных нейронов может способствовать повышенному уровню потребления алкоголя.
Примечательно, что такое воздействие алкоголя также стимулирует пролиферацию нейронов OX, что впоследствии приводит к увеличению их экспрессии и плотности генов (Chang, Karatayev, Liang, Barson, & Leibowitz, 2012; Sterling et al., 2016). Это говорит о том, что большее количество нейропептидных нейронов может способствовать повышенному уровню потребления алкоголя.
4.2.4. Клинические доказательства роли орексина / гипокретина в употреблении алкоголя
Лица с OX-дефицитной нарколепсией демонстрируют значительные различия в употреблении алкоголя. Было обнаружено, что они с большей вероятностью будут участвовать в частых приступах употребления алкоголя по сравнению с контрольной группой (Barateau et al., 2016), как и в случае с вкусной едой, что, возможно, отражает компенсаторный механизм хронической и значительной потери OX.Однако это же исследование показало, что эти субъекты с меньшей вероятностью будут употреблять алкоголь в больших количествах (Barateau et al., 2016), что соответствует роли OX в продвижении фармакологически значимого приема алкоголя. Таким образом, что касается алкоголя, OX может быть больше вовлечен в чрезмерное употребление алкоголя, которое затрагивает экстрагипоталамические лимбические области мозга и отвечает за изменение поведения, а не в тип потребления, который включает гипоталамус и в основном предназначен для калорий.
Таким образом, что касается алкоголя, OX может быть больше вовлечен в чрезмерное употребление алкоголя, которое затрагивает экстрагипоталамические лимбические области мозга и отвечает за изменение поведения, а не в тип потребления, который включает гипоталамус и в основном предназначен для калорий.
4.3. Роль орексина / гипокретина в потреблении никотина
Существует литература, которая также связывает OX с использованием никотина у животных и сигарет у людей.Как и в случае с другими полезными веществами, введение ОХ способствует потреблению никотина, причем конкретные вовлеченные области мозга еще предстоит определить, а уровни эндогенного ОКС, в свою очередь, повышаются за счет потребления никотина. Стимулирующий эффект никотина на ОХ наблюдался во все исследованные временные точки, что позволяет более четко, чем с вкусной едой и алкоголем, предполагать, что ОХ взаимодействует с никотином по положительной обратной связи, увеличивая чрезмерное потребление веществ.
4.
 3.1. Влияние орексина / гипокретина на аспекты потребления никотина
3.1. Влияние орексина / гипокретина на аспекты потребления никотина Доказательства, полученные в основном с помощью системных инъекций антагонистов рецепторов OX, демонстрируют, что OX способствует не только потреблению никотина, но и готовности работать на никотин и возобновлению поиска никотина.При фиксированном соотношении 5 подкрепления в операционной камере потребление никотина снижается антагонистом OX1R SB-334867 при системном введении (Hollander, Lu, Cameron, Kamenecka, & Kenny, 2008; LeSage, Perry, Kotz, Shelley, & Corrigall, 2010) или в лимбическую островную кору, но не в прилегающую соматосенсорную кору (Hollander et al., 2008). Эти отчеты предполагают функцию эндогенной активности OX1R в коре островка, способствующую потреблению никотина, с дальнейшими исследованиями, необходимыми для определения участия других лимбических областей мозга и OX2R в этом поведении.Анализ готовности работать на никотин указывает на роль OX1R, но не OX2R, при этом нажатие рычага на никотин в задаче с прогрессивным соотношением, как было обнаружено, снижается SB-334867 (Hollander et al.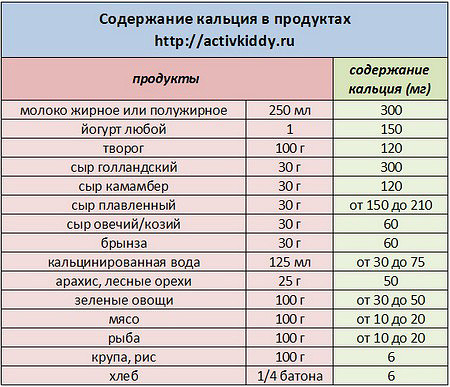 , 2008), но не антагонистом OX2R 2 -СОРА (Усланер и др., 2014). С другой стороны, оба рецептора могут участвовать в поиске никотина в рамках некоторых моделей восстановления с интрацеребровентрикулярной инъекцией OX-A, достаточной для восстановления ранее прекращенного поиска никотина (Plaza-Zabala, Martin-Garcia, de Lecea, Maldonado, & Berrendero, 2010) и с SB-334867 и 2-SORA, независимо ослабляющими или блокирующими вызванное сигналом восстановление поиска никотина (Plaza-Zabala et al., 2013; Усланер и др., 2014). Эти рецепторы, по-видимому, не участвуют в других моделях восстановления никотина, поскольку антагонист OX1R не влияет на восстановление поиска никотина, вызванное ударом стопы (Plaza-Zabala et al., 2010), а антагонист OX2R не влияет на индуцированный никотином восстановление на работе (Усланер и др., 2014). Эти данные, согласующиеся с данными о вкусной еде и алкоголе, подтверждают роль OX во многих аспектах поведения, связанных с потреблением никотина, таких как готовность работать и определенные модели поиска, но конкретные вовлеченные области мозга еще предстоит определить.
, 2008), но не антагонистом OX2R 2 -СОРА (Усланер и др., 2014). С другой стороны, оба рецептора могут участвовать в поиске никотина в рамках некоторых моделей восстановления с интрацеребровентрикулярной инъекцией OX-A, достаточной для восстановления ранее прекращенного поиска никотина (Plaza-Zabala, Martin-Garcia, de Lecea, Maldonado, & Berrendero, 2010) и с SB-334867 и 2-SORA, независимо ослабляющими или блокирующими вызванное сигналом восстановление поиска никотина (Plaza-Zabala et al., 2013; Усланер и др., 2014). Эти рецепторы, по-видимому, не участвуют в других моделях восстановления никотина, поскольку антагонист OX1R не влияет на восстановление поиска никотина, вызванное ударом стопы (Plaza-Zabala et al., 2010), а антагонист OX2R не влияет на индуцированный никотином восстановление на работе (Усланер и др., 2014). Эти данные, согласующиеся с данными о вкусной еде и алкоголе, подтверждают роль OX во многих аспектах поведения, связанных с потреблением никотина, таких как готовность работать и определенные модели поиска, но конкретные вовлеченные области мозга еще предстоит определить.
Поскольку никотин является стимулятором, его потребление приводит как к вознаграждению, так и к тревоге, причем эти эффекты частично опосредуются OX1R (Hollander et al., 2008; Plaza-Zabala et al., 2010). Примечательно, что способность никотина снижать порог внутричерепной самостимуляции блокируется системным введением SB-334867 (Hollander et al., 2008). Точно так же способность никотина усиливать тревожное поведение в приподнятом крестообразном лабиринте также противодействует SB-334867 (Plaza-Zabala et al., 2010).Таким образом, помимо стимулирования потребления никотина, OX также играет роль в эмоциональной реакции на это потребление.
4.3.2. Влияние потребления никотина на орексин / гипокретин
По отношению к потреблению никотина активность нейронов OX, экспрессия генов и уровни пептидов повышаются по анатомически отличному паттерну, причем активность нейронов, экспрессирующих OX, выше, чем у добровольных никотина потребление, а также после приема никотина. В частности, уровни c-Fos повышаются в нейронах OX после предъявления сигнала, предсказывающего доступность никотина, в перифорномическом и латеральном гипоталамусе, но не в дорсомедиальном гипоталамусе (Plaza-Zabala et al. , 2013). Этот эффект также наблюдается в перифорниальном и дорсомедиальном гипоталамусе после острой инъекции никотина в относительно низкой дозе (Plaza-Zabala et al., 2010), тогда как во всех популяциях нейронов OX после более высокой дозы никотина (Pasumarthi & Fadel, 2008). ; Pasumarthi, Reznikov, & Fadel, 2006). Эта разница в участках, задействованных при низкой дозе никотина по сравнению с высокой, может отражать большую чувствительность перифорнийских и дорсомедиальных нейронов гипоталамуса к ацетилхолину. Эти эффекты на активность нейронов также могут быть специфичными для нейронов OX, поскольку они не обнаруживаются в соседних нейронах, экспрессирующих меланин-концентрирующий гормон (Pasumarthi et al., 2006), и они также очевидны in vitro, , при остром применении никотина, стимулирующем возбуждение ОХ-нейронов (Huang, Xu, & van den Pol, 2011; W. L. Zhou, Gao, & Picciotto, 2015). Повторное воздействие никотина in vivo , либо посредством инъекции, вводимой экспериментатором, либо добровольного перорального питья, увеличивает экспрессию генов OX и уровни пептидов OX-A и OX-B в гипоталамусе (Kane et al.
, 2013). Этот эффект также наблюдается в перифорниальном и дорсомедиальном гипоталамусе после острой инъекции никотина в относительно низкой дозе (Plaza-Zabala et al., 2010), тогда как во всех популяциях нейронов OX после более высокой дозы никотина (Pasumarthi & Fadel, 2008). ; Pasumarthi, Reznikov, & Fadel, 2006). Эта разница в участках, задействованных при низкой дозе никотина по сравнению с высокой, может отражать большую чувствительность перифорнийских и дорсомедиальных нейронов гипоталамуса к ацетилхолину. Эти эффекты на активность нейронов также могут быть специфичными для нейронов OX, поскольку они не обнаруживаются в соседних нейронах, экспрессирующих меланин-концентрирующий гормон (Pasumarthi et al., 2006), и они также очевидны in vitro, , при остром применении никотина, стимулирующем возбуждение ОХ-нейронов (Huang, Xu, & van den Pol, 2011; W. L. Zhou, Gao, & Picciotto, 2015). Повторное воздействие никотина in vivo , либо посредством инъекции, вводимой экспериментатором, либо добровольного перорального питья, увеличивает экспрессию генов OX и уровни пептидов OX-A и OX-B в гипоталамусе (Kane et al. , 2000; Tsuneki et al. др., 2016). В то время как уровни OX-A повышаются только в дорсомедиальном гипоталамусе, уровень OX-B повышается как в дорсомедиальном, так и в паравентрикулярном гипоталамусе (Kane et al., 2000), предполагая, что некоторые из основных эффектов никотина опосредуются OX2R. Хотя это не измеряется в экстрагипоталамических областях, вполне вероятно, что OX аналогичным образом высвобождается в другие лимбические области после приема никотина, где он действует, чтобы еще больше закрепить это поведение.
, 2000; Tsuneki et al. др., 2016). В то время как уровни OX-A повышаются только в дорсомедиальном гипоталамусе, уровень OX-B повышается как в дорсомедиальном, так и в паравентрикулярном гипоталамусе (Kane et al., 2000), предполагая, что некоторые из основных эффектов никотина опосредуются OX2R. Хотя это не измеряется в экстрагипоталамических областях, вполне вероятно, что OX аналогичным образом высвобождается в другие лимбические области после приема никотина, где он действует, чтобы еще больше закрепить это поведение.
4.3.3. Влияние пренатального воздействия никотина на орексин / гипокретин
Примечательно, что при одновременном стимулировании и активации ОКС потреблением никотина у взрослых животных потребление этого нейропептида и никотина аналогичным образом увеличивается у животных, подвергшихся воздействию никотина in utero .Доказано, что пренатальное воздействие никотина в диапазоне доз приводит к увеличению потребления никотина у животных-подростков (Chang, Karatayev, & Leibowitz, 2013; Levin et al. , 2006). Пренатальное воздействие никотина в низких дозах (0,15 — 1,5 мг / кг / сут) также увеличивает экспрессию гена OX и уровни пептидов (Chang et al., 2013; Morgan, Harrod, Lacy, Stanley, & Fadel, 2013), в то время как количество На нейроны OX и их экспрессия генов никотин не влияет или не снижает их при высоких уровнях (6 мг / кг / сут) (Boychuk, Fuller, & Hayward, 2011).Необходимы дальнейшие тесты, чтобы определить, действительно ли эндогенный оксид кислорода является решающим фактором повышенного потребления никотина, наблюдаемого у потомства, подвергшегося воздействию в раннем возрасте.
, 2006). Пренатальное воздействие никотина в низких дозах (0,15 — 1,5 мг / кг / сут) также увеличивает экспрессию гена OX и уровни пептидов (Chang et al., 2013; Morgan, Harrod, Lacy, Stanley, & Fadel, 2013), в то время как количество На нейроны OX и их экспрессия генов никотин не влияет или не снижает их при высоких уровнях (6 мг / кг / сут) (Boychuk, Fuller, & Hayward, 2011).Необходимы дальнейшие тесты, чтобы определить, действительно ли эндогенный оксид кислорода является решающим фактором повышенного потребления никотина, наблюдаемого у потомства, подвергшегося воздействию в раннем возрасте.
4.3.4. Клинические доказательства роли орексина / гипокретина в потреблении никотина
Изменения функции OX были связаны с курением сигарет у людей, хотя направление этой связи неясно. Например, аллель OX2R был связан с никотиновой зависимостью в популяции Японии (Nishizawa et al., 2015). Кроме того, обнаружено, что люди с OX-дефицитной нарколепсией, у которых наблюдаются нарушения в привычках употребления алкоголя, с большей вероятностью курят сигареты, чем соответствующие контрольные субъекты (Barateau et al. , 2016). Хотя точный характер взаимосвязи еще предстоит выяснить, эти результаты предоставляют некоторые доказательства связи ОХ с использованием никотина.
, 2016). Хотя точный характер взаимосвязи еще предстоит выяснить, эти результаты предоставляют некоторые доказательства связи ОХ с использованием никотина.
4.4. Роль орексина / гипокретина в употреблении кокаина
Исследования также связывают ОХ с употреблением кокаина, хотя имеющиеся исследования показывают, что эта связь менее прямая, чем та, которая наблюдается с вкусной едой, алкоголем и никотином.Возможными причинами более сильной и прямой связи между ОХ и этими последними веществами может быть тот факт, что нейроны ОХ очень чувствительны к глюкозе, которая повышается при приеме вкусной пищи (Бурдаков и др., 2005), экспрессируют оба рецептора ГАМК, которые, как известно, сильно зависит от приема алкоголя (Backberg et al., 2003; Backberg et al., 2004), а также экспрессируют никотиновые рецепторы ацетилхолина, сильно стимулируемые приемом никотина (Garcia et al., 2015). Напротив, взаимосвязь между OX и кокаином может быть более слабой или менее прямой из-за того, что нейроны OX редко экспрессируют рецепторы дофамина (Bubser et al. , 2005), который значительно увеличивается при приеме кокаина. Таким образом, несмотря на то, что эндогенный ОХ способен стимулировать различные аспекты поведения, связанного с потреблением кокаина, потребление кокаина остается в значительной степени неизменным, что указывает на то, что этот препарат не может напрямую влиять на нейроны ОХ и изменять их функцию.
, 2005), который значительно увеличивается при приеме кокаина. Таким образом, несмотря на то, что эндогенный ОХ способен стимулировать различные аспекты поведения, связанного с потреблением кокаина, потребление кокаина остается в значительной степени неизменным, что указывает на то, что этот препарат не может напрямую влиять на нейроны ОХ и изменять их функцию.
4.4.1. Влияние орексина / гипокретина на аспекты употребления кокаина
Исследования OX1R показали, что эндогенный OX способствует потреблению кокаина, хотя и только при определенных условиях.В то время как интрацеребровентрикулярная инъекция OX-A и системная инъекция антагониста OX1R SB-334867 не влияют на оперант, отвечающий на стандартные дозы кокаина в соответствии с парадигмой фиксированного соотношения 1 (Boutrel et al., 2005; Espana et al., 2010; Hutcheson et al., 2011; L. Zhou et al., 2012), есть и другие свидетельства того, что OX включается, когда животные должны работать, чтобы достичь желаемого уровня кокаина в крови. Таким образом, SB-334867 значительно снижает оперантную реакцию с фиксированным соотношением 1 на очень низкие дозы кокаина (Brodnik, Bernstein, Prince, & Espana, 2015), а также оперантную реакцию в парадигме дискретных испытаний, включающих строго ограниченные периоды доступа (Espana et al., 2010). Кроме того, как SB-334867, так и генетический нокаут OX1R приводят к тому, что животные потребляют меньше кокаина в соответствии с парадигмой высокой работы с фиксированным соотношением 5 (Hollander, Pham, Fowler, & Kenny, 2012). Одно исследование, изучающее участие определенных областей мозга в опосредовании действий OX, показало, что самовведение кокаина снижается путем инъекции SB-334867 в центральное ядро миндалины (Schmeichel, Herman, Roberto, & Koob, 2017). Хотя это говорит о том, что OX1R в миндалине может участвовать в стимулировании приема кокаина в условиях, требующих работы, возможная роль других лимбических областей мозга и OX2R требует дальнейшего изучения.
Таким образом, SB-334867 значительно снижает оперантную реакцию с фиксированным соотношением 1 на очень низкие дозы кокаина (Brodnik, Bernstein, Prince, & Espana, 2015), а также оперантную реакцию в парадигме дискретных испытаний, включающих строго ограниченные периоды доступа (Espana et al., 2010). Кроме того, как SB-334867, так и генетический нокаут OX1R приводят к тому, что животные потребляют меньше кокаина в соответствии с парадигмой высокой работы с фиксированным соотношением 5 (Hollander, Pham, Fowler, & Kenny, 2012). Одно исследование, изучающее участие определенных областей мозга в опосредовании действий OX, показало, что самовведение кокаина снижается путем инъекции SB-334867 в центральное ядро миндалины (Schmeichel, Herman, Roberto, & Koob, 2017). Хотя это говорит о том, что OX1R в миндалине может участвовать в стимулировании приема кокаина в условиях, требующих работы, возможная роль других лимбических областей мозга и OX2R требует дальнейшего изучения.
Неудивительно, что производительность в задаче с прогрессивным соотношением, которая измеряет, сколько человек готов работать ради кокаина, опосредуется OX1R. В частности, точка разрыва для кокаина снижается периферической инъекцией SB-334867, но не антагониста OX2R 4PT (Borgland et al., 2009; Brodnik et al., 2015; Prince, Rau, Yorgason, & Espana, 2015). Этот эффект OX1R, по-видимому, конкретно затрагивает вентральную область покрышки, где инъекция SB-334867 повторяет снижение точки разрыва (Espana et al., 2010), а инъекция OX-A увеличивает точку останова (Espana, Melchior, Roberts, & Jones, 2011). Обнаружено, что эти инъекции в вентральную область покрышки, соответственно, ингибируют или усиливают эффекты кокаина на передачу сигналов дофамина (Espana et al., 2011; Espana et al., 2010), вполне вероятно, что дофамин опосредует эти изменения в количество усилий, затраченных на получение этого препарата.
В частности, точка разрыва для кокаина снижается периферической инъекцией SB-334867, но не антагониста OX2R 4PT (Borgland et al., 2009; Brodnik et al., 2015; Prince, Rau, Yorgason, & Espana, 2015). Этот эффект OX1R, по-видимому, конкретно затрагивает вентральную область покрышки, где инъекция SB-334867 повторяет снижение точки разрыва (Espana et al., 2010), а инъекция OX-A увеличивает точку останова (Espana, Melchior, Roberts, & Jones, 2011). Обнаружено, что эти инъекции в вентральную область покрышки, соответственно, ингибируют или усиливают эффекты кокаина на передачу сигналов дофамина (Espana et al., 2011; Espana et al., 2010), вполне вероятно, что дофамин опосредует эти изменения в количество усилий, затраченных на получение этого препарата.
Как показано с другими полезными веществами, поиск кокаина также поддерживается OX в соответствии с рядом парадигм восстановления и опосредуется OX1R или OX2R в зависимости от исследуемой области мозга.Центральная инъекция OX сама по себе достаточна, чтобы вызвать возобновление поиска кокаина, при этом это поведение опосредуется OX1R, но не OX2R в вентральной тегментальной области (B. Wang, You, & Wise, 2009) и OX2R, но не OX1R в паравентрикулярный таламус (Matzeu, Kerr, Weiss, & Martin-Fardon, 2016). Напротив, антагонисты OX эффективны при подавлении возобновления поиска кокаина после предъявления кокаиновой пары сигналов, возвращения в среду самостоятельного введения, стресса или йохимбина, но не после прайминга самим кокаином, который оказывает минимальное влияние на уровни OX ( см. раздел 4.4.2). Например, вызванное сигналом возобновление поиска кокаина снижается SB-334867, но не антагонистом OX2R 4PT при системном введении (Hutcheson et al., 2011; Martin-Fardon & Weiss, 2014a; Smith, See, & Aston-Jones, 2009) или в вентральную область покрышки (James et al., 2011; Mahler, Smith, & Aston-Jones, 2013). Кроме того, системная инъекция SB-334867 подавляет поиск кокаина, вызванный контекстом (Smith, Tahsili-Fahadan, & Aston-Jones, 2010), стрессом от удара ногой (Boutrel et al., 2005) или йохимбин (L. Zhou et al., 2012), причем последнее восстановление также снижается путем инъекции SB-334867 в центральное ядро миндалины (Schmeichel et al.
Wang, You, & Wise, 2009) и OX2R, но не OX1R в паравентрикулярный таламус (Matzeu, Kerr, Weiss, & Martin-Fardon, 2016). Напротив, антагонисты OX эффективны при подавлении возобновления поиска кокаина после предъявления кокаиновой пары сигналов, возвращения в среду самостоятельного введения, стресса или йохимбина, но не после прайминга самим кокаином, который оказывает минимальное влияние на уровни OX ( см. раздел 4.4.2). Например, вызванное сигналом возобновление поиска кокаина снижается SB-334867, но не антагонистом OX2R 4PT при системном введении (Hutcheson et al., 2011; Martin-Fardon & Weiss, 2014a; Smith, See, & Aston-Jones, 2009) или в вентральную область покрышки (James et al., 2011; Mahler, Smith, & Aston-Jones, 2013). Кроме того, системная инъекция SB-334867 подавляет поиск кокаина, вызванный контекстом (Smith, Tahsili-Fahadan, & Aston-Jones, 2010), стрессом от удара ногой (Boutrel et al., 2005) или йохимбин (L. Zhou et al., 2012), причем последнее восстановление также снижается путем инъекции SB-334867 в центральное ядро миндалины (Schmeichel et al. , 2017). Напротив, ни SB-334867, ни 4PT не влияют на возобновление поиска кокаина, вызванное самим кокаином (Mahler et al., 2013; Smith et al., 2009; L. Zhou et al., 2012). Эти результаты демонстрируют, что возобновление поиска кокаина стимулируется OX в различных парадигмах восстановления, но не в восстановлении, вызванном наркотиками.
, 2017). Напротив, ни SB-334867, ни 4PT не влияют на возобновление поиска кокаина, вызванное самим кокаином (Mahler et al., 2013; Smith et al., 2009; L. Zhou et al., 2012). Эти результаты демонстрируют, что возобновление поиска кокаина стимулируется OX в различных парадигмах восстановления, но не в восстановлении, вызванном наркотиками.
Исследования обычно подтверждают участие OX в вознаграждении за прием кокаина. В парадигме условного предпочтения места, в которой животные приучены ассоциировать отдельную камеру с вводимым экспериментатором кокаином, обнаружено, что двойной антагонист рецептора OX альморексант снижает проявление этого предпочтения места (Steiner, Lecourt, & Jenck, 2013), аналогично эффекта, вызванного нокаутом гена OX (Shaw et al., 2016). Напротив, прямой инъекции OX-A в вентральную область покрышки достаточно для восстановления исчезнувшего предпочтения места (Tung et al., 2016). Кроме того, было обнаружено, что вызванное кокаином снижение порога внутричерепной самостимуляции может быть отменено системной инъекцией SB-334867 крысам (Hollander et al. , 2012), хотя этого не было обнаружено при использовании более высокой дозы у мышей. (Райдей и др., 2012). В целом, эти результаты подтверждают роль OX в вознаграждении за употребление кокаина.
, 2012), хотя этого не было обнаружено при использовании более высокой дозы у мышей. (Райдей и др., 2012). В целом, эти результаты подтверждают роль OX в вознаграждении за употребление кокаина.
4.4.2. Влияние употребления кокаина на орексин / гипокретин
Что касается приема кокаина, OX, по-видимому, участвует в поведении, которое происходит до его приема, но этот нейропептид мало изменяется в ответ на его потребление.Как и в случае с другими полезными веществами, активность нейронов, экспрессирующих OX, увеличивается до поиска кокаина, о чем свидетельствует обнаружение того, что уровни c-Fos в нейронах OX повышаются за счет уменьшения количества кокаина (Martin-Fardon, Cauvi, Kerr, & Weiss, 2016) или размещение в среде самоуправления (Hamlin, Clemens, & McNally, 2008). Однако, в отличие от других веществ, повторные инъекции кокаина мало влияют на экспрессию гена OX в гипоталамусе (Y. Zhou et al., 2008), а острая инъекция кокаина также не влияет на уровни пептидов OX-A или OX-B в прилежащем ядре (Zhang, Mao, Liu, & Wang, 2007). Эти результаты являются дополнительным доказательством того, что OX участвует в стимулировании употребления кокаина, но само по себе это поведение существенно не влияет.
Эти результаты являются дополнительным доказательством того, что OX участвует в стимулировании употребления кокаина, но само по себе это поведение существенно не влияет.
4.4.3. Клинические доказательства роли орексина / гипокретина в употреблении кокаина
В настоящее время существует только одно исследование, в котором изучалась связь ОХ с употреблением кокаина у людей. Лица с OX-дефицитной нарколепсией, у которых обнаружены различия в привычках употребления алкоголя и курения сигарет, не обнаруживают разницы в вероятности употребления кокаина по сравнению с подобранными контрольными субъектами (Barateau et al., 2016). Это открытие может быть связано с низкой частотой употребления кокаина среди выбранных групп населения, что указывает на необходимость дальнейших трансляционных исследований по этой теме.
5. Выводы
Хотя OX изначально был определен из-за его роли в приеме пищи и энергетическом гомеостазе, с тех пор стало ясно, что OX участвует в ряде форм поведения, которые регулируются как гомеостатически, так и негомеостатически. Многие виды поведения, которым способствует OX, можно классифицировать как адаптивные, включая прием пищи, регулирование сна и бодрствования, совокупление и материнское поведение.Такое поведение в значительной степени контролируется высвобождением OX в гипоталамусе, при этом потребление пищи затрагивает те же области гипоталамуса, что и транскрипция OX (перифорниальная, дорсомедиальная и латеральная области), при бодрствовании дополнительно вовлекаются такие области, как голубое пятно, спаривание и материнская поведение, затрагивающее медиальную преоптическую область гипоталамуса. Реализация этого адаптивного поведения приводит к сигналам обратной связи, таким как глюкоза, которые негативно регулируют активность OX, сигнализируя о завершении поведенческой последовательности.Мы предполагаем, что ОХ в стимулировании этого адаптивного поведения в физиологических условиях играет важную роль в поддержании возбуждения, способствуя выживанию, как бодрящему, так и мотивирующему поведению, необходимому для распространения генов человека.
Многие виды поведения, которым способствует OX, можно классифицировать как адаптивные, включая прием пищи, регулирование сна и бодрствования, совокупление и материнское поведение.Такое поведение в значительной степени контролируется высвобождением OX в гипоталамусе, при этом потребление пищи затрагивает те же области гипоталамуса, что и транскрипция OX (перифорниальная, дорсомедиальная и латеральная области), при бодрствовании дополнительно вовлекаются такие области, как голубое пятно, спаривание и материнская поведение, затрагивающее медиальную преоптическую область гипоталамуса. Реализация этого адаптивного поведения приводит к сигналам обратной связи, таким как глюкоза, которые негативно регулируют активность OX, сигнализируя о завершении поведенческой последовательности.Мы предполагаем, что ОХ в стимулировании этого адаптивного поведения в физиологических условиях играет важную роль в поддержании возбуждения, способствуя выживанию, как бодрящему, так и мотивирующему поведению, необходимому для распространения генов человека.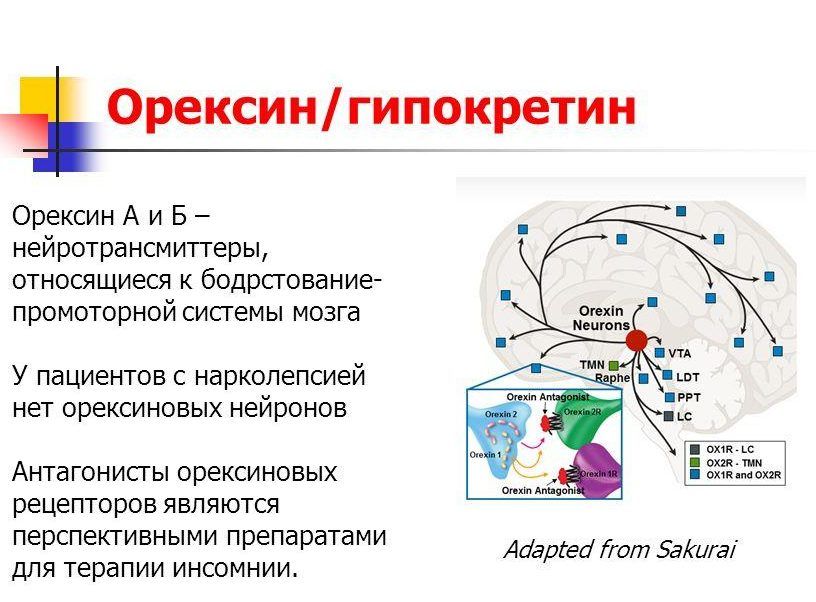 Дальнейшие исследования открывают еще одно свойство OX, его способность способствовать чрезмерному потреблению полезных веществ, вызывающих злоупотребление, таких как вкусная еда, алкоголь, никотин и кокаин, при этом этот пептид как стимулирует, так и стимулирует потребление этих веществ.Эта функция ОХ осуществляется через другой набор лимбических ядер за пределами гипоталамуса, в первую очередь прилежащее ядро, вентральную тегментальную область и паравентрикулярное ядро таламуса, а также миндалину, префронтальную кору и кора островка. Через эти внегипоталамические лимбические области мозга OX способствует потреблению, готовности к работе, поиску и вознаграждению за счет приема полезных веществ. Эти эффекты опосредуются активностью OX1R в большинстве лимбических областей, за исключением паравентрикулярного таламуса, где они опосредуются OX2R.Более того, в ответ на потребление или воздействие этих полезных веществ в молодом возрасте экспрессия генов OX и уровни пептидов, как правило, еще больше повышаются, образуя порочный круг, включающий положительную обратную связь, а не отрицательную обратную связь, характерную для гомеостатических циклов.
Дальнейшие исследования открывают еще одно свойство OX, его способность способствовать чрезмерному потреблению полезных веществ, вызывающих злоупотребление, таких как вкусная еда, алкоголь, никотин и кокаин, при этом этот пептид как стимулирует, так и стимулирует потребление этих веществ.Эта функция ОХ осуществляется через другой набор лимбических ядер за пределами гипоталамуса, в первую очередь прилежащее ядро, вентральную тегментальную область и паравентрикулярное ядро таламуса, а также миндалину, префронтальную кору и кора островка. Через эти внегипоталамические лимбические области мозга OX способствует потреблению, готовности к работе, поиску и вознаграждению за счет приема полезных веществ. Эти эффекты опосредуются активностью OX1R в большинстве лимбических областей, за исключением паравентрикулярного таламуса, где они опосредуются OX2R.Более того, в ответ на потребление или воздействие этих полезных веществ в молодом возрасте экспрессия генов OX и уровни пептидов, как правило, еще больше повышаются, образуя порочный круг, включающий положительную обратную связь, а не отрицательную обратную связь, характерную для гомеостатических циклов. В совокупности эти результаты предполагают, что система OX в широком диапазоне внегипоталамических лимбических областей мозга может кооперироваться с помощью поощрительных веществ, таких как вкусная еда, алкоголь, никотин и кокаин, чтобы стимулировать потребление негомеостатически и, в конечном итоге, привести к зависимости. .
В совокупности эти результаты предполагают, что система OX в широком диапазоне внегипоталамических лимбических областей мозга может кооперироваться с помощью поощрительных веществ, таких как вкусная еда, алкоголь, никотин и кокаин, чтобы стимулировать потребление негомеостатически и, в конечном итоге, привести к зависимости. .
Орексин A — обзор
Действия орексина на клеточном уровне
Было показано, что орексин A возбуждает норадренергические нейроны LC, обеспечивая механизм, с помощью которого орексин может способствовать бодрствованию 116–118 и подавлять быстрый сон дозозависимым образом. Работа in vitro на трансгенной мыши с сильной экспрессией зеленого флуоресцентного белка в LC, которая была совместно локализована с иммунореактивной тирозингидроксилазой, показала, что орексин A и B увеличивал частоту спайков, при этом орексин A был на порядок более сильным; постсинаптическое возбуждение, как полагали, опосредовано входящим внутрь катионным током, поскольку эффекты орексина блокировались замещением холин-Cl на NaCl. 119 Другой отчет предполагает, что возбуждение происходит за счет подавления активности калиевых каналов внутреннего выпрямителя, связанных с G-белком. 120
119 Другой отчет предполагает, что возбуждение происходит за счет подавления активности калиевых каналов внутреннего выпрямителя, связанных с G-белком. 120
Работа на крысах in vitro показала, что орексин довольно равномерно возбуждает ГАМКергические нейроны вентральной тегментальной области, в то время как влияние на дофаминергические нейроны было более сложным: примерно одна треть возбуждалась, одна треть показывала развитие колебательного взрыва стрельба и одна треть не ответили. 121 Большинство нейронов деполяризовались в ответ на орексин A и B (100 нМ), постсинаптический эффект (сохраняется при применении тетродотоксина).Эксперименты с одноклеточной ПЦР показали, что оба рецептора орексина экспрессируются как в дофаминергических, так и в недопаминергических нейронах. Несколько удивительно, что дофаминергические нейроны в компактной части черной субстанции не были затронуты орексинами, в то время как, напротив, нанесение ванны орексина A (100 нМ) или орексина B (5-300 нМ) значительно увеличивало скорость активации ГАМКергических нейронов в части ретикулата. 122
122
В DRN орексины A и B, действующие постсинаптически, увеличивали скорость возбуждения серотониновых нейронов; возбуждающие эффекты орексина были перекрыты предыдущим применением фенилэфрина, что позволяет предположить, что орексин и норадренергические системы действуют через общие эффекторные механизмы. 123 Опосредованные орексином I эффекты оказались несколько сильнее, чем эффекты, опосредованные орексином II, на основании как силы сигнала в одноклеточной ПЦР в триптофангидроксилазоположительных нейронах, так и немного большего количества серотониновых нейронов, реагирующих на орексин A, чем B. Интересно, что агонисты трех связанных с возбуждением систем, воздействующих на дорсальный шов (системы орексин / гипокретин, гистамин и норадреналин), вызывали внутренний ток и увеличение шума тока в записях патч-кламп целых клеток от этих нейронов в срезах мозга.В большинстве случаев орексин активирует смешанный катионный канал с относительной проницаемостью для натрия и калия 0,43 и 1 соответственно.
В исследовании туберомаммиллярного ядра in vitro орексин А и орексин В деполяризовали гистаминергические нейроны и увеличили скорость их возбуждения за счет воздействия на постсинаптические рецепторы. 124 Деполяризация была связана с небольшим уменьшением входного сопротивления и, вероятно, была вызвана активацией как электрогенного обменника Na + / Ca 2+ , так и тока Ca 2+ .Одноклеточное исследование обратной транскриптазы-ПЦР (ОТ-ПЦР) в этом ядре показало, что большинство туберомаммиллярных нейронов экспрессируют как орексин А, так и орексин В, с более сильной экспрессией рецептора орексина II. Иммуноцитохимия показала, что нейроны гистамина и орексина часто располагались очень близко друг к другу и, по-видимому, взаимно взаимодействовали. Другие данные предполагают пресинаптические эффекты орексина. 125
Как отмечалось ранее, фармакологические методы, методы регистрации повреждений и единичной записи у нескольких видов животных определили область PRF (SubC), расположенную непосредственно вентрально от LC, как критически важную для генерации REM-сна. Однако внутренние свойства мембран и ответы нейронов SubC на нейротрансмиттеры, важные для контроля быстрого сна, такие как ACh и орексины, ранее не изучались ни у одного вида животных и, таким образом, были объектом этого исследования.
Однако внутренние свойства мембран и ответы нейронов SubC на нейротрансмиттеры, важные для контроля быстрого сна, такие как ACh и орексины, ранее не изучались ни у одного вида животных и, таким образом, были объектом этого исследования.
Brown et al. 126 получили записи патч-кламп целых клеток от визуально идентифицированных нейронов SubC в срезах мозга крысы in vitro. Две группы крупных нейронов были предварительно идентифицированы как холинергические (ростральный SubC) и норадренергические (каудальный SubC) нейроны.Ретикулярные нейроны SubC (нехолинергические, не-норадренергические) демонстрировали деполяризующий провал среднего размера во время импульсов гиперполяризующего тока и часто имели обратную деполяризацию (LTS). Во время импульсов деполяризующего тока они слабо адаптировались и срабатывали с максимальной частотой 30–90 Гц. Те ретикулярные нейроны SubC, возбужденные карбахолом ( n = 27), спонтанно запускались с частотой 6 Гц, часто демонстрировали LTS среднего размера и широко варьировали по размеру. Подвергнутые карбахолу ретикулярные нейроны SubC были среднего размера (15-25 мкм) и составляли две группы.Большая группа молчала в покое и обладала выраженным LTS и 1–4 связанными потенциалами действия. Вторая, меньшая группа имела отложенный возврат к исходному уровню из-за смещения гиперполяризующих импульсов. Орексины возбуждали как возбужденные карбахолом, так и ингибированные карбахолом ретикулярные нейроны SubC.
Подвергнутые карбахолу ретикулярные нейроны SubC были среднего размера (15-25 мкм) и составляли две группы.Большая группа молчала в покое и обладала выраженным LTS и 1–4 связанными потенциалами действия. Вторая, меньшая группа имела отложенный возврат к исходному уровню из-за смещения гиперполяризующих импульсов. Орексины возбуждали как возбужденные карбахолом, так и ингибированные карбахолом ретикулярные нейроны SubC.
Ретикулярные нейроны SubC обладали внутренними мембранными свойствами и ответами на карбахол, подобными тем, которые описаны для других ретикулярных нейронов, но было обнаружено большее количество нейронов, ингибированных карбахолом (> 50%), большинство из которых демонстрировали выраженный LTS и могут соответствовать к нейронам «PGO-on».Некоторые или все нейроны, возбуждаемые карбахолом, предположительно являются нейронами быстрого сна. Выяснение точных механизмов, с помощью которых орексин модулирует быстрый сон, требует дальнейшего изучения, учитывая наблюдаемые до сих пор в целом возбуждающие эффекты орексина.
Спад в середине дня? Почему сахарная лихорадка не может быть ответом — ScienceDaily
Белок, а не сахар, стимулирует клетки, делая нас тонкими и бодрыми, говорится в новом исследовании.
Новое исследование показало, что белок, а не сахар активирует клетки, ответственные за бодрствование и сжигание калорий.Исследование, опубликованное в номере от 17 ноября научного журнала Neuron , имеет значение для понимания ожирения и нарушений сна.
Бодрствование и расход энергии зависят от «клеток орексина», которые выделяют в головном мозге стимулятор, называемый орексином / гипокретином. Снижение активности этих уникальных клеток приводит к нарколепсии и увеличению веса.
Ученые Кембриджского университета сравнили действие различных питательных веществ на клетки орексина.Они обнаружили, что аминокислоты — питательные вещества, содержащиеся в белках, таких как яичный белок, — стимулируют нейроны орексина гораздо больше, чем другие питательные вещества.
«Режим сна, здоровье и масса тела взаимосвязаны. Посменная работа, а также неправильное питание могут привести к ожирению», — сказал ведущий исследователь д-р Денис Бурдаков из отдела фармакологии и Института метаболических наук. «Электрические импульсы, излучаемые орексиновыми клетками, стимулируют бодрствование и говорят организму сжигать калории. Мы задались вопросом, изменяют ли эти импульсы пищевые вещества.«
Чтобы исследовать это, ученые выделили клетки орексина (которых мало и их трудно найти) с генетически направленной флуоресценцией в мозге мышей. Затем они ввели различные питательные вещества, такие как смеси аминокислот, подобные яичным белкам, отслеживая при этом импульсы орексиновых клеток.
Они обнаружили, что аминокислоты стимулируют орексиновые клетки. Предыдущая работа группы показала, что глюкоза блокирует клетки орексина (что было названо причиной сонливости после еды), поэтому исследователи также изучали взаимодействие между сахаром и белком. Они обнаружили, что аминокислоты не дают глюкозе блокировать орексиновые клетки (другими словами, белок нейтрализует влияние сахара на клетки).
Они обнаружили, что аминокислоты не дают глюкозе блокировать орексиновые клетки (другими словами, белок нейтрализует влияние сахара на клетки).
Эти данные могут пролить свет на ранее необъяснимые наблюдения, показывающие, что белковая пища может заставить людей чувствовать себя менее спокойными и более внимательными, чем углеводная.
«Что интересно, так это наличие рационального способа« настроить »отдельные клетки мозга, чтобы они были более или менее активными, решая, какую пищу есть», — сказал д-р Бурдаков. «Не все клетки мозга просто активируются всеми питательными веществами, состав рациона имеет решающее значение.
«Чтобы бороться с ожирением и бессонницей в современном обществе, нам нужно больше информации о том, как диета влияет на сон и клетки аппетита. На данный момент исследования показывают, что если у вас есть выбор между джемом на тосте или яичным белком на тосте, выбирайте последнее. ! Даже несмотря на то, что они могут содержать одинаковое количество калорий, небольшое количество белка скажет организму сжигать больше калорий из потребленных ».
История Источник:
Материалы предоставлены Кембриджским университетом .Оригинальная история находится под лицензией Creative Commons. Примечание. Содержимое можно редактировать по стилю и длине.
Пептидный и непептидный агонист рецепторов орексина | [Наука о жизни] Продукты
Обзор
YNT-185 · 2HCl является непептидным агонистом рецептора орексина 2 (OX 2 R). Орексины — это семейство нейропептидов, которые секретируются продуцирующим орексин нервом, присутствующим в гипоталамусе. Есть два варианта, рецепторы орексина существуют как два типа рецепторов, тип 1 и тип 2.В частности, рецептор орексина 2 участвует в регуляции сна и бодрствования, а дефицит орексина в мозге вызывает нарколепсию, нарушение сна, проявляющееся в невыносимой сонливости в течение дня. Хотя сообщалось, что внутрижелудочковое введение орексина приводит к облегчению симптомов на моделях нарколепсии на мышах, терапевтических эффектов нельзя ожидать, если он не вводится в мозг, поскольку орексин является пептидом и не может проходить через гематоэнцефалический барьер. Было показано, что внутрижелудочковое или внутрибрюшинное введение YNT-185 · 2HCl продлевает время бодрствования, а также, как сообщается, улучшает симптомы на моделях нарколепсии у мышей.
Было показано, что внутрижелудочковое или внутрибрюшинное введение YNT-185 · 2HCl продлевает время бодрствования, а также, как сообщается, улучшает симптомы на моделях нарколепсии у мышей.
- Внешний вид: Белый ~ слегка светло-коричневый кристаллический порошок ~ порошок
- Содержание (ВЭЖХ): 98,0% или более
- Растворимость: физиологический раствор (pH 2,4 ) … 1,3 моль / л 1)
※ Оптимальный pH при растворении составляет около 2,4 или меньше. - EC 50: OX 2 R… 0.028 мкмоль / л (свободное основание) 1) 、 OX 1 R… 2,750 мкмоль / л (свободное основание) 1)
- C 33 H 37 N 5 O 5 S ・ 2HCl ・ nH 2 O (C 33 H 37 N 5 O 5 S ・ 2HCl = 688,66)
- CAS RN ® : 1804978-82-2 (ангидрид)
Пробуждающий эффект
Когда YNT-185 · 2HCl вводили мышам интрацеребровентрикулярно, было показано увеличение уровня бодрствования в зависимости от объема. У мышей с дефицитом орексина эффекта пробуждения не наблюдалось. На основании этого было подтверждено, что YNT-185 ・ 2HCl оказывает влияние на рецепторы орексина.
У мышей с дефицитом орексина эффекта пробуждения не наблюдалось. На основании этого было подтверждено, что YNT-185 ・ 2HCl оказывает влияние на рецепторы орексина.
(данные предоставлены Янагисава М., Нагасе Х. и Фунато Х. из Международного института интегративной медицины сна (WPI-IIIS), Университет Цукуба)
Список литературы
- Нагахара, Т., Сайто, Т., Куцумура, Н., Ирукаяма-Томобе, Ю., Огава, Ю., Курода, Д., Гауда, Х., Кумагаи, Х., Фудзи, Х., Янагисава, , М. и Нагасе, Х.: J.Med. Chem. , 58, , 7931 (2015).
- Ирукаяма-Томобе, Ю., Огава, Ю., Томинага, Х., Исикава, Ю., Хосокава, Н., Амбай, С., Кавабе, Ю., Учида, С., Накадзима, Р., Сайто, T., Kanda, T., Vogt, K., Sakurai, T., Nagase, H., Yanagisawa, M.: Proc. Natl. Акад. Sci. США , 114 (22), 573 (2017).
- Тояма, С., Симояма, Н., Тагайто, Ю., Нагасе, Х., Сайто, Т., Янагисава, М. и Симояма, М.: Анестезиология , 128 , 992 (2018).
- Ямамото, К.


 , Уильямс, С.К., Ричардсон, Дж. А., Козловски, Г.П., Уилсон, С., Арч, Дж. Р., Бэкингем, Р. Э., Хейнс, А. К., Карр, С. А., Аннан, Р. С., Макналти, Д. Д., Лю, В. С., Террет, Дж. А., Эльшурбади, Н. А., Бергсма, Д. Д.,… Янагисава, М. (1998). Орексины и рецепторы орексина: семейство гипоталамических нейропептидов и рецепторов, связанных с G-белком, которые регулируют пищевое поведение.Ячейка, 92 (4), 573–585. Https://doi.org/10.1016/s0092-8674 (00) 80949-6
, Уильямс, С.К., Ричардсон, Дж. А., Козловски, Г.П., Уилсон, С., Арч, Дж. Р., Бэкингем, Р. Э., Хейнс, А. К., Карр, С. А., Аннан, Р. С., Макналти, Д. Д., Лю, В. С., Террет, Дж. А., Эльшурбади, Н. А., Бергсма, Д. Д.,… Янагисава, М. (1998). Орексины и рецепторы орексина: семейство гипоталамических нейропептидов и рецепторов, связанных с G-белком, которые регулируют пищевое поведение.Ячейка, 92 (4), 573–585. Https://doi.org/10.1016/s0092-8674 (00) 80949-6  , Преценцано, Ф., Тафури, Д., Салерно, М., Филиппи, Н., Нуччо , Ф., Руберто, М., Де Лука, В., Чиполлони, Л., Чибелли, Г., Моллика, М. П., Яконо, Д., Нигро, Э., Монда, М., Мессина, Г., & Мессина, А. (2017). Система орексинов: ключ к здоровой жизни. Границы физиологии, 8, 357. https://doi.org/10.3389/fphys.2017.00357
, Преценцано, Ф., Тафури, Д., Салерно, М., Филиппи, Н., Нуччо , Ф., Руберто, М., Де Лука, В., Чиполлони, Л., Чибелли, Г., Моллика, М. П., Яконо, Д., Нигро, Э., Монда, М., Мессина, Г., & Мессина, А. (2017). Система орексинов: ключ к здоровой жизни. Границы физиологии, 8, 357. https://doi.org/10.3389/fphys.2017.00357  Расстройство пищевого поведения и обмена веществ у нарколептических больных. Сон, 30 (10), 1267–1273. Https://doi.org/10.1093/sleep/30.10.1267
Расстройство пищевого поведения и обмена веществ у нарколептических больных. Сон, 30 (10), 1267–1273. Https://doi.org/10.1093/sleep/30.10.1267  smrv.2016.09.004
smrv.2016.09.004 
