НМИЦ онкологии им. Н.Н. Блохина
Научно-исследовательский институт экспериментальной диагностики и терапии опухолей (НИИ ЭДиТО) является структурным подразделением, входящим в состав ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Основные направления научной деятельности Института — разработка эффективных средств и методов диагностики, лечения и профилактики злокачественных новообразований человека.
История института
Институт был организован 26 марта 1981года , в соответствии с Приказом Министерства здравоохранения СССР, на базе уже существовавших научно-исследовательских лабораторий и нескольких вновь созданных подразделений. Основной целью деятельности института стало создание эффективных средств и новых методов диагностики, лечения и профилактики злокачественных новообразований. Институтом учрежден научный научно-практический журнал «Российский биотерапевтический журнал», который регулярно издается с 2002 года по настоящее время с периодичностью 4 раза в год.
Первым директором Института, на долю которого выпала непростая задача – фактически сформировать единый коллектив, наладить постоянное взаимодействие самостоятельных научных подразделений для наиболее эффективного решения основных задач – стал высококлассный специалист в области химиотерапии опухолей и клинической фармакологии, доктор медицинских наук, профессор Леонид Власович Мороз, с 1982 по 1989 г. Под его непосредственным руководством выполнялись исследования по комбинированной химиотерапии злокачественных новообразований различных локализаций в клинике, разработаны методические подходы к модификации лечебного действия противоопухолевых препаратов в эксперименте.
В 1989 году коллектив института возглавил широко известный в области экспериментальной онкологии учёный, руководитель фармакологии и токсикологии, а затем – одноименного отдела института, доктор медицинских наук, профессор Анатолий Борисович Сыркин. Большую часть своей жизни Анатолий Борисович посвятил разработке и изучению проблем в области экспериментальной химиотерапии опухолей, фармакологии и токсикологии противоопухолевых препаратов. Он внес конкретный существенный научно-практический вклад в создание новых отечественных противоопухолевых препаратов, в изучение их механизма действия, а также в совершенствование методологии токсикологического отбора и углубленного изучения токсических свойств противоопухолевых препаратов.
Большую часть своей жизни Анатолий Борисович посвятил разработке и изучению проблем в области экспериментальной химиотерапии опухолей, фармакологии и токсикологии противоопухолевых препаратов. Он внес конкретный существенный научно-практический вклад в создание новых отечественных противоопухолевых препаратов, в изучение их механизма действия, а также в совершенствование методологии токсикологического отбора и углубленного изучения токсических свойств противоопухолевых препаратов.
С 1998 года институтом руководил один их наиболее авторитетных специалистов России в области медицинской биотехнологии и онкоиммунологии, доктор медицинских наук, профессор, заслуженный деятель науки и техники РФ, лауреат премии Правительства РФ Анатолий Юрьевич Барышников (1998 – 2015 гг.). По его инициативе начал выпускаться журнал «Российский биотерапевтический журнал», организованы конференции «Отечественные противоопухолевые препараты». На последней XIII Всероссийской научно-практической конференции с международным участием «Отечественные противоопухолевые препараты», которая проходила в г.
В 2015 году коллектив института возглавила Зоя Сергеевна Шпрах, кандидат фармацевтических наук, автор более 150 научных работ, в том числе разделов Государственной Фармакопеи Российской Федерации XII-XIII изданий, перечня стандартных терминов, используемых в сфере обращения лекарственных средств (EDQM Standard Terms),изобретений и методических рекомендаций. Научная и организационная деятельность Зои Сергеевны Шпрах посвящена разработке противоопухолевых лекарственных средств, их доклиническим и клиническим исследованиям. Член EUFEPS (European Federation for pharmaceutical Sciences). Главный редактор журнала «Российский биотерапевтический журнал».
С 26 марта 2018 года по ноябрь 2018 года исполняющим обязанности директора по научной работе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России – директора НИИ экспериментальной диагностики и терапии опухолей был доктор медицинских наук, профессор Константин Константинович Лактионов.
Константин Константинович Лактионов – специалист в области клинических и прикладных исследований с использованием современных молекулярно-генетических, иммуноморфологических, биохимических методик, направленных на изучение биологических особенностей злокачественных новообразований, индивидуальных прогностических факторов, механизмов метастазирования, что позволяет проводить всесторонний анализ опухолевого материала, и предлагать наиболее оптимальный вариант лечения для каждого пациента. Инициатор создания компьютерной базы данных по тематике рак легкого с возможностью ее использования в многофакторном анализе. В 2006 г. он получил свидетельство об официальной регистрации программы для ЭВМ №2006613749 «ФАКТОР-ПРОГНОЗ-БИОМАРКЕРЫ» – система индивидуализации лечения больных раком легкого по биологическим маркерам.
Константин Константинович Лактионов принимает активное участие в научных конференциях. Автор и соавтор более 60 печатных работ. Материалы научно-практических исследований представлены на отечественных, зарубежных съездах и конференциях онкологов.
Материалы научно-практических исследований представлены на отечественных, зарубежных съездах и конференциях онкологов.
В настоящее время исполняющим обязанности директора по научной работе ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России – директора НИИ экспериментальной диагностики и терапии опухолей стал кандидат биологиеческих наук Косоруков Вячеслав Станиславович. Косоруков Вячеслав Станиславович начал свою научную деятельность в 1997г. в ГНУ «Биотехцентр» РАСХН где создал лабораторию молекулярной генетики. Научные исследования лаборатории вскоре сконцентрировались на получении лекарственных белков человека различными биотехнологическими методами. В 2002г в НИИ ЭДиТО была создана лаборатория трансгенных препаратов, где заведующим стал Косоруков Вячеслав Станиславович. Автор и соавтор более 50 публикаций и патентов, участник научных конференций в области онкологии и биотехнологии. Один из создателей технологии производства рекомбинантных моноклональных антител в растительной биомассе.
Структура, научная и научно-организационная деятельность НИИ Экспериментальной диагностики и терапии опухолей
За время существования института его структура динамично перестраивалась в соответствии с изменениями приоритетов в развитии медицинской науки. В настоящее время НИИ экспериментальной диагностики и терапии опухолей включает 15 структурных подразделений, которые занимаются решением фундаментальных и прикладных задач экспериментальной онкологии.
Основной задачей института является осуществление научных исследований в области разработки новых методов диагностики злокачественных заболеваний, создания оригинальных лекарственных препаратов, клеточных и молекулярно-биологических технологий.
В институте разрабатывают новые теоретические, экспериментальные и методические подходы к проблемам диагностики и терапии опухолей, проводятся исследования биологических, морфологических, биохимических, иммунологических, генетических и молекулярных возможностей диагностики и терапии опухолей в эксперименте.
Выполняются исследования по химическому синтезу активных субстанций и выделению активных соединений из растительного сырья, проводится разработка биопрепаратов, трансгенных препаратов, противоопухолевых вакцин, клеточных технологий и нанотехнологий, скрининг на противоопухолевую активность in vitro и in vivo.
В институте проводится разработка лекарственных форм противоопухолевых препаратов, охватывающих почти весь спектр имеющихся на международном рынке синтетических лекарственных средств. С использованием фармацевтических нанотехнологий создаются современные наноструктурированные формы (мицеллы, липосомы) различных субстанций.
Возможность создания новых оригинальных противоопухолевых препаратов обеспечивается комплексом доклинических, токсикологических и фармакологических исследований, которые проводятся в институте на высоком профессиональном уровне.
В институте создан банк опухолевых материалов животных и человека, обеспечивающий научные исследования не только в институтах НМИЦ, но и в профильных учреждениях России и зарубежных стран.
Функционирует разведение иммунодефицитных мышей, которое позволяет проводить исследования с первичными опухолями человека (ксенографтами) и прогнозировать эффективность новых препаратов. Поддерживается единственное в стране разведение собак породы английский бигль, необходимое для проведения токсикологических исследований.
В институте ведется поиск и разработка новых мишень-направленных препаратов (таргетных) на основе молекулярно-биологических и молекулярно-генетических исследований, комплексируясь с профильными учреждениями НМИЦ онкологии и другими организациями РФ и других стран.
Особое место в исследованиях занимает разработка методов диагностики злокачественных новообразований человека на основе использования молекулярно-биологических маркеров, технологии биологических микрочипов.
В институте разработаны диагностические моноклональные антитела, предназначенные для анализа иммунного статуса пациентов и дифференциальной диагностики лейкозов; получены моноклональные антитела к раково-тестикулярным антигенам, ведутся работы по доклиническому исследованию биохимических, противоопухолевых свойств моноклональных гуманизированных антител против опухолевого антигена Her2, получаемых из растительного источника; ведутся работы по созданию продуцентов рекомбинантных белков для терапевтических и диагностических целей. Также ведутся работы по получению и разработке новых терапевтических и диагностических антител.
В институте проводятся исследования по разработке стратегии создания биоимплантатов на основе клеточных технологий — проводится разработка биоимплантатов на основе внеклеточного костного матрикса или полимерных материалов с биоактивным покрытием. Разрабатываемые модели систем оценки показаний и противопоказаний применения биоимплантатов позволят выработать персонализированный подход при выборе методов реконструкции в зависимости от патологии, анатомической зоны, индивидуальных данных пациента, что оптимизирует применение данной технологии в широкой клинической практике.
Разрабатываемые модели систем оценки показаний и противопоказаний применения биоимплантатов позволят выработать персонализированный подход при выборе методов реконструкции в зависимости от патологии, анатомической зоны, индивидуальных данных пациента, что оптимизирует применение данной технологии в широкой клинической практике.
В НИИ экспериментальной диагностики и терапии опухолей успешно развивается такое направление, как иммунотерапия злокачественных новообразований – проводится разработка методов иммунотерапии на основе методов вакцинотерапии и геномного анализа.
Институт участвует в подготовке научно-исследовательских кадров для разработки проблем экспериментальной диагностики и терапии опухолей.
Свои знания и опыт ученые института передают молодым сотрудникам и аспирантам, представляют в докладах на отечественных и международных конференциях. В научно-практическом журнале «Российский биотерапевтический журнал», который пользуется заслуженным интересом ученых и медицинских работников, представлены статьи, отражающие научную деятельность института.
Сотрудники института принимают активное участие в организации конференций, симпозиумов, семинаров для обсуждения актуальных вопросов онкологии, тематических выставок по различным направлениям медицинской науки, в издании и распространение печатной продукции, содержащей результаты научной деятельности института, а также монографий, сборников научных трудов, материалов конференций и симпозиумов, статистических справочников, учебно-методической литературы и т.п.
Сотрудники института участвуют в учебном процессе специализированных кафедр ряда ВУЗов Москвы. На базе НИИ экспериментальной диагностики и терапии опухолей работает кафедра Первого ГММУ им. И.М. Сеченова фармакологии с курсом технологии лекарств.
В лабораториях института постоянно проводится подготовка дипломников и стажеров-исследователей. За последние 5 лет сотрудниками института защищено 6 докторских и 22 кандидатских диссертаций. Готовятся к защите 3 докторских и 10 кандидатских диссертаций.
Готовятся к защите 3 докторских и 10 кандидатских диссертаций.
В настоящее время в НИИ экспериментальной диагностики и терапии опухолей работает 160 сотрудников, из которых 113 являются научными сотрудниками. Среди них 22 доктора наук (9 имеют звание профессора) и 62 кандидата наук. Достижения ученых института отмечены высокими наградами правительства России: 2 заслуженных деятеля науки РФ, 1 заслуженный работник здравоохранения РФ, 2 лауреата «Премии Правительства РФ».
НМИЦ онкологии им. Н.Н. Блохина
История
Лаборатория экспериментальной диагностики и биотерапии опухолей НИИ ЭДиТО ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России была основана в июне 2002 года Анатолием Юрьевичем Барышниковым, который возглавлял ее с 2002 по 2015 гг.
Научная деятельность и достижения
Под руководством профессора А.Ю. Барышникова сотрудниками лаборатории созданы и запатентованы ряд клеточных линий меланомы человека; разработаны противоопухолевые вакцины, клинически апробированные при следующих нозологиях: меланома, рак почки, рак яичников, опухоли ЦНС, нейробластома, рак мочевого пузыря. Продолжаются исследования дендритноклеточной вакцины для терапии злокачественных новообразований и работа по созданию гибридом-продуцентов моноклональных антител. Разработаны и проходят исследования иммунолипосомальные лекарственные формы противоопухолевых препаратов. За время существования лаборатории были представлены к защите 3 докторские и 16 кандидатских диссертаций, получены 49 патентов на изобретения.
Продолжаются исследования дендритноклеточной вакцины для терапии злокачественных новообразований и работа по созданию гибридом-продуцентов моноклональных антител. Разработаны и проходят исследования иммунолипосомальные лекарственные формы противоопухолевых препаратов. За время существования лаборатории были представлены к защите 3 докторские и 16 кандидатских диссертаций, получены 49 патентов на изобретения.
На сегодняшний день в лаборатории выполняется научно-исследовательская работа по следующим темам:
-
«Разработка иммунологических подходов к диагностике и терапии опухолей с использованием моноклональных антител и клеточных вакцин»;
-
«Маркеры стволовой опухолевой клетки меланомы человека».
Лабораторией поддерживаются тесные рабочие взаимоотношения с НИИ КО и НИИ ДОиГ ФГБУ «НМИЦ онкологии им Н.Н.Блохина» Минздрава России, ГБУЗ МО МОНИКИ, НИЯУ «МИФИ», МГУ им. М.В.Ломоносова и другими исследовательскими базами.
М.В.Ломоносова и другими исследовательскими базами.
В настоящее время в лаборатории к защите готовятся 1 докторская и 3 кандидатские работы, а также студентами российских ВУЗов проводятся исследования для курсовых и дипломных работ под руководством сотрудников лаборатории.
Публикации сотрудников лаборатории
-
Vartanian А., Baryshnikova M., Burova O., Afanasyeva D., Misyurin V., Shprakh Z. Inhibitor of vasculogenic mimicry restores sensitivity of resistant melanoma cells to DNA-damaging // Melanoma Research. – 2017. – V .27, №1. – Р. 8 – 16.
-
Вартанян А.А., Бурова О.С., Уласов И.В., Барышникова М.А. Вовлечении аутофагии в васкулогенную мимикрию при меланоме // Российский биотерапевтический журнал. – 2017. – Т.16, №2. – С. 66 – 73.
-
Вартанян А.А. Метаболизм железа, ферроптоз, рак // Российский биотерапевтический журнал.
 – 2017. – Т.16, №3. – C. 14 – 20.
– 2017. – Т.16, №3. – C. 14 – 20.
-
Nikiforov V.N., Ivanov A.V., Brusentsov N.A., Gendler T.S., Irkhin V.Yu. Magnetically sensitive nanoparticles for magnetically controlled thermochemotherapy // Int. J. Nanotechnol. – 2017. – V. 14, № 7/8. – Р. 646 – 653.
-
Ivanov A.V., Nikiforov V.N., Shevchenko S.V., Timoshenko V.Yu., Pryadun V.V., Bulychev N.A., Bychenko A.B., Kazaryan M.A. Properties of metal oxide nanoparticles prepared by plasma discharge in water with ultrasonic cavitation // Int. J. Nanotechnol. – 2017. – Vol. 14, № 7/8. – Р. 618 – 626.
-
Nikiforov V.N., Goodilin E.A., Ivanov A.V., Ignatenko A.N.,. Irkhin V.Yu Influence of size and surface on magnetism of magnetite and maghemite nanoparticles // Int. J. Nanotechnol. – 2017. – V. 14, № 7/8. – Р. 654 – 664.
-
Khachatryan D.S., Belus S.
 K., Misyurin V.A., Baryshnikova M.A., Kolotaev A.V., Matevosyan K.R. Synthesis and properties of 1,2-dihydro-4(3H)-quinazolinones // Russian Chemical Bulletin, International Edition. – 2017. – V. 66, № 6. – P. 1044 – 1058.
K., Misyurin V.A., Baryshnikova M.A., Kolotaev A.V., Matevosyan K.R. Synthesis and properties of 1,2-dihydro-4(3H)-quinazolinones // Russian Chemical Bulletin, International Edition. – 2017. – V. 66, № 6. – P. 1044 – 1058.
-
Nifontova G., Zvaigzne M., Baryshnikova M., Korostylev E., Ramos-Gomes F., Alves F., Nabiev I., Sukhanova A. Next-Generation Theranostic Agents Based on Polyelectrolyte Microcapsules Encoded with Semiconductor Nanocrystals: Development and Functional Characterization // Nanoscale Research Letters 2018; 13:30. DOI 10.1186/s11671-018-2447-z
-
Тырсина Е.Г., Никулицкий С.И., Иншаков А.Н., Рябая О.О. VEGF-R1 как потенциальная молекулярная мишень для противоопухолевой терапии // Доклады Академии Наук (Биохимия, биофизика, молекулярная биология). – 2018. – Т. 478, № 2. – С. 236 – 239
-
Мисюрин В.А. Клиническое значение экспрессии гена PRAME при онкогематологических заболеваниях // Клиническая онкогематология.
 2018. – Т. 11, №1. – С. 26 – 33.
2018. – Т. 11, №1. – С. 26 – 33.
-
Пономарев А.В., Солодовник А.А., Мкртчян А.С., Финашутина Ю.П., Турба А.А., Мисюрин В.А., Мисюрин А.В., Барышникова М.А. Связь делеций и точечных мутаций гена р53 с резистентностью клеточных линий метастатической меланомы кожи человека к аранозе // Российский биотерапевтический журнал. – 2018. – Т. 17, №1. – С. 64 – 69.
-
Долгополов И.С., Чкадуа Г.З. Иммунотерапия и иммунопрофилактика некоторых видов рака: смена парадигмы // Онкопедиатрия. – 2018. – Т. 5, №1. – С. 70-74.
Группа молекулярных маркеров опухолей
Исследования проводятся по двум темам, утвержденным Минздравом РФ в рамках ГЗ:
«Разработка новых подходов к повышению эффективности противоопухолевой терапии, основанных на модификации действия лекарств и молекулярном фенотипе опухоли». Рук. – проф. Т.А. Богуш.
«Молекулярные маркеры опухолей торакоабдоминальной локализации: фундаментальные аспекты и оценка клинической значимости». Рук.: профессора Б.Е.Полоцкий, С.А. Тюляндин, Т. А. Богуш.
Рук.: профессора Б.Е.Полоцкий, С.А. Тюляндин, Т. А. Богуш.
Начало развития этих направлений исследований в рамках Онкологического научного центра можно отнести к 1969 году. У истоков стояли такие всемирно признанные ученые как академик АМН СССР Лев Манусович Шабад, член-корреспондент РАН Юрий Маркович Васильев, профессор Геннадий Алексеевич Белицкий. С
1976 г. группа сотрудников, развивавших это направление, работала в составе отдела фармакологии и токсикологии под руководством и при постоянной поддержке ведущего токсиколога страны профессора Анатолия Борисовича Сыркина. По его инициативе в 1993 году была организована лаборатория медицинской химии, которую возглавила профессор Т. А. Богуш. В 2017 году лаборатория медицинской химии преобразована в группу молекулярных маркеров опухолей.
В настоящее время проводятся исследования экспрессии опухолевых маркеров на хирургическом биопсийном материале с?лидных опухолей человека. Коллектив лаборатории адаптировал метод проточной цитофлуориметрии, традиционно применяемый в исследованиях биологических жидкостей, для изучения с?лидных опухолей человека. В результате был создан строго количественный, относительно простой и лишенный субъективизма метод, позволяющий анализ большой популяции опухолевых клеток, что в значительной степени решает проблему гетерогенности опухолей.
Коллектив лаборатории адаптировал метод проточной цитофлуориметрии, традиционно применяемый в исследованиях биологических жидкостей, для изучения с?лидных опухолей человека. В результате был создан строго количественный, относительно простой и лишенный субъективизма метод, позволяющий анализ большой популяции опухолевых клеток, что в значительной степени решает проблему гетерогенности опухолей.
С использованием данного метода мы исследуем экспрессию молекулярных маркеров, прогнозирующих (а) – резистентность к противоопухолевым препаратам и (б) – агрессивность течения болезни.
Наиболее важные разделы экспериментально-клинических исследований
1. Получены первые данные о молекулярных отличиях с?лидного и рецидивного асцитного рака яичников, которые свидетельствуют о молекулярной дедифференцировке эпителиальной опухоли в сторону мезенхимальной при росте в жидкости. А это значит, что при лечении генерализованной по брюшине форме этого заболевания существует реальная возможность для «вне нозологической» классификации, на основании которой противоопухолевая терапия должна принципиально отличаться от применяемой при лечении с?лидного очага рака яичников.
Проблема неэффективности лечения канцероматоза актуальна не только для рака яичников, поэтому мы продолжаем молекулярное фенотипирование опухолей других локализаций при диссеминации по брюшине и плевре. В первую очередь – это рак желудка, так как терапию канцероматоза также проводят препаратами, которые используются для лечения с?лидных эпителиальных опухолей желудочно-кишечного тракта. А насколько сохранён эпителиальный фенотип при диссеминации опухоли – это пока вопрос. Вероятно, что при выборе терапии асцитной формы рака желудка, как и при раке яичников, необходимо ориентироваться на молекулярную «вне нозологическую» классификацию заболевания, в соответствии с которой и подбирать препараты.
2. Отдельный аспект работы – молекулярная диагностика локальной распространенности немелкоклеточного рака легкого как ориентира, уточняющего радикализм хирургического вмешательства и тактику адъювантной терапии, что особенно важно на начальных стадиях этого заболевания.
Мы предположили, что ключом к решению этой задачи может стать молекулярная диагностика опухолевого узла и окружающей ткани легкого, основанная на исследовании белков, которые вовлечены в процесс малигнизации, но не выявляются в нормальных тканях. Это уникальное свойство присуще белку TUBB3, который экспрессируется только в опухолевых, но не в нормальных клетках.
К настоящему времени мы проанализировали около 80 пар хирургических образцов нормальной и опухолевой ткани легкого. В морфологически нормальной ткани экспрессия TUBB3 выявлена приблизительно в 80% случаев, при этом у разных больных уровень экспрессия этого опухолеспецифического белка различался значительно, но во всех случаях был ниже, чем в ткани немелкоклеточного рака легкого того же больного.
Этот результат свидетельствует о том, что морфологически нормальная ткань, окружающая очаг немелкоклеточного рака легкого, может быть вовлечена в процесс малигнизации, а потому, наряду с опухолью, должна рассматриваться как обязательный объект для молекулярной диагностики.
В полной мере это относится и к опухолям других локализаций, так как оценка локальной распространенности процесса при сравнительном исследовании опухоли и морфологически нормальной окружающей ткани органа может оказаться важным ориентиром при выборе объема хирургического вмешательства, а также при решении вопроса о целесообразности проведения химиотерапии как первичной, так и рецидивной опухоли.
3. Результаты количественной оценки экспрессии эстрогеновых рецепторов разных типов – ЭРa и ЭР? в хирургических образцах (более 400) немелкоклеточного рака легкого (НМРЛ) и рака яичников показали перспективность развиваемой нами новой стратегии адъювантной гормональной терапии злокачественных новообразований, отличных от рака молочной железы. Речь идет о возможности внедрении в клинику антиэстрогена тамоксифена, который на протяжении уже более 40 лет остается неизменно эффективным «золотым стандартом» адъювантной терапии больных раком молочной железы с положительным статусом ЭРa в опухоли.
При исследовании НМРЛ показано, что эстрогеновые рецепторы выявляются в опухоли у всех больных? при этом основным маркером являются ЭР?, т.к. медиана уровня экспрессии ЭР? почти в 2 раза превышает показатель для ЭРa. Именно ЭР? могут являться потенциальной мишенью антиэстрогенов при адьювантной терапии немелкоклеточного рака легкого.
Оценка корреляции показателей экспрессии ЭРa и ЭР? с выживаемостью больных НМРЛ при сроке наблюдения около 10 лет проведена у 124 пациента из 215, включенных в молекулярное исследование. При использовании метода Каплана-Майера не выявлено ассоциации между продолжительностью жизни пациентов и уровнем экспрессии в опухоли ЭРa. В то же время с высокой статистической достоверностью продемонстрирована неблагоприятная значимость экспрессии ЭР? в прогнозе выживаемости больных немелкоклеточным раком легкого при уровне экспрессии маркера выше 40%.
По нашему мнению объем исследования, длительность наблюдения, четкость полученной корреляции и финансовая доступность антиэстрогена тамоксифена для любого пациента, обосновывает необходимость внедрения «старого» и неизменно эффективного при раке молочной железы препарата по новому назначению. Речь идет о внедрении в клинику адъювантной антиэстрогеновой терапии больных немелкоклеточным раком легкого с уровнем экспрессии в опухоли ЭР? выше 40%. Это особенно важно в тех случаях, когда после радикальной операции больного оставляют под динамическим наблюдением.
Речь идет о внедрении в клинику адъювантной антиэстрогеновой терапии больных немелкоклеточным раком легкого с уровнем экспрессии в опухоли ЭР? выше 40%. Это особенно важно в тех случаях, когда после радикальной операции больного оставляют под динамическим наблюдением.
Результаты клинических оценок пока не опубликованы. Сторонние организации в работе участия не принимали, то есть это – приоритет Центра.
Дополнительно к сказанному, в рамках экспериментальной темы НИР проводятся исследования на животных по перепрофилированию лекарств. Речь идет об использовании совместно с химиотерапией средств, применяемых при неонкологических заболеваниях, для повышения эффективности цитостатиков. В частности, мы проводим исследования по совместному использованию цисплатина с сердечными гликозидами (дигоксин), с унитиолом и метформином. Для первых двух модификаторов получены убедительные доказательства возможности повышения эффективности цисплатина, доксорубицина, вепезида.
Работа по молекулярной диагностике резистентности методом проточной цитофлуориметрии продолжается со следующими молекулярными белковыми маркёрами: ERCC1; Pgp и другие АВС-транспортеры; Ki67; эстрогеновые рецепторы a и ?; виментин (диагностика эпителиально-мезенхимального перехода).
В настоящее время выполняются 6 кандидатских диссертаций (4 – совместно с клиникой). На постоянной основе дипломные работы выполняют студенты факультета фундаментальной медицины и биологического факультета МГУ им. М.В. Ломоносова В настоящее время работает 7 студентов.
Список основных публикаций за последние 5 лет приведен ниже. Многократно сотрудники лаборатории выступали с устными и стендовыми докладами на отечественных и зарубежных Симпозиумах, Съездах и Конференциях. Получено 2 патента.
Исследования поддержаны Российским Фондом Фундаментальных исследований. Сотрудники лаборатории неоднократно являлись лауреатами различных научных конкурсов. Работы студентов, участвующих в исследованиях лаборатории, неоднократно награждались дипломами «За лучший доклад на научной студенческой конференции», поддерживались Грантами оргкомитетов Международных студенческих конференций для представления докладов.
Работы студентов, участвующих в исследованиях лаборатории, неоднократно награждались дипломами «За лучший доклад на научной студенческой конференции», поддерживались Грантами оргкомитетов Международных студенческих конференций для представления докладов.
В России на базе НМИЦ им. Блохина открылась самая крупная детская онкологическая клиника — Общество
МОСКВА, 15 февраля. /ТАСС/. Научно-исследовательский институт детской онкологии и гематологии (НИИ ДОиГ) открылся в понедельник в Москве на базе Национального медицинского исследовательского центра (НМИЦ) онкологии им. Блохина. В торжественной церемонии открытия приняли участие вице-премьер России Татьяна Голикова и министр здравоохранения Михаил Мурашко, передает корреспондент ТАСС.
«Хочу сразу сказать, что этот центр является одной из составляющих тех реорганизаций в системе онкологии, начиная с 2018 года <…> То, что сегодня делается, это системная работа», — сказал Мурашко.
Новый корпус включает 275 коек. В частности, как уточнили в пресс-службе Центра им. Блохина, 25 коек крупнейшего в стране трансплантационного центра, позволит принимать до 1,5 тыс. детей в год, что поможет закрыть оставшуюся потребность страны в высокотехнологичной онкологической помощи пациентам от 0 до 18 лет — инновационная онкохирургия, трансплантация костного мозга, высокодозная химио- и иммунная терапия.
В частности, как уточнили в пресс-службе Центра им. Блохина, 25 коек крупнейшего в стране трансплантационного центра, позволит принимать до 1,5 тыс. детей в год, что поможет закрыть оставшуюся потребность страны в высокотехнологичной онкологической помощи пациентам от 0 до 18 лет — инновационная онкохирургия, трансплантация костного мозга, высокодозная химио- и иммунная терапия.
Отмечается также, что пациенты НИИ детской онкологии и гематологии получают лечение по международным протоколам, каждый из них проходит молекулярно-генетическое тестирование, что дает возможность разрабатывать персональный режим высокодозной химиотерапии у детей со злокачественными опухолями высокого риска. «Новые современные подходы в диагностике и лечении позволяют врачам НИИ детской онкологии и гематологии НМИЦ онкологии им. Н. Н. Блохина сохранять жизни до 80% заболевших детей (в среднем по всем видам опухолевых заболеваний). Год от года совершенствуются органосохраняющие технологии. Пациенты, страдающие опухолями костей, успешно эндопротезируются. При опухолях орбиты и глаза врачи в большинстве случаев сохраняют ребенку глаз и зрение. Органосохраняющее лечение получает 95% пациентов», — отметили в пресс-службе.
При опухолях орбиты и глаза врачи в большинстве случаев сохраняют ребенку глаз и зрение. Органосохраняющее лечение получает 95% пациентов», — отметили в пресс-службе.
ФГБУ «НМИЦ онкологии им. Н. Н. Блохина» Минздрава России — крупнейшая онкологическая клиника России и Европы, конгломерат медицинской помощи, образования и науки. Включает три клинических института — НИИ клинической онкологии, НИИ детской онкологии и гематологии, НИИ клинической и экспериментальной радиологии. А также два института, занимающихся фундаментальными научными разработками — НИИ канцерогенеза, НИИ экспериментальной диагностики и терапии опухолей. С 2014 года работает производственный филиал «Наукопрофи», где разрабатываются оригинальные противоопухолевые лекарственные препараты. Ежегодно в центре проходят лечение более 221 тыс. пациентов. Здесь сосредоточены лучшие онкологи страны, проводящие множество уникальных операций, используется новейшее оборудование и передовые методики диагностики и лечения всех видов рака.
Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина
Федеральное государственное бюджетное учреждение «Национальный медицинский исследовательский центр онкологии имени Н.Н. Блохина» Министерства здравоохранения Российской ФедерацииФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России – крупнейшая онкологическая клиника России и Европы.
В структуру центра входят пять подразделений:
- Научно-исследовательский институт клинической онкологии имени Н.Н. Трапезникова,
- Научно-исследовательский институт детской онкологии и гематологии,
- Научно-исследовательский институт клинической и экспериментальной радиологии,
- Научно-исследовательский институт канцерогенеза,
- Научно-исследовательский институт экспериментальной диагностики и терапии опухолей
Основными видами деятельности центра являются:
- оказание высококвалифицированной медицинской помощи больным со злокачественными новообразованиями и предопухолевой патологией,
- проведение научных исследований в области изучения биологии опухолевой клетки, механизмов канцерогенеза и опухолевой прогрессии (молекулярные, вирусологические, химико-физические, генетические, клеточные, иммунологические аспекты),
- экспериментальная и клиническая разработка новых технологий в области хирургического лечения злокачественных опухолей,
- разработка новых средств и методов диагностики, лекарственной, лучевой и комбинированной терапии, а также активной профилактики опухолей.

Главный врач к.м.н Дорошев Игорь Анатольевич
Главная медицинская сестра Аскерова Ирина Юрьевна
Адрес: г. Москва, Каширское шоссе, д. 23.
Тел.+7(499)3241919
E-mail [email protected] Оф.сайт: www.ronc.ru
Национальный медицинский исследовательский центр онкологии им. Н. Н. Блохина
ФГБУ «Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина» Минздрава России – крупнейшая онкологическая клиника России и Европы, одна из самых крупных онкологических клиник в мире, имеющая в своем арсенале новейшее оборудование и все передовые методики диагностики и лечения рака.
Своей целью мы видим непрерывное улучшение качества и доступности онкологической помощи. Для достижения этой цели мы работаем над совершенствованием системы организации медицинской помощи и внедрением последних технологий.
В структуру центра входят пять подразделений:
- Научно-исследовательский институт клинической онкологии имени Н.
 Н. Трапезникова, рассчитанный на 900 коек;
Н. Трапезникова, рассчитанный на 900 коек; - Научно-исследовательский институт детской онкологии и гематологии, рассчитанный на 150 коек;
- Научно-исследовательский институт клинической и экспериментальной радиологии, рассчитанный на 50 коек;
- Научно-исследовательский институт канцерогенеза, включающий в себя 16 лабораторий;
- Научно-исследовательский институт экспериментальной диагностики и терапии опухолей, включающий в себя 15 лабораторий.
В настоящее время в центре работают более 3500 человек, в том числе 5 академиков Российской академии наук, 7 членов-корреспондентов РАН, 89 профессоров и более 200 докторов наук.
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России имеет три филиала: Алтайский филиал в Барнауле, Приволжский филиал в Республике Татарстан и Научно-производственный филиал «Наукопрофи», расположенный в Москве. На базе центра работают 8 кафедр медицинских академий и университетов.
С 2017 по настоящее время ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава РФ возглавляет член-корреспондент РАН, профессор Иван Стилиди. Иван Сократович является признанным лидером онкохирургии в России и за рубежом, опытный клиницист-онколог, универсальный хирург, в совершенстве владеющий всеми типами и объемами операций, в том числе сложными реконструктивными вмешательствами у детей и взрослых больных новообразованиями торако-абдоминальной локализации. Владеет современными видеотораколапароскопическими технологиями оперирования на органах грудной и брюшной полостей.
Н.Н. Блохина» Минздрава РФ возглавляет член-корреспондент РАН, профессор Иван Стилиди. Иван Сократович является признанным лидером онкохирургии в России и за рубежом, опытный клиницист-онколог, универсальный хирург, в совершенстве владеющий всеми типами и объемами операций, в том числе сложными реконструктивными вмешательствами у детей и взрослых больных новообразованиями торако-абдоминальной локализации. Владеет современными видеотораколапароскопическими технологиями оперирования на органах грудной и брюшной полостей.
Сотрудниками центра проводятся масштабные исследования в области экспериментальной и клинической онкологии.
Научно-исследовательский институт экспериментальной диагностики и терапии опухолей
Все клиники в Москве
Запись к врачу по телефону в нии — Научно-исследовательский институт экспериментальной диагностики и терапии опухолей по адресу Каширское ш., 24А, Москва
Запомни телефон:Открыто. Местное время 11:14
| Пн | Вт | Ср | Чт | Пт | Сб | Вс |
|---|---|---|---|---|---|---|
9:00 — 17:15 | 9:00 — 17:15 | 9:00 — 17:15 | 9:00 — 17:15 | 9:00 — 16:00 | — | — |
Голосов: 0 чел. Рейтинг: 0 из 5.
Рейтинг: 0 из 5.
Как Вы записываетесь к врачу? (Кол-во голосов: 91340)
Через интернет
По телефону
Посещаю лично
Чтобы проголосовать, кликните на нужный вариант ответа.РезультатыНаучно-исследовательский институт экспериментальной диагностики и терапии опухолей
Рейтинг: 0 оценок
Записываясь на прием к врачу в нии «Научно-исследовательский институт экспериментальной диагностики и терапии опухолей» обратите внимание на особенности:
государственная организацияДа
Рабочее время в которое можно записаться на прием к врачу Пн 09:00 — 17:15, Вт 09:00 — 17:15, Ср 09:00 — 17:15, Чт 09:00 — 17:15, Пт 09:00 — 16:00
Научно-исследовательский институт экспериментальной диагностики и терапии опухолей находится по адресу:
Каширское ш., 24А, Москва
Интересно: Как записаться на прием к врачу через портал «Госуслуги»
О компании
Нии НИИ ЭД и ТО — мед. учреждение, которое располагает новейшим профессиональным оборудованием опытным штатом сотрудников. Принимает клиника в следующее время — пн-чт 9:00–17:15; пт 9:00–16:00.
Принимает клиника в следующее время — пн-чт 9:00–17:15; пт 9:00–16:00.
Недорогие услуги мед учреждения, грамотный подход к лечению клиента — лишь часть того, что делает мед учреждение популярным у жителей Москвы.
У нас на портале можете произвести запись на приемв учреждение «Нии НИИ ЭД и ТО» , ознакомиться с прайс-листом на услуги мед. учреждения, ознакомиться с перечнем предоставляемых услуг. Сделать запись в в нии можно в любое время.
По выше приведенным телефонам задавайте ваши вопросы, консультируйтесь у сотрудников о насущных проблемах.
Грамотный, индивидуальный подход к каждому больному — слоган компании «Нии НИИ ЭД и ТО». Мы находимся здесь: Россия, Москва, Каширское шоссе, 24а.
Записывайтесь на прием к врачу к нам в нии и мы с большим желанием примем Вас!
Фото объекта
Все клиники в Москве
Построить маршрут по карте до объекта нии, либо до ближайших объектов:
2-й Котляковский пер., 1, стр. 35, Москва
ул. Москворечье, 7, стр. 7, Москва
7, Москва
ул. Москворечье, 7, стр. 6, Москва
Каширское ш., 34, стр. 9, Москва
ул. Москворечье, 7, стр. 8, Москва
Научно-исследовательский институт экспериментальной диагностики и терапии опухолей Текст научной статьи по специальности «Фундаментальная медицина»
74. Mechetner E.B., Shipova L.Y., Baranov V.N., Agranovich I.M. II Oncodevelop.proteins and clinical applications. — Moskou, 1990.
75. Moravia A., Levskin Y. I/ Prevent medicine. — 1992. — Vol. 21. — P. 151 — 161.
76. Morozov V.A., Saal F., Yessain A. et al. Intervir. — 1991. — Vol. 32.
— P. 253—257.
77. Myasisheva N. V. II Biomical and Physiology of vitamin B12. — London, 1990. — P. 193—198.
78. Rovensky Y.A., Bershadsky A. D., Vasiliev J.M. et al. // Exp.Cell Res.
D., Vasiliev J.M. et al. // Exp.Cell Res.
— 1991, —Vol. 197.— P. 107—112.
79. SenjutaN., Pavlish O., Gurtsevich V. II Lancet. — 1991. — Vol. 338.
— P. 1394.
80. Sokova O.P. et al. // Cancer Genet.Cytogenet. — 1992. — Vol. 58.
— P. 24—28.
81. Spitkovsky D.D., Royer-Pokora D., Delins H. et al. // Nucleic Acids Res. — 1991. — Vol. 20, № 4. — P. 797—803.
82. Stavrovskaya A.A., Djuraeva F.N., Stromskaya T.P. II J. Cancer Res.Clin.Oncol. — 1990. — Vol. 117. — P. 95—96.
83. Tichonencko F.T. et al. // Virus.Genes. — 1990. — Vol. 3. — P.267—269.
© А. Б.Сыркин, 1992 УДК 616-006:061.6
Б.Сыркин, 1992 УДК 616-006:061.6
А.Б.Сыркин
Научно-исследовательский институт экспериментальной диагностики и терапии опухолей
НИИ экспериментальной диагностики и терапии опухолей
В 1981 г. организован Научно-исследовательский институт экспериментальной диагностики и терапии опухолей (НИИ ЭДиТО), первым директором которого был проф. Л.В.Мороз. Институт входит в состав Онкологического научного центра РАМН.
Основными направлениями фундаментальных и прикладных исследований института являются поиск, изучение и создание новых противоопухолевых препаратов, усовершенствование других видов терапии, разработка новых подходов к диагностике и профилактике опухолей.
В институте имеется весь комплекс подразделений, необходимых для создания и исследования новых противоопухолевых препаратов. Синтез и выделение новых соединений ведутся в лаборатории химии противоопухолевых соединений (С.Я.Мельник) и группах химии природных соединений (Ф.Ф.Бланко) и пептидов (Л.И.Смирнова). Противоопухолевая активность новых соединений определяется в отделе экспериментальной химиотерапии (Г.К.Герасимова), в группах первичного отбора in vitro (О.С.Жукова), in vivo (Н.Я.Юрченко), изучения противоопухолевых веществ (А. Л .Коновалова) , природных веществ (Е.М.Трещалина), гормональных веществ (З.С. Смирнова), экспериментальной терапии метастазов (А.М.Козлов). Перспективные соединения передаются в лабораторию разработки лекарственных форм (Н.А.Оборотова) и лабораторию химикофармацевтического анализа (Б.С.Кикоть).
Синтез и выделение новых соединений ведутся в лаборатории химии противоопухолевых соединений (С.Я.Мельник) и группах химии природных соединений (Ф.Ф.Бланко) и пептидов (Л.И.Смирнова). Противоопухолевая активность новых соединений определяется в отделе экспериментальной химиотерапии (Г.К.Герасимова), в группах первичного отбора in vitro (О.С.Жукова), in vivo (Н.Я.Юрченко), изучения противоопухолевых веществ (А. Л .Коновалова) , природных веществ (Е.М.Трещалина), гормональных веществ (З.С. Смирнова), экспериментальной терапии метастазов (А.М.Козлов). Перспективные соединения передаются в лабораторию разработки лекарственных форм (Н.А.Оборотова) и лабораторию химикофармацевтического анализа (Б.С.Кикоть).
Переносимость и биодоступность соединений с выявленной противоопухолевой активностью в виде лекарственной формы изучаются в отделе фармакологии и токсикологии (А.Б.Сыркин), в лаборатории токси-
84. Tichonenko А.Т. et al. // Virology. — 1991. — Vol. 181. — P.367—370.
Tichonenko А.Т. et al. // Virology. — 1991. — Vol. 181. — P.367—370.
85. Tint I.S., Bershadsky A.D., Vasiliev I.M. 11 Proc.Nat.Acad.Sci. USA. — 1991. — Vol. 88. — P. 6318—6322.
86. Tint I.S., Hollenbeck P.I., Verkhovsky A.B. et al. // J.Cell Sci. — 1991. — Vol. 98. — P. 375—384.
87. Turusov К5., Truchanova L.S., Parfenov V.D. II Cancer Lett. — 1991. — Vol. 56. — P. 29—36.
88. Yasova A.JC, Goussev A.I., Poltoranina V.S., Yakimenko E.F. II Immun.Lett. — 1990. — Vol. 25. — P.325—330.
89. Zaridze D.G. II Recent progress in research on nutrition and cancer. — Nagaya, 1991. — P. 203—207.
90. Zaridze D.G., Safaev R.D., Belitsky G.A. et al. IIIARC Scientific Publications. — 1991. — Vol. 105. — P. 485—488.
— Vol. 105. — P. 485—488.
91. Zaitseva M.B., Moshnikov S.A., Kozhich A.T. et al. // Scand.J.Immunol. — 1992. — Vol. 35 — P. 267—274.
Поступила 02.06.92. / Submitted 02.06.92.
A.B.Syrkin
The Research Institute of Experimental Diagnostics and Therapy of Tumors
Research Institute of Experimental Diagnostics and Therapy of Tumors
The Research Institute of Experimental Diagnostics and Therapy of Tumors (RIEDTT) was established in 1981 under the head of Professor L.V.Moroz. The Institute is a division of the Cancer Research Center of the RAMS.
The main trends of fundamental and applied research at the Institute include search for, study and development of new antitumor drugs, improvement of therapeutic modalities, working out of new approaches to diagnosis and prevention of tumors.
The Institute incorporates a complex of units necessary for development and study of new antitumor drugs. Synthesis and isolation of new compounds are carried out at the Laboratory of Antitumor Compounds Chemistry (S.Ya.Melnik) and groups of natural compound (F.F.Blanko) and peptide (L.I.Smimova) chemistry. Antitumor activity of new compounds is assessed at the Experimental Chemotherapy Unit (G.K.Gerasimova) and groups of primary screening in vitro (O.S.Zhukova), in vivo (N.Ya.Yurchenko), study of antitumor compounds (A.L.Konovalova), natural compounds (E.M.Treschalina), hormonal substance (Z.S.Smirnova) and experimental metastasis therapy (A.M.Kozlov). Promising compounds are passed over to the Drug Development Laboratory (N.A.Oborotova) and the Laboratory of Chemical and Pharmaceutical Analysis (B.S.Kikot).
Tolerance and bioavailability of compounds with antitumor activity as pharmaceutical forms are studied at the Pharmacology and Toxicology Laboratory (A. B.Syrkin), the Drug Toxicology Laboratory (LM. Mikhailova),
B.Syrkin), the Drug Toxicology Laboratory (LM. Mikhailova),
41
Биоконтроль (токсичность, пирогенность) Biocontrol Itoxldty, pyrogenldty)
Схема фармакотоксикологических исследований
* Программа мини-токси зависит от химической структуры соединения и выявляет преимущества в переносимости нового препарата перед известными.
Diagram of pharmacotoxicological investigations
* The mini-foxi program depends upon fhe compound chemical structure and is to reveal advantages of the new drug with respect to tolerance over medicines already known..
колонии лекарств (Л.М.Михайлова), группах патоморфологии (Т.Н.Гаврилова) и фармакокинетики и биодоступности (Н. И.Зимакава). Действующие начала (субстанции) новых препаратов нарабатываются в опытно-наработочной лаборатории (В.Н.Толкачев) в количествах, необходимых для предклинического и клинического изучения в рамках I и II фаз. Наработку готовых лекарств для клинического изучения производит соответствующая труппа (Т.И.Клоч-кова). На этом этапе объединенными усилиями химиков, технологов и фармацевтов создается лабораторно-технологический регламент на производство препарата для подготовки к передаче технологии на опытно-промышленное, а затем и промышленное производство.
И.Зимакава). Действующие начала (субстанции) новых препаратов нарабатываются в опытно-наработочной лаборатории (В.Н.Толкачев) в количествах, необходимых для предклинического и клинического изучения в рамках I и II фаз. Наработку готовых лекарств для клинического изучения производит соответствующая труппа (Т.И.Клоч-кова). На этом этапе объединенными усилиями химиков, технологов и фармацевтов создается лабораторно-технологический регламент на производство препарата для подготовки к передаче технологии на опытно-промышленное, а затем и промышленное производство.
После подведения итогов предклинического изучения в Фармакологический комитет направляются соответствующие документы для получения разрешения на клинические испытания.Основные классы химических соединений, в которых ведется поиск новых противоопухолевых препаратов, следующие: нитрозомочевины, комплексные соединения платины, триазеноимидазолы, гормоноцитостатики, гидразоны стероидных гормонов, хлорэтиламины, модифицированные нуклеозиды, полисахариды, пептидные гормоны, ферменты. Модели отбора новых противоопухолевых препаратов: 1) трансплантированные опухоли мышей и крыс, включая опухоли с приобретенной устойчивостью, 2) индуцированные опухали мышей и крыс, 3) спонтанные опухоли животных, 4) стационарные клеточные культуры меланомы и толстой кишки человека, 5) первичные краткосрочные культуры опухолей человека, 6) опухоли человека, пересаженные под капсулу почки, 7) опухоли человека, трансплантированные иммунодефицитным мышам и крысам. Последовательность фармакотоксикологических исследований представлена на схеме.
Модели отбора новых противоопухолевых препаратов: 1) трансплантированные опухоли мышей и крыс, включая опухоли с приобретенной устойчивостью, 2) индуцированные опухали мышей и крыс, 3) спонтанные опухоли животных, 4) стационарные клеточные культуры меланомы и толстой кишки человека, 5) первичные краткосрочные культуры опухолей человека, 6) опухоли человека, пересаженные под капсулу почки, 7) опухоли человека, трансплантированные иммунодефицитным мышам и крысам. Последовательность фармакотоксикологических исследований представлена на схеме.
groups of pathomorphology (T.N.Gavrilova), pharmacokinetics and bioavailability (N.I.Zimakova). Active agents (substances) of new drugs are produced at the Experimental Manufacture Laboratory (V.N.Tol-kachev) in amounts needed for preclinical and phase I, II clinical studies. A special group (T.I.Klochkova) is engaged in manufacture of drugs ready for clinical trial. At this stage laboratory and technology reglaments for production of the drug are developed by joint action of chemists, technologists and pharmaceutists to be further passed over to experimental industrial and industrial production units.
After results of the preclinical study are summed up a set of papers are submitted to the Pharmacology Committee for permission of clinical trial.
The main classes of chemical compounds for development of new antitumor drugs are as follows: nitrosoureas, platinum complexes, triazenoimidazoles, hormono-cytostatics, hydrazones of steroid hormones, chlo-roethylamines, modified nucleozides, polysaccharides, peptide hormones, enzymes. Screening models of new antitumor drugs incorporate 1) transplanted tumors of rats and mice including neoplasms with acquired resistance, 2) induced rat and mouse tumors, 3) spontaneous animal tumors, 4) stationary cell cultures of human melanoma and colonic carcinoma, 5) primary short-term human tumor cultures, 6) subrenal capsule human tumor implants, 7) human tumor implants to nude rats and mice. The sequence of pharmacotoxicological investigations is presented in the diagram.
During the last years a carbohydrate-containing nitrosourea derivative aranose (synthesized under the head of M.N.Preobrazhenskaya) has been recom-
В последние годы углеводсодержащее производное нитрозомочевины — араноза (руководитель синтеза М.Н.Преображенская) рекомендовано к практическому применению для лечения меланомы и продолжает исследоваться в клинике. Другие производные нитрозомочевины и имидазолкарбоксамида успешно проходят клинические испытания по II фазе. Комплексное соединение платины—платин (цисдиги-дроксиламиндихлороплатина, II) (предложено А.И.Стеценко) разрешено к практическому применению для лечения злокачественных опухолей яичка и яичника. Комплексное соединение платины 2-й генерации — циклоплатам (III) (руководитель синтеза П.А.Чельцов) передано на I фазу клинических испытаний. На I фазу в клинику переданы также тести-фенон (I) и кортифен (II). Ряд других препаратов находится на разных стадиях изучения (см. таблицу).
таблицу).
Стадии изучения и создания препаратов, исследованных в НИИ ЭДиТО
Предклиниче-ские исследования Клинические исследования Рекомен-
дованы и ис-
1 фаза II фаза пользуются в
практике
Гидразоны сте- Циклоплатам Производное Розевин —
роидных Кортифен нитрозомоче- воспроизве-
гормонов Тестифенон вины денный вин-
Асалин Производное бластин
ИМБ-97 имидазолкар- Платин
Сарколизин боксамида Араноза
(для инъекций) Рибамидил —
Ьаспарагиназа воспроизве-
Глюкоспаза денный вира-
Лизиноксидаза зол
Липохромин Кальция фоли-
Митоксантрон нат — воспро-
Сетреме — медь- изведенный
содержащее лейковорин
соединение
Исследования механизма и закономерностей биологического действия противоопухолевых препаратов привели к установлению ряда новых фактов.
Основной задачей лаборатории клеточного метаболизма является изучение молекулярных механизмов действия новых и уже применяемых в клинике противоопухолевых препаратов. В этом плане выявлена важная роль рецепторов гормонов и нейромедиаторов в реализации противоопухолевого эффекта цитостатиков. На поверхности клеток перевиваемых опухолей обнаружены и охарактеризованы рецепторы нейромедиаторов. Показано, что ряд противоопухолевых препаратов разных классов (сарколизин, актиномицин и др.) с высокой степенью специфичности связываются с этими рецепторами, меняя их число и чувствительность к природным лигандам, что приводит к дезорганизации или блокированию ответа опухолевых клеток на действие митогенов.
Установлено, что протеинкиназа С является важной
mended for practical use in treatment for melanoma and continues to be studied clinically. Other derivatives of nitrosourea and imidazolecarboxamide are a success in phase II clinical trial. A platinum complex platin (cis-dihydroxylamminedichloroplatinum, II) (proposed by A.I.Stetsenko) is sanctioned for practical use in treatment for malignant tumors of the testis and ovary. A second generation platinum complex cycloplatam (III) (synthesized under the head of P.A.Cheltsov) is passed over to phase I clinical trial. Testifenon (I) and cortifen (II) are also on phase I clinical trial. A number of other drugs are at different stages of the study (see the table).
Other derivatives of nitrosourea and imidazolecarboxamide are a success in phase II clinical trial. A platinum complex platin (cis-dihydroxylamminedichloroplatinum, II) (proposed by A.I.Stetsenko) is sanctioned for practical use in treatment for malignant tumors of the testis and ovary. A second generation platinum complex cycloplatam (III) (synthesized under the head of P.A.Cheltsov) is passed over to phase I clinical trial. Testifenon (I) and cortifen (II) are also on phase I clinical trial. A number of other drugs are at different stages of the study (see the table).
Stages of drug study and development at the RIEDTT
Precllnlcal study Clinical trial Recommended and used In practice
phase 1 phase II
Hydrazones of Cycloplatam Nitrosourea Rosevin —
steroid Cortifen derivative reconstituted
hormones Testifenon Imldazoie- vinblastine
IMB-97 carboxamide Platin
Asalln derivative Aranose
Sarcolysin (for Rlbamldyl —
Injections) reconstituted
L-asparaglnase vlrasoi
Glucospase Calcium
Lyslnoxydase follnate —
Mltoxanthron reconstituted
Setremed — leucovorin
copper-
containing
compound
Investigations of mechanism and regularities of antitumor drug biologic action have resulted in discovery of new facts.
Activities of the Laboratory of Cellular Metabolism are aimed at study of molecular mechanisms of action of new antitumor drugs and those used in the clinical practice. A significant role of hormone and neuromediator receptors is discovered in realization of antitumor effect of cytostatics. Neuromediator receptors are found on the surface of transplanted tumors and characterized. A number of antitumor drugs belonging to different classes (sarcolysin, actinomycin etc.) with high degree of specificity are shown to bind to these receptors and change their number and sensitivity to natural ligands which results in desorganization and blockade of the tumor cell response to action of mitogens.
The proteinkinase C is proven to be an important target for some antitumor drugs. New data are obtained about the structure of DNA supramolecular complexes of neoplastic and normal cells as a target of antitumor drug action. In particular, 3 groups of disulfide bonds are discovered in the DNA-protein complex that control DNA subunits compatible in size with transcriptons, re-plicons and domain-cluster structures of eukaryotic cells. The disulfide bonds of tumor cells (leu-
In particular, 3 groups of disulfide bonds are discovered in the DNA-protein complex that control DNA subunits compatible in size with transcriptons, re-plicons and domain-cluster structures of eukaryotic cells. The disulfide bonds of tumor cells (leu-
мишенью в действии некоторых противоопухолевых препаратов. Получены новые данные о структуре надмолекулярных комплексов ДНК опухолевых и нормальных клеток как мишени действия противоопухолевых препаратов. В частности, установлены 3 группы дисульфидных связей в комплексе ДНК—белок, которые контролируют субъединицы ДНК, соразмерные транскриптонам, репликонам и доменокластерным структурам клеток эукариот. Показана большая чувствительность дисульфидных связей опухолевых клеток (лейкоз Р388), чем нормальных, к действию ряда агентов. Эти данные дают рациональное объяснение определенной избирательности действия противоопухолевых препаратов, повреждающих дисульфидные связи (алкилирующие соединения, платиновые препараты и др. ).
).
Разработаны краткосрочные биохимико-фармаколо-гические тесты для выявления больных гемобластоза-ми, устойчивыми к цитозару, винкристину, позволяющие оценивать биохимические механизмы устойчивости бластных клеток.
Совместно с Институтом проблем Управления РАН разработана наиболее полная из известных в настоящее время математическая модель биосинтеза пуриновых и пиримидиновых нуклеотидов, синтеза ДНК и РНК (более 60 ферментов) и действия антиметаболитов на этот комплекс реакций. Модель используется для изучения регуляторных связей внутри изучаемого комплекса реакций и создания гипотез оптимального сочетания антиметаболитов для опухолей с разной чувствительностью к ним.
Совместно с лабораторией медицинской кибернетики ОНЦ оценена информативность экспериментальных тестов, используемых для прогноза клинической активности противоопухолевых препаратов. Компьютерный анализ показал, что используемые при поиске новых препаратов экспериментальные модели опухолей не позволяют выявлять препараты, эффективно воз-
Компьютерный анализ показал, что используемые при поиске новых препаратов экспериментальные модели опухолей не позволяют выявлять препараты, эффективно воз-
kemia P388) are shown to be more sensitive to some agents than normal cells. These data give a rational explanation of certain selectiveness of action of some antitumor drugs that damage the disulfide bonds (alkylating compounds, platinum complexes, etc.).
Short-term biochemical and pharmacological tests have been developed for detection of hemoblastoses resistant to cytosar, vincristine, that allow assessment of biochemical resistance mechanisms of blasts.
Together with the Institute of Management Problems of the RAS we have developed a mathematical model for biosynthesis of purine and pyrimidine nucleotides, DNA and RNA synthesis (more than 60 enzymes) and action of metabolites on this complex of reactions which is the most complete among all mathematical models known so far. The model is used to study regulatory bonds in the reaction complex under consideration and to derive hypotheses of optimal combination of antimetabolites for tumors of different sensitivity to them.
The model is used to study regulatory bonds in the reaction complex under consideration and to derive hypotheses of optimal combination of antimetabolites for tumors of different sensitivity to them.
Together with the Laboratory of Medical Cybernetics of the CRC we have estimated informative content of experimental tests used in prognosis of clinical activity of antitumor drugs. A computer-based analysis has shown that experimental tumor models do not allow discovery of drugs efficient against human tumors such as pancreatic, gastric, colonic, small intestinal cancers and some others. We have also found some highly informative characteristics for prognosis of drug efficacy in treatment for lung, prostatic and some other cancers.
Software and information technology of the data bank of antitumor drugs are developed (G.N.Aprysh-ko). The data bank is composed of 6 data bases bound with the drug code, as follows structural formulae;
nomenclature characteristics and descriptor data; physical and chemical properties; cytotoxic activity;
действующие на такие опухоли человека, как рак поджелудочной железы, желудка, толстой и тонкой кишок и др. В то же время найдены некоторые высокоинформативные показатели, позволяющие прогнозировать эффективность препаратов в отношении рака легкого, предстательной железы и др.
В то же время найдены некоторые высокоинформативные показатели, позволяющие прогнозировать эффективность препаратов в отношении рака легкого, предстательной железы и др.
Разработаны программные средства и информационная технология банка данных по противоопухолевым препаратам (Г.Н.Апрышко). Банк данных построен по модульному принципу и содержит 6 связанных кодом препарата баз данных:
по структурным формулам, по номенклатурным характеристикам и паспортным данным, по физико-химическим свойствам, по цитотоксической активности, по противоопухолевым свойствам, по токсическим свойствам.
Банк данных реализован на персональном компьютере IBM PS-2. Программное обеспечение банка позволяет проводить ввод, хранение и поиск по всем перечисленным группам данных, включая структурный и подструктурный поиск, а также визуализировать данные в удобном для использования виде (включая графические изображения химических структурных формул).
В группе первичного отбора противоопухолевых препаратов in vivo используются следующие линии опухолевых клеток человека: карциномы толстой кишки (линия WiDr), карциномы молочной железы (линия МаТи), немелкоклеточного рака легкого (линия А-549), карциномы яичника (линия CaOv), меланомы (линия MeWo) и моноцитарного лейкоза (линия L-41). Данные линии дифференциально чувствительны к основным классам клинических препаратов: цитозару, 5-фторурацилу, метотрексату, цис-ДДП, сарколизину, адриамицину, рубомицину, винкристину, НММ и ACNU.
Общее число веществ, прошедших первичный отбор, составило 1060, из них противоопухолевую активность проявили 15 соединений.
В группе изучения противоопухолевых веществ создаются штаммы резистентных опухолей. За последние годы созданы 4 штамма (лейкоза L-1210), резистентных к нитрозоалкилмочевинам, и 3 штамма, резистентных к комплексным соединениям платины МОРС-406/ДДП, L-1210/ДДП, Р388/циклоплатам.
Проводятся также исследования, направленные на снижение токсичности и повышение эффективности отобранных и переданных на клинические испытания препаратов.
Группой изучения гормональных веществ показано, что меланостатин за счет повышения толерантности организма к цитотоксической терапии позволяет применять токсические дозы циклофосфана и адриамици-на и тем самым усиливать их противоопухолевый эффект. Проведена работа по выбору перевиваемых опу-
antitumor properties;
toxicity.
The data bank is IBM PC-2 based. The bank software provides for input, storage and retrieval of data in all the above-mentioned groups including structural and substructural retrieval, as well as visualization of the data (including graphic display of chemical structural formulae).
The primary in vivo screening of antitumor drugs uses the following human tumor cell lines: colonic carcinoma (WIDR), breast carcinoma (MaTu), non-small cell lung carcinoma (A-549), ovarian carcinoma (CaOv), melanoma (MeWo) and monocytic leukemia (L-41). These lines exhibit differential sensitivity to main classes of chemical drugs, i.e. cytosar, 5-fluorou-racil, methotrexate, c/s-DDP, sarcolysin, adriamycin, rubomycin, vincristine, NMU and ACNU.
There are 1060 substances that have passed the primary screening of which 15 compounds possess antitumor activity.
The group of antitumor substances culture strains of refractory tumors. For the last years they have obtained 4 strains (leukemia L-1210) resistant to nitro-soalkylureas and 3 strains resistant to platinum complexes MOPC-406/DDP, L-1210/DDP, P388/cyclo-platam.
Investigations are carried out with the aim to decrease toxicity and increase efficiency of the selected drugs ready for clinical trial.
The group of hormonal substances has shown that melanostatin increases tolerance to cytostatic therapy and therefore allows administration of toxic doses of cy-clophosphane and adriamycin thus ensuring enhancement of the antitumor effect. A research in selection of tumors for transplantation and their orthotopic variants has been carried out. It has been proven that cancer of the uterine cervix RSM-5 implanted to the uterus may be used for screening of progestin derivatives, and melanoma B-16 becomes sensitive to estrogens after administration of corticosteroids and castration.
The group of natural substances has evaluated prospects of polysaccharide- and phospholipide-based agents of natural origin as antitumor and adjuvant drugs. An experimental model is constructed for screening of antitumor drugs to be used in treatment for malignant tumor pleuritis, and a technique is worked out of experimental intrapleural tumor implantation. Regularities of action of antileukemic enzyme L-asparagi-nase in immobilization on bioundegradable polymers are established. A new class of antitumor drugs is developed on the basis of ascorbigent derivatives with a cytotoxic group.
Regularities of action of antileukemic enzyme L-asparagi-nase in immobilization on bioundegradable polymers are established. A new class of antitumor drugs is developed on the basis of ascorbigent derivatives with a cytotoxic group.
The group of experimental metastasis therapy has created an experimental model for evaluation of antimetastatic activity of drugs. In order to increase adequacy of the experimental models to actual clinical situations new methods of ectopic transplantation of
холей и их ортотопических вариантов. Установлено, что рак шейки матки РШМ-5, перевитый в матку, может использоваться для отбора производных прогести-нов, а меланома В-16 на фоне кастрации и введения кортикостероидов становится чувствительной к эстрогенам.
В группе изучения природных веществ оценена перспективность использования в онкологии в качестве противоопухолевых и вспомогательных средств препаратов на основе полисахаридов, фосфолипидов природного происхождения. Создана экспериментальная модель для скрининга противоопухолевых препаратов, предназначенных для лечения злокачественного опухолевого плеврита, и разработан метод внутриплев-ральной прививки опухолей в эксперименте. Установлены закономерности действия противолейкозного фермента L-аспарагиназы при иммобилизации на био-недеградируемом полимере. Найден новый класс противоопухолевых препаратов, созданных на основе производных аскорбигентов с цитотоксической группой.
Создана экспериментальная модель для скрининга противоопухолевых препаратов, предназначенных для лечения злокачественного опухолевого плеврита, и разработан метод внутриплев-ральной прививки опухолей в эксперименте. Установлены закономерности действия противолейкозного фермента L-аспарагиназы при иммобилизации на био-недеградируемом полимере. Найден новый класс противоопухолевых препаратов, созданных на основе производных аскорбигентов с цитотоксической группой.
Группой экспериментальной терапии метастазов разработана экспериментальная модель для оценки ан-тиметастатической активности препаратов. Для повышения степени адекватности экспериментальных моделей клинической ситуации разработаны новые способы эктопической трансплантации ряда перевиваемых опухолей (акатол — в стенку толстой кишки, меланомы В-16 — внутрикожно, АК-755 — в ложе молочной железы) , оценена чувствительность их к химиотерапевтическим препаратам и способность к метастазированию. Проводятся работы по изучению механизма метастази-рования опухолей. Обнаружено значительное повышение содержания и активности активаторов плазминоге-на в метастазирующих опухолях и нарастание активности ингибиторов протеиназ в циркуляторном русле, сопровождающееся снижением фибринолитической активности крови.
Проводятся работы по изучению механизма метастази-рования опухолей. Обнаружено значительное повышение содержания и активности активаторов плазминоге-на в метастазирующих опухолях и нарастание активности ингибиторов протеиназ в циркуляторном русле, сопровождающееся снижением фибринолитической активности крови.
В лаборатории экспериментальной эндокринной терапии опухолей (И.С.Буренин) получены модели злокачественных опухолей яичника, предстательной и молочной желез, адекватные человеческим по злокачественности и реактивности на гормональные воздействия. Разработаны подходы к лечению некоторых гормонозависимых опухолей с использованием регуляторных пептидов. В частности, показана возможность использования агониста люлиберина в комплексной терапии опухолей предстательной железы, яичника и матки. Так, наблюдались удлинение сроков ремиссии при использовании агонистов люлиберина у животных с опухолями яичника после химиотерапии и эффективность агониста люлиберина при рецидиве рака яичника.
На базе созданных в лаборатории фармакоцитокинетики (Я.В.Добрынин) скрининговых систем для отбора противоопухолевых веществ in vitro было изучено более 1000 синтезированных соединений из классов модифицированных пуриновых и пиримидиновых оснований и их нуклеозидов (индолы, изатины, пирролопири-
some tumors are worked out (Akatol — into the colonic wall, melanoma B-16 subcutaneously, AC-755 — into the breast bottom), their sensitivity to chemotherapeu-ticals and ability to metastasize are also estimated. A research in metastasizing mechanism is carried out. A considerable rise is discovered in content and activity of plasminogen activators in metastasizing tumors, as well as increasing activity of proteinase inhibitors in the circulatory stream accompanied by decreasing fibrinolytic blood activity.
Models of malignant tumors of the ovary, prostate and breast adequate to human neoplasms in malignancy and response to hormonal influence are obtained at the Laboratory of Experimental and Endocrine Therapy of Tumors (I. S.Burenin). Approaches are worked out to treatment for some hormone-dependent tumors using regulatory peptides. In particular, possibility of employment of luliberin agonists in complex therapy of tumors of the prostrate, ovary and uterus is shown. Administration of luliberin agonists resulted in longer remissions in animals with ovarian tumors after chemotherapy, luliberin agonists were also efficient in treatment for ovarian cancer relapse.
S.Burenin). Approaches are worked out to treatment for some hormone-dependent tumors using regulatory peptides. In particular, possibility of employment of luliberin agonists in complex therapy of tumors of the prostrate, ovary and uterus is shown. Administration of luliberin agonists resulted in longer remissions in animals with ovarian tumors after chemotherapy, luliberin agonists were also efficient in treatment for ovarian cancer relapse.
More than 1000 synthesized compounds belonging to classes of modified purine and pyrimidine bases and their nucleosides (indoles, isatines, pyrrolopyrimid-ines, pyrasolopyrimidines, triazoles, benzimidazoles etc.) were studied on the basis of in vitro antitumor drug screening systems developed at the Laboratory of Pharmacokinetics (Ya.V.Dobrynin). The selected compounds with biological activity were the basis for new antitumor and antiviral drugs silur, aranose, ribomidyl. More than 200 organical compounds of selenium, germanium, silicon were studied.
Separate antiviral and antiproliferative activity was discovered in interferons.
A method of radiometric estimation of sensitivity of tumor bioptic preparations to antitumor drugs and a DNA-cytometric method of postoperative tumor disease prognosis are developed and used in the clinical practice. Populational tumor composition (ploidy, multiclo-nality) is proven significant for prediction of disease duration and patients’ life time.
Mechanisms of the alternating magnetic field effect on tumor cells and experimental animal tumors are studied. Activation of cellular natural antitumor resistance is proven important.
The Laboratory of Biologic Antitumor Immunity Modifiers (V.I.Kupin) has demonstrated potentiating effect of natural biologically active immunity modifiers of vegetable origin (Eleutherococcus, Ginseng, Rhodio-la, Schisandra chinensis, Ganoderma lucidum, lenti-nan, etc. ) on the immune system; the drugs are proven to induce interferon production.
) on the immune system; the drugs are proven to induce interferon production.
The group of laser treatment (A.V.Ivanov) has discovered a potential effect of non-damaging laser radiation on immunity characteristics of both normal
мидины, пиразолопиримидины, триазолы, бензимида-золы и др.). Отобранные биологически активные вещества являлись основой для создания препаратов (противовирусных и противоопухолевых) силур, араноза, ри-бамидил. Изучено более 200 элементорганических соединений селена, германия, кремния.
В результате изучения интерферонов выявлена раздельная противовирусная и антипролиферативная активность.
Разработаны и используются в клинической практике метод радиометрического определения чувствительности биоптатов опухолей к противоопухолевым препаратам и ДНК-цитометрический метод прогнозирования течения опухолевого процесса в послеоперационном периоде. Показана значимость популяционного состава опухолей (плоидность, многоклоновость) в предсказании давности заболевания и продолжительности жизни больных.
Показана значимость популяционного состава опухолей (плоидность, многоклоновость) в предсказании давности заболевания и продолжительности жизни больных.
Изучены механизмы воздействия переменного магнитного поля на опухолевые клетки и экспериментальные опухоли животных. Показана значимость активации клеток естественной противоопухолевой резистентности.
В лаборатории биологических модификаторов противоопухолевого иммунитета (В.И.Купин) показано по-тенциирующее влияние природных биологически активных модификаторов иммунитета растительного происхождения (элеутерококка, женьшеня, родиолы розовой, китайского лимонника, Ganoderma Lucidum, лентинана и др.) на иммунную систему; обнаружены интерферониндукторные свойства у этих препаратов.
В группе лазерных методов лечения (А.В.Иванов) выявлен потенциальный эффект лазерного излучения неповреждающей интенсивности на иммунологические показатели как здоровых людей, так и больных со злокачественными новообразованиями. Намечены перспективы использования лазерных источников излучения в различных областях: гелий-неонового — в онкологии и гелий-кадмиевого — в аллергологии, трансплантологии при аутоиммунных процессах. Разработан и используется в практике лечения метод лазерной адаптивной фотоиммунотерапии женщин с опухолью молочных желез для профилактики метастазирования.
Намечены перспективы использования лазерных источников излучения в различных областях: гелий-неонового — в онкологии и гелий-кадмиевого — в аллергологии, трансплантологии при аутоиммунных процессах. Разработан и используется в практике лечения метод лазерной адаптивной фотоиммунотерапии женщин с опухолью молочных желез для профилактики метастазирования.
Объектом исследования лаборатории сравнительной онкологии (В.И.Пономарьков) и в последние годы клинико-экспериментальной терапии (В.Н.Митин) являются спонтанно возникающие опухоли у собак и кошек. Материалы, накопленные в лаборатории, свидетельствуют о том, что структура онкологических заболеваний собак и кошек так же разнообразна, как и у человека, а в клинико-морфологическом отношении они чрезвычайно близки аналогичным опухолям человека. На животных с опухолями костей, кроветворной ткани, молочных желез, кожи прошли доклиническое изучение такие отечественные противоопухолевые химиопрепараты, как циклоплатам, араноза, кортифен и другие.
Одним из направлений работы лаборатории является
people and patients with malignant lesions. Laser sources of helium-neon radiation are planned to be used in oncology, helium-cadmium lasers — in allergology, in autoimmune processes in transplantology. A technique of laser adaptive photoimmunotherapy is developed and used in treatment of women with breast tumors for metastasis prevention.
The Laboratory of Comparative Oncology (V.I.Pono-markov) and, for the last years, the Clinic of Experimental Therapy (V.N.Mitin) carry out research in spontaneous tumors of dogs and cats. The material gathered at the Laboratory proves that the malignancy pattern in dogs and cats is as diverse as in man, and their tumors are very close to human neoplasms by clinical implications and morphology. A number of Russian antitumor chemotherapeuticals such as cyclopla-tam, aranose, cortifen and others have been preclini-cally studied on these animals having tumors of bones, the hemopoietic tissue, breast, skin.
Comparative study of specific peculiarities of pathogenesis, histogenesis and morphology of tumors in dogs is an important trend of the research. Investigations performed have proven the interspecific comparison of basic parameters of tumor growth to be a promising approach to comprehension of the tumor nature.
The Laboratory of Radiative Methods of Treatment for Tumors (A.A.Vainson) has developed and passed over for practical use methods of improving radiotherapy of malignant lesions based on polyradiomodification, including hyperthermia, induction of short-term hyperglycemia and reduction of the blood stream in the tumor. An optimal sequence of agents is established to be used to reach the same inhibition of tumor growth with half the dose of ionizing radiation as compared with the modalities without modifiers. This significant rise in the radiation damaging effect is selective and does not lead to affection of normal tissues. The selectiveness of the radiomodifying action is based on structural differences in the circulatory system of the normal tissue and the tumor.
The selectiveness of the radiomodifying action is based on structural differences in the circulatory system of the normal tissue and the tumor.
The efficiency of radiotherapy may be improved by a method of selective protection of normal tissues worked out at the Laboratory together with other units of the Center that consists in inhalation by the patient of gas mixtures with decreased oxygen content. The protection of normal tissues allows a higher radiation dose to be delivered to the tumor and therefore increases the damage to malignant cells. Inhalation of a 8 % oxygen air-nitrogen mixture during preoperative irradiation of gastric cancer permits a 40% rise in the dose and increases the patients’ survival, as well as reduces severity of radiation complications. The method of hypo-xyradiotherapy developed at the Laboratory is used in many countries. Professor S.P.Yarmonenko, the head of the Laboratory for many years, was awarded the State Prize for the text book «Human and Animal Radiobiology». The group of biophysics of ionizing radi-
The group of biophysics of ionizing radi-
также изучение в сравнительном аспекте видовых особенностей патогенеза, гистогенеза и морфологии опухолей собак. Исследования, выполненные в этом направлении, показали, что межвидовое сопоставление основных параметров опухолевого роста является обещающим подходом к пониманию природы опухолей.
В лаборатории лучевых методов лечения опухолей (А.А.Вайнсон) разработаны и переданы для практического использования способы повышения эффективности лучевой терапии злокачественных новообразований за счет использования методов полирадиомодификации, включающих гипертермическое воздействие, создание кратковременной гипергликемии и применение средств снижения кровотока опухоли. Установлена оптимальная последовательность применения агентов, позволяющая получить такое же подавление опухолевого роста при использовании вдвое меньшей дозы ионизирующего излучения по сравнению с облучением опухоли без использования модификаторов. Столь значительное усиление повреждающего действия излучения на опухоли является строго избирательным и не сопровождается усилением поражения нормальных тканей. Избирательность радиомодифицирующего действия основана на принципиальных различиях в строении кровеносной сети нормальных тканей и опухоли.
Столь значительное усиление повреждающего действия излучения на опухоли является строго избирательным и не сопровождается усилением поражения нормальных тканей. Избирательность радиомодифицирующего действия основана на принципиальных различиях в строении кровеносной сети нормальных тканей и опухоли.
Повышению эффективности лучевой терапии опухолей способствует разработанный в лаборатории вместе с другими подразделениями Центра метод избирательной защиты нормальных тканей путем перевода больных в момент облучения на дыхание газовыми смесями с пониженным по сравнению с воздухом содержанием кислорода. Защита нормальных тканей создала возможность повышения подводимой к опухоли дозы радиации и тем самым усиления поражения злокачественных клеток. Воздушно-азотная дыхательная смесь, содержащая 8% кислорода, при предоперационном облучении рака желудка и лучевом лечении рака шейки матки позволила увеличить на 40% подводимую к опухоли дозу, улучшить выживаемость больных при снижении тяжести лучевых осложнений. Разработанный в лаборатории метод, получивший название гипоксира-диотерапии, начал использоваться в нескольких странах. Проф. С.П.Ярмоненко, руководившему лабораторией многие годы, за учебник «Радиобиология человека и животных» присуждена Государственная премия. Биологические эффекты электромагнитных полей исследуются группой биофизики неонизирующих излучений (А.Ю.Смирнов).
Разработанный в лаборатории метод, получивший название гипоксира-диотерапии, начал использоваться в нескольких странах. Проф. С.П.Ярмоненко, руководившему лабораторией многие годы, за учебник «Радиобиология человека и животных» присуждена Государственная премия. Биологические эффекты электромагнитных полей исследуются группой биофизики неонизирующих излучений (А.Ю.Смирнов).
Коллекция штаммов мышиных опухолей с различным метастатическим потенциалом и различной органной тропностью метастазов создана в группе метаста-зирования (В.М.Сенин). В лаборатории биохимических механизмов действия противоопухолевых препаратов (А.Локшин) завершена разработка метода скрининга противоопухолевых препаратов с использованием клеток меланомы человека ВгО, пересаженных под капсулу почки иммунодепрессированным мышам.
ation (A.Yu.Smirnov) carries out research in biologic effects of electromagnetic fields.
A collection of murine tumor strains with different metastatic potentials and different organic tropicity of metastases has been gathered at the metastasizing research group (V.M.Senin). The Laboratory of Biochemical Mechanisms of Action of Antitumor Drugs (A.Lockshin) has developed a method of antitumor drug screening based on employment of human melanoma (BrO) cells implanted under the renal capsule of nude mice.
The Laboratory of Antitumor Compound Chemistry is engaged in working out techniques of synthesis of nucleosides containing «anchor» groups in the carbohydrate residue able of non-covalent interaction with nucleic acids by intercalation, ion binding, etc.
The Laboratory has performed synthesis of modified pyrimidine nucleosides and desoxynucleosides containing residues of nicotinic, chinaldinic and anthrachinon-carbonic acids bound to the nucleoside with an esteric or amidic bond as «anchor» groups. A research is carried out in synthesis of derivatives in which aminoalco-hols are used to bind the modifying fragment, this allows variation of both the bond type and remoteness of the «anchor» from the nucleoside. Compounds with cytotoxic and antitumor activity have been found among the new nucleoside derivatives synthesized.
A research is carried out in synthesis of derivatives in which aminoalco-hols are used to bind the modifying fragment, this allows variation of both the bond type and remoteness of the «anchor» from the nucleoside. Compounds with cytotoxic and antitumor activity have been found among the new nucleoside derivatives synthesized.
The peptide chemistry group has synthesized mela-nostatin, somastatin analogs (penta-, hexa- and octa-peptides) and C-end gastrin analogs (tetra- and penta-peptides) for screening.
The group of natural compound chemistry has accomplished chemical characterization of polysaccharides exhibiting antitumor and immunomodulating activity isolated from mushrooms Aspergillus oryrae and Picnoporus cinnabarinus and overground plants Coma-rum palustre, Glechoma hederaceae and Picnoporus cinnabarinus, as well as from microorganisms Bacillus polymyxa, Auerobasidium pollulans, Acinetobacter sp. and Xanthomonas campestres.
and Xanthomonas campestres.
The medical chemistry group (T.A.Bogush) develops methods of increasing activity of cytostatics by modifying their metabolism with liver monooxygenases and interaction with cells. About one third of cancer patients have decreased activity of liver monooxygenases before treatment, and therefore, the chemotherapeutic effect on these patients cannot be optimal even in high tumor sensitivity. In order to reduce toxicity and improve treatment outcomes in patients with low metabolic liver activity the liver function should be stimulated upto the normal level.
The Laboratory of Experimental Diagnostics of Tumors (G.A.Tkacheva) is engaged in development of new immunologic methods of human tumor diagnosis based on hybridomal technology. The researchers have obtained 20 hybridomal producers of monoclonal antibodies to tumor-associated antigens, 18 of them
В лаборатории химии противоопухолевых соединений разрабатываются методы синтеза нуклеозидов, содержащих в углеводном остатке «якорные» группы, способные к нековалентному взаимодействию с нуклеиновыми кислотами по типу интеркаляции, ионного связывания и т. п. В ходе исследований осуществлен синтез модифицированных пиримидиновых нуклеозидов и дезоксинуклеозидов, содержащих в качестве «якорных» групп остатки никотиновой, хи-нал ьдиновой или антрахинонкарбоновой кислоты, соединенных с нуклеозидом сложноэфирной или амидной связью. Изучаются пути синтеза производных, в которых для привязки модифицирующего фрагмента используются аминоспирты, что позволяет варьировать не только тип связи, но и удаленность «якоря” от нуклеозида. Среди синтезированных новых производных нуклеозидов найдены соединения с цитотокси-ческой и противоопухолевой активностью.
п. В ходе исследований осуществлен синтез модифицированных пиримидиновых нуклеозидов и дезоксинуклеозидов, содержащих в качестве «якорных» групп остатки никотиновой, хи-нал ьдиновой или антрахинонкарбоновой кислоты, соединенных с нуклеозидом сложноэфирной или амидной связью. Изучаются пути синтеза производных, в которых для привязки модифицирующего фрагмента используются аминоспирты, что позволяет варьировать не только тип связи, но и удаленность «якоря” от нуклеозида. Среди синтезированных новых производных нуклеозидов найдены соединения с цитотокси-ческой и противоопухолевой активностью.
В группе химии пептидов синтезированы для скрининга меланостатин, аналоги соматостатина (пента-, гекса- и октапептиды) и С-концевые аналоги гастрина (тетра- и пентапептиды).
В группе химии природных соединений химически охарактеризованы обладающие противоопухолевой и иммуномодулирующей активностью полисахариды из грибов Aspergillus oryzae и Picnoporus cinnabarinus и надземных растений Comarum palustre, Glechoma hederaceae и Picnoporus cinnbarinus, а также из микроорганизмов Bacillus polymyxa, Auerobasidium pullulans, Acinetobacter sp. и Xanthomonas campestres.
и Xanthomonas campestres.
В группе медицинской химии (Т.А.Богуш) разрабатываются методы повышения эффективности цитоста-тиков путем модификации их метаболизма моноокси-геназами печени и взаимодействия с клетками. Около трети онкологических больных перед проведением лечения имеют сниженную активность монооксигеназ печени, а следовательно, даже при высокой чувствительности опухолевых клеток эффект химиотерапии у больных не может быть оптимальным. Для уменьшения токсичности и повышения эффективности лечения больных со сниженной метаболической активностью печени необходима ее стимуляция до уровня нормально функционирующего органа.
В лаборатории экспериментальной диагностики опухолей (Г.А.Ткачева) занимаются разработкой новых иммунологических методов диагностики опухолей человека на основе гибридомной технологии. Получено 20 гибридом-продуцентов моноклональных антител к опухолеассоциированным антигенам, 18 из них депонировано в Российской коллекции клеточных линий (Институт цитологии, Санкт-Петербург). Наибольший интерес представляют моноклональные антитела к мембранным антигенам эпителиальных злокачественных опухолей прямой и толстой кишок (СЕА-1, СЕА-2, СЕА-4), молочной железы (ВСА-2), яичника (MOCA-1, МОСА-2). Показана пригодность этих моноклональных антител для использования в дифференциальной
Наибольший интерес представляют моноклональные антитела к мембранным антигенам эпителиальных злокачественных опухолей прямой и толстой кишок (СЕА-1, СЕА-2, СЕА-4), молочной железы (ВСА-2), яичника (MOCA-1, МОСА-2). Показана пригодность этих моноклональных антител для использования в дифференциальной
have been deposited in the Russian collection of cell lines (Cytology Institute, St Petersburg). Of the most interest are monoclonal antibodies to membrane antigens of epithelial malignant tumors of the colon and rectum (CEA-1, CEA-2, CEA-4), breast (BCA-2), ovary (MOCA-1, MOCA-2). These monoclonal antibodies are proven to be useful in differential diagnosis of tumors of the gastrointestinal tract, ovaries, womb, breast, lung, in cytologic and morphologic studies. Based on these monoclonal antibodies 5 immunoenzy-matic diagnosticums are developed and made ready for industrial production for estimation of concentration of tumor-associated markers, such as breast, ovary, prostate cancer antigens, /З-2-microglobulin and carci-noembryonic antigen. 3 immunocytochemical diagnosticums on the basis of monoclonal antibodies are developed and passed over for clinical trial.
3 immunocytochemical diagnosticums on the basis of monoclonal antibodies are developed and passed over for clinical trial.
The Laboratory of Non-Toxic Immunomodulators (A.V.Sergeev) develops agents for active cancer prevention based on natural anticarcinogens and nontoxic immunomodulators. As a result of the fundamental research in immunopharmacology the most promising agents have been selected, such as a complex from dog-rose fruits with high content of carotenoids, synthetic /З-carotene, polysaccharides from plants (palus-tran, tagentan), milk glycopeptides. These compounds make a basis for prophylactic drugs and food additives.
We attach great importance to international cooperation. We carry out joint research together with the Antitumor Drug Center of the Roswell Park Memorial Institute (Buffalo, USA). Screening of new chemical compounds for cytotoxic and antitumor activity is performed together with the European Organization for Research of Cancer (EORTC, Netherlands) and National Cancer Institute (USA). Together with the Carolina Institute (Stockholm, Sweden) we study reparative changes in DNA of tumor cells exposed to radiation and modification of radiation affection with electron acceptor radiosensitizers. Our Institute carries out joint research with Bulgaria, Moldova, Latvia, Ukraine and other countries.
Together with the Carolina Institute (Stockholm, Sweden) we study reparative changes in DNA of tumor cells exposed to radiation and modification of radiation affection with electron acceptor radiosensitizers. Our Institute carries out joint research with Bulgaria, Moldova, Latvia, Ukraine and other countries.
Submitted 02.06.92 / Поступила 02.06.92
диагностике опухолей органов желудочно-кишечного тракта, яичников, матки, молочной железы, легкого в цитологических и морфологических исследованиях. На основе этих моноклональных антител разработано и подготовлено к промышленному освоению 5 иммуно-ферментных диагностикумов для определения концентрации опухолеассоциированных маркеров: антигенов рака молочной железы, яичника, предстательной железы /32-микроглобулина и раково-эмбрионального антигена. Разработаны и переданы на клиническую апробацию 3 иммуноцитохимических диагностикума на основе моноклональных антител.
Лаборатория по созданию нетоксичных иммуномодуляторов (А.В.Сергеев) разрабатывает средства активной профилактики злокачественных новообразований на основе естественных антиканцерогенов и нетоксичных иммуномодуляторов. В результате фундаментальных изысканий по иммунофармакологии выбраны наиболее перспективные объекты исследования: высо-кокаротиноидный комплекс из плодов шиповника, синтетический /3-каротин, полисахариды из растений (па-люстран, тагентан), гликопептиды молочного происхождения. На основе этих соединений создаются лекарственные средства и пищевые добавки для использования с профилактическими целями.
В рамках международного сотрудничества, расширению которого придается большое значение, ведутся совместные исследования с Центром изучения противоопухолевых препаратов Росвел Парк мемориал Института (США, Буффало). Скрининг новых химических соединений на цитотоксическую и противоопухолевую активность проводится совместно с Европейской организацией по изучению и лечению рака (EORTC, Нидерланды) и Национальным раковым институтом (NCI, США). Совместно с Каролинским институтом (Швеция, Стокгольм) проводятся исследования динамики репарации ДНК облученных опухолевых клеток, а также модификации радиационных повреждений с помощью электроноакцепторных радиосенсибилизаторов. Совместные исследования проводятся с Болгарией, Молдовой, Латвией, Украиной и другими государствами.
Совместно с Каролинским институтом (Швеция, Стокгольм) проводятся исследования динамики репарации ДНК облученных опухолевых клеток, а также модификации радиационных повреждений с помощью электроноакцепторных радиосенсибилизаторов. Совместные исследования проводятся с Болгарией, Молдовой, Латвией, Украиной и другими государствами.
Иммунотерапия рака яичников — Институт исследования рака (CRI)
Иммунотерапия рака яичников демонстрирует огромный потенциал в борьбе с этим разрушительным заболеванием, и в настоящее время проводится несколько клинических испытаний новых методов лечения.
Рак яичников часто значительно прогрессирует до того, как пациенту будет поставлен диагноз. Это связано с тем, что симптомы рака яичников можно легко спутать с менее опасными для жизни проблемами пищеварения, такими как вздутие живота, запор и газы.Примерно только 20 процентов случаев рака яичников выявляются до того, как он распространяется за пределы яичников. К сожалению, на сегодняшний день не было продемонстрировано, что скрининговые тесты улучшают раннее выявление и исходы у женщин с раком яичников.
К сожалению, на сегодняшний день не было продемонстрировано, что скрининговые тесты улучшают раннее выявление и исходы у женщин с раком яичников.
Наиболее заметным фактором риска этого заболевания является семейный анамнез, включающий рак груди или яичников. Женщины с положительным результатом теста на наследственные мутации в генах BRCA1 или BRCA2 подвергаются значительно большему риску — от 45% до 65% риска развития рака груди и от 10% до 20% риска развития рака яичников к 70 годам.
Во всем мире рак яичников ежегодно диагностируется примерно у 300 000 женщин и является причиной примерно 180 000 смертей. В 2020 году рак яичников был диагностирован примерно у 21750 женщин и стал причиной 13 940 смертей в Соединенных Штатах, где он является основной причиной смерти от гинекологического рака.
Несмотря на то, что в области хирургического и химиотерапевтического лечения рака яичников были достигнуты значительные успехи, показатели выживаемости улучшились лишь незначительно. Низкая выживаемость при распространенном раке яичников связана как с поздней диагностикой, так и с отсутствием эффективной терапии второй линии для пациентов с рецидивом.Многие женщины, страдающие прогрессирующим раком яичников, реагируют на химиотерапию, но ее эффекты обычно непродолжительны. Клиническое течение пациентов с раком яичников характеризуется периодами ремиссии и рецидива, которые последовательно сокращаются до тех пор, пока не разовьется резистентность к химиотерапии. Более 80% пациентов с раком яичников страдают рецидивом заболевания, и более 50% этих пациентов умирают от болезни менее чем через пять лет после постановки диагноза.
Низкая выживаемость при распространенном раке яичников связана как с поздней диагностикой, так и с отсутствием эффективной терапии второй линии для пациентов с рецидивом.Многие женщины, страдающие прогрессирующим раком яичников, реагируют на химиотерапию, но ее эффекты обычно непродолжительны. Клиническое течение пациентов с раком яичников характеризуется периодами ремиссии и рецидива, которые последовательно сокращаются до тех пор, пока не разовьется резистентность к химиотерапии. Более 80% пациентов с раком яичников страдают рецидивом заболевания, и более 50% этих пациентов умирают от болезни менее чем через пять лет после постановки диагноза.
Существует острая необходимость в новых методах лечения рецидивирующего рака яичников на поздних стадиях.
Подписаться на уведомления по электронной почте
Лечение рака яичников первой линии включает хирургическое вмешательство, за которым следует режим химиотерапии, сочетающий лечение на основе платины (обычно карбоплатин) и лечения на основе таксана (обычно паклитаксел). Этот курс лечения приводит к полному ответу примерно у 80% пациентов. Полный ответ означает отсутствие видимых признаков заболевания при сканировании изображений и нормальных анализах крови.После завершения предварительной химиотерапии пациенты могут иметь право на поддерживающую терапию новым классом лекарств, называемых ингибиторами PARP, которые, как было продемонстрировано, значительно задерживают и, возможно, даже предотвращают рецидив заболевания у некоторых пациентов, особенно пациентов, опухоль которых несет мутации в BRCA1 и Гены BRCA2.
Этот курс лечения приводит к полному ответу примерно у 80% пациентов. Полный ответ означает отсутствие видимых признаков заболевания при сканировании изображений и нормальных анализах крови.После завершения предварительной химиотерапии пациенты могут иметь право на поддерживающую терапию новым классом лекарств, называемых ингибиторами PARP, которые, как было продемонстрировано, значительно задерживают и, возможно, даже предотвращают рецидив заболевания у некоторых пациентов, особенно пациентов, опухоль которых несет мутации в BRCA1 и Гены BRCA2.
Пациенты, которые сначала реагируют на лечение, но затем рецидивируют через шесть месяцев или более, могут проходить ту же терапию. Пациенты, у которых наблюдается прогрессирование во время лечения первой линии или рецидив в течение шести месяцев после успешного лечения первой линии, считаются рефрактерными или устойчивыми к лечению на основе платины.Для этих пациентов есть несколько вариантов химиотерапии; однако каждый из них показал лишь незначительную выгоду.
Иммунотерапия — это класс лечения, в котором используется собственная иммунная система человека для уничтожения раковых клеток. В настоящее время существует один одобренный FDA вариант иммунотерапии рака яичников.
Целевые антитела
- Бевацизумаб (Авастин®): моноклональное антитело, которое нацелено на путь VEGF / VEGFR и ингибирует рост кровеносных сосудов опухоли; одобрен для пациентов с впервые выявленным и рецидивирующим раком яичников
Иммуномодуляторы
- Пембролизумаб (Keytruda®): ингибитор контрольной точки, нацеленный на путь PD-1 / PD-L1; одобрено для подгруппы пациентов с распространенным раком яичников с высокой микросателлитной нестабильностью (MSI-H), дефицитом репарации несоответствия ДНК (dMMR) или высоким мутационным бременем опухоли (TMB-H)
Женщины с опухолями 1 стадии (выживаемость которых превышает 95% после комплексной операции), как правило, не нуждаются в рассмотрении клинических испытаний. Пациенты с резистентным к платине, рецидивирующим раком яичников или всеми стадиями рака яичников выше стадии 1 / степени 1 должны рассмотреть возможность участия в клинических испытаниях иммунотерапии.
Пациенты с резистентным к платине, рецидивирующим раком яичников или всеми стадиями рака яичников выше стадии 1 / степени 1 должны рассмотреть возможность участия в клинических испытаниях иммунотерапии.
Найдите клиническое испытание рака яичников
С 1985 года Научно-исследовательский институт рака выделил более 21 миллиона долларов в виде грантов на открытие и разработку эффективных иммунотерапевтических средств для лечения рака яичников.Ученые, финансируемые CRI, показали, что наличие Т-клеток иммунной системы в опухолях яичников сильно коррелирует с улучшением выживаемости у этих пациентов.
Результаты исследований ведущих иммунологов продолжают демонстрировать потенциал и многообещающие перспективы иммунного лечения пациентов с раком яичников, принося надежду и оптимизм в отношении более эффективных методов лечения этого грозного заболевания, спасающих жизнь.
- Джордж Кукос, доктор медицины, доктор философии, член сети клинических исследований CRI и профессор университетской больницы Лозанны, Швейцария, возглавляет исследование фазы I / II дурвалумаба (IMFINZI®, MedImmune / AstraZeneca) , ингибитор контрольной точки анти-PD-L1, липосомальный доксорубицин и мотолимод, агонист Toll-подобного рецептора 8, для пациентов с рецидивирующим, резистентным к платине раком яичников, брюшины или маточной трубы, которым показан липосомальный доксорубицин.
- Дмитрий Замарин, доктор медицинских наук, Мемориальный онкологический центр им. Слоуна Кеттеринга, и Кунле Одунси, доктор медицинских наук, доктор философии, член Научно-консультативного совета CRI, который является заместителем директора Комплексного онкологического центра Розуэлл-Парк , возглавляют исследование фазы I / II (NCT02963831), объединяющее онколитический вирус и ингибитор контрольной точки анти-PD-1, у пациентов с распространенным раком аппендикса, колоректальным раком и раком яичников.

- В исследовании, проведенном следователем CRI Кунле Одунси, М.D., доктор философии, в Центре комплексного рака Розуэл-Парк, пациенты с первой ремиссией, получавшие противораковую вакцину NY-ESO-1, показали среднее время до прогрессирования заболевания 21 месяц по сравнению со средним историческим показателем 16 месяцев.
- Дэвид Лампи Хермансон, доктор философии, недавний научный сотрудник CRI в Университете Миннесоты, произвел иммунные клетки Natural Killer из стволовых клеток, вставив рецептор химерного антигена (CAR), способный распознавать мезотелин, белок, который экспрессируется в 70 % больных раком яичников.
- Хуан Р. Кубильос-Руис, доктор философии, бывший научный сотрудник CRI и исследователь CLIP в Медицинском колледже Weill Cornell, обнаружил белок XBP1, который может представлять собой очень многообещающую мишень для иммунотерапии, направленной на усиление уже существующих иммунные ответы против рака яичников. Совсем недавно доктор Кубильос-Руис показал, как стресс эндосплазматического ретикулума может способствовать подавлению иммунных ответов против рака яичников.

Узнайте больше о нашем текущем финансировании исследований рака яичников.
Пожертвовать на исследование рака яичников
Хронология прогресса в иммунотерапии
На 4-м Международном семинаре по лимфокинам сообщается о клонировании нескольких цитокинов, включая: первую из трех цепей рецептора IL-2, IL-2R-альфа, Уоррен Леонард и его коллеги [i]; первый гемопоэтический фактор роста IL-3 (мульти-CSF) лабораторией Яна Г.Молодые в Австралии [ii]; GM-CSF Энтони Берджесс, Эшли Данн и Николас Гоф из Мельбурнского отделения LICR [iii]; M-CSF Эрнеста Кавасаки и его коллег [iv]; и G-CSF Лоуренсом Соуза и его коллегами [v] и, независимо, Шигеказу Наката и его коллегами. [vi]
[i] Леонард В. Дж., Деппер Дж. М., Крэбтри Г. Р., Рудикофф С. , Памфри Дж., Робб Р. Дж., Крёнке, Светлик П. Б., Пеффер Н. Дж., Вальдманн Т. А.. Молекулярное клонирование и экспрессия кДНК рецептора интерлейкина-2 человека.Nature 1984 18-24 октября; 311: 626-631. (PMID: 6090948)
, Памфри Дж., Робб Р. Дж., Крёнке, Светлик П. Б., Пеффер Н. Дж., Вальдманн Т. А.. Молекулярное клонирование и экспрессия кДНК рецептора интерлейкина-2 человека.Nature 1984 18-24 октября; 311: 626-631. (PMID: 6090948)
[ii] Fung MC, Hapel AJ, Ymer S, Cohen DR, Johnson RM, Campbell HD, Young IG. Молекулярное клонирование кДНК интерлейкина-3 мыши. Nature 1984 19-25 января; 307: 233-237. (PMID: 6420702)
[iii] Гоф Н. М., Гоф Дж., Меткалф Д., Келсо А., Грааль Д., Никола Н. А., Берджесс А. В., Данн А. Р.. Молекулярное клонирование кДНК, кодирующей мышиный регулятор роста кроветворения, фактор, стимулирующий колонии гранулоцитов-макрофагов. Nature 1984, 28 июня; 309: 763-767.(PMID: 6610831)
[iv] Кавасаки Е.С., Ладнер М.Б., Ван А.М., Ван Арсделл Дж., Уоррен М.К., Койн М.Ю., Швейкарт В.Л., Ли М.Т., Уилсон К.Дж., Бусман А. … Марк Д.Ф. Молекулярное клонирование комплементарной ДНК, кодирующей человеческий макрофаг-специфический колониестимулирующий фактор (CSF-1). Science 1985, 18 октября; 230: 291-296. (PMID: 2996129)
(PMID: 2996129)
[v] Souza LM, Boone TC, Gabrilove J, Lai PH, Zsebo KM, Murdock DC, Chazin VR, Bruszewski J, Lu H, Chen KK et. al. Рекомбинантный гранулоцитарный колониестимулирующий фактор человека: влияние на нормальные и лейкозные миелоидные клетки.Science 1986, 4 апреля; 232: 61-65. (PMID: 2420009)
[vi] Наката С., Цучия М., Асано С., Казиро Ю., Ямазаки Т., Ямамото О., Хирата И., Кубота Н., Охеда М., Номура Н., Оно М. Молекулярное клонирование и экспрессия кДНК для человеческий гранулоцитарный колониестимулирующий фактор. Nature 1986 30 января; 319: 415-418. (PMID: 3484805)
Экспериментальная терапия и лечение рака
Отдел экспериментальной терапии возглавляет усилия по координации всех этапов терапевтического открытия и процесса разработки.Наша инициатива заключается в разработке новых, более эффективных и специфических лекарств с меньшей токсичностью, нацеленных на индивидуальную терапию, и ускорении доставки этих новых лекарственных препаратов от исследовательского стенда к постели пациента.
Наша миссия начинается с исследования, основанного на гипотезах, которое определяет и проверяет цели; продолжает открытие, разработку и проектирование биологических методов лечения и лекарственных средств; за которыми следуют доклинические и клинические испытания, каждый шаг которых направлен на достижение цели персонализированной медицины.
Создание Центра таргетной терапии, который занимает одно из семи уникальных, ультрасовременных помещений, входящих в Институт раннего выявления и лечения рака им. Реда и Чарлин Маккомбс, расположенный в южном кампусе онкологического центра доктора медицины Андерсона. Center предоставляет исследователям и клиницистам четко определенный путь для целенаправленной разработки лекарственных препаратов — впервые для академического учреждения.
Тесное сотрудничество со специализированными службами онкологического центра MD Anderson, включая химию, фармакологию и токсикологию, а также с отделением онкологической медицины, Институтом Роберта Дж. Kleberg, Jr., и Helen C. Kleberg Center for Molecular Markers, а также предоставят исследователям возможность максимизировать терапевтический эффект от лечения и ограничить нежелательные побочные эффекты терапевтических агентов. Минимально инвазивные процедуры визуализации и тканевые биомаркеры будут использоваться для выбора тех пациентов, которые, вероятно, будут реагировать на лекарственное лечение, а затем будут следить за реакцией на лекарство, что позволит нашим исследователям идентифицировать подтипы респондеров и смешивать и подбирать лекарства для индивидуализации. лечение пациента.
Kleberg, Jr., и Helen C. Kleberg Center for Molecular Markers, а также предоставят исследователям возможность максимизировать терапевтический эффект от лечения и ограничить нежелательные побочные эффекты терапевтических агентов. Минимально инвазивные процедуры визуализации и тканевые биомаркеры будут использоваться для выбора тех пациентов, которые, вероятно, будут реагировать на лекарственное лечение, а затем будут следить за реакцией на лекарство, что позволит нашим исследователям идентифицировать подтипы респондеров и смешивать и подбирать лекарства для индивидуализации. лечение пациента.
Командные усилия фундаментальных исследователей, клиницистов и трансляционных исследователей представляют собой «трехногий стул» успешного индивидуального лечения рака — каждая нога необходима для достижения желаемого баланса. Наши лабораторные ученые будут иметь свободный доступ к образцам пациентов и клиническим наблюдениям, которые необходимы для создания новых лекарственных препаратов, а наши химики смогут разработать химическую структуру лекарства, чтобы сделать его более эффективным или уменьшить его побочные эффекты.
Определенные нами молекулярные и генетические мишени станут следующим рубежом в лечении рака, но также и в профилактике рака, позволяя врачам исправлять или уничтожать клетки с дефектами до того, как они станут угрозой для здоровья.
Поскольку онкологический центр доктора медицины Андерсона стремится улучшить уход за своими пациентами за счет расширения своего исследовательского фокуса на таргетную терапию и использования беспрецедентных возможностей, предоставляемых последними научными достижениями в области геномики и молекулярной биологии, факультет экспериментальной терапии будет здесь, чтобы претворить это в жизнь. исследование более эффективных, менее токсичных и индивидуальных стратегий лечения и профилактики.
Наше видение — не что иное, как лечение рака.
Свяжитесь с нами
Администратор отдела: Аарон Уолтон; 713-792-2668
Вопросы председателя: Грейс Таупо; 713-792-8141
Программа терапии и фармакологии в GSBS: Тиша Баркер; 713-745-1175 или GSBS 713-500-9850
Клинический центр адресной терапии: 713-563-1930
Факс: 713-745-1710
Физический адрес
South Campus Research Building 4
1901 East Road
Houston, Texas 77054
Почтовый адрес
Experimental Therapeutics — Unit 1950
MD Anderson Cancer Center
P. О. Box 301429
О. Box 301429
Хьюстон, Техас 77230-1429
Исследования рака — Медицинский факультет Университета Луисвилля
В США более раннее выявление и улучшение лечения увеличили пятилетнюю выживаемость онкологических больных до 68 процентов по сравнению с 50 процентами 30 лет назад. Хотя смертность от рака снижается, в Кентукки по-прежнему самый высокий уровень смертности от рака в стране. Кроме того, количество новых случаев рака в штате — около 25 000 в 2014 году — является самым высоким в стране.
Поскольку жители Кентукки несут непропорционально тяжелое бремя рака, JGBCC фокусируется на исследованиях, которые могут быстро воплотить лабораторные данные в медицинскую практику, где пациенты могут получить пользу от эффективных новых методов лечения. Акцент на трансляционные исследования позволил создать один из самых надежных трубопроводов противораковых препаратов среди всех американских онкологических центров. Базовые и клинические исследователи JGBCC приняли участие в более чем 500 клинических испытаниях, и более 30 новых методов лечения в настоящее время находятся в стадии доклинической разработки в лабораториях JGBCC.
- Первая разработка противораковой вакцины, произведенной на растениях табака (для шейки матки). рак)
- Первое описание VSEL (очень маленьких эмбрионоподобных стволовых клеток), которые обладают большим потенциалом для революции в области применения клеточной терапии против рака
- Первое открытие, что G-богатые олигонуклеотиды ингибируют рост раковых клеток, и первое развитие противораковое лекарственное средство (AS1411), полученное из этих белков
- Первое использование изображений ядерного магнитного резонанса (ЯМР) для отслеживания отдельных атомов глюкозы у пациентов с раком легких, выявление неожиданных метаболических различий между нормальной и злокачественной тканью легкого
- Первое использование бета-глюкан, доступный перорально диетический стимулятор, стимулирующий иммунную систему против опухолевых клеток.
 ls
ls - Первое использование цветных ягод (черники) для предотвращения рака у людей с высоким риском
- Первое клиническое испытание фазы I ингибитора метаболизма рака, PFK-158
- Первое клиническое испытание фазы II для проверки концепции, что истощение регуляторные Т-клетки могут стимулировать иммунитет у пациентов с запущенным раком
- Первое клиническое испытание фазы II для тестирования везикул, полученных из винограда, в качестве противовоспалительных агентов и средств доставки лекарств у онкологических пациентов
Для пациентов с распространенным раком поджелудочной железы (стадии II и III) средняя выживаемость в США.С. в течение пяти лет с момента постановки диагноза составляет 5,3%. Но в JGBCC пятилетняя выживаемость пациентов с распространенным раком поджелудочной железы составляет 10,8 процента, что более чем вдвое превышает средний показатель по стране. Аналогичным образом, для пациентов с JGBCC с распространенным раком прямой кишки (стадии II и III) пятилетняя выживаемость составляет 68,9, что почти на 18 процентов выше, чем в среднем по стране (58,5). Показатели выживаемости в JGBCC также выше для пациентов с излечимым раком груди (87,3 по сравнению с 85,0 по стране) и опухолями головного мозга (двухлетняя выживаемость составляет 33.7 по сравнению с 31,6 в национальном масштабе).
Аналогичным образом, для пациентов с JGBCC с распространенным раком прямой кишки (стадии II и III) пятилетняя выживаемость составляет 68,9, что почти на 18 процентов выше, чем в среднем по стране (58,5). Показатели выживаемости в JGBCC также выше для пациентов с излечимым раком груди (87,3 по сравнению с 85,0 по стране) и опухолями головного мозга (двухлетняя выживаемость составляет 33.7 по сравнению с 31,6 в национальном масштабе).
Известные успехи JGBCC в исследованиях и уходе за пациентами позволили нам с 2000 года получить благотворительную поддержку в размере 195 миллионов долларов, в том числе более 50 миллионов долларов от Фонда Джеймса Грэма Брауна и 12,5 миллионов долларов от Kosair Charities. Обладая национальной репутацией в области инновационных исследований, JGBCC также заручился поддержкой организаций за пределами региона Луисвилл. Например, благотворительный фонд Helmsley Charitable Trust пожертвовал более 9 миллионов долларов на поддержку исследований в области лечения рака на основе растений и вакцин. А в прошлом году JGBCC также получил три престижных многомиллионных гранта от Национальных институтов здравоохранения. Этот беспрецедентный уровень поддержки превратил JGBCC из небольшого лечебного учреждения в академический онкологический центр с национальной репутацией в области инновационных исследований.
А в прошлом году JGBCC также получил три престижных многомиллионных гранта от Национальных институтов здравоохранения. Этот беспрецедентный уровень поддержки превратил JGBCC из небольшого лечебного учреждения в академический онкологический центр с национальной репутацией в области инновационных исследований.
На протяжении десятилетий академические исследователи и их коллеги в фармацевтической промышленности сосредоточили большую часть своих усилий на разработке противораковых препаратов, которые нацелены на побочные эффекты генетических мутаций, вызывающих рак.К сожалению, почти ни один из лекарств, разработанных в рамках этой схемы, не дает излечения на всю жизнь. Большинство раковых клеток по своей природе генетически нестабильны и в конечном итоге развивают дополнительные генетические мутации, которые подрывают действие лекарства.
Под руководством нового директора, доктора Джейсона Чесни, ученые JGBCC придерживаются совершенно иной стратегии. Вместо того, чтобы нацеливаться на генетические неудачи, вызывающие рак, исследователи из JGBCC исследуют химические реакции, разделяемые раковыми клетками, которые отличают их от нормальных, здоровых клеток.Например, клеточный метаболизм — процесс, который создает энергию и строительные блоки, с помощью которых клетки растут и размножаются, — требует расщепления глюкозы. Чтобы вызвать быстрый рост клеток, характерный для рака, опухолевые клетки повышают уровни белков, которые перемещают молекулы глюкозы в клетки и превращают их в строительные блоки для производства энергии, ускоряющей рост клеток.
Вместо того, чтобы нацеливаться на генетические неудачи, вызывающие рак, исследователи из JGBCC исследуют химические реакции, разделяемые раковыми клетками, которые отличают их от нормальных, здоровых клеток.Например, клеточный метаболизм — процесс, который создает энергию и строительные блоки, с помощью которых клетки растут и размножаются, — требует расщепления глюкозы. Чтобы вызвать быстрый рост клеток, характерный для рака, опухолевые клетки повышают уровни белков, которые перемещают молекулы глюкозы в клетки и превращают их в строительные блоки для производства энергии, ускоряющей рост клеток.
JGBCC находится в авангарде усилий по разработке новых классов противораковых препаратов, подавляющих метаболизм глюкозы.Эта новая стратегия недавно привела к фазе I клинических испытаний препарата, нацеленного на метаболизм глюкозы, — первого в своем роде в мире. Препарат под названием PFK-158 действует путем ингибирования белка PFKFB3, который стимулирует метаболизм глюкозы в раковых клетках и способствует росту опухоли. Исследователи JGBCC во главе с доктором. Джейсон Чесни и Джон Трент продемонстрировали на мышах, что PFK-158 блокирует захват глюкозы, подавляя нормальную активность PFKFB3, ограничивая рост раковых клеток. Поскольку он подавляет метаболические процессы, общие для большинства раковых клеток, PFK-158, вероятно, будет эффективен против широкого спектра рака человека.Биотехнологическая компания Advanced Cancer Therapeutics, базирующаяся в Луисвилле, лицензировала и разработала PFK-158, который в настоящее время оценивается на предмет активности у пациентов с раком кожи, легких, толстой кишки, груди и поджелудочной железы в Университете Луисвилля, Джорджтаунском университете и MD Anderson Cancer. Центр.
Исследователи JGBCC во главе с доктором. Джейсон Чесни и Джон Трент продемонстрировали на мышах, что PFK-158 блокирует захват глюкозы, подавляя нормальную активность PFKFB3, ограничивая рост раковых клеток. Поскольку он подавляет метаболические процессы, общие для большинства раковых клеток, PFK-158, вероятно, будет эффективен против широкого спектра рака человека.Биотехнологическая компания Advanced Cancer Therapeutics, базирующаяся в Луисвилле, лицензировала и разработала PFK-158, который в настоящее время оценивается на предмет активности у пациентов с раком кожи, легких, толстой кишки, груди и поджелудочной железы в Университете Луисвилля, Джорджтаунском университете и MD Anderson Cancer. Центр.
Несмотря на то, что у нас есть несколько конкретных научных программ, наши клинические и трансляционные исследователи сгруппированы в четыре области исследований рака: Экспериментальная терапия и диагностика, Иммунология опухолей, Профилактика и контроль рака и Клинические испытания.
Опухоль головного мозга: Последние исследования | Cancer.Net
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете о научных исследованиях, проводимых с целью узнать больше об опухолях головного мозга и способах их лечения. Используйте меню для просмотра других страниц.
Врачи работают над тем, чтобы больше узнать об опухолях головного мозга, способах их предотвращения, способах их наилучшего лечения и о том, как обеспечить наилучшую помощь людям, у которых диагностирована опухоль головного мозга. Следующие области исследований могут включать новые варианты для пациентов в ходе клинических испытаний.Всегда говорите со своим врачом о наиболее подходящих для вас вариантах диагностики и лечения.
Тесты расширенной визуализации. Исследуются новые методы сканирования изображений. Это может помочь врачам лучше отслеживать эффективность лечения и следить за возможным рецидивом или ростом опухоли.

Биомаркеры. Исследователи изучают биомаркеры, которые могут помочь диагностировать опухоль головного мозга, оценить прогноз пациента и / или предсказать, подействует ли конкретное лечение.
Иммунотерапия. Иммунотерапия, также называемая терапией с модификатором биологического ответа (BRM), разработана для усиления естественной защиты организма для борьбы с опухолью. Он использует материалы, созданные организмом или в лаборатории, для улучшения, нацеливания или восстановления функции иммунной системы. В отношении опухолей головного мозга изучаются различные методы, такие как использование дендритных клеток или использование вакцин, направленных против конкретной молекулы на поверхности опухолевых клеток.Несколько методов в настоящее время проходят клинические испытания.
Онколитическая вирусная терапия.
 В этой терапии используется вирус, который поражает и разрушает опухолевые клетки, сохраняя здоровые клетки мозга. В настоящее время он исследуется как средство лечения опухолей головного мозга.
В этой терапии используется вирус, который поражает и разрушает опухолевые клетки, сохраняя здоровые клетки мозга. В настоящее время он исследуется как средство лечения опухолей головного мозга.Таргетная терапия. Как указано в разделе «Типы лечения», этот тип лечения нацелен на дефектные гены или белки, которые способствуют росту и развитию опухоли. Продолжаются исследования по использованию методов лечения опухолей головного мозга, направленных на различные способы роста опухоли, способы распространения опухоли и гибели опухолевых клеток.
Нарушение гематоэнцефалического барьера. Этот метод временно разрушает естественный защитный барьер мозга, чтобы химиотерапия легче проникала в мозг из кровотока.
Новые препараты и комбинации лекарственных средств.
 Исследователи изучают возможность использования имеющихся в настоящее время лекарств от других видов рака в качестве лечения опухоли головного мозга. Кроме того, изучаются комбинации лекарств, нацеленных на различные пути роста и распространения опухоли.Поскольку опухоли могут развить устойчивость к химиотерапии, что означает, что лечение перестает работать, другой подход заключается в использовании лечения, которое нацелено на то, как опухолевые клетки развивают устойчивость.
Исследователи изучают возможность использования имеющихся в настоящее время лекарств от других видов рака в качестве лечения опухоли головного мозга. Кроме того, изучаются комбинации лекарств, нацеленных на различные пути роста и распространения опухоли.Поскольку опухоли могут развить устойчивость к химиотерапии, что означает, что лечение перестает работать, другой подход заключается в использовании лечения, которое нацелено на то, как опухолевые клетки развивают устойчивость.Генная терапия. Этот тип терапии направлен на замену или восстановление аномальных генов, которые вызывают или помогают росту опухоли.
Генетические исследования. Исследователи ищут дополнительную информацию о мутациях конкретных генов и о том, как они связаны с риском и ростом опухоли головного мозга.В частности, Исследовательская сеть атласа генома рака — это крупная, постоянная попытка Национальных институтов здравоохранения узнать больше о связи между генетикой и глиомой.
 Недавние результаты включают открытие 3 специфических генетических мутаций, ранее не связанных с глиобластомой: NF1 , ERBB2 и PIK3R1 . Другое исследование сосредоточено на том, как ген MGMT и мутации гена IDH связаны с опухолями головного мозга. Эта информация полезна для исследователей и может в конечном итоге привести к прогрессу в диагностике и лечении глиомы.Изучаются подходы точной медицины, направленные на борьбу с опухолеспецифическими мутациями.
Недавние результаты включают открытие 3 специфических генетических мутаций, ранее не связанных с глиобластомой: NF1 , ERBB2 и PIK3R1 . Другое исследование сосредоточено на том, как ген MGMT и мутации гена IDH связаны с опухолями головного мозга. Эта информация полезна для исследователей и может в конечном итоге привести к прогрессу в диагностике и лечении глиомы.Изучаются подходы точной медицины, направленные на борьбу с опухолеспецифическими мутациями.Паллиативная помощь / поддерживающая терапия . В настоящее время проводятся клинические испытания, чтобы найти более эффективные способы уменьшения симптомов и побочных эффектов существующих методов лечения опухолей головного мозга для повышения комфорта и качества жизни пациентов.
Хотите узнать больше о последних исследованиях?
Если вам нужна дополнительная информация о последних областях исследований опухолей головного мозга, изучите эти связанные вопросы, которые выведут вас за рамки этого руководства:
Следующий раздел в этом руководстве — Как справиться с лечением . Он предлагает некоторые рекомендации о том, как справиться с физическими, эмоциональными, социальными и финансовыми изменениями, которые может принести опухоль головного мозга и ее лечение. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Он предлагает некоторые рекомендации о том, как справиться с физическими, эмоциональными, социальными и финансовыми изменениями, которые может принести опухоль головного мозга и ее лечение. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Центр трансляционных исследований рака
Центр трансляционных исследований рака Макгилла (MCTRC)
Большая проблема, с которой сталкивается исследовательское сообщество в области онкологии, заключается в переводе данных лабораторных и клинических исследований в клинические результаты, приносящие пользу при оценке, лечении и профилактике рака.Центр трансляционных исследований рака Макгилла (MCTRC) был основан благодаря щедрому пожертвованию от Семейного фонда Гольдфарб и Семейного фонда Александра и был официально признан Сенатом Университета Макгилла в 1996 году. Последующая значительная поддержка включала пожертвование от Монреальский фонд рака груди. Статья 1997 года в McGill Reporter описывает происхождение MCTRC (MCTRC McGill Reporter1997 [pdf]), а в 2001 году Журнал Национального института рака освещает новую инфраструктуру (JNCI 93: 1373-1374). С первых лет существования он добился значительного финансирования и публикаций, а также выдающихся достижений в области новейших методов диагностики и лечения рака.
С первых лет существования он добился значительного финансирования и публикаций, а также выдающихся достижений в области новейших методов диагностики и лечения рака.
Базирующийся в Онкологическом центре Сигала / Исследовательском институте леди Дэвис Еврейской больницы общего профиля, Центр обеспечивает инфраструктуру и целенаправленную работу, чтобы объединить ключевых исследователей, участвующих в трансляционных исследованиях, для разработки новых подходов к профилактике, диагностике и лечению рака. С самого начала он был разработан, чтобы быть междисциплинарным, мультиинституциональным и включать в себя клинических и фундаментальных ученых со всего Квебека.Основное внимание Центра уделяется инновациям, генерированию новых знаний и быстрой трансляции открытий из лаборатории в клинику.
Команда исследователей MCTRC имеет доступ к различным основным объектам, оснащенным новейшими технологиями, которые позволяют делать важные открытия в различных аспектах исследования рака. Ученые и клиницисты MCTRC сгруппированы по шести исследовательским темам, охватывающим широкий спектр, от биохимии и дизайна лекарств до иммунотерапии и трансляционной протеомики, а также применения искусственного интеллекта и информатики в диагностических методах.MCTRC может внести свой вклад в быстрое расширение и углубление проводимых трансляционных исследований рака. Мы используем множество потенциальных возможностей взаимодействия и создаем новые партнерские отношения с правительством, биотехнологиями и фармацевтическими компаниями, чтобы делиться научными открытиями с пациентами и обществом.
Ученые и клиницисты MCTRC сгруппированы по шести исследовательским темам, охватывающим широкий спектр, от биохимии и дизайна лекарств до иммунотерапии и трансляционной протеомики, а также применения искусственного интеллекта и информатики в диагностических методах.MCTRC может внести свой вклад в быстрое расширение и углубление проводимых трансляционных исследований рака. Мы используем множество потенциальных возможностей взаимодействия и создаем новые партнерские отношения с правительством, биотехнологиями и фармацевтическими компаниями, чтобы делиться научными открытиями с пациентами и обществом.
Научный сотрудник II Молекулярная диагностика Экспериментальная терапия Исследовательская лаборатория Гоэля — Монровия
Подробная информация о работе Полный рабочий день3 часа назад Квалификация — Опыт работы в лаборатории — Опыт в исследовательской лаборатории — Исследования — Степень бакалавра — Степень магистра Полное описание работы О Городе надежды: Город надежды, инновационное биомедицинское научно-исследовательское, лечебное и образовательное учреждение, в котором работает более 6000 сотрудников, занимается профилактикой и лечением рака и других опасных для жизни заболеваний и руководствуется философией сострадания, ориентированной на пациента. Город надежды, основанный в 1913 году и расположенный в Дуарте, Калифорния, является замечательным некоммерческим учреждением, где сострадание и передовая забота идут рука об руку с передовым опытом в клинических и научных исследованиях. Город надежды является Национальным институтом рака, назначенным Комплексным онкологическим центром и членом-учредителем Национальной комплексной онкологической сети, альянса ведущих национальных онкологических центров, который разрабатывает и устанавливает стандарты лечения рака. Резюме должности: мы ищем нескольких научных сотрудников II, которые станут частью многопрофильной исследовательской группы, возглавляемой доктором Дж.Аджай Гоэль, профессор и заведующий кафедрой молекулярной диагностики и экспериментальной терапии. В нашу многопрофильную исследовательскую группу входят биологи, гастроэнтерологи, хирурги, онкологи и биоинформатики, которые реализуют ряд совместных проектов с участием крупных международных консорциумов. Наши исследования сосредоточены на трансляционных исследованиях, поскольку они связаны с геномной и эпигеномной характеристикой различных видов рака желудочно-кишечного тракта (ЖКТ), включая рак прямой кишки, поджелудочной железы и желудка, и некоторые из ключевых тем исследований включают: Разработка циркулирующих биомаркеров жидкой биопсии на основе ДНК / РНК.
Город надежды, основанный в 1913 году и расположенный в Дуарте, Калифорния, является замечательным некоммерческим учреждением, где сострадание и передовая забота идут рука об руку с передовым опытом в клинических и научных исследованиях. Город надежды является Национальным институтом рака, назначенным Комплексным онкологическим центром и членом-учредителем Национальной комплексной онкологической сети, альянса ведущих национальных онкологических центров, который разрабатывает и устанавливает стандарты лечения рака. Резюме должности: мы ищем нескольких научных сотрудников II, которые станут частью многопрофильной исследовательской группы, возглавляемой доктором Дж.Аджай Гоэль, профессор и заведующий кафедрой молекулярной диагностики и экспериментальной терапии. В нашу многопрофильную исследовательскую группу входят биологи, гастроэнтерологи, хирурги, онкологи и биоинформатики, которые реализуют ряд совместных проектов с участием крупных международных консорциумов. Наши исследования сосредоточены на трансляционных исследованиях, поскольку они связаны с геномной и эпигеномной характеристикой различных видов рака желудочно-кишечного тракта (ЖКТ), включая рак прямой кишки, поджелудочной железы и желудка, и некоторые из ключевых тем исследований включают: Разработка циркулирующих биомаркеров жидкой биопсии на основе ДНК / РНК. для диагностики рака, прогноза и прогнозирующего ответа на различные методы лечения.Изучить эпигенетические основы рака желудочно-кишечного тракта (например, аберрантное метилирование ДНК, модификации гистонов и некодирующие РНК. Генетическая основа раннего и семейного / наследственного колоректального рака. Роль опухолевого микроокружения, стволовых клеток, иммунной регуляции и выявления новых таргетная терапия. Роль внеклеточных везикул / экзосом в патогенезе рака и их роль в качестве биомаркеров заболевания. Наша группа проводит передовые исследования в области онкологии желудочно-кишечного тракта, очень продуктивна и публикуется в таких авторитетных журналах, как Gastroenterology, JNCI, Clinical Cancer Исследования, сообщения о природе, Анналы хирургии и т. Д.Основные обязанности включают: Исследование роли аберрантного метилирования ДНК, модификаций гистонов и некодирующих РНК (miRNA, lncRNA, snoRNA, piRNAs и т. Д.) При раке желудочно-кишечного тракта. Создание инновационных методологий для разработки биомаркеров на основе эпигенетических и некодирующих РНК для более ранней диагностики, прогноза и прогнозных ответов на химиотерапию при неоплазии желудочно-кишечного тракта Понимание генетической основы раннего и семейного колоректального рака Молекулярные механизмы химиотерапии рака, стволовых клетки, химиорезистентность и химиосенсибилизация.
для диагностики рака, прогноза и прогнозирующего ответа на различные методы лечения.Изучить эпигенетические основы рака желудочно-кишечного тракта (например, аберрантное метилирование ДНК, модификации гистонов и некодирующие РНК. Генетическая основа раннего и семейного / наследственного колоректального рака. Роль опухолевого микроокружения, стволовых клеток, иммунной регуляции и выявления новых таргетная терапия. Роль внеклеточных везикул / экзосом в патогенезе рака и их роль в качестве биомаркеров заболевания. Наша группа проводит передовые исследования в области онкологии желудочно-кишечного тракта, очень продуктивна и публикуется в таких авторитетных журналах, как Gastroenterology, JNCI, Clinical Cancer Исследования, сообщения о природе, Анналы хирургии и т. Д.Основные обязанности включают: Исследование роли аберрантного метилирования ДНК, модификаций гистонов и некодирующих РНК (miRNA, lncRNA, snoRNA, piRNAs и т. Д.) При раке желудочно-кишечного тракта. Создание инновационных методологий для разработки биомаркеров на основе эпигенетических и некодирующих РНК для более ранней диагностики, прогноза и прогнозных ответов на химиотерапию при неоплазии желудочно-кишечного тракта Понимание генетической основы раннего и семейного колоректального рака Молекулярные механизмы химиотерапии рака, стволовых клетки, химиорезистентность и химиосенсибилизация. Микробиом кишечника и его влияние на рак желудочно-кишечного тракта. Проводит множество рутинных и нестандартных лабораторных исследований.Записывает и проверяет результаты на точность и полноту. Устраняет неполадки в процедурах, если результаты эксперимента являются неожиданными или неудовлетворительными. Рекомендует альтернативные процедуры. Отвечает за точный учет выполненной работы, включая результаты и методологию. Рассчитывает, обобщает и анализирует данные, полученные в результате выполненной работы. Независимо оценивает данные исследования и инициирует альтернативные подходы для улучшения качества результатов, предоставляя исходные данные для общего дизайна исследования. Обучает сотрудников лаборатории специальным процедурам, оборудованию и теоретическим концепциям, лежащим в основе уникальных тестов.Может способствовать подготовке рукописей, описывая методы и специальные техники. В курсе новых и улучшенных методик. Обеспечивает, чтобы все лабораторные действия выполнялись в соответствии с каждой процедурой (процедурами), используя процедуры и инструкции по безопасности при обращении, хранении и удалении биологически опасных, инфекционных и токсичных материалов.
Микробиом кишечника и его влияние на рак желудочно-кишечного тракта. Проводит множество рутинных и нестандартных лабораторных исследований.Записывает и проверяет результаты на точность и полноту. Устраняет неполадки в процедурах, если результаты эксперимента являются неожиданными или неудовлетворительными. Рекомендует альтернативные процедуры. Отвечает за точный учет выполненной работы, включая результаты и методологию. Рассчитывает, обобщает и анализирует данные, полученные в результате выполненной работы. Независимо оценивает данные исследования и инициирует альтернативные подходы для улучшения качества результатов, предоставляя исходные данные для общего дизайна исследования. Обучает сотрудников лаборатории специальным процедурам, оборудованию и теоретическим концепциям, лежащим в основе уникальных тестов.Может способствовать подготовке рукописей, описывая методы и специальные техники. В курсе новых и улучшенных методик. Обеспечивает, чтобы все лабораторные действия выполнялись в соответствии с каждой процедурой (процедурами), используя процедуры и инструкции по безопасности при обращении, хранении и удалении биологически опасных, инфекционных и токсичных материалов. Посещает лабораторные собрания, читает заданную литературу и иногда создает презентации по своему проекту по запросу исследователя.Человек будет выполнять методы генетики рака и эпигенетики, а также общее обслуживание лаборатории, которое помогает в проведении исследовательского проекта исследователя. Они должны продемонстрировать способность к приобретению знаний и новых навыков, связанных с генетикой и эпигенетикой рака. Соблюдает установленные City of Hope и департамента политики, процедуры, цели, повышение производительности, посещаемость, безопасность, защиту окружающей среды и меры инфекционного контроля, включая соблюдение Кодекса поведения на рабочем месте и Плана соблюдения нормативных требований.Соблюдая конфиденциальность, соблюдает высокий уровень добросовестности и честности. Выполняет другие связанные обязанности по поручению или запросу. Квалификация Базовое образование, опыт и навыки, необходимые для рассмотрения: степень бакалавра. Степень магистра предпочтительна. Два года соответствующего исследовательского / лабораторного опыта со степенью бакалавра или один год соответствующего исследовательского / лабораторного опыта со степенью магистра Ассистент и преформ Иммунологические методы, такие как культивирование тканей, проточная цитометрия (анализ) и / или молекулярные тесты, в соответствии со стандартом лаборатории Операционные процедуры.
Посещает лабораторные собрания, читает заданную литературу и иногда создает презентации по своему проекту по запросу исследователя.Человек будет выполнять методы генетики рака и эпигенетики, а также общее обслуживание лаборатории, которое помогает в проведении исследовательского проекта исследователя. Они должны продемонстрировать способность к приобретению знаний и новых навыков, связанных с генетикой и эпигенетикой рака. Соблюдает установленные City of Hope и департамента политики, процедуры, цели, повышение производительности, посещаемость, безопасность, защиту окружающей среды и меры инфекционного контроля, включая соблюдение Кодекса поведения на рабочем месте и Плана соблюдения нормативных требований.Соблюдая конфиденциальность, соблюдает высокий уровень добросовестности и честности. Выполняет другие связанные обязанности по поручению или запросу. Квалификация Базовое образование, опыт и навыки, необходимые для рассмотрения: степень бакалавра. Степень магистра предпочтительна. Два года соответствующего исследовательского / лабораторного опыта со степенью бакалавра или один год соответствующего исследовательского / лабораторного опыта со степенью магистра Ассистент и преформ Иммунологические методы, такие как культивирование тканей, проточная цитометрия (анализ) и / или молекулярные тесты, в соответствии со стандартом лаборатории Операционные процедуры. Иметь возможность пользоваться всем оборудованием и приборами, необходимыми для выполнения работы. Всегда работайте в соответствии с политикой безопасной лабораторной практики, установленной Исследовательским институтом Бекмана Города надежды. Выполняйте обычную лабораторную чистку и обслуживание в соответствии со Стандартными рабочими процедурами, например, используйте соответствующие чистящие средства для протирки поверхностей столов и вытяжек, инкубаторов, водяных бань и другого оборудования или аппаратов. Следите за оборудованием для оптимальной работы. Запишите все выполненные эксперименты и полученные данные в лабораторный журнал в соответствии с политикой и процедурой, установленными Исследовательским институтом Бекмана города Надежды.Дополнительная информация: пожалуйста, приложите свое текущее резюме / резюме вместе с сопроводительным письмом, в котором освещаются ваши исследовательские достижения, кратким заявлением, объясняющим, как ваши прошлые исследования связаны с целями нашей лаборатории, и планами будущей карьеры.
Иметь возможность пользоваться всем оборудованием и приборами, необходимыми для выполнения работы. Всегда работайте в соответствии с политикой безопасной лабораторной практики, установленной Исследовательским институтом Бекмана Города надежды. Выполняйте обычную лабораторную чистку и обслуживание в соответствии со Стандартными рабочими процедурами, например, используйте соответствующие чистящие средства для протирки поверхностей столов и вытяжек, инкубаторов, водяных бань и другого оборудования или аппаратов. Следите за оборудованием для оптимальной работы. Запишите все выполненные эксперименты и полученные данные в лабораторный журнал в соответствии с политикой и процедурой, установленными Исследовательским институтом Бекмана города Надежды.Дополнительная информация: пожалуйста, приложите свое текущее резюме / резюме вместе с сопроводительным письмом, в котором освещаются ваши исследовательские достижения, кратким заявлением, объясняющим, как ваши прошлые исследования связаны с целями нашей лаборатории, и планами будущей карьеры. Для получения дополнительной информации о новаторских исследованиях, проводимых в лаборатории доктора философии Аджая Гоэля, посетите. City of Hope стремится к созданию разнообразной среды и гордится тем, что является работодателем с равными возможностями. Все квалифицированные кандидаты получат вознаграждение за трудоустройство независимо от расы, религии, цвета кожи, национального происхождения, пола, сексуальной ориентации, гендерной идентичности, возраста, статуса ветерана, находящегося под защитой, или статуса квалифицированного лица с ограниченными возможностями.Показать полное описание вакансии Подать заявку
Для получения дополнительной информации о новаторских исследованиях, проводимых в лаборатории доктора философии Аджая Гоэля, посетите. City of Hope стремится к созданию разнообразной среды и гордится тем, что является работодателем с равными возможностями. Все квалифицированные кандидаты получат вознаграждение за трудоустройство независимо от расы, религии, цвета кожи, национального происхождения, пола, сексуальной ориентации, гендерной идентичности, возраста, статуса ветерана, находящегося под защитой, или статуса квалифицированного лица с ограниченными возможностями.Показать полное описание вакансии Подать заявку

 2018. – Т. 11, №1. – С. 26 – 33.
2018. – Т. 11, №1. – С. 26 – 33.

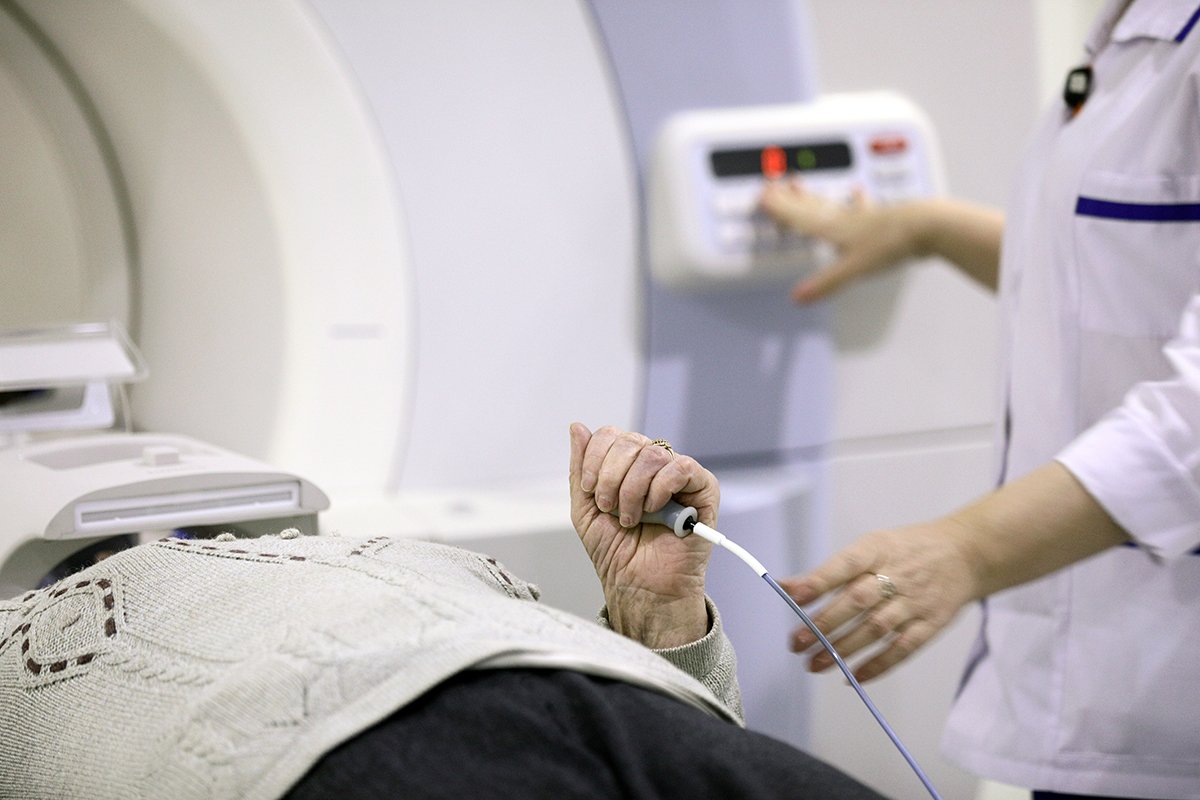 Н. Трапезникова, рассчитанный на 900 коек;
Н. Трапезникова, рассчитанный на 900 коек;
 ls
ls
 В этой терапии используется вирус, который поражает и разрушает опухолевые клетки, сохраняя здоровые клетки мозга. В настоящее время он исследуется как средство лечения опухолей головного мозга.
В этой терапии используется вирус, который поражает и разрушает опухолевые клетки, сохраняя здоровые клетки мозга. В настоящее время он исследуется как средство лечения опухолей головного мозга. Исследователи изучают возможность использования имеющихся в настоящее время лекарств от других видов рака в качестве лечения опухоли головного мозга. Кроме того, изучаются комбинации лекарств, нацеленных на различные пути роста и распространения опухоли.Поскольку опухоли могут развить устойчивость к химиотерапии, что означает, что лечение перестает работать, другой подход заключается в использовании лечения, которое нацелено на то, как опухолевые клетки развивают устойчивость.
Исследователи изучают возможность использования имеющихся в настоящее время лекарств от других видов рака в качестве лечения опухоли головного мозга. Кроме того, изучаются комбинации лекарств, нацеленных на различные пути роста и распространения опухоли.Поскольку опухоли могут развить устойчивость к химиотерапии, что означает, что лечение перестает работать, другой подход заключается в использовании лечения, которое нацелено на то, как опухолевые клетки развивают устойчивость.