Рак мочевого пузыря: лечение, прогноз и специалисты
Что такое рак мочевого пузыря?
Рак мочевого пузыря является злокачественным опухолевым заболеванием слизистой мочевого пузыря. Различают инвазивные и неинвазивные опухоли мочевого пузыря. Ежегодно выявляется около 30 000 новых случаев рака мочевого пузыря в Германии, при чем мужчины страдают два раза чаще, чем женщины. В среднем мужчины заболевают с 72 лет, женщины -с 74 лет.
Функция мочевого пузыря
Наши почки- органы с хорошо развитой сосудистой сетью, которые постоянно производят мочу. Для того чтобы каждый раз не бежать в туалет, наш организм снабжен неким резервуаром для мочи, мочевым пузырем. Он может значительно увеличиваться в размерах и собирать мочу до тех пор, мы не захотим его опорожнить.
Через мочу из организма выводится избыток воды, кислоты и щелочи, а также водорастворимые токсины. Моча попадает в мочевой пузырь через две почки и мочеточник, а затем покидает организм через мочеиспускательный канал (у мужчин сначала через простату).
Каковы причины рака мочевого пузыря?
Как и в случае многих видов рака, точные причины развития рака мочевого пузыря неизвестны. Однако с годами были выявлены определенные факторы риска.
Сильнейшим негативным фактором является табачный дым. С этим связано около 30-70 % опухолей мочевого пузыря. Токсичные вещества, содержащиеся в дыме, проходят через легкие в кровь, фильтруются почками и выводятся с мочой. Таким образом, канцерогены приводят не только к чрезвычайно высокому риску
Некоторые химические вещества, называемые ароматическими аминами, также могут вызывать рак мочевого пузыря. Многие из этих веществ ранее использовались в промышленности и сегодня запрещены. Из-за того, что потребовалось долгое время для их выявления, такие патологии, классифицируемые как профессиональные заболевания, сегодня все еще могут приводить к раку мочевого пузыря.
Тропический вредитель может также быть причиной рака мочевого пузыря через шистосомоз (заболевание, вызываемое вредителем). Также считается, что частое раздражение мочевого пузыря, например, через катетеры при хронической инфекции мочевого пузыря, может привести к раку.
Как обнаружить рак мочевого пузыря?
Первоначально рак мочевого пузыря связан с нехарактерными симптомами. Часто они неверно истолковываются как ц истит. К ним относятся повышенная частота мочеиспускания, но при этом количество выделений небольшое (поллакиурия), нарушение мочеиспускания (дизурия) с подтеканием и болезненное мочеиспускание или необъяснимая боль в боку.
Явным предупреждающим признаком всегда является кровь в моче (изменение цвета от красноватого до коричневатого) без боли (болезненная макрогематурия). В таком случае необходимо обратиться к урологу, ппоскольку тогда есть хорошие шансы на выздоровление.
Как диагностируется рак мочевого пузыря?
Даже первый разговор с пациентом может привести к подозрению на рак мочевого пузыря. Это предположение могут подтвердить профессиональные заболевания, курение и специфические патологии. Далее следуют различные исследования: тестирование мочи на кровь и раковые клетки, анализы крови на функции почек, экскреторная урограмма с использованием контрастного вещества, которое выводится из организма почками; во время мочеиспускания могут быть выполнены несколько рентгенограмм, а также УЗИ органов в брюшной полости.
Это предположение могут подтвердить профессиональные заболевания, курение и специфические патологии. Далее следуют различные исследования: тестирование мочи на кровь и раковые клетки, анализы крови на функции почек, экскреторная урограмма с использованием контрастного вещества, которое выводится из организма почками; во время мочеиспускания могут быть выполнены несколько рентгенограмм, а также УЗИ органов в брюшной полости.
Точный диагноз обеспечивает цистоскопия . В этом случае уролог проводит эндоскоп (тонкая гибкая трубка с камерой спереди) в мочевой пузырь, осматривает слизистую оболочку и берет с помощью небольших щипцов образцы ткани с подозрительных участков.
Если это глубокая (инвазивная) карцинома мочевого пузыря, в организме могут быть дочерние опухоли (метастазы). Чтобы обнаружить их, используют КТ, МРТ и сцинтографию скелета.
Как лечится рак мочевого пузыря?
Терапия неинвазивного рака мочевого пузыря
В случае поверхностного (неинвазивного) рака мочевого пузыря основное лечение проводится через цистоскопию.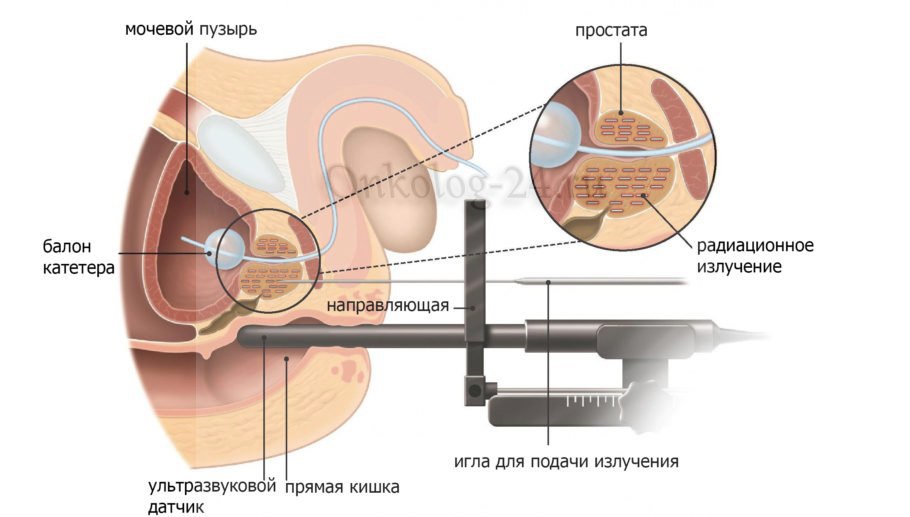
Затем удаленная ткань изучается патологом. Если края разреза не имеют опухолей, лечение заканчивается на данном этапе. В противном случае ТУР поверхностного рака мочевого пузыря повторяется в течение шести недель. Этим способом могут быть полностью удалены 70 % опухолей в мочевом пузыре.
В случае рецидива (рак мочевого пузыря к этому склонен ) дополнительно в течение 2 часов может проводится химиотерапия , чтобы предотвратить повторения новообразований. Альтернативно, посредством иммунотерапии в мочевой пузырь многократно вводится определенное вещество (БЦЖ) для повышения активности организма к борьбе с раковыми клетками.
Терапия инвазивного рака мочевого пузыря
В случае инвазивного рака мочевого пузыря проводится либо операция, либо лучевая терапия. И то и другое можно сочетать с химиотерапией. При последней возможно сохранение мочевого пузыря.
Хирургическое лечение заключается в удалении мочевого пузыря (цистэктомия). При этом удаляются все пораженные органы (лимфатические узлы, простата, семенные пузырьки или матка, яичники, часть влагалища). В качестве замены мочевого пузыря используются различные варианты, которые сильно зависят от состояния здоровья пациента, его возраста и желания.
С помощью ткани кишечника можно создать новый мочевой пузырь, который напоминает старый, но является резервуаром, который необходимо самостоятельно опорожнять через брюшную стенку. Варианты, которые подходят именно для вас, будут подробно обсуждены с вашим лечащим урологом.
Прогноз и шансы на выздоровление при раке мочевого пузыря
Как и любая операция, удаление мочевого пузыря несет в себе такие риски, как воспаление, кровотечение, повреждение соседних органов или тромбообразование.
Если выполняется замена мочевого пузыря, кишечной ткани может потребоваться некоторое время, чтобы приспособиться к своей новой задаче.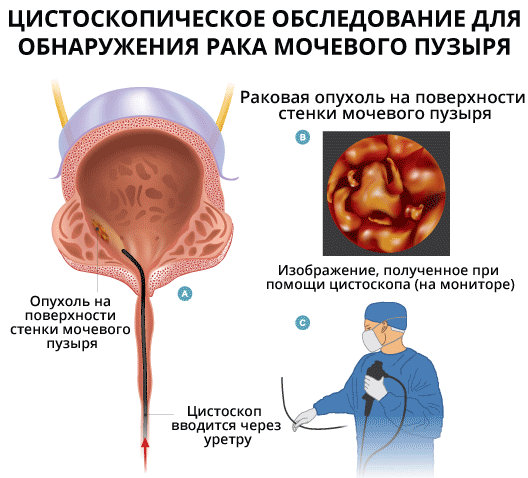
У мужчин после удаления простаты могут возникнуть проблемы с эрекцией, но с ними легко справляются различные методы современной медицины.
Однако наиболее важным является постоянное и регулярное послеоперационное наблюдение . Если у вас есть дополнительные вопросы о лечении и прогнозе при раке мочевого пузыря, смело обращайтесь к лечащему урологу.
Источники:
Гассер, Томас (2009): Базовая урология. С 13 таблицами. 4-е издание. Гейдельберг: Springer (учебник Springer). (Gasser, Thomas (2009): Basiswissen Urologie. Mit 13 Tabellen. 4., vollst. überarb. Aufl. Heidelberg: Springer (Springer-Lehrbuch).
Rюбен Херберт (2009): Уроонкология. С 269 таблицами. 5-е издание. Гейдельберг: Springer Medicine Verl. (Rübben, Herbert (2009): Uroonkologie. Mit 269 Tabellen. 5. vollst. überarb.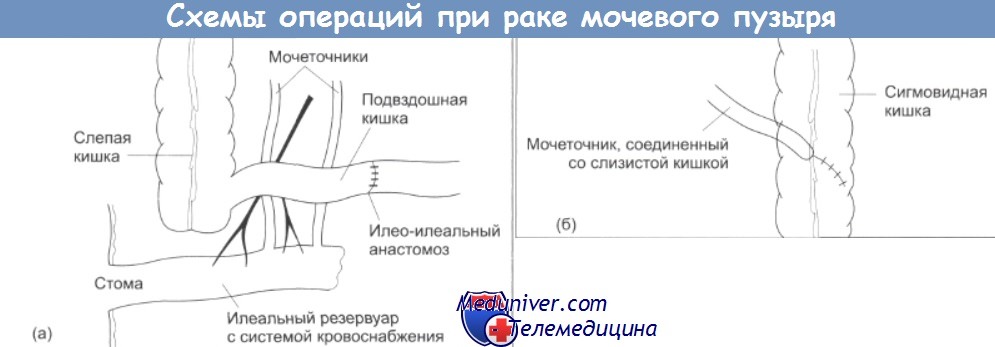 Aufl. Heidelberg: Springer Medizin Verl.)
Aufl. Heidelberg: Springer Medizin Verl.)
Органосохраняющее лечение рака мочевого пузыря : Tuality Healthcare
Органосохраняющее лечение рака мочевого пузыря
Read this page in: español | английском языке
Доктор Тимур Митин, главный врач онкологического центра Tuality/OHSU, рассказывает об органосохраняющем лечении мочевого пузыря, являющимся альтернативой далению мочевого пузыря у пациентов с раком мочевого пузыря.
В онкологическом центре Tuality/OHSU предлагается доказанный многолетними клиническими испытаниями в ведущих онкологических клиниках Америке и Европе подход к лечению рака мочевого пузыря. Пациентов с мышечно-инвазивным раком мочевого пузыря можно вылечить, сохранив при этом мочевой пузырь.
Альтернатива хирургическому удалению мочевого пузыря
Лечение, направленное на сохранение мочевого пузыря, применяется в течение последних 40 лет во многочисленных клинических исследованиях в США и Европе при участии более 1500 пациентов. Несмотря на то, что большинство врачей, специализирующихся на лечении рака мочевого пузыря, часто рекомендуют удаление мочевого пузыря полностью, опубликованные данные ставят под сомнение этот подход. Ознакомьтесь с дополнительной информацией о лечении, направленном на сохранение мочевого пузыря.
Несмотря на то, что большинство врачей, специализирующихся на лечении рака мочевого пузыря, часто рекомендуют удаление мочевого пузыря полностью, опубликованные данные ставят под сомнение этот подход. Ознакомьтесь с дополнительной информацией о лечении, направленном на сохранение мочевого пузыря.
Факты
- В 2013 году согласно нормам доказательной медицины, выработанным Национальной комплексной онкологической сетью (NCCN), было признано сохранение мочевого пузыря в качестве приемлемой альтернативы цистэктомии – хирургического удаления мочевого пузыря.
- Удаление мочевого пузыря приводит к значительно более кардинальному снижению качества жизни, в сравнении с органосохраняющим лечением. Ознакомьтесь с дополнительной информацией о качестве жизни при органосохраняющем лечении рака мочевого пузыря. (Формат PDF) »
- Большой мета-анализ сравнения результатов лечения 10000 пациентов, перенесших цистэктомию, с результатами органосохраняющего леченияу 3000 пациентов, показал, что пациенты живут дольше, если их мочевой пузырь не удалялся.
 Ознакомьтесь с дополнительной информацией о сравнении результатов органосохраняющего лечения и цистэктомии. (Формат PDF) »
Ознакомьтесь с дополнительной информацией о сравнении результатов органосохраняющего лечения и цистэктомии. (Формат PDF) » - Рандомизированное клиническое исследование, проведённое в Великобритании, показало одинаковый процент выживаемости у пациентов прошедших цистэктомию и органосохраняющеелечение рака мочевого пузыря с использованием химиотерапии и лучевой терапии. Ознакомьтесь с дополнительной информацией о результатах рандомизированное исследования, проведенного в Великобритании. Формат PDF) »
Пациенты онкологического центра Tuality/OHSU могут получить заключение специалиста в отношении тактики лечения мышечно-инвазивного рака мочевого пузыря. Им предоставляется выбор прохождения курса органосохраняющего лечения непосредственно в центре или по месту их жительства у специалистов, рекомендованных центром.
Первым шагом является удаление злокачественной опухоли внутри мочевого пузыря урологом пациента.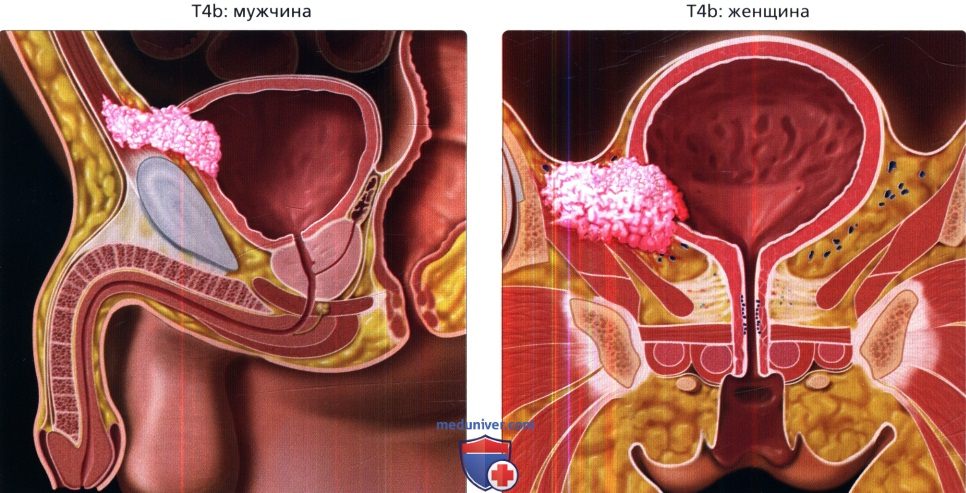 За этим следует лучевая терапия в режиме ежедневных сеансов в течение четырех недель с использованием химиотерапия. Затем пациенту предоставляется четырехнедельный перерыв в лечении, в течение которого уролог проводит внутренний осмотр мочевого пузыря, чтобы убедиться в достижении планируемых результатов лечения. После перерыва пациент продолжает ежедневные сеансы радиационной терапии в сочетании с химиотерапией еще в течение двух с половиной недель. Пациенты проходят последующие урологические осмотры с целью выявления рецидивов опухоли каждые три-шесть месяцев первоначально, а впоследствии – реже. Отсутствие признаков рецидивов опухоли в течение трех лет после завершения лечения свидетельствует о маловероятном риске локального рецидива опухоли.
За этим следует лучевая терапия в режиме ежедневных сеансов в течение четырех недель с использованием химиотерапия. Затем пациенту предоставляется четырехнедельный перерыв в лечении, в течение которого уролог проводит внутренний осмотр мочевого пузыря, чтобы убедиться в достижении планируемых результатов лечения. После перерыва пациент продолжает ежедневные сеансы радиационной терапии в сочетании с химиотерапией еще в течение двух с половиной недель. Пациенты проходят последующие урологические осмотры с целью выявления рецидивов опухоли каждые три-шесть месяцев первоначально, а впоследствии – реже. Отсутствие признаков рецидивов опухоли в течение трех лет после завершения лечения свидетельствует о маловероятном риске локального рецидива опухоли.
Специалист, подготовленный новаторами
Доктор Тимур Митин, главврач онкологического центра Tuality/OHSU, является специалистом в области органосохраняющего лечениярака мочевого пузыря, и выступает за его широкое практическое применение. Он прошел программу профессиональной подготовки в области радиационной онкологии Гарвардского университета в Бостоне и был приглашен на работу в качестве научного сотрудника Центральной больницы штата Массачусетс – учреждения, в котором создавалась и совершенствовалась программа органосохраняющего лечения рака мочевого пузыря в Северной Америке в течение последних 40 лет. Доктор Митин занимался лечением пациентов, участвовавших в национальных клинических исследованиях методики органосохраняющего лечения рака мочевого пузыря. Ознакомьтесь с дополнительной информацией о взглядах доктора Митина на лечение рака мочевого пузыря. (в формате PDF) »
Он прошел программу профессиональной подготовки в области радиационной онкологии Гарвардского университета в Бостоне и был приглашен на работу в качестве научного сотрудника Центральной больницы штата Массачусетс – учреждения, в котором создавалась и совершенствовалась программа органосохраняющего лечения рака мочевого пузыря в Северной Америке в течение последних 40 лет. Доктор Митин занимался лечением пациентов, участвовавших в национальных клинических исследованиях методики органосохраняющего лечения рака мочевого пузыря. Ознакомьтесь с дополнительной информацией о взглядах доктора Митина на лечение рака мочевого пузыря. (в формате PDF) »
Свяжитесь с нами для получения дополнительных сведений
Для получения дополнительной информации о сохранении мочевого пузыря и лечении рака мочевого пузыря в онкологическом центре организации «Tuality»/университета OHSU, пожалуйста, звоните по телефону 503-681-4200 или посетите нас для получения консультации.
Лучевая терапия — радиотерапия — Neolife Tıp Merkezi
Лучевая терапия
Лучевая терапия — радиотерапия
Лучевая терапия (радиотерапия) является общепринятым безопасным и эффективным методом лечения злокачественных опухолей. Преимущества данного метода для пациентов неоспоримы.
Преимущества данного метода для пациентов неоспоримы.
Радиотерапия обеспечивает сохранение анатомии и функции органа, улучшает качество жизни и показатели выживаемости, уменьшает болевой синдром. Уже десятилетия лучевая терапия при раке (ЛТ) широко используется при большинстве онкологических заболеваний. Никакой другой метод лечения рака не способен столь же эффективно заменить ЛТ с целью уничтожения опухоли или облегчения боли и других симптомов.
Лучевая терапия используется при лечении практически всех злокачественных новообразований, в каких бы тканях и органах они не возникали. Облучение при онкологии используется отдельно или в сочетании с другими методами, например хирургической операцией или химиотерапией. Радиотерапия может проводиться с целью полного излечения от рака или облегчения его симптомов, когда исчезновение опухоли невозможно.
В настоящее время полное излечение возможно более чем в 50% случаев злокачественных опухолей, для чего крайне важна радиотерапия. Как правило, радиология на каком-либо этапе заболевания требуется около 60% пациентов, проходящих лечение по поводу рака. К большому сожалению, в российской действительности этого не происходит.
Как правило, радиология на каком-либо этапе заболевания требуется около 60% пациентов, проходящих лечение по поводу рака. К большому сожалению, в российской действительности этого не происходит.
Что же такое радиотерапия?
Лучевая терапия в онкологии подразумевает лечение злокачественных новообразований с помощью высокоэнергетического излучения. Онколог-радиолог использует облучение с целью полного излечения от рака или облегчения болевого синдрома и других симптомов, которые вызваны опухолью.
Принцип действия облучения при раке сводится к нарушению репродуктивных возможностей раковых клеток, то есть их способности к размножению, в результате чего организм естественным образом избавляется от них.
Радиотерапия повреждает раковые клетки путем негативного влияния на их ДНК, в результате чего клетки более не способны делиться и расти. Данный метод лечения рака является самым эффективным при уничтожении активно делящихся клеток.
Высокая чувствительность клеток злокачественных опухолей к излучению обусловлена двумя основными факторами:
- они делятся намного быстрее здоровых клеток и
- они не способны к такому же эффективному восстановлению повреждений, как здоровые клетки.

Онколог-радиолог может проводить наружную (внешнюю) радиотерапию, источником излучения при которой является линейный ускоритель заряженных частиц (устройство, ускоряющее электроны с целью формирования рентгеновских или гамма-лучей).
Брахитерапия — внутренняя лучевая терапия
Облучение при раке также возможно с помощью источников радиоактивного излучения, которые помещаются в организм пациента (так называемая брахитерапия, или внутренняя ЛТ).
При этом радиоактивное вещество находится внутри игл, катетеров, зерен или специальных проводников, которые временно или постоянно имплантируются внутрь опухоли или размещаются в непосредственной близости от нее.
Брахитерапия является весьма распространенным методом лучевой терапии при раке предстательной железы, матки и шейки матки или молочной железы. Метод излучения настолько точно воздействует на опухоль изнутри, что последствия (осложнения после лучевой терапии на здоровые органы) — практически исключаются.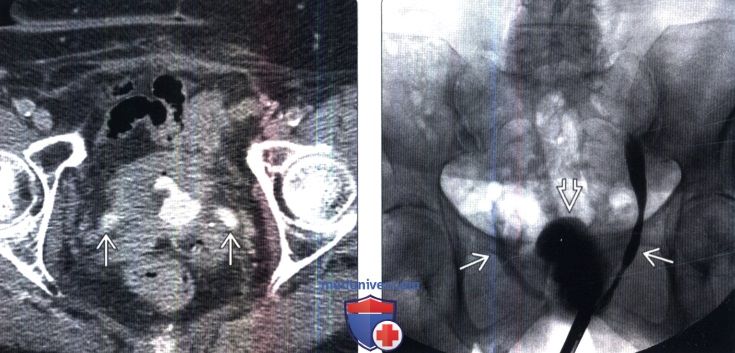
Некоторым пациентам, страдающим злокачественной опухолью, радиотерапия назначается вместо хирургического вмешательства. Подобным образом нередко проводится лечение рака предстательной железы и рака гортани.
Адъювантное лечение с радиотерапией
В некоторых случаях ЛТ является лишь частью плана лечения пациента. В тех случаях, когда облучение при раке назначается после хирургической операции, оно называется адъювантным.
Например, женщине лучевая терапия может быть назначена после органосохраняющей операции на молочной железе. Это позволяет полностью излечить рак молочной железы и сохранить анатомию груди.
Индукционная радиотерапия
Кроме этого, возможно проведение радиотерапии до хирургического вмешательства. В таком случае она носит название неоадъювантной или индукционной и позволяет улучшить показатели выживаемости или облегчить для хирурга проведение операции. Примерами такого подхода служит облучение при раке пищевода, прямой кишки или легких.
Комбинированное лечение
В некоторых случаях перед хирургическим удалением рака ЛТ назначается пациенту совместно с химиотерапией. Комбинированное лечение позволяет уменьшить объем оперативного вмешательства, который мог бы потребоваться в противном случае. Например, некоторым пациентам, страдающим раком мочевого пузыря, при одновременном назначении всех трех методов лечения удается полностью сохранить данный орган. Возможно одновременное проведение химиотерапии и радиотерапии без хирургического вмешательства с целью улучшения местного ответа опухоли на лечение и уменьшения выраженности метастазирования (распространения опухоли).
В некоторых случаях, например при раке легких, органов головы и шеи или шейки матки, подобного лечения может оказаться вполне достаточно без необходимости проведения операции.
Поскольку излучение повреждает и здоровые клетки, очень важно, чтобы оно было прицельно направлено на область раковой опухоли. Чем меньше облучение воздействует на здоровые органы, тем меньше возможно негативное последствие лучевой терапии.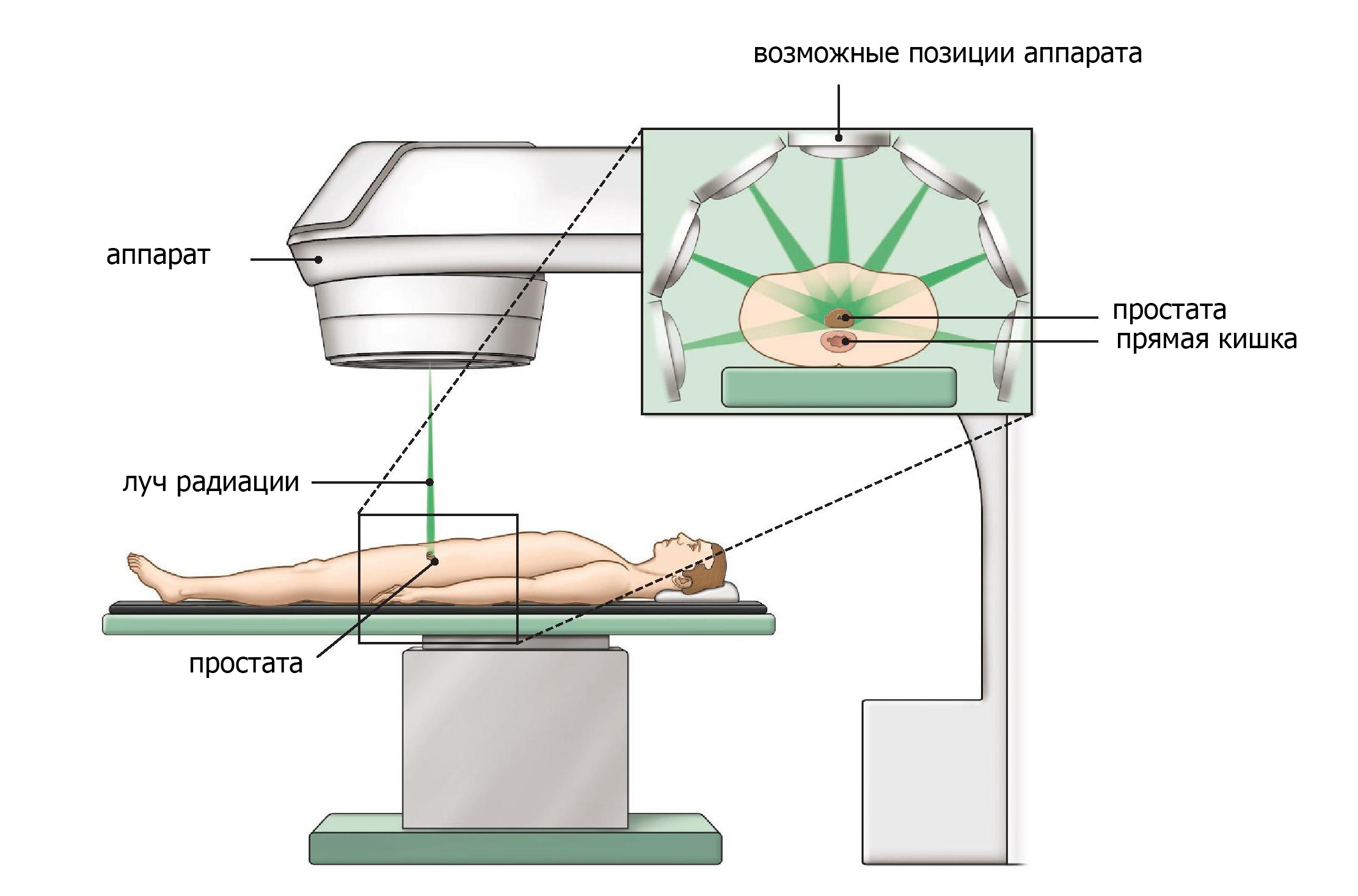 Именно поэтому при планировании лечения используются различные методы визуализации (отображения опухоли и окружающих ее органов), что обеспечивает точную доставку излучения к опухоли, защиту рядом расположенных здоровых тканей и уменьшение выраженности побочных эффектов и осложнений радиотерапии впоследствии.
Именно поэтому при планировании лечения используются различные методы визуализации (отображения опухоли и окружающих ее органов), что обеспечивает точную доставку излучения к опухоли, защиту рядом расположенных здоровых тканей и уменьшение выраженности побочных эффектов и осложнений радиотерапии впоследствии.
Радиотерапия с модулированной интенсивностью — РТМИ
Более точное соответствие дозы излучения объему новообразования обеспечивает современный метод трехмерной конформной лучевой терапии под названием радиотерапия с модулированной интенсивностью (РТМИ). Данный метод облучения при раке позволяет безопасно подводить к опухоли более высокие дозы, чем при традиционной ЛТ. Нередко РТМИ используется совместно с радиотерапией под визуальным контролем (РТВК), что обеспечивает крайне точную доставку выбранной дозы излучения к злокачественному новообразованию или даже какой-либо определенной зоне внутри опухоли. Современные разработки в области радиологии в онкологии, такие как РТВК, позволяют подстраивать ход процедуры под особенности органов, склонных к движению, например легких, а также под опухоли, которые расположены близко к жизненно важным органам и тканям.
Стереотаксическая радиохирургия
К другим методикам ультраточной доставки излучения к опухоли относится стереотаксическая радиохирургия, в ходе которой для определения четких координат новообразования используется трехмерная визуализация. После этого прицельно наведенные рентгеновские или гамма-лучи сходятся на опухоли с целью ее уничтожения. Методика «Гамма-нож» использует кобальтовые источники радиоактивного излучения для фокусировки множества лучей на небольших зонах. В ходе стереотаксической лучевой терапии для доставки излучения к головному мозгу также используются линейные ускорители заряженных частиц. Подобным образом возможно лечение опухолей и других локализаций. Такая лучевая терапия называется экстракраниальная стереотаксическая радиотерапия (или СР тела). Особую ценность данный метод представляет при лечении опухолей легких, рака печени и костей.
Лучевая терапия также используется для уменьшения притока крови к опухоли, расположенной в богатых сосудами органах, например, печени. Так, в ходе стереотаксической хирургии применяются особые микросферы, наполненные радиоактивным изотопом, которые закупоривают кровеносные сосуды опухоли и вызывают ее голодание.
Помимо способа активного лечения рака, радиотерапия также является паллиативным методом. Это означает, что ЛТ позволяет облегчить боль и страдание пациентов с прогрессирующими формами злокачественных новообразований. Паллиативное облучение при раке улучшает качество жизни пациентов, испытывающих сильные боли, затруднение при передвижении или приеме пищи на фоне растущей опухоли.
Рак мочевого пузыря — Docrates
Чаще всего рак мочевого пузыря поверхностный и не выходит за пределы слизистой оболочки. Однако этот вид рака может распространиться на стенку мочевого пузыря и метастазировать, например, в печень, легкие или костную ткань. Случаи рака, проникающего в мышечный слой, составляют всего 20-25% из всех злокачественных опухолей мочевого пузыря. Риск рецидива болезни высок, поэтому пациенту следует регулярно проходить осмотры на протяжении всей жизни.
Факторы риска pакa мочевого пузыря
С возрастом риск рака мочевого пузыря, впрочем, как и многих других видов злокачественных опухолей, повышается. В основную группу риска попадают люди, организм которых подвергается воздействию химикатов (ароматических аминов), а также курильщики. На современных промышленных предприятиях используют эффективное защитное снаряжение, что значительно снижает риск заболеть. Также ведется тщательный контроль за тем, чтобы предельные значения канцерогенов не превышали допустимую норму. В Финляндии расходы на лечение рака мочевого пузыря могут оплачиваться страховкой, покрывающей лечение профессиональных заболеваний при условии, что будет подтверждена зависимость болезни от условий труда. Этот вид рака может быть также и наследственным.
Симптомы pакa мочевого пузыря
Типичными симптомами рака мочевого пузыря являются появление крови в моче и боль при мочеиспускании. Если опухоль препятствует прохождению мочи из почек в мочевой пузырь, это может привести к дисфункции почек, которая, в свою очередь, выражается болью в области почек. Если же опухоль блокирует уретру, то процесс мочеиспускания может проходить весьма затруднительно.
Диагностика pакa мочевого пузыря
При подозрении на опухоль мочевого пузыря делаются основные обследования: берется анализ мочи для подтверждения наличия в ней крови, анализ мочи на цитологию и проводится внутреннее обследование мочевого пузыря (цистоскопия). Как правило, делается рентген мочевыводящих путей (урография) и УЗИ. Зачастую проводится КТ-урография (визуальное исследование на компьютере) для определения локального распространения опухоли.
Затем проводится ультразвуковое исследование, которое позволяет увидеть крупные новообразования в мочевом пузыре и изменения в почках. На начальном этапе проводят также обследование почек с помощью контрастного вещества (урография). Это помогает подтвердить, что в верхних мочевыводящих путях отсутствуют опухоли и мочеточники ничем не блокированы. Помимо этого врач проводит внутреннее обследование мочевого пузыря.
В случае резекции мочевого пузыря, как правило, пациенту проводится КТ всего тела, если есть подозрение на то, что рак проник в мышечную ткань.
Лечение pакa мочевого пузыря
Рак мочевого пузыря лечится разными методами – либо по отдельности, либо комплексно. Из-за многоликости рака мочевого пузыря и разницы в прогнозах заболевания для выбора оптимального лечения необходимо максимально точно определить степень распространенности опухоли и правильно классифицировать вид ткани, определенный патологом (гистология).
Если опухоль поверхностная и не распространилась за пределы слизистой мочевого пузыря в мышечную ткань, проводится трансуретральная резекция мочевого пузыря (ТУР). Во время операции, с помощью, установленного через уретру резектоскоп, проводится резекция опухоли и прижигание кровоточащих сосудов (коагуляция).
Если рак проникает в мышечную ткань или существует риск этого, в качестве лечения может быть проведена радикальная операция (тотальная цистэктомия), т. е. полное или частичное удаление мочевого пузыря и удаление предстательной железы. В таком случае отведение мочи происходит в резервуар, который создается из участка кишечника и выполняет функцию мочевого пузыря, либо резервуар для мочи может выводиться наружу, через специальное отверстие, стому.
В зависимости от типа опухоли, ее размера и наличия метастазов возможна также лучевая терапия и внутривенное лечение цитостатическими препаратами. Химиолучевая терапия дает такие же хорошие результаты, как и традиционная операция.
При поверхностном раке мочевого пузыря с хорошим прогнозом опухоль удаляется через уретру с помощью резетоскопа. Для снижения риска рецидива во время процедуры или сразу после нее проводится разовое промывание мочевого пузыря цитостатиками. После медикаментозного лечения поверхностных видов рака, имеющих большой риск рецидива, проводят многократное промывание мочевого пузыря цитостатиками.
Как правило, во время операции мужчинам удаляется также предстательная железа, однако уретру на сегодняшний день обычно сохраняют. Женщинам чаще всего удаляется уретра, матка и включая сопутствующие органы. Если по причине плохого общего состояния или затруднительной локализации опухоли операция невозможна, прибегают к лучевой терапии.
На момент диагностирования болезни метастазы обнаруживаются лишь примерно у 5% пациентов. В этих случаях вместо удаления мочевого пузыря применяют лучевую или химиотерапию. Если опухоль метастазировала, то лучевую терапию используют для облегчения симптомов, например, боли, недержания, вызванных большим размером опухоли и блокированием мочевыводящих путей. Для лечения метастазов применяют химиотерапию, с помощью которой они уменьшаются, и симптомы болезни становятся не столь выраженными.
Лечение рака мочевого пузыря в Израиле, цены
Хирурги в Израиле стараются прибегать к органосохраняющим операциям. Основным методом является трансуретральная хирургия (TUR). Удаление опухоли через уретру без разрезов скальпелем, а с использованием резектоскопа. Такие процедуры минимально инвазивны и практически бескровны. Иногда требуется частичное удаление органа вместе с опухолью, процесс мочеиспускания в этом случае не изменяется, увеличивается только частота мочеиспусканий.
В некоторых случаях, если при рассмотрении всех вариантов врачи пришли к выводу, что мочевой пузырь необходимо удалить, назначается цистэктомия. После радикальной операции моча может отводиться несколькими способами: через дренажное отверстие в брюшной стенке и собираться в специальный мешок; врач создает в брюшной полости небольшой карман, где скапливается моча, ее необходимо сливать несколько раз в день при помощи катетера; реконструкция мочевого пузыря. Из части кишечника создается резервуар для мочи, который соединяется с уретрой и мочеточниками, что позволяет сохранить естественное мочеиспускание.
В Израиле применяются хирургические методы, дающие возможность сохранить нервы и предотвратить половую дисфункцию, либо, удалив мочевой пузырь, сохранить простату. Лечением рака мочевого пузыря в Израиле занимается многопрофильная команда, специализирующаяся на лечении рака мочевыводящих путей. В состав команды входят урологи (врачи с опытом хирургии мочевого пузыря), онкологи, имеющие опыт лечения рака мочевого пузыря с помощью химиотерапии, лучевой терапии и инновационных методов лечения, радиологи, интерпретирующие результаты визуализационных тестов, патологи, диагностирующие тип и степень заболевания, квалифицированный младший медицинский персонал. В зависимости от глубины поражения стенки мочевого пузыря опухоли делятся на две группы: неинвазивные, опухоль ограничена слизистой оболочкой. Инвазивные (инфильтративные). Рак прорастает в мышечный слой или стенки органа.
Внутрипузырная иммунотерапия БЦЖ при раке мочевого пузыря
Внутрипузырная иммунотерапия БЦЖ — наиболее эффективный метод внутрипузырного лечения поверхностного рака мочевого пузыря. Она снижает частоту рецидивов и предотвращает прогрессирование злокачественных опухолей. В отношении рака мочевого пузыря БЦЖ-терапия значительно превосходит химиотерапию и уменьшает частоту рецидивов в среднем на 40%, в то время как химиотерапия снижает только на 14%.
Вакцина БЦЖ — это взвесь ослабленных жизнеспособных бацилл Кальметта-Герена (Calmette-Guerin). Впервые ее стали применять в 1921 году для вакцинации человека против туберкулеза. Дальнейшие исследования показали, что у больных туберкулезом после вакцинации реже встречаются злокачественные опухоли. Это послужило основанием для изучения эффективности данного метода лечения и на уровне мочевого пузыря, где размножаясь внутриклеточно, бациллы Кальметта-Герена стимулируют местный иммунитет.
БЦЖ-терапия уже много лет применяется как за рубежом, так и в России, в частности в Урологической клинике ЕМС. Многие пациенты не отмечают никаких побочных эффектов после проведения процедуры, но описаны редкие случаи, когда БЦЖ-терапия могла спровоцировать цистит или простатит.
Показания к применению БЦЖ-терапии:
-
Рак мочевого пузыря
-
Опухоль (в том числе доброкачественная) мочевого пузыря
-
Неинвазивный (поверхностный) рак
Противопоказания к применению БЦЖ-терапии:
-
Туберкулез, в том числе в анамнезе
-
Повышенная чувствительность к компонентам препарата
-
Лучевая терапия мочевого пузыря в анамнезе
-
Врожденный или приобретенный иммунодефицит (СПИД, лейкемия, лимфома)
-
Проведение иммуносупрессивной терапии
-
Тяжелые сопутствующие заболевания в стадии декомпенсации
-
Беременность и грудное вскармливание
Схема лечения:
Курс лечения и схема назначается индивидуально врачом-онкоурологом согласно результатам гистологического исследования. Обычно стандартный индукционный курс включает 6-8 еженедельных процедур. Примерно через 2 часа после вакцинации препарат концентрируется в мочевом пузыре.
-
НИИ ОНКОЛОГИИ РФ Минздрав России
-
EAU (European Association of Urology)
-
AUA (American Association of Urology)
-
NCCN (National Comprehensive Cancer Network)
-
FICBT (First International Consultation on Bladder Tumours)
Самарская городская клиническая больница №8 Новости
Постлучевойцистит часто встречающаяся проблема у женщин после проведенной лучевой терапии. Лучевой цистит – это воспаление мочевого пузыря, вызванное радиоизлучением. Дело в том, что оболочка мочевого пузыря чувствительна к различным раздражителям.Лучевая терапия раздражает стенки мочевого пузыря, нарушает кровообращениев тканях и провоцирует появление язв. По статистике, у каждой пятой женщины после лечения рака тела и шейки матки или других заболеваний органов малого таза при помощи лучевой терапии, возникает постлучевой цистит.
Главным признаком постлучевого цистита является наличие болей при мочеиспускании, также пациент может заметить присутствие патологических примесей в моче.
Различают пять основных видов лучевых повреждений органа и для каждого из них характерны свои симптомы:
- телеангиоэктазия мочевого пузыря характеризуется частым мочеиспусканием и наличием крови в моче, как и при геморрагическом цистите. При выполнении цистоскопии видны участки кровоизлияний, расширенные и извитые сосуды.
- катаральный цистит проявляется учащенным мочеиспусканием, сопровождающимся болью. При проведении цистоскопии наблюдается уменьшение емкости мочевого пузыря до 150 мл.
- постлучевые язвы мочевого пузыря характеризуются учащенным мочеиспусканием с болью, наличием крови, хлопьев, песка или гноя в моче. При проведении цистоскопии в органе наблюдается язвы.
- инкрустирующий цистит имеет теже симптомы, что и при постлучевых язвах. При этом емкость может быть снижена до 100 мл.
- псевдорак- в данном случае происходят изменения мочевого пузыря, которые напоминают рак.
Клинические проявления повреждения органа обычно наблюдаются в срок от 3 до 48 недель с момента окончания радиотерапии. К ним присоединяются проявления кастрационного синдрома. Это значительно снижает качество жизни пациенток, нарушая обычный ритм жизни.
Атрофические и постлучевые изменения в эпителии урогенитального тракта, проявляющиеся сухостью слизистой, неприятным запахом мочи и болями в низу живота, усложняют сексуальные отношения с партнером. Все эти осложнения влияют на психосоматическое состояние женщин, что часто приводит к депрессии. Подход к лечению постлучевого цистита должен быть комплексным.
Конечно, их перечень у онкобольных ограничен. Немаловажным аспектом является психологический. Пациенты не всегда признаются в этой проблеме. Качественный сбор жалоб и профессиональный подход к пациенту играет важную роль в постановке диагноза и своевременном лечении.
При возникновение симптомов цистита не рекомендуется применять лекарственную терапию самостоятельно.
При своевременном обращении к специалисту и выполнении всех врачебных предписаний пациент может рассчитывать на благоприятный исход возникшего осложнения.
Записаться на прием к врачу можно по тел. : 933-96-96
Лучевая терапия рака мочевого пузыря
Лучевая терапия использует высокоэнергетическое излучение для уничтожения раковых клеток.
Когда используется лучевая терапия?
Лучевая терапия может быть использована:
- В рамках лечения некоторых видов рака мочевого пузыря на ранних стадиях , после операции, при которой не удаляется весь мочевой пузырь (например, TURBT)
- В качестве основного лечения для людей с раком на ранних стадиях, которые не могут пройти операцию или химиотерапию
- Чтобы избежать цистэктомии (операции по удалению мочевого пузыря)
- В рамках лечения запущенного рака мочевого пузыря (рак, распространившийся за пределы мочевого пузыря)
- Для предотвращения или лечения симптомов, вызванных распространенным раком мочевого пузыря
Лучевая терапия часто проводится вместе с химиотерапией, чтобы улучшить ее действие.Это называется химиолучевой терапией .
Как проводится лучевая терапия?
Тип излучения, наиболее часто применяемый для лечения рака мочевого пузыря, называется лучевой терапией внешним лучом . Он фокусирует излучение от источника за пределами тела на раке.
Перед началом лечения ваша радиационная бригада проведет тщательные измерения, чтобы определить точные углы для наведения лучей излучения и правильную дозу излучения. Этот сеанс планирования, называемый имитацией , обычно включает в себя получение визуальных тестов, таких как компьютерная томография или МРТ.Это помогает врачу определить местонахождение опухоли в вашем теле. Вам будет предложено опорожнить мочевой пузырь перед симуляцией и перед каждым сеансом лечения.
Лечение очень похоже на рентген, но радиация сильнее. Радиация не повредит. Каждая процедура длится всего несколько минут, но время настройки — подготовка к лечению — обычно занимает больше времени. Чаще всего лучевая терапия проводится 5 дней в неделю в течение многих недель.
Возможные побочные эффекты лучевой терапии
Побочные эффекты радиации зависят от введенной дозы и обрабатываемой области.Они, как правило, ухудшаются, когда химиотерапия проводится вместе с радиацией. Они могут включать:
- Изменения кожи в областях, подвергающихся облучению, от покраснения до волдырей и шелушения
- Тошнота и рвота
- Симптомы мочевого пузыря, такие как жжение или боль при мочеиспускании, частые позывы к мочеиспусканию или кровь в моче
- Диарея
- Кровь в стуле и / или моче
- Усталость (утомляемость)
- Низкие показатели крови, которые могут привести к усталости, появлению синяков или кровотечений или к повышенному риску заражения
Эти эффекты обычно проходят со временем после лечения, но у некоторых людей могут быть более долгосрочные проблемы.Например:
- У некоторых людей лучевая терапия может привести к недержанию мочи (проблемы с задержкой мочи) позже.
- Радиация может повредить слизистую оболочку мочевого пузыря. Это называется лучевым циститом и может вызывать долгосрочные проблемы, такие как кровь в моче или болезненное мочеиспускание.
- Соседние нервы и кровеносные сосуды могут быть повреждены, что приведет к проблемам с эрекцией у мужчин.
Если у вас наблюдаются побочные эффекты лучевой терапии, поговорите со своим лечащим врачом.Они могут предложить способы облегчить многие из них.
Лучевая терапия рака мочевого пузыря
Лучевая терапия использует точно сфокусированные пучки высокой энергии для уничтожения раковых клеток. Наши врачи проводят лучевую терапию в различных формах. Форма, которую мы рекомендуем, зависит от типа рака, местоположения опухоли и от того, распространилась ли она.
В рамках лечения рака мочевого пузыря вы можете пройти лучевую терапию до, во время или после операции. Это может уменьшить опухоль или уничтожить оставшиеся раковые клетки.Для некоторых людей мы можем использовать радиацию, часто в сочетании с низкой дозой химиотерапии, вместо хирургического вмешательства.
Наши онкологи-радиологи используют передовые методы для нацеливания на зоны риска при одновременном снижении радиационного воздействия на нормальные ткани.
Интраоперационная лучевая терапия при хирургии рака мочевого пузыря
Интраоперационная лучевая терапия — это лечение, проводимое во время операции по поводу рака мочевого пузыря для снижения риска рецидива рака. Этот подход обеспечивает мощное излучение через тонкие трубки, называемые катетерами, которые помещаются непосредственно на ткань.Это может убить раковые клетки, которые могут остаться после удаления опухоли. Чаще всего рекомендуется, если рак распространился за пределы мочевого пузыря.
Поскольку это лечение проводится во время операции и может быть доставлено в точно определенную область, можно использовать более высокую, чем обычно, дозу радиации. Нормальные ткани, особенно кишечник, можно временно отодвинуть от зоны лечения или накрыть защитными устройствами во время доставки излучения.
Интраоперационная лучевая терапия обычно занимает всего несколько минут во время хирургической процедуры.Как только доза облучения доставлена, все материалы, связанные с облучением, удаляются, и операция продолжается.
Внешняя лучевая терапия рака мочевого пузыря
Наружная лучевая терапия — наиболее распространенный вид лучевой терапии. Доставляется машиной извне тела. Излучение чаще всего бывает в виде рентгеновских лучей. Иногда используются заряженные частицы, называемые протонами, или другие типы энергии. Наши врачи могут порекомендовать дистанционную лучевую терапию в сочетании с химиотерапией в низких дозах в качестве альтернативы цистэктомии (удалению мочевого пузыря).Это означает, что опухоль разрушена, но мочевой пузырь остается нетронутым.
Лучевая терапия рака мочевого пузыря под визуальным контролем
Чтобы проверить расположение опухоли и положение мочевого пузыря до и во время проведения лучевой терапии, мы используем форму внешней лучевой терапии, называемую лучевой терапией под визуальным контролем. Одна из проблем при проведении лучевой терапии рака мочевого пузыря заключается в том, что мочевой пузырь двигается, когда он опорожняется и наполняется мочой. Чтобы точно нацелить опухоль на несколько сеансов лучевой терапии, мы имплантируем золотые маркеры, чтобы показать точное местоположение опухоли и отслеживать движение мочевого пузыря изо дня в день.
Мы также используем компьютерные томографы, связанные с аппаратами, доставляющими излучение. Сканеры позволяют нам визуализировать мочевой пузырь, а также нормальные окружающие ткани, такие как кишечник и прямая кишка. Используя эти передовые методы, мы можем добиться высоких показателей излечения и максимизировать шансы на сохранение здорового мочевого пузыря.
Лучевая терапия с модуляцией интенсивности для лечения рака мочевого пузыря
Точные методы визуализации, которые мы используем при планировании лечения, позволяют нам безопасно и эффективно использовать лучевую терапию с модуляцией интенсивности.Этот метод использует компьютерные программы для расчета и доставки различных доз радиации непосредственно к опухоли под разными углами. Наши онкологи-радиологи в тесном сотрудничестве с командой медицинских физиков сыграли ведущую роль в разработке этого вида лучевой терапии.
Рак мочевого пузыря: виды лечения
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете основы различных видов лечения, которые врачи используют для лечения людей с раком мочевого пузыря. Используйте меню для просмотра других страниц.
В этом разделе описаны виды лечения, являющиеся стандартными при лечении рака. «Стандарт лечения» означает лучшие методы лечения, известные на сегодняшний день. При принятии решения о плане лечения вам рекомендуется рассмотреть возможность проведения клинических испытаний. Клиническое испытание — это научное исследование, в котором проверяется новый или модифицированный подход к лечению. Врачи хотят узнать, является ли новое лечение безопасным, эффективным и, возможно, лучше, чем стандартное лечение. В клинических испытаниях можно проверить новое лекарство, новую комбинацию стандартных методов лечения или новые дозы стандартных лекарств или других методов лечения.Клинические испытания — отличный вариант для лечения и ухода на всех стадиях рака. Ваш врач может помочь вам рассмотреть все варианты лечения, включая клинические испытания. Узнайте больше о клинических испытаниях в разделах «О клинических испытаниях» и «Последние исследования» этого руководства.
Обзор лечения
Ниже приведены основные описания наиболее распространенных видов лечения рака мочевого пузыря. Найдите время, чтобы узнать обо всех вариантах лечения, и обязательно задавайте вопросы о том, что неясно.Кроме того, поговорите со своим врачом о целях каждого лечения и о том, чего вы можете ожидать от лечения. Такие разговоры называются «совместным принятием решений». Совместное принятие решений — это когда вы и ваши врачи вместе выбираете методы лечения, которые соответствуют целям вашего лечения. Совместное принятие решений особенно важно при раке мочевого пузыря, потому что существуют разные варианты лечения. Узнайте больше о принятии решений о лечении.
Чтобы увидеть общие варианты лечения в зависимости от степени рака мочевого пузыря, прочтите следующий раздел этого руководства, «Лечение по стадиям».
Хирургия
Хирургия — это удаление опухоли и некоторых окружающих здоровых тканей во время операции. Существуют разные виды операций при раке мочевого пузыря. Ваша медицинская бригада порекомендует конкретную операцию в зависимости от стадии и степени заболевания.
Трансуретральная резекция опухоли мочевого пузыря (ТУР мочевого пузыря). Эта процедура используется для диагностики и определения стадии, а также для лечения. Во время TURBT хирург вводит цистоскоп через уретру в мочевой пузырь.Затем хирург удаляет опухоль с помощью инструмента с небольшой проволочной петлей, лазера или фульгурации (высокоэнергетическое электричество). Перед началом процедуры пациенту вводят анестетик, лекарство, блокирующее осознание боли.
Людям с неинвазивным раком мочевого пузыря, не инвазивным в мышцах, ТУР мочевого пузыря может устранить рак. Однако врач может порекомендовать дополнительные методы лечения, чтобы снизить риск возврата рака, например, внутрипузырную химиотерапию или иммунотерапию (см. Ниже).Людям с мышечно-инвазивным раком мочевого пузыря обычно рекомендуются дополнительные методы лечения, включающие хирургическое вмешательство по удалению мочевого пузыря или, что реже, лучевую терапию. Химиотерапия обычно используется при мышечно-инвазивном раке мочевого пузыря.
Радикальная цистэктомия и лимфодиссекция. Радикальная цистэктомия — это удаление всего мочевого пузыря и, возможно, близлежащих тканей и органов. У мужчин обычно также удаляются простата и часть уретры. У женщин матка, маточные трубы, яичники и часть влагалища могут быть удалены.У всех пациентов удаляются лимфатические узлы в тазу. Это называется диссекцией тазовых лимфатических узлов. Расширенное рассечение тазовых лимфатических узлов — самый точный способ обнаружить рак, распространившийся на лимфатические узлы. В редких, очень специфических ситуациях может оказаться целесообразным удалить только часть мочевого пузыря, что называется частичной цистэктомией. Однако эта операция не является стандартом лечения людей с мышечно-инвазивным заболеванием.
Во время лапароскопической или роботизированной цистэктомии хирург делает несколько небольших разрезов, или разрезов, вместо 1 большего разреза, используемого при традиционной открытой хирургии.Затем хирург использует телескопическое оборудование с помощью робота или без него, чтобы удалить мочевой пузырь. Хирург должен сделать разрез, чтобы удалить мочевой пузырь и окружающие ткани. Для этого типа операции требуется хирург, имеющий большой опыт в этом виде хирургии. Ваш врач может обсудить с вами эти варианты и помочь вам принять обоснованное решение.
Отвод мочи. Если удалить мочевой пузырь, врач создаст новый способ вывода мочи из организма. Один из способов сделать это — использовать часть тонкой или толстой кишки для отвода мочи в стому или стому (отверстие) на внешней стороне тела.Затем пациент должен носить мешок, прикрепленный к стоме, для сбора и слива мочи.
Хирурги иногда могут использовать часть тонкой или толстой кишки для создания резервуара для мочи, который представляет собой мешочек для хранения, который находится внутри тела. При этих процедурах пациенту не нужен мочевой мешок. У некоторых пациентов хирург может соединить сумку с уретрой, создав так называемый нео- пузырь, чтобы пациент мог выводить мочу из тела. Однако пациенту может потребоваться ввести тонкую трубку, называемую катетером, если новый пузырь не полностью опорожнен от мочи.Кроме того, у пациентов с новым пузырем больше не будет позывов к мочеиспусканию, и им нужно будет научиться мочиться по постоянному графику. Для других пациентов создается внутренний (внутри брюшной полости) мешочек из тонкой кишки, который соединяется с кожей живота или пупка (пупок) через небольшую стому (например, «мешок Индианы»). При таком подходе пациентам не нужно носить сумку. Пациенты осушают внутренний мешок несколько раз в день, вводя катетер через небольшую стому и немедленно удаляя катетер.
Побочные эффекты хирургии рака мочевого пузыря
Жизнь без мочевого пузыря может повлиять на качество жизни пациента. Поиск способов сохранить весь мочевой пузырь или его часть — важная цель лечения. Для некоторых людей с мышечно-инвазивным раком мочевого пузыря планы лечения, включающие химиотерапию и лучевую терапию после оптимальной ТУР (см. «Сохранение мочевого пузыря» в разделе «Лечение по стадиям»), могут использоваться в качестве альтернативы удалению мочевого пузыря.
Побочные эффекты хирургического вмешательства при раке мочевого пузыря зависят от процедуры.Исследования показали, что наличие хирурга, имеющего опыт лечения рака мочевого пузыря, может улучшить исход лечения людей с раком мочевого пузыря. Пациенты должны подробно поговорить со своим врачом, чтобы точно понять, какие побочные эффекты могут возникнуть, в том числе побочные эффекты со стороны мочевыводящих и половых органов, и как с ними бороться. В общем, побочные эффекты могут включать:
Увеличенное время исцеления
Инфекция
Сгустки крови или кровотечение
Дискомфорт после операции и травма близлежащих органов
Инфекции или утечки мочи после цистэктомии или отведения мочи.Если образовался новый пузырь, пациент может иногда быть не в состоянии помочиться или полностью опорожнить мочевой пузырь.
Неспособность полового члена стать эрегированным, называемая эректильной дисфункцией, после цистэктомии. Иногда может быть выполнена нервосберегающая цистэктомия. Когда это будет сделано успешно, у мужчин может быть нормальная эрекция.
Повреждение нервов в области таза и потеря полового ощущения и оргазма у мужчин и женщин. Эти проблемы могут быть устранены при дальнейшем лечении.
Риски, связанные с анестезией или другими сопутствующими заболеваниями
Потеря выносливости или физической силы на некоторое время
Перед операцией поговорите со своим лечащим врачом о возможных побочных эффектах конкретной операции, которую вам предстоит перенести. Узнайте больше об основах хирургии рака.
Лечение с использованием лекарств
Системная терапия — это использование лекарств для уничтожения раковых клеток. Этот тип лекарств вводится через кровоток или изо рта для достижения раковых клеток по всему телу («система» в «системной терапии»).Системные методы лечения обычно назначаются онкологом, врачом, специализирующимся на лечении рака с помощью лекарств.
Обычные способы проведения системной терапии включают внутривенную (IV) трубку, вводимую в вену с помощью иглы, либо в таблетку или капсулу, которые проглатываются (перорально).
Типы системных методов лечения рака мочевого пузыря включают:
Химиотерапия
Иммунотерапия
Таргетная терапия
Каждый из этих видов терапии обсуждается ниже более подробно.Человек может получать одновременно 1 тип системной терапии или комбинацию системных терапий. Их также можно назначать как часть плана лечения, который включает хирургическое вмешательство и / или лучевую терапию.
Лекарства, используемые для лечения рака, постоянно проходят экспертизу. Часто лучший способ узнать о прописанных вам лекарствах, их назначении, потенциальных побочных эффектах и взаимодействии с другими лекарствами — поговорить с врачом. Также важно сообщить своему врачу, если вы принимаете какие-либо другие лекарства или добавки, отпускаемые по рецепту или без рецепта.Травы, добавки и другие лекарства могут взаимодействовать с лекарствами от рака. Узнайте больше о своих рецептах с помощью доступных для поиска баз данных о лекарствах.
Химиотерапия
Химиотерапия — это использование лекарств для уничтожения раковых клеток, обычно путем удержания раковых клеток от роста, деления и образования новых клеток. Схема или расписание химиотерапии обычно состоит из определенного количества циклов, проводимых в течение определенного периода времени. Пациент может получать 1 лекарство за раз или комбинацию разных лекарств в один и тот же день.
Есть 2 типа химиотерапии, которые можно использовать для лечения рака мочевого пузыря. Тип, рекомендуемый врачом, и время его назначения зависит от стадии рака. Пациентам следует поговорить со своим врачом о химиотерапии до или после операции.
Внутрипузырная химиотерапия. Внутрипузырная или местная химиотерапия обычно назначается урологом. Во время этого типа терапии лекарства доставляются в мочевой пузырь через катетер, который вводят через уретру.Местное лечение уничтожает только поверхностные опухолевые клетки, контактирующие с химиотерапевтическим раствором. Он не может достичь опухолевых клеток в стенке мочевого пузыря или опухолевых клеток, которые распространились на другие органы. Митомицин-С (доступен в виде дженерика), гемцитабин (Гемзар), доцетаксел (Таксотер) и валрубицин (Валстар) — это препараты, наиболее часто используемые для внутрипузырной химиотерапии. В 2020 году FDA также одобрило митомицин (Jelmyto) для лечения низкосортного уротелиального рака верхних мочевых путей.
Системная химиотерапия. Наиболее распространенные схемы системной химиотерапии или химиотерапии всего тела для лечения рака мочевого пузыря включают:
Цисплатин и гемцитабин
Карбоплатин (доступен как дженерик) и гемцитабин
MVAC, который объединяет 4 препарата: метотрексат (Rheumatrex, Trexall), винбластин (Velban), доксорубицин и цисплатин
Плотный по дозе (DD) -MVAC с поддержкой фактора роста: это тот же режим, что и MVAC, но между курсами лечения меньше, и он в основном заменил MVAC
Доцетаксел или паклитаксел (доступны как дженерик)
Пеметрексед (Алимта)
Многие системные химиотерапевтические препараты продолжают проверяться в ходе клинических испытаний, чтобы помочь выяснить, какие препараты или комбинации препаратов лучше всего подходят для лечения рака мочевого пузыря.Обычно комбинация лекарств работает лучше, чем одно лекарство. Доказательства убедительно подтверждают использование химиотерапии на основе цисплатина перед радикальной операцией при мышечно-инвазивном раке мочевого пузыря. Это называется «неоадъювантной химиотерапией».
Если химиотерапия на основе платины уменьшает или замедляет / стабилизирует прогрессирующий или метастатический уротелиальный рак, можно использовать иммунотерапию авелумабом (Бавенсио, см. Ниже), чтобы попытаться предотвратить или отсрочить возвращение рака и помочь людям жить дольше. Это называется поддерживающим вмешательством.
Побочные эффекты химиотерапии зависят от конкретного препарата, комбинированного режима и применяемой дозы, но они могут включать усталость, риск инфекции, образование тромбов и кровотечение, потерю аппетита, изменения вкуса, тошноту и рвоту, выпадение волос, диарею и т. Д. среди прочего. Эти побочные эффекты обычно проходят после завершения лечения.
Узнайте больше об основах химиотерапии.
Иммунотерапия
Иммунотерапия, также называемая биологической терапией, разработана для усиления естественной защиты организма для борьбы с раком.В нем используются материалы, произведенные организмом или в лаборатории, для улучшения, нацеливания или восстановления функции иммунной системы. Его можно вводить местно или по всему телу.
Местная терапия
Bacillus Calmette-Guerin (BCG). Стандартный иммунотерапевтический препарат при раке мочевого пузыря — это ослабленная микобактерия, называемая БЦЖ, которая похожа на бактерии, вызывающие туберкулез. БЦЖ вводится непосредственно в мочевой пузырь через катетер. Это называется внутрипузырной терапией. БЦЖ прикрепляется к внутренней оболочке мочевого пузыря и стимулирует иммунную систему к разрушению опухолевых клеток.БЦЖ может вызывать гриппоподобные симптомы, среди прочего, лихорадку, озноб, усталость, чувство жжения в мочевом пузыре, кровотечение из мочевого пузыря.
Интерферон (Роферон-А, Интрон А, Альферон). Интерферон — это еще один вид иммунотерапии, который редко может применяться в качестве внутрипузырной терапии. Иногда ее комбинируют с БЦЖ, если использование одной только БЦЖ не помогает в лечении рака, но в настоящее время это встречается крайне редко.
Системная терапия
Ингибиторы иммунных контрольных точек ( обновлено 03/2021, ). Активное направление исследований в области иммунотерапии — это лекарства, которые блокируют белок PD-1 или его лиганд PD-L1. PD-1 находится на поверхности Т-клеток, которые представляют собой тип белых кровяных телец, которые напрямую помогают иммунной системе организма бороться с болезнями. Поскольку PD-1 не дает иммунной системе разрушать раковые клетки, прекращение работы PD-1 позволяет иммунной системе лучше устранять рак.
Авелумаб (Бавенсио), ниволумаб (Опдиво) или пембролизумаб (Кейтруда) можно использовать для лечения запущенной или метастатической уротелиальной карциномы, которая не купируется химиотерапией платиной.Пембролизумаб — единственная иммунотерапия, которая, как было показано, помогает людям с запущенной или метастатической уротелиальной карциномой жить дольше (по сравнению с химиотерапией таксаном или винфлунином) после того, как предыдущее лечение химиотерапией на основе платины не помогло. Пембролизумаб или атезолизумаб (Тецентрик) также можно использовать для лечения запущенного уротелиального рака у людей, которые не могут получать химиотерапию на основе цисплатина и у которых есть опухоли со сверхэкспрессией PD-L1. В Соединенных Штатах люди, которые не могут получить какую-либо химиотерапию на основе платины, могут получать пембролизумаб или атезолизумаб независимо от того, сверхэкспрессируют ли их опухоли PD-L1.Если химиотерапия замедлила или уменьшила прогрессирующий уротелиальный рак, авелумаб можно использовать для продления жизни и снижения риска обострения рака. Этот вид лечения называется поддерживающим лечением. Пембролизумаб также одобрен для лечения неинвазивного мышечно-инвазивного рака мочевого пузыря (ТИС), который не купируется БЦЖ-терапией у людей, которые не могут пройти радикальную цистэктомию или решили отказаться от нее. Несколько ингибиторов иммунных контрольных точек в настоящее время изучаются в нескольких клинических испытаниях на всех стадиях рака мочевого пузыря.
Различные виды иммунотерапии могут вызывать разные побочные эффекты. Общие побочные эффекты включают усталость, кожные реакции (такие как зуд и сыпь), симптомы гриппа, изменения функции щитовидной железы, гормональные изменения и / или изменения веса, диарею и воспаление легких, печени и кишечника. Любой орган тела может быть мишенью сверхактивной иммунной системы, поэтому поговорите со своим врачом о возможных побочных эффектах рекомендованной вам иммунотерапии, чтобы вы знали, какие изменения следует искать, и могли заранее сообщить о них медицинской бригаде.Узнайте больше об основах иммунотерапии.
Таргетная терапия
Таргетная терапия — это лечение, направленное на специфические гены, белки рака или тканевую среду, которая способствует росту и выживанию рака. Этот тип лечения блокирует рост и распространение раковых клеток и пытается ограничить повреждение здоровых клеток.
Не все опухоли имеют одинаковые мишени. Чтобы найти наиболее эффективное лечение, ваш врач может провести геномные тесты, чтобы определить гены, белки и другие факторы в вашей опухоли.Это помогает врачам лучше подбирать каждому пациенту наиболее эффективное стандартное лечение и соответствующие клинические испытания, когда это возможно. Кроме того, продолжаются исследования, чтобы узнать больше о конкретных молекулярных мишенях и новых методах лечения, направленных на них. Узнайте больше об основах целевого лечения.
Эрдафитиниб (Балверса). Эрдафитиниб — это лекарство, принимаемое внутрь (перорально), которое одобрено для лечения людей с местно-распространенной или метастатической уротелиальной карциномой с генетическими изменениями FGFR3 или FGFR2 , которые продолжали расти или распространяться во время или после химиотерапии платиной.Существует специальный сопутствующий тест, одобренный FDA, чтобы выяснить, кому может быть полезно лечение эрдафитинибом.
Общие побочные эффекты эрдафитиниба могут включать повышенный уровень фосфата, язвы во рту, усталость, тошноту, диарею, сухость во рту / коже, отделение ногтей от ногтевого ложа или плохое формирование ногтей, а также изменение аппетита и вкуса, среди прочего. Эрдафитиниб также может вызывать редкие, но серьезные проблемы со зрением, включая ретинопатию и отслоение эпителия, которые могут вызывать слепые пятна, которые называются дефектами поля зрения.Обследование у офтальмолога или оптометриста необходимо, по крайней мере, в первые 4 месяца, наряду с частыми оценками по сетке Амслера дома.
Энфортумаб ведотин-эйфв (Падцев). Энфортумаб ведотин-ejfv одобрен для лечения местнораспространенного (неоперабельного) или метастатического уротелиального рака у людей, которые уже получили ингибитор иммунных контрольных точек PD-L1 (см. «Иммунотерапия» выше) и химиотерапию платиной. Энфортумаб ведотин-ejfv представляет собой конъюгат антитело-лекарственное средство, нацеленный на нектин-4, который присутствует в раковых клетках уротелия.Конъюгаты антитело-лекарство прикрепляются к мишеням на раковых клетках, а затем высвобождают небольшое количество противоракового лекарства непосредственно в опухолевые клетки. Общие побочные эффекты энфортумаба ведотин-ejfv включают, среди прочего, усталость, периферическую невропатию, сыпь, выпадение волос, изменения аппетита и вкуса, тошноту, диарею, сухость глаз, зуд, сухость кожи и повышение уровня сахара в крови.
Поговорите со своим врачом о возможных побочных эффектах конкретного лекарства и о том, как с ними бороться.
Лучевая терапия
Лучевая терапия — это использование высокоэнергетических рентгеновских лучей или других частиц для уничтожения раковых клеток.Врач, специализирующийся на проведении лучевой терапии для лечения рака, называется онкологом-радиологом. Наиболее распространенный вид лучевой терапии называется дистанционной лучевой терапией, которая представляет собой лучевую терапию, проводимую с помощью аппарата, расположенного вне тела. Когда лучевая терапия проводится с использованием имплантатов, это называется внутренней лучевой терапией или брахитерапией. Однако брахитерапия не используется при раке мочевого пузыря. Схема или расписание лучевой терапии обычно состоит из определенного количества процедур, проводимых в течение определенного периода времени.
Лучевая терапия обычно не используется сама по себе в качестве основного лечения рака мочевого пузыря, но обычно проводится в сочетании с системной химиотерапией. Некоторые люди, которые не могут получить химиотерапию, могут получать только лучевую терапию. Комбинированная лучевая терапия и химиотерапия могут использоваться для лечения рака, локализованного только в мочевом пузыре:
Для уничтожения любых раковых клеток, которые могут остаться после оптимальной ТУР, чтобы не удалять весь мочевой пузырь или его часть, когда это необходимо (см. «Сохранение мочевого пузыря» в разделе «Лечение по стадиям»).
Для облегчения симптомов, вызванных опухолью, таких как боль, кровотечение или закупорка (так называемое «паллиативное лечение», см. Раздел ниже).
Побочные эффекты лучевой терапии могут включать усталость, легкие кожные реакции и жидкий стул. При раке мочевого пузыря побочные эффекты чаще всего возникают в области таза или брюшной полости и могут включать раздражение мочевого пузыря с необходимостью частого мочеиспускания в течение периода лечения и кровотечение из мочевого пузыря или прямой кишки; другие побочные эффекты могут возникать реже.Большинство побочных эффектов проходят относительно вскоре после окончания лечения.
Узнайте больше об основах лучевой терапии.
Физические, эмоциональные и социальные последствия рака
Рак и его лечение вызывают физические симптомы и побочные эффекты, а также эмоциональные, социальные и финансовые последствия. Управление всеми этими эффектами называется паллиативной или поддерживающей терапией. Это важная часть вашего ухода, которая включается в лечение, направленное на замедление, остановку или устранение рака.
Паллиативная помощь направлена на улучшение вашего самочувствия во время лечения путем устранения симптомов и поддержки пациентов и их семей с другими, немедицинскими потребностями. Любой человек, независимо от возраста, типа и стадии рака, может получить такую помощь. И часто он работает лучше всего, когда его начинают сразу после позднего диагноза рака. Люди, которые получают паллиативную помощь наряду с лечением рака, часто имеют менее серьезные симптомы, лучшее качество жизни, сообщают, что они более удовлетворены лечением и могут жить дольше.
Паллиативные методы лечения широко варьируются и часто включают в себя лекарства, изменения в питании, техники релаксации, эмоциональную и духовную поддержку и другие методы лечения. Вы также можете получить паллиативное лечение, подобное тому, которое предназначено для избавления от рака, например химиотерапию, хирургическое вмешательство или лучевую терапию.
Перед началом лечения поговорите со своим врачом о целях каждого лечения в плане лечения. Вам также следует поговорить о возможных побочных эффектах конкретного плана лечения и вариантах паллиативной помощи.
Во время лечения ваша медицинская бригада может попросить вас ответить на вопросы о ваших симптомах и побочных эффектах и описать каждую проблему. Обязательно сообщите медицинскому персоналу, если у вас возникла проблема. Это помогает медицинским работникам как можно быстрее устранять любые симптомы и побочные эффекты. Это также может помочь предотвратить более серьезные проблемы в будущем.
Узнайте больше о важности отслеживания побочных эффектов в другой части этого руководства. Узнайте больше о паллиативной помощи в отдельном разделе этого сайта.
Ремиссия и вероятность рецидива
Ремиссия — это когда рак не может быть обнаружен в организме и нет никаких симптомов. Это также может называться «отсутствие признаков болезни» или NED.
Ремиссия может быть временной или постоянной. Эта неопределенность заставляет многих людей беспокоиться о том, что рак вернется. Хотя многие ремиссии носят постоянный характер, важно обсудить с врачом возможность возвращения рака. Понимание вашего риска рецидива и вариантов лечения может помочь вам почувствовать себя более подготовленным, если рак все же вернется.Узнайте больше о том, как справиться со страхом повторения.
Если рак возвращается после первоначального лечения, это называется рецидивирующим раком. Он может вернуться в том же месте (так называемый местный рецидив), поблизости (региональный рецидив) или в другом месте (отдаленный рецидив, также известный как метастаз).
Когда это произойдет, снова начнется новый цикл тестирования, чтобы узнать как можно больше о повторении. После того, как это обследование будет выполнено, вы и ваш врач обсудите варианты лечения.
В общем, неинвазивный рак мочевого пузыря, который возвращается в том же месте, что и исходная опухоль, или где-то еще в мочевом пузыре, можно лечить так же, как и первый рак. Однако, если рак продолжает возвращаться после лечения, может быть рекомендована радикальная цистэктомия. Рак мочевого пузыря, рецидивирующий за пределами мочевого пузыря, сложнее устранить хирургическим путем, и его часто лечат с помощью системной терапии, лучевой терапии или того и другого. Ваш врач может также предложить клинические испытания, изучающие новые способы лечения этого типа рецидивирующего рака.Какой бы план лечения вы ни выбрали, паллиативная помощь может иметь важное значение для облегчения симптомов и побочных эффектов.
Люди с рецидивирующим раком часто испытывают такие эмоции, как неверие или страх. Вам предлагается поговорить с медицинским персоналом об этих чувствах и спросить об услугах поддержки, которые помогут вам справиться с этим. Узнайте больше о том, как бороться с рецидивом рака.
Если лечение не работает
Полное выздоровление от рака мочевого пузыря не всегда возможно. Если рак невозможно вылечить или контролировать, болезнь можно назвать запущенной или метастатической.
Этот диагноз вызывает стресс, и многим людям трудно обсуждать запущенный рак. Однако важно вести открытые и честные беседы со своим лечащим врачом, чтобы выразить свои чувства, предпочтения и опасения. Медицинская бригада обладает особыми навыками, опытом, знаниями и знаниями для поддержки пациентов и их семей и всегда готова помочь. Чрезвычайно важно обеспечить человеку физический комфорт, отсутствие боли и эмоциональную поддержку.
Пациенты с запущенным раком и ожидаемая продолжительность жизни менее 6 месяцев могут обратиться за помощью в хоспис. Хосписная помощь — это особый вид паллиативной помощи, призванный обеспечить максимально возможное качество жизни людям, находящимся на грани конца жизни. Вам и вашей семье рекомендуется обсудить с медицинским персоналом варианты ухода в хосписе, которые включают уход на дому, специальный центр хосписа или другие медицинские учреждения. Медсестринский уход и специальное оборудование могут сделать пребывание дома удобным для многих семей.Узнайте больше о расширенном планировании лечения рака.
После смерти любимого человека многим людям нужна поддержка, чтобы помочь им справиться с утратой. Узнайте больше о горе и утрате.
Информация о стадии и степени рака поможет врачу порекомендовать конкретный план лечения. Следующий раздел в этом руководстве — Лечение по этапам . Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Последние достижения в исследованиях и клиническом применении
Реферат
Роль лучевой терапии (ЛТ) в лечении рака мочевого пузыря претерпела несколько изменений за последние десятилетия.В последнее время было разработано множество протоколов, поддерживающих использование мультимодальной терапии, и концепция сохранения органов стала пересматриваться. Достижения в области планирования, проверки и проведения лучевой терапии обеспечивают метод оптимизации лучевой терапии при раке мочевого пузыря и преодоления трудностей, которые ранее ограничивали успех этого лечения. Они предлагают возможность повысить терапевтическое соотношение за счет уменьшения объема облучаемой нормальной ткани и увеличения дозы облучения или использования более интенсивного фракционирования и синхронных режимов химиотерапии.Эти методы имеют большой потенциал для улучшения терапевтического результата рака мочевого пузыря. В ближайшем будущем появится возможность предложить избранным пациентам с мышечно-инвазивным раком мочевого пузыря органосохраняющее, но эффективное комбинированное лечение. В этом обзоре мы стремимся представить роль лучевой терапии в лечении мышечно-инвазивного рака мочевого пузыря. Также обсуждаются альтернативные методы повышения точности лечения, такие как спиральная томотерапия, адаптивная лучевая терапия и радиохимиотерапия.
Ключевые слова: Рак мочевого пузыря, лучевая терапия, HT, VMAT, ART
Введение
Карцинома мочевого пузыря всех гистологических типов остается серьезной проблемой глобального здравоохранения: в 2008 г. во всем мире зарегистрировано более 385 000 новых случаев [1]. В США от этой болезни умирает около 14 100 человек в год, что составляет 2,5% всей смертности, связанной с раком [2]. Переходно-клеточная карцинома (TCC) составляет более 90% случаев рака мочевого пузыря, и менее распространенные типы включают плоскоклеточную карциному, аденокарциному и мелкоклеточную карциному [3].
Рак мочевого пузыря можно клинически классифицировать по стадиям как мышечно-инвазивный или неинвазивный в зависимости от поражения мышцы-детрузора. Около 70-85% пациентов имеют поверхностное заболевание, и в настоящее время их обычно называют немышечно-инвазивным раком мочевого пузыря (NMIBC) [4]. С другой стороны, мышечно-инвазивный рак мочевого пузыря (MIBC) (T2-T4) представляет собой потенциально серьезную опасность с долгосрочным выживанием около 50% [5,6].
Радикальная цистэктомия с отведением мочи долгое время считалась стандартом лечения МИРМР [7].В современных исследованиях описана 5-летняя общая выживаемость 45–67% после радикальной цистэктомии с выживаемостью без рецидива в диапазоне 62–71% [8–10]. Несмотря на агрессивное и часто раннее вмешательство, многие пациенты с MIBC, леченные одним хирургическим вмешательством, по-прежнему подвергаются значительному риску рецидива и смерти от рака мочевого пузыря. Большинство рецидивов происходит в течение 3 лет после операции, и у 75% этих пациентов не удается получить отдаленные метастазы [11].
Лучевая терапия (ЛТ) — альтернативное лечение со сравнительно хорошими результатами для тех, кто слишком слаб, чтобы подвергнуться цистэктомии, или для тех, кто отказывается от операции [12,13] ().Hayter et al. [14] сообщили о 20 906 новых случаях рака мочевого пузыря, диагностированных в Канаде. Среди пациентов с MIBC не наблюдалось разницы в выживаемости между пациентами, получавшими лучевую терапию, и пациентами, перенесшими цистэктомию. Пятилетняя специфическая выживаемость по причинам для пациентов, получавших лучевую терапию, составила 41%. Около четверти пациентов, получавших лучевую терапию, могли прожить 5 лет при сохранении мочевого пузыря. Радикальная лучевая терапия с цистэктомией для спасения сравнима с первичной цистэктомией и имеет преимущество в сохранении нормальной функции мочевого пузыря [15,16].
Таблица 1
Только лучевая терапия при инвазивном раке мочевого пузыря
| Исследование | Пациенты (n) | Стадия | Лечение (Гр) | 3–5-летняя выживаемость (%) | от 3 до LCR за 5 лет (%) |
|---|---|---|---|---|---|
| Moonen et al. (1998) | 379 | T1G3-T3a | Только RT 50-75 Гр | 40,3 | |
| Piet et al. (2008) | 92 | T2-T4 | Только RT 55 Гр | 36 | 56 |
| Jenkins et al.(1988) | 182 | T2-T3 | Только RT | 40 | |
| Moonen et al. (1994) | 40 | T1G3-T3a | TUR + RT 30 Gy | 86 | 84 |
| Yavuz et al. (2004) | 87 | T1-T4 | Только RT 67,5 Гр | 46 | 64 |
| Horwich et al. (2005) | 229 | T2-T3 | AF (60,8 Гр) n = 129 | 54 VS.47 | |
| CF (64 Гр) n = 100 | 37 VS. 40 |
Множество учреждений и кооперативных групп сыграли роль в разработке и совершенствовании современного подхода к сохранению мочевого пузыря на основе лучевой терапии [6,17]. Сохранение мочевого пузыря с помощью агрессивной трансуретральной хирургии (ТУР), системной химиотерапии и лучевой терапии привело к 5-летней выживаемости, примерно такой же, как после цистэктомии (60%), при этом 40% пациентов выживают с неповрежденным мочевым пузырем [15].При сравнении подходов ТУР плюс химиотерапия только с ТУР плюс одновременной химиотерапии и лучевой терапии, 5-летняя выживаемость с сохраненным мочевым пузырем для всех введенных пациентов колеблется от 20-33%, когда лучевая терапия не применялась, и от 41-45%, когда использовалась лучевая терапия. [18]. Таким образом, использование лучевой терапии одновременно с химиотерапией после ТУР увеличивает вероятность выживания без рецидива инвазивной опухоли. Этот обзор будет сосредоточен на текущем применении лучевой терапии в MIBC и доказательствах в поддержку этого лечения.
Традиционная лучевая терапия
Обычно ЛТ фракционируют от 1,8 до 2 Гр в день, 5 дней в неделю. Общая доза от 45 до 50 Гр доставляется в таз и от 55 до 70 Гр в ложе опухоли мочевого пузыря, что позволяет достичь оптимальных показателей местного контроля [19].
Канадское исследование сообщило о длительных результатах наблюдения за пациентами с МИРМ, получавшими радикальную лучевую терапию [20]. Только лучевую терапию получали 247 пациентов. 36 пациентов получали лучевую терапию и одновременную химиотерапию цисплатином, а 57 пациентов получали неоадъювантную химиотерапию с последующей лучевой терапией.Частота полного ответа (ПО) составила 63,5% для всей группы. Общая 10-летняя выживаемость по конкретным причинам и уровень местного контроля составили 19%, 35% и 32%. У 131 пациента с заболеванием, ограниченным стенкой мочевого пузыря (T2N0M0), 10-летняя причинно-специфическая выживаемость и частота местных безрецидивных причинно-специфической выживаемости составили 68% и 60%.
Между 1996 и 2000 годами Kotwal et al. [21] сравнили исходы у пациентов, получавших радикальное хирургическое вмешательство или лучевую терапию в качестве терапевтического лечения рака мочевого пузыря. Не было различий в общей, конкретной причине и отдаленной безрецидивной выживаемости через 5 лет между двумя группами, несмотря на то, что группа RT была старше (средний возраст 75 лет.3 года против 68,2 года). В более поздней когорте средний возраст пациентов с лучевой терапией был выше, чем в вышеупомянутой когорте, а пациенты, перенесшие радикальную цистэктомию, были значительно моложе пациентов с лучевой терапией (средний возраст 67,9 года против 78,4 года), тем не менее, метод лечения не повлияло на выживаемость. Радикальная лучевая терапия — это возможный вариант лечения для этих пациентов с преимуществом сохранения органов.
Традиционная лучевая терапия в сочетании с химиотерапией или отдельно дает преимущества для пациентов с местнораспространенным раком мочевого пузыря.Однако в исследованиях, в которых облучение проводилось с помощью традиционных методов лучевой терапии, у пациентов развивалась гематологическая токсичность 3 или 4 степени или токсичность для органов малого таза. В исследовании RTOG 95-06 у 21% пациентов с МИРМБ, перенесших ТУР плюс сопутствующую химиотерапию и ЛТ, была гематологическая токсичность 3 или 4 степени, а у 15% — кишечная токсичность 3 степени [22]. Обычная лучевая терапия, при которой доза не может быть уменьшена для критических органов, вызывает неизбежные побочные эффекты.
Трехмерная конформная лучевая терапия (3D-CRT) и лучевая терапия с модуляцией интенсивности (IMRT)
За последние десятилетия произошел значительный прогресс в технологиях как медицинской визуализации, так и конформной доставки дозы.Достижения в области доставки RT, такие как 3D-CRT и IMRT, были разработаны для концентрации излучения на органе-мишени, доставки достаточно высоких доз в опухоль, чтобы остановить ее рост, не вызывая неприемлемо высоких показателей неблагоприятных эффектов для нормальных тканей.
3D-CRT
Шен и др. [23] изучали эффективность, поздние осложнения и прогностические факторы 3D-CRT при раке мочевого пузыря. С 1995 по 2007 год были ретроспективно проанализированы 109 пациентов с первичным раком мочевого пузыря. Средний возраст составлял 68 лет.Средняя общая доза 3D-CRT после ТУР составила 49,2 Гр (39,3-62,2 Гр). Уровень местного контроля через 1, 3 и 5 лет составил 63%, 47% и 42% соответственно. Общая выживаемость в течение 1, 3 и 5 лет составила 80%, 48% и 37% соответственно. Из 109 пациентов 33 умерли от прогрессирования опухоли или метастазирования. 42 показали местный рецидив, а 22 — метастазы в лимфатические узлы. Ранние урологические побочные эффекты, связанные с облучением 1, 2, 3 и 4 степени, составили 22, 59, 12 и 1% соответственно. Соответствующие поздние урологические побочные эффекты составили 29%, 28%, 2% и 1% соответственно.
IMRT
Turgeon et al. [24] сообщили о своем опыте лечения с сохранением мочевого пузыря с использованием IMRT для пожилых пациентов с MIBC. Подходили 24 пациента со средним возрастом 79 лет. ПР был подтвержден у 83% пациентов. Общая выживаемость и выживаемость в отношении рака через 3 года составили 61% и 71% соответственно. 75% выживших пациентов имеют здоровый и функционирующий мочевой пузырь. Только у 4% пациентов наблюдалась острая желудочно-кишечная или мочеполовая токсичность 3 степени, а острая гематологическая токсичность 3 или 4 степени, токсичность для печени или и то и другое наблюдались у 17% когорты.Ни у одного пациента не было желудочно-кишечной или мочеполовой токсичности 4 степени.
Hsieh et al. [25] обнаружили, что IMRT обеспечивает хорошую выживаемость без локорегионального прогрессирования, особенно в группе пожилых людей с раком мочевого пузыря. Средний возраст пациентов составлял 80 лет. Средняя выживаемость составила 21 месяц (от 5 до 26 месяцев). Из 19 подходящих пациентов у 17 (89,5%) не было местного рецидива. 2-летняя общая выживаемость для T3-T4 составила 35,4%.
По сравнению со стандартной CRT, методы IMRT дают даже лучшее формирование распределения дозы вокруг опухоли с потенциально большим снижением поздних эффектов нормальных тканей и / или большим увеличением контроля над опухолью.Meijer et al [26] сообщили о 20 пациентах с инвазивной карциномой мочевого пузыря T2-T4N0M0. Лечение IMRT переносилось очень хорошо; все пролеченные пациенты без перерыва выполняли предписанный режим. Токсичности 3 степени не наблюдалось. van Rooijen et al. [27] также упомянули аналогичный отчет с IMRT при раке мочевого пузыря, что статистически значимое снижение дозы в тонком кишечнике может быть достигнуто при одновременном покрытии обеих опухолей.
Однако потенциальный негатив IMRT включает увеличенное время, необходимое для доставки RT, и связанный с этим риск наполнения мочевого пузыря и изменения формы и размера мочевого пузыря.Недавно было продемонстрировано, что величина наполнения мочевого пузыря во время лечения составляет приблизительно 1 см 3 в минуту, но с широкими вариациями между пациентами [28]. Другим недостатком IMRT является увеличенное количество необходимых мониторных единиц (MU), что приводит к большей общей дозе на организм с потенциально повышенным риском вторичных злокачественных новообразований [29]. Тем не менее Рубен и др. [30] обнаружили, что влияние на индукцию вторичного рака за счет распределения низкой и средней дозы с IMRT невелико.Хотя IMRT увеличивает потребность в MU по сравнению с 3D-CRT, сообщается, что меньший размер поля и уменьшенная средняя интенсивность поля уменьшают разброс более чем в достаточной степени, чтобы компенсировать любое увеличение утечки головки.
Спиральная томотерапия (HT)
Спиральная томотерапия (HT), IMRT под визуальным контролем, разработанная в Университете Висконсина, США, обеспечивает высоко конформное распределение дозы по мишеням, одновременно с сохранением критических органов [25]. Было опубликовано несколько исследований, в которых ГТ сравнивалась с другими методами IMRT [31,32].Он вводит концепцию кольцевого гентри в RT с использованием комбинации мегавольтного компьютерного томографа и терапевтического линейного ускорителя [33]. Излучение испускается в виде веерного пучка линейным ускорителем, установленным на вращающемся гентри, и модулируется быстродействующим бинарным щелевым коллиматором с пневматическим приводом. Во время лечения пациента перемещают через отверстие гентри, в то время как гентри непрерывно вращается, что приводит к нанесению дозы по спирали. ГТ может обеспечить высоко конформное распределение дозы в различных местах для многих различных опухолевых образований [33-35].Помимо этих возможностей с точки зрения достижимого распределения дозы, HT предлагает уникальную систему управления изображением. Реализация кольцевого гентри позволила интегрировать визуализацию MV-CT. Благодаря форме и расположению опухоли мочевого пузыря подходят для ГТ.
Hsieh et al. [25] сообщили о своем клиническом опыте с пациентами с раком мочевого пузыря, получавшими IMRT или HT для сохранения органов, уделяя особое внимание выполнимости HT, клиническому исходу и ранней токсичности. Они включили 19 пациентов с раком мочевого пузыря, 9 в группу IMRT и 10 в группу HT.Пациенты получили 64,8 Гр в мочевой пузырь с одновременной химиотерапией или без нее. Средняя выживаемость составила 21 месяц. Актуарная 2-летняя общая выживаемость для групп IMRT и HT составила 26,3% против 37,5% соответственно; 2-летняя безрецидивная выживаемость составила 58,3% против 83,3% соответственно. Трое из 19 пациентов (16%) страдали анемией 3/4 степени, двое в группе IMRT и один в группе HT. ГТ показала статистически значимо лучшие результаты по сохранению органов.
Система HT со встроенным MV-CT позволяет лечить стандартные случаи превосходным способом, обрабатывать несколько целей быстрее, чем обычные методы, когда необходимо несколько целевых точек.В рамках одной процедуры удалось достичь высоко конформного распределения дозы для целей любого размера и для нескольких целей. Это было возможно, даже если желаемая иммобилизация была невозможна из-за ожирения, клаустрофобии, боли или неврологических нарушений. Для подтверждения этих предварительных результатов необходимо долгосрочное наблюдение.
Объемно-модулированная дуговая терапия (VMAT)
VMAT — это новый метод IMRT, позволяющий изменять мощность дозы, скорость вращения гентри и положения нескольких створок (MLC) во время вращения гентри на полные 360 °. градус дуги.Недавно он был введен в клиническую практику для сравнения с традиционными методами лучевой терапии при различных злокачественных новообразованиях, включая опухоли головного мозга, головы и шеи, простаты, анального канала и шейки матки [36–38]. В VMAT скорость гентри, положение MLC и мощность дозы динамически изменяются во время вращения гентри, обеспечивая быструю и высоко конформную доставку лечения [39]. RapidArc (Varian Medical Systems, Пало-Альто, Калифорния) использует алгоритм оптимизации, впервые описанный Отто, К. [40], для планирования VMAT. Эта технология недавно была внедрена в клиническую практику и становится все более широко применяемой в центрах лучевой терапии.Преимущество VMAT заключается в значительном сокращении количества МЕ с соответствующим сокращением времени лечения.
Foroudi et al. [37] сравнили вероятность осложнений 3D-CRT с контролем опухоли и нормальными тканями с планами IMRT и VMAT для 15 пациентов с раком мочевого пузыря T2-4N0M0. Среднее время планирования для 3D-CRT, IMRT и VMAT составляло 30,0, 49,3 и 141,0 минут соответственно. Средний индекс соответствия PTV (CI) для 3D-CRT, IMRT и VMAT составлял 1,32, 1,05 и 1,05. Индекс однородности PTV (HI) составил 0.080 для 3D-CRT, 0,073 для IMRT и 0,086 для VMAT. Вероятность опухолевого контроля и осложнений со здоровыми тканями у них была одинаковой. Среднее время проведения лечения составляло 2:25 мин (диапазон 2: 01-3: 09) для 3D-CRT; 4:39 мин (диапазон 3: 41-6: 40) для IMRT; и 1:14 мин (диапазон 1: 13–1: 14) для VMAT. VMAT обеспечивает более быстрое время доставки, чем 3D-CRT и IMRT. Cozzi et al. [38] обнаружили, что RapidArc улучшает однородность дозы и щадит прямую кишку, мочевой пузырь и тонкую кишку в области средних и высоких доз.Ожидается, что улучшенное сохранение костной ткани мочевого пузыря, прямой кишки и таза при средних и высоких дозах с использованием VMAT по сравнению с IMRT приведет к дальнейшему снижению острой и поздней токсичности, особенно для пациентов, которым требуется местная стимуляция и одновременная / последовательная химиотерапия.
Ряд исследований на других участках опухоли показал, что VMAT приводит к аналогичному качеству плана со значительным сокращением времени лечения по сравнению с IMRT [40,41]. Учитывая преимущества с точки зрения сокращения MU, а также времени лечения, VMAT представляется идеальной технологией для использования с ежедневной лучевой терапией с визуальным контролем или адаптивной лучевой терапией для MIBC.Это сокращение времени проведения лечения имеет клиническое значение с точки зрения комфорта пациента и инфрафракционного движения. Более быстрые роды могут улучшить приверженность пациента лечению и уменьшить внутрифракционные движения. Кроме того, более высокая эффективность доставки также дала больше времени для проведения лучевой терапии под визуальным контролем, что еще больше снизило границы лечения и токсичность. В настоящее время в литературе очень мало информации об оптимальном планировании мочевого пузыря с использованием VMAT. Клиническое значение этих различий в отношении дозиметрии и эффективности доставки излучения требует дальнейшего изучения.
Адаптивная лучевая терапия (ART)
Адаптивная лучевая терапия — один из новых подходов, в которых широко используются новые технологии. Обычно это определяется как использование высококачественных изображений пациента, полученных во время или непосредственно перед проведением лечения, для изменения планов лечения и, таким образом, для устранения вариаций лечения, вызванных движением органов. Методы как автономной АРТ, где единый адаптивный план лечения создается с использованием различных повторных компьютерных томографий (КТ) или конусно-лучевой компьютерной томографии (КЛКТ); и онлайн-АРТ, где ежедневный план лечения выбирается из библиотеки заранее запланированных планов лечения на основе изображений КЛКТ [42,43].Первый из них является распространенной стратегией при раке головы и шеи, когда могут потребоваться сложные решения и полная перепланировка [44]. В последнем случае изображения используются напрямую не только для перемещения пациента в правильное положение, но и для воздействия на план лечения, выполняемый в этот день. Стратегии адаптивного лечения рака мочевого пузыря изучались несколькими исследовательскими группами [42-45].
Foroudi et al. [42] пришли к выводу, что автономная стратегия адаптивного лечения дает более высокий индекс соответствия и улучшает охват дозы клинического целевого объема (CTV) по сравнению с традиционным планированием.Группа NKI сообщила о 21 пациенте с одиночным раком мочевого пузыря T1-T4N0M0, получавшем автономную адаптивную лучевую терапию с использованием повторной КТ [45]. Оффлайн адаптивная процедура оказалась эффективной, объемы лечения сократились на 40%.
Несколько групп продемонстрировали, что лучевая терапия рака мочевого пузыря дает значительную пользу от онлайн-адаптивной лучевой терапии [45–48]. Из-за ежедневных колебаний объема мочевого пузыря можно подготовить планы для разных размеров мочевого пузыря и выбрать наиболее подходящий план для пациента, который он / она представляет в этот день.Планы могут быть подготовлены либо с заранее определенными границами, либо на основе результатов ежедневной объемной визуализации в течение первой недели лечения [48,49]. Перед доставкой каждой фракции медицинский персонал выбирает лучший план на основании объемной визуализации на месте, такой как КЛКТ.
Было проведено сравнение адаптивного и традиционного лечения на основе охвата CTV и сохранения нормальных тканей [48]. 27 пациентов с переходно-клеточной карциномой мочевого пузыря Т2-4 лечили ежедневной онлайн-адаптивной лучевой терапией под контролем изображений с использованием КЛКТ.Средний объем нормальной ткани, получившей дозу> 45 Гр, составил 29%, что меньше при адаптивной лучевой терапии по сравнению с традиционной лучевой терапией. Средний объем нормальной ткани, получающей> 5 Гр, был на 15% меньше при адаптивной лучевой терапии по сравнению с традиционной лучевой терапией. Онлайн-адаптивная лучевая терапия возможна в академическом центре лучевой терапии. Объем облучаемой нормальной ткани может быть значительно меньше без уменьшения охвата CTV.
Вестергаард и др. [46] сравнили потенциал сохранения нормальной ткани двух стратегий АРТ: выбор ежедневного плана (PlanSelect) и повторная оптимизация ежедневного плана (ReOpt).В исследование были включены семь пациентов с раком мочевого пузыря. Для стратегии PlanSelect была создана библиотека из трех планов для конкретного пациента, и был выбран наиболее подходящий план, основанный на КЛКТ до лечения. Для ежедневной стратегии ReOpt планы были повторно оптимизированы на основе CBCT для каждой дневной фракции. Были рассчитаны распределения накопленных доз для стратегий АРТ, а также для неадаптивной ЛТ. По сравнению с неадаптивной лучевой терапией объем приема более 57 Гр (что соответствует 95% предписанной дозы) был уменьшен до 66% (диапазон 48-100%) для PlanSelect и до 41% (диапазон 33-50%) для ReOpt.Это исследование продемонстрировало значительный потенциал АРТ в сохранении нормальных тканей при облучении мочевого пузыря с явно лучшими результатами при ежедневной адаптивной повторной оптимизации.
McDonald et al. [50] оценили целевой охват и сохранение нормальных тканей при АРТ. Конформные планы были разработаны для 25 пациентов. Средний охват клинического целевого объема 95% изодозой составил 99%. Среднее уменьшение объема нормальной ткани, обработанной до 95% предписанной дозы, составило 219 см 3 по сравнению с предыдущим институциональным стандартным подходом.Хорошее соответствие в выборе плана показано с клинической реализацией адаптивной стратегии. Адекватный охват цели был достигнут за счет уменьшения объема нормальной ткани, облученной высокой дозой, по сравнению с предыдущим стандартным подходом.
В попытке свести к минимуму радиационно-индуцированный побочный эффект на нормальные ткани, АРТ стала альтернативным методом традиционной лучевой терапии. Влияние АРТ на сохраненный объем кишечника при выбранном уровне дозы определяется и сравнивается с традиционной неадаптивной лучевой терапией с постоянными границами на основе единственного набора изображений для планирования лечения.Кроме того, покрытие CTV сравнивается между адаптивными и неадаптивными методами, чтобы получить уверенность в том, что вы не пропустите цель при внедрении более сложных адаптивных процедур в повседневную практику RT. Стратегия обеспечивает адекватный охват цели с соответствующим сокращением облучения нормальных тканей. Используя опубликованные данные о зависимости токсичности тонкой кишки от дозы и объема [51], можно оценить, что вероятность острой желудочно-кишечной токсичности (диареи) степени ≥ 2, требующей частого приема лекарств, снизилась с 35% до минимума. 7% в среднем.Чтобы продемонстрировать клиническую значимость АРТ в лечении рака мочевого пузыря и снижении острой токсичности кишечника, потребуется долгосрочное тщательное наблюдение и большее количество пациентов.
Брахитерапия
Брахитерапия, как альтернатива лечению с использованием внешнего луча (ДЛТ), позволяет локально доставить высокую дозу излучения в небольшую область мочевого пузыря с относительной щадью остальной стенки мочевого пузыря и ближайших органов. соседство, такое как тонкий кишечник.
Несколько онкологов-радиологов сообщили о хороших результатах сочетания ограниченного хирургического вмешательства после дистанционной лучевой терапии (ДЛТ) с последующей брахитерапией при МИРМР [52-56]. Koning et al. [52] собрали данные из 12 из 13 отделений в многоцентровой базе данных, в результате чего получено около 1040 пациентов: 811 мужчин и 229 женщин со средним возрастом 66 лет (диапазон 28-92 года). Результаты были проанализированы в зависимости от стадии и диаметра опухоли, степени гистологии, возраста и техники брахитерапии, мощности непрерывной низкой дозы (CLDR) и мощности импульсной дозы (PDR).Через 1, 3 и 5 лет местная безрецидивная выживаемость составила 91%, 80% и 75%, выживаемость без метастазов составила 91%, 80% и 74%, выживаемость без признаков заболевания составила 85%, 68% и 61%. % и общая выживаемость составила 91%, 74% и 62% соответственно.
Де Неве и др. [54] сообщили о результатах 32 пациентов, отобранных для имплантации в ретроспективном исследовании. Схема лечения включала внешнюю лучевую терапию с дозой 12 Гр в двух-трех фракциях с последующей имплантацией от 4 до 6 игл, заполненных цезием, в опухоль под общей или спинальной анестезией.Доза брахитерапии составила в среднем 53 Гр. Эту группу пациентов ретроспективно сравнивали с пациентами со стадией T1 и T2, получавшими радикальную лучевую терапию или предоперационную лучевую терапию и цистэктомию. Выживаемость, связанная с раком мочевого пузыря, увеличилась до 76% в группе брахитерапии по сравнению с 50% и 49% в двух других группах.
В заключение, EBRT с последующей брахитерапией в сочетании с ограниченным хирургическим вмешательством предлагает отличные результаты с точки зрения сохранения мочевого пузыря для отдельных групп пациентов, страдающих от рака мочевого пузыря.
Доза и фракционирование
Режимы, наиболее часто используемые при традиционном лечении всего мочевого пузыря, составляют 60-66 Гр на 30-33 фракции [57,58]. В обзоре, проведенном в Нидерландах [59], подчеркивается важность лечебной дозы, при которой увеличение конечной дозы ЛТ на 10 Гр приводит к увеличению примерно на 50% скорости местного контроля за три года. Увеличение дозы облучения с использованием обычного фракционирования приводит к повышенной токсичности для нормальных тканей, особенно желудочно-кишечного тракта, и может увеличивать продолжительность лечения.Попытки увеличить доставляемую эффективную дозу облучения, таким образом, были больше сосредоточены на интенсификации дозы с использованием ускоренного гиперфракционирования.
Ускоренное гиперфракционированное фракционирование
Ускоренное ОТ подразумевает введение того же количества фракций за более короткий период времени, другими словами, эквивалентную более высокую общую дозу [60].
Польский научно-исследовательский институт оценил токсичность, клиническую эффективность и выживаемость ТУР, неоадъювантной химиотерапии и ускоренной гиперфракционированной лучевой терапии у пациентов с MIBC [61].В период с 2004 по 2009 год 35 пациентов с гистологически доказанной инвазивной карциномой мочевого пузыря (T2-T4aN0-1M0) были отобраны для протокола сохранения мочевого пузыря. Общая актуарная выживаемость через 3 и 5 лет составила 75% и 66% соответственно. Актуарные коэффициенты выживаемости по конкретным заболеваниям через 3 и 5 лет составили 81% и 71% соответственно.
Явуз и др. [62] оценили токсичность и клиническую эффективность ускоренной суперфракционированной лучевой терапии при местно-инвазивной карциноме мочевого пузыря.Отобрано 87 пациентов (неподходящих или отказывающихся от цистэктомии) с инвазивным раком мочевого пузыря. Первоначально весь таз обрабатывался обычными ежедневными фракциями по 1,8 Гр до общей дозы 45 Гр. Небольшое усиление поля, охватывающее грубое заболевание, было добавлено в качестве второй суточной фракции (1,5 Гр) в течение последних 3 недель 5-недельного графика до общей дозы 67,5 Гр. Межфракционный интервал составлял минимум 6 ч. Трехлетний актуарный местный контроль, дистанционный контроль болезни, выживаемость по конкретным причинам и общая выживаемость составили 64%, 78%, 58% и 46% соответственно.Для стадий T2 и T3 уровень местного контроля за 3 года составил 77% и 48% соответственно.
Гипофракционированная
Гипофракционированная ЛТ, которая состоит из введения более крупных суточных фракций (обычно от 2,5 Гр до 6 Гр). В одном исследовании оценивалась острая токсичность и смягчение симптомов еженедельного гипофракционированного режима 3D-CRT в качестве радикального лечения пожилых пациентов с раком мочевого пузыря с ограниченным органом [63] (). В период с 2005 по 2011 год 58 пациентов, у которых был диагностирован рак мочевого пузыря, проходили лечение внешней 3D-CRT.Все кандидаты были неоперабельны по состоянию здоровья, с плохой успеваемостью и в возрасте от 75 до 88 лет. Была назначена доза 36 Гр за 6 недельных фракций. Острая желудочно-кишечная токсичность составила 13/58 (22,4%) и 5/58 (5,6%) для I и II степени соответственно. Острая мочеполовая токсичность составила 19/58 (32,7%) и 10/58 (17,2%) для I и II степени соответственно. Что касается клинического исхода, 55/58 пациентов (94,8%) сообщили о паллиативном эффекте гематурии, а 19 из 58 сообщили об отсутствии изменений частоты и дизурии.Все пациенты сообщили о значительном уменьшении боли (P <0,01) относительно оценки визуального аналога до и после лучевой терапии. Средняя выживаемость без прогрессирования составила 14 месяцев.
Таблица 2
Гипофракционированная лучевая терапия при раке мочевого пузыря
(1997)| Исследование | Пациенты (n) | Стадия | Лечение (Гр) | Результат |
|---|---|---|---|---|
| 65 | T2-T4 | 30 Гр / 5F (n = 53) | OS 9 месяцев | |
| 36 Gy / 6F (n = 12) | ||||
| Turgeon et al.(2008) | 24 | T2-T3 | 50 Гр / 20F | 3-летняя ОС 61% |
| 3-летняя DSS 71% | ||||
| Кулулиас и др. (2013) | 58 | T1-T2 | 36 Гр / 6F | PFS 14 месяцев |
| Fosså et al. (1991) | 39 | T4 | 30 Гр / 10F | OS 7,5 месяцев |
| Salminen et al. (1992) | 94 | T1-T4 | 30 Гр / 6F | DSS 13.3 месяца |
| 5-летняя ОС 13% |
McLaren et al. [64] сообщили об исследовании 55 пожилых пациентов (средний возраст 78 лет), чтобы свести к минимуму острые радиационные эффекты и максимизировать переносимость и удобство пациента в этой слабой группе, которые подвергались еженедельной схеме с 6 Гр за сеанс, в то время как общая доза варьировалась от 30 -36 Гр. Всего 13% пациентов заметили улучшение через 1 месяц. 92% пациентов с гематурией были полностью освобождены от лечения по сравнению с только 24% пациентов с дизурией и частой дизурией.Средняя общая выживаемость составила всего 9 месяцев (от 2 до 41 месяца). Острая токсичность 3 степени, связанная с лечением мочевыводящих путей и кишечника, зарегистрирована у 18% и 9% пациентов.
Turgeon et al. [24] сообщили, что в исследование были включены 24 пациента со средним возрастом 79 лет. Общая выживаемость и выживаемость в отношении рака через 3 года составили 61% и 71% соответственно. 75% выживших пациентов имеют здоровый и функционирующий мочевой пузырь. Возможно введение гипофракционированной ЛТ в мочевой пузырь с приемлемым уровнем острой токсичности в группе пациентов с плохим прогнозом.
Лучевая терапия и химиотерапия
Эффективные химиотерапевтические агенты, действующие на местном уровне как радиосенсибилизаторы (и системно за счет предотвращения метастатического роста), имеют основополагающее значение для органосохраняющего подхода. Цисплатин сам по себе или в комбинации был наиболее часто используемым радиосенсибилизатором [65], в то время как паклитаксел и гемцитабин недавно были добавлены к выбору химиотерапевтических агентов. Химиотерапия пытается устранить местное и системное заболевание и усилить эффект ЛТ на локорегиональный контроль ().
Таблица 3
Радикальная лучевая терапия или радиохимиотерапия при инвазивном раке мочевого пузыря
| Исследование | Пациенты (n) | Стадия | Экспериментальная группа | Контрольная группа | 3-5 лет OS (%) | DSS на 3-5 лет (%) |
|---|---|---|---|---|---|---|
| Rödel et al. (2002) | 415 | T1-T4 | TUR + RCT (DDP / CBP / PF) n = 289 | TUR + RT n = 126 | 51 | 56 |
| Atasoy et al.(2014) | 26 | T2-T4a | RCT (GEM) | 58,5 | 59,5 | |
| James et al. (2012) | 360 | T2-T4a | РКИ (MMC + 5Fu) n = 182 | Только RT n = 178 | 48 VS. 35 | |
| Choudhury et al. (2011) | 50 | T2-T3 | RCT (GEM) | 75 | 82 | |
| Mitin et al. (2013) | 93 | T2-T4a | TUR + RCT (DDP + TAX) + GTP n = 46 | TUR + RCT (DDP + 5Fu) + GTP n = 47 | 71 VS.75 | |
| Hoskin et al. (2010) | 333 | T1G3-T4a | РКИ (CON) n = 168 | Только RT n = 165 | 59 VS. 46 | |
| Kaufman et al. (2000) | 34 | T2-T4a | TUR + RCT (PF) | 83 | ||
| Nowak-Sadzikowska et al. (2013) | 35 | T2-T4a | TUR + NEO (GP / GC) + RT + DDP | 75 VS.66 | 81 В.С. 71 |
Сопутствующая химиотерапия может повысить чувствительность опухолей мочевого пузыря и повысить ответ. Улучшенный местный контроль снизит потребность в цистэктомии и добавит возможности для сохранения мочевого пузыря, а преимущество выживания комбинированной химиотерапии с метотрексатом, винбластином, адриамицином и цисплатином (MVAC) было зарегистрировано в рандомизированном исследовании фазы III [66]. MVAC в течение многих лет был предпочтительным режимом; однако у пациентов наблюдались высокие уровни токсичности.В новых режимах химиотерапии была сделана попытка предложить аналогичную или лучшую эффективность с точки зрения общей выживаемости, скорости ответа и времени до прогрессирования заболевания при одновременном снижении токсичности.
В британском многоцентровом исследовании III фазы 360 пациентам с МИРМ была проведена лучевая терапия с синхронной химиотерапией или без нее [1]. Схема включала фторурацил во время фракций с 1 по 5 и с 16 по 20 лучевой терапии и митомицин C в день 1. Через 2 года показатели локально-региональной выживаемости без признаков заболевания составили 67% в группе химиолучевой терапии и 54% в группе лучевой терапии.Пятилетняя общая выживаемость составила 48% в группе химиолучевой терапии и 35% в группе лучевой терапии. Нежелательные явления 3 или 4 степени встречались несколько чаще в группе химиолучевой терапии, чем в группе лучевой терапии во время лечения (36,0% против 27,5%, P = 0,07), но не во время последующего наблюдения (8,3% против 15,7%, P = 0,07). ).
В исследовании RTOG 0233 оценивалась эффективность, безопасность и переносимость паклитаксела или фторурацила при добавлении к лучевой терапии плюс цисплатин с последующей адъювантной химиотерапией для пациентов [67].Девяносто три пациента с переходно-клеточной карциномой T2-4a были случайным образом распределены в группы, получавшие паклитаксел плюс цисплатин (группа паклитаксела) или фторурацил плюс цисплатин (группа фторурацила). Всем пациентам была проведена ТУР и лучевая терапия два раза в день до 40,3 Гр вместе с назначенной химиотерапией с последующей цистоскопической и биопсийной оценкой ответа. Пациенты, у которых был ответ опухоли с понижением стадии, получали консолидирующую химиолучевую терапию до 64,3 Гр с тем же режимом химиотерапии. Если после индукционной химиолучевой терапии опухоль имела стадию T1 или хуже, рекомендовалась цистэктомия.Из 46 пациентов в группе паклитаксела 31 завершил полный протокол адъювантной химиотерапии. Из 47 пациентов в группе фторурацила 25 полностью выполнили протокол. 5-летняя общая выживаемость составила 71% в группе паклитаксела и 75% в группе фторурацила. Пятилетняя выживаемость без повреждения мочевого пузыря составила 67% в группе паклитаксела и 71% в группе фторурацила. В целом, это рандомизированное исследование показало, что цисплатин с паклитакселом или фторурацилом в сочетании с лучевой терапией дает хорошие результаты с точки зрения борьбы с раком и сохранения мочевого пузыря.
Испытание фазы II оценило ответ МИРБХ на одновременную химиолучевую терапию гемцитабином еженедельно с 4-недельной лучевой терапией [68]. Было набрано 50 пациентов с переходно-клеточной карциномой на стадии T2-3N0M0 после ТУР и магнитно-резонансной томографии. Все пациенты завершили лучевую терапию, 46 пациентов перенесли все четыре цикла гемцитабина. 47 пациентам была выполнена цистоскопия после лечения, у 44 (88%) был достигнут полный эндоскопический ответ. При среднем сроке наблюдения 36 месяцев 36 пациентов были живы, и у 32 из них был функциональный и неповрежденный мочевой пузырь.Используя анализ Каплана-Мейера, 3-летняя выживаемость в отношении рака составила 82%, а общая выживаемость — 75%. Аналогичным образом Atasoy et al. [69] сообщили, что для определения эффективности и токсичности низких доз гемцитабина еженедельно с лучевой терапией было набрано 26 пациентов. Медиана наблюдения составила 51 месяц (диапазон 14–118 месяцев). Уровень CR составил 62,5%. Пятилетняя локальная выживаемость без прогрессирования, выживаемость при конкретном заболевании и общая выживаемость составили 40,6%, 59,5% и 58,5% соответственно.
Альтернативным подходом к радиосенсибилизации может быть лечение гипоксии опухоли, как сообщалось в другом исследовании фазы III в Соединенном Королевстве [70].В этом исследовании 333 пациента были случайным образом распределены для прохождения либо только лучевой терапии, либо одновременной лучевой терапии никотинамидом и карбогеном. Анализ первичного результата 3-летней локорегиональной безрецидивной выживаемости не имел статистической значимости (54% для комбинированной терапии против 43% для одной лучевой терапии; отношение рисков 0,88; 95% доверительный интервал от 0,76 до 1,01; P = 0,06) , хотя сообщалось о значительном улучшении 3-летней общей выживаемости (59% для комбинированной терапии против 46% для одной только ЛТ; отношение рисков 0,86; 95% ДИ 0,74 до 0.99; P = 0,04). При комбинированной терапии не отмечалось увеличения частоты острых токсических эффектов.
Качество жизни (QoL)
Радикальная цистэктомия считается золотым стандартом лечения инвазивного рака мочевого пузыря. Хотя количество осложнений и смертность снизились благодаря прогрессу в хирургических техниках и периоперационном уходе за пациентами, операция может снизить качество жизни (QoL) [71,72]. Утрата функции мочевого пузыря может считаться одним из основных видов увечий [73,74].Поэтому многие пациенты испытывают сильное беспокойство по поводу удаления мочевого пузыря. Терапия по сохранению мочевого пузыря предлагает лечебный вариант для пациентов, по состоянию здоровья не пригодных для радикального хирургического вмешательства, и альтернативное консервативное лечение для отдельных пациентов, которые являются потенциальными кандидатами на цистэктомию. Лагранж и др. [75] оценили сохранение и функциональное качество мочевого пузыря после одновременной химиолучевой терапии MIBC у 53 пациентов. Облучение таза дало 45 Гр, после чего следовало усиление на 18 Гр.Пациентам, первоначально подходящим для операции, была проведена макроскопически полная ТУР через 45 Гр с последующей радикальной цистэктомией в случае неполного ответа. Опросник, конкретные вопросы о функции мочевого пузыря и поздних эффектах в нормальных тканях, использовались для оценки качества жизни до лечения и через 6, 12, 24 и 36 месяцев после лечения. Медиана наблюдения составила 8 лет. Мочевой пузырь сохранился у 67% пациентов. Удовлетворительная функция мочевого пузыря была отмечена у 100% пациентов с сохраненным мочевым пузырем и местно контролируемым заболеванием через 6-36 месяцев после начала лечения.Удовлетворительная функция мочевого пузыря была отмечена у 35% пациентов до лечения и у 43%, 57% и 29%, соответственно, через 6, 18 и 36 месяцев.
В исследовании с долгосрочным наблюдением (медиана 6,3 года) оценивали качество жизни и функцию мочевого пузыря с помощью уродинамики [76]. Они обследовали 71 выжившего пациента, получавшего терапию по сохранению мочевого пузыря, 75% пациентов сохранили нормальную функцию мочевого пузыря. Проблемы с мочеиспусканием были зарегистрированы у 6% пациентов, позывы к мочеиспусканию — у 15% и подтекание мочи — у 19%.
Эта проспективная оценка поддерживает опубликованные ретроспективные данные, свидетельствующие о хорошем качестве жизни у пациентов с инвазивным раком мочевого пузыря, которым удалось сохранить мочевой пузырь после ТУР и одновременной химиолучевой терапии.
Паллиативная лучевая терапия
Короткие курсы гипофракционированных режимов использовались для смягчения местных симптомов, поскольку многие фракции обременительны для пациентов. В публикации «Улучшение результатов при урологическом раке», опубликованной Национальным институтом клинического мастерства, говорится, что паллиативная помощь является неотъемлемой частью ведения пациентов с урологическим раком и должна быть доступна при необходимости для обеспечения контроля симптомов, а также социальной, духовной и психологической поддержки [ 77].
В исследовании оценивалась краткосрочная и среднесрочная клиническая эффективность ЛТ для достижения гемостаза у пациентов с макрогематурией, связанной с раком мочевого пузыря, которые были непригодны для хирургического вмешательства [78]. Тридцать два пациента были включены в гемостатическую лучевую терапию. Стандартное лечение составляло 30 Гр за 10 фракций в течение 2 недель. Более тяжелые пациенты подвергались гипофракционному режиму с дозой 20 Гр за 5 фракций в течение одной недели. Через 2 недели у 69% пациентов не было гематурии. Анализ подгрупп показал, что 79% пациентов, перенесших гипофракционированный режим, не имели гематурии.В общей сложности у 54% пациентов при стандартном режиме гематурия не наблюдалась. В зависимости от стадии опухоли гематурия контролировалась через 2 недели для 57% опухолей без инвазии в мышцу и 72% опухолей с инвазией в мышцы. Через 6 месяцев у 69% пациентов возник рецидив, независимо от стадии опухоли или схемы лечения.
McLaren et al. [79] сообщили о влиянии 36 Гр на 6 фракций у 65 пациентов, не подходящих для хирургического вмешательства. Паллиативность была достигнута у 52% пациентов. Подобные результаты были подтверждены в исследовании Salminen, в котором участвовали 94 пациента с симптомами, получавших 30 Гр в 6 фракциях по 2 фракции в неделю.Боль уменьшилась у 68%, а неотложность позывов — у 55% пациентов [80]. Однако менее обнадеживающие результаты были достигнуты в проспективном исследовании Fosså et al. [81], включая в основном пациентов с опухолями Т4 и сопутствующими отдаленными метастазами, с использованием 30 Гр в 10 фракциях. Мы посчитали, что разница заключалась в том, что в последнем случае у большинства пациентов был рак на поздней стадии и отдаленные метастазы. Паллиативное лечение должно обеспечивать правильный баланс между эффективностью, удобством, токсичностью и продолжительностью.
Выводы
Во всех органосохраняющих методах лечения ЛТ остается основной частью местного лечения. С дальнейшим развитием как лучевой терапии, так и других методов в этих программах, в ближайшем будущем, возможно, станет возможным предложить избранным пациентам комплексное консервативное лечение, которое приведет к хорошей долгосрочной функции мочевого пузыря и низким показателям спасительной цистэктомии. важно для пожилых, относительно ослабленных групп пациентов.
Последние достижения в области планирования, проверки и проведения лучевой терапии предлагают возможность преодолеть препятствия, которые ранее ограничивали достижение лучевой терапии мочевого пузыря.Современные методы, использующие HT, VMAT и ART, позволяют увеличить дозу до целевых показателей лечения с более низкими дозами для нормальных окружающих тканей и, как следствие, меньшей токсичностью, связанной с лечением. Преимущество уменьшения объема облучаемой нормальной ткани позволит клиницистам повысить эффективность ЛТ за счет увеличения дозы облучения, изучения интенсивного фракционирования и комбинированных схем с системной терапией.
Улучшение качества жизни с сохранением органов является важным аспектом для пациентов с раком мочевого пузыря.Были применены новейшие современные технологии для улучшения качества жизни при достижении сопоставимого долгосрочного выживания. Оптимизация проведения лучевой терапии в сочетании с новыми системными методами лечения может позволить в будущем улучшить и принять стратегию сохранения органов для большего числа пациентов с раком мочевого пузыря. Эти стратегии требуют полного сотрудничества урологов, радиологов и медицинских онкологов.
Как мы лечим рак мочевого пузыря — Институт рака Дана-Фарбер
Вы можете быть уверены в лечении в Центре мочеполовой онкологии Lank при Дана-Фарбер / Бригам и в женском онкологическом центре (DF / BWCC), поскольку наши специалисты специализируются исключительно на раке мочеполовой системы.Если вам нужна операция, лучевая терапия или химиотерапия, вы встретитесь со специалистами в каждой области, которые занимаются конкретно раком мочевого пузыря. По этой причине пациенты с раком мочевого пузыря со всей страны обращаются за лечением в DF / BWCC. Исследования показали, что у пациентов выше показатели выздоровления и выживаемости. которые проходят лечение в комплексном медицинском центре с многопрофильной командой экспертов, как в Lank Center.
Для лечащих врачей
Поскольку лечащий врач пациента или общественный специалист является неотъемлемой частью команды по уходу за пациентом, мы стремимся сотрудничать в уходе за вашим пациентом.
Если вы врач и у вас есть пациент с раком мочевого пузыря, мы будем рады сотрудничать с вами.
Узнать больше о как направить пациента в DF / BWCC.
Узнать о Physician Gateway, наш портал, который помогает вам отслеживать пациентов, которых вы направили на лечение. Physician Gateway доступен для поставщиков первичной медико-санитарной помощи, направляющих поставщиков и сотрудников вашего уполномоченного офиса.
Междисциплинарный подход
Наши клинические группы и группы поддержки работают не только для лечения вашего рака; они здесь, чтобы заботиться о вас.Мы составляем индивидуальный план для каждого пациента и учитываем все аспекты вашего здоровья при составлении рекомендаций.
В нашу многопрофильную команду входят опытные урологи, медицинские онкологи, онкологи-радиологи, радиологи, патологи, исследователи, медсестры, фельдшеры и социальные работники, которые лечат, консультируют и заботятся о каждом пациенте с самоотдачей. и сострадание. У вас есть преимущество в том, что вы можете встретиться со всей медицинской бригадой за одно посещение. Ваша команда также будет регулярно встречаться, чтобы обсудить ваше здоровье и варианты лечения и убедиться, что вы получите наилучшее обслуживание.
Начиная с вашего первого приема, наши медсестры проведут вас через весь процесс лечения, убедившись, что вы знаете, чего ожидать и где найти полезные ресурсы, такие как консультации, советы по питанию или паллиативная помощь. Кроме того, каждый У пациента есть личный социальный работник, который предоставит дополнительную поддержку и руководство.
Лечение рака мочевого пузыря по стадиям
В зависимости от того, насколько распространился рак, вам может быть назначено одно лечение или комбинация методов лечения.Лечение во многом зависит от стадии и распространения заболевания, но перед лечением всегда учитываются ваше общее состояние здоровья и возраст.
- Если вам поставлен диагноз стадия 0 или стадия I рака мочевого пузыря (поверхностный) , ваше лечение, вероятно, будет включать иммунотерапию для лечения внутренней части мочевого пузыря. Минимальная операция также может быть частью вашего плана лечения. В редких случаях рекомендуется химиотерапия или лучевая терапия.
- При раке мочевого пузыря II стадии (мышечно-инвазивном и локализованном) хирургическое вмешательство, как правило, является первой линией лечения.Облучение также рассматривается, если опухоль не распространилась или вы не можете перенести операцию. Химиотерапия может быть предложена в некоторые случаи.
- Если вам поставлен диагноз рак мочевого пузыря III стадии (мышечно-инвазивный и запущенный) , хирургическое вмешательство и химиотерапия являются основными формами лечения. Химиотерапия может быть предложена до или после операции, а лучевая терапия используется при случай.
- Лечение стадии IV (метастатического) рака мочевого пузыря обычно состоит из химиотерапии, клинических испытаний или их комбинации.Операция может быть выполнена для удаления пораженных лимфатических узлов или облегчения симптомов поздней стадии болезнь. На этом этапе также может быть назначена лучевая терапия для облегчения боли и облегчения симптомов.
Активное наблюдение
Активное наблюдение (также известное как «бдительное ожидание») является важной частью любого плана лечения пациентов с раком мочевого пузыря. Рак мочевого пузыря имеет тенденцию возвращаться, даже если рак находится на ранней стадии или неинвазивный диагноз. По этой причине многие пациенты пройдут первоначальное лечение, а затем будут тщательно контролироваться врачами по окончании лечения.Врачи будут внимательно следить за мочевыводящими путями без лечения пациента, периодического взятия биопсии и рекомендаций иммунотерапевтического лечения. чтобы держать рак в страхе. Активное наблюдение всегда является частью любого плана после лечения.
Хирургия
Хирургические подходы к лечению рака мочевого пузыря включают:
- Трансуретральная резекция опухоли мочевого пузыря (TURBT) : используются специальные инструменты, прикрепленные к цистоскопу, чтобы вырезать опухоль и удалить ее с помощью электрического устройства для прижигания или лазера.
- Сегментарная цистэктомия или частичная цистэктомия : удаляет только ту часть мочевого пузыря, которая содержит раковые клетки.
- Радикальная цистэктомия при распространенном раке мочевого пузыря : Удаляет мочевой пузырь, близлежащие лимфатические узлы и органы, содержащие раковые клетки. У мужчин радикальная цистэктомия удаляет мочевой пузырь и семенные пузырьки. У женщин радикальная цистэктомия удаляет матка, яичники и часть влагалища.
- Роботизированная радикальная цистэктомия : использует сочетание 3D-увеличения высокой четкости, роботизированной технологии и миниатюры инструменты для повышения квалификации хирурга-уролога при удалении злокачественного мочевого пузыря.
- Недержание мочи, также называемое уростомией. : Создает новое отверстие для мочеиспускания с помощью мешка, который надевается на внешнюю сторону вашего тела для сбора мочи.
- Континентальный отвод мочи : Создает новый мочевой пузырь, чтобы вы могли контролировать, когда моча покидает ваше тело, и вам не нужно носить сумку.
Химиотерапия
Медицинские онкологи — это врачи, которые изучают раковые опухоли и проводят химиотерапию (препараты, которые уничтожают раковые клетки или останавливают их деление).Врачи-онкологи DF / BWCC предлагают наиболее эффективные методы лечения, помогая при этом поддерживать ваш качество жизни во время лечения. Онкологи-медики и исследователи DF / BWCC постоянно тестируют и изучают новые комбинации химиотерапевтических препаратов для улучшения результатов, уменьшения побочных эффектов и замедления роста или рецидива опухоли.
Химиотерапия при раке мочевого пузыря может проводиться на любой стадии заболевания, чтобы контролировать опухоль или облегчить хирургический процесс. Химиотерапию можно использовать до или после операции или в сочетании с лучевой терапией, чтобы сохранить мочевой пузырь.Он также используется в сочетании с хирургическим вмешательством, когда рак имеет высокий риск распространения. Однако химиотерапия обычно предназначена для пациентов с раком мочевого пузыря с мышечно-инвазивным раком мочевого пузыря или на поздних стадиях заболевания, при котором рак распространился. к другим частям тела.
В клинике Дана-Фарбер проводится химиотерапия. Центр лечения рака Yawkey, один из самых современных амбулаторных онкологических центров в стране, разработанный пациентами для пациентов.
Иммунотерапия
Иммунотерапия — это метод лечения, который использует иммунную систему пациента для борьбы с раковыми клетками.Вещества, производимые организмом или в лаборатории, могут использоваться для усиления, стимулирования или восстановления защиты иммунной системы пациента от рака.
Иммунотерапия обычно рекомендуется при раннем поверхностном раке мочевого пузыря. В стандартном иммунотерапевтическом лечении поверхностного рака используются бактерии Bacillus Calmette-Guerin (BCG). В этих случаях раковые клетки удаляются со стенки мочевого пузыря, и мочевой пузырь наполнен раствором БЦЖ. Этот раствор вызывает иммунный ответ, который разрушает раковые клетки.БЦЖ — чрезвычайно эффективное средство, препятствующее распространению или возвращению рака. Степень успеха этого типа иммунотерапии выше 70 процентов. При редких или запущенных стадиях рака мочевого пузыря иммунотерапия также может быть рекомендована в качестве клинического испытания.
Клинические испытания
DF / BWCC предлагает одну из крупнейших и наиболее активных доступных программ клинических испытаний, включая клинические испытания для пациентов с раком мочевого пузыря. Мы увлечены открытием и предложением новых возможностей для пробных версий, которых нет ни в одном другом магазине. комплексный онкологический центр.Мы предлагаем широкий спектр клинических испытаний новых методов лечения рака мочевого пузыря на всех стадиях. Клинические испытания, проведенные в DF / BWCC, оказали сильное влияние на тип медицинской помощи, оказываемой во всем мире.
Для некоторых пациентов с распространенным раком мочевого пузыря участие в клинических испытаниях является лучшим вариантом лечения. Хотя есть возможности для клинических испытаний на ранних и поздних стадиях заболевания, их чаще всего предлагают на поздних стадиях. рака мочевого пузыря. Однако наши исследователи стремятся создать испытания для всех стадий рака мочевого пузыря.Мы особенно привержены созданию вариантов испытаний иммунотерапии и исследованию таргетных методов лечения. Если вы подходите для клинического Ваш врач тщательно рассмотрит вместе с вами все варианты и порекомендует лучшее время для начала исследования (до, во время или после лечения рака).
Клинические испытания являются частью процесса исследования рака; они представляют собой безопасные и регулируемые научные исследования, чтобы определить, являются ли новые методы лечения рака эффективными или лучше, чем текущий план. Мало того, что испытания могут привести к новым открытиям и улучшить лечение рака, но они также могут иметь спасательные преимущества.Клинические испытания могут включать биологические методы лечения или методы лечения, которые используют иммунную систему пациента для борьбы с раком (иммунотерапия или биотерапия). Испытания также включают таргетную терапию или терапию с использованием лекарства для выявления и атаки определенных раковых клеток мочевого пузыря без вреда для здоровых клеток.
Узнать больше о клинические испытания в DF / BWCC.
Подробная информация о клинических исследованиях доступна на сайте Веб-сайт NCI.
Для проведения общенациональных клинических испытаний, пожалуйста, посетите Клинические испытания.губ.
Вопросы о клинических исследованиях, которые следует задать врачу
Если ваш врач предлагает провести клиническое испытание в рамках лечения рака, у вас могут возникнуть вопросы, прежде чем вы начнете. Просмотрите некоторые часто задаваемые вопросы о клинических испытаниях и обсудите их со своим врачом.
Лучевая терапия
Передовые методы и выдающееся мастерство врачей DF / BWCC обеспечивают исключительную точность при проведении лучевой терапии.Наша бригада радиационной онкологии обладает высокой квалификацией в лечении необычных и сложных случаев. Члены команды имеют обширный опыт лечения рецидивирующего рака мочевого пузыря с помощью лучевой терапии.
Радиация может использоваться для лечения некоторых пациентов с раком мочевого пузыря, но не рекомендуется для большинства пациентов, поскольку при раке мочевого пузыря часто требуется много лучевых методов лечения. Лучевая терапия наиболее распространена для случаев рака мочевого пузыря II стадии, когда рак мочевого пузыря проник в мышцу, но не распространился. Этот вид терапии в сочетании с химиотерапией может быть альтернативой хирургическому вмешательству для некоторых пациентов.При необходимости для облегчения симптомов и улучшения качества жизни можно использовать облучение.
Для пациентов, которые являются хорошими кандидатами на облучение, вы можете быть уверены, что врачи DF / BWCC могут нацелить вашу опухоль с максимальной точностью и безопасно доставить высокие дозы радиации, не повреждая здоровые клетки. Наши радиационные онкологи доставляют самые передовые методы лучевой терапии рака мочевого пузыря, включая лучевую терапию с трехмерным изображением, также называемую лучевой терапией с модуляцией интенсивности (IMRT).IMRT использует компьютерные изображения для поиска раковой опухоли и нацеливания на нее, осторожно стреляя тонкими лучами. облучения опухоли под разными углами. Это уменьшает повреждение окружающих здоровых тканей.
Революционный визуализационная терапия
Все пациенты с раком мочевого пузыря, которым требуется лучевая терапия, будут проходить лечение в инновационной операционной и исследовательской среде, разработанной в Brigham and Women’s Hospital (BWH) в 2011 году. Пакет Advanced Multimodality Image Guided Operating (AMIGO), наша команда хирургов, интервенционных радиологов, физиков-визуализаторов, компьютерных специалистов, биомедицинские инженеры, медсестры и технологи используют новейшие инструменты визуализации для разработки и предоставления самых безопасных и современных методов лечения.Пакет AMIGO уникален, поскольку он сочетает в себе технологии ПЭТ / КТ, МРТ и операционной в одной операционной. BWH — это одна из немногих больниц в Соединенных Штатах, в которой работает комплекс AMIGO.
Лучевая терапия рака мочевого пузыря
Лучевая терапия, также известная как лучевая терапия, использует контролируемую дозу радиации для уничтожения или повреждения раковых клеток. Излучение обычно имеет форму рентгеновских лучей.
Сама по себе лучевая терапия может помочь контролировать рак мочевого пузыря. В этом случае у вас может быть одно занятие или до 20 занятий с понедельника по пятницу в течение четырех недель. Этот подход может быть рекомендован, если вы слишком плохо себя чувствуете для других методов лечения или если рак распространился на другие части тела.
Лучевая терапия иногда может сочетаться с другими видами лечения в тримодальной терапии с целью излечения рака.
Вы встретитесь с бригадой радиационной онкологии, чтобы спланировать лечение.Во время сеанса лучевой терапии вы будете лежать на столе для осмотра, а аппарат направит излучение на ваш мочевой пузырь. Лечение безболезненно, его нельзя увидеть или почувствовать.
Побочные эффекты лучевой терапии
Лучевая терапия при раке мочевого пузыря может вызывать временные побочные эффекты, в том числе необходимость более частого и более срочного мочеиспускания, жжение при мочеиспускании, утомляемость, потерю аппетита, диарею и болезненность вокруг ануса. Симптомы имеют тенденцию нарастать во время лечения и обычно начинают улучшаться через несколько недель после его окончания.
Реже лучевая терапия может необратимо воздействовать на кишечник или мочевой пузырь. Движение кишечника может быть более частым и слабым, а повреждение слизистой оболочки мочевого пузыря (лучевой цистит) может вызвать появление крови в моче. Лучевая терапия также может вызвать плохую эрекцию и вызвать дискомфорт при эякуляции в течение нескольких месяцев после лечения.
Подробнее см. Лучевая терапия.
Слушайте наши подкасты о том, как справиться с диагнозом рака и принять решения о лечении
Видео: Что такое лучевая терапия?
Посмотрите это короткое видео, чтобы узнать больше о лучевой терапии.
Рак мочевого пузыря | Лечение рака мочевого пузыря
Лечение рака мочевого пузыря
Специфическое лечение рака мочевого пузыря определит ваш врач на основании:
- ваш возраст, общее состояние здоровья и история болезни
- степень болезни
- степень и стадия рака
- ваша переносимость определенных лекарств, процедур или методов лечения
- ожидания от течения болезни
- ваше мнение или предпочтение
У большинства людей с раком мочевого пузыря есть поверхностные и неинвазивные опухоли.Лечение этих опухолей часто бывает очень эффективным с прекрасным прогнозом. Остальные виды рака мочевого пузыря проникают глубоко в стенки и мышцы мочевого пузыря. В этих случаях повышается риск метастазирования в другие ткани. В зависимости от степени рака мочевого пузыря можно лечить с помощью одной терапии или комбинации методов лечения.
Лечение может включать:
Операция Есть несколько хирургических процедур, используемых для лечения рака мочевого пузыря. Обычно требуется госпитализация и анестезия.Это включает:
- трансуретральная резекция — хирург вводит цистоскоп через уретру в мочевой пузырь. Ткань, содержащая раковые клетки, может быть удалена хирургическим путем или сожжена электрическим током, называемым фульгурацией.
- цистэктомия — операция по удалению части или всего мочевого пузыря.
- сегментарная цистэктомия — удаление небольшого участка мочевого пузыря, содержащего злокачественную ткань. Эта процедура наиболее эффективна, когда в мочевом пузыре находится только один участок раковых клеток.
- радикальная цистэктомия — удаление мочевого пузыря, лимфатических узлов рядом с мочевым пузырем и любых близлежащих органов, содержащих раковые клетки. Эта процедура обычно используется, когда в мочевом пузыре есть несколько участков раковых клеток и есть метастазы в другие участки. При удалении мочевого пузыря проводится процедура уростомии. Это хирургическая процедура для создания еще одного отверстия для слива мочи. У женщин, перенесших радикальную цистэктомию, обычно также удаляют матку, яичники и часть влагалища.У мужчин, перенесших радикальную цистэктомию, обычно удаляют предстательную железу и семенные пузырьки.
Лучевая терапия Лучевая терапия использует высокоэнергетические лучи, чтобы убить или уменьшить раковые клетки. При лечении рака мочевого пузыря можно использовать внутреннее или внешнее облучение, или и то, и другое. При внутреннем облучении в мочевой пузырь помещается радиационный имплант для прямого воздействия на раковые клетки. Внешнее излучение использует машину вне тела, чтобы направить лучи на более широкую область.Лучевая терапия при раке мочевого пузыря может иметь побочные эффекты, включая тошноту, рвоту, диарею и дискомфорт при мочеиспускании, и может влиять на половую функцию как у мужчин, так и у женщин.
Химиотерапия В химиотерапии используются противоопухолевые препараты для уничтожения раковых клеток. Химиотерапия может проводиться внутрь, помещая препараты непосредственно в мочевой пузырь, что называется внутрипузырной химиотерапией. Его также можно вводить системно, чтобы воздействовать на раковые клетки по всему телу. Как и другие химиотерапевтические препараты, те, которые используются для лечения рака мочевого пузыря, могут иметь побочные эффекты, которые могут включать выпадение волос, тошноту, рвоту, синяки и усталость.Другие побочные эффекты включают язвы во рту, повышенный риск инфекций и возможное повреждение почек. Лекарства, вводимые непосредственно в мочевой пузырь, могут вызвать раздражение или кровотечение.
Биологическая терапия Биологическая терапия использует собственную иммунную систему организма для борьбы с раком. В одной из форм этой терапии раствор, называемый Bacillus Calmette-Guerin (BCG), помещается в мочевой пузырь, где он стимулирует иммунную систему к уничтожению раковых клеток.
Клинические испытания Клинические испытания и исследования проводятся для оценки новых методов лечения.Некоторые из них включают фотодинамическую терапию, которая включает использование света для уничтожения раковых клеток и использование интерферона в качестве противоракового агента.
Долгосрочный прогноз для людей с раком мочевого пузыря зависит от размера опухоли, поражения лимфатических узлов и степени метастазирования (распространения) на момент постановки диагноза. Иногда поверхностный рак мочевого пузыря рецидивирует локально в мочевом пузыре, в месте первоначального диагноза или в других местах мочевого пузыря.

 Ознакомьтесь с дополнительной информацией о сравнении результатов органосохраняющего лечения и цистэктомии. (Формат PDF) »
Ознакомьтесь с дополнительной информацией о сравнении результатов органосохраняющего лечения и цистэктомии. (Формат PDF) »