L-орнитин-L-аспартат для людей с хронической болезнью печени и печеночной энцефалопатией (плохое функционирование головного мозга)
Актуальность
Цирроз является хроническим заболеванием печени. У людей с этим заболеванием часто развивается печеночная энцефалопатия, осложнение, которое приводит к плохому функционированию головного мозга. У некоторых людей с циррозом развиваются очевидные клинические признаки нарушения функционирования мозга, например, проблемы с речью, балансом и повседневными функциями; в таких случаях говорят об очевидной печеночной энцефалопатии; изменения могут быть недолгими, могут повторяться или могут сохраняться в течение длительного времени. У других людей с циррозом может не быть очевидных клинических изменений, но имеются нарушения некоторых аспектов функции головного мозга, такие как внимание и способность выполнять сложные задачи; в таких случаях говорят о минимальной печеночной энцефалопатии. Причины развития печеночной энцефалопатии у людей сложны, но накопление в крови токсинов из кишечника, в частности, аммониевых соединений, играет ключевую роль. L-орнитин-L-аспартат понижает уровень аммония в крови и поэтому может иметь полезные эффекты у людей с печеночной энцефалопатией или помочь остановить её развитие.
Вопрос обзора
Мы изучили использование L-орнитин-L-аспартата, применяемого через рот (перорально) или вводимого в виде жидкости капельно в вену (внутривенно) для профилактики и лечения печеночной энцефалопатии, проведя обзор клинических испытаний, в которых люди с циррозом были в случайном порядке определены в группы для получения L-орнитин-L-аспартата, неактивного препарата-пустышки (называемого плацебо), отсутствия лечения, или применения другого лекарства для этого состояния, например, лактулозы, пробиотиков и рифаксимина. Мы включили участников с циррозом, с явной или минимальной печеночной энцефалопатией, или с риском развития этого осложнения.
Дата поиска
Декабрь 2017 года.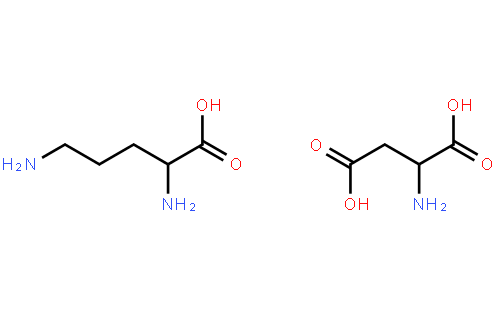
Источники финансирования исследований
Шесть из 36 рандомизированных клинических испытаний, которые мы включили, не получали финансирования или какой-либо другой поддержки от фармацевтических компаний. Семнадцать испытаний получили финансовую поддержку от фармацевтических компаний и еще три получили L-орнитин-L-аспартат или неактивное плацебо бесплатно; в отношении остальных 10 испытаний не было информации о финансировании.
Характеристика исследований
Мы включили 33 рандомизированных клинических испытания, в которых L-орнитин-L-аспартат сравнивали с неактивным плацебо или с отсутствием вмешательства, и шесть рандомизированных клинических испытаний, в которых L-орнитин-L-аспартат сравнивали с другими видами лечения энцефалопатии; в некоторых испытаниях было более одного сравнения. В пяти из включенных испытаний исследовали L-орнитин-L-аспартат для профилактики печеночной энцефалопатии, а в 30 испытаниях изучали его использование в качестве лечения у людей с острой, хронической или минимальной печеночной энцефалопатией. Продолжительность лечения в испытаниях, в которых изучали внутривенные препараты, варьировала от 3 до 35 дней (в среднем, восемь дней) и от 7 до 180 дней в испытаниях, в которых изучали пероральные препараты (в среднем, 30 дней).
Основные результаты
Наши анализы показали, что L-орнитин-L-аспартат может уменьшить смертность, улучшить течение печеночной энцефалопатии и предотвратить серьезные побочные эффекты, в сравнении с плацебо или отсутствием лечения, но он не имеет никаких дополнительных полезных эффектов в сравнении с другими лекарствами, используемыми для профилактики и лечения этого состояния.
Качество доказательств
Доказательства, которые мы нашли, был очень слабыми, и поэтому мы не уверены, что L-орнитин-L-аспартат следует использовать для профилактики или лечения печеночной энцефалопатии у людей с циррозом. Многие исследования не были опубликованы и поэтому не были тщательно проверены, а многие из опубликованных испытаний получили поддержку от фармацевтической промышленности, что вносит элемент смещения.
(PDF) Hepatoprotection by L-Ornithine L-Aspartate in Non-Alcoholic Fatty Liver Disease
27
Обзоры / Reviews
www.gastro-j.ru
Рос журн гастроэнтерол гепатол колопроктол 2019; 29(1) / Rus J Gastroenterol Hepatol Coloproctol 2019; 29(1)
ление синтеза глутамина в печени может представ-
лять собой важный этап, относящийся к гепатопро-
текторным свойствам L-орнитина-L-аспартата при
неалкогольной жировой болезни печении / неал-
когольном стеатогепатите, исходя из данных о том,
что применение глутамина приводит к улучшению
состояния печени, чье поражение вызвано рядом
факторов, включая травму, ишемию/реперфузию,
а также факторами, обусловленными хроническим
употреблением алкоголя [15, 16]. Позднее отчеты
о двух исследованиях экспериментальной неалко-
гольной жировой болезни печени / неалкогольного
стеатогепатита продемонстрировали значительные
гепатопротекторные эффекты глутамина [17, 18].
В ходе первого из этих исследований неалкогольная
жировая болезнь печени была индуцирована рацио-
ном с высоким содержанием жиров, а прием внутрь
глутамина привел к снижению экспрессии печеноч-
ных маркеров оксидативного стресса и ингибиро-
ванию транскрипционного фактора NFkB p65, что
сопровождалось снижением выраженности стеатоза
печени. В ходе второго исследования гепатопротек-
торное действие пероральных добавок глутамина
при неалкогольном стеатогепатите, индуцированном
диетой западного образца, было связано с защитой
от перекисного окисления липидов в печени. Кро-
ме того, добавки глутамина обусловливали значимое
уменьшение провоспалительной активности (рис. 1).
1).
Глутатион
Другой важный продукт глутамата — произво-
дного L-орнитина-L-аспартата, а именно глутатион
(GSH), является сильным антиоксидантом, обла-
дающим нужными свойствами для контроля окис-
лительного повреждения, и было доказано, что
лечение L-орнитином-L-аспартатом корректирует
потерю глутатиона в сыворотке животных с пече-
ночной недостаточностью, обусловленной токси-
ческим поражением печени [19]. В совокупности
эти данные представляют убедительное объясне-
ние гепатопротекторного действия L-орнитина-L-
аспартата, а именно антиоксидантных свойств двух
продуктов его метаболизма (глутамина и антиокси-
данта глутатиона).
Применение антиоксидантов для лечения неал-
когольной жировой болезни печени / неалкоголь-
ного стеатогепатита к настоящему времени пред-
лагалось и оценивалось неоднократно с несколько
неоднозначными результатами. Первые исследова-
ния по применению витамина E у пациентов с не-
алкогольной жировой болезнью печени привели
к улучшению уровней трансаминаз. Однако эф-
фекты, касающиеся гистологического улучшения,
остаются неоднозначными. На данный момент
первые клинические исследования с применением
гиполипидемического антиоксиданта пробукола
привели к неутешительным результатам [20]. Оче-
видно, что необходимо проведение дальнейших ис-
следований.
Оксид азота
Было предположено, что изменения синусои-
дальной перфузии при стеатозе приводят к ком-
прессии синусоидальных пространств и к последу-
ющим нарушениям печеночной микроциркуляции
[21]. Поэтому увеличение выработки или высво-
бождения вазоактивного модулятора оксида азо-
та (NO) может обеспечить новую эффективную
стратегию предотвращения и лечения неалкоголь-
ной жировой болезни печени [22]./42_2.jpg) Действительно,
Действительно,
результаты двух исследований представили дока-
зательства, соответствующие этой возможности.
В ходе первого исследования было доказано, что
применение гепатоселективного донатора NO со-
единения [O(2)-винил-1(пирролидин-1-ил) диазен-
1-иум-1,2-диолата], V_PYRRO/NO, оказывает
защитное действие в отношении стеатоза печени,
индуцированного рационом с высоким содержа-
нием жиров. Было предположено, что такие наце-
ленные на печень донаторы NO, не оказывающие
системного гипотензивного действия, представля-
ют перспективную терапевтическую стратегию при
неалкогольной жировой болезни печени [22].
В ходе второго исследования, которое также
непосредственно касалось NO, было установлено,
что применение L-аргинина, субстрата синтазы ок-
сида азота, улучшает микрососудистую перфузию
при жировой болезни печени [23]. Эти данные
о благоприятном эффекте L-аргинина представ-
ляют особый интерес, учитывая результаты ис-
следований при экспериментальном хроническом
заболевании печени, которые четко продемонстри-
ровали, что лечение L-орнитином-L-аспартатом
приводило к значимому 2,5-кратному увеличению
уровней L-аргинина в плазме [13]. Кроме того, со-
общалось об увеличении уровней циркулирующего
L-аргинина у пациентов с циррозом после лечения
L-орнитином-L-аспартатом [14]. Эти данные указы-
вают на механизм, посредством которого L-орнитин-
L-аспартат обладает потенциалом для улучшения
микроциркуляции при неалкогольной жировой
болезни печени / неалкогольном стеатогепатите,
а именно, на обеспечение увеличения концентраций
производного L-орнитина-L-аспартата L-аргинина,
необходимого для синтеза NO (рис. 2).
Заключение
Данные клинических исследований подтверж-
дают тезис о том, что L-орнитин-L-аспартат обла-
дает гепатопротекторными свойствами у пациентов
с неалкогольной жировой болезнью печени / неал-
когольным стеатогепатитом. Эти данные включают
Эти данные включают
способность L-орнитина-L-аспартата уменьшать по-
вышенные уровни ферментов печени, в том числе
уровни аланинаминотрансферазы, а также снижать
уровни триглицеридов в сыворотке. Кроме того, ле-
чение L-орнитином-L-аспартатом приводит к зна-
чительным улучшениям соотношения плотности
Гепатопротекция с использованием L-орнитина-L-аспартата при неалкогольной жировой болезни печени | Баттерворт
1. Blachier M., Leleu H., Peck-Radosavljevic M., Valla D.C., Roudot-Thoraval F. The burden of liver disease in Europe: a review of available epidemiological data. J Hepatol. 2013;58:593–608.
2. Felipo V., Urios A., Montesinos E. et al. Contribution of hyperammonemia and inflammatory factors to cognitive impairment in minimal hepatic encephalopathy. Metab Brain Dis. 2012;27:51–8.
3. Gutierez-de-Juan V., Lopez de Davalilo S., FernandezRamos D. et al. A morphological method for ammonia detection in liver. PLoS One. 2017;12:e0173914.
4. Butterworth R.F., Kircheis G., Hilger N., McPhail M.J.W. Effect of L-ornithine L-aspartate for the treatment of hepatic encephalopathy and hyperammonemia in cirrhosis: systematic review and meta-analysis of randomized controlled trials. J Clin Exp Hepatol. 2018. DOI: 10.1016/j.jceh.2018.05.004
5. Grungreiff K., Lambert-Baumann J. Efficacy of L-ornithine L-aspartate granules in chronic liver diseases. Med Welt. 2001;52:219–26.
6. Tian L.Y., Lu L.G., Tang C.W., Xie Y., Luo H.S., Tan S.Y. et al. Aspartate-ornithine granules in the treatment of non-alcoholic steatohepatitis: a multiple-dose parallel controlled clinical trial.
7. Ermolova T., Ermolov S. Correction of intrahepatic microcirculation disorders by L-ornithine L-aspartate in chronic liver disease patients. J Hepatol. 2018;68(Suppl 1):S585–6.
8. Kaiser S., Gerok W., Haussinger D. Ammonia and glutamine metabolism in human liver slices: new aspects on the pathogenesis of hyperammonaemia in chronic liver disease. Eur J Clin Invest. 1988;18:535–42.
9. Bhanji R.A., Narayanan P., Allen A.M., Watt K.D. Sarcopenia in hiding: the risk and consequence of underestimating muscle dysfunction in non-alcoholic steatohepatitis. Hepatology. 2017;66:2055–65.
10. Reynolds N., Downie K., Smith K., Kircheis G., Rennie M.J. Treatment with L-Ornithine L-Aspartate (LOLA) infusion restores muscle protein synthesis responsiveness to feeding in patients with cirrhosis. J Hepatol. 1999;30(Suppl 1):3.
12. Kumar A., Davuluri G., Silva R.N.E., Engelen M.P.K.J., Ten Have G.A.M., Prayson R. et al. Ammonia lowering reverses sarcopenia of cirrhosis by restoring skeletal muscle proteostasis. Hepatology. 2017;65:2045–58.
13. Rose C., Michalak A., Pannunzio P., Therrien G., Quack G.-1200x630.jpg)
14. Staedt U., Leweling H., Gladisch R., Kortsik C., Hagmuller E., Holm E. Effects of ornithine aspartate on plasma ammonia and plasma aminoacids in patients with cirrhosis. A doubleblind, randomized study using a four-fold crossover design. J Hepatol. 1993;19:424–30.
16. Peng H.C., Chen Y.L., Chen J.R., Yang S.S., Huang K.H., Wu Y.C. et al. Effects of glutamine administration on inflammatory responses in chronic ethanol-fed rats. J Nutr Biochem. 2011;22:282–8.
17. Lin Z., Cai F., Lin N., Ye J., Zheng Q., Ding G. Effects of glutamine on oxidative stress and nuclear factor-κB expression in the livers of rats with non-alcoholic fatty liver disease. Exp Ther Med. 2014;7:365–70.
18. Sellmann C., Jin C.J., Degen C., De Bandt J.P., Bergheim I. Oral glutamine supplementation protects female mice from non-alcoholic steatohepatitis. J Nutr. 2015;145:2280–6.
19. Najmi A.K., Pillai K.K., Pal S.N., Akhtar M., Aqil M., Sharma M. Effect of L-ornithine L-aspartate against thioacetamide-induced hepatic damage in rats. Ind J Pharmacol. 2010;42:384–7.
20. Adams L.A., Angelo P. Treatment of non-alcoholic fatty liver disease. Postgrad Med J. 2006;82:315–22.
Postgrad Med J. 2006;82:315–22.
21. Ramalho F.S., Fernandez-Monteiro I., Rosello-Catafau J., Peralta C. Hepatic microcirculatory failure. Acta Cir Bras. 2006;21:48–53.
22. Kus K., Walczak M., Maslak E., Zakrzewska A., Gonciarz-Dytman A., Zabielski P. et al. Hepatoselective Nitric Oxide (NO) Donors, VPYRRO/NO and V-PROLI/ NO, in non-alcoholic fatty liver disease: a comparison of antisteatotic effects with the biotransformation and pharmacokinetics. Drug Metab Dispos. 2015;43:1028–36.
23. Ijaz S., Yang W., Winslet M.C., Seifalian A.M. The role of nitric oxide in the modulation of hepatic microcirculation and tissue oxygenation in an experimental animal model of hepatic steatosis. Microvasc Res. 2005;70:129–36.
Effect of L-ornithine L-aspartate on some liver function parameters in patients after liver resection
Management of Postoperative Hepatic Failure / Motaz Qadan, James Garden, Carlos U. Corvera, Brendan C. Visser // Journal American College of Surgeons. — 2016. — 222. — С. 195-208.
Post-hepatectomy liver failure in patients with colorectal liver metastases / M. Narita, E. Oussoultzoglou, P. Bachellier, D. Jaeck // Surgery Today. — 2015. — № 45. — С. 1218-26.
Posthepatectomy liver failure: A definition and grading by the International Study Group of Liver Surgery (ISGLS) / [N. Rahbari, J. Garden, R. Padbury et al. // Surgery. — 2011. — 149. — С. 713-724.
Safety, Tolerability and Pharmacokinetics of L-Ornithine Phenylacetate in Patients with Acute Liver Injury/Failure and Hyperammonemia. [Електронний ресурс] // Hepatology. — 2017. — Oct 28. — Режим доступу: https://www. ncbi.nlm.nih.gov/pubmed/29080224.
ncbi.nlm.nih.gov/pubmed/29080224.
Balzan S. The ‘‘50–50 criteria’’ on postoperative day 5: an accurate predictor of liver failure and death after hepatectomy / Balzan S., Belghiti J., Farges O. // Annals of surgery. — 2005. — № 242. — С. 824-8.
Liver failure after partial hepatic resection: de¢nition, pathophysiology, risk factors and treatment / Maartje A.J. van den Broek, Steven W.M. Olde Damink, Cornelis H.C. Dejong et al. // Liver International. — 2008. — № 1478. — С. 767.
The critical value of remnant liver volume-to-body weight ratio to estimate posthepatectomy liver failure in cirrhotic patients / Lin X.J., Yang J., Chen X.B. et al. // The journal of surgical research. — 2014. — № 188. — С. 489-95.
DeLeve L.D., Shulman H.M., McDonald G.B. Toxic injury to hepatic sinusoids: sinusoidal obstruction syndrome (venoocclusive disease) // Semin. Liver Dis. — 2002. — 22. — 27-42.
Rubbia-Brandt L., Mentha G., Terris B. Sinusoidal obstruction syndrome is a major feature of hepatic lesions associated with oxaliplatin neoadjuvant chemotherapy for liver colorectal metastases // J. Am. Coll. Surg. — 2006. — 202. — 199-200.
Fong Y., Bentrem D.J. CASH (chemotherapy-associatedsteatohepatitis) costs // Ann. Surg. — 2006. — 243. — 8-9.
Prediction of Postoperative Hepatic Failure after Liver Resection for Hepatocellular Carcinoma: Significance of the Aspartate Aminotransferase-to-Platelet Ratio Index / Tanaka S., Iimuro Y., Hirano T. et al. // Hepatogastroenterology. — 2014. — № 61. — С. 755-61.
Effect of ornithine on transferrin secretion of rat and human hepatocyte cultures / G. Lescoat, О. Loreal, B. Desvergne та ін. // Liver. — 1988. — № 8. — С. 360-365.
Stauch S., Kircheis G., Adler G., Beckh K., Ditschuneit H., Gortelmeyer R. et al. Oral L-ornithine-L-aspartate therapy of chronic hepatic encephalopathy: results of a placebo-controlled double-blind study // J. Hepatol. — 1998. — 28. — 856-864.
Hepatol. — 1998. — 28. — 856-864.
L-ornithine L-aspartate in bouts of overt hepatic encephalopathy / Sidhu S.S., Sharma B.C., Goyal O. et al. // Hepatology. — 2017. — Dec 27.
Transferrin as a Predictor of Survival in Cirrhosis / Viveiros A., Finkenstedt A., Schaefer B. et al. // Liver Transplantation. — 2017. — Nov 17.
Low serum transferrin correlates with acute-on-chronic organ failure and indicates short-term mortality in decompensated cirrhosis / Bruns T., Nuraldeen R., Mai M. et al. // Liver International. — 2017. — № 37. — С. 232-241.
Guidelines for Perioperative Care for Liver Surgery: Enhanced Recovery After Surgery (ERAS) Society Recommendations / Emmanuel Melloul, Martin Hubner, Michael Scott et al. // World Journal of Surgery. — 2016. — № 40. — С. 2425-2440.
Shalimar, Acharya S.K. Management in Acute Liver Failure / Shalimar, Subrat K. Acharya // Journal of Clinical & Experimental Hepatology. — 2015. — 5. — S104-S115.
Randomised clinical trial: L-ornithine-L-aspartate reduces significantly the increase of venous ammonia concentration after TIPSS / Bai M., Yin Z., Niu J. et al. // Alimentary pharmacology and therapeutics. — 2014. — 1. — 63-71.
Lowering blood ammonia prevents hepatocyte injury and apoptosis / Gao G., Yu Z., Yan J. et al. // International journal of clinical and experimental medicine. — 2015. — 8. — 12347-55.
Lescoat G., Theze N., Fraslin J.M., Pasdewup N., Kneip В. Influence of ornithine on albumin synthesis by fetal and neonatal hepatocytes maintained in culture // Cell. Differ. — 1987. — 21. — 21-29.
Oratz M., Rothshcild M.A., Schreiber S.S., Burks A. The role of the urea cycle and polyamines in albumin synthesis // Hepatology. — 1983. — 3. — 567-571.
Stokes C.S., Goh E.T., Vilstrup H., Morgan M.Y., Gluud L. L. L-ornithine aspartate for people with cirrhosis and hepatic encephalopathy (Protocol) // Cochrane Database of Systematic Reviews. — 2016. — 10.
L. L-ornithine aspartate for people with cirrhosis and hepatic encephalopathy (Protocol) // Cochrane Database of Systematic Reviews. — 2016. — 10.
Клинические исследование Cirrhosis of Liver: L-ornithine L-aspartate, Плацебо — Реестр клинических исследований
A. Введение и обзор литературы
Печеночная энцефалопатия (HE) в широком смысле определяется как изменение психического статуса и когнитивные функции, возникающие при печеночной недостаточности. клиническая картина HE возникает как осложнение хронического и, реже, острого заболевания печени, встречается до 70% пациенты с циррозом печени на каком-то этапе их заболевания (1,2). характеризуется изменениями личности, интеллектуальными нарушениями и депрессивным уровнем сознание.Он может быть клинически незаметным (минимальный ПЭ), обнаруженный аномальным нейропсихометрические или нейрофизиологические тесты (3). Обычно это явная ПЭ, которая возникает у пациентов с запущенным циррозом печени с портально-системным коллатеральным кровообращением. Эпизоды HE у пациентов с циррозом печени вызваны провоцирующими факторами, такими как обезвоживание, гипокалиемия, потребление большого количества белка, желудочно-кишечное кровотечение, запор, инфекции, употребление психотропных препаратов, прием алкоголя или острое повреждение печени (гепатит).
Патогенез печеночной энцефалопатии У пациентов с циррозом печени увеличивается структурное замещение гепатоцитов соединительной тканью приводит к потере функций печеночная паренхиматозная ткань и снижение детоксикационной способности печени. Кроме того, развивающаяся портальная гипертензия приводит к образованию коллатерального кровообращения. через которую недетоксифицированная кровь может пройти через печень и попасть в системный кровоток. Оба эти механизма способствуют тому, что нейротоксины, присутствующие в крови воротной вены, достигают мозг через большой круг кровообращения. Ряд нейротоксинов вовлечены в патогенез ПЭ, где аммиак является наиболее важным (4,5).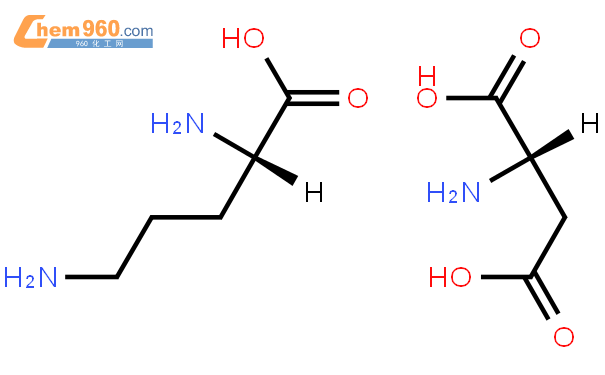 достижения в нашем понимании печеночной энцефалопатии подтвердили центральную роль аммиак в патогенезе портосистемной энцефалопатии. Аммиак нарушает функцию нейроны и астроциты, вызывающие симптомы печеночной энцефалопатии.
достижения в нашем понимании печеночной энцефалопатии подтвердили центральную роль аммиак в патогенезе портосистемной энцефалопатии. Аммиак нарушает функцию нейроны и астроциты, вызывающие симптомы печеночной энцефалопатии.
Классификация / степень HE может быть классифицирована как тип A (острая печеночная недостаточность), B (при острой печеночной недостаточности). Портосистемные шунты без внутреннего заболевания печени) и C (пациенты с циррозом портальная гипертензия / портосистемные шунты) (5,6) .При циррозе печени дополнительно проявляется HE типа C подразделяются на эпизодическую, стойкую и минимальную ПЭ. Пациенты с хронической стойкой явной ПЭ те, кто может быть относительно стабильным с небольшими ежедневными колебаниями своего психического статуса. Пациенты с эпизодической (нестабильной) HE определяются как пациенты, которые ранее были стабильными, но у которых более часов и, возможно, дней развиваются клинически различимые признаки HE, требующие медицинского внимание и госпитализация.Минимальная ПЭ не проявляется клинически и определяется нейропсихометрические или нейрофизиологические тесты (3).
Точная градация HE важна для прогнозирования и планирования соответствующего подхода к В зависимости от степени тяжести ПЭ традиционно делят на четыре стадии. на основе изменений в состоянии сознания, интеллектуальной функции, поведения и нервно-мышечные признаки (шкала Вест-Хейвена) (5).
Недавно была предложена новая классификация, названная SONIC (7). необходимо, потому что различие между минимальным и I степени не надежно, но существует хорошая воспроизводимость результатов между экспертами при идентификации HE степени II. предложил сгруппировать пациентов с минимальной ПЭ и ПЭ I степени. подчеркивает, что ухудшение когнитивной функции является континуумом, а не категорией, как подчеркивалось на 11-м Всемирном конгрессе в Вене. Он классифицирует пациентов с циррозом печени как здоровых. нарушение нейрокогнитивной функции. Нарушение когнитивной функции подразделяется на скрытые HE (минимальный HE и уровень I HE) и явный HE (уровни II-IV). Таким образом, он включает Запад Критерии Хейвена, но при этом подчеркивают преемственность, а не категоричность. функция у ослабленных, нестабильных пациентов может колебаться от синдрома острой спутанности сознания до комы. (Степени I – IV). Это пациенты с так называемой эпизодической ПЭ типа С.
Таким образом, он включает Запад Критерии Хейвена, но при этом подчеркивают преемственность, а не категоричность. функция у ослабленных, нестабильных пациентов может колебаться от синдрома острой спутанности сознания до комы. (Степени I – IV). Это пациенты с так называемой эпизодической ПЭ типа С.
Терапия печеночной энцефалопатии Основной целью терапии HE является (а) снижение токсины кишечного происхождения, вырабатываемые чрезмерной бактериальной активностью и снижающие содержание аммиака производство или (б) увеличить детоксикацию аммиака (1,2,8,9).
1. уменьшить производство аммиака:
Энтеросолюбильное производство аммиака можно уменьшить с помощью неабсорбируемых дисахаридов, таких как лактулоза или лактитол и неабсорбируемые антибиотики, такие как рифаксимин. Лактулоза / лактитол проходят через тонкий кишечник непереваренными. В толстом кишечнике бактерии разлагают лактулозу до различных органических кислот (например, молочная кислота, уксусная кислота) с последующее снижение рН толстой кишки. Режим снижения аммиака может включать бактериостатические эффекты, катарсические эффекты или усиление превращения аммиака в аммоний с избытком иона водорода; предположительно, аммоний затем выводится с калом и устранена (9, 10) .Лактулоза остается основным средством терапии явной ПЭ, несмотря на малочисленность и непоследовательность клинических испытаний, демонстрирующих его эффективность (11). Дозировка должна быть скорректирована для достижения двух-трех мягких дефекаций каждый день. Лактулозу можно вводить через назогастральный зонд или с помощью удерживающих клизм. доза составляет 30-120 мл каждый день в несколько приемов. pH стула должен быть ниже шести. включают вздутие живота и метеоризм, тяжелую диарею с обезвоживанием и гипергликемией. ацидоз возникает при слишком высокой дозировке.
Неабсорбируемые антибиотики неомицин, метронидазол и паромомицин являются традиционными. антибиотики для лечения HE (12). из-за ототоксических и нефротоксических побочных эффектов, в настоящее время неомицин используется нечасто.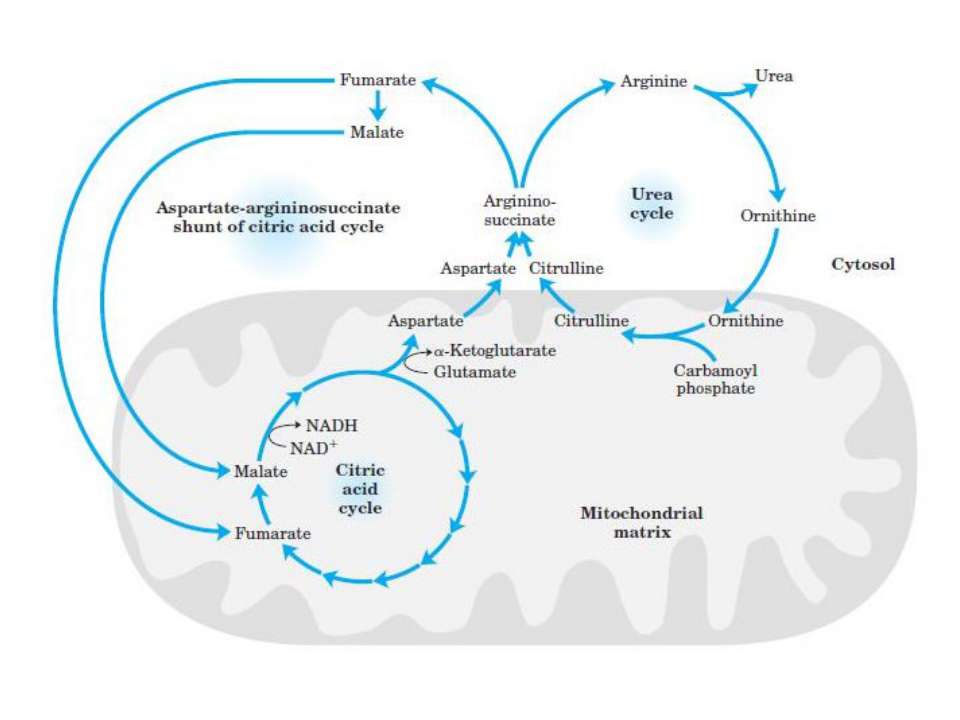 Метронидазол не вызывает особых побочных эффектов, но Во избежание нейропатии терапия не должна превышать двух недель. продемонстрировал свое действие на уровне лактулозы (13) или лактита (14, 15) для пациентов с печеночная энцефалопатия.
Метронидазол не вызывает особых побочных эффектов, но Во избежание нейропатии терапия не должна превышать двух недель. продемонстрировал свое действие на уровне лактулозы (13) или лактита (14, 15) для пациентов с печеночная энцефалопатия.
2. Увеличьте детоксикацию аммиака:
Уровень аммиака можно снизить с помощью детоксикации. L-орнитин-L-аспартат (LOLA), соль природных аминокислот орнитина и аспартата действует через механизм активация субстрата для детоксикации аммиака. подробный механизм действия и клинические испытания LOLA обсуждаются ниже.
L-орнитин-L-аспартат (LOLA):
L-орнитин-L-аспартат (LOLA) представляет собой соль природных аминокислот орнитина и аспартат.
1.Механизм действия:
LOLA стимулирует цикл мочевины (который превращает аммиак в мочевину) в печени (16,17). В перипортальных гепатоцитах, которые синтезируют мочевину, орнитин служит активатором орнитинтранскарбамоилаза и карбамоилфосфатсинтетаза. Кроме того, орнитин может действовать как субстрат для образования мочевины, следовательно, LOLA может активировать перипортальную мочевину. цикл в печени. Аспартат и орнитин после преобразования в альфа-кетоглутарат, также служит источником углерода для перивенального синтеза глутамина. мышцы, LOLA активирует синтез глутамина за счет обеспечения субстрата для глутамина синтетазы, хотя снижение мышечной массы при циррозе не позволяет этому синтезу Аммиак расходуется во время образования мочевины и синтеза глутамина, а также тем самым LOLA снижает уровень аммиака в крови. мочевина и глютамин (после дальнейшего метаболизм) может выводиться через почки. таким образом, LOLA активирует два важных метаболические пути в организме человека для детоксикации аммиака. при циррозе остается некоторая клеточная масса печени, которая сохраняет способность детоксифицировать аммиак в виде в отличие от острой печеночной недостаточности.
2. Испытания LOLA при печеночной энцефалопатии:
LOLA уже много лет используется для лечения HE при циррозе печени, особенно минимальная и явная хроническая ПЭ низкой степени. Клиническая эффективность LOLA уже были всесторонне исследованы и описаны в терапевтических наблюдениях, клинические испытания (16, 18-25) и метаанализ (26, 27). В этих исследованиях использование LOLA в виде инфузии, перорального приема или их комбинации были зарегистрированы у пациентов при печеночной недостаточности легкой и тяжелой степени. ЛОЛА продемонстрировала статистически значимый эффект. в отношении улучшения психического состояния (снижение оценки HE) увеличилось детоксикация (снижение концентрации аммиака в крови) и положительный влияние на психомоторную функцию (сокращение времени, необходимого для соединения числа тест) при минимальной печеночной энцефалопатии и явной хронической печеночной энцефалопатии I-II степени. Энцефалопатия и острый явный HE: на основании этих данных доказательная медицина критерии демонстрации эффективности выполнены.
Клиническая эффективность LOLA уже были всесторонне исследованы и описаны в терапевтических наблюдениях, клинические испытания (16, 18-25) и метаанализ (26, 27). В этих исследованиях использование LOLA в виде инфузии, перорального приема или их комбинации были зарегистрированы у пациентов при печеночной недостаточности легкой и тяжелой степени. ЛОЛА продемонстрировала статистически значимый эффект. в отношении улучшения психического состояния (снижение оценки HE) увеличилось детоксикация (снижение концентрации аммиака в крови) и положительный влияние на психомоторную функцию (сокращение времени, необходимого для соединения числа тест) при минимальной печеночной энцефалопатии и явной хронической печеночной энцефалопатии I-II степени. Энцефалопатия и острый явный HE: на основании этих данных доказательная медицина критерии демонстрации эффективности выполнены.
В недавнем рандомизированном плацебо-контролируемом исследовании, проведенном в Карачи (25), пациенты с Острый HE были рандомизированы для получения LOLA или плацебо. NCT-A, уровень аммиака, клинический оценивалась степень ПЭ и продолжительность госпитализации. Улучшение ПЭ было выше (n = 40, 66,7%) в группе LOLA (n = 28, 46,7%, p = 0,027). Продолжительность госпитализации составила ниже в группе LOLA по сравнению с плацебо (p = 0,025). Побочных эффектов в группе не наблюдалось. любая группа.
3. Побочные эффекты LOLA L-орнитин-L-аспартата обычно хорошо переносятся (18-25). К настоящему времени в ходе клинических испытаний сообщалось о серьезных нежелательных явлениях. События, о которых сообщалось примерно у 14% пациентов, получавших LOLA, включают:
1. тошнота.
2. рвота
3. усталость
Б. Материалы и методы
1.Дизайн и постановка исследования:
Это будет проспективный, рандомизированный, двойной слепой, плацебо-контролируемый интервенционный учиться.
Исследование будет проводиться на пациентах с циррозом печени, поступивших с явной HE в больнице. Отделение гастроэнтерологии, Медицинский колледж и больница Даянанд, Лудхиана и Отделение гепатологии, больница GB Pant, Нью-Дели, необходимо получить информированное согласие от ближайшего родственника пациента для включения в исследование.
Исследование должно быть представлено на утверждение Комитету по этике учреждения до включение пациентов в исследование, которое должно быть зарегистрировано в клиническом исследовании Регистр, Индия и регистр ClinicalTrials.gov.
2.Популяция исследования:
Критерии включения и исключения упоминались в другом месте.
3. методы исследования:
Назначение: последовательные пациенты с диагнозом острой явной ПЭ будут рандомизированы. на две группы (группа A и B), используя запечатанные непрозрачные конверты, содержащие случайные числа, генерируемые компьютером.Нет ограничений, блокировок или стратификация последовательности рандомизации. Координатор исследования, который будет генерировать последовательность не должна иметь никакого значения для набора, лечения или оценки пациентов.
Маскировка: пронумерованные коробки, содержащие идентичные ампулы LOLA или плацебо, в соответствии с порядком распределения обеспечит сокрытие распределения. ящиков будет делать координатор исследования и скрывать от лечащих Консультанты. Весь исследовательский персонал будет не осведомлен о назначении лечения (плацебо или LOLA) на время исследования. Плацебо и LOLA будут похожи по внешнему виду и в режиме администрирования. Код последовательности распределения останется с координатор исследований.Это будет раскрыто только после набора, сбора данных и проведен анализ результатов. Координатор не будет иметь доступа пациентам, участвовавшим в исследовании.
Внедрение рандомизации: набор пациентов, оценка правомочности и получение информированного согласия будет осуществляться одним из исследователей (С.С. Сидху или О. Гоял, BC Sharma) Вмешательство в исследование: пациенты будут рандомизированы для получения либо плацебо, либо LOLA в дозе 30 г в день путем внутривенной инфузии в течение 24 часов. (Исследуемые препараты и плацебо будут предоставлены Win Medicare Pvt Ltd., 1400, Modi Tower, 98, Nehru Place, New Delhi — 110019). LOLA будет поставляться в виде ампул (каждая ампула, содержащая 5 г LOLA в 10 мл прозрачного раствора) Шесть ампул (т.е. 30 г LOLA) будет вводиться в течение 24 часов. Флаконы с плацебо (10 мл стерильной воды в каждом флакон) будет поставляться и вводиться идентично. Доза LOLA (30 г за 24 часа) была на основе предыдущих исследований, показывающих эффективность этой дозы в снижении аммиака (17,26,28). Обе группы должны получать лечение в течение 5 дней. Пациенты в обеих группах группы, у которых сохраняется печеночная энцефалопатия в конце периода исследования (5 дней), получит стандартную медицинскую помощь и проконсультирован по поводу трансплантации печени.
4. лабораторные испытания:
Биохимические тесты: Гемограмма, глюкоза крови, функциональные пробы печени, протромбиновое время, электролиты сыворотки, мочевина крови и креатинин сыворотки будут определены на исходном уровне и во 2-м и 5-й день лечения или раньше, если показано. АФП сыворотки крови будет взят при поступлении. Уровни цитокинов в сыворотке (интерлейкин 1, 6, 10 и TNF-альфа) будут определены на исходный уровень и через 5 дней лечения.
Микробиологические тесты: Диагностический парацентез будет выполнен всем пациентам с асцит в исходном состоянии для диагностики спонтанного бактериального перитонита. (Общий и дифференциальный) проводится на 5-й день у пациентов с диагнозом Спонтанный бактериальный перитонит Посев крови, посев мочи, посев аспиратов из эндотрахеальных трубок у пациентов, находящихся на ИВЛ, на наличие аэробных и анэробных бактерий, и грибки надо делать. Также должна быть сделана рентгенограмма грудной клетки.
Оценка аммиака: уровни аммиака в венах натощак будут оцениваться по крови. измеритель аммиака (PocketChem BA) на исходном уровне, а затем ежедневно в течение следующих 5 дней. Аммиакомер PocketChem BA — это прибор для быстрого прикроватного определения аммиака в крови. Было показано, что он имеет приемлемую точность, адекватную линейность и удовлетворительный согласие с эталонным ферментативным методом, обычно используемым в клинических лабораториях (29).
Принцип измерения: PocketChem BA измеряет содержание аммиака в крови на основе микродиффузионный метод. Когда образец крови (20 мкл) наносится на принимающий образец слой тестовой области на тест-полоске, щелочной буферный агент (боратный буфер), пропитанный в слое, растворяется, делая образец щелочным. ионы аммония в образце газифицируются в щелочном состоянии в газообразный аммиак. газообразный аммиак проходит через поры спейсера к индикатору (бромкрезоловый зеленый) запускает развитие цвета.Поскольку степень развития цвета пропорциональна концентрация образующегося газообразного аммиака, уровень аммиака в крови количественно определяется путем измерения цвета.
Анализы для этиологической оценки: этиология цирроза печени будет принята как алкоголь, если в анамнезе большое количество алкоголя (40-60 г / день для женщин и 60-80 г / день для мужчин в течение 10 лет) .Каждый пациент будет проверен на поверхностный антиген гепатита В. (HbsAg) и антитела против гепатита C (HCV) с использованием коммерческого ELISA третьего поколения. Где показано, аутоиммунный гепатит будет диагностирован с использованием антинуклеарных антител. антитела против гладких мышц и против LKM; и гемохроматоз с использованием сывороточного железа, TIBC, насыщение ферритина и трансферрина.Каждому пациенту следует При наличии показаний будет проведена УЗИ-эндоскопия.
5. стандарт ухода за лечением:
Стандарт медицинской помощи пациентам с циррозом печени и явной острой энцефалопатией всем пациентам.
1. выявление других потенциальных причин изменения психического состояния, например, травмы головы. или наркотическое опьянение.
2. Выявление и лечение первопричин энцефалопатии, таких как: сепсис, желудочно-кишечное кровотечение, гипокалиемия (уровень калия в сыворотке
3. Сироп лактулозы: 30-120 мл в три приема через назогастральный зонд / перорально для производства 2-3 полуформированных стула и / или удерживающих клизм лактулозы (300 мл лактулоза +700 мл воды) два раза в день. Никакие другие средства, снижающие содержание аммиака дан этим пациентам.
6. Мониторинг и последующие действия:
Клинический мониторинг:
Все пациенты будут помещены в отделение интенсивной терапии / отделение интенсивной терапии, и переведены в палату, как только они вернутся к первой степени HE. Неврологический мониторинг должен проводиться два раза в день и оценка психическое состояние будет соответствовать критериям Вест-Хейвена.
Определение ответа на терапию:
Оценка клинического ответа будет определяться следующим образом:
1.Решение: исчезновение клинического синдрома ПЭ во время исследования.
2. Улучшение: снижение ВО на 1 балл, но не до 0 балла.
3. без улучшения: без улучшения HE
4. Неудача: переход на высшую ступень ВО.
Биохимический мониторинг:
Биохимический мониторинг и мониторинг уровней аммиака должны выполняться, как указано выше. (в разделе «лабораторные испытания»)
Мониторинг нежелательных явлений:
Любое нежелательное явление будет зарегистрировано с указанием времени начала, продолжительности и степень тяжести и отношение к исследуемому препарату.
Переносимость: Переносимость исследуемого препарата будет оцениваться путем сравнения полной подсчет клеток крови, функциональные пробы печени и почечные функциональные пробы в начале и в конце лечения.
7. конечные точки:
Первичная конечная точка
1. Завершение 5 дней лечения
Вторичная конечная точка
1. смерть, связанная с печенью
2. смерть по другим причинам
3. прекращение приема из-за побочных эффектов
4. Выписка из больницы.
8. Размер выборки: размер выборки для этого исследования был оценен с использованием результатов предыдущего исследования. которые сообщили о полном излечении энцефалопатии у 79% пациентов в группе LOLA и 55,6% пациентов в группе плацебо (25) при 80% мощности и 5% уровне значимости (двусторонний), 71 пациент в каждой группе должен был бы обнаружить разницу в 22% в Предполагая, что процент отсева составляет примерно 15% (28), нам нужно будет зачислить 164 пациента, то есть по 82 в каждой группе лечения.
9. Статистический анализ: критерий хи-квадрат будет использоваться для сравнения доли пациенты с полным обращением HE через 5 дней в группах лечения LOLA и плацебо. Также будет рассчитан 95% доверительный интервал для разницы в пропорциях. Затем будет использован критерий хи-квадрат для сравнения оценок HE через 5 дней между Уровни аммиака в крови будут сравниваться между группами с использованием независимого t-тест образцов; в то время как продолжительность пребывания в больнице не будет нормально распределяться и поэтому будет сравниваться с использованием непараметрического критерия Манна-Уитни. тесты будут двусторонними с 5% уровнем значимости. .
Орнитин (L-ornithine) — описание, инструкция, свойства вещества
Общее описание
Общеизвестно, что в ряду жизненно важных для человека химических соединений аминокислоты занимают одно из центральных мест. Эти органические кислоты, содержащие аминогруппу – атом азота и 2 атома водорода, – уникальный строительный материал для нескольких миллионов белков. Они задействованы в огромном количестве обменных процессов, и нехватка хотя бы одной из них нарушает слаженную работу всего организма. Их деление на заменимые и незаменимые подразумевает, что первые образуются в организме человека, а вторые могут поступать в него только извне. Понятие «заменимые» может вызвать иллюзию, что потребление этой разновидности веществ необязательно. Однако это не так: дефицит заменимых аминокислот также возможен и опасен развитием патологических состояний.
Орнитин это заменимая, но необходимая для организма человека кислота выполняет очень ответственные функции. Именно поэтому она нашла широкое применение в медицине и спорте. Орнитин был открыт в 1937 году Д. Аккерманом, который синтезировал его из тканей акульей печени. Это водорастворимое бесцветное вещество кристаллической формы. Орнитин в оптимальной природной форме и дозировке содержится в продуктах пчеловодства — таких как цветочная пыльца, маточное молочко. Как и многие другие аминокислоты, орнитин представлен двумя формами – L и D, отражающими строение их молекул. Формы L, в отличии от D, обладают высокой биологической активностью. Поэтому, когда мы говорим о роли орнитина в метаболизме, мы подразумеваем форму орнитина L. При оральном употреблении именно L-формы без переваривания оперативно попадают в кровоток и вступают в обменные процессы.
Роль орнитина в организме человека
Его синтезирование и функции в нашем организме напрямую связаны с другой заменимой аминокислотой – аргинином, из которого он производится и в которое сам преобразуется. Однако, в отличие от своего близкого родственника, орнитин не входит в состав белковых соединений.
Вместе с аргинином орнитин причастен к продуцированию соматотропного гормона, ответственного как за рост в высоту (детей и подростков), так и за анаболические процессы – то есть синтез протеинов, а следовательно, увеличение мышечной массы. Гормон роста способствует переработке липидов в протеины, то есть трансформации жировых излишков в мышцы. Более того, соматропин ещё и антикатаболик, то есть вещество, препятствующее разрушению протеинов. Отмечается также влияние орнитина на увеличение секреции инсулина, также улучшающего анаболизм.
Крайне важна роль орнитина в выводе аммиака, возникающего в организме в результате метаболизма азота. Не случайно путь образования мочевины из продуктов распада называется орнитиновым циклом. Выведение токсичных азотосодержащих веществ из организма предупреждает эндогенное (обусловленное внутренними факторами) отравление и к тому же благотворно влияет на нервную систему, делая человека менее возбудимым и раздражительным. А вот нарушение этого процесса чревато гипотрофией, развитием умственной отсталости, нервно-психическими отклонениями, помутнением сознания вплоть до впадения в кому или смерти.
Орнитин участвует в производстве ряда веществ: полиаминов спермидина и спермина, путресцина, присутствующих в клеточных ядрах самых разных человеческих органов и участвующих в молекулярных взаимодействиях с ДНК и РНК.
Также диаминовалериановая кислота причастна к синтезу цитруллина, пролина, глютаминовой кислоты, а также ниацина, или никотиновой кислоты, активирующей обменные процессы и дыхание тканей, кроветворение и кровообращение, вывод токсинов. Влияет орнитин и на выработку глюкозы, нормализуя количество её содержания в крови.
Применение орнитина
Применение орнитина в спорте связано в первую очередь с его свойством активизировать посредством синтеза соматропина и увеличения выработки инсулина анаболические процессы, ведущие к росту мышечной массы. Особенно рекомендуется приём этого вещества в силовых видах спорта, таких как бодибилдинг, культуризм, пауэрлифтинг и другие. Орнитин также помогает обрести красивые формы за счёт своей способности ускорять сжигание жиров, что ценно при сушке тела.
Усиленные физические нагрузки и избыток белковой пищи ведут к высокой концентрации конечных метаболитов, то есть продуктов распада, отравляющих организм спортсмена. И здесь диаминовалериановая кислота приходит на помощь, помогая выводить вредные вещества, тем самым облегчая работу печени. Хотя орнитин и вырабатывается организмом, однако при интенсивных занятиях потребность в нём возрастает и собственного производства оказывается недостаточно.
Кроме того, отмечаются антиболевые, иммунокорректирующие, ранозаживляющие и энергетические свойства орнитина, восстанавливающее и укрепляющее воздействие на сухожилия и связки.
Приём орнитина способствует нормализации кислотно-основного состояния, что очень ценно при больших мышечных нагрузках, чреватых накоплением молочной кислоты и ацидозом. Его успокаивающее влияние на нервную систему также может быть полезным для спортсменов, подверженных частым стрессам и высоким психоэмоциональным нагрузкам.
Литература:
https://leveton.su/ornitin/
Входит в состав следующих препаратов:
ОПЫТ ПРИМЕНЕНИЯ ОРНИТИНА АСПАРТАТА (ГЕПА-МЕРЦ) И ПРОБИОТИКА БИОФЛОРУМ ФОРТЕВ ЛЕЧЕНИИ НЕТЯЖЕЛЫХ ФОРМ АЛКОГОЛЬНОЙ И НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ | Ильченко
1. Агеева Е.А., Алексеенко С.А. Опыт применения пероральной формы препарата «L-орнитин-L-аспартат» при гипераммониемии у больных с хроническими заболеваниями печени на доцирротической стадии. Клин. перспект. гастроэнтерол. гепатол. 2015; 6: 24-26. Ageyeva Ye.A., Alekseyenko S.A. Application of the oral «L-ornithineL-aspartate» at hyperammoniemia at chronic liver diseases at precirrhotic stage. Clin. Prospekts Gastroenterol. Gepatol. 2015; 6: 24-26 [In Russian].
2. Богомолов П.О., Буеверов А.О., Уварова О.В., Мациевич М.В. Гипераммониемия у пациентов с заболеваниями печени на доцирротической стадии: возможно ли это? Клин. перспект. гастроэнтерол. гепатол. 2015; 5: 3-8. Bogomolov P.O., Bueverov S.A., Uvarov O.V., Matsievich M.V. Hyperammonemia in patients with liver disease at dotsirroticheskoy stage: is it possible? Promising clinical gastroenterology hepatology 2015; 5: 3-8 [In Russian].
3. Дисбиоз кишечника. Руководство по диагностике и лечению. под ред. проф. Е.И. Ткаченко, проф. А.Н. Суворова. Спб.; Спецлит. 2007. 238 с. Tkachenko E.I., Suvorov A.N. Intestinal dysbiosis. Diagnostic and treatment manual. Spb.; SpeсLit. 2007. 238 p [In Russian].
4. Ильченко Л.Ю., Шапошникова Н.А., Винницкая Е.В., Петраков А.В., Карлович Т.И. Ранняя диагностика и лечение печеночной энцефалопатии у больных хроническими заболеваниями печени. Гепатология. 2005; 5: 4-9. Ilchenko L.Yu., Shaposhnikova N.A., Vinnytsia E.V., Petrakov A.V., Karlovic T.I. Early diagnosis and treatment of hepatic encephalopathy in patients with chronic liver disease. Hepatology. 2005; 5: 4-9 [In Russian].
5. Огурцов П.П., Нужный В.П. Экспресс-диагностика (скрининг) хронической алкогольной интоксикации у больных соматического профиля. Клин. фармакол. тер. 2001; 1: 34-39. Ogurtcov P.P., Nuzhnyi V.P. Express-diagnostics (screening), chronic alcohol intoxication in patients with somatic profile. Clinical Pharmacology and Therapeutics. 2001; 1: 34-39 [In Russian].
6. Осипенко М.Ф., Редькина А.В., Бикбулатова Е.К. и др. Оценка L-орнитин-L-аспартата (Гепа-Мерц) в комплексном лечении неалкогольного стеатогепатита. Consillium Medicum. Гастроэнтерол. 2010; 1: 35-38. Osipenko M.F., Redkina A.V., Bikbulatova E.K. et al. Evaluation of l-ornithine-l-aspartate in the treatment of NASH. Consilium Medicum Gastroenterol. 2010; 1: 35-38 [In Russian].
7. Соловьева Г.А., Кваченюк Е.Л. Гепа-Мерц в лечении алкогольного и неалкогольного стеатогепатита. Лекарства Украины. 2011; 7: 64-70. Solovieva G.A., Kvachenyuk E.L. Hepa-Merz in the treatment of alcoholic and non-alcoholic steatohepatitis. Medications Ukraine. 2011; 7: 64-70 [In Russian].
8. Bedossa PFLIP Pathology Consortium. Utility and appropriateness of the fatty liver inhibition of progression (FLIP) algorithm and steatosis, activity, and fibrosis (SAF) score in the evaluation of biopsies of nonalcoholic fatty liver disease. Hepatol. 2014; 60: 565-575.
9. Bellentani S., Saccoccio G., Masutti F. et al. Prevalence of and risk factors for hepatic steatosis in Northern Italy. Ann. Intern. Med. 2000; 132: 12-117.
10. Hauser W., Schnur M., Steder-Neukamm U. et al. Validation of the German version of the chronic liver disease Questionnaire. Europ. J. Gastroenterol. Hepatol. 2004; 16: 599-606.
11. EASL Clinical Practical Guidelines: Management of Alcoholic Liver Disease. J. Hepatol. 2012; 57: 399-420.
12. EASL-EASD-EASO Clinical Practice Guidelines for the management of non-alcoholic fatty liver disease. Obes. Facts. 2016; 9: 65-90.
13. Fedchuk L., Nascimbeni F., Pais R. et al. Performance and limitations of steatosis biomarkers in patients with nonalcoholic fatty liver disease. Aliment. Pharmacol. Ther. 2014; 40: 1209-1222.
14. Grungreiff K., Lambert-Baumann J. Efficacy of L-ornithine-L-aspartate granules in the treatment of chronic liver disease. Med. Welt. 2001; 52: 219-226.
15. Liu Y.L., Reeves H.L., Burt A.D. et al. TM6SF2 rs58542926 influences hepatic fibrosis progression in patients with non-alcoholic fatty liver disease. Nat. Commun. 2014; 5: 4309-4314.
16. Loomba R., Sanyal A.J. The global NAFLD epidemic. Rev. Recent. Clin. Trials. 2014; 9: 126-133.
17. McGee R.G., Bakens A., Wiley K. et al. Probiotics for patients with hepat¬ic encephalopathy (Review) The Cochrane Library 2011, Issue 11. (URL: http://www.thecochranelibrary.com (Дата обращения: 24.06.2016 г.).
18. Non-Alcoholic Fatty Liver Disease: A Practical Guide. ed. G.C. Farrell, A.J. McCullough, Ch.P. Day. Wiley-Blackwell. 2013. 324 p.
19. Ong J.P., Aggarwal A., Krieger D. et al. Correlation between ammonia levels and the severity of hepatic encephalopathy. Am. J. Med. 2003; 114: 188-193.
20. Parekh P.J., Balart L.A. Ammonia and its role in the pathogenesis of hepatic encephalopathy. Clin. Liver Dis. 2015; 19: 529-537.
21. Ratziu V., Bellentani S., Cortez-Pinto H., Day C., Marchesini G. A position statement on NAFLD/NASH based on the EASL 2009 special Conference. J. Hepatol. 2010; 53: 372-384.
22. Valenti L., Al-Serri A., Daly A.K. et al. Homozygosity for the patatin-like phospholipase-3/adiponutrin I148M polymorphism influences liver fibrosis in patients with nonalcoholic fatty liver disease. Hepatol. 2010; 51: 1209-1217.
23. Vilstrup H., Amodio P., Bajaj J. et al. Hepatic encephalopathy in chronic liver disease: 2014 practice guideline by the American association of the study of liver diseases and the European association for the study of the liver. Hepatol. 2014; 60: 715-734.
24. Younossi Z.M., Guyatt G., Kiwi M. et al. Development of a disease specific questionnaire to measure health related quality of life in patients with chronic liver disease. Gut. 1999; 45: 295-300.
Обзор, применение, побочные эффекты, меры предосторожности, взаимодействия, дозировка и отзывы
Acharya, SK, Bhatia, V., Sreenivas, V., Khanal, S., and Panda, SK Эффективность L-орнитина L-аспартата при острой болезни печеночная недостаточность: двойное слепое рандомизированное плацебо-контролируемое исследование. Гастроэнтерология 2009; 136 (7): 2159-2168. Просмотреть аннотацию.
Ахмад, И., Хан, А.А., Алам, А., Дилшад, А., Батт, А.К., Шафкат, Ф., Малик, К., и Сарвар, С. Эффективность инфузии L-орнитина-L-аспартата в печеночная энцефалопатия.J.Coll.Physitors Surg.Pak. 2008; 18 (11): 684-687. Просмотреть аннотацию.
Feher J, Lang I Gogl A Varga L Varga L Tompos G Pronai L. Влияние инфузии орнитина-аспартата на повышенную концентрацию аммиака в сыворотке крови у пациентов с циррозом печени — результаты рандомизированного плацебо-контролируемого двойного слепого многоцентрового исследования. Монитор медицинской науки. 1997; 3 (5): 669-673.
Кирхейс, Г., Нилиус, Р., Хельд, К., Берндт, Х., Бюхнер, М., Гортельмейер, Р., Хендрикс, Р., Крюгер, Б., Куклински, Б., Мейстер, Х. ., Otto, HJ, Rink, C., Rosch, W., and Stauch, S. Терапевтическая эффективность инфузий L-орнитин-L-аспартата у пациентов с циррозом и печеночной энцефалопатией: результаты плацебо-контролируемого двойного слепого исследования . Гепатология 1997; 25 (6): 1351-1360. Просмотреть аннотацию.
Ковальский П. и Бенецкий М. Исследование фармакокинетики и биодоступности L-орнитин-L-аспартата у здоровых добровольцев — сравнительное исследование двух пероральных препаратов. J.Pharm.Biomed.Anal. 6-7-2006; 41 (3): 1061-1064. Просмотреть аннотацию.
Миттал В. В., Шарма Б. К., Шарма П. и Зарин С. К. Рандомизированное контролируемое исследование, сравнивающее лактулозу, пробиотики и L-орнитин L-аспартат в лечении минимальной печеночной энцефалопатии. Eur.J. Гастроэнтерол.Гепатол. 2011; 23 (8): 725-732. Просмотреть аннотацию.
Ндраха, С., Хасан, И. и Симадибрата, М. Влияние L-орнитина, L-аспартата и аминокислот с разветвленной цепью на энцефалопатию и статус питания при циррозе печени с недоеданием. Acta Med.Indones. 2011; 43 (1): 18-22.Просмотреть аннотацию.
Ong, JP, Oehler, G., Kruger-Jansen, C., Lambert-Baumann, J., and Younossi, ZM. Оральный L-орнитин-L-аспартат улучшает качество жизни, связанное со здоровьем, у пациентов с циррозом и печеночной энцефалопатией : открытое проспективное многоцентровое обсервационное исследование. Clin.Drug Investig. 2011; 31 (4): 213-220. Просмотреть аннотацию.
Poo, JL, Gongora, J., Sanchez-Avila, F., Aguilar-Castillo, S., Garcia-Ramos, G., Fernandez-Zertuche, M., Rodriguez-Fragoso, L., and Uribe, M. .Эффективность перорального L-орнитин-L-аспартата у пациентов с циррозом и гипераммонемической печеночной энцефалопатией. Результаты рандомизированного контролируемого лактулозой исследования. Ann.Hepatol. 2006; 5 (4): 281-288. Просмотреть аннотацию.
Stauch, S., Kircheis, G., Adler, G., Beckh, K., Ditschuneit, H., Gortelmeyer, R., Hendricks, R., Heuser, A., Karoff, C., Malfertheiner, P ., Mayer, D., Rosch, W., and Steffens, J. Оральная терапия хронической печеночной энцефалопатии L-орнитин-L-аспартатом: результаты плацебо-контролируемого двойного слепого исследования.J.Hepatol. 1998; 28 (5): 856-864. Просмотреть аннотацию.
Абид С., Джафри В., Мумтаз К. и др. Эффективность L-орнитин-L-аспартата в качестве адъювантной терапии у пациентов с циррозом печени и печеночной энцефалопатией. Дж. Колл Врачи Сург Пак 2011; 21: 666-71. Просмотреть аннотацию.
Alehagen U, Alexander J, Aaseth J. Добавка с селеном и коэнзимом Q10 снижает сердечно-сосудистую смертность у пожилых людей с низким уровнем селена. Вторичный анализ рандомизированного клинического исследования. PLoS One. 1 июля 2016 г .; 11 (7): e0157541.Просмотреть аннотацию.
Альварес-да-Силва М.Р., де Араужо А., Вичензи Дж. Р. и др. Пероральный L-орнитин-L-аспартат при минимальной печеночной энцефалопатии: рандомизированное двойное слепое плацебо-контролируемое исследование. Hepatol Res 2014; 44: 956-63. Просмотреть аннотацию.
Бай М., Хе Ц, Инь З и др. Рандомизированное клиническое испытание: L-орнитин-L-аспартат значительно снижает повышение концентрации аммиака в венах после TIPSS. Алимент Pharmacol Ther 2014; 40: 63-71. Просмотреть аннотацию.
Бай М., Ян З., Ци Х и др.L-орнитин-L-аспартат при печеночной энцефалопатии у пациентов с циррозом печени: метаанализ рандомизированных контролируемых исследований. J Gastroenterol Hepatol 2013; 28: 783-92. Просмотреть аннотацию.
Goh ET, Stokes CS, Sidhu SS, Vilstrup H, Gluud LL, Morgan MY. L-онритин L-аспартат для профилактики и лечения печеночной энцефалопатии у людей с циррозом печени. Кокрановская база данных Syst Rev.2018, 15 мая; 5: CD012410. Просмотреть аннотацию.
Микульски Т., Дабровски Дж., Хильджер В. и др. Влияние добавок с аминокислотами с разветвленной цепью и аспартатом орнитина на аммиак в плазме и утомление центральной нервной системы во время упражнений у здоровых мужчин.Folia Neuropathol 2015; 53: 377-86. Просмотреть аннотацию.
Перес Эрнандес JL, Игера-де-ла-Тиера F, Серральде-Суньига AE, Abdo Francis JM. Критический анализ исследований, оценивающих эффективность инфузии L-орнитина L-аспартата при клинической печеночной энцефалопатии у пациентов с печеночной недостаточностью. Энн Хепатол 2011; 10 Дополнение 2: S66-9. Просмотреть аннотацию.
Рис С., Оппонг К., Мардини Н. и др. Влияние L-орнитин-L-аспартата на пациентов с TIPS и без них, подвергающихся провокации глутамином: двойное слепое плацебо-контролируемое исследование.Gut 2000; 47: 571-4 .. Просмотреть аннотацию.
Schmid M, Peck-Radosavljevic M König F Mittermaier C Gangl A Ferenci P. Двойное слепое рандомизированное плацебо-контролируемое исследование внутривенного L-орнитин-L-аспартата для постурального контроля у пациентов с циррозом печени. Liver Int. 2010; 30 (4): 574-582. Просмотреть аннотацию.
Шалимар, Ачарья СК. Тактика при острой печеночной недостаточности. Журнал J Clin Exp Hepatol 2015; 5: S104-15. Просмотреть аннотацию.
Шарма К., Пант С., Мисра С. и др. Влияние рифаксимина, пробиотиков и l-орнитина-l-аспартата на минимальную печеночную энцефалопатию: рандомизированное контролируемое исследование.Сауди Дж. Гастроэнтерол 2014; 20: 225-32. Просмотреть аннотацию.
Вараканахалли С., Шарма BC, Шривастава С., Сачдева С., Дахале А.С. Вторичная профилактика печеночной энцефалопатии при циррозе печени: двойное слепое рандомизированное контролируемое исследование L-орнитина L-аспартата по сравнению с плацебо. Eur J Gastroenterol Hepatol. 2018 30 апреля. Посмотреть аннотацию.
Waghray A, Waghray N, Mullen K. Ведение скрытой печеночной энцефалопатии. Журнал J Clin Exp Hepatol 2015; 5: S75-81. Просмотреть аннотацию.
Zhu GQ, Shi KQ, Huang S и др.Систематический обзор с сетевым метаанализом: сравнительная эффективность и безопасность вмешательств у пациентов с явной печеночной энцефалопатией. Алимент Фармакол Тер 2015; 41: 624-35. Просмотреть аннотацию.
Какова роль L-орнитина L-аспартата (LOLA) в лечении печеночной энцефалопатии (HE)?
Баттерворт РФ. Нейростероиды при печеночной энцефалопатии: новые идеи и новые терапевтические возможности. Дж. Стероид Биохим Мол Биол . 2016 июн. 160: 94-7.[Медлайн].
Луо М., Гуо Дж.Й., Цао В.К. Воспаление: новая цель современных методов лечения печеночной энцефалопатии при циррозе печени. Мир Дж. Гастроэнтерол . 2015 7 ноября. 21 (41): 11815-24. [Медлайн].
Patidar KR, Bajaj JS. Скрытая и явная печеночная энцефалопатия: диагностика и лечение. Клин Гастроэнтерол Гепатол . 2015 13 ноября (12): 2048-61. [Медлайн].
Shawcross DL, Dunk AA, Jalan R, et al.Как диагностировать и лечить печеночную энцефалопатию: согласованное заявление о ролях и обязанностях, выходящих за рамки специалиста по печени. Eur J Гастроэнтерол Hepatol . 2016 28 февраля (2): 146-52. [Медлайн].
Riggio O, Efrati C, Catalano C и др. Высокая распространенность спонтанного портально-системного шунтирования при персистирующей печеночной энцефалопатии: исследование случай-контроль. Гепатология . 2005 ноябрь 42 (5): 1158-65. [Медлайн].
Альви А.А., Пичардо Дж., Гупта С., Гоял П., Маттана Дж.Интересный случай врожденного внутрипеченочного порто-печеночного шунта как причины необъяснимой энцефалопатии. Cureus . 2020 11 апреля 12 (4): e7639. [Медлайн]. [Полный текст].
Poordad FF. Обзорная статья: бремя печеночной энцефалопатии. Алимент Фармакол Тер . 2007 25 февраля Дополнение 1: 3–9. [Медлайн].
Бустаманте Дж., Римола А., Вентура П. Дж. И др. Прогностическое значение печеночной энцефалопатии у больных циррозом печени. Дж. Гепатол . 1999 Май. 30 (5): 890-5. [Медлайн].
Ференци П. Печеночная энцефалопатия. Haubrich WS, Schaffner F, Berk JE, ред. Бокус Гастроэнтерология . 5-е изд. Филадельфия, Пенсильвания: У. Б. Сондерс; 1995. 1998-2003 гг.
Volk ML, Tocco RS, Bazick J, Rakoski MO, Lok AS. Повторная госпитализация пациентов с декомпенсированным циррозом печени. Ам Дж. Гастроэнтерол . 2012 Февраль 107 (2): 247-52. [Медлайн]. [Полный текст].
Степанова М, Мишра А, Венкатесан С, Юноси З.М.Смертность в больницах и экономическое бремя, связанное с печеночной энцефалопатией в США с 2005 по 2009 год. Clin Gastroenterol Hepatol . 2012 сентября, 10 (9): 1034-41.e1. [Медлайн].
Баджадж Дж. С., Уэйд Дж. Б., Гибсон Д. П. и др. Многогранное бремя цирроза и печеночной энцефалопатии для пациентов и лиц, осуществляющих уход. Ам Дж. Гастроэнтерол . 2011 сентябрь 106 (9): 1646-53. [Медлайн].
Ференци П., Локвуд А., Маллен К. и др.Печеночная энцефалопатия — определение, номенклатура, диагностика и количественная оценка: заключительный отчет рабочей группы на 11-м Всемирном конгрессе гастроэнтерологов, Вена, 1998. Гепатология . 2002 марта, 35 (3): 716-21. [Медлайн].
Brusilow SW. Гипераммонемическая энцефалопатия. Медицина (Балтимор) . 2002 май. 81 (3): 240-9. [Медлайн].
Донован Дж. П., Шафер Д. Ф., Шоу Б. В. Мл. И др. Отек мозга и повышение внутричерепного давления при хроническом заболевании печени. Ланцет . 1998 7 марта. 351 (9104): 719-21. [Медлайн].
Баттерворт РФ. Патогенез печеночной энцефалопатии: новые выводы из нейровизуализации и молекулярных исследований. Дж. Гепатол . 2003 августа 39 (2): 278-85. [Медлайн].
Chatauret N, Баттерворт РФ. Влияние печеночной недостаточности на межорганный трафик аммиака: последствия для лечения печеночной энцефалопатии. Дж Гастроэнтерол Гепатол . 2004 г.19: S219-223.
Stahl J. Исследования аммиака крови при заболеваниях печени. Его диагностическое, прогностическое и терапевтическое значение. Энн Интерн Мед. . 1963, январь, 58: 1–24. [Медлайн].
Шафер Д.Ф., Джонс Е.А. Печеночная энцефалопатия и нейромедиаторная система гамма-аминомасляной кислоты. Ланцет . 2 января 1982 г. (8262): 18-20. [Медлайн].
Ahboucha S, Баттерворт РФ. Патофизиология печеночной энцефалопатии: новый взгляд на ГАМК с молекулярной точки зрения. Метаб Мозг Дис . 2004 декабря 19 (3-4): 331-43. [Медлайн].
Баттерворт РФ. Астроцитарный («периферический тип») бензодиазепиновый рецептор: роль в патогенезе портальной системной энцефалопатии. Нейрохим Инт . 2000 апр. 36 (4-5): 411-6. [Медлайн].
Ahboucha S, Pomier-Layrargues G, Mamer O, et al. Повышенные уровни прегненолона и его нейроактивного метаболита аллопрегнанолона в тканях мозга пациентов с циррозом, умерших в печеночной коме. Нейрохим Инт . 2006 Сентябрь 49 (4): 372-8. [Медлайн].
Bajaj JS, Schubert CM, Heuman DM, et al. Сохранение когнитивных нарушений после разрешения явной печеночной энцефалопатии. Гастроэнтерология . 2010 июн 138 (7): 2332-40. [Медлайн]. [Полный текст].
Sotil EU, Gottstein J, Ayala E, Randolph C, Blei AT. Влияние предоперационной явной печеночной энцефалопатии на нейрокогнитивную функцию после трансплантации печени. Трансплантация печени . 2009 15 февраля (2): 184-92. [Медлайн].
Гарсия-Мартинес Р., Ровира А., Алонсо Дж. И др. Печеночная энцефалопатия связана с когнитивной функцией и объемом мозга после трансплантации. Трансплантация печени . 2011 17 января (1): 38-46. [Медлайн].
Blei AT, Cordoba J, Комитет параметров практики Американского колледжа гастроэнтерологии. Печеночная энцефалопатия. Ам Дж. Гастроэнтерол . 2001 июл.96 (7): 1968-76. [Медлайн].
Каппус MR, Bajaj JS. Скрытая печеночная энцефалопатия: не такая уж минимальная, как вы думаете. Клин Гастроэнтерол Гепатол . 2012 10 ноября (11): 1208-19. [Медлайн].
Munoz SJ. Вождение автомобиля с минимальной печеночной энцефалопатией: последствия в реальном мире ?. Ам Дж. Гастроэнтерол . 2007 сентябрь 102 (9): 1910-1. [Медлайн].
Bajaj JS, Hafeezullah M, Hoffmann RG, et al. Нарушение навыков навигации: еще одно измерение трудностей вождения при минимальной печеночной энцефалопатии. Гепатология . 2008 Февраль 47 (2): 596-604. [Медлайн].
Bajaj JS, Saeian K, Schubert CM, et al. Минимальная печеночная энцефалопатия связана с автомобильными авариями: реальность за пределами экзамена по вождению. Гепатология . 2009 Октябрь 50 (4): 1175-83. [Медлайн]. [Полный текст].
Bajaj JS, Cordoba J, Mullen KD, et al. Обзорная статья: дизайн клинических испытаний печеночной энцефалопатии — консенсус Международного общества печеночной энцефалопатии и метаболизма азота (ISHEN). Алимент Фармакол Тер . 2011 Апрель 33 (7): 739-47. [Медлайн].
Буркхард П.Р., Делавель Дж., Дю Паскье Р., Спар Л. Хронический паркинсонизм, связанный с циррозом: отдельная разновидность приобретенной гепато-церебральной дегенерации. Арка Нейрол . 2003 Апрель 60 (4): 521-8. [Медлайн].
Кок Б, Фокстон MR, Клаф C, Shawcross DL. Рифаксимин является эффективным средством лечения паркинсонического фенотипа печеночной энцефалопатии. Гепатология . 2013 Октябрь 58 (4): 1516-7. [Медлайн].
Caldwell C, Werdiger N, Jakab S и др. Использование модели для точек исключения терминальной стадии заболевания печени для ранней трансплантации печени и успешного лечения миелопатии печени с обзором литературы. Трансплантация печени . 2010 июл.16 (7): 818-26. [Медлайн].
Конн Хо, Россл М, Леви Л, Глокер FX. Портосистемная миелопатия: спастический парапарез после портосистемного шунтирования. Сканд Дж Гастроэнтерол . 2006 май. 41 (5): 619-25. [Медлайн].
Сингхал А., Нагараджан Р., Кумар Р. и др. Магнитно-резонансная Т2-релаксометрия и 2D L-коррелированная спектроскопия у пациентов с минимальной печеночной энцефалопатией. Дж. Магнитно-резонансная томография . 2009 30 ноября (5): 1034-41. [Медлайн]. [Полный текст].
Кулисевский Дж., Пуйоль Дж., Баланцо Дж. И др. Паллидная гиперинтенсивность на магнитно-резонансной томографии у пациентов с циррозом печени: клинические корреляции. Гепатология . 1992 16 декабря (6): 1382-8. [Медлайн].
Stewart CA, Reivich M, Lucey MR, et al. Нейровизуализация при печеночной энцефалопатии. Клин Гастроэнтерол Гепатол . 2005 3 марта (3): 197-207. [Медлайн].
Маллен К.Д., Дасарати С. Печеночная энцефалопатия. Schiff ER, Sorrell MF, Maddrey WC, eds. Болезни печени Шиффа . 8-е изд. Филадельфия, Пенсильвания: Липпинкотт-Рэйвен; 1999. 545-81.
Гай С., Танцер-Торрес Г., Палезе М. и др.Снижает ли назоэнтеральная нутритивная поддержка смертность после трансплантации печени? Гепатология . 1995. 22: 144A.
Кордова Дж., Лопес-Хеллин Дж., Планас М. и др. Нормальная белковая диета при эпизодической печеночной энцефалопатии: результаты рандомизированного исследования. Дж. Гепатол . 2004 Июль 41 (1): 38-43. [Медлайн].
Gluud LL, Dam G, Les I, et al. Аминокислоты с разветвленной цепью для людей с печеночной энцефалопатией. Кокрановская база данных Syst Rev .2015 17 сентября. 9: CD001939. [Медлайн].
Sharma P, Agrawal A, Sharma BC, Sarin SK. Профилактика печеночной энцефалопатии при остром кровотечении из варикозно расширенных вен: рандомизированное контролируемое испытание лактулозы по сравнению с отсутствием лактулозы. Дж Гастроэнтерол Гепатол . 2011 июн. 26 (6): 996-1003. [Медлайн].
Фредерик РТ. Современные концепции патофизиологии и лечения печеночной энцефалопатии. Гастроэнтерол Гепатол (N Y) . 2011 апр.7 (4): 222-33. [Медлайн].
Сатьянараяна У., Чакрапани У. Углеводы. Биохимия . 4-е изд. Нью-Дели, Индия: Эльзевир; 2013. Глава 2.
Als-Nielsen B, Gluud LL, Gluud C. Невсасывающиеся дисахариды при печеночной энцефалопатии: систематический обзор рандомизированных исследований. BMJ . 2004 г., 1 мая. 328 (7447): 1046. [Медлайн].
Prasad S, Dhiman RK, Duseja A, Chawla YK, Sharma A, Agarwal R.Лактулоза улучшает когнитивные функции и качество жизни, связанное со здоровьем, у пациентов с циррозом печени с минимальной печеночной энцефалопатией. Гепатология . 2007 Март 45 (3): 549-59. [Медлайн].
Mittal VV, Sharma BC, Sharma P, Sarin SK. Рандомизированное контролируемое исследование, сравнивающее лактулозу, пробиотики и L-орнитин L-аспартат в лечении минимальной печеночной энцефалопатии. Eur J Гастроэнтерол Hepatol . 2011 23 августа (8): 725-32. [Медлайн].
Шарма BC, Sharma P, Agrawal A, Sarin SK.Вторичная профилактика печеночной энцефалопатии: открытое рандомизированное контролируемое исследование лактулозы по сравнению с плацебо. Гастроэнтерология . 2009 Сентябрь 137 (3): 885-91, 891.e1. [Медлайн].
Agrawal A, Sharma BC, Sharma P, Sarin SK. Вторичная профилактика печеночной энцефалопатии при циррозе: открытое рандомизированное контролируемое исследование лактулозы, пробиотиков и отсутствия терапии. Ам Дж. Гастроэнтерол . 2012 Июль 107 (7): 1043-50. [Медлайн].
Sharma P, Sharma BC, Agrawal A, Sarin SK.Первичная профилактика явной печеночной энцефалопатии у пациентов с циррозом: открытое рандомизированное контролируемое исследование лактулозы по сравнению с отсутствием лактулозы. Дж Гастроэнтерол Гепатол . 2012 августа, 27 (8): 1329-35. [Медлайн].
Gluud LL, Dam G, Borre M, et al. Лактулоза, рифаксимин или аминокислоты с разветвленной цепью при печеночной энцефалопатии: какие доказательства ?. Метаб Мозг Дис . 2013 июн.28 (2): 221-5. [Медлайн].
Мас А., Родес Дж., Суньер Л. и др.Сравнение рифаксимина и лактита при лечении острой печеночной энцефалопатии: результаты рандомизированного двойного слепого контролируемого клинического исследования с двойной фиксацией. Дж. Гепатол . 2003 января 38 (1): 51-8. [Медлайн].
Miglio F, Valpiani D, Rossellini SR и др. Рифаксимин, неабсорбируемый рифамицин, для лечения печеночной энцефалопатии. Двойное слепое рандомизированное исследование. Curr Med Res Opin . 1997. 13 (10): 593-601. [Медлайн].
Bajaj JS.Обзорная статья: потенциальные механизмы действия рифаксимина при лечении печеночной энцефалопатии и других осложнений цирроза. Алимент Фармакол Тер . 2016, 43 января, приложение 1: 11–26. [Медлайн].
Басс Н.М., Маллен К.Д., Саньял А. и др. Лечение рифаксимином при печеночной энцефалопатии. N Engl J Med . 2010 25 марта. 362 (12): 1071-81. [Медлайн].
Sidhu SS, Goyal O, Mishra BP, Sood A, Chhina RS, Soni RK.Рифаксимин улучшает психометрические характеристики и качество жизни, связанное со здоровьем, у пациентов с минимальной печеночной энцефалопатией (исследование RIME). Ам Дж. Гастроэнтерол . 2011 Февраль 106 (2): 307-16. [Медлайн].
Кирхейс Г., Нилиус Р., Хелд С. и др. Терапевтическая эффективность инфузий L-орнитин-L-аспартата у пациентов с циррозом и печеночной энцефалопатией: результаты плацебо-контролируемого двойного слепого исследования. Гепатология . 1997 июн.25 (6): 1351-60.[Медлайн].
Delcker AM, Jalan R, Comes G. Сравнение L-орнитин-1-аспартата с плацебо при лечении печеночной энцефалопатии: метаанализ рандомизированных плацебо-контролируемых исследований с использованием индивидуальных данных. Гепатология . 2000. 32: 310A.
Marchesini G, Fabbri A, Bianchi G и др. Добавки цинка и аминокислотно-азотный обмен у пациентов с запущенным циррозом печени. Гепатология . 1996 май. 23 (5): 1084-92. [Медлайн].
Bresci G, Parisi G, Banti S. Ведение печеночной энцефалопатии с пероральным приемом цинка: долгосрочное лечение. Eur J Med . 1993 август-сентябрь. 2 (7): 414-6. [Медлайн].
Мина Р.К., Г.С., Сараванан П., П.К., Рамадосс К., А.В. Уровень цинка в сыворотке крови при декомпенсированном заболевании печени и его корреляция со стадией печеночной энцефалопатии. Дж. Ассошиэйтед врачей Индия . 2019 января 67 (1): 30-2. [Медлайн]. [Полный текст].
Sushma S, Dasarathy S, Tandon RK и др.Бензоат натрия в лечении острой печеночной энцефалопатии: двойное слепое рандомизированное исследование. Гепатология . 1992 16 июля (1): 138-44. [Медлайн].
Batshaw ML, MacArthur RB, Tuchman M. Альтернативная терапия для нарушений цикла мочевины: двадцать лет спустя. Дж. Педиатр . 2001, январь 138 (1 приложение): S46-54; обсуждение S54-5. [Медлайн].
Габрил М., Зупанец И.А., Вирлинг Дж. И др. Глицерин фенилбутират у пациентов с циррозом и эпизодической печеночной энцефалопатией: пилотное исследование безопасности и влияния на концентрацию аммиака в венах. Clin Pharmacol Drug Dev . 2013 Июль 2 (3): 278-84. [Медлайн].
Rockey DC, Vierling JM, Mantry P, et al, для исследовательской группы HALT-HE. Рандомизированное двойное слепое контролируемое исследование фенилбутирата глицерина при печеночной энцефалопатии. Гепатология . 2014 Март 59 (3): 1073-83. [Медлайн].
Malaguarnera M, Pistone G, Elvira R и др. Эффекты L-карнитина у пациентов с печеночной энцефалопатией. Мир Дж. Гастроэнтерол .2005, 7 декабря, 11 (45): 7197-202. [Медлайн].
Терриен Дж., Роуз С., Баттерворт Дж. И др. Защитный эффект L-карнитина при энцефалопатии, вызванной аммиаком, у крыс, подвергнутых шунтированию через портакавальный шунт. Гепатология . 1997 25 марта (3): 551-6. [Медлайн].
Spahr L, Coeytaux A, Giostra E, et al. Блокатор гистамина h2 гидроксизин улучшает сон у пациентов с циррозом и минимальной печеночной энцефалопатией: рандомизированное контролируемое пилотное исследование. Ам Дж. Гастроэнтерол . 2007 апр. 102 (4): 744-53. [Медлайн].
Fanelli F, Salvatori FM, Rabuffi P, et al. Ведение рефрактерной печеночной энцефалопатии после установки TIPS: отдаленные результаты сокращения шунта с помощью стент-графта, расширяемого баллоном в форме песочных часов. AJR Ам Дж. Рентгенол . 2009 декабрь 193 (6): 1696-702. [Медлайн].
Trebicka J, Bastgen D, Byrtus J, et al. Стенты, покрытые трансъюгулярным внутрипеченочным портосистемным шунтом меньшего диаметра, увеличивают выживаемость. Клин Гастроэнтерол Гепатол . 2019 17 (13) декабря: 2793-2799.e1. [Медлайн]. [Полный текст].
Баттерворт РФ. От редакции: рифаксимин и минимальная печеночная энцефалопатия. Ам Дж. Гастроэнтерол . 2011 Февраль 106 (2): 317-8. [Медлайн].
Weissenborn K, Ennen JC, Schomerus H, Ruckert N, Hecker H. Нейропсихологическая характеристика печеночной энцефалопатии. Дж. Гепатол . 2001 Май. 34 (5): 768-73. [Медлайн].
Bajaj JS, Hafeezullah M, Franco J, et al.Контрольный тест на подавление для диагностики минимальной печеночной энцефалопатии. Гастроэнтерология . 2008 ноябрь 135 (5): 1591-1600.e1. [Медлайн].
Bajaj JS, Thacker LR, Heuman DM, et al. Приложение для смартфона Stroop — это краткий и действенный метод выявления минимальной печеночной энцефалопатии. Гепатология . 2013 Сентябрь 58 (3): 1122-32. [Медлайн].
Ватанабе А., Сакаи Т., Сато С., Имаи Ф, Ото М., Аракава Ю. Клиническая эффективность лактулозы у пациентов с циррозом печени с субклинической печеночной энцефалопатией и без нее. Гепатология . 1997 26 декабря (6): 1410-4. [Медлайн].
Groeneweg M, Quero JC, De Bruijn I, et al. Субклиническая печеночная энцефалопатия нарушает повседневную работу. Гепатология . 1998 июл.28 (1): 45-9. [Медлайн].
Роман Э, Кордова Дж, Торренс М. и др. Минимальная печеночная энцефалопатия связана с падениями. Ам Дж. Гастроэнтерол . 2011 Март 106 (3): 476-82. [Медлайн].
Kircheis G, Knoche A, Hilger N, et al.Печеночная энцефалопатия и способность управлять автомобилем. Гастроэнтерология . 2009 ноябрь 137 (5): 1706-15.e1-9. [Медлайн].
Bajaj JS, Hafeezullah M, Hoffmann RG, Saeian K. Минимальная печеночная энцефалопатия: средство для несчастных случаев и нарушений правил дорожного движения. Ам Дж. Гастроэнтерол . 2007 сентябрь 102 (9): 1903-9. [Медлайн].
Bajaj JS, Heuman DM, Wade JB, et al. Рифаксимин улучшает характеристики симулятора вождения в рандомизированном исследовании пациентов с минимальной печеночной энцефалопатией. Гастроэнтерология . 2011 Февраль 140 (2): 478-87.e1. [Медлайн]. [Полный текст].
Коэн С.М., Ким А., Метропулос М., Ан Дж. Правовые последствия для врачей пациентов, которые водят машину с печеночной энцефалопатией. Клин Гастроэнтерол Гепатол . 2011 Февраль 9 (2): 156-60. [Медлайн].
Нарделли С., Аллампати С., Риджио О. и др. Печеночная энцефалопатия связана со стойкими нарушениями обучаемости, несмотря на адекватное лечение: многоцентровое международное исследование. Dig Dis Sci . 2017 Март 62 (3): 794-800. [Медлайн].
Хассанеин Т. Текущее состояние знаний о печеночной энцефалопатии (часть IV): Управление печеночной энцефалопатией с помощью систем поддержки печени. Метаб Мозг Дис . 2017 Апрель, 32 (2): 303-6. [Медлайн].
Брюнель М., Серсте Т., Либерт В. и др. Улучшение параметров архитектуры сна у пациентов с циррозом печени с рецидивирующей печеночной энцефалопатией при применении рифаксимина. Eur J Гастроэнтерол Hepatol . 2017 29 марта (3): 302-8. [Медлайн].
Ким СК, Беликофф Б.Г., Гевара С.Дж., Парк С.Дж. Алгоритм ведения после установки трансъюгулярного внутрипеченочного портосистемного шунта по клиническим проявлениям. Dig Dis Sci . 2017 Февраль 62 (2): 305-18. [Медлайн].
Мораталла А., Ампуэро Дж., Беллот П. и др. Лактулоза снижает транслокацию бактериальной ДНК, что ухудшает нейрокогнитивную форму у пациентов с циррозом и минимальной печеночной энцефалопатией. Печень Инт . 2017 Февраль 37 (2): 212-23. [Медлайн].
Alsahhar JS, Rahimi RS. Обновленная информация о патофизиологии и терапевтических целях при печеночной энцефалопатии. Курр Опин Гастроэнтерол . 2019 май. 35 (3): 145-54. [Медлайн].
Kerbert AJC, Jalan R. Последние достижения в понимании и лечении печеночной энцефалопатии при хроническом заболевании печени. F1000Res . 2020. 9: [Medline]. [Полный текст].
[Рекомендации] Вилструп Х., Амодио П., Баджадж Дж. И др.Печеночная энцефалопатия при хроническом заболевании печени: Практическое руководство 2014 г. Американской ассоциации по изучению заболеваний печени и Европейской ассоциации по изучению печени. Гепатология . 2014 Август 60 (2): 715-35. [Медлайн].
L-орнитин L-аспартат при явной печеночной энцефалопатии — Просмотр полного текста
A. Введение и обзор литературы
Печеночная энцефалопатия (HE) в широком смысле определяется как изменение психического статуса и когнитивной функции, возникающее при печеночной недостаточности.Клиническая картина ПЭ возникает как осложнение хронического, реже острого заболевания печени. HE возникает примерно у 70% пациентов с циррозом печени в какой-то момент в течение их болезни (1,2). Для него характерны изменения личности, интеллектуальные нарушения и пониженный уровень сознания. HE может быть клинически незаметным (минимальная HE), обнаруженная с помощью аномальных нейропсихометрических или нейрофизиологических тестов (3). Обычное проявление — явная ПЭ, которая возникает у пациентов с запущенным циррозом печени с портально-системным коллатеральным кровообращением.Эпизоды HE у пациентов с циррозом печени вызваны провоцирующими факторами, такими как обезвоживание, гипокалиемия, потребление большого количества белка, желудочно-кишечное кровотечение, запор, инфекции, прием психотропных препаратов, прием алкоголя или острое повреждение печени (гепатит).
Патогенез печеночной энцефалопатии У пациентов с циррозом печени усиление структурного замещения гепатоцитов соединительной тканью приводит к потере функционирующей паренхиматозной ткани печени и снижению способности печени к детоксикации.Кроме того, развивающаяся портальная гипертензия приводит к образованию коллатерального кровообращения, через которое недетоксифицированная кровь может пройти через печень и достичь системного кровообращения. Оба эти механизма способствуют тому, что нейротоксины, присутствующие в крови воротной вены, достигают головного мозга через системный кровоток. В патогенез HE вовлечен ряд нейротоксинов, наиболее важным из которых является аммиак (4,5). Фундаментальные концептуальные достижения в нашем понимании печеночной энцефалопатии подтвердили центральную роль аммиака в патогенезе портосистемной энцефалопатии.Аммиак нарушает функцию нейронов и астроцитов, вызывая симптомы печеночной энцефалопатии.
Классификация / степень HE можно разделить на тип A (при острой печеночной недостаточности), B (при портосистемных шунтах без внутреннего заболевания печени) и C (пациенты с циррозом и портальной гипертензией / или портосистемными шунтами) (5,6). При циррозе печени HE типа C подразделяется на эпизодическую, стойкую и минимальную. Пациенты с хронической стойкой явной ПЭ — это пациенты, которые могут быть относительно стабильными с небольшими ежедневными колебаниями своего психического статуса.Пациенты с эпизодической (нестабильной) ПЭ определяются как пациенты, которые ранее были стабильны, но у которых в течение нескольких часов, а возможно и дней развиваются клинически различимые признаки ПЭ, требующие медицинской помощи и госпитализации. Минимальная HE клинически не проявляется и выявляется аномальными нейропсихометрическими или нейрофизиологическими тестами (3).
Точная градация HE важна для прогнозирования и планирования соответствующего подхода к лечению. По степени тяжести HE традиционно разделяют на четыре стадии на основе изменений состояния сознания, интеллектуальной функции, поведения и нервно-мышечных признаков (шкала West Haven) (5).
Недавно была предложена новая классификация, получившая название SONIC (7). Это было необходимо, потому что дифференциация между минимальной HE и HE степени I ненадежна, но существует хорошая воспроизводимость между экспертами при идентификации HE степени II. Было предложено объединить пациентов с минимальной ПЭ и ПЭ I степени. В нем подчеркивается, что ухудшение когнитивной функции является континуумом, а не категорией, как подчеркивалось на 11-м Всемирном конгрессе в Вене.Он классифицирует пациентов с циррозом как здоровых и с нарушенной нейрокогнитивной функцией. Нарушение когнитивной функции подразделяется на скрытое HE (минимальное HE и HE степени I) и явное HE (уровни II-IV). Таким образом, он включает критерии Вест-Хейвена, но подчеркивает преемственность, а не категоричность. Нейрокогнитивные функции ослабленных, нестабильных пациентов могут колебаться от острого синдрома спутанности сознания до комы (степени от I до IV). Это пациенты с так называемой эпизодической ПЭ типа С.
Терапия печеночной энцефалопатии Основная цель терапии HE заключается в (а) уменьшении кишечных токсинов, продуцируемых чрезмерной бактериальной активностью, и уменьшении выработки аммиака или (б) повышении детоксикации аммиака (1,2,8,9).
Уменьшение производства аммиака:
Энтеросолюбильное производство аммиака можно уменьшить с помощью неабсорбируемых дисахаридов, таких как лактулоза или лактит, и неабсорбируемых антибиотиков, таких как рифаксимин.Лактулоза / лактитол проходят через тонкую кишку непереваренными. В толстой кишке бактерии разлагают лактулозу до различных органических кислот (например, молочной кислоты, уксусной кислоты) с последующим снижением pH толстой кишки. Режим снижения содержания аммиака может включать бактериостатические эффекты, катарсические эффекты или усиление превращения аммиака в аммоний с избытком иона водорода. Предположительно, аммоний затем выводится с калом и выводится (9, 10). Лактулоза остается основным средством терапии явной ПЭ, несмотря на немногочисленность и непоследовательность клинических испытаний, демонстрирующих ее эффективность (11).Дозировка должна быть скорректирована таким образом, чтобы совершать два-три мягких испражнения каждый день. Лактулозу можно вводить через назогастральный зонд или с помощью удерживающих клизм. Обычная доза составляет 30-120 мл каждый день в несколько приемов. PH стула должен быть ниже шести. Побочные эффекты включают вздутие живота и метеоризм. При слишком высокой дозировке возникает тяжелая диарея с обезвоживанием, гипергликемией и ацидозом.
Невсасывающиеся антибиотики Неомицин, метронидазол и паромомицин являются традиционными антибиотиками для лечения HE (12).Из-за ототоксических и нефротоксических побочных эффектов неомицин в настоящее время используется нечасто. Метронидазол не вызывает особых побочных эффектов, но терапия не должна длиться более двух недель, чтобы избежать нейропатии. Совсем недавно было продемонстрировано, что рифаксимин не уступает лактулозе (13) или лактитолу (14, 15) пациентам с печеночной энцефалопатией.
- Повышение детоксикации аммиака:
Уровень аммиака можно снизить с помощью детоксикации. L-орнитин-L-аспартат (LOLA), соль природных аминокислот орнитина и аспартата, действует через механизм активации субстрата для детоксикации аммиака.Подробный механизм действия и клинические испытания LOLA обсуждаются ниже.
L-орнитин-L-аспартат (LOLA):
L-орнитин-L-аспартат (LOLA) представляет собой соль природных аминокислот орнитина и аспартата.
Механизм действия:
LOLA стимулирует цикл мочевины (который превращает аммиак в мочевину) в печени (16,17). В перипортальных гепатоцитах, которые синтезируют мочевину, орнитин служит активатором орнитинтранскарбамоилазы и карбамоилфосфатсинтетазы.Кроме того, орнитин может действовать как субстрат для образования мочевины. Следовательно, LOLA может активировать перипортальный цикл мочевины в печени. Аспартат и орнитин после преобразования в альфа-кетоглутарат также служат источниками углерода для перивенального синтеза глутамина. В скелетных мышцах LOLA активирует синтез глутамина за счет предоставления субстрата для глутаминсинтетазы, хотя снижение мышечной массы при циррозе не позволяет этому синтезу быть значительным. Аммиак расходуется во время образования мочевины и синтеза глутамина, и, таким образом, LOLA снижает уровень аммиака в крови.Мочевина и глутамин (после дальнейшего метаболизма) могут выводиться через почки. Таким образом, LOLA активирует два важных метаболических пути в организме человека для детоксикации аммиака. При циррозе остается некоторая масса клеток печени, которая сохраняет способность выводить токсины из аммиака, в отличие от острой печеночной недостаточности.
Испытания LOLA при печеночной энцефалопатии:
LOLA используется в течение многих лет для лечения HE при циррозе печени, особенно при минимальной и явной хронической HE низкой степени злокачественности.Клиническая эффективность LOLA уже была всесторонне исследована и сообщена в терапевтических наблюдениях, клинических испытаниях (16, 18-25) и метаанализе (26,27). В этих исследованиях было зарегистрировано использование LOLA в виде инфузии, перорального приема или их комбинации у пациентов с печеночной недостаточностью от легкой до тяжелой степени. LOLA продемонстрировала статистически значимый эффект в отношении улучшения психического состояния (снижение степени HE), усиление детоксикации (снижение концентрации аммиака в крови) и положительное влияние на психомоторную функцию (сокращение времени, необходимого для теста соединения чисел. ) при минимальной печеночной энцефалопатии и явной хронической печеночной энцефалопатии I-II степени и острой явной HE.Благодаря этим результатам критерии доказательной медицины для демонстрации эффективности были выполнены.
В недавнем рандомизированном плацебо-контролируемом исследовании, проведенном в Карачи (25), пациенты с острой HE были рандомизированы для получения LOLA или плацебо. Оценивали NCT-A, уровень аммиака, клиническую степень HE и продолжительность госпитализации. Улучшение HE было выше (n = 40, 66,7%) в группе LOLA (n = 28, 46,7%, p = 0,027). Продолжительность госпитализации была меньше в группе LOLA по сравнению с плацебо (p = 0.025). Ни в одной из групп побочных эффектов не наблюдалось.
Побочные эффекты LOLA L-орнитин-L-аспартат обычно хорошо переносятся (18-25). В ходе клинических испытаний до сих пор не сообщалось о серьезных побочных эффектах. Различные побочные эффекты, зарегистрированные примерно у 14% пациентов, получавших LOLA, включают:
- Тошнота
- Рвота
- Усталость
Б.Материалы и методы
Дизайн исследования и постановка:
Это будет проспективное рандомизированное двойное слепое плацебо-контролируемое интервенционное исследование.
Исследование будет проводиться на пациентах с циррозом печени, поступивших с явной HE в отделение гастроэнтерологии, Медицинский колледж и больница Даянанда, Лудхиана, и отделение гепатологии, госпиталь GB Pant, Нью-Дели. Информированное согласие должно быть получено от ближайшего родственника пациента для включения в исследование.
Исследование должно быть представлено на утверждение в комитет по этике учреждения до включения пациентов в исследование. Он должен быть зарегистрирован в Реестре клинических испытаний Индии и в реестре ClinicalTrials.gov.
Исследуемая популяция:
Критерии включения и исключения упоминались в другом месте.
Методы исследования:
Задание: Последовательные пациенты с диагнозом острой явной HE будут рандомизированы на две группы (группы A и B) с использованием запечатанных непрозрачных конвертов, содержащих случайные числа, сгенерированные компьютером.Не должно быть никаких ограничений, блокировок или стратификации последовательности рандомизации. Координатор исследования, который будет генерировать последовательность, не должен иметь никакого отношения к набору, лечению или оценке пациентов.
Маскирование: последовательно пронумерованные коробки, содержащие идентичные ампулы LOLA или плацебо, в соответствии с последовательностью распределения обеспечат маскирование распределения. Нумерация ящиков будет производиться координатором исследования и скрыта от лечащих консультантов.Весь исследовательский персонал будет не осведомлен о назначении лечения (плацебо или LOLA) на время исследования. Плацебо и LOLA будут похожи по внешнему виду и способу введения. Код последовательности распределения останется у координатора исследования. Это станет известно только после того, как будет проведен набор, сбор данных и анализ результатов. Координатор не будет иметь доступа к пациентам, участвующим в исследовании.
Внедрение рандомизации: набор пациентов, оценка правомочности и получение информированного согласия будет проводиться одним из исследователей (С.S. Sidhu или O. Goyal, BC Sharma) Вмешательство в исследование: Пациенты будут рандомизированы для получения плацебо или LOLA в дозе 30 г в день путем внутривенной инфузии в течение 24 часов. (Исследуемые препараты и плацебо будут предоставлены Win Medicare Pvt Ltd., 1400, Modi tower, 98, Nehru Place, New Delhi- 110019). LOLA будет поставляться в виде ампул (каждая ампула содержит 5 граммов LOLA в 10 мл прозрачного раствора). Шесть ампул (т.е. 30 г LOLA) будут введены в течение 24 часов. Флаконы с плацебо (10 мл стерильной воды в каждом флаконе) будут поставляться и вливаться одинаково.Доза LOLA (30 г за 24 часа) была основана на предыдущих исследованиях, показывающих эффективность этой дозы в снижении уровня аммиака (17,26,28). Обе группы будут получать лечение в течение 5 дней. Пациенты в обеих группах, у которых сохраняется печеночная энцефалопатия в конце периода исследования (5 дней), получат стандартное лечение и будут проконсультированы по поводу трансплантации печени.
Лабораторные испытания:
Биохимические тесты: Гемограмма, уровень глюкозы в крови, функциональные пробы печени, протромбиновое время, электролиты сыворотки, мочевина крови и креатинин сыворотки будут выполнены на исходном уровне, а также на 2-й и 5-й день лечения или раньше, если показано.При поступлении будет проведен анализ сывороточного АФП. Уровни цитокинов в сыворотке (интерлейкин 1, 6, 10 и TNF-альфа) определяют на исходном уровне и через 5 дней лечения.
Микробиологические тесты: Всем пациентам с асцитом на исходном уровне будет проводиться диагностический парацентез для диагностики спонтанного бактериального перитонита. Повторный подсчет клеток (общий и дифференциальный) следует проводить на 5-й день у пациентов с диагнозом спонтанный бактериальный перитонит. Необходимо сделать посев крови, посев мочи, посев аспиратов из эндотрахеальных трубок у пациентов, находящихся на ИВЛ, на наличие аэробных и анэробных бактерий и грибков.Также должна быть сделана рентгенограмма грудной клетки.
Оценка аммиака: Уровни аммиака в венах натощак будут оцениваться с помощью измерителя аммиака в крови (PocketChem BA) вначале, а затем ежедневно в течение следующих 5 дней. Аммиакомер PocketChem BA — это прибор для быстрого определения содержания аммиака в крови у постели больного. Было показано, что он имеет приемлемую точность, адекватную линейность и удовлетворительное согласие с ферментативным эталонным методом, обычно используемым в клинических лабораториях (29).
Принцип измерения: PocketChem BA измеряет содержание аммиака в крови на основе метода микродиффузии.Когда образец крови (20 микролитров) наносится на принимающий образец слой тестовой области на тест-полоске, пропитанный в этом слое щелочной буферный агент (боратный буфер) растворяется, делая образец щелочным. Ионы аммония в образце газифицируются в щелочном состоянии в газообразный аммиак. Газообразный аммиак проходит через поры спейсера к индикатору (бромкрезоловому зеленому), вызывая появление цвета. Поскольку степень развития цвета пропорциональна концентрации выделяемого газообразного аммиака, уровень аммиака в крови количественно определяется путем измерения цвета.
Тесты для этиологической оценки: Этиология цирроза печени будет принята как алкоголь, если в анамнезе имеется значительное потребление алкоголя (40-60 г / день для женщин и 60-80 г / день для мужчин в течение 10 лет). Каждый пациент будет проверен на наличие поверхностного антигена гепатита B (HbsAg) и антител против гепатита C (HCV) с использованием коммерческого ИФА третьего поколения. Где показано, аутоиммунный гепатит будет диагностирован с использованием антинуклеарных антител, антител против гладких мышц и анти-LKM; и гемохроматоз с использованием сывороточного железа, TIBC, ферритина и насыщения трансферрина.Каждому пациенту следует пройти ультразвуковое исследование брюшной полости. При наличии показаний будет проведена эндоскопия UGI.
Стандарт медицинской помощи Лечение:
Стандарт медицинской помощи пациентам с циррозом печени и явной острой энцефалопатией должен быть предоставлен всем пациентам.
- Необходимо выявить другие возможные причины изменения психического состояния, например, травмы головы или наркотического опьянения.
- Выявление и лечение основных причин энцефалопатии, таких как сепсис, желудочно-кишечное кровотечение, гипокалиемия (уровень калия в сыворотке <3.5 мэкв / л), алкалоз, азотемия, обезвоживание, мочегонные средства, запор, потребление большого количества белка и психоактивных препаратов.
- Сироп лактулозы: 30-120 мл в три приема через назогастральный зонд / перорально для получения 2-3 полуформированных стула и / или клизм для удержания лактулозы (300 мл лактулозы +700 мл воды) два раза в день. Этим пациентам нельзя давать никакие другие средства, снижающие содержание аммиака.
Мониторинг и сопровождение:
Клинический мониторинг:
Все пациенты будут помещены в отделение интенсивной терапии / отделение интенсивной терапии и переведены в палату, как только они вернутся к первой степени HE.Необходимо проводить постоянный мониторинг основных показателей жизнедеятельности. Неврологический мониторинг должен проводиться два раза в день, а оценка психического состояния будет производиться в соответствии с критериями Вест-Хейвена.
Определение ответа на терапию:
Оценка клинического ответа будет определяться следующим образом:
- Разрешение: исчезновение клинического синдрома ПЭ при исследовании
- Улучшение: снижение ВО на 1 балл, но не до 0 балла
- Нет улучшений: нет улучшений в HE
- Неудача: переход на более высокую степень ВО.
Биохимический мониторинг:
Биохимический мониторинг и мониторинг уровней аммиака должны выполняться, как указано выше (в разделе «лабораторные испытания»)
Мониторинг нежелательных явлений:
Любое нежелательное явление будет регистрироваться с указанием времени начала, продолжительности, тяжести и связи с исследуемым лекарством.
Переносимость: Переносимость исследуемого препарата будет оцениваться путем сравнения полного количества клеток крови, тестов функции печени и тестов функции почек в начале и в конце лечения.
Конечные точки:
Первичная конечная точка
1. Завершение 5 дней лечения
Вторичная конечная точка
- Смерть, связанная с печенью
- Смерть по другим причинам
- Прекращение приема из-за побочных эффектов
- Выписка из больницы
- Размер выборки: размер выборки для этого исследования был оценен с использованием результатов предыдущего исследования, в котором сообщалось о полном выздоровлении энцефалопатии у 79% пациентов в группе LOLA и у 55.6% пациентов в группе плацебо (25). При 80% мощности и 5% уровне значимости (двусторонний) 71 пациент в каждой группе должен был бы обнаружить 22% разницу в пропорциях. Предполагая, что процент выбывания составляет примерно 15% (28), нам нужно будет зарегистрировать 164 пациента, то есть 82 в каждой группе лечения.
- Статистический анализ: критерий хи-квадрат будет использоваться для сравнения доли пациентов с полным обращением HE через 5 дней в группах лечения LOLA и плацебо. Также будет рассчитан 95% доверительный интервал для разницы в пропорциях.Затем будет использован критерий хи-квадрат для сравнения оценок HE через 5 дней между группами. Уровни аммиака в крови будут сравниваться между группами с использованием t-критерия независимых образцов; в то время как продолжительность пребывания в больнице не будет иметь нормального распределения и поэтому будет сравниваться с использованием непараметрического критерия Манна-Уитни. Все статистические тесты будут двусторонними и с 5% уровнем значимости.
L-орнитин L-аспартат для людей с хроническим заболеванием печени и печеночной энцефалопатией (плохое функционирование мозга)
Предпосылки
Цирроз — хроническое заболевание печени.У людей с этим заболеванием обычно развивается печеночная энцефалопатия — осложнение, которое приводит к плохому функционированию мозга. У некоторых людей с циррозом развиваются очевидные клинические признаки нарушения функционирования мозга, такие как трудности с речью, равновесием и повседневным функционированием; говорят, что у них явных печеночных энцефалопатий; изменения могут быть кратковременными, могут повторяться или сохраняться в течение длительного времени. Другие люди с циррозом печени могут не демонстрировать очевидных клинических изменений, но при тестировании обнаруживается, что некоторые аспекты функции их мозга, такие как внимание и способность выполнять сложные задачи, нарушены; говорят, что у них минимальная печеночная энцефалопатия.Причина, по которой у людей развивается печеночная энцефалопатия, сложна, но ключевую роль играет накопление в крови токсинов из кишечника, особенно соединения, называемого аммиаком. L-орнитин L-аспартат снижает уровень аммиака в крови и, таким образом, может оказывать благотворное влияние на людей с печеночной энцефалопатией или помогать им останавливать ее развитие.
Обзорный вопрос
Мы исследовали использование L-орнитина L-аспартата, вводимого перорально (перорально) или в вену в виде жидкости (внутривенно) для профилактики и лечения печеночной энцефалопатии, изучив клинические испытания в какие люди с циррозом были случайным образом распределены для лечения L-орнитин L-аспартатом, для неактивного манекена (называемого плацебо), для отсутствия лечения или для лечения этого состояния другим лекарством, таким как лактулоза, пробиотики и рифаксимин.Мы включили участников с циррозом печени, у которых была явная или минимальная печеночная энцефалопатия или у которых был риск развития этого осложнения.
Дата поиска
Декабрь 2017 г.
Источники финансирования исследования
Шесть из 36 рандомизированных клинических испытаний, которые мы включили, не получали финансирования или какой-либо другой поддержки со стороны фармацевтических компаний. Семнадцать испытаний получили финансовую поддержку от фармацевтических компаний, а еще три получили L-орнитин L-аспартат или неактивное плацебо бесплатно; по оставшимся 10 исследованиям информации о финансировании не было.
Характеристики исследования
Мы включили 33 рандомизированных клинических испытания, сравнивающих L-орнитин L-аспартат с неактивным плацебо или отсутствием вмешательства, и шесть рандомизированных клинических испытаний, сравнивающих L-орнитин L-аспартат с другими противоэнцефалопатическими методами лечения; некоторые испытания включали более одного сравнения. Пять из включенных испытаний тестировали L-орнитин L-аспартат для предотвращения печеночной энцефалопатии, а 30 испытаний проверяли его использование в качестве лечения людей с острой, хронической или минимальной печеночной энцефалопатией.Продолжительность лечения варьировала от трех до 35 дней в испытаниях препарата для внутривенного введения (в среднем восемь дней) и от семи до 180 дней в исследованиях препарата для перорального введения (в среднем 30 дней).
Ключевые результаты
Наш анализ показал, что L-орнитин L-аспартат может снизить смертность, улучшить печеночную энцефалопатию и предотвратить серьезные побочные эффекты по сравнению с плацебо или отсутствием лечения, но что он не имеет дополнительных положительных эффектов по сравнению с другими лекарствами используется для предотвращения и лечения этого состояния.
Качество доказательств
Доказательства, которые мы обнаружили, были очень слабыми, и поэтому мы не уверены, что L-орнитин L-аспартат может использоваться для профилактики или лечения печеночной энцефалопатии у людей с циррозом. Многие исследования были неопубликованными и поэтому не подвергались тщательной проверке, а многие из опубликованных исследований получили поддержку со стороны фармацевтической промышленности, что вносит элемент предвзятости. Соответственно, требуется больше информации, прежде чем можно будет определить ценность L-орнитина L-аспартата для профилактики и лечения печеночной энцефалопатии.
Преодоление порочного цикла
Саркопения — частое осложнение цирроза, которое отрицательно влияет на исход после трансплантации, качество жизни, связанное со здоровьем (HRQOL), и выживаемость пациентов. Исследования на экспериментальных животных и пациентах демонстрируют, что аммиак напрямую участвует в патогенезе саркопении при циррозе через механизмы, включающие повышенную экспрессию миостатина и маркеров аутофагии, таких как липидирование LC3 и p62, что приводит к дисметаболизму мышц и саркопении.Парадоксально, но скелетные мышцы заменяют печень в качестве основного участка детоксикации аммиака в результате модификации генов, кодирующих ключевые белки, участвующие в метаболических путях снижения уровня аммиака при циррозе. Таким образом, возникает порочный круг, когда гипераммонемия вызывает серьезное повреждение мышц и саркопению, что, в свою очередь, ограничивает способность мышц удалять избыток аммиака, переносимого с кровью, и цикл продолжается. Рандомизированные клинические испытания и метаанализы подтверждают, что L-орнитин L-аспартат (LOLA) является эффективным средством, снижающим содержание аммиака, используемым в настоящее время для лечения печеночной энцефалопатии (HE), которое стимулирует как синтез мочевины остаточными гепатоцитами, так и синтез мышечного глутамина вместе с предполагаемые гепатопротекторные действия.Лечение пациентов с циррозом печени с помощью LOLA ограничивает вызванную аммиаком саркопению за счет улучшения синтеза и функции мышечного белка. Вполне возможно, что антисаркопеническое действие LOLA способствует его эффективности для лечения HE при циррозе печени.
1. Введение
Саркопения или тяжелое истощение мышц — частое осложнение хронических заболеваний печени, включая неалкогольную жировую болезнь печени (НАЖБП) [1, 2], а также цирроз печени [3, 4], когда это связано с плохим прогнозом с негативным влиянием на выживаемость, качество жизни, связанное со здоровьем, и исходы после трансплантации.Медиана 6-месячной выживаемости пациентов с саркопенией и циррозом печени значительно ниже по сравнению с пациентами без саркопении.
Наличие саркопении является предиктором целого ряда осложнений цирроза центральной нервной системы (ЦНС), которые включают печеночную энцефалопатию (HE) по степени тяжести от минимальной (или скрытой) до более высокой степени, характеризующейся ступором и комой [5], а также HE, связанный с процедурой трансъюгулярного внутрипеченочного шунтирования стента (TIPS) [6].
Настоящая статья представляет собой обзор доказательств в поддержку двойной гипотезы о том, что (1) гипераммонемия запускает порочный круг, в результате которого сниженный синтез мышечного белка и аутофагия, характерная для саркопении, снижает способность мышц удалять переносимый с кровью аммиак, что приводит к обострению болезни. гипераммониемия и (2) лечение аммиачным агентом L-орнитин L-аспартатом (LOLA) может разорвать этот цикл.
2. Саркопения при хроническом заболевании печени: связь с гипераммониемией
Избыточные количества аммиака в нормальных физиологических условиях выводятся почти исключительно печенью либо путем синтеза мочевины перипортальными гепатоцитами, либо путем преобразования в глутамин ферментом глутаминсинтетазой. (GS) расположены в перивенозных гепатоцитах. Эти процессы происходят одновременно. Результаты невропатологических, спектроскопических и визуализационных исследований продолжают поддерживать гипотезу о том, что повышенные концентрации аммиака играют важную роль в патогенезе ЦНС осложнений цирроза [7].При хронических заболеваниях печени эта схема доставки аммиака в печень претерпевает изменения, поскольку серьезно нарушается способность как к синтезу мочевины, так и к продукции глутамина.
В этих условиях скелетные мышцы играют важную роль в удалении аммиака и, в отличие от печени, этот процесс происходит исключительно за счет синтеза глутамина, поскольку мышечные клетки не экспрессируют составляющие ферменты цикла мочевины. Доказательства этого метаболического переключения с печени на мышцы основываются на результатах исследований у пациентов с хронической печеночной недостаточностью.В первом таком исследовании артериовенозные различия аммиака и глутамина были измерены в предплечье у 14 пациентов с декомпенсированным циррозом печени и гипераммониемией. Фракционная экстракция аммиака была значительно снижена у 5 пациентов с выраженным мышечным истощением [8], а артериовенозная для глутамина в группе пациентов была увеличена в несколько раз, что позволяет предположить, что мышцы играют ключевую роль в удалении аммиака у пациентов с циррозом печени и что большая часть аммиака, поглощенного мышцами, высвобождается в виде глютамина.Эти данные были подтверждены в последующем исследовании динамики метаболизма аммиака у пациентов с хроническим заболеванием печени с использованием 13 NH 3 , где наблюдался значительный метаболический захват аммиака мышцами [9].
Молекулярные исследования на экспериментальных животных показывают, что этот альтернативный путь удаления аммиака, вовлекающий скелетные мышцы в хронические заболевания печени, облегчается посттрансляционной индукцией GS [10] вместе с увеличением экспрессии переносчиков аммиака [11].Метаболические преобразования, вовлеченные в альтернативный путь, упрощенно схематично изображены на рисунке 1.
Учитывая доказательства того, что мышцы становятся основным путем удаления аммиака при хроническом заболевании печени, очевидно, что саркопения, вероятно, приведет к ухудшению гипераммониемии. Такое наблюдается в описанных выше исследованиях [8, 9, 12].
Результаты недавних исследований in vitro и моделей на животных показывают, что аммиак сам по себе участвует в патогенезе саркопении при хронических заболеваниях печени.В серии новаторских исследований воздействие аммиака в миллимолярных концентрациях на миотрубки в течение 24 часов приводило к уменьшению диаметра мышечных трубок, снижению синтеза белка и увеличению экспрессии ряда маркеров аутофагии [12]. Затем исследователи продемонстрировали, что удаление аммиака привело к значительному ослаблению и, в некоторых случаях, к полному обращению этих изменений.
Использование хорошо зарекомендовавшего себя крысиного препарата с сквозным портакавальным шунтированием (PCA), рекомендованного Международным обществом печеночной энцефалопатии и метаболизма азота (ISHEN) для изучения механизмов, участвующих в патогенезе хронических заболеваний печени и их осложнений [13], Дасарати и его коллеги продолжили изучение роли гипераммониемии в патогенезе саркопении при хроническом заболевании печени [12].Через неделю после PCA безжировая масса тела, сила захвата, мышечная масса и диаметр мышечных волокон были значительно уменьшены по сравнению с контрольными животными, получавшими парное вскармливание, и эти изменения происходили параллельно со значительным увеличением концентрации аммиака в крови и мышцах.
Результаты аутофагии в скелетных мышцах, опосредованной гипераммониемией, были впоследствии подтверждены в материалах пациентов, что привело к предположению, что такие изменения способствуют саркопении при циррозе [14].
На основании вышеизложенных результатов можно сделать вывод, что при хроническом заболевании печени возникает порочный круг, при котором гипераммонемия, возникающая в результате снижения выведения печенью аммиака в форме мочевины и / или глутамина, вызывает тяжелый мышечный дисметаболизм и аутофагию, характерные для саркопении.Возникающее в результате нарушение функции мышц и потеря альтернативного пути удаления аммиака мышцами при хроническом заболевании печени приводит к обострению гипераммониемии, и цикл продолжается (Рисунки 2 (a) и 2 (b)).
Наличие такого цикла дает правдоподобное объяснение общепринятому клиническому наблюдению, что пациенты с циррозом печени и тяжелой потерей мышечной массы плохо себя чувствуют. В исследовании неотобранной серии пациентов с циррозом, которым была проведена экстренная операция портакавального шунта, тяжелое мышечное истощение было связано с худшим прогнозом выживаемости [9] со значительным негативным влиянием также на качество жизни, исходы после трансплантации и повышенную распространенность. внепеченочных осложнений, в том числе HE.Следовательно, эффективное снижение уровня аммиака в крови может иметь ключевое значение для эффективного лечения саркопении при циррозе [15].
3. LOLA и саркопения при циррозе
LOLA регулярно используется в клинике для эффективного снижения циркулирующего аммиака у пациентов с циррозом, и это было подтверждено в недавнем систематическом обзоре и метаанализе [16]. Ранее было показано, что LOLA снижает содержание аммиака в крови у крыс, у которых гипераммониемия вызвана PCA [17], т.е. на той же животной модели, которая использовалась для демонстрации эффектов гипераммонемии на целостность скелетных мышц [12].Лечение крыс PCA LOLA и добавление антибиотика рифаксимина привело к значительному улучшению безжировой массы тела, силы захвата, массы скелетных мышц и диаметра мышечных волокон в зависимости от заметного снижения концентрации циркулирующего и скелетных мышц аммиака [12]. Скорость синтеза белка в икроножной мышце, которая была значительно снижена после PCA, была улучшена за счет стратегии снижения уровня аммиака.
Эти данные дополняют новый массив доказательств, указывающих на роль LOLA в лечении саркопении при циррозе печени.Например, в метаболическом исследовании 16 пациентов с циррозом и саркопенией, рандомизированных для получения LOLA или плацебо, скорость синтеза мышечного белка, измеренная при чрескожной биопсии anterior tibialis мышцы, значительно улучшилась в группе лечения LOLA [18]. Результаты этого исследования также продемонстрировали улучшение синтеза мышечного белка в ответ на кормление после лечения LOLA.
4. Механизмы
4.1. Механизмы, связанные с воздействием аммиака на мышцы, ведущие к саркопении
Гипераммонемия приводит к усилению транскрипции миостатина, члена суперсемейства TGF [19], и исследования дифференцированных мышиных миотрубок, подвергшихся воздействию аммиака, или в мышцах крыс с гипераммониемией PCA. Экспрессия миостатина также увеличивалась.Результаты этих исследований также выявили нарушение передачи сигналов к рапамициновому комплексу-1 (mTORC1) у млекопитающих и повышенное фосфорилирование эукариотического фактора инициации 2-альфа (eIF2), репрессора трансляции [20], потенциально способного приводить к снижению синтеза мышечного белка [ 12]. Гипераммонемия также приводила к повышенной экспрессии маркеров аутофагии, таких как липидирование LC3 и экспрессия p62 в белковых экстрактах [12]. Снижение содержания аммиака привело к значительному ослаблению повышающей регуляции экспрессии миостатина и связанного с этим снижения синтеза мышечного белка в экспериментах in vitro и in vivo и, кроме того, привело к отмене повышенных маркеров аутофагии [14].
4.2. Механизмы, связанные с благоприятным воздействием LOLA на саркопению при циррозе печени
Исследования на экспериментальных моделях HE на животных [17], а также на пациентах с циррозом и гипераммониемией [21] последовательно показали, что LOLA эффективна для снижения циркулирующей крови аммиак, что приводит к уменьшению тяжести HE. Ответственный механизм включает печень и скелетные мышцы. Поскольку L-орнитин является ключевым промежуточным продуктом цикла мочевины, он обладает способностью стимулировать превращение аммиака в мочевину остаточными перипортальными гепатоцитами [17].Одновременно с этим аммиак также удаляется в значительной степени за счет повышенного превращения в глутамин, главным образом в мышцах [9, 17] через GS, поскольку трансаминирование L-орнитина обеспечивает глутамат, облигатный субстрат для GS. Посредством этих двух независимых механизмов (синтез мочевины в печени и синтез глутамина в мышцах) лечение LOLA снижает уровень аммиака как в крови, так и в мышцах, что приводит к улучшению фенотипа и функции скелетных мышц вместе с ослаблением вредных молекулярных нарушений, вызванных аммиаком [12].
Однако вполне возможно, что механизмы, отличные от (или в дополнение к) простого действия LOLA по снижению уровня аммиака, вовлечены в благоприятные эффекты LOLA в отношении саркопении при циррозе. Например, появляется все больше доказательств того, что LOLA обладает гепатопротекторными свойствами у пациентов с циррозом печени [22]. Доказательства многогранны и основаны на результатах клинических испытаний LOLA, в которых наблюдается улучшение циркулирующих печеночных трансаминаз и билирубина, а также протромбинового времени [22-25].Об улучшении показателей по шкале Чайлд-Пью и MELD также сообщалось у пациентов с хроническим заболеванием печени, получавших LOLA, у которых улучшение функции печени сопровождалось значительным снижением циркулирующего аммиака, а также улучшением когнитивной функции [23].
Предполагаемые механизмы, предложенные для объяснения гепатопротекторных свойств LOLA, включают антиоксидантные свойства, опосредованные повышенным синтезом глутатиона [26], полученного в результате трансаминирования L-орнитина через глутамат, а также улучшения микроциркуляции в печени в результате повышенного синтеза оксида азота (NO ) [27] в результате повышенного синтеза L-аргинина [21], облигатного субстрата синтазы оксида азота.Хотя необходимы дальнейшие исследования, чтобы определить, участвует ли NO в патогенезе саркопении при циррозе, интересно отметить, что повышенная продукция NO в мышцах, ведущая к S-нитрозилированию кальпаина, приводит к замедлению саркопении при старении [28]. Независимо от того, возникает ли подобный механизм при саркопении, связанной с циррозом, предстоит получить результаты текущих исследований.
5. Выводы
Межорганный перенос аммиака изменяется при хроническом заболевании печени, в результате чего нормальное удаление аммиака печенью в виде мочевины или глутамина уступает место его включению в глутамин скелетными мышцами.Эта метаболическая адаптация является результатом посттрансляционной индукции мышечного GS вместе с повышенной экспрессией транспортера аммиака в мышцах. Как ни парадоксально было показано, что аммиак оказывает вредное воздействие на синтез мышечного белка и приводит к аутофагии. Эти два процесса вместе составляют саркопению.
Создается порочный круг, при котором гипераммониемия вызывает повреждение мышц (саркопению), что ограничивает способность мышц выполнять свою альтернативную функцию снижения уровня аммиака при хронических заболеваниях печени.Доказательства существования цикла с участием оси печень-мышца основываются на результатах экспериментов с использованием методов in vitro , а также в доклинических и предварительных клинических исследованиях у пациентов с циррозом.
LOLA обладает способностью восстанавливать синтез мышечного белка в ответ на кормление у пациентов с циррозом печени, открытие, которое было недавно подтверждено. Механизм, с помощью которого LOLA полезен для лечения саркопении при циррозе, в первую очередь связан с его действием по снижению уровня аммиака.Кроме того, LOLA обладает гепатопротекторными свойствами, опосредованными преобразованием L-орнитина в ключевые субстраты, включая глутамин, глутатион (антиоксидант) и L-аргинин, субстрат для синтазы оксида азота, фермента, ответственного за продукцию NO.
Наконец, основное внимание в настоящем обзоре уделяется потенциальным преимуществам лечения саркопенией при циррозе с помощью LOLA. Тем не менее, появляются новые данные, подтверждающие мнение о том, что он также может быть полезен у пациентов с саркопенией, связанной с НАЖБП / НАСГ [29].Например, в исследовании 463 пациентов с ожирением печени, 29% из которых не употребляли алкоголь, получавших пероральный LOLA в течение 60 дней, было отмечено значительное снижение ферментов печени [30], а в последующем РКИ 72 пациента, получавших пероральная LOLA в течение 12 недель показала значительное дозозависимое снижение трансаминаз вместе со снижением триглицеридов и улучшением соотношения печень / селезенка [31]. В предварительном отчете описывается улучшение микроциркуляции в печени у пациентов с НАСГ, получавших LOLA [32].
Подтверждение этих первоначальных данных о положительном эффекте LOLA для лечения саркопении при хронических заболеваниях печени (как НАЖБП, так и циррозе) теперь необходимо в хорошо контролируемых испытаниях с достаточной мощностью, чтобы продемонстрировать, что монотерапия LOLA обеспечивает эффективное средство. для профилактики и лечения саркопении при этих хронических заболеваниях печени.
Конфликты интересов
Автор выполняет специальных консультационных услуг для Abbott Pharmaceuticals (Швейцария), Merz Pharmaceuticals (Германия) и Ocera Pharmaceuticals (США).
Выражение признательности
Исследовательские проекты и расходы на соответствующие публикации исследовательского подразделения автора финансировались за счет грантов Канадского института исследований в области здравоохранения (CIHR).
L-аспартат, L-орнитин и L-орнитин-L-аспартат (LOLA) и их влияние на энергетический метаболизм мозга
Goh ET, Stokes CS, Sidhu SS, Vilstrup H, Gluud LL (2018) Morgan MY L-орнитин L-аспартат для профилактики и лечения печеночной энцефалопатии у людей с циррозом.Кокрановская база данных Syst Rev 5: CD012410
PubMed Google Scholar
Kircheis G, Wettstein M, Vom Dahl S, Häussinger D (2002) Клиническая эффективность L-орнитина-L-аспартата в лечении печеночной энцефалопатии. Metab Brain Dis 17: 453–462
CAS PubMed Google Scholar
Баттерворт РФ (2019) Положительные эффекты L-орнитина L-аспартата для профилактики явной печеночной энцефалопатии у пациентов с циррозом: систематический обзор с метаанализом.Метаб. Brain Dis. 35: 75–81
PubMed PubMed Central Google Scholar
Rose C, Michalak A, Rao KV, Quack G, Kircheis G, Butterworth RF (1999) L-орнитин-L-аспартат снижает содержание аммиака в плазме и спинномозговой жидкости и предотвращает отек мозга у крыс с острой печеночной недостаточностью. Гепатология 30: 636–640
CAS PubMed Google Scholar
О’Кейн Р.Л., Вина Дж. Р., Симпсон И., Сарагоса Р., Мокаши А., Хокинс Р.А. (2006) Транспорт катионных аминокислот через гематоэнцефалический барьер опосредуется исключительно системой y +.Am J Physiol Endocrinol Metab 291: E412 – E419
PubMed Google Scholar
Stoll J, Wadhwani KC, Smith OR (1993) Идентификация переносчика катионных аминокислот (система y +) гематоэнцефалического барьера крысы. J Neurochem 60: 1956–1959
CAS PubMed Google Scholar
Jäger K, Wolf S, Dobrowolny H, Steiner J, Nave H, Maronde E, Bogerts B, Bernstein HG (2013) Дифференциальная топохимия трех белков-переносчиков катионных аминокислот, hCAT1, hCAT2 и hCAT3, в мозг взрослого человека.Аминокислоты 44: 423–433
PubMed Google Scholar
Haitina T, Lindblom J, Renstrom T, Fredriksson R (2006) Четырнадцать новых человеческих членов семейства митохондриальных переносчиков растворенных веществ 25 (SLC25), широко экспрессируемых в центральной нервной системе. Геномика 88: 779–790
CAS PubMed Google Scholar
Yoneda Y, Roberts E, Dietz GW (1982) Новый синаптосомный путь биосинтеза глутамата и ГАМК из орнитина и его ингибирование с помощью ГАМК по отрицательной обратной связи.J Neurochem 38: 1686–1694
CAS PubMed Google Scholar
Даун Г., Зайлер Н. (1988) Взаимосвязь между орнитином, глутаматом и ГАМК. II. Последствия ингибирования ГАМК-Т и орнитинаминотрансферазы в головном мозге. Neurochem Res 13: 69–75
CAS PubMed Google Scholar
Kurata K, Nagasawa M, Tomonaga S, Aoki M, Morishita K, Denbow DM, Furuse M (2011) Пероральный прием L-орнитина повышает уровни L-орнитина в мозге и оказывает на мышей анксиолитический эффект.Nutr Neurosci 14: 243–248
CAS PubMed Google Scholar
Tetsuka K, Takanaga H, Ohtsuki S, Hosoya KI, Terasaki T (2003) L-изомер-селективный транспорт аспарагиновой кислоты опосредуется ASCT2 на гематоэнцефалическом барьере. J Neurochem 87: 891–901
CAS PubMed Google Scholar
Хосоя К.И., Сугавара М., Асаба Х, Терасаки Т. (1999) Гематоэнцефалический барьер вызывает значительный отток L-аспарагиновой кислоты, но не D-аспарагиновой кислоты.Acid J Neurochem 73: 1206–1211
CAS PubMed Google Scholar
Oppedisano F, Pochini L, Galluccio M, Indiveri C (2007) Транспортер глутамина / аминокислот (ASCT2), восстановленный в липосомах: механизм транспорта, регуляция АТФ и характеристика антипорта глутамина / глутамата. Biochimica et Biophysica Acta (BBA) -. Биомембраны 1768: 291–298
CAS Google Scholar
Bröer A, Brookes N, Ganapathy V, Dimmer KS, Wagner CA, Lang F, Bröer S (1999) Астроглиальный переносчик аминокислот ASCT2 как медиатор оттока глутамина. J Neurochem 73: 2184–2194
PubMed Google Scholar
Toth E, Lajtha A (1981) Повышение мозговых уровней заменимых аминокислот in vivo путем введения больших доз. Neurochem Res 6: 1309–1317
CAS PubMed Google Scholar
Hindmarsh JT, Kilby D, Wiseman G (1966) Влияние аминокислот на всасывание сахара. J Physiol 186: 166–174
CAS PubMed PubMed Central Google Scholar
Шанк Р.П., Кэмпбелл Г.Л. (1983) Орнитин как предшественник глутамата и ГАМК: захват и метаболизм нейрональным и глиальным клеточным материалом. J Neurosci Res 9: 47–57
CAS PubMed Google Scholar
Hertz L, Rothman DL (2017) Поток глутамин-глутаматного цикла аналогичен в культивируемых астроцитах и головном мозге, и производство и окисление глутамата в основном катализируются аспартатаминотрансферазой. Биология 6:17
PubMed Central Google Scholar
Fröhlich D, Suchowerska AK, Voss C, He R, Wolvetang E, von Jonquieres G, Simons C, Fath T, Housley GD, Klugmann M (2018) Паттерн экспрессии аспартил-тРНК синтетазы DARS в человеческий мозг.Front Mol Neurosci 11:81
PubMed PubMed Central Google Scholar
Fröhlich D, Suchowerska AK, Spencer ZHT, von Jonquieres G, Klugmann CB, Bongers A, Delerue F, Stefen H, Ittner LM, Fath T, Housley GD, Klugmann M (2017) Характеристика in vivo аспартил-тРНК синтетаза DARS: определение лейкодистрофии HBSL. Neurobiol Dis 97: 24–35
PubMed Google Scholar
Taft RJ, Vanderver A, Leventer RJ, Damiani SA, Simons C, Grimmond SM, Miller D, Schmidt J, Lockhart PJ, Pope K (2013) Мутации в DARS вызывают гипомиелинизацию с поражением ствола и спинного мозга, а также спастичность ног. Am J Hum Genet 92: 774–780
CAS PubMed PubMed Central Google Scholar
Рэй К., Балкар В. А. (2014) Отрезок старого блока: срез мозга как модель для метаболических исследований компартментации мозга и нейрофармакологии.В: Hirrlinger J, Waagepetersen HS (eds) Энергетический метаболизм мозга. Springer, New York, pp. 217–241
Google Scholar
Rae CD, Davidson JE, Maher AD, Rowlands BD, Kashem MA, Nasrallah FA, Rallipalli SK, Cook JM, Balcar VJ (2014) Этанол, метаболизм в мозге не обнаруживается, значительно снижает метаболизм мозга, вероятно, через действует на специфические рецепторы ГАМК (А) и имеет измеримые метаболические эффекты при очень низких концентрациях.J Neurochem 129: 304–314
CAS PubMed Google Scholar
Le Belle JE, Harris NG, Williams SR, Bhakoo KK (2002) Сравнение методов экстракции клеток и тканей с использованием спектроскопии ЯМР 1H высокого разрешения. ЯМР Биомед 15: 37–44
PubMed Google Scholar
Rowlands BD, Lau CL, Ryall JG, Thomas DS, Klugmann M, Beart PM, Rae CD (2015) Модулятор регулятора 1 тихой информации ресвератрол увеличивает выработку лактата в мозге и подавляет митохондриальный метаболизм, тогда как SRT1720 увеличивает окислительный метаболизм.J Neurosci Res 93: 1147–1156
CAS PubMed Google Scholar
Achanta LB, Rowlands BD, Thomas DS, Housley GD, Rae CD (2017) β-гидроксибутират усиливает метаболизм митохондрий и нейронов, но не предпочтительнее глюкозы в активированных условиях. Neurochem Res 42: 1710–1723
CAS PubMed Google Scholar
Rowlands BD, Klugmann M, Rae CD (2017) Метаболизм ацетата не отражает астроцитарную активность, вносит непосредственный вклад в синтез ГАМК и усиливается активацией регулятора 1 молчащей информации.J Neurochem 140: 903–918
CAS PubMed Google Scholar
Lowry OH, Rosebrough NJ, Farr AL, Randall RJ (1951) Измерение белка с фенольным реагентом Folin. J Biol Chem 193: 265–275
CAS PubMed Google Scholar
Rae C, Lawrance ML, Dias LS, Provis T, Bubb WA, Balcar VJ (2000) Стратегии исследования потенциально нейротоксических механизмов, включающих недостаточный транспорт L-глутамата: антисмысловой нокаут в мозге крысы in vivo и изменения в метаболизме нейромедиаторов после ингибирования транспорта глутамата в срезах мозга морских свинок.Brain Res Bull 53: 373–381
CAS PubMed Google Scholar
Насралла Ф.А., Махер А.Д., Ханрахан Дж.Р., Балкар В.Дж., Рэй С.Д. (2010) γ-гидроксибутират и ГАМКергический след. Метаболомный подход к раскрытию действия GHB. J Neurochem 115: 58–67
CAS PubMed Google Scholar
Maher AD, Solo V, Rae CD (2013) Метаболомика на основе магнитного резонанса для понимания неврологических расстройств: текущее состояние и соображения.Curr Metab 1: 2–14
CAS Google Scholar
Rae CD, Williams SR (2017) Глутатион в мозге человека: обзор его роли и измерение с помощью магнитно-резонансной спектроскопии. Anal Biochem 529: 127–143
CAS PubMed Google Scholar
Furlong TM, Duncan JR, Corbit LH, Rae CD, Rowlands BD, Maher AD, Nasrallah FA, Milligan CJ, Petrou S, Lawrence AJ (2016) Вдыхание толуола крысам-подросткам снижает гибкость поведения во взрослом возрасте и изменяет глутаматергическая и ГАМКергическая передача сигналов.J Neurochem 139: 806–822
CAS PubMed Google Scholar
Erecińska M, Silver IA (1990) Метаболизм и роль глутамата в мозге млекопитающих. Прог Нейробиол 35: 245–296
PubMed Google Scholar
Rae C, Moussa CE-H, Griffin JL, Parekh SB, Bubb WA, Hunt NH, Balcar VJ (2006) Метаболомный подход к функции подтипа ионотропных рецепторов глутамата: исследование ядерного магнитного резонанса in vitro.J Cereb Blood Flow Metab 26: 1005–1017
CAS PubMed Google Scholar
Albrecht J, Hilgier W, Januszewski S, Quack G (1996) Контрастные эффекты повреждения печени, вызванного тиоацетамидом, на показатели поглощения мозгом орнитина, аргинина и лизина: модуляция обработкой орнитина аспартатом. Metab Brain Dis 11: 229–237
CAS PubMed Google Scholar
Vogels B, Karlsen O, Maas M, Boveé W, Chamuleau R (1997) L-орнитин против L-орнитин-L-аспартата как лечение энцефалопатии, вызванной гипераммониемией у крыс. J Hepatol 26: 174–182
CAS PubMed Google Scholar
Столл Б., МакНелли С., Бушер Н.П., Хауссингер Д. (1991) Функциональная гетерогенность гепатоцитов в поглощении глутамата, аспартата и α-кетоглутарата: гистоавторадиографическое исследование. Гепатология 13: 247–253
CAS PubMed Google Scholar
Foulkes EC (1971) Влияние тяжелых металлов на почечный транспорт аспартата и характер движения растворенных веществ в срезах коры почек. Biochim Biophys Acta (BBA) Biomembr 241: 815–822
CAS Google Scholar
Wu F, Orlefors H, Bergstrom M, Antoni G, Omura H, Eriksson B, Watanabe Y, Langstrom B (2000) Поглощение меченных 14C и 11C глутамата, глутамина и аспартата in vitro и in vivo . Anticancer Res 20: 251–256
CAS PubMed Google Scholar
Grover VP, McPhail MJ, Wylezinska-Arridge M, Crossey MM, Fitzpatrick JA, Southern L, Saxby BK, Cook NA, Cox IJ, Waldman AD (2017) Продольное исследование пациентов с циррозом печени, получавших L-орнитин L-аспартат , исследовали с помощью переноса намагниченности, диффузионно-взвешенной визуализации и магнитно-резонансной спектроскопии. Metab Brain Dis 32: 77–86
CAS PubMed Google Scholar
Kakoki M, Kim H-S, Arendshorst WJ, Mattson DL (2004) Поглощение l-аргинина влияет на выработку оксида азота и кровоток в мозговом веществе почек.Am J Physiol-Regul Integr Comp Physiol 287: R1478 – R1485
CAS PubMed Google Scholar
Albrecht J, Hilgier W, Januszewski S, Kapuściński A, Quack G (1994) Увеличение индекса поглощения мозгом L-орнитина у крыс с печеночной энцефалопатией. Нейроотчет 5: 671–673
CAS PubMed Google Scholar
Skowrońska M, Albrecht J (2012) Нарушения функции гематоэнцефалического барьера при гипераммониемии.Overv Neurotox Res 21: 236–244
Google Scholar
Орнитин аспартат — обзор
Печеночная энцефалопатия
Печеночная энцефалопатия может быть определена как нарушение функции центральной нервной системы из-за печеночной недостаточности. Это широкое определение отражает существование спектра нейропсихиатрических проявлений, связанных с нормальным набором патофизиологических механизмов. Эти проявления присутствуют как при острой, так и при хронической печеночной недостаточности и потенциально обратимы.Кратковременная потеря памяти, недостаток концентрации, изменение цикла сна и раздражительность на ранних стадиях могут серьезно повлиять на повседневную деятельность; более запущенное заболевание с летаргией, ступором или комой требует госпитализации и может быть опасным для жизни. Медицинское обслуживание со стороны лица, оказывающего первичную медико-санитарную помощь, имеет первостепенное значение для улучшения качества жизни, а также для обращения вспять потенциально опасного для жизни состояния. Большинство теорий, объясняющих патогенез печеночной энцефалопатии, допускают, что азотистые вещества, поступающие из кишечника, отрицательно влияют на функцию мозга.Эти соединения получают доступ к системному кровообращению в результате снижения функции печени или портосистемных шунтов. 109 Попадая в ткани мозга, они производят изменения нейротрансмиссии, которые влияют на сознание и поведение. Нарушения глутаматергических, серотонинергических, гамма-аминомасляных ацидергических (ГАМКергических) и катехоламиновых путей, среди прочего, были описаны при экспериментальной печеночной энцефалопатии. 109 Большое количество работ указывает на то, что аммиак является ключевым фактором патогенеза печеночной энцефалопатии. 110 При остром и хроническом заболевании печени обычно наблюдается повышенный уровень аммиака в артериальной крови. При молниеносной печеночной недостаточности повышенный уровень артериального давления (> 200 мг / дл аммиака) связан с повышенным риском церебральной грыжи. 111 Однако корреляция уровней в крови с психическим состоянием при циррозе часто бывает неточной.
Подход к печеночной энцефалопатии за последние годы существенно не изменился. Подозрение на печеночную энцефалопатию у пациентов с хроническим заболеванием печени должно побудить к поиску провоцирующих факторов и других причин изменения психического статуса.Общие провоцирующие факторы включают желудочно-кишечное кровотечение, электролитные нарушения, почечную недостаточность, инфекцию, недавнее введение TIPS 112 и использование седативных / снотворных средств, развитие гепатоцеллюлярной карциномы и запор. Также следует учитывать другие менее вероятные причины изменения психического статуса, такие как внутричерепное кровотечение или новообразования, гипогликемия и постиктальное состояние. Печеночная энцефалопатия — это диагноз исключения и в основном клинический. Хотя гипераммониемия связана с печеночной энцефалопатией, уровень аммиака не коррелирует с уровнем энцефалопатии.Электроэнцефалограмма может быть полезна на поздних стадиях, чтобы избежать ошибочного диагноза.
Цели лечения.
Целями лечения печеночной энцефалопатии являются оказание поддерживающей терапии, выявление и устранение провоцирующих факторов, а также снижение азотсодержащей нагрузки в кишечнике. В конечном итоге очень важна оценка потребности в длительной терапии. 113 Пациенты с новым началом или обострением печеночной энцефалопатии должны быть обследованы на предмет обезвоживания, кровотечения из варикозно расширенных вен, спонтанного бактериального перитонита и почечной недостаточности.Помимо этого, следует исключить другие причины резкого изменения психического статуса, такие как внутричерепное кровотечение, новообразование, токсичность лекарств, системная инфекция или аномальный уровень электролитов.
Управление питанием.
Повышенная скорость катаболизма цирроза приводит к рекомендации от 1 до 1,5 г белка / кг в день. 113 Цинк, кофактор ферментов цикла мочевины, может быть дефицитным у пациентов с циррозом печени, особенно если это связано с недоеданием. Добавка цинка улучшает активность цикла мочевины в экспериментальных моделях цирроза печени. 114 В одном испытании оценивалось влияние цинка за короткий период (до 1 недели) без значительного улучшения. 115 В положительном исследовании цинк вводили в течение 3 месяцев, хотя исследование не было рандомизированным. 116 Дефицит цинка спровоцировал энцефалопатию у хорошо описанного пациента. 117 Пациенты с дефицитом цинка должны получать пероральные добавки цинка (см. Главу 34 «Лечение портального гипертонического кровотечения в эпоху трансплантации печени»). 113
Стратегия снижения уровня аммиака.
Невсасывающиеся дисахариды, такие как лактулоза, обычно используются для уменьшения выработки аммиака в кишечнике. Лактулоза увеличивает выведение азота с калом за счет облегчения включения аммиака в бактерии, а также за счет катарсического эффекта. 118 При пероральном введении лактулоза достигает слепой кишки, где она метаболизируется кишечными бактериями, вызывая падение pH. 119 Это падение pH приводит к метаболическому сдвигу у бактерий, способствующему поглощению аммиака.Дозу корректируют таким образом, чтобы ежедневно производить два или три мягких испражнения. 118 Антибиотики, такие как неомицин, также полезны для снижения содержания аммиака в крови, в основном за счет воздействия на производство аммиака кишечными бактериями. Однако терапия неомицином связана со значительными побочными токсическими эффектами. 118
Альтернативной стратегией снижения уровня аммиака в крови является стимуляция фиксации аммиака. 120 В нормальных физиологических условиях аммиак удаляется путем образования мочевины в перипортальных гепатоцитах и путем синтеза глутамина в перивенозных гепатоцитах, скелетных мышцах и головном мозге.При циррозе в печени снижаются ферменты цикла мочевины и активность глутаминсинтетазы. Стратегии стимулирования остаточной активности цикла мочевины и / или синтеза глутамина были опробованы в течение последних 20 лет. Одним из наиболее успешных на сегодняшний день агентов является l-орнитин-1-аспартат (OA). Рандомизированные контролируемые клинические испытания ОА демонстрируют значительное снижение уровня аммиака и сопутствующее улучшение психометрических тестов. 121
Бензоат также эффективен в снижении уровня аммиака в крови как у пациентов с наследственными нарушениями цикла мочевины, так и у пациентов с циррозом печени. 120 В рандомизированном контролируемом клиническом исследовании бензоата натрия по сравнению с лактулозой было обнаружено, что улучшение психоневрологических функций было сопоставимым. 122
Использование препаратов, действующих на центральную нервную систему.
Было проведено несколько контролируемых клинических испытаний для оценки эффективности антагониста бензодиазепиновых рецепторов флумазенила у пациентов с циррозом печени с различной степенью тяжести печеночной энцефалопатии. 120 Захватывающие улучшения психоневрологического статуса были зарегистрированы в подгруппе пациентов, получавших флумазенил. 123, 124 Однако возможные смешивающие эффекты предшествующего воздействия бензодиазепинов и отсутствие корреляции между клинической реакцией и уровнями веществ в крови умерили энтузиазм по поводу этого подхода к антагонистам бензодиазепиновых рецепторов у этих пациентов. 125
Почечная недостаточность и гепаторенальный синдром
Считается, что острая почечная недостаточность часто встречается у пациентов с циррозом, 126 , но ее точная частота варьируется.Пациенты с циррозом печени предрасположены к острой почечной недостаточности из-за таких осложнений, как кровотечение из варикозно расширенных вен или введение нефротоксических препаратов, таких как нестероидные противовоспалительные препараты, антибиотики и дилтиазем. Причина почечной недостаточности может быть преренальной, внутрипочечной или гепаторенальной. Лечение почечной недостаточности у пациентов, ожидающих трансплантации печени, направлено на предотвращение дополнительных повреждений и оптимизацию существующей функции почек. Точная оценка исходной функции почек является обязательной во время начального обследования.Измерения сывороточного креатинина могут неточно отражать основную функцию почек, потому что у пациентов с циррозом часто истощается мышечная масса. Коэффициенты клубочковой фильтрации при использовании иоталамата более точны. После установления исходной функции почек следует избегать дополнительных инсультов. Особое внимание следует уделять статусу объема, который часто бывает незначительным у пациентов с выраженным асцитом, получающих терапию высокими дозами диуретиков. Нестероидные противовоспалительные препараты следует использовать только при тщательном наблюдении, поскольку последующее снижение почечного простагландина может спровоцировать острую почечную недостаточность.К рентгенографическим исследованиям с использованием внутривенного контрастного красителя также следует подходить с осторожностью из-за известного риска почечного повреждения. Использование ацетилцистеина вместе с гидратацией является методом выбора для защиты от нефропатии, вызванной рентгенологическим контрастированием. 127 Парацентез большого объема с последующей внутривенной инфузией альбумина снижает риск острой почечной недостаточности после парацентеза. 88 Результаты использования альбумина в этой клинической обстановке лучше, чем у других расширителей объема, таких как декстран. 128, 129
Более того, у пациентов с циррозом развивается специфическая острая почечная недостаточность, называемая гепаторенальным синдромом (HRS). Это диагноз исключения (Таблица 32-2). HRS — опасное осложнение терминальной стадии болезни печени. Ретроспективные исследования показывают, что HRS присутствует примерно у 17% пациентов, поступивших в больницу с асцитом, и у более чем 50% пациентов с циррозом, которые умирают от печеночной недостаточности. Отличительными признаками HRS являются обратимое сужение почек и легкая системная гипотензия. 130, 131 Почки структурно нормальны, и, по крайней мере, на ранней стадии синдрома канальцевая функция не нарушена, что отражается в высокой задержке натрия и олигурии. 130, 131 Причина почечной вазоконстрикции неизвестна, но может включать как усиление вазоконстриктора, так и снижение вазодилататорных факторов, преимущественно участвующих в его патогенезе. 130, 131 В клинической практике наблюдаются две модели HRS: тип 1 и тип 2.HRS 1 типа — острая форма HRS при тяжелом заболевании печени, которая прогрессирует.
