Хронический лейкоз
Вам поставили диагноз: Хронический лейкоз?Наверняка Вы задаётесь вопросом: что же теперь делать?
Подобный диагноз всегда делит жизнь на «до» и «после». Все эмоциональные ресурсы пациента и его родных брошены на переживания и страх. Но именно в этот момент необходимо изменить вектор «за что» на вектор «что можно сделать». Очень часто пациенты чувствуют себя безгранично одинокими вначале пути. Но вы должны понимать — вы не одни.
Мы поможем вам справиться с болезнью и будем идти с вами рука об руку через все этапы вашего лечения.
Предлагаем вашему вниманию краткий, но очень подробный обзор хронического лейкоза.
Его подготовили высоко квалифицированные специалисты Отдела лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба и Отдела лекарственного лечения опухолей МНИОИ имени П.А. Герцена – филиалов ФГБУ «НМИЦ радиологии» Минздрава России под редакцией заведующих отделами, д.
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Хронический лимфолейкоз (ХЛЛ)— Опухолевое заболевание, морфологическим субстратом которого являются малого размера зрелые В-лимфоциты, обнаруживающиеся преимущественно в крови, костном мозге, лимфатических узлах, селезёнке и печени.
Для установления диагноза ХЛЛ, согласно современным критериям, необходимо наличие трех признаков: абсолютное число лимфоцитов крови не менее 5 х10 9 /л, более 30% лимфоцитов в костном мозге, иммунологическое подтверждение наличия опухолевых лимфоцитов со строго определенными характеристиками, без которого диагноз ХЛЛ не может считаться доказанным, поскольку дифференциальный диагноз с похожими заболеваниями проводится на основании именно иммунофенотипирования .
ХЛЛ — наиболее распространенный вид лейкоза в странах Европы и Северной Америки, где на его долю приходится до 30% всех лейкозов. Ежегодная заболеваемость ХЛЛ в этих странах составляет 3-3,5 случая на 100000 населения в год, при этом среди лиц старше 65 лет – до 20 случаев и старше 70 лет – до 50 на 100000.
Средний возраст заболевших — 65 лет, почти 70% заболевают между 50 и 70 годами, только около 10% — до 40 лет. Мужчины заболевают в 2 раза чаще женщин.
В большинстве случаев на ранних этапах ХЛЛ характеризуется медленным течением с постепенно нарастающим лейкоцитозом, который без лечения может достигать 500-1000 х109/л и более, лимфоцитозом, обычно коррелирующим с уровнем лейкоцитоза и составляющим 70-85-99%. Уровни гемоглобина, числа тромбоцитов на ранних этапах болезни обычно нормальные. При высоком лейкоцитозе и лимфоцитозе — уровни гемоглобина и числа тромбоцитов часто сниженные за счет вытеснения нормального кроветворения лейкозным клоном или присоединения нередких для ХЛЛ аутоиммунных осложнений – аутоиммунной гемолитической анемии и/или тромбоцитопении.
Темпы течения болезни и продолжительность жизни при ХЛЛ колеблются в широких пределах – от 2-3 до 20-30 лет. Медленное развитие в начале болезни – причина того, что у 70% пациентов с ХЛЛ диагностируется при анализе крови, сделанном в связи с другими заболеваниями. Примерно у 15-20% больных клинические и гематологические признаки заболевания остаются стабильными и минимально выраженными без лечения на протяжении многих лет и не влияют на продолжительность жизни.
При медленном прогрессировании ХЛЛ больной остается под наблюдением (выжидательная тактика), сигналом к началу лечения служат:
• Массивная инфильтрация костного мозга лимфоцитами (более 80% лимфоцитов в миелограмме), особенно если при этом имеется снижение уровня эритроцитов и тромбоцитов.
• Быстрое нарастание лимфоцитоза – удвоении абсолютного числа лимфоцитов в крови менее чем за 12 мес.
Химиотерапия хронического лейкоза:В настоящее время препаратом выбора при ХЛЛ являются флударабин и флударабинсодержащие режимы. Схема FCR (флударабин, циклофосфамид, ритуксимаб) является стандартом терапии 1-й линии у молодых пациентов без тяжелой сопутствующей патологии. Хлорамбуцил (лейкеран), в настоящее время остаются стандартом стартовой терапии у пациентов преклонного возраста. Увеличение показателей выживаемости без прогрессирования может быть достигнуто путем добавления к хлорамбуцилу ритуксимаба.
Схема FCR (флударабин, циклофосфамид, ритуксимаб) является стандартом терапии 1-й линии у молодых пациентов без тяжелой сопутствующей патологии. Хлорамбуцил (лейкеран), в настоящее время остаются стандартом стартовой терапии у пациентов преклонного возраста. Увеличение показателей выживаемости без прогрессирования может быть достигнуто путем добавления к хлорамбуцилу ритуксимаба.
Препарат Бендамустин, вследствие своей низкой токсичности иногда является единственной возможностью терапии у пожилых пациентов, а также больных с сопутствующей патологией.
Таргетная (избирательная, точечная) терапия ХЛЛ: Важным шагом в разработке новых методов терапии при ХЛЛ стало добавление к флударабин-содержащим режимам моноклональных антител к антигену CD20 (ритуксимаб, обинотузумаб). В настоящее время лечение большинства пациентов проводится с использованием моноклональных анти-CD-20-антител.
Спектр таргетных препаратов при ХЛЛ расширяется с каждым годом. В настоящее время в России зарегистрирован препарат ибрутиниб (ингибитор тирозинкиназы Брутона) для лечения крайне неблагоприятной группы пациентов ХЛЛ с делецией хромосомы 17р или мутацией ТР53.
ФГБУ «НМИЦ радиологии» Минздрава России обладает всеми необходимыми технологиями лучевого, химиотерапевтического и хирургического лечения, включая расширенные и комбинированные операции. Все это позволяет выполнить необходимые этапы лечения в рамках одного Центра, что исключительно удобно для пациентов.
Отдел лекарственного лечения злокачественных новообразований МРНЦ имени А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующая отделом, д.м.н. ФАЛАЛЕЕВА Наталья Александровна
8 (484) 399 – 31-30, г. Обнинск, Калужской области
Отдел лекарственного лечения опухолей МНИОИ имени П.А. Герцена –филиал ФГБУ «НМИЦ радиологии» Минздрава России
Заведующий отделом, д.м.н. ФЕДЕНКО Александр Александрович
ФЕДЕНКО Александр Александрович
8 (494) 150 11 22
Лимфолейкоз
Лимфолейкоз – это злокачественное заболевание, при котором костный мозг вырабатывает большое количество незрелых, неспособных выполнять свои функции лимфоцитов. Лимфоциты являются разновидностью лейкоцитов и отвечают за иммунитет. Злокачественные лейкоциты не справляются с защитной функцией, при этом подавляют образование нормальных клеток крови и нарушают работу других органов.
Существует много разновидностей этого заболевания. Лимфолейкозы делят в зависимости от скорости развития патологического процесса, степени зрелости лимфоцитов, типа поврежденных лимфоцитов (Т- и В-лимфоциты). Однако чаще всего выделяют 2 основных типа: острый лимфобластный лейкоз и хронический лимфоцитарный лейкоз.
Лечение лейкозов обычно комплексное. На данный момент существует несколько вариантов терапии, и каждый год появляются новые, все более эффективные методы лечения лимфолейкозов. Прогноз при остром лимфолейкозе благоприятный – 95 % пациентов полностью излечиваются. Прогноз при хроническом лимфолейкозе зависит от скорости развития заболевания и сопутствующих патологий, он неуклонно прогрессирует, однако соответствующее лечение часто приводит к ремиссии и значительному улучшению состояния пациента.
Прогноз при остром лимфолейкозе благоприятный – 95 % пациентов полностью излечиваются. Прогноз при хроническом лимфолейкозе зависит от скорости развития заболевания и сопутствующих патологий, он неуклонно прогрессирует, однако соответствующее лечение часто приводит к ремиссии и значительному улучшению состояния пациента.
Синонимы русские
Острый лимфолейкоз, острый лимфоцитарный лейкоз, острый лимфобластный лейкоз, хронический лимфолейкоз, хронический лимфоцитарный лейкоз.
Синонимы английские
Pediatric acute lymphoblastic leukemia, childhood acute lymphoblastic leukemia, acute lymphocytic leukemia, ALL, chronic lymphocytic leukemia, CLL.
Симптомы
Острый лимфобластный лейкоз развивается достаточно быстро – обычно в течение нескольких недель. Симптомами его являются:
- лихорадка,
- слабость, недомогание,
- кровоточивость десен, частые носовые кровотечения,
- боли в животе,
- боли в костях,
- головные боли,
- увеличение лимфатических узлов шеи, подмышечной и паховой области,
- бледность.

Хронический лимфоцитарный лейкоз обычно никак не проявляется на начальной стадии. Он развивается годами, и постепенно возникают следующие симптомы:
- частые инфекционные заболевания,
- повышенная потливость, особенно ночью,
- кровоизлияния в кожу и слизистые,
- тяжесть в животе,
- слабость, недомогание,
- беспричинная потеря веса,
- бледность,
- одышка.
Общая информация о заболевании
Лимфоциты – это разновидность лейкоцитов. Как и все остальные клетки крови, лимфоциты образуются из единой стволовой клетки, которая находится в костном мозге и дает начало лимфоидной и миелоидной стволовым клеткам. От лимфоидной стволовой клетки происходят лимфоциты, от миелоидной – другие виды лейкоцитов, эритроциты и тромбоциты.
Для того чтобы из лимфоидной стволовой клетки развились зрелые Т- и В-лимфоциты, она должна пройти через ряд последовательных делений. Сначала из лимфоидной стволовой клетки образуются лимфобласты, которые затем дают начало 2 типам клеток – предшественникам Т-лимфоцитов и предшественникам В-лимфоцитов. В процессе деления клетки становятся все более зрелыми и специализированными. Последние этапы созревания лимфоцитов проходят уже не в костном мозге, а в лимфоидных органах: тимусе, лимфатических узлах и селезенке. В результате формируются зрелые Т- и В-лимфоциты.
Сначала из лимфоидной стволовой клетки образуются лимфобласты, которые затем дают начало 2 типам клеток – предшественникам Т-лимфоцитов и предшественникам В-лимфоцитов. В процессе деления клетки становятся все более зрелыми и специализированными. Последние этапы созревания лимфоцитов проходят уже не в костном мозге, а в лимфоидных органах: тимусе, лимфатических узлах и селезенке. В результате формируются зрелые Т- и В-лимфоциты.
Лимфоциты, по сути, – клетки иммунитета. Это значит, что они участвуют в распознавании и уничтожении чужеродных тел (вирусов, бактерий) или патологически измененных тканей собственного организма (например, клеток опухоли). Т- и В- лимфоциты делают это по-разному. В-лимфоциты борются с чужеродными клетками (антигенами) с помощью иммуноглобулинов – белков, которые связывают антигены и запускают процесс их разрушения специальными белками. Т-лимфоциты распознают антигены, разрушают их самостоятельно или при взаимодействии с другими клетками крови, активируют выработку иммуноглобулинов В-лимфоцитами.
При лимфолейкозе нарушается формирование лимфоцитов. Появляется большое количество незрелых клеток, которые не способны выполнять свою работу. Это приводит к серьезным сбоям иммунитета. Человек становится более подвержен таким инфекционным заболеваниям, как туберкулез, кандидоз. Могут возникать серьезные осложнения от плановых прививок. Часто появляются так называемые аутоиммунные реакции – то есть иммунитет борется с нормальными клетками организма, например эритроцитами. В результате возникает анемия.
Злокачественные лимфоциты проникают в лимфатические узлы и селезенку, вызывая их увеличение, могут повреждать печень, легкие, головной мозг, кости.
При остром лимфолейкозе в костном мозге преобладают лимфобласты. Они очень быстро делятся, вытесняют из костного мозга и крови другие клетки, активно заселяют лимфатические узлы, селезенку. Чаще всего встречаются острые В-клеточные лейкозы, при которых образуется большое количество незрелых В-лимфоцитов. Острый В-клеточный лейкоз – самый распространенный вид лейкозов среди детей.
При хроническом лимфолейкозе в крови находят более зрелые формы лимфоцитов, которые способны некоторое время выполнять свои функции. Этот тип лейкоза характерен для людей старше 50-55 лет.
Кто в группе риска?
При остром лимфолейкозе в группе риска:
- люди, подвергавшиеся радиоактивному облучению,
- люди, подвергавшиеся химиотерапии или лучевой терапии в связи с другой формой рака,
- больные синдромом Дауна и другими генетическими нарушениями,
- люди, у братьев или сестер которых был диагностирован острый лимфолейкоз.
При хроническом лимфолейкозе в группе риска:
- представители европеоидной расы,
- люди старше 60 лет,
- люди, у родственников которых наблюдались случаи лейкоза.
Диагностика
- Общий анализ крови (без лейкоцитарной формулы и СОЭ) с лейкоцитарной формулой. Это исследование дает врачу информацию о количестве, соотношении и степени зрелости элементов крови.

- Лейкоциты. При остром лимфолейкозе лейкоциты могут быть повышены, в норме или понижены. Лейкоцитарную формулу (соотношение отдельных видов лейкоцитов) определяют по мазку крови. Для этого тонкий мазок наносится на предметное стекло, окрашивается специальными красителями, а затем исследуется под микроскопом. Таким образом врач может не только определить соотношение лейкоцитов, но и выявить патологические, незрелые клетки, которые внешне отличаются от нормальных.
- При остром лимфолейкозе в крови могут быть обнаружены лимфоциты разной степени зрелости – от лимфобластов до зрелых клеток.
-
При хроническом лимфолейкозе лимфобласты обычно отсутствуют в крови. Характерным признаком хронического лейкоза является обнаружение в мазке крови клеток (или теней) Боткина – Гумпрехта. Они представляют собой остатки разрушенных лимфоцитов. Тени Боткина – Гумпрехта отсутствуют в жидкой крови и образуются в процессе приготовления мазка. Их количество определяет интенсивность разрушения лимфоцитов в крови.

- Тромбоциты могут быть снижены.
- Эритроциты и гемоглобин. Тоже могут быть снижены.
- Проточная цитометрия, иммунофенотипирование. При сложных вариантах лимфолейкоза эти методики позволяют точно определить тип злокачественных клеток. При проточной цитометрии измеряют параметры клетки с помощью лазерного луча. Иммунофенотипирование заключается в обнаружении специфических для разных типов клеток белков на поверхности мембраны лимфоцита.
- Цитогенетические исследования. Обычно берут венозную кровь. Клетки крови фиксируют и окрашивают, после чего специалист под микроскопом исследует их кариотип – полный набор хромосом, который идентичен в любой клетке человека. Используется для выявления хромосомных нарушений, характерных для лимфолейкоза. При лимфолейкозе могут быть повреждены 11-я, 13-я, 17-я хромосомы – выпадает определенный их участок, а так же может появляться лишняя 12-я хромосома (трисомия). Прогноз заболевания во многом зависит от вида хромосомных аномалий.
 Например, выпадение участка 13-й хромосомы или трисомия по 12-й при отсутствии других изменений в хромосомах являются благоприятным признаком, а выпадение участка 11-й или 17-й хромосом определяют более плохой прогноз.
Например, выпадение участка 13-й хромосомы или трисомия по 12-й при отсутствии других изменений в хромосомах являются благоприятным признаком, а выпадение участка 11-й или 17-й хромосом определяют более плохой прогноз. - Биопсия костного мозга – взятие образца костного мозга из грудины или костей таза с помощью тонкой иглы. Проводится после предварительной анестезии. Затем под микроскопом выявляют лейкозные клетки.
- Спинномозговая пункция для выявления в спинномозговой жидкости, омывающей спинной и головной мозг, лейкозных клеток. Образец спинномозговой жидкости берется тонкой иглой, которая вводится между 3-м и 4-м поясничными позвонками после местной анестезии.
- Рентгенография грудной клетки. Может показать увеличение лимфатических узлов.
- УЗИ органов брюшной полости. Помогает выявить увеличение печени и селезенки.
Лечение
- Химиотерапия – это использование специальных препаратов, которые разрушают лейкозные клетки или препятствуют их делению.

- Лучевая терапия – разрушение лейкозных клеток с помощью ионизирующего излучения.
- Таргетированная терапия – назначение препаратов, имеющих направленное действие на определенные виды злокачественных клеток. Эти препараты взаимодействуют с определенными белками на поверхности лейкозных клеток и вызывают их разрушение.
- Пересадка костного мозга – пациенту пересаживают нормальные клетки костного мозга от подходящего донора. Предварительно проводят курс химиотерапии или лучевую терапию в высоких дозах, чтобы уничтожить все патологические клетки.
- Лучевая терапия – разрушение лейкозных клеток с помощью ионизирующего излучения. Может быть использована при остром лимфолейкозе для полного разрушения лейкозных клеток перед пересадкой костного мозга.
При остром лимфобластном лейкозе прогноз благоприятный, особенно у детей. Большинство пациентов полностью излечиваются. Прогноз хронического лимфолейкоза зависит от скорости прогрессирования болезни и чувствительности к химиотерапии. Средняя продолжительность жизни пациентов с хроническим лимфолейкозом составляет 3-5 лет.
Средняя продолжительность жизни пациентов с хроническим лимфолейкозом составляет 3-5 лет.
Профилактика
Специфической профилактики лимфолейкозов нет. Необходимо своевременно проходить профилактические осмотры, в ходе которых нередко выявляют заболевания крови.
Рекомендуемые анализы
- Общий анализ крови
- Лейкоцитарная формула
- Гемоглобин
- Цитологическое исследование пунктатов, соскобов других органов и тканей
Что такое ХЛЛ и как его лечить? — Фонд борьбы с лейкемией
Врач-онкогематолог Елена Стадник о хроническом лимфобластном лейкозе
Как ни странно, но онкологические заболевания могут быть хроническими. Иногда они даже не требуют лечения (а только наблюдения). В других случаях лечение может продолжаться всю жизнь…
Кто ставит диагноз?
ХЛЛ, или хронический лимфолейкоз характеризуется прогрессирующим накоплением фенотипически зрелых злокачественных B-лимфоцитов.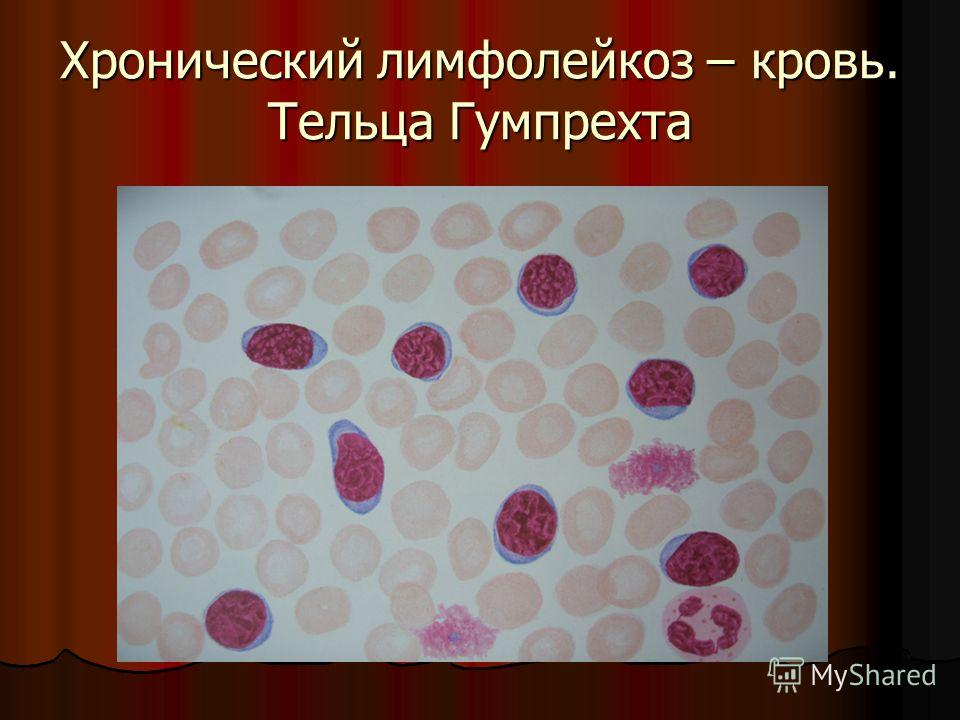 Это весьма коварное злокачественное заболевание крови. Дело в том, что может много лет «таиться» в организме, не давая о себе знать. Как правило, находят его случайно. Может, внимательный терапевт заметит высокий уровень лейкоцитов и направит к гематологу, а, может, кто-то обратит внимание на увеличенные лимфоузлы, усталость, ночную потливость и температуру.
Это весьма коварное злокачественное заболевание крови. Дело в том, что может много лет «таиться» в организме, не давая о себе знать. Как правило, находят его случайно. Может, внимательный терапевт заметит высокий уровень лейкоцитов и направит к гематологу, а, может, кто-то обратит внимание на увеличенные лимфоузлы, усталость, ночную потливость и температуру.
Для того, чтобы подтвердить диагноз, нужно сделать тест. Это анализ крови, который называется иммунофенотипирование. Такой метод позволяет идентифицировать и посчитать группы лейкоцитов с помощью моноклональных антител, которые образуются против антигенов клеточной поверхности. Иммунофенотипирование позволяет узнать их тип и функциональное состояние по наличию того или иного набора клеточных маркеров. Проще говоря, клетки болезни находят будто по их паспортным данным. Для того, чтобы поставить диагноз ХЛЛ, страшных тестов, вроде биопсии костного мозга, делать не нужно: клетки болезни в костном мозге те же, что в периферической крови.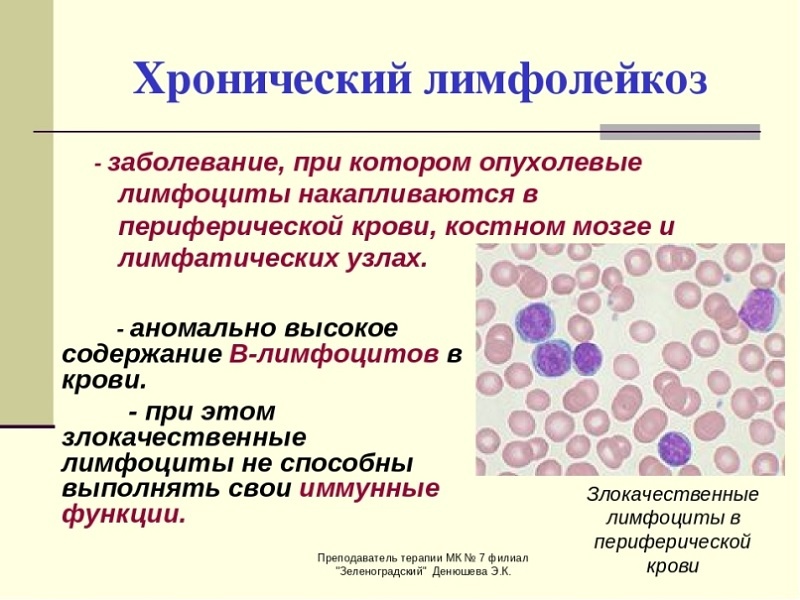 В крупных городах результат такого теста можно получить за два часа.
В крупных городах результат такого теста можно получить за два часа.
Кто болеет?
Раньше считалось, что ХЛЛ – это болезнь бабушек и дедушек. Молодые пациенты, хоть и редко, но встречались. Однако диагноз ХЛЛ им никто не ставил. Как правило, их состояние определяли как неходжкинскую лимфому и, как следствие, неправильно лечили. Сейчас – благодаря качественной диагностике – диагноз помолодел. Встречаются и пациенты моложе 30, но это все равно редкость.
Показания к лечению?
Для многих ХЛЛ звучит как немедленный приговор. Однако этот диагноз — вовсе не сигнал к действию. Больных со спящим лейкозом не лечат. Их наблюдают. Когда больные ХЛЛ узнают о своем диагнозе, им трудно поверить, что некоторое время болезнь не нужно лечить. Они спешат обратиться за помощью к зарубежным врачам, тратя время, деньги и силы, а ответ получают тот же: ждите. Конечно, ждать и каждый день думать, не случится ли что-то ужасное, невыносимо трудно. Но ХЛЛ — не Дамоклов меч. Не стоит думать о том, что завтра придет беда. С болезнью живут, ее лечат..
Но ХЛЛ — не Дамоклов меч. Не стоит думать о том, что завтра придет беда. С болезнью живут, ее лечат..
Вот показания для начала лечения:
— Анемия, снижение количества тромбоцитов.
— Кровотечения, инфекции.
— Увеличение лимфоузлов.
— Время удвоения лейкоцитов меньше, чем два месяца.
— Осложнения, особенно аутоиммунные.
— Специальные симптомы: лихорадка, слабость, ночная потливость, потеря веса.
Как лечить?
Несмотря на то, что таргетные препараты официально зарегистрированы в качестве первой линии терапии при ХЛЛ, для уменьшения опухолевой массы многим хватает химиотерапии по стандартному протоколу. Есть группа пациентов, о которых с самого начала известно, что они не ответят на химиотерапию. Это пациенты с делецией 17 или 11 хромосомы, а также с немутированным типом ХЛЛ. Таких больных сразу лечат таргетными препаратами. Молодым пациентам, несмотря на риск, предлагают пересадку костного мозга. Успешная ТКМ означает полное излечение от хронического лимфолейкоза.
Успешная ТКМ означает полное излечение от хронического лимфолейкоза.
Таргетная терапия при лечении ХЛЛ
Долгое время химиотерапия была единственным возможным методом лечения хронического лимфолейкоза. Да, она помогала, но пациент получал ряд побочных эффектов и осложнений. Выпадение волос, тошнота, головокружение, рвота, гибель клеток-предшественников костного мозга, кардиотоксичность и вторичные опухоли. Здоровые клетки гибли вместе с больными. Иногда осложнения от химиотерапии приводили к гибели пациента. Появление таргетной терапии изменило очень многое…
Что это такое?
Таргетная терапия — это вид молекулярной медицины, которая позволяет блокировать рост раковых клеток с помощью вмешательства в механизм действия болезнетворных молекул, вызывающих рост опухоли. Химиотерапия препятствует размножению всех быстро делящихся клеток в организме, а таргетная — только плохих. Красноречивее всего об эффективности таргетной терапии расскажут цифры. Если раньше в ремиссию выходило 20% больных, сейчас их 80%.
Если раньше в ремиссию выходило 20% больных, сейчас их 80%.
Возникает вопрос: если с таргетной терапией все так хорошо, почему бы не лечить ей всех? Ответ прост: пока что это дорого. Впрочем, таргетные препараты уже зарегистрированы как первая линия терапии при ХЛЛ. А экономический анализ показал, что лечить таргетными препаратами безопаснее и проще, потому что расходы на них меньше, чем на осложненную химиотерапию, где лечишь не только болезнь, но и осложения. Если бы можно было достать из кармана таргетные препараты и раздать всем нуждающимся, химиотерапия в случае хронического лимфолейкоза канула бы в Лету.
Прошло уже восемь лет с тех пор, как первые больные начали принимать таргетные препараты в рамках клинических исследований. У российских больных стаж меньше: пять лет. Использование таргетной терапии показало потрясающие результаты. Больные хорошо переносят лечение. Те, кого считали безнадежными, обрели надежду. Теперь их ждет не паллиативное лечение, а полноценная жизнь. Жизнь человека, глядя на которого никогда не скажешь, что он вообще чем-то болел.
Жизнь человека, глядя на которого никогда не скажешь, что он вообще чем-то болел.
Коронавирус и хронический лимфолейкоз
Чем опасен?
Коронавирусы – это огромная группа вирусов. Из них для человека опасны только 7, в том числе и коронавирус, или SARS-CoV-2. Он вызывает потенциально тяжелую острую респираторную инфекцию, которая может протекать как в легкой, так и в тяжелой форме. Опасен он тем, что в качестве осложнения чаще всего приводит к вирусной пневмонии, из которой развивается острый респираторный дистресс-синдром, а после — острая дыхательная недостаточность. Проблема с острой дыхательной недостаточностью в том, что дома ее не вылечить. Необходима кислородная терапия и респираторная поддержка. Именно поэтому COVID-19 опасен не только для людей, но и для системы здравоохранения в целом. Когда прирост заболевших в день исчисляется тысячами, есть риск, что из-за переполненности больниц помощь получит не каждый. Несмотря на то, что общая летальность от коронавируса нового типа 2,3%, число его жертв в мире — миллион человек.
Кто в группе риска?
В условиях пандемии особенно важно позаботиться о людях, для которых этот вирус потенциально наиболее опасен. К группе риска в первую очередь относятся люди старше 65 лет, люди с сердечно-сосудистыми заболеваниями, сахарным диабетом и болезнями легких, и только потом — онкологические больные. Те, у кого онкологическое заболевание в ремиссии, кто не находится на химиотерапии или на лучевой терапии, с точки зрения риска инфицирования COVID-19 рассматриваются как здоровые люди.
Кому же тогда стоит особо внимательно отнестись к профилактике заражения COVID-19? Больным, получающим химиотерапию или только что ее закончившим. Людям, которые перенесли трансплантацию костного мозга в первый год после нее. Так же тем, кто на радиотерапии, гормональном и иммуносупрессивном лечении. Очень важно беречься людям с хроническими лейкозами и неходжкинскими лимфомами. Это связано с тем, что такие заболевания неизлечимы и присутствуют в организме даже в период стойкой ремиссии. Все вышеописанные состояния предполагают вторичный иммунодефицит, из-за которого так опасен COVID-19.
Все вышеописанные состояния предполагают вторичный иммунодефицит, из-за которого так опасен COVID-19.
Что делать?
Для того, чтобы обезопасить себя, придется научиться жить по-другому. Хотя бы на какое-то время. Кто лучше знает, что такое «жить по-другому», чем онкологический больной? Самое важное — это, конечно, самоизоляция. Необходимо найти другие средства связи с родными и близкими, помимо личных встреч. Удивительно, но семейный ужин может состояться и по видеосвязи. Стоит также сократить число визитов в больницу. Выбирать для этого маленькие клиники, а не большие медицинские учреждения, где много людей. Перед тем, как совершать какие-то медицинские манипуляции, нужно оценить вред и пользу. В этом поможет лечащий врач. В остальном — телемедицина.
Есть случаи, в которых посещение больницы неизбежно. Например, проведение курса химиотерапии. Это сопряжено с особым риском заражения COVID-19, поэтому, если можно отложить начало лечения, его лучше отложить. Если курс уже идет, конечно, его нужно продолжать. По возможности лучше перейти на таргетную терапию. Она таблетированная и не требует стационарного наблюдения.
Если курс уже идет, конечно, его нужно продолжать. По возможности лучше перейти на таргетную терапию. Она таблетированная и не требует стационарного наблюдения.
Предупрежден — значит вооружен. Соблюдая все правила профилактики заражения COVID-19 можно быть уверенным в собственной безопасности. Главное — помнить, что однажды пандемия закончится. А пока пейте чай и оставайтесь дома.
Качество жизни при хроническом лимфолейкозе. Случай из практики
История берет начало в 2014 году. Нина, как это обычно бывает, в плановом порядке сдала биохимический анализ крови, в котором оказались повышены лейкоциты. Откуда они взялись никто не знал, ведь Нина была совершенно здоровой молодой девушкой. Ей было всего 28 лет. Когда результат иммунофенотипирования указал на хронический лимфолейкоз, белорусские врачи (а в тот момент Нина отдыхала в санатории в Беларуси) отказывались верить в диагноз: молодые ХЛЛ не болеют. Тогда Нине пришлось в срочном порядке вернуться в Москву. В НМИЦ Гематологии диагноз подтвердили. В происходящее было действительно трудно поверить. Нина чувствовала себя прекрасно. Болезнь будто бы спала, хотя уровень лейкоцитов говорил об обратном. Еще год назад Нина была абсолютно здорова. Однако болезнь прогрессировала.
В НМИЦ Гематологии диагноз подтвердили. В происходящее было действительно трудно поверить. Нина чувствовала себя прекрасно. Болезнь будто бы спала, хотя уровень лейкоцитов говорил об обратном. Еще год назад Нина была абсолютно здорова. Однако болезнь прогрессировала.
ХЛЛ у Нины — один из самых опасных: с делецией 17 хромосомы. Лимфоциты множились, лимфоузлы увеличивались, опухолевая масса росла. Хотя Нина чувствовала себя хорошо, нужно было срочно начинать лечение. Когда речь идет о пожилых пациентах, их лечат с помощью химиотерапии или таргетных препаратов. Это помогает отсрочить рецидив. В ее же случае рецидива не должно было быть. Как молодой пациентке ей предложили рискованный, но единственно верный выход — трансплантацию костного мозга. Для того, чтобы осуществить пересадку, сначала нужно редуцировать опухолевую массу. Такого эффекта врачи пытались достичь при помощи химиотерапии, но, как это часто бывает у пациентов с делецией 17 хромосомы, редукции не было.
Стоит сказать, что, если бы эта история разворачивалась на пару лет раньше, Нине уже было бы нечем помочь, но ей повезло. Она лечилась уже в эру таргетных препаратов. Лечение оказалось успешным. Лейкоциты пришли в норму, а опухолевая масса уменьшилась.
Она лечилась уже в эру таргетных препаратов. Лечение оказалось успешным. Лейкоциты пришли в норму, а опухолевая масса уменьшилась.
Теперь Нина была готова к трансплантации. Донором стала женщина из Польши. Однако вздохнуть с облегчением было рано. Мало пересадить костный мозг, нужно, чтобы он еще и прижился. К сожалению, у Нины этого не происходило. И все же молодая женщина не собиралась сдаваться. Она искала фонд, который помог бы ей с повторной пересадкой. А дальше случилось чудо. Когда провели повторный анализ, оказалось, что костный мозг прижился на 99%.
Теперь у Нины четвертая отрицательная группа крови, такая же, как и у ее донора, а не первая положительная, как раньше. Это хорошо. Когда группа крови донора отлична от группы крови пациента, легко определить, чей костный мозг сейчас трудится: донорский или родной. Если донорский костный мозг у Нины перестал бы работать, ее группа крови снова стала бы первой положительной, а не четвертой отрицательной.
Сейчас Нина в ремиссии, она живет обычной жизнью, воспитывает дочь. Два десятка лет назад в такую историю никто бы не поверил. Увы, каждый шаг на этом пути – борьба. Борьба за дорогое лечение, за поиск донора, за трансплантацию, за жизнь. Пациенты в прошлом веке на таргетную терапию рассчитывать не могли. Ее просто не было. А молодые пациенты и вовсе оставались без диагноза. Кто бы им поставил ХЛЛ? Сейчас все по-другому. Всегда нужно бороться и ждать. Чудеса по-другому не случаются.
Два десятка лет назад в такую историю никто бы не поверил. Увы, каждый шаг на этом пути – борьба. Борьба за дорогое лечение, за поиск донора, за трансплантацию, за жизнь. Пациенты в прошлом веке на таргетную терапию рассчитывать не могли. Ее просто не было. А молодые пациенты и вовсе оставались без диагноза. Кто бы им поставил ХЛЛ? Сейчас все по-другому. Всегда нужно бороться и ждать. Чудеса по-другому не случаются.
Качество жизни при хроническом лимфолейкозе. История пациента
Молодой мужчина работал на производстве, где каждый год сдавал анализ крови. Во время очередной диспансеризации лейкоциты в крови были слегка повышены, но никто не обратил на это внимания, в том числе и сам Шамиль. Зима, эпидемия гриппа, Санкт-Петербург. Что тут удивительного? Через год он собирался поехать в пансионат. Как и положено, перед отъездом сдал кровь – и снова высокие лимфоциты. На этот раз терапевт отправил мужчину к гематологу, который и поставил ему диагноз — хронический лимфолейкоз. На тот момент Шамилю Камильевичу было сорок лет.
На тот момент Шамилю Камильевичу было сорок лет.
Хоть диагноз и был поставлен, показаний к началу лечения не было. Шамиля Камильевича отпустили домой. На три года он вернулся к своей привычной жизни, до тех пор, пока в 2015 году не заболел воспалением легких. Он заметил, что в целом стал чаще болеть. К тому же у него увеличились лимфоузлы на шее, при чем настолько, что было неудобно поворачивать голову. Оказалось, что лейкоциты и лимфоциты перевалили за сотню. Нужно было срочно начинать лечение.
На стандартный курс химиотерапии Шамиль отвечал плохо. У него был немутированный тип ХЛЛ, который очень тяжело лечить. Назначили таргетный препарат, добавили еще один, и уже через пару недель лимфоузлы уменьшились. Первый месяц лечения Шамиль, как и положено, провел в больнице, под наблюдением врачей. Препараты он переносил хорошо. Разве что говорил, что не привык пить так много воды, хотя все равно пил.
Наконец, мужчину выписали из больницы, но вскоре ему пришлось туда вернуться. Перед Новым Годом упали нейтрофилы. Снова лечение в стационаре, и наконец – домой. После этого в течение 2 лет Шамиль принимал назначенные препараты амбулаторно. Сейчас у него полная клинико-гематологическая ремиссия с радикацией минимальной остаточной болезни. Проще говоря, хорошая глубокая ремиссия. Хоть он и все еще под наблюдением врачей, но чувствует себя обычным и здоровым человеком.
Перед Новым Годом упали нейтрофилы. Снова лечение в стационаре, и наконец – домой. После этого в течение 2 лет Шамиль принимал назначенные препараты амбулаторно. Сейчас у него полная клинико-гематологическая ремиссия с радикацией минимальной остаточной болезни. Проще говоря, хорошая глубокая ремиссия. Хоть он и все еще под наблюдением врачей, но чувствует себя обычным и здоровым человеком.
Текст составлен на основе эфиров «Разговор с врачом- онкогематологом Еленой Александровной Стадник».
Записи эфиров:
https://bit.ly/3jdFZn5
Благодарим за возможность проведения эфиров компанию Abbvie.
Медики установили, что болезнь пожилых — хронический лимфолейкоз
«Моя сестра, которой еще нет и 45 лет, страдает онкологическим заболеванием крови — хроническим лимфолейкозом. Выяснилось это около года назад. Сестре было предоставлено современное бесплатное лечение, которое быстро поставило ее на ноги. Сейчас моя сестра чувствует себя здоровой. Она вновь работает, гуляет с внучкой, с удовольствием занимается нашимсадом. Однако тревога не покидает меня. Врачи сказали, что полногоизлечения гарантировать, к сожалению, не могут. Болезнь вернется — может быть, через 2 или 3 года, а может быть, и раньше. Тогда у нас должно быть наготове лекарство. А вот с лекарством теперь — большие трудности. Программа дополнительного лекарственного обеспечения изменилась, теперь врачи не имеют возможности выписывать тот препарат, который нужен больному. «Сверху» спущен бюджет, в который наши врачи — хочешь не хочешь — должны укладываться. А лекарство для моей сестры стоит очень дорого — сами мы его никак не осилим, даже если всей семьей будем деньги собирать. Возникает проблема: или моей сестре лекарство получить, или 20 больным с другими заболеваниями помочь. Но разве так можно ставить вопрос? Что же нам делать? Объясните, как теперь будут обеспечиваться такие больные, которым жизненно необходимы очень дорогие лекарства. Ведь от этого зависит их жизнь!»
Программа дополнительного лекарственного обеспечения изменилась, теперь врачи не имеют возможности выписывать тот препарат, который нужен больному. «Сверху» спущен бюджет, в который наши врачи — хочешь не хочешь — должны укладываться. А лекарство для моей сестры стоит очень дорого — сами мы его никак не осилим, даже если всей семьей будем деньги собирать. Возникает проблема: или моей сестре лекарство получить, или 20 больным с другими заболеваниями помочь. Но разве так можно ставить вопрос? Что же нам делать? Объясните, как теперь будут обеспечиваться такие больные, которым жизненно необходимы очень дорогие лекарства. Ведь от этого зависит их жизнь!»
С уважением,
М. Мамонтова,
г. Набережные Челны
Получая с пугающей регулярностью подобные письма, мы попросили нашего корреспондента встретиться с сотрудником Гематологического научного центра РАМН, занимающегося проблемой хронического лимфолейкоза, кандидатом медицинских наук Евгением Никитиным. Хотелось понять: каков в действительности прогноз больных с онкозаболеваниями крови, почему так дорого стоят препараты, которые могут таким больным помочь и какие шаги предпринимаются для того, чтобы люди, страдающие такими серьезными недугами, не чувствовали себя беспомощными и брошенными.
Хотелось понять: каков в действительности прогноз больных с онкозаболеваниями крови, почему так дорого стоят препараты, которые могут таким больным помочь и какие шаги предпринимаются для того, чтобы люди, страдающие такими серьезными недугами, не чувствовали себя беспомощными и брошенными.
Российская газета: Евгений Александрович, расскажите, пожалуйста, о хроническом лимфолейкозе. Каков прогноз и как часто люди этим заболеванием страдают?
Евгений Никитин: Хронический лимфатический лейкоз (ХЛЛ) — опухоль, возникающая из лимфоцитов, клеток иммунной системы. Заболевание проявляется поражением периферической крови, костного мозга, лимфатических узлов и селезенки. Основными проблемами являются увеличение количества белых клеток крови, увеличение лимфатических узлов и селезенки, появление малокровия, кровоточивости и склонности к инфекциям.
ХЛЛ чаще заболевают люди, перешагнувшие 50-летний рубеж. О частоте заболеваемости ХЛЛ в России говорить сложно, поскольку объективных статистических данных недостаточно. Национальный регистр в настоящее время только создается. Разумеется, у главных гематологов городского и регионального масштаба имеются довольно точные цифры, в соответствии с которыми они заказывают необходимые лекарственные препараты. Приблизительно можно сказать, что в России ежегодно появляются 4,5 тысячи вновь заболевших ХЛЛ.
Национальный регистр в настоящее время только создается. Разумеется, у главных гематологов городского и регионального масштаба имеются довольно точные цифры, в соответствии с которыми они заказывают необходимые лекарственные препараты. Приблизительно можно сказать, что в России ежегодно появляются 4,5 тысячи вновь заболевших ХЛЛ.
РГ: Это заболевание, при котором счет идет на дни и недели?
Никитин: Нет, хронический лимфолейкоз — медленно текущая болезнь. Скажу больше, 40 процентов больных мы не начинаем лечить сразу после установления диагноза. Это звучит очень странно: для большинства онкологических заболеваний верен принцип: чем раньше выявлена опухоль, тем больше шансов вылечиться. ХЛЛ — жидкая опухоль, при ней нельзя ничего удалить, эта болезнь исходно распространена по всему организму. Иногда заболевание в течение многих лет протекает почти без динамики, а иногда очень скоро ставит больного на грань между жизнью и смертью.
В последние годы нам удалось разработать молекулярные маркеры, предсказывающие течение В-ХЛЛ, но пройдет еще несколько лет, пока мы получим доказательные данные, оправдывающие более раннее начало терапии у больных с неблагоприятным прогнозом. Таким образом, сейчас врачи во всем мире придерживаются тактики выжидательного наблюдения вплоть до появления показаний к терапии. В этот период пациент должен просто регулярно наблюдаться у врача. К сожалению, со временем у большинства заболевших появляются серьезные проблемы. Основная опасность связана с тяжелыми инфекциями и кровоточивостью.
Таким образом, сейчас врачи во всем мире придерживаются тактики выжидательного наблюдения вплоть до появления показаний к терапии. В этот период пациент должен просто регулярно наблюдаться у врача. К сожалению, со временем у большинства заболевших появляются серьезные проблемы. Основная опасность связана с тяжелыми инфекциями и кровоточивостью.
РГ: Почему ХЛЛ называется болезнью второй половины жизни?
Никитин: Дети и молодые люди не болеют ХЛЛ. Кроме того, частота выявления этого заболевания увеличивается с возрастом. Поэтому распространено мнение, что ХЛЛ — болезнь пожилых. Но надо сказать, что в последние годы болезнь сильно «помолодела». По-видимому, это связано с улучшением качества диагностики. Появились современные более точные методы — иммунофенотипирование и иммуногистохимия, благодаря которым мы научились лучше понимать разновидности опухолей лимфатической системы. По данным ГНЦ РАМН, 40 процентов больных ХЛЛ — люди, моложе 55 лет.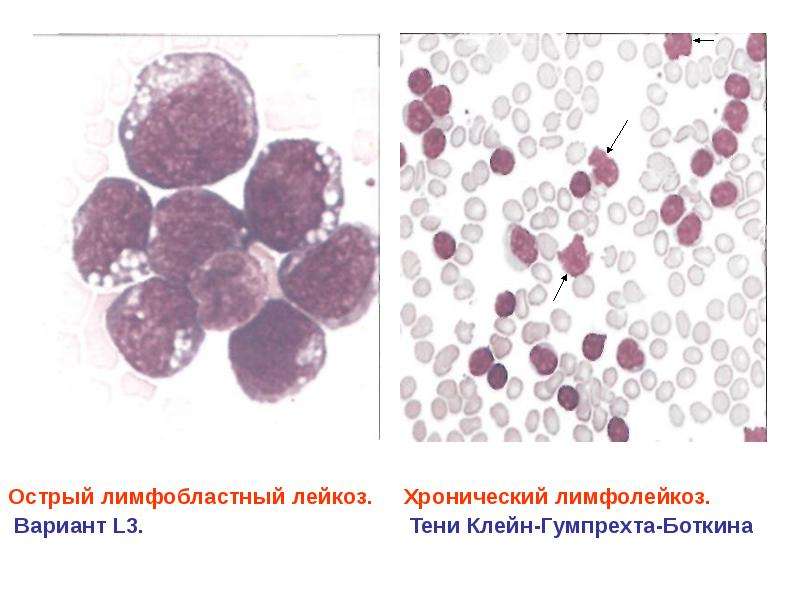 Вы понимаете, что это пора продуктивной деятельности, социальной активности. ХЛЛ — самый частый вид лейкозов у взрослых, таких пациентов много. Поэтому лечение таких больных — серьезная социальная проблема.
Вы понимаете, что это пора продуктивной деятельности, социальной активности. ХЛЛ — самый частый вид лейкозов у взрослых, таких пациентов много. Поэтому лечение таких больных — серьезная социальная проблема.
РГ: Давайте теперь поговорим о лечении таких больных. Чем прежде лечили ХЛЛ и чем лечат теперь?
Никитин: C лечением ХЛЛ произошли большие перемены. Раньше в нашем распоряжении были препараты, с помощью которых можно было проводить только паллиативное лечение, направленное на то, чтобы облегчить симптомы болезни, улучшить состояние больного. Сегодня разработаны два принципиально новых класса препаратов. Это аналоги пуринов и моноклональные антитела.
Лечение моноклональными антителами еще называют иммунотерапией. Она обладает рядом удивительных свойств. Действие иммунотерапии высокоизбирательно, благодаря чему она лишена целого ряда недостатков, свойственных обычным химиопрепаратам. Во время иммунотерапии у людей не выпадают волосы, не бывает тошноты, стоматитов и многих других тяжелых осложнений, развивающихся не в результате самого заболевания, а из-за токсичности химиотерапии.
Но самое главное — с использованием этих новых лекарств мы научились добиваться при ХЛЛ состояния, которое называется ремиссией, при которой отсутствуют все проявления болезни. К сожалению, это не означает окончательного излечения, болезнь может вернуться через какое-то время. Но пока человек на несколько лет здоров. Можно назвать такое состояние «временным здоровьем».
В конце концов все в этом мире временно. Люди, получившие современное лечение, могут вернуться к нормальному образу жизни, работать, растить детей или внуков, радоваться жизни…И это настоящая мирная революция. Раньше больной ХЛЛ был привязан к больнице, его жизнь представляла собой бесконечное лечение. Сегодня мы научились обеспечивать довольно продолжительные, по нескольку лет, промежутки без болезни, когда он может вернуться к полноценной жизни. Я уверен, что в ближайшие десятилетия мы научимся вылечивать ХЛЛ. На сегодняшний день основная задача врача — сделать так, чтобы периоды ремиссии длились как можно дольше, а периоды лечения были как можно короче и сопровождались минимальными проблемами. Сегодня это возможно.
Сегодня это возможно.
РГ: Известно, что эти инновационные препараты очень дорогие. Почему это так?
Никитин: Дорого стоит производство, особенно моноклональных антител, поскольку это высокотехнологичный процесс. Кроме того, речь не идет о том, чтобы выбрать один препарат из десятка имеющихся или предпочесть один вид терапии другому. Речь идет о препаратах, которые включены системами здравоохранения всех цивилизованных стран в стандарты лечения ХЛЛ.
Прежде чем препарат достигает такого уровня, он проходит 2 фазы доклинических и 3-й фазы клинических испытаний. Большинство лекарств отбрасываются на этапе доклинических испытаний. В первой фазе клинических испытаний подбирается безопасная доза препарата, во второй — тестируется эффективность у самых тяжелых больных, в третьей — новый препарат или вид лечения сравнивают с другим, наиболее эффективным на данный момент. Клинические испытания 3-й фазы представляют собой международные исследования, в которых участвует много клиник. Если препарат доходит до 3-й фазы — это уже грандиозный успех разработчиков. Но доходят единицы.
Если препарат доходит до 3-й фазы — это уже грандиозный успех разработчиков. Но доходят единицы.
При ХЛЛ, например, разрабатывалось несколько аналогов пуринов, но победил только один. Новые препараты нередко создаются в университетских лабораториях, но ни один университет, ни одно государство не в состоянии финансировать проведение масштабных клинических испытаний и выдерживать риски, связанные с менее удачными препаратами, которых большинство. Даже если вы сделали лекарство, которое вылечивает онкологическое заболевание, и это абсолютно очевидно, вам придется организовать десятки клинических испытаний в разных странах, чтобы убедить мировое сообщество и регулирующие организации США (FDA) и Европы (EMEA), что оно безопасно и эффективно. Другого пути нет. Иначе будут возникать трагедии, каких фармакология знала немало. Вот откуда берется цена.
Между тем путь нового лекарства на этом не завершается. Препарат поступает в распоряжение врачей, и их задача — научиться его максимально эффективно применять. И надо сказать, что этот этап может иногда иметь очень большое значение. Например, при ХЛЛ наиболее эффективны именно комбинированные схемы терапии, которые были разработаны уже после регистрации ключевых препаратов. Пострегистрационные исследования проводятся по инициативе врачей, но нередко финансируются компаниями-разработчиками.
И надо сказать, что этот этап может иногда иметь очень большое значение. Например, при ХЛЛ наиболее эффективны именно комбинированные схемы терапии, которые были разработаны уже после регистрации ключевых препаратов. Пострегистрационные исследования проводятся по инициативе врачей, но нередко финансируются компаниями-разработчиками.
Онкология всегда была дорогой. Вы не назовете ни одного дешевого противоопухолевого препарата, разработанного за последние 10 лет. Но посмотрите, как выросли ее возможности. Разумеется, среднестатистический человек — не только в нашей стране, но и в других странах мира — оплатить это лечение просто не в состоянии. Оплату лечения берут на себя страховые компании или государство. У нас до появления программы ДЛО новые препараты для лечения ХЛЛ были доступны единицам, хотя появились в России уже довольно давно. Только программа ДЛО сделала новое современное лечение доступным тем, кому это было необходимо по жизненным показаниям. К сожалению, положение снова резко осложнилось.
РГ: Сейчас вроде бы принято решение выделить онкогематологию в специальную подпрограмму, а может быть, даже по отдельным заболеваниям. Как вы к этому относитесь?
Никитин: Мне трудно комментировать ситуацию с программой дополнительного лекарственного обеспечения (ДЛО), поскольку я не располагаю для этого достаточной информацией. Могу сказать одно: до 2005 года ситуация была просто плачевной. Мы знали, что есть новые лекарства, имелся опыт их применения в центральных институтах, отдельных клиниках, но для подавляющего большинства пациентов это лечение было совершенно недоступно. Настоящая перемена произошла в 2006 году, когда дорогостоящие препараты перестали быть в отчаянном дефиците и люди наконец-то увидели свет в конце тоннеля.
Как бы вам точнее сказать… Цитируя Джонатана Свифта, мы перестали «умерять желания, отрезая себе ноги, когда нам нужны ботинки». Все благодаря программе ДЛО. Но… Сейчас над людьми, начавшими получать лечение, вновь нависла угроза лишиться препаратов, спасающих им жизнь. Опять невозможно ничего выписать. Многие пациенты начали лечение и вынуждены прервать его из-за отсутствия препаратов, а этого делать никак нельзя. Российский стандарт лечения ХЛЛ, в который включены новые препараты, разработан и ожидает утверждения в Минздравсоцразвития России. Так что вопрос теперь находится исключительно в сфере компетенции государственных структур, занимающихся этой проблемой.
Опять невозможно ничего выписать. Многие пациенты начали лечение и вынуждены прервать его из-за отсутствия препаратов, а этого делать никак нельзя. Российский стандарт лечения ХЛЛ, в который включены новые препараты, разработан и ожидает утверждения в Минздравсоцразвития России. Так что вопрос теперь находится исключительно в сфере компетенции государственных структур, занимающихся этой проблемой.
Будет ли продлена жизнь нашим согражданам, остро нуждающимся в современном лечении, или же опыт 2006 года станет легендой, так и не воплотившейся в жизнь? На этот вопрос пока нет ответа. Очень хотелось бы надеяться на то, что в кратчайшие сроки он будет найден.
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
V РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА И СОВРЕМЕННЫЕ ПОДХОДЫ К ЕГО ТЕРАПИИ
М.А. Волкова
Онкологический научный центр им. Н.Н.Блохина РАМН, Москва
Н.Н.Блохина РАМН, Москва
Хронический лимфолейкоз (ХЛЛ) — наиболее распространенный вид лейкоза в странах Европы и Северной Америки, поэтому клиническая картина и особенности его течения давно и хорошо изучены. В то же время отсутствие необходимых методических подходов в течение долгих лет не позволяло предпринять попытки расшифровать биологическую сущность заболевания. Появление современных цитогенетических, иммунологических и молекулярно-биологических методов вызвало взрыв интереса к изучению ХЛЛ, и в настоящее время этому заболеванию посвящено наибольшее количество исследований в области гематологии.
В последние годы подходы к лечению ХЛЛ радикально изменились. Эти изменения вызваны не только появлением новых, более эффективных, чем прежние, средств терапии, но и значительными успехами в понимании биологии заболевания, что реализовалось в выделении новых прогностических критериев, учитываемых в настоящее время при определении необходимости и интенсивности терапии.
Прежде всего, было показано, что представления о ХЛЛ как о необыкновенно вариабельном по клиническим проявлениям и течению заболевании не вполне соответствуют действительности и обусловлены невозможностью во многих случаях без иммунологического исследования дифференцировать хронический лимфолейкоз и лимфомы низкой степени злокачественности с лейкемизацией. Согласно современным представлениям, нашедшим отражение в последних классификациях (REAL, ВОЗ), ХЛЛ относится к заболеваниям периферических органов иммунной системы. Морфологическим субстратом ХЛЛ является клон CD5+ В-лимфоцитов, (с имунофенотипом CD5+,CD19+,CD20+, СD23+, слабой экспрессией CD22 и поверхностных иммуноглобулинов, FMC7-), аналогичный нормальным CD5+ В-лимфоцитам мантийной зоны вторичного фолликула лимфоузла, участвующим в независимом от Т-лимфоцитов иммунном ответе (1, 2). Установлено, что имеется два вида ХЛЛ: примерно в половине случаев морфологическим субстратом заболевания являются В-лимфоциты, еще не встречавшиеся с антигеном и поэтому не имеющие признаков соматических мутаций в генах вариабельной части тяжелых цепей иммуноглобулинов (VH ген), так называемые «наивные» лимфоциты, в другой половине случаев ХЛЛ патологические В-лимфоциты имеют признаки мутаций VH гена, они уже встречались с антигеном, под влиянием которого в своей дифференцировке прошли зародышевый центр вторичного фолликула лимфоузла и превратились в «клетки памяти». Многочисленными работами показано, что ХЛЛ, морфологическим субстратом которого являются «наивные» лимфоциты, имеет более агрессивное течение и нуждается в более интенсивной терапии, чем ХЛЛ из «клеток памяти»(3, 4).
Многочисленными работами показано, что ХЛЛ, морфологическим субстратом которого являются «наивные» лимфоциты, имеет более агрессивное течение и нуждается в более интенсивной терапии, чем ХЛЛ из «клеток памяти»(3, 4).
Долгое время считалось, что при ХЛЛ нет хромосомных аберраций, и на этом основании некоторыми авторами заболевание расценивалось как доброкачественная опухоль. Появление цитогенетических методов, дающих возможность анализировать кариотип неделящихся клеток (FISH), позволило выявить изменения кариотипа лейкемических клеток более чем у 80% больных, хотя до сих пор не обнаружено гена или генов, изменения которых ответственны за возникновение ХЛЛ. Наиболее часто встречающимися и прогностически значимыми оказались делеция длинного плеча хромосомы 13 (13q-), трисомия 12 хромосомы, делеция длинного плеча хромосомы 11 (11q-) и делеция короткого плеча хромосомы 17 (17p-). Сопоставление найденных хромосомных аберраций с течением болезни и ответом на терапию у 325 больных показало, что изменения кариотипа являются независимым прогностическим фактором, при этом 13q- в случаях, когда эта аномалия является единственной, предвещает стабильное состояние или медленное течение болезни и благоприятный ответ на терапию (медиана выживаемости — 133 мес. , больше, чем в группе больных с нормальным кариотипом — 111 мес.), в то время как остальные аберрации, в особенности 11q- и 17p- предвещают быстрое прогрессирование и резистентность к терапии (медианы выживаемости больных с трисомией 12 — 114 мес., 11q- 79мес, 17p- 32 мес.). Сопоставление хромосомных аберраций с мутационным статусом IgVH гена обнаружило четкую корреляцию: 13q- статистически значимо чаще встречалась у больных с мутациями гена IgVH, в то время как 11q- и 17p- с высокой степенью достоверности чаще при отсутствии таких мутаций (5). Более ранними работами уже было показано, что 11q- ассоциирована с выраженной лимфаденопатией и плохим прогнозом (6). Возможно, 17p- является наиболее неблагоприятной аномалией, потому что делеция 17 хромосомы захватывает место локализации гена р53, осуществляющего надзор за состоянием клеточного генома и инициирующего апоптоз клеток с измененным геномом. При наличии мутации аллельного гена, нередкой при ХЛЛ, этот дефект вносит свой вклад в неблагоприятное течение болезни.
, больше, чем в группе больных с нормальным кариотипом — 111 мес.), в то время как остальные аберрации, в особенности 11q- и 17p- предвещают быстрое прогрессирование и резистентность к терапии (медианы выживаемости больных с трисомией 12 — 114 мес., 11q- 79мес, 17p- 32 мес.). Сопоставление хромосомных аберраций с мутационным статусом IgVH гена обнаружило четкую корреляцию: 13q- статистически значимо чаще встречалась у больных с мутациями гена IgVH, в то время как 11q- и 17p- с высокой степенью достоверности чаще при отсутствии таких мутаций (5). Более ранними работами уже было показано, что 11q- ассоциирована с выраженной лимфаденопатией и плохим прогнозом (6). Возможно, 17p- является наиболее неблагоприятной аномалией, потому что делеция 17 хромосомы захватывает место локализации гена р53, осуществляющего надзор за состоянием клеточного генома и инициирующего апоптоз клеток с измененным геномом. При наличии мутации аллельного гена, нередкой при ХЛЛ, этот дефект вносит свой вклад в неблагоприятное течение болезни. При изучении частоты мутаций гена р53 у 114 больных ХЛЛ было показано, что эти изменения имеют место в 14% случаев, причем более чем в половине случаев они биаллельны. Продолжительность достигнутых ремиссий после идентичного лечения и общая продолжительность жизни были достоверно короче у больных с мутацией гена р53 (продолжительность ремиссии — 4 мес., продолжительность жизни — 29 мес. в группе с изменениями гена р53; 27 мес. и 67 мес. соответственно в группе без изменений). Больные с изменениями гена р53 оказались резистентными к терапии алкилирующими агентами и флюдарабином (7).
При изучении частоты мутаций гена р53 у 114 больных ХЛЛ было показано, что эти изменения имеют место в 14% случаев, причем более чем в половине случаев они биаллельны. Продолжительность достигнутых ремиссий после идентичного лечения и общая продолжительность жизни были достоверно короче у больных с мутацией гена р53 (продолжительность ремиссии — 4 мес., продолжительность жизни — 29 мес. в группе с изменениями гена р53; 27 мес. и 67 мес. соответственно в группе без изменений). Больные с изменениями гена р53 оказались резистентными к терапии алкилирующими агентами и флюдарабином (7).
В последние годы многими работами была показана неблагоприятная роль экспрессии на поверхности лимфоцитов CD38. Детальный анализ клинической картины и течения заболевания у 168 больных ХЛЛ показал, что экспрессия CD38 с высокой степенью значимости коррелировала с продвинутой стадией заболевания или с быстрым переходом начальной стадии в более неблагоприятную, требующую лечения, плохим ответом на терапию (80% ремиссий при лечении флюдарабином в группе больных без экспрессии CD38 и 28,6% при наличии экспрессии) и значительно худшей выживаемостью (8 лет прожили 90,4% больных в группе CD38 и лишь 42,3% в группе CD38+)(8).
Уже с середины 90-х годов стали появляться данные о неблагоприятной роли высокого уровня лактатдегидрогеназы (ЛДГ), b2-микроглобулина и растворимой CD23 — активатора иммунных Т-лимфоцитов. К настоящему времени это подтверждено на больших (более 400 чел.) группах больных. Показано, что при уровне ЛДГ, превышающем нормальный в 1,25 раза, медиана продолжительности жизни составляет 4,4 года, в то время как при нормальном уровне — 12,6 лет; при концентрации b2-микроглобулина более 3 мг/л — 4,6 лет, менее — 12,6 лет; при уровне растворимой CD23, превышающем норму в 10 раз, выживаемость составила 6,4 года, при меньшем содержании — около 10 лет (9).
Работами последних лет показана также неблагоприятная прогностическая роль повышенного уровня тимидин киназы — клеточного фермента, который активируется в клетке перед ее делением и осуществляет фосфорилирование не только экзогенного, но и эндогенного тимидина, ускоряя тем самым процесс построения ДНК. Поэтому уровень тимидин киназы отражает активность клеточной пролиферации (10). Исследование содержания тимидин киназы в сыворотке больных ХЛЛ в начальной стадии заболевания показало, что в группе с уровнем тимидин киназы менее 7 ед./л среднее время без признаков прогрессирования составило 49 мес., в то время как в группе больных с более высоким уровнем фермента — только 8 мес. (11).
Поэтому уровень тимидин киназы отражает активность клеточной пролиферации (10). Исследование содержания тимидин киназы в сыворотке больных ХЛЛ в начальной стадии заболевания показало, что в группе с уровнем тимидин киназы менее 7 ед./л среднее время без признаков прогрессирования составило 49 мес., в то время как в группе больных с более высоким уровнем фермента — только 8 мес. (11).
Один из важнейших вопросов терапии ХЛЛ касается оптимального срока начала терапии. В отличие от острого лейкоза или хронического миелолейкоза у 15-20% больных ХЛЛ в течение многих лет не наблюдается прогрессирования заболевания. Поскольку большими рандомизированными исследованиями показано, что раннее начало терапии не увеличивает продолжительность жизни при ХЛЛ, считается, что лечение может быть отложено до тех пор, пока сохраняется стабильная картина при минимальных проявлениях болезни (А стадия по Binet, 0-I по Rai) (12, 13). Показанием к началу терапии считается наличие «общих симптомов» (слабость, потливость, потеря веса), подверженность повторным бактериальным инфекциям, развитие анемии или тромбоцитопении, обусловленной инфильтрацией костного мозга патологическими лимфоцитами или аутоиммунным процессом, массивная лимфаденопатия или спленомегалия, выраженная (80% и более) инфильтрация костного мозга патологическими лимфоцитами, быстрое увеличение числа лимфоцитов в крови (удвоение менее чем за 12 мес.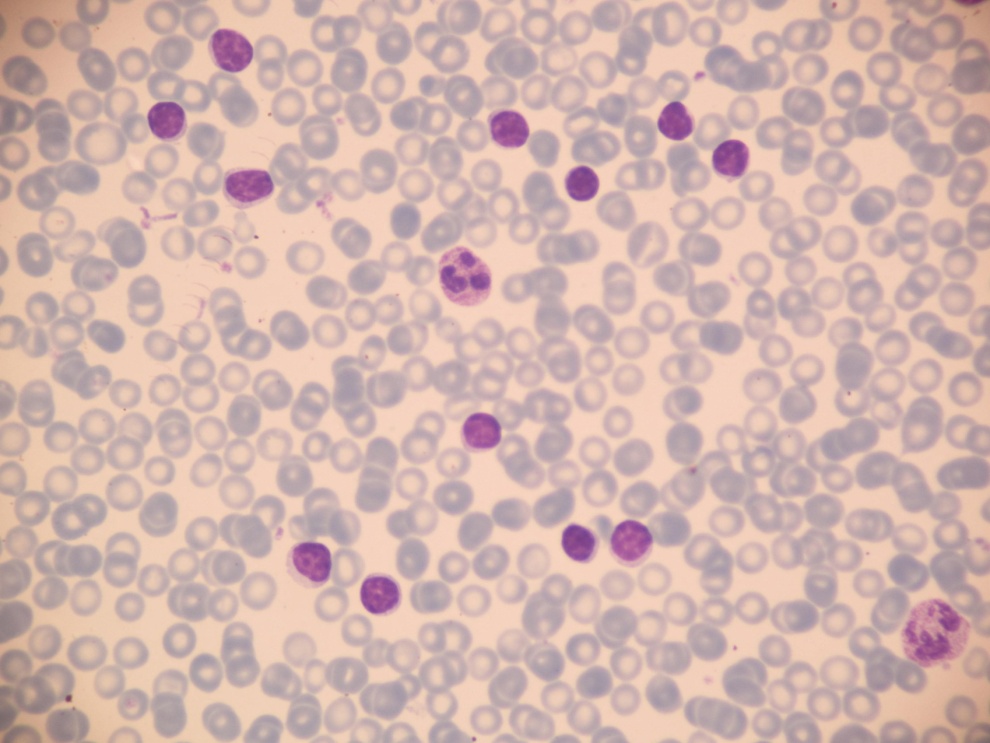 ), то есть при В и С стадиях по Binet, II-IV по Rai. В последние годы большинство авторов считают, что лечение следует начинать и в более ранних стадиях при отсутствии или слабой выраженности перечисленных симптомов, но при наличии указанных ранее неблагоприятных прогностических признаков — комплексные хромосомные аберрации или обнаружение 11q- или 17p-, наличие немутировавшего гена IgVH, экспрессия CD38, высокий уровень ЛДГ, сывороточной тимидин киназы, b2-микроглобулина или растворимой CD23.
), то есть при В и С стадиях по Binet, II-IV по Rai. В последние годы большинство авторов считают, что лечение следует начинать и в более ранних стадиях при отсутствии или слабой выраженности перечисленных симптомов, но при наличии указанных ранее неблагоприятных прогностических признаков — комплексные хромосомные аберрации или обнаружение 11q- или 17p-, наличие немутировавшего гена IgVH, экспрессия CD38, высокий уровень ЛДГ, сывороточной тимидин киназы, b2-микроглобулина или растворимой CD23.
В течение более 40 лет препаратом выбора при ХЛЛ был хлорамбуцил (лейкеран, хлорбутин). Хлорамбуцил в качестве монотерапии или в комбинации с преднизолоном позволял почти у всех больных добиться снижения уровня лейкоцитов, а использование его при первых признаках прогрессирования заболевания у ряда больных на несколько лет сдерживало это прогрессирование. Поскольку у подавляющего числа больных с помощью хлорамбуцила, его комбинации с преднизолоном и появившихся поздней других алкилирующих препаратов (циклофосфан, дегранол, дипин, фотрин) удавалось получить лишь частичные ремиссии (только в нескольких исследованиях было получено небольшое количество непродолжительных полных ремиссий), в 70-80-х годах для лечения ХЛЛ стали применяться схемы, разработанные на базе алкилирующих препаратов и ставшие «золотым стандартом» в терапии лимфом — COP, CHOP, CAP, а также LVPP, M-2, POACH. Применение комбинированной терапии, по некоторым данным, несколько увеличило число полных ремиссий при ХЛЛ, однако рандомизированные исследования не показали достоверных преимуществ в продолжительности безрецидивного периода и общей выживаемости при использовании комбинированной терапии по сравнению с лечением хлорамбуцилом и преднизолоном: по данным ECOG, частота полных ремиссий при лечении высокими дозами хлорамбуцила — 23%, при комбинированной терапии — 25%, продолжительность безрецидивного периода 1,9 и 2 года, общая выживаемость 3,9 и 4,8 лет соответственно (14). Это дало основание считать, что химиотерапия не привела к увеличению продолжительности жизни больных ХЛЛ в течение трех десятилетий (60-90 годы), а некоторое ее увеличение за этот период связано с более эффективным лечением инфекций, являющихся наиболее частым и грозным осложнением и основной причиной смерти больных ХЛЛ.
Применение комбинированной терапии, по некоторым данным, несколько увеличило число полных ремиссий при ХЛЛ, однако рандомизированные исследования не показали достоверных преимуществ в продолжительности безрецидивного периода и общей выживаемости при использовании комбинированной терапии по сравнению с лечением хлорамбуцилом и преднизолоном: по данным ECOG, частота полных ремиссий при лечении высокими дозами хлорамбуцила — 23%, при комбинированной терапии — 25%, продолжительность безрецидивного периода 1,9 и 2 года, общая выживаемость 3,9 и 4,8 лет соответственно (14). Это дало основание считать, что химиотерапия не привела к увеличению продолжительности жизни больных ХЛЛ в течение трех десятилетий (60-90 годы), а некоторое ее увеличение за этот период связано с более эффективным лечением инфекций, являющихся наиболее частым и грозным осложнением и основной причиной смерти больных ХЛЛ.
В начале 90-х годов в лечении ХЛЛ произошло событие, названное «мирной революцией» и заметно изменившее имевшиеся результаты: появились пуриновые аналоги, позволившие сделать первый шаг в увеличении продолжительности жизни больных ХЛЛ благодаря существенному увеличению числа и продолжительности полных ремиссий. Из трех препаратов этого ряда (флюдарабин, пентостатин и кладрибин) наибольшую эффективность при ХЛЛ продемонстрировал флюдарабин. К настоящему времени флюдарабин считается наиболее эффективным препаратом в терапии ХЛЛ, позволяющим получить до 80% ремиссий (у 30% — полные) у ранее не леченных больных, столько же у ранее леченных алкилирующими препаратами и чувствительных к ним и у 35-40% нечувствительных к алкилирующим препаратам (15, 16). В двух больших рандомизированных исследованиях (CLGB, SWOG, ECOG, NCIC-CTG), включавших 544 больных, было показано высоко статистически значимое преимущество флюдарабина по сравнению с хлорамбуцилом: 70% ремиссий, из них 27% полных, продолжительность безрецидивного периода 32 мес. у леченных флюдарабином, 47%, 3% и 18 мес. соответственно в группе получивших хлорамбуцил (17). Аналогичные результаты получены Французской кооперативной группой в исследовании, включавшем 695 больных, при сравнении эффективности флюдарабина, CHOP и CAP: 81%, 77% и 66% ремиссий соответственно, из них полных 37%, 28% и 13% (р=0,0001) (18).
Из трех препаратов этого ряда (флюдарабин, пентостатин и кладрибин) наибольшую эффективность при ХЛЛ продемонстрировал флюдарабин. К настоящему времени флюдарабин считается наиболее эффективным препаратом в терапии ХЛЛ, позволяющим получить до 80% ремиссий (у 30% — полные) у ранее не леченных больных, столько же у ранее леченных алкилирующими препаратами и чувствительных к ним и у 35-40% нечувствительных к алкилирующим препаратам (15, 16). В двух больших рандомизированных исследованиях (CLGB, SWOG, ECOG, NCIC-CTG), включавших 544 больных, было показано высоко статистически значимое преимущество флюдарабина по сравнению с хлорамбуцилом: 70% ремиссий, из них 27% полных, продолжительность безрецидивного периода 32 мес. у леченных флюдарабином, 47%, 3% и 18 мес. соответственно в группе получивших хлорамбуцил (17). Аналогичные результаты получены Французской кооперативной группой в исследовании, включавшем 695 больных, при сравнении эффективности флюдарабина, CHOP и CAP: 81%, 77% и 66% ремиссий соответственно, из них полных 37%, 28% и 13% (р=0,0001) (18). Эти исследования показали, что эффективность флюдарабина при ХЛЛ превосходит эффективность не только отдельных препаратов, но и всех известных схем полихимиотерапии, причем эффект флюдарабина у ранее леченных больных равен или даже выше эффекта других препаратов у первичных пациентов больных. Помимо внутривенной имеется форма флюдарабина для приема внутрь. В настоящее время проводятся сравнительные исследования, которые установят, получено ли достоверное увеличение продолжительности жизни больных, леченных флюдарабином, но уже показано, что ремиссии после флюдарабина сохраняются дольше, чем после хлорамбуцила.
Эти исследования показали, что эффективность флюдарабина при ХЛЛ превосходит эффективность не только отдельных препаратов, но и всех известных схем полихимиотерапии, причем эффект флюдарабина у ранее леченных больных равен или даже выше эффекта других препаратов у первичных пациентов больных. Помимо внутривенной имеется форма флюдарабина для приема внутрь. В настоящее время проводятся сравнительные исследования, которые установят, получено ли достоверное увеличение продолжительности жизни больных, леченных флюдарабином, но уже показано, что ремиссии после флюдарабина сохраняются дольше, чем после хлорамбуцила.
Стремление улучшить достигнутые с помощью флюдарабина результаты привело к комбинациям флюдарабина с другими препаратами. Совместное применение флюдарабина и хлорамбуцила не показало большей эффективности, чем монотерапия флюдарабином и вызывало длительную миелосупрессию. Высоко эффективными оказались комбинации флюдарабина с митоксантроном (77% ремиссий, из них 20% — полных) (19), эпирубицином (92% ремиссий, 40% — полных) (20) и циклофосфаном (88-100% ремиссий, 35-50% — полных) (21). Добавление к комбинации флюдарабина с циклофосфаном G-CSF, позволившего за счет укорочения периода миелосупрессии исключить вынужденное удлинение интервалов между курсами, дало возможность получить 100% ремиссий — 47% полных и 53% частичных (22).
Добавление к комбинации флюдарабина с циклофосфаном G-CSF, позволившего за счет укорочения периода миелосупрессии исключить вынужденное удлинение интервалов между курсами, дало возможность получить 100% ремиссий — 47% полных и 53% частичных (22).
Настоящее время характеризуется активными поисками биологических препаратов для лечения ХЛЛ. Широко исследовавшийся интерферон a показал лишь слабую и короткую эффективность, не усилив и не удлинив эффект флюдарабина (23, 24).
В конце 80-х — начале 90-х годов появились первые сообщения об использовании моноклональных антител в лечении ХЛЛ. К настоящему времени клиническое применение нашли два препарата: Rituximab (Mabthera) и Campath-1H. Rituximab — гуманизированные моноклональные антитела к антигену CD20, который экспрессирован на поверхности всех человеческих В-лимфоцитов, в том числе на патологических В-лимфоцитах при лимфомах и ХЛЛ. Эффективность Rituximab при ХЛЛ оказалась заметно ниже, чем при лимфомах, что, по всей вероятности, объясняется более низкой плотностью CD20 на лимфоцитах больных ХЛЛ. При использовании обычно эффективных при лимфомах доз 375 мг/м2 только у 10-15% больных ХЛЛ удается получить частичные ремиссии. Однако после 4 недель лечения в дозах 500-825 мг/м2 эффект достигается у 22% больных, 1000-1500 мг/м2 — у 43%, 2250 мг/м2 — у 75% (25).
При использовании обычно эффективных при лимфомах доз 375 мг/м2 только у 10-15% больных ХЛЛ удается получить частичные ремиссии. Однако после 4 недель лечения в дозах 500-825 мг/м2 эффект достигается у 22% больных, 1000-1500 мг/м2 — у 43%, 2250 мг/м2 — у 75% (25).
Высоко эффективной оказалась комбинация анти-CD20 антител с флюдарабином и циклофосфаном: ремиссии получены у 93% ранее не леченных больных, в том числе у 60% — полные (26). У ранее леченных больных, в том числе резистентных к алкилирующим агентам и/или флюдарабину, эффект достигнут в 70% случаев, у 14% больных получены полные ремиссии (27). На небольшом, но первом в нашей стране опыте, мы можем подтвердить высокую эффективность данной комбинации — эффект у 85% (57% полных и 28% частичных ремиссий) больных с плохими прогностическими признаками либо резистентных к предыдущей терапии. Высокая эффективность, по всей вероятности, объясняется синергизмом действия флюдарабина и Rituximab: конечный эффект действия Rituximab заключается в комплемент-зависимом лизисе клеток, флюдарабин подавляет экспрессию ингибиторов комплемента CD55 и CD46, способствуя тем самым более активному действию антител (28). В недавних исследованиях было обнаружено, что интерферон a при ХЛЛ увеличивает экспрессию многих антигенов на поверхности В-лимфоцитов, в том числе и CD20. Это обусловливает более активное связывание антигена с антителами к нему (29). Возможно сочетание Rituximab с интерфероном окажется перспективным.
В недавних исследованиях было обнаружено, что интерферон a при ХЛЛ увеличивает экспрессию многих антигенов на поверхности В-лимфоцитов, в том числе и CD20. Это обусловливает более активное связывание антигена с антителами к нему (29). Возможно сочетание Rituximab с интерфероном окажется перспективным.
Campath-1H — гуманизированные антитела к антигену CD52, который экспрессирован на всех В- и Т-лимфоцитах как здоровых, так и больных ХЛЛ. Клинические испытания показали эффективность препарата даже у больных, рефрактерных ко всей предыдущей терапии, в том числе к флюдарабину (33% частичных ремиссий средней продолжительностью 12,4 мес.) (30). Первые результаты использования сочетания Campath-1H и флюдарабина для терапии рефрактерных больных показали высокую эффективность: ремиссии получены почти у всех больных, в том числе и полные (31). К сожалению, лечение моноклональными антителами сопряжено с целым рядом побочных эффектов: высокая температура, озноб, нередко одышка и падение артериального давления, которые часто сопровождают первое введение препаратов, особенно у больных с высоким лейкоцитозом, что объясняется высвобождением цитокинов, главным образом, интерлейкина 6 (IL-6) и фактора некроза опухоли альфа (TNFa) при распаде лимфоцитов (32). Не менее серьезным является резкое снижение иммунитета и развитие тяжелых инфекций в связи с действием антител на нормальные лимфоциты. Поэтому лечение антителами, особенно Campath-1H, следует сочетать с антибактериальной и противовирусной терапией.
Не менее серьезным является резкое снижение иммунитета и развитие тяжелых инфекций в связи с действием антител на нормальные лимфоциты. Поэтому лечение антителами, особенно Campath-1H, следует сочетать с антибактериальной и противовирусной терапией.
Трансплантация костного мозга или периферических стволовых клеток при ХЛЛ не получили столь широкого распространения, как при других лейкозах, в связи с пожилым возрастом большинства пациентов и частым отсутствием совместимого сиблинга. Тем не менее, к настоящему времени сделано более 400 трансплантаций. Аллогенная трансплантация считается показанной больным до 55 лет с вышеуказанными неблагоприятными прогностическими признаками, больным до 65 лет при наличии признаков плохого прогноза показана аутологичная трансплантация, а больным до 75 лет — трансплантация с немиелоаблативными режимами кондиционирования. Полные ремиссии, достигнутые после трансплантации, как правило, оказываются ПЦР-негативными и остаются таковыми в течение многих лет (33).
Новые методы лечения в сочетании с успехами антибиотической, противогрибковой и противовирусной терапии привели к тому, что если в 80-х годах 10 и более лет жили всего 30% больных ХЛЛ, в 90-х — 50%, то в настоящее время этот процент возрос до 60.
Среди новых направлений терапевтических поисков, прежде всего, следует упомянуть радиоиммунотерапию — препарат Zevalin (IDEC-Y2B8), представляющий собой соединение мышиных анти-CD20 антител с иттрием. Продолжается поиск наиболее эффективных комбинаций препаратов, включающих флюдарабин, особенно для плохо поддающихся стандартной терапии вариантов ХЛЛ — пролимфоцитарного и Т-клеточного. Первые обнадеживающие результаты получены при сочетании флюдарабина с гуанин-арабинозидом (Ara-G, 506U78). Начато изучение эффективности ингибиторов циклин-зависимой протеинкиназы (бриостатин, флавопиридол, UCN-01), фарнезилтрансферазы, препаратов, направленных на подавление ангиогенеза (талидомид, SU5416). На стадии лабораторного изучения находятся работы по созданию антиидиотипических вакцин против ХЛЛ и очень интересные работы по генной терапии — стимуляция иммунной функции здоровых Т-лимфоцитов, направленной против лейкемических В-лимфоцитов благодаря усилению антиген-презентирующей способности В-лимфоцитов путем трансдукции лиганда CD40 CD154 c аденовирусным вектором. Эти исследования показывают возможность рождения в ближайшем будущем патогенетической терапии ХЛЛ.
Эти исследования показывают возможность рождения в ближайшем будущем патогенетической терапии ХЛЛ.
Список литературы:
1. F. Caligaris-Cappio et al. Towards a better understanding of the biology of B-chronic lymphocytic leukemia. Sixth Meeting of the European Hematology Association, Frankfurt, Germany, 21-24 June 2001, Educational book, pp. 102-106.
2. P. Youinou et al. CD5 expression in human B-cell population. Immunol Today. 1999,20, 312-316.
3. T.J. Hamblin et al. Unmutated IgV(H) genes are associated with more aggressive form of chronic lymphocytic leukemia. Blood 1999, 94, 1848-1854.
4. R.N. Damle et al. IgV gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. Blood 1999, 94, 1840-1847.
5. H. Dohner et al. Risk classification of chronic lymphocytic leukemia based on genetics. Sixth Meeting of the European Hematology Association, Frankfurt, Germany, 21-24 June 2001, Educational book, pp. 107-109.
Sixth Meeting of the European Hematology Association, Frankfurt, Germany, 21-24 June 2001, Educational book, pp. 107-109.
6. H. Dohner et al. 11q deletions identify a new subset of B-cell chronic lymphocytic leukemia characterized by extensive nodal involvement and inferior prognosis. Blood 1997, 89, 2516-2522.
7. A. Roeber et al. P53 aberrations in B-CLL predict survival and are associated with in vivo resistance to therapy. Blood 2000, 96, 175b, abstr. 4463.
8. G. Del Poeta et al. CD38 expression identifies two distinct prognostic subsets in B-chronic lymphocytic leukemia, Blood 2000, 96, 366a, abstr. 1584.
9. B. Desablens et al. Prognostic factors among 477 patients with stage A B-CLL. Leukemia 2000 towards the cure, Program and abstract book, p. 62, abstr. P068.
10. A. B. Pardee. G1 events and regulation of cell proliferation. Science 1989, 246,603-608.
11. M. Hallek et al. Elevated serum thymidine kinase levels identify a subgroup at high risk of disease progression in early, non-smouldering chronic lymphocytic leukemia. Blood 1999, 93,1732-1737.
M. Hallek et al. Elevated serum thymidine kinase levels identify a subgroup at high risk of disease progression in early, non-smouldering chronic lymphocytic leukemia. Blood 1999, 93,1732-1737.
12. G. Digiero at al. Clorambucil in indolent chronic lymphocytic leukemia. N Engl J Med 1998, 338, 1506-1514.
13. Chemotherapeutic options in indolent chronic lymphocytic leukemia: a meta-analysis of the randomized trials. J Natl Cancer Inst 1999, 91, 861-868.
14. B. Raphael at al. Comparison of chlorambucil and prednisone versus cyclophosphamide, vincristine, and prednisone as initial treatment for chronic lymphocytic leukemia: Long term follow-up of an Eastern Cooperative Oncology Group randomized clinical trial. J Clin Oncol 1991, 9, 770-776.
15. M. Keating. Fludarabine phosphate in the treatment of chronic lymphocytic leukemia. Semin Oncol 1990, 17, 49-62.
16. M. Keating et al. Fludarabine: A new agent with marked cytoreductive activity in untreated chronic lymphocytic leukemia. J Clin Oncol 1991, 9,44-49.
Fludarabine: A new agent with marked cytoreductive activity in untreated chronic lymphocytic leukemia. J Clin Oncol 1991, 9,44-49.
17. К. Rai et al. A randomized comparison of fludarabine and chlorambucil for patient with previously untreated chronic lymphocytic leukemia. Blood 1996, 88, p141a, abstr. 552.
18. M. Leporrier at al. Randomized comparison of fludarabine, CAP and CHOP in 695 previously untreated stage B and C CLL. Hematol Cell Ther 1997, 39, S58-59.
19. S. O’Brien, Clinical challenges in chronic lymphocytic leukemia. Semin Oncol 1998, 35, suppl. 3, 22-26.
20. M. Rummel at al. Fludarabine and epirubicin in the treatment of chronic lymphocytic leukemia, a German multicenter Phase II study. Ann Oncol 1999,10,183-188.
21. I. Flinn et al. Fludarabine and cyclophosphamide: A highly active and well-tolerated regimen for patients with previously untreated chronic lymphocytic leukemia. Blood 1998, 92, suppl. 1, p. 104a, abstr. 424.
Blood 1998, 92, suppl. 1, p. 104a, abstr. 424.
22. I. Flinn et al. Fludarabine and cyclophosphamide with filgrastim support in patients with previously untreated indolent lymphoid malignancies. Blood 2000, 96, 71-75.
23. M. O’Connel et al. Clinical trial of recombinant leukocyte A interferon as initial therapy for chronic lymphocytic leukemia. ECOG pilot study. J Clin Oncol 1986,4,128-136.
24. S. O’Brien et al. Interferon maintenance therapy for patients with chronic lymphocytic leukaemia in remission after fludarabine. Blood 1995, 86, 1296-1300.
25. S. O’Brien. The emerging role of monoclonal antibodies in CLL. Leukaemia 2000 towards the cure, Program and abstract book, p. 28, abstr. S31.
26. M. Keating et al. Combination therapy in CLL. Leukemia 2000 towards the cure, Program and abstract book, p. 26, abstr. S25.
27. G. Garcia-Manero et al. Combination fludarabine, cyclophosphamide and Rituximab for previously treated patients with chronic lymphocytic leukemia. Blood 2000, 96, p. 757a, abstr. 3275.
Blood 2000, 96, p. 757a, abstr. 3275.
28. Y.M. Xiao et al. Fludarabin synergies with anti CD20 monoclonal antibody Rituximab in complement mediated cell lysis. The Hematology Journal 2000, v1, suppl1, Abstracts for the 5th Annual Meeting of the European Haematology Association, Birmingham, UK, 24-28 June 2000, p. 63, abstr. 240.
29. P. Venugopal et al. Interferon-alpha can augment multiple antigens on the surface of lymphoproliferative disorders that can be targeted using monoclonal antibodies. Blood 2000, 96, p. 279a, abstr. 1281.
30. K. Rai et al. Campath-1H is an effective salvage therapy for fludarabine failing CLL patients. Results of a phase II trial. Blood 2000, 96, p.163a, abstr. 703.
31. B. Kennedy et al. Campath-1H with fludarabine: a novel, highly active combination in refractory CLL. Blood 2000, 96, p. 289b, abstr. 4991.
32. U. Winkler et al. Cytokine-release syndrome in patients with B-cell chronic lymphocytic leukaemia and high lymphocyte counts after treatment with an anti-CD20 monoclonal antibody.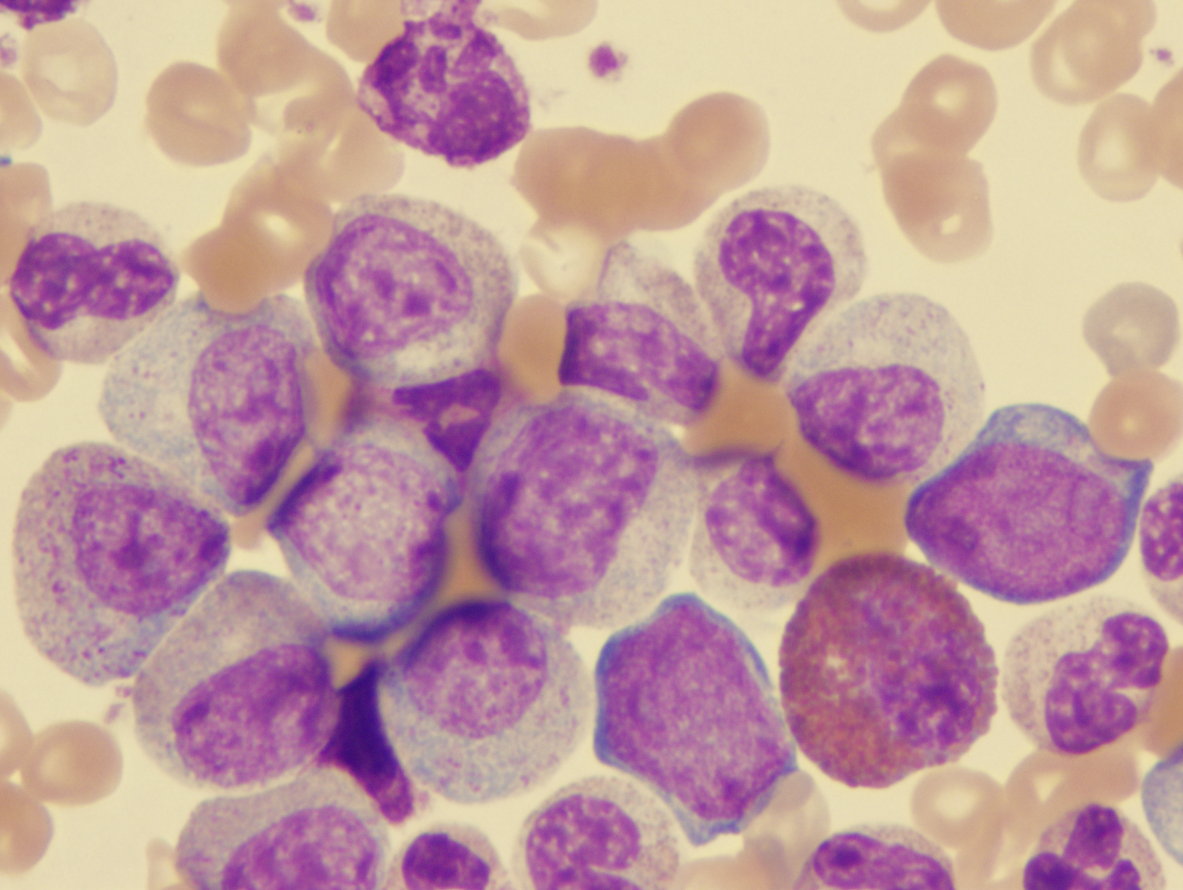 Blood 1999, 94, 2217-2224.
Blood 1999, 94, 2217-2224.
33. M. Michallet et al. HLA-identical sibling bone marrow transplantation in younger patients with chronic lymphocytic leukemia. European Group for Blood and Marrow Transplantation and the International Bone Marrow Transplant Registry, Ann Intern Med 1996, 124, 311-315.
Поиск
| Выпуск | Название | |
| Том 62, № 1 (2017) | ОПЫТ ПРИМЕНЕНИЯ ИБРУТИНИБА ПРИ ЛЕЧЕНИИ БОЛЬНОГО С РЕФРАКТЕРНЫМ ТЕЧЕНИЕМ ХРОНИЧЕСКОГО ЛИМФОЛЕЙКОЗА | Аннотация PDF (Rus) похожие документы |
Н. В. Куркина, E. A. Репина, Н. Н. Машнина В. Куркина, E. A. Репина, Н. Н. Машнина | ||
| «… хроническим лимфолейкозом, которые бы не ухудшали их качество жизни. Представлено клиническое наблюдение …» | ||
| Том 65, № 3 (2020) | Репертуар HLA-аллелей у российских больных хроническим лимфолейкозом с неблагоприятным прогнозом | Аннотация PDF (Rus) похожие документы |
Б. В. Бидерман, Е. Б. Ликольд, А. Р. Абдрахимова, Е. А. Леонов, Е. Г. Хамаганова, А. Б. Судариков В. Бидерман, Е. Б. Ликольд, А. Р. Абдрахимова, Е. А. Леонов, Е. Г. Хамаганова, А. Б. Судариков | ||
| Том 61, № 4 (2016) | Значение минимальной остаточной болезни при хроническом лимфолейкозе в эру таргетных лекарственных препаратов | Аннотация PDF (Rus) похожие документы |
А. Ю. Кувшинов, С. В. Волошин, И. С. Мартынкевич, Е. В. Клеина, А. В. Чечеткин Ю. Кувшинов, С. В. Волошин, И. С. Мартынкевич, Е. В. Клеина, А. В. Чечеткин | ||
| «… после первой линии химиоиммунотерапии у большинства больных хроническим лимфолейкозом (ХЛЛ). Тем не …» | ||
| Том 62, № 3 (2017) | КЛИНИЧЕСКИЕ АСПЕКТЫ ОПРЕДЕЛЕНИЯ СВОБОДНЫХ ЛЕГКИХ ЦЕПЕЙ ИММУНОГЛОБУЛИНОВ СЫВОРОТКИ КРОВИ У БОЛЬНЫХ ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ | Аннотация PDF (Rus) похожие документы |
E. В. Катаева, A. K. Голенков, T. A. Митина, E. Ф. Клинушкина, E. В. Трифонова, Л. Л. Высоцкая, Ю. Б. Черных, Ю. Ю. Чуксина, И. H. Когарко, Б. С. Когарко, С. А. Марьина, К. A. Белоусов, С. Г. Захаров В. Катаева, A. K. Голенков, T. A. Митина, E. Ф. Клинушкина, E. В. Трифонова, Л. Л. Высоцкая, Ю. Б. Черных, Ю. Ю. Чуксина, И. H. Когарко, Б. С. Когарко, С. А. Марьина, К. A. Белоусов, С. Г. Захаров | ||
| «… У 15 больных впервые выявленным хроническим лимфолейкозом проводили анализ свободных легких цепей …» | ||
| Том 61, № 4 (2016) | Ассоциации полиморфизма ряда генов врожденного иммунитета с риском развития хронических лимфопролиферативных заболеваний | Аннотация PDF (Rus) похожие документы |
Е. Л. Назарова, В. Т. Демьянова, В. И. Шардаков, Е. Н. Зотина, И. А. Докшина Л. Назарова, В. Т. Демьянова, В. И. Шардаков, Е. Н. Зотина, И. А. Докшина | ||
| «… генов, в том числе врожденного иммунного ответа. Обследовали 51 больного хроническим лимфолейкозом (ХЛЛ …» | ||
| Том 64, № 1 (2019) | ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ ОЛИГОНУКЛЕОТИДА DSP30 В СОЧЕТАНИИ С ИНТЕРЛЕЙКИНОМ-2 ДЛЯ ВЫЯВЛЕНИЯ ХРОМОСОМНЫХ АБЕРРАЦИЙ У БОЛЬНЫХ ХРОНИЧЕСКИМ ЛИМФОЛЕЙКОЗОМ | Аннотация PDF (Rus) похожие документы |
М. А. Кислицына, Т. Н. Обухова, Г. А. Алимова, Л. А. Шишигина, Л. А. Гребенюк, Т. В. Абрамова, С. Р. Горячева, Т. Н. Моисеева А. Кислицына, Т. Н. Обухова, Г. А. Алимова, Л. А. Шишигина, Л. А. Гребенюк, Т. В. Абрамова, С. Р. Горячева, Т. Н. Моисеева | ||
| «… клеток крови/костного мозга/лимфоузла больных хроническим лимфолейкозом (ХЛЛ) для выявления клональных …» | ||
| 1 — 6 из 6 результатов | ||
Хронический лимфолейкоз: прогрессивные технологии в Израиле
Получить ценыНа сегодняшний день хронический лимфолейкоз в Израиле не считается смертельно опасным заболеванием: медленное развитие патологии дает врачам возможность тщательно контролировать состояние пациента и делать все возможное, чтобы человек с данной патологией вел полноценный образ жизни. Но для того чтобы лечение хронического и острого лимфолейкоза было высокоэффективным, в Израиле лечение рака крови доверяют только квалифицированным врачам.
Но для того чтобы лечение хронического и острого лимфолейкоза было высокоэффективным, в Израиле лечение рака крови доверяют только квалифицированным врачам.
В клиниках такого уровня, как Топ Ихилов, работают лучшие специалисты страны. Остановив свой выбор на Топ Ихилов, пациенты с хроническим лимфоцитарным лейкозом могут не сомневаться в том, что ими будут заниматься врачи, в совершенстве владеющие самыми современными методиками лечения лейкемии.
Современные методики как залог исцеления
Лечение хронического лимфолейкоза в Израиле отличается высокой эффективностью: уровень медицины в этой стране таков, что практически у всех пациентов достигаются стойкие ремиссии, которые длятся довольно долго, что позволяет больным вести нормальный образ жизни. В Топ Ихилов практикуется несколько методов лечения острого лимфолейкоза, выбор каждого из которых зависит в Израиле от множества факторов.
- Динамичное наблюдение. Если лимфолейкоз был диагностирован на ранней стадии, израильские врачи не предпринимают активных действий, чтобы не усугубить состояние пациента побочными эффектами терапии.
 Тем не менее пациент должен регулярно сдавать анализы и проходить обследование, чтобы врач не упустил тот момент, когда заболевание начнет прогрессировать.
Тем не менее пациент должен регулярно сдавать анализы и проходить обследование, чтобы врач не упустил тот момент, когда заболевание начнет прогрессировать. - Химиотерапия является основным методом лечения хронического и острого лимфолейкоза в Израиле. Химиопрепараты должны назначаться пациенту только опытным врачом и в строго индивидуальном порядке. Химиотерапия может быть пероральной, внутривенной либо комбинированной. Специалисты клиники Топ Ихилов составляют для каждого пациента схему лечения, подбирают максимально эффективные лекарственные средства, делают все возможное, чтобы уменьшить проявление побочных эффектов.
- Медикаментозное лечение хронического лимфолейкоза. В Израиле могут назначаться стероиды, а также лекарственные средства, необходимые для устранения проявлений лейкемии (антибиотики для борьбы с инфекциями, иммуноглобулины и т. д.).
- Моноклональная терапия – инновационный метод, широко практикующийся в Израиле и дающий очень хорошие результаты.
 Суть терапии заключается в том, что пациенту вводят моноклональные антитела, уничтожающие только атипичные клетки в обход здоровых.
Суть терапии заключается в том, что пациенту вводят моноклональные антитела, уничтожающие только атипичные клетки в обход здоровых. - Лучевая терапия назначается пациентам с увеличенными лимфоузлами, селезенкой и печенью. Облучению подвергают только пораженные участки организма, а при распространенном процессе – весь организм.
- Лимфолейкоз: операция в Израиле. Удалению подлежат увеличенные селезенка, лимфоузлы. Операцию в Израиле комбинируют с медикаментозным и лучевым лечением лимфолейкоза, что дает потрясающие результаты излечения.
- Пересадка костного мозга – это очень эффективный метод, позволяющий врачам назначить пациенту курс интенсивной химиотерапии, полностью уничтожающей атипичные стволовые клетки, и пересадить ему абсолютно здоровый костный мозг.
Медицинские процедуры
Диагностика хронического лимфолейкоза в клинике Топ Ихилов
Диагностика хронического лимфолейкоза в Израиле проводится самым тщательным образом с применением новейших технологий. В Топ Ихилов базовая диагностическая программа для пациентов с хроническим лимфолейкозом производится в течение 3 дней.
В Топ Ихилов базовая диагностическая программа для пациентов с хроническим лимфолейкозом производится в течение 3 дней.
День первый – осмотр и консультация
В первый день пациента осматривает врач онкогематолог, тщательно анализирует и изучает историю болезни и результаты проведенных исследований. Если врач считает результаты неудовлетворительными, он отправляет их на ревизию.
День второй – диагностика
На второй день пациент проходит исследования, назначенные врачом для уточнения диагноза.
- Развернутые анализы крови.
- Пункция костного мозга и его исследование в лаборатории.
- Рентгенография грудной клетки.
- ПЭТ-КТ и ПЭТ-МРТ как самые современные и высокоинформативные методики.
Помимо вышеперечисленных мероприятий врач может назначить пациенту опциональные процедуры:
- цитогенетическое исследование;
- иммунофенотипирование;
- анализ на определение специфических антител в крови;
- биопсию увеличенного лимфоузла;
- КТ.

День третий – заключение врачей
Получив данные исследований, врач созывает консилиум специалистов, которые решают вопрос о дальнейшем лечении пациента.
Диагностические процедуры
Хронический лимфолейкоз: цены на лечение в Израиле
В Израиле в Топ Ихилов стоимость лечения хронического и острого лимфолейкоза значительно демократичнее, чем в Европе и США. Разница в цене составляет от 30 до 50%. И это при высоком уровне диагностики и лечения! Точные цены на лечение хронического лимфолейкоза вы можете узнать только после проведения диагностики. Для получения информации о приблизительной стоимости лечения хронического лимфолейкоза в одной из лучших клиник Израиля оставьте заявку на нашем сайте.
Сообщите мне ценыХронический и острый лимфолейкоз: преимущества лечения в Израиле
- Врачи высокой квалификации, отдающие себя полностью и свои знания для исцеления пациентов.
- Медицинское оборудование, которому нет аналогов в СНГ.

- Медицинское обслуживание высокого уровня по доступным ценам.
Топ Ихилов: доверьте свое здоровье лучшим врачам Израиля
- Онкологическое и гематологическое отделения клиники Топ Ихилов являются одними из лучших в Израиле.
- В Топ Ихилов работают высококлассные специалисты, которые со всей ответственностью подходят к лечению каждого пациента.
- Израиль занимает ведущее место в мире по излечению пациентов онкологического профиля.
- 5
- 4
- 3
- 2
- 1
Лечение хронического лимфоцитарного лейкоза (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI). База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны понятным, нетехническим языком. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке.Версии для пациентов написаны понятным, нетехническим языком. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI входит в состав Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении хронического лимфолейкоза.Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход. Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациента была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и лучшие способы помочь больным раком.Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным». Пациенты могут захотеть принять участие в клиническом исследовании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводку информации о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно. Тем не менее, пользователю будет разрешено написать такое предложение, как «Сводка информации о раке PDQ NCI о профилактике рака груди указывает риски следующим образом: [включить выдержку из резюме]».
Лучший способ процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment.PDQ Лечение хронического лимфоцитарного лейкоза. Bethesda, MD: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/leukemia/patient/cll-treatment-pdq. Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389485]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ. Если вы хотите использовать изображение из сводки PDQ и не используете все сводки, вы должны получить разрешение от владельца.Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об отказе от ответственности
Информация, содержащаяся в этом резюме, не должна использоваться для принятия решений о страховом возмещении. Более подробная информация о страховом покрытии доступна на сайте Cancer.gov на странице «Управление онкологическими услугами».
Более подробная информация о страховом покрытии доступна на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Дополнительная информация о том, как связаться с нами или получить помощь при раке.gov можно найти на странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Лейкемия — Хронический лимфоцитарный — ХЛЛ: виды лечения
НА ЭТОЙ СТРАНИЦЕ: Вы узнаете о различных типах лечения, которые врачи используют для лечения людей с ХЛЛ. Используйте меню для просмотра других страниц.
В этом разделе объясняются типы лечения, являющиеся стандартом лечения ХЛЛ. «Стандарт лечения» означает лучшие известные методы лечения.При принятии решения о плане лечения вам рекомендуется рассмотреть возможность проведения клинических испытаний. Клиническое испытание — это научное исследование, в котором проверяется новый подход к лечению. Врачи хотят узнать, является ли новое лечение безопасным, эффективным и, возможно, лучше, чем стандартное лечение. Клинические испытания могут тестировать новое лекарство, новую комбинацию стандартных методов лечения или новые дозы существующих лекарств или других методов лечения. Клинические испытания — это один из вариантов лечения и ухода на всех стадиях рака.Ваш врач может помочь вам рассмотреть все варианты лечения. Чтобы узнать больше о клинических испытаниях, см. Разделы «О клинических испытаниях» и «Последние исследования».
Врачи хотят узнать, является ли новое лечение безопасным, эффективным и, возможно, лучше, чем стандартное лечение. Клинические испытания могут тестировать новое лекарство, новую комбинацию стандартных методов лечения или новые дозы существующих лекарств или других методов лечения. Клинические испытания — это один из вариантов лечения и ухода на всех стадиях рака.Ваш врач может помочь вам рассмотреть все варианты лечения. Чтобы узнать больше о клинических испытаниях, см. Разделы «О клинических испытаниях» и «Последние исследования».
Обзор лечения
В области лечения рака разные врачи часто работают вместе, чтобы создать общий план лечения пациента, который сочетает в себе различные виды лечения. Это называется мультидисциплинарной командой. Бригады по лечению рака включают в себя множество других специалистов в области здравоохранения, таких как фельдшеры, медсестры-онкологи, социальные работники, фармацевты, консультанты, диетологи и другие.
Варианты лечения и рекомендации зависят от нескольких факторов, включая тип и стадию лейкемии, возможные побочные эффекты, предпочтения пациента, возраст и общее состояние здоровья. Ваш план лечения может также включать лечение симптомов и побочных эффектов, что является важной частью лечения рака. Поскольку ХЛЛ часто развивается медленно, многим людям может не потребоваться немедленное лечение, а некоторым вообще может не потребоваться лечение. Хотя современные стандартные методы лечения могут быть высокоэффективными, неясно, может ли какое-либо лечение полностью избавиться от ХЛЛ, и большинство пациентов не излечиваются от болезни с помощью лечения.Цель лечения — облегчить симптомы и вызвать длительную ремиссию (см. Ниже).
Ваш план лечения может также включать лечение симптомов и побочных эффектов, что является важной частью лечения рака. Поскольку ХЛЛ часто развивается медленно, многим людям может не потребоваться немедленное лечение, а некоторым вообще может не потребоваться лечение. Хотя современные стандартные методы лечения могут быть высокоэффективными, неясно, может ли какое-либо лечение полностью избавиться от ХЛЛ, и большинство пациентов не излечиваются от болезни с помощью лечения.Цель лечения — облегчить симптомы и вызвать длительную ремиссию (см. Ниже).
Описание распространенных типов лечения, используемых при ХЛЛ, приводится ниже. Найдите время, чтобы узнать обо всех вариантах лечения, и обязательно задавайте вопросы о том, что неясно. Поговорите со своим врачом о целях каждого лечения и о том, чего вы можете ожидать от лечения. Узнайте больше о принятии решений о лечении.
Наблюдение и ожидание / активное наблюдение для ранней стадии CLL
Пациенты с симптомами и / или большим количеством ХЛЛ в крови, лимфатических узлах или селезенке часто нуждаются в лечении вскоре после постановки диагноза. Однако для других пациентов немедленное лечение не требуется. Таким людям рекомендуется тщательное наблюдение за заболеванием без активного лечения. Это стандартный подход для пациентов с ранней стадией заболевания и отсутствием симптомов. Этот подход может быть трудным для понимания, что может вызвать стресс. Однако пациенты могут обнаружить, что их опасения по поводу этого подхода со временем уменьшаются. Если у вас есть вопросы или опасения, поговорите со своим лечащим врачом.
Однако для других пациентов немедленное лечение не требуется. Таким людям рекомендуется тщательное наблюдение за заболеванием без активного лечения. Это стандартный подход для пациентов с ранней стадией заболевания и отсутствием симптомов. Этот подход может быть трудным для понимания, что может вызвать стресс. Однако пациенты могут обнаружить, что их опасения по поводу этого подхода со временем уменьшаются. Если у вас есть вопросы или опасения, поговорите со своим лечащим врачом.
В это время внимательно следят за анализом крови пациента и регулярно проводят медицинские осмотры.Если ХЛЛ показывает признаки ухудшения, тогда начинается активное лечение. Исследования показали, что подход ожидания и ожидания, также называемый активным наблюдением или бдительным ожиданием, не приносит никакого вреда по сравнению с немедленным лечением на ранней стадии ХЛЛ. У некоторых пациентов симптомы не развиваются годами или даже десятилетиями, и им никогда не понадобится лечение. Пациентам, у которых показатели крови не менялись в течение нескольких месяцев или лет, возможно, нужно будет проверять их только каждые 3-6 месяцев.
Хотя многие пациенты с ХЛЛ могут комфортно жить без активного лечения, полезно использовать это время для улучшения общего состояния здоровья. Это включает в себя отказ от курения и своевременное обновление всех прививок. Однако пациентов с ХЛЛ не должны получать вакцину против опоясывающего лишая (опоясывающего лишая), поскольку она может вызвать инфекцию опоясывающего лишая у пациентов с ослабленной иммунной системой.
Лечение рекомендуется людям с ухудшением показателей крови, у которых также развились симптомы.Эти симптомы могут включать повышенную утомляемость, ночную потливость, увеличение лимфатических узлов или снижение количества эритроцитов или тромбоцитов. Людям с ХЛЛ рекомендуется обсудить со своим врачом, нуждаются ли их симптомы в лечении, уравновешивая преимущества лечения с риском побочных эффектов
Лечение с использованием лекарств
Системная терапия — это использование лекарств для уничтожения раковых клеток. Этот тип лекарств вводится через кровоток, чтобы достичь раковых клеток по всему телу. Системные методы лечения обычно назначает гематолог-онколог.
Системные методы лечения обычно назначает гематолог-онколог.
Обычные способы проведения системной терапии включают введение внутривенной (IV) трубки с помощью иглы в вену, таблетки или капсулы, которые можно проглотить (перорально). Системные методы лечения также могут применяться в виде инъекций под кожу, называемых подкожными инъекциями.
Типы системной терапии, используемые при ХЛЛ, включают:
Химиотерапия
Таргетная терапия
Каждый из этих видов терапии обсуждается ниже более подробно.Человек может получать только 1 тип системной терапии за один раз или комбинацию системных терапий, проводимых одновременно. Их также можно назначать как часть плана лечения, который включает хирургическое вмешательство и / или лучевую терапию. Клинические испытания других препаратов описаны в разделе «Последние исследования».
Лекарства, используемые для лечения рака, постоянно проходят экспертизу. Зачастую лучший способ узнать о прописанных вам лекарствах, их назначении и их потенциальных побочных эффектах или взаимодействии с другими лекарствами — поговорить с врачом. Узнайте больше о своих рецептах с помощью доступных для поиска баз данных лекарств.
Узнайте больше о своих рецептах с помощью доступных для поиска баз данных лекарств.
Химиотерапия
Химиотерапия — это использование лекарств для уничтожения раковых клеток, обычно путем прекращения способности раковых клеток расти и делиться.
Общие препараты от ХЛЛ включают:
Бендамустин (Бендека, Треанда)
Флударабин (Fludara), наиболее часто встречающийся у людей с ХЛЛ, которые моложе и не имеют делеции в хромосоме 17
Пентостатин (Нипент)
Кладрибин (лейстатин)
Хлорамбуцил (лейкеран)
Циклофосфамид (Цитоксан)
Побочные эффекты химиотерапии зависят от человека и применяемой дозы, но они могут включать усталость, риск инфекции, тошноту и рвоту, выпадение волос, потерю аппетита и диарею.Эти побочные эффекты обычно проходят после завершения лечения.
Узнайте больше об основах химиотерапии.
Таргетная терапия
Таргетная терапия — это лечение, направленное на специфические гены лейкоза, белки или тканевую среду, которая способствует его росту и выживанию. Этот тип лечения блокирует рост и распространение лейкозных клеток, ограничивая повреждение здоровых клеток.
Этот тип лечения блокирует рост и распространение лейкозных клеток, ограничивая повреждение здоровых клеток.
Не все виды рака имеют одинаковые цели. Чтобы найти наиболее эффективное лечение, ваш врач может провести тесты для определения генов, белков и других факторов лейкемии.Это помогает врачам лучше подбирать каждому пациенту наиболее эффективное лечение, когда это возможно. Кроме того, продолжаются научные исследования, чтобы узнать больше о конкретных молекулярных мишенях и новых методах лечения, направленных на них. Узнайте больше об основах целевого лечения. Таргетная терапия ХЛЛ включает:
Моноклональные антитела. Моноклональное антитело распознает и присоединяется к определенному белку на поверхности лейкозных клеток, и оно не влияет на клетки, в которых этот белок отсутствует.Моноклональные антитела к ХЛЛ включают:
Ритуксимаб (Ритуксан)
Офатумумаб (Арзерра)
Обинутузумаб (Газива)
Венетоклакс (Venclexta)
Ингибиторы киназ.
 Киназы — это ферменты, обнаруженные как в здоровых, так и в раковых клетках. Некоторые раковые клетки могут быть уничтожены лекарствами, блокирующими определенный фермент киназы. Ингибиторы киназ для ХЛЛ являются относительно новыми и могут быть доступны только для пациентов с ХЛЛ, который вернулся (так называемый рецидивирующий ХЛЛ) или обострился (так называемый рефрактерный ХЛЛ), или в ходе клинических испытаний.
Киназы — это ферменты, обнаруженные как в здоровых, так и в раковых клетках. Некоторые раковые клетки могут быть уничтожены лекарствами, блокирующими определенный фермент киназы. Ингибиторы киназ для ХЛЛ являются относительно новыми и могут быть доступны только для пациентов с ХЛЛ, который вернулся (так называемый рецидивирующий ХЛЛ) или обострился (так называемый рефрактерный ХЛЛ), или в ходе клинических испытаний.Ибрутиниб (Имбрувика) одобрен для людей с ХЛЛ, которые уже получили как минимум 1 другое лечение. Он также одобрен в качестве первого метода лечения пациентов с делецией хромосомы 17. Однако он может вызвать кровотечение и не рекомендуется пациентам, принимающим антикоагулянты.
Idelalisib (Zydelig) — еще один тип ингибитора киназы, который вводится перорально. Он также одобрен для лечения рецидивирующего ХЛЛ в комбинации с ритуксимабом.
Побочные эффекты таргетной терапии зависят от применяемого препарата. Часто первые сеансы лечения ритуксимабом, обинутузумабом или офатумумабом вызывают жар и озноб, которые обычно проходят после нескольких первых сеансов лечения. Лечение венетоклаксом может вызвать почечную недостаточность и синдром лизиса опухоли (TLS) — опасную для жизни неотложную медицинскую помощь, которая может возникнуть после лечения. Однако ваш врач может назначить определенные лекарства, которые помогут облегчить эти симптомы. Узнайте больше о том, когда обращаться к врачу во время лечения рака.
Часто первые сеансы лечения ритуксимабом, обинутузумабом или офатумумабом вызывают жар и озноб, которые обычно проходят после нескольких первых сеансов лечения. Лечение венетоклаксом может вызвать почечную недостаточность и синдром лизиса опухоли (TLS) — опасную для жизни неотложную медицинскую помощь, которая может возникнуть после лечения. Однако ваш врач может назначить определенные лекарства, которые помогут облегчить эти симптомы. Узнайте больше о том, когда обращаться к врачу во время лечения рака.
Комбинированная системная терапия
Схема или график лечения обычно состоит из определенного количества циклов, проводимых в течение определенного периода времени. Иногда врач может использовать комбинацию лекарств, но комбинация лекарств не всегда лучше, чем одно лекарство. Когда начинается лечение, врачи могут использовать ряд различных препаратов в зависимости от стадии заболевания, возраста и состояния здоровья человека.
Комбинации, перечисленные ниже, могут использоваться для CLL. Комбинации, включающие флударабин, обычно используются для более молодых пациентов:
Комбинации, включающие флударабин, обычно используются для более молодых пациентов:
Ритуксимаб и флударабин (иногда сокращенно FR)
Циклофосфамид и флударабин (называемые FC)
Циклофосфамид, флударабин и ритуксимаб (называемые FCR)
Пентостатин, циклофосфамид и ритуксимаб (так называемая ПЦР)
Бендамустин и ритуксимаб (называемые BR)
Иделалисиб и ритуксимаб для пациентов с рецидивирующим ХЛЛ
Обинитузумаб и хлорамбуцил для пожилых пациентов
Ибрутиниб, бендамустин и ритуксимаб при рецидивирующем ХЛЛ
Трансплантация костного мозга / трансплантация стволовых клеток
Трансплантация костного мозга — это медицинская процедура, при которой костный мозг, содержащий лейкоз, заменяется высокоспециализированными клетками, называемыми гемопоэтическими стволовыми клетками, которые развиваются в здоровый костный мозг. Гемопоэтические стволовые клетки — это кроветворные клетки, обнаруживаемые как в кровотоке, так и в костном мозге. Сегодня эту процедуру чаще называют трансплантацией стволовых клеток, а не трансплантацией костного мозга, поскольку обычно пересаживаются стволовые клетки крови, а не сама ткань костного мозга.
Гемопоэтические стволовые клетки — это кроветворные клетки, обнаруживаемые как в кровотоке, так и в костном мозге. Сегодня эту процедуру чаще называют трансплантацией стволовых клеток, а не трансплантацией костного мозга, поскольку обычно пересаживаются стволовые клетки крови, а не сама ткань костного мозга.
Существует 2 типа трансплантации стволовых клеток в зависимости от источника замещения стволовых клеток крови: аллогенные (ALLO) и аутологичные (AUTO). ALLO использует донорские стволовые клетки, а AUTO — собственные стволовые клетки пациента.ALLO — это тип трансплантата, используемый для лечения ХЛЛ, и обычно его применяют для более молодых пациентов, когда стандартные методы лечения не сработали или у пациента есть высокий риск более быстрого возвращения ХЛЛ. Цель состоит в том, чтобы уничтожить все раковые клетки в костном мозге, крови и других частях тела с помощью высоких доз химиотерапии и / или лучевой терапии, а затем позволить замещающим стволовым клеткам крови создать здоровый костный мозг.
Побочные эффекты зависят от типа трансплантата, вашего общего состояния здоровья и других факторов.Узнайте больше об основах трансплантации стволовых клеток и костного мозга.
Лучевая терапия
Лучевая терапия — это использование высокоэнергетических рентгеновских лучей или других частиц для уничтожения раковых клеток. Врач, специализирующийся на проведении лучевой терапии для лечения рака, называется онкологом-радиологом. Схема или расписание лучевой терапии обычно состоит из определенного количества процедур, проводимых в течение определенного периода времени. Лучевая терапия не часто используется для лечения ХЛЛ, поскольку болезнь распространяется по всему телу.Однако лучевая терапия может быть очень полезной для уменьшения увеличенной селезенки или опухших лимфатических узлов и облегчения определенных симптомов.
Побочные эффекты лучевой терапии могут включать усталость, легкие кожные реакции, расстройство желудка и жидкий стул. Большинство побочных эффектов проходят вскоре после окончания лечения. Узнайте больше об основах лучевой терапии.
Узнайте больше об основах лучевой терапии.
Хирургия
Иногда может быть рекомендована операция по удалению селезенки, называемая спленэктомией, поскольку у человека с ХЛЛ селезенка может сильно увеличиться.Хирург-онколог — это врач, который специализируется на лечении рака с помощью хирургии.
Перед операцией поговорите со своим лечащим врачом о возможных побочных эффектах конкретной операции, которая вам предстоит. Узнайте больше об основах хирургии.
Лечение симптомов и побочных эффектов
Лейкоз и его лечение часто вызывают побочные эффекты. Помимо лечения, предназначенного для замедления, остановки или устранения заболевания, важной частью лечения является облегчение симптомов и побочных эффектов человека.Этот подход называется паллиативным или поддерживающим уходом и включает в себя поддержку пациента с его или ее физическими, эмоциональными и социальными потребностями.
Паллиативная помощь — это любое лечение, направленное на уменьшение симптомов, улучшение качества жизни и поддержку пациентов и их семей.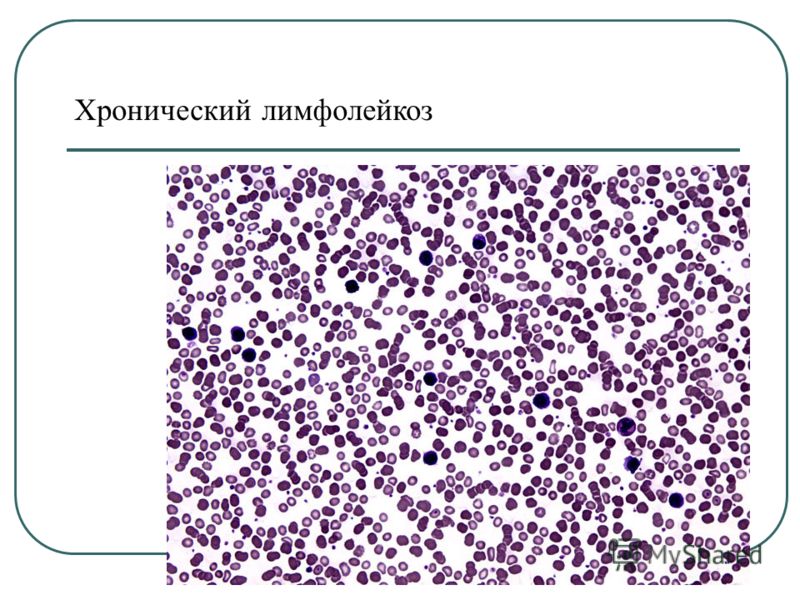 Любой человек, независимо от возраста, типа и стадии рака, может получить паллиативную помощь. Лучше всего это работает, когда паллиативную помощь начинают как можно раньше в процессе лечения рака. Люди часто получают лечение от лейкемии одновременно с лечением, чтобы ослабить побочные эффекты.Фактически, люди, которые получают оба препарата одновременно, часто имеют менее серьезные симптомы, лучшее качество жизни и сообщают, что они более удовлетворены лечением.
Любой человек, независимо от возраста, типа и стадии рака, может получить паллиативную помощь. Лучше всего это работает, когда паллиативную помощь начинают как можно раньше в процессе лечения рака. Люди часто получают лечение от лейкемии одновременно с лечением, чтобы ослабить побочные эффекты.Фактически, люди, которые получают оба препарата одновременно, часто имеют менее серьезные симптомы, лучшее качество жизни и сообщают, что они более удовлетворены лечением.
Паллиативные методы лечения широко варьируются и часто включают прием лекарств, изменения питания, методы релаксации, эмоциональную поддержку и другие методы лечения. Вы также можете получать паллиативное лечение, подобное тому, которое предназначено для устранения ХЛЛ, например химиотерапию или лучевую терапию. Поговорите со своим врачом о целях каждого лечения в вашем плане лечения.
Паллиативные методы лечения ХЛЛ могут включать:
Иммуноглобулин от повторяющихся инфекций. Это может быть полезно внутривенно каждый месяц, потому что у людей с ХЛЛ меньше нормальных антител, которые помогают им бороться с инфекциями.

Высокие дозы кортикостероидов могут помочь организму перестать вырабатывать антитела, разрушающие эритроциты и / или тромбоциты.
Спленэктомия (см. Раздел «Хирургия» выше) для пациентов, у которых вырабатываются антитела против собственных здоровых клеток крови.
Ритуксимаб также может быть полезен, если иммунная система пациента вырабатывает антитела против собственных клеток крови (см. «Симптомы и признаки»).
Перед началом лечения поговорите со своим лечащим врачом о возможных побочных эффектах конкретного плана лечения и вариантах паллиативной помощи. Во время и после лечения обязательно сообщите своему врачу или другому члену медицинской бригады, если у вас возникла проблема, чтобы ее можно было решить как можно быстрее.Узнайте больше о паллиативной помощи.
Огнеупорный CLL
Если лейкоз не поддается лечению, болезнь называется рефрактерной. Если это произойдет, рекомендуется поговорить с врачами, имеющими опыт лечения. У врачей могут быть разные мнения о лучшем стандартном плане лечения. Клинические испытания также могут быть вариантом. Узнайте больше о том, как получить второе мнение перед началом лечения, чтобы вам было комфортно с выбранным планом лечения.
У врачей могут быть разные мнения о лучшем стандартном плане лечения. Клинические испытания также могут быть вариантом. Узнайте больше о том, как получить второе мнение перед началом лечения, чтобы вам было комфортно с выбранным планом лечения.
Если ХЛЛ становится устойчивым к 1 препарату, что означает, что препарат больше не действует, часто рекомендуются другие методы лечения или препараты.Паллиативная помощь также будет иметь важное значение для облегчения симптомов и побочных эффектов.
Для большинства людей диагноз «рефрактерный ХЛЛ» вызывает большой стресс и временами является трудным. Вам и вашей семье рекомендуется поговорить о своих чувствах с врачами, медсестрами, социальными работниками или другими членами медицинской бригады. Также может быть полезно поговорить с другими пациентами, в том числе через группу поддержки.
Ремиссия
Целью лечения является облегчение любых симптомов ХЛЛ и максимальное уменьшение количества оставшихся ХЛЛ.Полная ремиссия (ПР) наступает, когда врач не может найти никаких доказательств лейкемии, оставшейся после повторного тестирования. Частичная ремиссия (ЧР) — это когда остается лейкоз.
PR чаще всего встречается у людей с ХЛЛ, которые получают текущее стандартное лечение. Благодаря PR пациенты могут чувствовать себя достаточно хорошо с нормальными показателями крови, не иметь увеличенных лимфатических узлов или селезенки, но все же иметь обнаруживаемое количество ХЛЛ в костном мозге.
Новые методы мониторинга, называемые методами минимальной остаточной болезни (MRD; раковые клетки, не уничтоженные лечением), позволяют лучше обнаруживать меньшее количество аномальных лимфоцитов, а также определять разницу между аномальными и здоровыми лимфоцитами.Для определения глубины ремиссии у пациентов с ХЛЛ в настоящее время все чаще используются методы MRD.
Цель новых, более интенсивных методов лечения или таргетной терапии — уничтожить больше раковых клеток в надежде продлить жизнь человека. В будущем определение CR в CLL, вероятно, изменится с развитием технологий. Например, некоторые чувствительные тесты могут обнаружить очень небольшие уровни аномальных изменений ДНК, специфичных для ХЛЛ. Когда эти чувствительные тесты больше не могут обнаружить ХЛЛ, это называется молекулярной ремиссией.
Вероятность повторения
Ремиссия может быть временной или постоянной. Эта неопределенность заставляет многих беспокоиться о том, что рак вернется. Рецидивирующий ХЛЛ — это ХЛЛ, который вернулся после лечения. Хотя многие ремиссии длятся долго, важно обсудить с врачом возможность возвращения болезни. Понимание риска рецидива и вариантов лечения может помочь вам почувствовать себя более подготовленным, если лейкемия все же вернется. Узнайте больше о том, как справиться со страхом повторения.
Если есть повторение, новый цикл тестирования начнется снова, чтобы узнать как можно больше о повторении. После того, как это обследование будет сделано, вы и ваш врач обсудите варианты лечения. Часто план лечения будет включать лечение, описанное выше, такое как химиотерапия и таргетная терапия, но они могут использоваться в другой комбинации или проводиться с другой скоростью. Ваш врач может предложить клинические испытания, в которых изучаются новые способы лечения этого типа рецидивирующего лейкоза.Какой бы план лечения вы ни выбрали, паллиативная помощь будет иметь важное значение для облегчения симптомов и побочных эффектов.
Обнаружение рецидива ХЛЛ не означает, что лечение необходимо немедленно. Фактически, обычно рекомендуется наблюдать и ждать (см. Выше), когда активное лечение начинается только в том случае, если болезнь снова вызывает симптомы.
Люди с рецидивирующей лейкемией часто испытывают такие эмоции, как неверие или страх. Вам предлагается поговорить с медицинским персоналом об этих чувствах и спросить об услугах поддержки, которые помогут вам справиться с этим.Узнайте больше о том, как бороться с рецидивом рака.
Если лечение не работает
Излечиться от лейкемии не всегда возможно. Если рак не поддается лечению или контролю, болезнь можно назвать поздней или терминальной.
Этот диагноз вызывает стресс, и многим людям трудно обсуждать запущенный рак. Однако важно вести открытые и честные беседы со своим лечащим врачом, чтобы выразить свои чувства, предпочтения и опасения. Медицинская бригада всегда готова помочь, и многие члены команды обладают особыми навыками, опытом и знаниями, чтобы поддерживать пациентов и их семьи.Чрезвычайно важно убедиться, что человеку физически комфортно и он не испытывает боли.
Люди с запущенным заболеванием и ожидаемая продолжительность жизни менее 6 месяцев могут обратиться за помощью в хоспис. Уход в хосписе призван обеспечить максимально возможное качество жизни людям, находящимся на грани конца жизни. Вам и вашей семье рекомендуется обсудить с медицинским персоналом варианты ухода в хосписе, которые включают уход на дому, специальный центр хосписа или другие медицинские учреждения.Уход за больными и специальное оборудование могут сделать пребывание дома приемлемым вариантом для многих семей. Узнайте больше о расширенном планировании лечения рака.
После смерти любимого человека многим людям нужна поддержка, чтобы помочь им пережить утрату. Узнайте больше о горе и утрате.
Следующий раздел в этом руководстве — О клинических испытаниях . Он предлагает больше информации об исследованиях, направленных на поиск лучших способов лечения больных раком.Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Хронический лимфоцитарный лейкоз: варианты лечения
Лечение зависит от тяжести сопутствующих симптомов, а также от скорости роста рака. Если у пациентов отсутствуют симптомы или проявляются незначительные симптомы, врачи могут решить не лечить болезнь сразу. Такой подход называется «активным наблюдением» (также известным как «наблюдай и жди» или «бдительное ожидание»). С помощью этой стратегии общее состояние здоровья и болезни пациентов контролируется путем регулярных проверок и различных процедур оценки, таких как лабораторные исследования и визуальные исследования.Активное лечение начинают, если у пациента начинают развиваться симптомы, связанные с лимфомой, или есть признаки прогрессирования заболевания на основании анализов во время последующих посещений. Исследования показали, что пациенты с менее запущенным заболеванием, лечение которых ведется с использованием активного подхода к эпиднадзору, имеют результаты, аналогичные результатам лечения пациентов на ранних стадиях заболевания. Однако пациентам с высоким риском заболевания может потребоваться немедленное начало лечения.
В настоящее время существует множество вариантов лечения первой линии для лечения ХЛЛ / SLL.Выбор лечения будет зависеть от стадии заболевания, симптомов пациента, возраста и общего состояния здоровья пациента, а также преимуществ лечения по сравнению с побочными эффектами. Выбор лечения также может варьироваться в зависимости от того, отсутствуют ли в клетках лимфомы пациента части определенных хромосом (так называемые делеции). Одна возможная делеция в CLL обнаружена в меньшем плече хромосомы 17 (так называемая делеция 17p). Хотя 17p — одна из наиболее часто встречающихся делеций, есть и другие, которые могут повлиять на варианты лечения.
Общие препараты или комбинации препаратов, используемые в качестве начального лечения ХЛЛ / SLL, включают:
- Акалабрутиниб (Calquence)
- BR (бендамустин [Treanda] и ритуксимаб [Rituxan])
- CG (хлорамбуцил [лейкеран] и обинутузумаб [газива])
- FCR (флударабин [Флудара], циклофосфамид [Цитоксан] и ритуксимаб)
- FR (флударабин и ритуксимаб)
- Ибрутиниб (Имбрувица)
- Ибрутиниб-Обинутузумаб (Имбрувица-Газива)
- Ибрутиниб-ритуксимаб (Имбрувица-Ритуксан)
- Офатумумаб (Арзерра) и хлорамбуцил
- ПЦР (пентостатин, циклофосфамид и ритуксимаб)
- Ритуксимаб и хлорамбуцил
- Ритуксимаб и гиалуронидаза и человек (Rituxan Hycela)
- Venetoclax (Venclexta)
Чтобы узнать о методах лечения ХЛЛ / СЛЛ, которые исследуются, загрузите Информационный бюллетень о хроническом лимфоцитарном лейкозе / малой лимфоцитарной лимфоме.
См. Также:
Удачный поворот событий в хроническом лимфоцитарном лейкозе
Ноябрь 2013 года ознаменовал начало борьбы Сони Долинджер с сильной усталостью, головными болями и сильными болями в носовых пазухах. «Я чувствовала себя так, будто у меня мононуклеоз», — говорит она. «Я спал часами, а когда проснулся, почувствовал, что мне нужно спать больше».
Долинджер, которому тогда было 39 лет, поступил в магистратуру по программе медсестер в Университете Мэриленда с целью оказания помощи больным раком.Она была трехлетней матерью — самой младшей из них было всего 5 лет — и постоянно ухаживала за своей матерью, которая только что умерла от рака яичников. «Я пыталась связать усталость с горем или стрессом, но рак всегда был в моей памяти», — говорит она.
Она посетила своего лечащего врача, который обнаружил опухшие лимфатические узлы возле уха Долинджера. Анализы крови показали высокое количество лейкоцитов. Отчаявшись разобраться в своих симптомах, Долинджер попросила специалиста по ушам, носу и горлу удалить и проверить один из узлов.Диагноз: хронический лимфолейкоз (ХЛЛ), рак лимфоцитов или В-клеток, который начинается в костном мозге и мигрирует в кровь, а иногда и в лимфатические узлы.
ХЛЛ поражает более 20 000 человек в Соединенных Штатах каждый год, по данным Американского онкологического общества, и поражает больше мужчин, чем женщин. Некоторые исследования показывают, что люди, которые подверглись воздействию Agent Orange, токсичного гербицида, использованного во Вьетнамской войне, имеют больший риск развития ХЛЛ. Другие указывают на генетические факторы риска: у людей, у которых есть родственники первой степени родства с ХЛЛ, в два-четыре раза выше вероятность развития этого заболевания.Но для большинства людей с ХЛЛ, включая Долинджера, болезнь возникает из-за плохой руки.
При ХЛЛ лейкозные клетки медленно накапливаются в костном мозге, в конечном итоге вытесняя нормальные лейкоциты, эритроциты и тромбоциты. Поскольку отличительным признаком ХЛЛ является ненормальный анализ крови, большинство пациентов обнаруживают, что у них заболевание, почти случайно во время планового осмотра. «Я использую аналогию с моими пациентами: клетки лейкемии подобны сорнякам, растущим в вашем саду. Если он забит сорняками, хорошие растения не прорастут », — говорит доктор.Дэвид Л. Портер, Джоди Фишер Хоровиц, профессор передового опыта в лечении лейкемии в Медицинской школе Перельмана и директор по клеточной терапии и трансплантологии в Пенсильванской медицине в Филадельфии.
Исторически врачи считали ХЛЛ неизлечимой болезнью с ограниченными возможностями лечения, ни одно из которых не было излечивающим. Пациенты либо отвечали на начальное лечение, иногда в течение многих лет, прежде чем в конечном итоге рецидивировали, либо их заболевание ухудшалось в течение шести месяцев после начальной терапии (рефрактерный ХЛЛ).Теперь у врачей в арсенале больше инструментов, чем когда-либо, для борьбы с ХЛЛ, включая более полдюжины схем без химиотерапии.
«За последнее десятилетие картина лечения ХЛЛ резко изменилась, как для людей с рецидивом заболевания, так и для людей, получающих первичное лечение», — говорит д-р Нитин Джайн, доцент кафедры лейкемии в The Онкологический центр доктора медицины Андерсона Техасского университета в Хьюстоне. «С развитием таргетных методов лечения, в том числе одноэлементных и комбинированных схем, пациенты достигают более стойких ремиссий и лучшего качества жизни.
Ученые до сих пор не до конца понимают, что вызывает ХЛЛ и как окончательно остановить его развитие. Они не знают, почему ХЛЛ часто возвращается после лечения или почему некоторые пациенты вообще не реагируют. Многие люди годами страдают рецидивом заболевания и нуждаются в нескольких курсах лечения. К счастью, с новыми вариантами лечения и комбинированной терапией, ХЛЛ все больше превращается из неизлечимого хронического заболевания в рак, который можно вылечить.
ЛЕЧЕНИЕ ODYSSEY
Когда такие пациенты, как Долинджер, получают диагноз ХЛЛ, они часто чувствуют, что их будущее стирается.«Слышать слова« неизлечимая болезнь »было похоже на удар в живот», — говорит Долинджер.
После поиска в Интернете ответов Долинджер узнал о потенциально лечебном лечении под названием Имбрувика (ибрутиниб). «Я помню, как читал о пациенте, который принимал Имбрувицу в хосписе. Через несколько недель к нему вернулась жизнь », — говорит Долинджер. «Это вселило в меня надежду».
Она присоединилась к группе онлайн-поддержки, где все ветераны с ХЛЛ говорили одно и то же: обратитесь к специалисту по ХЛЛ.В течение двух месяцев Долинджер сидел перед доктором Брюсом Чесоном, заместителем начальника отделения гематологии / онкологии в Джорджтауне Комплексного онкологического центра Ломбарди в Вашингтоне, округ Колумбия. Чесон лечил пациентов с ХЛЛ в течение десятилетий, но во время первого визита Долинджер с он сказал ей, что лучше всего ничего не делать. Он прописал Adderall, лекарство от синдрома дефицита внимания и гиперактивности, чтобы облегчить ее усталость, и назначил ей график проверок, чтобы контролировать уровень ее крови.
В отличие от солидных опухолей, скажем, груди, простаты и легких, в которых основное внимание уделяется раннему выявлению и немедленному лечению, подход первой линии при ХЛЛ иногда состоит в том, чтобы наблюдать и ждать. Начиная с 1980-х и 1990-х годов, в нескольких исследованиях не сообщалось об улучшении выживаемости от лечения ХЛЛ после постановки диагноза. «Если мы начнем лечение слишком быстро, мы рискуем подвергнуть пациентов токсическому воздействию без какой-либо пользы», — говорит доктор Таня Сиддики, гематолог-онколог из City of Hope в Дуарте, Калифорния.
Врачи принимают решение о лечении на основании признаков прогрессирования заболевания в соответствии с рекомендациями, установленными Международным семинаром по хроническому лимфоцитарному лейкозу. Факторы включают такие факторы, как увеличение лимфатических узлов, селезенки или печени; снижение количества крови и тромбоцитов; свидетельство аутоиммунной гемолитической анемии; и изнуряющие, похожие на грипп симптомы. Когда
приходит время для лечения, у врачей есть множество вариантов лекарств, таких как:
- Химиотерапия, такая как флудара (флударабин), бендека (бендамустин) и цитоксан (циклофосфамид).
- Целенаправленная терапия — ингибиторы киназ для блокирования путей роста раковых клеток, такие как Имбрувика и Зиделиг (иделалисиб), и белки BCL-2 для регулирования роста и гибели клеток, такие как Venclexta (венетоклакс).
- Моноклональные антитела, которые прикрепляются к специфическому белку (CD20) на поверхности В-клеток, способствующему заболеванию, и убивают клетки, такие как Ритуксан (ритуксимаб), Арзерра (офатумумаб) и Газива (обинутузумаб).
Когда 71-летний Терри Эванс получил диагноз ХЛЛ в 2000 году, наиболее эффективными вариантами лечения были химиоиммунотерапия (коктейль из трех препаратов Флудара, Цитоксан и Ритуксан, более известный как FCR) и трансплантация костного мозга. .Менеджер по компьютерным технологиям в городе Лонг-Бич, штат Калифорния, Эванс проплыл годами почти без симптомов.
«Я предполагал, что являюсь частью счастливых 20–30% пациентов, которые не нуждаются в лечении», — говорит он. Эванс вышел на пенсию в 2005 году. Затем, в 2007 году, количество его лейкоцитов увеличилось вдвое в течение месяца. В следующем месяце он снова удвоился. Он начал испытывать ночную потливость, усталость и мышечную слабость и похудел. «Я был так слаб, что мне пришлось сесть после душа, чтобы просто высохнуть», — говорит он.
Вот тогда он решил обратиться к специалисту. Оказалось, что у Эванса развилась аутоиммунная гемолитическая анемия, осложнение ХЛЛ, при котором иммунная система атакует собственные эритроциты. «Врач посмотрел на мою кровь под микроскопом и доставил меня в больницу», — говорит Эванс. «Если бы я не пришел, — сказал доктор, — я бы умер в течение 48 часов».
Как только его аутоиммунное состояние было под контролем, Эванс присоединился к клиническому испытанию трех препаратов, в котором изучались ингибитор BCL-2, называемый навитоклакс (ранее ABT-263), Бендека и Ритуксан.Во время лечения его уровень в крови вернулся к норме, но режим нанес серьезный ущерб ферментам его печени, вынудив его отказаться от участия в исследовании.
Два года спустя он участвовал в другом исследовании, в котором сравнивали Имбрувицу и Арзерру. Он участвовал в обеих группах испытания, затем снова случился рецидив. В мае 2017 года Эванс присоединился к третьему испытанию, в котором он остался на Имбрувице и добавил Венклексту. «В течение одного месяца комбинированного режима мои показатели крови были самыми низкими за восемь лет», — говорит Эванс.«Мой врач провел тест на минимальную остаточную болезнь (MRD), проверяя одну из 100 000 клеток, и не смог обнаружить ХЛЛ в моем организме».
Такая карусель лечения является нормой для пациентов с ХЛЛ, но доказательства МОБ среди пролеченных пациентов также становятся все более распространенными. К тому времени, когда Долинджер окунулась в лечебный бассейн в ноябре 2016 года, режимы химиотерапии для ХЛЛ начали терять популярность, и новые препараты, такие как последний коктейль Эванса, стали стандартной терапией.В нескольких исследованиях сообщалось, что эти агенты дают лучшие результаты с меньшим количеством опасений по поводу токсичности.
НАЧАЛО НАПРАВЛЕННОЙ АТАКИ
Существуют доказательства того, что таргетная терапия, такая как имбрувика, может со временем снизить частоту инфекций и может помочь восстановить иммунную систему пациентов. Такие эксперты, как доктор Джон Аллан, доцент кафедры гематологии и медицинской онкологии в New York-Presbyterian и Weill Cornell Medicine в Нью-Йорке, утверждают, что Имбрувика, в частности, настолько эффективна в изменении естественной истории ХЛЛ, что лечит пациенты могут приближаться к продолжительности жизни населения в целом.
В июле испытание, в котором участвовало более 500 пациентов с впервые выявленным ХЛЛ, показало, что комбинация имбрувики и ритуксана остановила прогрессирование лейкемии у 89,4% участников примерно через три года по сравнению с 72,9% тех, кто получал традиционную химиотерапию. комбинация — FCR. Кроме того, через три года 98,8% людей, получавших комбинацию, по сравнению с 91,5% тех, кто получал традиционное лечение.
В настоящее время исследователи изучают комбинированную терапию, сочетающую Имбрувику и Венклексту, по той же схеме, что и Эванс.В исследовании New England Journal of Medicine 2019 года исследователи сообщили, что после 12 циклов комбинированных лекарств у 88% участников не было признаков рака, а у 61% была ремиссия с неопределяемым MRD. Исследователи также проверяют, может ли терапия с тремя препаратами — Имбрувика, Венклекста и Газива — еще больше усилить реакцию.
«Обратной стороной является то, что многие из этих вариантов являются терапиями на протяжении всей жизни, и каждый вариант представляет определенный уровень токсичности», — говорит Портер. «Вот почему« смотри и жди »- предпочтительная стратегия первой линии.«Поскольку существует два типа ХЛЛ — быстрорастущий и медленнорастущий, — ключевым моментом является пристальное наблюдение. Оба типа пациентов в клинике выглядят одинаково, но имеют разные маркеры крови, генетические и белковые маркеры.
Эти маркеры помогают врачам определить не только, у каких пациентов наиболее вероятно прогрессирование, но и какая форма терапии может работать лучше всего. «Некоторые из этих характеристик риска меняются со временем и в ответ на действия различных агентов», — говорит Сиддики. «Поэтому, прежде чем пациент начнет лечение, поменяет лекарство или перейдет на новое лечение, он должен снова проверить прогностические маркеры.”
Когда ожидание закончилось, наилучшее начальное лечение зависит от возраста пациента, медицинских проблем, причины лечения и личных предпочтений. Некоторые пациенты предпочитают пероральный препарат инфузиям, другие хотят избегать пожизненной терапии, а третьи плохо переносят побочные эффекты. «Таким образом, мы можем выбирать и адаптировать лечение с учетом этих различных вариантов», — говорит Аллан.
Когда пришло время Долинджер, она работала полный рабочий день в качестве старшего менеджера кампании в Обществе лейкемии и лимфомы.Она начала исследовать клинические испытания и под руководством своего врача приняла участие в испытании трех препаратов в Государственном университете Огайо, в котором изучались Газива, Имбрувица и Венклекста. «Это было одно из первых клинических испытаний с окончательной точкой остановки: 16 месяцев», — говорит Долинджер. «Я сказал детям, что буду лечиться в другом состоянии, вернусь и поправлюсь — и в это я действительно верил».
Но ее набег на лечебное помещение был мучительным. Как и у большинства пациентов, у Долингера была реакция на инфузию после первой дозы Газивы.Поскольку раковые клетки отмирают массово, пациенты часто испытывают тошноту, симптомы гриппа и чувство стеснения в груди. В ночь первого сеанса лечения Долинджер проснулась в своем гостиничном номере, вся в поту, с лихорадкой и болью. «Я направилась прямо в скорую», — говорит она. «У меня было значительное повреждение печени в результате лечения, поэтому они держали меня под наблюдением. Потом у меня случился сепсис, и одно из моих легких разрушилось ».
Долинджер оправилась от реакции, обнаружила, что количество лейкоцитов упало до нормального уровня, и продолжила исследование.Через шесть месяцев после ее первого лечения биопсия костного мозга не показала признаков заболевания в ее системе — 90% ее клеток были положительными на ХЛЛ в начале испытания. Она завершила 16-месячное испытание. Она сохранила свой отрицательный статус MRD после испытания, но испытала серьезные побочные эффекты, начиная от инфекций и заканчивая надпочечниковой недостаточностью, которые длились целый год. «Я только сейчас снова начинаю чувствовать себя нормальной», — говорит она.
БОЛЬШОЙ ВОПРОСНИК
У каждого пациента с ХЛЛ своя траектория заболевания.Некоторые пациенты смотрят и ждут десятилетиями. Другие получают начальное лечение химиотерапией или целевым лечением и переходят в ремиссию на неопределенный срок. Но типичный курс ХЛЛ включает периоды безрецидивной ремиссии, перемежающиеся с лечением.
Независимо от того, в какой лагерь попадают пациенты, данные об отдаленных результатах отсутствуют. «Некоторые из этих новых агентов, такие как Имбрувика, существуют только с 2010 года, поэтому мы не знаем, каковы эффекты длительного непрерывного лечения», — говорит Аллан.«Кроме того, многие из этих методов лечения используются бесконечно долго, пока они эффективны. При затратах более 100 000 долларов в год это чрезвычайно дорого ».
Даже когда лечение работает, у пациентов часто возникают рецидивы. Когда это происходит, терапия химерными антигенными рецепторами (CAR) -T-клетками может быть вариантом. С помощью этой терапии врачи удаляют
Т-клеток человека, реконструируют их, чтобы распознавать CLL-специфический белок, называемый CD19, и возвращают их пациенту, чтобы помочь бороться с раковыми клетками.Но в отличие от пожизненной таргетной терапии, терапия CAR-T-клетками является одноразовым лечением, которое, вероятно, будет продолжать тестироваться и продвигаться дальше по цепочке лечения.
«Были получены поразительные результаты у пациентов с высокой рефрактерностью, у которых не было других вариантов. Некоторые пациенты находятся на лечении уже много лет, и у них не обнаруживается никаких заболеваний, — говорит Аллан. Самая большая проблема: только от 25% до 35% пациентов достигают стойких ремиссий или отсутствуют признаки рака в течение разумного периода времени.
Даже эти цифры начинают меняться.В Городе надежды команда Сиддики наблюдала за 23 пациентами с рефрактерным ХЛЛ в течение в среднем 9 месяцев и обнаружила, что более 80% из них достигли общей ремиссии с примерно 45% полными ремиссиями и около 70% имели отрицательные результаты MRD в крови и биопсия костного мозга в течение месяца после получения CAR-T-клеток. Эти результаты были устойчивыми при трех-, шестимесячном и девятимесячном наблюдении, а за тремя пациентами наблюдали без рецидивов более одного года. «Сейчас мы изучаем, может ли комбинация терапии CAR-T-клетками и имбрувики дать еще лучший ответ», — говорит Сиддики.
А пока такие люди, как Долинджер и Эванс, чувствуют себя так, будто играют в русскую рулетку. Испытание Долинджер завершилось в феврале 2018 года, и с тех пор она сосредоточилась на укреплении своей иммунной системы. Эванс находился на схеме Имбрувика / Венклекста почти 14 месяцев, и его показатели крови остаются в пределах нормы. «Но я всегда смотрю на шаг вперед, на случай, если у меня снова случится рецидив», — говорит он.
Ученые все больше верят, что есть основания для надежды. Хотя эти новые, более мощные агенты еще не известны как излечивающие, число пациентов с рефрактерным ХЛЛ начинает сокращаться.«Все еще есть пациенты, у которых развивается устойчивость даже к новым агентам, но они составляют все меньший и меньший процент пациентов с ХЛЛ», — говорит Портер.
С появлением новых и более эффективных методов лечения ХЛЛ медленно трансформируется из хронического заболевания, требующего пожизненного лечения, в рак, который врачи могут искоренить. «Мы еще не знаем, достигли ли мы этого, но я думаю, что мы можем начать думать о том, чтобы потенциально вылечить это», — говорит Портер.
Такие люди, как Эванс и Долинджер, отстаивают дело, участвуют в клинических испытаниях, повышают осведомленность о новых терапевтических средствах и даже собирают деньги для продвижения исследований в направлении лечения.Начиная с начала лечения в 2008 году, Эванс помогает пациентам с вновь диагностированным и рефрактерным заболеванием в группе поддержки. Благодаря своей работе с Обществом CLL, Эванс помог создать более 31 отделения группы поддержки по CLL в США и два в Канаде. «Обучение фасилитаторов групп поддержки стало для меня второй карьерой», — говорит он.
Благодаря своей работе в Обществе лейкемии и лимфомы Долинджер также сделала карьеру в мире ХЛЛ. Для нее это значит действовать, а не сидеть в стороне — и это стало семейным делом.«Мои сыновья коллективно собрали 60 000 долларов на исследования ХЛЛ, — говорит она. «Это их способ сделать что-то, чтобы помочь маме».
Хронический лимфолейкоз — Лечение
Лечение хронического лимфолейкоза (ХЛЛ) во многом зависит от того, насколько далеко оно развито на момент постановки диагноза.
Возможно, сначала вам просто нужно будет наблюдать, если это обнаружится на ранней стадии. Химиотерапия — это основное лечение, если оно более продвинутое.
Лечение часто помогает удерживать ХЛЛ под контролем на долгие годы.
Он может исчезнуть после лечения вначале (известная как ремиссия), но обычно возвращается (рецидив) через несколько месяцев или лет, и может потребоваться повторное лечение.
Этапы CLL
Врачи используют «стадии», чтобы описать степень развития ХЛЛ и помочь им определить, когда его нужно лечить.
Есть 3 основных этапа CLL:
- стадия A — у вас увеличены лимфатические узлы менее чем в 3 областях (например, шея, подмышки или пах) и высокое количество лейкоцитов
- стадия B — у вас увеличены лимфатические узлы в 3 или более областях и высокое количество лейкоцитов
- стадия C — у вас увеличены лимфатические узлы или увеличенная селезенка, высокое количество лейкоцитов и низкое количество эритроцитов или тромбоцитов
Стадии B и C ХЛЛ обычно лечат сразу.Стадия А обычно требует лечения только в том случае, если она быстро ухудшается или начинает вызывать симптомы.
Мониторинг ХЛЛ на ранней стадии
Лечение может не потребоваться, если на момент постановки диагноза ХЛЛ у вас нет никаких симптомов.
Это потому, что:
- ХЛЛ часто развивается очень медленно и может не вызывать симптомов в течение многих лет
- Нет смысла начинать лечение раньше
- лечение может вызвать серьезные побочные эффекты
В этих случаях вам обычно просто нужны регулярные визиты к врачу и анализы крови для наблюдения за состоянием.
Лечение химиотерапией обычно рекомендуется только в том случае, если у вас появятся симптомы или тесты показывают, что состояние ухудшается.
Химиотерапия при более поздних стадиях ХЛЛ
Многим людям с ХЛЛ в конечном итоге потребуется химиотерапия. Это включает в себя прием лекарств, чтобы держать рак под контролем.
Существует ряд различных лекарств от ХЛЛ, но большинство людей будут принимать 3 основных лекарства в циклах лечения продолжительностью 28 дней.
Эти лекарства:
- флударабин — химиотерапевтическое лекарство, обычно принимаемое в виде таблеток в течение 3-5 дней в начале каждого цикла лечения
- Циклофосфамид — химиотерапевтическое лекарство, которое также обычно принимают в виде таблеток в течение 3-5 дней в начале каждого цикла лечения
- ритуксимаб — противораковое лекарственное средство, вводимое в вену в течение нескольких часов (внутривенная инфузия) в начале каждого цикла лечения
Флударабин и циклофосфамид обычно можно принимать дома.Ритуксимаб назначают в больнице, и иногда вам может потребоваться остаться в больнице на ночь.
Можно также попробовать ряд различных лекарств, если у вас нет этих лекарств, вы пробовали их, но они не помогли, или ваш ХЛЛ вернулся после лечения.
К ним относятся бендамустин, хлорамбуцил, ибрутиниб, иделалисиб, обинутузумаб, офатумумаб и преднизолон (стероидный препарат).
Побочные эффекты лечения
Лекарства, используемые для лечения ХЛЛ, могут вызывать некоторые серьезные побочные эффекты, в том числе:
Большинство побочных эффектов проходят после прекращения лечения.Сообщите вашей медицинской бригаде, если вы испытываете какие-либо побочные эффекты, поскольку есть некоторые методы лечения, которые могут помочь.
Узнайте больше о побочных эффектах химиотерапии
Трансплантаты стволовых клеток или костного мозга
Трансплантация стволовых клеток или костного мозга иногда используется, чтобы попытаться полностью избавиться от ХЛЛ или контролировать его на более длительный период.
Стволовые клетки — это клетки, вырабатываемые губчатым материалом, находящимся в центре некоторых костей (костный мозг), и могут превращаться в различные типы клеток крови, включая лейкоциты.
Трансплантация стволовых клеток включает:
- пройти высокодозную химиотерапию и лучевую терапию для уничтожения раковых клеток в вашем теле
- Удаление стволовых клеток из крови или костного мозга донора — в идеале это будет кто-то из близких вам родственников, например, брат или сестра
- трансплантация донорских стволовых клеток непосредственно в одну из ваших вен
Это единственное потенциальное лекарство от ХЛЛ, но его делают не очень часто, поскольку это интенсивное лечение, и многие люди с ХЛЛ старше и недостаточно здоровы, чтобы польза от него перевешивала риски.
Первоначальное лечение химиотерапией и лучевой терапией может вызвать значительную нагрузку на ваше тело и вызвать неприятные побочные эффекты.
Также существует риск серьезных проблем после трансплантации, таких как реакция «трансплантат против хозяина». Здесь пересаженные клетки атакуют другие клетки вашего тела.
Узнайте больше о том, что происходит во время трансплантации стволовых клеток, и о рисках трансплантации стволовых клеток.
Другие методы лечения ХЛЛ
Существует также ряд других методов лечения, которые иногда используются для лечения некоторых проблем, вызванных ХЛЛ, особенно если вы не можете пройти химиотерапию или она не работает.
Сюда входят:
- Лучевая терапия для уменьшения увеличенных лимфатических узлов или опухшей селезенки
- Операция по удалению опухшей селезенки
- антибиотики, противогрибковые и противовирусные препараты, помогающие снизить риск заражения инфекцией во время лечения
- Переливание крови для увеличения количества эритроцитов и тромбоцитов (тромбоцитов) при тяжелой анемии или проблемах с кровотечением и синяками
- Заместительная иммуноглобулиновая терапия — переливание антител, взятых из донорской крови, которое может помочь предотвратить инфекции
- инъекций лекарства, называемого гранулоцитарно-колониестимулирующим фактором (G-CSF), для увеличения количества лейкоцитов
Вам также может потребоваться дополнительное лечение при любых развивающихся осложнениях ХЛЛ.
Отказ от лечения
Поскольку многие методы лечения ХЛЛ могут иметь неприятные побочные эффекты, которые могут повлиять на качество вашей жизни, вы можете отказаться от конкретного вида лечения.
Это полностью ваше решение, и ваша терапевтическая бригада будет уважать любое ваше решение.
Вам не придется спешить с принятием решения о лечении, и вы можете поговорить со своим врачом, партнером, семьей и друзьями, прежде чем принять решение.
Обезболивающее и уход за больными по-прежнему будут доступны по мере необходимости.
Клинические испытания ХЛЛ
В настоящее время в Великобритании проводится несколько клинических испытаний, чтобы попытаться найти лучший способ лечения ХЛЛ.
Это исследования, в которых используются новые и экспериментальные методы, чтобы увидеть, насколько хорошо они работают при лечении и, возможно, излечении состояния.
Если вы заинтересованы в участии в клиническом исследовании, ваша группа по уходу может сообщить вам, есть ли в вашем районе бега, и объяснить связанные с этим преимущества и риски.
Узнайте больше о клинических испытаниях или поищите на веб-сайте UK Clinical Trials Gateway подробную информацию о клинических испытаниях хронического лимфоцитарного лейкоза, которые в настоящее время проводятся в Великобритании.
Последняя проверка страницы: 7 февраля 2019 г.
Срок следующего рассмотрения: 7 февраля 2022 г.
Лечебных решений | Хронический лимфолейкоз
,00Информация о том, как ваш врач принимает решение о том, какое лечение вам необходимо, и о том, какое лечение по этапам.
Основные виды лечения
Когда врачи выбирают для вас лучшее лечение, они обращают внимание на:
- степень развития лейкемии (стадия)
- ваше общее состояние здоровья
- ваш возраст и уровень физической подготовки
Возможно, вам не понадобится лечение сразу, если у вас очень ранняя стадия ХЛЛ и у вас нет симптомов. Если вам нужно лечение, вам назначат химиотерапию. Вы также можете пройти лучевую терапию.
Если ваш ХЛЛ продвинулся на более поздней стадии или вернулся после ранее проведенного лечения, вам может быть назначена химиотерапия целевым лекарством от рака.
Небольшое количество людей может пройти интенсивное лечение, что означает химиотерапию с трансплантацией костного мозга или стволовых клеток.
Ранние стадии
Многие люди не имеют симптомов, когда им впервые ставят диагноз. Возможно, это было обнаружено при обычном анализе крови. Если у вас нет симптомов, ваш специалист, вероятно, посоветует вам пока не лечиться.
CLL может развиваться очень медленно. Вы можете быть старше на момент постановки диагноза и, возможно, никогда не будете нуждаться в лечении.Начало лечения при отсутствии симптомов вряд ли поможет.
Ваш терапевт или гематолог будет регулярно наблюдать за вами и проверять количество клеток крови. Это называется бдительным ожиданием.
Вы можете начать лечение по следующим причинам:
- быстро развивающееся заболевание
- увеличенные лимфатические узлы или селезенка
- недостаточность костного мозга
- усталость (утомляемость), сильная потеря веса, обильная ночная потливость
Ваш врач, вероятно, порекомендует химиотерапию.Они также могут порекомендовать лучевую терапию для уменьшения опухших лимфатических узлов или операцию по удалению опухшей селезенки.
Лечение не избавит от ХЛЛ навсегда, но может привести к ремиссии. Ремиссия означает, что при сканировании или тестах нет признаков лейкемии и у вас нет симптомов.
При ранней стадии ХЛЛ ремиссия может длиться годами. Через некоторое время лейкоз может снова стать активным и вызвать симптомы. Это называется рецидивом.
Более поздние стадии
Поздняя стадия ХЛЛ включает ХЛЛ стадии В с симптомами или ХЛЛ стадии С.Если у вас более поздняя стадия, ваш врач может предложить химиотерапию, возможно, в сочетании с лекарством под названием ритуксимаб.
С помощью лечения можно контролировать лейкоз (в стадии ремиссии). У вас может быть период, когда вы не нуждаетесь в лечении.
Если ХЛЛ возвращается после лечения, ваш врач может порекомендовать дополнительную химиотерапию или таргетное лекарство от рака.
У многих людей с ХЛЛ могут быть дальнейшие ремиссии при дополнительном лечении каждый раз, когда лейкоз возвращается.Чем дольше вы проходите курс лечения, тем короче ремиссии.
Если у вас увеличились лимфатические узлы, врач может порекомендовать лучевую терапию для их уменьшения. Если ваша селезенка опухла, они могут порекомендовать операцию по ее удалению.
Интенсивное лечение
Небольшое количество людей проходят интенсивное лечение ХЛЛ с помощью трансплантации костного мозга или стволовых клеток, но это все еще экспериментальное лечение. Интенсивное лечение направлено на то, чтобы попытаться навсегда избавиться от ХЛЛ или контролировать его дольше, чем при стандартном лечении.
Прежде чем вы сможете пройти этот вид лечения, вам нужно пройти обследование, чтобы убедиться, что вы достаточно хорошо себя чувствуете, чтобы пройти через него. Если вы не в хорошей физической форме, то интенсивное лечение слишком рискованно.
Если вы собираетесь пройти интенсивное лечение, сначала вам будет проведена химиотерапия, чтобы попытаться вывести ХЛЛ в ремиссию.
Затем вам сделали пересадку стволовых клеток или костного мозга. Это означает больше химиотерапии, а иногда и лучевой терапии, с последующим капельным введением (инфузией) донорского костного мозга или стволовых клеток крови.
Клинические испытания
Исследователи и врачи продолжают искать лучшие методы лечения или различные комбинации лечения ХЛЛ. Они тестируют их в клинических испытаниях. Ваш врач может предложить вам присоединиться к исследованию. В нашем разделе исследований вы найдете информацию о клинических испытаниях, в том числе о том, каково это принять участие.
Хронический лимфолейкоз — NORD (Национальная организация по редким заболеваниям)
Лечение
Лечение ХЛЛ зависит от стадии заболевания, симптомов и прогноза.Пациенты с ХЛЛ могут не проявлять никаких симптомов в течение многих лет и не требуют особого ухода. Однако на более поздних стадиях заболевания химиотерапия является обычным методом лечения. Другой вариант лечения — терапия моноклональными антителами, которые связывают белки с раковыми клетками, активируя механизм их разрушения. Использование обоих этих методов лечения вместе обычно дает наивысший ответ на лечение.
В особо агрессивных или рецидивирующих случаях ХЛЛ многообещающей является трансплантация стволовых клеток крови и костного мозга.
Вся помощь пациентам с ХЛЛ, независимо от того, получают ли они специфическую терапию или нет, включает то, что мы называем поддерживающей терапией, и включает переливания тромбоцитов, которые используются при кровотечениях, связанных со стойким снижением количества тромбоцитов в крови (тромбоцитопения). При анемии обычно назначают переливание эритроцитов. Антибиотики используются для борьбы с бактериальными инфекциями, обычно связанными с уменьшением количества лейкоцитов (лимфопения) и низким уровнем гаммаглобулина в крови.Прививки важны и должны включать ежегодные вакцины против гриппа, а также пневмококковые вакцины, превнар и пневмовакс. Однако подобные живые вирусные вакцины против опоясывающего лишая могут быть опасными.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило противораковый препарат Ритуксан (ритуксимаб) в 2010 году для лечения некоторых пациентов с хроническим лимфолейкозом. Ритуксан предназначен вместе с химиотерапией для пациентов с ХЛЛ, которые начинают терапию первой линии. Ритуксан вводят с двумя другими химиотерапевтическими препаратами: Флудара (флударабин) и Цитоксан (циклофосфамид).
Другие антитела с той же мишенью, что и ритуксимаб, были одобрены Управлением по контролю за продуктами и лекарствами США для первичной терапии ХЛЛ в сочетании с пероральными химиотерапевтическими таблетками Лейкеран (хлорамбуцил): Газива (обинутузумаб) и Арзерра (офатумумаб) были одобрены для борьбы с ХЛЛ. Изначально Arzerra был одобрен для лечения рефрактерных пациентов, но совсем недавно был одобрен для ранее не леченных пациентов в комбинации с лейкераном, а также для пациентов, которые ранее прошли химиоиммунотерапию и находятся в стадии ремиссии.
Treanda (бендамустина гидрохлорид) был одобрен FDA для лечения ХЛЛ. Было показано, что Treanda может быть эффективной при приеме один раз в четыре недели, как и другие виды химиотерапии.
За последние несколько лет произошел взрыв очень эффективных низкомолекулярных ингибиторов ХЛЛ. Это таскен в форме таблеток, которые обычно хорошо переносятся. Зиделиг (иделалисиб) был одобрен для лечения рецидивов ХЛЛ с сопутствующими медицинскими проблемами в 2014 году. Также в 2014 году имбрувика (ибрутиниб) был одобрен для лечения пациентов с хроническим лимфолейкозом, которые получали хотя бы одну предыдущую терапию, а также пациентов с высоким риском del17p.В 2016 году лейбл Imbruvica был расширен и теперь включает всех пациентов с ХЛЛ, включая тех, кто ранее не лечился.




 Например, выпадение участка 13-й хромосомы или трисомия по 12-й при отсутствии других изменений в хромосомах являются благоприятным признаком, а выпадение участка 11-й или 17-й хромосом определяют более плохой прогноз.
Например, выпадение участка 13-й хромосомы или трисомия по 12-й при отсутствии других изменений в хромосомах являются благоприятным признаком, а выпадение участка 11-й или 17-й хромосом определяют более плохой прогноз.
 Тем не менее пациент должен регулярно сдавать анализы и проходить обследование, чтобы врач не упустил тот момент, когда заболевание начнет прогрессировать.
Тем не менее пациент должен регулярно сдавать анализы и проходить обследование, чтобы врач не упустил тот момент, когда заболевание начнет прогрессировать. Суть терапии заключается в том, что пациенту вводят моноклональные антитела, уничтожающие только атипичные клетки в обход здоровых.
Суть терапии заключается в том, что пациенту вводят моноклональные антитела, уничтожающие только атипичные клетки в обход здоровых.

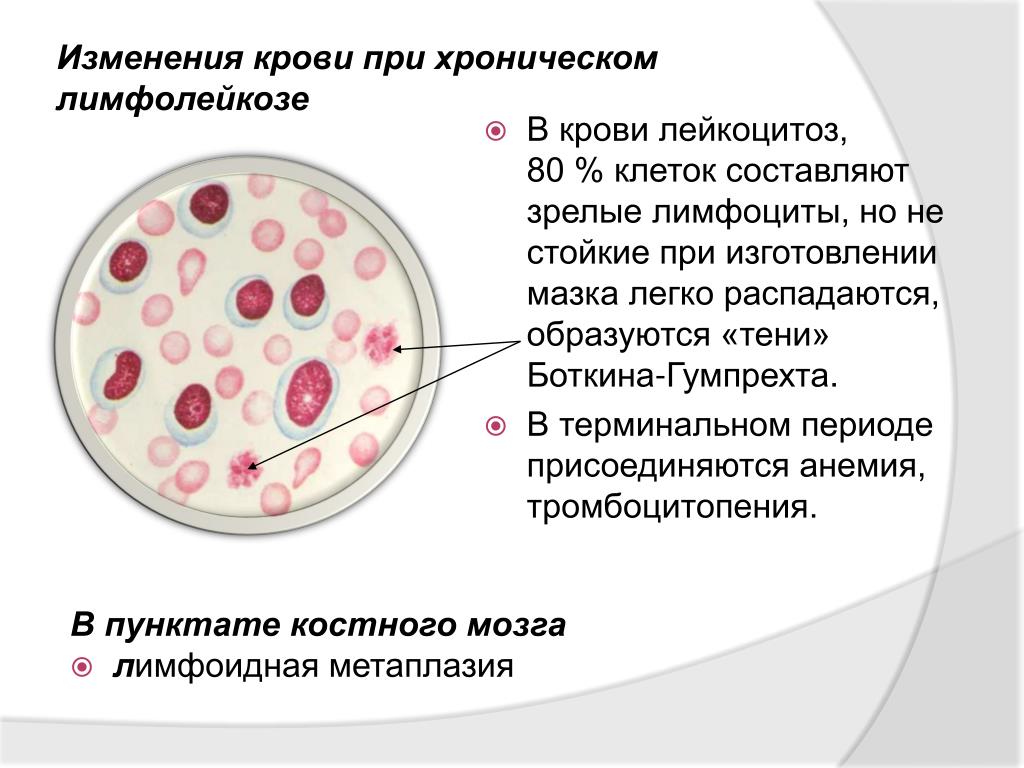 Киназы — это ферменты, обнаруженные как в здоровых, так и в раковых клетках. Некоторые раковые клетки могут быть уничтожены лекарствами, блокирующими определенный фермент киназы. Ингибиторы киназ для ХЛЛ являются относительно новыми и могут быть доступны только для пациентов с ХЛЛ, который вернулся (так называемый рецидивирующий ХЛЛ) или обострился (так называемый рефрактерный ХЛЛ), или в ходе клинических испытаний.
Киназы — это ферменты, обнаруженные как в здоровых, так и в раковых клетках. Некоторые раковые клетки могут быть уничтожены лекарствами, блокирующими определенный фермент киназы. Ингибиторы киназ для ХЛЛ являются относительно новыми и могут быть доступны только для пациентов с ХЛЛ, который вернулся (так называемый рецидивирующий ХЛЛ) или обострился (так называемый рефрактерный ХЛЛ), или в ходе клинических испытаний.