Хронический лимфоцитарный лейкоз. Инновации в лечении
Хронический лимфоцитарный лейкоз (ХЛЛ) — онкологическое заболевание системы кроветворения. Это самый частый вид лейкозов у взрослых. Поэтому лечение таких больных — серьезная социальная проблема. При этом серьезной проблемой является лечение тех больных, которые уже не восприимчивы к традиционной химиотерапии. Между тем, применение в качестве второй линии терапии современных препаратов позволяет добиться ремиссии и хорошо контролировать хронический лимфолейкоз. При этом продолжительность жизни больных увеличивается и, самое главное, сохраняется ее хорошее качество. С вопросами о таких современных методах лечения этого жизнеугрожающего заболевания мы обратились к заведующей гематологическим отделением Павлодарской областной больницы им. Г. Султанова, главному внештатному гематологу Павлодарской области, врачу-гематологу высшей категории Ж.Б. СЕЙСЕНБЕКОВОЙ и врачу-гематологу Костанайской областной больницы С.Ф. ШАРНЕВСКОЙ.
— Расскажите в целом о хроническом лимфолейкозе. Как часто это заболевание встречается и какими симптомами сопровождается?
— Ж.Б. Сейсенбекова: Хронический лимфоцитарный лейкоз — одно из наиболее распространенных онкогематологических заболеваний у взрослых, относится к группе лимфопролиферативных заболеваний. Оно характеризуется неконтролируемым образованием и накоплением атипичных моноклональных зрелых В-лимфоцитов в крови, костном мозге, лимфотических узлах, печени и селезенке, размножаясь и накапливаясь в костном мозгу, они мешают выработке и функционированию нормальных клеток крови.
— С.Ф. Шарневская:

Сейчас подходы к терапии хронического лимфолейкоза изменились. Ранее лечение начиналось сразу после постановки диагноза, сейчас, если больного ничего не беспокоит и нет резкого прогрессирования, то терапия откладывается. Т.е. тактика такова, что раннее начало лечения этого заболевания не оказывает влияния на продолжительность жизни, лечение начинается, когда имеется симптоматика, мешающая качеству жизни пациента.
— Жаннур Балтабаевна, какие методы применяются в терапии этого заболевания? Чем прежде лечили ХЛЛ и чем лечат сегодня?
— Стандартная химиотерапия хронического лимфолейкоза, как правило, включает один или несколько препаратов. Выбор программы лечения зависит от возраста, соматического здоровья и других факторов. При этом в последнее время терапия хронического лимфоцитарного лейкоза шагнула далеко вперед. Глубокие исследования этиологии и патогенеза данного заболевания позволили на молекулярном уровне дифференцировать его различные формы. Это открыло возможности для разработки целевых препаратов, антител, которые прицельно уничтожают лишь опухолевые клетки, не затрагивая здоровые органы и ткани.
— Сегодня, применительно к злокачественным новообразованиям, мы часто говорим о персонализированной терапии. Имеются ли в распоряжении врачей-гематологов такие средства для лечения хронического лимфолейкоза?
— Ж.Б. Сейсенбекова: В первой линии терапии хронического лимфолейкоза используется химиотерапевтические средства. Конечно, они очень токсичны и такое лечение меняет качество жизни пациента настолько, что он уже не может быть активным членом общества и получает только в условиях стационара из-за опухолевых интоксикаций, анемии различной глубины и других проблем. Химиотерапия может быть дополнена биологическими препаратами направленного действия, в частности, ритуксимабом. Потом больной переходит в разряд амбулаторных больных и на этом этапе он уже не получает такую агрессивную терапию, пациент наблюдается и ему назначаются уже другие препараты.
— Ж.Б. Сейсенбекова: Сегодня в распоряжении онкогематологов появился инновационный препарат — ибрутиниб. Он представляет собой ингибитор тирозинкиназы Брутона, который играет важную роль в поддержании жизнеспособности злокачественных клеток. Блокируя тирозинкиназу
Брутона, ибрутиниб уменьшает проявления хронического лимфолейкоза. Препарат очень хорошо себя зарекомендовал в клинической практике и показал эффективность в терапии даже рефрактерных пациентов, которые не отвечают на стандартное лечение. Т.е. это препарат второй линии, он применяется, когда препараты первой линии уже не эффективны.
— Имеют ли возможность казахстанские пациенты лечиться этим высокоэффективным препаратом?
— С.Ф. Шарневская: В Костанайской области ее получают два пациента. Они были полностью невосприимчивы к тому лечению, которое проводилось ранее. Поэтому препарат помог не только сохранить им жизнь, но и положительно сказался на ее качестве. Причина — хорошая переносимость, амбулаторный прием. Кроме того, препарат, в отличие от традиционных химиопрепаратов, не вызывает развитие вторичных солидных опухолей. Мы получили полный гематологический ответ, полностью восстановилась картина крови, нет иммунодефицита, сократились в объеме лимфоузлы, отсутствуют очаги пролиферации. Пациенты вернулись к нормальному образу жизни.
Поэтому препарат помог не только сохранить им жизнь, но и положительно сказался на ее качестве. Причина — хорошая переносимость, амбулаторный прием. Кроме того, препарат, в отличие от традиционных химиопрепаратов, не вызывает развитие вторичных солидных опухолей. Мы получили полный гематологический ответ, полностью восстановилась картина крови, нет иммунодефицита, сократились в объеме лимфоузлы, отсутствуют очаги пролиферации. Пациенты вернулись к нормальному образу жизни.
— Ж.Б. Сейсенбекова: В Павлодарской области на учете состоит более 30 больных с ХЛЛ. Это пациенты разных возрастов, с разной сопутствующей патологией, разными стадиями и тяжестью заболевания и т.д. Для участия в программе раннего доступа к терапии были отобраны два пациента, имеющие
минимальное количество сопутствующих заболеваний и уже получавшие препараты первой линии.
Они лечились пероральным ибрутинибом амбулаторно. У них наблюдался хороший ответ на терапию, при этом она сопровождалась минимальным количеством побочных эффектов.
— Расскажите более подробно о программе раннего доступа к терапии ибрутинибом.
— Ж.Б. Сейсенбекова: В 2016 году в рамках корпоративной социальной ответственности компания-производитель ибрутиниба инициировала в нашей стране программу раннего доступа к терапии этим препаратом. Главным образом, она предназначена для пациентов с рецидивирующим или резистентным хроническим лимфолейкозом, которые нуждались в препарате ибрутиниб в качестве второй и последующих линиях терапии.
По условиям программы пациент обеспечивается лечением на безвозмездной основе за счет компании до того момента, пока обеспечение ибрутинибом не сможет взять на себя государство. Это очень важно, так как в данном случае речь идет о длительном и беспрерывном лечении дорогостоящим препаратом, которое пациент оплатить за счет собственных средств однозначно не сможет.
Это очень важно, так как в данном случае речь идет о длительном и беспрерывном лечении дорогостоящим препаратом, которое пациент оплатить за счет собственных средств однозначно не сможет.
— Какие преимущества дает лечение ибрутинибом? Насколько эффективно амбулаторное лечение по сравнению с обычной госпитализацией?
— Ж.Б. Сейсенбекова: Ибрутиниб выпускается в пероральной форме, имеет очень удобную схему приема и хороший профиль безопасности. Он может применяться на амбулаторном уровне, т.е. для лечения препаратом нет никакой нужды ложиться в стационар. Его включение в список препаратов для лекарственного обеспечения на амбулаторном уровне (отсутствует в приказе МЗ РК от 4 ноября 2011 года №786 «Об утверждении Перечня лекарственных средств и изделий медицинского назначения для бесплатного обеспечения населения в рамках гарантированного объема бесплатной медицинской помощи на амбулаторном уровне с определенными заболеваниями (состояниями) и специализированными лечебными продуктами») не только откроет доступ к высокоэффективной терапии для тех больных В-клеточным лейкозом, которые уже не отвечают на стандартное лечение, но и позволит экономить финансовые ресурсы.
Подготовила Ольга БАИМБЕТОВА
Чтоб жить нам до 120! | Статьи
Современная медицина не стоит на месте — появляются новые методы лечения и диагностики, совершенствуется оборудование операционных, создаются новые лекарства, способные остановить опасную болезнь на клеточном уровне. Новейшим средствам от рака, как отмечают специалисты, даже удалось поменять само понятие «лечение онкологического заболевания». И то, что раньше казалось фантастикой, сегодня обретает реальные черты. «За последние 20 лет вероятность выздоровления почти по всем болезням сильно выросла. По некоторым на 10%, а по другим до 100%», — рассказывает заведующий отделом оптимизации лечения подростков и молодежи с гематологическими заболеваниями Федерального клинического центра имени Дмитрия Рогачева, доктор медицинских наук, профессор Сергей Семочкин.
Прогресс наступает
Сегодня уже научились справляться даже с тяжелыми гематологическими заболеваниями, многие из которых еще в начале 2000-х годов считались неизлечимыми, а диагноз фактически равнялся приговору. «Медицина научилась лечить большинство заболеваний крови, а некоторые даже полностью излечивать, — отметил Сергей Семочкин. — Я уверен, что еще через несколько лет большинство гематологических болезней перейдет из разряда неизлечимых в разряд хронических». А это значит, что медики смогут контролировать течение болезни, что позволит существенно продлить пациенту жизнь и, что очень важно, улучшить ее качество.
Уже сейчас это возможно, например, в случае промиелоцитарного лейкоза, который еще 15 лет назад считался неизлечимым и убивал пациента буквально за несколько месяцев. «С появлением нового лекарства — полностью трансретиноевой кислоты (третиноин) — ситуация совершенно изменилась, — подчеркнул Сергей Семочкин. — Теперь, по данным российских исследований, более 90% пациентов полностью излечивается от этого заболевания». Причем применение этого лекарства практически не имеет негативных последствий для здоровья человека. А с появлением нового препарата — триоксида мышьяка, который комбинируется с третиноином, медикам удается излечить более 95% пациентов. Пока он применяется только на Западе, но специалисты рассчитывают, что скоро этот препарат будет доступен и в России.
Причем применение этого лекарства практически не имеет негативных последствий для здоровья человека. А с появлением нового препарата — триоксида мышьяка, который комбинируется с третиноином, медикам удается излечить более 95% пациентов. Пока он применяется только на Западе, но специалисты рассчитывают, что скоро этот препарат будет доступен и в России.
Показатели выживаемости существенно улучшились и у пациентов, страдающих острым лимфобластным лейкозом. «Сегодня благодаря комбинированию препаратов вылечивается 80% детей с этим заболеванием, а между тем еще в 50-х годах прошлого века не выживал никто», — рассказывает профессор.
После внедрения в практику инновационных препаратов — иммуномодуляторов и ингибиторов протеасом (стимуляторы самоуничтожения клеток) — был достигнут колоссальный прогресс и в лечении второго по распространенности онкологического заболевания крови — множественной миеломы. Средняя продолжительность жизни пациентов увеличилась до 6–7 лет. «В США и Европе — там, где применяются все современные средства лечения, — больные живут и 15, и 20 лет, а в начале ХХ века пациенты жили не более 36 месяцев, — говорит Сергей Семочкин. — Представьте себе, какой прогресс всего за четверть века!»
— Представьте себе, какой прогресс всего за четверть века!»
Уже сейчас с помощью инновационных средств лечения удается добиваться длительной полной ремиссии у 15–20% пациентов с миеломой. «А благодаря дальнейшему развитию инноваций мы готовы сделать шаг от продолжительной ремиссии к полному излечению», — утверждает Сергей Семочкин.
Естественно, такие результаты потребовали от законодателей, органов здравоохранения и врачей по всему миру огромной работы. А также огромного количества клинических испытаний и гигантских финансовых затрат, которые разделили не только государственные бюджеты разных стран, но и крупные фармацевтические компании.
Использовать испытания
Гиганты фарминдустрии продолжают свои исследования в надежде получить еще более действенные лекарства. «Сейчас вместо традиционных химических препаратов разрабатываются биопрепараты уже третьего поколения, — рассказал Дмитрий Сычев, клинический фармаколог, терапевт, профессор Первого МГМУ им.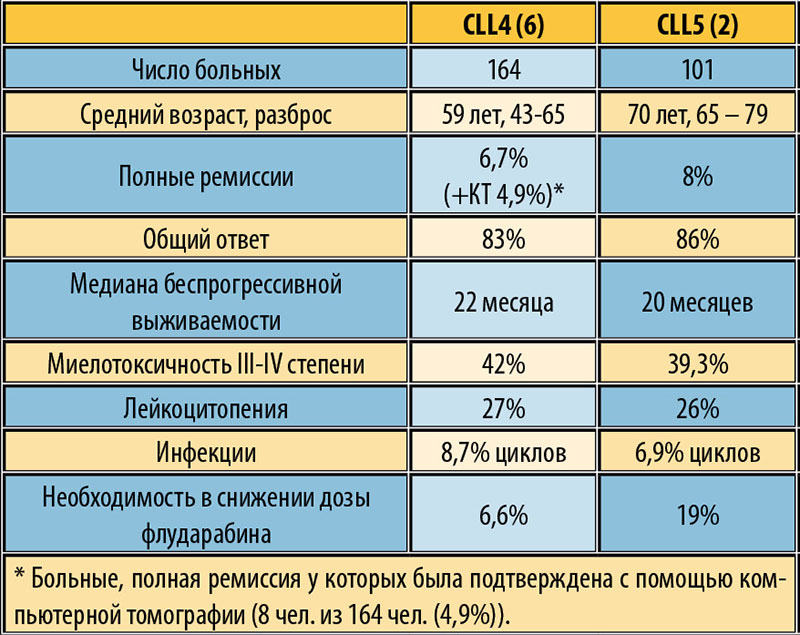 И. М. Сеченова. — Это таргетные препараты — то есть лекарства, направленно действующие на саму структуру молекулы и гораздо более эффективные в борьбе с болезнью».
И. М. Сеченова. — Это таргетные препараты — то есть лекарства, направленно действующие на саму структуру молекулы и гораздо более эффективные в борьбе с болезнью».
Существенный прогресс произошел в создании новых терапевтических антител. Это сложные биологические молекулы, которые могут распознавать специфические антигены на поверхности опухолевых клеток, приводя к их разрушению, при этом не повреждая здоровые клетки. Для лечения рецидивов В-клеточного острого лимфобластного лейкоза было синтезировано антитело блинатумомаб, позволяющее получить полную ремиссию у 40% больных. Для лечения рецидивирующего хронического лимфолейкоза весьма перспективными оказались новое моноклональное антитело офатумумаб и селективный ингибитор тирозинкиназы Брутона — ибрутиниб. Применение этих препаратов существенно продлевает жизнь и улучшает ее качество. Многие из них уже находятся на последних стадиях испытаний и, как надеются врачи, скоро появятся в продаже.
Клинические испытания таких лекарств проводятся по всему миру и, конечно же, в российских клиниках. «Мы участвуем во всех новейших разработках и ничуть не отстаем от Запада», — уверяет Сергей Семочкин. И это очень важно как для развития отечественной медицины, так и для самих пациентов. Ведь зачастую, попав в такую программу, больной получает не только бесплатные лекарства, которые сам не может купить, но и строгий медицинский контроль, необходимый при лечении. А значит, надежду выжить. «В рутинной практике врачу, перегруженному различными обязанностями, бывает трудно контролировать пациентов: пришел к врачу — хорошо, не пришел — что-то забывается. А в такой программе все расписано пошагово: в какой день человек должен появиться у врача, какой анализ сдать и какое лекарство принять», — рассказывает профессор.
«Мы участвуем во всех новейших разработках и ничуть не отстаем от Запада», — уверяет Сергей Семочкин. И это очень важно как для развития отечественной медицины, так и для самих пациентов. Ведь зачастую, попав в такую программу, больной получает не только бесплатные лекарства, которые сам не может купить, но и строгий медицинский контроль, необходимый при лечении. А значит, надежду выжить. «В рутинной практике врачу, перегруженному различными обязанностями, бывает трудно контролировать пациентов: пришел к врачу — хорошо, не пришел — что-то забывается. А в такой программе все расписано пошагово: в какой день человек должен появиться у врача, какой анализ сдать и какое лекарство принять», — рассказывает профессор.
Поэтому для «сложного пациента» попасть в такую программу — вопрос жизни и смерти. Правда, здесь начинаются трудности: дело в том, что в нашей стране данные о клинических исследованиях не обобщены, а значит, ни пациент, ни даже его лечащий врач этой информацией не располагают. «Было бы очень полезно собрать все данные о клинических исследованиях, идущих в России, и разместить на сайте Минздрава, чтобы любой врач мог зарегистрироваться и об этом узнать», — считает Сергей Семочкин. В Греции, например, так и сделали. И в результате 70% пациентов с гематологическими проблемами там лечатся по бесплатным программам клинических исследований, и, таким образом, уровень лечения болезней крови в этой стране соответствует уровню США и Западной Европы, где на это выделяются огромные средства.
«Было бы очень полезно собрать все данные о клинических исследованиях, идущих в России, и разместить на сайте Минздрава, чтобы любой врач мог зарегистрироваться и об этом узнать», — считает Сергей Семочкин. В Греции, например, так и сделали. И в результате 70% пациентов с гематологическими проблемами там лечатся по бесплатным программам клинических исследований, и, таким образом, уровень лечения болезней крови в этой стране соответствует уровню США и Западной Европы, где на это выделяются огромные средства.
В России возможностью получить дорогостоящие лекарства для пациентов, страдающих такими тяжелыми заболеваниями, является государственная программа «7 нозологий». Список лекарств, субсидируемых из бюджета, постоянно дополняется новейшими препаратами. Совсем недавний успех, достигнутый благодаря усилиям российских гематологов и пациентских организаций, — включение в перечень иммуномодулятора второго поколения леналидомида, который жизненно необходим для лечения множественной миеломы. Он может стать доступным для российских пациентов уже в 2015 году. Препарат помогает людям, которым не помогли другие лекарства, при этом он хорошо переносится, к тому же его принимают в виде капсул, что позволяет пациентам хорошо себя чувствовать и не менять привычный образ жизни.
Он может стать доступным для российских пациентов уже в 2015 году. Препарат помогает людям, которым не помогли другие лекарства, при этом он хорошо переносится, к тому же его принимают в виде капсул, что позволяет пациентам хорошо себя чувствовать и не менять привычный образ жизни.
Все мы — одной крови
Новые препараты и их эффективность постоянно обсуждаются ведущими мировыми учеными и медиками на международных конгрессах и конференциях. Такие встречи очень важны для специалистов, потому что становятся площадкой для обсуждения исследований, выявления ошибок, разработки дальнейшей программы действий по борьбе с болезнями. У гематологов есть две основные дискуссионные площадки — конгресс Европейской гематологической ассоциации и конгресс Американского гематологического общества, которые проводятся ежегодно. Ученые делятся последними данными о терапии онкогематологических заболеваний, результатами клинических испытаний как новых препаратов, так и комбинаций уже существующих лекарственных средств. В конце 2014 года конгресс в Сан-Франциско собрал более 20 тыс. участников со всего мира, в том числе и представительную делегацию ведущих российских специалистов.
В конце 2014 года конгресс в Сан-Франциско собрал более 20 тыс. участников со всего мира, в том числе и представительную делегацию ведущих российских специалистов.
«Обсуждение эффективности иммуномодулятора нового поколения — помалидомида, который используется при лечении множественной миеломы, стало одной из центральных тем дискуссий», — отметил профессор Семочкин, побывавший на этом мероприятии. Пока помалидомид зарегистрирован только на Западе, но медики надеются, что скоро он появится и в нашей стране. Ученые уверены: новый препарат поможет пациентам, у которых вследствие длительной терапии утрачена чувствительность к лечению. «Применяя его или комбинируя с другими лекарствами, пациент опять сможет достичь клинической ремиссии и хорошо себя чувствовать», — подчеркнул Сергей Семочкин.
Этот препарат поможет пациентам, казалось бы, совершенно исчерпавшим ресурсы лечения, и изменит существующие терапевтические схемы. «Перед нами открылась новая дверь в области лечения миеломы, — отметил доктор Поль Ричардсон из Института рака Даны Фарбер (США). — Наука не стоит на месте, и, возможно, в ближайшей перспективе будут найдены совершенные способы полного излечения этой болезни».
— Наука не стоит на месте, и, возможно, в ближайшей перспективе будут найдены совершенные способы полного излечения этой болезни».
Прорыв в будущее
Подтвердили ученые и хорошие результаты испытаний леналидомида, вошедшего в список субсидируемых государством лекарств. Некоторые исследования продемонстрировали, что общая выживаемость у пациентов, получавших продолжительную терапию леналидомид-содержащей схемой, была выше по сравнению с теми больными, которым были назначены традиционно используемые схемы лечения. Полученные данные послужили основанием для подачи заявки в регулирующие органы Европейского союза и США — на одобрение леналидомида в комбинации с низкими дозами дексаметазона для лечения вновь диагностированной множественной миеломы.
«Научный поиск последних лет был направлен на создание препаратов, воздействующих непосредственно на миеломную клетку таким образом, чтобы иммунная система человека могла ее разрушить, — рассказывает доктор Джозеф Микаэль из Клиники Мейо (Скоттсдейл, США). — Это так называемая концепция «умной бомбы». Другой подход — использование нового поколения иммуномодуляторов и ингибиторов протеасом. Есть исследования, которые показывают, что данная комбинация препаратов вызывает некроз миеломных клеток. Имеется и масса других инновационных лекарственных средств, каждое из которых внесло свой весомый вклад в лечение этого заболевания».
— Это так называемая концепция «умной бомбы». Другой подход — использование нового поколения иммуномодуляторов и ингибиторов протеасом. Есть исследования, которые показывают, что данная комбинация препаратов вызывает некроз миеломных клеток. Имеется и масса других инновационных лекарственных средств, каждое из которых внесло свой весомый вклад в лечение этого заболевания».
Для поиска максимально эффективного метода лечения миеломы год назад была запущена исследовательская программа «Черный лебедь», над которой работают эксперты крупнейших медицинских институтов Европы и США. В настоящее время исследователи разрабатывают тесты, позволяющие достоверно определить уровень минимальной остаточной болезни. На форуме также были представлены обнадеживающие данные о лечении пациентов с миелодиспластическим синдромом (МДС), зависимых от гемотрансфузий. Много докладов было посвящено терапии крайне агрессивного заболевания — острого миелоидного лейкоза, который характеризуется стремительным течением и с трудом поддается лечению. Изучение нового лекарства — азацитидина — показало, что его применение в два раза увеличивает общую выживаемость пожилых пациентов по сравнению со стандартной терапией.
Изучение нового лекарства — азацитидина — показало, что его применение в два раза увеличивает общую выживаемость пожилых пациентов по сравнению со стандартной терапией.
На конгрессе также обсудили результаты применения иммуномодуляторов для терапии других гемабластозов — лимфом. Так, профессор из Института рака Розуэлла Парка (США) Мирон Кзуцман представил данные новых исследований, которые показали, что при терапии леналидомидом продолжительность ремиссии и общий уровень выживаемости были значительно выше, чем при стандартном лечении. «Лечение таких пациентов всегда было сложной задачей, — отметил доктор Кзуцман. — Результаты исследования показывают, что в будущем леналидомид может играть важную роль в оптимизации лечения».
Ученые сходятся во мнении, что новые лекарства, которые сейчас проходят клинические испытания, уже через несколько лет смогут еще больше повысить процент выживаемости пациентов с гематологическими заболеваниями и качество их жизни. «Каждый новый препарат сам по себе увеличивает процент выздоровления. Кроме того, медики продолжают изучать возможности его комбинаций с другими лекарствами для более эффективного лечения», — резюмировал Сергей Семочкин.
Кроме того, медики продолжают изучать возможности его комбинаций с другими лекарствами для более эффективного лечения», — резюмировал Сергей Семочкин.
В СФУ создаётся ДНК-зонд для обследования пациентов с хроническим лимфолейкозом
Группа исследователей Сибирского федерального университета на базе лаборатории Красноярского филиала Национального медицинского исследовательского центра гематологии Минздрава Российской Федерации разрабатывают технологию, позволяющую выявить делецию 17p (делеция — утрата участка хромосомы) у пациентов, страдающих хроническим лимфолейкозом.
«ДНК-зондом называют меченый тем или иным способом фрагмент ДНК, использующийся для гибридизации со специфическим участком хромосомы. Мы создаём инструмент, который поможет достоверно выявить с помощью FISH-анализа характерные для лимфолейкоза изменения кариотипа, связанные с „поломками“ в 17-й хромосоме. К сожалению, в нашей стране нет отечественных производителей наборов реагентов для выявления хромосомных поломок методом FISH-анализа — и мы планируем исправить эту ситуацию.Разработанная в СФУ технология может в дальнейшем использоваться также для выявления других хромосомных аномалий при различных злокачественных новообразованиях.
Известно, что именно делеции 17р и 11q, а также наличие дополнительной хромосомы 12 считаются прогностически неблагоприятными маркерами лимфолейкоза. Продолжительность жизни пациентов с такими генетическими мутациями значительно сокращается, и у них развивается устойчивость к стандартной терапии. Чтобы обнаружить таких пациентов как можно раньше и назначить им эффективную терапию, требуется лабораторное обследование на наличие хромосомных поломок. Наша разработка может ускорить и удешевить этот процесс. В настоящее время подготовлены необходимые олигонуклеотидные последовательности и ведётся оптимизация условий синтеза зонда», — сообщает магистрант кафедры водных и наземных экосистем Института фундаментальной биологии и биотехнологии СФУ Дарья Лагутинская.
Хронический лимфолейкоз — заболевание, характеризующееся пролиферацией и увеличением в периферической крови количества зрелых лимфоцитов на фоне лимфоцитарной инфильтрации костного мозга, лимфатических узлов, селезёнки и других органов. Это самый частый вид лейкозов у взрослых. В России ежегодно появляются 4,5 тысячи вновь заболевших хроническим лимфолейкозом.
Это самый частый вид лейкозов у взрослых. В России ежегодно появляются 4,5 тысячи вновь заболевших хроническим лимфолейкозом.
Исследование ведётся под научным руководством кандидата медицинских наук, директора Гематологического научного центра РАМН Игоря Ольховского.
Добавим, проект стал победителем конкурса «УМНИК» и будет поддержан грантом программы.
Значение возраста и сопутствующих заболеваний в терапии хронического лимфолейкоза Текст научной статьи по специальности «Клиническая медицина»
Клиническая онкогематология. 2016;9(2):162-75
ОН!
ГЕМАТОЛОГИЯ
Clinical oncohematology. 2016;9(2):162-75
HEMATOLOGY
КЛИНИКА, ДИАГНОСТИКА И ЛЕЧЕНИЕ ЛИМФОИДНЫХ ОПУХОЛЕЙ
LYMPHOID MALIGNANCIES
Значение возраста и сопутствующих заболеваний в терапии хронического лимфолейкоза
В. В. Стругов1, ЕА. Стадник12, Ю.В. Вирц1, Т.О. Силина1, АЮ. Зарицкий12
В. Стругов1, ЕА. Стадник12, Ю.В. Вирц1, Т.О. Силина1, АЮ. Зарицкий12
1 ФГБУ «Северо-Западный федеральный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России, ул. Аккура-това, д. 2, Санкт-Петербург, Российская Федерация, 197341
2 ГБОУ ВПО «Первый Санкт-Петербургский государственный медицинский университет им. акад. И.П. Павлова» Минздрава России, ул. Льва Толстого, д. 6/8, Санкт-Петербург, Российская Федерация, 197022
Role of Patient’s Age and Comorbidities in Therapy of Chronic Lymphocytic Leukemia
VV Strugov1, EA Stadnik12, YuV Virts1, TO Silina1, AYu Zaritskii12
1 V.A. Almazov Federal North-West Medical Research Centre, 2 Akkuratova str., Saint Petersburg, Russian Federation, 197341
2 Academician I. P. Pavlov First St. Petersburg State Medical University, 6/8 L’va Tolstogo str., Saint Petersburg, Russian Federation, 197022
P. Pavlov First St. Petersburg State Medical University, 6/8 L’va Tolstogo str., Saint Petersburg, Russian Federation, 197022
РЕФЕРАТ
ABSTRACT
Актуальность и цели. Новые схемы противоопухолевой терапии хронического лимфолейкоза (ХЛЛ) привели к улучшению показателей выживаемости относительно молодых пациентов, результаты лечения больных старческого возраста по-прежнему остаются неудовлетворительными. Нельзя исключить, что определенную роль играет ошибочно завышенная оценка ожидаемой токсичности стандартных режимов терапии у некоторых пациентов пожилого возраста, приводящая к назначению менее эффективных схем терапии. В этой связи поиск объективных критериев стратификации рисков при ХЛЛ является актуальной задачей. Цель исследования — оценить прогностическое значение возраста и индекса С1ЯБ-0 у пожилых пациентов, получавших лечение по содержащим флударабин схемам в первой линии вне клинических исследований. = 0,018). На основании ретроспективной оценки переносимости терапии у первичных пожилых пациентов с различным числом баллов по шкале С1ЯБ-0 в рутинной клинической практике показано, что индекс не имеет самостоятельного прогностического значения. Из всех компонентов
= 0,018). На основании ретроспективной оценки переносимости терапии у первичных пожилых пациентов с различным числом баллов по шкале С1ЯБ-0 в рутинной клинической практике показано, что индекс не имеет самостоятельного прогностического значения. Из всех компонентов
Background & Aims. New schemes of the antitumor therapy of CLL resulted in improvement of survival of relatively young patients. However, the therapy outcomes of elderly patients are still unsatisfactory. Erroneous overestimation of expected toxicity of standard therapeutic regimens in some elderly patients may play a certain role, thus leading to prescription of less effective regimens. Therefore, the urgent problem is to find objective criteria for risk stratification in CLL. The aim of the study is to evaluate the prognostic significance of patient’s age and the CIRS-G index in elderly patients treated with fludarabine-containing regimens in first line treatment outside clinical trials.
Methods. A retrospective analysis of 90 elderly CLL patients, treated with standard FC and FCR regimens in the clinic of internal medicine of the First St. Petersburg State Medical University from 2001 till 2011. The age median was 59 years (range from 43 to 78 years). The comorbidity index was determined for each patient using the CIRS-G score. Results. The overall response rate did not significantly differ between FC and FCR groups and was equal to 81.6 % and 93.4 %, respectively (p = 0.109). Complete remissions were achieved in 72.3 % of FCR group patients and only in 46.5 % of FC group patients (p = 0.018). The retrospective analysis of treatment tolerability in primary elderly patients with different CIRS-G scores in the routine clinical practice demonstrated that the index has no independent prognostic significance. Among all CIRS-G components (14 organs and systems), only renal and hepatic diseases demonstrated significant correlation with the overall survival rate (p < 0. 001 and p = 0.028, respectively).
001 and p = 0.028, respectively).
Conclusion. The creatinine clearance value in the beginning of treatment is the most important predictor of FC and
162
© 2016 практическая медицина
CIRS-G (14 органов и систем) только заболевания почек и печени статистически значимо коррелировали с общей выживаемостью (р < 0,001 и р = 0,028). Заключение. Важнейшим предиктором эффективности режимов FC и FCR у пожилых больных является клиренс креатинина на момент начала лечения. Использование индекса коморбидности с порогом 6 баллов в качестве противопоказания для назначения терапии с флудараби-ном не оправдано.
I
Ключевые слова: хронический лимфолейкоз, ХЛЛ, индекс коморбидности, CIRS-G, FCR.
FCR regimen efficacy in elderly patients. The use of the comorbidity index with a 6-score threshold as a contraindication for fludarabine-containing regimens proved to be unjustified.
I
Keywords: chronic lymphocytic leukemia, CLL, morbidity index, CIRS-G, FCR.
co-
Получено: 15 января 2016 г. Принято в печать: 3 февраля 2016 г.
Received: January 15, 2016 Accepted: February 3, 2016
Для переписки: Владимир Владимирович Стругов, научный сотрудник, ул. Аккуратова, д. 2, Санкт-Петербург, Российская Федерация, 197341; тел.: +7(906)277-86-64; e-mail: strugov@almazovcentre.ru Для цитирования: Стругов В. В., Стадник Е.А., Вирц Ю.В. и др. Значение возраста и сопутствующих заболеваний в терапии хронического лимфолейкоза. Клиническая онкогематология. 2016;9(2):162-75. DOI: 10.21320/2500-2139-2016-9-2-162-175
В., Стадник Е.А., Вирц Ю.В. и др. Значение возраста и сопутствующих заболеваний в терапии хронического лимфолейкоза. Клиническая онкогематология. 2016;9(2):162-75. DOI: 10.21320/2500-2139-2016-9-2-162-175
For correspondence: Vladimir Vladimirovich Strugov, scientific worker, 2 Akkuratova str., Saint Petersburg, Russian Federation, 197341; Tel.: +7(906)277-86-64; e-mail: strugov@almazovcentre.ru For citation: Strugov VV, Stadnik EA, Virts YuV, et al. Role of Patient’s Age and Comorbidities in Therapy of Chronic Lymphocytic Leukemia. Clinical oncohematology. 2016;9(2):162-75 (In Russ). DOI: 10.21320/2500-2139-2016-9-2-162-175
ВВЕДЕНИЕ
Хронический лимфолейкоз (ХЛЛ) — наиболее распространенный вариант лейкоза среди взрослого европеоидного населения. Медиана возраста первичных больных ХЛЛ достигает 72 лет, т. е. пик заболеваемости приходится на период хронологической старости (рис. 1). Рост продолжительности жизни («старение») населения приводит к увеличению распространенности ХЛЛ [1]. К сожалению, сведения о демографии ХЛЛ в РФ отсутствуют, однако по данным крупнейших зарубежных онкологических регистров, 70 % пациентов заболевают в возрасте старше 65 лет, а 43 % — старше 75 [2]. Если учесть, что от момента постановки диагноза до начала специфической терапии, как правило, проходит 2—3 года, а ожидаемая продолжительность предстоящей жизни в возрасте 65 лет превышает 10 лет [3], становится понятно, что лечение ХЛЛ требует знания основ гериатрической онкологии и гематологии.
1). Рост продолжительности жизни («старение») населения приводит к увеличению распространенности ХЛЛ [1]. К сожалению, сведения о демографии ХЛЛ в РФ отсутствуют, однако по данным крупнейших зарубежных онкологических регистров, 70 % пациентов заболевают в возрасте старше 65 лет, а 43 % — старше 75 [2]. Если учесть, что от момента постановки диагноза до начала специфической терапии, как правило, проходит 2—3 года, а ожидаемая продолжительность предстоящей жизни в возрасте 65 лет превышает 10 лет [3], становится понятно, что лечение ХЛЛ требует знания основ гериатрической онкологии и гематологии.
<20 30-34 35-44 45-54 55-64 65-74 75-84 85+ Возраст, лет
Рис. 1. Распределение больных хроническим лимфолейкозом по возрасту ко времени постановки диагноза (SEER, 2013 г.)
Fig. 1. Age distribution of chronic lymphocytic leukemia patients at the moment of diagnosing (SEER, 2013)
Используемые в настоящее время схемы лечения ХЛЛ позволяют добиться эрадикации минимальной остаточной болезни, однако они обладают сравнительно высокой токсичностью, особенно у пожилых пациентов. Клинический опыт свидетельствует, что отсутствие отбора больных приводит к увеличению побочных явлений и ухудшению результатов лечения в старших возрастных группах [4]. С другой стороны, в последнее время показано, что пациенты старшего возраста с удовлетворительным соматическим статусом могут хорошо переносить даже относительно интенсивную терапию, получая преимущество в общей выживаемости [5].
Клинический опыт свидетельствует, что отсутствие отбора больных приводит к увеличению побочных явлений и ухудшению результатов лечения в старших возрастных группах [4]. С другой стороны, в последнее время показано, что пациенты старшего возраста с удовлетворительным соматическим статусом могут хорошо переносить даже относительно интенсивную терапию, получая преимущество в общей выживаемости [5].
В действительности пожилые пациенты представляют собой разнородную популяцию. Хотя и преклонный возраст в целом связан со снижением функции многих органов и систем, психоэмоциональными и когнитивными нарушениями, а также ухудшением адаптационных возможностей организма, значительная часть пожилых людей ведет активную жизнь и не испытывает существенных проблем со здоровьем (в англоязычной литературе их называют «go-go»). С другой стороны, некоторые люди даже в относительно молодом возрасте имеют низкий функциональный статус и сниженную устойчивость к минимальным стрессовым воздействиям, что соответствует определению («no go»). Кроме того, можно выделить промежуточную группу пациентов с относительно сохранным соматическим статусом и умеренно сниженным функциональным статусом («slow go»).
Кроме того, можно выделить промежуточную группу пациентов с относительно сохранным соматическим статусом и умеренно сниженным функциональным статусом («slow go»).
Такое разделение, предложенное германской группой по изучению ХЛЛ (DCLLSG), активно используется в современных рекомендациях. Целесообразность его применения на практике заключается в необходимости адаптировать цели и, соответственно, интенсивность лечения к ожидаемой продолжительности жизни и прогнозируемому количеству побочных эффектов у конкретного пациента. Например, только больным в категории «no go» оправдано проведение паллиативной терапии. Поиск объективных критериев, позволяющих отнести больного
к одной из групп, а также создание оптимальных, с позиций доказательной медицины, алгоритмов лечения еще не закончены. Отчасти из-за этого, несмотря на улучшение показателей выживаемости у более молодых пациентов, продолжительность жизни пожилых больных за последние годы существенно не изменилась [6].
В настоящее время экспертный консенсус заключается в том, что одним из ключевых критериев оценки состояния пожилого пациента является количество и тяжесть сопутствующих заболеваний [7, 8]. Известно, что пациенты старше 65 лет имеют не менее одного дополнительного диагноза, а в возрасте старше 75 лет медиана числа сопутствующих заболеваний достигает 4,2 [9]. Следует отметить, что примерно у 45 % больных ХЛЛ на момент установления лейкоза имеется как минимум одно серьезное сопутствующее заболевание (рис. 2) [10, 11]. Связь их количества с показателями выживаемости была показана в ряде наблюдений [12]. B. Eichhorst и соавт. приводят несколько объяснений этого феномена [13]. Во-первых, сопутствующие заболевания могут служить противопоказанием к назначению оптимального варианта терапии; так, например, почечная недостаточность не позволяет использовать содержащие флударабин режимы. Во-вторых, возможно увеличение токсичности стандартных вариантов терапии за счет лекарственных взаимодействий или ухудшения течения хронических заболеваний (например, анемия на фоне ишемической болезни сердца может провоцировать развитие инфаркта миокарда). В-третьих, часть летальных исходов является следствием исключительно сопутствующей патологии и не имеет отношения к течению основного заболевания. Тем не менее она ухудшает определенные результаты лечения.
В-третьих, часть летальных исходов является следствием исключительно сопутствующей патологии и не имеет отношения к течению основного заболевания. Тем не менее она ухудшает определенные результаты лечения.
Стремление получить объективный инструмент оценки коморбидного фона привело к появлению целого ряда специализированных шкал. В настоящее время можно констатировать, что ни одна из них не является одновременно универсальной, простой, воспроизводимой и апробированной в рутинной клинической практике. В клинических исследованиях DCLLSG широко применяется гериатрическая версия кумулятивного индекса коморбидности CIRS-G (см. приложение) [14]. В ней тяжесть сопутствующих заболеваний оценивается по 14 органам и системам. При этом в каждом из подразделов
46 %—43 %
П серьезные
□ незначительные
□ нет
11 %
Рис. у пожилых пациентов, получавших лечение по содержащим флударабин схемам в первой линии вне клинических исследований.
у пожилых пациентов, получавших лечение по содержащим флударабин схемам в первой линии вне клинических исследований.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен ретроспективный анализ историй болезни 90 больных ХЛЛ, которым в период с 2001 по 2011 г. проводилась стандартная химиотерапия первой линии в режимах FC и FCR на базе клиники факультетской терапии ПСПбГМУ. Часть пациентов наблюдалась в отделении онкогематологии СЗФМИЦ им. В.А. Алмазова. Специального отбора больных не проводилось.
Характеристика пациентов представлена в табл. 1 [19]. Медиана возраста составила 59 лет (диапазон 43—78 лет). Мужчин было в 2 раза больше, чем женщин, что соответствует эпидемиологическим данным. В процессе анализа у каждого пациента был определен спектр сопутствующих заболеваний ко времени начала лечения и рассчитан индивидуальный индекс коморбидности по шкале CIRS-G [20]. Дополнительно проведен расчет клиренса креатинина по формуле Кокрофта—Голта.
Дополнительно проведен расчет клиренса креатинина по формуле Кокрофта—Голта.
Статистический анализ выполнялся в программном пакете SPSS, версия 17. Бессобытийная выживаемость рассчитывалась от момента начала лечения до даты подтверждения прогрессии заболевания, назначения нового варианта терапии или смерти больного. Общая выживаемость оценивалась от момента начала терапии до даты летального исхода или даты последнего обращения к врачу. Показатели выживаемости сравнивались с помощью лог-рангового критерия. Для оценки влияния различных прогностических факторов на выживаемость в зависимости от типа переменной использовались
Таблица 1. Характеристика пациентов [19]
Показатель Все FC FCR Р
Число пациентов 90 43 47
Медиана (диапазон) возраста, 59 58 59 0,698
лет (43-78) (44-78) (43-73)
> 65 30 16 14
> 70 9 5 4
Мужской пол 59 (66 %) 31 (72 %) 28 (60 %) 0,212
Медиана(диапазон) индекса 4 (0-10) 4 (0-10) 4 (0-8) 0,613
CIRS-G, баллы
< 6 69 34 35 0,606
> 6 21 9 12
Клиренс креатинина < 90 мл/мин 62 30 32 0,192
Медиана(диапазон) времени 18,5 29 (1-82) 15 0,440
до начала терапии, мес. (0-137) (0-137)
(0-137) (0-137)
Лейкоциты (медиана, 61,2 88,4 40 < 0,001
диапазон), х 109/л (6,4-300) (13-300) (6,4-300)
Стадии по Rai
I 7 1 6 0,005
II 54 21 33
III 6 5 1
IV 23 16 7
Стадии по Binet
A 7 2 5 0,003
B 54 20 34
C 29 21 8
Внутрибрюшная и забрюшинная лимфаденопатия
Имеется 45 28 17 0,006
Отсутствует 45 15 30
Уровень экспрессии CD38
> 30 % 32 17 15 0,050
< 30 % 34 10 24
Неизвестен 24 16 8
Мутационный статус IgHV-генов
Немутированный 28 16 12 0,400
Мутированный 18 8 10
Неизвестен 44 19 25
Таблица 2. Результаты лечения пациентов с хроническим лимфолейкозом моложе и старше 65 лет
тесты Манна—Уитни, Фишера и /2. Медиана времени наблюдения составила 85 мес. Уровень статистической значимости принят какр < 0,05.
Показатель < 65 лет > 65 лет Р
Число пациентов 60 30
Медиана числа курсов терапии 6 6
Медиана ШБ-б, баллы 4 7 < 0,001
Клиренс креатинина < 70 мл/мин 11 9 0,209
< 90 мл/мин 37 25 0,097
Режим терапии FC 27 16 0,507
FCR 33 14
Медиана БСВ, мес. Все 31 28 0,362
FC 16 24 0,378
FCR 64 28 0,115
Медиана ОВ, мес. Все 61 56 0,116
FC 41 45 0,923
FCR НД 56 0,025
БСВ — бессобытийная выживаемость; ОВ — общая выживаемость; НД — нет данных.
100
80
60
40
20
80
Т
100
«I
120
Время, мес.
РЕЗУЛЬТАТЫ
Уровень общего ответа на терапию в группах FC и FCR статистически значимо не различался и составил 81,6 и 93,4 % соответственно (р = 0,109). Полные ремиссии были достигнуты у 72,3 % пациентов в группе FCR, а в группе FC — только у 46,5 % (р = 0,018). Минимальная остаточная болезнь не оценивалась. Показатели выживаемости были существенно лучше в группе больных, которым проводилось лечение в режиме FCR. Примечательно, что 66 % пациентов в группе FCR оставались под наблюдением на момент последнего контроля, в то время как в группе FC летальность к этому времени составила 80 %.
Пациентам моложе и старше 65 лет было проведено приблизительно одинаковое число курсов терапии (табл. 2). Сравнительный анализ у пациентов моложе и старше 65 лет не показал различий в бессобытийной и общей выживаемости как во всей выборке, так и в подгруппе, получавшей лечение в режиме FC., бессобытийной
0
0
и общей выживаемостью, в т. ч. при использовании пороговых значений 3 и 6 баллов (табл. 3). Отсутствие прогностической значимости отмечалось в обеих терапевтических группах (р = 0,203). Помимо этого отсутствовала корреляция между числом баллов по шкале CIRS-G и количеством проведенных курсов терапии. Наконец, пациенты с высоким индексом коморбидности (> 6 баллов), получавшие лечение по схеме FCR, имели даже более высокую медиану выживаемости без прогрессирования (47 ив 25 мес.; р = 0,003) и общую выживаемость (89 ив 53 мес.; р = 0,011) по сравнению с пожилыми больными, получавшими лечение в режиме FC.
Поскольку индекс QRS-G оказался недостаточным предиктором выживаемости, мы попытались оценить прогностическую значимость отдельных его компонентов. Из 14 органов и систем только заболевания почек и печени статистически значимо коррелировали с общей выживаемостью (р < 0,001 и р = 0,028). Мы предположили, что клиренс креатинина может иметь самостоятельное прогностическое значение, сравнимое с индексом почечной комор-бидности по шкале QRS-G. Действительно, у пациентов со снижением клиренса креатинина менее 70 мл/мин и даже менее 90 мл/мин имели место более низкие показатели общей выживаемости (медиана 43 и 61 мес.; р < 0,001) (рис. 4). Примечательно, что среди пациентов старше 65 лет в группе FCR у всех имелось снижение клиренса креатинина менее 90 мл/мин, в то время как в группе FC преобладали пациенты с нормальной почечной функцией. В связи с этим мы полагаем, что снижение общей выживаемости среди пожилых пациентов в группе FCR нашей выборки объясняется нарушением фильтрационной функции почек.
Негативный прогностический вклад сопутствующих заболеваний печени можно объяснить случаями (п = 5) реактивации оккультного гепатита В с фульминантным течением, которые имелись у пациентов, получавших лечение по схеме FCR. Как правило, у таких пациентов отмечалось незначительное повышение печеночных ферментов перед началом лечения. Современные рекомендации предусматривают более детальный скрининг HBV-инфекции при назначении ритуксимаба [21].
Анализ токсических осложнений химиотерапии для части пациентов был опубликован ранее при описании более крупной когорты больных [22]. К сожалению, нам не удалось проанализировать осложнения терапии у всех пациентов в настоящей выборке. Частота нейтропении была выше у пожилых пациентов, особенно в подгруппе FCR (данные не представлены).
Исход был летальным у 51 больного. Основными причинами летальных исходов были инфекции во время проведения последующих линий химиотерапии (п = 24), прогрессирование заболевания (п = 9), вторые опухоли
Таблица 3. Результаты лечения хронического лимфолейкоза с учетом индекса коморбидности
Медиана (диапазон) возраста, лет 57 (43-78) 66 (50-72) < 0,001
БСВ — бессобытийная выживаемость; ОВ — общая выживаемость.
(п = 6, преимущественно в подгруппе FC) и синдром Рихтера (п = 2). Особенно высокой была летальность, связанная с активацией гепатита В (п = 5).
ЗАКЛЮЧЕНИЕ
Гериатрическая проблематика в полной мере представлена в практике гематологов, занимающихся лечением больных ХЛЛ. Хотя появление новых схем терапии и привело к улучшению показателей выживаемости относительно молодых пациентов, результаты лечения больных старческого возраста по-прежнему остаются неудовлетворительными. Возраст сохраняет отрицательное значение в структуре современных прогностических шкал, предложенных MDACC [23] и DCLLSG [24].
Поскольку различия в биологии заболевания в разных возрастных группах не описаны [25], основной причиной ухудшения выживаемости может быть недостаток вариантов терапии для лечения пациентов со сниженным соматическим статусом и клинически значимыми сопутствующими заболеваниями. Кроме того, нельзя исключить, что определенную роль играет ошибочно завышенная оценка ожидаемой токсичности стандартных режимов терапии у некоторых пациентов пожилого возраста, приводящая к назначению менее эффективных схем терапии. В этой связи поиск объективных критериев стратификации рисков является актуальной задачей.
Многие авторы предлагают использовать гериатрическую версию кумулятивного индекса коморбидности (QRS-G) в качестве одного из критериев для назначения пожилым пациентам схем на основе флударабина. В нашей работе мы провели ретроспективную оценку переносимости данной терапии у первичных пожилых пациентов с различным числом баллов по шкале CIRS-G в рутинной клинической практике и показали, что индекс не имеет самостоятельного прогностического значения. Таким образом, он не может быть использован для выбора терапевтической тактики.
Время, мес.
Рис. 4. Общая выживаемость в группах пациентов с различным значением клиренса креатинина
Fig. 4. Overall survival rate in patient groups with different creatinine clearance values
CIRS-G < 6 CIRS-G > 6
Показатель баллов баллов Р
Число пациентов 69 21
Число неблагоприятных событий 51 (74 %) 15 (71 %) 0,822
Число летальных исходов 39 (57 %) 12 (57 %) 0,960
Медиана БСВ, мес. 25 39 0,679
Медиана ОВ, мес. 57 77 0,991
По всей вероятности, причиной этого служит тот факт, что шкала CIRS-G учитывает многие нозологии, которые в действительности мало влияют на функциональный статус и переносимость терапии. К таким состояниям относятся, например, гиперлипидемия, катаракта, снижение слуха, запор, геморроидальные кровотечения, перенесенная холецистэктомия, микролиты мочевыводящей системы, доброкачественная гиперплазия предстательной железы, остеоартроз крупных суставов, избыточная масса тела, хронические заболевания щитовидной железы и многие другие. Комбинация из нескольких таких сопутствующих состояний поднимает индекс выше порогового уровня, и при формальном подходе больной может быть ошибочно исключен из числа кандидатов на интенсивную терапию.
С другой стороны, индекс CIRS-G недооценивает роль некоторых состояний, существенно влияющих на токсичность химиопрепаратов. Нарушение функции почек, которое приводит к замедлению элиминации метаболитов флударабина и циклофосфамида, широко распространено среди пожилых. Снижение расчетного клиренса креатинина менее 60 мл/мин отмечается у 38 % пациентов старше 70 лет [26], а частота хронических заболеваний почек среди госпитализированных пациентов терапевтического профиля, по российским данным, достигает 48 % [27]. В настоящей работе показана корреляция между клиренсом креатинина менее 90 мл/мин и снижением показателей общей и бессобытийной выживаемости при использовании режимов FC и FCR. На наш взгляд, это связано с увеличением миелотоксичности, инфекционных осложнений и, соответственно, незапланированных перерывов противоопухолевого лечения. Независимая от возраста прогностическая роль клиренса креатинина показана в исследовании CALGB 9011 [28]. Сходные данные получены в работе A.S. Michallet и соавт. [29].
В последние годы возможности лечения пожилых пациентов (в т. ч. со сниженной фильтрационной функцией почек) существенно расширились за счет появления новых высокоэффективных и малотоксичных препаратов. Хорошей альтернативой режиму FCR является комбинация бендамустина с ритуксимабом [30]. В исследовании CLL10 показано, что у пациентов с соматически сохранным статусом старше 65 лет режимы FCR и BR одинаково эффективны при меньшей токсичности последнего [31]. Недавно V Goede и соавт. сообщили результаты применения комбинации хлорамбуцила с обинутузумабом у пациентов с индексом CIRS-G > 6 баллов и/или снижением клиренса креатинина [32]. Медиана возраста в данном исследовании составила 73 года. Схема позволила добиться полной ремиссии у 22,3 % пациентов и улучшить выживаемость без прогрессирования в сравнении с режимом хлорамбуцил + ритуксимаб. Наконец, совсем инновационные результаты были получены в исследовании PCYC-1102, в котором 29 пациентам старше 65 лет (медиана 71 год) проводилась терапия ибрутинибом [33]. Общая и 2-летняя выживаемость без прогрессирования в данной группе приближались к 100 % при минимальном количестве побочных эффектов, причем у 2 пациентов с del(17p) получен противоопухолевый эффект. Появление обинутузумаба и ибрутиниба послужило основанием для пересмотра рекомендаций NCCN у пожилых пациентов [34].
Таким образом, важнейшим предиктором эффективности режимов FC и FCR у пожилых больных является
клиренс креатинина на момент начала лечения. Использование индекса коморбидности с порогом 6 баллов в качестве противопоказания для назначения содержащей флударабин терапии не оправдано. Результаты данной работы требуют подтверждения в более крупном проспективном клиническом исследовании.
КОНФЛИКТЫ ИНТЕРЕСОВ
Авторы заявляют об отсутствии конфликтов интересов.
ИСТОЧНИКИ ФИНАНСИРОВАНИЯ
Исследование не имело спонсорской поддержки.
ВКЛАД АВТОРОВ
Концепция и дизайн: В.В. Стругов, Е.А. Стадник, А.Ю. За-рицкий.
Сбор и обработка данных: В.В. Стругов, Е.А. Стадник, Ю.В. Вирц, Т.О. Силина.
Предоставление материалов исследования: Е.А. Стадник, Ю.В. Вирц.
Анализ и интерпретация данных: В.В. Стругов, Е.А. Стадник, А.Ю. Зарицкий. Подготовка рукописи: В.В. Стругов. Окончательное одобрение рукописи: все авторы.
ЛИТЕРАТУРА/REFERENCES
1. Del Giudice I, Mauro FR, Foa R. Chronic lymphocytic leukemia in less fit patients: «slow-go». Leuk Lymphoma. 2011;52(12):2207-16. doi: 10.3109/10428194.2011.606386.
2. Gribben JG. Chronic lymphocytic leukemia: planning for an aging population. Expert Rev Anticancer Ther. 2010;10(9):1389-94. doi: 10.1586/era.10.127.
3. Ожидаемая продолжительность предстоящей жизни по Российской Федерации [электронный документ]. Доступно по: http://www.gks.ru/ free_doc/new_site/population/generation/dem2.xlsx. Ссылка активна на 15.08.2015.
[Ozhidaemaya prodolzhitel’nost’ predstoyashchei zhizni po Rossiiskoi Federatsii. (Life expectancy in the Russian Federation.) [Internet] Available from: http://www.gks.ru/free_doc/new_site/population/generation/dem2.xlsx. (accessed 15.08.2015) (In Russ)]
4. Tam CS, O’Brien S, Wierda W, et al. Long-term results of the fludarabine, cyclophosphamide, and rituximab regimen as initial therapy of chronic lym-phocytic leukemia. Blood. 2008;112(4):975-80. doi: 10.1182/blood-2008-02-140582.
5. Hallek M, Fischer K, Fingerle-Rowson G, et al. Addition of rituximab to fluda-rabine and cyclophosphamide in patients with chronic lymphocytic leukaemia: a randomised, open-label, phase 3 trial. The Lancet. 2010;376(9747):1164-74. doi: 10.1016/S0140-6736(10)61381-5.
6. Abrisqueta P, Pereira A, Rozman C, et al. Improving survival in patients with chronic lymphocytic leukemia (1980-2008): the Hospital Clinic of Barcelona experience. Blood. 2009;114(10):2044-50. doi: 10.1182/blood-2009-04-214346.
7. Merli F, Mammi C, Ilariucci F. Integrating oncogeriatric tools into the management of chronic lymphocytic leukemia: current state of the art and challenges for the future. Curr Oncol Rep. 2015;17(7):31. doi: 10.1007/s11912-015-0454-0.
8. Hallek M, Cheson BD, Catovsky D, et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines. Blood. 2008;111(12):5446-56. doi: 10.1182/blood-2007-06-093906.
9. Yancik R. Cancer burden in the aged: an epidemiologic and demographic overview. Cancer. 1997;80(7): 1273-83. doi: 10.1002/(sici) 1097-0142(19971001)80:7<1273::aid-cncr13>3.0.co;2-4.
10. Thurmes P, Call T, Slager S, et al. Comorbid conditions and survival in unselected, newly diagnosed patients with chronic lymphocytic leukemia. Leuk Lymphoma. 2008;49(1):49-56. doi: 10.1080/10428190701724785.
11. Molica S, Brugiatelli M, Morabito F, et al. Treatment of elderly patients with chronic lymphocytic leukemia: an unmet clinical need. Expert Rev Hematol. 2013;6(4):441-9. doi: 10.1586/17474086.2013.814845.
12. Goede V, Cramer P, Busch R, et al. Interactions between comorbidity and treatment of chronic lymphocytic leukemia: results of German Chronic Lympho-
cytic Leukemia Study Group trials. Haematologica. 2014;99(6):1095-100. doi: 10.3324/haematol.2013.096792.
13. Eichhorst B, Goede V, Hallek M. Treatment of elderly patients with chronic lymphocytic leukemia. Leuk Lymphoma. 2009;50(2):171-8. doi: 10.1080/10428190802688517.
14. Miller M, Towers A. A manual of guidelines for scoring the cumulative illness rating scale for geriatrics (CIRS-G). May 1991. [Internet] Available from: http://www.anq.ch/fileadmin/redaktion/deutsch/20121211_CIRSG_Manual_E. pdf. (accessed 12.04.2016).
15. Stilgenbauer S, Montillo M, Tadeusz R, et al. Prognostic Assessment In Patients With Chronic Lymphocytic Leukemia (CLL) In Clinical Practice: A European Research Initiative On CLL (ERIC) Survey. Blood. 2013;122(21): Abstract 4156.
16. Никитин Е.А., Халлек М., Байков В.В. и др. Российские клинические рекомендации по диагностике и лечению хронического лимфолейкоза (версия 2012 г.). Клиническая онкогематология. 2013;6(1):99-109.
[Nikitin EA, Khallek M, Baykov VV, et al. Russian clinical guidelines for diagnosis and treatment of chronic lymphocytic leukemia (version 2012). Klin-icheskaya onkogematologiya. 2013;6(1):99-109. (In Russ)]
17. Repetto L, Fratino L, Audisio RA, et al. Comprehensive geriatric assessment adds information to Eastern Cooperative Oncology Group performance status in elderly cancer patients: an Italian Group for Geriatric Oncology Study. J Clin Oncol. 2002;20(2):494-502. doi: 10.1200/jco.20.2.494.
18. Bonanad S, De la Rubia J, Gironella M, et al. Development and psychometric validation of a brief comprehensive health status assessment scale in older patients with hematological malignancies: The GAH Scale. J Geriatr Oncol. 2015;6(5):353-61. doi 10.1016/j.jgo.2015.03.003.
19. Стругов В.В., Стадник Е.А., Вирц Ю.В., Зарицкий А.Ю. Ретроспективное исследование результатов применения режимов FC/FCR в первой линии терапии хронического лимфолейкоза. Трансляционная медицина. 2012;6(17):104-15.
[Strugov VV, Stadnik EA, Virts YuV, Zaritskii AYu. Retrospective studies of outcomes of FC/FCR regimens in first-line therapy if chronic lymphocytic leukemia. Translyatsionnaya meditsina. 2012;6(17):104-15. (In Russ)]
20. Salvi F, Miller MD, Grilli A, et al. A manual of guidelines to score the modified cumulative illness rating scale and its validation in acute hospitalized elderly patients. J Am Geriatr Soc. 2008;56(10):1926-31. doi: 10.1111/j.1532-5415.2008.01935.x.
21. Hwang JP, Somerfield MR, Alston-Johnson DE, et al. Hepatitis B Virus Screening for Patients With Cancer Before Therapy: American Society of Clinical Oncology Provisional Clinical Opinion Update. J Clin Oncol. 2015;33(19):2212-20. doi: 10.1200/JTO.2015.61.3745.
22. Стадник Е.А., Никитин Е.А., Бидерман Б.В. и др. Ретроспективное сравнение эффективности и токсичности режимов лечения FC и FCR у первичных больных В-клеточным хроническим лимфолейкозом. Онкогематология. 2008;1-2:39-46.
[Stadnik EA, Nikitin EA, Biderman BV, et al. Comparison of efficacy and toxicity of FC and FCR regimens in the treatment of primary B-cell chronic lymphocytic leukemia: a retrospective study. Onkogematologiya. 2008;1-2:39-46. (In Russ)]
23. Wierda WG, O’Brien S, Wang X, et al. Prognostic nomogram and index for overall survival in previously untreated patients with chronic lymphocytic leukemia. Blood. 2007;109(11):4679-85. doi: 10.1182/blood-2005-12-051458.
24. Pflug N, Bahlo J, Shanafelt TD, et al. Development of a comprehensive prognostic index for patients with chronic lymphocytic leukemia. Blood. 2014;124(1):49-62. doi: 10.1182/blood-2014-02-556399.
25. Baumann T, Delgado J, Santacruz R, et al. Chronic lymphocytic leukemia in the elderly: clinico-biological features, outcomes, and proposal of a prognostic model. Haematologica. 2014;99(10):1599-604. doi: 10.3324/ haematol.2014.107326.
26. Coresh J, Astor BC, Greene T, et al. Prevalence of chronic kidney disease and decreased kidney function in the adult US population: Third National Health and Nutrition Examination Survey. Am J Kidney Dis. 2003;41 (1 ): 1-12. doi: 10.1053/ajkd.2003.50007.
27. Пигарева Ю.А., Авдошина С.В., Дмитрова Т.Б. и др. Распространенность хронической болезни почек среди пациентов терапевтического стационара. Клиническая нефрология. 2012;3:4-9. [Pigareva YuA, Avdoshina SV, Dmitrova TB, et al. Prevalence of chronic kidney disease in patients of clinic of internal diseases. Klinicheskaya nefrologiya. 2012;3:4-9. (In Russ)]
28. Martell RE, Peterson BL, Cohen HJ, et al. Analysis of age, estimated creatinine clearance and pretreatment hematologic parameters as predictors of fludarabine toxicity in patients treated for chronic lymphocytic leukemia: a CALGB (9011) coordinated intergroup study. Cancer Chemother Pharmacol. 2002;50(1):37-45. doi: 10.1007/s00280-002-0443-5.
29. Michallet AS, Cazin B, Bouvet E, et al. First immunochemotherapy outcomes in elderly patients with CLL: a retrospective analysis. J Geriatr Oncol. 2013;4(2):141-7. doi: 10.1016/j.jgo.2013.01.002.
30. Kolibaba KS, Sterchele JA, Joshi AD, et al. Demographics, treatment patterns, safety, and real-world effectiveness in patients aged 70 years and over with chronic lymphocytic leukemia receiving bendamustine with or without rituximab: a retrospective study. Ther Adv Hematol. 2013;4(3):157-71. doi: 10.1177/2040620713478629.
31. Eichhorst B, Fink AM, Busch R, et al. Frontline chemoimmunotherapy with fludarabine (F), cyclophosphamide (C), and rituximab (R) (FCR) shows superior efficacy in comparison to bendamustine (B) and rituximab (BR) in previously untreated and physically fit patients (pts) with advanced chronic lymphocytic leukemia (CLL): final analysis of an international, randomized study of the German CLL study group (GCLLSG) (CLL10 study). Blood. 2014;124(21): Abstract 19.
32. Goede V, Fischer K, Busch R, et al. Obinutuzumab plus chlorambucil in patients with CLL and coexisting conditions. N Engl J Med. 2014;370(12):1101-10. doi: 10.1056/NEJMoa1313984.
33. O’Brien S, Furman RR, Coutre SE, et al. Ibrutinib as initial therapy for elderly patients with chronic lymphocytic leukaemia or small lymphocytic lymphoma: an open-label, multicentre, phase 1b/2 trial. Lancet Oncol. 2014;15(1):48-58. doi: 10.1016/S1470-2045(13)70513-8.
34. Zelenetz AD, Gordon LI, Wierda WG, et al. Chronic lymphocytic leukemia/ small lymphocytic lymphoma, version 1.2015. J Natl Compr Canc Netw. 2015;13(3):326-62.
Красноярские ученые создают зонд для диагностики хромосомных нарушений при раке и лейкозе
Ученые Сибирского федерального университета (СФУ) намерены разработать первую отечественную технологию для диагностики хронического лимфолейкоза — онкологического заболевания, при котором поражаются лейкоциты, костный мозг, периферическая кровь, лимфоидные органы (лимфатические узлы, миндалины). Об этом сообщила пресс-служба вуза.
«Группа исследователей СФУ на базе лаборатории Красноярского филиала Национального медицинского исследовательского центра гематологии Минздрава России начала разрабатывать технологию, позволяющую выявить делецию 17p (делеция — утрата участка хромосомы) у пациентов, страдающих хроническим лимфолейкозом. <…> В настоящее время в России нет отечественных производителей наборов реагентов для выявления хромосомных поломок таким способом», — говорится в сообщении.
Именно делеции 17р и 11q, а также наличие дополнительной хромосомы 12 считаются маркерами лимфолейкоза. Продолжительность жизни пациентов с такими генетическими мутациями значительно сокращается, и у них развивается устойчивость к стандартной терапии. Чтобы обнаружить таких пациентов как можно раньше и назначить им эффективную терапию, требуется лабораторное обследование на наличие хромосомных поломок.
Ученые СФУ начали разработку инструмента — ДНК-зонда, то есть меченого тем или иным способом фрагмента ДНК, который поможет достоверно выявить с помощью FISH-анализа (определения наличия или отсутствия последовательностей ДНК на хромосоме) характерные для лимфолейкоза изменения, связанные с «поломками» в 17 хромосоме.
«К сожалению, в нашей стране нет отечественных производителей наборов реагентов для выявления хромосомных поломок методом FISH-анализа — и мы планируем исправить эту ситуацию. Разработанная в СФУ технология может в дальнейшем использоваться также для выявления других хромосомных аномалий при различных злокачественных новообразованиях. Наша разработка может ускорить и удешевить этот процесс.», — сказала магистрант кафедры водных и наземных экосистем Института фундаментальной биологии и биотехнологии СФУ Дарья Лагутинская.
Хронический лимфолейкоз — самый частый вид лейкозов у взрослых. В европейских странах это заболевание встречается у четырех на 100 тыс. человек в год, и непосредственно связана с возрастом (у лиц старше 80 лет она составляет более 30 человек на 100 тыс. населения в год). В России ежегодно появляются 4,5 тысячи вновь заболевших хроническим лимфолейкозом.
Проект ученых уже стал
победителем в конкурсе инновационных проектов «УМНИК» и получил
финансирование — 500 тысяч на 2 года. Кроме того, проектом также
заинтересовались сотрудники малого инновационного предприятия при ФИЦ КНЦ СО РАН — ООО «Формула гена» (г. Красноярск). Они готовы помочь внедрить наборы в клиники города.
Страница статьи : Клиническая медицина
Секержинская Е.Л., Лазарев А.Ф., Петрова В.Д. Факторы риска развития первично-множественных злокачественных новообразований. Российский биотерапевтический журнал. 2009; 8(2): 85-91.
Волкова М.А., ред. Клиническая онкогематология. М.: Медицина; 2007.
Dores G.M., Anderson W.F., Curtis R.E., Landgren O., Ostroumova E., Bluhm E.C. et al. Chronic lymphocytic leukaemia and small lymphocytic lymphoma: overview of the descriptive epidemiology. Br. J. Haematol. 2007; 139(5): 809-19.
Kalil N., Cheson B.D. Management of chronic lymphocytic leukaemia. Drugs Aging. 2000; 16(1): 9-27.
Никитин Е.А. Хронический лимфолейкоз: новое в понимании биологии хронического лимфолейкоза, новые подходы к лечению. Онкогематология. 2006; 1(2): 124-7
Robak T., Kantarjian H., Robertson L., Lerner S., Keating M.J. Therapy of chronic lymphocytic leukaemia with purine nucleoside analogues: facts and controversies. Drugs Aging. 2005; 22(12): 983-1012
Романенко Н.А., Бессмельцев С.С., Ругаль В.И., Потихонова Н.А., Зенина М.Я., Абдулкадыров К.М. Сочетание множественной миеломы и первичного миелофиброза с последующей трансформацией в острый миелоидный лейкоз (обзор и случай из практики). Медицинский академический журнал. 2011; 11(1): 46-57
Takada M., Umeda M., Shikoshi K., Shirai T. IgG lambda-type multiple myeloma associated with myelofibrosis accompanied by thrombocytosis. Rinsho Ketsueki. 1991; 32(9): 1001-5.
Richter M.N. Generalized reticular cell sarcoma of lymph nodes associated with lymphatic leukemia. Am. J. Pathol. 1928; 4(4): 285-92.
Harousseau J.L., Flandrin G., Tricot G., Brouet J.C., Seligmann M., Bernard J. Malignant lymphoma supervening in chronic lymphocytic leukemia and related disorders. Richter’s syndrome: a study of 25 cases. Cancer. 1981; 48(6): 1302-8.
Tsimberidou A.M., O’Brien S., Kantarjian H.M., Koller C., Hagemeister F.B., Fayad L. et al. Hodgkin transformation of chronic lymphocytic leukemia: the M.D. Anderson Cancer Center experience. Cancer. 2006; 107(6): 1294-302.
Reddy N., Thompson-Arildsen M.A. Hodgkin’s lymphoma: Richter’s transformation of chronic lymphocytic leukemia involving the liver. J. Clin. Oncol. 2010; 28(29): e543-4.
Adiga G.U., Abebe L., Wiernik P.H. Partially successful treatment of a patient with chronic lymphocytic leukemia and Hodgkin’s disease: case report and literature review. Am. J. Hematol. 2003; 72(4): 267-73.
Serratrice De Roux C., Coso D., Bouabdallah R., Serratrice J., Disdier P., Weiller P.J. Chronic lymphocytic leukemia and Hodgkin’s disease. Clinicopathologic study of three cases with good prognosis. Haematologica. 2000; 85(8): 878-9.
ВОЛОСАТОКЛЕТОЧНЫЙ ЛЕЙКОЗ У БОЛЬНЫХ СТАРШЕГО ВОЗРАСТА
Л.С. Аль-Ради, А.В. Пивник
Волосатоклеточный лейкоз – особый вариант хронического лимфопролиферативного заболевания с вовлечением костного мозга и селезенки, морфологическим субстратом которого служат В-лимфоциты со своеобразным фестончатым краем цитоплазмы. Основные признаки заболевания: панцитопения с лимфоцитозом, моноцитопенией и спленомегалия.
Заболевание подробно описано и впервые выделено в самостоятельную нозологическую единицу Bertha Bouroncle в 1958 г. у 26 больных как «лейкемический ретикулоэндотелиоз», а в 1966 г. Schrek и Donnelly ввели термин «волосатоклеточный лейкоз».
Ежегодная заболеваемость волосатоклеточным лейкозом составляет 1-1,5 на 100 000 населения. На его долю приходится примерно 2% всех лейкозов, он встречается у мужчин в 2-4 раза чаще, чем у женщин. Средний возраст заболевших превышает 50 лет, то есть болезнь чаще встречается в старшей возрастной группе. Существуют 2 формы волосатоклеточного лейкоза: встречающаяся у 80% больных классическая форма с цитопенией и вариантная форма – с нормальным или повышенным уровнем лейкоцитов.
К настоящему времени известный уже более полувека как отдельная нозология волосатоклеточный лейкоз стал примером блестящего лечебного эффекта современной терапии, позволяющей практически у всех больных получать длительные стойкие ремиссии, причем у абсолютного большинства – полные, хотя и с наличием минимальной остаточной болезни в костном мозге. При этом алгоритм терапии прост и применяемые в лечении препараты не обладают тяжелыми побочными эффектами, что особенно важно для пациентов пожилого возраста.
Как и при других опухолях, многие, если не все, особенности проявлений волосатоклеточного лейкоза связаны с биологическими характеристиками опухолевых лимфоцитов. К настоящему времени установлено, что ворсинчатые лимфоциты являются аномальным клоном резко активированных зрелых В-лимфоцитов, остановленных на поздней стадии созревания и дифференцировки на этапе переключения изотипов тяжелых цепей иммуноглобулинов. Причины подобной активации до настоящего времени неизвестны. Тем не менее, несмотря на активацию, у этих лимфоцитов низкий индекс пролиферации, вследствие чего болезнь обычно протекает хронически.
В процессе нормального иммунного ответа активация В-лимфоцитов является результатом быстрой последовательности реакций в ответ на стимуляцию антигеном, окружающими клетками и цитокинами. Ворсинчатые лимфоциты также проходят этот этап, поскольку на их поверхности сильно экспрессированы маркеры активации нормальных В-лимфоцитов, а маркеры, теряемые в норме после В-клеточной активации, экспрессируются в очень небольшом количестве. Возможно, самым наглядным проявлением активации волосатых лимфоцитов является их необычная клеточная поверхность с множеством цитоплазматических отростков, отражающая изменение цитоскелета клетки при активации. Эта активация сопровождается появлением у этих клеток специфического профиля рецепторов адгезии, ответственных, вероятно, за отличительную для волосатоклеточного лейкоза лимфоидную инфильтрацию красной, а не белой пульпы селезенки и печеночных синусов. Ворсинчатые лимфоциты содержат интегрин α4β1, осуществляющий связь с клетками эндотелия. При этом клеточным лигандом для α4β1 является VCAM-1, экпрессирующийся именно в клетках стромы костного мозга и синусоидов печени и селезенки; видимо, поэтому для волосатоклеточного лейкоза характерны эти области поражения. Еще одним механизмом специфической инфильтрации селезенки может являться интегрин αvβ3, присутствующий на поверхности воринчатых лимфоцитов. Этот интегрин вызывает клеточную миграцию в области, богатые витронектином, которого особенно много в строме красной пульпы селезенки. Более того, в красной пульпе опухолевые лимфоциты не только взаимодействуют с эндотелиальными клетками, но и способны стимулировать образование ими псевдосинусоидов. Внеклеточным лигандом для α4β1 является фибронектин, этим объясняется появление характерной фиброзной ретикулиновой сети в инфильтрированных участках костного мозга. Ранние стадии реализации лимфоидными клетками «инстинкта дома» связаны с не-интегриновыми рецепторами семейства селектинов. L-селектин (наиболее важный на начальных этапах миграции лимфоцитов в лимфоузлы) утрачен «волосатыми» лимфоцитами, что, вероятно, является одной из причин отсутствия лимфоаденопатии в большинстве случаев заболевания.
Клиническая картина
Клинические симптомы заболевания при классической и вариантной форме волосатоклеточного лейкоза сходны, так как связаны с проявлениями спленомегалии и цитопении. Поэтому на ранних этапах симптомов может не быть, и болезнь обнаруживается при случайном исследовании крови или УЗИ брюшной полости, однако с течением времени возникают тяжесть в левом подреберье из-за спленомегалии, а также слабость, потливость и похудание как проявления интоксикации. В связи с нарастающей анемией могут наблюдаться тахикардия и одышка. Однако основную опасность для жизни пациента представляют разнообразные инфекционные осложнения, очень часто развивающиеся у больных волосатоклеточным лейкозом в связи с нейтропенией. Эти инфекции склонны к затяжному течению, абсцедированию и генерализации, поэтому при любом подозрении на воспалительно-инфекционный процесс жизненно необходимо назначать массивную антибактериальную терапию. Геморрагический синдром, несмотря на тромбоцитопению, возникает нечасто и обычно ограничен умеренными кожными проявлениями, тем не менее, не редкость возникновение межмышечных гематом с последующим инфицированием и формированием абсцессов (особенно часто в икроножных мышцах). Лимфоузлы обычно не увеличены, хотя в 20-30% случаев, особенно при вариантной форме болезни, встречается небольшое увеличение единичных висцеральных (чаще внутри- и забрюшинных, реже – внутригрудных) и изредка единичных периферических лимфоузлов. Селезенка в 90% случаев увеличена, размером от четко пальпируемого нижнего полюса в левом подреберье до гигантской спленомегалии, достигающей нижним полюсом малого таза. Размеры печени увеличены незначительно.
Поражение некроветворных органов встречается редко. В нашей практике встречалось специфическое поражение кожи, печени и легких, в литературе описаны редкие случаи специфического поражения костей, легких, нервной системы, мягких тканей и других органов. Поражение кожи может носить характер васкулита и быстро регрессировать на фоне специфической терапии лейкоза. Чаще выявляется неспецифическое поражение кожи в виде воспалительных гнойно-септических очагов, связанное с лейкопенией. В целом, специфическое поражение некроветворных органов не является плохим прогностическим фактором и успешно излечивается при проведении адекватной терапии лейкоза.
Несмотря на довольно четкие и несложные критерии диагностики волосатоклеточного лейкоза, к сожалению, больные нередко поступают к гематологу в крайне тяжелом состоянии, с глубокой цитопенией и инфекцией из-за потери времени на выяснение диагноза и, часто, неадекватной терапии кортикостероидами.
Лабораторная диагностика
В анализе периферической крови выявляется одно-, двух- или трехростковая цитопения, связанная с угнетением и вытеснением элементов нормального кроветворения лимфоидными клетками. Анемия в основном нормохромная нормоцитарная, но у пожилых больных может встречаться и сочетание с железо- или В12-дефицитной анемией, аутоиммунный гемолиз встречается крайне редко. Тромбоцитопения варьирует в широких пределах, изредка проявляясь кожным геморрагическим синдромом при снижении числа тромбоцитов менее 30×109/л. При типичной форме волосатоклеточного лейкоза лейкоциты снижены, часто довольно значительно – менее 1,5 ×109/л, но при вариантной форме лейкопении не наблюдается, может быть даже лейкоцитоз (обычно умеренный). Тем не менее, вне зависимости от числа лейкоцитов, обнаруживается характерная для этого лейкоза лейкоцитарная формула – лимфоцитоз от 50% до 95%, при этом часть лимфоцитов более крупного размера, с «разрыхленной», более нежной структурой хроматина ядра, и своеобразным фестончатым или ворсинчатым краем цитоплазмы. При типичной форме лейкоза также выявляется моноцитопения, однако она часто отсутствует при вариантной форме болезни или при сопутствующей микобактериальной инфекции (туберкулез).
Для уточнения диагноза волосатоклеточного лейкоза необходимо исследование костного мозга – миелограмма и трепанобиопсия. Для волосатоклеточного лейкоза характерно то, что аспират костного мозга получается с трудом, что связано с фиброзом костного мозга (существует даже специальный термин «сухой пунктат»). В миелограмме выявляется лимфоцитоз с наличием атипичных «ворсинчатых» лимфоцитов, количество бластов не увеличено, нормальные ростки гемопоэза сужены. В гистологическом препарате костного мозга на фоне уменьшения элементов нормального кроветворения (иногда до степени выраженной аплазии) выявляется диффузная инфильтрация неплотно расположенными зрелыми лимфоцитами с довольно крупной неровной цитоплазмой, фиброз, поля кровоизлияний – картина, позволяющая отграничить этот вид лейкоза от других лимфопролиферативных заболеваний.
Подтверждением диагноза волосатоклеточного лейкоза служат цитохимическая реакция на присутствие тартрат-устойчивой кислой фосфатазы (TRAP) и иммунофенотипирование лимфоцитов крови или костного мозга. При иммунофенотипировании выявляется κ- или λ-клон иммунологически зрелых В-лимфоцитов, несущих характерные для волосатоклеточного лейкоза маркеры CD103, CD25, CD11c, HC-2, FMC7, DBA.44. При этом обычно отсутствуют маркеры CD23, CD5, CD10, хотя иногда (чаще при вариантной форме) эти маркеры могут слабо экспрессироваться на части клеток, наряду с типичными маркерами волосатоклеточного лейкоза. Кроме того, для вариантной формы заболевания считается характерным более слабая степень экспрессии или отсутствие CD103 или CD25. Поскольку в крови популяция «волосатых лимфоцитов» может быть невелика, а аспират костного мозга нередко «сухой» и малоклеточный, особое значение для диагностики волосатоклеточного лейкоза приобретает иммуногистохимическое исследование трепанобиоптата. При этом выявляется сильная экспрессия В-клеточных маркеров CD20, CD79a и высокоспецифичных маркеров этого лейкоза CD103, CD25 и DBA.44, выявляемых более чем в 90% случаев. Цитохимическую реакцию на TRAP невозможно провести на фиксированном материале, однако можно провести иммуногистохимическое исследование трепанобиоптата с анти-TRAP-антителом 9С5.
Интересно, что волосатоклеточный лейкоз является еще одним заболеванием, наряду с лимфомой мантийной зоны, при котором выявлена гиперэкспрессия циклина D1. Но, в отличие от мантийной лимфомы, эта экспрессия при волосатоклеточном лейкозе не связана с транслокацией 11;14 (и, соответственно, нет перестройки bcl-1). Моноклональная секреция нехарактерна для волосатоклеточного лейкоза, однако в небольшом проценте случаев может выявляться клональный иммуноглобулин в сыворотке крови или моче. Чаще такая секреция носит следовой характер, крайне редко достигает измеряемых значений и не ухудшает течение и прогноз болезни.
При компьютерной томографии и ультразвуковом исследовании органов брюшной полости определяется спленомегалия разной степени, умеренное увеличение размеров печени, иногда – небольшая абдоминальная лимфаденопатия, в основном в воротах селезенки и близких областях. Томографическое исследование грудной клетки также может выявлять незначительное увеличение размера внутригрудных лимфоузлов, но гораздо чаще обнаруживаются неспецифические воспалительные изменения легочной ткани, возможен туберкулез.
Дифференциальный диагноз проводится с цитопениями и спленомегалиями при других заболеваниях, как гематологических (в первую очередь, лимфоцитома селезенки, лейкоз из больших гранулированных лимфоцитов, селезеночная форма лимфомы из клеток мантийной зоны), так и терапевтических – цирроз печени, перенесенная вирусная инфекция, ревматические болезни.
Лечение
Продолжительность жизни при естественном течении заболевания без лечения составляет около 5 лет, но в настоящее время при своевременном и адекватном лечении продолжительность жизни пациентов с волосатоклеточным лейкозом не короче общей продолжительность жизни в популяции.
Так как ранее (с 1960-х гг.) основным лечебным методом являлась спленэктомия, лечение проводилось лишь при показаниях, к которым относились симптомная цитопения и спленомегалия, инфекционные и аутоиммунные осложнения. Эффект спленэктомии наблюдался у 90% больных и не зависел от размеров селезенки, но у большинства больных был кратковременным, и рецидив цитопении наступал в течение 6-12 мес. после операции. В связи с этим к спленэктомии в настоящее время прибегают реже, особенно у пожилых больных с отягченным терапевтическим анамнезом. Общая 4-летняя выживаемость пациентов после спленэктомии составляла около 65%. Среди наших пациентов максимальная продолжительность ремиссии после спленэктомии составила 24 года, с последующим рецидивом, который в свою очередь был успешно лечен последовательно α-интерфероном и кладрибином (2-CdA).
Прорыв в лечении волосатоклеточного лейкоза с середины 1980-х годов связан с применением препаратов интерферона-a, позволивших добиться ремиссий в 75-90% случаев. Несмотря на то, что абсолютное большинство этих ремиссий были частичные и требовали почти постоянной поддерживающей терапии, 5-летняя выживаемость при лечении интерфероном-a выросла до 90%. Интерферон-a применяли чаще всего в дозе 3 млн. ед./сут. в течение 4-6 недель (в зависимости от степени цитопении) с переходом на поддерживающую дозу 3 млн. ед. 3 раза/нед. длительно, не менее года, а в большинстве случаев пожизненно. В настоящее время интерферон-a применяется лишь как первый, подготовительный этап терапии в течение 3-4 мес. перед проведением одного курса цитостатической терапии препаратами из группы пуриновых аналогов (2-дезоксикоформицин и 2-хлордезоксиаденозин). Изредка интерферон-a приходится быстро отменять из-за индивидуальной непереносимости или иммунокомплексных осложнений, самым частым из которых является индуративный миозит (чаще мышц голеней). Гипертермия и гриппоподобный синдром не являются признаками непереносимости, для их профилактики используется парацетамол или индаметацин и начало терапии по 1 млн.ед. интерферона-a с постепенным повышением дозы до 3 млн.ед × 3 р/нед. Такое ступенчатое начало терапии облегчает переносимость лечения, что важно у пожилых пациентов с множеством сопутствующих заболеваний.
С 1990-х гг. в результатах терапии зрелоклеточных лимфопролиферативных заболеваний и, в частности, волосатоклеточного лейкоза произошли революционные улучшения, связанные с внедрением в лечебную практику новых лекарственных препаратов из группы аналогов пуринов. В лечении волосатоклеточного лейкоза наибольшей активностью обладают 2 препарата: 2-дезоксикоформицин (2-DCF, пентостатин) и 2-хлордезоксиаденозин (2-CdA, кладрибин, леустатин, биодрибин, лейкладин, вера-кладрибин). Эти препараты являются структурными аналогами аденозина, их применение приводит к внутриклеточному накоплению трифосфатов аденозина и дезоксиаденозина, что через ряд промежуточных этапов ингибирует синтез ДНК и препятствует восстановлению ДНК. Ценным качеством препаратов этой группы является то, что они действуют как на делящиеся, так и на покоящиеся лимфоидные клетки, что и обуславливает их высокую эффективность при таком медленно пролиферирующем заболевании, как волосатоклеточный лейкоз.
Наиболее высока эффективность лечения при использовании 2-CdA, когда в результате применения одного 5-7 дневного курса удается получить ремиссии у 95% больных, при этом большинство ремиссий (до 80%) полные и длительные (3-15 лет, медиана 5 лет), и эффективность лечения не зависит от предшествующего лечения a-интерфероном, спленэктомии, рецидива или рефрактерности к другим видам терапии. Эффективность непрерывного внутривенного введения в течение 7 суток и 2-часовых внутривенных инфузий идентична, поэтому мы в последнее время применяем 2-часовые инфузии кладрибина в дозе 0,1 мг/кг/сут в течение 7 дней или 0,14 мг/кг/сут в течение 5 дней, что позволяет проводить лечение в амбулаторном режиме.
Препарат отлично переносится, не вызывая обычных побочных эффектов, таких, как тошнота, рвота и аллопеция. В используемых дозах кладрибин не обладает нефро- и гепатотоксичностью. Единственным побочным эффектом является миелосупрессия до степени агранулоцитоза, который может быть довольно длительным. Однако степень и длительность агранулоцитоза напрямую связана с уровнем нейтропении перед применением кладрибина, поэтому при успешном предварительном лечении интерфероном-a в стандартной дозе в течение 8-12 недель (для уменьшения гранулоцитопении и лимфоцитоза в крови) последующий недельный курс 2-CdA либо не вызывает агранулоцитоза, либо этот агранулоцитоз очень короток, протекает без инфекционных осложнений и заканчивается без назначения ростовых факторов. При амбулаторном ведении больных следует иметь в виду, что агранулоцитоз может быть отсроченным – в течение 1-2 недель после курса, в связи, с чем необходимо контролировать анализы крови 2 раза в неделю в течение этого времени. На фоне курса 2-CdA сразу происходит снижение числа лимфоцитов, затем примерно в течение 2-4 недель происходит прирост тромбоцитов, гемоглобина и лейкоцитов. Селезенка также сокращается в процессе лечения, и сокращение ее размеров продолжается в течение 1-2 мес. после завершения терапии.
После проведения одного курса лечения кладрибином пациент не нуждается в терапии, необходимо только наблюдение с контролем показателей крови и размеров селезенки ежеквартально, затем каждые 6 мес. О полной ремиссии свидетельствует уровень гемоглобина >120 г/л, тромбоцитов >100×109, нейтрофилов >1,5×109, отсутствие «ворсинчатых» лимфоцитов в крови и <5% этих клеток в костном мозге, нормальные размеры селезенки. Полноту ремиссии в костном мозге целесообразно оценивать не ранее полугода после окончания лечения. Небольшая остаточная спленомегалия может быть обусловлена фиброзом и не требует лечения. Улучшение перечисленных показателей более чем на 50% от исходного уровня соответствует частичной ремиссии. Обнаружение иммуногистохимических признаков минимальной остаточной болезни в костном мозге не является плохим прогностическим признаком и не коррелирует со сроком ремиссии.
Мы наблюдали за 15-летний период (с 1995 г. по 2010 г.) 42 пациента с волосатоклеточным лейкозом в возрасте старше 60 лет (от 60 до 83 лет, медиана 64 года), что составило около 20% от общего количества больных с этим лейкозом в клинике Гематологического Научного Центра Минздравсоцразвития России (Москва). Среди пациентов старшего возраста отмечалось преобладание мужчин (34 мужчины и 8 женщин, м:ж=4,25:1) с типичной формой заболевания (36 с типичной и 6 с вариантной формой лейкоза).
У 40% больных заболевание было диагностировано в период инфекционных осложнений (пневмония, туберкулез, бронхит, абсцесс, парапроктит, отит и др.). Несмотря на проведение интенсивной антибактериальной терапии, 3 пациента умерли от инфекционных осложнений до начала противоопухолевой терапии. У 6 больных была удалена увеличенная селезенка весом от 2,4 до 4 кг (медиана 3,5 кг). Спленэктомия привела к многолетней ремиссии у 3 пациентов, однако у 2 больных в дальнейшем развился рецидив болезни. У 38 больных мы применяли интерферон-α по 3 млн. ед. × 3 р/нед. подкожно или внутримышечно, а затем у 35 пациентов был применен кладрибин внутривенной длительной (3-4 часа) инфузией в дозе 0,1 мг/кг/сут. №7 или 0,14 мг/кг/сут. №5. При такой последовательности лечения только у 2 (5%) больных развился короткий агранулоцитоз (3 и 4 дня), протекавший без инфекционных осложнений. Ремиссия после применения кладрибина была достигнута у всех пациентов, в том числе у 9 больных с рецидивом заболевания после многолетнего применения интерферона-α в предыдущие годы. У 31 больного (89%) ремиссия сохранялась при сроках наблюдения от 1 года до 14 лет (медиана 7 лет). У 4 пациентов (11%) развился рецидив лейкоза в сроки от 2 до 7 лет после курса химиотерапии кладрибином, успешно леченный повторным последовательным применением интерферона-α и кладрибина у 2 больных.
В лечении волосатоклеточного лейкоза мы с равным эффектом применяли препараты кладрибина разных производителей – Леустатин (Ortho Bioteсh, США и Janssen Сilag, Бельгия-Швейцария), Биодрибин (Биотон, Польша), Лейкладин (Белмедпрепараты, Беларусь), Веро-кладрибин (Верофарм, Россия).
Наш опыт лечения волосатоклеточного лейкоза показывает, что возраст отнюдь не является фактором неблагоприятного прогноза при этой болезни. Так, в числе наших пациентов наблюдаются мужчина 90 лет во второй ремиссии и женщина 87 лет в первой ремиссии заболевания. Возраст этих пациентов на момент установления диагноза волосатоклеточного лейкоза составлял соответственно 71 год и 83 года, продолжительность первой ремиссии – 4 года в обоих случаях. После развития рецидива у первого пациента было успешно проведено повторное лечение интерфероном-α и кладрибином, с достижением второй ремиссии, длящейся более 9 лет, а всего с данным заболеванием пациент наблюдается уже 20 лет.
У второй пациентки первая ремиссия сохраняется спустя 4 года наблюдения. Интересно, что правильный диагноз у этой больной был установлен не сразу, и в течение 3 лет пациентка наблюдалась в различных гематологических учреждениях с диагнозом хронический лимфолейкоз. Цитостатической терапии не проводилось в связи с небольшим лейкоцитозом (<20×109/л) и отсутствием лимфоаденопатии, однако беспокоили проявления анемии (гемоглобин <80 г/л), по поводу чего неоднократно получала гемотрансфузии, препараты железа. В связи с рецидивирующей анемией и нарастающей спленомегалией пациентке планировалось проведение химиотерапии хронического лимфолейкоза, однако до начала лечения больная была обследована в клинике Гематологического Научного Центра (Москва), где впервые обратили внимание на «ворсинчатую» морфологию лимфоцитов, выполнили иммунофенотипирование и цитохимическое исследование лимфоцитов. Исследования показали, что 52% лимфоцитов крови содержат тартрат-устойчивую кислую фосфатазу, а 70% лимфоцитов у этой больной представлены κаппа-клоном В-лимфоцитов с фенотипом CD5-, CD10-, CD23-, CD43-, CD19+, CD20++, CD22++, CD25+, CD103+, CD11c+, FMC7+, что соответствует диагнозу не хронического лимфолейкоза, а волосатоклеточного лейкоза и требует другой тактики лечения. Источником ошибочного первоначального диагноза в данном случае послужил умеренный лейкоцитоз, что увело диагностический поиск в сторону хронического лимфолейкоза, хотя отсутствие лимфаденопатии, спленомегалия и, главное, «ворсинчатая» морфология лимфоцитов должны были стать поводом к уточнению диагноза с помощью цитохимического и иммунофенотипического исследований вариантной формы волосатоклеточного лейкоза. Больной была проведена терапия интерфероном-α в течение 3 мес., приведшая к улучшению гемограммы – приросту гемоглобина, тромбоцитов, снижению лимфоцитоза, сокращению размеров селезенки, после чего был применен 1 пятидневный курс кладрибина. Вся терапия проводилась амбулаторно. При контрольных обследованиях в течение 4 лет после терапии сохраняется полная клиническая ремиссия волосатоклеточного лейкоза.
У пациентов с волосатоклеточным лейкозом старше 60 лет мы наблюдали редкие случаи сочетания волосатоклеточного лейкоза со вторым гематологическим заболеванием – по одному случаю сочетания волосатоклеточного лейкоза с хроническим лимфолейкозом и с гетерозиготной дельта/бета талассемией.
Как и при других лимфопролиферативных заболеваниях, у пациентов с волосатоклеточным лейкозом могут возникать солидные опухоли. Мы наблюдали возникновение вторых опухолей у 4 (9,5%) пациентов старшего возраста, позже их число увеличилось до 7 за счет заболевших волосатоклеточным лейкозом в более молодом возрасте, у которых вторая опухоль развилась в возрасте старше 60 лет. Вторую опухоль выявляли на 2-20 году (медиана 12 лет) заболевания волосатоклеточным лейкозом, независимо от вида предшествующего лечения. Среди опухолей диагностированы аденокарцинома сигмы – в 2 случаях, низкодифференцированный рак желудка, рак молочной железы, мочевого пузыря, легкого, простаты – по 1 случаю.
Прогноз
Продолжительность жизни при своевременно диагностированном и адекватно леченном волосатоклеточном лейкозе не отличается от общей в популяции. Без лечения заболевание в течение 5 лет заканчивается смертью больного из-за разнообразных осложнений, в первую очередь, инфекционных. В наших наблюдениях максимальная давность заболевания составляла 25 лет.
Из 42 наблюдавшихся нами пациентов пожилого возраста живы 34 (81%) больных. Умерли 8 (19%) больных, в их числе 5 больных – от инфекционных осложнений (3 в дебюте заболевания и 2 в рецидиве) и 3 пациента в ремиссии волосатоклеточного лейкоза – от других причин (инсульт, аденокарцинома).
Таким образом, волосатоклеточный лейкоз – в прошлом грозное, смертельное из-за осложнений заболевание – в последние годы стал одной из наиболее простых для лечения болезней. После обязательной 2-3–месячной терапии препаратами интерферона-α амбулаторное лечение кладрибином занимает 5 или 7 дней. Ремиссия с полным сохранением работоспособности больного сохраняется 5 лет и более. Отличающаяся от классической формы волосатоклеточного лейкоза вариантная форма (с лейкоцитозом), скорее всего, представлена неоднородной группой разнообразных лимфатических опухолей, имеющих один или несколько, но не полный набор признаков классической формы, что может быть причиной укорочения срока ремиссии после стандартной терапии интерфероном и кладрибином. В случае короткой (менее 3 лет) продолжительности ремиссии рекомендуется дополнительная поддерживающая терапия моноклональным антителом анти-CD20 (ритуксимаб, мабтера) в дозе 375 мг/м2 раз в 3 мес. №4-8.
Выживаемость при хроническом лимфолейкозе
Хронический лимфолейкоз (ХЛЛ) часто развивается очень медленно. Вам может потребоваться незначительное лечение или полное его отсутствие. Хотя болезнь обычно неизлечима, ее можно контролировать в течение многих лет. Но у некоторых людей ХЛЛ может прогрессировать быстрее. Это может означать, что вам нужно лечение раньше или вам нужно много разных курсов лечения.
Перспективы (прогнозы) могут быть разными. Некоторые люди живут много лет. Но для некоторых перспективы менее хороши.
Имейте в виду, что лечение ХЛЛ улучшается, поскольку врачи используют новые целевые препараты. Эти новые методы лечения могут улучшить прогноз для некоторых людей.
Это общая статистика, основанная на больших группах пациентов. Помните, они не могут сказать вам, что произойдет в вашем конкретном случае.
Ваш врач может дать вам больше информации о вашем собственном мировоззрении. Вы также можете поговорить об этом с медсестрами, занимающимися исследованием рака в Великобритании. Номер бесплатного телефона: 0808 800 4040 с 9:00 до 17:00 с понедельника по пятницу.
Выживание для всех людей с CLL
Статистические данные по выживаемости при ХЛЛ в Великобритании отсутствуют. Доступны статистические данные по ХЛЛ, диагностированным в одном районе Англии в период с 2004 по 2016 год.
Обычно для всех людей с CLL:
- Около 85 из 100 человек (около 85%) переживут лейкоз в течение 5 или более лет после постановки диагноза
Это для всех возрастов. Молодые люди, как правило, добиваются большего успеха, чем люди старшего возраста:
Для лиц младше 60 лет:
- около 95 из 100 (около 95%) переживут лейкоз в течение 5 или более лет после постановки диагноза
Для лиц в возрасте от 60 до 69 лет:
- Почти 90 из 100 (почти 90%) переживут лейкоз в течение 5 или более лет после постановки диагноза
Для лиц в возрасте от 70 до 79 лет:
- более 80 из 100 (более 80%) переживут лейкоз в течение 5 или более лет после постановки диагноза
Для лиц старше 80 лет:
- Примерно 65 из 100 (около 65%) переживут лейкоз в течение 5 или более лет после постановки диагноза
Сеть исследования гематологических злокачественных новообразований (HMRN)
Доступ к март 2021 г.
Статистика HMRN предназначена для оценки относительной выживаемости.Относительная выживаемость учитывает, что некоторые люди умрут не от рака, а от других причин. Это дает более точную картину выживаемости при раке.
Что влияет на выживаемость
Несколько факторов могут повлиять на ваше мировоззрение (прогноз). Это так называемые прогностические факторы.
Эти факторы включают степень развития вашего ХЛЛ (стадию), а также ваш возраст и генетические изменения в лейкозных клетках. Наше понимание ХЛЛ и возможных методов лечения изменилось за последние несколько лет.Информация о том, как эти факторы влияют на выживаемость, немного отстает от этих улучшений.
Некоторые врачи используют шкалу, называемую Международным прогностическим индексом хронического лимфоцитарного лейкоза (CLL-IPI). Это поможет им обсудить с вами ваш прогноз.
Международный прогностический индекс хронического лимфоцитарного лейкоза (CLL-IPI)
Эта шкала включает 5 прогностических факторов, которые врачи могут использовать для прогнозирования вашего прогноза. Вот эти 5 факторов:
- старше 65 лет
- с хроническим лимфолейкозом стадии B или C по Бине
- с изменениями в гене TP53
- , а не с изменениями в гене IGHV
- более высокий уровень в крови белка, называемого бета 2 микроглобулина
Ваш врач дает вам баллы по каждому фактору — некоторые факторы получают больше баллов, чем другие.Они используют вашу оценку, чтобы разделить людей с ХЛЛ на 4 группы риска:
- низкий риск
- средний (средний) риск
- высокий риск
- очень высокий риск
Хотя этот прогностический индекс появился совсем недавно, лечение продолжает меняться. Врачи используют новые таргетные препараты для лечения ХЛЛ. Это может улучшить перспективу для некоторых людей.
Врачи по-прежнему считают этот индекс полезным инструментом для прогнозирования прогноза. Исследователи продолжают собирать информацию о пациентах, получающих эти новые методы лечения.Они будут использовать эту новую информацию для просмотра индекса.
Выживаемость для групп риска CLL
Мы использовали для представления статистики выживаемости для различных групп стадий CLL (стадии A, B и C). Но выживаемость для ХЛЛ изменилась. Врачи используют новые целевые препараты, которые улучшили прогноз для людей с более поздними стадиями. И врачи знают, что на ваше мировоззрение влияют и другие факторы, например, возраст или изменения генов.
Вместо выживания по стадиям мы предоставляем статистику выживаемости из исследования Международного прогностического индекса хронического лимфоцитарного лейкоза (CLL-IPI).В этом исследовании рассматривались данные о пациентах с ХЛЛ из 8 международных клинических испытаний. Исследователи изучили все данные испытаний вместе. Больных делят на 4 группы риска.
Приведенные ниже статистические данные относятся к 4 различным группам риска.
Нам известно, что вы могли пройти не все тесты для определения вашей группы риска. И ваш врач мог не говорить вам о прогностическом индексе или вашей группе риска. Поэтому может быть сложно найти информацию, которую вы ищете ниже.
Поговорите со своим врачом о своем прогнозе. Они могут рассказать вам больше о вашей группе риска и ваших взглядах.
Имейте в виду, что лечение ХЛЛ улучшается, поскольку врачи используют новые целевые препараты. Таким образом, у людей, пролеченных сейчас, может быть лучше прогноз
Низкий риск
Почти 95 из 100 человек (почти 95%) выживают в течение 5 и более лет после постановки диагноза.
Промежуточный риск
Около 80 из 100 человек (около 80%) выживают в течение 5 и более лет после постановки диагноза.
Высокий риск
Почти 65 из 100 человек (почти 65%) выживают в течение 5 и более лет после постановки диагноза.
Очень высокий риск
Почти 25 из 100 человек (почти 25%) выживают в течение 5 и более лет после постановки диагноза.
Международный прогностический индекс для пациентов с хроническим лимфолейкозом (CLL-IPI): метаанализ индивидуальных данных пациента
Международная рабочая группа CLL-IPI
Lancet Oncology Volume 17.Выпуск 6, июнь 2016, страницы 779-790
Об этой статистике
Термины 1 год и 5 лет не означают, что вы проживете только 1 или 5 лет. Управление национальной статистики (ONS) и исследователи собирают информацию о том, что происходит с людьми, больными раком, через годы после того, как им поставили диагноз. 5 лет — это обычная временная точка для измерения выживаемости. Но некоторые люди живут намного дольше этого. 5-летняя выживаемость — это количество людей, которые не умерли от рака в течение 5 лет после постановки диагноза.
Дополнительная информация
выживших с ХЛЛ обеспокоены ожидаемой продолжительностью жизни и качеством жизни
В то время как пациенты с хроническим лимфолейкозом (ХЛЛ), как правило, имеют долгую ожидаемую продолжительность жизни, многим из них прописан подход «слежения и ожидания», недавнее исследование Службы поддержки рака Сообщество (CSC) обнаружило, что более половины пациентов, живущих с этим заболеванием, сообщили, что наличие ХЛЛ влияет на их точку зрения относительно ожидаемой продолжительности жизни.
«Это исследование — важный первый шаг к пониманию проблем и проблем, характерных для пациентов с ХЛЛ, и психосоциальных последствий постановки диагноза ХЛЛ», — сказала Линда Хаус, президент CSC, в своем сообщении.
CSC — крупнейшая в мире профессионально управляемая сеть поддержки рака, представившая свои выводы на ежегодном собрании и выставке Американского общества гематологов (ASH) в 2017 году.
В исследовании приняли участие 134 человека с ХЛЛ, которые были зарегистрированы в онлайн-реестре онкологических заболеваний CSC. Участники заполнили опросы, в которых изучались как качество жизни, связанное со здоровьем, так и финансовые вопросы.
В группе 49 пациентов (37 процентов) применяли метод ожидания; восемь пациентов (6 процентов) проходили курс лечения первой линии; 16 (12 процентов) их активное второе или последующее лечение; и 52 (39 процентов) были в ремиссии.
Несмотря на то, что только пять пациентов (4 процента) имели плохое здоровье (остальные — отличные, очень хорошие, хорошие и удовлетворительные), 62 процента заявили, что ХЛЛ «отчасти или очень сильно» повлияла на их взгляды на жизнь. ожидание.
Сорок один процент сообщили о беспокойстве по поводу качества своей жизни, 40 процентов беспокоились о финансах и 34 процента беспокоились о своей трудоспособности. Около четверти пациентов (26 процентов) также беспокоились об отношениях с семьей и друзьями.
В целом пациенты, участвовавшие в исследовании, сообщили о значительно худшем качестве жизни — особенно когда дело дошло до беспокойства и усталости — по сравнению с населением в целом в Соединенных Штатах, однако неясно, как прогрессирование болезни и лечение способствуют низкому качеству. жизни.
«Эти результаты подчеркивают важность изучения изменений качества жизни и стресса на протяжении всего периода лечения рака и того, что психосоциальные услуги, подобные тем, которые предлагаются через CSC, играют жизненно важную роль в поддержке пациентов и выживших, у которых есть эти симптомы и проблемы», — сказал Александра Залета, к.Н., Старший директор по исследованиям CSC.
Заглядывая в будущее, исследователи отметили, что необходимы дальнейшие исследования факторов, повышающих риск неблагоприятных исходов у пациентов с ХЛЛ, а также меры, принимаемые в настоящее время для устранения эмоционального стресса и повышения качества жизни, особенно с теми, кто прогрессирует болезнь.
Часто задаваемые вопросы о хроническом лимфоцитарном лейкозе (ХЛЛ)
Даже самые простые вопросы в CLL могут иметь некоторые противоречия и тонкости в ответах.
Ниже приведены самые основные факты. Мы будем постоянно развивать и обновлять этот сайт, добавляя более подробные комментарии.
Диагностика
Что такое CLL?
ХЛЛ (хронический лимфоцитарный лейкоз) — это обычно медленно растущий рак крови, обнаруживаемый в виде лейкоцитов, называемых В-лимфоцитами (лимфоциты являются преобладающими клетками в лимфатической ткани). (См. Комментарий к диагностике )
Где в моем организме находятся клетки CLL?
Клетки CLL обнаруживаются в основном в кровотоке, костном мозге, лимфатических узлах и селезенке.
Как диагностируется ХЛЛ?
ХЛЛ обычно диагностируется на основании анализа крови, хотя иногда его диагностируют при биопсии лимфатических узлов. (Подробнее см. Комментарий к диагностике)
Что вызывает ХЛЛ?
ХЛЛ начинается, когда одна белая кровяная клетка, в частности лимфоцит В-клетки, мутирует и становится злокачественной. Эта единственная клетка реплицируется, клонируя себя. Эти клоны CLL не функционируют как нормальные лимфоциты, борющиеся с болезнями.Хотя количество лимфоцитов в организме увеличивается, лимфоциты CLL (которые часто составляют основную массу лимфоцитов) не помогают вашей иммунной системе.
Есть ли что-нибудь, что увеличивает риск развития ХЛЛ?
Радиационное облучение от Чернобыля и воздействие Agent Orange были связаны с повышенным риском ХЛЛ. Связь с несколькими предшествующими эпизодами пневмонии не доказана. Неизвестно о повышенном риске от воздействия растворителей и химических веществ, таких как бензол, которые, как доказано, связаны с другими видами рака крови.
Унаследовал ли я свой CLL?
Небольшой процент ХЛЛ действительно протекает в семьях. 5% пациентов с ХЛЛ будут иметь родственников, больных лейкемией. Относительный риск заболевания ХЛЛ у человека на 8,5 выше, если у него есть брат, сестра или родитель с ХЛЛ, но абсолютный риск все еще очень низок. Большинство людей с ХЛЛ — единственные в своей семье, кто страдает этим заболеванием. MBL (моноклональный В-клеточный лимфоцитоз), доброкачественный предшественник ХЛЛ, также чаще встречается у родственников этих ХЛЛ.
Могут ли мои дети и внуки унаследовать от меня ХЛЛ?
Возможно, но маловероятно.
Является ли ХЛЛ заразным?
№
Являются ли одни этнические группы более или менее вероятными, чем другие, заболеть ХЛЛ?
Да. Евреи-ашкенази подвергаются более высокому риску. В США среди кавказцев чаще встречается ХЛЛ по сравнению с афроамериканцами или азиатами.Заболеваемость ХЛЛ чрезвычайно низка в Китае и Японии, где, по оценкам, она встречается примерно в 10% от заболеваемости в западных странах. В Африке заболеваемость не так низка, как в Азии.
Мой диагноз: «ХЛЛ / СЛЛ». Что такое SLL?
SLL расшифровывается как Small Lymphocytic Lymphoma. Поскольку ХЛЛ обнаруживается в лимфатических узлах, а также в крови, ХЛЛ классифицируют как лейкоз, так и лимфому. Но CLL и SLL — это одно и то же заболевание, причем клетки CLL и SLL под микроскопом совершенно одинаковы.. (См. Комментарий к диагностике )
Чем CLL отличается от SLL?
Если у вас SLL, клетки CLL находятся в основном в лимфатических узлах, а не в костном мозге или крови.
Существуют ли разные типы ХЛЛ?
Да. А тесты для определения того, какой у вас тип ХЛЛ, могут помочь определить, как скоро вам может потребоваться лечение, а также какой тип лечения лучше всего подойдет для вашего типа ХЛЛ.Это чрезвычайно важная тема для понимания.
Что означает «хронический лейкоз»?
Хронический лейкоз растет медленно, в отличие от «острых» лейкозов, которые растут очень быстро и требуют срочного лечения. Лечение ХЛЛ, хронического лейкоза, может не понадобиться годами… если вообще когда-либо.
Мой врач назвал ХЛЛ «хорошим раком». Что это обозначает?
Это означает, что ваш врач не очень хорошо разбирается в ХЛЛ. Хорошего рака НЕТ ! (См. Комментарий к «Хорошему диагнозу рака» )
Сколько лет после постановки диагноза может прожить человек с ХЛЛ?
Никто не может сказать, так как это сильно варьируется от человека к человеку. У многих пациентов с ХЛЛ есть основания ожидать, что они доживут до нормальной продолжительности жизни.
ЛечениеПочему бы мне не начать лечение немедленно, когда мне поставили диагноз ХЛЛ? Разве я не хочу убить как можно больше раковых клеток СЕЙЧАС, пока их не стало больше?
Все методы лечения рака обладают некоторой токсичностью, и пациенты с ХЛЛ часто проходят многие годы, даже десятилетия, прежде чем им действительно нужно лечиться от ХЛЛ.Фактически, около 30% пациентов с ХЛЛ НИКОГДА не нуждаются в лечении. Поэтому лучше избегать возможных побочных эффектов лечения до тех пор, пока пациенту с ХЛЛ не потребуется лечение. Более того, было показано, что раннее лечение одной терапией (хлорамбуцилом) действительно ухудшает результаты. Доказано, что раннее вмешательство не улучшает выживаемость.
Есть ли лучший или предпочтительный метод лечения ХЛЛ?
В настоящее время существует множество различных методов лечения ХЛЛ. Ваше лечение должно соответствовать вашим обстоятельствам.Не должно быть никакого «поваренного» подхода к управлению ХЛЛ. Лучшая терапия для каждого пациента зависит от многих факторов, включая тип ХЛЛ, возраст пациента, состояние здоровья и предпочтения в лечении.
Как мой врач решит, какое лечение лучше всего при моем ХЛЛ?
Ваш врач проведет различные тесты, чтобы определить, какой у вас тип ХЛЛ и как он себя ведет. При рассмотрении вопроса о лечении он / она также учтет ваши предпочтения и любые другие проблемы со здоровьем, которые могут у вас возникнуть, например, проблемы с сердцем или почками.Затем вы и ваш врач вместе должны решить, какое лечение будет лучше всего для вас.
Есть ли лечение, которое вылечит ХЛЛ?
В настоящее время единственным известным лекарством от ХЛЛ является успешная трансплантация аллогенных стволовых клеток (получение от кого-то совершенно новой системы крови для замены раковых клеток). Трансплантация — это лечение высокого риска, но, если оно будет успешным, ХЛЛ может быть устранена. Некоторые избранные пациенты с очень специфическим типом ХЛЛ могут очень долго реагировать на FCR (лекарственный коктейль), который рассматривается некоторыми исследователями как возможное лекарство, но это не было доказано.
Будет ли мне со временем становиться все хуже и хуже без лечения моего ХЛЛ? ?
Возможно, но часто ХЛЛ «ухудшается» ОЧЕНЬ медленно. Насколько быстро или медленно прогрессирует ХЛЛ, будет зависеть от каждого конкретного случая ХЛЛ. И у многих пациентов с ХЛЛ есть МНОГО времени, прежде чем их ХЛЛ станет «достаточно плохим» для лечения. Около 30% пациентов с ХЛЛ никогда не нуждаются в лечении от ХЛЛ . Многие пациенты с ХЛЛ умирают от ХЛЛ, а не от него.
Может ли мой ХЛЛ вылечиться самостоятельно без лечения?
Несмотря на то, что было несколько достоверных сообщений о спонтанных ремиссиях, для вашего CLL будет очень редко действительно улучшаться с течением времени. Заболевание многих пациентов с ХЛЛ может оставаться довольно стабильным в течение многих лет или даже десятилетий. Но без лечения количество клеток ХЛЛ в крови, лимфатических узлах и костном мозге обычно увеличивается.
Как лечится ХЛЛ?
Существует множество вариантов лечения ХЛЛ, включая химиотерапию, моноклональные антитела, стероиды, таргетную терапию, экспериментальную клеточную терапию, трансплантацию стволовых клеток и многое другое.И, к счастью для пациентов с ХЛЛ, в ходе продолжающихся клинических испытаний продолжают разрабатываться новые методы лечения.
Как мне узнать, когда мне следует начать лечение?
Решение о том, когда начинать терапию, должно приниматься совместно врачом. Возможных причин много, в том числе обильная ночная потливость, необъяснимая лихорадка или потеря веса, быстро растущее количество лимфоцитов или трудно поддающиеся лечению осложнения ХЛЛ, такие как низкие показатели крови или сильная усталость. Важно отметить, что в большинстве случаев нет одного только подсчета лимфоцитов, независимо от того, насколько они высоки, что требует лечения.Врачи лечат пациентов, а не результаты лабораторных исследований. (См. Симптомы )
Может ли лечение ХЛЛ вызвать у меня тошноту?
Реакции и побочные эффекты на лечение варьируются от одного пациента к другому и от одного лечения к другому. Но большинство методов лечения ХЛЛ достаточно хорошо переносятся большинством пациентов. Для лечения ХЛЛ редко требуется очень суровая химиотерапия.
Приведет ли лечение ХЛЛ к потере волос?
При использовании большинства современных методов лечения ХЛЛ выпадение волос маловероятно.Возможным исключением может быть более суровая химиотерапия, которая иногда необходима при подготовке к трансплантации стволовых клеток.
Придется ли меня госпитализировать, если я получу лечение ХЛЛ?
Наверное, нет, хотя для некоторых высокоэффективных экспериментальных методов лечения и трансплантации стволовых клеток может потребоваться время в больнице. За этими немногими исключениями, большинство методов лечения ХЛЛ амбулаторно.
Придется ли мне пропускать работу во время лечения ХЛЛ?
Это будет варьироваться от одного лечения к другому и от одного пациента к другому.
Существуют ли комплексные методы лечения, которые используются для лечения или снижения риска ХЛЛ?
Было показано, что активный ингредиент зеленого чая, называемый EGCG, замедляет прогрессирование у некоторых пациентов на ранних стадиях их заболевания. Физические упражнения могут снизить риск развития ХЛЛ, а у людей с более высоким уровнем витамина D в крови на момент постановки диагноза болезнь прогрессирует медленнее. Некоторые доклинические исследования предполагают потенциальную пользу куркумина. Некоторые пациенты сообщили об успешном применении различных методов лечения, таких как традиционная китайская медицина, низкие дозы налтрексона и многие другие методы лечения, но они не были тщательно изучены.Более того, даже методы лечения, которые показывают возможные преимущества в лабораторных исследованиях, могут быть неэффективными с клинической точки зрения. Любую дополнительную альтернативную терапию следует обсудить с вашим врачом.
Кто должен знать, что у меня ХЛЛ?
Кому я должен сказать, что у меня ХЛЛ?
Это личный выбор, и у каждого пациента с ХЛЛ, вероятно, будут свои причины рассказывать или не рассказывать членам семьи, друзьям, деловым партнерам, клиентам и т. Д.
Кому НЕ следует рассказывать о моем ХЛЛ?
Ситуация у всех разная.Сразу после того, как вы узнали, что у вас ХЛЛ, вам, возможно, потребуется сделать глубокий вдох и потратить некоторое время на изучение ХЛЛ, прежде чем рассказывать об этом очень многим другим людям. В конце концов, когда вы лучше поймете болезнь, у вас будет лучшее представление о том, кто в вашей жизни должен и не должен знать о вашем ХЛЛ.
Следует ли мне говорить своим детям, что у меня ХЛЛ?
Конечно, это зависит от ваших детей и их возраста, способности понимать и т. Д. Но поскольку пациенту с ХЛЛ может не потребоваться лечение в течение многих лет, многие родители предпочитают не рассказывать об этом своим детям сразу.
Должен ли я сказать своим клиентам / начальнику / коллегам, что у меня ХЛЛ?
Опять же, это зависит от обстоятельств. Но многие предпочитают не рассказывать об этом своему работодателю или клиентам. Услышав слово «лейкемия», клиент или работодатель может ошибочно предположить, что вы очень скоро заболеете и, следовательно, не сможете работать (что очень редко бывает в случае ХЛЛ).
Общее состояние здоровья и благополучия
Может ли человек с ХЛЛ жить нормальной жизнью?
Обычно ответ да , но, как и все остальное с CLL, это зависит.Это зависит от вашего конкретного случая ХЛЛ, от того, проходите ли вы лечение, есть ли у вас постоянная усталость и т. Д.
Будет ли мой ХЛЛ со временем становиться все хуже и хуже, пока я не стану инвалидом?
Наверное, нет. Если болезнь усугубляется, существует множество вариантов лечения, которые, скорее всего, приведут к ремиссии ХЛЛ.
Следует ли мне принимать специальные витамины и / или пищевые добавки, потому что у меня ХЛЛ?
Вероятно, вам следует принимать витамины и пищевые добавки только в случае их дефицита.Например, если у вас низкий уровень витамина D, вам могут потребоваться добавки. Эту тему следует дополнительно обсудить с врачом.
Должен ли я как пациент с ХЛЛ придерживаться специальной диеты?
По сути, вы должны стремиться к здоровому питанию. Специальной диеты для ХЛЛ нет.
Как мне справиться со страхом и тревогой, которые я чувствую большую часть времени с тех пор, как узнал, что у меня ХЛЛ?
Большинство нормальных людей испытывают разную степень страха и беспокойства, когда им говорят, что у них лейкемия.Но пациенты с ХЛЛ, которые особенно тяжело переживают тревогу и / или депрессию, должны поговорить со своим врачом об этой проблеме. Кроме того, многие пациенты с ХЛЛ считают, что обмен своими проблемами с другими ХЛЛ через онлайн или местные группы поддержки может быть очень хорошим способом научиться справляться с взлетами и падениями жизни с ХЛЛ.
Вызывает ли утомление ХЛЛ?
Утомляемость — обычная жалоба при ХЛЛ, но, с другой стороны, многие пациенты с ХЛЛ никогда не испытывают сильной усталости.Все разные. Некоторые методы лечения могут вызвать усталость.
Нужно ли мне ограничивать (или увеличивать) мои упражнения / активность теперь, когда у меня ХЛЛ?
Большинство пациентов с ХЛЛ смогут продолжить или даже увеличить их обычное количество упражнений после того, как им поставят диагноз ХЛЛ. Однако пациент с утомляемостью, связанной с ХЛЛ, может быть не в состоянии тренироваться так много, как ему хотелось бы. Это будет тема для обсуждения со своим врачом.
Повышает ли меня ХЛЛ риск заражения такими инфекциями, как грипп? Если да, то почему?
Да, пациенты с ХЛЛ подвержены более высокому риску инфекций.Фактически инфекция (обычно пневмония) является наиболее вероятной причиной смерти пациента с ХЛЛ. ХЛЛ ослабляет нашу иммунную систему, поэтому мы не можем противостоять инфекции так же, как люди с нормальной иммунной системой.
Следует ли мне держаться подальше от толпы или принять другие меры предосторожности для здоровья теперь, когда у меня ХЛЛ?
Пациент с ХЛЛ не может жить в пузыре, но пациенту с ХЛЛ необходимо быть более бдительным, чем большинству людей, избегать микробов и инфекций. Нам нужно избегать больных, тщательно мыть руки и подумать о том, чтобы пойти к врачу раньше, чем позже, когда мы почувствуем себя больным или «отключимся».
Следует ли делать прививку от гриппа каждый год?
Да. Из-за ослабленной иммунной системы вакцина против гриппа может принести меньше пользы, чем людям с нормальной иммунной системой. Вакцина от гриппа («прививка», а не назальный спрей) не может повредить нам, потому что инъекция вакцины против гриппа — это убитый вирус, и она просто может помочь.
Следует ли мне делать прививку от опоясывающего лишая?
Старая вакцина против опоясывающего лишая ( Zostavax) — это живая вакцина, и ее НЕ следует вводить людям с ХЛЛ или лицам с ослабленной иммунной системой.Однако новая вакцина Шингрикс — это рекомбинантная (не живая) вакцина, которая намного более эффективна, и ее следует тщательно обсудить с вашей лечащей бригадой. Более подробные сведения о новой вакцине можно найти здесь.
Может ли кто-то с ХЛЛ с большей или меньшей вероятностью заболеть дополнительным раком, например, раком легких или раком кожи?
Те из нас, кто страдает ХЛЛ, более подвержены риску вторичного рака просто потому, что из-за ХЛЛ наша иммунная система не так хороша, как должна быть.Таким образом, пациенты с ХЛЛ должны быть даже более бдительными, чем пациенты без ХЛЛ, когда речь идет о соответствующих проверках и тестах на другие виды рака. Это означает, что маммография, проверка на рак кожи, тесты на уровень ПСА и т. Д. Важны как никогда.
Барб Мэсси, Брайан Коффман и Патти Коффман
Стадии ХЛЛ и объяснение лечения с помощью изображений
ИЗОБРАЖЕНИЙ ПРЕДОСТАВЛЕНЫ:
1) Научный источник
2) Гетти
3) Гетти
4) Гетти
5) Научный источник
6) Научный источник
7) Научный источник
8) Научный источник
9) Гетти
10) Thinkstock
11) Гетти
12) Thinkstock
13) Гетти
14) Гетти
15) Гетти
16) Гетти
17) Гетти
ИСТОЧНИКОВ:
Американское онкологическое общество: «Что такое хронический лимфолейкоз?» «Каким этапом является хронический лимфолейкоз?» «Таргетная терапия хронического лимфоцитарного лейкоза», «Моноклональные антитела против хронического лимфоцитарного лейкоза», «Трансплантация стволовых клеток при хроническом лимфоцитарном лейкозе», «Хирургия хронического лимфоцитарного лейкоза», «Поддерживающая терапия при хроническом лимфолейкозе», Переживший лимфоцитарный лейкоз.«
Национальный институт рака: «Лечение хронического лимфоцитарного лейкоза (PDQ®) — версия для пациентов».
Клиника Мэйо: «Хронический лимфолейкоз».
Общество лейкемии и лимфомы: «Хронический лимфолейкоз», «Стадия ХЛЛ», «Смотри и жди», «Химиотерапия и лекарственная терапия», «Спленэктомия».
UCSF Health: «Хронический лимфолейкоз», «Лечение хронического лимфоцитарного лейкоза».
Хронический лимфолейкоз — симптомы и причины
Обзор
Хронический лимфолейкоз (ХЛЛ) — это тип рака крови и костного мозга — губчатой ткани внутри костей, в которой образуются клетки крови.
Термин «хронический» при хроническом лимфолейкозе исходит из того факта, что он обычно прогрессирует медленнее, чем другие типы лейкемии. Термин «лимфоцитарный» при хроническом лимфолейкозе происходит от клеток, пораженных болезнью — группы белых кровяных телец, называемых лимфоцитами, которые помогают вашему организму бороться с инфекцией.
Хронический лимфолейкоз чаще всего поражает пожилых людей. Существуют методы лечения, которые помогают контролировать болезнь.
Лечение хронического лимфолейкоза в клинике Майо
Товары и услуги
Показать другие товары от Mayo ClinicСимптомы
Многие люди с хроническим лимфолейкозом не имеют ранних симптомов.Те, у кого действительно появляются признаки и симптомы, могут испытывать:
- Увеличенные, но безболезненные лимфатические узлы
- Усталость
- Лихорадка
- Боль в верхней левой части живота, которая может быть вызвана увеличением селезенки
- Ночные поты
- Похудание
- Частые инфекции
Когда обращаться к врачу
Запишитесь на прием к врачу, если у вас есть постоянные признаки и симптомы, которые вас беспокоят.
Причины
Врачи не уверены, что запускает процесс, вызывающий хронический лимфолейкоз.Что известно, так это то, что происходит что-то, что вызывает генетическую мутацию в ДНК кроветворных клеток. Эта мутация заставляет клетки крови производить аномальные, неэффективные лимфоциты.
Помимо того, что эти аномальные лимфоциты неэффективны, они продолжают жить и размножаться, тогда как нормальные лимфоциты умирают. Аномальные лимфоциты накапливаются в крови и некоторых органах, где вызывают осложнения. Они могут вытеснять здоровые клетки из костного мозга и мешать нормальному производству клеток крови.
Врачи и исследователи работают над тем, чтобы понять точный механизм, вызывающий хронический лимфолейкоз.
Факторы риска
Факторы, которые могут увеличить риск хронического лимфолейкоза, включают:
- Ваш возраст. Заболевание чаще всего встречается у пожилых людей. В среднем люди с диагнозом хронический лимфолейкоз находятся в возрасте 70 лет.
- Твоя раса. У белых чаще развивается хронический лимфолейкоз, чем у людей других рас.
- Семейный анамнез рака крови и костного мозга. Семейный анамнез хронического лимфолейкоза или других видов рака крови и костного мозга может увеличить ваш риск.
- Воздействие химикатов. Определенные гербициды и инсектициды, в том числе Agent Orange, использованный во время войны во Вьетнаме, связаны с повышенным риском хронического лимфолейкоза.
Осложнения
Хронический лимфолейкоз может вызывать такие осложнения, как:
- Частые инфекции. Люди с хроническим лимфолейкозом могут часто заражаться. В большинстве случаев эти инфекции являются распространенными инфекциями верхних и нижних дыхательных путей. Но иногда могут развиться более серьезные инфекции.
- Переход к более агрессивной форме рака. У небольшого числа людей с хроническим лимфолейкозом может развиться более агрессивная форма рака, называемая диффузной большой B-клеточной лимфомой. Иногда врачи называют это синдромом Рихтера.
- Повышенный риск других видов рака. Люди с хроническим лимфолейкозом имеют повышенный риск других видов рака, включая рак кожи, такой как меланома, и рак легких и пищеварительного тракта.
- Проблемы с иммунной системой. У небольшого числа людей с хроническим лимфолейкозом может развиться проблема иммунной системы, из-за которой клетки иммунной системы, борющиеся с болезнями, по ошибке атакуют красные кровяные тельца или тромбоциты.
Лечение хронического лимфолейкоза в клинике Мэйо
3 апреля 2019 г.
Показать ссылки- Kaushansky K, et al., Eds. Хронический лимфолейкоз. В: Гематология Вильямса. 9 изд. Нью-Йорк, штат Нью-Йорк: образование McGraw-Hill; 2016. http://www.accessmedicine.mhmedical.com. Проверено 9 августа 2017 г.
- Niederhuber JE, et al., ред. Хронический лимфолейкоз. В: Клиническая онкология Абелова. 5-е изд. Филадельфия, Пенсильвания: Черчилль Ливингстон Эльзевьер; 2014. https://www.clinicalkey.com. Проверено 9 августа 2017 г.
- AskMayoExpert. Хронический лимфолейкоз. Рочестер, Миннесота: Фонд Мейо медицинского образования и исследований; 2017.
- Лечение хронического лимфолейкоза (PDQ). Национальный институт рака. http://www.cancer.gov/types/leukemia/patient/cll-treatment-pdq. По состоянию на 9 августа 2017 г.
- Хронический лимфолейкоз / малый лимфолейкоз. Форт Вашингтон, Пенсильвания: Национальная всеобъемлющая онкологическая сеть. http://www.nccn.org/professionals/physician_gls/f_guidelines.asp. Проверено 9 августа 2017 г.
- Усталость, связанная с раком. Форт Вашингтон, Пенсильвания: Национальная всеобъемлющая онкологическая сеть. http://www.nccn.org/professionals/physician_gls/f_guidelines.asp. Проверено 9 августа 2017 г.
- Shanafelt TD, et al. Испытание фазы 2 ежедневного перорального приема полифенона E у пациентов с бессимптомным хроническим лимфолейкозом стадии 0–2 Rai.Рак. 2013; 119: 363.
- Чай зеленый. Натуральные лекарства. https://naturalmedicines.therapeutresearch.com. Проверено 9 августа 2017 г.
- D’Arena G, et al. Регулирующая модуляция Т-клеток зеленым чаем при хроническом лимфолейкозе. Международный журнал иммунопатологии и фармакологии. 2013; 26: 117.
- CRC сайтов. Консорциум по исследованию хронического лимфоцитарного лейкоза. http://cll.ucsd.edu/sites.html. Проверено 9 августа 2017 г.
- Parihk SA (заключение эксперта).Клиника Мэйо, Рочестер, Миннесота, 3 сентября 2017 г.
- Ding W, et al. Пембролизумаб у пациентов с ХЛЛ и трансформацией Рихтера или с рецидивом ХЛЛ. Кровь. 2017; 26: 3419.
- Shanafelt TD, et al. Опыт гематолога / онколога по конкретным заболеваниям и выживаемость: уроки хронического лимфоцитарного лейкоза (ХЛЛ) / малого лимфоцитарного лейкоза (SLL). Рак. 2012; 118: 1827.
- Warner KJ. Allscripts EPSi. Клиника Мэйо, Рочестер, Миннесота, 15 июня 2017 г.
Связанные
Связанные процедуры
Показать другие связанные процедурыПродукты и услуги
Показать больше продуктов и услуг Mayo ClinicХронический лимфолейкоз
Стадия и прогноз хронического лимфоцитарного лейкоза
Эти тесты часто используются врачами для определения степени прогрессирования хронического лимфолейкоза (ХЛЛ).Это называется стадией и помогает определить прогноз (перспективы) человека и направить лечение.
Подробнее о:
Слушайте наши подкасты о принятии решений о лечении и борьбе с диагнозом рака
Промежуточный CLL
Для CLL обычно используются две промежуточные системы: система Binet и система Rai. В Австралии большинство врачей используют систему Бине.
Ступенчатая система Бине
| стадия A | Имеется большое количество лейкоцитов, но меньше трех увеличенных участков лимфатической ткани (лимфатические узлы, печень и / или селезенка). |
| стадия B | Имеется большое количество лейкоцитов и три или более увеличенных участка лимфатической ткани. |
| стадия C | Существует большое количество лейкоцитов с низким количеством эритроцитов (анемия) и / или тромбоцитов (тромбоцитопения), а также увеличенными лимфатическими узлами или селезенкой. |
Промежуточная система Rai
Система Rai делит ХЛЛ на пять стадий и разделяет эти стадии на группы низкого, среднего и высокого риска.Он используется в основном в США.
Прогноз
Прогноз означает ожидаемый исход болезни. Вам нужно будет обсудить свой прогноз с врачом, который сможет указать вам, на какой стадии лейкемии вы страдаете.
Ни один врач не может знать точное течение вашего заболевания. Однако ваш врач может сказать вам, могут ли какие-либо результаты ваших тестов, особенно генетических или хромосомных, помочь предсказать, как ХЛЛ может реагировать на определенные формы лечения.
Хотя ХЛЛ, как правило, неизлечимое заболевание, перспективы для людей с ХЛЛ постоянно улучшаются. У многих людей ХЛЛ прогрессирует медленно, лечение не требуется, и они живут нормальной жизнью. У других ХЛЛ прогрессирует быстрее, но лечение контролирует ХЛЛ и позволяет им поддерживать хорошее качество жизни в течение многих лет.
Хронический лимфолейкоз, ХЛЛ, лечение ХЛЛ, симптомы ХЛЛ
Существовало общее мнение, что ХЛЛ — это вялотекущее заболевание, связанное с длительным (от 10 до 20 лет) клиническим течением, и что возможной причиной смерти может быть не связаны с ХЛЛ.
Однако это наблюдение верно менее чем для 30 процентов всех случаев ХЛЛ. У некоторых пациентов он может проявляться гораздо более агрессивным заболеванием, при этом симптомы появляются в течение двух-трех лет после постановки диагноза, из-за осложнений или причин, непосредственно связанных с ХЛЛ. Другие пациенты живут от 5 до 10 лет с относительно доброкачественным начальным течением, за которым следует терминальная фаза продолжительностью от одного до двух лет. Во время этой терминальной фазы наблюдается значительная заболеваемость как от самого заболевания, так и от осложнений терапии.
Как отмечалось выше, естественная история ХЛЛ чрезвычайно разнообразна: время выживания от первоначального диагноза колеблется от 2 до 20 лет, а средняя выживаемость составляет приблизительно 10 лет.
Система стадирования Rai основана на концепции, согласно которой при ХЛЛ происходит постепенное и прогрессирующее увеличение содержания лейкозных лимфоцитов в организме, начиная с крови и костного мозга (лимфоцитоз), постепенно поражая лимфатические узлы (лимфаденопатия), селезенку и печень. (органегалия) с возможным нарушением функции костного мозга (анемия и тромбоцитопения).
Здесь доктор Тони Талеби обсуждает общие концепции хронического лимфоцитарного лейкоза (ХЛЛ) с доктором Джозефом Розенблаттом, главой гематологии / онкологии Университета Майами Универсального онкологического центра и всемирно известным экспертом в этой области. Обсуждение включает симптомы, диагноз, генетические последствия, прогноз, аутоиммунные гемолитические анемии, повышенный риск инфекций и химиотерапевтическое лечение хронического лимфолейкоза, прогноз ХЛЛ, причины ХЛЛ, признаки ХЛЛ, симптомы ХЛЛ, ХЛЛ, ХЛЛ стадии 4, лечение ХЛЛ, ассоциация ХЛЛ, четвертая стадия ХЛЛ, мелкоклеточный ХЛЛ, симптомы ХЛЛ, причины ХЛЛ, химиотерапия ХЛЛ, что такое ХЛЛ, ХЛЛ, информация о ХЛЛ, профилактика ХЛЛ, ХЛЛ стадии 4, информация о ХЛЛ, стадия IV ХЛЛ, ХЛЛ признаки, симптом ХЛЛ, излечимость ХЛЛ, ХЛЛ стадии 3b, симптомы рака легких, выживаемость для ХЛЛ, симптомы ХЛЛ, выжившие с ХЛЛ, симптомы ХЛЛ, выживаемость ХЛЛ, лечение ХЛЛ, симптомы ХЛЛ, статистика ХЛЛ, немелкоклеточный ХЛЛ , Химиотерапия при ХЛЛ, выживаемость ХЛЛ, крупноклеточный ХЛЛ, эффекты ХЛЛ, скрининг ХЛЛ, диагностика ХЛЛ, общество ХЛЛ, клинические испытания ХЛЛ, метастазы ХЛЛ, выживаемость ХЛЛ, симптомы ХЛЛ, информация о ХЛЛ, новые методы лечения ХЛЛ, насколько распространен ХЛЛ.
Удостоверение доктора Джозефа Розенблатта.
Профессор гематологии и микробиологии
Заведующий отделением гематологии / онкологии
Сертификаты совета
Американский совет по внутренней медицине
Американский совет по внутренней медицинской онкологии
Места практики
Комплексный онкологический центр им. Сильвестра при Университете Майами
Образование
| UCLA — Медицинский факультет Калифорнийского университета Лос-Анджелес, CA | Стипендия | Гематология-онкология | 1986 |
| UCLA — Калифорнийский университет, медицинский факультет Лос-Анджелес, CA | Резиденция | Медицинский факультет | 1983 |
| UCLA — Калифорнийский университет, медицинский факультет Лос-Анджелес, CA | М. |

 Разработанная в СФУ технология может в дальнейшем использоваться также для выявления других хромосомных аномалий при различных злокачественных новообразованиях.
Разработанная в СФУ технология может в дальнейшем использоваться также для выявления других хромосомных аномалий при различных злокачественных новообразованиях.