НЕПРОСТАЯ ПРОСТУДА | Наука и жизнь
Когда в холодное время года кто-то из наших близких начинает кашлять, мы нередко обращаемся к домашним средствам: в каждой семье есть свои рецепты. Но если домашние средства не помогают и кашель продолжается более двух недель, не стоит экспериментировать и менять одно противокашлевое средство на другое. Нужно вызывать врача. Вполне возможно, что заболевание вызвано болезнетворными микроорганизмами.Бытует мнение, что простуда — заболевание, вызванное переохлаждением организма. Попарился в бане, попил горячего травяного чаю с медом — и недуг пройдет. Однако это не так. В последние десять-пятнадцать лет выяснилось, что простуду могут вызвать микроорганизмы — микоплазмы, хламидии, пневмоцисты. Они настолько малы (даже «по меркам» микроорганизмов), что могут проходить через фильтры, которые не пропускают бактерии других видов. Такие организмы, называемые фильтрующимися, трудно обнаружить обычными способами.
Фильтрующиеся бактерии, если сравнивать их с агрессивным вирусом гриппа, не так заразны и поражают чаще всего детей с ослабленной иммунной системой. В медицинской классификации занимают они промежуточное положение между бактериями, грибами и вирусами. Существовать самостоятельно эти микроорганизмы не могут и обычно паразитируют на клетках организма-хозяина, получая из них питательные вещества. Микоплазмы, например, прикрепляются к клеткам эпителия, выстилающего дыхательный тракт, и вызывают воспалительные заболевания горла, бронхов и легких. Устойчивость этих микроорганизмов во внешней среде невелика, гибнут они быстро. Поэтому заразиться ими можно только при тесном контакте с нездоровым человеком. Дети чаще всего заражаются в детском саду, школе, во дворе, в гостях или дома от постоянно подкашливающей бабушки или сестренки. Насколько интенсивно будет протекать заболевание, зависит от состояния иммунной системы ребенка: «слабые» детишки болеют чаще и тяжелее.
Инфекции начинают «приставать» к детям с двух лет, а иногда и раньше. Может заразиться микоплазмой и хламидиями даже грудной младенец — от инфицированной мамы во время родов. У малыша поражаются бронхи, легкие, возникают воспаления глотки и носа.
Может заразиться микоплазмой и хламидиями даже грудной младенец — от инфицированной мамы во время родов. У малыша поражаются бронхи, легкие, возникают воспаления глотки и носа.
Гораздо чаще встречается у детей микоплазма, реже — пневмоцисты, а иногда микоплазма и пневмоцисты вместе, и тогда у больного ребенка на долгое время повышается температура до 37-38 градусов, он сильно потеет, слабеет и плохо спит, поскольку кашель поднимает его среди ночи.
Порой к этой инфекции присоединяются грибы рода кандиля, они атакуют ослабленный организм и прекрасно «уживаются» рядом с микоплазмой. Обычно «кандидозный» кашель возникает тогда, когда во время простуды ребенка неумеренно или неправильно лечили антибактериальными препаратами, такими как бисептол, бактрим, септрим, ампициллин, ампиокс.
Сотрудники московского Университета дружбы народов, работающие под руководством профессора, доктора медицинских наук Л. Г. Кузьменко, установили, что микоплазма, пневмоциста, хламидии, а также еще один микроорганизм — цитомегаловирус нередко поселяются в организме детей с бронхиальной астмой и астматическим бронхитом. Из-за неправильных диагностики и лечения ребенок может болеть очень долго. Единственный путь — выявить скрытую инфекцию с помощью современных исследований.
Диагностировать микоплазмоз, пневмоцистоз, хламидиоз, кандидоз и цитомегаловирус традиционными методами достаточно сложно. Признаков, характерных только для одного заболевания, нет, а сами микробы настолько малы, что их невозможно обнаружить под обычным микроскопом. В настоящее время на помощь врачам пришел метод полимеразной цепной реакции, открытый в 1985 году американским ученым Кэри Мюллисом, который получил за это открытие Нобелевскую премию. Первое время этот метод использовали для лабораторных исследований в молекулярной биологии и генетике, но через несколько лет благодаря своей простоте и эффективности метод полимеразной цепной реакции (ПЦР) прочно вошел в медицинскую практику.
Менее надежны, чем ПЦР, методы иммунофлуоресценции и иммуноферментный анализ — исследование крови, взятой из вены, позволяющее обнаружить защитные белки — антитела, которые организм вырабатывает в ответ на вторжение возбудителей.
При подозрении на инфекцию приходится сдавать анализы сразу на несколько возбудителей — велика вероятность, что больной заражен не одним из них. К сожалению, сдать анализы методом ПЦР (мазок из зева, мокрота) в районной поликлинике сегодня невозможно — государство пока не располагает средствами, позволяющими делать такие исследования. Но будем надеяться, что новейшие достижения науки скоро войдут в кабинеты самой обычной поликлиники.
КАК ИЗБЕЖАТЬ ПРОСТУДЫ
Чтобы предупредить простудные заболевания, попробуйте принять простые профилактические меры. Они достаточно эффективны, если ваш иммунитет не слишком ослаблен.
•Хорошо провести два-три курса лечения растительными адаптогенами — женьшенем или элеутерококком. Принимать эти препараты нужно утром и днем (по 10 капель взрослым, по 2-5 капель детям, в зависимости от возраста). Вечером, чтобы снять дневное напряжение и подготовиться ко сну, выпейте отвар таких трав, как валерьяна или пустырник. Несмотря на простоту схемы и безопасность этих лекарств, прежде чем принимать их, посоветуйтесь с врачом — он подберет индивидуальные, подходящие именно вам дозы препаратов.
•Чтобы не заболеть во время эпидемии вирусных заболеваний, принимайте витамины и гомеопатические лекарственные средства грипхель, антигриппин, инфлюцид.
•Тем, кто часто болеет отитами, ангинами, бронхитами, следует обратить внимание на препараты, защищающие от стафилококков, стрептококков, гемофильной палочки, клебсиеллы: рибомунил и бронхомунал. Подбор схемы лечения лучше доверить врачу.
Подбор схемы лечения лучше доверить врачу.
•Если в семье кто-то заболел, поставьте в разных местах квартиры блюдечки с мелко нарезанным или давленым чесноком. И еще один простой и эффективный рецепт: положите мелко нарезанный чеснок в предварительно ошпаренный заварочный чайник без воды и подышите 5-10 минут парами через «носик».
•Помогут укрепить защитные силы организма ингаляции противовоспалительными травами (зверобоем, шалфеем, эвкалиптом, травы лучше не смешивать) или прополисом. Можно использовать и готовые препараты: настойку эвкалипта, «Эвкабал», «Доктор MOM», «Бронхикум».
•Хорошим общеукрепляющим действием на организм обладают дрожжевые препараты, например дрожжевой экстракт «Фаворит». Особенно необходимы они весной, когда происходит естественное ослабление иммунитета.
О том, где провести исследования по методу полимеразной цепной реакции (ПЦР) (а также, где это сделать дешевле), можно узнать по телефону (095) 247-88-63.
Наука и жизнь // Иллюстрации
В момент приступа бронхиальной астмы у 60% заболевших детей в мазке с помощью метода полимеразной цепной реакции (ПЦР) была обнаружена микоплазма, у 52% — пневмоциста, у 18% — хламидии и у 10% — цитомегаловирус.
‹
›
Инфекции, передающиеся половым путем | Сеть медицинских центров «ДНК-Диагностика» в Барнауле
Хламидиоз
- АТ двух классов к хламидиям (IgG, IgA)
- АТ трех классов к хламидиям (IgG, IgA, IgM)
- Хламидия (Chlamydia trahomatis) методом ПЦР
- Комплекс АТ к хламидии трахоматис (АТ к хламидиям IgA, АТ к хламидиям IgG, АТ к белку HSP60)
Микоплазмоз/уреаплазмоз
- Уреаплазма (Ureaplasma spp.) методом ПЦР
- Биовары уреаплазмы (Ureaplasma urealyticum / Ureaplasma parvum) методом ПЦР
- Количественное определение ДНК Ureaplasma parvum
- Количественное определение ДНК Ureaplasma urealyticum
- Микоплазма хоминис (Mycoplasma hominis) методом ПЦР
- Микоплазма гениталиум (Mycoplasma genitalium) методом ПЦР
Гонорея
- Гонококк (Neisseria gonorrhoeae) методом ПЦР
Трихомониаз
- Трихомонада (Trichomonas vaginalis) методом ПЦР
Кандидоз (молочница)
- Кандида (Candida albicans) методом ПЦР
- ПЦР комплекс «Дифференциальная диагностика кандид» (общая ДНК грибов, Candida: albicans, glabrata, krusei)
- ПЦР комплекс «Расширенная дифференциальная диагностика кандид» (общая ДНК грибов, Candida: albicans, glabrata, krusei, parapsilosis, guilliermondii, famata, tropicalis)
Инфекции, вызванные вирусом папилломы человека (ВПЧ)
- Скрининг ВПЧ высокого риска (типы 16, 18, 31, 33, 35, 39, 45, 52, 58, 59, 67) методом ПЦР
- Количественный скрининг ВПЧ высокого риска (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) методом ПЦР
- Количественное определение ВПЧ 16 и 18 типов методом ПЦР
- ВПЧ 16 и 18 типов методом ПЦР
- ВПЧ 31 и 33 типов методом ПЦР
- ВПЧ 6 и 11 типов методом ПЦР
- Короткое типирование ВПЧ (типы 6, 11, 16, 18, 31, 33) методом ПЦР
- Качественное типирование ДНК ВПЧ-12 (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59), качественное
- Количественное типирование ДНК ВПЧ-12 (типы 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59)
- Количественное типирование ВПЧ-квант-21 (типы низкого (6, 11, 44) и высокого (16, 18, 26, 31, 33, 35, 39, 45, 51, 52, 53, 56, 58, 59, 66, 68, 73, 82) онкогенного риска) методом ПЦР
Герпесвирусные инфекции
- АТ + авидность IgG к вирусу простого герпеса 1/2 типов
- АТ к вирусу простого герпеса 1 и 2 типов IgG/IgM
- АТ + авидность IgG к вирусу генитального герпеса 2 типа (для взрослых пациентов)
- Вирус простого герпеса 1/2 типов методом ПЦР
- Раздельное выявление вируса простого герпеса 1 и 2 типов методом ПЦР
Цитомегаловирусная инфекция
- АТ к цитомегаловирусу, колич.
 IgG/кач. IgM
IgG/кач. IgM - АТ + авидность IgG к цитомегаловирусу
- Цитомегаловирус методом ПЦР
Бактериальный вагиноз
- Гарднерелла (Gardnerella vaginalis) методом ПЦР
- Мобилункус (Mobiluncus curtisii) методом ПЦР
- Бактероиды (Prevotella spp.) методом ПЦР
- Атопобиум (Atopobium vaginae) методом ПЦР
- ПЦР при бактериальном вагинозе («Флороценоз. Бактериальный вагиноз» (общая бактериальная масса, лактобактерии, гарднерелла, атопобиум), биовары уреаплазмы, бактероиды, мобилункус)
- ПЦР комплекс «Флороценоз. Бактериальный вагиноз» (общая бактериальная масса, лактобактерии, гарднерелла, атопобиум)
- ПЦР-профили оценки биоценоза влагалища
Неспецифические воспалительные процессы
- Посев мочи на уропатогенную флору
- Посев из цервикального канала и влагалища на флору
- Посев из уретры у мужчин на флору
Профили ПЦР-исследований
- ПЦР комплекс ХУМГар (Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis, Gardnerella vaginalis)
- ПЦР комплекс ХУМген (Chlamydia trachomatis, Ureaplasma spp., Mycoplasma genitalium)
- ПЦР комплекс ХУМ (Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis)
- ПЦР комплекс ХУММ (Chlamydia trachomatis, Ureaplasma spp., Mycoplasma hominis, Mycoplasma genitalium)
- ПЦР комплекс «Генитальные патогены» (Trichomonas vaginalis, Chlamydia trachomatis, гонококк Neisseria gonorrhoeae, Mycoplasma genitalium)
- ПЦР комплекс «Условно-патогенная флора полный» (кишечная палочка Escherichia coli, энтеробактер Enterobacter spp., энтерококк Enterococcus faecalis + Enterococcus faecium, протей Proteus spp., стрептококки Streptococcus spp., золотистый стафилококк Staphylococcus aureus, кандида Candida albicans, синегнойная палочка Pseudomonas aeruginosa)
- ПЦР комплекс «Условно-патогенная флора стандартный» (кишечная палочка Escherichia coli, энтерококк Enterococcus faecalis + Enterococcus faecium, протей Proteus spp.
 А.В. Аверьянов
А.В. АверьяновКлиническая больница № 83 ФМБА России, г. Москва
В статье представлен обзор роли микоплазм (Mycoplasma pneumoniae) и хламидий (Chlamydophila pneumoniae) при патологии нижних дыхательных путей — внебольничной пневмонии, бронхиальной астме и хронической обструктивной болезни легких. Рассмотрены механизмы участия микоплазм и хламидий в патогенезе этих заболеваний, особенности диагностики данных инфекций и подходы к антибактериальной терапии.
Ключевые слова: микоплазмы, хламидии, внебольничная пневмония, бронхиальная астма, хроническая обструктивная болезнь легких, диагностика, лечение, антибактериальные препараты.
Микоплазмы (Mycoplasma pneumoniae) и хламидии (Chlamydophila pneumoniae) относятся наряду с пневмококком, гемо-фильной палочкой и вирусами к числу наиболее распространенных респираторных патогенов, вызывающих острые заболевания нижних дыхательных путей. Кроме того, данные микроорганизмы нередко вмешиваются в течение хронических заболеваний органов дыхания, таких как бронхиальная астма (БА) и хроническая обструктивная болезнь легких (ХОБЛ). С. pneumoniae и M. pneumoniae нередко называют “атипичными” возбудителями, имея в виду свойства, отличающие их от большинства бактериальных респираторных патогенов:
• отсутствие роста на стандартных питательных средах;
• внутриклеточная локализация;
• способность к длительной персистенции в организме человека;
• устойчивость к Р-лактамным антибиотикам.
Интересна история изучения респираторных видов микоплазм и хламидий.
Контактная информация: Аверьянов Александр Вячеславович, averyanovav@mail.
 ru
ruВ 1929—1930 годах в мире наблюдались вспышки тяжело протекавшей пневмонии после контактов с птицами. Coles и Lillie удалось тогда выделить в легочной ткани у больных людей и у птиц-переносчиков характерные внутриклеточные колонии неизвестных микроорганизмов. Заболевание получило название орнитоза, а его возбудитель был похож на Chlamydozoa, обнаруженный на 20 лет ранее в конъюнктиве больных трахомой (L. Halberstaedter и S. von Prowazek). Термин “Chlamydia” был введен в 1945 г. и стал общепризнанным для обозначения семейства микроорганизмов. До начала 1980-х годов актуальными для патологии человека считались лишь Chlamydia trachomatis, вызывающая воспалительные поражения глаз и органов мочеполовой системы, и Chlamydia psittaci, являющаяся возбудителем орни-тоза (пситтакоза). Однако в 1983—1985 годах в США при вспышках фарингита в мазках из зева пациентов были обнаружены хламидиеподобные микроорганизмы. Этот вид получил название TWAR (Taiwan Acute Respiratory), поскольку ранее он уже был выделен из конъюнктивы у детей на Тайване, но не считался в то время виру-
Хламидийная и микоплазмеииая инфекция
лентным. В 1989 г. этот вид был переименован в Chlamydia pneumoniae, а с 1999 г., после введения новой таксономической классификации хламидий, отнесен к роду Chlamydophila.
Mycoplasma pneumoniae впервые была выделена M. Eaton в 1944 г. из мокроты у больных пневмонией, которая протекала существенно легче, чем пневмококковая, со скудной аускультативной и рентгенологической симптоматикой, что позволило назвать ее “атипичной”. Около 20 лет микроорганизм (отнесенный тогда к вирусам) носил название агента Итона, пока L. Hayflick не удалось культивировать его в лабораторных условиях и идентифицировать его как микоплазму с присвоением современного названия (Mycoplasma pneumoniae).

мо учитывать при назначении антибактериальной терапии, продолжительность которой должна составлять не менее 2 циклов, т.е. не менее 6 дней.
У микоплазм отсутствует ригидная клеточная оболочка, что обусловливает полиморфизм сероваров и устойчивость к антибактериальным препаратам, подавляющим синтез клеточной стенки. Микоплазмы выступают как мембранные паразиты, связываясь со стенкой клеток хозяина и “маскируясь” под ее антигенный состав, что позволяет избегать активной иммунной реакции и способствует малосимптомному и персистирующему течению инфекционного процесса. По тем же причинам невозможно создание эффективных антимико-плазменных вакцин.
Особенности возбудителей
Хламидии имеют уникальный, отличный от остальных бактерий цикл развития. Они являются облигатными внутриклеточными паразитами, существующими за счет энергии клеток хозяина. Две основные, переходящие друг в друга формы существования хламидий: элементарные тельца (ЭТ) и ретикулярные тельца (РТ). Элементарные тельца более мелкие (0,25—0,35 мкм), они обладают инфекционными свойствами, способны передаваться от одного хозяина к другому, проникать в клетку, но не могут самостоятельно размножаться. Кроме того, в отличие от РТ они нечувствительны к антибиотикам. Попадая в клетку, ЭТ преобразуются в РТ, которые начинают расти и размножаться. В процессе созревания из РТ образуется множество новых ЭТ. При высвобождении ЭТ из клетки происходит ее разрушение, и в таком случае развивается местная воспалительная реакция. Хламидии могут покидать клетку и без повреждения клеточной стенки — путем экзоцитоза, при этом возможно бессимптомное течение инфекции. Полный цикл развития хламидий занимает 48—72 ч, что необходи-
Диагностика
Диагностика “атипичных” возбудителей при патологии органов дыхания представляет собой непростую задачу не только из-за ограниченной доступности методов, но и из-за проблемы интерпретации полученных результатов.

Культуральный метод диагностики хла-мидийных и микоплазменных инфекций ценен тем, что позволяет определять присутствие жизнеспособных микроорганизмов. Практического применения он, однако, не находит из-за необходимости создания особых условий культивирования, сложности, дороговизны, больших затрат времени и труда.
Значительно более распространены им-муноферментные методы выявления в сыворотке крови видоспецифических иммуноглобулинов (Ig) классов A, M и G к С. pneumoniae и M. pneumoniae. В случаях острой инфекции (например, пневмонии) эти методы достаточно надежны. При длительном персистировании микроорганизмов чувствительность серодиагностики значительно снижается, а оценка результатов затруднена. Диагностические титры для хла-
мидийной инфекции составляют для IgG >1 : 512, для IgM >1 : 16. Для M. pneumoniae диагностические титры IgM различаются в зависимости от производителя тест-системы. Нужно учитывать, что выработка IgM в ответ на микоплазменную инфекцию нередко запаздывает, особенно у пожилых пациентов, поэтому отрицательный результат в первую неделю заболевания полностью не исключает микоплазменную этиологию пневмонии.
Еще одним иммунологическим методом диагностики хламидийных и микоплаз-менных инфекций является реакция иммунофлюоресценции (РИФ). Метод основан на обработке клеточного материала, полученного у больного, реагентами, содержащими моноклональные антитела к антигенам хламидий или микоплазм с флюоресцентными метками. Чувствительность метода напрямую зависит от количества микроорганизмов в исследуемом образце, поэтому РИФ находит широкое применение в гинекологической и офтальмологической практике, где легко получить мазок или соскоб со слизистой оболочки. Присутствие микоплазм и хламидий в эпителии задней стенки глотки не может служить безусловным доказательством их роли в инфекционном процессе в нижних дыхательных путях.
 При исследовании же мокроты значительно возрастает вероятность ложноотрицательных результатов РИФ из-за бедности клеточного состава мокроты.
При исследовании же мокроты значительно возрастает вероятность ложноотрицательных результатов РИФ из-за бедности клеточного состава мокроты.Большие надежды возлагались на внедрение в клиническую практику молекулярно-биологических методов диагностики “атипичных” возбудителей, преимуществом которых является очень высокая чувствительность. Однако положительные результаты полимеразной цепной реакции (ПЦР) свидетельствуют лишь о присутствии данного генетического материала в исследуемом субстрате, а вопрос о жизнеспособности микроорганизма остается открытым. Даже после гибели возбудителей “обломки” их ДНК могут выделяться с мо-
кротой в течение нескольких месяцев. Наконец, положительная ПЦР в мазке со слизистой оболочки носа или задней стенки глотки может свидетельствовать о хронической колонизации, а не об инфекционном процессе.
Таким образом, каждый из методов диагностики “атипичных” возбудителей имеет свои преимущества и недостатки. Некоторые авторы считают, что достоверный диагноз хламидиоза и микоплазмоза возможен лишь при подтверждении двумя различными методами.
Оценка роли “атипичных” возбудителей в патогенезе воспалительных заболеваний дыхательных путей затрудняется недостаточной чувствительностью и специфичностью, а нередко и противоречивостью результатов распространенных методов диагностики. В одной из работ среди 55 обследованных больных БА у 18 присутствовали серологические доказательства инфекции C. рneumoniae, у 7 — положительные данные ПЦР (причем только у 3 пациентов оба метода дали положительный результат), однако культуральный метод не обнаружил роста хламидий ни в одном случае. В другом исследовании среди 306 больных вне-больничной пневмонией (ВП), вызванной М. рneumoniae, диагностический уровень IgM определялся у 204 пациентов, ПЦР была позитивной в 148 случаях, и только у 46 больных оба теста были положительными одновременно.

Клиническое значение
Проведенные в течение последних лет исследования свидетельствуют о прямом или косвенном участии M. pneumoniae и C. pneumoniae в развитии острых (синусит, фарингит, бронхит, пневмония) и хронических (БА и ХОБЛ) заболеваний дыхательных путей, а также разнообразной внелегочной патологии. С инфекцией C. pneumoniae могут быть ассоциированы следующие внелегочные заболевания: ате-
росклероз, болезнь Альцгеймера, рассеянный склероз, с M. pneumoniae — энцефалит, менингит, артрит, миокардит, перикардит, дерматиты, гломерулонефрит, конъюнктивит, ретинит, отит, гемолитическая анемия. Для микоплазм более свойственно развитие острых воспалительных и аутоиммунных реакций, тогда как хлами-дийная инфекция ассоциируется преимущественно с хроническими процессами.
Пневмония
С. pneumoniae и M. pneumoniae в этиологическом спектре внебольничных пневмоний занимают второе место после S. pneumoniae, а у пациентов с ВП, которым не требуется госпитализация, “атипичные” микроорганизмы лидируют среди всех возбудителей. Несмотря на объективные трудности в диагностике, M. pneumoniae удается выделить у 6—34% больных ВП, С. pneumoniae — у 1—22%.
Традиционно считается, что хламидий-ные и микоплазменные пневмонии отличаются более легким течением и благоприятным прогнозом. В масштабном (n = 4532) исследовании CAPNETZ (2009) обнаружено, что пациенты с ВП, вызванной M. pneumoniae, в среднем были моложе (41 и 62 года), имели меньше сопутствующих заболеваний и менее значительный воспалительный ответ (лейкоцитоз и уровень С-реактивного белка в плазме) по сравнению с больными, у которых пневмония была вызвана другими возбудителями. При микоплазменной пневмонии наблюдались более короткие сроки пребывания в стационаре (9 и 14 дней) и меньшая летальность (0,7 и 8,7%).
 Однако было бы ошибкой считать, что “атипичные” возбудители вызывают только нетяжелые пневмонии. При возникновении тяжелых пневмоний у пожилых больных и лиц с хроническими сердечно-легочными заболеваниями С. pneu-moniaе обнаруживается с той же частотой, что и пневмококк. От 3 до 10% пациентов с
Однако было бы ошибкой считать, что “атипичные” возбудители вызывают только нетяжелые пневмонии. При возникновении тяжелых пневмоний у пожилых больных и лиц с хроническими сердечно-легочными заболеваниями С. pneu-moniaе обнаруживается с той же частотой, что и пневмококк. От 3 до 10% пациентов сРис. 1. Микоплазменная пневмония. Рентгенография грудной клетки пациента (имеется усиление легочного рисунка, инфильтратив-ные изменения не визуализируются).
микоплазменной пневмонией имеют массивное поражение легких (целая доля и более), причем M. pneumoniae может вызвать тяжелое течение ВП с летальным исходом даже у практически здоровых лиц. Особенно опасна микоплазменная пневмония для пациентов с тяжелыми иммунодефицитами, когда заболевание быстро прогрессирует с развитием острой дыхательной недостаточности и поражением других органов.
Рентгенологическая симптоматика мико-плазменных и хламидийных пневмоний имеет определенные особенности. В 10—20% случаев воспалительные изменения в ткани легких невозможно визуализировать на обычных рентгенограммах. Для “атипичных” пневмоний в отличие от пневмококковых характерно утолщение сосудистобронхиальных пучков с перибронхиальны-ми и внутридольковыми узелковыми инфильтратами по данным компьютерной томографии (КТ). Для хламидийных пневмоний типична сетчатая или тонкая линейная инфильтрация, а для микоплаз-менных — сопутствующая внутригрудная лимфаденопатия (рис. 1, 2). Таким образом, рентгенологический диагноз “атипичных” пневмоний труден и часто требу-
Рис. 2. Микоплазменная пневмония. Компьютерная томография легких того же пациента (двусторонние линейные и очаговые перибронхиальные инфильтраты, характерные для “атипичных” пневмоний).
ет применения дополнительных методов лучевой диагностики.

Клиническая картина ВП, вызванных С. pneumoniae и M. pneumoniae, обычно выражена менее ярко, чем в случае других возбудителей. Как правило, пневмонии предшествуют явления фарингита. Среди сопутствующих симптомов часто встречаются миалгии, артралгии, головная боль, тошнота, диарея. Затяжное течение пневмонии, длительное сохранение остаточных симптомов в виде субфебрильной лихорадки, кашля, недомогания часто становятся следствием персистенции внутриклеточных возбудителей.
Бронхиальная астма
Хотя инфекционно-зависимые механизмы развития БА не рассматриваются в настоящее время как доминирующие, нельзя
отрицать их роль в контексте “атипичных” возбудителей. Б одной из первых работ, посвященных данной проблеме, была показана роль острой инфекции C. pneumoniae в дебюте БА и возникновении бронхиальной обструкции у больных бронхитом. Б дальнейшем были получены многочисленные доказательства участия C. pneumoniae (и в меньшей степени M. pneumoniae) в развитии обострений БА, а также значительного влияния этих возбудителей на клиническую картину и характер течения болезни в случае их персистенции.
При обследовании школьников, страдающих БА, выяснилось, что у детей с частыми обострениями БА (>4 в год) уровень секреторного IgA к C. pneumoniae был почти в 7 раз выше, чем у детей с редкими обострениями (Cunningham A. et al.). При этом значимых различий между периодами обостре-
Хламидийная и микоплазменная инфекция
углубленной диагностики хламидийной и
ния и ремиссии по частоте выявления хла-мидий (методом ПЦР в назальном аспирате) получено не было. Эти данные свидетельствуют о преимущественной роли пер-систирующей, нежели острой хламидий-ной инфекции в рецидивировании симптомов БА.
 В исследовании P.N. Black et al. уровень антител к C. pneumoniae коррелировал с тяжестью течения БА, находясь в прямой зависимости с частотой и выраженностью симптомов и в обратной — с объемом форсированного выдоха за 1-ю секунду (ОФВ1). Одно из последних опубликованных исследований по обсуждаемой проблеме (Cosentini R. et al.) подтвердило высокую распространенность (38%) острого респираторного хламидиоза и микоплаз-моза у больных с тяжелым обострением БА: у этих пациентов в 87% случаев выявлялась C. pneumoniae, в 9% — в M. pneumoniae и в 4% — оба микроорганизма.
В исследовании P.N. Black et al. уровень антител к C. pneumoniae коррелировал с тяжестью течения БА, находясь в прямой зависимости с частотой и выраженностью симптомов и в обратной — с объемом форсированного выдоха за 1-ю секунду (ОФВ1). Одно из последних опубликованных исследований по обсуждаемой проблеме (Cosentini R. et al.) подтвердило высокую распространенность (38%) острого респираторного хламидиоза и микоплаз-моза у больных с тяжелым обострением БА: у этих пациентов в 87% случаев выявлялась C. pneumoniae, в 9% — в M. pneumoniae и в 4% — оба микроорганизма.Еще одним доказательством участия C. pneumoniae и M. pneumoniae в патогенезе БА служит положительный эффект, оказываемый макролидными антибиотиками на симптомы БА и маркеры эозинофильного воспаления у лиц с подтвержденной инфекцией (в том числе по данным Кокра-новского систематического обзора). Так, терапия кларитромицином в течение 6 нед у больных БА с подтвержденной методом ПЦР инфекцией M. pneumoniae и C. pneumoniae привела к достоверному улучшению ОФВ1. В группе с отрицательной ПЦР к данным возбудителям, как и в группе, получавшей плацебо, динамики ОФВ1 не наблюдалось. В исследовании D.L. Hahn et al. пациенты с персистирующей БА и диагностическим титром антител к C. pneumoniae получали азитромицин (по 500 мг/сут в первые 3 дня, затем по 500 мг 1 раз в неделю в течение 5 нед), результатом чего стало уменьшение или полное исчезновение симптомов БА.
Логичным выводом из этих данных являются рекомендации о необходимости
микоплазменной инфекции у лиц, страдающих БА, прежде всего в случаях тяжелого течения или частых обострений БА. Хотя антибактериальная терапия не входит в стандарты лечения больных БА, при обнаружении этих возбудителей показано лечение препаратами первой линии, к которым относятся современные макролиды — ази-тромицин и кларитромицин.

ХОБЛ
Роль “атипичных” возбудителей при обострениях ХОБЛ, по-видимому, не так велика, как Н. influenzae и S. pneumoniae. Тем не менее данная группа патогенов самостоятельно или в комбинации с другими микроорганизмами вызывает обострения ХОБЛ не столь уж редко — от 4 до 34% случаев (преобладает С. pneumoniae).
В ряде работ получены данные о влиянии персистирующей хламидийной инфекции на течение ХОБЛ. В исследовании F. Blasi et al. было доказано, что частота выявления хламидий коррелирует с тяжестью обструкции у больных ХОБЛ, а частота обострений ХОБЛ за 2 года наблюдения у пациентов с положительной ПЦР на хла-мидии была значительно выше, чем у ПЦР-негативных пациентов (2,03 против 1,43 обострения). При проспективном 5-летнем наблюдении за больными ХОБЛ, у которых имелись диагностические титры антител к С. pneumoniaе, изучалось влияние инфекционного фактора на прогрессирование заболевания. Средний уровень IgG к С. pneumoniaе (1 : 32—1 : 64) коррелировал с более медленным снижением ОФВ1, в то время как уровень IgA >1 : 16 (признак хронической инфекции) ассоциировался с более быстрым его снижением. По-видимому, частые обострения ХОБЛ также могут быть связаны с персистенцией внутриклеточных возбудителей: в нашем исследовании среди больных ХОБЛ среднетяжелого течения, у которых возникало
>3 обострений в год, диагностические титры IgG к C. pneumoniae наблюдались в 71% случаев.
Проведя электронно-микроскопические исследования резецированной легочной ткани у оперированных больных с эмфиземой, морфологи из Германии в большинстве образцов обнаружили в участках паренхиматозной деструкции элементарные тельца хламидий. Эти данные согласуются с результатами работ, которые свидетельствуют о влиянии хламидийных антигенов на выработку альвеолярными макрофагами матриксных металлопротеиназ — ферментов, играющих важную роль в развитии эмфиземы.

Патогенетические механизмы участия C. pneumoniae и M. pneumoniae в прогрессировании ХОБЛ и БА окончательно не установлены, однако известно, что инфицирование этими внутриклеточными возбудителями приводит к повышению уровней цитокинов: интерлейкинов 1, 8 и 10, фактора некроза опухоли а, у-интерферо-на. Эта реакция иммунной системы направлена на подавление острой инфекции, однако не всегда она приводит к успеху из-за “ускользания” возбудителя внутрь клетки. Длительная персистенция хлами-дий, имеющих поверхностный антиген — белок теплового шока, приводит к постоянной стимуляции моноцитов и макрофагов и непрерывной экспрессии цитокинов, являющихся патогенетическими факторами воспалительного процесса при БА и ХОБЛ.
Еще одним возможным механизмом прогрессирования хронических обструк-тивных болезней легких может быть влияние C. pneumoniae на цилиарную активность. Заражение реснитчатых эпителиальных клеток культурой С. рneumoniae приводило к достоверному замедлению движения ресничек, в то время как C. trachomatis такого эффекта не оказывала.
M. рneumoniae обладает свойствами молекулярной мимикрии. Ее адгезивные бел-
ки и глицерофосфолипиды могут служить триггерами аутоиммунных реакций против миозина, кератина, фибриногена, тканей легких и мозга. Примерно в 50% случаев острой микоплазменной инфекции в организме человека формируются IgM против антигена I эритроцитов, циркулирующие в крови несколько недель.
Лечение
Всего несколько групп антибактериальных препаратов используются для лечения заболеваний, вызываемых С. pneumoniae и M. pneumoniae, — это тетрациклины, мак-ролиды (и близкие к ним кетолиды) и фторхинолоны.
Тетрациклины применялись для лечения заболеваний, вызванных “атипичными” возбудителями, с момента появления этих антибактериальных препаратов, преимущественно при трахоме и поражениях урогенитального тракта.
 В настоящее время из-за частых нежелательных эффектов их применение минимизировано, а в качестве препарата резерва свое значение сохраняет лишь доксициклин.
В настоящее время из-за частых нежелательных эффектов их применение минимизировано, а в качестве препарата резерва свое значение сохраняет лишь доксициклин.Среди фторхинолонов наиболее эффективен против С. pneumoniae и M. pneumoniae моксифлоксацин, а менее активны препараты II поколения — ципрофлокса-цин и офлоксацин. Фторхинолоны остаются препаратами второй линии при “атипичных” инфекциях, но их назначение возможно только у взрослых и подростков с 14-летнего возраста.
Антибиотиками выбора для лечения респираторных заболеваний, вызванных хла-мидиями и микоплазмами, в последние годы считаются современные 14- и 15-членные макролиды (азитромицин, кларитро-мицин). Это обусловлено не только их высокой активностью в отношении микоплазм и хламидий, но также хорошей переносимостью, наличием иммуномодулирующих и противовоспалительных эффектов
Хламидийная и микоплазменная инфекция
и возможностью безопасного назначения длительных курсов.
Использование Р-лактамов в качестве препаратов первой линии у больных ВП может быть неэффективным из-за ее “атипичной” этиологии. Кроме того, необходимо помнить, что в случае пневмонии тяжелого течения обязательным является применение препаратов, активных против Legionella pneumophila, — современных макролидов или “респираторных” фтор-хинолонов.
В 2009 г. опубликованы результаты экспериментального исследования, показавшего, что в случае пневмоний, развивающихся на фоне гриппа, где, казалось бы, “атипичные” возбудители неактуальны, назначение макролидов может быть более эффективным, чем Р-лактамов. A. Karlstrom etal., применяя ампициллин, клиндами-цин и азитромицин у мышей, зараженных вирусом гриппа, у которых развилась пневмококковая пневмония, установили, что выживаемость была максимальной в группе азитромицина (92%), в группе клиндамицина — 82%, а при терапии ампициллином выжили только 56% особей.
 Авторы предположили, что разрушение клеточной стенки микроорганизма препаратами пенициллинового ряда ведет к временному усилению системной воспалительной реакции, которая, суммируясь с токсическими эффектами гриппа, приводит к летальному исходу.
Авторы предположили, что разрушение клеточной стенки микроорганизма препаратами пенициллинового ряда ведет к временному усилению системной воспалительной реакции, которая, суммируясь с токсическими эффектами гриппа, приводит к летальному исходу.Продолжительность курса лечения определяется конкретной клинической ситуацией, но в любом случае назначение множества сменяющих друг друга антибиотиков и иммуномодуляторов (особенно широко распространенное в гинекологической практике) при респираторной патологии не является обоснованным.
Довольно долго считалось, что при вне-больничной пневмонии, вызванной “атипичными” возбудителями, длительность антибактериальной терапии должна состав-
лять не менее 14 дней. Однако в ряде исследований было подтверждено, что частота выздоровления при ВП микоплазменной и хламидийной этиологии близка к 100% при использовании 10-дневного курса клари-тромицина, эритромицина или мокси-флоксацина либо 5-дневного курса азитро-мицина. При нетяжелых ВП эффективны 7-дневные курсы левофлоксацина или мок-сифлоксацина. В связи с этим клинические рекомендации Американского торакального общества (2007) уже не содержат жестких сроков антибактериальной терапии “атипичных” пневмоний, а предлагают продолжать лечение в течение 48—72 ч после достижения клинического улучшения и нормализации температуры тела. Тем не менее курс лечения в любом случае должен перекрывать 2 жизненных цикла хламидий, т.е. продолжаться не менее 6—7 дней (3 дней для азитромицина).
В лечении инфекционного обострения ХОБЛ, когда вероятны «атипичные» возбудители (нетяжелое обострение с падением ОФВХ не ниже 50% от должного), используются те же препараты, что и при ВП. При этом из числа макролидов рекомендуются лишь азитромицин и кларитромицин, активные не только против хламидий и микоплазм, но и наиболее частого патогена при обострениях ХОБЛ — H.
 influenzae.
influenzae.В последние годы опубликованы результаты исследований, позволяющие предположить, что 14- и 15-членные макролиды могут быть полезны при ХОБЛ не только благодаря их антибактериальному действию, но и за счет их противовоспалительных и иммуномодулирующих эффектов, которые проявляются при длительном приеме субтерапевтических доз. В рандомизированном исследовании T.A. Seemungal et al. показано достоверное снижение частоты тяжелых и среднетяжелых обострений ХОБЛ при 12-месячном приеме эритромицина в дозе 250 мг 2 раза в день по сравнению с плацебо. У больных ХОБЛ с часто——————-Лечебное дело 4.2009
той обострений более 5 раз в год доказано достоверное уменьшение числа обострений и госпитализаций по сравнению с контролем в группе, получавшей азитромицин 3-дневными курсами через каждые 3 нед в течение 9 мес (Gomez J. et al.).
Макролиды подавляют миграцию лимфоцитов и нейтрофилов в ткани, усиливают их апоптоз и уменьшают экспрессию цитокинов, что приводит к торможению воспалительного ответа в бронхиальном дереве. Важнейшим свойством азитроми-цина как представителя 15-членных макро-лидов следует признать его элиминацион-ный эффект в отношении P. aeruginosa. Азитромицин не оказывает прямого антибактериального действия на синегнойную палочку, однако его субтерапевтические концентрации уменьшают адгезивные свойства и разрушают биопленки P. aeruginosa, которые ответственны за хроническую колонизацию дыхательных путей и неэффективность антибактериальных препаратов. Поскольку бронхоэктазы (главный фактор риска колонизации P. aeruginosa) встречаются примерно у трети больных ХОБЛ, становится понятным еще один механизм профилактического эффекта длительных курсов макролидов. Дополнительным полезным свойством азитромицина, кларитромицина и телитромицина является их подавляющее влияние на продукцию муцина, стимулированную С.
 pneumoniae.
pneumoniae.Одним из аргументов против эмпирического назначения макролидов в случаях, когда вероятна как “атипичная”, так и пневмококковая этиология заболевания, является возможная устойчивость возбудителя к Р-лактамам и макролидам. Проблема резистентности S. pneumoniae к макроли-дам, в частности азитромицину, вносит определенные ограничения в их назначение в странах Западной Европы, где уровень резистентности пневмококка достигает 40% и более. В России данная проблема пока не стоит, тем не менее интересны данные, недавно опубликованные группой японских
авторов (Yanagihara K. et al.). Трехдневный курс лечения азитромицином (500 мг/сут однократно) у больных среднетяжелой вне-больничной пневмонией приводил к клинической (выздоровление) и бактериологической эффективности в 83 и 78% случаев. При этом у пациентов, у которых in vitro имелся высокий уровень устойчивости S. рneumoniae к макролидам, эффективность была такой же, как в группе в целом. Таким образом, лабораторная резистентность не влияла на клиническую эффективность препарата.
Выбор препарата для лечения заболеваний, вызванных или индуцированных “атипичными” возбудителями, не представляет сложной клинической проблемы. В ряду других эффективных антибиотиков особое место занимает азитромицин, который отличают не только высокая активность против большинства респираторных патогенов (S. pneumoniae, H. influenzae, S. aureus, M. catarrhalis, С. pneumoniae и M. pneumoniae), но и противовоспалительные и иммуномодулирующие свойства, а также возможность проведения коротких курсов лечения с доказанной клинической эффективностью и минимумом нежелательных реакций.
Заключение
Несмотря на сравнительно короткую историю изучения роли “атипичных” возбудителей в патологии дыхательных путей, накопилось достаточно данных, чтобы утверждать, что С.
 pneumoniae и M. pneumoniae являются важными этиопатогене-тическими факторами развития и прогрессирования наиболее распространенных болезней органов дыхания. Об этом необходимо помнить практическому врачу, когда он принимает решение о выборе антибактериального препарата или сталкивается с клинической ситуацией, где традиционное лечение (например, БА или ХОБЛ) не приносит ожидаемых результатов.
pneumoniae и M. pneumoniae являются важными этиопатогене-тическими факторами развития и прогрессирования наиболее распространенных болезней органов дыхания. Об этом необходимо помнить практическому врачу, когда он принимает решение о выборе антибактериального препарата или сталкивается с клинической ситуацией, где традиционное лечение (например, БА или ХОБЛ) не приносит ожидаемых результатов.Хламидийная и микоплазменная инфекция
Рекомендуемая литература
Тартаковский И.С. Современные подходы к диагностике атипичных пневмоний // Клин. микробиол. и антимикроб. химиотер. 2000. Т 2. № 1. С. 60-68.
Чучалин А.Г., Синопальников А.И., Чернехов-ская Н.Е. Пневмония. М., 2002.
Black P.N., Scicchitano R, Jenkins C.R. et al. Serological evidence of infection with Chlamydia pneumoniae is related to the severity of asthma // Eur. Respir. J. 2000. V. 15. P. 254-259.
Blasi F. Atypical pathogens and respiratory tract infections // Eur. Respir. J. 2004. V. 24. P. 171-182.
Clyde W.A. Jr. Mycoplasma pneumonaie infections of man // The mycoplasmas. II. Human and animal mycoplasmas / Ed. by J.G. Tully, R.F. Whitcomb. V. II. N.Y.: Academic Press, 1979. P. 275-306.
Cosentini R., Tarsia P., Canetta C. et al. Severe asthma exacerbation: role of acute Chlamydophila pneumonia and Mycoplasma pneumoniae infection // Respir. Res. 2008. V. 9. P. 48.
Erkan L., Uzun O, Findik S. et al. Role of bacteria in acute exacerbations of chronic obstructive pulmonary disease // Int. J. Chron. Obstruct. Pulmon. Dis. 2008. V. 3. № 3. P.
 463-467.
463-467.Gencay M., Rudiger J.J., Tamm M. et al. Increased frequency of Chlamydia pneumoniae antibodies in patients with asthma // Am. J. Respir. Crit. Care Med. 2001. V. 163. P. 1097-1100.
Gomez J, Banos V., Simarro E. et al. Estudio prospective y comparative (1994-1998) sobre la influencia del tratamiento corto profilactico con azitromicina en pacientes con EPOC evolu-cionada // Rev. Esp. Quimioterap. 2000. V. 13. P. 379-383.
Hahn D.L., Plane M.B., Mahdi O.S. et al. Secondary outcomes of a pilot randomized trial of azithromycin treatment for asthma // PLoS Clin. Trials. 2006. V. 1. P. e11.
Karlstrom A., BoydK.L., English B.K., McCullers J.A. Treatment with protein synthesis inhibitors improves outcomes of secondary bacterial pneumonia after influenza // J. Infect. Dis. 2009. V. 199. № 3. P. 311-319.
Karnak D, Beng-sun S., Beder S., Kayacan O. Chlamydia pneumoniae infection and acute
exacerbation of chronic obstructive pulmonary disease (COPD) // Respir. Med. 2001. V. 95. № 10. P. 811-816.
Kobayashi H. Biofilm disease: its clinical manifestation and therapeutic possibilities of macrolides // Am. J. Med. 1995. V. 99. P. 26S-30S.
Kraft M., Cassell G.H., Pak J., Martin R.J. Mycoplasma pneumoniae and Chlamydia pneumoniae in asthma: effect of clarithromycin // Chest. 2002. V. 121. P. 1782-1788.
Labro M.T. Cellular and molecular effects of macrolides on leukocyte function // Curr. Pharm. Des. 2004. V. 10. P. 3067-3080.
Lee P.I., Wu M.H., Huang L.
 M. et al. An open, randomized, comparative study of clarithromycin and erythromycin in the treatment of children with community-acquired pneumonia // J. Microbiol. Immunol. Infect. 2008. V. 41. № 1. P. 54-61.
M. et al. An open, randomized, comparative study of clarithromycin and erythromycin in the treatment of children with community-acquired pneumonia // J. Microbiol. Immunol. Infect. 2008. V. 41. № 1. P. 54-61.Mandell L.A., Wunderink R.G., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society consensus guidelines on the management of community-acquired pneumonia in adults // Clin. Infect. Dis. 2007. V. 44. Suppl. 2. P. S27-S72.
Mason R.J., Murray J.F., Broaddus V.C., Nadel J.A. Textbook of Respiratory Medicine. 4th ed. Philadelphia: Saunders Elsevier, 2005. V. 1. P. 941-943.
Morinaga Y., Yanagihara K., Miyashita N. Azithromycin, clarithromycin and telithromycin inhibit MUC5AC induction by Chlamydophila pneumoniae in airway // Pulm. Pharmacol. Ther. 2009. V. 22. № 6. P. 580-586.
Reittner P., Muller N.L., Heyneman L. et al. Mycoplasma pneumoniae pneumonia: radiographic and high-resolution CT features in 28 patients // Am. J. Roentgenol. 2000. V. 174. P. 37-41.
Richeldi L., Ferrara G., Fabbri L.M. et al. Macrolides for chronic asthma (Cochrane Review) // The Cochrane Library, Issue 1. Oxford: Update Software, 2003.
Seemungal T.A., Wilkinson T.M., Hurst J.R. Longterm erythromycin therapy is associated with decreased chronic obstructive pulmonary disease exacerbations // Am. J. Respir. Crit. Care Med. 2008. V. 178. № 11. P. 1098-1099.
Strachan D.P., Carrington D., Mendall M. et al. Chlamydia pneumoniae serology, lung function
Обзоры
decline and treatment for respiratory disease // Am.
 J. Respir. Crit. Care Med. 2000. V. 161. P 493-497.
J. Respir. Crit. Care Med. 2000. V. 161. P 493-497.Takeoka K., Ichimiya T, Yamasaki T. The in vitro effect of macrolides on the interaction of human polymorphonuclear leukocytes with Pseudomonas aeruginosa in biofilm // Chemotherapy. 1998. V. 44. P. 190-197.
Theegarten D., Mogilevski G., Anhenn O. et al. The role of chlamydia in the pathogenesis of pulmonary emphysema. Electron microscopy and immunofluorescence reveal corresponding findings as in atherosclerosis // Virchows Arch. 2000. V. 437. P. 190-193.
von Baum H., Welte T., Marre R. et al. Mycoplasma pneumoniae pneumonia revisited within the German Competence Network for Community-acquired pneumonia (CAPNETZ) // BMC Infect. Dis. 2009. V. 9. P 62-71.
Waites K., Talkington D. Mycoplasma pneumoniae and its role as a human pathogen // Clin. Microbiol. Rev. 2004. V. 17. № 4. P. 697-728.
Yanagihara K., Izumikawa K., Higa F. et al. Efficacy of azithromycin in the treatment of community-acquired pneumonia, including patients with macrolide-resistant Streptococcus pneumoniae infection // Intern. Med. 2009. V. 48. № 7. P 527-535.
Infection with Chlamydia and Mycoplasma in the Pathology of the Lower Airways A.V. Averyanov
The impact of Mycoplasma pneumoniae and Chlamydophila pneumoniae on pathologies of the lower airways (community-acquired pneumonia, bronchial asthma, chronic obstructive pulmonary disease) is reviewed. Mechanisms of participation of mycoplasma and chlamydia in the pathogenesis of mentioned diseases, special details of diagnostics of infections and approaches to antibacterial therapy are presented.
Key words: mycoplasma, chlamydia, community-acquired pneumonia, bronchial asthma, chronic obstructive pulmonary disease, diagnostics, treatment, antibacterial treatment.

Книги Издательского холдинга “Атмосфера”
Хронические заболевания желчевыводящих путей (автор Р.А. Иванченкова)
В монографии изложено современное состояние проблемы желчеобразования и желчевыделения. Показана роль нарушений процессов желчеобразования и желчевыделения в развитии хронических заболеваний желчного пузыря. Описаны основные механизмы формирования хронического холецистита, желчнокаменной болезни, продемонстрирована определяющая роль липидов крови при формировании желчи. Рассмотрен патогенез такого малоизвестного, но широко распространенного заболевания, как холестероз желчного пузыря. В контексте современной клинической практики обсуждается так называемый постхолецист-эктомический синдром. Особое внимание уделено патофизиологии симптомов и синдромов, патогномоничности биохимических показателей. Приведены дифференциально-диагностические таблицы, изложены новые подходы в лечении желчнокаменной болезни, холестероза желчного пузыря, представлены схемы лечения и обследования больных.
При изложении материала автор использовал в основном результаты собственных исследований, проводившихся в клинике пропедевтики внутренних болезней им. В.Х. Василенко ММА им. И.М. Сеченова на протяжении многих лет. 416 с., ил.
Для клиницистов-гастроэнтерологов, врачей широкого профиля, слушателей ФПК, студентов медицинских вузов.
Информацию по вопросам приобретения книг можно получить на сайте www.atmosphere-ph.ru или по телефону (499) 973-14-16.
Диагностика и лечение микоплазменной и хламидийной пневмоний | #08/04
Cреди всех видов пневмоний практическому врачу наиболее часто приходится сталкиваться с внебольничной пневмонией.
 По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
Наиболее распространенной причиной внебольничных пневмоний является Streptococcus pneumoniae (30–50%) [5, 11, 13]. Однако все большее значение среди этиологических факторов внебольничной пневмонии в последние годы придается так называемым атипичным микроорганизмам, прежде всего Mycoplasma pneumoniae и Chlamydophila (Chlamidia) pneumoniae, на долю которых приходится от 8 до 25% случаев заболевания [5, 9, 12].
Mycoplasma pneumoniae в структуре внебольничных пневмоний варьирует в пределах 5–50% [7, 11, 13]. Наиболее часто микоплазменная пневмония диагностируется у детей старше 5 лет и лиц молодого возраста (до 25 лет) [3, 4, 7, 10]. Каждые 3–5 лет наблюдаются эпидемиологические подъемы заболеваемости, которые длятся несколько месяцев. Вспышки заболевания характерны для изолированных и полуизолированных групп населения (военнослужащие, студенты, школьники и др., семейные вспышки) [10, 11]. Признается наличие сезонных колебаний, а именно большая распространенность инфекции в осенне-зимний период [6, 10, 13]. Источником инфекции являются как больные, так и носители. Механизм передачи инфекции — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период длится 2–3 нед. Летальность при микоплазменной пневмонии составляет 1,4% [4, 11].
Mycoplasma pneumoniae занимает промежуточное положение между вирусами, бактериями и простейшими и является мембрано-ассоциированным (но может быть и внутриклеточным) анаэробом, имеет трехслойную цитоплазматическую мембрану вместо клеточной стенки, что обусловливает резистентность к различным агентам, подавляющим синтез клеточной стенки, прежде всего к пенициллину и другим β-лактамам [6, 10].
 С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
Считается, что от 5 до 15% внебольничных пневмоний вызываются хламидиями, а в период эпидемии эти показатели могут увеличиваться до 25% [4, 5, 10]. Наиболее часто хламидийная пневмония встречается у взрослых, особенно у лиц среднего и пожилого возраста [2, 10]. Описаны эпидемиологические вспышки в изолированных и полуизолированных коллективах, случаи внутрисемейной передачи хламидийной инфекции [7, 10, 13]. Сезонной закономерности распространения этой инфекции не выявлено. Единственным известным резервуаром инфекции является человек. Механизм передачи — аэрогенный, путь передачи — воздушно-капельный. Инкубационный период составляет 2–4 нед. Летальность при хламидийных пневмониях достигает 9,8% [4, 5, 13].
Chlamydophila pneumoniae — это патогенные облигатные внутриклеточные грамотрицательные бактерии, способные к латентному существованию или персистенции в организме хозяина. Характеризуются двухфазным циклом развития, состоящим из чередования функционально и морфологически различных форм — элементарных и ретикулярных телец [2, 4, 7, 10].
Клинические проявления микоплазменнойи хламидийной пневмоний
У 30–40% пациентов, заболевших микоплазменной и/или хламидийной пневмонией, диагноз ставится лишь в конце первой недели болезни; первоначально у них чаще всего ошибочно диагностируются бронхит, трахеит или ОРЗ. Это связано с тем, что, в отличие от бактериальных пневмоний, микоплазменная и хламидийная не имеют отчетливых физикальных и рентгенологических признаков инфильтрации, а культуральная диагностика их невозможна, так как микоплазмы и хламидии являются внутриклеточными возбудителями.
 Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
Обычно микоплазменная и хламидийная пневмонии начинаются с респираторного синдрома, проявляющегося трахеобронхитом, назофарингитом, ларингитом; протекают с субфебрильной температурой, малопродуктивным, мучительным кашлем, скудными аускультативными данными; характеризуются наличием внелегочных проявлений — кожных, суставных, гематологических, гастроэнтерологических, неврологических и других, а также нетипичными лабораторными показателями — отсутствием лейкоцитоза и нейтрофильного сдвига в периферической крови [3, 4, 7, 10, 11]. Рентгенологические изменения в легких отмечаются усилением легочного рисунка, перибронхиальной или субсегментарной инфильтрацией [5, 10, 11, 13].
Нами были обследованы 60 пациентов: 44 — с микоплазменной пневмонией и 16 — с хламидийной пневмонией. Анализ клинического материала показал, что начало заболевания при микоплазменной и хламидийной пневмониях может быть как острым, так и постепенным (табл. 1). При подостром течении пневмония начинается с поражения верхних дыхательных путей, ухудшения общего состояния и познабливания. Температура тела может быть нормальной или субфебрильной в течение 6–10 дней и лишь потом повышается до 38–39,9°С при микоплазменной и до 38–38,9°С при хламидийной пневмонии. При остром начале симптомы интоксикации появляются уже в первый день и достигают максимума к 3-му дню болезни. У пациентов с постепенным началом болезни интоксикация наиболее выражена на 7–12-й день от начала заболевания. Характерными признаками интоксикации для микоплазменной и хламидийной пневмоний являются умеренная головная боль, миалгия, общая слабость.
Одним из постоянных признаков микоплазменной и хламидийной пневмоний, по нашим данным, является кашель, который возникает одновременно с лихорадкой.
 У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р < 0,001) и проявляется заложенностью носа и нарушением носового дыхания, у части больных наблюдаются небольшие либо умеренные слизисто-серозные или слизисто-гнойные выделения из носа. У пациентов же с микоплазменной пневмонией чаще регистрируются явления фарингита и ларингита, проявляющиеся гиперемией ротоглотки и осиплостью голоса (77,3 ± 6,3%, р < 0,05).
У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р < 0,001) и проявляется заложенностью носа и нарушением носового дыхания, у части больных наблюдаются небольшие либо умеренные слизисто-серозные или слизисто-гнойные выделения из носа. У пациентов же с микоплазменной пневмонией чаще регистрируются явления фарингита и ларингита, проявляющиеся гиперемией ротоглотки и осиплостью голоса (77,3 ± 6,3%, р < 0,05).
Из внелегочных проявлений при микоплазменной пневмонии чаще отмечались миалгия (63,6%), макуло-папулезная сыпь (22,7%), явления желудочно-кишечного дискомфорта (25%), при хламидийной — артралгия (18,8%) и миалгия (31,3%).
Изменения в легких, характерные для уплотнения легочной ткани, при физикальном обследовании пациентов с пневмониями, вызванными атипичными возбудителями (в отличие от больных с бактериальными пневмониями), определялись не всегда. В частности, укорочение перкуторного звука у больных микоплазменной и хламидийной пневмониями наблюдалось в 68,2 и 68,8% случаев соответственно (табл. 1). Этот признак всегда выявлялся у больных с сегментарной, полисегментарной, долевой пневмонией и лишь у 1/3 пациентов с перибронхиальной инфильтрацией. У больных микоплазменной пневмонией над зоной поражения чаще выслушивались ослабленное дыхание (40,9%), сухие и влажные хрипы (47,7%), у пациентов с хламидийной пневмонией — как ослабленное (37,5%), так и бронхиальное дыхание (31,2%) и влажные хрипы (62,5%).
При рентгенографии органов грудной клетки у больных микоплазменной и хламидийной пневмониями выявлялись и типичные пневмонические инфильтрации и интерстициальные изменения.
 При микоплазменной пневмонии чаще наблюдается двустороннее поражение легких (40,9%) с усилением легочного рисунка (22,7%) и перибронхиальной инфильтрацией (50%), при хламидийной пневмонии — наоборот, чаще полисегментарная инфильтрация (43,7%) и реже интерстициальные изменения (31,3%).
При микоплазменной пневмонии чаще наблюдается двустороннее поражение легких (40,9%) с усилением легочного рисунка (22,7%) и перибронхиальной инфильтрацией (50%), при хламидийной пневмонии — наоборот, чаще полисегментарная инфильтрация (43,7%) и реже интерстициальные изменения (31,3%).
В общем анализе крови у больных микоплазменной и хламидийной пневмониями чаще отмечается нормальное количество лейкоцитов и умеренное повышение СОЭ (в среднем 37,1 ± 1,9 мм/ч).
По нашим наблюдениям, для микоплазменной и хламидийной пневмоний характерно затяжное рецидивирующее течение.
Таким образом, согласно клинико-рентгенологическим данным и с учетом эпидемиологической ситуации, из общего числа пациентов с внебольничными пневмониями можно выделить больных с микоплазменной и/или хламидийной пневмониями. В нашем исследовании таких больных оказалось 80, из них у 60 (75%) в дальнейшем лабораторным методом была установлена микоплазменная или хламидийная этиология пневмонии.
Диагностика микоплазменной и хламидийной пневмоний
Решающая роль в выявлении микоплазменной и хламидийной инфекции отводится лабораторной диагностике.
Самым специфичным и чувствительным методом лабораторной диагностики микоплазменной и хламидийной инфекции является выделение культуры Mycoplasma pneumoniae и Chlamydophila pneumoniae («золотой стандарт») [1, 2, 5, 6, 10, 11], однако это чрезвычайно трудоемкий и длительный процесс: микроорганизмы растут медленно (не менее 7–14 сут), требуют специальных сред [11, 13]. В связи с этим общепринятым методом диагностики является серотипирование, т. е. выявление специфических IgM- и IgG-антител к Chlamydophila pneumoniae, Mycoplasma pneumoniae. Чаще всего используются метод иммуноферментного анализа (ИФА) (Thermo Electron, Beckman Coulter, Abbot Laboratories, Medac Diagnostica), реакция микроиммунофлюоресценции (МИФ). Стандартом серологической диагностики микоплазменной инфекции на сегодня является ИФА-метод обнаружения специфических IgM- и IgG-антител (>1:64), хламидийной инфекции — тест ИФА-метод и реакция МИФ, позволяющие идентифицировать специфические IgМ, IgG и IgА в диагностически значимых титрах (>1:16, >1:512 и >1:256 соответственно) и/или 4-кратное повышение титра IgG или IgА в парных сыворотках крови [1, 4, 7, 10].
 По динамике уровня специфических антител, определяемых ИФА-методом (табл. 2), можно установить характер и стадию заболевания [10, 11, 13].
По динамике уровня специфических антител, определяемых ИФА-методом (табл. 2), можно установить характер и стадию заболевания [10, 11, 13].
Также в последнее время для этиологической диагностики микоплазменной и хламидийной инфекции используется ПЦР, основанная на определении ДНК возбудителя с применением метода генных зондов [3, 4, 5, 7, 10]. С помощью ПЦР возможна быстрая диагностика микоплазменной и хламидийной инфекции, но этот метод не позволяет отличить активную инфекцию от персистирующей [1, 7, 10, 11].
Таким образом, для достоверной этиологической идентификации микоплазменной и хламидийной пневмоний необходимо проведение серологических тестов в комплексе с методами, основанными на выявлении ДНК микроорганизма.
Лечение микоплазменной и хламидийной пневмоний
Рассмотренные выше микробиологические особенности Mycoplasma pneumoniae и Chlamydophila pneumoniae (главным образом внутриклеточный цикл развития) объясняют неэффективность широко используемых в клинической практике β-лактамных антибиотиков (пенициллины и цефалоспорины) и обусловливают необходимость применения антимикробных препаратов, способных проникать и накапливаться в пораженных клетках, а также блокировать внутриклеточный синтез белка. Такими свойствами обладают макролиды, фторхинолоны и тетрациклины, которые и являются средствами эрадикационной терапии при Mycoplasma pneumoniae— и Chlamydophila pneumoniae-инфекции [3, 4, 7, 10, 11].
С учетом особенностей спектра антимикробной активности и фармакокинетики препаратами первого ряда считаются макролиды [5, 10, 11]. К тому же макролиды по сравнению с тетрациклинами и фторхинолонами безопаснее при лечении новорожденных, детей и беременных. Механизм действия макролидов связан с нарушением синтеза белка в клетках чувствительных микроорганизмов. Кроме того, для большинства этих препаратов характерен постантибиотический эффект, в основе которого лежат необратимые изменения в рибосомах микроорганизма.
 Благодаря этому антибактериальное действие усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки. Более того, макролиды обладают противовоспалительными и иммуномодулирующими свойствами, которые обусловлены несколькими механизмами [11]. Во-первых, макролиды оказывают модулирующее влияние на такие функции нейтрофилов, как фагоцитоз, хемотаксис, киллинг. Под влиянием 14-членных макролидов происходит ингибирование окислительного «взрыва», в результате чего уменьшается образование высокоактивных окисляющих соединений, способных повреждать не только бактериальные клетки, но и собственные ткани [10, 11]. Кроме того, взаимодействуя с клетками иммунной системы, макролиды могут ингибировать синтез и/или секрецию таких провоспалительных цитокинов, как интерлейкины-1, -6, -8, фактор некроза опухоли α, и, наоборот, усиливать секрецию противовоспалительных интерлейкинов-2, -4, -10. Установлено, что макролиды препятствуют адгезии бактерий к поверхности клеток макроорганизма, а также тормозят экспрессию факторов вирулентности некоторых микробов [5, 10, 11].
Благодаря этому антибактериальное действие усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки. Более того, макролиды обладают противовоспалительными и иммуномодулирующими свойствами, которые обусловлены несколькими механизмами [11]. Во-первых, макролиды оказывают модулирующее влияние на такие функции нейтрофилов, как фагоцитоз, хемотаксис, киллинг. Под влиянием 14-членных макролидов происходит ингибирование окислительного «взрыва», в результате чего уменьшается образование высокоактивных окисляющих соединений, способных повреждать не только бактериальные клетки, но и собственные ткани [10, 11]. Кроме того, взаимодействуя с клетками иммунной системы, макролиды могут ингибировать синтез и/или секрецию таких провоспалительных цитокинов, как интерлейкины-1, -6, -8, фактор некроза опухоли α, и, наоборот, усиливать секрецию противовоспалительных интерлейкинов-2, -4, -10. Установлено, что макролиды препятствуют адгезии бактерий к поверхности клеток макроорганизма, а также тормозят экспрессию факторов вирулентности некоторых микробов [5, 10, 11].
В России макролиды представлены широким спектром препаратов (см. табл. 3). Среди них наиболее активным в отношении Mycoplasma pneumoniae признан азитромицин, имеющий ряд преимуществ перед эритромицином и кларитромицином [4, 10, 11]. В отношении Chlamydophila pneumoniae наиболее активным средством признается кларитромицин [10]. Также эффективны в отношении этих внутриклеточных патогенов и некоторые другие представители макролидов: джозамицин, спирамицин. Старый антимикробный препарат из этой группы — эритромицин — также обладает антимикоплазменной и антихламидийной активностью, но, несомненно, уступает в этом отношении вышеперечисленным антибиотикам, обладая при этом целым рядом побочных эффектов [5, 10, 11].
Значительной активностью по отношению к Mycoplasma pneumoniae и Chlamydophila pneumoniae обладают фторхинолоны — офлоксацин (заноцин, таривид, офло), ципрофлоксацин (ципробай, ципролет, цифран, сифлокс, медоциприн, цифлоксинал), в связи с чем эти антимикробные препараты рассматриваются в качестве альтернативы макролидам при данной инфекции.
 Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.
Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.
При лечении микоплазменных и хламидийных пневмоний эффективны и тетрациклины, однако антибиотики этой группы не применяются при беременности, а также печеночной недостаточности. Вероятность проявления побочных эффектов при их применении может быть выше. Из тетрациклинов активны в отношении атипичных микроорганизмов доксициклин и моноциклин (см. табл. 3).
Продолжительность антимикробной терапии неосложненных бактериальных внебольничных пневмоний составляет 5–10 дней. Для лечения микоплазменной и хламидийной пневмоний рекомендуется применять антимикробные средства не менее 2–3 нед [4, 5, 10, 11]. Сокращение сроков лечения чревато развитием рецидива инфекции [4, 10].
При нетяжелом течении микоплазменной и хламидийной пневмоний антимикробные препараты назначаются внутрь в среднетерапевтических дозах. Естественно, при тяжелых пневмониях предпочтение следует отдавать внутривенному применению антибиотика. Эритромицин фосфат назначается до 1–2 г/сут в 2–3 введения (максимально по 1 г каждые 6 ч). Спирамицин используется внутривенно по 1,5 млн МЕ 3 раза в сутки, а кларитромицин — по 250 мг 2 раза в сутки с равными интервалами. Для разведения спирамицина и кларитромицина следует применять 5%-ный раствор глюкозы.
Стоимость внутривенного лечения антибиотиками (в частности, макролидами) весьма высока, поэтому используют ступенчатую терапию, при которой лечение начинается с внутривенного применения антибиотиков, а по достижении клинического эффекта (обычно через 2–3 дня) пациент переводится на пероральную терапию тем же препаратом или другим макролидом. Ступенчатая монотерапия макролидами может проводиться эритромицином, кларитромицином, спирамицином, т. е. препаратами, которые выпускаются в двух формах: для внутривенного введения и для приема внутрь.

Несмотря на большой спектр противомикробных препаратов, эффективное лечение микоплазменных и хламидийных пневмоний представляет до настоящего времени большую проблему [2, 6, 10, 11]. Это связано с тем, что их развитие, как правило, происходит на фоне снижения антиинфекционной резистентности организма, обусловленного угнетением иммунитета [8, 9, 10, 12]. Проведенное нами исследование показателей иммунограммы у пациентов с внебольничной пневмонией микоплазменной и хламидийной этиологии выявило снижение абсолютного числа лимфоцитов, зрелых Т-лимфоцитов (CD3+), Т-хелперов (CD4+), абсолютного числа Т-супрессоров (CD8+), угнетение функциональной активности Т-системы, проявляющееся снижением плотности рецепторов к IL-2 (CD25+), способности к бласттрансформации (CD71+ — лимфоциты) и апоптозу (CD95+), а также активацию гуморального иммунитета, что проявлялось повышением числа В-лимфоцитов (CD20+), уровня IgM и ЦИК.
Микоплазмы и хламидии на разных стадиях развития располагаются как внутриклеточно, так и внеклеточно, что требует для их элиминации участия гуморальных и клеточных механизмов иммунитета [8, 9, 10, 12]. Большинство антимикробных средств действует преимущественно на внеклеточную форму возбудителей. Это приводит к персистенции возбудителей, диссеминации ее в организме, хронизации процесса, формированию осложнений. Применение лишь антимикробных средств означает лишь временное подавление возбудителей, так как на фоне такой терапии происходит сохранение и даже усугубление иммунологических расстройств, что повышает риск рецидива заболеваний [14]. Так, по результатам наших исследований, к концу курса традиционной терапии происходило усугубление Т-клеточной депрессии: снижалось относительное и абсолютное количество Т-лимфоцитов (CD3+), Т-хелперов (CD4+), Т-супрессоров (CD8+) на фоне повышения уровня IgG, ЦИК, фагоцитарного индекса и уменьшения IgA.
В связи с этим хотелось бы подчеркнуть, что терапия микоплазменной и хламидийной пневмоний должна быть комплексной и включать, помимо антимикробных средств, препараты, действие которых направлено на коррекцию иммунного ответа.

С этой целью у больных микоплазменной и хламидийной пневмониями нами применяются иммуномодуляторы (ронколейкин, ликопид, тималин, тимоген).
Включение иммуномодуляторов в комплексное лечение микоплазменных и хламидийных пневмоний позволяет добиться ярко выраженного иммунологического эффекта. Последний сочетается с выраженным клиническим воздействием, проявляющимся сокращением сроков достижения клинико-лабораторной ремиссии в среднем на 3 койко-дня, уменьшением интоксикационных симптомов через 1–3 сут после начала лечения, сокращением лихорадочного периода в 2 раза, четкой положительной рентгенологической динамикой к 12-му дню лечения у 76,7% больных; значительным уменьшением вероятности развития повторных рецидивов и хронизации процесса.
Литература
- Бочкарев Е. Г. Лабораторная диагностика хламидийной инфекции // Иммунопатология, аллергология, инфектология. — 2000. — № 4. — С. 65–72.
- Гранитов В. М. Хламидиозы. — М., 2000. — 48 с.
- Новиков Ю. К. Атипичные пневмонии // Русский медицинский журнал. — 2002. — Т. 10. — № 20. — С. 915–918.
- Ноников В. Е. Диагностика и лечение атипичных пневмоний // CONSILIUM medicum. — 2001. — T. 3. — № 12. — C. 569–574.
- Проект практических рекомендаций МЗ РФ. Внебольничная пневмония у взрослых: диагностика, лечение, профилактика. — М., 2002. — 51 с.
- Прозоровский С. В., Раковская И. В., Вульфович Ю. В. Медицинская микоплазмология. — М.: Медицина, 1995. — 285 с.
- Синопальников А. И. Атипичная пневмония // Русский медицинский журнал. — 2002. — Т. 10. — № 23. — С. 1080–1085.
- Справочник по иммунотерапии для практического врача / Под ред. А. С. Симбирцева. — СПб.: Диалог, 2002. — 480 с.
- Хаитов Р. М., Игнатьева Г. А., Сидорович И. Г. Иммунология. — М.: Медицина, 2000. — 432 с.
- Хаитов Р. Ф., Пальмова Л. Ю. Mycoplasma pneumoniae и Chlamydophila pneumoniae инфекции в пульмонологии: актуальные вопросы клиники, диагностики и лечения.
 — Казань, 2001. — 64 с.
— Казань, 2001. — 64 с. - Чучалин А. Г., Синопальников А. И, Чернеховская Н. Е. Пневмония. — М.: Экономика и информатика, 2002. — 480 с.
- Boym A. Separation of leucocytes from blood und bone marrow // Scand J Clin. Lad. Jnvest. — 1968. — V. 21. — Suppl. 87. — P. 77–82.
- Guidelines for management of adult community-acquired lower respiratory tract infections. European Study in Community-acquired Pneumonia (ESOCAP) Committee // Eur Resp J. — 1998. — № 11. — Р. 986–991.
- Kawamoto M., Oshita Y., Yoshida H. et al. Two cases hypoxemic acute broncholitis due to Mycoplasma pneumoniae // Kansenshogaku Zasshi. — 2000. — V. 74. — № 3. — P. 259–263.
Г. Г. Мусалимова, кандидат медицинских наук
В. Н. Саперов, доктор медицинских наук, профессор
Т. А. Никонорова
Чувашский ГМУ, г. ЧебоксарыЛечение хламидиоза, уреаплазмоза и микоплазмоза. | Он-Лайн Клиник
Чем опасны эти заболевания?
Почему их так сложно вылечить?
Это бактерии или вирусы?
Инфекций, передающихся половым путем много, но особое внимание мы обратим сейчас на Хламидию, уреаплазму и микоплазму. Т.к.в организме каждого человека эти инфекции находятся в латентном состоянии, и часто начало заболевания проходит без каких-либо ярко выраженных симптомов. Поэтому женщины узнает о заболевании совершенно случайно, когда обращаются по поводу лечения осложнений, вызванных этими инфекциями. Между тем, без лечения эти инфекции приводят к серьезным осложнениям и ухудшают качество жизни.
До сегодняшнего дня ученые спорят о роли этих инфекций в этиологии и патогенезе заболеваний урогенитального тракта. В советское время уреаплазмоз и микоплазмоз не рекомендовали лечить до беременности. В последних исследованиях авторы указывают на то, что именно хламидиоз, микоплазмоз и уреаплазмоз являются частой причиной неблагоприятных исходов беременности, усугубляют риск преждевременных родов и смерти сильно недоношенных детей.
 (Румянцева, Татьяна «Уреаплазмоз» — диагноз, которого нет. Румянцева, MD акушер-гинеколог, к. м. н. (18 сентября 2018). Дата обращения 29 октября 2019.).
(Румянцева, Татьяна «Уреаплазмоз» — диагноз, которого нет. Румянцева, MD акушер-гинеколог, к. м. н. (18 сентября 2018). Дата обращения 29 октября 2019.).Основной способ проникновения этих инфекций в организм мужчин и женщин – половой акт. При этом барьерные методы (презервативы) не защищают на 100% — заражение часто носит экстрагенитальные формы (хламидийный конъюктивит, пневмония, для микоплазмы и уреаплазмы еще поражение слизистой оболочки глотки, плацентарная форма проникновения в организм).
Хламидиоз (хламидиаз) — инфекционное заболевание, передающееся половым путём, вызываемое хламидиями(Chlamydia trachomatis). По статистике ежегодно хламидиозом в мире заболевает 100 млн человек, а число инфицированных хламидиями людей на всем земном шаре по самым скромным подсчётам достигает одного миллиарда. По данным ВОЗ и многочисленных отечественных и зарубежных исследователей, урогенитальный хламидиоз является одним из самых распространённых заболеваний, передаваемых половым путём. По разным данным, от 5 до 15 % молодых сексуально активных людей заражены хламидийной инфекцией.
Хламидии относят к группе бактерий, но у них присутствуют черты, схожие с вирусами. Отличительной особенностью хламидий является то, что они могут инфицировать клетки организма и размножаться непосредственно внутри них. Именно поэтому первичное инфицирование часто проходит незаметным. Бактерии очень устойчивы к различным неблагоприятным воздействиям. Внедряясь в живую клетку, бактерия наделяется способностью делиться и расти в этой клетке, надежно защищенная от иммунной системы человека. После формирования новых клеток хламидии покидают клетку-хозяина и она через некоторое время погибает. Такой процесс размножения и деления продолжается в течение 2-3 дней, и хламидии начинают искать новые клетки-жертвы. При отсутствии лечения, или не полном лечении заболевание всегда переходит в хроническую форму и наблюдается поражение как нижних, так и верхних отделов мочеполовой системы.

Метод заражения. Попадание бактерий в организм может происходить при анальном, вагинальном и оральном сексе и даже через бытовые предметы и внутриутробно: от матери – к ребенку. При внутриутробном заражении у детей отмечается хламидийный конъюктивит и пневмония.
Очень часто хламидийная инфекция соседствует в организме с микоплазмами, анаэробами, гонококками и другими инфекциями, т.к. поражение хламидиями снижает защитные способности организма человека.
Симптомы: Болевые ощущения в нижней части живота, дискомфорт в паху и промежности, скудные выделения из влагалища и уретры, жжение и зуд в области наружных половых органов и мочеиспускательном канале.
Осложнения. У женщин хламидии приводят к появлению сактосальпинксов – спаечного процесса в малом тазу, и, как следствие, трубному бесплодию, внематочной беременности. У мужчин заболевание может поражать придатки яичек, семенные пузырьки и простату.
Уреаплазмоз описан как заболевание, вызываемое условно-патогенной микрофлорой — микоплазмами видов Ureaplasma urealyticum и Ureaplasma parvum. Уреаплазмы широко распространены (10–80% среди разных групп населения) и часто обнаруживаются у людей, не имеющих клинических симптомов, наряду с Mycoplasma hominis выявляются в гениталиях у 5–20% клинически здоровых людей.
Чаще всего уреаплазмоз протекает без симптомов в хронической форме, и пациенты не подозревают о том, что заболели. Отмечают только появление симптомов, схожих с «молочницей». Уреаплазмы считаются условно-патогенными микроорганизмами, и у некоторых женщин входят в состав нормальной микрофлоры влагалища.
Уреаплазма былает нескольких видов. Самой болезненной разновидностью считают Ureaplasma urealyticum. Она локализуется преимущественно на слизистых оболочках мочеполовой системы, но иногда и на слизистых ротовой полости и глотки.
 Уреаплазмозом болеют и мужчины и женщины. Ureaplasma urealyticum активно влияет на среду обитания, довольно легко расщепляет мочевину с выведением аммиака. Это приводит к обширному воспалительному процессу и скоплению солей мочевой кислоты в почках. Что, в свою очередь, может привести к болезненному мочеиспусканию, циститу, задержке жидкости в организме.
Уреаплазмозом болеют и мужчины и женщины. Ureaplasma urealyticum активно влияет на среду обитания, довольно легко расщепляет мочевину с выведением аммиака. Это приводит к обширному воспалительному процессу и скоплению солей мочевой кислоты в почках. Что, в свою очередь, может привести к болезненному мочеиспусканию, циститу, задержке жидкости в организме.Ureaplasma parvum менее агрессивная разновидность инфекции. Она провоцирует воспалительный процесс лишь при общем снижении общего и местного иммунитета у женщин. Например, если присутствуют другие инфекции в малом тазу, во время беременности, после медицинского вмешательства (гистероскопии, аборта, биопсии), при эрозии шейки матки и др. бактерия имеет слабо выраженную мембрану и легко внедряется в слизистые половых органов и мочевыводящих путей. Во время беременности Ureaplasma parvum становится агрессивной и опасной, тк. Может проникать через плаценту и представлять угрозу развития плода.
Метод заражения. Плацентарный, может передаться от матери к ребенку, попасть в половые пути новорожденного и сохраняться в них в течение всей жизни, находясь в неактивном состоянии. При вагинальном, анальном и оральном сексе.
Факторы риска. Частая смена половых партнеров, продолжительный прием антибиотиков (активизируются скрытые формы из-за снижения иммунитета), наличие других инфекций, перепады температуры.
Симптомы. Выделения из мочеиспускательного канала после задержки мочи, жжение при мочеиспускании и во время полового акта, болевые ощущения внизу живота, ненормальные влагалищные выделения, аммиачный запах, тянущая боль в области мочевого пузыря и почек.
При отсутствии лечения длительная и вялотекущая инфекция может вызвать развитие серьезных осложнений. Бактерии могут поражать яички и простату у мужчин, придатки, матку и влагалище у женщин. Отсутствие лечения приводит к развитию простатита, аднексита, эндометрита, кольпита и цистита.

При глубоком поражении уреаплазмой систем и органов лечение длительное и не всегда эффективное.
Микоплазмоз — это хроническое заболевание, которое вызывают паразитирующие в организме человека мелкие бактерии – микоплазмы. Микоплазмы — микроорганизмы, занимающие промежуточное положение между бактериями, грибами и вирусами. Обычно микоплазмы прикрепляются на клетки эпителия — слизистой выстилки кишечного, дыхательного и мочеполового трактов. Паразитируют в клетках хозяина. Среди достаточно большого количества микоплазм, встречающихся у человека только 4 вида могут при определенных условиях вызвать болезнь.
Микоплазма опасна тем, что при создании определенных условий (снижение общего и местного иммунитета) активизирует воспалительный процесс в малом тазу и становится причиной развития такой патологии, как микоплазмоз. Эта болезнь без лечения активно передается половым путем и может стать причиной серьезных осложнений как у мужчин, так и у женщин.
Микоплазму по свойствам можно отнести как к вирусам (из-за размера), так и к бактериям (из-за структуры). Как у вирусов у микоплазмы отсутствует клеточная стенка, и она может спокойно внедряться в клетки организма и паразитировать на них.
Метод заражения. Основной путь заражения – половой контакт, но в редких случаях и бытовой путь, плацентарный, может передаться от матери к ребенку.
Инкубационный период от 3 до 5 недель.
Симптомы. У мужчин выделения из уретры, дискомфорт при мочеиспускании, у женщин белые, желтые или прозрачные выделения из влагалища, болевой синдром, жжение при мочеиспускании и половом акте, покраснения половых органов.
При отсутствии лечения симптоматика усиливается. У мужчин может появиться болевой синдром в области мошонки, прямой кишки и промежности, а у женщин дискомфорт в области малого таза и поясницы.
У женщин после перенесенного заболевания может развиться хронический эндометрит.
 Во время беременности микроорганизмы могут передаваться от матери к ребенку, что часто становится причиной выкидышей в первом триместре, а на последних неделях беременности – преждевременные роды. У детей микоплазма провоцирует развитие патологий органов дыхания и мочеполовой системы.
Во время беременности микроорганизмы могут передаваться от матери к ребенку, что часто становится причиной выкидышей в первом триместре, а на последних неделях беременности – преждевременные роды. У детей микоплазма провоцирует развитие патологий органов дыхания и мочеполовой системы.Диагностика и лечение. Игнорировать эти заболевания нельзя. Лечить микоплазму, уреаплазму и хламидиоз необходимо у обоих партнеров одновременно, чтобы исключить повторное заражение. Диагностика занимает 2-3 дня. Необходимо провести исследование методом ПЦР отделяемого из половых органов у женщин (сделать мазок из влагалища и цервикального канала). Перед анализами нужна подготовка: половое воздержание накануне исследования и «разумная» гигиена. «Разумная» — отказаться от спринцевания антибактериальными средствами накануне и в день сдачи анализов. (Прим. О подготовке мужчин читать статью «Скрытая угроза: Инфекции, передающиеся половым путем«).
Лечение таких заболеваний, как уреаплазмоз, микоплазмоз и хламидиоз – довольно длительный процесс. Но рекомендациями врача пренебрегать нельзя, тк без лечения, или при неполном лечении могут развиться серьезные осложнения заболевания (См. статью «Причины, симптомы и методы лечения эндометрита«).
Мировая медицинская практика показывает, что избавиться от этих инфекций за один курс медикаментозного лечения довольно проблематично, т.к. чаще всего из-за скрытого начала течения заболевания пациенты обращаются несвоевременно. После тщательного обследования врачи подбирают курс медикаментозной терапии, но наилучшие результаты дает комплексный подход: физиотерапия с лекарственными препаратами местного действия. Многие врачи считают, что при устранении таких инфекций важно не навредить иммунной системе и желудочно-кишечному тракту, поэтому при лечении нужно минимизировать воздействие сильнодействующих препаратов на организм. Т.к. при снижении иммунитета эти заболевания начинают активно размножаться в организме.
 Это означает, что курс лечения лучше проходить в медицинском центре, где есть ультразвуковая санация лекарственными препаратами (ГИНЕТОН), лазеротерапия, магниты, электростимуляция (БТЛ) и иммунокоррекция внутривенным лазером (ВЛОК).
Это означает, что курс лечения лучше проходить в медицинском центре, где есть ультразвуковая санация лекарственными препаратами (ГИНЕТОН), лазеротерапия, магниты, электростимуляция (БТЛ) и иммунокоррекция внутривенным лазером (ВЛОК).При лечении уреаплазмоза, хламидиоза, микоплазмоза необходимо отказаться от употребления спиртосодержащих напитков, от половой жизни, острых, жирных и сладких блюд. Принципиально важно не допустить инфицирование микроорганизмами, которые вызывают развитие половых инфекций.
ВАЖНО! Т.к. Хламидии, уреаплазма, микоплазма из-за своей двойственной структуры способны проникать внутрь живых клеток, оставаясь долгое время незаметными для иммунной системы человека (без симптомов) важно: сдавать анализ ПЦР на эти инфекции раз в год, даже если нет симптомов, проверять и лечить обоих партнеров одновременно, проходить полный курс лечения – минимум 10-14 дней медикаментозный курс совместно с физиопроцедурами, тк дозировка препаратов рассчитана на лечение от этих инфекций и закрепление результата, т.е. воздействие на инфекции в активной фазе размножения и в скрытой (внутриклеточной).
Профилактика хламидиоза, уреаплазмоза и микоплазмоза. В первую очередь нужно отказаться от случайных половых связей и проходить регулярные исследования на половые инфекции. Профилактика половых инфекций включает повышение защитных сил организма (общего и местного иммунитета) и сохранение нормальной микрофлоры в половых органах. Для этих целей в нашей клинике вы можете пройти полную диагностику методом ПЦР в современной лаборатории. Срок готовности анализов 2-3 дня. А также пройти профилактический курс ультразвуковой санации на аппарате ГИНЕТОН с маслом чайного дерева, иммуностимулирующими и противовирусными препаратами. ГИНЕТОН мягко очищает шейку матки, восстанавливает естественную микрофлору влагалища и поднимает местный иммунитет. Для поднятия общего иммунитета эффективен внутривенный лазер ВЛОК.
 Для профилактики достаточно проходить курс из 10 процедур раз в 6 месяцев.
Для профилактики достаточно проходить курс из 10 процедур раз в 6 месяцев.Симптомы и лечение хламидийной пневмонии
Симптомы и лечение хламидийной пневмонии
- Обновлено: 07.07.2016 09:11
- Опубликовано: 07.07.2016 09:11
Хламидийная пневмония может быть вызвана несколькими видами микроорганизмов, которые вызывают различные проявления у детей и взрослых. Наиболее часто в патогенезе участвуют хламидия пневмония (Chlamydia pneumoniae) или хламидофила пневмония (Сhlamidophila).
Особенности паразитирования хламидии в организме человека.
Хламидии – внутриклеточные паразиты, не способные существовать вне клетки хозяина. Передаются воздушно капельным путем.
Chlamydia pneumoniae вызывает заболевания верхних дыхательных путей и воспаление легких у детей. Обсуждается вопрос о возможности влияния данного возбудителя на возникновение бронхиальной астмы и аутоиммунных заболеваний.
Симптомы данной атипичной формы.
Клинические симптомы у детей наиболее часто развиваются с явлений острой вирусной инфекции. Хламидийная пневмония относится к атипичным формам, и вначале маскируются под следующие заболевания: фарингит; ринит; ларингит; синусит; бронхит; отит.
На этом фоне появляются симптомы: повышение температуры тела, недомогание, боль в мышцах, слабость, ознобы не характерны. Настораживать должен сухой приступообразный кашель, переходящий в продуктивный с небольшим количеством слизисто-гнойной мокроты. Неяркие симптомы часто затрудняют диагностику пневмонии, что не позволяет начать своевременное лечение.
Инфкция у детей и новорожденных.
У детей до 6 месяцев хламидиоз пневмония передается «вертикально» от зараженной матери внутриутробно или при прохождении по родовым путям. Симптомы заражения сочетают в себе проявления конъюнктивита с воспалением верхних дыхательных путей.

Респираторные инфекции при микоплазмозе пневмония.
Хотя Mycoplasma pneumoniae известна в первую очередь как возбудитель атипичной пневмонии, вызванная ею инфекция чаще всего протекает как микоплазменный трахеобронхит. Больные жалуются на боль в горле, головную боль, озноб, насморк, недомогание. Слизистая зева при микоплазменном трахеобронхите гиперемирована; шейные лимфоузлы, как правило, не увеличены. Возможными осложнениями микоплазменного трахеобронхита могут являться — менингит и отит.
Тяжесть вызванных Mycoplasma pneumoniae инфекций колеблется в довольно широких пределах. Тяжелая микоплазменная пневмония может возникать у здоровых до того детей и взрослых любого возраста. Микоплазменная пневмония способна осложниться абсцессом легкого, пневматоцеле, поражением целой доли, дыхательной недостаточностью, плевритом. Небольшой плевральный выпот выявляется при микоплазменной пневмонии у 20% больных.
Иногда Mycoplasma pneumoniae обнаруживается в выпоте и при относительно тяжелом плеврите — микоплазменном плеврите.
.
Внелегочные осложнения микоплазмоза.
Поражения нервной системы при микоплазмозе.
Описаны менингоэнцефалит, серозный менингит, энцефалит, восходящий паралич и поперечный миелит, вызванные микоплазмозом.При поражении центральной нервной системы (ЦНС) микоплазмозом — выздоровление обычно идет медленно, а в некоторых случаях наблюдаются остаточные дефекты. Возможны смертельные исходы. Попытки доказать проникновение Mycoplasma pneumoniae в ЦНС долгое время терпели неудачу
Кардиальные осложнения при микоплазмозе.
Кардиологические осложнения при микоплазмозе считаются редкими, но истинная их частота неизвестна. Дисфункция миокарда часто обусловлена гемолитической анемией; иногда картина напоминает инфаркт миокарда.
 При микоплазмозе описаны перикардит, миокардит, гемоперикард, сердечная недостаточность, полная АВ-блокада. Выраженные изменения ЭКГ иногда обнаруживают в отсутствие жалоб. Иногда Mycoplasma pneumoniae бывает единственным микроорганизмом, выделяемым из перикардиального выпота и ткани сердца.
При микоплазмозе описаны перикардит, миокардит, гемоперикард, сердечная недостаточность, полная АВ-блокада. Выраженные изменения ЭКГ иногда обнаруживают в отсутствие жалоб. Иногда Mycoplasma pneumoniae бывает единственным микроорганизмом, выделяемым из перикардиального выпота и ткани сердца.Поражение кожи и слизистых при микоплазмозе.
Поражение кожи и слизистых встречается у 25% больных микоплазмозом. Чаще всего это – пятнисто-папулезная и везикулярная сыпь. У половины больных с сыпью наблюдаются афты и конъюнктивит. Во многих случаях в мазках из зева и содержимом везикул обнаруживают Mycoplasma pneumoniae.
Суставные проявления микоплазмоза.
Иногда при микоплазмозе наблюдается поражение суставов, в том числе артрит. Описан синдром, напоминающий ревматическую атаку.
Другие осложнения микоплазмоза.
Приблизительно у 25% больных вызванные Mycoplasma pneumoniae инфекции сопровождаются тошнотой, рвотой или поносом.
Диагностика и лечение респираторных атипичных заболеваний в амбулаторной практике
Сигиневич Л.Ф.
Проблема острых респираторных заболеваний верхних и нижних дыхательных путей на сегодняшний день очень актуальна и имеет большое социальное значение. В последние года атипичные возбудители: мельчайшие бактерии семейства микоплазм и хламидий, рассматриваются как один из ведущих этиологических факторов в отношении респираторных инфекций.
Клинически острое респираторное заболевание, обусловленное микоплазмами и хламидиями не отличаются от ОРЗ другой этиологии.
Микоплазмы и хламидии являются внутриклеточными возбудителями и могут долго персистировать в клетках эпителия, лимфоглоточном кольце, способствовать аллергии, обуславливать более тяжелое течение неспецифических заболеваний легких. Эти возбудители могут колонизировать респираторный тракт человека, не вызывая никакой патологической картины.

Есть данные, подтверждающие цитопатическое действие микоплазмов на мерцательный эпителий слизистой бронхов и способность хламидий блокировать двигательную активность ресничек, нарушая механизмы самоочищения бронхов.
Данные микроорганизмы отличаются двухфазовым циклом развития, состоящим из неинфекционной внутриклеточной и инфекционной внеклеточной стадий.
Активная способность микоплазм и хламидий провоцировать аллергическую реактивность организма имеет особое значение для людей с генетической предрасположенностью к гиперчувствительности и с дисфункцией иммунной системы. Поскольку в раннем детском возрасте иммунная система не полностью сформирована, и защитная функция организма недостаточно развита, создаются условия для более легкого инфицирования детского организма. Это подтверждается данными обследований разных возрастных групп населения. Процент выявления микоплазм и хламидий в группе детей до 5 лет составляет от 50 до 74 %.
Источником инфекций является больной или носитель.
Инфицирование микоплазмами и хламидиями происходит контактным или воздушно-капельным путем.
Входными воротами при воздушно-капельном пути являются слизистая оболочка верхних дыхательных путей и легкие. Дальнейшая служба инфекционного процесса зависит от состояния иммунной системы. Респираторная форма заболевания может заканчиваться выздоровлением в течение недели. При недостаточной иммунной защите развивается картина ринофарингита, трахеита, бронхита или интерстициальной пневмонии.
Диагностировать в повседневной клинической практике микоплазменную и хламидийную инфекцию верхних и нижних дыхательных путей в остром периоде заболевания практически невозможно ввиду отсутствия обязательного специфического обследования больных с симптомами ОРВИ. Заподозрить эти инфекции можно лишь в отдельных случаях, ориентируясь на известное клиническое своеобразие болезни и отдельные детали эпидемиологического анамнеза.
В условиях нашей поликлиники для обнаружения антигенов возбудителей и специфических антител применяются серологические исследования.

С помощью ИФА в крови больных имеется возможность определять антитела (АТ), относящиеся к различным классам иммуноглобулинов (Ig A, M, G).
Существует определенная последовательность разных классов иммуноглобулинов.
В начальные периоды заболевания организм вырабатывает в основном антитела класса М (Ig M).
В дальнейшем, через 7-10 дней синтез иммуноглобулинов класса М снижается, и организм начинает вырабатывать большое количество антител класса G (Ig G), осуществляющих наиболее эффективную защитную функцию.
Выявление Ig G одинаково эффективно и информативно как при остром воспалительном процессе, так и при вялотекущих процессах. Спустя 3-4 недели после инфицирования уровень Ig G становится постоянным и сохраняется продолжительное время даже после полной элиминации бактерий. Поскольку стойкого иммунитета эти инфекции не вызывают, то при успешном лечении примерно через 3 месяца после окончания приема антибиотиков определяемый титр Ig G должен быть ниже диагностических показателей. Ig G могут находиться на низком уровне в течение многих лет.
В лечении респираторных заболеваний, вызванных атипичными возбудителями, имеются определенные трудности. Микоплазмы и хламидии на разных стадиях развития располагаются как внутриклеточно, так и внеклеточно. А большинство антимикробных средств действует преимущественно на внеклеточную форму возбудителей, не действуя на внутриклеточную форму. Таким образом, создаются условия для персистенции возбудителя, хронизации процесса и даже формирования осложнений.
Антибиотики эритромицин и доксициклин в настоящее время становятся все менее эффективными.
На современном этапе успешно используем фторхинолоны и макролиды. Эти препараты способны создавать в очагах воспаления более высокие, чем в сыворотке крови, концетрации антибиотиков. Наиболее интенсивно макролиды накапливаются в миндалинах, лимфоузлах, придаточных пазухах носа, легких, бронхиальном секрете, плевральной жидкости.
Представляет интерес случай внутрисемейного заболевания атипичной респираторной инфекции в феврале 2011 года.

На прием пришел мужчина 40 лет с симптомами затянувшегося респираторного заболевания на 9 день болезни.
Жалобы на общую слабость, повышенную утомляемость, вечерный субфебрилитет, сухой кашель, першение в горле. Лечение: полоскание и орошение горла, синекод с незначительным улучшением.
Эпид. анамнез: В семье первым заболел ребенок 5 лет, посещавший детский сад, с аналогичными симптомами, через неделю заболела жена, а еще через 2 дня сам пациент. У ребенка в настоящее время сохраняется сухой кашель.
В первый день заболевания отмечал ломоту в теле, суставах, фебрильную температуру, которая держалась 3 дня, затем снизилась. Позже присоеднились боль и першение в горле, и появился частый сухой кашель.
В клиническом анализе крови: лейкоцитоз 9,3 тыс./мкл СОЭ 23 мм/час.
Рентген легких: картина усиления легочного рисунка. В легких выслушиваются единичные сухие хрипы при форсированном выдохе. С учетом эпидситуации и сохраняющихся респираторных проявлений назначено серологическое исследование крови на атипичные инфекции, которое выявило АТ к хламидиям трахоматис в 8 раз превышающие норму.
На следующий день на прием пришла жена с ухудшением состояния (после кратковременного кажущегося улучшения): прогрессирование слабости, першение и боль в горле, сухой кашель, субфебрилитет на 11 день заболевания.
При аускультации: дыхание везикулярное, сухие незвучные хрипы слева. Сделана рентгенография легких: легкие энфизиматозны. Усилен бронхососудистый рисунок в нижних прикорневых отделах.
В клиническом анализе крови: лейкоцитоз до 9,8 тыс./мкл, СОЭ — 35 мм/час. Назначена антибактериальная терапия хемомицином, отхаркивающие средства, взят серологический анализ крови.
Телефонный контакт с пациенткой через 3 дня выявил ухудшение состояния: наличие приступообразного сухого кашля по ночам, повышение потливости, сохранение субфебрилитета. Пациентка была повторно приглашена на прием, сделана КТ легких, которая выявила 2-х стороннюю полисегментарную пневмонию по типу интерстициальной с увеличением лимфоузлов средостения до 20 мм.

Пациентка была госпитализирована в стационар в пульмонологическое отделение. В сыворотке крови, взятой в нашей поликлинике, обнаружены антитела к хламидиям трахоматис класса G с увеличением нормы в 10 раз. В динамике в стационаре антитела увеличились в 13 раз. Антитела класса М не обнаружились. С-реактивный белок 48 мг/л. Антибактериальная терапия проводилась ровамицином и моксифлоксацином (авелокс). На фоне проводимой в стационаре комплексной терапии явления пневмонии регрессировали, интерстициальные изменения в легких практически полностью исчезли, размеры лимфоузлов в средостении уменьшились. Через 3 недели после выписки из стационара обоим супругам в поликлинике провели контрольное серологическое исследование крови на хламидии: выявили значительное уменьшение Ig G. Еще через 3 недели титр Ig G был незначительно повышен у обоих.
Анализ этих случаев интересен.
Во-первых, он наглядно показывает этиологическую связь с атипичной хламидийной инфекцией острого бронхита у мужа, а у жены хламидийной пневмонии.
Во-вторых, удалось обнаружить серологические признаки активной хламидийной инфекции путем повторного взятия сыворотки крови в остром периоде заболевания и в период реконвалесценции.
В обоих случаях на фоне лечения макролидами и моксифлоксацином достигнуто клиническое и рентгенологическое выздоровление.
Список литературы:
1. Тартаковский И.С. Клиническая микробиология, антимикробная химиотерапия.
2. Чучалин А.Г. и др. Практические рекомендации по диагностике и лечению атипичных инфекций.
Mycoplasma genitalium / Chlamydia Coinfection: распространенность и частота возникновения устойчивости к макролидам
Согласно исследованию, опубликованному в Заболевания, передаваемые половым путем , хотя коинфекция с Mycoplasma genitalium среди женщин с хламидиозом встречается нечасто, это может зависеть от населения. Исследователи также отметили, что у значительного числа женщин, принявших участие в исследовании, при последующем наблюдении было повторное обнаружение M genitalium , вероятно, из-за мутаций, связанных с устойчивостью к макролидам, которые привели к отсутствию реакции на азитромицин, назначенный для хламидиоза.

Инфекция M genitalium , передающаяся половым путем, связана с воспалительными заболеваниями органов малого таза, цервицитом и бесплодием у женщин, и сообщаемая распространенность обнаружения M genitalium у женщин с хламидиозом колеблется от 4,8% до 42,9% в имеющихся исследованиях — ни один из которые оценивают исходы M genitalium для женщин, лечившихся от хламидиоза, и M genitalium , коинфекцию азитромицином. Лечение хламидиоза первой линии — азитромицин и доксициклин — оба имеют низкие показатели излечения по сравнению с M genitalium .Настоящее исследование было разработано для изучения частоты и характеристик, которые прогнозировали коинфекцию у женщин (N = 302), и частоты M genitalium с мутациями, связанными с устойчивостью к макролидам, что привело к повторному выявлению через 3 месяца наблюдения после лечения хламидиозом. с азитромицином.
В исследовании приняли участие 302 женщины с хламидиозом в возрасте от 16 до 50 лет (средний возраст 22 года). Из этого числа 93% были чернокожими, 42,1% принимали гормональные противозачаточные средства, 48.7% имели предшествующую инфекцию хламидиозом (согласно медицинской карте или самооценке), 52,3% не имели урогенитальных симптомов, 28,8% имели бактериальный вагиноз, 2,7% имели воспалительные заболевания органов малого таза, 12,6% имели вульвовагинальный кандидоз, 18,9% — цервицит, 3,6% имели инфекции Trichomonas vaginalis , а 7,3% (n = 22) имели M. genitalium . Ни одна из этих характеристик среди участников, включая наличие или отсутствие симптомов, не показала значительной связи с коинфекцией M genitalium .
Из 21 пациента, который вернулся на 3-месячный контрольный визит, у 28,6% (n = 6) было обнаружено M genitalium , и у всех 6 из них было штаммов M genitalium с мутацией, связанной с устойчивостью к макролидам. Хотя 83,3% (n = 5) из этих 6 участников также имели штамм M genitalium с мутациями, связанными с устойчивостью к макролидам, обнаруженными на исходном уровне, у одного участника (16,7%) был штамм дикого типа, что указывает на то, что лечение азитромицином может способствовали развитию мутации, связанной с устойчивостью к макролидам.

Исследование было ограничено небольшим размером выборки. Исследователи пришли к выводу, что «наше исследование показало, что коинфекция [ M genitalium ] редко возникала в нашей когорте [ инфицированных Chlamydia trachomatis ] женщин; однако при рассмотрении результатов других опубликованных исследований оказывается, что распространенность коинфекции [ M genitalium ] у женщин, инфицированных [ C trachomatis ], может зависеть от исследуемой популяции.”
Номер ссылки
Харрисон С.А., Олсон К.М., Рэтлифф А.Е. и др. Коинфекция Mycoplasma genitalium у женщин с инфекцией Chlamydia trachomatis [опубликовано в Интернете 5 июня 2019 г.]. Секс Трансмиссия . DOI: 10.1097 / OLQ.0000000000001028
«Разница в детерминантах Chlamydia trachomatis и Mycoplasma genitalium в выборке молодых австралийских женщин». | BMC Infectious Diseases
- 1.
Департамент здравоохранения и старения: Национальная система надзора за заболеваниями, подлежащими регистрации.2009, Канберра: Содружество Австралии
Google Scholar
- 2.
Hocking JS, Willis J, Tabrizi S, Fairley CK, Garland SM, Hellard M: исследование распространенности хламидиоза среди молодых женщин, живущих в Мельбурне, Виктория. Сексуальное здоровье. 2006, 3 (4): 235-240. 10.1071 / SH06033.
Артикул PubMed Google Scholar
- 3.
Kong F, Hocking JS, Link CK, Chen MY, Hellard ME: Секс и спорт: скрининг на хламидиоз в сельских спортивных клубах.BMC Инфекционные болезни. 2009, 9 (1): 73-10.1186 / 1471-2334-9-73.
Артикул PubMed PubMed Central Google Scholar
- 4.
Hocking JS, Walker J, Regan D, Chen MY, Fairley CK: Скрининг на хламидиоз — Австралия должна стремиться к тому, чего не достигли другие. Медицинский журнал Австралии.
 2008, 188 (2): 106-
2008, 188 (2): 106-PubMed Google Scholar
- 5.
Дженсен Дж., Орсум Р., Дон Б., Ульдум С., Червь А, Линд К.: Mycoplasma genitalium : причина мужского уретрита ?.Мочеполовая медицина. 1993, 69 (4): 265-269.
CAS PubMed PubMed Central Google Scholar
- 6.
Коэн CR, Manhart LE, Bukusi EA, Astete S, Brunham RC, Holmes KK, Sinei SK, Bwayo JJ, Totten PA: Связь между Mycoplasma genitalium и острым эндометритом. Ланцет. 2002, 359 (9308): 765-766. 10.1016 / S0140-6736 (02) 07848-0.
Артикул PubMed Google Scholar
- 7.
Clausen H, Fedder J, Drasbek M, Nielsen P, Toft B, Ingerslev H, Birkelund S, Christiansen G: Серологическое исследование Mycoplasma genitalium у бесплодных женщин. Репродукция человека. 2001, 16 (9): 1866-1874. 10.1093 / humrep / 16.9.1866.
CAS Статья PubMed Google Scholar
- 8.
Mavedzenge N: Ассоциация Mycoplasma genitalium и ВИЧ-инфекции: систематический обзор и метаанализ.СПИД. 2009, 23 (5): 611-10.1097 / QAD.0b013e328323da3e.
Артикул Google Scholar
- 9.
Манхарт Л. Е., Холмс К. К., Хьюз Дж. П., Хьюстон Л. С., Тоттен, Пенсильвания: Mycoplasma genitalium среди молодых людей в США: возникающая инфекция, передаваемая половым путем. Американский журнал общественного здравоохранения. 2007, 97 (6): 1118-1125. 10.2105 / AJPH.2005.074062.
Артикул PubMed PubMed Central Google Scholar
- 10.
Андерсен Б., Соколовски И., Остергаард Л., Мёллер Дж. К., Олесен Ф., Йенсен Дж. С.: Mycoplasma genitalium : распространенность и поведенческие факторы риска в общей популяции. Инфекции, передающиеся половым путем.
 2007, 83 (3): 237-241. 10.1136 / sti.2006.022970.
2007, 83 (3): 237-241. 10.1136 / sti.2006.022970.Артикул PubMed Google Scholar
- 11.
Hay PE, Окшотт П., Керри С., Агаизу А., Атертон Х., Тейлор-Робинсон Д., Симмс И., Рид Ф., Дж. С.. Дж .: Является ли Mycoplasma genitalium у женщин «новым хламидиозом»? Распространенность на уровне сообществ и проспективное когортное исследование.ISSTDR: 2009. Лондон, Великобритания. 2009
Google Scholar
- 12.
Carlsen KH, Jensen JS: Mycoplasma genitalium ПЦР: влияет ли замораживание образцов на чувствительность ?. Журнал клинической микробиологии. 2010, 48 (10): 3624-3627. 10.1128 / JCM.00232-10.
Артикул PubMed PubMed Central Google Scholar
- 13.
Walker J, Fairley CK, Urban E, Chen MY, Bradshaw CS, Walker S, Donovan B, Tabrizi S, McNamee K, Currie M и др .: Методы максимального удержания в продольном исследовании молодых женщин : австралийская потенциальная когорта.ISSTDR. Лондон, Великобритания, 2009
Google Scholar
- 14.
Йошида Т., Дегучи Т., Ито М., Маэда С., Тамаки М., Исико Х .: Количественное определение Mycoplasma genitalium в моче первого прохождения у мужчин с уретритом и бессимптомных мужчин с помощью ПЦР в реальном времени. Журнал клинической микробиологии. 2002, 40 (4): 1451-1455. 10.1128 / JCM.40.4.1451-1455.2002.
CAS Статья PubMed PubMed Central Google Scholar
- 15.
Резник Р., Корнелиссен М., Райт Д., Эйхингер Г., Фокс Н., Шеггет Дж., Манос М.: Обнаружение и типирование вируса папилломы человека в архивных образцах рака шейки матки путем амплификации ДНК с консенсусными праймерами. Журнал JNCI Национального института рака. 1990, 82 (18): 1477-10.1093 / jnci / 82.18.1477.
CAS Статья PubMed Google Scholar
- 16.

Jensen JS, Uldum SA, Sondergard-Andersen J, Vuust J, Lind K: Полимеразная цепная реакция для обнаружения Mycoplasma genitalium в клинических образцах.Журнал клинической микробиологии. 1991, 29 (1): 46-50.
CAS PubMed PubMed Central Google Scholar
- 17.
Jensen JS, Bjornelius E, Dohn B, Lidbrink P: Использование 5 ‘нуклеазы TaqMan 5’ ПЦР в реальном времени для количественного определения ДНК Mycoplasma genitalium у мужчин с уретритом и без него, посетивших клинику по лечению заболеваний, передающихся половым путем . Журнал клинической микробиологии. 2004, 42 (2): 683-692. 10.1128 / JCM.42.2.683-692.2004.
CAS Статья PubMed PubMed Central Google Scholar
- 18.
Twin J, Taylor N, Garland SM, Hocking JS, Walker J, Bradshaw CS, Fairley CK, Tabrizi SN: Сравнение двух методик обнаружения полимеразной цепной реакции Mycoplasma genitalium в реальном времени. Журнал клинической микробиологии. 2011, JCM.02328-02310
Google Scholar
- 19.
Стивенс М.П., Близнец Дж., Фэрли К.К., Донован Б., Тан С.Е., Ю Дж., Гарланд С.М., Табризи С.Н.: Разработка и оценка количественного ПЦР-анализа в реальном времени ompA для определения Chlamydia trachomatis и серовара. Журнал клинической микробиологии. 2010, 48 (6): 2060-10.1128 / JCM.02308-09.
CAS Статья PubMed PubMed Central Google Scholar
- 20.
Стивенс М.П., Табризи С.Н., Мюллер Р., Краузе В., Гарланд С.М.: Характеристика генотипов Chlamydia trachomatis omp1, обнаруженных в образцах мазков из глаз в отдаленных австралийских общинах.Журнал клинической микробиологии. 2004, 42 (6): 2501-10.1128 / JCM.42.6.2501-2507.2004.
CAS Статья PubMed PubMed Central Google Scholar
- 21.

Edberg A, Jurstrand M, Johansson E, Wikander E, Hoog A, Ahlqvist T, Falk L, Jensen JS, Fredlund H: сравнительное исследование трех различных ПЦР-тестов для обнаружения Mycoplasma genitalium в урогенитальных образцы от мужчин и женщин. Журнал медицинской микробиологии.2008, 57 (3): 304-10.1099 / jmm.0.47498-0.
CAS Статья PubMed Google Scholar
- 22.
Австралазийский колледж врачей сексуального здоровья: Клинические рекомендации по ведению инфекций, передаваемых половым путем, среди приоритетных групп населения. По состоянию на 2005 год [онлайн], [http://www.ashm.org.au]
- 23.
Mena LA, Mroczkowski TF, Nsuami M, Martin DH: рандомизированное сравнение азитромицина и доксициклина для лечения микоплазмы genitalium — положительный уретрит у мужчин.Клинические инфекционные болезни. 2009, 48 (12): 10.1086 / 599033.
- 24.
Bradshaw CS, Chen MY, Fairley CK: Персистенция Mycoplasma genitalium после терапии азитромицином. PLoS One. 2008, 3 (11): 10.1371 / journal.pone.0003618.
- 25.
Stata Corporation: Статистическое программное обеспечение Stata: выпуск 10.2. 2007, Колледж-Стейшн, Техас: StatCorp, 10.0
Google Scholar
- 26.
Австралийское статистическое бюро: перепись 2006 г.2006, Канберра: Австралийское Содружество
Google Scholar
- 27.
Смит AMA, Rissel CE, Richters J, Grulich AE, de Visser RO: Секс в Австралии: обоснование и методы австралийского исследования здоровья и взаимоотношений. Австралийский и новозеландский журнал общественного здравоохранения. 2003, 27 (2): 106-117. 10.1111 / j.1467-842X.2003.tb00797.x.
Артикул PubMed Google Scholar
- 28.
Пепин Дж., Лаббе А.С., Хонде Н., Десландес С., Алари М., Дзокото А., Асамоа-Аду С.
 , Меда Х, Фрост Е: Mycoplasma genitalium : организм, обычно связанный с цервицитом среди секс-работников Западной Африки. Инфекции, передаваемые половым путем. 2005, 81 (1): 67-72. 10.1136 / ст.2003.009100.
, Меда Х, Фрост Е: Mycoplasma genitalium : организм, обычно связанный с цервицитом среди секс-работников Западной Африки. Инфекции, передаваемые половым путем. 2005, 81 (1): 67-72. 10.1136 / ст.2003.009100.CAS Статья Google Scholar
- 29.
Anagrius C, Lore B, Jensen JS: Mycoplasma genitalium: распространенность, клиническое значение и передача.Инфекции, передающиеся половым путем. 2005, 81 (6): 458-462. 10.1136 / sti.2004.012062.
CAS Статья PubMed PubMed Central Google Scholar
- 30.
Gomes J, Borrego M, Atik B, Santo I, Azevedo J, Brito de Sá A, Nogueira P, Dean D: Корреляция инфекционной нагрузки Chlamydia trachomatis с урогенитальным экологическим успехом и патогенезом заболевания. Микробы и инфекции. 2006, 8 (1): 16-26. 10.1016 / j.micinf.2005.05.014.
CAS Статья PubMed Google Scholar
- 31.
Korte JE, Baseman JB, Cagle MP, Herrera C, Piper JM, Holden AEC, Perdue ST, Champion JD, Shain RN: Цервицит и симптомы мочеполовой системы у женщин с положительным результатом посева на Mycoplasma genitalium . Американский журнал репродуктивной иммунологии. 2006, 55 (4): 265-10.1111 / j.1600-0897.2005.00359.x.
Артикул PubMed Google Scholar
- 32.
Ginige S, Chen MY, Hocking JS, Read TR, Fairley CK: потребление антибиотиков и распространенность хламидиоза в международных исследованиях. Сексуальное здоровье. 2006, 3 (4): 221-10.1071 / SH06013.
Артикул PubMed Google Scholar
- 33.
Bradshaw CS, Jensen JS, Tabrizi SN, Read TR, Garland SM, Hopkins CA, Moss LM, Fairley CK: отсутствие азитромицина при уретрите Mycoplasma genitalium. Возникающие инфекционные заболевания. 2006, 12 (7): 1149-1152.
CAS Статья PubMed PubMed Central Google Scholar
- 34.

Bjornelius E, Anagrius C, Bojs G, Carlberg H, Johannisson G, Johansson E, Moi H, Jensen JS, Lidbrink P: Лечение антибиотиками симптоматической инфекции Mycoplasma genitalium в Скандинавии: контролируемое клиническое испытание. Инфекции, передающиеся половым путем. 2008, 84 (1): 72-76. 10.1136 / sti.2007.027375.
CAS Статья PubMed Google Scholar
- 35.
Национальный центр эпидемиологии и клинических исследований ВИЧ Университет Нового Южного Уэльса: Вирусные инфекции, передаваемые с кровью, и инфекции, передаваемые половым путем у аборигенов и жителей островов Торресова пролива: отчет по эпиднадзору и оценке за 2010 г., Сидней, 2010 г.: Национальный центр эпидемиологии и клинических исследований ВИЧ
Google Scholar
- 36.
Batteiger B, Xu F, Johnson R, Rekart M: Защитный иммунитет к Chlamydia trachomatis генитальная инфекция: данные исследований на людях.Журнал инфекционных болезней. 2010, 201: 178-189. 10.1086 / 652400.
Артикул Google Scholar
- 37.
Смит А., Агиус П., Барретт С., Митчелл А., Питтс М.: Студенты средней школы и сексуальное здоровье, 2008 г. 2009 г., Мельбурн: Австралийский исследовательский центр по вопросам секса, здоровья и общества, Университет Латроб
Google Scholar
- 38.
LaMontagne D, Patrick E, Fine DN, Marrazzo J: Переоценка критериев выборочного скрининга на хламидийную инфекцию среди женщин в U.С. Тихоокеанский Северо-запад. Заболевания, передающиеся половым путем. 2004, 31 (5): 283-289. 10.1097 / 01.OLQ.0000124613.85111.6B.
Артикул Google Scholar
- 39.
Миллер В.С., Форд Калифорния, Моррис М., Хэндкок М.С., Шмитц Дж. Л., Хоббс М. М., Коэн М. С., Харрис К. М., Удри Дж. Р.: Распространенность хламидийных и гонококковых инфекций среди молодых людей в Соединенных Штатах.
 Журнал Американской медицинской ассоциации. 2004, 291 (18): 2229-2236. 10.1001 / jama.291.18.2229.
Журнал Американской медицинской ассоциации. 2004, 291 (18): 2229-2236. 10.1001 / jama.291.18.2229.CAS Статья Google Scholar
- 40.
Low N, McCarthy A, Macleod J, Salisbury C, Horner PJ, Roberts TE, Campbell R, Herring A, Skidmore S, Sanford E, et al: Скрининговые исследования хламидий: обоснование и дизайн. Инфекции, передающиеся половым путем. 2004, 80: 342-348. 10.1136 / sti.2003.006197.
CAS Статья PubMed PubMed Central Google Scholar
- 41.
Fenton K, Copas A, Mitchell K, Elam G, Carder C, Ridgway G, Wellings K, Erens B, Field J, Johnson A: Допустимость тестирования LCR в моче на Chlamydia trachomatis среди участников вероятностного выборочного обследования сексуальные отношения и образ жизни. Инфекции, передающиеся половым путем. 2001, 77: 194-198. 10.1136 / sti.77.3.194.
CAS Статья PubMed PubMed Central Google Scholar
- 42.
Листер Н., Чавес Н., Панг С., Смит А., Фэрли С. Клиническое значение аноректальных симптомов, выявленных в анкетном опросе или клинически зарегистрированных аноректальных симптомов для прямой кишки. .Сексуальное здоровье. 2008, 5: 77-82. 10.1071 / SH07068.
Артикул PubMed Google Scholar
- 43.
Morré SA, Rozendaal L, Van Valkengoed IGM, Boeke AJP, van Voorst Vader PC, Schirm J, De Blok S, Van den Hoek JAR, Van Doornum GJJ, Meijer C: Urogenital Chlamydia trachomatis serovars мужчины и женщины с симптоматической или бессимптомной инфекцией: связь с клиническими проявлениями ?. Журнал клинической микробиологии.2000, 38 (6): 2292-
PubMed PubMed Central Google Scholar
- 44.
Уильямс Х., Табризи С.Н., Ли В., Ковач Г.Т., Гарланд С. Подростковый возраст и другие факторы риска Chlamydia trachomatis мочеполовой инфекции у женщин в Мельбурне, Австралия.
 Инфекции, передающиеся половым путем. 2003, 79: 31-34. 10.1136 / sti.79.1.31.
Инфекции, передающиеся половым путем. 2003, 79: 31-34. 10.1136 / sti.79.1.31.CAS Статья PubMed PubMed Central Google Scholar
- 45.
Heal C, Jones B, Veitch C, Lamb S, Hodgens S, Browning S, Butler H, Carey M: Скрининг на хламидиоз в общей практике. Австралийский семейный врач. 2002, 31 (8): 779-782.
PubMed Google Scholar
- 46.
Pimenta J, Catchpole M, Rogers P, Perkins E, Jackson N, Carlisle C, Randall S, Hopwood J, Hewitt G, Underhill G и др.: Оппортунистический скрининг на генитальную хламидийную инфекцию. 1: Доступность анализа мочи в учреждениях первичной и вторичной медико-санитарной помощи.Инфекции, передающиеся половым путем. 2003, 79: 16-21. 10.1136 / sti.79.1.16.
CAS Статья PubMed PubMed Central Google Scholar
- 47.
Haggerty CL: Доказательства роли Mycoplasma genitalium в воспалительных заболеваниях органов малого таза. Современные взгляды на инфекционные болезни. 2008, 21 (1): 65-69. 10.1097 / QCO.0b013e3282f3d9ac.
Артикул Google Scholar
- Водянистые выделения из полового члена
- Жжение, покалывание или боль при мочеиспускании
- Выделения из влагалища
- Боль во время секса
- Кровотечение после секса
- Между менструальным кровотечением
- Боль в области таза под пупком
- Aavitsland, Tidsskr Nor Legeforen, 2016
- Jurstrand, J Med Microbiol, 2005. PMID: 155
- Manhart, Clin Infect Dis, 2011. PMID: 22080266
- Hunt, сайт, 2016
- Зуд влагалища
- Жжение при мочеиспускании
- Боль во время полового акта
- Кровотечение между менструациями или после секса
- При бактериальном вагинозе, рыбном запахе после секса и изменениях выделений из влагалища
- Выделения из уретры
- Жжение при мочеиспускании
- Боль и припухлость суставов (артрит)
Является ли Mycoplasma genitalium у женщин «новым хламидиозом»? Перспективное когортное исследование на уровне сообществ | Клинические инфекционные болезни
Аннотация
Фон. Роль Mycoplasma genitalium в воспалительных заболеваниях органов малого таза неясна. Мы провели когортное исследование, чтобы определить распространенность и предикторы инфекции M. genitalium у студенток, изучить ее роль в воспалительных заболеваниях органов малого таза и оценить ежегодную заболеваемость и уровень стойкости.
Методы. Две тысячи триста семьдесят восемь многонациональных сексуально активных студенток (средний возраст 21 год) предоставили дубликаты взятых самостоятельно вагинальных проб для скринингового исследования на хламидиоз. Из этой популяции 2246 (94%) наблюдались через 12 месяцев и оценивали частоту клинических воспалительных заболеваний органов малого таза. Кроме того, 900 женщин (38%) отправили образцы для последующего наблюдения через почтовую службу через 11–32 месяца после набора. Сохраненные образцы были протестированы на M. genitalium .
Из этой популяции 2246 (94%) наблюдались через 12 месяцев и оценивали частоту клинических воспалительных заболеваний органов малого таза. Кроме того, 900 женщин (38%) отправили образцы для последующего наблюдения через почтовую службу через 11–32 месяца после набора. Сохраненные образцы были протестированы на M. genitalium .
Результаты. Распространенность M. genitalium на исходном уровне составляла 3,3% (78 из 2378 женщин; 95% доверительный интервал [ДИ], 2,6–4,1%). Инфекция чаще встречалась у женщин, у которых в прошлом году было ≥2 половых партнеров, у женщин с бактериальным вагинозом, у женщин в возрасте <18 лет, у женщин чернокожей национальности и курящих.Множественные партнеры и бактериальный вагиноз были независимыми факторами риска для M. genitalium (скорректированный коэффициент риска, 2,23 [95% ДИ, 1,39–3,58] и 2,54 [95% ДИ, 1,61–4,01], соответственно). Частота воспалительных заболеваний органов малого таза в течение 12 месяцев составила 3,9% (3 из 77 женщин) среди женщин с инфекцией M. genitalium по сравнению с 1,7% (36 из 2169 женщин) среди женщин без инфекции (соотношение рисков 2,35; 95% CI 0,74–7,46; P = 0,14). Ежегодная заболеваемость инфекцией M. genitalium у 873 женщин без M.genitalium исходно у тех, кто вернул образцы по почте, было 0,9% (95% ДИ, 0,5% –1,6%). Семь (26%; 95% ДИ, 9–43%) из 27 женщин с инфекцией M. genitalium на исходном уровне оставались положительными через 12–21 месяцев; Результаты генотипирования позволяют предположить, что это были хронические инфекции.
Выводы. Инфекция M. genitalium вряд ли станет основным фактором риска клинических воспалительных заболеваний органов малого таза в этой популяции.
Mycoplasma genitalium — это возбудитель, передающийся половым путем [1, 2], вызывающий уретрит у мужчин [3, 4] и уретрит и цервицит у женщин [1, 5, 6]. Подобно Chlamydia trachomatis, инфекция у женщин часто протекает бессимптомно [6–8]. Однако в Соединенном Королевстве нет данных о распространенности инфекции M. genitalium среди женщин в обществе, а ее естественное течение и роль в воспалительных заболеваниях органов малого таза (ВЗТ) неясны [9–11]. С.trachomatis и Neisseria gonorrhoeae — известные причины ВЗОМТ, которые поражают более 1 миллиона американских женщин ежегодно и могут привести к бесплодию или внематочной беременности. Однако до 70% случаев ВЗОМТ патогены не обнаруживаются [9]. Может ли инфекция M. genitalium объяснить некоторые из них?
Подобно Chlamydia trachomatis, инфекция у женщин часто протекает бессимптомно [6–8]. Однако в Соединенном Королевстве нет данных о распространенности инфекции M. genitalium среди женщин в обществе, а ее естественное течение и роль в воспалительных заболеваниях органов малого таза (ВЗТ) неясны [9–11]. С.trachomatis и Neisseria gonorrhoeae — известные причины ВЗОМТ, которые поражают более 1 миллиона американских женщин ежегодно и могут привести к бесплодию или внематочной беременности. Однако до 70% случаев ВЗОМТ патогены не обнаруживаются [9]. Может ли инфекция M. genitalium объяснить некоторые из них?
Инокуляция M. genitalium обезьянам может привести к цервициту и сальпингиту [3, 12]. У людей перекрестные исследования показали, что M. genitalium связано с ВЗОМТ [12–14].Микроорганизм был обнаружен в образцах эндометрия и маточных труб женщин с острой тазовой инфекцией [15]. Однако 2 проспективных исследования были либо небольшими [16], либо краткосрочными [17], и никаких проспективных исследований с участием женщин, набранных за пределами медицинских учреждений, не проводилось.
Ввиду продолжающихся споров об эффективности скрининга на хламидиоз [18], крайне важно создать доказательную базу воздействия новых бактериальных инфекций, передаваемых половым путем, таких как M.genitalium , прежде чем сформулировать политику. Несмотря на растущий интерес [7, 19] и продолжающуюся разработку коммерческих тестов [10], тестирование на M. genitalium не является рутинным в большинстве стран Европы и США.
Мы использовали дубликаты сохраненных вагинальных мазков из нашего исследования по скринингу на хламидиоз для предотвращения ВЗОМТ [20], чтобы исследовать распространенность и предикторы M. genitalium у 2378 студенток, набранных в Лондоне в 2004–2006 годах. Участники были случайным образом распределены для скрининга и лечения хламидиоза или отложенного скрининга через 12 месяцев и наблюдались через год.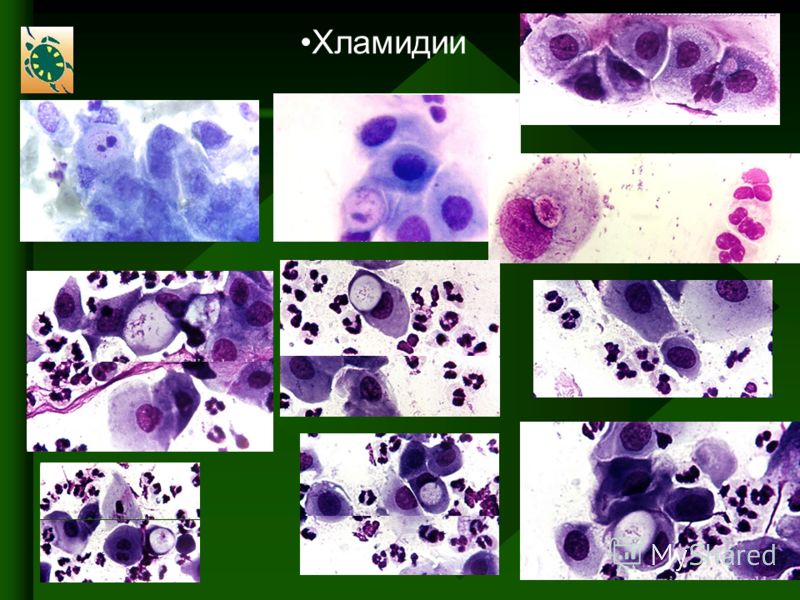 Тестирование сохраненных образцов для M. genitalium также позволило нам изучить его роль в развитии клинической ВЗОМТ. Кроме того, мы получили мазки для последующего наблюдения через почтовую службу через 1-2 года, чтобы оценить частоту инфекции M. genitalium и частоту персистирующей инфекции.
Тестирование сохраненных образцов для M. genitalium также позволило нам изучить его роль в развитии клинической ВЗОМТ. Кроме того, мы получили мазки для последующего наблюдения через почтовую службу через 1-2 года, чтобы оценить частоту инфекции M. genitalium и частоту персистирующей инфекции.
Методы
Дизайн и методы набора участников скринингового исследования по профилактике тазовых инфекций (POPI) на хламидиоз описаны в других источниках [21, 22].Вкратце, 2529 студенток были приняты на работу из 20 лондонских университетов и колледжей дополнительного образования. Учащиеся имели право принять участие, если они были в возрасте ≤27 лет, вели половую жизнь, не были беременны и не проходили тестирование на C. trachomatis в течение последних 3 месяцев. Участников попросили заполнить анкету и предоставить взятые самостоятельно вагинальные образцы. Они также согласились вернуть дополнительные образцы по почте, заполнить еще одну анкету через 12 месяцев и предоставить доступ к своим медицинским картам.Базовый опросник включал демографические данные, сексуальный анамнез и симптомы. Два самостоятельно взятых вагинальных мазка помещали в транспортную среду Aptima (Gen-Probe). Один мазок был использован в скрининговом исследовании C. trachomatis [22]. Другой катали по предметному стеклу для анализа на бактериальный вагиноз [20], помещали в транспортную среду Aptima, а затем хранили при -80 ° C и тестировали на M. genitalium в текущем исследовании. 151 студент (6%) предоставил только 1 базовый мазок, оставив 2378 участников, которые были включены в это исследование.Исследование было одобрено Комитетом по этике исследований Бромли (ссылка 07 / Q0705 / 16).
Двенадцатимесячное наблюдение и повторные почтовые пробы. На рисунке 1 показан дизайн когортного исследования M. genitalium . Последующее наблюдение осуществлялось посредством электронной почты или анкеты почтовой службы с телефонными звонками.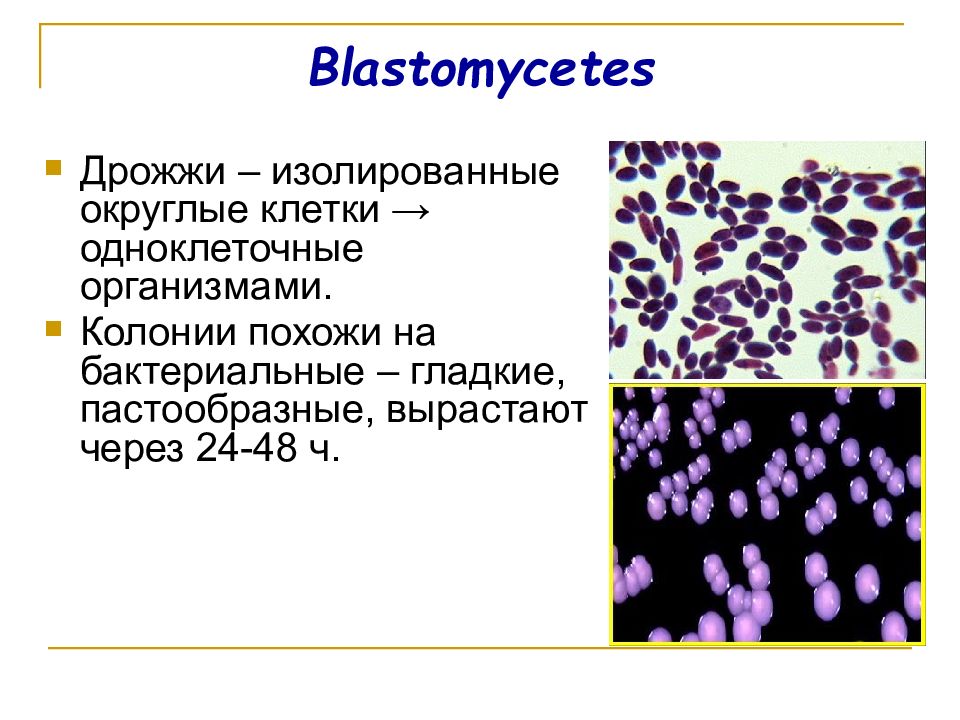 В анкете последующего наблюдения спрашивалось о развитии ВЗОМТ или связанных с ним симптомов за последние 12 месяцев. Для женщин с возможным ВЗОМТ и тех, кто не прислал анкеты, мы провели поиск клинических деталей в записях врача общей практики и / или в больничных записях [22].Мы также провели поиск в истории болезни среди 65 женщин, которые сообщили, что им поставили диагноз хламидийной инфекции в течение 12-месячного периода наблюдения. Кроме того, участникам, согласившимся вернуть их, через 1-2 года после приема на работу были отправлены дубликаты повторных мазков для возврата через почтовую службу. Один мазок был немедленно проверен на хламидиоз, и результат был возвращен участнику. Другой был сохранен и проанализирован в текущем исследовании, что позволило провести повторное тестирование для M. genitalium .
В анкете последующего наблюдения спрашивалось о развитии ВЗОМТ или связанных с ним симптомов за последние 12 месяцев. Для женщин с возможным ВЗОМТ и тех, кто не прислал анкеты, мы провели поиск клинических деталей в записях врача общей практики и / или в больничных записях [22].Мы также провели поиск в истории болезни среди 65 женщин, которые сообщили, что им поставили диагноз хламидийной инфекции в течение 12-месячного периода наблюдения. Кроме того, участникам, согласившимся вернуть их, через 1-2 года после приема на работу были отправлены дубликаты повторных мазков для возврата через почтовую службу. Один мазок был немедленно проверен на хламидиоз, и результат был возвращен участнику. Другой был сохранен и проанализирован в текущем исследовании, что позволило провести повторное тестирование для M. genitalium .
Рисунок 1.
Поток участников через исследование.
Рисунок 1.
Поток участников через исследование.
Диагностика возможного PID. Поскольку было бы неэтично требовать лапароскопической диагностики, мы использовали модифицированные клинические критерии Хагера [23] и рекомендации Центров по контролю и профилактике заболеваний [24] для диагностики ВЗОМТ. К ним относятся боль в области таза, болезненность при движении шейки матки и болезненность матки или придатков.Женщины также были классифицированы как имеющие ВЗОМТ, если их лечил врач от ВЗОМТ [20]. Чтобы уменьшить систематическую ошибку, подтверждение диагноза было выполнено путем анализа всех данных (анкеты, подкрепленные медицинскими записями) двумя врачами (решено третьим в случае разногласий), которые не знали исходных результатов бактериологических тестов [22]. Мы включили пациентов с ВЗОМТ, у которых развились симптомы или которые были осмотрены медицинским работником в течение 12-месячного периода наблюдения.
Тестирование M.Гениталии . В течение 2008–2009 годов вагинальные мазки транспортировались на сухом льду в Данию. ДНК экстрагировали из 200 мкл транспортной среды Aptima с использованием набора DNeasy Blood & Tissue Kit (Qiagen) и тестировали с помощью контролируемого ингибитором количественного анализа полимеразной цепной реакции, выявляющего ген адгезина MgPa M. genitalium [25]. . Все положительные результаты были подтверждены второй полимеразной цепной реакцией, выявляющей ген рибосомной РНК 16S [26]. Типирование M.genitalium [2] использовался для различения стойких и новых инфекций в контрольных образцах. Мутации в области V гена рибосомной РНК M. genitalium 23S, приводящие к устойчивости к макролидным антибиотикам, были обнаружены путем секвенирования ДНК ампликонов полимеразной цепной реакции, как описано в другом месте [27].
ДНК экстрагировали из 200 мкл транспортной среды Aptima с использованием набора DNeasy Blood & Tissue Kit (Qiagen) и тестировали с помощью контролируемого ингибитором количественного анализа полимеразной цепной реакции, выявляющего ген адгезина MgPa M. genitalium [25]. . Все положительные результаты были подтверждены второй полимеразной цепной реакцией, выявляющей ген рибосомной РНК 16S [26]. Типирование M.genitalium [2] использовался для различения стойких и новых инфекций в контрольных образцах. Мутации в области V гена рибосомной РНК M. genitalium 23S, приводящие к устойчивости к макролидным антибиотикам, были обнаружены путем секвенирования ДНК ампликонов полимеразной цепной реакции, как описано в другом месте [27].
Статистический анализ. Размер выборки для этого исследования был ограничен 2500 женщинами, которые, как ожидалось, будут включены в скрининговое исследование на хламидиоз [22].Мы предположили, что распространенность M. genitalium на исходном уровне будет составлять примерно половину 5,8% распространенности хламидиоза (т.е. 3%; 95% доверительный интервал [ДИ] 2,4–3,8%) [20]. Мы предположили, что 30% когорты были чернокожими, что позволило бы нам выявить разницу в распространенности M. genitalium на 4,9% у чернокожих женщин по сравнению с 2,5% в остальных, с 80% достоверностью и 5. % значимость. χ 2 тестов были использованы для изучения взаимосвязи между M.genitalium на исходном уровне и (1) исходные предикторы инфекции и (2) развитие ВЗОМТ или связанных с ним симптомов в течение 12 месяцев. Результаты были представлены как относительный риск, а скорректированные риски были рассчитаны с использованием биноминальной регрессии. Мы использовали точные методы [28] для оценки относительного риска заражения.
Результаты
Последующие действия. Из 2529 женщин, включенных в исследование, 2378 (94%) предоставили дубликаты образцов на исходном уровне и включены в это исследование.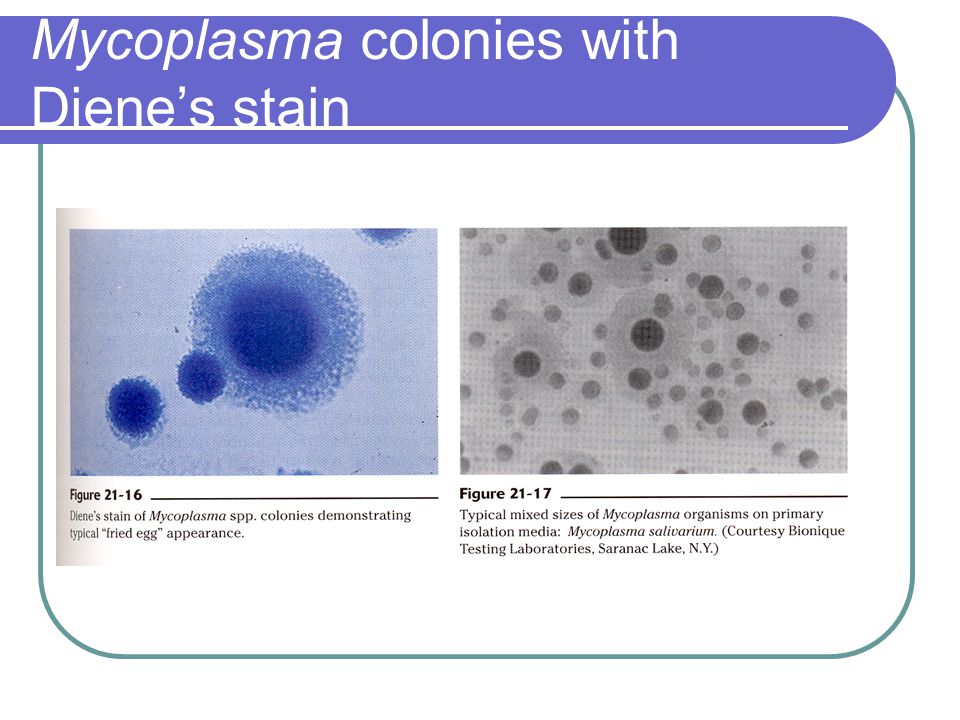 Уровень последующего наблюдения через 12 месяцев составил 94% (2246 из 2378 женщин), и 900 (38%) женщин вернули образцы через почтовую службу через 11–32 месяцев. Женщины, которые не предоставили дубликаты образцов на исходном уровне, были немного моложе при последующем наблюдении. Из 2529 женщин, включенных в исследование, 2378 (94%) предоставили дубликаты образцов на исходном уровне и включены в это исследование. Уровень последующего наблюдения через 12 месяцев составил 94% (2246 из 2378 женщин), и 900 (38%) женщин вернули образцы через почтовую службу через 11–32 месяца.Женщины, которые не предоставили дубликаты образцов на исходном уровне, были немного моложе (средний возраст ± стандартное отклонение [SD], 20,4 ± 2,8 против 20,9 ± 2,8 года; P <0,05) и с большей вероятностью принадлежали к чернокожей национальности, чем те, кто это сделал. предоставить повторяющиеся образцы (54 [36%] из 149 против 634 [27%] из 2363 женщин; P <0,05). То же самое относится к женщинам, которые были потеряны для последующего наблюдения или которые не отправили повторные образцы через почтовую службу (данные не показаны).
Уровень последующего наблюдения через 12 месяцев составил 94% (2246 из 2378 женщин), и 900 (38%) женщин вернули образцы через почтовую службу через 11–32 месяцев. Женщины, которые не предоставили дубликаты образцов на исходном уровне, были немного моложе при последующем наблюдении. Из 2529 женщин, включенных в исследование, 2378 (94%) предоставили дубликаты образцов на исходном уровне и включены в это исследование. Уровень последующего наблюдения через 12 месяцев составил 94% (2246 из 2378 женщин), и 900 (38%) женщин вернули образцы через почтовую службу через 11–32 месяца.Женщины, которые не предоставили дубликаты образцов на исходном уровне, были немного моложе (средний возраст ± стандартное отклонение [SD], 20,4 ± 2,8 против 20,9 ± 2,8 года; P <0,05) и с большей вероятностью принадлежали к чернокожей национальности, чем те, кто это сделал. предоставить повторяющиеся образцы (54 [36%] из 149 против 634 [27%] из 2363 женщин; P <0,05). То же самое относится к женщинам, которые были потеряны для последующего наблюдения или которые не отправили повторные образцы через почтовую службу (данные не показаны).
Распространенность инфекции на исходном уровне. Распространенность M. genitalium на исходном уровне составляла 3,3% (95% ДИ, 2,6–4,1%; 78 из 2378 женщин). Распространенность C. trachomatis составила 5,8% (95% ДИ, 4,9–6,8%; 137 из 2377 женщин), а у 8 женщин (0,3%) были двойные инфекции. Из 2254 слайдов, доступных для анализа, 459 (20,4%; 95% ДИ, 18,7–22,1%) были положительными на бактериальный вагиноз по критериям Ньюджента. Распространенность N. gonorrhoeae составила 0,3% (95% ДИ, 0,2–0,7%; 8 из 2369 женщин).
М.genitalium чаще встречалась у женщин, у которых в прошлом году было ≥2 партнеров (Таблица 1). Уровень позитивности у тех, у кого было 0, 1, 2, 12 партнеров, соответственно, составил 1,2% (1 из 87), 2,0% (25 из 1255), 3,8% (20 из 528) и 6,5% (32 из 493 женщин). ; P <0,001). Кроме того, M. genitalium чаще встречалась у женщин с бактериальным вагинозом, у женщин моложе 18 лет, у женщин чернокожей национальности и у курильщиков. Многофакторный анализ показал, что ≥2 партнеров за предыдущие 12 месяцев и бактериальный вагиноз были независимыми прогностическими факторами инфекции.
; P <0,001). Кроме того, M. genitalium чаще встречалась у женщин с бактериальным вагинозом, у женщин моложе 18 лет, у женщин чернокожей национальности и у курильщиков. Многофакторный анализ показал, что ≥2 партнеров за предыдущие 12 месяцев и бактериальный вагиноз были независимыми прогностическими факторами инфекции.
Таблица 1.
Демографические характеристики, сексуальный образ жизни и коинфекция у 2378 женщин по данным Mycoplasma genitalium Статус на исходном уровне
Таблица 1.
Демографические характеристики, сексуальный образ жизни и коинфекция у 2378 женщин по данным Mycoplasma Статус на исходном уровне
Развитие возможного ВЗОМТ в соответствии с исходным уровнем M. genitalium Статус у 2246 женщин с данными наблюдения в течение 12 месяцев. У 39 женщин (1,7%) развились клинические ВЗОМТ в течение 12 месяцев, из которых 3 (8%) имели M. genitalium (но были отрицательными по хламидиозу) на исходном уровне. Частота ВЗОМТ у женщин с M. genitalium и без него на исходном уровне составляла 3,9% (3 из 77 женщин) и 1,7% (36 из 2169 женщин), соответственно (относительный риск 2,35; 95% ДИ 0,74–7,46; P = 0,14). Инфекция M. genitalium на исходном уровне не была связана с развитием симптомов (аномальные выделения из влагалища, боль в области таза, диспареуния или межменструальное кровотечение) в течение последующих 12 месяцев.
Заболеваемость инфекцией M. genitalium у 873 женщин, отправивших образцы для последующего наблюдения через почтовую службу. Частота возникновения инфекции M. genitalium у женщин без M. genitalium , выявленных на исходном уровне, составила 1,26% (95% ДИ, 0,63–2,24%; 11 из 873 женщин). Принимая во внимание время выборки для последующего наблюдения (среднее время после набора, 16 месяцев; диапазон, 11–32 месяца), годовая частота инфицирования составила 0.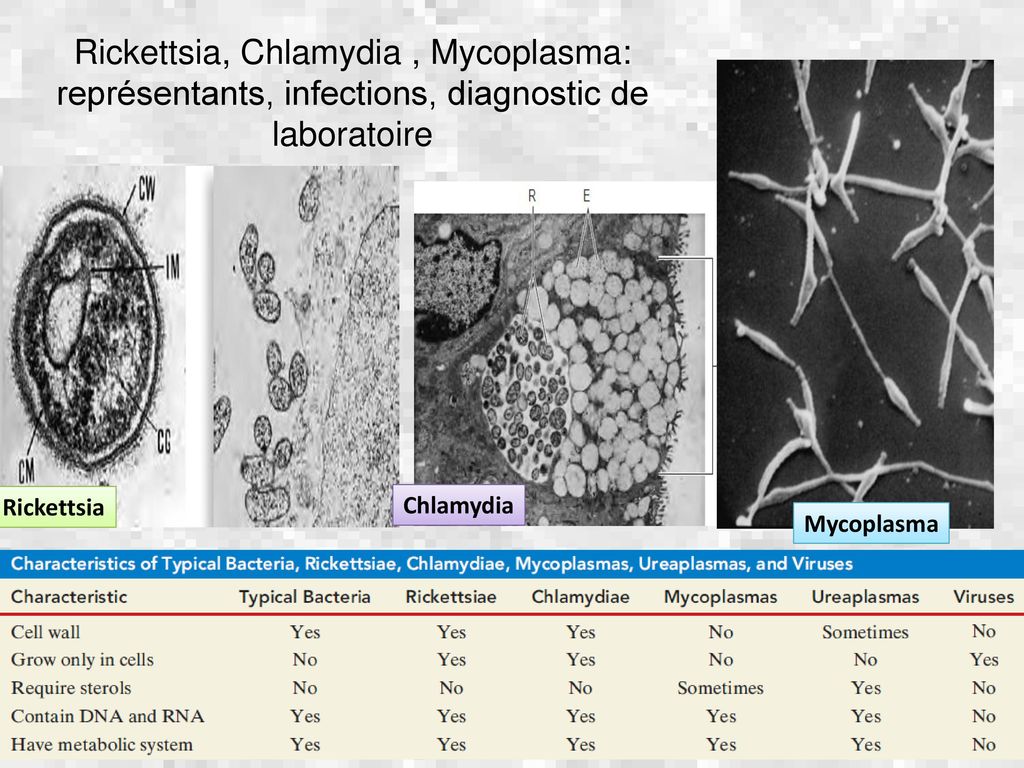 91% (95% ДИ, 0,46–1,63%). Тремя значимыми предикторами инфекции были исходный бактериальный вагиноз, чернокожая этническая принадлежность и наличие ≥2 партнеров за предыдущие 12 месяцев (таблица 2).
91% (95% ДИ, 0,46–1,63%). Тремя значимыми предикторами инфекции были исходный бактериальный вагиноз, чернокожая этническая принадлежность и наличие ≥2 партнеров за предыдущие 12 месяцев (таблица 2).
Таблица 2.
Факторы риска для инцидента Mycoplasma genitalium Инфекция у 873 M. genitalium -Отрицательные женщины, которые вернули повторную почтовую пробу через 16 месяцев в среднем
Таблица 2.
Факторы риска инцидента Mycoplasma genitalium Инфекция в 873 M.genitalium -отрицательные женщины, которые отправили повторную почтовую пробу в среднем через 16 месяцев
Персистентность M. genitalium инфекция . Из 27 женщин с M. genitalium, выявленных на исходном уровне, которые вернули повторные образцы, у 7 (25,9%; 95% ДИ, 9,4–42,5%) были положительные результаты через 12–21 месяц (в среднем 16 месяцев). Типирование последовательности ДНК 7 парных образцов продемонстрировало тот же штамм M. genitalium , что позволяет предположить, что это были стойкие инфекции.Кроме того, все M. genitalium -положительных образцов, исследованных на мутацию, опосредующую устойчивость к макролидам, несли последовательность гена рибосомной РНК 23S дикого типа, что позволяет предположить, что штаммы были чувствительны к макролидам.
Сравнение M. genitalium с инфекцией C. trachomatis . Исходная распространенность C. trachomatis была выше, чем M.гениталии . Кроме того, C. trachomatis сильнее ассоциировалось с ВЗОМТ, чем M. genitalium . Среди женщин в группе отложенного скрининга, предоставивших дубликаты образцов и имевших недиагностированную хламидийную инфекцию на исходном уровне, риск развития ВЗОМТ в течение следующих 12 месяцев составил 10,0% (95% ДИ, 2,97% –17,03; 7 из 70 женщин) по сравнению с 1,5% (0,95–1,98%; 31 из 2114 женщин) среди тех, кто был отрицательным по хламидиозу (относительный риск, 6,82; 95% ДИ, 3,11–14,95).
Обсуждение
Распространенность M.genitalium среди 2378 сексуально активных студенток составляла 3%, а ежегодная заболеваемость составляла 1%. Как распространенные, так и случайные инфекции чаще встречались у женщин, у которых за последний год было более двух партнеров, а также у женщин с бактериальным вагинозом. У женщин с инфекцией M. genitalium риск развития клинических ВЗОМТ в течение 12 месяцев был в два раза выше, чем у неинфицированных женщин, хотя разница не была статистически значимой. Примерно 25% женщин с M.genitalium , обнаруженный в начале исследования, имел хроническую инфекцию в течение как минимум года.
Насколько нам известно, это крупнейшее проспективное исследование M. genitalium на сегодняшний день и первое в Соединенном Королевстве. Он уникален в плане приема на работу когорты женщин вне медицинских учреждений. Повторные образцы, отправленные через почтовую службу, позволили нам получить новые данные о заболеваемости и устойчивости M. genitalium у молодых сексуально активных женщин в обществе.Более 1000 женщин в когорте были подростками, из которых> 40% принадлежали к этническим меньшинствам. Сообщаемое количество сексуальных партнеров в предыдущем году было таким же, как и среди женщин в возрасте 16–24 лет, принявших участие в Национальном обследовании сексуальных отношений и образа жизни Соединенного Королевства 2000 г. [29], что позволяет предположить, что наши участники могут быть достаточно репрезентативными. Наконец, важным достижением было наблюдение за 94% этого молодого, мобильного городского населения через 12 месяцев, а также получение повторных проб через почтовую службу у 38%.
Основным ограничением является то, что размер выборки был ограничен 2378 женщинами, которые принимали участие в исследовании «Профилактика тазовых инфекций» (POPI) [20], и у них было недостаточно возможностей для подтверждения предполагаемой связи между инфекцией M. genitalium и ВЗОМТ. Кроме того, диагностика ВЗОМТ неточна [24, 30] и не обладает чувствительностью и специфичностью [13, 31]. Клинический диагноз симптоматической ВЗОМТ имеет положительную прогностическую ценность 65–90% по сравнению с лапароскопией [24, 32], в зависимости от профиля риска в популяции.Кроме того, у многих женщин с ВЗОМТ симптомы отсутствуют или отсутствуют [24, 33]; более половины женщин с трубным бесплодием не имели в анамнезе ВЗОМТ [34]. Даже если у женщины есть легкие симптомы, врач может не распознать их как ВЗОМТ [33]. Также неясно, как риск хронических осложнений зависит от клинически диагностированного или субклинического ВЗОМТ. Эти трудности означают, что, вероятно, диагноз ВЗОМТ в нашем исследовании был неправильным у некоторых женщин и пропущен у других, что может ограничить надежность наших выводов.
genitalium и ВЗОМТ. Кроме того, диагностика ВЗОМТ неточна [24, 30] и не обладает чувствительностью и специфичностью [13, 31]. Клинический диагноз симптоматической ВЗОМТ имеет положительную прогностическую ценность 65–90% по сравнению с лапароскопией [24, 32], в зависимости от профиля риска в популяции.Кроме того, у многих женщин с ВЗОМТ симптомы отсутствуют или отсутствуют [24, 33]; более половины женщин с трубным бесплодием не имели в анамнезе ВЗОМТ [34]. Даже если у женщины есть легкие симптомы, врач может не распознать их как ВЗОМТ [33]. Также неясно, как риск хронических осложнений зависит от клинически диагностированного или субклинического ВЗОМТ. Эти трудности означают, что, вероятно, диагноз ВЗОМТ в нашем исследовании был неправильным у некоторых женщин и пропущен у других, что может ограничить надежность наших выводов.
Другой недостаток заключается в том, что при отборе выборки, возможно, недооценили распространенность и заболеваемость M. genitalium . Выборка не проводилась на популяционной основе, и женщины из группы повышенного риска с меньшей вероятностью предоставили повторные и последующие образцы. Точно так же использование хранимых замороженных образцов могло снизить чувствительность микробиологических тестов [35]. Однако 10 сохраненных образцов, которые дали положительные результаты на хламидиоз на исходном уровне, остались положительными при повторном тестировании через год [36].Мы не спрашивали об использовании антибиотиков в течение года испытания, но в целом тип антибиотика припоминается плохо, что приводит к менее достоверной информации. Наконец, результаты могут быть неприменимы к разным группам населения, таким как женщины с высоким риском из развивающихся стран [15, 37] или те, кто посещает клиники мочеполовой медицины и больницы [5, 6, 38].
Распространенность M. genitalium в 3,3% была сопоставима с показателями распространенности в небольших исследованиях на уровне сообществ молодых женщин из Дании [39] и Японии [40]. В соответствии с другими сообщениями, M. genitalium чаще встречается среди женщин, сообщающих о большем количестве сексуальных партнеров [5, 7, 16, 39, 40], чернокожих [5, 41] и курящих женщин [5, 42]. ]. Однако это первое исследование, в котором установлено, что M. genitalium независимо связана с бактериальным вагинозом [11].
В соответствии с другими сообщениями, M. genitalium чаще встречается среди женщин, сообщающих о большем количестве сексуальных партнеров [5, 7, 16, 39, 40], чернокожих [5, 41] и курящих женщин [5, 42]. ]. Однако это первое исследование, в котором установлено, что M. genitalium независимо связана с бактериальным вагинозом [11].
M. genitalium , как ранее было обнаружено, ассоциирован с ВЗОМТ в небольших больничных и клинических поперечных и проспективных исследованиях [13–17]. Хаггерти и др. [17] обнаружили M.genitalium у 88 (15%) из 586 женщин с ВЗОМТ. Недавнее исследование случай-контроль показало, что M. genitalium было связано с ВЗОМТ после прерывания (отношение шансов, 6,29; 95% ДИ, 1,56–25,2) [43]. Наконец, небольшое проспективное исследование первичной медико-санитарной помощи, проведенное в США, показало, что у 31% женщин с нелеченными M. genitalium персистирующая инфекция длилась> 8 недель [16], что сопоставимо с нашими результатами за более длительный период. Однако наше исследование, по-видимому, первое, в котором описывается ежегодная заболеваемость M.genitalium у женщин в сообществе, связанные с этим факторы риска и годовой уровень стойкости.
Примерно 3% распространенности и 1% годовой заболеваемости M. genitalium составляли примерно половину распространенности [20] и заболеваемости [44] C. trachomatis в нашей когорте. Это может быть слишком мало для скрининга населения [39]. Однако женщины из группы высокого риска, например женщины, сообщающие о нескольких сексуальных партнерах, могут подвергаться выборочному обследованию. Принимая во внимание распространенность инфекции и риск ВЗОМТ, наши результаты предполагают, что популяция приписывает риск ВЗОМТ из-за M.genitalium составляет ∼4% по сравнению с 25% для C. trachomatis . Это означает, что M. genitalium не является основным фактором риска ВЗОМТ в нашей популяции. Тем не менее, было высказано предположение, что тестирование M. genitalium может быть рассмотрено для женщин с возможными ВЗОМТ, чтобы убедиться, что они получают соответствующую схему лечения антибиотиками [10]. Хотя все случаи, изученные в этом исследовании, были чувствительны к макролидам, увеличение использования азитромицина для лечения хламидийной инфекции в рамках Национальной программы скрининга на хламидиоз может привести к резистентности в будущем.
genitalium может быть рассмотрено для женщин с возможными ВЗОМТ, чтобы убедиться, что они получают соответствующую схему лечения антибиотиками [10]. Хотя все случаи, изученные в этом исследовании, были чувствительны к макролидам, увеличение использования азитромицина для лечения хламидийной инфекции в рамках Национальной программы скрининга на хламидиоз может привести к резистентности в будущем.
В заключение, инфекция M. genitalium у женщин может быть в некоторых отношениях «новым хламидиозом», но она менее распространена, чем хламидиоз, среди женщин, набранных за пределами медицинских учреждений, и с меньшей вероятностью вызывает ВЗОМТ. Необходимы дополнительные доказательства для разработки руководств по тестированию и лечению M. genitalium в сообществе.
Благодарности
Мы очень благодарны доктору Гарри Маллинсону за проведение тестов для C.trachomatis . Мы также благодарим врачей ГУМа, докторов Лиззи Уильямс, Катю Прайм и Пэдди Хорнера за помощь с клиническим диагнозом тазовой инфекции, и мы благодарим всех терапевтов, медсестер, врачей больниц и административный персонал, которые приложили огромные усилия, чтобы предоставить нам соответствующие клинические данные. подробности. Мы также благодарны участвующим студентам и сотрудникам следующих лондонских университетов и колледжей дальнейшего образования: Лондонский университет Саутбэнк, Кингстонский университет, Городской университет, Университет Святого Георгия, Лондонский университет, Рохэмптонский университет, Лондонский колледж моды, Лондонский колледж связи, Университет. Восточного Лондона, Гринвичский университет, Вестминстерский университет, Уимблдонская школа искусств, Кингстонский колледж, Ламбетский колледж, Саутваркский колледж, Саут-Темзский колледж, Льюишемский колледж, Бромли-колледж, Северо-Восточный Суррейский технологический колледж, Каршалтонский колледж, Мертонский колледж, Колсдонский колледж , Кройдонский колледж. Наконец, мы благодарим научных сотрудников Симу Хэй, Салли Дин, Дебби Бэнкс, Рут Харбит и Мигеля Ардида Кэндела; и равные рекрутеры Стелла Иваз, Линзи Лонг, Мишель Лэмб, Лаура Проктор, Сара Симмс, Сара Керри и Шейла Керри.
Наконец, мы благодарим научных сотрудников Симу Хэй, Салли Дин, Дебби Бэнкс, Рут Харбит и Мигеля Ардида Кэндела; и равные рекрутеры Стелла Иваз, Линзи Лонг, Мишель Лэмб, Лаура Проктор, Сара Симмс, Сара Керри и Шейла Керри.
Финансовая поддержка. Финансирование исследования M. genitalium было предоставлено Комитетом по стратегии исследований в области сексуального здоровья и ВИЧ Совета медицинских исследований Великобритании; скрининговое испытание на хламидиоз «Профилактика тазовых инфекций» (POPI) финансировалось Фондом BUPA; наборы для сбора хламидиоза были предоставлены Gen-Probe.
Возможный конфликт интересов. Все авторы: без конфликтов.
Список литературы
1.,,.Mycoplasma genitalium : распространенность, клиническое значение и передача
,Sex Transm Infect
,2005
, vol.81
(стр.458
—462
) 2.,,, Et al.Последовательное типирование Mycoplasma genitalium показывает передачу половым путем
,J Clin Microbiol
,2006
, vol.44
(стр.2078
—2083
) 3.,,.Встречаемость Mycoplasma genitalium в разных популяциях и ее клиническое значение
,Clin Infect Dis
,1993
, vol.17
(стр.66
—68
) 4 ..Mycoplasma genitalium : этиологический агент уретрита и других заболеваний, передающихся половым путем
,J Eur Acad Dermatol Venereol
,2004
, vol.18
(стр.1
—11
) 5.,,, Et al.Слизисто-гнойный цервицит и Mycoplasma genitalium
,J Infect Dis
,2003
, vol.187
(стр.650
—657
) 6.,,.Признаки и симптомы уретрита и цервицита у женщин с Mycoplasma genitalium или Инфекция Chlamydia trachomatis
,Sex Transm Infect
,2005
, vol.
81
(стр.73
—78
) 7.,,,,.Mycoplasma genitalium среди молодых людей в Соединенных Штатах: новая инфекция, передаваемая половым путем
,Am J Public Health
,2007
, vol.97
(стр.1118
—1125
) 8.,,,.Mycoplasma genitalium у бессимптомных пациентов: значение для скрининга 2
,Sex Transm Infect
,2009
, vol.85
(стр.436
—437
) 9 ..Доказательства роли Mycoplasma genitalium в воспалительных заболеваниях органов малого таза
,Curr Opin Infect Dis
,2008
, vol.21
(стр.65
—69
) 10.,.Mycoplasma genitalium как инфекция, передаваемая половым путем: значение для скрининга, тестирования и лечения
,Sex Transm Infect
,2006
, vol.82
(стр.269
—271
) 11 ..Mycoplasma genitalium — обновление
,Int J STD AIDS
,2002
, vol.13
(стр.145
—151
) 12.,,.Серологические доказательства причастности Mycoplasma genitalium к воспалительным заболеваниям органов малого таза
,Lancet
,1984
, vol.1
(стр.1102
—1103
) 13.,,, Et al.Связи между Mycoplasma genitalium , Chlamydia trachomatis и воспалительными заболеваниями органов малого таза
,Sex Transm Infect
,2003
, vol.79
(стр.154
—156
) 14.,,,.Mycoplasma genitalium среди женщин с негонококковыми, нехламидийными воспалительными заболеваниями органов малого таза
,Infect Dis Obstet Gynecol
,2006
, vol.2006
стр.30184
15.,,, et al.Обнаружение Mycoplasma genitalium у женщин с лапароскопическим диагнозом острого сальпингита
,Sex Transm Infect
,2005
, vol.81
(стр.463
—466
) 16. ,,, Et al.
,,, Et al.Mycoplasma genitalium среди женщин-подростков и их партнеров
,J Adolesc Health
,2007
, vol.40
(стр.412
—417
) 17.,,, Et al.Неспособность цефокситина и доксициклина уничтожить эндометрий Mycoplasma genitalium и последствия для клинического лечения воспалительного заболевания органов малого таза
,Sex Transm Infect
,2008
, vol.84
(стр.338
—342
) 18.,,,,.Эффективность скрининга на хламидиоз: систематический обзор
,Int J Epidemiol
,2009
, vol.38
(стр.435
—448
) 19.Устный вопрос баронессы Нойбергер
,столбец 247. 23-3-2005
Лондон
Палата лордов Хансард
20.,,, et al.Рандомизированное контролируемое испытание скрининга на Chlamydia trachomatis для предотвращения воспалительных заболеваний органов малого таза: испытание POPI (профилактика тазовых инфекций) 1
,BMJ
,2010
, vol.340
стр.c1642
21.,,,,,.Набор молодых женщин для пробного обследования на хламидиоз — так же просто, как кажется?
,Испытания
,2007
, т.8
стр.41
22.,,, et al.Испытание на уровне сообщества по скринингу Chlamydia trachomatis для предотвращения воспалительных заболеваний органов малого таза: испытание POPI (Профилактика тазовых инфекций)
,Испытания
,2008
, vol.9
стр.73
23.,.Критерии диагностики и классификации сальпингита
,Obstet Gynecol
,1983
, vol.61
(стр.113
—114
) 24.Центры по контролю за заболеваниями
.Руководство по лечению болезней, передающихся половым путем
,MMWR
,2006
, vol.55
(стр.56
—57
) 25.,,,.Использование нуклеазной ПЦР TaqMan 5 в реальном времени для количественного определения ДНК Mycoplasma genitalium у мужчин с уретритом и без него, которые посещали клинику по лечению заболеваний, передающихся половым путем
,J Clin Microbiol
,2004
, vol.
42
(стр.683
—692
) 26.,,.Обнаружение Mycoplasma genitalium с помощью ПЦР-амплификации гена 16S рРНК
,J Clin Microbiol
,2003
, vol.41
(стр.261
—266
) 27.,,,,.Неэффективность лечения азитромицином у Mycoplasma genitalium -положительных пациентов с негонококковым уретритом связана с индуцированной резистентностью к макролидам 1
,Clin Infect Dis
,2008
, vol.47
(стр.1546
—1553
) 28.,.Сравнительный анализ двух показателей
,Stat Med
,1985
, vol.4
(стр.213
—226
) 29.,,, Et al.Сексуальное поведение в Великобритании: партнерство, практика и поведение, связанное с риском заражения ВИЧ 2
,Lancet
,2001
, vol.358
(стр.1835
—1842
) 30.,,,,.Дальнейшие наблюдения, в основном серологические, на группе женщин с воспалительными заболеваниями органов малого таза или без них 2
,Int J STD AIDS
,2009
, vol.20
(стр.712
—718
) 31.,,, Et al.Частота тяжелых осложнений со стороны репродуктивного тракта, связанных с диагностированной генитальной хламидийной инфекцией: исследование UppsalaWomen’s Cohort
,Sex Transm Infect
,2006
, vol.82
(стр.212
—218
) 32.,,, Et al.Точность клинических данных и лапароскопии при воспалительных заболеваниях органов малого таза 5
,Am J Obstet Gynecol
,1991
, vol.164
(стр.113
—120
) 33.,,.Атипичное воспалительное заболевание органов малого таза — можем ли мы определить клинические предикторы 1
,Am J Obstet Gynecol
,1993
, vol.169
(стр.341
—346
) 34.,,,.Трубный фактор бесплодия — связь с предшествующей хламидийной инфекцией и бессимптомным сальпингитом 1
,Fertil Steril
,1988
, vol.
49
(стр.451
—457
) 35.,,,.Сравнение первых образцов мочи и урогенитального мазка для выявления Mycoplasma genitalium и Chlamydia trachomatis с помощью полимеразной цепной реакции у пациентов, посещающих клинику по лечению заболеваний, передающихся половым путем 1
,Sex Transm Dis
,2004
, vol.31
(стр.499
—507
) 36.,,, Et al.Заболеваемость воспалительными заболеваниями органов малого таза у нелеченных женщин Chlamydia trachomatis
,Int J STD AIDS
,2008
, vol.19
(стр.283
—4
) 37.,,, Et al.Инфекция Mycoplasma genitalium и персистентность в когорте женщин секс-бизнеса в Найроби, Кения
,Sex Transm Dis
,2007
, vol.34
(стр.274
—279
) 38.,,,,,.Клиническая картина инфекции Mycoplasma genitalium в сравнении с инфекцией Neisseria gonorrhoeae среди женщин с воспалительными заболеваниями органов малого таза
,Clin Infect Dis
,2009
, vol.48
(стр.41
—47
) 39.,,,,,.Mycoplasma genitalium : распространенность и поведенческие факторы риска в общей популяции
,Sex Transm Infect
,2007
, vol.83
(стр.237
—241
) 40.,,,,.Распространенность Mycoplasma genitalium среди студенток профессиональных школ Японии
,Sex Transm Infect
,2008
, vol.84
(стр.303
—305
) 41.,,, Et al.Распространенность Mycoplasma genitalium на ранних сроках беременности и взаимосвязь между ее наличием и исходом беременности
,BJOG
,2004
, vol.111
(стр.1464
—1467
) 42.,,, Et al.Демографические, сексуальные и поведенческие корреляты инфекции Mycoplasma genitalium среди женщин с клинически подозреваемым воспалительным заболеванием органов малого таза 1
,Sex Transm Infect
,2010
, vol.
86
(стр.29
—31
) 43.,,.Связь между Mycoplasma genitalium и воспалительными заболеваниями органов малого таза после прерывания беременности
,BJOG
,2010
, vol.117
(стр.361
—364
) 44.,,.Услуги по охране сексуального здоровья: третий путь?
,Int J STD AIDS
,2006
, vol.17
стр.783
© 2010 Американского общества инфекционистов
Mycoplasma Genitalium ЗППП: симптомы, лечение и профилактика
Mycoplasma genitalium (MG) — это тип бактерий, которые могут вызывать ЗППП.Вы получаете это, занимаясь сексом с тем, у кого это есть. Даже если вы не будете заниматься вагинальным сексом «до конца», вы можете получить MG через сексуальные прикосновения или растирание.
Ученые знали об этой бактерии с 1980-х годов, но недавнее исследование показало, что она может быть у более чем 1 из 100 взрослых.
Симптомы
MG не всегда вызывает симптомы, поэтому можно иметь это и не знать об этом.
У мужчин симптомы следующие:
Симптомы для женщин следующие:
Диагноз MG
В отличие от других ЗППП, не существует теста на MG, одобренного FDA.Но если вы или ваш врач думаете, что у вас это может быть, вы можете пройти тест на амплификацию нуклеиновых кислот (NAAT).
Для этого теста вам, возможно, придется сдать образец своей мочи. Ваш врач может также использовать мазок для взятия пробы из влагалища, шейки матки или уретры — трубки, по которой моча выводится из вашего тела.
Другие проблемы со здоровьем MG может вызвать
MG может вызвать ряд осложнений:
Ученые не уверены, может ли инфекция MG затруднить мужчине беременность.
Лечение
MG может быть сложной проблемой для лечения. Обычные антибиотики, такие как пенициллин, убивают бактерии, повреждая клеточные стенки зародыша. Но у бактерий MG нет клеточных стенок, поэтому эти препараты не очень эффективны.
Ваш врач может сначала попробовать азитромицин (Zithromax, Zmax). Если это не сработает, врач может прописать вам моксифлоксацин (авелокс).
Продолжение
Через месяц вы можете пройти еще один тест, чтобы убедиться, что инфекция исчезла, но не рекомендуется проходить обычные тесты, если у вас нет симптомов MG.Если симптомы не исчезнут, но болезнь не исчезнет, вам потребуется дополнительное лечение.
Продолжение
Ваш врач может также сосредоточиться на лечении других состояний, которые может вызвать MG, таких как уретрит, ВЗОМТ или цервицит.
Ваши сексуальные партнеры должны поговорить со своими врачами о прохождении тестирования и лечении, чтобы они не заразили других людей и не вернули это вам. Вы все равно можете снова получить MG, даже если уже прошли курс лечения.
Prevention
Презервативы могут снизить вероятность заражения MG, но они не могут гарантировать, что вы его не получите.Если у вас есть заболевание, избегайте половых контактов в течение 7 дней после начала лечения, чтобы не заразить других.
Mycoplasma Genitalium | Новосанис
Mycoplasma Genitalium — распространенная инфекция, передаваемая половым путем (ИППП) . В целом, исследования этой бактерии все еще находятся на стадии предварительной подготовки. Это вызвано бактерией под названием Mycoplasma Genitalium . Текущие исследования исследуют эффективность Colli-Pee ™ при обнаружении и скрининге Mycoplasma Genitalium.
Mycoplasma Genitalium обычно вызывает воспаление уретры. Это состояние известно как уретрит. Наиболее частые симптомы этой инфекции включают выделения из половых органов, зуд влагалища, а у женщин инфекция может вызывать боль во время полового акта.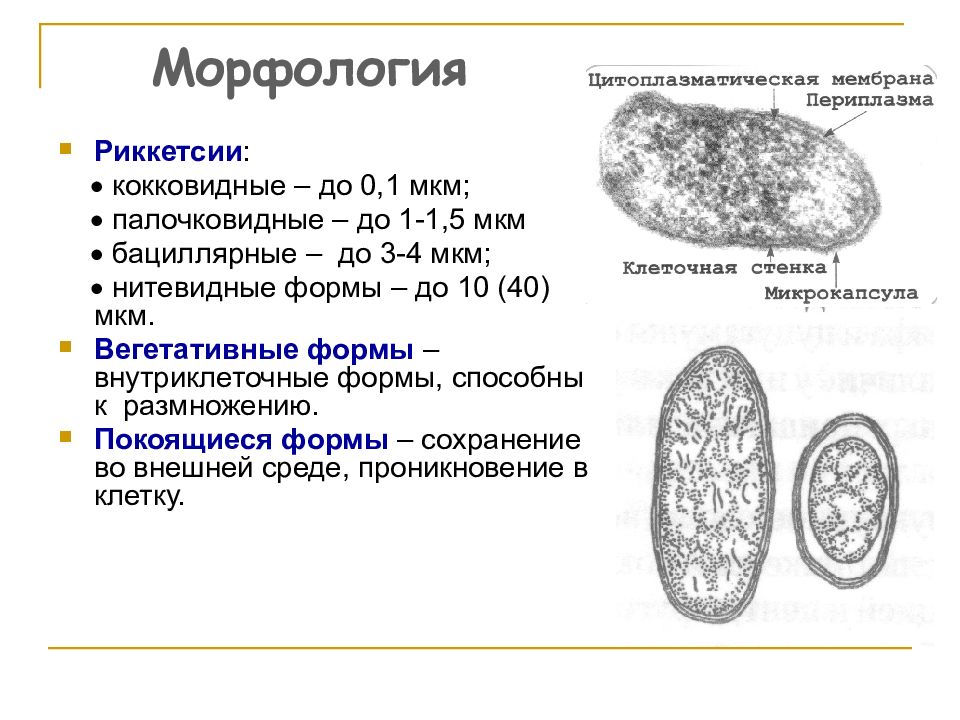
Как и большинство ИППП, инфекции Mycoplasma Genitalium можно предотвратить, используя презерватив во время полового контакта. Презерватив обеспечивает хорошую защиту от инфекций Mycoplasma Genitalium, поскольку бактерии присутствуют в выделениях из влагалища или полового члена.
Помимо первичной профилактики, скрининг может повысить уровень выявления ИППП и предотвратить дальнейшее инфицирование в бессимптомных случаях. Например, Норвегия в настоящее время изучает преимущества и связанные с этим затраты на скрининг на Mycoplasma Genitalium (1). Colli-Pee может значительно улучшить эти типы программ скрининга. С Colli-Pee гарантирован сбор мочи с первым мочеиспусканием, что делает анализ мочи более надежным как для пациентов женского, так и мужского пола. Коллектор мочи на первое мочеиспускание также прост в использовании.Отбор проб на дому может уменьшить чувство стыда, связанное с тестированием на гонорею и сбором мочи в кабинете врача. С помощью Colli-Pee образцы мочи можно получить в домашних условиях.
Mycoplasma Genitalium может быть обнаружен при исследовании мазка (из шейки матки для женщин или из уретры для мужчин), взятого врачом, с помощью самостоятельно взятых вагинальных мазков или по мочеиспусканию (2). Образец мочи для обнаружения Mycoplasma Genitalium должен состоять из первой порции мочи (первая часть потока мочи), поскольку эта часть потока мочи содержит больше частиц ДНК, чем другая часть, что делает клиническое обнаружение Mycoplasma Genitalium более чувствительным. .
Инфекции Mycoplasma Genitalium лечат антибиотиками (3).
При отсутствии лечения Mycoplasma Genitalium может вызвать серьезные осложнения как для мужчин, так и для женщин. Это может ослабить иммунную систему до такой степени, что инфицированный человек станет более восприимчивым к другим инфекциям. Mycoplasma Genitalium может вызвать коинфекцию Chlamydia, что, как следствие, может вызвать внематочную беременность. Риск бесплодия может увеличиваться во время активных инфекций.Наконец, есть вероятность заражения внутренних органов (4).
Новосанис в настоящее время сотрудничает с Институтом тропической медицины (Антверпен, Бельгия) для оценки теста Colli-Pee на ИППП у МСМ (мужчин, практикующих секс с мужчинами). В этом исследовании обнаружены четыре ИППП: хламидиоз, гонорея, Mycoplasma Genitalium и трихомонады. Образцы берутся дома и отправляются в лабораторию обычной почтой. Наряду с диагностической чувствительностью и специфичностью также оцениваются удобство использования и готовность к использованию.Дальнейшие исследования будут посвящены, например, Тестирование на ИППП у женщин.
Артикул:
Диагностика и лечение Mycoplasma Genitalium
Бактерии Mycoplasma genitalium (MG) — это инфекция, передающаяся половым путем (ИППП).Это может вызвать вагинальный зуд, жжение при мочеиспускании и кровотечение кожи вокруг влагалища у женщин, а также выделения из уретры или симптомы артрита у мужчин.
Джесс Виберг / Getty ImagesСвязанные условия
MG является причиной нескольких типов инфекций, включая формы бактериального вагиноза (BV) и негонококкового уретрита (NGU).
Он также был связан с воспалительными заболеваниями органов малого таза (ВЗОМТ) и связан с другими инфекциями, которые ранее приписывались другим бактериям.
Симптомы
По большому счету, большинство случаев MG протекает бессимптомно. Если симптомы действительно появляются, они в значительной степени неспецифичны и легко принимаются за другие ИППП, такие как хламидиоз и гонорея. Симптомы MG также значительно различаются у женщин и мужчин.
Женские симптомы включают:
Мужчины могут испытывать:
MG является наиболее частой причиной нехламидийного НГУ у мужчин.Взаимодействие с другими людьми
Проблемы диагностики
Основным препятствием для диагностики MG является отсутствие утвержденного анализа крови для подтверждения инфекции. Для прямой диагностики требуется бактериальный посев, рост которого занимает до шести месяцев.
У врачей есть другие способы напрямую идентифицировать микоплазму гениталий, но эти тесты в основном предназначены для исследований.
Из-за этого MG обычно диагностируется предположительно. Другими словами, ваш врач может диагностировать MG как причину ваших симптомов после того, как другие варианты были исключены.
Фактически, MG присутствует в большинстве инфекций BV и NGU. По данным Центров по контролю и профилактике заболеваний, от 15% до 20% случаев негонококкового уретрита напрямую вызваны MG.
MG участвует в каждом третьем случае стойкого или рецидивирующего уретрита.
Микоплазма может быть обнаружена у 30% женщин с симптомами воспаления или инфекции шейки матки.
Лечение
Mycoplasma genitalium обычно лечится антибиотиками, чаще всего однократной дозой азитромицина в 1 грамм.Хотя азитромицин считается безопасным и эффективным, есть доказательства повышения устойчивости к этому препарату среди населения, в котором он широко используется.
В то время как другие антибиотики могут заменять азитромицин, доксициклин считается менее эффективным (хотя и с меньшим риском резистентности). В некоторых исследованиях было показано, что расширенный курс моксифлоксацина очень эффективен, однако более короткие курсы часто неэффективны.
Проблемы с лечением
Однако презумпция MG в случаях NGU может привести к неэффективности лечения.Это может произойти в результате синдромного лечения ИППП, когда все ИППП лечат одинаково, без определения причины.
Этот тип лечения может привести к тому, что вы будете принимать лекарства, которые могут не работать, а также лечение, которое выбрал бы ваш врач, если бы знал, какая у вас конкретная инфекция. При бактериальных инфекциях неправильный антибиотик может привести к появлению устойчивых к антибиотикам бактерий.
Растущая обеспокоенность по поводу устойчивой к антибиотикам гонореи привела к изменениям в рекомендуемой схеме лечения за последнее десятилетие.Беспокойство заключается в том, что со временем никакое лечение этого распространенного ЗППП не будет надежным.
Распространенность Mycoplasma genitalium у мужчин-геев равна распространенности хламидиоза
Распространенность Mycoplasma genitalium — ИППП, о которой многие люди никогда не слышали — среди геев и бисексуалов сопоставима с распространенностью хламидиоза, сообщают австралийские исследователи в исследовании Sexually Передаваемые инфекции . Обобщение результатов 46 международных исследований показало, что Mycoplasma genitalium инфицированы 5% в уретре, 6% в прямой кишке и 1% в горле.Распространенность была выше среди мужчин с симптомами ИППП, а частота уретральной инфекции была выше среди ВИЧ-положительных мужчин.
«Распространенность Mycoplasma genitalium в этом исследовании была аналогична оценкам распространенности хламидиоза у мужчин, имеющих половые контакты с мужчинами, о которых сообщалось в порядке 3,5–3,7% в уретре, 5,6% в прямой кишке и 0,5%. % в глотке », — комментируют следователи.
Впервые выявлено в 1981 г. Mycoplasma genitalium — это бактериальная ИППП.Он может передаваться через анальный, оральный и вагинальный секс. Инфекция уретры может вызывать выделения и боль при мочеиспускании, а инфекция прямой кишки может сопровождаться проктитом (воспалением прямой кишки). Инфекция лечится различными схемами антибиотиков, включая азитромицин, доксициклин и моксифлоксацин. Однако были обнаружены высокие показатели устойчивости к антибиотикам. Важно не возобновлять половую жизнь до тех пор, пока контрольные анализы не подтвердят, что инфекция исчезла.
Глоссарий
прямая кишка
Последняя часть толстой кишки чуть выше анального отверстия.
хламидиоз
Хламидиоз — это распространенная инфекция, передающаяся половым путем, вызываемая бактериями под названием Chlamydia trachomatis. Женщины могут заразиться хламидиозом в шейке матки, прямой кишке или горле. Мужчины могут заразиться хламидиозом в уретре (внутри полового члена), прямой кишке или горле. Хламидиоз лечится антибиотиками.
проктит
Воспаление слизистой оболочки прямой кишки. Это может вызвать боль в прямой кишке, диарею, кровотечение и выделения, а также постоянное ощущение необходимости сходить в туалет.
антибиотиков
Антибиотики, также известные как антибактериальные средства, — это лекарства, которые уничтожают или замедляют рост бактерий. Их используют для лечения заболеваний, вызванных бактериями.
Международные руководства по ИППП содержат различные рекомендации относительно Mycoplasma genitalium. В то время как они обычно рекомендуют, чтобы геи и бисексуалы регулярно проходили скрининг на наличие гонореи и хламидиоза в уретре, прямой кишке и горле, они не рекомендуют скрининг на Mycoplasma genitalium .Это связано с отсутствием ясности в естественной истории инфекции и проблемами с лечением из-за резистентных штаммов. Однако британские и австралийские руководящие принципы теперь рекомендуют проводить тестирование на инфекцию у мужчин с такими симптомами, как выделения из уретры, боль и проктит.
Учитывая эти несоответствия, группа исследователей во главе с доктором Рози Латимер из Сексуального центра, Альфред Хелс, Мельбурн, объединила результаты 46 исследований, чтобы определить распространенность инфекции Mycoplasma genitalium у геев в уретре и прямой кишке. и горло.Они также хотели узнать, различается ли распространенность в зависимости от наличия симптомов и статуса ВИЧ-инфекции.
Включенные исследования включали минимум 50 мужчин-геев и проводились в период с 1981 по 2018 год.
Большинство исследований (42%) проводились в Европе, 28% — в регионе Западной части Тихого океана (в основном, в Австралии и Китае), 26% — в Северной и Южной Америке (в основном США) и только одно — в Африке.

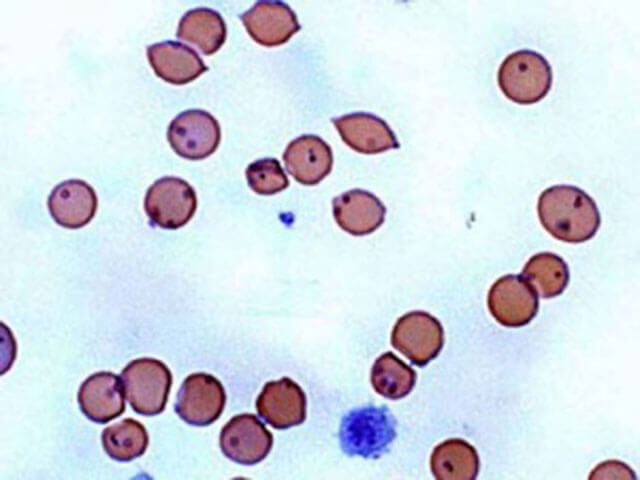 IgG/кач. IgM
IgG/кач. IgM А.В. Аверьянов
А.В. Аверьянов ru
ru
 При исследовании же мокроты значительно возрастает вероятность ложноотрицательных результатов РИФ из-за бедности клеточного состава мокроты.
При исследовании же мокроты значительно возрастает вероятность ложноотрицательных результатов РИФ из-за бедности клеточного состава мокроты.
 Однако было бы ошибкой считать, что “атипичные” возбудители вызывают только нетяжелые пневмонии. При возникновении тяжелых пневмоний у пожилых больных и лиц с хроническими сердечно-легочными заболеваниями С. pneu-moniaе обнаруживается с той же частотой, что и пневмококк. От 3 до 10% пациентов с
Однако было бы ошибкой считать, что “атипичные” возбудители вызывают только нетяжелые пневмонии. При возникновении тяжелых пневмоний у пожилых больных и лиц с хроническими сердечно-легочными заболеваниями С. pneu-moniaе обнаруживается с той же частотой, что и пневмококк. От 3 до 10% пациентов с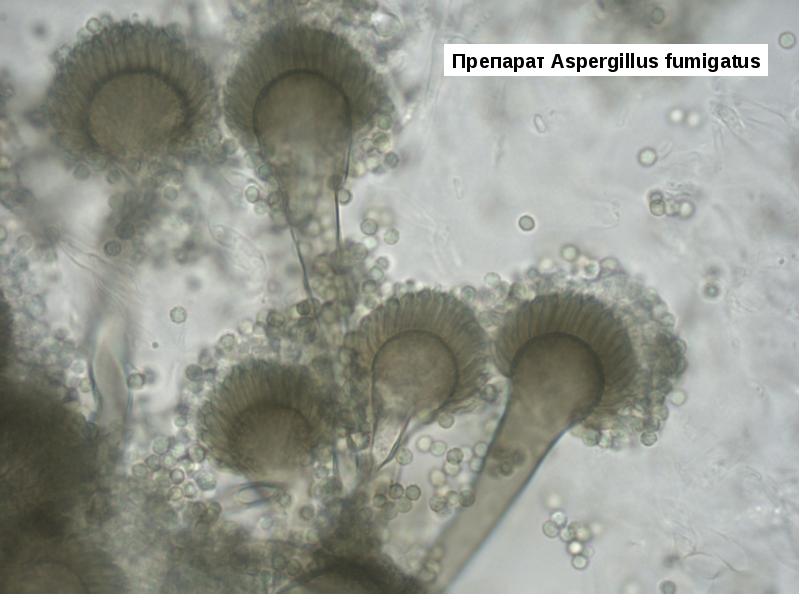
 В исследовании P.N. Black et al. уровень антител к C. pneumoniae коррелировал с тяжестью течения БА, находясь в прямой зависимости с частотой и выраженностью симптомов и в обратной — с объемом форсированного выдоха за 1-ю секунду (ОФВ1). Одно из последних опубликованных исследований по обсуждаемой проблеме (Cosentini R. et al.) подтвердило высокую распространенность (38%) острого респираторного хламидиоза и микоплаз-моза у больных с тяжелым обострением БА: у этих пациентов в 87% случаев выявлялась C. pneumoniae, в 9% — в M. pneumoniae и в 4% — оба микроорганизма.
В исследовании P.N. Black et al. уровень антител к C. pneumoniae коррелировал с тяжестью течения БА, находясь в прямой зависимости с частотой и выраженностью симптомов и в обратной — с объемом форсированного выдоха за 1-ю секунду (ОФВ1). Одно из последних опубликованных исследований по обсуждаемой проблеме (Cosentini R. et al.) подтвердило высокую распространенность (38%) острого респираторного хламидиоза и микоплаз-моза у больных с тяжелым обострением БА: у этих пациентов в 87% случаев выявлялась C. pneumoniae, в 9% — в M. pneumoniae и в 4% — оба микроорганизма.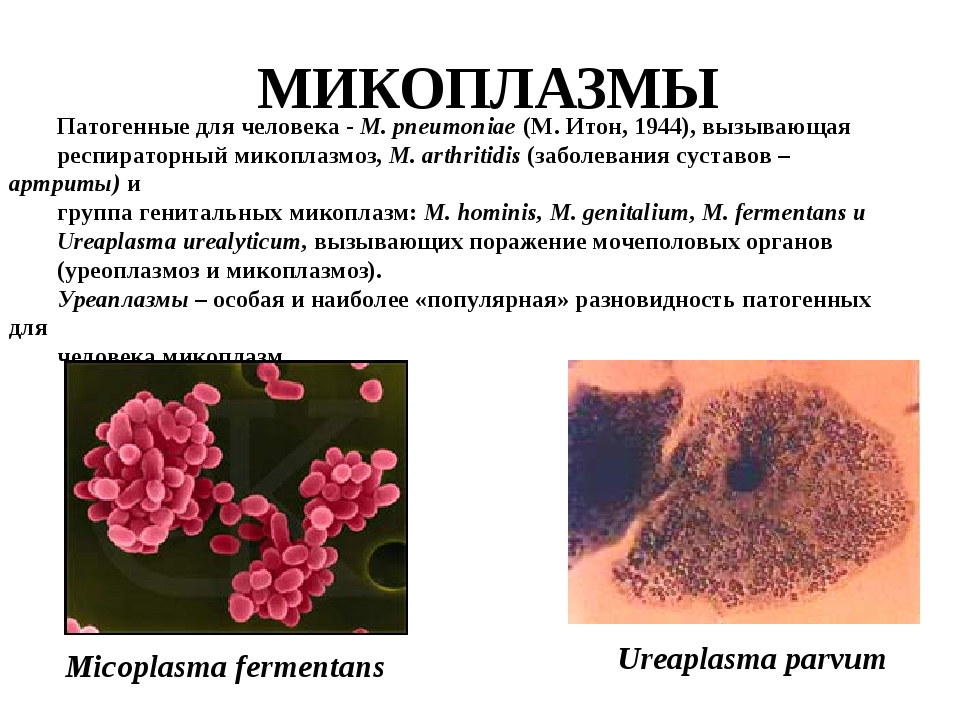
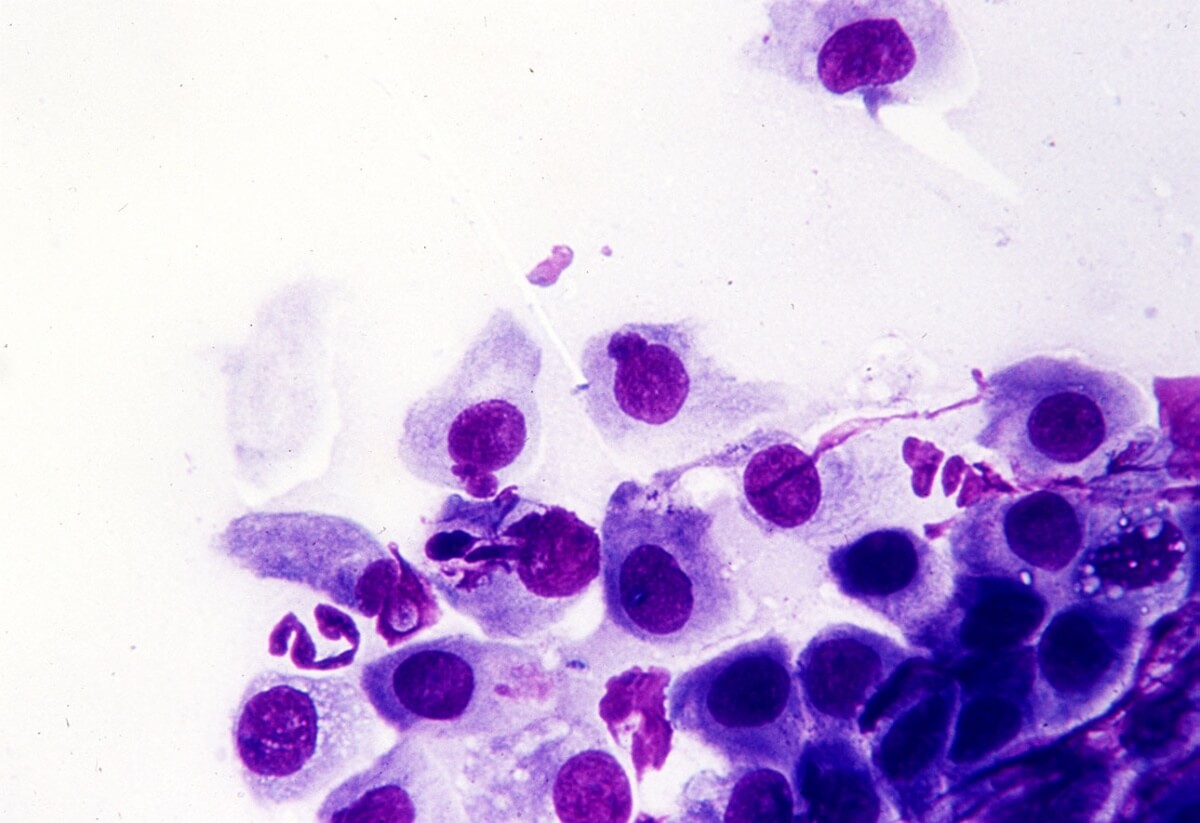 В настоящее время из-за частых нежелательных эффектов их применение минимизировано, а в качестве препарата резерва свое значение сохраняет лишь доксициклин.
В настоящее время из-за частых нежелательных эффектов их применение минимизировано, а в качестве препарата резерва свое значение сохраняет лишь доксициклин. Авторы предположили, что разрушение клеточной стенки микроорганизма препаратами пенициллинового ряда ведет к временному усилению системной воспалительной реакции, которая, суммируясь с токсическими эффектами гриппа, приводит к летальному исходу.
Авторы предположили, что разрушение клеточной стенки микроорганизма препаратами пенициллинового ряда ведет к временному усилению системной воспалительной реакции, которая, суммируясь с токсическими эффектами гриппа, приводит к летальному исходу. influenzae.
influenzae. pneumoniae.
pneumoniae. pneumoniae и M. pneumoniae являются важными этиопатогене-тическими факторами развития и прогрессирования наиболее распространенных болезней органов дыхания. Об этом необходимо помнить практическому врачу, когда он принимает решение о выборе антибактериального препарата или сталкивается с клинической ситуацией, где традиционное лечение (например, БА или ХОБЛ) не приносит ожидаемых результатов.
pneumoniae и M. pneumoniae являются важными этиопатогене-тическими факторами развития и прогрессирования наиболее распространенных болезней органов дыхания. Об этом необходимо помнить практическому врачу, когда он принимает решение о выборе антибактериального препарата или сталкивается с клинической ситуацией, где традиционное лечение (например, БА или ХОБЛ) не приносит ожидаемых результатов. 463-467.
463-467. M. et al. An open, randomized, comparative study of clarithromycin and erythromycin in the treatment of children with community-acquired pneumonia // J. Microbiol. Immunol. Infect. 2008. V. 41. № 1. P. 54-61.
M. et al. An open, randomized, comparative study of clarithromycin and erythromycin in the treatment of children with community-acquired pneumonia // J. Microbiol. Immunol. Infect. 2008. V. 41. № 1. P. 54-61. J. Respir. Crit. Care Med. 2000. V. 161. P 493-497.
J. Respir. Crit. Care Med. 2000. V. 161. P 493-497.
 По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
По данным официальной статистики МЗ РФ, заболеваемость внебольничной пневмонией в России среди лиц старше 18 лет составляет 3,9%. Зарубежные исследователи установили, что заболеваемость внебольничной пневмонией среди лиц молодого и среднего возраста варьирует от 1 до 11,6%, а в старшей возрастной группе достигает 25–44% [11, 13].
 С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
С помощью терминальной структуры микоплазма прикрепляется к клеткам хозяина (эритроцитам, клеткам реснитчатого эпителия бронхов и др.) [6]. Микоплазма также обладает механизмом мимикрии под антигенный состав клетки-хозяина, что способствует длительной персистенции возбудителя и вызывает образование аутоантител и развитие аутоиммунных процессов при микоплазменной инфекции [6, 10]. Предполагается, что именно с формированием аутоантител связано развитие нереспираторных проявлений Mycoplasma pneumoniae-инфекции.
 Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
Поэтому диагностика микоплазменной и хламидийной пневмоний основывается в первую очередь на выявлении особенностей клинико-рентгенологических данных и подтверждается серологически или с помощью полимеразно-цепной реакции (ПЦР).
 У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р < 0,001) и проявляется заложенностью носа и нарушением носового дыхания, у части больных наблюдаются небольшие либо умеренные слизисто-серозные или слизисто-гнойные выделения из носа. У пациентов же с микоплазменной пневмонией чаще регистрируются явления фарингита и ларингита, проявляющиеся гиперемией ротоглотки и осиплостью голоса (77,3 ± 6,3%, р < 0,05).
У больных микоплазменной пневмонией, в отличие от хламидийной, наблюдается частый, преимущественно непродуктивный, навязчивый, мучительный, приступообразный кашель (см. табл. 1). Наряду с кашлем, у пациентов с хламидийной и микоплазменной пневмониями наблюдаются умеренные признаки поражения верхних дыхательных путей — ринит, фарингит, ларингит. Ринит чаще всего встречается у больных хламидийной пневмонией (75,0 ± 10,8%, р < 0,001) и проявляется заложенностью носа и нарушением носового дыхания, у части больных наблюдаются небольшие либо умеренные слизисто-серозные или слизисто-гнойные выделения из носа. У пациентов же с микоплазменной пневмонией чаще регистрируются явления фарингита и ларингита, проявляющиеся гиперемией ротоглотки и осиплостью голоса (77,3 ± 6,3%, р < 0,05).
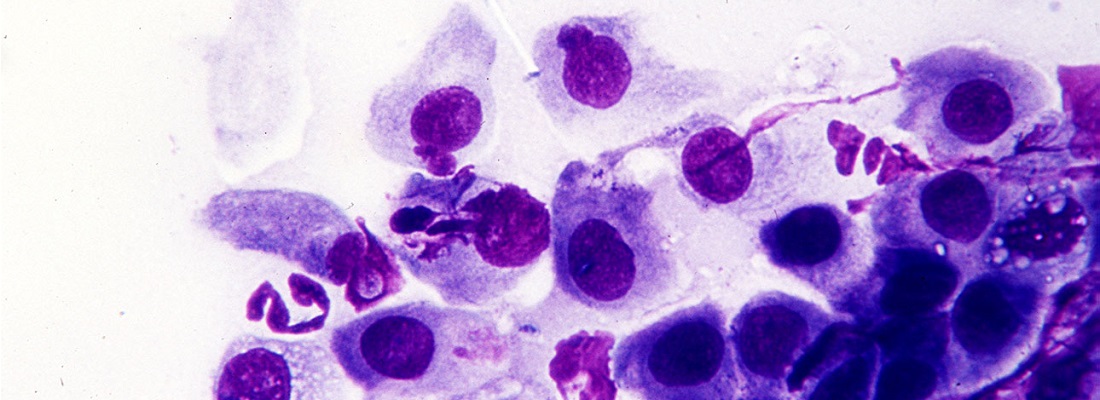 При микоплазменной пневмонии чаще наблюдается двустороннее поражение легких (40,9%) с усилением легочного рисунка (22,7%) и перибронхиальной инфильтрацией (50%), при хламидийной пневмонии — наоборот, чаще полисегментарная инфильтрация (43,7%) и реже интерстициальные изменения (31,3%).
При микоплазменной пневмонии чаще наблюдается двустороннее поражение легких (40,9%) с усилением легочного рисунка (22,7%) и перибронхиальной инфильтрацией (50%), при хламидийной пневмонии — наоборот, чаще полисегментарная инфильтрация (43,7%) и реже интерстициальные изменения (31,3%).
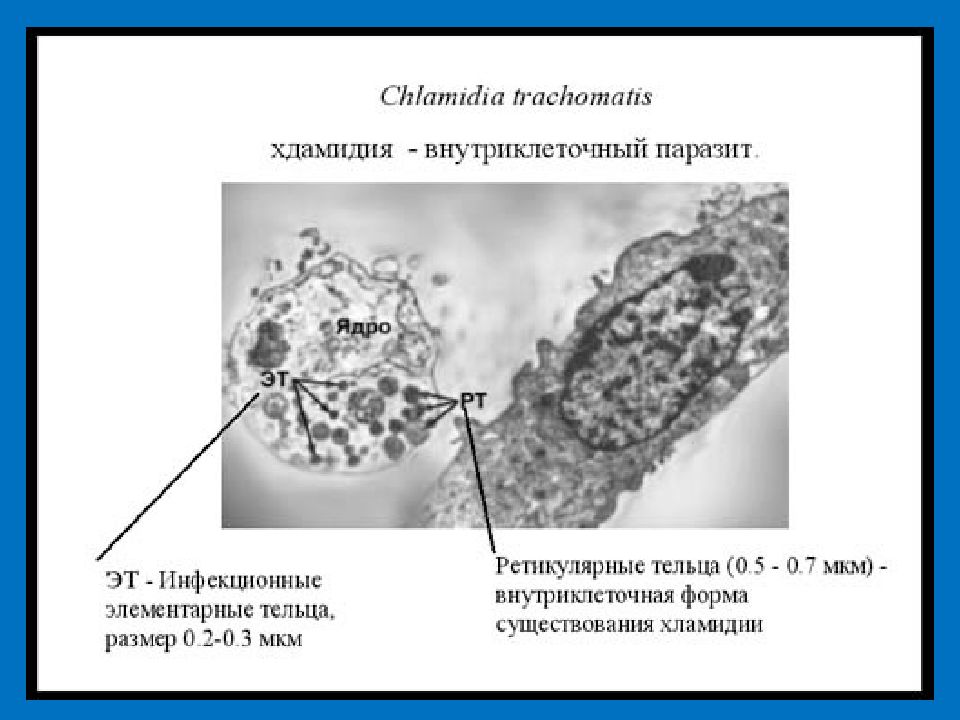 По динамике уровня специфических антител, определяемых ИФА-методом (табл. 2), можно установить характер и стадию заболевания [10, 11, 13].
По динамике уровня специфических антител, определяемых ИФА-методом (табл. 2), можно установить характер и стадию заболевания [10, 11, 13].
 Благодаря этому антибактериальное действие усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки. Более того, макролиды обладают противовоспалительными и иммуномодулирующими свойствами, которые обусловлены несколькими механизмами [11]. Во-первых, макролиды оказывают модулирующее влияние на такие функции нейтрофилов, как фагоцитоз, хемотаксис, киллинг. Под влиянием 14-членных макролидов происходит ингибирование окислительного «взрыва», в результате чего уменьшается образование высокоактивных окисляющих соединений, способных повреждать не только бактериальные клетки, но и собственные ткани [10, 11]. Кроме того, взаимодействуя с клетками иммунной системы, макролиды могут ингибировать синтез и/или секрецию таких провоспалительных цитокинов, как интерлейкины-1, -6, -8, фактор некроза опухоли α, и, наоборот, усиливать секрецию противовоспалительных интерлейкинов-2, -4, -10. Установлено, что макролиды препятствуют адгезии бактерий к поверхности клеток макроорганизма, а также тормозят экспрессию факторов вирулентности некоторых микробов [5, 10, 11].
Благодаря этому антибактериальное действие усиливается и пролонгируется, сохраняясь в течение срока, необходимого для ресинтеза новых функциональных белков микробной клетки. Более того, макролиды обладают противовоспалительными и иммуномодулирующими свойствами, которые обусловлены несколькими механизмами [11]. Во-первых, макролиды оказывают модулирующее влияние на такие функции нейтрофилов, как фагоцитоз, хемотаксис, киллинг. Под влиянием 14-членных макролидов происходит ингибирование окислительного «взрыва», в результате чего уменьшается образование высокоактивных окисляющих соединений, способных повреждать не только бактериальные клетки, но и собственные ткани [10, 11]. Кроме того, взаимодействуя с клетками иммунной системы, макролиды могут ингибировать синтез и/или секрецию таких провоспалительных цитокинов, как интерлейкины-1, -6, -8, фактор некроза опухоли α, и, наоборот, усиливать секрецию противовоспалительных интерлейкинов-2, -4, -10. Установлено, что макролиды препятствуют адгезии бактерий к поверхности клеток макроорганизма, а также тормозят экспрессию факторов вирулентности некоторых микробов [5, 10, 11].
 Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.
Высокую активность проявляют новые фторхинолоны — левофлоксацин (таваник) и моксифлоксацин (авелокс). Моксифлоксацин и левофлоксацин успешно подавляют практически любую флору, вызывающую пневмонии.


 — Казань, 2001. — 64 с.
— Казань, 2001. — 64 с.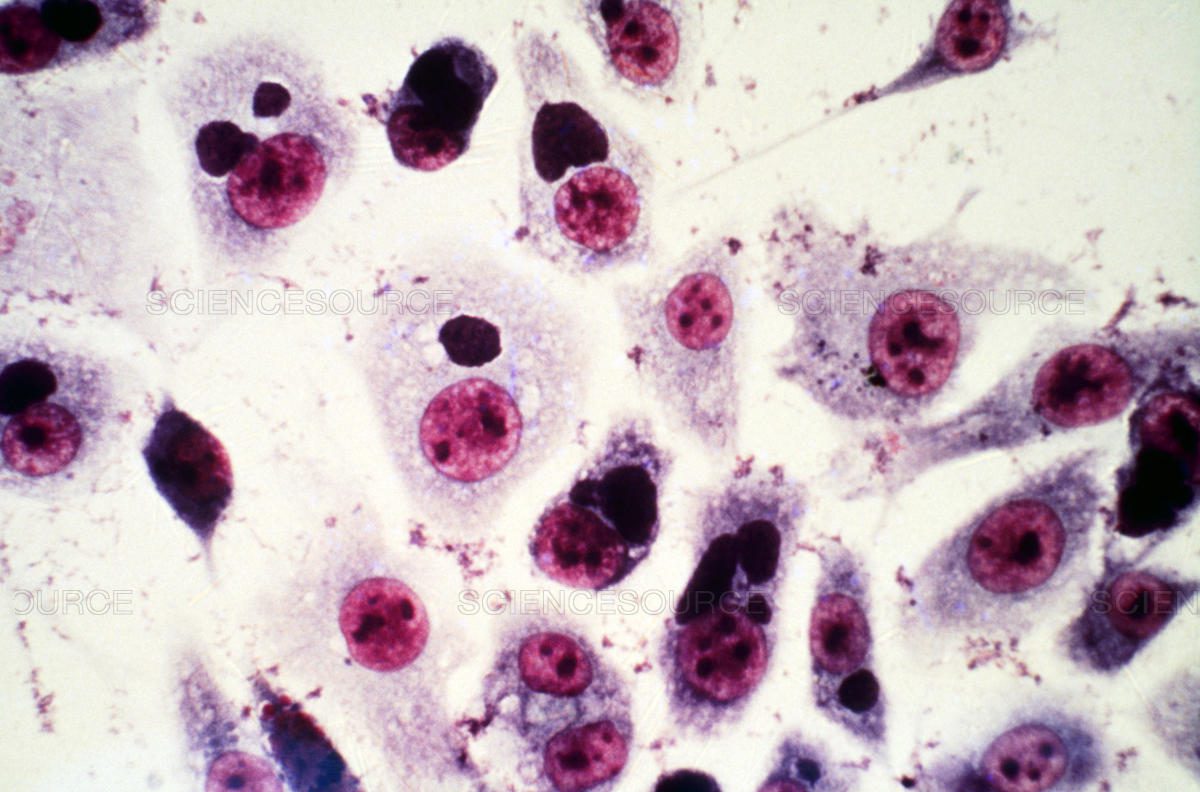 (Румянцева, Татьяна «Уреаплазмоз» — диагноз, которого нет. Румянцева, MD акушер-гинеколог, к. м. н. (18 сентября 2018). Дата обращения 29 октября 2019.).
(Румянцева, Татьяна «Уреаплазмоз» — диагноз, которого нет. Румянцева, MD акушер-гинеколог, к. м. н. (18 сентября 2018). Дата обращения 29 октября 2019.).
 Уреаплазмозом болеют и мужчины и женщины. Ureaplasma urealyticum активно влияет на среду обитания, довольно легко расщепляет мочевину с выведением аммиака. Это приводит к обширному воспалительному процессу и скоплению солей мочевой кислоты в почках. Что, в свою очередь, может привести к болезненному мочеиспусканию, циститу, задержке жидкости в организме.
Уреаплазмозом болеют и мужчины и женщины. Ureaplasma urealyticum активно влияет на среду обитания, довольно легко расщепляет мочевину с выведением аммиака. Это приводит к обширному воспалительному процессу и скоплению солей мочевой кислоты в почках. Что, в свою очередь, может привести к болезненному мочеиспусканию, циститу, задержке жидкости в организме.
 Во время беременности микроорганизмы могут передаваться от матери к ребенку, что часто становится причиной выкидышей в первом триместре, а на последних неделях беременности – преждевременные роды. У детей микоплазма провоцирует развитие патологий органов дыхания и мочеполовой системы.
Во время беременности микроорганизмы могут передаваться от матери к ребенку, что часто становится причиной выкидышей в первом триместре, а на последних неделях беременности – преждевременные роды. У детей микоплазма провоцирует развитие патологий органов дыхания и мочеполовой системы. Это означает, что курс лечения лучше проходить в медицинском центре, где есть ультразвуковая санация лекарственными препаратами (ГИНЕТОН), лазеротерапия, магниты, электростимуляция (БТЛ) и иммунокоррекция внутривенным лазером (ВЛОК).
Это означает, что курс лечения лучше проходить в медицинском центре, где есть ультразвуковая санация лекарственными препаратами (ГИНЕТОН), лазеротерапия, магниты, электростимуляция (БТЛ) и иммунокоррекция внутривенным лазером (ВЛОК). Для профилактики достаточно проходить курс из 10 процедур раз в 6 месяцев.
Для профилактики достаточно проходить курс из 10 процедур раз в 6 месяцев.
 При микоплазмозе описаны перикардит, миокардит, гемоперикард, сердечная недостаточность, полная АВ-блокада. Выраженные изменения ЭКГ иногда обнаруживают в отсутствие жалоб. Иногда Mycoplasma pneumoniae бывает единственным микроорганизмом, выделяемым из перикардиального выпота и ткани сердца.
При микоплазмозе описаны перикардит, миокардит, гемоперикард, сердечная недостаточность, полная АВ-блокада. Выраженные изменения ЭКГ иногда обнаруживают в отсутствие жалоб. Иногда Mycoplasma pneumoniae бывает единственным микроорганизмом, выделяемым из перикардиального выпота и ткани сердца.

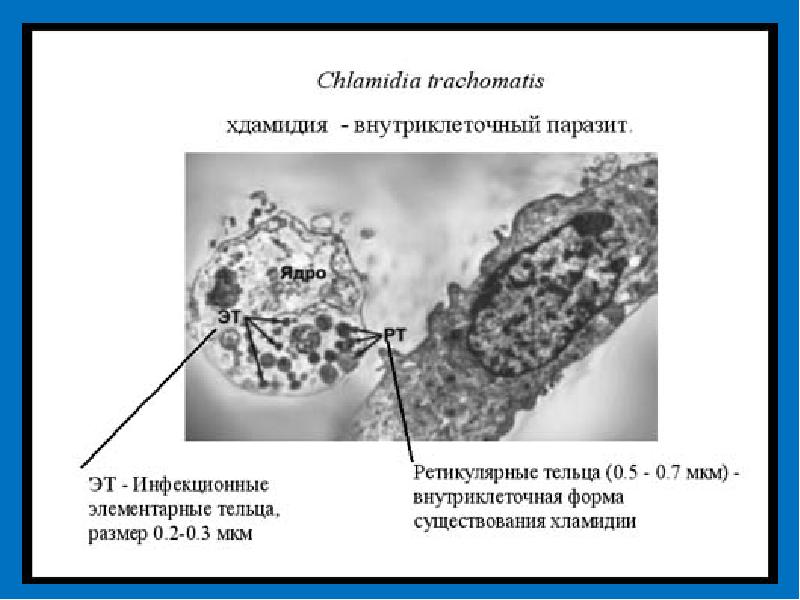


 2008, 188 (2): 106-
2008, 188 (2): 106- 2007, 83 (3): 237-241. 10.1136 / sti.2006.022970.
2007, 83 (3): 237-241. 10.1136 / sti.2006.022970.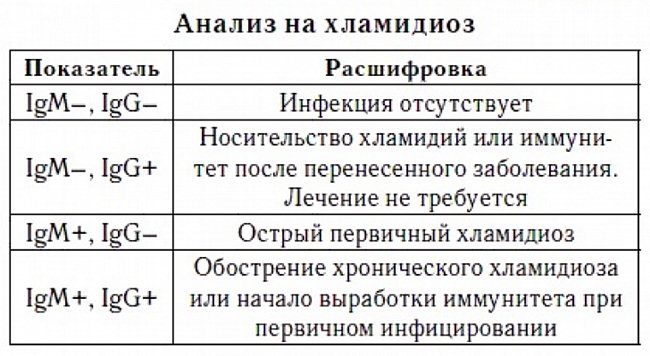
 , Меда Х, Фрост Е: Mycoplasma genitalium : организм, обычно связанный с цервицитом среди секс-работников Западной Африки. Инфекции, передаваемые половым путем. 2005, 81 (1): 67-72. 10.1136 / ст.2003.009100.
, Меда Х, Фрост Е: Mycoplasma genitalium : организм, обычно связанный с цервицитом среди секс-работников Западной Африки. Инфекции, передаваемые половым путем. 2005, 81 (1): 67-72. 10.1136 / ст.2003.009100.
 Журнал Американской медицинской ассоциации. 2004, 291 (18): 2229-2236. 10.1001 / jama.291.18.2229.
Журнал Американской медицинской ассоциации. 2004, 291 (18): 2229-2236. 10.1001 / jama.291.18.2229. Инфекции, передающиеся половым путем. 2003, 79: 31-34. 10.1136 / sti.79.1.31.
Инфекции, передающиеся половым путем. 2003, 79: 31-34. 10.1136 / sti.79.1.31.