Гестационная гипотироксинемия: исходы, профилактика, лечение
1. Анучков В.Б., В.А. Привалов, Я.В. Пельцвергер и др. «Использование УЗИ в диагностике заболеваний щитовидной железы», Актуальные проблемы эндокринологии: Тезисы докладов III всероссийского съезда эндокринологов, М 1996, стр 119.
2. Балаболкин М.Н. «Эндокринология» Москва, Изд-во «Медицина» 89, стр. 184-185.
3. Бахарева И.В. «Прогностическое значение некоторых эндокринных и биохимических показателей при невынашивании беременности», Дисс. канд.мед.наук, М-1997.
4. Бенкер Г. «Лекарственная терапия нетоксического зоба», Тироид Россия. Сборник лекций. М 1997, с. 13-18.
5. Бурумнулова Ф.Ф., Герасимов Г. А. «Заболевания щитовидной железы и беременность», Проблемы эндокринологии 1998 г., Т 4, N 2, стр. 27-32.
6. Варламова Т.М., Соколова М.Ю. «Репродуктивное здоровье женщины и недостаточность функции щитовидной железы» Гинекология. Журнал для практических врачей 2004г. Т6,№1, с.29-32
7. Великолуг К. А. «Функциональные механизмы взаимодействия системы гипофиз-щитовидная железа и фетоплацентарного комплекса у беременных женщин с тиреопатиями в условиях Европейского севера», Дисс. канд. мед. наук, Архангельск -1997.
А. «Функциональные механизмы взаимодействия системы гипофиз-щитовидная железа и фетоплацентарного комплекса у беременных женщин с тиреопатиями в условиях Европейского севера», Дисс. канд. мед. наук, Архангельск -1997.
8. Гайтман Э. «Зобогенные факторы окружающей среды» В книге: Болезни щитовидной железы. Под редакцией Л.И. Браверманна. Пер. с англ. М.:Медицина.-2000. с.359-377.
9. Гельфанд М., Редферн К.С. «Скрининговое обследование для выявления заболеваний щитовидной железы», Часть I Обзор литературы, Часть II — Клинические рекомендации. Международный журнал медицинской практики-99, N 10, N 11.
10. Герасимов Г.А. «Йодный дефицит в странах Восточной Европы и Центральной Азии состояние проблемы в 2003 году», Клиническая тиреидология — 2003. Т.1, №3, с.5-13.
11. Герасимов Г.А. «Лабораторные методы в диагностике заболеваний щитовидной железы», Клинико-лабораторная диагностика -1998, N6.
12. Герасимов Г.А. «Рекомендации по лечению препаратами гормонов щитовидной железы и йода», Москва 2000.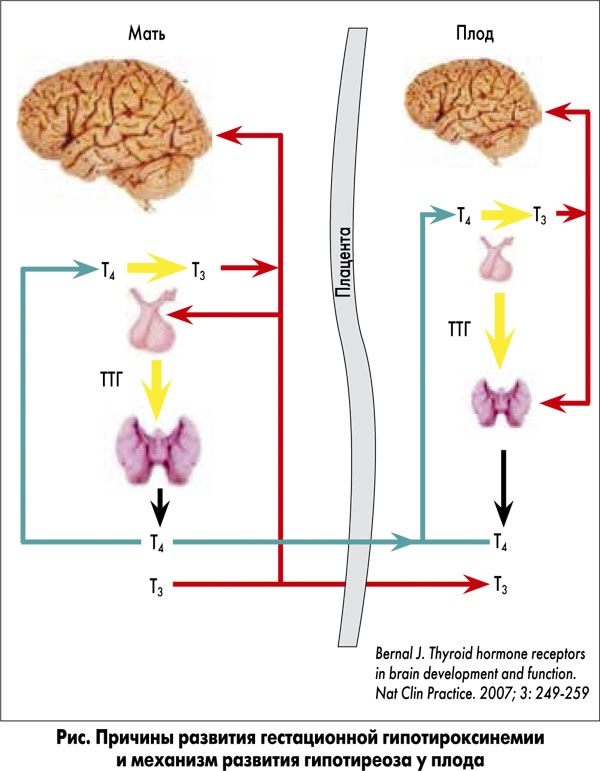
13. Герасимов Г.А. «Эпидемиология, профилактика и лечение йоддефицитных заболеваний в Российской Федерации. Сборник лекций. Москва 1997, с 39-40.
14. Герасимов Г.А., Петунина H.A. «Йод и аутоиммунные заболевания щитовидной железы» Проблемы эндокринологии 1994 год, Т 40, N 6, стр 41-43
15. Герасимов Г.А., Фадеев В.В., Свириденко Н.Ю., Мельниченко Г.А., Дедов И.И. «Йоддефицитные заболевания в России. Простое решение сложной проблемы» М-2002, с. 168
16. Гитель Е.П., Мельниченко Г.А. «Клинико-лабораторные алгоритмы оценки функциональной активности щитовидной железы «Клинико-лабораторная диагностика N 5, 1999 г.
17. Дедов И.И., Герасимов Г. А., Свириденко Н.Ю. «Йоддефицитные заболевания в Российской федерации (эпидемиология, диагностика, профилактика)», Методическое пособие, М — 99, с.29.
18. Дедов И.И., Петеркова В.А, Безлепкина О.Б. «Врожденный гипотиреоз у детей» Методические рекомендации, Москва 99.
19. Дедов И.И., Свириденко Н.Ю. «Стратегия ликвидации йоддефицитных заболеваний в Российской Федерации» Проблемы эндокринологии 2001, Т47, №6
20. Дедов И.И., Свириденко Н.Ю., Герасимов Г.А., Петеркова В.В. «Оценка йодной недостаточности в отдельных регионах России». Лекция для клинических врачей. Москва 99.
Дедов И.И., Свириденко Н.Ю., Герасимов Г.А., Петеркова В.В. «Оценка йодной недостаточности в отдельных регионах России». Лекция для клинических врачей. Москва 99.
21. Дедов И.И., Трошина Е.А., Александрова Г.Ф. «Диагностика, лечение и профилактика узловых форм заболеваний щитовидной железы», Руководство для врачей, Москва 99.
22. Древаль A.B., Нечаева O.A., Камынина Т.С., Герасимов Р.Н. «Оценка эффективности долгосрочной профилактики йоддефицита методом биологического мониторинга». Проблемы эндокринологии — 2000,N2.
23. Ешимбетова Г.З. Патогенгетические механизмы формирования невынашивания беременности у женщин с ДНЗ/ Канд. Дисс. На д.м.н. Ташкент 2004
24. Зельцер М.Е., Базарбекова Р.Б. «Мать и дитя в очаге йодного дефицита», Алматы-99.
25. Иен С.С.К., Р.Б. Джофф. Репродуктивная эндокринология. Москва, «Медицина», 1998.Т.1, с.587-609.
26. Касаткина Э.П. «Врожденный гипотиреоз», Клинические лекции для врачей-эндокринологов, Москва 2001.
27. Касаткина Э. П. «Роль тиреоидного статуса беременной женщины в формировании интеллекта ребенка» Гинекология 2002, Т4,№3,с. 132-135
П. «Роль тиреоидного статуса беременной женщины в формировании интеллекта ребенка» Гинекология 2002, Т4,№3,с. 132-135
28. Кобозева Н.В., Гуркин Ю.А. «Перинатальная эндокринология» Руководство для врачей, Ленинград 1986, с. 128-163.
29. Коволенко Т.В., Щеплягина Л.А. «Тиреоидный гомеостаз в системе мать-плацента-плод-новорожденный в норме и в условияхйодной недостаточности» Российский педиатрический журнал — 2003, №1,с.46-47.
30. Курмачева H.A., Щеплягина JI.A. «Гипотироксинемия матери и состояние здоровья ребенка» Современные проблемы профилактической педиатрии. Материалы VIII Конгресса педиатров России. М-2003. с. 187.
31. Куулар Н.К. Оптимизация диспансерной тиреоидологической службы в регионе умеренно-тяжелой йодной недостаточности (республика Тыва) / Автореф. Дис.канд. мед. наук Москва 2004
32. Лесникова C.B. Функциональное состояние щитовидной железы у беременных женщин в регионе легкого йодного дефицита/ Автореф. Дис.канд. мед. наук Москва-2003
33. Логачева Т. С. Возможности ультразвукового исследования в диагностике заболеваний щитовидной железы у новорожденных и детейпервого года жизни/ Автореф. Дис.канд. мед. н Автореф. Дис.канд. мед. Наук аук Москва 2004
Логачева Т. С. Возможности ультразвукового исследования в диагностике заболеваний щитовидной железы у новорожденных и детейпервого года жизни/ Автореф. Дис.канд. мед. н Автореф. Дис.канд. мед. Наук аук Москва 2004
34. Макаров А.Д., Базаров Э.Н., Козлов Г.И. «Об ассоциации многоузлового коллоидного эутиреоидного зоба с некоторыми генетическими маркерами», Проблемы эндокринологии 1993, Т39, N6.
35. Мельниченко Г.А. «Гипотиреоз» Клинические лекции, Москва 2000
36. Мельниченко Г.А., Лесникова C.B. «Особенности функционирования щитовидной железы во время беременности», Гинекология 99, Т1, N2.
37. Мельниченко Г.А., Мурашко JI.E., Клименченко Н.И. «Заболевания щитовидной железы и беременность», РМЖ 99, Т 7, N 3, с.145-150.
38. Мельниченко Г. А., Мурашко Л.Е., Клименченко Н.И., Малясова C.B. «Заболевания щитовидной железы и беременность», РМЖ 99, N 3.
39. Моргунова Т.В., Степанова Е.М. «Особенности функционирования щитовидной железы у беременных в условиях крупного промышленного центра» Клиническая тиреидология 2004, Т2, №3, с. 27-29.
27-29.
40. Мурашко Л.Е., Мельниченко Г. А., Клименченко Н.И., Вильданова М.В., Хазова Е.И. «Щитовидная железа и беременность» (Обзоры), Проблемы беременности, Научно-практический журнал 2000, N 1, с. 4-11.
41. Никифировский Н.К., Петрова C.B., Трошина Е.А. «Состояние фетоплацентарной системы у беременных с эутиреоидным зобом» Клиническая тиреидология 2004, Т1, №3, с. 13-17.
42. Паршин B.C. «УЗ-диагностика заболеваний щитовидной железы», Дисс. д-ра мед. наук. Обнинск 1994.
43. Петрухин В.А., Бурумкулова Ф.Ф., Шидловская Н.В., Витушко С.А., Склянкина И.В. «Распространенность Тиреоидной патологии среди беременных, проживающих на территории Московской области» Клиническая тиреидология 2004, Т2, №2, с. 30-32.
44. Подзолкова Н.М., Глазкова O.JI. «Симптом. Синдром. Диагноз. Дифференциальная диагностика в гинекологии» Москва 2003
45. Потемкин В.В. «Эндокринология», Москва, «Медицина» 99, издание третье, переработанное.
46. Сазонова С.Н. «Гипоталамо-гипофизарные взаимоотношения в патогенезе диффузного нетоксического зоба», Дисс. кандидат мед. наук, Л-1988.
кандидат мед. наук, Л-1988.
47. Самсонова Л.Н., Киселева Е.В., Ибрагимова Г.В., Рябых A.B., Тарасова A.A., Науменко Л.Л., Касаткина Э.П. «Врожденный транзиторный гипотиреоз: распространенность, прогноз» Москва 2003 (www.clinthyroid.ru)
48. Свириденко Н.Ю., Мельниченко Г.А. «Эпидемиология, мониторинг и профилактика заболеваний, обусловленных дефицитом йода». Методические рекомендации. Москва — 99.
49. Старкова Н.Т. «Клиническая эндокринология» Руководство для врачей. Москва-91, с 108-163.
50. Сурков С.И. «Патогенетические механизмы развития диффузного нетоксического зоба и методы их коррекции», Дисс. кандидат мед. наук, М-1990.
51. Туровина Е.В. «Сравнительный анализ эффективности методов йодной профилактики у беременных женщин, проживающих в условиях зобной эндемии» Автореф. Дис.канд. мед. наук Самара 2002 -23с
52. Фадеев В.В. Иододефицитные и аутоиммунные заболевания щтовидной железы в регионе легкого йодного дефицита Автореф. Дис. .доктора, мед. наук Москва 2004
53. Фадеев В.В. «Нормативы уровня ТТГ: нужны ли изменения?» Клиническая тиреидология 2004, Т2, №3, с. 5-9.
Фадеев В.В. «Нормативы уровня ТТГ: нужны ли изменения?» Клиническая тиреидология 2004, Т2, №3, с. 5-9.
54. Фадеев В.В. «Патогенетическая терапия эутиреоидного зоба», Consilium medicum 2002,т.4, №10, с.516-520.
55. Фадеев В.В., Лесникова С.В. «Иододефицитные заболевания и беременность» Гинекология 2001, т.З, №5, с.191-194.
56. Фадеев В.В., Лесникова С.В., Мельниченко Г.А. «Функциональное состояние щитовидной железы у беременных женщин в условиях легкого дефицита» Клиническая тиреидология 2003, т1, №2, с.17-32.
57. Фадеев В.В., Мельниченко Г.А. «Йоддефицитные заболевания и беременность», РМЖ 99, Т 7, N 18.
58. Фадеев В.В., Мельниченко Г.А. «Гипотиреоз». Руководство для врачей. М.: РКИ Соверо пресс, 2002
59. Фадеев В.В., Мельниченко Г.А. «Физиологические дозы йода и носите льство антител к тиреопероксидазе: открытое рандомизированное исследование», Проблемы эндокринологии 2004, № 5, с. 3-7.
60. Хосталек У. «Заболевания щитовидной железы и возможности их эффективного лечения».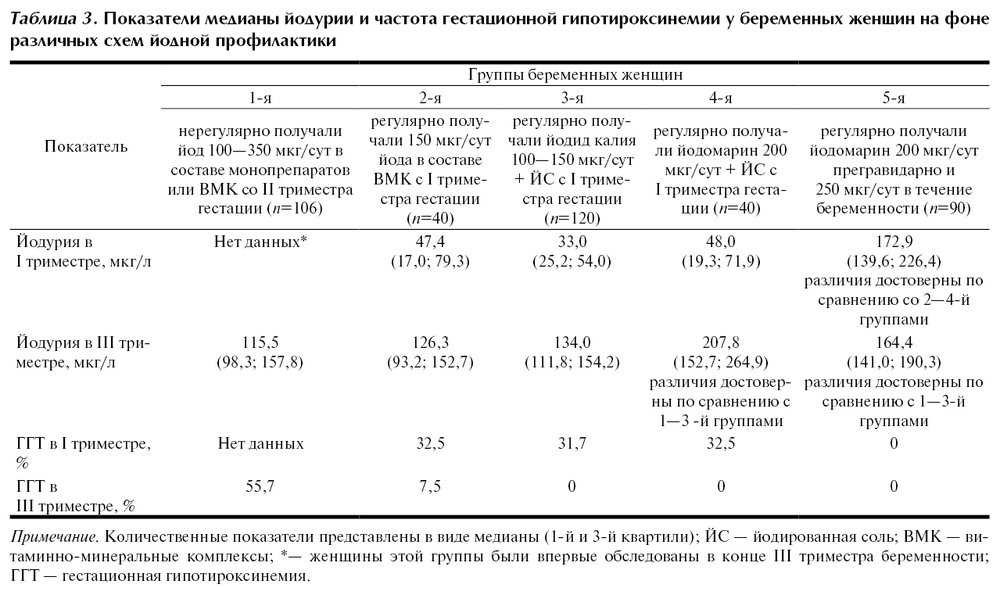 Тироид Россия. Сборник лекций. Москва 1997, с. 6-12.
Тироид Россия. Сборник лекций. Москва 1997, с. 6-12.
61. Чуприн В.Ф. «Гигиеническая оценка роли оксида углерода и генетических факторов в этиологии эндемического зоба» Автореф. Дис канд.мед.наук Москва 1984г 22с.
62. Шилин Д.Е. «Гормональный анализ в диагностике заболеваний щитовидной железы», Руководство для эндокринологов и сотрудников гормональных лабораторий, Москва 98.
63. Шилин Д.Е. «Профилактика дефицита йода у беременной, плода, новорожденного» Гинекология 2000, Т2,№6,с.173-176
64. Щеплягина JI.A. «Медико-социальные последствия роста напряженности зобной эндемии для детей и подростков», Тироид Россия-Сборник лекций, Москва 1997, с41-42.
65. Щеплягина JI.A. «Проблема йодного дефицита», РМЖ 99,Т 7,N 11
66. Щеплягина JI.A., Курмачева Н.А. «Йодная профилактика у детей раннего возраста», РМЖ 2003, 11(12)
67. Щеплягина Л.А., Курмачева Н.А., Дейнеко О.Я., Гайфулина Г.Н., Стуколова Т.И. «Состояние здоровья детей первого года жизни в йоддефицитном регионе» РМЖ 2003, том 11, №1, (www. rmj. ru)
rmj. ru)
68. ACOG Practice Bulletin. Clinical management guidelines for obstetrician-gynecologisfcs. Number 37, August 2002. (Replaces Practice Bulletin Number 32, November 2001). Thyroid disease in pregnancy. Obstet Gynecol 2002 Aug; 100(2):3 87-96.
69. ACOG practice bulletin. Thyroid disease in pregnancy. Number 37, August 2002. American College of Obstetrics and Gynecology, hit 3 Gynaecol Obstet 2002 Nov,79(2): 171-80.
70. Allan WC; Haddow JE; Palomaki GE; Williams JR; Mitchell ML; Hermos RJ; Faix JD; Klein RZ. //Maternal thyroid deficiency and pregnancy complications: implications for population screening.// Journal of medical screening; 7; 3; 127-30; 2000 (2000)
71. Aghini-Lombardi F., Antonangeli et al. The spectrum of thyroid disorders in an iodine deficient community: the pescopagana survery// The J. of Clinical Endocr. And Metab.1999, V.84, № 3, p561-566.
72. Ardawi MS, Nasrat HA, Mustafa BE. //Urinary iodine excretion and maternal thyroid function. 3(4):413-22.
3(4):413-22.
73. Ballabio M. et al, «Pregnancy induced changes in thyroid function: role of human chorionic gonadotropin as putative regulator of maternal thyroid», J. Clin. Endocrinol. Metab. 1991, V73, p 824 — 831.
74. Ballabio M. et al, «Rol of hCG in regulating maternal thyroid function: Longitudinal studi in a normal population», J. Endocrinol 1990, V124, p 85.
75. Baloch Z.,Carayon P., et al. Guide-lines Committee, National Academy of Clinical Biochemistry. Laboratory medicine practice guidelines. ‘Laboratory support for the diagnosis and monitoring of thyroid disease.» Thyroid 2003. Vol. 13, p. 3-126
76. Black R.E. Micronutrients in pregnancy. // Br J. Nutr 2001 May;85 Suppl 2:S 193-7
77. Browne-Martin K., Emerson C.H. «Postpartum thyroid dysfunction» Clinical Obst. And Gynecol. 1997, V40, N1, p 90-101.
78. Burrow G.N., Fisher D.A., Larsen P.R. Mechanisms of disease: Maternal and fetal thyroid function // N. Engl. J. Med. 1994. Vol. 331. p. 10721078
79. Cooper D.S., «Subclinical hypothyroidism», J. Am. Med. Ass. 1987, V258, p 246-249.
Cooper D.S., «Subclinical hypothyroidism», J. Am. Med. Ass. 1987, V258, p 246-249.
80. D’Arviento M. et al. «Transient subclinical hypothyroidism», Feltraz Med. 1992, 33: 480 484.
81. Dakine N; Oliver C; Grino M. Effects of experimental hypothyroidism on the development of the hypothalamo-pituitary-adrenal axis in the rat.// Life sciences; 67; 23; 2827-44; 20001027 (2000)
82. Delange F. //Iodine deficiency as cause of brain damage.// POSTGRADUATE MEDICAL JOURNAL LONDON,77(906):217-220 2001
83. Delange F. «Йодный дефицит в Европе состояние проблемы на 2002 год» Thyronet.rusmedsenv.com
84. Delange F. Int.J.Endocrinol.Metab.2004;2(l):l-12.
85. Delange F. Postgrad. Med. J.- 2001, V77, p217-220.
86. Delange F. Thyroid 1998, V 8, N12, p 1185-92.
87. Delange F.//The role of iodine in brain development.// Proc Nutr Soc 2000 Feb; 59(l):75-9
88. Eltom A; Elnagar B; Gebre-Medhin M. //Thyroid hormones and iodine status in Sudanese pregnant women with goitre. // INTERNATIONAL JOURNAL OF FOOD SCIENCES AND NUTRITION, 50 (2) 105-9 (1999).
// INTERNATIONAL JOURNAL OF FOOD SCIENCES AND NUTRITION, 50 (2) 105-9 (1999).
89. Glinoer D. //Autoimmune thyroid disorders, maternal hypothyroxinemia and its potential repercussions for the progenu// in «Thyroid and Environment» European Thyroid Symposium, Budapest 2000, p 121-133
90. Glinoer D. «Maternal and fetal impact of chroniciodine deficiency» Clinical Obst. And Gynecol. 1997; (40), N1, p 102-16.
91. Glinoer D. «Maternal and neonatal thyroid function at birth in a area of marginally low iodine intake»,J. Clin. Endocr. Metab. 1992; 75: 800805.
92. Glinoer D. «Maternal and neonatal thyroid function in mild iodine deficiency» Merck European Thyroid Symposium «The Thyroid and Iodine», Warsaw 1996; 129-42
93. Glinoer D. et al. «A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects», J. Clin. Endocrinol. Metab.1995, V80,N1, p 258-69.
94. Glinoer D. //What happens to the normal thyroid during pregnancy? //Papers from the Symposium on Thyroid Disease in Pregnancy and the Postpartum Period Amelia Island, Florida, USA. November 6-8,1998. THYROID, 9 (7) 631-5 (1999).
November 6-8,1998. THYROID, 9 (7) 631-5 (1999).
95. Glinoer D., «The Regulaton of Thyroil Function in Pregnancy: Pathways of Endocrine Adoptation from Physiology to Pathology», Endocrinc Reviews 1997, VI8, N3.
96. Glinoer D; Delange F. //The potential repercussions of maternal, fetal, and neonatal hypothyroxinemia on the progeny.// Thyroid : official journal of the American Thyroid Association; 10; 10; 871-87; 200010 (2000).
97. Glinoer D; Smaundge RS. //The impact of maternal thyroid disease on the developing fetus: implications for diagnosis, treatment and screening,// HOT THYRJIDOLOGY (www.hotthyroidology.com) April, No 1,2004.
98. Glinoer D., Daniel. //Pregnancy end iodine.// THYROID, 11(5):471 -481 2001.
99. Hadi H., Strickland D., «Prenatal diagnosis and management of fetal goiter caused by maternal Grave’s disease», American J. of Perinatal 1995, V12, N4, p 240 242.
100. Hara T. et al. «The role of TSAb in the thyroid function of patients with postpartum hypothyroidism/ 1992; 36: 69-74.
101. Hershman J.M. Role of human chorionic gonadotropin as a thyroid stimulator // J. Clin. Endocrinol. Metab. 1992. Vol 74. p. 258-259.
102. Hufner M.M.W. Fortscbr Med. 2002; 8:136-9
103. Joshi J. et al. «Menstrual irregularities and lactacion failure may precede thyroid dysfunction or goiter» J. of postgraduate Medicine 1993; 39:137-41.
104. Joshimiira M. et al. «Thyroid- stimulating activity of human chorionic gonadotropin in sera of normal pregnant women» Acta Endocrinol.(Copenh) 1990; 123: 277-81.
105. Kamijo K. et al. «Transient subclinical hypothyroidism in early pregnancy», Endocrinol. Jpn 1990, 37:397 403.
106. Kelly F.C., Snedden W.W., «Эндемический зоб», ВОЗ, Женева 1963, стр. 27-226.
107. Kennedy R.L. et al, «The role of hCG in the regulation of the thyroid gland in normal and abnormal pregnancy», J. Obstet. Gynecol. 1991, Y78, p 298 307.
108. Kennedy R.L. et al., «HCG may not be responsible for thyroid-stimulating activity in normal pregnancy serum», J. Clin. Endocrinol. Metab. 1992, V74, p 260-265.
Clin. Endocrinol. Metab. 1992, V74, p 260-265.
109. Klein RZ , Sargent JD , Larsen PR , Waisbren SE , Haddow JE , Mitchell ML. //Relation of severity of maternal hypothyroidism to cognitive development of offspring. //J Med Screen, 8(1): 18-20 2001.
110. Koudo K., Levy A.,Lightman S.L. J. Endocrinol. 1997, V152, N3, p 423-430.
111. Lazarus J.H. and Othman S. «Review: thyroid disease in relation to pregnancy», Clin. Endocrinol. 1991, 34: 91 98.
112. Man B.E. Thyroid function in pregnancy and infancy. Maternal hypothyroxinemia and retardation of progeny.// CRC Crit. Rev. Clin. Lab. Sciences 1972,3:203:225
113. Mestman J.H. «Thyroid diseases in pregnancy» Clinical Obst. And Gynecol. 1997, V40, N1, p 1-2.
114. Mitchell ML, Klein RZ, Sargent JD, Meter RA, Haddow JE, Waisbren SE, Faix JD. //Iodine sufficiency and measurements of thyroid function in maternal hypothyroidism.// Clin Endocrinol(Oxf) 2003 May;58(5):612-6.
115. Morreale de Escobar G, ObregTin MJ, Escobar del Rey F. //Is neuropsychological development related to maternal hypothyroidism or to maternal hypothyroxmemia? // J Clin Endocrinol Metab, 2000, 85(11): 397587.
//Is neuropsychological development related to maternal hypothyroidism or to maternal hypothyroxmemia? // J Clin Endocrinol Metab, 2000, 85(11): 397587.
116. Morreale de Escobar G., Escobar del Rey F. et al. Hot Thyroidolody (www.hotthyroidolody.com) 2002,2
117. Nohr SB, Laurberg P. //Opposite variations in maternal and neonatal thyroid function induced by iodine supplementation during pregnancy.// J Clin Endocrinol Metab 2000 Feb;85(2):623-7.
118. O’Donnell KJ, Rakeman MA, Zhi-Hong D, Xue-Yi C, Mei ZY, DeLong N, Brenner G, Tai M, Dong W, DeLong GR. //Effects of iodine supplementation during pregnancy on child growth and development at school age. // Dev Med Child Neurol 2002 Feb;44(2):76-81.
119. Othman S. et al., «Long term follow up of postpartum thyroiditis», Clin. Endocrinol 1990, 32: 559 564.
120. Porterfield S.P., Hendrich C.E. «The role of thyroid hormones in prenatal and neonatal neurological development current perspectives» Endocrine Re-Views 1993; 14-1: 94-103.
121. Schumn-Draeger P., M.Risk, «Benefit of thyroid hormone treatment in euthyroid conditions diffuse goiter. The Thyroid and Tissues», Eds Orgazzi J., Leclere J., Stuttgart, New-York, Schattauer 1994, p 169 175.
122. Soliman S. et al, «Color Doppler imaging of the thyroid gland in a fetus with congenital doiter», American J. of Perinatal 1994, VI1, p21 23.
123. Thorpe-Beeston et al, «Maturation of the secretion of thyroid hormone in the fetus», N.-Engl. J. Med. 1991, V324, p532 536.
современный взгляд на проблему. Конгресс «Эндокринология Северо-Запада Роcсии – 2015». Сателлитный симпозиум компании Merck Serono uMEDp
В рамках конгресса «Эндокринология Северо-Запада Роcсии – 2015» (Санкт-Петербург, 18–20 июня) состоялся симпозиум, организованный при поддержке компании Merck. Ведущие эндокринологи страны рассмотрели актуальные вопросы эндокринологии – диагностику и лечение гипотироксинемии и синдрома поликистозных яичников.
Профессор В. В. Фадеев
В. Фадеев
Рис. 1. Алгоритм лечения субклинического гипотиреоза Европейской тиреоидной ассоциации
Профессор Е.Н. Гринева
Рис. 2. Уровень глюкозы и инсулина у больных СПКЯ до и после шести месяцев лечения метформином
Гипотироксинемия: биохимический, клинический и лабораторный феномен
Заведующий кафедрой эндокринологии лечебного факультета Первого Московского государственного медицинского университета им. И.М. Сеченова, председатель Московской ассоциации эндокринологов, председатель секции по заболеваниям щитовидной железы Российской ассоциации эндокринологов, д.м.н., профессор Валентин Викторович ФАДЕЕВ в своем докладе затронул вопросы диагностики и лечения гипотироксинемии. Выступающий отметил, что 180 лет назад была опубликована статья Роберта Джеймса Грейвса (Robert James Graves) о системном аутоиммунном заболевании, которое развивалось вследствие выработки антител к рецептору тиреотропного гормона (ТТГ) и клинически проявлялось поражением щитовидной железы.
Гипотироксинемию можно рассматривать с нескольких позиций – биологической, клинической и лабораторной. С биологической точки зрения гипотироксинемия – состояние, развивающееся вследствие дефицита тиреоидных гормонов. Тироксин (тетрайодтиронин – Т4) – универсальный тиреоидный гормон, регулирующий процесс потребления клеткой кислорода. Однако при дефиците этого гормона в организме уменьшается не только потребление кислорода. Снижаются также скорость окислительного процесса, синтез аденозинтрифосфата. Как следствие, наступает гипоэнергетическое состояние организма, нарушается функциональная и пролиферативная активность клетки. Гормон влияет на все виды обмена веществ и функцию всех органов и систем организма.
Диагностика гипотироксинемии основывается на клинических лабораторных исследованиях, предполагающих прямое определение уровня Т4 (общий и свободный Т4) и непрямую оценку тканевых эффектов Т4 (ТТГ, периферические маркеры эффектов тиреоидных гормонов). Однако доступные иммунометрические методы определения уровня свободного Т4 не всегда точны, поскольку не предусматривают физического разделения свободного гормона и связанного и зависят от изменений уровня связывающих белков. При избытке белков уровень свободного Т4 понижается, при дефиците – повышается.
Часто выявляется существенная вариабельность результатов оценки уровня свободного Т4 разными методами в период беременности. В исследовании, в котором уровень свободного Т4 оценивали с помощью девяти различных иммунометрических тестов, а также равновесного диализа, показано, что у части женщин без каких-либо признаков патологии щитовидной железы и при нормальном значении ТТГ уровень свободного Т4 на поздних сроках гестации был значительно снижен

Следует отметить, что с несовершенством рутинных методов определения свободного Т4 связано такое состояние беременных, как изолированная гестационная гипотироксинемия. Это означает, что во время беременности при нормальном значении ТТГ выявляют сниженный уровень свободного Т4.
Согласно клиническим рекомендациям Американской тиреоидной ассоциации лечение при изолированной гипотироксинемии в период беременности нецелесообразно2.
Определение в сыворотке крови уровня ТТГ высокочувствительными методами признано самым распространенным способом оценки тиреоидной функции. ТТГ вырабатывается гипофизом и регулирует выработку гормонов щитовидной железы (Т4 и трийодтиронина – Т3) по системе обратной связи, которая позволяет поддерживать стабильную концентрацию этих гормонов в крови. Особое значение имеет референсный диапазон, поскольку от него зависят точность и надежность анализа уровня ТТГ как диагностического инструмента. Сегодня референсный диапазон для ТТГ в разных группах больных обсуждают многие специалисты. Эта дискуссия началась в середине 1990-х гг., когда были опубликованы результаты британского популяционного исследования, продемонстрировавшие, что у лиц с ТТГ более 2 мЕд/л увеличивается риск развития гипотиреоза.
В американском исследовании уровень ТТГ 2,5–4 мЕд/л выявлен у 5% взрослых обследованных лиц. У большинства пациентов (95%) зафиксирован относительно низкий уровень ТТГ – 0,45–2,5 мЕд/л3.
Таким образом, необходимо интерпретировать итоги гормональных исследований с учетом факторов, влияющих на результаты.
Периферический дефицит тиреоидных гормонов может играть важную роль в расхождении между клинической картиной гипотиреоза и нормальным уровнем ТТГ.
Еще один метод диагностики гипотироксинемии заключается в определении периферических маркеров эффектов тиреоидных гормонов на ткани. Один из них – уровень холестерина, отражающий реакцию печени на циркулирующие тиреоидные гормоны. В недавних американских рекомендациях был затронут вопрос об использовании периферических тканевых маркеров действия тиреоидных гормонов для оценки адекватности заместительной терапии первичного гипотиреоза. Эксперты не рекомендуют в этом случае применять тканевые маркеры эффектов тиреоидных гормонов, за исключением научных исследований, поскольку подобные параметры обладают низкой специфичностью. Однако у больных с вторичным гипотиреозом, у которых единственным контрольным параметром является уровень самих тиреоидных гормонов, в качестве дополнительных методов оценки адекватности заместительной терапии можно использовать периферические маркеры уровня тиреоидных гормонов
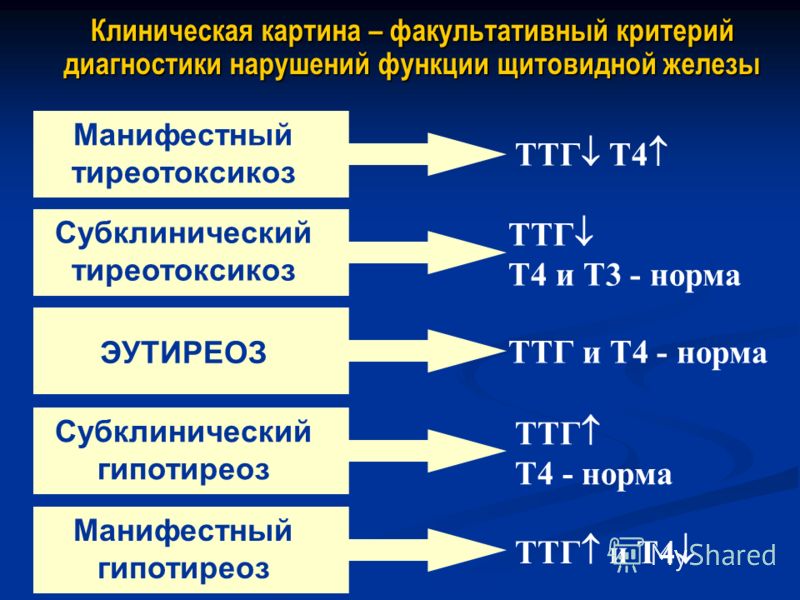
Европейская тиреоидная ассоциация в 2013 г. предложила рекомендации по субклиническому гипотиреозу. Субклинический гипотиреоз – состояние, характеризующееся повышением уровня сывороточного ТТГ и нормальными показателями циркулирующих в крови Т4 и Т3. Согласно рекомендациям, повышение уровня ТТГ может иметь две степени: среднюю – 4,0–10,0 мЕд/л (90% популяции) и высокую – более 10,0 мЕд/л. Схемы лечения субклинического гипотиреоза зависят от уровня ТТГ и возраста пациента. Алгоритм лечения субклинического гипотиреоза Европейской тиреоидной ассоциации представлен на рис. 1.
По мнению экспертов, для большинства взрослых пациентов целью лечения субклинического гипотиреоза является стойкое поддержание уровня ТТГ в нижней половине референсного диапазона – 0,4–2,5 мЕд/л5.
В заключение профессор В.В. Фадеев отметил, что эффективным средством лечения гипотиреоза является Эутирокс® (левотироксин натрия) – синтетический левовращающий изомер тироксина, выпускаемый компанией Merck.
Метформин. Синдром поликистозных яичников
Синдром поликистозных яичников (СПКЯ) считается распространенной эндокринной патологией и одной из наиболее частых причин бесплодия у женщин репродуктивного возраста. Он включает в себя гетерогенную группу гинекологических расстройств с различной степенью яичниковой и надпочечниковой гиперандрогенемии. О применении метформина в терапии пациентов с СПКЯ рассказала директор Института эндокринологии ФГБУ «Федеральный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России (Санкт-Петербург), главный внештатный специалист эндокринолог по Северо-Западному федеральному округу, д.м.н., профессор Елена Николаевна ГРИНЕВА. Она отметила, что СПКЯ характеризуется сочетанием хронической ановуляции и гиперандрогенемии. В последние десятилетия эксперты разных стран предложили несколько подходов к диагностике СПКЯ.
В 1990 г. Национальным институтом здоровья США были утверждены критерии для диагностики СПКЯ – хроническая ановуляция, клинические и/или биохимические признаки гиперандрогении. В 2003 г. Роттердамский консенсус утвердил рекомендации для диагностики СПКЯ, предусматривающие наличие хотя бы двух из трех признаков: олигоменорея и/или ановуляция, гиперандрогения (клинические или биохимические признаки), ультразвуковые (УЗ) признаки поликистозных яичников6. В 2006 г. эти рекомендации были дополнены Ассоциацией по изучению избытка андрогенов и синдрома поликистозных яичников. Согласно рекомендациям, критерии диагностики СПКЯ основаны на выраженности и сочетании таких симптомов, как гиперандрогенизм (андрогензависимая дермопатия, гирсутизм), повышение андрогенов в крови, дисфункция яичников (олиго- и/или ановуляция), УЗ-картина поликистозных яичников
Наряду с сочетанием хронической ановуляции и гиперандрогенемии важным критерием диагностики СПКЯ признаны морфологические изменения в яичниках, выявляемые с помощью УЗ-исследования. Определение УЗ-признаков поликистоза яичников сформулировано Роттердамским консенсусом. Это 12 или более фолликулов диаметром 2–9 мм либо увеличенные в объеме яичники (более 10 см3)8.
Со временем понятие СПКЯ стало мультидисциплинарным. Сегодня СПКЯ включает не только гинекологические, но и метаболические нарушения. После того как в 1980 г. была доказана связь между СПКЯ и гиперинсулинемией, внимание исследователей привлекла роль инсулинорезистентности и гиперинсулинемии в развитии СПКЯ.
В ходе исследований установлены общие характеристики для СПКЯ и метаболического синдрома. Можно сказать, что СПКЯ – метаболический синдром женщин репродуктивного возраста.
В ходе исследований отмечена прямая зависимость между наследственностью, образом жизни, гормональными изменениями, ожирением и уровнями инсулина и андрогенов9.
Кроме того, по мнению ряда исследователей, существует тесная связь между индексом массы тела (ИМТ) и инсулинорезистентностью, причем как при избыточной, так и нормальной массе тела. В случае СПКЯ инсулинорезистентность реализуется не столько в жировой ткани, особенно в отсутствие ожирения, сколько на уровне мышечной ткани. Безусловно, избыточный вес, в большей степени у женщин с СПКЯ, усиливает инсулинорезистентность, которая имеет патогенетическое значение в развитии не только метаболических, но и гинекологических заболеваний10. Таким образом, взаимосвязь СПКЯ и метаболических нарушений очевидна.
Изучение роли гиперинсулинемии и инсулинорезистентности при СПКЯ способствовало внедрению новых терапевтических схем на основе препаратов, улучшающих чувствительность к инсулину, прежде всего метформина (Глюкофаж® Лонг, компания-производитель Merck). Терапевтический эффект препарата при СПКЯ – положительное влияние на такие метаболические параметры, как избыточная масса тела, окружность талии, нарушения углеводного и липидного обмена. Кроме того, метформин оказывает действие на гинекологические нарушения, характерные для СПКЯ, такие как гиперандрогенемия, гирсутизм, гиперплазия эндометрия, нарушение фертильности.
Данные клинических исследований продемонстрировали, что эффект метформина при СПКЯ сопровождается снижением избыточной массы тела, уровня глюкозы и инсулина (рис. 2)11.
На фоне применения метформина у больных СПКЯ снижается активность секреции андрогенов яичниками. Доказан эффект метформина (непрямой механизм) в отношении уменьшения уровня тестостерона и выраженности гирсутизма12.
В ряде исследований показано, что комбинированное применение метформина и кломифена цитрата является эффективным способом индукции овуляции у женщин с СПКЯ. Метформин не продемонстрировал значительного преимущества перед кломифеном. Однако его использование у больных СПКЯ и ИМТ более 32 кг/м2 способствовало большему числу овуляций, беременностей и родоразрешений по сравнению с плацебо13.
Получены положительные результаты назначения метформина в программах вспомогательной репродукции. Важным преимуществом стало снижение риска развития синдрома гиперстимуляции яичников14.
На сегодняшний день для лечения бесплодия у женщин с СПКЯ может быть использован кломифен (при нормальной массе тела) и комбинированная терапия кломифеном и метформином (при избыточной массе тела).
Профессор Е.Н. Гринева подчеркнула, что недостаток многих исследований заключается в том, что метформин назначали коротким курсом, максимально шесть месяцев. Необходимо более длительное применение препарата – в течение 9–12 месяцев с возможным добавлением после шести месяцев кломифена. Женщинам с СПКЯ и нарушениями углеводного обмена, не планирующим беременность, показано применение метформина, а также изменение образа жизни. Отметим, что ожирение или наличие поликистозных яичников не является показанием к назначению метформина. Назначать терапию метформином необходимо после рассмотрения индивидуальных особенностей пациенток.
Таким образом, применение метформина при лечении СПКЯ является эффективным патогенетическим средством терапии, направленным на коррекцию гиперинсулинемии и инсулинорезистентности.
Заключение
Эутирокс® – препарат гормонов щитовидной железы. Он представляет собой синтетический левовращающий изомер тироксина, влияющий на развитие и рост тканей, обмен веществ. Эутирокс® стимулирует рост и развитие, повышает потребность тканей в кислороде, активирует метаболизм белков, жиров и углеводов, повышает функциональную активность сердечно-сосудистой и нервной систем. Показаниями к применению Эутирокса являются гипотиреоз, эутиреоидный зоб, заместительная терапия и профилактика рецидива зоба после оперативных вмешательств на щитовидной железе, рак щитовидной железы (после оперативного лечения), диффузный токсический зоб (после достижения эутиреоидного состояния на фоне антитиреоидной терапии) в виде комбинированной или монотерапии.
Глюкофаж® Лонг (метформина гидрохлорид) относится к группе бигуанидов. Он является препаратом первой линии в лечении сахарного диабета типа 2. Глюкофаж® Лонг показан для применения у взрослых больных в качестве монотерапии или в сочетании с другими пероральными гипогликемическими препаратами либо с инсулином.
Глюкофаж® Лонг повышает чувствительность периферических рецепторов к инсулину и утилизацию глюкозы клетками, оказывает благоприятный эффект на метаболизм липидов. Применение препарата способствует торможению глюконеогенеза в печени и снижению всасывания углеводов в кишечнике.
По данным исследований, Глюкофаж® Лонг уменьшает уровень глюкозы в крови без увеличения массы тела, приводит к снижению риска сердечно-сосудистых осложнений. Кроме того, препарат не стимулирует секрецию инсулина и не оказывает гипогликемического действия у здоровых лиц.
Йод–дефицитные заболевания и беременность: профилактика, диагностика и лечение | Арбатская Н.Ю.
Для цитирования: Арбатская Н.Ю. Йод–дефицитные заболевания и беременность: профилактика, диагностика и лечение. РМЖ. 2004;13:755.
Й од–дефицитные заболевания (ЙДЗ) являются одними из наиболее распространенных неинфекционных заболеваний человека. Причина йодной недостаточности относительно проста: она развивается там, где в окружающей среде содержится мало йода и где население не получает адекватного количества этого микроэлемента с привычными продуктами питания и напитками. Ранее дефицит йода ассоциировался с эндемическим зобом, распространенность которого коррелирует со степенью йодной недостаточности, достигая 100% в регионах тяжелого йод–дефицита. В 80–90–х годах прошлого столетия удалось получить более реальное представление как о спектре патологических состояний, вызываемых у человека недостаточностью йода, так и о многомиллионных жертвах этой формы нарушения питания во всем мире. По определению ВОЗ (2001), ЙДЗ называются все патологические состояния, развивающиеся в популяции вследствие недостаточности йода, которые могут быть предотвращены при нормализации его потребления (табл. 1). Для нормального функционирования щитовидной железы (ЩЖ) человеку в сутки необходимо получать 100–200 мкг йода, который является частью молекул гормонов тироксина (Т4), содержащего 4 атома йода, и трийодтиронина (Т3), в состав которого входят 3 атома йода. Т4 и Т3 стимулируют скорость потребления кислорода всем организмом, а также отдельными тканями и субклеточными фракциями. Проникая в ядро клетки, тиреоидные гормоны (ТГ) взаимодействуют с рецепторами хроматина, благодаря чему возрастает активность РНК–полимеразы и увеличивается образование высокомолекулярной РНК. Помимо генерализованного влияния на геном, ТГ (в большей степени Т3) могут избирательно стимулировать синтез РНК, кодирующей синтез специфических белков различных органов и тканей. ТГ в сочетании с адреналином и инсулином способны повышать захват кальция клетками и увеличивать в них концентрацию цАМФ, а также транспорт аминокислот и сахаров через клеточную мембрану. Регуляция синтеза и секреции гормонов ЩЖ осуществляется центральной нервной системой (ЦНС) через гипоталамо–гипофизарную систему. Гипоталамус секретирует тиреотропин–рилизинг гормон (ТРГ),который, попадая в гипофиз, стимулирует выработку тиреотропного гормона (ТТГ). ТТГ по кровяному руслу достигает ЩЖ и регулирует ее рост и функцию. В условиях дефицита йода снижается синтез и секреция тиреоидных гормонов, что приводит к развертыванию цепи приспособительных реакций, стимулирующих механизмы захвата йода щитовидной железой и последующие этапы его внутритиреоидного метаболизма. Длительный дефицит йода, а также ситуации, требующие повышенного количества ТГ, в частности, беременность, могут привести к срыву механизмов адаптации с последующим развитием целого ряда заболеваний (табл. 1), обусловленных влиянием йодной недостаточности на рост и развитие организма. Таким образом, основную проблему здравоохранения в связи с дефицитом йода составляет не видимое проявление последнего (зоб), а негативное влияние йодной недостаточности на развивающийся мозг плода и новорожденного. Крайняя степень дефицита йода клинически проявляется эндемическим кретинизмом – глубоким нарушением умственного и физического развития. Однако и меньшие степени йодной недостаточности, влияя на гомеостаз тиреоидных гормонов в системе мать–плацента–плод, могут нарушать развитие мозга, что, как правило, проявляется общим снижением интеллектуального потенциала общества. Именно этот факт является основанием для международных усилий по ликвидации ЙДЗ. В настоящее время уточнена роль тиреоидных гормонов беременной женщины в формировании психоневрологического статуса ее будущего ребенка. Закладка ЩЖ плода происходит на 4–5–й неделе внутриутробного развития, на 10–12–й неделе она способна накапливать йод и синтезировать йодтиронины, и только к 16–17–й неделе беременности ЩЖ плода полностью дифференцирована и активно функционирует. Материнские ТГ обнаруживаются у плода уже на эмбриональной стадии развития (от зачатия до 12 недели беременности), т.е. когда его собственная ЩЖ еще не функционирует. В эмбриональный период ТГ обеспечивают процессы нейрогенеза, активно участвуют в формировании слуха и тех церебральных структур, которые отвечают за моторные функции человека. Дефицит материнских ТГна этом этапе развития приводит к снижению интеллекта и слуха у будущего ребенка и формирует психомоторные нарушения. Эти данные подтверждены группой исследователей (D. Glinoer, J. Haddow, R. Klein и др.), которые в конце прошлого века доказали возможность трансплацентарного переноса материнских ТГ, их роль в формировании мозга плода и корреляцию тяжести материнской гипотироксинемии с тяжестью ментальных нарушений у потомства. По данным авторов, основной причиной дефицита ТГ у беременных женщин являются аутоиммунный тиреоидит и дефицит йода в окружающей среде. Во второй половине беременности и в неонатальном периоде также происходят важные процессы формирования головного мозга: нейрональная пролиферация и миграция, миелинизация нервных волокон. Процесс миелинизации не возможен без активного участия ТГ, вырабатываемых, в основном, ЩЖ плода. Всего 20% общего пула фетальных тиреоидных гормонов имеют материнское происхождение. Однако в случае снижения функциональной активности фетальной ЩЖ материнские ТГ обладают протекторным эффектом. Отсюда следует, что залогом нормального интеллектуального и физического развития ребенка является высокая функциональная активность ЩЖ матери на протяжении всей беременности. Уже с первых недель беременности происходит ряд физиологических изменений в гипоталамо–гипофизарно–тиреоидной системе женщины, которые прямо или косвенно стимулируют ее ЩЖ вырабатывать необходимое количество ТГ для нормального эмбриогенеза. Наиболее мощным стимулятором ЩЖ в первой половине беременности является хорионический гонадотропин (ХГ), который имеет структурное сходство с ТТГ. Значительная концентрация ХГ на ранних сроках беременности приводит к гиперстимуляции ЩЖ женщины и возрастанию уровней Т4 и Т3, что по принципу отрицательной обратной связи может приводить к транзиторному снижению ТТГ. По данным D. Glinoer (1995), у 18–20% беременных уровень ТТГ в I триместре беременности может быть ниже пределов нормальных значений. Во II и III триместрах беременности уровень ТТГ в большинстве случаев возвращается к норме, но иногда может оставаться сниженным вплоть до родов. При многоплодной беременности уровень ХГ достигает очень высоких значений, а ТТГ в первой половине беременности оказывается значительно снижен (или даже подавлен) практически у всех женщин. Физиологическое нарастание продукцииэстрогенов во время беременности стимулирует повышенный синтез тироксинсвязывающего глобулина (ТСГ) в печени, уровень которого к 18–20 неделе беременности удваивается. Повышение уровня ТСГ сопровождается дополнительным связыванием биологически активных Т4 и Т3, что приводит к увеличению концентрации связанных с белком Т4 и Т3 и транзиторному снижению свободных фракций гормонов. Снижение последних вызывает дополнительную стимуляцию ЩЖ беременной со стороны ТТГ. В результате свободные фракции Т4 и Т3 сохраняются на нормальном уровне, тогда как уровень общих (свободных и связанных с ТСГ) Т4 и Т3 оказывается в норме повышен у всех беременных женщин. Возможно, таким образом создается дополнительный резерв тиреоидных гормонов во время беременности. Кроме того, в период гестации происходит постепенное увеличение объема почечного кровотока, возникает клубочковая гиперфильтрация, что приводит к повышению экскреции йода с мочой и создает дополнительную косвенную стимуляцию ЩЖ женщины. Формирование и функционирование фетоплацентарного комплекса также обусловливает изменение метаболизма ТГ. Плацента содержит большое количество дейодиназы 3–го типа, осуществляющей трансформацию материнского Т4 в реверсивный Т3, а также Т3 в Т2 (дийодтиронин), то есть превращение биологически активных ТГ в неактивные метаболиты. Дейодирование Т4 в плаценте регулирует поступление Т3 в ткани плода, что оберегает ребенка от избыточного или недостаточного поступления материнских гормонов. В то же время за счет этой реакции плод получает йод и использует его для синтеза собственных ТГ. Таким образом, в условиях йодного дефицита плацентарное дейодирование ТГ матери может стать дополнительным источником йода для плода и еще одной причиной гиперстимуляции ЩЖ матери. Если вне беременности умеренный дефицит йода в организме может компенсироваться интенсификацией синтеза ТГ, то под действием вышеперечисленных факторов гиперстимуляции щитовидной железы беременной может происходить декомпенсация адаптивных механизмов с ее двумя главными последствиями: формирование зоба и относительной гестационнойгипотироксинемии. В условиях йодного дефицита снижается синтез и секреция Т4 и Т3, для которых йод является субстратом, что по принципу обратной связи приводит к активации синтеза ТТГ. Под влиянием стимуляции ТТГ в щитовидной железе происходит адаптация механизмов поглощения йода и других этапов его метаболизма. Одним из проявлений этой адаптации является преимущественный синтез и секреция Т3, который, в свою очередь, является наиболее активным тиреоидным гормоном; при этом на его синтез требуется не 4, а всего 3 атома йода. Путем ТТГ–зависимого увеличения поглощения йода ЩЖ захватывает из крови все большее количество экзогенного йода и увеличивает повторное использование эндогенного йода, что повышает эффективность биосинтеза ТГ. Под влиянием ТТГ происходит как гипертрофия (увеличение в размерах) так и гиперплазия (увеличение количества) фолликулярных клеток ЩЖ. В результате железа увеличивается в размере и объеме и формируется зоб, что на начальных этапах можно считать компенсаторной реакцией, направленной на обеспечение организма тиреоидными гормонами в условиях йодного дефицита. Даже легкий дефицит йода является причиной увеличения объема ЩЖ женщин к концу беременности на 20–40% по сравнению с этим показателем до беременности, при этом у 10–20% женщин к концу беременности происходит формирование зоба. Как уже обсуждалось выше, в I триместре беременности, когда происходят активные процессы эмбриогенеза, ЩЖ плода не функционирует. Следовательно, мать будущего ребенка вынуждена снабжать его адекватным количеством собственных гормонов. Кроме того, и сама женщина в связи с высоким уровнем обменных процессов в период беременности нуждается в дополнительных количествах ТГ. Продукция Т4 в первой половине беременности для адекватного развития плода должна увеличиваться на 30–50%. При этом даже у здоровых женщин с хорошими компенсаторными возможностями щитовидной железы и проживающих в регионах с достаточным содержанием йода может формироваться физиологическая транзиторная гестационная гипотироксинемия. Под этим термином подразумевается феномен снижения уровня циркулирующегов крови свободного Т4 у беременной женщины ниже его нормального уровня для здоровых беременных, но при этом значения гормона находятся в пределах нормы для здоровых людей вне беременности. Увеличение объема ЩЖ (в пределах нормальных размеров), которое возникает в ответ на снижение уровня Т4, быстро нормализует тиреоидный статус здоровой беременной. В условиях йодного дефицита ЩЖ женщины еще до беременности функционирует, в той или иной степени затрачивая свои резервные возможности, и даже мощные компенсаторные механизмы гиперстимуляции ЩЖ во время беременности в ряде случаев могут не обеспечить столь значительного увеличения продукции ТГ. Без адекватного поступления йода компенсаторные возможности ЩЖ беременной ограничены, что приводит к прогрессивному снижению концентрации свободного Т4 и недостаточному поступлению гормона в кровь плода на критических этапах роста и развития мозга. В ряде исследований было показано, что у женщин в условиях даже легкого йодного дефицита уровень свободного Т4 в I триместре беременности оказывается на 10–15% ниже по сравнению с таковым у женщин, получающих йодную профилактику. Снижение уровня тироксина в крови становится еще более выраженным в том случае, если в результате дефицита йода ЩЖ самого плода также оказывается неспособной продуцировать необходимое количество этого гормона. Сочетание у беременной низкого уровня свободного Т4 с нормальным уровнем ТТГ и нормальным или даже повышенным (!) уровнем свободного Т3 можно объяснить компенсаторной реакцией ЩЖ в ответ на ухудшение тиреоидного статуса беременной женщины. В тех случаях, когда увеличение размеров ЩЖ не нормализует тиреоидный статус, включается еще один компенсаторный механизм – синтез более активного гормона Т3. Компенсаторное повышение уровня Т3 нормализует уровень ТТГ, что усложняет диагностику доклинических форм гипотиреоза. На сегодняшний день термин относительная гестационная гипотироксинемия имеет лишь теоретическое обоснование, поскольку для этого состояния отсутствуют конкретные диагностические критерии. Однако именно у женщин с низким уровнем Т4 во время беременности (даже при нормальных значениях ТТГ и свободного Т3) чаще рождаются дети с легкими психомоторными нарушениями, которые являются основной причиной снижения усредненного коэффициента интеллектуального развития населения в регионах йодной недостаточности. По данным исследований, у 35% детей этих женщин в возрасте 7 лет уровень IQ был в 2–3 раза ниже этого показателя у детей контрольной группы. Кроме того, именно у этих женщин имел место высокий индекс осложнений беременности, характерных для гипотиреоза: спонтанные аборты, преждевременные роды, перинатальная смертность, врожденные пороки развития плода, осложнения в родах. Таким образом, роль гипотироксинемии беременных в формировании психомоторных нарушений у потомства не вызывает сомнений. Следовательно, чем больше женщин в регионах с дефицитом йода будут иметь гипотироксинемию во время беременности, а особенно в I триместре, тем большее количество их детей не смогут достичь генетически заложенного уровня интеллектуального развития. Известно, что психомоторные нарушения, возникшие на этапе развития мозга, устранить невозможно, но их можно предупредить. В связи с этим наибольшее значение приобретает профилактикаи лечение йодной недостаточности на максимально ранних сроках гестации, так как профилактические мероприятия, проводимые после I триместра беременности, не могут улучшить интеллектуальные возможности ребенка. Наиболее оптимальной является профилактика ЙДЗ у всех женщин фертильного возраста, особенно у тех, кто планирует беременность. Последние обязательно должны быть осмотрены эндокринологом, при необходимости им следует определить объем ЩЖ, ее функциональную активность. Если в результате обследования исключены патологические состояния ЩЖ, требующие лечения до наступления беременности (тиреотоксикоз, гипотиреоз, рак ЩЖ и т.д.), женщинам на этапе предгравидарной подготовки назначается адекватная йодная профилактика – 200 мкг йода в сутки (рекомендации ВОЗ, 2001). Йодную профилактику необходимо продолжать и назначать во время беременности в виде препаратов йода или минерально–витаминных комплексов для беременных. Следует отметить, что не во всех комплексных препаратах для беременных содержится йод или его количество оказывается недостаточным для периода беременности (как правило, в таких комплексах содержится 100–150 мкг йода). В таких случаях обязательно следует добавить к терапии 50–100 мкг йодида калия, в зависимости от содержания йодида в комплексе, а при его отсутствии – 200 мкг йода. С целью индивидуальной йодной профилактики у беременных женщин не следует использовать йодсодержащие биологически активные добавки. Только индивидуальное назначение точно дозированных лекарственных препаратов йода обеспечивает достаточное поступление микроэлемента во время беременности для роста и развития плода и обеспечивает профилактику самых тяжелых ЙДЗ. Единственным противопоказанием для назначения индивидуальной йодной профилактики во время беременности является патологический тиреотоксикоз (болезнь Грейвса, тиреотоксическая аденома). Носительство антител к тиреоидной пероксидазе (АТ к ТПО) не является противопоказаниям к назначению препаратов йода, хотя и требует динамического контроля функции ЩЖ на протяжении беременности. Если беременная получала монотерапиюлевотироксином еще до беременности, то с целью индивидуальной йодной профилактики ей также необходимо назначить 200 мкг йода. В ситуации, когда пациентка впервые приходит на консультацию во время беременности и уже принимает левотироксин по не вполне понятным показаниям, пересмотр диагноза следует отложить на послеродовый период в связи с необходимостью временной отмены препарата. Отменять беременной левотироксин (если доза препарата более 25 мкг в сутки) нецелесообразно, поскольку его отмена несет риск развития у пациентки гипотироксинемии. Haddow J. с соавторами (1999) выдвинули предположение о том, что скрининг заболеваний ЩЖ у всех беременных оправдан, а своевременное назначение лечения, при выявлении уровня ТТГ в сыворотке крови выше 98 перцентиля от нормативных показателей, позволяет увеличить IQ их детей приблизительно на 4 пункта. Учитывая данное обстоятельство, а также риск развития асимптоматической гипотироксинемии у беременных, проживающих в йод–дефицитных регионах, маскировку симптомов гипотиреоза или тиреотоксикоза симптомами беременности, риск снижения интеллектуальных возможностей будущего ребенка велик, что диктует необходимость обязательного исключения у будущей матери любых заболеваний ЩЖ и назначение индивидуальной йодной профилактики беременной и планирующей беременность женщине. Скрининг беременных с целью выявления и лечения заболеваний ЩЖ пока не входит в перечень обязательного медицинского обследования во время беременности, хотя, по мнению большинства исследователей, эта процедура является единственно возможной мерой предупреждения дальнейшего снижения интеллекта населения. На практике приходится сталкиваться с тем, что беременным женщинам при первом обращении в медицинское учреждение необоснованно назначается весь спектр гормональных исследований, с определением общих фракций Т4 и Т3 и использованием старых низкочувствительных методов определения ТТГ. Исследование функции ЩЖ у беременных такими способами делает анализ неинформативным и дорогим, так как зачастую уровень ТТГ оказывается подавленным, а общие фракции тиреоидныхгормонов повышенными, и для дифференциальной диагностики с патологическим тиреотоксикозом требуется повторное определение уровня ТТГ высокочувствительным методом и свободного Т4. Во избежание гипер– и гиподиагностики патологических состояний ЩЖ во время беременности предлагается возможный алгоритм их диагностики и лечения (рис. 1). Следует отметить, что обязательным условием исследования гормонов ЩЖ у беременных является предварительная консультация специалиста – эндокринолога, знакомого с физиологическими изменениями функции ЩЖ и принципами диагностики и лечения ее заболеваний в период гестации. Грамотная интерпретация результатов лабораторных исследований гормонов ЩЖ беременных поможет избежать множества ненужных (и дорогих!) исследований, назначения небезопасных препаратов (тиреостатики) во время беременности, обеспечить своевременную профилактику ЙДЗ матери и плода.
Литература 1. Касаткина Э.П. роль асимптоматической гипотироксинемии у беременных с зобом в формировании ментальных нарушений у потомства // Пробл. Эндокринол. — 2003. – Т. 49. – № 2. – С. 3–7. 2. Мельниченко Г.А., Фадеев В.В., Дедов И.И. Заболевания щитовидной железы во время беременности. Диагностика, лечение, профилактика. Пособие для врачей. М.: ИнтелТек, 2003. 3. Преодоление последствий дефицита йода: зарубежный опыт. М .: Интерсэн , 1999. 4. Glinoer D. The Thyroid and Age: Merck European Thyroid Symposium. – Budapest, 2000. – P. 121–133. 5. Glinoer D., De Nayer P., Delange F. et al. A randomized trial for the treatment of mild iodine deficiency during pregnancy: maternal and neonatal effects // J. Clin. Endocrinol. – 1995. – Vol. 80. – P. 258–269. 6. Haddow J.E., Palomaki G.E., Allan W.C. et al. Maternal thyroid deficiency during pregnancy and subsequent neuropsychological development of the child // N. Engl. J. Med. – 1999. – Vol. 341. – N. 8. – P. 549–555.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Podgotovka k beremennosti v usloviyakh yododefitsita (klinicheskaya lektsiya) | Sokolova
Podgotovka k beremennosti v usloviyakh yododefitsita (klinicheskaya lektsiya)
- Алгоритмы профилактики и лечения йододефицитных заболеваний. Под ред. Г.А.Мельниченко. М., 2005.
- Акушерство и гинекология. Клинические рекомендации. Под ред. В.И.Кулакова. М.: ГЭОТАР-Медиа, 2006.
- Дедов И.И. Эндокринология. Под ред. И.И.Дедова, Г.А.Мельниченко, В.В.Фадеева. М.: Медицина, 2000.
- Евдокимова Ю.А. Гестационная гипотироксинемия: исходы, профилактика и лечение. Автореф. дис. … канд. мед. наук. М., 2005.
- Йододефицитные заболевания в России. Простое решение сложной проблемы. Под ред. Г.А.Герасимова и др. М.: Адамантъ, 2002.
- Клинические рекомендации Российской ассоциации эндокринологов (РАЭ) по диагностике и лечению узлового зоба. Под ред. И.И.Дедова и др. Клин. тиреоидология. 2004; 2 (4): 47-52.
- Краснопольский В.И., Петрухин В.А., Бурумкулова Ф.Ф. и др. Заболевания щитовидной железы и беременность (акушерские и перинатальные аспекты). Всероссийская конференция с международным участием «Клиническая морфология щитовидной железы». Белгород, 2004; с. 51-3.
- Мельниченко Г.А. Заболевания щитовидной железы во время беременности. Диагностика, лечение, профилактика. Пособие для врачей. Под ред. Г.А.Мельниченко, В.В.Фадеева, И.И.Дедова. М.: МедЭкспертПресс, 2003.
- Профилактика и лечение йододефицитных заболеваний в группах повышенного риска. Под ред. И.И.Дедова и др. М., 2004.
- Современные концепции клинической эндокринологии. Тезисы докладов пятого московского городского съезда эндокринологов (23-24 марта 2006 г.). М.: Геос, 2006.
- Соколова М.Ю. Экстрагенитальная патология у беременных: Руководство для врачей. М.: Медицинское информационное агентство, 2011.
- American Association of Clinical Endocrinologists and Assocazione Medici Endocrinologi medical guidelines for clinical practice for the diagnosis and management of thyroid nodules. Endocr Pract 2006; 12 (1): 63-102.
Cited-By
Article Metrics
Refbacks
- There are currently no refbacks.
This work is licensed under a Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
Особенности лечения заболеваний щитовидной железы у беременных | #10/08
При обследовании и лечении беременных с заболеваниями щитовидной железы врачу необходимо учитывать физиологические изменения тиреоидной функции. Можно выделить шесть основных физиологических механизмов или факторов, которые во время беременности влияют на концентрацию тиреоидных гормонов в крови, иногда имитируя то или иное заболевание щитовидной железы.
Прежде всего, с первых недель беременности под воздействием эстрогенов увеличивается концентрация тиреоид-связывающего глобулина. Это влечет за собой увеличение общего пула тиреоидных гормонов, что не позволяет ориентироваться на их уровень как на диагностический параметр при обследовании беременных женщин.
Свободные фракции тиреоидных гормонов в норме претерпевают незначительные изменения во время беременности, оставаясь в пределах нормальных величин. В первом триместре в период пика концентрации хорионического гонадотропина отмечается повышение их уровня с постепенным снижением во втором и третьем триместрах в результате увеличения объема циркулирующей плазмы.
Во время беременности увеличивается скорость фильтрации в почках, что приводит к ускоренной экскреции йода. В результате увеличивается степень йодного дефицита. Отсутствие йодной профилактики во время беременности ведет к развитию гипотироксинемии, неблагоприятной для развития плода.
Необходимо учитывать влияние вырабатываемых в плаценте гормонов. Хорионический гонадотропин, вследствие своей структурной схожести с тиреотропным гормоном, оказывает стимулирующее влияние на щитовидную железу. Результатом этого влияния является снижение, а в ряде случаев подавление уровня тиреотропного гормона на фоне пика концентрации хорионического гонадотропина в первом триместре беременности. У 10% беременных одновременно с подавленным уровнем тиреотропного гормона выявляется повышенное количество свободного тироксина. Эти изменения не носят патологического характера, но требуют дифференциации с диффузным токсическим зобом (ДТЗ) и другими заболеваниями, сопровождающимися тиреотоксикозом.
В плаценте активно протекают процессы дейодинации, в результате которых Т3 и Т4 преобразуются в метаболически неактивные rТ3 и Т2. Образующиеся в процессе дейодинации свободные атомы йода проникают через плаценту и используются щитовидной железой плода для синтеза собственных тиреоидных гормонов. Через плаценту проникает и непосредственно тироксин, необходимый для правильного развития плода. Для восполнения потерь тиреоидных гормонов вследствие трансплацентарного переноса и активных процессов дейодинации необходимо увеличение их эндогенного синтеза или экзогенного введения в случае гипотиреоза.
Во время беременности изменяется активность иммунной системы. Точные механизмы этого процесса не установлены, но хорошо известно, что с развитием беременности происходит снижение уровня антитиреоидных антител, иногда до их полного исчезновения. Это необходимо учитывать при обследовании беременных с заболеваниями щитовидной железы. Особенно важно об этом помнить при проведении дифференциальной диагностики ДТЗ и транзиторного гестационного тиреотоксикоза (ТГТ): двух состояний, сопровождающихся тиреотоксикозом, но требующих принципиально различной тактики.
Сохранение эутиреоза на протяжении всей беременности чрезвычайно важно для сохранения беременности и правильного развития плода. Изменения тиреоидной функции как в сторону тиреотоксикоза, так и гипотиреоза сопровождаются угрозой выкидыша и преждевременных родов, а также развитием других осложнений беременности. Развитие гипотироксинемии у беременной, особенно в первом триместре, ведет к нарушению правильного формирования центральной нервной системы и отдаленным психоневрологическим нарушениям у плода. Некомпенсированный тиреотоксикоз на протяжении всей беременности приводит к развитию различных пороков у плода. Все это диктует необходимость поддержания эутиреоидного состояния у женщины на протяжении всей беременности.
Особенности ведениябеременных с диффузнымнетоксическим зобом (ДНЗ)
Вступление в беременность женщины с ДНЗ принципиально изменяет тактику ведения больной. Если вне беременности это заболевание не требует частого контроля функции щитовидной железы и, зачастую, не требует и лечения, то во время беременности эти женщины относятся к группе риска развития гипотироксинемии, которая может неблагоприятно сказаться на здоровье плода.
Нами было детально обследовано 34 беременных с ДНЗ. Среди беременных с ДНЗ, как и в группе беременных без заболеваний щитовидной железы, не было выявлено гипотироксинемии в первом триместре, даже относительной. Вероятно, в регионе легкого йододефицита, к которому относится Московская область, количество поступающего в организм беременной йода все-таки достаточно, чтобы предотвратить гипотироксинемию на ранних сроках беременности.
Во втором и третьем триместрах, когда потребность беременной в йоде существенно возрастает, частота относительной гипотироксинемии у беременных с зобом зависела от наличия и сроков начала йод-профилактики. Среди беременных, начавших прием препаратов йода только со второго триместра, отмечалась тенденция к повышению частоты относительной гипотироксинемии во втором и третьем триместрах (рис.). Среди беременных, не получавших препараты йода, к концу беременности частота гипотироксинемии была достоверно выше, чем среди получавших йод-профилактику в течение всей беременности, и встречалась в 87,5% случаев (по сравнению с 25%, р=0,04, рис.).
В нашем исследовании мы применяли 150 и 200 мкг йода. Развитие гипотироксинемии даже на фоне йодной профилактики у беременных с ДНЗ показало, что, вероятно, эта доза йода недостаточна или требуется комбинированное лечение препаратами йода и левотироксина. В 2007 г. ВОЗ рекомендовала увеличить дозу йода для беременных и женщин в период лактации до 250 мкг в сутки.
Результаты нашего исследования показали, что принципиально важна не только доза йода, но и сроки начала йодной профилактики, которая должна быть начата не позднее первого триместра беременности, а в идеальной ситуации на стадии планирования беременности.
Так как беременные с ДНЗ относятся к группе риска развития гипотироксинемии, то необходимо контролировать функцию щитовидной железы каждые 2 месяца в течение первых II триместров. Патологическое значение гипотироксинемии снижается в третьем триместре, поэтому важность контроля функции щитовидной железы в этот период уменьшается.
В случае выявления гипотироксинемии, даже относительной (т.е. снижения уровня тироксина ниже 10 перцентиля) в первом триместре показано проведение комбинированного лечения препаратами йода (Йодомарин, Йодид) и левотироксина (L-Тироксин, Эутирокс) по правилам лечения гипотиреоза. Во втором триместре опасность повреждения центральной нервной системы плода меньше, поэтому назначение левотироксина показано при развитии только явной гипотироксинемии. После родов препараты левотироксина необходимо отменить с последующим контролем функции щитовидной железы через 4–8 недель для исключения персистирующего гипотиреоза. Препараты йода женщина должна продолжать принимать весь период лактации с целью обеспечения новорожденного йодом. В дальнейшем тактика ведения определяется по общим правилам.
Особенности лечения гипотиреоза во время беременности
Гипотиреоз встречается у 2–4% беременных, при этом у части женщин заболевание не диагностировано. Так как состояние эутиреоза принципиально важно для правильного формирования плода и сохранения беременности, эндокринологическими сообществами различных стран активно обсуждается вопрос о целесообразности скрининга беременных на гипотиреоз.
Ориентироваться на клиническую картину для выделения группы риска наличия гипотиреоза чрезвычайно сложно, поскольку жалобы при гипотиреозе неспецифичны и многие из них, например слабость, сонливость, могут являться проявлениями самой беременности. Кроме этого доказано неблагоприятное влияние на течение беременности не только манифестного, но и субклинического гипотиреоза, при котором жалобы вообще отсутствуют. В связи с вышеперечисленным необходимо исследование тиреоидной функции хотя бы в группах риска, к которым относятся: 1)женщины, принимавшие левотироксин в анамнезе по любой причине; 2)женщины с аутоиммунными заболеваниями или семейным анамнезом аутоиммунных заболеваний; 3)женщины с зобом; 4)женщины, перенесшие операции на щитовидной железе или облучение шеи.
В случае выявления гипотиреоза, манифестного или субклинического, показано назначение сразу полной заместительной дозы левотироксина (L-Тироксин, Эутирокс, а не постепенное повышение дозы, как это часто принято в обычной практике. Это позволяет быстро нормализовать уровень тироксина, который, проникая через плаценту, обеспечивает нормальное развитие плода. Так как этот показатель важен для нормального развития беременности и правильного формирования плода, то и контроль компенсации гипотиреоза у беременных осуществляется не по уровню ТТГ, а по уровню свободного Т4. Уровень ТТГ является дополнительным к уровню свободного Т4 параметром, подтверждающим компенсацию гипотиреоза. Это объясняется тем, что ТТГ медленно реагирующий показатель, и для его нормализации после назначения лечения требуется 2–3 месяца в зависимости от исходных значений. Решение же о необходимости коррекции дозы левотироксина необходимо принимать гораздо быстрее, ориентируясь на уровень свободного Т4. Целевыми значениями при лечении гипотиреоза являются для ТТГ— 0,5–2,5 мЕд/л, а для свободного Т4— верхняя граница нормы.
Нами было проведено детальное обследование 13 беременных с впервые выявленным гипотиреозом. Из табл. 1 видно, что в группе беременных с гипотиреозом, выявленным в первом триместре беременности, ТТГ достиг целевых значений только в третьем триместре, что подтверждает его второстепенную роль при контроле компенсации гипотиреоза у беременных.
Контроль свободного Т4 необходимо проводить через 2 недели и повторно вместе с ТТГ через 4 недели после начала лечения. При нормальных показателях контроль в дальнейшем необходимо проводить каждые 2 месяца в течение первых двух триместров. В третьем триместре обычно достаточно однократного контроля уровня гормонов, так как в этот период уже не происходит резких изменений в уровне гормонов и патологическое значение гипотироксинемии не доказано. После родов женщинам, которым диагноз гипотиреоза был установлен во время беременности, требуется отмена лечения для того, чтобы выяснить характер нарушения функции щитовидной железы. В случае субклинического гипотиреоза вопрос о дальнейшем лечении решается индивидуально.
Часть женщин на момент наступления беременности уже получает лечение по поводу гипотиреоза. В связи с физиологическими изменениями, происходящими в организме беременной, увеличивается потребность в экзогенном левотироксине. Нами было обследовано 43 беременных с гипотиреозом, диагностированным до беременности. Декомпенсация заболевания была выявлена у 50% женщин с послеоперационным гипотиреозом и почти у 40% женщин с гипотиреозом, развившимся в результате аутоиммунного тиреоидита. В нашем исследовании декомпенсация гипотиреоза у всех беременных, за исключением одной, произошла в первом триместре беременности, однако по данным литературы декомпенсация может развиться и во втором и даже третьем триместрах беременности. Это диктует необходимость частого контроля гормонального анализа крови у беременных с гипотиреозом. Раннее развитие декомпенсации начиная с первых недель беременности требует, во-первых, планирования беременности у женщин с известным диагнозом гипотиреоза, а во-вторых, контроля гормонального анализа сразу после наступления беременности.
Так как потребность в тиреоидных гормонах увеличивается во время беременности, то требуется увеличение дозы левотироксина. В нашем исследовании было показано, что независимо от этиологии гипотиреоза увеличение дозы левотироксина на 50% предупреждало развитие гипотироксинемии у беременных на протяжении всей беременности. В случае меньшего увеличения дозы во втором и третьем триместрах возникала необходимость в дополнительной коррекции заместительной терапии.
Контроль тиреоидного статуса необходимо осуществлять 1 раз в 4 недели на протяжении первого триместра, когда особенно опасно развитие гипотироксинемии, далее 1 раз в 8 недель.
После родов в течение 4–6 недель потребность в левотироксине обычно возвращается к исходной. Но окончательное решение о дозе препарата необходимо принимать после получения результатов гормонального анализа.
Необходимо также отметить, что в регионе с дефицитом йода беременным с гипотиреозом показано проведение йодной профилактики с целью адекватного обеспечения этим микроэлементом плода. При сравнении тиреоидного статуса беременных с гипотиреозом, развившимся вследствие аутоиммунного тиреоидита, было показано, что компенсация гипотиреоза не зависела от приема препаратов йода, а применение препаратов йода сопровождалось некоторым увеличением массы тела и роста детей при рождении (3234,0±477,1 г, 50,4±2,4 см с йодопрофилактикой и 2931,1±590,2 г, 48,9±3,0 см без йодопрофилактики). В исследовании была показана прямая зависимость показателей интеллектуального развития от массы тела новорожденных, которая находилась в пределах нормальных значений. Таким образом, можно предположить благоприятное влияние йодной профилактики у беременных с гипотиреозом на развитие плода.
Особенности лечения беременных с тиреотоксикозом
Тиреотоксикоз встречается в 1–2 случаях на 1000 беременных. Хотя распространенность этого заболевания невелика, но лечение тиреотоксикоза у беременной является трудной и ответственной задачей для эндокринолога, ввиду потенциальных осложнений для беременной и плода как некомпенсированного тиреотоксикоза, так и назначаемого лечения.
В первом триместре беременности ДТЗ необходимо дифференцировать с ТГТ, так как лечебная тактика при этих состояниях различна.
ТГТ— доброкачественное состояние, не представляющее угрозы для беременной и плода, которое развивается вследствие стимулирующего влияния хорионического гонадотропина. Это состояние не требует лечения, разрешается обычно самостоятельно, но требует наблюдения и дифференциальной диагностики с ДТЗ.
Нами было проведено сравнение клинической картины у 8 беременных с впервые диагностированным тиреотоксикозом, причиной которого являлся ДТЗ, и 10 беременных с ТГТ. Из клинических проявлений достоверно чаще при диффузном токсическом зобе встречались дрожь в руках (62,5% при ДТЗ и 10% при ТГТ, р<0,05), повышенное систолическое давление (140,0±18,5 мм рт. ст. при ДТЗ и 115,6±7,3 мм рт. ст. при ТГТ, р=0,003), увеличение щитовидной железы (30,8±8,7 см3 при ДТЗ и 11,8±2,7 см3 при ТГТ, р=0,04). На основании однократного гормонального анализа невозможно определить причину тиреотоксикоза, поскольку нами не было получено достоверных различий в уровне ТТГ и свободного Т4 в группах с впервые развившимся ДТЗ и ТГТ (табл. 2). Однако повторные исследования тиреоидного статуса показали, что при ТГТ происходит самостоятельная нормализация показателей ТТГ и свободного Т4. При ДТЗ уровень свободного Т4 нормализуется только на фоне лечения, а ТТГ остается подавленным до конца беременности в большинстве случаев (табл. 2).
В дифференциальной диагностике может помочь определение антител к рецепторам ТТГ, которые повышены только при ДТЗ. Однако необходимо учитывать, что определение антител малоинформативно после первого триместра, так как по мере прогрессирования беременности уровень их снижается в результате изменения активности иммунитета. Кроме того, необходимо учитывать метод их определения, который может быть недостаточно чувствительным.
Таким образом, при проведении дифференциальной диагностики причин тиреотоксикоза у беременных необходимо учитывать совокупность факторов: клиническую картину (дрожь в руках, повышение систолического артериального давления, увеличение щитовидной железы), уровень антител к рецепторам ТТГ в первом триместре беременности, изменение уровня тиреоидных гормонов в динамике. Наличие эндокринной офтальмопатии и/или претибиальной микседемы делает диагноз ДТЗ несомненным.
В настоящее время общепризнанным является консервативный метод лечения тиреотоксикоза во время беременности. Крайне редко по показаниям во втором триместре беременности может быть проведено хирургическое лечение. Лечение радиоактивным йодом противопоказано.
Препаратом выбора лечения тиреотоксикоза у беременных является пропилтиоурацил (Пропицил). Однако, в случае недоступности этого препарата, допустимо использование тиамазола (Мерказолил, Тирозол). Основная причина предпочтительного использования пропилтиоурацила— это отсутствие сообщений о его тератогенном действии. Кроме этого по некоторым данным он в меньшей степени проникает через плаценту и дополнительно к основному действию блокирует конверсию Т4 в Т3, что ускоряет достижение эутиреоза.
При лечении тиреотоксикоза у беременных необходимо соблюдать несколько правил. Во-первых, нельзя использовать высокие дозы препаратов: максимальной разрешенной дозой тиамазола (Мерказолил, Тирозол) является 20 мг в сутки, а пропилтиоурацила (Пропицил) 100 мг 3 раза в сутки. Необходимо назначать минимальные, но в то же время эффективные дозы для скорейшего достижения эутиреоза. Во-вторых, при снижении уровня свободного Т4 необходимо уменьшать дозу тиреостатиков под контролем уровня свободного Т4, иногда вплоть до полной отмены во избежание развития гипотироксинемии. В-третьих, у беременных с тиреотоксикозом никогда не применяется схема «блокируй и замещай», так как при этом используются большие дозы тиреостатиков и возрастает опасность блокирования щитовидной железы плода.
В нашем исследовании было проведено сравнение тиреоидного статуса и течения беременности у 17 женщин с декомпенсированным тиреотоксикозом, выявленным в первом триместре, и 16 беременных без патологии щитовидной железы.
Было показано, что в группе с тиреотоксикозом, несмотря на нормализацию уровня свободного Т4, ТТГ оставался подавленным на протяжении всей беременности, что не позволяет ориентироваться на него, как на показатель компенсации тиреотоксикоза. Показателем компенсации тиреотоксикоза у беременных служит свободный Т4, который должен оставаться у верхней границы нормы или немного выше нее, во избежание развития гипотироксинемии, неблагоприятной для плода.
В нашем исследовании была доказана безопасность применения 300 мг пропилтиоурацила (Пропицил) в первом триместре беременности с постепенным снижением дозы до 25–50 мг в сутки. Такая схема лечения не оказывала влияния на объем щитовидной железы беременной, не приводила к развитию гипотироксинемии и не влияла на уровень ТТГ новорожденных. Применение же 100 и более мг пропилтиоурацила в третьем триместре беременности приводило к повышению уровня ТТГ новорожденных (в пределах нормальных величин) и в одном случае у новорожденного развился транзиторный гипотиреоз, обусловленный блокадой щитовидной железы плода применяемым тиреостатиком. Таким образом, быстрое достижение эутиреоза у беременной с тиреотоксикозом и снижение дозы тиреостатика до поддерживающей является важным фактором предупреждения блокирования щитовидной железы плода.
По вопросам литературы обращайтесь в редакцию.
Рисунок. Зависимость уровня свободного Т4 и частоты развития относительной гипотироксинемии от наличия и сроков начала йодной профилактики у беременных с ДНЗ
Гормональные показатели у беременных с впервые выявленным гипотиреозом с указанием частоты гипотироксинемии
Динамика тиреоидного статуса у беременных с ДТЗ (n = 6) и ТГТ (n = 9)
А. В. Древаль, доктор медицинских наук, профессор Т. П. Шестакова, кандидат медицинских наук О. А. Нечаева, кандидат медицинских наук МОНИКИ им. М. Ф. Владимирского, Москва
Дальневосточный медицинский журнал
УДК 618.3:616-053.31:546.15.002.234] (571.6)
О.А. Сенькевич, Ю.Г. Ковальский, Р.Ф Езерский
Антенатальный йододефицит на дальнем востоке — фактор риска формирования патологических состояний новорожденных
Дальневосточный государственный медицинский университет, 680000, ул. Муравьева-Амурского, 35, тел.: 8-(4212)-32-63-93, e-mail: nauka@mail.fesmu.ru, г. Хабаровск
Контактная информация: О.А. Сенькевич, e-mail: senkevicholga@ya.ruРезюме:
Беременность в условиях йодного дефицита является зобогенным фактором, несет риск формирования и прогрессирования зоба у женщин и нарушения развития плода. Исследован уровень йодурии у практически здоровых женщин в конце физиологически протекающей беременности, в раннем послеродовом периоде и их новорожденных детей, проживающих на Дальнем Востоке, выявлена неадекватная обеспеченность йодом. Йододефицит определен в 8 из 9 обследованных территорий, легкая степень йододефицита установлена у большинства здоровых новорожденных детей, тогда как у матерей показатели йодурии значительно ниже, иногда в несколько раз. Без индивидуальной йодной профилактики уровень йодурии в конце физиологически протекающей беременности усугубляется до средней степени тяжести. Исследовано содержание йода в грудном молоке в норме и при преждевременных родах. В условиях йододефицита содержание йода в грудном молоке ниже оптимального уровня как при нормальных срочных, так и при преждевременных родах. Прием физиологических доз медикаментозных препаратов йода женщинами на любом сроке гестации нормализует содержание йода в грудном молоке, что особенно значимо в условиях йододефицита.
Ключевые слова:
беременность, плод, новорожденный, йодурия, йододефицит, грудное молоко
O.A. Senkevitch, Yu.G.Kovalskiy, R.F.Yezerskiy
Antenatal iodine deficiency in the Far East — risk factor for neonatal pathology
Far East State Medical University
Summary:
Pregnancy associated with iodine deficiency is a threatening factor resulting in the development and progression of goiter in women and fetal pathology. The level of urinary iodine excretion in healthy women at the end of physiological pregnancy, early postpartum period and in newborns living in the Far East was found to be inadequate. Iodine deficiency is detected in 8 out of 9 surveyed areas, mild iodine deficiency is diagnosed in the majority of healthy infants, whereas maternal urinary iodine excretion rates significantly lower, sometimes in several times. Without individual iodine prophylaxis urinary iodine deficiency at the end of physiological pregnancy becomes moderately severe. The level of iodine in breast milk in normal and preterm labor was studied. In iodine deficiency, the iodine in breast milk is below the optimal level as well as in normal term and preterm delivery. Physiological doses of drugs containing iodine taken by women at any stage of gestation normalize the iodine level in breast milk that is particularly important under conditions of iodine deficiency.
Key words:
pregnancy, fetus, newborn, urinary iodine, iodine deficiency, breast milk
Введение |
|
Повышение потребности в йоде во время беременности обусловлено увеличенной потребностью в тироксине для поддержания нормального метаболизма организма матери; наличием переноса Т4 и йода от матери к плоду; возможными повышенными потерями йода в период беременности за счет увеличенного почечного клиренса [4]. Беременность в условиях йодного дефицита становится зобогенным фактором и несет риск формирования и прогрессирования зоба у женщин, создания относительной гестационной гипотироксинемии и нарушения развития плода. Большинство беременных, проживающих на территории Российской Федерации [3], относятся к наиболее опасной группе в плане формирования значимых медико-социальных проявлений йододефицитных состояний [5, 4]. Реальное поступление йода составляет не более 40-80 мкг в день, и беременная получает в 2,5-3 раза меньше йода, чем необходимо.
Если вне беременности умеренный дефицит йода в организме может компенсироваться интенсификацией синтеза тиреоидных гормонов, то под действием факторов гиперстимуляции щитовидной железы беременной может происходить декомпенсация адаптивных механизмов с ее двумя главными последствиями: формированием зоба и относительной гестационной гипотироксинемией. При этом даже у здоровых женщин с хорошими компенсаторными возможностями щитовидной железы и проживающих в йод-достаточных регионах может формироваться физиологическая транзиторная гестационная гипотироксинемия — снижение уровня циркулирующего в крови свободного Т4 у беременной женщины ниже нормальной для здоровых беременных величины, когда содержание гормона находится в пределах нормы для здоровых вне беременности [3]. Даже небольшое транзиторное снижение уровня свободного Т4 во время беременности в результате дефицита йода или заболевания щитовидной железы является фактором риска нарушения психомоторного развития плода [1]. Именно скрытая гипотироксинемия (минимальная тиреоидная недостаточность) имеет наиболее тяжелые последствия у беременных и женщин фертильного возраста, которые относятся к группе «суперкритического риска» даже в условиях невыраженного дефицита йода [7, 9].
У новорожденных высока потребность как в йоде, так и в Т4, при этом интратиреоидный резерв йода незначителен [10]. В норме запасы гормонов в ЩЖ покрывают потребности человека в течение 2 мес., что является механизмом приспособления к разному количеству поступающего с пищей йода [11]. У недоношенных новорожденных содержание йода и тиреоглобулина в ЩЖ меньше, чем у доношенных, и не увеличивается вплоть до 42 нед. от времени зачатия. Содержание тиреоглобулина в ЩЖ ребенка зависит от поступления йода в организм матери во время беременности [11], в связи с чем у недоношенных, новорожденных матерей с йодным дефицитом резерв йода в ЩЖ будет значительно сниженным.
Содержание йода в грудном молоке отличается значительной вариабельностью и зависит от обеспеченности лактирующей женщины йодом [8]. В среднем в РФ содержание йода в грудном молоке лактирующих женщин не превышает 30-50 мкг/л, при этом вероятность развития ЙДС у ребенка повышается в 3 раза при ЙДС у матери и в 5 раз — при низком уровне йода в грудном молоке [8].
Синтез адекватного количества тиреоидных гормонов и формирование депо йода в щитовидной железе новорожденного возможны только при поступлении 15 мкг йода на 1 кг веса в сутки, а у недоношенных детей — 30 мкг на 1 кг. При более низком содержании йода в питании повышается риск развития гипотиреоза, особенно у недоношенных новорожденных [5, 6]. Высокие темпы роста, значительный уровень основного обмена определяют высокие физиологические потребности недоношенных детей и особенную зависимость от пищевого обеспечения на фоне существенного недостатка депонирования нутриентов и энергии [6].
В связи с вышеизложенным, цель нашего исследования состояла в определении значимости йододефицита в формировании патологических состояний у новорожденных Дальнего Востока.
Материалы и методы |
|
Обследованы здоровые 232 женщины и 206 новорожденных из 9 населенных пунктов ДФО, в которых проживает более 2/3 общей численности населения, что обеспечивало репрезентативность эпидемиологических исследований. В том числе проспективно наблюдались 45 женщин на протяжении третьего триместра беременности и в процессе лактации после родов; 20 детей, родившихся недоношенными, на протяжении 2 лет жизни. Осуществлялось определение содержания йода в моче и грудном молоке церий-арсенитовым способом — методом, рекомендованным ВОЗ для массовых исследований (ВОЗ, 1993). Исследования проводились в учреждениях здравоохранения Дальнего Востока (ДВ), специальные исследования проведены в ЦНИЛ ДВГМУ. Полученные результаты были подвергнуты комплексной статистической обработке по общепринятым методикам, в работе использованы только достоверные различия.
Было проведено комплексное клиническое наблюдение и обследование новорожденных детей и их матерей в парах «мать-дитя» с оценкой неонатальной адаптации, антропометрических показателей при рождении, анализом заболеваемости, данных общеклинического лабораторного обследования с учетом стандартных учетных форм (ф-№ 96-у, ф-№ 097-у, ф-№ 003-у, ф-№ 112-у). Все дети были разделены на две группы — основную (маловесные новорожденные) и контрольную (здоровые новорожденные). Дети основной группы были также распределены: доношенные с СЗРП и недоношенные с учетом срока гестации: 27-32 нед., 33-34 нед. и 35-36 нед. гестации.
Результаты и обсуждение |
|
С целью определения обеспеченности йодом гестационного процесса проведено исследование йодурии в конце третьего триместра беременности — на сроке 37-39 нед. гестации — у 30 молодых здоровых женщин с физиологическим течением беременности, проживающих в г. Хабаровске. Пятнадцать беременных в течение месяца получали физиологическую дозу (200 мкг) йодсодержащих фармакологических препаратов (табл. 1).
| Группы | n | Медиана | Границы колебаний |
|---|---|---|---|
| Здоровые небеременные | 25 | 62 | 27-126 |
| Йодурия при беременности без приема препаратов йода | 15 | 46 | 21-74 |
| Йодурия при беременности на фоне приема препаратов йода | 15 | 162 | 84-184 |
Результаты исследований, представленные в табл. 1, убедительно доказывают, что без дополнительного приема медикаментозных препаратов йода уровень йодурии в конце физиологически протекающей беременности у 100% обследованных нами женщин соответствовал йододефициту среднетяжелой степени (Ме 46 мкг/л), прием физиологических доз препаратов йода повышал до нормы обеспеченность йодом у 90% женщин (Ме 162 мкг/л).
Кроме того, йододефицит также был выявлен у подавляющего большинства обследуемых почти на всей территории ДФО, что свидетельствует о необходимости коррекции дефицита йода в перинатальном периоде (табл. 2).
| Регион, город | Ме йодурии матерей | Число (n) матерей | Ме йодурии детей | Число (n) детей |
|---|---|---|---|---|
| Хабаровск | 54,5 | 25 | 69 | 25 |
| Нерюнгри (Саха (Якутия) | 69 | 23 | 67 | 23 |
| Оха (Сахалин) | 48,5 | 26 | 61 | 24 |
| Петропавловск-Камчатский | 155 | 20 | 190 | 23 |
| Комсомольск-на-Амуре | 25,5 | 30 | 64 | 31 |
| Амурск | 19,5 | 19 | 75 | 17 |
| Биробиджан | 26,5 | 20 | 24,5 | 22 |
| Николаевск-на-Амуре | 75 | 21 | 86 | 21 |
| Ванино | 31 | 19 | 96 | 20 |
После родов у здоровых родильниц и их новорожденных нами выявлен йододефицит различной степени в 8 из 9 обследованных территорий ДФО, причем в половине территорий — средней тяжести, в г. Амурске — тяжелой степени. При этом минимальная степень йододефицита зарегистрирована у большинства здоровых новорожденных детей, тогда как у их матерей дефицит йода был более выражен.
В периоде новорожденности проблема адекватного потребления ребенком йода решается коррекцией питания матери с регулярным приемом препаратов йода в течение всего периода лактации. Содержание йода в грудном молоке напрямую зависит от обеспеченности лактирующей женщины йодом и в условиях адекватного содержания должно составлять 150-180 мкг (для недоношенных детей — 200 мкг) в литре зрелого женского молока [2]. По нашим данным, содержание йода в грудном молоке ниже оптимального уровня как при нормальных (Ме = 55 мкг/л), так и при преждевременных родах (Ме = 56 мкг/л). Прием препаратов йода при нормальном сроке гестации нормализует содержание йода в грудном молоке (Ме = 119 мкг/л) и создает возможность для пищевой профилактики йододефицита у детей. При преждевременных родах даже удвоение содержания йода в грудном молоке на фоне приема препаратов йода (до 119,5 мкг/л) оказывается недостаточным для адекватного обеспечения недоношенного ребенка, что требует увеличения дозы препаратов йода до 250-350 мкг/сут.
Исследования по обеспеченности йодом недоношенных новорожденных с разными сроками гестации позволили установить, что выраженность йододефицита тем выше, чем менее зрелый ребенок (Me = 77 мкг/л при сроке 27-33 нед., Me = 91 мкг/л при сроке 35-36 нед.), усугубляется у недоношенных детей при задержке внутриутробного развития (Me = 76 мкг/л). Максимально выражен дефицит йода у доношенных новорожденных с синдромом ЗВУР (Ме = 55 мкг/л). Также установлено, что чем более выражен йододефицит, тем значительнее диспропорции развития за счет снижения длины тела (r = 0,369). Йододефицит вызывает выраженную катаболическую направленность обменных процессов у развивающегося плода и преобладание их над анаболическими; клиническим индикатором является синдром задержки развития плода.
Выводы |
|
По результатам собственных исследований на ДВ установлена неадекватная обеспеченность йодом у здоровых на момент обследования женщин в конце гестационного периода, в раннем послеродовом периоде и у их новорожденных детей, что позволяет обосновать и разработать мероприятия по профилактике антенатального йодного дефицита. Полученные нами данные подтвердили необходимость проведения индивидуальной йодной профилактики, т. к. большинство беременных женщин не получают ее в адекватной форме, и их новорожденные уже в раннем неонатальном периоде испытывают йодный дефицит, выраженность которого будет нарастать при отсутствии йодной профилактики лактирующим женщинам. При этом оптимальной дозой препарата йода для кормящей женщины следует считать ту, которая будет обеспечивать содержание йода в грудном молоке на уровне физиологических величин (130-180 мкг йода в литре), т. е. необходима персонификация дозовых рекомендаций для женщин с физиологическим и патологическим течением беременности, проживающих в различных условиях йодной обеспеченности.
Проведенные исследования позволили установить, что выраженность йододефицита тем выше, чем менее зрелый ребенок; йодный дефицит усугубляется при недоношенности с СЗРП; максимальное проявление дефицита йода обнаруживается у доношенных новорожденных с СЗРП. Также установлено, что чем ниже степень йодурии, тем значительнее диспропорции физического развития за счет снижения длины тела.
Следовательно, клиническими проявлениями антенатального дефицита йода можно считать недоношенность, особенно в сочетании с СЗРП, наличие синдрома задержки развития плода при доношенной беременности, нарушение пропорциональности телосложения со сниженной длиной тела.
Литература |
|
- 1. Бате Нэнси, Кобб Кэтлин, Двайер Джоана и др. Рекомендации по питанию детей грудного и раннего возраста (программа Start Healthy «Расти здоровым с первых дней») // Вопросы совр. педиатрии. — 2007. — Т. 5, № 1. — С. 115-129.
- 2. Вахлова И.В., Щеплягина Л.А., Санникова Н.Е. Йодная обеспеченность и показатели роста, развития и состояния здоровья детей, находящихся на естественном вскармливании // Сб. мат. 10 съезда педиатров. — М., 2005. — С. 87-88.
- 3. Герасимов Г.А. Прогресс в устранении йододефицитных заболеваний: вопросы мониторинга и профилактики // Consilium medicum, прилож. «Педиатрия». — 2006. — № 2. — С. 59-64.
- 4. Дефицит йода — угроза здоровью и развитию детей России. Пути решения проблемы: национальный доклад / колл. авт. — М., 2006. — 124 с.
- 5. Руководство по лечебному питанию детей [под ред. К.С. Ладодо]. — М.: Медицина, 2000. — 384 с.
- 6. Сиротин Б.З., Захаренко Р.В. Йоддефицитные заболевания в Хабаровском крае. — Хабаровск: РИОТИП, 2004. — 124 с.
- 7. Щеплягина Л.А., Гайфуллина Г.Н. Йодный дефицит у недоношенных новорожденных и возможности коррекции // Лечащий врач. — 2004. — № 1. — С. 10-13.
- 8. Delange F. Optimal iodine nutrition during pregnancy lactation and neonatal period. Int G Endocrinol Metab.- 2004. — Т. 2. — С. 2-12.
- 9. Rogahn J., Ryan S., Wells J., et. al. Randomised trial of iodine intake and thyroid status in preterm infants. // Arch Dis Child Fetal Neonatal Ed. — 2000. — № 83. — P. 86-90.
- 10. Van de Hove MF, Beckers C., Devlieger H., et. al. Hormone synthesis and storage in the thyroid of human preterm and term newborns: Effect of thyroxine treatment. // Biochimie. — 1999. — № 81. — Р. 563-570.
- 11. Vulsma T. Etiology and pathogenesis of congenital hypothyroidism. Evaluation and examination of patients detected by neonatal screening in the Netherlands. Academisch Proefschrift Amsterdam: Rodopi, 1991. — № 63.
Академия Медицинских Наук при Министерстве Здравоохранения и Социальной Защиты Населения Республики Таджикистан
ГОРМОНАЛЬНАЯ ФУНКЦИЯ ПЛАЦЕНТЫ У БЕРЕМЕННЫХ ЖЕНЩИН С ЭУТИРЕОИДНЫМ ЗОБОМ И ГИПОТИРОКСИНЕМИЕЙ
САЙДАХМАДОВА Ш.ДЖ, КАМИЛОВА М.Я.,
МУМИНОВА Ш.Т., БАХРИЕВ К.ДЖ.
ГУ «Таджикский научно–исследовательский институт акушерства, гинекологии и перинатологии» МЗиСЗН РТ
Цель исследования. Изучить гормональную функцию плаценты у женщин с диффузным эутиреоидным зобом и гипотироксинемией.
Материал и методы. Объект исследования – беременные женщины в третьем триместре беременности (в сроке 30-40 недель беременности), среди которых 30 – с физиологическим течением беременности, 60 – с диффузным эутиреоидным зобом (ДЭЗ), 20 – с гестационной гипотироксинемией.
Уровни гормонов щитовидной железы – трийодтиронин – Т3, тироксин (Т4), тиреотропного гормона (ТТГ) гипофиза и фето-плацентарного комплекса плацентарного лактогена (ПЛГ), эстрадиола (Э2), эстриола (Э3) и прогестерона (Р) – определяли иммуноферментным методом. Проведены визуальное, дигитальное и ультразвуковое исследование щитовидной железы, допплерометрия маточного-плодово-плацентарного кровотока, кардиотокография.
Результаты. Установлено увеличение частоты женщин со сниженными уровнями и статистически достоверным снижением средних уровней ПЛГ, Э2, Э3 и Р у беременных с ДЭЗ, при этом выявлено более выраженное снижение при гестационной гипотироксинемии. Обнаружено, что снижение уровней гормонов фето-плацентарного комплекса связано с частотой осложнений беременности.
Заключение. Полученные данные доказывают, что у женщин с гипотироксинемией функциональные нарушения плаценты выражены в большей степени, чем при диффузном эутиреоидном зобе.
Ключевые слова: диффузный эутиреоидный зоб, гипотироксинемия, беременность, гормональная функция плаценты, осложнения беременности
ЛИТЕРАТУРА
1. Арабова С.У., Мулкамонова Л.Н., Ишан-Ходжаева Ф.Р. Роль апоптоза и иммуноэндокринные взаимоотношения при физиологической беременности // Вестник Авиценны. –2016. –№ 4 (69). –С. 88–93.
2. Додхоева М.Ф., Колобов А.В., Карев В.Е., Ятимова М.А. Механизмы плацентарной недостаточности у беременных женщин с эндемическим зобом // Доклады Академии наук Республики Таджикистан. – 2014. – Т 57, №2. – С.156-163.
3. Павлова Т.В., Малютина Е.С. Влияние патологии щитовидной железы на состояние течения беременности и родов. // Фармация. Серия медицина.– 2011. – №10 (105), Вып. 14. – С. 9-14.
4. Павлова, Н.Г., Аржанова, О.Н. Плацентарная недостаточность. В кн.: Акушерство. Национальное руководство / Под ред. Э.К. Айламазяна, В.Н. Серова, В.Е. Радзинского, Г.М. Савельевой; Москва: ГЭОТАРМедиа, 2012. – С.167-172.
5. Романенко Т.Г., Чайка О.И. Профилактика йоддефицитных заболеваний при беременности // Здоровье женщины. – 2014. – №6.–С.92.
6. Трошина Е.А. Современные аспекты профилактики и лечения йододефицитных заболеваний // Медицинский совет.–2013. – №3. – С. 82–85.
7. Трошина Е.А., Платонова Н.М., Абдулхабирова Ф.М., Герасимов Г.А. Йододефицитные заболевания в Российской Федерации: время принятия решений / под ред. И.И. Дедова, Г.А. Мельниченко.–Москва, 2012. – 54 с.
8. Халимова Ф.Т. Эпигенетические факторы в диагностике нарушений репродукции // Вестник Академии медицинских наук Таджикистана. –2017. –№ 3 (23). –С. 91–97.
9. WHO Guidlines Fortification of food–grade salt with iodine for the prevention and control of iodine deficiency disorders.–Geneva: WHO, 2014.–Р. 41–45.
10. Zimmermann M.B., Hess S.Y., Molinari L., de Benoist B., Delange F., Braverman L.E. et al. New reference values for thyroid volume by ultrasound in iodine-sufficient schoolchildren: a World Health Organization/ Nutrition for Health and Development Iodine Deficiency Study Group Report // American Journal of Clinical Nutrition.–2004.–Vol. 79.–P. 231–237.
Сведения об авторах:
Сайдахмадова Шахло Джумахоновна – соискатель ТНИИАГиП МЗиСЗН РТ, зав. кафедрой акушерства и гинекологии ГОУ “Республиканский медицинский колледж”; тел.: (+992)917620010; e–mail: Saydakhmadova @ inbox. ru
Камилова Мархабо Ядгаровна – руководитель акушерского отдела ТНИИАГиП МЗиСЗН РТ, д.м.н., доцент; e–mail: marhabo1958@mail.ru
Муминова Шаходат Табаровна – учёный секретарь ТНИИАГиП МЗиСЗН РТ
Бахриев Камолиддин Джумаевич – врач акушер-гинеколог ЦРБ района Рудаки
Страницы: 293-299
Скачать статью
Может ли изолированная гипотироксинемия во время беременности быть вызвана дефицитом железа?
КЛИНИЧЕСКАЯ ТИРОИДОЛОГИЯ ДЛЯ ОБЩЕСТВЕННОСТИ
Публикация Американской тироидной ассоциации
Обзоры для общественности Clinical Thyroidology (из последних статей в Clinical Thyroidology)
Содержание | PDF-файл для сохранения и печати
Щитовидная железа и беременность
Может ли изолированная гипотироксинемия во время беременности быть вызвана дефицитом железа?
СОКРАЩЕНИЯ И ОПРЕДЕЛЕНИЯ
Гипотиреоз: заболевание, при котором щитовидная железа недостаточно активна и не вырабатывает достаточного количества гормонов щитовидной железы.Лечение требует приема таблеток гормона щитовидной железы.
Тироксин (Т4): главный гормон, вырабатываемый щитовидной железой. Т4 превращается в активный гормон Т3 в различных тканях организма.
ТТГ: тиреотропный гормон — вырабатывается гипофизом, регулирующим функцию щитовидной железы; также лучший скрининговый тест, чтобы определить, нормально ли функционирует щитовидная железа.
ИСТОРИЯ ВОПРОСА
Изолированная гипотироксинемия — это состояние во время беременности, при котором уровни Т 4 у матери низкие, но уровни ТТГ в норме.Это не приводит к гипотиреозу у матери и со временем проходит. Причина изолированной гипотироксинемии неизвестна. Однако изолированная гипотироксинемия, возникающая на ранних сроках беременности, может необратимо нарушить развитие мозга ребенка. Существует связь между дефицитом железа и изолированной гипотироксинемией, но неясно, является ли это причиной и следствием, или низкий уровень T 4 и уровень железа вызваны другой аналогичной причиной. Целью этого исследования было изучить связь дефицита железа с функцией щитовидной железы у женщин на ранних сроках беременности и у небеременных женщин.
ПОЛНОЕ НАИМЕНОВАНИЕ СТАТЬИ:
Yu X et al. Дефицит железа, независимый фактор риска изолированной гипотироксинемии у беременных и небеременных женщин детородного возраста в Китае. J Clin Endocrinol Metab. 19 января 2015 г. [Epub перед печатью].
РЕЗЮМЕ ИССЛЕДОВАНИЯ
Исследование проводилось на северо-востоке Китая, в регионе с адекватным потреблением йода. В исследование были включены 7953 беременных на сроке от 4 до 12 недель беременности и 2000 женщин детородного возраста, которые не были беременны.Из них была изучена субпопуляция, включающая 3340 беременных и 1052 небеременных женщины с достаточным потреблением йода и отсутствием доказательств проблем со щитовидной железой. Гипотироксинемия определялась как уровни FT 4 ниже 10-го процентиля (легкая) и 5-го процентиля (тяжелая) с нормальным ТТГ. Общее количество железа в организме, ферритин сыворотки и рецептор трансферрина сыворотки использовались в качестве индикаторов питания железом.
Сыворотка FT 4 уровни были значительно ниже как у беременных, так и у небеременных женщин с дефицитом железа по сравнению с женщинами без дефицита железа.Распространенность легкой и тяжелой гипотироксинемии была заметно выше как у беременных, так и у небеременных женщин с дефицитом железа, чем у женщин без него.
КАКОВЫ ПОСЛЕДСТВИЯ ЭТОГО ИССЛЕДОВАНИЯ?
Это исследование предполагает связь между дефицитом железа и изолированной гипотироксинемией как у беременных, так и у небеременных женщин детородного возраста, независимо от воздействия йода и основных проблем с щитовидной железой. Авторы предполагают, что дефицит железа может быть причиной гипотироксинемии.Для дальнейшего изучения этой связи необходимы дополнительные исследования. До тех пор все беременные женщины должны принимать пренатальные витамины, содержащие железо. Неясно, следует ли распространять эту рекомендацию на всех женщин детородного возраста.
— Алан П. Фарвелл, Мэриленд
ССЫЛКИ НА БРОШЮРУ ЩИТОВИДНОЙ ЖЕЛЕЗЫATA
Щитовидная железа и беременность: http://www.thyroid.org/thyroid-disease-and-pregnancy
Тесты функции щитовидной железы: http://www.thyroid.org/blood-test-for-thyroid
Гипотиреоз: http: // www.thyroid.org/what-is-hypothyroidism
Содержание | PDF-файл для сохранения и печати
(PDF) Гестационная гипотироксинемия и положительные эффекты раннего обогащения йодом
привычек, а также приема лекарств; здоровье детей до 18-
месяцев; и семейная социально-экономическая среда,
, что привело к 23 подходящим случаям. Из них еще 10 были потеряны из-за
последующих наблюдений, в результате чего окончательный размер выборки составил 13 младенцев в группе 1.
Эти дети, таким образом, представляют собой субпопуляцию, рожденную
от женщин, беременность которых произошла при наиболее адекватных
возможных состояниях щитовидной железы, а именно с нормальным уровнем сыворотки
свободного T
4
уровней и добавками йода с раннего возраста и
и далее.
В группу 2 вошли 102 женщины, которые были включены в исследование на сроке гестации
12–14 недель и получали добавку йода с
на этот раз до прекращения грудного вскармливания.В эту группу были отобраны
29 женщин (28%) с первоначально изолированной гипотироксинемией
(уровни свободного Т
4
между 0-м и 10-м процентилем
). На следующем этапе 21 женщина, у которых уровни свободного Т
4
были выше 20-го перцентиля на момент родов, осталась исключенной. Третий этап, который включал применение строгих критериев кластеризации ex-
для факторов, не связанных с щитовидной железой, привел к исключению
, еще семь случаев и еще два были потеряны для последующего наблюдения.
Таким образом, было 12 детей из этой группы, которые прошли оценку
нервного развития. Таким образом, эти младенцы представляют собой субпопуляцию, рожденную от матерей с менее благоприятной беременностью
с точки зрения адекватности функции щитовидной железы матери
— по сравнению с группой 1 — из-за преходящей гипотироксинемии на ранних сроках беременности и дополнительные 6–10
Период беременностинедели до начала приема йода —
ция.Удивительно (и авторы не дают объяснения этому
), что доля женщин с гипотироксинемией в
группе 2 не была существенно больше, чем в группе 1 (28,4% против
30,4%), поскольку, если их гипотироксинемия возникла в результате ID,
, мы ожидаем, что влияние ID на функцию щитовидной железы матери
станет более частым и тяжелым по мере прогрессирования гестации
(8).
В группу 3 вошли 151 женщина, которые были включены в исследование на сроке
(37–40 недель) и получали только йодные добавки
с этого времени до окончания лактации.В эту группу было отобрано
женщин (37,7%) с изолированной гипотироксинемией в срок. Примечательно, что доля женщин с гипотиреозом
в этой группе была больше (37,7%), чем в
группах 1 и 2 (30,4% и 28,4% соответственно), предположительно
из-за отсутствия добавка йода во время беременности
. Затем 40 из 57 женщин остались отобранными на основе
на основании наличия свободного Т
4
между 0–10 процентами на
к сроку.Третий этап отбора с применением критериев исключения
для факторов, не связанных с щитовидной железой, привел к исключению 19
случаев, еще два были потеряны для последующего наблюдения, в конечном итоге оставив
19 младенцев (18 ± 1, потому что был близнец). беременность) для оценки развития нервной системы
. Таким образом, эти младенцы
представляют собой субпопуляцию, рожденную от матерей, беременность которых
протекала в наименее благоприятных условиях щитовидной железы, с гипотироксинемией hy-
в срок (и предположительно также раньше) и добавление йода
началось только после родов.
Прежде чем обсуждать результаты исследования, мы должны прокомментировать
конкретной популяции беременных женщин в этом исследовании. Во-первых,
в отношении уровней свободного T
4
, неясно, представляет ли этот диапазон
нормальную небеременную популяцию или референсный диапазон производителя
для используемого анализа или диапазон
конкретно посвящен бесплатным T
4
определений во время беременности
.Независимо от этого, интервал 0–10-го процентиля составлял
от 0,71 до 0,82 нг = дл, 10–20-й процентиль
значений от 0,83 до 0,91 нг = дл, а интервал 20–100-го процентиля
между 0,92 и 1,85 нг = дл.
Во-вторых, что касается значений свободного Т
4
у женщин, распространенность
женщин с гипотироксинемией была чрезвычайно высокой —
— от 28,4% (группа 2) до 37,7% (группа 3).
Взятые вместе в трех группах, одна треть женщин
представила бессывороточный Т
4
в 0–10 перцентиле на одной
или другой стадии гестации, с 6.5–9,9% женщин с
бессывороточным T
4
ниже нижнего предела нормальности
(<0,71 нг = дл). Эта чрезвычайно высокая распространенность iso-
lated гипотироксинемии необычна и указывает на несколько вопросов, на которые нет ответов. Почему распространенность была такой высокой в этом исследовании
, явно гораздо более высокой, чем в любом другом аналогичном исследовании
? Кроме того, поскольку авторы предположили, что эта аномалия
была в основном связана с ID, почему сывороточный ТТГ не увеличивался,
, особенно потому, что прогрессивные изменения сывороточного ТТГ составляют
, что является отличительной чертой ID во время беременности (9).Fur-
Кроме того, почему только шесть случаев из всей когорты из
345 женщин имели ТТГ в сыворотке> 4,8 мЕ = л? Наконец, почему
авторов не исследовали психоневрологический статус
детей, рожденных от женщин с более тяжелым типом изо-
выраженной гипотироксинемии, а именно тех, кто родился от 22 женщин
в группе 1, у которых ранее не было сыворотки крови. T
4
между 0–
10-м процентилем и теми, кто родился у 28 женщин с сывороткой
свободной T
4
ниже нормы на той или иной стадии гестации (6
случаев в группе 1, 7 случаев в группе 2 и 15 случаев в группе 3).
Вместе эти женщины потенциально могли составить
четвертую сильную группу из 50 женщин с более тяжелой гипотироксинемией, чем те, которые в настоящее время отобраны авторами,
и все еще с нормальным уровнем ТТГ в сыворотке. Сравнение нейро-
исходов развития последних младенцев с таковыми из
групп с 1 по 3 могло бы дать весьма актуальную информацию, особенно то, что их матери лечились с применением той же схемы приема йода. .
В-третьих, что касается йодного статуса женщин, стоит отметить
, отметив, что для определения экскреции йода с мочой (UIE) было взято только одно точечное измерение в ливрее de-
.
UIE был самым низким (как и ожидалось) в группе 3, которая имела среднее значение
75 мг = л, по сравнению с группами 1 и 2, в которых средние значения UIE
были значительно выше из-за добавок йода
(121 и 97 мг = L соответственно). Однако остается загадкой,
, что диапазоны UIE не различались между тремя группами
, потому что мы ожидали, что значения UIE будут
смещены вправо (т.е., с более высокими пределами диапазона) в группах
, получавших 200 мг KI во время беременности. Кроме того, несмотря на
добавок йода, предоставленных в группах 1 и 2 во время беременности, частота женщин с ИМЭ <50 мг = Lwerenot
различается, достигая 20% во всех трех группах. Эти соображения вызывают озабоченность по поводу того, что авторы не могли объективно оценить, принимали ли добавки йода все
женщин на протяжении всего исследования.
В-четвертых, в отличие от вышеприведенных комментариев относительно уровня йода
tus, взаимосвязь между тестами функции щитовидной железы и приемом пищевых добавок io-
во время беременности была очевидной. В
группах 1 и 2, соответственно, 95,6% и 85,7% женщин
имели свободный Т
4
выше 20-го перцентиля в срок, и ни у одного из
не было обнаружено гипотироксинемии, в отличие от
группа 3 женщины, из которых 37,7% имели гипотироксинемию на сроке
.Однако, несмотря на значительно более низкое среднее значение свободного содержания в сыворотке
T
4
в группе 3 на момент родов (0,77 нг = дл), чем в группах 1 и 2
(1,02 нг = дл), удивительно, что значения ТТГ в сыворотке были
одинаковыми в трех группах на момент родов: 2,10–2,23 mU = L (отметьте
, что эти значения были зарегистрированы только для матерей, чьи дети in-
позже прошли оценку нервного развития).
432 ГОСТЕВАЯ РЕДАКЦИЯ
Гестационная гипотироксинемия увеличивает иммунный ответ потомства, страдающего экспериментальным аутоиммунным энцефаломиелитом.
Abstract
Есть больше доказательств, подтверждающих важность здоровой беременности перед импринтингом потомства. Это касается эндокринного статуса матери и иммунной системы. Гипотироксинемия (Hpx) — очень частое состояние дефицита гормона щитовидной железы у беременных женщин, характеризующееся низким уровнем тироксина (T 4 ) с нормальным уровнем трийодтиронина (T 3 ) и тиреотропного гормона (TSH) в крови. Известно, что у матери это заболевание протекает бессимптомно, однако у потомства ухудшается познавательная способность.В этой работе мы показали, что эффекты гестационного Hpx выходят за рамки центральной нервной системы, также влияя на иммунный ответ. Мы наблюдали, что гестационный Hpx увеличивает иммунный ответ у потомства, страдающего экспериментальным аутоиммунным энцефаломиелитом (EAE). EAE — экспериментальная модель, используемая для изучения рассеянного склероза (РС). Мы показываем здесь, что мыши C57BL / 6, беременные с Hpx, индуцированным EAE, страдают более ранними и более выраженными симптомами EAE по сравнению с мышами C57BL / 6, беременными с эутиреозом.Несмотря на то, что популяция регуляторных Т-клеток (Treg) в селезенке была сходной у мышей, беременных с Hpx, и мышей с эутиреозом, Treg-клетки от мышей, беременных с Hpx, обладают меньшей способностью подавлять Т-эффекторные клетки и секретировать IL-10. . Мыши, беременные с Hpx, имеют высокие базальные уровни TNF-α и IL-17 и обладают повышенной проницаемостью гематоэнцефалического барьера. В этой работе мы проанализировали популяцию Th-17 и способность секретировать IL-17 из кишечника, мозговых оболочек и селезенки у мышей, беременных с Hpx, которые страдают EAE.Эти результаты очень новы и влияют на наши знания о том, как на иммунную систему потомства может повлиять дефицит материнских гормонов щитовидной железы во время беременности.
- Copyright © 2017 Американская ассоциация иммунологов, Inc.
Изолированная материнская гипотироксинемия у женщин с гестационным сахарным диабетом и ее связь с необходимостью инсулинотерапии | ECE2010 | 12-й Европейский конгресс эндокринологов
1 Первое отделение клинической медицины, Центр диабетологии, Университетская больница, Пльзень, Чешская Республика; 2 Первое отделение клинической медицины, эндокринология, Университетская клиника, Пльзень, Чешская Республика.
Введение: Изолированная материнская гипотироксинемия приводит к более высокой распространенности детского аутизма, синдрома дефицита внимания / гиперактивности и умеренного когнитивного дефицита. Частота гипотироксинемии среди женщин с гестационным сахарным диабетом (ГСД) неясна, а рутинный скрининг не установлен.
Цель: Выявить распространенность изолированной материнской гипотироксинемии у женщин с ГСД и оценить связь с необходимостью инсулинотерапии.
Методы: открытое ретроспективное обсервационное исследование.В исследование были включены четыреста восемьдесят пять женщин с ГСД. У всех женщин с помощью РИА измеряли свободный тироксин (fT 4 ), гормон стимуляции щитовидной железы (ТТГ) и антитела к тироидной пероксидазе. Исключались женщины с ранее существовавшим или недавно обнаруженным заболеванием щитовидной железы или с повышенным уровнем антител к тироидной пероксидазе или с другим аутоиммунным заболеванием. Все испытуемые получали общие добавки йода (поливитамины с йодом). Статистический анализ проводился с использованием критерия Манна – Уитни и критерия корреляции Спирмена.
Результаты: сывороточные уровни fT 4 были ниже 10-го процентиля в соответствии с нормальными значениями у 173 женщин, ниже 5-го процентиля у 65 женщин. В этих трех группах — ниже 5-го процентиля, ниже 10-го и выше 10-го процентилей — не наблюдалось различий в исходном метаболизме (ТТГ, общий холестерин сыворотки, триглицериды сыворотки, глюкоза в плазме натощак, гликозилированный гемоглобин, проявления GDM) и антропометрических (возраст, вес, ИМТ) параметры. Значительно часто инсулинотерапия требовалась в группе ниже 10-го перцентиля (62 женщины — 35.8%), чем в группе выше 10-го перцентиля (59 женщин — 18,9%).
Заключение: У наших пациенток с гестационным сахарным диабетом мы наблюдали более высокую частоту изолированной материнской гипотироксинемии по сравнению с литературными данными (1–5%). Женщины с более низким fT 4 нуждались в инсулинотерапии значительно чаще (примерно дважды).
Гипотиреоз — Консультант по терапии рака
Гипотиреоз и беременность
1. Что должен знать каждый врач
Явный гипотиреоз осложняет от 1/1000 до 3/1000 беременностей.Женщины с явным гипотиреозом подвергаются повышенному риску осложнений беременности, таких как прерывание беременности на ранних сроках, преэклампсия, отслойка плаценты, низкая масса тела при рождении и мертворождение. Лечение женщин с явным гипотиреозом было связано с улучшением исходов беременности.
Наиболее частой причиной первичного гипотиреоза у беременных является хронический аутоиммунный тиреоидит (тиреоидит Хашимото). Это безболезненное воспаление с прогрессирующим увеличением щитовидной железы, характеризующееся диффузной лимфоцитарной инфильтрацией, фиброзом, атрофией паренхимы и эозинофильными изменениями.Другие важные причины первичного гипотиреоза включают эндемический дефицит йода и анамнез абляционной радиойодтерапии или тиреоидэктомии.
Вторичный гипотиреоз имеет гипофизарное происхождение. Например, синдром Шихана, вызванный акушерским кровотечением в анамнезе, характеризуется ишемией и некрозом гипофиза с последующим дефицитом некоторых или всех гормонов гипофиза. Другая этиология вторичного гипотиреоза включает лимфоцитарный гипофизит и гипофизэктомию в анамнезе.
Третичный или гипоталамический гипотиреоз встречается очень редко. Центральный гипотиреоз относится к неадекватной стимуляции щитовидной железы из-за дефекта на уровне гипофиза или гипоталамуса.
2. Диагностика и дифференциальная диагностика
Наличие или отсутствие патологически увеличенной щитовидной железы (т. Е. Зоба) зависит от этиологии гипотиреоза. Женщины, живущие в районах с эндемическим дефицитом йода или страдающие тиреоидитом Хашимото, гораздо чаще болеют зобом.Он характеризуется расплывчатыми, неспецифическими признаками или симптомами, которые часто незаметны в начале. Первоначальные симптомы включают усталость, запор, непереносимость холода и мышечные судороги. Они могут прогрессировать до бессонницы, увеличения веса, синдрома запястного канала, выпадения волос, изменения голоса и умственной отсталости.
Другие признаки гипотиреоза включают периорбитальный отек, сухость кожи и длительную фазу расслабления глубоких сухожильных рефлексов. Диагностика клинического гипотиреоза во время беременности особенно сложна, поскольку многие из перечисленных выше признаков или симптомов также являются общими для беременности.Тестирование щитовидной железы следует проводить женщинам с симптомами заболевания или тем, у кого в анамнезе имеется заболевание щитовидной железы.
Основой диагностики заболеваний щитовидной железы является измерение сывороточного ТТГ. Сывороточный ТТГ более чувствителен, чем свободный Т 4 для выявления гипо- и гипертиреоза. Если ТТГ отклоняется от нормы, рекомендуется оценка свободного Т 4 . Недостатком этой стратегии тестирования ТТГ является то, что необычные состояния щитовидной железы, характеризующиеся несогласованными результатами по ТТГ и свободному Т 4 , могут остаться незамеченными.Диагноз явного гипотиреоза обычно устанавливается по повышенному уровню ТТГ в сыворотке и низкому уровню свободного Т 4 .
Нормальный диапазон сывороточных концентраций ТТГ у небеременных людей составляет 0,45–4,5 мЕд / л. Однако недавние данные показывают, что более 95% нормальных людей имеют уровень ТТГ ниже 2,5 мЕд / л и что у лиц с ТТГ от 2,5 до 4,5 мЕд / л повышен риск прогрессирования до явной болезни. Это побудило некоторых рекомендовать снизить верхний предел референсного диапазона ТТГ до 2.5 мМЕ / л, в то время как другие предполагают, что это изменение только усилит диагноз субклинического гипотиреоза без четких доказательств пользы от лечения.
На ранних сроках беременности наблюдается падение уровня ТТГ в сыворотке и умеренное увеличение свободного тироксина из-за структурно связанной тиреотропной активности хорионического гонадотропина человека. Эти физиологические изменения затрудняют диагностику гипотиреоза во время беременности и подчеркивают необходимость определения пороговых значений ТТГ, зависящих от гестационного возраста (см. Рисунок 1).О таких порогах сообщалось, и они основаны на большом популяционном исследовании беременных женщин.
Рисунок 1.
Пороговые значения ТТГ для гестационного возраста
Например, сообщалось, что верхний предел статистически определенного нормального диапазона для ТТГ (97,5 th процентиль) в первой половине беременности составляет 3,0 мЕд / л. Более того, если популяционные медианы ТТГ определяются для каждого триместра в конкретной лаборатории, эти данные показывают, что верхний предел ТТГ в течение первого триместра должен быть равен 4.0 кратных медианы (мес.) И 2,5 мес. Для второго и третьего триместра при одноплодной беременности.
Влияние изменений уровней свободного T 4 во время нормальной беременности стало предметом многочисленных споров, особенно с появлением автоматизированных иммуноанализов на свободные гормоны. Диагностическая точность этих тестов на свободный T 4 зависит от связывания с белками, особенно с учетом физиологических изменений в тироидсвязывающем глобулине (TBG) и других белках во время беременности.
Хотя наблюдается значительное снижение уровня свободного Т 4 на поздних сроках беременности по сравнению с небеременными женщинами или женщинами в первом триместре, общие концентрации свободного Т 4 остаются в пределах нормы (0,7-1,8 нг / дл) на протяжении всей беременности. Поэтому для диагностики гипотиреоза рекомендуется использовать пороговые значения free-T 4 для небеременных.
Также может быть полезно подтвердить наличие антимикросомных антител у беременных женщин с гипотиреозом.В частности, наличие антитиреоидных антител может идентифицировать группу женщин с особым риском осложнений беременности, послеродового тиреоидита и прогрессирования симптоматического заболевания. Одно недавнее исследование показало, что у 50% женщин с антителами к ТПО на 16 неделе беременности развилась послеродовая дисфункция щитовидной железы, а у каждой четвертой из этих женщин в течение года развился постоянный явный гипотиреоз.
Субклинический гипотиреоз
Субклинический гипотиреоз определяется повышенным уровнем ТТГ в сыворотке, но аномальной концентрацией тироксина в сыворотке.Сообщения, свидетельствующие об увеличении гибели плода или последующих осложнениях нервного развития у потомства женщин с умеренным гипотиреозом, побудили рекомендовать назначать левотироксин для восстановления уровня ТТГ до нормального диапазона у этих женщин. Однако нет опубликованных интервенционных испытаний, конкретно оценивающих эффективность такого лечения для улучшения нейропсихологических показателей у потомства женщин с субклиническим гипотиреозом (т. Е. Повышенным ТТГ и нормальным свободным T 4 ).
Недавно результаты Международного контролируемого дородового скрининга щитовидной железы (CATS) показали, что лечение женщин с субклиническим гипертиреозом или изолированной гипотироксинемией не улучшило интеллектуальную функцию потомства в возрасте 3 лет. Обычный скрининг и лечение субклинических заболеваний щитовидной железы во время беременности не подходят. рекомендован Американским колледжем акушеров и гинекологов. Тем не менее, признается, что акушеры испытывают определенное давление с целью скрининга и лечения материнского субклинического гипотиреоза.
Действительно, несколько национальных эндокринологических организаций рекомендуют обследование и лечение беременных женщин от субклинического гипотиреоза. Однако до тех пор, пока не будет продемонстрирована очевидная польза для рутинного скрининга и лечения субклинического гипотиреоза во время беременности, такие методы не рекомендуются.
Изолированная гипотироксинемия
Изолированная материнская гипотироксинемия, определяемая как нормальный уровень ТТГ с низким уровнем свободного Т4, также связана с нарушением нервного развития плода.В частности, у потомков голландских женщин из области с достаточным содержанием йода и с изолированной гипотироксинемией, определяемой свободным Т4 ниже 10-го перцентиля на 12 неделе беременности, по данным шкалы развития младенцев Бейли, наблюдалась значительная задержка в развитии.
Однако низкие уровни свободного Т4 в сыворотке с парадоксально нормальным или даже немного сниженным ТТГ в сыворотке более классически указывают на центральный гипотиреоз, который является редким заболеванием. Центральный гипотиреоз чаще всего возникает из-за макроаденомы гипофиза, хирургии гипофиза или облучения.Изолированная гипотироксинемия также связана с йодной недостаточностью из-за ауторегуляторной реакции щитовидной железы, которая приводит к изолированному низкому уровню свободного Т4. Наконец, при обнаружении противоречивых результатов тестов на щитовидную железу следует также учитывать неточность лабораторных исследований из-за технических помех.
Если учесть влияние беременности на уровни гормонов щитовидной железы и повышенное давление на акушеров с целью скрининга дисфункции щитовидной железы во время беременности, то, безусловно, будет увеличение числа беременных женщин с низким уровнем свободного T 4 , но нормальным ТТГ уровни.Однако, как и в случае субклинического гипотиреоза, нет сообщений о том, что лечение такой изолированной гипотироксинемии полезно для матери или ее потомства.
Фактически, результаты исследования CATS, описанного выше, не поддерживают лечение субклинических заболеваний щитовидной железы во время беременности. Таким образом, обследование и лечение женщин с изолированной гипотироксинемией неоправданно и должно считаться экспериментальным.
3. Менеджмент
Целью лечения беременных с явным гипотиреозом является клинический и биохимический эутиреоз.Левотироксин натрия является препаратом выбора для рутинного лечения гипотиреоза. Начальная доза обычно составляет 1,0–2,0 мкг / кг / день или приблизительно 100 мкг / день. Затем с интервалом в 6-8 недель измеряют ТТГ, а дозу левотироксина корректируют с шагом 25-50 мкг. Терапевтическая цель — ТТГ от 0,5 до 2,5 мЕд / л (см. Рисунок 2).
Важно отметить, что значения ТТГ в сыворотке могут вводить в заблуждение во время ранней терапии гипотиреоза. Это связано с тем, что гипофизарной секреции ТТГ требуется 6 недель или более, чтобы восстановить равновесие до нового статуса гормонов щитовидной железы.Оценка free-T 4 может быть полезна при мониторинге ответа на лечение.
Женщинам с гипотиреозом в анамнезе до зачатия следует оценить уровень ТТГ в сыворотке при первом дородовом посещении. Почти половине этих женщин, в зависимости от этиологии дисфункции щитовидной железы, может потребоваться увеличение заместительной терапии щитовидной железы во время беременности. Из-за повышенной вероятности биохимического гипотиреоза на ранних сроках беременности некоторые авторы рекомендуют регулярно повышать дозу левотироксина беременным женщинам на 25-30% при подтверждении беременности.
Однако эффективность этой практики не доказана, и у таких женщин существует значительный потенциал чрезмерного лечения. При лечении щитовидной железы лучше всего руководствоваться исследованиями функции щитовидной железы, проводимыми в начале дородового наблюдения с учетом влияния беременности на аналиты щитовидной железы. У женщин с хорошо контролируемым заболеванием щитовидной железы рекомендуется впоследствии повторять исследования функции щитовидной железы в течение каждого триместра. Примечательно, что некоторые препараты могут влиять на абсорбцию левотироксина (например,грамм. холестирамин, сульфат железа, антациды гидроксида алюминия) или его метаболизм (например, фенитоин, карбамазепин и рифампицин).
4. Прогноз и исход
После родов терапию левотироксином следует вернуться к дозе до беременности и проверить ТТГ через 6-8 недель после родов. Грудное вскармливание не противопоказано женщинам, леченным от гипотиреоза. Левотироксин выделяется с грудным молоком, но уровни слишком низкие, чтобы изменить функцию щитовидной железы у младенца или помешать программам скрининга щитовидной железы новорожденных.Обычно рекомендуется периодический мониторинг с ежегодной концентрацией ТТГ в сыворотке, учитывая, что изменение веса и возраста может повлиять на функцию щитовидной железы.
Послеродовой тиреоидит
Преходящий аутоиммунный тиреоидит выявляется почти у 10% женщин в течение первого года после родов. Гистологически выявлен деструктивный лимфоцитарный тиреоидит. Вероятность развития послеродового тиреоидита предшествует беременности и связана с повышением уровня аутоантител щитовидной железы в сыворотке крови.Для получения дополнительной информации перейдите в раздел о послеродовом тиреоидите при гипертиреозе и беременности.
5. Каковы доказательства для конкретных рекомендаций по ведению и лечению
Д-р Гроот Л, Абалович М, Александр Э. «Управление дисфункцией щитовидной железы во время беременности и в послеродовом периоде: руководство по клинической практике эндокринного общества». J Clin Endocrinol Metab. об. 97. 2012. С. 2543
.Лазарус, Дж. Х., Бествик, Дж. П., Ченнон, С. «Антенатальный скрининг щитовидной железы и когнитивные функции у детей». N Engl J Med. об. 366. 2012. С. 1650
.Брент, Джорджия. «Дебаты по поводу скрининга функции щитовидной железы во время беременности». N Engl J Med. об. 366. 2012. С. 562
.Gyamfi, C, Wapner, RJ, D’Alton, ME. «Дисфункция щитовидной железы во время беременности: фундаментальные научные и клинические данные, подтверждающие противоречия в управлении». Акушерский гинекол. об. 113. 2009. С. 702
.Клири-Голдман, Дж., Мэлоун, Ф. Д., Ламберт-Мессерлиан, Г. «Гипофункция щитовидной железы матери и исход беременности». Акушерский гинекол. об. 112. 2008. С. 85
.Кейси, BM, Левено, KJ. «Заболевания щитовидной железы при беременности». Акушерский гинекол. об. 108. 2006. pp. 1283
.Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине». Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
Гипотироксинемия у матери, связанная с симптомами СДВГ у потомства
Уилл Боггс, MD
НЬЮ-ЙОРК — Низкие уровни гормонов щитовидной железы у матери на ранних сроках беременности связаны с усилением симптомов синдрома дефицита внимания / гиперактивности (СДВГ) у детей, согласно результатам исследования. исследование поколения R в Нидерландах.
Гипотироксинемия у матери связана с неблагоприятными нейрокогнитивными исходами у детей, и в некоторых сообщениях гипотироксинемия на ранних сроках беременности связывается с поведенческими проблемами у потомства, включая СДВГ.
Д-р Ахгар Гассабиан и его коллеги из Медицинского центра Эразмус и детской больницы Софии, Роттердам, использовали данные 3873 детей в исследовании поколения R, чтобы оценить взаимосвязь между материнской гипотироксинемией на ранних сроках беременности и родительскими оценками симптомов СДВГ у детей в возрасте 8 лет. возраста.
Согласно онлайн-отчету JAMA Pediatrics от 6 июля, у 3,4% матерей была гипотироксинемия, а у 5,0% — антитела к тироидной пероксидазе.
Показатели индекса СДВГ у детей, подвергшихся материнской гипотироксинемии, были примерно на 7% выше, чем у детей, не подвергавшихся воздействию.
Связь между материнской гипотироксинемией и показателями СДВГ у потомства была немного ослаблена после корректировки на коэффициент невербального интеллекта детей.
Функция щитовидной железы матери на ранних сроках беременности не была связана с показателями оппозиции у детей в возрасте 8 лет, и не было никакой связи между материнским субклиническим гипотиреозом и показателями индекса СДВГ у детей.
«Наши результаты подтверждают возможную роль легкой недостаточности гормонов щитовидной железы у матери на ранних сроках беременности в поведенческом развитии потомства, в частности СДВГ», — заключили исследователи. «Нейровизуализация и исследования на животных необходимы для изучения основного механизма связи между легкой недостаточностью щитовидной железы у матери и СДВГ у детей».
Доктор Эйла Суванто из Университета Оулу в Финляндии ранее сообщила о связи между повышенными концентрациями тиреотропного гормона во время беременности (но не низкими уровнями свободного Т4 у матери) и симптомами СДВГ у девочек (но не мальчиков).Она сообщила агентству Reuters Health по электронной почте: «Заболеваемость СДВГ среди 8-летних детей составляет 4-5% во всем мире. Таким образом, 40 из 1000 детей имеют СДВГ. Увеличение на 10% будет означать четыре дополнительных случая. Так что это не драматично. менять.»
«Гипотиреоз матери следует принимать во внимание и лечить при обнаружении», — сказал д-р Суванто. «Гипотироксинемия у матери может иметь некоторое влияние на симптомы СДВГ, но эффект далеко не драматический».
Доктор Суванто добавил, что «60-90% СДВГ объясняется генетическим фоном, поэтому факторы окружающей среды, такие как среда внутриутробных гормонов, играют гораздо меньшую роль.«
Доктор Гассабиан не ответил на запрос о комментариях.
ИСТОЧНИК: http://bit.ly/1G2ZQcj
JAMA Pediatr 2015.
(c) Авторские права Thomson Reuters 2015. Нажмите, чтобы узнать об ограничениях — http: //about.reuters.com/fulllegal.asp
Колебания щитовидной железы при беременности влияют на риск СДВГ
Известно, что уровни материнских гормонов щитовидной железы на ранних сроках беременности влияют на развитие мозга плода и последующие нейрокогнитивные исходы у детей, при этом некоторые исследования указывают на связь между материнским гипотиреозом и СДВГ или расстройствами аутистического спектра.Транзиторный гипотиреоз (гипотироксинемия) не является редкостью во время беременности и также может повлиять на результаты, но в какой степени?
Небольшие ретроспективные исследования, в некоторых из которых отсутствовали четко определенные результаты или средства контроля для искажающих факторов, обнаружили ассоциации. Теперь более надежные выводы по этому поводу были получены из исследования поколения R, популяционной когорты голландских детей, родившихся в период с 2002 по 2006 год. 1
Модесто и его коллеги 1 получили доступ к данным поколения R о матери- пары детей, для которых были доступны значения гормонов щитовидной железы, и провели анализ, в котором сравнивали показатели материнских гормонов на ранних сроках беременности с показателями СДВГ у детей в возрасте 8 лет.Всего в исследование были включены 3873 ребенка. Результаты указывают на умеренно повышенный риск симптомов СДВГ у детей матерей, перенесших гипотироксинемию на ранних сроках беременности.
В этом исследовании материнский тиреотропин, свободный тироксин (FT4) и антитела к тироидной пероксидазе измерялись при первом пренатальном посещении, которое имело место в среднем на 13,6 неделе беременности. После родов снова измерили уровень гормонов щитовидной железы. Гипотироксинемия у матери определялась как уровень тиреотропина 0.От 1 до 2,5 мМЕ / л и уровни FT4 ниже 0,85 нг / дл в соответствии с рекомендациями Американской тироидной ассоциации.
[[{«type»: «media», «view_mode»: «media_crop», «fid»: «40320», «attributes»: {«alt»: «Гипотироксинемия и СДВГ», «class»: «media -image media-image-right «,» id «:» media_crop_5372269402416 «,» media_crop_h «:» 0 «,» media_crop_image_style «:» — 1 «,» media_crop_instance «:» 4111 «,» media_crop_rotate «:» 0 «, «media_crop_scale_h»: «0», «media_crop_scale_w»: «0», «media_crop_w»: «0», «media_crop_x»: «0», «media_crop_y»: «0», «style»: «float: right;» , «title»: «», «typeof»: «foaf: Image»}}]] Когда потомство достигло 8 лет, симптомы СДВГ, включая симптомы оппозиционного вызывающего расстройства, оценивались с использованием пересмотренной краткой шкалы оценки родителей Коннерса. (CPRS-R: S).Баллы для этого вопросника из 27 пунктов варьируются от 0 до 36, а его шкалы включают когнитивные проблемы / невнимательность, гиперактивность, оппозиционность и индекс СДВГ. Более высокие баллы указывают на большее количество симптомов СДВГ. Также были получены данные из ряда других когнитивных и поведенческих тестов, собранных в течение периода наблюдения поколения R в возрасте до 8 лет.
Всего у 127 женщин, что составляет 3,4% матерей, участвовавших в исследовании, была обнаружена гипотироксинемия на ранних сроках беременности. Гипотироксинемия у матери действительно была связана с более высокими показателями индекса CPRS-R: S ADHD у потомства после поправки на такие факторы, как пол, этническая принадлежность, возраст матери, уровень образования и доход матери.Однако увеличение было небольшим ( P = 0,04), при этом индекс СДВГ был в среднем на 7% выше для детей, рожденных от матерей, перенесших гипотироксинемию на ранних сроках беременности. Корреляции с симптомами оппозиции не наблюдалось.
Исследователи предположили, что недостаточность гормонов щитовидной железы во время беременности, хотя и имеет глобальное влияние, может повлиять на одни субрегионы мозга плода больше, чем на другие. Кроме того, не было обнаружено корреляции между субклинической материнской гипотироксинемией и риском СДВГ.
Исследователи пришли к выводу, что внутриутробное воздействие недостаточного уровня гормонов щитовидной железы — даже легкая недостаточность на ранних сроках беременности — может повлиять на развитие нервной системы. Хотя дизайн их исследования был более надежным, чем предыдущие родственные исследования, они отметили, что измерение гормонов щитовидной железы только один раз во время беременности является ограничением. Повторное тестирование могло дать представление о влиянии колебаний уровня гормонов на исходы СДВГ.
Ссылки:
1. Модесто Т., Тимейер Х., Петерс Р.П. и др.У матери умеренная гормональная недостаточность щитовидной железы на ранних сроках беременности и симптомы синдрома дефицита внимания / гиперактивности у детей.
