Дисплазия шейки матки | Многопрофильная частная клиника «Оберіг»
ПРЕИМУЩЕСТВА ДИАГНОСТИКИ И ЛЕЧЕНИЯ ДИСПЛАЗИИ ШЕЙКИ МАТКИ В УНИВЕРСАЛЬНОЙ КЛИНИКЕ «ОБЕРІГ»
Дисплазия шейки матки – это заболевание, при котором в эпителии шейки матки появляются аномальные клетки. Дисплазия шейки матки протекает бессимптомно. Обычно она обнаруживается при проведении ПАП-теста (мазок на онкоцитологию). Дисплазия шейки матки требует лечения в зависимости от степени. Но если женщина не была своевременно обследована и не получала адекватное лечение, дисплазия шейки матки может перерасти в рак.
Дисплазия шейки маткиПРИЧИНЫ ДИСПЛАЗИИ ШЕЙКИ МАТКИ
Основной причиной возникновения дисплазии шейки матки считается вирус папилломы человека (ВПЧ). Вирус папилломы человека очень распространен среди женщин и мужчин репродуктивного возраста. Чаще всего вирус поражает молодых женщин до 20 лет.
Заражение ВПЧ обычно происходит во время полового акта. Но вирус может передаваться при любом контакте слизистых оболочек здорового человека и носителя вируса.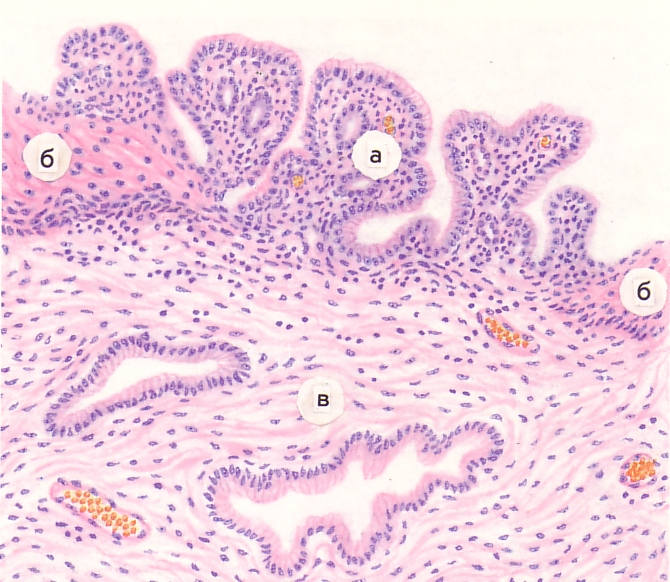 Использование презервативов снижает вероятность заражения, но не дает стопроцентную защиту.
Использование презервативов снижает вероятность заражения, но не дает стопроцентную защиту.
Известно более 100 разновидностей ВПЧ. Некоторые из них вызывают дисплазию и рак, а некоторые – остроконечные кондиломы. Рак шейки матки наиболее сильно связан с высокоонкогенными подтипами вируса, особенно ВПЧ 16 и ВПЧ 18. От инфицирования вирусом до развития злокачественной опухоли проходит 10-20 лет. А при определенных факторах (стресс, сниженный иммунитет, гормональные нарушения) – несколько месяцев.
В этот период возникает дисплазия шейки матки. Она обозначается аббревиатурой CIN (cervical intraepithelial neoplasia). Со временем дисплазия может прогрессировать – от легкой до умеренной и тяжелой степени (CIN1, CIN2, CIN3).
Дисплазия шейки матки развивается при длительном течении ВПЧ-инфекции. В большинстве случаев иммунная система уничтожает ВПЧ самостоятельно за 1-2 года. Но у некоторых пациенток организм не может справиться с вирусом. Носителями ВПЧ бывают женщины, которые начали половую жизнь до 18 лет или имеют несколько половых партнеров.
Среди женщин-носителей ВПЧ тяжелая дисплазия шейки матки развивается в два раза чаще у курильщиц. Хроническая ВПЧ-инфекция и дисплазия шейки матки также связаны с ослабленным иммунитетом. Например, вследствие применения иммуносупрессивных препаратов после пересадки органов или ВИЧ, наличия хронических воспалительных заболеваний в организме и т.п.
ДИАГНОСТИКА ДИСПЛАЗИИ ШЕЙКИ МАТКИ
Для своевременного выявления изменений шейки матки во время профилактических осмотров проводится кольпоскопия (осмотр шейки матки под микроскопом) и мазок на онкоцитологию. Дополнительно может быть рекомендован анализ ПЦР, который определяет наличие высокоонкогенных штаммов ВПЧ. Если вирус папилломы человека не обнаружен, это свидетельствует о низком риске развития дисплазии шейки матки. Иногда необходима биопсия – забор образца тканей шейки матки, который отправляют на лабораторное исследование.
СIN I (йод-отрицательные участки после проведения пробы Шиллера)ЛЕЧЕНИЕ ДИСПЛАЗИИ ШЕЙКИ МАТКИ
В некоторых случаях легкая дисплазия шейки матки самостоятельно исчезает без лечения.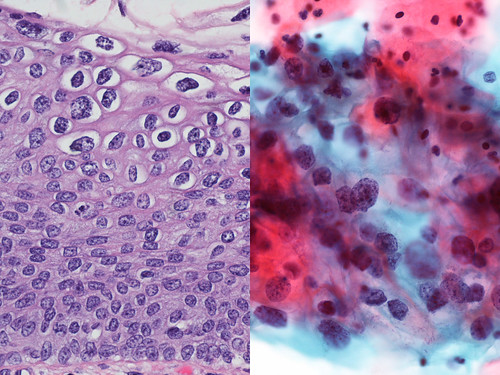 Поэтому пациентке может быть рекомендовано наблюдение с регулярными ПАП-тестами каждые 3-6 месяцев. Но дисплазия умеренной и тяжелой степени, а также дисплазия легкой степени, которая сохраняется два года, требует лечения с целью удаления аномальных клеток.
Поэтому пациентке может быть рекомендовано наблюдение с регулярными ПАП-тестами каждые 3-6 месяцев. Но дисплазия умеренной и тяжелой степени, а также дисплазия легкой степени, которая сохраняется два года, требует лечения с целью удаления аномальных клеток.
В настоящее время не существует методов лечения ВПЧ с доказанной эффективностью. Поэтому мы не можем повлиять на основную причину дисплазии, но можем предотвратить ее прогрессирование и развитие рака шейки матки.
Одна из разновидностей лечения дисплазии шейки матки – абляция, поверхностное разрушение эпителия с дисплазией. Недостаток абляции состоит в том, что после ее проведения не остается образцов тканей для гистологического исследования. Также она не может убрать участки дисплазии в глубине канала шейки матки.
Эксцизия – это удаление поверхностных частей шейки матки и цервикального канала. При конизации иссекается конусообразный фрагмент шейки матки и цервикального канала. После эксцизии или конизации удаленные ткани отправляют на гистологическое исследование.
Выбор метода лечения зависит от степени дисплазии, изменений тканей в цервикальном канале. В дальнейшем пациентки должны находиться под наблюдением врача и сдавать мазок на онкоцитологию каждые 6-12 месяцев.
Для профилактики дисплазии шейки матки женщинам желательно избегать раннего начала половой жизни, пользоваться презервативами и соблюдать моногамию. Также желательно бросить курить. В настоящее время существуют вакцины, которые защищают от высокоонкогенных штаммов ВПЧ или их влияния на организм. Прививку делают девочкам в возрасте 11-12 лет до начала половой жизни.
Защитите себя от рака шейки матки! Запишитесь на прием к врачу-гинекологу по телефону:
(044) 521 30 03
Дисплазия шейки матки. | МЕДПРАЙМ
Шейка матки представляет собой нижнюю часть матки, которая соединяет полость матки с влагалищем.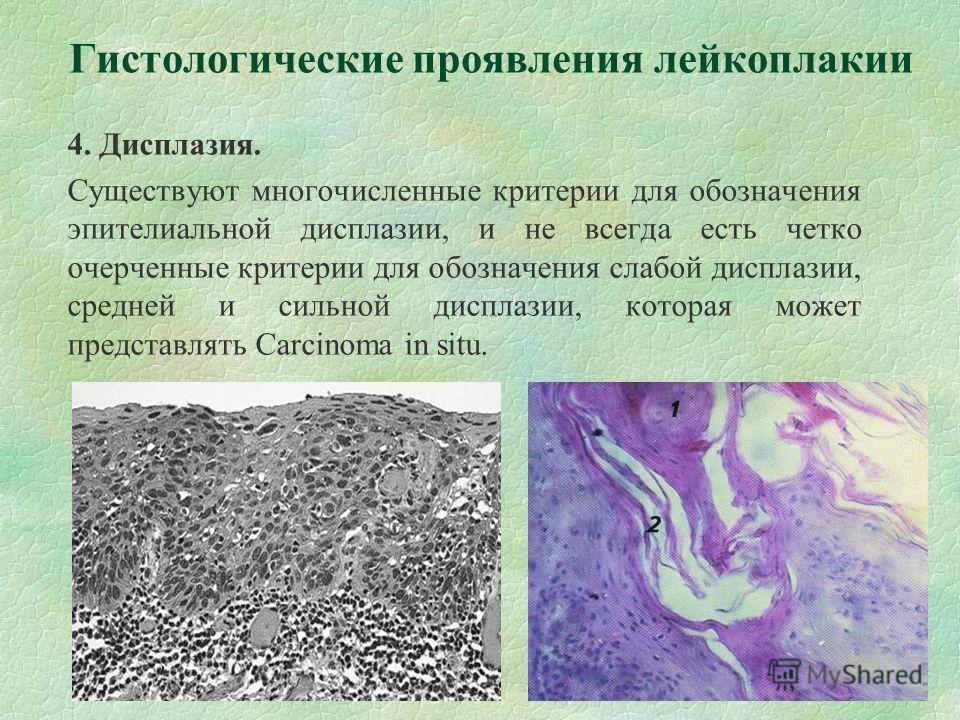 При осмотре врач видит влагалищную часть шейки матки с наружным зевом — отверстием цервикального (шеечного) канала. Цервикальный канал в полости матки заканчивается внутренним зевом. Эпителий (покровная ткань) шейки матки представлен двумя типами. Влагалищная часть шейки матки и влагалище покрыты многослойным плоским эпителием. Слизистая оболочка цервикального канала представлена цилиндрическим эпителием состоящим из множества трубчатых железистых клеток продуцирующих слизь. Место перехода многослойного плоского эпителия в цилиндрический называется переходная зона. Если переходная зона смещается и влагалищная часть шейки покрывается цилиндрическим эпителием, говорят об эктопии
При осмотре врач видит влагалищную часть шейки матки с наружным зевом — отверстием цервикального (шеечного) канала. Цервикальный канал в полости матки заканчивается внутренним зевом. Эпителий (покровная ткань) шейки матки представлен двумя типами. Влагалищная часть шейки матки и влагалище покрыты многослойным плоским эпителием. Слизистая оболочка цервикального канала представлена цилиндрическим эпителием состоящим из множества трубчатых железистых клеток продуцирующих слизь. Место перехода многослойного плоского эпителия в цилиндрический называется переходная зона. Если переходная зона смещается и влагалищная часть шейки покрывается цилиндрическим эпителием, говорят об эктопии
цилиндрического эпителия или псевдоэрозии.
Дисплазия эпителия шейки матки или цервикальная интраэпителиальная неоплазия — предраковое заболевание, для которого характерно появление атипичных (изменённых) клеток в различных слоях многослойного плоского эпителия. В зависимости от того, как глубоко находят эти клетки дисплазия бывает 3 степеней:
В зависимости от того, как глубоко находят эти клетки дисплазия бывает 3 степеней:
- лёгкая ( CIN I)— атипичные клетки находятся только в нижнем слое многослойного плоского эпителия;
- умеренная ( CIN II)— атипия затрагивает нижний и средние слои эпителия;
- тяжёлая (CIN III) — атипические клетки находят во всех слоях многослойного плоского эпителия, но не выходят за его пределы.
В большинстве случаев причиной развития дисплазии является поражение шейки матки вирусом папилломы человека (чаще ВПЧ-16 и ВПЧ-18). Существуют и предрасполагающие факторы — раннее начало половой жизни, большое количество сексуальных партнёров, иммунодефицитные состояния (хронические заболевания, стрессы, приём некоторых медикаментов), курение, гормональные нарушения, травмы шейки матки, инфекции передающиеся преимущественно половым путём — трихомонады, хламидии, вирус простого герпеса и др.
Дисплазия в большинстве случаев протекает бессимптомно.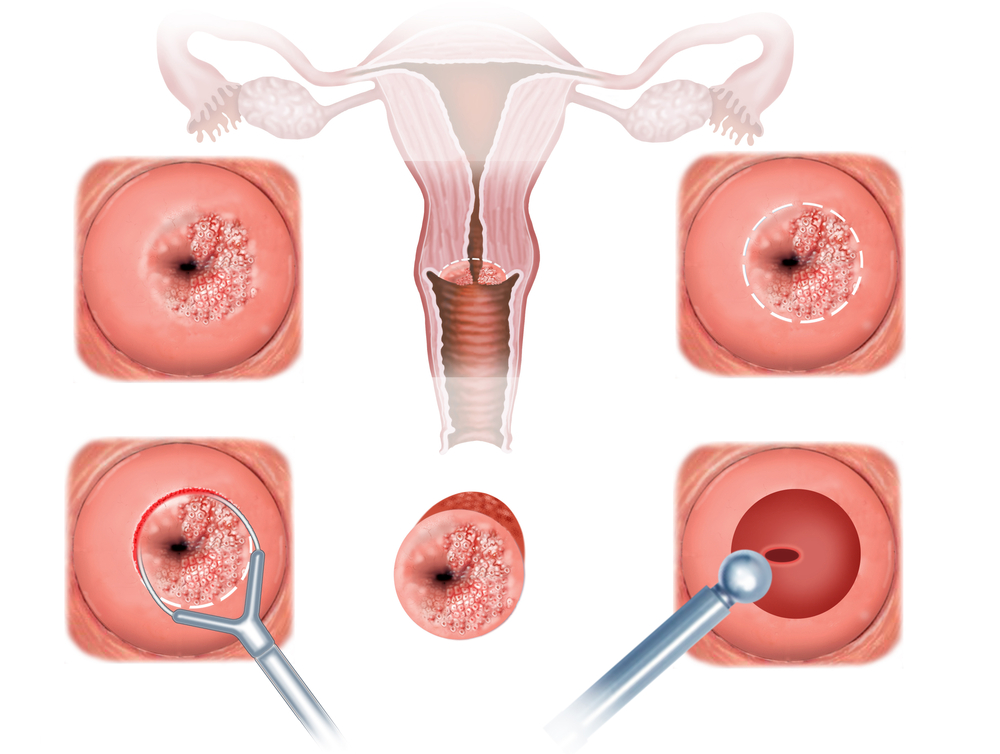 При присоединении воспаления женщину могут беспокоить неприятные выделения из влагалища, зуд, жжение, дискомфорт внизу живота.
При присоединении воспаления женщину могут беспокоить неприятные выделения из влагалища, зуд, жжение, дискомфорт внизу живота.
Дисплазию (эрозию шейки матки) может выявить только врач гинеколог. Для этого проводится ряд диагностических мероприятий. Осмотр шейки матки в зеркалах. Расширенная кольпоскопия — осмотр шейки матки под увеличением.
Кольпоскопия.
Цитологическое исследование мазков с поверхности шейки матки и цервикального канала.
Методика забора цитологичкского материала с шейки матки.
Прицельная биопсия с гистологическим исследованием кусочка шейки матки.
Лечение дисплазии шейки матки всегда начинается с выявления и устранения причины заболевания. Для этого женщине предлагают пройти обследование (лучше ПЦР-диагностику) на наличие в организме инфекций передающихся преимущественно половым путём и в первую очередь, на наличие папилломовируса человека высокого онкогенного риска. Затем при необходимости проводится курс противовоспалительной, противовирусной, иммуномодулирующей терапии. В ряде случаев после такого лечения дисплазия исчезает. Если же изменения на шейке матки остаются, приступают к радикальному лечению дисплазии.
Затем при необходимости проводится курс противовоспалительной, противовирусной, иммуномодулирующей терапии. В ряде случаев после такого лечения дисплазия исчезает. Если же изменения на шейке матки остаются, приступают к радикальному лечению дисплазии.
При этом важно не только успешно вылечить дисплазию, но и сохранить структуру шейки матки, такого важного в репродуктивном отношении органа.
Лечение заболеваний шейки в медицинском центре МЕДПРАЙМ мы проводим при помощи новейшей технологии – квантово-молекулярно резонансного метода. Уникальный аппарат подаёт энергию квантами, частота которых совпадает с частотой колебаний молекул человеческого организма. За счёт возникновения резонанса мы удаляем патологически изменённые клетки без выделения большого количества теплоты, что делает лечение быстрым, безболезненным, без ожогов и образования рубцов на шейке матки.
По окончании лечения наши пациентки получают рекомендации по поводу режима дня, питания.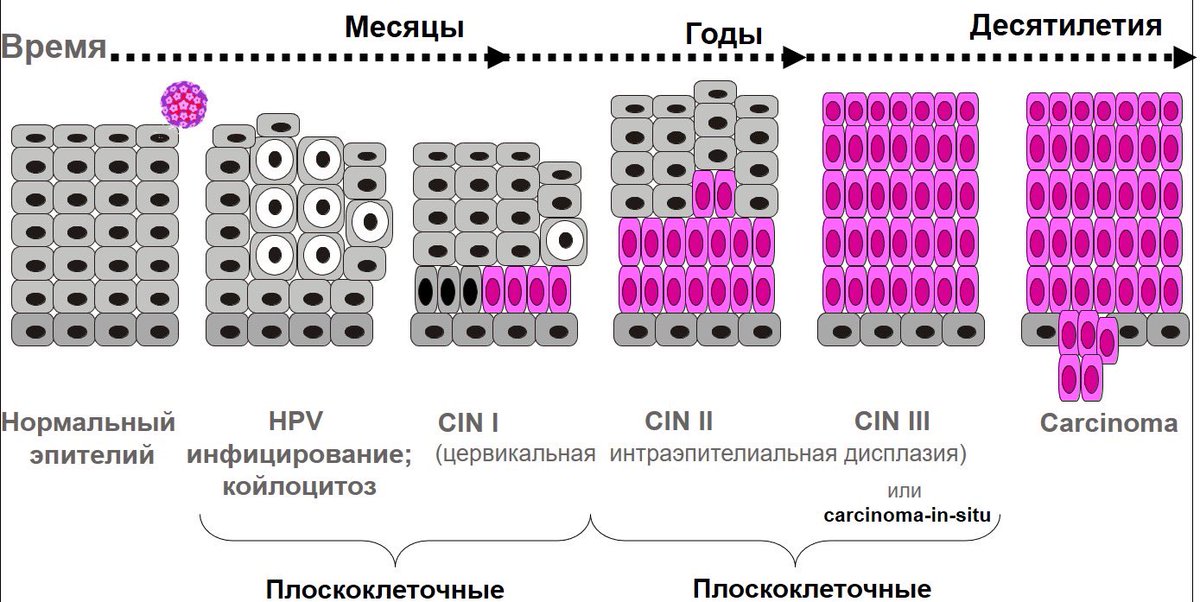
При заболеваниях шейки матки большое значение имеет полноценное питание с высоким содержанием витаминов С, Е, А. Особенно важны витамины группы В. Включайте в свой рацион рыбу северных морей жирных сортов, печень, горошек, брокколи, шпинат. В профилактике и для лечения таких заболеваний, как дисплазия шейки матки и рак шейки матки рациональное питание играет важную роль.
Запишитесь на лечение дисплазии шейки безболезненным методом QMR прямо сейчас! Лечение дисплазии шейки матки проводит опытный гинеколог в Запорожье Светлана Сергеевнв Матюхина.
Дисплазия шейки матки: лечени
Акушерство и гинекология Дисплазия шейки маткиДисплазия шейки матки – предраковое состояние. Эта формулировка подразумевает, что у девушек и женщин с подтвержденным диагнозом дисплазия шейки матки, вероятность развития рака шейки матки возрастает во много раз. Но абсолютно не обозначает, что он разовьется в 100 процентов случаев у женщин с дисплазией шейки матки.
- CIN I — легкая дисплазия шейки матки
- CIN II — умеренная дисплазия шейки матки
- CIN III — тяжелая дисплазия шейки матки
Степень (стадия) дисплазии шейки матки определяется по глубине проникновения патологического процесса (нарушений клеточных преобразований в слоях эпителия).
Нормальный эпителий на поверхности шейки матки имеет четыре слоя плоского эпителия. Более поверхностные изменения характеризуют легкую дисплазию шейки матки, глубокие изменения (атипия клеток во всех слоях, кроме самого последнего, самого глубоко расположенного) характерны для тяжелой дисплазии шейки матки.
Результаты эпидемиологических исследований свидетельствуют о том, что каждая четвертая женщина имеет патологию шейки матки, причем у 20% небеременных и у 40% беременных диагностируется предраковое состояние – дисплазия шейки матки.
Причины развития дисплазии шейки матки
- Экзогенные (полученные извне) – инфицирование вирусами папилломы человека (ВПЧ), герпес (герпетическая инфекция), заболевания, передающиеся половым путем (хламидиоз, уреаплазмоз, микоплазмоз, гонорея, трихомоноз)
- Эндогенные факторы (факторы внутренней среды организма) – гормональные нарушения, снижение иммунных сил защиты)
- Смешанные факторы.
Ведущую роль в развитии дисплазии шейки матки играют вирусы папилломы человека (ВПЧ), особенно штаммы высокой онкогенной активности.
Вирус папилломы человека насчитывают более 100 типов, часть из которых относится к вирусам папилломы человека (ВПЧ) высокого онкогенного риска.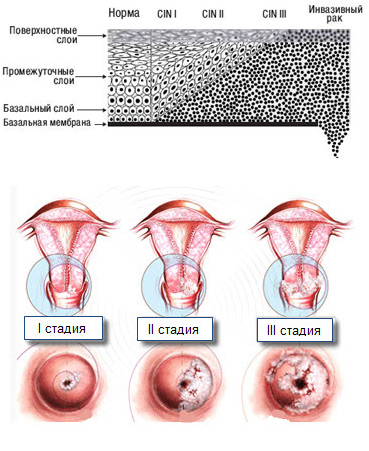 Типы ВПЧ высокого онкогенного риска: 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66, 67, 68, 70. Типы ВПЧ низкого онкогенного риска 6, 11, 42, 43, 44. Выявление вируса папилломы человека (ВПЧ), даже вирусов высокого онкогенного риска совершенно не значит, что Вы заболеете дисплазией шейки матки или раком шейки матки. При слаженности работы иммунной системы эти вирусыв течении года могут самостоятельно ликвидироваться вашим собственным организмом при отсутствии воспаления даже без лечебных процедур. Такая выжидательная тактика допустима при отсутствии выраженных изменений эпителия шейки матки, при нормальных результатах ПАП-теста (цитология). Цитология (онкоцитология, ПАП-тест, цитоморфологическое исследование эпителия шейки матки) – обследование, которая женщина проходит в идеале ежегодно. Цитология позволяет подтвердить или опровергнуть диагноз дисплазия шейки матки.
Типы ВПЧ высокого онкогенного риска: 16, 18, 31, 33, 35, 39, 45, 52, 56, 58, 59, 66, 67, 68, 70. Типы ВПЧ низкого онкогенного риска 6, 11, 42, 43, 44. Выявление вируса папилломы человека (ВПЧ), даже вирусов высокого онкогенного риска совершенно не значит, что Вы заболеете дисплазией шейки матки или раком шейки матки. При слаженности работы иммунной системы эти вирусыв течении года могут самостоятельно ликвидироваться вашим собственным организмом при отсутствии воспаления даже без лечебных процедур. Такая выжидательная тактика допустима при отсутствии выраженных изменений эпителия шейки матки, при нормальных результатах ПАП-теста (цитология). Цитология (онкоцитология, ПАП-тест, цитоморфологическое исследование эпителия шейки матки) – обследование, которая женщина проходит в идеале ежегодно. Цитология позволяет подтвердить или опровергнуть диагноз дисплазия шейки матки.
Диагностика дисплазии шейки матки
Для полноценной диагностики дисплазии шейки матки применяются:
- Кольпоскопия.

- Цитология (ПАП-тест, онкоцитология, цитоморфологическое исследование эпителия шейки матки).
Кольпоскопия – это осмотр шейки матки специальным прибором на гинекологическом кресле под увеличением в 10-30 раз с освещением. Кольпоскопия – абсолютно безболезненная процедура, т.к. она бесконтактная. Простая кольпоскопия – это осмотр шейки матки без диагностических проб. Расширенная кольпоскопия — метод более точной диагностики дисплазии шейки матки. Производится изучение эпителия и сосудов шейки матки с применением диагностических проб. Проба с 3% раствором уксусной кислоты. Проба с раствором Люголя – проба Шиллера. Это наиболее важные и хорошо изученные диагностические пробы, позволяющие более четко ограничить и изучить очаги дисплазии шейки матки. Кроме диагностики, данные растворы являются и профилактическими антисептиками. Выполнение проб безболезненно. Под контролем кольпоскопии забор анализав выполняется максимально точно, особенно это важно при выявлении «подозрительных мест» — очагов дисплазии шейки матки.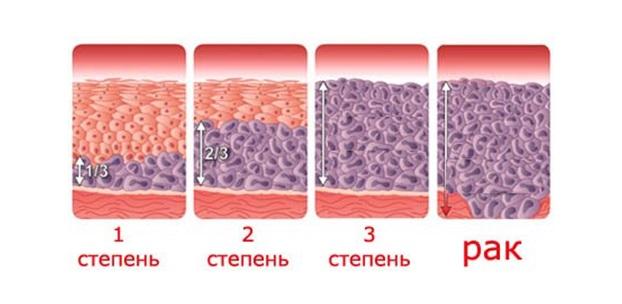
При обнаружении дисплазии шейки матки, особенно при патологической картине цитологии, вторым шагом диагностики является биопсия шейки матки. Биопсия шейки матки чаще всего проводится под местной анестезией. С помощью современных радиоволновых аппаратов (ФОТЕК) процесс биопсии короткий, малоболезненный и высокоинформативный. Биопсия выполняется специальным петлевым электродом, сама процедура занимает несколько секунд. Условия для проведения биопсии шейки матки — отсутствие воспаления шейки матки. При воспалении шейки матки можно проводить биопсию шейки матки только на фоне специфической антибактериальной и противовоспалительной терапии.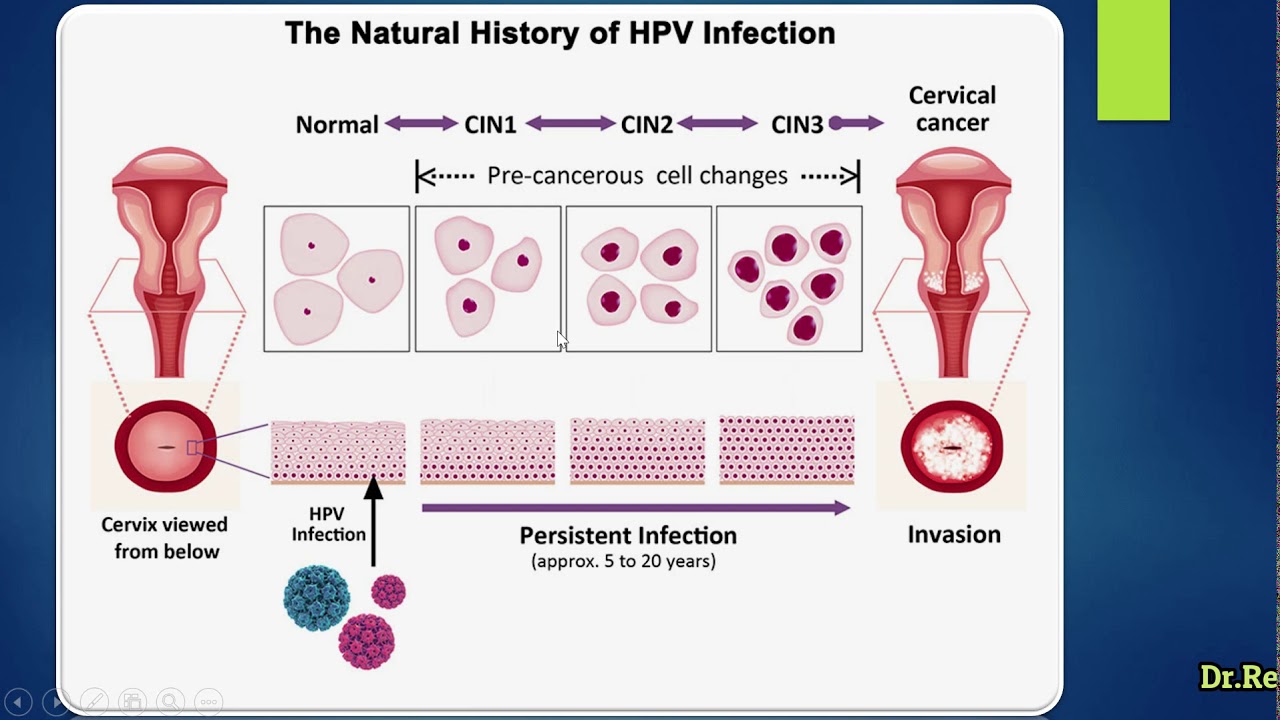
В некоторых случаях, при выявлении дисплазии шейки матки матки в цервикальном канале (внутри шейки матки), требуется выскабливание цервикального канала с анализом удаленной ткани.
Лечение дисплазии шейки матки
Единственным доказанно эффективным методом лечения дисплазии шейки матки является деструкция очага дисплазии (аргоноплазменная абляция (коагуляция), радиоволновая коагуляция, лазерная коагуляция, прижигание жидким азотом (криодеструкция шейки матки), диатермокоагуляция). Сочетание одной из этих методик со специфическим лечением (при обнаружении заболеваний, передающихся половым путем), противовирусной терапией (при обнаружении вирусов папилломы ВПЧ) проводится по показаним.
Сочетание одной из этих методик со специфическим лечением (при обнаружении заболеваний, передающихся половым путем), противовирусной терапией (при обнаружении вирусов папилломы ВПЧ) проводится по показаним.
Лечение дисплазии шейки нерожавшим следует проводить наиболее щадящими но достаточно эффективными способами. Осложнения после прижигагия дисплазии шейки матки – рубцевание. Если у нерожавшей образуется рубец на шейке после прижигания дисплазии шейки матки– роды в последующем проходят достаточно мучительно в связи с плохим раскрытием плотной (рубцовой) шейки и могут, в связи с этим, закончиться операцией кесарева сечения. Достаточно часто рубцы образуются после прижигания (замораживания) жидким азотом (криодеструкция шейки матки), после применения прижигания лазером (лазерная вапоризация, лазерная коагуляция) — (особенно в руках не очень опытного доктора), после прижигания током (диатермокоагуляция), и другими контактными методами, когда «прижигатель» непосредственно прикасается к шейке матки.
Прогрессивно новым методом лечения эрозии шейки матки и дисплазии шейки матки является аргоноплазменная абляция (коагуляция) шейки матки. Метод аргоноплазменной абляции (коагуляции) — это воздействие на ткани плазмой , формируемой ионизированным аргоном. Это бесконтактная процедура, без прикосновения инструмента к тканям. Безопасное воздействие на ткани вследствие четко контролируемой глубины проникновения. Без обугливания и дымления тканей, отсутствие неприятных запахов при манипуляции. Эффективно применяется для поверхностной коагуляции, однородного гемостаза и девитализации тканей.Щадящее лечение патологии шейки матки – дисплазия шейки матки, эрозия шейки матки — происходит практически безболезненно, не оставляет рубцов и широко используется для лечения эрозии шейки матки и дисплазии шейки матки у нерожавших женщин.
Процедура является полностью безопасной, т.к. глубина проникновения факела аргоновой плазмы составляет 0,5 мм до 3 мм.
Естественно, аргоноплазменная абляция широко применяется и у рожавших женщин, благодаря своей надежности, эффективности и безопасности.
Современный аппарат для лечения патологии шейки матки «Фотек 401» сочетает в себе возможность применения радиоволновой коагуляции (для лечения более глубоких поражений, особенно при тяжелой дисплазии шейки матки) и аргоноплазменной абляции – при легкой дисплазии шейки матки. Подобных установок в Украине не много, это обусловлено их сравнительно высокой стоимостью.
При проведении коагуляции аргоном, болезненность незначительная или практически полностью отсутствует. После процедуры необходимо соблюдать половой покой 1 мес. Выделения из половых путей могут незначительно усилиться, но это не будет доставлять дискомфорт в повседневной жизни. Полное заживление проходит за 2 месяца. Беременность планировать возможно уже через 3-6 мес после процедуры.
Условия для проведения процедуры:
- Отсутствие воспаления.
- День менструального цикла с 6 по 10.
Необходимые анализы:
- Анализ выделений (мазок) не более 1 мес. (исключение воспаления)
- Цитология (ПАП-тест) не более 6 мес.
 (для исключения рака шейки матки)
(для исключения рака шейки матки) - Анализы на инфекции, передающиеся половым путем (отсутствие хламидий, уреаплазм, микоплазм).
При выявлении воспаления и/или инфекций, передающихся половым путем, производиться сначала специфическое лечение этих состояний.
В нашей клинике мы соблюдаем все современные требования к лечению и диагностике патологии шейки матки (эрозия шейки матки, дисплазия шейки матки), основанные на мировых стандартах.
причины, симптомы и лечение в Москве
Дисплазия вульвы — это патология женских половых органов, для которой характерно изменение структуры их плоского эпителия. Развитие данного заболевания довольно непросто прогнозировать, поскольку в некоторых случаях оно на протяжении долгого времени остается стабильным, в других начинает регрессировать, а в некоторых приводит к возникновению рака вульвы. Чтобы предотвратить развитие онкологического заболевания, очень важно своевременно диагностировать дисплазию вульвы и подобрать наиболее оптимальную методику ее лечения.
Формы дисплазии
В результате обследования может быть установлена одна из форм дисплазии вульвы: локальная или диффузная. Кроме того, разделяют заболевания в зависимости от степени поражения клеток на легкую, умеренную и тяжелую формы. Для легкой формы наиболее характерным является очень слабо выраженные изменения в эпителиальном пласте. Умеренная форма патологии характеризуется поражением двух третей плоского эпителия. При тяжелой форме дисплазии вульвы врачи наблюдают поражение практически всего пласта эпителия. При этом тяжелая форма дисплазии вульвы считается очень сложным заболеванием. Ее даже причисляют к инвазивному раку, при этом ядерно-клеточная атипия и пролиферация клеток не наблюдаются.
Прогноз и профилактика дисплазии вульвы
Дисплазия вульвы — это опасное и серьезное заболевание, которое может прогрессировать и стать причиной онкологической болезни. Поэтому диагностировать патологию крайне важно на ранней стадии ее развития. Конечно, сделать это не так уж и просто, поскольку практически всегда болезнь протекает без видимых симптомов. Очень важно проходить два раза в год гинекологический осмотр, в ходе которого врач смог бы своевременно выявить патологию. Чем дольше отсутствует лечение заболевания, тем больше шансов на то, что женщина заболеет раком. Если же не лечить тяжелую степень дисплазии вульвы, это может привести даже к инвазивному раку.
Благоприятный прогноз на полное восстановление и выздоровление может дать только ранняя диагностика заболевания. После лечения остается риск рецидива дисплазии вульвы, поэтому крайне важно регулярно посещать гинеколога. После лечения патологии очень важно пройти курс реабилитации, воздерживаться от половых контактов, физических нагрузок, необходимо соблюдать предписания врача и не применять гигиенические тампоны.
Обычно женщин, которые перенесли дисплазию вульвы, ставят на диспансерный учет и контролируют их состояние. В случае диагностирования тяжелой формы патологии больную ставят также на учет у онколога. Что касается профилактических мер по предупреждению заболевания, то к ним прежде всего можно отнести полноценное питание, использование барьерной контрацепции, санацию очагов инфекции, ограниченное количество половых партнеров.
Причины дисплазии вульвы
Главным фактором, который в большинстве случаев вызывает дисплазию вульвы, считается вирус папилломы человека. В особенности опасными являются 16 и 18 его виды, которые считаются онкогенными. Возникновению, а затем и развитию патологии способствуют нередко воспаления наружных половых органов — кольпит, вульвит, бартолинит. Причинами дисплазии вульвы могут также стать иммунодефицит, нейроэндокринные и обменные нарушения, метаплазии плоского эпителия, дистрофические процессы вульвы.
Во многих случаях патология развивается на фоне дисплазии шейки матки. А именно, клинические исследования доказывают, что в 35-60% случаях дисплазия вульвы и шейки матки диагностируются одновременно. Следует также указать факторы риска, которые способствуют образованию патологии. К ним относят в первую очередь раннее начало половой жизни, курение и беспорядочную половую жизнь.
Симптомы дисплазии вульвы
Зачастую заболевание протекает бессимптомно, поэтому диагностировать его крайне сложно. Обнаруживаются симптомы практически всегда только во время осмотра у гинеколога. Тем не менее, некоторые симптомы, которые можно заметить, все же проявляются. Например, наиболее очевидным проявлением дисплазии вульвы является наличие кондиломы на половых органах и анусе. Пораженных участков может быть несколько.
Если болезнь начнет прогрессировать, женщина начнет чувствовать в области половых органов постоянный зуд, который постепенно переходит на анус или влагалище. В этих участках также возможно появление болезненных ощущений. Тем не менее, стоит знать, что все эти симптомы не обязательно характерны именно для дисплазии вульвы. Они также могут свидетельствовать о развитии вагинита или кольпита. Поэтому на начальных стадиях заболевания выявить его оказывается крайне сложно. В некоторых случаях дисплазию вульвы вызывают разного рода инфекции, которые становятся причиной отеков и выделений.
Обнаружили симптомы данного заболевания?Звоните
Наши специалисты проконсультируют Вас!
Диагностика дисплазии вульвы
Поскольку в большинстве случаев заболевание развивается без каких-либо заметных симптомов, огромную роль в его диагностировании играет гинекологический осмотр на кресле. Если визуального осмотра врачу будет недостаточно для того, чтобы поставить диагноз, можно также прибегнуть и к кольпоскопии. Эта процедура позволит детализировать особенности заболевания. С подозрительных участков вульвы, которые были обнаружены во время осмотра, врач берет отпечатки для цитологического исследования.
Кроме того проводится обследование на наличие вируса папилломы человека, а также постановка Шиллер-теста. Гинеколог обязательно должен провести биопсию, а также гистологическое исследование отобранного материала, чтобы подтвердить или опровергнуть наличие рака вульвы. В диагностике заболевания могут принимать участие помимо гинеколога также онколог и венеролог.
Лечение дисплазии вульвы
Лечение заболевания в каждом отдельном случае подбирается и назначается индивидуально. К тому же, стоит учитывать, что дисплазия вульвы относится к группе хронических болезней и может сопровождаться другими заболеваниями. Именно поэтому лечение обязательно должно быть комплексным. В том случае, если причиной заболевания стал вирус папилломы человека, важно пройти курс лечения противовирусными препаратами.
Консервативные методы
Консервативное лечение патологии предусматривает достижение ремиссии заболевания, а затем и вовсе его устранения. Если выбирается именно такой вид лечения, назначаются следующие препараты:
- седативные;
- десенсибилизирующие;
- гормональные;
- общеукрепляющие;
- противовирусные.
В том случае если в процессе терапии обнаруживается лейкоплакия, консервативное лечение прекращается, поскольку длительного эффекта оно не принесет.
Хирургическое вмешательство
Для устранения тяжелой формы дисплазии вульвы выбирают оперативное вмешательство. Однако если больная молодая и нерожавшая девушка, могут быть выбраны альтернативные варианты, в том числе лечение жидким азотом, удаление мелких очагов лазером, лечение радиоволновым методом. Использовать все эти методики можно только при обнаружении легкой формы заболевания.
Во всех иных случаях врачи выбирают хирургическое вмешательство. А именно, операция рекомендована в следующих случаях:
- больная уже вступила в возраст, в котором наступает менопауза;
- диагностирована очень тяжелая форма заболевания;
- в анамнезе указаны случаи рецидива болезни;
- зафиксированы очень большие поражения.
Фотодинамическая терапия
Поскольку операция повреждает половые органы, после ее проведения рекомендуется пластическое вмешательство. Стоит отметить еще один применяемый метод лечения дисплазии вульвы — фотодинамическая терапия. Она предполагает накопление в клетках вульвы фотосенсибилизированного красителя. После этого все эти клетки уничтожаются световой волной. Вне зависимости от того, какой из методов лечения был выбран врачом, лечение патологии всегда проводится исключительно в стационарных условиях. После завершения лечения обязательно проводится цитологическое исследование.
Данная статья размещена исключительно с целью ознакомления в познавательных целях и не является научным материалом или профессиональным медицинским советом. За диагностикой и лечением обратитесь к врачу.
Цитологический метод в диагностике опухолей и опухолеподобных процессов
Цитопатология, клиническая или диагностическая цитология, изучает клеточный состав патологических процессов. В качестве отдельной медицинской специальности официально признана в 1941 г. после работ Папаниколау Г. и Траута Н. К чести нашей страны разработка цитологического метода диагностики начата в 1938 г. в клинико-диагностической лаборатории Московского научно-исследовательского онкологического института им. П.А. Герцена. В 1941 г. профессор Н.Н. Шиллер-Волкова на сессии института доложила о первых результатах по исследованию выделений из влагалища, мокроты и пунктатов. В развитии цитологии можно выделить три основных этапа: эксфолиативная, в основном гинекологическая цитопатология; аспирационная цитология, бурный расцвет которой начинается с 80-х годов и связан с внедрением ультразвуковой диагностики, и современный этап развития определяется применением иммуноцитохимических и молекулярных методов исследования, а также автоматизированного скрининга в гинекологической цитологии.
Цитологический метод технически прост, быстр, сравнительно дешев, малотравматичен. Однако «легкость» цитологического метода обманчива, так как цитологическое исследование должно заканчиваться формулировкой заключения, основываясь на котором разрабатывается тактика лечения.
По способу получения материала цитологию можно подразделить на дооперационную (эксфолиативную, абразивную, аспирационную) и интраоперационную. Эксфолиативная цитология включает в себя исследование вагинальных мазков, мокроты, мочи, плевральной, перитонеальной, перикардиальной, цереброспинальной, синовиальной жидкости и т.д. Этот раздел цитологии отличается простотой техники получения большого количества различного типа клеток, в том числе воспалительного ряда. Клеточный материал может быть не очень хорошо сохранен. Для получения информативного материала с поверхности патологического очага удаляют гноевидные массы, корочки, некротический налет. Если полученный материал представляет жидкость, то в нее добавляется цитрат натрия, чтобы жидкость не свернулась.
Абразивная цитология получает материал из определенного участка внутренних органов, в том числе исследуются субэпителиальные поражения с помощью фиброоптических инструментов. При таком взятии материала клетки хорошо сохраняются, и препараты легко интерпретировать. Материал получают из шейки матки, вагины, эндометрия, респираторного, желудочно-кишечного, мочеполового тракта.
Тонкоигольная биопсия в настоящее время позволяет получить материал практически из любого органа. Метод постоянно совершенствуется и дает оптимальные результаты, что делает его в плане диагностики высокоэффективным и экономичным.
Взятый для цитологического исследования материал помещают на край предметного стекла и другим предметным или покровным стеклом равномерно, сильно не надавливая, тонким слоем распределяют по всей поверхности препарата.
В последние годы помимо рутинных цитологических мазков для получения качественных монослойных цитологических препаратов используется жидкостная система: пунктаты вносятся в специальную среду накопления, после чего центрифугируются в режиме 1000 оборотов в течение 5 минут при среднем ускорении на центрифуге (Суtospin-3, Суtospin-4). Применение методики жидкостной цитологии имеет ряд преимуществ: обеспечивает сохранность клеточных структур, уменьшает фон, клетки сосредотачиваются в одном месте – «окошке», что сокращает время просмотра препарата и значительно экономит дорогие сыворотки при проведении иммуноцитохимического исследова-
ния. Для создания архива и возможности последующего исследования материала используется методика Cell-block, при которой получаются препараты, занимающие промежуточное положение между цитологическими и гистологическими.
Влажная фиксация препарата в спирте сразу после взятия мазков применяется при окраске по Папаниколау. В остальных случаях мазки высушивают на воздухе, а затем фиксируют уже в лаборатории. Наиболее распространенный способ фиксации – в равных объемах спирта и эфира (смесь Никифорова). Для иммуноцитохимического исследования применяют фиксацию ацетоном. При окраске мазков используют панхромную окраску азур-эозином по методу Романовского – Гимза в различных модификациях (Лейшмана, Паппенгейма), а также окраска гематоксилином и эозином, особенно при исследовании гинекологического материала используется окраска по Папаниколау. Возможно при рутинном исследовании или специальной окраске выявление бактериальной флоры, в том числе бацилл Коха, лепры, хеликобактера, трихомонад и т.д.
Цитологическая диагностика основана на следующих принципах:
- Разница клеточного состава в норме и патологии.
- Оценка не одной отдельно взятой клетки, а совокупности клеток, большое значение придается фону препарата.
- Цитолог должен иметь патологоанатомический базис.
- Каждое исследование завершается формулировкой заключения.
Критерии цитологической диагностики злокачественных новообразований составляются из оценки клетки, ядра и ядрышка.
Клетка:
– увеличена в размере, иногда гигантская, редко размер близок к норме, что затрудняет цитологическую диагностику, например, при коллоидном, тубулярном раке, маститоподобном варианте долькового рака молочной железы, фолликулярном раке щитовидной железы, карциноиде, почечноклеточном светлоклеточном раке, высокодифференцированных веретеноклеточных саркомах;
– изменение формы и полиморфизм клеточных элементов;
– нарушение соотношения ядра и цитоплазмы в сторону увеличения доли ядра;
– диссоциация степени зрелости ядра и цитоплазмы, например, молодое ядро в ороговевшей цитоплазме при высокодифференцированном плоскоклеточном раке.
Ядро:
– увеличение размера, полиморфизм, бугристость, неравномерный рисунок хроматина, наиболее постоянный признак – неровность контуров, гиперхромия, фигуры клеточного деления в цитологических препаратах сравнительно редки.
Ядрышко:
– число ядрышек больше, чем в нормальной клетке, ядрышки увеличены в размере, неправильной формы.
Несмотря на присутствие критериев злокачественности у подавляющего большинства клеток, в некоторых клетках рака эти критерии могут отсутствовать или быть выражены в неполном объеме. Необходимо обращать внимание на особенности взаимного расположения клеток, характер межклеточных связей. Заключение формулируют по совокупности признаков при достаточном количестве клеточного материала. Попытка оценить мазок по неадекватно взятому материалу – наиболее частая причина ошибочных заключений.
Основные задачи цитологической диагностики состоят в следующем:
- Формулировка заключения до лечения.
- Интраоперационная срочная диагностика.
- Контроль эффективности лечения.
- Оценка важнейших факторов прогноза течения заболевания.
Цитологическое заключение до лечения включает:
- определение гистогенеза новообразований;
- установление степени дифференцировки опухолевого процесса;
- уточнение степени распространенности опухоли;
- изучение фоновых изменений;
- определение некоторых факторов прогноза;
- возможность исследования бактериальной флоры.
Современное цитологическое заключение не только констатирует наличие рака, но и указывает гистологический тип опухоли и степень дифференцировки согласно общепринятым международным классификациям (МКБ-О и ВОЗ).
Критериями достоверности цитологического метода являются результаты сопоставления с плановым гистологическим исследованием. Наибольший процент совпадений цитологического заключения с окончательным гистологическим заключением наблюдается при исследовании образований кожи, молочной, щитовидной железы, при метастатическом поражении лимфатических узлов. Результаты исследования гиперпластических процессов в эндометрии неудовлетворительны (достоверность 30–50%) и заставляют искать пути совершенствования диагностики. Достоверность цитологической диагностики патологии шейки матки составляет 75–90%. 3–24% исследований, в зависимости от локализации и способа получения материала, оказываются неудачными из-за неадекватно полученного, неинформативного материала.
Таблица 1. Достоверность цитологических исследований
опухолей различных локализаций.
| Локализация | % совпадения цитологического и гистологического диагноза | % совпадения по данным литературы | % неудавшихся пункций |
|---|---|---|---|
| Легкое | 95,5-97 | 79-98 | 2,9-3,0 |
| Молочная железа | 95,8-97,4 | 90-96 | 2,6-8,3 |
| Лимфатические узлы | 98,4-98,7 | 90 | 1,6-10,7 |
| Кожа | 91,2-92,7 | 90-98 | 2,4-12,5 |
| Мягкие ткани (без указания гистологического типа опухоли) |
90,2-93,8 | 65-93,4 | 5-12,3 |
| Желудочно-кишечный тракт | 92,3-97,5 | 73-93,6 | 2,5-4,4 |
| Щитовидная железа | 85,5-93,2 | 57-94 | 1,6-4,2 |
| Шейка матки | 89,5-93,2 | 65-90 | 3,5-4,5 |
| Эндометрий | 78,9-84,8 | 30-90 | 3,8-15,4 |
| Почка | 86,2-89,3 | 76,4-91,3 | 7,1-11,5 |
| Экссудаты | 95,7-100 | – | 1,2-2,7 |
Уверенное цитологическое заключение о наличии злокачественного новообразования, совпадающее с клиническими симптомами и данными других диагностических исследований, расценивается как морфологическое подтверждение диагноза злокачественной опухоли. Это предъявляет к цитологическому методу высокие требования и заставляет искать пути предупреждения возможных ошибок. По характеру ошибки цитологов можно разделить на две большие группы: ложноотрицательные и ложноположительные. Ложноотрицательные заключения преобладают и приводят к гиподиагностике опухолевого процесса, чаще всего из-за небольшого количества информативного материала в пунктате. Имеются и объективные трудности в оценке изменений, связанные чаще с высокой дифференцировкой опухоли, например, практически невозможно диагностировать фолликулярный рак щитовидной железы с минимальной инвазией, трудно диагностируется тубулярный, маститоподобная форма долькового рака молочной железы.
Гипердиагностика опухолей на нашем материале многие годы не превышает 1%, однако может служить причиной ненужного, а иногда и калечащего лечения. Истинная гипердиагностика, то есть ложное цитологическое заключение о наличии опухоли, объясняется несколькими наиболее типичными причинами.
Выраженная пролиферация клеточных элементов является наиболее частой причиной гипердиагностики рака. Например, пролиферация эпителия протоков и долек молочной железы при фиброаденоме и пролиферирующем аденозе, особенно при укрупнении ядер, наиболее часто приводит к гипердиагностике рака молочной железы. Правильной диагностике помогает анализ ядерных характеристик клеток опухоли: наличие ровных контуров ядра и равномерное распределение хроматина.
Реактивные изменения эпителия служат также нередкой причиной неадекватной цитологической диагностики. Наиболее тяжелые ошибки встречаются при ангиомиолипоме почки, при которой реактивные изменения почечного эпителия с укрупнением и полиморфизмом ядер приводят к ошибочному диагнозу высокодифференцированного почечноклеточного светлоклеточного рака. Диагностике ангиомиолипомы помогает обнаружение сосудистых структур и веретенообразных клеток, экспрессирующих виментин, десмин, НМВ-45.
Хронический аутоиммунный тиреоидит типа Хашимото сопровождается образованием сосочковоподобных структур, к оценке которых необходимо подходить осторожно и помнить, что при этом процессе реактивные изменения эпителия можно ошибочно принять за папиллярный рак щитовидной железы. Для хронических дерматитов, язв характерны атипические реактивные разрастания многослойного плоского эпителия, нередко представляющие непреодолимые трудности в дифференциальной диагностике с высокодифференцированным плоскоклеточным раком. Выраженные дистрофические изменения клеток являются также одной из причин ошибочной цитологической диагностики. Например, выраженная жировая дистрофия гепатоцитов может привести к гипердиагностике метастаза почечноклеточного светлоклеточного рака, особенно при уже состоявшемся диагнозе рака почки.
Большую проблему цитологии представляет дифференциальная диагностика различных степеней диспластических изменений эпителия и внутриэпителиального рака. Присутствие при тяжелой дисплазии полиморфных крупных клеток с большими неправильно округлыми ядрами, иногда с увеличенными ядрышками, двуядерных клеток с тяжистым рисунком хроматина может быть неверно расценено как рак. При диспластических изменениях плоского эпителия необходимо учесть, что большинство клеток сходны с клетками глубоких слоев, крупные атипические клетки находятся в тесной связи с клетками без признаков атипии, имеются клетки стромы. Для объективизации дифференциальной диагностики различных степеней дисплазии и внутриэпителиального рака желательно проведение морфометрии клеток и ядер, что позволяет значительно снизить процент ошибочных заключений.
Нередко причиной гипердиагностики метастатического поражения в лимфатических узлах являются комплексы клеток укрупненного эндотелия и гистиоцитов, образующих эпителиоподобные структуры, а также наличие макрофагов с содержанием бурого пигмента. При затруднениях диагностики помогает иммуноцитохимическое исследование с небольшим набором антител (VIII фактор, цитокератины, ЭМА, НМВ-45), позволяющее подтвердить или отвергнуть наличие метастазов рака или меланомы.
Во избежание ошибок морфологической диагностики большое значение имеет четкое указание на характер проведенного лечения. Например, прием довольно распространенного антибиотика тетрациклина приводит к накоплению в клетках щитовидной железы бурого пигмента и ошибочному диагнозу метастаза меланомы. Прием мерказолила при зобе сопровождается резким полиморфизмом фолликулярного эпителия, что служит причиной цитологической и даже гистологической гипердиагностики фолликулярного рака. Проведение лучевой терапии вызывает выраженные изменения не только опухолевых клеток, но и нормального эпителия: укрупнение, полиморфизм клеток, патологическое ороговение, что является причиной гипердиагностики рака.
Имеются и объективные диагностические проблемы, например, в дифференциальной диагностике между эндометриоидной высокодифференцированной аденокарциномой и атипической гиперплазией эндометрия, себоррейной (базальноклеточной) кератомой и базально-клеточным раком, инфекционным мононуклеозом и болезнью Ходжкина, где достаточно высокий процент ошибочных заключений и требуется дальнейшая разработка цитологических критериев диагностики.
Знание клинической картины, характера проведенного лечения, применение современных методик морфологической диагностики с использованием иммуноцитохимии и морфометрии способствует сведению случаев гипердиагностики к нулю.
Вместе с истинной цитологической гипердиагностикой существует ложная гипердиагностика, когда цитолог дает уверенное заключение о злокачественном процессе, а при гистологическом исследовании опухоли не обнаруживается, то есть фактически имеет место гистологическая гиподиагностика. Пересмотр цитологических препаратов несколькими высококвалифицированными специалистами, повторное взятие биопсии, клиническое течение заболевания в дальнейшем подтверждают результаты цитологического исследования. Больше всего ложной цитологической гипердиагностики относится к исследованию биопсийного материала из бронхов и гортани, а также при исследовании лимфатическиих узлов, когда при цитологическом исследовании выявлялись единичные комплексы анаплазированных клеток, несомненно принадлежащих раку. При приготовлении гистологических препаратов эти комплексы теряются в готовых гистологических препаратах. Реальная потеря немногочисленных опухолевых клеток при приготовлении гистологических препаратов не допускает игнорирования клиницистом данных цитологического исследования и приводит к «золотому» стандарту – совместному цитологическому и гистологическому исследованию биоптата.
Интраоперационная цитологическая диагностика – одно из основных направлений цитологического метода исследования. Во время операции, используя цитологический метод, уточняется характер патологического процесса, степень распространенности с выявлением метастазов в лимфатические узлы, печень и другие органы, производится контроль радикальности выполненной операции с исследованием краев резекции. Роль цитологии возрастает при разработке показаний к расширенным лимфоаденэктомиям и при определении так называемых «сторожевых», или «сигнальных», лимфатических узлов, которых может быть шесть, и применение гистологического метода невозможно из-за длительности исследования. По данным ведущих клиник, ошибка срочного гистологического исследования «сторожевых» лимфатических узлов составляет 25%, поэтому они рекомендуют использовать интраоперационное цитологическое исследование отпечатков с поверхности разрезанного лимфатического узла. По нашим данным, достоверность срочного цитологического исследования по выявлению метастатического поражения лимфатических узлов составляет 97-99%.
Надо отметить, что к срочному морфологическому исследованию могут быть противопоказания. Срочное интраоперационное морфологическое исследование не рекомендуется выполнять при подозрении на внутриэпителиальный рак с ограниченным очагом поражения из-за того, что не останется материала для планового гистологического исследования. Цитологические критерии внутриэпителиального рака только разрабатываются, и цитолог может дать заключение о раке, не указывая, что это Carcinoma in situ. При внутрипротоковых папилломах небольшого размера срочное гистологическое исследование лучше не выполнять, а цитологическое исследование достоверно поможет установить характер процесса.
При срочной морфологической диагностике существенно помогает макроскопическое исследование операционного материала. Опытный морфолог при визуальном исследовании уже может поставить диагноз, но для подтверждения диагноза необходимо микроскопическое исследование. Например, опухолевый узел классической звездчатой формы может быть при трех совершенно разных процессах: при раке, склерозирующем аденозе с центром Семба и липогранулеме. И только микроскопическое исследование позволяет правильно поставить диагноз.
Цитологический метод позволяет в динамике, не травмируя пациента, изучать лечебный патоморфоз при химиолучевой и фотодинамической терапии.
XX столетие названо в медицинских кругах веком цитопатологии. Оценивая возможности цитологического метода, можно сказать, что есть еще возможности его развития в комбинации с другими дисциплинами и методами.
Иммуноцитохимическое исследование нередко является решающим в дифференциальной диагностике новообразований, когда при рутинном исследовании возникают непреодолимые трудности для установления гистогенеза отдельных опухолей, определения источника метастазирования, трактовки первично-множественных поражений.
За последние годы достигнут огромный прогресс в клиническом использовании различных биологических маркеров. В отличие от сывороточных маркеров, клеточные маркеры определяются непосредственно в опухолевых клетках ИЦХ исследованием, в основе которого лежит реакция антиген-антитело. В их числе онкогены, рецепторы эстрогенов и прогестерона, молекулы, опосредующие апоптоз, рецепторы факторов роста и т. д. Все эти показатели позволяют более детально изучить молекулярно-биологические особенности опухолевых клеток, ассоциированные со степенью дифференцировки, способностью к инвазии и метастазированию, чувствительностью к химиотерапии, и, следовательно, с особенностями течения и прогнозом заболевания в каждом конкретном случае.
Специфических маркеров дифференциальной диагностики злокачественных и доброкачественных опухолевых процессов не существует, но на сегодняшний день активно ведутся научные изыскания в решении этой проблемы. Так, равномерное окрашивание герминативных центров лимфоидных фолликулов с использованием антител bcl-2 указывает на фолликулярную лимфосаркому, в то время как негативная реакция свидетельствует о доброкачественном гиперпластическом процессе; реакция с антителами HBME-1 при ИЦХ исследовании опухолей щитовидной железы часто положительная в злокачественных новообразованиях и практически отсутствует при доброкачественных, в дифференциальной диагностике широко применяют галектин-3, экспрессирующийся карциномами щитовидной железы из А-клеток (папиллярный, фолликулярный) с отсутствием экспрессии в фолликулярных аденомах, зобах и нормальной ткани щитовидной железы.
Для установления гистогенеза и дифференциальной диагностики опухолей разработаны и постоянно совершенствуются, схемы C.R.Taylor и R.J. Cote (1994 г.). Разнообразие моноклональных антител, используемых в иммуноцитохимических исследованиях тонкоигольных пунктатов, в каждом конкретном случае позволяет ответить на вопрос, имеет ли данная опухоль эпителиальное происхождение или является саркомой, меланомой, лимфомой. Иммуноцитохимия широко применяется для иммунофенотипирования злокачественных лимфом, без чего, по современным канонам, невозможно начать лечение.
Иммуноцитохимическое исследование помогает в определении источника метастазирования при невыявленном первичном очаге. К сожалению, органоспецифических маркеров не так уж и много. К их числу могут быть отнесены специфический антиген предстательной железы (ПСA), позволяющий идентифицировать метастазы рака простаты более чем в 95% случаев; тиреоглобулин, экспрессирующийся в 92–98% фолликулярного и папиллярного рака щитовидной железы, и кальцитонин, экпрессирующийся в 80% медуллярных раков щитовидной железы В некоторых случаях рак щитовидной железы может экспрессировать и кальцитонин, и тиреоглобулин, что только с помощью иммуноферментной диагностики позволяет диагностировать диморфные А-С-клеточные раки.
Одним из первых показателей, вошедших в практику лечения больных раком молочной железы (РМЖ), и относящихся к категории клеточных маркеров, были рецепторы стероидных гормонов. Рецепторы стероидных гормонов – это белки, специфически и избирательно связывающие соответствующие стероиды после их проникновения в клетку.
По данным ВОЗ (2003 г.), экспрессия рецепторов эстрогенов (РЭ+) и прогестерона (РП+) в инвазивных протоковых раках составляет 70-80%; инвазивный дольковый рак в 70-95% экспрессирует РЭ, в 60-70% -РП, 100% экспрессия РЭ отмечена в инвазивном криброзном, муцинозных опухолях молочной железы. Эдокринная терапия наиболее эффективна у больных с первичными опухолями с высоким уровнем рецепторов стероидов. При метастатических поражениях степень реакции на эндокринную терапию также зависит от наличия РЭ и РП в опухоли: её эффективность составляет около 10–15% при гормонотрицательных опухолях, 27% при опухоли с РЭ+ и РП-, 46% при статусе РЭ- и РП+ и 75% при опухолях, содержащих РЭ+ и РП+. Рецепторположительные опухоли молочной железы имеют более высокую дифференцировку и более благоприятный прогноз.
Необходимо отметить, что рецепторы гормонов в доброкачественных образованиях молочной железы еще мало изучены. Отмечено повышение числа РЭ+ клеток в нормальной ткани молочной железы с увеличением возраста, а также при склерозирующем аденозе, папилломах, фиброаденомах и листовидных опухолях. Коэкспрессия РЭ+/Ki-67+ с разной степенью выраженности и соотношения большей частью выявлялась в патологии, связанной с риском развития РМЖ.
Рецепторы эстрогенов экспрессируются в клетках рака эндометрия, яичников, шейки матки, щитовидной железы, кишечника, нейроэндокринных опухолей, в том числе карциноидов.
Иммуноцитохимическое исследование позволяет на дооперационном этапе установить важнейшие факторы прогноза опухолевого процесса и скоррегировать схемы лечения. Пролиферативная активность многих новообразований оценивается с помощью антител Ki-67 в злокачественных лимфомах, опухолях молочной, предстательной, поджелудочной железы, легких, гипофиза, толстой кишки. Обнаружена связь между значениями индекса пролиферации и степенью гистологической дифференцировки опухоли и клиническим прогнозом при раке эндометрия, яичников, легкого, молочной железы, мочевого пузыря, лимфомах, опухолях нервной системы.
Гиперэкспрессия онкопротеина C-erbB-2(HER2/neu), являющегося рецептором эпидермального фактора роста 2-го типа, придающего клеткам свойство неограниченного деления, служит фактором риска рецидива заболевания для ряда опухолей: рака молочной железы, толстой кишки, лёгкого и др. Экспрессия онкобелка C-erbB-2 при ИГХ исследовании обнаруживается в 15–40% РМЖ. Выявление онкопротеина C-erbB-2, по мнению некоторых авторов, ассоциируется с высокой степенью злокачественности опухоли, отсутствием РЭ и РП, высокой митотической активностью, устойчивостью к химиотерапии и требует назначение герцептина.
Наличие метастазов в лимфатических узлах при опухолевом поражении является главным дискриминирующим прогностическим признаком. С помощью иммуноцитохимического исследования можно выявить единичные циркулирующие кератин-положительные клетки РМЖ в костном мозге и периферической крови. Применение ИЦХ исследования повышает выявляемость микрометастазов в лимфатических узлах на 3,2–24%.
Иммуноцитохимические реакции оцениваются как качественно при уточнении гистогенеза опухоли, наличии метастаза в лимфатическом узле или другом органе, иммунофенотипировании лимфом, так и количественно – при оценке пролиферативной активности, экспрессии рецепторов гормонов в опухоли, онкопротеина С-erbB-2 и т.д. Иммуноцитохимическая реакция может быть ядерной, цитоплазменной и мембранной. Ядерная реакция проявляется интенсивным окрашиванием ядра и бывает при определении РЭ и РП, Ki–67, PCNA, p53 и т.д. Цитоплазменная реакция характеризуется диффузным окрашиванием цитоплазмы или отложением гранул в виде грубых пятен и зерен. Цитоплазменное окрашивание дают хромогранин, синаптофизин, белок S-100, виментин, десмин, тиреоглобулин, кальцитонин, цитокератины, bcl-2 и т.д. Оценка этой реакции требует большой осторожности и контроля, так как фоновое окрашивание цитоплазмы клеток может быть принято за истинную реакцию. Мембранное окрашивание наблюдается при проведении реакции с онкопротеином C-erbB-2 и ЭМА (эпителиальным мембранным антигеном). Окрашивание в таких случаях только цитоплазмы не должно учитываться как экспрессия антигена. Маркер крупноклеточной анаплазированной лимфомы CD-30 может экспрессироваться как в цитоплазме, так и на мембране клетки.
Для количественной оценки экспрессии маркера Мс. Carthy и соавторы разработали систему подсчета Histo score (H.S.). Система подсчета включает интенсивность иммуноцитохимической окраски, оцениваемую по 4-балльной шкале, и долю окрашенных клеток и представляет собой сумму произведений процентов, отражающих долю клеток с различной интенсивностью окраски на балл, соответствующий интенсивности реакции. Интенсивность окраски в баллах: 0 – нет окрашивания, 1 – слабое окрашивание, 2 – умеренное окрашивание, 3 – сильное, 4 – очень сильное окрашивание. Формула подсчета:
Histochemical score = ∑ P(i)×i (гистосчет),
где i – интенсивность окрашивания, выраженная в баллах от 0 – 4,
Р(i) – процент клеток, окрашенных с разной интенсивностью.
Максимальное количество Histo score соответственно должно быть 400. Подсчет проводится в трех когортах по 100 опухолевых клеток в различных полях зрения (объектив х 40).
В практической работе допустимо использование полуколичественной оценки. Реакция считается отрицательной при полном отсутствии или экспрессии антигена менее 5%–10% опухолевых клеток, слабоположительной – от 5%–10% до 24% клеток, умеренно положительной – в 25%–75%, выраженной – более чем в 75% клеток. При оценке иммуноферментной реакции принимают во внимание интенсивность и полноту окрашивания цитолеммы клеток в центре опухолевого очага. Так, яркая, мембранная, беспрерывная по контуру клетки реакция обозначает выраженную экспрессию белка С-erbB-2 (+++), что в 95% случаев подтверждается амплификацией гена С-erbB-2, выявляемой с помощью FISH (флуоресцентной гибридизацией in situ).
Сопоставляя данные иммуноцитохимических исследований различных опухолей с целью уточнения гистогенетической принадлежности и результатов послеоперационных морфологических заключений, получены следующие результаты: 89% совпадений при анализе опухолей щитовидной железы, 83% при уточнении гистогенеза первичной опухоли и метастазах в лимфатических узлах, 89% – при опухолях мягких тканей и кожи и 100% – при исследовании биологических жидкостей. При определении гормонального статуса РМЖ процент совпадения ИЦХ и ИГХ исследований составляет 88,3%, при исследовании пролиферативной активности – 83%, при определении онкопротеина C-erbB-2 – 93,2%.
При сравнении возможностей ИЦХ исследования при выполнении пункционной биопсии и ИГХ исследования при трепанобиопсии преимущества ИЦХ, на наш взгляд, несомненны. Пункционная биопсия – более простая процедура, не сопровождается такими осложнениями, как воспаление, кровотечение, и позволяет получить полноценный клеточный материал. При неудачной пункции и попадании в некроз, строму опухоли, окружающие ткани можно практически безболезненно повторить процедуру. Кроме того, отсутствует потеря и маскировка антигенов при проводке и депарафинизации материала с использованием агрессивных химических реагентов.
Использование иммуноцитохимического исследования позволяет расширить возможности морфологических методов и на дооперационном этапе уточнить гистогенез, диагностировать первично-множественные поражения, степень распространения и оценить некоторые показатели прогноза и чувствительность опухоли к химиогормонотерапии.
На современном этапе развития в цитологии используются методы молекулярной и генной диагностики: гибридизация in situ, Southern Blotting, Nothern Blooting, Western Blotting, DNK Microarray и т.д) В научной и практической работе цитологи применяют проточную цитофотометрию.
Одним из путей совершенствования цитологического метода исследования является применение морфометрии, что позволяет получать объективные количественные параметры. Например, при обработке на компьютере выделены наиболее информативные морфометрические признаки, относящиеся к параметрам ядра с использованием основных диагностических морфометрических признаков: площадь, периметр, оптической плотности, коэффициент поляризации ядер, числа ядрышек, их площади и периметра. Разработаны объективные морфометрические признаки различных степеней дисплазии при дисгормонально-гиперпластических процессах молочной железы, шейки матки, что уменьшило долю субъективизма в определении различных степеней дисплазии.
Развиваются новые методы микроскопии: фазово-контрастная, флюоресцентная, конфокальная и т.д. Создание компьютерных систем обучения, развитие метода телеконсультации также предъявляют новые требования и, несомненно, будут способствовать развитию и совершенствованию цитологического метода диагностики.
Волченко Надежда Николаевна
д.м.н., профессор, руководитель отделения
онкоцитологии МНИОИ им.П.А.Герцена
симптомы, причины, лечение и диагноститка
Одной из опасных патологий женских половых органов считается атипическая гиперплазия вульвы. Заболевание связано с изменением структуры верхних слоев кожи. Клетки эпителия отличаются необычной формой и размерами. В пораженных участках наблюдается активный процесс их деления. Коварство данного заболевания заключается в том, что вульва это объединение нескольких органов половой системы женщины. Диагностировать проблемы больших и малых половых губ, клитора, лобка, промежности, влагалища и девственной плевы не всегда легко и просто. Бывает стабильное состояние остается без изменений на протяжении длительного периода времени. Имеются случаи, когда наступает ухудшение. Рак вульвы может возникнуть незаметно. Поэтому весьма важно обнаружить гиперплазию вульвы своевременно и выбрать правильный метод лечения заболевания.
Формы и стадии патологии
Согласно гинекологическим обследованиям гиперплазия вульвы может быть представлена двумя формами: локальной и диффузной. В зависимости от степени поражения половых органов женщины различают несколько стадий патологии.
- Первая стадия. Изменения эпителиального слоя выражены в легкой форме. Площадь поражения составляет 1/3 слизистой оболочки половых органов.
- Вторая стадия. Участок пораженного эпителия вульвы составляет две трети.
- Третья стадия. Обычно патология представлена тяжелой формой заболевания. Иногда медики считают заболевание относящимся к онкологии (инвазивный рак). Хотя атипичных клеток нет, и их интенсивного размножения за счет деления не наблюдается.
Как предотвратить гиперплазию вульвы
Патологическое изменение структуры эпителия вульвы констатируется медицинскими светилами как опасное заболевание. Интенсивное прогрессирование болезни может вызвать онкологию. Значимость своевременной диагностики не подлежит даже обсуждению. Ярко выраженной симптоматики у патологии нет, поэтому только осмотры гинеколога способны выявить происходящие изменения. Если гиперплазию вульвы не лечить, последствия могут быть очень печальными.
Только ранняя диагностика способна дать пациентке благоприятный прогноз на будущее. Правильно проведенное лечение, наблюдение у гинеколога, прохождение реабилитационного курса, исключение чрезмерной физической нагрузки, воздержание от половых контактов способны не допустить появления рецидива заболевания.
Пациенток, перенесших гиперплазию вульвы, ставят на диспансерный учет. Они находятся под наблюдением специалиста довольно продолжительный период времени. Если была диагностирована третья стадия заболевания, пациентка наблюдается у онколога. Среди важных профилактических мер, медики выделяют:
- организацию полноценного питания женщины;
- своевременную санацию возникающих очагов инфекции;
- применение барьерной контрацепции;
- ограниченное количество половых партнеров.
Чем вызвана патология
По утверждению медиков главным провокатором этого серьезного заболевания является вирус папилломы человека (ВПЧ). Особую опасность представляют его разновидности под номерами 16 и 18. Именно они имеют онкогенную природу.
Довольно часто патология возникает в связи с развитием воспалительных процессов вульвы (вульвит, кольпит, бартолинит). В большинстве случаев, если женщина страдает от нарушений иммунной и эндокринной систем, вероятность заболеть гиперплазией вульвы очень большая. Метаплазия плоского эпителия, наличие дистрофических процессов вульвы могут привести к ее гиперплазии.
Проводимые исследования в гинекологических клиниках доказывают, что у многих пациенток заболевание возникает на фоне гиперплазии шейки матки. Эти две патологии диагностируются, как правило, одновременно. Возникновение дисплазии вульвы обусловлено такими факторами риска, как ранняя половая жизнь, низкий иммунитет, злоупотребление курением, алкоголем и частая сменяемость половых партнеров. Изменение баланса гормонов в организме женщины может также вызвать дисплазию вульвы во время климакса.
Как проявляется гиперплазия вульвы
Сложность диагностики патологии заключается в отсутствии ярко выраженной клинической картины. В этом то и суть коварства болезни. Ее может обнаружить на ранней стадии только врач-гинеколог во время осмотра пациентки. Иногда на половых органах или в области заднего прохода появляются кондиломы. Это может быть явным доказательством наличия у пациентки гиперплазии вульвы.
Когда болезнь начинает прогрессировать, переходит из первой стадии во вторую, женщину начинает беспокоить постоянный зуд на наружных половых органах. В области ануса и влагалища появляются болезненные ощущения. В некоторых случаях врач диагностирует кольпит или вагинит. Бывает, что в организм женщины попадает инфекция, появляются отеки и выделения. Отсутствие лечения порой приводит к дисплазии вульвы.
Как выявляют патологию
Гинекологический осмотр пациентки на кресле способен выявить большинство случаев заболевания. Ведь явных симптомов, которые может обнаружить сама женщина, просто нет.
Помимо визуального осмотра среди диагностических методов выделяют:
- кольпоскопию, процедуру, предусматривающую обследование половых органов пациентки с помощью кольпоскопа;
- проведение теста Шиллера с обработкой влагалищного свода и шейки матки специальным раствором, позволяющим заметить патологические изменения;
- исследование на ВПЧ;
- цитологическое исследование соскобов из пораженных участков вульвы.
Обязательно проводится обследование на наличие онкологии вульвы. Участниками диагностических процедур являются, помимо гинеколога, онколог и венеролог.
Методы лечения дисплазии вульвы
Каждый обнаруженный случай патологии лечится строго индивидуально. Учитывая тот факт, что патология вульвы классифицируется как хроническое заболевание, ее лечение предполагает комплексный подход. Если болезнь спровоцирована ВПЧ, пациентке показаны противовирусные препараты.
Консервативная форма лечения гиперплазии вульвы.
Метод ставит своей основной целью добиться ремиссии патологии и постепенного устранения заболевания. Данная методика основывается на использовании:
- противовирусных лекарств;
- седативных и десенсибилизирующих препаратов;
- гормональных и общеукрепляющих медикаментозных средств;
При обнаружении лейкоплакии с утолщением эпителия шейки матки консервативное лечение незамедлительно прекращается. Результативности и длительного эффекта способ не принесет.
Оперативное вмешательство.
Хирургический метод показан, если у пациентки обнаружена тяжелая форма или третья стадия заболевания. Врачи обязательно учитывают возраст больной. Нерожавшей женщине или юной девушке при обнаружении легкой формы патологии вульвы предлагают лечение лазером, жидким азотом или методом использования радиоволн. Так можно удалить пораженные участки небольших объемов.
Гинекологи прибегают к оперативному вмешательству в следующих случаях.
- Возраст пациентки соответствует периоду менопаузы.
- Анамнез содержит рецидив болезни.
- Площадь пораженных участков достаточно большая.
Операции связаны с повреждением половых органов. После их проведения пациенткам показано пластическая коррекция.
Фотодинамическая терапия. Метод предусматривает накопление в клетках вульвы специального красящего вещества (фотосенсибилизированный краситель) с последующим его уничтожением. Световая волна удаляет окрашенные клетки.
Любой вид лечения уместен только в условиях стационара. Заключительным его этапом является цитологическое исследование. Делается микроскопический анализ биоматериала, чтобы врач мог удостовериться, насколько эффективным оказался метод его лечения.
Контуры патологии — Дисплазия
Полость рта и ротоглотка
Потенциально злокачественные и дисплазия
Дисплазия
Тема завершена: 1 ноября 2013 г.
Незначительные изменения: 13 октября 2020 г.
Copyright : 2004-2021.com, Pathology
PubMed Search : Дисплазия [TI] полости рта [TIAB]
Просмотры страниц в 2020 году: 11,395
Количество просмотров страниц в 2021 году по настоящее время: 4,114
Цитируйте эту страницу: Honarpisheh H, Haberland C.Дисплазия. Сайт PathologyOutlines.com. https://www.pathologyoutlines.com/topic/oralcavitydysplasia.html. По состоянию на 25 апреля 2021 г.
Определение / общее
- Дисплазия, предраковое состояние, относится к аномальному росту эпителия, характеризующемуся целым спектром цитологических, созревательных и архитектурных изменений.
- Карцинома in situ означает, что аномальные изменения наблюдаются по всей толщине эпителия, от базального слоя клеток до поверхности.
- Вульва и шейка матки: дисплазия средней и тяжелой степени несут повышенный риск последующего прогрессирования до инвазивной плоскоклеточной карциномы
- Полость рта: связь дисплазии с инвазивной карциномой менее четко определена; при дисплазии средней степени вероятность злокачественной трансформации составляет 4-11%; при тяжелой дисплазии 20-35%
Терминология
- Термины легкая, умеренная и тяжелая дисплазия применяются, если архитектурная и цитологическая атипия (см. Микроописание) затрагивает <1/3, от 1/3 до 2/3 и> 2/3 эпителия соответственно
- Карцинома in situ (CIS): цитологическая или архитектурная атипия на всю толщину без инвазии опухолевых кератиноцитов через базальную мембрану в поддерживающую соединительную ткань
Эпидемиология
- Полость рта CIS имеет такое же распределение по возрасту и полу, что и инвазивная плоскоклеточная карцинома полости рта (SCC) — мужчины пятого-восьмого десятилетия жизни, которые курят и пьют
- Риск SCC полости рта увеличивается с возрастом
- Пристрастие к мужскому полу (3: 1), исторически связанное с более широким употреблением / злоупотреблением табаком и алкоголем мужчинами
- Вирус папилломы человека (ВПЧ) вовлечен в этиологию ПКР полости рта и основания языка / глотки, но не всегда обнаруживался при дисплазии / CIS
Участки
- Наиболее частыми местами возникновения в полости рта в порядке убывания частоты являются язык (заднее — латеральное и вентральное)> дно рта> мягкое небо> десна> слизистая оболочка щеки> слизистая оболочка губ> твердое небо
Патофизиология
- Умеренная и тяжелая дисплазия прогрессирует до инвазивной плоскоклеточной карциномы за счет накопления гистологических и молекулярных дефектов
- Канцерогенез HPV влияет на клеточный контроль транскрипции и клеточного цикла через вирусные онкопротеины E6 и E7, которые связываются с белками-супрессорами опухоли p53 и pRb (продукт гена ретинобластомы) и инактивируют их, а также активируют теломеразу.
Этиология
- Этологические факторы, подобные SCC
- Образ жизни, связанный с курением и употреблением алкоголя, является наиболее важным фактором риска
- ВПЧ высокого риска типов 16 и 18 и, что гораздо реже, ВПЧ низкого риска типов 6 и 11 были обнаружены в карциномах полости рта (Mod Pathol 2006; 19: 1310)
- ВПЧ16 + опухоли полости рта и ротоглотки, по-видимому, представляют собой отдельный болезненный процесс с более благоприятной выживаемостью
- История SCC головы и шеи у родственника первой степени является фактором риска
- К другим факторам риска относятся:
- К факторам питания относятся, например, синдром Пламмера-Винсона (хронический дефицит железа) и дефицит витамина А.
- Орех арека (орех бетель)
- Употребление бездымного табака: обычно происходит на месте хранения табака.
- Состояния с ослабленным иммунитетом: иммуносупрессивная терапия злокачественных новообразований или трансплантация органов
- СПИД
- Факторы окружающей среды включают воздействие фенольных агентов (рабочие, работающие с деревом)
- Сифилис: третичный сифилис увеличивает риск SCC спинного языка
- Долгосрочный пегилированный липосомальный доксорубицин для лечения рака яичников (Онколог 2012; 17: 1541)
Клинические особенности
- Небольшие поражения могут протекать бессимптомно или присутствовать с минимальными признаками и нечеткими симптомами
- Более крупные поражения, в зависимости от размера и расположения, могут проявляться изъязвлением, болью (местной и отраженной), кровотечением; также затрудненное глотание, речь, жевание, открытие рта
- Плоская слизистая оболочка полости рта реагирует на хронические травмы или канцерогенные раздражители гиперплазией или атрофией, проявляясь лейкоплакией или эритроплакией соответственно:
- Лейкоплакия или «белое пятно»: представляет собой доброкачественный гиперкератоз в 80% случаев, дисплазию в 12%, карциному in situ (CIS) в 3% и инвазивные карциномы в 5% случаев.
- Эритроплакия или «красное пятно»: представляет собой особо опасное поражение слизистой оболочки полости рта, представляющее собой карциному в 51% случаев, тяжелую дисплазию или CIS в 40% случаев и дисплазию от легкой до умеренной в 9% случаев.
- Эритролейкоплакия или пятнистая лейкоплакия: сочетание лейкоплакии и эритроплакии, также имеет более высокую частоту выраженной дисплазии при биопсии
- Эти поражения могут быть экзофитными (папиллярная, грибовидная масса) или эндофитными (изъязвленная поверхность с уплотнением мягких тканей, обычно скрученные границы) (Int J Clin Oncol 2011; 16: 5)
Диагноз
- Любой стойкий длительно незаживающие поражения полости рта или глотки следует провести биопсию в течение одного месяца с момента их появления.
Факторы прогноза
- Распространение и распространение диспластических клеток с поверхностного эпителия вниз по выводным слюнным протокам без признаков стромальной инвазии сопровождается той же частотой рецидивов, что и при инвазивной плоскоклеточной карциноме; это может частично объяснить рецидивы на дне рта после поверхностного иссечения или лазерной абляции.
Лечение
- Устранение таких факторов риска, как употребление алкоголя и курение
- Удаление дисплазии эпителия полости рта с помощью обычного хирургического иссечения, лазера и криохирургии
- Рецидивы не редкость и могут потребовать хирургического вмешательства.
Клинические изображения
Изображения, размещенные на других серверах:
Лейкоплакия слизистой оболочки рта
Микроскопическое (гистологическое) описание
- Архитектурные особенности дисплазии включают:
- Нерегулярное расслоение эпителия, потеря нормального расслоения и полярности, каплевидные перегородки
- Митозы в среднем и верхнем эпителии, преждевременное ороговение отдельных клеток (дискератоз), гиперплазия и анаплазия базальных клеток, кератиновые жемчужины в сетчатых штифтах
- Цитологические особенности аналогичны тем, которые используются для других эпителий: увеличение ядер и плеоморфизм, повышенное соотношение ядер и цитоплазмы, выступающие ядрышки, гиперхромазия
Молекулярное / цитогенетическое описание
- Плоскоклеточная интраэпителиальная неоплазия имеет общие молекулярные и генетические изменения с плоскоклеточным раком
- Потеря гетерозиготности в 3p, 9p и 17p связана с дисплазией
- Повышенная экспрессия p53 при умеренной и тяжелой дисплазии и карциноме in situ
- «Золотой стандарт» для оценки дисплазии — все еще рутинная гистология.
Дифференциальный диагноз
- Хроническая травматическая язва : необходимо определить очаговый источник травмы (сломанный зуб, острый край зубного протеза)
- Фрикционный кератоз , связанный с хронической механической травмой слизистой оболочки полости рта
- Красный плоский лишай
- Хроническое заболевание слизистых оболочек с иммуноопосредованной этиологией, обычно женщины (2/3) в возрасте от 30 до 60 лет
- Клинически поражения двусторонние, симметричные и неизолированные.
- Имеют полосообразный лимфоцитарный инфильтрат непосредственно под эпителием, демонстрирующий частичное растворение базальной мембраны и очаговую миграцию лимфоцитов в эпителий; дисплазии эпителия не наблюдается
- Кандидоз полости рта: гиперпластический кандидоз
- Пиогенная гранулема
- Реактивная масса разрастающейся грануляционной ткани в виде красной, изъязвленной, быстро растущей круглой массы, обычно на десне, языке или слизистой оболочке щеки.
- Встречается во втором-пятом десятилетии, чаще у женщин во время беременности и, вероятно, вызвано эндокринным дисбалансом
- Нюхательные щипцы / кератоз табачных мешочков:
- Белый кератотический налет, связанный с бездымными табачными изделиями
- Обычно расположены только в зонах прямого контакта с нюхательным или жевательным табаком (слизистая оболочка щек, дно рта)
- Почти всегда полностью обратимо, когда больной перестает употреблять табак
Дополнительные ссылки
- Миллс: Диагностическая хирургическая патология Штернберга, 5-е издание, 2009 г., Флинт: Отоларингология Каммингса — хирургия головы и шеи, 5-е издание, 2010 г., Калонье: Патология кожи Макки, 4-е издание, 2011 г., Woo: Патология полости рта — Исчерпывающий атлас и текст, 1-е издание, 2012 г., Невилл: Патология полости рта и челюстно-лицевой области, 3-е издание, 2008 г.
Плоскоклеточный рак верхних отделов пищеварительного тракта: дисплазия и отдельные варианты
Криссман Дж. Д., Зарбо Р. Дж..Дисплазия, in situ карцинома и прогрессирование до инвазивной плоскоклеточной карциномы верхних отделов пищеварительного тракта. Am J Surg Pathol 1989; 13 (приложение 1): 5–16.
PubMed Google Scholar
Криссман Д.Д., Гнепп Д.Р., Гудман М.Л. и др. . Преинвазивные поражения верхних дыхательных путей. Гистологические определения и клинические значения (симпозиум). Патол Анну 1987; 22 : 311–353.
PubMed Google Scholar
Гейл Н., Хилле Дж., Иордания R и др. , Поражения предшественников. Дисплазия In: El-Naggar AK, Grandis JR, Slootweg PJ et al (eds). Классификация опухолей головы и шеи ВОЗ , 4-е изд. Международное агентство по изучению рака (IARC): Лион, Франция, 2017 г. (в печати).
Nucci MR, Lee KR, Crum CP Опухоли женских половых путей В: Fletcher CDM (ed.). Диагностическая гистопатология опухолей 4-е изд. Elsevier Saunders: Philadelphia, 2013, стр. 814–871.
Google Scholar
Friedmann I, Ferlito A Предшественники плоскоклеточного рака In: Ferlito A (ed.). Новообразования гортани . Черчилль Ливингстон: Эдинбург, 1993, стр. 97–111.
Google Scholar
Гейл Н., Камбич В., Майклс Л. и др. .Люблянская классификация: практическая стратегия диагностики предраковых поражений гортани. Adv Анат Патол 2000; 4 : 240–251.
Артикул Google Scholar
Гейл Н., Благус Р., Эль-Мофти СК и др. . Оценка новой системы оценок для плоскоклеточных интраэпителиальных поражений гортани — предложенной унифицированной классификации. Гистопатология 2014; 65 : 456–464.
Артикул Google Scholar
Бастурк О., Хонг С.М., Вуд ЛД и др. .Пересмотренная система классификации и рекомендации Балтиморского консенсусного совещания для предшественников новообразований в поджелудочной железе. Am J Surg Pathol 2015; 39 : 1730–1741.
Артикул Google Scholar
Crissman JD. Кератоз гортани и последующий рак. Head Neck Surg 1979; 1 : 386–391.
CAS Статья Google Scholar
McGavran MH, Bauer WC, Ogura JH.Изолированный кератоз гортани: его связь с карциномой гортани на основании клинико-патологического исследования 87 последовательных случаев с долгосрочным наблюдением. Ларингоскоп 1960; 70 : 932–951.
Артикул Google Scholar
Норрис К.М., Пил, штат Арканзас. Кератоз гортани. Дж Ларингол Отол 1963 г .; 77 : 635–647.
CAS Статья Google Scholar
Габриэль К.Э., Джонс Д.Г.Гиперкератоз гортани. Дж Ларингол Отол 1973; 87 : 129–134.
CAS Статья Google Scholar
Генри Р.С. Трансформация лейкоплакии гортани в рак. Дж Ларингол Отол 1979; 93 : 447–459.
CAS Статья Google Scholar
Barnes L Болезни гортани, гортани и пищевода In: Barnes L (ed.). Хирургическая патология головы и шеи . Марсель Деккер: Нью-Йорк, 2001, стр. 127–237.
Google Scholar
Woo S-B, Cashman EC, Lerman MA. Оральная интраэпителиальная неоплазия, ассоциированная с вирусом папилломы человека. Mod Pathol 2013; 26 : 1288–1297.
CAS Статья Google Scholar
McCord C, Xu J, Xu W et al .Связь инфицирования вирусом папилломы человека высокого риска с дисплазией эпителия полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol 2013; 115 : 549.
Артикул Google Scholar
Чернок Р.Д., Нуссенбаум Б., Торстад В.Л. и др. . Обширная связанная с ВПЧ карцинома in situ верхних отделов пищеварительного тракта с гистологическими признаками, не вызывающими ороговения. Голова Шея Патол 2014; 8 : 322–328.
Артикул Google Scholar
Миллер А. Х., Фишер HR. Подсказки к истории жизни рака гортани in-situ. Ларингоскоп 1971; 81 : 1475–1480.
CAS Статья Google Scholar
Криссман Дж. Д., Зарбо Р. Дж., Дроздович С. и др. . Карцинома in situ и микроинвазивный плоскоклеточный рак голосовой щели гортани. Arch Otolaryngol Head Neck Surg 1988; 114 : 299–307.
CAS Статья Google Scholar
Gillis TM, Incze MS, Vaughan CW et al . Естественный анамнез и лечение кератоза, атипии, карциномы in situ и микроинвазивного рака гортани. Am J Surg 1983; 146 : 512–516.
CAS Статья Google Scholar
Panwar A, Lindau R 3rd, Wieland A.Лечение предраковых поражений гортани. Expert Rev Anticancer Ther 2013; 13 : 1045–1051.
CAS Статья Google Scholar
DeSanto LW. Рак надгортанной гортани: обзор 260 больных. Otolaryngol Head Neck Surg 1985; 93 : 705–711.
CAS Статья Google Scholar
Криссман Дж. Д., Кессис Т., Шах К. В. и др. .Плоскоклеточная папиллярная неоплазия верхних отделов пищеварительного тракта. Хум Патол 1988; 19 : 1387–1396.
CAS Статья Google Scholar
Thompson LDR, Wenig BM, Heffner DK et al . Экзофитный и папиллярно-плоскоклеточный рак гортани: клинико-патологическая серия из 104 случаев. Otolaryngol Head Neck Surg 1999; 120 : 718–724.
CAS Статья Google Scholar
Suarez PA, Adler-Storthz K, Luna MA et al .Папиллярный плоскоклеточный рак верхних отделов пищеварительного тракта: клинико-патологическое и молекулярное исследование. Голова Шея 2000; 22 : 360–368.
CAS Статья Google Scholar
Джо В.Й., Mills SE, Stoler MH и др. . Папиллярный плоскоклеточный рак головы и шеи: частая связь с инфекцией вируса папилломы человека и инвазивной карциномой. Am J Surg Pathol 2009; 33 : 1720–1724.
Артикул Google Scholar
Рассел Дж. О., Хошар А. П., Шарпф Дж. Папиллярный плоскоклеточный рак головы и шеи: клинико-патологический ряд. Am J Отоларингол. 2011; 32 : 557–563.
Артикул Google Scholar
Эль-Мофти СК. Варианты плоскоклеточного рака головы и шеи, связанные с ВПЧ. Голова Шея Патол 2012; 6 (Дополнение 1): S55 – S62.
Артикул Google Scholar
Мехрад М., Карпентер Д.Х., Чернок РД и др. . Папиллярный плоскоклеточный рак головы и шеи: клинико-патологические и молекулярные особенности с особым упором на вирус папилломы человека. Am J Surg Pathol 2013; 37 : 1349–1356.
Артикул Google Scholar
Ян Ч., Хуанг СС, Ко МТ и др. .Папилломавирусная инфекция и плоскоклеточный рак в области головы и шеи. Tumor Biol 2013; 34 : 301–307.
Артикул Google Scholar
Дин Й, Ма Л., Ши Л. и др. . Папиллярный плоскоклеточный рак слизистой оболочки полости рта: клинико-патологическое и иммуногистохимическое исследование 12 случаев и обзор литературы. Ann Diagn Pathol 2013; 17 : 18–21.
Артикул Google Scholar
Фитцпатрик С.Г., Нойман А.Н., Коэн Д.М. и др. . Папиллярный вариант плоскоклеточного рака десны, возникающий на десне: зарегистрирован 61 случай из более крупной серии плоскоклеточного рака десны. Голова Шея Патол 2013; 7 : 320–326.
Артикул Google Scholar
Ackerman LV.Веррукозный рак полости рта. Хирургия 1948; 23 : 670–678.
CAS PubMed Google Scholar
Батсакис Дж. Г., Хибелс Р., Криссман Дж. Д. и др. . Патология опухолей головы и шеи: Веррукозная карцинома, часть 15. Head Neck Surg 1982; 5 : 29–38.
CAS Статья Google Scholar
Ферлито А, Рехер Дж.Опухоль Акермана (бородавчатая карцинома) гортани. Клинико-патологическое исследование 77 случаев. Cancer 1980; 46 : 1617–1630.
CAS Статья Google Scholar
Medina JE, Dichtel W, Luna MA. Веррукозно-плоскоклеточный рак полости рта. Клинико-патологическое исследование 104 случаев. Арка Отоларингол 1984; 110 : 437–440.
CAS Статья Google Scholar
Walvekar RR, Chaukar DA, Deshpande MS и др. .Веррукозная карцинома полости рта: клинико-патологическое исследование 101 случая. Oral Oncol 2009; 45 : 47–51.
Артикул Google Scholar
дель Пино М., Бликер М.С., Квинт WG и др. . Комплексный анализ распространенности вируса папилломы человека и потенциальной роли типов с низким уровнем риска в бородавчатой карциноме. Mod Pathol 2012; 25 : 1354–1363.
CAS Статья Google Scholar
Одар К., Коцян Б.Дж., Хошняк Л. и др. .Веррукозная карцинома головы и шеи — не опухоль, связанная с вирусом папилломы человека? J Cell Mol Med 2014; 18 : 635–645.
CAS Статья Google Scholar
Дайсон Н., Хоули П.М., Мюнгер К и др. . Онкобелок E7 вируса папилломы человека-16 способен связывать продукт гена ретинобластомы. Science 1989; 243 : 934–937.
CAS Статья Google Scholar
Shear M, Pindborg JJ.Веррукозная гиперплазия слизистой оболочки рта. Cancer 1980; 46 : 1855–1862.
CAS Статья Google Scholar
Хансен Л.С., Олсон Дж. А., Сильверман С. Пролиферативная веррукозная лейкоплакия. Долгосрочное исследование тридцати пациентов. Oral Surg Oral Med Oral Pathol 1985; 60 : 285–298.
CAS Статья Google Scholar
Муррах В.А., Батсакис Дж.Пролиферативная бородавчатая лейкоплакия и бородавчатая гиперплазия. Ann Otol Rhinol Laryngol 1994; 103 : 660–663.
CAS Статья Google Scholar
Gillenwater AM, Vigneswaran N, Fatani H и др. . Пролиферативная веррукозная лейкоплакия (ПВЛ): обзор неуловимого патологического объекта !. Adv Анат Патол 2013; 20 : 416–423.
Артикул Google Scholar
Батсакис Дж. Г., Суарес П., Эль-Наггар АК.Пролиферативная веррукозная лейкоплакия и связанные с ней поражения. Oral Oncol 1999; 35 : 354–359.
CAS Статья Google Scholar
Пател К.Р., Чернок Р.Д., Чжан Т.Р. и др. . Веррукозные карциномы головы и шеи, в том числе связанные с плоскоклеточным раком, не имеют транскрипционно активного вируса папилломы человека высокого риска. Хум Патол 2013; 44 : 2385–2392.
CAS Статья Google Scholar
Левентон GS, Эванс Х.Л. Саркоматоидный плоскоклеточный рак слизистых оболочек головы и шеи: клинико-патологическое исследование 20 случаев. Cancer 1981; 48 : 994–1003.
CAS Статья Google Scholar
Thompson LD, Wieneke JA, Miettinen M et al . Веретено-клеточная (саркоматоидная) карцинома гортани: клинико-патологическое исследование 187 случаев. Am J Surg Pathol 2002; 26 : 153–170.
Артикул Google Scholar
Вишванатан С., Рахман К., Паллави С. и др. . Саркоматоидная (веретено-клеточная) карцинома области слизистой оболочки головы и шеи: клинико-патологический обзор 103 случаев из специализированного онкологического центра. Голова Шея Патол 2010; 4 : 265–275.
Артикул Google Scholar
Джерри Д., Фрич В.А., Ленч Е.Дж.Веретено-клеточная карцинома верхнего пищеварительного тракта: анализ 341 случая по сравнению с обычной плоскоклеточной карциномой. Анн Отол Ринол Ларингол 2014; 123 : 576–583.
Артикул Google Scholar
Лассер К.Х., Наим Ф., Хиггинс Дж. и др. . «Псевдосаркома» гортани. Am J Surg Pathol 1979; 3 : 397–404.
CAS Статья Google Scholar
Ларсен ЭТ, Дугган Массачусетс, Иноуэ М.Отсутствие ДНК вируса папилломы человека в плоскоклеточных карциномах веретена ротоглотки. Am J Clin Pathol 1994; 101 : 514–518.
CAS Статья Google Scholar
Watson RF, Chernock RD, Wang X и др. . Веретено-клеточные карциномы головы и шеи редко содержат транскрипционно-активный вирус папилломы человека. Голова Шея Патол 2013; 7 : 250–257.
CAS Статья Google Scholar
Ансари-Лари, Массачусетс, Хоке, Миссури, Калифано, J и др. .Иммуногистохимические паттерны экспрессии р53 при саркоматоидных карциномах верхних дыхательных путей. Am J Surg Pathol 2002; 26 : 1024–1031.
Артикул Google Scholar
Мариони Дж., Альтавилла Дж., Марино Ф. и др. . Плоскоклеточный рак гортани с остеосаркомоподобной стромальной метаплазией. Acta Otolaryngol 2004; 124 : 870–873.
Артикул Google Scholar
Roy S, Purgina B, Seethala RR.Веретено-клеточная карцинома гортани с рабдомиобластным гетерологичным элементом: редкая форма дивергентной дифференцировки. Голова Шея Патол 2013; 7 : 263–267.
Артикул Google Scholar
Эллис Дж., Ланглосс Дж. М., Энцингер FM. Совместная экспрессия кератина и десмина при карциносаркоме с поражением альвеолярного гребня верхней челюсти. Oral Surg Oral Med Oral Pathol 1985; 60 : 410–416.
CAS Статья Google Scholar
Зарбо Р.Дж., Криссман Д.Д., Венкат Х. и др. .Веретено-клеточная карцинома слизистой оболочки пищеварительного тракта: иммуногистологическое и ультраструктурное исследование 18 двухфазных опухолей и сравнение с семью монофазными веретено-клеточными опухолями. Am J Surg Pathol 1986; 10 : 741–753.
CAS Статья Google Scholar
Эллис Г.Л., Ланглосс Дж.М., Хеффнер Д.К. и др. . Веретено-клеточная карцинома пищеварительного тракта: иммуногистохимический анализ 21 случая. Am J Surg Pathol 1987; 11 : 335–342.
CAS Статья Google Scholar
Офир Д, Маршак Г, Чернобыльский Б. Отличительная иммуногистохимическая маркировка эпителиальных и мезенхимальных элементов при псевдосаркоме гортани. Ларингоскоп 1987; 97 : 490–494.
CAS PubMed Google Scholar
Льюис Дж. Э., Олсен К. Д., Себо Т. Дж.Веретено-клеточная карцинома гортани: обзор 26 случаев, включая содержание ДНК и иммуногистохимию. Hum Pathol 1997; 28 : 664–673.
CAS Статья Google Scholar
Bishop JA, Montgomery EA, Westra WH. Использование иммуногистохимии p40 и p63 и тестирования вируса папилломы человека в качестве вспомогательных инструментов для распознавания саркоматоидной карциномы головы и шеи и ее отличия от доброкачественных и злокачественных мезенхимальных процессов. Am J Surg Pathol 2014; 38 : 257–264.
Артикул Google Scholar
Nakleh RE, Zarbo RJ, Ewing S и др. . Миогенная дифференцировка при веретеноклеточной (саркоматоидной) карциноме верхних отделов пищеварительного тракта. Appl. Immunohistochem 1993; 1 : 58–68.
Google Scholar
Wenig BM, Devaney K, Bisceglia M.Воспалительные миофибробластные псевдоопухоли гортани: клинико-патологический отчет о восьми случаях, включая иммуногистохимический и ультраструктурный анализ. Cancer 1995; 76 : 2217–2229.
CAS Статья Google Scholar
Лоуренс Б., Перес-Атайде А., Хиббард МК и др. . Онкогены TPM3-ALK и TPM4-ALK при воспалительной миофибробластической опухоли. Am J Pathol 2000; 157 : 377–384.
CAS Статья Google Scholar
Coffin CM, Patel A, Perkins S и др. . Экспрессия ALK и p80 и хромосомные перестройки с участием 2p23 в воспалительной миофибробластической опухоли (IMT). Mod Pathol 2001; 14 : 569–576.
CAS Статья Google Scholar
Wain SL, Kier R, Vollmer RT и др. .Базалоидно-плоскоклеточный рак языка, гортани и гортани. Хум Патол 1986; 17 : 1158–1166.
CAS Статья Google Scholar
Бэнкс Э.Р., Фриерсон Х.Ф. младший, Миллс SE и др. . Базалоидный плоскоклеточный рак головы и шеи: клинико-патологическое и иммуногистохимическое исследование 40 случаев. Am J Surg Pathol 1992; 16 : 939–946.
CAS Статья Google Scholar
Ereño C, Gaafar A, Garmendia M и др. .Базалоидный плоскоклеточный рак головы и шеи: клинико-патологическое и последующее исследование 40 случаев и обзор литературы. Голова Шея Патол 2008; 2 : 83–91.
Артикул Google Scholar
Fritsch VA, Lentsch EJ. Базалоидный плоскоклеточный рак ротоглотки: анализ 650 случаев. Otolaryngol Head Neck Surg 2013; 148 : 611–618.
Артикул Google Scholar
Begum S, Westra WH.Базалоидный плоскоклеточный рак головы и шеи — это смешанный вариант, который в дальнейшем может быть решен с помощью статуса ВПЧ. Am J Surg Pathol 2008; 32 : 1044–1050.
Артикул Google Scholar
Chernock RD, Lewis JS Jr, Zhang Q и др. . Базалоидная плоскоклеточная карцинома верхних отделов пищеварительного тракта с положительной реакцией на папилломавирус человека: отдельный клинико-патологический и молекулярный подтип плоскоклеточной базалоидной карциномы. Хум Патол 2010; 41 : 1016–1023.
CAS Статья Google Scholar
Weineke J, Thompson LDR, Wenig BM. Базалоидный плоскоклеточный рак полости носа и придаточных пазух носа. Cancer 1999; 85 : 841–854.
Артикул Google Scholar
Morice WG, Ferreiro JA. Отличие базалоидной плоскоклеточной карциномы от аденоидно-кистозной и мелкоклеточной недифференцированной карциномы с помощью иммуногистохимии. Хум Патол 1998; 29 : 609–612.
CAS Статья Google Scholar
Дисплазия эпителия полости рта: что это на самом деле означает?
, Nancy W. Burkhart, RDH, EdD
nburkhart@bcd.tamhsc.edu
Пациенты иногда наблюдаются в течение определенного периода времени по поводу того, что называется дисплазией, лейкоплакией, кератотическими поражениями и ранее выраженной карциномой. При любой степени изменения тканей за пациентом следует внимательно следить и всегда определять этиологию.Иногда предлагается удалить фрикционный компонент; в других случаях поражение может иметь более зловещий вид, что будет предупреждать клинициста о том, что рак может занимать одно из первых мест в дифференциальном списке. Очевидно, что при очень подозрительных поражениях биопсия будет произведена немедленно.
Пациенты иногда сообщают врачу, что им ранее делали биопсию, и в отчете отмечается «свидетельство дисплазии». Иногда ставится диагноз дисплазии, но со временем поражение становится карциномой даже после первоначального удаления очага поражения.Обратное также может быть верным, когда тело реагирует физически, и ткани восстанавливают состояние здоровья.
Рисунок 1: На этом изображении изображена умеренная дисплазия, демонстрирующая нарастающую цитологическую атипию и изменение созревания в нижней половине эпителия. Любезно предоставлено доктором Джоном Райтом из отдела общей и оральной патологии для стоматолога-гигиениста. Lippincott Williams & Wilkins, 2008. |
Почему у одного человека развивается карцинома, а у другого может развиться легкая эпителиальная дисплазия? Возможно, организм способен остановить прогрессирование или повернуть вспять состояние прогрессирования.Это вопросы, которые исследователи продолжают оценивать и изучать.
Фрикционный кератоз, однако, не относится к той же категории, что и дисплазия. Когда фрикционный компонент будет удален, поражение исчезнет. Примером распространенного поражения, имеющего компонент трения, является жевание щеки или morsicatio buccarum. Однако хроническое трение или химическое воздействие на ткань с течением времени также может вызвать диспластические изменения.
Тело обладает чудесной способностью восстанавливать повреждения, нанесенные окружающей средой и факторами образа жизни.Например, мы открываем для себя роль, которую наша пища играет в снижении риска рака и даже в изменении нашей восприимчивости к генетическим факторам. Наш умственный, физический и духовный облик будет играть очень важную роль в отдельных болезненных состояниях, а также во время выздоровления. В настоящее время исследователи обнаруживают, что сама пища, которую мы кладем в наш организм, обладает огромными целебными свойствами и может предотвратить многие известные болезни, одновременно способствуя общему здоровью. В том же ключе документально подтверждено, что воздействие факторов окружающей среды оказывает глубокое воздействие и на наш организм.
Факторы, которые позволяют стоматологу диагностировать диспластический образец ткани (см. Рисунок 1), следующие (Wright J, 2008):
- Увеличение соотношения ядер клеток и цитоплазмы
- Округлые ребра ретейна, часто описываемые как «пилообразный» вид
- Заметное созревание
- Очевидный митоз с атипичными признаками, а также митоз в верхних слоях эпителия
- Видимые изменения плеоморфизма в размере клетки, а также в форме отдельных клеток
- Темный , окрашенные клетки видны — ядерный гиперхроматизм
- Ядрышки увеличены и выглядят тёмно окрашенными
- Клеточная адгезия потеряна
- Возникают аномальные образцы кератинизации
Все особенности будут различаться в зависимости от отдельных образцов ткани и степени дисплазии классифицируется, может варьироваться в зависимости от патологов, просматривающих один и тот же образец ткани.Обычно существует три классификации: легкая дисплазия, умеренная дисплазия и тяжелая дисплазия.
Если ткань не лечить хирургическим путем или не удалять с помощью лазерной хирургии, вероятно возникнет карцинома in situ или явная плоскоклеточная карцинома. Любой способствующий этому образ жизни, например употребление алкоголя или табака, может привести к прогрессированию дисплазии, и его следует прекратить. По мере продолжения прогрессирования будет происходить инвазия трансформированных клеток в ткань под базальной мембраной, и обозначение инвазивной карциномы становится очевидным.
Невозможно переоценить важность устного экзамена, включая как экстраоральный, так и внутриротовой. Несмотря на новейшие методы с освещением, полосканием и различными тестами, золотым стандартом в любой необъяснимой находке, когда невозможно установить этиологию, является биопсия для микроскопического подтверждения. Некоторые поражения невозможно увидеть, особенно в самых задних областях и в миндалинах / криптах миндалин, поэтому пальпация и тщательный визуальный осмотр являются ключевым фактором.
Дилемма возникает, когда у подозрительной области нет известной причины, и решение зависит от того, проводить ли в это время биопсию, следить за областью или использовать одно из доступных дополнительных устройств для получения дополнительной информации.Все вспомогательные вещества, которые можно использовать, всего лишь вспомогательные вещества. При правильном выполнении ничто не заменит тщательного внутриротового и внеротового осмотра. Имея всю доступную информацию, врач должен вместе с пациентом решить, какой оптимальный выбор должен быть в данный момент. Можно выбрать направление, выполнить биопсию или контролировать поражение.
В недавней редакционной статье, написанной доктором Марком Лингеном, главным редактором журналов Oral Surgery, Oral Medicine, Oral Pathlogy, Oral Radiology и Endodontology, подчеркивается необходимость стоматологического образования в области скрининга головы и шеи на плоскоклеточный рак.С ежегодной заболеваемостью во всем мире более 500 000 случаев, это шестое по распространенности злокачественное новообразование. Д-р Линген похвалил усилия Американской академии стоматологической медицины и Академии челюстно-лицевой патологии за их постоянное внимание к обучению студентов-стоматологов проведению осмотра головы и шеи. Он приветствовал усилия, предпринятые Комиссией по аккредитации стоматологов Американской стоматологической ассоциации, требующие, чтобы студенты-стоматологи владели экзаменом на рак полости рта во время школы и в качестве квалификационного экзамена по окончании учебы.Он также задал несколько хороших вопросов о том, как эти усилия будут осуществляться и как будут оцениваться студенты в долгосрочной перспективе.
В редакционной статье рассматривается вопрос о том, как школы будут обеспечивать высокий уровень подготовки своих преподавателей и сдачи стоматологического экзамена для обучения студентов. Доктор Линген цитирует несколько исследований, проведенных за последние несколько лет, которые показывают, что выпускники стоматологического факультета и практикующие врачи не чувствуют себя комфортно после стоматологического осмотра при обнаружении рака головы и шеи и что они чувствуют себя недостаточно подготовленными.Он также подчеркивает необходимость продолжения навыков патологии и стоматологического осмотра в течение всех лет, которые студент-стоматолог проводит в школе.
На протяжении многих лет я переписывался с тысячами пациентов, которые связались со мной через Международную группу поддержки красного плоского лишая (основана в 1997 году). Я слышал больше раз, чем хочу упомянуть, что «стоматологический кабинет на самом деле никогда не проверяет мой красный плоский лишай, и они просто говорят мне, чтобы я научился жить с этим — это всего лишь плоский лишай.»
Мы столько раз слышим от пациентов с долгосрочными поражениями полости рта — красным плоским лишаем, состояниями язвенной болезни и даже долгосрочными недиагностированными поражениями — и где-то по пути ткань стала дисплазией или, в конечном итоге, раком полости рта. Любое поражение необходимо Чтобы поставить диагноз, необходимо регулярно и через определенные промежутки времени тщательно контролировать хронические болезненные состояния. Длительное воспаление в любой части тела является пагубным. Даже предыдущие дисплазии и рак следует тщательно отслеживать из-за возможного рецидива.Понятие «полевой канцерогенез» означает, что другие злокачественные новообразования могут возникать из новых очагов и трансформации клеток, связанных с предыдущим поражением.
Мы слышали от членов семьи, что человек, который переписывался с нами, умер, но они связываются с нами, чтобы поблагодарить вас за попытку помочь, хотя было уже слишком поздно.
Часто именно человек, который подвергается операции с лучевой терапией, отправляет мне электронное письмо, чтобы сообщить мне о своем прогрессе.
Эмоциональная поддержка требует много времени, но она очень нужна и предоставляется бесплатно.В загруженных офисах обычно мало времени, но ответы на вопросы, общение с пациентами и высказывание своего беспокойства — это часть процесса исцеления. Это действительно печально, что так много внимания уделяется косметическим процедурам, а времени на хороший устный экзамен в офисе так мало. Я считаю, что гигиенисты должны уделять первоочередное внимание стоматологическому обследованию в своей практике каждого пациента и при каждом посещении.
Если вы не уверены в своих силах при сдаче устного экзамена, поищите курс CE в вашем регионе, чтобы улучшить свои навыки.Никто не настолько осведомлен, чтобы он не мог использовать немного больше обновлений и образования, чтобы стать лучшим поставщиком медицинских услуг.
Жизнь — это непрерывный образовательный процесс, независимо от того, к какому аспекту мы обращаемся. Образование по своей природе никогда не теряется зря.
Как педагог, я твердо уверен, что непрерывное образование необходимо в таких ключевых областях, как патология полости рта и стоматология, не только в стоматологических школах, но и в офисах. Мы — поставщики первичной медицинской помощи, которые могут так много рассказать о человеке, просто выполнив качественный внутриротовой и экстраоральный осмотр.В связи со старением населения, увеличением заболеваемости раком полости рта среди лиц моложе 40 лет и даже с развитием заболеваний полости рта у детей, которые обычно не наблюдались в прошлом, нам необходимо сосредоточиться на том, что действительно важно. Обновите свои навыки и начните делиться своим опытом, помогая другим!
Прислушивайтесь к своим пациентам и всегда задавайте хорошие вопросы!
Нэнси В. Беркхарт, BSDH, EdD, адъюнкт-профессор кафедры пародонтологии стоматологического колледжа Бейлора и Техасского центра здравоохранения A&M, Даллас.Д-р Буркхарт является основателем и совладельцем Международной группы поддержки плоского плоского лишая (http://bcdwp.web.tamhsc.edu/iolpdallas/) и соавтором книги «Общая и устная патология для стоматолога-гигиениста». Ее веб-сайт для семинаров: www.nancywburkhart.com .
Ссылки
Канник Г.Ф., Горовиц А.М., Друри Т.Ф., Рид С.Г., Day TA. Оценка осведомленности о раке полости рта среди студентов-стоматологов в Южной Каролине. J Am Dent Assoc 2005; 136: 373-8.
Кан М.Дополнительные пероральные устройства для предопухолевого скрининга — клинический протокол №12. Откуда: DeLong L, Burkhart NW. Общая и оральная патология для стоматолога-гигиениста. Липпинкотт, Уильямс и Уилкинс. Балтимор, 2008.
Линген М. Обеспечение компетентности студентов-стоматологов в области скрининга рака головы и шеи. От редакции в Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2011; 111: 3,267-68.
Pannone G, Santoro A, Papagerakis S, Lo Muzio L, De Rosa G, Bufo P. Роль вируса папилломы человека в патогенезе плоскоклеточного рака головы и шеи: обзор.Заразить агент рака 2011; 29 марта: 6: 4.
Siegel M, Murrah V, Aloise D. Исследование рака головы, шеи и полости рта. MedEdPORTAL; 2009 г. Доступно по адресу: http://services.aamc.org/30/mededportal/servlet/s/segment/mededportal/?subid=7768.
Другие статьи RDHПрошлые выпуски RDH
Оценка эпителиальной дисплазии полости рта — обзор
Мастхан М. К., Э. Раджеш Э, Тамилараси У., Анита Н. Оценка оральной эпителиальной дисплазии — обзор. Biomed Pharmacol J 2016; 9 (2).
Рукопись получена: 10 июля 2016 г.
Рукопись принята: 5 августа 2016 г.
Опубликована онлайн: —
Как Citeclose | История публикаций Закрыть Просмотры: (Посещений 3619 раз, посещений сегодня 2) Загрузки в формате PDF: 862
М.К. Мастхан, Э. Раджеш, У. Тамилараси и Н. Анита
Отделение оральной патологии, Стоматологический колледж и больница Шри Баладжи, Университет Бхарата, Палликаранаи, Ченнаи-600100.
DOI: https://dx.doi.org/10.13005/bpj/1012
Абстракция
Патологоанатом оценивает предраковые поражения полости рта с их диспластическими особенностями путем классификации дисплазии эпителия полости рта (OED). Оценка предраковых поражений возникает из-за двух факторов (1) отсутствия знаний в прогнозировании будущего развития рака.(2) Отсутствие оценки уже установленных критериев. В этой статье представлен подробный обзор всех систем оценивания.
Ключевые слова
эпителиальная дисплазия; предраковый; фотографический
Загрузите эту статью как:| Скопируйте следующее, чтобы процитировать эту статью: Мастхан М. К., Э. Раджеш Э, Тамилараси У., Анита Н. Классификация оральной эпителиальной дисплазии — обзор. Biomed Pharmacol J 2016; 9 (2). |
| Скопируйте следующее, чтобы процитировать этот URL: Мастхан М.К, Э. Раджеш Э., Тамилараси У., Анита Н. Оценка оральной эпителиальной дисплазии — обзор. Biomed Pharmacol J 2016; 9 (2). Доступно по ссылке: http://biomedpharmajournal.org/?p=8072 |
Введение
Плоскоклеточный рак полости рта — наиболее частое изменение слизистой оболочки полости рта 1 .лейкоплакия — одно из наиболее частых потенциально злокачественных заболеваний 2 . Дисплазия обратима. Когда стимул будет удален, диспластические изменения вернутся к норме. Когда раздражитель удален, эпителий показывает клеточную атрофию 3 . Это проявляется как смерть клетки или неопластическая трансформация. В эпителиальной дисплазии злокачественное развитие более важно, чем клинические характеристики 2,4.
Классификация дисплазии
В системе оценок используется множество комбинаций диспластических признаков, и существует трудность в оценке различных степеней дисплазии эпителия.Для оценки тяжести диспластических особенностей было предложено множество систем оценки. Существуют различные системы оценок, предлагаемые многими авторами, ниже приведены наиболее часто используемые системы оценок
Классификация Смита и Пиндборга 5
1978 Классификация ВОЗ 6
Любляна классификация плоскоклеточных интраэпителиальных поражений (SIL) 7,8
2005 Классификация ВОЗ 9
Новая двоичная система 10
Классификация Смита и Пиндборга 5
В 1969 году Смит и Пиндборг первыми стандартизировали классификацию эпителиальной дисплазии.Эта система была основана на различных гистологических изменениях и фотографическом методе. В этом методе стандартизированные фотографии сравниваются с гистологическими срезами и получают 13 гистологических признаков. Теперь они оценили дисплазию эпителия как отсутствующую, выраженную или незначительную, а также выставили оценку. За отсутствующий балл был равен нулю, а за сильный или незначительный балл составлял от 1 до 10
.1978 Классификация ВОЗ 6
«Гистопатологическое типирование рака и предраковых поражений» было дано ВОЗ в 1997 году.Они дали 12 характеристик эпителиальной дисплазии, которые были классифицированы как легкие, средние и тяжелые в соответствии с присутствующими признаками.
Список характерных черт
Потеря полярности базальных клеток
Повышенное ядерно-цитоплазматическое соотношение
Колышки в форме капли
Наличие более одного слоя клеток, имеющих базалоидный вид
Увеличение числа митотических фигур
Нерегулярное расслоение эпителия
Наличие митотических фигур в поверхностной половине эпителия
Ядерный гиперхроматизм
Клеточный полиморфизм
Уменьшение клеточной сплоченности
Увеличенные ядрышки
Кератинизация отдельных клеток или групп клеток в
слой шиповатых клеток
Они классифицировали дисплазию эпителия как
Мягкая
Умеренная
Серьезная
Легкая дисплазия
Ядерная аномалия незначительна в базальной трети эпителия и минимальна в верхнем слое по мере созревания клеток.Некоторые аномальные митозы могут сопровождаться хроническим воспалением.
Дисплазия средней степени
Базальные 2/3 эпителия показывают ядерные аномалии, сохраняющиеся до поверхности. Созревание и стратификация клеток видны в верхнем слое. Митоз возникает в парабазальном и промежуточном слое.
Тяжелая дисплазия
Более чем на 2/3 эпителия обнаруживаются ядерные аномалии, и созревание клеток прекращается. стратификация и аномальный митоз видны в поверхностных слоях.Карцинома in situ превратилась в тяжелую дисплазию.
Любляна Классификация SIL
В 2003 году Зеоднер предложил критерии классификации гиперпластических эпителиальных поражений полости рта как простые, атипичные и аномальные гиперплазии.
Простая гиперплазия
Базальный и парабазальный слой остаются нетронутыми, без клеточной атипии и наблюдается утолщение слоя шиповидных клеток.
Аномальная гиперплазия
Он показывает увеличение в размерах от базального слоя до половины толщины эпителия.Стратификация остается неизменной с умеренно увеличенными ядрами. Слой базальных клеток демонстрирует митоз, а дискератоз наблюдается менее чем у 5% эпителиальных клеток
Атипичная гиперплазия (опасный эпителий)
Клетки эпителия изменены со злокачественными изменениями, но не с образованием карциноматозных клеток. Наслоение эпителия остается неизменным, ядра увеличиваются с неправильным контуром. Митотические показатели увеличиваются до 2/3 эпителия с повышенным ядерно-цитоплазматическим соотношением.Могут присутствовать тельца Civatte и дискератотические клетки.
Карцинома in situ
Стратификация полностью утрачена, митотические фигуры видны по всему эпителию 7
2005 Классификация ВОЗ 9
В 2003 году ВОЗ классифицировала дисплазию эпителия полости рта как легкую, среднюю, тяжелую, карциному in situ или гиперплазию на основании архитектурных изменений и наличия или тяжести клеточной атипии в зависимости от наличия и степени тяжести клеточной атипии и архитектурных особенностей.Он был выпущен ВОЗ в новой книге «Классификация опухолей головы и шеи». 9
Архитектурные характеристики
Аномально поверхностные митозы
Нерегулярное расслоение эпителия
Каплевидные гребни
Кератиновый жемчуг в сетчатых колышках
Потеря полярности базальных клеток
Увеличение числа митотических фигур
Характеристики сотовой связи
Анизонуклеоз и анизоцитоз
Ядерный и клеточный плеоморфизм
Дискератоз
Увеличение количества и размеров ядрышек
Повышенное ядерно-цитоплазматическое соотношение
Атипичные митотические фигуры
Системы оценки дисплазии эпителия полости рта
Легкая дисплазия
Архитектурные изменения ограничиваются только нижней третью эпителия вместе с цитологической атипией
Дисплазия средней степени
Видны архитектурные изменения, распространяющиеся на среднюю треть эпителия.Степень цитологической атипии требует обновления
Тяжелая дисплазия
Видны архитектурные нарушения Более 2/3 эпителия и повышенное количество цитологической атипии
Карцинома in situ
Архитектурные нарушения видны по всей толщине эпителия. Аномальный митоз виден на поверхностном слое с атипичными цифрами
Заключение
Тяжесть дисплазии эпителия полости рта, оцененная гистологически, остается золотым стандартом для прогнозирования злокачественной трансформации предраковых поражений
Список литературы
- Warnakulasuriya S, Johnson NW, van der Waal I.Номенклатура и классификация потенциально злокачественных заболеваний слизистой оболочки полости рта. J Oral Pathol Med 2007; 36: 575-80.
- van der Waal I, Schepman KP, van der Meij EH, Smeele LE. Лейкоплакия полости рта: клинико-патологический обзор. Орал Oncol1997; 33: 291‑301.
- Раджендран Р., Шивапада Сундарам Б. Доброкачественные и злокачественные опухоли полости рта. Шафер, Хайн, Лави, редакторы Учебник патологии полости рта Шафера, Индия: Elsevier2009: 120-7.
- Люмерман Х, Фридман П., Керпель С.Дисплазия эпителия полости рта и развитие инвазивной плоскоклеточной карциномы. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1995; 79: 321-9.
- Крамер И.Р., Лукас РБ, Пиндборг Дж. Дж., Собин Л. Х. Определение лейкоплакии и родственных поражений: помощь в исследованиях предраковых заболеваний полости рта. Сотрудничающий центр ВОЗ по предраковым поражениям полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 1994; 67: 22-9.
- Варнакуласурия С. Гистологическая классификация дисплазии эпителия полости рта: повторный визит.Дж. Патол 2001; 194: 294-7.
- Fleskens S, Slootweg P. Системы оценки дисплазии головы и шеи: их прогностическая ценность, недостатки и полезность. HeadNeck Oncol 2009; 1: 11-9.
- Махаджан MC, Хазарей ВК. Оценка орального эпителиодисплазии с использованием критериев системы оценок Смита и Пиндборга и системы оценок Любляны при предраковых поражениях полости рта. Журнал J OralMaxillofac Pathol 2004; 8: 73-81.
- Бранес Л., Эвесон Дж. В., Райхарт П., Мир DS. Опухоли полости рта и ротоглотки.Патол Генет 2005; 67: 177-9.
- Куджан О., Оливер Р.Дж., Хаттаб А., Робертс С.А., Таккер Н., Слоан П. Оценка новой бинарной системы классификации оральной эпителиальной дисплазии для прогнозирования злокачественной трансформации. Устный Онкол 2006; 42: 987-93.
Новый взгляд на дисплазию полости рта
Ежегодно во всем мире1 диагностируется около 300000 случаев рака полости рта, а общая смертность в США составляет около 40 процентов2, преимущественно из-за диагностики на поздней стадии3 ( Рис.1 ). Ранняя диагностика локализованного заболевания значительно снижает уровень смертности.
РИСУНОК 1. Карцинома на правом бугорке верхней челюсти.
Самая распространенная форма рака полости рта, плоскоклеточная карцинома слизистой оболочки, обычно развивается поэтапно от нормальных стадий предзлокачественной опухоли до инвазивной карциномы.5 Предраковые стадии могут иметь различные проявления, включая белые поражения, красные поражения или белые / красные поражения.Они могут быть плоскими, бородавчатыми или даже папиллярными. Эти предраковые поражения полости рта встречаются примерно у 2,5% населения и обычно протекают бессимптомно.5,6 Они обычно обнаруживаются как случайная находка во время обычного стоматологического осмотра ( Рис. 2 ).
РИСУНОК 2. Дисплазия ротовой полости правого языка.
В то время как лечение предракового поражения или ранней плоскоклеточной карциномы полости рта может включать лишь незначительное хирургическое удаление и тщательный последующий мониторинг, более запущенное заболевание требует обширной резекции, часто включающей рассечение шеи и / или лучевую терапию ( Рис.3 ). Эти методы лечения приводят к значительным заболеваемости и значительным расходам. Пациенты страдают как функциональным, так и косметическим дефицитом, испытывают дисгевзию, дисфагию, дисфонию, ксеростомию и трудности с жеванием. Если применяется лучевая терапия, пациенты предрасположены к будущему кариесу зубов и остеорадионекрозу. Пациенты с запущенными метастазами обычно плохо реагируют на перехватывающую химиотерапию, и лечение в основном паллиативное.
РИСУНОК 3. Роджер Эберт (слева) после операции по удалению раковой ткани ротовой полости возле его правой челюсти.(Справа) Портрет Роджера до операции.
Стоматологическое сообщество гигиенистов, стоматологов и стоматологов имеет возможность играть важную роль в ранней диагностике и лечении рака полости рта. Большинство населения не склонно посещать своего врача так же регулярно, как стоматолог. Когда они посещают своего врача, осмотр ротовой полости в кабинете врача редко бывает таким подробным, как при посещении стоматолога.Стоматологи гораздо более внимательны к заболеваниям полости рта и потенциально предраковым поражениям ( Рис. 4 ). Доступен ряд продуктов для скрининга, но исследования поставили под сомнение их полезность. Использование толуидинового синего и различных ламп для осмотра имеет сомнительную ценность по сравнению с правильно проведенным осмотром полости рта для выявления злокачественных или предраковых поражений полости рта.7-11 В конечном счете, для установления диагноза необходима биопсия.
РИСУНОК 4. Дисплазия полости рта на дне.
В настоящее время стандартным методом оценки предраковых поражений является определение степени дисплазии с использованием рутинной гистопатологии. Поражения классифицируются как легкие, умеренные или тяжелые диспластические. Система оценок, хотя и основана на объективных рекомендациях, в значительной степени субъективна по своей природе.12 Оценки могут значительно совпадать, и патологоанатомы не во всех случаях приходят к одному и тому же диагностическому заключению.13 Классификация дисплазии не всегда надежна и имеет ограниченную ценность в диагностике. прогнозирование риска будущей злокачественной трансформации у пациентов, которым сделана биопсия.Пациенты хотят знать, разовьется ли у них внутриротовой рак, а клиницисты хотели бы получить какое-то объективное указание относительно частоты повторной оценки последующего наблюдения за пациентом. Ограничения нашей текущей практики привели к широко признанной острой необходимости в более эффективных прогностических биомаркерах, которые могут определять риск развития рака у пациентов с диагностированными предраковыми поражениями полости рта. Такая оценка риска внесет некоторую ясность для пациентов и даст рекомендации для медицинских работников.
Пациенты с диспластическим и потенциально предраковым поражением эпителия или лечившиеся от рака полости рта сталкиваются с другой проблемой.Предраковые молекулярные изменения могли произойти в ткани, удаленной от исходного поражения или от краев резекции, без видимых клинических изменений. Когда края биопсированной ткани исследуются под микроскопом с использованием стандартной гистопатологии, они могут казаться нормальными, и поражение может казаться адекватно иссеченным, хотя на самом деле есть предраковые изменения на краях или на удалении от исходного поражения. Обычная гистопатология может подтвердить, что края резекции свободны от микроскопических диспластических изменений, но не могут обнаружить молекулярные изменения или дать рекомендации относительно возможного рецидива в месте резекции.
Исследователи из Йоркского университета и больницы Mount Sinai в Торонто, Канада, изучающие белки в тканях от рака полости рта и глотки, идентифицировали ряд белков, связанных со злокачественными изменениями. Одним из нескольких потенциальных белковых биомаркеров, который, по мнению ученых, мог предшествовать неопластической трансформации, был белок S100A7.16 Когда S100A7 оценивался в последовательных биопсиях пациентов с диспластическими поражениями полости рта, повышение уровня S100A7 было связано со злокачественными изменениями.S100A7 оказался отличным прогностическим маркером прогрессирования рака при предраковых поражениях слизистой оболочки (дисплазия; Fig. 5 ) 17,18
РИСУНОК 5.
Теперь стало возможным определить, какие диспластические поражения наиболее подвержены риску развития плоскоклеточного рака полости рта. Для дальнейшего повышения чувствительности и специфичности с использованием ретроспективных данных из крупнейшего в мире хранилища предраковых / злокачественных тканей полости рта в больнице Mount Sinai был разработан алгоритм, который определял относительный риск злокачественных изменений в образце биопсии с использованием цифрового сканирования, окрашенного S100A7. секции ( рис.6 ). Это было дополнительно уточнено в самой последней версии программы, чтобы включить морфометрическую клеточную оценку, чтобы определить, у каких пациентов с предраковыми поражениями полости рта наиболее вероятно развитие рака полости рта, и проинформировать их об их риске развития рака полости рта в будущем. От пациента не требуется дополнительный биопсийный материал, так как оценка проводится на ткани, отправленной на стандартную гистопатологию.
РИСУНОК 6.
РИСУНОК 7.
Эта новая служба оценки, которая предоставляет пациентам индивидуальный пятилетний риск прогрессирования рака, теперь доступна от Proteocyte Diagnostics Inc.Торонто, под торговым названием Straticyte ( Рис. 7 ). В настоящее время он проходит бета-тестирование в Онтарио и вскоре станет широко доступным, а надежность службы будет и дальше повышаться по мере сбора большего количества данных с расширением службы. Наконец, у нас есть оценка, которая дает некоторые объективные данные для рационального ведения пациентов с предраковыми заболеваниями полости рта. Straticyte может произвести революцию в том, как мы заботимся об этих пациентах. ОН
Барри М.Реник, больничная и частная практика Саут-Лейк, Ньюмаркет. Неоплачиваемый консультант службы диагностики протеоцитов, Торонто.
Oral Health приветствует эту оригинальную статью.
Ссылки :
1. Ферли Дж. С.И., Эрвик М., Дикшит Р., Эзер С., Мазерс К., Ребело М., Паркин Д.М., Форман Д., Брей, Ф., GLOBOCAN 2012 v1.0, Заболеваемость раком и смертность во всем мире. : IARC CancerBase No. 11. 2012, Международное агентство по изучению рака.
2. 2Зигель Р., Д. Найшадхам и А. Джемаль, Статистика рака, 2012. CA Cancer J Clin, 2012. 62 (1): p. 10-29.
3. 3Lingen, M.W., et al., Критическая оценка диагностических средств для обнаружения рака полости рта. Орал Онкол, 2008. 44 (1): с. 10-22.
4. Якобсон, Дж. Дж. И др., Стоимость рака полости рта, глотки и слюнных желез по трем группам: коммерческое страхование, Medicare и Medicaid. Head Neck Oncol, 2012. 4: с. 15.
5. Маккалоу, М.Дж., Г. Прасад, К.С. Фарах, Злокачественные новообразования слизистой оболочки полости рта и потенциально злокачественные поражения: обновленная информация об эпидемиологии, факторах риска, диагностике и лечении. Aust Dent J, 2010. 55 Приложение 1: с. 61-5.
6. Вейр, Дж. К., Дэвенпорт У., Скиннер Р. Л. Диагностическое и эпидемиологическое исследование 15 783 поражений полости рта. J Am Dent Assoc, 1987. 115 (3): p. 439-42.
7. Варнакуласурия, К.А., Джонсон, Н.В. Чувствительность и специфичность ополаскивателя для полости рта с толуидиновым синим OraScan® при обнаружении рака полости рта и предрака.J. Oral Pathol Med (1996) 25: 97-103.
8. Мартин, И.С., Керавала, С.Дж., Рид, М. Применение толуидинового синего в качестве диагностического дополнения при обнаружении дисплазии эпителия. Oral Surg Oral Med Oral pathol Oral Radiol Endod (1998) 85: 444-6.
9. Ох, Е.С., Ласкин, Д.М. Эффективность системы ViziLite при выявлении поражений полости рта. J Oral Maxillofac Surg 2007; 65: 424-426.
10. Марк В. Линген, М.В., Кальмар, Дж. Р., Каррисон, Т. Спейт, П.М. Критическая оценка диагностических средств для обнаружения рака полости рта.Онкология полости рта (2008) 44, 10–22.
11. Кристин К. Макнамара, К.К., Брент Д. Мартин, Б.Д., Эванс, Э.У., Кальмар, Дж.Р. Роль прямого визуального флуоресцентного исследования (VELscope) в рутинном скрининге на предмет потенциально злокачественных поражений слизистой оболочки полости рта. Oral Surg Oral Med Oral Pathol Oral Radiol 2012; 114: 636-643.
12. Варнакуласурия, С. и др., Системы классификации дисплазии эпителия полости рта: прогностическая ценность, полезность, слабые места и возможности для улучшения. J Oral Pathol Med, 2008.37 (3): с. 127-33.
13. McGurk, M. and S.E. Скотт, Реальность раннего выявления рака полости рта в общей стоматологической практике. Br Dent J, 2010. 208 (8): p. 347-51.
14. Линген М.В. Скрининг предраковых заболеваний полости рта и рака: какая платформа и какие биомаркеры? Cancer Prev Res (Phila), 2010. 3 (9): p. 1056-9.
15. Смит, Дж. И др., Биомаркеры дисплазии полости рта: систематический обзор. Орал Онкол, 2009. 45 (8): с. 647-53.
16. Ралхан Р.и др., Открытие и проверка биомаркеров рака головы и шеи с помощью анализа дифференциальной экспрессии белков с использованием мечения iTRAQ, многомерной жидкостной хроматографии и тандемной масс-спектрометрии. Mol Cell Proteomics, 2008. 7 (6): с. 1162-73.
17. Kaur, J., et al., Сверхэкспрессия S100A7 является прогностическим маркером высокого риска злокачественной трансформации при дисплазии полости рта. Int J Cancer, 2014. 134 (6): p. 1379-88.
18. Tripathi, S.C., et al., Nuclear S100A7 ассоциируется с плохим прогнозом рака головы и шеи.PLoS One, 2010. 5 (8): с. e11939.
Отчет о вашей патологии: рак легкого на месте
При проведении биопсии легкого взятые образцы были изучены под микроскопом врачом-специалистом с многолетней подготовкой под названием патолог . Патологоанатом отправляет вашему врачу отчет с диагнозом для каждого взятого образца. Информация в этом отчете будет использована для управления вашим лечением. Следующие вопросы и ответы призваны помочь вам понять медицинский язык, который вы можете найти в отчете о патологии, который вы получили после биопсии легкого.
Каково нормальное строение легкого?
Когда вы вдыхаете, воздух входит через рот или нос и попадает в легкие через трахею (дыхательное горло). Трахея делится на трубки, называемые бронхами (single, bronchus), которые делятся на более мелкие ветви, называемые бронхиолами. В конце бронхиол находятся крошечные воздушные мешочки, известные как альвеол или ацинусов .
Через альвеолы проходит множество крошечных кровеносных сосудов. Они поглощают кислород из воздуха, которым вы вдыхаете, в кровь и выводят углекислый газ из организма в альвеолы.Он выводится из тела при выдохе. Поглощение кислорода и избавление от углекислого газа — основные функции ваших легких.
Что такое карцинома in situ (карцинома in situ)?
Карциномы могут возникать в клетках, выстилающих внутреннюю часть бронхов, бронхиол или альвеол. Если клетки карциномы находятся только в верхнем слое клеток бронхов, бронхиол или альвеол, не врастая в более глубокие слои ниже, это называется карциномой in situ (также называемой карциномой in situ или CIS). .Это считается предраком.
После того, как эти клетки вырвались из внутренней оболочки бронхов, бронхиол или альвеол, они больше не находятся на месте и могут тогда называться инвазивной или инфильтрирующей карциномой . Инвазивная карцинома считается настоящим раком легких, потому что клетки могут распространяться (метастазировать) за пределы легких в лимфатические узлы и другие части вашего тела.
Что означает, если мой предраковый период называется плоскоклеточной карциномой in situ или атипичной аденоматозной гиперплазией?
Плоскоклеточная карцинома in situ является предраком, который может превратиться в инвазивную плоскоклеточную карциному (тип немелкоклеточного рака легкого).Атипичная аденоматозная гиперплазия — это предрак, который может перерасти в аденокарциному (другой тип немелкоклеточного рака легкого). Если какой-либо из них присутствует в биопсии, это может означать, что есть инвазивная карцинома в другом месте легкого, образец которого не был взят при биопсии. Если какой-либо из них был обнаружен при эксцизионной биопсии (при удалении опухоли или другой аномальной области) или резекции / лобэктомии доли (при удалении всей или части доли легкого) и не было обнаружено инвазивного рака, прогноз (вероятный исход) отличный.Тем не менее, легкие могут по-прежнему содержать другие области предрака, которые не находятся рядом с первой (иногда называемые областями пропуска , ).
Что такое плоскоклеточная метаплазия?
Когда воздушный проход раздражен (например, из-за курения или инфекции), клетки, выстилающие его, могут превратиться из прямоугольников, стоящих рядом друг с другом, в более плоские и наложенные друг на друга. Это изменение называется плоскоклеточной метаплазией , потому что теперь клетки выглядят как клетки того типа, которые называются плоскоклеточными клетками .Когда раздражение исчезает, например, когда вы бросаете курить или инфекция проходит, клетки слизистой оболочки возвращаются к своему нормальному виду. Плоскоклеточная метаплазия не считается предраком, но если раздражение не проходит, оно может перейти в плоскоклеточную дисплазию.
Что такое плоскоклеточная дисплазия?
Дисплазия — это ранняя форма предрака. Его часто разделяют на разные категории в зависимости от того, насколько аномальными являются клетки и ткани под микроскопом:
- Когда это наименьшее отклонение от нормы, это называется легкая дисплазия .
- Когда это наиболее ненормально, это называется тяжелая дисплазия .
- Дисплазия средней степени находится между двумя другими.
Чем тяжелее дисплазия, тем больше она похожа на плоскоклеточный рак in situ, который является предраком. Если при биопсии выявляется плоскоклеточная дисплазия, это может означать, что есть что-то более серьезное, например, инвазивная карцинома или инвазивная карцинома, где-то еще в легком, образцы которой не были взяты при этой биопсии.
Что делать, если в моем отчете о биопсии упоминаются поля или чернила?
При удалении всей опухоли или аномальной области патолог покрывает внешние края или края ткани чернилами, иногда чернилами разного цвета с разных сторон.Если обнаружен рак (и / или предраковое заболевание), патолог может определить, доходит ли он до краев удаленной ткани. Это известно как положительная маржа . Если это так, это может означать, что какой-то рак (или предраковое заболевание) остался позади. Иногда это не вызывает беспокойства, потому что хирург удалил другие ткани в этой области. Тем не менее, если некоторые виды рака (или предраковые заболевания) остались позади, вам может потребоваться дополнительное лечение, например лучевая терапия или хирургическое вмешательство. Поговорите со своим врачом о наилучшем подходе для вас, если рак (или предраковое заболевание) обнаруживается на периферии.
Что означает, если в моем отчете также упоминается любой из следующих терминов: рубцы, эмфизема, эмфизематозные изменения или воспаление?
Все это термины для обозначения незлокачественных изменений, которые патолог может увидеть под микроскопом. Обычно они не важны, если их увидеть на образце биопсии, который также имеет предраковое заболевание или рак.
Что, если в моем отчете упоминается любое из следующего: гранулемы, метенамин серебра (GMS), кислотоустойчивые бациллы (AFB) или периодическая кислота Schiff (PAS)?
Гранулемы — это видимые под микроскопом структуры, которые часто, хотя и не всегда, вызваны определенными типами инфекций.Иногда микробы, вызывающие инфекцию, можно увидеть только с помощью специальных пятен (таких как GMS, пятна для AFB и PAS), которые патолог применяет к микроскопическим предметным стеклам. Большинство гранулем вызвано инфекциями, но их могут вызывать и другие причины, например, болезнь под названием саркоидоз, аллергические реакции и вызванное пылью заболевание легких (пневмокониоз).
предраковых поражений — Фонд рака полости рта
Приведенный выше материал был разработан на основе этих ссылок.
1.Axell T, Pindborg JJ, Smith CJ, van der Waal I. Белые поражения полости рта с особым акцентом на предраковые и связанные с табаком поражения: выводы международного симпозиума, проведенного в Упсале, Швеция, 18-21 мая 1994 г. J Oral Pathol Med 1996 ; 25: 49-54.
2. Сильверман С.-младший, Горский М., Лозада Ф. Лейкоплакия полости рта и злокачественная трансформация: последующее исследование 257 пациентов. Рак 1984; 53: 563-8.
3. Shafer WG, Waldron CA. Эритроплакия полости рта. Рак 1975; 36: 1021-8.
4. Крутчков Д. Д., Айзенберг Э. Лихеноидная дисплазия: отдельная гистопатологическая сущность. Oral Surg Oral Med Oral Pathol 1985; 30: 308-15.
5. DeJong WFB, Альбрехт М., Баноци Дж., Ван дер Ваал I. Дисплазия эпителия красного плоского лишая полости рта. Int J Oral Maxillofac Surg 1984; 13: 221-5.
6. Сильверман С.-младший, Горский М., Лозада-Нур Ф., Джаннотти К. Проспективное исследование результатов и лечения 214 пациентов с красным плоским лишаем полости рта. Oral Surg Oral Med Oral Pathol 1991; 72: 665-70.
7. Каугарс Дж. Э., Бернс Дж. К., Гансолли Дж. Эпителиальная дисплазия полости рта и губ. Рак 1988; 62: 2166-70.
8. Waldron CA, Shafer WG. Повторный визит к лейкоплакии. Клинико-патологическое исследование 3256 лейкоплакий полости рта. Рак 1975; 36: 1386-92.
9. Сильверман С.-младший, Горски М. Эпидемиологические и демографические обновления рака полости рта: Калифорния и национальные данные — 1973–1985 гг. J Am Dent Assoc 1990; 120: 495-9.
10. Минсер HH, Коулман С.А., Хопкинс К.П. Наблюдения за клиническими характеристиками поражений полости рта, показывающими гистологическую дисплазию эпителия.Oral Surg Oral Med Oral Pathol 1972; 33: 389-99.
11. Люмерман Х., Фридман П., Керпель С. Дисплазия эпителия полости рта и развитие инвазивной плоскоклеточной карциномы. Oral Surg Oral Med Oral Pathol 1995; 79: 321-9.
12. Крутчкофф Д.Д., Чен Дж., Айзенберг Э., Кац Р.В. Рак полости рта: исследование 566 случаев, проведенное Службой биопсии оральной патологии Университета Коннектикута, 1975-1986 гг. Oral Surg Oral Med Oral Pathol 1990; 70: 192-8.
13. Östör AG. Естественная история цервикальной интраэпителиальной неоплазии: критический обзор.Int J Gynecol Pathol 1993; 12: 186-92.
14. Richart RM, Barron BA. Контрольное исследование пациентов с дисплазией шейки матки. Am J Obstet Gynecol 1969; 105: 386-93.
15. Кристоферсон WM. Дисплазия, карцинома in situ и микроинвазивная карцинома шейки матки. Human Pathol 1977; 8: 489-501.
16. Сильверман С.-младший, Миглиорати С., Барбоза Дж. Окрашивание толуидиновым синим при обнаружении предраковых и злокачественных поражений полости рта. Oral Surg Oral Med Oral Pathol 1984; 57: 379-82.
17. Машберг А., Самит А. Ранняя диагностика бессимптомного плоскоклеточного рака полости рта и ротоглотки. CA Cancer J Clin 1995; 45: 328-51.
18. Сотрудничающий центр ВОЗ по предраковым поражениям полости рта. Определение лейкоплакии и родственных поражений: помощь в исследованиях предрака полости рта. Oral Surg Oral Med Oral Pathol 1978; 46: 518-39.
19. Баноци Дж., Чиба А. Возникновение эпителиальной дисплазии при лейкоплакии полости рта. Oral Surg Oral Med Oral Pathol 1976; 42: 766-74.
20.Роденбург Ю.Л., Пандерс А.К., Вермей А. Хирургия лейкоплакии полости рта с помощью углекислотного лазера. Oral Surg Oral Med Oral Pathol 1991; 71: 670-4.
21. Чу ФВК, Сильверман С. Младший, Дедо Х. Х. CO-лазерное лечение лейкоплакии полости рта. Ларингоскоп 2 1988; 98: 125-9.
22. Vedtofte P, Holmstrup P, Hjorting-Hansen E, Pindborg JJ. Хирургическое лечение предраковых поражений слизистой оболочки полости рта. Int J Oral Maxillofac Surg 1987; 16: 656-64.
23. Тот BB, Мартин Дж. В., Липпман С. М., Гонконг.Химиопрофилактика как форма борьбы с раком. J Am Dent Assoc 1993; 124: 243-6.
24. Каугарс Г.Е., Сильверман С. мл., Ловас Дж.Г.Л. и др. Использование антиоксидантных добавок при лечении лейкоплакии ротовой полости человека. Oral Surg Oral Med Oral Pathol 1996; 81: 5-14.
25. Липпман С.М., Батсакис Дж. Г., Тот BB и др. Сравнение низких доз изотретиноина с бета-каротином для предотвращения орального канцерогенеза. N Engl J Med 1993; 328: 15-20.
26. Garewal HS, Meyskens FL, Killen D, et al.Ответ оральной лейкоплакии на бета-каротин. Дж. Клин
Онкол 1990; 8: 1715-20.
27. Тома С., Альбанезе М., Де Лоренци М. и др. Бета-каротин в лечении лейкоплакии полости рта. Proc Am Soc Clin Oncol 1990; 9: 179 (аннотация).
28. Малакер К., Андерсон Б.Дж., Бикрофт В.А., Ходсон Д.И. Лечение дисплазии слизистой оболочки полости рта с помощью бета-каротина и ретиноевой кислоты: пилотное перекрестное исследование. Cancer Detect Prev 1991; 15: 335-40.
29. Стич Х.Ф., Канифоль М.П., Хорнби А.П. Ремиссия оральных лейкоплакий и микроядер у людей, пережевывающих табак / бетель, получавших бета-каротин и бета-каротин плюс витамин А.Int J Cancer 1988; 42: 195-9.
30. Toma S, Benso S, Albanese E, et al. Лечение лейкоплакии полости рта бета-каротином. Онкология 1992; 49: 77-81.
31. Канлифф WJ, Миллер AJ. Ретиноидная терапия: обзор клинических и лабораторных исследований. Ланкастер, Англия: MTP Press Limited, 1984: 1-21.
32. Хонг В.К., Эндикотт Дж., Итри Л.М. 13-цис-ретиноевая кислота в лечении лейкоплакии полости рта. N Engl J Med 1986; 315: 1501-5.
33. zur Hausen H. Вирусы папилломы при аногенитальном раке как модель для понимания роли вирусов в раковых заболеваниях человека.Cancer Res 1989; 49: 4677-81.
34. Stoler MH, Rhodes CR, Whitbeck A, et al. Экспрессия генов вируса папилломы человека 16 и 18 типов при неоплазиях шейки матки. Human Pathol 1992; 23: 117-28.
35. Scheffner M, Werness BA, Huibregtse JM, et al. Онкобелок E7, кодируемый вирусом папилломы человека 16 и 18 типов, способствует деградации. Cell 1990; 63: 1129-36.
36. Ishiji T, Lace MJ, Parkkinen S, et al. Фактор усилителя транскрипции (TEF) -1 и его клеточно-специфический коактиватор активируют трансципцию EG вируса папилломы 16 человека и онкогена E7 в кератиноцитах и клетках карциномы шейки матки.Embo J 1992; 11: 2271-81.
37. Gassenmaier A, Hornstein OP. Наличие ДНК вируса папилломы человека при доброкачественных и предраковых лейкоплакиях полости рта и плоскоклеточном раке. Дерматология 1988; 176: 224-33.
38. Грир Р., Eversole LR. Обнаружение геномной ДНК ВПЧ при дисплазиях эпителия полости рта, лейкоплакиях, связанных с бездымным табаком, и злокачественных новообразованиях эпителия. J. Oral Maxillofac Surg 1990; 48: 1201-5.
39. Лонинг Т., Икенберг Х., Беккер Дж. Х. и др. Анализ оральных папиллом, лейкоплакий и инвазивных карцином IV-10 на ДНК, относящуюся к типу вируса папилломы человека.Дж. Инвест дерматол 1985; 84: 417-20.
40. Шройер К.Р., Грир РО. Обнаружение ДНК вируса папилломы человека путем гибридизации ДНК in situ и полимеразной цепной реакции при предраковых и злокачественных поражениях полости рта. Oral Surg Oral Med Oral Pathol 1991; 71: 708-13.
41. Абдельсаед Р.А. Изучение вируса папилломы человека при дисплазии эпителия полости рта и эпидермоидной карциноме при отсутствии употребления табака и алкоголя. Oral Surg Oral Med Oral Pathol 1991: 71: 730-2.
42. Сырьянен С.М., Сырьянен К.Дж., Хаппонен Р.П.Последовательности ДНК вируса папилломы человека (ВПЧ) в предраковых поражениях полости рта и плоскоклеточной карциноме, продемонстрированные гибридизацией in situ. J Oral Pathol 1988; 17: 273-8.
43. Джалал Х., Сандерс С.М., Прайм С.С. и др. Обнаружение ДНК вируса папилломы человека типа 16 в чешуях ротовой полости здоровых молодых людей. J Oral Pathol Med 1992; 21: 465-70.
44. Палефски Дж. М., Сильверман С. Младший, Абдель-Салам М., Дэниэлс Т. Э., Гринспен Дж. С.. Связь между пролиферативной веррукозной лейкоплакией и инфекцией вирусом папилломы человека 16 типа.J Oral Pathol Med 1995; 24: 193-7.
45. Ватт С.Л., Брюэр Э.Е., Фрай Т.Л. Типы ДНК вируса папилломы человека при плоскоклеточном раке головы и шеи. Oral Surg Oral Med Oral Pathol 1991; 71: 701-7.
46. Йеудалл В.А., Патерсон И.С., Пател В., Прайм С.С. Присутствие последовательностей вируса папилломы человека в опухолевых кератиноцитах ротовой полости человека, экспрессирующих мутант. Eur J Cancer, Часть B Oral Oncol
1995; 31B: 136-43.
47. Мин Б.М., Бэк Дж. Х., Шин К. Х. и др. Инактивация гена либо мутацией, либо инфекцией ВПЧ чрезвычайно часто встречается в клеточных линиях плоскоклеточной карциномы ротовой полости человека.Eur J Cancer, Часть B Oral Oncol 1994; 30B: 338-45.
48. Шин Д.М., Ким Дж., Ро СП. Активация экспрессии генов в предраковых поражениях при онкогенезе головы и шеи. Cancer Res 1994; 54: 321-6.
49. Беннер С.Е., Липпман С.М., Хиттельман В.Н., Гонконг В.К. Биомаркеры: промежуточные конечные точки для испытаний химиопрофилактики верхних дыхательных путей. Раковый Бык 1992; 44: 49-53. IV-11
.

 (для исключения рака шейки матки)
(для исключения рака шейки матки)