Дисбактериоз у детей
Дисбактериоз у детей – явление очень частое. К счастью, диагнозом дисбактериоз кишечника не является, то есть не входит в международную классификацию болезней. Тем не менее, дисбактериоз существует, и в особенности часто у детей.
Что же такое дисбактериоз?
Ребенок, как мы с Вами знаем уже из предыдущих статей, рождается в этом мире абсолютно стерильным. Важным моментом в формировании на коже новорожденного малыша и его слизистых оболочках поверхностной микрофлоры является прохождение ребенка по родовым путям матери и первый контакт с ее кожей, когда младенца акушеры должны выложить на мать. В первые часы жизни новорожденного начинается самое активное заселение поверхностей его тела множеством бактерий, которые в дальнейшем должны сформировать защитный слой везде, где возможен контакт наших с вами оболочек (кожи, слизистого эпителия) с возбудителями опасных инфекций.
Если в эти первые часы жизни в организм ребенка попадут помимо условно хороших бактерий еще и не очень хорошие, или патогенные бактерии, то у ребенка с самого момента его появления на свет будет нарушено состояние поверхностной защиты, иными словами, пленка может оказаться с дырками.
Точно также «дырки в защитной пленке» образуются в результате применения различных химиотерапевтических препаратов, прежде всего, антибиотиков.
Отсюда вывод: если мама ребенка во время беременности или во время лактации (кормления грудью), или же сам ребенок сразу после рождения получали
А как следствие дисбактериоза возникают проблемы с аллергией, вплоть до непереносимости белка материнского молока. В настоящее время уже появились анализы на антитела IgE и IgG грудного ребенка к белку не только коровьего, но даже грудного материнского молока.
Как мы можем вылечить дисбактериоз?
Справедливости ради надо сказать, что вылечить дисбактериоз нельзя, поскольку это не болезнь, как уже написано выше. Но если в микробиологическом анализе кала на дисбактериоз высеиваются патогенные бактерии, то это – не дисбактериоз, а кишечная инфекция, которая лечится, увы, антибиотиками.
Во всех остальных случаях нарушения нормальной микрофлоры кишечника, запомните, дисбактериоз Не лечится антибиотиками!
В настоящее время принято очень много схем лечения дисбактериоза, которые включают различные бактериофаги – специальные вирусы, которые паразитируют на плохих микробах, во все схемы лечения дисбактериоза обязательно входят сорбенты – препараты, связывающие и выводящие из организма токсины патогенных бактерий, а также пищевые аллергены.
Но основным методом лечения дисбактериоза кишечника по-прежнему остается длительный прием пробиотиков, то есть колоний хороших, полезных бактерий, которые очень нужны для правильного пищеварения и профилактики аллергии у детей, кто бы и что Вам не говорил.
Лечение дисбактериоза – это длительный и сложный процесс, но стоит того, чтобы предотвратить у ребенка развитие хронического запора или остановить развитие атопического дерматита.
Самостоятельно нельзя начинать прием никаких препаратов для лечения дисбактериоза, так как любые препараты имеют и плюсы, и минусы, то есть возможные побочные эффекты, и только грамотный врач педиатр, аллерголог илигастроэнтеролог должны подобрать и контролировать необходимый курс лечения.
Дисбактериоз у новорожденных и грудных детей | Bifiform ru
В норме микрофлора кишечника состоит в среднем из 1 млн микробов на 1 мл содержимого. Нормальную микрофлору составляют 15-20 представителей анаэробных (бактерии, которые не могут жить в присутствии кислорода) и аэробных (способных существовать в присутствии кислорода) бактерий основных родов: бактероиды, бифидобактерии, лактобактерии и другие. Бифидобактерии относятся к доминирующей микрофлоре (Ig10-11)1,2
Здоровая микрофлора участвует в пищеварительных процессах организма, усиливает активность пищеварительных ферментов, действует на моторику желудочно-кишечного тракта, способствует выработке витаминов, гормонов, аминокислот и повышает иммунитет.
Также микрофлора выполняет детоксикационную и антиаллергенную функции. Защитные функции кишечника сводятся к созданию барьера для размножения болезнетворных бактерий и разрушения аллергенов. Нормальная микрофлора также обладает антиоксидантными, антимутагенными и противораковыми функциями1,2
Формирование микрофлоры
Формирование и функционирование иммунной системы происходит в 2 этапа. Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Первый заключается в формировании клонов Т- и В-лимфоцитов на основе генетического материала, который был представлен в период раннего эмбриогенеза (ранние этапы беременности).
Второй этап — начинается после рождения человека и заселения микробами слизистых оболочек, в том числе и ЖКТ. Кишечник – представляет собой не только часть пищеварительной системы, но и является иммунным органом, до 80% иммунных клеток располагаются именно в кишечнике. Таким образом, формирование собственного кишечного иммунитета у грудного ребенка происходит с период ранней микробной колонизации и начинается сразу после рождения ребенка. Поэтому момент появления на свет является одним из ключевых этапов в формировании здорового ЖКТ3.
В становлении нормальной микрофлоры ребенка особенно важную роль играют бифидобактерии. Количество бифидобактерий в кишечнике ребенка, находящегося на грудном вскармливании, быстро нарастает в первые недели его жизни. В течение первого года жизни меняется видовой состав кишечной микрофлоры, что связано с различными периодами в жизни ребенка: периодом грудного вскармливания до введения прикорма, после введения прикорма, после появления в рационе твердой пищи, после прекращения грудного вскармливания.
Нормальная микрофлора ребенка
Микрофлора обусловливает защиту слизистой кишечника от внедрения патогенных микроорганизмов, поддерживает и активирует иммунную систему, участвует в обмене белков, липидов, углеводов, выполняет антиаллергическую функцию, участвует в синтезе аминокислот, витаминов, гормонов, влияет на пищеварительные функции желудочно-кишечного тракта 1.
Пробиотический комплекс Бифиформ Бэби можно давать даже новорожденным с первых дней жизни. Его основное назначение – формирование сбалансированной микрофлоры кишечника, в том числе, при различных проблемах, связанных с кормлением. Особый комплекс бактерий может способствовать профилактикекишечных расстройств различного характера, включая колики 4.
Нормальную микрофлору кишечника составляют множество видов микроорганизмов. Одни из значимых и изученных на сегодняшний день:
Бифидобактерии
Представители рода Bifidobacterium являются наиболее важным компонентом нормальной микробиоты желудочно-кишечного тракта человека. Большая часть бифидобактерий находится в толстой кишке, составляя у детей более 90% всех микроорганизмов 5 Начинают доминировать в кишечной микрофлоре младенцев к концу первой недели жизни. Синтезируют аминокислоты и белки, витамин К, пантотеновую кислоту, витамины группы В: B1 — тиамин, B2 — рибофлавин, B3 — никотиновую кислоту, фолиевую кислоту, B6 — пиридоксин. Способствуют усилению процессов всасывания через стенки кишечника ионов кальция, железа, витамина D 6.
Лактобактерии
Уменьшают активность пероксидазы, оказывая антиоксидантный эффект, обладают противоопухолевой активностью, стимулируют продукцию иммуноглобулина А (IgA), подавляют рост патогенной микрофлоры и стимулируют рост лакто- и бифидофлоры, оказывают противовирусное действие 6
Нарушения микрофлоры
Дисбактериоз является нарушением качественного и количественного состава микрофлоры кишечника.
Дисбактериоз у грудных детей может проявляться в виде изменения частоты, состава и цвета стула, нарушения процессов переваривания пищи, повышенного газообразования, беспокойного поведения ребенка, плача, повышенной раздражительности, плохого аппетита и сна, ухудшение состояния кожного покрова и даже аллергических реакций 3.
Причины возникновения дисбактериоза у новорожденных и грудничков
В группе риска по нарушению баланса микрофлоры находятся дети, мамы которых имели различные осложнения в период беременности и родах, а также дети, находящиеся на искусственном вскармливании, недоношенные. Простудные заболевания, прием некоторых лекарственных препаратов (лечение антибиотиками) могут приводить к нарушениям баланса микрофлоры кишечника. Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Внешними проявлениями этого состояния могут быть нарушения сна, плаксивость, нарушение аппетита, аллергические высыпания, колики и постоянное бурчание в животе после кормления 1,3.
Сдача анализов
При возникновении симптомов недомогания у Вашего ребенка, обязательно проконсультируйтесь с врачом. Для постановки диагноза дисбактериоза врач может порекомендовать сдать анализ кала на дисбактериоз.
Как правильно собрать кал для анализа на дисбактериоз:
Кал собирается в стерильную баночку, предварительно прокипяченную вместе с крышкой в течение 20 минут. Посуда для анализа, на основании результатов которого будет проводиться лечение дисбактериоза у грудных детей, должна храниться в холодильнике не более суток. Собранный в стерильную емкость анализ доставляется в лабораторию в течение 2 часов (не позднее). Результаты подготавливаются через 7-10 дней.
Для получения информации о том, где можно приобрести Бифиформ Бэби , посетите раздел «Где купить».
БАД. НЕ ЯВЛЯЕТСЯ ЛЕКАРСТВЕННЫМ СРЕДСТВОМ
- Донских Е.Е. Микрофлора — Дисбактериоз у детей http://lekmed.ru/info/literatyra/disbakterioz-y-detei.html
- Корниенко Е.А., Мазанкова Л.Н., Горелов А.В. Применение пробиотиков в педиатрии: анализ лечебного и профилактического действия с позиций доказательной медицины. Лечащий врач 2015.
- И.А. Беляева. Пробиотические добавки для коррекции младенческих колик: перспективы использоавния.
- Беляева И.А., Митиш М.Д., Катосова Л.К. Эффективность использования пробиотиков у недоношенных детей. РМЖ 2009.
- Рыбальченко О.В., Бондаренко В.М. Оценка микробиоты и пробиотических штаммов с позиций новых научных технологий. Фарматека №11, 2016
- Бельмер С.В., Малкоч А.В. Кишечная микрофлора и значение пребиотиков для ее функционирования. Лечащий врач 2006, 4
PP-BIB-RUS-0082
Дисбактериоз у ребенка | Официальный сайт Huggies®
- Что такое дисбактериоз
- Дисбактериоз у детей: причины возникновения
- Дисбактериоз у ребенка: симптомы
- Лечение дисбактериоза у детей
- Немедикаментозное лечение дисбактериоза
Содержание:
Если у ребенка болит живот или плохо переваривается пища, врач часто ставит диагноз «дисбактериоз». Отечественные педиатры давно и успешно лечат детей от дисбактериоза, в то время как на западе такого слова не знают вовсе. Что же это за заболевание, как диагностировать и чем лечить дисбактериоз у ребенка?
Отечественные педиатры давно и успешно лечат детей от дисбактериоза, в то время как на западе такого слова не знают вовсе. Что же это за заболевание, как диагностировать и чем лечить дисбактериоз у ребенка?
Что такое дисбактериоз
Современные педиатры все чаще говорят, что дисбактериоз — это не болезнь, а состояние любых слизистых оболочек, при котором нарушен баланс микрофлоры. Чаще всего встречается дисбактериоз кишечника у детей — уменьшение полезной микрофлоры и размножение патогенных организмов.
Дисбактериоз у детей до года — очень распространенное явление. В норме в кишечнике человека присутствуют бифидо- и лактобактерии, они защищают кишечник от патологической флоры и токсинов, участвуют в пищеварении, позволяют полноценно усваивать белки, жиры, углеводы, витамины, различные кислоты.
Помимо полезных бактерий в кишечнике ребенка живут и условно-патогенные организмы (стафилококк, энтерококк и другие), которые в незначительном количестве не опасны, но размножаясь, могут вызывать признаки дисбактериоза у детей: тошноту, вздутие и боль в животе и так далее.
Дисбактериоз у детей: причины возникновения
Незрелость желудочно-кишечного тракта
Дисбактериоз у месячного ребенка чаще всего обусловлен несформированностью микрофлоры слизистых оболочек желудка и кишечника. Работа ЖКТ новорожденного еще только налаживается, и полезных бактерий для стабильной работы кишечника может не хватать.
Неправильное питание
Несоответствующее возрасту питание (частая смена смесей или слишком ранний ввод прикорма), а также употребление в пищу аллергенов (например, молочных продуктов при непереносимости лактозы) может способствовать развитию дисбактериоза.
Дисбактериоз после антибиотиков у ребенка
Если ребенок принимал антибиотики, естественная микрофлора его кишечника нарушается, так как антибиотики убивают любые бактерии, не разбирая, болезнетворные они или полезные.
Кишечные инфекции
Если функциональное нарушение пищеварения у грудного ребенка чаще всего вызвано незрелостью ЖКТ или погрешностями в питании, то дисбактериоз у ребенка 2 лет может быть следствием вирусной инфекции (ротавируса, дизентерии, сальмонеллеза), в результате которой в кишечник попали болезнетворные микробы.
Неблагоприятная экология
На состояние желудка и кишечника влияет и окружающая среда: загрязненный промышленными выхлопами воздух, химические отравления, недостаточно чистая питьевая вода могут спровоцировать развитие дисбактериоза.
Еще до обращения к врачу родители обычно понимают, что у ребенка дисбактериоз кишечника. Симптомы у детей проявляются довольно ярко и причиняют дискомфорт, особенно новорожденным и грудным малышам.
Дисбактериоз у ребенка: симптомы
Боли, чувство тяжести и вздутия в области живота, метеоризм;
расстройство стула: запоры или поносы;
остатки непереваренной пищи, слизь или крупинки в кале;
обильные срыгивания, отрыжка, а иногда и рвота;
шелушение и покраснение кожи, высыпания и опрелости, атопический дерматит;
выпадение волос, ломкость ногтей, кровоточивость десен;
неприятный запах изо рта;
белый или серый налет на языке;
темный налет на зубах;
плохой аппетит.

Многие заболевания ЖКТ имеют такие же симптомы, как симптомы дисбактериоза у детей. Лечение же должно быть различным, поэтому так важно правильно поставить диагноз.
Лечение дисбактериоза у детей
Для определения качественного и количественного состава микрофлоры кишечника необходимо сдать копрологический, биохимический и бактериологический анализ кала. В зависимости от того, какая условно-патогенная флора и в каких количествах будет обнаружена, врач-гастроэнтеролог подберет лечение.
Для борьбы с дисбактериозом применяются:
бактериофаги — препараты, уничтожающие бактерии-возбудители дисбактериоза;
пробиотики — препараты на основе живых микроорганизмов, позволяющие искусственно заселить кишечник полезной флорой;
пребиотики — неперевариваемые вещества (лактулоза, клетчатка), стимулирующие двигательную функцию кишечника;
пищеварительные ферменты — вещества, помогающие расщеплять и переваривать пищу.

При выборе препаратов учитывается и причина, вызвавшая дисбактериоз. Если виной расстройству кишечника — антибиотики, лечение будет одно, если аллергическая настроенность организма — другое.
Не выбирайте препараты для лечения микрофлоры кишечника самостоятельно. В аптеках их сейчас множество («Аципол», «Линекс», «Бифидумбактерин», «Бифиформ Малыш» и др.) и фармацевт обязательно посоветует вам что-нибудь, но неправильно подобранный препарат и неверная дозировка могут еще больше нарушить микрофлору кишечника.
Немедикаментозное лечение дисбактериоза
Заселяя кишечник ребенка полезной флорой, не забывайте и об основных принципах питания:
Сохраняйте грудное вскармливание
Дисбактериоз у грудных детей бывает реже, чем у детей на искусственном вскармливании, так как грудное молоко — источник полезных лактобактерий. Если сохранение или восстановление грудного вскармливания невозможно, применяйте лечебные смеси.
Придерживайтесь диеты
Если ребенок уже не питается грудным молоком, позаботьтесь о его диете: исключите из рациона сырые овощи, фрукты, белый хлеб, бобовые, молочные и другие продукты, повышающие газообразование. Основу рациона должны составлять крупы, нежирное мясо, кисломолочные продукты, из фруктов допускаются бананы и печеные яблоки.
Основу рациона должны составлять крупы, нежирное мясо, кисломолочные продукты, из фруктов допускаются бананы и печеные яблоки.
Соблюдайте режим дня
При лечении дисбактериоза очень важно создать для ребенка спокойные и комфортные условия, исключить стрессы и уделить внимание здоровому сну, прогулкам, физической активности на свежем воздухе.
Дисбактериоз у детей: лечим правильно!
На следующей стадии дисбактериоза, когда в микрофлоре уже появляются патогенные бактерии, проявлений значительно больше. Они могут быть похожи на симптомы различных заболеваний.
У грудных детей наблюдаются срыгивания, рвота, вздутие живота, через 1,5-2 часа после еды малыш беспокоится, притягивает ножки к животу, у него нарушается сон, он плохо прибавляет в весе.
У детей постарше могут наблюдаться признаки гастрита (воспаления желудка). После приема пищи появляется чувство распирания или боли в животе; снижается, а иногда и совсем пропадает аппетит; часто случается изжога, может появиться отрыжка, тошнота и даже рвота; периодически болит верхняя часть живота; постоянны усиленное газообразование и запоры.
Дисбактериоз может проявляться симптомами энтерита (воспаления тонкого кишечника), а именно частыми поносами, вздутием живота, метеоризмом, болями в животе. Ребенок становится раздражительным, но в то же время слабым, вялым, он быстро устает, жалуется на головную боль. Стул при этом жидкий, может быть пенистым, с кислым запахом, со слизью и зеленью.
В некоторых случаях дисбактериоз имеет все признаки энтероколита. Ребенок плохо растет, но зато энергично прибавляет в весе, жалуется на схваткообразные боли в животе, у него скопление газов, которые отходят с большим трудом, стул неустойчив: у одних детей частые поносы, у других — запоры.
Дети теряют интерес к пище, даже самые любимые в прошлом продукты им уже не по вкусу. Поскольку нарушаются всасывательные функции кишечника, наблюдается симптом проскальзывания пищи (только поел и уже просится на горшок), появляются сбои в обменных процессах. Дети вялы, им явно не хватает витаминов и минеральных веществ.
Порой дисбактериоз своими симптомами напоминает колит (воспаление толстого кишечника). У ребенка неустойчивый стул: то поносы, то запоры. Практически всегда присутствует синдром неполного опорожнения кишечника: после туалета малыш беспокоен, нервничает, не может объяснить, что его тревожит. Язык обложен налетом, скапливаются газы.
Дисбактериоз у детей, симптомы и лечение
Каждая вторая мама знакома с таким недугом, как дисбактериоз кишечника у детей. Особенно активно он прогрессирует при ослаблении иммунной системы малыша.
Дисбактериоз представляет собой сбой в работе кишечника из-за нарушения баланса полезных и «вредных» бактерий в желудочно-кишечном тракте. Устранение дисбактериоза кишечника у детей значительно повышает качество жизни как малыша, так и мамы.
Дисбактериоз – нарушение соотношения нормальной микрофлоры кишечника. Состояние редко имеет
идиопатический характер, не является самостоятельным заболеванием. Развивается в любом возрасте,
более уязвимы грудные дети. Чтобы противостоять дисбактериозу, стоит ознакомиться с провоцирующими
его факторами и знать, что делать при дисбактериозе кишечника у ребенка
Состояние редко имеет
идиопатический характер, не является самостоятельным заболеванием. Развивается в любом возрасте,
более уязвимы грудные дети. Чтобы противостоять дисбактериозу, стоит ознакомиться с провоцирующими
его факторами и знать, что делать при дисбактериозе кишечника у ребенка
Причины дисбактериоза и кишечный иммунитет
Перед рождением ребенок находится в стерильных условиях, его кишечник также стерилен. После первого сосания груди и приема молозива поступают питательные вещества, иммунные комплексы, гормоны, полезные бактерии. В течение последующих 5–7 дней бактериальные клетки колонизируются, подавляется рост патогенных микроорганизмов. У ослабленных и недоношенных малышей дисбаланс кишечной микрофлоры может развиваться самостоятельно, без фонового заболевания
Причины дисбактериоза у детей до года:
- неправильное питание кормящей женщины,
- резкая отмена грудного вскармливания,
- снижение иммунного ответа,
- кормление искусственными смесями,
- заражение золотистым стафилококком,
- прием антибактериальных средств.

Этиология дисбактериоза у детей после 1 года связана с глистной инвазией, частыми простудными болезнями, ослаблением моторики и ферментативной недостаточностью кишечника, подверженностью стрессовому воздействию. Все перечисленные состояния ведут к снижению иммунной реакции.
Местный иммунитет в кишечнике играет колоссальную роль в борьбе с патогенной микрофлорой, вирусными и бактериальными агентами. Клеточные макрофаги расщепляют и поглощают поступившие антигены.
Последствия ослабления иммунитета и возникновения дисбактериоза
Первым признаком дисбактериоза кишечника у детей является нарушение отхождения кашицеобразного стула.
Он становится жидким, с резким кислым запахом, цвет от бледно-желтого до болотно-зеленого или
отмечаются стойкие запоры с болезненным актом дефекации.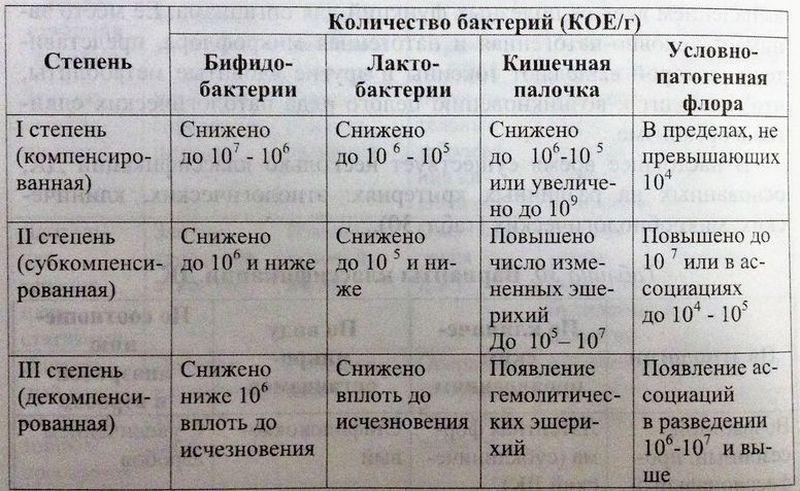
Другие последствия:
- урчание в животике;
- повышенное газообразование;
- появление колик у малыша, сопровождающееся болями;
- аллергические высыпания на фоне интоксикации;
- отставание в физическом развитии – недостаток витаминов группы В, витаминов Е, Д.
При выявлении подобных признаков рекомендовано обращение в клинику к педиатру. Только специалист сможет объективно оценить состояние здоровья малыша.
Первый сигнал о дисбактериозе – появление сыпи разной локализации на теле, которая чешется и для которой характерен полиморфизм высыпания. Так проявляются аллергические реакции на коже.
Что делать при дисбактериозе у малышей?
Коррекция дисбактериоза кишечника у детей направлена на устранение причины и симптомов нарушения. Женщинам, желающим узнать, как помочь малышу при коликах и газах, желательно ознакомиться с советами
доктора. Зачастую специалист назначает:
Женщинам, желающим узнать, как помочь малышу при коликах и газах, желательно ознакомиться с советами
доктора. Зачастую специалист назначает:
- бактериофаги;
- пероральные сорбенты;
- ферментативные средства;
- ветрогонные препараты;
- назначают пробиотики для малышей, чтобы заселить микрофлору, или пребиотики для стимуляции роста собственных колоний;
- иногда антибиотик;
- прием интерферонов.
Для коррекции дисбиоза также показаны прогулки на свежем воздухе, дополнение рациона питания пробиотическими продуктами и нормализация режима сна и отдыха детей
Как поддержать естественную микрофлору
Поддерживать естественную микрофлору кишечника могут помочь капли для приема внутрь – Аципол® Малыш,
капли. Они относятся к биологически активным добавкам, в состав которых входит необходимое
количество колониеобразующих организмов – лактобактерии, бифидобактерии.
Они относятся к биологически активным добавкам, в состав которых входит необходимое
количество колониеобразующих организмов – лактобактерии, бифидобактерии.
Способ дозирования средства очень прост – есть насадка-дозатор. Разводить вещество не нужно, оно выпускается в суспензии. Согласно инструкции по применению, Аципол® Малыш, капли дают ребенку 1 раз в день по 5 капель, допускается добавление в смесь, воду.
Действие компонентов Аципол® Малыш, капли
Действие Аципол® Малыш, капли сходно с аналогичными средствами, относящимися к группе пробиотиков. Лактобактерии и бифидобактерии заселяют желудочно-кишечный тракт и оказывают благотворное влияние на организм.
Образующиеся колонии полезных бактерий вытесняет патогенную микрофлору. Результатом использования
такого средства служит нормализация стула малыша, уменьшение болей в животике, снижение
интоксикации.
Стоит отметить, что применение только Аципол® Малыш, капли при дисбактериозе кишечника у детей нецелесообразно, обязательна комплексная терапия с применением лекарственных препаратов, которые вам назначит специалист вместе с Аципол® Малыш, капли
При выявлении первых признаков дисбактериоза у ребенка следует обратиться за медицинской помощью к профилирующему специалисту. Причин развития патологического состояния много, только специалист может определить этиологию недуга и назначить адекватное лечение с учетом возраста ребенка и степени тяжести патологии.
ABC-медицина
При эубиозе (то есть в норме) микрофлора кишечника представляет собой оптимальное соотношение различных бактерий – кишечной палочки, лактобацилл, энтерококков и др., всего более 500 видов. Дисбактериозом называют дисбаланс микробов, который длится продолжительное время. Это очень распространенное состояние, встречающееся примерно у 90 % взрослых и 95 % детей.
Это очень распространенное состояние, встречающееся примерно у 90 % взрослых и 95 % детей.
При должной коррекции, которую может назначить только врач, дисбактериоз кишечника проходит, но при отсутствии лечения обычно переходит в более тяжелую, прогрессирующую форму. Данное бактериологическое состояние принято рассматривать в качестве проявления или осложнения какого-либо заболевания, чаще всего – желудочно-кишечного тракта.
Причины развития дисбактериоза
Гибель полезных бактерий, населяющих микрофлору кишечника, может быть связана с такими факторами, как:
- изменение функций желудка, поджелудочной железы или печени, приводящее к недостатку пищеварительных ферментов и появлению непереваренных остатков пищи, которые способствуют росту болезнетворных микробов;
- пониженный тонус гладкой мускулатуры кишечника или ее спазмы, возникающие в результате психического или физического стресса, хирургического вмешательства, вегетососудистой дистонии – все это приводит к нарушению передвижения пищевых масс;
- различные заболевания желудочно-кишечного тракта, такие как холецистит, гастрит, панкреатит и пр.
 , связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов;
, связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов; - неправильное пищевое поведение (диеты, недостаток кисломолочных продуктов и клетчатки, употребление консервантов) препятствует нормальному росту полезных микробов или провоцирует их уничтожение;
- наличие в кишечнике паразитов или болезнетворных микробов, чьи продукты жизнедеятельности убивают полезные микроорганизмы – обычно это связано с дизентерией, сальмонеллезом, вирусными заболеваниями и пр.;
- прием антибиотиков, пагубно действующих не только на вредных микробов, но и на полезных.
К факторам, повышающим риск развития дисбактериоза кишечника, относят постоянные стрессы и неблагоприятную экологию, от которых страдают жители современных мегаполисов.
Общая симптоматика
Симптомы дисбактериоза кишечника различаются по локализации дисбиотических изменений и степени их выраженности. На тяжесть клинических проявлений влияют возраст, образ жизни, состояние иммунной системы, стадия развития патологии.
На тяжесть клинических проявлений влияют возраст, образ жизни, состояние иммунной системы, стадия развития патологии.
1 стадия
На данном этапе дисбаланс бактерий выражен слабо: пациента могут беспокоить небольшие расстройства кишечника. Обычно такое состояние связано с кратковременным воздействием на микрофлору, например, со сменой привычной пищи, напитков. После окончания воздействия провоцирующих факторов или привыкания к новым условиям баланс микрофлоры восстанавливается.
2 стадия
Прекращается производство кишечником необходимого количества ферментов, обеспечивающих нормальное пищеварение. В результате возникает процесс брожения, который проявляется болью и вздутием живота, горечью во рту, метеоризмом, запорами или, наоборот, диареей. Это могут быть симптомы как прогрессирующего дисбактериоза, так и развития заболеваний желудочно-кишечного тракта.
3 стадия
На этой стадии при воздействии большого количества патогенной флоры на стенки кишечника развивается воспалительный процесс. Такой дисбактериоз уже требует медицинского вмешательства. К выраженным симптомам добавляются тошнота, рвота, непереваренные фрагменты пищи в стуле, сильные боли в животе. В некоторых случаях – повышение температуры тела.
Такой дисбактериоз уже требует медицинского вмешательства. К выраженным симптомам добавляются тошнота, рвота, непереваренные фрагменты пищи в стуле, сильные боли в животе. В некоторых случаях – повышение температуры тела.
4 стадия
Это состояние кишечника, при котором нормальная микрофлора практически полностью вытеснена болезнетворными микроорганизмами, что приводит к нарушению всасывания полезных веществ, развитию авитаминоза и даже анемии. Образующиеся в результате токсины попадают в кровь и провоцируют тяжелые аллергические реакции. Клинические проявления включают возникновение сыпи, экземы, крапивницы, возможно развитие астмы, бессонницы, хронической усталости. Пациент может жаловаться на проблемы с концентрацией внимания. При отсутствии своевременного лечения возникает угроза развития тяжелых кишечных инфекций.
Крайняя степень дисбактериоза – проникновение бактерий желудочно-кишечного тракта в кровь (бактериемия), в некоторых случаях – развитие сепсиса.
Диагностика дисбактериоза
Основная цель диагностики – определение вида микробов, заселяющих кишечник, и их количества. Как правило, используются следующие основные методы:
- бактериологическое исследование, на качество результатов которого влияют соблюдение сроков доставки и сохранности материала, а также условий культивирования разных видов бактерий;
- исследование метаболитов микрофлоры, которое основано на определении летучих жирных кислот, выделяемых микроорганизмами. Отличается точностью результатов, простотой и оперативностью выполнения.
При проведении диагностики и постановке диагноза учитывается также, что микрофлора кишечника индивидуальна для каждого человека. Ее состав может зависеть от возраста, потребляемой пищи и сезона. В связи с этим специалист основывается не только на результатах анализов, но и на дополнительных обследованиях, позволяющих выявить причину развития дисбактериоза.
Лечение дисбактериоза
Лечение дисбактериоза у взрослых зависит от причин и симптомов и назначается комплексно. Стандартная схема обычно включает меры, направленные на:
Стандартная схема обычно включает меры, направленные на:
- устранение избыточности патогенных микроорганизмов;
- восстановление нормальной микрофлоры;
- улучшение процесса пищеварения;
- нормализацию моторики кишечника;
- стимулирование реактивности всего организма.
Помните, что назначить грамотное и эффективное лечение может только специалист. Чтобы получить квалифицированную консультацию, запишитесь на прием к врачу клиники «АВС-Медицина» по номеру +7 (495) 223-38-83 или заполните заявку на нашем сайте.
причины и симптомы у детей и взрослых. Бифилакт БИОТА — Биота
Появление сыпи при дисбактериозе является одним из распространенных симптомов, поскольку данное заболевание тесно связано с аллергической реакцией. Большинство аллергических проявлений и некоторых видов дерматита спровоцированы именно нарушением состава микрофлоры кишечника.
Причины возникновения дисбактериоза
Сыпь при дисбактериозе может появиться при наличии следующих негативных факторов:
сниженная иммунная система;
несбалансированное питание, преобладание в рационе вредных продуктов;
наличие таких заболеваний, как язва, гастрит, панкреатит, протекающих на фоне дисбактериоза;
хирургическое вмешательство на органах ЖКТ;
ранее перенесенные заболевания инфекционного характера: сальмонеллез, дизентерия;
бесконтрольный и частый прием антибактериальных препаратов.

Сыпь при дисбактериозе
Раскрыть причину развития сыпи при дисбактериозе получается практически всегда, ввиду ее взаимосвязи с аллергической реакцией. Многие болезни аллергического характера протекают на фоне нарушенного состава микрофлоры кишечника, к таким относятся пищевая аллергия, бронхиальная астма, крапивница, экзема и некоторые виды дерматита.
Основной причиной появления сыпи при дисбактериозе является повышенная чувствительность организма к тем или иным аллергенам.
Иммунитет полностью формируется только к школьному возрасту. Из-за ее незрелости организм ребенка не в силах справиться с активностью аллергенов, которые при контакте с иммунитетом дают ответную реакцию в виде сыпи. Сыпь при дисбактериозе у взрослых может развиться при пищевой аллергии, спровоцированной вторжением в организм аллергенов и нарушением пищеварения. Если аллергеном является какой-либо продукт, то сыпь может появляться постоянно. Хроническая форма дисбактериоза на фоне пищевой аллергии является признаком нарушения пищеварения, при этом обнаружить раздражителя довольно тяжело, поэтому повторные реакции приводят к внутренним и функциональным нарушениям в пищеварительном канале и различных органах.
Дисбактериоз высыпания на коже ребенка
Выявить причину появления сыпи при дисбактериозе легко, поскольку заболевание имеет отношение к аллергической реакции. На фоне нарушения микрофлоры кишечника у детей нередко наблюдается развитие других заболеваний.
Дисбактериоз проявляется ответной реакцией организма на раздражитель в виде сыпи и шелушения. К причинам появления высыпаний у детей относятся:
искусственное вскармливание;
травмирование малыша во время родов;
применение медикаментозных препаратов во время кормления грудью.
Высыпания у ребенка локализуются на одной части или на всей поверхности тела малыша. Сыпь может иметь красный оттенок, кожа в пораженном месте подвергается шелушению. При своевременном устранении первопричин, заболевание способно пройти самостоятельно.
Симптомы дисбактериоза грудничков
Сыпь при дисбактериозе у грудничков в виде кратковременного проявления является нормой, но если признаки повторяются раз за разом, то это может говорить об устойчивом дисбалансе состава микрофлоры. К основным симптомам дисбактериоза относятся:
К основным симптомам дисбактериоза относятся:
Малыш срыгивает после каждого кормления. В большинстве случаев данный симптом не является патологическим, поскольку наблюдается у многих младенцев. Рекомендуется после приема пищи держать ребенка около 10 минут в вертикальном положении. При развитии дисбактериоза срыгивания являются обильными, иногда переходящими в рвоту.
Колики и повышенное газообразование. О данных проявлениях может указывать поведение ребенка, его беспокоят газики, он капризничает, плачет, прижимает ножки к животу.
Нарушение стула. При дисбактериозе у грудничка наблюдается смена запора диареей.
Частые запоры. При естественном вскармливании грудничка, опорожнение кишечника происходит раз в три дня, не вызывая дискомфорта, что является нормой. При искусственном вскармливании опорожнение должно быть чаще – раз в сутки. При развитии дисбактериоза стул формируется намного реже.
Жидкий зеленый стул.
 При дисбактериозе стул грудничка может приобретать зеленый цвет, примеси, белые комочки, кал пениться и имеет неприятный запах.
При дисбактериозе стул грудничка может приобретать зеленый цвет, примеси, белые комочки, кал пениться и имеет неприятный запах.Беспокойство ребенка. При нарушении микрофлоры ребенок плохо спит и ест, не набирает в весе.
Стоит учесть, что установить точный диагноз только по клинической картине нельзя, поэтому врач должен назначить ряд анализов.
Причины высыпаний при дисбактериозе
Не всегда появление высыпаний при дисбактериозе говорит о взаимосвязи с аллергией. У взрослых причинами развития дисбактериоза служит неправильное питание, сниженный иммунитет, ранее проведенные операции органов ЖКТ, прием лекарственных препаратов.
Нарушение микрофлоры кишечника у детей зачастую зависит от характера питания. К основным причинам нарушения состава флоры у детей относятся:
Перекорм. Многие молодые мамы выбирают метод кормления по требованию, но стоит учесть что ребенок может проголодаться только через 2-3 часа при достаточном объеме молока.
 При слишком частом кормлении может возникнуть проблема с пищеварением и-за недостаточной выработки ферментов. Пища не переваривается до конца, что приводит к гнилостному процессу и брожению, вызывая колики, вздутие и другие симптомы.
При слишком частом кормлении может возникнуть проблема с пищеварением и-за недостаточной выработки ферментов. Пища не переваривается до конца, что приводит к гнилостному процессу и брожению, вызывая колики, вздутие и другие симптомы.Недокорм. Если ребенок съедает только переднее грудное молоко, богатое лактозой, но с недостаточным количеством жиров, то у него могут появиться такие симптомы, как жидкий стул зеленого цвета и вздутие живота. Поэтому необходимо, чтобы ребенок высасывал и заднее молоко, содержащее ферменты и жиры, для этого не следует давать вторую грудь, пока малыш не опустошит первую.
Смена смесей. Если малыш на искусственном вскармливании, то дисбактериоз может развиться при переходе на другую смесь. Организму необходимо некоторое время, чтобы он подстроился под новый состав смеси и выработал необходимые ферменты.
Ранний прикорм. Нарушение функций ЖКТ происходит, если ребенок до полугода начинает употреблять различные соки, мясные блюда и овощи.
 Необходимо вводить прикорм согласно возрасту ребенка. При появлении симптомов дисбактериоза необходимо пересмотреть рацион малыша.
Необходимо вводить прикорм согласно возрасту ребенка. При появлении симптомов дисбактериоза необходимо пересмотреть рацион малыша.
В большинстве случаев при устранении неподходящих продуктов и нормализации питания, симптомы дисбактериоза проходят самостоятельно. Более тяжелые формы заболевания, спровоцированные попаданием в организм инфекции, требует комплексного лечения.
Сыпь у ребенка при дисбактериозе
Сыпь у ребенка является ответной реакцией организма на нарушение состава микрофлоры кишечника, при усвоении организмом минералов и витаминов, поступающих с пищей. Также нередко, помимо высыпаний можно встретить кровоточивость десен. Стоит помнить, что самостоятельное назначение препаратов запрещено, только специалист вправе назначить лечение на основании результатов анализов.
Зафиксированы случаи скрытой формы дисбактериоза у детей при котором заболевание не имеет ярко выраженной симптоматики. У малыша часто возникают простудные заболевания, он плохо спит, не набирает в весе, на коже имеются высыпания, что косвенно может указывать на нарушение микрофлоры кишечника. При возникновении каких-либо подозрений, необходимо обратиться к врачу, который проведет диагностику с помощью анализов.
При возникновении каких-либо подозрений, необходимо обратиться к врачу, который проведет диагностику с помощью анализов.
Для выявления дисбактериоза требуется провести анализ кала, способный показать концентрацию бактерий в кишечнике ребенка.
Стоит помнить, что стул грудничка имеет жидкую консистенцию, поэтому содержание бактерий в кале не всегда свидетельствует о развитии дисбактериоза. Кал необходимо собрать в стерильную емкость в день сдачи анализов и только после подтверждения нарушения состава микрофлоры врач назначает соответствующее лечение.
Сыпь при дисбактериозе у взрослых
Нарушение микрофлоры кишечника в большинстве случаев проявляется целым комплексом признаков характерных для заболевания, обусловленных качественным или количественным составом флоры кишечника.Заболевание часто диагностируется на фоне сниженной иммунной системы или нарушении обменных процессов в организме. Поэтому дисбактериоз нельзя оставлять без внимания, он требует должного лечения.
Нарушение микрофлоры кишечника у взрослых может проявляться в разнообразной симптоматике. Чаще всего заболевание имеет аллергический характер, поэтому основными признаками дисбактериоза являются высыпания, зуд кожи и плохое самочувствие. Помимо проявлений на поверхности кожи, у больного появляется боль в животе, отрыжка, потеря аппетита, рвота, запор или диарея.
Сыпь при дисбактериозе у взрослого может развиться на фоне приема антибиотиков, при наличии инфекционного заболевания или вследствие перенесенной операции. Также высыпания могут быть при протекании дисбактериоза на фоне таких заболеваний, как язва, гастрит или панкреатит.
Неправильное и несбалансированное питание также может стать причиной появления сыпи. Если в рационе преобладает жареная, соленая и жирная пища, но отсутствуют кисломолочные продукты и клетчатка, то со временем может произойти нарушение работы пищеварительной системы.
При появлении сыпи и других симптомов необходимо обратиться к специалисту, который на основании анализов и постановления диагноза назначит лечение.
Дисбактериоз кишечника новорожденных | Журнал перинатологии
Домингес-Белло М.Г., Годой-Виторино Ф., Найт Р., Блазер М.Дж. Роль микробиома в развитии человека. Кишечник. 2019; 68: 1108–14.
CAS PubMed PubMed Central Google ученый
Генсоллен Т., Айер С.С., Каспер Д.Л., Блумберг Р.С. Как колонизация микробиотой в раннем возрасте формирует иммунную систему. Наука. 2016; 352: 539–44.
CAS PubMed PubMed Central Google ученый
Ayres JS. Совместное поведение микробной толерантности в мутуализме микробиоты хозяина. Клетка. 2016; 165: 1323–31.
CAS PubMed PubMed Central Google ученый
Санчес К.К., Чен Г.Й., Шибер AMP, Редфорд С.Е., Шохирев М.Н., Леблан М. и др. Совместная метаболическая адаптация хозяина может способствовать бессимптомной инфекции и способствовать снижению вирулентности кишечного патогена. Клетка. 2018; 175: 146–58.e15.
CAS PubMed PubMed Central Google ученый
Сорбара МТ, Памер Э.Г. Межбактериальные механизмы устойчивости к колонизации и стратегии, используемые патогенами для их преодоления. Mucosal Immunol. 2019; 12: 1–9.
CAS PubMed PubMed Central Google ученый
Ко А., Бэкхед Ф. От ассоциации к причинной связи: роль микробиоты кишечника и ее функциональных продуктов в метаболизме хозяина. Mol Cell. 2020; 78: 584–96.
2020; 78: 584–96.
CAS PubMed PubMed Central Google ученый
Геверс Д., Кугатасан С., Денсон Л.А., Васкес-Баеза И., Ван Треурен В., Рен Б. и др. Микробиом, не получавший лечения при впервые возникшей болезни Крона. Клетка. Хост-микроб. 2014; 15: 382–92.
CAS PubMed PubMed Central Google ученый
Клингберг Э., Магнуссон М.К., Стрид Х., Демингер А., Шталь А., Сундин Дж. И др. Различный состав микробиоты кишечника у пациентов с анкилозирующим спондилитом связан с повышенным уровнем калпротектина в кале.Arthritis Res Ther. 2019; 21: 248.
CAS PubMed PubMed Central Google ученый
Фалони Дж., Джоосенс М., Виейра-Силва С., Ван Дж., Дарзи Й., Фауст К. и др. Популяционный анализ изменчивости микробиома кишечника. Наука. 2016; 352: 560–4.
CAS PubMed PubMed Central Google ученый
Яцуненко Т.Р., Манари М.Дж., Трехан И., Домингес-Белло М.Г., Контрерас М., Магрис М. и др.Микробиом кишечника человека в зависимости от возраста и географии. Природа 2012; 486: 222–7.
CAS PubMed PubMed Central Google ученый
Биттингер К., Чжао С., Ли Й, Форд Э, Фридман Э.С., Ни Дж. И др. Бактериальная колонизация перепрограммирует метаболом кишечника новорожденных. Nat Microbiol. 2020; 5: 838–47.
CAS PubMed PubMed Central Google ученый
Vangay P, Ward T, Gerber JS, Knights D. Антибиотики, детский дисбактериоз и болезни. Клетка. Хост-микроб. 2015; 17: 553–64.
CAS PubMed PubMed Central Google ученый
Deshmukh HS, Liu Y, Menkiti OR, Mei J, Dai N, O’Leary CE, et al. Микробиота регулирует гомеостаз нейтрофилов и устойчивость хозяина к сепсису Escherichia coli K1 у новорожденных мышей. Nat Med. 2014; 20: 524–30.
CAS PubMed PubMed Central Google ученый
Грачи MG, Гарретт WS. Кишечник. микробиота, метаболиты и иммунитет хозяина. Nat Rev Immunol. 2016; 16: 341–52.
CAS PubMed PubMed Central Google ученый
Ольшак Т., Ан Д., Цейссиг С., Вера М.П., Рихтер Дж., Франке А. и др. Воздействие микробов в молодом возрасте оказывает стойкое влияние на функцию естественных Т-клеток-киллеров. Наука. 2012; 336: 489–93.
CAS PubMed PubMed Central Google ученый
Кокс Л.М., Яманиши С., Сон Дж., Алексеенко А.В., Леунг Дж. М., Чо И. и др. Изменение микробиоты кишечника во время критического периода развития имеет долгосрочные метаболические последствия. Клетка. 2014; 158: 705–21.
CAS PubMed PubMed Central Google ученый
Кимура И., Миямото Дж., Оуэ-Китано Р., Ватанабе К., Ямада Т., Онуки М. и др. Микробиота кишечника матери во время беременности влияет на метаболический фенотип потомства мышей. Наука. 2020; 367: eaaw8429.
Наука. 2020; 367: eaaw8429.
CAS PubMed PubMed Central Google ученый
Гордон Х.А., Пести Л. Животное-гнотобиотическое животное как инструмент в изучении микробных взаимоотношений хозяина. Бактериол. Ред. 1971; 35: 390–429.
CAS PubMed PubMed Central Google ученый
Лучински П., МакВей Нойфельд К.А., Ориач К.С., Кларк Дж., Динан Т.Г., Крайан Дж. Ф.Выращивание в пузыре: использование стерильных животных для оценки влияния микробиоты кишечника на мозг и поведение. Int J Neuropsychopharmacol. 2016; 19: pyw020.
PubMed PubMed Central Google ученый
Уилкс М. Бактерии и раннее развитие человека. Early Hum Dev. 2007; 83: 165–70.
PubMed PubMed Central Google ученый
Гериг Дж. Л., Венкатеш С., Чанг Х. В., Хибберд М. С., Кунг В. Л., Ченг Дж. И др.Влияние продуктов, направленных на микробиоту, на животных-гнотобиотов и детей с недостаточным питанием. Наука. 2019; 365: eaau4732.
PubMed PubMed Central Google ученый
Turnbaugh PJ, Ley RE, Mahowald MA, Magrini V, Mardis ER, Gordon JI. Микробиом кишечника, связанный с ожирением, с повышенной способностью собирать энергию. Природа. 2006; 444: 1027–31.
PubMed PubMed Central Google ученый
Safari Z, Джерард П. Связь между микробиомом кишечника и неалкогольной жировой болезнью печени (НАЖБП). Клетка. Mol Life Sci. 2019; 76: 1541–58.
CAS PubMed PubMed Central Google ученый
Цзян Ц., Ли Дж., Хуанг П., Лю З., Чжао Б. Микробиота кишечника и болезнь Альцгеймера. J. Alzheimers Dis. 2017; 58: 1–15.
PubMed PubMed Central Google ученый
Lee YP, Chiu CC, Lin TJ, Hung SW, Huang WC, Chiu CF, et al. Моноколонизация мышей без микробов с помощью Bacteroides fragilis улучшает индуцированный азоксиметаном / декстрансульфатом натрия колоректальный рак, вызванный колитом. Immunopharmacol Immunotoxicol. 2019; 41: 207–13.
CAS PubMed PubMed Central Google ученый
Tissier H. Recherches sur la flore кишечника дез нурриссон. C R Mem Soc Biol. 1899; 51: 943.
Google ученый
Logan WR. Кишечная флора младенцев и детей раннего возраста. J Pathol. 1913; 18: 527–51.
Google ученый
Гарридо Д., Бариле Д., Миллс Д.А. Молекулярная основа обогащения бифидобактериями желудочно-кишечного тракта младенцев. Adv Nutr. 2012; 3: 415С – 21С.
CAS PubMed PubMed Central Google ученый
Ruiz-Moyano S, Totten SM, Garrido DA, Smilowitz JT, German JB, Lebrilla CB, et al.Различия в потреблении олигосахаридов грудного молока младенческими кишечными штаммами Bifidobacterium breve. Appl Environ Microbiol. 2013; 79: 6040–9.
Appl Environ Microbiol. 2013; 79: 6040–9.
CAS PubMed PubMed Central Google ученый
Живкович AM, German JB, Lebrilla CB, Mills DA. Гликобиом грудного молока и его влияние на микробиоту желудочно-кишечного тракта младенцев. Proc Natl Acad Sci USA. 2011; 108 (Приложение 1): 4653–8.
CAS Google ученый
Хенрик Б.М., Хаттон А.А., Палумбо М.С., Касабури Дж., Митчелл Р.Д., Андервуд М.А. и др. Повышенный pH фекалий указывает на глубокое изменение микробиома кишечника грудного ребенка из-за уменьшения количества бифидобактерий за последнее столетие. мСфера. 2018; 3: e00041–18.
PubMed PubMed Central Google ученый
Litvak Y, Byndloss MX, Tsolis RM, Baumler AJ. Распространение дисбиотических протеобактерий: микробный признак дисфункции эпителия.Curr Opin Microbiol. 2017; 39: 1–6.
CAS Google ученый
Милани С., Дуранти С., Боттачини Ф., Кейси Е., Туррони Ф., Махони Дж. И др. Первые микробные колонизаторы кишечника человека: состав, деятельность и последствия для здоровья микробиоты кишечника младенца. Microbiol Mol Biol Rev.2017; 81: e00036-17.
PubMed PubMed Central Google ученый
La Rosa PS, Warner BB, Zhou Y, Weinstock GM, Sodergren E, Hall-Moore CM и др. Наблюдаемое развитие бактериальных популяций в кишечнике недоношенных детей. Proc Natl Acad Sci USA. 2014; 111: 12522–7.
2014; 111: 12522–7.
Google ученый
Korpela K, Blakstad EW, Moltu SJ, Strommen K, Nakstad B, Ronnestad AE, et al. Развитие кишечной микробиоты и гестационный возраст у недоношенных новорожденных. Научный отчет 2018; 8: 2453.
PubMed PubMed Central Google ученый
Ватанен Т., Плихта Д.Р., Сомани Дж., Мунк П.К., Артур Т.Д., Холл А.Б. и др. Геномная изменчивость и штамм-специфическая функциональная адаптация микробиома кишечника человека в раннем возрасте. Nat Microbiol. 2019; 4: 470–9.
CAS Google ученый
Raman AS, Gehrig JL, Venkatesh S, Chang HW, Hibberd MC, Subramanian S, et al. Единица разреженного коваринга, которая описывает развитие здоровой и нарушенной микробиоты кишечника человека. Наука. 2019; 365: eaau4735.
Единица разреженного коваринга, которая описывает развитие здоровой и нарушенной микробиоты кишечника человека. Наука. 2019; 365: eaau4735.
PubMed PubMed Central Google ученый
Younge NE, Newgard CB, Cotten CM, Goldberg RN, Muehlbauer MJ, Bain JR, et al. Нарушение созревания микробиоты и метаболома у крайне недоношенных детей с послеродовой задержкой роста. Научный доклад 2019; 9: 8167.
PubMed PubMed Central Google ученый
Лю Дж, Ли Й, Фэн Й, Пан Л, Се З, Янь З и др.Структурированное прогрессирование микробиоты кишечника, связанное с некротическим энтероколитом и поздним сепсисом у недоношенных детей: проспективное исследование в отделении интенсивной терапии новорожденных в Китае. PeerJ. 2019; 7: e7310.
PeerJ. 2019; 7: e7310.
PubMed PubMed Central Google ученый
Галаццо Дж., Ван Бест Н., Бервоетс Л., Дапаа И.О., Савелкул PH, Хорнеф М.В. и др. Развитие микробиоты и ассоциации с режимом рождения, диетой и атопическими расстройствами в продольном анализе образцов стула, собранных с младенчества до раннего детства.Гастроэнтерология. 2020; 158: 1584–96.
CAS Google ученый
Madan JC, Hoen AG, Lundgren SN, Farzan SF, Cottingham KL, Morrison HG, et al. Связь кесарева сечения и добавления смеси с кишечным микробиомом 6-недельных младенцев. JAMA Pediatr. 2016; 170: 212–9.
PubMed PubMed Central Google ученый
Стюарт С.Дж., Аджами, штат Нью-Джерси, О’Брайен Д.Л., Хатчинсон Д.С., Смит Д.П., Вонг М.К. и др.Временное развитие микробиома кишечника в раннем детстве по данным исследования TEDDY. Природа. 2018; 562: 583–8.
CAS PubMed PubMed Central Google ученый
Combellick JL, Shin H, Shin D, Cai Y, Hagan H, Lacher C и др. Различия в фекальной микробиоте новорожденных, рожденных дома или в больнице. Научный доклад 2018; 8: 15660.
PubMed PubMed Central Google ученый
Savage JH, Lee-Sarwar KA, Sordillo JE, Lange NE, Zhou Y, O’Connor GT и др. Диета во время беременности и младенчества и микробиом кишечника младенца. J Pediatr. 2018; 203: 47–54. e4.
e4.
PubMed PubMed Central Google ученый
Лундгрен С.Н., Мадан Дж. К., Эмонд Дж. А., Моррисон Х. Г., Кристенсен Б. К., Карагас М. Р. и др. Диета матери во время беременности связана с микробиомом детского стула в зависимости от способа родов.Микробиом. 2018; 6: 109.
PubMed PubMed Central Google ученый
Williams JE, Carrothers JM, Lackey KA, Beatty NF, Brooker SL, Peterson HK, et al. Между молочным, оральным и фекальным микробиомами в диадах мать-младенец существуют сильные многомерные отношения в течение первых шести месяцев после родов. J Nutr. 2019; 149: 902–14.
PubMed PubMed Central Google ученый
Азад М.Б., Конья Т., Персо Р.Р., Гутман Д.С., Чари Р.С., Филд С.Дж. и др. Влияние антибиотиков во время родов, метода родов и грудного вскармливания на микробиоту кишечника в течение первого года жизни: проспективное когортное исследование. Int J Obstet Gynaecol. 2016; 123: 983–93.
CAS Google ученый
Coker MO, Hoen AG, Dade E, Lundgren S, Li Z, Wong AD, et al. Конкретный класс антибиотиков во время родов связан с созреванием микробиоты кишечника младенца: проспективное когортное исследование.Int J Obstet Gynaecol. 2020; 127: 217–27.
CAS Google ученый
Eck A, Rutten N, Singendonk MMJ, Rijkers GT, Savelkoul PHM, Meijssen CB, et al. Развитие микробиоты новорожденных и действие антибиотиков в раннем возрасте определяется двумя разными типами поселенцев. PloS ONE. 2020; 15: e0228133.
PloS ONE. 2020; 15: e0228133.
CAS PubMed PubMed Central Google ученый
Гупта Р.В., Тран Л., Норори Дж., Феррис М.Дж., Эрен А.М., Тейлор С.М. и др. Блокаторы рецепторов гистамина-2 изменяют фекальную микробиоту у недоношенных детей. J Pediatr Gastroenterol Nutr. 2013; 56: 397–400.
CAS Google ученый
Леви Э.И., Хоанг Д.М., Ванденплас Й. Влияние ингибиторов протонной помпы на микробиом у маленьких детей. Acta Paediatr. 2020; 109: 1531–8.
CAS Google ученый
Vich Vila A, Collij V, Sanna S, Sinha T, Imhann F, Bourgonje AR, et al. Влияние часто используемых препаратов на состав и метаболическую функцию микробиоты кишечника. Nat Commun. 2020; 11: 362.
Влияние часто используемых препаратов на состав и метаболическую функцию микробиоты кишечника. Nat Commun. 2020; 11: 362.
CAS PubMed PubMed Central Google ученый
Джексон М.А., Верди С., Максан М.Э., Шин С.М., Зирер Дж., Бойер Р.Ц.и др. Связь микробиоты кишечника с распространенными заболеваниями и лекарствами, отпускаемыми по рецепту, в популяционной когорте.Nat Commun. 2018; 9: 2655.
PubMed PubMed Central Google ученый
Iszatt N, Janssen S, Lenters V, Dahl C, Stigum H, Knight R, et al. Экологические токсиканты в грудном молоке норвежских матерей, а также состав и метаболиты кишечных бактерий у их младенцев в возрасте 1 месяца. Микробиом 2019; 7: 34.
PubMed PubMed Central Google ученый
Лауэ Х.Э., Моройши Ю., Джексон Б.П., Палис Т.Дж., Мадан Дж.С., Карагас МР.Смеси питательных и токсичных элементов и микробиом кишечника в раннем постнатальном периоде в когорте продольных рождений в США. Environ Int. 2020; 138: 105613.
CAS Google ученый
Маклин С., Джун С., Козырский А. Влияние курения матери на микробиоту кишечника младенца и его связь с избыточным весом ребенка: обзорный обзор. Мир J Pediatr. 2019; 15: 341–9.
Google ученый
Tun HM, Konya T, Takaro TK, Brook JR, Chari R, Field CJ и др. Контакт с домашними пушистыми домашними животными влияет на микробиоту кишечника младенца в возрасте 3-4 месяцев после различных сценариев рождения. Микробиом. 2017; 5: 40.
Микробиом. 2017; 5: 40.
PubMed PubMed Central Google ученый
D’Agata AL, Wu J, Welandawe MKV, Dutra SVO, Kane B, Groer MW. Влияние стресса ОИТН в раннем возрасте на развивающийся микробиом кишечника. Dev Psychobiol. 2019; 61: 650–60.
PubMed PubMed Central Google ученый
Ho TTB, Groer MW, Kane B, Yee AL, Torres BA, Gilbert JA, et al. Дихотомическое развитие микробиома кишечника у недоношенных детей. Микробиом. 2018; 6: 157.
PubMed PubMed Central Google ученый
Парра-Льорка А., Гормаз М., Алькантара С. , Сернада М., Нуньес-Рамиро А., Венто М. и др. Микробиом кишечника недоношенных в зависимости от типа кормления: значение донорского грудного молока.Front Microbiol. 2018; 9: 1376.
, Сернада М., Нуньес-Рамиро А., Венто М. и др. Микробиом кишечника недоношенных в зависимости от типа кормления: значение донорского грудного молока.Front Microbiol. 2018; 9: 1376.
PubMed PubMed Central Google ученый
Тафт Д.Х., Салинеро Л.К., Вонгбхавит К., Каланетра К.М., Масарве К., Ю А. и др. Бактериальная колонизация и гены устойчивости к противомикробным препаратам в неонатальных трубках для энтерального питания. FEMS Microbiol Ecol. 2019; 95: физ039.
CAS PubMed PubMed Central Google ученый
Ногачка А., Салазар Н., Суарес М., Милани С., Арболея С., Солис Г. и др.Влияние антимикробной профилактики во время родов на микробиоту кишечника и распространенность генов устойчивости к антибиотикам у доношенных новорожденных, родившихся через естественные родовые пути. Микробиом. 2017; 5: 93.
Микробиом. 2017; 5: 93.
PubMed PubMed Central Google ученый
Гаспаррини А.Дж., Крофтс Т.С., Гибсон М.К., Тарр П.И., Уорнер Б.Б., Дантас Г. Нарушение антибиотиками микробиома кишечника недоношенных детей и резистома. Кишечные микробы. 2016; 7: 443–9.
CAS PubMed PubMed Central Google ученый
Гибсон М.К., Ван Б., Ахмади С., Бернхэм Калифорния, Тарр П.И., Уорнер Б.Б. и др. Динамика развития микробиоты кишечника недоношенных новорожденных и антибиотикорезистома. Nat Microbiol. 2016; 1: 16024.
CAS PubMed PubMed Central Google ученый
Rutayisire E, Huang K, Liu Y, Tao F. Способ родоразрешения влияет на разнообразие и характер колонизации кишечной микробиоты в течение первого года жизни младенцев: систематический обзор.BMC Gastroenterol. 2016; 16:86.
PubMed PubMed Central Google ученый
Dahl C, Stigum H, Valeur J, Iszatt N, Lenters V, Peddada S, et al. У недоношенных новорожденных есть различные микробиомы, которые не объясняются способом родов, продолжительностью грудного вскармливания или воздействием антибиотиков. Int J Epidemiol. 2018; 47: 1658–69.
PubMed PubMed Central Google ученый
Tun MH, Tun HM, Mahoney JJ, Konya TB, Guttman DS, Becker AB. и другие. Послеродовое воздействие бытовых дезинфицирующих средств, микробиоты кишечника младенцев и последующий риск избыточного веса у детей. Can Med Assoc J. 2018; 190: E1097 – e107.
Can Med Assoc J. 2018; 190: E1097 – e107.
Google ученый
Шоу К.А., Берта М., Хофмеклер Т., Чопра П., Ватанен Т., Шриватса А. и др. Дисбактериоз, воспаление и реакция на лечение: продольное исследование педиатрических субъектов с недавно диагностированным воспалительным заболеванием кишечника.Genome Med. 2016; 8: 75.
PubMed PubMed Central Google ученый
Xia GH, You C, Gao XX, Zeng XL, Zhu JJ, Xu KY, et al. Индекс дисбактериоза инсульта (SDI) в микробиоме кишечника связан с травмой головного мозга и прогнозом инсульта. Фронт Neurol. 2019; 10: 397.
PubMed PubMed Central Google ученый
Го Й, Чжан И, Герхард М., Гао Дж. Дж., Мехиас-Луке Р., Чжан Л. и др.Влияние Helicobacter pylori на микробиоту желудочно-кишечного тракта: популяционное исследование в Linqu, зоне высокого риска рака желудка. Кишечник. 2019. https://doi.org/10.1136/gutjnl-2019-319696.
Casen C, Vebo HC, Sekelja M, Hegge FT, Karlsson MK, Ciemniejewska E, et al. Отклонения в микробиоте кишечника человека: новый диагностический тест для определения дисбактериоза у пациентов с IBS или IBD. Пищевая Pharmacol Therap. 2015; 42: 71–83.
CAS Google ученый
Мандл Т., Марсал Дж., Олссон П., Олссон Б., Андреассон К. Тяжелый кишечный дисбактериоз распространен при первичном синдроме Шегрена и связан с системной активностью заболевания. Arthritis Res Ther. 2017; 19: 237.
Arthritis Res Ther. 2017; 19: 237.
PubMed PubMed Central Google ученый
Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоса Э.А., Яссур М. и др. Изменение иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей.Клетка. 2016; 165: 842–53.
CAS PubMed PubMed Central Google ученый
Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. 2018; 562: 589–94.
CAS PubMed PubMed Central Google ученый
Chua HH, Chou HC, Tung YL, Chiang BL, Liao CC, Liu HH, et al.Дисбактериоз кишечника с обилием ruminococcus gnavus ассоциируется с аллергическими заболеваниями у младенцев. Гастроэнтерология. 2018; 154: 154–67.
PubMed PubMed Central Google ученый
Lee MJ, Kang MJ, Lee SY, Lee E, Kim K, Won S, et al. Нарушения генов микробиома кишечника у младенцев с атопическим дерматитом в зависимости от типа кормления. J Allergy Clin Immunol. 2018; 141: 1310–9.
CAS PubMed PubMed Central Google ученый
Ламонт Р.Ф., Моллер Люф Б., Стенер Йоргенсен Дж. Воспалительное заболевание и нарушение обмена веществ у детей после воздействия антибиотиков во время беременности, антенатального, интранатального и неонатального периода. F1000Res. 2020; 9: 144.
F1000Res. 2020; 9: 144.
Google ученый
Доухауэр Карпа К., Пол И.М., Леки Дж. А., Шунг С., Каркачи-Салли Н., Врана К. Е. и др. Обзор ретроспективной карты для выявления перинатальных факторов, связанных с пищевой аллергией. Нутр Дж. 2012; 11: 87.
PubMed PubMed Central Google ученый
Metz TD, McKinney J, Allshouse AA, Knierim SD, Carey JC, Heyborne KD. Воздействие стрептококковой антибиотикопрофилактики группы B и индекс массы тела в раннем детстве в когорте вагинальных родов. J Matern Fetal Neonatal Med. 2020; 33: 3318–3323.
PubMed PubMed Central Google ученый
Wohl DL, Curry WJ, Mauger D, Miller J, Tyrie K. Антибиотики во время родов и детский атопический дерматит. J Am Board Fam Med. 2015; 28: 82–9.
PubMed PubMed Central Google ученый
Памми М., Коуп Дж., Тарр П.И., Уорнер Б.Б., Морроу А.Л., Май В. и др. Дисбактериоз кишечника у недоношенных детей, предшествующий некротическому энтероколиту: систематический обзор и метаанализ. Микробиом. 2017; 5:31.
PubMed PubMed Central Google ученый
Olm MR, Bhattacharya N, Crits-Christoph A, Firek BA, Baker R, Song YS, et al.Некротическому энтероколиту предшествует усиленная репликация кишечных бактерий, клебсиелл и бактерий, кодирующих фимбрии. Sci Adv. 2019; 5: eaax5727.
2019; 5: eaax5727.
CAS PubMed PubMed Central Google ученый
Esmaeilizand R, Shah PS, Seshia M, Yee W, Yoon EW, Dow K. Воздействие антибиотиков и развитие некротического энтероколита у очень недоношенных новорожденных. Педиатр детского здоровья. 2018; 23: e56 – e61.
PubMed PubMed Central Google ученый
Esaiassen E, Fjalstad JW, Juvet LK, van den Anker JN, Klingenberg C. Воздействие антибиотиков у новорожденных и ранние неблагоприятные исходы: систематический обзор и метаанализ. J Antimicrob. Chemother. 2017; 72: 1858–70.
CAS PubMed PubMed Central Google ученый
Guillet R, Stoll BJ, Cotten CM, Gantz M, McDonald S, Poole WK, et al. Связь терапии блокаторами h3 и более высокой частоты некротического энтероколита у младенцев с очень низкой массой тела при рождении.Педиатрия. 2006; 117: e137–42.
PubMed Google ученый
Hewitt KM, Mannino FL, Gonzalez A, Chase JH, Caporaso JG, Knight R, et al. Бактериальное разнообразие в двух отделениях интенсивной терапии новорожденных (ОИТН). PloS ONE. 2013; 8: e54703.
CAS PubMed PubMed Central Google ученый
Бокулич Н.А., Миллс Д.А., Андервуд М.А. Поверхностные микробы в отделении интенсивной терапии новорожденных: изменения в процессе регулярной очистки и со временем. J Clin Microbiol. 2013; 51: 2617–24.
J Clin Microbiol. 2013; 51: 2617–24.
PubMed PubMed Central Google ученый
Брукс Б., Олм М.Р., Файрек Б.А., Бейкер Р., Геллер-МакГрат Д., Реймер С.Р. и др. Развивающийся микробиом кишечника недоношенных детей является основным фактором, формирующим микробиом отделений неонатальной интенсивной терапии. Микробиом. 2018; 6: 112.
PubMed PubMed Central Google ученый
Стюарт С.Дж., Эмблтон Н.Д., Маррс Э.Л., Смит Д.П., Фофанова Т., Нельсон А. и др. Продольное развитие микробиома и метаболома кишечника у недоношенных новорожденных с поздним началом сепсиса и здоровых людей. Микробиом. 2017; 5: 75.
PubMed PubMed Central Google ученый
Сингер JR, Blosser EG, Zindl CL, Silberger DJ, Conlan S, Laufer VA и др. Предотвращение дисбактериоза кишечного микробиома новорожденных мышей защищает от позднего сепсиса.Nat Med. 2019; 25: 1772–82.
CAS PubMed PubMed Central Google ученый
Masi AC, Stewart CJ. Роль кишечного микробиома недоношенных при сепсисе и некротизирующем энтероколите. Early Hum Dev. 2019; 138: 104854.
PubMed PubMed Central Google ученый
Хемми М.Х., Вольке Д., Шнайдер С. Связь между проблемами плача, сна и / или кормления в младенчестве и долгосрочными поведенческими результатами в детстве: метаанализ.Arch Dis Child. 2011; 96: 622–9.
PubMed PubMed Central Google ученый
Loughman A, Quinn T, Nation ML, Reichelt A, Moore RJ, Van TTH, et al. Детская микробиота при коликах: прогнозирующие ассоциации с проблемным плачем и последующим поведением ребенка. J Dev Orig Health Dis. 2020: 1–11. https://doi.org/10.1017/S2040174420000227.
Huttenhower C, Kostic AD, Xavier RJ. Воспалительное заболевание кишечника как модель трансляции микробиома.Иммунитет. 2014; 40: 843–54.
CAS PubMed PubMed Central Google ученый
Mayer EA, Tillisch K, Gupta A. Ось кишечника / мозга и микробиота. J Clin исследования. 2015; 125: 926–38.
PubMed PubMed Central Google ученый
Honda K, Littman DR. Микробиота в адаптивном иммунном гомеостазе и болезни. Природа. 2016; 535: 75–84.
CAS PubMed PubMed Central Google ученый
Schroeder BO, Bäckhed F. Сигналы от микробиоты кишечника к отдаленным органам в физиологии и болезнях. Nat Med. 2016; 22: 1079–89.
CAS PubMed PubMed Central Google ученый
Леви М., Колодзейчик А.А., Тайс К.А., Элинав Э. Дисбактериоз и иммунная система. Nat Rev Immunol. 2017; 17: 219–32.
CAS PubMed PubMed Central Google ученый

Марувада П., Леоне В., Каплан Л. М., Чанг Е.Б. Микробиом человека и ожирение: выход за рамки ассоциаций. Клетка. Хост-микроб. 2017; 22: 589–99.
CAS PubMed PubMed Central Google ученый
Бах Дж.Ф. Гипотеза гигиены при аутоиммунных заболеваниях: роль патогенов и комменсалов. Nat Rev Immunol. 2018; 18: 105–20.
CAS PubMed PubMed Central Google ученый
Браун JM, Хазен SL. Микробная модуляция сердечно-сосудистых заболеваний. Nat Rev.2018; 16: 171–81.
CAS Google ученый
Тилг Х., Змора Н., Адольф Т.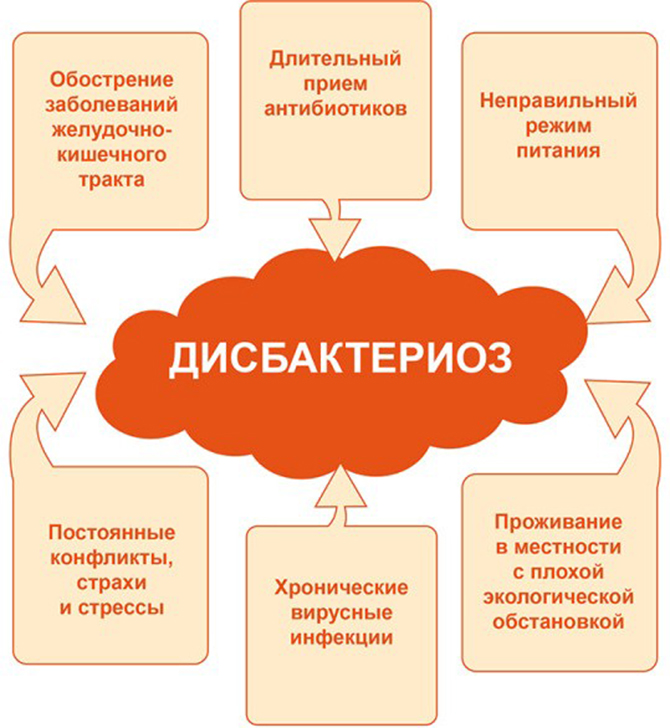 Е., Элинав Э. Микробиота кишечника, питающая метаболическое воспаление. Nat Rev Immunol. 2020; 20: 40–54.
Е., Элинав Э. Микробиота кишечника, питающая метаболическое воспаление. Nat Rev Immunol. 2020; 20: 40–54.
CAS PubMed PubMed Central Google ученый
Iacob S, Iacob DG. Инфекционные угрозы, кишечный барьер и его троянский конь: дисбактериоз.Front Microbiol. 2019; 10: 1676.
PubMed PubMed Central Google ученый
Fouhse JM, Yang K, More-Bayona J, Gao Y, Goruk S, Plastow G, et al. Воздействие амоксициллина на новорожденных изменяет долгосрочный иммунный ответ, несмотря на временное воздействие на кишечную микробиоту у поросят. Фронт Иммунол. 2019; 10: 2059.
CAS PubMed PubMed Central Google ученый
Бомонт М., Паес С., Муссар Э., Кнудсен С., Каукиль Л., Эймард П. и др. Метаболиты кишечной микробиоты способствуют созреванию кишечного барьера при переходе от сосания к отъему. Кишечные микробы. 2020; 11: 1268–86.
PubMed PubMed Central Google ученый
Suh SH, Choe K, Hong SP, Jeong SH, Mäkinen T., Kim KS, et al. Микробиота кишечника регулирует целостность молочных желез, индуцируя VEGF-C в макрофагах ворсинок кишечника.EMBO Rep.2019; 20: e46927.
PubMed PubMed Central Google ученый
Kulkarni DH, McDonald KG, Knoop KA, Gustafsson JK, Kozlowski KM, Hunstad DA, et al. Пассажи антигена, связанные с бокаловидными клетками, ингибируются во время инфекции Salmonella typhimurium, чтобы предотвратить распространение патогена и ограничить реакцию на пищевые антигены. Mucosal Immunol. 2018; 11: 1103–13.
Mucosal Immunol. 2018; 11: 1103–13.
CAS PubMed PubMed Central Google ученый
Abo H, Chassaing B, Harusato A, Quiros M, Brazil JC, Ngo VL и др. Регулятор-1 дифференцировки эритроидов, индуцированный микробиотой в раннем возрасте, управляет пролиферацией и регенерацией стволовых клеток кишечника. Nat Commun. 2020; 11: 513.
CAS PubMed PubMed Central Google ученый
Fung TC, Vuong HE, Luna CDG, Проновост Г.Н., Александрова А.А., Райли Н.Г. и др. Воздействие кишечного серотонина и флуоксетина модулирует бактериальную колонизацию кишечника.Nat Microbiol. 2019; 4: 2064–73.
PubMed PubMed Central Google ученый
Canfora EE, Meex RCR, Venema K, Blaak EE. Метаболиты кишечных микробов при ожирении, НАЖБП и СД2. Обзоры природы. Эндокринология. 2019; 15: 261–73.
CAS PubMed PubMed Central Google ученый
Lau WL, Vaziri ND. Микробные короткоцепочечные жирные кислоты кишечника и риск диабета.Нат Рев Нефрол. 2019; 15: 389–90.
PubMed PubMed Central Google ученый
Санна С., ван Зуйдам Н.Р., Махаджан А., Курильщиков А., Вич Вила А., Воса У и др. Причинно-следственные связи между микробиомом кишечника, короткоцепочечными жирными кислотами и метаболическими заболеваниями. Нат Жене. 2019; 51: 600–5.
CAS PubMed PubMed Central Google ученый
Де Ваддер Ф., Ковачева-Датчари П., Гонсалвес Д., Винера Дж., Зитоун С., Дюшампт А. и др.Метаболиты, вырабатываемые микробиотой, улучшают метаболизм через нейронные цепи кишечника и мозга. Клетка. 2014; 156: 84–96.
PubMed PubMed Central Google ученый
Далиле Б., Ван Ауденхове Л., Вервлиет Б., Вербеке К. Роль короткоцепочечных жирных кислот в коммуникации между микробиотой, кишечником и мозгом. Нат Рев Гастроэнтерол Гепатол. 2019; 16: 461–78.
PubMed PubMed Central Google ученый
Parada Venegas D, De la Fuente MK, Landskron G, Gonzalez MJ, Quera R, Dijkstra G и др. Короткоцепочечные жирные кислоты (SCFA), опосредуемые эпителиальной и иммунной регуляцией кишечника, и ее значение при воспалительных заболеваниях кишечника. Фронт Иммунол. 2019; 10: 277.
Фронт Иммунол. 2019; 10: 277.
PubMed PubMed Central Google ученый
Frese SA, Hutton AA, Contreras LN, Shaw CA, Palumbo MC, Casaburi G, et al. Стойкость добавок Bifidobacterium longum subsp.Infantis EVC001 у младенцев на грудном вскармливании. мСфера. 2017; 2: e00501–17.
PubMed PubMed Central Google ученый
Zheng N, Gao Y, Zhu W., Meng D, Walker WA. Короткоцепочечные жирные кислоты, образующиеся при взаимодействии кишечных комменсальных бактерий с сцеженным грудным молоком, обладают противовоспалительным действием в незрелых энтероцитах человека. PloS ONE. 2020; 15: e0229283.
CAS PubMed PubMed Central Google ученый
Waligora-Dupriet AJ, Dugay A, Auzeil N, Nicolis I, Rabot S, Huerre MR, et al. Короткоцепочечные жирные кислоты и полиамины в патогенезе некротического энтероколита: аспекты кинетики у гнотобиотических перепелов. Анаэроб. 2009; 15: 138–44.
CAS PubMed PubMed Central Google ученый
Рой С.К., Менг К., Садовиц Б.Д., Коллиш-Сингул М., Епури Н., Саталин Дж. И др. Энтеральное введение смеси, ферментированной бактериями, новорожденным поросятам: высокоточная модель некротического энтероколита (NEC).PloS ONE. 2018; 13: e0201172.
PubMed PubMed Central Google ученый
Meng D, Sommella E, Salviati E, Campiglia P, Ganguli K, Djebali K, et al. Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвид Infantis, оказывает противовоспалительное действие в незрелом кишечнике. Pediatr Res. 2020. https://doi.org/10.1038/s41390-019-0740-x.
Индол-3-молочная кислота, метаболит триптофана, секретируемый Bifidobacterium longum подвид Infantis, оказывает противовоспалительное действие в незрелом кишечнике. Pediatr Res. 2020. https://doi.org/10.1038/s41390-019-0740-x.
Mukhopadhyay S, Wade KC, Puopolo KM.Препараты для профилактики и лечения сепсиса у новорожденных. Clin Perinatol. 2019; 46: 327–47.
PubMed PubMed Central Google ученый
Кабальеро-Флорес Г., Сакамото К., Цзэн М.Ю., Ван Й., Хаким Дж., Матус-Акуна В. и др. Иммунизация матери обеспечивает защиту потомства от прикрепляющегося и удаляющегося патогена за счет доставки IgG с грудным молоком. Клетка. Хост-микроб. 2019; 25: 313–23.e4.
CAS PubMed PubMed Central Google ученый
Mukhopadhyay S, Sengupta S, Puopolo KM. Проблемы и возможности рационального использования антибиотиков среди недоношенных детей. Arch Dis Child. 2019; 104: F327 – f32.
Google ученый
Шульман Дж., Диманд Р. Дж., Ли Х. К., Дуэнас Г. В., Беннетт М. В., Гулд Дж. Б.. Применение антибиотиков в отделении интенсивной терапии новорожденных. Педиатрия. 2015; 135: 826–33.
PubMed PubMed Central Google ученый
Шульман Дж., Профит Дж., Ли ХК, Дуэнас Дж., Беннетт М.В., Паруча Дж. И др. Варианты использования антибиотиков в неонатальном периоде. Педиатрия. 2018; 142: e20180115.
PubMed PubMed Central Google ученый
Chi C, Buys N, Li C, Sun J, Yin C. Влияние пребиотиков на сепсис, некротический энтероколит, смертность, непереносимость кормления, время до полного энтерального питания, продолжительность пребывания в больнице и частоту стула в недоношенные дети: метаанализ.Eur J Clin Nutr. 2019; 73: 657–70.
CAS PubMed PubMed Central Google ученый
Sun J, Marwah G, Westgarth M, Buys N, Ellwood D, Gray PH. Влияние пробиотиков на некротический энтероколит, сепсис, внутрижелудочковое кровоизлияние, смертность, продолжительность пребывания в больнице и прибавку в весе у очень недоношенных новорожденных: метаанализ. Adv Nutr. 2017; 8: 749–63.
PubMed PubMed Central Google ученый
Deshpande G, Jape G, Rao S, Patole S. Преимущества пробиотиков у недоношенных новорожденных в странах с низким и средним доходом: систематический обзор рандомизированных контролируемых испытаний. BMJ Open. 2017; 7: e017638.
PubMed PubMed Central Google ученый
Dermyshi E, Wang Y, Yan C, Hong W, Qiu G, Gong X и др. «Золотой век» пробиотиков: систематический обзор и метаанализ рандомизированных и наблюдательных исследований недоношенных детей.Неонатология. 2017; 112: 9–23.
CAS PubMed PubMed Central Google ученый
Olsen R, Greisen G, Schroder M, Brok J. Профилактические пробиотики для недоношенных детей: систематический обзор и метаанализ наблюдательных исследований. Неонатология. 2016; 109: 105–12.
Неонатология. 2016; 109: 105–12.
PubMed PubMed Central Google ученый
Куанг Л., Цзян Ю. Влияние пробиотических добавок на беременных женщин: метаанализ рандомизированных контролируемых исследований.Br J Nutr. 2020; 123: 870–80.
CAS Google ученый
Skonieczna-Zydecka K, Janda K, Kaczmarczyk M, Marlicz W., Loniewski I, Loniewska B. Влияние пробиотиков на симптомы, микробиоту кишечника и маркеры воспаления при детской колике: систематический обзор, метаанализ и мета-регрессия рандомизированных контролируемых исследований. J Clin Med. 2020; 9: 999.
CAS Google ученый
van den Akker CHP, van Goudoever JB, Shamir R, Domellof M, Embleton ND, Hojsak I, et al. Пробиотики и недоношенные младенцы: позиционный документ Европейского общества педиатрической гастроэнтерологии, гепатологии и комитета по питанию по вопросам питания и Европейского общества детской гастроэнтерологии, гепатологии и рабочей группы по питанию по пробиотикам и пребиотикам. J Pediatr Gastroenterol Nutr. 2020; 70: 664–80.
Google ученый
van den Akker CHP, van Goudoever JB, Szajewska H, Embleton ND, Hojsak I., Reid D., et al. Пробиотики для недоношенных детей: систематический обзор штаммов и сетевой метаанализ. J Pediatr Gastroenterol Nutr. 2018; 67: 103–22.
Google ученый

Su GL, Ko CW, Bercik P, Falck-Ytter Y, Sultan S, Weizman AV, et al. Руководство AGA по клинической практике о роли пробиотиков в лечении желудочно-кишечных расстройств.Гастроэнтерология. 2020. https://doi.org/10.1053/j.gastro.2020.05.059.
Льюис З.Т., Шани Г., Масарве К.Ф., Попович М., Фрезе С.А., Села Д.А. и др. Подтверждение идентичности видов и подвидов бифидобактерий в коммерческих пробиотических продуктах. Pediatr Res. 2016; 79: 445–52.
CAS Google ученый
Chiang MC, Chen CL, Feng Y, Chen CC, Lien R, Chiu CH. Lactobacillus rhamnosus сепсис, связанный с терапией пробиотиками у крайне недоношенного ребенка: патогенез и обзор для клиницистов.J Microbiol Immunol Infect. 2020. https://doi.org/10.1016/j.jmii. 2020.03.029
2020.03.029
Pell LG, Loutet MG, Roth DE, Sherman PM. Аргументы против рутинного приема пробиотиков для профилактики НЭК. Curr Opin Pediatrics. 2019; 31: 195–201.
Google ученый
Границы | Грибковый дисбактериоз и воспаление кишечника у детей с бета-клеточным аутоиммунитетом
Введение
Диабет 1 типа (T1D) — это иммуноопосредованное заболевание, при котором аутоиммунные механизмы считаются ответственными за разрушение инсулин-продуцирующих бета-клеток поджелудочной железы.Хотя триггеры болезненного процесса остаются открытыми, развитие местного воспаления в островках поджелудочной железы и образование аутоантител против антигенов бета-клеток являются ранними событиями в развитии СД1 (1–4). Аутоантитела появляются против различных антигенов бета-клеток, таких как инсулин, глутаматдекарбоксилаза, островковый антиген 2 и переносчик цинка 8, за несколько лет до клинического проявления заболевания, и риск СД1 коррелирует с количеством аутоантител к бета-клеткам. Другие иммунологические отклонения при T1D включают активацию путей IFNG и IL-17 (5–9). Ранее мы показали, что у детей с аутоиммунным заболеванием бета-клеток снижено количество бактерий, продуцирующих бутират, и повышено количество бактерий, принадлежащих к типу Bacteroidetes, в микробиоте кишечника (10, 11). Подобные изменения в бактериальном сообществе у детей с бета-клеточным аутоиммунитетом были подтверждены в нескольких более поздних исследованиях (12–14). Воспаление кишечника было связано с СД1, о чем свидетельствует повышенная экспрессия молекулы HLA класса II и цитокинов IFNG, TNFA и мРНК IL-4 в биоптатах тощей кишки (15).
Другие иммунологические отклонения при T1D включают активацию путей IFNG и IL-17 (5–9). Ранее мы показали, что у детей с аутоиммунным заболеванием бета-клеток снижено количество бактерий, продуцирующих бутират, и повышено количество бактерий, принадлежащих к типу Bacteroidetes, в микробиоте кишечника (10, 11). Подобные изменения в бактериальном сообществе у детей с бета-клеточным аутоиммунитетом были подтверждены в нескольких более поздних исследованиях (12–14). Воспаление кишечника было связано с СД1, о чем свидетельствует повышенная экспрессия молекулы HLA класса II и цитокинов IFNG, TNFA и мРНК IL-4 в биоптатах тощей кишки (15).
Роль микробиоты кишечника как регулятора аутоиммунного диабета хорошо известна на животных моделях СД1, в которых модуляция микробиоты влияет на развитие болезни (16). На сегодняшний день исследования микробиома в отношении T1D были сосредоточены на бактериальном сообществе микробиоты кишечника, однако микробиом человека представляет собой сложную экосистему, состоящую из бактерий, грибов, архей и вирусов. В желудочно-кишечном тракте человека было идентифицировано несколько видов грибов (17, 18), что составляет 0.1–1,0% кишечной микробиоты (обычно обозначаемой как микобиота ). Количество грибковых клеток меньше, чем бактериальных, но, как эукариотические организмы, грибы имеют значительно более разнообразные биохимические пути, чем бактерии (19). Таким образом, когда принимается во внимание биоактивная способность кишечной микробиоты, роль микобиоты имеет большое значение с замечательным потенциалом для модуляции клеточных функций хозяина. Тем не менее, текущие знания об участии микобиоты в нарушениях микробных сообществ и здоровья хозяина ограничены.Роль микобиоты как регулятора воспаления кишечника и воспалительных заболеваний была подчеркнута в недавних исследованиях воспалительных заболеваний кишечника, аллергии и астмы (20–22).
В желудочно-кишечном тракте человека было идентифицировано несколько видов грибов (17, 18), что составляет 0.1–1,0% кишечной микробиоты (обычно обозначаемой как микобиота ). Количество грибковых клеток меньше, чем бактериальных, но, как эукариотические организмы, грибы имеют значительно более разнообразные биохимические пути, чем бактерии (19). Таким образом, когда принимается во внимание биоактивная способность кишечной микробиоты, роль микобиоты имеет большое значение с замечательным потенциалом для модуляции клеточных функций хозяина. Тем не менее, текущие знания об участии микобиоты в нарушениях микробных сообществ и здоровья хозяина ограничены.Роль микобиоты как регулятора воспаления кишечника и воспалительных заболеваний была подчеркнута в недавних исследованиях воспалительных заболеваний кишечника, аллергии и астмы (20–22).
Более того, изменения в бактериальной микробиоте могут быть связаны с изменениями микобиоты, которые, вероятно, нарушают межцерковные взаимодействия в микробиоме, как это видно при болезни Крона (21, 22). Действительно, микобиота кишечника может модулировать состав бактериального компартмента либо путем прямого взаимодействия с бактериями, либо через иммунную систему хозяина (18, 23).
Действительно, микобиота кишечника может модулировать состав бактериального компартмента либо путем прямого взаимодействия с бактериями, либо через иммунную систему хозяина (18, 23).
В текущем исследовании мы проанализировали состав грибковой и бактериальной микробиоты кишечника, а также маркеры кишечного воспаления в когорте детей с положительной и отрицательной активностью островковых аутоантител, несущих HLA-обусловленную генетическую предрасположенность к T1D. Затем мы проследили когорту развития СД1 в течение 8 лет и 8 месяцев. Объединив данные о грибах и бактериях, дети с генетическим риском СД1 были сгруппированы в три основных кластера, определяемых относительной численностью Saccharomyces , Clostridiales и Bacteroidales (Firmicutes и Bacteroidetes phyla соответственно).Повышенное соотношение Bacteroidales и Clostridiales было обнаружено у детей с положительной реакцией на аутоантитела, в то время как у детей, у которых во время последующего наблюдения также развился клинический СД1, было обнаружено высокое содержание Saccharomyces и Candida , а также признаки воспаления кишечника, т. Е. повышенный уровень фекального HBD2 и циркулирующего IgG к ASCA. Наши результаты показывают, что дисбактериоз грибковой и бактериальной микробиоты кишечника, а также воспаление кишечника связаны с развитием СД1.
Е. повышенный уровень фекального HBD2 и циркулирующего IgG к ASCA. Наши результаты показывают, что дисбактериоз грибковой и бактериальной микробиоты кишечника, а также воспаление кишечника связаны с развитием СД1.
Материалы и методы
Объекты исследования
Экспериментальный план текущего исследования представлен на рисунке 1. Здесь мы собрали образцы кала и крови у 52 детей с HLA-предрасположенностью к T1D (таблица 1) и проследили их развитие в течение 8 лет и 8 лет. месяцев (диапазон 8 лет и 2 месяцев − 9 лет и 1 месяц). Детей, изучаемых на фекальный микробиом, набирали из участников исследований по питанию (24–26).Мы определили 26 детей с положительным результатом по крайней мере на одно T1D-ассоциированное аутоантитело (IAA, GADA, IA-2A или ICA) (случаи), и выбрали здоровых контрольных детей с отрицательными аутоантителами, подходящих по возрасту, полу, генотипу HLA-DQB1 и раннему возрасту. питание жизни. В начале наблюдения образцы кала были собраны (в период с февраля 2009 г. по февраль 2010 г.) с использованием пробирок для сбора стула и сразу же помещены в домашние морозильные камеры (-20 ° C). Замороженные образцы были доставлены в исследовательский центр, и образцы хранили при -80 ° C до обработки.На момент сбора образцов кала у испытуемых не было гастроэнтерита, и они не получали лечение антибиотиками в течение последних 3 месяцев. За время наблюдения у девяти детей развился СД1. Дети контрольной группы остались недиабетическими и отрицательными по всем четырем проанализированным аутоантителам. Исследование было одобрено комитетами по этике участвующих больниц, и семьи и / или дети, принимавшие участие в исследовании, дали свое письменное информированное согласие.
по февраль 2010 г.) с использованием пробирок для сбора стула и сразу же помещены в домашние морозильные камеры (-20 ° C). Замороженные образцы были доставлены в исследовательский центр, и образцы хранили при -80 ° C до обработки.На момент сбора образцов кала у испытуемых не было гастроэнтерита, и они не получали лечение антибиотиками в течение последних 3 месяцев. За время наблюдения у девяти детей развился СД1. Дети контрольной группы остались недиабетическими и отрицательными по всем четырем проанализированным аутоантителам. Исследование было одобрено комитетами по этике участвующих больниц, и семьи и / или дети, принимавшие участие в исследовании, дали свое письменное информированное согласие.
Рисунок 1 .Дизайн исследования: состав микробиома, воспаление кишечника и развитие клинического диабета 1 типа (СД1) в период наблюдения. Образцы фекалий и крови были взяты у 26 детей, у которых был обнаружен положительный результат по крайней мере на одно аутоантитело, ассоциированное с диабетом (IAA, GADA, IA-2A или ICA), и у соответствующих детей с отрицательными аутоантителами и предрасположенностью к HLA к T1D. Пары случай-контроль были сопоставлены по гаплотипу HLA-DQB1, возрасту, полу и питанию в раннем детстве. Секвенирование бактериального 16S и ITS2 грибов и анализ маркеров кишечного воспаления, а именно HBD2, кальпротектина и общего секреторного IgA, проводили с использованием образцов фекалий.Образцы крови анализировали на уровень ASCA IgA / IgG и циркулирующих цитокинов IFNG, IL-17 и IL-22. После анализов у детей наблюдали развитие клинического СД1 (в среднем 8 лет и 8 месяцев). В ходе последующего наблюдения девяти детям с положительным результатом на аутоантитела был поставлен диагноз СД1, тогда как ни у одного из детей с отрицательным результатом на аутоантитела не развился СД1.
Пары случай-контроль были сопоставлены по гаплотипу HLA-DQB1, возрасту, полу и питанию в раннем детстве. Секвенирование бактериального 16S и ITS2 грибов и анализ маркеров кишечного воспаления, а именно HBD2, кальпротектина и общего секреторного IgA, проводили с использованием образцов фекалий.Образцы крови анализировали на уровень ASCA IgA / IgG и циркулирующих цитокинов IFNG, IL-17 и IL-22. После анализов у детей наблюдали развитие клинического СД1 (в среднем 8 лет и 8 месяцев). В ходе последующего наблюдения девяти детям с положительным результатом на аутоантитела был поставлен диагноз СД1, тогда как ни у одного из детей с отрицательным результатом на аутоантитела не развился СД1.
Таблица 1 . Характеристики изучаемых предметов. AAb + — это дети, положительные по крайней мере в отношении одного аутоантитела, связанного с диабетом, а дети AAb- отрицательны в отношении бета-клеточных аутоантител.Объекты исследования были участниками пилотных исследований TRIGR и FINDIA.
Анализ аутоантител
Биохимически определенные аутоантитела IAA, IA-2A и GADA были проанализированы с помощью метода специфического радиоактивного связывания, а ICA — с помощью стандартного метода иммунофлуоресценции, как описано ранее в (24–26). Использованные пороговые уровни составляли 2,80 относительных единиц (RU) для IAA, 5,36 RU для GADA и 0,78 RU для IA-2A, определенных как уровень выше 99 процентилей у более чем 350 финских детей, не страдающих диабетом.Антитела островковых клеток измеряли с использованием метода непрямой иммунофлуоресценции с использованием порогового значения 2,5 единиц фонда Juvenile Diabetes Foundation.
Генотипирование HLA
Скрининг аллелей риска HLA проводился, как описано ранее (24–26). Первоначальное типирование HLA-DQB1 для связанных с риском (DQB1 * 02, DQB1 * 03: 02) и защитных (DQB1 * 03: 01, DQB1 * 06: 02 и DQB1 * 06: 03) аллелей было дополнено типированием DQA1 для Аллели DQA1 * 02: 01 и DQA1 * 05 у пациентов с DQB1 * 02 без защитных аллелей или аллеля основного риска DQB1 * 03: 02.
Экстракция ДНК
ДНКэкстрагировали из образцов фекалий с помощью набора QIAamp Fast DNA Stool Mini Kit (Qiagen, Германия). Вкратце, образцы фекалий (180–220 мг) размораживали в 1 мл буфера InhibitEX, встряхивали в течение 1 мин и инкубировали при 95 ° C в течение 10 мин для усиления лизиса трудно лизируемых таксонов. После центрифугирования 200 мкл супернатанта переносили в новую пробирку с протеиназой К и буфером AL и тщательно перемешивали. Лизат инкубировали при 70 ° C в течение 10 мин с последующим добавлением 0.3 т. абсолютного этанола. Затем образцы встряхивали, переносили пипеткой на спин-колонку QIAamp и центрифугировали при 20000 × g в течение 1 мин. Колонку промывали буферами AW1 и AW2, чистую ДНК элюировали 200 мкл буфера ATE и хранили при -20 ° C. Количество и качество ДНК определяли с помощью спектрофотометра NanoDrop ND-1000 (Thermo Fisher Scientific, Wilmington, DE, USA).
Амплификация бактериальной 16s рРНК и области ITS2 грибов
Бактериальные гипервариабельные области V4-V5 гена 16S рРНК амплифицировали с использованием праймеров F519 (5′-CAGCMGCCGCGGTAATWC-3 ‘) и R926 (5′-CCGTCAATTCCTTTRAGTTT-3’). Праймер F519 содержал последовательность А адаптера пиросеквенирования Ion Torrent (Thermo Fisher Scientific, США), уникальную последовательность штрих-кода длиной 9 п.н. и один нуклеотидный линкер. Праймер R926 содержал последовательность trP1 адаптера Ion Torrent. Для грибкового анализа область ITS2 амплифицировали с использованием праймеров fITS7 (5′-GTGARTCATCGAATCTTTG-3 ‘) и ITS4 (5′-TCCTCCGCTTATTGATATGC-3’), включая адаптер пиросеквенирования Ion Torrent со штрих-кодовой последовательностью 10 п.н. для праймера ITS4 ( 27). Реакции ПЦР проводили в трех повторах, каждый из которых содержал 1x буфер Phusion GC, 0.4 мкМ прямого и обратного праймеров, 200 мкМ dNTP, 0,5 ед. ДНК-полимеразы Phusion High-Fidelity (Thermo Fisher Scientific) и 50 нг ДНК геномного сообщества в качестве матрицы и вода молекулярной чистоты в общем объеме реакции 50 мкл. Для бактерий условия цикла ПЦР были следующими: начальная денатурация при 98 ° C в течение 3 минут, 35 циклов амплификации при 98 ° C в течение 10 секунд, 64 ° C в течение 10 секунд и 72 ° C в течение 20 секунд, затем заключительный этап удлинения 72 ° C в течение 7 мин.
Праймер F519 содержал последовательность А адаптера пиросеквенирования Ion Torrent (Thermo Fisher Scientific, США), уникальную последовательность штрих-кода длиной 9 п.н. и один нуклеотидный линкер. Праймер R926 содержал последовательность trP1 адаптера Ion Torrent. Для грибкового анализа область ITS2 амплифицировали с использованием праймеров fITS7 (5′-GTGARTCATCGAATCTTTG-3 ‘) и ITS4 (5′-TCCTCCGCTTATTGATATGC-3’), включая адаптер пиросеквенирования Ion Torrent со штрих-кодовой последовательностью 10 п.н. для праймера ITS4 ( 27). Реакции ПЦР проводили в трех повторах, каждый из которых содержал 1x буфер Phusion GC, 0.4 мкМ прямого и обратного праймеров, 200 мкМ dNTP, 0,5 ед. ДНК-полимеразы Phusion High-Fidelity (Thermo Fisher Scientific) и 50 нг ДНК геномного сообщества в качестве матрицы и вода молекулярной чистоты в общем объеме реакции 50 мкл. Для бактерий условия цикла ПЦР были следующими: начальная денатурация при 98 ° C в течение 3 минут, 35 циклов амплификации при 98 ° C в течение 10 секунд, 64 ° C в течение 10 секунд и 72 ° C в течение 20 секунд, затем заключительный этап удлинения 72 ° C в течение 7 мин. Для грибов температура отжига была доведена до 56 ° C, тогда как другие условия цикла ПЦР оставались неизменными.После амплификации продукты ПЦР из объединенных трех повторностей реакций очищали с помощью гранул Agencourt AMPure XP (Agencourt Bioscience, Массачусетс, США) и количественно оценивали с помощью Agilent 2,100 Bioanalyzer (Agilent Technologies, Калифорния, США). Затем ампликоны из каждого образца объединяли в эквимолярных концентрациях для создания библиотек секвенирования. Секвенирование проводили в Центре секвенирования Biocenter Oulu с использованием системы Ion Torrent PGM на чипе 316v2 с использованием химии 400 п.н. (Thermo Fisher Scientific, США).
Для грибов температура отжига была доведена до 56 ° C, тогда как другие условия цикла ПЦР оставались неизменными.После амплификации продукты ПЦР из объединенных трех повторностей реакций очищали с помощью гранул Agencourt AMPure XP (Agencourt Bioscience, Массачусетс, США) и количественно оценивали с помощью Agilent 2,100 Bioanalyzer (Agilent Technologies, Калифорния, США). Затем ампликоны из каждого образца объединяли в эквимолярных концентрациях для создания библиотек секвенирования. Секвенирование проводили в Центре секвенирования Biocenter Oulu с использованием системы Ion Torrent PGM на чипе 316v2 с использованием химии 400 п.н. (Thermo Fisher Scientific, США).
Биоинформатический анализ
Данные бактериального и грибкового секвенирования обрабатывали с помощью QIIME v.1.9.1 (28). Качество считываемых данных контролировалось с помощью конвейера фильтров качества usearch, таким образом потенциальные химерные последовательности были идентифицированы и удалены с помощью учиме (29). После фильтрации низкокачественных и химерных считываний набор бактериальных данных состоял из 1,202 миллиона считываний по 52 образцам, в среднем 23120 считываний на образец. Соответствующий окончательный набор данных о грибах состоял из 130 000 высококачественных считываний без химер из 52 образцов, в среднем 2501 считывание на образец.Последовательности были сгруппированы в операционные таксономические единицы (OTU) с порогом сходства 97% с usearch (30). OTU с низкой численностью (представленные <5 считываний) были удалены из наборов данных. Таксономия была присвоена с использованием справочной базы данных генов 16S рРНК Greengenes (31) для бактерий (v.13_8) и базы данных UNITE ITS для грибов (выпуск 2019 г., v.8) (32). Перед последующим анализом таблицы OTU бактерий и грибов были уменьшены до 5 800 и 327 считываний на образец соответственно, чтобы избежать систематических ошибок, вызванных различиями в глубине секвенирования между образцами (33).Все необработанные данные секвенирования были депонированы в базе данных NCBI-SRA с регистрационным номером SUB3267498.
После фильтрации низкокачественных и химерных считываний набор бактериальных данных состоял из 1,202 миллиона считываний по 52 образцам, в среднем 23120 считываний на образец. Соответствующий окончательный набор данных о грибах состоял из 130 000 высококачественных считываний без химер из 52 образцов, в среднем 2501 считывание на образец.Последовательности были сгруппированы в операционные таксономические единицы (OTU) с порогом сходства 97% с usearch (30). OTU с низкой численностью (представленные <5 считываний) были удалены из наборов данных. Таксономия была присвоена с использованием справочной базы данных генов 16S рРНК Greengenes (31) для бактерий (v.13_8) и базы данных UNITE ITS для грибов (выпуск 2019 г., v.8) (32). Перед последующим анализом таблицы OTU бактерий и грибов были уменьшены до 5 800 и 327 считываний на образец соответственно, чтобы избежать систематических ошибок, вызванных различиями в глубине секвенирования между образцами (33).Все необработанные данные секвенирования были депонированы в базе данных NCBI-SRA с регистрационным номером SUB3267498.
Мы оценили бета-разнообразие, используя невзвешенные и взвешенные расстояния UniFrac (а также нефилогенетическое несходство Брея-Кертиса) между выборками. Оба показателя UniFrac учитывают филогенетические расстояния между таксонами, но в то время как невзвешенный UniFrac сравнивает микробные сообщества на основе информации о наличии / отсутствии, взвешенный UniFrac также учитывает различия в численности таксонов (34).Различия в структуре микробиоты кишечника грибков и бактерий среди детей визуализировали с помощью анализа главных координат (PCoA) с использованием EMPeror (35).
Измерения фекального HBD2, общего IgA и кальпротектина
Размороженные образцы фекалий смешивали с буфером для экстракции и тщательно встряхивали. Затем супернатант собирали и хранили при -20 ° C до анализа уровней общего IgA, HBD2 и кальпротектина. Концентрации общего IgA анализировали, как описано ранее (36).Анализ HBD2 проводили с помощью коммерческого набора для ELISA согласно инструкциям производителя (Immunodiagnostik AG, Бенсхайм, Германия). Уровни кальпротектина в фекалиях определяли с помощью теста ELISA Calprolab calprotectin в соответствии с инструкциями производителя (Calpro AS, Lysaker, Норвегия).
Уровни кальпротектина в фекалиях определяли с помощью теста ELISA Calprolab calprotectin в соответствии с инструкциями производителя (Calpro AS, Lysaker, Норвегия).
ELISA-анализ уровней сывороточного ASCA IgA / IgG
Концентрации IgA и IgG ASCA в сыворотке анализировали с помощью коммерческого набора для ELISA в соответствии с инструкциями производителя (Demeditec, Германия), за исключением того, что использовали разведение образцов сыворотки 1:10.Образцам ниже нижнего предела обнаружения (LOD) давали произвольное значение 50% от LOD, составляющего 0,5 Ед / мл как для ASCA IgA, так и для IgG.
Анализ цитокинов сыворотки
Концентрации IFNG, IL-17A и IL-22 в сыворотке анализировали с использованием набора Milliplex MAP (HTh27MAG-14K) в соответствии с рекомендациями производителя (Merck-Millipore Corp., Billerica, MA, USA). Количественную оценку маркеров проводили с помощью прибора Bio-plex 200 Luminex и программного обеспечения Bio-Plex Manager (Bio-Rad, Швеция). Образцам ниже минимальной определяемой концентрации (MinDC) DC давали произвольное значение 50% MinDC.
Образцам ниже минимальной определяемой концентрации (MinDC) DC давали произвольное значение 50% MinDC.
Статистический анализ
Призма Graph Pad Prism 6.04 (Graph Pad Inc., Ла-Хойя, Калифорния, США), SPSS 22 (SPSS, Чикаго, Иллинойс, США) и статистическое программное обеспечение JMP 13.0.0 использовались для статистического анализа, если не указано иное. Непараметрический критерий Манна – Уитни U использовался для сравнения между двумя группами. Групповые сравнения проводились с помощью теста Краскела – Уоллиса.Корреляции между переменными были проанализированы с помощью непараметрического корреляционного теста Спирмена. Точный тест Фишера был использован для анализа распределения аутоантител-положительных детей и прогрессирующих заболеваний в различных кластерах. Все статистические анализы были двусторонними. P <0,05 считали статистически значимым. Несмотря на совпадение аутоантител-положительных и отрицательных детей по возрасту, генотипу риска СД1 и полу, пары считались независимыми при статистическом анализе.
Для анализа иерархической кластеризации данные об относительной численности были импортированы в JMP 13.0.0 (SAS Institute Inc. Cary, Северная Каролина, США). Все значения численности обрабатывались как числовые, а иерархическая кластеризация Уорда выполнялась с использованием стандартизованных данных с настройками по умолчанию. Статистическая значимость группировки выборок для анализа бета-разнообразия была определена с помощью перестановочного многомерного дисперсионного анализа (PERMANOVA) и анализа сходства (ANOSIM) (999 перестановок), реализованного функциями adonis и anosim в веганском R-пакете ( 37).
Результаты
Дизайн исследования и клинический СД1 в ходе наблюдения
В этом исследовании мы проанализировали микробиом кишечника детей с положительным и отрицательным результатом на аутоантитела с риском развития СД1 по HLA (рис. 1). Мы объединили секвенирование (1) гена бактериальной 16S рибосомальной РНК (рРНК) (2) и области внутреннего транскрибируемого спейсера 2 (ITS2) гриба и соединили это с анализом (3) маркеров кишечного воспаления, а именно фекального HBD2, секреторного общий IgA и кальпротектин. Образцы крови проверяли на уровни ASCA IgA / IgG и циркулирующих цитокинов IFNG IL-17 и IL-22. Наконец, дети в когорте наблюдались на предмет развития клинического СД1 (в среднем 8 лет и 8 месяцев). В течение периода наблюдения девяти детям с положительным результатом на аутоантитела был поставлен диагноз СД1, и ни у одного из детей с отрицательным результатом на аутоантитела не развился СД1 или аутоантитела.
Образцы крови проверяли на уровни ASCA IgA / IgG и циркулирующих цитокинов IFNG IL-17 и IL-22. Наконец, дети в когорте наблюдались на предмет развития клинического СД1 (в среднем 8 лет и 8 месяцев). В течение периода наблюдения девяти детям с положительным результатом на аутоантитела был поставлен диагноз СД1, и ни у одного из детей с отрицательным результатом на аутоантитела не развился СД1 или аутоантитела.
Грибковый и бактериальный дисбиоз у детей с бета-клеточным аутоиммунитетом
Микобиота кишечника состояла из двух типов грибов, Ascomycota и Basidiomycota, но преобладали Ascomycota (в среднем 93%) на уровне филума и Saccharomyces на уровне рода (в среднем 43%) (Рисунки 2A, B).Все 52 объекта исследования были положительными на Ascomycota, а 29 из них (56%) положительными на Basidiomycota (11 из 26 положительных по аутоантителам и 18 из 26 отрицательных людей, 42 и 69%, соответственно). У детей с аутоантителами было незначительное увеличение численности Ascomycota и снижение уровня Basidiomycota (рис. 2A). Наиболее часто наблюдаемыми родами были Saccharomyces (обнаружены у всех 52 человек), Candida (обнаружены у 9 из 26 положительных по аутоантителам и 13 из 26 отрицательных по аутоантителам, 35 и 50%) и Debaryomyces (обнаружены у 9 из 26 аутоантител-положительных и 4 из 26 аутоантител-отрицательных индивидуумов, 35 и 15%).У детей с аутоантителами было увеличено количество Debaryomyces и уменьшилось количество Malassezia (Рисунки 2B – D). Однако количество детей, положительных на Debaryomyce s или Malassezia , было низким, и 25,0 и 23,1% исследованных детей были положительными на Debaryomyces (13/52) и Malassezia (12/52) , соответственно. У детей с положительной реакцией на аутоантитела, у которых во время последующего наблюдения развился клинический СД1, численность рода Verticillium значительно снизилась по сравнению с детьми с аутоантителами или без них (рис. 2E). Verticillium положительный результат был обнаружен у 16 из 26 (62%) положительных по аутоантителам и у 17 из 26 (65%) отрицательных по аутоантителам детей.
2A). Наиболее часто наблюдаемыми родами были Saccharomyces (обнаружены у всех 52 человек), Candida (обнаружены у 9 из 26 положительных по аутоантителам и 13 из 26 отрицательных по аутоантителам, 35 и 50%) и Debaryomyces (обнаружены у 9 из 26 аутоантител-положительных и 4 из 26 аутоантител-отрицательных индивидуумов, 35 и 15%).У детей с аутоантителами было увеличено количество Debaryomyces и уменьшилось количество Malassezia (Рисунки 2B – D). Однако количество детей, положительных на Debaryomyce s или Malassezia , было низким, и 25,0 и 23,1% исследованных детей были положительными на Debaryomyces (13/52) и Malassezia (12/52) , соответственно. У детей с положительной реакцией на аутоантитела, у которых во время последующего наблюдения развился клинический СД1, численность рода Verticillium значительно снизилась по сравнению с детьми с аутоантителами или без них (рис. 2E). Verticillium положительный результат был обнаружен у 16 из 26 (62%) положительных по аутоантителам и у 17 из 26 (65%) отрицательных по аутоантителам детей.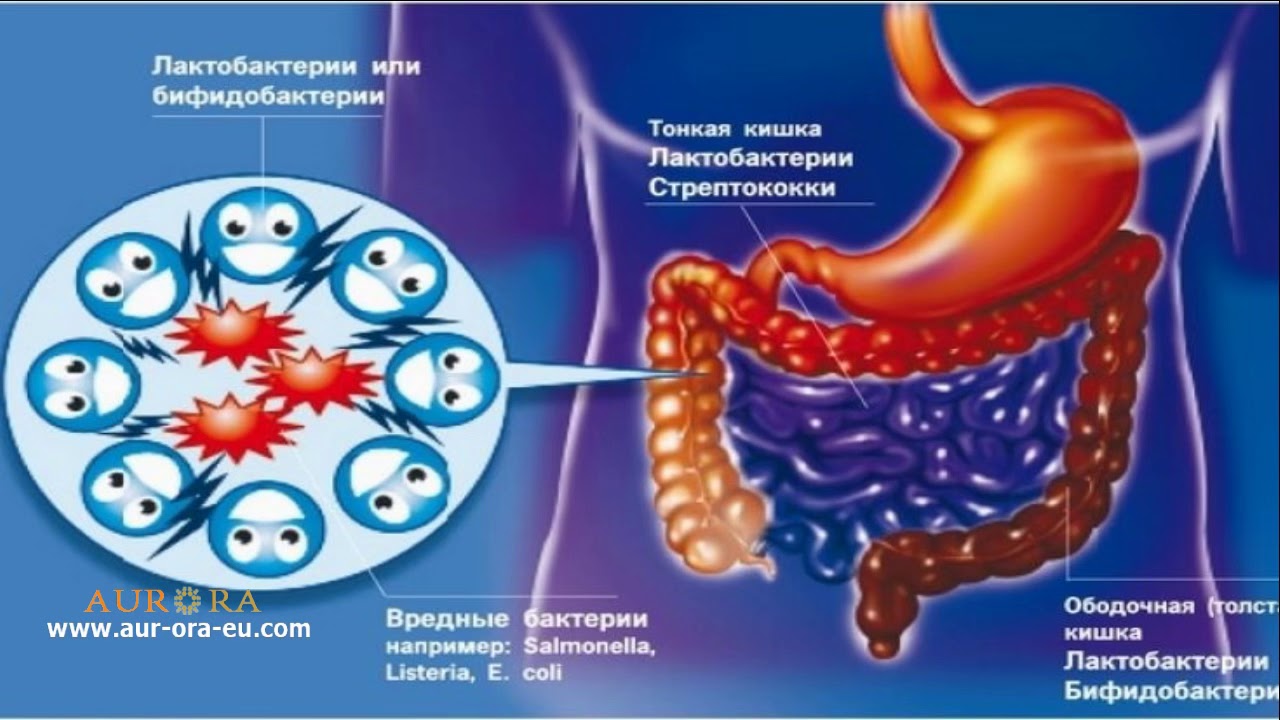 Мы не наблюдали различий в количестве ОТЕ между детьми с аутоантителами или без них (рис. 2F). Дети, у которых развился СД1, имели меньшее разнообразие грибов (Шеннон) по сравнению с детьми с множественными аутоантителами (рис. 2G). Анализ основных координат, основанный на взвешенных и невзвешенных расстояниях UniFrac, не показал четких различий между детьми, не имеющими аутоантитела, и детьми, не имеющими аутоантитела (дополнительные рисунки 1C, D).Состав грибного сообщества согласуется с сообществами микобиома кишечника, о которых ранее сообщалось для людей (18, 38, 39). Список наиболее распространенных видов грибов среди детей с отрицательными и положительными антителами представлен в дополнительной таблице 1.
Мы не наблюдали различий в количестве ОТЕ между детьми с аутоантителами или без них (рис. 2F). Дети, у которых развился СД1, имели меньшее разнообразие грибов (Шеннон) по сравнению с детьми с множественными аутоантителами (рис. 2G). Анализ основных координат, основанный на взвешенных и невзвешенных расстояниях UniFrac, не показал четких различий между детьми, не имеющими аутоантитела, и детьми, не имеющими аутоантитела (дополнительные рисунки 1C, D).Состав грибного сообщества согласуется с сообществами микобиома кишечника, о которых ранее сообщалось для людей (18, 38, 39). Список наиболее распространенных видов грибов среди детей с отрицательными и положительными антителами представлен в дополнительной таблице 1.
Рисунок 2 . Характеристики грибкового сообщества у детей с аутоантителами, ассоциированными с T1D, или без них. (A) Относительная численность грибов типа Ascomycota (левые столбцы) и Basidiomycota (правые столбцы).Дети без аутоантител: черные столбцы и дети с аутоантителами: серые столбцы. (B) Относительная численность 20 наиболее распространенных родов грибов у детей с (серые столбцы) и без аутоантител (черные столбцы). (C – E) Относительная численность Debaryomyces (C) , Malessezia (D) и Verticillium (E) у здоровых детей без аутоантител, у детей с другим числом аутоантител и у детей, которые перешли от аутоантителположительного состояния к клиническому СД1. (F, G) Число ОТЕ и индекс разнообразия Шеннона у здоровых детей без аутоантител, у детей с другим количеством аутоантител и у детей, которые перешли от аутоантителположительного состояния к клиническому СД1. Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами — черными кружками, а дети, у которых клиническое заболевание прогрессировало, — красным кружком. p -значения были рассчитаны с помощью теста Манна-Уитни U .* p <0,05, ** p <0,01.
(B) Относительная численность 20 наиболее распространенных родов грибов у детей с (серые столбцы) и без аутоантител (черные столбцы). (C – E) Относительная численность Debaryomyces (C) , Malessezia (D) и Verticillium (E) у здоровых детей без аутоантител, у детей с другим числом аутоантител и у детей, которые перешли от аутоантителположительного состояния к клиническому СД1. (F, G) Число ОТЕ и индекс разнообразия Шеннона у здоровых детей без аутоантител, у детей с другим количеством аутоантител и у детей, которые перешли от аутоантителположительного состояния к клиническому СД1. Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами — черными кружками, а дети, у которых клиническое заболевание прогрессировало, — красным кружком. p -значения были рассчитаны с помощью теста Манна-Уитни U .* p <0,05, ** p <0,01.
Затем мы обратились ко всей микробиоте и выполнили комбинированный анализ грибковых и бактериальных сообществ. Наш иерархический кластерный анализ, основанный на комбинированных данных о грибах и бактериях, выявил наличие трех основных кластеров, определяемых различными комбинациями грибов, принадлежащих к типу Ascomycota и бактериальным типам Bacteroidetes и Firmicutes (Рисунки 3A – C). Структуры грибковых и бактериальных сообществ различались у детей, отнесенных к разным кластерам ( p <0.001, ПЕРМАНОВА) (см. Дополнительную таблицу 2). Кластер 1 ( n = 17, 33%) характеризовался высокой численностью Clostridiales и низкой численностью Bacteroidales в сочетании с высокой численностью Saccharomyces (рисунки 3B, C и дополнительный рисунок 2A). Напротив, кластеры 4 ( n = 22, 42%) и 5 ( n = 8,15%) характеризовались высокой численностью Bacteroidales и низкой численностью Clostridiales, а кластер 4 также показал высокую численность Candida . по сравнению с кластером 1 (рисунки 3B, C и дополнительный рисунок 2B).Хотя численность Ascomycota была высокой в кластерах 1 и 4, численность Saccharomyces и Candida значительно различалась между кластерами (Рисунок 3B, дополнительные рисунки 2A, B и дополнительные таблицы 2, 3). Относительная численность Debaryomyces, Malassezia и Verticillium в кластерах 1, 4 и 5 показана на дополнительных рисунках 2C – E. Относительные количества Saccharomyces и Candida у детей с аутоантителами или без них показаны на дополнительных рисунках 2F, G.Анализ сходства грибных и бактериальных сообществ между различными кластерами показал, что кластеры 4 и 5 отличаются от кластера 1 как для грибковых, так и для бактериальных сообществ (дополнительная таблица 3). Пол хозяина не оказал статистически значимого ( p > 0,05, PERMANOVA) объяснительного эффекта на грибковые и бактериальные сообщества (дополнительная таблица 2). Детский возраст и класс риска HLA внесли статистически значимый вклад в общую изменчивость бактериального сообщества ( p = 0.
по сравнению с кластером 1 (рисунки 3B, C и дополнительный рисунок 2B).Хотя численность Ascomycota была высокой в кластерах 1 и 4, численность Saccharomyces и Candida значительно различалась между кластерами (Рисунок 3B, дополнительные рисунки 2A, B и дополнительные таблицы 2, 3). Относительная численность Debaryomyces, Malassezia и Verticillium в кластерах 1, 4 и 5 показана на дополнительных рисунках 2C – E. Относительные количества Saccharomyces и Candida у детей с аутоантителами или без них показаны на дополнительных рисунках 2F, G.Анализ сходства грибных и бактериальных сообществ между различными кластерами показал, что кластеры 4 и 5 отличаются от кластера 1 как для грибковых, так и для бактериальных сообществ (дополнительная таблица 3). Пол хозяина не оказал статистически значимого ( p > 0,05, PERMANOVA) объяснительного эффекта на грибковые и бактериальные сообщества (дополнительная таблица 2). Детский возраст и класс риска HLA внесли статистически значимый вклад в общую изменчивость бактериального сообщества ( p = 0.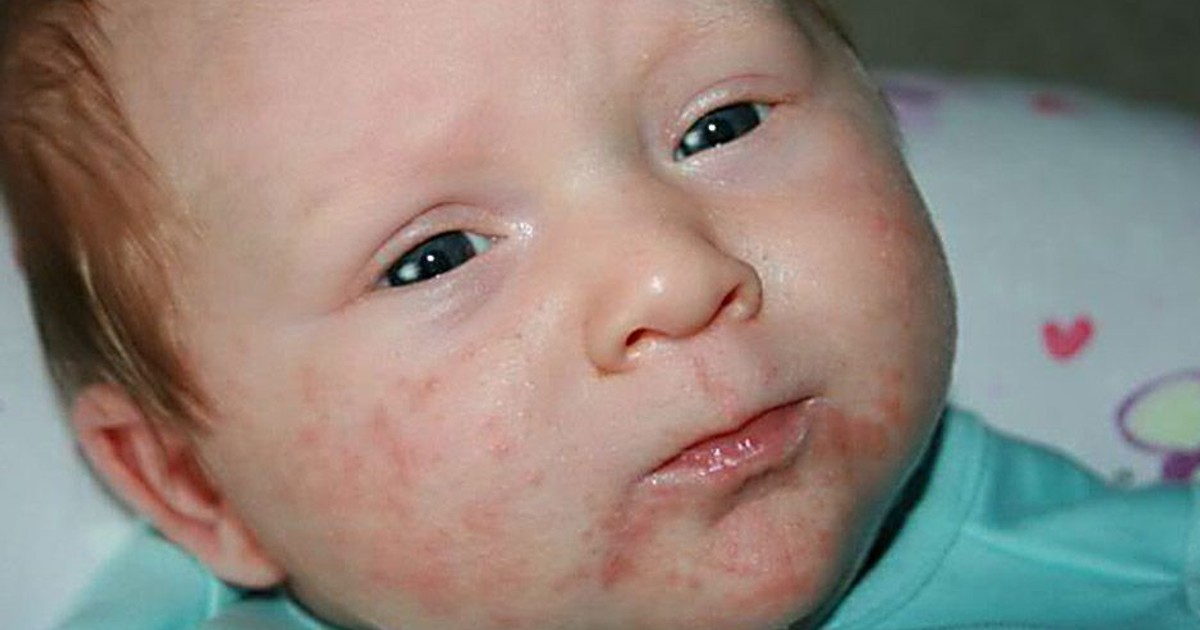 02, R 2 = 0,08, p <0,001, R 2 = 0,14, для возраста хозяина и класса HLA-риска соответственно), хотя и с относительно низким коэффициентом детерминации, и без -существенный ( p > 0,05) вклад обоих факторов в структуру сообщества микобиома (дополнительная таблица 2).
02, R 2 = 0,08, p <0,001, R 2 = 0,14, для возраста хозяина и класса HLA-риска соответственно), хотя и с относительно низким коэффициентом детерминации, и без -существенный ( p > 0,05) вклад обоих факторов в структуру сообщества микобиома (дополнительная таблица 2).
Рисунок 3 . Иерархическая кластеризация по таксонам бактерий и грибов и участкам PCoA грибных и бактериальных сообществ. (A) Тепловая карта, показывающая кластеризацию относительной численности. В результате кластеризации были образованы три основных кластера (кластеры 1, 4 и 5), определяемые различной численностью грибов, принадлежащих к типу Ascomycota и бактериальным типам Firmicutes и Bacteroidetes. Кластеры 1, 4 и 5 обведены черной рамкой. На тепловой карте дети с аутоантителами обозначены AAb + (красный шрифт), а дети с отрицательными аутоантителами — AAb (синий шрифт). Дети, у которых наблюдается прогрессирование аутоантител-положительного состояния до клинического заболевания, обозначаются СД1 и красным кружком на тепловой карте.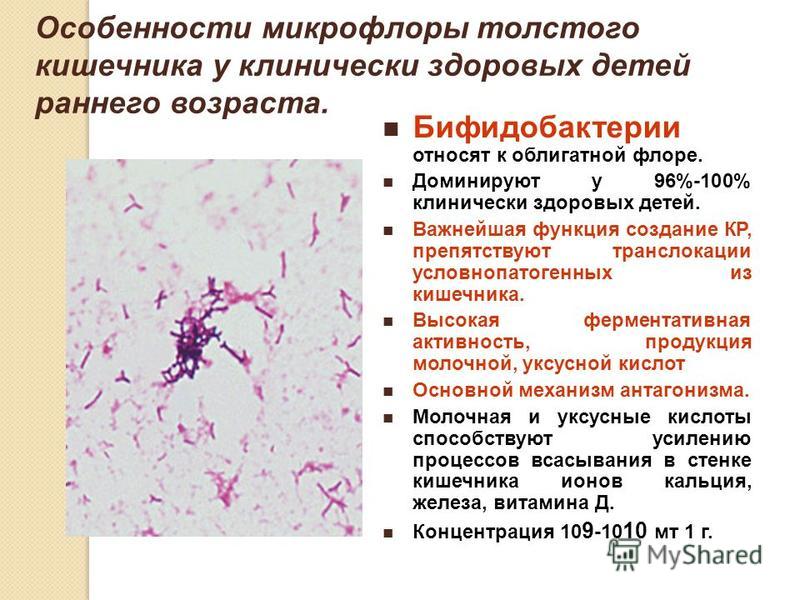 Интенсивность цвета тепловой карты увеличивается с относительной численностью таксонов от низкого (синий) до высокого (красный). (B, C) Биплоты анализа основных координат (PCoA) (включают информацию о таксономии) взвешенных расстояний UniFrac между грибами (B) и бактериями (C) Профили кишечных микробных сообществ детей из группы риска 1-го типа развитие диабета. Каждая точка представляет собой одну выборку и окрашена в соответствии с основными кластерами таксонов (кластеры 1, 4, 5 и другие), как определено с помощью анализа иерархической кластеризации.Порядок и таксономия на уровне родов, отображаемые стрелками двух графиков, показывают, что численность (B) , Saccharomyces и Candida способствует разделению кластера 1 и кластера 4, а (C) Clostridiales и Bacteroidales вносят вклад в отчетливые шаблоны кластеризации кластера 1 по сравнению с кластерами 4 и 5. p -значения были рассчитаны с помощью теста Манна-Уитни U .
Интенсивность цвета тепловой карты увеличивается с относительной численностью таксонов от низкого (синий) до высокого (красный). (B, C) Биплоты анализа основных координат (PCoA) (включают информацию о таксономии) взвешенных расстояний UniFrac между грибами (B) и бактериями (C) Профили кишечных микробных сообществ детей из группы риска 1-го типа развитие диабета. Каждая точка представляет собой одну выборку и окрашена в соответствии с основными кластерами таксонов (кластеры 1, 4, 5 и другие), как определено с помощью анализа иерархической кластеризации.Порядок и таксономия на уровне родов, отображаемые стрелками двух графиков, показывают, что численность (B) , Saccharomyces и Candida способствует разделению кластера 1 и кластера 4, а (C) Clostridiales и Bacteroidales вносят вклад в отчетливые шаблоны кластеризации кластера 1 по сравнению с кластерами 4 и 5. p -значения были рассчитаны с помощью теста Манна-Уитни U .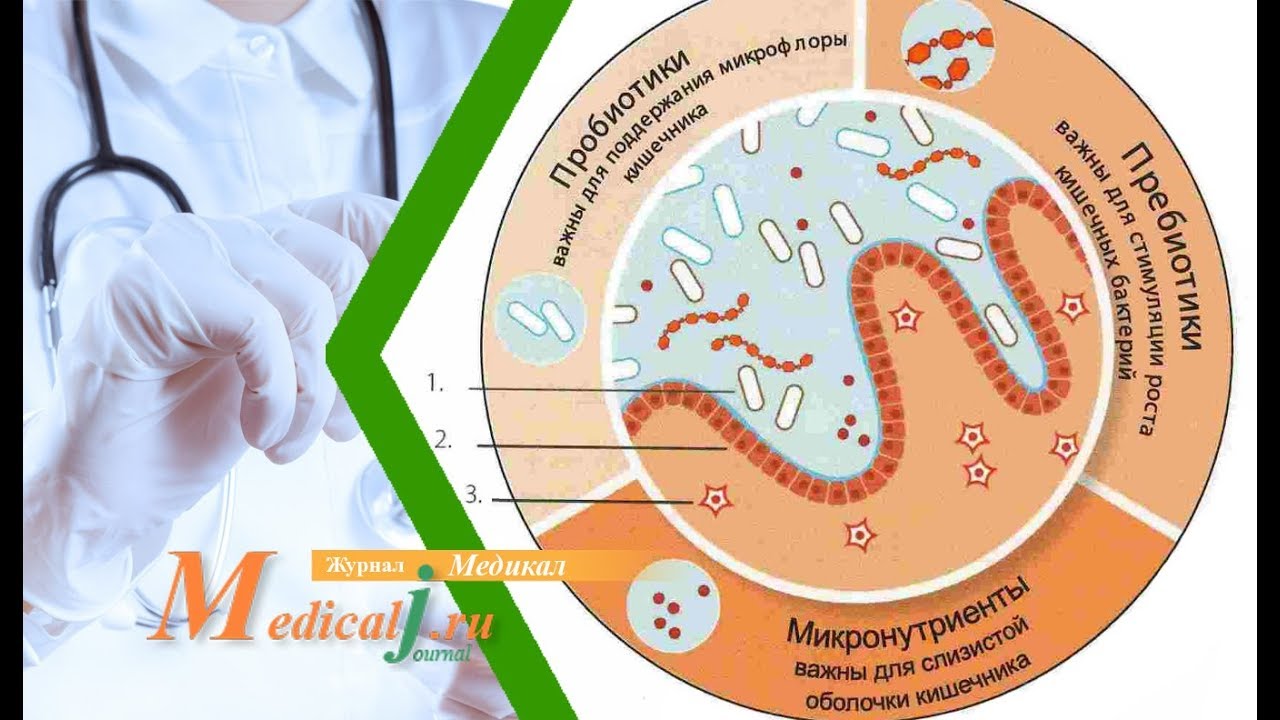 * p <0,05, ** p <0.01. Значимость группировки определялась с использованием PERMANOVA (999 перестановок) с функцией adonis в веганском R-пакете ( p <0,001).
* p <0,05, ** p <0.01. Значимость группировки определялась с использованием PERMANOVA (999 перестановок) с функцией adonis в веганском R-пакете ( p <0,001).
Затем мы проанализировали распределение детей с положительным и отрицательным результатом на аутоантитела в этих трех основных кластерах микробиома. Дети с бета-клеточным аутоиммунитетом были обогащены в кластерах 4 и 5 (кластер 1 против кластера 4, p = 0,004, кластер 1 против кластера 5, p = нс и кластер 4 против кластера.Кластер 5, p = нс, точный критерий Фишера), в то время как дети, отрицательные по бета-клеточному аутоиммунитету и, следовательно, считающиеся здоровыми детьми, были обогащены в кластере 1 (показано на рисунке 3A и в таблице 2). К концу периода наблюдения у 6 из 22 детей в кластере 4 (27%) развился СД1, у одного из восьми детей в кластере 5 (13%) и только у одного из 17 детей в кластере 1 (6%) были диагностированы СД1 (кластер 4 против 5, p = 0,64 и кластер 4 против 1, p = 0,11, соответственно). У одного ребенка, который не был включен ни в один из трех основных кластеров, развился СД1.
У одного ребенка, который не был включен ни в один из трех основных кластеров, развился СД1.
Таблица 2 . Распределение детей с отрицательными аутоантителами, детей с одним или несколькими аутоантителами и прогрессоров заболевания в различных кластерах.
Воспаление кишечника у детей с грибковым и бактериальным дисбактериозом
Чтобы выяснить взаимосвязь между составом кишечной микробиоты и воспалительным ответом хозяина, мы проанализировали фекальные концентрации HBD2, который представляет собой антимикробный пептид, секретируемый эпителиальными клетками в ответ на микробный стимул и активацию пути IL-17 / IL-22 ( 40).Интересно, что у детей в кластере 4 были более высокие уровни HBD2 в фекалиях по сравнению с детьми в кластерах 1 и 5 (рис. 4A), и, следовательно, у детей с положительной реакцией на аутоантитела уровень HBD2 в кале был выше, чем у детей с отрицательными антителами (рис. 4B). Однако у детей с положительной реакцией на антитела в кластере 4 уровень HBD2 в кале был выше, чем у детей в кластере 5 (дополнительный рисунок 3). Примечательно, что дети с одним аутоантителом показали более высокий уровень HBD2 в фекалиях по сравнению с детьми без аутоантител (рис. 4C).Уровни фекального кальпротектина не различались у детей с отрицательным или положительным результатом на аутоантитела или между группами видов (дополнительные рисунки 4D – F).
Примечательно, что дети с одним аутоантителом показали более высокий уровень HBD2 в фекалиях по сравнению с детьми без аутоантител (рис. 4C).Уровни фекального кальпротектина не различались у детей с отрицательным или положительным результатом на аутоантитела или между группами видов (дополнительные рисунки 4D – F).
Рисунок 4 . Маркеры воспаления в различных кластерах и у детей с аутоиммунитетом бета-клеток или без них. (A) Концентрации HBD2 в фекалиях в кластерах 1, 4 и 5. Уровни HBD2 были выше в кластере видов 4 по сравнению с кластерами 1 и 5. (B) Дети с аутоантителами имели повышенные уровни HBD2 в фекалиях по сравнению с детям с отрицательными аутоантителами. (C) Дети с одним аутоантителом имели повышенный уровень HBD2 в фекалиях по сравнению с детьми без аутоантител. (D) Концентрации IgG ASCA в сыворотке были значительно выше в кластерах 1 и 4 по сравнению с кластером 5. (E) Концентрации IgG ASCA в сыворотке крови у детей с AAb- и AAb +.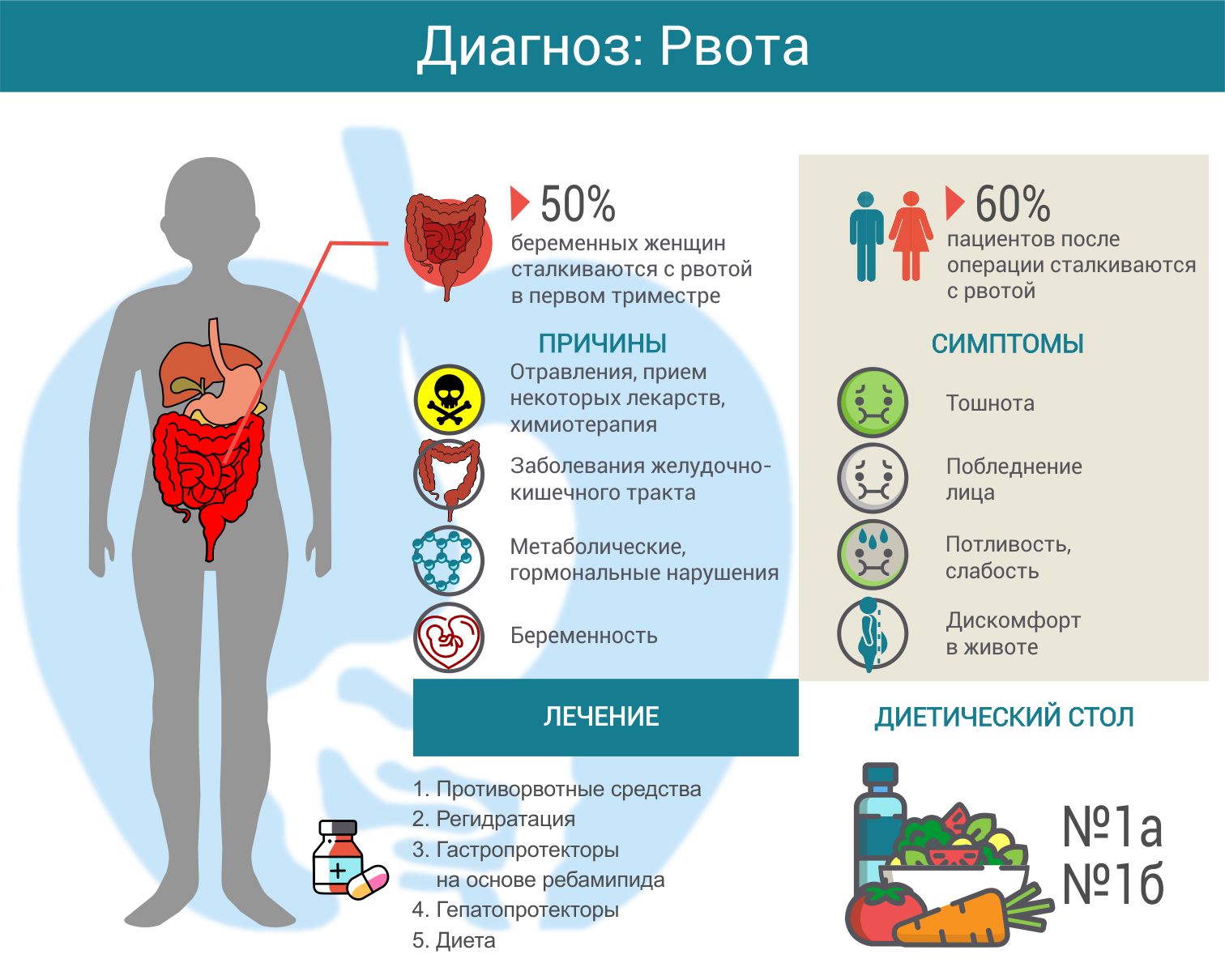 (F) У детей с положительным результатом на аутоантитела, у которых развилось клиническое заболевание, уровень антител IgG к ASCA в сыворотке был выше, чем у детей с отрицательным результатом. (G) Взаимосвязь между уровнями сывороточного ASCA IgA и продолжительностью серопозитивности в кластере видов 4. (H) Взаимосвязь между общим IgA в фекалиях и относительной численностью сахаромицетов в кластере 4. (I) Взаимосвязь между общий фекальный IgA и относительное содержание Saccharomyces в кластере 4. Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами — черными кружками, а дети, у которых клиническое заболевание прогрессировало, — красным кружком.Горизонтальные линии представляют собой медианные значения. p -значения были рассчитаны с помощью теста Манна-Уитни U . Корреляции рассчитывались с помощью теста ранговой корреляции Спирмена. * p <0,05, ** p <0,01.
(F) У детей с положительным результатом на аутоантитела, у которых развилось клиническое заболевание, уровень антител IgG к ASCA в сыворотке был выше, чем у детей с отрицательным результатом. (G) Взаимосвязь между уровнями сывороточного ASCA IgA и продолжительностью серопозитивности в кластере видов 4. (H) Взаимосвязь между общим IgA в фекалиях и относительной численностью сахаромицетов в кластере 4. (I) Взаимосвязь между общий фекальный IgA и относительное содержание Saccharomyces в кластере 4. Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами — черными кружками, а дети, у которых клиническое заболевание прогрессировало, — красным кружком.Горизонтальные линии представляют собой медианные значения. p -значения были рассчитаны с помощью теста Манна-Уитни U . Корреляции рассчитывались с помощью теста ранговой корреляции Спирмена. * p <0,05, ** p <0,01.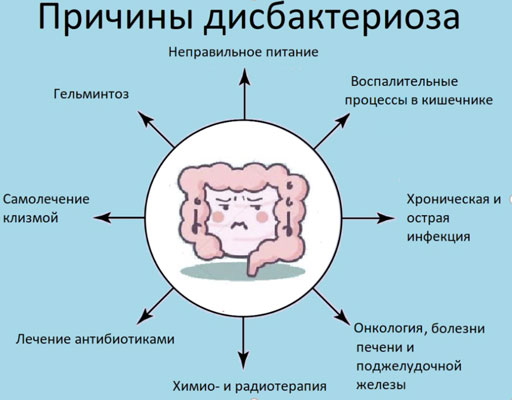
Поскольку высокая численность отряда Saccharomycetales (самые многочисленные роды в наборе данных, относящиеся к Saccharomycetales: Saccharomyces, Candida и Debaryomyces ) была ключевой особенностью детей в кластерах 1 и 4, мы измерили Ранее было показано, что уровни сывороточного ASCA связаны с грибковым дисбиозом при болезни Крона (41, 42).Уровни ASCA IgG были значительно выше у детей, принадлежащих к кластерам 1 и 4, по сравнению с детьми в кластере 5 (рис. 4D), что позволяет предположить, что продукция ASCA IgG действительно индуцируется высокой численностью сахаромицетов, которая наблюдалась у детей в кластерах 1. и 4. Уровни ASCA IgG, однако, не коррелировали с численностью Saccharomycetes или Saccharomyces ни у детей в кластере 1, ни в 4 ( p = 0,33 и p = 0,73). Действительно, самые высокие уровни ASCA IgG наблюдались у детей, которые прогрессировали до клинического СД1, независимо от назначенного кластера (рисунки 4E, F).Более того, уровни ASCA IgG продемонстрировали тенденцию к положительной корреляции с продолжительностью позитивности аутоантител у детей кластера 4 (рисунок 4G). Уровни ASCA IgA существенно не различались между кластерами, но следует отметить, что у большинства исследованных лиц уровни ASCA IgA были ниже нижнего предела обнаружения (дополнительные рисунки 4G – I). Мы также наблюдали положительную корреляцию между уровнями общего IgA в кале и численностью Saccharomycetes (а также Saccharomyces ) в кластере 4, предполагая местный иммуностимулирующий эффект на кишечник Saccharomyces у детей в кластере 4 (рисунки 4H, I).
Уровни ASCA IgA существенно не различались между кластерами, но следует отметить, что у большинства исследованных лиц уровни ASCA IgA были ниже нижнего предела обнаружения (дополнительные рисунки 4G – I). Мы также наблюдали положительную корреляцию между уровнями общего IgA в кале и численностью Saccharomycetes (а также Saccharomyces ) в кластере 4, предполагая местный иммуностимулирующий эффект на кишечник Saccharomyces у детей в кластере 4 (рисунки 4H, I).
Соотношение Bacteroidetes и Firmicutes как регулятор системного воспаления низкой степени тяжести
Учитывая, что иммунитет Th2 и Th27 ранее был связан с грибковым дисбиозом (43) и T1D (6, 9, 44), мы измерили концентрации циркулирующих цитокинов IFNG, IL-17A и IL-22 в образцах сыворотки участники исследования. В кластере 1, обогащенном аутоантител-отрицательными детьми и представляющем, таким образом, здоровых детей, концентрации как IFNG, так и IL-17A положительно коррелировали с численностью Bacteroidetes (Рисунки 5A, D) и обратно с численностью Firmicutes (Рисунки 5B, E). В соответствии с этим мы обнаружили, что дети в кластере 5, характеризующиеся повышенным соотношением Bacteroidetes к Firmicutes, демонстрировали повышенные уровни циркулирующих IFNG и IL-17A (рисунки 5C, F). В кластере 4, обогащенном аутоантител-положительными детьми с воспалением кишечника, не наблюдалось корреляций между циркулирующими цитокинами и составом микробиоты. Не было обнаружено корреляции между относительной численностью Saccharomyces и циркулирующими цитокинами (Рисунки 5G, H) в кластере 1.Концентрации IFNG и IL-17A в сыворотке крови у детей с бета-клеточным аутоиммунитетом или без него показаны на дополнительном рисунке 5.
В соответствии с этим мы обнаружили, что дети в кластере 5, характеризующиеся повышенным соотношением Bacteroidetes к Firmicutes, демонстрировали повышенные уровни циркулирующих IFNG и IL-17A (рисунки 5C, F). В кластере 4, обогащенном аутоантител-положительными детьми с воспалением кишечника, не наблюдалось корреляций между циркулирующими цитокинами и составом микробиоты. Не было обнаружено корреляции между относительной численностью Saccharomyces и циркулирующими цитокинами (Рисунки 5G, H) в кластере 1.Концентрации IFNG и IL-17A в сыворотке крови у детей с бета-клеточным аутоиммунитетом или без него показаны на дополнительном рисунке 5.
Рисунок 5 . Концентрация цитокинов в сыворотке крови в разных кластерах. (A, B) Взаимосвязь между IFNG в сыворотке и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. (D, E) Взаимосвязь между сывороточным IL-17A и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. Уровни (C, F) IFNG и IL-17A были значительно выше в кластере 5 по сравнению с кластерами 1 и 4. (G, H) Взаимосвязь между IFNG в сыворотке и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. Горизонтальные линии представляют медианные значения. p -значения были рассчитаны с помощью теста Манна-Уитни U . Корреляции рассчитывались с помощью теста ранговой корреляции Спирмена. * p <0,05, ** p <0,01.
Уровни (C, F) IFNG и IL-17A были значительно выше в кластере 5 по сравнению с кластерами 1 и 4. (G, H) Взаимосвязь между IFNG в сыворотке и относительной численностью фекальных Bacteroidetes и Firmicutes в кластере 1. Горизонтальные линии представляют медианные значения. p -значения были рассчитаны с помощью теста Манна-Уитни U . Корреляции рассчитывались с помощью теста ранговой корреляции Спирмена. * p <0,05, ** p <0,01.
Обсуждение
В проспективном исследовании с участием 52 детей с риском СД1 мы показали, что дисбактериоз кишечника связан с более поздним развитием СД1 и характеризуется измененными грибковыми и бактериальными сообществами и воспалением кишечника.Признаки воспаления кишечника и повышенной проницаемости ранее были связаны с клиническим СД1 (15, 26, 45–47). Bosi et al. (48) показали повышенную кишечную проницаемость также при предиабете (48). Однако, насколько нам известно, такого рода ассоциации между составом кишечного микробиома, кишечными воспалительными маркерами и их потенциальным вкладом в прогрессирование заболевания ранее не наблюдались у детей из группы риска СД1.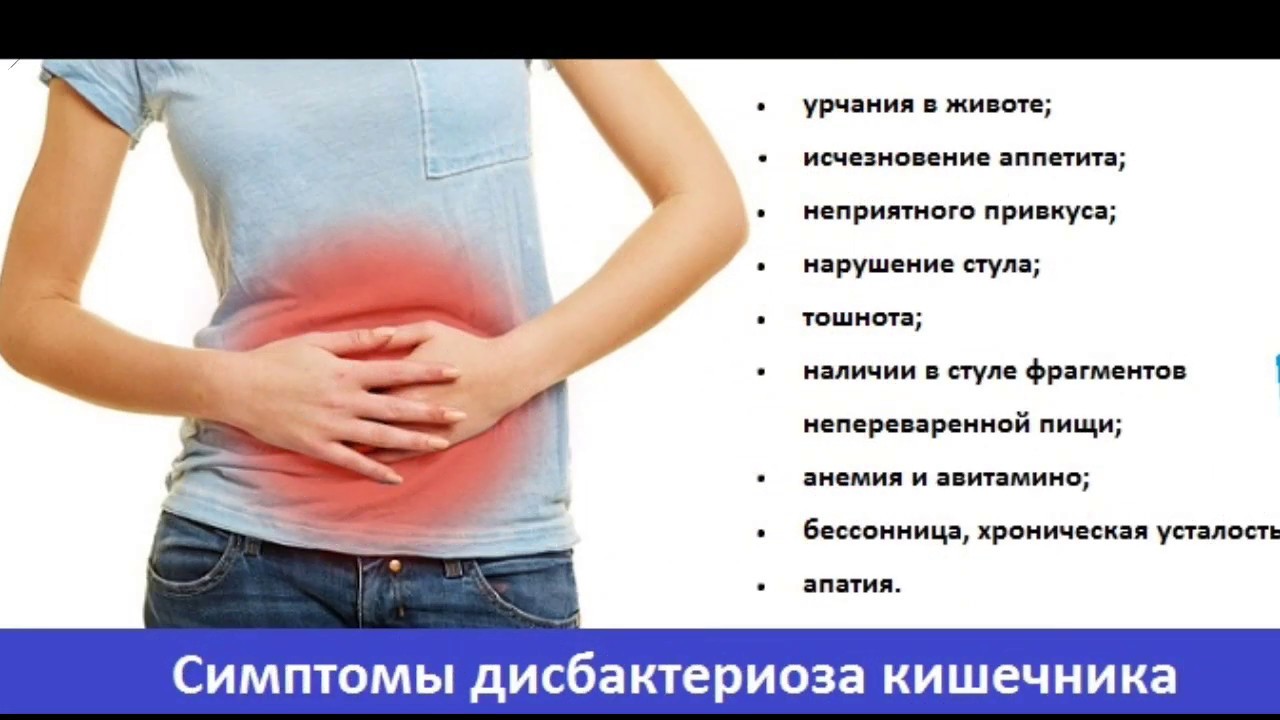
Комбинированный иерархический кластерный анализ таксонов грибов и бактерий обеспечил разделение детей с положительным результатом на аутоантитела на две группы, которые различались по прогрессированию до СД1 в течение периода наблюдения.Долгосрочные последующие исследования редки, но показывают, что почти у всех детей с положительным результатом на множественные аутоантитела и генетический риск СД1 клиническое заболевание развивается через 15–20 лет (49). Таким образом, детей, у которых развился СД1, в нашей когорте можно рассматривать как быстро прогрессирующих (кластер 4) по сравнению с аутоантителопозитивными детьми, которые остались здоровыми (кластер 5). Уровни HBD2 в кале, указывающие на воспаление эпителия кишечника, были самыми высокими у детей с быстрым прогрессированием заболевания (т.е., кластер 4), предполагая, что воспаление кишечника является маркером прогрессирования заболевания. Измененное бактериальное сообщество, которое наблюдалось в кластерах 4 и 5, вероятно, связано с развитием аутоиммунитета бета-клеток как такового. Мы не обнаружили существенных различий в уровнях кальпротектина в фекалиях между группами или детьми с аутоиммунитетом бета-клеток или без него, что позволяет предположить, что активация нейтрофилов не опосредует воспаление кишечника. Уровни фекального кальпротектина в нашей группе исследования были сопоставимы с уровнями, о которых сообщалось ранее у здоровых детей (50).
Мы не обнаружили существенных различий в уровнях кальпротектина в фекалиях между группами или детьми с аутоиммунитетом бета-клеток или без него, что позволяет предположить, что активация нейтрофилов не опосредует воспаление кишечника. Уровни фекального кальпротектина в нашей группе исследования были сопоставимы с уровнями, о которых сообщалось ранее у здоровых детей (50).
Наши данные о микобиоме предполагают, что грибковый дисбиоз может играть роль в нарушении гомеостаза кишечника и развитии субклинического субклинического воспаления кишечника низкой степени, которое ассоциируется с прогрессированием заболевания.
Измененное количество грибов, отнесенных к таксонам Malassezia и Debaryomyces , было обнаружено у детей с бета-клеточным аутоиммунитетом, а снижение численности грибов, отнесенных к роду Verticillium , наблюдалось у детей, у которых позже развился клинический СД1.Fecal Debaryomyces и Malassezia время от времени сообщалось в исследованиях на людях, но в настоящее время нет единого мнения о том, являются ли эти грибковые таксоны постоянными резидентами микробиоты кишечника человека (17). Verticillium очень редко встречается у людей (51, 52). В соответствии с недавним всесторонним обзором микобиоты кишечника человека (18), роды Saccharomyces и Candida были наиболее часто наблюдаемыми таксонами грибов с наибольшей относительной численностью среди детей в нашей когорте.
Verticillium очень редко встречается у людей (51, 52). В соответствии с недавним всесторонним обзором микобиоты кишечника человека (18), роды Saccharomyces и Candida были наиболее часто наблюдаемыми таксонами грибов с наибольшей относительной численностью среди детей в нашей когорте.
Важно отметить, что высокая относительная численность Candida была характерна для грибкового дисбиоза, который отделял детей с положительным результатом на аутоантитела с быстрым прогрессированием заболевания от остальных детей с положительным результатом на аутоантитела, у которых не развился СД1, и от детей с отрицательным результатом. Таким образом, повышенная колонизация Candida может быть важным фактором, способствующим воспалению кишечника и дальнейшему прогрессированию СД1.
Candida является членом здорового кишечного микробиома, а степень колонизации Candida регулируется факторами, связанными с хозяином, такими как целостность эпителия и иммунитет к IL-17 / IL-22, а также составом комменсальных бактерий. сообщество (43, 53–56).Комменсальные бактерии препятствуют колонизации грибов и конкурируют за поверхность и питательные вещества, а продуцируемые бактериями короткоцепочечные жирные кислоты (SCFA) могут ингибировать вирулентность Candida , предотвращая переход дрожжей в гиф (57). Бактерии также могут модулировать функцию и целостность эпителиального барьера с помощью своих метаболитов SCFA, таких как бутират, и путем регуляции выработки слизи, IL-22 и антимикробных пептидов (54, 55, 58). Таким образом, низкая относительная численность Clostridiales и бутират-продуцирующих бактерий, обнаруженная у детей с положительным результатом на аутоантитела, может способствовать усилению колонизации Candida .В более ранних исследованиях также сообщалось о низкой численности бутират-продуцирующих бактерий у детей с положительной реакцией на антитела (10, 59). Однако, несмотря на низкую численность Clostridiales как в кластере 4, так и в 5, увеличение количества Candida наблюдалось только в кластере 4, включая быстро прогрессирующие.
сообщество (43, 53–56).Комменсальные бактерии препятствуют колонизации грибов и конкурируют за поверхность и питательные вещества, а продуцируемые бактериями короткоцепочечные жирные кислоты (SCFA) могут ингибировать вирулентность Candida , предотвращая переход дрожжей в гиф (57). Бактерии также могут модулировать функцию и целостность эпителиального барьера с помощью своих метаболитов SCFA, таких как бутират, и путем регуляции выработки слизи, IL-22 и антимикробных пептидов (54, 55, 58). Таким образом, низкая относительная численность Clostridiales и бутират-продуцирующих бактерий, обнаруженная у детей с положительным результатом на аутоантитела, может способствовать усилению колонизации Candida .В более ранних исследованиях также сообщалось о низкой численности бутират-продуцирующих бактерий у детей с положительной реакцией на антитела (10, 59). Однако, несмотря на низкую численность Clostridiales как в кластере 4, так и в 5, увеличение количества Candida наблюдалось только в кластере 4, включая быстро прогрессирующие. У людей для эффективного контроля и искоренения Candida требуется активация IL17A и продуцирующих IFNG клеток Th27 (60, 61). Таким образом, возможно, что наблюдаемые высокие уровни циркулирующих IL-17 и IFNG в кластере 5 могут обеспечить устойчивость к колонизации грибами.Действительно, численность Saccharomyces была значительно снижена в кластере 5 с самыми высокими уровнями циркулирующих IL-17 и IFNG. Повышение уровня IL-17 и IFNG в кластере 5 на самом деле может быть следствием бактериального дисбиоза, характеризующегося низкой численностью Firmicutes и высокой численностью Bacteroidetes, аналогично тому, как это наблюдается у детей с отрицательными аутоантителами в кластере 1, которые показали положительную корреляцию с циркулирующий IL-17 и IFNG и высокое отношение Bacteroidetes к Firmicutes.Вместо этого в кластере 4 дети не реагировали на бактериальный дисбиоз с помощью активации IL-17 и IFNG, что могло обеспечить нишу для колонизации Candida и, наконец, на местное воспаление слизистой оболочки кишечника.
У людей для эффективного контроля и искоренения Candida требуется активация IL17A и продуцирующих IFNG клеток Th27 (60, 61). Таким образом, возможно, что наблюдаемые высокие уровни циркулирующих IL-17 и IFNG в кластере 5 могут обеспечить устойчивость к колонизации грибами.Действительно, численность Saccharomyces была значительно снижена в кластере 5 с самыми высокими уровнями циркулирующих IL-17 и IFNG. Повышение уровня IL-17 и IFNG в кластере 5 на самом деле может быть следствием бактериального дисбиоза, характеризующегося низкой численностью Firmicutes и высокой численностью Bacteroidetes, аналогично тому, как это наблюдается у детей с отрицательными аутоантителами в кластере 1, которые показали положительную корреляцию с циркулирующий IL-17 и IFNG и высокое отношение Bacteroidetes к Firmicutes.Вместо этого в кластере 4 дети не реагировали на бактериальный дисбиоз с помощью активации IL-17 и IFNG, что могло обеспечить нишу для колонизации Candida и, наконец, на местное воспаление слизистой оболочки кишечника. Когда мы анализировали взаимосвязь между относительной численностью Saccharomyces или Candida и циркулирующими цитокинами, мы не наблюдали значительных корреляций у детей в кластере 1, что подчеркивает важность Bacteroidetes и Firmicutes в регуляции ответов IFNG и IL-17 у здоровых людей. государственный.
Когда мы анализировали взаимосвязь между относительной численностью Saccharomyces или Candida и циркулирующими цитокинами, мы не наблюдали значительных корреляций у детей в кластере 1, что подчеркивает важность Bacteroidetes и Firmicutes в регуляции ответов IFNG и IL-17 у здоровых людей. государственный.
Микробиота кишечника человека — это динамическая система бактерий, грибов, протистов и вирусов, которые сосуществуют и, таким образом, могут сходиться в ответ на различные внешние или внутренние раздражители. Ранее сообщалось о взаимосвязях между бактериями и грибами в микробиоме кишечника при болезни Крона, когда разные роды грибов положительно коррелировали с несколькими таксонами бактерий (21, 22). Способность микобиоты регулировать бактериальный компартмент подтверждается исследованиями на животных, показавшими, что на восстановление бактериального компартмента после истощения антибиотиков бактериями сильно влияла колонизация C.albicans (62). В модели повреждения печени на мышах введение Saccharomyces boulardii изменило состав бактериального компартмента кишечника за счет увеличения относительной численности Bacteroidetes и уменьшения относительной численности бактерий, принадлежащих к Firmicutes (63). Интересно, что Enterobacteriaceae, такие как Escherichia coli , взаимодействуют с дрожжами, способствуя их колонизации и воспалительным свойствам в кишечнике на животной модели язвенного колита (64).Смысл этих данных заключается в том, что кишечные грибковые и бактериальные сообщества могут регулировать друг друга, но понимание экологической сети и ее перекрестные связи с хозяином остаются в значительной степени неизвестными.
Интересно, что Enterobacteriaceae, такие как Escherichia coli , взаимодействуют с дрожжами, способствуя их колонизации и воспалительным свойствам в кишечнике на животной модели язвенного колита (64).Смысл этих данных заключается в том, что кишечные грибковые и бактериальные сообщества могут регулировать друг друга, но понимание экологической сети и ее перекрестные связи с хозяином остаются в значительной степени неизвестными.
Мы признаем, что наше исследование имеет ограничения, такие как относительно небольшое количество исследованных лиц и отсутствие продольно собранных образцов кала и крови во время последующего наблюдения. Хотя мы наблюдали изменения в бактериальном и грибковом сообществах и в маркерах кишечного воспаления в образцах, собранных за несколько лет до появления признаков клинического СД1, продольный отбор образцов и механистические исследования укрепили бы исследование, которое в настоящее время носит описательный характер.Временная взаимосвязь бактериального и грибкового дисбактериоза, связанного с развитием кишечного воспаления, бета-клеточного аутоиммунитета и СД1, требует дальнейших проспективных и механистических исследований, и, как всегда, результаты должны быть воспроизведены в независимых когортах, прежде чем результаты можно будет обобщить.
Существует острая потребность в новых биомаркерах, которые можно было бы использовать для идентификации лиц с повышенным риском аутоиммунитета к бета-клеткам и для прогнозирования прогрессирования от аутоантител-положительности к T1D.Возникает соблазн предположить, что увеличение численности Candida и связанное с ним воспаление кишечника, измеренное по повышенным уровням ASCA и HBD2, может предоставить новые инструменты для более точного прогнозирования СД1.
Продольные исследования необходимы для получения информации о последовательном порядке изменений микробиоты кишечника, воспаления кишечника и периферического иммунитета, ведущих к бета-клеточному аутоиммунитету и клиническому СД1. Несмотря на ограничения в данном исследовании, наши результаты показывают, что микобиота кишечника разнообразна и может быть проанализирована в образцах фекалий у детей.Наши результаты подчеркивают важность грибкового дисбиоза, помимо бактериального дисбактериоза, в формировании гомеостаза кишечника и воспаления, предшествующего T1D.
Все данные микробиома были загружены в базу данных NCBI BioProject с регистрационным номером PRJNA420169 и PRJNA420171. Остальные наборы данных доступны по запросу первому автору (JH).
Заявление об этике
Исследования с участием людей были рассмотрены и одобрены этическим комитетом больничного округа Хельсинки и Уусимаа.Письменное информированное согласие на участие в этом исследовании было предоставлено законным опекуном / ближайшими родственниками участников.
Авторские взносы
JH, JK и OV придумали первоначальную идею. JH и OV написали рукопись. JK, AL и MT отвечали за анализ ДНК и биоинформатику микробиологических исследований. DM отвечал за кластерный анализ. AV провела анализ сывороточного уровня ASCA Ig и цитокинов. JH, LO, JK, AL, MT, AV, CF и DM проанализировали данные. TR и KL координировали набор субъектов исследования и сбор образцов.МК внесла свой вклад в набор предметов исследования и отредактировала рукопись. JK, AL и AP внесли свой вклад в написание и критически рассмотрели рукопись. MK и TH отвечали за анализ аутоантител. JI отвечал за типирование HLA. LO провела анализ HBD2, общего IgA и кальпротектина. OV отвечал за дизайн исследования.
JK, AL и AP внесли свой вклад в написание и критически рассмотрели рукопись. MK и TH отвечали за анализ аутоантител. JI отвечал за типирование HLA. LO провела анализ HBD2, общего IgA и кальпротектина. OV отвечал за дизайн исследования.
Финансирование
Эта работа была поддержана Финским культурным фондом (JH), Финским фондом исследований диабета (JH и OV), Академией Финляндии (OV), Фондом Пяйвикки и Сакари Зольбергов (OV) и Европейским фондом изучения Диабет (OV).
Конфликт интересов
DM использовалась компанией AstraZeneca, но AstraZeneca не участвовала в исследовании.
Остальные авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
Марко Суокас из центра секвенирования Biocenter Oulu (Университет Оулу, Оулу, Финляндия) признателен за предоставление услуг по секвенированию.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www. frontiersin.org/articles/10.3389/fimmu.2020.00468/full#supplementary-material
frontiersin.org/articles/10.3389/fimmu.2020.00468/full#supplementary-material
Дополнительный рисунок 1. Разнообразие грибных сообществ. (A) Кривые разрежения, показывающие альфа-разнообразие грибкового сообщества во всех образцах, и (B) у детей с 1-4 β-клеточными аутоантителами (красная кривая) и отрицательными по аутоантителам образцами (синяя кривая).Каждая кривая показывает среднее количество OTU, обнаруженных в данном количестве выбранных последовательностей после разрежения на глубине 327 последовательностей на выборку. Графики анализа главных координат (PCoA) основаны на взвешенных (C) и невзвешенных (D) UniFrac расстояниях между фекальными грибковыми сообществами у детей с (красные точки) или без (синие точки) аутоантителами.
Дополнительный рисунок 2. Относительная численность грибов родов Saccharomyce s, Candida, Debaryomyces, Malassezia и Verticillium в различных кластерах и у детей с аутоантителами, ассоциированными с СД1 или без них.Относительная численность Saccharomyces (A) и Candida (B) в основных кластерах 1, 4 и 5. (C – E) относительная численность Debaryomyces, Malassezia и Verticillium в образцы фекалий от детей в основных кластерах. (F, G) Здоровые дети без аутоантител отмечены светлыми кружками, дети с 1–4 аутоантителами — черными кружками и дети, у которых клиническое заболевание прогрессировало, — красным кружком. P -значения были рассчитаны с помощью теста Манна-Уитни U . * p <0,05, ** p <0,01.
Дополнительный рисунок 3. Воспаление кишечника у детей с аутоантителами в кластерах 4 и 5. Дети с AAb + в кластере 5 имели значительно более низкие уровни HBD2 в фекалиях по сравнению с детьми AAb + в кластере 4. Горизонтальные линии представляют медианные значения. Дети с 1–4 аутоантителами отмечены черными кружками, а дети, у которых клиническое заболевание прогрессирует, — красным кружком.Пунктирная линия представляет наивысшее наблюдаемое значение в кластере 5. 81% лиц в кластере 4 имели уровень HBD2 выше, чем наивысшее значение в кластере 5. p -значения были рассчитаны с помощью шкалы Манна-Уитни U — тест. * p <0,05.
Дополнительный рисунок 4. Воспалительные маркеры в различных кластерах и у детей с аутоиммунитетом бета-клеток или без них. (A) Концентрация общего IgA в кале в кластерах 1, 4 и 5 основных видов. (B) Концентрации общего IgA в кале у детей с AAb + и AAb- детей. (C) Концентрация общего IgA в кале у детей с AAb, у детей с другим количеством аутоантител и у детей, у которых клинически развился СД1. (D) Концентрация кальпротектина в фекалиях у основных видов, кластеры 1, 4 и 5. (E) Концентрация кальпротектина в фекалиях у детей с AAb + и AAb- детей. (F) Концентрация кальпротектина в кале у детей с AAb, у детей с различным количеством аутоантител и у детей, у которых клинически развился СД1. (G) Уровни сывороточных антител IgA к ASCA в различных кластерах видов. (H) Уровни сывороточного ASCA IgA у детей AAb- и AAb +. (I) Концентрация ASCA IgA в сыворотке крови у детей с AAb- и у детей с одним или несколькими аутоантителами, а также у тех детей, у которых болезнь прогрессировала. (J) Уровни IL-22 в сыворотке крови в различных кластерах видов. (K) Уровни IL-22 у детей AAb- и AAb +. (L) Уровни IL-22 у детей AAb и детей с различным количеством аутоантител.
Дополнительный рисунок 5. (A, B) Концентрация IFNG и IL-17A в сыворотке у детей с бета-клеточным аутоиммунитетом или без него.
Дополнительная таблица 1. 25 самых распространенных видов грибов (на основе наблюдаемых последовательностей) распространены среди детей с отрицательными аутоантителами и детей с аутоантителами.
Дополнительная таблица 2. Сводка перестановочного многомерного дисперсионного анализа (PERMANOVA). Статистические тесты PERMANOVA проводились на взвешенных расстояниях UniFrac и различиях Брея Кертиса между (1) профилями грибковых и (2) бактериальных микробных сообществ кишечника детей с риском развития диабета 1 типа.Статистические тесты проводились с использованием функции adonis в пакете R vegan (с 999 перестановками). Значимые (<0,05) значения выделены жирным шрифтом.
Дополнительная таблица 3. Резюме анализа сходства (ANOSIM). Статистические тесты ANOSIM были выполнены на взвешенных расстояниях UniFrac и различиях Брея Кертиса между (1) профилями грибковых и (2) бактериальных микробных сообществ кишечника детей с риском развития диабета 1 типа. Статистические тесты проводились с использованием функции anosim в пакете R vegan (с 999 перестановками).Для расчета q-значений использовалась поправка Бенджамини-Хохберга на частоту ложных обнаружений (FDR) для множественного тестирования. Значимые (<0,05) значения выделены жирным шрифтом.
Список литературы
1. Бенделак А, Карно С, Буитар С, Бах Дж. Ф. Сингенная передача аутоиммунного диабета от диабетических мышей NOD к здоровым новорожденным. потребность как в L3T4 +, так и в Lyt-2 + Т-клетках. J Exp Med. (1987) 166: 823–32. DOI: 10.1084 / jem.166.4.823
PubMed Аннотация | CrossRef Полный текст | Google Scholar
2.Bottazzo GF, Florin-Christensen A, Doniach D. Антитела островковых клеток при сахарном диабете с аутоиммунной полиэндокринной недостаточностью. Ланцет. (1974) 2: 1279–83. DOI: 10.1016 / S0140-6736 (74)
-8PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Маккуиш А.С., Ирвин В.Дж., Барнс Е.В., Дункан Л.Дж. Антитела к клеткам островков поджелудочной железы у инсулинозависимых диабетиков с сопутствующим аутоиммунным заболеванием. Ланцет. (1974) 2: 1529–31. DOI: 10.1016 / S0140-6736 (74)
-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
5.Феррейра Р.К., Го Х., Колсон Р.М., Смит Д.Д., Пекальски М.Л., Буррен О.С. и др. Транскрипционная сигнатура интерферона I типа предшествует аутоиммунному развитию у детей, генетически подверженных риску диабета 1 типа. Диабет. (2014) 63: 2538–50. DOI: 10.2337 / db13-1777
PubMed Аннотация | CrossRef Полный текст | Google Scholar
7. Каллионпаа Х., Эло Л.Л., Лааяла Э., Микканен Дж., Рикано-Понсе I, Ваарма М. и др. Врожденная иммунная активность выявляется до сероконверсии у детей с предрасположенностью к HLA-индуцированному диабету 1 типа. Диабет. (2014) 63: 2402–14. DOI: 10.2337 / db13-1775
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Марваха А.К., Кром С.К., Панагиотопулос С., Берг К.Б., Цинь Х., Оуян К. и др. На переднем крае: увеличение количества Т-клеток, секретирующих IL-17, у детей с впервые возникшим диабетом 1 типа. J Immunol. (2010) 185: 3814–8. DOI: 10.4049 / jimmunol.1001860
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Райнерт-Хартвалл Л., Хонканен Дж., Сало Х.М., Ниеминен Дж. К., Луопаярви К., Харконен Т. и др.Пластичность Th2 / Th27 является маркером развитого аутоиммунитета бета-клеток и нарушения толерантности к глюкозе у людей. J Immunol. (2015) 194: 68–75. DOI: 10.4049 / jimmunol.1401653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
10. Де Гоффау М.С., Луопаярви К., Книп М., Илонен Дж., Руохтула Т., Харконен Т. и др. Состав фекальной микробиоты у детей с бета-клеточным аутоиммунитетом и без него различается. Диабет. (2013) 62: 1238–44. DOI: 10.2337 / db12-0526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Гионго А., Гано К. А., Крабб Д. Б., Мукерджи Н., Новело Л. Л., Казелла Г. и др. К определению аутоиммунного микробиома диабета 1 типа. ISME J. (2011) 5: 82–91. DOI: 10.1038 / ismej.2010.92
PubMed Аннотация | CrossRef Полный текст | Google Scholar
12. Костич А.Д., Геверс Д., Сильяндер Х., Ватанен Т., Хиотилайнен Т., Хамалайнен А.М. и др. Динамика микробиома кишечника младенца человека в развитии и прогрессировании к диабету 1 типа. Клеточный микроб-хозяин. (2015) 17: 260–73. DOI: 10.1016 / j.chom.2015.01.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Ватанен Т., Франзоза Э.А., Швагер Р., Трипати С., Артур Т.Д., Вехик К. и др. Микробиом кишечника человека при диабете типа 1 с ранним началом из исследования TEDDY. Природа. (2018) 562: 589–94. DOI: 10.1038 / s41586-018-0620-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Ватанен Т., Костич А.Д., д’Хеннезель Э., Сильяндер Х., Франзоза Э.А., Яссур М. и др.Изменение иммуногенности LPS микробиома способствует развитию аутоиммунитета у людей. Cell. (2016) 165: 842–53. DOI: 10.1016 / j.cell.2016.04.007
CrossRef Полный текст | Google Scholar
15. Вестерхольм-Ормио М., Ваарала О., Пихкала П., Илонен Дж., Савилахти Э. Иммунологическая активность слизистой оболочки тонкой кишки у педиатрических пациентов с диабетом 1 типа. Диабет. (2003) 52: 2287–95. DOI: 10.2337 / диабет.52.9.2287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16.Вен Л., Лей Р.Е., Волчков П.Ю., Странджес ПБ, Аванесян Л., Стоунбрейкер А.С. и др. Врожденный иммунитет и микробиота кишечника в развитии диабета 1 типа. Природа. (2008) 455: 1109–13. DOI: 10.1038 / nature07336
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18. Ричард М.Л., Сокол Х. Микобиота кишечника: анализ, взаимодействие с окружающей средой и роль в желудочно-кишечных заболеваниях. Nat Rev Gastroenterol Hepatol. (2019) 16: 331–45.DOI: 10.1038 / s41575-019-0121-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Fujimura KE, Sitarik AR, Havstad S, Lin DL, Levan S, Fadrosh D, et al. Микробиота кишечника новорожденных связана с мультисенсибилизированной атопией в детском возрасте и дифференцировкой Т-клеток. Nat Med. (2016) 22: 1187–91. DOI: 10,1038 / нм 4176
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Hoarau G, Mukherjee PK, Gower-Rousseau C, Hager C., Chandra J, Retuerto MA, et al.Взаимодействие бактериома и микобиома подчеркивает микробный дисбиоз при семейной болезни Крона. МБио. (2016) 7: e01250–16. DOI: 10.1128 / mBio.01250-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
25. Сджорос М., Иития А., Илонен Дж., Рейхонен Х., Ловгрен Т. Анализ гибридизации с тройной меткой для аллелей HLA, связанных с диабетом 1 типа. Биотехники. (1995) 18: 870–7.
PubMed Аннотация | Google Scholar
26. Ваарала О., Илонен Дж., Руохтула Т., Песола Дж., Виртанен С.М., Харконен Т. и др.Удаление бычьего инсулина из смеси коровьего молока и раннее инициирование бета-клеточного аутоиммунитета в пилотном исследовании FINDIA. Arch Pediatr Adolesc Med. (2012) 166: 608–14. DOI: 10.1001 / archpediatrics.2011.1559
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Ихрмарк К., Бодекер И.Т., Крус-Мартинес К., Фриберг Х., Кубартова А., Шенк Дж. И др. Новые праймеры для амплификации области ITS2 грибов — оценка путем секвенирования 454 искусственных и естественных сообществ. FEMS Microbiol Ecol. (2012) 82: 666–77. DOI: 10.1111 / j.1574-6941.2012.01437.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Капорасо Дж. Г., Кучински Дж., Стомбо Дж., Биттингер К., Бушман Ф. Д., Костелло Е. К. и др. QIIME позволяет анализировать высокопроизводительные данные секвенирования сообщества. Нат. Методы. (2010) 7: 335–6. DOI: 10.1038 / nmeth.f.303
PubMed Аннотация | CrossRef Полный текст | Google Scholar
29. Эдгар Р.К., Хаас Б.Дж., Клементе Д.К., Айва К., Найт Р.UCHIME улучшает чувствительность и скорость обнаружения химер. Биоинформатика. (2011) 27: 2194–200. DOI: 10.1093 / биоинформатика / btr381
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31. Макдональд Д., Прайс М.Н., Гудрич Дж., Навроцки Е.П., де Сантис Т.З., Пробст А. и др. Усовершенствованная таксономия greengenes с явными рангами для экологического и эволюционного анализа бактерий и архей. ISME J. (2012) 6: 610–8. DOI: 10.1038 / ismej.2011.139
PubMed Аннотация | CrossRef Полный текст | Google Scholar
32.Nilsson RH, Larsson KH, Taylor AFS, Bengtsson-Palme J, Jeppesen TS, Schigel D, et al. База данных UNITE для молекулярной идентификации грибов: работа с темными таксонами и параллельная таксономическая классификация. Nucleic Acids Res. (2019) 47: D259–64. DOI: 10.1093 / nar / gky1022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
33. Вайс С., Сюй З.З., Педдада С., Амир А., Биттингер К., Гонсалес А. и др. Стратегии нормализации и дифференциальной численности микробов зависят от характеристик данных. Микробиом. (2017) 5:27. DOI: 10.1186 / s40168-017-0237-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Lozupone CA, Hamady M, Kelley ST, Knight R. Количественные и качественные измерения бета-разнообразия позволяют по-разному понимать факторы, которые структурируют микробные сообщества. Appl Environ Microbiol. (2007) 73: 1576–85. DOI: 10.1128 / AEM.01996-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
35.Vazquez-Baeza Y, Pirrung M, Gonzalez A, Knight R. EMPeror: инструмент для визуализации высокопроизводительных данных микробного сообщества. Gigascience. (2013) 2:16. DOI: 10.1186 / 2047-217X-2-16
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Лехтонен О.П., Гран Э.М., Штальберг TH, Лайтинен Л.А. Количество и авидность антител в слюне и сыворотке к Streptococcus mutans в двух группах людей с различной восприимчивостью к кариесу. Infect Immun. (1984) 43: 308–13. DOI: 10.1128 / IAI.43.1.308-313.1984
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Hoffmann C, Dollive S, Grunberg S, Chen J, Li H, Wu GD и др. Археи и грибы микробиома кишечника человека: корреляция с диетой и бактериальными жителями. PLoS ONE. (2013) 8: e66019. DOI: 10.1371 / journal.pone.0066019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Мотоока Д., Фудзимото К., Танака Р., Ягути Т., Гото К., Маэда Ю. и др.Стратегии глубокого секвенирования ITS1 грибов для реконструкции состава сообщества из 26 видов и оценки микобиоты кишечника здоровых японцев. Front Microbiol. (2017) 8: 238. DOI: 10.3389 / fmicb.2017.00238
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Лян С.К., Тан XY, Люксенберг Д.П., Карим Р., Дунусси-Джоаннопулос К., Коллинз М. и др. Интерлейкин (IL) -22 и IL-17 коэкспрессируются клетками Th27 и совместно усиливают экспрессию антимикробных пептидов. J Exp Med. (2006) 203: 2271–9. DOI: 10.1084 / jem.20061308
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Израильский Э, Грот I, Гилбурд Б., Балисер Р.Д., Голдин Э., Виик А. и др. Анти-Saccharomyces cerevisiae и антинейтрофильные цитоплазматические антитела как предикторы воспалительного заболевания кишечника. Gut. (2005) 54: 1232–6. DOI: 10.1136 / gut.2004.060228
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44.Каллманн Б.А., Хутер М., Тубес М., Фельдкамп Дж., Бертрамс Дж., Грис Ф.А. и др. Системный уклон производства цитокинов в сторону клеточно-опосредованной иммунной регуляции при IDDM и в сторону гуморального иммунитета при болезни Грейвса. Диабет. (1997) 46: 237–43. DOI: 10.2337 / диабет.46.2.237
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. Kuitunen M, Saukkonen T, Ilonen J, Akerblom HK, Savilahti E. Кишечная проницаемость для маннита и лактулозы у детей с диабетом 1 типа с аллелем HLA-DQB1 * 02. Аутоиммунитет. (2002) 35: 365–8. DOI: 10.1080 / 08
021000008526PubMed Аннотация | CrossRef Полный текст | Google Scholar
46. Тийттанен М., Вестерхольм-Ормио М., Веркасало М., Савилахти Е., Ваарала О. Инфильтрация P3-экспрессирующих клеток вилочного блока в слизистую оболочку тонкой кишки при целиакии, но не при диабете 1 типа. Clin Exp Immunol. (2008) 152: 498–507. DOI: 10.1111 / j.1365-2249.2008.03662.x
CrossRef Полный текст | Google Scholar
47.Ваарала О., Аткинсон М.А., Ной Дж. Идеальный шторм для диабета 1 типа: сложное взаимодействие между кишечной микробиотой, проницаемостью кишечника и иммунитетом слизистых оболочек. Диабет. (2008) 57: 2555–62. DOI: 10.2337 / db08-0331
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Бози Э., Молтени Л., Радаэлли М.Г., Фолини Л., Фермо I, Баззигалуппи Э. и др. Повышенная кишечная проницаемость предшествует клиническому началу диабета 1 типа. Diabetologia. (2006) 49: 2824–7.DOI: 10.1007 / s00125-006-0465-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49. Ziegler AG, Rewers M, Simell O, Simell T, Lempainen J, Steck A, et al. Сероконверсия к множественным островковым аутоантителам и риск развития диабета у детей. JAMA. (2013) 309: 2473–9. DOI: 10.1001 / jama.2013.6285
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Колхо К.Л., Сиппонен Т., Валтонен Э., Савилахти Е. Уровни фекального кальпротектина, MMP-9 и бета-дефенсина-2 человека при воспалительных заболеваниях кишечника у детей. Int J Colorectal Dis. (2014) 29: 43–50. DOI: 10.1007 / s00384-013-1775-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Хамад И., Сохна С., Рауль Д., Биттар Ф. Молекулярное обнаружение эукариот в одном образце стула человека из Сенегала. PLoS ONE. (2012) 7: e40888. DOI: 10.1371 / journal.pone.0040888
PubMed Аннотация | CrossRef Полный текст | Google Scholar
52. Scanlan PD, Marchesi JR. Микроэукариотическое разнообразие микробиоты дистального отдела кишечника человека: качественная оценка с использованием культурально-зависимого и независимого анализа фекалий. ISME J. (2008) 2: 1183–93. DOI: 10.1038 / ismej.2008.76
PubMed Аннотация | CrossRef Полный текст | Google Scholar
53. де Лука А., Зеланте Т., Д’Анджело С., Загарелла С., Фалларино Ф, Спрека А. и др. IL-22 определяет новый иммунный путь противогрибковой устойчивости. Mucosal Immunol. (2010) 3: 361–73. DOI: 10,1038 / mi.2010.22
PubMed Аннотация | CrossRef Полный текст | Google Scholar
54. Киннебрю М.А., Баффи К.Г., Дил Г.Е., Зеневич Л.А., Лейнер И., Холь TM и др.Продукция интерлейкина 23 дендритными клетками кишечника CD103 (+) CD11b (+) в ответ на бактериальный флагеллин усиливает врожденную иммунную защиту слизистой оболочки. Иммунитет. (2012) 36: 276–87. DOI: 10.1016 / j.immuni.2011.12.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
55. Шаубер Дж., Сванхольм С., Термен С., Иффланд К., Мензель Т., Шеппах В. и др. Экспрессия кателицидина LL-37 модулируется короткоцепочечными жирными кислотами в колоноцитах: значимость сигнальных путей. Gut. (2003) 52: 735–41. DOI: 10.1136 / gut.52.5.735
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Fan D, Coughlin LA, Neubauer MM, Kim J, Kim MS, Zhan X, et al. Активация HIF-1α и LL-37 комменсальными бактериями подавляет колонизацию Candida albicans . Nat Med. (2015) 21: 808–14. DOI: 10,1038 / нм.3871
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58. Отте Дж. М., Здебик А. Э., Бренд С., Хромик А. М., Штраус С., Шмитц Ф. и др.Влияние кателицидина LL-37 на целостность кишечного эпителиального барьера. Regul Pept. (2009) 156: 104–17. DOI: 10.1016 / j.regpep.2009.03.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Бахер П., Хонштейн Т., Бирбаум Э., Рокер М., Бланго М.Г., Кауфманн С. и др. Человеческий противогрибковый иммунитет Th27 и патология зависят от перекрестной реактивности против Candida albicans . Cell. (2019) 176: 1340–55.e15. DOI: 10.1016 / j.cell.2019.01.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61. Зелински К.Э., Меле Ф., Ашенбреннер Д., Ярроссей Д., Рончи Ф., Гатторно М. и др. Индуцированные патогеном клетки Th27 человека продуцируют IFN-γ или IL-10 и регулируются IL-1β. Природа. (2012) 484: 514–8. DOI: 10.1038 / nature10957
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Эрб Даунворд мл., Фальковски Н. Р., Мейсон К. Л., Муралья Р., Хаффнэгл, Великобритания. Модуляция постантибиотической повторной сборки бактериального сообщества и ответа хозяина с помощью Candida albicans . Научный доклад (2013) 3: 2191. DOI: 10.1038 / srep02191
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Yu L, Zhao XK, Cheng ML, Yang GZ, Wang B, Liu HJ, et al. Введение Saccharomyces boulardii изменяет микробиоту кишечника и уменьшает повреждение печени, вызванное D-галактозамином. Научный доклад (2017) 7: 1359. DOI: 10.1038 / s41598-017-01271-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Sovran B, Planchais J, Jegou S, Straube M, Lamas B, Natividad JM и др. Enterobacteriaceae необходимы для изменения степени тяжести колита, вызываемого грибами. Микробиом. (2018) 6: 152. DOI: 10.1186 / s40168-018-0538-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Что такое дисбактериоз: как бактерии в вашем теле разрушают ваше здоровье
Дисбактериоз — это заболевание, от которого страдают многие люди, осознают они это или нет. Дисбактериоз связан с такими заболеваниями, как СРК, болезнь Крона, язвенный колит, аутизм и ожирение.И хотя это обычное заболевание, его влияние на организм все еще в значительной степени неправильно понимается.
В этой статье будет рассказано, что такое дисбактериоз, каковы его причины и как его лечить.
Сначала разберемся, что такое дисбактериоз.
Что такое дисбактериоз?
Дисбиоз или дисбактериоз — это нарушение баланса микробных сообществ в организме. Это может проявляться в более высокой распространенности определенных бактерий, отсутствии бактерий и недостаточном разнообразии бактерий.Дисбаланс может возникнуть в любом из участков тела с микробами, включая кожу, кишечник, влагалище и нос.
Дисбактериоз обычно ассоциируется с заболеваниями, связанными с ЖКТ, такими как СИБР, болезнь Крона, язвенный колит и другие. Хотя дисбактериоз связан не только с микробиомом кишечника, он также может влиять на другие микробиомы тела, включая кожу, рот и нос.
Что вызывает дисбактериоз?
Есть некоторые известные факторы, вызывающие дисбактериоз, но не все факторы известны или полностью изучены.Среди известных факторов, которые могут привести к дисбактериозу, — изменение диеты, прием антибиотиков и стресс. Часто дисбактериоз возникает из-за комбинации этих факторов, и предрасположенности также могут играть роль.
Исследования показали, что воздействие дезинфицирующих средств, бытовых чистящих средств и других химикатов, особенно в молодом возрасте, может привести к увеличению риска дисбактериоза. Способ родов также считается предрасполагающим фактором риска развития дисбактериоза. Те, кто родился в результате кесарева сечения вместо естественного рождения, представляют более высокий риск дисбактериоза и состояний, связанных с дисбактериозом.
Кто подвержен риску дисбактериоза?
Предрасположенность, образ жизни и окружающая среда могут подвергнуть человека более высокому риску развития дисбактериоза. Дети, рожденные в результате кесарева сечения, представляют собой более высокий риск, как и дети, которые в раннем возрасте подвергаются высокому воздействию дезинфицирующих средств и антибиотиков. Это связано с высокой пластичностью микробиома на этапах развития детства.
Для пожилых людей окружающая среда и состояние здоровья могут способствовать риску. Опять же, употребление антибиотиков увеличивает риск, а также увеличивает стресс и ослабляет иммунную систему.Те, кто находится в больнице или в медицинских учреждениях длительного пребывания, подвержены повышенному риску дисбактериоза, чем те, кто живет самостоятельно, с меньшим количеством бактериальных и вирусных инфекций.
Симптомы и состояния дисбактериоза
Симптомы дисбактериоза зависят от типа и расположения бактериального дисбаланса в организме. Дисбиоз может возникнуть в любой нише микробиома, включая микробиом кишечника, микробиом кожи, микробиом полости рта и многое другое. Симптомы могут быть от легких до тяжелых и могут быть связаны с другими состояниями, помимо дисбактериоза.
Общие симптомы дисбактериоза включают:
- Тошнота
- Расстройство желудка
- Диарея
- Запор
- Вздутие живота
- Усталость
- Затрудненное мочеиспускание
- Галитоз (неприятный запах изо рта)
- Боль в груди
- Сыпь
- Проблемы с концентрацией
- Беспокойство
- Депрессия
Если вы испытываете какие-либо из этих симптомов в течение длительных периодов времени или хронически, вам следует проконсультироваться с врачом.
Состояния, связанные с дисбактериозом
Говоря о дисбактериозе и связанных с ним состояниях, мы представляем курицу и ситуацию с яйцом. Является ли микробиом при дисбактериозе причиной воспаления, или воспаление является причиной дисбактериоза, или, возможно, это сочетание причины и следствия. В любом случае, исследователи установили связь между следующими заболеваниями / состояниями и дисбактериозом:
Связь между дисбактериозом и этими состояниями привела к появлению новых видов лечения, включая трансплантацию фекальной микробиоты (FMT) и другие курсы лечения, ориентированные на бактерии.
Исцеление от дисбактериоза кишечника
Дисбактериоз может быть сложно поддающимся лечению состоянием, но есть определенные диеты и методы лечения, которые, как было показано, уменьшают симптомы дисбактериоза. Некоторые люди придерживаются диеты FODMAP, в то время как другие используют определенную углеводную диету, какой бы она ни была, диета может быть эффективным способом уменьшить бактериальный дисбаланс.
Еда:
- Темная листовая зелень, например, шпинат и капуста
- Рыба
- Свежее мясо (без мясной обработки)
Продукты, которых следует избегать:
- Молочная
- Продукты с высоким содержанием сахара Мясные продукты мясные
- Простые углеводы, такие как кукуруза, овес или хлеб
- Некоторые фрукты, такие как бананы, яблоки и виноград
Существуют также методы лечения дисбактериоза, а именно FMT.
Трансплантаты фекальной микробиоты все чаще используются для лечения дисбактериоза. Лечение включает пересадку стула от здорового донора в кишечник человека с дисбактериозом. При трансплантации кал, который является богатым источником микробиоты (то есть бактерий, грибов, простейших и вирусов), способен помочь ослабить микробиом пациента и вернуть его в более сбалансированное и здоровое состояние.
Микробиота кишечника в раннем возрасте и здоровье легких у детей
Микробиота желудочно-кишечного тракта играет решающую роль в питании, обмене веществ и иммунной функции у младенцев и детей младшего возраста и имеет значение для будущего состояния здоровья легких.Понимание роли дисбактериоза кишечника в прогрессировании хронического заболевания легких даст возможность разработать ранние вмешательства для улучшения течения болезни. Микробиота кишечника устанавливается в течение первых 1–3 лет жизни и остается относительно стабильной на протяжении всей жизни. В этом обзоре мы сообщаем о последних достижениях в исследованиях оси кишечник-легкие, с акцентом на влияние нацеливания на микробиоту младенцев и детей с риском или с прогрессирующими заболеваниями легких.Основная идея состоит в том, чтобы использовать этот подход в критическом окне для достижения наилучших результатов в управлении здоровьем в будущем.
1. Введение
Клинические исследования последних десятилетий были сосредоточены на перекрестных помехах между хозяином и микробом, особенно на кишечном уровне, что выдвинуло гипотезу о том, что микробиота кишечника является одним из ключевых факторов, определяющих здоровье хозяина. На иммунные и метаболические функции влияет заселение кишечника дружественными бактериями [1], и растущее число заболеваний связано с составом микробиоты кишечника.Изменение структуры микробиоты часто начинается в раннем возрасте у детей с хроническими заболеваниями, такими как муковисцидоз, или с риском их развития [2, 3].
Микробиом устанавливается в течение первых 1–3 лет жизни и остается относительно стабильным на протяжении всей жизни [4]. Неонатальный период — это критическое окно для иммунного программирования, которое влияет на глобальное состояние здоровья на всю жизнь, а развитие кишечной микробиоты может помочь в прогнозировании риска конкретного заболевания и его прогрессирования или полного устранения болезни [5].
В этом обзоре мы анализируем основные факторы и фазы раннего микробного импринтинга, ось кишечник-легкие в прогрессировании хронических заболеваний легких у детей и манипуляции с микробиотой кишечника в раннем возрасте для изменения истории болезней легких у детей.
2. Факторы, влияющие на состав кишечной микробиоты в раннем младенчестве
Факторы окружающей среды вместе с генетикой и активностью иммунной системы влияют на паттерн микробной колонизации у новорожденных Таблица 1. Концепция стерильности плода была пересмотрена после обнаружения микробных следов у плода и плода. материнские отсеки [6, 7].В настоящее время считается, что существует пренатальная колонизация вертикально перенесенным микробным материалом.
| 00000 Тип родов влияет на характер колонизации кишечника младенца.Младенцы, рожденные естественным путем, колонизируются сообществами бактерий из влагалищного и кишечного тракта матери. Младенцы, рожденные после кесарева сечения, лишены такого воздействия, что приводит к появлению первых бактерий, подобных микробиоте кожи человека [8]. Кроме того, задерживается колонизация кишечника Lactobacillus , Bifidobacteria и Bacteroides у младенцев, рожденных путем кесарева сечения [9]. Кормление грудных детей оказывает долгосрочное влияние на микробный состав кишечника.Грудное вскармливание связано с целым рядом долгосрочных положительных эффектов, включая снижение частоты ожирения [10], диабета [11] и аллергии [12, 13]. Грудное молоко является золотым стандартом в питании детей грудного возраста, потому что это виды, специально адаптированные к потребностям ребенка в питании и способствующие развитию иммунной системы. В дополнение к питательной поддержке грудное молоко содержит биоактивные компоненты, которые способствуют росту широкого и динамичного множества микроорганизмов [14].В молозиве более высокое микробное разнообразие, чем в переходном и зрелом молоке, и факторы, влияющие на микробное сообщество в грудном молоке, также зависят от статуса питания матери и типа родов. Микробиота кишечника младенцев, в которой преобладают бифидобактерии , неизменно ассоциируется со здоровьем хозяина. Преобладание Bifidobacteria в стуле вскармливаемых грудью младенцев было впервые обнаружено более 100 лет назад, что позволяет предположить, что грудное молоко содержит специфические молекулы, которые стимулируют рост этих бактерий, определяемых как факторы бифидоза [15].Сегодня убедительные доказательства показывают, что пребиотики в грудном молоке способствуют росту бифидобактерий . Последние доминируют в микробиоте младенцев, находящихся на грудном вскармливании, в то время как младенцы, вскармливаемые смесями, имеют более высокие доли Bacteroides и членов групп Clostridium coccoides и Lactobacillus [16]. Кроме того, грудное вскармливание модулирует врожденный иммунный ответ [17]. Антибиотики оказывают большое влияние на состав микробиома кишечника, особенно у младенцев.В последнем случае структура кишечных бактерий очень нестабильна, и постоянное и многократное использование антибиотиков, особенно если используемый антибиотик широкого спектра действия, глубоко изменяет микробную структуру кишечника с серьезными поздними клиническими последствиями. Недавние статьи показывают, что пренатальное использование антибиотиков связано с повышенным риском последующей астмы [18]. Конечно, антибиотики часто необходимы при определенных условиях, но их использование следует рассматривать в свете новых данных, обобщенных в таблице 2.Russell и его коллеги обнаружили, что перинатальное использование антибиотиков вызывает высокоселективные модификации резидентной флоры кишечника, что, в свою очередь, приводит к очень специфическим изменениям восприимчивости к воспалительным заболеваниям легких, вызванным Th3 или Th2 / Th27 [19]. Недавнее исследование показало, что у детей, лишенных четырех типов бактерий, вероятность развития астмы выше, но единственным значимым фактором окружающей среды среди этих детей было получение большего количества антибиотиков в первый год жизни, чем у детей с более низким риском астмы [18].Инфекции раннего младенчества, включая общие кишечные инфекции, действительно изменяют микробную структуру кишечника с долгосрочными эффектами [20].
3.Ось кишечник-легкие в прогрессировании хронических заболеваний легких у детейКишечный и респираторный эпителий создают физический барьер против проникновения микробов, а колонизация нормальной микробиотой порождает устойчивость к патогенам. Роль микробиоты в гомеостазе легких и иммунитете подтверждается плохими исходами мышей, свободных от микробов, которые подверглись острым инфекциям [21], и их предрасположенностью к аллергическим заболеваниям дыхательных путей [22]. Дисбактериоз кишечника недавно был связан с изменениями иммунных ответов и развитием заболеваний в легких.В последние несколько лет изучались хронические заболевания легких, такие как астма и кистозный фиброз, чтобы оценить потенциальную роль дисбактериоза кишечника в их развитии. В первую очередь, обострения хронических заболеваний кишечника и легких имеют общие концептуальные черты с нарушением регуляции микробной экосистемы кишечника. Муковисцидоз (МВ) — это заболевание, при котором рецидивирующая и хроническая инфекция приводит к прогрессирующему снижению функции легких и, в конечном итоге, к смерти. В обсервационных исследованиях на людях МВ был связан с аберрантной микробной колонизацией кишечника и дыхательных путей.Эти находки являются вероятными последствиями потери функции регулятора трансмембранной проводимости (CFTR) при CF и, как следствие, изменения микросреды [23]. Мутации в CFTR фундаментально влияют на микросреду дыхательных путей и кишечника и приводят к патологическому паттерну колонизации микроорганизмов у пациентов с CF даже в отсутствие воздействия антибиотиков [24]. Более тяжелые аллельные варианты CFTR, такие как гомозиготный DF508, коррелируют с более значительными изменениями в структуре микробиома кишечника.Хроническое воспаление кишечника наблюдается при МВ даже при отсутствии явных желудочно-кишечных симптомов и считается причиной системного воспаления, отличительного признака заболевания [25]. Связь между микробной колонизацией кишечника в раннем возрасте и респираторными исходами у пациентов с МВ была исследована, а грудное вскармливание было связано с отсроченными обострениями, разнообразием кишечника и продолжительными периодами благополучия и специфическими бактериальными сообществами в кишечнике до респираторных осложнений [ 26].Бактерии дыхательных путей при МВ происходят из кишечной микробиоты и, как полагают, вносят вклад в динамические взаимодействия между хозяином и микробными сообществами при МВ [27]. Исследования также продемонстрировали связь между плохим питанием и развитием бронхолегочной дисплазии у недоношенных новорожденных, которым требуется длительная дополнительная кислородная терапия [28]. Никаких данных о дисбактериозе кишечника в этой ситуации нет. Дети, у которых развивается астма, имеют меньшее микробное разнообразие кишечника в первый год жизни по сравнению со здоровыми детьми [29].В частности, способ родоразрешения был связан с хрипом и астмой до школьного возраста, опосредованным определенными группами кишечных бактерий [30]. Присутствие полезных бактерий, таких как Bifidobacterium longum , и снижение содержания Bacteroides fragilis [31] в кишечнике было связано с более низкой частотой случаев астмы. Относительная численность бактерий родов Lachnospira , Veillonella , Faecalibacterium и Rothia , по-видимому, значительно снижается у детей с риском астмы, что приводит к снижению уровня ацетата в кале и нарушению регуляции энтерогепатических метаболитов [31]. 4. Манипуляции с микробиотой кишечника в раннем возрасте при заболеваниях легких у детейПероральное введение пробиотиков и пребиотиков или их комбинации (так называемый «синбиотический подход») может косвенно влиять на состав микробиоты дыхательных путей через высвобождение бактериальных продуктов или метаболитов, которые достигают легких и способствуют размножению полезных бактерий или напрямую, через микроаспирацию пробиотического штамма из кишечного тракта в дыхательные пути [32].Эти механизмы могут восстанавливать полезную для здоровья микробиоту и благотворно влиять на течение болезни. Более того, несколько пробиотических штаммов играют роль в изменении течения заболеваний легких. В исследованиях на животных Lactobacilli оказывают сильное иммунорегулирующее действие на легкие, но результаты клинических испытаний на людях сильно различаются. Различия в деформациях могут частично объяснить наблюдаемую изменчивость. У людей введение Lactobacillus GG (LGG) отрицательно повлияло на заболеваемость вентилятор-ассоциированной пневмонией [33] и уменьшило респираторные инфекции как у здоровых, так и у госпитализированных детей [34]. Астма является основной потенциальной мишенью для пробиотиков из-за ее частоты, соответствующего патогенеза и отсутствия последовательно эффективных профилактических стратегий. Однако данные о раннем манипулировании микробами кишечника отсутствуют, поскольку астма прогрессивно развивается до школьного возраста, а длительное наблюдение за исследованием пробиотиков и пребиотиков ограничено. Манипулирование кишечной микробиотой при МВ путем изменения содержания в рационе неперевариваемых углеводов и короткоцепочечных жирных кислот, а именно бутирата, может улучшить недостаточное питание и оказать противовоспалительное действие на животных [35].Восстановление кишечной микробиоты пробиотиками улучшает пищевой статус, потребление энергии и респираторную функцию при муковисцидозе [35]. Три РКИ пришли к выводу, что введение пробиотиков, в частности LGG и Lactobacillus reuteri , было связано с уменьшением эпизодов обострений легких у детей с МВ [36–38]. Первые доказательства потенциальных преимуществ применения пробиотиков при МВ были получены в проспективном рандомизированном плацебо-контролируемом перекрестном исследовании, проведенном в двух группах пациентов с МВ, хронически колонизированных Pseudomonas aeruginosa .Девятнадцать детей получали LGG в течение 6 месяцев, а затем плацебо (раствор для пероральной регидратации) в течение следующих 6 месяцев. Параллельно 19 детям давали плацебо в течение 6 месяцев, а затем пробиотик в течение того же периода времени. У пациентов, получавших LGG, наблюдалось значительное снижение воспаления кишечника, эпизодов обострений легких и количества госпитализаций со снижением уровня IgG, что свидетельствует о взаимосвязи между воспалением кишечника и легких. Прием этого пробиотика был связан со значительным увеличением максимального объема форсированного выдоха за 1 секунду (ОФВ1) по сравнению с плацебо, а также со значительным увеличением массы тела [36].В другом проспективном рандомизированном двойном слепом плацебо-контролируемом исследовании 61 пациент с МВ был рандомизирован для получения 10 10 колониеобразующих единиц Lactobacillus reuteri в день или плацебо в течение 6 месяцев. Обострения легких и количество инфекций верхних дыхательных путей были значительно снижены в группе лечения по сравнению с группой плацебо [39]. Что касается бронхолегочной дисплазии, то исследования на людях с пре- или пробиотиками не проводились.Более того, при перемежающейся гипоксии, индуцированной на животных моделях, добавление пробиотиков может улучшить состояние легких, воздействуя на специфические матриксные металлопротеиназы, что указывает на положительный эффект на воспаление легких. Кроме того, использование пребиотиков было связано с задержкой передачи сигналов фактора роста эндотелия сосудов легких, принимающего активное участие в развитии микрососудов легких, что предполагает сохранение ангиогенеза [40]. Однако эффекты пробиотиков, вероятно, будут зависеть от времени, что указывает на необходимость проведения сравнительных клинических испытаний, оценивающих влияние модуляции микробиоты в раннем возрасте на состояние здоровья легких.В частности, необходимы будущие исследования, чтобы проанализировать, как микробный состав кишечника в раннем возрасте влияет на возникновение и историю заболеваний легких, а также изучить роль функциональных пищевых продуктов в предотвращении и / или изменении состояния здоровья легких у детей. Конфликт интересовАвторы заявляют, что у них нет конфликта интересов. БлагодарностиЭта статья была подготовлена при поддержке Североамериканского фонда кистозного фиброза (грант №GUARIN10A0). Квазипарная когортная стратегия выявляет нарушение детоксицирующей функции микробов в кишечнике аутичных детейAbstractРастущие данные свидетельствуют о том, что расстройство аутистического спектра (РАС) тесно связано с дисбиозом в микробиоме кишечника с точными механизмами. все еще неясно. Мы предложили новую аналитическую стратегию — квазипарную когорту — и применили ее к метагеномному исследованию микробиома РАС. Сравнивая парные выборки пациентов с РАС и нейротипиков, мы выявили значительный дефицит у детей с РАС детоксикационных ферментов и метаболических путей, которые показывают сильную корреляцию с биомаркерами митохондриальной дисфункции.Диагностические модели, основанные на этих детоксифицирующих ферментах, точно отличали людей с РАС от контрольной, а оценка дисфункции, выведенная из модели, увеличивалась с клиническими оценками РАС. Таким образом, наши результаты предполагают ранее не обнаруженную потенциальную роль нарушенной кишечной микробной детоксикации в накоплении токсинов и митохондриальной дисфункции, ключевом компоненте патогенеза РАС. Эти результаты открывают путь к разработке будущих терапевтических стратегий для восстановления возможностей микробной детоксикации для пациентов с РАС. ВВЕДЕНИЕРасстройство аутистического спектра (РАС) — это сложное расстройство нервного развития, характеризующееся нарушением социальных коммуникаций и повторяющимся и стереотипным поведением, интересами или деятельностью ( 1 ). Распространенность РАС растет во всем мире и, по оценкам Сети мониторинга аутизма и нарушений развития в 2014 году, затрагивает примерно 1,6% американских 8-летних детей ( 2 ). Этиология РАС остается неизвестной и, вероятно, связана с широким спектром факторов окружающей среды, которые влияют на многие физиологические процессы у генетически предрасположенных людей ( 3 ).Недавно появились данные, свидетельствующие о возможном вкладе кишечного микробиома в патогенез РАС, как и во многих других заболеваниях ( 4 ). Во-первых, у детей с РАС часто встречается сопутствующая желудочно-кишечная патология ( 5 ). Во-вторых, пациенты с РАС в основном разборчивы в еде ( 6 ) и часто испытывают дефицит пищеварительных ферментов ( 7 ), что неизбежно изменяет питательные вещества или среду микробов, населяющих их кишечник, и влияет на рост составляющих видов, что приводит к дисбактериоз.Наконец, многие исследования выявили явный дисбактериоз в микробиоме кишечника пациентов с РАС, например, дефицит Bifidobacterium longum и чрезмерный рост Clostridium spp. и Candida albicans ( 8 , 9 ). Считается, что дисбактериоз микробиома ASD связан с воспалением кишечного эпителия и повышенной проницаемостью кишечно-гематологического барьера ( 10 ). Однако то, как микробиом кишечника влияет на патогенез РАС, до конца не изучено. Исследование метагенома, основанное на секвенировании дробовика, широко применяется для изучения взаимодействий микроб-хозяин и патогенеза, связанного с микробиомом, при многих заболеваниях. По сравнению с целевым секвенированием рибосомной ДНК (рДНК) 16 S , которое представляет только профили видов, секвенирование дробовика является более информативным, поскольку оно дает исчерпывающую информацию для вывода конкретных метаболических путей и физиологических функций микробиома ( 11 ) . Хотя было опубликовано несколько исследований метагеномного анализа на основе дробовика для кишечного микробиома РАС ( 12 , 13 ), препятствия остаются из-за высокого межличностного разнообразия, на которое влияет широкий спектр факторов, таких как генетика, возраст, диета и здоровые условия ( 14 ).Индивидуальное разнообразие часто настолько велико и трудно поддается контролю, что оно даже подавляет изменения, связанные с заболеванием, и глубоко влияет на идентификацию связанных с заболеванием особенностей микробиома. Таким образом, результаты метагеномных исследований сильно зависят от собранных образцов и часто включают стохастические ложноположительные или отрицательные результаты ( 15 , 16 ). Хорошо известно, что состав микробиома широко варьируется даже среди здоровых людей ( 17 ).Более того, микробные компоненты и их количество находятся под сильным влиянием сложных метаболических взаимодействий и строго ограничены всей метаболической сетью микробиома ( 18 , 19 ). Таким образом, относительную активность определенного пути можно сравнить между образцами схожего метаболического фона ( 16 , 20 ). На основе этой концепции мы разработали новую стратегию метагеномного анализа, «квазипарную когорту», в которой мы объединили образцы ASD с контрольными образцами аналогичного метаболического фона, то есть профиля метаболических путей, выведенного из метагеномных данных. .Этот подход позволил нам преобразовать исходную групповую когорту в парную когорту, которая не только контролирует индивидуальное разнообразие, но и увеличивает статистическую мощность. Затем мы выполнили метагеномное секвенирование 79 образцов фекалий от людей с РАС и здоровых людей из контрольной группы; Эта аналитическая стратегия позволила нам выявить очевидные недостатки в путях раскисления и деградации токсичных веществ в микробиоме РАС. Поскольку воздействие токсинов было эпидемиологически продемонстрировано как один из основных этиологических факторов РАС ( 21 ), нарушение детоксикационной способности кишечного микробиома предполагает ранее неизвестный механизм, объясняющий, почему пациенты с РАС более уязвимы к воздействию токсичных веществ и как Кишечный микробиом вносит свой вклад в патогенез РАС. МАТЕРИАЛЫ И МЕТОДЫДизайн исследованияДетей с РАС и нейротипичных контрольных групп, соответствующих полу и возрасту, последовательно набирали из Центра исследований аутизма при Научном центре здоровья Пекинского университета и близлежащих сообществ. Образцы фекалий и утренней мочи были собраны у каждого участника для секвенирования метагенома и измерения метаболитов в моче соответственно. Следуя протоколам квазипарной когорты (см. Ниже), была создана парная когорта, в которой индивидуумы из контрольной группы и группы с РАС были объединены в пары для выявления характеристик микробиома, связанных с РАС (см. Ниже и рис.1). Характеристики микробиома, такие как обилие метаболических путей, сравнивались между образцами в каждой паре, и те, которые были значительно перепредставлены или недостаточны в образцах ASD, были предложены как связанные с ASD. Биомаркеры мочи и клинические рейтинговые баллы использовались для подтверждения роли идентифицированных характеристик микробиома, связанных с РАС. Наконец, идентифицированные особенности были использованы для построения диагностической модели, и ее производительность была оценена с помощью анализа рабочих характеристик приемника (ROC). Рис. 1 Принцип квазипарного когортного анализа.( A ) Групповая когорта индивидуумов с РАС и здоровых контрольных участников. ( B ) Было построено многомерное пространство с каждой особенностью микробиома, представляющей измерение, и образцы были размещены. Образцы с аномально далекими расстояниями от других (контуры, помеченные синими прямоугольниками) или слишком близкие (дубликаты, помеченные розовыми прямоугольниками) были удалены. ( C ) Граничные выборки около границы принятия решения (черная линия) были выбраны для обеих групп и спарены с ближайшими к ним выборками из противоположной группы.( D ) Квазипарную когорту составляли и использовали для проверки значимости разницы по каждому параметру (микробной характеристике) между случайными и контрольными образцами. УчастникиБыли набраны дети с РАС и обычно развивающиеся одинаковые контрольные субъекты в возрасте от 3 до 8 лет. Диагнозы РАС были подтверждены с помощью Пересмотренного диагностического интервью по аутизму ( 22 ) и Таблицы диагностики аутизма (ADOS) ( 23 ) согласно критериям Диагностического и статистического руководства по психическим расстройствам (пятое издание).Рейтинговые или оценочные инструменты Шкалы оценки детского аутизма (CARS) ( 24 ), Пересмотренной шкалы повторяющегося поведения (RBS-R) ( 25 ), Контрольного списка поведения при аутизме (ABC) ( 26 ) и Индекса тяжести желудочно-кишечного тракта ( 27 ) также проводились для детей-аутистов. Для контрольных субъектов были проведены медицинские осмотры и беседы с родителями, чтобы исключить кого-либо с психическими расстройствами. Испытуемые также исключались, если они перенесли инфекцию или принимали психоактивные препараты, антибиотики, пробиотики, пребиотики или специальную диету (например, кетогенную диету) за 3 месяца до включения. Секвенирование и аннотация метагеномаОбразцы фекалий всех участников были собраны и немедленно заморожены при -20 ° C в пробирках для образцов и сохранены при -80 ° C для последующего секвенирования метагенома. Суммарную ДНК из каждого образца фекалий экстрагировали с использованием набора QIAamp PowerFecal Pro DNA Kit (QIAGEN), а секвенирование парных концов выполняли на платформе Illumina HiSeq X10 (150 пар оснований × 2). Необработанные чтения сначала были применены для контроля качества, где неоднозначные последовательности и адаптеры были отфильтрованы с помощью FastQC (версия 0.11,5; www.bioinformatics.babraham.ac.uk/projects/fastqc/), а низкокачественные базы и чтения были обрезаны с помощью FASTX-Toolkit (версия 0.0.13; http://hannonlab.cshl.edu/fastx_toolkit/). Затем были удалены считывания человеческого происхождения, сопоставленные с человеческими геномами Hs37 с помощью Burrows-Wheeler Aligner (модуль памяти с параметрами по умолчанию; http://bio-bwa.sourceforge.net/), а дубликаты полимеразной цепной реакции были удалены с помощью PRINSEQ ( http://prinseq.sourceforge.net/). Окончательные чистые считывания были применены к аннотации таксономии и метаболической функции.Для каждого образца MetaPhlAn2 (www.huttenhower.org/metaphlan2) использовался для выполнения классификации микробов и расчета относительной численности каждого вида, а HUMAnN2 (http://huttenhower.sph.harvard.edu/humann2) использовался для аннотирования микробных путей в соответствии с коллекцией баз данных BioCyc (https://biocyc.org/) и для определения численности каждого пути. Альфа-разнообразие каждого образца было обозначено индексом Шеннона, который был рассчитан с использованием пакета R vegan (https: //cran.r-project.org / web / packages / vegan / index.html), а анализ основных компонентов (PCA) использовался для оценки бета-разнообразия среди образцов. Построение квазипарной когортыЧтобы построить «парную когорту» из исходной групповой когорты, мы сначала построили многомерное пространство, где изобилие каждого метаболического пути представляло собой измерение, и все субъекты были расположены в пространстве. в соответствии с их профилями метаболических путей. Наша цель состоит в том, чтобы очертить границу между образцами случая и контроля, описанными как существенные различия в путях, связанных с РАС.Во-первых, сходство каждой выборки с ее ближайшими соседями k было представлено как KNN (среднее расстояние Брея-Кертиса до ближайших соседей k ), где k было квадратным корнем из размера выборки. Затем были удалены слишком большие выбросы (KNN> среднее значение KNN + SD) и избыточности, которые были слишком близки (KNN <среднее значение KNN - SD) к своим соседям, чтобы избежать стохастического воздействия этих выборок на выбор парной выборки и статистики. Чтобы определить границу между РАС и контролем, мы определили граничные образцы для обеих групп, используя образцы, которые были более похожи на соседей в противоположной группе, чем на их собственную группу, т.е.е., внутригрупповой KNN> межгрупповой KNN. Эти граничные образцы, которые имеют сходный фон с соседями из противоположной группы, более ценны, чем другие, в контроле метаболического фона, оставляя различные метаболические пути между парными образцами с большей вероятностью, связанные с РАС. Затем для каждой группы было выбрано сопоставимое количество граничных образцов, и пары ASD-контроль были построены с одним граничным образцом и одним из его ближайших соседей k противоположной стороны.Таким образом, пары состоят из образцов сходного метаболического фона (ближайших соседей в многомерном пространстве), но в противоположных фенотипических группах. Наконец, квазипарная когорта была построена с этими парами ASD-контроль после удаления избыточности (рис. 1 и рис. S1). Измерение органической кислоты в мочеУтренняя моча детей с РАС и контрольной группы собиралась и немедленно замораживалась при -20 ° C, а затем переносилась в морозильную камеру -80 ° C. Для каждого образца мочи было измерено в общей сложности 75 метаболитов с помощью газового хроматографа-масс-спектрометра Agilent 7890A (Agilent Technologies, Санта-Клара, Калифорния, США) в соответствии с инструкциями производителя и проанализировано с помощью MSD ChemStation (E.02.02.1431) для расчета концентрации каждого метаболита, нормированной на концентрацию креатина в том же образце. Модель случайного лесаМодель случайного леса была построена с кареткой (https://cran.r-project.org/web/packages/caret/) и randomForest (https://cran.r-project.org /web/packages/randomForest/index.html) R пакеты для выбора наиболее отклоняющихся маркеров ферментов. Модель была обучена на 50% выборок посредством двойной перекрестной проверки и протестирована на всех выборках.Самозагрузка производилась 1000 раз. Для каждого результата начальной загрузки регистрировали вклад каждого фермента в модель и диагностический балл для каждого субъекта. Затем диагностическая способность модели отличать пациентов с РАС от контрольных субъектов была оценена с помощью AUC (площадь под кривой ROC) с помощью пакетов R pROC (https://cran.r-project.org/web/packages/ pROC / index.html) и ROCR (https://cran.r-project.org/web/packages/ROCR/index.html). Средние вклады каждого фермента в модель были рассчитаны для оценки их отклонений между ASD и контролем.Средний диагностический балл каждого субъекта, который был выведен из обилия детоксикационных ферментов и скорректирован моделью в соответствии с их отклонениями между РАС и контролем, использовался для всестороннего представления степени дисфункции микробной детоксикации и проверялся на корреляцию с клинической оценкой. оценки. Статистический анализКритерий суммы рангов Вилкоксона был использован для сравнения среднего значения между ASD и контрольной группой по их показателям альфа-разнообразия, численности каждого вида или метаболическому пути, с скорректированным P <0.05 как значительный. Различия в количестве путей между парными выборками квазипарной когорты были протестированы с помощью знакового рангового критерия Вилкоксона для парных выборок, при этом значение P <0,05 и частота ложных открытий (FDR) <0,1 считались достоверными. Корреляции метаболических путей с органическими кислотами в моче и баллами детоксикационной дисфункции по сравнению с рейтингами РАС оценивали с помощью коэффициента ранговой корреляции Спирмена и считали сильно коррелированными, если r <-0,4 или r> 0.4. РЕЗУЛЬТАТЫКишечный микробиом продемонстрировал большое индивидуальное разнообразиеВ исследовании приняли участие 79 участников, в том числе 39 детей с РАС и 40 нейротипичных контрольных субъектов соответствующего возраста и пола (средний возраст 5,59 лет; диапазон от 3 до 8 лет; процент мужчин, 82%; таблица S1). Секвенирование метагенома и анализ образцов стула выявили в общей сложности 209 видов во всех образцах, в каждом образце 101 ± 14 видов. Альфа-разнообразие или богатство микробиома было одинаковым у пациентов с РАС и контрольной группы (рис.S2A). Среди 209 видов 18 показали значительные различия между группами (рис. S2B), которые включали виды Veillonella parvula и Lactobacillus rhamnosus , обогащенные ASD, и виды B. longum и Prevotella copri , обогащенные контролями ( Критерий суммы рангов Вилкоксона, P <0,05, FDR <0,3). Эти результаты частично согласуются с предыдущими исследованиями по профилированию видов на основе секвенирования 16 S рДНК ( 8 , 28 , 29 ).Тем не менее, каждое из этих исследований, включая наше, выявило список специфических для исследования дифференциальных видов РАС, и эти виды не предоставляют точных механизмов для понимания патогенеза РАС. PCA профилей видов явно не отделял образцы ASD от образцов контроля (рис. S2C) при нанесении на график с двумя верхними ПК, а образцы каждой группы были широко разбросаны, что указывает на большое индивидуальное разнообразие даже среди образцов одного и того же группа. Затем мы вычислили попарные расстояния Брея-Кертиса между каждой парой образцов и обнаружили, что межгрупповые расстояния не превышают внутригрупповые различия (рис.S2D), подразумевая, что индивидуальное разнообразие было настолько большим, что подавляло связанные с РАС изменения. После функциональной аннотации метаболических путей, присутствующих в микробиоме, мы сделали вывод о распространенности каждого пути для каждого образца. PCA метаболических профилей показал, что образцы из одной и той же группы не группировались (рис. S2E), а расстояния Брея-Кертиса парных образцов на основе пути были одинаковыми между группами и внутри группы (рис. S2F), что свидетельствует о большом метаболическом разнообразии среди образцы тоже.Прямое сравнение распространенности каждого метаболического пути в группах случаев и контрольных группах не выявило многих соответствующих путей; только три пути показали значительное обогащение выборок ASD по сравнению с контрольными образцами (критерий суммы рангов Вилкоксона, P <0,05). Эти три пути представляют собой митохондриальную взаимную конверсию NAD.NADP.NADH.NADPH (дрожжи), супер-путь биосинтеза ацетил-кофермента А и супер-путь биосинтеза тиаминдифосфата. Стратегия квазипарной когорты выявила недостаточную микробную детоксикацию в ASDПоскольку традиционный анализ не дал четких указаний на то, как микробиом способствует патогенезу ASD, мы затем провели анализ, основанный на стратегии квазипарной когорты.При этом мы построили когорту из 65 пар РАС-контроль, в которую в конечном итоге вошли 20 субъектов РАС и 18 контрольных субъектов из исходных групп на основе метаболических профилей образцов. Сравнение парных выборок выявило в общей сложности 96 путей, связанных с РАС (знаковый ранговый критерий Уилкоксона, P <0,05, FDR <0,1; таблица S2) с 39 избыточно представленными и 57 недостаточными путями, вовлеченными во многие метаболические категории (таблица S3). . Среди списка путей, связанных с РАС, мы выявили заметную тенденцию дефицита метаболической категории детоксикации в образцах РАС.Всего пять полных путей в этой категории продемонстрировали очевидное снижение численности у субъектов с РАС по сравнению с их контрольными аналогами (рис. 2). В генерации глутатиона (GSH) участвовали два нарушенных пути детоксикации при РАС: пути γ-глутамилового цикла и биосинтез l-глутамата и l-глутамина, предшественника GSH (рис. S3). Три других пути задействованы в разложении органических токсикантов метилфосфоната, 3-фенилпропаноата или 3- (3-гидроксифенил) пропаноата и метилглиоксаля (рис.S4). Почти все ферменты метаболических путей обнаруживают значительный дефицит в образцах ASD, включая следующие ключевые ферменты (критерий знакового ранга Вилкоксона, P <0,05): глутамат-цистеинлигаза ( gshA ), GSH-синтаза ( gshB ), 𝛾-глутамилтрансфераза (ggt) и аминопептидаза B ( pepB ) в биосинтезе GSH; C-P лиаза ( phnJ ), которая удаляет фосфатную группу при разложении метилфосфоната; дегидрогеназа ( hcaB ) и оксидаза ( mhpB ), которые разрывают бензольное кольцо; и глиоксалаза ( gloA ) и гидролаза ( gloB / gloC ), которые разлагают метилглиоксаль до лактата (рис.2). Рис. 2 Детоксифицирующие ферменты и пути, связанные с РАС.На тепловой карте показано относительное содержание каждого детоксифицирующего фермента в каждом образце, включенном в парную когорту. Цвета указывают на относительную численность, которая нормализована с оценкой z . Названия модулей пути и репрезентативных генов энзима энтеробактерий помечены слева и справа от тепловой карты соответственно. Сравнения относительного количества путей между контрольной группой и субъектами с РАС показаны с правой стороны тепловой карты и связаны с соответствующими путями стрелками.Значимость была проверена с помощью знакового рангового критерия Вилкоксона; * P <0,05, ** P <0,01 и *** P <0,001. HC, здоровый контроль. Помимо вышеуказанных путей детоксикации, мы дополнительно изучили все ферменты, участвующие в деградации различных видов токсинов, и сравнили их количество между субъектами с РАС и их контрольными аналогами (критерий знакового ранга Вилкоксона, P <0,05). Ни один из ферментов не демонстрирует значительного перепредставления, в то время как восемь имели значительный дефицит ASD и участвовали в деградации широкого спектра токсичных веществ, включая хлоралкан / хлоралкен, аминобензоат, бензамид, стирол, нафталин, ксилол и бензоат (рис.2 и таблица S4). Эти токсиканты широко используются в качестве инсектицидов и пищевых добавок. Дефицит этих критических ферментов предполагает более широкий диапазон нарушений детоксикации при РАС, хотя соответствующие пути, которые содержат эти ферменты, существенно не различались между парными образцами. Другие пути, связанные с РАС, которые мы идентифицировали, в значительной степени соответствовали предыдущим знаниям о РАС, в том числе многие из них, участвующие в биосинтезе пиримидина, пурина и тетрагидрофолата (таблица S3), проявляли дефицит у детей с РАС.Хорошо известно, что метаболизм тетрагидрофолата часто нарушен у пациентов с РАС ( 30 ). Тетрагидрофолат является одноуглеродным донором для биосинтеза нуклеотидов и реметилирования гомоцистеина с образованием метионина и впоследствии S -аденозилметионина. Основным источником фолиевой кислоты, предшественника тетрагидрофолата, является пища, что подразумевает общий дефицит фолиевой кислоты для метаболизма тетрагидрофолата как микробами, так и хозяином при РАС. Кроме того, из 39 путей, обогащенных ASD, 17 происходят от дрожжей.Один из этих дрожжевых путей синтезирует 2-амино-3-карбоксимуконат полуальдегид (таблица S3), промежуточное соединение для образования эксайтотоксина, хинолиновой кислоты. Эти результаты согласуются с предыдущими данными о избыточном производстве хинолиновой кислоты ( 31 ) и чрезмерном росте дрожжей в кишечнике у пациентов с РАС ( 32 ). Согласованность ассоциированных с РАС путей, которые мы идентифицировали с ранее сообщенными метаболическими изменениями при РАС, подтверждают надежность квазипарного когортного метода и дополнительно подтверждают вклад микробного метаболизма кишечника в организм хозяев. Нарушение микробной детоксикации связано с митохондриальной дисфункцией и степенью тяжести РАСИз-за очевидных метаболических нарушений, наблюдаемых при РАС, мы количественно определили абсолютные концентрации метаболитов в моче, чтобы оценить метаболические изменения у наших субъектов. Результаты показали, что у большинства детей с РАС наблюдались метаболические нарушения по сравнению с контрольной группой в соответствии с предыдущими данными (таблица S5) ( 33 ). Наиболее значительные аномальные метаболиты у наших пациентов с РАС включали аконитовую кислоту, субериновую кислоту, 2-гидроксигиппуровую кислоту и фумаровую кислоту.Все эти органические кислоты являются метаболитами, участвующими в цикле Кребса, и могут выделяться в кровоток и выводиться из мочи при повреждении митохондрий, таким образом, служа биомаркерами повреждения или дисфункции митохондрий. Измерения этих биомаркеров отрицательно коррелировали с изобилием большинства ферментов детоксикации, дефицитных у пациентов с РАС (рис. 3). Эти корреляции предполагают потенциальную защитную роль этих ферментов микробной детоксикации для митохондрий: проглоченные токсические вещества окружающей среды, которые могут вызвать повреждение митохондрий, в значительной степени детоксифицируются кишечными микробами.Утрата такой защиты при РАС может способствовать дисфункции митохондрий, одному из основных патологических изменений в различных тканях детей с РАС, включая мозг. Рис. 3 Корреляция детоксифицирующих ферментов с биомаркерами митохондриальной дисфункции в моче.( Top ) Средние концентрации каждого биомаркера митохондриальной дисфункции в моче (обозначены под тепловой картой) в ASD и контрольных образцах. На оси и указаны их концентрации (мкмоль, нормализованные по концентрации креатина в том же образце).Значимость была помечена как * P <0,05 и *** P <0,001 на основе критерия суммы со знаком Вилкоксона. ( Нижний ) Тепловая карта корреляций между каждым детоксицирующим ферментом и биомаркером мочи. Цвет указывает значение ρ рангового теста Спирмена * ρ ≥ 0,4 или ρ ≤ −0,4. Чтобы еще больше подтвердить роль этих детоксикационных ферментов в патогенезе РАС, мы построили случайный лесной классификатор на основе количества идентифицированных нами детоксикационных ферментов, связанных с РАС (как показано на рис.2) и оценил его эффективность в различении РАС от контрольных субъектов. Оценка ROC с помощью 1000 бутстрапов показала, что модель, основанная на панели ферментов детоксикации, точно описывает отклонения между ASD и контрольными субъектами и достигла диагностической мощности 88% AUC (рис. 4A). Диагностическая модель также выводит вклад каждого фермента в модель с пятью основными ферментами в качестве ключевых ферментов в биосинтезе GSH и l-глутамата / l-глутамина и разложения аминобензоата, хлоралкана / хлоралкена / нафталина и метилглиоксаля, что означает ферменты в основном различаются между ASD и контролем (рис.4Б). Рис. 4 Диагностическая модель, основанная на детоксикационных ферментах для определения статуса РАС.Все идентифицированные детоксифицирующие ферменты были использованы для построения диагностической модели для прогнозирования статуса РАС с помощью случайных лесных классификаторов с 1000 повторениями начальной загрузки. ( A ) ROC-анализ производительности диагностической модели. ( B ) Средние вклады каждого детоксифицирующего фермента на основе 1000 повторений начальной загрузки. ( C ) Баллы дисфункции микробной детоксикации, выведенные из диагностической модели для образцов в каждом квартиле пациентов, разделенные в соответствии с их клиническими рейтинговыми баллами РАС. Кроме того, мы исследовали корреляции между средней диагностической оценкой каждого образца, выведенной из модели, и тяжестью РАС. Поскольку диагностическая оценка была выведена из обилия ферментов детоксикации и скорректирована с учетом их соответствующего отклонения между РАС и контролем, оценка может рассматриваться как общая оценка степени нарушения микробной детоксикации и далее называется оценкой дисфункции. Поскольку не существует объективных биомаркеров тяжести заболевания или даже диагноза РАС, мы применили клинические рейтинговые баллы для РАС, т.е.е., ADOS, ABC, CARS и RBS-R, чтобы разделить пациентов на соответствующие квартили в соответствии с каждой из оценок. Показатели дисфункции пациентов в квартилях имеют тенденцию к увеличению с увеличением рейтинговых баллов (рис. 4С). Логистическая регрессия между баллами дисфункции и клиническими рейтинговыми баллами в значительной степени подтвердила их положительные корреляции, хотя они не были значимыми, возможно, из-за субъективности клинической оценки РАС (рис. S5). Эти корреляции между нарушенной микробной детоксикацией и степенью тяжести РАС дополнительно продемонстрировали участие кишечного микробиома в патогенезе РАС из-за его дисфункции при детоксикации. ОБСУЖДЕНИЕПри поддержке квазипарной когортной стратегии наше исследование выявило ранее не идентифицированный ассоциированный с РАС дефицит микробной детоксикации, который обнаружил сильную корреляцию со степенью митохондриальной дисфункции, а также серьезностью клинических проявлений. Проявления РАС. Эпидемиологически подтверждено, что воздействие токсичных веществ является важным этиологическим фактором РАС, и у пациентов часто наблюдаются некоторые клинические проявления интоксикации.Млекопитающие постоянно подвергаются воздействию токсичных веществ из внешней среды, таких как глифосат, или от внутренних метаболических процессов хозяина или микробов, таких как метилглиоксаль. Таким образом, способность к детоксикации необходима для жизни. В дополнение к системе детоксикации хозяина, такой как печеночные ферменты, такие как P450, микробиом кишечника может действовать как первые защитные токсины, разрушая или изгоняя их, поскольку пищеварительный тракт является основным путем, по которому мы попадаем в организм токсинов. Таким образом, микробная детоксикация служит важным компонентом системы детоксикации хозяина. Одним из основных патологических проявлений РАС является дисфункция митохондрий, основных мишеней органических токсикантов из-за их липофильных свойств. Когда кишечная микробная детоксикация серьезно нарушена при РАС, большее количество токсичных веществ внешнего и внутреннего происхождения может попасть в кровоток и повредить митохондрии различных тканей. Таким образом, наш вывод о нарушении микробной детоксикации помогает объяснить, почему дети с РАС настолько уязвимы для токсинов окружающей среды, и предполагает, что нарушение микробной детоксикации может быть вовлечено в патогенез РАС (рис.5). Однако причины недостатков микробной детоксикации не ясны. Одна из возможностей заключается в том, что дефицит микробной детоксикации является следствием дисбиоза микробиома, вызванного различными генетическими факторами и факторами окружающей среды, такими как изменение диеты и дефекты пищеварительной системы, которые изменяют питательные вещества, предоставляемые микробным обитателям. Рис. 5 Роль нарушенной микробной детоксикации в патогенезе РАС.Цветные точки в просвете кишечника указывают на непереваренные токсические вещества.ПАУ, полициклический ароматический углеводород; ФП, фосфорорганические; ХОП, хлорорганические пестициды; и MGO, метилглиоксаль. Кишечные бактерии, отмеченные зеленым цветом, указывают на микробы, способные детоксифицировать токсичные вещества, которых не хватает при РАС. Больше токсичных веществ может попасть в кровоток, если функция кишечной микробной детоксикации нарушена, а накопление токсикантов в тканях потенциально может вызвать повреждение митохондрий или другой целостности структуры / функции, что представляет собой характерные проявления РАС. Токсиканты, вызывающие РАС, включают хлорорганические пестициды, полициклические ароматические углеводороды, автомобильные выхлопные газы и тяжелые металлы, большинство из которых являются органическими соединениями, особенно ароматическими и галогенированными соединениями.Органические токсиканты часто липофильны и склонны накапливаться в жировой ткани, такой как мозг, после хронического приема, а затем повреждают мембранные структуры, такие как структуры митохондрий. Глифосат ( N -фосфонометил-глицин), наиболее широко используемый гербицид в мире, представляет собой метилфосфонат, хорошо известный своей ядерной и митохондриальной токсичностью. Микробное разложение метилфосфоната очень распространено у бактерий, и многие виды используют этот путь в качестве единственного источника фосфора ( 34 ).По нашим результатам, эта важная функция детоксикации микробов явно недостаточна при РАС. Ароматические углеводороды — это соединения, содержащие одно бензольное кольцо или более одного конденсированного кольца (полиароматические углеводороды). Многие виды бактерий, особенно в типах Proteobacteria и Actinobacteria, могут расщеплять ароматические углеводороды путем разложения 3-фенилпропаноата и 3- (3-гидроксифенил) -пропаноата, что также является дефектом при ASD. Метилглиоксаль — неизбежный побочный продукт процессов гликолиза и метаболизма жирных кислот и белков.Метилглиоксаль может проникать в клетки и вреден как сильнодействующий гликирующий агент, реагирующий с белками, липидами и нуклеиновыми кислотами с образованием конечных продуктов гликирования, которые участвуют в различных дегенеративных процессах, включая поражения головного мозга ( 35 ). Одно исследование показало, что метилглиоксаль изменяет функцию и окислительное состояние митохондрий и вызывает повреждение митохондрий в головном мозге людей с РАС ( 36 ). Следовательно, кишечные микробы могут быстро разлагать местный метилглиоксаль in situ, чтобы поддерживать концентрацию метилглиоксаля в кишечнике на низком, нетоксичном уровне. Помимо прямой деградации токсинов, в микробиоме ASD также отсутствует биосинтез GSH. GSH является одним из основных антиоксидантов организма и ключевым кофактором многих детоксифицирующих ферментов. GSH необходим для разложения органических токсичных веществ и удаления тяжелых металлов, которые способствуют поддержанию нормальных функций митохондрий ( 37 ). Как предшественник GSH, l-глутамин не только участвует в деградации органических токсинов, но также способствует заживлению язв.Глютамин помогает поддерживать целостность и функцию кишечного барьера, предотвращая попадание в кровоток органических токсичных веществ, таких как липополисахариды ( 38 , 39 ). Таким образом, GSH, вырабатываемый кишечными микробами, вносит существенный вклад в локальную детоксикацию. Растущее количество данных свидетельствует о важности митохондриальной дисфункции в патогенезе РАС как с врожденными дефектами митохондрий, так и с приобретенными повреждениями, вызванными токсинами окружающей среды, о которых сообщается в РАС ( 33 ).Исследования показали, что поврежденные митохондрии могут высвобождать митохондриальную ДНК и другие связанные с повреждениями молекулярные паттерны, которые активируют низкую воспалительную реакцию в различных тканях, включая мозг ( 40 ). Такое системное воспаление низкой степени с повышенными воспалительными цитокинами, хемокинами и клеточной иммунной активностью хорошо задокументировано у пациентов с РАС ( 41 ), и поэтому функция нейроцитов и развитие мозга могут быть нарушены. Недавно сообщалось о перекрестном взаимодействии микробиома и митохондрий ( 42 ), поскольку определенные микробные продукты могут подавлять или точно настраивать функцию митохондрий ( 43 — 45 ).Здесь мы сообщили о защитном эффекте микробиома на структурную и функциональную целостность митохондрий, что иллюстрируется тесной корреляцией между нарушенной микробной детоксикацией и митохондриальной дисфункцией. Хотя это исследование обнаружило дефицит в путях детоксикации кишечного микробиома у пациентов с РАС на основе метагеномных данных, доказательства накопления токсичных веществ получить нелегко. Во-первых, многие токсиканты и их восстановительные антиоксиданты, которые мы идентифицировали, очень химически активны, такие как метилглиоксаль и GSH, и они быстро реагируют с окружающими биомолекулами, что затрудняет обнаружение этих соединений в замороженных образцах.Во-вторых, степень воздействия токсичных веществ часто колеблется, и, возможно, токсические вещества не обнаруживаются в фекалиях после всасывания. Однако вызываемое ими хроническое нарушение может длиться долгое время, что отделяет концентрацию токсического вещества в образцах от клинических проявлений интоксикации. В-третьих, вещества, катализируемые ферментами детоксикации, которые мы идентифицировали, составляют длинный список органических токсикантов, и их воздействие варьируется от человека к человеку, что затрудняет количественную оценку долгосрочного воздействия на любую когорту рассечения. различные токсиканты и их взаимосвязь с клиническими проявлениями РАС.Наконец, в настоящее время нет подходящего метода для одновременного измерения абсолютных концентраций метаболитов. Таким образом, для прояснения процесса патогенеза, связанного с воздействием токсичных веществ и детоксикацией при РАС, необходимы новые методы измерения токсических веществ, которые будут не только полезны для демонстрации накопления токсических веществ, но также ценны для клинической оценки индивидуальных этиологических факторов. Помимо потенциальной защитной роли кишечной микробной детоксикации против развития РАС, квазипарная когорта также является достоинством этого исследования, которое позволяет идентифицировать связанные с заболеванием микробные особенности по сотням измерений.Принцип этого метода аналогичен принципу исследования близнецов для выявления генетических вариантов, связанных с заболеванием, в которых образцы близнецов являются мощным инструментом для контроля межличностного разнообразия в миллионах локусов однонуклеотидного полиморфизма, и только те вариации, которые различаются по случаю и контролю между близнецами признаются причинными факторами болезни. При построении квазипарной когорты отбираются только граничные выборки и их ближайшие соседи из противоположной группы, которые являются более ценными, как в двойных выборках, применяемых для генетического анализа.Преимущества квазипарной когорты по сравнению с традиционным анализом включают следующее: (i) лучший контроль высокого межиндивидуального разнообразия в метагеномных данных; (ii) повышенная статистическая мощность за счет преобразования групповой когорты в парную когорту, что требует гораздо меньшего размера выборки для достижения того же уровня статистической значимости; и (iii) повышенная чувствительность при выявлении причинных особенностей микробиома с низкой численностью. В заключение, наше исследование предлагает новую стратегию метагеномного анализа — квазипарную когорту — и успешно определяет заметную тенденцию ухудшения детоксикации в микробиоме кишечника с РАС.Нарушение микробной детоксикации коррелирует с клинической оценкой РАС и степенью митохондриальной дисфункции, одного из основных патологических изменений РАС, что убедительно свидетельствует о том, что нарушение микробной детоксикации глубоко вовлечено в патогенез РАС. Такая ранее неизвестная защитная роль кишечных микробов предполагает потенциальные будущие терапевтические стратегии восстановления нарушенной микробной детоксикации для пациентов с РАС. Более того, новая квазипарная когортная стратегия является мощным инструментом для метагеномного анализа и может быть применена к исследованиям других сложных заболеваний или даже других наборов данных -omics с аналогичными характеристиками высокой размерности и сложности. Выражение признательности: Это исследование было одобрено институциональным наблюдательным советом Пекинского университета (Документ этического обзора №: IRB00001052-17100). Исследовательская группа получила информированное согласие родителей / опекунов на сбор образцов кала и мочи, а также информацию об испытаниях. Мы подтвердили, что все методы были выполнены в соответствии с рекомендациями IRB и соответствующими нормативными актами. Мы благодарны всем детям, принявшим участие в этом исследовании, и их родителям за сотрудничество. Финансирование: Эта работа была поддержана грантом Центра медицинских наук Пекинского университета (BJMU88443Y0306 и BMU2018MX002), Национального научного фонда Китая (31671350, 31970568), Главного национального проекта науки и технологий Китая (2018ZX10712001-018-002). ) и программы Китайской академии наук (QYZDY-SSW-SMC017 и Y8YZ02E001). Вклад авторов: J.W. и Ю.К. задумал и спроектировал проект. M.Z., Y.H. и R.D. собрали информацию от участников.Y.C., Q.M. и X.S. обработали и проанализировали все данные секвенирования метагенома. Y.C. и X.S. провели статистический анализ. Ю.К. и J.Y. задумал и согласовал проект. Z.W. набирали, диагностировали и обследовали набранных участников. Хуан Чжан, J.L. и Цзе Чжан предоставили образцы для исследования. Все авторы внесли свой вклад в написание рукописи. Конкурирующие интересы: Авторы заявляют, что у них нет конкурирующих интересов. Доступность данных и материалов: Все данные, необходимые для оценки выводов в статье, представлены в документе и / или дополнительных материалах.Необработанные данные секвенирования метагенома, представленные в этой статье, были депонированы в Архиве геномных последовательностей в BIG Data Center Пекинского института геномики (BIG) Китайской академии наук под номерами доступа CRA001746 по адресу http://bigd.big.ac. cn / gsa. Дополнительные данные, относящиеся к этой статье, могут быть запрошены у авторов.
Профиль кишечной микробиоты у детей, страдающих атопическим дерматитом, и оценка устойчивости пробиотической смеси в кишечникеTan, THT, Ellis, JA, Saffery, R. & Allen, KJ Роль генетики и окружающей среды в рост детской пищевой аллергии. Clin. Exp. Аллергия 42 , 20–29 (2012). CAS Статья Google ученый Флор, К. и Манн, Дж. Новые взгляды на эпидемиологию детского атопического дерматита. Аллергия 69 , 3–16 (2014). CAS Статья Google ученый Куэлло-Гарсия, К. А. и др. . Рекомендации Всемирной организации по аллергии и Университета Макмастера по профилактике аллергических заболеваний (GLAD-P): пребиотики. World Allergy Organ. J . 9 (2016). Fiocchi, A. et al. . Руководство Всемирной организации по аллергии и Университета Макмастера по профилактике аллергических заболеваний (GLAD-P): Пробиотики. World Allergy Organ. J . 8 (2015). Новер, М. К. и Хаффнагл, Г. Б. «Гипотеза микрофлоры» аллергических заболеваний. Clin. Exp. Аллергия J. Br. Soc. Allergy Clin. Иммунол. 35 , 1511–1520 (2005). CAS Статья Google ученый Round, J. L. & Mazmanian, S. K. Индуцибельное развитие регулирующих Т-клеток Foxp (3+) комменсальной бактерией кишечной микробиоты. Proc. Natl. Акад. Sci. США 107 , 12204–12209 (2010). ADS CAS Статья Google ученый Vernocchi, P. et al . Понимание роли пробиотиков у детей-аллергиков: ключ к профилированию микробиоты кишечника. Curr. Мнение. Allergy Clin.Иммунол. 15 , 495–503 (2015). CAS Статья Google ученый Косми, Л., Лиотта, Ф., Магги, Э., Рорньяни, С. и Аннунциато, Ф. Th27 и неклассические клетки Th2 при хронических воспалительных заболеваниях: две стороны одной медали. Внутр. Arch. Allergy Immunol. 164 , 171–177 (2014). CAS Статья Google ученый Елазаб, Н. и др. . Введение пробиотиков в молодости, атопии и астме: метаанализ клинических испытаний. Педиатрия 132 , E666 – E676 (2013). Артикул Google ученый Харди, Х., Харрис, Дж., Лайон, Э., Бил, Дж. И Фоуи, А. Д. Пробиотики, пребиотики и иммуномодуляция защитных функций слизистой оболочки кишечника: гомеостаз и иммунопатология. Питательные вещества 5 , 1869–1912 (2013). CAS Статья Google ученый Пробиотики в пищевых продуктах: полезные и питательные свойства и рекомендации по оценке . (Продовольственная и сельскохозяйственная организация Объединенных Наций: Всемирная организация здравоохранения, 2006 г.). Винклер П., Гадими Д., Шрезенмейр Дж. И Краехенбуль Дж. П. Молекулярные и клеточные основы взаимодействий микрофлоры и хозяина. Дж.Nutr. 137 , 756S – 772S (2007). CAS Статья Google ученый Хуанг Р. и др. . Пробиотики для лечения атопического дерматита у детей: систематический обзор и метаанализ рандомизированных контролируемых исследований. Фронт. Клетка. Заразить. Microbiol. 7 , 392 (2017). Артикул Google ученый Ким, С.-О. и др. . Эффекты пробиотиков для лечения атопического дерматита: метаанализ рандомизированных контролируемых исследований. Ann. Allergy Asthma Immunol. Выключенный. Publ. Являюсь. Coll. Allergy Asthma Immunol. 113 , 217–226 (2014). Артикул Google ученый Путиньяни, Л. и др. . MALDI-TOF масс-спектрометрия, протеомное фенотипирование клинически значимых грибов. Mol Biosyst 7 , 620–9 (2011). CAS Статья Google ученый Ying, Y. X., Ding, W. L. & Li, Y. Характеристика почвенных бактериальных сообществ в ризосферной и внеризосферной почве Panax ginseng. Biochem. Genet. 50 , 848–859 (2012). CAS Статья Google ученый Эрколини Д., Де Филиппис Ф., Ла Сториа А. и Яконо М.«Ремейк» путем высокопроизводительного секвенирования микробиоты, участвующей в производстве сыра моцарелла из водяного буйвола. Appl Env. Microbiol 78 , 8142–5 (2012). CAS Статья Google ученый Капорасо, Дж. Г. и др. . QIIME позволяет анализировать высокопроизводительные данные секвенирования сообщества. дюймы. Nat. Методы 7 , 335–6 (2010). CAS Статья Google ученый Reeder, J. & Knight, R. Быстрое устранение шумов в считывании ампликонов пиросеквенирования путем использования распределений ранг-распространенность. в Nat Methods 7 , 668–9 (2010). CAS Статья Google ученый Эдгар Р. К. Поиск и кластеризация на порядки быстрее, чем BLAST. Биоинформатика 26 , 2460–1 (2010). CAS Статья Google ученый Rapid Cycle Real-Time PCR , https://doi.org/10.1007/978-3-642-59524-0 (Springer Berlin Heidelberg, 2001). Мак-Мерди, П. Дж. И Холмс, С. phyloseq: Пакет R для воспроизводимого интерактивного анализа и графики данных переписи микробиома. PLoS One 8 , e61217 (2013). ADS CAS Статья Google ученый Сегата, Н. и др. . Открытие и объяснение метагеномных биомаркеров. Genome Biol. 12 , R60 (2011). Артикул Google ученый Холм С. Простая процедура множественного тестирования с последовательным отбрасыванием. Сканд. J. Stat. 6 , 65–70 (1979). MathSciNet МАТЕМАТИКА Google ученый Toh, Z. Q., Anzela, A., Тан, М. Л. и Личкарди, П. В. Пробиотическая терапия как новый подход к лечению аллергических заболеваний. Front Pharmacol 3 , 171 (2012). CAS Статья Google ученый Нюлунд, Л., Сатокари, Р., Салминен, С. и де Вос, В. М. Микробиота кишечника в раннем возрасте — влияние на здоровье и болезни. Proc. Nutr. Soc. 73 , 457–469 (2014). Артикул Google ученый Абрахамссон, Т. Р. и др. . Низкое разнообразие микробиоты кишечника у младенцев с атопической экземой. J. Allergy Clin. Иммунол. 129 , 434 – U244 (2012). Артикул Google ученый Marrs, T. и Flohr, C. Как микробиота влияет на развитие и естественное течение экземы и пищевой аллергии? Pediatr Infect J 35 , 1258–1261 (2016). Артикул Google ученый Нюлунд, Л. и др. . Тяжесть атопического заболевания обратно пропорциональна разнообразию кишечной микробиоты и бактерий, продуцирующих бутират. Аллергия 70 , 241–244 (2015). CAS Статья Google ученый Вест, К. Э., Дженмальм, М. К. и Прескотт, С. Л. Микробиота кишечника и ее роль в развитии аллергических заболеваний: более широкая перспектива. Clin Exp Allergy 45 , 43–53 (2015). CAS Статья Google ученый Родригес, Дж. М. и др. . Состав микробиоты кишечника на протяжении всей жизни с акцентом на молодость. Microb Ecol Health Dis 26 , 26050 (2015). PubMed Google ученый Берни Канани, Р. и др. . Смесь с добавкой Lactobacillus rhamnosus GG увеличивает количество штаммов бактерий, продуцирующих бутират, у детей с пищевой аллергией. Isme J 10 , 742–50 (2016). CAS Статья Google ученый Candela, M. et al. . Нарушение баланса кишечной микробиоты у детей с атопией. BMC Microbiol 12 , 95 (2012). CAS Статья Google ученый Nylund, L. et al. . Анализ микроматрицы показывает заметное отклонение кишечной микробиоты у младенцев, страдающих экземой, по сравнению со здоровыми детьми из группы риска по атопическому заболеванию. БМС Микробиол . 13 (2013). Watanabe, S. et al. . Различия в микрофлоре кала между пациентами с атопическим дерматитом и здоровыми контрольными субъектами. J Allergy Clin Immunol 111 , 587–91 (2003). Артикул Google ученый Miquel, S. et al. . Faecalibacterium prausnitzii и здоровье кишечника человека. Curr Opin Microbiol 16 , 255–61 (2013). CAS Статья Google ученый Сонг, Х., Ю, Й., Хван, Дж., На, Ю. С. и Ким, Х. С. Faecalibacterium prausnitzii, дисбиоз на уровне подвида в микробиоме кишечника человека, лежащий в основе атопического дерматита. J Allergy Clin Immunol 137 , 852–60 (2016). CAS Статья Google ученый Сокол, Х. и др. .Faecalibacterium prausnitzii — это противовоспалительная комменсальная бактерия, выявленная при анализе микробиоты кишечника пациентов с болезнью Крона. Proc Natl Acad Sci U A 105 , 16731–6 (2008). ADS CAS Статья Google ученый Gophna, U., Konikoff, T. & Nielsen, H. B. Oscillospira и родственные бактерии — от метагеномных видов до метаболических особенностей. Env. Microbiol 19 , 835–841 (2017). CAS Статья Google ученый Коникофф Т. и Гофна У. Осциллоспира: центральный, загадочный компонент микробиоты кишечника человека. Trends Microbiol. 24 , 523–524 (2016). CAS Статья Google ученый Хуа, X., Гёдерт, Дж. Дж., Пу, А., Ю, Г. и Ши, Дж. Ассоциации аллергии с фекальной микробиотой взрослых: Анализ Американского проекта кишечника. EBioMedicine 3 , 172–179 (2016). Артикул Google ученый Odamaki, T. et al. . Распространение различных видов группы Bacteroides fragilis у лиц с поллинозом японского кедра. Заявл. Environ. Microbiol. 74 , 6814–6817 (2008). CAS Статья Google ученый Кирьявайнен, П. В., Арвола, Т., Салминен, С. Дж. И Исолаури, Э. Аберрантный состав кишечной микробиоты детей с аллергией: цель бифидобактериальной терапии при отъеме? Кишечник 51 , 51–55 (2002). CAS Статья Google ученый Sipka, S. & Bruckner, G. Иммуномодулирующая роль желчных кислот. Int Arch Allergy Immunol 165 , 1–8 (2014). CAS Статья Google ученый Curtis, M. M. и др. . Комменсальный кишечник Bacteroides thetaiotaomicron обостряет кишечную инфекцию за счет изменения метаболического ландшафта. Клеточный микроб-хозяин 16 , 759–769 (2014). CAS Статья Google ученый Gophna, U., Sommerfeld, K., Gophna, S., Doolittle, W. F. и Veldhuyzen van Zanten, S.J.O. Различия между тканевой микрофлорой кишечника пациентов с болезнью Крона и язвенным колитом. J. Clin. Microbiol. 44 , 4136–4141 (2006). CAS Статья Google ученый Li, M. et al. . Симбиотические кишечные микробы модулируют метаболические фенотипы человека. Proc. Natl. Акад. Sci. США 105 , 2117–2122 (2008). ADS CAS Статья Google ученый Мур, У. Э. и Мур, Л.V. Бактерии заболеваний пародонта. Periodontol 2000 5 , 66–77 (1994). CAS Статья Google ученый Rajilic-Stojanovic, M. & de Vos, W. M. Первые 1000 культивируемых видов желудочно-кишечной микробиоты человека. FEMS Microbiol Rev 38 , 996–1047 (2014). CAS Статья Google ученый Чо, Г.С. и др. . Количественная оценка Slackia и Eggerthella spp. в кале человека и адгезия представителей штаммов к клеткам Caco-2. Front Microbiol 7 , 658 (2016). PubMed PubMed Central Google ученый Моринага С., Сакамото К. и Кониси К. Противоопухолевая активность и ее свойства Eubacterium lentum. Jpn. J. Cancer Res. Ганн 79 , 117–124 (1988). CAS Статья Google ученый Хайзер, Х. Дж. и др. . Прогнозирование и управление инактивацией сердечных лекарственных препаратов кишечной бактерией человека Eggerthella lenta. Наука 341 , 295–8 (2013). ADS CAS Статья Google ученый Reichardt, N. et al. . Филогенетическое распределение трех путей производства пропионата в кишечной микробиоте человека. Isme J 8 , 1323–35 (2014). CAS Статья Google ученый Шу М. и др. . Ферментация Propionibacterium acnes, комменсальной бактерии в микробиоме кожи человека, в качестве кожных пробиотиков против метициллин-резистентного Staphylococcus aureus. PloS One 8 , e55380 (2013). ADS CAS Статья Google ученый Macia, L. и др. . Влияние микробов на целостность эпителия и иммунную функцию как основа воспалительных заболеваний. Immunol Rev 245 , 164–76 (2012). CAS Статья Google ученый Де Бенедетто, А. и др. . Дефекты плотного соединения у пациентов с атопическим дерматитом. J Allergy Clin Immunol 127 , 773-86.e1–7 (2011). Google ученый Парвез, С., Малик, К. А., Ах Кан, С. и Ким, Х. Ю. Пробиотики и их ферментированные пищевые продукты полезны для здоровья. J Appl Microbiol 100 , 1171–85 (2006). CAS Статья Google ученый Vitali, B. et al. . Влияние синбиотической пищи на микробную экологию кишечника и метаболические профили. BMC Microbiol 10 , 4 (2010). Артикул Google ученый Иноуэ, Ю., Ивабучи, Н., Сяо, Ж.-З., Яешима, Т., Ивацуки, К. Подавляющее действие штамма Bifidobacterium breve M-16V на иммунные ответы Т-хелперов 2 типа на мышиной модели. Biol. Pharm. Бык. 32 , 760–763 (2009). CAS Статья Google ученый Drago, L., De Vecchi, E., Gabrieli, A., De Grandi, R. & Toscano, M. Иммуномодулирующие эффекты Lactobacillus salivarius LS01 и Bifidobacterium breve BR03, отдельно и в комбинации, на периферических Мононуклеарные клетки крови аллергических астматиков. Allergy Asthma Immunol. Res. 7 , 409–413 (2015). CAS Статья Google ученый Каллиомаки, М. и др. . Пробиотики в первичной профилактике атопического заболевания: рандомизированное плацебо-контролируемое исследование. Ланцет 357 , 1076–9 (2001). CAS Статья Google ученый Fiocchi, A. и др. . Клиническое использование пробиотиков при детской аллергии (CUPPA): документ с изложением позиции Всемирной организации по аллергии. World Allergy Organ J 5 , 148–67 (2012). Артикул Google ученый Kim, J. Y. et al. . Влияние смеси пробиотиков (Bifidobacterium bifidum, Bifidobacterium lactis, Lactobacillus acidophilus) на первичную профилактику экземы: двойное слепое рандомизированное плацебо-контролируемое исследование. Pediatr. Allergy Immunol. Выключенный. Publ. Евро. Soc. Педиатр. Allergy Immunol. 21 , e386–393 (2010). Артикул Google ученый Licari, A. et al. . Атопический дерматит: есть ли роль пробиотиков? J. Biol. Regul. Гомеост. Агенты . 29 , 18–24 (2015). Кирьявайнен, П. В., Салминен, С. Дж. И Изолаури, Э. Пробиотические бактерии в лечении атопических заболеваний: подчеркивание важности жизнеспособности. J. Pediatr. Гастроэнтерол. Нутр . 36 , 223–227, https://doi.org/10.1097/00005176-200302000-00012 (2003). «Суперантигены», связанные с загадочным синдромом COVID-19 у детейСчитайте детей в США, заразившихся COVID-19 с февраля, и скоро вы превысите численность населения Бостона. К счастью, большинство из этих 697 000 подтвержденных или вероятных случаев имели сравнительно легкое заболевание, и где-то от 16 до 45 процентов детей могут вообще не проявлять никаких симптомов.Тем не менее, у некоторых из этой группы — клинически определяемых как лица моложе 21 года — развивается серьезное заболевание, называемое мультисистемным воспалительным синдромом у детей, или MIS-C. Благодаря месяцам срочных исследований то, что начиналось как загадочный спектр симптомов, превратилось в поддающееся определению заболевание с ранними признаками, включая жар, сыпь, боль в животе, диарею и рвоту. Хотя MIS-C встречается редко — на данный момент в США подтверждено 1027 случаев, — он может перерасти в серьезное воспаление в течение нескольких часов, часто требует интенсивной терапии и иногда приводит к летальному исходу.В недавнем отчете Центров по контролю и профилактике заболеваний США проанализированы случаи смерти от коронавируса среди людей моложе 21 года и установлено, что большинство из них были из MIS-C. «Это происходит так быстро, и дети настолько больны, что 70 процентов потребуют помещения в отделение интенсивной терапии», — говорит Альваро Морейра, ученый-медик из Центра медицинских наук Университета Техаса в Сан-Антонио, который недавно опубликовал анализ результатов. из нескольких научных статей в EClinicalMedicine на основе 662 случаев MIS-C. Даже по мере того, как проясняется ранняя стадия синдрома, возникают вопросы о его истинной распространенности и его долгосрочных результатах. MIS-C обычно развивается через несколько недель после появления у детей классических признаков коронавируса, таких как кашель, ломота в теле и насморк. Исследования также показали, что заболевание может появиться после бессимптомного заражения вирусом. «Вот что пугает», — говорит Морейра. «Это может развиться, даже когда родители не знают, что их ребенок болен COVID-19.” Продолжительные последствия также изучаются после того, как несколько исследований показали, что даже после прохождения через дыхательные пути коронавирус может продолжать размножаться в пищеварительной системе, особенно у детей. Это открытие имеет далеко идущие последствия, выходящие за рамки редких детских случаев. «Данные показывают, что вирус может оставаться в стуле до месяца», — говорит Сью Нг, заместитель директора Центра исследований кишечной микробиоты Китайского университета Гонконга. Другое недавнее исследование вирусной структуры может дать ключ к разгадке как воздействия болезни на желудочно-кишечный тракт, так и причин, по которым иммунная система некоторых пациентов выходит из строя.«Подразумевается, что COVID-19 — это не только респираторное заболевание». Суперантиген коронавирусаКогда врачи впервые встретили детей с этими странными симптомами, сначала в Италии, а затем в Великобритании, они заподозрили болезнь Кавасаки, еще одно серьезное заболевание у маленьких детей, которое вызывает воспаление кровеносных сосудов. По словам Моше Ардити, эксперта по болезни Кавасаки и профессора педиатрии и биомедицинских наук в Cedars-Sinai, медицинском центре в Лос-Анджелесе, хотя некоторые клинические симптомы совпадают, между ними есть явные различия. Большинство пациентов MIS-C старше. Средний возраст заболевших — девять, в то время как пациенты Кавасаки обычно моложе двух лет. Они также несут более высокие уровни биомаркеров — белков, обнаруженных в анализах крови, — которые предсказывают уровни воспаления, и они часто испытывают сильную боль в животе, «до такой степени, что [случаи] путают с аппендицитом», — говорит Ардити. Вместе с соавтором Ивет Бахар, выдающимся профессором вычислительной и системной биологии Университета Питтсбурга, Ардити искал ключи к разгадке того, как вирус может вызывать эти реакции.Коронавирус SARS-CoV-2 имеет сферическую форму с шипами, которые прикрепляются к белку на поверхности человеческих клеток, называемому ACE2. Похоже на микроскопическую версию тех заусенцев, которые прилипают к носкам после похода. (По теме: узнайте, как коронавирус атакует тело и как организм сопротивляется.) В отличие от других известных коронавирусов, Бахар и Ардити обнаружили, что SARS-CoV-2 имеет уникальную особенность в одной части шипов. Этот спайковый фрагмент напоминает бактериальные токсины, известные как суперантигены — белки, которые вызывают чрезмерную реакцию Т-клеток, жизненно важного члена иммунной системы.Другие исследования показывают, что тяжелая форма COVID-19 является результатом чрезмерной реакции иммунной системы на коронавирус, вызывая каскады чрезмерного воспаления, которые необратимо повреждают многие части тела. Ардити говорит, что фрагмент шипа может объяснить, почему MIS-C имеет вид того, что происходит при инфекциях крови, таких как сепсис или синдром бактериального токсического шока. «Мы могли бы ожидать, что эта [спайковая] область вызовет такой же тип очень сильного ответа [как другие суперантигены]», — говорит Бахар. Это открытие может помочь понять, как и почему коронавирус вызывает другие типы гипервоспаления.Ардити говорит: «Мы наконец нашли вирусный спайк-сегмент, который может вызывать все эти иммунные ответы» — не только в MIS-C, но, возможно, и во взрослых случаях COVID-19. Новое исследование CDC, которое в значительной степени упускается из виду, поскольку оно вышло в те же выходные, что и диагноз COVID-19 президенту Трампу, показывает, что даже у взрослых с этим вирусом может развиться тяжелое состояние, подобное MIS-C. В отчете описаны 27 пациентов с «сердечно-сосудистыми, желудочно-кишечными, дерматологическими [кожными] и неврологическими симптомами без тяжелого респираторного заболевания» и названо состояние MIS-A — для взрослых. Мост между MIS-C и длительным COVID?Токсический шок также долгое время ассоциировался с краткосрочными и долгосрочными психическими расстройствами, поэтому Бахар задается вопросом, может ли суперантигенное качество всплеска SARS-CoV-2 также объяснить высокий процент неврологических симптомов, наблюдаемых у взрослых пациентов с COVID-19. В одном исследовании сообщалось, что почти у трети госпитализированных пациентов с COVID-19 наблюдались нарушения когнитивных функций спустя много времени после выписки. Отличительной чертой MIS-C и MIS-A являются желудочно-кишечные симптомы.Ардити говорит, что, опять же, ключ к разгадке может быть найден в суперантигенной области шипа вируса. Поскольку эти симптомы могут проявиться через несколько недель после начальной инфекции, мазки из носа и генетические тесты на вирус — современные методы подтверждения присутствия микроба — часто дают отрицательный результат. Некоторые исследователи теперь подозревают, что вирус все еще скрывается в организме во время синдрома MIS-C, возможно, в желудочно-кишечном тракте. «В нашем кишечнике находится самый большой иммунный орган — кишечник», — говорит Нг, учитывая, что пищеварительный тракт заполнен множеством иммунных клеток.«Мы не должны игнорировать это». Спайк-белокSARS-CoV-2 по структуре похож на стафилококковый энтеротоксин B (SEB), который вырабатывается бактериями и является одним из самых сильных желудочно-кишечных токсинов, известных в медицине. «Очень небольшое количество его в пище может вызвать сильное заболевание, сильную боль в животе и сильную рвоту», — объясняет Ардити. Респираторные коронавирусы у людей произошли от предков, которые, как известно, населяли кишечник летучих мышей, и вирус, стоящий за первоначальной эпидемией атипичной пневмонии в 2002-2003 годах, вызвал тяжелые желудочно-кишечные заболевания. Новое исследование в медицинском журнале Gut дополняет этот случай, показывая, что вирус сохраняется в пищеварительном тракте еще долго после того, как он исчезнет из носа, рта и легких. Нг, ведущий автор статьи, даже разработала тест на наличие коронавируса в стуле, потому что, по ее словам, это лучший способ скрининга детей и выявления возможных источников скрытой передачи. (По теме: Кто заразил президента Трампа? Этот генетический инструмент может легко определить источник.) Когда города были выгребными ямами болезней Города XIX века были рассадником болезней.Узнайте, какую роль сыграли плохие условия жизни и как открытие микроба привело к реформе общественного здравоохранения, которая продолжается и сегодня. «Это безопасно и легко собирать образцы», — говорит она. «Они все время какают». Гонконг использует эти тесты для проверки путешественников из группы риска с марта. Другое небольшое исследование, проведенное в июне, показало, что у двух детей вирус был в кале через 20 дней после того, как мазки из горла дали отрицательный результат. Аналогичная работа группы Нг показала, что некоторые пациенты с COVID-19, в том числе дети, продолжали страдать дисбактериозом кишечника — термином, обозначающим микробный дисбаланс — даже после выздоровления от первоначальных симптомов. «Мы были удивлены, увидев, насколько серьезен этот дисбактериоз даже у пациентов с легкой или средней степенью тяжести», — говорит Нг, чья команда проводит клиническое исследование того, может ли изменение состава микробов в кишечнике облегчить COVID-19. Ваш микробиом постоянно меняется в зависимости от вашего окружения, диеты и вашего возраста. Но Нг говорит, что у здоровых детей обычно бывает «золотой век» сбалансированного микробиома, который можно изменить в возрасте от двух до двенадцати лет — примерно в том возрасте, когда подростки начинают реагировать на COVID-19, как взрослые. Когда команда Нг проанализировала микробиомы пациентов в рамках отдельной статьи, опубликованной в сентябре, они определили 23 типа отсутствующих кишечных бактерий, которые были связаны с повышенной тяжестью COVID-19. «Мы хорошо знаем большинство функций этих бактерий. Они помогают нам производить жирные кислоты с короткой цепью », — говорит она. Длинные ставкиПо мере того, как эти вопросы начинают дразнить, остается неясным, как будут жить дети с MIS-C. Большинство из них выздоровеют, если им будет оказано правильное лечение, но Морейра обнаружила, что их пребывание в больнице было длительным, в среднем восемь дней. И он предупреждает, что мы не знаем долгосрочных последствий. «Мы знаем, что у пациентов с болезнью Кавасаки позже могут развиться аневризмы, тромбозы или тромбы, а также повышенный риск высокого кровяного давления и сердечных приступов в более молодом возрасте», — говорит он. Долгосрочные последствия заболевания могут неравномерно сказаться на чернокожих, коренных народах и цветных: как в обзоре Морейры, так и в отчете CDC о MIS-C установлено, что, как и в случае со взрослыми, инфицированными вирусом, расовые различия очевидны. Из 20 детей, умерших от MIS-C в США, 45 процентов были латиноамериканцами, 29 процентов — черными и 4 процента — американскими индейцами. К другим факторам риска относятся сопутствующие заболевания, такие как ожирение, которые могут ослабить сердечно-сосудистую систему.По словам Джозефа Абрамса, эпидемиолога CDC и автора недавнего исследования MIS-C, поражение сердца, по-видимому, происходит во многих случаях MIS-C, что вызывает опасения по поводу пожизненных последствий. Даже если это заболевание встречается редко, говорит Абрамс, пандемия настолько распространена, что может затронуть многих детей. И, добавляет он, «смерть любого ребенка — ужасная и трагическая ситуация». Примечание редактора. Эта статья была обновлена, чтобы исправить принадлежность Альваро Морейры. Это Центр медицинских наук Техасского университета в Сан-Антонио, а не Техасский университет в Сан-Антонио.. | ||||||||||||||||||||||||||||||||




 , связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов;
, связанные с повышением кислотности или щелочности среды обитания бактерий, что влечет за собой изменение обмена веществ и клеточных мембран полезных микроорганизмов;
 При дисбактериозе стул грудничка может приобретать зеленый цвет, примеси, белые комочки, кал пениться и имеет неприятный запах.
При дисбактериозе стул грудничка может приобретать зеленый цвет, примеси, белые комочки, кал пениться и имеет неприятный запах. При слишком частом кормлении может возникнуть проблема с пищеварением и-за недостаточной выработки ферментов. Пища не переваривается до конца, что приводит к гнилостному процессу и брожению, вызывая колики, вздутие и другие симптомы.
При слишком частом кормлении может возникнуть проблема с пищеварением и-за недостаточной выработки ферментов. Пища не переваривается до конца, что приводит к гнилостному процессу и брожению, вызывая колики, вздутие и другие симптомы. Необходимо вводить прикорм согласно возрасту ребенка. При появлении симптомов дисбактериоза необходимо пересмотреть рацион малыша.
Необходимо вводить прикорм согласно возрасту ребенка. При появлении симптомов дисбактериоза необходимо пересмотреть рацион малыша.