что нужно знать родственникам больного — Про Паллиатив
Публикуем краткую инструкцию по обработке распадающейся опухоли для родственников и ухаживающих за онкологическими больными в терминальной стадии заболевания. Об других аспектах ухода за человеком в конце жизни можно прочитать в книге «Рядом с тяжелобольным», выпущенной фондом помощи хосписам «Вера» в 2020 году.
Особого внимания при уходе требуют распадающиеся опухоли.
Врач или квалифицированная медсестра обязаны обучить вас правильным действиям. Внимательно следуйте их указаниям.
- При наружной локализации опухоли следует 2–3 раза в день очищать раковые язвы от покрывающих их гнойных масс. Обязательно делать это в перчатках. Лучше всего промывать язвы физиологическим раствором (0,9%-й раствор хлорида натрия) либо раствором фурацилина или хлоргексидина — любой из них можно приобрести в аптеке.
- Можно вымывать гной под небольшим давлением, аккуратно направляя струю раствора на рану из шприца (без иголки!). Затем просушить рану салфеткой. Кожу вокруг раны обработать хлоргексидином или раствором повидона-йода (водный, а не спиртовой раствор). Затем необходимо наложить повязку с лекарством, которое назначит врач.
- Если наложенная на рану повязка сильно мокнет, перевязывайте как можно чаще, по мере необходимости.
- Если от раны исходит неприятный резкий запах, используйте таблетки трихопола или метронидазола, мелко истолченные или измельченные при помощи кофемолки. До нанесения препаратов рану необходимо обработать (промыть физиологическим раствором или раствором фурацилина, как описано выше, и просушить салфетками), после чего слегка припудрить полученным из таблеток порошком. Можно также растворить порошок в небольшом количестве физиологического раствора и обработать рану.
Распад опухоли всегда сопровождается опасностью кровотечения.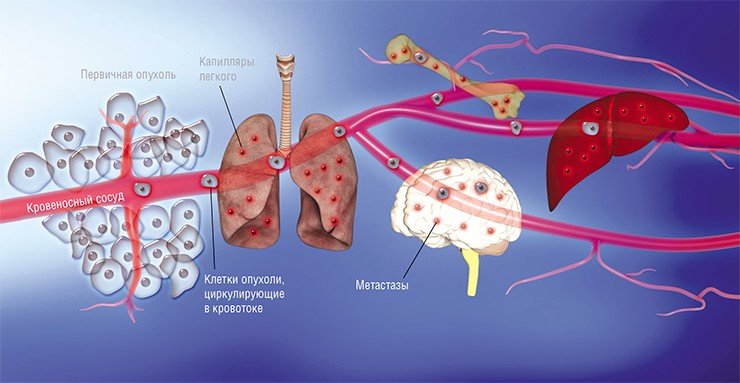 При появлении малейших признаков кровотечения (при капиллярном кровотечении на поверхности раны появляются капельки крови) нужен покой и кровоостанавливающие средства. При наружном расположении опухолей к месту кровотечения следует приложить гемостатическую губку, наложить давящую повязку и холод. Если кровотечение обильное, то нужно прикладывать тампоны (сложенные из нескольких слоев марли) с аминокапроновой кислотой.
При появлении малейших признаков кровотечения (при капиллярном кровотечении на поверхности раны появляются капельки крови) нужен покой и кровоостанавливающие средства. При наружном расположении опухолей к месту кровотечения следует приложить гемостатическую губку, наложить давящую повязку и холод. Если кровотечение обильное, то нужно прикладывать тампоны (сложенные из нескольких слоев марли) с аминокапроновой кислотой.
Если кровотечение не прекращается/не уменьшается, незамедлительно вызывайте скорую помощь (103, или общий номер экстренных служб 112).
При распадающихся опухолях внутренних органов может потребоваться срочная госпитализация больного.
Материал подготовлен с использованием гранта Президента Российской Федерации на развитие гражданского общества, предоставленного Фондом президентских грантов.
это хорошо или плохо? Синдром распада опухоли, симптомы и признаки
Распад опухоли — это закономерное следствие слишком активного роста ракового узла по периферии или осложнение избыточно высокой реакции распространённого злокачественного процесса на химиотерапию.
Не каждому пациенту доводится столкнуться с тяжелой проблемой распада ракового процесса, но при любой интенсивности клинических проявлений инициируемое распадом злокачественной опухоли состояние непосредственно угрожает жизни и радикально меняет терапевтическую стратегию.
Распад опухоли: что это такое?
Распад — это разрушение злокачественного новообразования, казалось бы, что именно к распаду необходимо стремиться в процессе противоопухолевой терапии. В действительности при химиотерапии происходит уничтожение раковых клеток, только убийство органичное и не массовое, а единичных клеток и небольших клеточных колоний — без гибели большого массива ткани с выбросами в кровь из распадающихся клеток токсичного содержимого.
Под действием химиотерапии клетки рака приходят не к распаду, а к процессу апоптоза — программной смерти. Останки раковых клеток активно утилизируются фагоцитами и уносятся прочь от материнского образования, а на месте погибших возникает нормальная рубцовая ткань, очень часто визуально не определяющаяся.
Останки раковых клеток активно утилизируются фагоцитами и уносятся прочь от материнского образования, а на месте погибших возникает нормальная рубцовая ткань, очень часто визуально не определяющаяся.
Регрессия злокачественного новообразования в форме апоптоза происходит медленно, если наблюдать за новообразованием с перерывами в несколько дней, то заметно, как по периферии раковый узел замещается совершенно нормальной тканью и сжимается в размере.
При распаде раковый конгломерат не замещается здоровыми клетками соединительной ткани, мертвые клеточные пласты формируются в очаг некроза, отграничивающийся от остальной раковой опухоли мощным воспалительным валом. Внутри злокачественного новообразования некроз не способен организоваться и заместиться рубцом, он только увеличивается, захватывая новые участки ракового узла, походя разрушая опухолевую сосудистую сеть. Из мертвого очага в кровь поступают продукты клеточного гниения, вызывая интоксикацию.
При некоторых злокачественных болезнях крови или лимфатической ткани на фоне химиотерапии тоже возникает распад, но без формирования зоны некроза, при этом массово погибающие раковые клетки выбрасывают в кровь свое содержимое, которое не успевает утилизироваться фагоцитами, «забивает» почки и заносится в сосуды других органов.
Массированный выброс клеточного субстрата становится причиной тяжелейшей интоксикации, способной привести к смерти.
Причины распада злокачественной опухоли
Инициируют распад ракового образования всего только две причины: сама жизнедеятельность клеток злокачественной опухоли и химиотерапия.
Первая причина спонтанного — самопроизвольного распада характерна для солидных новообразований, то есть рака, сарком, злокачественных опухолей головного мозга и меланомы. Вторая причина распада типична для онкогематологических заболеваний — лейкозов и лимфом, при онкологических процессах встречается чрезвычайно редко.
С течением времени центральная часть злокачественного новообразования любой морфологической принадлежности начинает испытывать трудности с доставкой питательных веществ.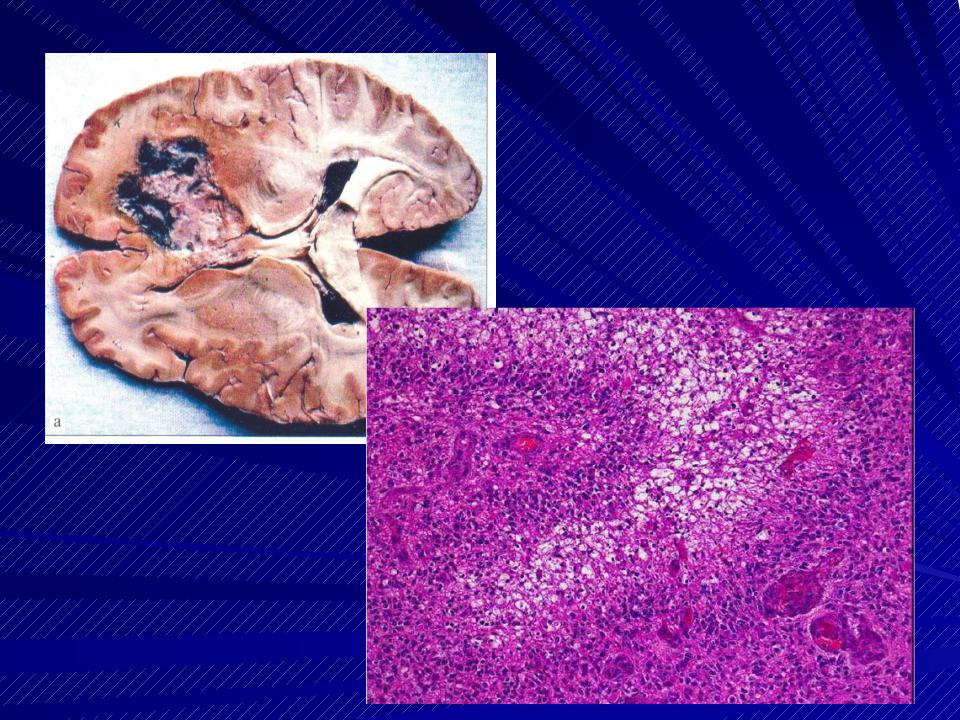 Происходит это из-за того, что раковые клетки размножаются быстрее, чем формируется «кормящая» их сосудистая сеть. Голодающие клеточные пласты погибают, что проявляется распадом с образованием зоны некроза, отграниченной от живой опухолевой ткани, с постепенным формированием полости, в которой протекают процессы медленного гниения.
Происходит это из-за того, что раковые клетки размножаются быстрее, чем формируется «кормящая» их сосудистая сеть. Голодающие клеточные пласты погибают, что проявляется распадом с образованием зоны некроза, отграниченной от живой опухолевой ткани, с постепенным формированием полости, в которой протекают процессы медленного гниения.
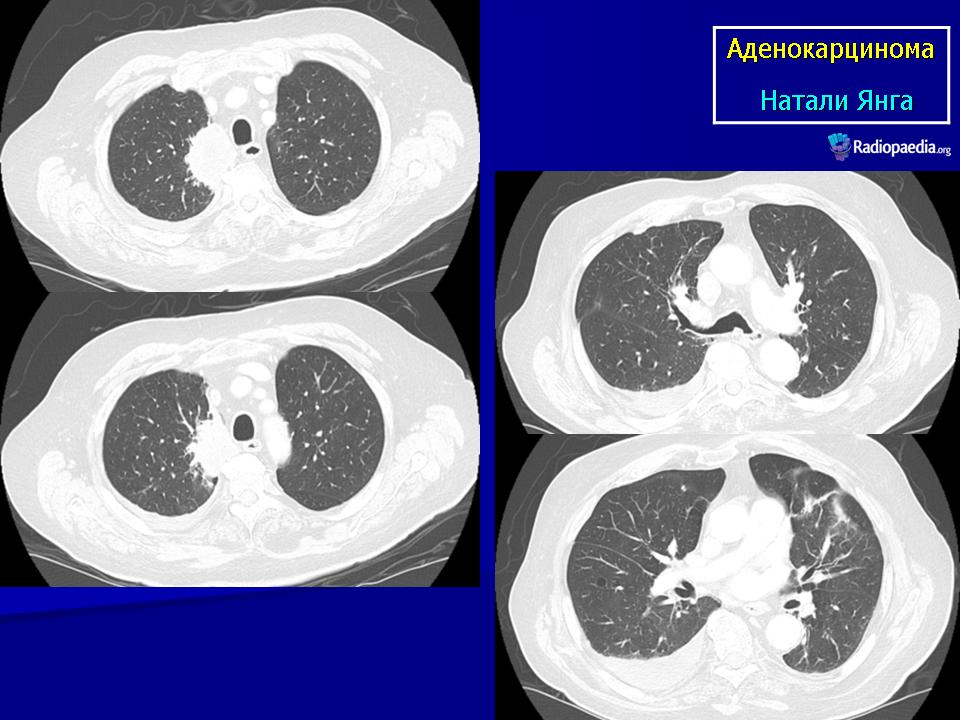
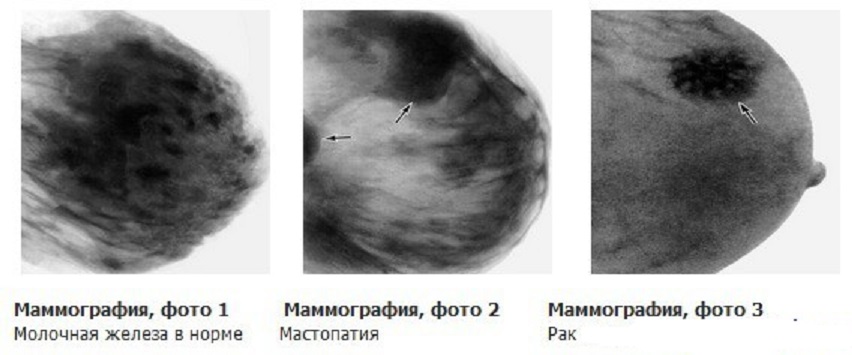
Если некротическая полость находится близко к коже, то может прорваться наружу в виде распадающегося «гнойника» и образованием незаживающей язвы, к примеру, молочной железы. В легком при рентгене внутри ракового узла с распадом будет видна тёмная «дырка» с отдельно расположенным внутри островковым кусочком некротической ткани — секвестром.
Второй вариант распада, типичный для онкогематологических заболеваний, можно констатировать по клиническим симптомам тяжелейшей интоксикации с осложнениями — тумор-лизис-синдрому (СОЛ) и биохимическим анализам крови, где резко повышена концентрация мочевой кислоты, калия и фосфора, но существенно снижен кальций. Конкретная побудительная причина для развития СОЛ — обширное злокачественное поражение с очень высокой чувствительностью к химиотерапии.
При онкологических процессах — раках, саркомах, меланоме реакция на цитостатики преимущественно умеренная и не столь стремительная, поэтому СОЛ принципиально возможен только в исключительных случаях мелкоклеточного, недифференцированного или анаплазированного злокачественного процесса.
Симптомы распада злокачественной опухоли
Клиническим итогом спонтанного распада раковой опухоли становится хроническая интоксикация, нередко сочетающаяся с симптомами генерализованного воспаления вследствие образования гнойного очага. Симптомы разнообразны, но у большинства отмечается прогрессивно нарастающая слабость, повышение температуры от субфебрильной до лихорадки, сердцебиение и даже аритмии, изменение сознания — оглушенность, нарушение аппетита и быстрая потеря веса.
Локальные проявления спонтанного разрушения раковой опухоли определяются её локализацией:
- рак молочной железы, меланома и карцинома кожи, опухоли ротовой полости — гнойная, обильно секретирующая открытая язва с грубыми подрытыми краями, часто источающая гнилостный запах;
- распадающаяся карцинома легкого — при прободении некротической полости в крупный бронх возникает приступообразный кашель с гнойной мокротой, нередко с прожилками крови, иногда случается обильное легочное кровотечение;
- разрушение новообразования органов желудочно-кишечного тракта — развитие локального перитонита при прободении ракового конгломерата в брюшную полость, кровотечение с чёрным стулом и рвотой кофейной гущей;
- распадающаяся карцинома матки — интенсивные боли внизу живота, нарушение мочеиспускания и дефекации при образование гнойных свищей.

Синдром опухолевого лизиса при лейкозах и лимфомах потенциально смертельное состояние, приводящее:
- в первую, очередь к осаждению кристаллов мочевой кислоты в почечных канальцах с выключением функции и острой почечной недостаточностью;
- дополнительно повреждает почки быстрое закисление крови — лактатацидоз;
- снижение уровня кальция и повышение фосфатов инициирует судорожный синдром, дополняемый неврологическими проявлениями вследствие выброса цитокинов;
- повышения калия негативно отражается на сердечной деятельности;
- выброс биологически-активных веществ из клеток приводит к повышению проницаемости мелких кровеносных сосудов, что снижает уровень белков и натрия крови, уменьшает объем циркулирующей плазмы, клинические проявляется падением давления и усугублением поражения почек;
- обширные и глубокие нарушения метаболизма во всех системах органов с исходом в полиорганную недостаточность.
Лечение распада опухоли
Для эффективного лечения распадающегося опухолевого конгломерата необходимо восстановление внутриопухолевого питания посредством быстрого формирования новой сосудистой сети, что совершенно невозможно. Поэтому при спонтанном распаде прибегают к симптоматической терапии, в том числе паллиативным хирургическим — «санитарным» вмешательствам.
Формально при распадающейся опухоли невозможна радикальная операция, зачастую заболевание считается неоперабельным, но химиотерапия и облучение исключаются из программы, потому что способны усугубить некроз. Отчаянное положение пациента и вероятность массированного кровотечения из изъеденного раком крупного сосуда оправдывает выполнение паллиативной операции, основная цель которой — удаление очага хронического воспаления и интоксикации.
Синдром лизиса опухоли лечится многочасовыми капельными вливаниями при усиленном диурезе — выведении мочи, связыванием мочевой кислоты специальными лекарствами. Одновременно поддерживается работа сердечно-сосудистой системы, купируется интоксикация и воспаление. При развитии острой почечной недостаточности проводится гемодиализ.
При развитии острой почечной недостаточности проводится гемодиализ.
Синдром лизиса опухоли сложно лечить, но можно предотвратить или хотя бы уменьшить его проявления. Профилактика начинается за несколько дней до курса химиотерапии и продолжается не менее трёх суток после завершения цикла. Кроме специальных препаратов, выводящих мочевую кислоту, назначаются продолжительные капельницы, вводятся недостающие микроэлементы, а избыточные выводятся или связываются другими лекарствами.
Профилактика лизиса опухоли стала стандартом лечения онкогематологических больных, чего нельзя сказать об онкологических пациентах с распадающимися злокачественными процессами, которым очень сложно найти хирурга, готового выполнить паллиативную операцию. Во вмешательстве по санитарным показаниям отказывают из-за сложности выхаживания тяжелого больного после обширного хирургического вмешательства. В нашей клинике никому не отказывают в помощи.
Список литературы
- Cairo M.S., Bishop M. /Tumour lysis syndrome: New therapeutic strategies and classification// Brit. J Haematol// 2004; 127.
- Howard S.C., Jones D.P., Pui C-H. /The Tumor Lysis Syndrome// N Engl J Med.; 2011;364(19).
- Jeha S. /Tumor lysis syndrome// Semin Hematol 2001; 38
- Sarno J./ Prevention and Management of Tumor Lysis Syndrome in Adults With Malignancy// J Adv Pract Oncol.; 2013; 4(2).
- Wossmann W., Schrappe M., Meyer U. et al./ Incidence of tumor lysis syndrome in children with advanced stage Burkitt’s lymphoma/leukemia before and after introduction of prophylactic use of urate oxidase//Ann Hematol, 2003.
Уход при распаде опухоли — Благотворительный фонд помощи хосписам «Вера»
Особого внимания при уходе требуют распадающиеся опухоли. При наружной локализации опухоли следует 2-3 раза в день очищать раковые язвы от покрывающих их гнойных масс. Обязательно делать это в перчатках. Лучше всего их промывать физиологическим раствором (0.9% раствор хлорида натрия), 3% перекисью водорода или раствором фурацилина – любой из них можно приобрести в аптеке. Можно вымывать гной под небольшим давлением, аккуратно направляя струю раствора на рану из шприца.
Обязательно делать это в перчатках. Лучше всего их промывать физиологическим раствором (0.9% раствор хлорида натрия), 3% перекисью водорода или раствором фурацилина – любой из них можно приобрести в аптеке. Можно вымывать гной под небольшим давлением, аккуратно направляя струю раствора на рану из шприца.
Если наложенная на рану повязка сильно мокнет, перевязывайте как можно чаще, по мере необходимости.
Если от раны появляется неприятный резкий запах, используйте таблетки трихопола или метронидозола, мелко истолченные или измельченные при помощи кофемолки. До нанесения препаратов рану необходимо обработать (промыть физраствором, перекисью или раствором фурацилина, как описано выше, и просушить салфетками), после чего слегка припудрить полученным из таблеток порошком. Можно также растворить порошок в небольшом количестве физиологического раствора и обработать рану.
Распад опухоли всегда сопровождается опасностью кровотечения. При появлении малейших признаков кровотечения (при капилярном кровотечении на поверхности раны появляются капельки крови) нужен покой и кровоостанавливающие средства. При наружном расположении опухолей к месту кровотечения следует приложить гемостатическую губку, наложить давящую повязку и холод. Если кровотечение обильное, то нужно прикладывать тампоны (сложенные из нескольких слоев марли) с аминокапроновой кислотой.
Если кровотечение не прекращается/не уменьшается, незамедлительно вызывайте скорую помощь.
При распадающихся опухолях внутренних органов может потребоваться срочная госпитализация больного. Если Вы заметили, что стул пациента черного цвета (при этом больной не принимает железосодержащие препараты) или же рвотные массы имеют вид «кофейной гущи», срочно вызывайте скорую помощь.
Также вы можете обратиться по телефону Горячей линии для неизлечимо больных людей — 8 800 700 84 36.
Работает круглосуточно и бесплатно во всех регионах России.
Синдром распада опухоли протокол
Комплекс симптомов, возникающий при быстром разрушении злокачественной опухоли. В большинстве случаев патология обусловлена лечением заболеваний крови, иногда – терапией по поводу онкологических процессов других локализаций. Симптомами синдрома являются метаболические расстройства, аритмия, брадикардия, судороги, нарушения сознания, острая почечная недостаточность, диарея, запор, тошнота, рвота, кишечная непроходимость. Диагноз устанавливают на основании анамнестической информации, клинических проявлений, физикального осмотра и дополнительных обследований. В рамках диагностики могут выполнять общий и биохимический анализ крови, печеночные пробы, электрокардиографию, ультразвуковое исследование, компьютерную томографию. Тошноту и рвоту купируют противорвотными средствами. Водно-солевые и кислотно-щелочные нарушения являются показаниями к инфузионной терапии. При тяжелом течении проводят гемодиализ. При своевременном лечении прогноз благоприятный. Летальный исход может быть обусловлен острой почечной недостаточностью, внутренним кровотечением, перитонитом.
В большинстве случаев патология обусловлена лечением заболеваний крови, иногда – терапией по поводу онкологических процессов других локализаций. Симптомами синдрома являются метаболические расстройства, аритмия, брадикардия, судороги, нарушения сознания, острая почечная недостаточность, диарея, запор, тошнота, рвота, кишечная непроходимость. Диагноз устанавливают на основании анамнестической информации, клинических проявлений, физикального осмотра и дополнительных обследований. В рамках диагностики могут выполнять общий и биохимический анализ крови, печеночные пробы, электрокардиографию, ультразвуковое исследование, компьютерную томографию. Тошноту и рвоту купируют противорвотными средствами. Водно-солевые и кислотно-щелочные нарушения являются показаниями к инфузионной терапии. При тяжелом течении проводят гемодиализ. При своевременном лечении прогноз благоприятный. Летальный исход может быть обусловлен острой почечной недостаточностью, внутренним кровотечением, перитонитом.
Патология развивается при лечении опухолей злокачественного характера. Химиопрепараты и лучевая терапия интенсивно разрушают клетки новообразования, которые затем попадают в кровь. Чаще всего синдром возникает у пациентов, страдающих лейкозом или лимфомами. Вероятность образования синдрома повышается при крупных неоплазиях, поскольку в них часто возникают участки, которые не снабжаются кровью.
Симптомы синдрома распада опухолиНа фоне распада злокачественного новообразования ухудшается общее состояние пациента. У него повышается температура тела и возникает прогрессирующая слабость. Больной жалуется на диспепсические нарушения: абдоминальные боли, тошноту, рвоту, плохой аппетит, запор и диарею. Поражения центральной нервной системы сопровождаются судорогами, парестезиями и расстройствами сознания. При поражениях сердечно-сосудистой системы отмечаются брадикардия, аритмия и пониженное артериальное давление. Уменьшение количества отделяемой почками мочи и отсутствие поступления мочи в мочевой пузырь свидетельствуют о почечной недостаточности. Для дисфункции печени характерно развитие желтушности кожи. Кроме общих симптомов отмечаются признаки, спровоцированные местом расположения злокачественной опухоли. Когда распадается неоплазия молочной железы, кожа на груди покрывается крупными язвами. При распаде новообразования в желудке и кишечнике возможны расплавление сосуда, кишечные кровотечения, перфорация стенки органа и перитонит. Рак легких может сопровождаться кровотечениями, пневмотораксом, отхождением обильной мокроты гнилостного характера.
Уменьшение количества отделяемой почками мочи и отсутствие поступления мочи в мочевой пузырь свидетельствуют о почечной недостаточности. Для дисфункции печени характерно развитие желтушности кожи. Кроме общих симптомов отмечаются признаки, спровоцированные местом расположения злокачественной опухоли. Когда распадается неоплазия молочной железы, кожа на груди покрывается крупными язвами. При распаде новообразования в желудке и кишечнике возможны расплавление сосуда, кишечные кровотечения, перфорация стенки органа и перитонит. Рак легких может сопровождаться кровотечениями, пневмотораксом, отхождением обильной мокроты гнилостного характера.
Пациенту могут потребоваться консультации специалистов онкологического, кардиологического, гастроэнтерологического и урологического профилей. Чтобы установить и подтвердить диагноз, доктор изучает историю болезни, анализирует клинические признаки, проводит физикальный осмотр и направляет больного на дополнительные обследования. Как правило, в рамках диагностики выполняют общий и биохимический анализ крови, печеночные пробы, электрокардиографию, ультразвуковое исследование, компьютерную томографию.
Лечение синдрома распада опухолиПри незначительных обменных нарушениях лечение амбулаторное. Развернутая клиническая картина синдрома является показанием к госпитализации больного в онкологического или реанимационное отделение. Тошноту и рвоту купируют противорвотными средствами. Для лечения запоров назначают клизмы и прием слабительных препаратов. Аритмию корректируют антиаритмическими средствами. Чтобы скорректировать водно-солевые и кислотно-щелочные нарушения проводится инфузионная терапия. Кроме того, пациенту корректируют питьевой режим. При тяжелом течении недуга выполняют гемодиализ. Медикаментозную схему могут дополнять анальгетиками и противовоспалительными препаратами.
Профилактика синдрома распада опухолиЗа несколько дней до химиотерапии, больному необходимо увеличить количество потребляемой жидкости. Во время противоопухолевого лечения врачи ежедневно выполняют общий и биохимический анализ крови для контроля уровня мочевой кислоты, кальция, креатинина, фосфатов.
Во время противоопухолевого лечения врачи ежедневно выполняют общий и биохимический анализ крови для контроля уровня мочевой кислоты, кальция, креатинина, фосфатов.
Синдром распада опухоли
Лечение противоопухолевыми агентами приводит к гибели клеток и влечет за собой высвобождение большого количества продуктов распада опухоли: калия, фосфора, пуринов и других веществ, которые наводняют межклеточные пространства. Такое внезапное поступление большого количества продуктов клеточного распада может превысить способность организма к их выделению, что приводит к острому нарушению электролитного и кислотно- щелочного равновесия.
Грубо говоря, возникновение данного синдрома – признак высокой эффективности терапии.
Причины
- быстро растущие опухоли с наличием большого объема опухолевой массы;
- острые лейкозы;
- лимфомы высокой степени злокачественности;
- некоторые солидные опухоли;
- саркомы, чаще на фоне высокодозной ХТ.
Электролитный дисбаланс приводит к нарушениям со стороны многих органов и систем. Повышенная концентрация мочевой кислоты в крови, выпадение ее в осадок в структура почек сопровождается острой мочекислой обструкцией мочевыводящих путей. При этом достаточно быстро развивается почечная недостаточность и при несвоевременном лечении осложнение может привести к летальному исходу.
Симптомы
- со стороны нервной системы: нарушение сознания (вплоть до комы), парестезии, судороги;
- со стороны сердечно-сосудистой системы: брадикардия, аритмия, фибрилляция желудочков, остановка сердца;
- со стороны желудочно-кишечного тракта: спазмы гладкой мускулатуры;
- со стороны мочевыделительной системы: почечная недостаточность.
Профилактика
- Перед началом химиотерапии по поводу лейкозов, лимфом или солидных опухолей с большим объемом опухолевой массы рекомендуется обильное питье, инфузионная терапия в течение 24– 48 ч, введение аллопуринола.

- Во время проведения химиотерапии проводится мониторинг диуреза, гемодинамики, содержания в сыворотке крови мочевой кислоты, креатинина, калия, кальция, фосфора, ЭКГ, коррекция любых метаболических нарушений.
http://med4share.ru/media/files/clinic_recommend/lysis_syndrome.pdf
http://nodgo.org/sites/default/files/%D0%A1%D0%9E%D0%9B%D0%9E.pdf
https://www.cancer.ca/en/cancer-information/diagnosis-and-treatment/managing-side-effects/tumour-lysis-syndrome/?region=on
https://www.oncolink.org/healthcare-professionals/o-pro-portal/articles-about-cancer-treatment-and-medications/tumor-lysis-syndrome-hcp-education
«Что такое синдром распада опухоли?» – Яндекс.Кью
Лечение противоопухолевыми агентами приводит к гибели клеток и влечет за собой высвобождение большого количества продуктов распада опухоли: калия, фосфора, пуринов и других веществ, которые наводняют межклеточные пространства.
Такое внезапное поступление большого количества продуктов клеточного распада может превысить способность организма к их выделению, что приводит к острому нарушению электролитного и кислотно- щелочного равновесия.
Грубо говоря, возникновение данного синдрома — это признак высокой эффективности терапии.
Причины:
- быстрорастущие опухоли с наличием большого объема опухолевой массы;
- острые лейкозы;
- лимфомы высокой степени злокачественности;
- некоторые солидные опухоли;
- саркомы, чаще на фоне высокодозной ХТ.
Электролитный дисбаланс приводит к нарушениям со стороны многих органов и систем. Повышенная концентрация мочевой кислоты в крови, выпадение ее в осадок в структуре почек сопровождается острой мочекислой обструкцией мочевыводящих путей. При этом достаточно быстро развивается почечная недостаточность и при несвоевременном лечении осложнение может привести к летальному исходу.
Симптомы:
- со стороны нервной системы: нарушение сознания (вплоть до комы), парестезии, судороги;
- со стороны сердечно-сосудистой системы: брадикардия, аритмия, фибрилляция желудочков, остановка сердца;
- со стороны желудочно-кишечного тракта: спазмы гладкой мускулатуры;
- со стороны мочевыделительной системы: почечная недостаточность.

Профилактика:
- Перед началом химиотерапии по поводу лейкозов, лимфом или солидных опухолей с большим объемом опухолевой массы рекомендуется обильное питье, инфузионная терапия до химиотерапии, терапия в течение 24– 48 ч, введение Аллопуринола.
- Во время проведения химиотерапии желателен мониторинг диуреза, гемодинамики, содержания в сыворотке крови мочевой кислоты, креатинина, калия, кальция, фосфора, ЭКГ, коррекция любых метаболических нарушений.
всё, что вы боялись спросить о раке / Новости общества Красноярска и Красноярского края / Newslab.Ru
Слов «у вас рак» из уст врача боится любой пациент — его жизнь словно раскалывается на две части, и вторая явно будет короче первой. Насколько оправдана канцерофобия и сможет ли человечество когда-нибудь победить онкологические заболевания — разбираемся вместе с экспертом, отвечая на самые главные вопросы про рак.
«Рак», «новообразование» и «опухоль» — это все синонимы?Нет. По традиции «раком» называют любое заболевание, подразумевающее идущий не по сценарию рост атипичных клеток в организме человека. На деле речь идет об опухоли (хотя опухолью в медицине также иногда называют отек в месте воспаления). Наиболее корректный термин, отражающий ситуацию, когда у пациента обнаружили подозрительное скопление клеток, но пока еще не знают, насколько все серьезно — новообразование.
А чем доброкачественные новообразования отличаются от злокачественных?В первом случае речь идет о нетипичном разрастании клеток, которые по своему строению довольно близки к здоровым. Как правило, размеры такой опухоли невелики, и сама по себе она не оказывает влияния на нормальные процессы, протекающие в организме.
Злокачественная опухоль — группа клеток-мутантов, которые потеряли всякое сходство со своими здоровыми «родственниками», растут очень быстро, отбирая питательные вещества у окружающих тканей, и способны метастазировать — расселяться по телу человека, деформируя органы и отравляя больного токсическими продуктами своей жизнедеятельности.
В зависимости от того, какой тип тканей послужил основой для злокачественного новообразования, опухоли называются по-разному. Под раком подразумевают только злокачественные опухоли, произошедшие из эпителиальных клеток, поэтому «рак крови» или «рак мозга» — это некорректные, обывательские термины.
Какие злокачественные опухоли наиболее опасны?Более четверти (27%) случаев смерти мужчин обусловлены раком трахеи, бронхов, легкого, виновником гибели каждого десятого пациента становится рак желудка (11%), следом в череде «убийц» — опухоли предстательной железы (8%), мочевыделительной системы (7%), ободочной (6%) и прямой (5%) кишки, поджелудочной железы (6%), губы, полости рта и глотки (5%), лимфатической и кроветворной ткани (5%).
Для женщин наиболее опасны новообразования молочной железы (17% всех смертей), далее следуют новообразования ободочной кишки (10%), желудка (9%), трахеи, бронхов, легкого (7%), поджелудочной железы (6%), прямой кишки (6%), яичника (6%), лимфатической и кроветворной ткани (6%), тела (5%) и шейки (5%) матки.
Можно ли предотвратить развитие опухоли?Застраховаться от такого диагноза нельзя, разве что, подобно Анджелине Джоли, решиться на ампутацию молочных желез, имея установленную генетическую предрасположенность к раку груди. Но ведь новообразований много, и у каждого из нас есть шанс столкнуться с любым из них.
Другое дело, что здоровый образ жизни, включающий правильное питание, регулярные физические нагрузки, отказ от вредных привычек и переезд в экологически чистый населенный пункт, позволяет снизить вероятность такого развития сценария. К тому же, некоторые опухоли являются следствием инфекции — например, рак шейки матки гораздо чаще возникает у женщин, зараженных вирусом папилломы человека. И если поставить прививку, то можно избежать встречи с распространенной и опасной опухолью.
А как вовремя и достоверно обнаружить рак?Регулярно обследоваться. Как бы мы ни любили обвинять во всем врачей и государство, на деле большинство пациентов обращается в больницы слишком поздно, чтобы гарантировать им выздоровление даже при условии оказания самой современной помощи.
Как бы мы ни любили обвинять во всем врачей и государство, на деле большинство пациентов обращается в больницы слишком поздно, чтобы гарантировать им выздоровление даже при условии оказания самой современной помощи.
Если вы ощутили боль, вызванную опухолью, — скорее всего, патологический процесс зашел уже очень далеко. На первой и второй стадиях рак, как правило, никак себя не проявляет: это просто маленькое скопление клеток. Чтобы своевременно «поймать» его — надо в соответствии с программой диспансеризации и индивидуальными врачебными рекомендациями периодически проходить УЗИ, маммографию, флюорографию, МРТ, КТ, фиброгастроскопию, колоноскопию и другие виды исследований, а также сдавать анализы.
А что такое стадии рака?Это — условное деление злокачественных опухолей, которое определяется тремя факторами: их размерами, вовлечением в патологический процесс лимфатических узлов и наличием метастазов. Как правило, даже крошечная опухоль с метастазами сразу относится к четвертой стадии. Такая классификация помогает сориентироваться в подходящих вариантах лечения и прогнозах для больного.
Сколько времени проходит от возникновения опухоли до смерти человека?Ответ зависит от большого количества факторов. В первую очередь — от вида новообразования, от сроков начала оказания и качества медицинской помощи и от общего состояния здоровья пациента. Иногда человек может «сгореть» буквально за несколько месяцев, и врачи попросту не успевают ничего предпринять. В других случаях опухоль растет десятилетиями, и медики могут принять решение не вмешиваться в этот процесс, поскольку агрессивное лечение сведет пожилого больного в могилу раньше, чем рак.
Считается, что в России плохо лечат рак. Это правда?Делать такие выводы — это как оценивать общую температуру по больнице. Учитывая, что опухоли бывают разные и, соответственно, требуют разных подходов к лечению, в каждой отрасли внутри онкологии ситуация складывается по-своему. Значение имеют и технические возможности, которыми располагает каждый конкретный онкоцентр, и человеческий фактор — опыт хирурга или специалиста по лучевой терапии, и организация поставок препаратов для химиотерапии.
Значение имеют и технические возможности, которыми располагает каждый конкретный онкоцентр, и человеческий фактор — опыт хирурга или специалиста по лучевой терапии, и организация поставок препаратов для химиотерапии.
Материалы по теме
В отечественной онкологии много системных проблем — поэтому всегда есть шанс, что вам предложат не самый современный и эффективный метод лечения, придется терять время в очереди на операцию или столкнуться с бюрократией, собирая справки для оформления квоты на высокотехнологичную помощи или «пробиваясь» на прием к нужному специалисту.
Тем не менее, испытывать панический страх перед государственной медициной и начинать искать деньги на лечение за рубежом сразу же, как вы узнали диагноз, не стоит. Самое разумное — как можно быстрее обратиться к онкологам и параллельно самостоятельно изучить информацию обо всех возможных вариантах лечения конкретной патологии, какие могут предложить в различных клиниках нашей страны и за ее пределами.
А когда уже изобретут универсальное лекарство от рака?Эксперты говорят, что, судя по всему, такого не случится никогда. Согласно некоторым теориям, возникновение злокачественных опухолей — это один из естественных механизмов старения организма, поэтому пытаться вылечить их раз и навсегда равносильно попытке обрести бессмертие.
Трагично, когда онкологические заболевания развиваются у детей и людей среднего возраста, однако рак в финале жизненного пути, вероятно, ждет почти каждого, кто сумеет избежать других распространенных причин естественного изнашивания органов и систем. В наших интересах — постараться максимально отсрочить эту встречу, проявляя внимание к своему здоровью и здоровью своих близких.
Ольга Кашубина специально для интернет-газеты Newslab.ru
Как пройти обследование на выявление рака в Красноярском онкодиспансере
Новое оружие против рака: ядерные нанокапсулы — ScienceDaily
Химики из Университета Райса нашли способ поместить некоторые из самых мощных радиоактивных частиц природы в трубки из чистого углерода размером с ДНК — метод, который они надеются использовать для нацеливания на крошечные опухоли и даже одиночные лейкозные клетки.
«Не существует одобренных FDA методов лечения рака, в которых используется альфа-излучение», — сказал ведущий исследователь Лон Уилсон, профессор химии. «Утвержденные методы лечения, в которых используются бета-частицы, не подходят для лечения рака на уровне отдельной клетки, потому что для уничтожения одиночной клетки требуются тысячи бета-частиц.Напротив, раковые клетки могут быть уничтожены одним прямым попаданием альфа-частицы в ядро клетки ».
В ходе исследования Уилсон, аспирант Райс Кейт Хартман, онколог-радиолог из Вашингтонского университета Скотт Уилбур и научный сотрудник Дональд Хэмлин из Вашингтонского университета разработали и протестировали процесс загрузки атомов астата внутрь коротких участков углеродных нанотрубок. Поскольку астатин является самым редким природным элементом на Земле — по оценкам, в земной коре в любой момент времени находится менее чайной ложки, — исследование проводилось с использованием астата, созданного на циклотроне UW.
Астатин, как и радий и уран, испускает альфа-частицы в результате радиоактивного распада. Альфа-частицы, содержащие два протона и два нейтрона, являются наиболее массивными частицами, испускаемыми в виде излучения. Они примерно в 4000 раз массивнее электронов, испускаемых бета-распадом — типом излучения, наиболее часто используемым для лечения рака.
«Это что-то вроде разницы между пушечным снарядом и BB», — сказал Уилсон. «Дополнительная масса увеличивает количество повреждений, которые альфа-частицы могут нанести раковым клеткам.«
Скорость радиоактивных частиц также является важным фактором при использовании в медицине. Бета-частицы перемещаются очень быстро. Это, в сочетании с их небольшими размерами, придает им значительную проникающую способность. Например, при лечении рака пучки бета-частиц могут создаваться вне тела пациента и направляться на опухоли. Альфа-частицы движутся намного медленнее, и, поскольку они также массивны, у них очень небольшая проникающая способность. Их можно остановить с помощью такой хлипкой бумаги, как папиросная бумага.
Их можно остановить с помощью такой хлипкой бумаги, как папиросная бумага.
«Уникальное сочетание низкой проникающей способности и большой массы частиц делает альфа-частицы идеальными для борьбы с раком на уровне отдельных клеток», — сказал Уилсон. «Сложность в разработке способов их использования для лечения рака возникла в поиске способов доставки их быстро и непосредственно к месту рака».
В предыдущей работе Уилсон и его коллеги разработали методы присоединения антител к углеродным фуллеренам, таким как нанотрубки. Антитела — это белки, вырабатываемые лейкоцитами.Каждое антитело предназначено для распознавания и связывания только с определенным антигеном, и врачи определили множество специфичных для рака антител, которые можно использовать для уничтожения раковых клеток.
В ходе последующих исследований Уилсон надеется протестировать подход к нацеливанию на одноклеточный рак путем присоединения специфичных для рака антител к нанотрубкам, нагруженным астатом.
Одним из осложняющих факторов в любой терапии рака на основе астата будет короткий период полураспада, составляющий 7,5 часов. В случае радиоактивного распада термин период полураспада означает время, необходимое для того, чтобы любое количество вещества распалось на половину своей начальной массы.Из-за короткого периода полураспада астатина любое лечение должно проводиться своевременно, прежде чем частицы потеряют свою активность.
Результаты исследования доступны в Интернете и должны быть опубликованы в следующем номере журнала Small.
Исследование финансировалось Фондом Уэлча, Центром Райса по биологическим и экологическим нанотехнологиям, Космическим центром Джонсона НАСА, Научным центром здоровья Техасского университета в Хьюстоне и Национальным институтом рака, подразделением Национальных институтов здравоохранения.Углеродные нанотрубки были предоставлены компанией Carbon Nanotechnologies Inc.
.История Источник:
Материалы предоставлены Университетом Райса . Примечание. Содержимое можно редактировать по стилю и длине.
Примечание. Содержимое можно редактировать по стилю и длине.
индукции рака от продуктов ядерного распада
индукции рака от продуктов ядерного распадаДжош Фрэнсис
25 марта 2014 г.
Представлено как курсовая работа для Ph341, Стэнфордский университет, зима 2014 г.,
Введение
| Рис.1: Чрезмерный относительный риск (ERR) как функция доза облучения при раке толстой кишки. [9] ERR — запутанная шкала. что соответствует повышенному проценту вероятности развитие рака на протяжении всей жизни. 1 ERR составляет 10% увеличение, а 0,5 — увеличение на 5%. Горизонтальная шкала в серых тонах (Гр). (По Престону и др. [9]) |
Недавняя волна вспышек рака среди латинских и Президенты Южной Америки побудили некоторых обвинить США разработки способа превратить рак в оружие.»Канер-ружье» можно было бы использовать для нацеливаться на политических противников страны, при этом позволяя этой стране с разумной степенью отрицания, поскольку определение прямого причина рака в настоящее время находится за пределами нашей научной досягаемости. Кроме того, у значительной части населения все равно разовьется рак (около 40% в США по данным National Cancer Программа SEER института). Доверие к такому заговору теория была подтверждена убийством Александра Литвиненко 2007 года в Лондон из-за отравления полонием-210 и бесчисленных случаев острой радиации Отравление (ARP).Следующее короткое эссе призвано дать простой рамки для решения проблемы индукции рака с использованием продуктов ядерный распад: гамма-излучение, бета-частицы, альфа-частицы и нейтроны.
Здесь есть тонкое различие между излучением
отравление и рак, вызванный радиацией. Радиационное воздействие 1 грей
(поглощение 1 джоуля энергии на 1 кг вещества) соответствует
примерно на 5% увеличивает вероятность развития рака за 30 лет (рис.1), воздействия двух серых тонов достаточно, чтобы вызвать острую лучевую болезнь,
и 3,5 грей имеют 50% смертность в течение 60 дней после воздействия. [1,2]
Существует тонкая грань между повышением шансов на развитие
рак и убийство этого человека радиационным отравлением. Мы
обсуждая первое. Последнее относительно легко сделать, если у вас есть
доступ к ядерным отходам, и его относительно легко обнаружить с помощью современных
лабораторные методы.
Радиационное воздействие 1 грей
(поглощение 1 джоуля энергии на 1 кг вещества) соответствует
примерно на 5% увеличивает вероятность развития рака за 30 лет (рис.1), воздействия двух серых тонов достаточно, чтобы вызвать острую лучевую болезнь,
и 3,5 грей имеют 50% смертность в течение 60 дней после воздействия. [1,2]
Существует тонкая грань между повышением шансов на развитие
рак и убийство этого человека радиационным отравлением. Мы
обсуждая первое. Последнее относительно легко сделать, если у вас есть
доступ к ядерным отходам, и его относительно легко обнаружить с помощью современных
лабораторные методы.
Как рак убивает
Человеческое тело имеет множество механизмов, обеспечивающих его выживание.Некоторые из этих механизмов должны перестать работать, чтобы человек в конечном итоге заболеть раком. Ниже приводится список необходимых генетические мутации, необходимые для нормальных клеток, чтобы развиться в раковые клетки и в конечном итоге убивают своего человеческого хозяина. [3]
Поддержание пролиферативной передачи сигналов: Человек тело регулирует рост клеток. Клетки должны получить митогенный рост сигналы от окружающих тканей, чтобы делиться и размножаться. Следовательно, опухолевые клетки должны генерировать множество собственных сигналов роста.Предполагается, что сигнальные пути роста во всех опухолях человека пострадали от дерегулирования. Помимо сигналов роста, клетки также имеют сигналы против роста. Эти сигналы подавляют рост клеток, когда окружающие ткани определяют, что это уместно. Раковые клетки должны развивают генетическую нечувствительность к этим антипролиферативным сигналам.
Рис. 2: Если ДНК повреждена радиацией, ее нужно восстановить.
механизмы активируются.Если эти механизмы не работают, то
у поврежденной клетки есть три возможных судьбы: рак, апоптоз
(запускает гибель клеток) или старение (клетки перестают делиться). Источник: Гарольд Бреннер в
Викимедиа
Commons) Источник: Гарольд Бреннер в
Викимедиа
Commons) |
Сопротивление смерти клеток: Клетки предварительно запрограммированы распадаться и умереть по прошествии определенного времени или в развитие определенных отклонений. Клетка умирает, распадается и поглощается соседними клетками.Этот процесс называется апоптозом и опухолевые клетки обладают уникальной способностью противостоять ему.
Включение репликативного бессмертия: Несмотря на полное отделение роста раковых клеток от различных сигналы окружающей среды, которые пытаются регулировать этот рост, раковые клетки также должны преодолеть внутреннюю клеточную программу, которая помещает ограничения на размножение клеток. Клетки обладают конечным репликативным потенциалом — после определенного количества делений клетки перестают размножаться (так называемое старение).Небольшие ошибки возникают после каждого деления клетки в конечном итоге делает клетку неспособной к дальнейшему воспроизведению. Опухоль клетки обладают способностью исправлять эти генетические ошибки после каждого разделение.
Индуцирование ангиогенеза: Клеткам нужен кислород и питательные вещества, чтобы выжить. Чтобы получить это необходимое питание, клетки должен находиться в пределах 100 микрон от капиллярного кровеносного сосуда. Раковые клетки должен вызывать рост новых кровеносных сосудов (так называемый ангиогенез), чтобы поддерживать любой макроскопический рост.Нормальные клетки не обладают способностью индуцируют ангиогенез от своего имени.
Активация вторжения и метастазирования: Опухоль
массы должны порождать кластеры пионерных ячеек, чтобы покинуть свой текущий
локализации и вторжения в соседние клетки и ткани, чтобы сформировать новые колонии
раковые клетки. Этот процесс метастазирования — основная причина
смерть от рака.
Повреждение генов-супрессоров опухолей: Вышеуказанное характеристики раковых клеток приобретаются прямо или косвенно через генетическую мутацию; но в ячейке существует сложный массив ДНК-мониторинг и восстанавливающие ферменты, которые стремятся поддерживать целостность ДНК.Поскольку маловероятно, что все мутации необходим для рака, может произойти в течение жизни человека и любая мутация что действительно происходит, можно исправить, раковые клетки должны обладать способностью ингибировать эти гены-супрессоры опухолей, иначе они должны быть повреждены некоторыми другой процесс.
Итак, чтобы вызвать рак, вышеуказанные механизмы должны активно реализовываться через генетические мутации. Есть примерно два пути радиации от ядерного распада, чтобы вызвать эти генетические мутации.Во-первых, свободные радикалы, созданные ионизирующим излучением, могут взаимодействуют с ДНК и вызывают мутации. Излучение с достаточной энергией может освободить электрон, связанный с атомом или молекулой. Этот атом или молекула тогда будет иметь неспаренный валентный электрон, который может ковалентно связываться с соседней ДНК, чтобы ввести генетическую ошибку, которую можно передать на воспроизведении (рис. 2). Во-вторых, излучение с достаточно кинетической энергия может повредить физическую структуру ДНК и вызвать однонитевой Разрывы (SSB) или двойные разрывы (DSB).Когда ремонтные механизмы В попытке ДНК исправить это повреждение могут быть внесены мутации.
Мутация ДНК с продуктами ядерного распада
Гамма-лучи: Хотя клинические исследования
пришел к выводу, что электромагнитное излучение (ЭМИ) является одной из причин
рака, нет единого научного мнения о том, как это происходит. [4]
Здесь задействованы как неионизирующее ЭМИ, так и ионизирующее ЭМИ. Фотоны
с достаточной энергией, как гамма-лучи, может ионизировать электроны, чтобы произвести
свободные радикалы и даже проникают через кожу человека, вызывая SSB и DSB в
ДНК.
Бета-частицы: Бета-частица — это электрон и антинейтрино (или позитрон и нейтрино). Бета может обжечь кожу и проникают через кожу на глубину до 20 мм, в зависимости от их кинетической энергии. Этот проникновение может быть наиболее эффективным для ионизации ДНК или создания свободных радикалы, если бета-частицы производятся внутри тела.
Альфа-частицы: Альфа-частицы не могут проникают через кожу (или даже на лист бумаги), поэтому они опасны только в том случае, если альфа-излучатель попадает в организм через дыхательные пути.С альфа частицы состоят из двух протонов и двух нейтронов, при попадании в организм они представляют наибольшую опасность для биологических тканей из всех ядерных распадов изделия из-за их относительно большой массы и заряда. Когда альфа-частица поражает ДНК, ее положительный заряд может ионизировать составляющие ДНК или депонировать энергию в процессе, называемом линейной передачей энергии (LET) вызывает SSB или DSB ДНК. Одна альфа-частица может вызвать ДНК повреждение, которое приведет к канцерогенной мутации.Альфа-частицы имеют также были связаны с повреждением генов-супрессоров опухолей. [5,6] Поглощение излучателя альфа-частиц, вероятно, является наиболее эффективным. способ вызвать острое радиационное отравление; проглатывая всего несколько сотен микрограммы альфа-излучающего полония-210, вероятно, будут фатальными. [7]
Нейтроны: По сравнению с альфа-частицами, нейтроны могут вызвать эквивалентное повреждение ДНК примерно таким же образом, но более эффективны при проникновении в кожу.Нейтроны замедляются только упругие столкновения с более легкими атомами или молекулами. Более медленные нейтроны тогда легче захватывается ядром. Этот захват может сделать ядро радиоактивно, что усугубит проблему, испуская больше радиация. Свободный нейтрон (не связанный в ядре) выживет только в течение около 15 минут, пока он не распадется на протон, испуская бета частица.
Эти четыре способа вызвать рак также используются для лечить рак: лучевая терапия (рентгеновские и гамма-лучи), открытый источник терапия (альфа, бета и гамма), радиофармпрепараты (альфа, бета и гамма), а также терапия быстрыми нейтронами.Различие в том, что достаточное количество радиации не только вызовет мутации в ДНК, но также разрушить эту ДНК. Для лечения рака достаточно излучения направлено на опухоль, чтобы разрушить клетки и ДНК опухоли, пытаясь минимизировать повреждение соседних здоровых клеток. Причины рака могут также уничтожьте его.
Заключение
Итак, подвергая кого-то чуть менее двух серых оттенков радиации от ядерного распада должно быть достаточно, чтобы увеличить чей-то риск заболеть раком на 5-10 процентов, надеясь избежать острого Радиационное отравление (которое раскрыло бы попытку убийства).Даже один нейтрон, альфа-частица или гамма-луч достаточно, чтобы вызвать раковую мутацию в гене, которая однажды может перерасти в метастазирующий рак. Конечно, это небольшое увеличение процентная вероятность развития рака займет от 2 до 5 лет в течение лейкоз и не менее 10 лет для других солидных видов рака. [8] К счастью однако этот длительный инкубационный период и по своей природе стохастический природа рака делает любую попытку вызвать рак с помощью радиации непрактично.Политические враги Соединенных Штатов могут спать сегодня вечером, зная, что им нечего бояться рака пистолет.
© Джош Фрэнсис. Автор дает разрешение на копировать, распространять и демонстрировать эту работу в неизменном виде, с ссылка на автора, только в некоммерческих целях. Все остальные права, в том числе коммерческие, принадлежат автору.
Список литературы
[1] Риск для здоровья от воздействия низких уровней Ионизирующее излучение: BEIR VII Phase 2 (National Academies Press, 2006 г.).
[2] Л. Ф. Фахардо, Лучевая патология (Oxford U. Press, 2001), стр. 10.
[3] Д. Ханахан, Р. А. Вайнберг, «Признаки Рак, Cell 100 , 57 (2000).
[4] D. Belpomme et al. , «Множество и Разнообразие канцерогенов в окружающей среде, Environ. Res. 105 , 414 (2007).
[5] M. Hollstein et al. , «мутация гена p53 анализ опухолей пациентов, подвергшихся действию альфа-частиц », Канцерогенез 18 , 511 (1997).
[6] M. Andersson et al. , «Мутации в Ген супрессора опухолей p53 при раке печени человека, вызванном Альфа-частицы, Эпидемиология рака. Биомаркеры Пред. 4 , 756 (1995).
[7] Б. Р. Скотт, «Оценка риска для здоровья Воздействие полония-210 на человека при проглатывании, «доза-реакция» 5 , 94 (2007).
[8] Руководство по оценке воздействия радиации для военных операций: Промежуточный отчет (National Academies Press, 1997).
[9] D. L. Preston et al. , «Исследования Смертность выживших после атомной бомбы. Отчет 13: Солидный рак и Смертность от нераковых заболеваний: 1950–1997, Radiat. Res. 160 , 381 (2003).
Оценка активности нонсенс-опосредованного распада мРНК при раке легких | BMC Medical Genomics
Мы используем следующие три показателя для измерения активности NMD в биологическом образце: (1) уровень экспрессии мРНК целевых генов NMD, (2) использование (т.е.е., процент) индуцирующей NMD изоформы сплайсинга в генах-мишенях NMD, которые имеют как индуцирующие NMD изоформы, так и изоформы, не содержащие NMD, и (3) соотношение численности мРНК, происходящих от индуцирующего NMD аллеля, к изоформ, не содержащему NMD тот же ген. Мы называем эти три показателя как R . мРНК , R изоформа и R аллель соответственно.В принципе, если активность NMD в образце высока, эти показатели будут иметь небольшие значения, потому что формы, индуцирующие NMD, разрушаются более эффективно. Для расчета этих показателей мы собрали данные РНК-секвенирования из крупномасштабного исследования [9], в ходе которого были получены данные для 72 пациентов, при этом у каждого пациента были секвенированы образцы опухоли и прилегающих нормальных тканей (дополнительный файл 1: таблица S1).
Сначала опишем процедуру расчета метрики R мРНК , г.е., содержание мРНК генов-мишеней NMD. Первым шагом была идентификация генов-мишеней NMD. Для этого мы собрали гены-мишени NMD из четырех исследований [15,16,17,18]. В этих исследованиях измеряли изменения экспрессии генов после ингибирования NMD. Мы классифицируем все гены, экспрессия которых повышается при ингибировании NMD, как мишени для NMD. Обратите внимание, что цели с помощью этого подхода могут включать как прямые, так и непрямые мишени NMD, но наша цель состоит в том, чтобы идентифицировать гены, которые могут использоваться в качестве индикатора активности NMD, поэтому любые гены с повышенной экспрессией после ингибирования NMD являются информативными.В целом 951 ген классифицируется как мишень NMD по крайней мере в одном исследовании, а 50 генов поддерживаются по крайней мере в трех исследованиях (см. Раздел «Методы»). Для точности мы используем эти 50 генов в качестве набора целевых генов NMD (дополнительный файл 2). Чтобы исключить вариацию экспрессии генов в выборках из-за систематической ошибки, мы нормализуем экспрессию мишеней NMD, деля ее на среднее значение экспрессии 4074 нецелевых генов (дополнительный файл 2; также см. Методы). Тогда R мРНК рассчитывается для каждого гена с использованием следующего уравнения.(1):
$$ {R} _ {mRNA} = {mE} _ {NMD} / median \ _ {mE} _ {nonNMD} $$
(1)
где mE NMD представляет собой экспрессию мРНК целевого гена NMD, а медиана _ mE без NMD — это медианное значение всех 4074 нецелевых генов из одного и того же образца. Чтобы сделать вывод об активности NMD в опухоли по сравнению с нормальной тканью, R мРНК ( опухоль ) / R мРНК ( нормальный ) вычисляется, т.е.е., соотношение R мРНК между опухолью и соответствующей нормальной тканью. Как показано на рис. 1, соотношение R мРНК ( опухоль ) / R мРНК ( нормальный ) варьирует как среди генов, так и среди пациентов, а у некоторых пациентов значительно отклоняется от единицы (рис.1; Дополнительный файл 1: Таблица S2). Этот результат предполагает, что большинство образцов опухолей имеют активность NMD, сравнимую с их нормальными исходными уровнями, и что некоторые образцы опухолей испытали резкие изменения в активности NMD.
Рис. 1Распределение R мРНК ( опухоль ) / R мРНК ( нормальный ) среди пациентов с аденокарциномой легкого.Пациенты со значительно более низким или более высоким уровнем R мРНК в опухоли, чем в соседних нормальных тканях (FDR, или частота ложных обнаружений, скорректированный парный критерий суммы рангов Уилкоксона P значение <0,05), выделены голубым или красным цветом соответственно
Далее посчитали R изоформа , использование изоформ альтернативного сплайсинга (AS), индуцирующих NMD, в данном гене:
$$ {R} _ {isoform} = {sE} _ {NMD} / \ left ({sE} _ { NMD} + {sE} _ {nonNMD} \ right) $$
(2)
где sE NMD и sE без NMD представляют собой количества изоформ сплайсинга, индуцирующих NMD, и свободных от NMD, соответственно.По сравнению с метрической R мРНК , R изоформа считается более чувствительным по двум причинам: (1) он может обнаруживать изменения активности NMD, когда изменения влияют только на относительное количество NMD-индуцирующей изоформы сплайсинга, но не на общее количество мРНК гена; (2) R изоформа использует изобилие изоформ того же гена, не содержащих NMD, в качестве нормализующего фактора, что лучше, чем использование экспрессии других генов в качестве этого фактора (как в R мРНК ), потому что не исключено, что динамика экспрессии в разных образцах может варьироваться в зависимости от генов.Для расчета R изоформа , мы идентифицировали 776 событий AS из 734 генов. Пятьсот двадцать восемь и 248 случаев запускают NMD, когда альтернативный экзон включен и исключен, соответственно (подробности см. В разделе «Методы»). Из них 14 событий AS происходят во всех выборках (дополнительный файл 3). Для расчета R изоформа в каждой выборке, мы используем либо все информативные события AS, происходящие в выборке, либо только 14 общих событий AS.Аналогично вычислению R мРНК , используем соотношение R изоформа (опухоль) до R изоформа (нормальный), чтобы учесть базовые различия между пациентами. Как показано на рис. 2 и в дополнительном файле 1: таблица S3, при использовании всех информативных событий AS в каждой выборке соотношение R изоформа (опухоль) / R изоформа (норма) значительно отклоняется от единицы у десятков пациентов.Количество существенных отклонений намного больше, чем при использовании R . мРНК , подтверждая вывод о более высокой чувствительности по R изоформа . При использовании 14 общих событий AS мы в основном наблюдаем ту же закономерность (дополнительный файл 1: рисунок S1, Spearman’s Rho = 0,6127131, P = 1,063e-08). Хотя метрика R изоформа более чувствителен, чем R мРНК , отношения опухоли к нормальным образцам из двух показателей положительно коррелированы (дополнительный файл 1: рисунок S2A, Rho = 0.36, P = 0,001422). Связь сохраняется только при использовании 14 общих событий (Дополнительный файл 1: Рисунок S2B, Rho = 0,2581838, P = 0,02882).
Рис.2Распределение R изоформа ( опухоль ) / R изоформа ( нормальных ) среди больных.Пациенты со значительно более низким или более высоким уровнем R изоформа в опухоли, чем в соседних нормальных тканях (скорректированный парный критерий суммы рангов Вилкоксона с поправкой на FDR P , значение <0,05), выделены голубым или красным цветом соответственно
Наконец, рассчитываем R аллель следующим образом:
$$ {R} _ {allele} = {aE} _ {NMD} / {aE} _ {nonNMD}, $$
, где aE NMD и aE без NMD представляют собой количества мРНК, происходящих от индуцирующих NMD и свободных от NMD аллелей одного и того же гена, соответственно.В этот анализ включены все обнаруженные гетерозиготные нонсенс-мутации (дополнительный файл 4). И снова соотношение R аллель (опухоль) до R аллель (нормальный) рассчитывается для каждого пациента, чтобы сделать вывод об изменении активности NMD. Этот подход использовался во многих исследованиях для проверки эффективности НПРО [20,21,22]. Однако в нашем анализе мы не обнаружили существенной разницы между опухолевыми и нормальными образцами ни для одного пациента, вероятно, из-за ограниченного количества участков (рис.3; Дополнительный файл 1: Таблица S4). Тем не менее, положительная корреляция между медианными отношениями R аллель ( опухоль ) / R аллель ( нормальный ) и R мРНК ( опухоль ) / R мРНК ( нормальный ) у всех пациентов (дополнительный файл 1: рисунок S3A, Rho = 0.2134399, P = 0,07183). И аналогично, немного лучшая корреляция между ( опухоль ) / R аллель ( нормальный ) и R изоформа ( опухоль ) / R изоформа ( нормальный ) (Дополнительный файл 1: Рисунок S3B, Rho = 0.3099928, P = 0,00805). Эти результаты показывают, что метрика R аллель может фиксировать изменение активности NMD в опухолях, но для того, чтобы показатель был достаточно эффективным, необходимо больше участков.
Рис.3Распределение R аллель ( опухоль ) / R аллель ( нормальных ) среди больных.Ни у одного пациента R аллель показывает значительную разницу между опухолью и прилегающими нормальными тканями
Затем мы исследуем, как эти показатели коррелируют с экспрессией девяти эффекторов NMD, включая Upf1, Upf2, Upf3a, Upf3b, Smg1, Smg5, Smg6, Smg7 и Pnrc2 [23, 24]. Теоретически мы ожидаем отрицательной корреляции между показателями активности NMD и выражением этих факторов, потому что меньшее значение показателя означает более сильную активность NMD, обусловленную более высокой экспрессией эффекторов NMD.Мы обнаружили, что R мРНК отрицательно коррелирует с выражением smg1, smg7, upf2 и pnrc2, , хотя и не всегда статистически значимо (дополнительный файл 1: таблица S5). Удивительно, но R мРНК положительно коррелирует с выражением upf1 , upf3a и smg6 в некоторых случаях.Эти результаты предполагают, что эффекторы NMD могли вносить вклад в активность NMD противоречивым образом, причем некоторые эффекторы были более важны, чем другие, в влиянии на активность NMD. Однако неясно, почему некоторые эффекторы, такие как upf1, экспрессируются на более высоком уровне, когда активность NMD проявляется слабее. Мы также исследуем аналогичные корреляции, используя R . изоформа , и ни один из них не является значимым, и признаки корреляции не всегда соответствуют ожиданиям (Дополнительный файл 1: Таблица S5).Все вместе они предполагают, что изменение активности NMD может не соответствовать изменению экспрессии всех эффекторов NMD, и, таким образом, необходимо лучшее понимание эффекторов NMD в регуляторной сети, чтобы сделать вывод об активности NMD из экспрессии эффекторов.
Радиоизотопы в медицинской диагностике и лечении
Цели обучения
- Перечислите радиоизотопы, которые используются в медицинской диагностике и / или лечении.
Почему я так медленно двигаюсь?
Молекула, изображенная выше, — это тироксин, соединение, вырабатываемое щитовидной железой.Эта молекула регулирует то, как организм использует энергию. В состоянии, известном как гипотиреоз, щитовидная железа вырабатывает меньше тироксина, чем обычно. Человек с этим заболеванием все время чувствует себя уставшим и часто прибавляет в весе. Лечение добавками гормонов щитовидной железы решает эту проблему.
Радиоизотопы в медицинской диагностике и лечении
Радиоизотопы широко используются для диагностики заболеваний и в качестве эффективных средств лечения. Для диагностики изотоп вводится, а затем обнаруживается в организме с помощью какого-либо сканера.Продукт распада (часто гамма-излучение) можно определить и измерить интенсивность. Количество изотопа, поглощаемого организмом, может дать информацию о степени медицинской проблемы.
Изотоп йода (I-131) используется как для диагностики, так и для лечения рака щитовидной железы. Щитовидная железа обычно поглощает йод для производства йодсодержащих гормонов щитовидной железы. Сверхактивная щитовидная железа поглощает радиоактивный материал, который затем может разрушить избыток ткани щитовидной железы или любой рак щитовидной железы.Этот материал иногда используется для изображения раковых образований в других частях тела.
Рисунок 1. Радиоизотопное сканирование для обнаружения опухолей.
Технеций-99m, возможно, является наиболее широко используемым радиоизотопом в диагностике и лечении («m» означает метастабильный). Этот изотоп распадается до Tc-99 и имеет низкую интенсивность гамма-излучения, что делает радиационный ущерб весьма незначительным. Период полувыведения составляет около шести часов, поэтому он остается в организме в течение некоторого времени. Tc-99m можно использовать для исследования сердечных повреждений.Изотоп течет в кровотоке; если в сердце меньше кровотока, в сердечной мышце будет меньше изотопов. Аналогичную информацию можно получить для кровотока в головном мозге.
Изотопы могут быть очень полезны при сканировании для обнаружения раковых клеток. У этого пациента множественные опухоли, которые распространились (метастазировали) из основной опухоли. Радиоизотоп был присоединен к антителам , которые связываются со специфическими раковыми клетками. Очень темные пятна в подмышечных впадинах, шее и паху представляют собой области, где существуют опухолевые клетки.
Можно привести множество других примеров. В настоящее время для диагностики и лечения используется более 25 различных изотопов. Очень неполный список можно увидеть в Таблице ниже.
| Изотоп | Период полураспада | Заявка |
| Кр-51 | 28 дней | маркировка эритроцитов |
| Fe-59 | 446 дней | исследование метаболизма железа в селезенке |
| Xe-133 | 5 дней | исследование функции легких |
| Ho-166 | 26 часов | Лечение рака |
Сводка
- Описаны радиоизотопы, используемые в медицинской диагностике и лечении.
Практика
Ознакомьтесь с материалом по ссылке ниже и ответьте на следующие вопросы:
http://www.rsc.org/images/essay5_tcm18-17767.pdf
- Каким было первое применение радиоизотопов в медицине?
- Откуда берется Tc-99m?
- Как Tc99m позволяет нам изучать кровоток в сердце?
Обзор
- Как I-131 лечит рак щитовидной железы?
- Как Tc-99m показывает повреждение сердца?
- Какой изотоп вы бы использовали для изучения красных кровяных телец?
Глоссарий
- антитело: Белок, который присоединяется к определенной молекуле.
Нацеливание на нонсенс-опосредованный распад мРНК при колоректальном раке с микросателлитной нестабильностью
Ларреа, А.А., Лухан, С.А., Кункель, Т.А. SnapShot: восстановление несоответствия ДНК. Ячейка 141 , 730e1 (2010).
Артикул Google Scholar
Дюваль А. и Хамелин Р. Мутации в кодирующих повторяющихся последовательностях при раковых заболеваниях человека с дефицитом репарации несовпадений: к новой концепции генов-мишеней для нестабильности. Cancer Res. 62 , 2447–2454 (2002).
CAS PubMed Google Scholar
Хауз, Р. Дж., Притчард, К. К., Шендуре, Дж. И Салипанте, С. Дж. Классификация и характеристика микросателлитной нестабильности при 18 типах рака. Nat. Med. 22 , 1342–1350 (2016).
CAS Статья Google Scholar
Liu, W. et al. Мутации в AXIN2 вызывают колоректальный рак с дефектной репарацией несоответствия за счет активации передачи сигналов бета-катенин / TCF. Nat. Genet. 26 , 146–147 (2000).
CAS Статья Google Scholar
Duval, A. et al. Ген фактора транскрипции 4 человеческих Т-клеток: структура, обширная характеристика альтернативных сплайсингов и мутационный анализ в клеточных линиях колоректального рака. Cancer Res. 60 , 3872–3879 (2000).
CAS PubMed Google Scholar
Попп М. В. и Макват Л. Е. Принципы организации нонсенс-опосредованного распада мРНК у млекопитающих. Annu. Преподобный Жене. 47 , 139–165 (2013).
CAS Статья Google Scholar
Nagy, E. & Maquat, L.E. Правило для положения терминального кодона в интронсодержащих генах: когда бессмыслица влияет на количество РНК. Trends Biochem. Sci. 23 , 198–199 (1998).
CAS Статья Google Scholar
Байерс, П. Х. Убийство посланника: новое понимание нонсенс-опосредованного распада мРНК. J. Clin. Вкладывать деньги. 109 , 3–6 (2002).
CAS Статья Google Scholar
Lykke-Andersen, J., Shu, M. D. & Steitz, J. A.Сообщение положения экзон-экзонных соединений механизму наблюдения мРНК с помощью белка RNPS1. Наука 293 , 1836–1839 (2001).
CAS Статья Google Scholar
Yamashita, A. et al. SMG-8 и SMG-9, две новые субъединицы комплекса SMG-1, регулируют ремоделирование комплекса наблюдения мРНК во время нонсенс-опосредованного распада мРНК. Genes Dev. 23 , 1091–1105 (2009).
CAS Статья Google Scholar
Chakrabarti, S., Bonneau, F., Schussler, S., Eppinger, E. & Conti, E. Фосфозависимые и фосфонезависимые взаимодействия геликазы UPF1 с факторами NMD SMG5 – SMG7 и SMG6. Nucleic Acids Res. 42 , 9447–9460 (2014).
CAS Статья Google Scholar
Шенберг, Д.Р. и Макват, Л. Е. Регулирование цитоплазматического распада мРНК. Nat. Преподобный Жене. 13 , 246–259 (2012).
CAS Статья Google Scholar
Фришмейер, П. А. и Дитц, Х. С. Нонсенс-опосредованный распад мРНК при здоровье и болезни. Hum. Мол. Genet. 8 , 1893–1900 (1999).
CAS Статья Google Scholar
Килинг К. М. и Бедвелл Д. М. Подавление бессмысленных мутаций как терапевтический подход к лечению генетических заболеваний. Wiley Interdiscip. Rev. RNA 2 , 837–852 (2011).
CAS Статья Google Scholar
Usuki, F. et al. Ингибирование нонсенс-опосредованного распада мРНК спасает фенотип при болезни Ульриха. Ann. Neurol. 55 , 740–744 (2004).
CAS Статья Google Scholar
Usuki, F. et al. Специфическое ингибирование нонсенс-опосредованных компонентов распада мРНК, SMG-1 или Upf1, устраняет фенотип фибробластов болезни Ульриха. Мол. Ther. 14 , 351–360 (2006).
CAS Статья Google Scholar
Бхуванагири М., Шлиттер А. М., Хентце М. В. и Кулозик А. Е. NMD: биология РНК встречается с генетической медициной человека. Biochem. J. 430 , 365–377 (2010).
CAS Статья Google Scholar
Попп М. В. и Макват Л. Е. Нонсенс-опосредованный распад мРНК и рак. Curr. Opin. Genet. Dev. 48 , 44–50 (2018).
CAS Статья Google Scholar
Chan, W. K. et al. Регуляторный переключатель, опосредованный UPF3, который поддерживает наблюдение за РНК. Nat. Struct. Мол. Биол. 16 , 747–753 (2009).
CAS Статья Google Scholar
Эль-Бчири, Дж. И др. Дифференциальный бессмысленный распад мутантных мРНК при колоректальном раке с дефицитом репарации несовпадений. Hum. Мол. Genet. 14 , 2435–2442 (2005).
CAS Статья Google Scholar
El-Bchiri, J. et al. Нонсенс-опосредованный распад мРНК влияет на канцерогенез, управляемый MSI, и противоопухолевый иммунитет при колоректальном раке. PLoS ONE 3 , e2583 (2008 г.).
Артикул Google Scholar
Shum, E. Y. et al. Паралоги антагонистических генов Upf3a и Upf3b регулируют нонсенс-опосредованный распад РНК. Ячейка 165 , 382–395 (2016).
CAS Статья Google Scholar
Lee, J.H. et al. Мутация сдвига рамки считывания гена WISP3 и ее региональная гетерогенность при раке желудка и колоректального рака. Hum. Патол. 50 , 146–152 (2016).
CAS Статья Google Scholar
Болиг, Л., Фридрих, М. и Энгеланд, К. p53 активирует ген PANK1 / miRNA-107, что приводит к подавлению активности белков клеточного цикла CDK6 и p130. Nucleic Acids Res. 39 , 440–453 (2011).
Артикул Google Scholar
Лин Дж.Л., Лю, Ф. Х. и Ван, С. Взаимодействие Hsp70 с p49 / STRAP, белком, связывающим фактор ответа сыворотки. Biochem. Биофиз. Res. Commun. 389 , 607–611 (2009).
CAS Статья Google Scholar
Chang, YJ, Holtzman, MJ & Chen, CC Дифференциальная роль киназ семейства Janus (JAK) в индуцированной интерфероном гамма-эпителиальной экспрессии ICAM-1 в легком: включая белковые взаимодействия между JAK, фосфолипазой Cgamma, c- Src и STAT1. Мол. Pharmacol. 65 , 589–598 (2004).
CAS Статья Google Scholar
Krishnan, K., Pine, R. & Krolewski, J. J. Киназодефицитные формы Jak1 и Tyk2 подавляют передачу сигналов интерферона альфа доминирующим образом. Eur. J. Biochem. 247 , 298–305 (1997).
CAS Статья Google Scholar
Collura, A. et al. Пациенты с колоректальными опухолями с микросателлитной нестабильностью и большими делециями в HSP110 T17 имеют улучшенный ответ на химиотерапию на основе 5-фторурацила. Гастроэнтерология 146 , 401–411 (2014).
CAS Статья Google Scholar
Dorard, C. et al. Экспрессия мутанта HSP110 повышает чувствительность клеток колоректального рака к химиотерапии и улучшает прогноз заболевания. Nat.Med. 17 , 1283–1289 (2011).
CAS Статья Google Scholar
Gonzalez-Hilarion, S. et al. Спасение бессмысленных мутаций амлексаноксом в клетках человека. Orphanet J. Rare Dis. 7 , 58 (2012).
Артикул Google Scholar
Durand, S. et al. Ингибирование нонсенс-опосредованного распада мРНК (NMD) новой химической молекулой показывает динамику факторов NMD в P-телец. J. Cell Biol. 178 , 1145–1160 (2007).
CAS Статья Google Scholar
Ионов, Ю., Новак, Н., Перучо, М., Марковиц, С. и Коуэлл, Дж. К. Манипуляция бессмысленным распадом выявляет генные мутации в клетках рака толстой кишки с микросателлитной нестабильностью. Онкоген 23 , 639–645 (2004).
CAS Статья Google Scholar
Ouyang, Z., Zheng, G., Tomchick, D. R., Luo, X. & Yu, H. Структурные основы и требования IP6 для Pds5-зависимой динамики когезина. Мол. Ячейка 62 , 248–259 (2016).
CAS Статья Google Scholar
Berthenet, K. et al. HSP110 способствует росту колоректального рака за счет активации STAT3. Онкоген 36 , 2328–2336 (2016).
Артикул Google Scholar
Yokoyama, T. et al. DA-Raf1, компетентный внутренний доминантно-негативный антагонист пути Ras-ERK, необходим для миогенной дифференцировки. J. Cell Biol. 177 , 781–793 (2007).
CAS Статья Google Scholar
Carter, M. S. et al. Механизм регуляции, который обнаруживает преждевременные бессмысленные кодоны в транскриптах Т-клеточных рецепторов in vivo, отменяется ингибиторами синтеза белка in vitro. J. Biol. Chem. 270 , 28995–29003 (1995).
CAS Статья Google Scholar
Wang, D. et al. Ингибирование нонсенс-опосредованного распада РНК микросредой опухоли способствует онкогенезу. Мол. Клетка. Биол. 31 , 3670–3680 (2011).
CAS Статья Google Scholar
Ноэнси, Э. Н. и Дитц, Х.C. Стратегия идентификации гена болезни посредством нонсенс-опосредованного ингибирования распада мРНК. Nat. Biotechnol. 19 , 434–439 (2001).
CAS Статья Google Scholar
Dang, Y. et al. Ингибирование нонсенс-опосредованного распада мРНК природным продуктом патеамином А через фактор инициации эукариот 4AIII. J. Biol. Chem. 284 , 23613–23621 (2009).
CAS Статья Google Scholar
Ямашита А., Охниши Т., Кашима И., Тая Ю. и Оно С. Человеческий SMG-1, новая протеинкиназа, связанная с фосфатидилинозитол-3-киназой, ассоциируется с компонентами комплекса наблюдения за мРНК и участвует в регуляции нонсенс-опосредованного распада мРНК. Genes Dev. 15 , 2215–2228 (2001).
CAS Статья Google Scholar
Баллал, В. В. Дж. Оральная медицина: Амлексанокс. руб.Вмятина. J. 217 , 208 (2014).
Артикул Google Scholar
Belenguer-Guallar, I., Jimenez-Soriano, Y. & Claramunt-Lozano, A. Лечение рецидивирующего афтозного стоматита. Обзор литературы. J. Clin. Exp. Вмятина. 6 , e168 – e174 (2014).
Артикул Google Scholar
Reilly, S. M. et al. Ингибитор протеинкиназ TBK1 и IKK-варепсилон улучшает метаболические дисфункции, связанные с ожирением, у мышей. Nat. Med. 19 , 313–321 (2013).
CAS Статья Google Scholar
Buhard, O. et al. Мультипопуляционный анализ полиморфизмов в пяти мононуклеотидных повторах, используемых для определения статуса микросателлитной нестабильности опухолей человека. J. Clin. Онкол. 24 , 241–251 (2006).
CAS Статья Google Scholar
Dorard, C. et al. Экспрессия мутанта HSP110 повышает чувствительность клеток колоректального рака к химиотерапии и улучшает прогноз заболевания. Nat. Med. 17 , 1283–1289 (2011).
CAS Статья Google Scholar
Marisa, L. et al. Классификация экспрессии генов рака толстой кишки на молекулярные подтипы: характеристика, валидация и прогностическая ценность. PLoS Med. 10 , e1001453 (2013).
CAS Статья Google Scholar
Ингибирование нонсенс-опосредованного распада восстанавливает функциональные изоформы p53β / γ в раковых опухолях, амплифицированных MDM2 опосредуют деградацию p53 дикого типа (WT) (p53α). Здесь мы показываем, что две альтернативно сплайсированные, функциональные, укороченные изоформы p53 (p53β и p53γ, содержащие экзоны 1-9 гена p53) могут быть значительно усилены фармакологическим или генетическим ингибированием нонсенс-опосредованного распада (NMD), регулятора. аберрантной стабильности мРНК.Эти изоформы лишены связывающего домена MDM2 и, следовательно, имеют пониженную чувствительность к деградации, опосредованной MDM2. В клетках со сверхэкспрессией MDM2, несущих ген
TP53 дикого типа, блокада NMD увеличивала экспрессию p53β / γ и активацию пути p53, повышала радиочувствительность и подавляла рост опухоли. Аналогичная картина наблюдалась в раковых клетках ВПЧ + и в раковых клетках с мутациями р53 ниже экзона 9. Эти результаты определяют новую терапевтическую стратегию восстановления функции р53 в опухолях, в которых р53 становится дефицитным из-за сверхэкспрессии MDM2, инфекции ВПЧ или некоторых других заболеваний. мутации р53.ВВЕДЕНИЕ
Потеря функции p53, наиболее распространенное изменение при раке, происходит через несколько механизмов, включая мутации гена TP53 или деградацию белков p53 дикого типа, опосредованную MDM2 и HPV-E6 (Vousden and Lu 2002, Levine 2019). Поэтому разработка терапевтических подходов для восстановления функции подавления опухоли p53 является критически важной и неудовлетворенной потребностью. Подходы, которые в настоящее время исследуются для опухолей WT TP53, включают ингибиторы MDM2 и генную терапию (Merkel, Taylor et al.2017), хотя ни один из них еще не прошел клиническую проверку. TP53 кодирует двенадцать различных изоформ (Bourdon, Fernandes et al. 2005), среди которых p53β и p53γ сохраняют ключевые функции p53 дикого типа (Bourdon, Fernandes et al. 2005, Marcel, Fernandes et al. 2014). В отличие от полноразмерного p53α, эти изоформы лишены С-концевой отрицательной регуляторной области, содержащей сигналы деградации белка (убиквитинированные лизины в положениях 370, 372, 373, 381, 382 и 386 (Rodriguez, Desterro et al.2000, Anczukow, Ware et al. .2008, Поюровский, Кац и др. 2010, Лаптенко, Тонг и др. 2016)) и, следовательно, они менее восприимчивы к MDM2-опосредованной деградации (Camus, Menendez et al. 2012). Однако, поскольку эти изоформы образуются путем альтернативного сплайсинга интрона-9, приводящего к кодонам преждевременной терминации (PTC) в экзоне 9β или экзоне 9γ, они, вероятно, будут разлагаться нонсенс-опосредованным распадом (NMD), путем наблюдения за РНК, который разрушает транскрипты с помощью PTC, возникающих в результате нонсенс-мутаций, ошибок транскрипции / сплайсинга, альтернативного сплайсинга и перестройки генов (Lewis, Green et al.2003 г., Чанг, Имам и др. 2007, Hwang and Maquat 2011). В соответствии с этим было показано, что изоформа p53β чувствительна к NMD (Anczukow, Ware et al. 2008, Cowen and Tang 2017). Интересно, что хотя p53γ имеет сходные с p53β запускающие функции NMD, его чувствительность к NMD не была показана.
В этом отчете мы исследовали, можно ли манипулировать содержанием эндогенных изоформ p53 путем изменения процессов, вовлеченных в деградацию мРНК в опухолевых клетках с избыточной экспрессией MDM2 и HPV, для восстановления индуцированного p53 пути гибели клеток, отмененного сверхэкспрессией MDM2 или ВПЧ-E6.Мы предположили, что ингибирование NMD может увеличивать экспрессию изоформ p53β / γ, способствующих пути гибели клеток, индуцированному p53, и что эту стратегию можно использовать для преодоления отмены пути гибели клеток, индуцированного p53 сверхэкспрессией MDM2, инфекцией HPV или NMD- индуцируя мутации p53 ниже экзона 9, изменения, которые вместе составляют примерно 8% опухолей с дефицитом p53 (The Cancer Genome Atlas (TCGA), (Arbyn, de Sanjose et al. 2012, Campbell, Alexandrov et al. 2016, Zehir, Benayed) и другие.2017 г., Siegel, Miller et al. 2019)) (таблицы EV1, EV3 и EV4).
РЕЗУЛЬТАТЫ
Ингибирование NMD стабилизирует изоформы p53β / γ и активирует путь p53 в опухолевых клетках со сверхэкспрессией MDM2
MDM2 амплифицируется примерно в 3,7% всех видов рака, 4% рака легких и 8% мультиформной глиобластомы (GBM) , ингибируя активность подавления опухоли p53 (Таблица EV1). Изоформы p53 модулируют транскрипционную активность p53 (Bourdon, Fernandes et al. 2005). Экспрессия изоформ p53 регулируется альтернативным сплайсингом, процессом, часто регулируемым NMD.Чтобы исследовать, стабилизирует ли ингибирование NMD экспрессию мРНК изоформ p53β / γ и генерирует ли белки p53β / γ, лишенные негативной регуляторной области (рис. 1A, B), мы использовали немелкоклеточный рак легкого (NSCLC) (h560, h2944 и A549). и линии клеток GBM (GSC289 и GSC231), несущие WT TP53 . Эндогенный MDM2 сверхэкспрессируется в h2944 и A549 относительно h560 и в GSC231 относительно GSC289 (рис. EV 1A, B). Мы обрабатывали клетки ингибитором NMD, IACS14140 (соединение 11j (Gopalsamy, Bennett et al.2012), далее именуемый NMDi), который избирательно ингибирует фосфорилирование UPF1 с помощью SMG1, что является критическим шагом для NMD (Chang, Imam et al.2007, Gopalsamy, Bennett et al.2012, Kim and Maquat 2019). Обработка NMDi (1 мкМ) и последующий анализ экспрессии мРНК с использованием праймеров, специфичных для изоформ (таблица EV2), показали значительное увеличение вариантов мРНК p53, содержащих экзон 9β, во всех клеточных линиях, в то время как варианты мРНК p53, содержащие экзон 9γ, в большинстве своем были активированы (рис. 1C). , D). Более того, обработка NMDi индуцировала усеченный белок p53 приблизительно 47-48 кДа, что соответствует предсказанному размеру p53β / γ, в дополнение к WT p53 (фиг. 1E).Анализ распада мРНК показал, что ингибирование NMD продлевает распад как p53β, так и p53γ, но не транскрипта p53α, дополнительно подтверждая чувствительность этих изоформ к NMD (рис. EV2).
Рис. 1. Ингибирование NMD индуцирует экспрессию p53β / γ в сверхэкспрессирующих MDM2 раковых клетках, несущих WT TP53 .(A) Схема, показывающая функциональные домены (черные линии) в гене TP53 ; аа представляет собой аминокислоты, охватывающие каждый домен.
(B) Схематическое изображение изоформ p53α и β / γ, генерируемых альтернативным сплайсингом интрона-9.С-концевой участок связывания MDM2 показан черным. Знаки остановки в экзонах i9 указывают на PTC, полученные в результате альтернативного сплайсинга. Аминокислоты, показанные на С-конце p53β и p53γ, происходят из интрона 9.
(C и D) Складчатое изменение (FC) в экспрессии мРНК p53β (C) и p53γ (D) после обработки NMDi в показанном Сотовые линии. Клетки обрабатывали либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов. Показанный анализ RT-qPCR (n = 2 технических повтора) представляет 3 независимых эксперимента.Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** ≤ 0,01, *** <0,001.
(E) Вестерн-блоты, показывающие индукцию усеченного p53 при ингибировании NMD в показанных клеточных линиях. Клетки обрабатывали либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов. GAPDH или винкулин использовали в качестве контроля загрузки. Показан один эксперимент, представляющий три.
(F) Вестерн-блоты, демонстрирующие эффективность нокдауна UPF1 в клеточных линиях A549 и h560, обработанных либо sicontrol, либо siUPF1. Показанные данные являются репрезентативными для двух экспериментов.
Экспрессия мРНК(G и H) FC p53β (G) и p53γ (H) соответственно в A549 и h560, обработанных указанными миРНК. Показанный анализ RT-qPCR (n = 2 технических повтора) представляет собой результаты двух независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01.
(I) Вестерн-блоттинг, показывающий индукцию усеченного белка p53β / γ в клеточных линиях A549 и h560, обработанных либо sicontrol, либо siUPF1. Показанные данные являются репрезентативными для двух экспериментов.
Чтобы получить дополнительные доказательства восприимчивости к NMD p53β и p53γ, мы истощили UPF1, ключевой фактор NMD (Chang, Imam et al.2007, Kim and Maquat 2019) в клетках A549 и h560 и проанализировали экспрессию экзона 9β и экзона 9γ, содержащего вариант мРНК. Истощение UPF1 значительно увеличивало экспрессию этих изоформ (рис. 1F-I). Чтобы исследовать влияние ингибирования NMD на путь p53, мы оценили уровни мРНК транскрипционных мишеней p53 GADD45A, p21 и PUMA. Мы наблюдали значительное увеличение уровней мРНК GADD45A и PUMA после обработки NMDi во всех пяти клеточных линиях, в то время как мРНК p21 была незначительно индуцирована в большинстве из них, предполагая, что ингибирование NMD будет активировать одни индуцируемые p53 промоторы, но не другие (рис. 2A). -C).Уровень экспрессии белка Puma сильно индуцируется в A549 и GSC289, тогда как белок p21 индуцируется только в A549, но не в клетках GSC289 (рис. 2D). Чтобы проверить, увеличивает ли ингибирование NMD транскрипционную активность p53 на промоторе PUMA, мы трансфицировали репортерную конструкцию гена люциферазы, управляемую промотором PUMA, содержащим сайты связывания p53 (Yu, Zhang et al. 2001), и оценили активность люциферазы с ингибированием или без него. NMD в клетках A549. Наши результаты продемонстрировали значительное увеличение люциферазной активности клеток, ингибированных NMD, что указывает на то, что ингибирование NMD увеличивает транскрипционную активность p53 на промоторе PUMA (рис. 2E).Клетки, истощенные UPF1, показали повышенную экспрессию мРНК GADD45A и p21 и повышенную экспрессию белков Puma и p21 (рис. 2F-H). Взятые вместе, эти результаты предполагают, что ингибирование NMD активирует альтернативно сплайсированные изоформы p53, включая p53β и p53γ, что может изменить транскрипционную активность p53 в субнаборе p53-индуцибельных генов в сверхэкспрессирующих MDM2 раковых клетках, несущих WT TP53 .
Рис. 2. Ингибирование NMD активирует путь p53 в сверхэкспрессирующих MDM2 раковых клетках, несущих ген WT TP53 .(A, B и C) FC в экспрессии мРНК GADD45A (A), p21 (B) и PUMA (C) после обработки NMDi в показанных клеточных линиях. Обработку NMDi проводили, как описано на фиг. 1. Показанный анализ RT-qPCR (n = 2 технических повтора) представляет 3 независимых эксперимента. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
(D) Вестерн-блоттинг, показывающий активацию пути p53 в обработанных NMDi A549 и GSC289. Показанные данные являются репрезентативными для трех экспериментов.
(E) Ингибирование NMD увеличивает транскрипционную активность p53.Клетки A549 трансфицировали репортерной конструкцией люциферазы 4XBS2-WT и обрабатывали 1,5 мкМ NMDi в течение 6 часов. Анализ люциферазы выполняли, как описано в разделе «Методы». Представленные данные представляют собой среднее значение ± стандартное отклонение. трех независимых экспериментов по трансфекции. Значения p, двусторонний t-критерий, * ≤0,05.
Экспрессия мРНК(F и G) FC транскрипционной мишени p53 GADD45A (F) и p21 (G) в A549 и h560, обработанных указанными миРНК. Показанный анализ RT-qPCR (n = 2 технических повтора) представляет собой результаты двух независимых экспериментов.Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01.
(H) Вестерн-анализ, показывающий повышенную экспрессию p21 и puma в клетках A549 и h560, обработанных указанными миРНК. Показанные данные представляют два независимых эксперимента.
Относительный вклад p53γ выше, чем вклад p53β в индуцированную ингибированием NMD реактивацию пути p53
Чтобы проверить, зависит ли эффект ингибирования NMD на экспрессию гена p21, PUMA и GADD45A от p53 и его изоформ, мы сравнили экспрессию p21, PUMA и GADD45A в ответ на ингибирование NMD в клетках A549, лишенных всех белков p53 или специфической изоформы p53 посредством RNAi-опосредованного нокдауна с использованием проверенных siRNA, специфичных для изоформы p53.Мы наблюдали, что гены p21, GADD45A и PUMA индуцировались по-разному в зависимости от коэкспрессируемых изоформ p53, что указывает на то, что наблюдаемая активация пути p53, обеспечиваемая ингибированием NMD, зависит от p53 (рис. 3 A-G).
Рис. 3. Активация пути p53, обусловленная ингибированием NMD, зависит от p53, и p53γ способствует этому.(A) Экспрессия мРНК p53β и p53γ FC при ингибировании NMD в клетках A549, обработанных указанными siRNA. Клетки, обработанные показанными миРНК, обрабатывали либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов.Показанные RT-qPCR (n = 2 технических повтора) являются представителями 3 независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01
(B) Вестерн-анализ, показывающий, что индуцированные NMDi усеченные белки p53 являются изоформами p53β и p53γ. Обработку миРНК и NMDi проводили, как в (А). Показанный западный анализ является представителями 3 независимых экспериментов.
Экспрессия мРНК(C, D и E) FC транскрипционных мишеней p53 p21 (C), GADD45A (D) и PUMA (E при ингибировании NMD в клетках A549, обработанных указанными миРНК.Обработку миРНК и NMDi проводили, как в (А). Показанные RT-qPCR (n = 2 технических повтора) являются представителями 3 независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001, **** <0,0001.
(Вестерн-анализ F и G, показывающий экспрессию p21 (F) и PUMA (G) при ингибировании NMD в клетках A549, обработанных показанными миРНК. Обработку миРНК и NMDi проводили, как в (A). Нижние панели в F и G представлены количественное определение (2 технических повтора) вестерн-блоттинга, нормализованное по GAPDH или винкулину.Показанный западный анализ является представителями 3 независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
Нокдаун интрона-9 вызывал значительное снижение мРНК p53β и p53γ ((рис. 3A) и усеченного белка p53 (рис. 3B), подтверждая необходимость интрона-9 для индуцированной NMDi активации p53β и p53γ. SiRNAs, специфичных для p53β и p53γ также снижает индуцированную NMDi экспрессию этих изоформ, подтверждая их идентичность (рис. 3A, B).Нацеливание siRNA на p53β снижает экспрессию p53γ и , наоборот, , что позволяет предположить, что их экспрессия может быть созависимой (рис. 3A). Интересно, что среди двух изоформ нокдаун p53γ показал наибольшее снижение экспрессии транскрипционных мишеней p53 (рис. 3C-E). Вестерн-анализ подтвердил данные экспрессии мРНК (рис. 3F, G), предоставив дополнительные доказательства того, что изоформы p53β / γ способствуют активации пути p53 и что относительный вклад p53γ, по-видимому, больше, чем вклад p53β в эти опухолевые клетки.
Ингибирование NMD стабилизирует изоформы p53β / γ и повторно активирует путь p53 в HPV-положительных раковых клетках
По оценкам, 1,8% всех случаев рака вызваны инфекцией HPV16 / 18 (таблица EV3) (Arbyn, de Sanjose et al. 2012 , Siegel, Miller et al.2019). Связанные с ВПЧ злокачественные опухоли включают рак шейки матки, головы и шеи, вульвы, влагалища, полового члена и анального канала (таблица EV3). Основной причиной патогенеза рака, вызванного инфекцией ВПЧ, является дефицит p53, возникающий из-за его деградации, опосредованной онковирусным белком E6, даже несмотря на то, что p53 преимущественно WT (Scheffner, Werness et al.1990 г., Balz, Scheckenbach et al. 2003 г., Страти и Ламберт 2008 г., Сано и Оридейт 2016 г., Фараджи, Заиди и др. 2017). Аминокислотные остатки 94-292 в p53 составляют область связывания ядра для E6-опосредованной деградации (Li and Coffino 1996, Martinez-Zapien, Ruiz et al., 2016), и хотя изоформы p53β / γ сохраняют эту область, отсутствие C- конец может изменять третичную структуру комплекса E6 / E6AP / p53β / γ, препятствуя их деградации. Учитывая наши данные о том, что ингибирование NMD индуцирует p53β и p53γ и способствует повторной активации пути p53 в клетках со сверхэкспрессией MDM2, мы исследовали, вызывает ли нацеливание на NMD аналогичный ответ в клетках HPV + , несущих p53 WT, и, следовательно, служит ли потенциальным терапевтический подход к этим опухолям.Мы использовали шесть линий клеток плоскоклеточного рака головы и шеи HPV + (HNSCC), две из которых (HMS001 и UPCISCC090) также показали повышенную экспрессию MDM2 (рис. EV1C). NMDi значительно увеличивал уровни мРНК как β-, так и γ-вариантов мРНК и индуцировал экспрессию соответствующих белков p53β и p53γ (рис. 4A-C). РНКи-опосредованный нокдаун в HMS001 дополнительно подтвердил идентичность p53β и p53γ (фиг. EV3A, B). NMDi значительно увеличивал экспрессию транскрипционных мишеней p53 в этих клетках (рис. 4D-F).Вестерн-блоттинг показал повышенную экспрессию белков p21 и puma в клетках, ингибированных NMD (рис. 4G, H). Оценка связывания р53 с промотором PUMA показала значительное увеличение активности связывания р53 при ингибировании NMD (фиг. 4I). Нокдаун, специфичный для изоформы в HMS001, показал, что p53γ способствует повышенной экспрессии p21 и PUMA при ингибировании NMD (FigEV3C-D). Эти результаты показывают, что ингибирование NMD эффективно реактивирует путь p53 в HPV + HNSCC независимо от статуса MDM2 и что эта реактивация зависит, по меньшей мере, частично от изоформы p53γ.
Рис. 4. Ингибирование NMD индуцирует экспрессию p53β / γ и активирует путь p53 в раковых клетках HPV + HNSCC. Показана экспрессия мРНК(A и B) FC p53β (A) и p53γ (B) в клеточных линиях HPV + HNSCC. Клетки обрабатывали либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов. Показанный анализ RT-qPCR (n = 2 технических повтора) является представителями 3 независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001, **** <0,0001.
(C) Вестерн-анализ, показывающий индукцию усеченного p53 в показанных клеточных линиях HPV + HNSCC, обработанных либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов.Показанный западный анализ является представителями 3 независимых экспериментов.
Экспрессия мРНК(D, E и F) FC GADD45A (D), p21 (E) и PUMA (F) в показанных клеточных линиях HPV + HNSCC, обработанных либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов . Показанный анализ RT-qPCR (n = 2 технических повтора) является представителями 3 независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
(G) Вестерн-анализ, показывающий активацию пути p53 в показанных линиях клеток HPV¾NSCC, обработанных либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов.SE, короткая выдержка, LE, длинная выдержка.
(H) Количественная оценка (2 технических повтора) вестерн-блоттинга, показанных на (G). GAPDH или винкулин использовали в качестве контроля загрузки. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
(I) Ингибирование NMD увеличивает транскрипционную активность р53. Клетки UMSCC47 трансфицировали репортерной конструкцией люциферазы 4XBS2-WT и обрабатывали 1 мкМ NMDi в течение 16 часов. Анализ люциферазы выполняли, как описано в разделе «Методы».Представленные данные представляют собой среднее значение ± стандартное отклонение. трех независимых экспериментов по трансфекции. Значения p, двусторонний t-критерий, * ≤0,05.
Ингибирование NMD восстанавливает путь p53 и запускает экспрессию p53β / γ в мутантных раковых клетках p53
Соматические мутации в TP53 обнаруживаются примерно в 45 процентах всех видов рака, из них 34 процента являются усекающими мутациями (Таблица EV4), которые приводят к дефициту p53. Около 4,8% усекающих мутаций расположены либо на конце экзона 9 (кодон 331), либо ниже него (таблица EV 4).Если транскрипты p53, несущие PTC-генерирующие мутации на С-конце, защищены от деградации с помощью NMD, они могут продуцировать почти полноразмерный белок и восстанавливать функцию p53 (рис. EV4A, B). Чтобы проверить это, мы использовали клетки h3228 (NSCLC), TCCSUP (рак мочевого пузыря) и UACC-893 (рак груди), несущие PTC в экзонах p53 9 (h3228) и 10 (TCCSUP и UACC-893) соответственно (рис. 5A). NMDi увеличивал экспрессию мРНК и белка мутантного p53 (рис. 5B, C), что согласуется с более ранними исследованиями, в которых сообщалось о спасении транскриптов p53, несущих нонсенс-мутации, посредством ингибирования NMD (Floquet, Deforges et al.2011 г., Чжан, Хелдин и др. 2017). Кроме того, NMDi увеличивал экспрессию транскриптов p53β / γ (рис. 5D, E) и значительно увеличивал уровни мРНК и белка транскрипционных мишеней p53 (рис. 5F-I). Эти результаты показывают, что для мутаций TP53, приводящих к образованию PTC в С-концевых экзонах, ингибирование NMD может помочь восстановить функцию p53 с помощью двух различных механизмов: предотвращение деградации мутантного транскрипта и усиление экспрессии функциональных изоформ p53β / γ, которые усечены в обратном направлении. мутации, индуцирующей PTC.Более того, в случае рака, несущего миссенс-мутации ниже экзона 9 p53, что приводит к потере функции (LOF) или усилению функции (GOF) (кодон 331; Таблица EV4), ингибирование NMD может восстанавливать функцию p53 путем активации изоформ p53β / γ. у которых отсутствует канонический С-конец и, следовательно, мутации (рис. EV4C, D).
Рис. 5. Ингибирование NMD восстанавливает путь p53 и запускает экспрессию p53β / γ в мутантных раковых клетках p53.(A) Схема, показывающая расположение PTC в мутантных клеточных линиях p53.
(B) Экспрессия мРНК FC общего р53 в мутантных клетках р53, обработанных либо ДМСО, либо 1 мкМ NMDi в течение 16 часов. Показанные данные (n = 2 технических повтора) являются репрезентативными для 3 независимых экспериментов. Среднее ± стандартное отклонение, значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
(C) Вестерн-блоты, показывающие повышенную экспрессию усеченного p53 после обработки NMDi в мутантных клетках p53. Клетки обрабатывали, как в (А).
Экспрессия мРНК(D и E) FC изоформ p53β (D) и p53γ (E) в мутантных клетках p53, обработанных NMDi.Клетки обрабатывали, как в (А). Показанные данные (n = 2 технических повтора) являются репрезентативными для 3 независимых экспериментов. Среднее ± стандартное отклонение, значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
Экспрессия мРНК(F, G и H) FC транскрипционных мишеней p53 GADD45A (F), p21 (G) и PUMA (h). Клетки обрабатывали, как в (А). Показанные данные (n = 2 технических повтора) являются репрезентативными для 3 независимых экспериментов. Среднее ± стандартное отклонение, значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0.001.
(I) Вестерн-блоттинг, показывающий повышенную экспрессию белка p21 и PUMA при ингибировании NMD. Клетки обрабатывали, как в (А). GAPDH или винкулин использовали в качестве контроля загрузки для вестерн-блоттинга.
Ингибирование NMD вызывает апоптоз, снижает жизнеспособность опухолевых клеток и увеличивает радиочувствительность.
Активацияp53 придает радиочувствительность и химиочувствительность раковых клетках (Fei and El-Deiry 2003, Lu and El-Deiry 2009). Наше открытие, что ингибирование NMD повторно активировало путь p53, побудило нас оценить, чувствительны ли линии клеток NSCLC, HPV + HNSCC и GBM к NMDi и увеличивает ли NMDi чувствительность к излучению.Наши результаты показали, что линии клеток NSCLC, HPV + HNSCC и GBM чувствительны к NMDi (рис. EV5A). Более того, большинство клеточных линий HPV + HNSCC также показали более высокую чувствительность к NMDi по сравнению с нутлином, широко используемым низкомолекулярным специфическим ингибитором MDM2 (Merkel, Taylor et al., 2017), и химиотерапевтическими агентами, цисплатином, этопозидом и пеметрекседом. (Рис. EV5B).
Поскольку Puma и p21, участвующие в апоптозе и остановке клеточного цикла, соответственно, были активированы ингибированием NMD, мы также выполнили анализ апоптоза и анализ клеточного цикла.Анализ клеток, обработанных NMDi, на апоптоз путем окрашивания аннексином V FITC / 7AAD показал значительное увеличение популяции как ранних, так и поздних апоптозных клеток по сравнению с их соответствующими контролями (фиг. 6A-E). Анализ клеточного цикла показал увеличение G0 / G1 и уменьшение G2 / M популяций в клетках, обработанных NMDi, что указывает на то, что ингибирование NMD нарушает развитие клеточного цикла (рис. EV5C). Затем мы проверили влияние ингибирования NMD на способность к образованию колоний. Результаты показали, что обработка NMDi значительно снижает колониеобразующую способность клеток NSCLC и HPV + HNSCC (фиг. 7A).Истощение UPF1 показало аналогичные результаты (рис. 7B), что еще раз подтверждает вывод. Поскольку p53 также участвует в увеличении ответа на ионизирующее излучение (IR) (Fei and El-Deiry, 2003), мы затем обработали клетки NSCLC и HPV + HNSCC излучением отдельно или в сочетании с NMDi и оценили жизнеспособность клеток. Ингибирование NMD увеличивало радиотерапевтическую чувствительность клеток NSCLC и HPV + HNSCC (фиг. 7C).
Рис. 6. Ингибирование NMD вызывает апоптоз в клетках NSCLC и HPV + HNSCC.(A, B и C) FACS-анализ контрольных или обработанных NMDi клеток A549 (A), UMSCC47 (B) и HMS001 (C). Числа в квадранте A2 указывают процент клеток, подвергшихся апоптозу, а числа в квадранте A4 указывают процент клеток в ранней фазе апоптоза. Показанные данные являются репрезентативными для двух независимых экспериментов.
(D и E) Количественная оценка апоптотических и ранних апоптотических клеток, обработанных или не обработанных NMDi. Показанные данные представляют собой среднее значение двух независимых экспериментов.Среднее ± стандартное отклонение, значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
Рис. 7. Ингибирование NMD снижает колониеобразующую способность, увеличивает радиационную чувствительность и замедляет рост опухоли.(A) Клоногенный анализ, показывающий снижение способности к образованию колоний при ингибировании NMD (левые панели). Количественная оценка (n = 2 эксперимента) колоний из клоногенного анализа (правые панели). Клетки NSCLC и HPV + HNSCC обрабатывали либо ДМСО, либо указанными концентрациями NMDi.Среднее ± стандартное отклонение, значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001. Показанные данные являются репрезентативными для двух экспериментов.
(B) Клоногенный анализ (левая панель), показывающий снижение способности к образованию колоний при истощении UPF1. Клетки обрабатывали либо sicontrol, либо siRNA против UPF1, через 24 часа высевали на чашки для клоногенного анализа. Показанные данные являются репрезентативными для двух экспериментов. Правая панель: количественная оценка (n = 2 эксперимента) колоний от соответствующих обработок. Среднее ± с.е., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01.
(C) Ингибирование NMD увеличивает радиационную чувствительность. Анализ клоногенной выживаемости клеточных линий NSCLC и HPV + HNSCC. Клетки обрабатывали либо ДМСО (контроль), либо указанными концентрациями NMDi в течение шестнадцати часов и подвергали воздействию различных доз радиации. Фракционную выживаемость анализировали, как описано в разделе «Методы».
(D и E) Рост опухоли подкожного ксенотрансплантата у мышей nude с использованием A549 (D) и UMSCC47 (E).Мышам инъецировали клетки A549 или UMSCC47, рандомизированные, как описано в разделе «Методы». Затем рандомизированных мышей (n = 10 на группу) лечили либо носителем, либо 75 мг / кг NMDi в течение указанного количества дней из пяти дней лечения и двух дней без режима лечения.
В совокупности наши результаты показывают, что ингибирование NMD активирует путь p53, индуцирует апоптоз, нарушает развитие клеточного цикла, что приводит к снижению жизнеспособности клеток и способности образовывать колонии, а также сенсибилизирует клетки к радиации.
Ингибирование NMD ухудшает рост опухолей NSCLC и HPV + ксенотрансплантат
Затем мы оценили терапевтические последствия ингибирования NMD, оценивая рост in vivo опухолей A549 и HPV + UMSCC47. Бестимусным мышам вводили подкожно клетки A549 или UMSCC47 и рандомизировали для получения носителя или NMDi. В обеих моделях опухолей мы наблюдали значительное уменьшение объема опухоли у животных, получавших NMDi, по сравнению с животными, получавшими носитель (фиг. 7D, E).Затем мы протестировали влияние NMDi на рост опухоли на ортотопической модели UMSCC47, в которой опухолевые клетки вводили в язык голых мышей. Обработка NMDi значительно ингибировала рост опухоли (фиг. EV5D). Чтобы исследовать, индуцирует ли обработка NMDi экспрессию изоформ p53β / γ и активирует путь p53 in vivo, мы собрали опухолевые ткани у животных и оценили экспрессию изоформ p53 и мишеней транскрипции с помощью ОТ-ПЦР. Мы наблюдали повышенную экспрессию мРНК p53β, p53γ, PUMA, GADD45A и BAX в опухолях A549, обработанных NMDi, и повышенную экспрессию мРНК p53γ, p21, GADD45A и PUMA в опухолях UMSCC47, обработанных NMDi, по сравнению с их соответствующими контролями, обработанными носителем (рис. EV5E).Эти данные предполагают, что ингибирование NMD реактивирует путь p53 in vivo и замедляет рост опухоли.
ОБСУЖДЕНИЕ
p53 является наиболее часто инактивированным опухолевым супрессором при раке. Здесь мы исследовали ингибирование NMD как стратегию повторной активации p53 и, в свою очередь, замедления роста опухоли и повышения чувствительности опухолевых клеток к обычно используемым терапевтическим схемам. Мы представляем доказательства того, что ингибирование NMD стабилизирует изоформы p53β и γ и восстанавливает активность p53 в нескольких основных типах p53-дефицитных опухолевых клеток, включая клетки с нонсенс-мутациями ниже сверхэкспрессии экзона 9 или MDM2, а также клетки HPV + HNSCC (рис. D).Изоформы p53β и γ лишены C-концевой отрицательной регуляторной области и, следовательно, менее восприимчивы к MDM2 и HPV-E6-опосредованной деградации, чем p53α. Таким образом, усиление экспрессии изоформ p53β и γ может особенно благоприятно сказаться на раковых заболеваниях, вызванных деградацией p53 дикого типа его негативными регуляторами (фиг. 8C).
Рис. 8. Ингибирование NMD стабилизирует изоформы p53β / γ и восстанавливает активность p53 в опухолях с дефицитом p53(A) В нормальных клетках сплайсинг пре-мРНК p53 приводит к образованию мРНК p53α и p53β / γ.мРНК p53β / γ расщепляется NMD, мРНК p53α транслируется.
(B) Ингибирование NMD стабилизирует мРНК p53β / γ, которые, в свою очередь, транслируются в белки p53β / γ.
(C) При раке, амплифицированном MDM2 или связанном с ВПЧ, белок p53α разрушается. Ингибирование NMD преодолевает дефицит p53 за счет увеличения экспрессии функциональных изоформ p53β / γ, устойчивых к деградации из-за отсутствия C-концевой отрицательной регуляторной области.
(D) У мутантов p53, несущих нонсенс-мутации ниже экзона 9.Ингибирование NMD стабилизирует мутантные транскрипты p53, а также транскрипты p53β / γ, которые транслируются в почти полноразмерные белки p53α и p53β / γ соответственно.
Знак остановки черного цвета, нормальный стоп-кодон; красный знак стоп, PTC; x, бессмысленная мутация ниже экзона 9. Экзоны 1-9 p53 показаны красным цветом, экзоны 10 и 11 — голубым.
Ингибирование NMD с использованием аминогликозидов или аталурена (PTC124) было терапевтической стратегией при многих заболеваниях, вызванных нонсенс-мутациями, включая мышечную дистрофию Дюшенна и муковисцидоз (Wilschanski, Yahav et al.2003, Финкель 2010). Эти фармакологические ингибиторы NMD действуют путем подавления PTC, вызванных нонсенс-мутациями, но не эффективны для защиты от деградации физиологических субстратов NMD, таких как альтернативно сплайсированные транскрипты. NMDi, используемый в данном исследовании, напротив, не только эффективно реверсирует NMD мутантных транскриптов мРНК p53, но также и физиологические субстраты NMD, такие как p53β и p53γ, генерируемые альтернативным сплайсингом. Лечение NMDi позволило синтезировать практически полноразмерные функциональные белки p53 в клеточных линиях NSCLC, рака груди и рака мочевого пузыря, несущих нонсенс-мутации ниже экзона 9 p53.Кроме того, NMDi также защищает p53β и p53γ от деградации в широком спектре злокачественных клеток с дефицитом p53, включая мутантный p53, сверхэкспрессирующий MDM2 и клеточные линии HPV + . Одним из важных запускающих свойств NMD является расположение PTC по отношению к конечному соединению экзон-экзон мРНК. Известно, что у людей PTC, расположенные по крайней мере на 50-55 нуклеотидов выше конечного соединения экзон-экзон, запускают NMD (Kurosaki and Maquat 2016). Несмотря на то, что и p53β, и p53γ соответствуют этому требованию, более ранние исследования не смогли обнаружить индукцию p53γ при ингибировании NMD и показали, что только p53β является субстратом NMD (Anczukow, Ware et al.2008, Cowen and Tang 2017). В этом исследовании мы показываем, что как p53β, так и p53γ являются субстратами NMD, и ингибирование NMD усиливает их экспрессию. Неспособность обнаружить p53γ при ингибировании NMD в более ранних исследованиях может быть из-за его низкой распространенности в определенных типах клеток.
Изоформы p53β и γ способствуют транскрипции генов-мишеней p53 и сохраняют функции подавления опухоли. Например, p53β и p53γ способствуют апоптозу и старению, индуцируя зависимую от p53α трансактивацию Bax и p21 соответственно (Bourdon, Fernandes et al.2005 г., Surget, Khoury et al. 2013 г., Соломон, Шарон и др. 2014). Более того, у пациентов с раком груди уровни p53β и p53γ связаны с более благоприятным клиническим исходом (Bourdon, Khoury et al. 2011, Avery-Kiejda, Morten et al. 2014). Экспрессия p53β показала отрицательную корреляцию с размером опухоли и положительную корреляцию с выживаемостью у пациентов с раком груди. Высокие уровни p53β особенно защищают пациентов с мутантным p53 и могут играть роль в противодействии повреждению, наносимому мутантным p53 (Avery-Kiejda, Morten et al.2014). Кроме того, пациенты с раком молочной железы, экспрессирующие p53γ вместе с мутантным p53, имели такой же хороший прогноз, как и пациенты с WT-p53, тогда как те, у которых не было p53γ и экспрессировалось только мутантный p53, имели заметно плохой прогноз (Bourdon, Khoury et al. 2011). Наше открытие, что как изоформы p53β, так и γ могут быть увеличены за счет ингибирования NMD в мутантных клетках p53, означает терапевтические преимущества ингибирования NMD при мутантном раке p53.
Мы обнаружили, что ингибирование NMD сенсибилизирует клетки NSCLC и HPV + HNSCC к ионизирующему излучению (IR).Интересно, что IR запускает экспрессию p53β, что, в свою очередь, способствует индуцированному IR клеточному старению (Chen, Crutchley et al., 2017). Здесь мы показываем, что уровни p53β / γ увеличиваются за счет ингибирования NMD и что раковые клетки, в которых ингибируется NMD, были более чувствительны к IR по сравнению с клетками без ингибирования NMD. Повышенная радиационная чувствительность в клетках, ингибированных NMD, может быть связана с защитой как индуцированного ингибированием NMD, так и индуцированного IR p53β от деградации.Вопрос о том, играет ли p53γ роль в повышении радиационной чувствительности, требует дальнейшего изучения.
Лекарства, разработанные для нацеливания на конкретную мутацию р53, имеют ограниченное применение против других мутаций р53. Например, NSC31397 восстанавливает активность p53 в мутантных раковых клетках R175H-p53, а p53R3 восстанавливает связывание ДНК мутантов p53 R175H и R273H (Hong, van den Heuvel et al. 2014). Подход, описанный здесь для восстановления p53, потенциально может быть широко применен не только к опухолям с мутациями p53 ниже экзона 9, но также и к опухолям, которые сверхэкспрессируют негативные регуляторы p53, такие как MDM2 и белок HPV-E6.Этот новый подход также может быть использован для устранения мутаций потери функции (LOF) или увеличения функции (GOF) примерно в 2,7% всех злокачественных опухолей, несущих мутации ниже экзона 9 p53 (Таблица EV4), поскольку изоформы p53β / γ не имеют канонических С-конец (рис. EV4). В совокупности стратегия ингибирования NMD может принести пользу примерно 8% всех видов рака, которые несут соответствующие мутации p53, амплификацию MDM2 или экспрессию HPV E6 (MDM2 амплифицирован, 3,7%; HV16 / 18-ассоциированные раки, 1,8% и мутации ниже экзона 9. , 2.7%: таблицы EV1, 3 и 4). Обнаружение того, что ингибирование NMD эффективно активирует путь p53, увеличивает радиочувствительность и снижает рост опухоли на доклинических моделях, предполагает, что ингибирование NMD заслуживает дальнейшего исследования в качестве терапевтической стратегии при большом количестве видов рака, дефицитных по p53.
МАТЕРИАЛЫ И МЕТОДЫ
Клеточные линии
Клетки A549, h560, h2944, h2395, h3228, TCCSUP и UACC-893 были из Американской коллекции типовых культур (ATCC). UMSCC47 и UMSCC104 были от Dr.Томас Э. Кэри (Мичиганский университет, Мичиган) (Бреннер, Грэм и др., 2010 г., Танг, Хауфф и др., 2012 г.). UDSCC2 был подарком Дж. Сильвио Гуткинд (Калифорнийский университет, Сан-Диего). UPCISCC090 и UPCISCC154 были созданы в Университете Питтсбурга (White, Weissfeld et al. 2007, Martin, Reshmi et al. 2008). Клеточная линия HMS001 была создана доктором М.Л. Лаборатория Гиллисона (Акаги, Ли и др., 2014). GSC231 и GSC289 были созданы и отпечатаны пальцами в лабораториях д-ра Эрика Сульмана и др.Фредерик Ланг-младший (отделение нейрохирургии, UT-M.D. Онкологический центр Андерсона). A549, h560 и h3228 выращивали в RPMI с 10% FBS. UDSCC2 и UMSCC104 выращивали в среде DMEM, содержащей 10% FBS и 1% заменимых аминокислот (NEAA). UPCISCC090 и UPCISCC154 выращивали в MEM с 10% FBS и 1% NEAA. UMSCC47 выращивали в DMEM с 10% FBS, HMS001 в DMEM / F12 с 10% FBS. HTB5, выращенный в MEM с 10% FBS, 1% NEAA и 1 мМ пирувата натрия. Клетки CRL-1902 выращивали в среде Лебовица L-15 (ATCC) с 10% FBS.Клетки GSC231 и GSC289 выращивали в нейтральной основной среде (DMEM / F12 50/50, 1X добавка B27, 20 нг / мл EGF, 20 нг / мл bFGF, 1% раствор Pen / Strep). Все клеточные линии были отрицательными на микоплазму.
NMDi лечение
NMDi было предоставлено доктором Филипом Джонсом (Институт прикладных онкологических наук, UT-M.D. Онкологический центр Андерсона, Хьюстон, Техас). Клетки обрабатывали либо ДМСО, либо 1 мкМ NMDi в течение ~ 16 часов и собирали для получения лизатов белков и РНК.
РНКи-опосредованный нокдаун
миРНК против человеческого UPF1 (aagatgcagttccgctccatttt) (Mendell, ap Rhys et al.2002), p53β (ggaccagaccagctttc), p53γ (cccttcagatgctacttga) и интрон-9 p53 (gaugcuacuugacuuacga) (Марсель, Фернандес и др., 2014) и общий p53 (gagguuggcucugacugua, siRNA_DRNA IDHIG0. От 700000 до 1 миллиона клеток высевали на 100-миллиметровые планшеты для тканевых культур в течение ночи. Исходные материалы миРНК (100 мкМ) разводили в воде, свободной от РНКазы, смешивали с DharmaFECT 1 (Dharmacon), инкубировали в течение 20 минут при комнатной температуре и добавляли к клеткам в среде без пенициллина / стрептомицина до конечной концентрации 100 нМ миРНК в целом. объем 8 мл / тарелка.Через 24 часа после трансфекции клетки делили на две чашки диаметром 60 мм каждая для экстракции белка и РНК. Клетки, обработанные siUPF1, собирали через 72 часа после трансфекции. Для клеток, обработанных sip53, sip53 интрон-9, sip53β и sip53γ, через 56 часов после трансфекции добавляли NMDi до конечной концентрации 1 мкМ и клетки собирали через 16 часов после обработки NMDi для экстракции белка и РНК.
Количественная ПЦР
РНКэкстрагировали с помощью TRI Reagent Soln (Ambion) или набора RNeasy (Qiagen) в соответствии с инструкциями производителя.Суммарную РНК определяли количественно с использованием спектрофотометра NANO DROP 2000C (ThermoScientific). кДНК, синтезированная путем обратной транскрипции с использованием iScript ™ Reverse Transcription Supermix для RT-qPCR (BIO-RAD), с использованием 1 мкг общей РНК, в соответствии с инструкциями производителя. Количественную ПЦР (qPCR) проводили на кДНК с использованием зондов PerfeCta SYBR Green FastMix Low Rox (Quantabio) и праймеров, перечисленных в таблице расширенных данных S1. ПЦР в реальном времени проводится в системе 7500 Fast Real-Time PCR System (Applied Biosystems). ΔΔ C t метод использовали для расчета кратных изменений экспрессии.GAPDH человека использовали в качестве эндогенного контроля экспрессии мРНК. Выраженные складчатые изменения нормализуются либо к контролю, обработанному siControl, либо к DMSO.
Оценка распада мРНК
Для оценки распада мРНК изоформ p53 клетки A549 обрабатывали либо ДМСО, либо NMDi (1 мкМ) в течение 16 часов, затем транскрипцию ингибировали добавлением 5,6-дихлор-1-β-D- рибофуранозилбензимидазол (100 мкМ) и РНК экстрагировали в различные моменты времени. Анализ экспрессии мРНК выполняли методом RT-qPCR.
Вестерн-блот
Лизаты белков (30 мкг-40 мкг) разделяли на гелях SDS-PAGE с градиентом 4-15%, переносили на мембрану из поливинилидендифторида (PVDF) с использованием влажной системы (BIO-RAD). Мембраны кратковременно промывали 1X TBS-Tween (TBST) и блокировали 5% (мас. / Об.) Сухим молоком в TBST в течение 1 часа. Их инкубировали в течение ночи при 4 ° C в первичных антителах, разведенных 1: 1000 в 5% (мас. / Об.) BSA-содержащем TBST, промывали 3 раза в TBST и инкубировали с соответствующими вторичными антителами, конъюгированными с пероксидазой хрена.Мембраны проявляли с использованием хемилюминесцентного субстрата Super Signal ™ West Pico PLUS (Thermo Scientific) и экспонировали на пленке Blue Lite Autorad (GeneMate). GAPDH, актин или винкулин использовали в качестве контроля нагрузки. Показанные изображения являются представителями трех отдельных белковых выделений и блоттингов, проведенных в трех экземплярах. Используемые антитела: p53 (7F5, Каталожный № 2527S), puma (D30C10, Каталожный № 12450S), p21 Waf1 / Cip1 (DCS60, Каталожный № 2946S), Upf1 (Каталожный № 9435) и GAPDH (Каталожный № 5174) от Cell Signaling Technology, MDM2 (HDM2-323, № по каталогу sc-56154) от Santa Cruz Biotechnology, β-актин (№ по каталогу A5441) и винкулин (№ по каталогу V9131) от SIGMA.Количественное определение белковых полос было выполнено с использованием ImageJ (Schneider, Rasband et al. 2012). Экспрессия белков была нормализована к экспрессии GAPDH, актина или винкулина.
Анализ репортерной люциферазы
Клетки A549 и UMSCC47 помещали в 24-луночные планшеты и трансфицировали 1 мкг / лунку репортерной конструкции 4XBS2 WT (Yu, Zhang et al., 2001) (каталог № 16593, аддген) с использованием липофектамина 2000 (Invitrogen ). Конструкцию Renilla (25 нг / лунку, Promega) котрансфицировали в качестве контроля эффективности трансфекции.Примерно через 24 часа после трансфекции клетки A549 обрабатывали 1,5 мкМ NMDi в течение 6 часов и приблизительно через 31 час после трансфекции, клетки UMSCC47 обрабатывали 1 мкМ NMDi в течение 16 часов. Клетки собирали в буфере для пассивного лизиса, и анализ люциферазы выполняли с использованием системы анализа двойной люциферазы (каталожный № E1960, Promega) в соответствии с инструкциями производителя. Люминесценцию измеряли с помощью люминометра GLOMAX 20/20 (Promega). Активность люциферазы нормализовалась с активностью Renilla.
RNAseq и анализ мутаций
RNAseq, статус HPV и данные мутаций были проанализированы, как описано (Kalu, Mazumdar et al., 2017). Экспрессия РНК для MDM2 и TP53 во всех доступных клеточных линиях в базе данных Онкологического центра им. М. Д. Андерсона (HN) и легких. Статус HPV был аннотирован для каждой линии клеток HN. Тепловая карта была отсортирована по экспрессии РНК MDM2.
Анализ опухоли PanCancer для амплификации MDM2 и частоты мутаций TP53 был выполнен с использованием данных из Атласа генома рака (TCGA) (Campbell, Alexandrov et al.2016 г., Зехир, Бенайед и др. 2017) портал.
Медикаментозное лечение для оценки жизнеспособности клеток и IC50.
Nutlin 3 (Каталожный № S1061) был приобретен у Selleck Chemicals LLC, Хьюстон, Техас. Цисплатин, этопозид и пеметрексед были от Институциональной аптеки Техасского университета, доктора медицины. Онкологический центр Андерсона. Шестьсот клеток / лунку для h560, 700 клеток / лунку для A549 и 1000 клеток / лунку для всех других клеточных линий высевали в 384-луночные планшеты (GreinerBio-one) в трех экземплярах на тот же планшет.Клетки обрабатывали ДМСО или семью различными концентрациями трехкратно разведенных лекарственных средств, максимальная концентрация составляла 9,6 мкМ, в конечном объеме 40 мкл. Спустя семьдесят два часа добавляли 11 мкл CellTiter Glo (анализ жизнеспособности люминесцентных клеток CellTiter-Glo, REF G7573, Promega), планшеты встряхивали в течение 10 мин, люминесценцию измеряли с использованием считывающего устройства для микропланшетов FLUOstar OPTIMA (BMG LABTECH). Значения люминесценции нормализовали для клеток, обработанных ДМСО. Каждый эксперимент повторяли два разных раза для получения биологических повторов.Значения IC50 оценивались с помощью программного обеспечения drexplorer, которое соответствовало множественным моделям доза-реакция и определяло лучшую модель с использованием остаточной стандартной ошибки (Tong, Coombes et al. 2015). Вкратце, данные доза-ответ были нормализованы по среднему ответу контролей до оценки параметров лекарственного средства. Точки с выбросами были обнаружены и удалены, как описано в (Tong, Coombes et al. 2015). На основании остаточной стандартной ошибки была выбрана лучшая модель доза-реакция. Параметры лекарственного средства, включая ингибирующие концентрации IC (IC10 ~ IC90, исходная шкала доз) и площадь под кривой (AUC, масштабированная кривой при ответе = 1; 0 означает чрезвычайно чувствительный и 1 означает чрезвычайно устойчивый), оценивали с помощью пакета drexplorer (Tong, Coombes et al.2015). Оценка значений IC была усечена наблюдаемыми дозами. Например, если IC50 не была достигнута, IC50 оценивалась как самая большая доза, использованная в эксперименте. Напротив, если лекарство является высокоэффективным, когда самая низкая доза убивает более 50% клеток, IC50 представляет собой наименьшую наблюдаемую дозу. Большинство профилей повторяются в двух экземплярах. Для этих экспериментов мы оценивали воспроизводимость экспериментов на основе коэффициента корреляции согласованности (CCC) и сдвига местоположения.Эксперименты с CCC> 0,8 или сдвигом местоположения <0,9 были отмечены как прошедшие контроль качества. Парный t-тест использовали для сравнения относительной жизнеспособности между контрольными группами, получавшими лекарственное средство, и обработанными ДМСО.
Анализ клеточного цикла
Один миллион клеток помещали на чашки диаметром 100 мм. Через двадцать четыре часа клетки обрабатывали либо ДМСО, либо NMDi (1 мкМ). Клетки собирали через 24 часа и 48 часов после обработки, фиксировали в 70% этаноле в течение 24 часов при 4 ° C, промывали 1X фосфатно-солевым буфером (PBS), обрабатывали 200 мкг / мл РНКазы A в 1X PBS в течение 1 часа при 37 °, окрашивали. с 40 мкг / мл иодида пропидия (PI) в течение 20 минут при комнатной температуре, центрифугировали при 500 г в течение 5 минут для удаления PI и осадок клеток повторно суспендировали в 1XPBS (500 мкл).Анализ сортировки активированных флуоресценцией клеток (FACS) выполняли в проточном цитометре BDFACSCanto.
Анализ апоптоза
150 000 клеток / лунку для A549 и 300 000 клеток / лунку для UMSCC47 и HMS001 помещали в планшеты с шестью лунками. Примерно через 24 часа клетки обрабатывали либо ДМСО, либо 3 мкМ (A549) или 2 мкМ (UMSCC47 и HMS001) NMDi в течение примерно 72 часов. Затем клетки трипсинизировали, дважды промывали ледяным PBS и обрабатывали для окрашивания с использованием набора для обнаружения апоптоза FITC Annexin V с 7AAD (Cat # 640922, BioLegend) в соответствии с инструкциями производителя.Клетки анализировали методом проточной цитометрии.
Анализ клоногенной выживаемости
Экспоненциально растущие клетки помещали в дубликаты с тремя разведениями в 6-луночные планшеты, содержащие 2 мл среды, и инкубировали в течение 24 ч в увлажненном CO2-инкубаторе при 37 ° C. Затем в среду добавляли NMDi на 16 часов. После предварительной обработки ДМСО (для контроля) и NMDi клетки были подвергнуты гамма-облучению 0, 2, 4 или 6 Гр с использованием облучателя клеток Mark 1-68A с источником цезия-137 при мощности дозы 3.254 Гр в минуту (J.L. Shepherd & Associates, Сан-Фернандо, Калифорния). Затем среду заменяли свежей средой, позволяя клеткам непрерывно расти для образования колоний в течение 10-14 дней. Для оценки клоногенной выживаемости после облучения клетки фиксировали глутаровым альдегидом (6,0% об. / Об.), Окрашивали кристаллическим фиолетовым (0,5% мас. / Об.). Колонии с более чем 50 клетками подсчитывали для определения процента выживаемости, и количество колоний, полученных из трех повторов, усредняли для каждой обработки.Эти средние значения были скорректированы в соответствии с эффективностью посева на соответствующие контроли для расчета выживаемости клеток для каждого уровня дозы. После корректировки эффективности посева рассчитывалась доля выживаемости, как сообщалось ранее (Franken, Rodermond et al. 2006), и подгонялась к линейно-квадратичной модели с использованием SigmaPlot 10.0 (Сан-Хосе, Калифорния). Анализы клоногенной выживаемости после облучения повторяли два раза для каждой клеточной линии.
Оценка колониеобразующей способности
Для оценки колониеобразующей способности после истощения UPF1 клетки, трансфицированные siControl или siUPF1, высевали в двух экземплярах при концентрации 200 клеток на лунку в шестилуночный планшет примерно через 26 часов после трансфекции.Для оценки колониеобразующей способности клеток, обработанных NMDi, клетки высевали в двух экземплярах при концентрации 100 клеток на лунку в 6-луночный планшет и через 24 часа обрабатывали либо ДМСО, либо NMDi. Среду заменили через 24 часа после обработки. Через десять-пятнадцать дней колонии окрашивали 0,25% кристаллическим фиолетовым в 100% метаноле. Подсчитывали колонии с более чем 50 клетками, и количество колоний, полученных из трех повторов, усредняли для каждой обработки.
Оценка роста опухоли
Все исследования на животных были одобрены Комитетом по использованию и уходу за животными при Онкологическом центре им. М. Д. Андерсона Техасского университета в соответствии с руководящими принципами Национальных институтов здравоохранения.Самок мышей (мышей Athymic Nude линии 69 (nu / nu)) были приобретены у Envigo. Мышей случайным образом распределяли в контрольную группу или группу лечения. Статистический метод не применялся для предварительного определения размера выборки, и исследователи, проводившие доклинические эксперименты, не были ослеплены. А549 (5 × 10 6 клеток на мышь) или UMSCC47 (2 × 10 6 клеток на мышь) вводили подкожно самкам мышей nude. Для ортотопической модели 60 000 клеток вводили в язык голых самок мышей.Мышей рандомизировали для лечения (не менее 10 на группу), когда размер опухоли достигал ~ 250-300 мм 3 для боковой модели и ~ 5-8 мм 3 для ортопической модели. Ксенотрансплантаты A549 обрабатывали в течение 3 недель, модель фланга UMSCC47 обрабатывали в течение 4 недель и ортотопическую модель UMSCC47 обрабатывали до тех пор, пока размер опухоли не достигал ~ 30 мм 3 . NMDi вводили в указанных дозах при 5-дневном режиме и 2-дневном перерыве для всех трех моделей. Опухоли собирали в конце режима лечения и обрабатывали для сбора РНК и анализа RT-qPCR.
Статистический анализ
Для оценки жизнеспособности клеток использовали парный t-тест для сравнения относительной жизнеспособности между контрольными группами, получавшими лекарственное средство, и обработанными ДМСО. Для анализа кратного изменения экспрессии мРНК использовали непарный t-тест (двусторонний) для сравнения относительной экспрессии между контрольными группами, получавшими лекарственное средство, и обработанными ДМСО. Для анализа данных о росте опухоли количественные данные подвергали двухфакторному дисперсионному анализу (ANOVA).
Финансирование
Эта работа была поддержана Техасским университетом Lung Spore P50CA070907, Moon Shot рака легких, Фондом Джейн Форд Петрин для исследований KRAS и грантами Фонда исследований рака легких, присужденными J.V.H и CCSG P30CA016672.
ВКЛАД АВТОРОВ
J.P.G. спроектировал и провел эксперименты и проанализировал данные. J.P.G. написал рукопись с помощью всех других авторов. T.C., A.P., F.Z., Q.W. и S.P провели эксперименты на мышах in vivo на мышах. T.C. и А.П. проанализировали рост опухоли. P.S. проведены исследования радиационной чувствительности. Н.М. помогла с лекарственными препаратами и анализами. П.Т., Л.Л., Л.С. и Дж. провели статистический анализ. М.Н. помогал с составлением и написанием рукописи.П.Дж. предоставил NMDi и руководил его использованием. E.S. и F.M.J. предоставили клеточные линии глиобластомы и HNSCC соответственно и поделились своим статусом мутации p53 и статусом HPV. J-C.B. предоставил информацию об интерпретации данных изоформы p53 и написании рукописи. J.V.H. придумал идеи и руководил исследованиями.
Конфликт интересов
Тина Касконе имеет консультативную роль в MedImmune и финансирует исследования со стороны Bristol-Myers Squibb и Boehringer Ingelheim, MedImmune. Филип Джонс является советником Tvardi Therapeutics и владеет опционами на акции Tvardi.Эрик П. Сульман входит в состав консультативного совета и получает финансирование исследований и командировок от Novocure; входит в состав консультативного совета и получает поддержку командировок от BrainLab; входит в состав консультативного совета и имеет финансирование исследований от AbbVie; в консультативном совете Blue Earth Diagnostics; имеет гонорары докладчикам и поддержку командировок от Merck и гонорары докладчиков от PER. Фэй М. Джонсон получила финансирование исследований от компаний PIQUR Therapeutics и Trovagene. Джон В. Хеймах является консультантом / членом совета директоров компаний Bristol-Myers Squibb, AstraZeneca, Merck, Genentech, EMD Serono, Boehringer Ingelheim, Spectrum, Lilly, Novartis и GSK.Другие авторы не сообщали о потенциальных конфликтах интересов.
Расширенный вид Обозначения к рисункам
Рис. EV1. Число копий MDM2 и статус экспрессии мРНК.
(A) анализ экспрессии мРНК и количества копий MDM2 клеточных линий NSCLC
(B) Вестерн-блоттинг, показывающий экспрессию MDM2 в клеточных линиях GBM.
(C) экспрессия мРНК и анализ числа копий MDM2 клеточных линий HNSCC.
Анализ экспрессии выполнен с использованием данных RNAseq. Указывается статус ВПЧ и статус мутации TP53 .CN, номер копии. Стрелки указывают клеточные линии, использованные в этом исследовании.
Рис EV2. Ингибирование NMD продлевает распад мРНК p53β / γ
(A) Анализ распада мРНК p53α, p53β и p53γ транскриптов мРНК из клеток A549, обработанных DMSO или NMDi (1 мкМ). Обработку NMDi и 5,6-дихлор-1-β-D-рибофуранозилбензимидазолом (100 мкМ) проводили, как описано в разделе «Методы». Показанный анализ RT-qPCR представляет собой среднее значение ± стандартная ошибка трех независимых экспериментов.
Рис EV3. p53γ способствует усилению активации пути p53 при ингибировании NMD в клеточной линии HPV + HNSCC.
(A) Экспрессия мРНК p53β и p53γ FC при обработке NMDi в клетках HMS001. Клетки обрабатывали указанными миРНК в течение 54 часов, а затем либо ДМСО (контроль), либо 1 мкМ NMDi в течение 16 часов. Показанные RT-qPCR (n = 2 технических повтора) являются представителями двух независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01.
(B) Вестерн-анализ, показывающий экспрессию p53α (полноразмерный) и усеченный p53β / γ. Обработку миРНК и NMDi проводили, как в (А).Показанный западный анализ является представителями двух независимых экспериментов.
Экспрессия мРНК(C, D и E) FC транскрипционных мишеней p53 p21 (C), GADD45A (D) и PUMA (E). Обработку миРНК и NMDi проводили, как в (А). Показанные RT-qPCR (n = 2 технических повтора) являются представителями 3 независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
(F и G) Вестерн-анализ, показывающий экспрессию p21 (F) и PUMA (G). Обработку миРНК и NMDi проводили, как в (А).Нижние панели в F и G представляют собой количественные оценки (2 технических повтора) вестерн-блоттинга, нормализованные по винкулину. Показанный западный анализ является представителями двух независимых экспериментов. Среднее ± s.e., значения p, двусторонний t-критерий, * ≤0,05, ** <0,01, *** <0,001.
Рис EV4. Стратегия восстановления функции p53 путем ингибирования NMD в транскриптах, несущих мутации ниже экзона 9.
(A) В отсутствие ингибирования NMD, NMD-индуцирующие нонсенс-мутации или мутации сайта сплайсинга ниже экзона 9 p53 вызывают деградацию мРНК
(B) Ингибируя NMD, транскрипты p53, несущие NMD-индуцируемые мутации ниже экзона 9, могут быть защищены и транслироваться в почти полноразмерные функциональные белки.
(C) Миссенс-мутации ниже экзона 9 могут генерировать мутантный белок p53 с изменением LOF / GOF.
(D) Ингибирование NMD может потенциально преодолевать эффект мутаций LOF / GOF ниже экзона 9, обеспечивая экспрессию функционального p53β / γ, который укорочен на С-конце.
Рис EV5. NMDi снижает жизнеспособность опухолевых клеток, нарушает развитие клеточного цикла, снижает рост опухоли и увеличивает экспрессию p53γ в опухолях.
(A) Клеточные линии NSCLC, HNSCC и GBM чувствительны к лечению NMDi.Обработка NMDi и расчеты IC50 выполнялись, как описано в разделе «Методы».
(B) Клеточные линии HPV + HNSCC более чувствительны к NMDi, чем указанные химиотерапевтические агенты и нутлин. Показанные клеточные линии были обработаны показанными агентами. Показанные IC50 являются средними для трех технических повторений. Эксперимент повторяли два разных раза.
(C) NMDi нарушает развитие клеточного цикла. Клетки A549 обрабатывали либо ДМСО, либо NMDi (1 мкМ) в указанные моменты времени, фиксировали в 70% этаноле, окрашивали йодидом пропидия и анализировали проточной цитометрией, как описано в разделе «Методы».
(D) Модель ортотопического роста опухоли UMSCC47 на языке голых мышей. Мышам инъецировали клетки UMSCC47 и рандомизировали, как описано в Методиках. Рандомизированным мышам (n = 10 на группу) вводили либо носитель, либо 50 мг / кг NMDi в течение указанного количества дней из пяти дней лечения и двух дней без режима лечения.
Экспрессия мРНК(E) FC в образцах опухолевой ткани, обработанных носителем или NMDi, полученных из подкожных ксенотрансплантатов A549 или UMSCC47. Опухоли собирали в конце обработки, экспрессию мРНК оценивали с помощью RT-qPCR.Среднее ± стандартное отклонение, n = 5 каждый.
БЛАГОДАРНОСТИ
Мы благодарим Ирен Гихарро Муньос за редакционную помощь и Хуэйин Сан за техническую помощь.
Здоровье зубов и полости рта | Cancer.Net
Слушайте подкаст Cancer.Net: «Стоматологическое здоровье во время лечения рака» , адаптированный из этого содержания.
Многие методы лечения рака имеют побочные эффекты, которые влияют на полость рта, зубы и слюнные железы. Слюнные железы производят слюну.Стоматологические и оральные побочные эффекты могут затруднить прием пищи, разговора, жевания или глотания. К счастью, при надлежащем уходе вы и ваш врач можете снизить риск этих побочных эффектов и справиться с ними, если они все же возникнут.
Ваш стоматолог общего профиля и несколько других стоматологов могут помочь вам в уходе за полостью рта до, во время и после лечения рака. Эти специалисты могут включать:
Онкологи-стоматологи, специализирующиеся на лечении зубов и полости рта у онкологических людей
Хирурги-стоматологи, проводящие операции на ротовой полости и челюсти
Пародонтологи, занимающиеся диагностикой и лечением заболеваний десен
Челюстно-лицевые протезисты, заменяющие зубы или другие структуры во рту и челюсти
Типы стоматологических и оральных побочных эффектов
Симптомы или побочные эффекты полости рта, вызванные раком или его лечением, могут включать:
Сухость во рту
Слюна сгущенная
Изменения вкуса
Язвы во рту
Кариес зуба
Затруднения при глотании
Затруднения при жевании или открытии рта
Инфекция
Болезнь костей
Воспаление или боль на слизистой оболочке рта и языка
Повышенный риск кариеса или заболевания десен
Большинство из этих побочных эффектов происходит во время лечения рака, но некоторые могут возникать и после его окончания.В любом случае, большинство побочных эффектов, связанных со ртом, не являются длительными или постоянными.
Причины побочных эффектов со стороны зубов или полости рта
Не все методы лечения рака влияют на полость рта, зубы и челюсть. Но следующие методы лечения могут вызвать определенные побочные эффекты со стороны зубов и полости рта. Чтобы узнать больше о риске возникновения этих побочных эффектов, поговорите со своим лечащим врачом.
Лучевая терапия головы и шеи. Побочные эффекты лучевой терапии головы и шеи могут быть временными или продолжаться в течение нескольких лет после лечения.Они могут включать:
Сухость во рту
Уменьшение слюны
Слюна сгущенная
Инфекция
Повышенный риск кариеса
Потеря или изменение вкусовых качеств
Язвы во рту
Болезнь костей
Скованность в челюсти
Повышенный риск кариеса и заболеваний десен
Лучевая терапия может изменить количество и консистенцию вашей слюны.Это увеличивает риск возникновения кариеса и заболеваний десен. Хорошая гигиена полости рта важна для снижения риска этих заболеваний. Ваш стоматолог может также порекомендовать специальные процедуры с фтором во время и после лучевой терапии. Это лечение, наряду с диетой с низким содержанием сахара, может помочь защитить ваши зубы. Ваш врач или стоматолог также могут порекомендовать упражнения для предотвращения скованности челюсти.
Узнайте больше о побочных эффектах лучевой терапии.
Химиотерапия. Стоматологические и оральные побочные эффекты химиотерапии обычно проходят вскоре после окончания лечения.В их числе:
Язвы во рту
Боль во рту и деснах
Шелушение или жжение языка
Инфекция
Изменения вкуса
Временное снижение способности вашего организма вырабатывать клетки, борющиеся с инфекциями
Кровотечение из десен
Узнайте больше о побочных эффектах химиотерапии.
Трансплантация костного мозга / стволовых клеток. Высокодозная химиотерапия, которая обычно назначается перед трансплантацией костного мозга или стволовых клеток, может вызвать побочные эффекты для зубов и полости рта. Они аналогичны описанным выше в разделе «химиотерапия».
Язвы во рту — частый побочный эффект высокодозной химиотерапии, применяемой для лечения лейкемии, лимфомы или множественной миеломы. Люди также получают высокодозную химиотерапию перед трансплантацией стволовых клеток. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США одобрило препарат палифермин (Kepivance) для предотвращения язв во рту, связанных с лечением.Люди получают палифермин через внутривенный зонд, вводимый в вену перед трансплантацией.
У людей, которым сделана трансплантация костного мозга ALLO, также может развиться побочный эффект, называемый реакцией «трансплантат против хозяина». Это заболевание может вызывать:
Узнайте больше о побочных эффектах трансплантации костного мозга.
Костномодифицирующие препараты. Лекарства, такие как бисфосфонаты и другие новые препараты, иногда используются для уменьшения распространения раковых клеток на кости.Их также можно использовать для лечения рака груди, который распространился на кости, или для лечения остеопороза у выживших после рака груди.
Необычным, но серьезным побочным эффектом этих препаратов является медикаментозный остеонекроз челюсти (MRONJ). MRONJ вызывает ослабление и потерю кости челюсти. Иногда это может вызвать боль, инфекцию, расшатывание зубов и оголение кости вокруг челюсти.
MRONJ обычно можно лечить с помощью хорошей гигиены полости рта, применения антибиотиков или простой процедуры удаления обнаженной кости.Если ваше состояние не улучшится или ухудшится, вам может потребоваться операция. Чтобы снизить риск MRONJ, посетите стоматолога до и во время лечения рака, которое включает препараты, модифицирующие кости, чтобы убедиться, что ваш рот здоров. Узнайте больше о рекомендациях ASCO по управлению MRONJ на отдельном веб-сайте.
Вы также можете найти дополнительную информацию о препаратах, модифицирующих костную ткань, при раке груди и множественной миеломе в различных разделах этого веб-сайта.
Новые виды лекарственной терапии. Новые эффективные лекарства от рака разрабатываются постоянно. Некоторые из них, называемые таргетной терапией, нацелены на определенные гены, белки или тканевую среду, которая способствует росту и выживанию рака. Некоторые целевые методы лечения могут иметь побочные эффекты, влияющие на полость рта. Например, препараты, называемые ингибиторами mTOR, могут вызывать язвы во рту. Язвы можно лечить с помощью определенных гелей или ополаскивателей, прописанных вашим лечащим врачом.
Иммунотерапия. Некоторые виды иммунотерапии могут вызывать побочные эффекты во рту, включая язвы во рту и изменения слюнных желез. Узнайте больше о побочных эффектах иммунотерапии.
Лекарства прочие. Другие лекарства, которые помогают управлять симптомами рака и побочными эффектами, также могут вызывать побочные эффекты для зубов и полости рта. Например, обезболивающие могут вызвать сухость во рту. А некоторые полоскания для рта, которые используются для лечения инфекций, могут обесцветить зубы.
Предотвращение побочных эффектов со стороны зубов или полости рта
Люди, у которых до лечения было хорошее здоровье зубов, имеют меньший риск этих состояний.Поэтому важно посетить стоматолога как минимум за 4 недели до начала лечения рака, чтобы вылечить любые возможные инфекции или раздражения.
Во время этих посещений ваш стоматолог или стоматолог может:
Лечить кариес, сломанные или инфицированные зубы и любую другую стоматологическую инфекцию
Убедитесь, что протезы подходят и не раздражают ваш рот
Снимите подтяжки, чтобы они не раздражали щеки или язык
Попросите стоматолога поделиться с онкологом подробностями о состоянии вашей полости рта.Таким образом, оба врача могут работать вместе, чтобы спланировать ваше лечение.
Обычно между стоматологической операцией и началом лечения рака у вас должно пройти не менее 2 недель на заживление. Вам также следует поговорить со своим врачом или другим членом вашей медицинской бригады о том, о каких проблемах полости рта вам следует немедленно сообщить стоматологу. Если вы начали лечение рака и не посещали стоматолога, обратитесь к нему как можно скорее.
Регулярное общение с вашим лечащим врачом важно для предотвращения побочных эффектов в зубах и ротовой полости.Если вы посещаете стоматолога во время лечения рака, важно, чтобы он поговорил с вашим онкологом, чтобы убедиться, что любое стоматологическое лечение, которое вы получаете, безопасно для вас.
Во время лечения рака следующие советы могут помочь улучшить здоровье полости рта и предотвратить побочные эффекты:
Осторожно чистите зубы 2 раза в день и регулярно пользуйтесь зубной нитью. Смочите сверхмягкую зубную щетку теплой водой, чтобы смягчить щетину перед чисткой. Попробуйте использовать мягкую зубную щетку детского размера, если ваша обычная щетка слишком громоздкая или неудобная.Ваш врач также может дать вам специальные инструкции, чтобы снизить риск кровотечения и инфекции. Спросите у стоматолога, следует ли вам использовать фторидный гель или ополаскиватель. Также сообщите своему лечащему врачу, если вы заметили сильное кровотечение при чистке зубов нитью.
Избегайте алкоголя и экстремальных текстур и вкусов в своем рационе. Ваши вкусы могут измениться из-за лечения рака. В общем, посмотрите, что работает для вас, но подумайте о том, чтобы есть мягкую и мягкую пищу. Чрезвычайно горячая, холодная, острая, кислая или хрустящая пища может вызвать раздражение во рту.Снизьте потребление сахара. Бактерии во рту используют сахар, чтобы жить, и в результате этого процесса образуется кислота, вызывающая кариес. Если у вас есть конкретные вопросы о том, что есть, спросите сертифицированного диетолога или диетолога.
Способствует хорошему здоровью костей. Получение достаточного количества витамина D и кальция каждый день помогает вашей челюсти и зубам оставаться сильными и здоровыми. Молочные продукты являются хорошими источниками кальция и, если они обогащены, витамина D. Другие варианты питания могут включать обогащенный сок и обогащенные хлопья для завтрака.Прежде чем принимать какие-либо добавки, поговорите со своим лечащим врачом.
Лечение и лечение побочных эффектов зубов или полости рта
Если во время лечения у вас возникнут какие-либо побочные эффекты со стороны зубов или полости рта, немедленно сообщите об этом своей медицинской бригаде. Снятие побочных эффектов — важная часть лечения и лечения рака. Это называется паллиативной или поддерживающей терапией.
Конкретное лечение, которое порекомендует ваш врач, будет зависеть от ваших симптомов. Существует несколько распространенных методов лечения побочных эффектов в полости рта и полости рта:
Ополаскиватели для полости рта, содержащие соль и пищевую соду, могут помочь при лечении язв во рту.Однако, если вы принимаете лекарства от высокого кровяного давления, вам может потребоваться избегать полоскания рта солью. Есть также множество рецептурных ополаскивателей, которые могут успокоить больные места.
Обезболивающие также можно использовать для снятия боли от язв во рту. Лекарства можно накладывать непосредственно на язвы, принимать внутрь или вводить через капельницу.
Антибиотики, противовирусные и / или противогрибковые препараты используются для лечения инфекций.
Питьевая вода и напитки без сахара могут помочь справиться с сухостью во рту.Также могут помочь сосание кусочков льда или жевательная резинка без сахара с ксилитом. Избегайте продуктов, которые сушат ротовую полость, таких как газированные напитки, фруктовый сок, сигареты, жевательный табак и алкоголь.