Дженерики и биосимиляры — в чем разница и причем тут спектроскопия кругового дихроизма? – TechnoInfo
В ближайшие несколько лет истекает срок патентной защиты сразу для множества биотехнологических препаратов, которые используются в лечении сложнейших онкологических, эндокринологических и других заболеваний. После окончания патентной защиты на рынке в большом количестве появляются их аналоги. Мы решили немного разобраться, чем такие препараты отличаются от дженериков, что нас ждет через несколько лет и какую роль в этой отрасли сыграет развитие метода кругового дихроизма.
Дженерик и биосимиляр. В чем разница?
Когда у какого-то оригинального препарата заканчивается срок патентной защиты, другие фармкомпании получают право использовать такое же действующее вещество в составе своих препаратов. Такие препараты, воспроизведенные другими производителями, называются термином дженерик (генерик). В российском законодательстве для этой группы препаратов используется определение «воспроизведенное лекарственное средство».
В зарубежной практике, в частности в Евросоюзе и США, считается, что дженерик как препарат, химически идентичный оригинальному, может быть произведен только для химических веществ (на основе малых молекул). А для биотехнологических препаратов произвести из живых организмов полностью идентичный аналог затруднительно. Они представляют собой сложные пептидные молекулы, чаще всего синтезируемые микроорганизмами, с массой от десятков до сотен кД. Белок может быть первичной, вторичной, третичной и четвертичной структуры, которая наиболее подвержена изменениям при незначительных модификациях технологического процесса. В отличие от химических молекул, взаимодействия внутри молекулы белка прогнозировать очень сложно. Таким образом, возможно произвести только похожий препарат — биосимиляр. Встречаются также такие варианты названия как биоаналог, биоаналогичный препарат, биоподобный препарат, follow-on protein products («препарат, подобный белковым лекарственным средствам»).
Особенности разработки и производства биосимиляров
Задача производителей биосимиляров – воспроизвести сложную молекулу и убедиться в том, что копия полностью соответствует оригиналу по структурным характеристикам, физико-химическим свойствам, биологическим активности и так далее.Процедуры одобрения, которые подходят для дженериков, не подходят для биоаналогов. Учитывая сложную пространственную структуру молекул, европейские регулирующие органы разработали руководство для производителей биосимиляров, в котором закрепили необходимость проведения дополнительных клинических исследований биосимиляров, а также установили требование демонстрации иммуногенности воспроизведенного препарата.
В результате тщательного изучения всех расхождений между биосимиляром и оригинальным препаратом производители биосимиляров добиваются такой степени схожести, когда спектроскопические данные обоих препаратов, практически совпадают, отражая не только идентичность состава, но и идентичность структуры.
Процессе изучения образцов молекул ученые могут не просто повторить оригинальную молекулу, но и оставить в ней те изменения, которые кажутся им наиболее полезными.
В некоторых направлениях регуляторы разрешают компаниям проявить свои возможности, и тогда появляются биоаналоги, которые отличаются большим сроком хранения, в том числе вне холодильника, меньшим содержанием примесей, меньшей вариативностью. То есть с биологической точки зрения они идентичны оригинальным, а с потребительской – даже обладают преимуществами.
Перспективы
Биотехнологические лекарственные средства внесли большой вклад в терапию тяжёлых метаболических и дегенеративных заболеваний, таких как сахарный диабет, аутоиммунные заболевания, псориаз, онкологические заболевания и др. Истечение сроков патентной защиты на большинство оригинальных биопрепаратов создало предпосылки к внедрению аналогичных биопрепаратов, так называемых биосимиляров.
Буквально за последние пару лет молекулы биопрепаратов, дающие около половины мировых продаж, уже потеряли патентную защиту. Ожидается, что к 2020 г. продажи биосимиляров превысят 100 млрд $. Среди основных факторов развития рынка биосимиляров называют умеренную цену по сравнению с оригинальными продуктами, широкую сферу применения, увеличение заинтересованности в них государства.
Итак, мы выяснили, что минимальные изменения в структуре высокого порядка белковой молекулы могут существенно повлиять на эффективность и иммуногенность препарата. И изучение структуры высокого порядка является важной составляющей критических атрибутов качества (CQA, critical quality attribute), которые используются для характеризации структуры, чистоты, функциональных свойств и стабильности потенциальных лекарственных средств.
Спектроскопия кругового дихроизма (КД) позволяет производить сопоставление вторичной и третичной структуры белков, по спектру КД можно определить содержание альфа- и бета-структур в цепочке, оценить упаковку белка. На 5 международном симпозиуме «Symposium on HOS ofProtein Therapeutics 2016» было отмечено, что круговой дихроизм необходим в 96% случаев при работе с биосимилярами на основе моноклональных антител.
Долгое время метод КД являлся сугубо качественным, вследствие несовершенства технологии калибровки. Сопоставление данных производилось на глаз. Однако Applied Photophysics в 2015 году произвели революцию в этой области, представив новый калибровочный стандарт и разработав методику количественного статистического сопоставления структур qCD (quantitative curcular dichroism).
Использование qCD для исследования биопрепаратов
Точность сопоставления структуры высокого порядка должна быть достаточно высокой чтобы обнаружить даже минимальные различия. При такой точности важна воспроизводимость спектральных данных.

Рассмотрим небольшой пример ниже.
КД-анализ третичной структуры в сильно поглощающем буфере показал различия в области триптофана Fab-фрагментов, ответственных за связывание антитела с антигеном, взятых из разных партий производителя оригинального лекарства.
Статистическая обработка полученных данных показала, что разница в структуре образцов препарата из Америки и Европы является значительной, поскольку выходит за пределы двойного стандартного отклонения.
Заключение
Направление биосимиляров является очень перспективным для российских фармацевтических компаний. Лояльное по сравнению с развитыми странами государственное регулирование (а точнее фактическое его отсутствие) открывает путь для упрощенной регистрации этих препаратов по системе дженериков. В то же время с каждым годом все больше оригинальных биотехнологических препаратов теряют патентную защиту, А курс на импортозамещение сохраняется. Так что ожидаем если не бурного, то хотя бы устойчивого развития нашей фарминдустрии в этой области.
Биосимиляры
После истечения срока действия соответствующих патентов, биологические лекарственные средства могут производить и продавать другие компании, помимо той компании, что первоначально выводила препарат на рынок. Данный новый подкласс биотехнологических препаратов чаще называют термином «биоаналогичные препараты», они могут именоваться «аналогичные биологические лекарственные средства», «биосимиляры», «воспроизведенные биологически активные лекарственные средства» или «аналогичные биотерапевтические препараты».
Биосимиляры открывают возможность более широкого доступа к доступному по цене лечению. Такая возможность, за прошедшие десять лет была равна значимости появления генерических препаратов. Конкуренция на рынке, возникающая вследствие внедрения даже ограниченного количества биосимиляров, позволит значительно сэкономить, так, на примере стран Европейского Союза (ЕС) до нескольких миллиардов евро ежегодно. Долгосрочный потенциал будущей экономии, благодаря биоаналогичным лекарственным средствам, включая биосимиляры моноклональных антител, будет гораздо выше.
Это новое направление в биотехнологии получило существенное развитие после первого принятия регулятивных руководств, стандартов и законов в ЕС в 2004 г, направленных на вывод этой категории лекарственных препаратов на рынки Европы. С того времени в Европе были получены разрешения на продажу более двадцати пяти биосимиляров. Биологические лекарственные препараты получены, из живых организмов с использованием биотехнологий, и зарегистрированы через централизованную процедуру, применяемую в Европе, контроль за которой осуществляется Европейским агентством по лекарственным средствам (EMA). Термин «биоаналогичное лекарственное средство» введен законодательством ЕС, регулирующим соответствующую процедуру утверждения. Также, как и в случае со всеми лекарственными средствами, для обеспечения качества, эффективности и безопасности биоаналогичных лекарственных средств, внедрены Европейские нормы и руководства. Качество, в данном контексте, подразумевает средства контроля и стандарты, постоянно применяемые ко всем процессам производства, приготовления и обработки препарата. Основными учитываемыми аспектами качества являются биологическая потенция и чистота препарата, которые должны находиться в пределах, демонстрируемых эталонным/референтным лекарственным средством.
Для получения регистрации или разрешения на применение биоаналогичные лекарственные средства должны демонстрировать качество, безопасность и эффективность, аналогичные оригинальным референтным препаратам. Биоаналогичные лекарственные средства проходят тщательную оценку на сопоставимость с референтным препаратом. Степень такой сравнимости определяется для каждого препарата индивидуально в тесном сотрудничестве с EMA. Сообразно всем остальным лекарственным препаратам, биоаналогичные лекарственные средства, после выдачи разрешения, постоянно контролируются: для обеспечения возможности непрерывной работы медицинских учреждений через клиницистов и фармацевтов, и для повышения доступа к жизненно-важным биоаналогичным лекарственным средствам большего числа пациентов. Важным критерием является то, что как клиницисты и фармацевты, так и пациенты уверены в том, что ЕМА проводит тщательную оценку таких препаратов с научных позиций, что ведет к одобрению их Европейской комиссией в качестве безопасных и эффективных.
Биосимиляры в ЕС получают разрешение только после длительной и тщательной экспертизы их регистрационных данных, которая всегда включает в себя полную оценку сопоставимости экспертных комиссий по оценке медицинских технологий, закупщиков лекарственных препаратов и изделий медицинского назначения и государственныых органов в сфере регулирования цен и возмещения затрат на лечение.
Основные характеристики биосимиляров:Биосимиляр – это биологический лекарственный препарат, в высокой степени подобный другому биологическому лекарственному препарату, ранее одобренному (так называемому «эталонному» или «референтному» препарату»).
Для изготовления биологических продуктов в основном с помощью рекомбинантной ДНК-технологии и гибридизации используют клетки животных, бактерий, вирусы, грибы и дрожжи.

Первичной структурой рекомбинантных биопрепаратов являются аминокислотные последовательности. В дальнейшем они стабилизируются дисульфидными мостиками (вторичная структура), в заключение препарат приобретает третичную структуру, а многие белки подвергаются гликозилированию, что создает множество изоформ, различающихся по месту гликозилирования и длине углеводных цепей. Такую сложную структуру, несмотря на использование современных методов, включающих контроль над источником клеток, процессом культивирования, очистки, посттрансляционной модификации и т. д., нельзя сделать тождественной, а только аналогичной.
При воспроизводстве биологического препарата могут существовать незначительные отличия от эталонного препарата. Эти незначительные отличия не имеют клинического значения, т.е. различия в безопасности и эффективности не предполагаются. Естественная изменчивость свойственна всем биологическим лекарственным препаратам, для гарантии отсутствия ее влияния на метод работы или безопасности лекарственного препарата применяются жесткие меры контроля.
Одобрение на применение биосимиляров выдаются в соответствии с теми же стандартами качества, безопасности и эффективности лекарственных средств, которые применяются ко всем разрешенным биологическим лекарственным препаратам.
Демонстрируя биоаналогичность, биосимиляр может основываться на показателях безопасности и эффективности, полученных при использовании референтного препарата. Это позволяет избежать ненужного повторения клинических испытаний, уже проведенных с референтным препаратом.
Доказательства, полученные за 10 лет клинического опыта, демонстрируют, что биосимиляры, разрешенные EMA, могут применяться также эффективно и безопасно по соответствующим показаниям к применению, как и другие биопрепараты.
Демонстрация биоаналогичности основывается на комплексных исследованиях сопоставимости с рефренным препаратом.

Если биосимиляр в высокой степени аналогичен эталонному препарату, и обладает сопоставимой эффективностью и безопасностью по одному терапевтическому показанию к применению, данные по безопасности и эффективности могут быть экстраполированы на другие показания к применению, уже разрешенные для референтного препарата. Экстраполяция должна подтверждаться научными данными, полученными в исследованиях сопоставимости (качества, доклинических и клинических).
Экстраполяция не является новой концепцией, но является хорошо обоснованным научным принципом, который уже используется в плановом порядке, когда биологические лекарственные препараты с несколькими утвержденными клиническими показаниями к применению подвергаются существенным изменениям в отношении процесса их производства (например, из-за введения новой рецептуры). В большинстве из этих случаев не требуется повторное проведение клинических испытаний для всех показаний к применению, изменения утверждаются на основании исследований качества и in vitro сопоставимости.
Все показания к применению биологических лекарственных препаратов (включая биосимиляры) были установлены, исходя из убедительных научных доказательств.
Безопасность биосимиляров контролируется посредством проводимых мероприятий по фармаконадзору, так же, как и в случае с любым другим лекарственным препаратом. Не существует отдельного требования по безопасности, применимого только к биосимилярам из-за другого способа их разработки.
За последние 10 лет системой мониторинга ЕС не было выявлено ни одно соответствующее отличие в характере, тяжести или частоте нежелательных явлений биосимиляров и их референтных препаратов.
Конкурентоспособность биосимиляров может дать преимущество системам здравоохранения стран, так как предполагается, что они позволят увеличить доступ пациентов к безопасным и эффективным биологическим лекарственным препаратам с проверенным качеством.

С момента первого клинического использования биосимиляра в 2006 году, в ЕС с каждым годом растет количество биосимиляров получающих разрешение на выход в рынок и затем безопасно применяющиеся в клинической практике.
За исключением иммунологических реакций, большинство побочных лекарственных действий могут быть предсказаны, исходя из фармакологического действия, и имеют место как при использовании референтного препарата, так и при использовании биосимиляра (например, высокий уровень гемоглобина при использовании эпоэтина).
Данные по безопасности биосимиляров у пациентов собирают в ходе активных мероприятий по фармаконадзору. К ним относятся плановые мероприятия по фармаконадзору и специальный мониторинг в соответствии с указанным в регистрационном досье — Плане управления риском (ПУР).
По результатам специального мониторинга за биосимилярами более чем за 10 лет:
из более чем 25 биосимиляров, разрешенных к применению в ЕС по сей день, ни один не был отозван или приостановлено использование, по соображениям безопасности или эффективности.
В течении последних 10 лет, система мониторинга ЕС по безопасности лекарственных средств не обнаружила какой-либо разницы в отрицательном действии, его силе и частоте, между биосимилярами и референтными препаратами.
Почему биосимиляры не считаются генерическими лекарственными средствами
Биосимиляр не рассматривается в качестве генерика биологического лекарственного препарата в основном потому, что естественная изменчивость и более сложный процесс производства биологических лекарственных препаратов не позволяют точно воспроизвести молекулярную микрогетерогенность. Соответственно, требуется проведение большего числа исследований для получения разрешений регуляторных органов на биосимиляры, чем на генерики, для гарантии того, что на безопасность или эффективность не окажут влияния незначительные изменения. В таблице приведено сравнение процесса разработки и характеристик генериков и биосимиляров.
В таблице приведено сравнение процесса разработки и характеристик генериков и биосимиляров.
Сравнение характеристик разработки генериков и биосимиляров | |
Генерический лекарственный препарат | Биоаналогичное лекарственное средство (биосимиляр) |
Как правило, производится методом химического синтеза. | Получают из биологического источника. |
Как правило, возможно получение точно такой же молекулы. | Возможно воспроизводство молекулы с высокой степенью подобия, благодаря уникальным биологическим методам производства и естественной биологической изменчивости |
В основном, молекулы меньшего размера, которые легче охарактеризовать. | В основном, молекулы большего размера, с более сложной структурой, которые требуют многочисленных технологий для составления их характеристик. |
Потребность в полных данных по фармацевтическому качеству. | Потребность в полных данных по фармацевтическому качеству, плюс дополнительные исследования качества, в которых осуществляется сравнение структуры и биологической активности биосимиляра с эталонным препаратом. |
Разработка на основании демонстрации биоэквивалентности (т.е. что генерик и эталонный препарат высвобождают в организм активное вещество с одинаковой скоростью и в той же степени в аналогичных условиях). | Разработка на основании демонстрации биоаналогичности с использованием исследований сопоставимости (комплексного прямого сравнительного исследования биосимиляра с эталонным препаратом для демонстрации высокой степени аналогичности химического строения, биологической функции, эффективности, безопасности и иммуногенности) |
Значение биосимиляровДля пациентов
В своей борьбе с болезнями, влияющими на дееспособность и угрожающими жизни, пациенты вправе иметь доступ к безопасным способам биологического лечения. Биосимиляры делают многие из этих биофармацевтических препаратов более доступными для пациентов, в некоторых случаях, значительно более доступными. Потенциальная экономия, ожидаемая от введения биосимиляров в систему здравоохранения ЕС, может привести к тому, что большее количество пациентов получит доступ к необходимым лекарственным средствам.
Биосимиляры делают многие из этих биофармацевтических препаратов более доступными для пациентов, в некоторых случаях, значительно более доступными. Потенциальная экономия, ожидаемая от введения биосимиляров в систему здравоохранения ЕС, может привести к тому, что большее количество пациентов получит доступ к необходимым лекарственным средствам.
Для врачей — биосимиляры являются безопасной терапевтической альтернативой для необходимых, но дорогостоящих референтных препаратов. Научный принцип разработки биосимиляров – это тщательное сравнение по качеству, эффективности и безопасности, направленное на доказательство схожести биосимиляра с исходным референтным препаратом. Как следствие успешной демонстрации сопоставимости того или иного биосимиляра референтному препарату, существующие профили безопасности и эффективности соответствующего референтного препарата станут также применимы к биосимиляру.
Для политических деятелей, советников и представителей правительственных структур и медицинских страховых компанийБиосимиляры повышают конкуренцию на рынке биофармацевтических препаратов, также как генерические лекарственные средства повышают конкуренцию на рынке небиофармацевтических препаратов. В результате этой высокой конкуренции, больше пациентов смогут получить доступ к необходимым биофармацевтическим препаратам, вследствие чего будет снижена стоимость лечения. Конкуренция стимулирует дальнейшее развитие инноваций в фармацевтической индустрии Казахстана. Понимание этих преимуществ должно подтолкнуть политических деятелей, советников и представителей правительственных структур, к поддержке соответствующих законодательных решений и быстрому введению биосимиляров на рынок лекарственных средств.
Таким образом, биосимиляры – являются терапевтически эквивалентной и более экономичной альтернативой существующим дорогостоящим биофармацевтическим препаратам. Это означает, что большее количество пациентов могут получить лечение в рамках того же бюджета, и по необходимости, лечение может начаться на более раннем этапе. Биосимиляры предоставляют уникальную возможность в управлении растущих расходов на биофармацевтические препараты. Аналогично тому, как генерические аналоги химических препаратов широко используются в наше время в системе здравоохранения стран ЕС, и уровень их использования намного выше, чем в начале их использования в 1980х годах, точно такой же процесс можно прогнозировать с биосимилярными видами биофармацевтических препаратов. Разумно полагать, что в ближайшие годы будут поданы новые заявки и получены новые разрешения на биосимиляры, особенно на биосимилярные препараты моноклональных антител.
Биосимиляры предоставляют уникальную возможность в управлении растущих расходов на биофармацевтические препараты. Аналогично тому, как генерические аналоги химических препаратов широко используются в наше время в системе здравоохранения стран ЕС, и уровень их использования намного выше, чем в начале их использования в 1980х годах, точно такой же процесс можно прогнозировать с биосимилярными видами биофармацевтических препаратов. Разумно полагать, что в ближайшие годы будут поданы новые заявки и получены новые разрешения на биосимиляры, особенно на биосимилярные препараты моноклональных антител.
Биосимиляры: новая группа лекарственных средств
Роза Ягудина о том, почему так называемые аналоги биотехнологических препаратов нельзя считать дженериками
В ближайшие несколько лет истекает срок патентной защиты сразу для множества биотехнологических препаратов, которые используются в лечении сложнейших онкологических, эндокринологических и других заболеваний. Так, до 2015 года истекает срок патентной защиты у более чем 30 оригинальных биотехнологических лекарственных средств, объем мирового рынка которых составляет около 50 миллиардов долларов США. После окончания патентной защиты на рынке в большом количестве появляются аналоги биотехнологических препаратов. Уже сегодня в медицинской практике используется большое количество аналогов препаратов, которые лишились патентной защиты, например, аналогов интерферона. Однако исследования ученых показывают, что в случае с биотехнологическими препаратами говорить об «аналогах» можно только условно. На самом деле произвести препарат, на 100% идентичный биотехнологическому оригинальному препарату, очень сложно, а зачастую и невозможно. Являются ли в такой ситуации так называемые аналоги оригинальных биотехнологических препаратов (биосимиляры) безопасными для пациентов? Можно ли проводить синонимическую замену оригинального биотехнологического препарата на его аналог без риска для больного? Этим и другим вопросам, связанным с аналогами биотехнологических препаратов, посвящена наша статья.
Революция в медицине: биотехнологические лекарства — биосимиляры
Сегодня зарегистрировано более 200 биотехнологических лекарственных средств, тысячи новых препаратов изучаются в клинических исследованиях и около 300 из них находятся на завершающих стадиях исследований. Около половины всех разрабатываемых в мире препаратов — это биотехнологические лекарственные средства.
Биотехнологические препараты перевернули представления человечества о возможностях медицины, поскольку они открыли пути лечения заболеваний, еще недавно считавшихся полностью неизлечимыми. Пациенты с такими страшными диагнозами, как онкологические заболевания, диабет, рассеянный склероз, хроническая болезнь почек в стадии почечной недостаточности и другие, получили возможность полностью излечиться или существенно повысить качество жизни и увеличить ее продолжительность.
Первые поколения биотехнологических препаратов представляли собой продукты животного или растительного происхождения, например, бычий инсулин, стрептокиназа и другие. Затем появились продукты человеческого происхождения — гормон роста, антигемофильный фактор VIII. Первым биотехнологическим лекарственным средством стал рекомбинантный человеческий инсулин, выпущенным на фармацевтический рынок в 1982 году.
Сегодня под биотехнологическими лекарственными средствами в зарубежной практике (например, согласно документам Европейского медицинского агентства, EMA – European Medicines Agency) подразумеваются иммунобиологические лекарственные средства, произведенные с помощью генной инженерии. В частности, при их производстве применяется технология рекомбинантной ДНК, метод контролируемой экспрессии генов и другие. Подавляющее большинство применяемых сегодня биотехнологических препаратов представляют собой рекомбинантные белки, полученные методом генной инженерии.
В российском законодательстве отсутствует определение биотехнологического лекарственного средства. Однако дано определение иммунобиологических лекарственных препаратов, под которыми подразумеваются лекарственные препараты биологического происхождения, предназначенные для иммунологической диагностики, профилактики и лечения заболеваний.
Что такое биосимиляры?
Прежде чем дать определение этому новому термину, необходимо разобраться с тем, почему вообще возникла необходимость в нем, ведь для обозначения аналога оригинального лекарственного средства уже используется термин «дженерик», а в российском законодательстве — термин «воспроизведенное лекарственное средство».
Согласно российскому законодательству, воспроизведенное лекарственное средство — это лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»). При этом в российском законодательстве под оригинальным лекарственным средством подразумевается лекарственное средство, содержащее впервые полученную фармацевтическую субстанцию или новую комбинацию фармацевтических субстанций, эффективность и безопасность которых подтверждены результатами доклинических исследований лекарственных средств и клинических исследований лекарственных препаратов (ФЗ № 61 от 12 апреля 2010 г. «Об обращении лекарственных средств»).
В зарубежной практике, в частности в Евросоюзе и США, считается, что дженерик как препарат, химически идентичный оригинальному, может быть произведен только для химических препаратов. А для биотехнологических препаратов произвести из живых организмов полностью идентичный аналог затруднительно. Можно произвести только похожий препарат — биосимиляр. Или, в другой терминологии, — биоаналог, биоаналогичный препарат, биоподобный препарат, follow-on protein products («препарат, подобный белковым лекарственным средствам»).
Определение биосимиляра дается в директиве Евросоюза 2003 года. Согласно ей, биосимиляр — это биотехнологическое лекарственное средство, схожее с произведенным впервые оригинальным лекарственным средством и представленное на регистрацию после истечения срока действия патента оригинального препарата.
В российском законодательстве понятие биосимиляра отсутствует, и подобные препараты регистрируются, согласно процедуре, аналогичной процедуре регистрации дженериков (воспроизведенных лекарственных средств). Однако за рубежом процесс регистрации биосимиляров в корне отличается от регистрации дженериков. Например, в Европе, чтобы вывести на рынок биосимиляр, необходимо провести клинические испытания, которые по объему и тщательности сопоставимы с испытаниями оригинального препарата.
Биосимиляры и дженерики: в чем разница?
Почему зарубежные ученые пришли к выводу о том, что биосимиляры нельзя считать дженериками? Ключевое различие между ними кроется в их химической структуре.
Дженерики, которые являются аналогами синтетических препаратов, имеют сравнительно простую структуру молекулы действующего вещества. С помощью методов современного химического анализа идентичность молекулы дженерика молекуле оригинального препарата может быть проверена на 100%. Именно поэтому для регистрации аналогов химических препаратов достаточно доказать идентичность действующего вещества и провести фармакокинетические исследования.
Биотехнологические препараты, напротив, имеют очень сложную структуру молекулы действующего вещества. Чаще всего это протеин, который имеет молекулярную массу в сотни и даже тысячи раз большую, чем вещества, получаемые методом химического синтеза. Причем на сегодняшний день практически не существует таких аналитических методик, которые позволяли бы оценить все биологические и клинические свойства белков в биосимилярах и на 100% подтвердить их идентичность веществам, которые использованы в оригинальных препаратах. Молекулы действующего вещества в биотехнологических препаратах имеют сложную пространственную структуру — первичную, вторичную, третичную и даже четвертичную. В одну молекулу может входить до 1300 аминокислот, а также дополнительные молекулы, например, сахара. Полностью оценить различия эффективности и безопасности между оригинальными биотехнологическими препаратами и биосимилярами можно только в ходе клинических испытаний.
Сравнение молекулы синтетического и биотехнологических препаратов
Диклофенак |
синтетические молекулы |
вес молекулы = 318 Дальтон 0 аминокислот |
Кальцитонин |
простые биопрепараты |
вес молекулы = 3455 Дальтон ~ 32 аминокислоты — без модификации клетки-хозяина — производится в дрожжах, бактериях
|
Моноклональные антитела (IgG) |
сложные биопрепараты |
вес молекулы = 150 000 Дальтон ~ 1300 аминокислот — с модификацией клетки-хозяина (гликозилирование и т.д.) — производится в клетках млекопитающих
|
Характеристики молекулы | Химический препарат | Биотехнологический препарат |
Размер молекулы | 300–1000 Да | До 150 000 Да |
Сложность | Простая молекула, нет аминокислот | Первичная, вторичная, третичная, четвертичная структура: более тысячи аминокислот в первичной структуре полипептидной цепи + дополнительные молекулы (например, сахара), сложная пространственная конфигурация |
Стабильность | Обычно стабильный | Часто нестабильный, стабильность зависит от множества условий |
Модификации | Определенная молекула | Много вариантов, различающихся по свойствам, эффективности и безопасности |
Производство | Предсказуемый химический синтез | Сложный процесс |
Контроль качества | Менее 500 тестов | Более 2000 тестов |
Характеризация продукта | Легко выполнима | Очень сложна, так как это смесь близкородственных молекул |
Создание идентичного препарата | Возможно | Затруднительно в связи со сложностью строения молекулы и сложностью процесса производства |
Не все биосимиляры одинаковы
Производство биотехнологического лекарственного средства — очень сложный процесс, который длится обычно более 10 лет. В создании нового биотехнологического препарата участвуют сотни специалистов, а стоимость его производства достигает миллиарда долларов.
В создании нового биотехнологического препарата участвуют сотни специалистов, а стоимость его производства достигает миллиарда долларов.
Процесс производства биотехнологического препарата очень сложен. Для создания белка, который будет использован в качестве действующего вещества в биотехнологическом препарате, используется уникальная линия живых клеток. Процесс производства включает более 5000 критических этапов, а для контроля качества препарата используется более 2000 тестов. При производстве биосимиляра точно воспроизвести всю сложнейшую технологию производства действующего вещества, мягко говоря, очень сложно.
Процесс производства уникален, и отличия на каждом этапе могут влиять на эффективность и безопасность препарата. В каждом производственном процессе используют свою оригинальную комбинацию растворителей, ферментов, материалов для колонок, буферных растворов. В результате в полученном действующем веществе остаются индивидуальные «отпечатки» примесей. Практически невозможно создать два абсолютно идентичных банка клеток для производства препарата. Также на качество конечного продукта может повлиять любое изменение условий культивирования клеток, методы очистки вещества и другие этапы производства. В итоге на выходе биосимиляр должен быть очень сходным с оригинальным препаратом.
Именно в связи с этими специфическими свойствами биотехнологических лекарственных препаратов в Евросоюзе на сегодняшний день детально проработано законодательство, регламентирующее допуск в сферу медицинского применения биотехнологических препаратов и их воспроизведенных копий — биосимиляров. Не все биосимиляры, которые предоставляются для регистрации в Евросоюзе, проходят этапы экспертизы до конца. Например, EMA в 2007 году отказало в регистрации трем биоаналогам инсулина, произведенным компанией Marvel, также было отказано в регистрации препарата «Интерферон альфа» компании Bio Partners.
К чему может привести изменения структуры действующего вещества в биотехнологических препаратах? Последствия могут быть очень серьезными — от снижения эффективности препарата до возникновения аллергических реакций. Например, в 2008 году было опубликовано исследование рекомбинантных эритропоэтинов, которое выявило, что некоторые биосимиляры этого препарата имели другую фармакокинетику, скорость выведения из организма, биологическую и терапевтическую активность и иммуногенность (Хасабов Н. Н. «Биологические лекарственные средства и их биоаналоги: определение, вопросы качества, идентичности и безопасности. «Вестник Росздравнадзора» №6, 2008 г.).
Например, в 2008 году было опубликовано исследование рекомбинантных эритропоэтинов, которое выявило, что некоторые биосимиляры этого препарата имели другую фармакокинетику, скорость выведения из организма, биологическую и терапевтическую активность и иммуногенность (Хасабов Н. Н. «Биологические лекарственные средства и их биоаналоги: определение, вопросы качества, идентичности и безопасности. «Вестник Росздравнадзора» №6, 2008 г.).
Европейское медицинское агентство (EMA) разработало жесткие требования к регистрации биосимиляров. В Евросоюзе для получения регистрации биосимиляра необходимо провести практически такой же объем исследований, как и для оригинального препарата. Производитель должен доказать, что эффективность, профиль безопасности и уровень иммуногенности препарата сравнимы с соответствующим оригинальным препаратом. Для этого необходимо провести доклинические исследования, клинические исследования, исследования иммуногенности и др. EMA разработало специальные требования для регистрации препаратов даже по отдельным группам биосимиляров: соматостатины, эритропоэтины, инсулины, гепарины, интерфероны и др. В целях однозначной идентификации жесткие требования применяются и к присвоению названий биосимиляров. Кроме того, эксперты в ЕС считают, что замена оригинального препарата на биосимиляр должна быть обоснована, она не может проводиться автоматически как синонимическая замена. Окончательное решение о применении биосимиляра принимает врач под свою ответственность.
Специальные процедуры экспертизы и допуска биосимиляров в сферу медицинского применения разработаны и в других странах, например в Австралии, Малайзии, Турции, Японии, Израиле, Канаде, Южной Корее и др.
Биосимиляры в России
Несмотря на то что в российском законодательстве нет понятия «биоаналог» или «биосимиляр», существование проблемы идентичности биосимиляров оригинальным препаратам косвенно признается. Всё чаще эта проблема обсуждается на конференциях для специалистов здравоохранения. Кроме того, есть отдельные примеры, показывающие, что российские специалисты признают особую природу биотехнологических лекарственных средств. Например, еще в 2007 году на законодательном уровне было принято решение о том, что ряд лекарственных средств, в том числе и некоторые биотехнологические препараты, составляют исключение из общего правила при размещении государственных заказов и могут закупаться не по международным непатентованным, а по торговым наименованиям. Кроме того, рассматривается вопрос о составлении перечня взаимозаменяемых лекарственных средств, который, конечно же, будет иметь большое значение для рассматриваемой нами группы биотехнологических препаратов.
Кроме того, есть отдельные примеры, показывающие, что российские специалисты признают особую природу биотехнологических лекарственных средств. Например, еще в 2007 году на законодательном уровне было принято решение о том, что ряд лекарственных средств, в том числе и некоторые биотехнологические препараты, составляют исключение из общего правила при размещении государственных заказов и могут закупаться не по международным непатентованным, а по торговым наименованиям. Кроме того, рассматривается вопрос о составлении перечня взаимозаменяемых лекарственных средств, который, конечно же, будет иметь большое значение для рассматриваемой нами группы биотехнологических препаратов.
В настоящее время подготовлено предложение по внесению в Федеральный закон «Об обращении лекарственных средств» понятия «биоаналогичного» или «биоподобного» препарата. Термин пока что уточняется. Вероятно, можно ожидать, что, как и во многих других странах, в России будут введены специальные требования для регистрации биосимиляров.
Биотехнологические препараты — это уникальные препараты, которые существенно расширили возможности современной медицины. Сегодня, когда истекает срок действия ряда патентов оригинальных биотехнологических препаратов, неизбежно появятся биоаналоги, биосимиляры. Это позволит увеличить доступность биотехнологических препаратов для населения. Однако важно, чтобы эти сложные современные препараты проходили тщательные испытания, чтобы доказывалась их эффективность и безопасность, прежде чем они будут применены для лечения пациентов. Только в этом случае применение различных биотехнологических лекарственных средств, в том числе и биосимиляров, приведет не к снижению, а к повышению качества жизни пациентов и продлению их жизни.
Уважаемые коллеги, мы только кратко и очень обзорно коснулись такой интересной и сложной темы, как биотехнологические лекарственные средства и биосимиляры. Безусловно, в рамках одной статьи невозможно дать полную картину.
Однако, если вам эта тема показалась интересной и полезной, более подробно вы можете ознакомиться с ней, прочитав подготовленную нами специальную монографию «Биотехнологические лекарственные средства и биосимиляры», которая вышла в середине прошлого года*.
*Р.И. Ягудина, М.В. Проценко «Биотехнологические лекарственные средства и биосимиляры». Издательство: «Шико», 2012
Описание | Объем продаж в ценах конечного потребления, в миллионах USD | |||
январь-октябрь 2012* | январь-октябрь 2011 | 2011 | 2010 | |
Биопрепараты, полученные из естественных источников (в т. ч. бакпрепараты) | 1 463 | 1 360 | 1 641 | 1 782 |
Биопрепараты, полученные методами генной инженерии (рекомбинантные лекарственные средства) | 1 302 | 1 367 | 1 569 | 1 458 |
| ||||
Описание | Объем продаж в натуральном выражении, в миллионах упаковок | |||
январь-октябрь 2012 | январь-октябрь 2011 | 2011 | 2010 | |
Биопрепараты, полученные из естественных источников (в т. ч. бакпрепараты) | 127 | 115 | 143 | 199 |
Биопрепараты, полученные методами генной инженерии (рекомбинантные лекарственные средства) | 26 | 23 | 29 | 35 |
По данным Центра маркетинговых исследований «Фармэксперт».
* Данные за ноябрь-декабрь 2012 г. на момент подготовки статьи отсутствовали.
препараты будущего – тема научной статьи по фундаментальной медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
!АШ|ЖадМ5ВИ5В11ИШЕ301К
Биосимиляры — препараты будущего
Ельцова Е.А., Раменская Г.В., Смолярчук Е.А., Бушманова А.В.
ГБОУ ВПО «Первый Московский Государственный Медицинский Университет им. И.М. Сеченова»,
г. Москва
Резюме. В статье изложены основные термины и определения, относящиеся к биосимилярам, дженерикам и оригинальным препаратам. Также описана краткая история возникновения и развития биотехнологической промышленности и препаратов, полученных с помощью биообъектов. Приведены основные различия между биосимилярами и дженериками, а также их отличия от инновационных лекарственных препаратов. Рассмотрен процесс биотехнологического производства и основные области применения биосимиляров. Проанализирована нормативно-правовая база Российской Федерации и Европейского Союза.
Ключевые слова: биосимиляр, биотехнология, биоаналог, подобный биологический лекарственный продукт, дженерики
Biosimilars — drugs of the future
Eltcova E.A., Ramenskaya G.V., Smolyarchuk E.A., Bushmanova A.V.
First Moscow State Medical University named after I.M. Sechenov, Moscow
Abstract. The article describes the basic terms and definitions relating to biosimilars, generics and original drugs.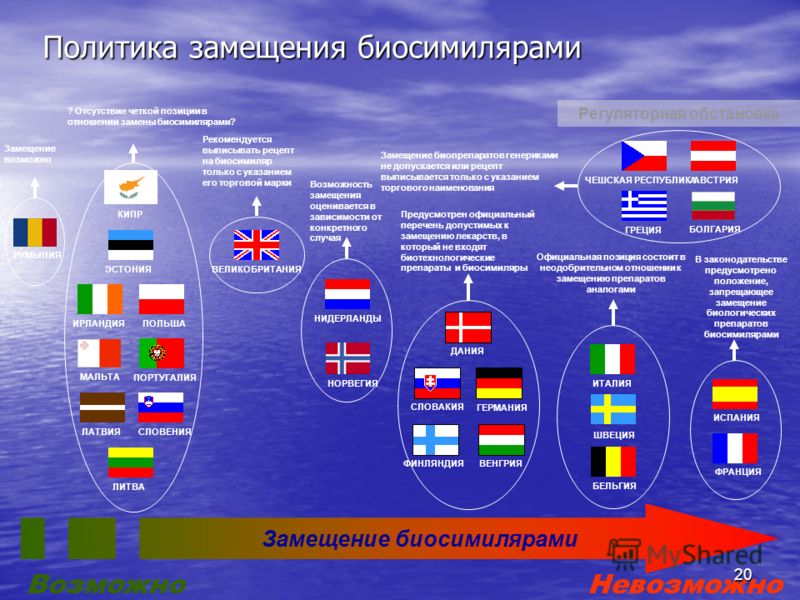 Also described a brief history of the origin and development of the biotechnology industry and drugs produced using biological objects. The main difference between biosimilars and generics, as well as their differences to innovative medicines. The process of biotechnological production, and main applications of biosimilars. It analyzed the legal framework of the Russian Federation and the European Union.
Also described a brief history of the origin and development of the biotechnology industry and drugs produced using biological objects. The main difference between biosimilars and generics, as well as their differences to innovative medicines. The process of biotechnological production, and main applications of biosimilars. It analyzed the legal framework of the Russian Federation and the European Union.
Keywords: biosimilar, biotechnology, bioanalogue, similar biological medicinal product, generic
Автор, ответственный за переписку:
Ельцова Е.А. — ГБОУ ВПО «Первый Московский Государственный Медицинский Университет им. И.М. Сеченова»; адрес: 119991, г. Москва, ул. Трубецкая, д. 8, стр. 2
Введение
Биотехнология — стремительно развивающаяся отрасль современного естествознания, которая находит всё большее применение в различных сферах деятельности, и особенно в медицине. Всё активнее разрабатываются и внедряются в медицинскую практику новые биофармацевтики — лекарственные средства, полученные с помощью современных биотехнологий [1].
Биосимиляры — это аналоги биофармацевтических лекарственных средств, с близкой, но не идентичной исходной молекулой. Они представляют собой современные лекарственные препараты на основе белков, полученных путём биологического синтеза в клетках дрожжей и бактерий [4]. На биотехнологические препараты сейчас возлагают основные надежды как на средства борьбы с наиболее опасными неинфекционными заболеваниями современности (рак, рассеянный склероз, болезнь Альцгеймера, болезни накопления и др.) [19].
Термины и определения
Воспроизведённые биологические лекарственные средства сегодня чаще всего называют биосимилярами (biosimilars). Этот термин возник в результате сокращения довольно длинного словосочетания, которым именуют эту категорию официальные документы («similar biological medicinal product»). Впервые понятие «аналогичный биологический лекарственный
Этот термин возник в результате сокращения довольно длинного словосочетания, которым именуют эту категорию официальные документы («similar biological medicinal product»). Впервые понятие «аналогичный биологический лекарственный
продукт» было использовано в Директиве 2003/63/ЕС (ч.2, абз.4), дополнившей Директиву Европарламента и Евросоюза 2001/83/ЕС (Европейский фармацевтический кодекс) [20].
Под термином биосимиляр понимают полученное с помощью биотехнологий воспроизведённое лекарственное средство (ЛС), которое может быть разрешено к медицинскому применению после истечения срока действия патента на оригинальное активное вещество [3].
Иногда эту категорию лекарственных препаратов называют также «биодженериками».
Однако это вряд ли верно, поскольку действующее вещество воспроизведённого биотехнологического препарата, в отличие от «классических» дженериков, не полностью идентично оригинальному веществу. Причиной неполной идентичности являются различные организмы, с помощью которых синтезируется целевой протеин, а также другие методы получения, очистки или иные способы гликозилирования. Всё это влияет на фармакокинетику и иммуногенность.
С точки зрения регуляторных органов, в частности FDA (Food and Drug Administration) и EMA (European Medicines Agency, ранее ЕМЕА), эти препараты следует называть аналогами биотехнологических ЛС или биоаналогами (biosimilars) [4].
В последнее время часто употребляется также термин Follow-on-Biologicals. Под ним понимают действительно новые, собственные разработки производителей по известным прототипам [4].
ткжадглвиыишЕзор
Дженерики, химически воспроизведённые ЛС, являются по существу аналогичными лекарственными препаратами. В отношении же биотехнологически воспроизведённых ЛС используется термин «подобный биологический лекарственный продукт». Хотя такого понятия («биосимиляр», «биоподобный лекарственный препарат») в российском законодательстве не закреплено.
В отношении же биотехнологически воспроизведённых ЛС используется термин «подобный биологический лекарственный продукт». Хотя такого понятия («биосимиляр», «биоподобный лекарственный препарат») в российском законодательстве не закреплено.
Развитие биотехнологических препаратов
Биотехнологические лекарственные препараты получают с помощью биообъектов, которые чаще всего представлены микроорганизмами и ферментами (также это могут быть растения) [17].
Своё развитие они начали в 1940 году, когда английский бактериолог Хоуард У. Флори и биохимики Э. Чейн работали над выделением и промышленным производством пенициллина.
Спустя почти 75 лет биотехнологические лекарственные препараты занимают большую часть рынка. В 2001 г. на долю биопрепаратов приходилось только 7% общего объёма продаж TOP-10 самых продаваемых препаратов. В 2012 г. этот показатель составил уже 71% [4].
Перспективы, которые открываются благодаря биотехнологии, объясняют такие темпы развития.
Преимуществами биотехнологического производства являются возможность получения специфических соединений, которые не удаётся создать с помощью химического синтеза, проведение биотехнологических процессов в мягких условиях (при относительно невысоких температурах и давлениях), экологичность (т.к. близки к естественным процессам, а также возможность использовать в качестве сырья отходы сельского хозяйства). Микроорганизмы, как биообъекты, имеют большую скорость роста, что позволяет синтезировать целевой продукт в больших количествах. При этом в настоящее время истекает срок патентной защиты многих биотехнологических препаратов, что и способствует производству биосимиляров [1].
Основные отличия биосимиляров и дженериков
Воспроизведённое лекарственное средство (джене-рик) — это лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию
таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства [2].
Таким образом, дженерик — это ЛС, аналогичное оригинальному препарату, полученное с помощью химического синтеза. Для того, чтобы он был терапевтически эквивалентен запатентованному ЛС, необходимо лишь доказать идентичность химической формулы одного или нескольких действующих веществ и провести фармако-кинетические исследования.
Поскольку нет необходимости проводить клинические исследования, дженерики ниже по стоимости и быстрее выводятся на рынок.
Ситуация же с биосимилярами совершенно другая. Они представляют собой сложные пептидные молекулы, чаще всего синтезируемые микроорганизмами, с массой от десятков до сотен кД. Белок может быть первичной, вторичной, третичной и четвертичной структуры, которая наиболее подвержена изменениям при незначительных модификациях технологического процесса. В отличие от химических молекул, взаимодействия внутри молекулы белка прогнозировать очень сложно [18].
Белковая природа молекулы также является причиной её нестабильности: свойства препарата могут меняться под воздействием различных факторов (температура, давление, кислород, влияние вспомогательных веществ и упаковки).
Биотехнологическое производство
Биотехнологическое производство представляет собой многоэтапный и сложный процесс, схему которого можно представить в следующем виде: выделение необходимого участка ДНК, введение его в вектор, встраивание вектора в клетку-хозяина, скрининг и отбор рекомбинантных клеток для создания банка клеток, культивирование и получение целевого продукта, выделение и очистка, создание лекарственной формы [11].
По определению EMA, биопрепараты — это лекарственные средства, произведённые путём биотехнологических процессов с применением технологии рекомби-нантной ДНК; метода контролируемой экспрессии генов, кодирующих выработку биологически активных белков,
Параметр сравнения Инновационный биотехнологический препарат Биосимиляр Дженерик
Производство • Синтезируются в специализированных клеточных линиях • Чувствительны к изменениям производственного процесса — используется дорогое и специализированное оборудование • Трудно установить воспроизводимость • Получают путём химического синтеза • Менее чувствительны к изменениям производственного процесса • Воспроизводимость легко установить
Клинические исследования • Обширные клинические исследования, включая фазы МП • Требуется постоянный фармаконадзор и периодические обновления данных по безопасности • Часто только фаза I исследований • Упрощённая процедура регистрации
Регуляторные аспекты На данный момент не предназначены для «автоматической» замены «Автоматическая» замена запрещена • Требуется доказательство биоэквивалентности • «Автоматическая» замена разрешена
Таблица 1
Сравнение дженериков, биосимиляров и инновационных биотехнологических продуктов [4]
!АШ|ЖадМ5ВИ5В11ИШЕ301К
методом гибрид и моноклональных антител [10]. Большинство протеинов подвергаются посттрансляционной модификации. Например, путём сплайсинга, повторов, замен аминокислот, олигомеризации, а также присоединения различных групп (гликозилирование, сульфатиро-вание, фосфорилирование). Эти процессы определяют как биологическую активность белка, так и микрогетерогенность [12].
Большинство протеинов подвергаются посттрансляционной модификации. Например, путём сплайсинга, повторов, замен аминокислот, олигомеризации, а также присоединения различных групп (гликозилирование, сульфатиро-вание, фосфорилирование). Эти процессы определяют как биологическую активность белка, так и микрогетерогенность [12].
Живые клеточные системы подвержены также и естественным изменениям, вследствие чего нельзя получить идентичный биотехнологический препарат. Можно произвести лишь подобный препарат, что и закреплено в терминологии — биосимиляр, биоаналог, биоподобный препарат, follow-on protein products («препарат, подобный белковым лекарственным средствам»). Поэтому безопасность и эффективность этих продуктов будет сильно зависеть от надёжности контроля качества [16, 21].
Система разработки и производства биосимиляров направлена на обеспечение эквивалентности референтному продукту. Для этого необходимо разрабатывать такие технологии, в результате которых различия будут не более значительны, чем после изменений производственных процессов оригинального продукта.
Области применения биосимиляров
К биотехнологическим препаратам относятся гормоны, цитокины, факторы свертывания крови, моно-клональные антитела, ферменты, колониестимулиру-ющие факторы, вакцины, антибиотики и препараты, созданные на базе клеток и тканей. Они используются при анемиях, лейкемиях, нейтропениях, при онкологии и в трансплантологии, при сахарном диабете, задержке роста, тромбозах и инфекциях. Производство лекарственных препаратов на основе моноклональных антител занимает второе место после вакцин, 80% из которых используется в онкологии.
Нормативно-правовая база
Европейское медицинское агентство по лекарственным средствам (EMA) является ведущим регуляторным органом по разработке нормативных актов касательно биотехнологических лекарственных препаратов: Директива 2003/63/ЕС, Директива 2004/27/ЕС [21], Руководство по подобным биологическим лекарственным продуктам 2005 г. В данных документах отражены общие понятия и положения по регулированию обращения биосимиляров. Также есть руководства по проведению доклинических и клинических исследований, контролю качества, оценке иммуногенности и приложения по вопросам доклинических и клинических исследований для отдельных классов биосимиляров для:
В данных документах отражены общие понятия и положения по регулированию обращения биосимиляров. Также есть руководства по проведению доклинических и клинических исследований, контролю качества, оценке иммуногенности и приложения по вопросам доклинических и клинических исследований для отдельных классов биосимиляров для:
• соматропина [7];
• инсулина [9];
• гранулоцитарного колониестимулирующего фактора [5];
• эритропоэтина [6];
• моноклональных антител [14];
• низкомолекулярных гепаринов [13];
• интерферонов альфа [15].
Анализ сопоставимости должен показывать, что био-симиляры полностью идентичны по эффективности, безопасности и качеству оригинальному биотехнологическому препарату. Но даже при полном соблюдении технологии производства клиническая эффективность биосимиляров может отличаться даже от серии к серии. Поэтому при их регистрации требуется проведение клинических исследований.
Однако и после регистрации необходимо также следить за безопасностью биосимиляра, т.к. временные рамки клинических исследований не позволяют полностью выявить ряд побочных явлений и иммуногенность препарата. Так, при длительном применении рекомби-нантных препаратов в организме пациентов вырабатываются антитела, которые нейтрализуют его.
Нормативно-правовая база в России пока не разработана. В ФЗ №61 не закреплено понятие «биоаналог». Однако в настоящее время существует проект поправок Федерального закона от 21 января 2013 г. «О внесении изменения в Федеральный закон «Об обращении лекарственных средств» и в статью 333. 32.1. части второй Налогового кодекса Российской Федерации», согласно которому биоаналоговое лекарственное средство (биоаналог) — биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством по технологии производства, фармацевтической субстанции (комбинации фармацевтических субстанций), лекарственной форме, показаниям к применению и поступившее в обращение с соблюдением прав интеллектуальной собственности на оригинальное лекарственное средство [3].
32.1. части второй Налогового кодекса Российской Федерации», согласно которому биоаналоговое лекарственное средство (биоаналог) — биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством по технологии производства, фармацевтической субстанции (комбинации фармацевтических субстанций), лекарственной форме, показаниям к применению и поступившее в обращение с соблюдением прав интеллектуальной собственности на оригинальное лекарственное средство [3].
Будущее биосимиляров
Биотехнологические лекарственные средства внесли большой вклад в терапию тяжёлых метаболических и дегенеративных заболеваний, таких как сахарный диабет, аутоиммунные заболевания, псориаз, онкологические заболевания и др. Истечение сроков патентной защиты на большинство оригинальных биопрепаратов создало предпосылки к внедрению аналогичных биопрепаратов, так называемых биосимиляров.
Согласно данным прогноза продаж фармацевтического рынка на 2014 год молекулы биопрепаратов, дающие около 40% мировых продаж потеряют патентную защиту к 2015 г. Ожидается, что к 2020 г. продажи биосимиляров превысят 100 млрд $.
Среди основных факторов развития рынка биосимиляров называют умеренную цену по сравнению с оригинальными продуктами, широкую сферу применения, увеличение заинтересованности в них государства.
ткжадглвиыишЕзор
Литература
1. На мировом фармрынке доминируют биопрепараты URL:http://www .pharmvestnik.ru/publs/lenta/obzory/na-mirovom-farmrynke-dominirujut-biopreparaty.html#.U0wwBFV_tc0.
2. Об обращении лекарственных средств [Электронный ресурс]: Федеральный закон от 12. 04.2010 N 61-ФЗ (ред. от 12.03.2014). Доступ из справ.-правовой системы «Консультант Плюс».
04.2010 N 61-ФЗ (ред. от 12.03.2014). Доступ из справ.-правовой системы «Консультант Плюс».
3. Проект Федерального закона от 21.01.2013 г. «О внесении изменений в Федеральный закон «Об обращении лекарственных средств» и в статью 333.32.1. части второй Налогового кодекса Российской Федерации».
4. Biosimilars: a overview. http://www.researchgate.net/publication/228730641_Biosimilars_an_overview.
5. Annex to Guideline on Similar Biological Medicinal Products Containing Biotechnology derived Proteins as Drug Substance —Non Clinical and Clinical Issues containing Recombinant Granulocyte Colony-Stimulating Factor, CHMP/31329/05, February 2006. URL: www.ema.europa. eu/pdfs/human/biosimilar/3132905en
6. Annex to Guideline on Similar Biological Medicinal Products Containing Biotechnology derived Proteins as Drug Substance — Non Clinical and Clinical Issues containing Recombinant Human Erythropoietin, CHMP/94526/05, March 2006. URL: www.ema.europa.eu/pdfs/human/ biosimilar/9452605en. Accessed 02 September 2010.
7. Annex to Guideline on Similar Biological Medicinal Products Containing Biotechnology derived Proteins as Drug Substance— Non Clinical and Clinical Issues containing Recombinant Human Growth Hormone, CHMP/94528/05, February 2006. URL: www.ema.europa.eu/pdfs/human/ biosimilar/9452805en.
8. Guideline on Immunogenicity Assessment of Biotechnology-derived Therapeutic Proteins. EMEA/CHMP/BMWP/14327/2006, December 2007. URL:http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003946.pdf.
9. Guideline on non-clinical and clinical development of similar biological medicinal products containing recombinant human insulin and insulin analogues EMEA/CHMP/BMWP/32775/2005_Rev. , December 2012. URL:http://www.ema.europa.eu/docs/en_GB/document_library/ Scientific_guideline/2012/12/WC500136392.pdf.
, December 2012. URL:http://www.ema.europa.eu/docs/en_GB/document_library/ Scientific_guideline/2012/12/WC500136392.pdf.
10. Guideline on Similar Biological MedicinalProducts, CPMP/437/04, October 2005. URL:http://www.ema.europa.eu/docs/en_GB/document_ library/Scientific_guideline/2009/09/WC500003517.pdf (дата обращения 14.04.2014).
11. Guideline on Similar Biological Medicinal Products Containing Biotechnology-derived Proteins as Drug Substance — Non Clinical and Clinical Issues, EMEA/CHMP/BMWP/42832/05, February 2006. URL: http://www.triskel.com/2%20Guideline%20biotech%20derived%20proteins. pdf.
12. Guideline on Similar Biological MedicinalProducts containing biotechnology-derived proteins as active substance: quality issues (revision 1). EMA, Committee for Medicinal Products for Human Use, 2012. URL:http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_ guideline/2012/05/WC500127960.pdf (датаобращения 14.04.2014).
13. Guideline on Similar Biological Medicinal Products Containing Low-molecular Weight Heparins. Draft released for consultation in April 2008. URL: www.ema.europa.eu/pdfs/human/biosimilar/11826407en.
14. Guideline on similar biological medicinal products containing monoclonal antibodies — non-clinical and clinical issues, CHMP/ BMWP/403543/2010, May 2012. URL:http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2012/06/ WC500128686.pdf.
15. Guideline on similar biological medicinal products containing recombinant interferon alpha, CHMP/BMWP/102046/2006, October 2007. URL:http://www.ema.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500003931.pdf.
16. IMS Health 2007 & 2009, Evaluate Pharma, Sandoz analysis.
17. Jenkins N., Murphy L., Tyther R. Post-translational modifications of recombinant proteins: significance for biopharmaceuticals. // Mol. Biotechnol.— 2008. — № 39. — Р. 113—118.
18. Misra A. Are biosimilars really generics? // Expert Opin. Biol. Ther. — 2010. — № 10(4). — Р. 489—494.
19. Goldsmith D., Kuhlmann M., Covic A. Through the looking glass: the protein science of biosimilars. // ClinExpNephrol. 2007;11: 191 — 195.
20. Sahoo N., Choudhury K., Manchikanti P. Manufacturing of biodrugs: need for harmonization in regulatory standards. // Biodrugs. 2009;23: 217—229.
21. The Commission of the European Communities (2003) Commission Directive 2003/63/EC of 25 June 2003 amending Directive 2001/83/EC of the European Parliament and of the Council on the Community code relating to medicinal products for human use. // In Official Journal of the European Union. — L159. — Р. 46—94.
22. The European Parliament and the Council of the European Union (2004) Directive 2004/27/EC of the European Parliament and of the Council of 31 March 2004 amending Directive 2001/83/EC on the Community code relating to medicinal products for human use. // In Official Journal of the European Union, L136, pp. 34—57.
Как биосимиляры изменят отрасль здравоохранения?
На фармацевтическом рынке Казахстана стали появляться аналоги оригинальных биотехнологических препаратов, биосимиляры – новая эра в лечении тяжелых заболеваний и новая эра в экономике систем здравоохранения. Биопрепараты будут все больше использоваться в терапии. В первой пятилетке 20-х годов года на многие оригинальные биопрепараты уже третьего поколения начнет истекать срок патентной защиты, поэтому на рынке будет появляться все больше их аналогов – биосимиляров.
Не так давно компания SANTO представила препарат для лечения почечной анемии и анемии, вызванной при терапией цитотоксическими препаратами в онкологии эпоэтин зета. Это не первый для нашей страны биосимиляр, но первый, представленный Polpharma в Казахстане. Препарат прошел регистрацию, используется в клинической практике и допущен к государственному тендеру.
Деловой еженедельник «Капитал.kz» совместно с компанией SANTO начинает серию публикаций о биосимилярах. Сегодня Ирина Чублукова, директор по продвижению специализированных препаратов и доступу на рынок компании SANTO, расскажет о том, что это такое – аналоги оригинальных биологических лекарственных средств, чем они отличаются от оригинальных препаратов, как их появление изменило подход к лечению и какой экономический эффект получает государство от применения их в клинической практике.
– Ирина, начнем с главного: что такое биосимиляры?
– По большому счету, «биосимиляр» – это регуляторный термин, которым обозначаются биотехнологические препараты, выходящие на рынок по истечении патента на оригинальные, или референтные, биотехнологические лекарственные средства.
Биологическая терапия появилась относительно недавно. Инсулины – это ее первый представитель. Бум в развитии биологической терапии именно в части биотехнологий с применением методов генной инженерии пришелся на 1990-е годы. Тогда на рынок стали выходить первые блокбастеры – лекарственные средства для лечения серьезных заболеваний, разработанные оригинальными компаниями. В том числе это были эпоэтины; эти препараты стимулируют выработку красных кровяных телец у пациентов, у которых этот процесс по серьезным патологическим причинам ухудшен (например, при хроническом заболевании почек, при терапии онкологическими химиопрепаратами). Еще был внедрен филграстим – стимулятор выработки белых кровяных телец, лейкоцитов; он применяется при угнетении кроветворной системы, что бывает после применения химиотерапии у онкологических больных.
В конце 1990-х – начале 2000-х происходит бум выхода на рынок более сложных биотехнологических препаратов, молекул так называемых моноклональных антител, у которых гораздо более сложная пространственная структура.
Сегодня, когда мы говорим о биосимилярах, речь идет о биотехнологических препаратах, содержащих те же действующие вещества, что и оригинальные препараты, но на которые истек патент. То есть появилась возможность создать воспроизведенные лекарственные средства с тем же действующим веществом, не нарушая права держателя патента. Биосимиляры эпоэтина и филграстима можно отнести к первой волне. ЭТО БИОСИМИЛЯРЫ С НАИБОЛЕЕ ДЛИТЕЛЬНЫМ ПЕРИОДОМ ПРИМЕНЕНИЯ В РЕАЛЬНОЙ ЕЖЕДНЕВНОЙ МЕДИЦИНСКОЙ ПРАКТИКЕ,ОКОЛО 10 ЛЕТ В ЕВРОПЕ, ЗА ЭТО ВРЕМЯ ПРЕПАРАТЫ БЫЛИ ХОРОШО ИЗУЧЕНЫ КАК В ОТНОШЕНИИ БЕЗОПАСНОСТИ И ЭФФЕКТИВНОСТИ У БОЛЬШОГО ЧИСЛА РАЗЛИЧНЫХ ПАЦИЕНТОВ. На рынке Казахстана уже есть биосимиляры моноклональных антител, ожидается, что в ближайшее время биоаналогичных препаратов второй волны будет больше, и в дальнейшем, в 2020-х годах, произойдет выход беспатентных версий биотехнологичных препаратов третьей волны, которые сегодня все еще представлены в виде монополии оригинальных молекул.
– В чем разница между генериком и биосимиляром?
– С регуляторной точки зрения, и то, и другое – беспатентная копия оригинального препарата. Разница в том, что генерики копируют химически синтезированные лекарственные средства, а биосимиляры – биотехнологические препараты.
Синтезированные лекарственные средства имеют малые молекулы, их легко и просто воспроизвести. Например, аспирин, патентная защита на него истекла давно. Сегодня достаточно много производителей выпускает ацетилсалициловую кислоту – действующее вещество фактически идентичное. Можно сказать, что одинаковые таблетки ацетилсалициловой кислоты разных производителей достаточно близки друг к другу по составу, и, попадая в организм человека, они будут проявлять одинаковое фармакологическое действие.
Современные биологические препараты, и биотехнологические препараты в том числе, представляют собой молекулы протеинов. Это крупные белки, которые по своей структуре напоминают или имитируют жизненно важные для организма человека белки. Эти препараты воспроизводят сложнейшую молекулу, она в сотни раз превышает по размеру молекулу химически синтезированного лекарственного средства. Синтезировать ее – совсем другая задача. Поэтому и был внедрен этот термин – «биосимиляр». Хотя в некоторых странах изначально подошли к беспатентным версиям биотехнологических препаратов как к химически синтезированным: необходимость выделять отдельную категорию биосимиляров не признавалась, их называли биогенериками. Но все же индустрия производства биосимиляров определила необходимость представить несколько другой путь получения одобрения, регистрации для таких препаратов. Пионером во внедрении термина «биосимиляры» стал Европейский Союз.
– С чем это было связано?
– Методами сравнения идентичности оригинального препарата и генерика невозможно показать идентичность оригинального биологического препарата и беспатентного биологического препарата. Был внедрен отдельный свод требований к беспатентному биологическому препарату, в первую очередь для демонстрации аналогичных клинических исходов по эффектвиности и безопасности у пациентов. Поэтому и был внедрен термин – «биосимиляр».
Хотя основная идея биосимиляров, как и генериков, – снижение финансовой нагрузки. Когда заканчивается монополия, появляется конкурентная среда, и это в итоге приводит к снижению стоимости терапии. Для биосимиляров это важно, потому что все-таки это беспатентные версии препаратов для современной терапии, той, которая решает задачи лечения серьезных заболеваний. Зачастую это лекарственные средства, спасающие жизни. Здесь вопрос в том, что даже незначительное снижение стоимости уже значительно облегчает нагрузку на бюджет, будь это бюджет государства или индивидуального пациента.
– Насколько могут снизиться расходы?
– Рынки разные, регулирование разное. Но общее правило такое: если приходит генерик на рынок после истечения срока защиты оригинального препарата, можно ожидать, что стоимость лечения снизится на 30-50-70%, и даже на 90% от стоимости оригинального препарата.
В случае с биосимилярами первоначальное снижение стоимости может составить от 10% до 30% – не более. Со временем на рынок могут выйти и другие аналоги биологических препаратов, появится более интенсивная конкурентная среда, и вот тогда не исключено более глубокое снижение цены. Например, в Германии с момента внедрения биосимиляров на эпоэтин произошло снижение стоимости терапии на 50% в течение первых пяти лет. Это произошло за счет того, что, с одной стороны, был представлен биосимиляр, имеющий более низкую, чем оригинальный препарат, цену, а с другой стороны, и оригинальный производитель не уходил с рынка, он просто был вынужден снизить цену.
В среднем стоимость лечения биотехнологическими препаратами в 25 раз выше, чем стоимость лечения химически синтезированными средствами. Естественно, даже небольшая экономия – 10-30% – это уже большие деньги.
– Почему разница между стоимостью биосимиляра и ценой на оригинальный препарат не столь велика, как в случае генерика и его прототипа?
– Это связано не с большими амбициями производителей, которые хотят заработать больше, а с тем, что производство биосимиляра по сравнению с производством генерика более сложное и затратное. И этот процесс под силу далеко не всем производителям. Посмотрите на количество фармкомпаний в мире, которые выпускают генерики. И посмотрите на производителей биосимиляров – их можно пересчитать практически по пальцам. Компании-производители биосимиляров максимально стараются снизить цену, но не стоит ожидать слишком глубокого падения.
Кроме дорогостоящей технологии производства, значение в вопросе цены имеет проведение клинических исследований. При регистрации генерика, чтобы показать его идентичность с оригинальным препаратом, зачастую достаточно провести исследование биоэквивалентности. А можно обойтись без этого, в зависимости от того, к какой категории относится лекарственный препарат. Однако для биосимиляров, согласно европейским требованиям и требованиям к регистрации на нашем рынке, необходимо представить данные клинических исследований третьей фазы – когда лекарственное средство изучается, сопоставляется по показателям эффективности, безопасности, иммуногенности с оригинальным препаратом у больного пациента. Как правило, требования к таким исследованиям достаточно жесткие. То есть сама необходимость проведения клинического исследования накладывает большие расходы на производителя.
– Сколько может составлять стоимость клинических исследований в общей стоимости биосимиляра?
– Есть статистика, что разработка европейского биосимиляра для вывода на рынок в современных условиях стоит от $200 млн и выше, генерика – от $1-2 млн. Нет определенных цифр, потому что молекулы разные по сложности, показаниям, это будет влиять на стоимость проведения клинических исследований. Если это более узкое показание, связанное с серьезным заболеванием, в основном в онкологии, то стоимость проведения клинических исследований будет достаточно высокой, поскольку необходимо рекрутировать пул пациентов, которые будут рандомизированы на две сравнительные группы – для оригинального препарата и для биосимиляра.
Нужно понимать, что любой производитель биосимиляра начинает свои разработки тогда, когда патентная защита еще действует. Это так называемый «разворот науки» от готового лекарственного препарата в обратном порядке до старта синтеза. Производитель биосимиляра фактически заново изобретает технологию производства этой биологической молекулы – большие затраты на этапе технологического девелопмента. Это также обоснует достаточно незначимую разницу в стоимости оригинального препарата и биосимиляра.
Сейчас в странах региона ICH (страны – участники Международной Конференции по гармонизации регуляторных требований с лекарственным препаратам, а именно США, страны Европы, Япония, Австралия, Канада, Южная Африка) делаются усилия для того, чтобы снизить затратную часть на клинику, потому что есть большая заинтересованность государственных плательщиков в том, чтобы стоимость беспатентных биотехнологических препаратов была ниже.
– Ирина, если говорить о методах лечения, как биосимиляры изменили их?
– Основная идея, которая стоит за внедрением биосимиляров, – это снижение стоимости препарата, за счет чего доступ к лечению появляется у большего количества пациентов. Если мы говорим о достаточно высокозатратных патологиях, может быть недостаточно бюджета для того, чтобы терапию получили все, кому это необходимо. Но когда используются биосимиляры – это наглядно видно на цифрах в Европейском союзе, особенно в странах Северной Европы, – доступ к терапии у пациентов резко увеличивается. Это основная гуманистическая идея внедрения биосимиляров – дать возможность получить лечение серьезных заболеваний пациентам вне зависимости от стоимости препарата.
– Как действуют биосимиляры, если говорить об их лечебном воздействии?
– Биосимиляры, и вообще биотехнологические препараты, по своей сути протеины, очень схожие с теми, которые содержатся в человеческом организме, и действуют они через те же механизмы, несколько модифицируя их в организме. Биотехнологические средства и биосимиляры проходят пути естественного процесса, которые в организме больного человека нарушены, моделируют эффект, нормализуют его, и в этом их действие отличается от действия химически синтезированных препаратов. Некоторые биотехнологические препараты и биоаналоги могут модифицировать естественные процессы в организме для того, чтобы развернуть организм на борьбу с болезнью. Например, МАБы позволяют организму отреагировать в нужных участках – там, где недостаточно реакций иммунной системы, чтобы убить раковые клетки, или прекратить доставку крови в необходимых количествах, чтобы раковая опухоль не росла и произошел некроз.
То есть по большому счету все биотехнологические средства так или иначе действуют опосредованно через естественные процессы организма, модифицируя их. Химически синтезированные средства, как правило, так не действуют, поскольку являются, в большинстве, чужеродными для организма человека субстратами.
– Можно ли в таком случае говорить о том, что биосимиляры лучше, чем генерики?
– Нет, это не так, невозможно приводить такое сравнение, у каждого из них есть конкретная точка применения – конкретные показания, по которым они применяются. Но биотехнологические лекарственные средства приходят, как правило, туда, где генерик не может справиться – дать необходимый уровень эффективности терапии, излечиваемости заболевания, либо полностью изменить подходы к терапии заболевания. То есть мы не можем сказать, что биологическая терапия лучше, чем терапия химически синтезированными средствами. Но сама необходимость появления биологической терапии была вызвана тем, что химически синтезированные средства зачастую не решали поставленных задач.
– Насколько в Казахстане развита биологическая терапия?
– Надо сказать, что Казахстан соответствует лучшим медицинским практикам согласно установленным клиническим стандартам ЕС и США по использованию современных биотехнологических средств для лечения серьезных заболеваний. Сюда относятся многие хронические, онкологические, редкие заболевания. У казахстанских пациентов есть доступ к большинству препаратов по списку орфанных заболеваний, которые признаны в Казахстане.
Препараты закупаются, но в достаточном ли количестве – другой вопрос, для этого необходимы хорошо функционирующие реестры пациентов, и эта практика только развивается. Думаю, для части пациентов покрытие лекарственными средствами недостаточное, препараты дорогие. Поэтому именно наличие биосимиляров наверняка расширит доступ к терапии, то есть не просто снизит затраты государства, но еще и даст возможность большему количеству пациентов получить лечение.
В следующий раз мы расскажем о том, что представляет собой рынок биоаналогов в мире, как компания SANTO выводила на рынок Казахстана биосимиляр, насколько конкурентна среда и каковы перспективы производства аналогов биотехнологических препаратов в нашей стране.
«Герофарм» ответил на популярные вопросы родителей
Родители детей с сахарным диабетом по всей стране просят Минздрав не заменять зарубежные оригинальные инсулины на российские биосимиляры. Они встревожены фактом перехода и возможными побочными эффектами, информация о которых проходит в том числе в СМИ.
ГЕРОФАРМ производит в России биосимиляры «РинГлар» (гларгин) и «РинЛиз» (лизпро).
Какие исследования проводил «Герофарм» для биосимиляров аналогов инсулина? Почему «Герофарм» не проводил все те исследования, которые проводили производители оригинальных препаратов? Почему вы решили остановиться на минимуме исследований?Такого понятия, как минимум или максимум исследований, не существует. Есть «доказательная база лекарственного препарата». На данный момент доказательная база зарегистрированных инсулинов «Герофарм» соответствует современным взглядам на биоаналоги, удовлетворяет требованиям регулятора, что позволило нам зарегистрировать их и начать применение у пациентов.
Для того чтобы понять, какие проводились испытания и почему, надо разобраться в принципе с целью исследования биосимиляров. Поскольку мы разрабатываем не новый препарат, а копию оригинального, необходимо в первую очередь доказать высокую степень схожести молекул референтного (оригинального) и разрабатываемого инсулинов. После этого – идентичность попадания молекулы в центральный кровоток, то есть эквивалентную биодоступность.
Правило воспроизведенных препаратов говорит о том, что если одинаковые лекарственные препараты попадают к месту своего действия одинаково, то и действовать они будут одинаково. При успешном доказательстве идентичности молекулы и эквивалентной биодоступности, а также проведенном исследовании безопасности, все характеристики референтного препарата применимы к разрабатываемому препарату. Поэтому в отношении разрабатываемого биосимилярного препарата не нужно проводить всех тех исследований, которые были проведены для референтного (оригинального) препарата. Такой подход к исследованиям биосимиляров инсулина закреплен в международных гайдлайнах, например Европейского медицинского агентства.
Комплекс сравнительных исследований биосимиляров аналогов инсулина «Герофарм» с референтным препаратом включал три этапа:
1) исследование физико-химических свойств – для доказательства идентичности состава оригинального инсулина и инсулина «Герофарм»,
2) In vitro фармакодинамические исследования – для доказательства идентичности механизма действия на клеточных линиях,
3) клинические исследования – для доказательства идентичности действия на людях.
При этом, в соответствии с рекомендациями Евразийского экономического союза (приняты на основании документов Европейского медицинского агентства), проведение клинических исследований включало два этапа:
1) исследование фармакокинетики и фармакодинамики – идентичности поступления инсулинов в центральный кровоток, метаболизма и выведение его оттуда.
2) исследования безопасности с акцентом на иммуногенность.
Почему «Герофарм» не публикует отчеты о результатах исследований?В общем доступе фармацевтические компании не публикуют отчеты о результатах клинических исследований (КИ). В исходном виде они содержат большое количество технических аналитических данных, интерпретировать которые могут только эксперты в области клинических исследований. Некоторые регуляторные агентства публикуют отчеты об оценке досье: например, European public assessment reports – EPAR. В них есть определенное количество информации, которое агентство раскрывает для общественности, но нельзя сказать, что это полный отчет о КИ. И, опять же, его публикует не фармацевтическая компания, а регуляторное агентство.
Сами данные мы регулярно представляем на международных и отечественных отраслевых конференциях, а также публикуем в рецензируемых журналах. Это общепринятая практика. Сразу по завершении исследований лекарственных препаратов аналогов инсулина ГЕРОФАРМ РинЛиз®, РинЛиз® Микс 25 и РинГлар® (перед регистрацией) был инициирован процесс подготовки публикаций, который занимает в среднем от полугода до года месяцев. В данный момент часть статей уже опубликована, остальные либо готовятся к публикации, либо находятся на рецензии.
Почему вы утверждаете, что препараты «Герофарм» обладают идентичной оригинальным эффективностью и безопасностью? Ведь это не дженерики, а биосимиляры? Все знают, что биотехнологические разработки и производство очень сложны, невозможно создать точно такую же молекулу.Суждение о том, что из-за сложности биотехнологических разработок и производства невозможно создать точно такую же молекулу (белок), действительно широко распространено. Но оно было оправданным 10-15 лет назад.
В современном мире некорректно говорить, что «невозможно создать точно такую же молекулу» по отношению к инсулину. Появились новые технологии, новые биореакторы, питательные среды, сорбенты для создания лучших условий — культивирования и очистки. Появились новые биоаналитические методы. Биотехнологии шагнули достаточно далеко, чтобы производить точно такой же белок и доказывать с помощью биоаналитики его идентичность.
Кроме того, инсулин имеет несложное строение: 51 аминокислота, молекулярная масса около 6 кД, всего 3 дисульфидные связи, нет посттрансляционных модификаций. Также на текущий момент существуют и биоаналитические методики, комбинация которых позволяет убедиться в том, что молекула идентична.
Перед регистрацией компания провела комплекс доклинических и клинических исследований, в ходе которых были доказаны идентичность молекулы, готовой лекарственной формы, эффективность и безопасность препарата.
Чем отличаются дженерики от биосимиляров?Дженерики и биоаналоги (биосимиляры) — это копии оригинальных препаратов. Они различаются процессом разработки и проводимыми исследованиями. Дженерики получают с помощью химического синтеза, а биосимиляры с использованием биотехнологий.
Процесс создания дженерика более простой. Эти препараты должны иметь такую же лекарственную форму и путь введения, что и оригинальные. Технология химического синтеза не очень сложна по сравнению с биотехнологией и хорошо воспроизводится. Именно поэтому достаточно доказать идентичность структуры физико-химическими методами и провести исследование эквивалентной биодоступности — попадания лекарственного средства в центральный кровоток.
Для производства биосимиляров, которые представляют собой белки, используют методы генной инженерии – технологию рекомбинантной ДНК. В продуцирующий белок клетки вставляют кольцевую ДНК – она содержит искусственный ген, необходимый для синтеза требуемого белка. Крайне важно убедиться, что штамм-продуцент будет правильно синтезировать целевой продукт на протяжении всего производственного процесса. Поэтому последовательность ДНК неоднократно проверятся после встраивания в клетку.
Идентичность структуры молекулы у биосимиляров проверяют при помощи гораздо большего, чем для дженериков, перечня физико-химических исследований и in vitro фармакологических исследований. Препарат проверяется на рецепторном и клеточном уровне. После этого проводятся исследования эквивалентной биодоступности, в которых в сравнительном с оригинальным препаратом аспекте оценивают не только фармакокинетические, но и фармакодинамические показатели. Таким образом изучается, как препарат поступает и выводится из центрального кровотока и как именно он действует на организм. Этого не проводится для дженериков. В некоторых случаях для биосимиляров необходимо также проведение исследования безопасности — иммуногенности.
Если все это доказано, прочие характеристики не требуют отдельного изучения: они будут такими же, как у оригинального препарата.
Отличается ли состав примесей биосимиляров аналогов инсулина «Герофарм» от оригинальных препаратов?Примеси в составе биосимиляров аналогов инсулина «Герофарм» не отличаются от таковых в оригинальных препаратах. Информацию о них можно найти в инструкции по медицинскому применению.
Почему не проводились исследования на детях?Клинические исследования биосимиляров на детях не проводятся ни в России, ни в странах с высоким уровнем регулирования. Например в Евросоюзе и США. Из-за того, что препараты сопоставимы, а их биодоступность эквивалентна, все показания и противопоказания для применения оригинального препарата распространяются и на инструкцию биоаналогов компании «Герофарм». Это следует из того, что одинаковые молекулы, попадая к месту своего действия, будут обладать одинаковыми эффектами и нежелательными реакциями. Поэтому проведение исследований на отдельных популяциях, в том числе на детях и беременных женщинах, избыточно. Кроме того, это неэтично: эффект препарата заранее известен, а любое клиническое исследование сопряжено с неудобствами для его участников.
Почему нет исследований иммуногенности инсулина лизпро на пациентах с СД 1 типа?
Исследования иммуногенности на пациентах с сахарным диабетом 2 типа проводились для инсулина лизпро двухфазный 25. Чтобы понять, почему это было сделано, необходимо обратиться к принципу биосимилярности и логике исследования биосимиляров. Как мы уже отмечали ранее, цель исследования биосимиляров аналогов инсулина – доказать идентичность молекулы, состава готовой лекарственной формы, эффективность и безопасность препарата.
Иммуногенность – потенциальная способность антигена (например лекарственного препарата) вызывать иммунный ответ. Цель исследования имунногенности оригинального инсулина — показать, что количество антител, вырабатываемых в ответ на введение данной молекулы инсулина, не способно снизить его терапевтический эффект. А биосимилярного инсулина – показать, что количество антител, которые вырабатываются при введении биосимиляра, не отличаются от количества при введении оригинальной молекулы.
«Герофарм» разрабатывала два инсулина (лизпро и лизпро микс 25) из одной фармацевтической субстанции — инсулин лизпро. В соответствии с международными и отечественными рекомендациями, «если производитель биоаналогичного (биоподобного) лекарственного препарата разрабатывает другие препараты, например, короткого, среднего действия и двухфазные препараты, содержащие одинаковый активный ингредиент, в исследование безопасности необходимо включить препарат с наибольшим ожидаемым иммуногенным потенциалом». То есть, если более иммуногенная форма инсулина в линейке разрабатываемых препаратов безопасна, то остальные препараты инсулина в данной линейке также безопасны, так как априори имеют меньший потенциал иммуногенности.
Инсулин лизпро микс 25 обладает большим иммуногенным потенциалом. Из-за наличия протамина в составе риск образования антител к инсулину при его использовании выше, чем при использовании препарата инсулин лизпро. Поэтому сравнительное исследование иммуногенности проводилось именно для инсулина лизпро микс 25.
Двухфазные инсулины, в том числе инсулин лизпро микс 25, не рекомендуется применять для терапии пациентов с сахарным диабетом 1 типа. Потому что лучшая компенсация при 1 типе достигается на базис-болюсном режиме. Именно поэтому, в интересах участников исследования и с сохранением научной ценности полученных доказательств биосмилярности, исследование было проведено на пациентах с СД 2 типа. В результате которого было доказано, что иммуногенность и безопасность биосимиляров не отличается от показателей оригинальных препаратов. Результаты проведенного исследования актуальны и для пациентов с СД 1 типа, поскольку принцип действия препаратов инсулина универсален и не зависит от типа СД.
Как «Герофарм» может гарантировать, что исследования действительно были проведены, а результаты не фальсифицированы?«Герофарм» проводил исследования в клиниках по всей России , где работают врачи высшей категории, кандидаты и доктора медицинских наук, профессионалы в своей отрасли. Нашими исследователями были такие эксперты в области эндокринологии, как А.Ю. Майоров (ФГБУ «НМИЦ эндокринологии» МЗ РФ), А.Г. Залевская (Санкт-Петербург, СПБМУ им. акад. Павлова), Т.Л. Каронова (ФГБУ «НМИЦ им. В.А. Алмазова).
Первая фаза исследований инсулина лизпро проводились на базе ФГБУ «НМИЦ эндокринологии Минздрава России» и «БиоЭк». Третья — в семнадцати клиниках. В исследованиях участвовали в общей сложности 286 человек.
Первая фаза клинических исследований инсулина гларгин проводились на базе ФГБУ «НМИЦ эндокринологии» и «НМИЦ им В. А. Алмазова» Минздрава России, третья — в 14 клиниках в регионах России. В двух стадиях клинических исследований инсулина гларгин участвовали 222 человека.
Клинические исследования проводились в соответствии с принципами надлежащей клинической практики (GCP). В исследовательские центры поставлялись оба препарата: тестируемый препарат «Герофарм» и соответствующий оригинальный.
На первом этапе, в клэмп-исследованиях (исследования фармакокинетики и фармакодинамики), применялся двойной слепой перекрестный дизайн. Каждый участник клэмп-исследования получил оба препарата. Однако ни исследователь, ни сам участник исследования не знали, какой именно препарат получали в каждый конкретный период клэмпа (двойной слепой дизайн).
На втором этапе в исследованиях иммуногенности каждый получал только один тип инсулина в соответствии с рандомизационным кодом. Картриджи и шприц-ручки препаратов инсулина «Герофарм» имеют уникальный дизайн, выдержанный в соответствии с корпоративным стилем компании. У оригинальных препаратов также уникальный дизайн картриджей и шприц-ручек. Поэтому внешне спутать препараты довольно сложно. Препарат выдавался врачом-исследоватем, факт введения и дозу инсулина каждый пациент регистрировал в дневнике самоконтроля. Количество фактически израсходованного препарата сопоставлялось с расходом, указанном в дневнике.
Каждое исследование компании «Герофарм» проходило независимый аудит, некоторые попали под инспекцию Росздравнадзора. Все это дает основание быть уверенным, что подложных данных в исследованиях нет.
Новые виды инсулинов разрабатываются с целью улучшения качества компенсации диабета и именно с этой целью идет периодическая смена старых препаратов на новые. Однако биосимиляр создан с иной целью. Может ли произойти срыв компенсации, подобранный врачом пациенту с инсулинозависимым СД при переводе его на биосимиляр? И разве это не влечет за собой риск и угрозу здоровью больного?Биосимиляры аналогов инсулина и соответствующие им оригинальные препараты взаимозаменяемы по МНН (Международное непатентованное наименование — Прим. АСИ), поскольку имеют одинаковое действующее вещество. Их схожая эффективность и безопасность были доказаны в доклинических и клинических исследованиях. Например, Лантус® Солостар® и РинГлар® – это инсулин гларгин, Хумалог® и РинЛиз® – это инсулин лизпро. Смена торгового наименования не влияет на самочувствие или показатели гликемии. Это было изучено на доклиническом и клиническом этапах разработки биосимиляров инсулинов компании «Герофарм».
При этом, если у пациента есть вопросы, связанные с подбором и корректировкой терапии, необходимой для качественной компенсации, он может обсудить их с лечащим врачом, который хорошо осведомлен обо всех особенностях течения заболевания.
Какими исследованиями подтверждается и гарантируется корректное использование инсулинов «Герофарм» в помповой инсулинотерапии?Комплекса проведенных компанией доклинических и клинических исследований достаточно, чтобы применять инсулин лизпро производства «Герофарм» в инсулиновых помпах.
Основной риск, с которым пациент может столкнуться, применяя как оригинальный препарат, так и биосимиляр, – это окклюзия инфузионной системы. К окклюзии инфузионной системы может приводить кристаллизация инсулина, вероятность которой определяется физико-химическими показателями инсулинов.
В соответствии с результатами проведенных исследований, инсулин РинЛиз® по своим физико-химическим свойствам полностью соответствует оригинальному препарату Хумалог® (лизпро). Таким образом, его использование не ведет к повышенному риску кристаллизации по сравнению с референтным препаратом.
Другими параметрами, определяющими эффективность инсулина, являются фармакокинетические и фармакодинамические характеристики. В сравнительных регистрационных клинических исследованиях инсулинов РинЛиз® и Хумалог® была доказана идентичность параметров фармакокинетики, фармакодинамики.
Как использовать препарат в терапии конкретного пациента, необходимо обсуждать с лечащим врачом, который на основании собственного медицинского опыта и имеющихся у него данных, в том числе инструкции по медицинскому применению, сможет дать на них обоснованный ответ.
Проводились ли исследования инсулинов ультракороткого действия (в частности, РинЛиз) у пациентов, находящихся на помповой инсулинотерапии?Нет необходимости отдельно включать в программу исследований пациентов, находящихся на помповой инсулинотерапии.
РинЛиз – биосимиляр оригинального препарата Хумалог. Термин «биоаналог» подразумевает, что разрабатываемый препарат схож с препаратом-оригинатором и обладает аналогичными показаниями к применению.
Основная задача проведения доклинических и клинических исследований в данном случае – доказать идентичность молекулы, состава готовой лекарственной формы, эффективность и безопасность препарата. Одинаковые молекулы демонстрируют схожую эффективность и безопасность у всех групп пациентов.
Известно, что для компенсации диабета требуется точно подобранная доза инсулина, не всегда кратная шагу 1 (особенно это важно для детей, имеющих высокую чувствительность к инсулину). Как «Герофарм» решает вопрос с дозировкой инсулина менее 1 единицы?
Картриджи, в которых выпускаются инсулины «Герофарм», универсальны и подходят к многим ручкам: Ринсапен® II, Биоматик Пен, Автопен Классик, Хумапен Саввио, Хумапен Люксура, Хумапен Эрго 2. Таким образом, пациенты, которым необходима доза, кратная 0,5 Ед, могут использовать картридж и многоразовую шприц-ручку с соответствующим шагом.
Возможно ли приравнять понятия «дженерик» и «биосимиляр», и если нет, то почему при введении их в широкую практику у пациентов эти препараты идут на равных? Не требует ли это, по вашему мнению, дополнительных изменений по их применению в законодательной документации?Исходя из особенностей разработки и производства «дженерик» и «биосимиляр» не являются равнозначными понятиями. Однако действующего законодательства и международных руководств по разработке и исследованиям как дженериков, так и биосимиляров достаточно, чтобы обеспечить идентичность молекулы, готовой лекарственной формы, эффективность и безопасность.
В СМИ появляются сообщения о тяжелых осложнениях после перевода на отечественный инсулин, в том числе симптомах инсульта (пример с 22:59 мин). Насколько вероятны тяжелые побочные действия отечественных инсулинов? Требуются ли дополнительные обследования детей перед переводом на лекарства «Герофарма», существуют ли группы, которым отечественный инсулин противопоказан?Несмотря на то, что «Герофарм» — единственный российский производитель инсулина по принципу полного цикла, есть и другие отечественные компании, в портфель которых входит инсулин. Мы можем комментировать исключительно информацию, связанную с собственной продукцией.
Наши биосимиляры аналогов инсулина только недавно начали применяться в терапии пациентов. Но у компании уже есть успешный восьмилетний опыт применения биоаналогов генно-инженерных инсулинов человека. Все это время проводится тщательный мониторинг соотношения «польза-риск». Отдел фармаконадзора компании, регуляторные органы РФ и стран экспорта подтверждают, что польза генно-инженерных инсулинов человека «Герофарм» достоверно превышает риск их применения, а число обращений не превышает таковое для оригинальных препаратов.
Препараты инсулина (как оригинальные, так и биосимиляры) могут вызывать нежелательные реакции, связанные с механизмом действия. Все эти реакции с частотой их возникновения приведены в инструкции по медицинскому применению препаратов и доступны как для врача, так и для пациента. По частоте нежелательных реакций препараты «Герофарм» не отличаются от оригинальных препаратов.
Мы уделяем большое внимание контролю безопасности лекарственных средств. В компании отлажена работа системы фармаконадзора, которая функционирует в соответствии с требованиями российских и международных регуляторных органов.
Случай с заявленными симптомами инсульта был обработан в соответствии с международными принципами ведения фармаконадзора, а также нормативными требованиями законодательства РФ. В ходе расследования была проанализирована информация об анамнезе пациента. Данные были получены от врача-эндокринолога, лечащего врача стационара и матери пациента. Было установлено: ввиду специфичности фармакологического действия инсулина и наличия дополнительных факторов в анамнезе прямой связи между состоянием пациента и препаратом нет.
Каждый случай подозреваемой нежелательной реакции, случаи неэффективности (недостаточной эффективности), а также иные подозрения в безопасности лекарственного препарата должны рассматриваться комплексно лечащим врачом и фиксироваться в системе фармаконадзора. Каждый пациент может оставить сообщение о нежелательной реакции. О том, как это сделать, можно узнать в разделе «Фармаконадзор» на нашем корпоративном сайте.
Мнения экспертов
«Опасения родителей объясняются предвзятым отношением к отечественным производителям. Так же, как, например, к китайским и индийским. Инсулины «Герофарма» такие же качественные, как импортные. Никаких дополнительных обследований детей перед переводом с импортных инсулинов на отечественные не нужно», — пояснила АСИ Валентина Петеркова, академик РАН, профессор, доктор медицинских наук, главный внештатный детский специалист-эндокринолог Минздрава России.
Она отметила, что насколько ей известно, на 2020 год практически все регионы закупили для детей импортные препараты.
«Я советую делать переход более мягким. То есть не категорично начать выдавать исключительно отечественный препарат, а делать это постепенно. Например только новым больным, и давать право выбора тем, кто много лет получал импортные лекарства», — сказала Петеркова.
«Дорожная клиническая больница на ст. Челябинск ОАО «РЖД», в которой я работаю, была одним из исследовательских центров для инсулинов компании – мы проверяли безопасность с отдельным вниманием к иммуногенности. Проведены все необходимые исследования, эффективность и безопасность препаратов доказана», — сообщила АСИ Наталья Краснопеева, врач-эндокринолог первой квалификационной категории НУЗ «Дорожная клиническая больница на ст. Челябинск ОАО РЖД».
Он отметила, что в процессе испытаний, врачи не заметили каких-либо существенных и принципиально отличных от импортных инсулинов нежелательных реакций. И противопоказания у инсулинов «Герофарма» точно такие же, как у оригинальных, поскольку они являются биосимилярами.
«Повсеместной необходимости в обследовании детей перед переводом нет, поскольку биосимиляры «Герофарма» и оригинальные препараты взаимозаменяемы по МНН. Это означает, что действующее вещество в препаратах одинаковое», — подчеркнула Краснопеевая.
АСИ также обратилось за комментарием в ФГБУ «НМИЦ эндокринологии» Минздрава России». Когда получим ответ, опубликуем его также.
Подписывайтесь на телеграм-канал АСИ.
Больше новостей некоммерческого сектора в телеграм-канале АСИ. Подписывайтесь.Биопрепараты и биосимиляры — проблемы регулирования обращения
В национальном НИИ общественного здоровья РАН состоялась экспертная сессия «Биопрепараты и биосимиляры — регуляторные и клинические аспекты. Современные вызовы регуляторной системе», посвященная одной из самых острых проблем современной медицины — практике применения биотехнологических лекарств, которые обладают огромным потенциалом в лечении самых тяжелых и сложных болезней, и вопросам регулирования их обращения. В дискуссии участвовали и чиновники, и авторитетные практикующие врачи, и представители пациентских сообществ.
Рамил Хабриев, директор Национального НИИ общественного здоровья» им. А.Н. Семашко РАН: — В процессе подготовки поправок к Федеральному закону «Об обращении лекарственных средств» одной из важных новелл стали положения о регулировании обращения биологических препаратов, которые в действующей редакции закона отсутствуют. Проблема взаимозаменяемости биологических препаратов настолько обострила ситуацию, что сразу же встал вопрос о том, чья заинтересованность стоит за той или иной поправкой. Поэтому неслучайно мы проводим экспертный «круглый стол», собравший авторитетных представителей научной, медицинской, пациентской общественности. Участники попытаются с учетом международного опыта и опыта нашей страны предложить согласованные решения, поскольку законодательство в сфере обращения лекарственных средств находится в процессе формирования.
Елена Попова, директор по регуляторным вопросам и политике в области здравоохранения Ассоциации международных фармацевтических производителей: — Сложность проблемы регулирования заключается в сложности самих биологических препаратов. Они отличаются от препаратов химического синтеза большим молекулярным весом, сложностью пространственной структуры (например, молекула моноклонального антитела в 833 раза больше по размеру молекулы аспирина), уникальностью производственного процесса и конкретных клеточных линий, высокой чувствительностью к условиям хранения, термолабильностью и высоким риском иммуногенности. В основу регулирования в Евросоюзе положен принцип биоподобия. Такие препараты по качеству, эффективности и безопасности в определенной лекарственной форме, дозировке и пути введения подобны оригинальному лекарственному препарату, зарегистрированному на основании полного досье. Полное досье включает соответствующий масштаб проведенных доклинических и клинических исследований, при этом признается, что такие препараты не идентичны, а подобны. Концепция биоподобия строится на пяти основах: полноценные сравнительные аналитические, доклинические и клинические исследования, фармаконадзор и GMP как гарантия стабильности качества. В мире накоплен значительный опыт регулирования обращения биологических и биоподобных препаратов (биосимиляров). Наибольший — в Евросоюзе, где издано более 45 официальных документов и специальных руководств. Сейчас в ЕС зарегистрировано всего 16 биосимиляров. В 2009 году ВОЗ также сформулировала свое видение проблемы: генерический подход, применяемый для препаратов химического синтеза, для биопрепаратов неприемлем. В США подходы к оценке биоподобных препаратов при регистрации схожи с основными принципами ЕС и ВОЗ.
В России все препараты, выведенные на рынок после оригинального биопрепарата, называются биоаналогами, но что подразумевается под аналогичностью, мы не знаем. Так в разное время с учетом требований разного законодательства в РФ было зарегистрировано более 40 препаратов, которые называются биоаналогами, но многие из них не проходили никаких клинических исследований и были зарегистрированы по генерическому принципу. В поправках, предложенных к Федеральному закону «Об обращении лекарственных средств», нет специальных требований к регистрации и обращению биоподобных препаратов, что не позволит, по нашему мнению, разработать соответствующую нормативную базу. Взамен этого вводится процедура подтверждения взаимозаменяемости, которая полностью интегрирована в процесс регистрации. Однако это два разных процесса — регистрация обеспечивает допуск качественного, эффективного и безопасного препарата на рынок, а взаимозаменяемость устанавливается, исходя из научной составляющей и целей системы здравоохранения. Нам представляется, что в предложенной форме законопроект вводит предпосылки для автоматической замены биологических препаратов. Такой подход противоречит мировому регуляторному опыту.
Марина Журавлева, заместитель директора Центра клинической фармакологии НЦЭСМП Минздрава России: — До 95% лечения занимает лекарственная терапия, поэтому так важно обеспечить пациентов высокоэффективными, качественными и безопасными препаратами. Но сегодня невозможно гарантировать быстрое лечение без применения инновационных лекарств. На рынке немало псевдодженериков, эффективность которых весьма сомнительна. Нередко врачам приходится увеличивать их дозу сразу вдвое по сравнению с оригинальным препаратом. По убеждению врачей, все лекарства, которые закупаются за деньги государства, должны быть исследованы со стопроцентной гарантией. Все то, на что государство тратит деньги, должно быть абсолютно гарантировано для дальнейшего назначения пациентам. Необходимо вводить систему оценки медицинских технологий, чтобы правильно выбирать методы лечения, в том числе и с экономической точки зрения.
Алексей Колбин, заведующий кафедрой клинической фармакологии и доказательной медицины Первого государственного медицинского университета им. ак. И.П. Павлова (Санкт-Петербург): — Сегодня на фармрынке более 150 биопрепаратов. Лидируют среди них моноклональные антитела, которые чаще всего применяются для лечения тяжелых заболеваний — онкологических, гематологических, аутоиммунных. Но многие из них обладают нежелательными эффектами — иммуногенными и канцерогенными. Эти явления можно выявлять только с помощью активного мониторинга. Согласно выводам ВОЗ, при применении современных биопрепаратов риск появления опухолей вырастает на 2,3%, инфекционных заболеваний — на 8,7%. Цифры, полученные Европейским медицинским агентством, еще выше — 20 и 22% соответственно. Насколько мы готовы к применению современных биопрепаратов? У нас была создана сеть региональных центров по мониторингу побочных эффектов, в каждую историю болезни были внедрены специальные формы для их регистрации. Но в 2013 году все решения по этому поводу отменили, региональные центры закрываются. При этом нежелательных побочных явлений в реальной клинической практике возникает больше, чем при регистрационных клинических исследованиях. Неслучайно в ЕС издана директива о существенном расширении ответственности фармаконадзора. Основой для биопрепаратов должна быть система управления рисками. Особую настороженность вызывает рост отечественных биопрепаратов и биоаналогов в практическом здравоохранении. Мы ничего не знаем о том, что с ними происходит. Информация о биопрепарате должна быть доступна, открыта для всех, особенно для пациентов. Реальному решению проблемы безопасности не только биопрепаратов, а и малых молекул лекарственных средств никто должного внимания в России не уделяет.
Алла Трапкова, заместитель начальника управления организации государственного контроля качества медицинской продукции Росздравнадзора: — Система региональных центров фармаконадзора, которые были не только источниками сообщений, но и центрами обучения региональных медицинских профессионалов в области фармаконадзора, действительно разрушена. Проблемы оценки рисков и GMP-инспекций стоят очень остро. Сегодня регистрируются препараты на основании лицензий, которые были выданы до принятия стандартов GMP, производства не проходили инспекции на соответствие им. Лицензии выдаются на производственные площадки и совершенно не касаются конкретных технологий производства препарата, что очень важно в отношении биосимиляров. Мы регистрируем и не знаем, где реально производятся эти лекарственные препараты, в каких условиях. Но в целом фармаконадзор развивается — создана электронная база спонтанных сообщений о нежелательных побочных реакциях на лекарственные препараты, ежегодно растет их число. Однако сообщения о биосимилярах не могут свидетельствовать о качестве этих препаратов — они, скорее всего, связаны с их заменой, которая происходит в системе лекарственного обеспечения, когда человек долгое время принимает один лекарственный препарат, потом его переводят на другой.
Юрий Жулев, сопредседатель Всероссийского союза пациентов: — К сожалению, последней версии поправок к 61-ФЗ мы не видели, и это неправильно. В нем принципиально поменялась концепция взаимозаменяемости биопрепаратов. Мы должны видеть финальный вариант документа, он должен быть обсужден среди экспертов и в пациентских организациях. Мы должны быть уверены, что при регистрации биоаналогов будет пройден полный цикл клинических исследований. Я полностью солидарен с тем, что по биологическим препаратам все нежелательные явления невозможно зарегистрировать и отследить на этапе клинических исследований в рамках регистрации. Знаю примеры за рубежом, когда компании были вынуждены в экстренном порядке по приказу регулятора отзывать с рынка препарат. Это действие очень жесткого механизма пострегистрационного контроля и системы фармаконадзора с возможностями отзыва регистрационного свидетельства или приостановки госзакупок этого препарата. В России нормой в системе госзакупок является то, что препарат регистрируется и может занять 100% рынка. Мы, как пациенты, должны быть уверены, что препараты действительно заменяемы. Но мы должны также обсуждать преемственность лечения при хронической пожизненной терапии. Из-за системы госзакупок мы вынуждены менять препараты, иногда крайне часто — буквально каждый месяц.
Андрей Васильев, директор центра экспертизы и контроля готовых лекарственных средств ФГБУ «НЦЭСМП» Минздрава России: — Комментировать поправки к 61-ФЗ не могу, так как с последней редакцией мы не знакомы. С точки зрения научной составляющей экспертизы, биологические препараты и биоаналоги, в частности, ни при каких обстоятельствах не могут считаться воспроизведенными дженериками. В любом случае, если у препарата нет полного регистрационного досье, то подтвердить его качество всего по 2-3 показателям невозможно. Сейчас действует норма, что препараты, зарегистрированные более 20 лет назад, могут регистрироваться вообще без клинических исследований.
Александр Хаджидис, главный клинический фармаколог Санкт-Петербурга: — Биопрепараты — это терапия отчаяния, главное в них — проблема эффективности и безопасности, и это касается и оригинальных препаратов, и биоаналогов. Сейчас у всех участников фармрынка приоритеты разные, но они должны сойтись в одном — защите интересов пациента, и это должно сделать государство. По дженерикам совпадают интересы государства и бизнеса. По оригинальным препаратам — интересы бизнеса и врачей. Оригинальные лекарства гораздо более исследованы, чем воспроизведенные. Надо давать компаниям-производителям госзадание, но нельзя за счет более низкой цены терять качество лекарств.
Сергей Зырянов, профессор кафедры клинической фармакологии РГМУ: — В нашей стране произошла подмена понятий. Мы все время считаем, что генерический препарат — это препарат, взаимозаменяемый с оригинальным. Но вот определение, которое дает ВОЗ: генерический препарат и многоисточниковый препарат — это препарат, который фармацевтически эквивалентен. Фармацевтически эквивалентный или фармацевтически альтернативный продукт может быть, а может и не быть терапевтически эквивалентным оригинальному. Терапевтическая эквивалентность является тем фактором, который регулирует вопросы взаимозаменяемости. Это значит, что вопросы взаимозаменяемости и регистрации — это разные вопросы. Генериковый препарат может быть зарегистрирован, но при этом может не быть терапевтически эквивалентным оригинальному и, соответственно, может не быть взаимозаменяемым с оригинальным препаратом. Точно так же и регистрация препарата в качестве биосимиляра не означает, что он может быть использован для замены оригинального средства. Биосимилярность, или биоподобность — это не синоним взаимозаменяемости. Сам факт регистрации биосимиляра не означает, что он может быть использован вместо биопрепарата.
В Европе простой взаимозаменяемости биопрепаратов и биоаналогов нет, лишь в нескольких странах есть позитивный формуляр взаимозаменяемых (список разрешенных к замене), в других — негативный (список запрещенных к замене). Так, в Финляндии вообще не разрешена замена всех препаратов, применяемых в лечебно-профилактических учреждениях. Во Франции замещение оригинальных лекарств дженериками разрешено, но замещение биопрепаратов в аптеке — только в случае начала лечения, если врач при этом не запретил замену. И если фармацевт заменил один препарат другим, то он обязан уведомить врача. В Германии замена возможна, если в сравнительных исследованиях у биопрепарата и биоаналога препарат сравнения был один и тот же, одна технология производства и одни и те же исходные материалы. В Европе в целом всем биопрепаратам должно быть присвоено уникальное название, их нельзя идентифицировать по МНН. В 2013 году минздрав признал, что у нас есть проблемы с эффективностью и безопасностью лекарств в пределах одного МНН и подтвердил необходимость пересмотра находящихся в обращении лекарственных препаратов. Раньше всегда говорили: все, что имеет одно МНН, работает одинаково.
Ольга Викулова, ведущий научный сотрудник Эндокринологического научного центра Минздрава России: — Иммуногенность биосимиляров можно оценить только в результате клинических исследований. Считается, что предпосылками для развития иммуногенности является либо структурная трансформация вследствие другого технологического процесса биосимиляра, либо наличие примесей. Результатом является образование антител, нейтрализующих белок действующего вещества препарата. В 2007 году в ЕС была отклонена первая попытка индийской компании зарегистрировать три биосимиляра инсулина. Почему? Недостаточный контроль качества технологического процесса и содержания примесей, недостаточно данных об отсутствии иммуногенности, нарушены правила проведения клинических исследований эквивалентности инсулинов, в частности, отсутствовал контроль за уровнем эндогенного инсулина, иные фармакокинетические свойства. Мы нередко слышим жалобы пациентов: «инсулин, как вода, не действует». В этих случаях пациент вместе с врачом повышают дозу, но при этом вырастает риск гипогликемии. Замещение биопрепаратов очень важно, но автоматическое замещение инсулинов практически во всех странах Европы запрещено. Препараты инсулина недопустимо выписывать по МНН, потому что их эффекты клинически определяются тем конкретным производителем, который этот препарат производит. В России мы вынуждены выписывать рецепты по МНН. Очень важно иметь систему регистрации нежелательных побочных реакций, которой у нас, к сожалению, нет.
Ян Власов, председатель Общественного совета по защите прав пациентов при Росздравнадзоре: — Пациентское сообщество отреагировало на появление биосимиляров для лечения рассеянного склероза остро. Количество жалоб на необоснованную смену лекарственного препарата с негативными результатами, которые пациенты подавали в Росздравнадзор в 2010 году, когда у нас впервые появилась эта проблема, выросло на 860%. Мы предложили поправку в закон о том, что биоаналог не может быть взаимозаменяем. Но в последней версии закона ее нет. С мест идет много сообщений, что биосимиляры не работают, однако в ряде регионов, прежде чем послать извещение в центр, эти сообщения фильтруют. Мы получаем биоаналоги для больных рассеянным склерозом, и нам приходится их перетитровывать, чтобы определить дозу. По 3-4 раза в год пациентов переводят с одного лекарства на другое — это полный провал лечения и пустая трата бюджета. Может быть, все же дать врачу возможность решать, чем лечить своих пациентов?
Тимофей Нижегородцев, начальник управления контроля социальной сферы и торговли ФАС: — Дискуссия по взаимозаменяемости идет уже более пяти лет. Исходя из логики профессионалов, нужно каждую серию любого препарата регистрировать по полному досье. Современные препараты — это высоко стандартизованный продукт. Мы урегулировали все разногласия по проекту поправок с минздравом. Мы ушли от упрощенного подхода, от полярных позиций, и шли навстречу друг другу: взаимозаменяемость должна доказываться эквивалентностями — в том числе и терапевтической — в ходе клинических исследований. Я не понимаю, почему последнюю версию законопроекта нельзя было выложить на сайте.
Неправда, что якобы лекарства не будут регистрировать без установления их взаимозаменяемости с аналогами. Расширено регистрационное досье и тем самым расширены основания для регистрирующего органа. Но если компании-оригинаторы не будут вносить в досье сведений о побочных эффектах и противопоказаниях, которые выявятся в ходе пострегистрационных исследований, это будет основанием для приостановки регистрации. Есть и другие основания, которые формируют модель фармаконадзора. К сожалению, у нас надзор разделен между тремя ведомствами — минздравом, минпромторгом и Росздравнадзором. Необходимо идти в сторону объединения.
Николай Медуницын, главный научный сотрудник Центра планирования и координации НЦЭСМП Минздрава России: — Происходит что-то непонятное с дефинициями. Говорить надо именно о «биоподобии», идентичности нет никогда. «Биологическими аналогами» в эндокринологии называют ряд естественных веществ, образующихся в организме, и использование термина «биоаналог» только запутает существующую классификацию лекарственных средств. Термин «биоаналог» не применяют ни ВОЗ, ни европейское сообщество. И нам не нужно идти этим неверным путем.
Алексей Масчан, заместитель директора Центра детской гематологии, онкологии и иммунологии им. Димы Рогачева: — Бесконечные замены одного препарата другим в рамках закупок по ОНЛС должны быть просто запрещены. В онкологии в меньшей степени мы пока столкнулись с биоаналогами. В основном сталкивались с дженериками. И дженерики — это абсолютно страшная вещь, потому что их недостаточная эффективность может проявляться через многие годы, и это вообще не может быть никак проконтролировано. Например, снижение на 15% суммарной дозы химиопрепаратов при лечении локализованных форм рака молочной железы снижает эффективность их применения через 10 лет на 100%. Я не понимаю, почему мы должны поддерживать отечественного производителя, а не пациента.
Екатерина Алексеева, заведующая ревматологическим отделением Научного центра здоровья детей РАН: — В отличие от онкологических больных, наши пациенты принимают препараты всю жизнь. И в зависимости от того, какой препарат подобран, зависит не только жизнь больного, а и то, встанет ли он утром с кровати. Ребенок уходит от нас компенсированный, но по месту жительства ему меняют препарат и форму введения — и весь эффект лечения уходит. Он снова возвращается к нам в тяжелом состоянии, с печеночной недостаточностью. И мы не может его защитить. Мы боролись с отечественным и индийским циклоспорином, провели их экспертизу. Оказалось, что действующего вещества в них было меньше, а примесей больше. Если компании хотят зарегистрировать свой аналог, пусть проводят полномасштабные клинические исследования. И показывают по меньшей мере такую же эффективность и токсичность. А по препаратам для детей надо проводить отдельные клинические исследования. Нельзя экстраполировать результаты взрослых на детей.
Елена Тельнова, ведущий научный сотрудник Национального НИИ общественного здоровья РАН: — Надо возрождать региональные центры фармаконадзора, нравится это кому-то или нет. За время их существования количество извещений возросло в 12 раз. Надо, чтобы врачи систематически присылали извещения о нежелательных эффектах препаратов. Но сейчас в законе такой нормы нет. И еще один вопрос — цены на биопрепараты. Да, они особенные, но это не значит, что цены на них должны быть заоблачными. Биопрепараты должны быть доступными для населения.
Участники экспертной сессии приняли резолюцию, в которой выразили общее мнение: проект поправок к закону «Об обращении лекарственных средств» не прошел широкого общественного обсуждения, недостаточно проработан и не решает многих проблем. Он требует существенной доработки с привлечением всех заинтересованных сторон — фармацевтического, медицинского и пациентского сообществ. В правительство и Минздрав России направлены предложения по совершенствованию нормативной базы обращения биопрепаратов и системы фармаконадзора.
Автор: Татьяна Батенёва
Источник: Российская газета
Биоподобных и взаимозаменяемых продуктов | FDA
Биологические продукты — это самый быстрорастущий класс терапевтических продуктов в США. Когда пациентам прописывают биологический продукт, биоаналогичные и взаимозаменяемые продукты могут предложить дополнительные варианты лечения, потенциально снижая затраты на здравоохранение.
Узнайте больше о биопрепаратах, биоаналогах, взаимозаменяемых продуктах и других связанных терминах ниже.
Что такое биологический продукт?
Биологические продукты регулируются Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) и используются для диагностики, предотвращения, лечения и лечения заболеваний и медицинских состояний. Биологические продукты представляют собой разнообразную категорию продуктов и, как правило, представляют собой большие сложные молекулы. Эти продукты могут быть произведены с помощью биотехнологии в живой системе, такой как микроорганизм, растительная клетка или животная клетка, и их часто труднее охарактеризовать, чем низкомолекулярные лекарства.Существует множество типов биологических продуктов, одобренных для использования в США, включая терапевтические белки (такие как филграстим), моноклональные антитела (такие как адалимумаб) и вакцины (например, против гриппа и столбняка).
Природа биологических продуктов, включая присущие им вариации, которые могут возникнуть в результате производственного процесса, может создавать проблемы при описании и производстве этих продуктов, которые часто отсутствуют при разработке низкомолекулярных лекарств.Незначительные различия между произведенными партиями одного и того же биологического продукта (т. Е. Допустимые вариации внутри продукта) являются нормальным явлением и ожидаются в рамках производственного процесса. В рамках своего обзора FDA оценивает производственный процесс и стратегию производителя по контролю вариаций внутри продукта. Эти стратегии контроля используются для обеспечения того, чтобы производители производили биологические продукты с неизменными клиническими характеристиками.
В начало
Что такое эталонный продукт?
Эталонный продукт — это единственный биологический продукт, уже одобренный FDA, с которым сравнивается предлагаемый биоподобный продукт.Эталонный продукт одобрен, среди прочего, на основании полного набора данных о безопасности и эффективности. Предлагаемый биоподобный продукт сравнивается и оценивается с эталонным продуктом, чтобы убедиться, что продукт очень похож и не имеет клинически значимых различий.
Вернуться к началу
Что такое биоподобный продукт?
Биоаналог — это биологический продукт, который очень похож и не имеет клинически значимых отличий от существующего препарата сравнения, одобренного FDA.Эти два стандарта описаны ниже.
Вернуться к началу
Что значит быть «очень похожим»?
Допускаются незначительные различия между эталонным продуктом и предлагаемым биоподобным продуктом в клинически неактивных компонентах.
Производитель, разрабатывающий предлагаемый биоаналог, демонстрирует, что его продукт очень похож на эталонный продукт, путем тщательного анализа (т.е. характеристики) структуры и функции как эталонного продукта, так и предлагаемого биосимиляра.Современные технологии используются для сравнения характеристик продуктов, таких как чистота, химический состав и биологическая активность. Производитель использует результаты этих сравнительных испытаний, а также другую информацию, чтобы продемонстрировать, что биоаналог очень похож на эталонный продукт.
Допускаются незначительные различия между эталонным продуктом и предлагаемым биоподобным продуктом в клинически неактивных компонентах. Например, они могут включать незначительные различия в стабилизаторе или буфере по сравнению с тем, что используется в контрольном продукте.Любые различия между предлагаемым биоподобным продуктом и эталонным продуктом тщательно оцениваются FDA, чтобы гарантировать, что биоаналог соответствует высоким стандартам одобрения FDA.
Как упоминалось выше, в процессе производства биологических продуктов ожидаются небольшие различия (т.е. допустимые вариации внутри продукта), независимо от того, является ли продукт биоподобным или эталонным. Как для эталонных продуктов, так и для биоподобных препаратов, различия между партиями (т.е. допустимые различия внутри продукта) тщательно контролируются и отслеживаются.
В начало
Что означает «отсутствие клинически значимых различий»?
Производитель также должен продемонстрировать, что предлагаемый им биоподобный продукт не имеет клинически значимых отличий от эталонного продукта с точки зрения безопасности, чистоты и активности (безопасности и эффективности). Это обычно подтверждается исследованиями фармакокинетики (воздействие) и фармакодинамики (реакция) на людях, оценкой клинической иммуногенности и, при необходимости, дополнительными клиническими исследованиями.
Вернуться к началу
Что такое взаимозаменяемый продукт?
Взаимозаменяемый продукт — это биоподобный продукт, отвечающий дополнительным требованиям, изложенным в Законе о ценовой конкуренции и инновациях в биопрепаратах. В рамках выполнения этих дополнительных требований необходима информация, чтобы показать, что ожидается, что взаимозаменяемый продукт даст тот же клинический результат, что и эталонный продукт, у любого данного пациента. Кроме того, для продуктов, вводимых пациенту более одного раза, будет оценен риск с точки зрения безопасности и снижения эффективности переключения между сменным продуктом и эталонным продуктом.
Взаимозаменяемый продукт может быть заменен эталонным продуктом без участия врача. Высокие стандарты одобрения FDA должны гарантировать поставщикам медицинских услуг уверенность в безопасности и эффективности взаимозаменяемого продукта, как и в случае с одобренным FDA эталонным продуктом.
Вернуться к началу
В чем разница между биоподобным и взаимозаменяемым продуктом?
Как упоминалось выше, взаимозаменяемый продукт, помимо того, что он биоподобен, отвечает дополнительным требованиям, основанным на дальнейшей оценке и тестировании продукта.Производителю предлагаемого сменного продукта потребуется предоставить дополнительную информацию, чтобы показать, что ожидается, что сменный продукт даст тот же клинический результат, что и эталонный продукт, у любого данного пациента. Кроме того, для продукта, который вводится пациенту более одного раза, производителю необходимо предоставить данные и информацию для оценки риска с точки зрения безопасности и снижения эффективности, чередования продуктов или переключения между ними.
В результате продукт, одобренный как взаимозаменяемый, означает, что FDA пришло к выводу, что он может быть заменен эталонным продуктом без консультации с врачом, выписывающим рецепт.Например, предположим, что пациент самостоятельно вводит биологический продукт путем инъекции для лечения ревматоидного артрита. Чтобы получить биоаналог вместо эталонного продукта, пациенту может потребоваться рецепт от врача, выписанный специально для этого биоаналога. Однако, как только продукт одобрен FDA как взаимозаменяемый, пациент может иметь возможность взять рецепт на эталонный продукт в аптеку, и, в зависимости от штата, фармацевт может заменить эталонный продукт сменным продуктом без консультации с лечащим врачом. .Обратите внимание, что законы и практика аптек варьируются от штата к штату.
FDA проводит тщательную и тщательную оценку, чтобы гарантировать, что все продукты, включая биоподобные и взаимозаменяемые продукты, соответствуют высоким стандартам Агентства для утверждения.
Вернуться к началу
Биоаналоги — это то же самое, что и дженерики?
Биосимиляры и дженерики являются версиями фирменных препаратов и могут предложить пациентам более доступные варианты лечения. Каждый из биосимиляров и дженериков одобряется разными сокращенными способами, что позволяет избежать дублирования дорогостоящих клинических испытаний.Но биоаналоги не являются дженериками, и между биоаналогами и дженериками есть важные различия.
Например, активные ингредиенты дженериков такие же, как и у фирменных препаратов. Кроме того, производитель дженерика должен продемонстрировать, что дженерик биоэквивалентен брендовому лекарству.
Напротив, производители биоподобных препаратов должны продемонстрировать, что биоаналоги очень похожи на эталонный продукт, за исключением незначительных различий в клинически неактивных компонентах.Производители биосимиляров также должны продемонстрировать отсутствие клинически значимых различий между биосимиляром и эталонным продуктом с точки зрения безопасности и эффективности.
Вернуться к началу
Разработка, проверка и одобрение биосимиляров
Все биологические продукты, одобренные FDA, включая эталонные, биоподобные и взаимозаменяемые продукты, проходят тщательную оценку, чтобы пациенты могли полагаться на их эффективность, безопасность и качество.
Узнайте больше о процессах разработки, проверки и утверждения биопрепаратов ниже.
Как проходит процесс утверждения биоподобных продуктов?
Все биологические продукты, одобренные FDA, включая эталонные продукты и биоподобные продукты, проходят тщательную оценку, чтобы пациенты могли быть уверены в эффективности, безопасности и качестве этих продуктов.
Эталонный продукт — это единственный биологический продукт, уже одобренный FDA, с которым сравнивается предлагаемый биоподобный продукт.Эталонный продукт утверждается в «отдельном» приложении, которое должно содержать все данные и информацию, необходимые для демонстрации его безопасности и эффективности. Как правило, данные и информация, необходимые для демонстрации безопасности и эффективности референсного продукта, включают клинические испытания по показаниям заболевания, которые запрашиваются производителем.
Биоподобный препарат очень похож и не имеет клинически значимых отличий по безопасности, чистоте и эффективности (безопасности и эффективности) от существующего препарата сравнения, одобренного Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA).Целью программы разработки биоподобных препаратов является демонстрация биоподобия между предлагаемым биоподобным продуктом и эталонным продуктом, а не независимое установление безопасности и эффективности предлагаемого продукта.
Производитель предлагаемого биоподобного продукта генерирует массив данных, сравнивая предлагаемый продукт с одобренным FDA эталонным продуктом, чтобы продемонстрировать биоподобие. Сравнительные данные генерируются и оцениваются поэтапно, начиная с детального анализа (структурных и функциональных) характеристик и сравнения продуктов, переходя при необходимости к исследованиям на животных, а затем к сравнительным клиническим исследованиям.
Следовательно, вместо того, чтобы создавать тот же полный профиль доклинических и клинических данных, что и эталонный продукт, производитель, который демонстрирует предлагаемый им биоподобный продукт, очень похож на утвержденный FDA эталонный продукт и не имеет клинически значимых отличий от него, может частично полагаться на него. Предыдущее определение FDA безопасности и эффективности эталонного продукта для утверждения. Как правило, это означает, что производителям биоподобных препаратов не нужно проводить столько дорогостоящих и длительных клинических испытаний, что потенциально приведет к более быстрому доступу к этим продуктам, дополнительным терапевтическим возможностям и снижению затрат для пациентов.
В начало
Какие данные требуются для утверждения биоподобного или взаимозаменяемого продукта?
Заявка на биоподобный продукт должна включать данные, демонстрирующие биологическое сходство с эталонным продуктом. Обычно сюда входят данные из:
- Аналитические исследования, демонстрирующие, что биологический продукт очень похож на эталонный продукт, несмотря на незначительные различия в клинически неактивных компонентах;
- Исследования на животных, включая оценку токсичности; и
- Клиническое исследование или исследования, достаточные для демонстрации безопасности, чистоты и эффективности предлагаемого биоподобного продукта при одном или нескольких показаниях, по которым лицензирован референсный продукт.Обычно это включает оценку иммуногенности, фармакокинетики (PK) и, в некоторых случаях, фармакодинамики (PD), а также может включать сравнительное клиническое исследование.
Помимо данных, перечисленных выше, заявка на сменный продукт также должна включать информацию или данные, подтверждающие, что:
- Предполагается, что предлагаемый сменный продукт даст тот же клинический результат, что и эталонный продукт, у любого данного пациента; и,
- Для продукта, вводимого человеку более одного раза, переключение между предлагаемым взаимозаменяемым продуктом и эталонным продуктом не увеличивает риски безопасности и не снижает эффективность по сравнению с использованием эталонного продукта без такого переключения между продуктами.
В начало
Все ли биоподобные приложения содержат одни и те же типы данных?
При рассмотрении вопроса о лицензировании биоподобного продукта FDA рассматривает совокупность данных и информации, включая основу для подробных аналитических (структурных и функциональных) характеристик, исследования на животных, если необходимо, затем переход к клиническим фармакологическим исследованиям и, при необходимости, другим. сравнительные клинические исследования.
Вышеупомянутые маркеры обозначают типы данных и информации, которые должны быть включены в заявку на биоподобный продукт.FDA оценивает каждый биоподобный продукт в каждом конкретном случае, чтобы определить, какие данные необходимы для демонстрации биоподобия и от каких элементов данных можно отказаться, если это будет сочтено целесообразным с научной точки зрения. Это определение может быть основано на том, что уже известно об эталонном продукте.
Многие факторы могут помочь адаптировать требования к данным для каждого биоподобного приложения. Некоторые примеры включают:
- Сила и надежность сравнительных аналитических исследований, показывающих схожую структуру и функции предлагаемого биоподобного препарата и эталонного продукта.Например, данные аналитического сходства, показывающие очень мало аналитических различий, могут убедительно подтвердить, что предлагаемый продукт очень похож.
- Насколько схожи профили PK и PD между биоподобным и эталонным продуктом.
- Существующая ранее информация о профиле безопасности эталонного продукта. Например, если известно, что у пациентов есть потенциал развития иммунных ответов с неблагоприятными исходами на эталонный продукт, FDA, вероятно, потребует более тщательной оценки иммунных ответов с биоаналогом.
В начало
Зачем нам нужен сокращенный способ утверждения биологических продуктов?
Биологические продукты — это самый быстрорастущий класс терапевтических продуктов в США, на которые приходится значительная и постоянно растущая часть расходов на здравоохранение. Конгресс посредством Закона о ценовой конкуренции и инновациях в биопрепаратах создал сокращенную процедуру утверждения, чтобы предоставить общественности более широкий доступ к безопасным и эффективным биологическим продуктам. Этот путь предоставляет больше вариантов лечения, потенциально снижая расходы на здравоохранение за счет конкуренции и увеличивая доступ к жизненно важным лекарствам.
Сокращенный путь лицензирования не означает, что к биоподобным или взаимозаменяемым продуктам применяется более низкий стандарт утверждения. Фактически, как описано выше, пакет данных, необходимый для утверждения биоаналогичного или взаимозаменяемого продукта, обширен. Если производитель биоаналога может продемонстрировать, что его продукт биоподобен эталонному продукту, то с научной точки зрения оправдано полагаться на определенные существующие научные знания о безопасности и эффективности эталонного продукта для подтверждения утверждения.Это позволяет проводить потенциально более короткие и менее затратные программы разработки лекарств для биоподобных препаратов.
В начало
Может ли биосимиляр быть одобрен для показания, которое одобрено для эталонного продукта, даже если биоаналог не исследуется напрямую по этому показанию?
Да, биоподобный продукт может быть одобрен для показания без прямых исследований биоподобного препарата по этому показанию. Если совокупные доказательства в заявке на биоподобие подтверждают демонстрацию биоподобия по крайней мере для одного из показаний эталонного продукта, то производитель биоподобия может использовать данные и информацию для научного обоснования утверждения других показаний, которые не были непосредственно изучены производитель биоподобных веществ.Эта концепция называется «экстраполяцией» и имеет решающее значение для целей сокращенного пути — улучшения доступа и возможностей при потенциально более низкой стоимости.
Экстраполяция основана на (1) всех доступных данных и информации о применении биоподобных препаратов, (2) предыдущих выводах FDA о безопасности и эффективности других утвержденных показаний для эталонного продукта и (3) знаниях и рассмотрении различных научных факторов для каждого из них. индикация. Экстраполяция не является предположением о том, что данных по одному непосредственно изученному показанию или популяции достаточно для подтверждения утверждения в другом неисследованном показании или популяции.Производитель биоподобных препаратов должен предоставить научное обоснование в поддержку экстраполяции.
Эти факторы научного обоснования включают знание механизма (ов) действия, PK, PD, эффективности, безопасности и иммуногенности референсного продукта в каждом из утвержденных показаний. FDA оценивает все данные о биоподобных продуктах, чтобы оценить, существуют ли различия между биоподобными и эталонными продуктами, которые могут повлиять на эти научные факторы при любом из показаний или популяциях, не изученных непосредственно производителем биоподобных препаратов.Если таких различий не выявлено, одобрение биосимиляра для других неисследованных показаний или популяций обычно поддерживается.
FDA работает с производителями биоподобных препаратов во время разработки продукта, чтобы определить, какие данные необходимы для поддержки экстраполяции. Помните, что производитель эталонного продукта должен показать, что его продукт безопасен и эффективен для каждого показания, для которого требуется одобрение, чаще всего посредством клинических испытаний по конкретным показаниям. Поскольку цели программы разработки биоаналога отличаются от целей программы разработки эталонного продукта (см. Первый вопрос выше), с научной точки зрения, как правило, нет необходимости требовать от производителя биоаналога проведения клинических испытаний при всех тех же показаниях для лечения заболеваний. эталонный продукт был изучен и одобрен.
В начало
биосимиляров: что это такое?
Биоподобные препараты — это очень похожие версии биологических препаратов, которые были одобрены для лечения тех же состояний и заболеваний, что и исходные биологические препараты. Они должны пройти тщательное клиническое тестирование и одобрение правительства, прежде чем они могут быть одобрены и прописаны широкой публике. Их часто используют для лечения серьезных заболеваний, таких как рак, болезнь Альцгеймера и ВИЧ.
Узнайте больше о биоподобных и биологических препаратах, в том числе о том, как они одобрены и как они могут изменить фармацевтическую промышленность.
Что такое биосимиляры?
Биоподобные препараты, иногда называемые биогенериками, представляют собой очень похожие версии биологических лекарств, изготовленных из живых микроорганизмов, обнаруженных в клетках растений или животных.
Как и дженерики, биоподобные препараты обладают такими же активными свойствами, как и другие лицензированные препараты.
Термин «дженерики» относится только к традиционным или низкомолекулярным лекарствам, которые биоэквивалентны уже одобренным низкомолекулярным лекарствам.
Исследователи и производители будут производить биоподобные продукты, аналогичные ранее одобренным лекарствам. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) требует, чтобы биоподобные препараты были «очень похожими», в том числе:
- Безопасность
- Сила
- Чистота
- Идентификационный номер химического вещества
- Биоактивность
Биоподобный продукт должен иметь сравнимые уровни эффективности и безопасности с исходным продуктом для утверждения в ускоренные сроки; единственные допустимые различия заключаются в неактивных ингредиентах или компонентах.Взаимодействие с другими людьми
Альтернативное наименование : биогенерические препараты, биогенерики, биоаналоги
Как работают биосимиляры
Большинство биопрепаратов — это очень большие, сложные молекулы или смеси молекул, используемые для лечения рака, болезни Альцгеймера, рассеянного склероза, ВИЧ / СПИДа и других серьезных заболеваний.
Биоподобный препарат отражает активные свойства и результаты ранее одобренного биологического препарата. Затем его можно использовать для лечения того же заболевания. Однако в отличие от стандартных непатентованных лекарств биоаналоги не полностью соответствуют своим фирменным лекарствам.
Биологические препараты, созданные из живых организмов, слишком сложны, чтобы их можно было в точности копировать. Вместо этого производители биоподобных лекарств пытаются создавать фармацевтические препараты, которые имеют высокий уровень сходства по своему составу, эффективности и результатам.
Биосимиляры должны пройти обширные клинические испытания, как для тестирования их в качестве лечения, так и для сравнения их с исходным биологическим препаратом, который они воспроизводят. В отличие от дженериков, биоподобные препараты необходимо назначать по названию.Их нельзя заменить без разрешения лечащего врача.
После того, как лекарство было одобрено FDA как «взаимозаменяемое», фармацевт может заменить прописанный биологический препарат без одобрения врача.
Ожидается, что одобрение биосимиляров поможет снизить затраты на жизненно важные методы лечения. Лечение биологическими препаратами может стоить пациентам и страховым компаниям от 100 000 до 300 000 долларов в год. Оценки, основанные на нескольких исследованиях, показывают, что увеличение количества биоподобных препаратов на рынке может сэкономить 54 миллиарда долларов за 10-летний период.Взаимодействие с другими людьми
Знаменитые события
Хотя биотехнологические компании годами исследуют биопрепараты и разрабатывают биоаналогичные препараты, их одобрение в Соединенных Штатах было получено сравнительно недавно.
Закон о ценовой конкуренции и инновациях в биопрепаратах
Президент Обама подписал Закон о защите пациентов и доступном медицинском обслуживании в 2010 году, и в рамках этого закона был утвержден сокращенный путь к одобрению биосимиляров. В соответствии с Законом о ценовой конкуренции и инновациях в биопрепаратах (BPCIA) продукт может быть признан биоподобным, если данные показывают, что он очень похож на уже одобренный биологический препарат.
Первый биосимилярный препарат, одобренный Zarxio
В 2015 году FDA одобрило Zarxio как первый биоподобный продукт в США. Zarxio является биоподобным Neupogen, лекарству, показанному для лечения нейтропении у онкологических больных.
С тех пор FDA одобрило 27 других биоподобных препаратов.
Влияние на промышленность
Ожидается, что биосимиляры продолжат оказывать значительное влияние на фармацевтическую промышленность США.С. и Европа, в том числе:
- Обострение конкуренции среди фармацевтических компаний
- Больше возможностей для лечения пациентов
- Более низкая стоимость лекарств от серьезных заболеваний
- Повышение доступности жизненно важных процедур
Утверждение FDA ускоренного графика выпуска биосимиляров сигнализирует об изменениях в отрасли и возможном серьезном падении прибылей фармацевтических компаний. Это возможность для организаций, специализирующихся на дженериках и биоаналогах, быстро развить свой бизнес.
Ключевые выводы
- Биоподобные препараты — это очень похожие версии биологических препаратов, которые были одобрены для лечения тех же состояний и заболеваний, что и исходные биологические препараты.
- Они должны пройти тщательные клинические испытания и одобрение правительства, прежде чем они могут быть одобрены и прописаны широкой публике.
- Биосимиляры часто используются для лечения серьезных заболеваний, таких как рак, болезнь Альцгеймера и ВИЧ.
- Ожидается, что одобрение биоаналогичных препаратов принесет пользу пациентам за счет расширения возможностей лечения и снижения затрат на сложные, спасающие жизнь процедуры.
Биопрепараты против биосимиляров: понимание различий
Учитывая потенциал таргетной терапии и снижение побочных эффектов, стремление к использованию биопрепаратов является захватывающим. Биопрепараты произвели революцию в профилактике, диагностике и лечении рака, аутоиммунных состояний и других заболеваний. Биосимиляры могут повысить доступность лечения, а с истечением срока действия биологических патентов наступила интересная эпоха для двух вариантов лечения. 1
Что такое биопрепараты?
Биопрепараты, такие как некоторые вакцины, существуют с 19 века, а в 1982 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило первый бактериальный биологический препарат — человеческий инсулин. 2 Биологические препараты содержат компоненты живых организмов, таких как люди, растения, животные и микроорганизмы. 3
Примеры биопрепаратов включают:
Вакцины (например, вакцина против вируса папилломы человека, предназначенная для предотвращения рака шейки матки)
Кровь и продукты крови (например, вакцина против вируса папилломы человека, предназначенная для предотвращения рака шейки матки).g., тромбоциты)
Генная терапия (генная терапия включает замену дефектного гена или добавление нового гена, чтобы попытаться вылечить болезнь или помочь вашему телу бороться с болезнью.)
Ткани для трансплантации (например, сухожилия и связок)
Рекомбинантные белки (например, инсулин)
Терапия стволовыми клетками (используется для определенных генетических заболеваний или рака)
Моноклональные антитела (например, те, которые усиливают естественные функции иммунной системы для борьбы с раком или лечения аутоиммунные заболевания)
Биопрепараты отличаются от традиционных фармацевтических препаратов тем, что они происходят из живых организмов.Они имеют более сложную структуру, более крупные молекулы и их нелегко воспроизвести.
Какие состояния можно лечить с помощью биопрепаратов?
Биопрепараты существуют уже давно и не являются новой концепцией. Биопрепараты, произведенные современной рекомбинантной ДНК, используются для лечения некоторых заболеваний с 1980-х годов. 8 Тем не менее, с годами, по мере развития знаний или биологических препаратов, они стали значимыми в лечении аутоиммунных заболеваний, рака и генетических состояний.Ассортимент биопрепаратов значительно расширился и теперь включает лечение следующих состояний:
Иммуноопосредованные заболевания, включая диабет, анкилозирующий спондилит, ревматоидный артрит, псориаз, псориатический артрит, множественный склероз, системную красную волчанку и язвенную болезнь Крона. колит. 4
Специфические виды рака, включая лейкоз, лимфому, рак желудка, груди и толстой кишки. 5
Редкие генетические нарушения, такие как серповидноклеточная анемия, гемофилия, болезнь Гоше и муковисцидоз. 6
Биологические препараты и рак
Биологическая терапия обеспечивает целевой и индивидуальный подход, который произвел революцию в лечении онкологии. 8 У раковых клеток есть способы избежать разрушения иммунной системой, а иммунотерапия с помощью биопрепаратов стимулирует иммунную систему нацеливаться и атаковать раковые клетки. 7 Проще говоря, он поддерживает собственную иммунную систему организма в борьбе с раковыми клетками.
Несмотря на то, что биологическая терапия не так распространена, как химиотерапия и лучевая терапия, при некоторых типах рака показано, что она направлена, уничтожает и останавливает распространение раковых клеток и, возможно, имеет меньше побочных эффектов, чем традиционные методы лечения рака.Есть биопрепараты, которые были разработаны для замедления роста опухолей. Внедрение биологической терапии обеспечило курс лечения некоторых типов прогрессирующих или метастатических опухолей, до которых не существовало эффективного лечения. 8
Что такое биосимиляры и чем они отличаются от биопрепаратов?
Из-за высокой стоимости биопрепаратов было принято новое законодательство, позволяющее производить биоаналоги для предоставления большего количества вариантов лечения, расширения доступа и более низкой стоимости 9 .После того, как в отношении биологического препарата будут учтены исключительные права и права интеллектуальной собственности, производители могут получить разрешение на продажу очень похожей версии исходного биологического препарата, известной как биоподобный.
FDA требует, чтобы биоподобные продукты были очень похожи на исходный «эталонный продукт». Чтобы получить разрешение на использование в США, производители должны доказать, что биосимиляры:
работают одинаково, имеют такую же силу и дозировку и, следовательно, могут приниматься так же, как и оригинальный биологический препарат.
Не имеет клинически значимых различий в безопасности или эффективности по сравнению с исходным биологическим препаратом.
Изготовлены по таким же высоким стандартам, что и оригинальные изделия.
Разработка биосимиляров экономит время и ресурсы, избегая ненужного дублирования клинических испытаний 9 .
Разница между биосимилярами и дженериками
Биосимиляры не являются точными копиями, они очень похожи на активный ингредиент эталонного биологического препарата, что отличает их от дженериков. 11 Дженерики состоят из небольших молекул, и их легко копировать и воспроизводить. Активным ингредиентом дженерика является тот же активный ингредиент, что и лекарственный препарат торговой марки. 10 Биосимиляры, как и все биопрепараты, обладают незначительной вариабельностью и могут иметь незначительные различия в клинически неактивных компонентах, но очень похожи на исходный продукт. 11 Как биоподобные, так и генерические препараты предлагают потенциально более доступный вариант лечения для некоторых пациентов.
Будущее биопрепаратов и биосимиляров
Нет сомнений в том, что биопрепараты изменили лечение рака, аутоиммунных заболеваний и генетических заболеваний, положительно изменив будущее многих людей. Независимо от того, проводится ли лечение в форме биологического препарата или биоаналога, стандарты FDA для одобрения лекарств означают, что не делается никаких компромиссов в отношении безопасности, качества или эффективности продукта. Независимо от того, какой тип лечения используется, оба революционных решения указывают на захватывающие будущие разработки в области лечения рака и других сложных заболеваний.
Ссылки:
Чопра Р., Лопес Г. Улучшение доступа к лечению рака: роль биосимиляров. Дж. Глоб Онкол. 2017; 3 (5): 596-610. DOI: 10.1200 / jgo.2016.008607. , по состоянию на 3 ноября 2020 г.
Чан, Джулиана К.Н. и Энтони Т.К. Чан. «Биопрепараты и биосимиляры: что, почему и как?». ESMO Open, vol 2, no. 1, 2017, стр. e000180. BMJ, DOI: 10.1136 / esmoopen-2017-000180. По состоянию на 18 октября 2020 г.
«Что такое« биологические »вопросы и ответы».Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, 2020 г., https://www.fda.gov/about-fda/center-biologics-evaluation-and-research-cber/what-are-biologics-questions-and-answers#:~:text = What% 20is% 20a% 20biological% 20product, ткани% 2C% 20and% 20recombinant% 20therapy% 20proteins. Доступ 18 октября 2020 г.
- Вулф Р., Энг Д. Биологические методы лечения аутоиммунных заболеваний и заболеваний соединительной ткани. Immunol Allergy Clin North Am . 2017; 37 (2): 283-299. DOI: 10.1016 / j.iac.2017.01.005. По состоянию на 3 ноября 2020 г.
- Информационный бюллетень по таргетной терапии рака. Национальный институт рака. https://www.cancer.gov/about-cancer/treatment/types/targeted-therapies/targeted-therapies-fact-sheet. Опубликовано 2020 г. По состоянию на 3 ноября 2020 г.
- Сунь В., Чжэн В., Симеонов А. Открытие и разработка лекарств для лечения редких генетических заболеваний. Американский журнал медицинской генетики, часть A . 2017; 173 (9): 2307-2322. DOI: 10.1002 / ajmg.a.38326. Доступ 3 ноября 2020 г.
«Иммунотерапия рака».Национальный институт рака, 2020 г., https://www.cancer.gov/about-cancer/treatment/types/immunotherapy. По состоянию на 18 октября 2020 г.
Falzone, Luca et al. «Эволюция фармакологического лечения рака на рубеже третьего тысячелетия». Границы фармакологии, том 9, 2018. Frontiers Media SA, DOI: 10.3389 / fphar.2018.01300. По состоянию на 18 октября 2020 г.
«О биоподобных и взаимозаменяемых продуктах». Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, 2020 г., https: //www.fda.gov / drug / biosimilars / biosimilar-and-interchangeable-products # biosimilars. По состоянию на 18 октября 2020 г.
- Обзор и основы. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. https://www.fda.gov/drugs/generic-drugs/overview-basics. Опубликовано 2020 г. По состоянию на 3 ноября 2020 г.
- van de Vooren K, Curto A, Garattini L. Биосимиляры в сравнении с дженериками: одно и то же, но разные ?. Политика в области здравоохранения Appl Health Econ . 2015; 13 (2): 125-127. DOI: 10.1007 / s40258-015-0154-9. Доступ 3 ноября 2020 г.
«Экономия средств на биоподобных веществах в Соединенных Штатах». Rand.Org, 2020 г., https://www.rand.org/pubs/periodicals/health-quarterly/issues/v7/n4/03.html. По состоянию на 18 октября 2020 г.
Интервью с Гэри М. Оуэнсом, доктором медицины. «Ценность биопрепаратов». Польза для здоровья и лекарств в Америке, т. 1,2 (2008): 20-8.
Ким, Х., Альтен, Р., Аведано, Л. и др. «Будущее биосимиляров: максимизация преимуществ при иммуноопосредованных воспалительных заболеваниях». Наркотики 80, 99–113 (2020).https://doi.org/10.1007/s40265-020-01256-5. По состоянию на 18 октября 2020 г.
- Raychaudhuri S, Raychaudhuri S. Biologics: Target — specific treatment of system and leather autoimmuneрабочие. Индийский J Dermatol . 2009; 54 (2): 100. DOI: 10.4103 / 0019-5154.53175
Что такое биосимиляры в лечении рака?
Снижение стоимости лечения было бы приятной новостью для больных раком и их близких. В конце концов, согласно заявлению Американского общества клинической онкологии (ASCO) за 2018 год, 8 из 10 самых дорогих лекарств на рынке являются лекарствами от рака.
Биосимиляры — потенциально более дешевые версии других лекарств, которые разрабатываются для лечения рака и других заболеваний. Однако важно отметить, что биоаналоги не определяются только их стоимостью, и в некоторых случаях они могут быть не намного дешевле, чем другие лекарства. Здесь вы узнаете, что такое биоаналоги, как их можно использовать для лечения рака и как они могут помочь снизить затраты на лечение рака.
1. Что такое биоаналог?
Биоподобный препарат — это версия известного и проверенного биологического препарата.Биологические препараты — это лекарства, которые сделаны из живых существ, таких как клетки, ткани или белки. Вакцины и антитела являются примерами биологических препаратов.
Биологические препараты важны при лечении рака по нескольким причинам. Некоторые биопрепараты могут вызвать естественную реакцию вашего организма на борьбу с раком. Иногда при раке ваше тело не распознает раковые клетки как плохие. Биологические препараты могут стимулировать ваше тело обнаруживать раковые клетки и атаковать их. Некоторые биопрепараты напрямую атакуют раковые клетки и мешают сигналам роста.Другие биопрепараты могут помочь вам бороться с инфекцией после химиотерапии.
Биоаналог основан на биологическом препарате, который уже был исследован, разработан, оценен на безопасность и эффективность в ходе клинических испытаний и одобрен Управлением по контролю за продуктами и лекарствами США (FDA). Биологический препарат часто называют «эталонным препаратом», потому что биоаналог основан на одобренном препарате. Биоподобный препарат действует так же, как и его референсный препарат, и также должен быть одобрен FDA.
Биоподобный препарат чем-то похож на генерическую версию биологического препарата, хотя эти два не совсем то же самое.Дженерик имеет те же активные ингредиенты, что и его фирменное лекарство. Биосимиляры не считаются дженериками, потому что между биосимиляром и его референсным препаратом могут быть небольшие различия. Однако эти вариации не вызывают клинических различий в безопасности или эффективности биосимиляра.
2. Как биоаналоги могут помочь в оплате лечения рака?
Биологические препараты дорогие. Они лечат одни из самых тяжелых, смертельных заболеваний. Они также более сложны по структуре, чем другие препараты.Их часто сложно производить и хранить, потому что они сделаны из живых существ. Они чувствительны к свету и температуре, а это значит, что их нужно производить в строго контролируемых условиях. Все эти факторы увеличивают стоимость препарата.
Биосимиляры основаны на лекарствах, которые уже прошли дорогостоящий процесс исследований и разработок, поэтому их изготовление и тестирование могут стоить меньше, чем эталонные биологические препараты. Из-за этого биосимиляры могут предлагать пациентам более дешевые варианты, обеспечивая при этом такую же эффективность лечения.Стоимость биосимиляров может быть разной для разных пациентов. Это связано с тем, что покрытие лекарств различается между поставщиками медицинского страхования, такими как Medicare, Medicaid или частное страхование. Хотя биосимиляры могут стоить меньше, чем их референсные препараты, биоаналоги по-прежнему не являются недорогим вариантом лечения рака.
Исследователи считают, что в конечном итоге биоаналоги можно заменить биологическими препаратами. Взаимозаменяемость означала бы, что безопасность и эффективность лечения не изменились бы, если бы пациента перевели на биоаналог с препарата сравнения.
3. Какие виды биосимиляров используются для лечения рака?
В Соединенных Штатах одобренные FDA биоаналоги могут использоваться для лечения рака груди, рака желудка, колоректального рака и других видов рака. Их также можно использовать для лечения побочных эффектов лечения рака, таких как низкий уровень лейкоцитов, повышающий риск инфекций. Ниже приведены некоторые биоаналоги против рака, одобренные в настоящее время в США. Вы также можете найти список всех биоподобных препаратов, одобренных FDA, на их веб-сайте.
В марте 2015 года FDA одобрило первый биоподобный препарат под названием филграстим-sndz (Zarxio). Это биоаналог, который помогает вашему организму бороться с инфекцией. Filgrastim-sndz стимулирует организм вырабатывать лейкоциты. Люди с раком, получающие химиотерапию, трансплантацию костного мозга и другие виды лечения, часто могут иметь низкий уровень лейкоцитов. Эталонный препарат Филграстима-СНДЗ называется филграстим (нейпоген). Филграстим-аафи (Нивестим) — еще один одобренный FDA биоподобный препарат филграстима.
В сентябре 2017 года FDA одобрило бевацизумаб-аввб (Мваси) в качестве первого биоаналога для лечения рака. Bevacizumab-awwb лечит некоторые виды рака прямой кишки, легких, головного мозга, почек и шейки матки. Его референсный препарат называется бевацизумаб (Авастин). Бевацизумаб-бвзр (Зирабев) — еще один биоподобный препарат бевацизумаба, одобренный Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов.
С 2017 по 2019 год FDA одобрило трастузумаб-dkst (Ogivri), трастузумаб-аннс (Kanjinti), трастузумаб-pkrb (Herzuma), трастузумаб-dttb (Ontruzant) и трастузумаб-qyyp (Тразимерасимилар), которые являются лекарственными препаратами. некоторые виды рака груди и желудка.Их референсный препарат — трастузумаб (Герцептин).
С 2018 по 2019 год FDA одобрило пегфилграстим-jmdb (Fulphila), пегфилграстим-cbqv (Udenyca) и пегфилграстим-бмез (Ziextenzo), которые являются биоаналогами, которые помогают бороться с инфекцией, особенно у людей с немиелоидным раком, получающих химиотерапию. . Их референсный препарат — пегфилграстим (Neulasta).
В ноябре 2018 года FDA одобрило ритуксимаб-абб (Труксима) в качестве первого биоаналога для лечения людей с неходжкинской лимфомой.Его референсный препарат — ритуксимаб (Ритуксан). Ритуксимаб-pvvr (Ruxience) — еще один одобренный FDA биоподобный препарат ритуксимаба.
Поговорите со своим лечащим врачом, если у вас есть вопросы о биоаналогах. Многие практики уже используют биоаналоги, поскольку они работают над тем, чтобы сделать лечение рака более доступным. Покрытие и компенсация за любые лекарства зависят от вашей медицинской страховки, поэтому поговорите со своей страховой компанией, если у вас есть вопросы о том, покрываются ли и как биосимиляры.
Почему биосимиляры не оправдывают своих ожиданий в США? | Журнал этики
Абстрактные
Биопрепараты являются одними из самых дорогих лекарств, отпускаемых по рецепту, в Соединенных Штатах, что создает серьезные препятствия для доступа пациентов к необходимому лечению.Сокращенный путь утверждения биоподобных препаратов, почти идентичных версий биопрепаратов, производимых разными производителями, был создан Конгрессом в 2010 году для стимулирования конкуренции в надежде снизить затраты и расширить доступ. Однако по состоянию на февраль 2019 года было одобрено только 17 биоподобных препаратов, и только 7 из них в настоящее время находятся на рынке. Из нескольких биоподобных препаратов, доступных в настоящее время пациентам, общее использование было ограниченным. В этой статье исследуется текущая картина рынка биоподобных препаратов, описывается тактика, используемая производителями биопрепаратов для отсрочки выхода на рынок и сдерживания назначения биосимиляров, а также дается оценка этических вопросов, связанных с увеличением внедрения биосимиляров.
Дорогие биопрепараты
Биологические препараты, которые включают терапевтические белки и моноклональные антитела, представляют собой большие сложные молекулы, обычно производимые с помощью генно-инженерных организмов, таких как модифицированные бактерии. 1 Биопрепараты могут быть чрезвычайно эффективными при лечении различных заболеваний, от аутоиммунных заболеваний до рака, но их высокие цены — часто превышающие 100 000 долларов на пациента в год — привели к постоянному росту расходов на лекарства, отпускаемые по рецепту. 1 В Соединенных Штатах на биопрепараты приходится от 38% до 40% всех расходов на фармацевтику, 2,3 , но их используют менее 2% американцев. 2 С 2010 по 2015 год на биопрепараты приходилось 70% роста расходов на лекарства в США. 2,3
Одним из предложенных решений для снижения высокой стоимости биопрепаратов было облегчение внедрения продуктов конкурентов (так называемых биоподобных препаратов), которые почти идентичны более старым, не запатентованным биопрепаратам, посредством сокращенного пути утверждения.Аналогичный путь для генерических низкомолекулярных препаратов был создан Законом Хэтча-Ваксмана № 4 1984 г. и оказался успешным. В настоящее время на непатентованные лекарства приходится около 90% всех выписанных по рецептам лекарств в Соединенных Штатах, и они сэкономили системе здравоохранения примерно 1 триллион долларов в период с 2002 по 2011 годы. 5,6 Соответственно, в 2010 году Конгресс принял Конкурс цен на биопрепараты и инновации. Закон (BPCIA), свободно смоделированный на основе Закона Хетча-Ваксмана, как часть Закона о доступном медицинском обслуживании, тем самым устанавливая сокращенный способ получения биосимиляров одобрения Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA). 7 В этой статье мы охарактеризуем ключевые клинические, экономические и этические вопросы, связанные с одобрением и использованием биоподобных препаратов.
Что такое биосимиляры?
Согласно BPCIA, FDA может одобрить биоаналог, если производитель покажет, что он «очень похож» на эталонный биологический препарат и не имеет «клинически значимых различий» в отношении его безопасности, чистоты и активности, 7 исключая Производителю биосимиляров необходимо провести полный набор предварительных клинических испытаний, которые требовались для оригинального лекарственного средства.Кроме того, BPCIA указывает, что биоаналог может считаться взаимозаменяемым с эталонным продуктом, если производитель биоаналога может показать, что биоаналог дает «тот же клинический результат», что и эталонный продукт у «любого данного пациента», и может быть заменен эталонным продуктом. без дополнительных рисков с точки зрения безопасности или снижения эффективности. 7 Для достижения этого более высокого порогового значения требуется предоставление дополнительных данных, включая результаты испытаний, в которых пациентов переводят с эталонного биологического препарата на биоаналог.В большинстве штатов получение этого статуса позволило бы фармацевтам заменить референсный биологический препарат на биоподобный без вмешательства лечащего врача. 4,5,7
Поскольку за последние несколько лет патенты на несколько биопрепаратов-блокбастеров перестали быть патентными, а в начале 2020-х годов планируется сделать это еще больше, биосимиляры готовы сыграть решающую роль в сокращении затрат на здравоохранение. По некоторым оценкам, биосимиляры могут сократить расходы на здравоохранение на 54 миллиарда долларов в период с 2017 по 2026 год. 3,8,9
Рыночный ландшафт
По состоянию на февраль 2019 года FDA одобрило 17 биоподобных препаратов, относящихся к 9 исходным биологическим препаратам (см. Таблицу). 10 Может показаться, что эти цифры положительно отразятся на BPCIA. Однако на сегодняшний день рынок биоподобных препаратов в США не смог развиваться по двум важным направлениям. Во-первых, не все биосимиляры, одобренные FDA, поступили в продажу. Только 7 из 17 биоподобных препаратов, включая 4 оригинальных биопрепарата, были коммерчески доступны для пациентов из США; 9 биосимиляров еще не поступили в продажу (а запуск другого по коммерческим причинам маловероятен 11 ) (см. Таблицу).Во-вторых, среди вышедших на рынок биоподобных препаратов снижение цен и проникновение на рынок были ограниченными. Например, филграстим-sndz, первый биоподобный препарат, одобренный BPCIA, вышел на рынок в сентябре 2015 года со скидкой всего 15% от прейскуранта производителя. 12 К концу 2016 года, через 5 кварталов после запуска, filgrastim-sndz приобрела от 15% до 20% рынка филграстима США. 12 Точно так же инфликсимаб-дийб, биоаналог инфликсимаба, запущенный в продажу в ноябре 2016 года по цене со скидкой 15% по сравнению с фирменным биологическим препаратом 13 , и на данный момент он приобрел менее 5% рынка инфликсимаба в США. . 14 Из-за низкого уровня использования биосимиляры еще не достигли поставленной политиками цели повышения конкуренции и снижения цен.
| Имя отправителя | Биоподобное имя | Месяц / год утверждения биосимиляра 15 | Biosimilar на Маркете? | Статус судебного разбирательства |
|---|---|---|---|---|
| Адалимумаб | Адалимумаб-атто | сен 2016 | № | Поселок; DE 16 |
| Адалимумаб-adbm | августа 2017 | № | Выполняется 17 | |
| Адалимумаб-адаз | октябрь 2018 | № | Поселок; DE 16 | |
| Бевацизумаб | Бевацизумаб-awwb | сен 2017 | № | Выполняется 18 |
| Эпоэтин альфа | Эпоэтин альфа-epbx | мая 2018 | Да, ноябрь 2018 г. 19 | |
| Этанерцепт | Этанерцепт-СЗЗ | Август 2016 | № | Выполняется 20 |
| Филграстим | Filgrastim-sndz | мар 2015 | Да, сентябрь 2015 г. 21 | |
| Filgrastim-aafi | июль 2018 | Да, октябрь 2018 г. 22 | ||
| Инфликсимаб | Инфликсимаб-дыйб | Апрель 2016 | Да, ноябрь 2016 г. 23 | |
| Инфликсимаб-абда | Апрель 2017 | Да, июль 2017 г. 24 | ||
| Инфликсимаб-qbtx | декабрь 2017 | № a | ||
| Пегфилграстим | Pegfilgrastim-jmdb | июн 2018 | Да, июль 2018 г. 25 | |
| Пегфилграстим-CBQV | ноя 2018 | Да, январь 2019 г. 26 | ||
| Ритуксимаб | Ритуксимаб-аббс | ноя 2018 | № | Поселок; DE 27 |
| трастузумаб | Трастузумаб-ДКСТ | декабрь 2017 | № | Поселок; DE 28 |
| трастузумаб-пкрб | декабрь 2018 | № | Поселок; DE 29 | |
| трастузумаб-dttb | янв 2019 | № | Выполняется 30 | |
Сокращение: DE, отложенный вход. a Компания Pfizer объявила, что не будет продавать инфликсимаб-qbtx, учитывая существующую коммерциализацию инфликсимаба-dyyb. 11 | ||||
Какие факторы объясняют отсутствие коммерциализации и низкий уровень потребления недавно одобренных биосимиляров? Производители оригинальных биологических продуктов использовали несколько тактик, чтобы задержать выход на рынок уже одобренных биосимиляров и препятствовать их использованию пациентами даже после успешного запуска биосимиляра.
Отложенный выход на рынок
Основными причинами задержки выхода на рынок являются продолжающиеся патентные тяжбы или соглашения об отсрочке выхода на рынок в результате урегулирования патентного спора. 31 Например, Sandoz и Mylan / Biocon достигли глобальных договоренностей с AbbVie и Genentech, соответственно, в отношении претензий о том, что биоаналоги адалимумаб-адаз и трастузумаб-dkst нарушают патенты, защищающие исходные биологические препараты адалимумаб и трастузумаб. 28,32 Пожалуй, самый заметный случай судебного разбирательства по патентам, приведший к задержке выхода на рынок биосимиляров, касается адалимумаба, самого продаваемого препарата в мире.В 2017 году мировые продажи адалимумаба составили 18,4 миллиарда долларов, что более чем вдвое больше, чем второй самый продаваемый препарат — леналидомид. 33 Компания AbbVie, производитель адалимумаба, получила более 100 патентов на этот продукт. Хотя патент AbbVie на активный ингредиент адалимумаба истек в 2016 году, ему была предоставлена серия патентов, защищающих все, от производственного процесса до новых рецептур препарата. 16 В одном отчете за 2018 год было обнаружено, что 89% этих патентных заявок были поданы после того, как адалимумаб появился на рынке, а 49% были поданы после истечения срока действия первого патента в 2014 году. 34 Эта стратегия создания стены патентов для защиты активов 34, 35 известна как разработка «патентной чащи». 16
AbbVie подала в суд на производителей биосимиляров адалимумаба, включая Amgen, Boehringer Ingelheim, Mylan, Pfizer, Samsung Bioepis и Sandoz, за нарушение патентных прав, при этом урегулирование споров было достигнуто во всех случаях, кроме одного. 16 Эти расчеты влекут за собой лицензионную сделку, по которой производители биоподобных препаратов откладывают выход на рынок и выплачивают AbbVie роялти после того, как они выходят на рынок. 36 В результате этих расчетов ожидается, что первые биоаналоги для адалимумаба выйдут на рынок США в январе 2023 года. 36,37 Ожидается, что годовой объем продаж адалимумаба в оставшиеся годы превысит 10 миллиардов долларов, что приведет к дополнительным расходам. к финансовому бремени, с которым в настоящее время сталкиваются плательщики и пациенты в Соединенных Штатах. 38,39,40
Сдерживание биоподобных рецептов
Между тем использование немногих биоподобных препаратов, поступивших на рынок США, было неоптимальным.Одна из стратегий, которые производители-оригиналы использовали для ограничения потребления биоподобных препаратов, заключалась в переговорах с плательщиками об исключительном праве в отношении формул. Например, в судебном иске 2017 года производитель биоподобных инфликсимабов утверждал, что производитель оригинального препарата заключил контракты с коммерческими плательщиками, чтобы исключить биоаналоги из формуляров лекарств или включить положения «сначала не справиться», которые потребовали бы от пациента отказа от первоначального препарата до стоимость биосимиляра может быть возмещена. 41
Схемы бонусов занимают видное место в этой практике.В иске против инфликсимаба содержалось обвинение в том, что производитель-производитель сообщил страховщикам, что, если они не предоставят исключительное право на использование его продукта, производитель откажется от скидок на другие продукты. 41,42 По крайней мере 70% застрахованных на коммерческой основе пациентов в США подпадают под действие этих исключающих договоров. 41 Одно исследование показало, что из 2547 планов Medicare, часть D, только 10% покрывали биоаналог инфликсимаба по сравнению с 96%, которые покрывали оригинал. 43
Ввиду ограниченной доступности биосимиляров в Соединенных Штатах, среди лиц, назначающих препараты, и пользователей по-прежнему существует значительный скептицизм в отношении эффективности и безопасности биосимиляров.Национальный опрос американских врачей 2016 года, специализирующийся на специальностях с высоким уровнем использования биопрепаратов, показал, что 55% не верят, что биоаналоги безопасны и подходят для использования пациентами. 44 Подобные исследования показали, что пациенты имеют низкий уровень осведомленности о биоаналогах, а также обеспокоены неадекватной эффективностью и повышенными рисками безопасности биоподобных препаратов, которые не согласуются с обнадеживающими доказательствами их клинической полезности. 45 Этот скептицизм якобы продвигали некоторые производители оригинальных материалов.В августе 2018 года гражданская петиция в FDA обвинила некоторых производителей биологических препаратов «неверно в характеристике важных элементов биоподобных критериев и создала сомнения и путаницу в отношении безопасности и эффективности биоподобных препаратов», 46,47 со ссылкой на одну веб-страницу Genentech, которая объясняет, что «FDA требует, чтобы биосимиляры были очень похожими, но не идентичными [эталонному продукту]», без указания, что одобренные биоаналоги не имеют клинически значимых отличий от эталонного продукта. 47 В петиции также цитировались брошюры для пациентов, в которых подчеркивалось, что биоаналог инфликсимаба «не утвержден как взаимозаменяемый» с оригинальной версией, что могло ввести пациентов в заблуждение, заставив их думать, что биоаналоги небезопасны. 47
Предлагаемые решения и проблемы этического характера
Было предложено множество решений для решения проблемы ограниченного использования биосимиляров. 5 Например, можно было бы принять законодательство для повышения прозрачности отчетности о биологических патентах, что позволило бы производителям биоподобных препаратов более легко оспаривать их действительность.Кроме того, регулирующие органы могут тщательно изучить антиконкурентную практику исключающих контрактов и принять более строгие правила против такой практики. Наконец, FDA могло бы активизировать свои усилия по просвещению врачей и общественности о биоэквивалентности биоподобных препаратов и удалить ненужную политику наименования, вызывающую путаницу среди пользователей, включая четырехбуквенные суффиксы, присваиваемые исключительно биоподобным препаратам с единственной целью отличить их от их создателей. . Решение этих проблем неизбежно приведет к увеличению использования биосимиляров.Однако есть ли этические проблемы, которые возникают при расширении использования биосимиляров?
Некоторые утверждали, что путь BPCIA недостаточно гарантирует эффективность или безопасность биоподобных препаратов, что лежит в основе скептицизма среди пациентов и врачей. 44,45 Хотя возможно, что незначительные структурные различия между биоаналогами могут привести к разной эффективности и безопасности, на сегодняшний день исследования не обнаружили значимых различий между биоаналогом и его соответствующим биологическим препаратом-источником в отношении безопасности и эффективности. 48-50 Тем не менее, постмаркетинговые исследования биосимиляров по-прежнему необходимы для оценки этих опасений.
Возможно, самый важный вопрос, стоящий перед политиками, заключается в том, улучшит ли более широкое использование биосимиляров общественное здоровье. Высокая стоимость биопрепаратов остается серьезным препятствием для доступа пациентов и соблюдения режима лечения. 51 Хотя биоаналоги, вероятно, останутся более дорогими, чем низкомолекулярные дженерики, снижение цен будет продолжать проявляться по мере того, как на рынке появляется большая конкуренция. 52,53,54 Эти более низкие цены снизят общие расходы на здравоохранение и могут улучшить приверженность пациентов лечению, что приведет к лучшим результатам в отношении здоровья.
Хотя биосимиляры еще не принесли той значительной экономии, которую они рекламировали, стремление к большей конкуренции между биосимилярами — стоящая цель. 3 Однако, если рынок дешевых биоподобных препаратов не является результатом политики, направленной на устранение барьеров для входа и использования, этический подход может заключаться в обязательном снижении цен на оригинальные биологические препараты после определенного периода времени на рынке. . 55 Такая политика могла бы достичь цели обеспечения пациентов доступными и доступными терапевтическими средствами, но, вероятно, нет политического аппетита к ее реализации. Таким образом, поощрение усиления конкуренции на рынке биопрепаратов с биоаналогами остается наиболее многообещающим механизмом для расширения доступа к столь необходимым лекарствам.
План действий по биосимилярам
В июле 2018 года FDA опубликовало План действий по биосимилярам, признав отсутствие конкуренции в области биологических препаратов. 56 Признавая многочисленные препятствия на пути разработки и использования биосимиляров, FDA обозначило 4 ключевые цели в решении этой проблемы, включая оптимизацию процесса утверждения, улучшение нормативной ясности, усиление образовательных усилий для улучшения понимания между заинтересованными сторонами и сотрудничество с федеральными властями. Торговая комиссия по борьбе с антиконкурентным поведением. 53 Несмотря на препятствия на пути их коммерциализации и внедрения, биоаналоги остаются мощным инструментом, способным снизить затраты на здравоохранение и улучшить доступ пациентов к ценным терапевтическим средствам.
Список литературы
- Ingrasciotta Y, Cutroneo PM, Marcianò I, Giezen T., Atzeni F, Trifirò G. Безопасность биопрепаратов, включая биоаналоги: перспективы текущего состояния и будущего направления. Сейф с наркотиками . 2018; 41 (11): 1013-1022.
Замечания комиссара FDA Скотта Готлиба, доктора медицины, подготовленные для передачи в Институт Брукингса по поводу выпуска Плана действий FDA по биосимилярам [пресс-релиз].Вашингтон, округ Колумбия: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США; 18 июля 2018 г. https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm613881.htm. По состоянию на 15 февраля 2019 г.
Mulcahy AW, Hlavka JP, Case SR. Снижение затрат на биосимиляры в США: начальный опыт и будущий потенциал. Rand Health Q . 2018; 7 (4): 3.
Закон о конкуренции цен на лекарства и восстановлении срока действия патента 1984 г., Pub L No.98-417, 98 Стат 1585.
Ассоциация доступных лекарств. Доступ к непатентованным лекарствам и сбережения в США. https://accessiblemeds.org/sites/default/files/2017-07/2017-AAM-Access-Savings-Report-2017-web2.pdf. Опубликовано в 2017 г. Проверено 2 мая 2019 г.
- Родовая фармацевтическая ассоциация. Отчет GPHA: триллион сбережений за 10 лет — экономия на непатентованных лекарствах в США. J Pharm Health Ser Res .2012; 3 (4): 229-236.
Закон о защите пациентов и доступном медицинском обслуживании 2010 г., Pub L No. 111-148, 124 Stat 119.
- Blackstone EA, Джозеф П.Ф. Экономика биоподобных препаратов. Am Health Drug Benefits . 2013; 6 (8): 469-478.
- Dahodwala H, Sharfstein ST. Биосимиляры: имитационные игры. ACS Med Chem Lett . 2017; 8 (7): 690-693.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Центр оценки лекарственных средств и исследований список лицензированных биологических продуктов с (1) эксклюзивностью эталонного продукта и (2) оценками биоподобия или взаимозаменяемости на сегодняшний день. https://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/TheotherapyBiologicApplications/Biosimilars/UCM560162.pdf. По состоянию на 15 февраля 2018 г.
Бреннан З. Pfizer не планирует запуск в США своего второго биоаналога Remicade, одобренного FDA. Нормативно-правовая база . 14 декабря 2017 г. https://www.raps.org/regulatory-focus%E2%84%A2/news-articles/2017/12/pfizer-not-planning-us-launch-of-its-second-remicade -биоаналог одобрен-FDA. По состоянию на 15 февраля 2019 г.
- Саршад М. Основные уроки, извлеченные из запуска Zarxio в США: начало биоподобной революции. GaBi J . 2017; 6 (4): 165-173.
Харрис Р. Небольшая экономия на лекарствах, имитирующих биотехнологические блокбастеры. NPR . 19 октября 2016 г. https://www.npr.org/sections/health-shots/2016/10/19/498559386/small-savings-for-drugs-made-to-mimic-biotech-blockbusters. По состоянию на 15 февраля 2019 г.
Сагоновски Э. По мере роста конкуренции цены на Remicade и biosims в США падают: аналитик. FiercePharma . 11 декабря 2018 г. https://www.fiercepharma.com/pharma/amid-biosim-competition-remicade-prices-gradually-slipping-analyst. По состоянию на 15 февраля 2019 г.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Purple Book: Списки лицензионных биологических продуктов с оценками исключительности эталонного продукта и биоподобия или взаимозаменяемости . https://www.fda.gov/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/TheotherapyBiologicApplications/Biosimilars/ucm411418.htm. Опубликовано в марте 2019 г. Проверено 15 февраля 2019 г.
Loftus P, Roland D. Добавляя патенты, производитель лекарств убирает более дешевые копии Humira из США. Уолл Стрит Джорнэл . 16 октября 2018 г. https://www.wsj.com/articles/biosimilar-humira-goes-on-sale-in-europe-widening-gap-with-u-s-1539687603. По состоянию на 15 февраля 2019 г.
AbbVie Inc против Boehringer Ingelheim International GMBH , № 1: 17-cv-01065 (дело Дель подано 2 августа 2017 г.).
Genentech, Inc против Amgen Inc , № 1: 17-cv-01407 (Заявление Дель подано 6 октября 2017 г.).
Sagonowsky E. Pfizer выпускает Retacrit, биосим для блокбастеров Amgen и J&J, посвященных анемии, с большой скидкой. FiercePharma . 14 ноября 2018 г. https://www.fiercepharma.com/pharma/amid-biosim-competition-remicade-prices-gradually-slipping-analyst. По состоянию на 15 февраля 2019 г.
Immunex Corporation против Sandoz Inc , No.2: 16-cv-01118 (D NJ, подана 26 февраля 2016 г.).
Sandoz запускает Zarxio (filgrastim-sndz), первый биоаналог в Соединенных Штатах [пресс-релиз]. Хольцкирхен, Германия: Сандоз; 3 сентября 2015 г. https://www.us.sandoz.com/news/media-releases/sandoz-launches-zarxiotm-filgrastim-sndz-first-biosimilar-united-states. По состоянию на 15 февраля 2019 г.
Davio K. Pfizer выпускает на рынок биоподобный филграстим, Nivestym, со значительной скидкой. Центр биосимиляров. 3 октября 2018 г. https://www.centerforbiosimilars.com/news/pfizer-launches-biosimilar-filgrastim-nivestym-at-a-substantial-discount. По состоянию на 15 февраля 2019 г.
Pfizer объявляет о выпуске в США биоаналога Inflectra (инфликсимаб-дийб) [пресс-релиз]. Нью-Йорк, штат Нью-Йорк: Pfizer; 7 октября 2016 г. https://www.pfizer.com/news/press-release/press-release-detail/pfizer_announces_the_u_s_availability_of_biosimilar_inflectra_infliximab_dyyb.По состоянию на 15 февраля 2019 г.
Merck объявляет о запуске в США препарата Renflexis (инфликсимаб-абда), биоаналога Remicade, для всех подходящих показаний [пресс-релиз]. Кенилворт, Нью-Джерси: Мерк; 24 июля 2017 г. https://www.mrknewsroom.com/news-release/corporate-news/merck-announces-us-launch-renflexis-infliximab-abda-biosimilar-remicade-. По состоянию на 15 февраля 2019 г.
Давио К. Милан запустит Fulphila со скидкой 33% по сравнению с Neulasta. Центр биосимиляров. 17 июля 2018 г. https://www.centerforbiosimilars.com/news/mylan-to-launch-fulphila-at-33-discount-to-neulasta. По состоянию на 15 февраля 2019 г.
Coherus подтверждает, что он запустил свой биоподобный пегфилграстим — Уденика. Центр биосимиляров. , 4 января 2019 г. https://www.centerforbiosimilars.com/news/coherus-confirms-that-it-has-launched-its-pegfilgrastim-biosimilar-udenyca. По состоянию на 15 февраля 2019 г.
Genentech, Inc v Celltrion, Inc , № 1: 18-cv-00574 (дата выпуска 2018 г.).
Mylan объявляет о глобальных соглашениях и лицензионных соглашениях с Genentech и Roche on Herception [пресс-релиз]. Хартфордшир, Англия: Милан; 13 марта 2017 г. http://newsroom.mylan.com/2017-03-13-Mylan-Announces-Global-Settlement-and-License-Agreements-with-Genentech-and-Roche-on-Herceptin-R. Доступ 21 февраля 2019 г.
Genentech, Inc против Celltrion, Inc , № 1: 18-cv-00095 (дата выпуска 2018 г.).
Genentech, Inc против Samsung Bioepis Co, Ltd , № 1: 18-cv-01363 (жалоба Дель подана 4 сентября 2018 г.).
Коттлер М., Уайтхилл Дж., Седор А. Биоподобные судебные процессы в 2018 году: грунтовка. BioPharma Dive . 14 декабря 2017 г. https://www.biopharmadive.com/news/the-2018-biosimilar-litigation-landscape-a-primer/512982/.По состоянию на 15 февраля 2019 г.
Sandoz объявляет о глобальном разрешении споров о патентах на биоподобный адалимумаб, обеспечивая доступ пациентов [пресс-релиз]. Хольцкирхен, Германия: Сандоз; 11 октября 2018 г. https://www.sandoz.com/news/media-releases/sandoz-announces-global-resolution-biosimilar-adalimumab-patent-disputes. По состоянию на 15 февраля 2019 г.
Уркхарт Л. Обзор рынка: лучшие препараты и компании по продажам в 2017 году. Nat Rev Drug Discov . 2018; 17 (4): 232.
И-МАК. Запатентовано, завышена цена: специальная версия Humira. http://www.i-mak.org/wp-content/uploads/2018/09/i-mak.humira.report.final_.0917.pdf. Опубликовано 18 сентября 2018 г. Проверено 15 февраля 2019 г.
- Вокингер К.Н., Кессельхейм А.С., Аворн Дж., Сарпатвари А. Стратегии, задерживающие выход на рынок непатентованных лекарств. JAMA Intern Med .2017; 177 (11): 1665-1669.
AbbVie объявляет о глобальном разрешении патентных споров HUMIRA (адалимумаб) с Sandoz [пресс-релиз]. Северный Чикаго, Иллинойс: AbbVie; 11 октября 2018 г. https://news.abbvie.com/news/abbvie-announces-global-resolution-humira-adalimumab-patent-disputes-with-sandoz.htm. По состоянию на 15 февраля 2019 г.
Loftus P. AbbVie и Amgen достигли урегулирования в патентном споре Humira. Уолл Стрит Джорнэл .28 сентября 2017 г. https://www.wsj.com/articles/abbvie-amgen-reach-settlement-in-humira-patent-dispute-1506635070. По состоянию на 15 февраля 2019 г.
AbbVie сообщает финансовые результаты за год и четвертый квартал 2017 года [пресс-релиз]. Северный Чикаго, Иллинойс: AbbVie; 26 января 2018 г. https://news.abbvie.com/news/abbvie-reports-full-year-and-fourth-quarter-2017-financial-results.htm. По состоянию на 15 февраля 2019 г.
- Schumock GT, Li EC, Wiest MD и др.Национальные тенденции в расходах на рецептурные препараты и прогнозы на 2017 год. Am J Health Syst Pharm . 2017; 74 (15): 1158-1173.
- Schumock GT, Stubbings J, Wiest MD, et al. Национальные тенденции в расходах на рецептурные препараты и прогнозы на 2018 г. Am J Health Syst Pharm . 2018; 75 (14): 1023-1038.
Pfizer Inc против Johnson & Johnson , 333 F Supp 3d 494 (ED Pa 2018).
Хьюмер К. Pfizer подает иск против J&J по контрактам с Remicade. Рейтер . 20 сентября 2017 г. https://www.reuters.com/article/us-pfizer-trial-johnson-johnson/pfizer-files-suit-against-jj-over-remicade-contracts-idUSKCN1BV1S8. По состоянию на 15 февраля 2019 г.
- Яздани Дж., Дадли Р.А., Лин Г.А., Чен Р., Ценг С.В. Наличные расходы на инфликсимаб и его биоаналог для лечения ревматоидного артрита в рамках Medicare Part D. JAMA . 2018; 320 (9): 931-933.
- Коэн Х., Бейдун Д., Чиен Д. и др. Осведомленность, знания и восприятие биоподобных препаратов среди врачей-специалистов. Adv Ther . 2017; 33 (12): 2160-2172.
Джейкобс И, Сингх Э., Сьюэлл К.Л., Аль-Саббаг А, Шейн Л.Г. Отношение пациентов и понимание биосимиляров: международный перекрестный опрос. Пациенты предпочитают приверженность . 2016; 10: 937-948.
Бреннан З. Pfizer требует руководства FDA по борьбе с ложной и вводящей в заблуждение рекламой биоподобных препаратов. Нормативно-правовая база . 28 августа 2018 г. https://www.raps.org/news-and-articles/news-articles/2018/8/pfizer-calls-for-fda-guidance-to-address-false-and. По состоянию на 15 февраля 2019 г.
Skeens LM; Петиция гражданина Pfizer Inc. https: //www.regulations.gov / contentStreamer? documentId = FDA-2018-P-3281-0001 & attachmentNumber = 1 & contentType = pdf. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США. Опубликовано 22 августа 2018 г. Проверено 15 февраля 2019 г.
Jørgensen KK, Olsen IC, Goll GL и др .; Исследовательская группа NOR-SWITCH. Переход с оригинального инфликсимаба на биоподобный CT-P13 по сравнению с поддерживаемым лечением оригинальным инфликсимабом (NOR-SWITCH): 52-недельное рандомизированное двойное слепое исследование не меньшей эффективности. Ланцет .2017; 389 (10086): 2304-2316.
- Голл Г.Л., Йоргенсен К.К., Секстон Дж. И др. Долгосрочная эффективность и безопасность биоподобного инфликсимаба (CT-P13) после перехода с оригинального инфликсимаба: открытое расширение исследования NOR-SWITCH. J Intern Med . 2019; 285 (6): 653-669.
- Коэн ХП, Блаувельт А., Рифкин Р.М., Данезе С., Гохале С.Б., Вуллетт Г.Переход от референтных лекарств к биоаналогам: систематический обзор клинических исходов в литературе. Наркотики . 2018; 78 (4): 463-478.
- Shrank WH, Hoang T, Ettner SL и др. Последствия выбора: назначение генерических или предпочтительных фармацевтических препаратов улучшает приверженность к лечению хронических состояний. Arch Intern Med .2006; 166 (3): 332-337.
Mestre-Ferrandiz J, Towse A, Berdud M. Biosimilars: как плательщики могут получить долгосрочные сбережения? Фармакоэкономика . 2016; 34 (6): 609-616.
- Грабовски Х., Гуха Р., Сальгадо М. Конкурс биосимиляров: уроки Европы. Nat Rev Drug Discov . 2014; 13 (2): 99-100.
- Хирш Б.Р., Балу С., Шульман К.А.Влияние специализированных фармацевтических препаратов как факторов, влияющих на расходы на здравоохранение. Центр Здоровья (Миллвуд) . 2014; 33 (10): 1714-1720.
- Дудзинский Д.М., Кессельхайм А.С. Научная и юридическая жизнеспособность последующих белковых препаратов. N Engl J Med . 2008; 358 (8): 843-849.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.План действий по биосимилярам: баланс между инновациями и конкуренцией. https://www.fda.gov/downloads/Drugs/DevelopmentApprovalProcess/HowDrugsareDevelopedandApproved/ApprovalApplications/TheotherapyBiologicApplications/Bioasimilars/UCM613761.pdf. Опубликовано в июле 2018 г. Проверено 15 февраля 2019 г.
Цитата
AMA J Ethics. 2019; 21 (8): E668-678.
DOI
10.1001 / amajethics.2019.668.Благодарности
Д-р Амит Сарпатвари — главный исследователь, получивший грант от Arnold Ventures на изучение рынка биоподобных препаратов.
Раскрытие информации о конфликте интересов
У автора (-ов) не было конфликта интересов, о котором следует сообщать.
Точки зрения, выраженные в этой статье, принадлежат авторам и не обязательно отражают взгляды и политику AMA.
Информация об авторе
Майк З. Чжай — студент третьего курса медицинского факультета совместной программы MD / MBA Гарвардской медицинской школы в Бостоне, штат Массачусетс. Он получил степень бакалавра в Пенсильванском университете.
Амит Сарпатвари, JD, PhD — преподаватель медицины в Гарвардской медицинской школе в Бостоне, штат Массачусетс.Он также является помощником директора Программы регулирования, терапии и права в отделе фармакоэпидемиологии и фармакоэкономики медицинского отделения больницы Бригама и женщин.
Аарон С. Кессельхейм, доктор медицины, доктор медицинских наук, магистр здравоохранения , профессор медицины Гарвардской медицинской школы в Бостоне, штат Массачусетс. Он также является директором Программы регулирования, терапии и права в отделе фармакоэпидемиологии и фармакоэкономики медицинского отделения больницы Бригама и женщин.
великих умов думают одинаково: плюсы и минусы биосимиляров | CG Life
Вы когда-нибудь мечтали воспроизвести вкус бутылки вина за 200 долларов, которое было выдержано до совершенства за последние четыре десятилетия? Эта задача практически невыполнима, поскольку требует от вас воспроизведения таких вещей, как окружающая среда, сбор урожая и условия хранения. Многие из этих вещей, например погоду, невозможно воспроизвести, но даже самые незначительные изменения могут означать разницу между невероятно вкусным вином и дорогим уксусом.
Трудность воспроизведения очень привередливых и точных условий в настоящее время характерна для класса лекарств, называемых биопрепаратами. Вы можете думать о биопрепаратах как о «прекрасном вине» фармацевтических препаратов, многие из которых одобрены для лечения заболеваний, которые не поддаются лечению никаким другим лекарством, включая различные виды рака, артриты, болезнь Крона и многие другие.
Поскольку срок действия патентов на некоторые из этих биопрепаратов начал истекать, фармацевтические компании пытаются воспроизвести их как «дженерики».Эти препараты чрезвычайно сложны, и создание идентичной, «непатентованной» версии похоже на воспроизведение хорошего вина — это практически невозможно.
Эта сложность положила начало разработке нового класса препаратов, называемых биоаналогами. Судя по названию, биоаналоги не совсем идентичны фирменным биопрепаратам, но, ну… похожи. Биосимиляры все еще довольно новы в США — FDA одобрило первый биоподобный препарат в 2015 году — и остается много вопросов, на которые нет ответа.
Отвечая на основные вопросы, такие как «что такое биоподобия?» и «каковы плюсы и минусы биосимиляров?», а также понимание проблем, связанных с производством биоподобных препаратов, могут помочь маркетологам в области биологических наук при работе с пациентами и компаниями, участвующими в разработке биосимиляров.
Биосимиляры 101: что такое биосимиляры и как они соотносятся с биологическими препаратами?
Итак, что такое биоаналоги? Чтобы действительно понять их, вы должны сначала рассмотреть процессы, с помощью которых производятся биопрепараты, и чем они отличаются от более простых фармацевтических препаратов, часто называемых низкомолекулярными фармацевтическими препаратами. Возьмем хорошо известный низкомолекулярный фармацевтический препарат, такой как аспирин: он имеет небольшую и простую химическую структуру (21 атом) и может быть легко изготовлен химиками в лаборатории или на заводе из относительно простых исходных материалов.Это позволяет (относительно) легко копировать. Как и в случае со многими другими низкомолекулярными фармацевтическими препаратами, после того как на них не распространяется патент, многие компании-производители все же создают копии. Эти идентичные копии называются дженериками, и их разработка дает множество преимуществ, включая прохождение сокращенного процесса проверки FDA и снижение затрат для пациентов примерно на 80-85%.
В отличие от низкомолекулярных фармацевтических препаратов, биопрепараты намного сложнее, а их синтез — гораздо менее прост.Химики не могут синтезировать эти лекарства, и, как следует из их названия, биологические препараты производятся в живых организмах, таких как бактерии, дрожжи или клетки животных. С помощью некоторых небольших инженерных приемов, применяемых в лаборатории, ученые могут уговорить этих одноклеточных рабочих лошадок конструировать для них биопрепараты.
Но, как обсуждалось выше, этот процесс сложен, и незначительные изменения в процессе производства могут изменить молекулярную структуру биологического препарата, что, в свою очередь, может привести к клиническим различиям как в безопасности, так и в эффективности.Любая компания, желающая скопировать биологический препарат, должна будет воспроизвести точный процесс производства фирменного биологического препарата. Эти сложные технические детали не часто публикуются, и компании придется потратить значительное количество времени на изучение различных производственных процессов и использование сложных биоаналитических методов для подтверждения биоидентичности. В некоторых случаях методы подтверждения точной молекулярной идентичности не существуют.
Следовательно, лучшее, на что могут надеяться многие фармацевтические компании, — это производить аналогичный препарат с аналогичной эффективностью и безопасностью.Таким образом родился биосимиляр.
От разработки до ценообразования: проблемы с биосимилярами
Поскольку биосимиляры отличаются от дженериков, они проходят отдельный путь разработки и утверждения FDA. Биосимиляры оцениваются в индивидуальном порядке, и для некоторых биосимиляров может потребоваться дополнительное тестирование фармакокинетики или иммуногенности. Хотя FDA разработало конкретные рекомендации по разработке биоподобных лекарств, некоторые аспекты разработки биосимиляров подверглись критике.Проблемы разработки биосимиляров и связанные с ними плюсы и минусы биосимиляров для пациентов и компаний включают:
Плюсы биосимиляров
- Ценообразование: из-за сокращенного процесса утверждения, который FDA требует для биосимиляров, эти препараты обычно дешевле в некоторых случаях примерно вдвое.
- Расширенные возможности лечения: одобрение биосимиляров создает дополнительные возможности лечения для часто дорогих фирменных продуктов.Эти варианты хороши для пациентов, поскольку могут возникнуть проблемы с производством данного биологического препарата, и в этом случае наличие одобренного варианта биоподобия может помочь пациентам продолжить лечение.
Минусы биосимиляров
- Экстраполяция показаний: некоторые биосимиляры могут получить одобрение по определенным показаниям, по которым был одобрен эталонный продукт (например, фирменный биологический препарат), без необходимости проведения дублирующих клинических испытаний. Это может быть опасно для пациентов, и некоторые исследования показали, что существует 30% -ная вероятность того, что пациент испытает неблагоприятное событие при приеме нового биологического препарата, не говоря уже о биоаналоге.
- Эффективность и безопасность: Несмотря на то, что биоаналоги проходят клинические испытания, они могут отличаться по эффективности и безопасности и, следовательно, не являются взаимозаменяемыми. Некоторые исследования показали, что биоаналоги очень отличаются по эффективности от их референсных препаратов. Поскольку это сложные молекулы, есть также дополнительные потенциальные проблемы безопасности, которые могут быть вызваны иммуногенностью.
Учитывая новый характер биосимиляров, остается еще много вопросов об эффективности и безопасности, на которые необходимо ответить.Одним из самых серьезных препятствий для использования биосимиляров является то, что сниженная цена на препарат не достигает пациентов из-за отказа некоторых страховщиков покрывать биоаналоги. В связи с тем, что девять биосимиляров в настоящее время одобрены FDA, многие другие находятся на рассмотрении, а крупные фармацевтические компании, такие как Pfizer, Sandoz и Amgen, инвестируют в разработку биосимиляров, непременно возникнет лучшее понимание и решения этих проблем.
Есть ли у вас мысли о биоподобных препаратах? Поделитесь ими с нами @CGLifeAgency.




 Однако, если вам эта тема показалась интересной и полезной, более подробно вы можете ознакомиться с ней, прочитав подготовленную нами специальную монографию «Биотехнологические лекарственные средства и биосимиляры», которая вышла в середине прошлого года*.
Однако, если вам эта тема показалась интересной и полезной, более подробно вы можете ознакомиться с ней, прочитав подготовленную нами специальную монографию «Биотехнологические лекарственные средства и биосимиляры», которая вышла в середине прошлого года*.