15)Бактерицидное и бактериостатическое действие антибиотиков.
По характеру действия антибиотиков на бактерии их можно разделить на две группы:
1)АБ бактериостатического действия
2)АБ бактерицидного действия
Бактериостатические АБ в концентрациях, которые можно создать в организме, задерживают рост микробов, но не убивают их, тогда как воздействие бактерицидных антибиотиков в аналогичных концентрациях приводит к гибели клетки. Однако в более высоких концентрациях бактериостатические антибиотики могут оказывать также и бактерицидное действие. К бактериостатическим антибиотикам относятся макролиды, тетрациклины, левомицетин и другие, а к бактерицидным –пенициллины, цефалоспорины, ристоцетин, аминогликозиды и другие.
За
последние годы были достигнуты большие
успехи в изучении механизма действия
антибиотиков на молекулярном уровне.
Пенициллин, ристомицин (ристоцетин),
ванкомицин, новобиоцин, D-циклосерин
нарушают синтез клеточной стенки
бактерий, то есть эти антибиотики
действуют лишь на развивающиеся бактерии
и практически неактивны в отношении
покоящихся микробов. Конечным результатом
действия этих антибиотиков является
угнетение синтеза муреина, который
наряду с тейхоевыми кислотами является
одним из основных полимерных компонентов
клеточной стенки бактериальной клетки.
Под воздействием этих антибиотиков
вновь образующиеся клетки, лишенные
клеточной стенки, разрушаются. Если
осмотическое давление окружающей
жидкости повысить, например внесением
в среду сахарозы, то лишенные клеточной
стенки бактерии не лизируются, а
превращаются в сферопласты или протопласты
(см. Протопласты бактериальные), которые
в соответствующих условиях способны
размножаться подобно L-формам бактерий.
После удаления антибиотика микробная
клетка, если она не погибла, вновь
становится способной образовывать
клеточную стенку и превращаться в
нормальную бактериальную клетку.
Механизм действия других антибактериальных антибиотиков – левомицетина, макролидов, тетрациклинов – заключается в нарушении синтеза белка бактериальной клетки на уровне рибосом. Как и антибиотики, подавляющие образование муреина, антибиотики, угнетающие синтез белка, действуют на различных этапах этого процесса и поэтому не имеют перекрестной устойчивости между собой.
Механизм действия антибиотиков аминогликозидов, например стрептомицинов, заключается в первую очередь в подавлении синтеза белка в микробной клетке за счет воздействия на 30 S-рибосомальную субъединицу), а также нарушения считывания генетического кода в процессе трансляции.
Противогрибковые антибиотики полиены нарушают целостность цитоплазматической мембраны у грибковой клетки, в результате чего эта мембрана теряет свойства барьера между содержимым клетки и внешней средой, обеспечивающего избирательную проницаемость. В отличии от пенициллина, полиены активны и в отношении покоящихся клеток грибков. Противогрибковое действие полиеновых антибиотиков обуславливается связыванием их со стеринами, содержащимися в цитоплазматической мембране клеток грибков. Устойчивость бактерий к полиеновым антибиотикам объясняется отсутствием в их цитоплазматической мембране стеринов, связывающихся с полиенами.
Противоопухолевые
антибиотики, в отличие от антибактериальных,
нарушают синтез нуклеиновых кислот в
бактериальных и животных клетках.
Антибиотики актиномицины и производные
ауреоловой кислоты подавляют синтез
ДНК-зависимой РНК, связываясь с ДНК
,служащей матрицей для синтеза РНК.
Антибиотик митамицин С оказывает
алкилирующее действие на ДНК, образуя
прочные ковалентные поперечные связи
между двумя комплементарными спиралями
ДНК, нарушая при этом ее репликацию.
Под действием бактерицидных антибиотиков бактерии убивают себя сами
Стал известен общий механизм, лежащий в основе бактерицидного действия большинства применяемых в настоящее время антибиотиков. Стимулируемое антибиотиками образование свободных радикалов приводит к накоплению критического количества поврежденных гуаниновых оснований в составе ДНК и РНК; попытка клетки исправить причиненный урон приводит к гибели.
Вот уже больше 50 лет человечество применяет антибиотики, благодаря чему практически избавлено от былой опасности бактериальных инфекций. Антибактериальные препараты делятся на два класса: бактерицидные, которые активно убивают бактерий с почти 100% эффективностью, и бактериостатические, которые просто останавливают рост культур.
К бактерицидным антибиотикам относятся β‑лактамы (пенициллин, амоксициллин и др.), блокирующие синтез пептидогликана — основного компонента бактериальной клеточной стенки; фторхинолоны (ципрофлоксацин), блокирующие бактериальную топоизомеразу II в процессе работы и тем самым вызывающие невосстановимые двухцепочечные разрывы в ДНК; аминогликозиды (канамицин), связывающиеся с 30S субъединицей бактериальной рибосомы и ингибирующие трансляцию.
Большинство других ингибиторов трансляции (хлорамфеникол, спектиномицин, тетрациклин и др.) оказывает бактериостатическое действие.
Большинство антибиотиков делают одно их трех: либо нарушают трансляцию белка, либо ингибируют процессы синтеза и поддержания структуры клеточной стенки, либо нарушают репликацию и репарацию ДНК. Благодаря отличиям физиологических процессов и структуры конкретных белков у прокариот и у эукариот антибиотики являются сравнительно нетоксичными для человека. Взаимодействия антибиотиков и их мишеней в деталях изучены, и положение молекулы лекарства в активном центре фермента известно вплоть до отдельного атома. Казалось бы, что осталось непонятного? Тем не менее, за годы изучения и применения антибиотиков накопилось множество разных фактов, свидетельствующих о том, что мы примитивно представляем себе процесс гибели клетки. Например, оказалось, что бактерицидное действие фторхинолонов требует активного синтеза АТФ и наличия синтеза белка. Мутации в системе SOS-ответа (ответа на повреждения ДНК) повышают бактериальную чувствительность к фторхинолонам, и, что уж совсем странно, к пенициллинам. Наконец, оставалось непонятным, почему одни ингибиторы трансляции (аминогликозиды) приводят к быстрой смерти бактерий, в то время как другие (хлорамфеникол, спектиномицин) просто останавливают рост клеток.
Благодаря отличиям физиологических процессов и структуры конкретных белков у прокариот и у эукариот антибиотики являются сравнительно нетоксичными для человека. Взаимодействия антибиотиков и их мишеней в деталях изучены, и положение молекулы лекарства в активном центре фермента известно вплоть до отдельного атома. Казалось бы, что осталось непонятного? Тем не менее, за годы изучения и применения антибиотиков накопилось множество разных фактов, свидетельствующих о том, что мы примитивно представляем себе процесс гибели клетки. Например, оказалось, что бактерицидное действие фторхинолонов требует активного синтеза АТФ и наличия синтеза белка. Мутации в системе SOS-ответа (ответа на повреждения ДНК) повышают бактериальную чувствительность к фторхинолонам, и, что уж совсем странно, к пенициллинам. Наконец, оставалось непонятным, почему одни ингибиторы трансляции (аминогликозиды) приводят к быстрой смерти бактерий, в то время как другие (хлорамфеникол, спектиномицин) просто останавливают рост клеток.
В 2007 году ученые из Бостона под руководством Джеймса Коллинза (James Collins) поставили перед собой амбициозную задачу выяснить, как, собственно, ингибирование клеточных ферментов приводит к гибели клеток. Для этого изучалось изменение транскрипции всех генов Escherichia coli в ответ на действие антибиотиков. Неожиданно для всех оказалось, что действие всех трех классов бактерицидных антибиотиков (фторхинолоны, аминогликозиды, β‑лактамы) приводит к активации одних и тех же групп генов: ответственных за метаболизм железа, борьбу с окислительным стрессом и репарацию ДНК. Исследователи предположили, что повреждение железо-серных кластеров в составе ферментов дыхательной цепи и высвобождение свободных ионов железа провоцирует радикальную реакцию с участием пероксида водорода, в ходе которой лавинообразно увеличивается количество гидроксил-радикалов OH·, повреждающих ДНК, белки и мембраны клетки.
Железо-серные кластеры — это комплексы связанных дисульфидными связями атомов железа, которые содержатся в активных центрах многих ферментов, осуществляющих окислительно-восстановительные реакции в клетке, например, аконитазы, NADH-дегидрогеназы, нитроредуктазы.
В Фентоновской реакции, описывающей взаимодействие ионов железа и пероксида водорода, суммарная степень окисления железа не меняется, таким образом, оно является катализатором образования свободных радикалов:
Fe2+ + H2O2 → Fe3+ + ·OH + OH−
Fe3+ + H2O2 → Fe2+ + ·OOH + H+
Перекись водорода, участвующая в реакции, постоянно образуется в клетке в процессе аэробного дыхания.
Действительно, применение веществ — захватчиков радикалов, таких как тиомочевина, позволило значительно снизить гибель клеток под действием антибиотиков; аналогичные результаты были достигнуты, когда с помощью мутаций была нарушена способность клеток синтезировать потенциально опасные железо-серные кластеры. Дальнейшие исследования показали, что дестабилизация железо-серных белков в свою очередь вызывается супероксид-анионом O
В этом апреле в журнале Science вышла статья биологов из Массачусетского технологического института (MIT) под руководством Грэма Уокера (Graham Walker), продолжающая и дополняющая работы Коллинза, что подтвердилось участием последнего в публикации.
Группа Уокера занимается изучением ДНК-полимеразы E. coli DinB (про более раннюю их работу уже выходила статья на «Элементах», см. Объяснен механизм копирования сбойных блоков в ДНК, «Элементы», 19.01.2006). DinB — это полимераза транслезионного синтеза (см. translesion synthesis), способная работать на поврежденных ДНК-матрицах (например, содержащих окисленные нуклеотиды, или тиминовые димеры (см. thymine dimer), являющиеся непреодолимым препятствием для основной ДНК-полимеразы E. coli — ДНК-полимеразы III). dinB является жизненно важным для клетки геном, позволяющим переживать стресс. Тем не менее, искусственное увеличение числа копий DinB («сверхэкспрессия») является смертельным для бактерии. Уокер и его коллеги решили проверить, не является ли гибель клетки и в этом случае зависящей от гидроксил-радикалов. Для этого они проводили сверхэкспрессию DinB либо в присутствии «захватчика» свободных радикалов, тиомочевины, либо в присутствии хелатора ионов железа 2,2’‑дипиридила, либо в анаэробных условиях. Оказалось, что любое из этих ухищрений способно полностью предотвратить гибель клеток.
coli — ДНК-полимеразы III). dinB является жизненно важным для клетки геном, позволяющим переживать стресс. Тем не менее, искусственное увеличение числа копий DinB («сверхэкспрессия») является смертельным для бактерии. Уокер и его коллеги решили проверить, не является ли гибель клетки и в этом случае зависящей от гидроксил-радикалов. Для этого они проводили сверхэкспрессию DinB либо в присутствии «захватчика» свободных радикалов, тиомочевины, либо в присутствии хелатора ионов железа 2,2’‑дипиридила, либо в анаэробных условиях. Оказалось, что любое из этих ухищрений способно полностью предотвратить гибель клеток.
Одной из важных потенциальных мишеней активных форм кислорода является азотистое основание гуанин. Окисленный гуаниновый нуклеотид, 8‑оксо-дезоксигуанидин (8‑oxo‑dG), является источником мутаций: он способен образовывать комплементарные пары как с С (цитозином), так и с А (аденином) (неповрежденный нуклеотид G в нормальных условиях образует пары только с С). В свою очередь, полимераза DinB, обладая пониженной точностью копирования, способна использовать окисленный 8‑оксо-дезоксигуанидинтрифосфат (8‑oxo‑dGTP) в качестве субстрата, вставляя его напротив А или напротив С. Может быть, при сверхэкспрессии DinB включает чересчур много 8‑oxo‑dG в состав ДНК, и клетка погибает от слишком большого числа мутаций? Ученые создали искусственную форму DinB, в которой замена одной аминокислоты значительно снижает возможность использования 8‑oxo‑dGTP в качестве субстрата. Как и предполагалось, сверхэкспрессия такой полимеразы безопасна для клеток.
Тем не менее, непосредственное мутагенное действие не может объяснить наблюдаемой скорости гибели клеток: DinB синтезирует ДНК очень медленно, и шанс, что достаточное количество клеток получит летальную мутацию за время эксперимента, продолжающегося несколько часов, очень невелик. Скорее всего, причина не в самих мутациях, а в попытках клетки их исправить: виновата система эксцизионной репарации (см. base excision repair), ответственная за распознавание и удаление поврежденных оснований. Если два окисленных гуаниновых нуклеотида расположены рядом друг с другом, действие ферментов-гликозилаз MutM и MutY может привести к образованию двухцепочечного разрыва ДНК (рис. 2). Действительно, оказалось, что удаление этих двух генов помогает клеткам выживать при сверхэкспрессии DinB. Другим способом почти полностью защитить клетки от гибели было одновременно с DinB сверхэкспрессировать фермент MutT, способный узнавать поврежденный 8‑oxo‑dGTP еще до того, как он встроится в ДНК, и гидролизовать его.
Если два окисленных гуаниновых нуклеотида расположены рядом друг с другом, действие ферментов-гликозилаз MutM и MutY может привести к образованию двухцепочечного разрыва ДНК (рис. 2). Действительно, оказалось, что удаление этих двух генов помогает клеткам выживать при сверхэкспрессии DinB. Другим способом почти полностью защитить клетки от гибели было одновременно с DinB сверхэкспрессировать фермент MutT, способный узнавать поврежденный 8‑oxo‑dGTP еще до того, как он встроится в ДНК, и гидролизовать его.
Какая же связь между этими открытиями и бактерицидным действием антибиотиков? Оказывается, токсичное действие ·OH‑радикалов, образующихся при действии антибиотиков, в основном связано именно с окислением гуанина. Так, сверхэкспрессия MutT способна на несколько порядков увеличить выживаемость клеток, подвергшихся действию фторхинолона, норфлоксацина, пенициллина или канамицина. К схожим результатам приводит «выбивание» генов двух полимераз, способных включать в состав ДНК 8‑oxo‑dG (DinB и UmuDC) или генов гликозилаз MutM и MutY, репарирующих поврежденное основание. Таким образом, долгий путь к установлению истинных причин гибели клеток под действием антибиотиков почти пройден; практическое применение полученных знаний позволит, как надеются ученые, значительно усилить потенциал существующих антибиотиков и преодолеть возникающую у микроорганизмов резистентность.
Источник: James J. Foti, Babho Devadoss, Jonathan A. Winkler, James J. Collins, Graham C. Walker. Oxidation of the guanine nucleotide pool underlies cell death by bactericidal antibiotics // Science. 2012. V. 336. Pp. 315–319.
См. также:
1) Daniel D. Dwyer, Michael A. Kohanski, Boris Hayete, James J. Collins. Gyrase inhibitors induce an oxidative damage cellular death pathway in Escherichia coli // Mol Syst Biol. 2007 V. 3. P. 91.
2) Michael A. Kohanski, Daniel J. Dwyer, Boris Hayete, Carolyn A. Lawrence, James J. Collins. A common mechanism of cellular death induced by bactericidal antibiotics // Cell. 2007. V. 130. Pp. 797–810.
2007. V. 130. Pp. 797–810.
3) Michael A. Kohanski, Daniel D. Dwyer, James J. Collins. How antibiotics kill bacteria: from targets to networks // Nat Rev Microbiol. 2010. V. 8. Pp. 423–435.
Дмитрий Гиляров
Антибиотики | GxP News
Антибиотики — вещества природного или полусинтетического происхождения, подавляющие рост живых клеток, чаще всего прокариотических или простейших.
По ГОСТ 21507-81 (СТ СЭВ 1740-79)
Антибиотик — вещество микробного, животного или растительного происхождения, способное подавлять рост микроорганизмов или вызывать их гибель.
Антибиотики природного происхождения чаще всего продуцируются актиномицетами, реже — немицелиальными бактериями.
- Некоторые антибиотики оказывают сильное подавляющее действие на рост и размножение бактерий и при этом относительно мало повреждают или вовсе не повреждают клетки макроорганизма, и поэтому применяются в качестве лекарственных средств;
- Некоторые антибиотики используются в качестве цитостатических (противоопухолевых) препаратов при лечении онкологических заболеваний.
Терминология
Полностью синтетические препараты, не имеющие природных аналогов и оказывающие сходное с антибиотиками подавляющее влияние на рост бактерий, традиционно было принято называть не антибиотиками, а антибактериальными химиопрепаратами. В частности, когда из антибактериальных химиопрепаратов известны были только сульфаниламиды, принято было говорить обо всём классе антибактериальных препаратов как об «антибиотиках и сульфаниламидах». Однако в последние десятилетия в связи с изобретением многих весьма сильных антибактериальных химиопрепаратов, в частности фторхинолонов, приближающихся или превышающих по активности «традиционные» антибиотики, понятие «антибиотик» стало размываться и расширяться и теперь часто употребляется не только по отношению к природным и полусинтетическим соединениям, но и к многим сильным антибактериальным химиопрепаратам.
Классификация
Огромное разнообразие антибиотиков и видов их воздействия на организм человека явилось причиной классифицирования и разделения антибиотиков на группы. По характеру воздействия на бактериальную клетку антибиотики можно разделить на три группы:
- бактериостатические (бактерии живы, но не в состоянии размножаться),
- бактерициды (бактерии умертвляются, но физически продолжают присутствовать в среде),
- бактериолитические (бактерии умертвляются, и бактериальные клеточные стенки разрушаются).
Классификация по химической структуре, которую широко используют в медицинской среде, состоит из следующих групп:
- Бета-лактамные антибиотики, делящиеся на две подгруппы
- Пенициллины — вырабатываются колониями плесневого грибка Penicillium;
- Цефалоспорины — обладают схожей структурой с пенициллинами. Используются по отношению к пенициллинустойчивым бактериям.
- Макролиды — антибиотики со сложной циклической структурой. Действие — бактериостатическое.
- Тетрациклины — используются для лечения инфекций дыхательных и мочевыводящих путей, лечения тяжелых инфекций типа сибирской язвы, туляремии, бруцеллёза. Действие — бактериостатическое.
- Аминогликозиды — обладают высокой токсичностью. Используются для лечения тяжелых инфекций типа заражения крови или перитонитов.
- Левомицетины — Использование ограничено по причине повышенной опасности серьезных осложнений — поражении костного мозга, вырабатывающего клетки крови. Действие — бактерицидное.
- Гликопептидные антибиотики нарушают синтез клеточной стенки бактерий. Оказывают бактерицидное действие, однако в отношении энтерококков, некоторых стрептококков и стафилококков действуют бактериостатически.
- Линкозамиды оказывают бактериостатическое действие, которое обусловлено ингибированием синтеза белка рибосомами.
 В высоких концентрациях в отношении высокочувствительных микроорганизмов могут проявлять бактерицидный эффект.
В высоких концентрациях в отношении высокочувствительных микроорганизмов могут проявлять бактерицидный эффект. - Противогрибковые — разрушают мембрану клеток грибков и вызывают их гибель. Действие — литическое. Постепенно вытесняются высокоэффективными синтетическими противогрибковыми препаратами.
Источник: Википедия
Вернуться на главную страницу Глоссария
Бактериостатические и бактерицидные вещества — Справочник химика 21
БАКТЕРИОСТАТИЧЕСКИЕ И БАКТЕРИЦИДНЫЕ ВЕЩЕСТВА [c.313]Введение в дезодоранты сильных антимикробных веществ может привести к серьезным нарущениям биологического равновесия кожи и снизить ее естественную защитную реакцию в отнощении болезнетворных микроорганизмов. Поэтому в последнее время предпочтение отдается не бактерицидным веществам, полностью уничтожающим микроорганизмы, а бактериостатическим, т. е. ограничивающим и приостанавливающим их рост и размножение. [c.108]
До открытия современных бактериостатических лекарственных препаратов гексаметилентетрамин применяли при лечении инфекционных заболеваний почек и мочевого пузыря. Его прием чередовали с приемом кислого фосфата натрия для снижения pH мочи до такой степени, чтобы сдвинуть равновесие реакции (23.1) влево путем снижения концентрации NHз в кислом растворе (превращения аммиака в ион Nh5), что приводит к образованию бактерицидного вещества формальдегида. [c.665]
Если вещество обладает бактериостатическим, бактерицидным или бактериолитическим свойством, то это указывает лишь на конечный результат действия антибиотика, а не на механизм, при помощи которого получен тот или другой биологический эффект. [c.413]
Для борьбы с вредной микрофлорой используются разнообразные физические и химические методы. К числу физических методов уничтожения микроорганизмов относятся термическая обработка (автоклавирование, пастеризация и др.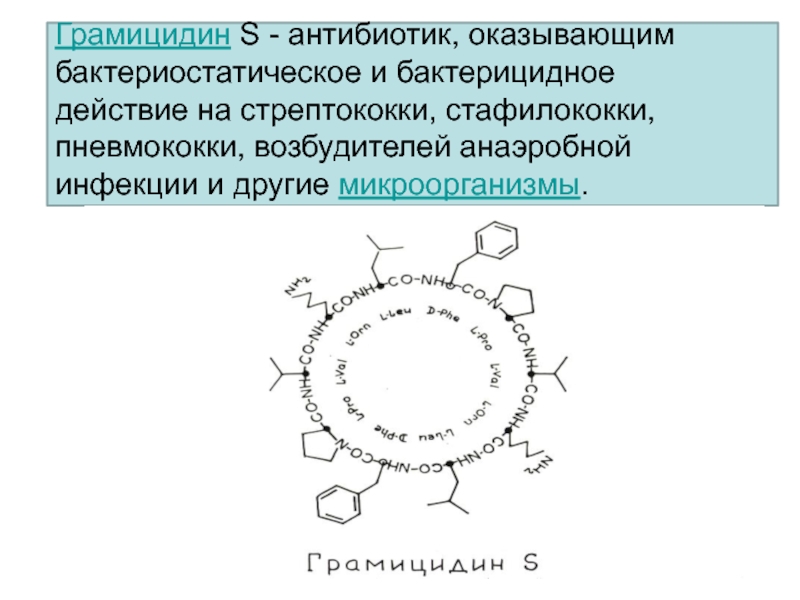 ), замораживание, действие ультрафиолетовых и рентгеновских излучений и др. При химических методах борьбы с микробами, вызывающими порчу продуктов, применяются различные бактериостатические или бактерицидные вещества (сернистый ангидрид, бензойная кислота, сорбиновая кислота и др.). [c.501]
), замораживание, действие ультрафиолетовых и рентгеновских излучений и др. При химических методах борьбы с микробами, вызывающими порчу продуктов, применяются различные бактериостатические или бактерицидные вещества (сернистый ангидрид, бензойная кислота, сорбиновая кислота и др.). [c.501]
Синтетические жирные спирты могут быть использованы для синтеза катионоактивных поверхностных веществ, в частности на их основе можно изготовлять четвертичные аммониевые соли, которые обладают рядом свойств поверхностно-активных веществ, а также бактерицидными и бактериостатическими свойствами. [c.17]
БЕНЗОЙНАЯ КИСЛОТА СбН СООН-простейший представитель одноосновных ароматических кислот. Б. к.— кристаллическое вещество (листочки или иглы), т. пл. 122,37° С плохо растворяется в воде, лучше — в спирте и эфире. Б. к. получают окислением толуола, из фталевой кислоты и другими способами. Б. к. и ее соли обладают большой бактерицидно и бактериостатической активностью. Бензоат натрия используется для консервации пищевых продуктов, а бензоаты лития, магния и кальция — в медицине для лечения подагры и ревматизма. Производные Б. к. широко применяются в органическом синтезе красителей, фармацевтических препаратов, в качестве инициаторов полимеризации, в пищевой промышленности и в парфюмерии. [c.41]
В целом нарушается синтез нуклеиновых кислот и клеточных белков, что и лежит в основе бактериостатического и бактерицидного действия лекарственного вещества. Эти препараты не действуют подобным образом на клетки человека, так как его организм не вырабатывает витамины, а получает их с пищей. [c.71]
В первом случае микроорганизмы погибают, и тогда говорят о бактерицидном действии данного консерванта, во втором — происходит глубокое торможение жизненных функций микроорганизма. В этом случае свидетельствуют о бактериостатическом действии консервирующего вещества. [c.159]
Вследствие того что длинноцепочечные основные молекулы катионных ПАВ несут положительный заряд, а большая часть межфазных поверхностей в водном растворе заряжена отрицательно, эти ПАВ обладают высокой субстантивностью по отношению к большому ряду материалов. Адсорбция катионных ПАВ на межфазных поверхностях уничтожает электростатическое отталкивание, способствующее протеканию процесса мытья, и поэтому соединения этого класса нельзя использовать как обычные моющие вещества. Однако субстантивность, приводящая к образованию защитной поверхностной плёнки, а в некоторых случаях также бактериостатические и бактерицидные свойства катионных ПАВ являются ценными в ряде специальных областей применения. Важнейшими из них являются следующие смягчение текстильных тканей (четвертичные аммониевые соли с двумя длинноцепочечными алкильными группами, стр. 547),модифицирование поверхности минералов (четвертичные аммониевые соли), флотация руд (ацетаты аминов) и получение асфальтовых эмульсий (оксиэтилированные амины и другие производные) кроме того, катионные ПАВ употребляют- [c.542]
Адсорбция катионных ПАВ на межфазных поверхностях уничтожает электростатическое отталкивание, способствующее протеканию процесса мытья, и поэтому соединения этого класса нельзя использовать как обычные моющие вещества. Однако субстантивность, приводящая к образованию защитной поверхностной плёнки, а в некоторых случаях также бактериостатические и бактерицидные свойства катионных ПАВ являются ценными в ряде специальных областей применения. Важнейшими из них являются следующие смягчение текстильных тканей (четвертичные аммониевые соли с двумя длинноцепочечными алкильными группами, стр. 547),модифицирование поверхности минералов (четвертичные аммониевые соли), флотация руд (ацетаты аминов) и получение асфальтовых эмульсий (оксиэтилированные амины и другие производные) кроме того, катионные ПАВ употребляют- [c.542]
Антибиотики, как правило, вызывают в организме человека бактериостатический эффект и редко бактерицидный. Механизм их действия на микроорганизмы в деталях еще не ясен, но они понижают жизнеспособность микробов, нарушая их обмен веществ. Под влиянием повторных действий многие микроорганизмы привыкают к антибиотику и приобретают к нему устойчивость. [c.468]
Волкова высказывает предположение, что в летнее время, в связи с пышной вегетацией водорослей и простейших, в водоемах происходит накопление органических веществ. Это, а также повышение температуры создает оптимальные условия для развития микроорганизмов как в воде, так и в илах. Многие из этих микроорганизмов могут выделять ядовитые для патогенных бактерий вещества. Осенью, когда наступает отмирание богатой водной растительности, микробы также активно размножаются, несмотря на некоторое снижение температуры водоемов. Зимой микробиологические процессы в грязях замирают, чем и объясняется снижение их бактерицидных и бактериостатических свойств. [c.537]
Вообще говоря, определить, является ли данное вещество бактерицидным или бактериостатическим средством, можно только условно. Принято, например, считать, что вещество обладает бактерицидными свойствами, если после его удаления бактериальные клетки теряют способность расти. Если же клетки оказываются способными к росту, то характер действия препарата определяется как бактериостатический. И все же бактериальные пробы нельзя считать надежным методом оценки бактерицидного средства, так как часто бывает трудно определить, погибла ли клетка. [c.262]
Принято, например, считать, что вещество обладает бактерицидными свойствами, если после его удаления бактериальные клетки теряют способность расти. Если же клетки оказываются способными к росту, то характер действия препарата определяется как бактериостатический. И все же бактериальные пробы нельзя считать надежным методом оценки бактерицидного средства, так как часто бывает трудно определить, погибла ли клетка. [c.262]
Механизм антибиотического действия непредельных жирных кислот не изучен. Правда, высказано предположение что эти вещества влияют в первую очередь на физико-химические свойства оболочки бактерий, изменяя прежде всего ее поверхностное натяжение. Однако эти высказывания нельзя считать обоснованными в должной степени. Следует также отметить, что непредельные жирные кислоты обладают бактериостатическим, а не бактерицидным действием. Это вытекает из способности некоторых веществ (холестерин, лецитин и др.) прекращать их действие и восстанавливать дальнейший нормальный рост микроорганизма даже через 2 дня после того, как он был остановлен прибавлением непредельных кислот [c.23]
Широкое распространение бактериостатических и бактерицидных агентов ясно показывает, что бактерии восприимчивы к действию различных химических веществ, которые в зависимости от кх природы либо ингибируют рост бактерий, либо убивают их. Широко известным примером ингибитора бактериального роста является фенол, а хлор — наиболее известный и широко используемый химический бактерицидный агент. Присутствие ингибиторов в бактериальной культуре может быть либо преднамеренным, либо непреднамеренным, и именно последний случай имеет отношение к очистке загрязненных стоков. Непреднамеренное присутствие ингибирующих соединений в процессе биологической очистки сточных вод проистекает от появления ингибирующих загрязнений (субстратов), образования интермедиатов-ингибиторов и высвобождения соединений-ингибиторов при клеточном лизисе. [c.96]
Для практических целей важно осуществлять контроль за ростом микроорганизмов и подавлять развитие нежелательных форм. Активность микроорганизмов может, например, приводить к порче продуктов и развитию заболеваний. Поэтому бывает необходимо подавить микроорганизм или приостановить его рост. Агенты, вызывающие такие последствия, называют соответственно бактерицидными и бактериостатическими. Характер действия антимикробного агента часто зависит от концентрации. К тому же следует помнить, что для некоторых микроорганизмов эти вещества, наоборот, могут быть источниками углерода и энергии. Если необходимо убить все микроорганизмы в (на) объекте, то говорят о стерилизации. Для стерилизации применяют антимикробные агенты с широким спектром действия. [c.82]
Активность микроорганизмов может, например, приводить к порче продуктов и развитию заболеваний. Поэтому бывает необходимо подавить микроорганизм или приостановить его рост. Агенты, вызывающие такие последствия, называют соответственно бактерицидными и бактериостатическими. Характер действия антимикробного агента часто зависит от концентрации. К тому же следует помнить, что для некоторых микроорганизмов эти вещества, наоборот, могут быть источниками углерода и энергии. Если необходимо убить все микроорганизмы в (на) объекте, то говорят о стерилизации. Для стерилизации применяют антимикробные агенты с широким спектром действия. [c.82]
Помимо этих старых и хорошо изученных соединений, в патентной литературе описано значительное число катионактивных веществ, обладающих бактерицидными свойствами, но почти не получивших практического применения. Относительно этих соединений было лишь указано, что они проявляют бактерицидное или бактериостатическое действие без каких-либо подтверждающих это указание количественных данных. Некоторые из этих соединений явились объектом широкого клинического изучения. К ним относятся [c.153]
Дезинфицирующее вещество применяют в соответствующей концентрации при неправильно выбранных концентрациях инактивации может не произойти, а излишне концентрированные растворы могут проявить токсическое действие или повредить материалы. От концентрации агента зависит, будет ли действие бактериостатическим или бактерицидным. [c.221]
Токсичное действие органических ксенобиотиков. Токсичные вещества могут задерживать развитие микроорганизмов — бактериостатическое действие, или вызывать гибель клеток — бактерицидное действие. Степень токсичности зависит от природы вещества, его дозы, продолжительности контакта. При высоких концентрациях вещество, проявляющее бактериостатическое действие, становится бактерицидным. Токсиканты в концентрациях ниже порога бактериостатического действия могут влиять на обмен веществ микроорганизмов.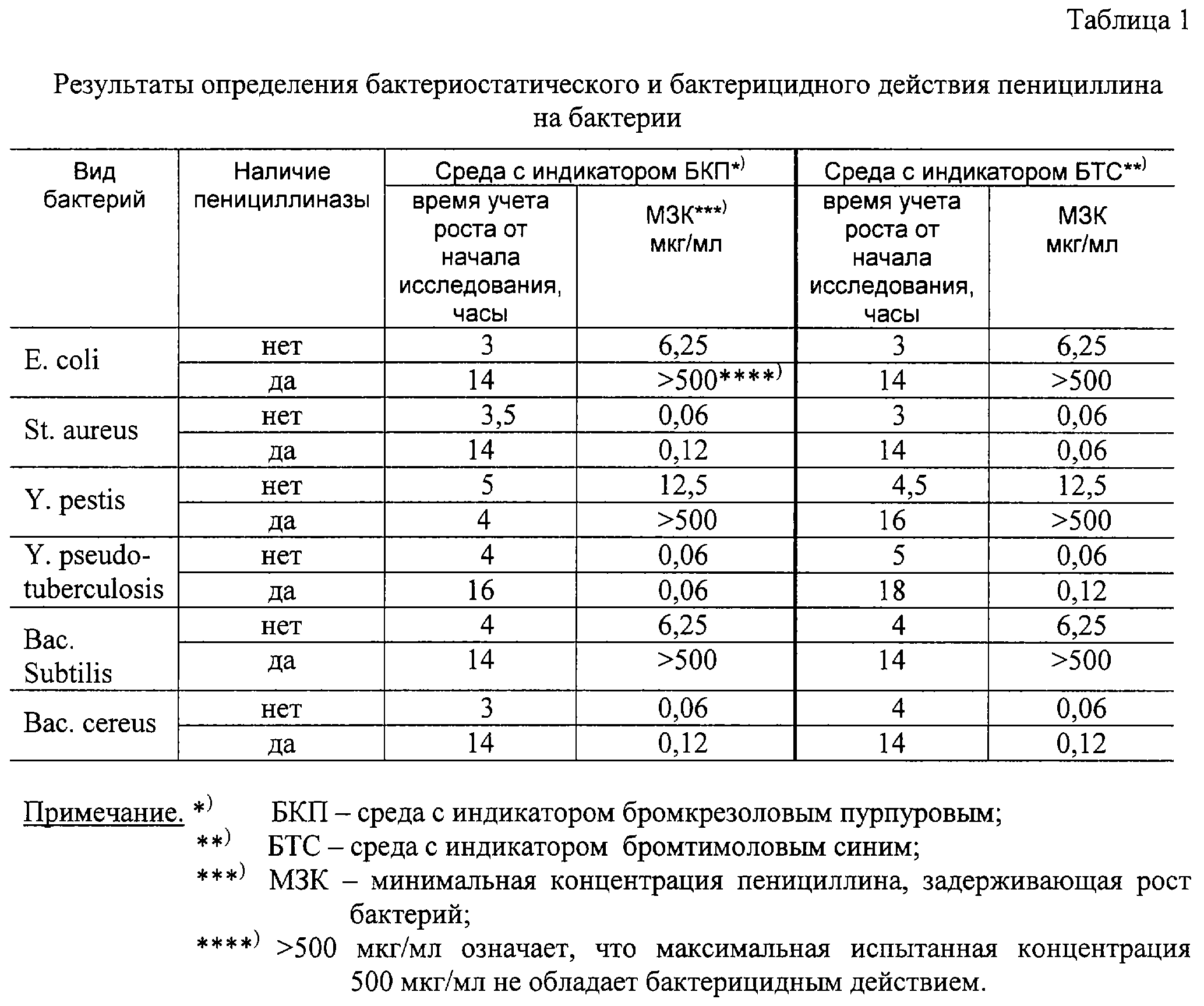 [c.359]
[c.359]
Таким образом, если антибиотик способен нарушать системы, регулирующие осмотические свойства клеточной стенки, иными словами, если антибиотик выступает в качестве поверх-ностно-активного соединения, то он может оказывать бактерицидное действие. К числу антибиотических веществ, механизм действия которых связан с поверхностно-активными свойствами, относят грамицидин С, тироцидин, полимиксины, а также тетрациклины, если последние применяются в концентрациях, во много раз превышающих бактериостатические. [c.417]
Он обладает бактериостатическим и бактерицидным действием и применяется для лечения ран, ожогов, воспалительных заболеваний, а также в качестве противозачаточного средства. Этот антибактериальный пептид интересен также тем, что в его составе фенилаланин имеет D-форму. В последнее время было вьщелено несколько небольших природных пептидов (из кожи древесных лягушек, ганглий улиток, яда пауков), которые содержат одну или две D-аминокислоты. Было подтверждено, что D-форма аминокислотного остатка в такого рода пептидах резко увеличивает их устойчивость к гидролитическому действию эк-30- и эндопротеаз. Этот факт учитывается при создании олиго-пептидных лекарственных веществ пролонгированного действия. [c.39]
Вследствие открытия терапевтической активности сульфамидов химиотерапия сделала большие успехи. В отличие от некоторых веществ, называемых бактерицидными, или антисептическими, уничтожающими микроорганизмы обычно за счет денатурации их белков, сульфамиды обладают бактериостатическим действием. Это действие заключается в ингибировании определенных реакций, необходимых для жизнедеятельности бактерий, в результате чего размножение последних приостанавливается. Наблюдалось, что сульфаниламид и остальные сульфамиды ингибируют действие ге-аминобензойной кислоты — вещества, необходимого для жизнедеятельности бактерий (витамин Н ) (Д. Д. Вудс, 1940 г.). Сульфаниламид подменяет п-аминобензойную кислоту в биохимическом синтезе более сложного соединения, выполняющего функцию фермента фолиевой кислоты). Следовательно, сульфамиды являются антагонистами га-аминобепзойной кислоты. [c.461]
Следовательно, сульфамиды являются антагонистами га-аминобепзойной кислоты. [c.461]
Механизм действия антибиотиков различен. Они либо препятствуют развитию микробов (бактериостатическое действие), либо вызывают их гибель (бактерицидное действие) или растворение (бактериолитическое действие). Некоторые антибиотики создают такие условия среды, в которых образуются нежизнеспособные дегенеративные формы микробов. Влияние антибиотиков на обмен веществ микробной клетки изучено недостаточно. Они избирательно поражают отдельные ферментативные системы и таким образом нарушают нормальный обмен веществ у микроорганизмов. Известно, например, что пенициллин подавляет обмен глютаминовой кислоты в клетках грамиоложительных бактерий и препятствует усвоению необходимых аминокислот из питательной среды. Террамицин оказывает задерживающее влияние на процессы фосфорилирования. Мало изучено влияние отдельных антибиотиков на макроорганизм. Установлено, что некоторые антибиотики оказывают благоприятное влияние. Так, например, ауреомицин в сочетании с кобаламином способствует росту и развитию птиц и свиней и получил поэтому широкое применение в сельскохозяйственной практике. [c.308]
Уже в прошлом веке было известно, что между различными микроорганизмами могут существовать как симбиотические, так и антагонистические взаимоотношения. Толчком к выяснению материальной основы антибиоза послужило наблюдение Флеминга, обнаружившего (1928), что колония гриба Peni illium notatum подавляла рост стафилококков. Выделяемое этим грибом вещество, которое диффундировало в агар, получило название пенициллина. С тех пор было выделено множество веществ с антибиотической активностью. Антибиотики-это вещества биологического происхождения, способные даже в низких концентрациях подавлять рост микроорганизмов. Различают вещества, подавляющие рост микробов (бактериостатические, фунгистатические) и убивающие их (бактерицидные, фунгицидные и т.д.). [c.337]
Вещества, способные убивать бактерии, носят название бактерицидных, а только задерживающие развитие бактерий, но не убивающие их полностью — бактериостатических. Вещества, задерживающие развитие плесеней, называются фунгистатиче-скими. К ним относится нафталин. Бактерицидные и бактерио-статические вещества составляют группу антисептиков. [c.114]
При биологическом разрушении синтетических моющих веществ наблюдается индукционный период, который значительно удлиняется и скорость реакции замедляется при повышенной концентрации моющего вещества. Это становится особенно заметно при содержании поверхостно-активных веществ более 15 частей на миллион частей воды, что, по-видимому, обусловлено бактерицидным или бактериостатическим действием поверхностно-активных веществ при повышенной концентрации и понижением растворимости кислорода с возрастанием концентрации поверхностно-активных веществ. При температуре О—5° С не происходит биологического разрушения поверхностно-активных веществ, но при 35° С индукционный период резко сокращается [12]. [c.291]
Методы строгой оценки бактерицидного и бактериостатического действия катионактивных веществ являлись объектом многочисленных дискуссий. Как правило, оценка положительных сторон и недостатков различных предложенных методов принадлежит главным образом бактериологам, а не химикам-технологам. Существо этих дискуссий можно коротко охарактеризовать следующим образом. До появления катионактивных веществ бактерицидную активность имевшихся в продаже стандартных дезинфицирующих средств оценивали так называемым фенольным коэффициентом , характеризующим соотношение между умерщвляющей способностью изучаемого бактерицида и умерщвляющей способностью фенола. Определение фенольного коэффициента производилось по стандартной методике, и полученные результаты хорошо согласовывались с практическими результатами, полученными с различными дезинфицирующими средствами фенольного типа. Когда по этой методике была произведена оценка только что вошедших в практику катионактивных веществ, оказалось, что для них характерно исключительно высокое значение фенольного коэффициента. На этом основании был сделан вывод, что катионактивные вещества можно эффективно применять при больших разведениях,, Однако на практике это не подтвердилось. Было установлено, что эффективность катионактивных веществ, определенная по этой методике, гораздо выше действительной, в связи с чем стала крайне необходимой разработка более надежных методов испытания бактерицидов. Решению этой задачи было посвящено множество исследований. В настоящее время нет такого метода in vitro, который был бы пригоден для всех случаев, но роль отдельных факторов стала гораздо более ясной. Благо- [c.162]
Универсальных средств защиты от микробиологической коррозии не существует. Описанные методы создания защитных покрытий обеспечивают изоляцию металлической поверхности от воды, а следовательно, и от микробиального воздействия. В некоторых случаях могут использоваться бактерицидные или бактериостатические вещества. Эффективным бактериостатом для сульфатредуцирующих бактерий является кислород, поэтому усиление аэрации способствует замедлению- коррозии, вызванной сульфатредуцирующими бактериями. Как мера предотвращения микробиологической коррозии этого типа может быть использовано подщелачивание среды (когда это возможно), так как рост и развитие сульфатредуцирующих бактерий полностью подавляются при pH = 9. [c.122]
Большое влияние на характер действия антибиотиков оказывает их концентрация. Суббактериостатические дозы некоторых антибиотических веществ не только не угнетают рост чувствительных к ним микробов, но, наоборот, стимулируют их развитие. Как правило, при концентрации антибиотика выше дозы, вызывающей бактериостатический эффект, наблюдается бактерицидное действие препарата. [c.413]
При низких концентрациях тетрациклиновые антибиотики проявляют бактериостатический эффект, а при повышении концентрации примерно в 10 раз наблюдается бактерицидное действие. Такие вещества, как глицин и цистеин, в определенной степени снимают действие тетрациклинов. Некоторые фамотри-цательные бактерии способны образовывать вещества, инактивирующие бактериостатическое действие хлортетрациклина. [c.435]
Идея создания такого препарата исходила из стремления поучить путем сочетания этих двух веществ (каждое из которых бладает в отдельности бактериостатической активностью) пре-арат, оказывающий бактерицидное действие и эффективный в тношении широкого круга грамположительных и грамотрица-5льных микроорганизмов, в том числе устойчивых к действию обычных сульфаниламидов. Возможность такого действия ос-овывалась на особенностях влияния каждого из этих веществ на [c.69]
Характер действия антибиотиков на микроорганизмы
- Характер действия антибиотиков на микроорганизмы
- Характер действия антибиотиков на микроорганизмы
По характеру действия антибиотики делятся на бактерицидные и бактериостатические. Бактерицидное действие характеризуется тем, что под влиянием антибиотика наступает гибель микроорганизмов. Достижение бактерицидного эффекта особенно важно при лечении ослабленных пациентов, а также в случаях заболевания такими тяжелыми инфекционными болезнями, как общее заражение крови (сепсис), эндокардит и др., когда организм не в состоянии самостоятельно бороться с инфекцией. Бактерицидным действием обладают такие антибиотики, как различные пенициллины, стрептомицин, неомицип, канамицин, ванкомицин, полимиксин.
При бактериостатическом действии гибель микроорганизмов не наступает, наблюдается лишь прекращение их роста и размножения. При устранении антибиотика из окружающей среды микроорганизмы вновь могут развиваться. В большинстве случаев при лечении инфекционных болезней бактериостатическое действие антибиотиков в совокупности с защитными механизмами организма обеспечивает выздоровление пациента.
Жизнь растений: в 6-ти томах. — М.: Просвещение. Под редакцией А. Л. Тахтаджяна, главный редактор чл.-кор. АН СССР, проф. А.А. Федоров. 1974.
.
- ХЕМОАВТОТРОФНЫЕ БАКТЕРИИ
- Характеристика отдельных видов и групп бактерий рода Pseudomonas
Смотреть что такое «Характер действия антибиотиков на микроорганизмы» в других словарях:
Применение антибиотиков в ветеринарии и животноводстве — Использование антибиотиков в ветеринарии началось сразу же после их открытия. Это объясняется целым рядом преимуществ, которыми обладают антибиотики по сравнению с другими химиотерапевтическими веществами: антимикробное действие в очень… … Биологическая энциклопедия
ВЗАИМООТНОШЕНИЯ В МИРЕ МИКРООРГАНИЗМОВ И ОБРАЗОВАНИЕ БАКТЕРИЯМИ И АКТИНОМИЦЕТАМИ АНТИБИОТИКОВ — В конкретных экологических условиях между разными группами микробов устанавливаются определенные взаимоотношения, характер которых зависит от физиологических особенностей и потребностей совместно развивающихся микробов. Кроме того,… … Биологическая энциклопедия
Жёсткокрылые — Запрос «Жук» перенаправляется сюда. Cм. также другие значения. ? Жёсткокрылые Бронзовка золотистая, Cetonia aurata Научная классификация … Википедия
Медицина — I Медицина Медицина система научных знаний и практической деятельности, целями которой являются укрепление и сохранение здоровья, продление жизни людей, предупреждение и лечение болезней человека. Для выполнения этих задач М. изучает строение и… … Медицинская энциклопедия
АНТИБИОТИКИ — вырабатываемые микроорганизмами химические вещества, которые способны тормозить рост и вызывать гибель бактерий и других микробов. Противомикробное действие антибиотиков имеет избирательный характер: на одни организмы они действуют сильнее, на… … Энциклопедия Кольера
Таваник — Действующее вещество ›› Левофлоксацин* (Levofloxacin*) Латинское название Tavanic АТХ: ›› J01MA12 Левофлоксацин Фармакологическая группа: Хинолоны/фторхинолоны Нозологическая классификация (МКБ 10) ›› A15 A19 Туберкулез ›› A41.9 Септицемия… … Словарь медицинских препаратов
Защи́та от ору́жия ма́ссового пораже́ния — (ЗОМП) комплекс организационных, инженерных, медицинских и других мероприятий, направленных на предотвращение или максимально возможное ослабление поражающего и разрушающего действия ядерного, химического и биологического оружия с целью… … Медицинская энциклопедия
Остеомиелит — I Остеомиелит Остеомиелит (osteomyelitis, греч. osteon кость + myelos костный мозг + itis) воспаление костного мозга, обычно распространяющееся на губчатое и компактное вещество кости и надкостницу. Классификация. По этиологическому признаку… … Медицинская энциклопедия
СССР. Естественные науки — Математика Научные исследования в области математики начали проводиться в России с 18 в., когда членами Петербургской АН стали Л. Эйлер, Д. Бернулли и другие западноевропейские учёные. По замыслу Петра I академики иностранцы… … Большая советская энциклопедия
Болезнь Лайма — Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей. У этого термина существуют и другие значения, см. Лайма (значения) … Википедия
Изучение бактерицидного и бактериостатического действия теотропина на микроорганизмы различной морфологической структуры Текст научной статьи по специальности «Ветеринарные науки»
логические исследования амфибий в Вологодской области / Радченко Н.М., Шабунов A.A. // Паразитология XXI веке — проблемы, методы, решения: Материалы IV Всероссийского Съезда Паразитологического общества при Российской академии наук, состоявшегося 20-25 октября 2008 г. в Зоологическом институте Российской академии наук в Санкт-Петербурге. — T.3. — С.-Петербург, 2008. — С.72-75.
5. Ручин А.Б. Трофическая роль озерной лягушки Rana ridibunda (Anura, Ranidae) в околоводных экосистема / Ручин А.Б., Рыжов М.К. // Биоразнообразие и роль зооценоза в естественных и антропогенных эко-
системах: Мат-лы II международной научной конференции. — Днепропетровск, 2003. — С.247-248.
6. Рыжиков К. М., Шарпило В. П., Шевченко Н.Н. Гельминты амфибий фауны СССР — М.: Наука, 1980. — 279 с.
7. Rapport, D.J., Howard, J., Lannigan, R., McMurtry, R., Jones, D.L., Anjema, C.M., Bend, J. R. Introducing ecosystem health into undergraduate medical education. / Conservation medicine. Ecological health in practice (ed. A.A. Aguirre, R.S. Ostfeld, G.M. Tabor, C. House, M.C. Pearl). Oxford, Oxford University Press, 2002. — P. 345-360.
УДК 619:578
изучение бактерицидного и бактериостатического действия теотропина на микроорганизмы различной морфологической структуры
Д.А. Васильев, доктор биологических наук, профессор И.Н. Хайруллин, доктор ветеринарных наук, профессор С.Н. Золотухин, доктор биологических наук, профессор Н.А. Феоктистова, кандидат биологических наук, доцент Н.Х. Курьянова, аспирант
ФГОУ ВПО «Ульяновская государственная сельскохозяйственная академия»
тел. 8(422)55-95-47
В статье дана характеристика препарата теотропина. Описано бактериостатиче-ское и бактерицидное действие теотропина на бактерии видов Listeria monocytogenes, Ornithobacterium rhinotracheale, Staphylococcus aureus. Эмпирическим путем подобраны дозы препарата, временные экспозиции для полной инактивации вышеназванных микроорганизмов.
Ключевые слова; теотропин, бактериостатическое и бактерицидное действие, Listeria monocytogenes, Ornithobacterium rhinotracheale, Staphylococcus aureus.
Введение
Изучение антибактериальных и антивирусных свойств соединений различных классов, с целью разработки новых нетоксичных, высокоэффективных, экологически безопасных консервантов и инактиваторов для изготовления биопрепаратов представляет собой весьма актуальную задачу современной биотехнологии [2,4,6].
Инактивирование с целью получения антигена для вакцин из убитых штаммов микроорганизмов в то же время должно со-
хранить иммуногенные структуры возбудителя в возможно более неизмененном виде. Поэтому прикладные исследования в разработке инактивированных вакцин направлены прежде всего на постоянный поиск «идеального» способа инактивации.
Для решения этой проблемы необходимо изыскание оптимальных средств и методов, которые бы необратимо повреждали имеющиеся в нуклеиновых кислотах возбудителя структуры и информации, ответственные за размножение, но оставляли
контактными антигенные структуры белково-полисахаридных молекул, ответственных за иммуногенность [1,3,7].
Применяемые для этой цели химические соединения типа формальдегида обладают остаточным действием, которое приходится устранять дополнительными реактивами, что усложняет технологию изготовления вакцинных биопрепаратов.
Теотропин — стабильное при хранении и нагревании вещество (плавится без разложения при температуре 194-196°С, стабилен при хранении в сухом виде и температуре не выше 40°С в течение не менее 10 лет — срок наблюдения). Он представляет собой порошок желтоватого цвета со слабым специфическим запахом или без запаха в зависимости от степени очистки. Хорошо растворим в воде (насыщенный раствор имеет концентрацию свыше 50%), спирте, ацетоне, рН 10 %-ого водного раствора в пределах 9,3-9,5. Теотропин не раздражает кожи и слизистых оболочек глаз, дыхательных путей, мочеполовой системы. Для приготовления концентрированных растворов и работы с ними следует использовать резиновые перчатки, для работы с разбавленными растворами специальных мер предосторожности не требуется, кроме предотвращения приема внутрь больших количеств раствора. При попадании в глаза их следует промыть водой и раствором борной кислоты, поскольку растворы теотропина обладают слабощелочным рН [5,8,9].
отсутствие раздражающего и токсического действия теотропина на организм теплокровных животных делает его перспективным препаратом как возможного средства для инактивации вакцинных штаммов микроорганизмов.
Целью наших исследований являлось изучение бактерицидного и бактериостати-ческого действия теотропина на микроорганизмы различной морфологической структуры при его применении как возможного инактивирующего препарата на производственные штаммы бактерий в технологии изготовления инактивированных вакцин.
Материалы и методы
Оборудование: холодильник бытовой, термостат ТС-80М-2; микроскопы МБИ-3; центрифуги лабораторные ОПн-8УХЛ4,2 и цлс-3, весы чашечные с разновесами, су-
шильный шкаф, машина для изготовления ватных пробок; водяная баня, колбы мерные емкостью 50, 100, 250, 500, 1000 см3; пипетки пастеровские, пипетки мерные на 1,0; 2,0; 5,0; 10 см3; флаконы емкостью 50, 100, 200 см3; стекла покровные, стекла предметные, чашки Петри, пробирки, стандарты мутности на 0,5 и 1,0 млрд. микробных клеток, термометры ртутные, фарфоровая ступка с пестиком.
Для бактериологического исследования использовали следующие питательные среды и реактивы: мясопептонный бульон (НПО «Питательные среды», г.Махачкала), мясо-пептонный агар (ГНЦ прикладной микробиологии, г. Оболенск), желточно-солевой агар, глюкоза, теотропин.
Бактериостатическую и бактерицидную концентрации теотропина определяли методом их серийных разведений согласно «Методическим указаниям по отбору, испытаниям и оценке антивирусных и антибактериальных химиопрепаратов среди соединений различных химических классов» (Москва, 2004), а также «Методическим указаниям по определению чувствительности микроорганизмов к антибактериальным препаратам. МУК 4.2.1890-04».
Концентрацию препарата теотропина в бактериальных суспензиях доводили до следующих величин: 5 мг/мл; 7,5 мг/мл; 10,0 мг/мл. Концентрацию бактерий в 1 мл физиологического раствора доводили до величины 1010 микробных тел по результатам титрования. Данная концентрация бактериальной суспензии не превышает одну дозу инактивированной бактериальной вакцины, что позволяло, при наличии положительных результатов, указать на возможность использования теотропина в качестве инактиватора.
В эксперименте были использованы следующие виды бактерий, имеющие разную морфологию, строение и химический состав клеточной стенки: грамотрицатель-ная палочка — Ornithobacterium rhinotra-cheale, грамположительная палочка Listeria monocytogenes, кокковая культура Staphylococcus aureus.
Бактериальную массу нарабатывали на оптимальных для микроорганизмов питательных средах, трёхкратно центрифугировали при 3000 об./мин в течение 30 минут,
освобождая от питательной среды, и доводили до указанной концентрации. В полученную бактериальную суспензию добавляли раствор препарата теотропина с учётом вышеуказанных его конечных концентраций. Посевы микроорганизмов и учет результатов исследований проводили в соответствии с рекомендациями, указанными в вышеупомянутых методических указаниях.
Результаты исследований
Бактериостатическое действие тео-тропина проверяли методом контрольного высева бактериальных культур, взаимодействующих с изучаемым препаратом в различные промежутки времени от 1 до 18 часов, с интервалом 1 час, без освобождения их от буферного раствора, содержащего препарат.
Бактерицидную активность теотропи-на определяли методом контрольного высева бактериальной суспензии после освобождения её от буферного раствора, содержащего препарат, используя те же временные параметры.
Методом центрифугирования при 3000
об./мин осаждали бактериальные клетки, надосадок с теотропином удаляли, осадок ресуспендировали в свободном от препарата физиологическом растворе и центрифугировали при вышеуказанных параметрах. Данную процедуру повторяли двукратно. После последнего ресуспендирования и часовой экспозиции раствора с бактериями высевали на плотные питательные среды. Отсутствие бактериального роста в течение трёх суток наблюдения (при положительном контроле с интактными штаммами) означает, что данная доза препарата при используемой экспозиции обладает бактерицидным действием.
Результаты исследований свидетельствуют, что изучаемый препарат в концентрации 5,0 и 7,5 мг/мл обладал бактериоста-тическим, но не бактерицидным действием за время экспозиции 18 часов на все штаммы изученных микроорганизмов (табл. 1-3).
Бактериостатический эффект на штамм Ornithobacterium rhinotracheale начинал проявляться при концентрации тео-тропина 5,0 мг/мл через 4 часа, на штаммы Listeria monocytogenes и Staphylococcus aureus — через 5 часов.
При концентрации теотропина 7,5 мг/
мл бактериостатическое действие на штамм Ornithobacterium rhinotracheale проявилось через 2 часа, на штаммы Listeria monocytogenes и Staphylococcus aureus — через 3 часа.
Теотропин в концентрации 10,0 мг/мл оказывал бактериостатическое действие на штамм Ornithobacterium rhinotracheale и Listeria monocytogenes уже через 2 часа, на штаммы и Staphylococcus aureus — через 3 часа.
Бактерицидные свойства теотропина в концентрации раствора 10 мл/г проявились для микроорганизмов вида Ornithobacterium rhinotracheale через 16, а для видов Listeria monocytogenes и Staphylococcus aureus через 18 часов.
Полученные результаты согласуются с литературными данными разных авторов о более высокой толерантности к физикохимическим воздействиям грамположитель-ных микроорганизмов по сравнению с гра-мотрицательными.
Таким образом, в результате проведённых исследований нами установлено, что препарат теотропин в дозе 5,0 мг/мл при концентрации бактерий в 1010/мл после 5-часовой экспозиции обладает бактериостати-ческим действием по отношению к бактериальным культурам как грамотрицательных, так и грамположительных микроорганизмов.
Концентрация препарата 7,5 мг/мл является бактериостатической для всех штаммов при 3-х часовой экспозиции.
Препарат в концентрации 10,0 мг/мл после 18-ти часовой экспозиции с бактериальными культурами проявил бактерицид-ность для всех изучаемых микроорганизмов.
Заключение
Полученные данные позволяют утверждать, что изучаемый препарат теотропин в концентрации 10,0 мг/мл и экспозиции 18 часов можно использовать в качестве ингибитора при производстве инактивированных вакцин из штаммов как грамотрицательных, так и грамположительных вегетативных форм микроорганизмов. При условии, что у убитых бактерий будут сохраняться имму-ногенные свойства и отсутствовать отрицательное влияние на организм теплокровных животных: иммунодепрессия, токсичность, аллергия и другие свойства, которые учитывают при контроле качества изготовленных
Таблица 1
Бактериостатическое и бактерицидное действие теотропина на штамм Ornithobacterium rhinotracheale, в зависимости от концентрации раствора и экспозиции.
Концентрация Экспозиции (час)
тиопентала 1 2 з 4 б б 7 в g 10 11 12 1з 14 15 1б 17 1в
5,0 мг/мл — — — ± ± ± ± ± ± ± ± ± ± ± ± ± ± ±
7,5 мг/мл — — ± ± ± ± ± ± ± ± ± ± ± ± ± ± ± ±
10,0 мг/мл — ± ± ± ± ± ± ± ± ± ± ± ± ± ± + + +
«-»- отсутствие бактериостатического и бактерицидного действия
«+» — бактерицидное действие
«±» — бактериостатическое действие
Таблица 2
Бактериостатическое и бактерицидное действие теотропина на штамм Listeria monocytogenes, в зависимости от концентрации раствора и экспозиции.
Концентрация Экспозиция (час)
тиопентала 1 2 з 4 б б 7 в g 10 11 12 1з 14 1б 1б 17 1в
5,0 мг/мл — — — — ± ± ± ± ± ± ± ± ± ± ± ± ± ±
7,5 мг/мл — — ± ± ± ± ± ± ± ± ± ± ± ± ± ± ± ±
10,0 мг/мл ± ± ± ± ± ± ± ± ± ± ± ± ± ± ± + +
«-»- отсутствие бактериостатического и бактерицидного действия
«+» — бактерицидное действие
«±» — бактериостатическое действие
Таблица 3
Бактериостатическое и бактерицидное действие теотропина на штамм Staphylococcus aureus, в зависимости от концентрации раствора и экспозиции.
Концентрация Экспозиция (час)
тиопентала 1 2 з 4 б б 7 в g 10 11 12 1з 14 1б 1б 17 1в
5,0 мг/мл — — — — ± ± ± ± ± ± ± ± ± ± ± ± ± ±
7,5 мг/мл — — ± ± ± ± ± ± ± ± ± ± ± ± ± ± ± ±
10,0 мг/мл ± ± ± ± ± ± ± ± ± ± ± ± ± ± ± +
«-»- отсутствие бактериостатического и бактерицидного действия
«+» — бактерицидное действие
«±» — бактериостатическое действие
биопрепаратов.
Библиографический список
1. Аржаков, В.Н. Дезинфекция и ее место в системе противоэпизоотических мероприятий / В.Н.Аржаков, Н.В. Аржаков // БИО — 2003. — №7. — С. 9-21.
2. Власов Н.А., Васильев Д.А., Козин А.И. Антибиотики и химиопрепараты для борьбы с инфекционными болезнями животных (Новые методы в профилактике и лечении инфекционных болезней) — Ульяновск, 1997. — С.22.
3. Высоцкий, А.Э. Бактерицидная
активность и токсикологическая характеристика дезинфицирующего препарата КД/ А.Э.Высоцкий // Проблемы ветеринарной санитарии, гигиены и экологии: сб. науч. тр. ВНИИВСГЭ.Т.117. — М., 2005. — С.183-195.
4. Высоцкий, А.Э. Сравнительная биоцидная активность дезинфектанта «Сандим-Д» / А.Э.Высоцкий // Проблемы ветеринарной санитарии, гигиены и экологии: сб. науч. тр. ВНИИВСГЭ. Т.117. — М., 2006. -С.176-182.
5. Каштанов, А.В. Исследование
бактерицидной и дезинфицирующей активности препарата однохлористый йод /
А.В.Каштанов // Проблемы ветеринарной санитарии, гигиены и экологии: сб. науч. тр. Всероссийского научно-исследовательского института ветеринарной санитарии, гигиены и экологии. Т. 115. -М., 2003. -С.242-249.
6. Костюкова, Т.А. Практические
аспекты выбора дезсредств / Т. А. Кострюкова, М.Н. Ляпин, Т.А. Малюкова // Санитарная охрана территорий государств СНГ: проблемы биологической безопасности и противодействия биотерроризму в современных условиях: материалы VI Межгосударственной науч.- практ. конф. государств-участников СНГ. — Волгоград. — 2005. — С. 249-250.
7. Попов, Н.И. Новое дезинфицирующее средство Бианол для дезинфекции объектов ветеринарного надзора / Н.И.Попов, Г.Д.Волковской, С.А.Мичко // Проблемы ве-
теринарной санитарии, гигиены и экологии: сб. науч. трудов Всероссийского научно-исследовательского института ветеринарной санитарии, гигиены и экологии. Т 115.-М., 2003. — С. 218-229.
8. Саврилов, М.Р Изыскание средств дезинфекции при сибирской язве / М.Р Саврилов // Проблемы мониторинга и генодиагностики инфекционных болезней животных: материалы Международной научной конференции молодых ученых, владимир, 2004.-С.175-177.
9. Шандала, М.Г. Новые дезинфекционные технологии для профилактики инфекционных болезней / М.Г.Шандала // Эпидемиология и инфекционные болезни. -2006. — №4. — С.15-17.
УДК 619:578
характеристика биологических свойств бактериофагов вида BACILLUS SUBTILIS
Д.А. Васильев, доктор биологических наук, профессор С.Н. Золотухин, доктор биологических наук, профессор И.Н. Хайруллин, доктор ветеринарных наук, профессор Н.А. Феоктистова, кандидат биологических наук, доцент А.И. Калдыркаев, ассистент М.А. Юдина, аспирант А.Х. Мустафин, аспирант
ФГОУ ВПО «Ульяновская государственная сельскохозяйственная академия»
тел. 8(422)55-95-47
В статье дана характеристика основных биологических свойств бактериофагов вида Bacillus subtilis (морфология негативных колоний, литическая активность, спектр литиче-ской активности, специфичность действия, температурная устойчивость, устойчивость к хлороформу, изменение литической активности при хранении). На основании изученных свойств были отобраны фаги для конструирования биопрепарата для фагоиндикации и фа-гоидентификации бактерий вида Bacillus subtilis в объектах санитарного надзора.
Ключевые слова: бактериофаги, Bacillus subtilis, морфология негативных колоний, литическая активность, спектр литической активности, специфичность действия, температурная устойчивость, устойчивость к хлороформу, изменение литической активности при хранении.
Антибиотик благодетель, враг и беззащитное создание.
Антибиотик: благодетель, враг и беззащитное создание.
С открытием антибиотиков, обладающих избирательным действием на микробы in vivo (в организме), могло показаться, что наступила эпоха окончательной победы человека над инфекционными болезнями. Но не тут, то было! Мало того, что в общественном сознании существуют два полярных мнения о том, когда и как нужно применять антибиотики, и насколько они опасны для здоровья, препараты, которым многие обязаны жизнью в течение десятка лет теряют свои лечебные свойства и становятся бессильны перед обладателями многовековых родословных — микроорганизмами.
Победитель грозной инфекции
Слово «антибиотик» происходит от латинских слов «анти» — против и «био» — жизнь. Антибиотиками считаются вещества, избирательно подавляющие жизненные функции некоторых микроорганизмов. В настоящее время более ста видов антибиотиков, но лишь немногие их них применяются в медицине, ведь антибиотики являются ядом не только для микроорганизмов, но и для организма человека токсичны в той или иной степени. Чтобы правильно использовать полезные свойства антибиотиков, не причиняя вред организму, очень важно понимать, как они действуют.
Прежде всего, нужно отметить, что антибиотики бывают бактерицидные и бактериостатические. Обе группы важны, но бактерицидные антибиотики имеют значительно большее значение, так как уничтожение возбудителя заболевания способствует наиболее скорому выздоровлению человека. Бактериостатические же антибиотики лишь задерживают деление микробной клетки, выздоровление происходит под влиянием иммунной системы организма. Если иммунные системы ослаблены, то после исчезновения антибиотиков возбудители заболевания опять начинают размножаться, проводя к возникновению рецидива. К бактерицидным относятся две группы антибиотиков:
Первая группа бактерицидных антибиотиков нарушает образование микробной стенки: пенициллины, цефалоспорины, карбапенемы, монобактамы, фосфомицин, гликопептидные. В момент деления микроба появляются две дочерней клетки, каждая из которых должна быть окружена вновь образующей микробной стенкой, выполняющей структурную и обменную функции. Если микробная стенка не покроет дочерние клетки, то они погибнут.
Вторая группа бактерицидных антибиотиков (полимиксины, отчасти аминогликозидные, полиеновые-антигрибковые антибиотики) нарушают функцию внутренней цитоплазматической мембраны микроорганизмов. Эта мембрана выполняет функцию транспорта ионов и различных метаболитов и, нужно заметить, что подобная структура полностью отсутствует у человека. Так вот, в результате действия антибиотиков, клетка теряет ионы калия, фосфаты, нуклеиновые кислоты и другие жизненно важные вещества и в результате микроб гибнет. Эти антибиотики влияют как на делящуюся, так и на покоящуюся клетку.
Третья группа антибиотиков – бактериостатические. Её представители нарушают синтез белков, нуклеиновых кислот внутри микробных клеток, преимущественно останавливая их деление. К этой группе антибиотиков относят макролиды, линкозамиды, аминогликозидные антибиотики, левомицетин, тетрациклины, рифампицин, фузидин.
Останавливая деление микробов, антибиотики третьей группы подавляют влияние на них антибиотиков первой группы, так как они воздействуют только на делящиеся микроорганизмы. То есть между антибиотиками первой и третьей групп существует антагонизм, и их совместное применение в подавляющем большинстве случаев не способствует возникновению лечебного эффекта и нередко может привести к ухудшению состояния больного.
Враг повержен и вот – поле брани…
Долгое время, да и сейчас тоже, антибиотики считались панацеей от всех бед и назначались при малейших признаках любой инфекции. Сегодня уже доказано, что их действие у нас в организме сродни эффекту «выжженной земли». Помимо сильнейших аллергических реакций, антибиотики оказывают губительное воздействие на жизнь и здоровье пациентов, пользующихся ими.
Вот лишь отдельные примеры коварного воздействия антибиотиков:
— стрептомицин может вызвать глухоту, головокружение
— биомицин даёт осложнения на органы пищеварения
— левомицетин тормозит кроветворение, что крайне опасно для жизни человека, когда его организм и так подвержен инфекции
— антибиотики активно угнетают жизненные функции клеток, которые производят протеин (белковый строительный материал зародыша), потому некоторые матери, употреблявшие в период беременности антибиотики, производили на свет нежизнеспособных младенцев или уродов.
Уже родившийся младенец также может пострадать, получая антибиотики с материнским молоком. Как выяснилось, на мать и ребёнка оказывают вредное воздействие все без исключения препараты этой группы. Вот лишь несколько примеров:
-дети, чьи матери применяли циклофсатин, страдают нарушением структуры костей, их размягчением
— аминоглюкозиды и тетрециклины повреждают кости малышей и их зубы: им угрожают болезни дёсен, кариесы (50 % таких людей к 30-ти годам будут вынуждены вставлять искусственные зубы)
— «популярный» антибиотик стрептомицин, относящийся к той же категории, действует на мозговую деятельность малыша и надолго дестабилизирует речевые функции
— септран вызывает постепенное увеличение билирубина в кишечнике новорожденного, что может привести к тяжёлому кишечному расстройству, нарушению деятельности органов пищеварения и угрожает жизни младенца
— пенициллин вызывает сильнейшую аллергию у 16 % новорожденных, а также нарушает деятельность кишечника.
Хочется отметить, что весь спектр «вредоносного» действия антибиотиков ещё до конца не изучен, и вполне вероятно, что в ближайшем времени мы узнаем о ещё каких-либо опасных для здоровья человека характеристиках антибиотиков.
Но, как бы там, ни было, пока без антибиотиков обойтись вряд ли удастся. И если их использовать, то нужно делать это грамотно.
Побеждает сильнейший
Все живое, в том числе и бактерии быстро приспосабливаются к неблагоприятным условиям внешней среды. Выработка устойчивости к антибиотикам – один из наиболее ярких примеров такого приспособления. Можно утверждать, что рано или поздно любой вид бактерий сможет выработать устойчивость к любому антибактериальному препарату. Выработка устойчивости происходит тем быстрее, чем в большем объеме применяется данное вещество. По мере того, как бактерии вырабатывают устойчивость к антибиотикам, человечество вынуждено изобретать все новые препараты. Поэтому можно предположить, что если сегодня мы будем бесконтрольно назначать антибактериальные препараты всем детям, то завтра внуков нам лечить будет просто нечем.
По данным учёных НИИ педиатрии РАМН, при острых респираторно-вирусных инфекциях (ОРВИ — острая респираторная вирусная инфекция) у детей лечение антибиотиками требуется всего в 6-8% случаев. Объясняется это тем, что при вирусной инфекции антибиотики, по меньшей мере, бесполезны, а, скорее всего, вредны из-за последующего заселения дыхательных путей несвойственной им флорой, чаще кишечной. К сожалению, частота назначения противомикробных препаратов у детей с ОРВИ очень велика: в поликлиниках 65-85% и в стационарах 98% детей назначают антибиотики.
Применение антибиотиков можно считать обоснованным, когда речь идёт о действительно серьёзной, угрожающей жизни инфекции. Во всех остальных случаях желательно использовать другие средства.
К сожалению, вошло в моду при любых недомоганиях (насморке, кашле, головной боли) применять антибиотики. Стоит ли говорить, какой вред это наносит организму человека? При такого рода заболеваниях лучше не хватать первый попавшийся антибиотик, а обратиться к препаратам, произведённым на растительной основе. Эти лекарства широкого спектра действия повышают иммунитет организма и в то же время подавляют инфекции. Ещё лучше предусмотрительно прививаться от опасных инфекций и вести здоровый образ жизни, и тогда уж точно об антибиотиках можно забыть.
На сегодняшний день в нашей стране большинство возбудителей наиболее распространенных инфекций устойчивы к таким препаратам, как бисептол, гентамицин и препаратам группы тетрациклинов. Неоднозначна ситуация с пенициллином, ампициллином и амоксициллином, чувствительность к этим препаратам сохраняет только один микроорганизм — пневмококк.
При работе с микроорганизмами микробиологи Карачаево-Черкесской Республики сталкиваются с тем, что на территории нашей республики от больных выделяются:
— S. aureus(стафилококки), являющиеся причиной воспалительных заболеваний ушей, глаз, бронхов, устойчивые (нечувствительные) к пенициллину и ампицилллину
— S. flexneri(шигеллы) – возбудители дизентерии, устойчивые к левомицетину и тетрациклину
— P. аeruginosa(синегнойная палочка), вызывающая гнойные осложнения после операций, заболевания мочевого пузыря, почек, устойчивая к цефтриаксону, цефтазидиму, гентамицину, офлоксацину.
Поэтому для выбора препарата для лечения, врачу необходимо знать, не только каким возбудителем вызвана инфекция, но и то, к какому препарату этот возбудитель чувствителен. Казалось бы, что эта проблема легко решается при проведении лабораторных исследований. Но, увы, при применении современных методов исследований ответ может быть получен лишь через 2 – 3 суток. Вследствие этого, в реальной жизни антибиотики назначают эмпирически, т.е. на основании имеющегося практического опыта. Но даже самый блестящий врач не может самостоятельно накопить опыт по применению всех возможных антибиотиков и уверенно сказать, что препарат А лучше чем препарат Б. К тому же необходимо учитывать насколько широко в конкретном географическом регионе среди бактерий распространена устойчивость к конкретному препарату. Врачу неизбежно приходится опираться на результаты специальных исследований, их критический анализ, мировой и национальный опыт, а также на рекомендации по стандартам лечения, разработанные экспертами.
Назначение антибиотиков детямне должно заменять назначение «валерьянки» родителям
После всего сказанного нужно подчеркнуть, что следует применять только при инфекциях, вызываемых бактериями. В стационаре при тяжелых и угрожающих жизни инфекционных заболеваниях (например, менингит – воспаление оболочек мозга, пневмония – воспаление легких и др.) ответственность за правильность выбора целиком лежит на враче, который основывается на данных наблюдения за пациентом и на результатах специальных исследований. При легких инфекциях, протекающих в «домашних» (амбулаторных) условиях, ситуация принципиально иная. Врач осматривает ребенка и назначает лекарства, иногда это сопровождается объяснениями и ответами на вопросы, иногда — нет. Нередко врача просят назначить антибиотик. В таких ситуациях врачу иногда психологически легче выписать рецепт, а не подвергать риску свою репутацию и тратить время на объяснение нецелесообразности такого назначения. Поэтому никогда не просите врача назначить ребенку антибиотики, тем более что после ухода врача обычно происходит домашний совет, звонки родственникам и знакомым и лишь затем принимается решение давать ребенку антибиотики или нет.
Рассмотрим некоторые ситуации, которые без сомнения интересует всех родителей. Антибиотики при инфекции дыхательных путей. В этой ситуации, прежде всего родители должны четко представлять, что естественная частота инфекций дыхательных путей у детей дошкольного возраста составляет 6 – 10 эпизодов в год и назначение антибиотиков при каждом эпизоде инфекции – непомерная нагрузка на организм ребенка.
Надежных внешних признаков или простых и дешевых лабораторных методов, позволяющих различать вирусную и бактериальную природу инфекций дыхательных путей, к сожалению, нет. В то же время известно, что острый ринит (насморк) и острый бронхит (воспаление слизистой оболочки бронхов) практически всегда вызываются вирусами, а ангина (воспаление небных миндалин и глотки), острый отит (воспаление уха) и синусит (воспаление слизистой оболочки околоносовых пазух) в значительной части случаев – бактериями. Естественно предположить, что подходы к антибактериальной терапии отдельных острых инфекций верхних дыхательных путей должны несколько различаться.
При остром рините (насморке) и бронхите антибиотики не показаны. На практике все происходит по-другому: один – два дня повышенной температуры и кашля у ребенка родители, как правило, достаточно легко выдерживают без дачи малышу антибиотиков. Но в последующем напряжение возрастает, больше всего родителей беспокоит вопрос, не осложнится ли бронхит пневмонией. Здесь стоит отметить, что развитие такого осложнения возможно, но его частота практически не зависит от предшествовавшего приема антибиотиков. Основными признаками развития осложнения служит ухудшение состояния (дальнейшее повышение температуры тела, усиление кашля, появление одышки), в такой ситуации надо немедленно вызывать врача, который и решит, надо ли корректировать лечение. Если же состояние не ухудшается, но и существенно не улучшается, то очевидной причины для назначения антибиотиков нет, тем не менее, именно в этот период некоторые родители не выдерживают и начинают давать препараты детям «на всякий случай». Что можно сказать в этом случае? Назначение антибиотиков детям не должно заменять назначение «валерьянки» родителям!
Особо следует отметить, что за этим очень популярным критерием назначения антибиотиков при вирусных инфекциях — сохранение повышенной температуры в течение 3-х дней – нет ровным счетом никаких обоснований. Естественная длительность лихорадочного периода при вирусных инфекциях дыхательных путей у детей значительно варьирует, возможны колебания от 3 до 7 дней, но иногда и больше. Более длительное сохранение так называемой субфебрильной температуры (37,0-37,5° градусов С) может быть связано со многими причинами. В таких ситуациях попытки добиться нормализации температуры тела назначением последовательных курсов различных антибиотиков обречены на неудачу и откладывают выяснение истиной причины патологического состояния. Типичным вариантом течения вирусной инфекции также является сохранение кашля на фоне улучшения общего состояния и нормализации температуры тела. Необходимо помнить, что антибиотики – не являются противокашлевыми средствами. У родителей в этой ситуации есть широкие возможности по применению народных противокашлевых средств. Кашель является естественным защитным механизмом, он исчезает последним из всех симптомов заболевания. Однако если у ребенка интенсивный кашель сохраняется 3 – 4 и более недель, то надо искать его причину.
Таким образом, беглого взгляда на особенности антибактериальной терапии достаточно для выделения основных принципов антибактериальной терапии: быстрое назначение наиболее эффективных препаратов в тех случаях, когда их эффект доказан и максимальное сокращение применения антибиотиков во всех других случаях. Применение антибиотиков можно считать обоснованным, когда речь идёт о действительно серьёзной, угрожающей жизни инфекции. Во всех остальных случаях желательно использовать другие средства.
Итак, антибиотики, конечно же, могут вызывать вполне определенные нежелательные реакции. Но вдобавок к их истинным грехам иногда приходится слышать и явно незаслуженные обвинения. Достаточно часто не только в научно-популярных, но и в специальных статьях как о чем-то совершенно очевидном говорят о способности антибиотиков угнетать иммунитет. Подобные утверждения абсолютно ничем не подтверждены. Многочисленными исследованиями однозначно установлено, что ни один из разрешенных к применению в медицинской практике антибиотиков при использовании в лечебных дозах не угнетает систему иммунитета.
В заключение необходимо еще раз подчеркнуть, что антибактериальные препараты являются единственными эффективными средствами лечения инфекционных болезней. Но, к сожалению, быстрое формирование бактериями устойчивости к антибиотикам, обусловленное нерациональным использованием бактериальных препаратов, приводит к быстрой утрате эффективности последних. Поэтому наряду с поиском препаратов с принципиально новыми механизмами действия необходимы совместные усилия врачей, фармацевтов и пациентов по упорядочению использования антибиотиков и сохранению их для будущего.
Е.Покровская,
пресс-секретарь Управления Роспотребнадзора по КЧР
Клиническая значимость бактериостатических и бактерицидных механизмов действия при лечении грамположительных бактериальных инфекций | Клинические инфекционные болезни
Аннотация
Различие между бактерицидными и бактериостатическими агентами очевидно согласно определению in vitro, но это применимо только в строгих лабораторных условиях и несовместимо для конкретного агента против всех бактерий. Различие более произвольно, когда агенты классифицируются в клинических ситуациях.Предполагаемое превосходство бактерицидных агентов над бактериостатическими агентами не имеет большого значения при лечении подавляющего большинства инфекций грамположительными бактериями, особенно у пациентов с неосложненными инфекциями и безупречной иммунной системой. Бактериостатические агенты (например, хлорамфеникол, клиндамицин и линезолид) эффективно используются для лечения эндокардита, менингита и остеомиелита — показаний, которые, как часто считается, требуют бактерицидной активности. Хотя бактериостатические / бактерицидные данные могут предоставить ценную информацию о потенциальном действии антибактериальных агентов in vitro, необходимо объединить эту информацию с фармакокинетическими и фармакодинамическими данными, чтобы обеспечить более значимое прогнозирование эффективности in vivo.Окончательным руководством по лечению любой инфекции должен быть клинический результат.
Антибактериальная терапия, являющаяся краеугольным камнем современной медицинской практики, представляет собой одно из немногих фармакологических методов лечения болезней. Многие клиницисты приняли определенные предположения и обобщения относительно антибактериальной терапии, которые не обязательно основаны на строгих научных данных. Одна из этих гипотез состоит в том, что агенты с бактерицидной активностью in vitro предпочтительнее агентов с бактериостатической активностью in vitro.
Недавно открытые антибактериальные агенты тестируются in vitro не только на способность подавлять бактерии, но и для определения того, действительно ли новый агент «убил» бактерии. Хотя может показаться, что для антибиотика предпочтительнее убивать болезнетворные бактерии, а не просто их ингибировать, клиническая важность того, чтобы бактерицидное действие in vitro было лучше, чем бактериостатическое действие, редко документировалось.
Из-за устойчивости к доступным в настоящее время противомикробным препаратам, используемым для лечения инфекций, вызываемых грамположительными бактериями [1–7], современные подходы к терапии этих инфекций должны быть пересмотрены.В конечном итоге целью лечения должно быть достижение хорошего клинического результата (клиническое / бактериологическое излечение и отсутствие рецидива) с наименьшей токсичностью. В этом обзоре рассматривается актуальность бактериостатического действия in vitro по сравнению с бактерицидным действием, поскольку оно связано с клинической эффективностью антибактериальных средств для лечения грамположительных бактериальных инфекций.
Определение бактериостатической / бактерицидной активности
Определения «бактериостатический» и «бактерицидный» кажутся простыми: «бактериостатический» означает, что агент предотвращает рост бактерий (т.е.е., он удерживает их в стационарной фазе роста), а «бактерицидный» означает, что он убивает бактерии. На самом деле существует , а не 2 чистых категории противомикробных агентов (один, который исключительно убивает бактерии, а другой, только подавляет рост). Скорее, те агенты, которые называются «бактерицидными», обычно не могут убить каждый организм (если, например, посевной материал большой) в течение 18–24 часов после теста, а большинство так называемых «бактериостатических» агентов убивают некоторые бактерии внутри 18–24 ч после теста — часто более 90–99% посевного материала, но недостаточно (> 99.9%), чтобы называть «бактерицидным». На микробиологическое определение in vitro того, является ли антибактериальный агент бактерицидным или бактериостатическим, могут влиять условия роста, плотность бактерий, продолжительность теста и степень уменьшения количества бактерий. Клиническое определение еще более произвольно. Большинство антибактериальных средств лучше описать как потенциально бактерицидные и бактериостатические.
Микробиологическое определение. Различные микробиологические методы in vitro для определения бактерицидной активности антибактериальных агентов против различных изолятов включают минимальную бактерицидную концентрацию (МБК), кривую «время-убил» и бактерицидный титр в сыворотке крови (SBT).Каждый метод может предоставить полезную информацию, но клиническая ценность этих методов ограничена техническими проблемами и трудностями в практической интерпретации [8–10]. До недавнего времени методы определения MBC не были стандартизированы, и они остаются нестандартными для определения SBT [11]. Методы определения МБК значительно различались с течением времени и между лабораториями, поэтому для конкретного организма предоставляется только моментальный снимок времени и места. Воспроизводимость результатов тестов остается постоянной проблемой при межлабораторной и внутрилабораторной стандартизации таких тестов.Таким образом, определение бактериостатической или бактерицидной активности антибактериального агента применимо только к конкретному организму (или даже штамму), против которого он был протестирован в конкретных используемых условиях тестирования.
Количественное тестирование чувствительности обычно выполняется путем 2-кратного разведения тестируемого антибактериального агента в жидкой культуральной среде, инокуляции его стандартным количеством микроорганизмов и инкубации при 35–37 ° C в течение ∼18–24 час Количество антибактериального средства, которое подавляет видимый рост (ингибирующую фазу) микроорганизма, называется «МПК».”Субкультуры образцов, полученных из прозрачных пробирок или лунок (в случае микротитрования), производятся на среде (обычно твердой), не содержащей антибактериальных агентов, и повторно инкубируются в течение дополнительных 18–24 часов для определения МБК, который является самой низкой концентрацией. антибактериального агента, который либо полностью предотвращает рост, либо приводит к снижению исходного посевного материала на ≥99,9% (т. е. 3-log 10 снижения колониеобразующих единиц [КОЕ] / мл) при субкультуре.
Руководство по проведению бактерицидных тестов было опубликовано в 1999 г. NCCLS [12].Важнейшие компоненты методологии для MBC включают посевной материал ≥5 × 10 5 КОЕ / мл и объем субкультуры 0,1 мл, чтобы точно предсказать, были ли убиты ≥99,9% бактерий. Хотя снижение плотности жизнеспособных бактерий на ≥99,9% в течение 18–24 часов является общепринятым определением бактерицидного действия, нет никаких доказательств того, что несколько более или менее строгое число не может быть одинаково полезным для прогнозирования клинической применимости. Также неясно, почему в этом тесте было выбрано время инкубации 18–24 ч, хотя, вероятно, оно было таким же, как и стандартное время окончания для тестирования чувствительности к МИК неприхотливых бактерий.Возможно, увеличение времени инкубации с 18–24 часов до 36 или даже 48 часов изменит классификацию многих антибактериальных средств с бактериостатических на бактерицидные или наоборот. Можно сделать аналогичные предположения относительно размера посевного материала и характеристик роста культуры. Таким образом, значения МБК представляют собой результат теста in vitro, в котором фиксированная статическая концентрация антибактериального агента проверяется по сравнению с изначально фиксированной концентрацией бактерий в водной среде.Это не соответствует ситуации in vivo, когда концентрация антибактериальных и бактериальных агентов в различных жидкостях и тканях организма может сильно колебаться [13, 14].
Бактериостатическая активность была определена как отношение МБК к МПК> 4, но многочисленные технические проблемы и другие факторы могут повлиять на определение отношения [8, 15–18]. Некоторые из этих факторов могут иметь важное влияние на интерпретацию ситуации in vivo. Культуры в стационарной фазе приводят к снижению показателей гибели [19] до такой степени, что бактерицидный эффект некоторых антибактериальных агентов, действующих на клеточную стенку, может быть устранен (например,g., против нерастущих или медленно растущих фаз Staphylococcus aureus ) [20]. Определение бактерицидной активности in vitro почти всегда проводится в отношении культур в логарифмической фазе роста, что может не отражать характер роста бактерий in vivo, и это может иметь клинические последствия. Условия испытаний MBC также могут повлиять на результаты [18, 21]; достаточные количества антибиотика могут быть перенесены в субкультуры для подавления роста выживших организмов [22, 23]; оксигенация, pH [24–26], продолжительность инкубации [21] или температура [24, 27] могут повлиять на надежность.Кроме того, осмолярность и содержание ионов в среде могут влиять на интерпретацию MBC.
Кривые «время-убийство» использовались для определения кинетики уничтожения бактерий in vitro, но обычно не для определения того, является ли антибактериальный агент бактериостатическим или бактерицидным. Они могут быть полезны для определения того, является ли уничтожение бактерий зависимым от концентрации и / или времени: зависимое от концентрации уничтожение бактерий происходит, когда скорость и степень уничтожения увеличивается с прогрессивным увеличением концентрации антибактериальных средств (например,g., для аминогликозидов и фторхинолонов), и зависящее от времени уничтожение происходит, когда повышение концентрации антибактериальных препаратов до значений, превышающих МИК, не приводит к пропорциональному увеличению числа уничтожений (например, для β-лактамов и оксазолидинонов). Площадь под кривой сывороточных концентраций, превышающая МИК, является критической для уничтожения в зависимости от времени.
SBT — это максимальное разведение сыворотки, которое обычно убивает 99,9% исходного бактериального инокулята после инкубации в течение 18–24 часов. Клиническая полезность SBT не доказана, и SBT обычно не применяется в клинической практике для мониторинга или управления индивидуальным уходом за пациентом.
Два связанных явления, которые мешают уничтожению бактерий, — это парадоксальный эффект и терпимость. Eagle и Mussleman [28] сообщили, что большая часть грамположительных организмов показала «парадоксальный» эффект, так что, когда концентрация пенициллина увеличивалась до уровня, превышающего оптимальную бактерицидную концентрацию, бактерии гибли при уменьшении, а не повышении. скорости, так что максимальный эффект был получен только в относительно узкой зоне [15, 17, 29–36]. Фенотипическая «толерантность» in vitro была определена как МБК, которая в 32 раза превышает МПК.Исследования на животных показали, что пенициллин-толерантный стрептококковый эндокардит труднее вылечить, чем эндокардит, вызванный нетолерантными штаммами [35, 37]. Терапевтическая неэффективность была документально подтверждена у людей с устойчивой к пенициллину пневмонией S. aureus [38] и повышенной заболеваемостью / неэффективностью лечения при эндокардите [39–41].
Клиническое определение. Классификация по бактериостатическим и бактерицидным свойствам в клинической практике не является абсолютной и может привести к ложным предположениям относительно антибактериальной терапии, особенно если игнорируются другие основные антибактериальные фармакокинетические / фармакодинамические параметры.Важно различать микробиологические и клинические определения. Доказательств в поддержку тестирования MBC для индивидуального ухода за пациентами недостаточно [8], даже несмотря на то, что это принятый параметр in vitro при оценке нового антибактериального агента. Антибактериальные агенты с самыми низкими значениями MIC или MBC могут быть не предпочтительнее агента с более высокими значениями MIC или MBC — например, хорошая бактерицидная аминогликозидная активность in vitro против Salmonella enterica серотипа Typhi не означает клинической эффективности.
Исключения из клинического определения. Некоторые широкие классы антибактериальных агентов, считающихся бактериостатическими, могут проявлять бактерицидную активность против некоторых бактерий на основании определения значений МБК / МИК in vitro. В высоких концентрациях бактериостатические агенты часто обладают бактерицидным действием против некоторых чувствительных организмов [33]. Макролиды считаются одним из классических классов бактериостатических препаратов, но эритромицин, азитромицин и кларитромицин показали бактерицидную активность in vitro против Streptococcus pyogenes и Streptococcus pneumoniae [42–45].Точно так же хлорамфеникол обладает бактерицидным действием против S. pneumoniae , но бактериостатическим действием против S. aureus и стрептококков группы B [46–49]. Клиндамицин может быть бактерицидным in vitro в зависимости от организма и условий роста [50, 51]. In vitro линезолид обладает бактериостатической активностью в отношении стафилококков и энтерококков, но бактерицидной активностью в отношении стрептококков, включая S. pneumoniae [52, 53].
Аналогичным образом, антибактериальные средства, которые считаются бактерицидными в широком классе, могут проявлять бактериостатическую активность только in vitro.В низких концентрациях бактерицидные препараты могут просто проявлять бактериостатическую активность. Хинупристин-далфопристин обычно считается бактерицидным in vitro против большинства штаммов стафилококков и стрептококков, но обладает бактериостатическим действием против Enterococcus faecium [54, 55]. Хотя все хинолоны являются бактерицидными, они имеют единственную концентрацию, при которой они наиболее бактерицидны: парадоксальный эффект снижения количества киллеров при более высоких концентрациях, скорее всего, является результатом дозозависимого ингибирования синтеза РНК [56, 57].Кроме того, устойчивость бактерицидного действия лекарства зависит от бактериальной нагрузки и фазы роста. Для определения бактерицидной активности in vitro плотность бактериальных клеток составляет 10 5–6 КОЕ / мл активно растущей культуры, тогда как концентрация микробов может достигать 10 8–10 КОЕ / г инфицированной ткани [58] . В этих плотных популяциях преобладают нерастущие бактерии. Таким образом, организмы, присутствующие при высоких нагрузках, растут медленнее, чем те, которые используются для измерения МБК in vitro [13], или представляют собой бактериальные популяции, которые преимущественно находятся в фазе отсутствия роста [58].Отсутствие эффективности при высокой бактериальной нагрузке было продемонстрировано in vivo для различных бактерицидных антибактериальных средств. К ним относятся ванкомицин и цефотаксим при экспериментальном эндокардите, вызванном грамположительными бактериями [59, 60], и пенициллин (но не клиндамицин) при экспериментальной инфекции бедра мыши Clostridium difficile и S. pyogenes [61, 62].
Факторы, влияющие на клинический результат антибактериальной терапии
Немикробиологические факторы влияют на реакцию на терапию, включая защитные механизмы хозяина, локализацию инфекции, основное заболевание [13, 14, 63], а также критические внутренние фармакокинетические и фармакодинамические свойства антибактериального агента.
Неадекватное проникновение в очаг инфекции — один из основных факторов, связанных с неэффективностью антибактериальной терапии. Активный препарат должен достичь бактерий в соответствующих жидкостях и тканях организма в концентрациях, необходимых для уничтожения или подавления роста патогена.
Способность антибактериальных агентов преодолевать гематоэнцефалический барьер является важным фактором при лечении менингита. Аминогликозиды не проникают эффективно в бронхиальный секрет [64]; поэтому легочные инфекции требуют более высоких доз препарата [65].Доступность свободного (активного) препарата зависит от степени связывания с белками. Клинически могут потребоваться более высокие дозы, чем те, которые указаны в данных in vitro. Для лечения внутриклеточных бактерий необходимо эффективное проникновение в клетки (например, макролиды обычно концентрируются в фагоцитах). Окутываясь волокнистым экзополисахаридным гликокаликсом, бактерии защищены от защиты хозяина и действия антибактериальных средств [66–69]: клиндамицин может влиять на уничтожение бактерий за счет прямой антибактериальной активности, а также путем ингибирования развития биопленок гликокаликса S.aureus [70, 71] и адгезия посредством связывания фибронектина S. aureus с клетками-хозяевами [72].
Клинические ситуации, при которых бактерицидное действие считается необходимым
Эндокардит. Бактерии в сердечной вегетации могут достигать очень высоких концентраций (10 8 –10 10 организмов на грамм ткани). При такой плотности скорость метаболизма и деления клеток, по-видимому, снижается, что приводит к снижению восприимчивости к бактерицидным эффектам агентов, действующих на клеточную стенку.Бактерии находятся в спящем состоянии, окружены фибрином, тромбоцитами и, возможно, кальцинированным материалом [73, 74]. Бактерии, которые в большинстве случаев считаются чувствительными к различным антибактериальным препаратам, относительно устойчивы при эндокардите [75]. Клиническое излечение часто достигается, но длительное введение относительно высоких доз бактерицидного антибактериального агента, действующего на клеточную стенку, обычно требуется для истинной стерилизации растительности, чтобы убить любые спящие бактерии, когда они начинают продуцировать клеточные стенки с делением.
Признание потенциальной важности бактерицидной активности для лечения эндокардита восходит к ранним наблюдениям [76], но важно то, что бактериостатический агент (клиндамицин) успешно использовался при лечении стафилококкового эндокардита (20 [74%] ] из 27 случаев были вылечены) [77]. Это похоже на более поздние исследования, в которых 21 (70%) из 30 пациентов с эндокардитом S. aureus были вылечены нафциллином, с гентамицином или без него [78], а 11 (73%) из 15 были излечены с помощью пенициллина, метициллина. , или нафциллин [79].Энтерококковый эндокардит представляет собой особую дилемму, при которой патогены часто проявляют устойчивость к пенициллинам, аминогликозидам и ванкомицину, агентам, которые в первую очередь рассматриваются при лечении эндокардита, вызванного грамположительными микроорганизмами [4]. В качестве отдельных агентов они проявляют бактериостатическую активность против чувствительных энтерококков in vitro [80]. Для лечения требуется комбинация пенициллина или ванкомицина с гентамицином или стрептомицином. Линезолид, который in vitro обладает бактериостатическим действием против энтерококков, вылечил несколько случаев резистентности к ванкомицину E.faecium эндокардит [81,82].
Менингит. Часто считается, что антибактериальные препараты для лечения менингита должны быть бактерицидными не только из-за необходимости как можно быстрее искоренить инфекцию, но и из-за плохой иммунологической компетентности ЦНС. Однако проникновение многих антибактериальных средств в спинномозговую жидкость является слабым или сильно зависит от степени воспаления. Некоторые антибактериальные агенты, которые обычно считаются бактериостатическими, — тетрациклин [83], хлорамфеникол [84], линезолид [85, 86] и триметоприм-сульфаметоксазол [87, 88], эффективно проникают в спинномозговую жидкость и успешно используются для лечения грампластинок. положительный бактериальный менингит.Однако в экспериментах на животных ампициллин оказался более эффективным, чем хлорамфеникол, при менингите S. pneumoniae [89], а клинические результаты были плохими у педиатрических пациентов с устойчивым к пенициллину менингитом S. pneumoniae , получавшим хлорамфеникол [90]. В редких случаях устойчивый к ванкомицину менингит E. faecium успешно лечился линезолидом [85, 86].
Остеомиелит. Поскольку при остеомиелите проникновение лекарств может быть плохим из-за недостаточного кровоснабжения, может показаться логичным выбрать бактерицидное средство для лечения; однако клиндамицин, бактериостатический агент, достигает высоких концентраций в кости и считается подходящим средством для лечения грамположительного бактериального остеомиелита [91, 92].Успешный исход остеомиелита определяется адекватной хирургической обработкой раны и выбором антимикробного агента, к которому чувствителен организм, а не его бактерицидными свойствами.
Нейтропения. Использование бактерицидной антибактериальной терапии было предложено для лечения бактериальных инфекций у пациентов с тяжелой нейтропенией [93, 94]. Подтверждающие данные, по-видимому, больше полагаются на предполагаемую синергетическую активность комбинированной терапии, обычно бета-лактама плюс аминогликозид.В настоящее время грамположительные бактерии стали важной трудноизлечимой причиной инфекции у пациентов с нейтропенией [93, 95, 96]. Бактериостатические средства у этих пациентов не изучены должным образом.
В таблице 1 перечислены классы бактерицидных и альтернативных бактериостатических антибактериальных средств, используемых при серьезных грамположительных бактериальных инфекциях.
Таблица 1
Бактерицидные и бактериостатические антибактериальные классы для серьезных грамположительных бактериальных инфекций.
Таблица 1
Бактерицидные и бактериостатические антибактериальные классы для серьезных грамположительных бактериальных инфекций.
Недостатки бактерицидного действия
Некоторые данные указывают на то, что потенциально неблагоприятные клинические последствия могут быть результатом быстрого литического действия бактерицидных антибактериальных средств [97, 98]. Всплеск эндотоксина хорошо документирован после антибактериальной терапии в спинномозговой жидкости новорожденных с грамотрицательным бактериальным менингитом [99, 100].При менингите, вызванном S. pneumoniae , быстрая гибель микроорганизмов приводит к продукции увеличенных фрагментов клеточной стенки и внутриклеточного пневмолизина, которые усиливают ответ лейкоцитов и высвобождение простагландинов, что приводит к усилению отека мозга и высокому уровню смертности от пневмококкового менингита [ 90, 101]. Даже хлорамфеникол является литическим по отношению к S. pneumoniae , поэтому независимо от того, какой агент используется, в результате бактериального лизиса может возникнуть заметная воспалительная реакция.
Преимущества бактериостатического действия
Экзотоксины стафилококков и стрептококков могут вызывать синдром токсического шока. Хотя эти бактерии обычно чувствительны к клиндамицину, его бактериостатическое действие в течение некоторого времени считалось недостатком, и предпочтение отдавалось бактерицидным антибактериальным средствам. Однако было показано, что клиндамицин полностью подавляет продукцию токсина-1 при синдроме токсического шока S. aureus как в культурах в фазе роста, так и в культурах стационарной фазы [102].При высокой бактериальной нагрузке клиндамицин также более эффективен, чем пенициллин, в снижении смертности от экспериментальной инфекции бедра, вызванной либо Clostridium perfringens [62], либо S. pyogenes [61]. Клиндамицин в настоящее время считается основным компонентом терапии синдрома токсического шока стафилококка и стрептококка [103]. Бактериостатические агенты подавляют синтез белка в покоящихся медленнорастущих бактериях, на которые не действуют бактерицидные β-лактамы.
Выводы
Чем больше невежество, тем больше догматизм.
Приписывается Уильяму Ослеру, 1902
Предположение о превосходстве бактерицидного действия in vitro над бактериостатическим действием при лечении грамположительных бактериальных инфекций является интуитивным, а не основанным на строгих научных исследованиях. Различие между терминами «бактерицидный» и «бактериостатический» может показаться ясным в соответствии с определением in vitro, но это применимо только в строгих лабораторных условиях, несовместимо для конкретного агента против всех бактерий и значительно более нечеткое с клинической точки зрения.Большинство авторов согласны с тем, что возможное превосходство бактерицидной активности над бактериостатическими антибактериальными препаратами не имеет большого клинического значения при лечении подавляющего большинства грамположительных бактериальных инфекций. Одно из доказанных показаний к бактерицидной активности — энтерококковый эндокардит. Менингит обычно лечат бактерицидными агентами, но бактериостатические агенты, такие как хлорамфеникол и линезолид, применялись эффективно. Бактериостатические / бактерицидные данные in vitro могут предоставить информацию о потенциальном действии антибактериальных средств, но это только один из многих факторов, необходимых для прогнозирования благоприятного клинического исхода.
Благодарности
Мы очень признательны за помощь Питера Тодда, Мэрион Стаффорд и Пэт С. Панки.
Список литературы
1.Изменяющаяся эпидемиология Staphylococcus aureus?
,Emerg Infect Dis
,2001
, т.7
(стр.178
—82
) 2,.Антибактериальная резистентность в отделениях интенсивной терапии
,Clin Chest Med
,1999
, vol.20
(стр.303
—16
) 3.Появление Staphylococcus aureus с пониженной чувствительностью к ванкомицину в Японии
,Am J Med
,1998
, vol.104
Доп. 5A
(стр.7
—10
) 4.Жизнь и время энтерококка
,Clin Microbiol Rev
,1990
, vol.3
(стр.46
—65
) 5,,.Секреты успеха патогена человека: молекулярная эволюция пандемических клонов метициллин-устойчивого Staphylococcus aureus
,Lancet Infect Dis
,2002
, vol.2
(стр.180
—9
) 6,,,,.Первый клинический изолят промежуточного звена ванкомицина Staphylococcus aureus во французской больнице [письмо]
,Lancet
,1998
, vol.351
стр.1212
7.Новые лица старого патогена: появление и распространение мультирезистентного. Streptococcus pneumoniae
,Am J Med
,1999
, vol.107
(Дополнение 1A)
(стр.55
—62
) 8,.Тесты на бактерицидное действие антибактериальных агентов: технические характеристики и клиническая значимость
,Clin Microbiol Rev
,1992
, vol.5
(стр.420
—32
) 9. ,.Бактерицидный тест сыворотки: прошлое, настоящее и будущее использование в ведении пациентов с инфекциями
,Современные клинические темы инфекционных болезней
,1989
, vol.10
Oxford
Blackwell Scientific Publications
(стр.44
—55
) 10. ,,.Клиническая микробиология
,Инфекционные болезни
,1992
Филадельфия
WB Saunders
(стр.107
—26
) 11,.Бактериостатическая активность в сравнении с бактерицидной
,Infect Dis Clin North Am
,1989
, vol.3
(стр.389
—98
) 12NCCLS
.Методы определения бактерицидной активности антибактериальных средств; утвержденное руководство
,NCCLS, документ M26-A
,1999
Villanova, PA
NCCLS
13.Обзор фармакокинетики и фармакодинамики антибактериальных средств
,Mayo Clin Proc
,1998
, vol.73
(стр.1114
—22
) 14,.Кинетика антибактериальной активности
,J Pediatr
,1986
, vol.108
(стр.835
—40
) 15,.Толерантность к антибиотикам среди клинических изолятов бактерий
,Rev Infect Dis
,1985
, vol.7
(стр.368
—86
) 16,,,.Средне-зависимые вариации бактерицидной активности антибиотиков против чувствительных Staphylococcus aureus
,Противомикробные агенты Chemother
,1978
, vol.13
(стр.665
—8
) 17.Проблемы определения толерантности к антибиотикам in vitro в клинических изолятах
,Противомикробные агенты Chemother
,1986
, vol.30
(стр.633
—7
) 18,,,.Определение минимальных бактерицидных концентраций оксациллина для Staphylococcus aureus: влияние и значение технических факторов
,Противомикробные препараты Chemother
,1983
, vol.23
(стр.142
—50
) 19,.Важность фазы роста бактерий в определении минимальных бактерицидных концентраций пенициллина и метициллина
,Противомикробные агенты Chemother
,1981
, vol.19
(стр.1075
—7
) 20,,,,.Бактерицидное действие антибиотиков на медленно растущие и нерастущие бактерии
,Противомикробные агенты Chemother
,1991
, vol.35
(стр.1824
—8
) 21,,.Вариация чувствительности штаммов Staphylococcus aureus к оксациллину, цефалотину и гентамицину
,Антимикробные агенты Chemother
,1976
, vol.10
(стр.707
—12
) 22,.Методы определения минимальных летальных концентраций антибактериальных агентов in vitro
,Am J Clin Pathol
,1979
, vol.71
(стр.88
—92
) 23,,,.Важность минимизации эффекта переходящего остатка в субкультуре при обнаружении толерантных к пенициллину стрептококков группы viridans
,Антимикробные агенты Chemother
,1983
, vol.23
(стр.614
—6
) 24.Действие пенициллина на бактерии
,Br Med J
,1945
, vol.1
(стр.107
—10
) 25,.Бактерицидная активность тейкопланина и даптомицина в присутствии альбумина или сыворотки в контролируемых условиях pH и ионизированного кальция
,Противомикробные агенты Chemother
,1993
, vol.37
(стр.605
—9
) 26,,.pH-зависимая толерантность к оксациллину Staphylococcus aureus
,Противомикробные агенты Chemother
,1983
, vol.23
(стр.232
—5
) 27,,.Влияние температуры на посевной материал как потенциальный источник ошибки при подсчете бактерицидных измерений в чашках для разведения агара
,Противомикробные агенты Chemother
,1988
, vol.32
(стр.513
—7
) 28,.Медленное восстановление бактерий от токсического действия пенициллина
,J Bacteriol
,1949
, vol.58
(стр.475
—90
) 29,,.,,,.Специальные тесты: бактерицидная активность, активность противомикробных препаратов в комбинации и определение продукции β-лактамаз
,Руководство по клинической микробиологии
,1980
3-е изд.Вашингтон, округ Колумбия
Американское общество микробиологии Press
(стр.478
—84
) 30.Фенотипическая устойчивость к антибактериальным агентам
,J Antimicrob Chemother
,1985
, vol.15
(стр.653
—5
) 31,.Антибактериальная химиотерапия инфекции человека, вызванной Listeria monocytogenes
,Eur J Clin Microbiol Infect Dis
,1995
, vol.14
(стр.165
—75
) 32,.Фармакодинамика антибактериальных средств и обоснование их дозирования
,J Chemother
,1997
, vol.9
Suppl 1
(стр.64
—73
) 33,. ,.Использование антибиотиков
,Практический подход к инфекционным болезням
,1991
3-е изд.Бостон
Little, Brown and Company
(стр.821
—1007
) 34.Фенотипическая толерантность: поиск бета-лактамных антибиотиков, убивающих нерастущие бактерии
,Rev Infect Dis
,1986
, vol.8
Suppl 3
(стр.279
—91
) 35,,.Толерантность к антибиотикам среди клинических изолятов бактерий
,Противомикробные агенты Chemother
,1986
, vol.30
(стр.521
—7
) 36,,.Переносимость пенициллина и неэффективность лечения при стрептококковом фаринготонзиллите группы А
,Eur J Clin Microbiol Infect Dis
,1996
, vol.15
(стр.107
—15
) 37.Сравнение четырех методов определения МИК и МБК пенициллина для стрептококков viridans и их значение для толерантности к пенициллину
,J Antimicrob Chemother
,1990
, vol.25
(стр.209
—16
) 38,,.Терапевтическая неудача при пневмонии, вызванной толерантным штаммом Staphylococcus aureus
,Scand J Infect Dis
,1982
, vol.14
(стр.309
—11
) 39,,,.Серьезные стафилококковые инфекции, штаммы которых устойчивы к бактерицидным антибиотикам
,Arch Intern Med
,1979
, vol.139
(стр.1026
—31
) 40,.Парадоксальный эффект пенициллина in vivo [письмо]
,J Antimicrob Chemother
,1985
, vol.15
(стр.507
—8
) 41,,,,.Новый тип устойчивости к пенициллину у Staphylococcus aureus
,Lancet
,1977
, vol.1
(стр.443
—7
) 42« и др.Оценка in vitro и in vivo A-56268 (TE-031), нового макролида
,антимикробных агентов Chemother
,1986
, vol.30
(стр.865
—73
) 43,.Наблюдения за механизмом действия эритромицина
,Proc Soc Exper Biol Med
,1952
, vol.81
(стр.188
—93
) 44,,.Кларитромицин и азитромицин: новые макролидные антибиотики
,Clin Pharm
,1992
, vol.11
(стр.137
—52
) 45,,, et al.Спектр и механизм действия азитромицина (CP-62,993), нового макролида с 15-членным кольцом с улучшенной эффективностью против грамотрицательных организмов
,Противомикробные агенты Chemother
,1987
, vol.31
(стр.1939
—47
) 46,,.Хлорамфеникол: обзор его использования в клинической практике
,Rev Infect Dis
,1981
, vol.3
(стр.479
—91
) 47,.Бактерицидное и бактериостатическое действие хлорамфеникола против менингеальных патогенов
,Противомикробные агенты Chemother
,1979
, vol.16
(стр.13
—8
) 48.Сравнение хлорамфеникола и ампициллина как бактерицидных агентов для Haemophilus influenzae тип B
,J Med Microbiol
,1977
, vol.10
(стр.127
—31
) 49,,.Антагонизм ампициллина и хлорамфеникола против менингеальных изолятов стрептококков группы B
,Противомикробные агенты Chemother
,1981
, vol.20
(стр.281
—5
) 50,.Бактерицидная активность пяти антибактериальных агентов против Bacteroides fragilis
,J Infect Dis
,1972
, vol.126
(стр.104
—7
) 51,.Антибактериальная терапия экспериментального эндокардита, вызванного Staphylococcus aureus
,J Infect Dis
,1975
, vol.131
(стр.367
—75
) 52,,,.Сравнительная бактерицидная активность оксазолидоновых антибиотиков in vitro в отношении энтерококков с множественной лекарственной устойчивостью
,Diagn Microbiol Infect Dis
,1998
, vol.30
(стр.109
—12
) 53« и др.In vitro активности U-100592 и U-100766, новых оксазолидиноновых антибактериальных агентов
,Противомикробные агенты Chemother
,1996
, vol.40
(стр.839
—45
) 54,,,.Хинупристин-далфопристин: обзор
,Фармакотерапия
,2000
, т.20
(стр.1469
—85
) 55,,.Quinupristin / dalfopristin: обзор его использования в лечении серьезных грамположительных инфекций
,Drugs
,1999
, vol.58
(стр.1061
—97
) 56,.Налидиксовая кислота: антибактериальный парадокс
,Противомикробные агенты Chemother
,1975
, т.8
(стр.251
—61
) 57,. .Химия и механизмы действия хинолоновых антибактериальных средств
,Хинолоны
,1988
Лондон
Academic Press
(стр.23
—81
) 58,.Фармакодинамика антибактериальных средств: бактерицидное и постантибиотическое действие
,Infect Dis Clin North Am
,1989
, vol.3
(стр.415
—21
) 59,,.Сравнительная эффективность даптомицина, ванкомицина и клоксациллина для лечения эндокардита Staphylococcus aureus у крыс и роль условий испытаний в этом определении
,Противомикробные агенты Chemother
,1990
, vol.34
(стр.2348
—53
) 60,,,,.Влияние состояния развития клапанных поражений на антибактериальную активность цефотаксима при экспериментальных энтерококковых инфекциях
,Противомикробные препараты Chemother
,1985
, vol.27
(стр.320
—3
) 61,,,.Еще раз об эффекте Игла: эффективность клиндамицина, эритромицина и пенициллина при лечении стрептококкового миозита
,J Infect Dis
,1988
, vol.158
(стр.23
—8
) 62,,,.Сравнение эффективности клиндамицина, рифампина, тетрациклина, метронидазола и пенициллина в профилактике экспериментальной газовой гангрены, вызванной Clostridium perfringens
,J Infect Dis
,1987
, vol.155
(стр.220
—8
) 63.Фармакодинамика антибактериальных средств как основа для определения режимов дозирования
,Eur J Clin Microbiol Infect Dis
,1993
, vol.12
Дополнение 1
(стр.6
—8
) 64,,.Концентрации гентамицина в бронхиальном секрете после внутримышечного и эндотрахеального введения
,J Clin Pharmacol
,1975
, vol.15
(стр.518
—24
) 65,,.Связь уровней аминогликозидов в плазме с терапевтическим исходом при грамотрицательной пневмонии
,Am J Med
,1984
, vol.77
(стр.657
—62
) 66,.Прилипание бактерий и гликокаликс и их роль в скелетно-мышечной инфекции
,Orthop Clin North Am
,1984
, vol.15
(стр.517
—35
) 67,,.Морфологическая стабилизация гликокаликов 23 штаммов пяти видов Bacteroides с использованием специфических антисывороток
,Can J Microbiol
,1984
, vol.30
(стр.809
—19
) 68,,,,.Прилипание бактерий и образование гликокаликса при остеомиелите, экспериментально вызванном Staphylococcus aureus
,Infect Immun
,1984
, vol.43
(стр.825
—33
) 69,.Ультраструктурные исследования адгезии Staphylococcus aureus при экспериментальном остром гематогенном остеомиелите
,Infect Immun
,1985
, vol.49
(стр.443
—6
) 70,,,,.Электронно-микроскопическое исследование влияния клиндамицина на адгезию Staphylococcus aureus к костным поверхностям
,Microbios
,1986
, vol.45
(стр.21
—32
) 71,,,.Электронно-микроскопическое исследование влияния терапии клиндамицином на адгезию бактерий и образование гликокаликса при экспериментальном остеомиелите Staphylococcus aureus
,Microbios
,1986
, vol.48
(стр.189
—206
) 72,,.Субингибирующие концентрации антибиотиков изменяют связывание фибронектина с Staphylococcus aureus
,Противомикробные агенты Chemother
,1983
, vol.24
(стр.823
—6
) 73,.Экспериментальный бактериальный эндокардит. I. Колонизация стерильной растительности
,Br J Exp Pathol
,1972
, vol.53
(стр.44
—9
) 74.,,.Общие терапевтические принципы
,Инфекционные болезни
,1992
Филадельфия
WB Saunders
(стр.153
—60
) 75,. ,.Сердечные инфекции
,Практический подход к инфекционным болезням
,1991
3-е изд.Бостон
Little, Brown and Company
(стр.278
—304
) 76.Размышления о механизме лечения бактериального эндокардита
,JAMA
,1950
, vol.144
(стр.524
—7
) 77.Терапия клиндамицином Staphylococcus aureus эндокардит: клинический рецидив и развитие устойчивости к клиндамицину, линкомицину и эритромицину
,Am J Med
,1976
, vol.60
(стр.419
—25
) 78,.Комбинированная антимикробная терапия эндокардита Staphylococcus aureus у пациентов, принимающих парентеральные препараты, и у лиц без зависимости: проспективное исследование
,Ann Intern Med
,1982
, vol.97
(стр.496
—503
) 79,.Инфекции, вызванные Staphylococcus aureus
,Медицина (Балтимор)
,1977
, vol.56
(стр.383
—409
) 80,. ,,,.Сердечно-сосудистые инфекции
,Принципы и практика инфекционных заболеваний Манделла, Дугласа и Беннета
,1995
4-е изд.Нью-Йорк
Черчилль Ливингстон
(стр.740
—83
) 81,,,,,.Успешное лечение ванкомицин-резистентного эндокардита Enterococcus пероральным линезолидом
,Clin Infect Dis
,2001
, vol.32
(стр.1373
—5
) 82,,,.Эффективность и безопасность линезолида в качестве лечения Staphylococcus aureus инфекций у пациентов, которые не переносят или не ответили на ванкомицин
,J Antimicrob Chemother
,2002
, vol.50
(стр.1017
—26
) 83,.Террамицин для внутримышечного введения при лечении менингита; отчет о 21 восстановлении
,Arch Pediatr
,1953
, vol.70
(стр.319
—25
) 84,,,,.Затяжной пневмонококковый менингит, вызванный организмом с повышенной устойчивостью к пенициллину
,Педиатрия
,1976
, т.58
(стр.378
—81
) 85,,.Успешное лечение менингита, устойчивого к ванкомицину Enterococcus faecium линезолидом: клинический случай и обзор литературы
,Scand J Infect Dis
,2001
, vol.33
(стр.375
—9
) 86,,,.Устойчивый к ванкомицину Enterococcus faecium Менингит успешно лечится с помощью линезолида: клинический случай и обзор литературы
,Clin Infect Dis
,2001
, vol.33
(стр.477
—82
) 87,.Триметоприм / сульфаметоксазол при бактериальном менингите
,Ann Intern Med
,1984
, vol.100
(стр.881
—90
) 88,,.Возможная роль триметоприм-сульфаметоксазола в лечении серьезных внутрибольничных бактериальных инфекций
,Rev Infect Dis
,1987
, vol.9
Suppl 2
(стр.160
—7
) 89,.Сравнение бактерицидной и бактериостатической антибиотикотерапии экспериментального пневмококкового менингита у кроликов
,J Clin Invest
,1983
, vol.71
(стр.411
—9
) 90,.Неудача лечения хлорамфениколом при пневмококковом менингите, резистентном к пенициллину
,Lancet
,1992
, vol.339
(стр.405
—8
) 91,. ,.Остеомиелит и инфекции диабетической стопы
,Практический подход к инфекционным болезням
,1991
3-е изд.Бостон
Little, Brown and Company
(стр.464
—98
) 92,,.Антимикробное лечение остеомиелита
,Clin Orthop
,1993
, vol.295
(стр.87
—95
) 93.Концепция эмпирической терапии комбинациями антибиотиков: показания и пределы
,Am J Med
,1986
, vol.80
Доп. 5C
(стр.2
—12
) 94.Эмпирическая антимикробная терапия нейтропенического хозяина [редакционная статья]
,N Engl J Med
,1986
, vol.315
(стр.580
—1
) 95.Нейтропения, лихорадка и инфекция
,Am J Med
,1984
, vol.76
(стр.421
—8
) 96« и др.Рандомизированное испытание, сравнивающее цефтазидим отдельно с комбинированной антибактериальной терапией у онкологических больных с лихорадкой и нейтропенией
,N Engl J Med
,1986
, vol.315
(стр.552
—8
) 97,.β-лактамное антибиотик-индуцированное высвобождение свободного эндотоксина: in vitro сравнение имипенема, специфичного к пенициллин-связывающему белку (PBP) 2, и цефтазидима, специфичного к PBP 3
,J Infect Dis
,1992
, vol.165
(стр.1033
—41
) 98,.Бактериальный менингит: патогенез, патофизиология и прогресс
,N Engl J Med
,1992
, vol.327
(стр.864
—72
) 99,,,.Концентрация кахектина в спинномозговой жидкости / фактора некроза опухоли-α и фактора активации тромбоцитов и тяжесть бактериального менингита у детей
,J Infect Dis
,1990
, vol.162
(стр.139
—47
) 100,,,,,.Повышенные концентрации эндотоксина и интерлейкина-1β в спинномозговой жидкости младенцев с колиформным менингитом и вентрикулитом, связанные с внутрижелудочковой терапией гентамицином
,J Infect Dis
,1989
, vol.160
(стр.891
—5
) 101,.Модуляция высвобождения провоспалительных бактериальных соединений антибактериальными средствами: потенциальное влияние на течение воспаления и исход при сепсисе и менингите
,Clin Microbiol Rev
,2002
, vol.15
(стр.95
—110
) 102,,,,.Комбинация флуклоксациллина и гентамицина подавляет продукцию токсина 1 синдрома токсического шока Staphylococcus aureus как в логарифмической, так и в стационарной фазах роста
,Антимикробные агенты Chemother
,1997
, vol.41
(стр.1682
—5
) 103,.Клиндамицин в лечении стрептококковых и стафилококковых синдромов токсического шока
,Ann Pharmacother
,2000
, vol.34
(стр.936
—9
)© 2004 Американское общество инфекционных болезней
Основы бактерицидных и бактериостатических антибиотиков
Люди слишком часто неправильно понимают разницу между бактерицидными и бактериостатическими антибиотиками.Чтобы помочь стажерам и практикующим врачам, ведущий врач-инфекционист изучает основы и последние клинические данные по бактерицидным и бактериостатическим антибиотикам.
Автор: Брэд Спеллберг, доктор медицины, FIDSA, FACP
[Последнее обновление: 27 декабря 2017 г.]
Хотя кажется интуитивным, что антибиотики, которые быстрее убивают бактерии, должны быть более клинически эффективными, недавний систематический обзор рандомизированных контролируемых испытаний не поддерживает это утверждение.Кроме того, существует множество недоразумений относительно значения слов «бактерицидный» и «бактериостатический».
На вопрос, что такое бактериостатическое средство, многие поставщики ответят, что бактериостатические агенты замедляют или подавляют рост бактерий, но не убивают их, по сравнению с бактерицидными антибиотиками, которые активно убивают. Несмотря на то, что названия, кажется, подразумевают именно такую интерпретацию, эта интерпретация неверна.
Определение бактерицидного и бактериостатического
Здесь важно уточнить два определения.Во-первых, минимальная ингибирующая концентрация (MIC) определяется как концентрация, которая подавляет видимый рост бактерий через 24 часа роста в определенных средах, при определенной температуре и при определенной концентрации углекислого газа. Во-вторых, минимальная бактерицидная концентрация (МБК) — это концентрация лекарственного средства, которая приводит к 1000-кратному снижению плотности бактерий через 24 часа роста в тех же конкретных условиях.
Формальное определение бактерицидного антибиотика — это антибиотик, для которого отношение МБК к МПК составляет ≤ 4, в то время как бактериостатический агент имеет отношение МБК к МПК> 4.Таким образом, антибиотик, который обеспечивает более чем 1000-кратное снижение плотности бактерий, но делает это при концентрации, которая в 8 раз превышает МПК лекарственного средства, считается бактериостатическим, несмотря на то, что он явно убивает бактерии.
Аналогичным образом, антибиотик, который обеспечивает 10-кратное или даже 500-кратное снижение плотности бактерий при концентрации в 2–4 раза выше МПК, характеризуется как бактериостатический, хотя и демонстрирует впечатляющую убивающую способность. Все антибиотики, которые считаются бактериостатическими, действительно убивают бактерии in vitro , только в концентрациях, которые намного превышают их МПК, чем бактерицидные средства.
Изучите антибиотики
Понимание влияния этих определений
Эти чисто лабораторные определения несколько произвольны. Почему должно быть так, что МБК требует уменьшения плотности бактерий в 1000 раз, а не в 100, 500, 5000 или даже 10 000 раз? Почему 24 часа? Почему MBC не должен быть более чем в 4 раза выше MIC, а не только в 2 раза, или, если на то пошло, в 16 или 24 раза? В конечном счете, целесообразно стандартизировать in vitro и сравнений скорости уничтожения антимикробными агентами, если считается, что знание этой характеристики агента имеет некоторую ценность.Но это не означает, что этот текущий стандартизированный метод позволяет прогнозировать, что происходит во время клинической инфекции.
Бактериостатический и бактерицидный — относительные in vitro, термины, не основанные на связи с какой-либо прогностической способностью исхода инфекций in vivo.
Текущие клинические данные
Наш анализ опубликованных рандомизированных контролируемых испытаний демонстрирует, что бактерицидные агенты по своей эффективности не превосходят бактериостатические агенты.В большинстве исследований по различным инфекциям не было обнаружено различий в эффективности бактериостатических и бактерицидных агентов.
Из семи испытаний, которые действительно обнаружили статистически значимую разницу в клинических исходах, шесть показали, что бактериостатический агент был более эффективным по эффективности. Единственное испытание, которое показало, что бактерицидный агент имеет более высокую эффективность, использовало фармакологически субоптимальную дозу статического агента, так что повторное испытание с использованием удвоенной дозы статического агента не обнаружило разницы в эффективности между статическим и цидным агентами.
Таким образом, рандомизированные контролируемые испытания не подтверждают превосходства бактерицидных средств. Скорее, имеющиеся данные предполагают, что другие характеристики лекарства, такие как оптимальная дозировка, фармакокинетика и проникновение в ткани, могут быть более важными факторами клинической эффективности, чем собственная скорость уничтожения бактерий in vitro .
Резюме текущих доказательств
Таким образом, существует множество доказательств того, что бактерицидные и бактериостатические агенты схожи по эффективности при лечении клинических инфекций, включая инфекции кожи и мягких тканей, пневмонию, неэндокардитные инфекции кровотока, интраабдоминальные инфекции и инфекции половых органов.
Подавляющее большинство исследований, сравнивающих бактериостатические и бактерицидные агенты для лечения инвазивных бактериальных инфекций, не обнаружили разницы в клинических исходах или смертности. Когда в таких исследованиях обнаруживаются различия, они обычно обнаруживают, что бактериостатический агент превосходит бактерицидный агент и является более рентабельным.
Когда бактериостатические агенты были признаны более низкими, объяснение, по-видимому, скорее связано с неадекватной дозировкой и / или достижимыми уровнями в месте заражения, а не с быстротой уничтожения микроба.
Пора отказаться от представления о том, что бактерицидные антибиотики по своей природе более эффективны, чем бактериостатические.
Предлагаемое чтение
РЕКОМЕНДУЕТСЯ ДЛЯ ВАС
Преобладает антагонизм между бактериостатическими и бактерицидными антибиотиками
РЕЗЮМЕ
Комбинированная терапия редко используется для противодействия развитию резистентности бактериальных инфекций.Расширение использования комбинированной терапии требует знания того, как лекарственные средства взаимодействуют при ингибирующих концентрациях. Более 50 лет назад было отмечено, что если бактерицидные препараты наиболее эффективны в отношении активно делящихся клеток, то ингибирование роста, вызванное бактериостатическим препаратом, должно приводить к общему снижению эффективности, когда препарат используется в сочетании с бактерицидным препаратом. лекарство. Наша цель здесь состояла в том, чтобы систематически исследовать эту гипотезу. Сначала мы построили кривые «время-время» с использованием пяти различных антибиотиков в клинически значимых концентрациях и наблюдали антагонизм между бактерицидными и бактериостатическими препаратами.Мы расширили наше исследование, выполнив скрининг попарных комбинаций 21 различных антибиотиков в субингибирующих концентрациях, и мы обнаружили, что сильные антагонистические взаимодействия были значительно усилены среди комбинаций бактериостатических и бактерицидных препаратов. Наконец, поскольку наша гипотеза основана на фенотипических эффектах, вызываемых различными классами лекарств, мы воссоздали эти эксперименты на микрофлюидном устройстве и выполнили покадровую микроскопию, чтобы напрямую наблюдать и количественно оценить рост и деление отдельных клеток с контролируемыми концентрациями антибиотиков.Хотя наши одноклеточные наблюдения подтвердили антагонизм между бактериостатическими и бактерицидными препаратами, они выявили неожиданное разнообразие клеточных ответов на антагонистические комбинации препаратов, предполагая, что в основе взаимодействий лежат множественные механизмы.
ВВЕДЕНИЕ
Проблема устойчивости к антибиотикам требует решения, основанного не только на разработке новых лекарств. Патогены неумолимо развивались в механизмах, позволяющих выжить перед лицом каждого лекарства, представленного на рынке.Комбинированная терапия, то есть одновременное применение двух или более антибиотиков, представляет собой привлекательный подход, который требует более тщательной оценки в качестве инструмента для борьбы с этой проблемой. При лечении важных инфекционных заболеваний, таких как ВИЧ-инфекция, туберкулез и малярия, комбинированная терапия стала стандартным подходом именно для того, чтобы задержать развитие лекарственной устойчивости (1–4). Напротив, при распространенных острых бактериальных инфекциях комбинации лекарств назначаются только в очень ограниченном числе случаев и с другим обоснованием (5).В этих конкретных случаях два препарата назначаются из-за их синергетического действия, то есть из-за того факта, что их комбинированные эффекты превышают сумму их индивидуальных эффектов. Было продемонстрировано, что лекарственный синергизм приводит к более эффективному избавлению от инфекций и достижению выведения при более низких концентрациях лекарств (6). Примеры таких случаев включают фузидиевую кислоту и рифампин для лечения метициллин-резистентных инфекций Staphylococcus aureus и триметоприм и сульфаметоксазол для лечения среднего отита (7, 8).Кроме того, недавняя теоретическая работа показывает, что синергические препараты могут предотвратить неудачу лечения, даже если бактерии, устойчивые к одному из препаратов, присутствуют в начале терапии (9).
Так же, как синергизм может использоваться для улучшения лечения, необходимо избегать комбинаций лекарств, которые подавляют друг друга и могут продлить инфекцию. Антагонизм, когда лекарство препятствует действию другого лекарственного средства, был зарегистрирован на ранних этапах истории применения антибиотиков и продолжает действовать как предупреждение против неопределенного лечения (10).В исследовании пациентов с пневмококковым менингитом 30% из тех, кто лечился одним пенициллином, не прошли лечение и умерли, в то время как 79% сопоставимых пациентов, получавших такую же дозу пенициллина плюс хлортетрациклин, антибиотик, который противодействует пенициллину, умерли (11, 12).
Несмотря на эти результаты, все большее количество лабораторных исследований показывает, что комбинации антагонистических препаратов заслуживают дополнительных исследований в качестве клинических вариантов (13). Недавняя работа в этой области предполагает, что различные типы взаимодействий оказывают значительное влияние на выбор и поддержание мутаций устойчивости к лекарствам.Используя эксперимент с прямой конкуренцией, Чейт и его коллеги продемонстрировали, как гиперантагонистическая комбинация лекарств способна отбирать бактериальную популяцию, устойчивую к одному из лекарств, и вместо этого отдавать предпочтение полностью чувствительному дикому типу (14). Кроме того, было показано, что скорость адаптации лабораторных бактерий к нескольким лекарствам коррелирует со степенью синергизма между отдельными антибиотиками (15). Хотя антагонистические комбинации лекарственных средств в настоящее время избегаются в клинических условиях, эти исследования показывают, что антагонизм между антибиотиками может помочь в разработке стратегий лечения, специально направленных на отсрочку появления резистентности.
В ответ на медленную разработку новых противомикробных препаратов возродился интерес к старым лекарствам, которые вышли из употребления из-за токсичности или недостаточной эффективности (16). Один из подходов, который можно применить для возврата этих лекарств в клинику, — это использование старого лекарства в сочетании с текущим лекарством (17). Преимущества синергизма и разнообразные нетривиальные эффекты антагонизма будут играть центральную роль в определении того, как лучше всего применять комбинированную терапию в клинических условиях.
Чтобы использовать потенциальные преимущества комбинированной терапии, нам нужно лучше понимать обстоятельства, при которых ожидается синергизм или антагонизм. Определение того, как более широкий спектр лекарств взаимодействует при ингибирующих концентрациях, и определение механизмов, ответственных за эти эффекты, могло бы позволить более разумное применение антибиотиков, которое поддерживает клинические возможности и не жертвует будущей полезностью этих лекарств.
В этом исследовании мы спросили, могут ли основные фармакодинамические свойства всех антибиотиков помочь предсказать, какие пары приведут к антагонизму.Широко признанной характеристикой антибиотиков является то, что они либо бактериостатичны и подавляют рост, не убивая клетки, либо обладают бактерицидным действием и приводят к гибели клеток (18). Таким образом, если бактерицидные препараты наиболее эффективны в отношении активно растущих клеток, как предполагалось более 50 лет назад (19, 20), то ингибирование роста, вызванное бактериостатическим препаратом, должно приводить к снижению эффективности препарата. Чтобы проверить эту гипотезу, мы определили типы взаимодействия между пятью различными препаратами в подавляющих концентрациях, оценив уровень смертности с помощью кривых «время-убийство».Затем мы расширили наши наблюдения и применили методы скрининга, чтобы выявить эффекты для пар из 21 различных лекарств в субингибирующих концентрациях. Поскольку наша гипотеза основана на пониженной чувствительности медленно растущих клеток к антибиотикам и способности некоторых лекарств влиять на это состояние, мы повторили наши эксперименты на уровне отдельных клеток с использованием покадровой микроскопии в микрофлюидных устройствах, чтобы исследовать клеточную динамику, лежащую в основе комбинированное действие антибиотиков.
МАТЕРИАЛЫ И МЕТОДЫ
Высокопроизводительные комбинированные скрининговые эксперименты.Мы выбрали 21 антибиотик с широким спектром механизмов действия, включая препараты, нацеленные на клеточную стенку, биосинтез нуклеиновой кислоты, белка и фолиевой кислоты (таблица 1). Свежие растворы антибиотиков готовили из запасов порошка еженедельно и стерилизовали фильтрованием перед использованием. Все эксперименты проводились на Escherichia coli K-12 (BW25113) в минимальной среде с добавлением 0,2% глюкозы и 0,1% казаминокислот. Комбинированные скрининги проводили в 384-луночных планшетах с использованием роботизированной системы для работы с жидкостью (рабочая станция Hamilton Star) для улучшения воспроизводимости.Объем культуры составлял 50 мкл. Каждый планшет содержал два разных блока дозовой матрицы размером 6 на 6 (один антибиотик в сочетании с двумя другими антибиотиками), по 4 повтора в каждом. Для каждой пары антибиотиков мы объединили 6 различных концентраций агентов в последовательно разведенной двумерной матрице доз, при этом точки дозировки были сосредоточены на 50% эффективной концентрации (EC 50 ) для каждого антибиотика. Самая низкая концентрация для каждого агента была 0, а самая высокая — выше 90% эффективной концентрации (ЕС 90 ) (Таблица 1).В дополнение к блокам дозовой матрицы каждый планшет включал 18 лунок, содержащих среду без антибиотиков (контрольные лунки).
ТАБЛИЦА 1Список всех антибиотиков, использованных в исследовании
Скрининг чувствительности к антибиотикам проводили путем выращивания клеток в течение ночи (оптическая плотность при 600 нм [OD 600 ], 4) при 30 ° C, встряхивании при 300 об / мин и разведение клеток до OD, эквивалентного 0,04. Затем, используя роботизированную систему для работы с жидкостью, клетки переносили в 384-луночные аналитические планшеты (в присутствии антибиотиков) с получением 4 × 10 4 клеток / лунку.Планшеты для анализа инкубировали в течение 18 ч при 30 ° C, встряхивая при 300 об / мин. Рост бактерий контролировали путем измерения оптической плотности (OD 600 ) жидких культур в единственной временной точке. Предварительные эксперименты показали, что однократное считывание оптической плотности после 18 ч инкубации показало сильную линейную корреляцию с площадью под кривой роста (дескриптор общего ингибирующего эффекта, охватывающего весь период роста) (21). Вкратце, это было определено с использованием параллельных культур E.coli, выращенных в десяти 384-луночных микротитрационных планшетах в ранее заявленных условиях. Оптическую плотность (OD 600 ) измеряли каждый час в течение 24 часов, а площади под кривыми роста определяли с использованием пользовательских скриптов MATLAB. Для ряда различных конечных моментов времени (например, 11, 12 и 13 часов) мы использовали модель линейной регрессии, чтобы определить, предсказывают ли последние измерения OD области под кривыми роста (384 × 10 = 3840 точек данных). Планшеты были приготовлены в виде нескольких (до 6) биологических повторов, и планшеты с проблемами контроля качества (например,g. рост в контрольных лунках был необычно низким или имел большие вариации, или агент не смог существенно ингибировать рост при высоких концентрациях или сильно подавил рост даже при низких дозах), были исключены из дальнейшего анализа.
У нас было две причины изучить взаимодействие антибиотиков в стандартной минимальной среде при относительно низкой температуре (30 ° C). Во-первых, поскольку объем культуры в нашем исследовании составлял 50 мкл, испарение было потенциальной проблемой. Чтобы свести к минимуму такой смешивающий эффект, 30 ° C оказались оптимальным решением.Во-вторых, наши экспериментальные условия были аналогичны предыдущим исследованиям (22), что позволяло напрямую сравнивать результаты двух исследований.
Этапы обработки данных и коррекции смещения. Чтобы преодолеть любое смещение измерения, вызванное неоднородностью внутри пластины, мы обработали необработанные данные об оптической плотности следующим образом. Мы включили 18 контрольных лунок в каждую чашку, содержащую среду без антибиотиков и инокулированную E. coli. Мы использовали эти лунки как для установки базовой линии для нулевого ингибирования, так и для оценки и устранения систематических ошибок внутри планшета.Сначала мы откалибровали значения OD, применив преобразование OD , калиброванное = OD + (0,40449 × OD 3 ), чтобы учесть нелинейную связь между OD и плотностью клеток при высоких плотностях клеток (параметры калибровочной формулы были получены, как в ссылка 23). Затем мы рассчитали значения относительного ингибирования на основе начальной OD (максимальное ингибирование) и средней OD контрольных лунок без антибиотиков (максимальный рост). Чтобы оценить и устранить пространственные эффекты внутри планшета, сначала мы применили линейный тренд к контрольным лункам, чтобы устранить пространственные градиенты.Затем для остатков мы использовали регрессию по Гауссу (24), чтобы устранить оставшиеся систематические пространственные смещения с использованием контрольных скважин. Оба шага для коррекции смещения были выполнены в MATLAB.
Идентификация взаимодействующих пар антибиотиков. Синергетические эффекты между комбинациями химических веществ, приводящие к усилению положительных эффектов или повышенной токсичности, имеют важное значение во всех областях биомедицины (25, 26). Соответственно, было разработано множество подходов для количественной оценки лекарственных взаимодействий (27).Для оценки антагонизма и синергизма между парами антибиотиков мы использовали модель аддитивности Loewe (28), которая предполагает, что лекарство не взаимодействует с самим собой. Геометрически аддитивность Loewe может быть представлена в виде линий одинаково эффективных доз (изобол) в двумерном линейном пространстве концентраций для двух препаратов. Отклонение формы изобол от линейности указывает либо на синергию (вогнутые изоболы), либо на антагонизм (выпуклые изоболы). Чтобы определить взаимодействия для каждой пары антибиотиков, сначала мы объединили данные из повторяющихся блоков матрицы доз, расположенных на одних и тех же 384-луночных планшетах.Затем мы сопоставили сигмоидальные кривые доза-реакция (уравнение Хилла) с ответами на единичный агент, используя процедуру аппроксимации максимального правдоподобия. Основываясь на кривых ответа на один агент для двух антибиотиков, мы рассчитали зависимость доза-ответ для комбинации антибиотиков, ожидаемой с помощью модели аддитивности Loewe. Для количественной оценки взаимодействий мы определили вогнутость набора изобол, выведенную из измерений комбинации для данной пары антибиотиков («наблюдаемые» изоболы). Чтобы достичь этого, мы использовали математическое преобразование, чтобы «согнуть» линейные изоболы, ожидаемые в рамках модели аддитивности Loewe, чтобы максимально приблизить наблюдаемые изоболы (см. Отчет Cokol и его коллег о подобном подходе [29]).Преобразование основывается на одном параметре для описания вогнутости наблюдаемых изобол, которую мы использовали в качестве меры взаимодействия с антибиотиками. Эта оценка равна нулю в отсутствие взаимодействия, отрицательна для антагонистических пар и положительна для синергетических пар. Наконец, были рассчитаны оценки взаимодействия ( B ) для каждой пары антибиотиков, взяв средние оценки, полученные из биологических повторений (т.е. независимых планшетов).
Погрешности измерения экранов взаимодействия оценивались путем тестирования 5 антибиотиков на взаимодействие между собой в нескольких повторностях (29).Поскольку при аддитивности Loewe лекарство не взаимодействует с самим собой, отклонение оценки взаимодействия от нуля дает оценку экспериментальной ошибки измерения взаимодействия. Таким образом, мы рассматривали два антибиотика как значительно взаимодействующие, когда оценка значительно отличалась от средней оценки для комбинаций собственных антибиотиков. Для расчета значений EC 50 мы следовали установленным протоколам (30). EC 50 относится к концентрации лекарственного средства, которая вызывает ингибирование роста на полпути между исходным и максимальным значениями после указанного времени воздействия.
Антибиотики и их концентрации для экспериментов с тайм-килл и покадровой микроскопией. Определение клинической полезности использования различных взаимодействий между парами антибиотиков потребует обширных испытаний на разных организмах, местах заражения и лекарствах, используемых для конкретных инфекций. Напротив, мы считаем нашу работу доказательством принципа исследования, и будущая работа должна подтвердить потенциальные клинические последствия. Хотя некоторые из используемых нами антибиотиков имеют усовершенствованные производные в клинике, выбор препаратов, которые мы использовали, основывался на двух критериях:д., (i) доступность очень подробной литературы о молекулярном механизме действия и (ii) возможность сравнения с результатами более раннего исследования (22). Точно так же используемые концентрации антибиотиков не отражают клинических рекомендаций. Например, хотя концентрация эритромицина, используемая в наших экспериментах по тайм-килл и покадровой микроскопии, выше, чем достижимая в крови, это лекарство было включено, чтобы проиллюстрировать эффект антагонизма между лекарством в ингибирующей концентрации и вторым лекарством в субингибирующая концентрация.Хотя МПК для эритромицина в E. coli MG1655 значительно превышает используемую нами концентрацию (от 500 до 1000 мкг / мл), мы были заинтересованы в том, чтобы определить, была ли субингибирующая концентрация этого препарата достаточной для противодействия убивающему эффекту второго препарата, чья концентрация была выше МПК.
Кривые зависимости от времени убийства. Определение МПК для антибиотиков, используемых в исследованиях с использованием тайм-килл и покадровой микроскопии, проводилось с использованием протокола разбавления бульона, аналогичного тому, который рекомендован Институтом клинических и лабораторных стандартов (использовалась среда LB вместо бульона Мюллера-Хинтона) (31).Концентрации лекарственных средств, используемых в следующих экспериментах, представляют собой фракции МПК: 25 мкг / мл стрептомицина и налидиксовой кислоты (2 × МПК), 12,5 мкг / мл тетрациклина (0,83 × МПК), 10 мкг / мл триметоприма (0,66 × МИК) и 200 мкг / мл эритромицина (0,4 × МИК).
Ночные культуры E. coli MG1655 разводили 1: 10 000 в свежем предварительно нагретом бульоне LB и инкубировали в течение 2 часов. Дальнейшее разведение 1: 2 выполняли перед внесением в колбы, содержащие либо один антибиотик, либо пару бактерицидных и бактериостатических антибиотиков.Затем их инкубировали при 37 ° C при встряхивании и аэрации. Пробы отбирали с интервалом в 1 час в течение до 5 часов. Плотность клеток для каждого образца оценивали по количеству колоний путем разведения в фосфатно-солевом буфере и посева на агар LB. Каждый эксперимент с временным уничтожением проводили дважды.
Покадровая микроскопия. Конкретные детали микрофлюидной системы, используемой в этом исследовании, материнской машины, были описаны ранее (32). Вкратце, это устройство состоит из 4000 каналов для роста, расположенных под прямым углом к большой траншеи, через которую проходит питательная среда.Затем питательные вещества диффундируют в каналы и вымывают растущие клетки, когда они выходят из этих каналов. Автоматизированный столик микроскопа позволяет контролировать несколько полей зрения, охватывающих все устройство. Этот метод приводит к постоянному наблюдению за ростом и делением большого количества отдельных клеток, поскольку они находятся в различных средах, содержащих антибиотики, а также за их выживанием или смертью после удаления лекарства.
Эксперименты по покадровой микроскопии проводились следующим образом.Культуры E. coli MG1655 выращивали в течение ночи в бульоне LB при 37 ° C. На следующий день 100 мкл культуры разводили в 10 мл свежего предварительно нагретого бульона LB и затем инкубировали в течение 2 ч при 37 ° C при встряхивании. Восемь миллилитров полученной культуры центрифугировали при 10000 об / мин в течение 5-7 минут и ресуспендировали в 20 мкл свежего бульона LB; Затем в материнскую машину вводили 10 мкл клеточной суспензии, и эксперимент начинали, когда более 80% каналов были заполнены клетками посредством диффузии.Шприцевой насос использовали для пропускания свежего бульона LB с добавлением бычьего сывороточного альбумина (BSA) и ДНК спермы лосося через устройство со скоростью 2 мл / ч. BSA и ДНК спермы лосося являются блокирующими агентами, которые используются для связывания с поверхностью микрофлюидного устройства для предотвращения образования пузырьков воздуха и чрезмерного прилипания клеток к каналам. Изображения получали от 15 до 25 полей зрения с 6-минутными интервалами с использованием автоматического микроскопа Olympus BX81 с фазово-контрастной масляной линзой UPLFN100 × O2PH / 1.3.Образцы и микроскоп выдерживали при 37 ° C с помощью инкубационной системы «кубик и ящик» (Life Imaging Services, Райнах, Швейцария). По крайней мере, через 4 часа роста в бульоне LB среду заменяли на бульон LB, содержащий BSA, сперму лосося и один или два антибиотика. Клетки выдерживали в этой среде в течение не менее 20 часов, а затем снова переводили в свежий бульон LB с добавлением BSA и ДНК спермы лосося на срок до 10 часов. Каждый эксперимент включал непрерывное сканирование полей не менее 30 часов.
Затем полученные покадровые изображения были проанализированы с помощью специально разработанного плагина для ImageJ, чтобы предоставить информацию о размере клеток и скорости деления во время трех различных фаз эксперимента. Первый шаг анализа состоит в определении длины ячейки, примыкающей к концу канала. Увеличивающаяся длина растущей ячейки по последующим кадрам отслеживается и записывается; События деления также регистрируются в зависимости от длины ячейки. Ручная проверка и аннотации выполнялись после каждого эксперимента.Таким образом, мы смогли получить количественную информацию о скорости удлинения и деления отдельных клеток. Мы также отслеживали долю клеток, которые пережили воздействие лечения и смогли снова делиться после возвращения в среду, свободную от антибиотиков. Возникновение филаментации во время воздействия антибиотиков эритромицина и налидиксовой кислоты привело к вытягиванию удлиненных клеток из их каналов роста во время потока. По этой причине в анализе учитывались только каналы, содержащие клетки, за которыми можно было следить на протяжении всего эксперимента.
РЕЗУЛЬТАТЫ
Кривые «время-убийство». Для количественной оценки взаимодействий между антибиотиками в клинически значимых концентрациях мы измерили уровень смертности при уровнях ингибирующего лекарства на основе кривых «время-убил». Мы протестировали каждую возможную бактерицидно-бактериостатическую пару среди пяти антибиотиков в концентрациях выше МПК. Антибиотики, использованные в экспериментах по тайм-килю, были выбраны из-за их различных механизмов действия и потому, что, насколько нам известно, нет сообщений о мутациях перекрестной устойчивости к этим препаратам у E.coli.
В присутствии бактерицидного препарата, который сам по себе способен уничтожить бактериальную популяцию, добавление бактериостатического препарата привело к снижению показателей гибели и значительному количеству выживших в конце эксперимента (рис. 1). Мы также отметили, что степень антагонизма различалась в зависимости от бактерицидного препарата, использованного в эксперименте. Приобретение мутации устойчивости в ходе эксперимента с кривой «время-убийство» могло быть смешанным эффектом, объясняющим снижение уровня смертности, наблюдаемое в бактериальных культурах, обработанных парой бактерицидно-бактериостатический.Чтобы контролировать эту возможность, колонии, полученные в конце каждого эксперимента с кривой время-уничтожение, реплицируют на планшеты, содержащие антибиотик. Мы не нашли доказательств эволюции устойчивости к одному или нескольким лекарственным препаратам в какой-либо повторности к какому-либо из препаратов, использованных в эксперименте (данные не показаны). Эти кривые «время-уничтожение» подтверждают, что антагонистические взаимодействия, обнаруженные между лекарственными средствами при ингибирующих концентрациях, проявляются в виде снижения скорости уничтожения и присутствия значительной доли чувствительных бактерий в конце эксперимента.
Рис. 1Кривые «время-убило» для комбинаций одного и двух препаратов. На каждом графике показана кривая «время — убивает» для пары бактерицидно-бактериостатическое лекарство и составляющих отдельных лекарств. Планки погрешностей представляют собой стандартные ошибки среднего (на основе 3 независимых повторов) количества культивируемых клеток, измеренного в КОЕ / мл в каждый момент времени. Используемые концентрации антибиотиков составляли 25 мкг / мл налидиксовой кислоты (NAL), 25 мкг / мл стрептомицина (STR), 12,5 мкг / мл тетрациклина (TET), 200 мкг / мл эритромицина (ERY) и 10 мкг / мл триметоприма (TRM). .
Систематическое изучение взаимодействий между бактерицидными и бактериостатическими антибиотиками. Мы расширили наши наблюдения взаимодействий между лекарствами до 21 антибактериального соединения. Эти антибиотики охватывают широкий спектр механизмов действия, и многие из них широко используются в клинической практике. Их основные мишени включают синтез ДНК, трансляционный аппарат и клеточную стенку, фолиевую кислоту и биосинтез липидов (таблица 1). Мы систематически измеряли действие всех пар антибиотиков на E.coli K-12. В частности, для каждой пары антибиотиков мы объединили 6 различных концентраций агентов в двумерной матрице доз, при этом точки дозировки были сосредоточены на половине максимальной эффективной концентрации каждого антибиотика (EC 50 ). Мы использовали модель аддитивности Loewe для оценки взаимодействия между антибиотиками (33). В отличие от других моделей, эта модель измеряет лекарственные взаимодействия на основе отклонения от эталона «лекарство с самим собой». Согласно модели аддитивности Loewe, если механизмы действия двух препаратов одинаковы, они не взаимодействуют друг с другом.Линии равных эффективных доз (изобол) представлены в двумерном линейном пространстве концентраций двух препаратов. Отклонение этих линий от линейной модели указывает на синергизм (вогнутость) или антагонизм (выпуклость). Мы ввели несколько шагов коррекции, чтобы преодолеть потенциальные ошибки измерения из-за неоднородности пластины, а также разработали строгую статистическую основу для оценки значимости взаимодействий. Следуя ранее разработанному методу, мы количественно оценили формы изобол путем измерения вогнутости (с использованием баллов взаимодействия B ), где B = 0 указывает на независимые эффекты двух препаратов (линейность), а B <0 и B > 0 указывают на антагонизм и синергизм, соответственно (см. Материалы и методы).В этой работе мы сосредоточены на изучении свойств только антагонистических пар антибиотиков; синергизм будет изучен в другом месте.
Используя статистический критерий для определения значимых взаимодействий (см. Материалы и методы), мы обнаружили, что 61% из 204 пар антибиотиков проявили антагонизм. Достоверность наших результатов была подтверждена сравнением с предыдущим систематическим скринингом комбинации препаратов, проведенным на E. coli (22). Несмотря на существенные различия в протоколах и исходных предположениях моделей, использованных в двух исследованиях, оценки взаимодействия хорошо коррелировали (коэффициент Спирмена, 0.529; P <0,0001) и антагонистические пары, выявленные в предыдущем исследовании, как правило, имели особенно низкие оценки на нашем экране (тест Mann-Whitney U , P <0,0001). Кроме того, наше высокопроизводительное исследование правильно выявило хорошо изученный антагонизм между ципрофлоксацином и тетрациклином (34).
Распределение антагонизма на карте взаимодействий в высшей степени неслучайно. Мы сравнили баллы B для взаимодействия антибиотиков в двух группах, т.е.е. пары антибиотиков, нацеленные на одну и ту же или разные клеточные подсистемы. Сравнение показало, что баллы B были особенно низкими для пар антибиотиков, нацеленных на разные клеточные подсистемы (тест Манна-Уитни U , P <0,0001). В соответствии с ожиданиями модели Loewe пары антибиотиков, нацеленные на одну и ту же клеточную подсистему, редко проявляли сильный антагонизм.
Более поразительно то, что комбинации ингибиторов синтеза белка 30S и биосинтеза клеточной стенки, синтеза белка 50S и ингибиторов гиразы, а также ингибиторов биосинтеза клеточной стенки и синтеза фолиевой кислоты часто проявляли антагонизм ( P <0.05 для каждой комбинации, точный тест Фишера). Общим свойством этих комбинаций является то, что бактериостатическое соединение сочетается с бактерицидным агентом. Чтобы свести к минимуму вероятность ошибочной классификации, мы использовали только информацию, специфичную для E. coli, для бактерицидных / бактериостатических классификаций (таблица 1). Чтобы проверить в более общем плане, был ли антагонизм усилен бактериостатически-бактерицидными комбинациями, мы классифицировали пары антибиотиков в соответствии с их убивающими свойствами, что привело к трем основным группам, а именно: пары бактерицидно-бактерицидные, бактерицидно-бактериостатические и бактериостатико-бактериостатические.Поразительно, но мы обнаружили, что пары антибиотиков с исключительно низкими показателями взаимодействия B , обозначающими высокую степень антагонизма, почти всегда были бактерицидно-бактериостатическими ( P = 0,0016, точный тест Фишера) (рис. 2). Этот результат сохраняется после исключения пар антибиотиков с перекрывающимися клеточными мишенями ( P = 0,0059). Таким образом, наши данные позволяют предположить, что бактериостатические агенты противодействуют действию антибиотиков, действующих на растущие клетки. Этот вывод в целом согласуется с более ранними сообщениями, демонстрирующими, что ингибирование роста за счет ограничения питательных веществ часто снижает эффекты бактерицидных соединений (35, 36).
FIG 2Систематическое изучение взаимодействий между бактерицидными и бактериостатическими антибиотиками при субингибирующих концентрациях. (A) Тепловая карта, показывающая парные взаимодействия между 21 антибиотиком, систематически измеренные в E. coli. Антибиотики сгруппированы в соответствии с их механизмами действия, а цвета отражают баллы взаимодействия. Отрицательный и положительный баллы соответствуют антагонизму (синий) и синергизму (красный) соответственно согласно критериям аддитивности Loewe. Белый, данные отсутствуют. Аббревиатуры и концентрации антибиотиков см. В таблице 1.(B) График, показывающий, что комбинация бактериостатического (stat) антибиотика с бактерицидным (cid) антибиотиком имеет тенденцию проявлять сильный антагонизм. Пары антибиотиков были разделены на категории в соответствии с их индивидуальными убивающими свойствами, что привело к трем основным группам: бактерицидно-бактериостатические, бактериостатические-бактериостатические и бактерицидно-бактерицидные. Пары антибиотиков с оценкой взаимодействия ( B ) ниже, чем -1 (т. Е. Те, которые демонстрируют сильный антагонизм), имели значительно большую вероятность попадания в бактерицидно-бактериостатическую категорию, чем остальные пары антибиотиков ( P = 0.0016, точный тест Фишера).
Сравнение рисунков 1 и 2 также показывает, что антагонистические лекарственные взаимодействия, наблюдаемые за пределами уровней МПК, не всегда проявляются при субингибирующих концентрациях. В будущих исследованиях следует систематически изучать механизмы, лежащие в основе таких различий во взаимодействии лекарств.
Монотерапия и комбинированная терапия с точки зрения отдельных клеток. Наша гипотеза, а именно, что бактериостатические препараты противодействуют бактерицидным лекарствам, не зависит от индивидуальных молекулярных механизмов действия лекарств, но зависит от воздействия антибиотиков на рост динамика одиночных ячеек.Поэтому мы воспроизвели условия наших кривых «время-убийство» в микрофлюидном устройстве с целью прямого наблюдения за эффектами различных пар антагонистических препаратов на отдельные клетки. Мы сосредоточились на понимании различий во влиянии на удлинение и деление клеток двух бактериостатических препаратов, которые связываются с разными рибосомными мишенями, то есть эритромицином и тетрациклином, с бактерицидным препаратом налидиксовой кислотой.
Используя устройство, предназначенное для отслеживания удлинения и деления сотен отдельных клеток в течение длительного периода (32), мы начали с выращивания E.coli в богатой среде без антибиотиков в течение как минимум 4 ч, чтобы определить базовую скорость этих клеточных процессов. После этого следовало воздействие одного препарата или пар препаратов в течение не менее 16 часов. Затем среду снова переключали на бульон, не содержащий лекарств, еще как минимум на четыре часа.
Путем анализа полученных покадровых изображений мы получили количественную информацию о скорости удлинения и деления отдельных клеток, когда они подвергались воздействию различных антибиотиков по отдельности или в антагонистических парах.Кроме того, мы отслеживали судьбу сотен клеток из каждого состояния, чтобы оценить жизнеспособность после изъятия среды, содержащей антибиотики. Хотя каждая клетка, подвергшаяся воздействию бактерицидных препаратов, либо была лизирована, либо не возобновила рост к концу эксперимента, от 30% до более 80% отдельных клеток, обработанных парами бактерицидно-бактериостатических препаратов, сохранили клеточную целостность и возобновили деление после замена среды без антибиотиков (см. Таблицу S1 в дополнительном материале).
Мы выбрали не менее 20 отдельных ячеек для каждого условия для подробного анализа с использованием специального программного обеспечения. Мы измерили скорость удлинения каждой отдельной клетки, количество удвоений длины клетки в час и скорость деления (количество делений в час). На рисунке 3 показаны длины ячеек для каждого условия на протяжении всего эксперимента. Графики показывают качественные различия в клеточных ответах на разные виды лечения антибиотиками. Наши покадровые изображения выявили противоположные реакции на бактериостатические препараты тетрациклин и эритромицин.Как сообщалось ранее, мы обнаружили, что воздействие тетрациклина снижает удлинение клеток и снижает скорость деления клеток (24). Однако эритромицин снижал только скорость деления, в результате чего нитчатые клетки продолжали делиться. Максимальная длина, изображенная на наших графиках, была ограничена длиной канала роста в микрофлюидном устройстве, и поэтому мы не могли измерить фактический размер индуцированных антибиотиком нитей.
Рис. 3Графики длительности и времени для отдельных клеток до, во время и после воздействия антибиотика.По крайней мере, 20 отдельных клеток на лечение антибиотиком были отобраны для анализа с использованием специального программного обеспечения; результаты каждого лечения были сопоставлены на одном графике, где каждая линия представляла длину одной клетки во времени. Отклонения этих линий вверх означают увеличение длины, а резкие отклонения вниз указывают на разделение. Заштрихованный участок на каждом графике обозначает период, в течение которого использовалась среда, содержащая антибиотик. Линии, которые резко заканчиваются, указывают на лизис наблюдаемой клетки.Анализ популяции, подвергшейся воздействию только эритромицина, был проблематичным из-за образования длинных нитчатых клеток, которые вытягивались из их каналов роста, когда среда протекала через первичный желоб устройства; это уменьшило количество клеток, доступных для наблюдения за весь эксперимент. Кроме того, в панели эритромицина большие колебания длины клеток указывают на увеличенный размер, до которого эти клетки вырастают, а также на продолжение событий деления.Используемые концентрации антибиотиков составляли 25 мкг / мл налидиксовой кислоты, 25 мкг / мл стрептомицина, 12,5 мкг / мл тетрациклина, 200 мкг / мл эритромицина и 10 мкг / мл триметоприма. (A) Клетки, обработанные бактерицидным лекарственным средством налидиксовой кислотой, либо были лизированы, либо никогда не было обнаружено возобновления деления даже после того, как среда была заменена на бульон, не содержащий лекарственного средства. (B) Тетрациклин снижает удлинение и полностью предотвращает деление во время воздействия антибиотиков, в то время как эритромицин только снижает скорость деления; это привело к появлению нитчатых клеток, которые все еще были способны делиться, хотя и с меньшей скоростью, чем клетки, выращенные в бульоне без лекарств.(C) Комбинация налидиксовой кислоты и тетрациклина дала динамику роста, аналогичную той, которая наблюдалась с одним тетрациклином. Однако эритромицин и налидиксовая кислота вызывали филаментацию и значительно снижали деление. Оба условия привели к появлению большого количества клеток, которые, как было обнаружено, возобновили рост после возвращения в бульон без лекарств.
Чтобы определить, может ли сильное уменьшение удлинения и деления, наблюдаемое с тетрациклином, аналогичным образом противодействовать другому бактерицидному антибиотику с несвязанным механизмом действия, мы также объединили тетрациклин с бактерицидным антибиотиком стрептомицином и повторили анализ.Результирующая динамика роста изображена на рис. S1 в дополнительном материале.
Помимо отслеживания скорости удлинения клеток в выбранных условиях, мы извлекли скорости деления отдельных клеток, когда они были подвергнуты воздействию различных сред, содержащих антибиотики. На рис. 4 мы представляем распределения скорости деления и скорости удлинения (как удвоение длины клеток в час) для каждой популяции в течение периода воздействия антибиотиков. Застой в делении и удлинении клеток наблюдался для отдельных клеток, подвергшихся воздействию бактериостатического антибиотика тетрациклина.Напротив, лечение бактериостатическим лекарственным средством эритромицином привело к снижению скорости удлинения и уменьшению, но не полностью ограничению скорости деления. Это привело к образованию нитчатых клеток, которые все еще были способны делиться, хотя и с меньшей скоростью, чем клетки, выращенные в отсутствие лекарства.
FIG 4Влияние отдельных и парных антибиотиков на деление и удлинение клеток. Мы извлекли скорости деления (A) и удлинения (удвоения длины клеток в час) (B) из каждой из отдельных клеток, включенных в наш подробный анализ, и мы представляем распределение этих показателей в виде прямоугольных диаграмм.Нормы для условий бульона LB без антибиотиков были рассчитаны путем объединения скоростей деления и удлинения для каждой отдельной клетки во всех условиях до воздействия лекарственного средства. Отрицательные скорости удлинения происходят от нитчатых клеток, которые делятся несколько раз без удлинения между событиями деления. Ящики охватывают диапазон между верхним и нижним квартилями. Толстые линии, медианы; усы, максимальное и минимальное значения все еще в пределах 1,5 межквартильных диапазонов верхнего и нижнего квартилей, соответственно; ○, точки данных за пределами этого диапазона.
Различия в клеточных ответах, наблюдаемые при исследовании клеток, подвергшихся воздействию бактериостатических препаратов, распространялись на результаты для пар антагонистических препаратов. Клетки, обработанные тетрациклином и любым из бактерицидных препаратов, демонстрировали значительно сниженную скорость роста и прекращали деление до тех пор, пока антибиотики не были отменены, в то время как эритромицин в сочетании с бактерицидным препаратом останавливал деление клеток, в результате чего образовывались длинные нитчатые клетки, которые продолжали деление только после замены препарата. свободная среда.Таким образом, наши эксперименты с покадровой микроскопией выявили противоположные реакции бактерий, подвергшихся воздействию лекарств, принадлежащих к тому же фармакодинамическому классу. Эти разные ответы распространялись на лечение разными парами антагонистических препаратов.
ОБСУЖДЕНИЕ
Уместность классификации антибиотиков как бактериостатических или бактерицидных была поставлена под сомнение из-за зависимости этих категорий от концентраций лекарств и обработанных организмов (37). То, как эти фармакодинамические свойства используются в конкретных клинических сценариях, выходит за рамки данной статьи.Вместо этого мы предполагаем, что эта бинарная классификация является полезным начальным шагом для определения того, когда два препарата в комбинации могут привести к сильному антагонизму и, следовательно, должны быть оценены, чтобы использовать различные эффекты этого конкретного взаимодействия.
Тесты, установленные Институтом клинических и лабораторных стандартов (31) для определения того, является ли антибиотик бактериостатическим или бактерицидным, включают оценку степени выживаемости жидкой культуры бактерий после определенного периода воздействия лекарственного средства.Таким образом, умеренный эффект уничтожения, который определяет бактериостатический агент, подразумевает индукцию клеточного стаза. Здесь мы показываем, что, хотя бактериостатические препараты приводят к преобладающим паттернам антагонистических взаимодействий с бактерицидными препаратами, их эффекты на одноклеточном уровне могут значительно различаться. Мы обнаружили, что тетрациклин эффективно индуцирует застой у чувствительных к антибиотикам бактерий. Напротив, обработка эритромицином снижает скорость удлинения до такой же степени, как и тетрациклин, в то время как скорость деления не так сильно снижается; это привело к образованию длинных нитчатых клеток.
Различия в динамике роста с аналогичными антагонистическими комбинациями антибиотиков (рис. 3C) предполагают, что разные клеточные механизмы лежат в основе увеличения выживаемости при использовании этих пар препаратов. Однако результаты нашего анализа покадровых изображений предлагают новый взгляд на то, как и когда клетки могут избежать уничтожения антибиотиками. Этот метод позволил исследовать рост клеток как отдельные скорости удлинения и деления (рис. 4). Подобное снижение скорости деления, производимое различными парами бактериостатических-бактерицидных препаратов, могло быть основой антагонизма.Что касается морфологических эффектов, которые мы количественно оценили, другие антибиотики способны вызывать изменения в форме клеток. Например, члены класса бета-лактамов вызывают лизис клеток посредством процесса, опосредованного выпуклостью, при котором цитозоль просачивается наружу через дефекты, образующиеся в слое пептидогликана (38). В будущих исследованиях следует рассмотреть, способны ли такие структурные эффекты модулировать скорость деления клеток и, следовательно, могут ли они вызывать антагонизм.
В дополнительном исследовании было обнаружено, что отдельный элемент бактериальной физиологии играет важную роль в уничтожении антибиотиками.Эллисон и его коллеги отделили метаболическую активность от роста как фактор, который потенцирует уничтожение спящих клеток аминогликозидами (39). Определение условий, которые влияют на определенные аспекты физиологии клетки, такие как повышение метаболической активности или ингибирование деления, может иметь важное значение для разработки новых антибиотиков или повышения эффективности имеющихся в настоящее время лекарств.
Наши результаты требуют осторожности перед формированием общих предположений относительно эффектов взаимодействия лекарственных средств.Хотя наши исследования бактериостатических и бактерицидных препаратов выявляют повсеместный антагонизм в отношении показателей роста и смертности, наблюдаемое нами разнообразие морфологических реакций может приводить к эффектам приспособляемости, специфичным для комбинации антибиотиков. Кроме того, система классификации бактериостатических / бактерицидных свойств различается для разных организмов и даже для разных концентраций лекарств, и взаимодействия между лекарствами могут аналогичным образом изменяться. Оценка взаимодействия in vitro и лекарственных средств в широком диапазоне концентраций может служить ориентиром для исследований in vivo , где такие переменные, как скорость всасывания, скорость выведения и режимы дозирования, могут приводить к колебаниям концентраций (6).Кроме того, другие переменные, присущие среде in vivo , такие как изменения pH в компартментах тела, могут привести к изменениям во взаимодействии лекарств, которые невозможно предсказать в экспериментах in vitro .
Комбинированная антибиотикотерапия остается важным вариантом стратегии лечения, направленной на сдерживание роста резистентности. По мере приближения к этой цели динамика отдельных клеток, которую мы наблюдали с различными парами антагонистических лекарств, показывает, что более тщательное изучение эффектов антибиотиков на отдельные компоненты бактериальной физиологии поможет нам понять и использовать комбинации лекарств для большего числа бактериальных инфекций.
БЛАГОДАРНОСТИ
Мы благодарим Иму Авалос Вискарру за помощь с микрофлюидикой, а также Рафаэля Пена-Миллера и Роба Бирдмора за разработку программного обеспечения для анализа изображений, которое мы использовали.
V.L., B.P., and C.P. благодарим Wellcome Trust, программу Lendulet Венгерской академии наук и Европейский исследовательский совет за их поддержку. С. был поддержан Европейским исследовательским советом в рамках 7-й рамочной программы Европейской комиссии (соглашение о гранте 268540).P.A.Z.W. получил финансирование от Швейцарского национального научного фонда и Немецкой службы академических обменов. М. Арнольдини и М. Акерманн получили финансирование от Швейцарского национального научного фонда.
- Авторские права © 2014, Американское общество микробиологии. Все права защищены.
Обзор антимикробной терапии | Безграничная микробиология
Происхождение противомикробных препаратов
Эпоха противомикробных препаратов начинается, когда Пастер и Жубер открывают, что один тип бактерий может предотвратить рост другого.
Цели обучения
Напомнить техническое определение антибиотиков
Основные выводы
Ключевые моменты
- Антибиотики — это только те вещества, которые производятся одним микроорганизмом, которые убивают или предотвращают рост другого микроорганизма.
- В современном обиходе термин «антибиотик» используется для обозначения практически любого лекарства, которое пытается избавить ваш организм от бактериальной инфекции.
- Открытие противомикробных препаратов, таких как пенициллин и тетрациклин, проложило путь к улучшению здоровья миллионов людей во всем мире.
Ключевые термины
- противомикробный : агент, который уничтожает микробы, подавляет их рост или предотвращает или противодействует их патогенному действию.
- пенициллин : любой из группы антибиотиков широкого спектра действия, полученных из плесневых грибов Penicillium или синтезированных; они имеют бета-лактамную структуру; большинство из них активны в отношении грамположительных бактерий и используются при лечении различных инфекций и заболеваний.
История противомикробных препаратов начинается с наблюдений Пастера и Коха, которые обнаружили, что один тип бактерий может препятствовать росту другого.В то время они не знали, что причина того, что одна бактерия не может расти, заключалась в том, что другая бактерия вырабатывала антибиотик. Технически антибиотики — это только те вещества, которые производятся одним микроорганизмом, которые убивают или предотвращают рост другого микроорганизма.
Александр Флеминг : В 1928 году Александр Флеминг наблюдал антибиотик против бактерий, вызываемый грибами рода Penicillium, и предположил, что его действие опосредовано антибактериальным соединением, пенициллином, и что его антибактериальные свойства могут быть использованы для химиотерапии.
Открытие Александром Флемингом таких противомикробных препаратов, как пенициллин и тетрациклин, проложило путь к улучшению здоровья миллионов людей во всем мире. До того, как в начале 1940-х годов пенициллин стал эффективным лекарством, не существовало настоящего лекарства от гонореи, ангины или пневмонии. Пациентам с инфицированными ранами часто приходилось удалять раненую конечность, или им грозила смерть от инфекции. Теперь большинство этих инфекций можно легко вылечить коротким курсом противомикробных препаратов.
Термин «антибиотик» впервые был использован в 1942 году Селманом Ваксманом и его сотрудниками в журнальных статьях для описания любого вещества, вырабатываемого микроорганизмом, которое антагонистично росту других микроорганизмов в высоком разведении.Это определение исключало вещества, которые убивают бактерии, но не производятся микроорганизмами (например, желудочный сок и перекись водорода). Также исключены синтетические антибактериальные соединения, такие как сульфаниламиды. Многие антибактериальные соединения представляют собой относительно небольшие молекулы с молекулярной массой менее 2000 атомных единиц массы. С развитием медицинской химии большинство современных антибактериальных средств химически представляют собой полусинтетические модификации различных природных соединений.
Antibiotic Discovery
Наблюдения за антибиотиками между микроорганизмами привели к открытию естественных антибактериальных средств, продуцируемых микроорганизмами.
Цели обучения
Опишите понятие «антибиоз» и вклад различных ученых, открывших его.
Основные выводы
Ключевые моменты
- До начала 20 века лечение инфекций основывалось в основном на медицинском фольклоре.
- Луи Пастер заметил: «Если бы мы могли вмешаться в антагонизм, наблюдаемый между некоторыми бактериями, это, возможно, возложило бы самые большие надежды на терапию».
- Термин «антибиотик», означающий «против жизни», был введен французским бактериологом Вюйлеменом как описательное название явления, проявляемого этими ранними антибактериальными препаратами.
Ключевые термины
- микроорганизм : микроорганизм (от греческого: μ, mikrós, «маленький» и ὀ, организм — s, «организм»; также пишется микроорганизм, микроорганизм или микроорганизм) или микроб — это микроскопический организм, который включает либо одиночная клетка (одноклеточная), либо скопления клеток, либо многоклеточные относительно сложные организмы.
- химиотерапия : любое химическое лечение, предназначенное для лечения болезненного состояния.
- инфекция : неконтролируемый рост вредных микроорганизмов в организме хозяина.
До начала 20-го, -го, -го века методы лечения инфекций основывались в основном на медицинском фольклоре. Смеси с антимикробными свойствами, которые использовались для лечения инфекций, были описаны более 2000 лет назад. Многие древние культуры, в том числе древние египтяне и древние греки, использовали специально подобранные плесневые и растительные материалы и экстракты для лечения инфекций.Более поздние лабораторные наблюдения антибиотиков между микроорганизмами привели к открытию естественных антибактериальных средств, продуцируемых микроорганизмами.
Луи Пастер заметил: «Если бы мы могли вмешаться в антагонизм, наблюдаемый между некоторыми бактериями, это, возможно, возложило бы самые большие надежды на терапию». Термин «антибиоз», означающий «против жизни», был введен французским бактериологом Вюйлеменом как описательное название явления, проявляемого этими ранними антибактериальными препаратами.Впервые антибиотик был описан в 1877 году у бактерий, когда Луи Пастер и Роберт Кох обнаружили, что воздушно-капельная палочка может подавлять рост Bacillus anthracis. Эти препараты были позже переименованы в антибиотики американским микробиологом Селманом Ваксманом в 1942 году.
Луи Пастер : Луи Пастер был французским микробиологом и химиком, наиболее известным своими экспериментами в поддержку теории микробов о болезни и своими вакцинациями, в первую очередь первой вакциной против бешенства.
Джон Тиндалл впервые описал антагонистическую активность грибов против бактерий в Англии в 1875 году. Химиотерапия синтетическими антибиотиками как наука и разработка антибактериальных препаратов началась в Германии с Полом Эрлихом в конце 1880-х годов. Эрлих отметил, что одни красители окрашивают клетки человека, животных или бактерий, а другие — нет. Затем он предложил идею создания химических веществ, которые действовали бы как селективное лекарство, которое могло бы связываться с бактериями и убивать их, не причиняя вреда человеческому хозяину.Проведя скрининг сотен красителей против различных организмов, он обнаружил лечебно-полезный препарат, синтетический антибактериальный сальварсан, который теперь называется арсфенамином. В 1895 году Винченцо Тиберио, врач Неаполитанского университета, обнаружил, что плесень (Penicillium) в колодце с водой обладает антибактериальным действием. После того, как это первоначальное химиотерапевтическое соединение оказалось эффективным, другие исследователи продолжили аналогичные исследования, но только в 1928 году Александр Флеминг обнаружил антибиотик против бактерий, вызываемый грибами рода Penicillium.Флеминг постулировал, что эффект был опосредован антибактериальным соединением под названием пенициллин, и что его антибактериальные свойства могут быть использованы для химиотерапии. Первоначально он охарактеризовал некоторые из его биологических свойств, но не стал заниматься его дальнейшим развитием.
Антибиотики и избирательная токсичность
Антибиотики способны избирательно воздействовать на определенные типы бактерий, не нанося вреда инфицированному хозяину.
Цели обучения
Опишите избирательную токсичность
Основные выводы
Ключевые моменты
- Их механизм действия, химическая структура или спектр действия — это способы классификации антибиотиков.
- Антибиотики широкого спектра действия воздействуют на широкий спектр бактерий, в то время как антибиотики узкого спектра действия способны воздействовать на определенные типы.
- Антибиотики должны пройти процесс скрининга, в ходе которого они выделяются, культивируются, а затем тестируются на производство диффундирующих продуктов, подавляющих рост определенных тест-организмов.
- Из-за потенциальных побочных эффектов антибиотики также необходимо проверять на их избирательную токсичность.
Ключевые термины
- антибактериальный : Лекарственное средство, убивающее или подавляющее бактерии.
- бактерицидный : средство, убивающее бактерии.
- бактериостатический : препарат, который предотвращает рост и размножение бактерий, но не обязательно убивает их. Когда его удаляют из окружающей среды, бактерии снова начинают расти.
Избирательная токсичность антибиотиков
Химиотерапия синтетическими антибиотиками как наука и разработка антибактериальных средств началась в Германии с Полом Эрлихом в конце 1880-х годов. Эрлих отметил, что одни красители окрашивают клетки человека, животных или бактерий, а другие — нет.Затем он предложил идею создания химических веществ, которые действовали бы как селективное лекарство, которое могло бы связываться с бактериями и убивать их, не причиняя вреда человеческому хозяину. Проведя скрининг сотен красителей против различных организмов, он обнаружил лечебно-полезный препарат, синтетический антибактериальный сальварсан, который теперь называется арсфенамином.
Антибиотики обычно классифицируются на основе их механизма действия, химической структуры или спектра действия. Более конкретно, антибиотики узкого спектра действия нацелены на определенные типы бактерий, такие как грамотрицательные или грамположительные бактерии, тогда как антибиотики широкого спектра действия влияют на широкий спектр бактерий.После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническую практику были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Бактериальные культуры : При производстве антибактериальных препаратов микроорганизмы необходимо изолировать, культивировать и тестировать на ингибирование роста организмов-мишеней и на их избирательную токсичность.
Некоторые антибактериальные препараты вызывают ряд побочных эффектов.Побочные эффекты варьируются от легких до очень серьезных в зависимости от используемых антибиотиков, целевых микробных организмов и конкретного пациента. Профили безопасности новых лекарств часто не так хорошо установлены, как для тех, которые давно используются. Побочные эффекты варьируются от лихорадки и тошноты до серьезных аллергических реакций, включая фотодерматит и анафилаксию. Общие побочные эффекты включают диарею, возникающую в результате нарушения видового состава кишечной флоры, что приводит, например, к чрезмерному росту патогенных бактерий, таких как Clostridium difficile .Антибактериальные препараты также могут влиять на флору влагалища и могут привести к чрезмерному росту дрожжевых грибов рода Candida в вульвовагинальной области. Дополнительные побочные эффекты могут возникать в результате взаимодействия с другими лекарствами, например, повышенный риск повреждения сухожилий при введении хинолонового антибиотика с системным кортикостероидом.
Антибактериальное производство
Несмотря на широкий спектр известных антибиотиков, менее 1% противомикробных агентов имеют медицинскую или коммерческую ценность.Например, в то время как пенициллин имеет высокий терапевтический индекс, поскольку он обычно не влияет на клетки человека, для многих антибиотиков это не так. Другие антибиотики просто не имеют преимуществ перед уже применяемыми или не имеют другого практического применения. Полезные антибиотики часто обнаруживаются в процессе скрининга. Для проведения такого скрининга изоляты многих различных микроорганизмов культивируются, а затем тестируются на производство диффундирующих продуктов, которые подавляют рост тестируемых организмов. Большинство антибиотиков, выявленных при таком скрининге, уже известны, поэтому их нельзя принимать во внимание.Остальные должны быть проверены на их избирательную токсичность и терапевтическую активность, а лучшие кандидаты могут быть исследованы и, возможно, модифицированы. Более современная версия этого подхода — программа рационального проектирования. Это включает в себя скрининг, направленный на поиск новых натуральных продуктов, которые ингибируют конкретную мишень, например фермент, обнаруживаемый только в целевом патогене, а не тесты, демонстрирующие общее ингибирование культуры.
Спектр антимикробной активности
Спектр антибиотиков может быть широким или узким.
Цели обучения
Сравните антибиотики узкого и широкого спектра действия
Основные выводы
Ключевые моменты
- Антибиотики широкого спектра действия действуют против большей группы бактерий.
- Антибиотики узкого спектра нацелены на специфические бактерии, такие как грамположительные или грамотрицательные.
- В клиническое использование введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Ключевые термины
- Окрашивание по Граму : метод дифференциации видов бактерий на две большие группы (грамположительные и грамотрицательные).
- Антибиотик узкого спектра действия : Тип антибиотика, который нацелен на определенные типы грамположительных или грамотрицательных бактерий.
- Антибиотик широкого спектра действия : Тип антибиотика, который может поражать широкий спектр бактерий.
Спектр бактерий, на которые воздействует антибиотик, можно разделить на узкий и широкий спектр.Антибиотики узкого спектра действия действуют против ограниченной группы бактерий, грамположительных или грамотрицательных, например фузидат натрия действует только против стафилококковых бактерий. Широкий спектр действия — антибиотики действуют против грамположительных и грамотрицательных бактерий, например амоксициллина.
Окрашивание по Граму (или метод Грама; это метод разделения видов бактерий на две большие группы (грамположительные и грамотрицательные). Он основан на химических и физических свойствах их клеточных стенок.В первую очередь, он обнаруживает пептидогликан, который присутствует в толстом слое у грамположительных бактерий. Грамположительный результат дает пурпурный / синий цвет, а грамотрицательный — розовый / красный цвет. Окрашивание по Граму почти всегда является первым шагом в идентификации бактериального организма и является окрашиванием по умолчанию, выполняемым лабораториями над образцом, когда не указывается конкретная культура. Хотя окрашивание по Граму является ценным диагностическим инструментом как в клинических, так и в исследовательских целях, не все бактерии могут быть окончательно классифицированы с помощью этого метода, что позволяет сформировать группы с грамм-переменной и грамм-неопределенной группой.
Окраска по Граму : Это микроскопическое изображение окрашивания по Граму смешанных грамположительных кокков ( Staphylococcus aureus , фиолетовый) и грамотрицательных бацилл ( Escherichia coli , красный).
Антибиотик широкого спектра действия действует как против грамположительных, так и грамотрицательных бактерий, в отличие от антибиотика узкого спектра действия, который эффективен против определенных семейств бактерий. Примером широко применяемого антибиотика широкого спектра действия является ампициллин.Антибиотики широкого спектра действия должным образом используются в следующих медицинских ситуациях: эмпирически (т. Е. На основе опыта практикующего врача), до формальной идентификации бактерий-возбудителей и когда существует широкий спектр возможных заболеваний и потенциально серьезное заболевание. результат, если лечение откладывается. Это происходит, например, при менингите, когда пациент может смертельно заболеть в течение нескольких часов, если не начать лечение антибиотиками широкого спектра действия. Антибиотики широкого спектра действия также используются для лекарственно-устойчивых бактерий, которые не реагируют на другие антибиотики более узкого спектра действия, а также в случае суперинфекций, когда существует несколько типов бактерий, вызывающих заболевание, что требует применения либо антибиотика широкого спектра действия, либо комбинированной антибиотикотерапии. .
После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническое использование были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид). .
Классификация антибиотиков
Бактерицидные антибиотики убивают бактерии; бактериостатические антибиотики замедляют их рост или размножение.
Цели обучения
Сравните два класса антибиотиков: бактерицидные и бактериостатические антибиотики
Основные выводы
Ключевые моменты
- Бактерицидные антитела подавляют синтез клеточной стенки.
- Бактериостатические антибиотики ограничивают рост бактерий, препятствуя производству бактериального белка, репликации ДНК или другим аспектам метаболизма бактериальных клеток.
- Бактериостатические антибиотики должны работать вместе с иммунной системой, чтобы удалить микроорганизмы из организма.
Ключевые термины
- бактерицидный : средство, убивающее бактерии.
- бактериостатический : препарат, который предотвращает рост и размножение бактерий, но не обязательно убивает их.Когда его удаляют из окружающей среды, бактерии снова начинают расти.
Антибиотики можно разделить на два класса по механизму действия. Бактерицидные антибиотики убивают бактерии; бактериостатические антибиотики подавляют их рост или размножение.
Одним из способов уничтожения бактерий бактерицидными антителами является подавление синтеза клеточной стенки. Примеры включают бета-лактамные антибиотики (производные пенициллина (пенамы), цефалоспорины (цефемы), монобактамы и карбапенемы) и ванкомицин.Другие способы, которыми бактерицидные антибиотики убивают бактерии, включают ингибирование бактериальных ферментов или трансляцию белка. Другие бактерицидные агенты включают даптомицин, фторхинолоны, метронидазол, нитрофурантоин, ко-тримоксазол и телитромицин. Аминогликозидные антибиотики обычно считаются бактерицидными, хотя они могут оказывать бактериостатическое действие на некоторые организмы. МБК (минимальная бактерицидная концентрация) — это минимальная концентрация лекарственного средства, которая может убить 99,99% населения.
Механизм ингибирования пенициллина : Пенициллин и большинство других β-лактамных антибиотиков действуют путем ингибирования пенициллин-связывающих белков, которые обычно катализируют сшивание стенок бактериальных клеток.
Бактериостатические антибиотики ограничивают рост бактерий, препятствуя производству бактериального белка, репликации ДНК или другим аспектам метаболизма бактериальных клеток. В эту группу входят: тетрациклины, сульфаниламиды, спектиномицин, триметоприм, хлорамфеникол, макролиды и линкозамиды. Они должны работать вместе с иммунной системой, чтобы удалить микроорганизмы из организма. Однако не всегда существует четкое различие между ними и бактерицидными антибиотиками. Некоторые бактериостатические агенты в высоких концентрациях также обладают бактерицидным действием.МИК (минимальная ингибирующая концентрация) — это минимальная концентрация лекарственного средства, которая может подавлять рост микроорганизма.
Структура тетрациклина : Тетрациклиновые антибиотики являются ингибиторами синтеза белка, ингибируя связывание аминоацил-тРНК с комплексом мРНК-рибосома. Они делают это в основном за счет связывания с 30S субъединицей рибосомы в комплексе трансляции мРНК.
Дальнейшая категоризация основана на их целевой специфичности. Антибактериальные антибиотики «узкого спектра» нацелены на определенные типы бактерий, такие как грамотрицательные или грамположительные бактерии, тогда как антибиотики широкого спектра действия воздействуют на широкий спектр бактерий, обычно как грамположительные, так и грамотрицательные клетки.После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническую практику были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
7.1.5: Классификации антибиотиков — Biology LibreTexts
- Последнее обновление
- Сохранить как PDF
- Ключевые моменты
- Ключевые слова
ЦЕЛИ ОБУЧЕНИЯ
Сравните два класса антибиотиков: бактерицидный и бактериостатический антибиотик
Антибиотики можно разделить на два класса по механизму действия.Бактерицидные антибиотики убивают бактерии; бактериостатические антибиотики подавляют их рост или размножение.
Одним из способов уничтожения бактерий бактерицидными антителами является подавление синтеза клеточной стенки. Примеры включают бета-лактамные антибиотики (производные пенициллина (пенамы), цефалоспорины (цефемы), монобактамы и карбапенемы) и ванкомицин. Другие способы, которыми бактерицидные антибиотики убивают бактерии, включают ингибирование бактериальных ферментов или трансляцию белка. Другие бактерицидные агенты включают даптомицин, фторхинолоны, метронидазол, нитрофурантоин, ко-тримоксазол и телитромицин.Аминогликозидные антибиотики обычно считаются бактерицидными, хотя они могут оказывать бактериостатическое действие на некоторые организмы. МБК (минимальная бактерицидная концентрация) — это минимальная концентрация лекарственного средства, которая может убить 99,99% населения.
Рисунок: Механизм ингибирования пенициллина : Пенициллин и большинство других β-лактамных антибиотиков действуют путем ингибирования пенициллин-связывающих белков, которые обычно катализируют сшивание стенок бактериальных клеток.Бактериостатические антибиотики ограничивают рост бактерий, препятствуя производству бактериального белка, репликации ДНК или другим аспектам метаболизма бактериальных клеток.В эту группу входят: тетрациклины, сульфаниламиды, спектиномицин, триметоприм, хлорамфеникол, макролиды и линкозамиды. Они должны работать вместе с иммунной системой, чтобы удалить микроорганизмы из организма. Однако не всегда существует четкое различие между ними и бактерицидными антибиотиками. Некоторые бактериостатические агенты в высоких концентрациях также обладают бактерицидным действием. МИК (минимальная ингибирующая концентрация) — это минимальная концентрация лекарственного средства, которая может подавлять рост микроорганизма.
Рисунок: Структура тетрациклина : Тетрациклиновые антибиотики являются ингибиторами синтеза белка, ингибируя связывание аминоацил-тРНК с комплексом мРНК-рибосома. Они делают это в основном за счет связывания с 30S субъединицей рибосомы в комплексе трансляции мРНК.Дальнейшая категоризация основана на их целевой специфичности. Антибактериальные антибиотики «узкого спектра» нацелены на определенные типы бактерий, такие как грамотрицательные или грамположительные бактерии, тогда как антибиотики широкого спектра действия воздействуют на широкий спектр бактерий, обычно как грамположительные, так и грамотрицательные клетки.После 40-летнего перерыва в открытии новых классов антибактериальных соединений в клиническую практику были введены три новых класса антибактериальных антибиотиков: циклические липопептиды (такие как даптомицин), глицилциклины (такие как тигециклин) и оксазолидиноны (такие как линезолид).
Ключевые моменты
- Бактерицидные антитела подавляют синтез клеточной стенки.
- Бактериостатические антибиотики ограничивают рост бактерий, препятствуя производству бактериального белка, репликации ДНК или другим аспектам метаболизма бактериальных клеток.
- Бактериостатические антибиотики должны работать вместе с иммунной системой, чтобы удалить микроорганизмы из организма.
Ключевые термины
- бактерицидный : средство, убивающее бактерии.
- бактериостатический : препарат, который предотвращает рост и размножение бактерий, но не обязательно убивает их. Когда его удаляют из окружающей среды, бактерии снова начинают расти.
ЛИЦЕНЗИИ И АТРИБУЦИИ
CC ЛИЦЕНЗИОННЫЙ КОНТЕНТ, ПРЕДЫДУЩИЙ РАЗДЕЛ
- Курирование и проверка. Предоставлено : Boundless.com. Лицензия : CC BY-SA: Attribution-ShareAlike
CC ЛИЦЕНЗИОННОЕ СОДЕРЖАНИЕ, СПЕЦИАЛЬНАЯ АТРИБУЦИЯ
Убийство бактерий Vs. Препараты, ингибирующие бактерии, при лечении инфекций — ScienceDaily
При лечении инфекции врачи могут столкнуться с выбором между использованием бактерицидного (убивающего бактерии) препарата, бактериостатического (подавляющего бактерии) препарата или их комбинации.Решение не всегда очевидно, особенно потому, что лекарство, обладающее бактерицидным действием в отношении одного штамма бактерий, может только подавлять рост другого штамма, согласно статье в выпуске журнала Clinical Infectious Diseases от 1 ноября, который теперь доступен в Интернете.
Хотя может показаться логичным, что бактерицидные препараты предпочтительнее бактериостатических, тип инфекции важен для определения того, какое лекарство использовать. Эндокардит лучше всего лечить бактерицидными препаратами.Менингит — еще один кандидат на применение бактерицидных препаратов. Поразительно, что бактериостатический препарат может противодействовать действию бактерицидного препарата при лечении менингита. Исследования показали, что при лечении инфекций мочевыводящих путей и профилактике стафилококковых раневых инфекций бактериостатические препараты действуют так же, как и бактерицидные.
При инфекциях центральной нервной системы быстрое бактерицидное лекарство может выделять бактериальные продукты, которые стимулируют воспаление. По этой причине рекомендуется назначать кортикостероиды одновременно с бактерицидным антибиотиком при бактериальном менингите.Некоторые бактериостатические препараты могут быть предпочтительнее в случаях стрептококковой и клостридиальной гангрены, поскольку они подавляют выработку токсинов, вызывающих большую часть заболеваемости.
По словам доктора Роберта Финберга из Массачусетского университета, ведущего автора исследования, некоторые врачи-инфекционисты ошибочно полагают, что препараты, убивающие бактерии, автоматически предпочтительнее тех, которые подавляют рост бактерий. «Заблуждение о том, что всегда лучше использовать бактерицидные препараты, неверно», — сказал д-р.Финберг.
«Вероятно, важно использовать бактерицидные препараты при лечении эндокардита и менингита, — добавил доктор Финберг, — но во многих ситуациях цидные препараты не предпочтительнее статических».
###
Основанный в 1979 году, журнал Clinical Infectious Diseases дважды в месяц публикует клинические статьи по различным областям инфекционных заболеваний и является одним из самых уважаемых журналов в этой области. Он издается под эгидой Американского общества инфекционистов (IDSA).IDSA находится в Александрии, штат Вирджиния, и представляет собой профессиональное сообщество, в котором представлены более 7700 врачей и ученых, специализирующихся на инфекционных заболеваниях. Для получения дополнительной информации посетите http://www.idsociety.org.
История Источник:
Материалы предоставлены Американским обществом инфекционных болезней . Примечание. Содержимое можно редактировать по стилю и длине.
типов антибиотиков: бактерицидные против бактериостатических и узкий спектр противШирокий спектр — Видео и стенограмма урока
Бактерицидные антибиотики
Как я уже упоминал ранее, бактерицидных антибиотиков убивают бактерии напрямую. Вы можете запомнить это слово, потому что суффикс «cidal» означает «убить», как в словах «убийство» или «самоубийство». Как бактерицидные антибиотики действительно убивают бактерии? Что ж, есть много разных антибиотиков, у всех разные механизмы, и вы можете узнать о них больше на других уроках. Но вот пара примеров.
Антибиотик , полимиксин B повреждает плазматическую мембрану бактерий, позволяя их содержимому вытекать наружу. В нормальных условиях бактерии и другие клетки должны поддерживать идеальный баланс ионов по обе стороны плазматической мембраны из-за осмоса. Полимиксин B нарушает этот баланс, а также позволяет другим важным молекулам, таким как ДНК и РНК, просачиваться наружу, так что бактерия погибает.
Бактериостатические антибиотики
В отличие от бактерицидных антибиотиков, бактериостатические антибиотики останавливают рост бактерий.Это слово также легко запомнить: суффикс «статический» означает «оставаться стабильным». Бактерии не умирают, но и не могут расти или размножаться.
Итак, как бактериостатические антибиотики помогают избавиться от инфекции, если они на самом деле не убивают бактерии? Что ж, бактерии обычно очень быстро делятся в нашем организме, и их количество может полностью выйти из-под контроля. Но если антибиотик остановит их рост и деление, иммунная система хозяина сможет избавиться от бактерий.
Тетрациклин является примером бактериостатического антибиотика.Он подавляет бактериальные рибосомы, поэтому новые белки не могут быть произведены. Это не убивает бактерии; у них уже есть белки, необходимые для того, чтобы какое-то время выжить. Однако они не могут реплицироваться, потому что им нужно будет произвести тонны новых белков, чтобы создать совершенно новую бактериальную клетку.
Другой класс бактериостатических антибиотиков — сульфаниламидных препаратов . Они предотвращают производство важных метаболитов, необходимых бактериям для создания новых ДНК, РНК и белков.Опять же, это не убивает бактерии, но они не могут реплицироваться и создавать новые бактерии без новой ДНК, РНК и белков. Хорошо, теперь мы понимаем разницу между бактерицидным и бактериостатическим антибиотиками. Давайте посмотрим на разницу между антибиотиками широкого и узкого спектра действия.
Антибиотики узкого спектра
Антибиотики узкого спектра эффективны только против узкого круга бактерий. Например, пенициллин G очень эффективен при уничтожении грамположительных бактерий, но не очень эффективен против грамотрицательных бактерий.
Почему? Что заставляет антибиотик иметь узкий спектр антимикробной активности? Часто это связано со способностью антибиотика проникать внутрь бактерии. У грамположительных бактерий относительно рыхлая внешняя стенка, через которую могут проникать многие антибиотики. Однако грамотрицательные бактерии имеют сложный внешний слой, который предотвращает прохождение многих более крупных или жирорастворимых молекул.
Другой причиной, по которой антибиотики могут обладать узким спектром действия, могут быть их молекулы-мишени.
Если антибиотик нацелен на молекулу, которой у бактерии даже нет, конечно, он не будет эффективен против этой бактерии. Например, изониазид нацелен на микобактерии, такие как бактерия, вызывающая туберкулез. Он специфичен, потому что предотвращает синтез миколиновых кислот, которые содержатся в клеточных стенках микобактерий, но не большинства других типов бактерий.
Хорошо лечить пациентов антибиотиками с узким спектром действия, потому что тогда «хорошие» бактерии, которые обычно живут внутри нас, не погибнут вместе с патогеном, вызвавшим инфекцию.Однако, когда пациент приходит в клинику с инфекцией, часто неясно, какой именно микроб вызывает ее. Поэтому в случае тяжелых инфекций, когда действительно важно, чтобы антибиотик действовал быстро, чтобы пациент мог выжить, антибиотики узкого спектра действия не будут лучшим выбором.
Антибиотики широкого спектра действия
В случае серьезной инфекции неизвестным микробом было бы лучше использовать антибиотики широкого спектра действия. Антибиотики широкого спектра действия эффективны против широкого спектра бактерий, поэтому есть хороший шанс, что антибиотик вылечит инфекцию и, возможно, спасет жизнь пациента.
Примером антибиотика широкого спектра действия является тетрациклин . Как вы помните из предыдущего урока, тетрациклин подавляет бактериальную рибосому и препятствует синтезу белка. Тетрациклин действует против грамположительных, грамотрицательных и даже облигатных внутриклеточных бактерий, которые являются бактериями, которые могут жить только внутри клеток своего хозяина, поэтому с ними еще труднее бороться с помощью антибиотиков.
Существует две основные причины, по которым тетрациклин обладает широким спектром действия:
- Бактериальная рибосома высоко консервативна среди различных типов бактерий и
- Тетрациклин может проникать в большинство бактериальных клеток
Одна проблема с антибиотиками широкого спектра действия заключается в том, что они часто убивают и «хорошие» бактерии пациента.Если наши «хорошие» бактерии погибнут, мы можем получить оппортунистические инфекции, которые случаются, когда микроб, который обычно не является патогенным, использует ситуацию и вызывает болезнь. Когда «хорошие» бактерии хозяина погибают, это дает дополнительное жизненное пространство и питательные вещества, которыми может воспользоваться условно-патогенный микроорганизм.
Но опять же, в случае тяжелой инфекции, очевидно, лучше убить «хорошие» бактерии пациента, чем инфекция, убивающая пациента. С любыми оппортунистическими инфекциями можно бороться позже, когда это не является неотложной ситуацией.
Краткое содержание урока
На этом уроке мы узнали несколько основных типов антибиотиков. Мы видели, что бактерицидных антибиотиков убивают бактерии напрямую, а бактериостатических антибиотиков останавливают рост бактерий. Является ли антибиотик бактерицидным или бактериостатическим, зависит от того, что именно лекарство делает с бактерией.
Мы также узнали о спектре действия антибиотиков. Антибиотики узкого спектра действия эффективны только против узкого круга бактерий, но антибиотики широкого спектра действия эффективны против широкого круга бактерий.

 В высоких концентрациях в отношении высокочувствительных микроорганизмов могут проявлять бактерицидный эффект.
В высоких концентрациях в отношении высокочувствительных микроорганизмов могут проявлять бактерицидный эффект.