CogniFit — Нейронная пластичность и когнитивность
«Под пластичностью мозга подразумевается способность нервной системы изменять свою структуру и функции на протяжении всей жизни в ответ на многообразие окружающей среды. Этому термину не так просто дать определение даже несмотря на то, что в настоящее время он широко применяется в психологии и нейронауке. Он используется для обозначения изменений, происходящих на различных уровнях нервной системы: в молекулярных структурах, изменения экспрессии генов и поведения».
Нейропластичность позволяет нейронам восстанавливаться как анатомически, так и функционально, а также создавать новые синаптические связи. Нейронная пластичность — это способность мозга к восстановлению и реструктуризации. Этот адаптивный потенциал нервной системы позволяет мозгу восстановиться после травм и нарушений, а также может уменьшить последствия структурных изменений, вызванных такими патологиями, как рассеянный склероз, болезнь Паркинсона, когнитивное расстройство, болезнь Альцгеймера, дислексия, СДВГ, бессонница у взрослых, бессонница у детей и т.
Нейронные сети до тренировокНейронные сети после 2-х недель когнитивной стимуляцииНейронные сети после 2-х месяцев когнитивной стимуляции
Синаптическая пластичность
Когда мы учимся или получаем новый опыт, мозг устанавливает серию нейронных связей. Эти нейронные сети представляют собой пути, по которым нейроны обмениваются между собой информацией. Эти пути формируются в мозге при обучении и практике, как, например, в горах образуется тропа, если по ней ежедневно ходит пастух со своим стадом. Нейроны взаимодействуют между собой посредством соединений, называемых синапсом, и эти коммуникационные пути могут восстанавливаться в течение всей жизни. Каждый раз, когда мы приобретаем новые знания (путем постоянной практики), коммуникация или синаптическая трансмиссия между участвующими в процессе нейронами усиливается. Улучшение коммуникации между нейронами означает, что электрические сигналы более эффективно передаются на протяжении всего нового пути. Например, когда вы пытаетесь распознать что за птица поёт, между некоторыми нейронами образуются новые связи. Так, нейроны зрительной коры определяют цвет птицы, слуховой коры — её пение, а другие нейроны — название птицы. Таким образом, чтобы идентифицировать птицу, нужно многократно сопоставить её цвет, голос, название. С каждой новой попыткой, при возвращении к нейронной цепи и восстановлении нейронной передачи между вовлечёнными в процесс нейронами, эффективность синаптической трансмиссии повышается. Таким образом, коммуникация между соответствующими нейронами улучшается, и процесс познания с каждым разом происходит быстрее. Синаптическая пластичность является основой пластичности человеческого мозга.
Например, когда вы пытаетесь распознать что за птица поёт, между некоторыми нейронами образуются новые связи. Так, нейроны зрительной коры определяют цвет птицы, слуховой коры — её пение, а другие нейроны — название птицы. Таким образом, чтобы идентифицировать птицу, нужно многократно сопоставить её цвет, голос, название. С каждой новой попыткой, при возвращении к нейронной цепи и восстановлении нейронной передачи между вовлечёнными в процесс нейронами, эффективность синаптической трансмиссии повышается. Таким образом, коммуникация между соответствующими нейронами улучшается, и процесс познания с каждым разом происходит быстрее. Синаптическая пластичность является основой пластичности человеческого мозга.
С учётом того, что синаптическая пластичность достигается путём улучшения коммуникаций в синапсе между существующими нейронами, под нейрогенезом подразумевается рождение и размножение новых нейронов в мозге. В течение длительного времени идея о регенерации нейронов в мозге взрослого человека считалась чуть ли не ересью. Учёные верили, что нервные клетки умирают и не восстанавливаются. После 1944 г., и особенно в последние годы, научным путём было доказано существование нейрогенеза, и сегодня мы знаем, что происходит, когда стволовые клетки (особый вид клеток, расположенных в зубчатой извилине, гиппокампе и, возможно, в префронтальной коре) делятся на две клетки: стволовую и клетку, которая превратится в полноценный нейрон, с аксонами и дендритами. После этого новые нейроны мигрируют в различные области (включая удалённые друг от друга) мозга, туда, где они нужны, поддерживая тем самым нейронную дееспособность мозга. Известно, что как у животных, так и у людей внезапная гибель нейронов (например, после кровоизлияния) является мощным стимулом для запуска процесса нейрогенеза.
Учёные верили, что нервные клетки умирают и не восстанавливаются. После 1944 г., и особенно в последние годы, научным путём было доказано существование нейрогенеза, и сегодня мы знаем, что происходит, когда стволовые клетки (особый вид клеток, расположенных в зубчатой извилине, гиппокампе и, возможно, в префронтальной коре) делятся на две клетки: стволовую и клетку, которая превратится в полноценный нейрон, с аксонами и дендритами. После этого новые нейроны мигрируют в различные области (включая удалённые друг от друга) мозга, туда, где они нужны, поддерживая тем самым нейронную дееспособность мозга. Известно, что как у животных, так и у людей внезапная гибель нейронов (например, после кровоизлияния) является мощным стимулом для запуска процесса нейрогенеза.
Функциональная компенсационная пластичность
В научной литературе по нейробиологии широко раскрыта тема снижения когнитивных способностей при старении и объяснено, почему пожилые люди демонстрируют более низкую когнитивную производительность, чем молодёжь. Удивительно, однако далеко не все пожилые люди показывают низкую производительность: у некоторых результаты ничуть не хуже, чем у молодых. Эти неожиданно разные результаты у подгруппы людей одного и того же возраста были исследованы научным путём, в результате чего было обнаружено, что при обработке новой информации пожилые люди с большей когнитивной производительностью используют те же самые области мозга, что и молодёжь, а также другие области мозга, которые не используются ни молодыми, ни другими пожилыми участниками эксперимента. Этот феномен сверхиспользования мозга пожилыми людьми был исследован учёными, которые пришли к выводу о том, что использование новых когнитивных ресурсов происходит в рамках компенсационной стратегии. В результате старения и снижения синаптической пластичности мозг, демонстрируя свою пластичность, начинает реструктурировать свои нейрокогнитивные сети. Исследования показали, что мозг приходит к этому функциональному решению путём активации других нервных путей, чаще задействуя области в обоих полушариях (что обычно характерно только для более молодых людей).
Удивительно, однако далеко не все пожилые люди показывают низкую производительность: у некоторых результаты ничуть не хуже, чем у молодых. Эти неожиданно разные результаты у подгруппы людей одного и того же возраста были исследованы научным путём, в результате чего было обнаружено, что при обработке новой информации пожилые люди с большей когнитивной производительностью используют те же самые области мозга, что и молодёжь, а также другие области мозга, которые не используются ни молодыми, ни другими пожилыми участниками эксперимента. Этот феномен сверхиспользования мозга пожилыми людьми был исследован учёными, которые пришли к выводу о том, что использование новых когнитивных ресурсов происходит в рамках компенсационной стратегии. В результате старения и снижения синаптической пластичности мозг, демонстрируя свою пластичность, начинает реструктурировать свои нейрокогнитивные сети. Исследования показали, что мозг приходит к этому функциональному решению путём активации других нервных путей, чаще задействуя области в обоих полушариях (что обычно характерно только для более молодых людей).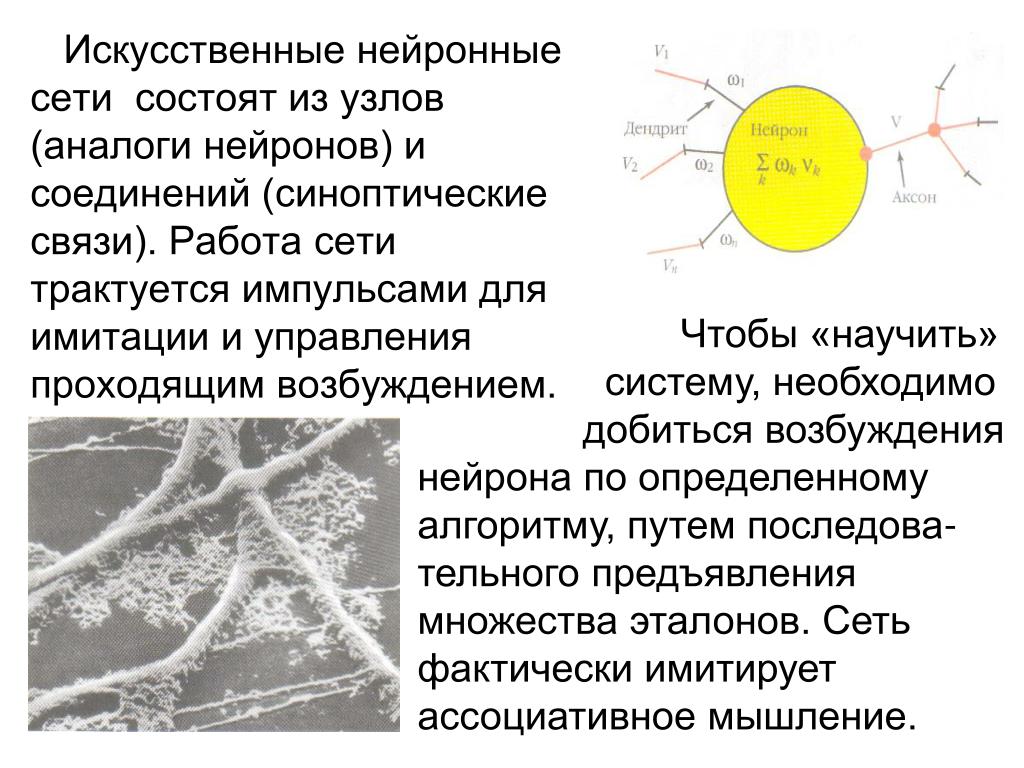
Функционирование и поведение: обучение, опыт и окружение
Мы рассмотрели, что пластичность — это способность мозга изменять свои биологические, химические и физические характеристики. Однако меняется не только мозг — также меняется поведение и функционирование всего организма. За последние годы мы узнали о том, что генетические или синаптические нарушения мозга происходят в результате как старения, так и воздействия огромного количества факторов окружающей среды. Особенно важны открытия о пластичности мозга, а также о его уязвимости в результате различных расстройств. Мозг учится на протяжении всей нашей жизни — в любой момент и по разным причинам мы получаем новые знания. Например, дети приобретают новые знания в огромных количествах, что провоцирует значительные изменения в мозговых структурах в моменты интенсивного обучения. Новые знания можно получить и в результате пережитой неврологической травмы, например, в результате повреждения или кровоизлияния, когда функции повреждённой части мозга нарушаются, и нужно учиться заново. Есть также люди с жаждой знаний, для которых необходимо постоянно учиться. В связи с огромным количеством обстоятельств, при которых может потребоваться новое обучение, мы задаемся вопросом, меняется ли каждый раз при этом мозг? Исследователи полагают, что это не так. По-видимому, мозг приобретает новые знания и демонстрирует свой потенциал пластичности в том случае, если новые знания помогут улучшить поведение. То есть для физиологических изменений мозга необходимо, чтобы следствием обучения были перемены в поведении. Другими словами, новые знания должны быть нужными. Например, знания о еще одном способе выживания. Вероятно, тут играет роль степень полезности. В частности, развить пластичность мозга помогают интерактивные игры. Было доказано, что такая форма обучения повышает активность префронтальной коры головного мозга (ПФК). Кроме того, полезно играть с положительным подкреплением и вознаграждением, что традиционно используется при обучении детей.
Есть также люди с жаждой знаний, для которых необходимо постоянно учиться. В связи с огромным количеством обстоятельств, при которых может потребоваться новое обучение, мы задаемся вопросом, меняется ли каждый раз при этом мозг? Исследователи полагают, что это не так. По-видимому, мозг приобретает новые знания и демонстрирует свой потенциал пластичности в том случае, если новые знания помогут улучшить поведение. То есть для физиологических изменений мозга необходимо, чтобы следствием обучения были перемены в поведении. Другими словами, новые знания должны быть нужными. Например, знания о еще одном способе выживания. Вероятно, тут играет роль степень полезности. В частности, развить пластичность мозга помогают интерактивные игры. Было доказано, что такая форма обучения повышает активность префронтальной коры головного мозга (ПФК). Кроме того, полезно играть с положительным подкреплением и вознаграждением, что традиционно используется при обучении детей.
Условия реализации пластичности мозга
Когда, в какой момент жизни мозг наиболее подвержен изменениям под воздействием факторов окружающей среды? По-видимому, пластичность мозга зависит от возраста, и предстоит сделать ещё немало открытий о влиянии на неё окружающей среды в зависимости от возраста субъекта.
1] Определение взято из: Колб, Б., Мохамед, A., & Гибб, Р., Поиск факторов, лежащих в основе пластичности мозга в нормальном и повреждённом состоянии, Revista de Trastornos de la Comunicación (2010), doi: 10. 1016/j.jcomdis.2011.04 0.007 Этот раздел является производным от работы Колба, B., Мохамеда, A., & Гибба, Р., Поиск факторов, лежащих в основе пластичности мозга в нормальном и повреждённом состоянии, Revista de Trastornos de la Comunicación (2010), doi: 10.1016 / j . jcomdis.2011.04.007
1016/j.jcomdis.2011.04 0.007 Этот раздел является производным от работы Колба, B., Мохамеда, A., & Гибба, Р., Поиск факторов, лежащих в основе пластичности мозга в нормальном и повреждённом состоянии, Revista de Trastornos de la Comunicación (2010), doi: 10.1016 / j . jcomdis.2011.04.007
Как работает наш мозг или как смоделировать душу? / Хабр
Здравствуй, Geektimes! В ранее опубликованной статье, была представлена модель нервной системы, опишу теорию и принципы, которые легли в её основу.
Теория основана на анализе имеющейся информации о биологическом нейроне и нервной системе из современной нейробиологии и физиологии мозга.
Сначала приведу краткую информацию об объекте моделирования, вся информация изложена далее, учтена и использована в модели.
Нейрон является основным функциональным элементом нервной системы, он состоит из тела нервной клетки и её отростков. Существуют два вида отростков: аксоны и дендриты. Аксон – длинный покрытый миелиновой оболочкой отросток, предназначенный для передачи нервного импульса на далекие расстояния. Дендрит – короткий, ветвящийся отросток, благодаря которым происходит взаимосвязь с множеством соседних клеток.
Аксон – длинный покрытый миелиновой оболочкой отросток, предназначенный для передачи нервного импульса на далекие расстояния. Дендрит – короткий, ветвящийся отросток, благодаря которым происходит взаимосвязь с множеством соседних клеток.
Нейроны могут сильно отличаться по форме, размерам и конфигурации, не смотря на это, отмечается принципиальное сходство нервной ткани в различных участках нервной системе, отсутствуют и серьезные эволюционные различия. Нервная клетка моллюска Аплизии может выделять такие же нейромедиаторы и белки, что и клетка человека.
В зависимости от конфигурации выделяют три типа нейронов:
а) рецепторные, центростремительные, или афферентные нейроны, данные нейроны имеют центростремительный аксон, на конце которого имеются рецепторы, рецепторные или афферентные окончания. Эти нейроны можно определить, как элементы, передающие внешние сигналы в систему.
б) интернейроны (вставочные, контактные, или промежуточные) нейроны, не имеющие длинных отростков, но имеющие только дендриты. Таких нейронов в человеческом мозгу больше чем остальных. Данный вид нейронов является основным элементом рефлекторной дуги.
Таких нейронов в человеческом мозгу больше чем остальных. Данный вид нейронов является основным элементом рефлекторной дуги.
в) моторные, центробежные, или эфферентные, они имеют центростремительный аксон, который имеет эфферентные окончания передающий возбуждение мышечным или железистым клеткам. Эфферентные нейроны служат для передачи сигналов из нервной среды во внешнюю среду.
Обычно в статьях по искусственным нейронным сетям оговаривается наличие только моторных нейронов (с центробежным аксоном), которые связаны в слои иерархической структуры. Подобное описание применимо к биологической нервной системе, но является своего рода частным случаем, речь идет о структурах, базовых условных рефлексов. Чем выше в эволюционном значении нервная система, тем меньше в ней превалируют структуры типа «слои» или строгая иерархия.
ПЕРЕДАЧА НЕРВНОГО ВОЗБУЖДЕНИЯПередача возбуждения происходит от нейрона к нейрону, через специальные утолщения на концах дендритов, называемых синапсами.
Важно отметить, что в биологическом нейроне постоянно происходят изменения, отращиваются новые дендриты и синапсы, возможны миграции нейронов. В местах контактов с другими нейронами образуются новообразования, для передающего нейрона — это синапс, для принимающего — это постсинаптическая мембрана, снабжаемая специальными рецепторами, реагирующими на медиатор, то есть можно говорить, что мембрана нейрона — это приемник, а синапсы на дендритах — это передатчики сигнала.СИНАПС
При активации синапса он выбрасывает порции медиатора, эти порции могут варьироваться, чем больше выделится медиатора, тем вероятнее, что принимаемая сигнал нервная клетка будет активирована. Медиатор, преодолевая синоптическую щель, попадает на постсинаптическую мембрану, на которой расположены рецепторы, реагирующие на медиатор. Далее медиатор может быть разрушен специальным разрушающим ферментом, либо поглощен обратно синапсом, это происходит для сокращения времени действия медиатора на рецепторы.
Медиатор, преодолевая синоптическую щель, попадает на постсинаптическую мембрану, на которой расположены рецепторы, реагирующие на медиатор. Далее медиатор может быть разрушен специальным разрушающим ферментом, либо поглощен обратно синапсом, это происходит для сокращения времени действия медиатора на рецепторы.
Синапсов связывающих нейрон с одной и той же целевой клеткой, может быть множество. Для упрощения примем, всю совокупность, оказываемого воздействия одним нейроном, на другой целевой нейрон за синапс с определённой силой воздействия. Главной характеристикой синапса будет, является его сила.
В состоянии покоя мембрана нейрона поляризована. Это означает, что по обе стороны мембраны располагаются частицы, несущие противоположные заряды.
 В состоянии покоя наружная поверхность мембраны заряжена положительно, внутренняя – отрицательно. Основными переносчиками зарядов в организме являются ионы натрия (Na+), калия (K+) и хлора (Cl-).
В состоянии покоя наружная поверхность мембраны заряжена положительно, внутренняя – отрицательно. Основными переносчиками зарядов в организме являются ионы натрия (Na+), калия (K+) и хлора (Cl-).Разница между зарядами поверхности мембраны и внутри тела клетки составляет мембранный потенциал. Медиатор вызывает нарушения поляризации – деполяризацию. Положительные ионы снаружи мембраны устремляются через открытые каналы в тело клетки, меняя соотношение зарядов между поверхностью мембраны и телом клетки.
Изменение мембранного потенциала при возбуждении нейрона
Характер изменений мембранного потенциала при активации нервной ткани неизменен. Независимо от того кокой силы воздействия оказывается на нейрон, если сила превышает некоторое пороговое значение, ответ будет одинаков.
Забегая вперед, хочу отметить, что в работе нервной системы имеет значение даже следовые потенциалы (см. график выше). Они не появляются, вследствие каких-то гармонических колебаний уравновешивающих заряды, являются строгим проявлением определённой фазы состояния нервной ткани при возбуждении.
Итак, далее приведу теоретические предположения, которые позволят нам создавать математические модели. Главная идея заключается во взаимодействии между зарядами формирующихся внутри тела клетки, во время её активности, и зарядами с поверхностей мембран других активных клеток. Данные заряды являются разноименными, в связи этим можно предположить, как будут располагаться заряды в теле клетки под воздействием зарядов других активных клеток.
Можно сказать, что нейрон чувствует активность других нейронов на расстоянии, стремится направить распространения возбуждения в направлении других активных участков.
В момент активности нейрона можно рассчитать определённую точку в пространстве, которая определялась бы, как сумма масс зарядов, расположенных на поверхностях других нейронов. Указанную точку назовем точкой паттерна, её месторождение зависит от комбинации фаз активности всех нейронов нервной системы. Паттерном в физиологии нервной системы называется уникальная комбинация активных клеток, то есть можно говорить о влиянии возбуждённых участков мозга на работу отдельного нейрона.
Нужно представлять работу нейрона не просто как вычислителя, а своего рода ретранслятор возбуждения, который выбирает направления распространения возбуждения, таким образом, формируются сложные электрические схемы. Первоначально предполагалось, что нейрон просто избирательно отключает/включает для передачи свои синапсы, в зависимости от предпочитаемого направления возбуждения. Но более детальное изучение природы нейрона, привело к выводам, что нейрон может изменять степень воздействия на целевую клетку через силу своих синапсов, что делает нейрон более гибким и вариативным вычислительным элементом нервной системы.
Какое же направление для передачи возбуждения является предпочтительным? В различных экспериментах связанных с образованием безусловных рефлексов, можно определить, что в нервной системе образуются пути или рефлекторные дуги, которые связывают активируемые участки мозга при формировании безусловных рефлексов, создаются ассоциативные связи. Значит, нейрон должен передавать возбуждения к другим активным участкам мозга, запоминать направление и использовать его в дальнейшем.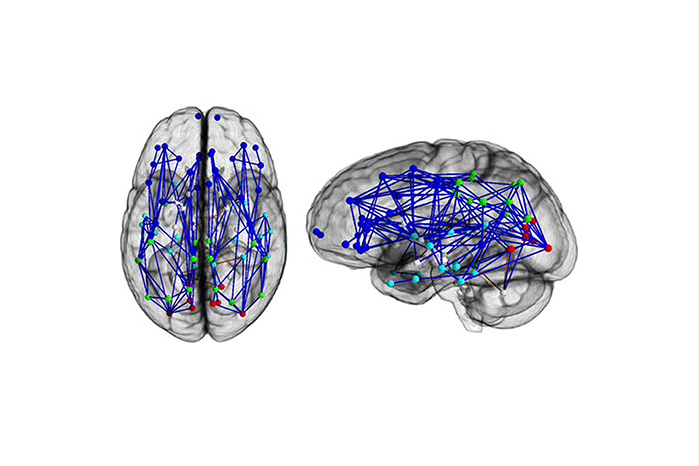
Представим вектор начало, которого находится в центре активной клети, а конец направлен в точку паттерна определённую для данного нейрона. Обозначим, как вектор предпочитаемого направления распространения возбуждения (T, trend). В биологическом нейроне вектор Т может проявляться в структуре самой нейроплазмы, возможно, это каналы для движения ионов в теле клетки, или другие изменения в структуре нейрона.
Нейрон обладает свойством памяти, он может запоминать вектор Т, направление этого вектора, может меняться и перезаписываться в зависимости от внешних факторов. Степень с которой вектор Т может подвергается изменениям, называется нейропластичность.
Этот вектор в свою очередь оказывает влияние на работу синапсов нейрона. Для каждого синапса определим вектор S начало, которого находится в центре клетки, а конец направлен в центр целевого нейрона, с которым связан синапс. Теперь степень влияния для каждого синапса можно определить следующим образом: чем меньше угол между вектором T и S, тем больше синапс будет, усиливается; чем меньше угол, тем сильнее синапс будет ослабевать и возможно может прекратить передачу возбуждения. Каждый синапс имеет независимое свойство памяти, он помнит значение своей силы. Указанные значения изменяются при каждой активизации нейрона, под влиянием вектора Т, они либо увеличиваются, либо уменьшаются на определённое значение.
Каждый синапс имеет независимое свойство памяти, он помнит значение своей силы. Указанные значения изменяются при каждой активизации нейрона, под влиянием вектора Т, они либо увеличиваются, либо уменьшаются на определённое значение.
Входные сигналы (x1, x2,…xn) нейрона представляют собой вещественные числа, которые характеризуют силу синапсов нейронов, оказывающих воздействие на нейрон.
Положительное значение входа означает побудительное воздействие, оказываемое на нейрон, а отрицательное значение – тормозящее воздействие.
Для биологического нейрона не имеет значение, откуда поступил возбуждающий его сигнал, результат его активности будет идентичен. Нейрон будет активизирован, когда сумма воздействий на него будет превышать определённое пороговое значение. Поэтому, все сигналы проходят через сумматор (а), а поскольку нейроны и нервная система работают в реальном времени, следовательно, воздействие входов должно оцениваться в короткий промежуток времени, то есть воздействие синапса имеет временный характер.
Результат сумматора проходит пороговую функцию (б), если сумма превосходит пороговое значение, то это приводит к активности нейрона.
При активации нейрон сигнализирует о своей активности системе, передовая информацию о своём положении в пространстве нервной системы и заряде, изменяемом во времени (в).
Через определённое время, после активации нейрон передает возбуждение по всем имеющимся синапсам, предварительно производя пересчет их силы. Весь период активации нейрон перестает реагировать на внешние раздражители, то есть все воздействия синапсов других нейронов игнорируются. В период активации входит так же период восстановления нейрона.
Происходит корректировка вектора Т (г) с учётом значения точки паттерна Pp и уровнем нейропластичности. Далее происходит переоценка значений всех сил синапсов в нейроне(д).
Обратите внимание, что блоки (г) и (д) выполняются параллельно с блоком (в).
Если внимательно проанализировать предложенную модель, то можно увидеть, что источник возбуждения должен оказывать большее влияние на нейрон, чем другой удалённый, активный участок мозга.
 Следовательно возникает вопрос: почему же все равно происходит передача в направлении другого активного участка?
Следовательно возникает вопрос: почему же все равно происходит передача в направлении другого активного участка?Данную проблему я смог определить, только создав компьютерную модель. Решение подсказал график изменения мембранного потенциала при активности нейрона.
Усиленная реполяризация нейрона, как говорилось ранее, имеет важное значение для нервной системы, благодаря ей создается эффект волны, стремление нервного возбуждения распространятся от источника возбуждения.
При работе с моделью я наблюдал два эффекта, ели пренебречь следовым потенциалом или сделать его недостаточно большим, то возбуждение не распространяется от источников, а в большей степени стремится к локализации. Если сделать следовой потенциал сильно большим, то возбуждение стремится «разбежаться» в разные стороны, не только от своего источника, но и от других.КОГНИТИВНАЯ КАРТА
Используя теорию электромагнитного взаимодействия, можно объяснить многие явления и сложные процессы, протекающие в нервной системе.
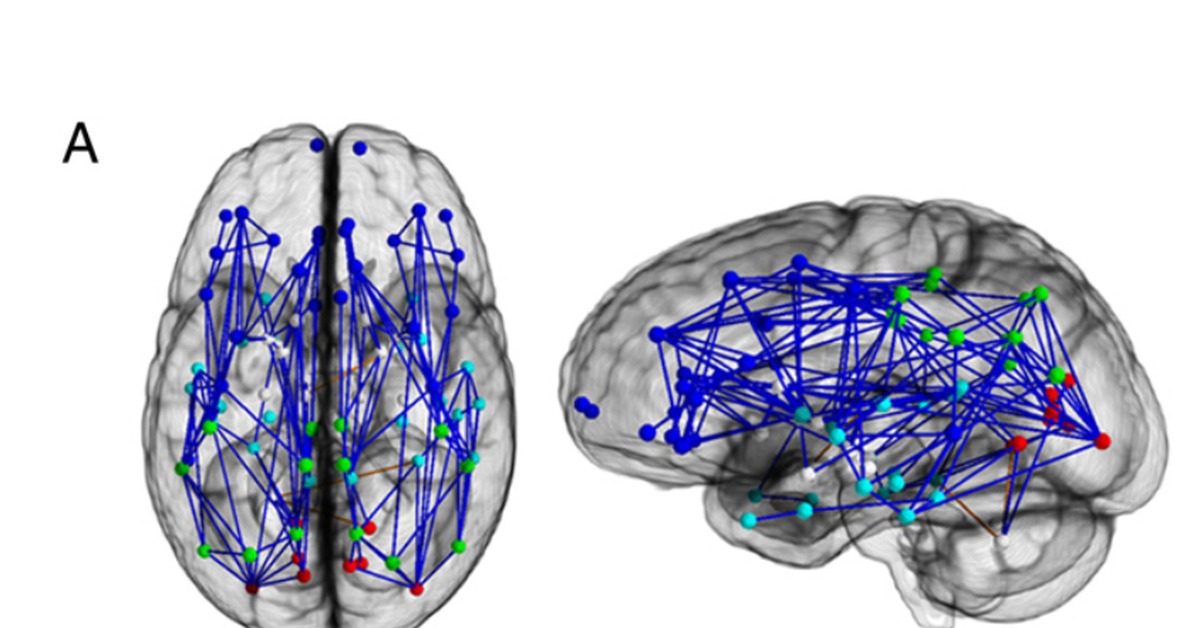
 К примеру, одним из последних открытий, которое широко обсуждается в науках о мозге, является открытие когнитивных карт в гиппокампе.
К примеру, одним из последних открытий, которое широко обсуждается в науках о мозге, является открытие когнитивных карт в гиппокампе. Гиппокамп – это отдел мозга, которому отвечает за кратковременную память. Эксперименты на крысах выявили, что определённому месту в лабиринте соответствует своя локализованная группа клеток в гиппокампе, причем, не имеет значение, как животное попадает в это место, все равно будет активирован соответствующий этому месту участок нервной ткани. Естественно, животное должно помнить данный лабиринт, не стоит рассчитывать на топологическое соответствие пространства лабиринта и когнитивной карты.
Каждое место в лабиринте представляется в мозге, как совокупность раздражителей различного характера: запахи, цвет стен, возможные примечательные объекты, характерные звуки и т. д. Указанные раздражители отражаются на коре, различных представительствах органов чувств, в виде всплесков активности в определённых комбинациях. Мозг одновременно обрабатывает информацию в нескольких отделах, зачастую информационные каналы разделяются, одна и та же информация поступает в различные участки мозга.
Активация нейронов места в зависимости от положения в лабиринте (активность разных нейронов показана разным цветом). источник
Гиппокамп расположен в центре мозга, вся кара и её области удалены от него, на одинаковые расстояния. Если определить для каждой уникальной комбинации раздражителей точку масс зарядов поверхностей нейронов, то можно увидеть, что указанные точки будут различны, и будут находиться примерно в центре мозга. К этим точкам будет стремиться и распространятся возбуждение в гиппокампе, формируя устойчивые участки возбуждения. Более того, поочередная смена комбинаций раздражителей, будет приводить к смещению точки паттерна. Участки когнитивной карты будут ассоциативно связываться друг с другом последовательно, что приведет к тому, что животное, помещенное в начало знакомого ей лабиринта, может вспомнить весь последующий путь.
ЗаключениеУ многих возникнет вопрос, где в данной работе предпосылки к элементу разумности или проявления высшей интеллектуальной деятельности?
Важно отметить, что феномен человеческого поведения, есть следствие функционирования биологической структуры.
 Следовательно, чтобы имитировать разумное поведение, необходимо хорошо понимать принципы и особенности функционирования биологических структур. К сожалению, в науке биологии пока не представлен четкий алгоритм: как работает нейрон, как понимает, куда необходимо отращивать свои дендриты, как настроить свои синапсы, что бы в нервной системе смог сформироваться простой условный рефлекс, на подобие тех, которые демонстрировал и описывал в своих работах академик И.П. Павлов.
Следовательно, чтобы имитировать разумное поведение, необходимо хорошо понимать принципы и особенности функционирования биологических структур. К сожалению, в науке биологии пока не представлен четкий алгоритм: как работает нейрон, как понимает, куда необходимо отращивать свои дендриты, как настроить свои синапсы, что бы в нервной системе смог сформироваться простой условный рефлекс, на подобие тех, которые демонстрировал и описывал в своих работах академик И.П. Павлов. С другой стороны в науке об искусственном интеллекте, в восходящем (биологическом) подходе, сложилось парадоксальная ситуация, а именно: когда используемые в исследованиях модели основаны на устаревших представлениях о биологическом нейроне, консерватизм, в основе которого берётся персептрон без переосмысления его основных принципов, без обращения к биологическому первоисточнику, придумывается все более хитроумные алгоритмы и структуры, не имеющих биологических корней.
Конечно, никто не уменьшает достоинств классических нейронных сетей, которые дали множество полезных программных продуктов, но игра с ними не является путем к созданию интеллектуально действующей системы.
/460711949-56a793d25f9b58b7d0ebda5c.jpg)
Более того, не редки заявления, о том, что нейрон подобен мощной вычислительной машине, приписывают свойство квантовых компьютеров. Из-за этой сверхсложности, нервной системе приписывается невозможность её повторения, ведь это соизмеримо с желанием смоделировать человеческую душу. Однако, в реальности природа идет по пути простоты и элегантности своих решений, перемещение зарядов на мембране клетки может служить, как для передачи нервного возбуждения, так и для трансляции информации о том, где происходит данная передача.
Несмотря на то, что указанная работа демонстрирует, как образуются элементарные условные рефлексы в нервной системе, она приближает к пониманию того, что такое интеллект и разумная деятельность.
Существуют еще множество аспектов работы нервной системы: механизмы торможения, принципы построения эмоций, организация безусловных рефлексов и обучение, без которых невозможно построить качественную модель нервной системы. Есть понимание, на интуитивном уровне, как работает нервная система, принципы которой возможно воплотить в моделях.
Создание первой модели помогли отработать и откорректировать представление об электромагнитном взаимодействии нейронов. Понять, как происходит формирование рефлекторных дуг, как каждый отдельный нейрон понимает, каким образом ему настроить свои синапсы для получения ассоциативных связей.
На данный момент я начал разрабатывать новую версию программы, которая позволит смоделировать многие другие аспекты работы нейрона и нервной системы.
Прошу принять активное участие в обсуждении выдвинутых здесь гипотез и предположений, так как я могу относиться к своим идеям предвзято. Ваше мнение очень важно для меня.
Нейропластичность мозга и нейробика
НеврологияТамара Барковская:
Доброе утро, уважаемые зрители и слушатели! В эфире программа «Консилиум». Я представляю гостью студии – врача-невролога, вертебролога, реабилитолога, члена Всероссийского общества неврологов, участника российских и международных конференций по неврологии – Горонок Яну Игоревну. И сегодня мы говорим о нейропластичности головного мозга, о таком понятии, как нейробика. И сегодня вместе со мной, Тамарой Барковской, мы будем освещать эту тему подробно, детально и узнаем, как она способствует улучшению памяти и мыслительных процессов. Итак, что же такое нейропластичность головного мозга?
И сегодня мы говорим о нейропластичности головного мозга, о таком понятии, как нейробика. И сегодня вместе со мной, Тамарой Барковской, мы будем освещать эту тему подробно, детально и узнаем, как она способствует улучшению памяти и мыслительных процессов. Итак, что же такое нейропластичность головного мозга?
Яна Горонок:
Если мы говорим о нейропластичности, я бы хотела немножко зайти издалека – понять, откуда произошел этот термин и немножко его раскрыть. Изначально одно из понятий – это пластичность. Что такое пластичность? Это способность нервной системы изменять свою структуру, а также функции на протяжении всей своей жизни в ответ на многообразие окружающей среды. Мы можем влиять на многообразие окружающей среды, так и окружающая среда может влиять на нас. Таким образом, наши мыслительные процессы улучшаются за счет того, что мы взаимодействуем с окружающей средой.
Тамара Барковская:
Встречный процесс.
Яна Горонок:
В этом плане мы взаимодействуем напрямую. Этот термин используется для обозначения изменений, то есть это сейчас очень актуальная и интересная тема, и эти изменения происходят на различных уровнях. Эти могут быть молекулярные структуры, изменения экспрессии генов и даже поведения человека. Если мы говорим о нейрональной пластичности или нейропластичности, мы делаем акцент на головной мозг.
Этот термин используется для обозначения изменений, то есть это сейчас очень актуальная и интересная тема, и эти изменения происходят на различных уровнях. Эти могут быть молекулярные структуры, изменения экспрессии генов и даже поведения человека. Если мы говорим о нейрональной пластичности или нейропластичности, мы делаем акцент на головной мозг.
Тамара Барковская:
То есть мы подразумеваем клетки головного мозга – нейроны.
Яна Горонок:
Головной мозг сам по себе очень много захватывает, большое количество информации. У нас сейчас такой век развития, век достаточно быстрого темпа, и при этом у нас головной мозг не меняет своего размера. Но при этом информация увеличилась, и поэтому мы ее должны структуризировать в нашем головном мозге, чтобы не сойти с ума от того количества информации, которое мы воспринимаем.
Тамара Барковская:
Есть определенные защитные механизмы в головном мозге?
Яна Горонок:
Да. И чтобы это происходило, нам головной мозг необходимо тренировать так же, как тренируем свое физическое тело. Нейропластичность позволяет нейронам восстанавливаться как на анатомическом уровне, так и на функциональном, что немаловажно, а также создавать новые синоптические связи. В нашем организме все достаточно логично. Есть клетки, которые называются «нейроны», «дендриты». Они очень похожи на веточки деревьев, которые взаимодействуют друг с другом. Это называется синоптическая связь. Кстати, советую всем посмотреть, как выглядят нервные клетки, они невероятно красивые, особенно если мы посмотрим на саму клетку – как происходит взаимодействие. Я это вижу, как будто какие-то молнии, которые взаимодействуют друг с другом, причем они словно светятся.
И чтобы это происходило, нам головной мозг необходимо тренировать так же, как тренируем свое физическое тело. Нейропластичность позволяет нейронам восстанавливаться как на анатомическом уровне, так и на функциональном, что немаловажно, а также создавать новые синоптические связи. В нашем организме все достаточно логично. Есть клетки, которые называются «нейроны», «дендриты». Они очень похожи на веточки деревьев, которые взаимодействуют друг с другом. Это называется синоптическая связь. Кстати, советую всем посмотреть, как выглядят нервные клетки, они невероятно красивые, особенно если мы посмотрим на саму клетку – как происходит взаимодействие. Я это вижу, как будто какие-то молнии, которые взаимодействуют друг с другом, причем они словно светятся.
Тамара Барковская:
Некоторые морфологическую и анатомическую картину под микроскопом связывают с аналогией космоса.
Яна Горонок:
Это невероятно красиво, поэтому я могу сказать, что у всех, у кого есть комплексы по поводу своей внешности – вы априори прекрасны, потому что наш организм просто невероятный.
Тамара Барковская:
Взгляните на себя изнутри.
Яна Горонок:
Нейропластичность позволяет восстанавливаться после травм. Достаточно клинических примеров, когда человек попадает в серьезную аварию, у него черепно-мозговая травма, и, казалось бы, эта травма несовместима с жизнью, или у человека могут быть какие-то нарушения в руках, в ногах, то есть в конечностях, и даже мыслительные, и человек посредством определенных занятий, посредством реабилитации восстанавливается.
Тамара Барковская:
Можно ли сказать, что на сегодняшний день эти моменты нейропластичности в какой-то степени недооценены?
Яна Горонок:
Да, есть. Дело в том, что об этом не совсем знает широкая аудитория.
Тамара Барковская:
Даже врачи не все знают, кто не имеет отношения к неврологии, психотерапии, психологии.
Яна Горонок:
Это некое нововеяние. Хотя уже с 1998 года об этом стали больше говорить. Американские ученые по этому поводу тоже проводили исследования. И необходимо больше раскрывать эту тему, больше вещать об этом, и в частности на приемах, потому что очень часто задают один вопрос: «Доктор, что мне делать с памятью?» Многие думают, что одной таблеткой мы можем улучшить память.
Хотя уже с 1998 года об этом стали больше говорить. Американские ученые по этому поводу тоже проводили исследования. И необходимо больше раскрывать эту тему, больше вещать об этом, и в частности на приемах, потому что очень часто задают один вопрос: «Доктор, что мне делать с памятью?» Многие думают, что одной таблеткой мы можем улучшить память.
Тамара Барковская:
Это Вы сейчас о какой возрастной группе речь ведете?
Яна Горонок:
В основном, это люди трудоспособного возраста, у которых достаточно многозадачная работа. Это руководители, у них накладывается еще и стрессовый компонент. Поэтому если мы говорим о возрастной категории, то это от 40 и выше, а также это могут быть молодые, особенно те, которые учатся. У них тоже бывает из-за загруженности, из-за того, что большое количество информации, они просто иногда не выдерживают, с учетом того, что у них учеба и отдых бывают нерациональные, и не умеют иногда люди разгружаться и отдыхать, поэтому у головного мозга есть свойство тоже уставать. И поэтому не память плохая становится, а просто головной мозг перегружен. Давать ему отдых тоже необходимо.
И поэтому не память плохая становится, а просто головной мозг перегружен. Давать ему отдых тоже необходимо.
Не память плохая становится, а просто головной мозг перегружен. Давать ему отдых тоже необходимо.
Тамара Барковская:
То есть на сегодняшний день это касается не только когорты возрастных пациентов, сейчас эта проблематика охватывает все возрастные группы.
Яна Горонок:
И я могу сказать, что это охватывает даже детей.
Тамара Барковская:
На детей вообще обрушивается бесчисленный объем информации на сегодняшний день.
Яна Горонок:
Невероятный, особенно в школах. Поэтому головной мозг необходимо тренировать, для того чтобы он был еще и стрессоустойчив, чтобы он смог выдержать ту нагрузку и ту информацию, которую нам дают, чтобы он умел фильтровать. Но когда мы начинаем решать задачи очень-очень много, не понимая, что нам надо в первую очередь сделать, организм начинает немножко сдаваться.
Я сказала про травмы. Это актуальная тема и при острых нарушениях мозгового кровообращения, в частности, это инсульты. Инсульт – это тоже сейчас очень распространенная тема. К сожалению, очень много инвалидизации, и очень тяжело адаптироваться людям с нарушениями в головном мозге к окружающему миру. И поэтому неврологи борются за эту зону. Она называется «зона пенумбры». Есть очаг катастрофы и очаг вокруг, то есть пенумбра. Вот эта зона, за которую борются, в которой нейроны еще могут восстановиться. Но они в полуживом состоянии.
Есть очень интересная тренировка, когда у человека есть левая сторона, она пластичная, и нужно ее тренировать, либо, наоборот, вялая. И, как правило, ставят зеркало. Это называется «зеркальные нейроны». Ставят зеркало со стороны той руки, которая хорошо двигается, закрывая ту сторону, которая мало двигается. Человек посредством отражения видит, и головной мозг начинает ему просто подавать сигнал. И это сейчас очень хорошо практикуется, так же, кстати, как и после инсульта сейчас стали чаще людей вертикализировать, то есть задавать им темп движения, потому что включается моторика, включаются ноги, то есть человек не залеживается. Человеку ни в коем случае после инсульта залеживаться нельзя. Его надо активизировать, вертикализировать в краткие сроки, даже это бывает и до суток.
Человеку ни в коем случае после инсульта залеживаться нельзя. Его надо активизировать, вертикализировать в краткие сроки, даже это бывает и до суток.
Тамара Барковская:
Получается, что в реабилитационном периоде, в постинсультном состоянии это все имеет большой смысл. И мы плавно подошли к самому понятию нейробики. Насколько я понимаю, это комплексный термин. Из чего он состоит, чтобы было понятно, откуда он сформировался?
Яна Горонок:
Нейробика созвучно со словом аэробика. Аэробика – мы четко понимаем, что это такое. Это аэробные упражнения, которые мы делаем в группе людей, что тоже немаловажно, потому что взаимодействие с людьми – это тоже важный компонент. И мы можем обучаться от людей, и люди могут от нас, то есть взаимодействие – это важный компонент. Все происходит под хорошую музыку, достаточно энергичную, которая задает темп нашему организму. И это держит в тонусе наше тело, а также это дает здоровье. А когда человек здоров, он будет и трудоспособный, и счастливый, и жизнь будет казаться более яркой.
То же самое происходит с головным мозгом, просто приставка «нейро» – это мы говорим о непосредственных нейронных клетках, поэтому это называется «нейробика». То есть это комплекс упражнений, которые активизируют головной мозг, дает ему возможность включиться в тот или иной процесс и его натренировать. И таким образом мы можем получить хороший результат. Один из важных моментов – это улучшение памяти. И если говорить о памяти, я очень хорошо помню один случай из моей клинической практики, когда ко мне пациент пришел, и у него была одна из основных жалоб: «У меня память страдает». Конечно, память бывает разная, бывает, когда человек уже при Альцгеймере, к сожалению, когда они могут что-то сказать и тут же забыть. Это уже больше патология. Но когда человек говорит о том, что он иногда может забыть, где лежат ключи, или в работе что-то забыть, я спрашиваю: «Многозадачная ли работа?» Это очень важный момент. «Да, и какие-то моменты мне надо записать». На самом деле, это не так страшно. И когда мы проводим тестирование, я понимаю, что у человека как таковая память сильно не страдает. Возможно, он переутомился. Возможно, у него был какой-то стресс. И мы просто сели, поговорили об этом, я дала комплекс упражнений, которые даже очень простые. Например, математические – от 100 отнимаем 7.
И когда мы проводим тестирование, я понимаю, что у человека как таковая память сильно не страдает. Возможно, он переутомился. Возможно, у него был какой-то стресс. И мы просто сели, поговорили об этом, я дала комплекс упражнений, которые даже очень простые. Например, математические – от 100 отнимаем 7.
Тамара Барковская:
Возвращаемся к курсу арифметики.
Яна Горонок:
Математика прекрасно тренирует память. Я бы хотела сразу же чуть-чуть задеть эту тему. Многие думают, что кроссворды тренируют память. К сожалению, это не так. Это наши базовые знания, которые мы применяем.
Многие думают, что кроссворды тренируют память. К сожалению, это не так. Это наши базовые знания, которые мы применяем.
А вот судоку, например, где нужно включить мыслительный процесс и расставить цифры в правильном порядке, где-то посчитать, включить голову – в этом неплохо. У меня даже некоторые пациенты говорят: «Нет-нет, в математике я совсем не понимаю». Но головной мозг начинает очень интенсивно в этот момент работать. И поэтому математические упражнения прекрасно тренируют.
Но головной мозг начинает очень интенсивно в этот момент работать. И поэтому математические упражнения прекрасно тренируют.
Тамара Барковская:
Мы не просто вытаскиваем ту информацию, которая уже у нас есть, готовую, а прилагаем усилия, чтобы включить логическое мышление, в том числе алгебраическое.
Яна Горонок:
Так же, если мы ломаем шаблоны. Предположим, вы ходите на работу одним и тем же путем, постоянно проходя этот дом. Вы уже его даже не замечаете, сколько окон в этом доме, какого он цвета. Вы настолько привыкли к тому, что происходит вокруг, что даже не обращаете внимания. И мы начали с самого простого. Алгебраические упражнения. Я попросила каждое утро чистить зубы не правой рукой, а левой. И я попросила, что когда вы идете на работу, попробуйте немножко изменить маршрут и посмотрите, понаблюдайте. Вы не нацелены идти на работу, а посмотрите, что вокруг вас, что вы увидите нового. У меня был очень хороший пациент, и когда он пришел ко мне буквально через пару недель – результативность достаточно быстрая, но это будет зависеть от того, насколько вы к этому подойдете систематически и ответственно, – он мне сказал: «Я чищу зубы левой рукой, моюсь в ванне с выключенным светом и постоянно считаю примеры в голове». Я спросила: «Как ваша эффективность?» Он сказал: «Я даже не ожидал, что такие простые моменты, которые можно включить в нашу жизнь, могут так повлиять». У него даже улучшилось настроение. И плюс это его еще сподвигло на изучение нового языка. Он человек, достаточно в этом деле понимающий, и говорит: «Я просто почитал еще дополнительные статьи. Мне стало интересно: а что еще есть кроме того, что вы мне предложили? И я прочитал, что изучение нового языка».
Я спросила: «Как ваша эффективность?» Он сказал: «Я даже не ожидал, что такие простые моменты, которые можно включить в нашу жизнь, могут так повлиять». У него даже улучшилось настроение. И плюс это его еще сподвигло на изучение нового языка. Он человек, достаточно в этом деле понимающий, и говорит: «Я просто почитал еще дополнительные статьи. Мне стало интересно: а что еще есть кроме того, что вы мне предложили? И я прочитал, что изучение нового языка».
Тамара Барковская:
Получается, что изучение любого нового языка уже сама по себе нейробика?
Яна Горонок:
Абсолютно. И мне понравился такой подход. Через месяц человек ко мне снова приходит и говорит: «Знаете, новый язык мне почему-то дался очень тяжело, но я отметил, что на работе я стал более продуктивным, память моя улучшилась». То есть он не выучил даже этого языка, но за счет того, что он приобрел новый навык, головной мозг начал работать совершенно по-другому. И это очень интересно, потому что таким образом мы можем свой головной мозг сподвигнуть на новые идеи.
Тамара Барковская:
Это не только интересно, но и практическая ценность. Кстати, я могу заметить немаловажную вещь, что сейчас даже во многие современные тренинги, и бизнес-тренинги включена вот эта рекомендация: делайте ежедневно что-то новое для себя – так вы увеличите и усилите свою продуктивность, соответственно, все вытекающее из этого.
Яна Горонок:
Я абсолютно с этим согласна, потому что когда мы делаем на автопилоте уже все, не замечая все вокруг – происходит какой момент? Предположим, вы не тренируете свое тело, свой организм. Человек ходит на работу, возможно, он дома делает легкие упражнения, что маловероятно. Но в целом он ведет гиподинамичный образ жизни. Что происходит с мышцами? У них снижается тонус. Для мужчин это не совсем бывает характерно, не для всех, но женщины на это реагируют сильнее. И они сразу: «Так, лето, я пойду в тренажерный зал», то есть они начинают заниматься собой. Мышцы приходят в тонус. Мы сразу видим рельеф тела. Конечно, у нас сразу улучшается настроение. Это приносит нам эстетическое удовольствие. То же самое с головным мозгом. Если вы не тренируете головной мозг, со временем он вам может просто сказать: «Ты мной не занимаешься, почему я должен дальше тогда что-то для тебя делать?» Потому что наш организм работает на нас 24/7, просто без остановки.
Конечно, у нас сразу улучшается настроение. Это приносит нам эстетическое удовольствие. То же самое с головным мозгом. Если вы не тренируете головной мозг, со временем он вам может просто сказать: «Ты мной не занимаешься, почему я должен дальше тогда что-то для тебя делать?» Потому что наш организм работает на нас 24/7, просто без остановки.
Очень хороший клинический пример, когда ко мне один пациент пришел и сказал: «Знаете, доктор, я очень сильно боюсь выступать перед аудиторией». Мы немножко отклонились тогда от темы – он пришел вообще лечить позвоночник. Но мы с пациентами развиваем другие категории мышления. И таким образом у нас на приеме происходит та же нейробика, то есть от меня пациенты узнают что-то новое, они включаются в этот процесс, и они могут, познав что-то новое, улучшить деятельность своего головного мозга. И я просто ему тогда сказала: «А вы просто попробуйте. Просто сделайте. Без лишних мыслей». И это так приятно, когда люди приходят к тебе с обратной связью, что я это смог, я это сделал, и сейчас меня не остановить, потому что человек просто попробовал. Если нам на что-то тяжело решиться, я всегда советую один момент: сделайте такую установку в голове, словно это эксперимент. Вот вы сейчас такой, какой вы есть, и какой вы будете даже через две недели. Что вам понравится больше: вы прошлый или вы сейчас, человек, который приложил какие-то усилия для того, чтобы поработать над своим головным мозгом. Почему нет?
Если нам на что-то тяжело решиться, я всегда советую один момент: сделайте такую установку в голове, словно это эксперимент. Вот вы сейчас такой, какой вы есть, и какой вы будете даже через две недели. Что вам понравится больше: вы прошлый или вы сейчас, человек, который приложил какие-то усилия для того, чтобы поработать над своим головным мозгом. Почему нет?
Тамара Барковская:
Мне известно, что Вы работаете в тандеме с профессором Фединым Анатолием Ивановичем.
Яна Горонок:
С Анатолием Ивановичем мы работаем. К нам приходят, как правило, достаточно тяжелые случаи. Анатолий Иванович занимается еще и вопросами эпилепсии. Эпилепсия – это очень обширная тема. Она очень сложна. В Москве обычно у нас занимается отдельная структура – это врачи-эпилептологи. Но ранее все неврологи знали, что такое эпилепсия, как ее лечить. Сейчас ушло такое ответвление, есть узкий специалист, который называется эпилептолог.
Тамара Барковская:
Также совместно занимаетесь вопросами лечения позвоночника и связанных с этим уже патологических состояний, то есть восстанавливаете людей после травмы. Это входит в класс пациентов, с которыми Вы работаете совместно?
Это входит в класс пациентов, с которыми Вы работаете совместно?
Яна Горонок:
Да, это все входит. Но мы беседуем с пациентом. Предположим, я спрашиваю: «Как с вашей памятью дела?» Если человек говорит: «Все нормально, все хорошо, я все помню», – я иногда все-таки не настаиваю на этом.
Тамара Барковская:
То есть зависит от степени выраженности травмы и как она повлияла на психические процессы, неврологические звенья цепи?
Яна Горонок:
Абсолютно. Потому что для некоторых людей это может быть даже некий стресс. Я считаю, что все должно делаться в удовольствие. Но это зависит еще и от нас, от докторов, как мы это донесем. Многие пациенты не хотят заниматься физкультурой. Их можно понять. Я нашла хороший подход в этом плане, и я многим советую: с утра, когда вы еще даже не открыли глаза, просто начните двигать руками и ногами. Как правило, это всегда работает.
Тамара Барковская:
Включает немного?
Яна Горонок:
И людям это нравится, они потом включаются в этот процесс, и уже им хочется это делать. Не надо человека вводить в стресс, ни в коем случае.
Не надо человека вводить в стресс, ни в коем случае.
Тамара Барковская:
Давайте сейчас немножко структурируем и обозначим, какие есть четкие показания и какие есть противопоказания к гимнастике головного мозга – нейробике, и прежде всего при каких патологических процессах или заболеваниях мы используем нейробику и она дает хорошие результаты, и когда этого делать нельзя.
Яна Горонок:
Здесь самый удивительный и приятный момент, что никаких нет противопоказаний, а показания есть у всех.
Тамара Барковская:
Даже условно здоровые могут заниматься нейробикой абсолютно спокойно?
Яна Горонок:
Абсолютно, для того чтобы структурировать свое мышление, знания, улучшить память. Это один из моментов, который человека вдохновляет, то есть он может посредством этих упражнений, которые абсолютно не сложные, прийти к тому, что: ага, я вот это попробовал, а может быть, еще что-то? То есть он начинает включаться в процесс и сам даже придумывать что-либо, таким образом немножко и свою творческую сторону развивает.
Тамара Барковская:
Это действительно работает. Проверено на себе. Не вдаваясь в терминологию, какое-то время назад, я очень четко на себе увидела все необходимые эффекты от процессов внедрения каких-то новых действий в свою жизнь. Это действительно работает и дает высокую продуктивность во многом.
Яна Горонок:
Все верно. Это как выйти из зоны комфорта. Мы четко понимаем, что сейчас какая-то ситуация – мы должны действовать не так, как раньше. Вот в этом, кстати, есть и подводный камень, если мы говорим о людях более пожилого возраста, как правило, им немного сложнее.
Тамара Барковская:
Вот тут могу даже немножко поспорить с Вами с позиции своей специальности, поскольку все зависит еще от психотипа и от жизненных установок человека.
Яна Горонок:
Я не обобщаю ни в коем случае и согласна с Вами, потому что я знаю прекрасных женщин 65-75 и даже под 80 лет, которые ходят на танцы, которые поют в хоре, которые прекрасно выглядят, в отличной физической форме. Это все мы тоже видим в своей профессии.
Это все мы тоже видим в своей профессии.
Тамара Барковская:
Но если брать большинство, то здесь я соглашусь.
Яна Горонок:
Иногда людям определенной возрастной категории просто сложнее освоить компьютер, мобильные телефоны.
Тамара Барковская:
Цифровой век требует своих навыков и скорости, включения во все эти процессы, и она у всех разная.
Яна Горонок:
Раньше люди стояли в очередях и платили за квартиры. Может быть, кто-то помнит эти огромнейшие очереди. Сейчас достаточно ввести в мобильном телефоне – и квартира тут же может быть оплачена, то есть никуда не надо идти. Для кого-то это просто, для кого-то – как это можно в мобильном сделать быстро?
Тамара Барковская:
А кто-то по старинке оплачивает коммунальные услуги. Это больше возрастное поколение.
Яна Горонок:
Есть в Москве «Московское долголетие» – прекрасная программа, которая людей призывает к тому, чтобы встречаться, общаться, ходить на какие-то тренинги, танцевать, рисовать. Предположим, человек никогда не рисовал. И он думает: «Я плохо рисую». Я всегда задаю вопрос: «А почему вы думаете, что плохо рисуете?» – «Ну как же? Я же не могу нарисовать красивый пейзаж». А может быть, просто попробовать? Мы же не все художники с рождения. Это ведь тоже приобретение навыка. Предположим, когда-то я рисовала дом – это были просто линии, труба, окно со створками. А если я буду полчасика даже раз в неделю это совершенствовать, то я уже нарисую не четыре линии квадрата, а более объемно. Где-то я включу какой-то цвет, то есть здесь задействуется очень много зон.
Предположим, человек никогда не рисовал. И он думает: «Я плохо рисую». Я всегда задаю вопрос: «А почему вы думаете, что плохо рисуете?» – «Ну как же? Я же не могу нарисовать красивый пейзаж». А может быть, просто попробовать? Мы же не все художники с рождения. Это ведь тоже приобретение навыка. Предположим, когда-то я рисовала дом – это были просто линии, труба, окно со створками. А если я буду полчасика даже раз в неделю это совершенствовать, то я уже нарисую не четыре линии квадрата, а более объемно. Где-то я включу какой-то цвет, то есть здесь задействуется очень много зон.
Тамара Барковская:
Плюс еще арт-терапия психогенного свойства, также влияющая достаточно позитивно. И мы опять уклонились от вопроса показаний, противопоказаний. Давайте все-таки перечислим, потому что многие люди в процессе реабилитации не знают тех компонентов, которые не требуют особых сил, существенных денежных затрат. Какие категории в периоде реабилитации по заболеваемости очень хорошо идут в плане воздействия с помощью нейробики?
Яна Горонок:
Однозначно это люди после острых нарушений мозгового кровообращения. Но мы должны оценивать, потому что все-таки инсульт бывает разный. Мы можем наблюдать картину, когда человек просто лежит, и мы понимаем, что прогноз не совсем хороший. А есть такое, что человек как-то включается, быстро восстанавливается. Поэтому с моей точки зрения, нейробика актуальна будет для всех людей после инсульта.
Но мы должны оценивать, потому что все-таки инсульт бывает разный. Мы можем наблюдать картину, когда человек просто лежит, и мы понимаем, что прогноз не совсем хороший. А есть такое, что человек как-то включается, быстро восстанавливается. Поэтому с моей точки зрения, нейробика актуальна будет для всех людей после инсульта.
Нейробика актуальна для всех людей после инсульта.
Тамара Барковская:
При любой выраженности постинсультной симптоматики, если постепенно включаться во все эти процессы, эффект однозначно будет. Другой вопрос, что у тех, кто с умеренно выраженной симптоматикой, быстрее положительную динамику мы отметим. Но те люди, которые находятся в тяжелом состоянии после инсульта, с высокой степенью обездвиженности, постепенно с помощью физических упражнений восстанавливается мышечный корсет, усиливается объем движений, и вслед за этим можно тренировать головной мозг.
Яна Горонок:
Я соглашусь по поводу того, что мы тренируем и физические навыки. Ведь физический навык тоже напрямую связан с головным мозгом. Даже у нас в реабилитационном центре есть специализированный стол для пациентов, у которых есть проблемы с мелкой моторикой. Среди своих это называется «пальцовка», когда мы определенными движениями задаем темп головному мозгу. И, кстати, для всех кофеманов очень хороший лайфхак, когда мы вместо кофе делаем упражнения посредством рук.
Ведь физический навык тоже напрямую связан с головным мозгом. Даже у нас в реабилитационном центре есть специализированный стол для пациентов, у которых есть проблемы с мелкой моторикой. Среди своих это называется «пальцовка», когда мы определенными движениями задаем темп головному мозгу. И, кстати, для всех кофеманов очень хороший лайфхак, когда мы вместо кофе делаем упражнения посредством рук.
Тамара Барковская:
Вы должны будете меня научить после эфира этому.
Яна Горонок:
Даже самые простые, то есть когда мы давим в область пальцев, точечная стимуляция. Причем это мы можем делать очень быстро. Мы можем делать это сначала медленно. Но вы не представляете, когда начинаете тренироваться, вы видите, какой прогресс в этом. Это тоже всегда очень радует людей.
Тамара Барковская:
Какие эффекты я получу, как кофеман после этой тренировки?
Яна Горонок:
Вы взбодритесь. Это будет большая бодрость, чем Вы выпьете кофе.
Это будет большая бодрость, чем Вы выпьете кофе.
Тамара Барковская:
Без внешних стимуляторов?
Яна Горонок:
Да. Причем такие упражнения, когда мы переставляем с одной стороны в другую, это бывает сложно. Честно сказать, даже я иногда не могу это быстро сделать. Но когда вы постоянно тренируетесь, это быстрее включает механизмы бодрости.
Тамара Барковская:
Кстати, школа скорочтения использует эти пальцевые техники для усиления скорости чтения.
Яна Горонок:
По методу Брайля ведь есть техника – жестовая техника. И в нейробике один из пунктов – как жестами можно передать какие-то слова, непосредственно буквенные обозначения. Это тоже очень важно. Глухонемые передают жесты, они в этом плане люди очень мудрые, у них головной мозг работает очень хорошо. Люди слепые постоянно водят руками и читают текст посредством рук – у них очень хороший слух, то есть это как компенсация.
Тамара Барковская:
Компенсаторно акценты смещаются и что-то концентрированно усиливается в навыках. Значит, первая категория – это с различной степенью нарушения мозгового кровообращения. Кто еще?
Яна Горонок:
Прекрасно идет даже и при Альцгеймере, но тут уже более глубокая патология. Понятное дело, нейробика не будет как панацея, это будет одно из составляющих упражнений. При болезни Паркинсона прекрасно тоже идет. Совсем недавно к нам прилетал пациент из Дагестана, у него наследственное, то есть у братьев, у отца – у всех был Паркинсон. Не часто ты сталкиваешься с пациентами, у которых симптоматика, как в учебнике. И я посмотрела, думаю: надо же, болезнь Паркинсона, 72 года, при этом прекрасно мыслит, отличная память. Единственное – тремор, поза просящего, очень часто бывает шаркающая походка. И я у него спросила: «Скажите, что вы делаете?» Он говорит: «У нас же горы». Он очень много двигается. Посредством этого человек смог еще задать и темп своему головному мозгу. Плюс посредством того, что он двигается, он созерцает. У них эта красота, горы, чистый воздух. И это тоже говорит о том, что кроме того, что мы тренируем головной мозг, мы еще тренируем и свою физическую составляющую. Не нужно забывать, что мы не голова отдельно, тело отдельно.
Плюс посредством того, что он двигается, он созерцает. У них эта красота, горы, чистый воздух. И это тоже говорит о том, что кроме того, что мы тренируем головной мозг, мы еще тренируем и свою физическую составляющую. Не нужно забывать, что мы не голова отдельно, тело отдельно.
Тамара Барковская:
Мы функционируем, как единый организм. Что касается случаев с травмами (черепно-мозговые травмы, травмы позвоночника) – всех ли уровней показана нейробика? Немножко поясните здесь, потому что очень много и в зимний период травм встречается, никто не исключает аварии на дорогах, есть большая категория пациентов, которые связаны с травматическими процессами. Здесь в какой степени играет роль нейропластичность и как она восстанавливается?
Яна Горонок:
Мы не говорим про открытые и сложные черепно-мозговые травмы. Это в основном закрытые черепно-мозговые травмы, легкие, сотрясения головного мозга. Здесь будет актуально. Когда сотрясение головного мозга, кто это претерпевал, прекрасно знают, насколько не до нейробики, потому что у человека идет проявление тошноты и головокружения. Но уже в дальнейшем мы можем подключить, потому что после мозговых травм люди приходят с астеническими синдромами. У них часто бывает утомляемость, плохо усваивается материал, даже если молодежь, которые учатся в университетах. Вот здесь можно подключить, для того чтобы головному мозгу задать тот темп, который был, но очень аккуратно, не вводя в стресс.
Но уже в дальнейшем мы можем подключить, потому что после мозговых травм люди приходят с астеническими синдромами. У них часто бывает утомляемость, плохо усваивается материал, даже если молодежь, которые учатся в университетах. Вот здесь можно подключить, для того чтобы головному мозгу задать тот темп, который был, но очень аккуратно, не вводя в стресс.
Тамара Барковская:
А что касается основных травм по опорно-двигательному аппарату? Позвоночник – там же могут затрагиваться разные отделы.
Яна Горонок:
Если это спинальные травмы, даже возьмем банальные боли в спине, хроническую боль, как правило, здесь вступает и психологический момент. Человек постоянно испытывает боль. Она уже ушла не на периферию, а в центр. Можно попробовать задействовать нейробику – это немного человека разгрузит и отвлечет, потому что нейробика сама по себе повышает стрессоустойчивость. И человек уже к своей боли будет относиться по-другому, потому что хронизация – это искажение восприятия боли. Как правило, применяют антидепрессанты, для того чтобы разорвать этот порочный круг. Но можно попробовать избежать этого.
Как правило, применяют антидепрессанты, для того чтобы разорвать этот порочный круг. Но можно попробовать избежать этого.
Тамара Барковская:
Мы подошли к очень интересным состояниям – к боли в спине на разных уровнях: откуда это все берется и как влияет на это все нейробика. Я думаю, что мы сделаем цикл программ по этой теме, чтобы охватить все показания, всех пациентов, которые нуждаются в этом немаловажном процессе и в этом тренинге, который для многих неизвестен, даже среди врачей. Поэтому я предлагаю еще раз встретиться и поговорить в последующих эфирах. Уважаемые зрители и слушатели, с вами были Тамара Барковская и Яна Горонок – врач-невролог, вертебролог, реабилитолог. Всего доброго!
связь с нейродегенерацией и синаптической дисфункцией – тема научной статьи по фундаментальной медицине читайте бесплатно текст научно-исследовательской работы в электронной библиотеке КиберЛенинка
УДК 591. 28
28
Метаболизм холестерина мозга и его нарушения: связь с нейродегенерацией и синаптической дисфункцией
А. М. Петров*, М. Р. Касимов, А. Л. Зефиров
Казанский государственный медицинский университет МЗ РФ, кафедра нормальной физиологии, 420012, Казань, ул. Бутлерова, 49 *E-mail: fysio@rambler.ru Поступила в редакцию 11.09.2015
РЕФЕРАТ Холестерин биологических мембран является не только важным структурным компонентом, но и принимает участие в компартментализации и сигнализации. Особенно высоко содержание холестерина в мозге, где он концентрируется в миелине и синаптических мембранах. Исследования последних лет указывают на особое значение холестерина в осуществлении синаптической передачи, также предполагается наличие взаимосвязей между изменениями гомеостаза холестерина и дисфункциями нервной системы. Нарушение синтеза, утилизации и транспорта холестерина в мозге наблюдается при многих нейродегенеративных заболеваниях. Однако до сих пор непонятно, на каком этапе происходят альтерации метаболизма холестерина и какое место это занимает в патогенезе. Одной из причин когнитивных нарушений и массивной нейродегенерации могут быть процессы, связанные с дефектами синаптической передачи. При этом аномалии в обмене холестерина могут выступать в роли пусковых факторов развития дисбаланса синаптической передачи. В данном обзоре мы сфокусировались на описании гомеостаза мозгового холестерина в норме и при ряде патологий (болезни Гентингтона, Нимана-Пика типа С, синдроме Смита-Лемли-Опица), рассмотрели возможные механизмы влияния мембранного холестерина на синаптические процессы. Нарушения обмена холестерина при болезни Альцгеймера, Паркинсона и расстройствах аутистического спектра будут рассмотрены в следующей статье.
Нарушение синтеза, утилизации и транспорта холестерина в мозге наблюдается при многих нейродегенеративных заболеваниях. Однако до сих пор непонятно, на каком этапе происходят альтерации метаболизма холестерина и какое место это занимает в патогенезе. Одной из причин когнитивных нарушений и массивной нейродегенерации могут быть процессы, связанные с дефектами синаптической передачи. При этом аномалии в обмене холестерина могут выступать в роли пусковых факторов развития дисбаланса синаптической передачи. В данном обзоре мы сфокусировались на описании гомеостаза мозгового холестерина в норме и при ряде патологий (болезни Гентингтона, Нимана-Пика типа С, синдроме Смита-Лемли-Опица), рассмотрели возможные механизмы влияния мембранного холестерина на синаптические процессы. Нарушения обмена холестерина при болезни Альцгеймера, Паркинсона и расстройствах аутистического спектра будут рассмотрены в следующей статье.
КЛЮЧЕВЫЕ СЛОВА липидные рафты, нейродегенеративные заболевания, оксистеролы, синаптическая передача, холестерин.
СПИСОК СОКРАЩЕНИЙ ABC — АТР-связывающие кассетные транспортеры; ACAT1 — ацетил-СоА-хо-лестерин-ацилтрансфераза; ApoE — аполипопротеин E; BDNF — нейротрофический фактор мозга; ГМГ-СоА — 3-гидрокси-3-метилглутарил-СоА; ГХ — гидроксихолестерин; ГЭБ — гематоэнцефалический барьер; Dhcr7 — 7-дегидрохолестеролредуктаза; LDL-рецептор — рецептор липопротеинов низкой плотности; LRP -белок, подобный рецептору LDL; LX-рецептор — печеночный рецептор Х; МЦД — метил-Р-циклодекстрин; СYP46A1 — холестерин-24-гидроксилаза; CYP27A1 — холестерин-27-гидроксилаза; CYP7B1 — оксистерол-7а-гидролаза; ЭПР — эндоплазматический ретикулум.
БАЛАНС ХОЛЕСТЕРИНА В МОЗГЕ
Общие сведения об источниках холестерина в мозге
Холестерин — основной липидный компонент мозга (23-25% всего холестерина сосредоточено в мозге), содержание которого поддерживается на уровне 15-30 мг/г ткани, средний показатель в других тканях — 2-3 мг/г [1]. В течение эволюции холестерин приобрел специфические функции в ЦНС. Обогащенные холестерином миелиновые муфты
В течение эволюции холестерин приобрел специфические функции в ЦНС. Обогащенные холестерином миелиновые муфты
уменьшают проницаемость для ионов, позволяя электрическим импульсам распространяться вдоль аксонов с высокой скоростью. Изобилие холестерина в синаптических мембранах необходимо для формирования и стабилизации синаптического контакта, осуществления нейропередачи. Продукция холестерина является лимитирующим фактором роста нервных отростков [2, 3].
В клетках млекопитающих холестерин синтезируется при участии более 30 ферментов. Вне ЦНС холестерин образуется как эндогенно (около 50-60%),
так и захватывается из липопротеинов (с усвоенными из пищи липидами), циркулирующих в крови. Однако липопротеины плазмы не проникают (или очень слабо проникают) через гематоэнцефалический барьер (ГЭБ), и почти весь (более 95%) холестерин мозга синтезируется in situ преимущественно в глиальных клетках [1]. Интенсивное проникновение стеролов из плазмы в мозг наблюдается только при нарушении ГЭБ [4]. Частичное нарушение проницаемости ГЭБ может происходить в процессе старения. Более выраженные повреждения ГЭБ выявлены при ней-родегенеративных заболеваниях, что способствует развитию патологии [5, 6]. Так, у мышей с дефицитом перицитов, важного компонента ГЭБ, возникает прогрессирующая с возрастом нейродегенерация [4, 6].
Интенсивное проникновение стеролов из плазмы в мозг наблюдается только при нарушении ГЭБ [4]. Частичное нарушение проницаемости ГЭБ может происходить в процессе старения. Более выраженные повреждения ГЭБ выявлены при ней-родегенеративных заболеваниях, что способствует развитию патологии [5, 6]. Так, у мышей с дефицитом перицитов, важного компонента ГЭБ, возникает прогрессирующая с возрастом нейродегенерация [4, 6].
Холестерин мозга сосредоточен в двух основных пулах. Меньший по размеру относительно быстро метаболизирующийся пул (время жизни 5-10 месяцев, 8 мг/г) представлен холестерином плазматических мембран нейронов (10%) и глии (20%). Большая часть (70%) холестерина ЦНС содержится в миелине (40 мг/г) и метаболически стабильна (время жизни ~ 5 лет) [7]. Максимальный синтез холестерина происходит во время активной миелинизации (первые недели-месяцы постнатального развития) мозга олигодендроцитами. При этом олигодендроциты используют для синтеза холестерина кетоновые тела (за счет метаболизирующих кетоны ферментов), концентрация которых в крови на порядок выше в период миелинизации. Если специфично нарушить синтез холестерина в олигодендроцитах, то они начнут захватывать холестерин из внеклеточных источников, но скорость миелинизации будет крайне медленной [8]. После завершения миелинизации синтез холестерина снижается на 90% и в зрелом мозге протекает с низкой интенсивностью преимущественно в астроцитах, а также в 5 раз медленнее — в нейронах [1]. Нейроны производят холестерин, необходимый для выживания, дифференцировки аксонов и ден-дритов, формирования новых «неэффективных» синапсов. Стимулировать образование холестерина нейронами может нейротрофический фактор мозга (BDNF) [9]. Для масштабного формирования функциональных синапсов (особенно пресинаптических частей, удаленных от сомы) требуется холестерин астроцитарного происхождения. Нейроны в культуре проявляют в 10 раз больше возбуждающей синаптической активности и образуют в 5-7 раз больше синапсов в присутствии астроцитов, что частично связано с продукцией холестерина астро-цитами. В целом, продукция холестерина нейронами важна на ранних стадиях развития мозга, тогда как для взрослого организма не требуется синтез холестерина нейронами [1, 7].
Если специфично нарушить синтез холестерина в олигодендроцитах, то они начнут захватывать холестерин из внеклеточных источников, но скорость миелинизации будет крайне медленной [8]. После завершения миелинизации синтез холестерина снижается на 90% и в зрелом мозге протекает с низкой интенсивностью преимущественно в астроцитах, а также в 5 раз медленнее — в нейронах [1]. Нейроны производят холестерин, необходимый для выживания, дифференцировки аксонов и ден-дритов, формирования новых «неэффективных» синапсов. Стимулировать образование холестерина нейронами может нейротрофический фактор мозга (BDNF) [9]. Для масштабного формирования функциональных синапсов (особенно пресинаптических частей, удаленных от сомы) требуется холестерин астроцитарного происхождения. Нейроны в культуре проявляют в 10 раз больше возбуждающей синаптической активности и образуют в 5-7 раз больше синапсов в присутствии астроцитов, что частично связано с продукцией холестерина астро-цитами. В целом, продукция холестерина нейронами важна на ранних стадиях развития мозга, тогда как для взрослого организма не требуется синтез холестерина нейронами [1, 7].
Регуляция синтеза холестерина
Синтез холестерина начинается с превращения ацетил-СоА ферментом ГМГ-СоА-синтетазой в 3-гидрокси-3-метилглутарил-СоА (ГМГ-СоА), который затем конвертируется ГМГ-СоА-редуктазой в мевалонат. Последняя реакция представляет собой лимитирующий и необратимый этап биосинтеза холестерина, который ингибируется статинами. Существуют два пути синтеза холестерина (рис. 1). В нейронах обнаруживаются преимущественно стеролы, принадлежащие к пути Kandutsch-Russell (7-дегидрохолестерин, ланостерол), тогда как в астроцитах — к пути Bloch (десмостерол) [10]. Холестерин синтезируется на территории эндоплаз-матического ретикулума (ЭПР). Причем содержание холестерина в ЭПР подвержено более сильным колебаниям, чем в плазматической мембране, и именно от концентрации холестерина в ЭПР зависит его синтез клеткой. ЭПР содержит неактивный связанный с мембраной фактор транскрипции SREBP-2 (белок, связывающий регулируемый стеролами элемент), который взаимодействует с неактивной протеа-зой SCAP (белок, расщепляющий и активирующий SREBP), содержащей чувствительный к холестерину домен. Когда холестерина много, комплекс SREBP-2/ SCAP удерживается в ЭПР молекулами INSIG-1 и -2 (белки 1 и 2, индуцируемые инсулином). При снижении содержания холестерина в ЭПР INSIG отсоединятся от комплекса SREBP-2/SCAP, при этом комплекс направляется в аппарат Гольджи, где SREBP-2 расщепляется протеазой SCAP с образованием активного несвязанного с мембраной N-концевого домена SREBP-2, проникающего в ядро и запускающего экспрессию более 30 генов, содержащих SRE (элемент, регулируемый стеролами) в промоторной области и ответственных за синтез холестерина (рис. 2) [1, 10-12].
Когда холестерина много, комплекс SREBP-2/ SCAP удерживается в ЭПР молекулами INSIG-1 и -2 (белки 1 и 2, индуцируемые инсулином). При снижении содержания холестерина в ЭПР INSIG отсоединятся от комплекса SREBP-2/SCAP, при этом комплекс направляется в аппарат Гольджи, где SREBP-2 расщепляется протеазой SCAP с образованием активного несвязанного с мембраной N-концевого домена SREBP-2, проникающего в ядро и запускающего экспрессию более 30 генов, содержащих SRE (элемент, регулируемый стеролами) в промоторной области и ответственных за синтез холестерина (рис. 2) [1, 10-12].
При дефиците SCAP содержание холестерина в мозге снижается на 30-40%, что сопровождается нарушением синаптической передачи [13]. Мутация SCAP в астроцитах ведет к микроцефалии, моторным и поведенческим дефектам, которые можно снизить, увеличив потребление холестерина с пищей [14]. Отсутствие SCAP в шванновских клетках вызывает задержку формирования миелина с типичными неврологическими симптомами, тремором и атакти-ческой походкой [15]. Блокирование синтеза холестерина снижает экспрессию ряда белков, образующих комплексы с холестерином, например, основных белков миелина [8].
Блокирование синтеза холестерина снижает экспрессию ряда белков, образующих комплексы с холестерином, например, основных белков миелина [8].
Однажды синтезированный холестерин покидает ЭПР везикулярным и невезикулярным путем (при участии переносчиков) и направляется в плазматическую мембрану, в результате в ЭПР поддержи-
Глюкоза
гликолиз
Долихилпирофосфат
Убихинон ■
Геранилгеранилпирофосфат-
Пренилирование белков
желчные кислоты
— Ацил-СоА+ Ацил-СоА
\ ГМГ-СоА-синтаза
ГМГ-СоА
| ГМГ-СоА-редуктаза Мевалонат
Фарнезилпирофосфат
Сквален
| Скваленэпоксидаза Ланостерол
-окисление
Пальмитат
путь Bloch
Зимостерол 7-дегидродесмостерол
|DHCR7 Десмостерол
DHCR24
CYP46A1
24-гидроксихолестерин
Холестерин АФК
ферменты
путь Kandutsch-Russell
24,25-дигидроланостерол Местенол Латостерол 7-дегидрохолестерин
7-дегидрохолестерол-редуктаза ACAT1 ш
■ Эфиры холестерина
CYP27A1
27-гидроксихолестерин
Холестан-3в,5а,6в-триол
Дендрогенины
3в,7а-дигидроксихолест-5-ен-26-овая кислота
7а-гидроксихолестерин холестерол- 7в-гидроксихолестерин эпоксид-
, гидролаза 5,6а-эпоксихолестерин 5,6в-эпоксихолестерин
7-кетохолестерин 3в-гидроксихолест-5-ен-26-овая
CYP7B1
кислота
Протекция
Токсичность
Рис.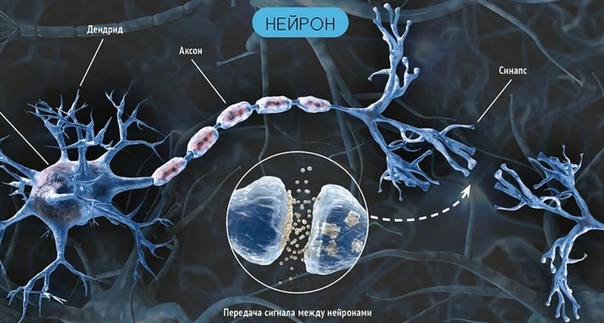 1. Синтез холестерина и образование оксистеролов. Холестерин образуется из ацетил-СоА в ходе многоступенчатого ферментативного процесса. Известны два пути синтеза холестерина, Bloch и Kandutsch-Russell. Холестерин может депонироваться в виде эфиров или окисляться ферментативным и неферментативным путем с образованием оксистеролов. Описано большое разнообразие оксистеролов, каждый из которых может специфически влиять на клеточные процессы. Подробные объяснения в тексте
1. Синтез холестерина и образование оксистеролов. Холестерин образуется из ацетил-СоА в ходе многоступенчатого ферментативного процесса. Известны два пути синтеза холестерина, Bloch и Kandutsch-Russell. Холестерин может депонироваться в виде эфиров или окисляться ферментативным и неферментативным путем с образованием оксистеролов. Описано большое разнообразие оксистеролов, каждый из которых может специфически влиять на клеточные процессы. Подробные объяснения в тексте
вается низкий уровень холестерина. Образование контакта между ЭПР и плазматической мембраной может быть кратчайшим путем транспорта липидов из мест синтеза к поверхности клетки [11, 16].
Депонирование, эфиры холестерина
В нейронах и других клетках избыток холестерина может превращаться в эфиры холестерина. Во взрослом мозге ~1% холестерина представлен эфирами и входит в состав липидных капель. Кратковременный пик этерификации, которой подвергаются более 5% холестерина, наблюдается в отдельном регионе мозга в начале периода миелиниза-ции. Эфиры холестерина могут служить резервом, который используется при миелинизации и формировании синаптических контактов. Накопление эфиров может быть связано с увеличением активности ацетил-СоА-холестерин-ацилтрансферазы (ACAT1/SOAT1), вызванного повышением уровня холестерина в ЭПР. Ингибирование ACAT1 сильно (на 86%) снижает концентрацию эфиров холестерина. Нейротоксичные компоненты и окислительный стресс, наоборот, увеличивают активность АСАТ1 [17]. ACAT1 более активна в нейронах, чем в глиаль-ных клетках. Однако в астроцитах ACAT1 активируется при нарушении выброса холестерина или перегрузки экзогенным холестерином [18]. Основной субстрат для этерификации холестерина поставляет фермент ЭПР стерол-СоА-десатураза, которая катализирует синтез мононенасыщенных жирных кислот из насыщенных жирных кислот [11].
Кратковременный пик этерификации, которой подвергаются более 5% холестерина, наблюдается в отдельном регионе мозга в начале периода миелиниза-ции. Эфиры холестерина могут служить резервом, который используется при миелинизации и формировании синаптических контактов. Накопление эфиров может быть связано с увеличением активности ацетил-СоА-холестерин-ацилтрансферазы (ACAT1/SOAT1), вызванного повышением уровня холестерина в ЭПР. Ингибирование ACAT1 сильно (на 86%) снижает концентрацию эфиров холестерина. Нейротоксичные компоненты и окислительный стресс, наоборот, увеличивают активность АСАТ1 [17]. ACAT1 более активна в нейронах, чем в глиаль-ных клетках. Однако в астроцитах ACAT1 активируется при нарушении выброса холестерина или перегрузки экзогенным холестерином [18]. Основной субстрат для этерификации холестерина поставляет фермент ЭПР стерол-СоА-десатураза, которая катализирует синтез мононенасыщенных жирных кислот из насыщенных жирных кислот [11].
В клетке эфиры холестерина постоянно разрушаются гидролазой.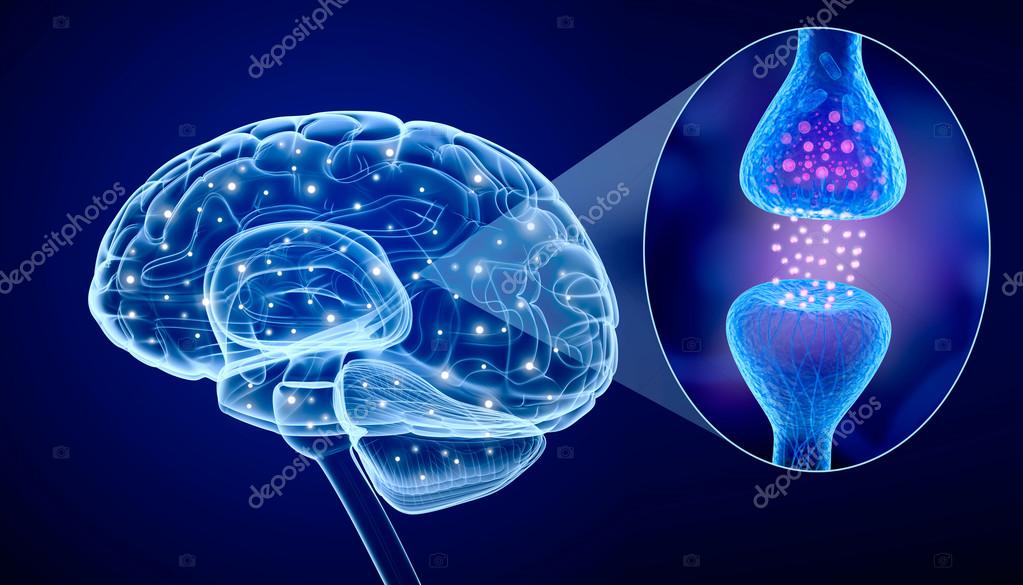 В норме уровень эфиров холестерина в мозге низкий и гидролаза способна превращать их в холестерин. При значительном повышении концентрации эфиров гидролаза «не справляется», и эфиры холестерина образуют липидные капли в цитоплазме нейронов [1].
В норме уровень эфиров холестерина в мозге низкий и гидролаза способна превращать их в холестерин. При значительном повышении концентрации эфиров гидролаза «не справляется», и эфиры холестерина образуют липидные капли в цитоплазме нейронов [1].
Межклеточный транспорт холестерина
Для транспорта холестерина мозг использует свои собственные липопротеины, состоящие из апо-липопротеинов (в основном E, 39 кДа) и липидов. Астроциты — главные продуценты холестерина и аполипопротеина Е (ApoE), которые вместе с фосфолипидами собираются в липопротеиновые комплексы (ApoE-частицы) (рис. 2). Сердцевина липопротеиновых частиц собирается в ЭПР, а обогащение липидами и секреция ApoE-частиц осуществляются с помощью одного или нескольких АТР-связывающих кассетных транспортеров (ABC), таких, как ABCA1, ABCG1 и ABCG4 [19-21]. ABCA1 катализирует начальную стадию переноса липидов на «свободные» аполипопротеины, формируя «рож-
дающиеся» частицы, которые затем полностью «наполняются» липидами и выбрасываются из клетки на второй стадии процесса с участием ABCG1/ ABCA1 [22]. Недостаточно обогащенные липидами частицы (например, при дефиците ABCA1) быстрее катаболизируются, что сопровождается снижением уровня ApoE в мозге. Инактивация ABCA1 в мозге вызывает астроглиоз и усиление экспрессии воспалительных генов, а также изменяет синаптическую передачу и сенсомоторное поведение [23].
Недостаточно обогащенные липидами частицы (например, при дефиците ABCA1) быстрее катаболизируются, что сопровождается снижением уровня ApoE в мозге. Инактивация ABCA1 в мозге вызывает астроглиоз и усиление экспрессии воспалительных генов, а также изменяет синаптическую передачу и сенсомоторное поведение [23].
Главными потребителями липопротеинов являются нейроны, которые захватывают липопротеины с помощью рецепторов, принадлежащих к семейству рецепторов липопротеинов низкой плотности: LDL-рецепторы и белки, подобные LDL-рецепторам (LRP, LRP1B, LRP2/мегалин, LRP4, LRP5/6, LRP8/ APOER2, LRP11/SORL1). Эти рецепторы связывают также белки, участвующие в развитии мозга (Sonic hedgehog, Wnt, релин), протеазы и ингибиторы про-теаз (а2-макроглобин), переносчики витаминов, ша-пероны, медиаторы воспаления [21]. Основной рецептор, опосредующий захват ApoE-частиц — LRP1, характеризуется высокой транспортной емкостью за счет высокой скорости эндоцитозного рециклирования (рис. 2). LRP1 экспрессируется преимущественно в нейронах, а рецептор LDL — в глии [24]. Делеция LRP1 в нейронах ведет к глобальному нарушению метаболизма холестерина и нейродеге-нерации [25]. После рецептор-опосредованного эн-доцитоза везикулы доставляют липидные частицы в поздние эндосомы/лизосомы. Сразу после эндо-цитоза ApoE отделяется от липидных компонентов и не направляется в лизосомы, а возвращается обратно на поверхность, т.е. подвергается рецикли-зации (рис. 2) [26]. Холестерин покидает поздние эндосомы/лизосомы при участии белков NPC1 и NPC2 и направляется в плазматическую мембрану или мембрану ЭПР, содержанием холестерина в которой по принципу отрицательной обратной связи (через путь SREBP-2/SCAP/INSIG-1) регулируются гены, вовлеченные в гомеостаз холестерина [16]. Предполагается, что в полости эндолизосомы холестерин связывается с NPC2 (трансмембранный белок), а затем взаимодействует с NPC1 (внутри-люменальный белок). В итоге холестерин оказывается огражденным от водной среды белками NPC1 и NPC2, после чего перебрасывается в ЭПР или плазматическую мембрану [27].
2). LRP1 экспрессируется преимущественно в нейронах, а рецептор LDL — в глии [24]. Делеция LRP1 в нейронах ведет к глобальному нарушению метаболизма холестерина и нейродеге-нерации [25]. После рецептор-опосредованного эн-доцитоза везикулы доставляют липидные частицы в поздние эндосомы/лизосомы. Сразу после эндо-цитоза ApoE отделяется от липидных компонентов и не направляется в лизосомы, а возвращается обратно на поверхность, т.е. подвергается рецикли-зации (рис. 2) [26]. Холестерин покидает поздние эндосомы/лизосомы при участии белков NPC1 и NPC2 и направляется в плазматическую мембрану или мембрану ЭПР, содержанием холестерина в которой по принципу отрицательной обратной связи (через путь SREBP-2/SCAP/INSIG-1) регулируются гены, вовлеченные в гомеостаз холестерина [16]. Предполагается, что в полости эндолизосомы холестерин связывается с NPC2 (трансмембранный белок), а затем взаимодействует с NPC1 (внутри-люменальный белок). В итоге холестерин оказывается огражденным от водной среды белками NPC1 и NPC2, после чего перебрасывается в ЭПР или плазматическую мембрану [27].
Взаимодействие между ApoE-частицами и рецепторами запускает пути внутриклеточной сигнализации, что важно для нормального функционирования и выживания нейронов [20, 21]. Например, синтез ApoE глиальными клетками более чем в 150 раз ускоряет репарацию нерва после повреждения [28].
ФерментЫ,
Нейрон
Рис. 2. Метаболизм холестерина в мозге. Нейрон-глиальные отношения. Основное количество холестерина (Х) во взрослом мозге продуцируется астроцитами с помощью ферментов эндоплазматического ретикулума (ЭПР). Синтез холестерина регулируется белками 1№Ю, SREBP и SCAP. При высоком уровне холестерина все белки удерживаются в составе комплекса в ЭПР, а снижение уровня холестерина вызывает распад комплекса, перемещение SREBP и SCAP в комплекс Гольджи, где протеаза SCAP отщепляет от SREBP активный фактор транскрипции, проникающий в ядро и запускающий экспрессию генов, отвечающих за синтез и транспорт холестерина. На территории ЭПР собирается липопротеиновая частица с АроЕ, которая попадает в эндосомы и секретируется во внеклеточную среду. Вновь синтезированный холестерин невезикулярным путем с помощью АТР-связывающих кассетных транспортеров (АВСА1) переносится из ЭПР в эндосомы или во внеклеточную среду. Инкрустированные холестерином АроЕ-частицы взаимодействуют с рецепторами на нейронах (LRP1), захватываются посредством эндоцитоза и направляются в лизосомы/поздние эндосомы. В эндолизосомах холестерин при участии белков №С1 и 2 перемещается в плазматическую мембрану или в ЭПР. В доставке холестерина в плазматическую мембрану принимает участие кавеолин-1 (Cav-1). В ЭПР находится СYP46A1, окисляющий холестерин до 24-гидроксихоле-стерина (24-ГХ), способного проникать через гематоэнцефалический барьер (ГЭБ) и попадать в циркуляцию, где связывается с липопротеинами низкой и высокой плотности (ЛНП, ЛВП). Избыток 24-ГХ в крови может окислять липопротеины плазмы (О-ЛП), которые с помощью скавенджер-рецептора ^-Р) могут аккумулироваться в лейкоцитах.
На территории ЭПР собирается липопротеиновая частица с АроЕ, которая попадает в эндосомы и секретируется во внеклеточную среду. Вновь синтезированный холестерин невезикулярным путем с помощью АТР-связывающих кассетных транспортеров (АВСА1) переносится из ЭПР в эндосомы или во внеклеточную среду. Инкрустированные холестерином АроЕ-частицы взаимодействуют с рецепторами на нейронах (LRP1), захватываются посредством эндоцитоза и направляются в лизосомы/поздние эндосомы. В эндолизосомах холестерин при участии белков №С1 и 2 перемещается в плазматическую мембрану или в ЭПР. В доставке холестерина в плазматическую мембрану принимает участие кавеолин-1 (Cav-1). В ЭПР находится СYP46A1, окисляющий холестерин до 24-гидроксихоле-стерина (24-ГХ), способного проникать через гематоэнцефалический барьер (ГЭБ) и попадать в циркуляцию, где связывается с липопротеинами низкой и высокой плотности (ЛНП, ЛВП). Избыток 24-ГХ в крови может окислять липопротеины плазмы (О-ЛП), которые с помощью скавенджер-рецептора ^-Р) могут аккумулироваться в лейкоцитах. Х-рецептор проникает в ядро и индуцирует экспрессию генов АроЕ и АВСА1, способствующих доставке холестерина из астроцитов в нейроны. Часть холестерина в составе комплексов с АроА1 может выбрасываться из нейронов и перебрасываться через ГЭБ. Избыток холестерина в ЭПР подвергается этерификации при участии фермента АСАТ1, образующиеся эфиры холестерина откладываются в виде капель в цитоплазме. Фермент стерол-СоА-десатураза (SCD) поставляет мононенасыщенные жирные кислоты для этерификации холестерина. Образование эфиров холестерина (в составе АроЕ-частиц, АроЕ-ХЭ) во внеклеточной среде связано с ферментом LCAT, секретируемым астроцитами. В митохондриях многих клеток (в частности, макрофагов) присутствует фермент CYP27A1, окисляющий холестерин до 27-гидроксихолестерина (27-ГХ), который может проникать в мозг через ГЭБ и менее эффективно, чем 24-ГХ, активировать LX-рецептор. 27-ГХ может преобразовываться ферментом нейронов CYP7B1 в 7а-гидрокси-3-оксо-4-холестеновую кислоту (ХК), которая выбрасывается из мозга в циркуляцию.
Х-рецептор проникает в ядро и индуцирует экспрессию генов АроЕ и АВСА1, способствующих доставке холестерина из астроцитов в нейроны. Часть холестерина в составе комплексов с АроА1 может выбрасываться из нейронов и перебрасываться через ГЭБ. Избыток холестерина в ЭПР подвергается этерификации при участии фермента АСАТ1, образующиеся эфиры холестерина откладываются в виде капель в цитоплазме. Фермент стерол-СоА-десатураза (SCD) поставляет мононенасыщенные жирные кислоты для этерификации холестерина. Образование эфиров холестерина (в составе АроЕ-частиц, АроЕ-ХЭ) во внеклеточной среде связано с ферментом LCAT, секретируемым астроцитами. В митохондриях многих клеток (в частности, макрофагов) присутствует фермент CYP27A1, окисляющий холестерин до 27-гидроксихолестерина (27-ГХ), который может проникать в мозг через ГЭБ и менее эффективно, чем 24-ГХ, активировать LX-рецептор. 27-ГХ может преобразовываться ферментом нейронов CYP7B1 в 7а-гидрокси-3-оксо-4-холестеновую кислоту (ХК), которая выбрасывается из мозга в циркуляцию. Хотя ГЭБ не пропускает холестерин крови в мозг, эндотелиальные клетки ГЭБ содержат АВС-транспортеры, LRP1 и S-Р, что указывает на существование путей взаимного влияния мозгового и периферического холестерина
Хотя ГЭБ не пропускает холестерин крови в мозг, эндотелиальные клетки ГЭБ содержат АВС-транспортеры, LRP1 и S-Р, что указывает на существование путей взаимного влияния мозгового и периферического холестерина
Экскреция холестерина из мозга. Оксистеролы
Из организма человека ежедневно выводится около 1 г холестерина: 0.5 г в виде желчных кислот, 0.5 г -как неметаболизированный холестерин или бактериальный метаболит копростанол. В мозге практически отсутствуют механизмы разрушения холестерина. Однако 0.02-0.04% (6-12 мг) холестерина мозга удаляются каждый день [1] преимущественно в форме 24-гидроксихолестерина (24-ГХ, 6-8 мг/день). 24-ГХ (в гомогенате мозга, 30 мкМ) проникает через ГЭБ (диффузией или при участии анионного транспортера, oatp2), в крови связывается с липопротеинами низкой плотности, поглощается гепатоцитами и выводится в составе желчи [7]. Небольшая часть холестерина покидает мозг в виде АроЕ/А-частиц через ГЭБ. Экспрессирующийся преимущественно в нейронах ABCA1 способен освобождать избыток холестерина в виде АроА1-частиц, которые перебрасываются через ГЭБ при участии LRP1 и скавенджер-рецептора класса 1 B (SR1B) [29]. Увеличение или снижение экспрессии ABCA1 в нейронах усиливает или снижает выведение холестерина соответственно [20].
Экспрессирующийся преимущественно в нейронах ABCA1 способен освобождать избыток холестерина в виде АроА1-частиц, которые перебрасываются через ГЭБ при участии LRP1 и скавенджер-рецептора класса 1 B (SR1B) [29]. Увеличение или снижение экспрессии ABCA1 в нейронах усиливает или снижает выведение холестерина соответственно [20].
24-ГХ продуцируется холестерин-24-гидрокси-лазой (CYP46A1), которая в норме экспрессируется в телах и дендритах некоторых нейронов (больших пирамидных клетках коры, гиппокампа, амигдалы, скорлупы, таламуса, клетках Пуркинье) (рис. 2) [7]. При патологических состояниях и после травмы CYP46A1 может появиться в ненейрональных клетках (астроциты, микроглия, макрофаги) [11]. В мозге 24-ГХ (как и другие оксистеролы) активирует ядерный LX-рецептор астроцитов и нейронов, который усиливает экспрессию белков, обеспечивающих синтез холестерина и его транспорт (ABCA1, ApoE). Следовательно, увеличение выведения холестерина из мозга способствует его синтезу в астроцитах и доставке нейронам. Повышение же уровня холестерина в ЭПР может стимулировать CYP46A1 [1]. Таким образом, в мозге формируется кругооборот продукции и экскреции холестерина. Если его остановить за счет мутации гена CYP46A1 (мыши CYP46A1 -/-, содержание 24-ГХ у которых составляет 5% от уровня у мышей дикого типа), то концентрация холестерина в мозге не возрастет, так как на 40-50% уменьшится его производство [7]. Сверхэкспрессия CYP46A1, увеличивающая продукцию 24-ГХ, также не изменяет уровень холестерина, так как возрастает его синтез [30]. Образование 24-ГХ в нейронах подавляется этерификацией холестерина, поэтому удаление гена ACAT1, на 13% снижающее общее содержание холестерина в мозге, на 32% повышает уровень 24-ГХ [17].
Повышение же уровня холестерина в ЭПР может стимулировать CYP46A1 [1]. Таким образом, в мозге формируется кругооборот продукции и экскреции холестерина. Если его остановить за счет мутации гена CYP46A1 (мыши CYP46A1 -/-, содержание 24-ГХ у которых составляет 5% от уровня у мышей дикого типа), то концентрация холестерина в мозге не возрастет, так как на 40-50% уменьшится его производство [7]. Сверхэкспрессия CYP46A1, увеличивающая продукцию 24-ГХ, также не изменяет уровень холестерина, так как возрастает его синтез [30]. Образование 24-ГХ в нейронах подавляется этерификацией холестерина, поэтому удаление гена ACAT1, на 13% снижающее общее содержание холестерина в мозге, на 32% повышает уровень 24-ГХ [17].
Повышение активности CYP46A1 наблюдается при стимуляции синаптической передачи. Уже через 30 мин синаптической активности в глутаматер-
гическом синапсе уровень мембранного холестерина немного, но достоверно снижается за счет освобождения 24-ГХ во внеклеточное пространство.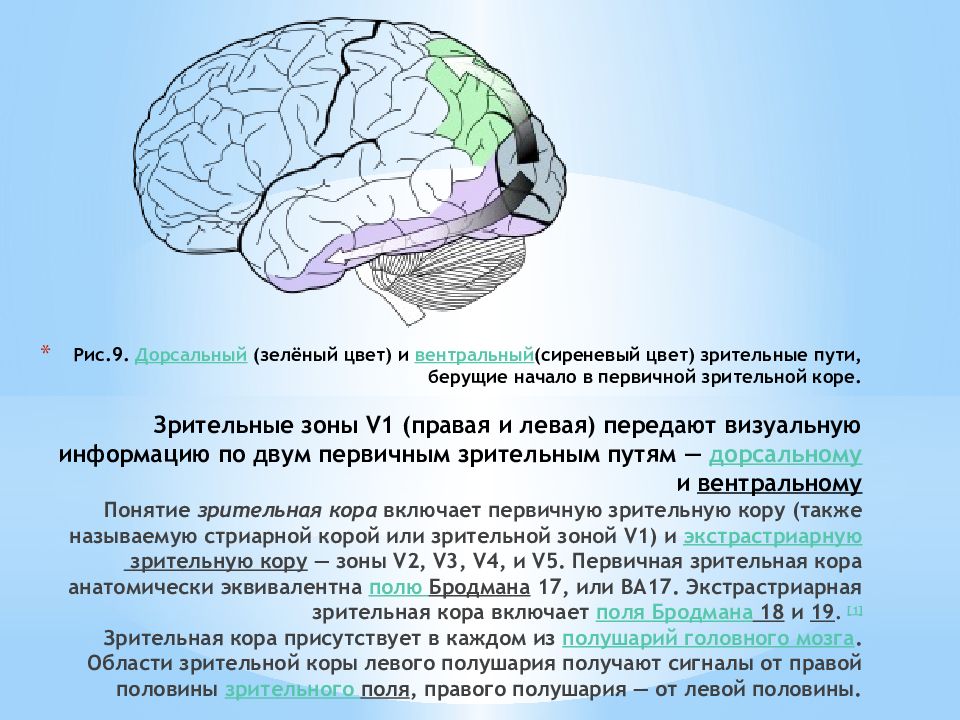 При этом СYP46A1 перемещается от ЭПР к плазматической мембране и активируется. Этот процесс зависит от повышения уровня цитозольного Са2+ и функционирования чувствительного к Са2+ белка STIM2 в полости ЭПР [31]. По мере старения, в нейронах повышается продукция активных форм кислорода, которые усиливают экспрессию СYP46А1, в результате чего наблюдается прогрессирующая потеря холестерина синаптическими мембранами [32].
При этом СYP46A1 перемещается от ЭПР к плазматической мембране и активируется. Этот процесс зависит от повышения уровня цитозольного Са2+ и функционирования чувствительного к Са2+ белка STIM2 в полости ЭПР [31]. По мере старения, в нейронах повышается продукция активных форм кислорода, которые усиливают экспрессию СYP46А1, в результате чего наблюдается прогрессирующая потеря холестерина синаптическими мембранами [32].
Другой оксистерол — 27-ГХ — главный метаболит холестерина в системной циркуляции, где его концентрация в норме составляет 0.15-0.73 мкМ, а при ряде патологий (например, при атеросклерозе) может достигать миллимолярного уровня [33]. 27-ГХ синтезируется из холестерина митохондриальным ферментом CYP27A1 почти во всех клетках (рис. 2). В нейронах, астроцитах и олигодендроцитах 27-ГХ образуется в очень низкой концентрации и выводится из мозга через ГЭБ [34]. Однако 27-ГХ, продуцируемый периферическими тканями, может проникать в мозг (5 мг/день). В норме соотношение 27-ГХ : 24-ГХ составляет 1 : 8 во фронтальной коре, 1 : 5 в затылочной коре и 1 : 10 в базальных ядрах [35]. Оксистерол-7а-гидролаза (CYP7B1) катализирует превращение 27-ГХ в 7а-гидрокси-3-оксо-4-холестеновую кислоту, которая удаляется через ГЭБ [1]. Интенсивное образование 27-ГХ происходит при гиперхолестеринемии и окислительном стрессе [34]. При окислительном стрессе существенная часть холестерина может превращаться в 27-ГХ, который аккумулируется в мозге, увеличивая риск нейродегенерации [33].
В норме соотношение 27-ГХ : 24-ГХ составляет 1 : 8 во фронтальной коре, 1 : 5 в затылочной коре и 1 : 10 в базальных ядрах [35]. Оксистерол-7а-гидролаза (CYP7B1) катализирует превращение 27-ГХ в 7а-гидрокси-3-оксо-4-холестеновую кислоту, которая удаляется через ГЭБ [1]. Интенсивное образование 27-ГХ происходит при гиперхолестеринемии и окислительном стрессе [34]. При окислительном стрессе существенная часть холестерина может превращаться в 27-ГХ, который аккумулируется в мозге, увеличивая риск нейродегенерации [33].
Макрофаги могут в значительных количествах производить 25-гидроксихолестерин (25-ГХ) с помощью холестерин-25-гидролазы, локализованной в ЭПР. В тканях (в том числе в мозге) экспрессия этого фермента повышается при индукции врожденного иммунного ответа, а образующийся 25-ГХ оказывает противовирусный эффект и способствует этери-фикации холестерина за счет усиления активности АСАТ1. В мозге концентрация 25-ГХ составляет примерно 1 мкМ и может локально повышаться при ней-родегенеративных заболеваниях. Следует отметить, что синтез следовых количеств 25-ГХ могут катализировать CYP46A1 и CYP27A1, а метаболизируется 25-ГХ при участии CYP7B1 [36].
Следует отметить, что синтез следовых количеств 25-ГХ могут катализировать CYP46A1 и CYP27A1, а метаболизируется 25-ГХ при участии CYP7B1 [36].
ОСТРОВКИ ХОЛЕСТЕРИНА В МОЗГЕ
Кратко о липидных рафтах
В нервной системе связь между организацией мембраны и клеточными процессами более выражена,
чем в других тканях. Нейроны и в меньшей степени глия — высокополяризованные клетки, содержащие различные мембранные компартменты: аксон, ден-дриты, синаптические мембраны, миелиновые муфты, перехваты и т.п. Даже внутри отдельного региона мембраны молекулы движутся не свободно, а формируют микродомены, обогащенные холестерином и сфинголипидами (липидные рафты). Холестерин выступает в роли «клея», объединяя липидные и белковые компоненты в микродомен [37]. Сфинголипиды (в частности, гликолипиды) мозга характеризуются высокой степенью структурного разнообразия, и отдельные популяции нейронов, глиальных клеток и разные рафты одной клетки обогащены различными гликолипидами. В ходе развития мозга и дифференцировки нейронов наблюдается увеличение экспрессии и разнообразия гликолипидов [3]. Нарушение синтеза сложных гликолипидов в нейронах вызывает тяжелые неврологические/синап-тические нарушения и гибель в течение 3 недель после рождения [38]. В целом, липидный состав раф-тов мозга зависит от региона, типа клетки и стадии развития. Отдельные рафты могут включать специфичные белковые компоненты (рецепторы, ионные каналы, белки экзо- и эндоцитоза, ферменты), которые на территории рафта создают сигнальные комплексы/специализированные компартменты [3, 24]. Например, высокое содержание холестерина/раф-тов — одна из причин существенно более медленной диффузии многих белков в синаптических сайтах, чем во внесинаптических регионах [39]. Увеличение концентрации холестерина и сфинголипидов усиливает объединение (коалесценцию) рафтов, вызывая появление в мембране больших (микрометровых) стабильных суперрафт-доменов (платформ). В живых клетках липидные платформы могут формироваться за счет сцепления содержащихся в разных рафтах белков при их связывании с одной и той же молекулой внеклеточного лиганда (например, фактора роста) или каркасными белками и белками цито-скелета.
В ходе развития мозга и дифференцировки нейронов наблюдается увеличение экспрессии и разнообразия гликолипидов [3]. Нарушение синтеза сложных гликолипидов в нейронах вызывает тяжелые неврологические/синап-тические нарушения и гибель в течение 3 недель после рождения [38]. В целом, липидный состав раф-тов мозга зависит от региона, типа клетки и стадии развития. Отдельные рафты могут включать специфичные белковые компоненты (рецепторы, ионные каналы, белки экзо- и эндоцитоза, ферменты), которые на территории рафта создают сигнальные комплексы/специализированные компартменты [3, 24]. Например, высокое содержание холестерина/раф-тов — одна из причин существенно более медленной диффузии многих белков в синаптических сайтах, чем во внесинаптических регионах [39]. Увеличение концентрации холестерина и сфинголипидов усиливает объединение (коалесценцию) рафтов, вызывая появление в мембране больших (микрометровых) стабильных суперрафт-доменов (платформ). В живых клетках липидные платформы могут формироваться за счет сцепления содержащихся в разных рафтах белков при их связывании с одной и той же молекулой внеклеточного лиганда (например, фактора роста) или каркасными белками и белками цито-скелета. Фосфорилирование обычно облегчает слияние белков рафтов за счет усиления белок-белковых взаимодействий. Слияние рафтов имеет значение в мембранном транспорте, в трансдукции сигналов и других процессах [3].
Фосфорилирование обычно облегчает слияние белков рафтов за счет усиления белок-белковых взаимодействий. Слияние рафтов имеет значение в мембранном транспорте, в трансдукции сигналов и других процессах [3].
С рафтами ассоциированы многие вовлеченные в сигнализацию белки, в том числе кавеолины, которые имеют каркасный домен, служащий сайтом взаимодействия с метаботропными рецепторами, G-белками, NO-синтазой, аденилатциклазой, фосфоинозитол-3-киназой, MAP-, Src-киназами, протеинкиназами А и С [40]. В нейронах кавеолин-1 колокализуется со специфичным каркасным постси-наптическим белком PSD-95, глутаматными NMDA-
рецепторами, а его нокаут вызывает потерю синапсов [41]. Ишемия мозга может разрушать ассоциированные с кавеолинами сигнальные комплексы в нейронах. Высокая экспрессия кавеолина-1 усиливает активность сигнальных молекул, обеспечивающих выживание и рост, делая мозг более устойчивым к ишемическому повреждению [40].
Липидные рафты и внутренне неупорядоченные белки
Белки, у которых отсутствует хорошо определяемая трехмерная структура, относятся к внутренне неупорядоченным белкам. Они составляют часть протеома, называемую unfoldome, и зачастую участвуют в сигнализации и мембранном транспорте [42, 43]. В число этих белков входят а-синуклеин, АРР (белок-предшественник амилоида), PrP (прионные белки), белок гентингтин и tau. Конформация этих белков зависит от окружения и может существенно изменяться. При определенных условиях (сверхпродукция, мутации, «пагубное» окружение) а-синуклеин, APP, PrP могут приобретать «патологическую» трехмерную структуру. Возможно, ведущую роль в превращении нормальных белков в патологические играют мембраны. При оседании на мембранах происходит концентрирование белков, что способствует образованию их агрегатов. а-Синуклеин, амилоидный пептид ß (продукт расщепления APP), PrP взаимодействуют избирательно с липидными рафтами [44], в результате чего изменяется конформация белков, что может ускорять их агрегацию. Амилоидный пептид ß узнает специфичные для рафтов гликосфин-голипиды (ганглиозид GM1, асиалоганглиозид GM1, галактозилцерамид) и холестерин, а-синуклеин -ганглиозиды GM1 и GM3, PrP — сфингомиелин, галактозилцерамид, ганглиозиды GM1 и GM3 [42]. Эти белки в изобилии представлены в синапсах, мембраны которых особенно богаты упомянутыми ганглио-зидами [45]. От локальных значений рН, концентрации холестерина, текучести микроучастка зависят сила взаимодействия и тип получающегося агрегата (глобулярная или фибриллярная структура) и, следовательно, его токсичность. Холестерин усиливает/ослабляет связывание этих белков со сфинго-липидами, включающими негидроксилированные/ гидроксилированные ацильные группы. При увеличении концентрации ганглиозидов GM1, снижении количества холестерина и белков в рафтах амилоидный пептид ß связывается с мембраной и образует токсичные фибриллы, тогда как повышение содержания холестерина в мембранах ингибирует агрегацию амилоидного пептида ß [46]. Мембраны могут катализировать превращение зрелых амилоидных фибрилл (слабо токсичных) в протофибриллярное
Амилоидный пептид ß узнает специфичные для рафтов гликосфин-голипиды (ганглиозид GM1, асиалоганглиозид GM1, галактозилцерамид) и холестерин, а-синуклеин -ганглиозиды GM1 и GM3, PrP — сфингомиелин, галактозилцерамид, ганглиозиды GM1 и GM3 [42]. Эти белки в изобилии представлены в синапсах, мембраны которых особенно богаты упомянутыми ганглио-зидами [45]. От локальных значений рН, концентрации холестерина, текучести микроучастка зависят сила взаимодействия и тип получающегося агрегата (глобулярная или фибриллярная структура) и, следовательно, его токсичность. Холестерин усиливает/ослабляет связывание этих белков со сфинго-липидами, включающими негидроксилированные/ гидроксилированные ацильные группы. При увеличении концентрации ганглиозидов GM1, снижении количества холестерина и белков в рафтах амилоидный пептид ß связывается с мембраной и образует токсичные фибриллы, тогда как повышение содержания холестерина в мембранах ингибирует агрегацию амилоидного пептида ß [46]. Мембраны могут катализировать превращение зрелых амилоидных фибрилл (слабо токсичных) в протофибриллярное
состояние, характеризующееся высокой токсичностью [47], т. е. амилоидные бляшки могут быть нестабильными и при изменении состояния липидных рафтов могут превращаться в источник токсичных протофибрилл. Олигомеры амилоидных пептидов в могут взаимодействовать с белками — резидентами рафтов, такими, как глутаматный NMDA-рецептор, метаботропный глутаматный рецептор 5, РгР. В итоге олигомеры способствуют формированию больших платформ, нарушающих функционирование синап-тического аппарата [24, 44]. В целом, сами внутренне неупорядоченные белки потенциально способны изменять структуру рафтов и мембран [42, 43].
е. амилоидные бляшки могут быть нестабильными и при изменении состояния липидных рафтов могут превращаться в источник токсичных протофибрилл. Олигомеры амилоидных пептидов в могут взаимодействовать с белками — резидентами рафтов, такими, как глутаматный NMDA-рецептор, метаботропный глутаматный рецептор 5, РгР. В итоге олигомеры способствуют формированию больших платформ, нарушающих функционирование синап-тического аппарата [24, 44]. В целом, сами внутренне неупорядоченные белки потенциально способны изменять структуру рафтов и мембран [42, 43].
ХОЛЕСТЕРИН И СИНАПТИЧЕСКАЯ ПЕРЕДАЧА
В самом общем виде механизм передачи информации в синапсе можно представить следующим образом (рис. 3). Пресинаптические нервные окончания содержат большое количество синаптических везикул, заполненных медиатором. В ответ на вызванный потенциалом действия вход Са2+ через потенциал-зависимые Са-каналы везикулы сливаются с пре-синаптической мембраной (экзоцитоз), освобождая медиатор в синаптическую щель. Достигнув постси-наптических рецепторов, медиатор активирует их, в результате изменяется потенциал постсинапти-ческой мембраны. Синаптическая передача — один из самых высокорегулируемых клеточных процессов. Длительные изменения ее эффективности лежат в основе интегративных феноменов и влияют на выживаемость и функционирование нейронов [37].
Пресинаптические механизмы и холестерин
Роль холестерина в пресинаптических процессах, обеспечивающих высвобождение нейромедиатора, связана с его способностью непосредственно влиять на биофизические свойства мембран; прямо взаимодействовать с белками, регулирующими экзо- и эн-доцитоз; участием в организации липидных рафтов.
В ходе экзоцитоза происходят радикальные изменения кривизны мембран, которые определяются составом липидов. Холестерин, в большом количестве представленный в синаптических везикулах (40% всех липидов) и пресинаптической мембране, поддерживает формирование сильно искривленных промежуточных мембранных структур в процессе слияния [48]. За счет способности к относительно легкому переходу между монослоями (флип-флопу) холестерин снижает «натяжение» мембран при деформациях, стабилизируя пору слияния. Холестерин способствует слиянию благодаря взаимодействию с везикулярными (синаптофизин) и пресинаптиче-скими (синтаксин-1) белками [37, 49]. В сайтах экзо-цитоза и мембранах везикул холестерин участвует
в формировании липидных рафтов [45]. В составе рафтов обнаружены ключевые белки везикул — протонный насос, синаптотагмины, синаптофизины, SV2, а также экзоцитозные белки пресинаптической мембраны — синтаксин, SNAP-25, синаптобревин, Munc18, потенциал-зависимые Са-каналы [50]. Чем выше содержание белков экзоцитоза в рафтах, тем эффективнее протекает экзоцитоз. Разные изофор-мы синтаксина холестерин-зависимым образом могут формировать в мембране отдельные скопления. Это предполагает возможность образования сайтов экзо-цитоза с различными свойствами [51]. Возможно, эк-зоцитоз может модулироваться слиянием/разделением отдельных рафтов. Например, с одной стороны, потенциал-управляемые Са-каналы и SNARE-белки, а с другой, белок NCS-1 (нейрональный сенсор кальция 1), усиливающий активность Са-каналов, локализуются в разных микродоменах, слияние которых может облегчать экзоцитоз [52]. Мутации в гене синапс-специфичной церамидазы SLAB, приводящие к перераспределению холестерина в пресинапти-ческой мембране, уменьшают на ~70% способность везикул к слиянию. В рафтах могут концентрироваться анионные липиды, фосфатидилинозитол-4,5-бисфосфаты, которые влияют на активность белков экзоцитоза и способность мембраны к деформации [49]. Оксистерол, 5а-холестан-3-он, нарушающий стабильность синаптических рафтов, угнетает эк-зоцитоз и ограничивает популяцию синаптических везикул, вовлекаемую в нейропередачу [53]. В целом, удаление даже небольшой фракции холестерина, ослабление его синтеза приводит к угнетению вызванного освобождения медиатора при низко-и высокочастотной активности [54, 55]. Нарушение метаболизма холестерина может нарушать кластеризацию синаптических везикул и угнетать ионные токи, формирующие потенциал действия [56, 57].
Мембранный холестерин избирательно способствует протеканию вызванного экзоцитоза, в то время как спонтанное освобождение нейромедиатора, наоборот, угнетается холестерином [54, 55, 58]. Возможно, холестерин ограничивает спонтанный экзоцитоз, предотвращая избыточную активацию ряда проте-инкиназ (в частности, протеинкиназ А, С, CAMK-II) и сигнального пути NADPH-оксидаза-активные формы кислорода-TRPV1-каналы-Са2+-кальцинейрин [58-60]. Поэтому при истощении мембранного холестерина усиливается спонтанный экзоцитоз, в результате может истощаться запас синаптических везикул, происходить десенситизация рецепторов, уменьшаться локальный белковый синтез. Кроме того, снижение содержания холестерина усиливает невезикулярное освобождение нейромедиаторов в периферических и центральных синапсах [61, 62].
синапсин
актин
сигнальные ферменты ПКА, ПКС, CAMK-
синаптофизин синаптобревин
А*
PUÍU
Н+-насос
STG
синтаксин
NCS-1
NoX /
EAAT1
« V»iLL
* • t«m > * • • * i
клатрин ^ЖГ -AP-2
динамин .ab1
Эндосома J
GSK3p
Akt
Рис. 3. Синаптическая передача: липид-белковые взаимодействия. Нейромедиатор освобождается из синапти-ческих везикул, которые сливаются (экзоцитоз) в специализированном участке пресинаптической мембраны, активной зоне, в ответ на вход Са2+ через потенциал-зависимые Са-каналы. Слияние везикул опосредуется белками, формирующими SNARE-комплекс (синаптобревин, синтаксин, SNAP-25), и регулируется многими холестеринсвязывающими белками (синаптотагмин/STG, Munc18, NCS-1) и сигнальными молекулами (проте-инкиназами, NADPH-оксидазой/Мох). После слияния белковые и липидные компоненты везикул подвергаются клатрин-опосредованному эндоцитозу. Большая часть синаптических везикул формирует резервный пул, который освобождает нейромедиатор только в период длительной синаптической активности. Доставка этих везикул в сайты экзоцитоза зависит от актина и синапсинов. В глутаматергическом синапсе освобождающийся нейромедиатор изменяет №+/Са2+-проводимость постсинаптической мембраны, активируя AMPA/NMDA-рецепторы. Количество постсинаптических рецепторов зависит от экзо- и эндоцитозного трафика рецепторов, который управляется малыми GTP-азами (Rabil) и киназами (Cdc42, GSK3P, фосфоинозитол-3-киназа/ФИ-3-К). Зависимая от рецепторов сигнализация связана со многими белками (Src, ERK, Cav-1). На схеме изображены молекулы холестерина (черные) и их скопления, фосфоинозитол-4,5-бифосфаты (ФИ-4,5-Ф2, красные), и белки, взаимодействующие с холестерином и ФИ-4,5-Ф2. Подробные объяснения в тексте
Эндоцитоз синаптических везикул. Эндоцитоз си-наптических везикул предотвращает истощение их запаса при синаптической активности. После эндо-цитоза везикулы заполняются нейромедиатором и доставляются в соответствующий пул. Холестерин может требоваться для облегчения инвагинации мембраны при эндоцитозе [37, 49]. Участки мембраны, обогащенные холестерином, способны активировать белки, участвующие в эндоцитозе [50]. Не исключено, что рафты в мембранах везикул предотвращают смешивание везикулярных белков с пресинаптически-ми, упрощая их сортировку в ходе эндоцитоза [45]. Фосфоинозитиды рафтов вовлечены в запуск эндо-цитоза и кластеризацию везикулярных белков [49]. Удаление даже небольшого количества холестерина из мембран везикул ведет к блокированию эндоци-тоза и накоплению мембранного материала везикул в плазматической мембране [54, 62].
Постсинаптические процессы и холестерин
Изменения в количестве/составе постсинаптических рецепторов требуются для феномена синаптической пластичности. Подобные изменения происходят за счет эндо- и экзоцитоза рецепторов, их латеральной диффузии между экстра- и синаптическими участками (рис. 3). Транспорт рецепторов контролируется как взаимодействием рецепторов с каркасными белками, так и липидным составом мембраны [3]. Активность рецепторов и последующая сигнализация также часто зависят от содержания мембранного холестерина. Многие из постсинаптических рецепторов локализуются в рафтах [2, 3, 11, 12]. В целом, постсинаптическая плотность — массивный мульти-белковый комплекс, включающий молекулы, участвующие в постсинаптической сигнализации и пластичности, физически ассоциирована с рафтами [39, 63]. В представленном обзоре мы уделим внимание только глутаматным AMPA- и NMDA-рецепторам.
Быстрое удаление холестерина подавляет токи через AMPA-рецепторы и их встраивание путем экзоцитоза [64]. Удаление холестерина/сфинголи-пидов в течение длительного времени увеличивает конститутивный эндоцитоз AMPA-рецепторов [63]. В нейронах с уровнем холестерина, сниженным (~ на 25%) в ходе естественного старения, наблюдается накопление AMPA-рецепторов на поверхности клетки вследствие нарушения их эндоцитоза и латеральной мобильности. Предполагается, что потеря холестерина ведет к отсоединению белка MARCKS от фосфоинозитол-4,5-бифосфатов мембраны, которые переводятся фосфоинозитол-3-киназой в фосфоинозитол-3,4,5-трифосфаты. Накопление последних стабилизирует F-актин, снижая подвижность постсинаптических AMPA-рецепторов,
и способствует активации киназы Akt, которая инактивирует киназу 3В гликогенсинтазы (GSK3ß), участвующую в эндоцитозе AMPA-рецепторов [12].
Локализация NMDA-рецепторов в рафтах облегчает их олигомеризацию, а удаление холестерина угнетает вход Са2+ через NMDA-рецепторы, способствует их десенситизации и ингибирует долговременную потенциацию в гиппокампе [65]. Наоборот, 24-ГХ, действуя как аллостерический модулятор, в субмикромолярных концентрациях потенцирует опосредуемый NMDA-рецепторами ответ, способствуя индукции долговременной потенциации в срезах гиппокампа. Интересно, что 25-ГХ (в субмикро-молярной концентрации) препятствует развитию данного эффекта 24-ГХ [66]. Вход Са2+ через NMDA-рецепторы может вызывать как феномены синапти-ческой пластичности, так и гибель клетки (эксайто-токсичность), что зависит от величины потока Са2+ и локализации рецепторов (в рафтах или нет, в си-наптическом или внесинаптическом регионе). NMDA-рецепторы рафтов взаимодействуют с кавеолином-1, что важно для активации сигнального пути Src-киназа/ERK-киназа, способствующего выживанию нейронов. Поэтому локализованные в рафтах рецепторы в меньшей степени опосредуют эксайтотоксич-ность. При длительном воздействии агониста и ишемии NMDA-рецепторы перемещаются в жидкую фазу мембраны [67]. Сверхактивация внесинаптиче-ских NMDA-рецепторов преимущественно вовлекается в эксайтотоксичность [12]. В липидных рафтах располагается транспортер возбуждающих аминокислот (EAAT1-4), и удаление холестерина снижает опосредуемый транспортером Na+-зависимый захват глутамата в глиальные и нейрональные клетки [68], способствуя эксайтотоксичности. Интересно, что активация NMDA-рецепторов вызывает быстрое снижение внутриклеточного содержания холестерина (возможно, рециклирующих эндосом), что ведет к активации Cdc42- и RabH-зависимого перемещения AMPA-рецепторов в постсинаптическую мембрану. Это способствует возникновению долговременной си-наптической потенциации [69].
ХОЛЕСТЕРИН И НЕЙРОДЕГЕНЕРАТИВНЫЕ ЗАБОЛЕВАНИЯ
В последнее время увеличивается количество данных, указывающих на связь дефектов в метаболизме холестерина и синаптической передаче с развитием нейродегенеративных заболеваний [2, 11, 12]. На значимость холестерина для мозга указывает большое число редких наследственных заболеваний с выраженными неврологическими симптомами, вызванных мутациями генов, прямо или косвенно вовлеченных в метаболизм холестерина. Мы проанализировали
данные об изменении обмена холестерина при ряде патологий ЦНС, непосредственно связанных с мутациями в генах, продукты которых вовлечены в биосинтез холестерина (синдром Смита-Лемли-Опица), его внутриклеточный трафик (болезнь Нимана-Пика типа С) и регуляцию синтеза (болезнь Гентингтона).
Синдром Смита-Лемли-Опица
Причиной некоторых заболеваний, вызывающих нейродегенерацию и пороки развития, являются нарушения путей биосинтеза холестерина. При латостеролозах обнаруживается дефект в 3в-гидроксистероид-5-десатуразе, при десмо-стеролозах — в 3в-гидроксистерол-24-редуктазе, при церебротендинальном ксантоматозе -в холестерин-27-гидроксилазе. Синдром Смита-Лемли-Опица — наиболее распространенное ау-тосомно-рецессивное заболевание этого класса (1/20000 живорожденных), вызывается мутациями в гене dhcr7, кодирующем 7-дегидрохолестеролре-дуктазу [70]. В наиболее тяжелых случаях мутации ведут к гибели плода или младенца. Dhcr7 катализирует последний этап пути Kandutsch-RusseU синтеза холестерина. В результате мутаций активность
Dhcr7 снижается, что ведет к увеличению содержания 7-дегидрохолестерина и недостатку холестерина в клетках, плазме и мозге (рис. 4). При синдроме Смита-Лемли-Опица концентрация 24-ГХ в плазме снижается, а 27-ГХ увеличивается [71]. При этом заболевании наблюдаются множественные аномалии развития мозга и органов, снижение умственных способностей, эмоциональные расстройства и проблемы со сном. У пациентов с сильно выраженными симптомами концентрация холестерина в плазме может составлять 2% от нормальных значений. При умеренных симптомах уровень холестерина в плазме может быть нормальным, однако это не может компенсировать дефицит функций мозга, что указывает на участие холестерина мозга в гене-зе неврологических симптомов [70]. С другой стороны, эти симптомы могут быть обусловлены накоплением субстрата Dhcr7 — 7,8-дегидродесмостерола и его окисленных метаболитов [72]. Некоторые тератогенные эффекты при синдроме Смита-Лемли-Опица вызваны, вероятно, дефектами в SHH-сигнализации, поскольку для активности белка SHH (морфогенный фактор, Sonic Hedgehog) требуется ковалентное присоединение холестерина [70].
dhcr7i
7-дегидрохолестерин t холестеринi
t текучесть мембраны дефектные рафты
tRho GTP-азы
цитоскелет
24-ГХ i
iSHH-сигнализация
окисленные метаболиты холестерина
-снижение реакции на глутамат
-нарушение сигнализации через 5НТаГР
-изменение экзо/эндоцитоза
t
Нарушение синоптической передачи
„JL-
Рис. 4. Нарушение синтеза холестерина при синдроме Смита-Лемли-Опица. Связь с си-наптической дисфункцией. Подробные объяснения в тексте
При синдроме Смита-Лемли-Опица холестерин в мембранах замещается 7-дегидрохолестерином, а поскольку его свойства сходны со свойствами холестерина, в функционировании мембран наблюдаются тонкие изменения. В частности, уменьшаются жесткость мембраны и способность стабилизировать изгибы, что важно при экзо- и эндоцитозе. Также формируются дефектные рафты с нарушенным белковым составом [73]. Снижение уровня холестерина может влиять на сигнализацию, зависимую от многих рецепторов. У мутантных мышей с синдромом Смита-Лемли-Опица нарушен ответ ММЮА-рецепторов на глутамат [74]. 7-Дегидрохолестерин окисляется активными формами кислорода с формированием десятков вариантов оксистеролов, некоторые из них проявляют активность в субмикромолярных концентрациях [72] и потенциально могут воздействовать на экзо- и эндоцитоз [55]. 7-Дегидрохолестерин может нарушать связывание с лигандом серотони-новых рецепторов 1А [75]. При синдроме Смита-Лемли-Опица в аксонах и дендритах нейронов гиппокампа, возможно, в результате изменения состояния липидных рафтов повышена активность малых GTP-аз семейства [76], вовлеченных в управление динамикой актинового цитоскелета. При синдроме Смита-Лемли-Опица происходит ги-
перфосфорилирование кофилина-1, который утрачивает способность разрушать актиновые филамен-ты. Стабилизация цитоскелета может опосредованно воздействовать на процессы экзо- и эндоцитоза, трафик синаптических везикул/рецепторов. Все это может приводить к нарушению высвобождения различных нейромедиаторов (серотонина, дофамина) и развитию неврологических симптомов [77].
Болезнь Нимана-Пика типа С
Прямая связь между нарушением метаболизма холестерина в мозге и нейродегенерацией ясно показана при болезни Нимана-Пика типа С, редкой аутосомно-рецессивной патологии (1/150000 новорожденных), при которой наблюдается прогрессирующая гибель нейронов и преждевременная смерть, часто развивается гепатоспленомегалия и болезни легких. При болезни Нимана-Пика типа С в головном мозге наблюдается массивная потеря клеток Пуркинье мозжечка, что согласуется с нарушением двигательного контроля [2]. Причиной заболевания являются мутации в генах NPC1 (95% случаев) или NPC2 (5%), которые приводят к дефициту соответствующих белков (рис. 5). При недостатке МРС1 или МРС2 в нейронах и глии холестерин и в меньшей степени другие липиды (в частности, гликолипи-
увеличение холестерина в поздних эндосомах/лизосомах
снижение холестерина в плазматической мембране и ЭПР
ТАРР/ВАСЕ в лизосомах 3|3,5а,6|3-
холестантриол, 6-кетостерол
I
окислительный изменение состава
стресс синаптических мембран
(в т.ч. синаптических везикул)
Внутрилизосомное накопление Ав *
нарушение экзоцитоза и рециклирования (в основном в ГАМК-ергических синапсах)
Рис. 5. Изменение обмена холестерина при болезни Нимана-Пика типа С. Влияние на синаптиче-скую передачу. Подробные объяснения в тексте
Нарушение синаптической передачи ♦
Когнитивные дефекты
ды) «запираются» в поздних эндосомах/лизосомах и не поступают в плазматическую мембрану и ЭПР [16]. Интересно, что при дефиците NPC1 содержание холестерина в дистальных частях аксонов резко уменьшается и повышается в телах нейронов. Возможно, неврологические дефекты при болезни Нимана-Пика типа С обусловлены снижением холестерина в аксонах, особенно в нервных окончаниях. Согласуется с этой идеей изменение состава и морфологии синаптических везикул, рециклирующих эндосом в нервном окончании при дефиците NPC1 [18]. При болезни Нимана-Пика типа С наблюдается усиленное образование ряда оксистеролов, 3р,5а,бр-холестантриола и 6-кетостерола в мозге, вызванное окислительным стрессом [2].
При болезни Нимана-Пика типа С дегенерация сомы нейронов является конечным звеном патологического каскада. Сначала же развивается дегенерация пресинаптических нервных терминалей, здесь же в рециклирующих эндосомах локализуется поврежденный белок NPC1 [18]. По-видимому, нейродегенерация может начинаться из нервных окончаний. На ранних стадиях заболевания (до ней-родегенерации и исчезновения синапсов) наблюдаются пресинаптические нарушения: угнетаются процессы вызванного экзоцитоза и доставки синап-тических везикул в сайты экзоцитоза [78]. Причем нарушения экзоцитоза и замедление кругооборота синаптических везикул сильнее выражены в ГАМК-ергических нервных окончаниях, что может рождать дисбаланс возбуждающей/тормозной нейропе-редачи [79]. Возможно, альтерации синаптической передачи являются причинами ряда симптомов болезни Нимана-Пика типа С, таких, как атаксия, катаплексия, нарушение рефлексов. Схожие изменения в экзоцитозе синаптических везикул наблюдаются при удалении мембранного холестерина высокими дозами метил-Р-циклодекстрина (МЦД) [78]. Обнаружение NPC1 в рециклирующих эндосомах в нервных окончаниях указывает на возможность участия NPC1 в медленном пути рециклирования везикул, важном для сохранения численности синапти-ческих везикул в течение длительной синаптической активности [18].
На сегодняшний день не существует эффективных методов лечения болезни Нимана-Пика типа С. Однако последние исследования дали повод надеяться на появление адекватной терапии. Однократное подкожное введение холестеринсвязывающего компонента (МЦД) животным с делецией генов NРС1 замедляло развитие нейродегенерации и вдвое увеличивало продолжительность жизни [80]. Хотя МЦД не может эффективно проникать через ГЭБ, малые его количества все же попадают в мозг. Высокие дозы
МЦД (5-10 мМ), обычно используемые для удаления существенного количества мембранного холестерина, токсичны для нейронов и блокируют синаптиче-скую передачу [3]. Низкие же дозы МЦД (например, 0.1 мМ) слабо влияют на мембранный холестерин [62] и могут подвергаться эндоцитозу, попадая в нейроны. Захваченные молекулы МЦД, возможно, могут освобождать «запертый» в поздних эндосомах/лизосомах холестерин и направлять его в ЭПР и плазматическую мембрану. Инъекции 2-гидроксипролил-ß-циклодекстрина в спинномозговую жидкость снижают накопление холестерина в эндо/лизосомах и улучшают выживаемость клеток Пуркинье [16]. Недавно были разработаны соединения (полиро-таксаны), которые могут расщепляться в лизосомах с освобождением ß-циклодекстринов. Они проявляют высокую эффективность, препятствуя накоплению холестерина в лизосомах при болезни Нимана-Пика типа С [81]. Следует заметить, что те же формы ци-клодекстринов обладают нейропротекторной активностью в клеточных и мышиных моделях болезни Альцгеймера [82].
При болезни Нимана-Пика типа С происходит внутриклеточное накопление амилоидного пептида ß (в нагруженных холестерином лизосомах) и фибриллярных клубков из гиперфосфорилированного белка tau. В спинномозговой жидкости при болезни Нимана-Пика типа С увеличивается концентрация амилоидных пептидов ß из 38, 40 и 42 аминокислотных остатков. Однако амилоидные бляшки не образуются, что, вероятно, связано с ранней летальностью при этом заболевании [83]. Диффузные амилоидные бляшки могут появиться при болезни Нимана-Пика типа С у носителей аллеля Apoe4, у которых снижен клиренс амилоидного пептида ß. Носительство ал-леля Apoe4 коррелирует с более тяжелым течением и ранним началом неврологических проявлений болезни Нимана-Пика типа С [84].
Болезнь Гентингтона
Это аутосомно-доминантное нейродегенеративное заболевание характеризуется когнитивными и моторными нарушениями. Болезнь Гентингтона возникает в результате увеличения количества остатков глутамина (более 36 копий, полиглутаминовая экспансия) в белке гентингтин. Токсичному воздействию данного белка подвержены нейроны стриа-тума и коры [85]. Биосинтез холестерина снижен в мозге при болезни Гентингтона [10]. Мутантный гентингтин снижает активность фактора транскрипции SREBP, что подавляет экспрессию его генов-мишеней и ведет к уменьшению образования холестерина в нейронах коры и стриатума (рис. 6). Уровень холестерина снижается сначала в си-
Мутантный гентингтин
синаптически везикулы
4- холестерина в синаптических
мембранах (кора, стриатум)
Рис. 6. Влияние мутантного белка гентингти-на на синаптиче-скую передачу и обмен холестерина. Подробные объяснения в тексте
Когнитивные дефекты
наптосомальных мембранах, а затем в миелине. Добавление экзогенного холестерина (до 15 мкМ) к нейронам стриатума, экспрессирующим мутант-ный гентингтин, увеличивает их выживаемость [86]. Чем больше длина полиглутаминового участка ген-тингтина, тем сильнее подавлен синтез холестерина и тяжелее протекает заболевание [34]. С возрастом различие в содержании холестерина у здоровых животных и животных с болезнью Гентингтона увеличивается [86]. При болезни Гентингтона наблюдается уменьшение на 50% синтеза холестерина в фибробластах, снижение общего содержания холестерина в плазме. Причем содержание холестерина в плазме значительно уменьшено уже на бессимптомной стадии [87]. Наоборот, концентрация 24-ГХ в начале болезни Гентингтона увеличивается, а на более поздних стадиях снижается за счет прогрессирующего снижения метаболизма холестерина при атрофии стриатума [10]. Начальный всплеск 24-ГХ может отражать последнюю «попытку» организма компенсировать недостаток обмена холестерина. Дальнейшее снижение 24-ГХ в мозге может способствовать уменьшению синтеза холестерина за счет ослабления активации LX-рецепторов и экспрессии
зависимых от LX-рецептора транскриптов (АВСА1, ABCG4, АроЕ). В итоге астроциты с мутантным ген-тингтином синтезируют и секретируют меньше АроЕ, а выделяемые АроЕ-частицы меньше по размеру и содержат меньше липидов, поэтому менее эффективно доставляют холестерин от астроцитов к нейронам и менее эффективно удаляют избыток холестерина [86]. Агонисты LX-рецепторов могут частично подавлять симптомы болезни Гентингтона [10]. В условиях сниженной продукции холестерина в мембранах и лизосомах/эндосомах могут образовываться скопления холестерина и его эфиров за счет снижения интенсивности удаления холестерина в составе АроЕ-частиц и 24-ГХ. Появление скоплений холестерина может быть связано с нарушением транспорта кавеолина-1 под влиянием мутантного гентингтина [88]. BDNF, освобождаемый из нервных окончаний кортикальных нейронов в стриатуме, вовлечен не только в синаптическую пластичность и контроль выживаемости, но и стимулирует синтез холестерина в постсинаптических нейронах. Мутантный гентингтин угнетает продукцию холестерина, воздействуя на транспорт и освобождение BDNF [10].
Белок гентингтин дикого типа может связываться с рядом ядерных рецепторов, вовлеченных в липид-ный метаболизм, например, LX-рецептор, PPARy (peroxisome-proliferator-activated receptor gamma), рецептор витамина D [10]. Сверхэкспрессия гентинг-тина активирует LX-рецептор, тогда как при его отсутствии наблюдается ингибирование транскрипции, опосредуемой LX-рецептором. Возможно, мутантный гентингтин в меньшей степени может стимулировать LX-рецептор и экспрессию его генов-мишеней, в том числе SREBP. В олигодендроцитах мутантный гентингтин подавляет эффект коактиватора 1 PPARy (PGCla) на экспрессию ферментов синтеза и метаболизма холестерина, белков миелина, нарушая образование миелиновой оболочки [89]. Еще на бессимптомной стадии при болезни Гентингтона снижена экспрессия PGCla в средних шипиковых нейронах стриатума. Это может быть одной из причин выраженной митохондриальной дисфункции, так как PGCla вовлечен в биогенез митохондрий и окислительный метаболизм, регулирует экспрессию компонентов электронно-транспортной цепи [90]. Нарушение функционирования митохондрий может вести к недостатку АТР, NADPH и субстратов, необходимых для синтеза холестерина. При болезни Гентингтона значительно возрастает текучесть мито-хондриальной мембраны, что может быть опосредовано нарушением синтеза холестерина. Холестерин-подобная молекула, олесоксим, способная проникать в клетку и накапливаться в мембране митохондрий, проявляет терапевтическую эффективность при коррекции митохондриальной дисфункции в моделях амиотрофического бокового склероза, периферической нейропатии и болезни Гентингтона. В последнем случае олесоксим понижает текучесть
мембран митохондрий, а при хроническом применении повышает в них содержание холестерина [91].
Перед клинической манифестацией болезни Гентингтона нарушаются процессы экзо- и эндоци-тоза синаптических везикул (рис. 6). Сам гентингтин концентрируется в пресинапсе и связывается с си-наптическими везикулами. У мышей с мутантным гентингтином наблюдается аномальное фосфорили-рование синапсина I и прогрессирующее снижение концентрации комплексина II, SNAP-25, рабфилина ЗА в нервных окончаниях специфических участков коры [92]. В итоге угнетается экзоцитоз и уменьшается размер пула синаптических везикул. Уровень цитоплазматического Са2+ в терминалях повышается, возможно, в результате ослабления ингибиторно-го влияния со стороны CSP (cysteine-string protein) или непосредственно гентингтина на кальциевые каналы N-типа или ITP-рецепторы соответственно [93]. Некоторые белки, участвующие в эндоцитозе, специфично связываются с гентингтином, — это HIP1 (huntingtin interacting protein 1), HIP1R, синдапин I, эндофилин. При болезни Гентингтона из пресинап-тических регионов пропадает эндоцитозный каркасный белок — синдапин, а HIP1 перестает должным образом функционировать, что приводит к сильному нарушению эндоцитоза. Кроме того, при болезни Гентингтона страдает связанная с эндосомами и зависимая от Rab11 рециклизация синаптических везикул, что ведет к появлению аномально маленьких синаптических везикул и угнетению синаптической передачи [94]. •
Работа поддержана грантом РФФИ (№ 14-0400094), а также частично другими грантами
РФФИ (№ 16-34-00127) и РНФ (№ 14-15-00847).
СПИСОК ЛИТЕРАТУРЫ
1. Dietschy J.M. // Biol. Chem. 2009. V. 390. № 4. P. 287-293.
2. Vance J.E. // Disease Models Mechanisms. 2012. V. 5. P. 746755.
3. Петров А.М., Зефиров А.Л. // Успехи физиологических наук. 2013. Т. 44. № 1. С. 17-38.
4. Saeed A.A., Genove G., Li T., Lütjohann D., Olin M., Mast N., Pikuleva I.A., Crick P., Wang Y., Griffiths W. // J. Biol. Chem. 2014. V. 289. № 34. P. 23712-23722.
5. Elahy M., Jackaman C., Mamo J.C.L., Lam V., Dhaliwal S.S., Giles C., Nelson D., Takechi R. // Immunity Ageing. 2015. V. 12. A. 2.
6. Sagare A.P., Bell R.D., Zhao Z., Ma Q., Winkler E.A., Ramana-than A., Zlokovic B.V. // Nat. Commun. 2013. V. 4. A. 2932.
7. Russell D.W., Halford R.W., Ramirez D.M., Shah R., Kotti T. // Annu. Rev. Biochem. 2009. V. 78. P. 1017-1040.
8. Saher G., Brügger B., Lappe-Siefke C., Möbius W., Tozawa R., Wehr M.C., Wieland F., Ishibashi S., Nave K.A. // Nat. Neuro-sci. 2005. V. 8. № 4. P. 468-475.
9. Numakawa T., Suzuki S., Kumamaru E., Adachi N., Richards M., Kunugi H. // Histol. Histopathol. 2010. V. 25. № 2. P. 237-258.
10. Leoni V., Caccia C. // Biochim. Biophys. Acta. 2015. pii: S1388-1981(15)00003-7.
11. Anchisi L., Dessl S., Pani A., Mandas A. // Front. Physiol. 2013. V. 3. P. 1-12.
12. Martin M.G., Ahmed T., Korovaichuk A., Venero C., Menchon S.A., Salas I., Munck S., Herreras O., Balschun D., Dotti C.G. // EMBO Mol. Med. 2014. V. 6. № 7. P. 902-917.
13. Suzuki R., Ferris H.A., Chee M.J., Maratos-Flier E., Kahn C.R. // PLoS Biol. 2013. V. 11. № 4. P. e1001532.
14. Camargo N., Brouwers J.F., Loos M., Gutmann D.H., Smit A.B., Verheijen M.H. // FASEB J. 2012. V. 26. № 10. P. 43024315.
15. Verheijen M.H., Camargo N., Verdier V., Nadra K., de Preux Charles A.S., Medard J.J., Luoma A., Crowther M., Inouye H., Shimano H. // Proc. Natl. Acad. Sci. USA. 2009. V. 106. № 50. P. 21383-21388.
16. Peake K.B., Vance J.E. // J. Biol. Chem. 2012. V. 287. P. 92909298.
17. Bryleva E.Y., Rogers M.A., Chang C.C., Buen F., Harris B.T., Rousselet E., Seidah N.G., Oddo S., LaFerla F.M., Spencer T. A., et al. // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 3081-3086.
18. Karten B., Campenot R.B., Vance D.E., Vance J.E. // J. Lipid Res. 2006. V. 47. P. 504-514.
19. Bu G. // Nat. Rev. Neurosci. 2009. V. 10. № 5. P. 333-344.
20. Hayashi H. // Biol. Pharm. Bull. 2011. V. 34. № 4. P. 453-461.
21. Lane-Donovan C., Philips G.T., Herz J. // Neuron. 2014. V. 83. № 4. P. 771-787.
22. Vaughan A.M., Oram J.F. // J. Lipid. Res. 2006. V. 47. № 11. P. 2433-2443.
23. Karasinska J.M., de Haan W., Franciosi S., Ruddle P., Fan J., Kruit J.K., Stukas S., Lütjohann D., Gutmann D.H., Wellington C.L. // Neurobiol. Dis. 2013. V. 54. P. 445-455.
24. Rushworth J.V., Griffiths H.H., Watt N.T., Hooper N.M. // J. Biol. Chem. 2013. V. 288. № 13. P. 8935-8951.
25. Liu Q., Trotter J., Zhang J., Peters M.M., Cheng H., Bao J., Han X., Weeber E.J., Bu G. // J. Neurosci. 2010. V. 30. № 50. P. 17068-17078.
26. Rensen P.C., Jong M.C., van Vark L.C., van der Boom H., Hendriks W.L., van Berkel T.J., Biessen E.A., Havekes L.M. // J. Biol. Chem. 2000. V. 275. № 12. P. 8564-8571.
27. Vance J.E., Karten B. // J. Lipid Res. 2014. V. 55. № 8. P. 1609-1621.
28. Ignatius M.J., Gebicke-Härter P. J., Skene J.H., Schilling J.W., Weisgraber K.H., Mahley R.W., Shooter E.M. // Proc. Natl. Acad. Sci. USA. 1986. V. 83. P. 1125-1129.
29. Gosselet F., Saint-Pol J., Fenart L. // Biochem. Biophys. Res. Commun. 2014. V. 446. № 3. P. 687-691.
30. Hudry E., Van Dam D., Kulik W., De Deyn P.P., Stet F.S., Ah-ouansou O., Benraiss A., Delacourte A., Bougneres P., Aubourg P. // Mol. Ther. 2010. V. 18. № 1. P. 44-53.
31. Sodero A.O., Vriens J., Ghosh D., Stegner D., Brachet A., Pallotto M., Sassoe-Pognetto M., Brouwers J.F., Helms J.B., Nieswandt B. // EMBO J. 2012. V. 31. № 7. P. 1764-1773.
32. Sodero A.O., Weissmann C., Ledesma M.D., Dotti C.G. // Neurobiol. Aging. 2011. V. 32. № 6. P. 1043-1053.
33. Marwarha G., Ghribi O. // Exp. Gerontol. 2014. pii: S0531-5565(14)00270-8.
34. Brown A.J., Jessup W. // Mol. Aspects Med. 2009. V. 30. № 3. P. 111-122.
35. Heverin M., Bogdanovic N., Lütjohann D., Bayer T., Pikuleva I., Bretillon L., Diczfalusy U., Winblad B., Björkhem I. // J. Lipid Res. 2004. V. 45. № 1. P. 186-193.
36. Lathe R., Sapronova A., Kotelevtsev Y. // BMC Geriatrics. 2014. V. 14. A. 36
37. Zefirov A.L., Petrov A.M. // Neurosci. Behav. Physiol. 2012. V. 42. № 2. P. 144-152.
38. Jennemann R., Sandhoff R., Wang S., Kiss E., Gretz N., Zuliani C., Martin-Villalba A., Jäger R., Schorle H., Kenzel-mann M. // Proc. Natl. Acad. Sci. USA. 2005. V. 102. № 35. P. 12459-12464.
39. Suzuki T., Zhang J., Miyazawa S., Liu Q., Farzan M.R., Yao W.D. // J. Neurochem. 2011. V. 119. № 1. P. 64-77.
40. Stary C.M., Tsutsumi Y.M., Patel P.M., Head B.P., Patel H.H., Roth D.M. // Front. Physiol. 2012. V. 3. P. 393.
41. Head B.P., Peart J.N., Panneerselvam M., Yokoyama T., Pearn M.L., Niesman I.R., Bonds J.A., Schilling J.M., Miyano-hara A., Headrick J. // PLoS One. 2010. V. 5. № 12. P. e15697.
42. Fantini J., Yahi N. // Adv. Exp. Med. Biol. 2013. V. 991. P. 15-26.
43. Uversky V.N. // Adv. Exp. Med. Biol. 2015. V. 855. P. 33-66.
44. Rushworth J.V., Hooper N.M. // Int. J. Alzheimers. Dis. 2011. P. 603052.
45. Petrov A.M., Kudryashova K.E., Odnoshivkina Yu.G., Ze-firov A.L. // Neurochem. J. 2011. V. 5. № 1. P. 13-19.
46. Matsuzaki K. // Int. J. Alzheimers. Dis. 2011. V. 2011. P. 956104.
47. Martins I.C., Kuperstein I., Wilkinson H., Maes E., Vanbra-bant M., Jonckheere W., van Gelder P., Hartmann D., D’Hooge R., De Strooper B. // EMBO J. 2008. V. 27. № 1. P. 224-233.
48. Tong J., Borbat P.P., Freed J.H., Shin Y.K. // Proc. Natl. Acad. Sci. USA. 2009. V. 106. № 13. P. 5141-5146.
49. Rohrbough J., Broadie K. // Nat. Rev. Neurosci. 2005. V. 6. № 2. P. 139-150.
50. Jia J.Y., Lamer S., Schümann M., Schmidt M.R., Krause E., Haucke V. // Mol. Cell Proteomics. 2006. V. 5. № 11. P. 20602071.
51. Sieber J. J., Willig K.I., Heintzmann R., Hell S.W., Lang T. // Biophys. J. 2006. V. 90. № 8. P. 2843-2851.
52. Taverna E., Saba E., Linetti A., Longhi R., Jeromin A., Righi M., Clementi F., Rosa P. // J. Neurochem. 2007. V. 100. № 3.
P. 664-677.
53. Kasimov M.R., Giniatullin A.R., Zefirov A.L., Petrov A.M. // Biochim. Biophys. Acta. 2015. V. 1851. № 5. P. 674-685.
54. Petrov A.M., Kasimov M.R., Giniatullin A.R., Tarakanova O.I., Zefirov A.L. // Neurosci. Behav. Physiol. 2010. V. 40. № 8. P. 894-901.
55. Petrov A.M., Kasimov M.R., Giniatullin A.R., Zefirov A.L. // Neurosci. Behav. Physiol. 2014. V. 44. № 9. P. 1020-1030.
56. Zamir O., Charlton M.P. // J. Physiol. 2006. V. 571. № 1. P. 83-99.
57. Tarakanova O.I., Petrov A.M., Zefirov A.L. // Doclady Biol. Sci. 2011. V. 438. P. 138-140.
58. Petrov A.M., Yakovleva A.A., Zefirov A.L. // J. Physiol. 2014. V. 592. № 22. P. 4995-5009.
59. Smith A.J., Sugita S., Charlton M.P. // J. Neurosci. 2010. V. 30. № 17. P. 6116-6121.
60. Petrov A.M., Zakyrjanova G.F., Yakovleva A.A., Zefirov A.L. // Biochem. Biophys. Res. Commun. 2015. V. 456. № 1. P. 145-150.
61. Tarasenko A.S., Sivko R.V., Krisanova N.V., Himmelreich N.H., Borisova T.A. // J. Mol. Neurosci. 2010. V. 41. № 3.
P. 358-367.
62. Petrov A.M., Naumenko N.V., Uzinskaya K.V., Giniatullin
A.R., Urazaev A.K., Zefirov A.L. // Neuroscience. 2011. V. 186. P. 1-12.
63. Hering H., Lin C.C., Sheng M. // J. Neurosci. 2003. V. 23. № 8. P. 3262-3271.
64. Hou Q., Huang Y., Amato S., Snyder S.H., Huganir R.L., Man H.Y. // Mol. Cell Neurosci. 2008. V. 38. № 2. P. 213-223.
65. Korinek M., Vyklicky V., Borovska J., Lichnerova K., Kania-kova M., Krausova B., Krusek J., Balik A., Smejkalova T., Horak M. // J. Physiol. 2015. V. 593. № 10. P. 2279-2293.
66. Paul S.M., Doherty J. J., Robichaud A.J., Belfort G.M., Chow
B.Y., Hammond R.S., Crawford D.C., Linsenbardt A.J., Shu H.J., Izumi Y. // J. Neurosci. 2013. V. 33. № 44. P. 17290-17300.
67. Head B.P., Patel H.H., Tsutsumi Y.M., Hu Y., Mejia T., Mora R.C., Insel P.A., Roth D.M., Drummond J.C., Patel P.M. // FASEB J. 2008. V. 22. № 3. P. 828-840.
68. Butchbach M.E., Tian G., Guo H., Lin C.L. // J. Biol. Chem. 2004. V. 279. № 33. P. 34388-34396.
69. Brachet A., Norwood S., Brouwers J.F., Palomer E., Helms J.B., Dotti C.G., Esteban J.A. // J. Cell Biol. 2015. V. 208. № 6. P. 791-806.
70. Nowaczyk M.J., Irons M.B. // Am. J. Med. Genet. C Semin. Med. Genet. 2012. V. 160C. № 4. P. 250-262.
71. Bjorkhem I., Starck L., Andersson U., Lütjohann D., von Bahr S., Pikuleva I., Babiker A., Diczfalusy U. // J. Lipid Res. 2001. V. 42. № 3. P. 366-371.
72. Korade Z., Xu L., Shelton R., Porter N.A. // J. Lipid Res. 2010. V. 51. № 11. P. 3259-3269.
73. Staneva G., Chachaty C., Wolf C., Quinn P.J. // J. Lipid Res. 2010. V. 51. № 7. P. 1810-1822.
74. Wassif C.A., Zhu P., Kratz L., Krakowiak P.A., Battaile K.P., Weight F.F., Grinberg A., Steiner R.D., Nwokoro N.A., Kelley R.I. // Hum. Mol. Genet. 2001. V. 10. № 6. P. 555-564.
75. Singh P., Paila Y.D., Chattopadhyay A. // Biochem. Biophys. Res. Commun. 2007. V. 358. № 2. P. 495-499.
76. Jiang X.S., Wassif C.A., Backlund P.S., Song L., Holtzclaw L.A., Li Z., Yergey A.L., Porter F.D. // Hum. Mol. Genet. 2010. V. 19. № 7. P. 1347-1357.
77. Sparks S.E., Wassif C.A., Goodwin H., Conley S.K., Lanham D.C., Kratz L.E., Hyland K., Gropman A., Tierney E., Porter F.D. // J. Inherit. Metab. Dis. 2014. V. 37. № 3. P. 415-420.
78. Hawes C.M., Wiemer H., Krueger S.R., Karten B. // J. Neu-rochem. 2010. V. 114. P. 311-322.
79. Xu S., Zhou S., Xia D., Xia J., Chen G., Duan S., Luo J. // Neuroscience. 2010. V. 167. P. 608-620.
80. Liu B., Turley S.D., Burns D.K., Miller A.M., Repa J.J., Dietschy J.M. // Proc. Natl. Acad. Sci. USA. 2009. V. 106. P. 2377-2382.
81. Tamura A., Yui N. // J. Biol. Chem. 2015. V. 290. № 15. P. 9442-9454.
82. Malnar M., Hecimovic S., Mattsson N., Zetterberg H. // Neu-robiol. Dis. 2014. V. 72 Pt A. P. 37-47.
83. Yamazaki T., Chang T.Y., Haass C., Ihara Y. // J. Biol. Chem. 2001. V. 276. № 6. P. 4454-4460.
84. Fu R., Yanjanin N.M., Elrick M.J., Ware C., Lieberman A.P., Porter F.D. // Am. J. Med. Genet. A. 2012. V. 158A. № 11. P. 2775-2780.
85. Margulis B.A., Vigont V., Lazarev V.F., Kaznacheyeva E.V., Guzhova I.V. // FEBS Lett. 2013. V. 587. № 13. P. 1997-2007.
86. Valenza M., Leoni V., Karasinska J.M., Petricca L., Fan J., Carroll J., Pouladi M.A., Fossale E., Nguyen H.P., Riess O. // J. Neurosci. 2010. V. 30. P. 10844-10850.
87. Wang R., Ross C.A., Cai H., Cong W.N., Daimon C.M., Carlson O.D., Egan J.M., Siddiqui S., Maudsley S., Martin B. // Front. Physiol. 2014. V. 5. P. 231.
88. Trushina E., Canaria C.A., Lee D.Y., McMurray C.T. // Hum. Mol. Genet. 2014. V. 23. № 1. P. 129-144.
89. Xiang Z., Valenza M., Cui L., Leoni V., Jeong H.K., Brilli E., Zhang J., Peng Q., Duan W., Reeves S.A. // J. Neurosci. 2011. V. 31. № 26. P. 9544-9553.
90. Tsunemi T., La Spada A.R. // Prog. Neurobiol. 2012. V. 97. № 2. P. 142-151.
91. Eckmann J., Clemens L.E., Eckert S.H., Hagl S., Yu-Taeger L., Bordet T., Pruss R.M., Muller W.E., Leuner K., Nguyen H.P. // Mol. Neurobiol. 2014. V. 50. № 1. P. 107-118.
92. Smith R., Klein P., Koc-Schmitz Y., Waldvogel H.J., Faull R.L., Brundin P., Plomann M., Li J.Y. // J. Neurochem. 2007. V. 103. № 1. P. 115-123.
93. Bezprozvanny I.B. // Acta Naturae. 2010. V. 2. № 1(4). P. 72-80.
94. Steinert J.R., Campesan S., Richards P., Kyriacou C.P., Forsythe I.D., Giorgini F. // Hum. Mol. Genet. 2012. V. 21. № 13. P. 2912-2922.
Сложный способ стать счастливым
Счастье — это побочный продукт системы выживания человека. Механизм, который был заложен эволюцией, чтобы поведение животного было рациональным.
Если понимать, как работает этот механизм, то появляется возможность им управлять.
1. В обществе доминирует мысль, что свобода является однозначным благом. Влажные мечты большинства людей — иметь неограниченную сумму денег, чтобы никогда не работать и делать, что хочется. Именно это ассоциируется со счастьем.
2. Однако, с точки зрения мозга, всё не так. Многие слышали, что счастье человек испытывает, когда какие-то там химические вещества, типа дофамина, выбрасываются в мозг. Это ошибочная модель того, как работает этот процесс.
3. Нейромедиатор (дофамин, окситоцин итд) — это вещество, выбрасывающиеся в местах соединения нейронов. Проще говоря, это «язык», с помощью которого нейроны обмениваются информацией.
4. Иногда нейроны шепчут друг другу на ухо: информация передаётся от нейрона к нейрону. Иногда кричат в полный голос: сильный выброс нейромедиаторов, который влияет на несколько нейронов вокруг.
5. В большинстве случаев, нейроны выделяют один конкретный нейромедиатор. Проще говоря, нейрон не может вначале выделять серотонин, а потом, с перепугу, начать гнать дофамин.
6. Если продолжить аналогию с языком, то можно сказать, что в мозге существуют разные гетто. Одна часть мозга говорит на своём «дофаминовом языке». Другая не «серотониновом диалекте». Такое разделение помогает разным отделам мозга не мешать друг другу.
7. Когда говорится, что выбросился тот или иной нейромедиатор, то это значит, что активировалась какая-то конкретная область мозга. Например, если выбросился окситоцин, то это условно значит, что активировалась группа нейронов, которая отвечает за размножение. Отсюда все сопутствующие эмоции.
8. Дофамин, и серотонин — это не гормоны счастья. Они не влияют напрямую на наш эмоциональный мир. Нельзя сказать, что русский и английский — это языки счастья. Нероймедиаторы выполняют функцию передачи информации.
Каюсь, я сам иногда использую концепцию химического счастья, чтобы что-то объяснить. Уж очень она у всех на слуху. Давайте рассмотрим альтернативную теорию.
9. Так чем же является счастье, если не химией? Всё просто. Эмоциональное состояние человека повышается, если мозг смог быстро обработать входящую сенсорную информацию. И снижается, если потребовались дополнительные энергозатраты.
10. Если человек слушал Киркорова всю жизнь, то в его мозге нарезаны «борозды» для обработки информации, связанной с певцом (внешность, текст песен, голос). Благодаря этому «обрабатывать Киркорова» мозгу проще, чем отвратительную песню Нирваны, которую слушает внук.
11. Если человеку что-то нравится, то это значит, что мозг смог легко обработать сигнал. Если что-то не нравится, то значит потребовались дополнительные затраты энергии. Весь глубокий мир предпочтений — это субъективное ощущение скорости обработки сигнала мозгом.
12. На скорость обработки влияет не только узнавание внешнего сигнала. Во-первых, имеет значение «зашумленность системы». Очищенный утренний мозг быстрее работает, поэтому утром мир кажется лучше, чем вечером.
13. Во-вторых, как уже было сказано, для обработки сигнала необходимы выбросы нейромедиаторов. При каждом выбросе их запасы истощаются. По этой причине нельзя получать кайф очень долго.
Процессы, идущие в синоптической щели (точке соприкосновения нейронов), конечно, гораздо сложнее. Но, для данной статьи, самое главное уловить суть — активация нейрона снижает вероятность его повторной активации. До тех пор, пока он не восстановится.
14. На весёлой вечеринке нейроны в мозге человека буквально орут друг на друга. Происходит активный выброс нейромедиаторов. Благодаря их избытку все сигналы обрабатываются легко. Человек испытывает эйфорию.
15. К сожалению, запасы исходников для нейромедиаторов внутри нейронов не бесконечны. Постепенно нейроны «теряют голос». Если вечеринка прошла хорошо, то человек чувствует себя подавленным на следующий день. Не хватает запаса нейромедиаторов для быстрой обработки сигнала.
Все наркотики так или иначе стимулируют выброс нейромедиаторов. Ускоряют работу мозга. Дозу увеличивают, чтобы «вытащить» последний запас нейромедиаторов в истощённых нейронах.
16. К сожалению, мозг человека совершенно не стремится к счастью. Он стремится проводить сигналы с минимальными затратами энергии. Если у него получилось — хорошо. Не получилось — насладись подавленным настроением. Отсюда человеческое стремление ничего не делать.
17. Есть прекрасная мантра, которую полезно запомнить: «ЧЕЛОВЕК ДЕЙСТВУЕТ ТОЛЬКО ПОД ДАВЛЕНИЕМ СРЕДЫ». Это давление может быть внешним (строгий начальник) и внутренним (хочу есть). Внутреннее давление может быть природным (страх огня) или выученным (привычка чистить зубы по утрам).
18. Нет давления — нет действия. Если человек избавится от внешнего давления, то постепенно пропадёт и внутреннее. Вслед за этим, с мозгом начнут происходить печальные изменения.
19. Представьте себе воздушный шар с кабиной, где хранятся баллоны с топливом. Огонь — это усилия, которые нужны мозгу, чтобы справляться с повседневными трудностями. Топливо — это нейронные связи, благодаря которым он может гореть. А высота полёта шара — уровень счастья.
20. Когда пропадает давление внешней среды, когда появляется свобода, то мозгу больше не нужно тратить усилия на поддержание огня. Не нужно активно работать, чтобы справляться со всеми вызовами окружающего мира. Огонь угасает, шар начинает падать. Чтобы не разбиться о скалы депрессии сбрасываются тяжелые баллоны с топливом — лишние нейронные связи.
21. Чем меньше становится нейронных связей, тем тусклее становится окружающий мир. Мозг переходит на пониженные обороты. Все сигналы обрабатываются с трудом. Ничего не радует. Из-за этого человек пытается сделать свою жизнь ещё проще, чтобы вернуть былое удовольствие. И так, шаг за шагом, до состояния овоща, который лежит на диване и смотрит в потолок. Даже если это потолок личной яхты.
22. Так уж устроен мозг. Его задача — функционирующий организм, при минимальных энергозатратах. Его цель «лететь» так низко, как это вообще возможно. И это не имеет никакого отношения к счастью. Счастье оно там, в небе. Где огонь горит ярко, а запасы топлива велики.
23. Иногда кажется, что человек очень много работает, очень устаёт, но не может найти счастье. Это значит, что человек погряз в рутине. Делает одни и те же действия. Человек устаёт физически, но для мозга вся это повседневная волокита — лёгкое шевеление пальцем левой ноги.
24. Счастье — это всегда результат борьбы. Чем сильнее мир пинает человека, чем сложнее и разнообразнее жизнь — тем счастливее человек.
25. Подведём итог, чтобы быть счастливым нужно:
— брать на себя ответственность на работе;
— брать на себя ответственность за людей;
— постоянно учиться;
— ставить перед собой цели, которые выходят за пределы возможностей;
— быть в окружение развивающихся людей;
— перестать мечтать о свободе и покое;
— привыкнуть заниматься спортом;
— привыкнуть читать;
— постоянно создавать для себя новые привычки, которые подталкивают к действиям.
— путешествовать;
— развивать круг общения;
— пробовать новое, непривычное.
Фраза «Счастье умереть на поле сражения» не о том, что хорошо умереть, а о том, что счастье — это результат борьбы.
Подписаться на авторский канал
Иннокентия Скирневского на Педсовете
Заболевание Аутизм
Аутизм – психологическое расстройство, возникающее вследствие нарушения развития головного мозга. Хоть заболевание и является врождённым, оно может быть диагностировано только в возрасте от трех лет и позже. В переводе слово «аутизм» обозначает – ушедший в себя человек, или человек внутри себя. Люди с таким заболеванием страдают нарушением социальных взаимодействий и расстройством в эмоциональной сфере.
ПРИЧИНЫ
На данный момент точная причина развития аутизма неизвестна. Долгое время считалось, что причина развития данного расстройства заключается в нарушении структуры генов, и их непосредственном влиянии на синоптические связи в коре головного мозга. Сейчас всё большую силу набирает предположение о том, что развитие аутизма связано с мутацией, возникающей во время внутриутробного развития плода. Статистика показывает, что в среднем аутизм встречается у 6 человек из 1000. При этом у мальчиков данное расстройство встречается в 4 раза чаще, чем у девочек.
СИМПТОМЫ
Так как заболевание является врождённым, первые симптомы аутизма можно заметить ещё в младенчестве. В первые месяцы жизни груднички менее подвижны, у них скудная мимика и онОбщими симптомами данного заболевания являются:
и меньше интересуются яркими предметами. В 5-6 месяцев дети с аутизмом практически не интересуются находящимися рядом предметами, не пытаются их схватить, при этом мышечный тонус рук у них развит нормально. В возрасте одного года малыши не производят характерных для своего возраста звуков, не указывают по просьбе на предмет, в полтора года не произносят слов, а в два года — элементарных фраз. Симптомами аутизма в раннем детском возрасте также может быть нежелание играть с игрушками или сосредоточение на одной из ее частей. Ребенок может выдвигать ряд необоснованных требований, а именно передвигаться по строго определенному маршруту, осуществлять определенные действия в строго установленном им порядке.
У взрослых людей аутизм проявляется в своеобразном увлечении определенными темами, характерными движениями, шаблонным мышлением. Примерно треть от людей с таким расстройством могут достигнуть определенного прогресса в обучении и карьере, однако все равно они будут постоянно испытывать трудности с коммуникацией.
Общими симптомами данного заболевания являются:
- Нарушение социального взаимодействия;
- Узконаправленные интересы и однообразные, часто повторяющиеся действия;
- Умственная отсталость;
- Задержка развития речи у ребенка;
- Нарушение коммуникации;
- Невосприятие таких явлений, как юмор, завуалированное общение, скрытый смысл;
- Нарушение чувственного восприятия (малейшее прикосновение вызывает дискомфорт).
ДИАГНОСТИКА
Ранняя постановка диагноза дает возможность помочь развить имеющийся у ребенка потенциал. Именно от времени постановки диагноза будет зависеть прогресс в развитии.
Существует большое количество тестов и опросов, позволяющие измерить уровень интеллекта ребенка и определить стадию заболевания. Также обследование может включать в себя проверку мышечной системы организма, которая при аутизме может существенно отставать в развитии.
При необходимости проводятся МРТ, ЭЭГ, хромосомный анализ.
ЛЕЧЕНИЕ
Не существует лечения, способного обеспечить полное выздоровление пациента. Однако при правильной терапии многие больные способны вести самостоятельную жизнь.
Для маленьких детей терапия проходит поэтапно:
- Формирование навыков, необходимых для общения с окружающими;
- Приобретение навыков самообслуживания и нахождения в социуме;
- Логопедическое лечение;
- Медикаментозная терапия (применяется только в случаи появления деструктивных расстройств).
Business FM Санкт-Петербург — О том, как мозг влияет на нашу жизнь
В 20 веке наука утверждала, что мозг развивается только в детстве, а нервные клетки не восстанавливаются. Сегодня нейропластичность, то есть способность мозга меняться и адаптироваться в ответ на новые события, доказана. Каждый опыт должен быть записан, чтобы при повторении ситуации у нас был шаблон эмоциональных реакций и действий. Но как это влияет на наши цели и повседневную жизнь?
В 2013 году доктор Джо Диспенза, нейробиолог и биохимик, опубликовал свою версию устройства мира, которая опровергает ньютоновскую концепцию причины и следствия. Автор опирается на результаты экспериментов, которые доказали, что мозг не видит разницы между действием, переживаемым в реальности, и тем же действием в нашем воображении. И в том и в другом случае мозг создаёт одинаковые синоптические нейронные связи.
Ученые выделяют у человека три мозга: неокортекс, лимбический узел и мозжечок. Неокортекс получает, обрабатывает и хранит знания. Его называют творческой лабораторией личности или мыслящим мозгом. Лимбический узел — химическое производство организма. Здесь вырабатываются пептиды, вещества, отражающие эмоции, реальные или воображаемые. Лимбический узел называют эмоциональным мозгом. Мозжечок отвечает за все подсознательные и автоматические процессы. Обучаясь, человек использует все три мозга, записывая новое знание в неокортекс, закрепляя действие молекулами радости или стресса и сохраняя его как автоматический навык.
Джо Диспенза утверждает, что обязательное условие создания новой реальности — направленное воображение. Уже на этом этапе мозг фиксирует новую картину как переживаемый в реальности опыт. Изменяя свои привычные убеждения и мысли, мы изменяем химические реакции организма, новый гормональный фон вызывает желание действовать по-другому. Новое поведение создаёт новые реакции и реальность.
Мозг — самый мощный биологический компьютер, его оборудование и программное обеспечение полностью зависят от нас. Ньютоновская картина мира, где есть внешнее событие и наша реакция на него, устарела. Сегодня новейшие научные концепции, соединяясь с древней мудростью, говорят, что может быть и по-другому. Сначала событие переживается в воображении, мозг создаёт нейронные связи, записывая знание и эмоциональный фон, после 6-8 повторений событие оседает в памяти, превращаясь в опыт, таким образом, наш компьютер записывает воспоминание о будущем, что абсолютно возможно с точки зрения квантовой физики. Психологи считают, что любая эмоционально-заряженная фантазия человека возможна, т.к. мозг не транслирует запись, которой в нем нет. Может быть, это воспоминание о том, какой должна быть наша жизнь?
нейробиологов раскрывают, как мозг может улучшить связи | MIT News
Когда мозг формирует воспоминания или изучает новую задачу, он кодирует новую информацию, настраивая связи между нейронами. Нейробиологи Массачусетского технологического института открыли новый механизм, который способствует укреплению этих связей, также называемых синапсами.
В каждом синапсе пресинаптический нейрон посылает химические сигналы одной или нескольким постсинаптическим принимающим клеткам. В большинстве предыдущих исследований того, как эти связи развиваются, ученые сосредоточились на роли постсинаптических нейронов.Однако команда Массачусетского технологического института обнаружила, что пресинаптические нейроны также влияют на силу связи.
«Этот механизм, который мы обнаружили на пресинаптической стороне, добавляет к инструментарию, который у нас есть для понимания того, как могут изменяться синапсы», — говорит Трой Литтлтон, профессор кафедры биологии, мозга и когнитивных наук в Массачусетском технологическом институте, член из Института обучения и памяти Пикауэра Массачусетского технологического института и старшего автора исследования, которое опубликовано 18 ноября в выпуске Neuron .
Более подробная информация о том, как синапсы изменяют свои связи, может помочь ученым лучше понять нарушения нервного развития, такие как аутизм, поскольку многие из генетических изменений, связанных с аутизмом, обнаруживаются в генах, кодирующих синаптические белки.
Ричард Чо, научный сотрудник Института Пикауэра, является ведущим автором статьи.
Перепрограммирование мозга
Один из самых больших вопросов в области нейробиологии — это то, как мозг перестраивается в ответ на изменение поведенческих условий — способность, известную как пластичность.Это особенно важно на раннем этапе развития, но продолжается на протяжении всей жизни, поскольку мозг учится и формирует новые воспоминания.
За последние 30 лет ученые обнаружили, что сильный вход в постсинаптическую клетку заставляет ее направлять больше рецепторов для нейротрансмиттеров на свою поверхность, усиливая сигнал, который она получает от пресинаптической клетки. Это явление, известное как долговременная потенциация (ДП), возникает после постоянной высокочастотной стимуляции синапса. Долгосрочная депрессия (LTD), ослабление постсинаптического ответа, вызванное очень низкочастотной стимуляцией, может возникнуть, когда эти рецепторы удалены.
Ученые меньше уделяют внимания роли пресинаптического нейрона в пластичности, отчасти потому, что его труднее изучать, говорит Литтлтон.
Его лаборатория потратила несколько лет на разработку механизма того, как пресинаптические клетки высвобождают нейромедиатор в ответ на всплески электрической активности, известные как потенциалы действия. Когда пресинаптический нейрон регистрирует приток ионов кальция, несущих электрический всплеск потенциала действия, везикулы, которые хранят нейротрансмиттеры, сливаются с клеточной мембраной и выливают свое содержимое за пределы клетки, где они связываются с рецепторами на постсинаптическом нейроне.
Пресинаптический нейрон также высвобождает нейромедиатор в отсутствие потенциалов действия в процессе, называемом спонтанным высвобождением. Ранее считалось, что эти «мини» представляют собой шум, возникающий в мозгу. Однако Литтлтон и Чо обнаружили, что minis можно регулировать, чтобы управлять структурной пластичностью синапсов.
Чтобы исследовать, как укрепляются синапсы, Литтлтон и Чо изучили тип синапсов, известный как нервно-мышечные соединения, у плодовых мушек. Исследователи стимулировали пресинаптические нейроны быстрой серией потенциалов действия в течение короткого периода времени.Как и ожидалось, эти клетки высвобождали нейромедиатор синхронно с потенциалами действия. Однако, к своему удивлению, исследователи обнаружили, что мини-события значительно усилились после того, как электрическая стимуляция закончилась.
«Каждый синапс в мозге запускает эти мини-события, но люди в значительной степени игнорируют их, потому что они вызывают лишь очень небольшую активность в постсинаптической клетке», — говорит Литтлтон. «Когда мы давали этим нейронам сильный импульс активности, эти мини-события, которые обычно очень низкочастотные, внезапно нарастали, и они оставались повышенными в течение нескольких минут, а затем снижались.
Синаптический рост
Усиление minis, по-видимому, провоцирует постсинаптический нейрон высвобождать сигнальный фактор, до сих пор не идентифицированный, который возвращается в пресинаптическую клетку и активирует фермент, называемый PKA. Этот фермент взаимодействует с белком везикул, называемым комплексином, который обычно действует как тормоз, зажимая везикулы, чтобы предотвратить высвобождение нейромедиатора до тех пор, пока он не понадобится. Стимуляция PKA модифицирует комплексин так, что он освобождает от его захвата везикулы нейротрансмиттера, производя мини-события.
Когда эти маленькие пакеты нейротрансмиттера высвобождаются с повышенной скоростью, они помогают стимулировать рост новых связей, известных как бутоны, между пресинаптическими и постсинаптическими нейронами. Это делает постсинаптический нейрон еще более восприимчивым к любой будущей коммуникации от пресинаптического нейрона.
«Обычно у вас есть около 70 таких бутонов на клетку, но если вы стимулируете пресинаптическую клетку, вы можете очень быстро вырастить новые бутоны. Это удвоит количество образующихся синапсов », — говорит Литтлтон.
Исследователи наблюдали этот процесс на протяжении всего личиночного развития мух, которое длится от трех до пяти дней. Однако Литтлтон и Чо продемонстрировали, что острые изменения синаптической функции также могут приводить к синаптической структурной пластичности во время развития.
«Механизм пресинаптического терминала можно очень быстро модифицировать, чтобы управлять определенными формами пластичности, что может быть действительно важно не только в развитии, но и в более зрелых состояниях, где синаптические изменения могут происходить во время поведенческих процессов, таких как обучение и т. Д. память, — говорит Чо.
Исследование имеет большое значение, поскольку оно одним из первых показывает, как пресинаптические нейроны способствуют пластичности, — говорит Мария Быховская, профессор неврологии медицинского факультета Уэйнского государственного университета, которая не принимала участия в исследовании.
«Было известно, что рост нейронных связей определяется активностью, но конкретно, что происходит, было не очень понятно», — говорит Быховская. «Они прекрасно использовали Drosophila для определения молекулярного пути.
Лаборатория Литтлтона сейчас пытается выяснить больше механистических деталей того, как комплексин контролирует высвобождение везикул.
Расширяющийся коллектор в трансмодальных регионах характеризует подростковая реконфигурация структурной организации коннектома
Существенные изменения:
— Во введении не так много говорится о том, почему колокализованные наборы генов представляют интерес для изучения. Что уже известно о развитии мозга с использованием этого подхода, и как текущая работа восполняет пробелы в наших знаниях?
Мы обновили Введение, добавив новый абзац, мотивирующий проведение транскриптомного анализа и подчеркивающий новизну нашей работы:
«Подходы визуализации и транскриптомики позволяют идентифицировать клеточные и молекулярные факторы, которые зависят от результатов визуализации (Arnatkeviciute et al., 2019; Форнито и др., 2019; Gorgolewski et al., 2014; Hawrylycz et al., 2015; Томпсон и др., 2013). Недавно созданные ресурсы, такие как Атлас человеческого мозга Аллена (Arnatkeviciute et al., 2019; Hawrylycz et al., 2015), можно использовать для пространственной связи макромасштабных данных визуализации / коннектомов с паттернами экспрессии тысяч генов. Эти результаты уже применялись в исследовании здоровых взрослых (Hawrylycz et al., 2015; Park et al., 2020b; Q. Xu et al., 2020) и типично развивающихся подростков (Mascarell Maričić et al., 2020; Падманабхан и Луна, 2014; Paquola et al., 2019a; Vértes et al., 2016; Whitaker et al., 2016), а также лиц, страдающих распространенными заболеваниями головного мозга (Altmann et al., 2018; Hashimoto et al., 2015; Klein et al., 2017; Park et al., 2020a; Patel et al. , 2021; Romero-Garcia et al., 2019). Наборы генов, которые зависят от результатов in vivo, могут, кроме того, подвергаться анализу обогащения набора генов для обнаружения потенциально связанных молекулярных, клеточных и патологических процессов (Ashburner et al., 2000; Carbon et al., 2019; Чен и др., 2013; Догерти и др., 2010; Кулешов и др., 2016; Morgan et al., 2019; Ромеро-Гарсия и др., 2018; Субраманиан и др., 2005). Например, исследования новорожденных показали, что морфология коры мозга отражает пространственно-временные паттерны экспрессии генов у плодов, связывая молекулярные механизмы с измерениями коркового развития in vivo в раннем возрасте (Ball et al., 2020). Кроме того, работа с подростками показала, что изменения в развитии региональных показателей толщины коры и прокси миелина пространственно совмещаются с паттернами экспрессии генов, участвующих в синаптической и олигодендроглиальной функции (Paquola et al., 2019a; Whitaker et al., 2016). Основываясь на этих предыдущих исследованиях, текущее исследование было направлено на изучение того, отражают ли структурные реконфигурации коннектомов подростков, оцениваемые с использованием разнообразных методов обучения, паттерны экспрессии конкретных генов, чтобы выявить потенциальные молекулярные признаки развития структурной сети на макроуровне ».
— Точно так же во введении говорится, что исследование направлено на «прогнозирование будущих показателей когнитивной функции». Какие когнитивные функции были интересны в этом исследовании и почему? Никакого обоснования или предыстории для проведения этих анализов не предоставляется.
Мы благодарим рецензентов за этот комментарий.
Мы включили дополнительное обоснование и детали когнитивного предсказания во Вступление:
«Чтобы также оценить поведенческие ассоциации разнообразных изменений коннектома, мы использовали контролируемое машинное обучение для прогнозирования будущих показателей когнитивной функции, количественно определяемых с помощью коэффициента интеллекта (IQ). IQ — широко используемый маркер общих когнитивных способностей, который показывает хорошую надежность повторных тестов (Brown, May, 1979; Canivez and Watkins, 1998; Catron, 1978; Matarazzo et al., 1973; Сноу и др., 1989; Wagner and Caldwell, 1979) и ранее применялся для индексации общей когнитивной функции во время развития (Crespi, 2016; Garde et al., 2005, 2000; Koenis et al., 2018; Park et al., 2016; Ramsden et al. , 2011; Shaw et al., 2006; Suprano et al., 2020). При исследовании развития нервной системы в отчетах о нейровизуализации ранее оценивалась связь между IQ и крупномасштабными сетевыми показателями у детей и подростков (Koenis et al., 2018; Ramsden et al., 2011; Seidlitz et al., 2018; Shaw et al., 2006; Suprano et al., 2020) ».
— Авторы утверждают, что их исследование изучает «весь подростковый период», однако некоторые утверждают, что 14 лет не является самым ранним возрастом начала подросткового возраста. Я думаю, было бы правильнее сказать, что исследование охватывает средний и поздний подростковый период.
Мы ценим комментарий рецензента.
Мы уточнили образец во Введении:
«Здесь мы наметили изменения в развитии структурной организации коннектома на основе ускоренного продольного нейровизуализационного исследования с участием 208 участников в возрасте от 14 до 26 лет (Kiddle et al., 2018; Whitaker et al., 2016) »
— В результатах указано, что три собственных вектора объясняют приблизительно 50% дисперсии матрицы сродства к шаблону. Здесь было бы полезно сообщить, какая именно часть дисперсии была объяснена каждым из них (E1, E2, E3).
Как и было предложено, мы предоставили дополнительную информацию в Результатах:
«Три собственных вектора (E1, E2 и E3) объясняют приблизительно 50% информации в матрице сродства к шаблону (т.е.е., 20,7 / 15,8 / 13,5% для E1 / E2 / E3, соответственно), причем каждый собственный вектор показывает другую ось пространственного изменения в корковой мантии (рис. 1A) ».
— Пубертатное развитие происходит во всех исследованных возрастных группах и влияет на структуру и функции мозга. Была ли доступна информация о стадии полового созревания участников? Были ли у некоторых участников изменения в пубертатном статусе с момента времени 1 до момента времени 2?
Консорциум NSPN собрал шкалу Таннера (Marshall and Tanner, 1970, 1969), которая количественно оценивает стадии полового созревания от 1 (до полового созревания) до 5 (заключительная фаза физического созревания).Однако оценка была получена на исходном уровне и только для 73/208 участников. Таким образом, мы не могли оценить продольные изменения разнообразных особенностей в соответствии с изменениями в стадиях пубертата, индексируемыми стадией Таннера. Тем не менее, линейное моделирование смешанного эффекта в подмножестве этих 73 участников подтвердило наши общие выводы. В то время как статистическая мощность была снижена в этом меньшем подмножестве, пространственные модели возрастных эффектов соответствовали более крупной выборке (Рисунок 1 — приложение к рисунку 13A). Примечательно, что множественный эксцентриситет в пределах идентифицированных областей, полученный из общей выборки и шкалы Таннера, показал значительный эффект взаимодействия (t = 2.36, р = 0,01; Рисунок 1 — приложение к рисунку 13B), что свидетельствует о том, что участники раннего полового созревания демонстрируют более сильные изменения во множестве эксцентриситетов в зависимости от возраста по сравнению с участниками на более поздних стадиях.
Мы обновили Результаты:
“k) Эксцентриситет коллектора и стадии полового созревания. Мы повторили продольное моделирование для подгруппы участников, заполнивших шкалу Таннера (n = 73) (Marshall and Tanner, 1970, 1969), и обнаружили относительно постоянные, хотя и более слабые возрастные изменения во множественном эксцентриситете по сравнению с общей выборкой (рис. 1 — приложение к рисунку 13А).Примечательно, что множественный эксцентриситет внутри идентифицированных областей, полученный из общей выборки и шкалы Таннера, выявил значительный эффект взаимодействия (t = 2,36, p = 0,01; Рисунок 1 — приложение к рисунку 13B), предполагая, что участники на ранних стадиях полового созревания демонстрируют более заметные изменения во множестве эксцентриситета. по возрасту по сравнению с теми, кто находится на более поздних стадиях ».
, а также Материалы и методы:
“k) Эксцентриситет коллектора и стадии полового созревания. Чтобы оценить взаимосвязь между разнообразным эксцентриситетом и стадиями пубертата, мы выбрали подмножество участников, заполнивших шкалу Таннера (Marshall and Tanner, 1970, 1969), которая количественно оценивает стадии пубертата от 1 (до полового созревания) до 5 (заключительная фаза физического созревания ).Однако оценка была получена на исходном уровне и только для 73/208 участников. Чтобы подтвердить надежность, мы выполнили линейное моделирование смешанного эффекта с использованием этого подмножества (рисунок 1 — приложение к рисунку 13A). Кроме того, мы оценили эффекты взаимодействия по шкале Таннера и множественный эксцентриситет, ограниченный областями, идентифицированными из общей выборки (рисунок 1 — приложение к рисунку 13B) ».
— Во введении ничего не говорится о толщине коры, поэтому результаты этих анализов несколько удивляют.
Как было предложено, мы теперь контекстуализируем изменения толщины коры головного мозга у подростков во Введении:
«Ранние поперечные и лонгитюдные исследования когорт неврологического развития были сосредоточены на анализе морфологических изменений (Gogtay et al., 2004; Shaw et al., 2006; Tamnes et al., 2017), включая толщину коры на основе МРТ (Shaw et al., 2006; Tamnes et al., 2017) и объемные меры (Gogtay et al., 2004; Tamnes et al., 2017). Исследования убедительно показывают, что первоначальное увеличение серого вещества до середины и конца детства с последующим снижением на протяжении всей оставшейся жизни.В подростковом возрасте толщина коркового слоя уменьшается в обширных областях мозга (Khundrakpam et al., 2013; Shaw et al., 2006; Sotiras et al., 2017; Tamnes et al., 2017). Таким образом, контекстуализация изменений коннектомов относительно установленных паттернов результатов определения толщины коры может установить, происходят ли межрегиональные сетевые изменения сверх этих диффузных эффектов регионального морфологического созревания ».
— Как и во введении, в обсуждении не так много интерпретации результатов транскриптома.
Как было предложено, мы расширили нашу интерпретацию результатов транскриптома в Обсуждении:
«Связывание макроскопических изменений во множественном эксцентриситете с данными микроматрицы после вскрытия, предоставленными Атласом человеческого мозга Аллена (Arnatkeviciute et al., 2019; Fornito et al., 2019; Gorgolewski et al., 2014; Hawrylycz et al., 2015; Thompson et al., 2013), мы определили наборы генов, экспрессируемые в корковых областях и подкорковых структурах таламуса и полосатого тела в позднем детстве, подростковом и юношеском возрасте.Несмотря на то, что эти результаты ассоциативны и основаны на отдельных наборах данных, они в целом подтверждают наши результаты о том, что созревание мозговой сети с позднего детства до раннего взросления затрагивает микро- и макромасштабные факторы как в подкорковых, так и в корковых сетях. Связанные сетевые и молекулярные изменения могут в конечном итоге изменить свойства подкорковых и корковых цепей, включая баланс возбуждения и торможения (E / I). Развитие человеческого мозга включает в себя пространственно-временные волны изменений экспрессии генов в различных областях мозга и временных окнах развития (Ip et al., 2010; Канг и др., 2011; Шин и др., 2018). При изучении развития подростков предыдущие исследования предполагали сдвиги в балансе E / I, развивающиеся от доминирующего тормозящего смещения на ранних стадиях развития к более сильному возбуждающему побуждению на более поздних стадиях, и предполагали, что они могут лежать в основе созревания когнитивных функций, таких как работа память и исполнительный контроль (Dorrn et al., 2010; Lander et al., 2017; Liu et al., 2007). При распространенных нарушениях развития нервной системы, включая аутизм, шизофрению и синдром дефицита внимания и гиперактивности, был продемонстрирован дисбаланс в корковом E / I и функции кортико-подкорковой сети (Cellot and Cherubini, 2014; Gandal et al., 2018; Ли и др., 2017; Льюис и др., 2005; Нельсон и Валах, 2015; Park et al., 2020a; Сохал и Рубинштейн, 2019; Trakoshis et al., 2020), потенциально ниже по течению от возмущений различных систем нейротрансмиттеров, таких как опосредованная интернейронами передача ГАМК (Bonaventura et al., 2017; Kilb, 2012; Liu et al., 2007; Park et al., 2020a; Silveri et al., 2013; Trakoshis et al., 2020; Tziortzi et al., 2014) ».
— Для построения структурного коннектома использовался атлас 7-сетей Шефера.Могут ли авторы прокомментировать, почему здесь использовался функциональный атлас (а не структурный)?
Мы выбрали широко используемую парцелляцию Шефера (Schaefer et al., 2018), поскольку она (i) позволяет контекстуализировать наши результаты в контексте внутренних функциональных сообществ (Yeo et al., 2011), (ii) включает возможность оценить результаты по разным номерам участков и (iii) согласовать текущее исследование с предыдущей работой нашей группы (Benkarim et al., 2020; Paquola et al., 2020; Park et al., 2021, 2020a; Rodríguez-Cruces et al., 2020) и другие (Baum et al., 2020; Betzel et al., 2019; Osmanlıolu et al., 2019).
Это обоснование теперь включено в Материалы и методы:
«Мы выбрали этот атлас, поскольку он (i) позволяет контекстуализировать наши результаты в рамках внутренних функциональных сообществ на макроуровне (Yeo et al., 2011), (ii) включает возможность оценки результатов с различной степенью детализации и (iii) согласовывает текущее исследование с предыдущей работой нашей группы (Benkarim et al., 2020; Paquola et al., 2020; Park et al., 2021, 2020a; Rodríguez-Cruces et al., 2020) и другие (Baum et al., 2020; Betzel et al., 2019; Osmanlıolu et al., 2019) ».
Мы согласны с рецензентом в том, что диффузионные МРТ-исследования часто проводились на основе структурных атласов. Таким образом, мы повторили наш анализ, используя схему структурного разделения с 200 узлами, которая сохраняет макроскопические границы атласа Desikan-Killiany (Desikan et al., 2006; Vos de Wael et al., 2020). Мы обнаружили в значительной степени согласованные возрастные эффекты на множественный эксцентриситет и подкорково-взвешенное многообразие в гетеромодальных ассоциативных областях, а также в хвостатом теле, гиппокампе и таламусе (рисунок 1 — приложение к рисунку 11).
Мы обновили Результаты:
“i) Коллекторы Connectome на основе структурного разделения. Мы повторили наш анализ со структурным разбиением, определенным с помощью суб-разбиения складчатости на основе атласа Desikan-Killiany (Desikan et al., 2006; Vos de Wael et al., 2020) (Рисунок 1 — приложение к рисунку 11). Несмотря на небольшие различия в топографии многократного эксцентриситета в латеральной префронтальной, височной и затылочной части коры, мы смогли воспроизвести сильные возрастные эффекты в гетеромодальных ассоциативных областях вместе с эффектами в хвостатом и гиппокампе (FDR <0.05) и немного в таламусе (FDR <0,1) ».
, а также Материалы и методы:
“i) Коллекторы Connectome на основе структурного разделения. Чтобы подтвердить, дают ли функциональные и структурные схемы парцелляции согласованные результаты, мы повторили наш основной анализ, используя схему структурной парцелляции 200 корковых узлов, которая сохраняет макроскопические границы атласа Десикана-Киллиани (Desikan et al., 2006; Vos de Wael et al. , 2020) (рисунок 1 — приложение к рисунку 11).”
— Хотя эта работа затрагивает важную тему, хорошо сочетается с растущим объемом работ по глобальным градиентам мозга, и ее общие выводы оправданы, я (пока) не уверен, что она предлагает принципиально новые идеи, которые невозможно было бы почерпнуть. из предыдущей работы (в конце концов, многообразное обучение просто отображает тень лежащих в основе паттернов; если паттерны меняются, то меняется и их тень). Я также не убежден в обосновании использования диффузионного встраивания: авторы заявляют, что последующие градиенты наследуются, сохраняются у разных видов, фиксируют паттерны функциональной активации во время состояний задачи и обеспечивают систему координат для исследования структуры и функций мозга, но это могло бы быть верным для любого метода, который адекватно фиксирует биологически значимую вариацию структурных паттернов связности.
Мы благодарим рецензента за положительную оценку нашей работы и рады предоставить дальнейшее обоснование использования градиентов. Будучи производными от коннектомов, мы согласны с тем, что методы градиентного картирования частично повторяют результаты, которые были ранее продемонстрированы с помощью более устоявшихся методов, например, теоретико-графического анализа, который рассматривает мозг как граф с узлами и ребрами и оценивает паттерны коннектомов. путем вычисления параметров графа, таких как центральность и модульные меры (Bullmore, Sporns, 2009; Rubinov, Sporns, 2010).Однако мы полагаем, что подходы к градиентному картированию предлагают многообещающую комбинацию методологических и концептуальных свойств: (i) Градиентное отображение, основанное на разнообразных подходах к обучению, сокращает коннектомы большой размерности (например, nxn ) в серию из k пространственных карт (т.е. , градиенты, каждый из которых имеет вид nx 1 ) управляемым данными способом и, таким образом, обеспечивают упрощенное представление о крупномасштабной организации коннектома. Следует отметить, что выбранная нами процедура уменьшения размерности (т.е., внедрение карты диффузии) является вычислительно эффективным и устойчивым к шуму при вычислении глобально оптимального решения по сравнению с линейными подходами (Tenenbaum et al., 2000). (ii) Как и в текущей работе, решение этих методов не обязательно является одним градиентом, но может быть несколько, потенциально перекрывающихся градиентов. Было предложено представление нескольких градиентов, чтобы дать возможность охарактеризовать как субрегиональную гетерогенность, так и функциональную множественность областей мозга (Haak and Beckmann, 2020).В предыдущей работе мы показали, что использование множественных диффузионных градиентов МРТ может помочь лучше понять динамические функциональные коммуникативные паттерны в коннектоме мозга взрослого человека (Park et al., 2021). (iii) Поскольку градиенты, полученные с помощью этих методов, могут служить непрерывными осями корковой организации, совместное использование нескольких градиентов позволяет генерировать внутренние системы координат в пространстве связности в соответствии с предыдущими концептуальными отчетами (Bijsterbosch et al., 2020; Haak et al., 2018; Huntenburg et al., 2018; Маргулис и др., 2016; Марс и др., 2018). (iv) В дополнение к вышеупомянутым методологическим достижениям предыдущая работа показала, что основные градиенты, например, оцененные с помощью функциональной МРТ без выполнения задач (Margulies et al., 2016), следуют установленным моделям корковой иерархии и ламинарной дифференциации (Mesulam, 1998). Эти наблюдения позволили подходам к градиентному картированию установить концептуальный контакт с основополагающими работами по корковой организации, эволюции и развитию (Buckner and Krienen, 2013; Goulas et al., 2018; Huntenburg et al., 2018; Санидес, 1969, 1962). Более того, появляющаяся литература показала полезность структуры градиента для изучения эволюции приматов и межвидового выравнивания (Blazquez Freches et al., 2020; Sofie L. Valk et al., 2020; T. Xu et al., 2020) , нейроразвитие (Hong et al., 2019; Paquola et al., 2019a), а также пластичность и структурно-функциональное взаимодействие (Park et al., 2021; Vázquez-Rodríguez et al., 2019).
Мы обновили Введение:
«Один из новых подходов к организации и развитию коннектома основан на применении разнообразных методов обучения к наборам данных о подключении.[…] Появляющаяся литература действительно показала полезность структуры градиента для изучения эволюции приматов и межвидового выравнивания (Blazquez Freches et al., 2020; Sofie L. Valk et al., 2020; T. Xu et al., 2020) ), нейроразвитие (Hong et al., 2019; Paquola et al., 2019a), а также пластичность и структурно-функциональное взаимодействие (Park et al., 2021; Sofie L Valk et al., 2020; Vázquez-Rodríguez et al. ., 2019) ».
Для создания структурных коннектомных коллекторов всей коры наша работа выбрала встраивание диффузионных карт, метод нелинейного уменьшения размерности (Coifman and Lafon, 2006), после основополагающего исследования градиента связности (Margulies et al., 2016). В последующей работе нашей и других групп использовался тот же подход (Hong et al., 2019, 2020; Huntenburg et al., 2017; Larivière et al., 2020; Margulies et al., 2016; Müller et al., 2020). ; Paquola et al., 2019a; Park et al., 2021; Sofie L. Valk et al., 2020; Vos de Wael et al., 2020). Помимо обеспечения преемственности с этими предыдущими исследованиями, нелинейные методы в целом объясняют больше информации с тем же количеством компонентов, чем линейные методы, что может повысить эффективность групповой классификации, идентификации кластеров и прогнозирования фенотипических оценок (Errity and McKenna, 2007; Галлос и др., 2020; Hong et al., 2020). Внедрение карты диффузии, в частности, контролируется только несколькими параметрами и, таким образом, эффективно с вычислительной точки зрения и довольно устойчиво к шуму (Errity and McKenna, 2007; Gallos et al., 2020; Hong et al., 2020; Tenenbaum et al., 2000 ). Следует отметить, что нелинейность просто вводится путем выполнения разложения по сингулярным значениям, которое также лежит в основе PCA, на марковской матрице нормализованного коннектома, что также дает прямую интерпретацию редуцированному многообразию как интерпретируемому как «карта диффузии» между узлами.
Тем не менее, мы согласны с точкой зрения рецензента о том, что нелинейные и линейные методы часто сходятся, и что еще не полностью установлено, какой подход должен быть приоритетным (Hong et al., 2020; Vos de Wael et al., 2020). Таким образом, для оценки согласованности мы повторили наш анализ, основанный на анализе главных компонентов (PCA), и наблюдали согласованные размеры многообразия (линейная корреляция = 0,998 ± 0,001 по E1 / E2 / E3; Рисунок 1 — приложение к рисунку 7A), а также аналогичный возраст. эффекты, как в основном анализе, в частности, аналогичное расширение пространства коллектора (Рисунок 1 — приложение к рисунку 7B).
Мы обновили Результаты:
“e) Создание коллекторов коннектомов с использованием анализа главных компонентов. В отдельном анализе мы сгенерировали собственные векторы, используя анализ главных компонент (Wold et al., 1987), вместо встраивания карты диффузии (Coifman and Lafon, 2006), и нашли согласованные пространственные карты (линейная корреляция = 0,998 ± 0,001 по E1 / E2. / E3; Рисунок 1 — дополнение к рисунку 7A) и продольные результаты (Рисунок 1 — приложение к рисунку 7B) ».
, а также Материалы и методы:
«Матрица аффинности была построена с нормализованным угловым ядром, а собственные векторы были оценены с помощью внедрения карты диффузии (рис. 1A), метода нелинейного уменьшения размерности (Coifman and Lafon, 2006), который проецирует коннектомные объекты в низкоразмерные многообразия (Маргулис и другие., 2016). Этот метод управляется только несколькими параметрами, эффективен с точки зрения вычислений и относительно устойчив к шуму по сравнению с другими нелинейными методами (Errity and McKenna, 2007; Gallos et al., 2020; Hong et al., 2020; Tenenbaum et al., 2000) и широко использовался в предыдущей литературе по картированию градиентов (Hong et al., 2019, 2020; Huntenburg et al., 2017; Larivière et al., 2020a; Margulies et al., 2016; Müller et al., 2020; Paquola et al., 2019a; Park et al., 2021; Sofie L. Valk et al., 2020; Vos de Wael et al., 2020) ».
“e) Создание коллекторов коннектомов с использованием анализа главных компонентов. Чтобы исследовать согласованность наших результатов при использовании различных методов уменьшения размерности, мы сгенерировали коннектомные многообразия, используя анализ главных компонентов (Wold et al., 1987), вместо того, чтобы полагаться на встраивание карты диффузии (Coifman and Lafon, 2006), и выполнили продольное моделирование ( Рисунок 1 — приложение к рисунку 7). Мы сравнили собственные векторы, оцененные на основе внедрения карты диффузии и анализа главных компонент с использованием линейных корреляций.”
— Авторы показывают, что изменение в созревании множества признаков предсказывает интеллект при последующем наблюдении, но не показывают, что сам интеллект демонстрирует изменения, которые превышают границы ошибок линии регрессии. Почему бы не предсказать изменение IQ?
Как было предложено, мы дополнительно спрогнозировали изменение IQ между исходным уровнем и последующим наблюдением, а не IQ при последующем наблюдении, используя функции визуализации. Однако мы не смогли найти значимых результатов для прогнозирования ∆IQ с использованием корковых характеристик на исходном уровне (среднее ± SD r = -0.10 ± 0,04, MAE = 6,62 ± 0,06, p = 0,27), ни при изменении исходного уровня, так и при созревании (r = -0,08 ± 0,04, MAE = 6,60 ± 0,06, p = 0,34). Добавление подкорковых областей не улучшило производительность (исходный уровень: r = -0,01 ± 0,03, MAE = 7,02 ± 0,12, p = 0,73; исходный уровень и изменение созревания: r = 0,03 ± 0,03, MAE = 6,53 ± 0,06, p = 0,67). Низкая производительность может быть связана с небольшими вариациями в ∆IQ, когда многие участники (42%) показали изменения IQ менее 5 и 76% менее 10.
Мы обновили Результаты:
«Мы также спрогнозировали изменение IQ между исходным уровнем и последующим наблюдением, вместо IQ при последующем наблюдении, используя функции визуализации.Однако мы не смогли найти значимых результатов ».
, а также Материалы и методы:
«Помимо прогнозирования будущего IQ, мы выполнили тот же прогнозный анализ, чтобы предсказать изменение IQ между исходным уровнем и последующим наблюдением».
— Небольшие улучшения в точности прогноза, наблюдаемые после добавления изменений созревания и подкорковых особенностей к признакам на исходном уровне, обязательно произойдут за счет добавления дополнительных параметров регрессии и могут не иметь смысла.
Чтобы повысить надежность анализа прогнозов, а также избежать переобучения, в пересмотренной работе использовалась вложенная десятикратная структура перекрестной проверки (Cawley and Talbot, 2010; Parvandeh et al., 2020; Tenenbaum et al., 2000; Varma and Simon, 2006) с упругой сеткой регуляризации (Zou and Hastie, 2005). В частности, мы разделили набор данных на обучающий (9/10) и тестовый (1/10) разделы, и каждый обучающий раздел был дополнительно разделен на внутренние обучающие и тестовые свертки с использованием еще одной десятикратной перекрестной проверки.Внутри внутренней складки эластичная чистая регуляризация находит набор неизбыточных характеристик для объяснения зависимой переменной. Используя линейную регрессию, мы спрогнозировали оценки IQ данных теста внутренней складки, используя особенности выбранных областей мозга, контролируя возраст, пол, местонахождение и движение головы. Модель с минимальной средней абсолютной ошибкой (MAE) по внутренней складке была применена к тестируемому разделу внешней складки, и были предсказаны оценки IQ данных теста внешней складки. Процедура прогнозирования повторялась 100 раз с разными наборами тренировок и тестов, чтобы уменьшить систематическую ошибку при выборе испытуемых.В ходе перекрестной проверки и итераций были выбраны 6,24 ± 5,74 (среднее ± стандартное отклонение) характеристики для прогнозирования IQ с использованием многократного эксцентриситета корковых областей на исходном уровне, 6,20 ± 5,14 корковых особенностей на исходном уровне и изменений созревания, 5,45 ± 5,99 корковых и подкорковых особенностей на исходном уровне. , и 5,16 ± 5,43 на исходном уровне и изменении созревания. В этом сценарии добавление дополнительных независимых переменных само по себе не может привести к повышению точности прогноза.
Мы обновили Результаты:
«Мы использовали эластичную сетевую регуляризацию с вложенной десятикратной перекрестной проверкой (Cawley and Talbot, 2010; Parvandeh et al., 2020; Тененбаум и др., 2000; Варма и Саймон, 2006; Zou and Hastie, 2005) (см. Методы), и повторил прогноз 100 раз с различными наборами обучающих и тестовых данных, чтобы уменьшить систематическую ошибку при выборе испытуемых. В ходе перекрестной проверки и итераций были выбраны 6,24 ± 5,74 (среднее ± стандартное отклонение) характеристики для прогнозирования IQ с использованием многократного эксцентриситета корковых областей на исходном уровне, 6,20 ± 5,14 корковых особенностей на исходном уровне и изменений созревания, 5,45 ± 5,99 корковых и подкорковых особенностей на исходном уровне. , и 5.16 ± 5,43 на исходном уровне и изменение созревания, что позволяет предположить, что добавление большего количества независимых переменных само по себе не может привести к повышению точности прогнозов ».
, а также Материалы и методы:
«Для каждой оценки подмножество характеристик, которые могут предсказать будущий IQ, было идентифицировано с использованием эластичной чистой регуляризации (= 0,5) с оптимизированными параметрами регуляризации (штрафные термины L1 и L2) посредством вложенной десятикратной перекрестной проверки (Cawley and Talbot, 2010; Parvandeh et al., 2020; Tenenbaum et al., 2000; Варма и Саймон, 2006; Дзоу и Хасти, 2005). Мы разделили набор данных на обучающие (9/10) и тестовые (1/10) разделы, и каждый обучающий раздел был дополнительно разделен на внутренние обучающие и тестовые секции с использованием еще одной десятикратной перекрестной проверки. Внутри внутренней складки эластичная чистая регуляризация находит набор неизбыточных характеристик для объяснения зависимой переменной. Используя линейную регрессию, мы спрогнозировали оценки IQ данных теста внутренней складки, используя особенности выбранных областей мозга, контролируя возраст, пол, местонахождение и движение головы.Модель с минимальной средней абсолютной ошибкой (MAE) по внутренней складке была применена к тестируемому разделу внешней складки, и были предсказаны оценки IQ данных теста внешней складки. Процедура прогнозирования повторялась 100 раз с разными наборами тренировок и тестов, чтобы уменьшить систематическую ошибку при выборе испытуемых ».
— Интерпретируемость и отсутствие сравнения
Авторы неоднократно заявляют, что они «извлекают выгоду из передовых разнообразных методов обучения».
Можно представить себе бесконечное количество документов, которые используют набор данных, используют метод извлечения метрики, X (например.g., эксцентриситет), а затем напишите об изменениях X с некоторым интересующим свойством Y (например, возрастом). Учитывая этот набор статей (и отсутствие независимости между множеством возможных X), читателя должны больше всего интересовать те X, которые обеспечивают лучшую производительность и простейшую интерпретацию, а другие статьи являются избыточными.
Таким образом, нюансированный подход к представлению такой статьи состоит в том, чтобы продемонстрировать, что используемая метрика представляет собой шаг вперед по сравнению с уже существующими альтернативными метриками, которые проще вычислить или лучше интерпретировать.
В этой статье, однако, авторы не демонстрируют преимущества своего конкретного выбора применения определенного метода нелинейного уменьшения размерности с использованием 3-х мерного выравнивания на шаблонном многообразии и последующего вычисления метрики эксцентриситета.
Мы благодарим рецензентов за это предложение. См. Пункты ниже. Вкратце, как линейные, так и нелинейные методы уменьшения размерности сжимают данные коннектома большой размерности ( n x n ) в серию собственных векторов меньшей размерности ( i.е., градиентов, каждый из которых имеет форму n x 1 ), предлагая синоптическое представление о развитии коннектома. В нашем случае мы использовали эти разнообразные методы обучения, чтобы получить трехмерное пространство связи, в котором мы могли чутко отслеживать изменения в развитии в подростковом возрасте. Помимо этих методологических соображений, предыдущая работа показала, что основные градиенты, оцененные на основе функциональной (Margulies et al., 2016), микроструктурной (Paquola et al., 2019b) и диффузионной МРТ (Park et al., 2020a) в целом сходятся в соответствии с установленной моделью сенсорно-фугальной нейронной иерархии и ламинарной дифференциации (Mesulam, 1998), что позволяет согласовать подход градиентного картирования с теориями корковой организации и эволюции (Buckner and Krienen, 2013; Goulas et al., 2018; Huntenburg et al., 2018; Sanides, 1969, 1962). Мы считаем, что относительная аналитическая простота и способность контекстуализировать работу в классической теории представляют собой привлекательное оправдание для методов градиентного картографирования.Ниже мы также рассмотрели конкретные комментарии:
Например:
и. Требуется ли нелинейность (например, превосходит ли она PCA или MDS)?
Теоретически привлекательными являются методы нелинейной размерности, поскольку они могут объяснить больше информации об исходных данных с тем же количеством компонентов, чем линейные методы, что может повысить производительность при групповой классификации, идентификации кластеров и прогнозировании фенотипических оценок (Errity and McKenna, 2007; Галлос и др., 2020; Hong et al., 2020). Следует отметить, что внедрение карты диффузии является аналитически простым, поскольку оно просто выполняет разложение по сингулярным значениям на матрице Маркова, что можно легко интерпретировать как процесс распространения по коннектому. Ранее исследователи применяли как линейные (Hong et al., 2020; Murphy et al., 2019; Shine et al., 2019; Tian et al., 2020), так и нелинейные методы (Guell et al., 2018; Haak and Beckmann, 2020; Hong et al., 2019; Huntenburg et al., 2017; Larivière et al., 2020; Маргулис и др., 2016; Мюллер и др., 2020; Paquola et al., 2019b, 2019a; Софи Л. Валк и др., 2020), и поэтому остается открытым вопрос, какой метод следует предпочесть (Хонг и др., 2020; Вос де Ваэль и др., 2020). Мы решили придерживаться карт диффузии в нашем основном анализе, чтобы оставаться в соответствии с предыдущей работой нашей и других групп (Hong et al., 2019, 2020; Huntenburg et al., 2017; Larivière et al., 2020; Margulies et al. ., 2016; Müller et al., 2020; Paquola et al., 2019a; Park et al., 2021; Софи Л. Валк и др., 2020; Вос де Ваэль и др., 2020). В пересмотренном анализе чувствительности мы также вывели градиенты с помощью PCA и показали последовательные множественные размеры, используя этот метод (линейная корреляция = 0,998 ± 0,001 по E1 / E2 / E3; Рисунок 1 — приложение к рисунку 7A), а также согласованные возрастные эффекты. от эксцентриситета коллектора (Рисунок 1 — дополнение к рисунку 7B).
Мы обновили Результаты:
“e) Создание коллекторов коннектомов с использованием анализа главных компонентов. В отдельном анализе мы сгенерировали собственные векторы с использованием анализа главных компонент (Wold et al., 1987), вместо встраивания карты диффузии (Coifman and Lafon, 2006), и обнаружил последовательные пространственные карты (линейная корреляция = 0,998 ± 0,001 по E1 / E2 / E3; Рисунок 1 — приложение к рисунку 7A) и продольные результаты (Рисунок 1- приложение к рисунку 7B) ».
Материалы и методы:
«Матрица аффинности была построена с нормализованным угловым ядром, а собственные векторы были оценены с помощью внедрения карты диффузии (рис. 1A), метода нелинейного уменьшения размерности (Coifman and Lafon, 2006), который проецирует коннектомные объекты в низкоразмерные многообразия (Маргулис и другие., 2016). Этот метод управляется только несколькими параметрами, эффективен с точки зрения вычислений и относительно устойчив к шуму по сравнению с другими нелинейными методами (Errity and McKenna, 2007; Gallos et al., 2020; Hong et al., 2020; Tenenbaum et al., 2000) и широко использовался в предыдущей литературе по картированию градиентов (Hong et al., 2019, 2020; Huntenburg et al., 2017; Larivière et al., 2020a; Margulies et al., 2016; Müller et al., 2020; Paquola et al., 2019a; Park et al., 2021; Sofie L. Valk et al., 2020; Vos de Wael et al., 2020) ».
“e) Создание коллекторов коннектомов с использованием анализа главных компонентов. Чтобы исследовать согласованность наших результатов при использовании различных методов уменьшения размерности, мы сгенерировали коннектомные многообразия, используя анализ главных компонентов (Wold et al., 1987), вместо того, чтобы полагаться на встраивание карты диффузии (Coifman and Lafon, 2006), и выполнили продольное моделирование ( Рисунок 1 — приложение к рисунку 7). Мы сравнили собственные векторы, оцененные на основе внедрения карты диффузии и анализа главных компонент с использованием линейных корреляций.”
а так же Обсуждение:
«В нашем лонгитюдном исследовании мы смогли выявить заметное расширение коннектомов в подростковом возрасте, в основном охватывающее трансмодальную и гетеромодальную ассоциативную кору в префронтальных, височных и задних областях, территориях, которые, как известно, созревают позже в процессе развития (Gogtay et al., 2004; Shaw et al., 2004; Shaw et al. др., 2006). Результаты остались неизменными, когда мы рассмотрели метод уменьшения линейной размерности, что свидетельствует о надежности методологических деталей этого анализа.”
ii. Есть ли что-то особенное в выборе трех измерений для расчета эксцентриситета? Требуется ли вообще уменьшение размерности (например, можно ли получить аналогичные результаты, вычислив эксцентриситет в полномерном пространстве?)
На основе экранного графика на рисунке 1A мы выбрали первые три собственных вектора, так как (i) они объясняют приблизительно 50% дисперсии в матрице сродства, (ii) каждый объясняет> 10% ( т.е. 20,7 / 15,8 / 13 .5% для E1 / E2 / E3 соответственно), и (iii) выбор трех собственных векторов захватил четко видимую собственную щель. В предыдущих работах был выбран аналогичный подход, поскольку компоненты более высокого порядка могут иногда не демонстрировать четких пространственных закономерностей и / или более высоких вкладов шума (Haak et al., 2018; Hong et al., 2019, 2020; Margulies et al., 2016; Paquola et al., 2019b, 2019a; Park et al., 2021, 2020a; Vos de Wael et al., 2018). В ответ на предложение рецензентов мы также оценили эксцентриситет во всем пространстве (Рисунок 1 — приложение к рисунку 9A-B).Пространственная картина эксцентриситета коллектора коррелировала с исходным решением на основе трех собственных векторов (r = 0,54, p <0,001). Более того, продольные изменения во множественном эксцентриситете были аналогичны исходным результатам (линейная корреляция t-статистической карты = 0,68, p <0,001; Рисунок 1 - приложение к рисунку 9C), подтверждая множественное расширение трансмодальной коры.
Мы обновили Результаты:
“g) Эксцентриситет коллектора по всем собственным векторам. Повторяя расчет эксцентриситета многообразия и моделирование возраста с использованием всех собственных векторов, вместо использования только первых трех, мы наблюдали относительно согласованные результаты с нашими исходными выводами (линейная корреляция эксцентриситета многообразия r = 0.54, р <0,001; t-статистическая карта r = 0,68, p <0,001), что также указывает на многократное расширение трансмодальных корковых органов (рисунок 1 - приложение к рисунку 9) ».
, а также Материалы и методы:
“g) Анализ эксцентриситета коллектора на основе всех собственных векторов. Мы повторили наш анализ, вычислив эксцентриситет по всем собственным векторам, чтобы оценить согласованность результатов (рисунок 1 — приложение к рисунку 9) ».
iii. Превосходит ли он основные меры коннектома (например,g., простые, вычисленные авторами)?
Чтобы сравнить влияние возраста на эксцентриситет многообразия с эффектами теории графов, мы вычислили меру центральности между, степенью и собственным вектором (Rubinov and Sporns, 2010). В то время как центральность по промежуточности не выявила значительных эффектов, центральность по степени и собственному вектору продемонстрировала эффекты в аналогичных областях, такие как множественный эксцентриситет (рисунок 1 — приложение к рисунку 8). Вычисляя линейную корреляцию между картами размера эффекта, мы обнаружили градуированный образец сходства, который был низким, но значимым для центральности промежуточности (r = 0.18, р = 0,02; значимость определяется 1000 спиновых тестов, которые учитывают пространственную автокорреляцию (Alexander-Bloch et al., 2018)) и умеренной для степени и центральности собственного вектора (r = 0,57, p <0,001; r = 0,47, p <0,001).
Мы обновили Результаты:
“f) Продольные изменения в теоретико-графических показателях. Повторяя продольное моделирование с использованием теоретико-графовых критериев центральности, мы обнаружили значительные возрастные продольные изменения степени и центральности собственного вектора, в то время как центральность промежуточности не выявила значительных эффектов в регионах, аналогичных тем, которые имели значительные возрастные изменения во множественном эксцентриситете Рисунок 1 — приложение к рисунку 8).Сопоставляя карты размера эффекта для множественного эксцентриситета и каждой меры графика, мы обнаружили значительное, но переменное пространственное подобие карт эффектов (центральность промежуточности: r = 0,18, спин-тест p = 0,02; центральность степени: r = 0,57, p <0,001 ; центральность собственного вектора: r = 0,47, p <0,001) ».
, а также Материалы и методы:
“f) Продольные изменения в теоретико-графических показателях. Чтобы сравнить продольные изменения эксцентриситета многообразия с изменениями в теоретико-графовых мерах центральности, мы вычислили промежуточность, степень и центральность собственных векторов структурных коннектомов и построили аналогичные линейные модели смешанных эффектов для оценки продольных изменений (рис.Центральность по промежуточности — это количество взвешенных кратчайших путей между любыми комбинациями узлов, которые проходят через этот узел, центральность по степени — это сумма весов ребер, связанных с данным узлом, а центральность по собственному вектору измеряет влияние узла на всю сеть (Lohmann et al. al., 2010; Рубинов, Спорнс, 2010; Zuo et al., 2012). Пространственное сходство между t-статистикой центральности и множественными мерами было оценено с помощью 1000 спиновых тестов, которые учитывают пространственную автокорреляцию (Alexander-Bloch et al., 2018) ».
Существует явная обратная сторона того, насколько непрозрачным является этот подход (и поэтому его трудно интерпретировать относительно, скажем, степени связности), поэтому можно было бы надеяться на соответственно сильный прирост производительности. Авторы также могли бы сделать больше, чтобы развить некоторую интуицию для идеи низкоразмерного пространства соединения-паттерна-подобия и того, как интерпретировать принятие евклидовых расстояний в таком пространстве.
CT = 1N [∑i = 1NT (E1) i, ∑i = 1NT (E2) i, ∑i = 1NT (E3) i]
ME = ∑e = 13 {I (Ee) −CT (e)} 2
Здесь мы использовали собственные векторы, оцененные с помощью метода разложения, чтобы сгенерировать новую систему координат в пространстве связности (Bijsterbosch et al., 2020; Haak et al., 2018; Huntenburg et al., 2018; Маргулис и др., 2016; Марс и др., 2018). Примечательно, что в этом многообразном пространстве взаимосвязанные области мозга с похожими паттернами связи расположены ближе друг к другу, в то время как области, которые не имеют существенной связи или сходства в паттернах связи, расположены дальше друг от друга. В нашей работе конкретное пространство — это карта диффузии, где евклидовы расстояния в многообразии соответствуют временам диффузии между узлами сети. Чтобы проанализировать, как структуры многомерного многообразия изменяются в пространстве многообразия низкой размерности, мы упростили многомерные собственные векторы до одного скалярного значения i.е., эксцентриситет коллектора . Эксцентриситет коллектора был рассчитан как евклидово расстояние между источником коллектора и всеми точками данных (, т.е. областей мозга) в пространстве коллектора. Например, с использованием трех собственных векторов эксцентриситет коллектора был определен следующим образом: CT — начало координат шаблона; N количество областей мозга; Т (•) шаблонный коллектор; Эксцентриситет коллектора ME; I (•) индивидуальный коллектор; CT (e) происхождение коллектора шаблона e th . Эта концепция визуализирована на Рисунке 1 — добавлении к рисунку 15.Каждая область мозга (, т. Е. каждая точка на диаграмме разброса) описывается как вектор из начала координат коллектора (, т. Е. Треугольная метка на диаграмме разброса), а эксцентриситет коллектора — это просто длина ( т. Е. евклидово расстояние) этого вектора. Таким образом, сдвиги в паттернах связности данной области приведут к сдвигам векторов, которые, в свою очередь, изменят эксцентриситет многообразия. Таким образом, многообразная эксцентриситет количественно определяет глобальную организацию мозга в пространстве взаимодействия.
Мы обновили Материалы и методы:
«Вкратце, собственные векторы, оцененные с помощью метода разложения, создают систему координат связности (Bijsterbosch et al., 2020; Haak et al., 2018; Huntenburg et al., 2018; Margulies et al., 2016; Mars et al., 2018) — карта диффузии, где […] сдвиги в паттернах связности данного региона, таким образом, приведут к сдвигам векторов, которые, в свою очередь, изменят эксцентриситет многообразия. Таким образом, множественный эксцентриситет количественно определяет глобальную организацию мозга, основанную на пространстве взаимодействия.”
— Анализ развития и обогащения
Как в основном тексте, так и в Материалах и методах это описывается как «гены использовались для анализа обогащения в процессе развития». Можно ли объяснить, что происходит между «кормлением» и тем, что выходит? Без четко описанных методов невозможно интерпретировать или критиковать этот компонент статьи. Если методологические детали непрозрачны, то значимость результатов может быть проверена численно относительно некоторых рандомизированных нулевых входных данных, которые «вводятся» для демонстрации специфичности тестируемого фенотипа.
Мы реализовали анализ развития с использованием инструмента анализа экспрессии, специфичного для клеточного типа (CSEA) (http://genetics.wustl.edu/jdlab/csea-tool-2) (Dougherty et al., 2010; Xu et al. ., 2014). Этот метод оценивает значимость совпадения между идентифицированным списком генов и данными RNAseq, полученными из набора данных BrainSpan (http://www.brainspan.org) в шести областях мозга (, т. Е. кора головного мозга, таламус, полосатое тело, мозжечок, гиппокамп, миндалевидное тело) и десять периодов развития (от раннего эмбрионального до молодой взрослой жизни), аппроксимированные по данным мышей, давая в общей сложности 60 комбинаций профилей развития обогащения (Xu et al., 2014). Значимость рассчитывается на основе точных критериев Фишера (Fisher, 1922) с поправкой FDR (Benjamini and Hochberg, 1995).
Мы обновили Результаты:
«Мы выполнили анализ обогащения набора генов развития с использованием инструмента анализа специфической экспрессии клеточного типа (CSEA), который сравнивает выбранный список генов с профилями обогащения в процессе развития (см. Методы) (Dougherty et al., 2010; Xu et al., 2014 ). Этот анализ выделяет временные окна развития в макроскопических областях мозга, в которых сильно экспрессируются гены.Мы обнаружили выраженную экспрессию генов, обогащенных с детства, в коре, таламусе и мозжечке (FDR <0,001; рис. 4B) ».
, а также Материалы и методы:
«Использование инструмента анализа экспрессии клеточного типа (CSEA), развивающего экспрессию (http://genetics.wustl.edu/jdlab/csea-tool-2) (Dougherty et al., 2010; Xu et al., 2014), мы оценили значимость перекрытия между генами, показывающими согласованную картину экспрессии всего мозга у доноров (FDR <0.05) с данными RNAseq, полученными из набора данных BrainSpan (http://www.brainspan.org). Значимость была рассчитана на основе точного критерия Фишера (Fisher, 1922) с поправкой FDR (Benjamini and Hochberg, 1995). Инструмент CSEA предоставляет упрощенные результаты профилей обогащения генов по шести основным областям мозга (т. Е. Кора, таламус, полосатое тело, мозжечок, гиппокамп, миндалевидное тело) в течение десяти периодов развития (от раннего плода до молодой взрослой жизни), аппроксимированные по данным мышей, что дает общий результат. 60 комбинаций профилей развития обогащения (Xu et al., 2014) ».
Как было предложено, мы дополнительно оценили пространственные корреляции между картами экспрессии гена post-mortem и повернутыми картами возрастных изменений во множественном эксцентриситете (100 сферических случайных вращений). Для каждой итерации выбранные гены использовались для анализа развития с использованием инструмента CSEA (Xu et al., 2014), и мы получали скорректированные с помощью FDR p-значения для каждого отдела мозга и периода развития. Таким образом, мы построили нулевое распределение, используя повернутые p-значения, в которые было помещено фактическое p-значение.Если фактическое значение p не принадлежало 95% нулевого распределения, оно считалось значимым. Результаты остались неизменными.
Мы обновили Материалы и методы:
«Мы повторили анализ развития с использованием генов, идентифицированных из повернутых карт возрастных изменений во множественном эксцентриситете (100 сферических вращений). Для каждой итерации мы получали профили онтогенетической экспрессии с использованием идентифицированных генов, где значения p с поправкой на FDR составляли нулевое распределение.Для каждого отдела мозга и периода развития, если фактическое значение p выходило за пределы 95% нулевого распределения, оно считалось значимым ».
— прогноз IQ
Прогнозы кажутся очень плохими (линии равенства, y = x, должны быть нарисованы на рисунке 5, чтобы показать, как будут выглядеть идеальные прогнозы; линейные регрессии бесполезны для задачи прогнозирования и обманывают соответствующее вычисление MAE. ). Авторы не проводят никаких сравнений в этом разделе (даже с реальной базовой моделью, такой как `predicted_IQ = mean (training_set_IQ)`).Они также не проводят статистических тестов (и не приводят p-значения), но, тем не менее, делают ряд заявлений, в том числе «значительный прогноз» или «точность прогноза была улучшена», «подчеркивают преимущества включения подкорковых узлов» и т.д. Эти утверждения должны быть проверены на основе точных статистических данных и сравнений с соответствующими базовыми / эталонными подходами.
Благодарим рецензента за комментарий. Чтобы оценить значимость нашей модели прогнозирования, мы сравнили эффективность прогнозирования с предлагаемой базовой моделью ( i.е., прогнозируемый IQ = среднее (IQ обучающей выборки)). Прогнозирование для базовой модели было плохим, показывая низкую отрицательную корреляцию между фактическими и прогнозируемыми значениями IQ (r = -0,15 ± 0,06, MAE = 8,98 ± 0,04, p = 0,12). Наша модель основана на корковых характеристиках (исходный уровень: r = 0,14 ± 0,04, MAE = 8,93 ± 0,16, p = 0,09; исходный уровень и изменение созревания: r = 0,18 ± 0,04, MAE = 9,10 ± 0,19, p = 0,04) и на основе как корковые, так и подкорковые особенности (исходный уровень: r = 0,17 ± 0,03, MAE = 8,74 ± 0.11, р = 0,04; изменения исходного уровня и созревания: r = 0,21 ± 0,02, MAE = 8,86 ± 0,14, p = 0,01) превзошли исходную модель (z-критерий Менга p <0,001 для всех случаев) (Meng et al., 1992). Результаты показывают, что, хотя многообразные особенности слабо связаны с IQ, они все же предоставляют информацию о будущем IQ выше и выше базовой модели.
Мы обновили Результаты:
«Мы сравнили эффективность прогнозирования нашей модели с базовой моделью, где IQ тестового набора был простым средним значением обучающего набора (r = -0.15 ± 0,06, МАЭ = 8,98 ± 0,04, p = 0,12; см. Методы). Мы обнаружили, что наша модель превосходит эту базовую модель (z-критерий Менга p <0,001) (Meng et al., 1992) ».
Материалы и методы:
«Чтобы оценить, превосходит ли наша модель базовую модель, мы спрогнозировали IQ тестовых данных, используя среднее значение IQ обучающих данных (то есть, прогнозируемый IQ = средний (IQ обучающей выборки)). Улучшение прогнозирования оценивалось с помощью z-критерия Менга (Meng et al., 1992) ».
а так же Обсуждение:
«Следует отметить, что хотя наша модель значительно превзошла базовую модель, связь между фактическими и прогнозируемыми значениями IQ не находилась на линии равенства, и сила связи была довольно слабой.Дальнейшие улучшения в прогнозировании интеллекта мозга в подростковом возрасте, например, за счет сочетания структурных и функциональных функций визуализации, будут в центре внимания будущей работы ».
Мы дополнительно выполнили прогнозный анализ, используя метод дерева регрессии (, т.е. обучение дерева решений ), нелинейный подход, основанный на модели дерева, составляющей корневой узел и разделенные листовые узлы, где листовые узлы содержат переменные отклика (Брейман и др. др., 1984). Однако результаты прогнозов не были улучшены по сравнению с линейной моделью (рисунок 5 — приложение 2).
Мы обновили Результаты:
“l) Прогнозирование IQ с использованием нелинейной модели. Мы спрогнозировали IQ при последующем наблюдении, используя метод дерева регрессии (Breiman et al., 1984), вместо модели линейной регрессии, но мы не смогли найти улучшенных показателей прогнозирования (рисунок 5 — приложение к рисунку 2) ».
, а также Материалы и методы:
“l) Прогнозирование IQ с использованием нелинейной модели. Мы дополнительно выполнили прогнозный анализ для прогнозирования будущего показателя IQ с использованием метода дерева регрессии (т.е., обучение по дереву решений), нелинейный подход, основанный на модели дерева, состоящей из корневого узла и разделенных листовых узлов, где листовые узлы содержат переменные отклика (Breiman et al., 1984) (рисунок 5 — приложение к рисунку 2). ”
— Group Connectome
Учитывая, насколько статья полагается на оценку структурного коннектома группы, ее следует визуализировать и охарактеризовать. Например, базовый анализ распределения весов и степеней ребер, особенно потому, что веса ребер могут варьироваться на порядки величины, и большие веса (скорее всего, будут короткие расстояния), следовательно, могут чрезмерно доминировать над некоторыми низкоразмерными компонентами).Авторы могут также рассмотреть возможность тестирования устойчивости альтернативных способов оценки коннектома [например, Oldham et al. NeuroImage 222, 117252 (2020)] и его резюме на уровне группы [например, Roberts et al. NeuroImage 145, 1-42 (2016)].
Мы благодарим рецензентов за эти предложения. Мы рассчитали структурный коннектом на индивидуальном уровне и оценили репрезентативный коннектом группы с использованием порогового значения, зависящего от расстояния (Betzel et al., 2019), который визуализирован на рисунке 1A.Как было предложено, мы выполнили продольное моделирование с использованием весов ребер коннектома и обнаружили значительное увеличение весов внутри лобно-теменных сетей и сетей по умолчанию, а также сетей внимания и сенсорных сетей (FDR <0,05; рисунок 1 - приложение к рисунку 12). Эти результаты согласуются с нашими основными выводами, основанными на множественном эксцентриситете, указывающем в основном на трансмодальные эффекты.
Мы обновили Результаты:
“j) Продольное моделирование с использованием краевых утяжелителей. Повторяя продольное моделирование по возрасту с использованием весов коннектомов, мы обнаружили значительное увеличение весов ребер в лобно-теменных сетях и сетях по умолчанию, а также в сетях внимания и сенсорных сетей (FDR <0.05; Рисунок 1 - приложение к рисунку 12), что согласуется с выводами, основанными на эксцентриситете коллектора ».
, а также Материалы и методы:
“j) Продольное моделирование с использованием краевых утяжелителей. В дополнение к анализу, основанному на множественном эксцентриситете, моделирование линейного смешанного эффекта с использованием весов краев коннектомов оценило связанные с возрастом продольные изменения силы линии тока (Рисунок 1 — рисунок в приложении 12) ».
Чтобы оценить надежность структурных коннектомов, репрезентативных для группы, мы построили коннектомы с помощью двух разных подходов: (i) пороговое значение, зависящее от расстояния (Betzel et al., 2019) был принят для основного анализа, и (ii) пороговое значение согласованности было оценено в дополнительном анализе. Подход с установлением пороговых значений согласованности усредняет матрицы конкретных субъектов, помимо выполнения пороговых значений 50, 40, 30, 20, 10%, а также простого усреднения (, т. Е. 0% пороговых значений) (Wang et al., 2019) (Рисунок 1 — приложение к рисунку 10). Мы вычислили линейные корреляции между пространственными картами собственных векторов, полученными с помощью пороговой обработки, зависящей от расстояния, и метода групповой согласованности и обнаружили высокое сходство (r = 0.89 ± 0,01 для E1; 0,93 ± 0,004 для E2; 0,85 ± 0,01 для E3 по порогам согласованности).
Мы обновили Результаты:
“h) Устойчивость структурного коннектома репрезентативной группы. Мы сравнили градиенты, полученные из репрезентативного структурного коннектома группы, на основе (i) порогового значения, зависящего от расстояния (Betzel et al., 2019) и (ii) порогового значения согласованности (Wang et al., 2019) (рисунок 1 — приложение к рисунку 10). . Мы обнаружили большое сходство в пространственных картах оцениваемых многообразий (r = 0.89 ± 0,01 для E1; 0,93 ± 0,004 для E2; 0,85 ± 0,01 для E3 по шести разным пороговым значениям), что указывает на надежность ».
, а также Материалы и методы:
“h) Устойчивость структурного коннектома репрезентативной группы. Мы сравнили пороговое значение, зависящее от расстояния (Betzel et al., 2019), которое было принято для основного анализа, с подходом определения порога согласованности (Wang et al., 2019). Последний усредняет специфические матрицы предмета, в дополнение к выполнению пороговых значений 50, 40, 30, 20, 10%, а также простого усреднения (т.е., пороговое значение 0%) (Рисунок 1 — приложение к рисунку 10) ».
— Индивидуальное выравнивание
В статье рассказывается о лицах, успешно выровненных по шаблонному коллектору. Соответственно, следует провести некоторый анализ, чтобы количественно определить, насколько хорошо отдельные люди могут быть нанесены на карту. Предположительно, одни предметы очень хорошо вписываются в шаблон, а другие нет. Есть ли что-то интересное в плохо поставленных предметах? Улучшаются ли ваши результаты при их исключении?
Индивидуальные коллекторы были выровнены с шаблонным коллектором с выравниванием Прокруста, что делает собственные векторы от разных людей более сопоставимыми e.g., , меняя знаки собственных векторов (Langs et al., 2015; Vos de Wael et al., 2020). Чтобы оценить процедуру, мы рассчитали линейные корреляции между шаблоном и отдельными коллекторами до / после выравнивания. Мы обнаружили значительное улучшение корреляций после совмещения отдельных коллекторов с шаблоном (0,92 ± 0,03 / 0,93 ± 0,03 / 0,94 ± 0,03 после совмещения; -0,02 ± 0,03 / -0,001 ± 0,37 / 0,003 ± 0,12 до совмещения для E1 / E2 / E3) .
Как было предложено, мы также выполнили продольное моделирование после исключения 10% субъектов с плохим выравниванием (отсечка r = 0.83; новый набор имел линейную корреляцию с эталонным многообразием среднего ± SD r = 0,94 ± 0,01). Мы по-прежнему могли найти согласованные результаты (рисунок 1 — рисунок в приложении 6), где t-статистика показала сильную корреляцию с результатами, полученными с использованием всех субъектов (r = 0,97, p <0,001), что свидетельствует об устойчивости.
Мы обновили Результаты:
“d) Точность выравнивания градиента. При вычислении линейных корреляций между шаблоном и отдельными коллекторами до и после выравнивания мы обнаружили значительное увеличение после выравнивания (r = 0.92 ± 0,03 / 0,93 ± 0,03 / 0,94 ± 0,03) по сравнению с до выравнивания (-0,02 ± 0,03 / -0,001 ± 0,37 / 0,003 ± 0,12) для E1 / E2 / E3, соответственно, поддерживая эффективность выравнивания. После исключения 10% субъектов с плохим выравниванием (порог r = 0,83; новый набор коррелировал с шаблонным многообразием, r = 0,94 ± 0,01), мы обнаружили последовательные возрастные изменения во множественном эксцентриситете (Рисунок 1 — приложение к рисунку 6) , при этом карта t-статистики показывает сильную корреляцию с картой, полученной для всей выборки (r = 0,97, p <0.001) ».
, а также Материалы и методы:
“d) Точность выравнивания градиента. Чтобы оценить надежность индивидуального выравнивания, мы вычислили линейные корреляции между шаблоном и отдельными коллекторами до и после выравнивания. Мы также повторили линейное моделирование смешанного эффекта после исключения 10% субъектов с наименьшим соответствием шаблонному многообразию (рис. 1 — приложение к рисунку 6) ».
https://doi.org/10.7554/eLife.64694.sa2Зачем детям нужны впечатления
Посмотрите это видео.Профессор Джейн Барлоу знакомит с концепциями ожидаемого и зависимого от опыта развития мозга.
В этом видео мы исследуем развитие мозга в течение первых двух постнатальных лет с точки зрения быстрого нервного развития (то есть синаптогенеза), которое происходит в этот период в результате того, что мозг очень чувствителен к воздействию окружающей среды на этот раз. Мы различаем, в частности, «ожидаемые от опыта» и «зависимые от опыта» типы развития мозга.Первый влияет на ряд аспектов развития мозга, включая зрение и слух, социальное и эмоциональное развитие, язык и высшие когнитивные функции. Ожидание опыта относится к тому факту, что средняя или нормальная среда предоставляет младенцам необходимые данные для развития нейронных связей, позволяющих ребенку функционировать в этих сферах. Однако, если мозг ребенка не получает входные данные в эти критические периоды, эти функции будут потеряны безвозвратно. Многие аспекты развивающегося мозга ребенка зависят от опыта и включают его социально-эмоциональное развитие, язык и некоторые из высших аспектов когнитивного развития.Они описываются как зависящие от опыта, потому что устанавливаемые нейронные связи полностью зависят от качества окружающей среды. Например, хотя все дети рождаются со способностью к языковому развитию, их способность к вербальному общению будет зависеть от их владения языком в ранние годы. Хотя большинство младенцев не испытывают тяжелой депривации в младенчестве, характерной для детских домов в России или Румынии, все дети сталкиваются с различными средами, которые влияют на развитие их мозга в зависимости от опыта.В этом курсе мы собираемся изучить один конкретный аспект этого разнообразия … ум их родителей.% PDF-1.3 % 719 0 объект > эндобдж xref 719 95 0000000016 00000 н. 0000002251 00000 н. 0000002354 00000 п. 0000002842 00000 н. 0000003056 00000 н. 0000003552 00000 н. 0000003680 00000 н. 0000004784 00000 н. 0000005053 00000 н. 0000005074 00000 н. 0000005200 00000 н. 0000005221 00000 н. 0000005337 00000 н. 0000005359 00000 п. 0000005698 00000 п. 0000005721 00000 н. 0000007432 00000 н. 0000007455 00000 н. 0000009274 00000 н. 0000009297 00000 н. 0000010935 00000 п. 0000011219 00000 п. 0000011488 00000 п. 0000011511 00000 п. 0000013202 00000 п. 0000013223 00000 п. 0000013244 00000 п. 0000013267 00000 п. 0000014962 00000 п. 0000014985 00000 п. 0000016516 00000 п. 0000016539 00000 п. 0000018065 00000 п. 0000018088 00000 п. 0000019714 00000 п. 0000019735 00000 п. 0000019827 00000 п. 0000019848 00000 н. 0000019940 00000 п. 0000019962 00000 п. 0000021034 00000 п. 0000021057 00000 п. 0000022782 00000 п. 0000022804 00000 п. 0000023240 00000 п. 0000023263 00000 п. 0000026122 00000 п. 0000026144 00000 п. 0000026748 00000 н. 0000026771 00000 п. 0000029777 00000 п. 0000029800 00000 н. 0000034344 00000 п. 0000034367 00000 п. 0000039728 00000 п. 0000039751 00000 п. 0000045373 00000 п. 0000045396 00000 п. 0000050677 00000 п. 0000050700 00000 п. 0000055540 00000 п. 0000055563 00000 п. 0000060597 00000 п. 0000060620 00000 п. 0000066123 00000 п. 0000066146 00000 п. 0000069850 00000 п. 0000069873 00000 п. 0000075583 00000 п. 0000075606 00000 п. 0000081371 00000 п. 0000081394 00000 п. 0000086485 00000 п. 0000086508 00000 п. 00000 00000 п. 00000
00000 п. 0000098245 00000 п. 0000098268 00000 п. 0000104098 00000 н. 0000104121 00000 п. 0000109223 00000 п. 0000109246 00000 н. 0000114007 00000 н. 0000114030 00000 н. 0000117329 00000 н. 0000117352 00000 н. 0000122740 00000 н. 0000122763 00000 н. 0000129624 00000 н. 0000129647 00000 н. 0000134806 00000 н. 0000134829 00000 н. 0000137708 00000 н. 0000002418 00000 н. 0000002820 00000 н. трейлер ] >> startxref 0 %% EOF 720 0 объект > эндобдж 721 0 объект > эндобдж 812 0 объект > поток Hb`a`, b`c`X Ȁ
Различия в подкорково-корковых взаимодействиях, выявленные на моделях коннектома и микросхемы при аутизме
Калужна-Чаплинска, Й., Журавич, Э. и Юзвик-Пруска, Й. Сосредоточьтесь на социальном аспекте аутизма. J. Autism Dev. Disord. 48 , 1861–1867 (2018).
PubMed Статья PubMed Central Google Scholar
Ганц, М. Л. Распределение дополнительных социальных издержек аутизма на протяжении жизни. Arch. Педиатр. Adolesc. Med. 161 , 343–349 (2007).
PubMed Статья PubMed Central Google Scholar
Christensen, D. L. et al. Распространенность и характеристики расстройства аутистического спектра среди детей в возрасте 8 лет — Сеть мониторинга аутизма и нарушений развития, 11 сайтов, США, 2012 г. MMWR Surveill. Сумм. 65 , 1–23 (2018).
PubMed PubMed Central Статья Google Scholar
Ли, Э., Ли, Дж. И Ким, Э. Дисбаланс возбуждения / торможения в моделях расстройств аутистического спектра на животных. Biol. Психиатрия 81 , 838–847 (2017).
PubMed Статья PubMed Central Google Scholar
Нельсон, С. Б. и Валах, В. Возбуждающий / тормозной баланс и гомеостаз контура при расстройствах аутистического спектра. Нейрон 87 , 684–698 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Hong, S.-J. и другие. Атипичная функциональная иерархия коннектомов при аутизме. Nat. Commun. 10 , 1022 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar
Наир, А., Трейбер, Дж. М., Шукла, Д. К., Ших, П. и Мюллер, Р. А. Нарушение таламокортикальной связи при расстройстве аутистического спектра: исследование функциональной и анатомической связи. Мозг 136 , 1942–1955 (2013).
PubMed PubMed Central Статья Google Scholar
Нуньес, А.С., Питфилд, Н., Вакорин, В. и Дусбург, С.М. Идиосинкратическая организация корковых сетей при расстройствах аутистического спектра. Neuroimage 190 , 182–190 (2019).
PubMed Статья Google Scholar
Сохал, В. С., Рубенштейн, Дж. Л. Р.Баланс возбуждения-торможения как основа для исследования механизмов психоневрологических расстройств. Мол. Психиатрия 24 , 1248–1257 (2019).
PubMed PubMed Central Статья Google Scholar
Tesink, C. M. J. Y. et al. Нейронные корреляты прагматического понимания речи при расстройствах аутистического спектра. Мозг 132 , 1941–1952 (2009).
CAS PubMed Статья PubMed Central Google Scholar
Вудворд, Н. Д., Хиральдо-Чика, М., Роджерс, Б. и Касио, К. Дж. Таламокортикальная дисфункция при расстройстве аутистического спектра: анализ обмена данными визуализации мозга при аутизме. Biol. Психиатрия Cogn. Neurosci. Нейровизуализация 2 , 76–84 (2017).
PubMed PubMed Central Google Scholar
Pereira, A. M. et al. Различия в структуре коры и функциональной связи МРТ при высокофункциональном аутизме. Фронт. Neurol . 9 , 539 (2018).
PubMed PubMed Central Статья Google Scholar
Jou, R.J. et al. Визуализация тензора диффузии при расстройствах аутистического спектра: предварительное свидетельство аномальной нейронной связи. Aust. Н. З. Дж. Психиатрия 45 , 153–162 (2011).
PubMed Статья PubMed Central Google Scholar
Ли Ю., Парк Б., Джеймс О., Ким С.-Г. И Парк, Х. Расстройство аутистического спектра, связанное с функциональными изменениями связности в языковой сети у детей, подростков и взрослых. Фронт. Гм. Neurosci. 11 , 418 (2017).
PubMed PubMed Central Статья Google Scholar
Ракич П. Спецификация областей коры головного мозга. Science 241 , 170–176 (1988).
ADS CAS PubMed Статья PubMed Central Google Scholar
Робертсон К. Э. и Барон-Коэн С. Сенсорное восприятие при аутизме. Nat. Rev. Neurosci. 18 , 671–684 (2017).
CAS PubMed Статья PubMed Central Google Scholar
Belmonte, M. K. et al. Аутизм как нарушение обработки нейронной информации: направления исследований и цели терапии. Мол. Психиатрия 9 , 646–663 (2004).
CAS PubMed Статья PubMed Central Google Scholar
Wang, P. et al. Инверсия крупномасштабной модели схемы показывает корковую иерархию в динамическом состоянии покоя человеческого мозга. Sci. Adv. 5 , eaat7854 (2019).
ADS PubMed PubMed Central Статья Google Scholar
Янг, Д. Ю. Дж., Бим, Д., Пелфри, К. А., Абдуллахи, С. и Джоу, Р. Дж. Морфологические маркеры коры у детей с аутизмом: исследование методом структурной магнитно-резонансной томографии толщины, площади, объема и гирификации. Мол. Аутизм 7 , 1–14 (2016).
Артикул Google Scholar
Лау, В. К. В., Леунг, М. К. и Лау, Б. В. М. Нарушения состояния покоя при расстройствах аутистического спектра: метаанализ. Sci. Отчетность 9 , 3892 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar
Williams, D. L. et al. Различия функций мозга при обработке речи у детей и взрослых с аутизмом. Autism Res. 6 , 288–302 (2013).
PubMed PubMed Central Статья Google Scholar
Pagani, M. et al. Удаление гена риска аутизма shank3 нарушает префронтальную связь. J. Neurosci. 39 , 5299–5310 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Liska, A. et al. Гомозиготная потеря гена риска аутизма cntnap2 приводит к снижению локальной и дальнодействующей префронтальной функциональной связи. Cereb. Cortex 28 , 1141–1153 (2018).
PubMed Статья PubMed Central Google Scholar
Bertero, A. et al. Связанная с аутизмом микроделеция 16p11.2 нарушает префронтальную функциональную связь у мыши и человека. Мозг 141 , 2055–2065 (2018).
PubMed Статья PubMed Central Google Scholar
Антуан, М. В., Лангберг, Т., Шнепель, П.И Фельдман Д. Э. Повышенное отношение возбуждения к подавлению стабилизирует возбудимость синапсов и контуров в четырех моделях мышей с аутизмом. Neuron 101 , 648–661.e4 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Caeyenberghs, K. et al. Нейронная подпись нарушения координации развития в структурном коннектоме, независимом от коморбидного аутизма. Dev. Sci. 19 , 599–612 (2016).
PubMed Статья PubMed Central Google Scholar
Catani, M. et al. Фронтальные сети у взрослых с расстройством аутистического спектра. Мозг 139 , 616–630 (2016).
PubMed PubMed Central Статья Google Scholar
D’Albis, M.A. et al. Локальная структурная взаимосвязь связана с социальным познанием при расстройстве аутистического спектра. Мозг 141 , 3472–3481 (2018).
PubMed Статья PubMed Central Google Scholar
Rudie, J. D. et al. Измененная функциональная и структурная организация сети мозга при аутизме. NeuroImage Clin. 2 , 79–94 (2013).
Артикул Google Scholar
Tournier, J. D. et al. MRtrix3: быстрая, гибкая и открытая программная среда для обработки и визуализации медицинских изображений. Нейроизображение 202 , 116137 (2019).
PubMed PubMed Central Статья Google Scholar
Турнье, Дж. Д., Каламанте, Ф. и Коннелли, А. MRtrix: диффузионная трактография в пересекающихся областях волокон. Внутр. J. Imaging Syst. Technol. 22 , 53–66 (2012).
Артикул Google Scholar
Смит Р.Э., Турнье, Дж. Д., Каламанте, Ф. и Коннелли, А. SIFT2: обеспечение плотной количественной оценки связности белого вещества мозга с использованием упрощенной трактографии. Neuroimage 119 , 338–351 (2015).
PubMed Статья Google Scholar
Смит, Р. Э., Турнье, Дж. Д., Каламанте, Ф. и Коннелли, А. Анатомически ограниченная трактография: улучшенная диффузионная МРТ упрощает трактографию за счет эффективного использования анатомической информации. Neuroimage 62 , 1924–1938 (2012).
PubMed Статья Google Scholar
Jeurissen, B., Tournier, J. D., Dhollander, T., Connelly, A. & Sijbers, J. Многотканевая сферическая деконволюция с ограничениями для улучшенного анализа данных диффузионной МРТ с множеством оболочек. Neuroimage 103 , 411–426 (2014).
PubMed Статья Google Scholar
Christiaens, D. et al. Глобальная трактография данных визуализации, взвешенных по диффузии, с использованием модели нескольких тканей. Neuroimage 123 , 89–101 (2015).
PubMed Статья Google Scholar
Хаак, К. В., Маркуанд, А. Ф. и Бекманн, К. Ф. Коннекопическое картирование с помощью фМРТ в состоянии покоя. Neuroimage 170 , 83–94 (2018).
PubMed Статья Google Scholar
Хаак К. В. и Бекманн К. Ф. Понимание организации мозга перед лицом функциональной неоднородности и функциональной множественности. Нейроизображение 220 , 117061 (2020).
PubMed Статья Google Scholar
Larivière, S. et al. Мультимасштабные структурно-функциональные градиенты в коннектоме новорожденных. Cereb. Cortex 30 , 47–58 (2020).
PubMed Статья Google Scholar
Paquola, C. et al. Сдвиги миелоархитектуры характеризуют развитие корковых градиентов у подростков. elife 8 , 1-23 (2019).
Артикул Google Scholar
Paquola, C. et al. Микроструктурные и функциональные градиенты все больше диссоциируют в трансмодальной коре. PLoS Biol. 17 , e3000284 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Vos de Wael, R. et al. BrainSpace: набор инструментов для анализа макромасштабных градиентов в наборах данных нейровизуализации и коннектомики. Commun. Биол. 3 , 103 (2020).
PubMed PubMed Central Статья Google Scholar
Deco, G. et al. Функциональная связность в состоянии покоя возникает из медленных линейных флуктуаций структурной и динамической формы. J. Neurosci. 33 , 11239–11252 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Ширнер, М., Макинтош, А. Р., Джирса, В., Деко, Г. и Риттер, П. Вывод многомасштабных нейронных механизмов с помощью моделирования сети мозга. elife 7 , 1–30 (2018).
Артикул Google Scholar
Хансен, Э. К. А., Батталья, Д., Шпиглер, А., Деко, Г.И Джирса, В. К. Динамика функциональной связности: моделирование поведения переключения в состоянии покоя. Neuroimage 105 , 525–535 (2015).
PubMed Статья Google Scholar
Брейкспир М. Динамические модели крупномасштабной мозговой активности. Nat. Neurosci. 20 , 340–352 (2017).
CAS PubMed Статья Google Scholar
Васкес-Родригес, Б. и др. Градиенты структурно-функционального связывания в неокортексе. Proc. Natl Acad. Sci. США 116 , 21219–21227 (2019).
PubMed Статья CAS Google Scholar
Суарес, Л. Э., Маркелло, Р. Д., Бецел, Р. Ф. и Мисич, Б. Связующая структура и функции в макромасштабных сетях мозга. Trends Cogn. Sci. 24 , 302–315 (2020).
PubMed Статья Google Scholar
Miŝic, B. et al. Отношения структуры и функции сетевого уровня в неокортексе человека. Cereb. Cortex 26 , 3285–3296 (2016).
PubMed PubMed Central Статья Google Scholar
Baum, G. L. et al. Развитие структурно-функциональной связи в сетях человеческого мозга в молодости. Proc. Natl Acad. Sci. США 117 , 771–778 (2020).
CAS PubMed Статья Google Scholar
Маргулис, Д. С. и др. Размещение сети режима по умолчанию вдоль основного градиента макроуровневой кортикальной организации. Proc. Natl Acad. Sci. США 113 , 12574–12579 (2016).
CAS PubMed Статья PubMed Central Google Scholar
Кулешов М.В. и др. Enrichr: обновление веб-сервера 2016 для комплексного анализа обогащения набора генов. Nucleic Acids Res. 44 , W90 – W97 (2016).
CAS PubMed PubMed Central Статья Google Scholar
Chen, E. Y. et al. Enrichr: интерактивный и совместный инструмент анализа пополнения списка генов HTML5. BMC Bioinformatics 14 , 128 (2013).
PubMed PubMed Central Статья Google Scholar
Догерти, Дж. Д., Шмидт, Э. Ф., Накадзима, М.& Хайнц, Н. Аналитические подходы к данным профилирования РНК для идентификации генов, обогащенных конкретными клетками. Nucleic Acids Res. 38 , 4218–4230 (2010).
CAS PubMed PubMed Central Статья Google Scholar
Цамардинос, И., Рахшани, А. и Лагани, В. Свойства оценки производительности протоколов на основе перекрестной проверки с одновременной оптимизацией гиперпараметров. Внутр. J. Artif. Intell. Инструменты 24 , 1540023 (2015).
Артикул Google Scholar
Cawley, G.C. и Talbot, N.L.C. О чрезмерной подгонке при выборе модели и последующем смещении отбора при оценке производительности. J. Mach. Учить. Res. 11 , 2079–2107 (2010).
MathSciNet МАТЕМАТИКА Google Scholar
Варма, С. и Саймон, Р. Предвзятость в оценке ошибок при использовании перекрестной проверки для выбора модели. BMC Bioinformatics 7 , 91 (2006).
PubMed PubMed Central Статья CAS Google Scholar
Parvandeh, S., Yeh, H. W., Paulus, M. P. & McKinney, B. A. Консенсус включает вложенную перекрестную проверку. Биоинформатика 36 , 3093–3098 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Di Martino, A. et al. Обмен данными визуализации мозга при аутизме: к крупномасштабной оценке внутренней архитектуры мозга при аутизме. Мол. Психиатрия 19 , 659–667 (2014).
PubMed Статья Google Scholar
Di Martino, A. et al. Расширение исследований коннектома при аутизме с использованием обмена данными изображений мозга аутизма II. Sci. Данные 4 , 170010 (2017).
PubMed PubMed Central Статья Google Scholar
Бецель, Р. Ф., Гриффа, А., Хагманн, П. и Мишиц, Б. Зависимые от расстояния пороговые значения консенсуса для создания структурных сетей мозга, репрезентативных для группы. Netw. Neurosci. 3 , 475–496 (2019).
PubMed PubMed Central Статья Google Scholar
Лангс, Г., Голланд, П. и Гош, С. С. Прогнозирование активации у отдельных лиц с помощью функционального соединения в состоянии покоя на основе слияния меток с несколькими атлалами. in Международная конференция по медицинской обработке изображений и компьютерному вмешательству 313–320 (2015).
Месулам, М. М. От ощущения к познанию. Мозг 121 , 1013–1052 (1998).
PubMed Статья PubMed Central Google Scholar
Yeo, B. T. T. et al. Организация коры головного мозга человека оценивается по внутренней функциональной связности. J. Neurophysiol. 106 , 1125–1165 (2011).
PubMed Статья PubMed Central Google Scholar
Bethlehem, R.A. I. et al. Дисперсия функциональных градиентов на протяжении взрослой жизни. Нейроизображение 222 , 117299 (2020).
PubMed PubMed Central Статья Google Scholar
Park, B. et al. Расширяющееся многообразие характеризует подростковые реконфигурации структурной организации коннектома. bioRxiv https://doi.org/10.1101/2020.06.22.165621 (2020).
Артикул PubMed PubMed Central Google Scholar
Alexander-Bloch, A. F. et al. О тестировании пространственного соответствия между картами структуры и функций человеческого мозга. Neuroimage 178 , 540–551 (2018).
PubMed PubMed Central Статья Google Scholar
Hawrylycz, M. J. et al. Анатомически исчерпывающий атлас транскриптома мозга взрослого человека. Nature 489 , 391–399 (2012).
ADS CAS PubMed PubMed Central Статья Google Scholar
Gorgolewski, K.J. et al. NeuroVault.Org: интернет-хранилище для сбора и обмена статистическими картами человеческого мозга без обновления. Фронт. Нейроинформ. 9 , статья 8 (2015).
Артикул Google Scholar
Арнаткевичуте, А., Фулчер, Б. Д. и Форнито, А. Практическое руководство по объединению экспрессии генов в мозге и данных нейровизуализации. Neuroimage 189 , 353–367 (2019).
PubMed Статья PubMed Central Google Scholar
Gandal, M. J. et al. Нарушение регуляции на уровне изоформ в масштабе всего транскриптома при РАС, шизофрении и биполярном расстройстве. Наука 362 , 1265 (2018).
Артикул CAS Google Scholar
Lake, B. B. et al. Подтипы и разнообразие нейронов, выявленные с помощью одноядерного секвенирования РНК человеческого мозга. Наука 352 , 1586–1590 (2016).
ADS CAS PubMed PubMed Central Статья Google Scholar
Lake, B. B. et al. Интегративный одноклеточный анализ транскрипционных и эпигенетических состояний в мозге взрослого человека. Nat. Biotechnol. 36 , 70–80 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Lord, C. et al. Таблица диагностических наблюдений за аутизмом — общий: стандартный метод измерения социальных и коммуникативных дефицитов, связанных со спектром аутизма. J. Autism Dev. Disord. 30 , 205–223 (2000).
CAS PubMed Статья PubMed Central Google Scholar
Zou, H. & Hastie, T. Регуляризация и выбор переменных через Elastic Net. J. R. Stat. Soc. Сер. B 67 , 301–320 (2005).
MathSciNet МАТЕМАТИКА Статья Google Scholar
Mueller, S. et al. Конвергентные результаты измененных функциональных и структурных соединений мозга у людей с высокофункциональным аутизмом: мультимодальное МРТ-исследование. PLoS ONE 8 , e67329 (2013).
ADS CAS PubMed PubMed Central Статья Google Scholar
Berman, J. I. et al. Мультимодальная диффузионно-МРТ и МЭГ-оценка развития слуховой и языковой систем при расстройствах аутистического спектра. Фронт. Нейроанат. 10 , 30 (2016).
PubMed PubMed Central Статья Google Scholar
Travers, B. et al. Визуализация тензора диффузии при расстройствах аутистического спектра: обзор. Autism Res . 5 , 289–313 (2012).
PubMed PubMed Central Статья Google Scholar
Эрнандес, Л.М., Руди, Дж. Д., Грин, С. А., Букхаймер, С. и Дапретто, М. Нейронные сигнатуры расстройств аутистического спектра: понимание динамики сети мозга. Нейропсихофармакология 40 , 171–189 (2015).
PubMed Статья PubMed Central Google Scholar
Li, H., Xue, Z., Ellmore, TM, Frye, RE & Wong, STC Сетевой анализ показывает более сильную локальную связь на основе диффузии и различные корреляции с навыками устной речи в мозгу детей с высокофункциональные расстройства аутистического спектра. Hum. Brain Mapp. 35 , 396–413 (2014).
PubMed Статья PubMed Central Google Scholar
Li, S.J. et al. Изменения связности белого вещества у детей дошкольного возраста с расстройством аутистического спектра. Радиология 288 , 209–217 (2018).
PubMed Статья PubMed Central Google Scholar
Roine, U. et al. Аномальное соединение коннектома у взрослых с высокофункциональным расстройством аутистического спектра. Мол. Аутизм 6 , 65 (2015).
PubMed PubMed Central Статья CAS Google Scholar
Fang, H. et al. Структурные сети у детей с расстройством аутистического спектра с регрессией: исследование теории графов. Behav. Brain Res. 378 , 112262 (2020).
PubMed Статья PubMed Central Google Scholar
Belmonte, M. K. et al. Аутизм и аномальное развитие мозговой связи. J. Neurosci. 24 , 9228–9231 (2004).
CAS PubMed PubMed Central Статья Google Scholar
Assaf, M. et al. Аномальное функциональное соединение подсетей режима по умолчанию у пациентов с расстройствами аутистического спектра. Neuroimage 53 , 247–256 (2010).
PubMed PubMed Central Статья Google Scholar
Мизуно, А., Вильялобос, М. Э., Дэвис, М. М., Даль, Б. К. и Мюллер, Р. А. Частичное усиление таламокортикальной функциональной связи при аутизме. Brain Res . 1104 , 160–174 (2006).
CAS PubMed Статья Google Scholar
Di Martino, A. et al. Аберрантная функциональная связность полосатого тела у детей с аутизмом. Biol. Психиатрия 69 , 847–856 (2011).
PubMed Статья Google Scholar
Nielsen, J. A. et al. Аномальная латерализация функциональной связи между языком и регионами режима по умолчанию при аутизме. Мол. Аутизм 5 , 8 (2014).
PubMed PubMed Central Статья Google Scholar
Jouravlev, O. et al. Сниженная латерализация языка при аутизме и более широкий фенотип аутизма по оценке с помощью надежного индивидуального анализа. Autism Res. 13 , 1746–1761 (2020).
PubMed Статья Google Scholar
Кляйнханс, Н. М., Мюллер, Р. А., Коэн, Д. Н., Курчесн, Э. Атипичная функциональная латерализация языка при расстройствах аутистического спектра. Brain Res . 1221 , 115–125 (2008).
CAS PubMed PubMed Central Статья Google Scholar
Postema, M. C. et al. Измененная структурная асимметрия мозга при расстройстве аутистического спектра в исследовании 54 наборов данных. Nat. Commun. 10 , 4958 (2019).
ADS PubMed PubMed Central Статья CAS Google Scholar
Кардинале, Р. К., Ши, П., Фишман, И., Форд, Л. М. и Мюллер, Р. А. Распространенные сдвиги асимметрии функциональных сетей вправо при расстройстве аутистического спектра. JAMA Psychiatry 70 , 975–982 (2013).
PubMed PubMed Central Статья Google Scholar
Эйлер, Л. Т., Пирс, К. и Куршен, Э. Неспособность левой височной коры специализироваться на речи является ранним и фундаментальным свойством аутизма. Мозг 135 , 949–960 (2012).
PubMed PubMed Central Статья Google Scholar
Floris, D. L. et al. Атипичная латерализация функциональной связности моторных цепей у детей с аутизмом связана с моторным дефицитом. Мол. Аутизм 7 , 35 (2016).
PubMed PubMed Central Статья Google Scholar
Облак, А.Л., Розен, Д.Л., Кемпер, Т.Л., Бауман, М.Л. и Блатт, Дж. Дж. Измененная циктоархитектура коры задней части поясной извилины, но нормальная плотность нейронов и интернейронов в задней части поясной извилины и веретенообразной извилине при аутизме. Autism Res. 4 , 200–211 (2011).
PubMed PubMed Central Статья Google Scholar
Симмс, М. Л., Кемпер, Т. Л., Тимби, К. М., Бауман, М.Л. и Блатт, Г. Дж. Передняя поясная кора при аутизме: неоднородность качественных и количественных цитоархитектонических характеристик предполагает возможные подгруппы. Acta Neuropathol. 118 , 673–684 (2009).
PubMed Статья PubMed Central Google Scholar
Кемпер Т. Л. и Бауман М. Вклад невропатологических исследований в понимание аутизма. Neurol. Clin. 11 , 175–187 (1993).
CAS PubMed Статья PubMed Central Google Scholar
Кемпер Т. Л. и Бауман М. Невропатология детского аутизма. J. Neuropathol. Exp. Neurol. 57 , 645–652 (1998).
CAS PubMed Статья PubMed Central Google Scholar
Казанова, М.Ф., Buxhoeveden, D. P., Switala, A. E. & Roy, E. Плотность и архитектура нейронов (индекс серого уровня) в мозге аутичных пациентов. J. Child Neurol. 17 , 515–521 (2002).
PubMed Статья PubMed Central Google Scholar
Казанова, М. Ф., Буксхеведен, Д. П., Свитала, А. Э. и Рой, Э. Миниколоночная патология при аутизме. Неврология 58 , 428–432 (2002).
PubMed Статья PubMed Central Google Scholar
Авино, Т. А. и Хатслер, Дж. Дж. Аномальное формирование клеточного паттерна на границе серого и белого вещества коры при расстройствах аутистического спектра. Brain Res. 1360 , 138–146 (2010).
CAS PubMed Статья PubMed Central Google Scholar
Зикопулос, Б.И Барбас, Х. Измененные нейронные связи в возбуждающих и тормозных корковых цепях при аутизме. Фронт. Гм. Neurosci. 7 , 609 (2013).
PubMed PubMed Central Статья Google Scholar
Хатслер, Дж. Дж. И Чжан, Х. Повышенная плотность дендритных позвонков на корковых проекционных нейронах при расстройствах аутистического спектра. Brain Res . 1309 , 83–94 (2010).
CAS PubMed Статья PubMed Central Google Scholar
Gonçalves, J. et al. Проверка гипотезы дисбаланса возбуждения / торможения на мышиной модели расстройства аутистического спектра: нейроспектроскопия in vivo и молекулярные доказательства региональных фенотипов. Мол. Аутизм 8 , 47 (2017).
PubMed PubMed Central Статья CAS Google Scholar
Gogolla, N. et al. Дефект общей цепи возбудительно-тормозного баланса в мышиных моделях аутизма. J. Neurodev. Disord. 1 , 172–181 (2009).
PubMed PubMed Central Статья Google Scholar
Guilmatre, A., Huguet, G., Delorme, R. & Bourgeron, T. Возникающая роль генов SHANK в нервно-психических расстройствах. Dev. Neurobiol. 74 , 113–122 (2014).
CAS PubMed Статья PubMed Central Google Scholar
Bourgeron, T. От генетической архитектуры до синаптической пластичности при расстройствах аутистического спектра. Nat. Rev. Neurosci. 16 , 551–563 (2015).
CAS PubMed Статья PubMed Central Google Scholar
Shao, Y. et al. Точное отображение аутичного расстройства на хромосоме 15q11-q13 с использованием фенотипических подтипов. Am. J. Hum. Genet. 72 , 539–548 (2003).
CAS PubMed PubMed Central Статья Google Scholar
млн лет назад, D. Q. et al. Выявление значительной ассоциации и взаимодействия генов-генов субъединиц ГАМК-рецепторов при аутизме. Am. J. Hum. Genet. 77 , 377–388 (2005).
CAS PubMed PubMed Central Статья Google Scholar
Zheng, Z., Zhu, T., Qu, Y. & Mu, D. Уровни глутамата в крови при расстройствах аутистического спектра: систематический обзор и метаанализ. PLoS ONE 11 , e0158688 (2016).
PubMed PubMed Central Статья CAS Google Scholar
Fatemi, SH, Folsom, TD, Kneeland, RE & Liesch, SB Повышение регуляции метаботропного рецептора глутамата 5 у детей с аутизмом связано с недостаточной экспрессией как ломкого протеина умственной отсталости X, так и рецептора бета 3 ГАМК у взрослых с аутизм. Анат. Рек. 294 , 1635–1645 (2011).
CAS Статья Google Scholar
Макфадьен, Дж., Долан, Р. Дж. И Гарридо, М. И. Влияние подкорковых сокращений на неупорядоченную сенсорную и когнитивную обработку. Nat. Ред. Neurosci . https://doi.org/10.1038/s41583-020-0287-1 (2020).
Ван, X. J. Макроскопические градиенты синаптического возбуждения и торможения в неокортексе. Nat. Rev. Neurosci. 21 , 169–178 (2020).
CAS PubMed PubMed Central Статья Google Scholar
Van Essen, D.C. et al. Проект WU-Minn Human Connectome: обзор. Neuroimage 80 , 62–79 (2013).
PubMed PubMed Central Статья Google Scholar
Ханнант П., Кэссиди С., Тавассоли Т. и Манн Ф. Сенсомоторные трудности связаны с тяжестью состояний аутистического спектра. Фронт. Интегр. Neurosci. 10 , 28 (2016).
PubMed PubMed Central Статья Google Scholar
Bertolero, M.A. et al. Сетевая архитектура человеческого мозга генетически закодирована модульной плейотропией. arXiv https://arxiv.org/abs/1905.07606 (2019).
Hawrylycz, M. et al. Канонические генетические признаки мозга взрослого человека. Nat. Neurosci. 18 , 1832–1844 (2015).
CAS PubMed PubMed Central Статья Google Scholar
Альтманн, А.и другие. Анализ на системном уровне подчеркивает активацию микроглии как модифицирующий фактор при распространенных формах эпилепсии человека. bioRxiv https://doi.org/10.1101/470518 (2018).
van den Heuvel, M. P. et al. Эволюционные модификации связности человеческого мозга, связанные с шизофренией. Мозг 142 , 3991–4002 (2019).
PubMed PubMed Central Статья Google Scholar
Форнито А., Арнаткявичюте А. и Фулчер Б. Д. Преодоление разрыва между коннектомом и транскриптомом. Trends Cogn. Sci. 23 , 34–50 (2019).
PubMed Статья PubMed Central Google Scholar
Romero-Garcia, R., Warrier, V., Bullmore, E. T., Baron-Cohen, S. & Bethlehem, R.A. I. Синаптические и транскрипционно подавляемые гены связаны с различиями в толщине коры при аутизме. Мол. Психиатрия 24 , 1053–1064 (2019).
CAS PubMed Статья PubMed Central Google Scholar
Burt, J. B. et al. Иерархия транскриптомной специализации коры головного мозга человека, зафиксированная топографией структурной нейровизуализации. Nat. Neurosci. 21 , 1251–1259 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Wang, Z. et al. Информированная сообществом коннектомика таламокортикальной системы при генерализованной эпилепсии. Неврология 93 , e1112 – e1122 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Хван, К., Бертолеро, М. А., Лю, В. Б. и Д’Эспозито, М. Таламус человека является интегративным центром функциональных сетей мозга. J. Neurosci. 37 , 5594–5607 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Colich, N. L. et al. Атипичная нейронная обработка иронических и искренних замечаний у детей и подростков с расстройствами аутистического спектра. Метафора Симв. 27 , 70–92 (2012).
PubMed PubMed Central Статья Google Scholar
Varoquaux, G.Ошибка перекрестной проверки: малые размеры выборки приводят к большим ошибкам. Neuroimage 180 , 68–77 (2018).
PubMed Статья Google Scholar
Poldrack, R.A. et al. Сканирование горизонта: к прозрачным и воспроизводимым исследованиям нейровизуализации. Nat. Rev. Neurosci. 18 , 115–126 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Ву, К. В., Чанг, Л. Дж., Линдквист, М. А. и Вейджер, Т. Д. Создание лучших биомаркеров: модели мозга в трансляционной нейровизуализации. Nat. Neurosci. 20 , 365–377 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Хонг, С. Дж., Валк, С. Л., Ди Мартино, А., Милхэм, М. П. и Бернхардт, Б. С. Многомерное нейроанатомическое подтипирование расстройства аутистического спектра. Cereb. Cortex 28 , 3578–3588 (2018).
PubMed Статья PubMed Central Google Scholar
Lombardo, M. V. et al. Режим по умолчанию — гипоконнективность визуальной сети в подтипе аутизма с выраженными трудностями социального визуального взаимодействия. elife 8 , e47427 (2019).
CAS PubMed PubMed Central Статья Google Scholar
Lombardo, M. V. et al. Крупномасштабные ассоциации между транскриптомом лейкоцитов и ЖЕЛТЫМИ ответами на речь различаются в подтипах ранних языковых исходов аутизма. Nat. Neurosci. 21 , 1680–1688 (2018).
CAS PubMed PubMed Central Статья Google Scholar
Ломбардо, М. В., Лай, М. К. и Барон-Коэн, С. Подходы с использованием больших данных для разложения неоднородности в спектре аутизма. Мол. Психиатрия 24 , 1435–1450 (2019).
PubMed PubMed Central Статья Google Scholar
Lord, C., Rutter, M. & Le Couteur, A. Пересмотренное диагностическое интервью для аутизма: пересмотренная версия диагностического интервью для лиц, осуществляющих уход за людьми с возможными распространенными нарушениями развития. J. Autism Dev. Disord. 24 , 659–685 (1994).
CAS PubMed Статья PubMed Central Google Scholar
Дейл, А. М., Фишл, Б. и Серено, М. I. Анализ кортикальной поверхности: I. Сегментация и реконструкция поверхности. Neuroimage 9 , 179–194 (1999).
CAS PubMed Статья PubMed Central Google Scholar
Фишл, Б., Лю, А. и Дейл, А. М. Автоматизированная хирургия многообразия: построение геометрически точных и топологически правильных моделей коры головного мозга человека. IEEE Trans. Med. Imaging 20 , 70–80 (2001).
CAS PubMed Статья PubMed Central Google Scholar
Фишл Б., Серено М. И. и Дейл А. М. Анализ кортикальной поверхности: II. Инфляция, выравнивание и система координат на основе поверхности. Neuroimage 9 , 195–207 (1999).
CAS PubMed Статья PubMed Central Google Scholar
Фишл Б., Серено М. И., Тутелл Р. Х. и Дейл А. М. Межсубъектное усреднение с высоким разрешением и поверхностная система координат. Hum. Brain Mapp. 8 , 272–284 (1999).
CAS PubMed PubMed Central Статья Google Scholar
Фишл Б. FreeSurfer Neuroimage 62 , 774–781 (2012).
PubMed PubMed Central Статья Google Scholar
Сегонн, Ф., Пачеко, Дж. И Фишл, Б. Геометрически точная коррекция топологии кортикальных поверхностей с использованием неразделимых петель. IEEE Trans. Med. Imaging 26 , 518–529 (2007).
PubMed Статья Google Scholar
Craddock, C. et al. На пути к автоматическому анализу коннектомов: настраиваемый конвейер для анализа коннектомов (C-PAC). Фронт. Нейроинформ. https: // doi.org / 10.3389 / conf.fninf.2013.09.00042 (2013).
Артикул Google Scholar
Behzadi, Y., Restom, K., Liau, J. & Liu, T. T. Метод коррекции шума на основе компонентов (CompCor) для BOLD и перфузионной фМРТ. Neuroimage 37 , 90–101 (2007).
PubMed PubMed Central Статья Google Scholar
Пауэр, Дж.D. et al. Методы обнаружения, характеристики и удаления артефактов движения в состоянии покоя фМРТ. Neuroimage 84 , 320–341 (2014).
PubMed Статья Google Scholar
Пауэр, Дж. Д., Барнс, К. А., Снайдер, А. З., Шлаггар, Б. Л. и Петерсен, С. Е. Ложные, но систематические корреляции в функциональной связности МРТ-сетей возникают из-за движения субъекта. Neuroimage 59 , 2142–2154 (2012).
PubMed Статья PubMed Central Google Scholar
Турнье, Ж.-Д., Каламанте, Ф. и Коннелли, А. Улучшенная трактография вероятностных линий тока за счет интегрирования 2-го порядка по распределению ориентации волокон. в Proc. Международное общество магнитного резонанса в медицине (2010).
Schaefer, A. et al. Локально-глобальное расчленение коры головного мозга человека с помощью МРТ внутренней функциональной связности. Cereb. Cortex 28 , 3095–3114 (2018).
PubMed Статья PubMed Central Google Scholar
Форнито А., Залески А. и Баллмор Э. Основы анализа сети мозга . (Академик Пресс, 2016).
Тененбаум, Дж. Б., де Сильва, В. и Лэнгфорд, Дж. С. Глобальная геометрическая структура для нелинейного уменьшения размерности. Наука 290 , 2319–2323 (2000).
ADS CAS PubMed Статья PubMed Central Google Scholar
Фон Люксбург, У. Учебное пособие по спектральной кластеризации. Stat. Comput. 17 , 395–416 (2007).
MathSciNet Статья Google Scholar
Park, B. et al. Распространение сигнала по градиентам коннектома и маршрутизация между концентраторами по-разному влияют на динамическую функцию человеческого мозга. Neuroimage 224 , 117429 (2021).
PubMed Статья PubMed Central Google Scholar
Бенджамини Ю. и Хохберг Ю. Контроль уровня ложных открытий: практичный и эффективный подход к множественному тестированию. J. R. Stat. Soc. 57 , 289–300 (1995).
MathSciNet МАТЕМАТИКА Google Scholar
Stoodley, C.J. et al. Изменение связности мозжечка при аутизме и опосредованное мозжечком спасение связанного с аутизмом поведения у мышей. Nat. Neurosci. 20 , 1744–1751 (2017).
CAS PubMed PubMed Central Статья Google Scholar
Francis, S. M. et al. Гипосоединение островных сетей состояния покоя у подростков с расстройством аутистического спектра. Psychiatry Res. Нейровизуализация 283 , 104–112 (2019).
PubMed Статья PubMed Central Google Scholar
Рамос, Т. К., Балардин, Дж. Б., Сато, Дж. Р. и Фуджита, А. Аномальная кортико-мозжечковая функциональная связь при расстройстве аутистического спектра. Фронт. Syst. Neurosci. 12 , 74 (2019).
PubMed PubMed Central Статья Google Scholar
Cerliani, L.и другие. Повышенная функциональная связь между подкорковыми и корковыми сетями состояния покоя при расстройстве аутистического спектра. JAMA Psychiatry 72 , 767–777 (2015).
PubMed PubMed Central Статья Google Scholar
Максимо, Дж. О. и Кана, Р. К. Аберрантная «глубокая взаимосвязь» при аутизме: исследование кортико-подкорковой функциональной взаимосвязи с помощью магнитно-резонансной томографии. Autism Res. 12 , 384–400 (2019).
PubMed Статья Google Scholar
Патенауд Б., Смит С. М., Кеннеди Д. Н. и Дженкинсон М. Байесовская модель формы и внешнего вида для подкорковой сегментации мозга. Neuroimage 56 , 907–922 (2011).
PubMed PubMed Central Статья Google Scholar
Дидрихсен, Дж., Балстерс, Дж. Х., Флавелл, Дж., Кассанс, Э. и Рамнани, Н. Вероятностный МР-атлас мозжечка человека. Neuroimage 46 , 39–46 (2009).
PubMed Статья Google Scholar
Фристон, К. Дж., Харрисон, Л. и Пенни, В. Динамическое причинное моделирование. Neuroimage 19 , 1273–1302 (2003).
CAS PubMed Статья Google Scholar
Хайнцле, Дж., Купманс, П. Дж., Ден Ауден, Х. Э. М., Раман, С. и Стефан, К. Э. Гемодинамическая модель для слоистых BOLD-сигналов. Neuroimage 125 , 556–570 (2016).
PubMed Статья Google Scholar
Стефан К. Э., Вейскопф Н., Дрисдейл П. М., Робинсон П. А. и Фристон К. Дж. Сравнение гемодинамических моделей с DCM. Neuroimage 38 , 387–401 (2007).
PubMed PubMed Central Статья Google Scholar
Wang, P. & Knösche, T.R. Реалистичная модель нейронной массы коры с ламинарно-специфическими связями и синаптической пластичностью — оценка с помощью слухового привыкания. PLoS ONE 8 , e77876 (2013).
ADS CAS PubMed PubMed Central Статья Google Scholar
Гандал, М. Дж., Леппа, В., Вон, Х., Парикшак, Н. Н. и Гешвинд, Д. Х. Путь к точной психиатрии: перевод генетики в механизмы болезни. Nat. Neurosci. 19 , 1397–1407 (2016).
CAS PubMed Статья Google Scholar
Steijger, T. et al. Оценка методов реконструкции транскриптов для RNA-seq. Nat. Методы 10 , 1177–1184 (2013).
CAS PubMed PubMed Central Статья Google Scholar
Любовь, М.I., Hogenesch, J. B. & Irizarry, R. A. Моделирование смещения последовательности фрагментов РНК-seq снижает систематические ошибки в оценке количества транскриптов. Nat. Biotechnol. 34 , 1287–1291 (2016).
CAS PubMed PubMed Central Статья Google Scholar
шаблонов протокола рака | Колледж американских патологов
© 2020 Колледж американских патологов (CAP). Все права защищены.
Колледж американских патологов (CAP) не разрешает воспроизведение какой-либо существенной части этих протоколов без своего письменного разрешения. Настоящим CAP разрешает использование этих протоколов врачами и другими поставщиками медицинских услуг при составлении отчетов о хирургических образцах, при обучении и проведении медицинских исследований в некоммерческих целях. Это разрешение не распространяется на воспроизведение или другое использование любой существенной части этих протоколов в коммерческих целях без письменного согласия CAP.
CAP также разрешает врачам и другим практикующим врачам создавать модифицированные версии протоколов исключительно для их личного использования при составлении отчетов о хирургических образцах для отдельных пациентов, обучении и проведении медицинских исследований в некоммерческих целях.
CAP также разрешает следующие виды использования врачами и другими практикующими медиками при составлении отчетов о хирургических образцах для отдельных пациентов, в обучении и проведении медицинских исследований в некоммерческих целях: (1) Диктовка с оригинала или модифицированного протоколы для создания текстовой карты пациента на бумаге или в текстовом редакторе; (2) Копирование исходных или измененных протоколов в текстовую карту пациента на бумаге или в текстовый документ; (3) Использование компьютеризированной системы для пунктов (1) и (2) при условии, что данные протокола хранятся в неизменном виде в виде единого текстового документа, а не в виде нескольких отдельных полей данных.
За исключением случаев использования (1), (2) и (3) выше, CAP не разрешает какое-либо использование Протоколов в системах электронных медицинских записей, системах информации о патологии, компьютерных системах реестров рака, компьютеризированных базах данных, сопоставлениях между кодированием работает или любую компьютеризированную систему без письменной лицензии от CAP.
Любое публичное распространение оригинальных или модифицированных протоколов запрещено без письменной лицензии от CAP.
Используется с разрешения Американского объединенного комитета по раку (AJCC), Чикаго, Иллинойс.Первоначальным и основным источником этой информации является руководство AJCC по стадированию рака, восьмое издание (2016 г.), опубликованное Springer Science + Business Media.
CAP разработала эти протоколы в качестве образовательного инструмента для помощи патологам в составлении полезной отчетности с соответствующей информацией. Он не выпускал протоколы для использования в судебных процессах, возмещении расходов или в других контекстах. Тем не менее, CAP признает, что протоколы могут использоваться больницами, адвокатами, плательщиками и другими лицами.Действительно, с 1 января 2004 г. Комиссия по онкологическим заболеваниям Американского колледжа хирургов санкционировала использование необходимых элементов данных протоколов в рамках своих стандартов противораковых программ для утвержденных онкологических программ. Поэтому для патологоанатомов еще более важно ознакомиться с этими документами. В то же время CAP предупреждает, что использование протоколов, отличных от их предполагаемых образовательных целей, может включать дополнительные соображения, выходящие за рамки этого документа.
Включение названия продукта или услуги в публикацию CAP не должно толковаться как одобрение такого продукта или услуги, а отсутствие названия продукта или услуги не должно толковаться как неодобрение.
Вернуться к началу
