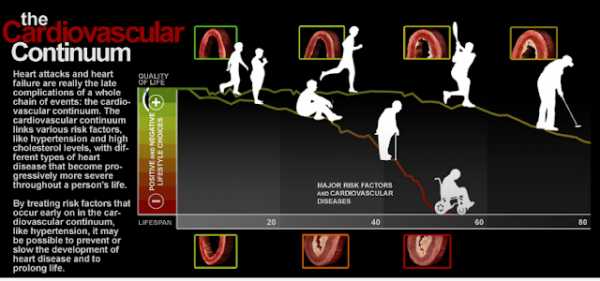
Сердечно-сосудистый континуум — ступени, ведущие к смерти
Сердечно-сосудистый континуум концептуально был предложен в 1991 году Dzau и Braunwald. Сердечно сосудистые заболевания (ССЗ) – ведущая причина смерти населения РФ (вклад в общую смертность составляет 57%).
В нашей стране до 80% смертей происходит дома, на работе, на даче, в общественных местах. Большая часть – скоропостижно или по механизму внезапной смерти. Однако, при владении и своевременном применении несложных приемов оказания самопомощи и/или взаимопомощи со стороны людей, окружающих человека, оказавшегося в таком критическом состоянии, можно в большинстве случаев спасти его жизнь.
Определены факторы, которые способствуют развитию и прогрессированию ССЗ. Это курение, нездоровое питание (недостаточное потребление овощей/фруктов, избыточное потребление насыщенных жиров и поваренной соли), низкая физическая активность и избыточное потребление алкоголя. Длительное негативное действие поведенческих факторов риска (ФР) приводит к развитию так называемых биологических факторов риска ССЗ.
В их числе артериальная гипертония (АГ), дислипидемия (нарушение обмена холестерина и других липидов), избыточная масса тела, ожирение и сахарный диабет (СД). Большой вклад в развитие и прогрессирование ССЗ вносят также психосоциальные факторы риска (низкий уровень дохода, низкая социальная поддержка, стресс, тревожные и депрессивные состояния).
Наибольший вклад в преждевременную смертность населения России вносят семь факторов риска (в скобках указана степень влияния в %):
- АГ (35,5%),
- гиперхолестеринемия (23%),
- курение (17,1%),
- избыточная масса тела (12,5%),
- избыточное потребление алкоголя (11,9%) и
- гиподинамия (недостаток подвижности) (9%)
Основой профилактики ССЗ и их осложнений является оздоровление образа жизни и устранение/коррекция факторов риска ССЗ. А также раннее выявление ССЗ и риска их развития и эффективное лечение.
Сердечно-сосудистый континуум
Сердечно-сосудистый континуум (ССК), представляет собой цепь последовательных событий, приводящих в финале к развитию хронической сердечной недостаточности (ХСН) и смерти больного. Пусковыми звеньями этого «фатального каскада» являются факторы риска.
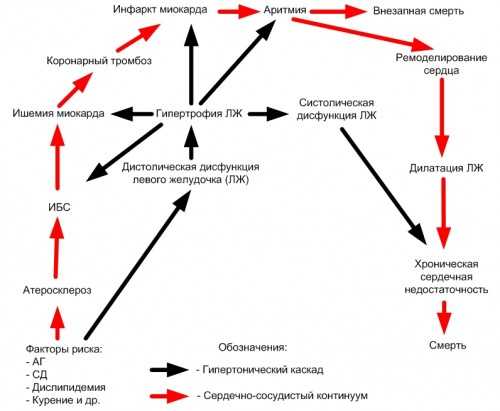 Ниже перечислены параметры для самоконтроля, которые снижают вероятность ССЗ, обусловленных атеросклерозом (каскада, обозначенного на рисунке красными стрелками):
Ниже перечислены параметры для самоконтроля, которые снижают вероятность ССЗ, обусловленных атеросклерозом (каскада, обозначенного на рисунке красными стрелками):
Позднее был предложен «гипертонический каскад» ССК, в котором центральную роль играет АГ и гипертоническое поражение сердца, приводящее в финале к развитию необратимых терминальных изменений, минуя сразу несколько этапов классического континуума (на рисунке обозначен черными стрелками).
ССК позволяет четко увидеть, как будут развиваться события, если не предпринимать никаких действий по профилактике ССЗ и оздоровлению организма. Кроме того, можно точно определить на каком этапе, в зависимости от наличия заболеваний, находится пациент. А главное, что нужно сделать, чтобы не перейти на следующий уровень. Попробовать как-то затормозить «движение в направлении стрелок», а возможно и «вернуться на ступеньку вниз». Здесь решающую роль играет
Приглашаем на вебинар
(Посетители 1 945 за все время, 1 визитов сегодня)
Поделитесь с друзьями- Tweet
Читайте также
edu-biz.org
Сердечно–сосудистый континуум: могут ли ингибиторы АПФ разорвать «порочный круг»? | Подзолков В.И., Осадчий К.К.
Сердечно–сосудистые заболевания (ССЗ) остаются в современном мире главной причиной смерти, унося ежегодно более 17 млн. жизней, в основном вследствие развития фатального инфаркта миокарда (ИМ) и мозгового инсульта [1].
Развитие наиболее социально значимых ССЗ, в основе которых лежит прогрессирование атеросклероза с дальнейшим возникновением его осложнений, в последние 15 лет рассматривается с позиций «сердечно–сосудистого континуума». Эта концепция, впервые высказанная V. Dzau и E. Braunwald в 1991 г. [2], на сегодня не только стала общепризнанной, но по сути представляет собой краеугольный камень, на котором зиждется наше понимание процессов развития важнейших ССЗ. Сердечно–сосудистый континуум представляет собой непрерывную цепь взаимосвязанных изменений в сердечно–сосудистой системе от воздействия факторов риска, через постепенное возникновение и прогрессирование ССЗ до развития терминального поражения сердца и смертельного исхода [3]. Позднее был предложен «гипертонический каскад» сердечно–сосудистого континуума, в котором центральную роль играет собственно артериальная гипертензия (АГ) и гипертоническое поражение сердца, приводящее в финале к развитию необратимых терминальных изменений, минуя сразу несколько этапов классического континуума [4] (рис. 1).
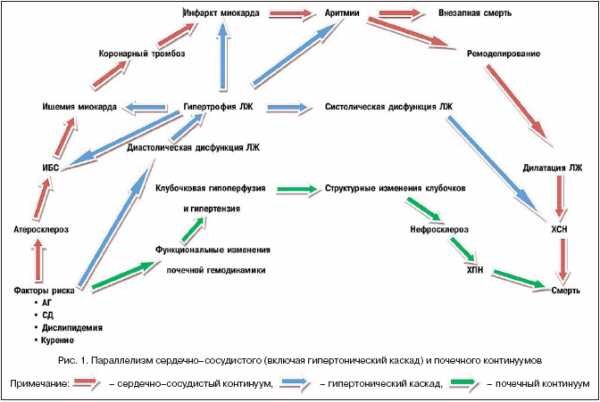
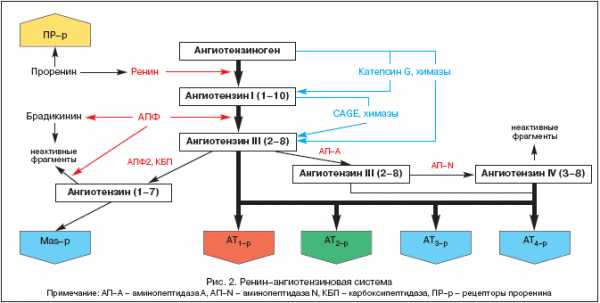
Непрерывная цепь взаимосвязанных изменений структуры и функции сразу нескольких органов и систем организма в рамках континуума предполагает наличие общих патофизиологических процессов, механизмов развития и прогрессирования органных повреждений. В основном все многообразие подобных механизмов может быть сведено к генетическим, гемодинамическим и нейрогуморальным факторам. Среди последних одна из центральных ролей принадлежит активации ренин–ангиотензин–альдостероновой системы (РААС), которая прослеживается практически на всех этапах сердечно–сосудистого континуума.
История изучения РААС берет свое начало в 1898 г., когда финский физиолог Tigelstedt и его студент Bergman выделили из почечной ткани первый компонент РААС – ренин, тогда еще не подозревая, какую роль этот факт сыграет в развитии патофизиологии, медицины и фармакологии в XX веке. Но лишь сегодня, более ста лет спустя, становится все более понятна центральная роль РААС и ангиотензина II не только в гомеостатической регуляции артериального давления (АД), перфузии тканей, баланса жидкости и электролитов, но и в широком спектре патологических процессов. Современные представления о компонентах РААС представлены на рисунке 2.
РААС представляет собой уникальную регуляторную систему, в которой активный эффектор ангиотензин II (Анг II) вырабатывается в межклеточном пространстве путем последовательного протеолитического расщепления его предшественников.
Предшественником Анг II является ангиотензиноген (Анг) – биологически инертный глобулин, синтезируемый в основном в печени (экспрессия мРНК Анг была также выявлена в почках, сердце, головном мозге, сосудах, надпочечниках, яичниках, плаценте и жировой ткани) [5]. Концентрация Анг в крови практически стабильна. Ренин, представляющий собой кислую протеазу, выделяется в кровь юкстагломерулярным аппаратом почек в виде прогормона – проренина, на долю которого приходится до 70–90% всего иммунореактивного ренина в плазме крови. Недавно описаны рецепторы проренина, их роль уточняется. Ренин может также выделяться некоторыми другими тканями (мозгом, сердцем, сосудами). Ренин воздействует на Анг и отщепляет от него несколько концевых фрагментов, что приводит к образованию ангиотензина I (Анг I) или Анг–(1–10). Именно этот процесс является скорость–лимитирующим во всем каскаде образования активных метаболитов РААС. Анг I обладает биологической активностью и может действовать как вазоконстриктор. Ангиотензинпревращающий фермент (АПФ) представляет собой экзопептидазу, локализованную на мембранах различных клеток (эндотелиальных, эпителиоцитов проксимальных почечных канальцев, нейроэпителиоцитов) и в некотором количестве в плазме крови. АПФ отщепляет от Анг I концевой дипептид, конвертируя Анг I в ангиотензин II (Анг II) или Анг–(1–8) – главный эффектор РААС. Кроме того, АПФ метаболизирует брадикинин и калликреин до неактивных метаболитов [6].
Под воздействием эндопептидаз, найденных в мозге и почках, из Анг II образуются Анг III и Анг IV. Последний, вероятно, действует в мозге совместно с Анг II и способствует повышению артериального давления (АД) [7].
Сравнительно недавно выделен новый фермент из класса эндопептидаз, получивший название АПФ2. В отличие от АПФ, он не конвертирует Анг I в Анг II и не подавляется ингибиторами АПФ (иАПФ). Под воздействием АПФ2 [8] из Анг I образуется биологически неактивный Анг–(1–9), в то время как Анг–(1–7) образуется под действием ткань–специфических эндопептидаз и из Анг II при участии АПФ2. Анг–(1–7) может дальше метаболизироваться при участии АПФ до Анг–(1–5), биологическая активность которого пока не выяснена. Эффекты Анг–(1–7) включают вазодилатацию, усиление диуреза и натрийуреза, антитрофическое действие, что реализуется через стимуляцию либо специфических рецепторов, либо MAS–р [9]. Стимуляция последних приводит к повышению продукции NO и простациклина. Сегодня Анг–(1–7) расценивают, как натуральный иАПФ. По–видимому, Анг–(1–7) представляет собой один из компонентов обратной связи в рамках РААС, оказывая противоположное Анг II действие. Таким образом поддерживается определенный баланс между прессорными/трофическими эффектами Анг II и депрессорными/атрофическими эффектами Анг–(1–7).
Основным эффектором РААС является Анг II, действие которого реализуется через специфические ангиотензиновые рецепторы (АТ–р). К настоящему моменту выделены 4 подтипа АТ–р. Наибольшее значение имеет АТ1–р, через стимуляцию которого реализуется большинство как физиологических, так и патофизиологических эффектов Анг II (табл. 1).
АТ1–р локализованы в кровеносных сосудах, сердце, почках, надпочечниках, печени, головном мозге и легких. АТ2–р. широко представлены в мозге, почках и других тканях плода, их количество в постнатальном периоде резко уменьшается. Тем не менее АТ2–р, по–видимому, играют контррегуляторную роль в отношении АТ1–р. (табл. 1), что подтверждается в ходе их блокады специфическим антагонистом PD 123319. Функции АТ3–р не изучены, а стимуляция АТ4–р Анг II, Анг III и Анг IV модулирует синтез ингибитора активатора плазминогена (PAI–1) [10]. Недавно выявлены также специфические рецепторы проренина, их роль уточняется. В эксперименте показана их роль в развитии диабетической нефропатии [11].
Выделение компонентов РААС из циркулирующей крови и различных тканей (сердца, почек, головного мозга, надпочечников, жировой ткани и др.) [12] позволило сформировать концепцию о наличии двух звеньев системы – циркулирующей РААС и тканевой РААС. Именно в рамках тканевой РААС (прежде всего почек и сердца) выделены альтернативные пути образования Анг II без участия АПФ под воздействием химаз, катепсина G и калликреин–подобных ферментов.
Взгляды на место РААС в регуляции функций человеческого организма в норме и патологии неоднократно пересматривались. Сегодня очевидно, что РААС является не только важнейшей регуляторной системой, но также играет центральную роль в широком спектре патологических процессов в различных тканях и органах человека. Выраженные изменения активности РААС (как активация, так и подавление) выявлены при более чем 30 нозологиях и синдромах [13].
В экспериментах in vitro, на животных моделях in vivo и в исследованиях у человека доказана роль РААС (прежде всего активации ее тканевого звена) в развитии эссенциальной и вторичных АГ, эндотелиальной дисфункции, ремоделирования артерий и атеросклероза, гипертрофии левого желудочка (ГЛЖ), ишемии миокарда, ремоделирования сердца после ИМ, ХСН, диабетической и недиабетической нефропатии, хронической почечной недостаточности (ХПН) (табл. 2).
Таким образом, патофизиологическая роль РААС прослеживается на всех этапах сердечно–сосудистого и почечного континуумов.
Сегодня в арсенале врача имеются три группы лекарств, способных блокировать активность РААС – иАПФ, блокаторы АТ1–рецепторов ангиотензина (БРА), прямой ингибитор ренина (алескирен).
Первыми лекарствами, блокирующими РААС, стали иАПФ, разработка которых началась еще в 60–х годах XX века, а первый непептидный иАПФ каптоприл был синтезирован в 1975 г. К настоящему моменту иАПФ являются важнейшим классом препаратов, применяющихся в кардиологии, и входят в группу так называемых лекарств, спасающих жизнь (life–saving drugs) в связи с доказанной способностью улучшать прогноз при целом ряде сердечно–сосудистых и почечных заболеваний.
Механизм действия иАПФ заключается в конкурентном подавлении АПФ, что, с одной стороны, приводит к уменьшению образования Анг II – основного эффектора РААС, а с другой стороны, уменьшает деградацию брадикинина, калликреина, субстанции Р. Это обусловливает фармакологические эффекты иАПФ: снижение сосудистого сопротивления, улучшение функции эндотелия, антипролиферативное действие, влияние на систему свертывания крови, улучшение функции почек.
Механизм действия и основные фармакологические эффекты едины для всего класса иАПФ. Однако выбор конкретного лекарства из группы иАПФ для лечения конкретного пациента может иметь важное значение. иАПФ представляют собой гетерогенную группу препаратов, отличающихся между собой как по химической структуре, особенностям фармакокинетики и фармакодинамики, так и по наличию доказательной базы для применения по различным показаниям. Важно понимать, что хотя способность иАПФ снижать АД и замедлять прогрессирование ХСН расцениваются как класс–эффекты [14], многие органопротективные эффекты отдельных иАПФ не могут быть с позиций доказательной медицины перенесены на весь класс препаратов.
Ингибиторы АПФ различаются по химической структуре (наличию сульфгидрильной группы и др.), особенностям метаболизма (наличие эффекта первого прохождения через печень), особенностям выведения из организма (только почками или почками совместно с печенью), тканевой специфичности (способности блокировать тканевые РААС) и продолжительности действия (табл. 3).
Одним из наиболее изученных по широкому спектру показаний иАПФ является рамиприл (Тритаце®). Препарат характеризуется высокой липофильностью (превосходит эналаприл практически в 20 раз), тканевой специфичностью (превосходит эналаприл в 3–10 раз в зависимости от ткани), длительным путем полувыведения, что позволяет применять его один раз в сутки. Особенно важно отметить, что доказательная база по применению рамиприла при ССЗ, основанная на результатах РКИ с жестким конечными точками, на сегодняшний день наибольшая среди всех иАПФ.
Антигипертензивная эффективность и безопасность рамиприла оценивалась в крупном открытом исследовании CARE, проводившемся в условиях реальной клинической практики. В испытание были включены 11100 больных АГ I–II ст., эффективность лечения оценивали у 8261 пациента. Рамиприл назначали в виде монотерапии в дозе от 2,5 до 10 мг/сут. Через 8 недель лечения было отмечено достоверное снижение как САД, так и ДАД в среднем на 13%, причем данный эффект отмечался и в группе больных с изолированной систолической АГ (ИСАГ). Частота ответа на лечение (достижение целевого АД ниже 140 и 90 мм рт.ст. или снижение ДАД>10 мм рт.ст., или снижение САД>20 мм рт.ст. при ИСАГ) составила в группе систоло–диастолической АГ более 85%, а в группе ИСАГ более 70%. Число побочных явлений в ходе терапии, оцененное у 11100 больных, было невысоким, частота кашля не превысила 3% [15].
Многочисленные исследования показали, что иАПФ способны вызывать регресс ГЛЖ и этот эффект обусловлен не только снижением АД, но и собственно блокадой РААС.
Мета–анализы РКИ, в которых изучались возможности различных классов антигипертензивных препаратов вызывать регресс ГЛЖ, также выявили преимущества иАПФ над другими препаратами [16,17].
Способность рамиприла уменьшать выраженность ГЛЖ изучали в двойном слепом плацебо–контролируемом РКИ HYCAR. В ходе исследования 115 больным АГ назначали либо рамиприл в дозах 1,25 мг/сут. и 5 мг/сут., либо плацебо. Через 6 месяцев масса миокарда ЛЖ достоверно увеличилась в группе плацебо и достоверно уменьшилась в группах рамиприла. Большее снижение было в группе с дозой рамиприла 5 мг/сут. [18]. В открытом многоцентровом РКИ со слепой конечной точкой RACE у 193 больных АГ I–II ст. сравнивали влияние рамиприла и атенолола на уровни АД и массу миокарда ЛЖ, оцененную эхокардиографически. Рамиприл назначали в дозе 2,5 мг/сут., атенолол в дозе 50 мг/сут. с последующей возможностью удвоения дозы через 2 недели. Длительность испытания составила 6 мес. В результате было отмечено, что и рамиприл, и атенолол достоверно снизили как САД, так и ДАД, причем в равной степени. Однако достоверное уменьшение индекса массы миокарда ЛЖ отмечалось только в группе рамиприла [19].
Важной вехой в изучении возможностей иАПФ в профилактике осложнений у пациентов высокого риска стало крупное РКИ HOPE (Heart Outcome Prevention Evaluation) [20]. Целью исследования была оценка возможности уменьшения заболеваемости и смертности от ССЗ у больных высокого риска под воздействием двух стратегий лечения: иАПФ рамиприлом и витамином Е. В это двойное слепое плацебо–контролируемое исследование с факториальным дизайном был включен 9541 пациент с высоким риском сердечно–сосудистых осложнений вследствие возраста (>55 лет), наличия сердечно–сосудистых заболеваний либо сахарного диабета в сочетании с заболеванием сосудов или факторами риска (АГ, курение, дислипидемия). Особенностями популяции больных, включенных в исследование, были отсутствие дисфункции ЛЖ и ХСН, невысокое среднее исходное АД (139 и 79 мм рт.ст.), хотя почти половина включенных в исследование имели АГ, использование других лекарственных препаратов, которые могли повлиять на исходы лечения. Так, 76% пациентов получали антитромбоцитарные средства (в основном ацетилсалициловую к–ту (АСК)), 45% – антагонисты кальция, 40% – β–адреноблокаторы, 30% – гиполипидемические препараты, 15% – диуретики. В ходе исследования частота использования гиполипидемических средств, β–блокаторов и диуретиков увеличивалась, а антагонистов кальция – снизилась на 5%. Исходно низкие значения АД в исследуемой популяции объясняются именно широким использованием антигипертензивных препаратов. Рамиприл назначался, начиная с дозы 2,5 мг/сут., с последующей титрацией до 10 мг/сут. Максимальную дозу к концу первого года исследования получали 82% пациентов, а к концу исследования (4,5 года) – 65% пациентов. Первичной конечной точкой исследования была комбинация сердечно–сосудистой смерти, нефатального ИМ и нефатального инсульта.
Исследование HOPE было остановлено досрочно (на полгода раньше) в связи с явными преимуществами рамиприла перед витамином Е. Эффективность последнего не отличалась от плацебо. Частота достижения первичной конечной точки в группе рамиприла составила 14% по сравнению с 17,8% в группе плацебо, что соответствует снижению относительного риска на 22% (р<0,001). Относительный риск развития отдельных компонентов первичной конечной точки также снизился: инсульта на 32%, ИМ на 20%, сердечно–сосудистой смерти на 26%. Применение рамиприла обеспечило также достоверное снижение риска развития ХСН (на 23%) и проведения процедур реваскуляризации (на 15%). Важнейшим результатом исследования НОРЕ стало снижение под влиянием рамиприла общей смертности на 16% (р=0,005), причем кривые Каплана–Майера разошлись уже к первому году и продолжали расходиться до конца исследования.
Результаты исследования не зависели от применения других препаратов и были значимы для различных подгрупп (с СД, АГ, предшествующими поражениями сосудов, мужчин и женщин).
На фоне применения рамиприла частота развития новых случаев СД была на 33% ниже, чем на фоне приема плацебо.
Важным выводом из исследования HOPE стал тот факт, что снижение частоты наступления конечных точек было гораздо более выраженным, чем ожидаемое от снижения АД. То есть протективные эффекты рамиприла явно простирались дальше его антигипертензивного действия. Это позволило предполагать, что рамиприл активно воздействовал на процессы ремоделирования сосудов и атерогенеза.
Способность иАПФ тормозить развитие атеросклероза была продемонстрирована на животных [21,22]. Однако исследования у человека дали противоречивые результаты. Среди всех иАПФ, тестировавшихся на возможность торможения атерогенеза in vivo, наибольшая доказательная база накоплена для рамиприла и периндоприла. В рамках испытания НОРЕ проводилось подисследование SECURE, в котором у 753 пациентов оценивалась способность рамиприла замедлять прогрессирование атеросклероза. На фоне применения высокой дозы рамиприла (10 мг/сут.) отмечено замедление на 37% по сравнению с плацебо прогрессирования атеросклероза в сонной артерии, оценивавшееся по увеличению толщины комплекса интима/медиа (КИМ). В группе низкой дозы рамиприла (2,5 мг/сут.) толщина КИМ тоже оказалась меньше, чем в группе плацебо, однако различия не были достоверными. Таким образом, антиатерогенный эффект рамиприла можно считать доказанным, но его следует рассматривать как дозозависимый [23].
Антиатерогенное действие рамиприла, выявленное в исследовании SECURE, по–видимому, объясняет во многом эффективность препарата во вторичной профилактике ССЗ, убедительно продемонстрированную в исследовании HOPE.
Продолжением исследования НОРЕ стал проект НОРЕ–ТОО [24], призванный оценить, сохраняется ли во времени способность рамиприла уменьшать число неблагоприятных сердечно–сосудистых событий и новых случаев СД у больных высокого риска. В исследование включили 4528 пациентов из исследования НОРЕ, которые либо продолжали принимать рамиприл 10 мг/сут. в открытом режиме, либо переводились на рамиприл после приема плацебо. К концу периода наблюдения (2,6 лет) было отмечено дальнейшее достоверное снижение относительного риска первичной конечной точки на 17%, ИМ на 19%, проведения процедур реваскуляризации на 16%, а новых случаев СД на 34%. Снижение относительного риска неблагоприятных событий отмечалось в различных подгруппах пациентов, включая подгруппы низкого, среднего и высокого риска. Таким образом, было доказано, что протективные эффекты рамиприла не только сохраняются во времени, но их выраженность существенно выше, чем это было показано в исследовании НОРЕ.
Применение рамиприла при ИМ, осложненном развитием сердечной недостаточности, изучалось в крупном двойном слепом плацебо–контролируем РКИ AIRE. В испытание включили 2006 пациентов с подтвержденным ИМ и симптомами сердечной недостаточности. Рамиприл назначался в дозе 5 мг/сут., начиная с 3–10 дня болезни, с последующей титрацией до 10 мг/сут. в течение 2 дней. Первичной конечной точкой была общая смертность, вторичными – неблагоприятные сердечно–сосудистые события (смерть, повторный инфаркт, инсульт, прогрессирование сердечной недостаточности). Длительность исследования составила в среднем 15 мес. (минимум 6 мес.). 59% пациентов в группе рамиприла были подвергнуты тромболизису, 77% принимали АСК, 25% – β–адреноблокаторы, 56% – нитраты. Применение рамиприла обеспечило достоверное снижение общей смертности на 27%, ставшее очевидным уже через 30 дней лечения. Относительный риск наступления вторичных конечных точек достоверно снизился на 19%. При этом кривые выживаемости продолжали расходиться на всем протяжении исследования (до 30 мес.). Эффект рамиприла сохранялся в различных подгруппах пациентов (мужчины и женщины, с АГ и без нее, и др.). Частота отмены препарата достоверно не отличалась от частоты отмены плацебо [25].
Продолжением AIRE явилось исследование AIREX, целью которого стала оценка эффективность долговременной (5 лет) терапии рамиприлом больных ИМ с симптомами сердечной недостаточности. В испытание включили 603 пациента из исследования AIRE, которые продолжали получать либо рамиприл, либо плацебо. Длительность лечения составила в среднем 59 мес. (минимум 42 мес.). В результате к 59–му месяцу абсолютная величина выживаемости была на 11,4% выше в группе рамиприла, что соответствует достоверному снижению относительного риска смерти на 36%. Среднее увеличение продолжительности жизни в группе рамиприла составило 1,45 г. В результате не только была вновь подтверждена высокая эффективность препарата в этой группе пациентов и ее сохранения во времени. Был также сделан вывод о том, что «лечение рамиприлом в дозе 5 мг дважды в сутки после острого ИМ, будучи однажды начатым, должно продолжаться неопределенно долго» [26].
Благоприятное влияние рамиприла на выживаемость пожилых больных, перенесших ИМ, показано в канадском ретроспективном исследовании, в которое включили 7512 пациентов старше 65 лет, получавших после выписки из стационара различные ингибиторы АПФ [27]. В результате по влиянию на выживаемость в течение первого года рамиприл достоверно превзошел эналаприл, фозиноприл, каптоприл, квинаприл и лизиноприл.
Интересные сравнительные данные получены при анализе исходов у пациентов, включавшихся в регистр MITRA PLUS. Среди 14608 больных ИМ с подъемом сегмента ST 4,7% получали рамиприл, 39,0% – другие иАПФ, 56,3% – не получали иАПФ. По сравнению с отсутствием терапии иАПФ и, что особенно важно, по сравнению с другими иАПФ лечение рамиприлом обеспечило достоверно более низкие показатели госпитальной летальности и частоты неблагоприятных сердечно–сосудистых и церебральных событий. Однако по частоте развития сердечной недостаточности различий между иАПФ не было [28].
Интересные данные получены в результате двойного слепого плацебо–контролируемого исследования DIAB–HYCAR, в котором оценивалось влияние низких доз рамиприла (1,25 мг/сут.) на частоту сердечно–сосудистых и почечных осложнений у 4912 пациентов с СД 2 типа и нефропатией, проявлявшейся микроальбуминурией или протеинурией. Применение препарата в столь низкой дозе способствовало некоторому снижению АД и уменьшению экскреции белка с мочой, однако не привело к значимому снижению ни сердечно–сосудистых, ни почечных конечных точек [29]. Этот результат еще раз подчеркивает, что благоприятные эффекты рамиприла реализуются при применении соответствующих доз – 10 мг/сут.
Недавно завершилось крупнейшее сравнительное РКИ ONTARGET, в котором сравнивались возможности профилактики осложнений у больных ССЗ или СД без сердечной недостаточности с помощью трех режимов терапии: иАПФ, БРА и комбинации иАПФ + БРА. В исследование включили 25620 больных с ИБС, заболеваниями периферических сосудов, цереброваскулярными заболеваниями или СД. Исходно у 89% пациентов имелись ССЗ, у 69% – АГ и у 38% – СД. При включении в исследование 80,9% больных принимали антиагреганты, 61,6% – статины, 56,9% – β–адреноблокаторы, 28,0% – диуретики. Пациентов рандомизировали в три группы: принимающих рамиприл в дозе 10 мг/сут. (n=8502), принимающих телмисартан в дозе 80 мг/сут. (n=8542) и принимающих комбинацию рамиприла с телмисартаном (n=8502). Продолжительность наблюдения составляла 56 мес.
В результате первичной комбинированной конечной точки, включавшей смертность от осложнений ССЗ, ИМ, инсульт или госпитализацию по поводу сердечной недостаточности, достигли 16,5% пациентов в группе рамиприла, 16,7% в группе телмисартана и 16,3% в группе комбинированного лечения. То есть не было отмечено различий между монотерапией рамиприлом, монотерапией телмисартаном и комбинированной терапией обоими препаратами. Частота развития отдельных неблагоприятных исходов, включенных в комбинированный показатель, и общая смертность также достоверно не различались. В то же время ухудшение функции почек чаще отмечалась в группе комбинированной терапии: относительный риск развития ХПН составил 1,33 (р<0,001) [30].
Таким образом, это крупнейшее сравнительное исследование не выявило преимуществ применения БРА над традиционной терапией иАПФ у больных ССЗ и СД, за исключением несколько меньшей частоты ангионевротического отека. Фактически телмисартан в дозе 80 мг/сут. обеспечивал 94% эффективности рамиприла в дозе 10 мг/сут., установленной в исследовании НОРЕ. Эти данные согласуются с результатами РКИ VALIANT, в котором эффект валсартана также не превзошел эффект каптоприла [31].
Все это позволило J.McMurray в редакционной статье New England Journal of Medicine высказать мнение, что поскольку БРА не превосходят традиционные иАПФ по эффективности, но существенно дороже, то область их применения в основном сводится к случаям непереносимости иАПФ из–за кашля [32].
Результаты исследования ONTARGET имеют большое научное значение не только в практическом плане. Они еще раз заставляют обратить внимание на предполагаемую роль брадикинина в обеспечении клинической эффективности препаратов, блокирующих РААС. И хотя иАПФ полностью не блокируют образование Анг II, в отличие от БРА они уменьшают деградацию брадикинина до неактивных метаболитов.
Таким образом, имеющиеся результаты РКИ с участием рамиприла показывают, что препарат обеспечивает положительное влияние на конечные точки, в том числе общую смертность, при различных ССЗ. По сути дела, это дает возможность обеспечивать органопротекцию на различных этапах сердечно–сосудистого (включая гипертонический каскад) континуума, начиная от воздействия факторов риска (прежде всего АГ и СД) и заканчивая терминальными органными поражениями (ХСН). При этом необходимо подчеркнуть важность правильного выбора дозировки препарата и необходимость длительного, зачастую пожизненного лечения.
Литература
1. Ezzati M, Hoorn SV, Rodgers A, et al. 2003. Estimates of global and regional potential health gains from reducing multiple major risk factors. Lancet, 362:271–80.
2. Dzau V, Braunwald E. Resolved and unresolved issues in the prevention and treatment of coronary artery disease: a workshop consensus statement. Am Heart J. 1991 Apr;121(4 Pt 1):1244–63.
3. Victor J. Dzau, Elliott M. Antman, Henry R. Black et al. The cardiovascular disease continuum validated: clinical evidence of improved patient outcomes: part I: Pathophysiology and clinical trial evidence (risk factors through stable coronary artery disease). Circulation. 2006 Dec 19;114(25):2850–70.
4. В.И.Подзолков, В.А.Булатов. Миокард. Нефрон. Взгляд через призму эволюции артериальной гипертензии. РМЖ 2008, 16(11): 1517–1523.
5. Morgan L, Broughton PF, Kalsheker N. Angiotensinogen: molecular biology, biochemistry and physiology. Int J Biochem Cell Biol. 1996;28:1211–22.
6. Carey RM, Siragy HM. Newly recognized components of the renin–angiotensin system: potential roles in cardiovascular and renal regulation. Endocr Rev. 2003;24:261–71.
7. Reudelhuber TL. The renin–angiotensin system: peptides and enzymes beyond angiotensin II. Curr Opin Nephrol Hypertens. 2005;14:155–59.
8. Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin–converting enzyme–related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1–9. Circ Res. 2000 Sep 1;87(5):E1–9.
9. Tallant EA, Ferrario CM, Gallagher PE. Angiotensin–(1–7) inhibits growth of cardiac myocytes through activation of the mas receptor. Am J Physiol Heart Circ Physiol 2005;289: h2560–h2566.
10. Stanton A. Therapeutic potential of renin inhibitors in the management of cardiovascular disorders. Am J Cardiovasc Drugs. 2003;3:389–94.
11. Ichihara A, Hayashi M, Kaneshiro Y, et al. Inhibition of diabetic nephropathy by a decoy peptide corresponding to the “handle” region for nonproteolytic activation of prorenin. J Clin Invest. 2004;114:1128–35.
12. Phillips MI. Tissue renin–angiotensin systems. In: Izzo JL, Black HR, ed. Hypertension Primer: The Essentials of High Blood Pressure. 2nd ed. Baltimore, MD: Lippincott William & Wilkins; 1999:23–24.
13. Paul M, Poyan Mehr A, Kreutz R. Physiology of local renin–angiotensin systems. Physiol Rev. 2006;86:747–803.
14. Lopez–Sendon J, Swedberg K, McMurray J, et al. Expert consensus document on angiotensin converting enzyme inhibitors in cardiovascular disease. The Task Force on ACE–inhibitors of the European Society of Cardiology. Eur Heart J. 2004 Aug;25(16):1454–70.
15. Kaplan NM. The CARE Study: a postmarketing evaluation of ramipril in 11,100 patients. The Clinical Altace Real–World Efficacy (CARE) Investigators. Clin Ther. 1996 Jul–Aug;18(4):658–70.
16. Dahlof B, Pennert K, Hansson L. Reversal of left ventricular hypertrophy in hypertensive patients. A metaanalysis of 109 treatment studies. Am J Hypertens. 1992 Feb;5(2):95–110.
17. Schmieder RE, Martus P, Klingbeil A. Reversal of left ventricular hypertrophy in essential hypertension. A meta–analysis of randomized double–blind studies. JAMA. 1996 May 15;275(19):1507–13.
18. Lievre M, Gueret P, Gayet C, et al. Remission of left ventricular hypertrophy with ramipril independently of blood pressure changes: the HYCAR study (cardiac hypertrophy and ramipril)] Arch Mal Coeur Vaiss. 1995 Feb;88 Spec No 2:35–42.
19. Agabiti–Rosei E, Ambrosioni E, Dal Palu C, Muiesan ML, Zanchetti A. ACE inhibitor ramipril is more effective than the beta–blocker atenolol in reducing left ventricular mass in hypertension. Results of the RACE (ramipril cardioprotective evaluation) study on behalf of the RACE study group. J Hypertens. 1995 Nov;13(11):1325–34.
20. The Heart Outcomes Prevention Evaluation Study Investigators. Effects of an angiotensin–converting–enzyme inhibitor, ramipril, on death from cardiovascular causes,myocardial infarction and stroke in high–risk patients.New Engl J Med 2000;342: 145–153.
21. Pitt B. Potential role of angiotensin–converting enzyme inhibitors in the treatment of atherosclerosis. Eur Heart J 1995;16:49–54.
22. Schoelkens BA, Landgraf W. ACE inhibition and atherosclerosis. Can J Physiol Pharmacol 2002;80:354–9.
23. Lonn E, Yusuf S, Dzavik V, et al. Effects of ramipril and vitamin E on atherosclerosis: the study to evaluate carotid ultrasound changes in patients treated with ramipril and vitamin E (SECURE). Circulation. 2001 Feb 20;103(7):919–25.
24. Bosch J, Lonn E, Pogue J, Arnold JM, Dagenais GR, Yusuf S; HOPE/HOPE–TOO Study Investigators. Long–term effects of ramipril on cardiovascular events and on diabetes: results of the HOPE study extension. Circulation. 2005 Aug 30;112(9):1339–46.
25. Effect of ramipril on mortality and morbidity of survivors of acute myocardial infarction with clinical evidence of heart failure. The Acute Infarction Ramipril Efficacy (AIRE) Study Investigators. Lancet. 1993 Oct 2;342(8875):821–8.
26. Hall AS, Murray GD, Ball SG. Follow–up study of patients randomly allocated ramipril or placebo for heart failure after acute myocardial infarction: AIRE Extension (AIREX) Study. Acute Infarction Ramipril Efficacy. Lancet. 1997 May 24;349(9064):1493–7.
27. Pilote L, Abrahamowicz M, Rodrigues E, Eisenberg MJ, Rahme E. Mortality rates in elderly patients who take different angiotensin–converting enzyme inhibitors after acute myocardial infarction: a class effect? Ann Intern Med. 2004 Jul 20;141(2):102–12.
28. Wienbergen H, Schiele R, Gitt AK, et al. Impact of ramipril versus other angiotensin–converting enzyme inhibitors on outcome of unselected patients with ST–elevation acute myocardial infarction. Am J Cardiol. 2002 Nov 15;90(10):1045–9.
29. Michel Marre, Michel Lievre, Gilles Chatellier, et al. on behalf of the DIABHYCAR Study Investigators. Effects of low dose ramipril on cardiovascular and renal outcomes in patients with type 2 diabetes and raised excretion of urinary albumin: randomised, double blind, placebo controlled trial (the DIAB–HYCAR study). BMJ 2004;328;495.
30. The ONTARGET Investigators. Telmisartan, ramipril or both in patients at a high risk for vascular events. N Eng J Med 2008;358:1547–1559
31. Pfeffer M, McMurray J, Velazquez E, et al. Valsartan, captopril or both in myocardial infarction complicated by heart failure, left ventricle dysfunction. N Eng J Med 2003;349:1893–1906
32. McMurray J. ACE–inhibitors in cardiovascular disease – unbeatable? N Eng J Med 2008;358:1615–1616
www.rmj.ru
Сердечно-Сосудистый континуум
ГБУ РО «ОКБ им. Н.А. Семашко»
Врач-терапевтвысшей категории приемного отделения
ВиноградоваГ.И.
Сердечно-Сосудистый континуум- это непрерывная цепь взаимосвязанных изменений в сердечно-сосудистой системе от воздействия факторов риска через постепенное возникновение и прогрессирование сердечно-сосудистых заболеваний до развития терминального поражения сердца и смертельного исхода.
Сердечно сосудистые заболевания (ССЗ) – ведущая причина смерти населения РФ (вклад в общую смертность составляет 57%).
Факторы,способствующие развитию и прогрессированию ССЗ:
- Курение
- Нездоровое питание (недостаточное потребление овощей/фруктов, избыточное потребление насыщенных жиров и поваренной соли)
- Низкая физическая активность
- Избыточное потребление алкоголя.
Длительное негативное действие поведенческих факторов риска (ФР) приводит к развитию так называемых биологических факторов риска ССЗ:
- артериальная гипертония (АГ),
- дислипидемия (нарушение обмена холестерина и других липидов),
- избыточная масса тела,
- ожирение
- сахарный диабет (СД).
Большой вклад в развитие и прогрессирование ССЗ вносят также психосоциальные факторы риска ( стресс, тревожные и депрессивные состояния).
Наибольший вклад в преждевременную смертность населения России вносят семь факторов риска (в скобках указана степень влияния в %):
- АГ (35,5%),
- гиперхолестеринемия (23%),
- курение (17,1%),
- недостаточное потребление овощей и фруктов (12,9%),
- избыточная масса тела (12,5%),
- избыточное потребление алкоголя (11,9%)
- гиподинамия (недостаток подвижности) (9%)
Основой профилактики ССЗ и их осложнений является оздоровление образа жизни и устранение/коррекция факторов риска ССЗ, а также раннее выявление ССЗ и риска их развития и эффективное лечение.
Для того, чтобы разорвать порочный круг патологии сердечно-сосудистой системынеобходимозаботиться о своем здоровьес молодости. Легче предупредить заболевание, чем потом его лечить,и невсегдалечениеуспешно.
Ниже перечислены параметры для самоконтроля, которые снижают вероятность ССЗ, обусловленных атеросклерозом.
old.xn--62-6kct0akqt0e.xn--p1ai
БЕРСЕРК ( БОЕВАЯ ФАРМАКОЛОГИЯ) : Сердечно-сосудистый континуум: единые причины многих болезней.
Новая парадигма: сердечно-сосудистый континуум.
Издавна было известно, что ожирение часто сочетается с такими заболеваниями, как ИБС, АГ, инфаркты, инсульты, атерогенная дислипидемия, СД 2 типа, подагра, бесплодие, поликистоз яичников, «венозный тромбоэмболизм», «ночное апноэ» и др. Представление о связи избытка жировой ткани с сердечно-сосудистыми заболеваниями появилось более полувека назад. Известный клиницист Е.М. Тареев в 1948 г писал: «Представление о гипертонике наиболее часто ассоциируется с ожирелым гиперстеником, с возможным нарушением белкового обмена, с засорением крови продуктами неполного метаморфоза — холестерина, мочевой кислотой…»
В 1991 году Dzau и Braunwald предложили концепцию сердечно–сосудистого континуума (cardiovascular continuum), представляющего собой цепь последовательных событий, приводящих в финале к развитию застойной сердечной недостаточности и смерти больного. Пусковыми звеньями этого «фатального каскада» являются сердечно–сосудистые факторы риска, артериальная гипертония (АГ), а также сахарный диабет. Многие заблуждаются, думая, что инфаркты и инсульты случаются внезапно, на самом деле всё предопределяется еще в молодости. Понимание данной концепции позволит более осознано подойти к лечению и профилактике сердечно-сосудистых заболеваний.
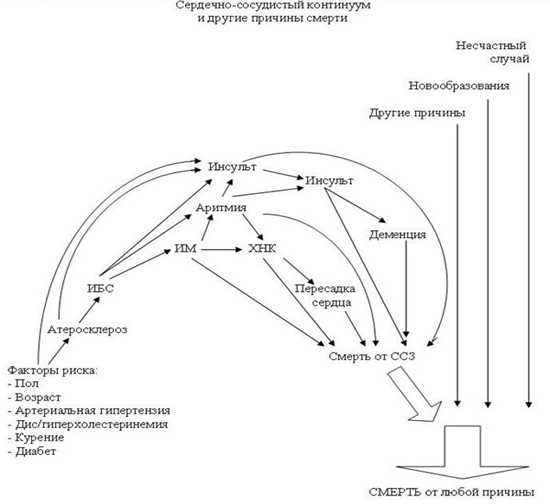
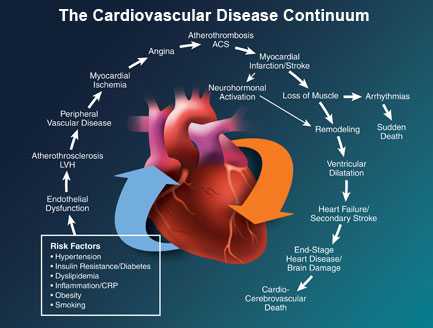
Сердечно-сосудистый континуум – единый механизм дерегуляции, включающий все патофизиологические процессы, приводящие от факторов риска к болезни, ремоделированию, дилатации левого желудочка, формированию ХСН (хронической сердечной недостаточности) и смерти. Суть феномена заключается в том, что такие факторы риска как АГ, сахарный диабет, дислипидемия, через гипертрофию и дилатацию левого желудочка, либо через развитие атеросклероза, ИБС, острого инфаркта миокарда приводят к гибели и гибернации кардиомиоцитов, активации тканевых и циркулирующих нейрогормонов и в результате к ремоделированию сердца и формированию ХСН.
В свою очередь, хроническая сердечная недостаточность приводит или к смерти от нарастающей декомпенсации, или через жизненно опасные тахи- и брадиаритмии к внезапной смерти таких тяжело больных. Важной особенностью сердечно-сосудистого континуума является то, что с определенного этапа поражения сердца прогрессирование ХСН происходит по общим закономерностям, практически не зависящим от этиологии заболевания.
В прогрессировании дисфункции и ремоделировании миокарда при ССЗ и ХСН (хроническая сердечная недостаточность) значительная роль принадлежит повышению активности таких нейрогормональных систем, как СНС и РААС.
Еще А.Л. Мясников в 1965 г. в монографии «Гипертоническая болезнь и атеросклероз» подчеркивал, что «сочетание гипертонической болезни с атеросклерозом и связанной с ним коронарной недостаточностью настолько часто встречается в практике и так преобладает над «чистыми» формами, что возникает задача рассматривать эти патологические состояния не только в их типичном изолированном виде, но и в часто встречающемся комплексе». Мета–анализ MacMahon et al., основанный на результатах 9 проспективных исследований, включивших в общей сложности более 400000 больных, еще раз подтвердил, что вероятность развития ишемической болезни сердца (ИБС) находится в прямой линейной зависимости от уровня как систолического (САД), так и диастолического (ДАД) АД.
Кроме того, АГ является важнейшим прогностическим фактором инфаркта миокарда (ИМ), острого и преходящего нарушения мозгового кровообращения, хронической сердечной недостаточности, общей и сердечно–сосудистой смертности. В свою очередь, наличие у больного с АГ ИБС, независимо от ее формы (стенокардия напряжения, инфаркт миокарда, перенесенная операция реваскуляризации миокарда) может рассматриваться как «сопутствующее клиническое состояние», в значительной степени влияющее на общий сердечно–сосудистый риск пациента. Международное Общество по Артериальной Гипертензии и Европейское Общество Кардиологов (ISH/ESC) рекомендует относить больного, страдающего одновременно ГБ и ИБС, к группе очень высокого риска.
Взаимосвязь между АГ и ИБС вполне объяснима. Во–первых, оба заболевания имеют одинаковые факторы риска, во–вторых, механизмы возникновения и эволюции АГ и ИБС во многом похожи. Так, считается общепризнанной роль эндотелиальной дисфункции (ЭД) в развитии как АГ, так и ИБС.
Дисбаланс между прессорной и депрессорной системами регуляции тонуса сосудов вызывает на начальных этапах повышение уровня АД, а впоследствии стимулирует процессы ремоделирования сердечно–сосудистой системы, затрагивающие левый желудочек, магистральные и регионарные сосуды, а также микроциркуляторное русло. На уровне коронарных артерий ЭД стимулирует атерогенез, приводящий к формированию, а в конечном итоге, к дестабилизации бляшки, ее разрыву и развитию инфаркта миокарда (ИМ) .
Особый интерес вызывает тот факт, что нарушения эндотелий–зависимой регуляции тонуса коронарных артерий создают дополнительный динамический стеноз к уже имеющемуся анатомическому.
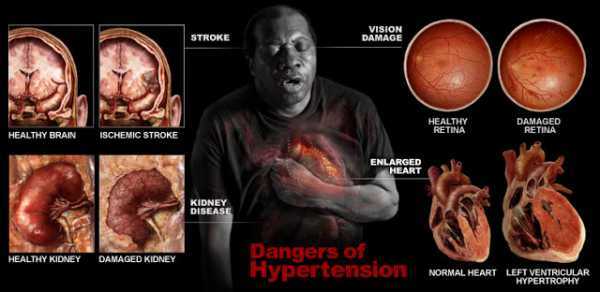
Короткие и длинные пути сердечно-сосудистого континуума.
определяют сердечно-сосудистый континуум следующим образом — это непрерывное развитие сердечно-сосудистых заболеваний — от факторов риска до гибели больного. Континуум можно проходить быстро или медленно. Существуют более длинные и более короткие пути от появления факторов риска до летального исхода. Сложный пациент, быстро проходящий сердечно-сосудистый континуум, умирает рано.
1. Пусковой момент.
Пусковым моментом сердечно-сосудистого континуума являются артериальная гипертензия, сахарный диабет, дислипидемия, ожирение, курение, все они объединяются термином «факторы риска». Все они способствуют развитию атеросклероза и дисфункции эндотелия (прежде всего нарушению секреции азота оксида и других вазодилататоров, снижению антиагрегационных, антипролиферативных свойств эндотелия).
2. Быстрый путь (смерть от инфаркта или аритмии).
Ведущую роль в нарушении метаболизма азота оксида и развитии эндотелиальной дисфункции играет активация нейрогормональных систем (ренин-ангиотензин-альдостероновой, симпатоадреналовой). Активация этих систем вызывает снижение экспрессии азота оксида, способствует гипертрофии сосудистой стенки и левого желудочка, повышению проницаемости сосудов, развитию микроангиопатий, что в свою очередь усугубляет дисфункцию эндотелия. Эндотелиальная дисфункция способствует дальнейшему развитию и прогрессированию атеросклероза, ишемической болезни сердца, дестабилизации атеросклеротической бляшки, повышению коагулянтных свойств крови. В итоге развиваются инфаркт миокарда с последующим ремоделированием миокарда левого желудочка и развитием хронической сердечной недостаточности, которая прогрессирует и без соответствующего лечения приводит к летальному исходу.
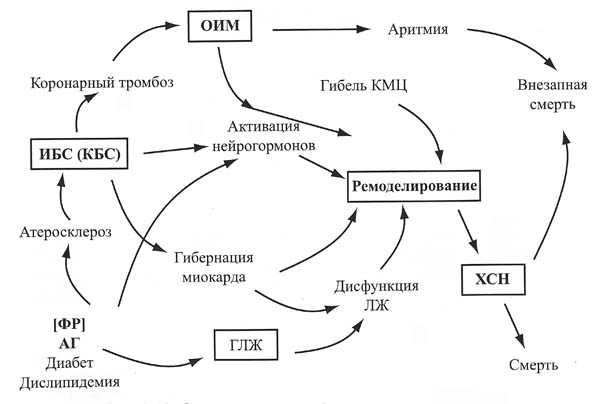
Возможная цепь событий включает:
развитие атеросклероза коронарных артерий – ИБС — выраженная дисфункция эндотелия — коронарный тромбоз — острый инфаркт миокарда — фатальная аритмия — смерть больного.
Возможен и другой вариант развития событий после острого инфаркта миокарда:
развитие очага некроза — процессы гибернации в миокарде — ремоделирование левого желудочка — хроническая сердечная недостаточность — смерть.
3. Долгий путь (хроническая сердечная недостаточноть, поражение органов-мишеней).
При артериальной гипертензии схема сердечно-сосудистого континуума выглядит следующим образом:
артериальная гипертензия — активация нейрогормонов и эндотелиальная дисфункция — гипертрофия левого желудочка и сосудистых стенок -ремоделирование левого желудочка, артерий — хроническая сердечная недостаточность — смерть.
Необходимой стадией развития сердечно-сосудистого континуума является ремоделирование левого желудочка. Ишемическая болезнь сердца может привести к развитию ишемической кардиомиопатии в связи с рецидивирующими эпизодами ишемии миокарда, состоянием гибернации в определенных участках миокарда, перенесенными инфарктами миокарда, наличием очагов постинфарктного кардиосклероза. В последующем развивается ремоделирование миокарда и хроническая сердечная недостаточность.
Артериальная гипертензия также приводит к ремоделированию сердца с последующим развитием хронической сердечной недостаточности . Следует еще раз подчеркнуть, что ключевыми этапами развития сердечно-сосудистого континуума являются активация нейрогормональных систем, дисфункция эндотелия, ремоделирование миокарда.
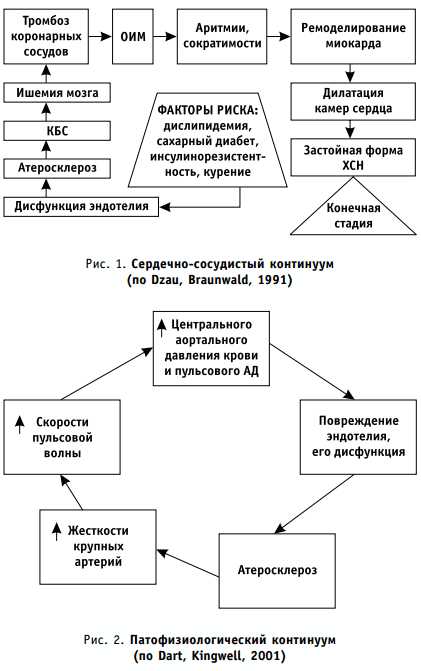
Порочный круг в сердечно-сосудистом континууме.
В 2001 г. A. M. Dart и B. A. Kingwell описали второй («патофизиологический») континуум, который представляет собой порочный круг, стартующий с этапа повреждения эндотелия сосудов и его дисфункции — этой первопричины атеросклероза артерий. Далее круг замыкается посредством повышения жесткости стенок резистивных сосудов, что ведет к ускорению пульсовой волны и повышению пульсового давления, а также давления крови в аорте. В итоге дисфункция эндотелия прогрессирует, повышается риск атеротромботических осложнений.
По этой модели артериальная гипертензия является ключевым фактором ускорения атеросклеротического процесса и появления коронарной болезни сердца. Последняя сопровождается ишемическим повреждением миокарда вплоть до развития ИМ и дисфункции сердечной мышцы.
У больных артериальной гипертензией сердце вынуждено адаптироваться к условиям работы против высокого сопротивления периферических сосудов, которые в ответ на повышение АД спазмируются. Рано или поздно стенка левого желудочка сердца утолщается, что на первых порах является результатом его адаптации. Со временем в гипертрофированных кардиомиоцитах (КМЦ) появляются дегенеративные изменения, в интерстициальных пространствах накапливается коллаген. Уже на ранних этапах артериальной гипертензии формируются гипертрофия левого желудочка (ГЛЖ) и диастолическая дисфункция левого желудочка (ДД ЛЖ).
Даже мягкая артериальная гипертензия увеличивает риск появления ГЛЖ в 2-3 раза — этого фактор риска возникновения инфаркта миокарда и желудочковых аритмий. Возникновение дисфункции эндотелия сосудов в условиях окислительного стресса способствует ускоренному прогрессированию атеросклеротического процесса в сосудах, в том числе и коронарных. Это создает угрозу ишемии миокарда и повышает риск возникновения ИМ, чему способствует снижение перфузии мышцы левого желудочка вследствие наличия его гипертрофии.
Если диастолическая дисфункция левого желудочка является результатом его нагрузки высоким сопротивлением, то систолическая дисфункция левого желудочка формируется вследствие перегрузки объемом. Снижение перфузии тканей кровью сопровождается компенсаторной активацией нейроэндокринных систем, прежде всего симпатоадреналовой (САС) и РААС.
Гиперактивация последних ускоряет процесс прогрессирования хронической сердечной недостаточности. Заметим, что систолическая дисфункция левого желудочка встречается у 2% населения, у 50% больных она протекает бессимптомно, пациенты не лечатся, что ухудшает прогноз их жизни.
При формировании диастолической дисфункции левого желудочка, когда снижается коронарный резерв и могут появляться разного рода аритмии, ситуация еще обратима. С этапа возникновения систолической дисфункции левого желудочка ремоделирование сердечной мышцы приобретает необратимый характер.
 |
| Сердечно-сосудистый континуум: единые причины многих болезней. |
Факторы риска.
Чем больше факторов риска, тем быстрее развиваются события у конкретного пациента. Современные рекомендации по диагностике и лечению сердечно–сосудистых заболеваний (ССЗ) уделяют большое внимание выявлению и коррекции факторов риска (ФР) развития патологий сердечно–сосудистой системы (ССС). Эти ФР во многом универсальны, то есть характерны для большинства ССЗ, и хорошо известны. В настоящее время ФР подразделяют на: «модифицируемые» – ожирение, уровень холестерина, уровень АД, наличие НТГ или СД 2 типа, курение; «немодифицируемые» – возраст, пол, расовая принадлежность, отягощенный семейный анамнез; «мягкие» ФР – низкий уровень ЛПВП, α–липопротеина и тканевого активатора плазминогена–1, высокий уровень С–реактивного протеина, гомоцистеина, мочевой кислоты.
Каждый ФР имеет свой удельный вес в вероятности развития того или иного заболевания ССС. При этом совместное воздействие нескольких ФР на одного пациента способствует существенному увеличению риска развития сердечно–сосудистых осложнений (ССО).
Основные ФР, такие как ожирение, АГ, СД, атерогенная дислипидемия, представляют собой начальный этап в «сердечно–сосудистом континууме» – в непрерывной последовательности патофизиологических событий, приводящих к прогрессирующему повреждению клеток различных органов, в частности, к поражению артериальной стенки (ремоделирование) и в конечном итоге клиническим проявлениям ССЗ.
Большинство обеспеченных людей, особенно в крупных городах цивилизованных стран, стремятся соответствовать современным стереотипам человеческой красоты и используют все доступные методы сохранения и поддержания «вечной молодости». Это наиболее актуально среди молодых людей репродуктивного возраста, когда нет еще серьезных хронических заболеваний и вопросы здоровья, как такового, их мало беспокоят, но есть желание достойно выглядеть, чтобы найти престижную работу, приобрести спутника жизни, обзавестись семьей, словом, быть в социуме.
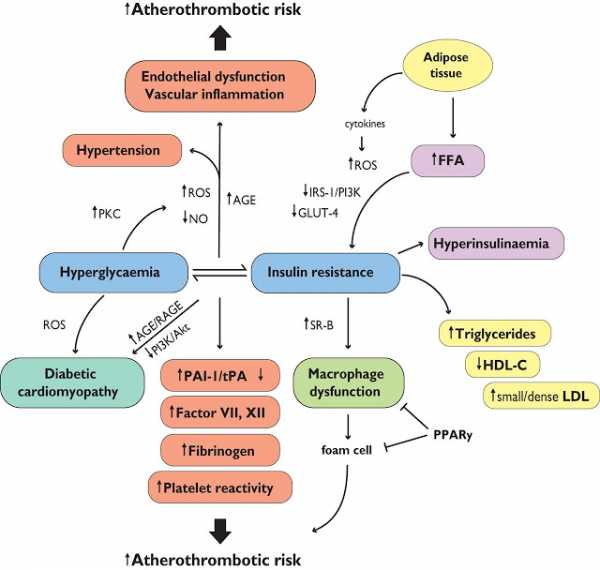
Когда к 50–60 годам жизни, а порой и ранее, возникают серьезные проблемы со здоровьем (АГ, ИБС, СД, заболевания суставов, гормональные нарушения и др.), то сопутствующее ожирение, если оно имеет место, уходит как бы на второй план. Тогда все внимание в лечении направлено на устранение возникших недугов, при этом упускается из вида, что их причиной, возможно, является именно избыточное отложение висцеральной жировой ткани. Еще раз прочитайте это предложение. Висцеральной жировой ткани, которая выделяет воспалительные цитокины!
Воспалительные цитокины
Жировая ткань – не просто пассивный накопитель жира – «аккумулятор энергии»: она является активным ауто–, пара– и эндокринным органом, секретирующим в кровоток различные биологически активные соединения пептидной и непептидной природы, играющие важную роль в гомеокинезе различных систем, в том числе и сердечно–сосудистой системы. Адипоциты – функциональные единицы жировой ткани, являются источником фактора некроза опухоли–альфа (ФНО–α), ингибитора активатора плазминогена–1 (ИАП–1), интерлейкина–6 (ИЛ–6), лептина, ангиотензиногена, инсулиноподобного фактора роста–1 (ИФР–1).
Повышенный уровень мочевой кислоты
В то же время имеется небольшое количество работ, посвященных клиническому и прогностическому значению гиперурикемии при хронической сердечной недостаточности, хотя эта патология остается одной из неблагоприятных в плане прогноза в ряду сердечно–сосудистых заболеваний. Гиперурикемия рассматривается как часть сердечно–сосудистого континуума, как фактор риска развития хронической сердечной недостаточности и маркер ее неблагоприятного течения.
Инсулинорезистентность
Развитие сердечно-сосудистых заболеваний у лиц с устойчивостью к инсулину — процесс прогрессирующий, характеризующийся ранней дисфункцией эндотелия и сосудистым воспалением, ведущим к вовлечению моноцитов, трансформацией их в пенистые клетки с образованием жировых полосок. Спустя многие годы, это ведёт к росту атеросклеротических бляшек, что, при наличии общего провоспалительного фона, выражается в нестабильности и разрыве бляшки с окклюзирующим тромбозом. Атеромы у лиц с сахарным диабетом имеют боль- шее содержание жира, в большей степени воспалительно изменены и демонстрируют более высокий риск тромбообразования, чем у лиц без диабета. Эти изменения происходят в течение 20–30 лет.
berserktakticalfarma.blogspot.com
Сердечно-сосудистый континуум: могут ли ингибиторы АПФ разорвать «порочный круг»?
К.К. Осадчий, В.И. Подзолков, Московская медицинская академия имени И.М. Сеченова, Россия
Сердечно-сосудистые заболевания (ССЗ) в современном мире остаются главной причиной смерти, унося ежегодно более 17 млн жизней, в основном вследствие развития фатального инфаркта миокарда (ИМ) и мозгового инсульта [1].
Развитие наиболее социально значимых ССЗ, в основе которых лежит прогрессирование атеросклероза с дальнейшим возникновением его осложнений, в последние 15 лет рассматривается с позиций сердечно-сосудистого континуума. Эта концепция, впервые высказанная V. Dzau и E. Braunwald в 1991 году [2], сегодня не только стала общепризнанной, но, по сути, представляет собой краеугольный камень, на котором зиждется наше понимание процессов развития важнейших ССЗ. Сердечно-сосудистый континуум представляет собой непрерывную цепь взаимосвязанных изменений в сердечно-сосудистой системе — от воздействия факторов риска, через постепенное возникновение и прогрессирование ССЗ, до развития терминального поражения сердца и смертельного исхода [3]. Позднее было предложено определение «гипертонический каскад» сердечно-сосудистого континуума, в котором центральную роль играет собственно артериальная гипертензия (АГ) и гипертоническое поражение сердца, приводящее в финале к развитию необратимых терминальных изменений, минуя сразу несколько этапов классического континуума [4] (рис. 1).
Непрерывная цепь взаимосвязанных изменений структуры и функции сразу нескольких органов и систем организма в рамках континуума предполагает наличие общих патофизиологических процессов, механизмов развития и прогрессирования органных повреждений. В основном все многообразие подобных механизмов может быть сведено к генетическим, гемодинамическим и нейрогуморальным факторам. Среди последних одна из центральных ролей принадлежит активации ренин-ангиотензин-альдостероновой системы (РААС), которая прослеживается практически на всех этапах сердечно-сосудистого континуума.
История изучения РААС берет свое начало в 1898 году, когда финский физиолог Tigelstedt и его студент Bergman выделили из почечной ткани первый компонент РААС — ренин, тогда еще не подозревая, какую роль этот факт сыграет в развитии патофизиологии, медицины и фармакологии в XX веке. Но лишь сегодня, более ста лет спустя, становится все более понятной центральная роль РААС и ангиотензина II (Анг II) не только в гомеостатической регуляции артериального давления (АД), перфузии тканей, баланса жидкости и электролитов, но и в широком спектре патологических процессов. Современные представления о компонентах РААС представлены на рисунке 2.
РААС представляет собой уникальную регуляторную систему, в которой активный эффектор Анг II вырабатывается в межклеточном пространстве путем последовательного протеолитического расщепления его предшественников.
Предшественником Анг II является ангиотензиноген (Анг) — биологически инертный
глобулин, синтезируемый в основном в печени (экспрессия мРНК Анг была также
выявлена в почках, сердце, головном мозге, сосудах, надпочечниках, яичниках,
плаценте и жировой ткани) [5]. Концентрация Анг в крови практически стабильна.
Ренин, представляющий собой кислую протеазу, выделяется в кровь
юкстагломерулярным аппаратом почек в виде прогормона — проренина, на долю
которого приходится до 70–90% всего иммунореактивного ренина в плазме крови.
Недавно описаны рецепторы проренина, их роль уточняется. Ренин может также
выделяться некоторыми другими тканями (мозгом, сердцем, сосудами). Ренин
воздействует на Анг и отщепляет от него несколько концевых фрагментов, что
приводит к образованию ангиотензина I (Анг I) или
Анг-(1–10). Именно этот
процесс является скорость-лимитирующим во всем каскаде образования активных
метаболитов РААС. Анг I обладает биологической активностью и может действовать
как вазоконстриктор. Ангиотензинпревращающий фермент (АПФ) представляет собой
экзопептидазу, локализованную на мембранах различных клеток (эндотелиальных,
эпителиоцитах проксимальных почечных канальцев, нейроэпителиоцитах) и в
некотором количестве — в плазме крови. АПФ отщепляет от Анг I концевой дипептид,
конвертируя Анг I в Анг II или Анг-(1–8) — главный эффектор РААС. Кроме того,
АПФ метаболизирует брадикинин и калликреин до неактивных метаболитов [6].
Под воздействием эндопептидаз, найденных в мозге и почках, из Анг II образуются ангиотензин III (Анг III) и ангиотензин IV (Анг IV). Последний, вероятно, действует в мозге совместно с Анг II и способствует повышению АД [7].
Сравнительно недавно выделен новый фермент из класса эндопептидаз, получивший название АПФ2. В отличие от АПФ, он не конвертирует Анг I в Анг II и не подавляется ингибиторами АПФ (иАПФ). Под воздействием АПФ2 [8] из Анг I образуется биологически неактивный Анг-(1–9), в то время как Анг-(1–7) образуется под действием ткань-специфических эндопептидаз и из Анг II при участии АПФ2. Анг-(1–7) может дальше метаболизироваться при участии АПФ до Анг-(1–5), биологическая активность которого пока не выяснена. Эффекты Анг-(1–7) включают вазодилатацию, усиление диуреза и натрийуреза, антитрофическое действие, что реализуется через стимуляцию либо специфических рецепторов, либо MAS-р [9]. Стимуляция последних приводит к повышению продукции NO и простациклина. Сегодня Анг-(1–7) расценивают как натуральный иАПФ. По-видимому, Анг-(1–7) представляет собой один из компонентов обратной связи в рамках РААС, оказывающий противоположное Анг II действие. Таким образом поддерживается определенный баланс между прессорными/трофическими эффектами Анг II и депрессорными/атрофическими эффектами Анг-(1–7).
Основным эффектором РААС является Анг II, действие которого реализуется через специфические ангиотензиновые рецепторы (АТ-р). На сегодняшний день выделены 4 подтипа АТ-р. Наибольшее значение имеет АТ1-р, через стимуляцию которого реализуется большинство как физиологических, так и патофизиологических эффектов Анг II.
АТ1-р локализованы в кровеносных сосудах, сердце, почках, надпочечниках, печени, головном мозге и легких. АТ2-р широко представлены в мозге, почках и других тканях плода, их количество в постнатальный период резко уменьшается. Тем не менее, АТ2-р, по-видимому, играют контррегуляторную роль в отношении АТ1-р, что подтверждается в ходе их блокады специфическим антагонистом PD 123319. Функции АТ3-р не изучены, а стимуляция АТ-р Анг II, Анг III и Анг IV модулирует синтез ингибитора активатора плазминогена (PAI-1) [10]. Недавно выявлены также специфические рецепторы проренина, их роль уточняется. В эксперименте показана их роль в развитии диабетической нефропатии [11].
Выделение компонентов РААС из циркулирующей крови и различных тканей (сердца, почек, головного мозга, надпочечников, жировой ткани и др.) [12] позволило сформировать концепцию о наличии двух звеньев системы — циркулирующей РААС и тканевой РААС. Именно в рамках тканевой РААС (прежде всего, почек и сердца) выделены альтернативные пути образования Анг II без участия АПФ под воздействием химаз, катепсина G и калликреин-подобных ферментов.
Взгляды на место РААС в регуляции функций человеческого организма в норме и при патологии неоднократно пересматривались. Сегодня очевидно, что РААС является не только важнейшей регуляторной системой, но также играет центральную роль в широком спектре патологических процессов в различных тканях и органах человека. Выраженные изменения активности РААС (как активация, так и подавление) выявлены при более чем 30 нозологиях и синдромах [13].
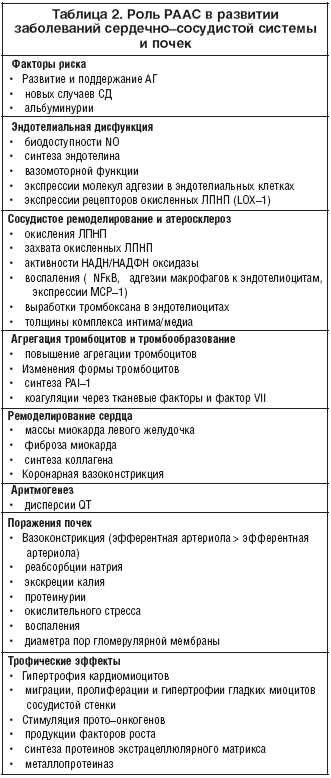
Роль РААС в развитии заболеваний сердечно-сосудистой системы и почек
Факторы риска
• развитие и поддержание АГ
• новые случаи сахарного диабета (СД)
• альбуминурия
Эндотелиальная дисфункция
• нарушение биодоступности NO
• синтез эндотелина
• вазомоторная функция
• экспрессия молекул адгезии в эндотелиальных клетках
• экспрессия рецепторов окисленных липопротеидов низкой плотности (ЛПНП) (LOX-1)
Сосудистое ремоделирование и атеросклероз
• окисление ЛПНП
• захват окисленных ЛПНП
• активность НАДН/НАДФН-оксидазы
• воспаление (NFKB, адгезия макрофагов к эндотелиоцитам, экспрессия
моноцитарного хемотаксического протеина 1 (МСР-1)
• выработка тромбоксана в эндотелиоцитах
• толщина комплекса интима-медиа (КИМ)
Агрегация тромбоцитов и тромбообразование
• повышение агрегации тромбоцитов
• изменение формы тромбоцитов
• синтез ингибитора активатора плазминогена (РАМ)
• коагуляция через тканевые факторы и фактор VII
Ремоделирование сердца
• изменение массы миокарда левого желудочка (ЛЖ)
• фиброз миокарда
• синтез коллагена
• коронарная вазоконстрикция
Аритмогенез
• дисперсия QT
Поражение почек
• вазоконстрикция
• реабсорбция натрия
• экскреция калия
• протеинурия
• окислительный стресс
• воспаление
• изменение диаметра пор гломерулярной мембраны
Трофические эффекты
• гипертрофия кардиомиоцитов
• миграция, пролиферация и гипертрофия гладких миоцитов сосудистой стенки
• стимуляция протоонкогенов
• продукция факторов роста
• синтез протеинов экстрацеллюлярного матрикса
• синтез металлопротеиназ.
В экспериментах in vitro, на животных моделях in vivo и в исследованиях у человека доказана роль РААС (прежде всего, активации ее тканевого звена) в развитии эссенциальной и вторичной АГ, эндотелиальной дисфункции, ремоделирования артерий и атеросклероза, гипертрофии левого желудочка (ГЛЖ), ишемии миокарда, ремоделирования сердца после ИМ, хронической сердечной недостаточности (ХСН), диабетической и недиабетической нефропатии, хронической почечной недостаточности (ХПН).
Таким образом, патофизиологическая роль РААС прослеживается на всех этапах сердечно-сосудистого и почечного континуумов.
Сегодня в арсенале врача имеются три группы лекарств, способных блокировать активность РААС — иАПФ, блокаторы АТ1-р ангиотензина (БРА), прямой ингибитор ренина.
Первыми препаратами, блокирующими РААС, стали иАПФ, разработка которых началась еще в 60-х годах XX века, а первый непептидный иАПФ каптоприл был синтезирован в 1975 году. В настоящее время иАПФ являются важнейшим классом препаратов, применяемых в кардиологии, и входят в группу так называемых лекарств, спасающих жизнь (life-saving drugs), в связи с доказанной их способностью улучшать прогноз при целом ряде сердечно-сосудистых и почечных заболеваний.
Механизм действия иАПФ заключается в конкурентном подавлении АПФ, что, с одной стороны, приводит к уменьшению образования Анг II — основного эффектора РААС, а с другой — к уменьшению деградации брадикинина, калликреина, субстанции Р. Это обусловливает фармакологические эффекты иАПФ: снижение сосудистого сопротивления, улучшение функции эндотелия, антипролиферативное действие, влияние на систему свертывания крови, улучшение функции почек.
Механизм действия и основные фармакологические эффекты едины для всего класса иАПФ. Однако выбор конкретного лекарства из группы иАПФ для лечения конкретного пациента может иметь важное значение. Ингибиторы АПФ представляют собой гетерогенную группу препаратов, отличающихся между собой как по химической структуре, особенностям фармакокинетики и фармакодинамики, так и по наличию доказательной базы для применения по различным показаниям. Важно понимать, что, хотя способность иАПФ снижать АД и замедлять прогрессирование ХСН расценивается как класс-эффекты [14], многие органопротективные эффекты отдельных иАПФ не могут быть с позиций доказательной медицины перенесены на весь класс препаратов.
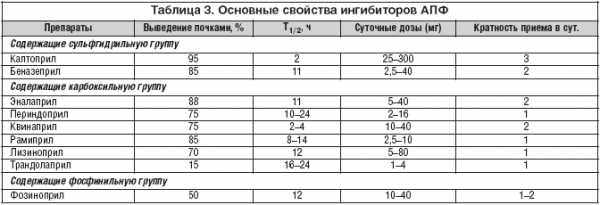
Ингибиторы АПФ различаются по химической структуре (наличию сульфгидрильной группы и др.), особенностям метаболизма (наличие эффекта первого прохождения через печень), путям выведения из организма (только почками или почками и печенью), тканевой специфичности (способности блокировать тканевые РААС) и продолжительности действия (таблица).
Одним из наиболее изученных по широкому спектру показаний иАПФ является рамиприл. Препарат характеризуется высокой липофильностью (превосходит эналаприл практически в 20 раз), тканевой специфичностью (превосходит эналаприл в 3–10 раз в зависимости от ткани), длительным путем полувыведения, что позволяет применять его один раз в сутки. Особенно важно отметить, что доказательная база по применению рамиприла при ССЗ, основанная на результатах рандомизированного клинического исследования (РКИ) с жесткими конечными точками, на сегодняшний день наибольшая среди всех иАПФ.
Антигипертензивная эффективность и безопасность рамиприла оценивались в крупном
открытом исследовании CARE, проводившемся в условиях реальной клинической
практики. В испытание были включены 11 100 больных с АГ I–II степени,
эффективность лечения оценивали у 8261 пациента. Рамиприл назначали в виде
монотерапии в дозе от 2,5 до 10 мг/сут. Через 8 недель лечения было отмечено
достоверное снижение как систолического артериального давления (САД), так и
диастолического (ДАД) в среднем на
13%, причем данный эффект отмечался и в
группе больных с изолированной систолической АГ (ИСАГ). Частота ответа на
лечение (достижение целевого АД ниже 140/90 мм рт.ст., или снижение ДАД>10 мм
рт.ст., или снижение САД>20 мм рт.ст. при ИСАГ) составила в группе
систоло-диастолической АГ более 85%, а в группе ИСАГ — более 70%. Число побочных
явлений в ходе терапии, оцененное у 11 100 больных, было невысоким, частота
кашля не превысила 3% [15].
Многочисленные исследования показали, что иАПФ способны вызывать регресс ГЛЖ, и этот эффект обусловлен не только снижением АД, но и собственно блокадой РААС.
Метаанализы РКИ, в которых изучались возможности различных классов антигипертензивных препаратов вызывать регресс ГЛЖ, также выявили преимущества иАПФ перед другими препаратами [16, 17].
Способность рамиприла уменьшать выраженность ГЛЖ изучали в двойном слепом контролируемом плацебо РКИ HYCAR. В ходе исследования 115 больным с АГ назначали рамиприл в дозах 1,25 и 5 мг/сут либо плацебо. Через 6 месяцев масса миокарда ЛЖ достоверно увеличилась в группе плацебо и достоверно уменьшилась в группах рамиприла. Большее снижение было в группе, где больные получали дозу рамиприла 5 мг/сут [18].
В открытом многоцентровом РКИ со слепой конечной точкой RACE у 193 больных с АГ I–II степени сравнивали влияние рамиприла и атенолола на уровни АД и массу миокарда ЛЖ, оцененную с помощью эхокардиографии. Рамиприл назначали в дозе 2,5 мг/сут, атенолол — 50 мг/сут с последующей возможностью удвоения дозы через 2 недели. Длительность испытания составила 6 месяцев. В результате было отмечено, что и рамиприл, и атенолол достоверно снизили как САД, так и ДАД, причем в равной степени. Однако достоверное уменьшение индекса массы миокарда ЛЖ отмечалось только в группе рамиприла [19].
Важной вехой в изучении возможностей иАПФ в профилактике осложнений у пациентов высокого риска стало крупное РКИ HOPE (Heart Outcome Prevention Evaluation) [20]. Целью исследования была оценка возможности уменьшения заболеваемости и смертности от ССЗ у больных высокого риска под воздействием двух стратегий лечения: иАПФ рамиприлом и витамином Е. В это двойное слепое контролируемое плацебо исследование с факториальным дизайном был включен 9541 пациент с высоким риском сердечно-сосудистых осложнений вследствие возрастных изменений (>55 лет), наличия сердечно-сосудистых заболеваний либо СД в сочетании с заболеванием сосудов или факторами риска (АГ, курение, дислипидемия). Особенностями популяции больных, включенных в исследование, были отсутствие дисфункции ЛЖ и ХСН, невысокое среднее исходное АД (139 и 79 мм рт. ст.), хотя почти у половины из них была АГ, они использовали другие лекарственные препараты, которые могли повлиять на исходы лечения. Так, 76% пациентов получали антитромбоцитарные средства (в основном ацетилсалициловую кислоту), 45% — антагонисты кальция, 40% — β-адреноблокаторы, 30% — гиполипидемические препараты, 15% — диуретики. В ходе исследования частота использования гиполипидемических средств, β-блокаторов и диуретиков повышалась, а антагонистов кальция — снизилась на 5%. Исходно низкие значения АД в исследуемой популяции объясняются именно широким использованием антигипертензивных препаратов. Рамиприл назначали, начиная с дозы 2,5 мг/сут, с последующей титрацией до 10 мг/сут. Максимальную дозу к концу первого года исследования получали 82% пациентов, а к концу исследования (4,5 года) — 65% больных. Первичной конечной точкой исследования были такие компоненты: сердечно-сосудистая смерть, нефатальный ИМ и нефатальный инсульт.
Исследование HOPE было остановлено досрочно (на полгода раньше) в связи с явными преимуществами рамиприла перед витамином Е. Эффективность последнего не отличалась от плацебо. Частота достижения первичной конечной точки в группе рамиприла составила 14% по сравнению с 17,8% в группе плацебо, что соответствует снижению относительного риска на 22% (р<0,001). Относительный риск развития отдельных компонентов первичной конечной точки также снизился: инсульта — на 32%, ИМ — на 20%, сердечно-сосудистой смерти — на 26%. Применение рамиприла обеспечило также достоверное снижение риска развития ХСН (на 23%) и необходимости проведения процедур реваскуляризации (на 15%). Важнейшим результатом исследования НОРЕ стало снижение под влиянием рамиприла общей смертности на 16% (р=0,005), причем кривые Каплана—Майера разошлись уже к первому году и продолжали расходиться до конца исследования.
Результаты исследования не зависели от применения других препаратов и были значимы для различных подгрупп (с СД, АГ, предшествующими поражениями сосудов, мужчин и женщин).
На фоне применения рамиприла частота развития новых случаев СД была на 33% ниже, чем на фоне приема плацебо.
Важным выводом из исследования HOPE стал тот факт, что снижение частоты наступления конечных точек было гораздо более выраженным, чем ожидаемое от снижения АД. То есть протективные эффекты рамиприла явно простирались дальше его антигипертензивного действия. Это позволило предположить, что рамиприл активно воздействовал на процессы ремоделирования сосудов и атерогенеза.
Способность иАПФ тормозить развитие атеросклероза была продемонстрирована на животных [21, 22]. Однако исследования у человека дали противоречивые результаты. Среди всех иАПФ, тестировавшихся на возможность торможения атерогенеза in vivo, наибольшая доказательная база накоплена для рамиприла и периндоприла. В рамках испытания НОРЕ проводилось подисследование SECURE, в котором у 753 пациентов оценивалась способность рамиприла замедлять прогрессирование атеросклероза. На фоне применения высокой дозы рамиприла (10 мг/сут) отмечено замедление на 37%, по сравнению с группой плацебо, прогрессирования атеросклероза в сонной артерии, оценивавшееся по увеличению толщины КИМ. В группе, где применялась низкая доза рамиприла (2,5 мг/сут), толщина КИМ тоже оказалась меньше, чем в группе плацебо, однако различия не были достоверными. Таким образом, антиатерогенный эффект рамиприла можно считать доказанным, но его следует рассматривать как дозозависимый [23].
Антиатерогенное действие рамиприла, выявленное в исследовании SECURE, по-видимому, объясняет во многом эффективность препарата во вторичной профилактике ССЗ, убедительно продемонстрированную в исследовании HOPE.
Продолжением исследования НОРЕ стал проект НОРЕ-ТОО [24], призванный оценить, сохраняется ли во времени способность рамиприла уменьшать число неблагоприятных сердечно-сосудистых событий и новых случаев СД у больных высокого риска. В исследование включили 4 528 пациентов из исследования НОРЕ, которые либо продолжали принимать рамиприл по 10 мг/сут в открытом режиме, либо переводились на рамиприл после приема плацебо. К концу периода наблюдения (2,6 года) было отмечено дальнейшее достоверное снижение относительного риска первичной конечной точки на 17%, ИМ — на 19%, проведения процедур реваскуляризации — на 16%, новых случаев СД — на 34%. Снижение относительного риска неблагоприятных событий отмечалось в различных подгруппах пациентов, включая подгруппы низкого, среднего и высокого риска. Таким образом, было доказано, что протективные эффекты рамиприла не только сохраняются во времени, но их выраженность существенно выше, чем это было показано в исследовании НОРЕ.
Применение рамиприла при ИМ, осложненном развитием сердечной недостаточности, изучалось в крупном двойном слепом контролируемом плацебо рандомизированном исследовании AIRE. В испытании участвовали 2 006 пациентов с подтвержденным ИМ и симптомами сердечной недостаточности. Рамиприл назначался в дозе 5 мг/сут, начиная с 3–10-го дня болезни, с последующей титрацией до 10 мг/сут в течение 2 дней. Первичной конечной точкой была общая смертность, вторичными — неблагоприятные сердечно-сосудистые события (смерть, повторный ИМ, инсульт, прогрессирование сердечной недостаточности). Длительность исследования составила в среднем 15 месяцев (минимум 6 месяцев). В группе рамиприла 59% пациентов были подвергнуты тромболизису, 77% больных принимали АСК, 25% — β-адреноблокаторы, 56% — нитраты. Применение рамиприла обеспечило достоверное снижение общей смертности на 27%, ставшее очевидным уже через 30 дней лечения. Относительный риск наступления вторичных конечных точек достоверно снизился на 19%. При этом кривые выживаемости продолжали расходиться на всем протяжении исследования (до 30 месяцев). Эффект рамиприла сохранялся в различных подгруппах пациентов (мужчины и женщины, больные с АГ и без нее и др.). Частота отмены препарата достоверно не отличалась от частоты отмены плацебо [25].
Продолжением AIRE стало исследование AIREX, целью которого была оценка эффективность долговременной (5 лет) терапии рамиприлом больных ИМ с симптомами сердечной недостаточности. В испытание включили 603 пациента из исследования AIRE, которые продолжали получать либо рамиприл, либо плацебо. Длительность лечения составила в среднем 59 месяцев (минимум 42 месяца). К 59-му месяцу абсолютная величина выживаемости была на 11,4% выше в группе рамиприла, что соответствует достоверному снижению относительного риска смерти на 36%. Среднее увеличение продолжительности жизни в группе рамиприла составило 1,45 года. В результате была вновь подтверждена высокая эффективность препарата в этой группе пациентов и ее сохранение во времени. Был также сделан вывод о том, что «лечение рамиприлом в дозе 5 мг дважды в сутки после острого ИМ, будучи однажды начатым, должно продолжаться неопределенно долго» [26].
Благоприятное влияние рамиприла на выживаемость больных пожилого возраста,
перенесших ИМ, показано в канадском ретроспективном исследовании, в которое
включили
7 512 пациентов старше 65 лет, получавших после выписки из стационара
различные иАПФ [27]. По влиянию на выживаемость в течение первого года рамиприл
достоверно превзошел эналаприл, фозиноприл, каптоприл, квинаприл и лизиноприл.
Интересные сравнительные данные получены при анализе исходов у пациентов, включавшихся в регистр MITRA PLUS. Среди 14 608 пациентов с ИМ с подъемом сегмента ST 4,7% больных получали рамиприл, 39,0% — другие иАПФ, 56,3% — не получали иАПФ. По сравнению с отсутствием терапии иАПФ и, что особенно важно, по сравнению с терапией другими иАПФ лечение рамиприлом обеспечило достоверно более низкие показатели госпитальной летальности и частоты неблагоприятных сердечно-сосудистых и церебральных событий. Однако по частоте развития сердечной недостаточности различий между иАПФ не было [28].
Интересные данные получены в результате двойного слепого контролируемого плацебо исследования DIABHYCAR, в котором оценивалось влияние низких доз рамиприла (1,25 мг/сут) на частоту сердечно-сосудистых и почечных осложнений у 4 912 пациентов с СД 2-го типа и нефропатией, проявлявшейся микроальбуминурией или протеинурией. Применение препарата в столь низкой дозе способствовало некоторому снижению АД и уменьшению экскреции белка с мочой, однако не привело к значимому снижению ни сердечно-сосудистых, ни почечных конечных точек [29]. Этот результат еще раз подчеркивает, что благоприятные эффекты рамиприла реализуются при применении соответствующих доз — 10 мг/сут.
Недавно завершилось крупнейшее сравнительное РКИ ONTARGET, в котором сравнивались возможности профилактики осложнений у больных ССЗ или СД без сердечной недостаточности с помощью трех режимов терапии: иАПФ, БРА и комбинации иАПФ + БРА. В исследование включили 25 620 больных с ишемической болезнью сердца, заболеваниями периферических сосудов, цереброваскулярными заболеваниями или СД. Исходно у 89% пациентов были ССЗ, у 69% — АГ и у 38% — СД. При включении в исследование 80,9% больных принимали антиагреганты, 61,6% — статины, 56,9% — β-адреноблокаторы, 28% — диуретики. Пациентов рандомизировали в три группы: терапия рамиприлом в дозе 10 мг/сут (n=8502), терапия телмисартаном в дозе 80 мг/сут (n=8542) и терапия рамиприлом в комбинации с телмисартаном (n=8502). Продолжительность наблюдения составляла 56 месяцев.
В результате первичной комбинированной конечной точки (смертность от осложнений ССЗ, ИМ, инсульт или госпитализация по поводу сердечной недостаточности) достигли 16,5% пациентов в группе рамиприла, 16,7% — в группе телмисартана и 16,3% — в группе комбинированного лечения. То есть не было отмечено различий между монотерапией рамиприлом, монотерапией телмисартаном и комбинированной терапией обоими препаратами. Частота развития отдельных неблагоприятных исходов, включенных в комбинированный показатель, и общая смертность также достоверно не различались. В то же время ухудшение функции почек чаще отмечалась в группе комбинированной терапии: относительный риск развития ХПН составил 1,33 (р<0,001) [30].
Таким образом, это крупнейшее сравнительное исследование не выявило преимуществ применения БРА перед традиционной терапией иАПФ у больных ССЗ и СД, за исключением несколько меньшей частоты развития ангионевротического отека. Фактически, телмисартан в дозе 80 мг/сут обеспечивал 94% эффективности рамиприла в дозе 10 мг/сут, установленной в исследовании НОРЕ. Эти данные согласуются с результатами РКИ VALIANT, в котором эффект валсартана также не превзошел эффект каптоприла [31].
Все это позволило J. McMurray в редакционной статье New England Journal of Medicine высказать мнение, что поскольку БРА не превосходят традиционные иАПФ по эффективности, но существенно дороже, то область их применения в основном сводится к случаям непереносимости иАПФ из-за кашля [32].
Результаты исследования ONTARGET имеют большое научное значение не только в практическом плане. Они еще раз заставляют обратить внимание на предполагаемую роль брадикинина в обеспечении клинической эффективности препаратов, блокирующих РААС. И хотя иАПФ полностью не блокируют образование Анг II, в отличие от БРА, они уменьшают деградацию брадикинина до неактивных метаболитов.
Следовательно, полученные результаты РКИ с применением рамиприла показывают, что препарат обеспечивает положительное влияние на конечные точки, в том числе общую смертность, при различных ССЗ. По сути дела, это дает возможность обеспечивать органопротекцию на различных этапах сердечно-сосудистого (включая гипертонический каскад) континуума, начиная от воздействия факторов риска (прежде всего, АГ и СД) и заканчивая терминальными органными поражениями (ХСН). При этом следует подчеркнуть важность правильного выбора дозы препарата и необходимость длительного, зачастую пожизненного лечения.
Список литературы находится в редакции.
Впервые статья была опубликована в «Русском медицинском журнале», 17, 2008.
urgent.com.ua
Артериальная гипертензия и сердечно-сосудистый континуум
Авторы: Л.М. Ена
назад к конгрессу
28-29 марта в Киеве прошел XI национальный медицинский конгресс с международным участием «Человек и лекарство – Украина 2018». Насыщенная научная программа конгресса охватила наиболее актуальные вопросы внутренней медицины. В том числе были рассмотрены проблемы терапии артериальной гипертензии (АГ). О менеджменте АГ и профилактике осложнений у лиц пожилого возраста в своем докладе рассказала руководитель отдела клинической и эпидемиологической кардиологии ГУ «Институт геронтологии им. Д. Ф. Чеботарева НАМН Украины» (г. Киев), доктор медицинских наук, профессор Лариса Михайловна Ена.
– АГ по-прежнему занимает лидирующие позиции среди факторов, влияющих на повышение уровня смертности во всем мире. АГ – наиболее значимый корригируемый фактор риска как в развитых, так и в развивающихся странах. Известно более десятка осложнений АГ, среди которых на первый план выходит формирование хронической сердечной недостаточности (ХСН), мозговых инсультов (МИ), ишемической болезни сердца (ИБС), фибрилляции предсердий (ФП) и др.
! Данные статистики показывают, что нормализация только лишь артериального давления (АД) позволяет предупредить столько же МИ, сколько отказ от курения и алкоголя, коррекция уровня холестерина и ФП вместе взятые.
Что касается работы с людьми пожилого и старческого возраста, то некоторые факторы риска у них отходят на второй план (например, избыточная масса тела). В этой возрастной группе собственно возраст и АГ – наиболее значимые факторы сердечно-сосудистого риска как у мужчин, так и у женщин.
В 2017 году Американская ассоциация сердца (American Heart Association, АНА), Американская коллегия кардиологов (American College of Cardiology, АСС) пересмотрели классификационные критерии АГ и опубликовали обновленную классификацию (табл.).
В связи с пересмотром классификации в США ожидают прирост числа больных АГ на 43%. Для взрослых с подтвержденной АГ и отсутствием маркеров повышенного сердечно-сосудистого риска целевое АД составляет 130-80 мм рт. ст. В новых рекомендациях подчеркивается, что лицам с повышенным АД (120-129 мм рт. ст.) следует рекомендовать нефармакологические методы лечения и модификацию образа жизни. Лицам с АГ 1 степени без факторов риска также проводят немедикаментозное лечение, а при наличии факторов риска – назначают медикаментозную антигипертензивную терапию. Пациентов с АГ 2 степени (САД 140-159 мм рт. ст. или ДАД 90-99 мм рт. ст.) в новых рекомендациях предложено лечить комбинацией антигипертензивных препаратов уже на старте лечения.
Немедикаментозная терапия имеет большое значение и не случайно отмечена во всех ключевых мировых рекомендациях по лечению АГ. Этот метод лечения эффективен на всех патогенетических этапах сердечно-сосудистого континуума у пациентов всех возрастов в терапии и профилактике заболеваний гипертензивного, атеросклеротического и метаболического генеза – он уменьшает лекарственную нагрузку и снижает риск развития побочных реакций. Немаловажно, что немедикаментозное лечение финансово не обременительно, однако как пациенты, так и врачи относятся к нему скептически и часто игнорируют. Вместе с тем в исследовании ТONЕ было показано, что снижение потребления поваренной соли и регулярная физическая активность у пациентов старше 65 лет с исходным АД 160-180/95-110 мм рт. ст. может приводить к снижению дозы антигипертензивных препаратов (у 50% исследуемых) вплоть до полного отказа от медикаментозной терапии (у 40% пациентов). Основной задачей врача остается формирование у пациента мотивации для изменения привычного образа жизни.
Хорошо известно, что адекватная медикаментозная терапия АГ положительно влияет на исходы заболевания: снижает риск формирования ХСН, МИ, коронарных событий и сердечно-сосудистой смертности. Целевым уровнем АД, к которому следует стремиться, является 130/80 мм рт. ст. и менее. Однако у коморбидных пациентов с низкой ожидаемой продолжительностью жизни, особенно у склонных к падениям или требующих постороннего ухода, должны быть рассмотрены индивидуальные целевые уровни АД.
Каковы общие подходы к терапии АГ у лиц пожилого и старческого возраста?
! Основное правило – старт лечения с низких доз и постепенное снижение АД. Как показано в клинических исследованиях, начало антигипертензивной терапии у пожилых лиц ассоциируется с повышением риска переломов. Агрессивная антигипертензивная терапия в начале лечения может вызывать головокружение и падения у пожилых пациентов.
Режим приема препаратов также имеет значение. R. C. Hermida и соавт. было проведено исследование MAPEC (Monitorizacion Ambulatoria para Prediccion de Eventos Cardiovasculares), в которое было включено 2156 пациентов. Больные с резистентной АГ были рандомизированы в две группы: в одной производилась замена одного из гипотензивных препаратов на новый, при этом утреннее время приема всех препаратов сохранялось, в другой группе время приема одного из гипотензивных препаратов переносилось на вечер.
В результате лечения было продемонстрировано снижение риска цереброваскулярных событий, ХСН, тромбозов, сердечно-сосудистой и общей смертности (на 63%) на фоне приема гипотензивных препаратов в вечернее время. Также у пациентов с недостаточным ночным снижением АД предпочтительным является назначение гипотензивных препаратов в вечернее время. Такой подход приводит к более значительному снижению АД во время ночного сна и возвращению суточного ритма АД к нормальным значениям.
На сегодняшний день не вызывает сомнений необходимость в комбинированном лечении АГ. Согласно последним рекомендациям АНА/АСС (2017), у пациентов с АД ≥140/90 мм рт. ст. при наличии факторов сердечно-сосудистого риска уже на старте лечения необходимо рассматривать назначение комбинированной лекарственной терапии. У 15-20% пациентов возникает необходимость в тройной антигипертензивной терапии.
Хорошо известно, что первую линию антигипертензивных препаратов составляют диуретики, бета-адреноблокаторы (БАБ), антагонисты кальциевых каналов (АКК) и блокаторы ренин-ангиотензин-альдостероновой системы (РААС) – ингибиторы ангиотензинпревращающего фермента (ИАПФ) и блокаторы рецепторов ангиотензина (БРА). Однако все ли эти группы в равной степени хороши для лечения АГ у пожилых пациентов? Во многих национальных рекомендациях БАБ исключены из первой линии лечения АГ. В Великобритании на второй план отошли диуретики, что связано с высокими темпами роста распространенности сахарного диабета. Поэтому британские рекомендации по терапии АГ у лиц старше 65 лет указывают на АКК как наиболее приемлемый стартовый препарат, к которому впоследствии может быть добавлен блокатор РААС, а при необходимости – тиазидный диуретик. Если достичь целевых цифр АД не удается при тройной терапии, четвертым препаратом следует добавить спиронолактон. В исследовании PATHWAY‑2 спиронолактон в качестве 4-го препарата показал наибольшее снижение АД у лиц с резистентной АГ (Williams B. et al., 2015). Канадская ассоциация по борьбе с АГ также указывает на целесообразность использования блокаторов РААС, тиазидных диуретиков и длительно действующих АКК у лиц пожилого и старческого возраста.
Не случайно АКК фигурируют практически во всех клинических руководствах по лечению АГ, ведь именно эти препараты имеют достоверное положительное влияние на снижение риска МИ – одного из наиболее грозных осложнений в этой возрастной группе.
В Украине ежегодно регистрируется более 100 тыс. случаев МИ. При этом только 20% инсультов являются манифестными, а 80% протекают скрыто. АКК способствуют снижению риска инсульта. Проведенный метаанализ 13 исследований, который включал суммарно 104 793 пациентов, показал достоверное уменьшение риска МИ на фоне терапии АКК на 14% по сравнению с ИАПФ (Verdecchia P. et al., 2005). Кроме того, доля пациентов, достигающих целевого АД на АКК, была выше (27%) по сравнению с диуретиками (23%), ИАПФ (18%) и БАБ (17%) (Morgan et al., 2001). АКК обычно хорошо переносятся больными и не имеют абсолютных противопоказаний к назначению.
Вместе с тем у 20-30% пациентов возможно развитие нежелательных побочных эффектов в виде периферических отеков, которые пугают пациентов и в ряде случаев побуждают их отказываться от дальнейшего лечения. Врачу также бывает сложно отличить отеки на фоне приема АКК от первых признаков ХСН. Поэтому для уменьшения риска развития периферических отеков рационально использовать левовращающий изомер амлодипина – S-амлодипин (Семлопин®, Кусум Фарм). Структура активного вещества S-изомера соответствует структуре рецептора и подходит к нему как ключ к замку. Таким образом, энантиомер сохраняет все эффекты амлодипина, но выраженность побочных реакций имеет значительно меньшую.
Необходимость в назначении комбинированной терапии возникает и у пациентов с АГ и дислипидемией, такое сочетание встречается у 75% пациентов с АГ. Аторвастатин (Етсет®, Кусум Фарм) – один из наиболее изученных статинов, который может использоваться для снижения уровня холестерина в крови. Вместе с тем необходимость принимать несколько таблеток значительно снижает приверженность пациентов к назначенному лечению. Так, в ретроспективном исследовании, длительностью 17 мес, пациенты принимали амлодипин и аторвастатин в двух таблетках или в форме фиксированной комбинации в одной таблетке. Приверженность к лечению была гораздо выше (56,5%) у пациентов, принимавших фиксированную комбинацию, чем у тех, кто принимал две разные таблетки (21,4%). Что крайне важно, более высокая приверженность терапии была ассоциирована с лучшей выживаемостью пациентов со снижением смертности в группе фиксированной комбинации. В Украине также зарегистрирована фиксированная комбинация s-амлодипина и аторвастатина (Амлостат® Кусум Фарм). Данный препарат может широко использоваться для лечения пациентов с АГ и дислипидемией.
В последние годы возрастает число пациентов, у которых сочетаются АГ и метаболический синдром. При лечении таких больных следует отказаться от БАБ и диуретиков, которые могут способствовать увеличению массы тела, индуцировать инсулинорезистентность и развитие сахарного диабета, нарушать липидный спектр крови, активировать РААС и провоцировать оксидативный стресс. Этой категории пациентов могут быть назначены сартаны. Согласно рекомендациям Европейского общества кардиологов по лечению АГ (2013), БРА показаны лицам с хронической болезнью почек и альбуминурией, метаболическим синдромом, сахарным диабетом, гипертрофией левого желудочка. Этот список дополнен в американском протоколе (ACC/AHA 2017) ФП и ХСН с сохраненной фракцией выброса.
Как видно, для БРА имеется достаточно широкий спектр показаний. Однако класс сартанов также неоднороден, среди них есть две молекулы, которые отличаются по своим фармакологическим свойствам от других БРА. Так, лозартан (Клосарт®, Кусум Фарм) снижает уровень мочевой кислоты и является препаратом выбора у пациентов с АГ, страдающих подагрой. Другая молекула с необычными свойствами – телмисартан (Хипотел®, Кусум Фарм). Телмисартан проявляет антагонизм к рецепторам ангиотензина ІІ 1 субтипа, а также активирует PPAR-γ-рецепторы. Благодаря уникальному влиянию на PPAR-γ-рецепторы телмисартан улучшает показатели углеводного обмена и уменьшает инсулинорезистентность. На фоне лечения телмисартаном снижается риск возникновения новых случаев сахарного диабета (на 16%), индекс инсулинорезистентности (на 25%), уровень инсулина плазмы (на 11%), гликозилированного гемоглобина (на 8%) (Kurtz K. W. et al., 2009). Кроме того, с влиянием на PPAR-γ-рецепторы связано также свойство телмисартана улучшать показатели липидного обмена: снижать общий холестерин (на 15%), липопротеины низкой плотности (на 11%), триглицериды (на 33%) (Derosa et al., 2004). Эти эффекты делают телмисартан препаратом выбора среди БРА для лечения АГ на фоне сахарного диабета 2 типа и метаболического синдрома.
Одна из наиболее частых клинических ситуаций в практике – сочетание АГ и ИБС. Как подобрать терапию для таких больных?
Все препараты, которые сегодня применяют для лечения этой категории пациентов, имеют доказанное влияние на прогноз (антиагреганты, статины, ингибиторы РААС) или на регресс симптомов (БАБ, АКК, нитраты, ивабрадин, никорандил, ранолазин, триметазидин).
Для вторичной профилактики ИБС используют комбинацию антигипертензивных средств, статинов, антиагрегантов. Среди последних наибольшей доказательной базой обладают кишечнорастворимые формы ацетилсалициловой кислоты (Лоспирин®, Кусум Фарм) и клопидогрель (Платогрил®, Кусум Фарм). В группе антигипертензивных средств препаратами первой линии для лечения АГ и ИБС являются БАБ и АКК. Однако при вазоспастической стенокардии на фоне ангиографически интактных коронарных артерий БАБ не рекомендуются. Таким пациентам для профилактики ангиозных приступов назначают АКК, а для купирования приступов – нитраты.
В тех случаях, когда спазм коронарных артерий имеет место на фоне стенозирующего атеросклероза, желательно назначать малые дозы БАБ в комбинации с АКК. К сожалению, прогностическое действие ацетилсалициловой кислоты, статинов, ИАПФ при вазоспастической стенокардии на фоне ангиографически интактных коронарных артерий на сегодня не изучено. У лиц с микрососудистой стенокардией для предупреждения болевых приступов в первую очередь назначаются БАБ, а при недостаточной эффективности используют АКК и нитраты длительного действия. В случаях сохраняющейся стенокардии назначают ИАПФ и никорандил.
В заключение необходимо сказать о лечении пациентов с АГ и ХСН. В соответствии с обновленными рекомендациями АСС/АНА (2017) у взрослых с ХСН с сохраненной фракцией выброса и клинической симптоматикой объемной перегрузки следует назначать диуретики для контроля АГ. После ликвидации отечного синдрома назначаются ИАПФ/БРА и БАБ с титрацией доз для достижения САД менее 130 мм рт. ст.
Таким образом, старение населения обусловлено увеличением средней продолжительности жизни на фоне достижений медицинской науки в лечении сердечно-сосудистой патологии. По прогнозам, до 2050 года количество лиц старше 80 лет возрастет на 800%. Терапия сердечно-сосудистых заболеваний и в первую очередь АГ у лиц пожилого и старческого возраста требует дифференцированного подхода. При этом основной целью лечения остается достижение целевых цифр АД.
Подготовила Мария Маковецкая
Также читайте:
Медична газета «Здоров’я України 21 сторіччя» № 8 (429), квітень 2018 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
www.health-ua.com
Дисбиоз пищеварительного тракта как фактор риска в сердечно-сосудистом континууме: патофизиология и лечение uMEDp
В статье приведены данные научной медицинской литературы о связи состояния микробиоты полости рта и желудочно-кишечного тракта с атерогенной дислипидемией и ее роли в развитии сердечно-сосудистых осложнений. Представлены результаты эпидемиологических исследований об уровне ассоциированности воспалительных заболеваний полости рта с атерогенными заболеваниями сердечно-сосудистой системы. Рассмотрены механизмы влияния микрофлоры пародонта на формирование нестабильных атероматозных бляшек в сосудистом русле с возможными клиническими проявлениями. Приведены собственные данные анализа 1000 амбулаторных карт пациентов с пародонтитом различной степени выраженности; показана взаимосвязь тяжести пародонтита с нарушениями углеводного и липидного обмена, активностью системного воспаления и окислительного стресса.
Рис. 1. Континуум сердечно-сосудистых заболеваний при метаболическом синдроме
Рис. 2. Взаимосвязь микробиоценоза полости рта и кишечника с метаболическими изменениями при метаболическом синдроме
Рис. 3. Схема формирования атеромы
Рис. 4. Формирование нестабильной бляшки и острого коронарного синдрома (ОКС)
Таблица 1. Состояние углеводно-липидного обмена, провоспалительного, окислительного и бактериального статусов до и после 12-недельной терапии
Таблица 2. Динамика состояния пародонта до и после лечения (24 недели)
Современные достижения в области экспериментальной и клинической медицины на клеточном и молекулярном уровне позволили переосмыслить патофизиологию различных заболеваний внутренних органов и связь между ними (полиморбидность). Сформулированное в 1991 г. V. Dzau и E. Braunwald понятие единого сердечно-сосудистого континуума прочно закрепилось в научно-медицинской практике. Применительно к практической медицине континуум (от англ. continuous – постоянный, непрерывный) подразумевает непрерывную последовательность этапов развития заболевания – от факторов риска (ФР) до летального исхода (рис. 1).В современных рекомендациях по диагностике и лечению различных сердечно-сосудистых заболеваний (ССЗ) особое место занимают выявление и коррекция факторов риска развития заболеваний сердечно-сосудистой системы (ССС). Эти ФР во многом универсальны, то есть характерны для большинства ССЗ. В настоящее время ФР подразделяют:
- на немодифицируемые: возраст, пол, расовая принадлежность, отягощенный семейный анамнез;
- модифицируемые: частота сердечных сокращений, ожирение, состояние микробиоты пищеварительного тракта, уровень холестерина, нарушение толерантности к глюкозе (НТГ) или сахарный диабет (СД) 2 типа, высокий уровень артериального давления (АД), курение, дефицит магния;
- «мягкие»: агрегационное состояние плазмы крови, низкий уровень липопротеинов высокой плотности (ЛПВП) и альфа-липопротеина, высокий уровень С-реактивного белка (маркер системного воспаления), воспалительных цитокинов – тканевого активатора плазминогена 1, фактора некроза опухоли альфа (ФНО-альфа), интерлейкинов (ИЛ) 1–10 и др.
Между тем в представленных публикациях не определены четкие механизмы взаимосвязи биоценозов различных отделов ЖКТ. Сочетание различных факторов риска развития хронических воспалительных заболеваний и изменения микрофлоры полости рта могут являться запускающими и прогностически неблагоприятными факторами в отношении качества жизни пациента. Неблагоприятные взаимные влияния биоценозов различных отделов ЖКТ редко учитываются в клинической практике, что может быть причиной низкой эффективности профилактических и лечебных мероприятий в отношении рецидивов и прогрессирования заболеваний.
Материал и методы исследования
Для изучения факторов риска в сердечно-сосудистом континууме, оценки влияния микрофлоры пищеварительного тракта на липидно-углеводный обмен и клинический статус нами был проведен ретроспективный анализ 1000 амбулаторных карт пациентов с пародонтитом различной степени тяжести, с распределением по группам в зависимости от индекса массы тела (ИМТ). ИМТ > 25 кг/м2 как фактор риска был выявлен в 57,2% случаев. В группе пациентов с ИМТ ≥ 35 кг/м2 (16%) генерализованное воспаление пародонта в 74,4% случаев имело тяжелую степень, в 23,6% носило агрессивный характер. В то же время в группе пациентов с ИМТ ≤ 25 кг/м2 генерализованное воспаление пародонта тяжелой степени отмечалось только в 54,9%. Это свидетельствовало о том, что избыточная масса тела – фактор риска дисбиоза пищеварительного тракта.
Исследование в динамике
Для объективизации роли пародонтита и состояния микрофлоры кишечника как факторов риска сердечно-сосудистых заболеваний нами было отобрано 20 пациентов с ИМТ 2 в контрольную группу и 73 пациентов с ИМТ ≥ 25 кг/м2 – в основную. Всем пациентам в динамике (до и после 12-недельного лечения) помимо исследования гликемического и липидного спектров крови, окислительного статуса проводили оценку биоптатов полости рта и кишечника (кал) с помощью полимеразной цепной реакции (ПЦР) в режиме реального времени. Пациентов – участников исследования обучали правилам гигиены полости рта, стандартной профессиональной гигиены с устранением местных факторов, способствующих скоплению и активации микробного статуса. Для объективной оценки клинического состояния пародонта определяли гигиенические индексы (Грина – Вермильона (Green – Vermillion) (1964), Силнеса – Лоэ (Silness – Loe) (1962)) и индексы кровоточивости (Мюллемана (Muhlemann) в модификации Коуэлла (Cowell) (1975)). Кроме того, регистрировали степень подвижности зубов по шкале Миллера (Miller) в модификации Флезара (Flezar) и глубину пародонтальных карманов. Микробный статус полости рта оценивали с помощью ПЦР в режиме реального времени [17]. К стандартной программе лечения ССЗ (бета-блокаторы, ингибиторы ангиотензинпревращающего фермента (иАПФ), фенофибраты) и пародонтита у пациентов с ИМТ ≥ 25 кг/м2 для компенсации дисбиоза и купирования окислительного стресса (системное воспаление) были добавлены эубиотик Про-Симбиофлор (10 капель три раза в день), пробиотик Симбиолакт Комп. (один пакетик в сутки) и комплексный катализатор Убихинон композитум (2 мл внутримышечно два раза в неделю). Результаты исследования до и после лечения представлены в табл. 1. Данные в отношении четырех пациентов из основной группы были исключены в связи с несоблюдением режима лечения. До лечения имелись статистически достоверные специфические межгрупповые различия в параметрах углеводно-липидного обмена и биоценозе (видовая и бактериальная масса) полости рта и нижних отделов кишечника. Выраженность изменений со стороны углеводно-липидного обмена, статуса системного воспаления (С-реактивный пептид), активности окислительного стресса и биоценоза полости рта и кишечника находится в прямой зависимости от ИМТ. В основной группе относительно низкий уровень тощаковой гликемии 5,2 ± 0,1 ммоль/л на фоне инсулинорезистентности (в этой группе коэффициент инсулинорезистентности HOMA-IR превышал аналогичный показатель в контрольной группе в 5,8 раза, p Интегральный показатель атерогенности плазмы крови (ИА) в группе пациентов с признаками метаболического синдрома (3,55 ± 0,3) превышал аналогичный показатель в контрольной группе (2,1 ± 0,15) в 1,7 раза (p Бактериальная масса флоры пищеварительного тракта пациентов основной группы (ИМТ ≥ 25 кг/м2) суммарно составила в полости рта 108,4 КОЕ/мл, в прямой кишке 1017,4 КОЕ/мл и статистически значимо (p 2): в полости рта – 104,5 КОЕ/мл, в прямой кишке – 1014,9 КОЕ/мл. Среди изучаемых микроорганизмов лидером роста по мере развития тяжести пародонтита являлись Porphiromonas gingivalis, количественное содержание которых при хроническом генерализованном пародонтите (ХГП) достигало 4 × 106 КОЕ/мл. Состояние и качественный состав микрофлоры полости рта в исследуемой группе находились в прямой зависимости от выраженности (агрессивная форма) воспалительных изменений пародонта с появлением уреазопродуцирующих бактерий (Klebsiella) и грибов (Candida spp.) – до 2 × 102 КОЕ/мл.Более выраженные провоспалительные и окислительные процессы в основной группе сопровождались в 100% случаев ХГП различной степени тяжести. В контрольной группе аналогичная патология регистрировалась в 73,3% случаев – по количественному составу с более легкой степенью тяжести (табл. 2).
Результаты
В отличие от людей со здоровым пародонтом у пациентов с пародонтитом определяется более высокий уровень медиаторов системного воспаления в сыворотке крови, включая С-реактивный белок.
Заключение
Закономерности, выявленные в ходе нашего исследования, позволяют сформулировать концепцию рекуррентно-реверсивного соотношения биоценозов различных отделов пищеварительного тракта, определить их влияние на липидно-углеводный обмен у пациентов с ИМТ ≥ 25 кг/м2 как одного из основных звеньев сердечно-сосудистого континуума в патогенезе атеросклероза, НТГ и сердечно-сосудистых осложнений. Патогенетически обоснованное включение в комплексную программу лечения на ранних этапах развития метаболического синдрома микробиологических препаратов (корректоры микрофлоры ЖКТ) и препарата с комплексным действием (Убихинон композитум) позволяет восстановить микрофлору пищеварительного тракта. В свою очередь нормализация микрофлоры пищеварительного тракта способствует восстановлению общего и регионального иммунного статуса, улучшению репаративных процессов в пародонте, купированию окислительных процессов, восстановлению чувствительности инсулиновых рецепторов, нормализации липидно-углеводного спектра крови.
umedp.ru