Рак желудка — симптомы и признаки
Содержание статьи:
Рак желудка – злокачественная опухоль, формирующаяся из клеток внутреннего слизистого слоя желудочной стенки. По мере увеличения она прорастает в средний мышечный и внешний серозный слои, соседние и отдаленные органы.Чаще возникает у мужчин. Средний возраст больных – 38 лет.
Патология занимает 3 место в мире по уровню смертности от онкозаболеваний: ежегодно от нее умирает 800 000 человек.По статистике выздоравливают 30% пациентов с раком желудка.Метастазы выявляют у 80-90% больных. При ранней диагностике 6-месячная выживаемость – 65%, при поздней – 15%. На практике чаще выявляется на 4-й стадии. У 1 из 50 больных с диспепсией диагностируют рак желудка.
Причины рака желудка и факторы риска
На вероятность возникновения заболевания влияют:
- наличие близких родственников с раком желудка в анамнезе;
- полипы желудка или аденоматозный полипоз;
- язвенная болезнь и хронический гастрит;
- повышенный уровень Helicobacter Pilory;
- кишечная метаплазия – замещение желудочного эпителия кишечным;
- неправильное питание – большое количество соленой, острой и копченой пищи, животных жиров, низкое содержание овощей и фруктов;
- недостаток витамина С;
- употребление низкокачественных и просроченных продуктов;
- курение и избыточное потребление алкоголя;
- возраст старше 60 лет, особенно у мужчин;
- срок 5-10 лет после операции на желудке.

Наличие факторов риска не означает, что вы точно заболеете. Отсутствие факторов риска не означает, что вы точно не заболеете.
Виды рака желудка
Аденокарцинома развивается из клеток слизистой желудка в любой части органа. По строению бывает тубулярной, папиллярной и муцинозной.
Стадии
По степени злокачественности и распространенности процесса различают стадии заболевания:
- 0 – единичные атипичные клетки обнаруживают только в верхнем слое слизистой желудка;
- I – клетки опухоли поражают слизистый и подслизистый слои желудочной стенки.
I стадия делится на подстадии:
- IА – поражен только подслизистый слой;
- IВ – поражен также мышечный слой желудка, выявлены метастазы в 1-2 близлежащих лимфоузлах.

IIстадия делится на подстадии:
- IIA – опухоль распространяется:
- на подслизистый или мышечный слои желудочной стенки, в 1-2 близлежащих лимфоузлах выявлены метастазы;
- подслизистый слой с метастазами в 3-6 близлежащих лимфоузлах.
- IIB – опухоль распространяется:
- на внешний слой желудочной стенки;
- субсерозный слой ткани под внешней оболочкой с метастазами в 1-2 близлежащих лимфоузлах;
- мышечный слой желудочной стенки с метастазами в 3-6 близлежащих лимфоузлах;
- подслизистый слой желудочной стенки с метастазами в 7 или более близлежащих лимфоузлах.
III стадия делится на подстадии:
- IIIA – опухоль распространяется:
- на внешний слой желудочной стенки с метастазами в1-2 близлежащих лимфоузлах;
- серозный слой ткани под внешней оболочкой с метастазами в 3-6 близлежащих лимфоузлах;
- мышечный слой желудочной стенки с метастазами в 7 или более близлежащих лимфоузлах.

- IIIB – опухоль прорастает:
- в близлежащие органы – селезенку, печень, диафрагму, почку, надпочечник, поджелудочную железу, поперечно-ободочную или тонкую кишку с метастазами в 1-2 близлежащих лимфоузла;
- во внешний слой желудочной стенки с метастазамив 3-6 близлежащих лимфоузлах.
- IIIC– опухоль прорастает:
- в близлежащие органы – селезенку, печень, диафрагму, почку, надпочечник, поджелудочную железу, поперечно-ободочную или тонкую кишку с метастазами в 3 и более лимфоузла;
- во внешний слой желудочной стенки с метастазами в 7 и более близлежащих лимфоузла.
- IV– опухоль за счет метастазирования распространяется в отдаленные органы и ткани – печень, яичники, надключичные лимфоузлы и т.п.
Основные симптомы
Первые признаки заболевания – дискомфорт и боль в области желудка, диспепсия. Кроме них на ранних стадиях возникают Источник:
Бессимптомное течение рака желудка.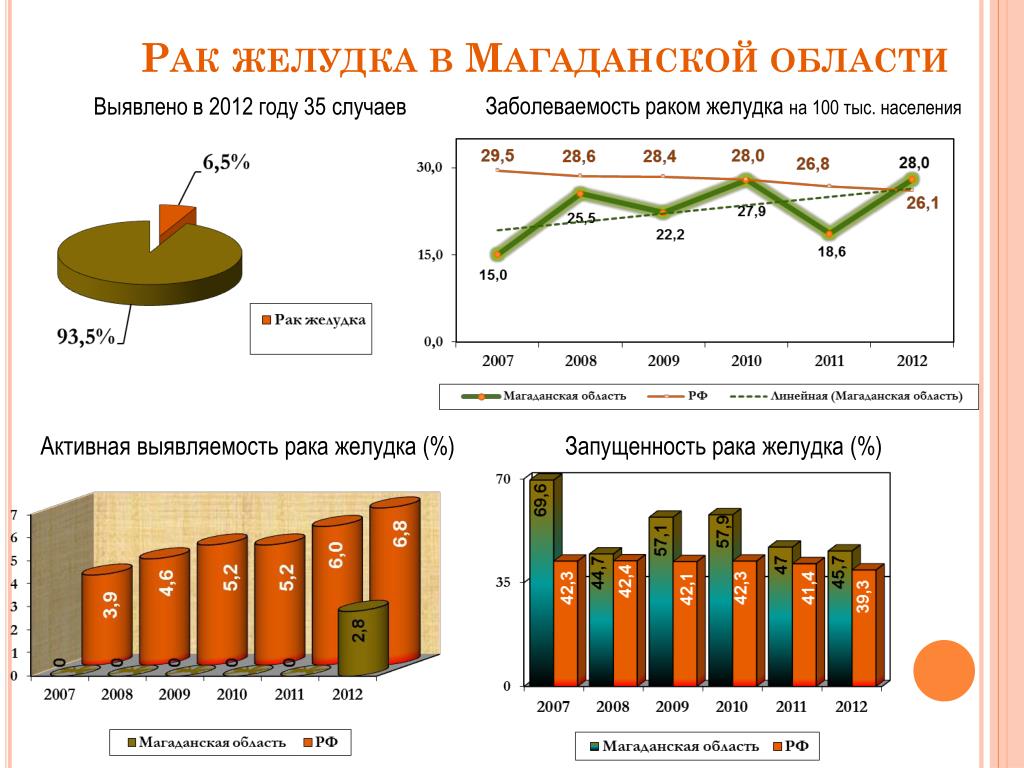 Шут.С.А., Платошкин Э.Н., Дорогокупец А.Ю.: Проблемы здоровья и экологии, 2019 г.:
Шут.С.А., Платошкин Э.Н., Дорогокупец А.Ю.: Проблемы здоровья и экологии, 2019 г.:
- изжога;
- тошнота;
- снижение аппетита;
- ощущение вздутия после еды;
- дискомфорт в верней части живота;
- повышенная утомляемость, слабость.
На более поздних стадиях симптомы рака желудка:
- рвота;
- кал черного цвета;
- отрыжка;
- чувство переполненного желудка;
- боли в животе;
- желтуха;
- асцит – увеличение объема живота из-за скопления жидкости;
- потеря веса.
Без лечения возможны осложнения рака желудка – кровотечения, перфорация опухоли, желудочная непроходимость, флегмона.
Диагностика
Чтобы поставить диагноз, проводят эндоскопическое исследование желудка ЭГДС. Через рот и пищевод вводят зонд с миниатюрной видеокамерой и источником света. Процедура позволяет выявлять местоположение опухоли.
Для определения точных размеров новообразования проводят КТ, иногда – с контрастным усилением. Для оценки распространенности процессов, состояния лимфоузлов и выявления метастазов назначают УЗИ. Для уточнения специфических характеристик опухоли делают рентгенографию с препаратами бария.
Уточняющая диагностика помогает выбирать наиболее эффективную лечебную тактику. Так, исследование крови на мутацию гена HER2/neuпомогает подобрать наиболее эффективныепротивоопухолевыепрепараты.Кроме этого, назначают:
- анализы на онкомаркеры РЭА и СА-19,9;
- внутрижелудочное УЗИ;
- позитронно-эмиссионную томографию (ПЭТ).
Методы лечения
Основной метод лечения рака желудка – хирургический. Лучевую и химиотерапию проводят дополнительно для повышения эффективности лечения Источник:
Комбинированное лечение рака желудка. Афанасьев С.Г., Тузиков С.А., Давыдов И.М.: Сибирский онкологический журнал, 2015 г.. В качестве монометодик при раке желудка они малоэффективны и назначаются, если операция противопоказана.
Афанасьев С.Г., Тузиков С.А., Давыдов И.М.: Сибирский онкологический журнал, 2015 г.. В качестве монометодик при раке желудка они малоэффективны и назначаются, если операция противопоказана.
Хирургическое лечение
Хирургическое лечение рака желудка. Рахов С.Б.:Вестник Казахского Национального медицинского университета, 2012 г..
Гастрэктомия – удаление всего желудка с опухолью, окружающей жировой клетчаткой и регионарными лимфоузлами. В ходе вмешательство возможна частичная либо полная резекция пораженных соседних органов. После иссечения формируют искусственное соустье – аностомоз – между пищеводом и тонким кишечником.
Резекция желудка дистальная либо проксимальная – удаление пораженной верхней либо нижней части с клетчаткой и регионарными лимфоузлами.
Эндоскопическая резекция желудочной слизистой – удаление пораженного участка слизистой через проколы без разрезов. Эффективна на начальной стадии онкопроцесса, а также у пожилых и ослабленных больных, которым из-за состояния противопоказана полноценная операция.
Паллиативное стентирование – установка специального стента, обеспечивающего просвет желудка. Показано больным на поздних стадиях для обеспечения беспрепятственного пищеварения.
Гастроэнтероаностомоз – паллиативная хирургическая помощь для восстановления просвета выходного отверстия из желудка в кишечник.
Химиотерапия
Лечение с помощью лекарственных препаратов, разрушающих раковые клетки либо блокирующих их деление. Введение одновременно нескольких таких медикаментов – полихимиотерапия – позволяет снизить дозировки каждого их них и негативные побочные эффекты лечения, повысить его эффективность. Назначается перед хирургической операцией либо после нее.
Назначается перед хирургической операцией либо после нее.
Лучевая терапия
Использование рентгеновских лучей для разрушения клеток опухоли или замедления ее роста. Показано до или после операции, при метастазах в лимфоузлах, на поздних стадиях и при невозможностихирургическоголечения. Для точной фокусировки (чтобы убивать опухоль, не воздействуя на близлежащие ткани)используют КТ-разметку.
Прогноз заболевания
Прогноз зависит от стадии онкопроцесса – насколько обширно и глубоко поражена желудочная стенка, поражены ли лимфоузлы и есть ли метастазы, а также от возраста и общего состояния здоровья пациента. При ранней диагностике и качественном лечении шанс на полное выздоровление значительно выше.
Пятилетняя выживаемость:
- у пациентов с 1-й стадией – 80%, из них 70% полностью выздоравливают;
- у больных со 2-й стадией – 56%, из них полностью выздоравливает 50%;
- у пациентов с 3-й стадией – 38%, из них полностью выздоравливает 25%;
- у больных с 4-й стадией – 5%, из них полностью выздоравливают 1,4%.

Если пациент прожил 5 лет после окончания лечения рака желудка, дальнейший прогноз улучшается. Риск рецидива зависит от стадии и обширности метастаз. Он выше через 2 года и снижается после 5-летней ремиссии.
Профилактика
- Сбалансированный рацион с преобладанием фруктов и овощей.
- Отказ от курения и злоупотребления алкоголем.
- Современное лечение болезней желудка – в частности HelicobacterPilory – с последующим врачебным наблюдением.
Важны также регулярные профилактические осмотры и скриниг людей с генетической и наследственной предрасположенностью к заболеванию. Чтобы проконсультироваться у профильного специалиста в СПб, заполните форму онлайн.
Источники:
- Бессимптомное течение рака желудка. Шут.С.А., Платошкин Э.Н., Дорогокупец А.Ю.: Проблемы здоровья и экологии, 2019 г.
- Комбинированное лечение рака желудка. Афанасьев С.Г., Тузиков С.А., Давыдов И.М.: Сибирский онкологический журнал, 2015 г.

- Хирургическое лечение рака желудка. Рахов С.Б.:Вестник Казахского Национального медицинского университета, 2012 г.
- Иммунотерапия рака желудка. Мансорунов Д.Ж., Алимов А.А., Апанович Н.В., Кузеванова А.Ю., Богуш Т.А., Стилиди И.С., Карпухин А.В.: Российский биотерапевтический журнал, 2019 г.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Читайте также
что нам ожидать от новых методов лечения?
Новости онкологии
08.04.2019
Рак желудка: что нам ожидать от новых методов лечения?
Рак пищевода и рак желудка – это агрессивные онкологические заболевания, в лечении которых наступает новая эра. Роль некоторых молекулярных механизмов, как, например, факторов VEGF, EGFR, рецепторов фактора роста фибробластов, PIK3CA и PARP-1, были изучены, и в ближайшем будущем ожидается разработка новых препаратов на основе этих сигнальных путей. Согласно отчету проекта «Атлас ракового генома» в 80% случаев опухолей, вызванных вирусом Эпштейна-Барр (EBV), и в 42% случаев опухолей, ассоциированных с микросателлитной нестабильностью, имеются мутации в гене PIK3CA. Это дает возможность предположить, что данный молекулярный механизм можно использовать для разработки нового вида системной терапии рака желудка. Следует отметить, что при раке желудка обнаруживается повышенная экспрессия PARP-1, что может свидетельствовать о более поздней стадии заболевания и о более неблагоприятном прогнозе. Кроме того, при раке желудка наблюдаются такие явления, как экспрессия PD-L1, высокая микросателлитная нестабильность и дефект репарации неспаренных оснований. Это позволяет думать, что у подобных пациентов иммунотерапия может также играть важную роль. В данной статье обсуждаются основные направления возможных новых видов лечения для пациентов с раком пищевода и раком желудка, которые могут появиться в ближайшем будущем.
Согласно отчету проекта «Атлас ракового генома» в 80% случаев опухолей, вызванных вирусом Эпштейна-Барр (EBV), и в 42% случаев опухолей, ассоциированных с микросателлитной нестабильностью, имеются мутации в гене PIK3CA. Это дает возможность предположить, что данный молекулярный механизм можно использовать для разработки нового вида системной терапии рака желудка. Следует отметить, что при раке желудка обнаруживается повышенная экспрессия PARP-1, что может свидетельствовать о более поздней стадии заболевания и о более неблагоприятном прогнозе. Кроме того, при раке желудка наблюдаются такие явления, как экспрессия PD-L1, высокая микросателлитная нестабильность и дефект репарации неспаренных оснований. Это позволяет думать, что у подобных пациентов иммунотерапия может также играть важную роль. В данной статье обсуждаются основные направления возможных новых видов лечения для пациентов с раком пищевода и раком желудка, которые могут появиться в ближайшем будущем.
Относительная частота рака желудка снизилась в последние десятилетия: если в 1975 году это был самый частый вид рака, то в настоящий момент рак желудка находится на пятом месте по распространенности онкологических заболеваний. Также рак желудка является третьей ведущей причиной смерти от онкологических заболеваний по всему миру у пациентов обоих полов [1,2]. Кроме того, рак желудка является ведущим видом онкологических заболеваний, возникших на фоне инфекций [3], так как в его этиологии играют роль Helicobacter pylori и вирус Эпштейна-Барр (EBV). Рак желудка в два раза чаще встречается у мужчин, чем у женщин. Его распространенность в мире неодинакова: самая высокая частота возникновения и смертности наблюдается в странах Азии, таких как Корея, Япония и Китай, а самый низкий показатель – в странах Запада, в частности, в Северной Америке, где он является одним из наименее распространенных видов онкологических заболеваний [4,5]. Южная Европа, где данное заболевание находится на шестом месте по распространенности злокачественных заболеваний, также считается регионом с высоким риском [6]. Среди факторов риска развития рака желудка такие факторы, как высокое потребление переработанных продуктов из красного мяса или копченых консервированных продуктов, курение, большое потребление алкоголя и инфекция Helicobacter pylori, которая является основной причиной возникновения рака внекардиальных отделов желудка; однако в странах с низким доходом, где высока частота встречаемости рака желудка, было проведено очень небольшое количество исследований [7].
Также рак желудка является третьей ведущей причиной смерти от онкологических заболеваний по всему миру у пациентов обоих полов [1,2]. Кроме того, рак желудка является ведущим видом онкологических заболеваний, возникших на фоне инфекций [3], так как в его этиологии играют роль Helicobacter pylori и вирус Эпштейна-Барр (EBV). Рак желудка в два раза чаще встречается у мужчин, чем у женщин. Его распространенность в мире неодинакова: самая высокая частота возникновения и смертности наблюдается в странах Азии, таких как Корея, Япония и Китай, а самый низкий показатель – в странах Запада, в частности, в Северной Америке, где он является одним из наименее распространенных видов онкологических заболеваний [4,5]. Южная Европа, где данное заболевание находится на шестом месте по распространенности злокачественных заболеваний, также считается регионом с высоким риском [6]. Среди факторов риска развития рака желудка такие факторы, как высокое потребление переработанных продуктов из красного мяса или копченых консервированных продуктов, курение, большое потребление алкоголя и инфекция Helicobacter pylori, которая является основной причиной возникновения рака внекардиальных отделов желудка; однако в странах с низким доходом, где высока частота встречаемости рака желудка, было проведено очень небольшое количество исследований [7].
По гистологическому признаку аденкарциномы желудка подразделяются на кишечный тип (85-90%) и диффузный тип (10-15%). Большинство случаев желудочных аденокарцином являются спорадическими (90-95%), и только в 5-10% случаев отмечается семейная предрасположенность. С анатомической точки зрения опухоли проксимального отдела более распространены в странах Запада, а опухоли вне проксимального отдела желудка чаще встречаются в странах Азии [6]. Опухоли проксимального отдела желудка, которые распространяются за пределы желудочно-пищеводного перехода, по системе стадирования Американского объединенного комитета по раку (AJCC) относятся к раку пищевода, соответственно подход к их лечению такой же, как при раке пищевода [8].
МОЛЕКУЛЯРНАЯ КЛАССИФИКАЦИЯ
Традиционно рак желудка подразделяется на кишечный и диффузный гистологические подтипы по так называемой классификации Lauren, но наблюдается и смешанный подтип [9]. Тщательный анализ драйверных мутаций в желудочных аденокарциномах выявил, что в развитии и прогрессировании этого вида рака принимает участие множество генов, в том числе TP53, ARID1A, PIK3CA и RHOA [10-12]. Некоторые из этих мутаций ассоциируются с определенным видом рака желудка; например, мутации RHOA встречаются практически исключительно при диффузном типе рака желудка. Кроме того, встречаются такие генетические аберрации, как амплификация генов ERBB2, FGFR2, MET и KRAS, приводящие к активации нисходящего сигнального пути рецептора тирозинкиназы и RAS, что открывает новые возможности для таргетной терапии (см. ниже). Однако в этом случае, как и при других типах аденокарцином, ответ на лечение монотаргетными препаратами часто бывает неудовлетворительным, что предполагает более комплексный подход и необходимость поиска дополнительных биомаркеров.
Некоторые из этих мутаций ассоциируются с определенным видом рака желудка; например, мутации RHOA встречаются практически исключительно при диффузном типе рака желудка. Кроме того, встречаются такие генетические аберрации, как амплификация генов ERBB2, FGFR2, MET и KRAS, приводящие к активации нисходящего сигнального пути рецептора тирозинкиназы и RAS, что открывает новые возможности для таргетной терапии (см. ниже). Однако в этом случае, как и при других типах аденокарцином, ответ на лечение монотаргетными препаратами часто бывает неудовлетворительным, что предполагает более комплексный подход и необходимость поиска дополнительных биомаркеров.
В своей основной публикации проект «Атлас ракового генома» (АРГ) предлагает разделять раковые опухоли желудка в зависимости от вида генетических нарушений на четыре молекулярных подтипа: EBV-ассоциированные опухоли (с повторными мутациями PIK3CA, крайне высокой степенью гиперметилирования ДНК и с амплификацией JAK2, PD-L1 и PD-L2), опухоли, обусловленные микросателлитной нестабильностью (MSI), генетически стабильные опухоли и опухоли с хромосомной нестабильностью (т. е. опухоли с выраженной анеуплоидией и с фокальной амплификацией гена рецептора тирозинкиназ) [13]. Чтобы объединить ситуации не только геномных аберраций, но и эпигенетических модификаций и гетерогенность микроокружения, в том числе, свойства иммунного инфильтрата и статус активации стромы, была разработана подробная классификация на основе экспрессии генов. Первые исследования были направлены на изучение профиля генной экспрессии, ассоциированной с раком кишечного типа и с диффузным раком желудка [14]. Tan et al [15] использовали репрезентативные клеточные линии для создания профилей, которые позволяли бы различить два подтипа рака желудка на основе данных экспрессии генов. Такое различение имеет также прогностическую ценность, поскольку клеточные линии, характерные для кишечного типа, как правило, отвечали на терапию оксалиплатином, тогда как клеточные линии диффузного рака желудка лучше отвечали на терапию цисплатином. В дальнейшем эта классификация была расширена и было определено три подтипа: пролиферативный тип, метаболический тип и мезенхимальный тип [16].
е. опухоли с выраженной анеуплоидией и с фокальной амплификацией гена рецептора тирозинкиназ) [13]. Чтобы объединить ситуации не только геномных аберраций, но и эпигенетических модификаций и гетерогенность микроокружения, в том числе, свойства иммунного инфильтрата и статус активации стромы, была разработана подробная классификация на основе экспрессии генов. Первые исследования были направлены на изучение профиля генной экспрессии, ассоциированной с раком кишечного типа и с диффузным раком желудка [14]. Tan et al [15] использовали репрезентативные клеточные линии для создания профилей, которые позволяли бы различить два подтипа рака желудка на основе данных экспрессии генов. Такое различение имеет также прогностическую ценность, поскольку клеточные линии, характерные для кишечного типа, как правило, отвечали на терапию оксалиплатином, тогда как клеточные линии диффузного рака желудка лучше отвечали на терапию цисплатином. В дальнейшем эта классификация была расширена и было определено три подтипа: пролиферативный тип, метаболический тип и мезенхимальный тип [16]. В этом случае ответ разных подтипов на терапию также отличался: опухоли желудка мезенхимального подтипа были чувствительны к применению ингибиторов PIK3CA, AKT и mTOR, а метаболический тип рака желудка был особо чувствителен к терапии фторурацилом. Позднее Азиатская группа по изучению рака (ACRG – Asian Cancer Research Group) предложила другую классификацию на основе экспрессии генов. В этой классификации было четыре подтипа опухолей: тип опухолей с микросателлитной нестабильностью, опухоли мезенхимоподобного типа, а также p53-активный и p53-неактивный типы опухолей [17]. Клиническое значение этих классификаций лучше всего показано для классификаций АРГ и ACRG.
В этом случае ответ разных подтипов на терапию также отличался: опухоли желудка мезенхимального подтипа были чувствительны к применению ингибиторов PIK3CA, AKT и mTOR, а метаболический тип рака желудка был особо чувствителен к терапии фторурацилом. Позднее Азиатская группа по изучению рака (ACRG – Asian Cancer Research Group) предложила другую классификацию на основе экспрессии генов. В этой классификации было четыре подтипа опухолей: тип опухолей с микросателлитной нестабильностью, опухоли мезенхимоподобного типа, а также p53-активный и p53-неактивный типы опухолей [17]. Клиническое значение этих классификаций лучше всего показано для классификаций АРГ и ACRG.
Что касается классификации АРГ, наилучший прогноз был у опухолей EBV-ассоциированного типа, на втором месте были опухоли с микросателлитной нестабильностью и с хромосомной нестабильностью, а опухоли с геномной нестабильностью ассоциировались с наихудшим прогнозом [18]. Классификация ACRG также продемонстрировала прогностическую ценность в нескольких когортных исследованиях, поскольку было выявлено, что подтип опухолей с микросателлитной нестабильностью ассоциируется с хорошим прогнозом, а мезенхимоподобный тип – с неблагоприятным исходом заболевания. В самом деле, определение подтипа опухоли (по классификации АРГ или ACRG) может помочь с определением тактики лечения, прогноза и в исследовании новых видов таргетной терапии.
В самом деле, определение подтипа опухоли (по классификации АРГ или ACRG) может помочь с определением тактики лечения, прогноза и в исследовании новых видов таргетной терапии.
Опухоли с хромосомной нестабильностью представляют 50% от всех случаев рака желудка [18]. При исследовании этого вида опухолей выявляется повторная амплификация таких генов, как HER2, EGFR, MET, CCNE1, CCND1, CDK6, VEGFA и FGFR2, которые могут представлять собой потенциальную мишень.
Подгруппа с высоким уровнем MSI составляет 22% всех случаев рака желудка и характеризуется повышенным уровнем мутаций и гиперметилирования. Медиана возраста при данном виде опухолей составляет 72 года, большинство пациентов (56%) – женщины. Более высокий уровень мутаций повышает вероятность образования неоантигенов, по этой причине опухоли с высоким уровнем MSI представляют собой потенциальную мишень для иммунотерапии [18,19].
Генетически стабильные опухоли составляют 20% всех случаев рака желудка. При этом подтипе могут обнаруживаться отдельные генетические изменения, такие как мутация гена сигнального пути RHOA, гибридный ген CLDN18-ARHGAP26 и амплификация гена рецептора фактора роста фибробластов (FGFR) 2 и гена VEGFA [5].
При этом подтипе могут обнаруживаться отдельные генетические изменения, такие как мутация гена сигнального пути RHOA, гибридный ген CLDN18-ARHGAP26 и амплификация гена рецептора фактора роста фибробластов (FGFR) 2 и гена VEGFA [5].
EBV-ассоциированный подтип, как правило, локализован на дне или в теле желудка, чаще встречается у мужчин (81%) и составляет 9% от всех злокачественных опухолей желудка. Данный вид опухоли характеризуется высоким уровнем гиперметилирования промоторов ДНК, повышенной экспрессией PD-L1 и PD-L2, амплификацией JAK2 и мутацией гена PIK3CA. Таким образом, повышенная экспрессия PD-L1 и PD-L2 повышает возможности для иммунной терапии данной подгруппы опухолей, равно как и опухолей с высокой микросателлитной нестабильностью. Амплификация гена JAK-2 и мутации в гене PIK3CA также могут служить возможными мишенями для терапии у данной группы пациентов (рис. 1).
Рисунок 1. Молекулярные механизмы и наиболее перспективные биомаркеры при раке желудка.
Сокращения: ACK1 – активированная Cdc42-ассоциированная киназа 1; AQP3 – аквапорин 3; BMP2 – костный морфогенетический белок-2; BMP4 – костный морфогенетический белок-4, CCND1 – циклин D1; CCNE1 – циклин E1; CDh2 – ген кадгерина-1; CDK6 – циклинзависимая протеинкиназа 6; CIMP – фенотип метилирования CpG-островков; EphA2 – эритропоэтинпродуцирующий гепатоцеллюлярный рецептор A2; FGFR2 – рецептор фактора роста фибробластов 2; hMLh2 – ген человека, кодирующий белок MLh2; p16 – ген-суппрессор опухолевого роста p16; MET – эпителиально-мезенхимальный переход; PIK3CA – ген, кодирующий PI3K; PLA2G2A – фосфолипаза A2 группы IIA; RUNX3 – транскрипционный фактор RUNX3 домена runt; SULF2 – ген SULF2.
ЛЕЧЕНИЕ
В 2017 году рак желудка составлял 1,7% от всех случаев рака в США, ежегодно здесь регистрируют 28 000 новых случаев. (В России в общей структуре онкологической заболеваемости рак желудка составлял 6,2% в 2016 году, было зарегистрировано 37 135 новых случаев – прим. ) Показатель относительной пятилетней выживаемости в США составлял 67,2% при локализованной форме заболевания, 30,7% в случае местнораспространенного рака и 5,2% при метастатической болезни.
) Показатель относительной пятилетней выживаемости в США составлял 67,2% при локализованной форме заболевания, 30,7% в случае местнораспространенного рака и 5,2% при метастатической болезни.
В США примерно 50% пациентов диагноз рака ставится на поздних стадиях заболевания, однако в некоторых странах, таких как Япония и Южная Корея, где скрининговые обследования являются рутинной процедурой, ранняя диагностика чаще имеет место [2]. Продолжительность пятилетней общей выживаемости (ОВ) при метастатическом раке желудка колеблется от 3 месяцев при проведении только симптоматической терапии до 16 месяцев в случае пациентов, имевших возможность принять участие в клинических исследованиях; таким образом, рак желудка остается одной из проблем в онкологии, решить которую еще только предстоит [20]. В большинстве стран Запада рак желудка и рак дистального отдела пищевода часто объединяют, применяя к ним единый подход в лечении и единые критерии включения пациентов в клинические исследования. В США рак пищевода является пятым по частоте раком желудочно-кишечного тракта, при этом ежегодно регистрируется 16 940 новых случаев. В мире это шестой по распространенности вид рака [21]. Примерно половина пациентов узнает о диагнозе рака пищевода на этапе, когда опухоль является неоперабельной или когда имеются метастазы. Терапия таких пациентов сводится к лечению дисфагии и других симптомов заболевания, улучшению качества жизни и продлению жизни. За прошедшие два десятилетия был достигнут умеренный успех в лечении неоперабельного рака без метастазов у пациентов, которым не показано хирургическое лечение, и у пациентов с нерезектабельной опухолью при местно-распространенном раке. В случае метастатического рака пищевода в качестве терапии первой линии было разработано несколько двухкомпонентных или трехкомпонентных режимов химиотерапии. Более того, за последние несколько лет были опубликованы отдаленные результаты нескольких крупных рандомизированных исследований III фазы с применением дополнительной таргетной терапии, которые могут повлиять на имеющиеся в настоящее время стандарты лечения и на дальнейшее направление научных исследований [21].
В США рак пищевода является пятым по частоте раком желудочно-кишечного тракта, при этом ежегодно регистрируется 16 940 новых случаев. В мире это шестой по распространенности вид рака [21]. Примерно половина пациентов узнает о диагнозе рака пищевода на этапе, когда опухоль является неоперабельной или когда имеются метастазы. Терапия таких пациентов сводится к лечению дисфагии и других симптомов заболевания, улучшению качества жизни и продлению жизни. За прошедшие два десятилетия был достигнут умеренный успех в лечении неоперабельного рака без метастазов у пациентов, которым не показано хирургическое лечение, и у пациентов с нерезектабельной опухолью при местно-распространенном раке. В случае метастатического рака пищевода в качестве терапии первой линии было разработано несколько двухкомпонентных или трехкомпонентных режимов химиотерапии. Более того, за последние несколько лет были опубликованы отдаленные результаты нескольких крупных рандомизированных исследований III фазы с применением дополнительной таргетной терапии, которые могут повлиять на имеющиеся в настоящее время стандарты лечения и на дальнейшее направление научных исследований [21]. В данной статье мы бы хотели обсудить возможные терапевтические подходы в будущем, а также применение биомаркеров в лечении рака пищевода и рака желудка на поздних стадиях заболевания.
В данной статье мы бы хотели обсудить возможные терапевтические подходы в будущем, а также применение биомаркеров в лечении рака пищевода и рака желудка на поздних стадиях заболевания.
Какие методы лечения рака желудка на поздних стадиях существуют сегодня?
В настоящий момент лечение рака желудка на поздних стадиях представляет собой серьезную проблему для онкологов по всему миру. Режимы химиотерапии, в том числе различные схемы с препаратами платины, фторпиримидинами, таксанами и антрациклинами, являются основой терапии первой линии при лечении этого вида рака на поздних стадиях [22,23]. Тем не менее, в последние годы в этот стандарт были включены некоторые новые виды терапии. Исследования показали, что пациенты с HER2-позитивным раком желудка демонстрируют гораздо лучшие результаты лечения при добавлении трастузумаба к комбинации платины с фторпиримидином [24]. Кроме того, по результатам клинических исследований III фазы RAINBOW и REGARD рамуцирумаб, представляющий собой антиангиогенное моноклональное антитело, был одобрен в виде монотерапии или в комбинации с паклитакселом в качестве терапии второй линии для лечения рака желудка [25,26]. Ингибитор тирозинкиназы (ТКИ) апатиниб, блокирующий VEGFR-2, продемонстрировал определенную эффективность у пациентов с раком желудка на поздних стадиях заболевания и с метастатическим раком желудка, резистентным к химиотерапии, что позволяет рассматривать его как возможный препарат третьей или последующих линий терапии [26]. Но, несмотря на все вышеизложенное, роль препаратов таргетной терапии в лечении рака желудка остается ограниченной. Тем не менее, дальнейшие исследования в этой области могут сделать терапию пациентов с раком желудка более эффективной.
Ингибитор тирозинкиназы (ТКИ) апатиниб, блокирующий VEGFR-2, продемонстрировал определенную эффективность у пациентов с раком желудка на поздних стадиях заболевания и с метастатическим раком желудка, резистентным к химиотерапии, что позволяет рассматривать его как возможный препарат третьей или последующих линий терапии [26]. Но, несмотря на все вышеизложенное, роль препаратов таргетной терапии в лечении рака желудка остается ограниченной. Тем не менее, дальнейшие исследования в этой области могут сделать терапию пациентов с раком желудка более эффективной.
Новые мишени и новое лечение
HER2
Гиперэкспрессия HER2 при раке желудка наблюдается в 9-23% случаев и встречается чаще при кишечном подтипе рака. Прогностическая ценность данного маркера остается пока неясной, однако анализ на HER2 методом модифицированного иммуногистохимического исследования следует делать всем пациентам, которым был диагностирован рак желудка с метастазами [27]. После получения крайне успешных результатов для рака молочной железы этот рецептор стал объектом изучения различных клинических исследований рака желудка.
В исследовании ToGA медиана ОВ составила 13,8 месяца у тех пациентов, которые были распределены в группу лечения трастузумабом в дополнение к химиотерапии, и 11,1 месяца в группе пациентов, получавших только химиотерапию. По результатам этого исследования Управление по надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration – FDA) в 2010 г. одобрило трастузумаб в комбинации с химиотерапией в качестве еще одного возможного стандарта лечения пациентов с HER2-позитивным раком желудка или раком гастроэзофагеального перехода (ГЭП) на поздних стадиях [24]. Более того, в настоящее время проводится ряд исследований, изучающих методы лечения HER2-позитивных пациентов различными комбинациями моноклональных антител, таких как трастузумаб, пертузумаб, TDM-1 или ТКИ лапатиниб, в сочетании с химиотерапией или с лучевой терапией (ЛТ). Таким образом, у различных комбинаций таргетных препаратов при лечении HER2-позитивных видов рака есть большой клинический потенциал.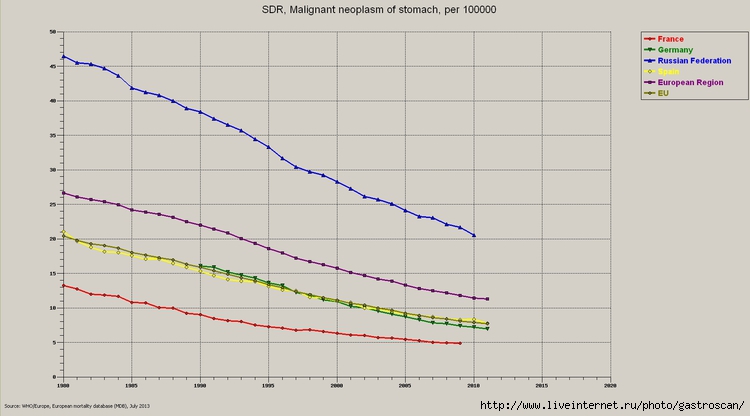 В настоящее время на сайте ClinicalTrials.gov зарегистрировано более 118 клинических исследований, изучающих терапию HER2-позитивного рака желудка. Информация об отдельных клинических исследованиях, которые авторы данной статьи сочли значимыми, приведена в таблице 1.
В настоящее время на сайте ClinicalTrials.gov зарегистрировано более 118 клинических исследований, изучающих терапию HER2-позитивного рака желудка. Информация об отдельных клинических исследованиях, которые авторы данной статьи сочли значимыми, приведена в таблице 1.
Таблица 1. Клинические исследования III фазы по изучению препаратов для терапии рака желудка с опубликованными результатами (опубликована в Газете RUSSCO №4 – 2019 (см. архив)).
В 2017 г. Doi et al. [28] опубликовали любопытные данные клинического исследования I фазы, которое изучало безопасность и противоопухолевую активность лекарственного средства трастузумаб дерукстекан, который является конъюгатом антитела к HER2 и препарата, при лечении пациентов на поздних стадиях рака молочной железы, рака желудка и гастроэзофагеального рака. Doi et al. оценивали данные 23 пациентов, у 10 (43%) из которых отмечался объективный ответ на терапию, а у 21 (91%) был достигнут контроль опухолевого процесса. Самыми частыми видами токсичности степени 3 и 4 были лимфопения, нейтропения и анемия. Таким образом, конъюгат трастузумаб дерукстекан продемонстрировал выраженную противоопухолевую активность в случае опухолей с гиперэкспрессией HER2. Необходимо дальнейшее проведение исследований II и III фазы, чтобы оценить роль этого препарата в лечении пациентов с РПЖ [28].
Самыми частыми видами токсичности степени 3 и 4 были лимфопения, нейтропения и анемия. Таким образом, конъюгат трастузумаб дерукстекан продемонстрировал выраженную противоопухолевую активность в случае опухолей с гиперэкспрессией HER2. Необходимо дальнейшее проведение исследований II и III фазы, чтобы оценить роль этого препарата в лечении пациентов с РПЖ [28].
Следует подчеркнуть, однако, что, в отличие от рака молочной железы, результаты таргетной терапии HER2-позитивных опухолей у пациентов с РПЖ не были стабильно положительными. В недавно проведенном исследовании JACOB (NCT01774786) 780 пациентов с HER2-позитивным метастатическим или местнораспространенным неоперабельным раком ГЭП или раком желудка получали в качестве терапии первой линии трастузумаб в комбинации с химиотерапией и с пертузумабом либо без него. К сожалению, в данном исследовании не было обнаружено преимущества в ОВ у пациентов, получавших терапию комбинацией пертузумаб, трастузумаб и химиотерапия, по сравнению с пациентами, получавшими трастузумаб, химиотерапию и плацебо. ОВ в первой группе составила 17,5 месяца, а в группе плацебо – 14,2 месяца (отношение рисков [Hazard ratio, HR] 0,84; 95% ДИ 0,71-1,00; p=,0565) [40]. Помимо этого, были проведены исследования TRIO-013/LOGIC и TyTan, в которых участвовали 545 пациентов. Медиана ОВ в группах лечения лапатинибом и плацебо составила 12,2 мес. (95% ДИ 10,6-14,2 мес.) и 10,5 мес. (95% ДИ 9,0-11,3 мес.) соответственно. Таким образом, статистически значимой разницы выявлено не было (HR 0,91; 95% ДИ 0,73-1,12). Несмотря на то, что исследования TRIO-013/LOGIC и TyTan дали отрицательные результаты [35,38], были и другие исследования терапии HER2-позитивного рака желудка лапатинибом, продемонстрировавшие более многообещающие результаты. Одним из таких протоколов было исследование MAGIC-B, в котором изучалось добавление лапатиниба или бевацизумаба к предоперационной химиотерапии эпирубицином, цисплатином и капецитабином. Исследование должно было закончиться в декабре 2017 г., его результаты пока не получены.
ОВ в первой группе составила 17,5 месяца, а в группе плацебо – 14,2 месяца (отношение рисков [Hazard ratio, HR] 0,84; 95% ДИ 0,71-1,00; p=,0565) [40]. Помимо этого, были проведены исследования TRIO-013/LOGIC и TyTan, в которых участвовали 545 пациентов. Медиана ОВ в группах лечения лапатинибом и плацебо составила 12,2 мес. (95% ДИ 10,6-14,2 мес.) и 10,5 мес. (95% ДИ 9,0-11,3 мес.) соответственно. Таким образом, статистически значимой разницы выявлено не было (HR 0,91; 95% ДИ 0,73-1,12). Несмотря на то, что исследования TRIO-013/LOGIC и TyTan дали отрицательные результаты [35,38], были и другие исследования терапии HER2-позитивного рака желудка лапатинибом, продемонстрировавшие более многообещающие результаты. Одним из таких протоколов было исследование MAGIC-B, в котором изучалось добавление лапатиниба или бевацизумаба к предоперационной химиотерапии эпирубицином, цисплатином и капецитабином. Исследование должно было закончиться в декабре 2017 г., его результаты пока не получены.
Наконец, было проведено клиническое исследование II фазы (NCT02015169), целью которого было изучить эффективность и безопасность комбинации схемы XELOX (капецитабин и оксалиплатин) с лапатинибом для лечения пациентов с HER2-позитивным раком желудка с метастазами в печень. Первичным критерием эффективности была частота полной резекции (частота случаев R0 резекции). Предполагаемая дата окончания исследования – май 2017 г. Несмотря на небольшое количество участников (32 пациента), это исследование может помочь определить актуальные проблемы других видов анти-HER2 терапии помимо трастузумаба.
Первичным критерием эффективности была частота полной резекции (частота случаев R0 резекции). Предполагаемая дата окончания исследования – май 2017 г. Несмотря на небольшое количество участников (32 пациента), это исследование может помочь определить актуальные проблемы других видов анти-HER2 терапии помимо трастузумаба.
Ингибиторы EGFR
Трансмембранный гликопротеин EGFR активирует каскад сигнальных тирозинкиназных путей Ras/Raf или Akt/mTOR. Таргетная терапия для этого рецептора успешно используется для лечения метастатического колоректального рака с диким типом опухоли по гену KRAS с применением терапии моноклональными антителами панитумумаб и цетуксимаб, а терапия цетуксимабом применяется для лечения плоскоклеточного рака головы и шеи. Кроме того, анти-EGFR ТКИ, такие как эрлотиниб, были одобрены для лечения рака легкого.
EGFR может служить независимым прогностическим фактором неблагоприятного исхода у пациентов с раком желудка [41]; его гиперэкспрессия наблюдается в 30-50% случаев гастроэзофагеальных опухолей, в этом случае данный рецептор может служить потенциальной мишенью таргетной терапии [23].
Препараты цетуксимаб (в исследовании EXPAND) и панитумумаб (в исследовании REAL3) не смогли продемонстрировать клиническое преимущество при лечении гастроэзофагеальных опухолей на поздних стадиях. Возможно, что гиперэкспрессия EGFR не является ведущим онкогенным механизмом, однако в этих исследованиях пациенты не отбирались на основании гиперэкспрессии EGFR; подобный подход следует применить при разработке новых исследований или для анализа в подгруппах [42].
В более позднем клиническом исследовании II фазы другого анти-EGFR моноклонального антитела – нимутузумаба – для лечения пациентов с раком желудка на поздних стадиях увеличения ОВ или выживаемости без прогрессирования в популяции в целом не отмечалось, однако у пациентов с гиперэкспрессией EGFR данные показатели были значительно лучше, что в очередной раз говорит о целесообразности отбора пациентов для анти-EGFR таргетной терапии на основании статуса EGFR [43]. Интересный ретроспективный анализ биомаркеров в исследовании COG [44] дает основания предполагать, что субпопуляция опухолей с числом копий гена EGFR может отвечать на анти-EGFR терапию. Это говорит о том, что выявление биомаркера EGFR может приводить к положительным результатам.
Это говорит о том, что выявление биомаркера EGFR может приводить к положительным результатам.
Ингибиторы контрольных точек иммунитета
Злокачественные новообразования верхнего отдела желудочно-кишечного тракта, а именно рак пищевода, рак ГЭП и рак желудка, отличаются высоким уровнем соматических мутаций, уступая по частоте мутаций в опухолевых клетках только меланоме, раку легкого и раку мочевого пузыря [45]. Принимая во внимание успешность иммунотерапии при лечении этих видов рака с высоким уровнем мутаций, в последнее время был проведен ряд фундаментальных и клинических исследований злокачественных опухолей верхних отделов желудочно-кишечного тракта, результаты лечения которых стандартной химиотерапией по-прежнему неудовлетворительны.
Целью иммунотерапии является изменение баланса между провоспалительными иммунными клетками-эффекторами и противовоспалительными клетками-супрессорами. Понятие «контрольные точки иммунитета» относится к различным ингибиторным сигнальным путям иммунной системы, которые играют важную роль в аутотолерантности, уменьшая выраженность и длительность физиологических иммунных реакций. Опухолевые клетки используют этот механизм для создания опухолевой резистентности посредством взаимодействия лиганд-рецептор. Ингибиторы контрольных точек потенциально могут усиливать противоопухолевый иммунитет, оказывая влияние на лиганд-рецепторное взаимодействие между опухолевыми клетками и T-клетками [46].
Опухолевые клетки используют этот механизм для создания опухолевой резистентности посредством взаимодействия лиганд-рецептор. Ингибиторы контрольных точек потенциально могут усиливать противоопухолевый иммунитет, оказывая влияние на лиганд-рецепторное взаимодействие между опухолевыми клетками и T-клетками [46].
В настоящее время FDA одобрило два класса иммунотерапии: ингибиторы рецептора PD-1 и его лиганда (PD-L1) и ингибиторы CTLA-4 [47]. Экспрессия PD-L1 наблюдается в 35-45% случаев рака пищевода [48,49], что позволяет говорить о целесообразности применения иммунотерапии для этого вида рака. Недавно завершенные, а также проходящие в настоящий момент клинические исследования изучают применение ингибиторов PD-1/PD-L1 и CTLA-4 в качестве монотерапии или в комбинации с другими видами терапии для лечения злокачественных заболеваний ЖКТ.
Экспрессия PD-L1, высокий уровень MSI, а также дефект репарации неспаренных оснований обнаруживаются и при раке желудка, что может говорить о целесообразности иммунотерапии при лечении пациентов с данным заболеванием. Пембролизумаб, гуманизированное моноклональное анти-PD-1 антитело, изначально изучался в исследовании IB фазы в качестве препарата для лечения пациентов с раком пищевода или ГЭП с противоопухолевой терапией в анамнезе, у которых экспрессия PD-L1 была более 1% [28]. Общий ответ на лечение составил 30,4% (95% ДИ 13,2-52,9%). При анализе в подгруппах доля пациентов, ответивших на лечение, среди пациентов с аденокарциномой составила 40,0%, а среди пациентов с плоскоклеточным раком – 29,4%. В более позднем клиническом исследовании II фазы с участием пациентов с раком желудка и ГЭП на поздних стадиях общий ответ на лечение составил 13,3% (95% ДИ 8,2-20%), при этом полный ответ отмечался в 1,4% случаев [50], а частичный ответ – в 11,9% случаев [51]. В исследовании могли участвовать пациенты с уровнем экспрессии PD-L1 в опухолевых или стромальных клетках не ниже 1% на основе данных иммуногистохимического исследования. В результате было получено ускоренное одобрение FDA этого препарата для лечения пациентов с рецидивирующей, местнораспространенной или метастатической формой аденокарценомы желудка или ГЭП.
Пембролизумаб, гуманизированное моноклональное анти-PD-1 антитело, изначально изучался в исследовании IB фазы в качестве препарата для лечения пациентов с раком пищевода или ГЭП с противоопухолевой терапией в анамнезе, у которых экспрессия PD-L1 была более 1% [28]. Общий ответ на лечение составил 30,4% (95% ДИ 13,2-52,9%). При анализе в подгруппах доля пациентов, ответивших на лечение, среди пациентов с аденокарциномой составила 40,0%, а среди пациентов с плоскоклеточным раком – 29,4%. В более позднем клиническом исследовании II фазы с участием пациентов с раком желудка и ГЭП на поздних стадиях общий ответ на лечение составил 13,3% (95% ДИ 8,2-20%), при этом полный ответ отмечался в 1,4% случаев [50], а частичный ответ – в 11,9% случаев [51]. В исследовании могли участвовать пациенты с уровнем экспрессии PD-L1 в опухолевых или стромальных клетках не ниже 1% на основе данных иммуногистохимического исследования. В результате было получено ускоренное одобрение FDA этого препарата для лечения пациентов с рецидивирующей, местнораспространенной или метастатической формой аденокарценомы желудка или ГЭП. В более крупном исследовании III фазы, в котором пембролизумаб изучался в качестве препарата терапии второй линии при лечении пациентов с аденокарциномой желудка или ГЭП на поздних стадиях, первичная конечная точка, которой служил показатель ОВ у пациентов с экспрессией PD-L1 в опухолевых клетках более 1%, не была достигнута (HR 0,82; 95% ДИ 0,66-1,03; p=,042) [52]. Есть вероятность, что PD-L1 не является оптимальным биомаркером при раке желудка либо что минимальный уровень экспрессии, определенный как 1%, оказался недостаточным. Возможно, что при отборе пациентов с более высоким уровнем экспрессии PD-L1 результаты терапии были бы более благоприятными.
В более крупном исследовании III фазы, в котором пембролизумаб изучался в качестве препарата терапии второй линии при лечении пациентов с аденокарциномой желудка или ГЭП на поздних стадиях, первичная конечная точка, которой служил показатель ОВ у пациентов с экспрессией PD-L1 в опухолевых клетках более 1%, не была достигнута (HR 0,82; 95% ДИ 0,66-1,03; p=,042) [52]. Есть вероятность, что PD-L1 не является оптимальным биомаркером при раке желудка либо что минимальный уровень экспрессии, определенный как 1%, оказался недостаточным. Возможно, что при отборе пациентов с более высоким уровнем экспрессии PD-L1 результаты терапии были бы более благоприятными.
Ниволумаб является полностью человеческим моноклональным антителом IgG4, ингибирующим PD-1, который экспрессируется на активированных T-клетках. В исследовании II фазы принимали участие пациенты с раком пищевода на поздних стадиях, ранее получавшие противоопухолевую терапию. PD-L1 статус не являлся критерием отбора. Объективный ответ на лечение был получен в 17% случаев (95% ДИ 10-28%) [50,53]. Похожие результаты были получены в исследовании III фазы, в котором участвовали больные раком желудка или ГЭП на поздних стадиях, получившие, по крайней мере, две линии химиотерапии, у которых при этом отмечалась непереносимость данной терапии. Ответ на лечение в этом исследовании составлял 11%. Также отмечалось улучшение показателя 12-месячной ОВ у пациентов, получавших ниволумаб, который в этой группе составил 26,2% (95% ДИ 20,7-32,0%), в сравнении с 10,9% (95% ДИ 6,2-17,0%) в группе плацебо [54]. В настоящее время проходит прямое сравнительное исследование III фазы, в котором лечение ниволумабом сравнивается со стандартной химиотерапией доцетакселом или паклитакселом у аналогичной когорты пациентов с рефрактерностью к химиотерапии [55].
Объективный ответ на лечение был получен в 17% случаев (95% ДИ 10-28%) [50,53]. Похожие результаты были получены в исследовании III фазы, в котором участвовали больные раком желудка или ГЭП на поздних стадиях, получившие, по крайней мере, две линии химиотерапии, у которых при этом отмечалась непереносимость данной терапии. Ответ на лечение в этом исследовании составлял 11%. Также отмечалось улучшение показателя 12-месячной ОВ у пациентов, получавших ниволумаб, который в этой группе составил 26,2% (95% ДИ 20,7-32,0%), в сравнении с 10,9% (95% ДИ 6,2-17,0%) в группе плацебо [54]. В настоящее время проходит прямое сравнительное исследование III фазы, в котором лечение ниволумабом сравнивается со стандартной химиотерапией доцетакселом или паклитакселом у аналогичной когорты пациентов с рефрактерностью к химиотерапии [55].
Тремелимумаб ингибирует CTLA-4, белковый рецептор, относящийся к суперсемейству иммуноглобулинов, который является контрольной точкой иммунитета. При экспрессии на поверхности клетки Т-хелпера он передает ингибирующий сигнал Т-клеткам при связывании с CD80 или CD86 на поверхности антиген-презентирующих клеток [56]. В исследовании II фазы с участием пациентов с метастатическим раком желудка или пищевода, ранее получавших противоопухолевую терапию, при лечении тремелимумабом объективного ответа на лечение выявлено не было. Несмотря на это, показатель длительности ответа в отдельной небольшой группе больных был обнадеживающим [57].
В исследовании II фазы с участием пациентов с метастатическим раком желудка или пищевода, ранее получавших противоопухолевую терапию, при лечении тремелимумабом объективного ответа на лечение выявлено не было. Несмотря на это, показатель длительности ответа в отдельной небольшой группе больных был обнадеживающим [57].
В настоящий момент имеются ограниченные данные о том, что комбинированная иммунотерапия более эффективна по сравнению с монотерапией. В исследовании I/II фазы с участием пациентов с раком желудка, пищевода или ГЭП, ранее получавших интенсивную противоопухолевую терапию, изучалось лечение ипилимумабом в комбинации с ниволумабом. На фоне данной терапии отмечался длительный ответ на лечение и повышение долгосрочной ОВ [58]. В настоящий момент проводится несколько исследований, изучающих комбинацию могамулизумаба, гуманизированного моноклонального антитела, связывающегося с хемокиновым рецептором, и ниволумаба для лечения рака верхних отделов ЖКТ на поздних стадиях [59,60]. В других текущих исследованиях с участием пациентов с метастатическим раком верхних отделов желудочно-кишечного тракта изучается комбинация LAG525, который связывается с молекулой LAG-3, и спартализумаба, комбинированного анти-PD-1 препарата [61]. Кроме того, изучается комбинация тремелимумаба с дурвалумабом, человеческим моноклональным антителом иммуноглобулин G1 каппа, которое блокирует взаимодействие PD-L1 с молекулами PD-1 и CD80 [62].
В других текущих исследованиях с участием пациентов с метастатическим раком верхних отделов желудочно-кишечного тракта изучается комбинация LAG525, который связывается с молекулой LAG-3, и спартализумаба, комбинированного анти-PD-1 препарата [61]. Кроме того, изучается комбинация тремелимумаба с дурвалумабом, человеческим моноклональным антителом иммуноглобулин G1 каппа, которое блокирует взаимодействие PD-L1 с молекулами PD-1 и CD80 [62].
Традиционно химиотерапия и лучевая терапия применяются на разных стадиях рака верхних отделов ЖКТ. При метастатическом раке верхних отделов ЖКТ частота ответа на лечение химиотерапией составляет от 35% до 40%, а преимущество по медиане выживаемости составляет 9-11 месяцев. Лучевая терапия применяется в случае местнораспространенного рака, а также в качестве паллиативного лечения у пациентов с метастатическим раком. Поскольку при лечении метастатического рака химиотерапией эффект лечения является довольно скромным, следующим логическим шагом было изучить эффективность иммунотерапии. Несмотря на то, что в доклинических исследованиях были получены обнадеживающие результаты, на стадии клинических испытаний терапевтическое преимущество при лечении рака верхних отделов ЖКТ было небольшим, а улучшения эффективности по сравнению с применением химиотерапии выявлено не было. Поскольку химиотерапия обладает доказанным преимуществом, в настоящее время проводятся исследования, в которых изучается комбинация химиотерапии с иммунотерапией и/или лучевой терапией.
Несмотря на то, что в доклинических исследованиях были получены обнадеживающие результаты, на стадии клинических испытаний терапевтическое преимущество при лечении рака верхних отделов ЖКТ было небольшим, а улучшения эффективности по сравнению с применением химиотерапии выявлено не было. Поскольку химиотерапия обладает доказанным преимуществом, в настоящее время проводятся исследования, в которых изучается комбинация химиотерапии с иммунотерапией и/или лучевой терапией.
Научное обоснование целесообразности комбинирования химиотерапии с иммунотерапией базируется на данных доклинических исследований. Их результаты говорят о том, что цитотоксические препараты могут выступать в роли иммуномодулятора посредством презентации опухолевых антигенов. В результате происходит стимуляция экспрессии опухолевых антигенов и молекул главного комплекса гистосовместимости I класса, с которыми связывается антиген. Также существует альтернативный молекулярный механизм, при котором химиотерапевтический препарат может также способствовать усилению выработки ко-стимулирующих молекул, таких как B7-1, или подавлению выработки ко-ингибирующих молекул, таких как PD-L1/B7-1H или B7-h5, экспрессирующихся на поверхности опухоли. При этом увеличивается выраженность эффекторной активности Т-клеток, происходит истощение популяции регуляторных T-клеток, высвобождаются гомеостатические или провоспалительные цитокины [63-66]. Химиотерапевтические агенты также могут делать клетки опухоли более чувствительными к лизису, опосредованному Т-клетками, с помощью fas-, перфорин- и гнанзим B- зависимых механизмов [67,68].
При этом увеличивается выраженность эффекторной активности Т-клеток, происходит истощение популяции регуляторных T-клеток, высвобождаются гомеостатические или провоспалительные цитокины [63-66]. Химиотерапевтические агенты также могут делать клетки опухоли более чувствительными к лизису, опосредованному Т-клетками, с помощью fas-, перфорин- и гнанзим B- зависимых механизмов [67,68].
С учетом этих механизмов начали проводить клинические исследования, в которых изучается комбинированное применение химиотерапии и иммунотерапии при злокачественных опухолях верхних отделов желудочно-кишечного тракта. В настоящее время проходит клиническое исследование III фазы, в котором оценивается применение ниволумаба и ипилимумаба, ниволумаба в комбинации с фторурацилом и цисплатином либо в комбинации только с фторурацилом или только с цисплатином [69,70]. Первичными конечными точками в этом исследовании выступают выживаемость без прогрессирования и ОВ у пациентов на поздних стадиях неоперабельного, рецидивирующего или метастатического плоскоклеточного рака пищевода, ранее не получавших противоопухолевую терапию. Также в настоящее время проводятся исследования пембролизумаба, применяемого самостоятельно или в комбинации с химиотерапией, в сравнении с лечением только химиотерапией у пациентов с аденокарциномой желудка или ГЭП в качестве первой линии [70], а также в качестве адъювантной и неоадъювантной терапии [71]. Целью еще одного исследования I/II фазы является оценка безопасности дурвалумаба в комбинации с оксалиплатином/капецитабином при лечении рака с метастазами.
Также в настоящее время проводятся исследования пембролизумаба, применяемого самостоятельно или в комбинации с химиотерапией, в сравнении с лечением только химиотерапией у пациентов с аденокарциномой желудка или ГЭП в качестве первой линии [70], а также в качестве адъювантной и неоадъювантной терапии [71]. Целью еще одного исследования I/II фазы является оценка безопасности дурвалумаба в комбинации с оксалиплатином/капецитабином при лечении рака с метастазами.
ЛТ является ключевым методом лечения многих форм рака пищевода. Также как и химиотерапия, лучевая терапия в доклинических исследованиях проявляла иммуномодулирующие свойства, задействуя различные механизмы, в том числе образование неоантигенов, увеличение экспрессии провоспалительных цитокинов, которые являются активаторами лейкоцитов, а также активацию иммунных клеток и привлечение их в зону опухолевого микроокружения [72,73]. Было обнаружено, что при воздействии на мышей ионизирующего облучения в микроокружении опухоли активируется экспрессия PD-L1 [74]. Подобное повышение экспрессии PD-L1 подавляет противоопухолевые свойства эффекторных Т-клеток, что говорит о целесообразности комбинации иммунотерапии и ЛТ.
Подобное повышение экспрессии PD-L1 подавляет противоопухолевые свойства эффекторных Т-клеток, что говорит о целесообразности комбинации иммунотерапии и ЛТ.
Доклинические модели [63,75,76] дают лишь ограниченное представление об эффектах сочетания ЛТ и иммунотерапии. Проведенный ранее небольшой ретроспективный анализ серии случаев продемонстрировал приемлемую переносимость и некоторое улучшение в ответе на лечение при сочетании иммунотерапии и ЛТ при различных формах заболевания [77,78]. На основе этих данных в настоящее время проводятся клинические исследования с участием пациентов с раком верхних отделов желудочно-кишечного тракта. Пембролизумаб в сочетании с ЛТ изучается для лечения пациентов с метастатическим раком пищевода [79], а также с раком желудка и ГЭП на поздних стадиях [80]. В качестве неоадъювантной терапии пембролизумаб, дурвалумаб, ниволумаб и ипилимумаб изучаются при их сочетании с химиолучевой терапией [81-83].
И, наконец, открытие опухолевых специфических антигенов позволяет говорить о специфических мишенях для новых видов иммунотерапии, в том числе о применении этих опухолевых специфических антигенов в клеточной терапии аутологичными Т-клетками, которые специфично связываются с данными антигенами у пациентов, опухоли которых их экспрессируют. Два наиболее часто встречающихся антигена, изученных в настоящий момент, которые экспрессируются при раке пищевода, – это ассоциированный с меланомой антиген 3 и NY-ESO-1. В 2017 г. Lu et al. [84] изучали случаи 17 пациентов с метастатическим раком, которые получали лечение с использованием главного комплекса гистосовместимости II – рестриктированного Т-клеточного рецептора, мишенью терапии был ассоциированный с меланомой эмбриональный раковый антиген 3. Пациенты получали лечение на базе противолимфоцитарной подготовительной терапии, после которого проводился адоптивный перенос очищенных CD4+ T-клеток, в которые с помощью ретровируса внедрялся Т-клеточный рецептор к ассоциированному с меланомой антигену 3, плюс системная терапия высокими дозами интерлейкина-2. Из девяти пациентов, которые получили самые высокие дозы, объективный частичный ответ наблюдался у пациента с раком пищевода (продолжительность – 4 месяца) [84]. Следует надеяться, что проходящие в настоящий момент исследования помогут выявить наилучшие сочетания при применении иммунотерапии, химиотерапии и/или лучевой терапии в оптимальных дозах и режимах.
Два наиболее часто встречающихся антигена, изученных в настоящий момент, которые экспрессируются при раке пищевода, – это ассоциированный с меланомой антиген 3 и NY-ESO-1. В 2017 г. Lu et al. [84] изучали случаи 17 пациентов с метастатическим раком, которые получали лечение с использованием главного комплекса гистосовместимости II – рестриктированного Т-клеточного рецептора, мишенью терапии был ассоциированный с меланомой эмбриональный раковый антиген 3. Пациенты получали лечение на базе противолимфоцитарной подготовительной терапии, после которого проводился адоптивный перенос очищенных CD4+ T-клеток, в которые с помощью ретровируса внедрялся Т-клеточный рецептор к ассоциированному с меланомой антигену 3, плюс системная терапия высокими дозами интерлейкина-2. Из девяти пациентов, которые получили самые высокие дозы, объективный частичный ответ наблюдался у пациента с раком пищевода (продолжительность – 4 месяца) [84]. Следует надеяться, что проходящие в настоящий момент исследования помогут выявить наилучшие сочетания при применении иммунотерапии, химиотерапии и/или лучевой терапии в оптимальных дозах и режимах.
PIK3CA
Сигнальный путь PI3K/Akt/mTOR играет важную роль в различных клеточных механизмах, таких как клеточный рост, клеточная пролиферация, трансляция белка и метаболизм. Нарушение регуляции этого пути, компонентом которого являются различные тирозинкиназы, часто наблюдается при многих опухолях. Это послужило основой для разработки разных видов таргетной терапии, которые воздействуют на звенья этого пути. Эти виды терапии испытывались на нескольких видах солидных опухолей, в том числе при раке желудка [85]. Согласно отчету АРГ, в 80% случаев EBV-ассоциированных опухолей и в 42% случаев MSI опухолей имеются мутации PIK3CA. Это дает основания предполагать, что данный сигнальный путь может служить потенциальной мишенью для новых видов терапии рака желудка.
В клиническом исследовании III фазы GRANITE, в котором изучался эверолимус для лечения пациентов с раком желудка на поздних стадиях, ранее получавших противоопухолевую терапию, улучшения выживаемости не происходило; однако в этом исследовании не изучались мутации PIK3CA, наличие мутаций PIK3CA у пациентов не проверялось и отбора пациентов по этому признаку не проводилось [34]. Перспективной тактикой лечения пациентов с раком желудка в будущем может стать предварительное определение мутации PIK3CA и проведение таргетной терапии, направленной на данный сигнальный путь, только пациентам с мутацией PIK3CA. Также в настоящее время для лечения рака желудка исследуются некоторые ингибиторы AKT, например, афуресертиб и AZD5363. Результаты этих исследований ожидаются в скором времени [5].
Перспективной тактикой лечения пациентов с раком желудка в будущем может стать предварительное определение мутации PIK3CA и проведение таргетной терапии, направленной на данный сигнальный путь, только пациентам с мутацией PIK3CA. Также в настоящее время для лечения рака желудка исследуются некоторые ингибиторы AKT, например, афуресертиб и AZD5363. Результаты этих исследований ожидаются в скором времени [5].
Ангиогенез
Важная роль образования новых сосудов в формировании и развитии резистентности злокачественных новообразований хорошо изучена [86]. VEGF, белок, представленный в различных изоформах, является стимулятором роста клеток эндотелия. Он в большом количестве экспрессируется в клетках различных солидных опухолей, особенно в зонах некроза и гипоксии. Гиперэкспрессия биомаркеров – факторов ангиогенеза ассоциируется с более агрессивным течением заболевания, таким образом, эти биомаркеры являются потенциальными мишенями при терапии рака желудка.
Бевацизумаб является анти-VEGF антителом, которое широко применяется при разных видах солидных опухолей, таких как колоректальный рак, рак яичников, рак молочной железы и рак легкого [85,87], однако при раке желудка его клиническая польза по-прежнему не определена. В клинических исследованиях III фазы AVATAR и AVAGAST клинического преимущества бевацизумаба при лечении рака желудка или ГЭП на поздних стадиях выявлено не было [29,30]. Тем не менее, рамуцирумаб, полностью человеческое моноклональное антитело, связывающееся с VEGFR-2, в клинических исследованиях III фазы REGARD [26] и RAINBOW [25] продемонстрировал клиническое преимущество при применении в качестве терапии второй линии у пациентов с раком желудка на поздних стадиях. В исследовании REGARD на фоне монотерапии рамуцирумабом в качестве второй линии терапии наблюдалось повышение ОВ в сравнении с оптимальной поддерживающей терапией. Медиана ОВ составила 5,2 мес. (межквартильный размах – 2,3-9,9 мес.) у пациентов группы рамуцирумаба и 3,8 мес. (межквартильный размах – 1,7-7,1 мес.) у пациентов группы плацебо (HR 0,776; 95% ДИ 0,603-0,998) [26]. В исследовании RAINBOW на фоне лечения рамуцирумабом в комбинации с паклитакселом наблюдалось повышение выживаемости без прогрессирования и ОВ по сравнению с группой лечения плацебо плюс паклитаксел.
В клинических исследованиях III фазы AVATAR и AVAGAST клинического преимущества бевацизумаба при лечении рака желудка или ГЭП на поздних стадиях выявлено не было [29,30]. Тем не менее, рамуцирумаб, полностью человеческое моноклональное антитело, связывающееся с VEGFR-2, в клинических исследованиях III фазы REGARD [26] и RAINBOW [25] продемонстрировал клиническое преимущество при применении в качестве терапии второй линии у пациентов с раком желудка на поздних стадиях. В исследовании REGARD на фоне монотерапии рамуцирумабом в качестве второй линии терапии наблюдалось повышение ОВ в сравнении с оптимальной поддерживающей терапией. Медиана ОВ составила 5,2 мес. (межквартильный размах – 2,3-9,9 мес.) у пациентов группы рамуцирумаба и 3,8 мес. (межквартильный размах – 1,7-7,1 мес.) у пациентов группы плацебо (HR 0,776; 95% ДИ 0,603-0,998) [26]. В исследовании RAINBOW на фоне лечения рамуцирумабом в комбинации с паклитакселом наблюдалось повышение выживаемости без прогрессирования и ОВ по сравнению с группой лечения плацебо плюс паклитаксел. ОВ была значимо выше в группе лечения комбинацией рамуцирумаб плюс паклитаксел по сравнению с группой плацебо плюс паклитаксел (медиана – 9,6 мес. [95% ДИ 8,5-10,8 мес.] в сравнении с 7,4 мес. [95% ДИ 6,3-8,4 мес.]; HR 0,807; 95% ДИ 0,678-0,962) [25].
ОВ была значимо выше в группе лечения комбинацией рамуцирумаб плюс паклитаксел по сравнению с группой плацебо плюс паклитаксел (медиана – 9,6 мес. [95% ДИ 8,5-10,8 мес.] в сравнении с 7,4 мес. [95% ДИ 6,3-8,4 мес.]; HR 0,807; 95% ДИ 0,678-0,962) [25].
ТКИ апатиниб блокирует VEGFR-2. Данный препарат продемонстрировал эффективность и безопасность в клинических исследованиях II и III фазы у пациентов с метастатическим раком желудка или раком желудка на поздних стадиях, с резистентностью к химиотерапии, что позволяет говорить о том, что препарат может потенциально служить терапией третьей или последующих линий [88]. Несмотря на положительные результаты предшествующих исследований, существуют некоторые опасения относительно клинической пользы рамуцирумаба и апатиниба при лечении рака желудка. Небольшое клиническое преимущество наблюдалось при лечении афатинибом (1,8 месяца) и рамуцирумабом (1,4-2,2 месяца), однако, возможно, дальнейшие исследования биомаркеров, комбинированной терапии, результатов секвенирования и поддерживающей терапии обеспечат более значимые результаты таргетной анти-VEGF терапии при раке желудка [89,90].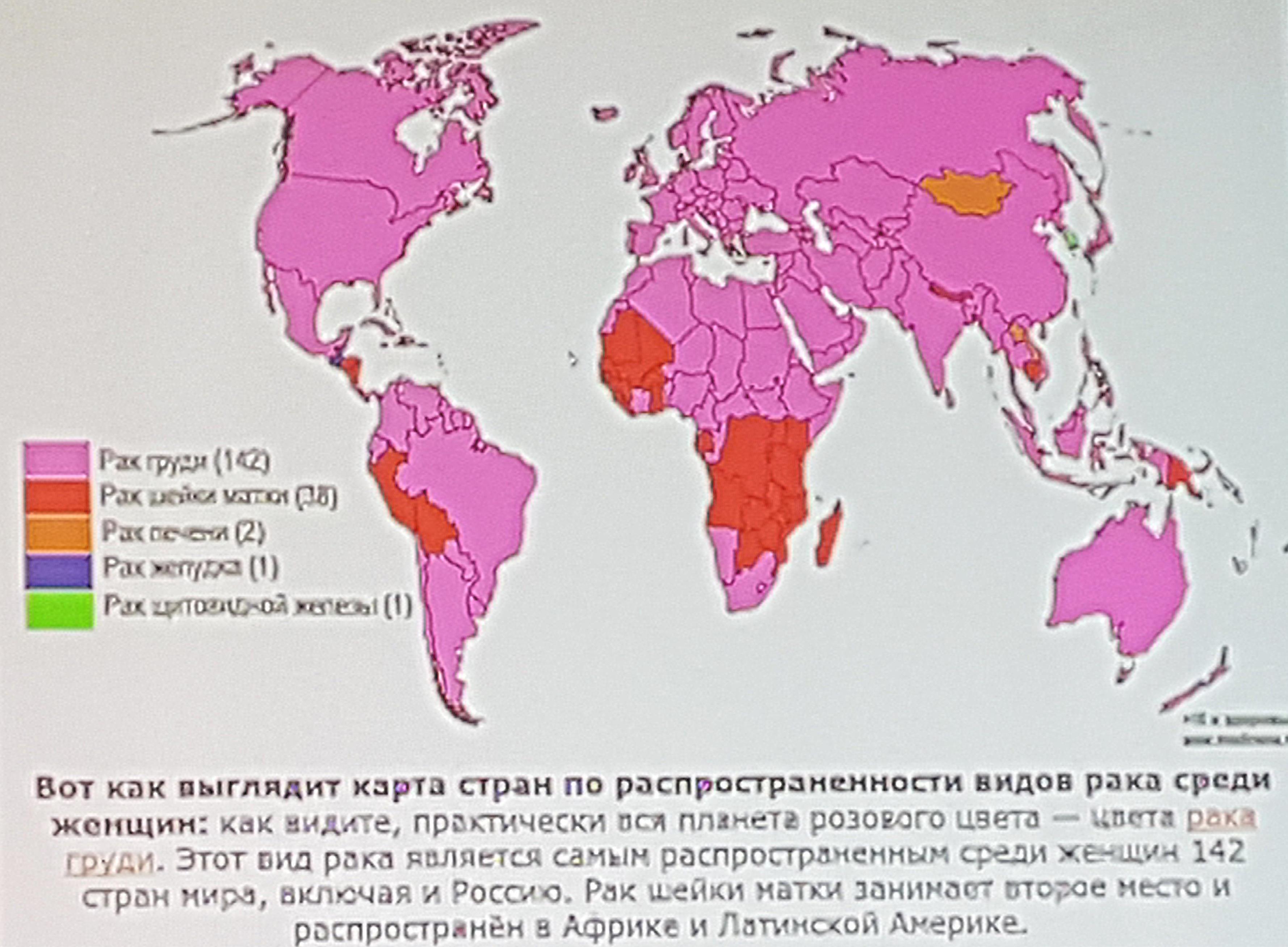
PARP
PARP – это группа ферментов, катализирующих АДФ-рибозилирование различных внутриклеточных белков [91]. Ферменты PARP участвуют в различных клеточных процессах, таких как транскрипция, репликация, рекомбинация и репарация ДНК [92]. Особенно важна их роль в репарации ДНК, поскольку некоторые опухоли, в которых поврежден механизм гомологичной рекомбинации, используют репарацию ДНК, опосредованную PARP, и могут быть чувствительны к ингибированию этого механизма репарации [93]. Ингибирование PARP уже занимает значимое место в лечении BRCA-ассоциированного рака молочной железы и рака яичников и может также играть важную роль в лечении других видов рака, таких как аденокарцинома желудка [94]. При раке желудка обнаруживается повышенная экспрессия PARP-1, что может говорить о более поздней стадии заболевания и менее благоприятном прогнозе.
После получения довольно многообещающих результатов в клиническом исследовании II фазы было проведено клиническое исследование III фазы GOLD, в котором на фоне лечения ингибитором PARP олапарибом значимого увеличения ОВ у пациентов с раком желудка на поздних стадиях, в том числе у группы пациентов с негативным результатом анализа на мутантный белок атаксии-телеангиэктазии, не отмечалось [33]. Возможно, причиной того, что в некоторых исследованиях конечные точки эффективности не были достигнуты, были особенности методов статистического анализа (например, определение статистически значимого p-значения < 0,025) и отсутствие стратификации по биомаркерам BRCA. Другие исследования, изучающие применение ингибиторов PARP для лечения рака желудка, к настоящему моменту не завершены. Клиническое исследование I фазы (NCT01123876) изучает применение ингибитора PARP велапариба в комбинации с FOLFIRI при раке желудка. В исследовании I/II фазы (NCT03008278) продолжается набор пациентов для оценки эффективности олапариба и рамуцирумаба (анти-VEGFR-2 антитело) при лечении пациентов с неоперабельным метастатическим или местнораспространенным рецидивирующим раком желудка или ГЭП. Новые комбинации препаратов и потенциальное использование биомаркеров для выбора тактики терапии являются теми проблемами, решение которых может изменить подход к лечению в ближайшем будущем.
Возможно, причиной того, что в некоторых исследованиях конечные точки эффективности не были достигнуты, были особенности методов статистического анализа (например, определение статистически значимого p-значения < 0,025) и отсутствие стратификации по биомаркерам BRCA. Другие исследования, изучающие применение ингибиторов PARP для лечения рака желудка, к настоящему моменту не завершены. Клиническое исследование I фазы (NCT01123876) изучает применение ингибитора PARP велапариба в комбинации с FOLFIRI при раке желудка. В исследовании I/II фазы (NCT03008278) продолжается набор пациентов для оценки эффективности олапариба и рамуцирумаба (анти-VEGFR-2 антитело) при лечении пациентов с неоперабельным метастатическим или местнораспространенным рецидивирующим раком желудка или ГЭП. Новые комбинации препаратов и потенциальное использование биомаркеров для выбора тактики терапии являются теми проблемами, решение которых может изменить подход к лечению в ближайшем будущем.
FGFR
Факторы роста фибробластов – это семейство протеинов, которые связываются с четырьмя видами трансмембранных тирозинкиназных рецепторов (FGFR) [95]. FGFR участвуют в различных внутриклеточных сигнальных каскадах, в том числе RAS-MAPK, PI3K-AKT и STAT, регулируя, таким образом, различные клеточные процессы, такие как пролиферация, клеточная миграция, выживание, дифференцировка и метаболизм [36,95]. Нарушение работы этих сигнальных путей, например, при амплификации генов, хромосомной транслокации или при мутациях, приводит к образованию опухолевых клеток, их выживанию, пролиферации и опухолевой инвазии, особенно при раке диффузного типа, как, например, в случае рака желудка [96].
FGFR участвуют в различных внутриклеточных сигнальных каскадах, в том числе RAS-MAPK, PI3K-AKT и STAT, регулируя, таким образом, различные клеточные процессы, такие как пролиферация, клеточная миграция, выживание, дифференцировка и метаболизм [36,95]. Нарушение работы этих сигнальных путей, например, при амплификации генов, хромосомной транслокации или при мутациях, приводит к образованию опухолевых клеток, их выживанию, пролиферации и опухолевой инвазии, особенно при раке диффузного типа, как, например, в случае рака желудка [96].
К настоящему моменту на сайте ClinicalTrials.gov зарегистрировано 11 исследований, в которых изучается анти-FGFR таргетная терапия при раке желудка. В исследовании II фазы SHINE изучалось применение AZD4547, ТКИ FGFR2, в сравнении с паклитакселом у пациентов с раком желудка с амплификацией/полисомией FGFR2. В данном исследовании улучшение по основной конечной точке эффективности, которой являлся показатель выживаемости без прогрессирования, не было доказано [97].
Некоторые препараты, такие как довитиниб, форетиниб и пазопаниб, являются мульти-ТКИ и ингибируют в том числе и FGFR [95]. Исследование II фазы (NCT01719549) изучало мульти-TKI довитиниб при лечении рака желудка у пациентов с амплификацией FGFR2. Другое исследование II фазы (NCT01921673) оценивало роль комбинированной терапии довитинибом с доцетакселом в качестве химиотерапии второй линии у пациентов с метастатическим или неоперабельным раком желудка. Оба исследования были завершены, однако их результаты еще не опубликованы. В настоящий момент непонятно, достаточно ли при применении таргетной терапии блокировать только один FGFR для лечения рака желудка, однако, возможно, будущее за препаратами, которые являются мульти-ТКИ и ингибируют FGFR наряду с другими киназными сигнальными путями.
ВЫВОДЫ И ДАЛЬНЕЙШИЕ ПЕРСПЕКТИВЫ
В настоящий момент лечение опухолей желудочно-кишечного тракта на поздних стадиях по-прежнему остается серьезной проблемой для онкологов и пациентов по всему миру. Злокачественные новообразования желудочно-кишечного тракта отличаются от других видов злокачественных опухолей, таких как рак простаты, рак легкого или меланома, поскольку до сих пор не существует всеохватывающих инновационных и эффективных методов лечения, основанных на драйверных мутациях и иммунотерапии. На сегодняшний день единственным подтвержденным предиктивным биомаркером, позволяющим определять тактику лечения пациентов, является экспрессия HER2. В настоящий момент существуют только два хорошо изученных препарата для лечения рака желудка на поздних стадиях: трастузумаб и рамуцирумаб. Не так давно в исследовании ATTRACTION-2 препарат ниволумаб продемонстрировал определенную эффективность при терапии опухолей желудочно-кишечного тракта на поздних стадиях у пациентов, получивших несколько линий химиотерапии в прошлом [54]. Новые принципы молекулярной классификации, как, например, классификация, предложенная АРГ, и классификация ACRG, призваны помочь выявлению потенциальных биомаркеров для разработки новых видов таргетной терапии, проведению новых клинических исследований, а также ретроспективного субанализа завершенных исследований.
Злокачественные новообразования желудочно-кишечного тракта отличаются от других видов злокачественных опухолей, таких как рак простаты, рак легкого или меланома, поскольку до сих пор не существует всеохватывающих инновационных и эффективных методов лечения, основанных на драйверных мутациях и иммунотерапии. На сегодняшний день единственным подтвержденным предиктивным биомаркером, позволяющим определять тактику лечения пациентов, является экспрессия HER2. В настоящий момент существуют только два хорошо изученных препарата для лечения рака желудка на поздних стадиях: трастузумаб и рамуцирумаб. Не так давно в исследовании ATTRACTION-2 препарат ниволумаб продемонстрировал определенную эффективность при терапии опухолей желудочно-кишечного тракта на поздних стадиях у пациентов, получивших несколько линий химиотерапии в прошлом [54]. Новые принципы молекулярной классификации, как, например, классификация, предложенная АРГ, и классификация ACRG, призваны помочь выявлению потенциальных биомаркеров для разработки новых видов таргетной терапии, проведению новых клинических исследований, а также ретроспективного субанализа завершенных исследований. В случае опухолей с амплификацией HER2 каскады VEGF, PARP, EGFR, PIK3CA и FGFR являются теми молекулярными сигнальными путями, которые потенциально могут служить мишенями для новых видов таргетных препаратов в ближайшем будущем. Однако для разработки этих новейших подходов необходимо проведение большого количества трансляционных и клинических исследований.
В случае опухолей с амплификацией HER2 каскады VEGF, PARP, EGFR, PIK3CA и FGFR являются теми молекулярными сигнальными путями, которые потенциально могут служить мишенями для новых видов таргетных препаратов в ближайшем будущем. Однако для разработки этих новейших подходов необходимо проведение большого количества трансляционных и клинических исследований.
Статья подготовлена редакцией газеты RUSSCO по материалам лекции Рамона Андраде де Мелло с соавторами на ежегодном конгрессе ASCO 2018.
Источники:
- Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015; 136: E359-E386. Medline, Google Scholar.
- Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018; 68: 7-30. Medline, Google Scholar.
- Corral JE, Delgado Hurtado JJ, Domínguez RL, et al. The descriptive epidemiology of gastric cancer in Central America and comparison with United States Hispanic populations.
 J Gastrointest Cancer. 2015; 46: 21-28. Medline, Google Scholar.
J Gastrointest Cancer. 2015; 46: 21-28. Medline, Google Scholar. - Irino T, Takeuchi H, Terashima M, et al. Gastric cancer in Asia: unique features and management. Am Soc Clin Oncol Educ Book. 2017; 37: 279-291. Google Scholar.
- Fontana E, Smyth EC. Novel targets in the treatment of advanced gastric cancer: a perspective review. Ther Adv Med Oncol. 2016; 8: 113-125. Google Scholar.
- De Mello RA. Gastric cancer in southern Europe: high-risk disease. Am Soc Clin Oncol Educ Book. 2017; 37: 261-266. Google Scholar.
- Sanchez FA. Best practices and practical nuances in the treatment of gastric cancer in high-risk global areas. Am Soc Clin Oncol Educ Book. 2017; 37: 258-260. Google Scholar.
- Edge SB, Compton CC. The American Joint Committee on Cancer: the 7th edition of the AJCC cancer staging manual and the future of TNM. Ann Surg Oncol. 2010; 6: 1471-1474. Google Scholar.
- Lauren P.
 The two histological main types of gastric carcinoma: diffuse and so‐called intestinal‐type carcinoma. Acta Pathol Microbiol Scand. 1965; 64: 31-49. Medline, Google Scholar.
The two histological main types of gastric carcinoma: diffuse and so‐called intestinal‐type carcinoma. Acta Pathol Microbiol Scand. 1965; 64: 31-49. Medline, Google Scholar. - Wang K, Kan J, Yuen ST, et al. Exome sequencing identifies frequent mutation of ARID1A in molecular subtypes of gastric cancer. Nat Genet. 2011; 43: 1219-1223. Medline, Google Scholar.
- Wang K, Yuen ST, Xu J, et al. Whole-genome sequencing and comprehensive molecular profiling identify new driver mutations in gastric cancer. Nat Genet. 2014; 46: 573-582. Medline, Google Scholar.
- Zang ZJ, Cutcutache I, Poon SL, et al. Exome sequencing of gastric adenocarcinoma identifies recurrent somatic mutations in cell adhesion and chromatin remodeling genes. Nat Genet. 2012; 44: 570-574. Medline, Google Scholar.
- Cancer Genome Atlas Research Network. Comprehensive molecular characterization of gastric adenocarcinoma. Nature. 2014; 513: 202-209. Medline, Google Scholar.

- Boussioutas A, Li H, Liu J, et al. Distinctive patterns of gene expression in premalignant gastric mucosa and gastric cancer. Cancer Res. 2003; 63: 2569-2577. Google Scholar.
- Tan IB, Ivanova T, Lim KH, et al. Intrinsic subtypes of gastric cancer, based on gene expression pattern, predict survival and respond differently to chemotherapy. Gastroenterology 2011; 2: 476-485. Google Scholar.
- Lei Z, Tan IB, Das K, et al. Identification of molecular subtypes of gastric cancer with different responses to PI3-kinase inhibitors and 5-fluorouracil. Gastroenterology. 2013; 145: 554-565. Google Scholar.
- Cristescu R, Lee J, Nebozhyn M, et al. Molecular analysis of gastric cancer identifies subtypes associated with distinct clinical outcomes. Nat Med. 2015;21:449-456. Medline, Google Scholar.
- Sohn BH, Hwang J-E, Jang H-J, et al. Clinical significance of four molecular subtypes of gastric cancer identified by The Cancer Genome Atlas Project.
 Clin Cancer Res. 2017; 15: 4441-4449. Google Scholar
Clin Cancer Res. 2017; 15: 4441-4449. Google Scholar - van der Post RS, Gullo I, Oliveira C, et al. Histopathological, molecular, and genetic profile of hereditary diffuse gastric cancer: current knowledge and challenges for the future. In Stem Cells, Pre-Neoplasia, and Early Cancer of the Upper Gastrointestinal Tract. New York: Springer, 2016; 371-391. Google Scholar.
- Shaib WL, Nammour JPA, Gill H, et al. The future prospects of immune therapy in gastric and esophageal adenocarcinoma. J Clin Med. 2016; 5: E100. Google Scholar.
- van Rossum PSN, Mohammad NH, Vleggaar FP, et al. Treatment for unresectable or metastatic oesophageal cancer: current evidence and trends. Nat Rev Gastroenterol Hepatol. Epub 2017 Dec 13. Google Scholar.
- Luis M, Tavares A, Carvalho LS, et al. Personalizing therapies for gastric cancer: molecular mechanisms and novel targeted therapies. World J Gastroenterol. 2013; 19: 6383-6397. Medline, Google Scholar.

- de Mello RA, Marques AM, Araújo A. HER2 therapies and gastric cancer: a step forward. World J Gastroenterol. 2013; 19: 6165-6169. Medline, Google Scholar.
- Bang Y-J, Van Cutsem E, Feyereislova A, et al; ToGA Trial Investigators. Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet. 2010; 376: 687-697. Medline, Google Scholar.
- Wilke H, Muro K, Van Cutsem E, et al; RAINBOW Study Group. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomised phase 3 trial. Lancet Oncol. 2014;15:1224-1235. Medline, Google Scholar.
- Fuchs CS, Tomasek J, Yong CJ, et al; REGARD Trial Investigators. Ramucirumab monotherapy for previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (REGARD): an international, randomised, multicentre, placebo-controlled, phase 3 trial.
 Lancet. 2014; 383: 31-39. Medline, Google Scholar.
Lancet. 2014; 383: 31-39. Medline, Google Scholar. - Hofmann M, Stoss O, Shi D, et al. Assessment of a HER2 scoring system for gastric cancer: results from a validation study. Histopathology. 2008; 52: 797-805. Medline, Google Scholar.
- Doi T, Shitara K, Naito Y, et al. Safety, pharmacokinetics, and antitumour activity of trastuzumab deruxtecan (DS-8201), a HER2-targeting antibody-drug conjugate, in patients with advanced breast and gastric or gastro-oesophageal tumours: a phase 1 dose-escalation study. Lancet Oncol. 2017; 18: 1512-1522. Google Scholar.
- Ohtsu A, Shah MA, Van Cutsem E, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a randomized, double-blind, placebo-controlled phase III study. J Clin Oncol. 2011; 29: 3968-3976. Link, Google Scholar.
- Shen L, Li J, Xu J, et al. Bevacizumab plus capecitabine and cisplatin in Chinese patients with inoperable locally advanced or metastatic gastric or gastroesophageal junction cancer: randomized, double-blind, phase III study (AVATAR study).
 Gastric Cancer. 2015; 18: 168-176. Google Scholar.
Gastric Cancer. 2015; 18: 168-176. Google Scholar. - Lordick F, Kang YK, Chung HC, et al; Arbeitsgemeinschaft Internistische Onkologie and EXPAND Investigators. Capecitabine and cisplatin with or without cetuximab for patients with previously untreated advanced gastric cancer (EXPAND): a randomised, open-label phase 3 trial. Lancet Oncol. 2013; 14: 490-499. Medline, Google Scholar.
- Thuss-Patience PC, Shah MA, Ohtsu A, et al. Trastuzumab emtansine versus taxane use for previously treated HER2-positive locally advanced or metastatic gastric or gastro-oesophageal junction adenocarcinoma (GATSBY): an international randomised, open-label, adaptive, phase 2/3 study. Lancet Oncol. 2017; 18: 640-653. Google Scholar.
- Bang Y-J, Xu R-H, Chin K, et al. Olaparib in combination with paclitaxel in patients with advanced gastric cancer who have progressed following first-line therapy (GOLD): a double-blind, randomised, placebo-controlled, phase 3 trial.
 Lancet Oncol. 2017; 18: 1637-1651. Google Scholar.
Lancet Oncol. 2017; 18: 1637-1651. Google Scholar. - Ohtsu A, Ajani JA, Bai Y-X, et al. Everolimus for previously treated advanced gastric cancer: results of the randomized, double-blind, phase III GRANITE-1 study. J Clin Oncol. 2013; 31: 3935-3943. Link, Google Scholar.
- Hecht JR, Bang Y-J, Qin SK, et al. Lapatinib in combination with capecitabine plus oxaliplatin in human epidermal growth factor receptor 2–positive advanced or metastatic gastric, esophageal, or gastroesophageal adenocarcinoma: TRIO-013/LOGiC—a randomized phase III trial. J Clin Oncol. 2016; 34: 443-451. Link, Google Scholar.
- Waddell T, Chau I, Cunningham D, et al. Epirubicin, oxaliplatin, and capecitabine with or without panitumumab for patients with previously untreated advanced oesophagogastric cancer (REAL3): a randomised, open-label phase 3 trial. Lancet Oncol. 2013; 14: 481-489. Medline, Google Scholar.
- Catenacci DVT, Tebbutt NC, Davidenko I, et al.
 Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1467-1482. Medline, Google Scholar.
Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1467-1482. Medline, Google Scholar. - Satoh T, Xu R-H, Chung HC, et al. Lapatinib plus paclitaxel versus paclitaxel alone in the second-line treatment of HER2-amplified advanced gastric cancer in Asian populations: TyTAN—a randomized, phase III study. J Clin Oncol. 2014; 32: 2039-2049. Link, Google Scholar.
- Van Cutsem E, de Haas S, Kang YK, et al. Bevacizumab in combination with chemotherapy as first-line therapy in advanced gastric cancer: a biomarker evaluation from the AVAGAST randomized phase III trial. J Clin Oncol. 2012; 30: 2119-2127. Link, Google Scholar.
- Tabernero J, Hoff P, Shen L, et al. 616O: pertuzumab (P)+ trastuzumab (H)+ chemotherapy (CT) for HER2-positive metastatic gastric or gastro-oesophageal junction cancer (mGC/GEJC): final analysis of a phase III study (JACOB). Ann Oncol. 2017;28(suppl_5):mdx369. Google Scholar.
- Lieto E, Ferraraccio F, Orditura M, et al. Expression of vascular endothelial growth factor (VEGF) and epidermal growth factor receptor (EGFR) is an independent prognostic indicator of worse outcome in gastric cancer patients. Ann Surg Oncol. 2008; 15: 69-79. Medline, Google Scholar.
- Lazăr DC, Tăban S, Cornianu M, et al. New advances in targeted gastric cancer treatment. World J Gastroenterol. 2016; 22: 6776-6799. Google Scholar.
- Satoh T, Lee KH, Rha SY, et al. Randomized phase II trial of nimotuzumab plus irinotecan versus irinotecan alone as second-line therapy for patients with advanced gastric cancer. Gastric Cancer. 2015; 18: 824-832. Medline, Google Scholar.
- Dutton SJ, Ferry DR, Blazeby JM, et al. Gefitinib for oesophageal cancer progressing after chemotherapy (COG): a phase 3, multicentre, double-blind, placebo-controlled randomised trial. Lancet Oncol. 2014; 15: 894-904. Medline, Google Scholar.
- Lawrence MS, Stojanov P, Polak P, et al. Mutational heterogeneity in cancer and the search for new cancer-associated genes. Nature. 2013; 499: 214-218. Medline, Google Scholar.
- Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012; 12: 252-264. Medline, Google Scholar.
- Michot JM, Bigenwald C, Champiat S, et al. Immune-related adverse events with immune checkpoint blockade: a comprehensive review. Eur J Cancer. 2016;54:139-148. Medline, Google Scholar.
- Derks S, Nason KS, Liao X, et al. Epithelial PD-L2 expression marks Barrett’s esophagus and esophageal adenocarcinoma. Cancer Immunol Res. 2015; 3: 1123-1129. Medline, Google Scholar.
- Ohigashi Y, Sho M, Yamada Y, et al. Clinical significance of programmed death-1 ligand-1 and programmed death-1 ligand-2 expression in human esophageal cancer. Clin Cancer Res. 2005; 11: 2947-2953. Medline, Google Scholar.
- Kudo T, Hamamoto Y, Kato K, et al. Nivolumab treatment for oesophageal squamous-cell carcinoma: an open-label, multicentre, phase 2 trial. Lancet Oncol. 2017; 18: 631-639. Medline, Google Scholar.
- Fuchs CS, Doi T, Jang RW-J, et al. KEYNOTE-059 cohort 1: efficacy and safety of pembrolizumab (pembro) monotherapy in patients with previously treated advanced gastric cancer. J Clin Oncol. 2017; 15: 4003. Google Scholar.
- Ohtsu A, Tabernero J, Bang Y-J, et al. Pembrolizumab (MK-3475) versus paclitaxel as second-line therapy for advanced gastric or gastroesophageal junction (GEJ) adenocarcinoma: phase 3 KEYNOTE-061 study. J Clin Oncol. 2016; 4 (4_suppl): TPS183. Google Scholar.
- Kojima T, Hara H, Yamaguchi K, et al. Phase II study of nivolumab (ONO-4538/BMS-936558) in patients with esophageal cancer: preliminary report of overall survival. J Clin Oncol. 2016; 4 (4_suppl): TPS175. Google Scholar.
- Kang Y-K, Boku N, Satoh T, et al. Nivolumab in patients with advanced gastric or gastro-oesophageal junction cancer refractory to, or intolerant of, at least two previous chemotherapy regimens (ONO-4538-12, ATTRACTION-2): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet. 2017; 390: 2461-2471. Medline, Google Scholar.
- NCT02569242. Study of Nivolumab in Unresectable Advanced or Recurrent Esophageal Cancer. clinicaltrials.gov/ct2/show/NCT02569242. Accessed March 12, 2018. Google Scholar.
- Krummel MF, Allison JP. CD28 and CTLA-4 have opposing effects on the response of T cells to stimulation. J Exp Med. 1995; 182: 459-465. Medline, Google Scholar.
- Ralph C, Elkord E, Burt DJ, et al. Modulation of lymphocyte regulation for cancer therapy: a phase II trial of tremelimumab in advanced gastric and esophageal adenocarcinoma. Clin Cancer Res. 2010; 16: 1662-1672. Google Scholar.
- Janjigian YY, Ott PA, Calvo E, et al. Nivolumab±ipilimumab in pts with advanced (adv)/metastatic chemotherapy-refractory (CTx-R) gastric (G), esophageal (E), or gastroesophageal junction (GEJ) cancer: CheckMate 032 study. J Clin Oncol. 2017; 15: 4014. Google Scholar.
- NCT02476123. Phase 1 Study of Combination Therapy With Mogamulizumab (KW-0761) and Nivolumab (ONO-4538/BMS-936558) in Subjects With Advanced Solid Tumors. clinicaltrials.gov/ct2/show/NCT02476123. Accessed March 12, 2018. Google Scholar.
- UMIN000021480. Phase I Study of Pre-Operative Combination Therapy With Mogamulizumab (Anti-CCR4) and Nivolumab (Anti-PD-1) Against Solid Cancer Patients. upload.umin.ac.jp/cgi-open-bin/ctr_e/ctr_view.cgi?recptno=R000024753. Accessed March 12, 2018. Google Scholar.
- NCT02460224. Safety and Efficacy of LAG525 Single Agent and in Combination with PDR001 in Patients With Advanced Malignancies. clinicaltrials.gov/ct2/show/NCT02460224. Accessed March 12, 2018. Google Scholar.
- NCT02340975. A Phase 1b/2 Study of MEDI4736 With Tremelimumab, MEDI4736 or Tremelimumab Monotherapy in Gastric or GEJ Adenocarcinoma. clinicaltrials.gov/ct2/show/NCT02340975. Accessed March 12, 2018. Google Scholar.
- Banissi C, Ghiringhelli F, Chen L, et al. Treg depletion with a low-dose metronomic temozolomide regimen in a rat glioma model. Cancer Immunol Immunother. 2009;58:1627-1634. Medline, Google Scholar.
- Ercolini AM, Ladle BH, Manning EA, et al. Recruitment of latent pools of high-avidity CD8(+) T cells to the antitumor immune response. J Exp Med. 2005; 201: 1591-1602. Medline, Google Scholar.
- Schiavoni G, Mattei F, Di Pucchio T, et al. Cyclophosphamide induces type I interferon and augments the number of CD44(hi) T lymphocytes in mice: implications for strategies of chemoimmunotherapy of cancer. Blood. 2000; 95: 2024-2030. Medline, Google Scholar.
- Machiels J-PH, Reilly RT, Emens LA, et al. Cyclophosphamide, doxorubicin, and paclitaxel enhance the antitumor immune response of granulocyte/macrophage-colony stimulating factor-secreting whole-cell vaccines in HER-2/neu tolerized mice. Cancer Res. 2001; 61: 3689-3697. Medline, Google Scholar.
- Chen G, Emens LA. Chemoimmunotherapy: reengineering tumor immunity. Cancer Immunol Immunother. 2013; 62: 203-216. Google Scholar.
- Peng J, Hamanishi J, Matsumura N, et al. Chemotherapy induces programmed cell death-ligand 1 overexpression via the nuclear factor-κB to foster an immunosuppressive tumor microenvironment in ovarian cancer. Cancer Res. 2015; 75: 5034-5045. Google Scholar.
- NCT03143153. A Study to Evaluate Efficacy in Subjects With Esophageal Cancer Treated With Nivolumab and Ipilimumab or Nivolumab Combined With Fluorouracil Plus Cisplatin Versus Fluorouracil Plus Cisplatin (CheckMate 648). clinicaltrials.gov/ct2/show/NCT03143153. Accessed March 12, 2018. Google Scholar.
- NCT02494583. Study of Pembrolizumab (MK-3475) as First-Line Monotherapy and Combination Therapy for Treatment of Advanced Gastric or Gastroesophageal Junction Adenocarcinoma (MK-3475-062/KEYNOTE-062). clinicaltrials.gov/ct2/show/NCT02494583. Accessed March 12, 2018. Google Scholar.
- NCT03221426. Study of Pembrolizumab (MK-3475) Plus Chemotherapy Versus Placebo Plus Chemotherapy in Participants With Gastric or Gastroesophageal Junction (GEJ) Adenocarcinoma (MK-3475-585/KEYNOTE-585). clinicaltrials.gov/ct2/show/NCT03221426. Accessed March 12, 2018. Google Scholar.
- Corso CD, Ali AN, Diaz R. Radiation-induced tumor neoantigens: imaging and therapeutic implications. Am J Cancer Res. 2011; 1: 390-412. Google Scholar.
- Kaur P, Asea A. Radiation-induced effects and the immune system in cancer. Front Oncol. 2012; 2: 191. Google Scholar.
- Deng L, Liang H, Burnette B, et al. Irradiation and anti-PD-L1 treatment synergistically promote antitumor immunity in mice. J Clin Invest. 2014; 124: 687-695. Medline, Google Scholar.
- Verbrugge I, Hagekyriakou J, Sharp LL, et al. Radiotherapy increases the permissiveness of established mammary tumors to rejection by immunomodulatory antibodies. Cancer Res. 2012; 72: 3163-3174. Medline, Google Scholar.
- Zeng J, See AP, Phallen J, et al. Anti-PD-1 blockade and stereotactic radiation produce long-term survival in mice with intracranial gliomas. Int J Radiat Oncol Biol Phys. 2013; 86: 343-349. Medline, Google Scholar.
- Kwon ED, Drake CG, Scher HI, et al; CA184-043 Investigators. Ipilimumab versus placebo after radiotherapy in patients with metastatic castration-resistant prostate cancer that had progressed after docetaxel chemotherapy (CA184-043): a multicentre, randomised, double-blind, phase 3 trial. Lancet Oncol. 2014; 15: 700-712. Medline, Google Scholar.
- Qin R, Olson A, Singh B, et al. Safety and efficacy of radiation therapy in advanced melanoma patients treated with ipilimumab. Int J Radiat Oncol Biol Phys. 2016; 96: 72-77. Google Scholar.
- NCT02642809. Pembrolizumab With Locally Delivered Radiation Therapy for the Treatment of Metastatic Esophageal Cancers. clinicaltrials.gov/ct2/show/NCT02642809. Accessed March 12, 2018. Google Scholar.
- NCT02830594. Pembrolizumab and Palliative Radiation Therapy in Treating Patients With Metastatic Esophagus, Stomach, or Gastroesophageal Junction Cancer. clinicaltrials.gov/ct2/show/NCT02830594. Accessed March 12, 2018. Google Scholar.
- NCT02735239. Study of Anti-PD-L1 in Combination With Chemo(radio)therapy for Oesophageal Cancer. clinicaltrials.gov/ct2/show/NCT02735239. Accessed March 12, 2018. Google Scholar.
- NCT02730546. Pembrolizumab, Combination Chemotherapy, and Radiation Therapy Before Surgery in Treating Adult Patients With Locally Advanced Gastroesophageal Junction or Gastric Cardia Cancer That Can Be Removed by Surgery. clinicaltrials.gov/ct2/show/NCT02730546. Accessed March 12, 2018. Google Scholar.
- NCT03044613. Nivolumab or Nivolumab/Ipilimumab Prior to Chemoradiation Plus Nivolumab With II/III Gastro/Esophageal Cancer. clinicaltrials.gov/ct2/show/NCT03044613. Accessed March 12, 2018. Google Scholar.
- Lu Y-C, Parker LL, Lu T, et al. Treatment of patients with metastatic cancer using a major histocompatibility complex class II–restricted T-cell receptor targeting the cancer germline antigen MAGE-A3. J Clin Oncol. 2017; 35: 3322-3329. Link, Google Scholar.
- Marques I, Araújo A, de Mello RA. Anti-angiogenic therapies for metastatic colorectal cancer: current and future perspectives. World J Gastroenterol. 2013; 19: 7955-7971. Google Scholar.
- Hanahan D, Weinberg RA. Hallmarks of cancer: the next generation. Cell. 2011; 144: 646-674. Medline, Google Scholar.
- de Mello RA, Costa BM, Reis RM, Hespanhol V. Insights into angiogenesis in non-small cell lung cancer: molecular mechanisms, polymorphic genes, and targeted therapies. Recent Pat Anticancer Drug Discov. 2012; 7: 118-131. Medline, Google Scholar.
- Zhang Y, Han C, Li J, et al. Efficacy and safety for apatinib treatment in advanced gastric cancer: a real world study. Sci Rep. 2017; 7: 13208. Google Scholar.
- de Mello RA, de Oliveira J, Antoniou G. Angiogenesis and apatinib: a new hope for patients with advanced gastric cancer? Future Oncol. 2017; 13: 295-298. Google Scholar.
- Ilson DH. Targeting the vascular endothelial growth factor pathway in gastric cancer: a hit or a miss? J Clin Oncol. 2016; 34: 1431-1432. Link, Google Scholar.
- Park S-H, Jang KY, Kim MJ, et al. Tumor suppressive effect of PARP1 and FOXO3A in gastric cancers and its clinical implications. Oncotarget. 2015; 6: 44819-44831. Google Scholar.
- Qin Q, Lu J, Zhu H, et al. PARP-1 Val762Ala polymorphism and risk of cancer: a meta-analysis based on 39 case-control studies. PLoS One. 2014; 9: e98022. Google Scholar.
- Morales J, Li L, Fattah FJ, et al. Review of poly (ADP-ribose) polymerase (PARP) mechanisms of action and rationale for targeting in cancer and other diseases. Crit Rev Eukaryot Gene Expr. 2014; 24: 15-28. Google Scholar.
- Verdaguer H, Saurí T, Macarulla T. Predictive and prognostic biomarkers in personalized gastrointestinal cancer treatment. J Gastrointest Oncol. 2017; 8: 405-417. Google Scholar.
- Hierro C, Alsina M, Sánchez M, et al. Targeting the fibroblast growth factor receptor 2 in gastric cancer: promise or pitfall? Ann Oncol. 2017; 28: 1207-1216. Google Scholar.
- Carlomagno N, Incollingo P, Tammaro V, et al. Diagnostic, predictive, prognostic, and therapeutic molecular biomarkers in third millennium: a breakthrough in gastric cancer. BioMed Res Int. 2017; 2017: 7869802. Google Scholar.
- Van Cutsem E, Bang Y-J, Mansoor W, et al. A randomized, open-label study of the efficacy and safety of AZD4547 monotherapy versus paclitaxel for the treatment of advanced gastric adenocarcinoma with FGFR2 polysomy or gene amplification. Ann Oncol. 2017; 28: 1316-1324. Google Scholar.
Почему в России и Японии так много рака желудка
О масштабе проблемы рассказывает хирург-онколог Городского клинического онкологического диспансера Эдуард Каливо.
Удар по мужчинам
Врачи определили пятерку стран-лидеров, на которые приходится 40% всех случаев рака желудка в мире. Это Япония, Корея, Китай, Чили и Россия.
Лидером является Япония – там заболеваемость в два раза превышает наши показатели. При этом в Стране восходящего солнца самая высокая выявляемость этого рака и самая высокая выживаемость – более 53%.
Самые низкие показатели – в США, Австралии, Новой Зеландии.
В России ежегодно регистрируется 40 тысяч новых случаев рака желудка. Больше всего этот вид рака выявляют в Новгородской области, Туве, а меньше – на Северном Кавказе, Чукотке и в Магаданской области.
«При этом мужчины болеют раком желудка вдвое чаще женщин», – говорит Эдуард Каливо.
Факторы риска
Исследования по сравнению регионов с высокой и низкой заболеваемостью раком желудка выявили взаимосвязь между особенностями питания и заболеваемостью.
Российские картошка и хлеб, азиатский рис вытесняют из меню свежие овощи и фрукты. Добавляет факторов риска повышенное потребление соли, маринованных, пережаренных, копченых продуктов. В 2,5 раза выше риск заболеть у ежедневно употребляющих животное масло по сравнению с любителями растительного.
Любопытно, что в 1930-е годы в США рак желудка занимал первое место в структуре заболеваемости. Затем Америка стала переходить на технологии замораживания вместо маринования и копчения как способа сохранения продуктов, это повлияло на резкое снижение заболеваемости. Примечательно, что благодаря улучшению рациона питания заболеваемость раком желудка во всем мире снизилась.
Спросите дедушку
В группе риска находятся люди, имеющие заболевших раком желудка родственников 1-й или 2-й линии. Генетический фактор был заподозрен в связи с тем, что у лиц с группой крови A (II) заболеваемость выше на 20%, чем у лиц с другими группами крови. Был выявлен мутантный ген, наличие которого резко повышает вероятность развития этого рака.
Онкологи также считают трагической ошибкой недооценку такого диагноза, как «гастрит». Со временем пациенты перестают обращаться к врачу, отказываются от ежегодной гастроскопии, принимают медикаменты «от боли в желудке». А ведь наибольший риск развития рака желудка как раз у тех, кто в молодом возрасте заболел хроническим гастритом.
«В нашем городе за 20 лет отмечено снижение заболеваемости раком желудка на 42%. В общей сложности под наблюдением врачей находятся около 125 тысяч онкобольных», – рассказал Эдуард Каливо.
Минздрав сообщил о самых распространенных видах рака в России :: Общество :: РБК
Рак кожи стал самым часто диагностируемым онкологическим заболеванием в России в 2017 году, следует из данных Минздрава. В целом число заболеваний раком выросло. Причина в том, что их стали лучше распознавать, говорит эксперт
Фото: Андрей Луковский / «Коммерсантъ»
Печальная тройка
Самое распространенное онкологическое заболевание в России в 2017 году — рак кожи, следует из данных, опубликованных в ежегодном статистическом сборнике Министерства здравоохранения.
При этом общее количество диагнозов по онкологическим заболеваниям в 2017-м увеличилось год к году на 3%, с 599,3 тыс. до 617,2 тыс. случаев (Минздрав с 2011 года учитывает не число пациентов, а количество обнаруженных заболеваний).
Новообразования кожи помимо меланомы были обнаружены в прошлом году у 78 тыс. россиян, меланома — еще у 11,2 тыс., всего более 89 тыс. случаев онкологических заболеваний кожи. Тот же диагноз — новообразования кожи — был самым распространенным и в 2014–2016 годах. В 2016-м рак кожи обнаружили у 74,7 тыс. человек, меланому — у 10,5 тыс. человек.
На втором месте по частоте обнаружения — рак груди. В 2017 году этот диагноз поставили 70,6 тыс. раз. За последние пять лет такие новообразования стали выявлять на 16,2% чаще.
На третьем месте — рак трахеи, бронхов и легких: в 2017 году диагностировано 62,2 тыс. случаев.
Можно ли избежать
Рак кожи — общемировая проблема, отметил в разговоре с РБК директор Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова Алексей Беляев. Но это заболевание достаточно легко лечится и не вызывает метастазов, главное — обнаружить его на ранней стадии, заметил эксперт. Меланома сложнее в лечении и вызывает метастазы. Для профилактики этих заболеваний Беляев рекомендует избегать долгого пребывания на солнце и отказаться от использования солярия.
«К сожалению, в 1970-х годах загар был популяризирован, много говорилось о пользе загара, детей кварцевали. Все это продолжает сейчас сказываться на заболеваемости этим видом рака», — заметил эксперт.
Основные причины появления рака груди и рака дыхательных органов одни и те же — наследственная предрасположенность и нарушение информационных характеристик ДНК, отметил в разговоре с РБК заслуженный врач России, заведующий отделением онкологии Скандинавского центра здоровья Андрей Коржиков. Среди причин, влияющих на возникновение заболевания, он называет также климатические условия и уровень радиационной нагрузки. «Когда эти факторы суммируются в одном организме, то они нацеливаются на одну мишень — на нарушение структуры ДНК, нарушение ее информационных характеристик. Обязательное условия для скоротечных форм рака — это стрессовые ситуации, тогда все эти механизмы на фоне стресса обостряются», — добавил эксперт.
Среди причин распространенности рака молочной железы Коржиков называет гормональные сдвиги, аборты и применение гормональных препаратов. Рак груди при раннем обнаружении тоже излечим, говорит Беляев. «Сейчас выделяют около 30 видов рака груди. И все они по-разному реагируют на терапию, по-разному развиваются. В целом за последние 25 лет этот рак стали лечить гораздо лучше», — сказал он.
Беляев считает, что увеличение числа диагностированных онкологических заболеваний не может говорить о том, что россияне стали болеть больше. «Я, как онколог, могу сказать: нет, люди не стали больше болеть раком, но его стали лучше находить. Кроме того, до своей онкологии стали доживать те пожилые люди, которые в том числе благодаря развитию медицины смогли избежать инфаркта или инсульта», — указал он.
Смертельная статистика
Онкологию все реже указывают в качестве причины смерти людей, у которых была злокачественная опухоль, следует из данных сборника Минздрава. В 2017 году в 30% случаев, когда умирал человек с онкологическим заболеванием, в качестве причины смерти не указывался рак, в 2013-м этот показатель составлял 23,6%, в 1993 году — 11,6%. Иными словами, 25 лет назад 88% умерших, имевших злокачественное новообразование, умирали именно от него, а в 2017 году онкологическое заболевание оказалось причиной смерти для 70% умерших.
«Раньше, если был диагноз «рак», чем бы человек еще ни болел, ему ставили причину смерти именно онкологию. Сейчас отслеживают злокачественные опухоли, пытаются разобраться в причине смерти и исключить необоснованные заключения о раке как причине смерти», — пояснил директор Национального медицинского исследовательского центра онкологии им. Н.Н. Петрова Алексей Беляев.
Выявляемость и смертность
Число умерших от злокачественных новообразований россиян в 2017 году составило 274,2 тыс. человек — почти столько же, сколько в 2015-м, когда в России был поставлен рекорд смертности от рака за 11-летний период. 22,5% пациентов, у которых впервые диагностировали злокачественное новообразование, умерли в первый же год после диагностики. Доля таких пациентов уменьшается: десять лет назад их было почти 30%, 20 лет назад — более 36%. Злокачественные новообразования на первой и второй стадиях стали выявлять на 1,5% чаще, чем в 2016 году.
По сравнению с 2016 годом в России стали чаще выявлять рак тестикул — на 13,2% случаев больше в 2017-м и пениса — на 7,4% больше.
Выявляемость в регионах
Самый большой рост числа новых пациентов с онкологическими заболеваниями зафиксирован в Хабаровском крае — 6,2 тыс. впервые выявленных злокачественных новообразований. Это на 14% больше, чем годом ранее.
Много новых пациентов также в Амурской области — там рост числа выявленных заболевших составил 11%. Реже, чем в 2016 году, стали выявлять злокачественные новообразования в Ленинградской области (на 9,7%) и в Адыгее (на 9,6%).
Самый высокий уровень онкологических заболеваний в 2017 году был в Курской области. Под диспансерным наблюдением в онкоцентрах там находятся 32,4 тыс. человек на миллион, то есть более 3% населения. Такая же ситуация была и в 2016 году. Более 3% населения состоит на учете в онкодиспансерах в Краснодарском крае и Мордовии. В Ингушетии число находящихся под диспансерным наблюдением в онкоцентрах увеличилось по сравнению с 2016-м почти на 11%.
В Севастополе зафиксировано самое существенное по России уменьшение доли населения, находящегося под наблюдением в онкодиспансерах, — с 3,2% в 2016 году до 2,8% в 2017-м.
Как Helicobacter pylori вызывает рак желудка
Специалисты из FAU расшифровали механизмы развития рака под воздействием бактерии.
Рак желудка входит в число пяти наиболее фатальных типов онкопатологии. Согласно статистике Всемирной организации здравоохранения (ВОЗ), около 750 000 пациентов ежегодно умирают вследствие развития этого заболевания. Основной причиной считают жизнедеятельность бактерии Helicobacter pylori (H. pylori). В настоящее время не существует эффективной терапии рака желудка, и быстрое распространение резистентных к антибиотикам штаммов дополнительно усложняет лечение инфекции.
Исследователи из Университета Эрлангена и Нюрнберга (Friedrich-Alexander-Universität Erlangen-Nürnberg, FAU) идентифицировали два механизма, посредством которых бактерия может вызывать рак желудка. Эти результаты открывают пути к разработке новых терапевтических подходов.
Международная команда ученых, руководимая доктором Николь Тегтмайер, на базе кафедры микробиологии Университета FAU исследовала процесс разрушения защитной оболочки инфицированного бактерией желудка. Этот плотный протекторный слой образован скученно расположенными эпителиальными клетками, которые защищают желудок от воздействия кислоты, содержащейся в желудочном соке. Как показывают результаты исследования, H. pylori вырабатывает специфический энзим, – протеолитический фермент (протеиназу), получивший название HtrA, – который используется бактерией как своего рода осадное орудие для проникновения сквозь заградительный слой. HtrA расщепляет три белка: окклюдин, клаудин-8 и E-кадгерин, разъедая слой эпителиальных клеток. В результате Helicobacter pylori может достичь более глубоких, в норме недоступных патогенам тканевых слоев, и нанести более серьезный ущерб. Это является первым шагом к запуску развития рака желудка.
Однако за первой фазой, как описывается в публикации, следует вторая, еще более опасная. Иглоподобные структурные элементы бактерии, названные секреторной системой IV типа, активируются к выполнению функции «молекулярного шприца». Используя рецепторно-зависимый механизм, они впрыскивают бактериальный токсин, – белок CagA, – сквозь базально-латеральные мембраны клеток-хозяев. Внедренный CagA последовательно перепрограммирует клетки, делая их потенциально онкогенными. Другой эффект данного белка состоит в том, что он не позволяет иммунной системе человека распознавать и уничтожать бактерии – что и является критически важным фактором долгосрочной выживаемости H. pylori в человеческом желудке.
Доктор Тегтмайер предполагает, что эти результаты создадут возможность разработки качественно новой методологии антибактериальной терапии, мишенями которой станут фермент HtrA и протеин CagA. Исследовательская группа уже приступила к испытаниям некоторых ингибиторов HtrA. «Мы надеемся, – поясняет Н.Тегтмайер, – что адекватно подобранный активный агент сможет либо полностью подавлять инфекцию, либо угнетать внедрение CagA».
Работа опубликована в журнале «Cell Host & Microbe» (2017; 22 (4)).По материалам сайта Science Daily
Профилактика онкологических заболеваний
|
Совместная борьба с онкологией Рак на протяжении многих лет является второй по значимости причиной смертности в России. Поэтому противодействие онкологическим заболеваниям является одной из приоритетных для медицинского сообщества. Как решается данная задача в Димитровграде? Этот вопрос мы адресовали Искандеру ГакифовичуШарафутдинову, заведующему первичным онкологическим отделением производственной поликлиники ФГБУЗ КБ №172 ФМБА России. |
Природа рака сложная, по этой причине мировая медицинская наука до сих пор не определила все причины, которые приводят человека к онкологическим заболеваниям. Но накопленный огромный опыт позволяет специалистам эффективно лечить многие виды рака.
Во всем мире с онкологией борются исходя из принципа «болезнь легче предупредить, чем лечить». Как показывают научные исследования, наряду с наследственной предрасположенностью, появление рака провоцируют образ жизни человека, стрессы и экология.
К сожалению, пока большинство людей снисходительно относятся к рекомендациям врачей вести здоровый образ жизни. Между тем, это очень важно! Вы должны понять сами и донести до близких, что здоровый образ жизни помогает организму поставить барьер для многих видов онкологических заболеваний. Наверное, для некоторых, в силу имеющихся привычек, будет трудно отказаться от курения, злоупотребления алкоголем, но это надо сделать ради здоровья. Кроме того, нельзя переедать. Надо принимать здоровую, богатую белками, углеводами, жирами и микроэлементами пищу. Следует регулярно, лучше ежедневно, включать в рацион фрукты и овощи. Необходимо больше времени проводить на свежем воздухе, занимаясь физкультурой, например, рано утром или вечером ходить в среднем темпе не менее 45 минут. Надо научиться защищать себя от отрицательных эмоций. Кому-то в этом может помочь чтение книг, просмотр фильмов, посещение концертов и спектаклей, общение с близкими людьми. Надеюсь, что эти рекомендации вы не отложите на послезавтра, а начнете применять уже сегодня.
Чтобы вам было понятно, что рак это ни нечто далекое и вас не касающиеся, приведу несколько цифр медицинской статистики. В Димитровграде проживает порядка 120 тысяч человек. Так вот ежегодно в нашей стране от онкологических заболеваний умирает почти 300 тысяч человек. Представили масштаб проблемы?
В прошлом году в Димитровграде от разных форм рака умерли 200 горожан. Сейчас на учете в первичном онкологическом отделении находится 3104 человека.
Что же, помимо здорового образа жизни, можно противопоставить раку? К счастью, в настоящее время современные методы лечения позволяют значительно продлить жизнь пациенту, а в некоторых случаях и победить болезнь. Эффект лечения напрямую зависит от времени выявления онкологии. Чем раньше обнаружат рак, тем выше шансы на успех лечения!
В связи с этим большую роль играют регулярные медицинские осмотры и диагностические исследования. И на этом этапе мы снова вынуждены говорить об ответственности человека к своему здоровью, к его готовности систематически, в профилактических целях, посещать врача. Кстати, в 2015 году у 54 горожан онкологические заболевания выявили во время профессиональных медицинских осмотров.
Так, женщинам рекомендую ежемесячно проводить самообследование молочных желез. Они должны регулярно посещать гинеколога, терапевта, дерматовенеролога, раз в год проходить ультразвуковое обследование молочных желез. Также после 40 лет женщины должны раз в два года делать маммографию. При показаниях чаще – раз в год.
Регулярные медицинские обследования необходимы и мужчинам, которые, к сожалению, к своему здоровью, за редким исключением, относятся достаточно легкомысленно.
Вы должны быть внимательные к себе. Например, вас должно насторожить изменение при мочеиспускании и дефекации, длительно незаживающая рана, необычные кровотечения или выделения, утолщение или уплотнение в молочной железе и не только, расстройства желудка и затруднение глотания, явные изменения родинки или бородавки, надсадный кашель или охрипший голос. В таких случаях надо обращаться к специалистам – участковым терапевтам, гинекологам. После необходимых минимальных обследований, которые они вам назначат, исходя из результатов анализов, человека направят к узкому специалисту.
Еще несколько слов о визите к доктору. Вы должны знать, что все врачи первичного амбулаторно-поликлинического звена (участковые врачи-терапевты) и узкие специалисты обязаны при выявлении у пациента подозрения на онкологическое заболевание, направлять его на дополнительные виды исследований и консультаций, в том числе в первичное онкологическое отделение клинической больницы. Записаться на прием к врачу-онкологу можно в окне регистратуры и по телефону. Также существует электронная запись по направлению врачей-специалистов.
Сейчас в первичном онкологическом отделении четыре ставки врача-онколога, что позволяет организовать работу поликлиники в две смены. Поэтому срок ожидания консультации у врача-специалиста не более трех дней. К слову, в 2014-2015 годах на работу приняли двух врачей-онкологов. Кроме того, в настоящее время в первичном онкологическом отделении проходят практику два клинических ординатора по специальности «онкология» с последующим трудоустройством в Клинической больнице №172 ФМБА России.
Первичное онкологическое отделение оснащено необходимым медицинским оборудованием. В клинико-диагностической лаборатории проводятся исследования крови на онкомаркеры.
Для повышения ранней диагностики онкологических заболеваний в клинической больнице стали чаще проводить разные виды скринингов – онкоцитологию (обследование, направленное на ранее выявление рака шейки матки), ПСА (выявление рака предстательной железы), маммографию (выявление рака молочной железы).
В 2014 году в многопрофильном стационаре №1 открыли кабинет колоноскопии, что расширило перечень эндоскопических обследований пациентов, в данном случае самого достоверного метода диагностики рака толстой кишки.
Также в МПС №1, только в 2015 году открыли кабинет бронхоскопии для ранней диагностики бронхолегочной патологии.
В поликлинике для взрослых №2 с 2014 года функционирует смотровой кабинет для мужчин города Димитровграда. В нем проводят профилактические осмотры мужчин от 30 лет и старше. Цель его работы – ранее выявление злокачественных опухолей и предопухолевых заболеваний визуальной локализаций (кожные покровы, губы, органы полости рта, щитовидная железа, периферические лимфатические узлы, наружные половые органы, прямая кишка). В этом кабинете в 2015 году у трех пациентов выявили злокачественные новообразования.
Кроме того, в 2014 году в первичном онкологическом отделении, в рамках политики по внедрению новых скрининговых методов исследования для ранней диагностики рака, открыли кабинет тонкоигольной пункционной биопсии под контролем УЗИ.
В первичном онкологическом отделении и поликлинике для взрослых №3 функционируют маммографические кабинеты. В подразделениях клинической больницы работают рентгеновские кабинеты и флюорографические аппараты.
Новые возможности для ранней диагностики заболеваний, в том числе онкологических, появились у специалистов клинической больницы с вводом в эксплуатацию 64-срезового мультиспиральногокомпьютерного томографа. Современная японская техника позволяет получить четкое послойное изображение (срез) любой области человека толщиной менее миллиметра и больше, помогает специалистам оценить состояние исследуемых органов и тканей, локализацию и распространенность патологического процесса, в частности злокачественных новообразований легких и других органов.
Работа по улучшению диагностических возможностей клинической больницы будет продолжена. Так, например, в 2016 году планируется (после приобретения инструментария) проводить биопсию предстательной железы под контролем УЗИ.
Настороженность населения к здоровью, расширение диагностических возможностей клинической больницы, позволили медицинским работникам увеличить процент раннего выявления рака. Наблюдается снижение онкологических заболеваний (402 против 466 в 2014 году) и смертности (200 против 222 годом ранее).
В 2015 году были поставлены на учет 402 пациента. Среди впервые выявленных больных с онкологическими диагнозами на первом месте рак кожи (74 случая), на втором месте – рак молочной железы (61), на третьем – легких (36).
Учитывая тяжесть заболевания, клиническая больница старается, чтобы онкологические пациенты могли получать необходимую медицинскую помощь в Димитровграде. Сейчас в хирургическом отделении МПС №1 развернуты койки для хирургического и химиотерапевтического лечения онкологических больных. В 2015 году в этом подразделении появились койки паллиативной помощи, финансируемые из федерального бюджета. Но, к сожалению, часть больных, в силу медицинских показаний, приходится направлять в Ульяновск – на консилиум специалистов: врача-онколога, врача-радиолога и химиотерапевта, чтобы они определили тактику лечения пациента, как в условиях стационара в региональном центре, так и по месту жительства.
Помимо этого, клиническая больница по медицинским показаниям направляет больных горожан в специализированные онкологические диспансеры и специализированные федеральные клиники и больницы, в первую очередь в медицинские организации ФМБА России. Так, в 2015 году высокотехнологичную медицинскую помощь в Москве получили 92 жителя Димитровграда.
Надеюсь, что представленная информация поможет читателям в профилактике рака.
Будьте здоровы!
лечение рака желудка 4 стадии с метастазами
Стадию рака желудка определяют по трем показателям, которые обозначаются буквами латинского алфавита:
- T (tumor) — размер первичной опухоли, глубина ее прорастания в стенку желудка и распространение на соседние ткани.
- N (nodes) — распространение раковых клеток в ближайшие (регионарные) лимфатические узлы.
- M (metastasis) — наличие метастазов, вторичных очагов, которые возникли в результате распространения раковых клеток с током крови или лимфы из желудка в другие органы.
При раке желудка 4 стадии первичная опухоль может иметь любые размеры, прорастать в стенку желудка на любую глубину, распространяться или не распространяться в соседние органы, лимфатические узлы. Но всегда есть отдаленные метастазы. Это ключевой признак.
В какие органы чаще всего метастазирует рак желудка?
Опухолевые клетки могут распространяться из желудка в другие органы разными способами:
- Рак может непосредственно прорастать в соседние органы. Чаще всего — в поджелудочную железу, реже — в поперечную ободочную кишку, левую долю печени.
- Иногда раковые клетки распространяются по поверхности брюшины — тонкой пленки из соединительной ткани, которая выстилает изнутри стенки брюшной полости и покрывает внутренние органы. При этом у женщин нередко обнаруживаются метастазы в яичниках (опухоль Крукенберга).
- Гематогенным путем (с током крови) рак желудка 4 стадии чаще всего распространяется в печень, реже — в легкие и кости.
- Лимфогенное распространение раковых клеток происходит вдоль печеночно-дуоденальной связки, чревного ствола, сосудов селезенки.
При раке желудка могут возникать специфические метастазы. Для них существуют специальные названия:
- Метастаз Вирхова — в лимфатическом узле, расположенном над ключицей.
- Метастаз сестры Марии Джозеф — в пупок.
- Метастазы Шницлера — в лимфатические узлы, расположенные вокруг прямой кишки.
- Метастазы Айриша — в лимфатические узлы, расположенные в подмышечной области.
Согласно статистике, рак желудка 4 стадии чаще всего метастазирует в печень (у 48% пациентов), брюшину (32%), легкие (15%), кости (12%).
Симптомы
При раке желудка 4 стадии могут беспокоить такие неспецифические симптомы, как плохой аппетит и потеря веса, вплоть до сильного истощения (кахексии), дискомфорт, чувство тяжести, распирания и боль в животе, изжога, тошнота и рвота (иногда с кровью), запоры, примесь крови в стуле.
Специфические симптомы — это желудочное кровотечение при распаде опухоли и анемия из-за кровопотери. Поражение опухолевыми клетками брюшины приводит к асциту (скоплению жидкости в брюшной полости). Также характерны зловонный стул черного цвета и рвота массами, напоминающими кофейную гущу.
Рак желудка длительно не дает о себе знать. На ранних стадиях многие люди не испытывают симптомов и не знают, что больны. У четырех из пяти больных диагноз устанавливают, когда опухоль уже успевает распространиться на другие органы.
Люди, имеющие повышенный риск рака желудка, должны регулярно проходить скрининг — гастроскопию. Это помогает диагностировать опухоль на ранних стадиях.
Методы диагностики
При раке желудка 4 стадии применяют разные методы диагностики, они помогают выявить первичную опухоль и вторичные очаги в других органах:
- Эндоскопическое исследование (гастроскопия, ФГДС) помогает обнаружить патологические изменения на слизистой оболочке желудка.
- Эндоскопическое ультразвуковое исследование — по сути та же ФГДС, но на конце гастроскопа находится ультразвуковой датчик. Он может «просветить» соседние органы и лимфатические узлы через стенку желудка. Зачастую это намного информативнее, чем обычное УЗИ.
- Биопсия. Исследование, во время которого врач получает образец опухолевой ткани и отправляет на анализ в лабораторию. На данный момент биопсию можно назвать самым точным методом диагностики онкозаболеваний. Исследовать можно ткань желудка, лимфатических узлов, других органов.
- Рентгенография с контрастным усилением. Этот метод диагностики используется довольно редко, так как гастроскопия более информативна (к тому же, во время нее можно взять материал для биопсии). Но рентгенография — менее инвазивный метод, во время нее в желудок не вводят никаких инструментов. Иногда это преимущество важно. Суть метода в том, что пациенту дают выпить раствор непроницаемого для рентгеновских лучей сульфата бария, затем делают снимки.
- Компьютерная томография. Более «продвинутая» разновидность рентгенографии, позволяет получить послойные снимки-«срезы» всего тела, на которых будет видна опухоль желудка и очаги в других органах.
- МРТ — в каком-то смысле аналог компьютерной томографии, но во время этого исследования вместо рентгеновских лучей используют мощное магнитное поле. Это безопаснее. МРТ лучше «видит» мягкие ткани. Минус метода в том, что он более сложен, нужен дорогой аппарат, который есть далеко не во всех клиниках.
- Позитронно-эмиссионная томография (ПЭТ). Идеальна для поиска метастазов, которые не могут обнаружить другие методы диагностики. В организм вводят безопасный радиоактивный сахар. Он накапливается в раковых клетках, так как они активно потребляют энергию, и делает их видимыми на специальных снимках.
- Рентгенография грудной клетки. Применяется для поиска метастазов в легких.
Современные методы лечения
Лечение при раке желудка четвертой стадии преследует две цели:
- Сократить размеры опухоли, замедлить ее прогрессирование.
- Устранить симптомы: боль, анемию, нарушение проходимости желудка, асцит.
Хирургическое лечение
Хирургическое вмешательство при раке желудка, как правило, направлено на восстановление проходимости, если опухоль мешает движению пищи. Иногда удается выполнить субтотальную резекцию — удалить часть желудка. Чаще проводят шунтирование: создают сообщение между верхней частью желудка и тощей кишкой, в обход участка, перекрытого опухолью.
В случаях, когда операцию выполнить нельзя, можно провести стентирование желудка. В месте его соединения с пищеводом или двенадцатиперстной кишкой (в зависимости от локализации опухоли) с помощью эндоскопа устанавливают стент — полый каркас с металлической сетчатой стенкой. Иногда проводят эндоскопическую абляцию: через эндоскоп подают лазерный луч, который разрушает опухолевую ткань.
Если человек с раком желудка 4 стадии не может нормально есть, и хирургическое лечение не помогает это исправить, может быть наложена гастростома или еюностома. Желудок или тощую кишку подшивают к коже, формируют отверстие. Через него будет происходить питание.
Химиотерапия и лучевая терапия
При раке желудка с метастазами проводят паллиативную химиотерапию и лучевую терапию. Их главная задача — уменьшить размеры опухоли и продлить жизнь пациента. Применяют разные комбинации химиопрепаратов:
- Эпирубицин + цисплатин + 5-фторурацил.
- Доцетаксел + цисплатин + 5-фторурацил.
- Иринотекан + цисплатин.
- Иринотекан + 5-фторурацил.
- Иринотекан + капецитабин.
- Оксалиплатин + 5-фторурацил.
- Оксалиплатин + капецитабин.
Комбинации из трех препаратов, а также химиотерапия в сочетании с лучевой терапией (химиолучевая терапия) более эффективны, но хуже переносятся, несут более высокий риск побочных эффектов.
Таргетная терапия
Таргетные препараты могут быть эффективны в случаях, когда химиотерапия не помогает. Это современная группа противоопухолевых средств, они атакуют определенные молекулы-мишени, которые важны для роста опухолевой ткани. При раке желудка четвертой стадии применяют два таргетных препарата:
- Трастузумаб блокирует белок-рецептор HER2, который находится на поверхности раковых клеток и заставляет их размножаться. Активность этого белка повышена в каждой пятой злокачественной опухоли желудка (такой рак называют HER2-позитивным).
- Рамуцирумаб блокирует VEGF — белок, который вырабатывается раковыми клетками и стимулирует рост новых сосудов, снабжающих опухоль кислородом и питательными веществами.
Таргетные препараты применяют самостоятельно или в сочетании с химиопрепаратами. Они эффективны, когда раковые клетки обладают определенными молекулярно-генетическими особенностями, когда в них повышена активность соответствующего «вещества-мишени».
Иммунотерапия
Иммунитет человека устроен очень сложно. В нем есть множество звеньев и всевозможных механизмов регуляции. Например, для того чтобы сдерживать себя от атаки на собственные здоровые ткани, иммунная система использует особые вещества — контрольные точки. Иногда их используют злокачественные опухоли, чтобы защититься от иммунной атаки. С этим помогают бороться современные лекарства, которые относятся к классу иммунопрепаратов и называются ингибиторами контрольных точек.
При раке желудка 4 стадии иногда эффективен ингибитор контрольных точек под названием пембролизумаб (Китруда).
Лечение анемии
Кровотечение при раке желудка может привести к анемии — состоянию, при котором в крови снижается количество эритроцитов и гемоглобина. В результате ухудшается качество жизни, выживаемость. Приходится снижать дозы химиопрепаратов и сокращать продолжительность курсов химиотерапии, лечение становится менее эффективным.
С анемией при раке желудка 4 стадии борются с помощью препаратов железа, фолиевой кислоты, витамина B12, переливаний эритроцитарной массы. Существуют препараты-аналоги гормона эритропоэтина, который вырабатывается почками и активирует образование новых эритроцитов в красном костном мозге. Обеспечить организм дополнительным количеством железа помогают некоторые рекомендации относительно рациона питания.
Лечение асцита при раке желудка 4 стадии
Асцит — скопление жидкости в брюшной полости — одно из самых частых осложнений рака желудка четвертой стадии. Это состояние возникает по двум причинам:
- Из-за метастазов рака в брюшину. При этом увеличивается проницаемость стенок кровеносных сосудов, жидкость из них в большем количестве поступает в брюшную полость. Работа лимфатических сосудов нарушается, они не могут выводить жидкость.
- Из-за метастазов в лимфатических узлах. Нарушается отток лимфы, лимфатические сосуды, которые в норме должны выводить жидкость из брюшной полости, больше не могут выполнять свою функцию.
При асците проводят лапароцентез: в стенке брюшной полости делают прокол и выводят через него лишнюю жидкость. Для того чтобы обеспечить постепенное выведение жидкости в течение некоторого времени, применяют специальные перитонеальные порт-системы. Уничтожать метастазы в брюшине помогает внутрибрюшинная химиотерапия, когда химиопрепарат вводят в брюшную полость. При любом из видов лечения необходима специальная диета и приём ряда препаратов, уменьшающих тошноту.
Сколько живут с раком желудка 4 стадии?
Главный прогностический показатель при онкологических заболеваниях — пятилетняя выживаемость. Он обозначает процент пациентов, которые остались живы спустя 5 лет с момента диагностики и начала лечения злокачественной опухоли. Для IV стадии рака желудка этот показатель составляет 4%. В течение пяти лет 96 больных из 100 погибают, 4 остаются в живых. Но такая удручающая статистика — не повод сдаваться. Методы лечения совершенствуются, сегодня онкологи могут сделать намного больше, чем десятилетия назад. Пациенты, которым не помогают стандартные методы, могут принять участие в клинических испытаниях новых препаратов.
Рак желудка | Симптомы, причины, этапы, лечение и выживаемость
Что такое рак желудка?
Рак желудка начинается в слизистой оболочке, самом внутреннем слое пяти слоев ткани стенки желудка. По мере роста он распространяется на другие четыре слоя: подслизистую основу, мышцы, суброзную оболочку и серозную оболочку.
Хорошая новость о раке желудка заключается в том, что заболеваемость раком в США снижается.По данным Американского онкологического общества, на этот рак приходится только около 1,5% всех онкологических заболеваний, диагностируемых каждый год.
Лечение рака желудка зависит от того, насколько далеко распространился рак. Правильный режим может улучшить качество жизни и продлить время выживания.
РАСШИРЯТЬ
Рак желудка начинается в самом внутреннем слое стенки желудка и по мере роста распространяется на внешние слои.
Факты о раке желудка- В 2021 году будет около 26 560 новых случаев рака желудка и 11 180 смертей.
- Около 60 процентов людей, у которых диагностирован рак желудка, в возрасте 65 лет и старше.
- Мужчины болеют раком желудка чаще, чем женщины.
- Общая пятилетняя выживаемость составляет 32 процента.
- Симптомы рака желудка на ранней стадии включают тошноту, потерю аппетита, несварение желудка, чувство вздутия живота после еды и изжогу.
- Факторами риска рака желудка являются курение, желудочные инфекции, пожилой возраст, мужской пол, употребление в пищу обработанного или копченого мяса и семейный анамнез рака.
- Лечение рака желудка включает хирургическое вмешательство, лучевую терапию, химиотерапию, таргетную терапию и иммунотерапию.
Признаки рака желудка
Обычно люди не замечают ранних симптомов рака желудка, потому что они напоминают симптомы других проблем со здоровьем.Симптомы рака желудка одинаковы как у мужчин, так и у женщин, хотя мужчины чаще заболевают этим заболеванием.
Нет ни одного первого признака рака желудка, но первыми тревожными признаками обычно являются желудочно-кишечные проблемы, такие как тошнота, потеря аппетита и дискомфорт в животе, продолжающийся в течение нескольких дней.
Ранние признаки рака желудка включают:«Люди больше не чувствуют голода и в конечном итоге начинают худеть, даже не пытаясь.Это, наверное, самый тревожный симптом «.
- Кислотный рефлюкс и изжога
- Ощущение вздутия после еды
- Потеря аппетита
- Тошнота
- Дискомфорт в желудке и несварение желудка
- Кровь в стуле
- Затруднения при глотании
- Жидкость в брюшной полости (асцит)
- Боль в животе
- Внезапная, неожиданная потеря веса
- Рвота
- Пожелтение глаз и кожи (желтуха) ,00
Причины и факторы риска
Аномальный рост клеток в слизистой оболочке желудка вызывает рост рака желудка.Но у каждого человека разные факторы риска, которые увеличивают индивидуальный риск развития болезни.
По данным Онкологического центра Моффитта, наиболее значительным фактором риска развития рака желудка является бактериальная инфекция Helicobacter pylori (H. pylori). Длительные инфекции могут вызвать предраковые изменения слизистой оболочки желудка.
Некоторые факторы, такие как возраст и пол, нельзя контролировать. Другие, такие как образ жизни и диета, можно контролировать.
Факторы, которые могут увеличить риск рака желудка, включают:«Наличие фактора риска не означает, что вы заболеете раком; отсутствие факторов риска не означает, что вы не заболеете раком.Поговорите со своим врачом, если считаете, что подвергаетесь риску ».
- Пол — Мужчины чаще заболевают раком желудка, чем женщины.
- Возраст — Риск увеличивается с возрастом, и большинство людей с этим раком находятся в возрасте от 60 лет и старше.
- Этническая принадлежность — жители островов Азиатско-Тихоокеанского региона, латиноамериканцы, коренные американцы и афроамериканцы более подвержены раку, чем белые неиспаноязычные.
- Вес — ожирение или избыточный вес увеличивает вероятность рака верхних отделов желудка.
- Диета — Употребление большого количества копченого, соленого или обработанного мяса увеличивает риск рака желудка.
- Курение — Курение удваивает риск рака желудка.
- Алкоголь — Употребление алкогольных напитков увеличивает риск рака желудка, особенно у людей, употребляющих три или более напитков в день.
- Предыдущая операция на желудке — У людей, которым удалили часть желудка, через много лет после операции может развиться рак желудка.
- Пагубная анемия — Пагубная анемия, состояние, которое влияет на способность организма вырабатывать новые эритроциты, может увеличить риск рака желудка.
- Семейный анамнез — Люди, чьи братья и сестры, родители или дети болели раком желудка, имеют более высокий риск заболевания.
- Группа крови — Люди с кровью группы А чаще заболевают раком желудка.
- Химическое воздействие — Некоторые люди, подвергающиеся воздействию химикатов в угольной, металлургической и резиновой промышленности, могут иметь повышенный риск рака желудка.
- Инфекция вирусом Эпштейна-Барра (EBV) — EBV вызывает инфекционный мононуклеоз (моно), и он обнаруживается у 5-10% людей с раком желудка.
N-нитрозодиметиламин (NDMA) и рак желудка
Высокое потребление N-нитрозодиметиламина (NDMA), вероятного канцерогена для человека, связано с повышенным риском рака желудка.
Некоторые продукты, такие как копчености, содержат в небольших количествах NDMA. Окружающая среда и вода также содержат NDMA. Проглатывание небольших количеств обычно не является проблемой для большинства людей.
«Низкие уровни NDMA обычно попадают в организм с пищей, например, NDMA присутствует в продуктах питания и в воде.Ожидается, что такие низкие уровни не приведут к увеличению риска рака. Однако устойчивые более высокие уровни воздействия могут увеличить риск рака у людей ».
В последние годы загрязнение NDMA различных рецептурных препаратов, включая метформин, валсартан и Зантак (ранитидин), привело к отзыву.
В апреле 2020 года FDA потребовало удалить с рынка все продукты ранитидина после того, как обнаружило, что уровни NDMA в ранитидине могут со временем увеличиваться, особенно при хранении при высоких температурах.
Исследование, опубликованное в 2021 году Джеральдом МакГвином в журнале «Рак», «предоставило прямую поддержку утверждению, что загрязненный NDMA ранитидин связан с возникновением рака желудочно-кишечного тракта».
Зантак и рак желудка
Некоторые исследования показали, что NDMA в Zantac вызывает повышенный риск рака, включая рак желудка. Узнайте больше о связи Zantac с раком.
Учить большеДиагностика
Врачи используют различные тесты, чтобы диагностировать рак желудка и посмотреть, насколько далеко он распространился. Степень распространения рака или его стадия помогает определить варианты лечения и выживаемость.
Тесты на рак желудка включают медицинский осмотр, анализы крови и взятие образцов ткани или жидкости.
Биопсия
Во время биопсии врачи берут небольшие кусочки ткани, которые патолог может исследовать под микроскопом. Это единственный точный способ диагностировать рак. Патолог будет искать аномальные клетки в образце ткани желудка, чтобы диагностировать заболевание.
Эндоскопия
Во время эндоскопии врачи вставляют в рот тонкую трубку с подсветкой, называемую эндоскопом, чтобы исследовать желудок и кишечник. Во время обследования пациент находится под легким седативным действием.
Во время эндоскопии врач может проверить наличие признаков рака и взять образец ткани для отправки в лабораторию.
Визуальные тесты
Визуализирующие тесты используют излучение, радиоволны или магнитные поля для создания изображений желудка и внутренних органов, чтобы диагностировать рак и увидеть, как далеко он распространился.
Общие методы визуализации при раке желудка включают:- Рентген — Рентгеновский снимок — это способ создать изображение структур внутри тела с использованием небольшого количества излучения.
- Бариевая глотка — Пациенты проглатывают бариевую жидкость, благодаря которой ткани, органы и аномалии легче увидеть на рентгеновском снимке.
- Компьютерная томография (КТ или CAT). — При компьютерной томографии используется излучение для создания подробных трехмерных изображений опухолей или аномалий. КТ позволяет измерить размер опухоли. Врачи могут вводить или не вводить специальный контрастный краситель внутривенно или перорально. Этот краситель делает опухоли более заметными.
- Магнитно-резонансная томография (МРТ). — Вместо излучения в МРТ используются магнитные поля для получения подробных изображений тела и измерения размера опухоли.Введенный краситель контрастного вещества может помочь врачам увидеть больше деталей.
Лапароскопия
Врачи используют лапароскопию, чтобы определить, распространился ли рак на слизистую оболочку брюшной полости или печени. Во время этой малоинвазивной операции врач вводит тонкую гибкую трубку с подсветкой, называемую лапароскопом, в брюшную полость для поиска опухолей.
Это более эффективно, чем визуализация при обнаружении рака, распространившегося на эти области.
Прогноз рака желудка
Прогноз рака желудка — это оценка шансов человека на выживание и эффективности лечения. Многие факторы влияют на прогноз. К ним относятся тип рака, стадия рака, возраст человека и общее состояние здоровья.
«Если 5-летняя относительная выживаемость для определенной стадии рака желудка составляет 70%, это означает, что люди, у которых есть этот рак, в среднем примерно на 70% выше, чем люди, у которых нет этого рака, чтобы выжить. не менее 5 лет после постановки диагноза.”
Исследователи используют пятилетнюю выживаемость, полученную на основе данных из базы данных Национального института рака, для определения прогноза. Эти данные сравнивают людей с одним и тем же типом и стадией рака с населением в целом, чтобы увидеть, насколько вероятно, что человек выживет через пять лет после постановки диагноза рака желудка.
Попросите врача определить ваш прогноз, это всего лишь рекомендации.
Пятилетняя выживаемость при раке желудка составляет:- Общая выживаемость — 32 процента
- Опухоль не распространилась за пределы желудка (локализована) — 70 процентов
- Опухоли распространились на близлежащие лимфатические узлы или структуры за пределами желудка (регионарные) — 32 процента
- Опухоли распространились на отдаленные органы и части тела — 6 процентов
Стадии рака желудка
Около 90-95 процентов всех случаев рака желудка — это аденокарциномы, которые начинаются на слизистой оболочке, внутренней оболочке желудка.
Аденокарциномы кишечника имеют лучший прогноз и могут поддаваться таргетной терапии. Диффузные аденокарциномы распространяются быстрее, их трудно лечить, но они встречаются реже.
Большинство раковых заболеваний желудка начинается в самом внутреннем слое стенки желудка, называемом слизистой оболочкой. Врачи используют систему TNM для определения стадии рака желудка.
T обозначает опухоль, N обозначает узел, а M обозначает метастаз. Врачи оценивают, насколько глубоко распространилась основная опухоль (T), достигла ли опухоль лимфатических узлов (N) и распространилась ли рак на другие части тела (M).Затем они определяют стадию каждой опухоли от стадии 0 до стадии IV на основе системы TNM.
РАСШИРЯТЬ
Рак желудка на ранней стадии все еще находится во внутренней оболочке желудка. По мере роста он распространяется на другие слои тканей, а затем из желудка.
Этап 0
Рак не распространился через слизистую оболочку на другие слои желудка.Это также называется карциномой in situ.
Стадия IA и IB
Опухоль стадии IA проросла в слизистую оболочку и, возможно, распространилась на подслизистую оболочку. На данном этапе он не распространился на лимфатические узлы.
Опухоли стадии IB распространились на слизистую оболочку, могли распространиться на подслизистую оболочку и могли или не могли распространиться на один или два лимфатических узла.
Опухоли стадии IB, которые не распространились на лимфатические узлы, распространились на мышечный слой.
Стадии IIA и IIB
Раковые образования стадии IIA имеют три возможных состояния.
У них могут быть:- Распространяется на подслизистую основу и от трех до шести лимфатических узлов, или
- Распространяется на мышечный слой желудка и один или два лимфатических узла, или
- Распространяется в суберозу без поражения лимфатических узлов.
- Распространяется на подслизистую основу и от семи до 15 близлежащих лимфатических узлов, или
- Распространяется на мышечный слой и от трех до шести ближайших лимфатических узлов, или
- Распространяется на суберозу и на один или два близлежащих лимфатических узла, или
- Распространяется на серозную оболочку и распространяется на от одного до шести ближайших лимфатических узлов.
Стадии IIIA, IIIB и IIIC
Опухоли стадии IIIA имеют четыре возможных состояния.
У них могут быть:- Распространяется на мышечную стенку и от семи до 15 близлежащих лимфатических узлов, или
- Распространяется на суберозу и от трех до шести лимфатических узлов, или
- Распространяется на серозную оболочку и от одного до шести близлежащих лимфатических узлов, или
- Распространяется на близлежащие органы, включая печень, толстую кишку, селезенку, брюшную стенку поджелудочной железы, надпочечники, тонкий кишечник, заднюю часть живота или почки.
Опухоли стадии IIIB имеют три возможных состояния.
У них могут быть:- Распространяется на подслизистую основу или мышечный слой и на 16 или более близлежащих лимфатических узлов, или
- Распространяется на суберозную или серозную оболочку и от семи до 15 лимфатических узлов, или
- Распространяется из желудка на близлежащие органы и от одного до шести близлежащих лимфатических узлов.
Опухоли стадии IIIC имеют два возможных состояния.
У них могут быть:- Распространяется на суберозную или серозную оболочку и 16 или более близлежащих лимфатических узлов, или
- Распространяется из желудка на близлежащие органы и семь или более близлежащих лимфатических узлов.
IV этап
Рак желудка стадии IV распространился на другие отдаленные части тела, такие как легкие, лимфатические узлы и ткани, выстилающие брюшную стенку.
Лечение
Варианты лечения зависят от стадии рака желудка. У каждого есть свои побочные эффекты.Врачи могут порекомендовать сочетание методов лечения.
Эндоскопическая резекция слизистой оболочки
На очень ранних стадиях рака врачи могут использовать нехирургический метод, называемый эндоскопической резекцией слизистой оболочки. Врачи вводят гибкую трубку с подсветкой, называемую эндоскопом, через рот в желудок, чтобы удалить раковые ткани или образования.
С помощью этой процедуры также можно брать образцы тканей для дальнейших лабораторных исследований.
Хирургия
Врачи хирургическим путем вырезают опухоль из желудка. Хирургия наиболее эффективна при раке на ранней стадии, который еще не распространился.
При раке желудка на ранней стадии врачи проводят частичную резекцию желудка, чтобы удалить часть желудка и лимфатические узлы.
Если рак распространился на внешнюю стенку желудка, врачи могут назначить лучевую терапию и химиотерапию вместе с хирургическим вмешательством. В зависимости от того, насколько далеко распространился рак, врач может выполнить полную гастрэктомию, удаление всего желудка.Это серьезная операция, которая может иметь серьезные побочные эффекты. Обязательно обсудите риски и преимущества со своим врачом.
Операция не рекомендуется при раке, который распространился на лимфатические узлы и несколько отдаленных органов.
Лучевая терапия
Лучевая терапия использует частицы высокой энергии для уничтожения раковых клеток в желудке. Внешняя лучевая терапия — облучение от аппарата вне тела — это тип терапии, который чаще всего используется для лечения рака желудка.
Побочные эффекты включают кожные реакции, усталость и проблемы с желудком.
Химиотерапия
В химиотерапии используются внутривенные или пероральные препараты для уничтожения раковых клеток. Эти препараты останавливают рост рака, замедляют рост рака или уменьшают тяжесть симптомов рака.
Химиотерапевтические препараты при раке желудка включают:Побочные эффекты включают риск инфекции, тошноту, усталость, рвоту, потерю аппетита, потерю волос и диарею.Эти побочные эффекты могут различаться и усиливаться в зависимости от дозы лекарства, но обычно проходят после лечения.
Таргетная терапия
Таргетная терапия определяет определенные белки и гены, которые помогают раку выжить и развиться. Затем он блокирует их распространение, помогая ограничить повреждение здоровых клеток. Мишени рака желудка включают рецептор 2 эпидермального фактора роста человека (HER2) и терапию против ангиогенеза.
HER2-таргетная терапия трастузумабом и химиотерапией может быть вариантом для людей с более поздними стадиями рака.
Терапия против ангиогенеза нацелена на способность опухоли образовывать новые кровеносные сосуды. Эта терапия заставляет опухоль голодать. Лечение рамуцирумабом (Цирамза) может быть дополнительным вариантом для людей, у которых опухоль выросла во время химиотерапии.
Иммунотерапия
Иммунотерапия, также называемая биологической терапией, разработана, чтобы помочь иммунной системе организма бороться с раком. Кейтруда (пембролизумаб) может помочь пациентам с запущенным раком с определенными онкомаркерами.
Побочные эффекты иммунотерапии включают симптомы гриппа, кожные реакции, изменение веса и диарею.
Профилактика
Хотя люди не могут контролировать все факторы риска рака желудка, они могут внести определенные изменения в образ жизни, которые могут снизить их риск.
Советы по предотвращению рака желудка включают:«Нет сомнений в том, что данные подтверждают диету, богатую свежими овощами, минимальным количеством фруктов и минимальным количеством мяса, особенно обработанного мяса.Отказ от этих токсичных продуктов не только снизит риск развития рака, но и снизит симптомы пищеварения от их употребления ».
- Если у вас избыточный вес или ожирение, поговорите со своим врачом о похудении
- Включите в свой рацион больше свежих фруктов и овощей
- Уменьшите или ограничьте количество копченых, консервированных и соленых продуктов, особенно тех, которые содержат нитриты
- Бросить курить
- Избегайте алкоголя
- Спросите своего врача, нужен ли вам скрининг на рак желудка
Рак | Статистика рака | Рак желудка | Темы о здоровье
Рак желудка
Анализ данных и отчеты
- Подробные данные о заболеваемости и смертности, пожизненном риске, распространенности и статистике выживаемости: Рак желудка
- Сводная таблица основных статистических данных по раку желудка.
Ниже приведены последние обновленные данные. Обратите внимание:
- На каждой странице некоторые файлы довольно большие, и их загрузка может занять несколько минут.
- Возможно, вам придется использовать раскрывающиеся меню в электронных таблицах, чтобы выбрать «Район проживания», «Пол» и «Место / тип рака», чтобы найти требуемые данные.
Рак желудка: МКБ-10 C16
Заболеваемость:
Годовая заболеваемость [940 КБ] (последние 25 лет) с разбивкой по возрасту, полу, сети и медицинскому обслуживанию
Пятилетняя сводка заболеваемости [197KB] по возрасту, полу, сети и медицинскому обслуживанию
Смертность:
Годовая смертность [752 КБ] (последние 25 лет) с разбивкой по возрасту, полу, сети и медицинскому обслуживанию
Пятилетняя сводка смертности [188KB] по возрасту, полу, сети и медицинскому обслуживанию
Выживание:
Выживаемость [33 КБ] (по возрасту и полу) через 1, 3, 5 и 10 лет после постановки диагноза (с 1987 г.)
Распространенность:
Распространенность рака [50KB]
Пожизненный риск:
Пожизненный риск [47 КБ] рака по возрасту и полу
Лишение:
Заболеваемость и смертность по категориям депривации [29KB]
Сводная статистика рака желудка
| Шотландия | Кобели | Женщины | человек |
|---|---|---|---|
| Ранг — заболеваемость (2017) | 12 | 14 | 13 |
| Ранг — смертность (2018) | 9 | 12 | 10 |
| Процентная частота всех видов рака — заболеваемость (2017) | 2.3% | 1,5% | 1,9% |
| Процентная частота всех видов рака — смертность (2018) | 3,3% | 2,3% | 2,8% |
| Количество новых случаев, диагностированных в 2017 году | 373 | 247 | 620 |
| Количество смертей, зарегистрированных в 2018 году | 273 | 181 | 454 |
| Изменение заболеваемости с 2007 по 2017 год | -35.9% | -28,6% | -33,7% |
| Изменение смертности с 2008 по 2018 год | -33,0% | -30,1% | -32,1% |
| Относительная выживаемость в течение 1 года для пациентов, диагностированных между 2007 и 2011 годами | 41,9% | 40,3% | 41.3% |
| 5-летняя относительная выживаемость пациентов, диагностированных между 2007 и 2011 годами | 15,4% | 20,5% | 17,2% |
Примечания:
1. Показатели выживаемости не стандартизированы по возрасту.
2. Изменение заболеваемости и смертности оценивается с помощью регрессии Пуассона.
Многие молодые пациенты с раком желудка имеют различные заболевания — ScienceDaily
Многие люди в возрасте до 60 лет, у которых развивается рак желудка, имеют «генетически и клинически отличное» заболевание, как показало новое исследование клиники Мэйо.Исследование показало, что по сравнению с раком желудка у пожилых людей эта новая форма с ранним началом часто растет и распространяется быстрее, имеет худший прогноз и более устойчива к традиционным химиотерапевтическим методам лечения. Исследование было недавно опубликовано в журнале Surgery .
В то время как заболеваемость раком желудка у пожилых пациентов снижается на протяжении десятилетий, этот рак с ранним началом растет и в настоящее время составляет более 30% диагнозов рака желудка.
«Я думаю, что это тревожная тенденция, поскольку рак желудка — разрушительное заболевание», — говорит старший автор Трэвис Гротц, М.Н., Хирург-онколог клиники Мэйо. «В США мало кто осведомлен о признаках и симптомах рака желудка, и многим пациентам более молодого возраста может быть поставлен диагноз поздно — когда лечение менее эффективно».
Исследовательская группа изучила 75 225 случаев, используя несколько баз данных рака для обзора статистики рака желудка с 1973 по 2015 год. Сегодня средний возраст человека, у которого диагностирован рак желудка, составляет 68 лет, но люди в возрасте 30, 40 и 50 лет подвергаются большему риску, чем они раньше был.
Хотя нет четкого предельного возраста для определения раннего и позднего начала рака желудка, исследователи обнаружили, что различия сохраняются, независимо от того, использовали ли они возрастной предел 60, 50 или 40 лет.Исследователи обнаружили, что заболеваемость раком желудка с поздним началом снижалась на 1,8% ежегодно в течение периода исследования, в то время как заболеваемость с ранним началом снижалась на 1,9% ежегодно с 1973 по 1995 год, а затем увеличивалась на 1,5% до 2013 года. рак желудка увеличился вдвое с 18% всех случаев в 1995 г. до более чем 30% всех случаев рака желудка.
«Обычно мы видим, что рак желудка диагностируется у пациентов в возрасте 70 лет, но все чаще мы видим, что диагноз ставят пациенты в возрасте от 30 до 50 лет», -Гроц говорит.
Д-р Гротц добавляет, что рост заболеваемости на раннем этапе не связан с ранним выявлением или скринингом. «Не существует универсального скрининга на рак желудка, и у более молодых пациентов действительно более поздняя стадия заболевания, чем у пациентов старшего возраста», — говорит он.
Исследователи обнаружили, что рак желудка с ранним началом не только более опасен, но и отличается генетически и молекулярно. Более того, традиционные факторы риска развития рака желудка у пожилых американцев, такие как курение табака, не коррелируют с его ранним проявлением.
«Надеюсь, что подобные исследования повысят осведомленность врачей и увеличат подозрения на рак желудка, особенно у молодых пациентов», — говорит д-р Гротц. Он добавляет, что более молодые пациенты, которые чувствуют себя сытыми до окончания еды или страдают рефлюксом, болями в животе, непреднамеренной потерей веса и затруднениями с приемом пищи, должны обратиться к своему врачу.
По данным Американского онкологического общества, рак желудка занимает 16-е место по распространенности в США. Пятилетняя выживаемость — 31.5%, и, по оценкам Национального института рака, в 2019 году будет около 27 510 новых случаев. Всемирная организация здравоохранения сообщает, что рак был второй ведущей причиной смерти в мире в 2018 году, а рак желудка был третьей по частоте причиной смерти от рака в этом году.
Далее исследовательская группа надеется лучше определить факторы риска для раннего начала рака желудка, используя Рочестерский эпидемиологический проект и, возможно, другие крупные базы данных.
История Источник:
Материалы предоставлены Mayo Clinic .Оригинал написан Адамом Харринга. Примечание. Содержимое можно редактировать по стилю и длине.
Рак Сегодня
Методы оценки зависят от страны, и качество каждой оценки зависит от качества и количества информации, доступной в каждой стране.
Теоретически существует столько же методов, сколько стран, и из-за разнообразия и сложности этих методов практически невозможно определить общий показатель качества для совокупных оценок заболеваемости и смертности.
Заболеваемость
Методы, используемые для оценки показателей заболеваемости раком в зависимости от пола и возраста в конкретной стране, делятся на следующие широкие категории в порядке приоритетности:
- Прогнозируемые показатели до 2012 г. (38 стран)
- Последние доступные ставки применительно к населению 2012 г. (20 стран)
- Рассчитано на основе национальных данных о смертности путем моделирования с использованием коэффициентов заболеваемости и смертности, полученных на основе данных, зарегистрированных национальными онкологическими регистрами (13 стран)
- Оценено на основе национальных оценок смертности путем моделирования с использованием коэффициентов заболеваемости и смертности, полученных на основе данных, зарегистрированных местными онкологическими регистрами в соседних странах (9 европейских стран)
- Рассчитано на основе национальных оценок смертности с использованием смоделированной выживаемости (32 страны)
- Рассчитано как средневзвешенное значение местных ставок (16 стран)
- Оценено с использованием данных из одного онкологического реестра, охватывающего часть страны, которые рассматриваются как репрезентативные для общенационального профиля (11 стран)
- Возрастные / половые коэффициенты для всех видов рака вместе были разделены с использованием данных об относительной частоте отдельных видов рака по возрасту и полу (12 стран)
- Тарифы соответствуют ценам соседних стран или регистров того же региона (33 страны)
Смертность
В зависимости от степени детализации и точности национальных данных о смертности использовался один из следующих шести методов в порядке приоритетности:
- Прогнозируемые показатели до 2012 г. (69 стран)
- Последние доступные ставки применительно к населению 2012 г. (26 стран)
- Рассчитано как средневзвешенное значение региональных показателей (1 страна)
- Оценено на основе национальных оценок заболеваемости путем моделирования с использованием выживаемости по конкретной стране (2 страны)
- Оценено на основе национальных оценок заболеваемости путем моделирования с использованием выживаемости по конкретной стране (2 страны)
- Тарифы соответствуют ценам соседних стран или регистров того же региона (3 страны)
Источники и методы, использованные для оценки глобальной заболеваемости и смертности в 2012 г., в дополнение к краткому описанию основных результатов по локализации рака и в 20 крупных регионах мира, можно найти в Ferlay et al.(2015) а . Дальнейшая оценка методов была также описана Antoni et al. (2016) б .
Распространенность
Оценки заболеваемости раком за 1, 3 и 5 лет в зависимости от пола и пола за 2012 г. были рассчитаны путем умножения соответствующих оценок за 2008 г. c на коэффициенты расчетного числа случаев заболеваемости среди взрослого населения в 2012 г. к соответствующему расчетному количеству дел на 2008 год.
Список литературы
a Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al.(2015). Заболеваемость и смертность от рака во всем мире: источники, методы и основные закономерности в GLOBOCAN 2012. Int J Cancer. 136 (5): E359–86. PMID: 25220842
b Antoni S, Soerjomataram I, Møller B, Bray F, Ferlay J (2016). Оценка методов GLOBOCAN для получения национальных оценок заболеваемости раком. Бюллетень Всемирной организации здравоохранения. 94: 174–84. DOI: http://dx.doi.org/10.2471/BLT.15.164384
c Брей Ф., Рен Дж. С., Масуйер Э., Ферли Дж.Оценки глобальной распространенности рака для 27 участков среди взрослого населения в 2008 г. Int J Cancer. 2013 1 марта; 132 (5): 1133-45. DOI: 10.1002 / ijc.27711. Epub 2012 26 июля
Статистика рака желудка | Рак Австралия
Рак желудка включает коды рака C16 по МКБ-10 (злокачественное новообразование желудка).
Новые чемоданы
В 2016 году в Австралии было диагностировано 2197 новых случаев рака желудка (1462 мужчины и 735 женщин). По оценкам, в 2020 году в Австралии будет диагностировано 2246 новых случаев рака желудка (1514 мужчин и 732 женщины).
Рис. 1. Расчетная оценка наиболее распространенных диагностированных видов рака, 2020 г.
Банкноты
В 2016 году стандартизованный по возрасту коэффициент заболеваемости составил 7,9 случая на 100 000 человек (11 для мужчин и 4,9 для женщин). По оценкам, в 2020 году стандартизированный по возрасту коэффициент заболеваемости составит 7,3 случая на 100 000 человек (10 для мужчин и 4,5 для женщин). Ожидается, что уровень заболеваемости раком желудка будет увеличиваться с возрастом и достигнет пика в возрастной группе 80–84 года.
Рисунок 2.Стандартизированные по возрасту коэффициенты заболеваемости раком желудка, 1982-2016 гг., С разбивкой по полу
Примечания:
- Данные получены из веб-отчета AIHW по раку в Австралии за 2020 год и дополнительных таблиц данных
Число новых диагностированных случаев рака желудка увеличилось с 1825 (1153 мужчины и 672 женщины) в 1982 году до 2197 в 2016 году. За тот же период стандартизованный по возрасту показатель заболеваемости снизился с 16 случаев на 100 000 человек (23 для мужчин. и 10 для женщин) в 1982 г. до 7.9 случаев на 100000 в 2016 году.
Смертей
В 2018 году в Австралии от рака желудка умерло 1138 человек (712 мужчин и 426 женщин). По оценкам, в 2020 году погибнет 1140 человек (705 мужчин и 435 женщин).
Рисунок 3. Наиболее частые причины смерти от рака, 2020 г.
Банкноты
В 2018 году стандартизованный по возрасту коэффициент смертности составил 3,8 смертей на 100 000 человек (5,1 для мужчин и 2,6 для женщин).По оценкам, в 2020 году стандартизованный по возрасту коэффициент смертности составит 3,6 смертей на 100 000 человек (4,8 для мужчин и 2,6 для женщин). Ожидается, что уровень смертности от рака желудка будет увеличиваться с возрастом.
Диаграмма 4. Стандартизированные по возрасту коэффициенты смертности от рака желудка, 1982–2018 гг., С разбивкой по полу
Примечания:
- Данные получены из веб-отчета AIHW по раку в Австралии за 2020 год и дополнительных таблиц данных
Число смертей от рака желудка снизилось с 1398 (874 мужчины и 524 женщины) в 1982 году до 1138 в 2018 году.За тот же период стандартизованный по возрасту коэффициент смертности снизился с 12 смертей на 100 000 человек (18 для мужчин и 8,1 для женщин) в 1982 г. до 3,8 смертей на 100 000 в 2018 г.
Выживание
В 2012–2016 годах вероятность выживания в течение пяти лет людей с диагнозом «рак желудка» составляла 31% (30% для мужчин и 33% для женщин) по сравнению с их сверстниками среди населения Австралии в целом. В период с 1987–1991 по 2012–2016 годы пятилетняя относительная выживаемость при раке желудка улучшилась с 19% до 31%.
Рисунок 5. 5-летняя относительная выживаемость при раке желудка, с 1987–1991 по 2012–2016 годы, в разбивке по полу
Примечания:
- Данные получены из веб-отчета AIHW по раку в Австралии за 2020 год и дополнительных таблиц данных
Распространенность
По состоянию на конец 2015 года насчитывалось 1544 человека, у которых был диагностирован рак желудка в этом году, 4482 человека, у которых был диагностирован рак желудка за предыдущие 5 лет (с 2011 по 2015 год), и 10 040 человек, живущих с диагнозом рака желудка. диагностирован рак желудка в предыдущие 34 года (с 1982 по 2015 год).
Дополнительные сведения о раковых заболеваниях см. На веб-сайте
NCCI.Национальные индикаторы борьбы с раком (NCCI) — это набор индикаторов по всему спектру онкологической помощи, от профилактики и скрининга до диагностики, лечения, психосоциальной помощи, исследований и результатов. Веб-сайт NCCI позволяет пользователям видеть визуальные представления данных по каждому индикатору с помощью интерактивных диаграмм.
Рак желудка | Причины, симптомы и лечение
Что такое рак желудка?
Рак желудка развивается, когда клетки слизистой оболочки желудка ненормально растут и делятся.Опухоли могут возникать в любом месте желудка, но большинство из них начинается в железистой ткани на внутренней поверхности желудка. Этот тип рака — аденокарцинома желудка (рак желудка).
Редкие типы рака желудка включают мелкоклеточные карциномы, лимфомы, нейроэндокринные опухоли и опухоли стромы желудочно-кишечного тракта.
Рак желудка — относительно распространенный вид рака в Австралии, однако число диагностированных людей сокращается. Он редко встречается у людей младше 50 лет и чаще встречается у мужчин, чем у женщин.
По оценкам, в 2020 году в Австралии будет диагностировано 2246 новых случаев рака желудка.
Пятилетняя выживаемость при раке желудка составляет 31%.
Симптомы рака желудка
ощущение боли или жжения в животе
изжога или расстройство желудка (диспепсия)
чувство сытости даже после небольшого приема пищи
тошнота или рвота
потеря аппетита и / или потеря веса
вздутие живота
необъяснимая усталость или слабость
кровь в рвоте
фекалии черного цвета.
Причины рака желудка
Некоторые факторы, которые могут увеличить риск рака желудка, включают:
курительный табак
возраст старше 60 лет
инфекция, вызванная бактериями Helicobacter pylori
диета с высоким содержанием копченых, маринованных и соленых продуктов и с низким содержанием свежих фруктов и овощей
потребление алкоголя
избыточный вес или ожирение
злокачественная анемия (низкий уровень эритроцитов)
хроническая гастрит (воспаление желудка)
семейный анамнез рака желудка
частичная гастрэктомия по поводу язвенной болезни (примерно через 20 лет)
наследственное генетическое изменение, вызывающее заболевания кишечника, семейный аденоматозный полипоз или наследственный неполипозный колоректальный рак.
Диагностика рака желудка
Если ваш врач считает, что у вас может быть рак желудка, вас направят на дополнительные анализы. Основное обследование — эндоскопия (также известная как гастроскопия). Врач будет использовать тонкую гибкую трубку с камерой (эндоскопом), которая проходит в рот, вниз по глотке и пищеводу в желудок, чтобы осмотреть пищеварительный тракт.
При обнаружении подозрительных участков можно удалить небольшое количество ткани слизистой оболочки желудка (биопсия) и исследовать ее под микроскопом.Реже используется эндоскопический ультразвук, когда на конце эндоскопа имеется ультразвуковой датчик.
После диагностики рака желудка
После того, как вам поставили диагноз «рак желудка», вы можете чувствовать себя шокированным, расстроенным, тревожным или сбитым с толку. Это нормальные ответы. Диагноз рака желудка или пищевода влияет на каждого человека по-разному. Для большинства это будет трудное время, однако некоторым удается продолжать свои обычные повседневные дела.
Возможно, вам будет полезно обсудить варианты лечения со своими врачами, семьей и друзьями.Задавайте вопросы и ищите столько информации, сколько считаете нужным. Вам решать, насколько вы хотите участвовать в принятии решений о своем лечении.
Узнайте больше о лучших методах лечения рака желудка:
Лечение рака желудка
Стадия
После постановки диагноза рака желудка один или несколько из следующих тестов используются для определения степени рака (его стадии):
- КТ
- УЗИ
- ПЭТ сканирование
- лапароскопия
- сканирование костей.
Виды лечения
Основным методом лечения рака желудка является хирургическое вмешательство — полная или частичная гастрэктомия (удаление всего или части желудка). Перед операцией может быть назначена химиотерапия, чтобы уменьшить опухоли большего размера. Его также можно использовать после операции, чтобы снизить риск возврата рака.
Паллиативная помощь
В некоторых случаях рака желудка ваша медицинская бригада может поговорить с вами о паллиативной помощи. Паллиативная помощь направлена на улучшение качества вашей жизни за счет облегчения симптомов рака.
Паллиативное лечение не только замедляет распространение рака желудка, но и облегчает боль и помогает справиться с другими симптомами. Лечение может включать лучевую терапию, химиотерапию или другие лекарственные препараты.
Лечебная бригада
В зависимости от вашего лечения ваша лечащая бригада может состоять из ряда различных медицинских специалистов, таких как:- GP (врач общей практики) — следит за вашим общим состоянием здоровья и работает с вашими специалистами для координации лечения.
- Гастроэнтеролог — специализируется на заболеваниях органов пищеварения.
- Хирург верхних отделов желудочно-кишечного тракта — специализируется на хирургии заболеваний верхних отделов пищеварительной системы.
- Радиолог-онколог — назначает и координирует лучевую терапию.
- Онкологические медсестры — помогают с лечением, а также предоставляют информацию и поддержку на протяжении всего лечения.
- Другие специалисты в области здравоохранения, такие как социальные работники, фармацевты и консультанты.
Скрининг на рак желудка
В настоящее время в Австралии нет национальной программы скрининга на рак желудка.
Профилактика рака желудка
Есть несколько шагов, которые вы можете предпринять, чтобы минимизировать риск рака желудка, в том числе:
- отказ от курения и отказ от курения
- сокращение потребления копченостей, маринованных и соленых продуктов
- Диета с высоким содержанием свежих овощей и фруктов
- лечение инфекции Helicobacter pylori может быть защитным.
Прогноз рака желудка
Прогноз человека зависит от типа и стадии рака, а также от его возраста и общего состояния здоровья на момент постановки диагноза.Лечение наиболее эффективно, если рак обнаружен на ранних стадиях; рак желудка можно вылечить, если удалить рак до того, как он распространился. Однако из-за отсутствия или нечеткости симптомов на ранних стадиях рак желудка часто не обнаруживается до тех пор, пока он не перейдет в более позднюю стадию.
Источники
- Понимание рака желудка и пищевода , Онкологический совет Австралии, © 2019. Последняя медицинская проверка исходного буклета: октябрь 2019 г.
- Австралийский институт здравоохранения и социального обеспечения (AIHW). Австралийские книги о заболеваемости и смертности от рака (ACIM): Рак желудка . Канберра: AIHW.
Бремя рака желудка в Центральной и Южной Америке
Основные моменты
- •
Показатели заболеваемости и смертности от рака желудка варьировались в 6 и 5–6 раз, соответственно.
- •
Самый высокий уровень заболеваемости был зарегистрирован в Чили, Коста-Рике, Колумбии, Эквадоре, Бразилии и Перу.
- •
Чили (мужчины) и Гватемала (женщины) имели одни из самых высоких показателей смертности в мире.
- •
Уровень заболеваемости снижался на 4% ежегодно в Бразилии, Чили и Коста-Рике с 1997 по 2008 год.
- •
Смертность снижалась на 4% ежегодно в Чили и Коста-Рике с 1997 по 2008 год.
- •
Рак без кардии встречается в 2–13 раз чаще, чем рак кардии.
Реферат
Обоснование и цель
Показатели смертности от рака желудка в Центральной и Южной Америке (CSA) являются одними из самых высоких в мире.Мы описываем текущее бремя рака желудка в CSA.
Методы
Мы получили данные о заболеваемости раком на региональном и национальном уровнях из 48 регистров населения (13 стран) и общенациональные данные о смертности от рака из базы данных ВОЗ о смертности (18 стран). Мы оценили стандартизированные по возрасту показатели заболеваемости (ASR) и смертности (ASMR) мирового населения на 100 000 человек и оценили годовое процентное изменение для описания временных тенденций.
Результаты
Рак желудка входит в пятерку наиболее часто диагностируемых онкологических заболеваний и является ведущей причиной смертности от рака.Между странами CSA заболеваемость варьировалась в 6 раз, а смертность — в 5–6 раз. У мужчин этот показатель был в 3 раза выше, чем у женщин. С 2003 по 2007 год самые высокие ASR были в Чили, Коста-Рике, Колумбии, Эквадоре, Бразилии и Перу (мужчины: 19,2–29,1, женщины: 9,7–15,1). Самые высокие ASMR были у мужчин из Чили, Коста-Рики, Колумбии и Гватемалы (17,4–24,6) и у женщин из Гватемалы, Эквадора и Перу (10,5–17,1). С 1997 по 2008 год заболеваемость снижалась на 4% в год в Бразилии, Чили и Коста-Рике; смертность снизилась на 3–4% в Коста-Рике и Чили.60–96% всех случаев рака не были определены в отношении участка желудка, но среди указанных случаев некардиальный рак встречался в 2–13 раз чаще, чем рак кардии.
Заключение
Различия в показателях могут отражать различия в распространенности инфекции Helicobacter pylori и других факторов риска.




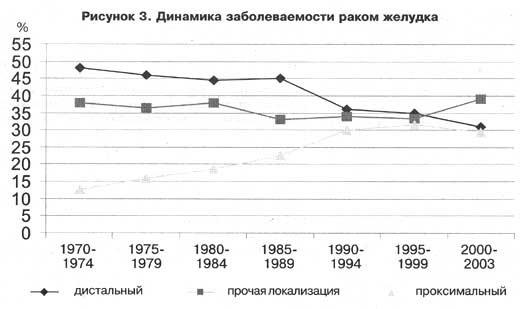
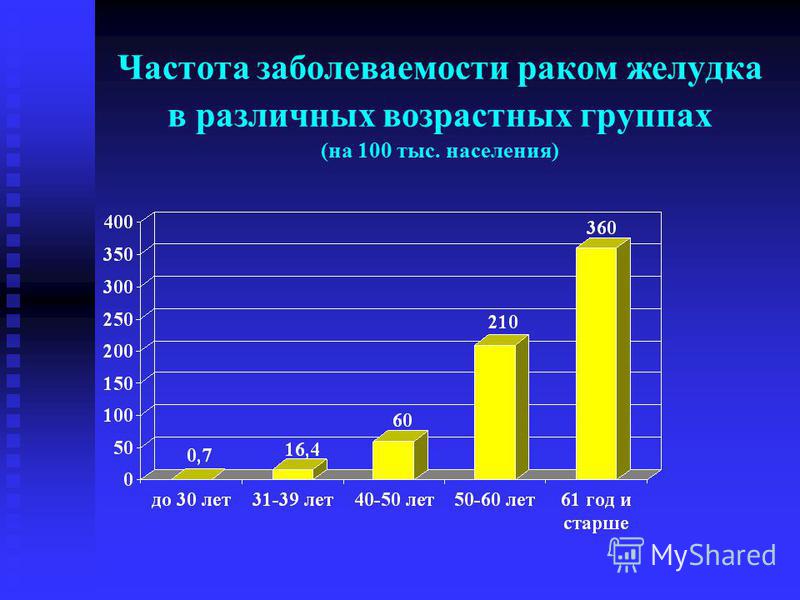 J Gastrointest Cancer. 2015; 46: 21-28. Medline, Google Scholar.
J Gastrointest Cancer. 2015; 46: 21-28. Medline, Google Scholar. The two histological main types of gastric carcinoma: diffuse and so‐called intestinal‐type carcinoma. Acta Pathol Microbiol Scand. 1965; 64: 31-49. Medline, Google Scholar.
The two histological main types of gastric carcinoma: diffuse and so‐called intestinal‐type carcinoma. Acta Pathol Microbiol Scand. 1965; 64: 31-49. Medline, Google Scholar.
 Clin Cancer Res. 2017; 15: 4441-4449. Google Scholar
Clin Cancer Res. 2017; 15: 4441-4449. Google Scholar
 Lancet. 2014; 383: 31-39. Medline, Google Scholar.
Lancet. 2014; 383: 31-39. Medline, Google Scholar. Gastric Cancer. 2015; 18: 168-176. Google Scholar.
Gastric Cancer. 2015; 18: 168-176. Google Scholar. Lancet Oncol. 2017; 18: 1637-1651. Google Scholar.
Lancet Oncol. 2017; 18: 1637-1651. Google Scholar. Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1467-1482. Medline, Google Scholar.
Rilotumumab plus epirubicin, cisplatin, and capecitabine as first-line therapy in advanced MET-positive gastric or gastro-oesophageal junction cancer (RILOMET-1): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol. 2017; 18: 1467-1482. Medline, Google Scholar.