Городская клиническая больница №31 — Пациентам в помощь. Гематологические заболевания. Введение. Часть I. Лимфомы (страница 9)
Страница 9 из 33
Первично медиастинальная (тимическая) В-клеточная крупноклеточная лимфома
Первично медиастинальная (тимическая) В-клеточная крупноклеточная лимфома является одним из самых агрессивных видов В-крупноклеточных лимфомы. Чаще всего она начинается в лимфатических узлах средостения (область за грудиной, то есть за центральной плоской костью на груди, к которой присоединяются рёбра). Болезнь быстро распространяется на все тело, и тогда лимфатические узлы увеличиваются группами на шее, подмышками, в паху и в других местах, а также появляются одиночные опухоли во внутренних органах. Увеличенные узлы можно прощупать руками или найти с помощью рентгена и ультразвука (УЗИ). У больного могут появляться такие признаки болезни, которые называются «В-симптомы»: поднимается температура, он быстро худеет и сильно потеет вечером и ночью.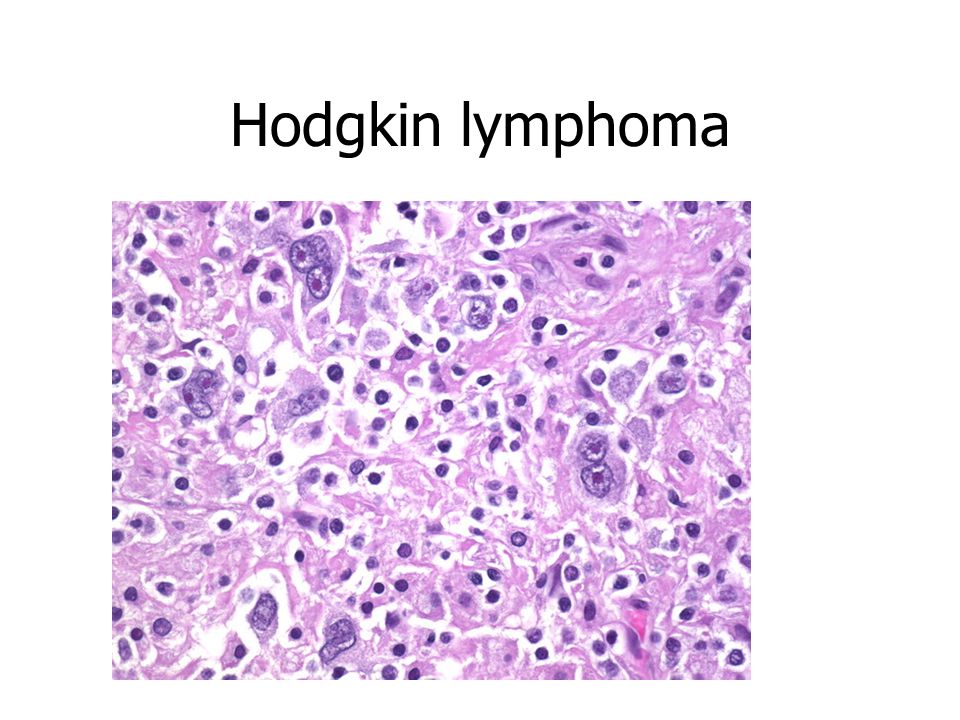 Первично медиастинальная В-крупноклеточная лимфома быстро прогрессирует, однако вполне излечима.
Первично медиастинальная В-крупноклеточная лимфома быстро прогрессирует, однако вполне излечима.
Диагноз
Чтобы поставить правильный диагноз, обязательно берут кусочек опухоли или увеличенного лимфатического узла для морфологического и иммуногистохимического исследования . Только после такого сложного комплексного анализа можно быть уверенным в диагнозе и провести эффективное лечение.
Для того чтобы точно узнать, есть ли увеличенные лимфатические узлы и каково их количество в тех частях тела, которые нельзя увидеть при внешнем осмотре, необходимо сделать компьютерную томографию грудной клетки, брюшной полости и малого таза. Стадию болезни устанавливают по системе «Ann-Arbor», которая показывает, какие органы и лимфатические узлы затронуты болезнью.
Лечение
Чтобы вылечить пациента с этим заболеванием, используют разнообразные схемы, применяя лекарство «ритуксимаб». Лечение зависит от особенностей болезни и, главное, от общего состояния здоровья больного.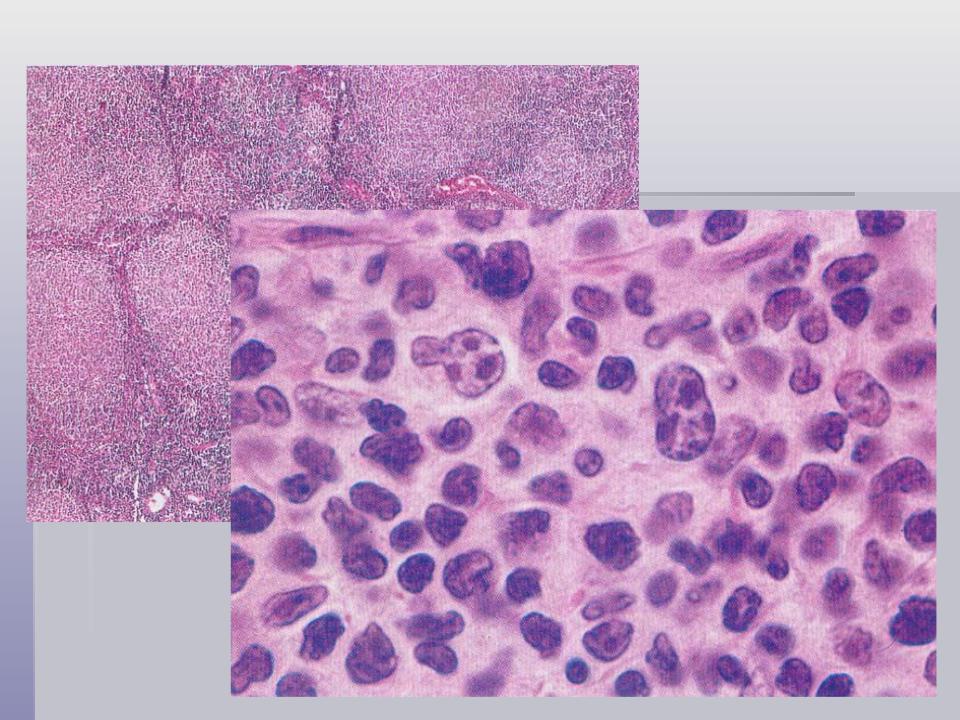 Между курсами химиотерапии, для оценки их эффективности, может потребоваться контрольная компьютерная томография. Если лечение небольшими дозами лекарств не помогает, то проводят более интенсивное лечение, так называемую высокодозную химиотерапию, которую поддерживают собственными стволовыми клетками больного
Между курсами химиотерапии, для оценки их эффективности, может потребоваться контрольная компьютерная томография. Если лечение небольшими дозами лекарств не помогает, то проводят более интенсивное лечение, так называемую высокодозную химиотерапию, которую поддерживают собственными стволовыми клетками больного
Применение современных методов и лекарств позволяет полностью излечить около 85% пациентов.
ЭКСТРАМЕДИАСТИНАЛЬНОЕ ПОРАЖЕНИЕ У БОЛЬНЫХ ПЕРВИЧНОЙ МЕДИАСТИНАЛЬНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМОЙ | Мангасарова
1. Lichtenstein A. K., Levine A., Taylor C. R. et al. Primary mediastinal lymphoma in adults. Am J Med 1980;68(4):509–14. DOI: 10.1016/0002-343(80)90294–6. PMID: 6892753.
2. Cazals-Hatem D., Lepage E., Brice P. et al. Primary mediastinal large B-cell lymphoma.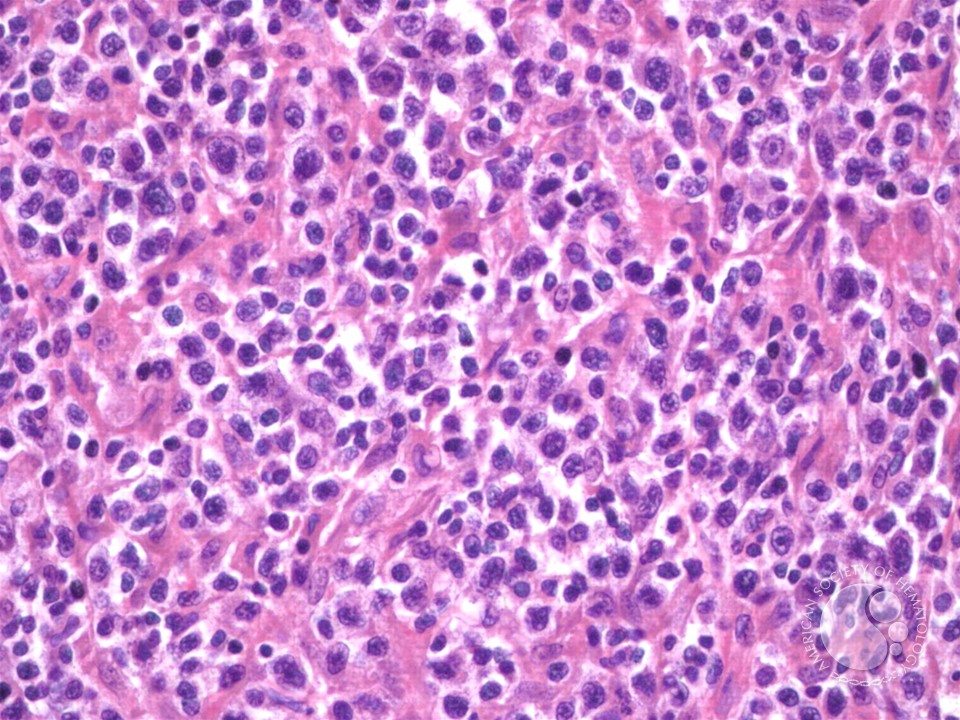
3. Rosenwald A., Wright G., Leroy K. et al. Molecular diagnosis of primary mediastinal B cell lymphoma identifies a clinically favorable subgroup of diffuse large B cell lymphoma related to Hodgkin lymphoma. J Exp Med 2003;198(6):851–862. DOI: 10.1084/jem.20031074. PMID: 12975453.
5. Meier C., Hoeller S., Bourgau C. et al. Recurrent numerical aberrations of JAK2 and deregulation of the JAK2-STAT cascade in lymphomas. Mod Pathol 2009;22(3):476–87. DOI: 10.1038/modpathol.2008.207. PMID: 19136931.
Mod Pathol 2009;22(3):476–87. DOI: 10.1038/modpathol.2008.207. PMID: 19136931.
6. Steidl C., Gascoyne R. D. The molecular pathogenesis of primary mediastial large B-cell lymphoma. Blood 2011;118(10): 2659–69. DOI: 10.1182/blood2011-05-326538. PMID: 21700770.
7. Joos S., Granzow M., Holtgreve-Grez H. et al. Non-Hodgkin’s lymphoma cell lines are characterized by frequent aberrations on chromosomes 2p and 9p including REL and JAK2. Int J Cancer 2003;103(4):489–95. DOI: 10.1002/ijc.10845. PMID: 12478664.
8. Мангасарова Я. К., Мисюрин А. В., Магомедова А. У. и др. Молекулярная диагностика первичной медиастинальной В-клеточной лимфомы и диффузной В-крупноклеточной лимфомы с первичным вовлечением лимфатических узлов средостения. Клиническая онкогематология 2011;4:142–5.
9. Twa D. D., Chan F. C., Ben-Neriah S. et al. Genomic rearrangements involving programmed death ligands are recurrent in primary mediastinal large B-cell lymphoma. Blood 2014;123(13):2062–5. DOI: 10.1182/blood-2013‑10‑535443. PMID: 24497532.
10. Bentz M., Barth T. F., Bruderlein S. et al. Gain of chromosome arm 9p is characteristic of primary mediastinal B-cell lymphoma (MBL): comprehensive molecular cytogenetic analysis and presentation of a novel MBL cell line. Gen Chromos Cancer 2001;30(4):393–401. PMID: 11241792.
11. Huang J., Sanger G., Greiner T. et al. The t(14;18) defines a unique subset of large B-cell lymphoma with a germinal center B-cell gene expression profile. Blood 2002;99(7):285–90. DOI: 10.1182/blood.V99.7.2285. PMID: 11895757.
12. Barans S., Connor S., Evans P. et al. Rearrangement of the BCL-6 locus at 3q27 is an independent poor prognostic factor in nodal diffuse large B-cell lymphoma. Br J Hematol 2002;117(2): 322–32. DOI: 10.1046/j.1365 2141.2002.03435.x. PMID: 11972514.
Barans S., Connor S., Evans P. et al. Rearrangement of the BCL-6 locus at 3q27 is an independent poor prognostic factor in nodal diffuse large B-cell lymphoma. Br J Hematol 2002;117(2): 322–32. DOI: 10.1046/j.1365 2141.2002.03435.x. PMID: 11972514.
13. Ковригина А. М., Пробатова Н. А. Лимфома Ходжкина и крупноклеточные лимфомы. М.: МИА, 2007. С. 108–124.
14. Yuan J., Wright G., Rosenwald A. et al. Identification of primary mediastinal large b-cell lymphoma at nonmediastinal sites by gene expression profiling. Am J Surg Pathol 2015;39(10):1322–30. DOI: 10.1097/PAS.0000000000000473. PMID: 26135560.
 1999.17.8.2479. PMID: 10561312.
1999.17.8.2479. PMID: 10561312.16. Магомедова А. У., Фастова Е. А., Ковригина А. М. и др. Поражение костного мозга при первичной медиастинальной В-крупноклеточной лимфоме. Терапевтический архив 2017;89(7):65–8.
Первичная медиастинальная В-крупноклеточная лимфома у беременных
Лимфопролиферативные заболевания — наиболее частые среди гематологических заболеваний, выявляемых у беременных (1 случай на 1000-6000 беременностей) [1]. В практике врача сложным является вопрос о возможности применения полихимиотерапии (ПХТ) при лимфоме во время беременности. Выбор тактики ведения таких пациенток зависит от основного заболевания, срока беременности, объема поражения, соматического статуса, возможного проникновения препаратов через плацентарный барьер и тератогенного воздействия на плод. В некоторых случаях, преимущественно при лимфоме Ходжкина, возможно отложить начало ПХТ до родоразрешения.
Диагностика ПМВККЛ у беременных должна проводиться в полном объеме с использованием гистологических, иммуногистохимических и молекулярных данных. Только подтвержденный диагноз позволяет выбрать адекватную схему ПХТ и достигнуть максимального эффекта [5, 6]. Как на этапе верификации диагноза, так и в дальнейшем, при оценке эффективности химиотерапии у беременных, существуют ограничения в использовании лабораторных методик. Выполнение компьютерной томографии (КТ), особенно брюшной полости, у беременных сопряжено с лучевой нагрузкой на плод. Считается, что доза менее 10 Рад безопасна для плода, т.е. риск развития неблагоприятных исходов при такой дозе составляет 1% [7-9].
Проведение химиотерапии на ранних сроках (в I триместре) беременности в большинстве случаев противопоказано в связи с развитием мальформации у плода. Начиная с фетальной фазы беременности, возможно применение ПХТ, так как к этому времени происходит закладка всех органов плода, и плацентарный барьер частично препятствует проникновению химиопрепаратов в органы и ткани плода [11, 12]. По данным большинства публикаций, у детей пациенток, получавших химиотерапию во II и III триместре беременности, пороки развития плода констатируются не более чем в 1,3% случаев, что не превышает число пороков в общей популяции [13, 14]. Срок родоразрешения зависит от состояния матери, плода и осложнений в результате проведенной ПХТ. Миелосупрессивная терапия не должна проводиться за 3 нед до предполагаемого родоразрешения в целях минимизации риска развития инфекционных и геморрагических осложнений [15]. При преждевременном родоразрешении, после 33-34 нед беременности, метод родоразрешения зависит от паритета пациентки, состояния плода и родовых путей. Предпочтительными у женщин с гематологическим заболеванием, особенно у повторнородящих, являются роды через естественные родовые пути. Однако при наличии акушерских и/или гематологических показаний родоразрешение проводится путем кесарева сечения (КС). Частота КС у женщин с лимфомами выше, чем в общей популяции, и составляет 37%, что часто связано с необходимостью досрочного родоразрешения [3].
Миелосупрессивная терапия не должна проводиться за 3 нед до предполагаемого родоразрешения в целях минимизации риска развития инфекционных и геморрагических осложнений [15]. При преждевременном родоразрешении, после 33-34 нед беременности, метод родоразрешения зависит от паритета пациентки, состояния плода и родовых путей. Предпочтительными у женщин с гематологическим заболеванием, особенно у повторнородящих, являются роды через естественные родовые пути. Однако при наличии акушерских и/или гематологических показаний родоразрешение проводится путем кесарева сечения (КС). Частота КС у женщин с лимфомами выше, чем в общей популяции, и составляет 37%, что часто связано с необходимостью досрочного родоразрешения [3].
Сообщение о первой успешно завершившейся беременности у больной с лимфопролиферативным заболеванием, протекавшей на фоне ПХТ, описано в 1977 г. J. Ortega [16]. В мировой практике описаны единичные случаи проведения химиотерапии (R-CНОР, СНОР, R-HCVAD, MACOP-B) пациенткам с диагнозом ПМВККЛ в период беременности. Все рожденные дети были практически здоровы [14, 17-19].
Все рожденные дети были практически здоровы [14, 17-19].
Существует ограниченное количество противоречивых сообщений о безопасности и эффективности применения иммунохимиотерапии, содержащей ритуксимаб, во время беременности. Химерное моноклональное антитело CD20 проникает через плацентарный барьер, тем самым может оказывать влияние на В-лимфоциты плода с возможным риском развития внутриутробной инфекции. Однако в литературе есть сообщение лишь об одном случае временной лимфоцитопении у новорожденного после использования ритуксимаба [20]. В других наблюдениях у беременных, получавших лечение с включением ритуксимаба, родились здоровые дети [21-23].
Одной из первых программ ПХТ, использовавшейся для лечения больных ПМВККЛ, была схема CHOP, применение которой позволяло достигнуть ремиссий в 13-35% случаев. Обращали внимание частое развитие резистентности к химиотерапии (35%) и короткая продолжительность жизни больных (17-25 мес). Сочетание СНОР и ЛТ увеличило медиану жизни до 26 мес [24].
Лечение пациенток ПМВККЛ по программам третьего поколения (МАСОР-В, VACOP-B, ProMACE-CytаBOM и т.д.) в сочетании с лучевой терапией (ЛТ) позволило улучшить результаты, 10-летняя общая выживаемость (ОВ) составила 71% [7, 25]. Проведение высокодозной терапии в сочетании с ЛТ привело к увеличению 10-летней ОВ до 89% [6, 7].
K. Dunleavy [26] опубликовал данные о высокой эффективности ПХТ по схеме R-EPOCH без ЛТ. При этом ОВ составила 100% при медиане наблюдения 4 года. Многие авторы обращают внимание на то, что первая линия терапии ПМВККЛ является наиболее важной, так как прогрессирование и рецидив основного заболевания плохо поддаются лечению и имеют неблагоприятный прогноз [27, 28].
На момент верификации диагноза размеры опухоли при ПМВККЛ в большинстве случаев превышают 7,5 см. После ПХТ в 40-60% случаев сохраняется остаточное образование, размеры которого могут не меняться длительное время или постепенно уменьшаться. Рецидив заболевания при наличии остаточного образования возникает в 30-40% случаев [7, 29]. Для верификации природы остаточного образования чаще всего применяются сцинтиграфия с 67Ga и позитронно-эмиссионная томография (ПЭТ) [29]. ПЭТ выполняют не ранее чем через 4-8 нед после последнего цикла ПХТ. Однако данный метод является неспецифичным. В проспективном исследовании
Для верификации природы остаточного образования чаще всего применяются сцинтиграфия с 67Ga и позитронно-эмиссионная томография (ПЭТ) [29]. ПЭТ выполняют не ранее чем через 4-8 нед после последнего цикла ПХТ. Однако данный метод является неспецифичным. В проспективном исследовании
C. Moskowitz [30], включавшем 94 пациента, после ПХТ выполняли ПЭТ для решения вопроса о дальнейшей тактике лечения. У 38 (40%) пациенток с позитивным результатом ПЭТ выполнена биопсия. Из них у 33 (87%) данных, подтверждающих наличие опухоли, не получено и только у 5 (13%) по результатам гистологического исследования доказана опухоль. В дальнейшем у 28 (74%) из 38 женщин сохранялась полная ремиссия заболевания.
Таким образом, в связи с ограниченным количеством сообщений о лечении ПМВККЛ у беременных остается много открытых вопросов: тактика ведения пациенток данной группы, выбор программы лечения, оценка осложнений, возникших в результате проведенной ПХТ на фоне беременности и после родоразрешения, состояние здоровья новорожденных.
Цель исследования — разработка тактики ведения беременных с ПМВККЛ и оценка токсичности проведенного лечения для матери и плода.
Материалы и методы
С 2004 по 2014 г. в ФГБУ «Гематологический научный центр» проходили лечение 94 больных (в их числе 63 женщины) с В-крупноклеточной лимфомой средостения, из них у 7 (7,4%) пациенток заболевание дебютировало во II-III триместрах беременности. Ведение беременных осуществляли совместно с сотрудниками ФГБУ НЦ АГиП им. В.И. Кулакова. Диагностика ПМВККЛ основывалась на особенностях клинического течения заболевания, гистологической картине и иммунофенотипе опухолевых клеток. С целью верификации диагноза беременным пациенткам выполняли торакоскопию в 1 случае, трансторакальную игольную биопсию в 2, медиастиноскопию в 1, биопсию периферического лимфатического узла в 3. У всех пациенток на момент верификации диагноза размеры опухоли средостения превышали 10 см и констатирован синдром сдавления верхней полой вены. Все относились к группе промежуточного высокого риска по aa-IPI. Медиана возраста составила 30 (от 23 до 32) лет, медиана срока беременности — 22 (18-29) нед.
Распространенность опухолевого процесса на момент установления диагноза и начала химиотерапии оценивали по результатам КТ и/или МРТ органов грудной клетки, УЗИ органов брюшной полости, забрюшинного пространства, молочных желез, средостения, трепанобиопсии с гистологическим и цитологическим исследованиями костного мозга. Стадию заболевания устанавливали по классификации Ann Arbor.
Оценку эффективности ПХТ проводили согласно критериям Международной рабочей группы (International Working Group) 2007 г. [8].
Индукционная терапия включала ПХТ по схемам VACOP-B или R-EPOCH. С консолидирующей целью через 3-4 нед после родоразрешения проводили ХТ по программе R+Dexa-BEAM с последующей ЛТ на область резидуального образования средостения. Для оценки природы остаточного образования через 1 мес после индукционного и консолидирующего лечения выполняли ПЭТ.
Медиана наблюдения за пациентками и рожденными детьми составила 35 (15-64) мес. У 5 из 7 пациенток с диагнозом ПМВККЛ проведена ПХТ по программе VACOP-B, 2/7 — по схеме R-EPOCH. ПЭТ после индукционного курса ПХТ (VACOP-B, R-EPOCH) выполнена 4 женщинам. Учитывая отсутствие полной ремиссии заболевания после индукционных курсов ПХТ и невыполнение протокола лечения в связи с родоразрешением (удлинение интервалов между курсами), с консолидирующей целью проводили ПХТ по схеме R+Dexa-BEAM + ЛТ. Лечение возобновляли через 3-4 нед после родов с целью минимизации инфекционных осложнений. ПЭТ после ПХТ по схеме R+Dexa-BEAM проведена 6 больным.
После индукционного лечения в группе пациенток VACOP-B у 4 из 5 достигнута частичная ремиссия, у 1 констатировано прогрессирование заболевания. В группе R-EPOCH у 2 из 2 больных достигнута частичная ремиссия. В послеродовом периоде лечение по схеме R+Dexa-BEAM получили 7 из 7 пациенток. В 4 случаях из 7 проведено 2 курса Dexa-BEAM, у 3 пациенток — 3 цикла: 1 — в связи с невозможностью выполнения ЛТ на область резидуального образования средостения, 1 — из-за прогрессирования основного заболевания, 1 — вследствие выполнения на этапах индукции (до родоразрешения) всего 2 курсов ПХТ R-EPOCH. Ритуксимаб включали в схему Dexa-BEAM у 3 из 7 пациенток. ЛТ в суммарной очаговой дозе 36 Гр на область остаточного образования средостения проведена 5 пациенткам. После выполненного протокола лечения ранний рецидив констатирован только у 1 из них в группе VACOP-B/Dexa-BEAM. Результаты представлены в табл. 1.
Индукционная терапия по схеме VACOP-B у 2 пациенток из 5 осложнилась развитием пневмоцистной пневмонии, в связи с чем во время беременности проводилась терапия бисептолом 100 мг/кг/сут (в расчете на сульфаметоксазол). У 1 больной из 2, получавшей лечение по программе R-EPOCH, диагностирован сепсис. У 3 пациенток из 7 констатирован тромбоз внутренней яремной вены, в связи с чем проводилась антикоагулянтная терапия (в 1 случае низкомолекулярным гепарином, в 2 — нефракционированным гепарином с круглосуточным введением) под контролем коагулограммы. Во всех случаях констатировано появление признаков реканализации тромба. Данные представлены в табл. 2.
На момент завершения ПХТ при оценке данных ПЭТ обращала внимание высокая частота наличие позитивных результатов, в 4 из 6 случаев, без признаков прогрессии основного заболевания, что затрудняло интерпретацию остаточного медиастинального образования и выбор тактики лечения. Данный феномен, вероятно, связан с биологией опухоли и макрофагальной реакцией [29]. Несмотря на наличие ПЭТ-позитивного остаточного медиастинального образования, все пациентки живы без признаков прогрессирования с медианой наблюдения 35 (15-64) мес.
На протяжении всей беременности проводили динамическое наблюдение за состоянием плода. После каждого курса ПХТ выполняли УЗИ (оценивали массоростовые параметры плода, количество околоплодных вод, состояние плаценты), проводили допплерометрию маточно-плацентарного и фетоплацентарного кровотока. Следует отметить, что, несмотря на проведение ПХТ, а в некоторых случаях и антибактериальной терапии, не зарегистрировано ни одного случая задержки развития, гипоксии или антенатальной гибели плода. Роды у 2 женщин были через естественные родовые пути на сроке 34 и 36 нед, у 5 пациенток — путем операции КС на 30, 32, 32, 32 и 36-й неделях. Операция КС в 2 случаях выполнена на сроке 32 нед в связи с необходимостью проведения высокодозной ПХТ после завершения запланированного индукционного курса, у 1 больной — на сроке 32 нед из-за развития тяжелого гестоза, у 1 пациентки — на сроке 30 нед в связи с сепсисом, вызванным грамположительной микрофлорой, и угрозой преждевременных родов.
Родились 7 детей: 3 мальчика и 4 девочки. Медиана массы тела составила 2182 (от 1700 до 3600) г, медиана роста 47 (от 40 до 53) см. Не отмечено ни одного порока развития плода. У 2 из 7 новорожденных, рожденных от женщин, которые получали ПХТ по схеме R-EPOCH, диагностировали внутриутробную пневмонию на фоне респираторного дистресс-синдрома, что, возможно, связано с недоношенностью плодов и применением ритуксимаба. У 1 ребенка, рожденного от пациентки, которая включена в протокол лечения по схеме VACOP-B, при рождении констатировали тромбоз верхней полой вены.
Проведение высокодозной ПХТ или R-EPOCH у больных с диагнозом ПМВККЛ позволяет достигнуть длительных ремиссий заболевания более чем в 90% случаев [26, 31]. Тактика ведения беременных с опухолью средостения зависит от многих факторов: срока беременности, течения основного заболевания и состояния плода. В I триместре в большинстве случаев рекомендуется прерывание беременности по медицинским показаниям в связи с тератогенностью химиопрепаратов. Во II-III триместрах возможно применение ПХТ, так как плацентарный барьер сформирован и произошла закладка всех органов плода. Кроме того, прерывание беременности на поздних сроках может привести к геморрагическим и гнойно-воспалительным осложнениям, а также нанести психологическую травму пациентке. К тому же это откладывает начало лечения, что при агрессивном течении заболевания и наличии угрожающих жизни осложнений сопряжено с худшим прогнозом для пациентки. Ведение пациенток с лимфомами, выявленными во время беременности, направлено на спасение жизни и матери, и плода. С одной стороны, проведение высокодозных курсов ПХТ у беременных приводит к высокому риску развития аномалии плода и преждевременным родам, с другой — отказ от адекватной терапии ухудшает прогноз для матери.
В нашем исследовании использовался следующий алгоритм лечения пациенток ПМВККЛ во время беременности: в индукции ремиссии до родоразрешения проводилась терапия по схемам VACOP-B или R-EPOC; с консолидирующей целью в послеродовом периоде через 3-4 нед после родоразрешения проводилась ХТ по программе R+Dexa-BEAM с последующей ЛТ на резидуальное образование средостения в суммарной очаговой дозе 36 Гр. Переход от схемы VACOP-B к R-EPOCH в индукционном периоде связан с 2 из 5 неудачами в лечении (1 — ранний рецидив, 1 — прогрессия заболевания), а также с появлением результатов K. Dunleavy [26], свидетельствующих о высокой эффективности программы R-EPOCH при ПМВККЛ. Обращает внимание, что в 2 случаях при применении ритуксимаба на фоне беременности у детей констатирована внутриутробная пневмония. Возможно, данное осложнение связано с недоношенностью и респираторным дистресс-синдромом. Для оценки влияния ритуксимаба на развитие инфекционных осложнений у плода необходимо большее количество наблюдений.
У пациенток с лимфомами во время II-III триместра беременности должна проводиться ПХТ без прерывания беременности, что дает возможность спасти 2 жизни.
В результате разработанного алгоритма лечения и ведения беременности все пациентки живы без признаков опухоли, а дети практически здоровы, без пороков и признаков отставания в развитии.
Первичная медиастинальная В-крупноклеточная лимфома и лимфома Ходжкина: клиника и дифференциальный диагноз
На правах рукописи
КИЧИГИНА МАРИЯ ЮРЬЕВНА
ПЕРВИЧНАЯ МЕДИАСТИНАЛЬНАЯ В-КРУПНОКЛЕТОЧНАЯ ЛИМФОМА И ЛИМФОМА ХОДЖКИНА: КЛИНИКА И ДИФФЕРЕНЦИАЛЬНЫЙ ДИАГНОЗ (14. 01. 12-онкология)
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
1 2 ИЮЛ 2012
Москва-2012
005046436
005046436
Работа выполнена в Федеральном государственном бюджетном учреждении «Российский онкологический научный центр имени Н.Н.Блохина» Российской академии медицинских наук
Научные руководители:
доктор медицинских наук Тумян Гаяне Сепуговна доктор биологических наук Ковригина Алла Михайловна
Официальные оппоненты:
Кадагидзе Заира Григорьевна доктор медицинских наук, профессор,
заведующая централизованным клинико-лабораторным отделом ФГБУ «РОНЦ им. Н.Н. Блохина» РАМН Сусулева Наталья Александровна доктор медицинских наук, профессор,
заведующая учебной частью кафедры детской онкологии ГБОУ ДПО РМАПО Минздравсоцразвигая России
Ведущая организация: ГБОУ ВПО Российский национальный исследовательский медицинский университет имени Н.» Шишкин Юрий Владимирович
Актуальность работы.
Лимфопролифёративные заболевания Т- и В-клеточного происхождения составляют примерно 25% от общего числа злокачественных опухолей средостения, из них более 80% приходится на долю В-крупноклеточных лимфом -лимфомы Ходжина и. первичной медиастинальной (тимической) В-кругагоклеточной лимфомы. Являясь самостоятельными нозологическими формами, эти два заболевания демонстрируют целый ряд общих клинических, морфоиммунологических и молекулярно-биологических признаков. Молодой возраст больных, преимущественная локализация основного массива опухоли в пределах ограниченного пространства переднего верхнего средостения, инфильтративный рост с вовлечением прилежащих органов и тканей обуславливают развитие похожей клинической картины.
Первичная медиастинальная В-крупноклеточная лимфома (ПМВКЛ) характеризуется диффузной опухолевой инфильтрацией лимфоидными клетками среднего и крупного размера с морфологией центробластов и/или иммунобластов в различных количественных соотношениях. Могут встречаться крупные многоядерные формы типа клеток Березовского-Рид-Штернберга. Так же, как и при лимфоме Ходжкина (JIX), характерным признаком является стромальный склероз, часто обнаруживаются очаги некроза.
При иммуногистохимическом исследовании опухолевой ткани больных ПМВКЛ наблюдается экспрессия основных В-клеточных антигенов (CD 19, CD20, CD22, CD79a), отсутствие экспрессии CD 10, CD21 и поверхностных иммуноглобулинов. В отличие от диффузной В-крупноклеточной лимфомы (ДВКЛ), опухолевые клетки ПМВКЛ экспрессируют активационный антиген CD23, который является типичным маркером для большинства В-лимфоцитов мозгового слоя тимуса. При ПМВКЛ, в отличие от ЛХ, отмечается невыраженная, гетерогенная мембранная экспрессия антигена CD30, dot-like реакция, как правило, отсутствует.
Опухолевые клетки при ПМВКЛ характеризуются уникальным профилем экспрессии генов, в целом отличным от ДВКЛ и имеющим большое сходство с молекулярным портретом клеток Березовского-Рид-Штернберга при ЛХ. Более
одной трети ключевых генов, (МАЬ, БИЛ, РБЬ2, ТАКС), экспрессирующихся при ПМВКЛ, типичны и для ЛХ. Все вышесказанное подтверждает гипотезу о возможном существовании единой клетки-предшественницы тимического происхождения при ПМВКЛ и ЛХ с преимущественным поражением средостения.
Таким образом, накопленные данные о сходстве клинических проявлений, открытие общих генетических нарушений и механизмов опухолевой трансформации заставляют обратить пристальное внимание и взглянуть под иным углом зрения на две отдельные нозологические формы: лимфому Ходжкина с преимущественным вовлечением средостения и первичную медиастинальную В-крупноклеточную лимфому. Локализация процесса в средостении, наличие склероза и некроза в опухолевой ткани при ЛХ и ПМВКЛ требуют тщательного изучения дифференциально-диагностических критериев разграничения этих вариантов крупноклеточных лимфом.
Несмотря на схожесть клинических и биологических характеристик, результаты терапии больных ПМВКЛ и ЛХ с вовлечением средостения значительно различаются. Дифференцированный подход к терапии с учетом объема опухолевой массы и определения группы риска больных, значительно повысил эффективность лечения ЛХ. Достижения в этой области, позволяющие добиваться полного излечения большей части пациентов, побуждают к поиску таких же эффективных терапевтических подходов к больным ПМВКЛ и представляют актуальную проблему сегодняшней онкогематологии.
Цель исследования.
Целью настоящего исследования явилось изучить клинические и морфоиммунологические особенности первичной медиастинальной В-крупноклеточной лимфомы и лимфомы Ходжкина с преимущественным поражением средостения.
Задачи исследования.
1. Выделить группы больных с В-крупноклеточными лимфомами и преимущественным поражением средостения.
2. Сопоставить морфологические и иммуногистохимические характеристики опухолевой ткани больных первичной медиастинальной В-крупноклеточной лимфомой и лимфомой Ходжкина.с вовлечением средостения.
3. Изучить дифференциально-диагностические критерии, в частности, частоту и уровень экспрессии маркеров CD20, CD10, CD1 lc, CD23, MUM1, c-REL и TRAF1 при первичной медиастинальной В-крупноклеточной лимфоме и лимфоме Ходжкина.
4. Оценить эффективность современных программ лечения больных первичной медиастинальной В-крупноклеточной лимфомой и лимфомой Ходжкина с учетом различных прогностических факторов.
5. Провести клинические и морфоиммунологические параллели между первичной медиастинальной В-крупноклеточной лимфомой и лимфомой Ходжкина с поражением средостения.
Научная новизна и практическая значимость.
Впервые на большом клиническом материале (144 первичных больных) проведен клинический и морфоиммунологический анализ двух наиболее распространенных вариантов В-крупноклеточных лимфом средостения. Показано, что все случаи лимфомы Ходжкина с поражением средостения представлены гистологическим вариантом — нодулярный склероз. Установлено, что морфологический полиморфизм первичной медиастинальной В-крупноклеточной лимфомы включает в себя признаки, характерные для лимфомы Ходжкина, а значит, четкая дифференциальная диагностика возможна только при проведении иммуногистохимического исследования. «Ключевыми» диагностическими маркерами для первичной медиастинальной В-крупноклеточной лимфомы следует считать коэкспрессию CD23 (выявлена в 74%), CDllc (90%), CD30 (мембранная реакция выявлена в 58% случаев). Маркеры c-REL и TRAF1 имеют важное дополнительное дифференциально-диагностическое значение и, в сложных случаях, должны входить в диагностическую панель иммуногистохимического исследования. В 26% случаев лимфомы Ходжкина была выявлена экспрессия
антигена CD20, что может создавать новые терапевтические возможности для лечения этого варианта заболевания. На собственном материале оценены и сопоставлены непосредственные и отдаленные результаты различных, в том числе интенсивных, программ лечения первичной медиастинальной В-крупноклеточной лимфомы, показана эффективность использования airra-CD20 моноклональных антител (ритуксимаб).
Апробация диссертации. Основные положения диссертации доложены и обсуждены 04 октября 2011г. на совместной научной конференции с участием сотрудников отделения химиотерапии гемобластозов, радиологического отделения, лаборатории иммунологии гемопоэза, отдела патологической анатомии опухолей человека РОНЦ им. H.H. Блохина РАМН, отделения химиотерапии гемобластозов НИИ детской онкологии и гематологии РОНЦ им. H.H. Блохина РАМН, кафедры онкологии Российской Медицинской Академии Последипломного Образования и кафедры онкологии Первого Московского Государственного Медицинского Университета им. И.М. Сеченова.
Публикации. По теме диссертации опубликовано 13 научных работ.
Объем и структура диссертации. Диссертация состоит из введения, 4 глав с обзором литературы, изложением материалов и методов, результатов собственных исследований, заключения, выводов и указателя литературы. Работа изложена на 143 страницах машинописного текста, содержит 28 таблиц и 64 рисунка. Библиографический указатель включает 4 отечественных и 82 зарубежных источников. ‘
Содержание работы
Материалы и методы исследования. В работу вошли данные клинического анализа и результаты морфологического исследования материала биопсии 144 больных ПМВКЛ и JIX с поражением средостения, которые наблюдались в РОНЦ им. H.H. Блохина РАМН с 2000 г. по 2010 г. С целью уточнения распространенности опухоли перед началом лечения и оценки ответа на терапию все пациенты проходили ряд обследований: рентгенологическое и компьютерно-томографическое исследование органов грудной клетки, гастроскопия, фибролярингоскопия, ультразвуковое исследование сердца, периферических
лимфатических узлов, органов брюшной полости и малого таза, трепанобиопсия подвздошной кости.
Диагноз ПМВКЛ или ЛХ устанавливался на основании гистологического исследования опухолевой ткани. При ПМВКЛ оценивался характер роста опухоли, наличие кольцевидного коллагенового или альвеолярного фиброза, некроза, клеточный состав опухолевой ткани. При ЛХ изучалась» степень выраженности эозинофильной инфильтрации, проводилась градация с выделением двух типов нодулярного склероза в соответствии с критериями Британской группы по изучению лимфом (BNLI) — NSl/(Grade 1) и NSII/(Grade 2). У 92 из 144 больных оценивались результаты иммуногистохимического исследования репрезентативного материала опухолевой ткани. Для дифференциальной диагностики крупноклеточных лимфом средостения использовалась расширенная панель антител: CD3, CD10, CDllc, CD15, CD20, CD23, CD30, РАХ5, CD45, MuM.l, HLA-DR, Ki-67. При наличии сохранного материала в достаточном объеме дополнительно исследовались маркеры активации сигнального пути NF-кВ (c-REL и TRAF1), отражающие молекулярные механизмы патогенеза опухоли.
Стадирование заболевания проводилось в соответствии с классификацией, предложенной в Ann-Arbor (1971г.), дополненной в Costwald (1989г.) для пациентов ЛХ и адаптированной для пациентов ПМВКЛ [DeVita V.T., 2001; Mauch P., 1999]. При верификации у больных ПМВКЛ с локальной опухолевой инвазией прилежащих структур внутри средостения, в том числе плевры, перикарда, легочной ткани и мягких тканей передней грудной стенки, устанавливалась II Е стадия заболевания [Savage K.J. et al., 2005].
Массивным (bulky) считалось поражение средостения, если по данным компьютерной томографии определялось наличие опухолевого поражения, равное или превышающее 6 см в диаметре [Zinzani P.L., 1999] и/или медиастинально-торакальный индекс (МТИ) превышал или был равен 0,33.
При ПМВКЛ проводилась оценка международного прогностического индекса (International Prognostic Index — IPI) и адаптированного к возрасту IPI (age-adjusted IPI).
В соответствии с рекомендациями GHSG (German Hodgkin’s lymphoma Study Group — Германская группа по изучению лимфомы Ходжкина) для выбора адекватного объема лечения все больные лимфомой Ходжкина были разделены на три прогностические группы: благоприятную, промежуточную и неблагоприятную.
Лечение пациентов ПМВКЛ проводилось по программам MACOP-B+R и CHOP+R. Контроль результатов осуществлялся после 4, 8 и 12 недель терапии по схеме МАСОР-В и после 2,4, 6 и 8 курсов лечения в режиме CHOP.
В зависимости от прогностической группы больные ЛХ получали химиотерапию по следующим режимам: ABVD, ВЕАСОРР-21, ВЕАСОРР-14.
Всем пациентам не позднее 28 дня после завершения лекарственного лечения при условии достижения полной или частичной ремиссии проводилась лучевая терапия на зоны первичного поражения. Облучение выполнялось на базе отдела радиационной онкологии и радиологического отделения РОНЦ им. H.H. Блохина РАМН. Разовая очаговая доза облучения составляла 2Гр, суммарная очаговая доза от 30 до ЗбГр. Облучение проводилось 1 раз в день, 5 дней в неделю.
Непосредственные осложнения лечения оценивались в соответствии со шкалой токсичности по критериям CTC-NCIC v.3.0 [Common Toxicity Criteria of National Cancer Institute, 2005].
Оценка эффективности противоопухолевого лечения выполнялась согласно рекомендациям международной рабочей группы [Cheson B.D., 1999].
При анализе отдаленных результатов лечения использовались следующие критерии:
Бессобытпйная выживаемость (EFS — event free survival) рассчитывалась от даты начала лечения до любого нежелательного события (прогрессирование, отсутствие ремиссии после завершения лечения, осложнения, вызвавшие прекращение лечения, рецидив, смерть от любой причины) или последней явки больного;
Выживаемость без прогрессирования (PFS — progression free survival) рассчитывалась от момента включения больного в исследование до прогрессирования, смерти от лимфомы или до даты последней явки больного;
Общая выживаемость (OS — overall survival) рассчитывалась от даты начала
лечения до смерти от любой причины или до даты последней явки больного [Cheson B.D., 2007].»
Статистическая обработка результатов исследования выполнялась с использованием программы SPSS на основе созданной базы данных. Оценка включала корреляционный анализ, сравнение средних, анализ по таблицам сопряженности признаков с применением критерия Построение кривых выживаемости осуществлялось по методике Kaplan-Meier.
Результаты исследования и обсуждение.
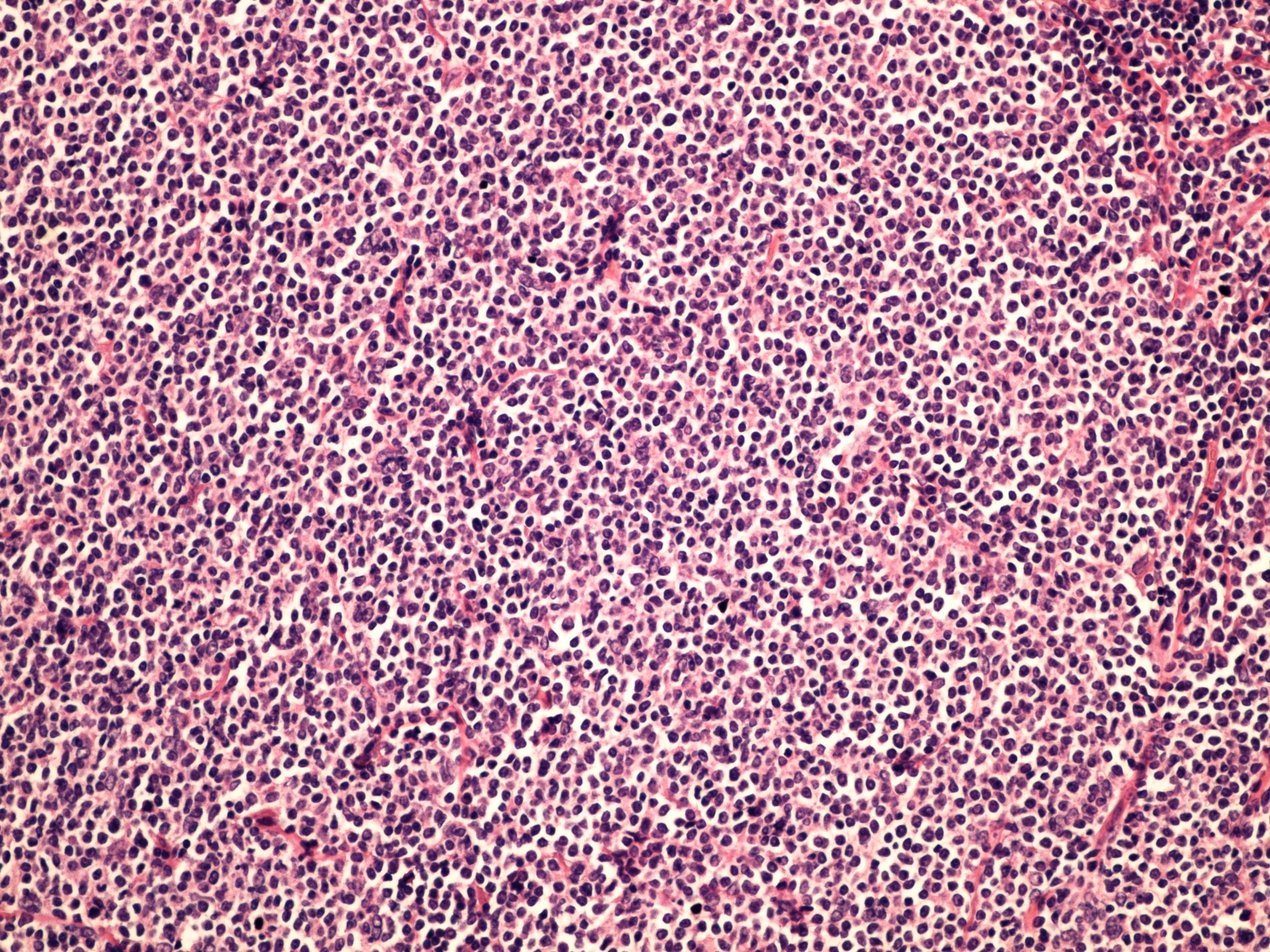
При морфологическом исследовании опухолевой ткани у 86 из 144 пациентов (60%) крупноклеточными лимфомами средостения был установлен диагноз ПМВКЛ. Морфологическое своеобразие ПМВКЛ определяется преимущественно диффузным ростом опухоли с наличием альвеолярного фиброза (74%) и очагов некроза (60%). Клеточный состав опухоли может быть представлен тремя цитоморфологическими вариантами: ценгробластный (36%), смешанно-клеточный (57%) и полиморфноклеточный (7%). Последний, редкий вариант опухоли с присутствием лакунарных клеток и крупных многоядерных форм типа клеток Березовского-Рид-Штернберга морфологически сходен с лимфомой Ходжкина.
Диагноз лимфомы Ходжкина установлен у 58 из 144 пациентов (40%) с преимущественным опухолевым поражением средостения. Все случаи JIX соответствовали по гистологическим признакам только варианту с нодулярным склерозом. В 45% случаев из них диагностирован неблагоприятный второй тип нодулярного склероза (NSII) с обширными полями фиброза и наличием очагов некроза.
При анализе степени выраженности эозинофильной инфильтрации опухолевой ткани при JIX выделены три основных варианта: со слабой эозинофильной инфильтрацией — 15 (26%), с умеренно выраженной — 20 (35%) и с выраженной эозинофильной инфильтрацией — 23 (39%) случая.
Иммуногистохимическое исследование было проведено на репрезентативном материале 92 пациентов с массивным и преимущественным
поражением средостения. Опухолевый субстрат ПМВКЛ характеризовался следующей иммуногистохимической картиной: пан-В-клеточный маркер СБ20 присутствовал во всех случаях (интенсивная мембранная реакция), антиген СБЗ был всегда отрицателен, положительная реакция отмечалась с дискретно расположенными среди опухолевой ткани Т-лимфоцитами. Реакция с антигеном СБ 10 изучалась в 44 случаях, причем опухолевые клетки практически всегда (95,5%) не экспрессировали данный антиген. Проводилась оценка экспрессии опухолевыми клетками при ПМВКЛ антигена СБ 11с (молекула адгезии, член суперсемейства интегринов). В 28 (90%) образцах отмечалась положительная реакция с маркером СБ 11с. Коэкспрессия антигена СБ23 определялась в 42 (74%) случаях. Степень выраженности реакции с данным антигеном была неоднородной -от яркой мономорфной до слабой, проявлявшейся только в части опухолевых клеток (мембранная реакция). В 36 случаях ПМВКЛ изучалась коэкспрессия антигена СБЗО, из них в 21 (58%) реакция была положительной. Общелейкоцитарный антиген СБ45 исследовался в 47 случаях и во всех 47 (100%) был позитивен.
Экспрессия маркера МиМ1/1КР4 в нашем исследовании изучалась в 45 случаях и была однородно позитивна в 43 из 45 (95,6%) образцах ПМВКЛ. Позитивная реакция опухолевых клеток с РАХ5 в виде интенсивной ядерной реакции была выявлена во всех изученных 47 (100%) случаях. Степень экспрессии НЬД-БЯ определялась в 30 случаях и колебалась в опухолевых клетках от 10% до 100%. В 24 (80%) случаях позитивная реакция составляла более 50% клеток опухолевой популяции, только в 6 (20%) — не достигла 50%. Маркер пролиферативной активности опухолевых клеток Кьб7 был позитивен в среднем в 60-80% опухолевых клеток.
Опухолевый субстрат с морфологически установленным диагнозом ЛХ (23 образца) имел следующие иммуногистохимические характеристики: реакция с СБЗ была отрицательна в опухолевых клетках в 100% исследованных биопсий. Во всех 23 случаях ЛХ крупные опухолевые клетки экспрессировали СБ 15 и СБЗО (мембранная, цитоплазматическая, сЫ-Нке-реакция в зоне аппарата Гольджи). Опухолевые клетки слабо экспрессировали В-клеточный транскрипционный
фактор РАХ5 (по сравнению с В-клетками реактивного микроокружения -интенсивная ядерная экспрессия).
Антиген СБ20 изучался во всех 23 (100%) случаях ЛХ. Положительная экспрессия антигена СБ20 выявлена у б (26%) пациентов. Реакция оценивалась как положительная при наличии позитивной экспрессии СБ20 более чем в 10% опухолевых клеток. Степень экспрессии не была однородна: в 2 случаях слабая, составлявшей чуть более 10%, в 3 — гетерогенная реакция отмечалась в 30-40% опухолевых клеток, в одном случае отмечена выраженная экспрессия в 90-100% клеток.
Важное дифференциально-диагностическое значение при ПМВКЛ и ЛХ имеет определение маркеров активации сигнального пути ОТ-кВ (с-ИЕЬ и ТКА1М) характеризующих молекулярные этапы лимфомогенеза. Эти маркеры исследовались в опухолевой ткани при наличии сохранного, репрезентативного по объему диагностического материала. Ядерная локализация онкопротеина с-ЯЕЬ выявлена в 77%, а цитоплазматический онкопротеин ТЯАР1 определялся в 80% случаев ПМВКЛ. Во всех образцах опухолевой ткани при ЛХ отмечалась цитоплазматическая реакция с ‘ШАР1 при отсутствии ядерной локализации онкопротеина с-ЯЕЬ (таблица №1).
Таблица №1
Сравнительная характеристика экспрессии маркеров с-ИЕЬ и ТИАР-! в
опухолевых клетках ПМВКЛ и ЛХ
Маркеры активации сигнального пути ОТ-кВ ПМВКЛ ЛХ
с-КЕЬ (ядерная экспрессия) 24 (77%) Не обнаружена
ПШ^ (цитоплазматическая экспрессия) 27 (80%) 23 (100%)
Данные сравнительного анализа иммуногистохимического исследования опухолевого субстрата при ПМВКЛ и ЛХ приводятся в таблице №2.
Таблица №2
Сравнительная характеристика опухолевого субстрата ПМВКЛ и ЛХ
Маркер ПМВКЛ Лимфома Ходжкина
CD3 — -
CD10 -/+ -
CDllc + Не определялся
CD15 — +
CD20 + -/+
CD23 + -
CD30 Мембранная реакция Мембранная, цитоплазматическая, dotlike реакция
РАХ5 Интенсивная ядерная Слабая ядерная
реакция экспрессия
CD45 + -
MuM.l + Не определялся
HLA-DR + Не определялся
Ki-67 60-80% Не определялся
c-REL + (ядерная экспрессия) — (ядерная экспрессия не обнаружена)
TRAF1 + (цитоплазматическая реакция) + (цитоплазматическая реакция)
В работе проанализированы клинические данные 86 пациентов с морфологически верифицированным диагнозом ПМВКЛ. В исследовании было 48 (56%) женщин и 38 (44%) мужчин. Возраст больных колебался от 15 до 63 лет (медиана 30 лет). Медиана наблюдения составила 32,5 месяца.
Для ПМВКЛ характерен быстрый рост опухоли с симптомами компрессии органов средостения и развитием дыхательной недостаточности. Ведущим клиническим проявлением заболевания был синдром сдавления верхней полой вены, который определялся в 39 (45%) случаях. Прорастание опухоли в магистральные сосуды отмечено у 18 (21%) больных, у 14 (16%) — определялись тромбозы вен верхней конечности. Сочетание синдрома верхней полой вены с инвазией стенки сосудов средостения выявлено у 11 (13%) пациентов. Сочетание тромбоза и инвазии сосудов отмечено в 4 (5%) случаях. Наличие выпота в плевральной и перикардиальной полости выявлялось одинаково часто: плеврит в 32 (37%), перикардит в 31 (36%) случае. Сочетание плеврита и перикардита отмечено у 21 (24%) пациента.
У всех больных ПМВКЛ диагностировано массивное поражение средостения, причем у 64 (74%) больных размер опухоли превышал 10см в диаметре. Помимо поражения средостения, у 51 (59%) больного определялись увеличенные лимфатические узлы в шейно-надключичной области, у 17 (20%) — в подмышечных областях.. Вовлечение забрюшинных лимфатических узлов выявлялось значительно реже (9 больных — 11%), у 2 больных были увеличенные подвздошные лимфатические узлы.
У большинства пациентов ПМВКЛ отмечался местно-локализованный опухолевый процесс в пределах переднего верхнего средостения с вовлечением органов грудной клетки: I-IIE стадии установлены у 54 (63%), III стадия — у 3 (3%) и IV стадия заболевания у 29 (34%) больных. Экстанодальные вовлечения выявлены у 68 (79%) больных ПМВКЛ. Поражение органов вне средостения в дебюте болезни отмечено у 13 (15%) пациентов, причем у 3 (4%) имело место вовлечение нескольких экстранодальных органов за пределами средостения. Наиболее часто отмечалось поражение легочной ткани — 56 больных (65%), у 33 (38%) пациентов было вовлечении перикарда и у 25 (29%) — плевры. В убывающей последовательности следовали остальные экстранодальные локализации: мягкие ткани передней грудной стенки — 21 (24%), щитовидная железа — 5 (6%), органы желудочно-кишечного тракта — 4 (5%), надпочечники — 4 (5%), почки — 3 (4%), яичники — 2 (2%), кости — 1 (1,2%), печень — 1 (1,2%). Поражение центральной нервной системы выявлено у 5 пациентов (6%) и только при прогрессировании заболевания.
Распределение больных по группам риска в зависимости от международного прогностического индекса было следующим: низкая группа риска — 30 (35%), низкая промежуточная — 22 (26%), высокая промежуточная — 23 (27%), высокая 11 (12%) пациентов. В работе проводилась оценка междунар одного прогностического индекса, соотнесенного с возрастом (age-adjusted — aalPI). В группу низкого риска вошло 5 (6%) пациентов, низкого промежуточного — 29 (34%), высокого промежуточного — 29 (34%), группу высокого риска составила 23 (26%) больных. Таким образом, в соответствии с критериями IPI, более половины больных (61%) составили группы низкого и промежуточного низкого риска
раннего прогрессирования. При распределении больных по системе aalPI, низкую и низкую промежуточную группу составили всего лишь 34 (40%) пациента.
На разных исторических этапах больные ПМВКЛ получали лекарственное лечение по 4 различным программам: CHOP — 17 больных (20%), R-CHOP — 18 (21%), МАСОР-В — 13 (15%) и R-MACOP-B — 38 (44%) больных (рисунок№1).
Рисунок №1
Методы лекарственной терапии
Один больной умер в процессе лечения без признаков болезни, полные или неподтвержденные полные ремиссии (ПР\нПР) в группе в целом достигнуты у 56 (66%) из 85 больных, частичные — у 13 (15%). Прогрессирование опухоли в процессе лечения и вскоре после него отмечено у 16 пациентов. Результаты лечения расценены как неудовлетворительные при использовании программы CHOP: только у 5 из 17 больных достигнуты ПР/нПР, резистентными к терапии оказались — 6. В то же время, остальные 3 программы (МАСОР-В, R-MACOP-B, R-СНОР) оказались высоко эффективными и, что особенно важно, непосредственные результаты были приблизительно одинаковыми во всех группах: частота ПР/нПР составила 77%, 76% и 72% соответственно.
Изучено влияние различных факторов на непосредственные результаты
лекарственной терапии при ПМВКЛ. Оказалось, что статистически значимыми
14
признаками, ассоциированными с непосредственной эффективностью лечения, были стадия заболевания, международный прогностический индекс и возможность выполнения полной программы лечения. Так, при местно-локализованных стадиях заболевания без эффекта были пролечены 6 (11%) больных, а при распространенных стадиях — 10 (32%) больных.
Прогностический индекс больных ПМВКЛ, определяемый, как по шкале IPI, так и aalPI, достоверно влиял на эффективность лечения. Так, частота ПР\нПР составила 83% в группе больных с 1Р1=1 и 27% в группе высокого риска 1Р1>3 (р=0,001). Наличие у больных ПМВКЛ трех неблагоприятных факторов, определяемых по шкале aalPI, также достоверно снижало частоту ПР\нПР с 100% до 41% (р=0,01).
В то же время, наличие симптомов интоксикации, синдрома компрессии верхней полой вены, плеврального или перикардиального выпота, повышение уровня ЛДГ или снижение гемоглобина, достоверно не влияли на эффективность терапии.
Более чем у половины больных (49 из 86 пациентов — 57%) в процессе противоопухолевого лечения развились различные осложнения. Эффективность лечения больных, завершивших полную программу лечения без существенного нарушения, составила 85%, при уменьшении объема лечения до 4 курсов CHOP+R или 8 недель MACOP-B+R, общая эффективность снизилась до 22% (р=0,01).
Трехлетняя выживаемость без прогрессирования (PFS) 86 больных ПМВКЛ составила 66%, общая выживаемость (OS) — 73%. Признаки прогрессирования заболевания наблюдались в первые 12 месяцев, поздних рецидивов не было. К моменту настоящего анализа умерли 19 (22%) больных.
В нашем исследовании 42 из 85 (49%) больных ПМВКЛ после завершения лекарственного лечения была выполнена позитронно-эмиссионная томография (ПЭТ). Оказалось, что у 13 из 42 (31%) больных определялись очаги патологического накопления радиопрепарата в остаточной опухоли средостения. Этот фактор имел важное прогностическое значение, причем независимо от типа лечения — PFS и OS были достоверно выше в группе ПЭТ-негативных больных
(р=0,02). Так, трехлетняя РРв у ПЭТ-негативных больных составила 86%, а у ПЭТ-позитивных — 54%; трехлетняя ОБ была соответственно 86% и 58%.
Лучевая терапия на область средостения + шейно-надключичные зоны проведена 60 больным (70%). Оценить эффективность лучевой терапии в нашем исследовании невозможно, поскольку она проводилась по возможности всем больным, у которых был достигнут полный или частичный ответ на лекарственное воздействие.
Было изучено влияние лучевой терапии на отдаленные результаты лечения в группе 42 больных, которым выполнялась позитронно-эмиссионная томография (ПЭТ) до облучения. Оказалось, что из 13 ПЭТ-позитивных больных 12 получили облучение и у 6 (51%) вскоре был выявлен рецидив заболевания. Из 29 ПЭТ-негативных больных лучевую терапию получили 23 и только у 1 из 23 (4%) пациентов вскоре было выявлено прогрессирование ПМВКЛ. Если же облучение не проводилась у ПЭТ-негативных больных, то рецидивы отмечены у 3 из 6 больных (таблица №3). Несмотря на небольшое число наблюдений, создается впечатление, что лучевая терапия показана всем ПЭТ-негативным больным, и пока нет оснований от нее отказываться, и в то же время, облучение не является достаточно эффективным методом консолидации у ПЭТ-позитивных больных.
Таблица №3
Результаты комбинированной терапии в зависимости от результатов
ПЭТ
ПЭТ активность Число больных Лучевая терапия Частота рецидива
ПЭТ+ 13 12 6 (51%)
ПЭТ- 29 23 1 (4%)
В процессе противоопухолевой терапии у 49 (57%) пациентов ПМВКЛ были отмечены одно или несколько осложнений, из них инфекционные (мукозиты, бронхиты, пневмонии) у 46 (53%), гематологические 3-4 степени — у 25 (30%), другие (метаболическая токсичность) — у 15 (17%) больных. Возбудителем инфекционных осложнений наиболее часто были бактерии — у 38 (44%) пациентов. Грибковые инфекции отмечены у 18 (21%), вирусные — у 4 (5%) больных.
Частота осложнений зависела от типа лекарственного лечения. Наиболее токсичной оказалась схема МАСОР-В (у 10 из 13 больных — 77%) и R-MACOP-B (у 32 из 38 больных — 84%). Значительно реже были отмечены осложнения при лечении по схеме СНОР (18%) и R-CHOP (22%).
При проведении терапии по схеме МАСОР-В и R-MACOP-B соответственно у 9 (70%) и 31 (82%) больного были выявлены различные инфекционные осложнения, у 38 пациентов (44%) противоопухолевая терапия была прервана на 2 и более недели. В нашем наблюдении у одного больного в полной ремиссии после программы R-MACOP-B развился некроз головки бедренной кости, ассоциированный с длительной терапией глюкокортикостероидами. Полученные данные послужили основанием для модификации программы МАСОР-В в виде редукции дозы глюкокортикостероидов (вместо ежедневного 12-недельного приема больные стали получать преднизолон в течение 1, 3, 5, 7, 9 и 11 неделей).
В нашей работе анализировалось влияние различных факторов на отдаленные результаты лечения больных ПМВКЛ. Так, наличие экстранодального вовлечения само по себе никак не влияло на выживаемость больных — трехлетняя выживаемость без прогрессирования составила 65% как при наличии, так и при отсутствии экстранодальных поражений (р=0,8). В то же время, вовлечение органов за пределами грудной клетки, соответствующее IV стадии заболевания, достоверно снижало показатели выживаемости без прогрессирования (PFS) и общей выживаемости (OS). Так, трехлетняя PFS при локальных стадиях составила 78%, при распространенных — 45% (р=0,001), трехлетняя OS была соответственно 82% и 49% (р=0,0001).
Симптомы интоксикации оказывали негативное влияние на течение заболевания. Так, при наличии Б-симптомов трехлетняя PFS составила 58%, а при отсутствии — 86% (р=0,03), трехлетняя OS была соответственно 61% и 94% (р=0,01).
Высокий прогностический индекс является неблагоприятным фактором, влияющим на течение заболевания. Так, показатели трехлетней PFS и OS при 1Р1=1 составили 80% и 85%, при 1Р1=2 — 72% и 75%, 1Р1=3 — 54% и 58%, в группе высокого риска (1Р1=4)-только 36% и 44% соответственно (р=0,01).
Отдаленные результаты лечения больных ПМВКЛ ассоциировались также и с международным прогностическим индексом, соотнесенным с возрастом. Так, трехлетняя РББ и ОБ при аа1Р1 =1 составили 77% и 83%, при аа1Р1=2 — 72% и 73%, при 1Р1= 3 — 36% и 39% соответственно (р=0,002 и р=0,004).
В то же время, присутствие симптомов компрессии верхней полой вены, высокий уровень ЛДГ, наличие плеврита и/или перикардита не оказывали достоверного влияния на прогноз заболевания (р>0,1).
На основании статистического анализа полученных данных четко обозначены два наиболее важных фактора, влияющих на исход ПМВКЛ. Это метод лекарственного лечения и его непосредственная эффективность (рисунок №2). Трехлетняя общая выживаемость больных с ПР\нПР составила 95% (медиана не достигнута), с ЧР — 38% (медиана 36 месяцев), при отсутствии эффекта на первой линии терапии всего лишь 10% (медиана 12 месяцев-р=0,00001). 0,4т
о,э-0.20.1-
ЧР
без эффекта
п=86 р=0,00001
месяцы
При анализе выживаемости больных без прогрессирования в зависимости от варианта лекарственной терапии, показано несомненное преимущество интенсифицированных программ лечения, причем эта интенсификация может идти как по пути добавления анти С020 моноклональных антител, так и при усилении режима химиотерапии.
Трехлетняя PFS в группе больных, получавших МАСОР-В, была 84% (медиана не достигнута), в группе CHOP — 27% (медиана 6 месяцев — р=0,004). Если же рассматривать трехлетнюю PFS в группе больных, получавших или нет ритуксимаб, то различия также оказались достоверными — 72% и 52% соответственно (р=0,03 — рисунок №3).
Рисунок №3
Выживаемость без ирогрессирования пациентов ПМВКЛ в зависимости от
применения мабтеры
В то же время, добавление ритуксимаба изменило течение болезни только в группе больных, получавших CHOP — трехлетняя PFS возросла с 27% (медиана 6 месяцев) до 64% (р=0,01). Трехлетняя OS составила 30% (медиана 16 месяцев) и 68% соответственно (р=0,02). При проведении химиотерапии по схеме МАСОР-В добавление ритуксимаба существенно не изменило отдаленные результаты: трехлетняя PFS при лечении по схеме МАСОР-В составила 84%, по программе R-МАСОР-В — 76% (р=0,5), трехлетняя OS была 92% и 79% соответственно (р=0,2).
Таким образом, отдаленные результаты лечения больных ПМВКЛ по программам МАСОР-В, R-MACOP-B и R-CHOP оказались приблизительно одинаковыми и представлены на рисунке №4.
Рисунок №4
Общая выживаемость больных ПМВКЛ при лечении по программам МАСОР-В, И-МАСОР-В и Я-СНОР
6
§
о а а
ш
0.00 12,00 24,00 36,00 46.00 60,00 72,00
месяцы
В нашей работе анализировались данные 58 пациентов лимфомой Ходжкина. Мужчин было 21 (36%), женщин 37 (64%), возраст колебался от 16 до 57 лет (медиана — 29 лет). Медиана наблюдения составила 47 месяцев.
Вовлечение лимфатических узлов средостения выявлено во всех 58 (100%) случаях, причем массивное поражение (МТИ>0,33) отмечалось у 45 (77%) больных. У большинства больных ЛХ поражение средостения сопровождалось периферической лимфаденопатией: вовлечение шейных лимфатических узлов отмечено у 50 (86%), подмышечных — у 16 (27%) пациентов. Поражение лимфатических узлов ниже диафрагмы отмечалось редко (5%). Симптомы интоксикации выявлены у 37 (64%) пациентов.
Преимущественно больные ЛХ в дебюте имели местно-локализованные стадии заболевания (39 пациентов — 67%), более редко регистрировались П1 (2 больных — 3,5%) и IV стадии (17 больных — 28,5%). Вовлечение экстранодальных органов отмечено у 29 (50%) больных, причем у 12 — имело место прорастании опухоли из медиастинальных лимфатических узлов. В отличие от больных ПМВКЛ, отдаленных метастазов за пределами средостения при ЛХ не отмечено.
20
1,0″ 0,00,60,7″ 0,6″ 0,50,40,30.20,10,0-
МАСОР-В
Я-МАСОР-В
Г1-СНОР
р=0,4 п=68
Из экстранодальных зон выявлено поражение легочной ткани (31%), перикарда (15%), костей (6%), мягких тканей (5%), плевры (3%).
Значительна реже по сравнению с больными ПМВКЛ, при ЛХ определялся выпот в грудной клетке: плевриты отмечены у 10 (17%), перикардиты у 6 (10%) больных. Сочетание плеврита и перикардита наблюдалось в 5 (8,6%) случаях. Несмотря на то, что у большинства больных определялось массивное поражение средостения, тромбоз отмечался у 2 (4%), инвазия опухоли в магистральные сосуды у 8 (14%) пациентов. Синдром компрессии верхней полой вены был только у одного больного ЛХ.
Повышение уровня ЛДГ встречалось у 13 (22%) пациентов, повышение СОЭ в 24 (41%) случаях, снижение уровня гемоглобина в дебюте заболевания отмечено у 22 (38%) больных.
С учетом распространенности заболевания (III-IV стадии), наличия массивного поражения средостения (bulky) и/или изолированного экстранодального вовлечения («Е»), 49 больных (84%) относились к группе с неблагоприятным прогнозом. Остальные 9 (15%) пациентов вошли в группу промежуточного прогноза.
Результаты терапии оценены у 58 (100%) пациентов лимфомой Ходжкина с поражением средостения. Вне зависимости от варианта проведенной терапии были получены следующие результаты: полные и неуверенные полные ремиссии (ПР\нПР) достигнуты у 32 (56%) больных, частичные ремиссии — в 23 (40%) случаях. У двух больных (4%) лечение без эффекта, 1 (2%) пациентка умерла в процессе терапии от инфекционных осложнений без признаков прогрессирования опухоли.
На момент анализа полученных данных, рецидив заболевания отмечен у 11 (19%) больных, 6 (10%) из них умерли в результате прогрессирования заболевания. Трехлетняя бессобытийная выживаемость пациентов ЛХ вне зависимости от проведенной терапии составила 81%, общая выживаемость — 90%.
В отличие от больных ПМВКЛ, при которой признаки прогрессирования заболевания наблюдались в первые 12 месяцев лечения, при ЛХ кривая
бессобытийной выживаемости (EFS) со временем несколько снижается. Так, трехлетняя EFS составляет 81%, а пятилетняя EFS — 75%.
Большинство больных ЛХ (43 пациента — 74%) получили терапию в режиме ВЕАСОРР: 36 (62%) пациентов лечились по схеме ВЕАСОРР-21, 7 (12%) — по программе ВЕАСОРР-14. Остальные 15 больных (27%) получали лечение по программам ABVD. У двух пациентов, получавших терапию по программе CHOP, в дебюте заболевания был установлен иной диагноз.
Из-за небольшого числа наблюдений в каждой группе достоверно судить об эффективности различных режимов химиотерапии не представляется возможным. В отличие от пациентов ПМВКЛ, большинству больных JIX программа химиотерапии была проведена в полном объеме, только у 2 (4%) лечение было редуцировано в связи с осложнениями.
Изучено влияние различных факторов на непосредственные и отдаленные результаты лекарственной терапии. Из всех проанализированных параметров только наличие плеврита достоверно снижало трехлетнюю OS больных JIX с 95% до 51% (р=0,002). Все остальные клинические факторы в нашем исследовании не оказали достоверного влияния на сроки жизни больных.
Оценить в нашем исследовании эффективность лучевой терапии невозможно, поскольку она проводилась по возможности всем больным ЛХ, у которых был достигнут противоопухолевый ответ на химиотерапию. Всего лучевая терапия на область средостения (с или без включения шейно-надключичных областей) проведена 46 больным (80%).
Чувствительность опухоли к проводимой терапии является основным фактором, определяющим сроки жизни больных ЛХ. Трехлетняя OS составила 95% в группе пациентов с ПР/нПР и 67% в группе больных, у которых терапия первой линии оказалась неэффективной (р=0,002 — рисунок №5).
Особенно наглядными являются показатели трехлетней бессобытийной выживаемости в зависимости от эффективности терапии, которые составили 93% и 22% соответственно (р=0,0001).
Рисунок №5
Общая трехлетняя выживаемость пациентов ЛХ в зависимости от достигнутого противоопухолевого эффекта
ё
§
ф га оа
л ОН
0.00 12,00 24,00 36,00 48,00 60,00
месяцы
Более половины больных ЛХ (31 из 58 больных — 53%) в ходе проведения программной терапии имели различные инфекционные осложнения. Наиболее часто осложнения диагностированы у пациентов, получавших лечение по схеме ВЕАСОРР-14 (у 6 из 7 больных). В нашем исследовании был также проанализирован спектр осложнений, отмечаемых у пациентов ЛХ в ходе терапии. Гематологические осложнения 3-4 степени встречались у 19 (33%), инфекционные у 28 (48%), пульмониты — у 13 (22%). Структура инфекционных осложнений отличалась гетерогенностью: в 23 (39%) случаях выявлена их бактериальная природа, в 14 (24%) грибковая, в 12 (21%) — вирусная. Токсические осложнения отмечены у 6 (10%) больных.
Несмотря на то, что лечение прерывалось у 11 (19%) пациентов на сроки от 2 до 6 недель, достоверного влияния на отдаленные результаты перерыв в терапии не оказал. Тем не менее, трехлетняя ЕББ в группе больных, у которых были осложнения, была все же несколько ниже и составила 76% и 88% соответственно (р=0,2).
ПР/нПР
ЧР,Ст,Прог
п=57 р=0,002
месяцы
В целом, можно заключить, что проведенный анализ в нашей работе позволил выделить и подчеркнуть различия в клинических проявлениях и предложить четкие дифференциально-диагностические критерии для разграничения первичной медиастинальной В-крупноклеточной лимфомы и лимфомы Ходжкина с преимущественным поражением средостения.
ВЫВОДЫ
1. Морфологическое своеобразие первичной медиастинальной (тимической) В-крупноклеточной лимфомы определяется смешанно-клеточным составом опухоли (57%), а также наличием в ней альвеолярного фиброза (74%) и очагов некроза (60%). Полиморфноклеточный состав опухоли с присутствием лакунарных клеток и крупных многоядерных форм типа клеток Березовского-Рид-Штернберга встречается в 7% случаев и морфологически сходен с лимфомой Ходжкина.
2. При лимфоме Ходжкина с преимущественным поражением средостения (58 больных) был установлен только вариант с нодулярным склерозом. В 45% случаев из них диагностирован неблагоприятный второй тип (N811) с обширными полями фиброза и наличием очагов некроза.
3. При первичной медиастинальной (тимической) В-крупноклеточной лимфоме, помимо экспрессии основных В-клеточных антигенов (СБ20, СБ79а, РАХ5), ключевым диагностическим событием следует признать коэкспрессию опухолевыми клетками антигенов СБ23 (74%) и СБ11с (90%). У 58% больных первичной медиастинальной (тимической) В-крупноклеточной лимфомой наблюдается невыраженная гетерогенная мембранная экспрессия антигена СБЗО, что отличает ее от лимфомы Ходжкина.
4. Важное дифференциально-диагностическое значение имеет определение маркеров с-ЯЕЬ и Т11АР-1, характеризующих молекулярные этапы лимфомогенеза. Ядерная локализация онкопротеина с-ШЗЬ выявлена в 77%, а цитоплазматический онкопротеин ТКАР-1 в 80% случаев первичной медиастинальной (тимической) В-крупноклеточной лимфомы. Во всех
образцах опухолевой ткани при лимфоме Ходжкина отмечалась цитоплазматическая реакция с TRAF-1 при отсутствии ядерной локализации онкопротеина c-REL.
5. При лимфоме Ходжкина экспрессия антигена CD20 наблюдается в 26% случаев, что создает дифференциально-диагностические сложности при разграничении с первичной медиастинальной (тимической) В-крупноклеточной лимфомой. Одновременно открываются новые возможности терапии, в частности, использование моноклональных антител.
6. При первичной медиастинальной (тимической) В-крупноклеточной лимфоме синдром сдавления верхней полой вены встречается в 45% случаев, прорастание опухоли в магистральные сосуды — в 21%, тромбозы вен верхних конечностей в — 16%. У больных лимфомой Ходжкина синдром компрессии верхней полой вены практически не диагностируется. При первичной медиастинальной (тимической) В-крупноклеточной лимфоме экстранодальные поражения за пределами средостения наблюдались в 15% случаев. Поражение центральной нервной системы установлено у 6% больных. При лимфоме Ходжкина отдаленных метастазов за пределами грудной клетки не было.
7. При лимфоме Ходжкина лечение по программе ВЕАСОРР получили 74% больных. Трехлетняя общая выживаемость (OS) больных составила 90%; бессобытийная выживаемость (EFS) — 81%.
8. При первичной медиастинальной (тимической) В-крупноклеточной лимфоме трехлетняя общая выживаемость (OS) составила 73%, а выживаемость без прогрессирования (PFS) — 66%. Признаки прогрессирования заболевания наблюдались в первые 12 месяцев, поздних рецидивов не было.
9. Исход первичной медиастинальной В-крупноклеточной (тимической) лимфомы зависит от выбора метода лекарственной терапии и ее эффективности. Результаты лечения по схеме CHOP (без ршуксимаба) расценены как неудовлетворительные. Высокоэффективными оказались программы R-CHOP, R-MACOP-B и МАСОР-В (без ритуксимаба). При достижении полной и неподтвержденной полной ремиссии трехлетняя
общая выживаемость (OS) составила 95%, частичной — 38%, при отсутствии эффекта — 10% (р=0,00001).
10. Применение ритуксимаба увеличило трехлетнюю выживаемость без прогрессирования в группе больных первичной медиастинальной В-крупноклеточной лимфомой с 52% до 72% (р=0,03). Добавление ритуксимаба к схеме CHOP достоверно (р=0,01) повлияло на сроки жизни больных (трехлетняя выживаемость без прогрессирования возросла с 27% до 64%). Комбинация ритуксимаба с программой МАСОР-В не оказала существенного влияния на непосредственные и отдаленные результаты лечения больных.
Список работ, опубликованных в журналах, рекомендованных ВАК РФ
1. Тумян, Г.С. Первичная медиастинальная В-крупноклеточная лимфома: диагностика, клиническая картина и лечение. / Г.С. Тумян, A.M. Ковригина, М.Ю. Кичигина, E.H. Сорокин, Д.А. Быков, Т.Т. Кондратьева, H.A. Пробатова, О.П. Трофимова, O.A. Коломейцев, И.В. Поддубная, H.H. Тупицын, В.Б. Ларинова, Д.Ш. Османов // Современная онкология. — 2008. -Т.10, №3. -С. 66-68.
2. Павлиш, O.A. Мутации гена LMP1 вируса Эшнтейн-Барр у российских больных лимфоидной патологией и здоровых лиц. / O.A. Павлиш, C.B. Дидук, К .В. Смирнова, Л.Н. Щербак, Е.В. Гончарова, H.A. Шалгинских, В.В. Архипов, М.Ю. Кичигина, В.Н. Степина, Н.В. Белоусова, Е.А. Османов, Л.С. Яковлева, В.Э. Гурцевич // Вопросы вирусологии. — 2008. — №1. — С. 1016.
3. Кичигина, М.Ю. Морфоиммунологическая характеристика крупноклеточных лимфом средостения. / М.Ю. Кичигина, A.M. Ковригина, Г.С. Тумян, Д.А. Быков, O.A. Коломейцев, A.A. Чекан, О.П. Трофимова, И.В. Поддубная, Д.Ш. Османов // Вестник РОНЦ им.Н.Н. Блохина РАМН. — 2010. -Т. 21, №2. С. 38-42.
4. Кпчнгина, М.Ю. Первичная медиаспгаальная (тимическая) В-крупноклеточная лимфома: обзор литературы и собственные данные. / М.Ю. Кичигина, Г.С. Тумян, A.M. Ковригина, О.П. Трофимова, В.Б. Ларионова, А.А Чекан, Д.А. Быков, Д.Ш. Османов // Терапевтический архив. — 2011. -№7. — С.38-46.
Тезисы конференций, конгрессов и симпозиумов
5. Pavlish, O.A. Epstein-Barr virus LMP 1 gene variants in Russian patients with lymphoproliferative disorders. / O.A. Pavlish, S.V. Diduk, K.V. Smirnova, L.N. Scherbak, E.V. Goncharova, N.A. Shalginskikh, M.Y.Kichigina, V.V. Arkhipov, N.V. Belousova, V.N. Stepina, E.A. Osmanov, L.S. Yakovleva, and V.E. Gurtsevitch // Russian Journal AIDS, Cancer and public health. — 2007. — V.l 1. -№1. — P.123.
6. Кичигина, М.Ю. Первичная медиастинальная В-крупноклеточная лимфома: диагностика, клиника и лечение. / М.Ю. Кичигина, Г.С. Тумян, А.М. Ковригина, E.H. Сорокин, Д.А. Быков, Т.Т. Кондратьева, H.A. Пробатова, О.П. Трофимова, O.A. Коломейцев, И.В. Поддубная, H.H. Тупицын, В.Б. Ларинова, Д.Ш. Османов. // Материалы XII Российского онкологического конгресса. — М.: издательская группа РОНЦ им. H.H. Блохина РАМН. -2008. — С. 149-150.
7. Кичигина, М.Ю. Клиника и результаты терапии больных первичной медиастинальной (тимической) В-крупноклеточной лимфомой (ПМВКЛ). / М.Ю Кичигина, Г.С. Тумян, A.M. Ковригина, E.H. Сорокин, О.П. Трофимова, O.A. Коломейцев, И.В. Поддубная, Д.Ш. Османов // Материалы V съезда онкологов и радиологов СНГ. Материалы съезда 14-16 мая 2008 г. Ташкент. — 2008. — С. 415.
8. Кичигина, М.Ю. Первичная медиастинальная В-крупноклеточная лимфома: клинико-морфологические особенности, результаты лечения. Кичигина М.Ю., Тумян Г.С., Ковригина A.M., Сорокин E.H., Быков Д.А., Трофимова О.П., Поддубная И.В., Османов Д.Ш. // Материалы XIII Российского онкологического конгресса. — М.: издательская группа РОНЦ им. H.H. Блохина РАМН. — 2009. — С. 276-278.
9. Kichigina, M. Efficacy and safety of MACOP-B+R and radiotherapy in primary mediastinal large B-cell lymphoma: a report on 21 patients treated in single institution. / M. Kichigina, G. Tumyan, A. Kovrigina, E. Sorokin, O. Kolomeytsev, N. Tupitsin, O. Trofimova, I. Poddubnaya, D. Osmanov. // Haematologica. 13th Congress of the European Hematology Association. Denmark, Copenhagen, June 12-15. — 2008. — 93 (si). — P. 558. Abstract 1481.
10. Kichigina, M. Rituximab+MACOP-B (R+MACOP-B) and radiotherapy in primary mediastinal large B-cell lymphoma: a single institution experience. / M. Kichigina, G. Tumyan, A. Kovrigina, E. Sorokin, L. Mazurok, O. Trofimova, I. Poddubnaya, D. Osmanov // 10th International Conference on Malignant Lymphoma. — Switzerland, Lugano. — June 04-07. — 2008. — Abstract 480.
11. Kichigina, M. Central nervous system involvement in primary mediastinal large B-cell lymphoma: a single institution experience. M. Kichigina, G. Tumyan, A. Kovrigina, A. Chekan, O. Trofimova, D. Bykov, N. Tupitsin, D. Osmanov // «Haematologica». 15th Congress of the European Hematology Association. -Spain, Barcelona, June 10-13.-2010. — 95 (s2). P. 619. Abstract 1564.
12. Chekan, A. Central nervous system recurrence in aggressive B-cell lymphoma: a single institution experience. / A. Chekan, M. Kichigina, G. Tumyan, A. Kovrigina, N. Tupitsin, O. Trofimova, D. Bykov, I. Poddubnaya, D. Osmanov // «Haematologica». 15th Congress of the European Hematology Association, Spain, Barcelona, June 10-13. — 2010. — 95 (s2). — P. 635-636. Abstract 1613.
13. Кичигина, М.Ю1 Клиническая характеристика и результаты лечения первичной медиастинальной В-крупноклеточной лимфомы. М.Ю. Кичигина, Г.С. Тумян, А.М. Ковригина, Е.Н. Сорокин, Д.А. Быков, А.А. Чекан, О.П. Трофимова, И.В. Подцубная, Д.Ш. Османов. // Злокачественные лимфомы. Сборник статей под редакцией член-корр. РАМН, проф. И.В.Поддубной. -2010. — С.55.
Подписано в печать 28.03.12 . Формат 60×84/16. Бумага офисная «5уе1оСору». Тираж 100 экз. Заказ №390 Отпечатано на участке множительной техники ФГБУ «РОНЦ им. Н.Н.Блохина» РАМН 115478, г. Москва, Каширское ш., 24
Лечение медиастинальной диффузной В-крупноклеточной лимфомы в Израиле: стоимость, отзывы, центры. Медиастинальная диффузная В-крупноклеточная лимфома Израиль: цены, больницы, клиники
Центр «ServiceMed»: получить бесплатную консультацию с врачом по вашему вопросу
Успешное применение новейших достижений медицинской науки, положенных в основу лечения медиастинальной диффузной В-крупноклеточной лимфомы в Израиле, позволяет добиться обнадеживающих результатов для пациентов с любой формой болезни.
Медиастинальная диффузная В-крупноклеточная лимфома – один из наиболее агрессивных видов В-крупноклеточных лимфом. Как правило, опухоль развивается в лимфоузлах средостения и быстро распространяется по всему телу. У больного наблюдается увеличение целых групп лимфоузлов на шее, в области подмышек, в паху, могут возникать одиночные опухоли внутренних органов. Для диффузной в крупноклеточной первичной медиастинальной лимфомы характерны так называемые В-симптомы: заболевшие жалуются на повышенную температуру, сильную потливость, они стремительно худеют. При наличии этих симптомов следует сразу обратиться к врачу и обследоваться, чтобы вовремя начать лечение медиастинальной диффузной В-крупноклеточной лимфомы. В клиниках Израиля для борьбы с этим опасным недугом применяются самые прогрессивные методики и используются доказавшие свою эффективность препараты нового поколения. Узнать больше…
Программа лечения медиастинальной диффузной В-крупноклеточной лимфомы в больницах Израиля составляется индивидуально по итогам диагностических исследований. После получения результатов и уточнения первоначального диагноза, а также определения стадии заболевания изначальная стоимость лечения медиастинальной диффузной В-крупноклеточной лимфомы в Израиле может потребовать внесения изменений.
- Биопсия с последующим иммунологическим и морфологическим исследованием образца ткани пораженного лимфоузла. Морфологическое исследование позволяет установить природу опухоли и уточнить вид лимфомы.
- КТ и МРТ дают возможность выявить опухоли в различных частях тела и определить стадию лимфомы.
- Иммунофенотипирование – инновационный метод, позволяющий определить тип аномальных клеток с помощью моноклональных антител.
По отзывам о лечении медиастинальной диффузной В-крупноклеточной лимфомы в Израиле, наилучшие результаты обеспечиваются, благодаря комплексному подходу.
- Химиотерапия направлена на уничтожение аномальных клеток в организме. В наиболее сложных случаях назначается интратекальная химиотерапия. Узнать больше…
- Таргетная терапия особенно эффективна на начальной стадии болезни, а также применяется в качестве паллеативной терапии. Препараты, содержащие моноклональные антитела, значительно улучшают результаты химиотерапии.
- Трансплантация стволовых клеток показана пациентам после агрессивной высокодозной химиотерапии. Цена лечения медиастинальной диффузной В-крупноклеточной лимфомы в Израиле данным методом более доступна, чем в других передовых странах.
Высокоточная диагностика, инновационное оборудование и прогрессивные методы лечения медиастинальной диффузной В-крупноклеточной лимфомы в центрах Израиля позволяют опытным специалистам добиться полного выздоровления пациентов с ранними стадиями заболевания и достичь стойкой ремиссии даже при запущенной болезни. Обратитесь в ServiceMed, и вы сами сможете в этом убедиться.
ServiceMed – это мировой уровень медуслуг по привлекательным ценам!
ВЫСОКОДОЗНАЯ ХИМИОТЕРАПИЯ ПЕРВИЧНОЙ ДИФФУЗНОЙ В-КРУПНОКЛЕТОЧНОЙ ЛИМФОМЫ ЦЕНТРАЛЬНОЙ НЕРВНОЙ СИСТЕМЫ. ПРОМЕЖУТОЧНЫЕ РЕЗУЛЬТАТЫ ПРОТОКОЛА CNS-2015 | Звонков
Введение
Первичная диффузная В-крупноклеточная лимфома центральной нервной системы (ПДВККЛ ЦНС) составляет от 1 до 3 % всех лимфом и не более 3 % всех опухолей головного мозга [1—5]. Медиана возраста больных на момент установления диагноза составляет 65 лет. Редкая встречаемость, особенности первичной локализации, агрессивное клиническое течение ПДВККЛ ЦНС создают объективные сложности диагностики и лечения. Длительное время считалось, что в основе химиорезистентности этой опухоли лежит ее уникальная локализация, а все химиотерапевтические подходы были связаны с преодолением гематоэнцефалического барьера (ГЭБ). Многочисленные попытки применения химиотерапии (ХТ) с максимальным набором цитостатических препаратов, способных преодолеть ГЭБ, не привели к существенному успеху [1, 2, 4—10]. Рецидивы заболевания, возникающие как в ранние сроки после ХТ, так и через несколько лет после ее окончания, выделяли ПДВККЛ ЦНС среди других форм диффузной В-крупноклеточной лимфомы (ДВККЛ). На протяжении последних лет, благодаря морфологическим, иммуногистохимическим, кариологическим и молекулярно-генетическим исследованиям, были выявлены уникальные биологические особенности ПДВККЛ ЦНС, радикально отличающие ее от других нодальных и экстранодальных форм ДВККЛ [11—22]. Факты, полученные при изучении нейроиммунологических свойств опухоли, также изменили стереотипное понимание «иммунопривилегированности» ПДВККЛ ЦНС. Стало понятным, что ГЭБ в условиях опухолевого поражения не является существенной «преградой» не только для большинства цитостатических препаратов, но и моноклональных антител [23], «малых молекул» [24] Т-клеток с химерным антигенным рецептором (CAR-T клетки) [25], что существенно изменило тактику лечения ПДВККЛ ЦНС.
Улучшить показатели безрецидивной (БРВ) и общей выживаемости (ОВ) ПДВККЛ ЦНС удалось после введения в протоколы лечения миелоаблативных режимов кондиционирования, включающего в себя высокие дозы тиофосфамида, бусульфана и циклофосфамида (ТВС режим) с последующей трансплантацией аутологичных гемопоэтических стволовых клеток крови (ауто-ТГСК) [26—33].
Изменилась тактика индукционной терапии ПДВККЛ ЦНС, целью которой стало не достижение длительной ремиссии за счет интенсификации химиотерапевтического воздействия, а максимально быстрая кинетическая редукция опухоли, восстановление неврологического статуса и возможность заготовить достаточное количество стволовых клеток крови (СКК) [26].
А. Omuro и соавт. [26] из Memorial Sloan Kettering Cancer Center удалось объединить эти новые терапевтические подходы в одном протоколе и достигнуть показателей БРВ и ОВ ПДВККЛ ЦНС, сопоставимых с таковыми при других экстранодальных диффузных В-крупноклеточных лимфомах (ДВККЛ). Авторами [26] было показано, что достижение 97 % общего ответа и 66 % полных ремиссий (ПР) у 32 больных ПДВККЛ ЦНС возможно на относительно нетоксичной четырехкомпонентной терапии (схема R-MPV — ритуксимаб, высокие дозы метотрексата, прокарбазин, винкристин). Эффективность терапии зависела не от способности этих препаратов, прежде всего ритуксимаба и винкристина, преодолевать ГЭБ, а скорее от кинетической противоопухолевой активности данной схемы. Применение высоких доз тиофосфамида, бусульфана, циклофосфамида (режим ТВС) позволило добиться 81 % пятилетней БРВ в общей группе и 100 % БРВ у 11 больных моложе 50 лет. Однако даже такая двухэтапная тактика не исключает развития рецидива примерно у 20 % больных. Многими авторами [34—36] обсуждается рациональность проведения поддерживающей терапии ПДВККЛ ЦНС (темозоломид, леналидомид, ниволумаб, ибрутиниб), однако утвержденных протоколов пока не разработано. J. Glass и соавт. [36] показали преимущества поддерживающей терапии темозоломидом у больных ПДВККЛ ЦНС после индукционного этапа, однако эффективность такого подхода после высокодозной ХТ не изучена.
Целью данной работы была проспективная оценка эффективности и токсичности высокодозной ХТ (R-MPV + ауто-ТГСК/ТВС) с последующей двухлетней поддерживающей терапией темозоломидом у больных ПДВККЛ ЦНС моложе 60 лет (протокол CNS- 2015) [4].
Материалы и методы
В период с июля 2015 г. по май 2019 г. в ФГБУ «НМИЦ гематологии» Минздрава России в проспективное исследование CNS-2015 было включено 20 больных с впервые установленным диагнозом ПДВККЛ ЦНС: 7 (35 %) женщин и 13 (65 %) мужчин. Медиана возраста на момент установления диагноза составила 42 года (20—62 года). Соматический статус у 17 (85 %) больных соответствовал 0—1 баллу по шкале ECOG и только у 3 (15 %) — 4 баллам [37]. Согласно критериям прогностической системы MSKCC [26], 18 (90 %) больных были отнесены к группе низкого риска и 2 (10 %) больных — к группе среднего риска. Характеристики больных представлены в таблице 1.
Таблица 1. Характеристики больных (n = 20)
Table 1. Patient characteristics (n = 20)
Для установления диагноза больным выполнялись стереотаксическая биопсия (п = 10) и хирургическое удаление опухоли (п = 10).
Протокол CNS-2015 был утвержден локальным этическим комитетом ФГБУ «НМИЦ гематологии» Минздрава России. Больные включались в протокол при наличии впервые установленного диагноза ПДВККЛ ЦНС, подтвержденного результатами гистологического и иммуногистохимического исследований биоптата опухоли. К другим критериям включения были отнесены возраст от 18 до 60 лет, фракция сердечного выброса >50 %, клиренс эндогенного креатинина >50 мл/мин, концентрация общего билирубина <20 мкмоль/л, негативные тесты на ВИЧ, отсутствие очагов поражения вне ЦНС, тяжелых инфекционных осложнений, психических расстройств, второго активного опухолевого процесса и предшествующей длительной терапии глюкокортикостероидными препаратами [4]. Двое из 20 больных, включенных в исследование, не соответствовали критериям включения: один больной в возрасте 62 лет был включен в протокол с учетом отсутствия коморбидности и одна больная — после предшествующей ХТ: ей было проведено два курса R-CHOP.
Всеми больными было подписано добровольное информированное согласие на включение в исследовательский протокол лечения.
При гистологическом и иммуногистохимическом исследованиях биоптатов опухолей все случаи были отнесены к non-GCB — иммуногистохимическому варианту ДВККЛ с высокой пролиферативной активностью по экспрессии Ki-67.
С целью исключения вторичного характера поражения ЦНС всем больным было проведено обследование, включавшее трепанобиопсию костного мозга, иммуно- химическое исследование сыворотки крови и мочи, компьютерную томографию (КТ) органов грудной клетки, брюшной полости и малого таза, магнитнорезонансную томографию (МРТ) головного мозга, ультразвуковое исследование органов мошонки (для мужчин), фиброгастродуоденоскопию. В результате проведенного обследования признаков опухолевой инфильтрации оболочек мозга, поражения спинного мозга выявлено не было. Офтальмологическое исследование было проведено у 16 больных, признаков специфической инфильтрации задних камер глаза не выявлено ни в одном случае. По данным МРТ головного мозга перед выполнением оперативного вмешательства у 10 (50 %) из 20 больных было выявлено более двух опухолевых очагов (рис. 1). У 2 из 10 больных с единичным опухолевым очагом выявлено поражение ствола головного мозга (рис. 2). Одному больному в связи с развитием внутричерепной гипертензии вследствие прорастания опухолью правого бокового желудочка и нарушения ликвородинамики выполнено вентрикулоцистернальное шунтирование по Торкильдсену.
Рисунок 1. Больная М. 52 г. МРТ головного мозга с в/в контрастным усилением (мультифокальное поражение ЦНС)
Figure 1. Patient M., 52 years old. Brain MRI with intravenous contrast enhancement (multiple foci of lymphomaj
Примечание. а) срез на уровне боковых желудочков; б) срез на уровне четверохолмия; в) срез на уровне мозжечка.
Note. a) slice at the level of the lateral ventricles; 6) slice at the level of the quadrigeminal bodies; в) slice at the level of the cerebellum.
Рисунок 2. Больная К. 41 г. Лимфома ЦНС, поражение стволовых структур мозга, МРТ головного мозга ИП Т2 FLAIR; с в/в контрастным усилением
Figure 2. Patient K., 41 years old. CNS lymphoma, lesion of brain stem structures, brain MRI, T2-FLAIR PS; with intravenous contrast enhancement
Примечание. а) ИП Т2FLAIR, очаг в продолговатом мозге справа; б) слабоинтенсивное постконтрастное усиление. ИП — импульсная последовательность. МРТ — магнитно-резонансная томография.
Note. a) T2-FLAIR PS, lesion in the medulla oblongata, on the right; 6) low-intensity post-contrast enhancement. PS — pulse sequence. MRI — magnetic resonance imaging.
Исследование ликвора было возможным провести только у 12 из 20 больных. Лишь у 1 больной в ликворе при нормальном цитозе методом проточной флуориметрии было обнаружено 10 % В-лимфоцитов с опухолевым иммунофенотипом. Всем 12 больным с профилактической целью было выполнено интратекальное введение трех цитостатических препаратов (дексаметазон 4 мг, метотрексат 15 мг, цитарабин 30 мг) [4]. Остальным 8 больным в связи с высоким риском осложнений спинномозговые пункции не выполнялись.
Перед началом терапии всем больным была выполнена электроэнцефалография, и на всех этапах терапии проводилась противосудорожная терапия.
Оценку токсичности проводили по шкале NCIC- CTC (National Cancer Institute — Common Toxicity Criteria, National Cancer Institute) [38].
Оценка МРТ-ответа проводилась с применением критериев RANO [39].
Статистический анализ данных проводили с использованием анализа выживаемости. Для расчетов использованы статистические программы StatView и 4 SAS 9.4. Для бессобытийной выживаемости событием являлась прогрессия заболевания, рецидив или смерть от любой причины, время отсчитывалось от начала ХТ. Для общей выживаемости событием являлась смерть от любой причины, время отсчитывалось от начала ХТ.
Результаты
Лечение по протоколу CNS-2015 проведено у 20 больных (16 больным проводится поддерживающая терапия темозоломидом). Характеристики гематологической и негематологической токсичности приведены в таблицах 2 и 3.
Таблица 2. Гематологическая токсичность (критерии токсичности по шкале NCIC-CTC) [37], %
Table 2. Hematological toxicity (NCIC-CTCj [37], %
Параметры Parameters | R-MPV | ГСК/TBC Auto-HSCT/TBC |
|---|---|---|
Нейтропения III-IV степени, % | 0 | 100 |
Neutropenia grade III-IV, % | ||
Тромбоцитопения III-IV степени, % Thrombocytopenia grade III-IV, % | 0 | 100 |
Анемия II-III степени, % Anemia grade III-IV, % | 0 | 100 |
Таблица 3. Негематологическая токсичность (критерии токсичности по шкале NCIC-CTC) [37] %
Table 3. Non-hematological toxicity (NCIC-CTCj [37], %
Примечание. АСТ — аспартатаминотрансфераза, АЛТ — аланинаминотрансфераза.
Notes. AST — aspartate aminotransferase, ALT — alanine aminotransferase.
Индукция ремиссии
В качестве индукции ремиссии больным было проведено от 3 до 5 курсов по программе R-MPV (ритук- симаб 375 мг/м2 в/в — 1-й день, метотрексат 3500 мг/м2 в/в — 2-й день, винкристин 2 мг в/в — 2-й день, про- карбазин 100 мг/м2 — 2—8-й дни перорально в нечетных курсах). В качестве сопроводительной терапии всем больным проводили противосудорожную (леве- тирацетам), противоотечную (маннитол) и антикоагулянтную терапию [4]. Тяжелой гематологической токсичности выявлено не было. Ни у одного больного на индукционном этапе не было миелотоксического агранулоцитоза, выраженной анемии, тромбоцитопении и зависимости от заместительной трансфузионной терапии.
У 18 из 20 больных было проведено четыре индукционных курса ХТ. У 1 больного после третьего курса ХТ при использовании высоких доз метотрексата отмечалось развитие острой почечной недостаточности (ОПН). Несмотря на комплекс проводимых мероприятий, включавших форсированный диурез, терапию фолинатом кальция, у больного в течение трех недель сохранялась гиперазотемия, отечный синдром и тенденция к олигурии. Учитывая высокий риск развития повторного эпизода ОПН и достижение максимальной редукции опухоли, четвертый курс R-MPV проведен не был.
Одному больному, у которого в связи с сохраняющимися признаками внутричерепной гидроцефалии был установлен вентрикулоцистернальный шунт, было выполнено повторное вентрикулоперитонеальное шунтирование. В связи с необходимостью решунтирования, требующего перерыва в лечении, больному перед операцией был проведен пятый курс индукционной ХТ.
Из наиболее частых негематологических осложнений было отмечено развитие периферической полинейропатии легкой степени у 50 % больных, вероятно, обусловленное токсическим действием винкристина. Вторым по частоте (10 %) осложнением являлось изолированное транзиторное повышение активности аминотрансфераз, максимально у одной больной до 40 норм после первого курса ХТ. В результате гепатопротекторной терапии удалось достичь полного регресса печеночной дисфункции, что позволило полностью выполнить программу лечения. У 1 больного после четырех курсов ХТ развилась двусторонняя нижнедолевая пневмония. По результатам исследования бронхоальвеолярного лаважа этиологию пневмонии установить не удалось. В результате противомикробной и противовирусной терапии удалось достичь полного обратного развития воспалительных изменений в легких. У 2 больных развилась фебрильная лихорадка без установленного очага инфекции. Наиболее вероятной причиной предполагалось побочное действие приема прокарбазина, при отмене которого у обоих больных температура тела нормализовалась.
Всем больным удалось эффективно выполнить мобилизацию и сбор СКК. Стимуляция гемопоэза гранулоцитарным колониестимулирующим фактором (Г-КСФ в дозе 10 мг/кг/сут) проводилась с 5-го дня межкурсового перерыва после 2-го цикла R-MPV. Среднее количество заготовленных СКК составило 7,8 х 106/кг С034+-клеток (3,4—12,4 х 106/кг).
После каждого цикла R-MPV всем больным выполняли МРТ головного мозга с внутривенным контрастированием. На этапе индукции ни у одного больного не наблюдалось прогрессии заболевания. У 15 больных была достигнута ПР и у 5 — частичная ремиссия (ЧР). Размеры резидуальных очагов составили от 6 до 17 мм.
Высокодозная ХТ и ауто-ТГСК
Всем 20 больным была выполнена ауто-ТГСК с режимом кондиционирования TBC (тиофосфамид 250 мг/м2 в/в с —8 по -6-й дни, бусульфан 4 мг/кг с —5 по -4-й дни перорально, циклофосфамид 60 мг/кг в/в с —3 по -2-й дни) [4]. У 2 больных при проведении кондиционирования отмечались тошнота и рвота на фоне приема бусульфана. Признаков развития веноокклюзионной болезни и тяжелых токсических осложнений не было. Гематологическая токсичность III-IV степени развивалась в 100 % случаев после ауто-ТГСК. Среднее время восстановления количества нейтрофилов составило 9 дней (от 8 до 14 дней). Всем больным с +1 дня после ауто-ТГСК проводилась стимуляция лейкопоэза Г-КСФ в дозе 5 мг/кг/сут [4]. У всех 20 больных после ауто-ТГСК на фоне миелотоксического агрануло- цитоза отмечалось развитие инфекционных осложнений. В 100 % случаев наблюдалось развитие мукозита III-IV степени, в 2 случаях болевой синдром вследствие мукозита потребовал применения наркотических анальгетиков. У половины больных отмечалось развитие герпесвирусных инфекций с различными клиническими проявлениями: мукозиты (5), цистит (1), поражение кожи (3) и ЦМВ-виремия (3). Случаи некротической энтеропатии наблюдались у 11 больных, и у 1 больного была доказана диарея, ассоциированная с Clostridium difficile. У 2 больных развились инфекции кровотока, в обоих случаях грамотрицательной этиологии (Klebsiella pneumoniae — 2), которые были купированы на фоне терапии противомикробными препаратами.
Среднее время восстановления количества тромбоцитов составило 13 дней (от 9 до 23 дней). В результате трансфузий концентратов тромбоцитов ни у одного больного не было тяжелых геморрагических осложнений.
У всех больных по данным МРТ головного мозга, выполненной после ауто-ТГСК, была констатирована ПР заболевания. У 2 из 20 больных был выявлен ранний рецидив заболевания (+4 и +5 месяцы) после ауто-ТГСК. В обоих случаях проведение противоре- цидивной таргетной терапии (леналидомид, ибрутиниб, ниволумаб) и лучевой терапии оказали только временный эффект. Спустя 24 и 26 месяцев после ауто-ТГСК больные умерли от прогрессии заболевания. Остальные 18 больных находятся в ПР заболевания. Средний срок наблюдения — 17 месяцев (от 1 до 46 месяцев) (рис. 3).
Рисунок 3. Бессобытийная выживаемость
Figure 3. Event-free survival
Поддерживающая терапия и контрольное обследование
Поддерживающая терапия включала в себя пе- роральный прием темозоломида в дозе 150 мг/м2 в течение 5 дней, каждые 3 месяца, в течение 2 лет. Переносимость была удовлетворительной. Закончили поддерживающую терапию 2 больных. Контрольная МРТ головного мозга проводилась каждые три месяца в течение 1-го года наблюдения, каждые шесть месяцев в течение 2-го года и далее 1 раз в год.
Обсуждение
Основным критерием диагноза первичной лимфомы центральной нервной системы является изолированное поражение головного или спинного мозга, задней камеры глаза или мозговых оболочек. Спектр лимфатических опухолей, локализующихся в ЦНС, невелик. Почти в 100 % случаев при поражении вещества головного и спинного мозга, а также задних камер глаза устанавливается диагноз ДВККЛ. Поражение мозговых оболочек и передней камеры глаза в большей степени характерно для лимфомы из клеток маргинальной зоны (MALT-лимфомы) [1—10]. Изучением лимфом ЦНС занимаются с начала прошлого века, однако остается множество нерешенных вопросов в их диагностике и лечении [40].
Предрасполагающими факторами развития первичной лимфомы центральной нервной системы являются иммунодефицитные состояния и аутоиммунные заболевания (синдром приобретенного иммунодефицита; проведение иммуносупрессивной терапии после органной трансплантации, рассеянный склероз и т. д.), однако причина развития опухоли у иммунокомпетентных больных до сих пор не установлена [1—8]. Почти все лимфатические опухоли ЦНС В-клеточной природы, однако в норме В-лимфоцит не способен преодолеть ГЭБ. Этот феномен также пока не объяснен [41].
Сложности диагностики и получения достаточного объема биопсийного материала, длительное время ограничивали изучение биологии ПДВККЛ ЦНС. Морфологическая диагностика не давала возможности выделить черты, отличающие ПДВККЛ ЦНС от других форм ДВККЛ, хотя ответ на терапию этих опухолей сильно отличался. Развитие методов молекулярной генетики и изучение профиля экспрессии генов позволили установить, что почти 100 % ПДВККЛ ЦНС относится к постгерминальному типу ДВККЛ (ABC-тип), который по сравнению с герминальным вариантом (GCB) ассоциируется с плохим прогнозом [8, 22]. В 2017 г. S. Mareschal и соавт. [12], применив метод секвенирования нового поколения (next generation sequencing — NGS), показали, что при ПДВККЛ ЦНС мутации в генах MYD88, CD79b и CARD11 обнаружены в 80, 32 и 8 % случаев соответственно. Для сравнения, при системной ДВККЛ АВС типа аналогичные мутации выявлены только в 28, 25 и 2 % случаев соответственно. Почти в 70 % случаев ПДВККЛ ЦНС была выявлена высокая сочетанная экспрессия белков с- Myc, B cl-6 и Bcl-2 (трипл-экспрессия), что обычно нехарактерно для других форм ДВККЛ [14, 20]. Почти в 100 % случаев ПДВККЛ ЦНС отмечалась выраженная экспрессия белка IRF/MUM1, что дает основание для эффективного применения иммуномодулирующих агентов [22]. Японскими авторами [11] выявлен уникальный профиль метилирования ДНК ПДВККЛ ЦНС, отличный от других форм ДВККЛ. Кроме того, для ПДВККЛ ЦНС характерно выраженное реактивное микроокружение с большим количеством PD-1+ Т-клеток, а также редуцированная экспрессия белков комплекса гистосовместимости [21]. Все это представляет, с одной стороны, трудности для иммунологического надзора за опухолью, с другой — определяет эффективность применения ингибиторов контрольных точек в терапии ПДВККЛ ЦНС. Современные данные нейроиммунологических исследований дают основания предполагать возможность проникновения через ГЭБ практически всех клеток крови, кроме В-лимфоцитов, что позволяет иначе взглянуть на возможности Т-клеточной терапии ПДВККЛ ЦНС [25]. Следовательно, ПДВККЛ ЦНС представляет собой биологически уникальную группу ДВККЛ, что необходимо учитывать при разработке новых программ лечения помимо тактики цитостатического проникновения через ГЭБ. Редкая встречаемость затрудняет проведение проспективных рандомизированных исследований, а большая часть работ по ПДВККЛ ЦНС построена на ретроспективных пилотных наблюдениях сравнительно небольшого числа больных [8].
Несмотря на объективные трудности, удалось доказать, что хирургическая резекция опухоли, лучевая терапия, стандартные режимы ХТ, применяемые для других форм ДВККЛ (схемы R-CHOP, NHL- BFM-90 и т.д.), неэффективны в терапии ПДВБКЛ ЦНС, поскольку пятилетняя БРВ не превышала 5 % [1—10]. Попытки увеличения концентрации цитоста- тических препаратов в ткани мозга путем интраартериального «разрыва» ГЭБ также оказались не только неэффективными, но и часто сопровождались тяжелыми, иногда смертельными, осложнениями [42].
До сих пор не существует утвержденного протокола лечения ПДВККЛ ЦНС. В ведущих онкогематологических руководствах в качестве терапии первой линии рекомендуется применение высоких доз метотрексата (>3 г/м2) в виде монотерапии или в комбинации с другими цитостатическими препаратами, способными преодолеть ГЭБ (цитарабин, кармустин, этопозид, ифосфамид, винкристин, прокарбазин, темозо- ломид, пеметрексед, тиофосфамид и т.д.) [1, 2, 4—10]. Доказанная дополнительная эффективность сочетания ХТ с ритуксимабом у больных ПДВККЛ ЦНС ставит под сомнение нормальную работу ГЭБ в условиях опухолевого поражения мозга с учетом большой молекулярной массы моноклонального антитела [23]. Большинство индукционных комбинаций ХТ оказываются эффективными в достижении первичного общего ответа (ОО), однако, почти у 40 % больных развивается рецидив заболевания в первые два года наблюдения, а пятилетняя БРВ и ОВ не превышают 40 %. Поиск оптимального индукционного курса привел к разработке схемы R-MPV, которая отвечала всем условиям необходимым для терапии этой категории больных [43]. Быстрый МРТ и неврологический ОО у 97 % больных (при достижении 66 % ПР), минимальная негематологическая и костномозговая токсичность, а также возможность заготовить адекватное количество СКК делают эту схему терапией выбора для большинства больных ПДВККЛ ЦНС [26]. У 20 больных в исследовании CNS-2015 также отмечена удовлетворительная переносимость схемы R-MPV. Костномозговая токсичность минимальна, всем больным заготовлено достаточное количество СКК. Повышение уровня креати- нина отмечено только у 1 больного. Полная ремиссия, определяемая по результатам МРТ головного мозга, была достигнута у 15 (80 %) из 20 больных. В дальнейшем у 5 больных, находившихся в ЧР, произошла конверсия в ПР после проведения ауто-ТГСК с режимом кондиционирования TBC, что не противоречит данным литературы [44].
Проведение консолидирующей высокодозной ХТ является сегодня необходимым условием достижения длительной БРВ и ОВ больных ПДВККЛ ЦНС [6-10, 26-33, 45-49]. По данным сравнительных исследований [1-10, 31], применение лучевой терапии в консолидации ремиссии менее эффективно, сопряжено с тяжелой ранней нейротоксичностью и значительно снижает качество и продолжительность жизни больных. Среди схем высокодозной ХТ, используемых в консолидации ремиссии, преимущества имеет терапия с включением высоких доз тиофосфамида и бу- сульфана [26-33]. Помимо нециклоспецифичной противоопухолевой активности эти препараты обладают высокой способностью проникать через ГЭБ (более 80 %). Рациональность добавления высоких доз цикло- фосфамида (схема ТВС) обсуждается. Эффективность схемы ТВС сначала была доказана у больных с рецидивами ПДВККЛ ЦНС (трехлетняя БРВ составила 37-53 %) [48], а затем и у больных, которым была проведена первая линия терапии (двухлетняя БРВ достигала 92 %) [26-33]. Были отмечены явные преимущества применения схемы ТВС у больных ПДВККЛ ЦНС в сравнении со схемой BEAM [47-49]. Однако при сравнительной оценке режимов ТВС и ВЕАМ у больных нодальной ДВККЛ значимых отличий в эффективности выявлено не было [49]. Рецидивы и резистентное течение после проведения схемы ТВС наблюдались у 10-20 % больных. По результатам проведенных 7 исследований (4 проспективных, 2 ретроспективных и 1 сравнительное) применения схемы ТВС у больных ПДВККЛ ЦНС [26-32], большинство рецидивов ПДВККЛ ЦНС развились в первые 2 года после ауто-ТГСК (в протоколе CNS-2015 констатировано 2 рецидива через 4 и 5 месяцев после ауто-ТГСК). Кроме того, высокая токсичность терапии и связанная с ней смертность, достигающая 12-14 %, затрудняют применение схемы ТВС у пожилых больных с высокой коморбидностью, больных с тяжелыми неврологическими дефектами, сопутствующими инфекционными осложнениями на фоне длительной терапии кортикостероидами. Есть только единичные сообщения в литературе о применении высокодозной ХТ у больных ПДВККЛ ЦНС старше 70 лет. В 2017 г. были опубликованы результаты исследования, включающего 52 больных, медиана возраста которых была 68,5 года. В качестве консолидации первой ремиссии высоко- дозная ХТ с ауто-ТГСК была проведена 15 больным и во второй или последующей линиях — 37 больным. При среднем сроке наблюдения 22 месяца медиана БПВ и ОВ составили 51,1 и 122,3 месяца соответственно. Смертность, связанная с лечением, составила всего 3,8 % [43]. Таким образом, у больных пожилого возраста протокол с применением высокодозной ХТ с последующей ауто-ТГСК эффективен и осуществим, но с учетом соматического статуса больного.
Большинство больных в протоколе CNS-2015 были из группы низкого риска, без тяжелых неврологических нарушений, без длительной терапии кортикостероидами и в возрасте до 60 лет. Смертей, связанных с токсичностью терапии, не было, что, вероятно, связано с селекцией больных и строгим выполнением протокола сопроводительной терапии [4].
Данные о поддерживающей терапии ПДВККЛ ЦНС ограниченны. Онкологической группой RTOG 0227 было проведено исследование, в котором после индукции ритуксимабом, метотрексатом, темозоломидом и лучевой терапии была проведена ежемесячная поддерживающая терапия темозоломидом в течение 1 года. Вследствие этого было получено существенное улучшение показателей БРВ и ОВ в сравнении с историческим контролем [36]. Данные об эффективности темозоломида у больных с впервые выявленной опухолью, а также у больных с рецидивом ПДВККЛ ЦНС дали основание применить его в виде «предфазы» и поддерживающей терапии в протоколе CNS- 2015 [50].
Перспективными представляются работы по применению таргетной терапии ПДВККЛ ЦНС. В протоколе CNS-2015 у 2 больных с рецидивом заболевания был достигнут ответ на терапии леналидомидом в течение 5 и 15 месяцев приема. В результате терапии ибрутинибом и ниволумабом длительность полного ответа была меньше — 1 и 2,5 месяца соответственно. По данным литературы [35, 36, 51—56], применение леналидомида, ибрутиниба и ниволумаба у больных с рецидивами ПДВККЛ ЦНС также показало высокую эффективность. Перспективным кажется применение таргетной терапии у больных с впервые выявленной опухолью, в комбинации с существующими протоколами ХТ, а также в виде поддерживающей терапии под контролем оценки минимальной резидуальной болезни (МРБ).
Появление сверхчувствительных методов оценки МРБ в крови и ликворе в перспективе дает возможность проводить ориентированную на наличие остаточного опухолевого клона ХТ и таргетную терапию у больных ПДВККЛ ЦНС. По данным De Mattos- Arruda L. и соавт. [19], концентрация свободной опухолевой ДНК в ликворе значительно выше, чем в крови больных ПДВККЛ ЦНС. Кроме того, при использовании метода NGS отмечена почти 100 %-ная корреляция выявленных драйверных мутаций в ликворе и первичном биоптате опухоли [13, 15]. Применение метода NGS при ПДВККЛ ЦНС имеет и другие преимущества. Даже небольшое количество биопсийного материала, обычно полученное после стереотаксиче- ской биопсии, дает возможность получить полноценную молекулярно-генетическую характеристику опухоли, недоступную другими методами. По данным H.D. Munch-Peterson и соавт. [16] и N. Galanina и соавт. [15], у 30—100 % больных ПДВККЛ ЦНС в биоптатах опухоли выявляется мутация в гене ТР53 [15, 16]. Однако негативное прогностическое значение имели только мутации, расположенные в локусах, связанных с ДНК-контактированием (до 30 % больных) [15]. Возможно, это объясняет резистентное к химиотерапевтическому воздействию течение заболевания у 20—30 % больных ПДВККЛ ЦНС даже после высокодозной ХТ. В качестве преодоления первичной резистентности только небольшое число авторов рассматривает проведение трансплантации аллогенных гемопоэтических стволовых клеток у больных ПДВККЛ ЦНС [57, 58]. Позитивный опыт даже единичных сообщений дает основания продолжить работу в этом направлении. Собственное наблюдение эффективной CAR-терапии у больной с первичной крупноклеточной В-клеточной медиастинальной лимфомой с поражением головного мозга в рецидиве заболевания дает основания предполагать о возможности трансплантированных донорских или модифицированных Т-клеток не только преодолевать ГЭБ, но и проявлять противоопухолевую активность.
Таким образом, по результатам проспективного исследования можно констатировать наличие в химиотерапевтическом арсенале высокоэффективного протокола высокодозной ХТ ПДВККЛ ЦНС. Достигнутые результаты значительно выше, чем в ранее применяемых протоколах лечения ПДВККЛ ЦНС. Эффективность и переносимость терапии зависит от адекватных диагностических и лечебных мероприятий после появления первых признаков заболевания. Осложненные «радикальные хирургические вмешательства», длительный прием кортикостероидов и сопутствующие инфекционные осложнения делают невозможным проведение высокодозной ХТ ПДВККЛ ЦНС. Выполнение высокодоз- ной ХТ у больных старше 60 лет может рассматриваться с учетом их соматического статуса. Выполнение высокодозной ХТ ПДВККЛ ЦНС возможно в любых специализированных гематологических стационарах, проводящих ауто-ТГСК, при строгом соблюдении схем ХТ и сопроводительного лечения [4]. При ПДВККЛ ЦНС перспективным является применение высокочувствительных методов оценки МРБ (свободно циркулирующая опухолевая ДНК) в ликворе и плазме, с обязательной детекцией мутаций в гене ТР53. С целью повышения эффективности и снижения токсичности рациональна разработка новых МРБ-ориентированных протоколов лечения ПДВККЛ ЦНС, с использованием таргетной терапии (леналидомид, ибрутиниб, ниволумаб). Также возможна разработка протоколов терапии с применением CAR-Т-клеток и трансплантации аллогенных гемопоэтических стволовых клеток для резистентных случаев ПДВККЛ ЦНС.
1. Губкин А.В., Звонков Е.Е., Кременецкая А.М. и др. Первичные лимфопролиферативные заболевания центральной нервной системы. Клиническая онкогематология. М., 2008; 1(4): 323–32.
2. Губкин A.В., Звонков Е.Е., Кременецкая А.М. и др. Первичные лимфопролиферативные заболевания центральной нервной системы. Терапевтический архив. 2009; 81(7): 85–91.
3. Воробьев А.И., Кременецкая А.М. Атлас опухолей лимфатической системы. М.: Ньюамед, 2007. — 292 с.
4. Звонков Е.Е., Королева Д.А., Габеева Н.Г. и др. Исследовательский протокол лечения больных первичной диффузной В-крупноклеточной лимфомой центральной нервной системы (протокол CNS-2015). Алгоритмы диагностики и протоколы лечения заболеваний системы крови, под редакцией академика РАН В.Г. Савченко. М., 2018; 2: 609–22.
5. Grommes C., DeAngelis L. M. Primary CNS Lymphoma. J. Clin. Oncol. 2017; 35(21): 2410–18. DOI: 10.1200/JCO.2017.72.7602
6. Fox C.P., Phillips E.H., Smith J. et al. Guidelines for the diagnosis and management of primary central nervous system diffuse large B-cell lymphoma. Br. J. Haematol. 2019; 184(3): 348–63. DOI: 10.1111/bjh.15661
7. Paydas S. Primary central nervous system lymphoma: essential points in diagnosis and management. Med. Oncol. 2017; 34(61). DOI: 10.1007/s12032-017- 0920-7
8. Löw S., Han C.H., Batchelor T.T. Primary central nervous system lymphoma. Therapeutic Advances in Neurological Disorders. 2018; 11: 1–16. DOI: 10.1177/1756286418793562
9. Sethi T.K., Reddy N.M. Treatment of newly diagnosed primary central nervous system lymphoma: current and emerging therapies. Leuk. Lymphoma. 2019; 60(1): 6–18. DOI: 10.1080/10428194.2018.1466296
10. Grommes C., Rubenstein J.L., DeAngelis L.M. et al. Comprehensive approach to diagnosis and treatment of newly diagnosed primary CNS lymphoma. Neuro Oncol. 2019; 21(3): 296–305. DOI: 10.1093/neuonc/noy192
11. Nakamura T., Yamashita S., Fukumura K. et al. Genomewide DNA methylation profi ling identifi es primary central nervous system lymphoma as a distinct entity different from systemic diffuse large B-cell lymphoma. Acta Neuropathol. 2017; 133(2): 321–4. DOI: 10.1007/s00401-016-1664-8
12. Mareschal S., Pham-Ledard A., Viailly P.J. et al. Identifi cation of somatic mutations in primary cutaneous diffuse large B-cell lymphoma, leg type by massive parallel sequencing. J Invest. Dermatol. 2017; 137: 1984–94. DOI: 10.1016/j. jid.2017.04.010
13. Fontanilles M., Marguet F., Bohers É. et al. Non-invasive detection of somatic mutations using next-generation sequencing in primary central nervous system lymphoma. Oncotarget. 2017; 8(29): 48157–68. DOI: 10.18632/oncotarget.18325
14. Brunn A., Nagel I., Montesinos-Rongen M. et al. Frequent triple-hit expression of MYC, BCL2, and BCL6 in primary lymphoma of the central nervous system and absence of a favorable MYClowBCL2low subgroup may underlie the inferior prognosis as compared to systemic diffuse large B cell lymphomas. Acta Neuropathol. 2013; 126: 603–5. DOI: 10.1007/s00401-013-1169-7
15. Galanina N., Bejar R., Choi M. et al. Comprehensive genomic profi ling reveals diverse but actionable molecular portfolios across hematologic malignancies: implications for next generation clinical trials. Cancers. 2018; 11(1). DOI: 10.3390/cancers11010011
16. Munch-Petersen H. D., Asmar F., Dimopoulos K. et al. TP53 hotspot mutations are predictive of survival in primary central nervous system lymphoma patients treated with combination chemotherapy. Acta Neuropathol. Commun. 2016; 4: 40. DOI: 10.1186/s40478-016-0307-6
17. Hickmann A.K., Frick M., Hadaschik D. et al. Molecular tumor analysis and liquid biopsy: a feasibility investigation analyzing circulating tumor DNA in patients with central nervous system lymphomas. BMC Cancer. 2019; 19: 192. DOI: 10.1186/s12885-019-5394-x
18. Nayyar N., White M. D., Gill C.M. et al. MYD88 L265P mutation and CDKN2A loss are early mutational events in primary central nervous system diffuse large B-cell lymphomas. Blood. 2019; 3: 3. DOI: 10.1182/bloodadvances.2018027672
19. De Mattos-Arruda L., Mayor R. et al. Cerebrospinal fl uid-derived circulating tumour DNA better represents the genomic alterations of brain tumors than plasma. Nat. Commun. 2015; 6: 8839. DOI: 10.1038/ncomms9839
20. Nosrati A., Monabati A., Sadeghipour A. et al. MYC, BCL2, and BCL6 rearrangements in primary central nervous system lymphoma of large B cell type. Ann. Hematol. 2019; 98(1):169–73. DOI: 10.1007/s00277-018-3498-z
21. Chapuy B., Roemer G.M., Stewart C. et al. Targetable genetic features of primary testicular and primary central nervous system lymphomas. Blood. 2016; 127(7): 869–81. DOI: 10.1182/blood-2015-10-673236
22. Cai Q., Fang Yu, Young K.H. Primary central nervous system lymphoma: molecular pathogenesis and advances in Treatment. Transl. Oncol. 2019; 12: 523– 38. DOI: 10.1016/j.tranon.2018.11.011
23. Holdhoff M., Ambady P., Abdelaziz A. et al. High-dose methotrexate with or without rituximab in newly diagnosed primary CNS lymphoma. Neurology. 2014; 83: 235–39. DOI: 10.1212/WNL.0000000000000593
24. Mendez J. S., Grommes C. Treatment of primary central nervous system lymphoma: from chemotherapy to small molecules. Am. Soc. Clin. Oncol. Educ Book. 2018; 23(38): 604–15. DOI: 10.1200/EDBK_200829
25. Abramson J.S., McGree B., Noyes S. et al. Anti-CD19 CAR T cells in CNS diffuse large-B-cell lymphoma. N. Engl. J. Med. 2017; 377(8): 783–4. DOI: 10.1056/NEJMc1704610
26. Omuro A., Correa D.D., DeAngelis L.M. et al. R-MPV followed by high-dose chemotherapy with TBC and autologous stem-cell transplant for newly diagnosed primary CNS lymphoma. Blood. 2015; 125: 1403–10. DOI: 10.1182/ blood-2014-10-604561
27. Scordo M., Bhatt V., Hsu M. et al. A comprehensive assessment of toxicities in patients with CNS lymphoma undergoing autologous stem cell transplantation using Thiotepa, Busulfan and Cyclophosphamide conditioning. Biol Blood Marrow Transplant. 2017; 23(1): 38–43. DOI: 10.1016/j.bbmt.2016.09.024
28. DeFilipp Z., Li S., El-Jawahri A. et al. High-Dose chemotherapy with Thiotepa, Busulfan, and Cyclophosphamide and autologous stem cell transplantation for patients with primary central nervous system lymphoma in fi rst complete remission. Cancer. 2017; 123(16): 3073–9. DOI: 10.1002/cncr.30695
29. Cheng T., Forsyth P., Chaudhry A. et al. High-dose thiotepa, busulfan, cyclophosphamide and ASCT without whole-brain radiotherapy for poor prognosis primary CNS lymphoma. Bone Marrow Transplant. 2003; 31: 679–85. DOI:10.1038/sj.bmt.1703917
30. Chen Yi-Bin, Batchelor T., Li S. et al. Phase 2 Trial of High-Dose Rituximab with high-dose cytarabine mobilization therapy and high-dose thiotepa, busulfan, and cyclophosphamide autologous stem cell transplantation in patients with central nervous system involvement by Non-Hodgkin lymphoma. Cancer. 2015; 121(2): 226–33. DOI: 10.1002/cncr.29023
31. Houillier C., Taillandier L., Dureau S. et al. Radiotherapy or autologous stemcell transplantation for primary CNS lymphoma in patients 60 years of age and younger: results of the intergroup ANOCEF-GOELAMS randomized phase II PRECIS study. J. Clin. Oncol. 2019; 37: 823–33. DOI: 10.1200/JCO.18.00306
32. Alimohamed N., Daly A., Owen C. et al. Upfront thiotepa, busulfan, cyclophosphamide, and autologous stem cell transplantation for primary CNS lymphoma: a single centre experience. Leuk. Lymphoma. 2012; 53(5): 862–67. DOI: 10.3109/10428194.2011.633250
33. Hu B. A Tale of two eras: The story of autologous stem cell transplantation with and without thiotepa for primary central nervous system lymphoma. Biol. Blood Marrow Transplantat. 2019; 25(5): 141–2. DOI: 10.1016/j.bbmt.2019.03.014
34. Terziev D., Hutter B., Klink B., et al. Nivolumab maintenance after salvage autologous stem cell transplantation results in long-term remission in multiple relapsed primary CNS lymphoma. Eur. J. Haematol. 2018; 101(1): 115–8. DOI: 10.1111/ ejh.13072
35. Rubenstein J.L., Geng H., Vu K. et al. Maintenance Lenalidomide in Primary CNS Lymphoma. Ann Oncol. 2019; 30(8):1397–8. DOI: 10.1093/annonc/mdz142
36. Glass J., Won M., Schultz C.J. et al. Phase I and II study of induction chemotherapy with methotrexate, rituximab, and temozolomide, followed by wholebrain radiotherapy and postirradiation temozolomide for primary CNS lymphoma: NRG Oncology RTOG 0227. J. Clin. Oncol. 2016; 34(14): 1620–5. DOI: 10.1200/JCO.2015.64.8634
37. Oken M., Creech R., Tormey D. et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am. J. Clin. Oncol. 1982; 5: 649–55.
38. ht tps://w w w.eor tc .be/ser vices/doc/c tc/CTC AE _v5 _Q uick _ Reference_5x7.pd
39. Wen P.Y., Chang S. M., Van den Bent M.J. et al. Response Assessment in Neuro-Oncology Clinical Trials. J. Clin. Oncol. 2017; 35(21): 2439–49. DOI: 10.1200/JCO.2017.72.7511
40. Russell S. and Rubinstei L. J. Pathology of Tumours of the Nervous System. J. Pathol. 1989; 158: 359–60. DOI: 10.1002/path.1711580413
41. Qian L., Tomuleasa C., Florian I. et al. Advances in the treatment of newly diagnosed primary central nervous system lymphomas. Blood 2017; 52: 159–66. DOI: 10.5045/br.2017.52.3.159
42. Angelov L., Doolittle N.D., Kraemer D.F. et al. Blood-brain barrier disruption and intra-arterial methotrexate-based therapy for newly diagnosed primary CNS lymphoma: a multi-institutional experience. J. Clin. Oncol. 2009; 27(21): 3503–9. DOI: 10.1200/JCO.2008.19.3789
43. Gavrilovic I.T., Hormigo A, Yahalom J. et al. Long-Term Follow-Up of HighDose Methotrexate-Based Therapy With and Without Whole Brain Irradiation for Newly Diagnosed Primary CNS Lymphoma. J. Clin. Oncol. 2006; 24(28): 4570–4. DOI: 10.1200/JCO.2006.06.6910
44. Schorb E., Fox C.P., Fritsch K. et al. High-dose thiotepa-based chemotherapy with autologous stem cell support in elderly patients with primary central nervous system lymphoma: a European retrospective study. Bone Marrow Transplant. 2017; 52(8): 1113–9. DOI: 10.1038/bmt.2017.23
45. Gaut D., Schiller G.J. Hematopoietic stem cell transplantation in primary central nervous system lymphoma: a review of the literature. International J. Hematol. 2019; 109(3): 260–77. DOI: 10.1007/s12185-019-02594-1
46. Alnahhas I., Jawish M., Alsawas M. et al. Autologous stem cell transplant for primary central nervous system lymphoma: A systematic review and metaanalysis. Clin. Lymphoma Myeloma Leuk. 2019; 19(3): 129–41. DOI: 10.1016/j. clml.2018.11.018
47. Dholaria B.R., Kumar A., Azzuqua A. et al. Autologous stem cell transplantation in central nervous system lymphoma: A multicenter retrospective series and a review of the literature. Clin. Lymphoma Myeloma Leuk. 2019; 19(6): 273–80. DOI: 10.1016/j.clml.2019.02.013
48. Soussain C., Suzan F., Hoang-Xuan K. et al. Results of intensive chemotherapy followed by hematopoietic stem-cell rescue in 22 patients with refractory or recurrent primary CNS lymphoma or intraocular lymphoma. J. Clin. Oncol. 2001; 19: 742–9. DOI: 10.1200/JCO.2001.19.3.742
49. Sellner L., Boumendil A., Finel H. et al. Thiotepa-based high-dose therapy for autologous stem cell transplantation in lymphoma: a retrospective study from the EBMT. Bone Marrow Transplant. 2016; 51: 212–8. DOI: 10.1038/bmt.2015.273
50. Osmani A.H., Masood N. Temozolomide for relapsed primary CNS lymphoma. J Coll Physicians Surg. Pak. 2012; 22(9): 594–5. DOI: 09.2012/JCPSP.594595
51. Kassa C., Reményi P., Sinkó J. et al. Successful nivolumab therapy in an allogeneic stem cell transplant child with post‐transplant lymphoproliferative disorder. Pediatr. Transplant. 2018; 22(8): 13302. DOI: 10.1111/petr.13302
52. Graham M.S., DeAngelis L. M. Improving outcomes in primary CNS lymphoma. Best Pract Res. Clin. Haematol. 2018; 31: 262–9. DOI: 10.1016/j. beha.2018.07.006
53. Nayak L., Iwamoto F. M, LaCasce A. et al. PD-1 blockade with nivolumab in relapsed/refractory primary central nervous system and testicular lymphoma. Blood. 2017; 129(23): 3071–3. DOI: 10.1182/blood-2017-01-764209
54. Grommes C., Nayak L., Tun H.W., Batchelor T.T. Introduction of novel agents in the treatment of Primary CNS Lymphoma. Neuro-Oncol. 2018; 21(3): 306–13. DOI: 10.1093/neuonc/noy193
55. Chamoun K., Choquet S., Boyle E. et al. Ibrutinib monotherapy in relapsed/ refractory CNS lymphoma: A retrospective case series. Neurology. 2017; 88(1): 101–2. DOI: 10.1212/WNL.0000000000003420
56. Houillier C., Choquet S., Touitou V. et al. Lenalidomide monotherapy as salvage treatment for recurrent primary CNS lymphoma. Neurology. 2015; 84(3): 325–6. DOI: 10.1212/WNL.0000000000001158
57. Atilla E., Sahin U., Atilla P.A. et al. Allogeneic stem cell transplantation for relapsed primary central nervous system lymphoma: Is it feasible? Hematol. Oncol. Stem. Cell Ther. 2018; 1658–3876(18): 30025–6. DOI: 10.1016/j.hemonc.2018.02.001
58. Varadi G., Or R., Kapelushnik J. et al. Graft-Versus-Lymphoma effect after allogeneic peripheral blood stem cell transplantation for primary central nervous system lymphoma. Leuk. Lymph. 1999; 34(1–2): 185–90. DOI: 10.3109/10428199909083396
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
VIII РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
ФАКТОРЫ ПРОГНОЗА ПРИ ДИФФУЗНОЙ КРУПНОКЛЕТОЧНОЙ В-КЛЕТОЧНОЙ ЛИМФОМЕ
И.В. Поддубная, Л.Г. Бабичева
Кафедра онкологии РМАПО, Москва
В последние годы заболеваемость неходжкинскими лимфомами (НХЛ) имеет неизменную тенденцию к росту; она выше в развитых странах, где за последние 20 лет увеличилась более чем на 50% и по темпу прироста превышает лимфогранулематоз. Наиболее часто встречающимся вариантом агрессивных НХЛ является диффузная крупноклеточная В-клеточная лимфома (ДККЛ), течение которой характеризуется склонностью к быстрой генерализации опухолевого роста, что определяет крайне неблагоприятный прогноз и высокую летальность больных: 5-летняя выживаемость составляет в среднем 38%, а медиана выживаемости не леченных больных не превышает 1 года (Gaynor E.R., 1998).
Разработанные в последние годы программы лечения позволили увеличить продолжительность ремиссии и жизни, но не решили проблему полного излечения больных. Повышение интенсивности терапевтических программ способствует увеличению эффективности, с одной стороны, но и развитию тяжелых осложнений на фоне миелосупрессии – с другой, и поэтому является оправданной не во всех случаях. Остаются мало разработанными критерии выбора оптимального объема и длительности лечения в каждом конкретном случае. Важным этапом решения проблемы индивидуализации лечебных программ является оценка прогностического значения ряда клинико-лабораторных характеристик заболевания у каждого больного до начала специфической терапии.
В области изучения НХЛ основное внимание уделяется прогностической ценности различных морфологических вариантов заболевания, при этом диффузная крупноклеточная В-клеточная лимфома определяется как наиболее неблагоприятный.
Не вызывает сомнений прогностическое значение клинической стадии заболевания. Результаты всех исследований отчетливо указывают на более низкую продолжительность жизни больных с III-IV стадиями в сравнении с I-II. Доказана зависимость прогноза течения лимфомы от возраста, наличия экстранодальных очагов, общего состояния больного и содержания сывороточной лактатдегидрогеназы (ЛДГ). Эти факторы легли в основу Международного прогностического индекса (МПИ). Недостаточно изученными остаются вопросы прогностической ценности симптомов интоксикации, исходного уровня гемоглобина, общего белка и альбуминов, большой опухолевой массы и т.д. Литературные сведения по этим вопросам неоднозначны и противоречивы.
В наше ретроспективное не рандомизированное исследование включены 136 больных диффузной крупноклеточной В-клеточной лимфомой, установленной в соответствие с классификацией REAL (1994 г.) и ВОЗ (2001 г.) на основании иммуноморфологического исследования опухолевой ткани. Пациенты получали лечение и наблюдались в РОНЦ с января 1995 г. по январь 2003 г.
Мужчин было 51% и женщин — 49%. Возраст больных варьировал от 14 до 87 лет, составляя в среднем 50,76±1,62 года; 54 (40%) пациента были старше 60 лет.
Определение стадии заболевания осуществлялось с помощью клинической классификации для злокачественных лимфом, предложенной в Анн-Арбор в 1971 г. I стадия заболевания была диагностирована у 10 (7,5%) больных, II стадия – у 36 (26,5%), III стадия – у 11 (8%) больных, а IV стадия – у 79 (58%) пациентов (рис. 1). Таким образом, к моменту постановки диагноза генерализованную стадию заболевания имели более половины (66%) больных.
Рис. 1. Распределение больных по стадиям.
Экстранодальные проявления лимфомы были выявлены у 115 (84,5%) больных, причем поражение более одной экстранодальной зоны изначально было обнаружено у 47 (34,6%) пациентов. Общее состояние 50 (37%) больных расценивалось как тяжелое, соответствующее 3-4 степени по шкале ECOG. Повышение уровня ЛДГ выше нормы отмечалось у 87 (64%) пациентов, причем в 31 (23%) случае уровень этого фермента составил более двух норм (?900 Ед/л). Следует отметить, что высокий уровень ЛДГ (>750 Ед./л) достоверно чаще регистрировался у больных моложе 60 лет (р=0,042).
Таким образом, в соответствии с МПИ, пациенты распределились следующим образом: к низкой степени риска раннего прогрессирования (0-1 фактор) были отнесены 37 (27%) больных, к промежуточной низкой (2 фактора) – 35 (26%) больных, в группу промежуточной высокой степени (3 фактора) вошел 31 (23%) больной, а высокой степени (4-5 факторов) — 33 (24%)больных. Следовательно, около половины пациентов (47%) были отнесены в неблагоприятную прогностическую группу (рис. 2).
Рис. 2. Распределение больных по количеству неблагоприятных факторов по МПИ.
Кроме основных факторов, входящих в МПИ, были отмечены симптомы интоксикации (В-симптомы), включающие снижение массы тела на 10% и более в течение 6 мес., наличие лихорадки (>38?С) в течение не менее 3 дней подряд без признаков воспалительного процесса и ночная профузная потливость. Они сопровождали заболевание в 29 (21%) случаях. Следует отметить, что частота этого признака была прямо пропорциональна количеству неблагоприятных факторов по МПИ.
В настоящее время массивным поражением (“bulky”) принято считать опухолевые образования диаметром более 10 см. К моменту постановки диагноза первичная опухоль достигала больших (более 10 см) размеров в 86 (63%) случаях, причем у 29 (21,3%) больных это было массивное поражение лимфоузлов средостения. Отмечена высоко достоверная зависимость этого признака от количества неблагоприятных факторов МПИ. Так, в группе низкого риска наличие “bulky “ зарегистрировано у 49% больных, а в группе высокого риска по МПИ– у 94% больных (р=0,001).
Снижение уровня общего белка сыворотки крови ниже нормы (минимальное значение составило 53,5 г/л) отмечалось у 15 (11%) пациентов. Уровень альбумина сыворотки крови ниже 35 г/л (до 26,1 г/л) зарегистрирован у 14 (10%) больных. Анемия (гемоглобин
Необходимо отметить такой показатель как общее количество зон поражения: у 82 (60%) пациентов к моменту постановки диагноза было выявлено менее 4 зон поражения; в 28 (21%) случаях их было от 4 до 7; более 7 зон поражения изначально было диагностировано у 26 (19%) больных.
В общей сложности 90 (66%) пациентов на момент поступления в клинику имели генерализованную (III-IV) стадию заболевания с наличием симптомов интоксикации в 29 (21%) случаях и биологической активности в 87 (64%) случаях. Только у 46 (34%) больных лимфома была распознана в локальных (I-II) стадиях. Среди причин позднего поступления больных в специализированное отделение можно назвать низкую специфичность начальных симптомов болезни, трудность диагностики основных локализаций в ранней стадии, выраженную агрессивность опухолевого роста и недостаточную онкологическую настороженность населения и врачей общей практики.
Все больные получали антрациклинсодержащие режимы химиотерапии. Полная программа лечения (6-8 курсов) проведена 65% больным, среднее количество курсов на одного человека составило 5. Стандартную схему СНОР (циклофосфан, адриамицин, винкристин, преднизолон) получили 67,7% пациентов.
При анализе результатов лечения была использована современная классификация оценки эффективности терапии при НХЛ, разработанная Международной Рабочей группой (B. Cheson, 1999). Согласно этой классификации, в результате индукционной терапии полная ремиссия была достигнута в 85 (62%) случаях, частичная ремиссия получена у 23 (17%) больных.
Нами выявлена высоко значимая обратная зависимость распространенности заболевания и частоты полных ремиссий, которая постепенно уменьшается со 100% при I стадии до 47% при IV стадии НХЛ (р=0,001). Частичная ремиссия также оказалась в прямой зависимости от стадии лимфомы, и ее частота увеличивалась от 0% при I стадии до 24% при IV.
Из 85 пациентов, достигших полной ремиссии, более чем у 1/3 больных (37,6%) отмечено развитие рецидива лимфомы в различные сроки. Наибольшая частота появления рецидива (26 случаев — 81%) зарегистрирована в течение первого года наблюдения, причем в подавляющем большинстве случаев (21 случай — 80%) в первые 6 мес. Всего у 5 (13,5%) больных рецидив был выявлен позже 24 мес. наблюдения, и только в 1 (2,7%) случае рецидив возник в течение второго года заболевания.
Среди 23 больных с частичной ремиссией у 5 (22%) пациентов выявлены рецидивы НХЛ, причем, во всех случаях – в первые 6 мес. наблюдения.
Из 37 пациентов с возвратом заболевания лишь 4 (11%) ответили на II линию лечения: в 2 случаях ранних рецидивов проводилась химиотерапия по схеме ВАЕМ, а у 2 пациентов с поздними рецидивами было повторено предыдущее лечение: в одном случае — по схеме СНОР, в другом – CIOP.
Прогрессирование заболевания на фоне лечения отмечено у 27 (20%) больных: в 4 (11%) случаях в группе со II стадией НХЛ против 23 (29%) больных с IV стадией лимфомы; разница статистически значима (р=0,005). Ни один из этих пациентов не ответил на последующие виды лечения. У 17 из 27 (63%) больных было зарегистрировано раннее прогрессирование заболевания (после 1-3 курсов химиотерапии). Следует отметить, что подавляющее большинство этих пациентов (15-88%) имели IV стадию заболевания и относились к группам неблагоприятного прогноза (3-4 фактора по МПИ).
Нами определена эффективность комбинированной химиолучевой терапии при I-II стадиях ДККЛ. В 10 (43,5%) случаях при I-II стадиях НХЛ больные получали лучевую терапию в составе комбинированного лечения после 3 курсов химиотерапии с последующим проведением еще 3 курсов (“sandwich”). После полной программы лечения (6-8 курсов химиотерапии) лучевую терапию получили 13 (56,5%) пациентов.
Рецидивы у больных с I и II стадиями ДККЛ после химиолучевого лечения были выявлены в 11 (48%) случаях, причем в 9 (82%) из них лучевая терапия проводилась в составе “sandwich”, и лишь в 2 (18%) случаях – после полной программы химиотерапии. Таким образом, в подавляющем большинстве случаев (в 9 из 11) рецидивы лимфомы отмечены у больных, которым лучевая терапия проводилась после первых 3 курсов химиотерапии в составе “sandwich”.
Из 136 больных, поступивших в отделение химиотерапии гемобластозов ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России за период с января 1995 г. по январь 2003 г., к моменту окончания исследования (январь 2004 г.) 73 (53,7%) пациента умерли от прогрессирования ДККЛ и/или от осложнений химиотерапии; 51 (37,5%) больной находился в состоянии полной ремиссии в течение 1 и более лет, остальные 12 (8,8%) пациентов продолжали лечение. Медиана наблюдения составила 18,5 мес.
Анализ выживаемости показывает, что более половины больных (41 человек – 56,2% от всех умерших) умерли в течение первого года заболевания. В последующем смертность снижалась: в течение второго года умерли 20 (27,4%) больных, а в течение последующих 3 лет – 12 (16,4% от всех умерших пациентов) больных. Медиана общей выживаемости составила 16 мес.
В соответствии с литературными данными общепринятым сроком оценки прогноза агрессивных НХЛ является 2-летняя выживаемость. С этой целью проведено сравнение основных клинико-лабораторных параметров, характеризующих течение диффузной крупноклеточной В-клеточной лимфомы, в двух группах: в первую вошли пациенты, пережившие 2-летний период, во вторую – больные, умершие в течение 2 лет после начала лечения.
Исходя из данных однофакторного анализа, более 1/3 пациентов в каждой группе были старше 60 лет, причем большее количество пожилых пациентов были в группе умерших (43% против 36% больных в группе с благоприятным исходом). Однако статистические различия выживаемости по всем возрастным группам не достигли статистической значимости (р>0,05). При анализе взаимосвязи возраста с другими клинико-лабораторными характеристиками диффузной В-крупноклеточной лимфомы выявлено несколько закономерностей: высокий уровень ЛДГ сыворотки крови (>750 Ед./л) достоверно чаще встречался у молодых пациентов (р=0,042), с высокой степенью статистической значимости у пациентов моложе 60 лет чаще наблюдалось поражение средостения и легких (р<0,005).
Прослежена четкая зависимость выживаемости от стадии лимфомы, установленной в момент диагностики заболевания согласно Анн-Арборской классификации. Если при I стадии 2-летняя выживаемость составила 89%, то во II-III – 63%, а в IV – 30%. Различия статистически значимы (p<0,005) (рис. 3).
Рис. 3. Влияние стадии заболевания на общую выживаемость больных ДККЛ.
Мы предположили, что влияние на прогноз лимфомы оказывает не только стадия заболевания, но и характер распространения опухолевого процесса к моменту начала специфической терапии. Проанализировано влияние на выживаемость 22 выявленных локализаций опухолевого поражения у больных ДККЛ в исследуемой группе. Результаты позволяют заключить, что из нодальных поражений лишь изменение внутрибрюшных и забрюшинных лимфатических узлов оказывает статистически значимое влияние на прогноз диффузной В-крупноклеточной лимфомы (р=0,004). Из экстранодальных проявлений достоверные различия в 2-летней выживаемости выявлены лишь при поражении костного мозга (р=0,047).
Высокоинформативным при однофакторном анализе и обладающим высоким диагностическим коэффициентом при многофакторном оказался признак, не упоминающийся в доступной нам отечественной и зарубежной литературе, – общее количество специфически пораженных зон. Отмечено четкое снижение 2-летней выживаемости по мере увеличения количества зон поражения. Если при наличии у пациентов менее 4 локализаций 2-летняя выживаемость составила 61,5%, то при выявлении более 7 специфически измененных зон этот показатель равнялся всего 8%; различия статистически значимы (р=0,001) (рис. 4).
1 группа — 1-3 зоны поражения; 2 группа — 4-6 зон поражения;
3 группа — >7 зон поражения.
Рис. 4. Влияние количества зон специфического поражения на общую выживаемость больных ДККЛ.
Анализ прогностической ценности симптомов интоксикации также выявил ее высокую значимость (р=0,003). Присоединение В-симптомов в 3 раза чаще отмечалось в группе больных с летальным исходом. При оценке тяжести общего состояния больных по шкале ECOG до начала специфического лечения отмечена статистически значимая корреляция IV степени ECOG с неблагоприятным исходом лимфомы. Так, среди 17 пациентов в крайне тяжелом состоянии 23% умерли и всего 6% пережили 2-летний срок (р=0,012). Проведен анализ выживаемости больных ДККЛ в зависимости от наличия или отсутствия большой опухолевой массы (“bulky”). Эта клиническая ситуация была выявлена в 74% случаях в группе с летальным исходом и в 54% среди выживших пациентов (р=0,025).
Прогностическая роль уровня гемоглобина обсуждается во многих работах, посвященных изучению НХЛ; мнения по этому вопросу весьма разноречивы. В нашем исследовании низкое ( 50 Ед./л зарегистрирован в 48% случаев в группе больных с летальным исходом против 20% выживших пациентов.
Помимо ЛДГ, уточнить прогноз течения диффузной В-крупноклеточной лимфомы можно с помощью определения содержания в сыворотке крови больного общего белка и альбуминов. Нами выявлено статистически значимое отрицательное влияние на 2-летнюю выживаемость снижения уровня общего белка
В исследовании было проанализировано влияние на выживаемость каждого в отдельности из 5 неблагоприятных факторов, вошедших в МПИ. Однако мы посчитали необходимым определить прогностическую значимость совокупности того или иного количества этих показателей согласно 4 группам риска раннего прогрессирования по МПИ. Так, среди выживших пациентов 40% были отнесены к группе низкого риска в сравнении с 10% в группе с летальным исходом (р=0,012). Отмечено высоко значимое (р=0,001) влияние на 2-летнюю выживаемость совокупности 4-5 факторов: среди выживших пациентов лишь 6% были отнесены к высокой степени риска против 42% в группе больных с летальным исходом (рис. 5).
Рис. 5. Влияние группы риска раннего прогрессирования по МПИ на общую выживаемость больных ДККЛ.
В особую группу прогностических факторов необходимо выделить непосредственные результаты I линии химиотерапии (достижение полной ремиссии, частичной ремиссии или прогрессирование), определяющие чувствительность опухоли к специфическому лечению. Так, в группе больных с благоприятным исходом полная ремиссия была достигнута в подавляющем большинстве случаев (94%), тогда как среди умерших пациентов полный эффект получен лишь у 28% больных (p<0,0001). Если в результате I линии химиотерапии получена частичная ремиссия, то имеет место обратная тенденция: 26% в группе с летальным исходом против 6% среди выживших пациентов (p=0,005). В случае прогрессирования заболевания во время лечения ни один больной не пережил 2-летний период (p<0,0001).
Таким образом, задачей индукционного лечения при ДККЛ является достижение полной ремиссии, а частичный эффект необходимо отнести к неудачам лечения.
С помощью многофакторного дисперсионного анализа выявлены факторы, статистически значимо влияющие на выживаемость (общую и бессобытийную):
-
1) МПИ, р=0,002, мощность=0,9;
2) стадия, р<0,0001, мощность=0,9;
3) уровень сывороточной ЛДГ, p=0,001, мощность=0,9;
4) уровень альбумина, p<0,0001, мощность=0,9;
5) общее количество зон поражения, p=0,007, мощность=0,9;
6) уровень общего белка, p=0,004, мощность=0,8;
7) наличие симптомов интоксикации, p=0,01, мощность=0,7;
8) поражение внутрибрюшных и забрюшинных лимфоузлов, р=0,02, мощность=0,6;
9) поражение легких, р=0,03, мощность=0,5;
10) поражение кольца Вальдейра, p=0,05, мощность=0,5;
11) поражение костного мозга, p=0,08, мощность=0,4;
Непосредственные результаты I линии химиотерапии:
12) полная ремиссия, p<0,0001, мощность=1;
13) прогрессирование, p<0,0001, мощность=0,9;
14) частичная ремиссия, p=0,005, мощность=0,8
Таким образом, тщательно собранный анамнез и клиническое обследование больного позволяют выделить критерии неблагоприятного прогноза. К ним относятся такие клинические факторы как возраст (старше 60 лет), симптомы интоксикации, локализация опухолевых очагов и их количество (более 7), наличие экстранодальных поражений, распространенная стадия заболевания, наличие большой опухолевой массы («bulky»), тяжесть общего состояния и непосредственные результаты I линии терапии, а также изменения лабораторных параметров (повышение уровня ЛДГ, анемия, гипопротеинемия и гипоальбуминемия).
Первичная В-крупноклеточная лимфома средостения
Первичная В-крупноклеточная лимфома средостения
Что нужно знать каждому врачу:
Первичная медиастинальная (тимическая) большая B-клеточная лимфома (PMBCL) была признана отдельным подтипом диффузной большой B-клеточной лимфомы (DLBCL) в Пересмотренной Европейско-американской классификации лимфомы в 1994 году, а недавно была включена во Всемирную организацию здравоохранения ( ВОЗ), основанная на уникальных клинических, патологических и генетических особенностях.
По определению, пациенты имеют новообразование в переднем средостении, и заболевание обычно возникает у молодых людей со средним возрастом примерно 35 лет и преобладанием женщин (в два раза больше женщин, чем мужчин).
Вы уверены, что у вашего пациента первичная В-крупноклеточная лимфома средостения? Что вы должны ожидать найти?
Пациенты поступают с передним, часто объемным новообразованием средостения и могут иметь сопутствующие респираторные симптомы. Синдром верхней полой вены (SVC) может проявляться отеком лица, одышкой, головной болью, вздутием шейных вен, а иногда и тромбозом.Пациенты, как правило, на момент постановки диагноза имеют объемные формы болезни I или II стадии и симптомы B (лихорадка, ночная потливость, потеря веса). Распространение внутригрудного отдела в легкие, грудную стенку, перикард и плевральные пространства является обычным явлением, однако внегрудное заболевание, включая поражение костного мозга, при клинических проявлениях встречается редко. Дальнейшее распространение на периферические лимфатические узлы происходит нечасто, хотя может происходить локальное распространение на надключичные узлы. При рецидиве могут быть задействованы необычные экстранодальные участки, такие как печень, почки и центральная нервная система.
ОпухолиPMBCL имеют диффузный характер роста крупных клеток с прозрачной цитоплазмой, и это обычно связано с фиброзом, который имеет тенденцию разделять опухоль на компартментализацию.
Следующие иммунофенотипические маркеры являются типично положительными: CD45 (общий лейкоцитарный антиген) и B-клеточные маркеры CD19, CD20, CD22 и PAX5. Однако, в отличие от других В-клеточных лимфом, у них может отсутствовать поверхностный или цитоплазматический иммуноглобулин (Ig), несмотря на экспрессию корецептора Ig, CD79a. CD30 присутствует часто, но обычно слаб и неоднороден по сравнению с классической лимфомой Ходжкина (CHL).Однако CD15 отсутствует.
Большинство случаев являются CD10-отрицательными, но имеют позитивный фенотип множественной миеломы-1 / регуляторного фактора интерферона-4 (MUM1 / IRF4) с вариабельной экспрессией B-клеточной лимфомы 6 (BCL6). Опухолевые клетки являются CD21-отрицательными, но могут быть CD23-положительными в 80% случаев, что согласуется с возможным образованием B-клеток тимуса. Экспрессия антигена MAL, компонента липидного растра, является еще одной уникальной характеристикой PMBCL, не обнаруженной в других DLBCL. Сообщалось об отсутствии молекул HLA класса I и / или класса II.
Таким образом, диагноз должен основываться на типичной клинической картине в дополнение к отличительным клинико-патологическим признакам.
Остерегайтесь других состояний, которые могут имитировать первичную крупноклеточную В-клеточную лимфому средостения:
PMBCL может имитировать карциному или тимому из-за фиброза. Видны многодольчатые ядра, которые могут напоминать клетки Ходжкина Рида-Штернберга (HRS). Диагностика может быть сложной задачей, если биопсия небольшого размера и при наличии склероза, некроза и / или артефактов разрушения клеток.Могут наблюдаться остатки эпителиальных структур тимуса, особенно на больших биоптатах или хирургических образцах, которые часто лучше выделяются с помощью окрашивания цитокератином. Тонкоигольный аспират никогда не подходит для диагностики, поскольку для точности диагностики важны и морфология, и иммунофенотипирование.
PMBCL также трудно отличить от классической лимфомы Ходжкина (NSCHL) с узловым склерозом. Обе патологии возникают у молодых людей, и поражение переднего средостения является обычным явлением при NSCHL.Недавние данные профилирования экспрессии генов предполагают, что существует также молекулярное перекрытие между NSCHL и PMBCL. Кроме того, в классификации ВОЗ лимфомы серой зоны средостения (MGZL) появилась новая сущность, которая сочетает в себе морфологические и фенотипические особенности как NSCHL, так и PMBCL и может быть диагностической проблемой для патологов.
Эти «лимфомы серой зоны» определены в ВОЗ как B-клеточная лимфома, неклассифицируемая, с признаками, промежуточными между диффузной большой B-клеточной лимфомой и классической лимфомой Ходжкина, и часто встречается у молодых мужчин (возраст от 20 до 40 лет) с передним средостением. участие.Это различие важно, поскольку прогноз MZGL хуже.
MGZL обычно состоят из сливающихся пластинчатых разрастаний плеоморфных опухолевых клеток в диффузно фиброзной строме. Клетки обычно больше и более плеоморфны, чем в PMBCL. Различные области опухоли могут иметь различный цитологический вид: некоторые области больше напоминают CHL, а другие — DLBCL. Обычно наблюдается редкий воспалительный инфильтрат. Иммунофенотип имеет характеристики CHL и PMBCL.Клетки обычно экспрессируют CD45, и, в отличие от CHL, программа B-клеток сохраняется, но маркеры типа Ходжкина, такие как CD30, CD15, экспрессируются аберрантно. Маркеры В-клеток CD20 и CD79a часто бывают положительными, но поверхностный Ig отсутствует. Часто встречается MAL, поддерживающий ссылку на PMBCL.
Еще одним фактором, который следует учитывать при дифференциальной диагностике, является «классический» DLBCL, связанный со вторичной инвазией средостения, которая, скорее всего, происходит из средостенных или прикорневых лимфатических узлов. В отличие от PMBCL, внегрудная болезнь встречается гораздо чаще, а склероз опухоли отсутствует.Кроме того, поражение средостения не является заметным очагом заболевания. Исследования профилей экспрессии генов также показали, что PMBCL имеет отличный профиль по сравнению с DLBCL с рядом уникально экспрессируемых генов. PMBCL также характеризуются наличием как фактора 1, связанного с TNF-рецептором (TRAF1), так и ядерного c-REL, которые, как было показано, являются высокоспецифичными для диагностики PMBCL по сравнению с другими DLBCL.
Какие люди наиболее подвержены риску развития первичной крупноклеточной В-клеточной лимфомы средостения:
Причина PMBCL неизвестна, но чаще всего встречается у молодых взрослых женщин.
Вирус Эпштейна-Барра, который может присутствовать в опухолях CHL, не обнаружен в PMBCL.
Какие лабораторные исследования следует заказать для постановки диагноза и как интерпретировать результаты?
Патологическое обследование гематопатологом необходимо для диагностики PMBCL и для обеспечения адекватности биопсии. Хотя лабораторные параметры, такие как ЛДГ (лактатдегидрогеназа), используются для прогноза, не существует лабораторных тестов, которые могли бы диагностировать любую лимфому.
Аспират костного мозга и биопсия также должны быть выполнены для завершения стадирования, хотя они редко бывают положительными, и в этом случае следует пересмотреть диагноз.
Какие визуализационные исследования (если таковые имеются) будут полезны при постановке или исключении диагноза первичной крупноклеточной В-клеточной лимфомы средостения?
Компьютерная томография (КТ) от шеи до таза выполняется в PMBCL для определения стадии. По определению, средостение должно быть преобладающим очагом заболевания; внегрудная болезнь, если присутствует, должна быть минимальной.Пересмотренные критерии ответа для лимфомы подтверждают, что позитронно-эмиссионная томография фтордезоксиглюкозы (FDG-PET) должна использоваться в конце терапии для оценки ответа. Для полной интерпретации результатов сканирования ФДГ-ПЭТ после лечения в идеале также следует выполнить промежуточную ПЭТ-ФДГ. В отличие от компьютерной томографии, FDG-PET — это инструмент функциональной визуализации, который может различать жизнеспособную опухоль и некроз или фиброз в остаточной массе.
Если вы решите, что у пациента первичная В-крупноклеточная лимфома средостения, какие методы лечения вам следует немедленно начать?
PMBCL — это агрессивная лимфома, и после завершения исследований по диагностике и стадированию следует как можно скорее начать терапию.Если есть симптомы синдрома ВПВ (см. Выше), прием стероидов можно рассматривать как проводящуюся химиотерапию.
Следует избегать облучения, за возможным исключением одной или двух доз для облегчения тяжелых симптомов до химиотерапии, поскольку это может отсрочить окончательную лечебную терапию и повысить токсичность.
Более точные методы лечения?
Стандартной терапией при PMBCL считается R-CHOP (ритуксимаб / циклофосфамид / доксорубицин гидрохлорид / винкристин / преднизолон), хотя были некоторые споры о том, какая химиотерапия позвоночника лучше всего при PMBCL, особенно при пре-ритуксимабе. эпоха лечения.Некоторые ретроспективные исследования показали, что более интенсивные режимы дозирования, такие как MACOPB (метотрексат / цитарабин / циклофосфамид / онковин / преднизон / блеомицин) или VACOP-B (этопозид / LV / доксорубицин / циклофосфамид / винкристин / преднизон / блеомицинOP, могут быть более эффективными по сравнению с CHNO). (циклофосфамид, доксорубицин, винкристин, преднизон), но это не было проверено в рандомизированном исследовании.
Совсем недавно в нескольких исследованиях было показано, что добавление ритуксимаба к химиотерапии CHOP улучшает показатели излечения при DLBCL по сравнению с одним CHOP.Рандомизированное исследование, сравнивающее CHOP и R-CHOP, не проводилось в PMBCL из-за редкости заболевания. Таким образом, истинная ценность добавления ритуксимаба к CHOP при PMBCL неизвестна, однако вполне вероятно, что будет наблюдаться такая же величина преимущества, наблюдаемая при DLBCL, и это может свести на нет любое преимущество интенсивности дозы.
Эффект усиленных схем уже описан при сравнении CHOP с CHOEP (циклофосфамид, доксорубицин, винкристин, этопозид, преднизон) у молодых пациентов с агрессивной лимфомой с хорошим прогнозом, большинство из которых были DLBCL (неходжкинская лимфома-B1). [NHL-B1]).В эту эпоху пре-ритуксимаба пациенты, получавшие CHOEP, имели более высокую выживаемость без событий (EFS), чем только CHOP. Однако с добавлением ритуксимаба это преимущество больше не было очевидным, что позволяет предположить, что ритуксимаб может быть «уравнителем» схем лечения.
В исследовании MINT (исследование Mabthera International Trial Group) сравнивались шесть циклов схем CHOP-подобных (чаще всего CHOP-21 [48%] CHOEP [44%]) с ритуксимабом и без ритуксимаба у молодых пациентов хорошего риска, определенных как возраст 18 лет. до 60 лет, со скорректированным по возрасту международным прогностическим индексом 0 или 1 (факторы риска: стадия III / IV заболевания, повышенный уровень ЛДГ и функциональный статус более двух), и сообщалось о более высоком EFS и общей выживаемости (OS) у пациентов, получавших ритуксимаб.Результаты подгруппы пациентов с PMBCL, рандомизированных в этом исследовании (n = 87), аналогичным образом отметили улучшение 3-летнего EFS у пациентов, получавших ритуксимаб (78%, n = 44), по сравнению с пациентами, которые этого не делали (52%, n = 43), (p = 0,012), но ОС не различалась статистически (89% против 78%, p = 0,158), что может отражать небольшое количество пациентов в каждой группе лечения. Число пациентов было слишком маленьким, чтобы оценить дополнительную пользу этопозида при сравнении R-CHOEP с R-CHOP. Важно отметить, что при многомерном анализе лечение ритуксимабом и отсутствие массивного заболевания были предикторами благоприятного исхода.Лечение ритуксимабом также привело к значительному снижению частоты прогрессирования заболевания (2,5% против 24%, p = 0,006). В ретроспективном исследовании сообщалось об исходах 76 пациентов, получавших R-CHOP, и описывалось аналогичное 3-летнее отсутствие прогрессирования (СЗП) 81% и 3-летняя общая выживаемость 89%. В целом, опубликованные исследования предполагают, что примерно у 20% пациентов терапия первой линии с помощью R-CHOP неэффективна.
Роль лучевой терапии в PMBCL остается неясной. Основной проблемой при лечении PMBCL является оценка остаточной массы после химиотерапии и того, является ли она активной лимфомой.Существует слабая корреляция между размером остаточной массы на компьютерной томографии и риском рецидива, поскольку во многих случаях остаточная плотность может отражать фиброзную ткань, в отличие от активной лимфомы. Консолидативная лучевая терапия средостения часто проводится; однако неясно, влияет ли это на частоту рецидивов или излечение, и существует неотъемлемая проблема долгосрочной токсичности медиастинальной лучевой терапии, включая повышенный риск сердечно-сосудистых заболеваний и вторичных злокачественных новообразований, особенно с учетом молодого населения, подверженного риску.
Хотя некоторые исследования подтвердили, что лучевая терапия улучшает EFS, другие анализы продемонстрировали, что одна химиотерапия эффективна во многих случаях, предполагая, что лучевая терапия не является обязательной для всех пациентов. Анализ, оценивающий влияние на выживаемость без прогрессирования заболевания с политикой, рекомендующей рутинную лучевую терапию после первичной химиотерапии, не продемонстрировал положительного эффекта, однако были использованы другие режимы химиотерапии. Ретроспективный характер такого анализа, включая определение доли ответов, является проблематичным, а рандомизированные исследования, посвященные этому вопросу, отсутствуют.Необходима более точная идентификация пациентов, которым может помочь дополнительная лучевая терапия.
Согласно ретроспективному анализу MINT, примерно половина пациентов получали лучевую терапию в соответствии с руководящими принципами центра для лечения массивного заболевания (различные определения) или экстранодального поражения. Авторы отметили, что 30% достигли улучшения ответа от лучевой терапии, но неясно, действительно ли это преобразовало частичные ремиссии в полные, поскольку ПЭТ-сканирование не проводилось, и влияние не коррелировало с исходом.
Недавно подход с интенсивной дозой, использующий скорректированную дозу (DA) -EPOCH-R (этопозид, преднизон, винкристин, циклофосфамид, доксорубицин, ритуксимаб), показал отличные результаты в проспективном исследовании II фазы PMBCL и может устранить необходимость в лучевой терапии . В этом протоколе доксорубицин, винкристин и этопозид вводятся в течение 96 часов, исходя из предположения, что непрерывное воздействие лекарственного средства может усилить уничтожение клеток. Существует дополнительная фармакодинамическая коррекция дозирования этопозида, доксорубицина и циклофосфамида по 20% каждого для достижения надир нейтрофилов ниже 0.5. Результаты 26 пациентов, включая некоторых детей, получавших DA-EPOCH-R, сравнивались нерандомизированным образом с 18 пациентами PMBCL, получавшими DA-EPOCH и EFS (p = 0,038) и OS (p = 0,023). ) в пользу DA-EPOCH-R. Результаты были обновлены на встрече в Лугано в 2011 г. 44 пациентов, получавших DA-EPOCH-R и 3-летнюю EFS и OS 95% и 100%, соответственно. Только два пациента прошли лучевую терапию.
Эти обнадеживающие результаты ждут более зрелых данных. Неизвестно, представляют ли эти результаты истинное превосходство DA-EPOCH-R над R-CHOP или отбор пациентов.Кроме того, в ближайшем будущем будет завершено текущее исследование US Intergroup по сравнению R-CHOP и DA-EPOCH-R без лучевой терапии в DLBCL, включая PMBCL, и, надеюсь, прояснит роль DA-EPOCH-R у этих пациентов. В настоящее время разумно рассматривать R-CHOP с лучевой терапией средостения или без нее в качестве стандартного лечения PMBCL, аналогично современной практике DLBCL.
Международная группа экстранодальных исследований (IELSG) планирует оценить использование ПЭТ-сканирования для проведения лучевой терапии при PMBCL после комбинированной химиотерапии на основе ритуксимаба, содержащей доксорубицин (включая R-CHOP и DA-EPOCH-R).Если пациенты после химиотерапии являются отрицательными по результатам ПЭТ, пациенты будут рандомизированы для лучевой терапии или наблюдения.
Какие другие методы лечения помогают уменьшить осложнения?
НЕТ
Что вы должны сказать пациенту и его семье о прогнозе?
В целом показатель излечения PMBCL отличный, и в ретроспективном исследовании MINT и Греции примерно 80% пациентов излечиваются с помощью первой линии химиотерапии R-CHOP. Эти результаты также согласуются с результатами другого исследования, оценивающего исходы у пациентов, получавших R-VACOPB (ритуксимаб / этопозид / лейковорин / доксорубицин / циклофосфамид / винкристин / преднизон / блеомицин) или R-CHOP, у которых 5 лет не наблюдалось. выживаемость (ВБП) составила 81%.Кроме того, в отличие от DLBCL, поздние рецидивы встречаются редко, а плато на кривой выживаемости превышает 2 года. В редких случаях возможны рецидивы со стороны центральной нервной системы, обычно паренхиматозные, и неизвестно, снизило ли рутинное применение ритуксимаба этот риск.
Международный прогностический индекс (IPI), который включает возраст (старше 60 лет), повышенный уровень ЛДГ, продвинутую стадию (III или IV), статус работоспособности (более двух) и количество экстранодальных участков, был первоначально разработан при диффузной крупноклеточной лимфоме, до распознавания PMBCL.Таким образом, хотя в этот анализ могли быть включены случаи PMBCL, они не рассматривались как отдельная группа. Последующие исследования, оценивающие IPI или aaIPI (с поправкой на возраст), не соответствовали PMBCL. Это может частично отражать различия между исследованиями, в которых пациенту назначается стадия IV или стадия 2E, если задействовано несколько, но смежных экстранодальных участков.
В нескольких исследованиях, в которых индекс оказался полезным, был применен IPI, предполагающий, что плохой прогноз в первую очередь определяется возрастом.Даже если используется скорректированный по возрасту IPI, который исключает количество экстранодальных участков как фактор риска, у большинства пациентов будет повышенный уровень ЛДГ, что опять же снижает его дискриминирующую способность. Другие факторы в отдельных исследованиях, которые, как было установлено, имеют прогностическое значение, включают плевральный и / или перикардиальный выпот, а также плохую работоспособность.
Сценарии «Что, если».
Пациент с синдромом верхней полой вены
Если у пациента есть признаки и симптомы синдрома ВПВ, необходимо срочно организовать лечение.
В идеале биопсия средостения должна быть организована до начала какой-либо терапии, однако, если это небезопасно, можно начать прием стероидов, но биопсию следует организовать быстро, поскольку диагностическая ценность будет снижена. , из-за высокой чувствительности лимфомы к стероидам. Кроме того, у пациентов, ожидающих подтверждения биопсии, которые не реагируют должным образом на стероиды, можно использовать несколько доз лучевой терапии до начала окончательной химиотерапии.
Патофизиология
Предполагаемая клетка происхождения PMBCL — медуллярная тимуса, астероидная В-клетка; однако механизм возникновения болезни неизвестен.Молекулярные исследования показали отличительные хромосомные приросты, в том числе 9p, что в некоторых случаях коррелирует с амплификацией киназы Janus 2 (JAK2). Интересно, что мутации или делеции были обнаружены в 45% гена SOCS-1 (супрессор передачи сигналов цитокинов), что связано с повышенной активностью JAK2. Мутации / делеции SOCS1 также были обнаружены в 40% CHL, подтверждая, что этот онкогенный путь может быть важным при обоих заболеваниях.
Недавно было обнаружено, что разрывы CIITA (главный регулятор главного комплекса гистосовместимости) происходят у 38% пациентов с PMBCL и связаны с исходом у пациентов, получавших CHOP (как).Подавление поверхностного HLA класса II и сверхэкспрессия PD-1 (запрограммированная гибель клеток) наблюдались в слияниях генов CIITA, что повышает вероятность того, что реаранжировка приводит к ускользанию от опухолевых клеток. Точно так же разрывы CIITA также были обнаружены в 15% CHL.
В целом, вышеприведенные наблюдения подтверждают, что PMBCL может быть патогенетически связана с классической лимфомой Ходжкина (cHL). Доказательства перекрывающейся взаимосвязи дополнительно подтверждаются исследованиями профилей экспрессии генов, которые продемонстрировали, что молекулярная сигнатура PMBCL не только отличается от таковой DLBCL, но также имеет поразительное сходство с профилем экспрессии клеточных линий HRS.Сигнатура характеризуется высокой экспрессией генов, участвующих в цитокине и интерлейкине 4/13. Костимулирующие молекулы семейства B7 (CD80, CD86 и PDL-2 (лиганд 1 запрограммированной гибели клеток) были высоко экспрессированы в PMBCL и очевидны в клетках HRS.
И PMBCL, и cHL проявляют склероз, что подчеркивает важность внеклеточного матрикса. В соответствии с этим PMBCL продемонстрировал высокие уровни экспрессии молекул адгезии и компонентов внеклеточного матрикса.
Кроме того, как описано, лимфомы серой зоны (GZL) с частично совпадающими характеристиками CHL и PMBCL признаны ВОЗ как отдельные образования.Кроме того, хорошо описаны комбинированные (CHL и PMBCL в одном образце опухоли) и последовательные лимфомы (диагностированные с PMBCL и рецидив с CHL или наоборот), что подчеркивает необходимость повторной биопсии в случае рецидива заболевания.
Какие другие клинические проявления могут помочь мне диагностировать первичную В-крупноклеточную лимфому средостения?
Важные вопросы по истории
Респираторные симптомы: кашель, одышка, боль в груди, отек лица
Системные симптомы: симптомы B (лихорадка, ночная потливость, потеря веса (более 10% массы тела), утомляемость
Зуд (редко)
Шишки: надключичная лимфаденопатия, новообразование грудной клетки
Важные или необычные признаки при физикальном осмотре
Расширенные вены на шее и грудной стенке
Надключичная / шейная лимфаденопатия
Масса грудной клетки
Маневр Пембертона: происходит при сдавлении верхней полой вены массой средостения
— Развитие покраснения лица, вздутие поверхностных вен шеи и головы, инспираторный стридор и повышение JVP (яремного венозного давления) при поднятии рук пациента над головой.
Какие еще дополнительные лабораторные исследования можно заказать?
ЛДГ
Какие доказательства?
Зинзани, П.Л., Мартелли, М., Бертини, М., Джанни, А.М., Девацци, Л., Федерико, М. «Стратегии индукционной химиотерапии первичной крупноклеточной В-клеточной лимфомы средостения со склерозом: ретроспективное многонациональное исследование с участием 426 ранее не леченных пациентов» . Haematologica. т. 87. 2002. С. 1258–64. [Ретроспективный анализ режимов интенсивной дозы по сравнению с CHOP при PMBCL.]
Rieger, M, Osterborg, A, Pettengell, R, White, D, Gill, D, Walewski, J. «Первичная B-клеточная лимфома средостения, леченная с помощью CHOP-подобной химиотерапии с ритуксимабом или без него: результаты Международной испытательной группы Mabthera изучать». Ann Oncol .. vol. 22. Март 2011 г., стр. 664–70. [Ретроспективный анализ пациентов с PMBCL, включенных в немецкие исследования агрессивной лимфомы, предназначенные для оценки воздействия ритуксимаба.]
Savage, KJ, Al-Rajhi, N, Voss, N, Paltiel, C, Klasa, R, Gascoyne, RD.«Благоприятный исход первичной В-крупноклеточной лимфомы средостения в одном учреждении: опыт Британской Колумбии». Ann Oncol .. vol. 17. 2006. С. 123-30. [Ретроспективное исследование пациентов с PMBCL и сравнение результатов с использованием интенсивных дозированных режимов по сравнению с CHOP.]
Данливи, К., Питталуга, С., Яник, Дж., Грант, Н., Стейнберг, С., Штаудт, Л. «Исход первичной крупноклеточной B-клеточной лимфомы средостения (PMBL) значительно улучшается при добавлении ритуксимаба с корректированной дозой (DA ) -EPOCH и преодолевает потребность в радиации ». Кровь .. об. 106. 2005. pp. 929a [Исследование фазы II DA-EPOCH-R в PMBCL.]
Vassilakopoulos, TP, Pangalis, GA, Katsigiannis, A, Papageorgeiou, SG, Constantinou, N, Terpos, E. «Ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон с лучевой терапией или без нее при первичной крупноклеточной B-лимфоме средостения: новый стандарт ухода ». Онколог. т. 17. 2012. С. 239–49. [Большое ретроспективное исследование R-CHOP в PMBCL.]
Savage, KJ, Monti, S, Kutok, JL, Cattoretti, G, Neuberg, D, De Leval, L.«Молекулярная сигнатура крупной B-клеточной лимфомы средостения отличается от других диффузных больших B-клеточных лимфом и имеет общие черты с классической лимфомой Ходжкина». Кровь. т. 102. С. 3871-9. [Исследование, сравнивающее сигнатуру профилирования экспрессии генов PMBCL и DLBCL с разработкой молекулярной диагностики PMBCL на основе экспрессии генов. Отдельное сравнение с клеточными линиями, полученными из CHL, подчеркивает сходство между PMBCL и CHL.]
Розенвальд, А, Райт, Дж, Лерой, К., Ю, Х, Голлар, П., Гаскойн, Род.«Молекулярная диагностика первичной В-клеточной лимфомы средостения выявляет клинически благоприятную подгруппу диффузной В-клеточной лимфомы большого размера, связанной с лимфомой Ходжкина». J Exp Med. т. 198. 2003. С. 851-62. [Исследование, сравнивающее сигнатуру гена PMBCL и DLBCL, а также с первичными образцами классической лимфомы Ходжкина. Эти исследования дополняют друг друга и предполагают частичное патогенетическое совпадение между PMBCL и CHL.]
Copyright © 2017, 2013 ООО «Поддержка принятия решений в медицине».Все права защищены.
Ни один спонсор или рекламодатель не участвовал, не одобрял и не платил за контент, предоставляемый Decision Support in Medicine LLC. Лицензионный контент является собственностью DSM и защищен авторским правом.
изображений этапов PMBCL и лечения
ИЗОБРАЖЕНИЙ ПРЕДОСТАВЛЕНЫ:
1) Научный источник
2) Медицинские изображения Getty Images
3) Научный источник
4) Getty Images
5) Getty Images
6) Getty Images
7) Getty Images
8) Getty Images
9) Научный источник
10) Getty Images
11) Научный источник
ИСТОЧНИКОВ:
Американское онкологическое общество: «Лечение В-клеточной неходжкинской лимфомы.”
Поддержка рака Macmillan: «Первичная В-клеточная лимфома средостения (PMBCL)».
Текущий гематологический отчет о злокачественных новообразованиях : «Первичная крупноклеточная В-клеточная лимфома средостения».
Клинические новости ASH: «Кратко о том, как я лечу: первичная В-клеточная лимфома средостения».
UpToDate: «Обучение пациентов: диффузная В-клеточная лимфома у взрослых (помимо основ)».
British Journal of Hematology : «R-CHOP по сравнению с дозированным R-EPOCH в первичном лечении первичной средостенной B-клеточной лимфомы: многоцентровый анализ.”
Институт рака Дана-Фарбер: «Первичная В-клеточная лимфома средостения».
Medscape: «Лимфома средостения».
Клиническая лимфома и миелома : «Ритуксимаб в сочетании с MACOP-B или VACOP-B и лучевой терапией при первичной крупноклеточной B-лимфоме средостения: ретроспективное исследование».
BMC Cancer : «Лечение первичной В-крупноклеточной лимфомы средостения: моноцентрический опыт двух десятилетий с 98 пациентами.”
Haematologica : «Окончание лечения и серийная ПЭТ-визуализация при первичной В-клеточной лимфоме средостения после коррекции дозы EPOCH-R: изменение парадигмы в принятии клинических решений».
FDA.gov: «FDA одобряет пембролизумаб для лечения рецидивирующего или рефрактерного PMBCL».
Трансплантация костного мозга : «Трансплантация аутологичных стволовых клеток при первичной В-клеточной лимфоме средостения: отдаленные результаты и роль лучевой терапии после трансплантации.Отчет Европейского общества трансплантации крови и костного мозга ».
Национальный институт рака: «Словарь терминов по раку NCI: CAR-T-клеточная терапия».
Детская первичная B-клеточная лимфома средостения (PMBL) — Институт рака Дана-Фарбер
Первичная B-клеточная лимфома средостения (PMBL) — это рак зрелых B-лимфоцитов. Это форма неходжкинской лимфомы, типа рака, который возникает в клетках иммунной системы, называемых лимфоцитами.
- Первичная В-клеточная лимфома средостения является редким типом неходжкинской лимфомы и чаще всего встречается у подростков и молодых людей.
- PMBL обычно начинается в области вилочковой железы, в части верхней части грудной клетки, называемой средостением.
- Под микроскопом PMBL похож на диффузную В-клеточную лимфому и лимфому Ходжкина.
- Первичная B-клеточная лимфома средостения часто проявляется симптомами кашля, одышки или отека головы и шеи из-за давления опухоли на трахею и крупные вены над сердцем.
- Современные методы лечения позволяют излечить многих детей с первичной В-клеточной лимфомой средостения.
Узнайте больше о неходжкинской лимфоме, включая причины и симптомы у детей и подростков.
Как мы лечим первичную В-клеточную лимфому средостения у детей
Дети и подростки с первичной В-клеточной лимфомой средостения проходят лечение в Детском онкологическом центре и болезнях крови Дана-Фарбер / Бостон в рамках программы детской лимфомы нашего Детского гематологического центра злокачественных новообразований.Dana-Farber / Boston Children’s предлагает всемирно известную помощь детям с онкологическими заболеваниями крови и иммунной системы.
Dana-Farber / Boston Children’s также предлагает широкий спектр услуг и программ поддержки для педиатрических пациентов и их семей во время и после лечения рака.
Первичная В-клеточная лимфома средостения содержит белок, называемый CD20, на поверхности раковых клеток. Ритуксимаб — это иммунотерапевтический препарат, нацеленный на белок CD20. Современные методы лечения PMBL включают ритуксимаб, а также химиотерапию.Традиционно лучевая терапия была частью лечения этого заболевания, но с добавлением ритуксимаба лучевая терапия может больше не понадобиться.
Наиболее часто применяемая схема лечения первичной В-клеточной лимфомы средостения как у подростков, так и у взрослых называется EPOCH-R с коррекцией дозы. Этот режим химиотерапии вводится в виде 96-часовой непрерывной инфузии в внутривенную линию один раз в три недели в течение шести курсов. Дозы химиотерапевтических препаратов корректируются на основании анализов крови, которые проводятся между курсами лечения.В это лечение входят этопозид, преднизон, винкристин, циклофосфамид, доксорубицин и ритуксимаб. Препарат под названием филграстим используется для быстрого восстановления лейкоцитов после каждого курса химиотерапии.
Лечение рецидивирующей или рефрактерной первичной В-клеточной лимфомы средостения
Для детской первичной B-клеточной лимфомы средостения, которая не отвечает на начальное лечение (рефрактерная) или которая возвращается после лечения (рецидив), рекомендации по лечению такие же, как и для других рецидивирующих или рефрактерных зрелых B-клеточных лимфом, таких как лимфома Беркитта. .
Узнайте о лечении детской лимфомы Беркитта.
Если лучевая терапия не была частью начального лечения, может быть рекомендовано лечение рефрактерной первичной B-клеточной лимфомы средостения.
Долгосрочное наблюдение за детьми с первичной В-клеточной лимфомой средостения
Рак в детстве когда-то считался неизменно смертельным, но сегодня большинство детей, у которых диагностирован рак, могут долго выживать.
Наряду с выживанием возникают многочисленные сложные проблемы: долгосрочные эффекты лечения и риск повторного рака, а также социальные и психологические проблемы.По этим причинам лица, пережившие первичную В-клеточную лимфому средостения у детей, должны получать регулярное последующее наблюдение и уход.
С 1993 года врачи, медсестры, исследователи и психологи, участвующие в наших программах по борьбе с раком у детей в клинике качества жизни Дэвида Б. Перини-младшего в Дана-Фарбер, помогли тысячам детей, переживших рак, проходивших лечение в Детском центре Дана-Фарбер / Бостон. и в других больницах Новой Англии и других стран, чтобы справиться с этими долгосрочными проблемами выживания при раке.
Бригада по лечению первичной В-клеточной лимфомы средостения у детей
Пациенты Dana-Farber / Boston-Children’s имеют доступ к самому широкому набору педиатрических гематологических и онкологических знаний. Широта нашего опыта позволяет нам собрать команду специалистов для удовлетворения конкретных потребностей вашего ребенка.
Посмотрите полный список специалистов в нашем Детском гематологическом онкологическом центре.
Что такое первичная В-клеточная лимфома средостения (PMBCL)?
Лисенко К., Дингельдейн Г., Кремер М., Кригсманн М., Хо А.Д., Ригер М. и др.Добавление ритуксимаба к CHOP-подобной химиотерапии при лечении первой линии первичной B-клеточной лимфомы средостения. BMC Рак . 2017 22 мая. 17 (1): 359. [Медлайн]. [Полный текст].
Майлз Р.Р., Манки С.К., Зайлер С.Э., третий, Смит Л.Б., Теруя-Фельдштейн Дж., Си Э.Д. и др. Экспрессия Grb2 отличает классические лимфомы Ходжкина от первичных средостенных B-клеточных лимфом и других диффузных больших B-клеточных лимфом. Хум Патол . 2009 декабрь 40 (12): 1731-7. [Медлайн].
Feuerhake F, Kutok JL, Monti S, Chen W., LaCasce AS, Cattoretti G, et al. Активность, функция и сигнатуры гена-мишени NFkappaB в подтипах первичной крупноклеточной B-клеточной лимфомы средостения и диффузной большой B-клеточной лимфомы. Кровь . 2005 15 августа. 106 (4): 1392-9. [Медлайн].
Savage KJ, Monti S, Kutok JL, Cattoretti G, Neuberg D, De Leval L, et al. Молекулярная сигнатура крупной B-клеточной лимфомы средостения отличается от таковой других диффузных больших B-клеточных лимфом и имеет общие черты с классической лимфомой Ходжкина. Кровь . 1 декабря 2003 г. 102 (12): 3871-9. [Медлайн].
Savage KJ, Al-Rajhi N, Voss N, Paltiel C, Klasa R, Gascoyne RD. Благоприятный исход первичной В-крупноклеточной лимфомы средостения в одном учреждении: опыт Британской Колумбии. Энн Онкол . 2006 17 января (1): 123-30. [Медлайн].
Rieger M, Osterborg A, Pettengell R, White D, Gill D, Walewski J. Первичная В-клеточная лимфома средостения, леченная с помощью CHOP-подобной химиотерапии с ритуксимабом или без него: результаты исследования Международной испытательной группы Mabthera. Энн Онкол . 2011 марта 22 (3): 664-70. [Медлайн].
Дубаши Б., Кириак С., Тенали С.Г. Клинико-патологический анализ и исходы первичных злокачественных новообразований средостения — отчет о 91 случае из одного института. Энн Торак Мед . 2009 июл.4 (3): 140-2. [Медлайн]. [Полный текст].
van Besien K, Kelta M, Bahaguna P. Первичная B-клеточная лимфома средостения: обзор патологии и лечения. Дж. Клин Онкол .2001 15 марта. 19 (6): 1855-64. [Медлайн].
Steidl C, Гаскойн РД. Молекулярный патогенез первичной В-крупноклеточной лимфомы средостения. Кровь . 2011 8 сентября. 118 (10): 2659-69. [Медлайн].
Bea S, Zettl A, Wright G, Salaverria I, Jehn P, Moreno V. Подгруппы диффузных больших B-клеточных лимфом имеют различные генетические профили, которые влияют на биологию опухоли и улучшают прогноз выживаемости на основе экспрессии генов. Кровь .2005 г. 1. 106 (9): 3183-90. [Медлайн].
Weniger MA, Gesk S, Ehrlich S, Martin-Subero JI, Dyer MJ, Siebert R. Прирост REL при первичной средостенной B-клеточной лимфоме совпадает с накоплением белка REL в ядрах. Гены Хромосомы Рак . 2007 апр. 46 (4): 406-15. [Медлайн].
Song HY, Rothe M, Goeddel DV. Белок цинкового пальца A20, индуцируемый фактором некроза опухоли, взаимодействует с TRAF1 / TRAF2 и ингибирует активацию NF-kappaB. Proc Natl Acad Sci U S A . 1996, 25 июня. 93 (13): 6721-5. [Медлайн].
Хонма К., Цузуки С., Накагава М., Тагава Х., Накамура С., Моришима Ю. и др. TNFAIP3 / A20 функционирует как новый ген-супрессор опухолей в нескольких подтипах неходжкинских лимфом. Кровь . 2009 17 сентября. 114 (12): 2467-75. [Медлайн].
Като М., Санада М., Като И., Сато Ю., Такита Дж., Такеучи К. Частая инактивация А20 при В-клеточных лимфомах. Природа .4 июня 2009 г. 459 (7247): 712-6. [Медлайн].
Дэйви Г.М., Хит В.Р., Старр Р. SOCS1: мощный и многогранный регулятор цитокинов и клеточно-опосредованного воспаления. Тканевые антигены . 2006 Январь 67 (1): 1-9. [Медлайн].
Mottok A, Renné C, Seifert M, Oppermann E, Bechstein W, Hansmann ML. Инактивирующие мутации SOCS1 вызываются аберрантной соматической гипермутацией и ограничиваются подмножеством субъектов В-клеточной лимфомы. Кровь .2009, 12 ноября. 114 (20): 4503-6. [Медлайн].
Mottok A, Woolcock B, Chan FC, Tong KM, Chong L, Farinha P и др. Геномные изменения при CIITA часты при первичной крупноклеточной B-лимфоме средостения и связаны со снижением экспрессии MHC класса II. Cell Rep . 2015 17 ноября. 13 (7): 1418-31. [Медлайн].
Lazzarino M, Orlandi E, Paulli M, Sträter J, Klersy C., Gianelli U, et al. Исход лечения и прогностические факторы первичной В-клеточной лимфомы средостения (тимуса): многоцентровое исследование с участием 106 пациентов. Дж. Клин Онкол . 1997 Apr, 15 (4): 1646-53. [Медлайн].
Traverse-Glehen A, Pittaluga S, Gaulard P, Sorbara L, Alonso MA, Raffeld M, et al. Лимфома средостения в серой зоне: недостающее звено между классической лимфомой Ходжкина и большой B-клеточной лимфомой средостения. Am J Surg Pathol . 2005 29 ноября (11): 1411-21. [Медлайн].
[Рекомендации] Национальная комплексная онкологическая сеть. Руководство NCCN по клинической практике в онкологии: В-клеточные лимфомы.NCCN.org. Доступно на https://www.nccn.org/professionals/physician_gls/pdf/b-cell.pdf. Версия 4.2019 — 18 июня 2019 г .; Дата обращения: 14 сентября 2019 г.
Сонг Х.Н., Ким С.Дж., Ко Ю.Х., Ким В.С. Лимфома средостения в серой зоне с характеристиками, промежуточными между классической лимфомой Ходжкина и первичной B-клеточной лимфомой средостения. Acta Haematol . 2016. 136 (3): 186-90. [Медлайн].
Sun W, Song K, Zervos M, Pass H, Cangiarella J, Bizekis C и др.Диагностическая ценность эндобронхиальной биопсии под контролем УЗИ при раке легкого и аденопатии средостения. Диагностика Цитопатол . 2010 май. 38 (5): 337-42. [Медлайн].
Джексон М.В., Рустховен К.Г., Джонс Б.Л., Камдар М., Рабинович Р. Улучшение выживаемости с помощью лучевой терапии при первичной B-клеточной лимфоме средостения стадии I-II: наблюдение, эпидемиология и анализ базы данных конечных результатов. Int J Radiat Oncol Biol Phys . 2015 25 сентября [Medline].
Zinzani PL, Stefoni V, Finolezzi E, Brusamolino E, Cabras MG, Chiappella A, et al. Ритуксимаб в сочетании с MACOP-B или VACOP-B и лучевой терапией при первичной крупноклеточной B-лимфоме средостения: ретроспективное исследование. Клин Лимфома Миелома . 2009 Октябрь 9 (5): 381-5. [Медлайн].
Savage KJ, Al-Rajhi N, Voss N, Paltiel C, Klasa R, Gascoyne RD и др. Благоприятный исход первичной В-крупноклеточной лимфомы средостения в одном учреждении: опыт Британской Колумбии. Энн Онкол . 2006 17 января (1): 123-30. [Медлайн].
Зинзани П.Л., Мартелли М., Маганьоли М., Пескармона Е., Скарамуччи Л., Паломби Ф. и др. Лечение и клиническое ведение первичной крупноклеточной B-клеточной лимфомы средостения со склерозом: режим MACOP-B и лучевая терапия средостения под контролем (67) Галлиевого сканирования у 50 пациентов. Кровь . 1999 г. 15 ноября. 94 (10): 3289-93. [Медлайн].
Dunleavy K, Pittaluga S, Maeda LS, Advani R, Chen CC, Hessler J.Терапия EPOCH-ритуксимабом с коррекцией дозы при первичной В-клеточной лимфоме средостения. N Engl J Med . 2013 г. 11 апреля. 368 (15): 1408-16. [Медлайн].
Witzens-Harig M, Ho AD, Kuhnt E, Trneny M, Rieger M, Österborg A, et al. Первичная В-клеточная лимфома средостения, леченная с помощью CHOP-подобной химиотерапии с ритуксимабом или без него: 5-летние результаты исследования Международной испытательной группы Mabthera (MInT). Кровь (Тезисы ежегодного собрания ASH) . 2012. 120: Аннотация 1612.
Джексон М.В., Рустховен К.Г., Джонс Б.Л., Камдар М., Рабинович Р. Повышение выживаемости с помощью комбинированной модальной терапии в современную эпоху первичной В-клеточной лимфомы средостения. Ам Дж. Гематол . 2016 май. 91 (5): 476-80. [Медлайн]. [Полный текст].
Spaepen K, Stroobants S, Dupont P, Van Steenweghen S, Thomas J, Vandenberghe P. Прогностическое значение позитронно-эмиссионной томографии (ПЭТ) с фтор-18-фтордезоксиглюкозой ([18F] FDG) после химиотерапии первой линии у неходжкинских больных. лимфома: является ли [18F] FDG-PET реальной альтернативой традиционным методам диагностики? Дж. Клин Онкол . 2001 15 января. 19 (2): 414-9. [Медлайн].
Jerusalem G, Beguin Y, Fassotte MF, Najjar F, Paulus P, Rigo P. Стойкая опухоль Поглощение 18F-FDG после нескольких циклов полихимиотерапии является прогностическим признаком неудачи лечения неходжкинской лимфомы. Haematologica . 2000 июн. 85 (6): 613-8. [Медлайн].
Haioun C, Itti E, Rahmouni A, Brice P, Rain JD, Belhadj K. [18F] позитронно-эмиссионная томография фтор-2-дезокси-D-глюкозы (FDG-PET) при агрессивной лимфоме: ранний прогностический инструмент для прогнозирования исход для пациента. Кровь . 2005 15 августа. 106 (4): 1376-81. [Медлайн].
Московиц С.Х., Шёдер Х., Теруя-Фельдштейн Дж., Сима С., Ясонос А., Портлок С.С. Адаптированная к риску иммунохимиотерапия с плотной дозой, определенная с помощью промежуточной FDG-PET при диффузной большой B-клеточной лимфоме на поздней стадии. Дж. Клин Онкол . 2010 апр. 10, 28 (11): 1896-903. [Медлайн].
Savage KJ, Yenson PR, Shenkier T., Klasa R, Villa D, Goktepe O, et al. Исход первичной крупноклеточной B-лимфомы средостения (PMBCL) в эпоху лечения R-CHOP. Кровь (Тезисы ежегодного собрания ASH) . 2012. 120: Аннотация 303.
Popat U, Przepiork D, Champlin R, Pugh W., Amin K, Mehra R, et al. Высокодозная химиотерапия при рецидивирующей и рефрактерной диффузной крупноклеточной В-клеточной лимфоме: локализация в средостении позволяет прогнозировать благоприятный исход. Дж. Клин Онкол . 1998 16 января (1): 63-9. [Медлайн].
[Рекомендации] Витоло Ю., Сеймур Дж. Ф., Мартелли М., Иллерхаус Г., Иллидж Т., Зукка Е. и др.Экстранодальная диффузная В-крупноклеточная лимфома (DLBCL) и первичная В-клеточная лимфома средостения: Клинические практические рекомендации ESMO по диагностике, лечению и последующему наблюдению. Энн Онкол . 2016, 27 сентября (приложение 5): v91-v102. [Медлайн]. [Полный текст].
Zinzani PL, Ribrag V, Moskowitz CH, Michot JM, Kuruvilla J, Balakumaran A, et al. Безопасность и переносимость пембролизумаба у пациентов с рецидивирующей / рефрактерной первичной крупноклеточной B-лимфомой средостения. Кровь .2017 20 июля. 130 (3): 267-270. [Медлайн]. [Полный текст].
Стратегии лечения первичной В-клеточной лимфомы средостения
Ваш браузер не поддерживает аудиоэлемент.В рамках нашего освещения ежегодной встречи и выставки Американского общества гематологов (ASH), проходившей 9–12 декабря в Атланте, мы говорим с Кироном Данливи, доктором медицины, о последних стратегиях лечения первичной В-клеточной лимфомы средостения ( PMBCL). Доктор Данливи — профессор медицины и директор программы по лимфоме в онкологическом центре Университета Джорджа Вашингтона в Вашингтоне, округ Колумбия.Он выступает с докладом на тему «Первичная В-клеточная лимфома средостения: биология и развивающиеся терапевтические стратегии» во время образовательной сессии на встрече.
Онкологическая сеть: Во-первых, не могли бы вы рассказать нам о PMBCL? Является ли это редким типом лимфомы и что мы знаем о биологии этого гематологического злокачественного новообразования?
Доктор Данливи: PMBCL — очень редкий тип неходжкинской лимфомы. Он составляет около 2% всех неходжкинских лимфом и исторически считается подтипом диффузной крупноклеточной В-клеточной лимфомы, которая является наиболее распространенным типом неходжкинской лимфомы.Но если вы внимательно посмотрите на его биологию, он сильно отличается от других подтипов диффузной большой B-клеточной лимфомы, которые являются подтипами активированных B-клеток (ABC) или B-клеток зародышевого центра (GCB). Фактически, его биология намного ближе к классической лимфоме Ходжкина. Он имеет примерно треть общих генов с классической лимфомой Ходжкина, что интересно, потому что большинство пациентов с PMBCL — женщины, и они, как правило, подростки и молодые люди, точно так же, как вы видите с наиболее распространенным типом лимфомы Ходжкина, узловой склерозирующей лимфомой Ходжкина.
Онкологическая сеть: Каков прогноз для пациентов с диагнозом PMBCL и каковы текущие варианты лечения?
Доктор Данливи: Прогноз для PMBCL очень хороший. Большинство пациентов излечиваются от болезни. Одна из проблем заключается в том, что стандартные методы лечения в прошлом включали химиотерапию с последующим облучением средостения. И хотя эти подходы оказались очень полезными, это очень молодая популяция, в основном женщины, поэтому долгосрочная токсичность медиастинальной радиации является очень важным фактором при выборе предварительной терапии.Режим R-CHOP (циклофосфамид, доксорубицин, винкристин и преднизон плюс ритуксимаб) является наиболее часто используемым при PMBCL, и хотя он очень эффективен при этом заболевании, особенно в локализованных случаях, почти во всех исследованиях, в которых изучались R -CHOP при этом заболевании большинство пациентов получали лучевую терапию средостения. Альтернативный подход — это режим средней интенсивности EPOCH-R с корректировкой дозы (этопозид, преднизон, винкристин, циклофосфамид и доксорубицин плюс ритуксимаб).Это было изучено у 51 пациента с PMBCL в проспективном исследовании. В рамках лечения облучение не применялось, и только 2 из 51 пациента потребовалось облучение средостения; бессобытийная выживаемость составила более 90%.
Недавно было опубликовано исследование Лизой Рот, доктором медицины, из Weill Cornell в British Journal of Hematology , в котором изучается реальный опыт применения EPOCH-R с коррекцией дозы в PMBCL. В рамках многоцентрового исследования она осмотрела более 150 пациентов, как взрослых, так и детей.В ее исследовании выживаемость без событий составляла более 80%, а общая выживаемость — более 90%, что, я думаю, подтверждает, что этот подход очень эффективен при PMBCL. Существуют и другие подходы, другие схемы, и некоторые из них будут обсуждаться и будут представлены на предстоящем заседании ASH.
Онкологическая сеть: Есть ли что-нибудь, что мы узнали о биологии и клиническом течении этого заболевания за последнее время, что может послужить основой для новых стратегий лечения?
Др.Данливи: Да, за последние несколько лет мы многое узнали о биологии PMBCL. У значительной части этих пациентов есть транслокации или аберрации в хромосоме 9p24, что связано с активацией определенных путей, таких как путь JAK / STAT, а также лиганд запрограммированной смерти 1 (PD-L1), и есть ингибиторы и антитела, которые специфичны для этих путей, которые разрабатываются для PMBCL. В ASH будет обновлена информация о пембролизумабе, который представляет собой антитело к PD-L1, которое изучается в PMBCL и до сих пор показало хорошую эффективность.В разработке находятся ингибиторы JAK / STAT. Обычно в PMBCL наблюдается повышенная экспрессия CD30, поэтому брентуксимаб ведотин изучался при этом заболевании. Мы будем много слышать о CAR-Т-клетках, в частности, о CAR-T-клетках CD19, и их количество невелико, но у пациентов с PMBCL были очень хорошие отзывы, поэтому мы услышим некоторые обновления по этому поводу на ASH.
Онкологическая сеть: Большое спасибо за то, что присоединились к нам сегодня, доктор Данливи, и наслаждайтесь встречей.
Др.Данливи: Спасибо.
Произошла ошибка при настройке пользовательского файла cookie
Произошла ошибка при настройке вашего пользовательского файла cookieЭтот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера на прием файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie.Вам необходимо сбросить настройки своего браузера, чтобы он принимал файлы cookie, или чтобы спросить, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались. Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г., браузер автоматически забудет файл cookie.Чтобы исправить это, установите правильное время и дату на своем компьютере.
- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie. Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу.Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта.Например, сайт не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Первичная B-клеточная лимфома средостения с поражением эндомиокарда
Первичная B-клеточная лимфома средостения (PMBCL) представляет собой необычную агрессивную подгруппу диффузных больших B-клеточных лимфом.Хотя PMBCL часто распространяется локально из тимуса в плевру или перикард, он редко проникает непосредственно через сердце. Здесь мы сообщаем о случае молодой мексиканской женщины с диагнозом PMBCL с явной инфильтрацией лимфомы через сердечную стенку в правое предсердие и трикуспидальный клапан, что привело к трикуспидальной регургитации. Это было продемонстрировано МРТ сердца и трансторакальной эхокардиограммой. Кроме того, МРТ сердца и компьютерная томография грудной клетки выявили большую массу средостения, полностью окружающую и разрушающуюся в стенку верхней полой вены (ВПВ), вызывая «воротничок».Инфильтрация сердца и ВПВ создала серьезную терапевтическую проблему, поскольку лимфомы очень чувствительны к химиотерапии, и лечение потенциально может привести к разрыву сосудистой стенки и кровотечению. Несмотря на отсутствие убедительных данных о нарушении гемодинамики, вызванном химиотерапией в таких сценариях, прогрессирующий тяжелый синдром ВПВ и респираторный дистресс потребовали срочного вмешательства. В дополнение к уникальному представлению этой редкой лимфомы в нашем отчете о клиническом случае подчеркивается безопасность лечения R-CHOP.
1. История болезни
23-летняя мексиканка, поступившая в отделение неотложной помощи с непрекращающимся кашлем в течение трех дней. Кашель и одышка начались за шесть недель до обращения и постепенно ухудшались, заставляя ее спать прямо. Она также испытала усталость, выраженный отек лица, набухание сосудов шеи, головные боли и потерю 25 фунтов веса. Подъем даже по четырем индивидуальным ступеням вызвал у бывшего футболиста сильную усталость и головокружение. Она отрицала, что у нее жар, озноб или ночная потливость.Она учится на дневном отделении колледжа, живет со своими родителями и братом или сестрой в Мексике. Там ей поставили диагноз: синдром Кушинга и гипотиреоз, ей прописали левотироксин. Она обратилась в наше отделение неотложной помощи после того, как ее состояние ухудшилось во время визита в США.
У пациента была температура 37,2 ° C, пульс 120 ударов в минуту, артериальное давление 96/57 мм рт.ст., частота дыхания 24 вдоха в минуту и сатурация кислорода 98% в воздухе помещения.У нее был значительный отек лица, шеи и верхней части туловища с видимыми набухшими сосудами. Присутствовал воротник стокс, и ее правая верхняя конечность была более отечной, чем левая. Слабый диастолический шум лучше всего слышался над правой границей грудины. Лимфаденопатии не было. Лаборатории выявили лейкоциты 11,4 (3,4–10,4 1000 / мкл) с 81% нейтрофилов, 11% лимфоцитов, 6% моноцитов, 1% эозинофилов, 1% базофилов и абсолютное количество нейтрофилов 9234 / мкл. ЛДГ в сыворотке была 1308 (125–243 МЕ / л).Кроме того, у нее калий был 3,2 (3,5–5,1 ммоль / л), кальций 9,8 (8,6–10,6 мг / дл), фосфор 4,2 (2,3–4,7 мг / дл) и магний 2 (1,6–2,6 мг / дл). Бета-2-микроглобулин составлял 1,82 (0,97–2,64 мг / л), а мочевая кислота — 4,4 (2,6–6 мг / дл).
Рентген грудной клетки показал большое новообразование в переднем средостении. Последующая КТ грудной клетки с контрастным усилением выявила большую дольчатую массу переднего средостения около правого предсердия с полным охватом и стиранием верхней полой вены (ВПВ) и инвазией в правое предсердие (Рисунки 1 и 2).Опухоль почти полностью заполнила правое предсердие, что привело к значительному расширению нижней полой вены, печеночных вен и воротной вены. КТ также выявила лимфаденопатию верхнего и переднего средостения. Трансторакальная эхокардиограмма показала образование с эрозией через ВПВ и распространением через эндокард в правое предсердие до кольца трикуспидального клапана, что привело к регургитации (рис. 3). Фракция выброса была нормальной — 60–69%. На МРТ определено образование в переднем средостении, инфильтрирующее через миокард в просвет правого предсердия, связанное с полной обструкцией ВПВ (рис. 4).
Биопсия новообразования под КТ выявила атипичные большие лимфоидные клетки с выступающими ядрышками, обильной цитоплазмой и узловым фиброзом. Неопластические клетки имели положительную экспрессию CD20 (диффузный), CD23, CD45, Bcl-6, Mum1, Pax-5, CD30 (тусклый), Bcl-2 (тусклый) и HLA-DR (тусклый). Клетки были отрицательными по ALK-1, CD10, CD19 и поверхностным иммуноглобулинам. Биопсия костного мозга, аспирация и цитогенетика были нормальными.
2.Обсуждение
Представление этой 23-летней женщины с прогрессирующим нарушением дыхательных путей и синдромом ВПВ коррелировало с результатами визуализации. Объемное образование средостения вызвало прогрессирующее сжатие и раздражение трахеи и бронхов, что привело к ее кашлю и невозможности лежать на спине. Обструкция ВПВ соответствовала выраженной васкуляризации и отеку ее лица и верхней части туловища. Припухлость была настолько заметной, что первоначально была интерпретирована как кушингоид.
У молодой женщины большая опухоль переднего средостения, скорее всего, является лимфомой, тимомой, опухолью половых клеток или саркомой.Лимфома средостения может представлять подтип узлового склероза классической лимфомы Ходжкина (NScHL) или, реже, первичную B-клеточную лимфому средостения. На основании морфологических и иммунофенотипических особенностей биопсии окончательный диагноз соответствовал PMBCL. Ткань была положительной по экспрессии B-клеточного антигена CD20, слабого CD30, отрицательных поверхностных иммуноглобулинов и морфологически не содержала клеток Рида-Штернберга, что исключало NScHL в качестве диагноза. Этап был определен как II-EA по критериям Ann-Arbor Staging.
PMBCL — это необычное клинико-патологическое образование, признанное классификацией лимфоидных злокачественных новообразований ВОЗ [1]. Он составляет 2-3% неходжкинских лимфом и может поражать молодых женщин третьего и четвертого десятилетий жизни [1]. PMBCL возникает из предполагаемых В-клеток мозгового вещества тимуса [2]. Во многих случаях наблюдается мелкодисперсный склероз и редко — клетки Рида-Штернберга [3]. Проточная цитометрия для определения иммунофенотипа опухолевых клеток обычно демонстрирует экспрессию ассоциированных с В-клетками антигенов (CD19, CD20 и CD22), CD45 и CD30 (слабая) и отсутствие поверхностных иммуноглобулинов, CD5 и CD10 [2] .TRAF-1 и ядерное окрашивание c-Rel, характерное для клеток Рида-Штернберга, также часто бывает положительным [2]. Отсутствие экспрессии иммуноглобулина на уровне белка, мРНК и частая экспрессия CD30, хотя и слабая в PMBCL, типичны для PMBCL и классической лимфомы Ходжкина (cHL) [3]. Этот паттерн не характерен для других форм диффузной крупноклеточной B-клеточной лимфомы (DLBCL). Несмотря на общие черты с cHL, PMBCL считается подмножеством DLBCL из-за консервативности программы B-клеток и синтеза белка Bcl-6 (в отличие от сайленсинга в cHL) [3, 4].Цитогенетически PMBCL может содержать хромосомные аберрации, включая увеличение хромосом 9p и 2p [5].
Представление нашего пациента типично для PMBCL. Это почти всегда связано с синдромом ВПВ или компрессией дыхательных путей [3]. 75% пациентов имеют массу более 10 см [2, 3, 6]. Около 50% пациентов имеют системные признаки B (лихорадка, ночная потливость и потеря веса), плевральный или перикардиальный выпот, а 77% имеют повышенный уровень ЛДГ [3]. У некоторых пациентов наблюдается локальное распространение в легкие, грудную стенку, плевру или перикард [2, 3, 6].Поражение костного мозга или отдаленных лимфатических узлов при поступлении необычно [4].
Случай этого конкретного пациента был интересен из-за четкой инфильтрации через сердечную стенку и вторжения в правое предсердие, что привело к трикуспидальной регургитации. МРТ сердца и эхокардиограмма продемонстрировали инфильтрацию массы через перикард, миокард и эндокард и оканчивающуюся в просвете правого предсердия массой размером с теннисный мяч. У нашего пациента также было полное окружение и вторжение через стену SVC.ВПВ и инфильтрация сердца создают серьезную терапевтическую проблему, поскольку лимфомы очень чувствительны к химиотерапии, и лечение может привести к разрыву сосудистой стенки и кровотечению. Однако ее прогрессирующий тяжелый синдром SVC и респираторный дистресс потребовали срочного вмешательства. После диагностической биопсии респираторный дистресс был первоначально купирован системными стероидами, которые быстро улучшили ее симптомы, и она могла спать ровно впервые за много недель. Это соответствовало известной чувствительности лимфомы к стероидной терапии.После патологического подтверждения PMBCL было принято решение лечить R-CHOP терапией, но с пропуском ритуксимаба во время ее первого цикла, чтобы минимизировать риск разрыва миокарда. Первый курс хорошо переносился без синдрома лизиса опухоли, нарушения гемодинамики или других острых токсических эффектов. Она продолжила лечение в Мексике и в настоящее время завершила цикл со второго по четвертый с терапией R-CHOP без токсических эффектов, связанных с лечением. Повторная визуализация и эхокардиография показали разрешение массы правого предсердия и регресс массы средостения.Симптомы ВПВ и дыхательных путей исчезли.
В нашем отчете о клиническом случае подчеркивается безопасность CHOP в таком сценарии при тщательном мониторинге жизненно важных функций пациента. Кроме того, в нем освещаются эпидемиология, диагностика, патология и лечение этой редкой лимфомы.
Оптимальная роль химиотерапии и консолидирующей лучевой терапии у пациентов с PMBCL четко не определена. Текущий стандарт лечения — ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон (R-CHOP) [7].Недавнее проспективное исследование фазы 2, проведенное в одной группе, с использованием дозированного этопозида, доксорубицина и циклофосфамида с винкристином, преднизоном и ритуксимабом (DA-EPOCH-R) и филграстимом без лучевой терапии у 51 пациента, показало высокую выживаемость без событий — 93 человека. % и общая выживаемость 97% в течение 5 лет, что указывает на роль этого режима [8]. Исследования Юго-западной онкологической группы, сравнивающие CHOP с химиотерапией 2-го и 3-го поколений при лечении DLBCL, проводились до признания PMBCL как отдельного объекта.Многие исследования проводились в эпоху преритуксимаба. Другие исследования показали превосходство химиотерапии с усиленными дозами, такой как метотрексат, циклофосфамид, доксорубицин, винкристин, преднизон и блеомицин (MACOP-B) [6]. Однако некоторые из них были основаны на исторических данных без рандомизированного сравнения и могли быть предметом систематической ошибки отбора и низкой мощности.
