Ученые отредактировали человеческие эмбрионы для изучения ранних стадий развития
Микроинъекция в ядра зиготы
Norah M. E. Fogarty et al / Nature 2017
В Великобритании редактирование генома эмбрионов человека впервые применили не для лечения врожденных заболеваний, как это уже делали в Китае и США, а в чисто исследовательских целях. Ученые из института Фрэнсиса Крика в Лондоне применили технологию CRISPR/Cas9 для редактирования здоровых человеческих эмбрионов, выключив у них фактор OCT4, чтобы изучить его функции на начальных стадиях эмбрионального развития. Исследование опубликовано в
Технология редактирования генома CRISPR/Cas9 за прошедшие пять лет с момента ее первого применения в клетках млекопитающих стала так популярна, что исследователи задумались о возможности редактирования эмбрионов человека для исправления вредных мутаций. О пионерских работах китайских исследователей, которые пытались вылечить у эмбрионов β-талассемию (безуспешно) и их американских коллег, исправивших в эмбрионах мутацию, ведущую к заболеванию сердца (успешно), мы недавно писали.
Однако английские ученые впервые использовали возможности CRISPR/Cas9 на человеческом материале не для лечения наследственных заболеваний, а просто в исследовательских целях. Авторы новой работы выключили в оплодотворенных яйцеклетках (зиготах) ген, участвующий в эмбриональном развитии, чтобы детальней изучить его функцию. По всей видимости, эта работа откроет путь к использованию человеческих эмбрионов в качестве стандартной лабораторной модели. До этого момента регуляторные органы запрещали подобные исследования по этическим соображениям.
В данной работе ученые использовали материал, полученный в результате искусственного оплодотворения в репродуктивных клиниках. «Ненужные» эмбрионы, а точнее, зиготы — оплодотворенные яйцеклетки, содержащие двойной набор хромосом, оставшиеся после успешных процедур, были пожертвованы для исследований клиентами клиник. До этого ученые пытались работать либо на «дефектных» эмбрионах, содержащих тройной набор хромосом, либо проводили процедуру искусственного оплодотворения самостоятельно.
Целью исследования было изучение функций белка OCT4, который кодируется геном POU5F1, на первых стадиях образования эмбриона до его имплантации, а также отработка технологий редактирования эмбрионов. Также ученые сравнили эффект выключения гена POU5F1 в человеческих и мышиных эмбрионах. Ген кодирует транскрипционный фактор OCT4, который, как было показано ранее на стволовых клетках, препятствует дифференциации клеток и поддерживает их плюрипотентное состояние, то есть способность развиться в любой тип клеток. Ученые предполагали, что при развитии эмбриона этот ген необходим для образования так называемой внутренней клеточной массы, из которой впоследствии развиваются зародышевые листки.
В эксперименте ученые ввели путем микроинъекции в ядра 37 зигот комплекс белка Cas9 с направляющей РНК для гена POU5F1. Предварительно последовательность направляющей РНК была подобрана на культуре эмбриональных стволовых клеток. Еще 17 зигот было использовано для контроля, в них ввели только белок Cas9. Параллельно было отредактировано некоторое количество мышиных эмбрионов для сравнения.
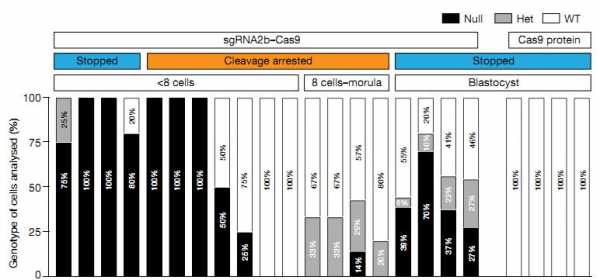
Результат редактирования генома клеток в составе человеческих эмбрионов. Белые столбики — исходная последовательность гена, черные — «сломанная» последовательность. sgRNA2b-Cas9 — комплекс белка с направляющей РНК, Cas9 — контрольный белок без «мишени» для редактирования. График показывает, что в случае успешного редактирования эмбрион не доходит даже до стадии восьми клеток.
Norah M. E. Fogarty et al / Nature 2017
Более половины экспериментальных зигот прошло через одно-два деления и остановилось в развитии, не достигнув стадии бластоциста — той стадии развития, на которой происходит имплантация эмбриона в стенку матки. Однако 19 процентов (7 из 37) эмбрионов все-таки развились в бластоцист, при этом в них наблюдалось уменьшенное количество клеточной массы, из которой, собственно, и развивается зародыш. Экспериментальные мышиные эмбрионы нормально сформировали бластоцисты.В ранних работах по редактированию эмбрионов эксперты
обсуждали два ключевых недостатка технологии CRISPR/Cas9
— нецелевое редактирование и мозаичность эмбрионов. Для того чтобы убедиться в
специфичности редактирования гена POU5F1, авторы обсуждаемой работы предсказали возможные участки связывания
направляющей РНК и проверили их секвенированием. Ни в человеческих ни в мышиных
эмбрионах никакой лишней активности Cas9 зарегистрировано не было. Эффективность редактирования при этом была
довольно высока — авторы говорят о 70 процентах успеха.
Однако, проанализировав клетки человеческих бластоцистов на наличие белка OCT4, ученые обнаружили, что в некоторых клетках он все-таки присутствует, что означает мозаичность эмбрионов. Впрочем, учитывая важность этого фактора для эмбрионального развития, в данном случае исследователи столкнулись с результатом давления отбора — только те эмбрионы смогли развиться в бластоцист, у которых осталось хотя бы минимальное количество белка.
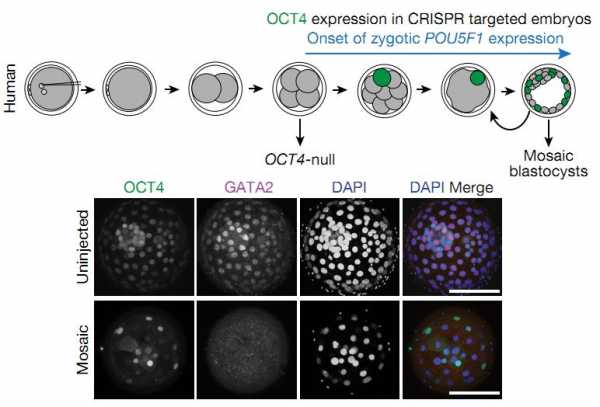
Схема образования мозаичного эмбриона в случае неполного редактирования. Полноценная копия гена хотя бы в одной из клеток позволяет сформировать бластоцист. На нижней панели зеленым цветом помечен OCT4 в составе такого мозаичного бластоциста.
Norah M. E. Fogarty et al / Nature 2017
Надо признать, что в данном случае успех редактирования определила относительная простота задачи. Сломать ген при помощи Cas9 гораздо проще, чем заменить в нем одну последовательность на другую, что пытались сделать авторы предшествующих работ. Тем не менее, успешное применение этой технологии означает, что «чисто исследовательские» работы на человеческих эмбрионах будут повторяться и совершенствоваться. В конце концов, как сказал один из комментаторов исследования, «если мы хотим изучать развитие человека, мы должны работать непосредственно на эмбрионах человека, а не полагаться на модели». Подробнее прочитать о технологии CRISPR/Cas9 можно в нашем материале.nplus1.ru
Британские учёные отредактировали геном человеческого эмбриона в чисто научных целях
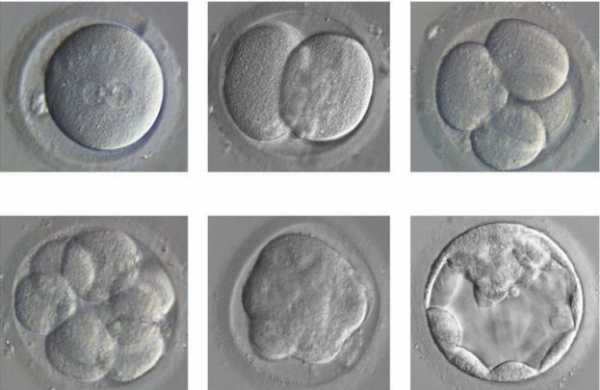 Ранние стадии развития человеческого эмбриона: от зиготы (слева вверху) до бластоцисты (справа внизу).
Ранние стадии развития человеческого эмбриона: от зиготы (слева вверху) до бластоцисты (справа внизу).Группа учёных из Института Фрэнсиса Крика (The Francis Crick Institute) внесла изменения в ДНК человеческих эмбрионов непосредственно после формирования зиготы. За развитием модифицированных эмбрионов исследователи наблюдали на протяжении 7 дней, после чего зародыши были уничтожены.
Как известно, развитие любого человека начинается с одной-единственной клетки, зиготы. Её «потомки» образуют самые разные ткани организма, от твёрдых, как костная, до жидких, как кровь и лимфа. Однако механизмы, лежащие в основе этого превращения, до сих пор не изучены до конца.
Прорыв в модифицировании ДНК позволил команде из Института Крика «выключить» ген, точнее, генетическую инструкцию, которая, предположительно, играет жизненно важную роль в развитии эмбриона. В ходе эксперимента учёные использовали технологию редактирования генома
Для работы исследователи использовали 41 человеческий эмбрион. Все эмбрионы были пожертвованы парами, проходившими ЭКО: фактически, для экспериментов использовались зародыши, оказавшиеся ненужными.
Удалив OCT4 из генома некоторых эмбрионов, учёные начали наблюдать за их развитием. Геном эмбрионов, составивших контрольную группу, модификациям не подвергался.
Обычно за 7 дней нормальный здоровый эмбрион успевает разрастись от одной клетки до двухсот. Кроме того, на этой стадии развития уже наблюдаются первые признаки дифференциации — появляются первые клетки, способные выполнять определённую работу. Формируется полость под названием бластоциста или зародышевый пузырёк — но в отсутствие
Впервые в истории геном человеческих эмбрионов был отредактирован, чтобы получить ответ на вопрос фундаментальной биологии.
Доктор Кэти Ниакан (Kathy Niakan), руководитель группы учёных в Институте Крика, рассказывает: «Это базовое исследование, которое дало нам фундаментальную информацию о раннем развитии человека».
Более глубокое понимание самых ранних моментов жизни может помочь разобраться с причинами бесплодия. В ходе ЭКО, из 100 оплодотворённых яйцеклеток менее 50 доходят до стадии формирования бластоцисты, 25 — переносятся в матку и только 13 развиваются дольше трёх месяцев.
Само по себе новое исследование, опубликованное в журнале Nature, не может объяснить, что идёт не так при ЭКО или почему у некоторых женщин случаются выкидыши. Однако изучение всех генов, предположительно играющих ту или иную роль в развитии эмбриона, может привести к появлению новых подходов к лечению бесплодия.
«Если бы мы знали, какие гены необходимы эмбриону для развития — я надеюсь, в будущем нам удастся это выяснить — мы могли бы улучшить вспомогательные репродуктивные технологии и получить ценную информацию о том, почему некоторые беременности заканчиваются неудачей», — добавляет Ниакан.
Этические дебаты
Такого рода эксперименты с человеческими эмбрионами в Великобритании были легализованы в 2008 г. По закону, учёные могут работать с зародышами в возрасте до 14 дней, при условии, что эти зародыши не имплантируются в матку. Однако пока группа авторов нового исследования занималась поиском ответов на фундаментальные научные вопросы, их коллеги пытались научиться удалять гены, вызывающие наследственные заболевания.
Такие работы становятся поводом для многочисленных споров этического толка.
Доктор Сара Чан (Sarah Chan), биоэтик из Эдинбургского университета (University of Edinburgh) говорит: «Я не думаю, что новое исследование должно стать поводом для беспокойства с точки зрения этики. Очевидно, что учёные преследовали чисто научные цели и не собирались создавать генетически модифицированных людей.
Впрочем, если мы однажды начнём использовать редактирование человеческих эмбрионов в медицинских целях, польза от этой методики может быть огромна. Но прежде чем мы сделаем этот шаг, хотелось бы убедиться в том, что уже состоялся активный всесторонний публичный диалог, охвативший все этические вопросы».
22century.ru
Ученые впервые успешно отредактировали человеческий эмбрион
Генетики из США, Китая и Южной Кореи впервые успешно отредактировали геном человеческого эмбриона на ранней стадии развития, устранив генетическую «поломку», вызывающую опасное заболевание сердца. Результаты их работы опубликованы в среду в журнале Nature.
О результатах ученых ранее сообщал MIT Technology Review со ссылкой на «людей, знакомых с результатами исследования». Это первое исследование такого рода в США после выхода рекомендаций Американской академии наук о редактировании генома человека (один из соавторов, Ицписуа Бельмонте, входил в состав комиссии, подготовившей эти рекомендации).
В новом исследовании ученые «чинили» мутацию в гене MYBPC3 на 11-й хромосоме, на которую приходится около 40% всех случаев наследственной гипертрофической кардиомиопатии. Гипертрофическая кардиомиопатия (ГКМП) — одно из более чем 10 тысяч наследственных заболеваний, вызываемых «поломкой» в одном гене. На данный момент заболевание, которое встречается примерно у одного из 500 человек, неизлечимо: оно проявляется только у взрослых и может стать причиной остановки сердца и смерти у внешне здоровых молодых людей.
Изображение: Npatchett at English Wikipedia / Wikimedia Commons / CC BY-SA 3.0Группа Шухрата Миталипова из Орегонского университета здравоохранения работала с донорскими яйцеклетками 12 здоровых женщин и донорской спермой одного мужчины, имеющего мутацию гена MYBPC3. Сначала они проверяли точность и эффективность работы системы CRISPR-Cas9 на индуцированных плюрипотентных стволовых клетках, а затем использовали лучшие варианты на зиготах.
Если не предпринимать никаких действий, шанс унаследовать здоровую копию гена для эмбриона составляет 50% (ошибочную копию гена несет каждый второй сперматозоид). В то же время с помощью CRISPR-Cas9 ученым удалось получить 42 здоровых эмбриона из 58 (72,4%). В оставшихся 16 эмбрионов генетические «ножницы» привели к появлению нежелательных вставок или вырезанных фрагментов ДНК.
«Это статистически значимая разница, которая свидетельствует о том, что почти в половине зигот с мутацией произошло редактирование. Если бы гипотетическая пара, в которой один или оба партнера имеют ГКМ, решила бы завести ребенка и хотела бы, чтобы он не имел этой болезни, то применение редактирования существенно повысило бы вероятность получения желаемого эмбриона», — пояснил «Чердаку» Константин Северинов, профессор Сколтеха и Университета Ратгерса (США), заведующий лабораториями Института молекулярной генетики и Института биологии гена РАН.
«Мы получили больше здоровых эмбрионов [чем в контрольной группе], но пока их не 100%, так что, я думаю, у нас есть возможность улучшить этот результат. Мы можем добиться эффективности в 90−100%», — сказал Миталипов на пресс-конференции во вторник.
В отличие от предыдущих, крайне неточных, работ китайских ученых группа Миталипова вводила генетические «ножницы» Cas9 с образцом РНК одновременно со сперматозоидом, а не позже — таким образом им удалось избежать мозаичности эмбриона, когда часть его клеток все же получают неотредактированную ДНК.
Зиготы с пронуклеусами. Фото: OHSUСеверинов добавил, что в более ранних опытах по редактированию эмбрионов белок-редактор работал недостаточно точно: кроме редактирования нужного места во многих эмбрионах обнаруживались нежелательные мутации. В данной работе такого нецелевого редактирования не наблюдалось.
«Возможно, авторам просто повезло, и их гидовая РНК оказалась менее склонной к узнаванию „неправильных“ мест. Кроме того, большое влияние на повышение точности сыграл способ, которым вводился редактор», — сказал Северинов.
Нергес Винблад и Фредрик Ланнер из Каролинского института в Швеции в комментарии к научной статье поясняют, что после надреза, сделанного Cas9, ДНК может восстанавливаться двумя способами. В одном случае используются случайные вставки нуклеотидов (этот способ называется NHEJ, негомологичное соединение концов), в другом ДНК копируется с образца синтетической РНК, принесенной вместе с системой CRISPR, или второй, здоровой копии гена (это HDR, гомологичная рекомбинация).
Как выяснилось, почти все зиготы использовали именно второй, более предпочтительный способ, копируя при этом вторую копию своего же гена, — синтетическим образцом «воспользовался» лишь один эмбрион. Это довольно неожиданный результат — так не ведут себя ни эмбрионы других видов, ни соматические, то есть взрослые неполовые, клетки и причины этого еще предстоит изучить.
«Редактированные эмбрионы развивались аналогично контрольным, и 50% достигли ранней стадии развития бластоцисты, когда эмбрионы уже имеют клетки разных типов. Это говорит о том, что редактирование генов не мешает развитию эмбриона», — отмечают ученые в комментарии.
Бластоцисты. Фото: OHSUАвторы нового исследования подчеркивают, что редактирование ДНК с помощью CRISPR-Cas9 в сочетании с экстракорпоральным оплодотворением и предимплантационной генетической диагностикой в теории могут помочь справиться и с другими генетическими болезнями. Однако, по их словам, прежде чем переходить к клиническим испытаниям этой технологии, ее нужно «оптимизировать». Помимо этого, ученых интересуют и другие мутации в генах, вызывающие кардиомиопатию, а также печально известные гены BRCA, мутации которых вызывают рак груди.
«В дальнейшем мы можем заняться и гомозиготными мутациями [когда повреждены обе копии гена]. В этом случае ситуация сложнее, потому что нет здорового образца, с которого можно было бы копировать ген после использования CRISPR-Cas9. Нам придется очень много поработать над тем, чтобы заставить эмбрионы использовать внешние образцы», — сказал на пресс-конференции Миталипов.
По мнению Северинова, теперь важно показать, насколько разработанная процедура применима как для других вариантов этого же гена, так и для других генов, ответственных за различные моногенные болезни.
«С неизбежностью в относительно недалеком будущем будет проведено редактирование и ЭКО, в результате которого родятся детишки. Избежать этого невозможно: слишком много людей, которые хотят иметь здоровых детей и для которых такого рода процедуры — единственная возможность осуществить это желание», — заключил ученый.
Быть в курсе событий мировой и отечественной науки
chrdk.ru
Геном жизнеспособного эмбриона человека впервые отредактирован в США — Альтернативный взгляд Salik.biz
С момента появления революционной технологии геномного редактирования CRISPR учёные провели немало смелых экспериментов. Пожалуй, самым громким стало редактирование генома человеческого эмбриона. Несмотря на призывы о запрете подобных опытов, в 2015 году китайские учёные впервые отредактировали ДНК непособных к жизни эмбрионов человека.
Пока в научном сообществе разгорались этические споры, гены эмбрионов человека продолжали подвергать модификации, правда, с низким уровнем эффективности.
— Salik.bizВ марте 2017 года метод CRISPR впервые испытали на жизнеспособных человеческих эмбрионах, то есть тех, что потенциально могли стать плодом в чреве женщины и родиться на свет. Тогда на противоречивый эксперимент вновь решились исследователи из Поднебесной, и вот теперь их “догнали” коллеги из Соединённых Штатов.
Собственно, первый эксперимент по редактированию генома человека в Америке стартовал ещё год назад. Теперь же команда под руководством Шухрата Миталипова (Shoukhrat Mitalipov) из Орегонского университета здоровья и науки заявила об успешном редактировании генома человеческого эмбриона.
Эта работа превзошла все предыдущие как по количеству эмбрионов, которые подверглись модификации, так и по результативности. Команда продемонстрировала, что безопасно и эффективно исправлять дефектные гены, отвечающие за наследственные заболевания, стопроцентно возможно.
Хотя ни одному из эмбрионов не позволили развиваться больше нескольких дней (и тем более не планировалось проводить с их помощью искусственное оплодотворение), эксперимент наглядно показал возможность создания генетически модифицированных людей.
Поясним, что при изменении кода ДНК человеческих эмбрионов цель учёных состоит в том, чтобы показать, что они могут «исправить» гены, ведущие к появлению таких болезней, как, например, бета-талассемия — это опасное заболевание крови.
Сам процесс такой модификации эксперты называют инженерией клеток зародышевой линии. Поскольку если допустить рождение ребёнка с «исправленной» ДНК, то он передаст изменения последующим поколениям через собственные клетки – яйцеклетку или сперму.
Рекламное видео:Вот почему такие эксперименты вызывают этические споры: теоретически исследователи могут создавать «дизайнерских» детей, то есть генетически усовершенствованных. Против такой перспективы сегодня решительно выступает ряд религиозных организаций, некоторые общественные деятели и биотехнологические компании, а технологию CRISPR уже называют потенциальным оружием массового уничтожения.
Более того, предыдущие исследования китайцев выявили некоторые ошибки, появляющиеся в процессе редактирования, и показали, что изменения ДНК могут затронуть не все клетки, а лишь некоторые. Это явление называется генетическим мозаицизмом. Американцем же удалось всего этого избежать: они доказали, что можно обойти как мозаицизм, так и «внецелевое» действие (или попросту ошибки) работы системы CRISPR.
Сам Шухрат Миталипов отказался давать комментарии, однако его коллеги подтвердили успешность экспериментов.
Известно, что в своём исследовании команда использовала несколько десятков эмбрионов, созданных благодаря сперме, предоставленной добровольцами-носителями унаследованных мутаций. Правда, пока что остаётся неизвестным, какие именно гены подверглись редактированию.
На видео ниже показано, как химические вещества, модифицирующие нужный ген, вводятся в яйцеклетку в момент оплодотворения.
Несмотря на очередной успех, споры вокруг редактирования генома человеческих эмбрионов продолжаются. Многие исследователи уже выступили в поддержку идеи о том, что в принципе нет ничего страшного в модифицировании, если речь идёт о серьёзных наследственных заболеваниях, угрожающих жизни будущего человека.
В то же время эксперты едины во мнении относительно любых генетических усовершенствований, например, для создания детей с потенциально более высоким интеллектом.
«Редактирование генома для улучшения каких-либо характеристик или способностей, а не здоровья, вызывает озабоченность по поводу того, могут ли преимущества превышать риски, и справедливо ли, что такие эксперименты будут доступны лишь немногим людям», — заключает Альта Чаро (Alta Charo), сопредседатель исследовательского комитета Национальной Академии наук США и профессор права и биоэтики в Висконсинском университете в Мэдисоне.
Сегодня в Штатах любые попытки дать жизнь эмбриону с отредактированной ДНК запрещены на законодательном уровне. Кроме того, существует законопроект об остановке любого финансирования подобных клинических испытаний. Впрочем, несмотря на такие барьеры, создание «генно-модифицированного» человека может осуществиться в любой стране, где правовых ограничений на этот процесс нет.
salik.biz
Зачем редактировать ДНК эмбрионов и почему мир боится “дизайнерских детей”
Мир Реальность Политика Экономика LifeStyle БудущееРазделы
Новости
Кремль отметился противоречивым высказыванием о протестах в Москве13:35
У НАПК возникли вопросы к одиозному нардепу13:30
После трех суток глубокой комы умер тяжело раненый на Донбассе солдат13:15
Атмосферный фронт Zorro против антициклона Andrea: какую погоду украинцам ждать завтра13:15
В США известную соцсеть для изображений продают в триста раз дешевле, чем купили13:01
Во Львовской области СБУ поймала шпиона, работавшего на разведку России — фото12:58
Вода для Крыма: в Киеве ответили «властям» оккупированного полуострова12:53
Суд отпустил под залог фигуранта дела «Роттердам+»12:44
Подарок иностранцам: Зеленский решил упростить получение украинского гражданства12:28
Верховный суд принял кассацию Кабмина по поводу увольнения и назначения главы «Нафтогаза»12:24
Минские соглашения: Зеленский не сможет отойти от «модели Порошенко», эксперт назвал причину12:21
В Украине состоится масштабная акция в поддержку узников Кремля11:58
На Донбассе представили нового командующего Объединенных сил — видео11:30
Во Львове неизвестный в балаклаве ограбил продовольственный магазин11:17
«Ты готов для Москвы, такой же как мы»: во Львове произошел скандал на футбольном матче11:13
Легендарного оперного певца обвинили в сексуальных домогательствах10:44
Иностранец устроил стрельбу в детской спортивной школе Днепра — фото10:26
Трампу грозит новый иск из-за «бесчеловечного» правила по мигрантам10:08
В «Слуге народа» ратуют за ведомство по гуманитарной политике и уже нашли кандидата в министры10:08
В оккупированном Крыму «власти» хотят договориться с Украинойrealist.online
В США впервые отредактировали геном человеческого эмбриона – журнал Vademecum
В лаборатории Oregon Health and Science University (город Портланд, США) впервые успешно отредактировали геном живого человеческого эмбриона при помощи технологии CRISPR, сообщает журнал Массачусетского технологического института.
Коллектив ученых под руководством Шухрата Миталипова, американского биолога казахского происхождения, при помощи технологии CRISPR впервые в США успешно отредактировал ДНК человеческого эмбриона, пишет издание.
Миталипов отказался комментировать эксперимент, ссылаясь на то, что вся необходимая информация будет обнародована в соответствующей научной публикации.
Известно лишь, что опыты были проведены на нескольких человеческих эмбрионах, и все они успешно развивались после этого несколько дней. Какая именно генетическая болезнь корректировалась с помощью CRISPR, также не уточняется.
«Хотя ни один из эмбрионов никогда не предназначался для помещения в человеческую матку, сам эксперимент, безусловно, стал важной вехой на пути к, похоже, неизбежному появлению на свет первых генетически модифицированных людей», – пишет журнал.
Это первый такого рода эксперимент в США и четвертый в мире, три других провели китайские ученые.
Создание генетически модифицированных людей, помимо чисто научных, вызывает и множество этических вопросов.
Тем не менее технология CRISPR сейчас широко исследуется как метод коррекции врожденных заболеваний – в конце 2016 года ученые из Университета Юты применили этот метод редактирования генома для лечения серповидно-клеточной анемии. Методика показала положительные результаты на мышах.
В Мексике в 2016 году родился первый ребенок, зачатый с помощью генетического материала трех родителей. Эта методика помогает людям с опасными генетическими мутациями иметь здоровых детей.
Поделиться в соц.сетях
vademec.ru
Зачем редактировать гены и отбирать эмбрионы — Wonderzine
В конечном итоге наша деятельность сводится к тому, чтобы вместо больного ребенка родился здоровый. Отбор, описанный выше, — один из способов этого добиться. Но есть другой вариант: те эмбрионы, которые есть, изменить так, чтобы они стали нормальными. Бытовое название у этого — редактирование генома. Сейчас появились хорошие технологии, которые позволяют это делать достаточно эффективно, в том числе технология CRISPR/Cas9. Что сделали в Китае: там взяли человеческий эмбрион и заменили ген, приводящий к мутации рака в молочной железе и яичниках, на нормальный. Эмбрион, разумеется, не переносили в матку, так что его развитие, как и положено, остановилось на 6-й день.
В Китае это разрешено. В остальном мире после этого начали суетиться — больше всех те, кто занимался технологией CRISPR/Cas9, но не на эмбрионах, а на образцах клеток, выделенных из периферической крови. Это так называемая ex vivo генная терапия, когда берут клетки из периферической крови, отбирают лейкоциты, вносят в них определенные генетические изменения, а потом пересаживают обратно. Таким образом можно лечить некоторые заболевания, связанные с работой костного мозга. Люди, которые этим занимаются, испугались, что сейчас генотерапию закроют всю, и, чтобы этого не допустить, они выступили с призывом запретить конкретно работу с эмбрионами. В Штатах такие опыты запретили.
Главный вопрос касательно технологии CRISPR/Cas9 или того, что проделали в Китае, — это насколько много или мало они создают новых мутаций, помимо тех, что они исправляют. С любой генотерапией такая опасность есть. В свое время генотерапия была очень сильно заторможена одним очень негативным клиническим случаем: ребенка лечили от некоего наследственного заболевания, но параллельно исправлениям в клетках случилась какая-то другая мутация, из-за чего у ребенка возник рак крови. После этого генотерапия стала развиваться гораздо медленнее, чем могла бы, потому что сырую технологию слишком рано запустили в клиническое применение.
Технология CRISPR/Cas9 находится в процессе анализа. Для того чтобы выяснить, достаточно ли она точна, проводится огромный объем научной работы. В Китае же было принципиально показать, что отредактировать человеческий эмбрион возможно. Дальше будет длинный период, когда эта технология будет подтверждать свою эффективность, безопасность, точность и так далее. Когда выяснится, что на 99 % всё хорошо, то, скорее всего, ею можно будет пользоваться.
www.wonderzine.com
