Ученые отредактировали человеческие эмбрионы для изучения ранних стадий развития
Микроинъекция в ядра зиготы
Norah M. E. Fogarty et al / Nature 2017
В Великобритании редактирование генома эмбрионов человека впервые применили не для лечения врожденных заболеваний, как это уже делали в Китае и США, а в чисто исследовательских целях. Ученые из института Фрэнсиса Крика в Лондоне применили технологию CRISPR/Cas9 для редактирования здоровых человеческих эмбрионов, выключив у них фактор OCT4, чтобы изучить его функции на начальных стадиях эмбрионального развития. Исследование опубликовано в
Технология редактирования генома CRISPR/Cas9 за прошедшие пять лет с момента ее первого применения в клетках млекопитающих стала так популярна, что исследователи задумались о возможности редактирования эмбрионов человека для исправления вредных мутаций. О пионерских работах китайских исследователей, которые пытались вылечить у эмбрионов β-талассемию (безуспешно) и их американских коллег, исправивших в эмбрионах мутацию, ведущую к заболеванию сердца (успешно), мы недавно писали.
Однако английские ученые впервые использовали возможности CRISPR/Cas9 на человеческом материале не для лечения наследственных заболеваний, а просто в исследовательских целях. Авторы новой работы выключили в оплодотворенных яйцеклетках (зиготах) ген, участвующий в эмбриональном развитии, чтобы детальней изучить его функцию. По всей видимости, эта работа откроет путь к использованию человеческих эмбрионов в качестве стандартной лабораторной модели. До этого момента регуляторные органы запрещали подобные исследования по этическим соображениям.
В данной работе ученые использовали материал, полученный в результате искусственного оплодотворения в репродуктивных клиниках. «Ненужные» эмбрионы, а точнее, зиготы — оплодотворенные яйцеклетки, содержащие двойной набор хромосом, оставшиеся после успешных процедур, были пожертвованы для исследований клиентами клиник. До этого ученые пытались работать либо на «дефектных» эмбрионах, содержащих тройной набор хромосом, либо проводили процедуру искусственного оплодотворения самостоятельно.
Целью исследования было изучение функций белка OCT4, который кодируется геном POU5F1, на первых стадиях образования эмбриона до его имплантации, а также отработка технологий редактирования эмбрионов. Также ученые сравнили эффект выключения гена POU5F1 в человеческих и мышиных эмбрионах. Ген кодирует транскрипционный фактор OCT4, который, как было показано ранее на стволовых клетках, препятствует дифференциации клеток и поддерживает их плюрипотентное состояние, то есть способность развиться в любой тип клеток. Ученые предполагали, что при развитии эмбриона этот ген необходим для образования так называемой внутренней клеточной массы, из которой впоследствии развиваются зародышевые листки.
В эксперименте ученые ввели путем микроинъекции в ядра 37 зигот комплекс белка Cas9 с направляющей РНК для гена POU5F1. Предварительно последовательность направляющей РНК была подобрана на культуре эмбриональных стволовых клеток. Еще 17 зигот было использовано для контроля, в них ввели только белок Cas9. Параллельно было отредактировано некоторое количество мышиных эмбрионов для сравнения.
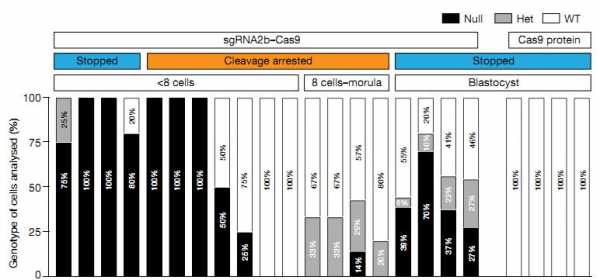
Результат редактирования генома клеток в составе человеческих эмбрионов. Белые столбики — исходная последовательность гена, черные — «сломанная» последовательность. sgRNA2b-Cas9 — комплекс белка с направляющей РНК, Cas9 — контрольный белок без «мишени» для редактирования. График показывает, что в случае успешного редактирования эмбрион не доходит даже до стадии восьми клеток.
Norah M. E. Fogarty et al / Nature 2017
Более половины экспериментальных зигот прошло через одно-два деления и остановилось в развитии, не достигнув стадии бластоциста — той стадии развития, на которой происходит имплантация эмбриона в стенку матки. Однако 19 процентов (7 из 37) эмбрионов все-таки развились в бластоцист, при этом в них наблюдалось уменьшенное количество клеточной массы, из которой, собственно, и развивается зародыш. Экспериментальные мышиные эмбрионы нормально сформировали бластоцисты.В ранних работах по редактированию эмбрионов эксперты
обсуждали два ключевых недостатка технологии CRISPR/Cas9
— нецелевое редактирование и мозаичность эмбрионов. Для того чтобы убедиться в
специфичности редактирования гена POU5F1, авторы обсуждаемой работы предсказали возможные участки связывания
направляющей РНК и проверили их секвенированием. Ни в человеческих ни в мышиных
эмбрионах никакой лишней активности Cas9 зарегистрировано не было. Эффективность редактирования при этом была
довольно высока — авторы говорят о 70 процентах успеха.
Однако, проанализировав клетки человеческих бластоцистов на наличие белка OCT4, ученые обнаружили, что в некоторых клетках он все-таки присутствует, что означает мозаичность эмбрионов. Впрочем, учитывая важность этого фактора для эмбрионального развития, в данном случае исследователи столкнулись с результатом давления отбора — только те эмбрионы смогли развиться в бластоцист, у которых осталось хотя бы минимальное количество белка.
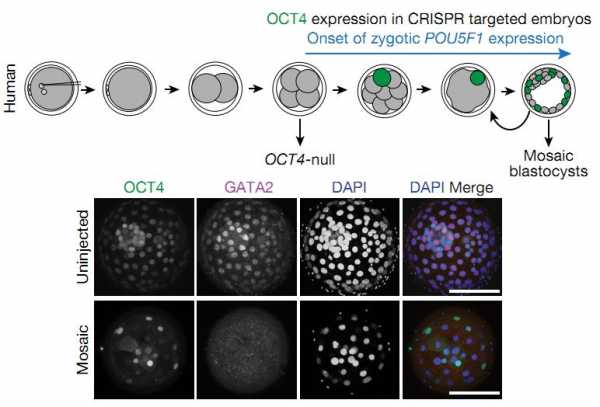
Схема образования мозаичного эмбриона в случае неполного редактирования. Полноценная копия гена хотя бы в одной из клеток позволяет сформировать бластоцист. На нижней панели зеленым цветом помечен OCT4 в составе такого мозаичного бластоциста.
Norah M. E. Fogarty et al / Nature 2017
Надо признать, что в данном случае успех редактирования определила относительная простота задачи. Сломать ген при помощи Cas9 гораздо проще, чем заменить в нем одну последовательность на другую, что пытались сделать авторы предшествующих работ. Тем не менее, успешное применение этой технологии означает, что «чисто исследовательские» работы на человеческих эмбрионах будут повторяться и совершенствоваться. В конце концов, как сказал один из комментаторов исследования, «если мы хотим изучать развитие человека, мы должны работать непосредственно на эмбрионах человека, а не полагаться на модели». Подробнее прочитать о технологии CRISPR/Cas9 можно в нашем материале.nplus1.ru
Будем править? В России разразился спор о праве вмешиваться в геном эмбрионов человека
Российский молекулярный биолог Денис Ребриков и его группа давно говорят, что занимаются отработкой технологии, и только что заявили, что нашли для своих экспериментов испытуемых. Ученые готовят заявку в Минздрав на то, чтобы тот разрешил им попытаться отредактировать эмбрион будущего ребенка родителей с наследственной глухотой. Их оппоненты во главе с Куцевым готовят встречное заявление в министерство, где предлагают объявить на эксперименты по редактированию генома эмбрионов человека мораторий — до тех пор, пока не появятся соответствующие нормативно-правовые документы.
«В Штатах [заявку Ребрикова] даже не приняли бы, — говорит биолог Федор Урнов. — Кроме того, законодательные органы США только что ввели в жизнь закон, согласно которому запрещено проводить геноредактирование зародыша».
Урнов — один из признанных мировых лидеров в области технологий редактирования генома. Выпускник биологического факультета МГУ, он много лет работает в США, где активно занимается модификацией генома живых организмов (включая и клетки людей) как в лаборатории, так и в клинической практике. Среди его регалий, в частности, разработка самого точного из ныне существующих инструментов редактирования генома человека — ZFN, или «цинковых пальцев»: в лабораториях им на смену сейчас пришла в разы более дешевая и простая система CRISPR/Cas, с которой работает и Ребриков, и генетики в Медико-генетическом научном центре (Куцев — его директор), да и подопечные Урнова в Беркли.
Изобретение CRISPR/Cas сильно снизило порог входа в профессию «геноредактора». В разы увеличилось число исследований в области генетического редактирования, а новые, менее подготовленные в инфраструктурном плане (сюда входят не только специалисты, но и лаборатории, логистические цепочки, законодательство и т.д.) страны включились в биотехнологическую гонку.
Стало ясно, что вот она, возможность не только догнать, но и перегнать Запад.
Победой тут должно стать успешное клиническое испытание технологии — избавление человека от той или иной наследственной болезни путем редактирования его генома.
Еще большим престижем было бы излечить какую-то наследственную болезнь «начисто», то есть сделав так, чтобы и у потомков пациента она уже не могла проявиться. Серия операций — и мир больше никогда не вспомнит о муковисцидозе или малокровии.
Медики против ученых
«Медицинского смысла здесь нет, а опасность есть, — говорит Сергей Куцев, возглавивший протест врачей-генетиков против экспериментов Ребрикова. — Так зачем же этим заниматься? У нас было заседание ученого совета. На нем были врачи-генетики, доктора наук, профессора, они принимали десятки тысяч пациентов с наследственными заболеваниями. Я спрашиваю, в вашей практике была какая-то такая ситуация, когда вообще ничего нельзя сделать в плане профилактики наследственных заболеваний и только редактировать эмбрион? Такую ситуацию никто не вспомнил».
Современные репродуктивные технологии позволяют диагностировать генетические заболевания на самом раннем этапе. Диагностировать и отобрать для экстракорпорального оплодотворения тот эмбрион, у которого патогенной мутации нет. Или проанализировать геном эмбриона на ранней стадии беременности и в случае обнаружения каких-то генетических поломок в нем предложить родителям решать, прерывать беременность или нет. И никаких дополнительных рисков, связанных с редактированием.
По словам Урнова, в сообществе западных медиков и ученых, которые занимаются наследственными заболеваниями и технологиями редактирования генома, встречаются две позиции. Первая — и ее, по оценкам ученого, придерживается где-то треть — гласит, что редактировать эмбрионы человека надо запретить. Вторая, более популярная точка зрения, такова: на клинические испытания технологии пока необходимо объявить полный мораторий. И только если «будут ситуации, когда с медицинской точки зрения это обосновано, то тогда это разрешить, если мы можем себя убедить в том, что это безопасно, этично и вреда не принесет».
«Я подозреваю, что в российском научном сообществе в целом настроение более пермиссивное [по отношению к клиническим испытаниям редактирования генома эмбриона человека], чем в западном, — говорит биолог Константин Северинов из Сколтеха. — Просто потому что это на уровне кузькину мать показать, шапку сорвать и об землю… Мечта объегорить всех этих англосаксов и показать, что мы можем это делать, а они нет, у нас у всех присутствует подспудно».
Сам Ребриков отказался комментировать свою позицию по этому вопросу после того, как Куцев выступил с призывом к Минздраву ввести мораторий. Однако еще в июле, говоря с порталом ТАСС «Чердак» о своих планах, признавал, что выбранные им и его командой цели для редактирования — ВИЧ, наследственная глухота, слепота, карликовость — действительно не являются чем-то несовместимым с жизнью и потому безальтернативной медицинской необходимости в редактировании генома эмбрионов нет. Но в более серьезных случаях речи о редактировании эмбрионов тоже не может быть: такие люди не заводят семьи.
Кроме того, возможны случаи, в которых все оплодотворенные яйцеклетки будут носителями дефектного гена, хотя если верить Куцеву, такого в его медицинской практике и практике его коллег никогда не случалось. В такой ситуации преимплантационная диагностика помочь не сможет, единственной доступной мерой будет редактирование.
Сам вопрос о редактировании тогда же, в июле, Ребриков считал вопросом не о технологии, а о регуляции, причем его риторика апеллировала к вопросу о лидерстве в биотехнологической гонке: «Либо [регулятор] скажет да, давайте сделаем такой эксперимент — и перенести эмбрион в матку матери мы готовы хоть завтра, — сказал тогда он. — Либо скажет: давайте еще 100500 проверок. Либо нет, жесткое нет. Мы подумали, что Россия не будет лидером в этой области».
Почему нельзя отмолчаться
Северинов крайне негативно оценивает возможные последствия от разрешения редактирования генома эмбрионов в России. Ученый при этом тоже занимается научными исследованиями, связанными с системой CRISPR/Cas.
Биолог называет призыв Куцева разумным и своевременным: «В России инфраструктурная часть научных исследований в области наук о жизни не готова к тому, чтобы такого рода эксперименты проводить на людях и гарантировать, что никаких последствий не будет, — считает Северинов. — Если дать этому волю, то мы придем в ту же дурацкую ситуацию, как было со стволовыми клетками. Лет десять назад все кому не лень потчевали всех стволовыми клетками с помощью процедур, безопасность и эффективность которых была не доказана. В СМИ можно найти немало примеров известных людей, которые пострадали из-за таких процедур, некоторые, возможно, из-за этого и умерли. Ну зачем повторять все это дело с «криспрами», рискуя создать долгосрочные проблемы для всего метода, безусловно, очень перспективного? Только для того, чтобы кто-то мог отрапортовать начальству о своем успехе?»
Куцев — председатель этического комитета при Минздраве. Однако, по его словам, он не уверен, что заявка Ребрикова будет проходить через этот орган министерства.
«Есть этический комитет, а есть этический совет. И не факт, что нам [эту заявку] подадут, ее могут подать в этический совет. А во-вторых, извините, я очень надеюсь на разумность членов этического комитета, но вообще-то это коллегиальный орган. А единого мнения нет, — признает Куцев. — Потому что есть такая фраза, которая мне совершенно не нравится: «Науку остановить нельзя». Но кто же ее просит останавливать? Мы же говорим о клиническом применении».
Именно поэтому, по словам генетика, он не стал дожидаться, пока Ребриков подаст документы в Минздрав, и публично призвал остановить эксперименты. Кроме того, Куцева подстегнула готовность Ребрикова обсуждать свои эксперименты с прессой.
«Мы уже не сможем сказать о том, что мы не слышали ничего, что мы ничего не знали и этот биолог российский сделал все это тайно, — поясняет свое недовольство публичностью Ребрикова Куцев. — Тут ответственность, она распределена этим биологом на все общество. И общество, которое молчит, оно получит потом результат, который будет потом осужден на всех уровнях и во всех странах как эксперимент на людях, и мы тут уже не сможем отмолчаться».
- Пора меняться. Российское государство заинтересовалось редактированием генома эмбрионов человека
- Правительство РФ запланировало создание 30 видов ГМ-организмов к 2027 году
Свое предложение Куцев формулирует так: запретить клиническое применение технологий редактирования генома эмбрионов и наложить мораторий на эксперименты до тех пор, пока не появится детальное законодательство в этой области. А оно, по его словам, готовится.
Первая попытка
26 ноября 2018 года в Гонконге открылся Международный саммит по вопросам редактирования генома человека, организованный совместными усилиями Национальной академии наук США, британского Королевского общества и Гонконгской академии наук. Среди приглашенных участников были, без особенного преувеличения, все лидирующие геноредакторы планеты — люди, профессионально связанные с применением генной терапии и развитием ее инструментов. На саммите предполагалось обсуждать крайне волнующую и одновременно болезненную тему — как именно должен решаться вопрос о готовности технологии и общества к редактированию эмбрионов людей?
Взвешенной дискуссии, на которую рассчитывали организаторы, однако, не вышло. Первые в истории человечества генно-модифицированные дети к этому моменту уже родились. Об этом стало известно за день до открытия саммита. Родились они в Китае, Академия наук которого за несколько месяцев до начала мероприятия вышла из состава его организаторов.
Героем — со знаком минус — саммита стал Цзянькуй Хэ, мало кому известный молекулярный биолог, получивший образование в США и затем вернувшийся на родину руководить лабораторией в Южном университете науки и технологий (Шэньчжэнь). Ученый, действовавший на свой страх и риск, как было объявлено потом, отредактировал несколько эмбрионов, чтобы внести в ген CCR5 специфическую мутацию delta32. Ее носители неуязвимы для ВИЧ-инфекции.
Дальше был скандал. Хэ осудило практически все научное и медицинское сообщество, китайские власти начали расследование, которое закончилось заявлением о том, что ученый и его коллеги нарушили китайское законодательство (важный нюанс: никаких определенных санкций за это нарушение законодательство не предусматривало). Хэ поставили в вину то, что он нарушил правила получения информированного согласия на эксперимент, то, что работал тайком и что никакой медицинской необходимости в том, чтобы редактировать эмбрионы, не было.
«Мне, как одному из первопроходцев геноредактирования, это было эмоционально очень трудно, — вспоминает Урнов, который был первым, кому позвонил журналист, раскопавший данные об эксперименте Хэ. — Потому что всем ученым хочется, чтобы то, что ты сделал, принесло пользу человечеству. Мы вроде пытаемся вылечить генные заболевания, а тут какой-то геноредактор ни с того ни с сего вроде бы сделал нокаут (то есть «выбил» целевой ген — прим. ТАСС), и во-первых, сделал его плохо! А во-вторых, [в этом] не было никакой медицинской необходимости. Это просто хулиганство. Никаким другим словом, кроме как хулиганство, я не могу это назвать».
«Как врач, я подумал о бессмысленности происходящего, — вспоминает о том дне Куцев. — Понятно, что редактирование гена CCR5 может, во-первых, не привести к желаемому результату: ВИЧ-инфицирование происходит не только в связи с наличием рецепторов CCR5, это понятно всем. А затем пришло и понимание, что абсолютно нет никаких гарантий, что это редактирование не привело к побочным эффектам. К нецелевому редактированию».
Что останавливает науку
Никто из участников саммита тогда не знал, что за несколько месяцев до того в российском журнале «Вестник РГМУ» вышла статья, описывающая эксперименты группы Ребрикова над 16 зиготами человека, непригодными для ЭКО. При помощи системы CRISPR/Cas9 ученые попытались добиться пропажи 32 нуклеотидов в гене CCR5 этих эмбрионов, то есть добиться того же результата, к которому стремилась группа Хэ. Как значится в статье, восемь из 16 зигот дожили до стадии бластоциты, и в пяти из них эмбрионы оказались отредактированы на 100%.
«Когда я увидел статью [Ребрикова], — говорит Урнов, — [то] сразу ему написал. Он ответил связно и немедленно. Но то, что он показал… сказать, что у меня есть чисто технические вопросы о том, а реально ли все это, — это мягко сказано. Экстраординарные заявления требуют экстраординарных подтверждений. Если речь о том, что он может исправить мутацию в зародыше без мозаицизма и без ненацеленных мутаций и сделать это воспроизводимо, то есть на сотнях зародышей, то давайте посмотрим на эти данные. Я этих данных не видел».
Сейчас Ребриков, имея на руках данные эксперимента на 16 зиготах, из которых выжила половина, и чуть больше половины из этой половины оказалась, кажется, отредактирована успешно, заявляет о том, что нашел испытуемых для совсем другого эксперимента — уже не по привитию неуязвимости к ВИЧ, а излечению тугоухости. Как и в случае со внесением мутации CCR5Δ32, это задача, требующая отредактировать один ген. У обоих родителей, которых нашел Ребриков, «сломан» ген GJB2: в нем есть мутация, из-за которой у ее носителей возникают проблемы со слухом. Ее-то и предполагается исправлять.
Между китайским и российским экспериментами есть разница. Хэ просто пытался «сломать», нокаутировать фрагмент гена CCR5 в ДНК эмбриона, чтобы получить мутацию CCR5Δ32. В эксперименте Ребрикова в эмбрион помимо самой системы CRISPR/Cas, нацеленной на нужный ген, вводилась «заплатка» с вариантом гена CCR5Δ32. Это было нужно для того, чтобы система репарации клетки, восстанавливая разрез на ДНК, сделанный редактором, руководствовалась шаблоном, который ей подсунули, и воссоздала на месте разреза нужный ученым вариант гена. Та же схема, по-видимому, будет использоваться и в случае с переписыванием гена GJB2.
Ребриков не просто «ломает», а исправляет гены. Это процедура сложнее технически.
«Ребята, вы хотите отредактировать ребенка методом исправления мутаций. А можно результаты посмотреть? — вопрошает Урнов. — Эта техническая проблема пока не решена. Вышла ровно одна статья в Nature, которая это показала, но никто этого результата больше получить не смог. Когда я смотрю на результаты, на которые [Ребриков] ссылается, я не понимаю, решена эта проблема [в его эксперименте] или нет».
Статья, которую упоминает Урнов, — это работа еще одного авторитетного американского ученого (и тоже российского происхождения) Шухрата Миталипова, в которой тот описывает свою попытку заменить ген MYBPC3, который отвечает за синтез белка, критически важный для формирования сердечной мышцы. Миталипов также столкнулся с проблемой недостаточной точности технологии: у него успех редактирования зародыша достиг 72,4%: из 58 зародышей с мутацией удалось получить 42 здоровых эмбриона.
«То, что Миталипов показывает, биологически невозможно, — не церемонится, однако, с именитым коллегой Урнов. — Я в лаборатории Миталипова не стоял, когда он это делал, поэтому скептицизмом я покрыт с ног до головы. Но и Миталипов, и Хэ сделали достаточное количество молекулярных анализов, которых в «Вестнике» Денис не показал. Обвинять его в недостатке знаний или навыков я никогда не стану. Я уверен, что эти результаты есть. Я уверен, что он все это сделал. Просто я их не видел».
Вторая проблема связана уже не с тем, что у Ребрикова и его команды слишком мало данных, чтобы другие ученые могли поверить в безопасность их технологии. Вторая проблема — фундаментальная для всей области, и из-за нее есть основания не доверять эффективности работы любой системы редактирования генома в эмбрионах.
«Берется яйцеклетка, берется сперматозоид, получается зародыш, одноклеточный. В него иголкой заносится редактор. И этот геноредактор начинает бегать по клетке, находит нужный ген и этот ген исправляет, — описывает механизм процедуры Урнов. — Вот в чем техническая тонкость: зародыш начинает делиться. Эксперименты показали, что геноредактор, он не то что отредактировал то, что нужно, и все, спасибо, до свидания, пошел отдыхать. Он свою работу продолжает. На стадии двух клеток, четырех и даже восьми. Результатом этого является то, что этот зародыш, пока еще состоящий всего из восьми клеток, он генетически неоднороден. Есть клетки отредактированные, а есть нет — этот феномен называется мозаицизм. Как эту проблему решить, не знает никто. Ни один геноредактор на планете Земля — нас сколько, 10, 20 тыс. человек? — ни одной матери в глаза не посмотрит и не скажет: «Знаете, Анна Ивановна, мы тут вам зародыш отредактировали, он лишен мозаицизма, у него все в порядке». Это невозможно сказать. Нет сейчас технологий, которые бы могли позволить сделать это заявление».
Например, насколько можно судить по крайне фрагментарным сведениям о результатах эксперимента Хэ, одна из родившихся девочек мозаична. А значит, она уязвима для ВИЧ — в ее теле есть клетки, в которых «защитная» мутация не появилась, и в них вирус может пробраться. Хотя, конечно, проверить это можно, только заразив ее вирусом, чего делать ни один здравомыслящий не то что врач, а вообще человек не будет.
Третья проблема — это риски нецелевого редактирования. Кроме того, что мы не можем гарантировать, что редактор успеет отработать во всех делящихся клетках зародыша, мы также не можем гарантировать и того, что он не отработает только по своей цели. И даже если другие правки в ДНК эмбриона придутся на «мусорную» часть генома, предсказать, каков будет эффект на здоровье будущего ребенка, невозможно. Мы до сих пор крайне мало знаем о том, какие варианты и каких генов связаны с функционированием организма человека.
«Если мы считаем, что геном человека расшифрован, то это неправда. Мы не все знаем о том геноме, который мы расшифровали. Следовательно, проанализировать, произошло что-то неблагоприятное в геноме или не произошло, мы не можем», — говорит Куцев. И заключает из этого: «Что бы ни случилось у ребенка в его жизни, меня спросят, может это состояние быть результатом того, что он подвергся редактированию? Я на все ситуации могу сказать «не исключено», — разводит руками генетик. — Вот будет он часто болеть ОРВИ, связано ли это? Возможно, связано».
Как найти ошибку
Отправить в эмбрион CRISPR/Cas, нацеленный на определенный участок генома, просто. Но после этого надо еще и проверить, сработала редактура или нет. А это уже намного более сложная процедура.
«Для того чтобы гарантировать, что никаких нет нецелевых эффектов, — а это самое главное! — нужно иметь возможность быстро, эффективно и точно делать фактически de novo секвенирование отдельных клеток (то есть прочтение их генома — прим. ТАСС), выделенных из зародышей на очень ранней стадии, — объясняет Константин Северинов. — При этом нужно гарантировать, что такого рода процедура изъятия клеток для секвенирования не повредит эмбриону».
Когда вы не собираетесь подсаживать отредактированный эмбрион матери, вы, конечно, можете позволить себе секвенировать все его клетки и внимательно изучить, везде ли прошло редактирование и везде ли вам удалось избежать нецелевых мутаций. Но в ходе секвенирования клетка гибнет. Соответственно, если вы работаете с эмбрионом, который затем должен развиться в ребенка, целиком его в секвенатор отправить у вас не получится. Как много предварительных экспериментов вам нужно провести, дабы быть уверенным, что когда вы смотрите на результаты секвенирования одной из сотен клеток бластоцисты, все остальные, не изученные вами, выглядят точно так же? И что изъятие этой клетки не повредило всем остальным? А если добавить к этому то, что точность секвенирования также неидеальна?
«Вот родится ребенок через девять месяцев. У него будут все части: руки, ноги, голова, уши, нос, — загибает пальцы Урнов. — А что если была одна неотредактированная клетка, и именно из нее возникнут органы слуха? И что мы будем делать? Извиняться перед родителями? Это хулиганство, это не наука. Поэтому я, как геноредактор, чисто технически — если забыть про этику, забыть про медицину, забыть про Минздрав, — пока эти проблемы не решены, я не понимаю, о чем может быть разговор. Возможно, у него есть какие-то данные, которые, я надеюсь, в Минздраве тщательно изучат, и он сможет убедить Минздрав, что он эти проблемы решил. Я уверен, что есть в Минздраве опытные генетики, геноредакторы, молекулярные биологи, которые эти данные посмотрят».
Зачем шум
Тем, что в США или Европе подобные эксперименты запрещены, собственно, и объясняется то, что первые генно-модифицированные дети родились в Китае, а по поводу вторых сейчас начинают спорить в России. При иных условиях «отцом» ГМ-детей мог бы давно стать тот же Урнов. Но тот к подобной славе не стремится.
«Я в 2015 году, когда только начались все эти разговоры, в Nature написал длинную статью под названием «Нельзя редактировать генофонд человека», — рассказывает он. — Так что я за мораторий руками, ногами, словами, делами. Не то чтобы Запад населен реакционерами, которые кричат «не пущать!», все с точностью до наоборот. Редактирование соматическое (то есть редактирование взрослых людей, эффект от которого уже не передастся всем последующим поколениям — прим. ТАСС) цветет пышным цветом. Я им занимаюсь, им занимаются сотни человек, десятки биотехнологических компаний, даже крупные фармацевтические типа «Новартиса» или «Пфайзера», у которых рыночная капитализация по $150–200 млрд, это серьезные люди. Россия в этом отношении может быть первопроходцем, но неплохо было бы первопроходить и не упасть под лед, пробирая эту стезю».
В том, что оружием победы человечества над наследственными заболеваниями станут технологии редактирования генома, мало кто в профессиональном сообществе сегодня сомневается. Признает это и Сергей Куцев, протестующий против попытки Ребрикова отредактировать геном нерожденного ребенка родителей с тугоухостью. Экспериментами по соматическому редактированию генома человека системой CRISPR/Cas для лечения наследственных болезней занимаются и в МГНЦ.
«Против прогресса никто не возражает, — говорит генетик. — Наука наукой, но клиника здесь при чем? Уберите руки от клиники, у вас нет диплома врача. У вас нет сертификата врача, у вас никаких навыков работы с пациентами».
Куцев отдельно подчеркивает, что он и его коллеги готовы проконсультировать семьи, которые согласились на участие в эксперименте Ребрикова, и призывает всех тех, кто имеет диплом врача, не вовлекаться в подобные эксперименты.
«Речь идет о клиническом применении непроверенных методов, — продолжает Куцев. — Это недопустимо. Я очень боюсь, что это будет сделано независимо от мнения общественности».
«У общества должна быть некоторая позиция на эту тему, — вторит Куцеву Северинов. — И выработана она должна быть не столько и не только непосредственно техническими специалистами, а широкой общественностью, которая должна включать философов, религиозных деятелей, этиков, юристов. Должна быть дискуссия, обсуждение, а не что-то на уровне того, что Денис зайдет к [министру здравоохранения Веронике] Скворцовой и она ему даст отмашку. Тем более что фактически нет никакой уверенности, что информированное согласие этими парами, которые он нашел, может быть дано. Непонятно, что в этом случае информированное согласие имеет в виду, потому что он не может им на самом деле рассказать, какие могут быть последствия. Чем быстрее будет выработан консенсус и закреплен в законодательстве, тем лучше. Иначе очень скоро в газетах и метро появятся соответствующие предложения от частных клиник. Платежеспособный, но неинформированный — спрос на такие услуги точно будет».
Николай Янковский, директор Института общей генетики РАН, знакомый с противостоянием Ребрикова и Куцева, в беседе с ТАСС воздержался от того, чтобы высказаться за или против моратория. Но не стал отрицать необходимости провести где-то черту.
«Есть научные вопросы, а есть те, которые требуют регуляции. Надо определиться, что здесь требует регуляции и в каких случаях имеет право человек определить, что он сам решит за себя, а где государство должно накладывать ограничения на то, что человек может решить про себя, — сказал ученый. — Эти вопросы надо различать. А то у нас обсуждение идет с точки зрения того, чего бы нам запретить или разрешить. И что вообще очень многие вопросы человек должен иметь право решить сам, это как-то не упоминается. Ребриков говорит о том, что должны быть вещи, которые человек решает сам про себя, он должен иметь на это право. Как это право будет ограничено государством, это пусть государство решит. Но лишать человека права решать за себя не надо».
Иван Шунин
nauka.tass.ru
Британские учёные отредактировали геном человеческого эмбриона в чисто научных целях
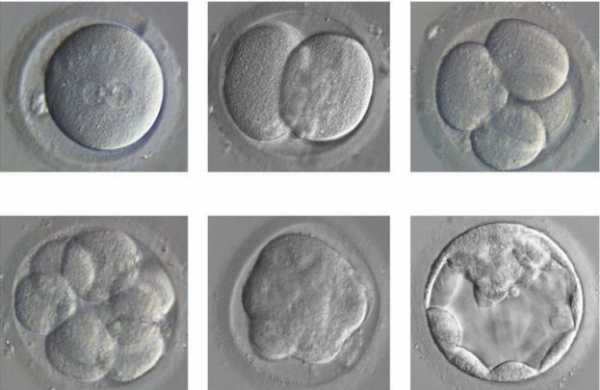 Ранние стадии развития человеческого эмбриона: от зиготы (слева вверху) до бластоцисты (справа внизу).
Ранние стадии развития человеческого эмбриона: от зиготы (слева вверху) до бластоцисты (справа внизу).Группа учёных из Института Фрэнсиса Крика (The Francis Crick Institute) внесла изменения в ДНК человеческих эмбрионов непосредственно после формирования зиготы. За развитием модифицированных эмбрионов исследователи наблюдали на протяжении 7 дней, после чего зародыши были уничтожены.
Как известно, развитие любого человека начинается с одной-единственной клетки, зиготы. Её «потомки» образуют самые разные ткани организма, от твёрдых, как костная, до жидких, как кровь и лимфа. Однако механизмы, лежащие в основе этого превращения, до сих пор не изучены до конца.
Прорыв в модифицировании ДНК позволил команде из Института Крика «выключить» ген, точнее, генетическую инструкцию, которая, предположительно, играет жизненно важную роль в развитии эмбриона. В ходе эксперимента учёные использовали технологию редактирования генома CRISPR-Cas9 и «вырезали» ген OCT4, управляющий ранним эмбриональным развитием.
Для работы исследователи использовали 41 человеческий эмбрион. Все эмбрионы были пожертвованы парами, проходившими ЭКО: фактически, для экспериментов использовались зародыши, оказавшиеся ненужными.
Удалив OCT4 из генома некоторых эмбрионов, учёные начали наблюдать за их развитием. Геном эмбрионов, составивших контрольную группу, модификациям не подвергался.
Обычно за 7 дней нормальный здоровый эмбрион успевает разрастись от одной клетки до двухсот. Кроме того, на этой стадии развития уже наблюдаются первые признаки дифференциации — появляются первые клетки, способные выполнять определённую работу. Формируется полость под названием бластоциста или зародышевый пузырёк — но в отсутствие OCT4 этого не происходит. Бластоциста пытается сформироваться, но постоянно «схлопывается». Для эмбриона это, конечно, катастрофа. А для учёных — бесценная информация.
Впервые в истории геном человеческих эмбрионов был отредактирован, чтобы получить ответ на вопрос фундаментальной биологии.
Доктор Кэти Ниакан (Kathy Niakan), руководитель группы учёных в Институте Крика, рассказывает: «Это базовое исследование, которое дало нам фундаментальную информацию о раннем развитии человека».
Более глубокое понимание самых ранних моментов жизни может помочь разобраться с причинами бесплодия. В ходе ЭКО, из 100 оплодотворённых яйцеклеток менее 50 доходят до стадии формирования бластоцисты, 25 — переносятся в матку и только 13 развиваются дольше трёх месяцев.
Само по себе новое исследование, опубликованное в журнале Nature, не может объяснить, что идёт не так при ЭКО или почему у некоторых женщин случаются выкидыши. Однако изучение всех генов, предположительно играющих ту или иную роль в развитии эмбриона, может привести к появлению новых подходов к лечению бесплодия.
«Если бы мы знали, какие гены необходимы эмбриону для развития — я надеюсь, в будущем нам удастся это выяснить — мы могли бы улучшить вспомогательные репродуктивные технологии и получить ценную информацию о том, почему некоторые беременности заканчиваются неудачей», — добавляет Ниакан.
Этические дебаты
Такого рода эксперименты с человеческими эмбрионами в Великобритании были легализованы в 2008 г. По закону, учёные могут работать с зародышами в возрасте до 14 дней, при условии, что эти зародыши не имплантируются в матку. Однако пока группа авторов нового исследования занималась поиском ответов на фундаментальные научные вопросы, их коллеги пытались научиться удалять гены, вызывающие наследственные заболевания.
Такие работы становятся поводом для многочисленных споров этического толка.
Доктор Сара Чан (Sarah Chan), биоэтик из Эдинбургского университета (University of Edinburgh) говорит: «Я не думаю, что новое исследование должно стать поводом для беспокойства с точки зрения этики. Очевидно, что учёные преследовали чисто научные цели и не собирались создавать генетически модифицированных людей.
Впрочем, если мы однажды начнём использовать редактирование человеческих эмбрионов в медицинских целях, польза от этой методики может быть огромна. Но прежде чем мы сделаем этот шаг, хотелось бы убедиться в том, что уже состоялся активный всесторонний публичный диалог, охвативший все этические вопросы».
22century.ru
Геном жизнеспособного эмбриона человека впервые отредактирован в США
С момента появления революционной технологии геномного редактирования CRISPR учёные провели немало смелых экспериментов. Пожалуй, самым громким стало редактирование генома человеческого эмбриона. Несмотря на призывы о запрете подобных опытов, в 2015 году китайские учёные впервые отредактировали ДНК непособных к жизни эмбрионов человека.
Пока в научном сообществе разгорались этические споры, гены эмбрионов человека продолжали подвергать модификации, правда, с низким уровнем эффективности.
В марте 2017 года метод CRISPR впервые испытали на жизнеспособных человеческих эмбрионах, то есть тех, что потенциально могли стать плодом в чреве женщины и родиться на свет. Тогда на противоречивый эксперимент вновь решились исследователи из Поднебесной, и вот теперь их “догнали” коллеги из Соединённых Штатов.
Собственно, первый эксперимент по редактированию генома человека в Америке стартовал ещё год назад. Теперь же команда под руководством Шухрата Миталипова (Shoukhrat Mitalipov) из Орегонского университета здоровья и науки заявила об успешном редактировании генома человеческого эмбриона.
Эта работа превзошла все предыдущие как по количеству эмбрионов, которые подверглись модификации, так и по результативности. Команда продемонстрировала, что безопасно и эффективно исправлять дефектные гены, отвечающие за наследственные заболевания, стопроцентно возможно.

Шухрат Миталипов, американский исследователь казахского происхождения, совершивший со своей командой прорыв в редактировании генома жизнеспособных эмбрионов человека.
Хотя ни одному из эмбрионов не позволили развиваться больше нескольких дней (и тем более не планировалось проводить с их помощью искусственное оплодотворение), эксперимент наглядно показал возможность создания генетически модифицированных людей.
Поясним, что при изменении кода ДНК человеческих эмбрионов цель учёных состоит в том, чтобы показать, что они могут «исправить» гены, ведущие к появлению таких болезней, как, например, бета-талассемия — это опасное заболевание крови.
Сам процесс такой модификации эксперты называют инженерией клеток зародышевой линии. Поскольку если допустить рождение ребёнка с «исправленной» ДНК, то он передаст изменения последующим поколениям через собственные клетки – яйцеклетку или сперму.
Вот почему такие эксперименты вызывают этические споры: теоретически исследователи могут создавать «дизайнерских» детей, то есть генетически усовершенствованных. Против такой перспективы сегодня решительно выступает ряд религиозных организаций, некоторые общественные деятели и биотехнологические компании, а технологию CRISPR уже называют потенциальным оружием массового уничтожения.
Более того, предыдущие исследования китайцев выявили некоторые ошибки, появляющиеся в процессе редактирования, и показали, что изменения ДНК могут затронуть не все клетки, а лишь некоторые. Это явление называется генетическим мозаицизмом. Американцем же удалось всего этого избежать: они доказали, что можно обойти как мозаицизм, так и «внецелевое» действие (или попросту ошибки) работы системы CRISPR.
Сам Шухрат Миталипов отказался давать комментарии, однако его коллеги подтвердили успешность экспериментов.
Известно, что в своём исследовании команда использовала несколько десятков эмбрионов, созданных благодаря сперме, предоставленной добровольцами-носителями унаследованных мутаций. Правда, пока что остаётся неизвестным, какие именно гены подверглись редактированию.
На видео ниже показано, как химические вещества, модифицирующие нужный ген, вводятся в яйцеклетку в момент оплодотворения.
Несмотря на очередной успех, споры вокруг редактирования генома человеческих эмбрионов продолжаются. Многие исследователи уже выступили в поддержку идеи о том, что в принципе нет ничего страшного в модифицировании, если речь идёт о серьёзных наследственных заболеваниях, угрожающих жизни будущего человека.
В то же время эксперты едины во мнении относительно любых генетических усовершенствований, например, для создания детей с потенциально более высоким интеллектом.
«Редактирование генома для улучшения каких-либо характеристик или способностей, а не здоровья, вызывает озабоченность по поводу того, могут ли преимущества превышать риски, и справедливо ли, что такие эксперименты будут доступны лишь немногим людям», — заключает Альта Чаро (Alta Charo), сопредседатель исследовательского комитета Национальной Академии наук США и профессор права и биоэтики в Висконсинском университете в Мэдисоне.
Сегодня в Штатах любые попытки дать жизнь эмбриону с отредактированной ДНК запрещены на законодательном уровне. Кроме того, существует законопроект об остановке любого финансирования подобных клинических испытаний. Впрочем, несмотря на такие барьеры, создание «генно-модифицированного» человека может осуществиться в любой стране, где правовых ограничений на этот процесс нет.
nauka.vesti.ru
Человеческим эмбрионам снова отредактировали геном
С помощью системы генетического редактирования CRISPR/Cas эмбрионы человека избавили от мутации, вызывающей болезнь сердца.
В 2015 году в журнале Protein & Cell появилась без преувеличения эпохальная статья китайских исследователей, в которой они описывали, как им удалось отредактировать гены в человеческом эмбрионе. Использованные в экспериментах эмбрионы изначально не смогли бы развиваться, как надо – яйцеклетки были оплодотворены сразу двумя сперматозоидами, а в таких случаях дальше самых-самых первых этапов эмбриогенеза дело не идет – так что результаты лишь указывали на возможность подобной процедуры с человеческим материалом. Тем не менее, сразу после выхода статьи среди специалистов в генной инженерии и биотехнологии возникал бурная дискуссия о том, этично ли вот так вмешиваться в человеческие гены.
Заодно масса людей узнала про метод CRISPR/Cas – именно с его помощью правили гены у эмбриона. Этот метод мы неоднократно описывали, так что сейчас напомним лишь, что изначально систему CRISPR/Cas обнаружили в бактериях, у которых она служит для защиты от вирусов; впоследствии же оказалось, что молекулярную машину CRISPR/Cas можно использовать для точного исправления последовательности ДНК в клетках животных и растений (впрочем, насчет точности метода в последнее время появляются некоторые сомнения). Перспективы у CRISPR/Cas оказались настолько заманчивыми, что исследователи все-таки решили, что можно использовать метод и с человеческими зародышами. И вот сейчас, спустя два года после пресловутой статьи в Protein & Cell выходит статья в Nature, в которой описывается, как человеческий зародыш с помощью CRISPR/Cas избавили от опасной мутации, приводящей к сложному сердечному расстройству.
Шухрат Миталипов и его коллеги из Орегонского университета науки и здоровья взяли более ста яйцеклеток, чтобы оплодотворить их сперматозоидами, у которых была мутация в гене MYBPC3. Дефекты в этом гене ведут к развитию гипертрофической кардиомиопатии: стенка сердечной мышцы становится ненормально толстой, волокна в ней располагаются неправильно, в итоге нарушается ритм сокращений, возникает сердечная недостаточность и т. д. Мужчине, чьи сперматозоиды использовали в эксперименте, из-за генетической кардиомиопатии в свое время пришлось поставить имплантат-дефибриллятор. Цель же исследователей была в том, чтобы получить эмбрионы без мутации в MYBPC3.
Молекулярный аппарат для редактирования генов вводили в оплодотворенную яйцеклетку, причем в некоторые яйцеклетки CRISPR/Cas вводили сразу же после оплодотворения, а в другие – спустя несколько часов. Редактирующая машина должна была исправить мутацию в отцовских генах. Яйцеклетка после прибытия сперматозоида какое-то время ждет, осваиваясь с полученным «грузом», а потом начинает подготовку к делению. Перед делением вся ДНК удваивается, соответственно, в эмбрионе появляется вторая копия мутантного гена. Если редактирующая машина войдет в зародыш чуть погодя, ей надо будет исправить дополнительную копию нужного гена, но она не всегда это делает – в результате получается то, что называется мозаицизмом: у эмбриона есть две разные копии одного и того же гена, и впоследствии какие-то клетки получают нормальную версию, а какие-то – мутантную. Предварительные опыты с мышиными эмбрионами показали, что если ввести CRISPR/Cas-редактор почти одновременно с оплодотворением, то мозаицизма можно избежать. Новые эксперименты это только подтвердили: из 58 яйцеклеток, которым вводили CRISPR/Cas сразу после оплодотворения, у 42 зародышей редактирование прошло успешно, а мозаичным по редактируемому гену оказался только один. С другой стороны, среди 54 эмбрионов, которым вводили редактирующую машину через 18 часов после оплодотворения, мозаичными оказались целых тринадцать. (Сами редактирующие молекулы, сделав свое дело, быстро распадались.)
Важно подчеркнуть, что здесь зародыши были абсолютно нормальными, в них не было никаких хромосомных аномалий, как в зародышах из китайской статьи, и, в принципе, если бы их пересадили женщине, из них могли бы получиться здоровые дети без мутации и без кардиомиопатии. С другой стороны, легко заметить, что эффективность метода CRISPR/Cas не стопроцентная – лишь 75% эмбрионов удалось избавить от мутации. Если же говорить о возможном применении CRISPR/Cas в клинике, то крайне желательно, чтобы он работал во всех зародышах, а не в 75%.
Наконец, есть известная проблема точности CRISPR-редактирования, о которой мы писали буквально на днях. Авторы работы уверяют, что никакого «левого редактирования» в подопытных эмбрионах не случилось. В то же время сама мутация в гене MYBPC3 была достаточно редкой: действительно, изменения в MYBPC3 обычно оказываются наиболее вероятной причиной гипертрофической кардиомиопатии, но ведь изменения в ДНК могут быть разными. И в некоторых случаях, нацеливая машину CRISPR/Cas на какой-нибудь дефект в нужном гене, мы можем вдруг обнаружить, что похожие цели есть и в других участках нашей необъятной ДНК, только в других участках они никакие не дефекты.
Но в целом исследователи добились своей цели – они показали, что редактирующий метод CRISPR/Cas работает на здоровых эмбрионах, которые могут нормально развиться. И даже если до клиники дело не дойдет, из таких экспериментов можно получить массу полезных данных. Например, сейчас вдруг удалось увидеть, что зародыши исправляют свою ДНК после вмешательства CRISPR/Cas не так, как другие клетки. Ферменты системы CRISPR/Cas вырезают фрагмент ДНК с мутацией, так что клетке приходится ставить тут заплатку. В качестве шаблона для заплатки вместе молекулярным редактором в клетку запускают образец – кусочек ДНК с нужной последовательностью, на основе которой клетка латает собственную хромосому; и именно так делают, например, стволовые клетки. Зародыши же поступают иначе – они не обращали никакого внимания на ту ДНК, которую им ввели извне, используя материнские хромосомы в качестве образца для заплатки на хромосомы отцовские.
Встреча человеческого сперматозоида и человеческой яйцеклетки. (Фото Dennis Kunkel Microscopy, Inc. / Visuals Unlimited / Corbis.)
Эмбрионы человека после редактирования генов продолжили делиться, как ни в чем не бывало. (Фото: Oregon Health & Science University.)
Шухрат Миталипов. (Фото: Leah Nash / NYT / Redux / eyevine.)
‹
›
www.nkj.ru
Сохранить изменения?. Ученые впервые успешно отредактировали человеческий эмбрион
О результатах ученых ранее сообщал MIT Technology Review со ссылкой на «людей, знакомых с результатами исследования». Это первое исследование такого рода в США после выхода рекомендаций Американской академии наук о редактировании генома человека (один из соавторов, Ицписуа Бельмонте, входил в состав комиссии, подготовившей эти рекомендации).
В новом исследовании ученые «чинили» мутацию в гене MYBPC3 на 11-й хромосоме, на которую приходится около 40% всех случаев наследственной гипертрофической кардиомиопатии. Гипертрофическая кардиомиопатия (ГКМП) — одно из более чем 10 тысяч наследственных заболеваний, вызываемых «поломкой» в одном гене. На данный момент заболевание, которое встречается примерно у одного из 500 человек, неизлечимо: оно проявляется только у взрослых и может стать причиной остановки сердца и смерти у внешне здоровых молодых людей.
 Изображение: Npatchett at English Wikipedia / Wikimedia Commons / CC BY-SA 3.0
Изображение: Npatchett at English Wikipedia / Wikimedia Commons / CC BY-SA 3.0Группа Шухрата Миталипова из Орегонского университета здравоохранения работала с донорскими яйцеклетками 12 здоровых женщин и донорской спермой одного мужчины, имеющего мутацию гена MYBPC3. Сначала они проверяли точность и эффективность работы системы CRISPR-Cas9 на индуцированных плюрипотентных стволовых клетках, а затем использовали лучшие варианты на зиготах.
Если не предпринимать никаких действий, шанс унаследовать здоровую копию гена для эмбриона составляет 50% (ошибочную копию гена несет каждый второй сперматозоид). В то же время с помощью CRISPR-Cas9 ученым удалось получить 42 здоровых эмбриона из 58 (72,4%). В оставшихся 16 эмбрионов генетические «ножницы» привели к появлению нежелательных вставок или вырезанных фрагментов ДНК.
«Это статистически значимая разница, которая свидетельствует о том, что почти в половине зигот с мутацией произошло редактирование. Если бы гипотетическая пара, в которой один или оба партнера имеют ГКМ, решила бы завести ребенка и хотела бы, чтобы он не имел этой болезни, то применение редактирования существенно повысило бы вероятность получения желаемого эмбриона», — пояснил «Чердаку» Константин Северинов, профессор Сколтеха и Университета Ратгерса (США), заведующий лабораториями Института молекулярной генетики и Института биологии гена РАН.
«Мы получили больше здоровых эмбрионов [чем в контрольной группе], но пока их не 100%, так что, я думаю, у нас есть возможность улучшить этот результат. Мы можем добиться эффективности в 90−100%», — сказал Миталипов на пресс-конференции во вторник.
В отличие от предыдущих, крайне неточных, работ китайских ученых группа Миталипова вводила генетические «ножницы» Cas9 с образцом РНК одновременно со сперматозоидом, а не позже — таким образом им удалось избежать мозаичности эмбриона, когда часть его клеток все же получают неотредактированную ДНК.
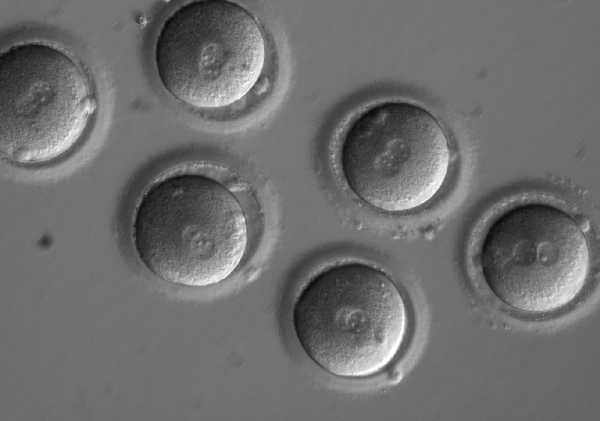 Зиготы с пронуклеусами. Фото: OHSU
Зиготы с пронуклеусами. Фото: OHSUСеверинов добавил, что в более ранних опытах по редактированию эмбрионов белок-редактор работал недостаточно точно: кроме редактирования нужного места во многих эмбрионах обнаруживались нежелательные мутации. В данной работе такого нецелевого редактирования не наблюдалось.
«Возможно, авторам просто повезло, и их гидовая РНК оказалась менее склонной к узнаванию „неправильных“ мест. Кроме того, большое влияние на повышение точности сыграл способ, которым вводился редактор», — сказал Северинов.
Нергес Винблад и Фредрик Ланнер из Каролинского института в Швеции в комментарии к научной статье поясняют, что после надреза, сделанного Cas9, ДНК может восстанавливаться двумя способами. В одном случае используются случайные вставки нуклеотидов (этот способ называется NHEJ, негомологичное соединение концов), в другом ДНК копируется с образца синтетической РНК, принесенной вместе с системой CRISPR, или второй, здоровой копии гена (это HDR, гомологичная рекомбинация).
Как выяснилось, почти все зиготы использовали именно второй, более предпочтительный способ, копируя при этом вторую копию своего же гена, — синтетическим образцом «воспользовался» лишь один эмбрион. Это довольно неожиданный результат — так не ведут себя ни эмбрионы других видов, ни соматические, то есть взрослые неполовые, клетки и причины этого еще предстоит изучить.
«Редактированные эмбрионы развивались аналогично контрольным, и 50% достигли ранней стадии развития бластоцисты, когда эмбрионы уже имеют клетки разных типов. Это говорит о том, что редактирование генов не мешает развитию эмбриона», — отмечают ученые в комментарии.
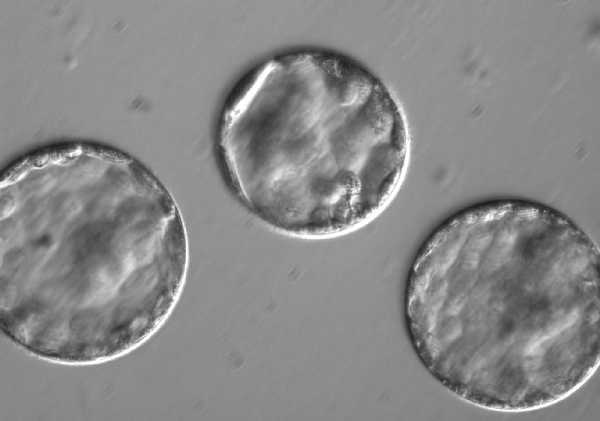 Бластоцисты. Фото: OHSU
Бластоцисты. Фото: OHSUАвторы нового исследования подчеркивают, что редактирование ДНК с помощью CRISPR-Cas9 в сочетании с экстракорпоральным оплодотворением и предимплантационной генетической диагностикой в теории могут помочь справиться и с другими генетическими болезнями. Однако, по их словам, прежде чем переходить к клиническим испытаниям этой технологии, ее нужно «оптимизировать». Помимо этого, ученых интересуют и другие мутации в генах, вызывающие кардиомиопатию, а также печально известные гены BRCA, мутации которых вызывают рак груди.
«В дальнейшем мы можем заняться и гомозиготными мутациями [когда повреждены обе копии гена]. В этом случае ситуация сложнее, потому что нет здорового образца, с которого можно было бы копировать ген после использования CRISPR-Cas9. Нам придется очень много поработать над тем, чтобы заставить эмбрионы использовать внешние образцы», — сказал на пресс-конференции Миталипов.
По мнению Северинова, теперь важно показать, насколько разработанная процедура применима как для других вариантов этого же гена, так и для других генов, ответственных за различные моногенные болезни.
«С неизбежностью в относительно недалеком будущем будет проведено редактирование и ЭКО, в результате которого родятся детишки. Избежать этого невозможно: слишком много людей, которые хотят иметь здоровых детей и для которых такого рода процедуры — единственная возможность осуществить это желание», — заключил ученый.
Ольга Добровидова
nauka.tass.ru
Зачем редактировать гены и отбирать эмбрионы — Wonderzine
В конечном итоге наша деятельность сводится к тому, чтобы вместо больного ребенка родился здоровый. Отбор, описанный выше, — один из способов этого добиться. Но есть другой вариант: те эмбрионы, которые есть, изменить так, чтобы они стали нормальными. Бытовое название у этого — редактирование генома. Сейчас появились хорошие технологии, которые позволяют это делать достаточно эффективно, в том числе технология CRISPR/Cas9. Что сделали в Китае: там взяли человеческий эмбрион и заменили ген, приводящий к мутации рака в молочной железе и яичниках, на нормальный. Эмбрион, разумеется, не переносили в матку, так что его развитие, как и положено, остановилось на 6-й день.
В Китае это разрешено. В остальном мире после этого начали суетиться — больше всех те, кто занимался технологией CRISPR/Cas9, но не на эмбрионах, а на образцах клеток, выделенных из периферической крови. Это так называемая ex vivo генная терапия, когда берут клетки из периферической крови, отбирают лейкоциты, вносят в них определенные генетические изменения, а потом пересаживают обратно. Таким образом можно лечить некоторые заболевания, связанные с работой костного мозга. Люди, которые этим занимаются, испугались, что сейчас генотерапию закроют всю, и, чтобы этого не допустить, они выступили с призывом запретить конкретно работу с эмбрионами. В Штатах такие опыты запретили.
Главный вопрос касательно технологии CRISPR/Cas9 или того, что проделали в Китае, — это насколько много или мало они создают новых мутаций, помимо тех, что они исправляют. С любой генотерапией такая опасность есть. В свое время генотерапия была очень сильно заторможена одним очень негативным клиническим случаем: ребенка лечили от некоего наследственного заболевания, но параллельно исправлениям в клетках случилась какая-то другая мутация, из-за чего у ребенка возник рак крови. После этого генотерапия стала развиваться гораздо медленнее, чем могла бы, потому что сырую технологию слишком рано запустили в клиническое применение.
Технология CRISPR/Cas9 находится в процессе анализа. Для того чтобы выяснить, достаточно ли она точна, проводится огромный объем научной работы. В Китае же было принципиально показать, что отредактировать человеческий эмбрион возможно. Дальше будет длинный период, когда эта технология будет подтверждать свою эффективность, безопасность, точность и так далее. Когда выяснится, что на 99 % всё хорошо, то, скорее всего, ею можно будет пользоваться.
www.wonderzine.com
