Гигантская листовидная опухоль молочной железы
Волченко А.А., Пак Д.Д., Усов Ф.Н., Фетисова Е.Ю., Ефанов В.В.
Московский научно-исследовательский онкологический институт им. П.А. Герцена, Москва, Россия
Опубликовано: Журнал «Онкохирургия», 2012, том 4, №2.
В статье представлено клиническое наблюдение гигантской листовидной опухоли молочной железы.
Материалы и методы. Приводим наблюдение успешного хирургического лечения больной В. 49 лет с гигантской листовидной опухолью левой молочной железы, данные УЗИ, маммографии, морфологического исследования, литературный обзор.
Результаты. Листовидная (филлодная) опухоль – редко встречающийся вариант фиброэпителиальной опухоли, состоящий из эпителиальной и соединительнотканного компонентов с преобладающим развитием последнего. Это название происходит от греческого слова phyllon – лист, отсюда правильнее называть листовидная или филлодная, а не листообразная или филлоидная опухоль.
Этот тип новообразований встречается редко и составляет 2-3% от фиброэпителиальных опухолей молочной железы и 0,3-1% от всех опухолей молочной железы у женщин. Присутствие эпителиального компонента отличает листовидную опухоль от саркомы. Ведущим морфологическим признаком листовидных опухолей молочных желез является гиперцеллюлярность, богатство стромы веретенообразным клетками типа фибробластов. Отсутствие указанного признака исключает диагноз листовидной опухоли. Дифференциальными морфологическими признаками листовидной опухоли и фиброаденом являются преобладание соединительнотканного компонента над эпителиальным в сочетании с выраженной клеточностью соединительнотканного компонента.
Пик заболеваемости у женщин приходится на 45-49 лет, однако филлодная опухоль может развиваться от подросткового до пожилого возраста. Примерно от 15% до 30% листовидных опухолей являются злокачественными. Гистологический тип листовидной опухоли является важным прогностическим фактором: пятилетняя выживаемость при доброкачественных листовидных опухолях по данным Reinfuss, et al. составляет 95,7%, пограничных – 73,7%, злокачественных – 66,1%. По данным Chaney, et al., при доброкачественных и пограничных листовидных опухолях – до 91%, злокачественных – до 82%. Метастазы злокачественных листовидных опухолей наблюдаются в 25-30%, тогда как для всех листовидных опухолей не более чем в 4% случаев. Основной путь метастазирования – гематогенный, чаще всего метастазы обнаруживают в легких, плевре и костях. Менее 1% злокачественных листовидных опухолей метастазируют в подмышечные лимфоузлы.
составляет 95,7%, пограничных – 73,7%, злокачественных – 66,1%. По данным Chaney, et al., при доброкачественных и пограничных листовидных опухолях – до 91%, злокачественных – до 82%. Метастазы злокачественных листовидных опухолей наблюдаются в 25-30%, тогда как для всех листовидных опухолей не более чем в 4% случаев. Основной путь метастазирования – гематогенный, чаще всего метастазы обнаруживают в легких, плевре и костях. Менее 1% злокачественных листовидных опухолей метастазируют в подмышечные лимфоузлы.
Лечение листовидных опухолей молочной железы хирургическое. Вероятность локальных рецидивов составляет около 20% при наличии клеток опухоли в краях резекции. Рутинная подмышечная лимфодиссекция не рекомендована. При злокачественном варианте листовидной опухоли обсуждается применение комплексного лечения.
Приводим наблюдение успешного хирургического лечения больной с гигантской листовидной опухолью левой молочной железы.
Выводы. Данный случай демонстрирует редкое клиническое наблюдение, когда доброкачественное новообразование при несвоевременном обращении пациента к врачу привело к обширному хирургическому вмешательству и утрате органа.
Данный случай демонстрирует редкое клиническое наблюдение, когда доброкачественное новообразование при несвоевременном обращении пациента к врачу привело к обширному хирургическому вмешательству и утрате органа.
Ключевые слова: листовидная опухоль молочной железы, гистологическая картина, хирургическое лечение
Листовидная (филлодная) опухоль – редко встречающийся вариант фиброэпителиальной опухоли, состоящий из эпителиального и соединительнотканного компонентов с преобладанием последнего. Это название происходит от греческого слова phyllon – лист, отсюда правильнее называть листовидная, или филлодная, а не листообразная, или филлоидная опухоль.
Впервые подробно листовидную опухоль описал J. Muller в 1838 г., дав ей название cystosarcoma phyllodes по двум ее компонентам: кистозным полостям и фиброзной ткани, напоминающей таковую при саркоме и имеющей вид листа капусты на разрезе макропрепарата [7].
Пик заболеваемости у женщин приходится на 45-49 лет [6], однако филлодная опухоль может развиваться от подросткового до пожилого возраста [11].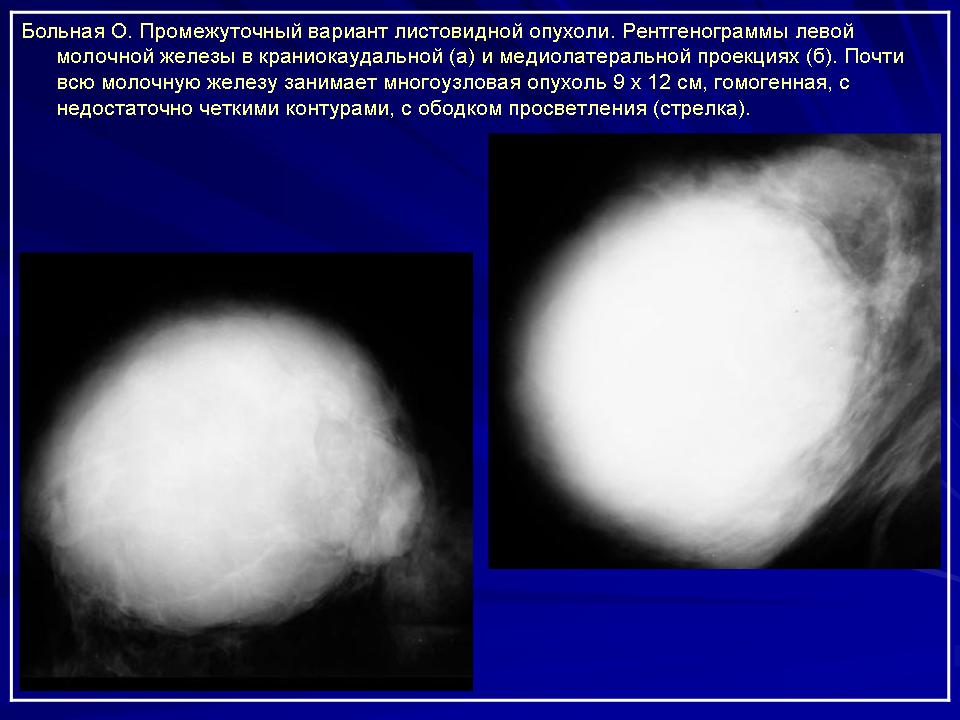 В литературе встречаются описания единичных наблюдений возникновения листовидной опухоли молочной железы у мужчин [5]. В настоящее время существует более 60 наименований данного новообразования, однако, по мнению ВОЗ, наиболее уместным является термин «листовидная опухоль» [9]. В иностранной литературе отдается предпочтение таким названиям, как гигантская фиброаденома и филлоидная цистосаркома. Среди листовидных опухолей Liang M. и соавт. (2008) выделяют доброкачественные, пограничные и злокачественные [6]. Для определения злокачественности процесса используют гистологические критерии, предложенные J. Azzopardi [3]. От 15% до 30% листовидных опухолей являются злокачественными [6]. Гистологический тип листовидной опухоли является важным прогностическим фактором: пятилетняя выживаемость при доброкачественных листовидных опухолях, по данным Reinfuss M. и соавт. (1996), составляет 95,7%, пограничных – 73,7%, злокачественных – 66,1% [10], по данным Chaney A.W. и соавт. (2000), при доброкачественных и пограничных листовидных опухолях – до 91%, при злокачественных – до 82% [4].
В литературе встречаются описания единичных наблюдений возникновения листовидной опухоли молочной железы у мужчин [5]. В настоящее время существует более 60 наименований данного новообразования, однако, по мнению ВОЗ, наиболее уместным является термин «листовидная опухоль» [9]. В иностранной литературе отдается предпочтение таким названиям, как гигантская фиброаденома и филлоидная цистосаркома. Среди листовидных опухолей Liang M. и соавт. (2008) выделяют доброкачественные, пограничные и злокачественные [6]. Для определения злокачественности процесса используют гистологические критерии, предложенные J. Azzopardi [3]. От 15% до 30% листовидных опухолей являются злокачественными [6]. Гистологический тип листовидной опухоли является важным прогностическим фактором: пятилетняя выживаемость при доброкачественных листовидных опухолях, по данным Reinfuss M. и соавт. (1996), составляет 95,7%, пограничных – 73,7%, злокачественных – 66,1% [10], по данным Chaney A.W. и соавт. (2000), при доброкачественных и пограничных листовидных опухолях – до 91%, при злокачественных – до 82% [4].
Лечение листовидных опухолей молочной железы – хирургическое. В случае малых размеров опухоли – это широкое иссечение с чистыми краями резекции, при больших размерах образования – простая мастэктомия. Вероятность локальных рецидивов составляет около 20% при наличии клеток опухоли в краях резекции. Рутинная подмышечная лимфодиссекция не рекомендована. При злокачественном варианте листовидной опухоли обсуждается применение комплексного лечения [8].
Приводим наблюдение успешного хирургического лечения больной с гигантской листовидной опухолью левой молочной железы.
Б-я В., 49 лет, поступила в отделение общей онкологии МНИОИ им.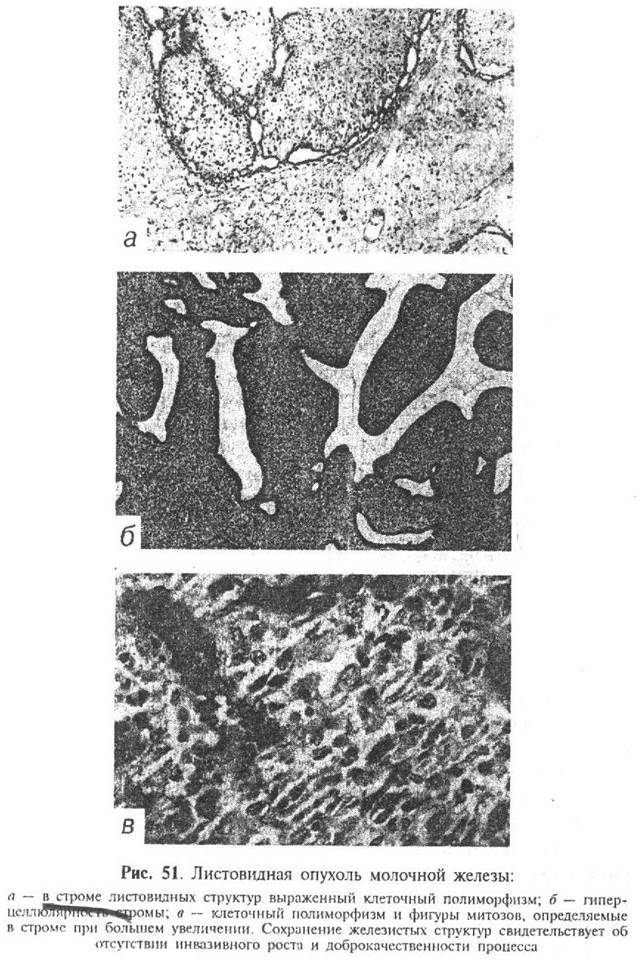
При осмотре левая молочная железа значительно увеличена за счет опухолевого компонента. Поверхность молочной железы неровная, бугристая (рис. 1). Кожа над опухолью не изменена, под ней контурируются крупные извитые сосуды. Пальпаторно ткани измененной левой молочной железы плотноэластической консистенции. Опухоль подвижна относительно грудой стенки. В подмышечной области на стороне поражения определяются увеличенные до 2 см лимфатические узлы.
Пальпаторно ткани измененной левой молочной железы плотноэластической консистенции. Опухоль подвижна относительно грудой стенки. В подмышечной области на стороне поражения определяются увеличенные до 2 см лимфатические узлы.
Рис. 1. Больная В., 45 лет, внешний вид.
УЗИ: вся левая молочная железа замещена опухолевым образованием гипоэхогенной многоузловой структуры. В подмышечной области определяются измененные, увеличенные лимфатические узлы. Проведена трепан-биопсия опухоли. По результатам гистологического исследования биопсийного материала картина более всего соответствует фиброаденоме. Злокачественного опухолевого роста не обнаружено. Маммография: опухоль занимает весь объем левой молочной железы (тотальное затемнение) (рис. 2).
Рис. 2. Маммография больной В., 45 лет. Описание в тексте.
Принимая во внимание клиническую картину, данные обследования (УЗИ, маммография) и морфологическое исследование биоптата из опухоли, пациентке выполнена мастэктомия слева.
Во время операции, при отсепаровке молочной железы, в подкожной клетчатке пересекали и лигировали множество патологически измененных сосудов крупного калибра, диаметром до 6 мм. По краю большой грудной мышцы определялись плотные фиброзные тяжи, в которых проходили кровеносные сосуды, питающие опухоль, сопоставимые по диаметру с подмышечной артерией и веной. При ревизии подмышечной области пальпировались и визуально определялись множественные увеличенные до 2 см в диаметре лимфатические узлы эластической консистенции. Выполнена подмышечная лимфаденэктомия. Ранний послеоперационный период протекал без осложнений. Лимфорея не отмечалась. На 2 сутки после операции удален дренаж, на 5-е пациентка выписана из отделения для продолжения лечения в амбулаторных условиях.
Плановое гистологическое исследование: удаленная молочная железа размерами 34×33×16 см. Сосок не изменен. Железа диффузно уплотнена, с крупнобугристой поверхностью. На разрезе в ткани железы определяется опухолевый узел размерами 28×17×20 см, занимающий практически всю толщу ткани железы (определяется по периферии узла). Узел четко отграничен, представлен плотной, волокнистой, розовато-белой дольчатой тканью с крупными сероватыми участками отека, кистозными полостями с полиповидными образованиями, представленными аналогичного вида тканью, мелкоочаговыми кровоизлияниями (рис. 3). Из подмышечной клетчатки выделено 15 эластичных лимфатических узлов диаметром 1-3 см. Микроскопическая картина (рис. 4, 5, 6): листовидная опухоль молочной железы с крупными участками отека, гиалиноза стромы, разрозненными участками клеточного строения стромы с умеренно выраженным полиморфизмом клеток и единичными митозами в редких полях зрения; сосок обычного строения, в окружающей ткани железы – картина мастопатии. В исследованных лимфатических узлах без опухолевого роста.
Узел четко отграничен, представлен плотной, волокнистой, розовато-белой дольчатой тканью с крупными сероватыми участками отека, кистозными полостями с полиповидными образованиями, представленными аналогичного вида тканью, мелкоочаговыми кровоизлияниями (рис. 3). Из подмышечной клетчатки выделено 15 эластичных лимфатических узлов диаметром 1-3 см. Микроскопическая картина (рис. 4, 5, 6): листовидная опухоль молочной железы с крупными участками отека, гиалиноза стромы, разрозненными участками клеточного строения стромы с умеренно выраженным полиморфизмом клеток и единичными митозами в редких полях зрения; сосок обычного строения, в окружающей ткани железы – картина мастопатии. В исследованных лимфатических узлах без опухолевого роста.
Заключение: листовидная опухоль пограничного строения (9020/1).
Рис. 3. Препарат удаленной опухоли.
Рис. 4. Листовидная опухоль.
Окраска гематоксилин-эозин, увеличение 5×10.
Рис. 5. Листовидная опухоль пограничного типа.
Выраженная пролиферация клеточных элементов стромы, митозы отсутствуют.
Окраска гематоксилин-эозином, увеличение 20×10.
Рис. 6. Пролиферация эпителия и клеточных элементов стромы.
Окраска гематоксилин-эозином, увеличение 20×10.
Данная больная демонстрирует редкое клиническое наблюдение, когда доброкачественное новообразование привело к обширному оперативному вмешательству и утрате органа.
Литература
- Кампова-Полева Е.Б., Чистяков С.С. Клиническая маммология. Современное состояние проблемы. М.: ГЭОТАР-Мед, 2006; 144-182.
- Кочергина Н.В., Корженкова Г.П., Ермилова В.Д., Воротников И.К., Курдюков Л.Н., Притула С.И., Зимина О.Г. Что такое листовидная опухоль молочных желез? Медицинская визуализация, 2000; 4: 54-59.

- Azzopardi JG. Prohh’nis in Breast Patholonn. Philadelphia: WB Saunders, 1979; 346-365.
- Chaney AW, Pollack A, McNeese MD, Zager GK, Pisters PW, Pollock RE et al. Primary treatment of cystosarcoma phyllodes of the breast. Cancer. 2000; 89: 1502-1511.
- Kahan Z, Toszegi AM, Szarvas F, et al. Reccurent phyllodes tumor in a man. Path Res Prac. 1997; 193(9): 653-658.
- Liang М, Ramaswamy В, Patterson С, McKelvey М, Gordillo G, Nuovo G, Carson W. Giant breast tumors: Surgical management of phyllodes tumors, potential for reconstructive surgery and a review of literature. World J Surg Oncol. 2008; 6: 117.
- Muller J. Uber den feinern bau und die formen der krankhaften geschwulste. Vol.1. Berlin: Reimer, 1838; 54-60.
- Muttarak M, Lerttumnongtum P, Somwangjaroen A, Chaiwun B. Phyllodes tumour of the breast. Biomed Imaging Interv J. 2006; 2(2): 33.
- Parker SJ, Harries SA. Phyllodes tumours. Postgrad Med J. 2001; 77: 428-435.

- Reinfuss M, Mitus J, Duda K, Stelmach A, Rys J, Smolak K. The treatment and prognosis of patients with phyllodes tumor of the breast: An analysis of 170 cases. Cancer. 1996; 77: 910-916.
- Stromberg BV, Golladay ES. Cystosarcoma phylloides in the adolescent female. J Pediatr Surg. 1978; 13: 423-425.
ФИЛЛОИДНЫЕ ОПУХОЛИ МОЛОЧНЫХ ЖЕЛЕЗ. СОВРЕМЕННОЕ СОСТОЯНИЕ ПРОБЛЕМЫ | Зикиряходжаев
1. Atalay C, Kinas V, Celebioglu S. Analysis of patients with phylloides tumor of the breast. Turkish J Surg. 2014; 30 (3): 129–132. DOI: 10.5152/UCD.2014.2719
2. Волченко А. А., Пак Д. Д., Усов Ф. Н., Фетисова Е. Ю., Ефанов В. В. Гигантская листовидная опухоль молочной железы. Онкохирургия. 2012; 4 (2): 77–80.
3. Müller J.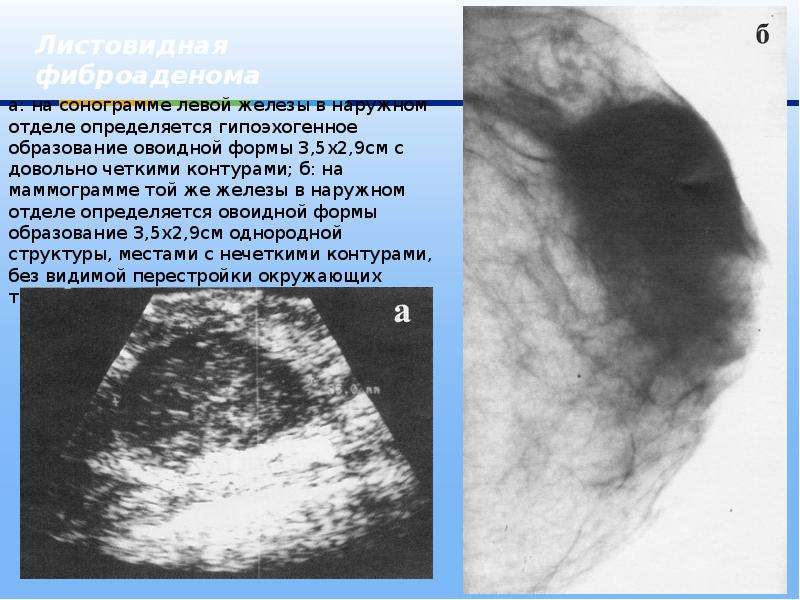 Über den feineren Ban und die Formen der Krankaften Geschwulste. Berlin: G Reiner. 1838; 1: 54–57.
Über den feineren Ban und die Formen der Krankaften Geschwulste. Berlin: G Reiner. 1838; 1: 54–57.
4. World Health Organization Histological typing of breast tumors. Tumori. 1982; 68: 181–198.
5. Liang М, Ramaswamy В, Patterson С, McKelvey MT, Gordillo G, Nuovo GJ, et al. Giant breast tumors: Surgical management of phyllodes tumors, potential for reconstructive surgery and a review of literature. World J Surg Oncol. 2008; 6: 117. DOI: 10.1186/1477–7819–6-117
6. Tavassoli FA, Devilee P.Pathology and genetics of tumours of the breast and female genital organs. In: World Health Organization Classification of Tumours, IARC Press, Lyons 2003. p. 99.
7. Bernstein L, Deapen D, Ross RK.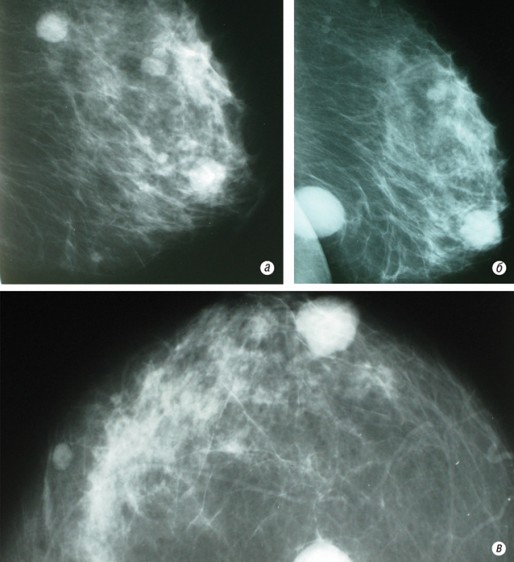 The descriptive epidemiology of malignant cystosarcoma phyllodes tumors of the breast. Cancer. 1993; 71 (10): 3020–3024. DOI: 10.1002/1097–0142 (19930515)71:10<3020:: AID-CNCR2820711022>3.0.CO;2-G
The descriptive epidemiology of malignant cystosarcoma phyllodes tumors of the breast. Cancer. 1993; 71 (10): 3020–3024. DOI: 10.1002/1097–0142 (19930515)71:10<3020:: AID-CNCR2820711022>3.0.CO;2-G
8. Barrio AV, Clark BD, Goldberg JI, Hoque LW, Bernik SF, Flynn LW, et al. Clinicopathologic features and long-term outcom es of 2 93phyllodes tum ors of the breast. Ann Surg Oncol 2007; 14 (10): 2961–2970. DOI: 10.1245/s10434–007–9439-z
9. Calhoun K, Lawton TJ, Kim JM, et al. Phyllodes tumors. In: Diseases of the breast. Harris J, Lippman ME, Osborne CK, Morrow M (eds). Lippincott Williams and Wilkins, 2010, p.781.
10. Telli ML, Horst KC, Guardino AE, Dirbas FM, Carlson RW. Phyllodes tumors of the breast: natural history, diagnosis, and treatment. J Natl Compr Canc Netw. 2007 Mar; 5 (3): 324–330. DOI: 10.6004/jnccn.2007.0027
2007 Mar; 5 (3): 324–330. DOI: 10.6004/jnccn.2007.0027
11. Carter BA, Page DL. Phyllodes tumor of the breast: local recurrence versus metastatic capacity. Hum Pathol. 2004; 35 (9): 1051–1052. DOI: 10.1016/j.humpath.2004.08.001
12. Reinfuss M, Mituś J, Duda K, Stelmach A, Ryś J, Smolak K. The treatment and prognosis of patients with phyllodes tumor of the breast: an analysis of 170 cases. Cancer. 1996; 77 (5): 910–916. DOI: 10.1002/(SICI)1097–0142 (19960301)77:5<910:: AID-CNCR16>3.0.CO;2–6
13. National Comprehensive Cancer Network (NCCN). NCCN Clinical practice guidelines in oncology. Availavle at: http://www.nccn.org/professionals/physician_gls/f_guidelines.asp (Accessed on February 27, 2016)
14. Jacklin RK, Ridgway PF, Ziprin P, Healy V, Hadjiminas D, Darzi A. Optimising preoperative diagnosis in phyllodes tumour of the breast. J Clin Pathol. 2006; 59 (5): 454–459. DOI: 10.1136/jcp.2005.025866
Jacklin RK, Ridgway PF, Ziprin P, Healy V, Hadjiminas D, Darzi A. Optimising preoperative diagnosis in phyllodes tumour of the breast. J Clin Pathol. 2006; 59 (5): 454–459. DOI: 10.1136/jcp.2005.025866
15. Jang JH, Choi MY, Lee SK, Kim S, Kim J, Lee J, et al. Clinicopathologic risk factors for the local recurrence of phyllodes tumors of the breast. Ann Surg Oncol. 2012 Aug; 19 (8): 2612–7. DOI: 10.1245/s10434–012–2307–5
16. Tavassoli FA, Devilee P.Genetics of tumours of the breast and female genital organs. In: World Health Organization Classification of Tumours, IARC Press, Lyons 2003. p. 99.
17. Kuijper A, Buerger H, Simon R, Schaefer KL, Croonen A, Boecker W, et al. Analysis of the progression of fibroepithelial tumours of the breast by PCR-based clonality assay. J Pathol. 2002; 197 (5): 575–581. DOI: 10.1002/path.1161
J Pathol. 2002; 197 (5): 575–581. DOI: 10.1002/path.1161
18. Wiratkapun C, Piyapan P, Lertsithichai P, Larbcharoensub N. Fibroadenoma versus phyllodes tumor: distinguishing factors in patients diagnosed with fibroepithelial lesions after a core needle biopsy. Diagn Interv Radiol. 2014 Jan-Feb; 20 (1): 27–33. DOI: 10.5152/dir.2013.13133
19. Летягин В. П., Ермилова В. Д., Воротников И. К. Злокачественные неэпиелиальные опухоли молочных желез. Вестник РОНЦ им. Н. Н. Блохина РАМН. 1996; 7 (3): 57–59
20. Волченко А. А., Пак Д. Д., Усов Ф. Н., Фетисова Е. Ю. Гигантская листовидная опухоль молочной железы: клиническое наблюдение. Опухоли женской репродуктивной системы. 2012; 2: 27–29.
21. Spitaleri G, Toesca A, Botteri E, Bottiglieri L, Rotmensz N, Boselli S, et al. Breast phyllodes tumor: a review of literature and a single center retrospective series analysis. Crit Rev Oncol Hematol. 2013 Nov; 88 (2): 427–36. DOI: 10.1016/j.critrevonc.2013.06.005
Spitaleri G, Toesca A, Botteri E, Bottiglieri L, Rotmensz N, Boselli S, et al. Breast phyllodes tumor: a review of literature and a single center retrospective series analysis. Crit Rev Oncol Hematol. 2013 Nov; 88 (2): 427–36. DOI: 10.1016/j.critrevonc.2013.06.005
22. Chaney AW, Pollack A, McNeese MD, Zagars GK, Pisters PW, Pollock RE, et al. Primary treatment of cystosarcoma phyllodes of the breast. Cancer 2000; 89 (7): 1502–1511.
23. Ward RM, Evans HL. Cystosarcoma phyllodes: a clinicopathologic study of 26 cases. Cancer. 1986; 58 (10): 2282–2289. DOI: 10.1002/1097–0142 (19861115)58:10<2282:: AID-CNCR2820581021>3.0.CO;2–2
24. Cohn-Cedermark G, Rutqvist LE, Rosendahl I, Silfverswärd C. Prognostic factors in cystosarcoma phyllodes. A clinicopathologic study of 77 patients. Cancer. 1991; 68 (9): 2017–2022. DOI: 10.1002/1097–0142 (19911101)68:9<2017:: AID-CNCR2820680929>3.0.CO;2-V
Cancer. 1991; 68 (9): 2017–2022. DOI: 10.1002/1097–0142 (19911101)68:9<2017:: AID-CNCR2820680929>3.0.CO;2-V
25. Norris HJ, Taylor HB. Relationship of histologic features to behavior of cystosarcoma phyllodes. Analysis of ninety-four cases. Cancer. 1967; 20 (12): 2090–2099. DOI: 10.1002/1097–0142 (196712)20:12<2090:: AID-CNCR2820201206>3.0.CO;2-L
26. Hawkins RE, Schofield JB, Fisher C, Fisher C, Wiltshaw E, McKinna JA. The clinical and histologic criteria that predict m etastases from cystosarcom a phyllodes. Cancer 1992; 69 (1): 141–147. DOI: 10.1002/1097–0142 (19920101)69:1<141:: AID-CNCR2820690125>3.0.CO;2–1
27. Fajdić J, Gotovac N, Hrgović Z, Kristek J, Horvat V, Kaufmann M. Phyllodes tumors of the breast diagnostic and therapeutic dilemmas.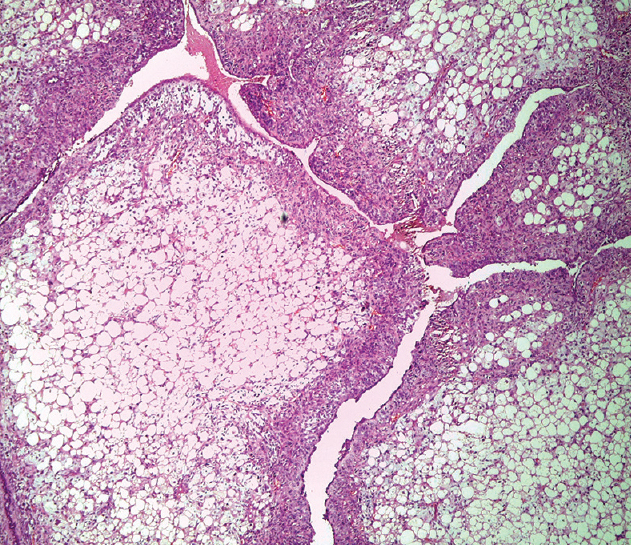 Onkologie. 2007 Mar; 30 (3): 113–118. DOI: 10.1159/000099580
Onkologie. 2007 Mar; 30 (3): 113–118. DOI: 10.1159/000099580
28. Macdonald OK, Lee CM, Tward JD, Chappel CD, Gaffney DK. Malignant phyllodes tumor of the female breast: association of primary therapy with cause-specific survival from the Surveillance, Epidemiology, and End Results (SEER) program. Cancer 2006; 107 (9): 2127–2133. DOI: 10.1002/cncr.22228
29. Barth RJ Jr, Wells WA, Mitchell SE, Cole BF. A prospective, multi-institutional study of adjuvant radiotherapy after resection of malignant phyllodes tumors. Ann Surg Oncol. 2009 Aug; 16 (8): 2288–2294. DOI: 10.1245/s10434–009–0489–2
30. Kapiris I, Nasiri N, A’Hern R, Healy V, Gui GP. Outcome and predictive factors of local recurrence and distant m etastases following prim ary surgical treatm ent of highgrade malignant phyllodes tumours of the breast. Eur J Surg Oncol. 2001; 27 (8): 723–730. DOI: 10.1053/ejso.2001.1207
Eur J Surg Oncol. 2001; 27 (8): 723–730. DOI: 10.1053/ejso.2001.1207
31. Parker SJ, Harries SA. Phyllodes tumours. Postgrad Med J. 2001 Jul; 77 (909): 428–435. DOI: 10.1136/pmj.77.909.428
32. Belkacémi Y, Bousquet G, Marsiglia H, Ray-Coquard I, Magné N, Malard Y, et al. Phyllodes tumor of the breast. Int J Radiat Oncol Biol Phys 2008; 70 (2): 492–500. DOI: 10.1016/j.ijrobp.2007.06.059
33. Pezner RD, Schultheiss TE, Paz IB. Malignant phyllodes tumor of the breast: local control rates with surgery alone. Int J Radiat Oncol Biol Phys. 2008 Jul 1; 71 (3): 710–713. DOI: 10.1016/j.ijrobp.2007.10.051
34. Gnerlich JL, Williams RT, Yao K, Jaskowiak N, Kulkarni SA. Utilization of radiotherapy for malignant phyllodes tumors: analysis of the National Cancer Data Base, 1998–2009. Ann Surg Oncol. 2014 Apr; 21 (4): 1222–30. DOI: 10.1245/s10434–013–3395–6
Ann Surg Oncol. 2014 Apr; 21 (4): 1222–30. DOI: 10.1245/s10434–013–3395–6
35. Morales-Vásquez F, Gonzalez-Angulo AM, Broglio K, Lopez-Basave HN, Gallardo D, Hortobagyi GN, et al. Adjuvant chemotherapy with doxorubicin and dacarbazine has no effect in recurrence-free surviv al of m alignant phyllodes tumors of the breast. Breast J. 2007 Nov-Dec; 13 (6): 551–556. DOI: 10.1111/j.1524–4741.2007.00510.x
36. Burton GV, Hart LL, Leight GS Jr, Iglehart JD, McCarty KS Jr, Cox EB. Cystosarcoma phyllodes. Effective therapy with cisplatin and etoposide chemotherapy. Cancer. 1989; 63 (11): 2088–2092. DOI: 10.1002/1097–0142 (19890601)63:11<2088:: AID-CNCR2820631103>3.0.CO;2-C
37. Sapino A, Bosco M, Cassoni P, Castellano I, Arisio R, Cserni G, et al. Estrogen receptor-beta is expressed in stromal cells of fibroadenoma and phyllodes tumors of the breast. Mod Pathol 2006; 19 (4): 599–606. DOI: 10.1038/modpathol.3800574
Mod Pathol 2006; 19 (4): 599–606. DOI: 10.1038/modpathol.3800574
38. Tse GM, Lee CS, Kung FY, Scolyer RA, Law BK, Lau TS, et al. Hormonal receptors expression in epithelial cells of mammary phyllodes tumors correlates with pathologic grade of the tumor: a multicenter study of 143 cases. Am J Clin Pathol. 2002; 118 (4): 522–526. DOI: 10.1309/D206-DLF8-WDNC–XJ8K
39. Confavreux C, Lurkin A, Mitton N, Blondet R, Saba C, Ranchère D, et al. Sarcomas and malignant phyllodes tumours of the breast — a retrospective study. Eur J Cancer. 2006 Nov; 42 (16): 2715–2721. DOI: 10.1016/j.ejca.2006.05.040
Клиническое наблюдение гигантской листовидной опухоли молочной железы.
Представлено клиническое наблюдение гигантской листовидной опухоли молочной железы. Листовидная (филлодная) опухоль — редко встречающийся вариант фиброэпителиальной опухоли, состоящий из эпителиальной и соединительной ткани с преобладающим развитием соединительнотканного компонента. Единственным радикальным методом лечения является хирургический.
Единственным радикальным методом лечения является хирургический.Листовидная (филлодная) опухоль — вариант фиброэпителиальной опухоли, состоящий из эпителиальной и соединительнотканного компонентов с преобладающим развитием последнего. Этот тип новообразований встречается редко и составляет 2-3 % от фиброэпителиальных опухолей молочной железы и 0,3-1 % от всех опухолей молочной железы у женщин(6,8). Пик заболеваемости у женщин приходится на 45-49 лет (6), однако филлодная опухоль может развиваться от подросткового до пожилого возраста (11). В литературе встречаются описания единичных случаев возникновения листовидной опухоли молочной железы у мужчин (5). В настоящее время существует более 60 наименований данного новообразования (гигантская фиброаденома и филлодная цистосаркома), однако по мнению ВОЗ наиболее уместным является термин «листовидная опухоль»(9).
Впервые подробно описал листовидную опухоль J. Muller в 1838 г и дал ей название «cystosarcoma phyllodes», соответственно её двум компонентам: кистозных полостей и фиброзной ткани, напоминающей таковую при саркоме и имеющей вид листа капусты на разрезе макропрепарата(7). Родоначальниками современного представления о листовидных опухолях являются американские патоморфологи Treves N. и Sunderland D., которые впервые стали выделять критерии доброкачественных, пограничных и злокачественных листовидных опухолей (2). Присутствие эпителиального компонента отличает листовидную опухоль от саркомы(6). Ведущим морфологическим признаком листовидных опухолей молочных желез является гиперцеллюлярность, богатство стромы веретенообразным клетками типа фибробластов. Отсутствие указанного признака исключает диагноз листовидной опухоли (1). Дифференциальными морфологическими признаками листовидной опухоли и фиброаденом являются преобладание соединительнотканного компонента над эпителиальным в сочетании с выраженной клеточностью соединительнотканного компонента.
Родоначальниками современного представления о листовидных опухолях являются американские патоморфологи Treves N. и Sunderland D., которые впервые стали выделять критерии доброкачественных, пограничных и злокачественных листовидных опухолей (2). Присутствие эпителиального компонента отличает листовидную опухоль от саркомы(6). Ведущим морфологическим признаком листовидных опухолей молочных желез является гиперцеллюлярность, богатство стромы веретенообразным клетками типа фибробластов. Отсутствие указанного признака исключает диагноз листовидной опухоли (1). Дифференциальными морфологическими признаками листовидной опухоли и фиброаденом являются преобладание соединительнотканного компонента над эпителиальным в сочетании с выраженной клеточностью соединительнотканного компонента.
Среди листовидных опухолей выделяют доброкачественные, пограничные и злокачественные (6). Для определения злокачественности процесса используют гистологические критерии, предложенные Azzopardi J.(3) Примерно от 15 до 30 % листовидных опухолей являются злокачественными (6).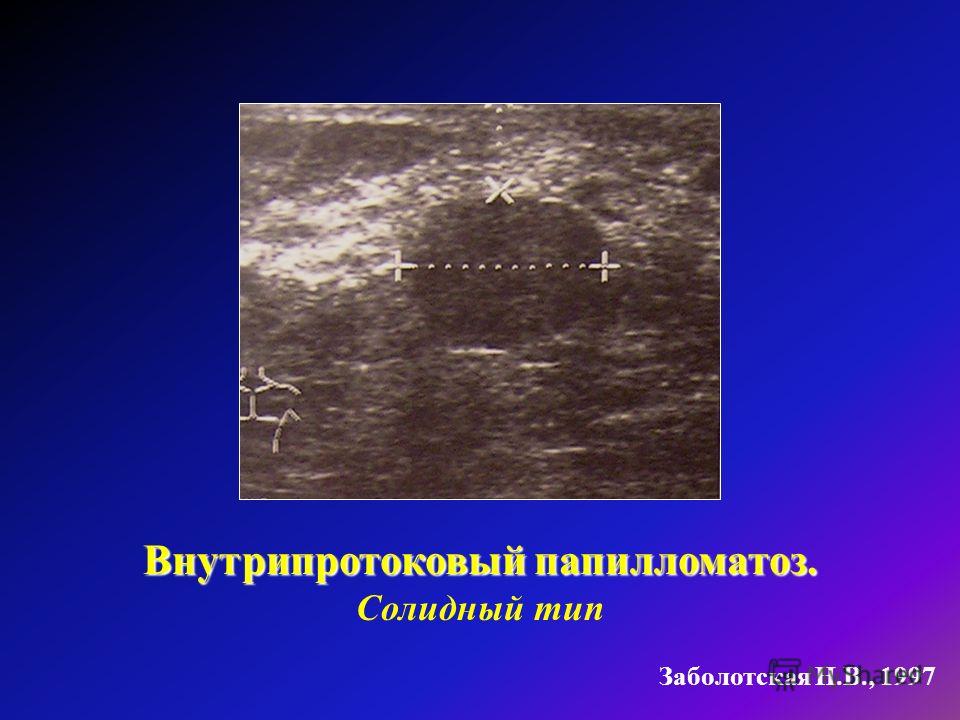 Гистологический тип листовидной опухоли является важным прогностическим фактором: пятилетняя выживаемость при доброкачественных листовидных опухолях по данным Reinfuss et. al составляет 95,7 % ,пограничных — 73,7%,злокачественных д- 66,1% (10). По данным Chaney et. al при доброкачественных и пограничных листовидных опухолях до 91 %, злокачественных до 82 % (4). Метастазы злокачественных листовидных опухолей наблюдаются в 25-30%, тогда как для всех листовидных опухолей не более чем в 4 % случаев(6).Основной путь метастазирования — гематогенный, чаще всего метастазы обнаруживают в легких, плевре и костях. Менее 1 % злокачественных листовидных опухолей метастазируют в подмышечные лимфатические узлы (8). Лечение листовидных опухолей молочной железы хирургическое. В случае малых размеров опухоли – это широкое иссечение с чистыми краями резекции, при больших размерах образования – простая мастэктомия. Вероятность локальных рецидивов составляет около 20 % при наличии клеток опухоли в краях резекции.
Гистологический тип листовидной опухоли является важным прогностическим фактором: пятилетняя выживаемость при доброкачественных листовидных опухолях по данным Reinfuss et. al составляет 95,7 % ,пограничных — 73,7%,злокачественных д- 66,1% (10). По данным Chaney et. al при доброкачественных и пограничных листовидных опухолях до 91 %, злокачественных до 82 % (4). Метастазы злокачественных листовидных опухолей наблюдаются в 25-30%, тогда как для всех листовидных опухолей не более чем в 4 % случаев(6).Основной путь метастазирования — гематогенный, чаще всего метастазы обнаруживают в легких, плевре и костях. Менее 1 % злокачественных листовидных опухолей метастазируют в подмышечные лимфатические узлы (8). Лечение листовидных опухолей молочной железы хирургическое. В случае малых размеров опухоли – это широкое иссечение с чистыми краями резекции, при больших размерах образования – простая мастэктомия. Вероятность локальных рецидивов составляет около 20 % при наличии клеток опухоли в краях резекции. Рутинная подмышечная лимфодиссекция не рекомендована. При злокачественном варианте листовидной опухоли обсуждается применение комплексного лечения. (8).
Рутинная подмышечная лимфодиссекция не рекомендована. При злокачественном варианте листовидной опухоли обсуждается применение комплексного лечения. (8).
Приводим клиническое наблюдение хирургического лечения больной с гигантской листовидной опухолью левой молочной железы
Больная В. 49 лет поступила в отделение общей онкологии МНИОИ им. П.А.Герцена с жалобами наличие опухоли в левой молочной железе. Известно, что пациентка самостоятельно обнаружила узловое образование в левой молочной железе в 2006 году. Диаметр образования не превышал 2 см. Больная обратилась к гинекологу по месту жительства, осмотрена, рекомендовано дообследование у онколога. По результатам обследования со слов пациентки предложено хирургическое лечение в объёме секторальной резекции, от которого она воздержалась. Самостоятельно лечилась нетрадиционными методами, узловое образование постепенно увеличивалось в размерах. В 2011 году больная отметила быстрый рост опухоли, которая уже занимала всю молочную железу и продолжала увеличиваться в размерах.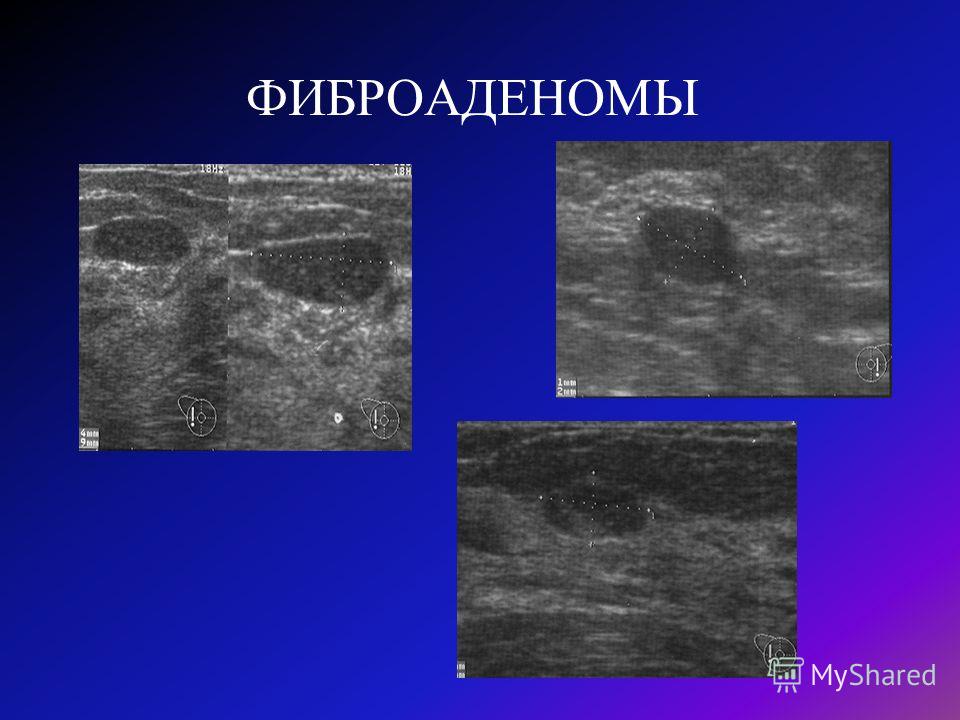 Осенью 2011 года больная обратилась для дообследования и лечения в МНИОИ им. П.А.Герцена.
Осенью 2011 года больная обратилась для дообследования и лечения в МНИОИ им. П.А.Герцена.
При осмотре левая молочная железа значительно увеличена за счет опухолевого компонента. Поверхность молочной железы не ровная, бугристая (Рис 1 а,б,в). Кожа над опухолью не изменена, под ней контурируются крупные, извитые сосуды. Пальпаторно ткани измененной левой молочной железы плотноэластической консистенции. Опухоль подвижна относительно грудой стенки. В подмышечной области на стороне поражения определяются увеличенные до 2 см лимфатические узлы.
Рис 1. (а) Больная В. 45 лет, внешний вид.
Рис 1. (б) Больная В. 45 лет, внешний вид.
Рис 1. (в) Больная В. 45 лет, внешний вид.
По данным УЗИ вся левая молочная железа замещена опухолевым образованием гипоэхогенной многоузловой структуры. В подмышечной области определяются измененные, увеличенные лимфатические узлы. Проведена трепан-биопсия опухоли. По результатам гистологического исследования биопсийного материала картина более всего соответствует фиброаденоме.
 Злокачественного опухолевого роста не обнаружено. При маммографии – опухоль занимает весь объём левой молочной железы (тотальное затемнение) (Рис 2 )
Злокачественного опухолевого роста не обнаружено. При маммографии – опухоль занимает весь объём левой молочной железы (тотальное затемнение) (Рис 2 )
Рис 2. Маммография больной В., 45 лет. Описание в тексте.
Принимая во внимание клиническую картину, данные обследования (УЗИ, маммографию) и морфологическое исследование биоптата из опухоли пациентке выполнена мастэктомия слева.
Вовремя операции, при отсепаровке молочной железы в подкожной клетчатке пересекали и лигировали множество патологически измененных сосудов крупного калибра, диаметром до 6 мм. По краю большой грудной мышцы определялись плотные фиброзные тяжи в которых проходили кровеносные сосуды питающие опухоль, сопоставимые по диаметру с подмышечной артерией и веной. При ревизии подмышечной области пальпировались и визуально определялись множественные увеличенные до 2 см в диаметре лимфатические узлы эластической консистенции. Выполнена подмышечная лимфаденэктомия. Ранний послеоперационный период протекал без осложнений. Лимфорея не отмечалась. На 2 сутки после операции удалён дренаж, на 5-е пациентка выписана из отделения для продолжения лечения в амбулаторных условиях.
Лимфорея не отмечалась. На 2 сутки после операции удалён дренаж, на 5-е пациентка выписана из отделения для продолжения лечения в амбулаторных условиях.
При плановом гистологическом исследовании удалённого препарата ( № Ф 4261-96, Ф 4317-22) молочная железа размерами 34х33х16 см. Сосок не изменен. Железа диффузно уплотнена, с крупнобугристой поверхностью. На разрезе в ткани железы определяется опухолевый узел размерами 28х17х20 см, занимающий практически всю толщу ткани железы (определяется по периферии узла). Узел чётко отграничен, представлен плотной, волокнистой, розовато-белой, дольчатой тканью с крупными сероватыми участками отека, кистозными полостями с полиповидными образованиями, представленными аналогичного вида тканью, мелкоочаговыми кровоизлияниями (Рис 3. ) Из подмышечной клетчатки выделено 15 эластичных лимфоузлов диаметром 1-3 см. Микроскопическая картина (Рис 4, 5). Листовидная опухоль молочной железы с крупными участками отёка, гиалиноза стромы; разрозненными участками клеточного строения стромы с умеренно выраженным полиморфизмом клеток и единичными митозами в редких полях зрения. Сосок обычного строения; в окружающей ткани железы – картина мастопатии. В исследованных л/у без опухолевого роста. Заключение. Листовидная опухоль пограничного строения (9020/1).
Сосок обычного строения; в окружающей ткани железы – картина мастопатии. В исследованных л/у без опухолевого роста. Заключение. Листовидная опухоль пограничного строения (9020/1).
Рис 3. Препарат удалённой опухоли
Рис 4. Листовидная опухоль, окраска гематоксилин-эозин, увеличение 5х10.
Рис 5. Пролиферация эпителия и клеточных элементов стромы, окраска гематоксилин-эозин, увеличение 20х10
Данный случай демонстрирует редкое клиническое наблюдение, когда доброкачественное новообразование при несвоевременном обращении пациента к врачу привело к обширному хирургическому вмешательству и утрате молочной железы.
Листовидная опухоль (листовидная фиброаденома)
В нашей клинике вы можете сдать анализ на выявление мутаций в генах BRCA1 и BRCA2 — данная процедура позволяет диагностировать высокую степень риска рака молочной железы. Подробнее…
Листовидная опухоль (листовидная цистосаркома, листовидная фиброаденома) – редкое новообразование молочной железы. Размер от 1 см до размера, превышающего размер молочной железы (см. фото ниже). Характеризуется быстрым ростом. Может быть доброкачественной, промежуточной и злокачественной. С течением времени происходит нарастание злокачественных характеристик. Необходимо срочное хирургическое лечение. Объём операции зависит от размера опухоли и гистологического диагноза.
Размер от 1 см до размера, превышающего размер молочной железы (см. фото ниже). Характеризуется быстрым ростом. Может быть доброкачественной, промежуточной и злокачественной. С течением времени происходит нарастание злокачественных характеристик. Необходимо срочное хирургическое лечение. Объём операции зависит от размера опухоли и гистологического диагноза.
Механизмы, обеспечивающие возникновение и рост опухоли, неизвестны.
По своему строению различают несколько типов листовидной опухоли:
- Доброкачественная листовидная фиброаденома
- Пограничная листовидная фиброаденома
- Злокачественная листовидная фиброаденома
Примеры из практики
Больная с мутацией гена TP53. На фотографии слева – злокачественная листовидная опухоль левой молочной железы. На фотографии справа – через 2 года после мастэктомии слева; на операционном столе, планируется мастэктомия справа.
Слева – злокачественная листовидная опухоль. Быстро растущая опухоль разрушила кожу.
Справа – злокачественная листовидная опухоль. Из-за быстрого роста опухоли перерастянутая кожа некротизируется. Удаление молочной железы производилось вместе с удалением большой грудной мышцы, поскольку опухоль врастала в неё.
Клиника и диагностика листовидной опухоли
Течение заболевания имеет стадийность. Вначале, когда размеры образования небольшие, процесс протекает крайне скрыто, без явной клинической симптоматики. В течение весьма длительного промежутка времени опухоль может не расти. Однако под воздействием неблагоприятных факторов внезапно наступает резкий и быстрый рост опухоли. В этих случаях листовидная фиброаденома приобретает большие размеры (десятки сантиметров в диаметре). Механизмы малигнизации также неизвестны, причем размеры опухоли и риск озлакочествления не связаны между собой.
Малые размеры опухоли не позволяют ее выявить во время очного осмотра. Такие образования выявляются случайно, при проведении УЗ исследований. В случае больших размеров образований диагностики особых сложностей не представляет. Пальпаторно можно определить плотный очаг, имеющий строение в виде долек или конгломератов, которые сливаются. Опухоль чаще подвижна, не спаяна с кожей. Гигантские листовидные фиброаденомы приводят к тому, что кожа над опухолью растягивается и становится тонкой. Также меняется цвет в сторону синюшного, поскольку имеется реактивное увеличение венозного русла в зоне опухоли.
В случае больших размеров образований диагностики особых сложностей не представляет. Пальпаторно можно определить плотный очаг, имеющий строение в виде долек или конгломератов, которые сливаются. Опухоль чаще подвижна, не спаяна с кожей. Гигантские листовидные фиброаденомы приводят к тому, что кожа над опухолью растягивается и становится тонкой. Также меняется цвет в сторону синюшного, поскольку имеется реактивное увеличение венозного русла в зоне опухоли.
Диагностика заключается в проведении УЗИ, маммографии и гистологического исследования биопсийного материала.
Лечение листовидной опухоли
Необходимо срочное хирургическое лечение! Объём операции зависит от размера опухоли и гистологического диагноза. При доброкачественном процессе проводится секторальная резекция или же квадрантэктомия. Если размеры образования гигантские, то нередко проводится удаление всей молочной железы. Из-за быстрого роста опухоли перерастянутая кожа некротизируется. Удаление молочной железы может выполняться вместе с удалением большой грудной мышцы, если имеет место прорастание в нее опухоли.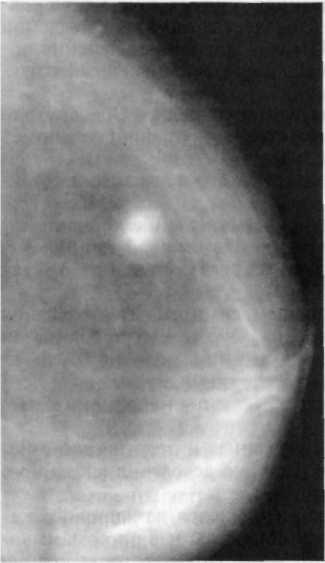
На схеме изображена секторальная резекции при доброкачественной листовидной опухоли, пунктиром показан объём удаляемой ткани.
При получении данных об озлакочествлении процесса лечение проводится в соответствии с принципами лечения рака молочной железы. В случае раннего выявления и небольших размерах образования прогноз лечения вполне благоприятный.
Принципиальными особенностями нашей технологии являются:
- Перед операцией необходимо получение гистологического диагноза (для этого выполняется кор-биопсия опухоли).
- Объём операции зависит от размера опухоли и гистологического диагноза. При необходимости мастэктомии возможно выполнение одномоментной реконструкции молочной железы. Достижение максимально возможного эстетического эффекта является неотъемлемой целью при выполнении всех маммологических операций.
- Гистологическое исследование опухоли.
Онкомаммология
Мастопатия
Кистозные патологии
Уплотнения, узлы
Боли
Дополнительно
Фиброаденома
Фиброаденома – это доброкачественная опухоль молочной железы. Пальпаторно фиброаденома (ФА) определяется как болезненное (жгучая, колющая боль), легко смещаемое объемное образование плотной консистенции, округлой или овальной формы. Средние размеры ФА обычно варьируют от 0,3 до 1,5 см и, как правило, не превышают 3 см в диаметре. Опухоль имеет гладкую поверхность, ровные, волнистые или крупнобугристые контуры, которые четко ограничены и не спаяны с окружающими тканями. Кожные покровы пораженной молочной железы не изменены. Опухолевый узел четко прощупывается при прижатии молочной железы ладонью к грудной клетке.
Пальпаторно фиброаденома (ФА) определяется как болезненное (жгучая, колющая боль), легко смещаемое объемное образование плотной консистенции, округлой или овальной формы. Средние размеры ФА обычно варьируют от 0,3 до 1,5 см и, как правило, не превышают 3 см в диаметре. Опухоль имеет гладкую поверхность, ровные, волнистые или крупнобугристые контуры, которые четко ограничены и не спаяны с окружающими тканями. Кожные покровы пораженной молочной железы не изменены. Опухолевый узел четко прощупывается при прижатии молочной железы ладонью к грудной клетке.
Согласно данным различных источников литературы, ФА диагностируется у 10% женского населения и дебютирует в различные возрастные интервалы, но чаще – в периоды репродуктивной активности (в среднем с 16 до 40 лет).
Основным этиологическим фактором ФА является гормональный дисбаланс, а именно гиперэстрогенемия с одновременным снижением уровня прогестерона. Т.е. наибольший риск развития или усиленного роста ФА возникает во время гормональных перестроек организма (половое созревание, беременность, лактация, предменопаузальный и менопаузальный периоды, сопровождающиеся заместительной гормональной терапией, опухоли щитовидной железы, патологические процессы в печени и пр. ). ФА состоит из двух видов тканей: фиброзная (соединительная) и эпителиальная.
). ФА состоит из двух видов тканей: фиброзная (соединительная) и эпителиальная.
В зависимости от соотношения этих тканей ФА классифицируют на 4 типа: периканаликулярные, интраканаликулярные, смешанные и филлоидные (листовидные) фиброаденомы. Риск малигнизации (озлокачествления, перехода в саркому молочной железы) у ФА I — III типов отсутствует в отличие от IV типа — листовидной ФА. Листовидная ФА молочной железы – это фиброэпителиальная опухоль, развивающаяся из внутрипротоковой фиброаденомы. Патогномоничным признаком данного типа ФА является быстрый рост опухолевого образования. Это как бы промежуточная форма между саркомой и фиброаденомой. По причине перечисленных особенностей, а, главное, повышенного риска малигнизации, листовидные ФА требуют немедленного оперативного вмешательства.
Также необходимо отметить, что ФА может иметь множественный характер и рецидивирующее течение. Кроме того, известны клинические случаи обратного развития ФА. Обычно это небольших размеров опухоли, подвергшиеся длительной консервативной терапии.
Факторы, диктующие необходимость хирургического лечения ФА:
- Быстрый рост опухоли, а именно увеличение в размерах объемного образования в два раза в течение 3–4 месяцев.
- Наличие множественных (в т.ч. двусторонних) ФА.
- Большие размеры опухоли, деформирующие окружающие ткани молочной железы.
- Наличие выраженной или атипической пролиферации эпителия в опухоли (по результатам цитологического исследования при пункционно-аспирационной биопсии).
- Беременность – как гормональный дисбаланс, инициирующий рост опухолевой ткани. Увеличенная в размерах ФА механически сдавливает млечные протоки, что затрудняет лактацию и способствует развитию патологических процессов в молочной железе (например, лактостаза или мастита).
- Филлоидная (листовидная опухоль).
Алгоритм диагностических действий при наличии опухолевого образования в молочной железе (в том числе, непальпируемой формы).
- Консультация онколога – маммолога.

- УЗИ молочных желез и региональных лимфатических узлов (в т.ч. с эластографией — дополнительная технология, используемая во время традиционного УЗИ, которая дает возможность оценить эластичность тканей исследуемого органа). Дело в том, что все ткани человека, в том числе и поврежденные тем или иным патологическим процессом, имеют определенную эластичность (жесткость).
- Маммография (прицельная и дополнительные рентгенограммы интересующей зоны в прямой, боковой, либо косой проекциях).
- Пункционная биопсия или трепан-биопсия (диагностическая пункция под рентген или УЗ – контролем, выполняемая с целью верификации диагноза и определения распространенности опухолевого процесса).
- Предоперационная маркировка опухоли при непальпируемой форме (накожная маркировка или чрезкожная установка маркировочной иглы «гарпун» под УЗ- или рентген-контролем).
Объем хирургического вмешательства, выполняемого по поводу ФА молочной железы:
- Энуклеация – вылущивание (enucleo – вынимать ядро, очищать от скорлупы).
 Применяется при отсутствии подозрений на наличие злокачественного процесса. При этом дефект тканей молочной железы (как осложнение операции) минимален или отсутствует вообще.
Применяется при отсутствии подозрений на наличие злокачественного процесса. При этом дефект тканей молочной железы (как осложнение операции) минимален или отсутствует вообще. - Секторальная резекция молочной железы – удаление опухолевого образования вместе с окружающими тканями молочной железы с последующим косметическим дефектом различной степени выраженности, который устраняется различными методами маммопластики (с использованием эндопротеза или местными тканями).
- Подкожная мастэктомия с одномоментной реконструкцией груди эндопротезом (имплантом) или местными тканями (при больших размерах опухоли или множественных ФА).
В нашем центре синтезированы общехирургические и косметические принципы при выборе методов в хирургии молочной железы. Разработаны и внедрены операции, которые обеспечивают не только адекватную радикальность, но и превосходный эстетический результат.
Орский онкологический диспансер — Доброкачественная опухоль молочной железы
К доброкачественным опухолям молочной железы относят:
Липома молочной железы — доброкачественная опухоль из жировой ткани.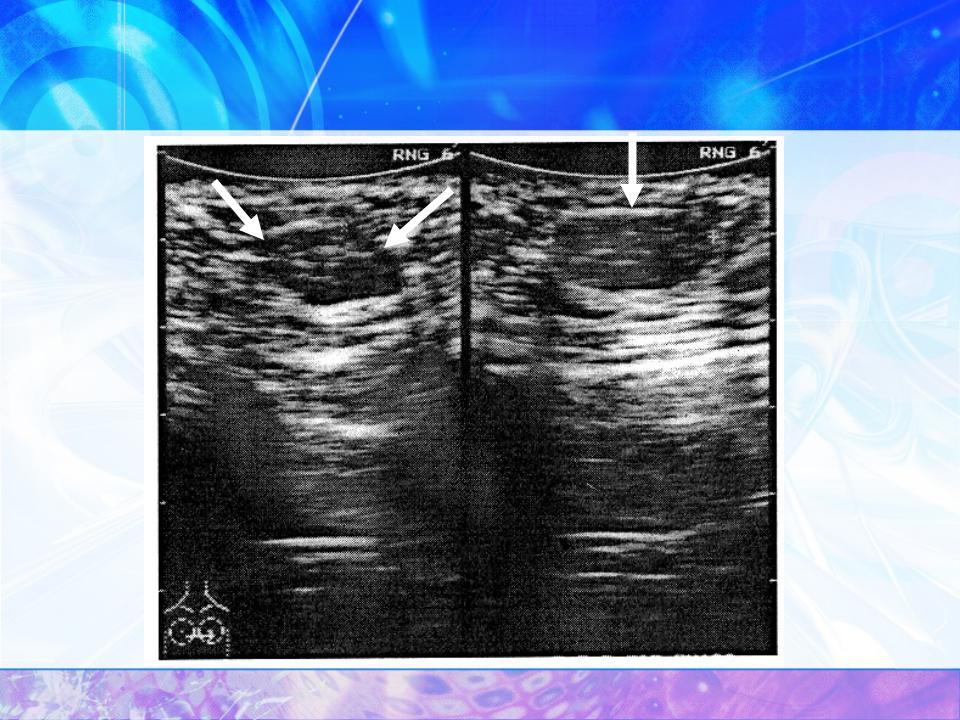
Фиброаденома — доброкачественная опухоль из ткани молочной железы
Цистоаденопапиллома — доброкачественная опухоль, возникающая в протоках молочной железы
Липома — доброкачественная опухоль, происходящая из жировой ткани. Липома встречаются практически везде, где есть жировая ткань. Чаще всего липомы возникают в подкожно-жировой клетчатке. Редко липомы возникают в молочной железе.
Липома не представляет опасности. Липомы в подкожно-жировой клетчатке перерождаются достаточно редко (в липосаркомы), в молочной железы липосаркома — крайне редкое явление. Липома не перерождается в рак.
Липомы могут интенсивно увеличиваться в размерах и деформировать молочную железу.
Диагностика
Заключается в проведении осмотра, маммографии, УЗИ, цитологического исследования.
Лечение
Как правило, рекомендуется удаление опухоли. Обычно выполняется энуклеация опухоли (вылущивание), реже (при подозрении на рак молочной железы) — секторальная резекция молочной железы.
Фиброаденома — это доброкачественная опухоль, происходящая из железистой ткани молочной железы.
Фиброаденому обычно находит сама женщина. Это новообразование определяется в молочной железе как «шарик», имеющий гладкую поверхность, четкий контур. Как правило, фиброаденома подвижна. В ряде случаев фиброаденома интенсивно увеличивается (двух-трехкратное увеличение за несколько месяцев).
Фиброаденома не перерождается в рак. В научной литературе обсуждается вопрос о злокачественном перерождении, однако количество зарегистрированных случаев перерождения фиброаденомы настолько мало, что вряд ли возможно говорить о каком-либо серьезном риске. Ряд исследователей считают сомнительным вообще возможность перерождения фиброаденомы в рак.
Филлоидная фиброаденома или листовидная опухоль — особая разновидность доброкачественных опухолей молочной железы. Характеризуется интенсивным ростом, а также возможностью перерождения в саркому (также как и рак является злокачественной опухолью).
Ни оральные контрацептивы, ни гормонсодержащие препараты, ни вообще какие-либо лекарственные средства, включая средства народной медицины и гомеопатические средства не могут привести к устранению фиброаденомы.
Фиброаденома никоим образом не влияет на беременность. При отсутствии показаний беременность (существующая или планируемая) не является показанием для оперативного вмешательства. Однако важно знать, что во время беременности фиброаденома под действием изменяющегося уровня гормонов может увеличиваться в размерах. И это может стать показанием к ее удалению.
Показания к удалению фиброаденомы:
— подозрение на рак (фиброаденома может симулировать рак, как при осмотре, так и при обследовании с помощью маммографии и УЗИ).
— интенсивное увеличение фиброаденомы (удаление больших опухолей нередко приводит к косметическим дефектам, поэтому удаление фиброаденомы при ее стремительном росте предупреждает эти последствия)
— большие размеры фиброаденомы, вызывающие косметический дефект
Принципиально проводится 2 типа операций.
Энуклеация (вылущивание) проводится при отсутствии подозрения на рак. Как правило, под местной анестезией через небольшой разрез (несколько сантиметров) проводится вылущивание опухоли. Дефект при такой операции обычно отсутствует или минимален.
Секторальная резекция — удаление опухоли вместе с окружающими тканями (отступя от 1 до 2–3 см от опухоли) — проводится при подозрении на рак. Косметический дефект при такой операции может быть заметен.
Фиброаденома может возникать повторно, хотя происходит это редко.
Цистоаденопапиллома — доброкачественная опухоль, происходящая из протоков молочной железы. Различают множественные и одиночные (солитарные) цистоаденопапилломы.
Причины возникновения четко не установлены.
Основным проявлением являются выделения из соска — серозные (прозрачные) и кровянистые выделения. Редко, при больших размерах, опухоль может прощупываться.
Обследование включает УЗИ, маммографию, цитологическое исследование выделений из соска.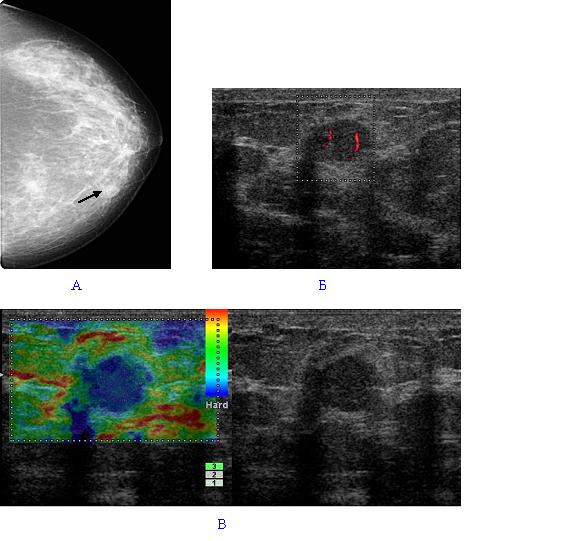 Дополнительно может назначаться маммография с контрастированием (введение контрастное вещества в протоки молочных желез).
Дополнительно может назначаться маммография с контрастированием (введение контрастное вещества в протоки молочных желез).
Одиночные или множественные цистоаденопапилломы ассоциируются с повышенным риском развития рака молочной железы. Цистоаденопапиллома может озлокачествляться и превращаться в рак молочной железы.
В связи с этим рекомендуется лечение этих опухолей. Хирургическое вмешательство рекомендуется при подозрении на озлокачествление, высказанное при любом из методов обследования. При отсутствии данных за перерождение может проводиться наблюдение. Оперативное вмешательство обычно проводится под общим обезболиванием и включает удаление тканей молочной железы, где находится папиллома.
В настоящее время выполняются оперативные вмешательства с сохранением соска (резекция центральной зоны). При расположении опухоли вне центральной зоны молочной железы выполняется стандартная секторальная резекция. При выявлении озлокачествления опухоли выполняется радикальное вмешательство — мастэктомия или органосохраняющее вмешательство.
Фиброаденома | Хозрасчетная поликлиника на Юношеской библиотеке
Фиброаденомы - это доброкачественные опухоли молочной железы, возникающие из фиброзной ткани молочной железы. Фиброаденома чаще встречается у девушек и молодых женщин до 30 лет. Все фиброаденомы состоят из железистых клеток и фибросоединительных или стромальных клеток. В большинстве случаев фиброаденома не вырастает больше чем 1-3 см в диаметре, изредка встречаются фиброаденомы до 5 см в диаметре. Такие большие опухоли молочной железы называются гигантскими фиброаденомами. Фиброаденомы у подростков иногда называются ювенильными фиброаденомами.
Причины возникновения фиброаденомы молочной железы
Фиброаденома — самая распространенная доброкачественная опухоль молочной железы. Фиброаденомы обычно имеют шаровидную форму и более гладкую поверхность, по сравнению со злокачественным опухолями. Раковые опухоли трудно смещаются внутри ткани, а фиброаденома – наоборот – довольно подвижна.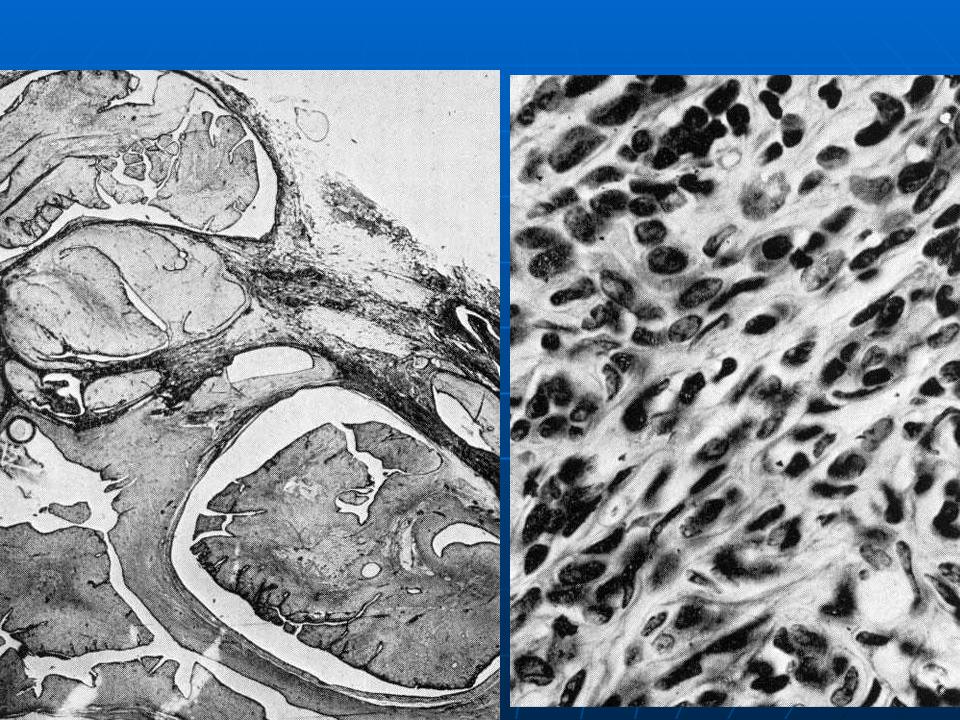
Фиброаденома растет под влиянием эстрогенов, поэтому эта опухоль молочной железы часто увеличивается в конце менструального цикла и во время беременности. После менопаузы фиброаденома уменьшается в размерах, т.к. после менопаузы снижается уровень эстрогенов. Гормональнозаместительная терапия, повышая уровень эстрогенов в организме, позволяет фиброаденоме сохранить свои размеры.
Симптомы фиброаденомы молочной железы
Фиброаденому обычно находит сама женщина. Это новообразование определяется в молочной железе как «шарик», имеющий гладкую поверхность, четкий контур. Как правило, фиброаденома подвижна. В ряде случаев фиброаденома интенсивно увеличивается (двух-трехкратное увеличение за несколько месяцев). Фиброаденома обычно безболезненна, хотя и не всегда — это зависит от ее размера и положения. При ощупывании фиброаденома упруга и напоминает резиновый шарик. Фиброаденома обычно является единичной опухолью молочной железы. У 10-15% пациенток фиброаденомы множественные и обнаруживаются в обеих молочных железах.
Перерождается ли фиброаденома в рак молочной железы? Фиброаденома молочной железы не перерождается в рак, за исключением случая листовидной фиброаденомы. В научной литературе обсуждается вопрос о злокачественном перерождении, однако количество зарегистрированных случаев перерождения фиброаденомы настолько мало, что вряд ли возможно говорить о каком-либо серьезном риске.
Фиброаденома никоим образом не влияет на беременность. При отсутствии показаний беременность (существующая или планируемая) не является показанием для оперативного вмешательства. Однако важно знать, что во время беременности фиброаденома под действием изменяющегося уровня гормонов может увеличиваться в размерах. И это может стать показанием к удалению данной опухоли молочной железы.
Что такое листовидная фиброаденома?
Филлоидная фиброаденома или листовидная опухоль молочной железы — особая разновидность доброкачественных опухолей молочной железы, свое название данный вид опухоли получил за строение, которое определяется на послойном разрезе. Для этой опухоли характерен быстрый рост. В 10 % случаев листовидная опухоль может перерождаться в злокачественную опухоль соединительной ткани — саркому. Листовидная саркома относится к «пограничным» опухолям – то есть она находится как бы на грани между доброкачественной и злокачественной опухолью молочной железы. При биопсии листовидной фиброаденомы определяются атипичные клетки. Они отличаются от нормальных клеток внешним видом, но пока что еще не являются злокачественными. Лечение фиброаденомы данного типа — оперативное.
Для этой опухоли характерен быстрый рост. В 10 % случаев листовидная опухоль может перерождаться в злокачественную опухоль соединительной ткани — саркому. Листовидная саркома относится к «пограничным» опухолям – то есть она находится как бы на грани между доброкачественной и злокачественной опухолью молочной железы. При биопсии листовидной фиброаденомы определяются атипичные клетки. Они отличаются от нормальных клеток внешним видом, но пока что еще не являются злокачественными. Лечение фиброаденомы данного типа — оперативное.
Диагностика фиброаденомы
Диагностика фиброаденомы молочной железы начинается с осмотра и пальпирования груди, потом выполняется маммография и/или ультразвуковое исследования груди и, наконец, биопсия. Биопсия — единственный метод исследования, позволяющий точно определить злокачественность или доброкачественность опухоли. Биопсия (забор кусочка ткани на анализ под микроскопом) может проводиться через небольшой разрез или с помощью иглы.
Девушкам и молодым женщинам 20-25 лет биопсия обычно не требуется, если исследуемая опухоль молочной железы на маммограмме и при УЗИ имеет все признаки фиброаденомы.
Лечение фиброаденомы
При наличии фиброаденомы размерами до 1,0 см возможно динамическое наблюдение (маммографический и УЗИ контроль).
Можно ли вылечить фиброаденому с помощью лекарственных средств? Нет. Ни оральные контрацептивы, ни гормонсодержащие препараты, ни вообще какие-либо лекарственные средства, включая средства народной медицины и гомеопатические средства не могут привести к устранению фиброаденомы.
Показания к удалению фиброаденомы:
Существуют показания к удалению фиброаденомы:— подозрение на рак (фиброаденома может симулировать рак, как при осмотре, так и при обследовании с помощью маммографии и УЗИ молочной железы).
— интенсивное увеличение фиброаденомы (удаление больших опухолей нередко приводит к косметическим дефектам, поэтому удаление фиброаденомы при ее стремительном росте предупреждает эти последствия).
— большие размеры фиброаденомы, вызывающие косметический дефект
Оперативное лечение фиброаденомы молочной железы
Принципиально проводится 2 типа операций:
Энуклеация (вылущивание) проводится при отсутствии подозрения на рак молочной железы.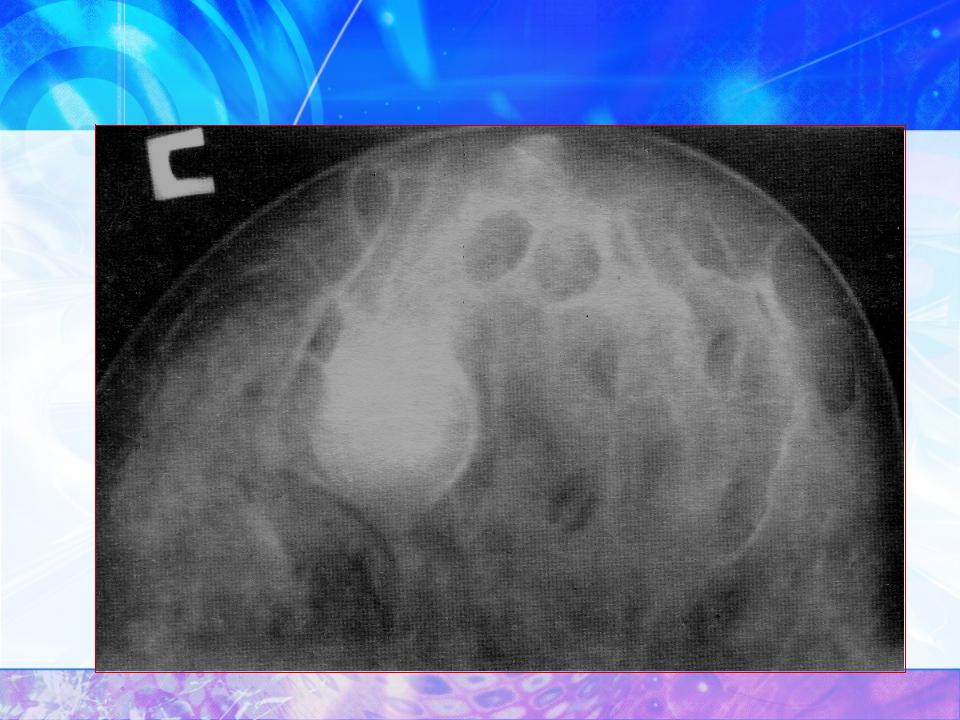 Как правило, под местной анестезией через небольшой разрез (несколько сантиметров) проводится вылущивание опухоли. Дефект при такой операции обычно отсутствует или минимален.
Как правило, под местной анестезией через небольшой разрез (несколько сантиметров) проводится вылущивание опухоли. Дефект при такой операции обычно отсутствует или минимален.
Секторальная резекция — удаление опухоли вместе с окружающими тканями (отступя от 1 до 2-3 см от опухоли) — проводится при подозрении на рак груди. Косметический дефект при такой операции может быть заметен.
Пациентки операцию по удалению фиброаденомы молочной железы утверждают, что страхи перед операцией совершенно не соответствую легкости послеоперационного периода. Дело в том что даже ранний послеоперационный период практически безболезнен. Срок снятия швов составляет около 9 (+/-2) дней после операции. Эта операция считается одной из самых легкопереносимых в хирургии молочной железы.
Опухоли типа Phyllodes: симптомы, диагностика и лечение
Опухоли типа Phyllodes — редкий тип опухоли молочной железы. Структура их клеток напоминает листья, а название «филлодис» происходит от греческого слова, означающего «листоподобный».
Структура их клеток напоминает листья, а название «филлодис» происходит от греческого слова, означающего «листоподобный».
Опухоли Phyllodes могут быстро расти, но не всегда распространяются за пределы груди.
Авторы обзора 2013 г. отмечают, что 35–64% опухолей филлодий являются доброкачественными, а остальные — пограничными или злокачественными. По данным Американского онкологического общества, около 25% являются злокачественными.
Хотя многие из этих опухолей являются доброкачественными, врач может порекомендовать операцию, чтобы снизить риск дальнейшего развития.
Опухоли типа Phyllodes могут образовываться в любом возрасте, но чаще встречаются у женщин в возрасте 35–55 лет. Те, которые развиваются у более молодых женщин, с большей вероятностью будут доброкачественными.
Очень редко филлодийные опухоли развиваются у мужчин, обычно у тех, кто страдает гинекомастией.
Наиболее частым признаком филлодийной опухоли является легко прощупываемое уплотнение в груди. Эти уплотнения часто образуются в верхнем внешнем квадранте груди.
Эти уплотнения часто образуются в верхнем внешнем квадранте груди.
Опухоли филлодий имеют тенденцию к быстрому росту. За несколько недель или месяцев опухоль может достигать как минимум 2–3 сантиметров (см). Средний размер около 4 см, но они могут быть в несколько раз больше. Около 20% опухолей филлодий превышают 10 см в диаметре.
Опухоль этого типа обычно безболезненна. Он может стать видимым, когда он прижимается к коже груди, и может расширять вены под кожей, из-за чего эта область груди становится синей.
Опухоль может вызвать образование язвы на коже груди, но это бывает редко. Язва может образоваться независимо от того, является ли опухоль доброкачественной, пограничной или злокачественной.
Опухоли Phyllodes могут образовываться в обеих молочных железах, но это очень редко.
Опухоли Phyllodes встречаются редко — они составляют 0,3–0,5% опухолей молочной железы у женщин. В результате врачи реже с ними сталкиваются, что затрудняет диагностику.
Кроме того, филлодозная опухоль может выглядеть как твердый рост груди, называемый фиброаденомой.Фиброаденома — это доброкачественное растущее образование из обычных клеток груди.
Фиброаденомы являются наиболее распространенным типом образования груди, и они часто развиваются у молодых женщин.
Некоторые исследователи предположили, что филлодийные опухоли могут быть разновидностью фиброаденомы. Однако есть два основных различия между этими типами опухолей.
Во-первых, филлодные опухоли имеют тенденцию расти быстрее, чем фиброаденомы. Во-вторых, филлодийные опухоли имеют тенденцию развиваться примерно через 10 лет, когда людям за 40.Фиброаденомы обычно появляются в возрасте от 20 до 30 лет.
Эти различия могут помочь врачу поставить точный диагноз.
Визуализация
Как и в случае с другими опухолями, диагностика филлодийной опухоли может включать:
Маммограмма : Результаты покажут округлую массу с четко очерченными краями. В некоторых случаях внутри опухоли могут появиться округлые доли.
В некоторых случаях внутри опухоли могут появиться округлые доли.
МРТ или УЗИ : Эти визуализационные тесты могут предоставить более подробную информацию.
Узнайте больше о том, что такое маммография.
Биопсия
Только биопсия груди может подтвердить, является ли новообразование филлодарной опухолью.
Биопсия включает взятие образцов ткани для исследования. Эти тесты обеспечивают подтверждение типа опухоли.
Врач может порекомендовать стержневую биопсию или эксцизионную биопсию. При биопсии стержневой иглой врач берет образец через кожу с помощью полой иглы. Это может не служить достаточным доказательством того, что опухоль является филлодарной.
При эксцизионной биопсии хирург удаляет всю опухоль для исследования.Осмотр всей опухоли может привести к более точному диагнозу.
Помимо подтверждения типа опухоли, биопсия может помочь определить, является ли опухоль доброкачественной, пограничной или злокачественной.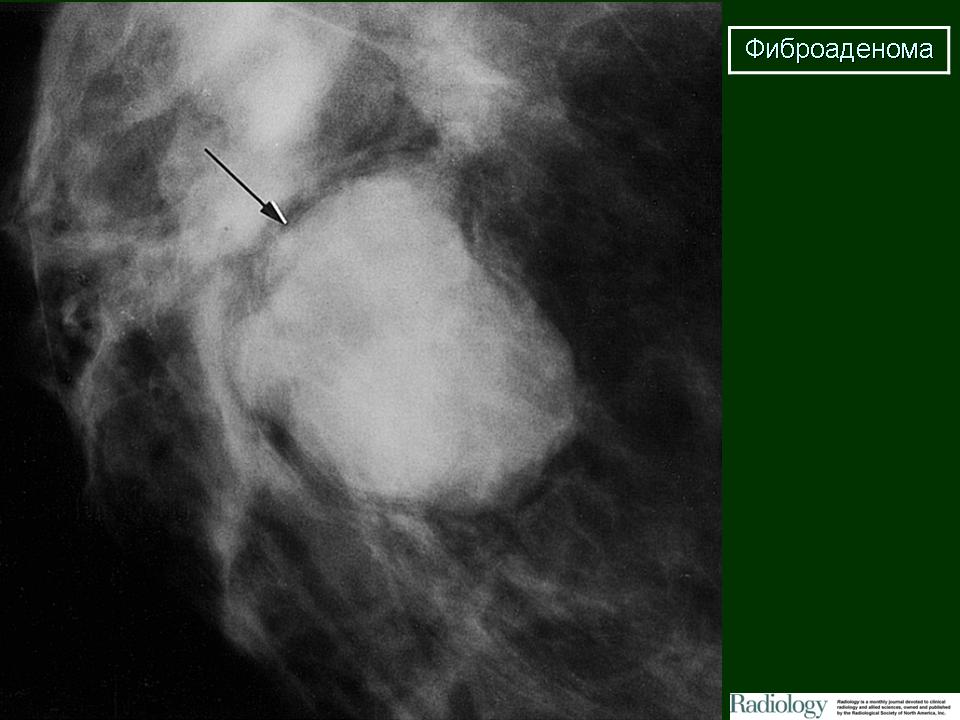
Идентификация опухоли
Признаки доброкачественной опухоли включают:
- четко очерченных краев
- клеток, которые не делятся быстро
- клеток соединительной ткани, которые не выглядят необычно
- отсутствие разрастания клеток соединительной ткани
Признаки злокачественной опухоли включают:
- неправильных краев
- клеток, которые кажутся быстро делящимися
- разросшихся клеток соединительной ткани с необычным внешним видом
Пограничные опухоли имеют признаки доброкачественной и злокачественной формы.
Злокачественные опухоли, особенно с чрезмерным разрастанием соединительной ткани, могут быстро распространяться и расти, возможно, выходя за пределы груди.
Единственный способ вылечить филлодийную опухоль — полностью удалить новообразование.
Это может помочь предотвратить образование дополнительных опухолей и не дать существующей опухоли вызвать осложнения, доброкачественные или злокачественные.
Хирург удалит опухоль и не менее 1 см окружающей ткани, чтобы уменьшить вероятность повторного роста опухоли.
Если опухоль злокачественная, хирург может удалить больше окружающей ткани.
На данном этапе лучевая терапия и химиотерапия вряд ли помогут при раковой опухоли филлодий, и эти опухоли не реагируют на гормональную терапию.
Если злокачественная опухоль филлодий рецидивирует, врач может порекомендовать мастэктомию, операцию по удалению части или всей груди. Они также могут порекомендовать лучевую терапию, химиотерапию или и то, и другое.
Хотя доброкачественные филлодийные опухоли не могут распространяться за пределы груди, они нуждаются в лечении, чтобы предотвратить их рост.В противном случае шишка может стать видимой и прорваться сквозь слои кожи, вызывая боль и дискомфорт.
Влияние на риск рака
Если злокачественная филлодическая опухоль рецидивирует, существует ограниченный риск развития этого типа опухоли за пределами груди. По данным Breastcancer.org, только 5% всех опухолей филлодий рецидивируют в других частях тела.
По данным Breastcancer.org, только 5% всех опухолей филлодий рецидивируют в других частях тела.
Наличие доброкачественной филлодарной опухоли не увеличивает риск развития рака, включая рак груди.
После удаления опухоли филлодий человек может испытывать боль в месте операции, но дальнейшие осложнения возникают редко.
Доброкачественные филлодийные опухоли реже рецидивируют, чем злокачественные. Врач будет следить за рецидивом, обычно в течение 1-2 лет после удаления.
Информационный центр по генетическим и редким заболеваниям отмечает, что перспективы для людей, перенесших операцию по поводу доброкачественных филлодий, превосходны.
Однако без лечения даже доброкачественные опухоли могут вызвать осложнения. По этой причине любой, кто заметит какие-либо изменения груди, должен обратиться за медицинской помощью.
Филлод Опухоли груди
Опухоли Phyllodes (FILL-odes или full-OH-deez) также могут быть обозначены как phylloides опухоли (full-OY-deez).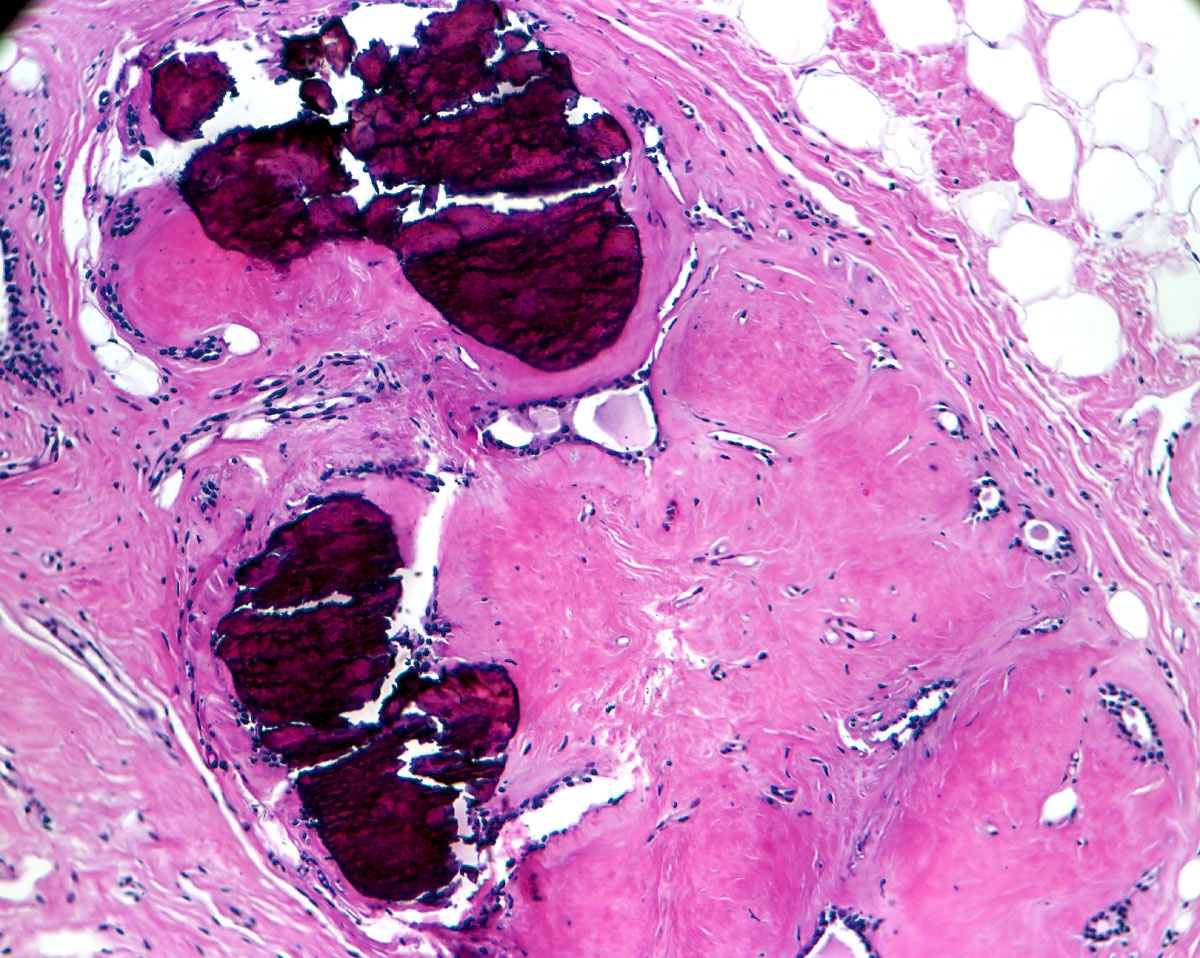 Это редкие опухоли груди, которые начинаются в соединительной (стромальной) ткани груди.
Это редкие опухоли груди, которые начинаются в соединительной (стромальной) ткани груди.
Опухоли Phyllodes чаще всего встречаются у женщин в возрасте от 40 лет, но они могут быть у женщин любого возраста. Женщины с синдромом Ли-Фраумени (редкое наследственное генетическое заболевание) имеют повышенный риск развития филлодий.
Большинство опухолей филлодий доброкачественные (не рак), но примерно 1 из 4 этих опухолей злокачественные (рак).
Диагностика
Опухоль обычно ощущается как безболезненное уплотнение в груди, но некоторые могут вызывать боль.Они имеют свойство быстро разрастаться и растягивать кожу. Иногда их сначала видят при визуализации (например, на УЗИ или маммографии), и в этом случае их часто трудно отличить от фиброаденомы. Диагноз часто можно поставить с помощью биопсии стержневой иглы, но иногда необходимо удалить всю опухоль (во время эксцизионной биопсии), чтобы точно знать, является ли опухоль филлодисом и злокачественна она или нет.
Как опухоли филлодий влияют на риск рака груди?
Наличие доброкачественной филлодарной опухоли не влияет на риск рака груди, но за вами могут наблюдать более пристально и регулярно проходить визуализационные тесты, поскольку эти опухоли могут вернуться после операции.
Лечение
Операция по сохранению груди (лампэктомия или частичная мастэктомия), при которой удаляется часть груди, обычно является основным лечением. Опухоли филлодий могут иногда возвращаться в том же месте, если их удалить, не забрав достаточное количество нормальной ткани вокруг них. По этой причине также удаляется край нормальной ткани груди вокруг опухоли. Мастэктомия (удаление всей груди) может потребоваться, если не удается удалить свободный от рака край нормальной ткани груди вместе с опухолью.
Если опухоль филлодий является раком, вместе с опухолью будет удалена более обширная область нормальной ткани. Или вся грудь может быть удалена с помощью мастэктомии. После операции можно провести лучевую терапию, особенно если не ясно, была ли удалена вся опухоль.
Злокачественные филлодийные опухоли отличаются от более распространенных типов рака груди. Они с меньшей вероятностью отреагируют на некоторые виды лечения, обычно используемые для лечения рака груди, такие как гормональная терапия или химиотерапевтические препараты, обычно применяемые при раке груди.Опухоли филлодий, которые распространились на другие части тела, часто больше похожи на саркомы (рак мягких тканей), чем на рак груди.
После операции можно провести лучевую терапию, особенно если не ясно, была ли удалена вся опухоль.
Злокачественные филлодийные опухоли отличаются от более распространенных типов рака груди. Они с меньшей вероятностью отреагируют на некоторые виды лечения, обычно используемые для лечения рака груди, такие как гормональная терапия или химиотерапевтические препараты, обычно применяемые при раке груди.Опухоли филлодий, которые распространились на другие части тела, часто больше похожи на саркомы (рак мягких тканей), чем на рак груди.
Поскольку эти опухоли могут рецидивировать, после лечения обычно рекомендуется тщательное наблюдение с частыми обследованиями молочных желез и визуализацией.
Симптомы, диагностика и лечение опухолевых заболеваний Phyllodes: Центр груди Джонса Хопкинса
Большинство опухолей Phyllodes доброкачественные, но 10% являются злокачественными (раковыми). Раковые опухоли Phyllodes — необычное проявление рака груди.Эти опухоли являются формой саркомы, потому что они растут в соединительной ткани груди, а не в протоках.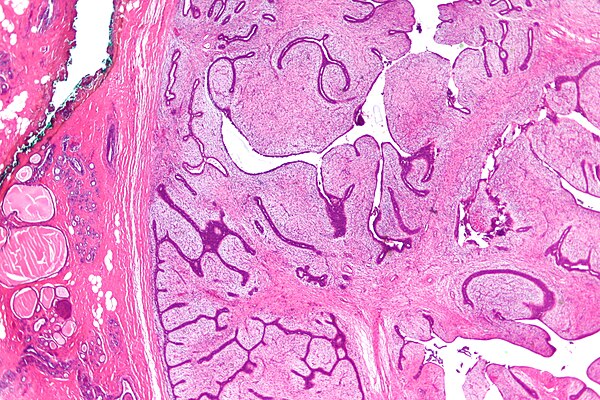 Этот рак настолько редок, что требуется подтверждение второго патолога.
Этот рак настолько редок, что требуется подтверждение второго патолога.
Каковы симптомы опухолей филлодий?
Эти опухоли обычно представляют собой опухоль в груди. Эти опухоли могут расти очень быстро, поэтому важно провести их обследование как можно скорее. Симптомы также могут имитировать симптомы других типов рака груди.
Как диагностируются опухоли филлодий?
Результаты в тот же день
Оценка любого нового образования груди включает клиническое обследование, визуализацию груди и игольную биопсию.Опухоли филлодий часто похожи на доброкачественные фиброаденомы (пожалуйста, укажите слово фиброаденома) на маммографии и ультразвуковом исследовании. Биопсия стержневой иглы также может быть безрезультатной, поскольку часто бывает трудно отличить доброкачественную филлодийную опухоль от клеточных фиброаденом, а злокачественные филлодийные опухоли можно спутать с другими злокачественными опухолями из веретенообразных клеток, такими как саркома из первичных веретенообразных клеток или метапластический рак молочной железы веретенообразного типа. Часто для постановки точного диагноза необходимо полностью удалить уплотнение.
Часто для постановки точного диагноза необходимо полностью удалить уплотнение.
В нашем центре груди большинство женщин могут узнать в течение 24 часов после осмотра нашей командой специалистов по раку груди, есть ли у них рак груди. Мы соблюдаем строгие правила при проведении биопсий и отчетов о патологии. Наши пациенты получают информацию о вероятности рака сразу после процедуры биопсии и подтверждение патологии обычно в течение 24 часов.
Узнайте больше о этапах диагностики, в том числе:
Как лечится опухоль филлодий?
Опухоли Phyllodes лечат полным удалением.Если они очень большие, может потребоваться мастэктомия. Квалифицированный патолог необходим для лечения филлодийных опухолей. Доброкачественные филлодийные опухоли с признаками низкого риска можно лечить путем ограниченного иссечения, которое позволяет сохранить размер и форму груди. Для лечения злокачественных филлодий или филлодий с признаками высокого риска требуется более обширное хирургическое вмешательство.
Для злокачественных (раковых) опухолей, в зависимости от стадии и роста опухоли, ваш врач может порекомендовать комбинацию любого из следующего:
- Лампэктомия — при выполнении этой процедуры остается 1 см границы нормальной ткани. обычно проводится по всему периметру опухоли, поскольку оставление любых остатков опухоли может вызвать ее регенерацию.
- Мастэктомия
- Радиация
Каков прогноз при опухолях филлодий?
Для доброкачественных филлодийных опухолей прогноз отличный. Большинство женщин со злокачественными опухолями филлодий излечиваются с помощью соответствующего лечения, но эти опухоли могут повторяться в груди и метастазировать в легкие.
Опухоль филлодий: лечение, симптомы и причины
Обзор
Опухоль филлодий — это редкая опухоль молочной железы. Опухоли филлодий растут в соединительной ткани груди, называемой стромой.Сюда входят ткани и связки, которые окружают протоки, кровеносные и лимфатические сосуды груди.
Название «филлодес» происходит от греческого слова «листоподобный». Название описывает структуру, по которой растут клетки этих опухолей, которая выглядит как лист.
К этому типу относятся менее 1 процента всех опухолей молочной железы.
Около 90 процентов опухолей филлодий не являются злокачественными, поэтому они редко распространяются за пределы груди. Однако они могут быстро расти. Некоторые филлодийные опухоли находятся между доброкачественными и злокачественными.Эти типы считаются «пограничными».
Хотя вы можете получить одну из этих опухолей в любом возрасте, они чаще всего встречаются у женщин в возрасте от 40 лет. У вас больше шансов получить опухоль филлодий, если у вас редкое наследственное генетическое заболевание, называемое синдромом Ли-Фраумени.
Врачи часто путают филлодийные опухоли с более распространенным ростом груди, называемым фиброаденомой. Фиброаденомы — это твердые образования, состоящие из соединительной ткани и тканей молочных протоков. Они не раковые. Основное различие между этими двумя состояниями заключается в том, что опухоли филлодий растут быстрее и возникают позже.
Они не раковые. Основное различие между этими двумя состояниями заключается в том, что опухоли филлодий растут быстрее и возникают позже.
Причина возникновения филлодий неизвестна. Они могут возникать просто с возрастом.
Несколько факторов могут быть вовлечены в рост этих опухолей, в том числе:
- травмы
- кормление грудью
- беременность
- повышенный уровень эстрогена, женского гормона
Опухоли Phyllodes растут очень быстро. Первым признаком часто бывает шишка под кожей. Шишка будет гладкой на ощупь. Кожа на груди также может покраснеть и стать теплой.Опухоль может расти достаточно быстро, и в конечном итоге вы сможете увидеть ее под кожей.
Несмотря на то, что большинство опухолей филлодий не являются злокачественными, они могут расти и вызывать боль. Если опухоль прорвет вашу кожу, вы можете увидеть открытую язву на груди.
Опухоли филлодий сложно диагностировать. Они очень похожи на другие уплотнения груди, такие как фиброаденомы.
Вы можете впервые почувствовать опухоль во время самообследования груди. Если вы обнаружите шишку, важно как можно скорее обратиться к врачу, потому что эти опухоли растут очень быстро.Ваш врач может провести тесты, чтобы подтвердить, есть ли у вас филлодическая опухоль.
Сначала врач проведет клинический осмотр груди. Они проверит форму и размер шишки.
Вы можете пройти один или несколько из следующих тестов, чтобы подтвердить, что у вас филлодическая опухоль:
- Маммограмма использует рентгеновские лучи для получения снимков вашей груди.
- Ультразвук использует звуковые волны для создания изображений вашей груди.
- МРТ использует мощные магниты и радиоволны для получения изображений поперечного сечения вашей груди.
- Биопсия включает удаление части опухоли через полую иглу или всей опухоли через разрез на коже.
Чтобы точно сказать, есть ли у вас филлодическая опухоль или фиброаденома, вашему врачу, скорее всего, придется удалить всю опухоль. Опухоль отправляется в лабораторию, где патологоанатомы рассматривают ее под микроскопом. Если опухоль доброкачественная, края будут четко очерченными, и клетки не будут быстро делиться.
Опухоль отправляется в лабораторию, где патологоанатомы рассматривают ее под микроскопом. Если опухоль доброкачественная, края будут четко очерченными, и клетки не будут быстро делиться.
Несмотря на то, что филлодозная опухоль доброкачественная, она может расти и вызывать боль и другие проблемы.Ваш врач порекомендует вам операцию по его удалению. Хирург удалит не только опухоль, но и часть здоровых тканей вокруг нее.
Для лечения филлодийных опухолей используется несколько различных хирургических вмешательств:
- Лампэктомия: Хирург удаляет опухоль вместе с минимум 1 сантиметром (0,4 дюйма) ткани вокруг нее. Удаление этой лишней ткани помогает предотвратить рецидив опухоли.
- Частичная мастэктомия: Если опухоль больше, хирург удаляет всю часть груди, в которой она находится.
- Полная мастэктомия: Хирург удаляет всю грудь. Вы можете сделать операцию по реконструкции груди одновременно или после мастэктомии.

Если опухоль злокачественная, ваш врач может порекомендовать следующие методы лечения:
- Радиация использует волны высокой энергии для уничтожения раковых клеток. Ваш врач может использовать его после операции для лечения раковой опухоли филлодий, которая не распространилась за пределы вашей груди.
- Химиотерапия использует химические вещества для уничтожения раковых клеток по всему телу.Это лечение возможно, если раковая опухоль распространилась на другие части вашего тела.
Опухоли Phyllodes обычно не являются злокачественными, но иногда могут возвращаться после лечения. Обычно эти опухоли возвращаются в течение года или двух после операции. Раковые опухоли могут вернуться раньше.
Чтобы поймать опухоль, если она все же вернется, вы будете регулярно посещать врача. Каждые 4–6 месяцев вы будете проходить клинические обследования груди. Вам также потребуются стандартные визуализирующие обследования, такие как маммография, ультразвук и МРТ, чтобы проверить, не вернулась ли опухоль в пораженную грудь.
Злокачественная филлодическая опухоль молочной железы с быстрым прогрессированием: история болезни | Отчеты о хирургических случаях
Злокачественная РТ — это редкое поражение груди, которое может имитировать доброкачественные образования, такие как фиброаденомы, при клиническом диагнозе, но характеризуется типичным быстрым ростом. ПП обычно возникают у женщин среднего возраста в возрасте от 35 до 55 лет, со средним показателем в 45 лет [4]. PT состоят из эпителиальных элементов и стромы соединительной ткани с более высокой клеточностью стромы.Злокачественный ПП отличается от доброкачественного / пограничного ПТ наличием выраженной клеточности стромы, клеточной атипии и митотической активности по крайней мере в 10/10 полях высокого увеличения [10].
Клиническая картина и рентгенологические данные злокачественного ПТ поразительно схожи с таковыми при доброкачественных поражениях, таких как фиброаденома, или даже доброкачественном ПП, поэтому врачам довольно сложно диагностировать или даже заподозрить заболевание на ранней стадии. . Хотя рутинная биопсия молочной железы может быть необоснованной, для клиницистов крайне важно учитывать и включать PT в свой дифференциальный диагноз.Более того, также очевидно, что врачи не могут полностью полагаться на рентгенологические данные.
. Хотя рутинная биопсия молочной железы может быть необоснованной, для клиницистов крайне важно учитывать и включать PT в свой дифференциальный диагноз.Более того, также очевидно, что врачи не могут полностью полагаться на рентгенологические данные.
В соответствии с рекомендациями Национальной комплексной онкологической сети (NCCN) по раку груди, лечение РП размером> 3,0 см представляет собой хирургическое иссечение с чистыми краями (≥ 1,0 см) без подмышечной стадии, независимо от того, доброкачественная ли опухоль или нет. пограничная или злокачественная [11]. Многие другие исследования подтвердили утверждение о том, что поля ≤ 1,0 см связаны с более высокой частотой рецидивов, начиная с 16.От 7 до 40% [4, 12].
Прогноз PT варьирует, частота местных рецидивов колеблется от 10 до 40% (в среднем 15%), а отдаленные метастазы встречаются в 10% всех PT и до 20% злокачественных PT [13]. Выживаемость после метастатического заболевания низкая, при этом в различных сериях случаев средняя выживаемость варьировала от 4 до 17 месяцев с большой вариабельностью в зависимости от места метастатического заболевания [14]. В других крупных проспективных исследованиях сообщается о 5-летней выживаемости без признаков заболевания 96% для доброкачественных ПП и 66% для злокачественных ПП [15].Большинство сарком метастазируют гематогенно, а частота поражения подмышечных лимфатических узлов при злокачественных ПТ колеблется от 1,1 до 3,8% [16].
В других крупных проспективных исследованиях сообщается о 5-летней выживаемости без признаков заболевания 96% для доброкачественных ПП и 66% для злокачественных ПП [15].Большинство сарком метастазируют гематогенно, а частота поражения подмышечных лимфатических узлов при злокачественных ПТ колеблется от 1,1 до 3,8% [16].
В настоящее время нет единого мнения относительно рекомендаций по лучевой терапии, гормональной терапии и системной химиотерапии злокачественных ПТ. На сегодняшний день двойного слепого многоцентрового исследования по этой теме не проводилось. В большинстве клинических случаев и исследований описывается лечение этих опухолей исключительно с помощью широкого местного иссечения в соответствии с действующими рекомендациями NCCN.Поскольку ПТ считаются саркомой мягких тканей, адъювантная химиотерапия доксорубицином плюс дакарбазин может дать некоторые преимущества пациентам с большими (> 5,0 см) опухолями высокого риска [17]. Более глубокое исследование дополнительных возможностей адъювантной терапии крупных агрессивных злокачественных опухолей ПТ может оказаться плодотворным [18]. Недавно сообщалось, что терапия доксорубицином и ифосфамидом эффективна для лечения метастазов злокачественных ПТ [19, 20]. В соответствии с предыдущими сообщениями [19, 20], мы проводили терапию AI с использованием 60 мг / м 2 доксорубицина и 10 г / м 2 ифосфамида на каждом курсе.
Недавно сообщалось, что терапия доксорубицином и ифосфамидом эффективна для лечения метастазов злокачественных ПТ [19, 20]. В соответствии с предыдущими сообщениями [19, 20], мы проводили терапию AI с использованием 60 мг / м 2 доксорубицина и 10 г / м 2 ифосфамида на каждом курсе.
Поскольку сообщений о злокачественных случаях ПТ не так много, имеющихся данных недостаточно для полного расчета статистики выживаемости, связанной с этими опухолями. Предыдущие отчеты о случаях и исследования показали, что прогноз злокачественной ПТ груди обычно плохой, в то время как общий прогноз доброкачественной ПТ является хорошим [14, 21].
Ранняя диагностика и определение стадии PT имеют решающее значение не только для улучшения общего исхода заболевания после лечения, но также для улучшения качества жизни пациента, вызывая меньшее обезображивание.В то время как руководство по скринингу на рак молочной железы предполагает, что женщинам старше 40 лет следует начинать рутинную маммографию для выявления наличия рака молочной железы, PT могут происходить за десять лет до этого минимального возраста скрининга, поскольку они происходят в течение третьего или четвертого десятилетия жизни.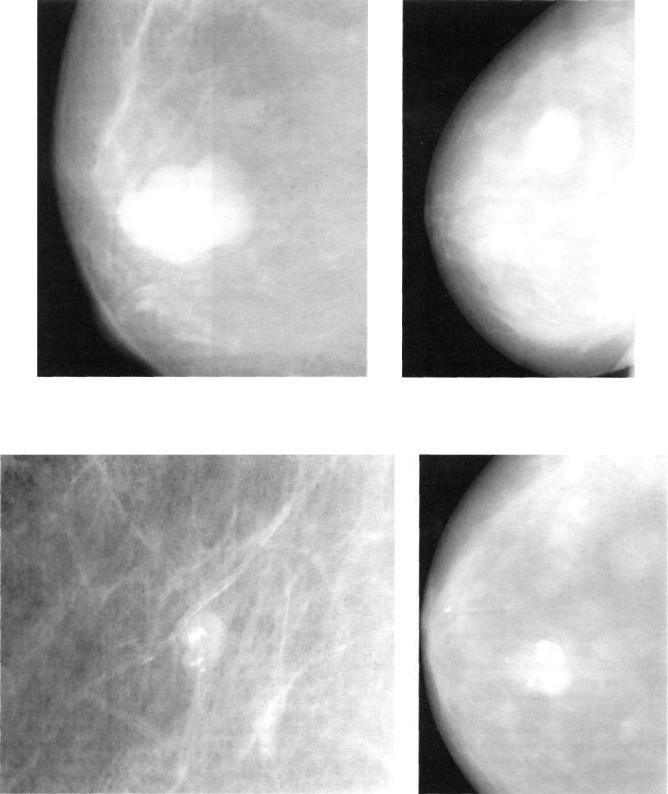 Более того, если пациент подозревает, что поражение демонстрирует рост в течение от 6 месяцев до года после первоначального обнаружения, его следует рассмотреть для дальнейшего обследования.
Более того, если пациент подозревает, что поражение демонстрирует рост в течение от 6 месяцев до года после первоначального обнаружения, его следует рассмотреть для дальнейшего обследования.
Фиброаденома — Симптомы и причины
Обзор
Фиброаденомы (fy-broe-ad-uh-NO-muhz) — это твердые доброкачественные уплотнения в груди, которые чаще всего возникают у женщин в возрасте от 15 до 35 лет.
Фиброаденома может быть твердой, гладкой, эластичной или твердой и иметь четко определенную форму. Обычно безболезненный, он может ощущаться в груди как шарик, легко движущийся под кожей при осмотре. Фиброаденомы различаются по размеру, и они могут увеличиваться или уменьшаться самостоятельно.
Фиброаденомы являются одними из самых распространенных доброкачественных опухолей груди у молодых женщин. Лечение может включать мониторинг для выявления изменений в размере или ощущении, биопсию для оценки опухоли или операцию по ее удалению.
Продукты и услуги
Показать больше продуктов от Mayo ClinicСимптомы
Фиброаденомы — это твердые уплотнения груди, которые обычно:
- Круглый с четкими гладкими краями
- Легко перемещается
- Прочная или эластичная
- Безболезненно
У вас может быть одна или несколько фиброаденом в одной или обеих молочных железах.
Когда обращаться к врачу
У здоровых женщин нормальная ткань груди часто кажется бугристой.Запишитесь на прием к врачу, если:
- Вы обнаружили новое уплотнение в груди
- Вы замечаете другие изменения в своей груди
- Уплотнение в груди, которое вы проверяли ранее, выросло или изменилось иным образом и, похоже, отделено от окружающей ткани груди
Причины
Причина фиброаденом неизвестна, но они могут быть связаны с репродуктивными гормонами. Фиброаденомы чаще возникают в репродуктивном возрасте, могут увеличиваться во время беременности или при использовании гормональной терапии и могут уменьшаться после менопаузы, когда уровень гормонов снижается.
Фиброаденомы чаще возникают в репродуктивном возрасте, могут увеличиваться во время беременности или при использовании гормональной терапии и могут уменьшаться после менопаузы, когда уровень гормонов снижается.
Типы фиброаденом
Помимо простых фиброаденом, существуют:
- Сложные фиброаденомы. Они могут содержать изменения, такие как чрезмерный рост клеток (гиперплазия), которые могут быстро расти. Патолог ставит диагноз сложной фиброаденомы после изучения ткани после биопсии.
- Ювенильные фиброаденомы. Это наиболее распространенный тип уплотнения в груди, обнаруживаемый у девочек и подростков в возрасте от 10 до 18 лет.Эти фиброаденомы могут увеличиваться в размерах, но большинство из них со временем уменьшаются, а некоторые исчезают.
- Гигантские фиброаденомы. Они могут вырасти более чем на 2 дюйма (5 сантиметров). Возможно, их придется удалить, потому что они могут давить или заменять другие ткани груди.

- Опухоль Phyllodes. Хотя обычно доброкачественные, некоторые опухоли филлодий могут стать злокачественными (злокачественными). Врачи обычно рекомендуют их удалить.
Осложнения
Большинство фиброаденом не влияют на риск рака груди.Однако риск рака молочной железы может немного увеличиться, если у вас сложная фиброаденома или филлоденома.
07 мая 2020
Показать ссылки- Фиброаденомы молочной железы. Американское онкологическое общество. https://www.cancer.org/cancer/breast-cancer/non-cancerous-breast-conditions/fibroadenomas-of-the-breast.html. Проверено янв.30, 2017.
- Sabel MS. Обзор доброкачественных заболеваний груди. http://www.uptodate.com/home. Доступ 30 января 2017 г.
- Понимание изменений груди: руководство по здоровью для женщин. Национальный институт рака.
 https://www.cancer.gov/types/breast/understanding-breast-changes. Доступ 30 января 2017 г.
https://www.cancer.gov/types/breast/understanding-breast-changes. Доступ 30 января 2017 г. - Факты для жизни: Доброкачественные заболевания груди. Сьюзан Г. Комен. http://ww5.komen.org/BreastCancer/BenignConditions.html. Доступ 30 января 2017 г.
- УЗИ — груди.RadiologyInfo.org. http://www.radiologyinfo.org/en/info.cfm?pg=breastus. Доступ 31 января 2017 г.
- Cerrato FE и др. Промежуточные и отдаленные исходы удаления гигантской фиброаденомы у подростков и молодых взрослых пациентов. Грудь J. 2015; 21: 254.
- Banikarim C, et al. Обзор образований груди у детей и подростков. http://www.uptodate.com/home. По состоянию на 1 февраля 2017 г.
Связанные
Связанные процедуры
Показать другие связанные процедурыПродукты и услуги
Показать больше продуктов и услуг Mayo Clinic[Полный текст] «Разорванная» злокачественная филлодная опухоль груди: случай r
Чагкрит Дитсатам, Ареван Сомвангпрасерт, Кирати Ватчарачан, Пханчапорн Вонгманеерунг
Отделение головы, шеи и груди, Отделение хирургии, Чиангмайский университет Май, Таиланд
Резюме: Филлодозная опухоль или филлодисцистосаркома — редкое заболевание, которое обычно наблюдается у пациентов среднего возраста. Разрыв опухоли филлодий — очень редкое заболевание. В нашем исследовании рассказывается о представлении пациента, методе диагностики и лечении необычного случая. У 58-летней женщины в пременопаузе была диагностирована опухоль филлодий, в течение 2 месяцев у нее была быстрорастущая масса, которая разорвалась 1 месяц спустя. Ей была сделана простая мастэктомия на левой стороне груди и проведена адъювантная лучевая терапия. Через 4 месяца после операции рецидива не было.
Разрыв опухоли филлодий — очень редкое заболевание. В нашем исследовании рассказывается о представлении пациента, методе диагностики и лечении необычного случая. У 58-летней женщины в пременопаузе была диагностирована опухоль филлодий, в течение 2 месяцев у нее была быстрорастущая масса, которая разорвалась 1 месяц спустя. Ей была сделана простая мастэктомия на левой стороне груди и проведена адъювантная лучевая терапия. Через 4 месяца после операции рецидива не было.
Введение
Phyllodes, опухоль или phyllodes цистосаркомы составляет примерно 0.3–0,9% всех опухолей груди 1 и обычно наблюдается у пациентов в возрасте от 40 до 50 лет. 2 Всемирная организация здравоохранения разделила эту опухоль на три подтипа — доброкачественную, пограничную и злокачественную. Стромальные элементы этих опухолей часто образуют листообразные выступы, выстланные эпителием. Хирургия остается основой лечения пациентов с опухолью филлодий, а полная хирургическая резекция обеспечивает высокий уровень местного контроля. 3
3
Опухоль с разрывом филлодий — очень редкое заболевание.В нашем исследовании рассказывается о представлении пациента, методе диагностики и лечении необычного случая, поступившего в отделение головы, шеи и груди университетской больницы Чиангмая.
Кейс-презентация
58-летняя женщина в пременопаузе с основным заболеванием мальформации Киари I и сирингомиелией уровня C1-T10 поступила в амбулаторное хирургическое отделение провинциальной больницы Таиланда. У нее в течение 2 месяцев было образование в левой груди и высыпание массы с гноем через кожу в течение 1 месяца.Пациент сообщил об ускорении роста новообразования за последний месяц, а также пожаловался на периодические кровотечения из новообразования.
При физическом осмотре обнаружено огромное образование с изъязвлениями неправильной поверхности, занимающее всю левую грудь (рис. 1). Масса кровоточила при поверхностном контакте. Подмышечной лимфаденопатии не было. Правая грудь в норме.
Рисунок 1 Опухоль всей левой груди (размер разрыва 22 × 18 см). |
Была проведена компьютерная томография грудной клетки, которая показала большую неоднородную увеличивающуюся массу в левой груди размером 13,4 × 14,8 × 14,3 см с узелком круглой формы в заднем базальном сегменте левого нижнего легкого. размером 0,6 см (рис. 2). Органы брюшной полости без особенностей.
Рис. 2 КТ грудной клетки показывает огромную неоднородную увеличенную массу на левой груди. |
Биопсия стержневой иглы показала фиброэпителиальное новообразование, а дифференциальный диагноз включал фиброаденому или опухоль филлодий. Пациенту была проведена простая мастэктомия под общим наркозом. Размер резецированного препарата составлял 22 × 18 см, опухоль не прорастала в окружающие ткани. Образец был отправлен на гистопатологическое макроскопическое исследование, так как дольки с очаговым некрозом и кровотечением, охватывающим весь образец. Гистопатология хирургического образца (рис. 3) выявила злокачественную филлодийную опухоль; 13 митозов / 10 полей при высоком увеличении, хирургические края приближались к латеральному и глубокому краям опухоли.
Гистопатология хирургического образца (рис. 3) выявила злокачественную филлодийную опухоль; 13 митозов / 10 полей при высоком увеличении, хирургические края приближались к латеральному и глубокому краям опухоли.
Рис. 3. Микроскопическое исследование филлодий опухоли. |
Больная выписана на 10-е сутки после операции в хорошем состоянии, без раневых осложнений; Через 4 мес после операции рецидивов не было.Протоколы исследования были одобрены Институциональным этическим комитетом Университета Чиангмая, Таиланд, также было получено информированное письменное согласие пациента.
Обсуждение
Опухоли типа Phyllodes встречаются редко, особенно если они разрываются. Из обзора литературы в базе данных было найдено несколько исследований, в каждом из которых сообщалось только об одном случае. 4–6 Эти опухоли обычно представляют собой четко очерченные, твердые и подвижные образования или узелки, характеризующиеся быстрым ростом в течение короткого периода времени и классифицируемые как доброкачественные, промежуточные или злокачественные опухоли. 7 При маммографии и ультразвуковых изображениях было трудно отличить фиброаденому от опухоли филлодий. 8 Гистопатология филлодийных опухолей характеризуется выстланными эпителием трещиноподобными пространствами с гиперклеточной стромой, организованными в листообразные отростки. Стандартным лечением филлодозной опухоли является хирургическое вмешательство, а лечение выбора — широкое местное иссечение 9 с адекватным краем здоровой ткани (более 1,0 см), но мастэктомия рекомендуется при большом соотношении опухоли к груди или при невозможности получить адекватные поля.
Из обзора литературы в базе данных было найдено несколько исследований, в каждом из которых сообщалось только об одном случае. 4–6 Эти опухоли обычно представляют собой четко очерченные, твердые и подвижные образования или узелки, характеризующиеся быстрым ростом в течение короткого периода времени и классифицируемые как доброкачественные, промежуточные или злокачественные опухоли. 7 При маммографии и ультразвуковых изображениях было трудно отличить фиброаденому от опухоли филлодий. 8 Гистопатология филлодийных опухолей характеризуется выстланными эпителием трещиноподобными пространствами с гиперклеточной стромой, организованными в листообразные отростки. Стандартным лечением филлодозной опухоли является хирургическое вмешательство, а лечение выбора — широкое местное иссечение 9 с адекватным краем здоровой ткани (более 1,0 см), но мастэктомия рекомендуется при большом соотношении опухоли к груди или при невозможности получить адекватные поля. Адъювантная химиотерапия, включающая доксорубицин и дакарбазин, редко используется для лечения этого типа опухоли груди; В нескольких исследованиях сообщалось, что это лечение не влияло на выживаемость пациентов. 10 , 11 Адъювантная лучевая терапия также вызывает споры. Некоторые исследования не показали улучшения прогноза, тогда как другие исследования показали лучший местный контроль 12 , но не повлияли на выживаемость без болезни или общую выживаемость. 13 Chaney et al. Предположили, что лучевая терапия рекомендуется для пограничных или злокачественных филлодийных опухолей, потому что риск местного рецидива высок, особенно с положительными границами, границами менее 0.5 см, размер опухоли более 10 см или рецидив заболевания. 10 Большинство филлодических опухолей экспрессируют ER и PR, и эндокринная терапия не имеет доказанной роли в адъювантном лечении, а ER и PR снижают экспрессию в подгруппе филлодозных опухолей высокой степени злокачественности.
Адъювантная химиотерапия, включающая доксорубицин и дакарбазин, редко используется для лечения этого типа опухоли груди; В нескольких исследованиях сообщалось, что это лечение не влияло на выживаемость пациентов. 10 , 11 Адъювантная лучевая терапия также вызывает споры. Некоторые исследования не показали улучшения прогноза, тогда как другие исследования показали лучший местный контроль 12 , но не повлияли на выживаемость без болезни или общую выживаемость. 13 Chaney et al. Предположили, что лучевая терапия рекомендуется для пограничных или злокачественных филлодийных опухолей, потому что риск местного рецидива высок, особенно с положительными границами, границами менее 0.5 см, размер опухоли более 10 см или рецидив заболевания. 10 Большинство филлодических опухолей экспрессируют ER и PR, и эндокринная терапия не имеет доказанной роли в адъювантном лечении, а ER и PR снижают экспрессию в подгруппе филлодозных опухолей высокой степени злокачественности. 14
14
Мы рассмотрели разорванную филлодисную опухоль молочной железы, и ее краткое изложение представлено в таблице 1.
Таблица 1 Данные литературы о пациентах с разрывом филлодийной опухоли 4,6,15,16 |
Заключение
Опухоли типа Phyllodes — это необычные фиброэпителиальные опухоли молочной железы, разрывы которых случаются крайне редко.Существует высокий показатель подозрения на эту опухоль, если у пациента в анамнезе отмечается быстрый рост массы груди. Опухоли филлодий часто появляются на УЗИ и маммографии, и их трудно отличить от фиброаденомы. Простая мастэктомия выполняется только в том случае, если отрицательные поля не могут быть получены широким местным иссечением. Неадекватное хирургическое лечение может привести к местному рецидиву. Адъювантная лучевая терапия рассматривается у отдельных пациентов.
Раскрытие информации
Авторы сообщают об отсутствии конфликта интересов в этой работе.
Список литературы
1. | Герреро М.А., Баллард Б.Р., Грау А.М. Злокачественная филлодическая опухоль молочной железы: обзор литературы и отчет о случаях чрезмерного роста стромы. Surg Oncol . 2003. 12 (1): 27–37. |
2. | Спиталери Г., Тоэска А., Боттери Е. и др. Опухоль филлодий молочной железы: обзор литературы и анализ ретроспективных серий в одном центре. Crit Rev Oncol Hematol .2013. 88 (2): 427–436. |
3. | Macdonald OK, Lee CM, Tward JD, Chappel CD, Gaffney DK. Злокачественная филлодическая опухоль женской груди. Рак . 2006. 107 (9): 2127–2133. |
4. | Наби Дж., Ахтер С.М., Authoy FN. Случай большой опухоли филлодий, вызвавшей «разрыв» груди: уникальная картина. Корпус Rep Oncol Med . 2013; 2013: 871292. |
5. | Walravens C, De Greef C. Гигантская филлодированная опухоль груди. J Plast Reconstr Aesthet Surg . 2008; 61 (10): e9 – e11. |
6. | Wijeyaratne SM. «Разрыв» груди из-за филлодарной опухоли. BMJ Case Rep . 2010; 2010. |
7. | Гренье Дж., Дельбальдо С., Зелек Л., Пьедбуа П. Tumeurs phyllodes et sarcomes du sein: mise au point [Опухоли филлодий и саркомы груди: обзор]. Бык-Рак . 2010. 97 (10): 1197–1207. |
8. | Герреро М.А., Баллард Б.Р., Грау А.М. Злокачественная филлодическая опухоль молочной железы: обзор литературы и отчет о случаях чрезмерного роста стромы. Surg Oncol . 2003. 12 (1): 27–37. |
9. | Робертс Н., Ранк DM. Агрессивная злокачественная опухоль филлодий. |
10. | Чейни А.В., Поллак А., Макнис, доктор медицины, Загарс Г.К. Адъювантная лучевая терапия филлодийной опухоли молочной железы. Радиат Онкол Расследование . 1998. 6 (6): 264–267. |
11. | Моралес-Васкес Ф., Гонсалес-Ангуло А.М., Брглио К. и др. Адъювантная химиотерапия доксорубицином и дакарбазином не влияет на выживаемость без рецидивов злокачественных филлодийных опухолей молочной железы. Грудь J . 2007. 13 (6): 551–556. |
12. | Пандей М., Мэтью А., Каттор Дж. И др. Злокачественная филлодическая опухоль. Грудь J . 2001. 7 (6): 411–416. |
13. | Gnerlich JL, Williams RT, Yao K, Jaskowiak N, Kulkarni SA. Использование лучевой терапии злокачественных филлодийных опухолей: анализ национальной базы данных по раку, 1998–2009 гг. |


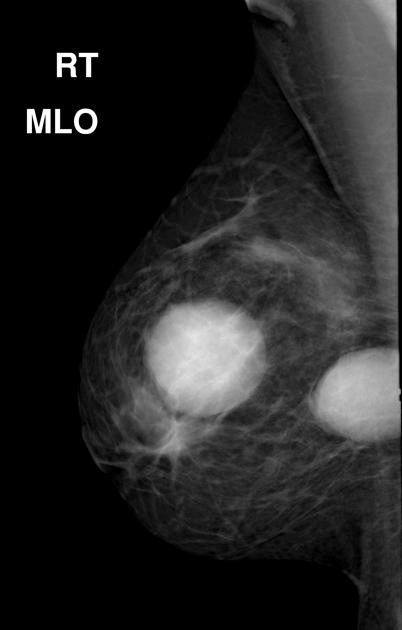

 Применяется при отсутствии подозрений на наличие злокачественного процесса. При этом дефект тканей молочной железы (как осложнение операции) минимален или отсутствует вообще.
Применяется при отсутствии подозрений на наличие злокачественного процесса. При этом дефект тканей молочной железы (как осложнение операции) минимален или отсутствует вообще.

 https://www.cancer.gov/types/breast/understanding-breast-changes. Доступ 30 января 2017 г.
https://www.cancer.gov/types/breast/understanding-breast-changes. Доступ 30 января 2017 г.
 Int J Surg Case Rep . 2015; 8С: 161–165.
Int J Surg Case Rep . 2015; 8С: 161–165.