Анализ на устойчивость к антибиотикам
Анализ на устойчивость к антибиотикам помогает правильно подобрать препарат для лечения и существенно повысить эффективность терапии. По результатам проведенного исследования врач составляет антибиотикограмму — список лекарств, к которым чувствителен или не чувствителен исследуемый микроорганизм. Единицей измерения является минимальное количество антибиотика, необходимого для устранения возбудителя.
Все микроорганизмы чувствительны к какой-либо группе антибиотиков. В зависимости от устойчивости к лекарствам, микробы делятся на три группы:
- чувствительные — гибнут под воздействием обычных доз;
- умеренно-устойчивые — погибают при приеме максимальных доз препаратов;
- устойчивые штаммы — выживают даже при максимальных количествах антибиотика.
Чтобы определить, какие антибиотики успешно справятся с бактериями-возбудителями заболевания, необходимо сдать посев.
Посев мочи
Посев мочи на устойчивость к лекарственным препаратам обычно сдают при диагностике мочеполовых инфекций, приводящих к возникновению цистита, уретрита, пиелонефрита. Показаниями к проведению исследования являются:
- болезненные мочеиспускания,
- поясничные боли,
- нарушения мочеиспускания,
- изменения в результатах общих анализов мочи.
Для анализа на устойчивость к антибиотикам нужно собрать утреннюю порцию мочи в стерильную емкость. Перед сбором биоматериала необходимо провести гигиенические процедуры. При таком способе забора, моча содержит максимальную концентрацию микроорганизмов. Если за несколько дней перед сдачей анализов пациент принимал лекарства, результат может быть ложноотрицательным. Об этом следует заранее предупредить врача.
Образец подвергают двум видам анализов. Первый помогает определить возбудителя инфекции, второй — уровень его чувствительности к тем или иным антибиотикам.
Посев крови
Анализ крови берут из вены.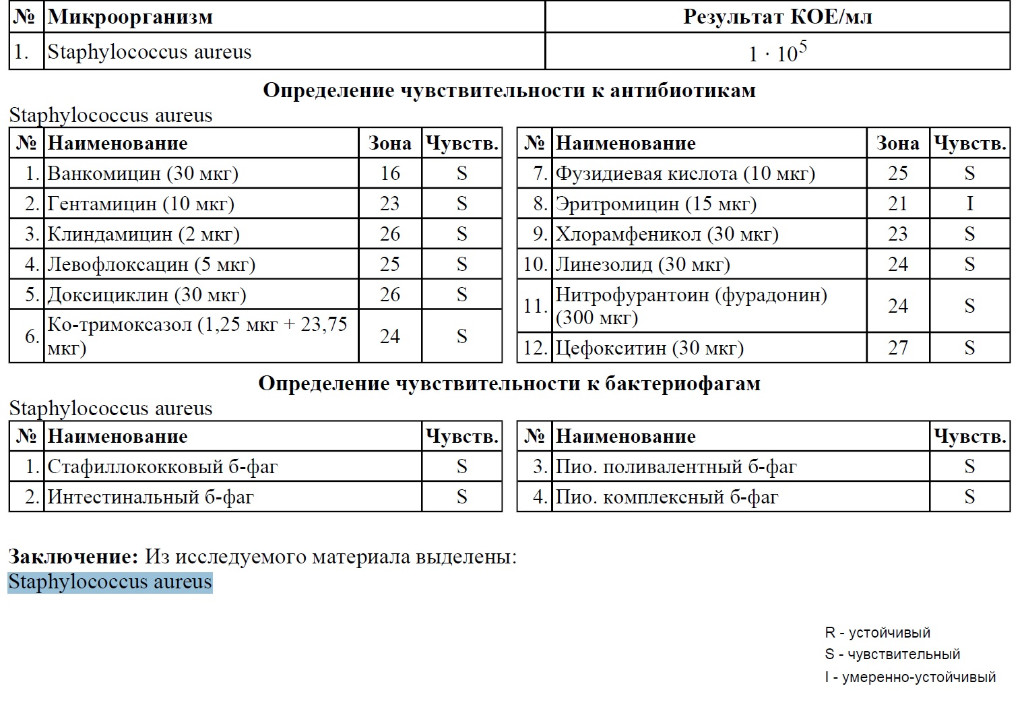 Биоматериал помещают в специальную стерильную бутыль, в которой создана питательная среда для бактерий. В первую очередь устанавливают типы микроорганизмов в образце, а затем проводят исследование на их чувствительность к лекарствам.
Биоматериал помещают в специальную стерильную бутыль, в которой создана питательная среда для бактерий. В первую очередь устанавливают типы микроорганизмов в образце, а затем проводят исследование на их чувствительность к лекарствам.
Результаты бактериологического посева крови могут быть следующими:
- нет роста бактерий — кровь стерильна;
- чистый рост — означает наличие одного вида микроорганизмов, например, при сепсисе;
- смешанный рост — из образца крови было выделено более одного вида микробов.
Результаты анализов на устойчивость к антибиотикам передают врачу. Он принимает решение о назначении тех или иных лекарств для терапии выявленной болезни.
Чтобы сдать анализы в нашей лаборатории, выбирайте нужный профиль и записывайтесь любым удобным способом — через интернет-регистратуру или по телефонам. Подробности о действующих скидках и акциях уточняйте у администраторов.
В нашей лаборатории действуют доступные цены на все исследования. Например, выгодно заказать оформление мужского или женского генетического паспорта здоровья. Вместе с документом Вы получаете заключение опытного генетика.
Все статьи
Посев крови на стерильность с определением чувствительности к антибиотикам
Посев крови на стерильность проводят при подозрении на бактериемию. Для получения достоверных результатов забор крови должен проводиться до начала лечения антибактериальными препаратами.
Кровь на чувствительность к антибактериальным препаратам исследуют только после изучения посева крови на стерильность и выявлении в ней роста микроорганизмов: стафилококки, стрептококки, энтерококки, менингококки и т. д.
Для подтверждения или исключения бактериемии, кровь помещается в специальную культуральную питательную среду и подвергается инкубации, при соблюдении температурного режима — 370С (оптимальная температура для роста микроорганизмов).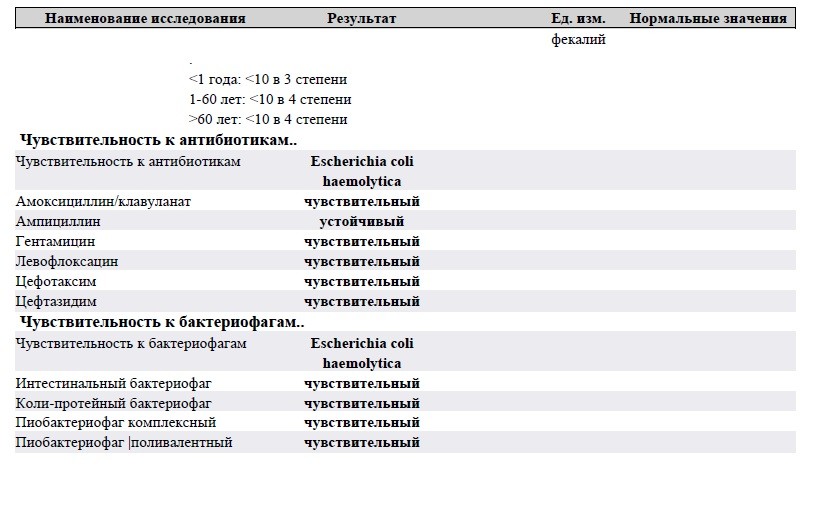
При обнаружении роста колоний, культуру окрашивают и микроскопируют. Определяется вид микроорганизмов (грам -; грам+ кокки, палочки и т. д.). Для более точной идентификации возбудителя, проводят посев на специальные плотные среды. После идентификации микроорганизмов, определяют чувствительность к антибактериальным препаратам, для определения эффективности действия.
Важно понимать, что бактериемия является жизнеугрожающим состоянием, требующим немедленного назначения антибактериальных препаратов. Данные посева на чувствительность к антибиотикам жизненно важны, если заболевание вызвано флорой, с приобретенной резистентностью к одному или нескольким антибактериальным препаратам.
Образец крови помещается в бутылку с гемокультурой, избегая контаминации (контакта с кожей пациента или персонала, предметами и т. д.). После открытия внешней (пластиковой крышки), внутренняя крышка флакона обрабатывается 70% этиловым спиртом в течении 1-2 минут. Кожа пациента, непосредственно над местом пункции, обрабатывается 70% этиловым спиртом и 1-2% йодом. После того, как обработанный участок высохнет, необходимо выполнить венепункцию, не касаясь руками обработанной поверхности. Кровь для исследования должна браться до начала антибактериальной терапии. При остром сепсисе необходимо 2-3 забора материала с интервалом в час, что позволяет обнаружить микроорганизмы, а также отдифференцировать истинную бактериемию (бактерии в обоих образцах) от загрязнения образца бактериями (бактерии в одном образце из-за несоблюдения техники забора материала). У лихорадящих пациентов кровь необходимо брать при подъеме температуры либо сразу, либо посде прохождения температурного пика.
При расшифровке анализа учитываются промежуточные (ежедневные) и окончательные заключения. Ответы с бактериологической лаборатории классифицируются на три типа:
* отрицательные (рост микроорганизмов отсутствует)
* выявлен чистый рост (рост только одного вида)
* обнаружен смешанный рост (свидетельствует о нарушении правил забора материала и загрязнении пробы).
В окончательном результате, при обнаружении микроорганизмов указывают их вид и результат исследования на чувствительность к антибактериальным препаратам.
Для чего нужно проверять кровь на стерильность?
В ТОГБУЗ «ГКБ им. Арх. Луки г. Тамбова» прошло очередное занятие в «Школе практического мастерства». Вели занятие, посвященное вопросам посева крови на стерильность и посева мочи для ее количественного экспресс-исследования, старший лаборант бактериологической лаборатории О. В. Бирюкова и Е. Н. Герасименко.
Для чего нужно проверять кровь на стерильность? Ответ на этот простой, казалось бы, вопроси обусловливает важность темы данного занятия не только для специалистов бактериологической службы больницы, но и для всего ее среднего медперсонала. А в преддверии сезонных респираторных заболеваний она особенно актуальна.
Дело в том, что в современной диагностической практике анализ крови на стерильность проводят для того, чтобы узнать о наличии бактериемии. Сдавать кровь на стерильность врачи рекомендуют непосредственно перед процессом терапии, остерегаясь получить неправильный результат.Показанием к проведению такого анализа может служить определение в крови патогенных микроорганизмов.
Примерами последних могут быть стрептококки, синегнойные палочки, золотистые стафилококки, дрожжевые грибы и энтеробактерии. Например, для обнаружения заражения эпидермальным стафилококком необходимо провести многократное тестирование.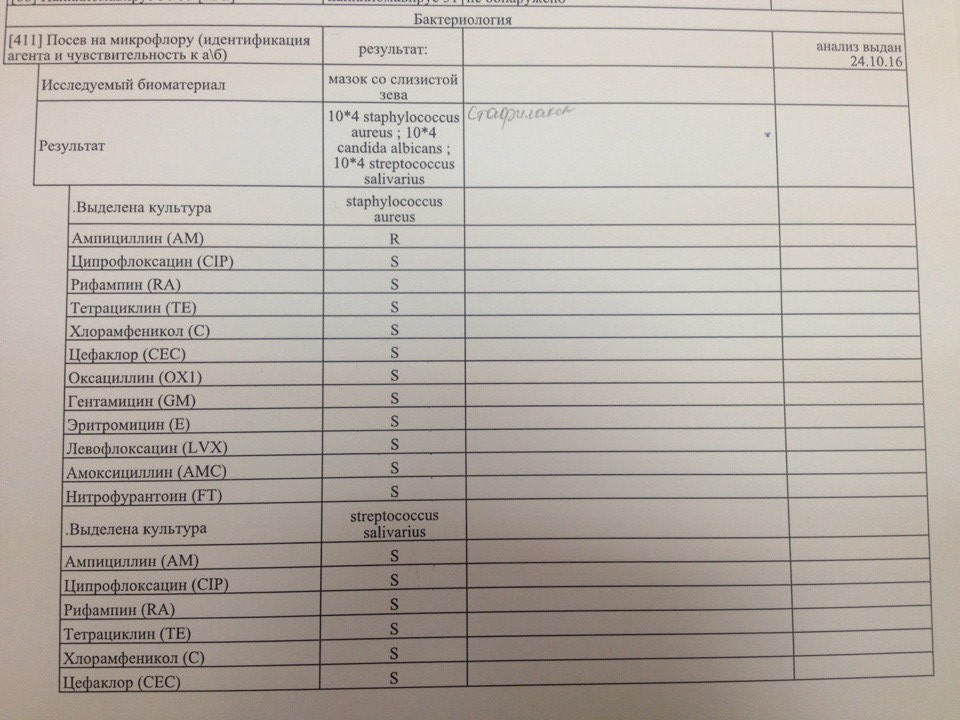
Такие виды исследований очень важны для больных людей с низким иммунитетом. К примеру, зараженные ВИЧ-инфекцией пациенты могут быть обладателями микобактерий туберкулеза.
В большинстве случаях анализ делают в тех случаях, когда у пациента уже длительное время держится и не спадает высокая температура, причем происходит это без особых на то причин. Помимо всего, анализ назначают при подозрении на сепсис или менингит.
Проведение этого анализа помогает определить бактерии, содержащиеся в составе крови. Это могут быть как опасные, так и условно-патогенные бактерии, которые также могут оказаться причиной болезни. Помимо того, что проведением анализа можно установить наличие определенной бактерии, можно определить и стадию, на которой находится заболевание.
Если посев крови проводится с целью определения чувствительности организма к разнообразию антибиотиков, то анализ поможет установить тип возбудителя и назначить подходящие антибиотики для проведения лечения. В данном случае анализ поможет определить неэффективное использование предыдущих антибиотических препаратов; наличие менингита или сепсиса, а также гнойничковое поражение кожи.
Перед проведением анализа необходимо придерживаться самых стандартных правил – пару дней не пить алкоголь, не употреблять жирную пищу, постараться отказаться от курения, хотя бы за пару часов до проведения анализа. Прием лекарственных препаратов назначается после проведения анализа.
Во время проведения анализа отдельное внимание стоит обратить на тот факт, что в 3% случаях эпидермальный стафилококк (загрязненная микрофлора кожи) может выступить в качестве гемокультуры. Именно поэтому его клиническое значение определяется только после многократных исследований.
Во время исследования необходимо произвести забор крови из вены у локтевого сгиба. У детей младшего возраста забор крови производится из пальца, пятки, мочки уха в меньшем количестве. Кровь для проведения анализа берут только после тщательной обработки кожи, соблюдая все правила асептики, используя одноразовый стерильный шприц.
Посев на питательные среды стерильного материала (кровь или другие, содержащие микробов жидкости у здоровых лиц) также лучше делать у постели больного, либо помещать в стерильную посуду, содержащую вещества, препятствующие свертыванию крови 0,3% раствора цитрата натрия, 0,1% раствор оксалата натрия). Обычно берут 5-10мл крови и засевают во флакон, содержащий 50-100 мл среды. Для этого используют для флакона с питательной средой (один для аэробов, другой для анаэробов). Посев крови производится на жидкие питательные среды – 10% желчный бульон, 1% сахарный бульон, двухфазную среду, а также жидкие и полужидкие среды для культивирования анаэробов в разведении 1:10. Флаконы с питательной средой получают в лаборатории, переливание крови из шприца во флакон необходимо производить над пламенем спиртовки, предварительно сняв иглу. Флакон с посевом направляется в лабораторию, а в вечернее и ночное время помещают в термостат.
Важным моментом является тот факт, что чем раньше произвести посев от начала болезни, тем больше возможность получить положительный результат, и наоборот, чем позднее, тем меньше шансов. При нормальной температуре получения положительного результата бывает очень редко.
Техника посева позволяет увидеть, как растут колонии, а также провести с образцовыми цепочками микроорганизмов тесты, позволяющие окончательно определить их тип.
Кровь для бактериологического посева необходимо сдавать до начала лечения антибиотиками, поскольку употребление антибиотиков может отсрочить или предотвратить рост бактерий, что приведет к ложноотрицательному результату. У пациентов с периодическим повышением температуры тела кровь нужно брать в период, когда температура растет или сразу же после прохождения пика температуры. Именно в это время в крови находится максимальное количество бактерий. Во многих лабораториях специалисты рекомендуют сдать второй образец крови не позднее, чем через один час после первого, для того, чтобы увеличить шансы обнаружения бактерий.
При бактериологическом посеве нужно придерживаться асептической техники, чтобы исключить возможность бактериального загрязнения крови. Если образец взят согласно правилам, в бутылку с питательной средой попадут только те микроорганизмы, которые находится в крови больного.
Правила взятия крови для бактериологического посева:
Кровь следует брать из периферической вены, без использования катетера, чтобы исключить загрязнение.
Процедура выполняется в стерильных перчатках. Место венепункции смазывается антисептиком.
Также антисептиком дезинфицируется и крышка бутылки с питательной средой.
Кровь берется стерильным шприцем.
В бутылку кровь вносится через резиновую пробку. Снимать пробку с бутылки нельзя.
Культура крови снабжается этикеткой с данными о пациенте.
Результаты бактериологического посева крови делятся на следующие три группы:
– роста бактерий нет;
– чистый рост бактерий;
– смешанный рост бактерий.
Отсутствие роста бактерий: нормальный результат, означающий, что кровь пациента стерильна.
Чистый рост бактерий: результат, означающий, что имеется рост одного вида бактерий, который был выделен из культуры. Получения такого результата следует ожидать, когда у пациента сепсис.
Смешанный рост: результат указывает на то, что из культуры было выделено более одного вида бактерий. Такое инфицирование крови случается редко. Чаще всего, смешанный рост бактерий является подтверждением того, что питательная среда была загрязнена.
Слушателям школы практического мастерства был продемонстрирован и дипстрик – полуавтоматическое устройство, правильно пользоваться которым может даже неквалифицированный медицинский персонал или пациенты в амбулаториях, стационарах и даже домашних условиях. Применение Дипстрика позволяет повысить безопасность бактериологического анализа мочи, так как в лабораторию вместо них поступают посевы в закрытых контейнерах.
Посев на анаэробную микрофлору и определение чувствительности к антибиотикам (Anaerobic culture, Routine.
 Bacteria Identification and Susceptibility)
Bacteria Identification and Susceptibility)Метод определения бактериологический, бактериоскопический
Исследуемый материал Смотрите в описании
Обнаружение анаэробной флоры при гнойно-воспалительных процессах.
Анаэробные микроорганизмы составляют абсолютное большинство нормальной микрофлоры человеческого тела. Но при определенных условиях они становятся причиной тяжёлых гнойно-воспалительных заболеваний.
Вне зависимости от локализации очага они имеют общие характерные клинические проявления, обусловленные гнилостным характером поражения, газообразованием. Большинство анаэробных инфекций эндогенны и чаще всего поражают органы места их естественного обитания анаэробов желудочно-кишечный тракт, мочеполовая система, верхние дыхательные пути. Только точная диагностика позволяет обосновать рациональную терапию и ликвидировать потенциально смертельно-опасную инфекцию.
Выделяемые возбудители: бактероиды, вейлонеллы, эубактерии, пептострептококки, актиномицеты, фузобактерии, клостридии, превотеллы, гемеллы, бифидобактерии, порфиромонас, пропионобактерии.
Материал для исследования:- аспираты из полостей (например, полости матки), биологические жидкости из брюшной, плевральной полостей, гнойное содержимое из абсцессов и флегмон;
- кусочки тканей при миозитах и мионекрозе (путем погружения кусочка вглубь угольной среды с помощью прилагаемого к ней тампона), отделяемое со дна язв;
- желчь;
- семенная жидкость (секрет простаты).
 (495) 363-0-363.
(495) 363-0-363.Литература
- Гладкова Н. С. и соавт. Оценка различных методов лабораторной диагностики урогенитальных микоплазм.
- Вести дерматол. Венерол., 1999, № 2, рр.43 — 45.
- Gorbach S. Et al./ Infectious Diseases (3rd edition)/2003/ Lippincott Williams & Wilkins/2700 ps.
- Jacobs D. et al. Laboratory test handbook/ Lexi-Comp./2002 — 1534 p.
Посев крови или др. биол. жид-тей из стерильных локусов на аэробную и анаэробную микрофлору и определение чувствительности к антибиотикам (Blood or other biological fluid Culture, Routine. Aerobic and Anaerobic Bacteria Identification and Susceptibility)
Исследуемый материал Венозная кровь (ЭДТА)
Обратите внимание! С 1.10.11 Независимая лаборатория ИНВИТРО прекращает прием биоматериала по Москве и Московской области на тест № 438. Данное ограничение не относится к работе службы ВНД.
Бактериологическая диагностика септических состояний и заболеваний.
Гнойно-воспалительные заболевания являются основной причиной смерти у очень многих больных в неинфекционных клиниках терапевтического и хирургического профиля. Это следствие широкого, подчас нерационального применения антибиотиков, использование инвазивных лечебных процедур.
Это следствие широкого, подчас нерационального применения антибиотиков, использование инвазивных лечебных процедур.
Основными возбудителями являются условно-патогенные бактерии родов Staphylococcus, Escherichia, Klebsiella, Enterobacter, Citrobacter, Proteus, Serratia, Pseumonas, Haemophilis, Bacteroides, Clostridium, Acinetobacter, Moraxella, Streptococcus, Peptococcus, Streptopeptococcus, грибы Candida, Cryptococcus, Aspergillus.
Все чаще причиной гнойно-воспалительных заболеваний становятся неспорообразующие анаэробы: грамотрицательные палочки, грамположительные кокки и неспорообразующие палочки. При этом чувствительность даже идентичных микробов к антибиотикам у различных больных может существенно отличаться.
Только микробиологические методы позволяют и идентифицировать патогенные микроорганизмы, и определить их чувствительность к антибиотикам, что значительно увеличивает эффективность терапии.
Выделяемые возбудители: стафилококки, энтеробактерии, стрептококки, энтерококки, гемофилы, неферментирующие грамотрицательные микроорганизмы, листерии, анаэробные стрептококки, клостридии, бактероиды и грибы рода кандида.
Литература
- Беркоу Р. (Ред.). Руководство по медицине, т. 2. М. «Мир», 1997. 872 с.
- Приказ МЗ СССР от 22 апреля 1985 г. № 535 Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений.
- Энциклопедия клинических лабораторных тестов под ред. Н.У. Тица. Издательство «Лабинформ» — М. — 1997 — 942 с.
- Nightingale C. et al./ Antimicrobial Pharmacodynamics in Theory And Clinical Practice/2006/ M.Dekker inc./ 550 ps.
Анализ на чувствительность к антибиотикам
Дата: 16. 10.2018
10.2018
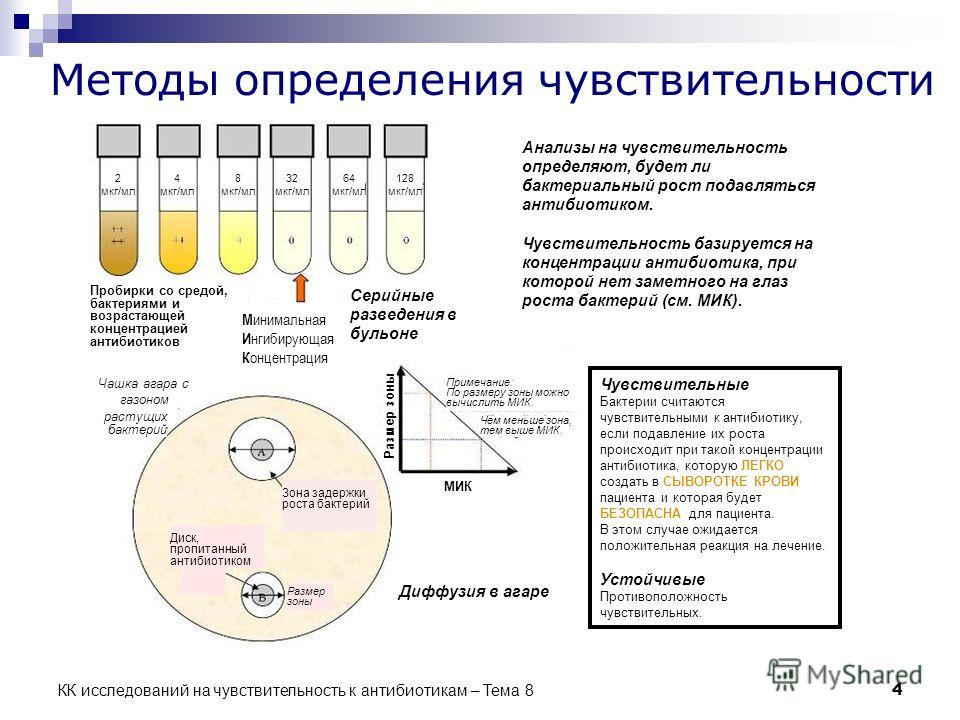
На сегодняшний день в медицине есть 3 метода определения чувствительности микробов к антибиотику:
- диффузный – это распыление препарата в плотную питательную среду, созданную с помощью бумажных дисков;
- анализ в бактериологическом анализаторе с количественной регистрацией результатов;
- метод серийных разведений в бульоне – считается максимально точным и эффективным.
По сути, вне зависимости от выбранного метода, анализ на чувствительность к антибиотикам сводится к выделению возбудителя болезни в чистой культуре с дальнейшим определением спектра чувствительности к тем или иным антибиотикам. Обязательно анализ на антибиотики делается с микроорганизмов, выделенных из первично стерильных жидкостей, органов и тканей человека (кровь, спинномозговая жидкость, моча, микрофлора влагалища и уретры).
В результате проведенного исследования составляется антибиотикограмма – это список антибиотиков, к которым чувствителен или не чувствителен исследуемый микроорганизм, единица измерения при этом – минимальное количество антибиотика, необходимое для уничтожения возбудителя болезни.
Все микробы подразделяются на 3 категории в зависимости от их устойчивости к антибиотикам:
- чувствительные – для этих бактерий достаточно обычных доз антибиотиков;
- умеренно-устойчивые – убиваются введением максимальных доз препаратов;
- устойчивыештаммы – они не подавляются даже при максимальных количествах антибиотика.
В зависимости от результатов исследования на чувствительность к антибиотикам, врач назначает необходимые препараты, их дозы и продолжительность приема для оптимального лечения заболевания. Однако следует помнить, что чувствительность микробов «in vitro» (в пробирке) и «in vivo» (в живом организме) – это разные вещи. Здесь важно знать не то, какая концентрация микробов в пробирке с питательной средой, а их количество именно в пораженном органе.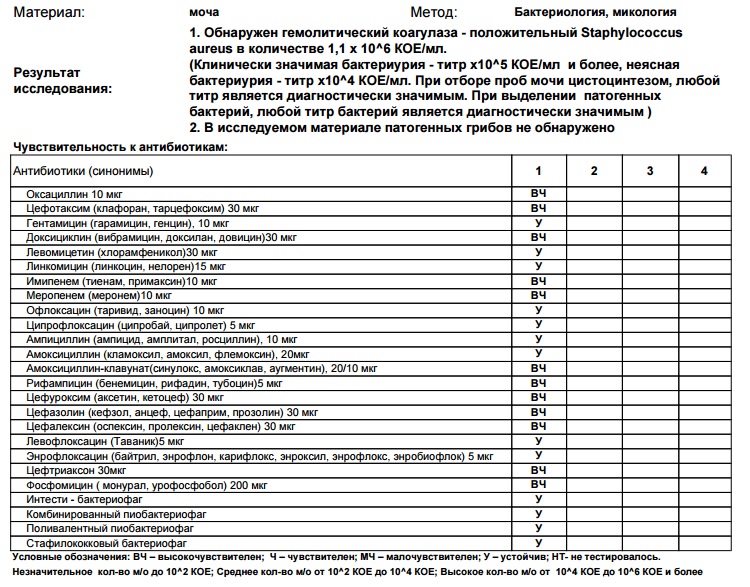 Сегодня технологии, с помощью которой можно было бы делать посев прямо из очагов болезни, нет, поэтому, несмотря на достаточно высокую точность анализов, следует помнить, что выявленная чувствительность к антибиотикам не всегда совпадает с реальностью, и на это должен сделать поправку врач, чтобы не допустить неэффективного приема пациентом антибиотиков.
Сегодня технологии, с помощью которой можно было бы делать посев прямо из очагов болезни, нет, поэтому, несмотря на достаточно высокую точность анализов, следует помнить, что выявленная чувствительность к антибиотикам не всегда совпадает с реальностью, и на это должен сделать поправку врач, чтобы не допустить неэффективного приема пациентом антибиотиков.
Посев мочи на антибиотики
Бактериологический посев на чувствительность к антибиотикам делается из образцов изначально стерильных жидкостей. Остановимся на двух из них – моче и крови.
1. Анализ мочи на антибиотики – это метод, применяемый для диагностики инфекций в мочевыделительной системе человека, приводящих к возникновению цистита, уретрита, пиелонефрита, а также при диабете и дефиците иммунной системы.
Показания к проведению посева мочи:
- болезненные мочеиспускания;
- поясничные боли;
- нарушения мочеиспускания;
- изменения в результатах общих анализов мочи;
- определение чувствительности к антибиотикам микробов в органах мочевыделения.
Для анализа на чувствительность к антибиотикам необходимо собрать утреннюю порцию мочи в специальную стерильную емкость, выпустив первые и последние капельки. Руки и половые органы перед сбором мочи следует тщательно вымыть. При таком способе забора мочи в лабораторию попадет максимальная концентрация микроорганизмов в случае их наличия у пациента. Будьте внимательны, сообщите врачу, если в последние дни перед сдачей анализов Вы принимали антибиотики – это может дать ложноотрицательный результат исследования. Продолжительность исследования – от одного до десяти дней в зависимости от типа микробов. За это время образец мочи подвергает различным анализам, и в результате определяется возбудитель инфекции, а также уровень его чувствительности к тем или иным антибиотикам, что помогает врачу принять правильное решение о назначении препарата.
2.Анализ крови на антибиотики также призван дать ответ на вопрос, есть ли в крови пациента бактерии. Бактериемия, то есть зараженность крови микробами – очень опасное явление, с этим шутить не стоит. Забор крови происходит до начала приема антибиотиков, поскольку они могут вызвать неправильный отрицательный результат.
Бактериемия, то есть зараженность крови микробами – очень опасное явление, с этим шутить не стоит. Забор крови происходит до начала приема антибиотиков, поскольку они могут вызвать неправильный отрицательный результат.
Кровь берут из вены при помощи одноразового катетера в количестве 5 – 10 мл, ее помещают в специальную стерильную бутыль с резиновой пробкой, в которой приготовлена питательная среда для бактерий. Обычно результат известен уже через 16 – 18 часов, однако в случае, если бактерии относятся к медленно растущим видам, тогда за образцом крови наблюдают несколько дней до момента, когда рост бактерий становится очевидным.
После того, как установлены типы микроорганизмов в крови пациента, начинается исследование их на устойчивость к антибиотикам. В окончательный результат записывают идентифицированные виды бактерий в крови, а также сведения об их устойчивости к антибиотикам.
Результаты бактериологического посева крови могут быть следующими:
- нет роста бактерий – это значит, что Ваша кровь стерильна;
- чистый рост – означает наличие единственного вида микроорганизмов, такое бывает, например, при сепсисе;
- смешанный рост — означает, что из образца крови было выделено более одного вида микробов
На этом исследование крови на антибиотики заканчивается, результат передается врачу, и он принимает решение о назначении тех или иных антибиотиков для лечения выявленного заболевания.
Бактериологический посев (бакпосев) — Клиника 1
Для наиболее точного диагностирования заболеваний недостаточно самого современного лабораторного оборудования. Точность результатов зависит не только от используемых реактивов и аппаратуры, но и от времени и правильности сбора исследуемого материала. При несоблюдении основных правил подготовки к анализам их результаты могут быть значительно искажены.
В бактериологической лаборатории проводятся исследования для обнаружения в клиническом материале микроорганизмов, являющихся возбудителями гнойно-воспалительных и инфекционных заболеваний, а также определение чувствительности микроорганизмов к антибактериальным и антимикотическим средствам, лечебным фагам.
В качестве клинического (биологического) материала используются: кровь, желчь, моча, грудное молоко, отделяемое верхних и нижних дыхательных путей, отделяемое инфицированных ран, отделяемое глаз, отделяемое ушей, отделяемое половых органов, содержимое пустул, полостей, кал. Выявляется 996 видов микроорганизмов (бактерии, дрожжеподобные грибы, грибы), имеющих диагностическое (медицинское) значение.
Кроме того выполняются отдельные методики: микробиологическое исследование кала на наличие дисбактериоза; бактериологическое исследование кала на наличие патогенных энтеробактерий; микробиологическое исследование отделяемого влагалища на дисбиоз, бактериологическое исследование на наличие Gardnerella vaginalis.
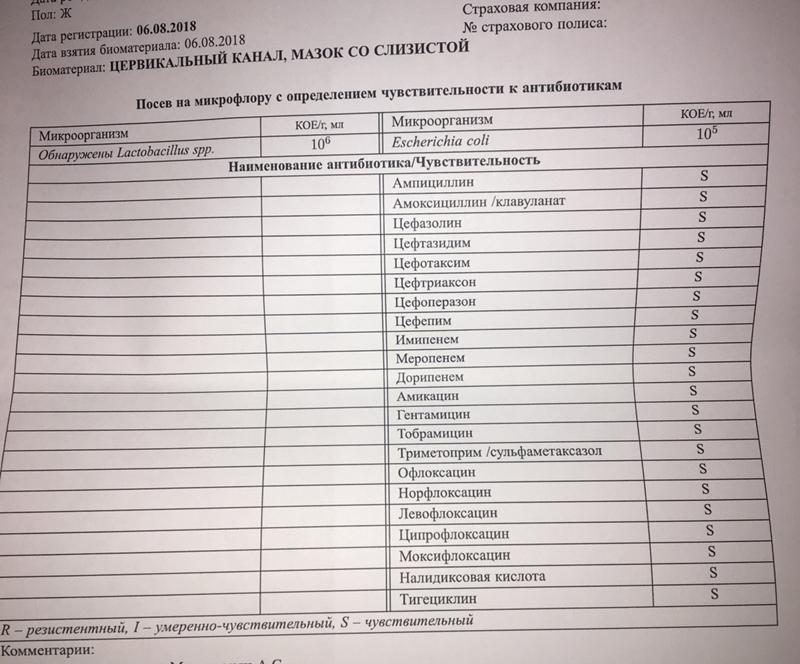
Комплексное исследование основных инфекций урогенитального тракта Бакпосев Ureaplasma spp. Бакпосев Mycoplasma hominis Бакпосев Gardnerella vaginalis Бакпосев Trichomonas vaginalis Чувствительность Ureaplasma spp. Чувствительность Mycoplasma hominis Бакпосев на флору и чувствительность к антибиотикам — из НОСА Бакпосев на флору и чувствительность к антибиотикам — из ЗЕВА Бакпосев на флору и чувствительность к антибиотикам — из СЛИЗИСТОЙ ГЛАЗА Бакпосев на флору и чувствительность к антибиотикам (отделяемое влагалища) Бакпосев на флору и чувствительность к антибиотикам — из ЦЕРВИКАЛЬНОГО КАНАЛА Бакпосев на флору и чувствительность к антибиотикам — из УРЕТРЫ Бакпосев на флору и чувствительность к антибиотикам — из МОЧИ Бакпосев на флору и чувствительность к антибиотикам — из МОЧИ (cito) Бакпосев на флору и чувствительность к антибиотикам — из СПЕРМЫ Бакпосев на флору и чувствительность к антибиотикам — из СЕКРЕТА ПРЕДСТ. ЖЕЛЕЗЫ
Бакпосев на флору и чувствительность к антибиотикам — из КРОВИ
Бакпосев на флору и чувствительность к антибиотикам — из МОКРОТЫ
Бакпосев на флору и чувствительность к антибиотикам
Микробиологический метод исследования грибов рода Candida с определением чувствительности к антимикотикам
Дисбиоз влагалища
Исследование биоматериала на наличие анаэробной микрофлоры (содержимое кист, полостей, закрытых ран)
Бакпосев на золотистый стафилококк (Staphylococcus aureus) и определение чувствительности к антибиотикам
Посев на гемофильную палочку (Haemphylus influenrae) и определение чувствительности к антибиотикам
Исследование кала на скрытую кровь
Анализ кала на дисбактериоз
Кал на яйца/глистов (гельминтов)
Скрытая кровь в кале, количественно (метод FOB Gold)
ЖЕЛЕЗЫ
Бакпосев на флору и чувствительность к антибиотикам — из КРОВИ
Бакпосев на флору и чувствительность к антибиотикам — из МОКРОТЫ
Бакпосев на флору и чувствительность к антибиотикам
Микробиологический метод исследования грибов рода Candida с определением чувствительности к антимикотикам
Дисбиоз влагалища
Исследование биоматериала на наличие анаэробной микрофлоры (содержимое кист, полостей, закрытых ран)
Бакпосев на золотистый стафилококк (Staphylococcus aureus) и определение чувствительности к антибиотикам
Посев на гемофильную палочку (Haemphylus influenrae) и определение чувствительности к антибиотикам
Исследование кала на скрытую кровь
Анализ кала на дисбактериоз
Кал на яйца/глистов (гельминтов)
Скрытая кровь в кале, количественно (метод FOB Gold)Тестирование чувствительности к антибиотикам | Лабораторные тесты онлайн
Источники, использованные в текущем обзоре
Street, T. (Обновлено 13 марта 2014 г.). Чувствительность к противомикробным препаратам. Medscape. Доступно в Интернете по адресу https://emedicine.medscape.com/article/2103786-overview?pa=rOBA1lN0uZhjg0bJO6bD2AgpF2o0ma5fK6AeuJMPuepOQ4%2B%2BoTWGQm%2Be5c5z2B%2BoTWGQm%2Be5c543zBU2. По состоянию на апрель 2018 г.
(Обновлено 13 марта 2014 г.). Чувствительность к противомикробным препаратам. Medscape. Доступно в Интернете по адресу https://emedicine.medscape.com/article/2103786-overview?pa=rOBA1lN0uZhjg0bJO6bD2AgpF2o0ma5fK6AeuJMPuepOQ4%2B%2BoTWGQm%2Be5c5z2B%2BoTWGQm%2Be5c543zBU2. По состоянию на апрель 2018 г.
Arena, F. et al. (2015). Тестирование на чувствительность к антибиотикам: настоящее и будущее.Medscape. Доступно на сайте https://www.medscape.com/viewarticle/851528_1. По состоянию на апрель 2018 г.
Григоренко Э. и Сталонс Д. Р. (5 октября 2016 г.). Устранение устойчивости к антибиотикам с помощью молекулярной диагностики. Клинические лабораторные продукты. Доступно на сайте http://www.clpmag.com/2016/10/addressing-antibiotic-resistance-molecular-diagnostics/. По состоянию на апрель 2018 г.
Syal, K. et al. (2017). Текущие и новые методы тестов на чувствительность к антибиотикам. Доступно в Интернете по адресу https: // www.ncbi.nlm.nih.gov/pmc/articles/PMC5479269/. По состоянию на апрель 2018 г.
Форвик, Л. Дж. (От 26 января 2017 г.). Анализ чувствительности. MedlinePlus. Доступно в Интернете по адресу https://medlineplus.gov/ency/article/003741.htm. По состоянию на апрель 2018 г.
Maurer, F. P. et al. (30 марта 2017 г.). Достижения в быстрой идентификации и тестировании на чувствительность бактерий в лаборатории клинкальной микробиологии: значение для ухода за пациентами и программы управления антимикробными препаратами. Сообщения об инфекционных заболеваниях. Доступно на сайте https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5391540/. По состоянию на апрель 2018 г.
(обновлено 7 декабря 2017 г.). Вопросы и ответы об устойчивости к антибиотикам. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/antibiotic-use/community/about/antibiotic-resistance-faqs.html. По состоянию на апрель 2018 г.
(© 1995-2018). Чувствительность к противомикробным препаратам, анаэробные бактерии, МПК. Медицинские лаборатории Мэйо. Доступно в Интернете по адресу https: // www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/56031. По состоянию на апрель 2018 г.
Медицинские лаборатории Мэйо. Доступно в Интернете по адресу https: // www.mayomedicallaboratories.com/test-catalog/Clinical+and+Interpretive/56031. По состоянию на апрель 2018 г.
(© 2018). Анитмикробная чувствительность — гены mecA / mecC с помощью ПЦР. Лаборатории Аруп. Доступно в Интернете по адресу http://ltd.aruplab.com/Tests/Pub/0060211. По состоянию на апрель 2018 г.
Rifai, N. et al. (© 2018). Учебник Тиц по клинической химии и молекулярной диагностике, шестое издание. Устойчивость к противомикробным препаратам и рекомендации по тестированию основных бактериальных патогенов, стр. 173700014 — 173700024.Доступно в Интернете по адресу https://expertconsult.inkling.com/read/rifai-tietz-textbook-clinical-chemistry-molecular-diagnost-6e/chapter-75/antimicrobial-resistance-and. По состоянию на апрель 2018 г.
(обновлено 2 апреля 2018 г.). О лабораторных испытаниях и ресурсах AR. Центры по контролю и профилактике заболеваний. Доступно в Интернете по адресу https://www.cdc.gov/drugresistance/laboratories.html. По состоянию на апрель 2018 г.
(3 апреля 2018 г.). Сдерживая необычное сопротивление. Центры по контролю и профилактике заболеваний.Доступно в Интернете по адресу https://www.cdc.gov/vitalsigns/contain-unusual-resistance/index.html. По состоянию на апрель 2018 г.
Устойчивость к противомикробным препаратам. Ассоциация лабораторий общественного здравоохранения. Доступно в Интернете по адресу https://www.aphl.org/programs/infectious_disease/Pages/Antimicrobial-Resistance.aspx. По состоянию на апрель 2018 г.
Источники, использованные в предыдущих обзорах
Томас, Клейтон Л., редактор (1997). Циклопедический медицинский словарь Табера. Компания F.A. Davis, Филадельфия, Пенсильвания [18-е издание].
Пагана, Кэтлин Д. и Пагана, Тимоти Дж. (2001). Справочник по диагностическим и лабораторным испытаниям Мосби, 5-е издание: Mosby, Inc., Сент-Луис, Миссури.
(апрель 2004 г.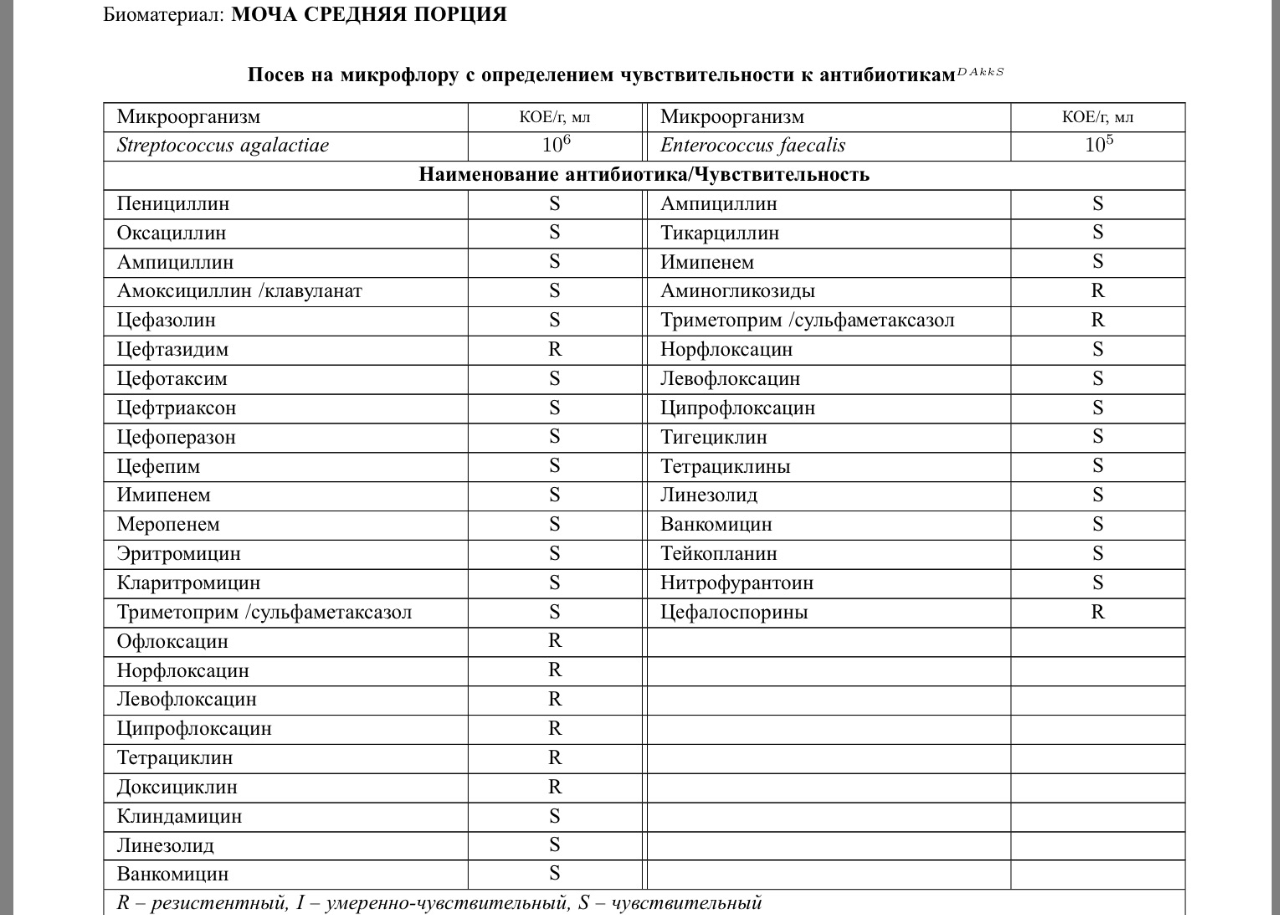 ). Проблема устойчивости к антибиотикам. Национальный институт аллергии и инфекционных заболеваний [Он-лайн информация]. Доступно в Интернете по адресу http://www.niaid.nih.gov/factsheets/antimicro.htm.
). Проблема устойчивости к антибиотикам. Национальный институт аллергии и инфекционных заболеваний [Он-лайн информация]. Доступно в Интернете по адресу http://www.niaid.nih.gov/factsheets/antimicro.htm.
(4 апреля 2003 г.). Устойчивость к антибиотикам, растущая угроза. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США [он-лайн информация].Доступно в Интернете по адресу http://www.fda.gov/oc/opacom/hottopics/anti_resist.html.
(19 февраля 2004 г.). Разумное использование антибиотиков. Mayoclinic.com, Центр инфекционных заболеваний [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayoclinic.com/invoke.cfm?id=FL00075.
(ноябрь 2003 г.). Информационный бюллетень о туберкулезе с множественной лекарственной устойчивостью. Американская ассоциация легких [Он-лайн информация]. Доступно в Интернете по адресу http://www.lungusa.org/site/pp.asp?c=dvLUK9O0E&b=35815.
Брен, Л.(Сентябрь 2003 г., исправленная). Битва ошибок: борьба с устойчивостью к антибиотикам. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США, журнал FDA Consumer [онлайн-информация]. Доступно в Интернете по адресу http://www.fda.gov/fdac/features/2002/402_bugs.html.
Клиническая диагностика и лечение Генри с помощью лабораторных методов. 21-е изд. Макферсон Р.А. и Пинкус М.Р., ред. Филадельфия: 2007, стр. 1048-1057.
(14 марта 2009 г.) Медицинская энциклопедия MedlinePlus. Анализ чувствительности. Доступно в Интернете по адресу http: // www.nlm.nih.gov/medlineplus/ency/article/003741.htm. По состоянию на май 2009 г.
Forbes, B. et. al. (© 2007). Диагностическая микробиология Бейли и Скотта, двенадцатое издание: Mosby Elsevier Press, Сент-Луис, Миссури. С. 187-214.
(6 августа 2007 г.). Станьте умнее: знайте, когда антибиотики работают, часто задаваемые вопросы. CDC [Он-лайн информация]. Доступно в Интернете по адресу http://www.cdc.gov/getsmart/index.html. По состоянию на июнь 2009 г.
По состоянию на июнь 2009 г.
Sutphen, S (30 августа 2007 г.). Устойчивость к антибиотикам в отделении неотложной помощи: первая линия защиты.Medscape CME [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/562056. Дата обращения 24.08.08.
Барклай, Л. (3 июля 2008 г.). Использование антибактериальных средств Medscape в домашних условиях может способствовать повышению устойчивости к микробам. Medscape Medical News [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/577055. По состоянию на июнь 2009 г.
Nicasio, A. et. al. (13 мая 2008 г.). Текущее состояние грамотрицательных бацилл с множественной лекарственной устойчивостью в Северной Америке.Medscape from Фармакотерапия [Он-лайн информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/572674. По состоянию на июнь 2009 г.
(27 августа 2009 г.). Лечение туберкулеза с множественной лекарственной устойчивостью и широкой лекарственной устойчивостью: текущее состояние и перспективы на будущее. Медицинская информация Medscape Reuters [Электронная информация]. Доступно в Интернете по адресу http://www.medscape.com/viewarticle/706826. По состоянию на июнь 2009 г.
(© 1995-2013). Чувствительность к противомикробным препаратам, аэробные бактерии, МПК.Клиника Мэйо Медицинские лаборатории Мэйо [Он-лайн информация]. Доступно в Интернете по адресу http://www.mayomedicallaboratories.com/test-catalog/Overview/8073. По состоянию на август 2013 г.
Форвик, Л. (Обновлено 22 января 2013 г.). Анализ чувствительности. Медицинская энциклопедия MedlinePlus [Он-лайн информация]. Доступно в Интернете по адресу http://www.nlm.nih.gov/medlineplus/ency/article/003741.htm. По состоянию на август 2013 г.
Hazen, K. (отредактировано в феврале 2013 г.). Тестирование на восприимчивость. Пособие Merck для специалистов здравоохранения [Он-лайн информация].Доступно на сайте http://www. merckmanuals.com. По состоянию на август 2013 г.
merckmanuals.com. По состоянию на август 2013 г.
Street, T. и Schmidt, S. (Обновлено 18 октября 2012 г.) Чувствительность к противомикробным препаратам. Справочник по Medscape [Он-лайн информация]. Доступно в Интернете по адресу http://emedicine.medscape.com/article/2103786-overview. По состоянию на август 2013 г.
Макферсон Р. и Пинкус М. (© 2011). Клиническая диагностика и лечение Генри с помощью лабораторных методов 22-е издание: Elsevier Saunders, Филадельфия, Пенсильвания. Стр. 11117-1128.
Быстрое тестирование чувствительности к противомикробным препаратам на положительных культурах крови с помощью инновационной технологии светорассеяния: оценка эффективности и времени обработки | BMC Infectious Diseases
Исследование проводилось в микробиологической лаборатории Clinique Universitaires Saint-Luc — UCL (CUSL), третичной больнице на 979 коек в Брюсселе, Бельгия.В среднем ежегодно берутся образцы 35 000 пар культур крови с положительным результатом 3,7%. Образцы крови от пациентов с подозрением на инфекцию кровотока засеваются во флаконы для культур крови (BD Bactec Plus Aerobic and Lytic Anaerobic medium, Becton Dickinson, Franklin Lanes, NJ, USA) и инкубируются 24 часа в сутки, 7 дней в неделю в устройстве Bactec FX. (BD Diagnostic Systems, Спаркс, Мэриленд, США). Стандартное ведение положительных культур крови выполняется в рабочее время лаборатории (т. Е. С 8:00 до 0:00, 7 дней в неделю) и включает немедленное окрашивание по Граму, идентификацию MALDI-TOF MS и автоматизацию (Phoenix, Becton Dickinson, Franklin Lakes, NJ, США. ) АСТ.
В течение 2 непоследовательных трехмесячных периодов (с февраля по апрель 2018 г. и с октября по декабрь 2018 г.) все посевы крови, обнаруженные положительными в период от 0 до 10 часов утра, рассматривались для включения в исследование, как показано на рис. 1. Окраска по Граму. результаты позволили включить положительные культуры крови с единичным присутствием грамположительных кокков или грамотрицательных бацилл. Для тестирования использовалась только первая бутылка каждого положительного посева крови. Затем каждая включенная культура крови была обработана 1) для посева и 5-часовой инкубации с последующей идентификацией MALDI-TOF MS из молодой субкультуры 2) для автоматизированного анализа AST непосредственно из крови с помощью Phoenix и 3) для автоматизированного AST непосредственно из крови с помощью Альфред 60 AST .
Для тестирования использовалась только первая бутылка каждого положительного посева крови. Затем каждая включенная культура крови была обработана 1) для посева и 5-часовой инкубации с последующей идентификацией MALDI-TOF MS из молодой субкультуры 2) для автоматизированного анализа AST непосредственно из крови с помощью Phoenix и 3) для автоматизированного AST непосредственно из крови с помощью Альфред 60 AST .
Рабочий процесс включения в исследование всех бутылочек с культурами крови, положительных между 0:00 и 10:00. AST: тест на чувствительность к противомикробным препаратам, GPB: грамположительные бациллы, GPC: грамположительные кокки, GNB: грамотрицательные бактерии, GNC: грамотрицательные кокки, ID: идентификация, MALDI-TOF MS: время ионизации лазерной десорбции с использованием матрицы летная масс-спектрометрия
Прямая AST бактерий с использованием Phoenix
Автоматизированная система Phoenix обычно использовалась в микробиологической лаборатории CUSL для оценки чувствительности к антимикробным препаратам.АСТ проводился непосредственно из крови положительного посева крови. Вкратце, 8 мл аспирата крови из бутыли с положительным результатом вводили в пробирку для разделения сыворотки (BD Diagnostic Systems, Sparks, MD, USA) и центрифугировали при 2000 об / мин в течение 10 мин. После удаления супернатанта бактерии на поверхности геля суспендировали в пробирке с бульоном Phoenix system ID и помещали на прибор BD Phoenix Autoprep для достижения 0,5 McFarland. В конечном итоге суспензия была внесена в соответствующую панель Phoenix (NMIC-408 (продукт №448877, BD) для грамотрицательных бацилл, PMIC-90 (номер продукта 448439, BD) для грамположительных кокков) и инкубировали в системе Phoenix в соответствии с рекомендациями производителей.
AST с Alfred 60
AST Противомикробные препараты, протестированные с подходом Alfred 60 AST , были выбраны из одобренного CE списка антибиотических реагентов Alifax после обсуждения с группой по контролю над противомикробными препаратами больницы и в соответствии с нашей местной эпидемиологией резистентности. В конечном итоге мы создали панель «грамотрицательные бациллы» и «грамположительные кокки», включающие набор лиофилизированных антибиотиков EUCAST.Все антибиотики из выбранной панели были протестированы для каждого включенного положительного посева крови. Однако после идентификации (тестирование MALDI-TOF MS в тот же день на молодой субкультуре) анализ результатов был проведен исключительно для антибиотиков, интерпретируемых с помощью EUCAST для идентифицированного штамма, как представлено в таблице 1. Производитель изменил состав цефуроксима и пиперациллина. реагенты -тазобактам Enterobacteriaceae (EB) между двумя периодами исследования.
В конечном итоге мы создали панель «грамотрицательные бациллы» и «грамположительные кокки», включающие набор лиофилизированных антибиотиков EUCAST.Все антибиотики из выбранной панели были протестированы для каждого включенного положительного посева крови. Однако после идентификации (тестирование MALDI-TOF MS в тот же день на молодой субкультуре) анализ результатов был проведен исключительно для антибиотиков, интерпретируемых с помощью EUCAST для идентифицированного штамма, как представлено в таблице 1. Производитель изменил состав цефуроксима и пиперациллина. реагенты -тазобактам Enterobacteriaceae (EB) между двумя периодами исследования.
Вкратце, 10 мкл крови из флакона с положительным результатом переносили в 3 мл флакон с обогащающим бульоном (Алифакс) и загружали в зону 37 ° C Прибор Alfred 60 AST со временем работы примерно 15 мин для 5 образцов.Первый рост бактерий контролировали по показаниям мутности каждые 5 минут, и как только суспензия достигала 0,4–0,6 Макфарланда, ее переносили в пустой флакон в охлаждаемой зоне. Затем 100 мкл бактериальной суспензии и 200 мкл каждого антибиотика из выбранной панели загружали во флаконы, содержащие 2 мл обогащающего бульона (Алифакс) для анализа AST в области 37 ° C. Один флакон, содержащий исключительно бактериальную суспензию, использовали в качестве эталонного флакона. Система Alfred 60 AST переводила измерения светорассеяния во времени всех флаконов в кривые роста и сравнивала их с кривыми из эталонного флакона.Когда устойчивые бактерии продолжали расти, мутность и светорассеяние увеличивались; наоборот, мутность оставалась низкой, а рассеяние света уменьшалось, когда бактерии были чувствительны к тестируемому антибиотику.
TAT
Измерения TAT начались, когда образец был загружен в Alfred 60 AST или в систему Phoenix, и остановились, когда все результаты AST стали доступны соответствующей системой.
Общая ТАТ к результатам с Альфредом 60 AST суммировала изменяющуюся ТАТ, чтобы получить 0.4–0,6 суспензия МакФарланда и фиксированные результаты TAT to AST, требующие 3-часового анализа для всех оцениваемых антибиотиков, за исключением цефуроксима, пиперациллин-тазобактама Enterobacteriaceae и цефтазидима Pseudomonas , требующих 5-часового анализа.
Анализ данных
Прямое тестирование Phoenix, проведенное на крови положительных культур крови, было рассмотрено в качестве эталонного метода для оценки микробиологических характеристик прибора Alfred 60 AST с выбранными антибиотическими реагентами с применением EUCAST 6.0 точек останова (2016). В случае несоответствия результаты проверяли методом дисковой диффузии с использованием фильтровальной бумаги (Bio-Rad, Марн-ла-Кокетт, Франция) и измерениями концентрации минимального ингибирования с использованием E-теста (bioMérieux, Марси л’Этуаль, Франция) из субкультивированных растений. колонии. Несоответствия с антибиотиками цефокситина были проверены с помощью собственной ПЦР для обнаружения гена mecA [13]. Молекулярное тестирование проводилось на всех устойчивых к цефалоспоринам Enterobacteriaceae третьего поколения для выявления β-лактамаз расширенного спектра (БЛРС) и карбапенемаз [14].
Alfred 60 Проверки AST были выполнены в соответствии с рекомендациями Cumitech по проверке и валидации процедур в лаборатории клинической микробиологии [15]. Сравнение результатов AST между Alfred 60 AST и эталонным методом было выражено в процентах категориального согласия (CA) (общее количество совпадений по категориям / общее количество протестированных антибиотиков × 100). Несоответствия были классифицированы на очень серьезные ошибки (VME: ложная восприимчивость с оцениваемым тестом), основные ошибки (ME: ложное сопротивление с оцененным тестом) и незначительные ошибки (mE: промежуточный результат эталонного теста и оцененный тест, чувствительный или устойчивый, или наоборот. ).
).
Уровень УМЭ рассчитывали путем деления количества УМЭ на количество устойчивых бактерий (контрольный метод) × 100. Уровень МЕ рассчитывали путем деления количества МЕ на число чувствительных бактерий (контрольный метод) × 100, в то время как показатель mE был рассчитан путем деления количества mE на общее количество протестированных штаммов × 100. Приемлемые показатели эффективности для CA должны быть ≥90%, тогда как приемлемые показатели для уровня VME должны быть ≤3%. Уровень ME должен быть ≤3%.Для комбинации ME и mE коэффициент ошибок должен составлять ≤7%.
Экспресс-тестирование чувствительности к антибиотикам из бутылочек для культур крови с помощью не зависящей от вида полимеразной цепной реакции в реальном времени
Abstract
Разработка и внедрение экспресс-тестов на чувствительность к противомикробным препаратам имеет решающее значение для оказания помощи пациентам и улучшения клинических результатов, особенно в случаях сепсиса. Один из подходов к сокращению времени ответа на вопрос о чувствительности к противомикробным препаратам — это мониторинг ингибирования продукции ДНК, поскольку различия в концентрациях ДНК проявляются быстрее по сравнению с изменениями оптической плотности в традиционных тестах на чувствительность к противомикробным препаратам.Здесь мы используем ПЦР в реальном времени, чтобы быстро определить чувствительность к противомикробным препаратам после коротких инкубаций с антибиотиком. Применение этого анализа к коллекции из 144 изолятов в имитационной культуре крови, охватывающей важные с медицинской точки зрения патогены, демонстрирующие высокую степень устойчивости, предоставило данные о чувствительности менее чем за 4 часа. Этот анализ показал категорическое согласие с эталонным методом в 96,3% случаев для всех видов. Секвенирование подмножества ампликонов ПЦР показало точную идентификацию на уровне рода.В целом, реализация этого метода может обеспечить точные результаты чувствительности с сокращением времени ответа для ряда важных с медицинской точки зрения бактерий, обычно выделяемых из посевов крови.
Образец цитирования: Maxson T, Blancett CD, Graham AS, Stefan CP, Minogue TD (2018) Экспресс-тестирование чувствительности к антибиотикам из бутылочек для культур крови с помощью не зависящей от вида полимеразной цепной реакции в реальном времени. PLoS ONE 13 (12): e0209042. https://doi.org/10.1371 / journal.pone.0209042
Редактор: Шамала Деви Секаран, Малайский университет, МАЛАЙЗИЯ
Поступила: 6 августа 2018 г .; Принята к печати: 27 ноября 2018 г .; Опубликовано: 13 декабря 2018 г.
Это статья в открытом доступе, свободная от всех авторских прав, и ее можно свободно воспроизводить, распространять, передавать, модифицировать, надстраивать или иным образом использовать в любых законных целях. Работа сделана доступной по лицензии Creative Commons CC0 как общественное достояние.
Доступность данных: Все соответствующие данные находятся в рукописи и ее файлах с вспомогательной информацией.
Финансирование: Эта работа проводилась при поддержке Агентства по уменьшению угрозы обороны (DTRA) номер проекта CB10097. Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Введение
Введение антибиотиков в стратегии лечения пациентов резко снизило заболеваемость и смертность, связанные с бактериальными инфекциями, и открыло двери для медицинских процедур, которые в противном случае сопряжены с высоким риском инфекции, включая инвазивные операции и имплантацию медицинских устройств.К сожалению, распространение устойчивости к противомикробным препаратам и появление штаммов с множественной лекарственной устойчивостью представляет собой глобальную проблему, ограничивающую возможности лечения и способствующую назначению неэффективных схем лечения антибиотиками, не способствующих лечению инфекций [1]. Следовательно, клиницистам необходимо иметь доступ к данным о чувствительности при назначении противомикробных препаратов, чтобы избежать эмпирического выбора неэффективных методов лечения, особенно в опасных для жизни случаях, чувствительных ко времени, таких как сепсис [2, 3].Традиционное культуральное тестирование на чувствительность к противомикробным препаратам (AST) часто занимает более 48 часов для ответа [4], что является неподходящим сроком для определения стратегии раннего лечения; таким образом, разработка более быстрых анализов AST может потенциально смягчить эти проблемы [5, 6]. Еще одним преимуществом быстрого AST является стимулирование инициативы по контролю над противомикробными препаратами, которая направлена на сокращение ненужного использования антибиотиков для улучшения результатов лечения пациентов и снижения резистентности к противомикробным препаратам, вызванной отбором [7, 8].Быстрая эволюция и распространение детерминант устойчивости в сочетании с проблемами разработки новых противомикробных средств и методов лечения подчеркивают важность поддержания эффективности имеющихся в настоящее время противомикробных препаратов [9].
Следовательно, клиницистам необходимо иметь доступ к данным о чувствительности при назначении противомикробных препаратов, чтобы избежать эмпирического выбора неэффективных методов лечения, особенно в опасных для жизни случаях, чувствительных ко времени, таких как сепсис [2, 3].Традиционное культуральное тестирование на чувствительность к противомикробным препаратам (AST) часто занимает более 48 часов для ответа [4], что является неподходящим сроком для определения стратегии раннего лечения; таким образом, разработка более быстрых анализов AST может потенциально смягчить эти проблемы [5, 6]. Еще одним преимуществом быстрого AST является стимулирование инициативы по контролю над противомикробными препаратами, которая направлена на сокращение ненужного использования антибиотиков для улучшения результатов лечения пациентов и снижения резистентности к противомикробным препаратам, вызванной отбором [7, 8].Быстрая эволюция и распространение детерминант устойчивости в сочетании с проблемами разработки новых противомикробных средств и методов лечения подчеркивают важность поддержания эффективности имеющихся в настоящее время противомикробных препаратов [9].
Идеальный анализ AST должен сообщать о фенотипической чувствительности, быть применимым к широкому спектру человеческих патогенов и антибиотиков, работать с клиническими образцами и давать результат в кратчайшие сроки. Для достижения этих целей работают различные новые подходы, включая, помимо прочего, генотипирование [10, 11], микроскопию отдельных клеток [12, 13], рамановскую спектроскопию [14], масс-спектрометрию [15-17] и амплификацию нуклеиновых кислот. [18–22].У каждой из этих стратегий есть сильные и слабые стороны, и текущая работа в соответствующих областях продолжает продвигать каждую методологию к идеальному AST. В частности, стратегии, направленные на амплификацию нуклеиновых кислот, особенно привлекательны, поскольку клеточный синтез ДНК и РНК может быть очень быстрым и на него прямо или косвенно влияет ингибирование антибиотиками чувствительных клеток.
Как правило, стратегии амплификации нуклеиновых кислот для AST сравнивают относительное количественное определение концентраций ДНК или РНК между образцами, обработанными антибиотиками, и необработанными контрольными образцами после лечения антибиотиками.Бактериальные штаммы, чувствительные к данному антибиотику, будут демонстрировать ингибирование роста, что приводит к значительно более низким концентрациям нуклеиновой кислоты, измеряемым с помощью количественной ПЦР (кПЦР) или других технологий амплификации [18]. Предыдущие исследования, в которых использовался этот подход, показали многообещающие результаты с высоким уровнем категориального согласия с анализами золотого стандарта [18–21]. Фактически, этот метод адекватно определял восприимчивость к нескольким классам антибиотиков и был применим к множеству бактериальных патогенов в зависимости от дизайна праймера (и зонда) [19, 21].В более поздних исследованиях основное внимание уделялось сокращению общего времени до ответа в анализе, уделяя особое внимание быстрым результатам, полученным с помощью технологий изотермической амплификации [20].
Настоящее исследование направлено на оценку ранее описанного набора праймеров и зондов кПЦР с широким охватом, анализа BactQuant, для использования в разработке анализа AST [23]. Анализ BactQuant нацелен на область V3-V4 последовательности гена 16S с особыми конструктивными особенностями, обеспечивающими улучшенный охват родов и видов по сравнению с более ранними анализами нацеливания на 16S [23].Здесь мы модифицировали метод анализа молекулярной чувствительности к антибиотикам RApid (RAMAST), описанный Beuving et al. [19], чтобы сократить время ответа и увеличить охват видов, и оценили анализ с большим набором важных патогенов человека. Анализ RAMAST был проведен на имитирующих культурах крови с тремя разными антибиотиками для каждого вида, что продемонстрировало применимость этого анализа к нескольким классам антибиотиков.
Материалы и методы
Бактериальные изоляты и культуры
клинических изолятов и эталонных штаммов были получены из Американской коллекции типовых культур (ATCC), Репозитория ресурсов для исследований биозащиты и возникающих инфекций (BEI Resources), Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), Центров по контролю за заболеваниями (CDC) и Объединенная коллекция культур, размещенная в Медицинском научно-исследовательском институте инфекционных заболеваний армии США (USAMRIID).Происхождение каждого штамма указано в таблицах A-E в файле S1. Изоляты размножали на кровяном агаре (триптиказо-соевый агар с 5% овечьей крови) при 35 ° C и культивировали в жидкой среде триптического соевого бульона (TSB) при 37 ° C при встряхивании, если не указано иное. Staphylococcus aureus 880 (BR-VRSA) быстро теряет устойчивость к ванкомицину в жидкой культуре и, таким образом, размножается в присутствии 32 мкг / мл ванкомицина, когда требовалась жидкая культура; Затем культуры с ванкомицином разводили по крайней мере в 1000 раз перед использованием в любом анализе (32 нг / мл значительно ниже минимальной ингибирующей концентрации ванкомицина (МИК) всех тестируемых штаммов).Антибиотики были получены от Sigma-Aldrich, Thermo Fisher Scientific или Gold Biotechnology и использовались в концентрациях, указанных для 100-кратных исходных растворов в воде.
Золотой стандарт определения чувствительности к антибиотикам
Референсные МПК определялись методом микроразведения в бульоне (BMD) в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI) [24]. Enterococcus faecium NR-32094 не демонстрировал видимого роста в стандартной тестовой среде (бульон Мюллера-Хинтона с поправкой на катионы, CAMHB) и вместо этого был протестирован в TSB. Staphylococcus aureus ATCC 13565 не продемонстрировал видимого роста в присутствии дополнительных 2% NaCl и был протестирован без добавления NaCl для определения оксациллина. Контрольные точки чувствительности к антибиотикам были взяты из рекомендаций CLSI 2017 г. [25].
Оценка чувствительности к антибиотикам с помощью qPCR
Бактериальные культуры, приготовленные в среде TSB, высевали из колоний на чашки со свежим кровяным агаром и инкубировали при 37 ° C при встряхивании в течение ночи (~ 16 ч).Ночные культуры использовали для добавления 10 мл цельной крови человека (BioIVT, Мэриленд, США), а целые аликвоты крови вводили в стандартные / 10 аэробные / F бутыли BD BACTEC (Becton Dickinson, Нью-Джерси, США). Бутылки для культур крови (BC) инкубировали в приборе BD BACTEC FX40 до тех пор, пока программное обеспечение прибора не отметило их положительными. В течение 30 минут после получения положительного результата 500 мкл культуры удаляли из каждого флакона и разбавляли 4,5 мл TSB комнатной температуры. Затем эту разбавленную культуру использовали для получения аликвот по 200 мкл.Либо антибиотики в исследуемых концентрациях, либо контроли без антибиотиков добавляли к каждой аликвоте из 100x запасов в воде. Аликвоты недолго встряхивали, а затем инкубировали при 37 ° C со встряхиванием в ThermoMixer (Eppendorf, Гамбург, Германия) в течение 1 или 2 часов. После инкубации образцы центрифугировали при 16000 x g в течение 3 минут при комнатной температуре, и супернатант осторожно удаляли пипеткой.
Гранулы ресуспендировали в 200 мкл лизирующего буфера (10 мМ трис-HCl, 1 мМ динатрий EDTA, pH 8.0, 20 мг / мл лизоцима, 300 ед / мл мутанолизина, 1,2% Triton X-100) и инкубировали при 37 ° C со встряхиванием при 1200 об / мин в ThermoMixer в течение 20 мин. Затем к образцам добавляли стеклянные шарики (0,1 мм PowerBeads; Qiagen, Hilden, Germany) до приблизительного объема 20 мкл и образцы встряхивали на максимальной скорости в течение 5 мин. Затем для завершения экстракции ДНК использовали буферы и спин-колонки из мини-набора QIaAMP DNA (Qiagen). К образцам биений шариков добавляли 200 мкл буфера AL и образцы перемешивали коротким встряхиванием.Затем добавляли 200 мкл 100% этанола и снова перемешивали образцы коротким встряхиванием. Образцы кратковременно центрифугировали и 450 мкл супернатанта переносили в спин-колонки набора. Затем образцы промывали в соответствии с инструкциями производителя и элюировали 200 мкл воды.
Элюированную ДНК разводили в 100 раз водой перед использованием в КПЦР. КПЦР выполняли, как описано ранее, с небольшими изменениями [23]. Вкратце, реакции ПЦР проводились в объемах 10 мкл и состояли из универсальных праймеров 16S BactQuant (5’-CCTACGGGDGGCWGCA-3 ’и 5’-GGACTACHVGGGTMTCTAATC-3’) в 1.8 мкМ, зонд (6FAM-5′-CAGCAGCCGCGGTA-3′-MGBNFQ) при 0,2 мкМ, Platinum qPCR Supermix-UDG (ThermoFisher) при 1x, вода и разбавленный образец ДНК (2,5 мкл). Амплификацию проводили на приборе LightCycler 480 II (Roche, Базель, Швейцария) в условиях цикла: 50 ° C в течение 2 минут, 95 ° C в течение 2 минут и 40 циклов при 95 ° C в течение 15 секунд и 60 ° C в течение 45 с. Значения цикла количественной оценки (Cq) рассчитывались автоматически с использованием метода max второй производной. КПЦР для каждого образца проводился в трех технических повторностях, и три значения были усреднены для получения окончательного значения Cq, используемого при анализе данных.
Анализ данных
Для определения чувствительности к антибиотикам значения ΔCq рассчитывали путем вычитания значения Cq, полученного из контрольного образца без антибиотика, из значений Cq для образцов, обработанных антибиотиком. Пороговые значения ΔCq определяли для каждого вида (или семейства для Enterobacteriaceae spp.) На основе кривых ROC, полученных на основе значений ΔCq, определенных для каждого изолята (рис. A в файле S1). Для каждого вида были выбраны пороговые значения, которые максимизировали отношение правдоподобия для правильного определения восприимчивости.Значения ΔCq, использованные в качестве пороговых значений для каждого вида или семейства, составляли:> 2,25 для Enterobacteriaceae spp .; > 2,00 для Acinetobacter baumannii ; > 1,70 для Pseudomonas aeruginosa ; > 1,55 для Enterococcus faecium ; и> 2,05 для S . золотистый . Значение ΔCq выше порогового значения использовалось для обозначения чувствительности к антибиотику, тогда как значение ΔCq ниже порогового значения указывало на резистентность. Ошибки определялись как незначительные, серьезные или очень серьезные.Основные ошибки были определены как результаты с ложной устойчивостью, а частота основных ошибок рассчитывалась как количество результатов с ложной устойчивостью по отношению к общему количеству чувствительных изолятов, определенному с помощью BMD. Очень серьезные ошибки были определены как ложно-чувствительные результаты, а очень большая частота ошибок была рассчитана как количество ложно-чувствительных результатов по отношению к общему количеству устойчивых изолятов, определенному с помощью BMD. Штаммы с промежуточным результатом устойчивости в результате МПК рассматривались как устойчивые для целей расчета категориального согласия, а результат «чувствительность» в результате анализа кПЦР для промежуточного штамма был определен как незначительная ошибка.
Секвенирование и анализ Amplicon
ампликонов из анализа qPCR секвенировали с помощью системы MiSeq (Illumina, California, USA). Сначала ампликоны были подвергнуты автоматической очистке ПЦР с использованием системы подготовки библиотеки Apollo 324 NGS (Takara Bio, Kusatsu, Япония) с использованием протокола «PCR Cleanup 32» прибора. Затем адаптеры TruSeq HT (Illumina) лигировали с использованием протокола Apollo 324 «PrepX ILM 32i DNA» для размера 520 пар оснований с использованием набора универсальной библиотеки ДНК SMARTer PrepX (Takara Bio).ПЦР-обогащение проводили на продуктах библиотеки, добавляя 25 мкл смеси KAPA HiFi HotStart ReadyMix (Roche), 5 мкл смеси праймеров для амплификации библиотеки KAPA и 5 мкл воды для молекулярной биологии к каждому образцу с последующей программой термоциклирования 98 °. C в течение 45 секунд, 10 циклов [98 ° C в течение 15 секунд, 60 ° C в течение 30 секунд и 72 ° C в течение 30 секунд] и 72 ° C в течение 1 минуты. Очистку с помощью ПЦР выполняли снова, как указано выше, перед количественным определением, разведением и объединением ДНК. Объединенную ДНК количественно оценивали с помощью qPCR с использованием набора для количественного анализа библиотеки KAPA (Roche), затем разбавляли до 2 нМ.Объединенную библиотеку ДНК размером 2 нМ смешивали с равным объемом 0,1 М NaOH и инкубировали при комнатной температуре в течение 5 минут до денатурирования. Библиотеку PhiX также получали путем смешивания равных объемов 2 нМ PhiX Sequencing Control v3 (Illumina) с 0,1 М NaOH и инкубирования при комнатной температуре в течение 5 минут для денатурирования. Обе денатурированные библиотеки разбавляли до 12 пМ предварительно охлажденным буфером HT1 (из набора реагентов MiSeq v2 (Illumina)), объединяли для получения конечного соотношения PhiX 25% и секвенировали на MiSeq с 600-цикловым картриджем MiSeq с парные чтения.
Анализ выполняли с использованием CLC Genomics Workbench (Qiagen). Импортированные парные концевые считывания были объединены и обрезаны с использованием показателя качества 0,05 и длины отсечения последовательности> 100 пар оснований. Проект базы данных рибосом (RDP) был использован для создания выбранной ниже справочной базы данных, состоящей из изолятов типовых штаммов из родов патогенов, имеющих медицинское значение (с включением всех видов этих родов), как сообщалось ранее [26]. В тщательно отобранной базе данных использовались только записи, содержащие более 1200 пар оснований хорошего качества.Было использовано строгое сопоставление операций чтения секвенирования с контролируемым RDP на основе ссылок со следующими настройками сопоставления: стоимость несоответствия 10, стоимость вставки 3, стоимость удаления 3, стоимость открытия вставки 6, стоимость расширения вставки 1, открытие удаления стоимость 6, стоимость расширения делеции 1, доля длины 0,5 и доля сходства 1. Для учета утечки образца использовались неэлементные контроли, а пороговое значение рассчитывалось с использованием среднего плюс 3-кратное стандартное отклонение для каждого рода. Считывания, которые упали ниже этого порогового значения, были удалены, и были рассчитаны общие считывания, нанесенные на карту для каждого образца, вместе с репрезентативным процентом каждого рода в образце.
Результаты и обсуждение
Разработка и оптимизация анализа
Мы решили провести анализ RAMAST на экстрагированной ДНК из-за необходимости определения относительного роста бактерий с помощью количественных измерений концентрации ДНК. Хотя добавление экстракции ДНК перед кПЦР увеличивало время цикла анализа, этот этап снизил вероятность ингибирования количественной ПЦР компонентами культуры для подтверждения концепции этого анализа. Удаление ингибиторов ПЦР особенно важно, когда в образце присутствует кровь [27], как это было в данном исследовании.В предыдущей работе по изучению AST с помощью кПЦР в основном использовались образцы мочи или чистая культура, за одним исключением, в котором использовались бактерии из бутылок с культурами крови, частично очищенные с помощью пробирок с сепаратором сыворотки перед инкубацией с антибиотиками [19]. Поскольку первоначальное тестирование со стандартной процедурой лизиса, предусмотренной в протоколе набора для экстракции ДНК, по-видимому, не привело к полному лизису, особенно для плотных культур грамположительных штаммов, наш метод экстракции ДНК включал строгую процедуру лизиса клеток, включая ферментативное расщепление и измельчение гранул. для обеспечения полного лизиса (рис. B в файле S1).В дальнейшем можно использовать альтернативные процедуры подготовки образцов до количественной ПЦР для сокращения времени анализа при сохранении адекватных характеристик, особенно для грамотрицательных видов.
Тест на чувствительность при положительных посевах крови
Эмпирическая оценка необходима до того, как какой-либо анализ может быть усовершенствован посредством клинической оценки. С этой целью мы протестировали в общей сложности 144 клинических и эталонных изолята после имитации культуры крови на чувствительность к антибиотикам с помощью анализа RAMAST: 50 Enterobacteriaceae spp., 30 Acinetobacter baumannii , 22 Pseudomonas aeruginosa , 22 Enterococcus faecium и 20 S . aureus (таблица 1). Оптимизация анализа для трех антибиотиков на вид (ципрофлоксацин, гентамицин и имипенем для грамотрицательных препаратов; ципрофлоксацин, ванкомицин и оксациллин для S . aureus ; ципрофлоксацин, ванкомицин и ампициллин для fae , ). по нескольким концентрациям, охватывающим контрольные точки CLSI, определили оптимальную концентрацию для различения чувствительных штаммов от устойчивых.Оптимальные концентрации найдены для каждой комбинации антибиотиков и видов в таблице 1. Из-за необходимости различных концентраций антибиотиков для разных видов анализ лучше всего проводить после идентификации видов. Мы обнаружили, что время инкубации антибиотика в течение 2 часов было достаточным для всех антибиотиков, за исключением ципрофлоксацина, для которого требовалась только 1-часовая инкубация антибиотика. Более короткое время инкубации, необходимое для ципрофлоксацина, может быть связано с антимикробным ингибирующим действием фторхинолона, которое включает ингибирование активности ДНК-гиразы и топоизомеразы IV за счет образования комплексов лекарственное средство-фермент-ДНК с косвенными последствиями для репликации ДНК [28].Ингибирование активности гиразы приводит к двухцепочечным разрывам ДНК в метаболически активных бактериях, прекращая дальнейшую репликацию ДНК, вероятно, с более высокой скоростью, чем это возможно с другими классами антибиотиков. Другие противомикробные препараты, нацеленные на ДНК, также могут обеспечить более короткое необходимое время инкубации, как отмечено в литературе как для нитрофурантоина, так и для ципрофлоксацина [20].
Ципрофлоксацин обычно не показан при инфекциях кровотока с E . faecium и S . aureus [24]; однако мы включили этот фторхинолон, чтобы подчеркнуть более короткое время инкубации. Кроме того, этот анализ можно легко переназначить для других матриц, таких как моча или виды бактерий, где тестирование ципрофлоксацина было бы более подходящим. При оптимизированном времени инкубации общее время цикла анализа составляло примерно 3 часа для ципрофлоксацина и 4 часа для других антибиотиков после положительного результата посева крови.
В оптимизированных условиях анализа мы протестировали в общей сложности 432 комбинации видов антибиотиков.Мы обнаружили общее категориальное согласие 96,3% с частотой основных ошибок 3,7% и частотой очень серьезных ошибок 3,1% (таблица 2, рис. 1) по сравнению с микродоразведением бульона (BMD). Частота серьезных и очень серьезных ошибок рассчитывалась как количество ложно-устойчивых или ложно-чувствительных результатов, деленное на количество истинно чувствительных или истинно устойчивых изолятов, соответственно. В знаменателе использовалось количество истинно восприимчивых и истинно устойчивых изолятов, а не общее количество образцов (последний метод иногда упоминается при оценке анализа AST, но обеспечивает обманчиво низкий уровень ошибок).Расчеты были выполнены таким образом, чтобы точно отразить высокий уровень ошибок, возникающих в результате даже одной ошибки, когда небольшая популяция устойчивых или чувствительных изолятов используется для оценки анализа. Мы расценили результат восприимчивости из анализа RAMAST для штамма с промежуточной устойчивостью как незначительную ошибку, только с двумя незначительными ошибками из 12 промежуточных штаммов, поскольку анализ дает двоичный результат, ограничивающий применение классификации промежуточной устойчивости. Повторное тестирование серьезных или очень серьезных ошибок в конкретных комбинациях антибиотик-штамм привело к получению 5 из 14 правильных результатов при повторной проверке (Таблица F в файле S1).Эти противоречивые данные могут быть из-за ошибки оператора, сбоя в столбце извлечения или ошибочных показаний КПЦР. В будущем автоматизация процедуры пробоподготовки снизит вероятность ошибки оператора, а также минимизирует время работы и время анализа. Возможность повторения ошибок при повторном тестировании может заключаться в том, что эти штаммы просто ведут себя иначе, чем другие штаммы того же вида, возможно, из-за различных механизмов устойчивости или генетической изменчивости в других частях генома.
Рис. 1. Распределение значений ΔCq для тестируемых изолятов.
Показаны значения ΔCq для всех изолятов, разделенные по антибиотику и чувствительности, определенной эталонным методом (BMD), для (a) Enterobacteriaceae spp., (B) A . baumannii , (в) П . aeruginosa , (г) E . faecium и (e) S . золотистый . Комбинации изолята и антибиотика, которые привели к незначительным, серьезным или очень серьезным ошибкам, окрашены в красный цвет.Sus, восприимчивый; int, промежуточный; res, стойкий; ЦИП, ципрофлоксацин; Gen, гентамицин; Ими, имипенем; Ван, ванкомицин; Амп, ампициллин; Окса, оксациллин.
https://doi.org/10.1371/journal.pone.0209042.g001
Анализ RAMAST в целом показал хорошие результаты при анализе результатов по видам и антибиотикам с Enterobacteriaceae spp., A . baumannii , P . aeruginosa и S . aureus (категориальное согласие 96–99%), но привело к большему количеству ошибок с E . faecium (92,4% категориального согласия, с 2 основными ошибками и 3 очень серьезными ошибками) (рис. 1, таблица G в файле S1). Комбинация ванкомицина с E . faecium оказался особенно сложным, с двумя очень серьезными ошибками и одной большой ошибкой при оптимизированной концентрации антибиотика (частота очень серьезных ошибок 25%, частота серьезных ошибок 7%). Более того, повторение анализа ошибочно названных изолятов с ванкомицином привело к воспроизведению обеих очень серьезных ошибок (таблица F в файле S1).Попытки дополнительно оптимизировать анализ для уменьшения количества очень серьезных ошибок за счет использования более низких концентраций ванкомицина привели к неприемлемо большому количеству серьезных ошибок (таблица H в файле S1). Мы также получили высокую частоту очень серьезных ошибок с ципрофлоксацином в E . faecium и оксациллин в S . aureus (у обоих 8,3% очень серьезных ошибок). Относительно небольшие размеры выборки для этих комбинаций антибиотиков и видов могли способствовать такому высокому уровню очень серьезных ошибок.Более длительная инкубация антибиотиков или другая оптимизация анализа, вероятно, обязательно приведет к достижению более приемлемого уровня точности. Аналогично ципрофлоксацин и . baumannii дало частоту серьезных ошибок 25%; но, опять же, набор образцов был небольшим, всего с 4 восприимчивыми штаммами.
В нескольких аналогичных исследованиях сообщалось о методах количественной ПЦР на AST, но, насколько нам известно, только исследование Beuving et al. использовали образцы из бутылочек с культурами крови [19]. Как обсуждалось выше, присутствие клеток крови и других компонентов сыворотки создает сложности, выходящие за рамки того, что можно было бы ожидать при проведении количественной ПЦР на чистой культуре или образцах мочи.По сравнению с Beuving et al., Мы сократили время инкубации антибиотика с 6 часов до 1 или 2 часов, в зависимости от антибиотика, за счет использования более богатой среды и минимально разведенных положительных культур крови вскоре после получения положительных результатов. Условия цикла кПЦР, используемые здесь с праймерами и зондом BactQuant, также были значительно быстрее, что позволило в целом сократить время цикла анализа с 9 до 3 или 4 часов (в зависимости от антибиотика).
Идентификация бактерий посредством секвенирования ампликонов
Поскольку данные последовательности 16S часто используются для окончательной идентификации бактерий для нечасто выделяемых патогенов, мы исследовали, можно ли использовать ампликон для анализа RAMAST для идентификации рода, учитывая широкий охват набора праймеров.Как уже упоминалось, праймеры BactQuant нацелены на вариабельные области V3 и V4 16S. Строгий анализ рибосомных последовательностей важных с медицинской точки зрения патогенов позволяет предположить, что область V3 подходит для различения всех бактериальных областей вплоть до уровня рода, за исключением близкородственных Enterobacteriaceae [29]. Используя секвенирование следующего поколения, мы секвенировали подгруппу из 29 штаммов, использованных в этом исследовании, охватывающих 17 различных видов, чтобы проверить, можно ли использовать таким образом ампликон для анализа RAMAST.Эти эксперименты привели к правильному соответствию на уровне родов для всех видов (таблица 3), за исключением Klebsiella oxytoca , посредством картирования считывания в релевантную с медицинской точки зрения базу данных рибосом 16S, как описано в Stefan et al. [26]. За исключением Klebsiella , более высокий процент считываний сопоставлен с Enterobacter для K . oxytoca ; тем не менее, Klebsiella имеет второй по величине процент картированных считываний, и оба эти рода тесно связаны между собой Enterobacteriaceae .Хотя этот метод определения видов работает медленнее, чем другие доступные методы (например, MALDI-TOF, биохимический), секвенирование ампликона 16S является полезным инструментом для редко выделяемых бактерий, которые могут быть неверно идентифицированы другими методами. Хотя относительно короткий, ампликон из анализа RAMAST обеспечивал достаточно длинные последовательности через вариабельные области гена 16S для дифференциации и подходил для секвенирования с помощью методов секвенирования по Сэнгеру или следующего поколения.
Заключение
Здесь мы показали, что использование анализа RAMAST для относительной количественной оценки ДНК после инкубации антибиотика может быть использовано для получения результатов фенотипической чувствительности к антибиотикам всего за 3-4 часа после положительного посева крови.Использование универсальной системы амплификации BactQuant 16S упростило анализ, требуя только одного набора праймеров и зондов для тестирования всех бактериальных патогенов. Дальнейшее улучшение этого анализа может быть достигнуто за счет применения недавно описанного метода термо-холодного лизиса для экстракции ДНК, что потенциально сокращает время работы и ошибки оператора [21]. В целом, наш анализ показал высокое категориальное согласие на 96,3%, при этом представляя значительное сокращение общего времени анализа по сравнению с аналогичным анализом КПЦР AST из посевов крови.
Благодарности
Мнения, толкования, выводы и рекомендации, содержащиеся в данном документе, принадлежат авторам и не обязательно поддерживаются армией США. Следующие реактивы были получены через хранилище ресурсов NIH Biodefense и Emerging Infections Research Resources, NIAID, NIH: A . baumannii изоляты NR-13380, NR-13383, NR-17780, NR-17781, NR-17782, NR-17784, NR-13379, NR-13378, NR-17786, NR-17778, NR-17787, NR- 13375; П . aeruginosa изоляты NR-31041, NR-50573, NR-48928; E faecium изоляты NR-32065, NR-32094, HM-463, NR-32053, NR-31967, NR-31916, NR-31937, NR-28979, NR-28982, HM-204, NR-31963, NR -31954, NR-28976, NR-31955, NR-31912, NR-31913, NR-32052, NR-32054; S . aureus изолирует 880 (BR-VRSA), S . золотистый 71080.
Список литературы
- 1. Laxminarayan R, Duse A, Wattal C, Zaidi AK, Wertheim HF, Sumpradit N, et al.Устойчивость к антибиотикам — необходимость глобальных решений. Lancet Infect Dis. 2013; 13 (12): 1057–98. pmid: 24252483
- 2. Fraser A, Paul M, Almanasreh N, Tacconelli E, Frank U, Cauda R, et al. Преимущество соответствующего эмпирического лечения антибиотиками: тридцатидневная смертность и продолжительность пребывания в больнице. Am J Med. 2006. 119 (11): 970–6. pmid: 17071166
- 3. Родос А., Эванс Л. Е., Альхазани В., Леви М. М., Антонелли М., Феррер Р. и др. Кампания по выживанию при сепсисе: Международные рекомендации по ведению сепсиса и септического шока: 2016 г.Intensive Care Med. 2017; 43 (3): 304–77. pmid: 28101605
- 4. Виганд I, Хильперт К., Хэнкок РЭ. Методы разбавления агара и бульона для определения минимальной ингибирующей концентрации (МИК) антимикробных веществ. Nat Protoc. 2008. 3 (2): 163–75. pmid: 18274517
- 5. Баренфангер Дж., Дрейк С., Качич Г. Клинические и финансовые преимущества быстрой идентификации бактерий и тестирования на чувствительность к противомикробным препаратам. J Clin Microbiol. 1999. 37 (5): 1415–8. pmid: 10203497
- 6.Маурер Ф.П., Кристнер М., Хеншке М., Роде Х. Достижения в области быстрой идентификации и тестирования чувствительности бактерий в лаборатории клинической микробиологии: значение для программ ухода за пациентами и антимикробной защиты. Infect Dis Rep.2017; 9 (1): 6839. pmid: 28458798
- 7. Малани А. Н., Ричардс П. Г., Капила С., Отто М. Х., Червински Дж., Сингал Б. Клинические и экономические результаты программы управления противомикробными препаратами общественной больницы. Am J Infect Control. 2013. 41 (2): 145–8.pmid: 22579261
- 8. Дэйви П., Марвик К.А., Скотт К.Л., Чарани Е., Макнил К., Браун Е. и др. Вмешательства по улучшению практики назначения антибиотиков стационарным больным. Кокрановская база данных Syst Rev.2017; 2: CD003543. pmid: 28178770
- 9. Ventola CL. Кризис устойчивости к антибиотикам: часть 1: причины и угрозы. Pharm Ther. 2015; 40 (4): 277–83.
- 10. Костич Т., Эллис М., Уильямс М.Р., Стедтфельд Т.М., Канини Дж. Б., Стедтфельд Р. Д. и др. Тридцатиминутный скрининг генов устойчивости к антибиотикам в бактериальных изолятах с минимальной пробоподготовкой на 64-х и 384 статических карточках для анализа.Appl Microbiol Biotechnol. 2015; 99 (18): 7711–22. pmid: 26227406
- 11. Zboromyrska Y, Vergara A, Cosgaya C, Verger G, Mosqueda N, Almela M и др. Быстрое обнаружение бета-лактамаз непосредственно из положительных культур крови с использованием анализа на основе петлевой изотермической амплификации (LAMP). Int J Antimicrob Agents. 2015. 46 (3): 355–6. pmid: 26141229
- 12. Fredborg M, Andersen KR, Jorgensen E, Droce A, Olesen T., Jensen BB и др. Оптическое тестирование чувствительности к антимикробным препаратам в режиме реального времени.J Clin Microbiol. 2013. 51 (7): 2047–53. pmid: 23596243
- 13. Балтекин О., Бухарин А., Тано Е., Андерссон Д. И., Эльф Дж. Тестирование чувствительности к антибиотикам менее чем за 30 минут с использованием прямого визуализации отдельных клеток. Proc Natl Acad Sci U S. A. 2017; 114 (34): 9170–5. pmid: 287
- 14. Лю CY, Han YY, Shih PH, Lian WN, Wang HH, Lin CH и др. Экспресс-тест бактериальной чувствительности к антибиотикам на основе простых спектроскопических биомаркеров комбинационного рассеяния света с поверхностным усилением. Научный доклад 2016; 6: 23375.pmid: 26997474
- 15. Lange C, Schubert S, Jung J, Kostrzewa M, Sparbier K. Количественная матричная лазерная десорбционная ионизация-времяпролетная масс-спектрометрия для быстрого обнаружения сопротивления. J Clin Microbiol. 2014. 52 (12): 4155–62. pmid: 25232164
- 16. Костшева М., Спарбир К., Майер Т., Шуберт С. MALDI-TOF MS: новый инструмент для быстрого определения устойчивости микроорганизмов к антибиотикам. Proteomics Clin Appl. 2013; 7 (11–12): 767–78. pmid: 24123965
- 17.Максон Т., Тейлор-Хауэлл К.Л., Миноуг Т.Д. Полуколичественный MALDI-TOF для тестирования чувствительности к противомикробным препаратам у Staphylococcus aureus. PLoS One. 2017; 12 (8): e0183899. pmid: 28859120
- 18. Rolain JM, Mallet MN, Fournier PE, Raoult D. ПЦР в реальном времени для универсального тестирования чувствительности к антибиотикам. J Antimicrob Chemother. 2004. 54 (2): 538–41. pmid: 15231761
- 19. Бевинг Дж., Вербон А., Гронхуд Ф.А., Стобберинг Э. Э., Вольфс П. Ф. Тестирование чувствительности к антибиотикам выращенных культур крови путем комбинирования культуры и полимеразной цепной реакции в реальном времени является быстрым и эффективным.PLoS One. 2011; 6 (12): e27689. pmid: 22194790
- 20. Шопп Н.Г., Шлаппи Т.С., Кертис М.С., Буткович С.С., Миллер С., Хамфрис Р.М. и др. Экспресс-тестирование патоген-специфической фенотипической чувствительности к антибиотикам с использованием цифрового количественного определения LAMP в клинических образцах. Sci Transl Med. 2017; 9 (410): eaal3693.
- 21. Ло Дж, Ю Дж, Ян Х, Вэй Х. Параллельное тестирование чувствительности бактерий с помощью количественной ПЦР в 96-луночных планшетах. Int J Infect Dis. 2018; 70: 86–92.pmid: 29559368
- 22. Mezger A, Gullberg E, Goransson J, Zorzet A, Herthnek D, Tano E, et al. Общий метод быстрого определения чувствительности к антибиотикам и их вида при бактериальных инфекциях. J Clin Microbiol. 2015; 53 (2): 425–32. pmid: 25411178
- 23. Лю С.М., Азиз М., Качур С., Сюэ П.Р., Хуанг Ю.Т., Кейм П. и др. BactQuant: расширенный бактериальный количественный ПЦР-анализ в реальном времени с широким охватом. BMC Microbiol. 2012; 12:56 pmid: 22510143
- 24.CLSI. Стандарты эффективности тестирования на чувствительность к противомикробным препаратам. 27-е издание. Дополнение CLSI M100. Уэйн, Пенсильвания, США: Институт клинических и лабораторных стандартов; 2017.
- 25. CLSI. Методы испытаний на чувствительность к противомикробным препаратам при разведении бактерий, которые растут в аэробных условиях; Утвержденный стандарт — десятое издание. Документ CLSI M07-A10. Уэйн, Пенсильвания, США: Институт клинических и лабораторных стандартов; 2015.
- 26. Стефан С.П., Зал АТ, Миноуг ТД. Обнаружение 16S рРНК и генов KPC из сложной матрицы с использованием анализа молекулярной инверсии для секвенирования следующего поколения.Sci Rep.2018; 8 (1): 2028. pmid: 29391471
- 27. Schrader C, Schielke A, Ellerbroek L, Johne R. Ингибиторы ПЦР — возникновение, свойства и удаление. J Appl Microbiol. 2012. 113 (5): 1014–26. pmid: 22747964
- 28. Хупер, округ Колумбия. Механизмы действия противомикробных препаратов: основное внимание уделяется фторхинолонам. Clin Infect Dis. 2001; 32 Приложение 1: S9 – S15.
- 29. Chakravorty S, Helb D, Burday M, Connell N, Alland D. Подробный анализ сегментов гена 16S рибосомной РНК для диагностики патогенных бактерий.J Microbiol Methods. 2007. 69 (2): 330–9. pmid: 17391789
Быстрое обнаружение бактерий и определение чувствительности к антибиотикам в цельной крови с использованием одноэтапной высокопроизводительной цифровой ПЦР крови
* Соответствующие авторы
a Velox Biosystems, 5 Mason, Suite 160, Irvine, CA 92618, США
Эл. Почта: tabram @ veloxbio.ком
б Центр исследования стволовых клеток Сью и Билла Гросс, Калифорнийский университет, Ирвин, 845 Health Sciences Road, Suite 3027, Irvine, CA 92697, США
Эл. Почта: weianz @ uci.edu
Тел .: +949 824 9744
c Департамент фармацевтических наук Калифорнийского университета, Ирвин, Ирвин, Калифорния 92697, США
г Департамент биомедицинской инженерии, Калифорнийский университет, Ирвин, Ирвин, Калифорния 92697, США
e Физико-технический факультет, Колледж Форт-Льюис, Дуранго, CO 81301, США
f Кафедра патологии и лабораторной медицины, Калифорнийский университет, Ирвин, Калифорния 92697, США
г Отделение инфекционных заболеваний, Медицинская школа UCI, Ирвин, Калифорния 92697, США
ч Лаборатория динамики флуоресценции, Калифорнийский университет, Ирвин, Калифорния 92697, США
i Комплексный онкологический центр семьи Чао, Калифорнийский университет, Ирвин, Ирвин, Калифорния 92697, США
j Центр наук о жизни Эдвардса передовых сердечно-сосудистых технологий, Калифорнийский университет, Ирвин, Ирвин, Калифорния 92697, США
к Кафедра биологической химии Калифорнийского университета, Ирвин, Ирвин, Калифорния 92697, США
Прямое тестирование на чувствительность к противомикробным препаратам из бутылочек с положительными посевами крови в лабораториях, в которых отсутствуют автоматизированные системы тестирования чувствительности к противомикробным препаратам
Реферат
Предпосылки
Своевременное введение соответствующего противомикробного препарата может улучшить результат с точки зрения снижения заболеваемости и смертности в дополнение к снижению затрат на здравоохранение .Наличие заблаговременного предварительного отчета по тесту на чувствительность к противомикробным препаратам (AST) будет полезно для направления противомикробной терапии. Цель исследования заключалась в том, чтобы коррелировать AST методом дисковой диффузии непосредственно из бутылок с культурой крови с положительной маркировкой с AST автоматическим методом.
Методы
Всего было обработано 144 флакона для аэробных культур крови, отмеченных как положительные с помощью автоматической системы культивирования крови. Бактерии осаждали двухступенчатым центрифугированием бульона из бутылки и использовали для получения мазка на окрашивание по Граму, а также в качестве посевного материала для тестирования чувствительности к противомикробным препаратам методом дисковой диффузии Кирби Бауэра.Также проводилась автоматическая идентификация и АСТ.
Результаты
При прямом окрашивании в 94 образцах были обнаружены грамотрицательные бациллы, в 39 — грамположительные кокки, а в 11 — дрожжевой или полимикробный рост. В случае грамотрицательных бактерий между прямым тестом на чувствительность и автоматическим тестированием на чувствительность было 99% категорическое согласие с несогласием в 1%. Среди грамположительных кокков было 96% категорического согласия с 4% несогласием между двумя методами.
Заключение
Высокая степень согласия между двумя методами является многообещающей и применимой к ситуациям, когда автоматическое тестирование чувствительности недоступно. Даже если системы доступны, этот метод может оказаться полезным в качестве дополнения к стандартной отчетности AST. Этот отчет о чувствительности может быть создан раньше, чем обычный AST, что позволяет выбрать подходящий противомикробный препарат.
Ключевые слова
Диско-диффузионные антимикробные тесты
Тест на микробную чувствительность
Культура крови
Бактерии
Рекомендуемые статьиЦитирующие статьи (0)
Полный текст© 2018 Вооруженные силы Медицинской службы (AFMS).
Рекомендуемые статьи
Цитирующие статьи
Быстрое тестирование чувствительности к антибиотикам при диагностике посевов крови, выполняемое прямым посевом с использованием платформ VITEK®-2 и BD Phoenix ™
Fleischmann C, Thomas-Rueddel DO, Hartmann M, Hartog CS, Welte T, Heublein S et al (2016) Уровень заболеваемости и смертности от сепсиса в больницах. Dtsch Arztebl Int 113 (10): 159–166
PubMed PubMed Central Google Scholar
Мартин Г.С. (2012) Сепсис, тяжелый сепсис и септический шок: изменения в заболеваемости, патогенах и исходах. Expert Rev Anti-Infect Ther 10 (6): 701–706
Статья CAS PubMed PubMed Central Google Scholar
Кумар А., Эллис П., Араби Ю., Робертс Д., Лайт Б., Паррилло Дж. Сундук 136 (5): 1237–1248
Артикул PubMed Google Scholar
Garnacho-Montero J, Gutierrez-Pizarraya A, Escoresca-Ortega A, Fernandez-Delgado E, Lopez-Sanchez JM (2015) Адекватная терапия антибиотиками до поступления в отделение интенсивной терапии у пациентов с тяжелым сепсисом и септическим шоком снижает больничную смертность. Crit Care 19: 302
Статья PubMed PubMed Central Google Scholar
Ferrer R, Martin-Loeches I, Phillips G, Osborn TM, Townsend S, Dellinger RP et al (2014) Эмпирическое лечение антибиотиками снижает смертность при тяжелом сепсисе и септическом шоке с первого часа: результаты из руководства программа повышения производительности.Crit Care Med 42 (8): 1749–1755
Статья CAS Google Scholar
Табак Ю.П., Ванкепурам Л., Йе Дж., Джефферс К., Гупта В., Мюррей П.Р. (2018) Время обработки посевов крови в больницах неотложной помощи США и последствия для оптимизации лабораторных процессов. Дж. Клин Микробиол 56 (12). https://doi.org/10.1128/JCM.00500-18
Лизенфельд О., Леман Л., Хунфельд К.П., Кост Г. (2014) Молекулярная диагностика сепсиса: новые аспекты и последние разработки.Eur J Microbiol Immunol (Bp) 4 (1): 1–25
Статья CAS Google Scholar
Синха М., Юп Дж., Мак Х., Коулман Т.П., Лоуренс С.М., Фрейли С.И. (2018) Новые технологии для молекулярной диагностики сепсиса. Clin Microbiol Rev 31 (2). https://doi.org/10.1128/CMR.00089-17
Tan KE, Ellis BC, Lee R, Stamper PD, Zhang SX, Carroll KC (2012) Перспективная оценка матричной лазерной десорбционной ионизационной системы масс-спектрометрии с функцией времени полета в клинической микробиологической лаборатории больницы для идентификация бактерий и дрожжей: лабораторное исследование для оценки влияния на время до идентификации и экономической эффективности.J Clin Microbiol 50 (10): 3301–3308
Статья CAS PubMed PubMed Central Google Scholar
Maelegheer K, Nulens E (2017) Идентификация в тот же день и определение чувствительности к антибиотикам на положительных культурах крови: простая и недорогая процедура. Eur J Clin Microbiol Infect Dis 36 (4): 681–687
Статья CAS PubMed Google Scholar
Munoz-Davila MJ, Yague G, Albert M, Garcia-Lucas T (2012) Сравнительная оценка идентификации Vitek 2 и тестирования чувствительности грамотрицательных палочек непосредственно и выделенных из бутылок с BacT / ALERT-положительными культурами крови. Eur J Clin Microbiol Infect Dis 31 (5): 663–669
Статья CAS PubMed Google Scholar
Lupetti A, Barnini S, Castagna B, Capria AL, Nibbering PH (2010) Быстрая идентификация и профилирование антимикробной чувствительности грамположительных кокков в культурах крови с помощью системы Vitek 2.Eur J Clin Microbiol Infect Dis 29 (1): 89–95
Статья CAS PubMed Google Scholar
Wattal C, Oberoi JK (2016) Идентификация микробов и автоматическое определение чувствительности к антибиотикам непосредственно из положительных культур крови с использованием MALDI-TOF MS и VITEK 2. Eur J Clin Microbiol Infect Dis 35 (1): 75–82
Статья CAS PubMed Google Scholar
Rhodes A, Evans LE, Alhazzani W, Levy MM, Antonelli M, Ferrer R et al (2017) Кампания по выживанию при сепсисе: международные рекомендации по ведению сепсиса и септического шока: 2016. Crit Care Med 45 (3): 486–552
Артикул Google Scholar
Habib G, Lancellotti P, Antunes MJ, Bongiorni MG, Casalta JP, Del Zotti F et al (2015) Руководство ESC по лечению инфекционного эндокардита, 2015 г., целевая группа по лечению инфекционного эндокардита Европейское общество кардиологов (ESC).Принято: Европейская ассоциация кардио-торакальной хирургии (EACTS), Европейская ассоциация ядерной медицины (EANM). Eur Heart J 36 (44): 3075–3128
Артикул PubMed Google Scholar
Jorgensen JH (1993) Критерии отбора для системы тестирования чувствительности к противомикробным препаратам. J Clin Microbiol 31 (11): 2841–2844
CAS PubMed PubMed Central Google Scholar
Tian Y, Zheng B, Wang B, Lin Y, Li M (2016) Быстрая идентификация и тестирование множественной чувствительности патогенов из стерильных биологических жидкостей с положительной культурой с помощью комбинированной масс-спектрометрии MALDI-TOF и системы определения чувствительности Vitek. Фронтальный микробиол 7: 523
PubMed PubMed Central Google Scholar
Bruins MJ, Bloembergen P, Ruijs GJ, Wolfhagen MJ (2004) Идентификация и тестирование чувствительности Enterobacteriaceae и Pseudomonas aeruginosa путем прямого посева из бутылок с положительными культурами крови BACTEC в Vitek 2.J Clin Microbiol 42 (1): 7–11
Статья PubMed PubMed Central Google Scholar
Quesada MD, Gimenez M, Molinos S, Fernandez G, Sanchez MD, Rivelo R et al (2010) Характеристики VITEK-2 Compact и ночных панелей MicroScan для прямой идентификации и тестирования чувствительности грамотрицательных бактерий из положительные флаконы для посева крови FAN BacT / ALERT. Clin Microbiol Infect 16 (2): 137–140
Статья CAS PubMed Google Scholar
Gherardi G, Angeletti S, Panitti M, Pompilio A, Di Bonaventura G, Crea F et al (2012) Сравнительная оценка систем Vitek-2 Compact и Phoenix для быстрой идентификации и тестирования чувствительности к антибиотикам непосредственно из грамотрицательных культур крови и грамположительные изоляты. Diagn Microbiol Infect Dis 72 (1): 20–31
Статья CAS PubMed Google Scholar
Funke G, Funke-Kissling P (2004) Использование автоматизированной микробиологической системы BD PHOENIX для прямой идентификации и тестирования чувствительности грамотрицательных палочек из положительных культур крови в трехфазном испытании.J Clin Microbiol 42 (4): 1466–1470
Статья CAS PubMed PubMed Central Google Scholar
Wimmer JL, Long SW, Cernoch P, Land GA, Davis JR, Musser JM et al (2012) Стратегия быстрой идентификации и тестирования чувствительности к антибиотикам грамотрицательных бактерий, полученных непосредственно из положительных культур крови с помощью Bruker MALDI Biotyper и система BD Phoenix. J Clin Microbiol 50 (7): 2452–2454
Артикул CAS PubMed PubMed Central Google Scholar
Prod’hom G, Durussel C, Greub G (2013) Простой препарат бактериального осадка для посева крови для более быстрой и точной прямой идентификации бактерий и тестирования чувствительности к антибиотикам с помощью системы VITEK 2. J Med Microbiol 62 (Pt 5): 773–777
Статья CAS PubMed Google Scholar
Machen A, Drake T, Wang YF (2014) Идентификация в тот же день и полное тестирование чувствительности к антимикробным препаратам бактерий из бутылок с положительными культурами крови стало возможным благодаря комбинированному методу лизиса-фильтрации с масс-спектрометрией MALDI-TOF VITEK и система VITEK2.PLoS One 9 (2): e87870
Артикул CAS PubMed PubMed Central Google Scholar
Romero-Gomez MP, Gomez-Gil R, Pano-Pardo JR, Mingorance J (2012) Идентификация и тестирование чувствительности микроорганизмов путем прямого посева из бутылочек с положительными культурами крови путем комбинирования MALDI-TOF и Vitek-2 Compact быстро и эффективно. J Inf Secur 65 (6): 513–520
Google Scholar
Ling TK, Liu ZK, Cheng AF (2003) Оценка системы VITEK 2 для быстрой прямой идентификации и тестирования чувствительности грамотрицательных бацилл из положительных культур крови. J Clin Microbiol 41 (10): 4705–4707
Статья PubMed PubMed Central Google Scholar
Lupetti A, Barnini S, Castagna B, Nibbering PH, Campa M (2010) Быстрая идентификация и тестирование на антимикробную чувствительность грамположительных кокков в культурах крови путем прямого посева в систему BD Phoenix.Clin Microbiol Infect 16 (7): 986–991
Статья CAS PubMed Google Scholar
Wisplinghoff H, Seifert H, Wenzel RP, Edmond MB (2003) Текущие тенденции в эпидемиологии внутрибольничных инфекций кровотока у пациентов с гематологическими злокачественными новообразованиями и солидными новообразованиями в больницах США. Clin Infect Dis 36 (9): 1103–1110
Статья PubMed Google Scholar
Karlowsky JA, Jones ME, Draghi DC, Thornsberry C, Sahm DF, Volturo GA (2004) Распространенность и антимикробная чувствительность бактерий, выделенных из посевов крови госпитализированных пациентов в США в 2002 году. Ann Clin Microbiol Antimicrob 3: 7
Статья PubMed PubMed Central Google Scholar
Wisplinghoff H, Bischoff T, Tallent SM, Seifert H, Wenzel RP, Edmond MB (2004) Нозокомиальные инфекции кровотока в больницах США: анализ 24 179 случаев из проспективного общенационального эпиднадзора.Clin Infect Dis 39 (3): 309–317
Статья PubMed Google Scholar
Fritzenwanker M, Imirzalioglu C, Herold S, Wagenlehner FM, Zimmer KP, Chakraborty T (2018) Варианты лечения устойчивых к карбапенемам грамотрицательных инфекций. Dtsch Arztebl Int 115 (20–21): 345–352
PubMed PubMed Central Google Scholar
Профиль чувствительности к антибиотикам изолятов культур крови возбудителей кишечной лихорадки в центре третичной медицинской помощи — ретроспективное исследование
Международный журнал исследований в области здравоохранения, 2018,6,2,9-15.
Дата публикации: апрель 2018 г.
Тип: Оригинальная статья
Авторы: Принадлежность к авторам:Абхишек Мехта *, Виджай Пракаш Сингх и Девеш Шарма
Кафедра микробиологии, Медицинский колледж KD, больница и исследовательский центр, NH # 2, 24 км. веха, Акбарпур (Уттарпрадеш), р-н. Матхура, ИНДИЯ.
Резюме:Цели: Это ретроспективное исследование было проведено для определения преобладающей модели устойчивости к противомикробным препаратам среди изолятов культур крови из подтвержденных посевом случаев кишечной лихорадки в сельской клинической больнице третичной медицинской помощи. Методы: Это ретроспективное исследование было проведено в сельской клинической больнице третичного уровня, в которой лабораторные данные о положительных результатах посева крови на кишечную лихорадку, сохранявшиеся в течение двух лет с июля 2015 года по июнь 2017 года, были повторно обработаны, проанализированы и проанализированы для определения Профиль чувствительности к антибиотикам изолятов S.enterica . Результаты: 512 проб крови, обработанных на чувствительность культур, дали 30 штаммов Salmonella typhi (86%) и 5 штаммов (14%) Salmonella paratyphi A.Штаммы S.typhi показали самую высокую чувствительность к имипенему (100%), за которым следовали цефалоспорины 3-го поколения (> 90%), азтреонам (90%), цефепим (90%), левофлоксацин (86,67%) и ципрофлоксацин (70%). Штаммы S.paratyphi A показали самую высокую чувствительность к цефиксиму, цефтазидиму, цефтриаксону, амикацину и имипенему. Заключение: Это исследование подчеркивает необходимость проведения посева крови и тестирования чувствительности к антибиотикам для каждого случая подозрения на кишечную лихорадку. Нерациональное ненадлежащее неизбирательное использование антибиотиков необходимо строго пресекать с помощью контроля над противомикробными препаратами, чтобы предотвратить появление штаммов с множественной лекарственной устойчивостью.
Профиль чувствительности штаммов S.typhi к антибиотикам
.