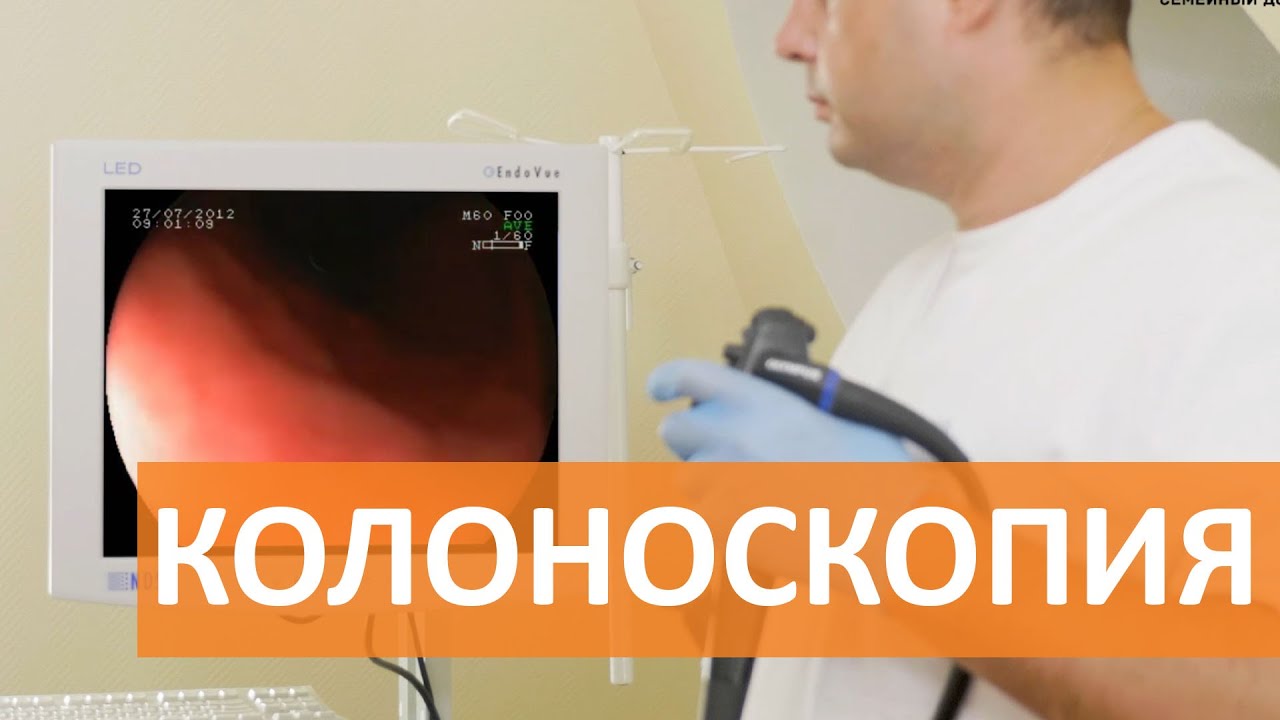
Колоноскопия — Euromed
Колоноскопия — это инструментальный осмотр толстой кишки, который выполняется гибким оптическим прибором — колоноскопом. Колоноскопию назначают в случаях, когда необходимо исключить какое-либо заболевание толстой кишки (полипы, рак, неспецифический язвенный колит или болезнь Крона), при наличии жалоб на боль в животе, проблемы с дефекацией (запоры или диарею), примесь крови или слизи в стуле, при анемии.
При колоноскопии пациент лежит на левом боку, врач вводит колоноскоп в прямую кишку пациента через заднепроходное отверстие и постепенно, управляя гибким концом колоноскопа, продвигается выше по ходу отделов толстой кишки. Опытные эндоскописты могут также заглянуть в дистальный отдел тонкой кишки (подвздошную кишку).
При осмотре кишки врач обращает внимание на состояние слизистой оболочки, наличие новообразований, перистальтику и содержимое кишки. При необходимости доктор может брать пробы для гистологического исследования, выполнять лечебные процедуры, такие как удаление полипов при помощи электропетли.
Как подготовку, так и саму процедуру нельзя назвать простыми.
Перед колоноскопией нельзя принимать пищу по крайней мере 12 часов, кроме того, кишечник необходимо подготовить для исследования, опорожнив его. Для этого накануне назначают препарат, вызывающий обильную дефекацию (иначе кишечник будет недоступен для осмотра).
Исследование длится 15-40 минут и проводится под общей анестезией.
Беременным исследование проводится без анастезии, а детям, наоборот, под анестезией хирургической (подключение искусственной вентиляции легких). В этих случаях нужно тщательно оценить необходимость исследования и его пользу, которая должна превышать потенциальный вред.
Альтернативой колоноскопии является видеокапсула — фотокамера в форме капсулы, которую пациент принимает как лекарство и ждет, пока она, пройдя весь пищеварительный тракт, выйдет естественным образом. По ходу продвижения камера автоматически делает снимки, сохраняя их на встроенном носителе. После того как камера выходит, снимки извлекают и расшифровывают. Недостатком метода является невозможность брать образцы тканей и проводить лечебные процедуры. Поэтому в нашей клинике мы не проводим капсульную колоноскопию.
После того как камера выходит, снимки извлекают и расшифровывают. Недостатком метода является невозможность брать образцы тканей и проводить лечебные процедуры. Поэтому в нашей клинике мы не проводим капсульную колоноскопию.
Диагностика и лечение болезней желудка и кишечника проводится опытными врачами-специалистами нашей клиники:
Записатьcя на консультацию к гастроэнтерологу можно по телефону +7(812)-327-03-01 или онлайн на нашем сайте
Колоноскопия в Минске. Сделать колоноскопию под наркозом
Проведение процедуры с биопсией от: 130 BYN
Что такое колоноскопия и зачем её нужно делать
Что может быть дороже здоровья? Пока организм работает нормально, люди не задумываются, какой ценностью обладают. Однако современный ритм жизни вносит свои коррективы: постоянные стрессы, недосыпание, нерегулярное и неправильное питание, неблагоприятная экологическая обстановка – все это отрицательным образом сказывается на нашем организме, в том числе и на желудочно-кишечном тракте.
Часто люди, ощущая плохое самочувствие, не спешат обращаться к врачу, а начинают заниматься самолечением, результат которого в большинстве случаев печален, или, что еще хуже, полагаются на русское «авось пронесет». Однако, как показывает практика, не всегда «проносит»: начинают проявляться более серьезные симптомы и беспокоить боли. И тут человек идет к врачу. Получая, порой, неутешительный диагноз, подвергается хирургическому вмешательству или другим малоприятным манипуляциям.
Немногие знают, что, если в семье были случаи онкологических заболеваний у близких родственников (мать, отец, сестра, брат), то существует вероятность проявления данного заболевания у других поколений.
Поэтому чтобы не допустить вышеперечисленных осложнений, специалисты нашего центра рекомендуют всем здоровым людям после сорока лет делать колоноскопию раз в 3-5 лет.
Колоноскопия – эндоскопическое исследование толстого кишечника при помощи специального аппарата — колоноскопа, представляющего собой гибкий управляемый зонд толщиной примерно 1 см и длиной около 1,2 метра, на конце которого размещается видеочип, передающий изображение на монитор. Таким образом, врач-эндоскопист осматривает внутренние стенки толстого кишечника.
Таким образом, врач-эндоскопист осматривает внутренние стенки толстого кишечника.
Поскольку многие испытывают страх перед данной процедурой, вызванный недостатком информации о методе и устройствах для её проведения, расскажем о колоноскопии подробнее.
В каких случаях следует делать колоноскопию
- Если есть подозрение, что в толстой кишке развивается опухоль.
- Если ранее были обнаружены полипы, которые могут быть предшественниками онкологического заболевания.
- Для динамического наблюдения при хронических колитах- воспалительных процессах внутренней оболочки толстого кишечника.
- При дивертикулезе стенок кишечника, т.к. выпячивания (или карманы) являются источником инфекции из-за скапливающихся в них каловых масс.
- При кровотечениях из прямой кишки, которые могут быть вызваны разными причинами.
- При немотивированной потере веса.
- При хронических поносах или запорах или изменении консистенции стула. Если Вы сомневаетесь в необходимости проведения данной процедуры, стоит посоветоваться с лечащим врачом.

Как проводится колоноскопия
Исследование проводится при помощи современного японского видеоэндоскопа OLYMPUS V-70, который дает возможность провести полное качественное и объемное исследование толстого кишечника. Перед проведением исследования пациент беседует с врачом эндоскопистом. Оформляется карточка, уточняется наличие аллергических реакций, хронических заболеваний, и прочее. Далее медицинская сестра проводит пациента в кабинет, где он готовится к процедуре: одевает одноразовое белье, укладывается на кушетку.
Врач эндоскопист осторожно вводит колоноскоп и выполняет осмотр. Во время исследования по специальному каналу аппарата в кишечник могут быть введены различные тонкие гибкие инструменты, с помощью которых, проводится забор ткани для биопсии, а так же различные мелкие хирургические манипуляции (удаление небольших образований, полипов, остановка кровотечений). Продолжительность всей процедуры составляет около 45-60 минут. После проведения манипуляции пациент самостоятельно переодевается и транспортируется в палату для дальнейшего наблюдения.
Колоноскопия позволяет обнаружить колит (воспаление отдельных участков внутренней оболочки толстого кишечника), дивертикулез (грыжеподобные выпячивания слизистой оболочки наружу за пределы кишечной стенки), полипы, опухоли и др.
Как правило, медикаментозное лечение полипов толстой кишки не позволяет избавиться от них окончательно. Любой полип, обнаруженный при колоноскопии, должен быть удален и исследован морфологически. Это связано с тем, что у пациентов с полипами рак толстой кишки случается гораздо чаще, чем у людей без полипов. Именно поэтому своевременное удаление маленьких «безобидных» полипов толстой кишки является основной мерой профилактики рака кишечника.
На основании результатов обследования наши врачи подберут индивидуальные рекомендации по дальнейшему образу жизни (диета и др.) и назначат лечебно-оздоровительный курс, соответствующий состоянию вашего здоровья.
Повторную колоноскопию рекомендуется проводить через 3-5 лет, в зависимости от предписания врача.
Диагностика проводится по предварительной записи по тел.: 160 (Мтс, Velcom, Life, Гор.) или +375 (17) 249-74-74
Подготовка к колоноскопии
- В течение 3-х дней до исследования соблюдать диету (исключить из пищи овощи, фрукты, бобовые, молочные продукты и т.д.)
- В течение 1-х суток перед исследованием — полный голод. Последний прием пищи — утро за сутки перед исследованием. Можно пить воду, сладкий чай
- Диабетикам можно пить кефир до 15:00
1-й способ
- В 16:00 выпить 50 г. касторового масла
- В 19:00 и в 20:00 сделать очистительные клизмы (2-2,5 литра воды комнатной температуры)
- Утром за 3 часа до исследования снова сделать очистительные клизмы (одну, две или более) до чистых вод
2-й способ
- Приобрести в аптеке препарат фортранс (4 пакета)
- Каждый пакет растворить в 1 литре воды, выпить раствор 4 литра в течение 4-х часов (с 15:00 до 19:00), принимая по 1 стакану каждые 15 минут. Можно использовать препарат прелакс белорусского производства.
 Флакон 400 мл. растворить в 4-х литрах воды
Флакон 400 мл. растворить в 4-х литрах воды - Принимать аналогично фортрансу
Помните! Своевременное обследование поможет Вам избежать больших проблем в будущем.
Исследование эндоскопического материала — цена анализа в Алматы в ИНВИТРО
Исследуемый материал Смотрите в описании
Материал для исследования.
Виды эндоскопических исследований:
- бронхоскопия мазки щёточкой, трансбронхиальные пунктаты, мазки из материала щипковых биопсий, промывные воды;
- гастроскопия мазки щёточкой, отпечатки с щипковых биопсий;
- колоноскопия, ректоскопия мазки с ватного тампона, щёточные мазки, отпечатки с биопсий;
- цистоскопия нативная моча, спиртовый смыв, отпечатки, с биопсийных кусочков;
- ларингоскопия мазки с участков поражения и отпечатки с кусочков.
Выбор способа взятия материала определяется характером поражения, локализацией, возможностью проведения инструментальных исследований. Желательно использование в комплексе всех доступных методов взятия материала. В частности, при поражениях мочевого пузыря для цитологического исследования может быть использована нативная моча (эффективность цитологической диагностики 40 — 50%), спиртовой смыв (эффективность цитологической диагностики 60 — 65%), мазки-отпечатки с кусочков опухоли, взятых при цистоскопии (эффективность цитологической диагностики около 90%). При комплексном обследовании эффективность цитологической диагностики составляет около 100%
В частности, при поражениях мочевого пузыря для цитологического исследования может быть использована нативная моча (эффективность цитологической диагностики 40 — 50%), спиртовой смыв (эффективность цитологической диагностики 60 — 65%), мазки-отпечатки с кусочков опухоли, взятых при цистоскопии (эффективность цитологической диагностики около 90%). При комплексном обследовании эффективность цитологической диагностики составляет около 100%
цены на колоноскопию, запись на анализ, отзывы пациентов
Если врач выписал вам направление на колоноскопию, можете обратиться в Диагностический центр Инвитро на Каширском шоссе. Здесь работают сотрудники, способные выполнить процедуру максимально аккуратно. Они рекомендуют не отказываться от этого метода диагностики и не искать ему альтернативу, потому что аппаратура, которую они применяют:
- позволяет осуществить лечебные мероприятия, избавляя тем самым пациента от хирургического вмешательства
- дает возможность целиком изучить весь внутренний просвет толстого кишечника при высокой четкости изображения
- не является источником радиационного излучения (в отличие от рентгена)
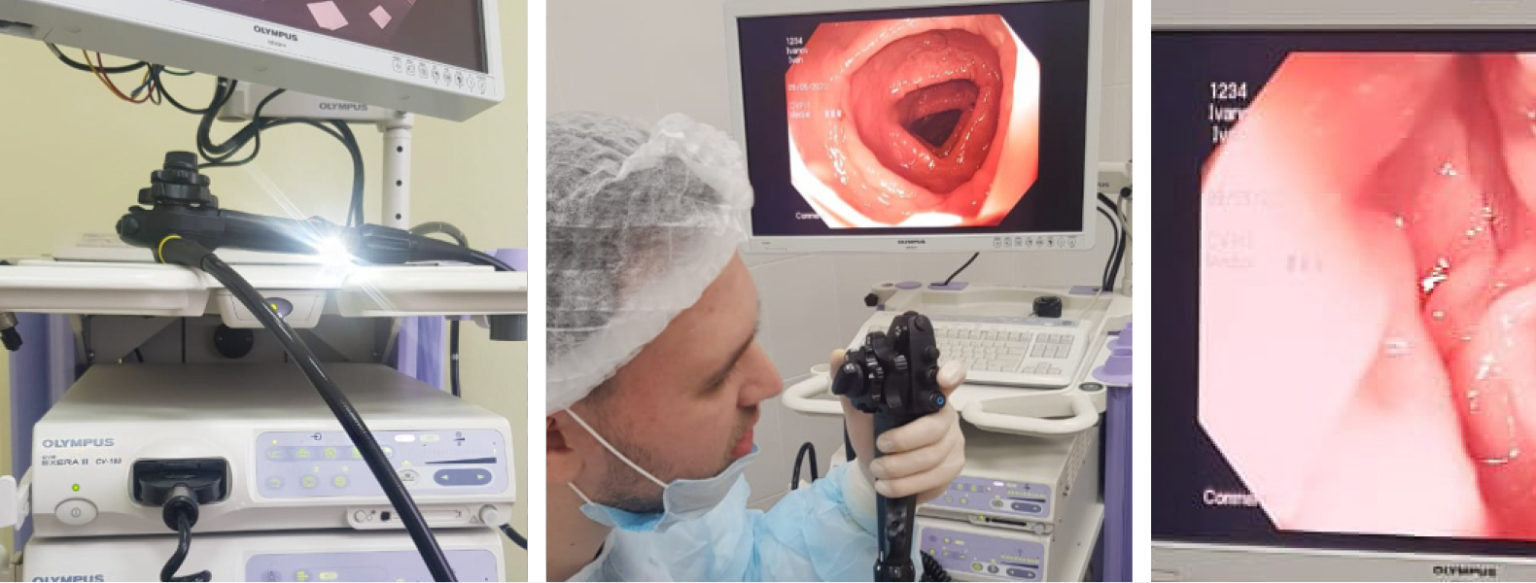 А если необходимо, то и удалит небольшие полипы или возьмет материал на биопсию.
А если необходимо, то и удалит небольшие полипы или возьмет материал на биопсию.Центр особенно подойдет тем, кому необходимо пройти комплексное обследование: здесь также есть возможность пройти лабораторную, ультразвуковую, функциональную диагностику, сделать МРТ, ФГС, рентген и другое. Уточните, какие обследования рекомендованы для вашей возрастной группы, и непременно запишитесь на них, так вы сможете избежать серьезных осложнений и длительного лечения.
Адрес организации: Москва, Каширское шоссе, 68, корп. 2 (рядом со станцией метро Кантемировская). Узнать подробности и записаться на прием можно по телефону +7 (495) 363-03-63 или на сайте www.invitro.ru. График работы пн-пт: 07:00 — 20:00, сб, вс: 07:00 — 19:00.
Услуги заведения
диагностический центр, медицинская лаборатория, МРТ, УЗИ, рентген, ведение беременности, маммология, неврология, урология, КТ брюшной полости, КТ височных костей, КТ головного мозга, КТ грудного отдела позвоночника, КТ грудной клетки, КТ желчного пузыря, КТ коленного сустава, КТ костей, КТ легких, КТ надпочечников, КТ нижних конечностей, КТ органов малого таза, КТ пазух носа, КТ позвоночника, КТ почек, КТ поясничного отдела позвоночника, КТ суставов, КТ тазобедренного сустава, КТ черепа, КТ шейного отдела позвоночника, МРТ коленного сустава, МРТ мозга, МРТ плечевого сустава, МРТ позвоночника, МРТ пояснично-крестцового отдела позвоночника, МРТ суставов, МРТ тазобедренного сустава, МРТ шейного отдела, УЗИ желчного пузыря, УЗИ лимфатических узлов, УЗИ матки, УЗИ молочных желез, УЗИ мягких тканей, УЗИ органов брюшной полости, УЗИ печени, УЗИ простаты, УЗИ сердца, УЗИ сосудов, ЭКГ, КТ
Колоноскопия в Минске, цены — МЦ Кравира
Колоноскопия – современный и очень эффективный метод эндоскопического исследования слизистой оболочки прямой и толстой кишки с целью своевременного выявления различных патологий, в том числе воспалительных процессов. Эта процедура хорошо переносится, имеет невысокий риск осложнений, но требует внимательного выполнения всех подготовительных рекомендаций врача.
Эта процедура хорошо переносится, имеет невысокий риск осложнений, но требует внимательного выполнения всех подготовительных рекомендаций врача.
Как проводится процедура
Проведение колоноскопии кишечника возможно как под внутривенным наркозом, так и без него с помощью прибора колоноскопа, гибкого зонда примерно в 1 см толщиной, который аккуратно вводится в анальное отверстие, чтобы можно было досконально исследовать внутреннюю поверхность кишечника и взять материал для исследований. Во время обследования возможны удаление полипов до 5 мм, а также биопсия при наличии сопутствующих показаний.
-
диагностика болезни Крона,
-
полипы,
-
колиты,
-
дивертикулы,
-
частые боли в животе, вздутие,
-
кровь в кале,
-
диагностика болезни Гиршпрунга,
-
регулярное расстройство стула,
-
подозрение на инородные тела,
-
подозрение на опухоли,
-
желудочно-кишечные кровотечения,
-
диагностика онкологических заболеваний.

-
спайки в кишечнике,
-
беременность,
-
сердечная недостаточность,
-
недавно перенесенный инсульт,
-
язвенная болезнь в сложной форме и т.
 д.
д.
Как подготовиться к колоноскопии
Колоноскопия требует соблюдения специальной подготовки, которая способствует очищению кишечника, что позволяет провести качественную диагностику его слизистой оболочки.
Подготовка с помощью препарата МОВИПРЕП
За 3 дня до того, как вы соберетесь делать колоноскопию, необходимо прервать прием препаратов железа и висмута, но можно продолжить пить сердечные медикаменты и гормоны. Стоит также предупредить врача о приеме других лекарств.
Стоит также предупредить врача о приеме других лекарств.
Что можно употреблять?
-
сыр, творог, сметану, йогурт и другие кисломолочные продукты,
-
яйца в любом виде,
-
мясо и рыбу, но нежирных сортов и в тушеном или вареном виде,
-
рис (исключительно белый и хорошо проваренный),
-
сахар или мед,
-
чистые, процеженные бульоны,
-
соки,
-
чай,
-
кофе.

Что нельзя принимать в пищу?
хлебобулочные изделия, продукты из муки,
много овощей, фруктов и ягод,
зелень,
грибы,
морскую капусту,
крупы и бобовые,
орехи и семечки,
слишком жесткое мясо с хрящами,
сосиски, колбасы,
консервированные продукты,
алкоголь,
газированные напитки,
варенье, кисель и компот.
Это препарат Фортранс, Форжект или Фордрайв Фортранс, солевое слабительное. Пить его необходимо по строгой схеме. Вечером, с 16:00 до 20:00, каждые 15 минут небольшими порциями – 1 пакет на 1 литр воды. Всего – 4 пакета.
Это взятие небольшого количества ткани для детального лабораторного исследования. Необходимое количество биопсий определяется только врачом во время диагностики, исходя из состояния желудка. Возможно взятие от 1 до 6 образцов.
Это разновидность обезболивания с помощью специальных препаратов, которые позволяют погрузить пациента в поверхностный сон.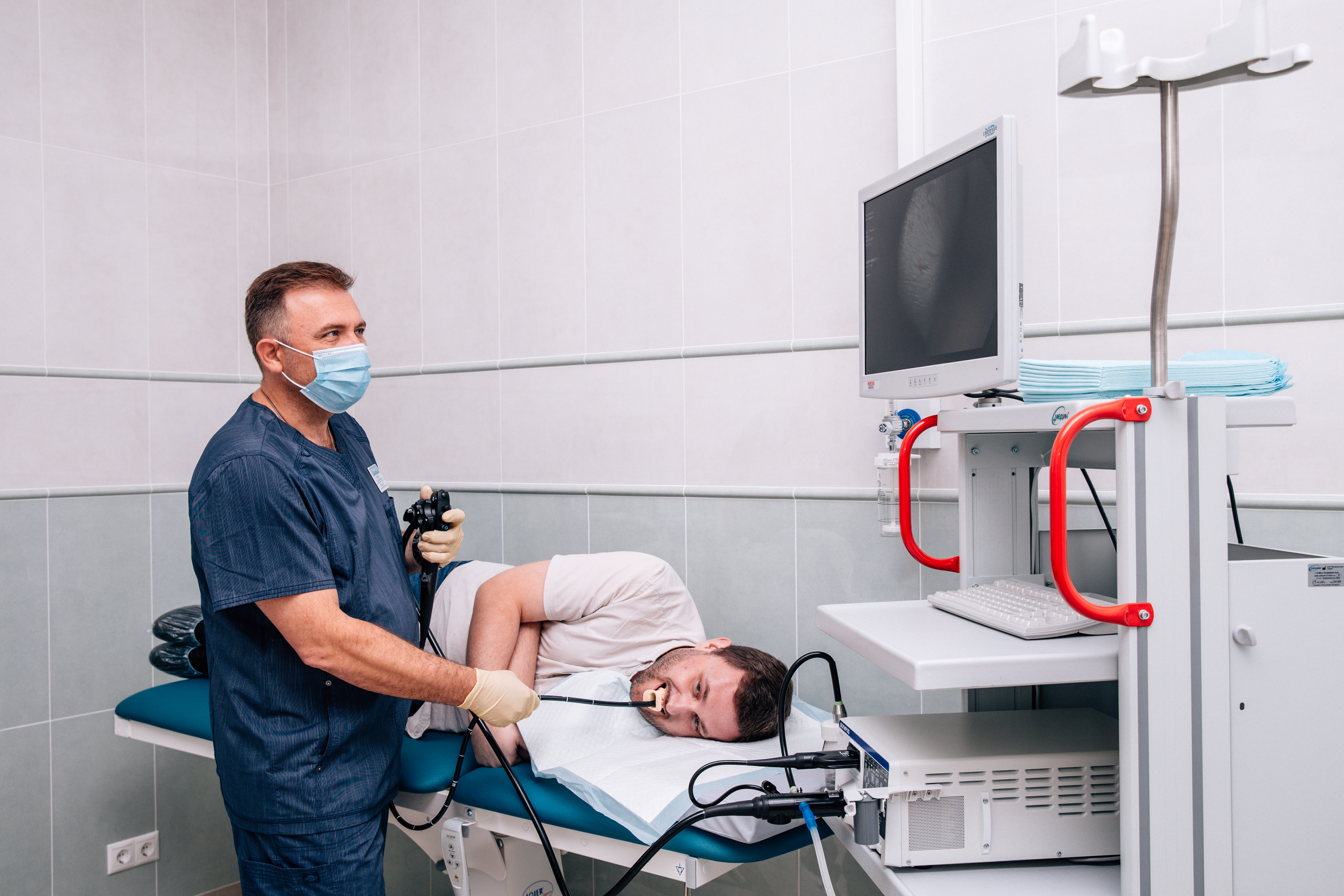
Помните, что срок годности анализов, которые вы сделали, – 10 дней, ЭКГ – 1 месяц.
регистратура, официальный сайт, запись к врачу, телефон, адрес, отзывы
г. Барабинск, ул. Кирова, 26
ИНВИТРО – крупнейшая частная медицинская компания в России, специализирующаяся на лабораторной диагностике и оказании других медицинских услуг.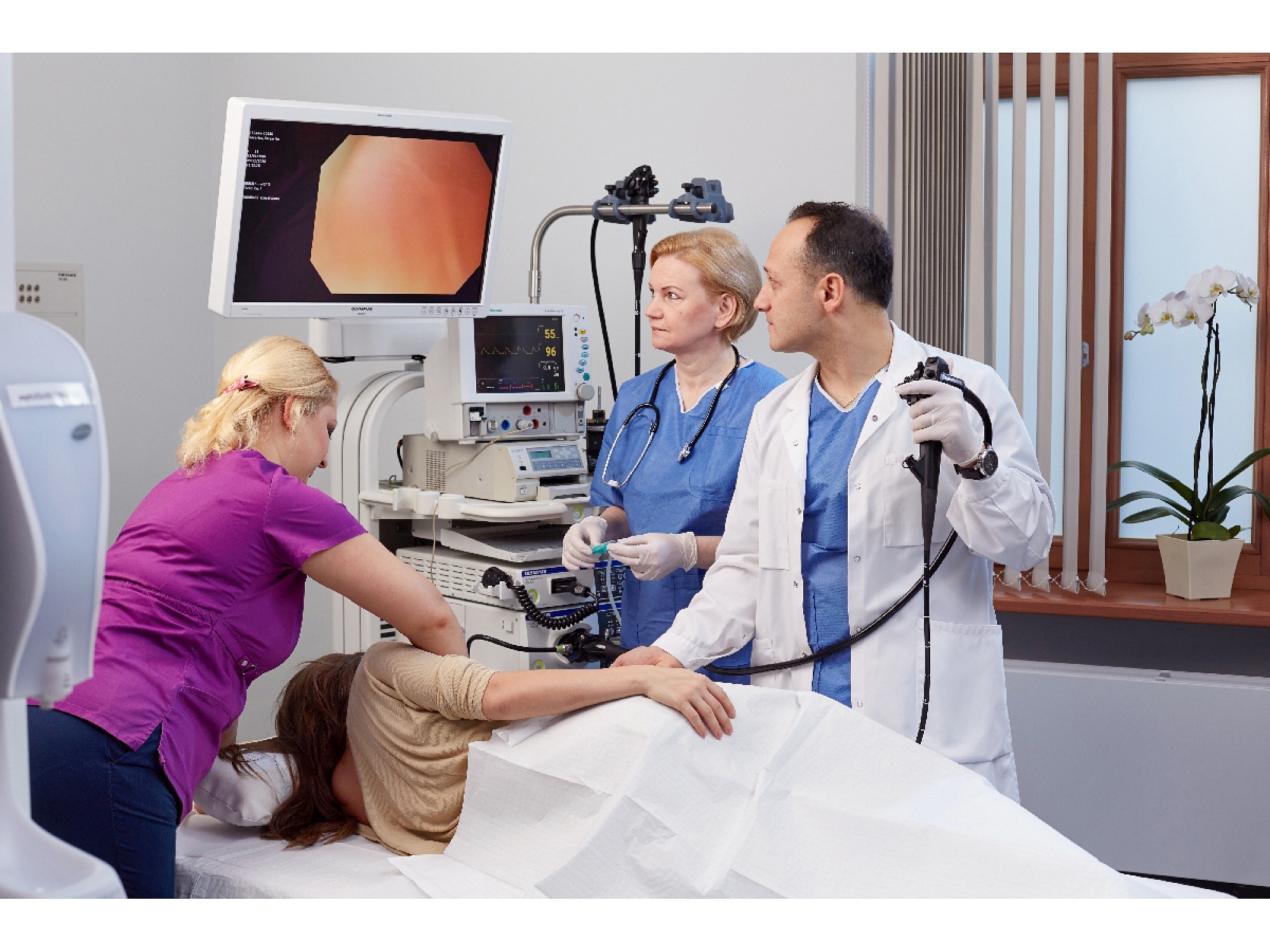
Международный уровень качества, исключительный сервис и высокотехнологичные инновационные решения – главные приоритеты нашей работы. Внедрение передовых международных практик и стандартов позволило ИНВИТРО достичь уровня лучших европейских лабораторий, доказав, что российская лаборатория может и должна соответствовать международным стандартам.
В центре используется только передовое медицинское оборудование ведущих мировых производителей, что гарантирует объективное изображение, полученное в результате исследования.
Диагностические услуги
- Магнитно-резонансная томография
- Компьютерная томография (КТ)
- Гастроскопия
- Денситометрия
- Колоноскопия
- Ректосигмоскопия
- Рентгенография
- УЗИ
- Маммография
- Функциональная диагностика
- КТ (виртуальная) колоноскопия
- Лазерная терапия в гинекологии
- Гистеросальпингография (ГСГ)
- Транспортировка маломобильных пациентов
- Химиотерапия
Проезд
- от ж/д вокзала до остановки «Госбанк»: автобус, маршрутное такси: №№ 1, 5;
- от площади Ленина до остановки «Поликлиника»: автобус и маршрутное такси № 4;
- от комбината «Марс» до остановки «Поликлиника»: автобу, маршрутное такси № 2.

Медицинский офис Барабинска расположен в здании бывшей швейной фабрики на первом этаже, с торца здания. Рядом расположена ГБУЗ НСО «Барабинская ЦРБ», супермаркеты: «Магнит», «Эконом лидер», «Магнит- косметик». С торца здания располагается бесплатная парковка.
Услуги
Отзывы
29.09.2019 06:48:34 0 Нормально |
Маркеры поражения желудочно-кишечного тракта | Медицинский центр ЛМД
Кальпротектин.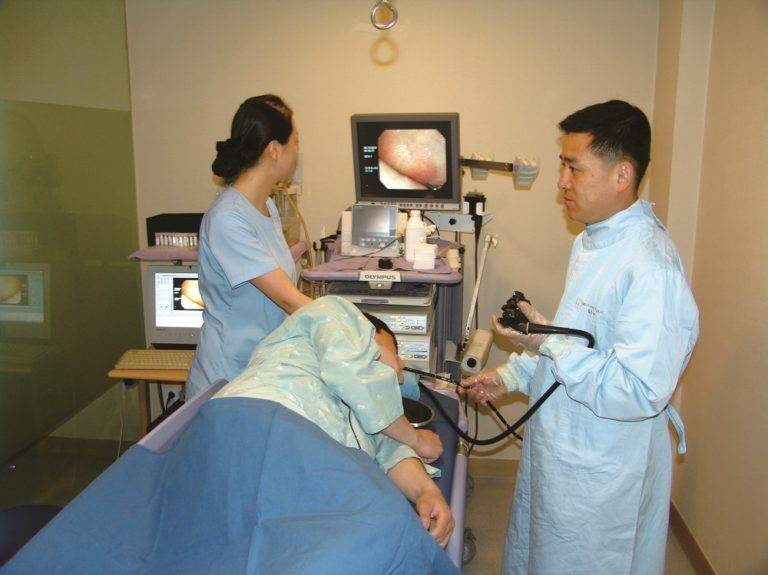
Кальпротектин представляет собой небольшой связывающий кальций белок, состоящий из двух тяжелых и двух легких полипептидных цепей, с молекулярным весом 36 kDa. Белок содержит в своем составе ионы кальция и цинка и обладает бактериостатическим и фунгицидным действием in vitro. Он присутствует в больших количествах в нейтрофилах, в которых составляет до 60% цитозольной фракции, а также в цитоплазме моноцитов и макрофагов. Кальпротектин является продуктом нейтрофильных гранулоцитов, обнаружение которых в кале указывает на воспаление в стенке кишки. Кальпротектин явялется стабильныи и медленно разлагающимся под действием протеаз микроорганизмов, что позволяет исследовать его концентрацию в стуле. Благодаря этому его относят к биомаркерам «фекального воспаления». Кальпротектин стабилен в кале свыше 7 дней при комнатной температуре и равномерно распределен в нем. При активном воспалительном заболевании кишечника наблюдается повышенная миграция лейкоцитов из сосудов в воспаленную слизистую кишки. Исследования выявили высокий уровень корреляции фекального кальпротектина с экскрецией меченых индием-111 лейкоцитов и с показателями интестинальной проницаемости. Наличие кальпротектина в кале отражает количество распавшихся лейкоцитов, таким образом, его концентрация в стуле прямо пропорциональна миграции нейтрофилов в желудочно-кишечный тракт. Хотя кальпротектин является чувствительным маркером воспаления в кишечнике, но это недостаточно специфичный маркер для подтверждения какого-либо диагноза.
Исследования выявили высокий уровень корреляции фекального кальпротектина с экскрецией меченых индием-111 лейкоцитов и с показателями интестинальной проницаемости. Наличие кальпротектина в кале отражает количество распавшихся лейкоцитов, таким образом, его концентрация в стуле прямо пропорциональна миграции нейтрофилов в желудочно-кишечный тракт. Хотя кальпротектин является чувствительным маркером воспаления в кишечнике, но это недостаточно специфичный маркер для подтверждения какого-либо диагноза.
Выявление фекального кальпротектина позволяет дифференцировать больных с синдромом раздраженной толстой кишки от органических причин поражения желудочно-кишечного тракта (ЖКТ). Умеренно повышенные значения кальпротектина отмечаются при поражении слизистой (целиакии, лактозной недостаточности, аутоиммунного гастрита), значительно повышенные концентрации отмечаются при воспалительных заболеваниях кишечника (болезнь Крона, язвенный колит), бактериальных инфекциях ЖКТ, дивертикулах и онкологических заболеваниях, постоянном приеме нестероидных противовоспалительных средств (НПВС). Концентрация фекального кальпротектина выше у новорожденных и детей до 1 года превышает 500 мкг/гр, поэтому определение кальпротектина следует использовать с осторожностью у детей моложе 4 лет. Повышенные концентрации фекального кальпротектина отмечаются более чем у 95% больных с воспалительными заболеваниями кишечника. Концентрация фекального кальпротектина в стуле коррелирует с гистологической и эндоскопической активностью заболевания.
Концентрация фекального кальпротектина выше у новорожденных и детей до 1 года превышает 500 мкг/гр, поэтому определение кальпротектина следует использовать с осторожностью у детей моложе 4 лет. Повышенные концентрации фекального кальпротектина отмечаются более чем у 95% больных с воспалительными заболеваниями кишечника. Концентрация фекального кальпротектина в стуле коррелирует с гистологической и эндоскопической активностью заболевания.
Фекальный кальпротектин является простым, неинвазивным и чувствительным маркером активности заболевания и ответа на терапию у тех пациентов, у которых имеется подтвержденный диагноз воспалительных заболеваний кишки. Преимуществом исследования фекального кальпротектина при болезни Крона является то, что повышенные концентрации могут отражать сегментарные поражение тонкой кишки, которая недоступна для эндоскопического и гистологического исследования. Сохраняющиеся повышенные уровни фекального кальпротектина могут указывать на неэффективность терапии, кроме того повышение содержания кальпротектина отмечается при приближающемся обострении заболевания.
В связи с низкой специфичностью, фекальный кальпротектин не может заменить инструментальные методы диагностики болезни Крона. Гистологическое исследование является «золотым стандартом» диагностики и комбинация эндоскопических и визуализационных методов позволяет уточнить объем и распределение поражения кишки. В определенной степени исследование фекального кальпротектина в сочетании с реацией стула на скрытую кровь и специфическими жалобами позволяет отобрать пациентов для проведения колоноскопии. Преимуществом исследования фекального кальпротектина при болезни Крона является то, что повышенные концентрации могут отражать сегментарные поражение тонкой кишки, которая недоступна для эндоскопического и гистологического исследования. Поскольку концентрация фекального кальпротектина в стуле непосредственно коррелирует с гистологической и эндоскопической активностью заболевания, стойко повышенные уровни фекального кальпротектина могут указывать на неэффективность терапии. Кроме того повышение содержания кальпротектина в динамике отмечается при приближающемся обострении заболевания.
Анализ кала на скрытую кровь.
Иммунохимический метод определения скрытой крови в стуле (fecal occult blood test — FOBT) оказался крупным открытием и серьезно повлиял на врачебную практику. Его использование уже сегодня изменило выявление (скриниг) одной из самых частых опухолей в развитых странах – рака толстой и прямой кишки. Данное исследование позволяет не только заподозрить опухоль, но еще и ее предшествующие предраковые состояния. К ним в первую очередь относятся аденоматозные полипы на «ножке». Эффект внедрения оказался настолько велик, что Европейским Союзом рекомендовано внедрение иммунохимического метода FOBT вместо всех ранее используемых методов определения скрытой крови в кале.
Белок (глобин), который определяется иммунохимически в кале, при поступлении из желудка переваривается в тонкой кишке. Поэтому скрытые кровотечения в желудке и 12-перстной кишке не выявляются этим методом. Метод не требует подготовки и исключения животных продуктов питания на время исследования по той же причине. Ряд исследователей не находят влияния и лекарственных препаратов на результаты метода FOBT, что позволяет не прерывать проводимого лечения.
Ряд исследователей не находят влияния и лекарственных препаратов на результаты метода FOBT, что позволяет не прерывать проводимого лечения.
Показнием для назначения анализа кала на скрытую кровь являются:
— подозрение на колоректальный рак. Среди особых показаний для регулярного скринига находятся лица с операциями на толстой кишке, лица с семейным анамнезом рака или рецидивирующего аденоматоза толстой кишки, лица пожилого возраста, страдающие сахарным диабетом, получающие НПВС или биологическую терапию, лица с воспалительными заболеваниями кишечника и псориазом. Ценность метода в том, что он позволяет выявить кровотечения только в толстой и прямой кишке то есть обладает избирательностью, в связи с чем метод FOBT показан в качестве основного скринингового метода выявления колоректального рака.
-воспалительные заболевания кишечника. Пациенты с воспалительными заболеваниями кишечника, манифестирующие в раннем возрасте и протекающие более 10 лет, из-за повышенной угрозы колоректального рака подлежат скринингу FOBT раз в два года.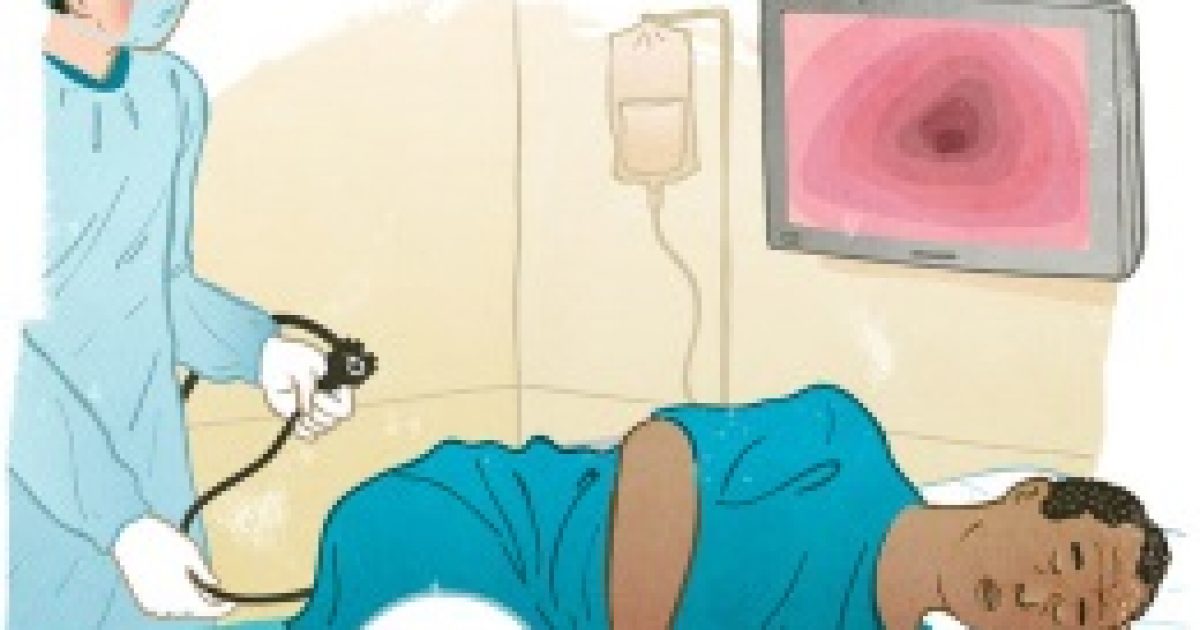 В случае положительного заключения FOB пациентам показана колоноскопия.
В случае положительного заключения FOB пациентам показана колоноскопия.
-внезапное появление аутоимунного заболевания с недостаточной реакцией на терапию для исключения паранеопластического синдрома, связанного с колоректальным раком.
-перед назначением аспирина или нестероидных противовоспалительных средств целесообразно провести FOBT и повторять его в первые годы приема для исключения патологических скрытых изменений, проявляющихся при назначении данных препаратов. При негативных результатах в связи с высокой специфичности теста можно ограничиться разовым определением. А при положительных результатах и необходимости проведения дальнейшей терапии аспирином проводить тест ежегодно или не реже раза в два года.
— необъяснимая железодефицитная анемия. Возможность скрытых кровопотерь из толстой кишки должна быть исключена в случаях необъяснимой железодефицитной анемии, как например, при целиакии, воспалительных забоелваний кишечника и колоректальном раке.
Точность исследования можно повысить, если одновременно с FOBT провести определение кальпротектина в кале. Кальпротектин повышается при воспалении в толстой кишке, в том числе, почти всегда при новообразовании. Но специфичность кальпротектинового теста для диагностики рака кишечника ниже из-за множества причин для развития воспаления.Поэтому комплексное исследование кальпротектина и FOBT повышает как чувствительность (за счет эффекта кальпротектина) , так и специфичность (за счет FOBT) скринига колоректального рака из одного образца. При получении одного и особенно двух положительных результатов тестах показано проведение неотложной колоноскопии.
Концетрация альфа 1-антитрипсин в стуле.
Альфа-1 антитрипсин (А1АТ) является острофазным сывороточным белком, концентрация которого в крови составляет 1-2 г/л. Основной функцией А1АТ является ингибирование сериновых протеаз, протеолитических ферментов, вырабатываемых пищеварительным трактом, а также клетками иммунной системы. Благодаря этой уникальной функции молекулы А1АТ очень стабильны к деградации протеолитическими ферментами, поэтому могут длительное время сохраняться в содержимом кишки, в то время как другие сывороточные белки подлежат быстрому протеолизу.
Благодаря этой уникальной функции молекулы А1АТ очень стабильны к деградации протеолитическими ферментами, поэтому могут длительное время сохраняться в содержимом кишки, в то время как другие сывороточные белки подлежат быстрому протеолизу.
Остаточная концентрация А1АТ в стуле является показателем проникновения плазмы в просвет кишечника при ряде патологических состояний, объединяющихся симптомокомплексом «протеин-теряющей энтеропатии». Протеин-теряющая энтеропатия связана с энтеритом, в том числе аллергическим энтеритом, целиакией, карциномой, псевдомембранозным колитом, амилоидозом, язвенным колитом, лимфатической обструкцией, язвенным повреждением слизистой и увеличенной проницаемостью слизистой кишечника. Показнием для проведения теста являются хроническая диарея, абдоминальная боль, прогрессирующая потеря веса, гипоальбуминемия с отечным синдромом, гипонатриемия, анемический синдром, гиповитаминоз.
Определение антигена Helicobacter pylori в стуле.
Выявление антигена H. pylori в кале (HpSA-тест) с использованием моноклональных антител представляет собой высокочувствительный (92%) и специфичный (98%) неинвазивный метод диагностики хеликобактериоза, который, согласно клиническим рекомендациям Маастрихт V/Флорентийского консенсуса по диагностике и лечению хеликобактерной инфекции, может применяться как при первичной диагностике инфекции H. pylori, так и для контроля лечения (не ранее, чем через 4-6 недель после окончания курса антихеликобактерной терапии), а также прогнозирования эффективности антихеликобактерной терапии. Отрицательный результат HpSA-теста свидетельствует об отсутствии антигена H. pylori в кале, однако, при наличии у пациентов симптомов язвенной болезни желудка и двенадцатиперстной кишки, гастрита, дуоденита, рекомендуется повторное проведение исследования, а также использование альтернативных методов диагностики инфекции H. pylori. Факторы, снижающие чувствительность HpSA-теста: кровотечение из верхних отделов желудочно-кишечного тракта, прием ингибиторов протонной помпы и антибактериальных препаратов, состояния атрофии и метаплазии желудочного эпителия.
pylori в кале (HpSA-тест) с использованием моноклональных антител представляет собой высокочувствительный (92%) и специфичный (98%) неинвазивный метод диагностики хеликобактериоза, который, согласно клиническим рекомендациям Маастрихт V/Флорентийского консенсуса по диагностике и лечению хеликобактерной инфекции, может применяться как при первичной диагностике инфекции H. pylori, так и для контроля лечения (не ранее, чем через 4-6 недель после окончания курса антихеликобактерной терапии), а также прогнозирования эффективности антихеликобактерной терапии. Отрицательный результат HpSA-теста свидетельствует об отсутствии антигена H. pylori в кале, однако, при наличии у пациентов симптомов язвенной болезни желудка и двенадцатиперстной кишки, гастрита, дуоденита, рекомендуется повторное проведение исследования, а также использование альтернативных методов диагностики инфекции H. pylori. Факторы, снижающие чувствительность HpSA-теста: кровотечение из верхних отделов желудочно-кишечного тракта, прием ингибиторов протонной помпы и антибактериальных препаратов, состояния атрофии и метаплазии желудочного эпителия. Инфекция Helicobacter pylori напрямую ассоциирована с развитием хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы, аденокарциномы желудка кишечного типа, а также играет определенную роль в развитии ряда экстрагастродуоденальных заболеваний (железодефицитная анемия неуточненной этиологии, идиопатическая тромбоцитопеническая пурпура, дефицит витамина В12, нарушение всасывания лекарственных препаратов (тироксин, леводопа)).
Инфекция Helicobacter pylori напрямую ассоциирована с развитием хронического гастрита, язвенной болезни желудка и двенадцатиперстной кишки, MALT-лимфомы, аденокарциномы желудка кишечного типа, а также играет определенную роль в развитии ряда экстрагастродуоденальных заболеваний (железодефицитная анемия неуточненной этиологии, идиопатическая тромбоцитопеническая пурпура, дефицит витамина В12, нарушение всасывания лекарственных препаратов (тироксин, леводопа)).
Определение антигена Giardia lamblia в стуле.
Тест определения антигена Giardia lamblia в кале представляет собой высокочувствительный и специфичный маркер для диагностики жиардиаза, особенно в случаях паразитирования лямблий в средних и дистальных отделах тонкой кишки. Лямблиоз (жиардиаз) – кишечная инвазия с преимущественным поражением тонкой кишки, вызываемая у человека одноклеточным паразитом, лямблией кишечной Lamblia intestinalis (синонимы: Giardia intestinalis, Giardia duodenalis, Giardia lamblia). Паразитируя в кишечнике, лямблии нарушают структуру и функцию тонкой кишки, приводя к рецидивирующим или упорным клиническим проявлениям, как правило, сочетающим болевые, диспепсические и астено-невротические симптомы. Признаки сходны с таковыми при других вариантах патологии гастродуоденальной зоны, кишечника, желчевыводящих путей, что делает клиническую диагностику практически невозможной, что, в свою очередь, требует обязательного лабораторного подтверждения диагноза.
Паразитируя в кишечнике, лямблии нарушают структуру и функцию тонкой кишки, приводя к рецидивирующим или упорным клиническим проявлениям, как правило, сочетающим болевые, диспепсические и астено-невротические симптомы. Признаки сходны с таковыми при других вариантах патологии гастродуоденальной зоны, кишечника, желчевыводящих путей, что делает клиническую диагностику практически невозможной, что, в свою очередь, требует обязательного лабораторного подтверждения диагноза.
Исследование панкреатической эластазы в кале.
Панкреатическая эластаза I — протеолитический фермент, синтезируемый исключительно ацинарными клетками поджелудочной железы и экскретируемый в просвет двенадцатиперстной кишки вместе с другими ферментами. Панкреатическая эластаза-1 определяется как наиболее чувствительный и специфичный биомаркер в диагностике экзокринной панкреатической недостаточности. Низкие значения концентрации панкреатической эластазы-1 в стуле (<100 мкг/г) свидетельствуют о наличии тяжелой степени экзокринной недостаточности поджелудочной железы, которая может быть обусловлена различными заболеваниями желудочно-кишечного тракта: хроническими панкреатитами, муковисцидозом, карциномой пожелудочной железы, сахарным диабетом 1 типа, холелитиазом, аутоиммунным панкреатитом, целиакией, синдромом раздраженного кишечника, синдромом короткой тонкой кишки, воспалительными заболеваниями кишечника, а также синдромами Швахмана-Даймонда и Золлингера-Эллисона. Результаты определения панкреатической эластазы I не зависят от приема пациентами панкреатических ферментов и ингибиторов протеолиза. Фермент не подвержен воздействиям при прохождении через кишечник, выделяется с калом в неизмененном виде и поэтому может достоверно отражать реальную экзокринную способность поджелудочной железы. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение панкреатической эластазы-1, химотрипсина и кислотного стеатокрита в стуле.
Результаты определения панкреатической эластазы I не зависят от приема пациентами панкреатических ферментов и ингибиторов протеолиза. Фермент не подвержен воздействиям при прохождении через кишечник, выделяется с калом в неизмененном виде и поэтому может достоверно отражать реальную экзокринную способность поджелудочной железы. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение панкреатической эластазы-1, химотрипсина и кислотного стеатокрита в стуле.
Исследование активности химотрипсина в стуле.
Химотрипсин представляет собой специфический протеолитический фермент, продуцируемый в виде белка-предшественника поджелудочной железой и секретируемый в тонкий кишечник, где он активируется трипсином. По изменению уровня активности химотрипсина в стуле можно судить о нарушениях секреции панкреатических ферментов при внешнесекреторной недостаточности поджелудочной железы, в частности, при хроническом панкреатите, а также оценивать эффективность заместительной ферментной терапии. Результаты теста коррелируют с результатами тестов прямой оценки секреции поджелудочной железы после гуморальной стимуляции холецистокинином-секретином. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение химотрипсина, панкреатической эластазы-1 и кислотного стеатокрита в стуле.
Результаты теста коррелируют с результатами тестов прямой оценки секреции поджелудочной железы после гуморальной стимуляции холецистокинином-секретином. Для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение химотрипсина, панкреатической эластазы-1 и кислотного стеатокрита в стуле.
Оценка стеатокрита для исследование содержания жира в стуле.
Нормальные значения кислотного стеатокрита (0-10%) в большинстве случаев свидетельствуют о нормальном переваривании жиров в стенке кишечника и отсутствии нарушений экзокринной функции поджелудочной железы. При этом для более детальной оценки экзокринной функции поджелудочной железы рекомендуется сочетанное определение кислотного стеатокрита, панкреатической эластазы-1 и химотрипсина в стуле. У детей в первые 6 месяцев и недоношенных детей отмечается «физиологическая стеаторея»: значения кислотного стеатокрита могут достигать до 80-100% без каких-либо различий между режимами кормления. Кислотный стеатокрит – гравиметрический метод оценки процентного содержания жира в отдельном образце кала. Определение кислотного стеатокрита является более чувствительным и специфичным скрининговым тестом на стеаторею по сравнению с традиционным микроскопическим исследованием стула, а также сопоставимо с результатами определения содержания жира в 3-дневном стуле. Значения кислотного стеатокрита более 10% свидетельствуют о наличии стеатореи, которая может быть обусловлена экзокринной недостаточностью поджелудочной железы (хронический панкреатит, муковисцидоз, карцинома пожелудочной железы, сахарный диабет 1 типа, холелитиаз, аутоиммунный панкреатит), нарушениями всасывания жиров при повреждении слизистой тонкого кишечника (целиакия, язвенный колит, болезнь Крона, синдром короткой тонкой кишки, аутоиммунная энтеропатия), а также при избыточном употреблении в пищу жирной пищи.
Кислотный стеатокрит – гравиметрический метод оценки процентного содержания жира в отдельном образце кала. Определение кислотного стеатокрита является более чувствительным и специфичным скрининговым тестом на стеаторею по сравнению с традиционным микроскопическим исследованием стула, а также сопоставимо с результатами определения содержания жира в 3-дневном стуле. Значения кислотного стеатокрита более 10% свидетельствуют о наличии стеатореи, которая может быть обусловлена экзокринной недостаточностью поджелудочной железы (хронический панкреатит, муковисцидоз, карцинома пожелудочной железы, сахарный диабет 1 типа, холелитиаз, аутоиммунный панкреатит), нарушениями всасывания жиров при повреждении слизистой тонкого кишечника (целиакия, язвенный колит, болезнь Крона, синдром короткой тонкой кишки, аутоиммунная энтеропатия), а также при избыточном употреблении в пищу жирной пищи.
Исследование углеводов в стуле и рН стула.
Реакция (рН) отражает кислотно-щелочные свойства стула. В норме реакция является нейтральной или слабощелочной (6,8-7,5). Кислая или щелочная реакция в кале обусловлена активизацией деятельности тех или других типов бактерий, что происходит при нарушении ферментации пищи. Кислая реакция (pH 5,5–6,7) отмечается при нарушении всасывания в тонкой кишке жирных кислот; резко-кислая реакция (pH менее 5,5) имеет место при бродильной диспепсии, при которой в результате активации бродильной флоры (нормальной и патологической) образуются углекислый газ и органические кислоты. Щелочная реакция (pH 8,0–8,5) наблюдается при гниении белков пищи (не переваренных в желудке и тонкой кишке) и воспалительном экссудате в результате активации гнилостной флоры и образовании аммиака и других щелочных компонентов в толстой кишке, резкощелочная реакция (pH более 8,5) – при гнилостной диспепсии (колите).
В норме реакция является нейтральной или слабощелочной (6,8-7,5). Кислая или щелочная реакция в кале обусловлена активизацией деятельности тех или других типов бактерий, что происходит при нарушении ферментации пищи. Кислая реакция (pH 5,5–6,7) отмечается при нарушении всасывания в тонкой кишке жирных кислот; резко-кислая реакция (pH менее 5,5) имеет место при бродильной диспепсии, при которой в результате активации бродильной флоры (нормальной и патологической) образуются углекислый газ и органические кислоты. Щелочная реакция (pH 8,0–8,5) наблюдается при гниении белков пищи (не переваренных в желудке и тонкой кишке) и воспалительном экссудате в результате активации гнилостной флоры и образовании аммиака и других щелочных компонентов в толстой кишке, резкощелочная реакция (pH более 8,5) – при гнилостной диспепсии (колите).
Исследование углеводов в стуле предназначено для определения суммарного содержания простых сахаров (моно- и дисахаридов) в кале. Наличие углеводов в кале может быть обусловлено, как недостатком соответствующего фермента в просвете тонкого кишечника, так и нарушением всасывания моносахаров через стенку кишечника в кровь. Тест используется, в первую очередь, для выявления лактазной недостаточности у детей первого года жизни, находящихся на грудном вскармливании или получающих искусственные молочные смеси, содержащие лактозу, а также при наличии хронической диареи, нарушений пищеварения, недостаточной массы тела и выявленном ранее синдроме мальабсорбции у взрослых.
Тест используется, в первую очередь, для выявления лактазной недостаточности у детей первого года жизни, находящихся на грудном вскармливании или получающих искусственные молочные смеси, содержащие лактозу, а также при наличии хронической диареи, нарушений пищеварения, недостаточной массы тела и выявленном ранее синдроме мальабсорбции у взрослых.
Определение эозинофильного нейротоксина (EDN) для диагностики пищевой аллергии в стуле.
Эозинофильный нейротоксин (эозинофильный протеин X, EDN, EPX, RNASE2) — катионный гликопротеин, входящий в состав вторичных эозинофильных гранул, обладающий цитотоксическим и нейротоксическим действием, а также противовирусной и противопаразитарной активностью. EDN секретируется в основных местах скопления эозинофилов, включая кожу, легкие, мочеполовую систему, а также желудочно-кишечный тракт. Увеличение содержания фекального EDN может служить маркером текущего клинического или субклинического хронического воспаления гастроинтестинальной области и повышения проницаемости кишечника, а также для определения элиминационной диеты при пищевой непереносимости. Выявление повышенных значений фекального эозинофильного нейротоксина (EDN) свидетельствуют о наличии эозинофильной инфильтрации в стенке кишечника, обусловленной различными заболеваниями ЖКТ, включая воспалительные заболевания кишечника, паразитарные инвазии, рак толстого кишечника, а также при не-IgE-опосредованных аллергических реакциях, в частности, к белкам коровьего молока, и при других видах пищевой непереносимости. Кроме того, увеличение содержания EDN в стуле служит неблагоприятным прогностическим фактором наличия коллагенозного колита у пациентов с хронической диареей без примесей крови, что требует проведения фиброколоноскопии. Для уточнения характера воспалительного процесса в кишечнике рекомендуется сочетанное определение содержания эозинофильного нейротоксина в стуле и фекального кальпротектина.
Выявление повышенных значений фекального эозинофильного нейротоксина (EDN) свидетельствуют о наличии эозинофильной инфильтрации в стенке кишечника, обусловленной различными заболеваниями ЖКТ, включая воспалительные заболевания кишечника, паразитарные инвазии, рак толстого кишечника, а также при не-IgE-опосредованных аллергических реакциях, в частности, к белкам коровьего молока, и при других видах пищевой непереносимости. Кроме того, увеличение содержания EDN в стуле служит неблагоприятным прогностическим фактором наличия коллагенозного колита у пациентов с хронической диареей без примесей крови, что требует проведения фиброколоноскопии. Для уточнения характера воспалительного процесса в кишечнике рекомендуется сочетанное определение содержания эозинофильного нейротоксина в стуле и фекального кальпротектина.
Токсин A/B Cl.difficile в стуле.
Выявление токсина Clostridium difficile указывает на инфекцию споро-образующей бактерией, которая вызывает поражение толстого кишечника, также называемое псевдомембранозным колитом. Инфекция C.difficile, часто вызываемая длительным назначением антибиотиков широкого спектра, может протекать скрыто с гриппоподобной картиной. Нередко колонизация микроорганизмом возникает в условиях стационара, а инфекция носит черты внутрибольничного и нозокомиального состояния. Продуция токсинов А и В приводит к типичной симптоматике, включая вздутие, газообразование, диаррею и боль в животе. Дифференциальный диагноз следует проводить с обострениями воспалительных заболеваний кишечника, которые дают сходную клиническую симптоматику. Тяжесть колита значительно варьирует, нередко отмечаются рецидивы клостридиального колита, даже несмотря на успешную терапию заболевания.
Инфекция C.difficile, часто вызываемая длительным назначением антибиотиков широкого спектра, может протекать скрыто с гриппоподобной картиной. Нередко колонизация микроорганизмом возникает в условиях стационара, а инфекция носит черты внутрибольничного и нозокомиального состояния. Продуция токсинов А и В приводит к типичной симптоматике, включая вздутие, газообразование, диаррею и боль в животе. Дифференциальный диагноз следует проводить с обострениями воспалительных заболеваний кишечника, которые дают сходную клиническую симптоматику. Тяжесть колита значительно варьирует, нередко отмечаются рецидивы клостридиального колита, даже несмотря на успешную терапию заболевания.
Моделирование микросреды колоректального рака человека в трехмерных совместных культурах опухоли и стромы in vitro и in vivo
Культура клеток
Звездчатые клетки печени человека, клетки LX2, были предоставлены доктором Скоттом Фридманом (Медицинская школа Икана на горе Синай, США). Нью-Йорк, штат Нью-Йорк).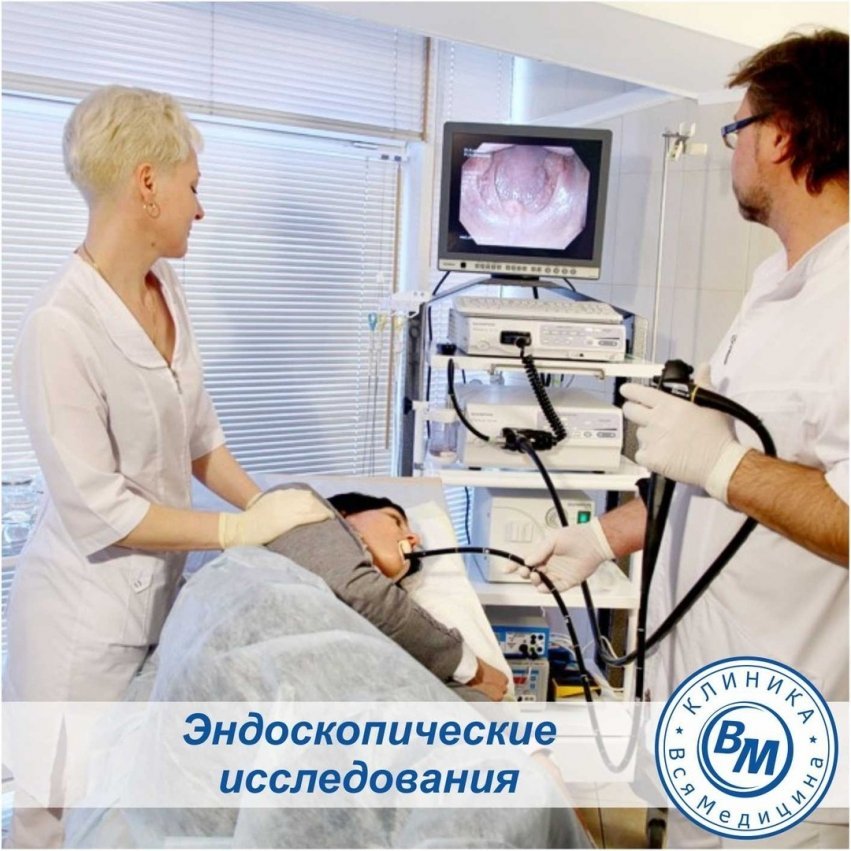 Клетки колоректальной карциномы человека, клетки HCT116, были получены из АТСС (№ CCL-247, АТСС, Манассас, Вирджиния). Оба типа клеток культивировали и размножали в пластиковых чашках, обработанных культурой тканей. Культуры пассировали, когда клетки достигли слияния 70–90%.Оба типа клеток культивировали с минимальной необходимой средой Дульбекко (DMEM, Millipore-Sigma, Сент-Луис, Миссури), содержащей 10% фетальной бычьей сыворотки (FBS, Hyclone, Logan, UT). Клетки отделяли от субстрата с помощью трипсина / ЭДТА (Hyclone) и ресуспендировали в среде перед использованием в конструкции или изготовлении сфероида. Использование культур LX2 было прекращено после девятого пассажа, и вместо этого продолжили использование свежего флакона.
Клетки колоректальной карциномы человека, клетки HCT116, были получены из АТСС (№ CCL-247, АТСС, Манассас, Вирджиния). Оба типа клеток культивировали и размножали в пластиковых чашках, обработанных культурой тканей. Культуры пассировали, когда клетки достигли слияния 70–90%.Оба типа клеток культивировали с минимальной необходимой средой Дульбекко (DMEM, Millipore-Sigma, Сент-Луис, Миссури), содержащей 10% фетальной бычьей сыворотки (FBS, Hyclone, Logan, UT). Клетки отделяли от субстрата с помощью трипсина / ЭДТА (Hyclone) и ресуспендировали в среде перед использованием в конструкции или изготовлении сфероида. Использование культур LX2 было прекращено после девятого пассажа, и вместо этого продолжили использование свежего флакона.
Изготовление конструкции
Сфероиды клеток HCT116 (1,0 × 10 4 клеток каждая) получали путем гомогенного суспендирования клеток в культуральной среде при 1.0 × 10 5 клеток / мл с последующим внесением 100 мкл суспензии клеточной среды в каждую лунку 96-луночного круглодонного планшета со сверхнизким прикреплением (CoStar # 7007, Corning, Corning, NY). Клетки наблюдали каждый день в течение 3 дней, к тому времени сфероиды сформировали плотные скопления без отклонений и немедленно использовали для изготовления конструкции.
Клетки наблюдали каждый день в течение 3 дней, к тому времени сфероиды сформировали плотные скопления без отклонений и немедленно использовали для изготовления конструкции.
3D-конструкции были изготовлены, как недавно описано (Дополнение Рис. 1a) 16 . Коллаген из хвоста крысы типа I (# 354236, Corning) получали в соответствии с протоколом производителя в концентрации 2 мг / мл.Клетки LX2 обрабатывали трипсином и подсчитывали, затем суспендировали в подготовленном коллагене при 5,0 × 10 6 клеток / мл. Среда из планшетов, содержащих сфероиды, была аспирирована, и 100 мкл раствора LX2-коллагена были внесены пипеткой в каждую лунку сфероида, осторожно, чтобы не нарушить структуру сфероида. Смесь LX2-коллаген-сфероид медленно пипетировали вверх и вниз, чтобы приостановить сфероид, затем весь объем распределяли в специальную форму для полидиметилсилоксана (DOW Sylgard 184, Midland, MI) 16 , обеспечивая относительно центральное размещение сфероида внутри полимеризуемый гидрогель (30 мин при 37 ° C) (Доп. Рис. 1а). После полной полимеризации коллагена медленно добавляли среду и удаляли формы. Образцы культивировали в течение различной продолжительности в зависимости от объема эксперимента.
Рис. 1а). После полной полимеризации коллагена медленно добавляли среду и удаляли формы. Образцы культивировали в течение различной продолжительности в зависимости от объема эксперимента.
Подкожная имплантация
Шестинедельные самки бестимусных голых мышей были получены из Charles River Laboratories (Wilmington, MA). Животных анестезировали 2% изофлураном и перед операцией делали подкожную инъекцию кетопрофена в дозе 5 мг / кг. На дорсальной стороне примерно в 15 мм от средней линии были сделаны два небольших разреза кожи.Подкожные карманы были созданы с помощью тупой диссекции и имплантированы по одному образцу на место. Разрезы закрывали шовным материалом из викрила 4–0 (Ethicon, Somerville, NJ) и покрывали пленкой Tegaderm (3 M, Maplewood, MN). Все процедуры выполнялись в строгом соответствии с Руководством NIH по уходу и использованию лабораторных животных и политикой Институционального комитета по уходу и использованию животных Университета Уэйк Форест (IACUC). Исследование было одобрено IACUC Университета Уэйк Форест, протокол No. A17–036. Животных умерщвляли через 2 и 4 недели путем асфиксии CO 2 с последующим смещением шейки матки. Кожные лоскуты открывали и извлекали эксплантаты.
A17–036. Животных умерщвляли через 2 и 4 недели путем асфиксии CO 2 с последующим смещением шейки матки. Кожные лоскуты открывали и извлекали эксплантаты.
Общая морфологическая оценка
Макроскопические изображения эксплантатов in vivo были получены камерой смартфона (Samsung, Сеул, Южная Корея) с метрической линейкой, удерживаемой в кадре изображения. Программное обеспечение ImageJ (National Institutes of Health, Bethesda, MD) использовалось для оценки размера эксплантата после начальной калибровки.
Химиотерапевтические процедуры
Конструкции со встроенными сфероидами культивировали в течение 72 часов, затем переносили в новые планшеты с лунками и инкубировали со средой, содержащей химиотерапевтические препараты. Перед анализом образцы подвергали воздействию химиотерапевтических средств в течение дополнительных 72 часов. Химиотерапевтические препараты были приготовлены с использованием следующих концентраций: 5-фторурацил 1 мМ, оксалиплатин 25 мкМ, иринотекан 50 мкМ, лейковорин 50 мкМ и регорафениб 50 мкМ.
Образцы человека
Слайды от неидентифицированных пациентов с CRC были приобретены в центре ресурсов Wake Forest Tumor Tissue and Shared Pathology Resource.Образцы были отобраны случайным образом из пула пациентов с определенной степенью опухоли (хорошо или плохо дифференцированной), и для каждого пациента были получены соответствующие слайды, не содержащие опухоли (здоровая ткань). Все клинические исследования и патологические анализы проводились сертифицированным патологоанатомом. Образцы человека фиксировали формалином перед гистологической обработкой.
Гистологический и иммуногистохимический (ИГХ) анализ
In vitro и образцы животных фиксировали в 4% параформальдегиде в течение ночи при 4 ° C, затем промывали фосфатно-солевым буфером (PBS) и хранили в 70% этаноле.После обработки парафином и заливки серийные срезы 5 мкм вырезали с помощью микротома (Leica Microsystems Inc., Buffalo Grove, IL) и помещали на предметные стекла. Для всех процедур окрашивания предметные стекла запекали в течение 1 ч при 60 ° C с последующей стандартной депарафинизацией и регидратацией. Окрашивание гематоксилином и эозином (H&E) проводилось на основных предприятиях Института регенеративной медицины Уэйк Форест. Окрашивание пикросириусом красным (PRS) проводили с использованием коммерческого набора для окрашивания (№ 24901, PolySciences, Warrington, PA) в соответствии с протоколом производителя.Окрашивание трихромом по Массону проводили с использованием коммерческого набора для окрашивания (# HT15, Millipore-Sigma) в соответствии с протоколом производителя.
Окрашивание гематоксилином и эозином (H&E) проводилось на основных предприятиях Института регенеративной медицины Уэйк Форест. Окрашивание пикросириусом красным (PRS) проводили с использованием коммерческого набора для окрашивания (№ 24901, PolySciences, Warrington, PA) в соответствии с протоколом производителя.Окрашивание трихромом по Массону проводили с использованием коммерческого набора для окрашивания (# HT15, Millipore-Sigma) в соответствии с протоколом производителя.
Для иммуногистохимии (ИГХ) все инкубации проводили при комнатной температуре, если не указано иное. Извлечение антигена выполняли с использованием инкубации с протеиназой K (DAKO, Carpinteria, CA) в течение 15 мин. Образцы подвергали проницаемости 0,05% Triton-X (Millipore-Sigma) в PBS в течение 5 мин. Неспецифическое блокирование антигена проводили с использованием инкубационного раствора для протеинового блока (# ab156024, Abcam, Cambridge, MA) в течение 30 мин.Затем слайды инкубировали с соответствующим первичным антителом против CK-18 (# ab82254, Abcam), FAK (# ab40794, Abcam), β-катенина (# 71-2700, Invitrogen-ThermoFisher), E-Cadherin (# ab40772, Abcam.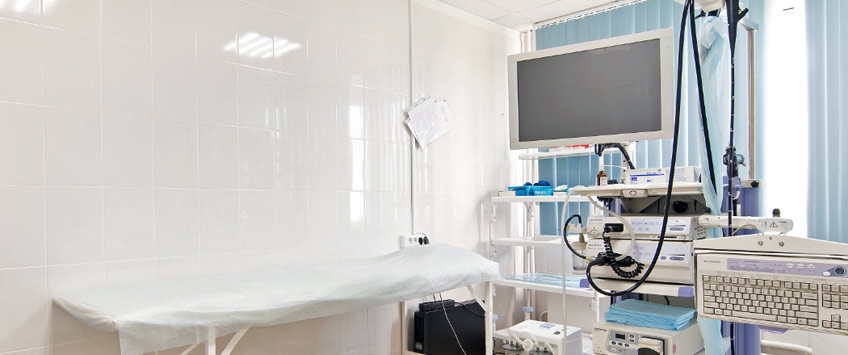 ), N-кадгерин (# ab76011, Abcam), CD44 (# ab51037, Abcam), CD133 (# orb10288, biorbyt, Сан-Франциско, Калифорния) или Ki-67 (# ab16667, Abcam) в рекомендованных разведениях в увлажненной камере в течение ночи. при 4 ° C. Затем предметные стекла тщательно промывали и инкубировали в течение 1 ч с подходящим вторичным антителом: биотинилированным антителом против кролика (BA-1000, Vector Laboratories) или биотинилированным антителом против мыши (BA-2000, Vector Laboratories) для хромогенных образцов; вторичные антитела против кроличьего Alexa Fluor 647 (# ab150075, Abcam) или антитела против Alexa Fluor 594 мыши (# ab150116, Abcam) (разведение 1: 200) для флуоресцентных образцов.Клетки контрастировали с помощью DAPI в течение 5 минут и 3 раза промывали 1X PBS перед флуоресцентной визуализацией. Из-за фиксации человеческих образцов формалином возникает значительная автофлуоресценция, что требует хромогенного мечения. Все образцы, сравниваемые непосредственно с образцами человека, также подвергались хромогенной обработке для согласованности сравнения.
), N-кадгерин (# ab76011, Abcam), CD44 (# ab51037, Abcam), CD133 (# orb10288, biorbyt, Сан-Франциско, Калифорния) или Ki-67 (# ab16667, Abcam) в рекомендованных разведениях в увлажненной камере в течение ночи. при 4 ° C. Затем предметные стекла тщательно промывали и инкубировали в течение 1 ч с подходящим вторичным антителом: биотинилированным антителом против кролика (BA-1000, Vector Laboratories) или биотинилированным антителом против мыши (BA-2000, Vector Laboratories) для хромогенных образцов; вторичные антитела против кроличьего Alexa Fluor 647 (# ab150075, Abcam) или антитела против Alexa Fluor 594 мыши (# ab150116, Abcam) (разведение 1: 200) для флуоресцентных образцов.Клетки контрастировали с помощью DAPI в течение 5 минут и 3 раза промывали 1X PBS перед флуоресцентной визуализацией. Из-за фиксации человеческих образцов формалином возникает значительная автофлуоресценция, что требует хромогенного мечения. Все образцы, сравниваемые непосредственно с образцами человека, также подвергались хромогенной обработке для согласованности сравнения. Для хромогенно обработанных образцов предметные стекла затем промывали и инкубировали с реагентом VECTASTAIN ABC (PK-4000, Vector Laboratories) в течение 30 мин. Воздействие сигнала было рассчитано по времени и визуализировано, пока предметные стекла инкубировали с субстратом DAB (SK-4105, Vector Laboratories) или Vector Red (SK-5105, Vector Laboratories).Слайды с двойным окрашиванием следовали этому протоколу дважды подряд для каждого отдельного маркера. Первым использовали субстрат Vector Red, а вторым — DAB. Соответствующие контрольные слайды готовили для каждого состояния и каждой комбинации антител, пропуская инкубацию с первичным антителом. Слайды были закреплены с помощью MM24 (# 3801120, Leica, Wetzlar, Germany), и изображения световой микроскопии с использованием линейно поляризованного света для срезов, окрашенных PSR, были получены с помощью микроскопа Olympus BX63 (Olympus, Center Valley, PA) с Olympus DP80. камера (Олимп).
Для хромогенно обработанных образцов предметные стекла затем промывали и инкубировали с реагентом VECTASTAIN ABC (PK-4000, Vector Laboratories) в течение 30 мин. Воздействие сигнала было рассчитано по времени и визуализировано, пока предметные стекла инкубировали с субстратом DAB (SK-4105, Vector Laboratories) или Vector Red (SK-5105, Vector Laboratories).Слайды с двойным окрашиванием следовали этому протоколу дважды подряд для каждого отдельного маркера. Первым использовали субстрат Vector Red, а вторым — DAB. Соответствующие контрольные слайды готовили для каждого состояния и каждой комбинации антител, пропуская инкубацию с первичным антителом. Слайды были закреплены с помощью MM24 (# 3801120, Leica, Wetzlar, Germany), и изображения световой микроскопии с использованием линейно поляризованного света для срезов, окрашенных PSR, были получены с помощью микроскопа Olympus BX63 (Olympus, Center Valley, PA) с Olympus DP80. камера (Олимп).
Анализ изображений и количественная оценка
Размер сфероида был оценен с использованием световых микрофотографий, окрашенных H и E, и сценария MatLab (2018b, MathWorks, Natick, MA) для количественного определения среднего диаметра. Количество инфильтрирующих кровеносных сосудов и размер сосудов определяли количественно с помощью скрипта Matlab. Изображения были получены с помощью микроскопа Olympus IX83 (Olympus, Center Valley, PA), оснащенного камерой Hamamatsu Orca-Flash 4.0 (Hamamatsu, Сидзуока, Япония). Сигнал
Количество инфильтрирующих кровеносных сосудов и размер сосудов определяли количественно с помощью скрипта Matlab. Изображения были получены с помощью микроскопа Olympus IX83 (Olympus, Center Valley, PA), оснащенного камерой Hamamatsu Orca-Flash 4.0 (Hamamatsu, Сидзуока, Япония). Сигнал
PRS количественно оценивали двумя способами: анализ оттенка сигнала коллагена и сегментация геометрических параметров коллагеновых волокон.Анализ оттенка для определения различных уровней связывания коллагена и фибрилляции был выполнен с использованием сценария Matlab. Сегментация и количественная оценка параметров волокна были выполнены с использованием CT-FIRE (Лаборатория оптических и вычислительных приборов, Университет Висконсина) 29 .
Оттенок сигнала трихрома Массона количественно определяли аналогично анализу оттенка PRS. Красные и синие пиксели идентифицировали и подсчитывали с помощью скрипта Matlab. Затем для сравнения рассчитывались отношения цветных пикселей к общему количеству пикселей ткани.
изображений IHC были импортированы как несжатые файлы в программное обеспечение Visiopharm (Broomfield, CO) для анализа и количественной оценки. В образцах, где опухолевые клетки было трудно отличить от стромальных клеток ( in vitro, и in vivo, имплантированные конструкции ), был написан сценарий для деконволюции сигнала Vector Red с последующим выделением окрашенных Vector Red положительных клеток CK-18, которые специфически метят HCT116 клетки. После сегментации клеток HCT116 был написан второй сценарий для деконволюции сигнала DAB и количественной оценки экспрессии или локализации: β-катенина, E-кадгерина, FAK, Ki67 и N-кадгерина (Suppl.Рис.13). Для β-катенина и Ki67 ядра помечали как положительные или отрицательные для окрашивания DAB и подсчитывали. Для E-кадгерина и N-кадгерина клетки были отмечены как положительные, если они имели полную мембранную локализацию DAB, и отрицательные в противном случае. Для FAK были получены отношения общей площади опухоли, окрашенной положительно на DAB.
Для анализа маркеров стволовых клеток CD44 и CD133 был написан сценарий для маркировки клеток с полной мембранной локализацией сигнала как положительных и отрицательных, если нет. Для анализа окрашивания каспазой 3 в образцах, обработанных лекарственным средством, был написан сценарий для определения мембранной и цитоплазматической локализации сигнала; клетки считались положительными, если они имели положительный сигнал каспазы 3.Для анализа окрашивания Ki67 в образцах, обработанных лекарственным препаратом, был написан сценарий для сегментации ядерного сигнала Ki67 и маркировки клеток как положительных, если они имели ядерную колокализацию сигнала Ki67.
Статистический анализ
Все эксперименты проводились с n = 3, если не указано иное. Статистический анализ параметрических данных проводили с использованием t-критерия Стьюдента или одностороннего дисперсионного анализа (ANOVA) с помощью апостериорного критерия множественного сравнения Тьюки. Статистический анализ непараметрических данных проводился с использованием критериев хи-квадрат Колмогорова-Смирнова. Значимость была определена как α ≤ 0,05, и все p-значения представлены вместе с соответствующими наборами данных. Программное обеспечение GraphPad Prism v6.0 (GraphPad Software, La Jolla, CA) использовалось для всех анализов.
Значимость была определена как α ≤ 0,05, и все p-значения представлены вместе с соответствующими наборами данных. Программное обеспечение GraphPad Prism v6.0 (GraphPad Software, La Jolla, CA) использовалось для всех анализов.
Моделирование и экспериментальная проверка in vitro кинетики колоноскопа в колоноскопии
Дж. Альтенбах, Х. Альтенбах и В. А. Еремеев. Об обобщенных теориях пластин и оболочек типа Коссера: краткий обзор и библиография. Arch. Прил. Мех. 80: 73–92, 2010.
Артикул Google Scholar
Чанг, Дж., Д. Шеперд и Дж. Дж. Чжан. Моделирование динамического отклика на основе пучка Коссера. Comput. Anim. Виртуальные миры 18 (4–5): 429–436, 2007.
Google Scholar
Cheng, W. B., M. Moser, S. Kanagaratnam, and W. J. Zhang. Развитие автономной микроробототехники в эндоскопии. J. Med. Англ. Technol. 35: 391–401, 2011.
PubMed Статья CAS Google Scholar
Cheng, W. B., M. Moser, S. Kanagaratnam, and W. J. Zhang. Обзор предстоящих достижений в колоноскопии. Dig. Endosc. 24: 1–6, 2012.
PubMed Статья Google Scholar
Cheng, W. B., M. Moser, S. Kanagaratnam, and W. J. Zhang. Анализ и понимание математической модели образования петель в колоноскопии. J. Eng. Med. 226: 858–867, 2012.
Статья Google Scholar
Cheng, W. B., M. Moser, S. Kanagaratnam, and W. J. Zhang. Предсказание относительного движения колоноскопа при колоноскопии. J. Mech. Med. Биол. 13: 1–14, 2012.
Google Scholar
Cheng, W. B., K. Y.Song, W. L. Luo, Z. Q. Qian, M. Moser, S. Kanagaratnam, and W.Дж. Чжан. Кинематическая модель и экспериментальная проверка колоноскопа. J. Med. Биол. Eng. 2012. DOI: 10.5405 / jmbe.1331.
J. Med. Биол. Eng. 2012. DOI: 10.5405 / jmbe.1331.
Cheng, W. B., M. Moser, S. Kanagaratnam, and W. J. Zhang. Влияние физических свойств колоноскопа на петлевание во время колоноскопии. J. Med. Биол. Англ. 2012 г. DOI: 10.5405 / jmbe.1139.
Дарио П., П. Чиарлетта, А. Менсиасси и Б. Ким. Моделирование и экспериментальное подтверждение передвижения эндоскопических роботов в толстой кишке. Внутр. J. Робот. Res. 23: 5540–5545, 2009.
Google Scholar
Dequidt, J., C. Duriez, S. Cotin, and E. Kerrien. К интерактивному планированию спиральной эмболизации при аневризмах головного мозга. MICCAI 12: 377–385, 2009.
PubMed Google Scholar
Duriez, C., C. Guebert, M. Marchal, S. Cotin, and L. Grisoni. Интерактивное моделирование введения гибких игл на основе моделей ограничений.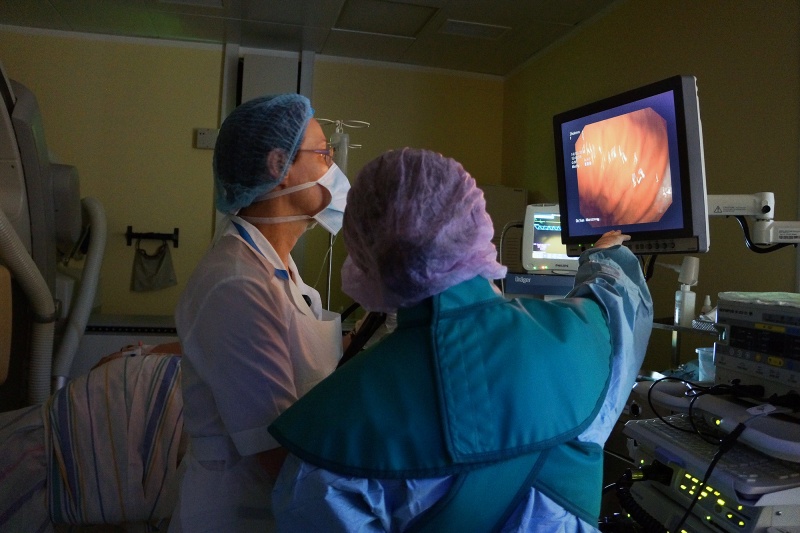 MICCAI 12: 291–299, 2009.
MICCAI 12: 291–299, 2009.
PubMed Google Scholar
Duriez, C., and A. Kheddar. Реалистичная тактильная визуализация взаимодействующих деформируемых объектов в виртуальных средах. IEEE Trans. Vis. Comput. График. 12: 1–12, 2006.
Статья Google Scholar
Фунг, Ю. К. Биомеханика: механические свойства живых тканей (2-е изд.). Нью-Йорк: Springer, стр. 278–279, 1993.
Google Scholar
Gilardi, G., and I. Sharf. Литературный обзор моделирования контактной динамики. мех. Мах. Теория 37: 1213–1239, 2002.
Статья. Google Scholar
Хеллье Д., Ф. Альбермни, Б. Эванс, Х. Д. Виссер, К. Адам и Дж. Пассегер. Жесткость колоноскопов на изгиб и кручение при комнатной температуре и температуре тела. J. Eng. Med. 225: 389–399, 2011.
Eng. Med. 225: 389–399, 2011.
Статья Google Scholar
Хеллье, Д. Определение свойств структуры колоноскопа для интерактивного моделирования колоноскопии. Магистерская диссертация, Университет Квинсленда, 2010.
Хонг, М., С. Юнг, М. Чой и С. В. Велч. Быстрое сохранение объема для системы масса-пружина. IEEE Comput. График. Прил. 26 (5): 83–91, 2006.
PubMed Статья Google Scholar
Икута, К. Виртуальная эндоскопическая система с ощущением силы. IEEE Int. Конф. Robotics Autom. 4: 1715–1721, 1999.
Google Scholar
Икута, К. Портативная виртуальная эндоскопическая система с силой и визуальным дисплеем для обучения введению. MICCAI 1935: 907–920, 2000.
Google Scholar

Конингс, М. К., Э. Б. ван де Краатс, Т.Олдерестен и В. Дж. Ниссен. Аналитический алгоритм движения проволочного проводника для моделирования эндоваскулярных вмешательств. Med. Биол. Англ. Comput. 41 (6): 689–700, 2003.
PubMed Статья CAS Google Scholar
Ленуар, Дж., С. Котин, К. Дурье и П. Ноймнм. Физические модели для моделирования катетера, проволочного проводника и стента. Шпилька. Health Technol. Поставить в известность. 119: 305–310, 2006.
PubMed Google Scholar
Луис Ю., Корман Л. Ю., Егоров В., Цурюпа С., Корбин Б., Андерсон М., Сарвазян Н., Сарвазян А. Характеристика сил, прикладываемых эндоскопистами во время колоноскопии, с помощью беспроводного монитора силы колоноскопии. Гастроинтест. Endosc. 71 (2): 327–334, 2010.
Статья Google Scholar

Miller, K., and K. Chinzei. Конститутивное моделирование мозговой ткани: эксперимент и теория. J. Biomech. 30: 1115–1121, 1997.
PubMed Статья CAS Google Scholar
Рем’ион Ю., Дж. М. Нуррит и Д. Гиллард. Динамическая анимация сплайновых объектов . J. Visual Comp. Анимат. 11 (1): 17–26, 1999.
Google Scholar
Шинья М. Теории моделирования массовых пружин в компьютерной графике: стабильность, затраты и улучшения. Ieice Trans. Инф. Syst. 88 (4): 767–774, 2005.
Статья Google Scholar
Спиллманн, Дж. И М. Тешнер. CORDE: стержневые элементы cosserat для динамического моделирования одномерных упругих объектов. Симпозиум Eurographics / ACM Siggraph по компьютерной анимации 2007, стр. 1–10.
Theetten, A., L. Grisoni, C. Andriot, and B. Barsky. Геометрически точные динамические шлицы. Comput.Помощь Дес. 40: 35–48, 2008.
Barsky. Геометрически точные динамические шлицы. Comput.Помощь Дес. 40: 35–48, 2008.
Статья Google Scholar
Валентини П. П. и Э. Пенести. Моделирование упругих балок с помощью динамических шлицев. Multibody Syst. Дин. 25: 271–284, 2011.
Статья Google Scholar
Ву, X., М. Даунс, Т. Гоктекин и Ф. Тендик. Адаптивные нелинейные конечные элементы для моделирования деформируемого тела с использованием динамических прогрессивных сеток. Comput. График. Форум 20: 349–358, 2001.
Статья Google Scholar
Zupan, D., and M. Saje. Теория трехмерной балки: формулировка конечных элементов на основе кривизны. Comput. Struct. 81: 1875–1888, 2003.
Статья Google Scholar
Произошла ошибка при настройке пользовательского файла cookie
Этот сайт использует файлы cookie для повышения производительности. Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Если ваш браузер не принимает файлы cookie, вы не можете просматривать этот сайт.
Настройка вашего браузера для приема файлов cookie
Существует множество причин, по которым cookie не может быть установлен правильно. Ниже приведены наиболее частые причины:
- В вашем браузере отключены файлы cookie. Вам необходимо сбросить настройки вашего браузера, чтобы он принимал файлы cookie, или чтобы спросить вас, хотите ли вы принимать файлы cookie.
- Ваш браузер спрашивает вас, хотите ли вы принимать файлы cookie, и вы отказались.Чтобы принять файлы cookie с этого сайта, используйте кнопку «Назад» и примите файлы cookie.
- Ваш браузер не поддерживает файлы cookie. Если вы подозреваете это, попробуйте другой браузер.
- Дата на вашем компьютере в прошлом. Если часы вашего компьютера показывают дату до 1 января 1970 г.,
браузер автоматически забудет файл cookie. Чтобы исправить это, установите правильное время и дату на своем компьютере.

- Вы установили приложение, которое отслеживает или блокирует установку файлов cookie.Вы должны отключить приложение при входе в систему или проконсультироваться с системным администратором.
Почему этому сайту требуются файлы cookie?
Этот сайт использует файлы cookie для повышения производительности, запоминая, что вы вошли в систему, когда переходите со страницы на страницу. Чтобы предоставить доступ без файлов cookie потребует, чтобы сайт создавал новый сеанс для каждой посещаемой страницы, что замедляет работу системы до неприемлемого уровня.
Что сохраняется в файле cookie?
Этот сайт не хранит ничего, кроме автоматически сгенерированного идентификатора сеанса в cookie; никакая другая информация не фиксируется.
Как правило, в файле cookie может храниться только информация, которую вы предоставляете, или выбор, который вы делаете при посещении веб-сайта. Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Например, сайт
не может определить ваше имя электронной почты, пока вы не введете его. Разрешение веб-сайту создавать файлы cookie не дает этому или любому другому сайту доступа к
остальной части вашего компьютера, и только сайт, который создал файл cookie, может его прочитать.
Специальный выпуск: Модели колоректального рака in vitro и in vivo для клинического применения
Доктор.Марта БайоккиЭлектронная почта Веб-сайт
Гостевой редактор
Отделение онкологии и молекулярной медицины, Istituto Superiore di Sanità, Viale Regina Elena 199, Roma 00161, Италия
Интересы: колоректальный рак; раковые стволовые клетки; биобанки стволовых клеток; высокопроизводительный анализ; целенаправленная терапия
Электронная почта Веб-сайт
Гостевой редактор
Отделение онкологии и молекулярной медицины, Istituto Superiore di Sanità, Viale Regina Elena 199, Roma 00161, Италия
Интересы: раковых стволовых клеток; колоректальный рак; рак молочной железы; покой; устойчивость к химиотерапии
Уважаемые коллеги,
В последние годы мы стали свидетелями беспрецедентного расширения терапевтических возможностей для лечения колоректального рака (CRC), при этом в клиническую практику вошли несколько агентов молекулярного таргетинга. Более того, в настоящее время проводится оценка многих новых подходов, нацеленных на различные аспекты биологии опухоли, включая пролиферирующие и покоящиеся раковые стволовые клетки, противоопухолевый иммунитет, взаимодействия опухоль-микросреда, метаболизм рака и эпигенетические модификации, связанные с раком. Достижения в области молекулярного анализа с высокой пропускной способностью продолжают открывать новые детали молекулярного ландшафта CRC, способствуя выявлению новых целей, определению улучшенных методов классификации пациентов и достижению лучшей настройки индивидуализированной терапии.Несмотря на растущие знания о молекулярных механизмах, лежащих в основе CRC, процент новых лекарств, получающих клиническое одобрение, в последние десятилетия постоянно снижается. Причина этого разрыва между фундаментальными / трансляционными исследованиями и соответствующими клиническими результатами кроется, по крайней мере частично, в ограничениях доклинических моделей, доступных в настоящее время для CRC.
Более того, в настоящее время проводится оценка многих новых подходов, нацеленных на различные аспекты биологии опухоли, включая пролиферирующие и покоящиеся раковые стволовые клетки, противоопухолевый иммунитет, взаимодействия опухоль-микросреда, метаболизм рака и эпигенетические модификации, связанные с раком. Достижения в области молекулярного анализа с высокой пропускной способностью продолжают открывать новые детали молекулярного ландшафта CRC, способствуя выявлению новых целей, определению улучшенных методов классификации пациентов и достижению лучшей настройки индивидуализированной терапии.Несмотря на растущие знания о молекулярных механизмах, лежащих в основе CRC, процент новых лекарств, получающих клиническое одобрение, в последние десятилетия постоянно снижается. Причина этого разрыва между фундаментальными / трансляционными исследованиями и соответствующими клиническими результатами кроется, по крайней мере частично, в ограничениях доклинических моделей, доступных в настоящее время для CRC. Фактически, все более сложные экспериментальные системы, воспроизводящие CRC in vitro и in vivo, такие как органоиды и полученные от пациентов ксенотрансплантаты, характеризуются как интригующими сложностями, так и внутренними ограничениями, некоторые из которых еще только начинают понимать.В этом сценарии в равной степени необходимо полностью понять потенциал существующих доклинических моделей CRC, а также разработать и проверить новые инструменты для противоопухолевой терапии. В этом специальном выпуске мы соберем оригинальные исследовательские работы и обзоры, отражающие текущее состояние и перспективы моделей CRC для доклинических и трансляционных исследований, изучая и обсуждая их полезность для диагностики и лечения пациентов.
Фактически, все более сложные экспериментальные системы, воспроизводящие CRC in vitro и in vivo, такие как органоиды и полученные от пациентов ксенотрансплантаты, характеризуются как интригующими сложностями, так и внутренними ограничениями, некоторые из которых еще только начинают понимать.В этом сценарии в равной степени необходимо полностью понять потенциал существующих доклинических моделей CRC, а также разработать и проверить новые инструменты для противоопухолевой терапии. В этом специальном выпуске мы соберем оригинальные исследовательские работы и обзоры, отражающие текущее состояние и перспективы моделей CRC для доклинических и трансляционных исследований, изучая и обсуждая их полезность для диагностики и лечения пациентов.
Доктор Марта Байокки
Доктор Энн Зойнер
Приглашенные редакторы
Информация для подачи рукописей
Рукописи должны быть представлены онлайн на сайте www.mdpi.com, зарегистрировавшись и войдя на этот сайт. После регистрации щелкните здесь, чтобы перейти к форме отправки. Рукописи можно подавать до установленного срока. Все статьи будут рецензироваться. Принятые статьи будут постоянно публиковаться в журнале (как только они будут приняты) и будут перечислены вместе на веб-сайте специального выпуска. Приглашаются исследовательские статьи, обзорные статьи, а также короткие сообщения. Для запланированных статей название и краткое резюме (около 100 слов) можно отправить в редакцию для объявления на этом сайте.
После регистрации щелкните здесь, чтобы перейти к форме отправки. Рукописи можно подавать до установленного срока. Все статьи будут рецензироваться. Принятые статьи будут постоянно публиковаться в журнале (как только они будут приняты) и будут перечислены вместе на веб-сайте специального выпуска. Приглашаются исследовательские статьи, обзорные статьи, а также короткие сообщения. Для запланированных статей название и краткое резюме (около 100 слов) можно отправить в редакцию для объявления на этом сайте.
Представленные рукописи не должны были публиковаться ранее или рассматриваться для публикации в другом месте (за исключением трудов конференции). Все рукописи тщательно рецензируются в рамках процесса одинарного слепого рецензирования. Руководство для авторов и другая важная информация для подачи рукописей доступна на странице Инструкции для авторов. Cancers — это международный рецензируемый журнал с открытым доступом, выходящий один раз в месяц, издающийся MDPI.
Пожалуйста, посетите страницу Инструкции для авторов перед отправкой рукописи. Плата за обработку статьи (APC) для публикации в этом журнале с открытым доступом составляет 2200 швейцарских франков.
Представленные статьи должны быть хорошо отформатированы и написаны на хорошем английском языке. Авторы могут использовать MDPI
Услуги редактирования на английском языке перед публикацией или во время редактирования автора.
Плата за обработку статьи (APC) для публикации в этом журнале с открытым доступом составляет 2200 швейцарских франков.
Представленные статьи должны быть хорошо отформатированы и написаны на хорошем английском языке. Авторы могут использовать MDPI
Услуги редактирования на английском языке перед публикацией или во время редактирования автора.
Модель микроопухоли колоректального рака человека, васкуляризированная in vitro, воспроизводит ответы in vivo на стандартную терапию
* Соответствующие авторы
а Кафедра молекулярной биологии и биохимии Калифорнийского университета, Ирвин, Ирвин, Калифорния, США
Электронная почта: cchughes @ uci. edu
edu
б Кафедра биологической химии Калифорнийского университета, Ирвин, Ирвин, Калифорния, США
с Кафедра биостатистики, Калифорнийский университет, Ирвин, Ирвин, Калифорния, США
д Департамент биомедицинской инженерии, Калифорнийский университет, Ирвин, Ирвин, Калифорния, США
и Департамент математики Калифорнийского университета, Ирвин, Ирвин, Калифорния, США
f Кафедра микробиологии и молекулярной генетики, Калифорнийский университет, Ирвин, Ирвин, Калифорния, США
г Кафедра физиологии и биофизики, Калифорнийский университет, Ирвин, Ирвин, Калифорния, США
ч Центр сложных биологических систем, Калифорнийский университет, Ирвин, Ирвин, Калифорния, США
Моделирование микроокружения опухоли человека в органоидах колоректального рака in vitro и in vivo
Abstract
Микроокружение опухоли (TME) играет важную роль в росте и метастазировании рака. Биоинженерные модели TME улучшат наше понимание прогрессирования рака и облегчат идентификацию новых противораковых терапевтических средств, нацеленных на компоненты TME, такие как внеклеточный матрикс (ECM) и стромальные клетки. Однако большинство современных моделей in vitro не в состоянии повторить обширные особенности стромы опухоли человека, особенно архитектуру внеклеточного матрикса, и не подвергаются воздействию физиологии интактного тела. С другой стороны, модели in vivo на животных не точно отражают архитектуру опухоли человека.Используя особенности биопсии ткани колоректального рака (CRC) в качестве руководства, мы устраняем эти недостатки, создавая человеческие органоиды, содержащие слой стромы ECM толстой кишки и сфероиды CRC. Органоиды исследовали in vitro и при имплантации мышам в течение 28 дней. Мы показываем, что стромальная микроархитектура ЕСМ, сгенерированная in vitro , сохранялась in vivo в течение по крайней мере 28 дней.
Биоинженерные модели TME улучшат наше понимание прогрессирования рака и облегчат идентификацию новых противораковых терапевтических средств, нацеленных на компоненты TME, такие как внеклеточный матрикс (ECM) и стромальные клетки. Однако большинство современных моделей in vitro не в состоянии повторить обширные особенности стромы опухоли человека, особенно архитектуру внеклеточного матрикса, и не подвергаются воздействию физиологии интактного тела. С другой стороны, модели in vivo на животных не точно отражают архитектуру опухоли человека.Используя особенности биопсии ткани колоректального рака (CRC) в качестве руководства, мы устраняем эти недостатки, создавая человеческие органоиды, содержащие слой стромы ECM толстой кишки и сфероиды CRC. Органоиды исследовали in vitro и при имплантации мышам в течение 28 дней. Мы показываем, что стромальная микроархитектура ЕСМ, сгенерированная in vitro , сохранялась in vivo в течение по крайней мере 28 дней. Кроме того, сравнения с биопсией опухолей CRC показали, что органоиды с упорядоченно структурированными TME вызывают эпителиальный фенотип в клетках CRC, аналогичный опухолям низкой степени злокачественности, по сравнению с мезенхимальным фенотипом, наблюдаемым в неупорядоченных TME, аналогичных опухолям высокой степени злокачественности.В целом, эти результаты являются первой демонстрацией репликации архитектуры ECM опухоли человека в биологических органоидах опухоли в условиях ex vivo и in vivo .
Кроме того, сравнения с биопсией опухолей CRC показали, что органоиды с упорядоченно структурированными TME вызывают эпителиальный фенотип в клетках CRC, аналогичный опухолям низкой степени злокачественности, по сравнению с мезенхимальным фенотипом, наблюдаемым в неупорядоченных TME, аналогичных опухолям высокой степени злокачественности.В целом, эти результаты являются первой демонстрацией репликации архитектуры ECM опухоли человека в биологических органоидах опухоли в условиях ex vivo и in vivo .
Введение
Опухоли являются продуктами окружающей среды. Они посылают сигналы, которые могут оказывать значительное влияние на локальные ткани, и они получают сигналы от близлежащих клеток и внеклеточного матрикса (ECM), которые могут изменить их прогрессирование. 1–3 Несмотря на важность окружающей среды опухоли, текущие стратегии прогнозирования опухолей сосредоточены на анализе отдельных опухолевых клеток, таком как морфологическая оценка или расчет индекса пролиферации. Хотя эти показатели коррелируют с прогрессированием опухоли, они не отражают динамику между опухолью и окружающим ее пространством, что приводит к неточностям при попытке предсказать прогрессирование опухоли и химиотерапевтический ответ. Новые технологии, улучшающие прогноз, окажут значительное влияние на смертность пациентов и приведут к разработке новых терапевтических средств, которые нацелены на опухолевые клетки и контролируют их, избавляя здоровые ткани от пагубного воздействия современных химиотерапевтических средств.
Хотя эти показатели коррелируют с прогрессированием опухоли, они не отражают динамику между опухолью и окружающим ее пространством, что приводит к неточностям при попытке предсказать прогрессирование опухоли и химиотерапевтический ответ. Новые технологии, улучшающие прогноз, окажут значительное влияние на смертность пациентов и приведут к разработке новых терапевтических средств, которые нацелены на опухолевые клетки и контролируют их, избавляя здоровые ткани от пагубного воздействия современных химиотерапевтических средств.
Недавние исследования определили, что микросреда опухоли (TME) является основным фактором, способствующим развитию и росту рака. Комбинация паракринных факторов, стромальных клеток, таких как эндотелиальные клетки, макрофаги и ассоциированные с опухолью фибробласты (TAF), белков ECM и тканевой механики сливаются в идеальную среду для развития рака и уклонения от лечения. 2,3 Особый интерес для нашего исследования: ряд исследований показал, что биомеханика тканей 4–6 и архитектура ECM 7,8 могут изменять и направлять фенотип раковых клеток, а также изменять терапевтический ответ. Эти результаты указывают на то, что TME является потенциальной мишенью для инновационной противораковой клеточной или модулирующей рак терапии. Чтобы разработать терапию, нацеленную на TME, необходимо разработать и проверить in vitro моделей TME. Многие группы, в том числе наша, использовали методы тканевой инженерии для изготовления опухолевых органоидов, которые воспроизводят уникальную комбинацию факторов TME. 9–11 Органоиды опухоли могут быть получены из компонентов, полученных от человека, что дает точное представление о взаимодействиях опухоль-строма, обнаруженных в TME, в отличие от многих стандартных моделей рака у животных.Однако органоиды не могут воспроизвести контекст физиологии всего тела для проверки побочных эффектов или фармакодинамики и фармакокинетики.
Эти результаты указывают на то, что TME является потенциальной мишенью для инновационной противораковой клеточной или модулирующей рак терапии. Чтобы разработать терапию, нацеленную на TME, необходимо разработать и проверить in vitro моделей TME. Многие группы, в том числе наша, использовали методы тканевой инженерии для изготовления опухолевых органоидов, которые воспроизводят уникальную комбинацию факторов TME. 9–11 Органоиды опухоли могут быть получены из компонентов, полученных от человека, что дает точное представление о взаимодействиях опухоль-строма, обнаруженных в TME, в отличие от многих стандартных моделей рака у животных.Однако органоиды не могут воспроизвести контекст физиологии всего тела для проверки побочных эффектов или фармакодинамики и фармакокинетики.
Ранее мы разработали трехмерный органоид подслизистой оболочки толстой кишки с обнаруженной здесь уникальной микроархитектурой. 9 Когда мы встроили опухолевые сфероиды, состоящие из клеток злокачественного колоректального рака, в эти органоиды, мы обнаружили, что опухолевые клетки ведут себя радикально по-разному в зависимости от организации ультраструктуры коллагена. В упорядоченных, организованных TME клетки CRC проявляли поведение, подобное здоровым эпителиальным клеткам толстой кишки, с поляризацией и низкой скоростью пролиферации. Интересно, что когда мы поместили те же самые раковые клетки в случайно выбранные матрицы коллагена I, клетки CRC стали очень подвижными и инвазивными с высоким индексом пролиферации — другими словами, они приняли агрессивный фенотип рака. Кроме того, структурированные TME индуцировали химиорезистентность в клетках CRC, в то время как случайно организованные TME вызывали химиочувствительность. 9 Эти результаты показали, что присутствие здоровых стромальных клеток, способных структурировать опухолевый ЕСМ, оказывает подавляющее действие на фенотип и рост опухолевых клеток. Интересно, что большинство опубликованных данных за последнее десятилетие предполагают противоположный эффект вовлечения стромальных клеток на прогрессирование рака, в первую очередь за счет паракринных факторов, которые усиливают пролиферацию и миграцию опухолевых клеток и снижают их чувствительность к химиотерапевтическим препаратам.
В упорядоченных, организованных TME клетки CRC проявляли поведение, подобное здоровым эпителиальным клеткам толстой кишки, с поляризацией и низкой скоростью пролиферации. Интересно, что когда мы поместили те же самые раковые клетки в случайно выбранные матрицы коллагена I, клетки CRC стали очень подвижными и инвазивными с высоким индексом пролиферации — другими словами, они приняли агрессивный фенотип рака. Кроме того, структурированные TME индуцировали химиорезистентность в клетках CRC, в то время как случайно организованные TME вызывали химиочувствительность. 9 Эти результаты показали, что присутствие здоровых стромальных клеток, способных структурировать опухолевый ЕСМ, оказывает подавляющее действие на фенотип и рост опухолевых клеток. Интересно, что большинство опубликованных данных за последнее десятилетие предполагают противоположный эффект вовлечения стромальных клеток на прогрессирование рака, в первую очередь за счет паракринных факторов, которые усиливают пролиферацию и миграцию опухолевых клеток и снижают их чувствительность к химиотерапевтическим препаратам. 12–14 Однако в этих исследованиях обычно использовались TAF, а не нормальные стромальные клетки, и не использовались органотипические модели. 2,11,15,16
12–14 Однако в этих исследованиях обычно использовались TAF, а не нормальные стромальные клетки, и не использовались органотипические модели. 2,11,15,16
Чтобы углубить наше понимание архитектуры TME и ее роли в модулировании роста опухоли, мы проанализировали биопсии CRC, обнаружив значительные изменения в организации ECM. Основываясь на наших клинических наблюдениях, мы изготовили органоиды CRC, содержащие звездчатые клетки печени, чтобы воспроизвести содержание и организацию стромальных клеток, обнаруженных в печени, наиболее частом месте метастазирования CRC. 17 Мы предположили, что присутствие стромальных клеток в TME будет управлять организацией ECM и впоследствии модулировать рост опухоли CRC в этих органоидах.Чтобы расширить область применения опухолевых органоидов в качестве модели роста опухоли ex vivo , мы имплантировали их подкожно голым мышам. Мы предположили, что управляемая стромальными клетками TME архитектура ex vivo будет сохраняться в течение длительного времени in vivo . Чтобы проверить наши гипотезы, мы проанализировали организации TME и соответствующие фенотипы опухолевых клеток в органоидах в течение 4 недель in vitro и in vivo и обнаружили, что органоиды с упорядоченно структурированным стромальным ECM, генерировавшим in vitro, , сохраняли эти структуры in vivo. на протяжении всего наблюдения и индуцировал эпителиальный фенотип в клетках CRC.Напротив, неупорядоченный ВКМ допускает мезенхимальный фенотип. Эти результаты показывают, что предварительно структурированный TME сохраняет свою архитектуру в контексте физиологии всего тела. Вместе мы представляем данные о взаимодействиях между архитектурой ECM и фенотипом раковых клеток в трех различных системах, in vitro, , у мышей и в клинических образцах. Эти результаты демонстрируют клиническую значимость нашего органоида CRC и могут использоваться в качестве модели для изучения роста опухоли ex vivo и прогнозирования потенциального ответа на химиотерапевтические препараты.
Чтобы проверить наши гипотезы, мы проанализировали организации TME и соответствующие фенотипы опухолевых клеток в органоидах в течение 4 недель in vitro и in vivo и обнаружили, что органоиды с упорядоченно структурированным стромальным ECM, генерировавшим in vitro, , сохраняли эти структуры in vivo. на протяжении всего наблюдения и индуцировал эпителиальный фенотип в клетках CRC.Напротив, неупорядоченный ВКМ допускает мезенхимальный фенотип. Эти результаты показывают, что предварительно структурированный TME сохраняет свою архитектуру в контексте физиологии всего тела. Вместе мы представляем данные о взаимодействиях между архитектурой ECM и фенотипом раковых клеток в трех различных системах, in vitro, , у мышей и в клинических образцах. Эти результаты демонстрируют клиническую значимость нашего органоида CRC и могут использоваться в качестве модели для изучения роста опухоли ex vivo и прогнозирования потенциального ответа на химиотерапевтические препараты.
Результаты
Ткань опухоли имеет меньше богатых коллагеном областей и неорганизованную структуру коллагена по сравнению с нормальной тканью толстой кишки
Количество коллагена в ткани часто сравнивается между здоровыми и больными тканями как мера прогрессирования заболевания. Чтобы качественно оценить различия в образцах богатых коллагеном участков между здоровой толстой кишкой и тканью CRC, мы выполнили окрашивание трихромом. 18–20 Мы взяли биопсию ткани толстой кишки у 12 здоровых, 6 пациентов с низкой степенью злокачественности и 6 пациентов с высокой степенью CRC.Здоровая ткань (рис. 1а) демонстрирует отчетливую компартментализацию коллагена (синий сигнал) вне структур крипт толстой кишки, а коллаген также выглядит полосатым и выровненным в подслизистых слоях. Ткань CRC (рис. 1b-c), наоборот, показывает меньше коллагена в целом, с дальнейшим снижением от низкого до высокого уровня, и коллаген становится более диспергированным с увеличением степени. Из-за различий между тканевыми компартментами мы разделили здоровую и злокачественную ткань толстой кишки на две отдельные области: слизистую оболочку / крипту и подслизистую оболочку (рис.1г-е). Чтобы дополнительно охарактеризовать организацию коллагеновых волокон в этих здоровых образцах толстой кишки и CRC, мы захватили сигнал двойного лучепреломления от окрашенных пикросириусом красным (PSR) участков, соответствующих этим областям (рис. 1d-f , начало ). Изображения PSR демонстрируют аналогичную картину для трихрома: выровненный и связанный коллаген в здоровых образцах и фибриллярный, неупорядоченный коллаген в образцах больных.
Из-за различий между тканевыми компартментами мы разделили здоровую и злокачественную ткань толстой кишки на две отдельные области: слизистую оболочку / крипту и подслизистую оболочку (рис.1г-е). Чтобы дополнительно охарактеризовать организацию коллагеновых волокон в этих здоровых образцах толстой кишки и CRC, мы захватили сигнал двойного лучепреломления от окрашенных пикросириусом красным (PSR) участков, соответствующих этим областям (рис. 1d-f , начало ). Изображения PSR демонстрируют аналогичную картину для трихрома: выровненный и связанный коллаген в здоровых образцах и фибриллярный, неупорядоченный коллаген в образцах больных.
Клинические образцы различной степени, как указано, были получены первоначально окрашенными трихромом Массона ( a, b, c ) для визуализации структуры, плотности и локализации коллагена (синий сигнал). Окрашивание H&E и визуализацию использовали для качественного разделения ткани на слизистую и подслизистую части ( d, e, f ). Затем было выполнено окрашивание PRS и визуализация для специфического выделения коллагеновых волокон.
Затем было выполнено окрашивание PRS и визуализация для специфического выделения коллагеновых волокон.
Мы разделили цифровым способом изображения, описанные на рис. 1d-f, в компартменты крипты или подслизистой оболочки, сохранив при этом исходную информацию о степени опухоли.Затем мы выполнили автоматическую сегментацию волокон с помощью CT-FIRE 21 для дальнейшей количественной оценки наших наблюдений структурных изменений коллагена в ткани CRC в зависимости от степени. В компартментах крипт мы наблюдали, что волокна коллагена (рис. 2a) становятся значительно более случайными (угловой анализ) и шире в образцах, полученных от пациентов с низким и высоким уровнем CRC, по сравнению со здоровой тканью (рис. 2b- слева и посередине). , соответственно ), тогда как длина волокна уменьшалась только в образцах пациентов с CRC высокой степени злокачественности (рис.2б- правый ). Цвет сигнала PSR указывает на образование пучков или зрелость коллагена: красный / оранжевый сигнал соответствует пучкам и утолщенным волокнам (зрелым), в то время как желтый / зеленый обозначает тонкий и ретикулярный коллаген (молодой или незрелый). Чтобы количественно оценить цвет, мы выполнили анализ оттенка с помощью специального скрипта Matlab. Анализ оттенка двулучепреломляющего сигнала не показал существенных различий между группами (рис. 2c). В подслизистых отделах мы обнаружили, что волокна коллагена имели более узкое угловое распределение в образце из раковых тканей по сравнению со здоровой тканью (рис.2e- слева ). Ширина волокна уменьшилась в образце от здоровых людей до низкосортного и далее уменьшилась в образце с высоким содержанием CRC (рис. 2e- , средний ). Длина волокна была меньше в образце от пациентов с CRC низкой и высокой степени злокачественности по сравнению с тканью от здоровых людей (рис. 2e- справа ). Качественный анализ изображений подтвердил эти результаты, показывая более длинные и широкие волокна в здоровом образце и более высокую плотность коротких и тонких волокон в образце опухоли (рис.2г). Однако анализ оттенка двулучепреломляющего сигнала не показал значительных различий между любой из групп, как и результаты в крипте (рис. 2f). Вместе эти результаты демонстрируют, что микроархитектура коллагеновых волокон изменяется во время прогрессирования рака с разной динамикой для каждой области ткани толстой кишки, слизистой или подслизистой оболочки.
Рисунок 2: Микроархитектура клинических образцов.Интересующие области (ROI) из крипт и подслизистых компартментов клинических образцов разной степени тяжести (n> 10 ROI из n = 4 индивидуальных образцов для каждого состояния), как указано, были окрашены PRS и отображены в поляризованном свете ( a, д ).Архитектура волокна была проанализирована с помощью программного обеспечения сегментации (CT-FIRE) для получения распределений угла, ширины и длины волокна ( b, e ). Сигнал оттенка изображений PRS был количественно определен для сравнения ( c, f ). Графики оттенка волокна представляют собой среднее значение + стандартное отклонение. экспериментов, проведенных в трех экземплярах. Графики угла, длины и ширины волокон представляют собой графики ящиков и усов с форматированием Тьюки объединенных волокон из экспериментов, выполненных в четырех экземплярах, что в общей сложности представляет 500-4000 волокон; индивидуально нарисованные точки лежат за пределами 1.5 * межквартильный размах графика.
Репликация нативной архитектуры коллагена с биоинженерными органоидами
Чтобы смоделировать влияние архитектуры коллагена на фенотип опухоли, мы получили органоиды, эквивалентные тканям, с микроокружающей архитектурой коллагена, подобной биопсии человека (изложено в Suppl. Fig. 1a ). 9 Мы встроили иммортализованные звездчатые клетки печени (LX2) в гидрогель коллагена I, который, в соответствии с нашими предыдущими исследованиями, 9 привел к активному ремоделированию коллагена I и формированию структурированных и связанных волокон, которые напоминают волокна, наблюдаемые в естественных условиях. ткань.Звездчатые клетки участвуют в образовании дометастатической ниши для метастазов CRC в печень и, таким образом, представляют собой релевантный тип клеток для моделей in vitro CRC. Параллельно мы производили органоиды голого коллагена, которые воспроизводили бы свойства неорганизованного коллагена в опухолях CRC высокой степени злокачественности. 9 Чтобы проверить, могут ли органоиды воспроизводить особенности организации коллагена, наблюдаемые в здоровой толстой кишке, при низком или высоком уровне CRC, мы охарактеризовали пучки коллагеновых волокон и микроархитектуру органоидов, культивированных in vitro и органоидов, имплантированных мышам .Дополнительная цель состояла в том, чтобы определить, могут ли органоиды, образованные in vitro , сохранять организацию коллагеновых волокон в физиологических условиях in vivo . Подобно анализу организации коллагеновых волокон в клинических образцах (рис. 2), мы использовали инструменты PSR-окрашивания и сегментации изображений для оценки свойств коллагеновых волокон в органоидах , культивируемых in vitro, и in vivo, эксплантированных органоидах (рис. 3). 21 Визуальный осмотр окрашенных коллагеновых волокон в органоидах показал, что органоиды LX2 производят усиленный красный и оранжевый сигнал in vitro и in vivo по сравнению с органоидами, содержащими только коллаген (рис.3а). Анализ оттенка подтвердил эти выводы и показал, что органоиды LX2, культивированные в течение 7 дней in vitro, производили пучки коллагеновых волокон с более высокими уровнями оранжевого и желтого коллагена (рис. 3b), что свидетельствует о том, что эти образцы были более организованными по сравнению с органоидами, содержащими только коллаген. Точно так же органоиды, эксплантированные через 14 дней, показали, что органоиды LX2 обладают более высокой степенью связывания со значительно более высокими количествами красного и оранжевого сигналов по сравнению с органоидами, содержащими только коллаген.
Рисунок 3: Организация органоидного внеклеточного матрикса (ЕСМ) in vitro и in vivo .Микроархитектура коллагеновых волокон в контроле коллагена и органоиды LX2, in vitro и in vivo , как указано, визуализировали с помощью PRS ( a ). Связывание волокон в пучки было количественно определено с помощью анализа оттенка сигнала ( b ): зеленый и желтый сигнал указывают на меньшее количество пучков волокон, а оранжевый и красный сигнал указывают на большее количество пучков. Коллагеновые волокна количественно оценивали с помощью программного обеспечения для сегментации (CT-FIRE).Распределение угла ( c ), длины ( d ) и ширины ( e ) волокон было получено из органоидов in vitro и in vivo . Графики оттенка волокна представляют собой среднее значение + стандартное отклонение. экспериментов, проведенных в трех экземплярах. Графики угла, длины и ширины волокон представляют собой графики ящиков и усов с форматированием Тьюки объединенных волокон из экспериментов, выполненных в четырех экземплярах или более; индивидуально нарисованные точки лежат за пределами 1,5 * межквартильного диапазона графика.
Количественный анализ организации коллагеновых волокон показал более широкое угловое распределение в органоидах LX2 по сравнению с органоидами, содержащими только коллаген (Fig. 3c). Однако у эксплантированных органоидов in vivo не наблюдалось значительных различий в угловом распределении коллагеновых волокон между группами, что свидетельствует о сходном, случайном, ассортименте волокон в целом (рис. 3c). С другой стороны, длина и ширина волокон были значительно выше в органоидах LX2 in vitro по сравнению с органоидами, содержащими только коллаген, и эта тенденция была аналогичной для эксплантированных образцов in vivo (рис.3 и е). Вместе эти результаты предполагают, что ремоделирование LX2 коллагена in vitro генерирует более связанные и упорядоченные микроструктуры волокон и, что важно, эти упорядоченные характеристики волокон коллагена сохраняются после 14 дней имплантации in vivo . Кроме того, различия в организации коллагеновых волокон между органоидами, содержащими LX2, и органоидами, содержащими только коллаген, моделируют различия между здоровой толстой кишкой и CRC низкой или высокой степени, соответственно.
Встроенные опухолевые сфероиды растут медленнее в организованной микросреде
Затем мы проверили влияние микроокружения (коллагенового волокна) на опухолевые клетки, присутствующие в органоидах с отчетливыми характеристиками коллагеновых волокон.Мы вставили сфероиды HCT116, метастатические клетки CRC, как в органоиды, содержащие LX2, так и в органоиды, содержащие только коллаген ( Suppl. Fig. 1b ), и проанализировали фенотип опухолевых клеток в органоидах in vitro, культивированных и in vivo, имплантированных органоидах.
H & E-окрашенные изображения показывают, что сфероиды HCT116 внутри органоидов LX2 оставались компактными и были значительно меньше органоидов, содержащих только коллаген, через 7 дней (рис. 4ai-ниже, c) и продолжали уменьшаться в размерах и сохраняли компактность. эпителиоподобная морфология к 28 суткам.Напротив, клетки HCT116, внедренные в органоиды, содержащие только коллаген, мигрировали за пределы исходного сфероидального тела, и через 7 дней выступы клеток были очевидны в большинстве радиальных направлений. Это миграционное поведение продолжалось и привело к значительному увеличению размера агрегатов через 28 дней (рис. 4ai-верхний, c) и потере компактной морфологии, возможно, из-за мезенхимального фенотипа, вызванного неструктурированной организацией матрикса, как мы ранее показали. . 9 Прогрессивные измерения роста сфероидов HCT116 с течением времени показали, что сфероиды в органоидах LX2 были ограничены по размеру и даже демонстрировали уменьшение размера, тогда как сфероиды HCT116 в органоидах, содержащих только коллаген, были способны увеличиваться (рис.4в).
Рисунок 4: Морфология органоида опухоли и рост in vitro и in vivo .Морфология сфероидов опухоли визуализировалась на 7 и 28 дни in vitro ( a ) и in vivo ( b ) как в контроле коллагена, так и в органоидах LX2, как указано. Интеграция сосудистой сети также наблюдалась на 28 день после имплантированных in vivo органоидов (вставки f, g, h, i ). Диаметр сфероида отслеживали во времени in vitro, ( c ), и in vivo, имплантированных органоида измеряли во время эксплантации для определения среднего диаметра ( d ).Примеры общего размера имплантата in vivo можно увидеть на вставках j и k . Данные по извлечению имплантата также были собраны и собраны для исследований in vivo, ( и ). Графики представляют среднее значение + стандартное отклонение. экспериментов, проведенных в трех экземплярах.
Затем мы проанализировали размер и морфологию in vivo, имплантированных LX2 и органоидов, содержащих только коллаген, через 14 и 28 дней (рис. 4b). Изображения, окрашенные H & E, показывают, что рост сфероида HCT116 в органоидах LX2 был ограничен на 14-й день, а большое некротическое ядро сформировалось на 28-й день, хотя опухолевый компартмент продолжал увеличиваться в размерах.Кровеносные сосуды были очевидны по периметру компартмента опухоли в органоидах, содержащих LX2, что позволяет предположить, что опухолевые клетки не смогли вызвать неоваскуляризацию внутри опухолевой массы (фиг. 4b , вставка h & i). Напротив, сфероиды HCT116 в органоидах, содержащих только коллаген, быстро росли, и к 28 дню большая часть опухолевого компартмента HCT116 оказалась жизнеспособной с низкой долей некротической области и обширной неоваскуляризацией в массе опухоли (рис. 4b- вверху и вставке f). & грамм).В целом, эксплантированные органоиды, содержащие только коллаген, содержали в среднем 35 сосудов по сравнению с примерно 4 в эксплантированных органоидах LX2 ( Suppl. Fig. 2 ). Измерения размеров эксплантированных органоидов не показали различий в среднем диаметре имплантатов, эксплантированных на 14-й день, однако органоиды LX2 были значительно меньше по сравнению с органоидами, содержащими только коллаген, на 28-й день (рис. 4d), и до иссечения органоидов можно было наблюдать значительные различия в размерах (рис. 4b вставка j & k). Следует отметить, что количество органоидов, которые могли быть эксплантированы, было различным в двух группах.Было успешно извлечено меньше органоидов LX2 по сравнению с органоидами, содержащими только коллаген, как на 14-й день (LX2: 60%; Col: 100%), так и на 28-й день (LX2: 55%; Col: 91%) (рис. 4e), что позволяет предположить, что Присутствие клеток LX2 в органоидах подавляет рост сфероидов HCT116 и может привести к потере органоидной ткани опухоли.
Взаимосвязь между организацией и архитектурой коллагеновых волокон и фенотипом раковых клеток в органоидах CRC и биопсиях тканей CRC
Рост опухолевых сфероидов в органоидах с разной архитектурой коллагена предполагает, что он может моделировать различия между раком низкой и высокой степени злокачественности.Ранее мы наблюдали, что микроархитектура и топография коллагеновых волокон оказали значительное влияние на EMT в клетках CRC в этих органоидах. 9 Соответственно, чтобы оценить фенотипическое сходство между органоидами и биопсированной тканью, мы выполнили иммуногистохимический (IHC) анализ срезов тканей органоидов CRC и биопсии ткани CRC на маркеры, связанные с EMT и онкогенезом ( Suppl. Figs. 3-7 ) и использовали пользовательские алгоритмы сегментации в Visiopharm TM для количественной оценки их выражения.
Пролиферацию опухолевых клеток определяли путем окрашивания на Ki-67 и анализа его ядерной экспрессии ( Suppl. Fig. 3 ). Как в органоидах , культивируемых in vitro, и in vivo, в эксплантированных органоидах, экспрессия Ki-67 была выше в органоидах, содержащих только коллаген, по сравнению с органоидами LX2. Точно так же увеличение экспрессии Ki-67 было связано с более высокой степенью классификации опухолевых образцов (фиг. 5a). E-Cadherin — это белок адгезии между клетками, который присутствует в здоровых эпителиальных клетках толстой кишки и может быть утерян, когда раковые клетки подвергаются EMT.E-кадгерин был обнаружен вокруг клеточной мембраны и казался непрерывным вокруг положительных клеток на изображениях IHC ( Suppl. Fig. 4 ). Мы количественно оценили экспрессию E-кадгерина путем подсчета только клеток с полностью окрашенными мембранами (рис. 5b). In vitro органоиды LX2 показали значительно более высокую экспрессию E-кадгерина по сравнению с органоидами, содержащими только коллаген. In vivo , между группами не наблюдалось значительных различий в экспрессии E-кадгерина. Примечательно, что биопсия опухоли CRC продемонстрировала значительное снижение экспрессии E-кадгерина по сравнению со здоровой тканью толстой кишки, и экспрессия дополнительно снижалась с увеличением степени злокачественности опухоли (рис.5б). N-кадгерин — это еще один белок клеточной адгезии, который обычно обнаруживается в клетках колоректального рака, подвергшихся EMT. 22 Мы количественно оценили N-кадгерин таким же образом, как и E-кадгерин, но также подсчитали клетки с ядерной экспрессией N-кадгерина, поскольку это указывает на цитоплазматическую экспрессию, которая не полностью локализована на мембране ( Suppl. Рис. 5 ). 22 Органоиды, содержащие только коллаген, показали значительно более высокие уровни экспрессии N-кадгерина по сравнению с органоидами LX2 как in vitro, , так и in vivo ( Suppl.Рис. 4 и Рис. 5c). Биопсия опухоли CRC и здоровая ткань толстой кишки показали очень низкую экспрессию N-кадгерина в целом, при этом около 1-3% раковых клеток были положительными по окрашиванию N-кадгерином. Путь WNT / β-Catenin является важным путем, связанным с EMT, в котором белок β-Catenin в конечном итоге накапливается в ядре, где он действует как часть комплекса факторов транскрипции и способствует усилению онкогенных процессов в организме хозяина. 23 Мы количественно оценили экспрессию β-катенина путем подсчета клеток с положительным сигналом β-катенина, локализованным в ядре ( Suppl.Рис.6 ). Органоиды, содержащие только коллаген, имели более высокие уровни ядерного β-катенина по сравнению с органоидами LX2 в группах in vitro, и in vivo, , хотя разница не была статистически значимой ( in vitro: p = 0,058) (рис. 5d ). Образцы опухолевой ткани, полученные от пациентов с CRC высокой степени, показали самые высокие уровни ядерной экспрессии β-катенина, подтверждая предыдущие результаты о том, что более высокие степени CRC связаны с EMT. Путь фокальной киназы адгезии (FAK) также связан с онкогенезом и EMT.FAK — это тирозинкиназа, которая образует адгезию с компонентами матрикса, и высокие уровни FAK обнаруживаются в агрессивных раковых клетках, тогда как нокдаун FAK может снизить или устранить подвижность раковых клеток. 24 Мы количественно оценили FAK, измерив долю положительно окрашенной площади от общей площади опухоли ( Suppl. Fig. 7 ). Экспрессия FAK была значительно выше в образцах, содержащих только коллаген, по сравнению с органоидами LX2 в группах in vitro и in vivo (рис.5д). Интересно, что образец опухоли низкой степени злокачественности продемонстрировал самую высокую экспрессию FAK, в то время как образец опухоли высокой степени злокачественности имел повышенную экспрессию по сравнению с нормальной тканью толстой кишки, но более низкую экспрессию по сравнению с опухолью низкой степени злокачественности. Этот результат предполагает, что в органоидах, содержащих только коллаген, подвижность раковых клеток может быть увеличена, подобно опухолям человека. В совокупности, анализ экспрессии этой выбранной панели белков показывает, что сфероиды опухолевых клеток, встроенные в органоиды, содержащие только коллаген, показали средний фенотип, который коррелирует с более высокой степенью CRC, по сравнению со сфероидами, встроенными в органоиды LX2, фенотип которых, по-видимому, коррелирует с низким комплектация CRC.
Рисунок 5: Иммунофенотипирование опухолевых клеток в органоиде и клиническом образце.Образцы органоидов, культивированных in vitro, , органоидов, имплантированных in vivo, , и клинические биопсии CRC разного уровня были окрашены иммунным ответом на маркеры, связанные с EMT и онкогенезом, как указано. Результаты окрашивания анализировали с помощью Visiopharm и отображали в виде графика доли раковых клеток с: ( a ) ядерной локализацией Ki67; ( b ) с полностью интактной, локализованной на мембране экспрессией E-кадгерина; (c ) с экспрессией N-кадгерина; ( d ) с ядерной локализацией β-катенина.( e ) Отношение общей площади, соответствующей положительной экспрессии FAK в опухолевом сфероиде и клинических биоптатах CRC различной степени. Графики представляют среднее значение + стандартное отклонение. трех областей интереса из каждой выборки экспериментов, выполненных в трех экземплярах.
Сфероиды опухоли, выращенные в неорганизованной микросреде, более чувствительны к химиотерапевтическим средствам
Поскольку опухолевые сфероиды HCT116 продемонстрировали существенно разные фенотипы в LX2 и органоидах, содержащих только коллаген, мы предположили, что они также будут иметь разные ответы на клинически используемые химиотерапевтические агенты.Чтобы проверить эту гипотезу, мы подвергли опухолевому сфероиду органоиды 4 препаратам: 5-фторурацил (5-FU), который разрушает тимидилатсинтазу, и его клинически используемые комбинации препаратов FOLFOX и FOLFIRI, а также таргетную терапию Регорафениб. FOLFOX — это комбинация 5-ФУ с фолиевой кислотой (лейковорин) и оксалиплатином (противоопухолевое средство на основе платины). FOLFIRI представляет собой комбинацию 5-ФУ, фолиевой кислоты и иринотекана (ингибитор топоизомеразы). Регорафениб — это мультирецепторный ингибитор тирозинкиназы.
Органоиды обрабатывали в течение 72 часов, затем собирали и окрашивали на Ki67 и каспазу 3, чтобы определить долю клеток, которые были либо активно пролиферирующими, либо апоптозными, либо ни одного из них (рис.6а и б). Все химиотерапевтические препараты оказывали минимальное влияние на апоптоз опухолевых клеток в строме, организованной LX2. Напротив, сфероиды HCT116 в органоидах, содержащих только коллаген, были высокочувствительны ко всем 5-FU и его комбинациям и демонстрировали значительно более высокие уровни апоптотических клеток по сравнению с органоидами LX2. С другой стороны, все химиотерапевтические препараты останавливали пролиферацию опухолевых клеток как в LX2, так и в органоидах, содержащих только коллаген. Однако эффекты 5-FU и FOLFOX на остановку роста опухолевых клеток были значительно выше в органоидах, содержащих только коллаген, по сравнению с органоидами LX2.Интересно, что эффекты лечения FOLFIRI на остановку роста были значительно выше в органоидах LX2 по сравнению с органоидами, содержащими только коллаген. Наконец, Регорафениб вызывал значительную остановку роста опухолевых клеток, но с небольшой разницей между LX2 и органоидами, содержащими только коллаген.
Рисунок 6. Химиотерапевтическая чувствительность и экспрессия маркеров раковых стволовых клеток в органоидах CRC.Контрольный коллаген и органоиды LX2, как указано, подвергались воздействию различных химиотерапевтических средств в течение 72 часов, и была проанализирована экспрессия Caspase3 (измеренная как процент от всех клеток) ( a ) и Ki67 (измеренная как процент от контроля) ( б ).Экспрессию CD44 и CD133 количественно оценивали в контроле коллагена и органоидах LX2, как указано, ( c ) с использованием IHC ( d ). Графики представляют среднее значение + стандартное отклонение. трех областей интереса из каждой выборки экспериментов, выполненных в трех или более экземплярах.
Раковые стволовые клетки часто считаются менее чувствительными к химиотерапии по сравнению с остальной популяцией опухолевых клеток. Сообщалось, что HCT116 и другие клетки CRC экспрессируют несколько известных маркеров CSC, особенно CD44 и CD133. 25 Чтобы определить потенциальные различия в маркерах стволовых клеток между органоидами с упорядоченными (LX2) и неупорядоченными (только коллаген) стромами, мы измерили экспрессию CD44 и CD133 в сфероидах HCT16 в этих органоидах (рис. 6d). CD44 экспрессировался как в органоидах LX2, так и в органоидах, содержащих только коллаген, со значительно более высокими уровнями, обнаруженными в органоидах, содержащих только коллаген, по сравнению с органоидами LX2 (фиг. 6c). Экспрессия CD133 была ниже по сравнению с экспрессией CD44, но аналогичным образом была выше в органоидах, содержащих только коллаген, по сравнению с органоидами LX2.Эти результаты предполагают, что неупорядоченная строма на основе коллагена обогащает популяцию раковых стволовых клеток сфероидами HCT116, встроенными в органоиды, содержащие только коллаген.
Обсуждение
У пациентов опухоли растут и прогрессируют в течение многих лет, часто оставаясь в неинвазивном равновесии в течение длительных периодов времени, не вызывая каких-либо внешних симптомов. События, до конца не изученные, сдвигают опухоль от неинвазивного фенотипа к инвазивному, который связан с быстрыми изменениями TME, включая деградацию ECM и активацию стромальных клеток, а также миграцию и пролиферацию опухолевых клеток.Хотя 2D-культура клеток привела к множеству прорывов в исследованиях рака, она не может воспроизвести нюансы TME, которые, как было обнаружено, значительно влияют на прогрессирование опухоли. Опухоли не только состоят из множества типов клеток, которые секретируют уникальную комбинацию сигнальных факторов, но и раковые клетки прикреплены к решетке белков, составляющих ЕСМ, — физическому TME, и часто требуют ее. Это означает, что терапевтические средства, разработанные в системах 2D-культивирования, могут плохо применяться для лечения опухолей in vivo , оказывая влияние на пациентов, а также приводя к высоким затратам на разработку лекарств.Технология органоидов опухолей, разработанная в последние годы, устраняет недостатки традиционных систем культивирования клеток, воспроизводя некоторые уникальные особенности TME. 9–11 Мы недавно опубликовали несколько исследований, описывающих технологию органоидов опухоли, которая позволяет систематически манипулировать структурными особенностями TME и впоследствии проверять влияние на фенотип опухолевых клеток. 9–11 Несмотря на ценность трехмерных опухолевых органоидов, их поддержание в условиях искусственного культивирования in vitro не может полностью оценить рост опухолевых клеток in vivo .Однако мышиные модели in vivo плохо имитируют физиологию человека и кинетику роста опухоли, так как TME будет в значительной степени состоять из компонентов мыши. Целью этого исследования было преобразование репликативных свойств in vitro биоинженерных органоидов в модель in vivo , чтобы охватить лучшее из обоих методов. Мы воспроизвели нативную архитектуру TME, наблюдаемую в клинических биопсиях, с органоидами CRC, а затем имплантировали их голым мышам, чтобы подвергнуть их воздействию in vivo и физиологии.Наши результаты демонстрируют, что органоиды, изготовленные для повторения TME и фенотипа опухолей различных степеней, сохраняли архитектурные особенности ECM в течение до 4 недель in vivo , и, кроме того, клетки CRC сохранили свои исходные, предполагаемые фенотипы, связанные с классом.
В текущем исследовании мы использовали звездчатые клетки печени (LX2) для моделирования стромальных клеток, которые участвуют в ремоделировании коллагена в микросреде метастазов печени. 26–29 Результаты, демонстрирующие, что LX2-опосредованная ECM структурированная микроархитектура подталкивает метастатические клетки CRC HCT116 к эпителиальному фенотипу по сравнению смезенхимальный фенотип, индуцированный неструктурированной архитектурой ВКМ, особенно интересен, поскольку они предполагают, что при определенных условиях звездчатые клетки печени, которые, как известно, поддерживают ЭМП и рост метастазов в печени 9,30,31 , могут подавлять рост и распространение метастазов. если есть возможность создать структурированную матрицу вокруг метастатических очагов. Кроме того, клетки HCT116 продемонстрировали пониженную химиотерапевтическую чувствительность органоидов LX2. Другие также нацелены на звездчатые клетки печени (HSC) в качестве возможных TAF и в качестве факторов, способствующих созданию преметастатической среды для клеток CRC.Например, добавление кондиционированной среды от активированных HSC к клеткам CRC в 2D-культуре приводило к повышенной подвижности и инвазивным характеристикам опухолевых клеток. 31,32 Эти данные предполагают паракринный эффект HSC на опухолевые клетки, однако эти исследования были выполнены в нефизиологической 2D культуральной системе, которая не улавливает важные особенности TME, в отличие от нашей органоидной модели. Хотя паракринная секреция факторов из TAF может явно управлять прогрессированием рака, участие TAF не останавливается на уровне передачи сигналов от внешних клеток; TAF обладают способностью изменять структуру и организацию ECM, и понимание последующего воздействия на раковые клетки является важным шагом на пути к более точному моделированию оси TAF-раковые клетки.
Основным мотивом этого исследования является создание более совершенной модели in vitro опухолевой ткани путем включения, помимо опухолевых клеток, стромальных клеток и внеклеточного матрикса. Для достижения этой цели мы использовали восходящий подход для репликации отдельных компартментов опухолевой ткани, как показано на рис. 1. Нативная подслизистая оболочка толстой кишки богата коллагеном и населена смесью SMC, фибробластов, жировых и иммунных клеток. которые проинформировали нас о нашем решении использовать коллаген в качестве основного гидрогеля с фибробластами в качестве основного стромального компонента.Кроме того, опухолевые компартменты в биоптатах были типизированы агрегатами (очагами) раковых клеток, которые мы моделировали с помощью ракового сфероида. Этот подход воспроизводил плотную клеточность, кинетику диффузии и межклеточные контакты, характерные для опухолей человека. Наша система также по своей сути является модульной; каждый компартмент можно модифицировать независимо, чтобы воспроизвести динамику опухоль-строма с широким спектром опухолей. Используемые здесь клетки HCT-116 могут быть заменены клетками более низкого уровня злокачественности, клетками пациентов или гетерогенной смесью раковых клеток.Стромальный компартмент может быть модифицирован для включения более широкого диапазона клеток, более высоких концентраций коллагена или различных компонентов ECM, таких как ламинин, фибронектин или эластин. В нашей предыдущей работе мы использовали клетки гладкой мускулатуры толстой кишки в стромальном компартменте, чтобы воспроизвести естественную здоровую толстую кишку. 9 Мы также ранее продемонстрировали, что стромальные клетки на нашей платформе реагируют на биохимические манипуляции, в данном случае на аминопропионитрил (BAPN), ингибитор лизилоксидазы, который снижает способность ремоделирования коллагена гладкомышечных клеток.В опухолях человека набор паракринных сигналов (TGFβ1, PDGF, IL-1β и т. Д.) Управляет вовлечением стромальных клеток, многие из которых можно смоделировать в нашей системе. Фактически, воздействие TGFβ1 на органоиды опухоли дополнительно стимулировало реструктуризацию ВКМ, создавая сильно связанные коллагеновые волокна и приводя к более жестким органоидам (рукопись в стадии подготовки).
Важным наблюдением этого исследования является согласованность результатов между экспериментами in vitro, и in vivo в физиологических условиях, , оба из которых согласуются с нашими предыдущими выводами. 9,11 Эти результаты указывают на то, что специфическая архитектура ниши может помочь определить EMT или MET фенотип метастатических опухолевых клеток печени и может объяснить, почему некоторые опухоли плохо реагируют на некомбинаторную антипролиферативную химиотерапию. 33 Это подчеркивает важную особенность: способность наших опухолевых органоидов демонстрировать аналогичные фенотипы во встроенных опухолевых клетках, как это видно при клинической биопсии опухоли. Кроме того, мы можем испытать наши органоиды с помощью большой библиотеки низкомолекулярных ингибиторов, химиотерапевтических средств и экспериментальных соединений и ожидать корреляции между нашими результатами и результатами, обнаруженными клинически.Будущие направления могут включать использование математического моделирования для переноса результатов, найденных in vitro , в прогностическую информацию для прогноза пациента или ответа на лекарства. Наконец, мы продемонстрировали, что организация волокон и опосредованное фибробластами ремоделирование ВКМ, по-видимому, влияет на раковые клетки и коррелирует со степенью рака в клинических образцах, указывая на то, что эти показатели имеют значительный потенциал для использования в качестве прогностических и / или диагностических инструментов.
В целом, это исследование является первым, которое охарактеризовало модель in vitro TME на основе наблюдений за нативной тканью и подтвердило ее в контексте физиологии всего тела.Нетрадиционные лечебные векторы, нацеленные на ЕСМ или стромальные клетки, могут предоставить ценные возможности для разработки новых методов лечения или комбинированной терапии, которые будут синергетически взаимодействовать с существующими химиотерапевтическими или лучевыми технологиями. Управляя реакцией раковых клеток посредством изменений TME, более низкие дозы химиотерапии или облучения могут стать эффективными, тем самым уменьшая или устраняя многие из нежелательных побочных эффектов традиционных методов лечения рака (, например, , цитотоксичность в здоровых тканях), а также приводя к более низкие показатели устойчивости опухолевых клеток.Органоиды — многообещающий метод разработки и скрининга лекарств, поскольку они могут воспроизводить физиологию человека на высоком уровне. Однако понимание фармакокинетики и фармакодинамики по-прежнему требует использования моделей на животных, которые, однако, имеют свои собственные ограничения при переводе на людей. Здесь мы устраняем разрыв между исследованием in vitro и моделированием на животных с использованием имплантированных органоидов опухоли человека и описываем новый механизм контроля раковых клеток — микроархитектуру ECM.
Материалы и методы
Культура клеток
Звездчатые клетки печени человека, клетки LX2, были предоставлены доктором Скоттом Фридманом (Медицинская школа Икана на горе Синай, Нью-Йорк, Нью-Йорк). Клетки колоректальной карциномы человека, клетки HCT116, были получены из АТСС (№ CCL-247, АТСС, Манассас, Вирджиния). Оба типа клеток культивировали и размножали в пластиковых чашках, обработанных культурой тканей. Культуры пассировали, когда клетки достигли 70-90% конфлюэнтности. Оба типа клеток культивировали с минимальной необходимой средой Дульбекко (DMEM, Millipore-Sigma, St.Louis, MO), содержащий 10% фетальной бычьей сыворотки (FBS, Hyclone, Logan, UT). Клетки отделяли от субстрата с помощью трипсина / ЭДТА (Hyclone) и ресуспендировали в среде перед использованием в производстве органоидов или сфероидов.
Изготовление органоидов
Сфероиды клеток HCT116 (1,0 × 10 4 клеток каждая) получали путем гомогенного суспендирования клеток в культуральной среде при 1,0 × 10 5 клеток / мл с последующим распределением 100 мкл суспензии клеточной среды в каждую лунку 96-луночного круглодонного планшета со сверхнизким прикреплением (CoStar # 7007, Corning, Corning, NY).Клетки наблюдали каждый день в течение 3 дней, к тому времени сфероиды сформировали плотные скопления без отклонений и немедленно использовали для изготовления органоидов.
Органоиды были изготовлены, как недавно описано ( Suppl. Fig. 1a ). 9 Коллаген из хвоста крысы типа I (№ 354236, Corning) получали в соответствии с протоколом производителя в концентрации 2 мг / мл. Клетки LX2 обрабатывали трипсином и подсчитывали, затем суспендировали в подготовленном коллагене при 5,0 × 10 6 клеток / мл. Среда из планшетов, содержащих сфероиды, была аспирирована, и 100 мкл раствора LX2-коллагена были внесены пипеткой в каждую лунку сфероида, осторожно, чтобы не нарушить структуру сфероида.Смесь LX2-коллаген-сфероид медленно пипетировали вверх и вниз, чтобы приостановить сфероид, затем весь объем распределяли в специальную форму полидиметилсилоксана (DOW Sylgard 184, Мидленд, Мичиган) 9 , обеспечивая относительно центральное размещение сфероида внутри полимеризующийся гидрогель (30 мин при 37ºC) ( Suppl. Fig.1a ). После полной полимеризации коллагена медленно добавляли среду и удаляли формы. Органоиды культивировали в течение различной продолжительности в зависимости от объема эксперимента.
Подкожная имплантация
Шестинедельные самки бестимусных голых мышей были получены из Charles River Laboratories (Wilmington, MA). Животных анестезировали 2% изофлураном и перед операцией делали подкожную инъекцию кетопрофена в дозе 5 мг / кг. На дорсальной стороне примерно в 15 мм от средней линии были сделаны два небольших разреза кожи. Подкожные карманы были созданы с помощью тупой диссекции и имплантированы по одному органоиду на место. Разрезы закрывали викриловой нитью 4-0 (Ethicon, Somerville, NJ) и закрывали пленкой Tegaderm ™ (3M, Maplewood, MN).Все процедуры выполнялись в строгом соответствии с Руководством NIH по уходу и использованию лабораторных животных и политикой Институционального комитета по уходу и использованию животных Университета Уэйк Форест (IACUC) (протокол № A17-036). Животных умерщвляли через 2 и 4 недели путем асфиксии CO 2 с последующим смещением шейки матки. Кожные лоскуты открывали и извлекали эксплантаты органоидов.
Общая морфологическая оценка
Макроскопические изображения эксплантатов in vivo органоидов были получены камерой смартфона (Samsung, Сеул, Южная Корея) с метрической линейкой, удерживаемой в кадре изображения.Программное обеспечение ImageJ (National Institutes of Health, Bethesda, MD) использовалось для оценки размера эксплантата после начальной калибровки.
Химиотерапевтические процедуры
Органоиды со встроенными сфероидами культивировали в течение 72 часов, затем переносили в новые лунки и инкубировали со средой, содержащей химиотерапевтические препараты. Органоиды подвергали воздействию химиотерапевтических средств в течение дополнительных 72 часов перед анализом. Химиотерапевтические препараты были приготовлены с использованием следующих концентраций: 5-фторурацил 1 мМ, оксалиплатин 25 мкМ, иринотекан 50 мкМ, лейковорин 50 мкМ и регорафениб 50 мкМ.
Гистологический и иммуногистохимический (ИГХ) анализ
Образцы фиксировали в 4% параформальдегиде в течение ночи при 4 ° C, затем промывали фосфатно-солевым буфером (PBS) и хранили в 70% этаноле. После обработки парафином и заливки серийные срезы 5 мкм вырезали с помощью микротома (Leica Microsystems Inc., Buffalo Grove, IL) и помещали на предметные стекла. Для всех процедур окрашивания предметные стекла запекали в течение 1 часа при 60ºC с последующей стандартной депарафинизацией и регидратацией. Окрашивание гематоксилином и эозином (H&E) проводилось на основных предприятиях Института регенеративной медицины Уэйк Форест.Окрашивание пикросириусом красным (PRS) проводили с использованием коммерческого набора для окрашивания (№ 24901, PolySciences, Warrington, PA) в соответствии с протоколом производителя. Окрашивание трихромом по Массону проводили с использованием коммерческого набора для окрашивания (# HT15, Millipore-Sigma) в соответствии с протоколом производителя.
Для иммуногистохимии (ИГХ) все инкубации проводили при комнатной температуре, если не указано иное. Извлечение антигена проводили с использованием инкубации с протеиназой K (DAKO, Carpinteria, CA) в течение 15 мин.Образцы подвергали проницаемости 0,05% Triton-X (производитель вставок) в PBS в течение 5 мин. Неспецифическое блокирование антигена проводили с использованием инкубационного раствора для протеинового блока (# ab156024, Abcam, Cambridge, MA) в течение 30 мин. Затем слайды инкубировали с соответствующим первичным антителом против CK-18 (# ab82254, Abcam), FAK (# ab40794, Abcam), β-катенина (# 71-2700, Invitrogen-ThermoFisher), E-Cadherin (# ab40772, Abcam. ), N-кадгерин (# ab76011, Abcam), CD44 (# ab51037, Abcam), CD133 (# orb10288, biorbyt, Сан-Франциско, Калифорния) или Ki-67 (# ab16667, Abcam) в рекомендуемых разведениях в увлажненной камере в течение ночи. при 4 ° C.Затем предметные стекла тщательно промывали и инкубировали в течение 1 ч с подходящим вторичным антителом: биотинилированным антителом против кролика (BA-1000, Vector Laboratories) или биотинилированным антителом против мыши (BA-2000, Vector Laboratories). Затем предметные стекла промывали и инкубировали с реагентом VECTASTAIN ABC (PK-4000, Vector Laboratories) в течение 30 мин. Воздействие сигнала было рассчитано по времени и визуализировано, пока предметные стекла инкубировали с субстратом DAB (SK-4105, Vector Laboratories) или Vector Red (SK-5105, Vector Laboratories). Слайды с двойным окрашиванием следовали этому протоколу дважды подряд для каждого отдельного маркера.Первым использовали субстрат Vector Red, а вторым — DAB. Соответствующие контрольные слайды готовили для каждого состояния и каждой комбинации антител, пропуская инкубацию с первичным антителом. Слайды были закреплены с помощью MM24 (# 3801120, Leica, Wetzlar, Germany), и изображения световой микроскопии с использованием линейно поляризованного света для срезов, окрашенных PSR, были получены с помощью микроскопа Olympus BX63 (Olympus, Center Valley, PA) с Olympus DP80. камера (Олимп).
Анализ изображений и количественная оценка
Размер сфероида был оценен с использованием световых микрофотографий, окрашенных H и E, и сценария MatLab (2018b, MathWorks, Natick, MA) для количественного определения среднего диаметра.Количество инфильтрирующих кровеносных сосудов и размер сосудов определяли количественно с помощью скрипта MatLab. Изображения были получены с помощью микроскопа Olympus IX83 (Olympus, Center Valley, PA), оснащенного камерой Hamamatsu Orca-Flash 4.0 (Hamamatsu, Сидзуока, Япония). Сигнал
PRS количественно оценивали двумя способами: анализ оттенка сигнала коллагена и сегментация геометрических параметров коллагеновых волокон. Анализ оттенка для выявления различных уровней связывания коллагена и фибрилляции был выполнен с использованием сценария MatLab.Сегментация и количественная оценка параметров волокна были выполнены с использованием CT-FIRE (Лаборатория оптических и вычислительных приборов, Университет Висконсина). 21
Оттенок сигнала трихрома Массона был определен количественно аналогично анализу оттенка PRS. Красные и синие пиксели идентифицировали и подсчитывали с помощью скрипта MatLab. Затем для сравнения рассчитывались отношения цветных пикселей к общему количеству пикселей ткани.
изображений IHC были импортированы как несжатые файлы в программное обеспечение Visiopharm (Broomfield, CO) для анализа и количественной оценки.В образцах, где опухолевые клетки было трудно отличить от стромальных клеток ( in vitro, и in vivo, имплантированных органоидов), был написан сценарий для деконволюции сигнала Vector Red с последующим выделением окрашенных Vector Red позитивных клеток CK-18, которые специфически метят HCT116. клетки. После сегментации клеток HCT116 был написан второй сценарий для деконволюции сигнала DAB и количественной оценки экспрессии или локализации: β-катенина, E-кадгерина, FAK, Ki67 и N-кадгерина. Для β-катенина и Ki67 ядра помечали как положительные или отрицательные для окрашивания DAB и подсчитывали.Для E-кадгерина и N-кадгерина клетки были отмечены как положительные, если они имели полную мембранную локализацию DAB, и отрицательные в противном случае. Для FAK были получены отношения общей площади опухоли, окрашенной положительно на DAB.
Статистический анализ
Все эксперименты проводили с n = 3, если не указано иное. Статистический анализ параметрических данных выполняли с использованием t-критерия Стьюдента или одностороннего дисперсионного анализа (ANOVA) с множественным сравнением Тьюки post hoc .Статистический анализ непараметрических данных проводился с использованием критериев хи-квадрат Колмогорова-Смирнова. Значимость была определена как α ≤ 0,05, и все p-значения представлены вместе с соответствующими наборами данных. Программное обеспечение GraphPad Prism v6.0 (GraphPad Software, La Jolla, CA) использовалось для всех анализов.
Вклад авторов
Эксперименты, разработанные MD, S.H., A.S. и S.S. Доктор медицины выполнил все экспериментов in vitro из . M.D., S.H. и A.D. провели все эксперимента in vivo .M.D., A.D. и E.W. выполнили иммуногистохимическое окрашивание и визуализацию. M.D. разработал и выполнил весь анализ цифровой сегментации. Доктор медицины разработал все фигуры. M.D., S.H. и S.S. подготовили рукописный текст. Все авторы рассмотрели данные и текст.
Конкурирующие интересы
У авторов нет конкурирующих интересов, о которых следует заявлять.
Благодарности
Мы благодарим доктора Скотта Фридмана из Медицинской школы Икана на горе Синай, Нью-Йорк, за предоставление клеток LX2.
3D-модели колоректальной опухоли in vitro: преимущества биотехнологии для повторения ранних стадий развития опухоли
Колоректальный рак (CRC), форма рака, которая возникает из толстой или прямой кишки, является третьей по распространенности злокачественной опухолью и основная причина смертности от рака в западном мире [1].Несмотря на относительно высокую выживаемость на ранних стадиях заболевания, распространение CRC на другие части тела, в частности на печень, приводит к трудно поддающимся лечению состояниям, которые обычно имеют плохой прогноз (14% 5- относительная выживаемость в течение года при КРР IV стадии, согласно данным исследования SEER 2007–2014 [2]). Поэтому необходимы новые и простые модели инициирования, поддержания и инвазивных процессов CRC, чтобы помочь понять болезнь, а также разработать и протестировать новые методы лечения, которые эффективно блокируют прогрессирование опухоли, что в конечном итоге приводит к общему увеличению выживаемости пациентов.
CRC был связан с хроническим воспалением и, все чаще, с атипичными воспалительными реакциями, как обсуждается в полном обзоре Lasry et al [3]. Известно, что воспалительные процессы запускаются на самых ранних стадиях развития опухоли, напрямую влияя на развитие и прогрессирование опухоли. С начала 20-го века опухоли описывались как «незаживающие раны» [4]: настройка микросреды опухоли (TME) и ее ремоделирование осуществляются путем привлечения связанных с опухолью макрофагов и связанных с раком фибробластов, функция которой управляется раковыми клетками, способствуя инвазии и колонизации дистальных тканей [5].Одной из основных проблем современных доклинических моделей in vitro для исследования CRC является использование стандартных пластин из полистирола (TCP, пластинка тканевых клеток) в качестве субстратов для клеточных культур. В этих традиционных моделях клетки (обычно иммортализованные клеточные линии) выращивают как плоские монослои и оценивают (1) подвижность / метастатический потенциал, (2) экспрессию соответствующих биомаркеров и (3) эффективность / устойчивость к лекарственным средствам. Были предложены более подходящие модели in vitro с включением второго типа клеток, т.е.е. совместное культивирование, чтобы понять взаимосвязь между раком и стромальными воспалительными клетками в микроокружении опухоли (TME). Однако сложность возникновения и прогрессирования опухоли трудно описать в таких двумерных (2D) системах; как уже было продемонстрировано за последнее десятилетие, эта стратегия приводит к очень низкому уровню успеха с точки зрения in vivo переводимости результатов [6-8]. В частности, широко обсуждались ограничения систем 2D in vitro для точной репликации взаимодействий как между клетками, так и между клетками и матриксом в соответствующем TME, подчеркивая необходимость включения основных компонентов для повторения TME и его развития: (a ) пространственная конфигурация или трехмерная (3D) культура клеток [9–11], (b) включение поддерживающих материалов с механическими свойствами, аналогичными свойствам внеклеточного матрикса (ECM) во время прогрессирования заболевания [12–14] ], и (c) сложность передачи сигналов in vivo и давления кислорода при изучении развития и прогрессирования рака [15].В результате существует острая необходимость в разработке более надежных моделей 3D in vitro , которые очень похожи на раковые ткани человека, потенциально способные интегрировать несколько типов клеток в контролируемую среду. Создание многоклеточных сфероидов — первый пример моделирования опухолей в 3D. Основная критика сфероидных культур присуща частичному повторению TME, поскольку сфероиды образуют внутренние зоны, содержащие покоящиеся и гипоксические клетки. Чтобы отразить структурную архитектуру ECM в 3D, модели in vitro должны включать знания биологии рака, материаловедения и биоинженерии, чтобы воссоздать наиболее важные особенности in vitro : механические и химические характеристики мишени ткани и правильный транспорт питательных веществ, кислорода, продуктов метаболизма и сигнальных молекул (рисунок 1).
Увеличить Уменьшить Сбросить размер изображения
Рис. 1. Парадигма тканевой инженерии применительно к раку: химические (растворимые факторы), физические (межтканевое давление, текучие материалы) и механические (жесткость) свойства являются фундаментальными проектными параметрами, которые следует учитывать при повторении микросреды опухоли (TME) in vitro . Эти параметры варьируются в зависимости от стадии прогрессирования опухоли, включая разные типы клеток и способствуя поляризации клеток в сторону подвижного фенотипа, т.е.е. эпителиально-мезенхимальный переход (ЭМП). Инженерные модели 3D in vitro , в принципе, обеспечивают более универсальную, доступную и высокопроизводительную систему, позволяющую ускорить понимание болезни и возможность применения вмешательств на доклинической стадии.
Загрузить рисунок:
Стандартный образ Изображение высокого разрешенияВ течение последнего десятилетия роль жесткости в поведении клеток широко исследовалась, в основном критикуя использование стандартного TCP-субстрата для 2D-культуры, поскольку он обладает значениями жесткости (порядка ГПа), не обнаруживаемыми в мягких тканях человека. здоровые или патологические.Жесткие субстраты для культивирования не являются репрезентативными для таких тканей и, вместе с геометрически ограниченным ростом клеток, они влияют на регуляцию морфологии клеток и задействованные сигнальные каскады [16]. Кроме того, следует учитывать продукты клеточной активности: системы 2D in vitro представляют собой упрощенные монослои живых пролиферирующих клеток (поскольку мертвые клетки в основном удаляются из культуры во время замены среды [9]), тогда как модели 3D in vitro способны точно представлять патологическую и гетерогенную замкнутую смесь живых клеток, мертвых клеток и мусора, которая в конечном итоге влияет на поведение раковых клеток.
Несмотря на все эти проблемы, 2D-культуры все еще широко используются в качестве высокопроизводительных моделей для идентификации опухолеспецифических маркеров и для скрининга лекарств [17], хотя 3D-модели в принципе могут предсказывать лучшее поведение опухолевых клеток и помогать переводить результаты. в клинику [18]. Перед исследователями стоит задача разработать простые, воспроизводимые и легкодоступные 3D-модели in vitro , чтобы преобразовать огромный объем знаний, накопленных на 2D-монослоях за последние 50 лет, в более физиологически релевантные данные с целью ускорения результатов в предварительных исследованиях. клинические исследования, скрининг терапевтических препаратов и ранняя диагностика рака.С этой целью могут быть особенно полезны подходы тканевой инженерии, обеспечивающие точный контроль над химическими, физическими и механическими свойствами (как показано на рисунке 1). За последнее десятилетие было выпущено огромное количество литературы, в которой обсуждаются оптимальные материалы, протоколы культивирования и высокопроизводительный анализ. Среди большого количества материалов и каркасов, описанных в литературе для конструирования таких моделей 3D in vitro , альгинатные гидрогели остаются одними из наиболее широко используемых, когда речь идет о биопроизводстве воспроизводимых и надежных систем.Альгинат — это природный полисахарид, извлеченный из бурых водорослей, обладающий высокой биосовместимостью, биоразлагаемостью, нецитотоксичностью и чрезвычайно биоинертным [19, 20]. Что наиболее важно, альгинат способен быстро инкапсулировать живые клетки со значительно меньшей жесткостью и более высокой эластичностью, чем у TCP [21, 22], и его свойства можно легко отрегулировать в соответствии с требованиями биологического производства для получения трехмерных конструкций с контролируемыми характеристиками, например размер, форма [23, 24]. Исследования культуры сфероидов и скрининга лекарств продемонстрировали важность третьего измерения при изучении устойчивости к противоопухолевым препаратам (больше по сравнению с обычными однослойными культурами).Тем не менее, существует потребность в более совершенном моделировании взаимодействия клеток с TME, чтобы (1) оптимизировать химиотерапевтические кандидаты, (2) доказать их эффективность и (3) передать результаты в клинику. Shakibaei и др. [25] впервые продемонстрировали преимущества использования CRC-клеток в альгинате в качестве 3D in vitro моделей для химиотерапевтического тестирования, сообщив о преимуществах использования более актуальных моделей для изучения и предотвращения явлений лекарственной устойчивости.
В этом исследовании мы сравниваем преимущества использования биофабрикатов для исследований рака по сравнению с золотым стандартом in vitro моделями , однослойными клетками TCP и трехмерными сфероидами, соответственно.В частности, мы подчеркиваем срочность разработки модели CRC на ранней стадии, поскольку большинство опубликованных исследований больше сосредоточены на метастатических процессах, связанных с CRC. Подходы с использованием тканевой инженерии были использованы для трехмерного моделирования ранней стадии CRC посредством инкапсуляции клеток эпителиальной колоректальной карциномы человека HCT-116 в альгинате; поэтому на васкуляризацию трехмерных конструкций не обращали внимания. Увеличение жесткости матрицы (около 25 кПа) вызывает фенотипические вариации HCT-116 в сторону более агрессивного и инвазивного поведения [24, 26], поэтому мы решили приготовить материалы с жесткостью ниже этого значения (снижая дальнейшую активацию фокальной адгезии [27]. ].Мы адаптировали процесс изготовления для получения 3D-модели in vitro на основе инкапсуляции клеток HCT-116 в альгинатные шарики, обеспечивая точный контроль над размером шариков и начальным количеством клеток. Это помогло нам соответствовать механическим требованиям и требованиям по обеспечению кислородом, регулируя концентрацию альгината (2% мас. / Об.), Параметры изготовления (напряжение, скорость потока, частота), концентрацию хлорида кальция (500 мМ) и время гелеобразования (5 мин) для получения микросферы диаметром менее 600 мкм м (критическая толщина для диффузии кислорода в гидрогелях [28–30]) и конечной жесткостью примерно 10–15 кПа [31–33].Кроме того, количество клеток было выбрано, избегая высоких значений плотности, типичных для поздних стадий прогрессирования опухоли, с более инвазивным поведением клеток. Мы сравнили производительность биофабричных 3D-моделей с золотым стандартом, используемым в настоящее время в исследованиях рака, то есть TCP (2D) и сфероидами (3D), сосредоточив внимание на росте клеток и экспрессии CD44 (как маркера популяции стволовых клеток, прогрессирование опухоли и метастатический потенциал [34]) и HIF-1 α (как маркер внутренней гипоксии и прогрессирования опухоли [15, 35]).Мы полагаем, что предлагаемый метод изготовления позволяет создать модели in vitro, которые более близко напоминают физические, механические и биохимические характеристики ткани колоректального рака человека. Мы считаем, что наша 3D-модель CRC in vitro является подходящей, простой, хорошо воспроизводимой и легко доступной системой для изучения биологии рака и поведения опухолевых клеток на ранних стадиях прогрессирования опухоли. Новизна этого подхода позволит выявить и понять роль ключевых факторов, влияющих на рост и инвазию опухоли; Эта простая, надежная и легко воспроизводимая биотехнологическая модель in vitro станет отправной точкой для дальнейших исследований, включая доклинические модели других типов рака, с конечной целью ускорения скрининга лекарств и выявления механизмов лекарственной устойчивости на различных этапах развитие опухоли.
2.1. Приготовление альгинатных шариков
2.1.1. Материалы
Натриевая соль альгиновой кислоты из бурых водорослей (Mw 120 000–190 000 г / моль, соотношение M / G 1,56, каталожный номер A0682, Sigma Aldrich, UK) растворяли до концентрации 2% (мас. / Об. ) в забуференном HEPES физиологическом растворе (HBS), состоящем из 150 мМ NaCl класса AR (433209, Sigma-Aldrich, Великобритания) и 20 мМ HEPES (h5034, Sigma Aldrich UK). Раствор механически перемешивали до полной солюбилизации альгината (1000 об / мин, 30 ° C, 2 ч). Наконец, раствор альгината стерилизовали фильтрованием с использованием 0.22 мкм мкм фильтр PES (SLGP033RS, Merck, UK). Готовили 500 мМ раствор хлорида кальция (HEPES) (C1016, Sigma Aldrich, UK) и стерильно фильтровали перед использованием (фильтр PES 0,22 мкм, мкм, SLGP033RS, Merck, UK).
2.1.2. Подготовка микрошариков
В этом исследовании инкапсулятор Inotech (IE-50, серийный № 05.002.01–2005, Inotech) был оснащен соплом с внутренним диаметром 300 мкм м. Вкратце, одноразовый шприц наполняли 2% (мас. / Об.) Раствором альгината в HBS, собирали капли альгината и физически желировали в 500 мМ хлориде кальция, осторожно перемешивая (100 об / мин), чтобы избежать агрегации шариков во время стадии гелеобразования.Для стандартизации процедуры изготовления был выброшен 1 мл раствора альгината, и сформированные шарики выдерживались в ванне для гелеобразования в течение 5 минут при комнатной температуре. По истечении этого времени альгинатные шарики собирали с помощью стерильных 15-миллиметровых вставок Netwell ™ с полиэфирной мембраной размером 74 мкм мкм (# 3477, Констар, США), промывали дистиллированной водой и затем собирали в дистиллированной воде до конечного объема 2 мл. . Во время оптимизации изготовления микрошариков (1) скорость потока раствора альгината, (2) вибрация экструзионной головки (частота и амплитуда) и (3) напряжение электрического поля варьировались для получения сферических шариков диаметром менее 600 мкм Диаметр м.
2.2. Клеточная культура
Клеточная линия колоректального рака человека HCT-116 (CCL-247 ™) была приобретена в ATCC (США) и культивирована в среде DMEM / F-12 (D6546) с добавлением 10% (об. / Об.) Фетального бычьего сыворотка (FBS, F7524) и 1% (об. / об.) пенициллин / стрептомицин (P4333) в увлажненной атмосфере воздуха с 5% (об.) CO 2 при 37 ° C. Обратите внимание, что все материалы были приобретены у Sigma-Aldrich (Великобритания), если не указано иное. Клетки поддерживали при конфлюэнтности менее 80% и выбрасывали по достижении пассажа номер 25.
2.2.1. 3D
in vitro модель : гранулы альгинатаКлетки HCT-116 суспендировали в 2% (мас. / Об.) Растворе альгината в HBS. Вкратце, клетки отделяли с помощью 0,25% трипсина-ЭДТА (T4049, Sigma-Aldrich, UK) после достижения слияния 70–80%, центрифугировали и повторно суспендировали в среде DMEM / F-12 с добавками. Аликвоты 1 × 10 6 , 2 × 10 6 и 5 × 10 6 клеток центрифугировали и осторожно суспендировали в 1 мл 2% (мас. / Об.) Раствора альгината, получая конечная суспензия HCT-116 в альгинате 1 × 10 6 клеток мл −1 , 2 × 10 6 клеток мл −1 и 5 × 10 6 клеток мл — 1 соответственно.Суспензии клеток в альгинате пипетировали в стерильный одноразовый шприц и устанавливали на привод шприца системы инкапсулятора, помещенный в шкаф безопасности категории II. Оптимизированные параметры изготовления были использованы для изготовления моделей 3D in vitro (скорость потока = 8,9 мл мин -1 , частота = 5500 Гц, напряжение = 1 кВ), шарики, инкапсулирующие HCT-116, были сброшены и загущены в течение 5 мин в раствор хлорида кальция и, наконец, собирают, как описано ранее. После сбора гранулы переносили в 12-луночные планшеты с полной средой для культивирования клеток DMEM / F-12 и культивировали в увлажненной атмосфере воздуха с 5% (об. / Об.) CO 2 при 37 ° C до 5 дней.Обратите внимание, что все части системы инкапсулятора были стерилизованы 70% -ным (об. / Об.) Раствором этанола в воде и подвергались УФ-излучению в течение 30 минут перед использованием.
2.2.2. 3D
in vitro Модель : сфероидыКлетки HCT-116 (1000 клеток / лунка) высевали в 96-луночные сфероидные микропланшеты Corning ® с ультранизким прикреплением (# 4515) в среде DMEM / F-12 с добавками и культивировали в увлажненной среде. 5% (об. / Об.) CO 2 воздушная атмосфера при 37 ° C.
2.2.3. 2D
in vitro модель : обычные монослои клеток из пластика культуры ткани (TCP)клеток HCT-116 засевали с плотностью 0.5 × 10 4 клеток см -2 в полистирольных 12-луночных планшетах с плоским дном (# 3513, Corning, UK), приблизительно с 1,9 × 10 4 клеток HCT-116 на лунку. Чтобы оценить влияние альгината на культивируемые клетки, HCT-116, суспендированный в 2% (мас. / Об.) Растворе альгината, использовали в качестве контроля.
2.3. Альгинатные микрошарики
2.3.1. Определение размера
Гранулы альгината были охарактеризованы по размеру и форме сначала как функция различных параметров изготовления, а затем как функция количества инкапсулированных клеток.Фазово-контрастные изображения изготовленных шариков получали с использованием инвертированного микроскопа (DMI6000B, Leica Microsystems, Великобритания), соединенного с камерой 5.5 Neo sCMOS (Андор, Великобритания). Программное обеспечение μ Manager (v.1.46, Vale Lab, UCSF, USA) использовалось для управления микроскопом и камерой, а также для захвата изображений. Для съемок использовались сухой объектив 2,5 × и сухой 10 × . Изображения обрабатывались и анализировались с помощью программного обеспечения ImageJ (v1.49p, http://rsb.info.nih.gov/ij). Обратите внимание, что минимальное количество 50 шариков для каждого эксперимента (с n = 3 техническими повторами) было отображено и измерено для обеспечения статистической достоверности.
2.3.2. Растворение гранул
Для мягкого растворения альгинатных микрогранул и восстановления жизнеспособных инкапсулированных клеток HCT-116 использовали следующий метод. Раствор, связывающий кальций, был приготовлен из HEPES (h5034, Sigma Aldrich, UK) и дигидрата тринатрийцитрата (W302600-K, Sigma Aldrich, UK) в фосфатно-солевом буфере (PBS, D1408, Sigma Aldrich, UK) до конечной концентрации 100 мМ и 500 мМ соответственно. PH доводили до 7,3 добавлением 1 M NaOH (водн.) (J / 7620/15, Thermo Fisher Scientific, UK) для обеспечения физиологического значения pH во время разрушения шариков.Перед использованием разрушающий раствор стерильно фильтровали (0,22 мкм мкм фильтр PES, SLGP033RS, Merck, UK), затем микрошарики промывали PBS (n = 2, комнатная температура), 2 мл разрушающего гранулы раствор добавляли в каждую лунку (содержащую в среднем 30 000 шариков) и инкубировали в течение 10 мин при 37 ° C, 5% (об. / об.) CO 2 . Наконец, чтобы гарантировать полное разрушение альгинатных микрогранул и ресуспендирование клеток, был проведен дополнительный этап осторожного пипетирования, и окончательное среднее количество клеток было выделено 37000.
2.4. Жизнеспособность и рост клеток
2.4.1. Анализ «живой / мертвый»: проточная цитометрия
Сбор данных проточной цитометрией проводили после окрашивания с помощью набора «живой / мертвый» (L3224, Thermo Fisher Scientific, Великобритания). Вкратце, клетки HCT-116 инкапсулировали в альгинатные шарики, высевали в 12-луночные планшеты и культивировали в стандартных условиях (временная точка = 5 дней, n = 3). В качестве контроля клетки HCT-116 высевали в 12-луночный планшет (0,5 × 10 4 клеток на см -2 ) и культивировали с альгинатом или без него.В каждый момент времени 2D-контроли промывали PBS, отделяли трипсином-EDTA (5 мин, 37 ° C), а затем клеточные суспензии переносили во флаконы на 1,5 мл. Для 3D-систем шарики промывали PBS в каждый момент времени, в каждую лунку добавляли 1 мл буфера для растворения и после инкубации (10 мин при 37 ° C) суспензии клеток переносили во флаконы на 1,5 мл. После центрифугирования (1000 об / мин, 5 мин, комнатная температура) 50 мкл л окрашивающего раствора (приготовленного в соответствии с инструкциями производителя) и 50 мкл мкл PBS были добавлены в каждый флакон, клетки осторожно ресуспендировали и инкубировали в течение 15 мин при комнатной температуре.Были выполнены две стадии промывки PBS (1000 об / мин, 5 мин, комнатная температура), и, наконец, клетки осторожно ресуспендировали в PBS и хранили на льду перед измерениями проточной цитометрией. Подсчет живых / мертвых клеток измеряли с помощью проточной цитометрии (анализатор клеток / проточный цитометр BD LSRFortessa), обнаруживая живые (кальцеин-AM, 494/517 нм) и мертвые (гомодимер этидия-1, 517/617 нм) клетки в 5000 отдельных случаях.
2.4.2. Анализ «живой / мертвый»: визуализация
клеток HCT-116, инкапсулированных в альгинатные шарики, были дополнительно визуализированы после окрашивания с помощью набора «живой / мертвый» в различные моменты времени (24, 48 и 72 ч).Вкратце, HCT-116 инкапсулировали в альгинатные шарики, помещали в 12-луночные планшеты и культивировали в стандартных условиях. В каждый момент времени шарики промывали PBS, переносили в 96-луночный планшет и, наконец, в каждую лунку добавляли 50 мкл мкл окрашивающего раствора (приготовленного в соответствии с инструкциями производителя) и 50 мкл мкл PBS. Инкапсулированные клетки инкубировали (15 мин, комнатная температура). Наконец, были выполнены две стадии промывки PBS и были получены изображения шариков с использованием инвертированного флуоресцентного инвертированного микроскопа (Leica DMI6000B, Leica Microsystems, Великобритания), соединенного с 5.5 Камера Neo sCMOS (Андор, Великобритания). Программное обеспечение μ Manager (v.1.46, Vale Lab, UCSF, USA) использовалось для управления микроскопом и камерой, а также для захвата изображений. Для регистрации использовался сухой объектив 10 × (N Plan 10x / 0,25 Ph2, Leica) с фильтрующими кубиками I3 (BP 450-490, LP 515) и N2.1 (BP 515-560, LP 590). Z-стопки были получены каждые 50 мкм м. Изображения обрабатывались с помощью ImageJ v1.49p.
2.4.3. Трипановый синий
Жизнеспособность инкапсулированных клеток HCT-116 измеряли в разные моменты времени, и результаты сравнивали с 2D-контролями.Трипановый синий использовался в качестве качественного и простого метода для мониторинга жизнеспособности клеток с течением времени, то есть через 24, 48 и 72 часа после изготовления шариков. Для 3D-системы шарики помещали в 12-луночные планшеты и культивировали в стандартных условиях, как описано ранее. В случае 2D-контроля клетки промывали PBS, отделяли раствором трипсин-EDTA (5 мин, 37 ° C) и переносили во флаконы. Суспензии клеток центрифугировали (1000 об / мин, 5 мин, комнатная температура) и осадок клеток осторожно суспендировали в 900 мкл мкл PBS и 100 мкл мкл 0.В каждый флакон добавляли 4% (мас. / Об.) Трипанового синего. Наконец, 10 мкл мкл клеточной суспензии осторожно пипетировали в гемоцитометр для подсчета исключения живых / мертвых с использованием инвертированного светового микроскопа (Olympus CKX41). Среднее количество живых / мертвых и процент были получены в каждый момент времени (n = 4). Скорость роста клеток в альгинатных микрошариках (около 30 000 шариков в каждом 12-луночном планшете, n = 4 для каждой временной точки) сравнивали со стандартной TCP (начальная плотность посева 2 × 10 4 клеток см −2 , n = 4 для каждой временной точки) и сфероида (начальная плотность засева 3 × 10 3 клеток см −2 , n = 3 для каждой временной точки) контролируют, измеряя количество жизнеспособных клеток в разные моменты времени.Альгинатные микрошарики разрушали, и клетки на TCP и сфероидах подвергали трипсинизации, следуя тем же процедурам, которые описаны выше. Собранные клетки центрифугировали (1000 об / мин, 5 мин, комнатная температура) и осторожно суспендировали в 900 мкл мкл PBS с последующим добавлением 100 мкл мкл 0,4% (мас. / Об.) Раствора трипанового синего (водн.). Наконец, 10 мкл мкл клеточной суспензии вносили пипеткой в гемоцитометр для подсчета исключения живых / мертвых с использованием инвертированного светового микроскопа (Olympus CKX41). Число клеток было усреднено по техническим повторениям (n = 3) и биологическим повторениям (по крайней мере, n = 3) для каждой временной точки.
2,5. Биомаркеры опухолевой прогрессии: CD44 и HIF-1
αКлетки HCT-116 культивировали в 2D и 3D моделях in vitro (как описано ранее) и экспрессия CD44 (общая, охватывающая как стандартные, так и вариантные изоформы белок) и HIF-1 α , измеренные с течением времени, то есть через 3 и 5 дней. Контроли (2D, TCP) промывали PBS, клетки отделяли, используя 0,25% трипсин-EDTA, центрифугировали (1000 об / мин, 5 мин) и суспендировали в буфере FACS (раствор фосфатного буфера с добавлением 5% FBS и 0.1% (мас. / Об.) Азида натрия). Альгинатные микрошарики (3D) сначала промывали HBS, затем разрушали добавлением 2 мл буфера для растворения, как описано ранее, и, наконец, клеточные суспензии переносили во флаконы на 2 мл и центрифугировали при 1000 об / мин в течение 5 минут. Сфероиды HCT-116 (3D ) собирали и дезагрегировали на суспензии индивидуально диспергированных клеток путем инкубации с 0,25% трипсин-ЭДТА в течение 15 мин при 37 ° C. Затем клетки центрифугировали при 1000 об / мин в течение 5 мин. Приблизительно 500000 клеток собирали для каждого метода культивирования и сначала окрашивали 100 мкл мкл крысиного антитела против человеческого CD44: AF647 (1: 400, 0,0.125 мкг г антитела для окрашивания 0,5 × 10 6 клеток в объеме 100 мк л) (Клон IM7, BioLegend), затем фиксировали 0,4% PFA в течение 15 мин при комнатной температуре, проницаемость 0,25% Triton-X (в PBS BSA 0,1%) в течение 15 минут при комнатной температуре и окончательно окрашивают 100 мкл мкл мышиных антител против HIF-1 человека α : PE (1:40, 0,0625 мк г антитела для окрашивания 0,5 × 10 6 клеток в объеме 100 мкл л) (Клон 546-16, BioLegend) в буфере FACS в течение 30 мин при комнатной температуре.Чтобы удалить избыток несвязавшегося антитела, были выполнены два последовательных этапа промывки / центрифугирования с PBS. Наконец, образцы были суспендированы в 400 мкл мкл PBS перед измерениями проточной цитометрией. Экспрессия двух маркеров была обнаружена по меньшей мере на 2000 живых и индивидуальных клетках с использованием цитометра BD LSRFortessa (BD Bioscience, Сан-Хосе, Калифорния, США), оснащенного программным обеспечением FACSDiva (v8.0.1). Данные анализировали с помощью FlowJo (vX.0.7, Tree Star, Ashland, OR, USA) после гейтирования живых клеток в окне FSC / SSC и синглетов в окне FSC-H / FSC-A, соответственно.MFI изотипического контроля использовали в качестве порогового значения для расчета MFI интересующего маркера.
2.6. Статистический анализ
Данные анализировали с помощью программного обеспечения GraphPad Prism 7 (GraphPad Software, Inc., Сан-Диего, Калифорния, США). Для сравнения экспрессии биомаркеров использовали двухфакторный дисперсионный анализ. Различия между группами считались значимыми при значении P <0,05.
3.1. Изготовление и определение характеристик альгинатных шариков
Inotech IE-50 — это гибкая система микрокапсулирования, которая обеспечивает контролируемый и автоматический процесс изготовления шариков.Процесс изготовления может быть адаптирован путем изменения диаметра сопла, вязкости раствора и других дополнительных контролируемых параметров для получения однородных сферических шариков с контролируемым размером. В этом исследовании контролировались следующие параметры: скорость потока раствора альгината, вибрация экструзионной головки (частота и амплитуда) и напряжение электрического поля (эффект показан на рисунке 2 (а)). Во время первого процесса оптимизации для изготовления альгинатных шариков использовали 2% (мас. / Об.) Раствор альгината в HBS (водн.).На этом этапе альгинатные шарики получали изображение с помощью светового микроскопа и классифицировали по размеру и форме для каждого набора параметров изготовления (таблицы 1–3). Оптимальный набор параметров для получения сферических и однородных альгинатных шариков диаметром 540 ± 20 мкм м бус был выбран следующим образом: 300 мкм м сопло, частота 5,5 кГц, напряжение 1 кВ, 8,9 мл мин — 1 расход.
Увеличить Уменьшить Сбросить размер изображения
Рисунок 2. Изготовление альгинатных шариков с использованием 2% (мас. / Об.) Альгината в HBS; Параметры изготовления: расход 8,9 л мин −1 , частота 5500 Гц, напряжение 1 кВ. (а) Влияние параметров изготовления: пример частоты колебательного напора при разрыве потока альгината. Обратите внимание, что с увеличением частоты поток становится более однородным, возвращая частицы монодисперсного размера. (b) Схема растворения гранул, позволяющая легко проводить последующий анализ культивируемых клеток. (c) Пример пустых альгинатных шариков, полученных после оптимизации процесса изготовления (размер 540 ± 20 мкм, мкм, масштабная линейка 600, мкм, мкм).(d) Пример клеток HCT-116, инкапсулированных в альгинатные шарики (начальная плотность клеток 1 × 10 6 клеток мл -1 , масштабная линейка 300 мкм мкм). (e) Пример клеток HCT-116, инкапсулированных в альгинатные шарики (начальная плотность клеток 5 × 10 6 клеток мл -1 , масштабная линейка 600 мкм мкм). Гранулы альгината, полученные с более высокой плотностью клеток, были немного больше (средний диаметр 610 ± 15 мкм м) и имели деформации из-за высокой плотности клеток (выделены стрелками).
Загрузить рисунок:
Стандартный образ Изображение высокого разрешенияТаблица 1. Средние диаметры шариков при различной скорости потока. Диаметр показан как средний ± ст.откл. измерено (n = 3 технических повторения).
| Расход | |||||
|---|---|---|---|---|---|
| Концентрация альгината | Частота (кГц) | Напряжение (кВ) | Установка инкапсулятора | Эквивалент мл мин −1 | Средний диаметр ± SD ( мкм м) |
| 2% (мас. / Об.) | 2.5 | 1,0 | 700 | 7,3 | 619,0 ± 28,5 |
| 750 | 7,8 | 593,0 ± 46,5 | |||
| 800 | 8,4 | 537,5 ± 42,5 | |||
| 850 | 8,9 | 504,5 ± 25,0 | |||
| 900 | 9.4 | 518,5 ± 37,0 | |||
| 950 | 9,9 | 666,0 ± 43,0 | |||
Таблица 2. Средний диаметр валика при переменном напряжении. Диаметр показан как средний ± ст.откл. измерено (n = 3 технических повторения).
| Расход | |||||
|---|---|---|---|---|---|
| Концентрация альгината | Частота (кГц) | Напряжение (кВ) | Установка инкапсулятора | Эквивалент мл мин −1 | Средний диаметр ± SD ( мкм м) |
| 2% (мас. / Об.) | 0.5 | 0,6 | 850 | 8,9 | 574,5 ± 35,0 |
| 1,0 | 586,5 ± 22,0 | ||||
| 1,2 | 577,5 ± 22,5 | ||||
| 1,6 | 584,0 ± 267,0 | ||||
Таблица 3. Средние диаметры валика с различной периодичностью. Диаметр показан как средний ± ст.откл. измерено (n = 3 технических повторения).
| Расход | |||||
|---|---|---|---|---|---|
| Концентрация альгината | Частота (кГц) | Напряжение (кВ) | Установка инкапсулятора | Эквивалент мл мин −1 | Средний диаметр ± SD ( мкм м) |
| 2% (мас. / Об.) | 1.0 | 1,0 | 850 | 8,9 | 586,0 ± 26,0 |
| 1,5 | 594,0 ± 19,0 | ||||
| 2,0 | 603,5 ± 28,5 | ||||
| 2,5 | 615,0 ± 27,5 | ||||
| 3,0 | 611.0 ± 23,5 | ||||
| 3,5 | 612,0 ± 24,5 | ||||
| 4,0 | 595,0 ± 22,5 | ||||
| 4,5 | 598,0 ± 27,0 | ||||
| 5,0 | 593,0 ± 28,0 | ||||
3.2. Инкапсуляция клеток HCT-116
Для определения оптимального состава гранул, который способствует жизнеспособности клеток в течение 5 дней культивирования клеток, были протестированы клетки HCT-116 различной плотности, суспендированные в 2% (мас. / Об.) Альгинате в HBS, т. Е. 1 , 3 и 5 × 10 6 клеток мл −1 . Гранулы альгината, инкапсулирующие HCT-116 при различной плотности клеток, также были проанализированы с точки зрения размера и формы после изготовления и во время культивирования клеток. Плотность клеток 1 × 10 6 клеток мл -1 оказалась оптимальной для изготовления нагруженных клетками гранул с характеристиками, аналогичными их пустому аналогу, т.е.е. сферические и однородные шарики диаметром 540 ± 20 мкм м (рисунки 2 (б) и (в)). Более высокая плотность клеток дает несферические и значительно более крупные шарики со значительным разрастанием клеток (рис. 2 (е)).
3.3. Жизнеспособность и рост клеток: 2D и 3D
Гранулы, изготовленные с использованием оптимизированных параметров (рисунок 2 (d), подробно на рисунке 3 (a)), были окончательно протестированы, чтобы оценить различия в поведении клеток между 2D и 3D моделями in vitro . Данные флуоресцентной микроскопии и проточной цитометрии окрашивания Live / Dead не выявили областей выраженной гибели клеток, вызванных процедурой изготовления, или гипоксических областей клеток, инкапсулированных в альгинатные шарики (рисунки 4 (a), (b)).Мы наблюдали увеличение количества мертвых клеток в сфероидных культурах, скорее всего, в результате образования некротического ядра. Жизнеспособность клеток дополнительно измеряли с использованием обычного окрашивания трипановым синим (счет гемоцитометра) после растворения гранул и восстановления клеток или разрушения сфероидов для 3D-моделей. Подсчет гемоцитометра показал, что средняя жизнеспособность инкапсулированных клеток в 3D-моделях составляет 60% по сравнению с 2D-контролем через 24 часа после инкапсуляции (данные не показаны). Окрашивание трипановым синим и счет гемоцитометра дополнительно использовали для получения кривой роста в различных условиях культивирования до 72 часов.Как показано на фиг. 3 (d), скорости роста клеток HCT-116, культивируемых либо в 2D, либо инкапсулированных в альгинат (3D), были неразличимы, и, как и ожидалось, присутствие альгината не оказывало влияния на пролиферацию клеток. С другой стороны, HCT-116 в культуре сфероидов демонстрирует другой профиль роста: с медленной скоростью роста, когда они формируют соединение клетка-клетка (до 48 часов), и более высокой скоростью роста, когда формируется сфероид и раковые клетки начинают экспоненциально расти. рост, имитирующий прогрессирование опухоли (72 ч, как сообщается в литературе).
Увеличить Уменьшить Сбросить размер изображения
Рисунок 3. Сравнение моделей in vitro : рост клеток. (a) Слева: Детальное изображение в светлом поле альгинатных шариков, инкапсулирующих 1 × 10 6 HCT-116 клеток мл -1 через 3 дня культивирования (средний размер шариков 540 мкм мкм; изготовление параметры: расход 8,9 мл мин −1 , частота 5500 Гц, напряжение 1 кВ) (шкала 200 мкм м). Справа: Флуоресцентное изображение (DAPI / ядра, шарики показаны на рисунке пунктирной линией). (b) Изображение в светлом поле репрезентативного сфероида HCT-116 после 3 дней культивирования в 96-луночных планшетах со сверхнизкой поверхностью прикрепления (начальная плотность посева 1000 клеток / лунка) (масштабная линейка 250 мкм мкм). (c) Изображение в светлом поле клеток HCT-116, выращенных как обычный монослой (масштабная линейка 50 мкм, мкм). (d) Нормализованное количество клеток для клеток HCT-116, культивированных в 2D TPC, 3D альгинатных шариках или 3D сфероидах до 72 часов (n = 3, N = 2).Обратите внимание, что контроль с HCT-116, выращенный на 2D с 2% (мас. / Об.) Альгинатом, также был протестирован без значительных изменений по сравнению со стандартным 2D контролем (данные не показаны).
Загрузить рисунок:
Стандартный образ Изображение высокого разрешенияУвеличить Уменьшить Сбросить размер изображения
Рисунок 4. Сравнение биологических маркеров в клетках HCT-116, культивируемых в виде монослоев (2D, TCP) или 3D in vitro моделей (в форме сфероидов или инкапсулированных в альгинатные шарики) для имитации ранней стадии колоректального рака.(а) Репрезентативные изображения флуоресцентной микроскопии HCT-116, инкапсулированного в альгинатные шарики через 24 часа после изготовления шариков, живое / мертвое окрашивание (живое: кальцеин-AM / зеленый; мертвое: йодид пропидия / красный) (шкала 200 мкм мкм, диаметр борта обозначен пунктирной линией). (b) Живой / мертвый сигнал, измеренный с помощью проточной цитометрии через 5 дней культивирования (n = 3). Экспрессия маркеров CD44 (c) и HIF-1 α (d), связанных с развитием опухоли, в разные моменты времени, то есть через 2 или 5 дней после посева / изготовления (n = 3), и соответствующее количество положительных клеток (e) , (е).Статистический анализ относится к сравнению маркеров, связанных с развитием опухоли, в отличительных моделях in vitro и различных временных точках: *** P <0,001, ** P <0,01, * P <0,5 (двусторонний дисперсионный анализ ANOVA). (g) Проточная цитометрия: пример стратегии стробирования, используемой для измерения экспрессии CD44 в HCT-116, инкапсулированном в альгинатные шарики (g): живые клетки, отдельные клетки и гистограмма.
Загрузить рисунок:
Стандартный образ Изображение высокого разрешения3.4. Экспрессия CD44 и HIF-1
αВариантные изоформы CD44 (CD44v) являются признанными прогностическими и диагностическими маркерами для нескольких типов опухолей; например, CD44v6 имеет значительную прогностическую ценность при CRC и считается ценным для выявления пациентов со склонностью к развитию отдаленных метастазов [36].В этом исследовании мы сосредоточили свое внимание на экспрессии общего CD44 (охватывающего все варианты изоформ) в HCT-116, инкапсулированном в альгинатные шарики, с течением времени и сравнили это выражение с двумя золотыми стандартами, которые в настоящее время используются в исследованиях рака: 2D TCP и 3D. сфероид in vitro модели . Экспрессию заякоренного в мембране CD44 исследовали путем прямого окрашивания флуоресцентно-меченным антителом и детектировали с помощью проточной цитометрии на живых клетках. Мы обнаружили, что экспрессия CD44 была стабильно выше в клетках, выращенных с использованием трехмерных моделей, чем в клетках, выращенных в виде двухмерных монослоев (рисунок 4 (c)).В каждый момент времени все протестированные модели in vitro возвращали более 95% положительных клеток на CD44 (рисунок 4 (d)). Обратите внимание, что мы исключили влияние альгината на обнаружение CD44, сравнив трехмерные модели с клетками, культивированными на 2D в присутствии 2% (мас. / Об.) Альгината (данные не представлены).
Затем мы сосредоточили наше внимание на HIF-1 α , маркере агрессивности опухоли, инвазивности и устойчивости к лучевой и химиотерапии в различных опухолях, таких как шейка матки [37], тройной негативный результат [38] и CRC [ 35].HIF-1 α — мощный стимулятор транскрипции, который, как известно, экспрессируется, когда кислород не может перфузировать в первичную опухолевую массу, что приводит к образованию гипоксических областей, которые запускают производство цитопротективных белков, которые обеспечивают выживание и пролиферацию. На этой стадии раковые клетки начинают привлекать стромальные клетки, участвующие в ангиогенезе. Как только масса опухоли достигает критического размера 1-2 мм, она начинает прогрессировать до более инвазивной и продвинутой стадии [39, 40]. Как и ожидалось, экспрессия белка HIF-1 α не была обнаружена в HCT-116, культивируемой на TCP.Подобные пренебрежимо малые уровни HIF-1 α были измерены в HCT-116, инкапсулированном в альгинатные шарики. Напротив, HIF-1 α был обнаружен в HCT-116, культивированном в виде сфероидов, со значительным увеличением экспрессии HIF-1 α и положительных клеток с течением времени (рисунки 4 (e), (f)). Эти результаты совпадают с результатами, наблюдаемыми для клеток HeLa, которые экспрессируют HIF-1 α при культивировании в виде сфероидов как в условиях гипоксии, так и в условиях нормоксии [41]. Недостаток кислорода и питательных веществ в сфероидах HCT-116 также отражается в более низкой жизнеспособности клеток, обнаруженной для сфероидов HCT-116 через 5 дней культивирования (проточная цитометрия, рисунок 4 (b)).Не было обнаружено значительного процента мертвых клеток HCT-116 в трехмерных альгинатных шариках или в стандартных 2D-моделях TCP in vitro .
За последние десятилетия значительные усилия были приложены к разработке 3D моделей клеток in vitro для исследований рака (например, открытие и разработка лекарств) из-за недостатков, связанных с традиционным двухмерным монослойным культивированием, в основном из-за его неспособности точно воспроизвести воссоздать in vivo сложности опухолей [42].Важность использования 3D-моделей как в фундаментальных исследованиях, так и в открытии / тестировании лекарств широко обсуждалась [16]. Более сложные 3D модели in vitro в исследованиях рака были впервые представлены в форме сфероидов [39, 43], демонстрируя преимущества (а) культивирования клеток в трехмерном пространстве, (б) содействия межклеточным взаимодействиям, аналогичным таковым у модели . in vivo система / модель на животных, (c) получение гетеротипической популяции, близкой к массе опухоли, и (d) индукция образования гипоксического ядра.Последние технологические достижения продемонстрировали два основных ограничения сфероидов: формирование межклеточного взаимодействия, типичного для опухолей, и повторение ранних стадий опухолевой прогрессии. Совсем недавно методы тканевой инженерии были использованы для разработки более сложных моделей опухоли in vitro , способных точно контролировать химические, физические и механические свойства и, следовательно, воссоздавать в 3D: (a) характеристики TME на разных стадиях развития опухоли, (b) клетки -клеточные взаимодействия и (c) взаимодействия клетка-матрица.Пример преимуществ использования инкапсулированного HCT-116 в альгинатных гранулах для изучения химиотерапии CRC и относительной лекарственной устойчивости был описан Shakibaei et al [25], в котором влияние сильнодействующих химиотерапевтических средств на позднюю и агрессивную / метастатическую стадию CRC было учился. Здесь мы описали новый подход к моделированию и биопроизводству ранней стадии CRC и его TME, позволяющий лучше контролировать (1) размер альгинатных гранул и (2) количество клеток CRC. Кроме того, мы сравнили стадию CRC клеток HCT-116, инкапсулированных в альгинатные микрошарики, с стадией HCT-116 в форме стандартных сфероидов.Наша цель состояла в том, чтобы сравнить две 3D модели in vitro для создания моделей ранней стадии CRC, где ангиогенез и стромальный ответ еще не задействованы [11, 40, 44, 45]. Первая часть исследования была посвящена оптимизации процесса изготовления и получению шариков, контролируемых по размеру, жесткости и количеству ячеек. Затем внимание было обращено на сравнение поведения инкапсулированного HCT-116 с клетками, культивируемыми в виде сфероидов или двумерных монослоев, с точки зрения жизнеспособности и экспрессии белка.Во время оптимизации изготовления моделей 3D на основе альгината in vitro мы исследовали роль исходной плотности клеток как стратегии для изготовления опухолей на ранних или поздних стадиях, то есть меньшего или большего количества раковых клеток на гранулу, соответственно. . Однако для этого конкретного исследования мы решили использовать более низкую плотность клеток (1 × 10 6 клеток на мл -1 ), чтобы избежать необходимости васкуляризации, необходимой для питания [40]. Затем были изучены оптимальные параметры изготовления шариков.Важно отметить, что диаметр шарика был установлен на значениях ниже 600 мкм м, чтобы можно было избежать гипоксических областей (типичных для сфероидов), что, в свою очередь, является ключевым важным фактором для разделения эффектов гипоксии и размерности ткани в 3D. модели [46]; а концентрация альгината и гелеобразование ([Ca 2+ ], время) были отрегулированы так, чтобы конечные шарики имели жесткость примерно 10-15 кПа, аналогично тому, что сообщалось в литературе, чтобы сохранить менее инвазивное поведение HCT-116. клетки [26, 31–33, 47].
Мы наблюдали различную скорость роста сфероидов с пиком роста клеток после 72 часов культивирования, тогда как модели альгинатных шариков (3D) и монослойные (2D) имеют одинаковую скорость роста. На жизнеспособность клеток напрямую не влияли, независимо от метода культивирования.
Поскольку предполагается, что модели 3D in vitro являются лучшей альтернативой для повторения прогрессирования опухоли, мы затем попытались понять, действительно ли взаимодействия клетки-клетки и клеточного материала были необходимы для точного имитации свойств TME на ранней стадии опухоли. прогрессия.С этой целью мы переключили наше внимание на оценку экспрессии двух разных биомаркеров прогрессии опухоли: CD44 (его избыточная экспрессия может указывать на раннее развитие и прогрессирование CRC [48]) и HIF-1 α (его экспрессия может быть использована. в качестве биомаркера опухолей CRC на поздней стадии [49]). Экспрессия двух биомаркеров была обнаружена в двух разных временных точках, то есть через 3 и 5 дней, имея в виду, что неконтролируемый рост клеток потенциально может влиять на их экспрессию.Примечательно, что клетки HCT-116, инкапсулированные в альгинатные шарики, экспрессировали более высокие количества общего CD44 и более низкие количества HIF-1 α по сравнению с клетками, культивированными в форме сфероидов. Таким образом, мы полагаем, что клетки HCT-116, культивируемые в альгинатных гранулах, могут более точно имитировать ранние стадии развития опухоли (CD44 высокий / HIF-1 α низкий ), которые было бы труднее воспроизвести в сфероидах на относительно короткие моменты времени культивирования (из-за малого количества клеток и межклеточного взаимодействия).Мы считаем, что биотехнологическая модель in vitro , представленная в этой работе, предлагает много преимуществ для воссоздания более физиологически релевантной модели опухоли CRC на ранней стадии, поскольку эти гидрогели обладают жесткостью, аналогичной жесткости мягких тканей брюшной полости (в отличие от выращенных TCP. 2D монослои) и обеспечивают более простую платформу для исследования поведения колоректального рака в 3D по сравнению со сфероидами, поскольку наша модель исключает влияние других факторов, таких как гипоксия, то есть позволяет изучать только влияние размерности.
Мы воссоздали и проверили метод биотехнологии для моделирования опухоли колоректального рака на ранней стадии: клетки CRC, культивируемые в этой новой модели 3D in vitro , сравнивали с золотыми стандартами in vitro культурами клеток , то есть однослойными и сфероидными. Альгинатные микрошарики с известным количеством инкапсулированных клеток HCT-116 были успешно изготовлены биологическим способом, способствуя росту и жизнеспособности клеток, избегая при этом гипоксических областей. Поскольку развитие рака связано с пространственно-временным измерением, микрогранулы гидрогеля обеспечивают вход в метод трехмерного культивирования клеток с высокой экспериментальной воспроизводимостью и легким доступом для последующего биологического анализа.Несмотря на то, что не удалось полностью воссоздать сложную микросреду опухоли, мы продемонстрировали, что экспрессию общих маркеров рака и белков-мишеней для доставки лекарств, таких как CD44, можно имитировать с помощью методов биотехнологии. Этот результат может указывать на то, что эта модель более точно отражает уровни экспрессии CD44, связанные с возникновением опухоли. Кроме того, более высокая экспрессия некротического фактора HIF-1 α в сфероидах предполагает, что эта трехмерная модель более точно представляет гетерогенную опухолевую массу, которая нуждается в питательных веществах и обеспечении кислородом, следовательно, в этих системах будет необходима сосудистая сеть, чтобы лучше имитировать патофизиология прогрессирования опухоли.
Таким образом, наши данные свидетельствуют о пригодности альгинатных гидрогелей в качестве платформы для трехмерной клеточной культуры для улучшения доклинических испытаний лекарств при CRC. Высокая пропускная способность 3D in vitro Системы , безусловно, являются будущим исследований рака и терапии, и мы заложили первый строительный блок для создания передовых моделей in vitro прогрессирования опухолей.

 Флакон 400 мл. растворить в 4-х литрах воды
Флакон 400 мл. растворить в 4-х литрах воды