Моноциты Морфология клеток моноцитопоэза
Монобласт – клетка диаметром 15-20 мкм с крупным округлым центрально расположенным ядром светло-фиолетового цвета. В ядре 1-2 ядрышка, хроматин тонкодисперсный. Цитоплазма голубоватого цвета.
Промоноцит – диаметр 15-18 мкм. Ядро бобовидное с 1-2 ядрышками. Хроматин крупносетчатый. Цитоплазма дымчатая с азурофильной зернистостью.
Моноцит – диаметр 14-20 мкм. Ядро светло-фиолетовое с центральным расположением. Характерна вариабельность формы: бобовидное, палочкообразное, лопастное (в форме «трилистника»). Цитоплазма обильная, дымчатого цвета с пылевидной азурофильной зернистостью.
В отличие от гранулоцитов моноциты не формируют КМ-ой резерв и выходят в кровь, где пребывают 2-4 суток. Нормальное содержание моноцитов в крови соответствует 4-9%. Моноцит — самая крупная клетка крови. Зрелые моноциты мигрируют в ткани. При этом часть моноцитов погибает путем апоптоза (вследствие отсутствия в тканях антиапоптотических факторов), часть дифференцируется в
Производные моноцитов:
— Миграция моноцитов в ЛУ и селезенку приводит к образованию макрофагов ЛУ и селезенки (литторальные клетки селезенки).
— Миграция макрофагов в костный мозг приводит к формированию костномозговых макрофагов.
— Миграция моноцитов в печень приводит к формированию клеток Купфера (купферовские клетки).
— Вокруг мышц и под кожей — гистиоцит (блуждающая клетка в покое).
— В головном мозге — микроглиальные клетки.
— В легких — альвеолярные макрофаги.
— В эритропоэтических островках костного мозга — «клетки-няньки».
— В костях — остеокласты.
— В серозных пространствах — перитонеальные макрофаги.
Биологические свойства моноцитов
Цитохимические маркеры клеток СМФ:
— миелопероксидаза (её содержание снижается по мере созревания клеток),
— неспецифическая эстераза и кислая фосфатаза (их активность наиболее выражена в макрофагах),
— незначительные количества гликогена и липидов.
Секреторные факторы: многочисленные цитокины (монокины) — провоспалительные (ИЛ-1, 6, 8, 12, 18, ФНО-α, ИФ-α, моноцитарный хемотаксический протеин и др.) и противовоспалительные (ИЛ-10, трансформирующий фактор роста β).
На поверхности моноцитов имеются молекулы адгезии (что определяет способность моноцитов прилипать к стеклу или пластику) и рецепторы к опсонинам (Fc-фрагменту антител и комплементу), лимфокинам, трансферрину и многим гормонам.
Функции клеток СМФ:
Защитная:
— участие в реакциях неспецифической резистентности: фаго-, пиноцитоз АГ, внешнее переваривание (эндоцитоз) путем генерации кислородных радикалов, продукции компонентов комплемента, лизоцима. Это самая важная функция моноцитов.
— участие в специфическом иммунном ответе — переработка и представление АГ иммунным лимфоцитам, АЗКЦ. При помощи секретируемого ИФ- блокируют репликацию вирусов.
Участие в воспалительных (в том числе аллергических) реакциях – за счет продукции про- и противовоспалительных цитокинов, а также веществ, разрушающих внеклеточный матрикс (эластаза, гиалуронидаза, коллагеназа).
Гемопоэтическая – за счет продукции цитокинов регулируют пролиферацию и дифференцировку различных клеток крови.
Морфогенетическая (трофоцитарная).
Увеличение содержания моноцитов в крови (моноцитоз) определяется при воспалительных и инфекционных заболеваниях, болезнях системы крови (хронический миелолейкоз, злокачественная лимфома и др.).
Система макрофагов | Симптомы болезней
Одним из мощных факторов резистентности является фагоцитоз. И. И. Мечников установил, что фагоцитарными свойствами обладают зернистые лейкоциты крови и лимфы, главным образом полиморфно-ядерные нейтрофилы (микрофаги), а также моноциты и различные клетки ретикулоэндотелиальной системы, которые он назвал макрофагами. В настоящее время под макрофагами понимают клетки, которые обладают высокой фагоцитарной активностью. Они различаются по форме и размерам, в зависимости от тканей, где они обнаруживаются. По классификации ВОЗ (1972), все макрофаги объединены в систему мононуклеарных фагоцитов (табл. 8).
| Клетки СМФ | Ткани, в которых эти клетки обнаруживаются |
| Клетки-предшественники Промоноциты Моноциты Макрофаги (обладающие высокой фагоцитарной активностью) | Костный мозг То же Периферическая кровь Соединительная ткань (гистиоциты) Печень (купферовские клетки) Легкие (альвеолярные макрофаги) Лимфатические узлы, селезенка (свободные и фиксированные макрофаги) Серозные полости (плевральные и перитонеальные макрофаги) Костная ткань (остеокласты) Нервная ткань (микроглиальные клетки) |
СМФ — система мононуклеарных фагоцитов.
Процесс фагоцитоза складывается из следующих этапов: продвижение фагоцита к объекту фагоцитоза, например к бактериальной клетке; прилипание бактерии к фагоциту; поглощение бактериальной клетки; исход фагоцитоза. Энергия, необходимая для поглощения макрофагами чужеродных частиц, обеспечивается благодаря гликолизу. Агенты, угнетающие гликолиз, резко подавляют фагоцитоз. Возможны три исхода фагоцитоза:
1) полное внутриклеточное переваривание микробных клеток — завершенный фагоцитоз;
2) приживление и активное размножение бактерий внутри фагоцита — незавершенный фагоцитоз
3) выталкивание микробов из фагоцитов обратно в окружающую среду. Незавершенный фагоцитоз часто наблюдается при вяло и длительно протекающих инфекционных болезнях и служит одной из причин хрониосепсиса. Еще И. И. Мечниковым было установлено, что во время фагоцитоза происходит резкий сдвиг рН внутри фагоцита в кислую сторону, вероятно, вследствие гликолиза. Предполагалось, что ацидоз и является непосредственной причиной гибели фагоцитированных микробов, а их переваривание осуществляется под влиянием ферментов цитоплазмы. Однако в последующем было выяснено, что механизм уничтожения фагоцитированных бактерий (бактерицидного действия фагоцитов) заключается в следующем.
В процессе фагоцитоза происходит «дыхательный», или «окислительный», взрыв, который приводит к образованию активных форм кислорода: супероксидного аниона (Oj), перекиси водорода (Н202) и радикала гидроксила (ОН~), которые и обусловливают бактерицидный эффект. Убитые клетки далее подвергаются Действию ферментов лизосом.
Макрофагам принадлежит исключительно важная роль в обеспечении защитных реакций. Основные функции, посредством которых они выполняют эту роль,
Страницы: 1 2
www.medicalbrain.ru
Средство, стимулирующее продукцию гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов
Изобретение относится к медицине, в частности к иммунологии, а именно к средствам иммунокоррекции, и может быть использовано в качестве индуктора гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов in vitro и для эфферентной терапии при патологических состояниях, сопровождающихся снижением клеточного иммунитета. Средство представляет собой окисленный декстран средней молекулярной массы 35-65 кДа. Средство может быть выполнено в виде раствора или нанолипосомальной эмульсии с концентрацией окисленного декстрана 1-5 мас.%. Средство применяют путем введения в культуру клеток системы мононуклеарных фагоцитов в количестве, содержащем 125-250 мкг окисленного декстрана на 1 мл культуральной среды. Средство по изобретению обладает высокой биосовместимостью. 2 н. и 6 з.п. ф-лы, 1 табл.
Изобретение относится к медицине, в частности к иммунологии, а именно к средствам иммунокоррекции, и может быть использовано в качестве индуктора гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов in vitro и для эфферентной терапии при патологических состояниях, сопровождающихся снижением клеточного иммунитета.
Гранулоцитарно-макрофагальный колониестимулирующий фактор (ГМ-КСФ) является гликопротеином и относится к одному из основных медиаторов иммунной системы. Он входит в группу цитокинов, которые продуцируются в живом организме в Т-лимфоцитах, эндотелиальных клетках, фибробластах, клетках системы мононуклеарных фагоцитов. По классификации ВОЗ все макрофаги объединены в систему мононуклеарных фагоцитов (СМФ), которая после лимфоидной системы является второй крупной популяцией клеток иммунной системы. СМФ включает происходящие из единой стволовой клетки костномозговые предшественники. Клетки СМФ являются универсальными участками иммунного ответа, они осуществляют опсонизацию и фагоцитоз антигенов, вырабатывают неспецифические факторы защиты, биологически активные вещества, регулируют агрегационные свойства крови и микроциркуляцию, осуществляют кооперацию иммунного ответа и его завершенность (1).
ГМ-КСФ стимулирует пролиферацию, дифференцировку и функцию гранулоцитов и моноцитов/макрофагов, которые образуют одну из важных систем защиты организма от бактерий, грибов, паразитов, опухолевых поражений, осуществляют фагоцитоз чужеродных агентов, секретируют биологически активные соединения, стимулируют иммунные процессы, регулируют продукцию цитокинов. При ряде заболеваний продукция ГМ-КСФ в организме снижена. В связи с этим для иммунокоррекции необходимо использовать индукторы ГМ-КСФ или синтетический (рекомбинантный) ГМ-КСФ.
Путем генной инженерии в последнее время удалось создать рекомбинантный человеческий ГМ-КСФ (коммерческие названия препарата — молграмостим, лейкомакс) (2). Рекомбинантный ГМ-КСФ используют при лейкопении и агранулоцитозе (при агранулоцитарной ангине, алиментарно-токсической алейкии, при отравлении рядом химических веществ, при лучевой болезни), при различных заболеваниях инфекционной этиологии, при различных онкологических и гранулематозных заболеваниях. Особенно широко рекомбинантный ГМ-КСФ используют в клинической практике при лечении онкологических больных, получающих химиотерапию (3, 4). Однако при неоднократном применении препараты рекомбинантного ГМ-КСФ нередко вызывают побочные эффекты: лихорадку, озноб, миалгию, потерю аппетита, сонливость и боль в костях (5, 6).
Известно средство, стимулирующее продукцию ГМ-КСФ в Т-лимфоцитах, включающее рекомбинантный TNF (фактор некроза опухолей) (7). Его недостатком является то, что при недостаточно эффективном отмывании культуры клеток он может индуцировать TNF-зависимый апоптоз клеток, стимулировать гранулемогенез при воспалительных процессах и другие нежелательные биологические эффекты, обусловленные этим фактором.
Известно средство, стимулирующее продукцию ГМ-КСФ в культуре клеток Т-лимфоцитов, включающее мурамилдипептид (МДП), являющийся минимальным компонентом клеточной стенки грамположительных бактерий (8). Недостатком известного средства является то, что оно обладает выраженными провоспалительными свойствами, а также является индуктором эндогенной продукции фактора некроза опухолей (TNF) в лимфоидных клетках, который может оказывать нежелательные побочные эффекты, указанные выше, т.е. обладает низкой биосовместимостью.
Наиболее близким к заявленному является средство, стимулирующее продукцию ГМ-КСФ в макрофагах, включающее N-ацетилглюкозаминил-1-4-N-ацетилмурамоил-L-аланил-D-изоглугамин, имеющий фармакопейное название ликопид и являющийся синтетическим производным мурамилдипептида (9). Хотя ликопид обладает меньшими побочными эффектами в сравнении с мурамилдипептидом (не вызывает повышение температуры тела), так как применяется преимущественно перорально, его недостатком также является способность вызывать провоспалительные реакции при парентеральном введении, так как по механизму влияния на иммунитет эти препараты практически идентичны. В связи с этим, ликопид также обладает низкой биосовместимостью при парентеральном пути введения, что значительно ограничивает возможности его использования для стимуляции иммунокомпетентных клеток in vitro с целью их последующего использования для эфферентных методов терапии.
Задачей настоящего изобретения является повышение биосовместимости средства.
Решение поставленной задачи достигается тем, что в качестве индуктора ГМ-КСФ используют окисленный декстран средней молекулярной массы 35-65 кДа; средство дополнительно содержит физиологически приемлемый растворитель или физиологически приемлемый растворитель и липосомообразующий агент; в качестве физиологически приемлемого растворителя оно включает воду для инъекций, физиологический или буферный раствор; в качестве липосомообразующего агента оно включает лецитин; средство может быть выполнено в виде раствора или нанолипосомальной эмульсии; средство может быть выполнено в виде раствора окисленного декстрана со средней молекулярной массой 35-65 кДа в физиологически приемлемых растворителях в концентрации 1-5 мас.%; средство применяют путем его введения в культуру клеток системы мононуклеарных фагоцитов в количестве, содержащем 125-250 мкг окисленного декстрана на 1 мл культуральной среды.
Описание сущности изобретения
Средство, стимулирующее продукцию гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов, включает в качестве активного агента окисленный декстран средней молекулярной массы 35-65 кДа.
Средство может быть выполнено в виде раствора. В таком случае оно дополнительно включает физиологически приемлемый растворитель, например воду для инъекций или физиологический раствор или физиологически приемлемый буферный раствор, например фосфатный буфер pH 7.3-7.5, и др. Стимуляция ГМ-КСФ происходит при использовании раствора окисленного декстрана указанной средней молекулярной массы в физиологически приемлемом растворителе, в концентрации 1-5 мас.%.
Средство может быть выполнено в виде нанолипосомальной эмульсии. В таком случае оно дополнительно включает физиологически приемлемый растворитель и липосомообразующий агент. В качестве липосомообразующего агента может быть использован лецитин и другие физиологически приемлемые липосомообразующие агенты.
Окисленный декстран представляет собой декстран, содержащий карбонильные группы. Он может быть получен известными способами на основе химического или радиационного окисления декстрана. В частности, окисленный декстран может быть получен химическим путем, например путем выделения фракций декстрана из коммерческого препарата «Реополиглюкин», последующего окисления декстрана периодатом натрия и осаждения окисленного декстрана этанолом (10). Известны модификации данного метода, отличающиеся использованием дополнительных способов очистки окисленного декстрана от примесей (11-14). В качестве окислителя используют также перманганат калия (15).
Окисленный декстран может быть также получен путем облучения раствора коммерческого препарата «Реополиглюкин» тормозным гамма-излучением в дозах 2,5-3,5 Мрад на ускорителе электронов ЭЛВ-2 (16).
Стимуляцию продукции ГМ-КСФ в клетках СМФ с использованием заявленного средства осуществляют следующим образом.
Методом эксплантации клеток перитонеального транссудата мышей, например мышей линии BALB/c, в культуру получают первичную культуру перитонеальных макрофагов, содержащую в своем составе моноциты (1-2%). Перитонеальные клетки (моноциты/макрофаги) вносят в чашки Петри и культивируют на покровных стеклах в течение 3 часов в среде 199, содержащей 10% сыворотки эмбрионов коров. Через 3 часа первичную инкубационную среду сливают, адгезированные клетки (моноциты/ макрофаги) отмывают от неадгезированных клеток (неприлипающих к стеклу клеток — лимфоцитов и лаброцитов) двукратным ополоскиванием клеток в свежей среде 199, содержащей 10% сыворотки эмбрионов коров. После повторного отмывания клеточного монослоя, содержащего 98-99% макрофагов и 1-2% моноцитов, промывочную среду заменяют на свежую среду 199, содержащую 7% сыворотки эмбрионов коров и добавляют к ней заявляемое средство в виде раствора окисленного декстрана в физиологически приемлемом растворителе с концентрацией окисленного декстрана 1-5 мас.% или в виде нанолипосомальной эмульсии до конечной концентрации по окисленному декстрану 125-250 мкг на 1 мл культуральной среды. Клетки инкубируют при температуре 37°С в атмосфере, содержащей 5% СО2 в течение 24 часов. Через 24 часа культивирования проводят оценку продукции ГМ-КСФ в клетках СМФ (моноциты/макрофаги) при помощи иммуноцитохимического метода анализа с использованием компьютерной морфометрии следующим образом.
Для оценки продукции ГМ-КСФ в клетках СМФ используют двухэтапный иммуноцитохимический метод определения экспрессии цитокинов в клетках. Клетки фиксируют в 4% растворе формальдегида (в фосфатном буфере pH 7,3-7,5) в течение 10 мин, демаскировку антигенов проводят при инкубировании в 0,3% растворе тритона Х 100 (в фосфатном буфере pH 7,3-7,5) 2 мин. Далее препараты клеточных культур инкубируют с «первыми» антителами к ГМ-КСФ (Rat Anti-Mouse GM-CSF; Isotype: Rat IgG2a) во влажной камере (60 мин). Препараты, обработанные небиотинилированными крысиными антителами, дополнительно инкубируют с антикрысиными биотинилированными антителами овцы (biotin-conjugated goat anti-rat Ig specific polyclonal antibody) во влажной камере (30 мин). Препараты, инкубированные с биотинилированными антителами, инкубируют со стрептавидин-пероксидазным комплексом (30 мин). Далее окраску препаратов проводят в растворе диаминобензидина (DAB) с субстратом, содержащим Н2O2 (используют стандартный BD DAB Kit). Клетки отмывают от свободного DAB дистиллированной водой, препараты высушивают (60 мин), докрашивают водным 1% раствором метилового зеленого (15 мин). Все процедуры иммуноцитохимической окраски клеток проводят при комнатной температуре. Зоны клеточных мембран или цитоплазмы, содержащие ГМ-КСФ, окрашиваются в «специфический» темно-коричневый цвет. Интенсивность такой окраски прямо пропорциональна количеству экспрессируемого ГМ-КСФ. Стимуляцию продукции ГМ-КСФ в клетках СМФ (моноциты/макрофаги) оценивают по кратности увеличения количества клеток, продуцирующих ГМ-КСФ (индекс стимуляции ГМ-КСФ). Для оценки биосовместимости композиции используют индекс функциональной активности клеток СМФ (% распластанных форм) и индекс жизнеспособности (% жизнеспособных клеток).
После инкубации клеток в среде для культивирования с добавлением заявляемого средства в культуре возрастает количество макрофагов, продуцирующих ГМ-КСФ, в 8-10 раз по сравнению с контролем (моноциты/макрофаги, культивируемые в среде без добавления заявляемого средства).
Определяющим существенным отличием заявляемого средства от прототипа является то, что оно обладает более высокой биосовместимостью. Результаты сравнительной оценки заявляемого средства и прототипа по критерию биосовместимости (индекс функциональной активности клеток и индекс жизнеспособности) приведены в таблице. Биосовместимость заявленного средства продемонстрирована на примере раствора окисленного декстрана средней молекулярной массы 35 кДа в воде для инъекций, в концентрации 1 мас.% при различных количествах его введения в культуру клеток.
Как видно из данных, представленных в таблице, заявляемое средство в отличие от прототипа при добавлении в культуру клеток в диапазоне 125-250 мкг на 1 мл культуральной среды обладает более высокой биосовместимостью, что подтверждается более низким торможением распластывания макрофагов и более высоким процентом жизнеспособных клеток.
Таким образом, заявляемое средство обладает способностью стимулировать продукцию ГМ-КСФ в культуре клеток СМФ (макрофаги/моноциты) в сочетании с высокой биосовместимостью.
ПРИМЕРЫ КОНКРЕТНОГО ВЫПОЛНЕНИЯ
Пример 1.
В качестве средства, стимулирующего ГМ-КСФ, использован раствор, содержащий 1 мас.% окисленного декстрана со средней молекулярной массой 35 кДа и 99 мас.% 0,05 М фосфатного буферного раствора, pH 7,4.
Методом эксплантации клеток перитонеального транссудата мышей линии BALB/c в культуру получают первичную культуру перитонеальных макрофагов, содержащую в своем составе моноциты (1-2%). Перитонеальные клетки вносят в чашки Петри и культивируют на покровных стеклах в течение 3 часов в среде 199, содержащей 10% сыворотки эмбрионов коров. Через 3 часа первичную инкубационную среду сливают, адгезированные клетки (моноциты/макрофаги) отмывают от неадгезированных клеток («неприлипающих к стеклу клеток — лимфоцитов и лаброцитов) двукратным ополоскиванием клеток в свежей среде 199, содержащей 10% сыворотки эмбрионов коров. После повторного отмывания клеточного монослоя, содержащего 98-99% макрофагов и 1-2% моноцитов, промывочную среду заменяют на свежую среду 199, содержащую 7% сыворотки эмбрионов коров и добавляют к ней заявляемое средство в виде раствора с концентрацией 1 мас.% до конечной концентрации по окисленному декстрану 125 мкг на 1 мл культуральной среды. Клетки инкубируют при температуре 37°С в атмосфере, содержащей 5% СO2, в течение 24 часов. Через 24 часа культивирования проводят оценку индекса стимуляции продукции ГМ-КСФ в клетках СМФ при помощи иммуноцитохимического метода анализа с использованием компьютерной морфометрии. Индекс стимуляции ГМ-КСФ составляет 8,1. Оценка биосовместимости: индекс функциональной активности клеток — 62%, индекс жизнеспособности — 100%.
Пример 2.
В качестве средства, стимулирующего ГМ-КСФ, использован раствор, содержащий 2,5 мас.% окисленного декстрана со средней молекулярной массой 65 кДа и 97,5 мас.% физиологического раствора.
Методом эксплантации клеток перитонеального транссудата мышей линии BALB/c в культуру получают первичную культуру перитонеальных макрофагов, содержащую в своем составе моноциты (1-2%). Перитонеальные клетки вносят в чашки Петри и культивируют на покровных стеклах в течение 3 часов в среде 199, содержащей 10% сыворотки эмбрионов коров. Через 3 часа первичную инкубационную среду сливают, адгезированные клетки (моноциты/макрофаги) отмывают от неадгезированных клеток (неприлипающих к стеклу клеток — лимфоцитов и лаброцитов) двукратным ополоскиванием клеток в свежей среде 199, содержащей 10% сыворотки эмбрионов коров. После повторного отмывания клеточного монослоя, содержащего 98-99% макрофагов и 1-2% моноцитов, промывочную среду заменяют на свежую среду 199, содержащую 7% сыворотки эмбрионов коров и добавляют к ней заявляемое средство в виде раствора с концентрацией 2,5 мас.% до конечной концентрации по окисленному декстрану 200 мкг на 1 мл культуральной среды. Клетки инкубируют при температуре 37° в атмосфере, содержащей 5% CO2, в течение 24 часов. Через 24 часа культивирования проводят оценку индекса стимуляции продукции ГМ-КСФ в клетках СМФ при помощи иммуноцитохимического метода анализа с использованием компьютерной морфометрии. Индекс стимуляции ГМ-КСФ составляет 9,8. Оценка биосовместимости: индекс функциональной активности клеток — 74%, индекс жизнеспособности — 100%.
Пример 3.
В качестве средства, стимулирующего ГМ-КСФ, использовали раствор, содержащий 5 мас.% окисленного декстрана со средней молекулярной массой 35 кДа и 95 мас.% воды для инъекций.
Методом эксплантации клеток перитонеального транссудата мышей линии BALB/c в культуру получают первичную культуру перитонеальных макрофагов, содержащую в своем составе моноциты (1-2%). Перитонеальные клетки вносят в чашки Петри и культивируют на покровных стеклах в течение 3 часов в среде 199, содержащей 10% сыворотки эмбрионов коров. Через 3 часа первичную инкубационную среду сливают, адгезированные клетки (моноциты/макрофаги) отмывают от неадгезированных клеток (неприлипающих к стеклу клеток — лимфоцитов и лаброцитов) двукратным ополоскиванием клеток в свежей среде 199, содержащей 10% сыворотки эмбрионов коров. После повторного отмывания клеточного монослоя, содержащего 98-99% макрофагов и 1-2% моноцитов, промывочную среду заменяют на свежую среду 199, содержащую 7% сыворотки эмбрионов коров и добавляют к ней заявляемое средство в виде раствора с концентрацией 5 мас.% до конечной концентрации по окисленному декстрану 250 мкг на 1 мл культуральной среды. Клетки инкубируют при температуре 37° в атмосфере, содержащей 5% СO2, в течение 24 часов. Через 24 часа культивирования проводят оценку индекса стимуляции продукции ГМ-КСФ в клетках СМФ при помощи иммуноцитохимического метода анализа с использованием компьютерной морфометрии. Индекс стимуляции ГМ-КСФ составляет 10,0. Оценка биосовместимости: индекс функциональной активности клеток — 81%, индекс жизнеспособности — 100%.
Пример 4.
В качестве средства, стимулирующего ГМ-КСФ, использовали окисленный декстран средней молекулярной массы 65 кДа, заключенный в нанолипосомальную эмульсию.
Для получение нанолипосомальной эмульсии 4,0 г окисленного декстрана со средней молекулярной массой 65 кДа растворяют в 95,0 мл 0,85% растворе хлорида натрия. В полученный раствор вносят 1,0 г липосомообразующего агента (лецитина) и смесь выдерживают 24-36 часов при 4-8°С, после чего суспендируют и многократно пропускают через фильтр с диаметром пор 0,45 мкм. В результате получают нанолипосомальную эмульсию с размером нанолипосом в диапазоне 250-450 нм, содержащую 4 мас.% окисленного декстрана.
Методом эксплантации клеток перитонеального транссудата мышей линии BALB/c в культуру получают первичную культуру перитонеальных макрофагов, содержащую в своем составе моноциты (1-2%). Перитонеальные клетки вносят в чашки Петри и культивируют на покровных стеклах в течение 3 часов в среде 199, содержащей 10% сыворотки эмбрионов коров. Через 3 часа первичную инкубационную среду сливают, адгезированные клетки (моноциты/макрофаги) отмывают от неадгезированных клеток (неприлипающих к стеклу клеток — лимфоцитов и лаброцитов) двукратным ополоскиванием клеток в свежей среде 199, содержащей 10% сыворотки эмбрионов коров. После повторного отмывания клеточного монослоя, содержащего 98-99% макрофагов и 1-2% моноцитов, промывочную среду заменяют на свежую среду 199, содержащую 7% сыворотки эмбрионов коров и добавляют к ней заявляемое средство в виде нанолипосомальной эмульсии до конечной концентрации по окисленному декстрану 200 мкг на 1 мл культуральной среды. Клетки инкубируют при температуре 37° в атмосфере, содержащей 5% СО2, в течение 24 часов. Через 24 часа культивирования проводят оценку индекса стимуляции продукции ГМ-КСФ в клетках СМФ при помощи иммуноцитохимического метода анализа с использованием компьютерной морфометрии. Индекс стимуляции ГМ-КСФ составляет 9,0. Оценка биосовместимости: индекс функциональной активности клеток — 82%, индекс жизнеспособности — 100%.
Список использованных источников информации
1. Ricardo S., Van Goor H. Eddy A. Macrophage diversity in renal injury and repair // J. Clin. Invest. 2008. Vol.18. №11. P.3522-3530.
2. Новиков Д.К., Сергеев Ю.В., Новикова В.И. Характеристика иммунофармакотерапевтических препаратов // Иммунопатология, иммунология, аллергология. — 2002. — №4. — С.7-27.
3. Пинегин Б.Ф., Андронова Т.М., Карсонова М.И. Препараты мурамилдипептидового ряда — иммунотропные лекарственные средства нового поколения // Int. J. Immunorehabilitation. — 1997. — №6. — P.27-34.
4. Попович A.M. Иммунотерапия в онкологии. Справочник по иммунотерапии для практического врача. СПб: изд-во «Диалог», 2002. С.335-352.
5. Лазарева Д.Н., Сакаева Д.Д., Муфазалова Н.А., Бакиров А.Б. Иммуностимуляторы в онкологии // Рациональное использование лекарств: Материалы Российской научно-практической конференции (10-12 марта 2004 года, Пермь). — Пермь, 2004. Ч.2. С.18-23.
6. Новиков Д.К., Новикова В.И., Сергеев Ю.В. Иммунотерапия, иммунокоррекция и иммунореабилитация // Иммунопатология, иммунология, аллергология. — 2002. — №3. — С.7-17.
7. Aggarwal В., Pocsik E. Cytokines: from clone to clinic // Arch. Biochem. Biophys., 1992, v.292, P.335-345.
8. Kerns H.M.M., Jutila M.A., Hedges J.F. The distinct response of γδ Т cells to the Nod2 agonist muramyl dipeptide // Cell Immunol. 2009. V.257. N.1-2. P.38-43.
9. Пинегин Б.В., Андронова Т.М. Некоторые теоретические и практические вопросы клинического применения иммуномодулятора ликопида // Иммунология. 1998. №4. С.60-63.
10. Патент на изобретение РФ №2087146. Способ лечения генерализованного туберкулезного процесса в эксперименте. Дата публикации 20.08.1997. МПК А61К 31/455, А61К 31/70.
11. Патент на изобретение РФ №2163120. Конъюгат изониазид-декстран и его применение в качестве противотуберкулезного препарата. Дата публикации 20.02.2001. МПК А61К 31/455, А61К 31/721.
12. Патент на изобретение РФ №2168994. Средство для лечения туберкулеза с низкой гепатотоксичностью. Дата публикации 20.06.2001. МПК А61К 31/455, А61К 31/70.
13. Патент на изобретение РФ №2185166. Средство для лечения туберкулеза с низким уровнем фибротических осложнений. Дата публикации 20.07.2002. МПК А61К 31/455, А61К 31/721, А61Р 31/06.
14. Патент на изобретение РФ №2125451. Способ получения конъюгата изониазид-декстран. Дата публикации 27.01.1999. МПК А61К 31/715, А61К 31/455.
15. Евразийский патент на изобретение №011718. Способ получения диальдегиддекстрана. Дата публикации 28.04.2009. МПК С08В 37/02.
16. Патент на изобретение РФ №2143900. Способ получения изониазида пролонгированного действия. Дата публикации 10.01.2000. МПК А61К 31/455, А61К 47/48.
| Таблица | ||||||
| Сравнительный анализ индекса стимуляции ГМ-КСФ, индекса функциональной активности клеток СМФ (моноциты/макрофаги) и их жизнеспособности при использовании в качестве индуктора ГМ-КСФ ликопида и раствора окисленного декстрана в диапазоне различных концентраций | ||||||
| Концентрация индуктора ГМ-КСФ в культуре мкг на 1 мл культуральной среды | Индуктор ГМ-КСФ | |||||
| Ликопид | Раствор окисленного декстрана средней молекулярной массы 35 кДа в воде для инъекций, концентрация раствора 1 мас.% | |||||
| Индекс стимуляции ГМ-КСФ | Индекс функциональной активности клеток (% распластанных форм) | Индекс жизнеспособности (% жизнеспособных клеток) | Индекс стимуляции ГМ-КСФ | Индекс функциональной активности клеток (% распластанных форм) | Индекс жизнеспособности (% жизнеспособных клеток) | |
| 2 | 4 | 30 | 90 | 2 | 20 | 100 |
| 10 | 8 | 40 | 80 | 3 | 40 | 100 |
| 125 | 0 | 0 | 0 | 8 | 60 | 100 |
| 250 | 0 | 0 | 0 | 10 | 80 | 100 |
1. Средство, стимулирующее продукцию гранулоцитарно-макрофагального колониестимулирующего фактора в клетках системы мононуклеарных фагоцитов, отличающееся тем, что оно включает окисленный декстран средней молекулярной массы 35-65 кДа.
2. Средство по п.1, отличающееся тем, что оно дополнительно включает физиологически приемлемый растворитель.
3. Средство по п.2, отличающееся тем, что в качестве физиологически приемлемого растворителя оно включает воду для инъекций, физиологический или буферный раствор.
4. Средство по п.1, отличающееся тем, что оно дополнительно включает физиологически приемлемый растворитель и липосомообразующий агент.
5. Средство по п.4, отличающееся тем, что в качестве липосомообразующего агента оно включает лецитин.
6. Средство по п.1, отличающееся тем, что оно выполнено в виде раствора или нанолипосомальной эмульсии.
7. Средство по п.6, отличающееся тем, что оно выполнено в виде раствора окисленного декстрана в физиологически приемлемом растворителе в концентрации 1-5 мас.%.
8. Применение средства по любому из пп.1-7 путем его введения в культуру клеток системы мононуклеарных фагоцитов в количестве, содержащем 125-250 мкг окисленного декстрана на 1 мл культуральной среды.
findpatent.ru
4. Рвст – прочие клетки (помимо тканеобразующих)
а) Клетки крови и их производные
Рис. 9.2. Макрофаг в РВСТ Плёночный препарат. Окраска железнымгематоксилином | 1) Макрофаги образуются в РВСТ из моноцитов. 2) На данном препарате у них – неправильная форма, чёткие границы, плотное ядро. |
|
Рис. 9.3. Плазмоциты в РВСТ Окраска на РНК – метиловым зелёным и пиронином | 1) Плазмоциты образуются из В-лимфоцитов, стимулированных антигеном, и продуцируют антитела. 2) Поэтому у них — много мембраносвязанных рибосом (отсюда – выявление окраской на РНК) и — развит аппарат Гольджи (светлая зона возле ядра – т.н. «дворик»). |
|
Рис. 9.4. Лаброциты (тучные клетки, тканевые базофилы) в РВСТ Окраска азуром II и эозином | 1) Лаброциты по многом аналогичны базофилам крови: в частности, тоже содержат крупные базофильные гранулы с гистамином и гепарином. 2) На поверхности сорбированы IgE. Связывание с ними попавших в организм антигенов вызывает дегрануляцию и развитиевоспалительнойилиаллергическойреакции. |
|
б) Клетки РВСТ со специальными свойствами
Рис. 9.5. Адипоциты (жировые клетки) в РВСТ Окраска азуром II и эозином | 1) В РВСТ адипоциты, как и лаброциты, обычно лежат возле сосуда – и не поодиночке, а группами. 2) Клетки – такие же, как в белой жировой ткани: весь объём клетки занят большой жировой каплей, которая при приготовлении препарата растворяется. Поэтому видны лишь границы адипоцитов. |
|
Меланоциты (пигментоциты) в РВСТ | 1) Основная локализация меланоцитов – базальный слой эпидермиса. Но в особо пигментированных участках кожи (соски молочных желёз, мошонка, анальная область) меланоциты находятся и в сосочковом(верхнем) слое дермы. 2) Меланоциты, в отличие от всех прочих клеток РВСТ, происходят не из мезенхимы, а из нервного гребня. 3) Пигмент меланин находится в мембранных гранулах – меланосомах. Видимо, последние могут передаваться другим клеткам. | |
5. Плотные волокнистые соединительные ткани
Рис. 9.6. Плотная неоформленная соед. ткань Кожа Окраска гематоксилином и эозином | 1) Данная ткань имеет единственную локализацию – сетчатый слой(2) дермы. 2) Клеток – мало, и состав их однообразен: фибробласты и фиброциты. 3) Преобладают толстые пучки коллагеновых волокон, идущие в разных направлениях. |
|
Рис. 9.7. Плотная оформленная соед. ткань коллагенового типа Сухожилие Окраска гематоксилином и эозином | 1) Эта ткань – основа капсул, фасций, сухожилий и большинства связок (кроме эластических). 2) Из клеток присутствуют практически лишь фиброциты(в сухожилиях называемыетендиноцитами) (2). 3) Коллагеновые волокна идут параллельно и объединяются в пучкинескольких порядков – от первого до четвёртого. |
|
Рис. 9.8. Плотная оформленная соед. ткань эластического типа Эластическая связка. Окраска пикрофуксином и гематоксилином | 1) При данной окраске эластические волокна приобретают жёлтый цвет. Они лежат параллельно и объединяются в пучки разной толщины. 2) Имеются также коллагеновые волокна, но при данной окраске они не выявляются. 3) Между пучками волокон находятся фиброциты. |
|
studfile.net
Бластные клетки — это… Что такое Бластные клетки?
- Бластные клетки
- Бластные клетки — этим термином обозначают самые незрелые клетки костного мозга, которые можно идентифицировать с помощью световой микроскопии. Бласты составляют около 1% всех нормально развивающихся клеток костного мозга. Они представлены в основном миелобластами, т. е. клетками, которые при созревании превращаются в нейтрофилы. В нормальных лимфатических узлах обнаруживается множество лимфобластов, т. е. клеток, которые являются одной из стадий созревания лимфоцитов.
У пациентов с острым лейкозом количество бластных клеток, внешне похожих на нормальные бласты, резко увеличено, и они могут составлять до 100% всех клеток костного мозга. При остром миелоидном лейкозе увеличивается количество миелобластов, а при остром лимфоидном лейкозе — лимфобластов. Эти виды лейкозов иногда не удается отличить друг от друга посредством микроскопического исследования окрашенных препаратов костного мозга, и для точного определения вида лейкоза требуется иммунофенотипирование или специальное окрашивание клеток костного мозга.
Источник: «Медицинский словарь»
Медицинские термины. 2000.
- Базофилы
- Гематолог
Смотреть что такое «Бластные клетки» в других словарях:
Клетки — получить на Академике рабочий купон на скидку Гулливер Тойс или выгодно клетки купить с бесплатной доставкой на распродаже в Гулливер Тойс
Стволовые клетки — Эмбриональные стволовые клетки человека под микроскопом. Стволовые клетки недифференцированные (незрелые) клетки, имеющиеся во всех … Википедия
Лейко́зы — (leucoscs; греч. leukos белый + ōsis; синоним лейкемия) заболевания опухолевой природы, протекающие с вытеснением нормальных ростков кроветворения: опухоль возникает из кроветворных клеток костного мозга. Заболеваемость Л. неодинакова в различных … Медицинская энциклопедия
Рефракте́рные анеми́и — (франц. refractaire невосприимчивый) гетерогенная группа приобретенных идиопатических клональных заболеваний костного мозга, характеризующихся рефракторной к лечению анемией в сочетании с различными цитопениями и другими количественными, а также… … Медицинская энциклопедия
Лейкоз — Микропрепарат костного мозга больного острой В лимфоцитарной лейкобластной лейкемией … Википедия
Кроветворение — I Кроветворение (синоним гемопоэз) процесс, заключающийся а серии клеточных дифференцировок, в результате которых образуются зрелые клетки крови. Во взрослом организме существуют родоначальные кроветворные, или стволовые, клетки. Предполагают,… … Медицинская энциклопедия
Лейкозы — Лейкоз наименование разнородных клональных злокачественных (неопластических) заболеваний кроветворной системы, при которых злокачественный клон происходит из незрелых гемопоэтических клеток костного мозга. Содержание 1 Течение 2 Принципы… … Википедия
Лейкемия — Лейкоз наименование разнородных клональных злокачественных (неопластических) заболеваний кроветворной системы, при которых злокачественный клон происходит из незрелых гемопоэтических клеток костного мозга. Содержание 1 Течение 2 Принципы… … Википедия
Лимфосарко́мы — (lymphosarcoma, единственное число; синоним неходжкинские лимфомы) злокачественные опухоли, развивающиеся из лимфоидной ткани. По типу роста выделяют нодулярные и диффузные Л. Для модулярных Л. характерен очаговый фолликулоподобный рост… … Медицинская энциклопедия
ЛЕЙКОЗЫ — – опухоль из кроветворных клеток, поражающая костный мозг с вытеснением нормальных ростков кроветворения, а также другие органы и ткани. Острые лейкозы характеризуются увеличением количества бластных, или лейкозных, «молодых», клеток в костном… … Энциклопедический словарь по психологии и педагогике
Острые лейкозы — Острые лейкозы группа клональных (онкологических) заболеваний, первично возникающих в костном мозге в результате мутации стволовой клетки крови. Следствием мутации является потеря потомками мутировавшей клетки способности к дифференцировке… … Википедия
dic.academic.ru
КЛЕТКА — это… Что такое КЛЕТКА?
КЛЕТКА, в биологии — основной компонент, из которого состоят все растительные и животные ткани. Клетка является наименьшей живой частицей, способной существовать независимо и обладающей собственной саморегулирующейся химической системой. Большинство клеток состоит из МЕМБРАНЫ, окружающей желеобразную массу ЦИТОПЛАЗМЫ, и расположенного в центре ЯДРА. Ядро является основой всей структуры, в нем находятся ХРОМОСОМЫ, содержащие ДНК. Животные клетки отличаются разнообразием форм. Например, ЭРИТРОЦИТ (красное кровяное тельце) представляет собою двояковогнутый диск, а НЕЙРОН — это длинное волокно. Клетки растений и водорослей заключены внутри стенки, что придает им большую жесткость. Клетки бактерий также имеют стенки, но лишены ядра и хромосом; у них петля ДНК плавает в цитоплазме. Более развитые клетки (имеющие ядра) часто содержат внутри мембраны также другие структуры, например, МИТОХОНДРИИ и ХЛОРОПЛАСТЫ. см. также ЭУКАРИОТЫ, ПРОКАРИОТЫ.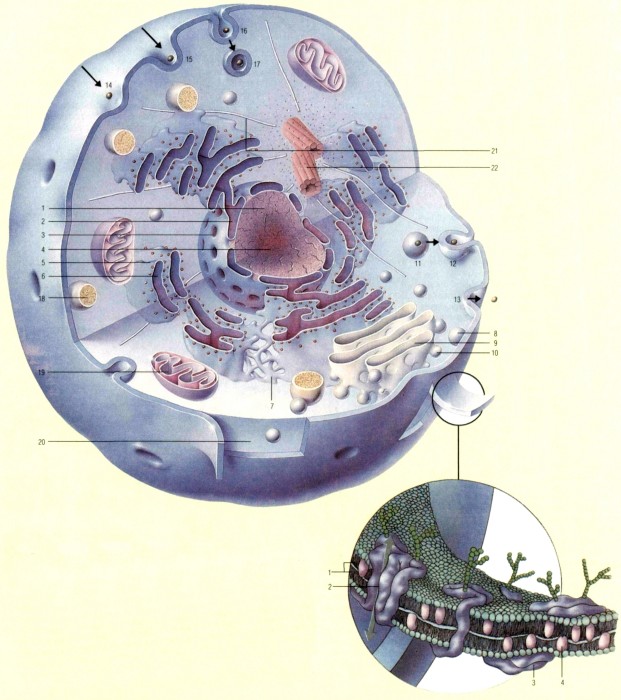
Все животные клетки поразительно сходны по строению. У миллионов различных видов животных, от простейших губок до сложнейших млекопитающих, клетки, из которых они состоят, практически одинаковы по внутренней организации. Человеческое тело состоит из 10 триллионов клеток, причем каждая клетка выполняет свою специфическую функцию, однако деятельность их всех согласована, что дает телу возможность существовать. Современные микроскопические исследования выявили сложность строения животной клетки. Одни ее компоненты служат для поддержания формы, другие собирают и переносят сложные молекулы, третьи предназначены для осуществления процессов деления клетки. Различные процессы внутри клеток протекают в особых отделах, называемых органеллами. Многие ор-ганеллы имеются и в животных, и в растительных клетках, однако между ними имеется весьма существенная разница: животные клетки не содержат хлоропластов и потому не могут осуществлять фотосинтез — они получают необходимую энергию от усваиваемой пищи. Животные клетки содержат несколько органелл Самая важная из них — это ядро (1), информационный центр клетки, в котором содержится генетический материал в виде удлиненных нитевидных хромосом. Ядро ограничено ядерной мембраной (2), в которой имеются поры (3), обеспечивающие сообщение между ядром и другими частями клетки. 8 ценгре ядра располагается ядрышко (4), в котором образуются рибосомы (5). В ри-босомах происходит выработка белка клетки;они прикрепляются к наружной поверхности грубой эндоплазмйческой сети (6). Эта сеть представляет собой систему уплощенных полостей и трубок, соединенных с мембраной ядра Она является источником информационных молекул РНК, управляющих синтезом белка и поступающих на рибосомы В ней же образуются ли-пиды, которые образуют мембрану клетки. Гладкая эндо-плазматическая сеть(7), примыкающая к грубой, вырабатывает небольшие покрытые оболочкой сферы, называемые мембранными пузырьками (8). Их назначение — переносить белки к комплексу Гольджй (9), где производится модификация, сортировка и упаковка многих больших молекул в другие пузырьки, отделяющиеся от комплекса (10) Далее они направляются к другим органеллам либо выделяются за пределы клетки Благодаря проникновению пузырьков внутрь клеточной мембраны частицы могут транспортироваться из клетки (этот процесс называется экзо-цитоз) (11 —13). Аналогично осуществляется и проникновение частиц внутрь клетки (14 — 17)(эндоцитоз). Молекулы, поступающие в клетку, могут расщепляться энзимами, содержащимися в особых пузырьках, называемых лизосомами (18). Митохондрии (19) служат источниками энергии для клегки; из кислорода и питательных веществ ими вырабатывается АТФ, который затем расходуется на различные процессы метаболизма. Большинство этих процессов представляет собой химические реакции, протекающие в водной среде цитоплазмы (20). Цитоплазма пронизана белковыми волокнами (микротрубочки, 21), играющими ропь каркаса или скелета, поддерживающего форму клетки, а также служащего для передвижения. Исходным пунктом этих нитей являются центриолй (22), которые также способствуют вы-страйванйю хромосом во время деления клетки. Клеточная мембрана — это ТОНКИЙ ДВОЙНОЙ СЛОЙ ЛйПИДНЫХ молекул (1), окружающий цитоплазму всех клеток. Лишь немногие молекулы могут сами по себе пройти сквозь клеточную мембрану. Специальные транспортные белки и выстеленные белками каналы (2) в мембране пропускают внутрь сахара, аминокислоты и необходимые ионы, например, натрий и каль ций. Другие белки (3) действуют как приемники химических сигналов и обеспечивают химический «код», по которому их распознают другие клетки, в частности, клетки иммунной системы. Молекулы холестерина (4) необходимы для обеспечения устойчивости мембраны, хотя при их переизбытке она может стать слишком жесткой.
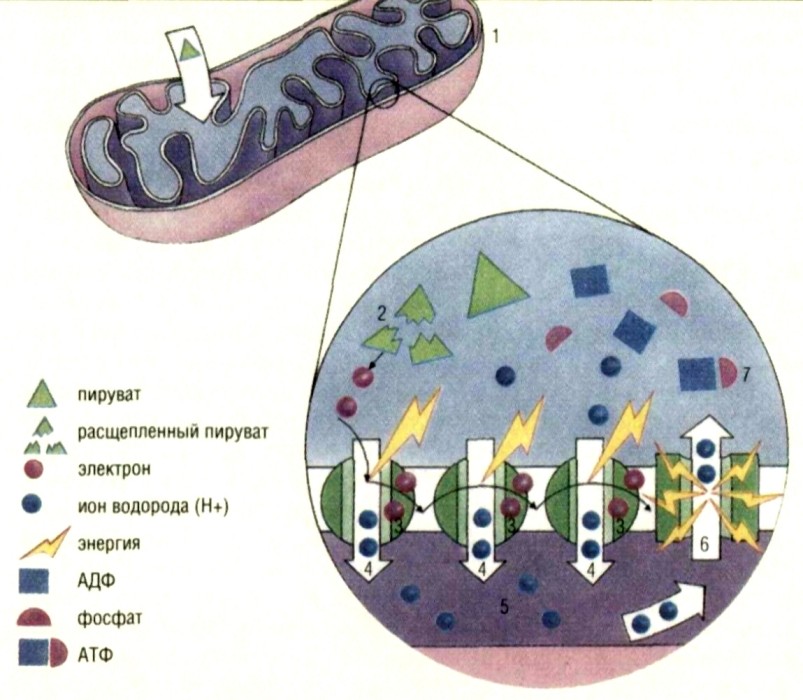
Клетки снабжаются энергией преимущественно за счет преобразования АТФ(адено-зинтрифосфата) в АДФ (аде-назиндифосфат). АТФ вырабатывается в митохондриях (1) за счет рециркуляции АДФ. Первый этап заключается в расщеплении пи-рувата (2) — топливной молекулы, произведенной в цитоплазме из глюкозы — на углекислый газ,водород и электроны высокой энергии. Эти электроны проходят по цепочке белков внутрь мембраны (3), сообщая им энер гию, необходимую для накачивания протонов(4)в межмебранное пространство (5). По мере того, как количество поступающих протонов увеличивается, в этом пространстве создается давление, вытесняющее протоны обратно Протоны могут проделать этот возвратный путь только посредством генератора АТФ (6) — энзима, называемого АТФ-синтетазой, и в ходе этого процесса они приводят во вращение «лопатки» этой турбины, в результате чего образуется АТФ (7).
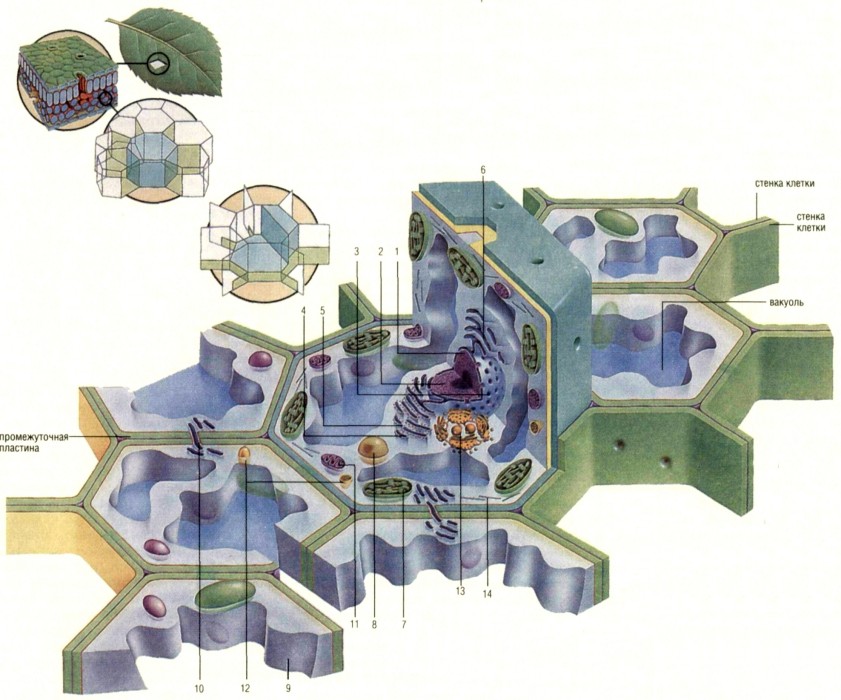
Растительные клетки отличаются огромным . лзнообразием форм и размеров, и не все из них содержат все признаки «типичной клетки», указанные ниже на рисунке. Однако все они имеют, помимо клеточной мембраны, еще и жесткую наружную оболочку из целлюлозы. Считается, что первые растительные клетки появились более чем миллиард лет назад, когда клетки, питавшиеся веществами из первичных морей, были колонизованы бактериями, способными к ФОТОСИНТЕЗУ. С ц’чением времени бактерии потеряли свою самостоятельность и превратились в хлоропласты. Сахара, получающиеся в результате фотосинтеза, расщепляются в МИТОХОНДРИЯХ, высвобождая энергию, питающую деятельность клетки, или используются как источник углерода для создания более крупных молекул, из которых образуется новое растительное вещество. Наличие структур, в которых вырабатывается и хранится питание, также является чертой, отличающей растительные клетки от животных. Раствор биологических молекул, окружающий ядро — это цитоплазма (9), которая соединяется с прилегающими клетками посредством плазмодесмов (10). Митохондрии (11), лизосо-мы (12) и тельца Гольджи (13) присутствуют во всех клетках, так же, как микронити и микротрубочки (14), образующие внутренний каркас клетки Наиболее примечательным компонентом растительной клетки является ядро (1), в котором содержится ДНК, то есть генетический материал клетки, обычно в виде тонких полосок, носящих название хроматина (2). Информационные молекулы, скопированные с ДНК, проходят через поры в ядерной мембране (3)и прикрепляются к рибосомам (4), где они управляют синтезом новых клеточных белков. Рибосомы прикреплены к параллельным мембранам — эндоплазмической сети (5), образующей в клетке нечто вроде паутины. Если в эндоплазмической сети нет рибо-сом, она называется гладкой (6). Растительные клетки содержат также хлоропласты (7) и микротела, в которых содержатся энзимы (8).
Научно-технический энциклопедический словарь.
dic.academic.ru
Клетка — это… Что такое Клетка?
Начиная знакомство с животным миром, необходимо сначала в самых общих чертах остановиться на строении и отправлениях клетки.
Клетка представляет собой структурную и функциональную единицу, лежащую в основе строения и развития организмов. В многоклеточном организме форма строения клеток в соответствии с выполняемыми ими функциями очень различна. Однако основные черты их организации свойственны как простейшим, так и многоклеточным животным и растениям. Каждая клетка состоит из цитоплазмы и ядра. Оба эти компонента представляют собой единую и неделимую структурную и функциональную систему, части которой не могут существовать раздельно.
Цитоплазму часто обозначают другим термином —протоплазмой. Однако многие ученые в слово «протоплазма» вкладывают иное содержание, обозначая им все живые части клетки, в том числе и ядро. Ввиду некоторой неопределенности термина «протоплазма» в дальнейшем изложении кы не будем им пользоваться.
Наука, изучающая строение и отправление клеток, называется цитологией. За последнее десятилетие она достигла больших успехов, что в значительной мере связано с разработкой новых методов исследования клетки.
Основным «орудием» цитологии служит микроскоп, позволяющий изучать строение клетки при увеличении в 2400—2500 раз. Клетки изучают в живом виде, а также после специальной обработки. Последняя сводится к двум основным этапам. Сначала клетки фиксируют, т. е. убивают их быстродействующими ядовитыми для клеток веществами, не разрушающими их структуры. Вторым этапом является окраска препарата. Она основана на том, что разные части клетки с разной степенью интенсивности воспринимают некоторые красители. Благодаря этому удается отчетливо выявить различные структурные компоненты клетки, которые без окраски благодаря сходному коэффициенту преломления не видны. Очень часто применяют метод изготовления срезов. Для этого ткани или отдельные клетки после специальной обработки заключают в твердую среду (парафин, целлоидин), после чего при помощи особого прибора — микротома, снабженного острой бритвой, раскладывают на тонкие срезы толщиной от 3 микрон (микрон = 0, 001 мм). Фиксированные и окрашенные препараты перед изучением заключают в среду с высоким коэффициентом преломления (глицерин, канадский бальзам и др.). Благодаря этому они становятся прозрачными, что облегчает исследование препарата.
В современной цитологии разработан ряд новых методов и приемов, применение которых чрезвычайно углубило знания о строении и физиологии клетки.
Очень большое значение для изучения клетки имеет применение биохимических и цитохимических методов.В настоящее время мы можем не только изучать строение клетки, но и определять ее химический состав и изменения его в процессе жизнедеятельности клетки. Многие из этих методов основаны на применении цветных реакций, позволяющих различать определенные химические вещества или группы веществ. Изучение распределения разных по своему химическому составу веществ в клетке путем цветных реакций представляет собой цитохимический метод. Он имеет большое значение для исследования обмена веществ и других сторон физиологии клетки.
В современной цитологии широко применяют ультрафиолетовую микроскопию. Ультрафиолетовые лучи невидимы для человеческого глаза, но воспринимаются фотографической пластинкой. Некоторые играющие особо важную роль в жизни клетки органические вещества (нуклеиновые кислоты) избирательно поглощают ультрафиолетовые лучи. Поэтому по снимкам, изготовленным в ультрафиолетовых лучах, можно судить о распределении нуклеиновых веществ в клетке.
Разработан ряд тонких методов, позволяющих изучать проникновение разных веществ в клетку из окружающей среды. Для этого, в частности, применяют прижизненные (витальные) красители. Это такие красящие вещества (например, нейтральный красный), которые проникают в клетку, не убивая ее. Наблюдая за живой витально окрашенной клеткой, можно судить о путях проникновения и накопления веществ в клетке.
Особенно большую роль в развитии цитологии, а также в изучении тонкого строения простейших сыграла электронная микроскопия.
Электронный микроскоп основан на ином принципе, чем световой оптический микроскоп. Объект изучают в пучке быстро летящих электронов. Длина волны электронных лучей во много тысяч раз меньше длины волны световых лучей. Это позволяет получить значительно большую разрешающую способность, т. е. гораздо большее увеличение, чем в световом микроскопе. Пучок электронов проходит сквозь изучаемый объект и затем падает на флуоресцирующий экран, на котором и проецируется изображение объекта. Чтобы объект был проницаемым для электронного пучка, он должен быть очень тонким. Обычные микротомные срезы толщиной в 3—5 мк для этого совершенно непригодны. Они полностью поглотят пучок электронов. Были созданы особые приборы — ультрамикротомы, которые позволяют получать срезы ничтожной толщины, порядка 100—300 ангстрем (ангстрем — единица длины, равная одной десятитысячной микрона). Различия в поглощении электронов разными частями клетки настолько малы, что без специальной обработки на экране электронного микроскопа они не могут быть обнаружены. Поэтому изучаемые объекты предварительно обрабатываются веществами, непроницаемыми или труднопроницаемыми для электронов. Таким веществом является четырехокись осмия (OsOJ. Она в различной степени поглощается разными частями клетки, которые благодаря этому по-разному задерживают электроны. Применяя электронный микроскоп, можно получить увеличения порядка 100 000.
Электронная микроскопия открывает новые перспективы в изучении организации клетки.
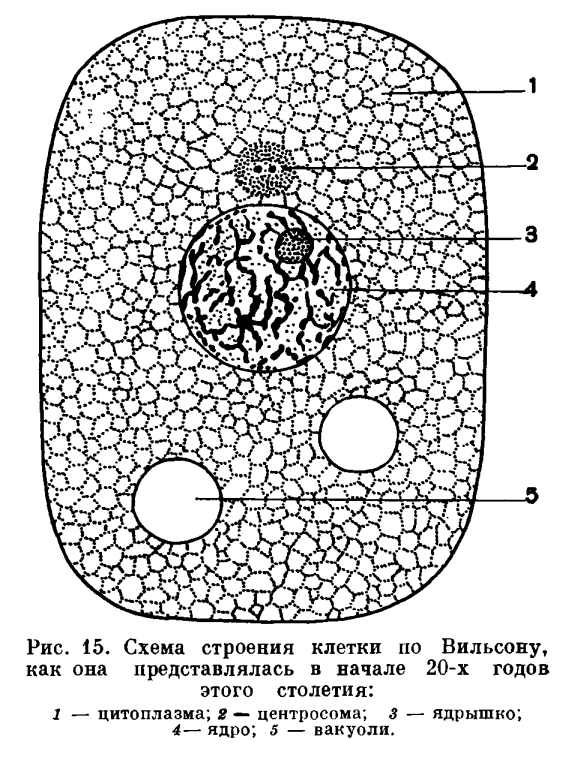
,
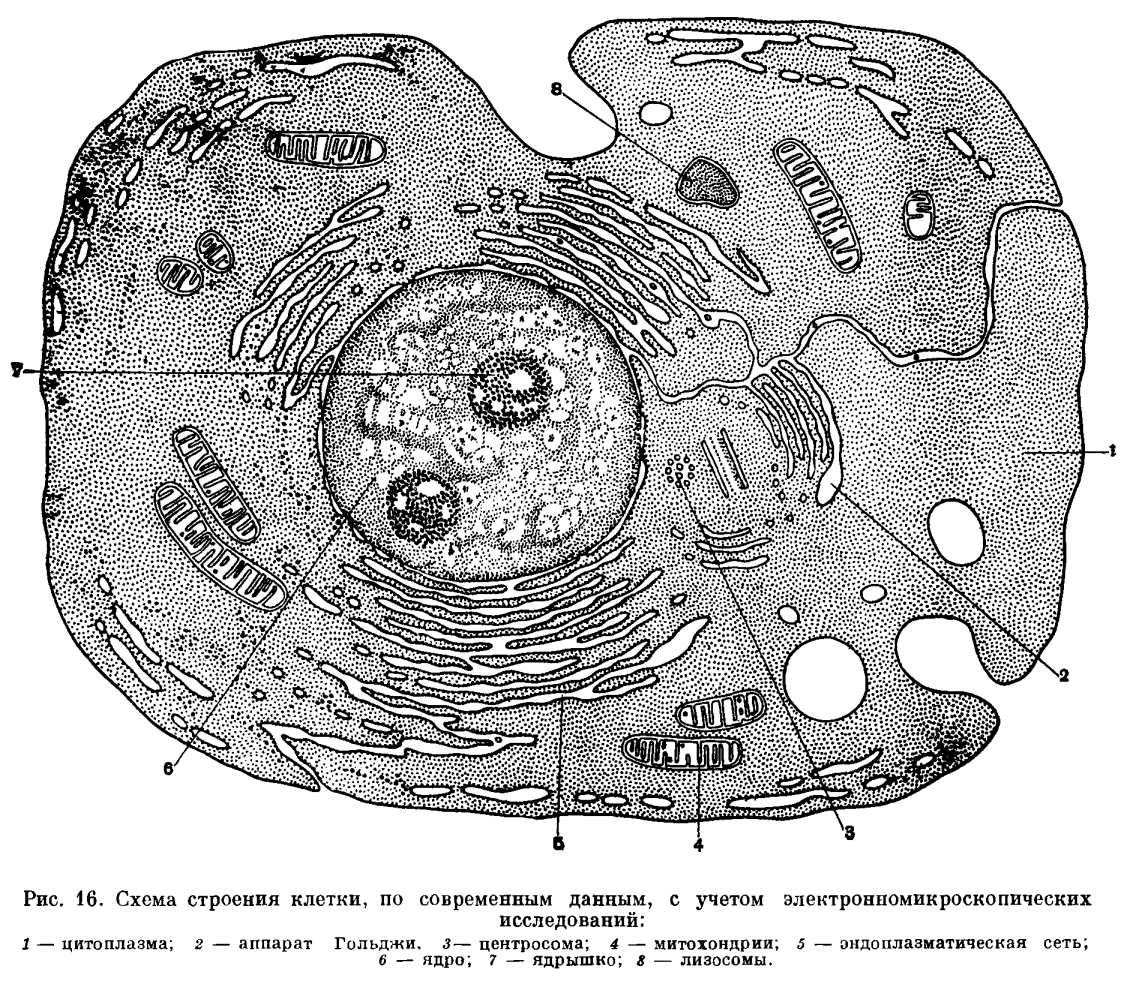
На рис. 15 и рис. 16 сопоставлена схема строения клетки, как она представлялась в двадцатых годах этого столетия и как она представляется в настоящее время.
Снаружи клетка отграничена от окружающей среды тонкой клеточной мембраной, которая играет важную роль в регуляции поступления веществ в цитоплазму. Основное вещество цитоплазмы имеет сложный химический состав. Основу его составляют белки, которые находятся в состоянии коллоидного раствора. Белки — это сложные органические вещества, обладающие крупными молекулами (молекулярный вес их очень высок, измеряется десятками тысяч по отношению к атому водорода) и большой химической подвижностью. Кроме белков, в цитоплазме присутствуют и многие другие органические соединения (углеводы, жиры), среди которых особенно большое значение в жизни клетки играют сложные органические вещества — нуклеиновые кислоты. Из неорганических составных частей цитоплазмы следует прежде всего назвать воду, которая по весу составляет значительно больше половины всех веществ, входящих в состав клетки. Вода важна как растворитель, так как реакции обмена веществ протекают в жидкой среде. Кроме того, в клетке присутствуют ионы солей (Са2+, К+, Na+, Fe2+, Fe3+ и др.).
В основном веществе цитоплазмы располагаются органоиды — постоянно присутствующие структуры, выполняющие определенные функции в жизни клетки. Среди них важную роль в обмене веществ играют митохондрии. В световом микроскопе они видны в форме небольших палочек, нитей, иногда гранул. Электронный микроскоп показал, что структура митохондрий очень сложна.Каждая митохондрия имеет оболочку, состоящую из трех слоев, и внутреннюю полость. От оболочки в эту полость, заполненную жидким содержимым, вдаются многочисленные перегородки, не доходящие до противоположной стенки, называемые кристами. Цитофизиологические исследования показали, что митохондрии являются органоидами, с которыми связаны дыхательные процессы клетки (окислительные). Во внутренней полости, на оболочке и кристах локализуются дыхательные ферменты (органические катализаторы), обеспечивающие сложные химические превращения, из которых слагается процесс дыхания.

В цитоплазме, кроме митохондрий, имеется сложная система мембран, образующая в совокупности эндоплазматическую сеть (рис. 16). Как показали электронно-микроскопические исследования, мембраны эндоплазматической сети двойные. Со стороны, обращенной к основному веществу цитоплазмы, на каждой мембране расположены многочисленные гранулы (называемые «тельцами Паллада» по имени открывшего их ученого). В состав этих гранул входят нуклеиновые кислоты (а именно рибонуклеиновая кислота), благодаря чему их называют также рибосомами. На эндоплазматической сети при участии рибосом осуществляется один из основных процессов жизнедеятельности клетки — синтез белков.
Часть цитоплазматических мембран лишена рибосом и образует особую систему, называемую аппаратом Гольджи. Это образование обнаружено в клетках уже довольно давно, ибо его удается выявить особыми методами при исследовании в световом микроскопе. Однако тонкая структура аппарата Гольджи стала известна лишь в результате электронно-микроскопических исследований. Функциональное значение этого органоида сводится к тому, что в области аппарата концентрируются различные синтезируемые в клетке вещества, например зерна секрета в железистых клетках и т. п. Мембраны аппарата Гольджи находятся в связи с эндоплазматической сетью. Возможно, что на мембранах аппарата Гольджи протекает ряд синтетических процессов.
Эндоплазматическая сеть связана с наружной оболочкой ядра. Эта связь играет, по-видимому, существенную роль во взаимодействии ядра и цитоплазмы. Эндоплазматическая сеть имеет также связь с наружной мембраной клетки и местами непосредственно переходит в нее.

При помощи электронного микроскопа в клетках был обнаружен еще один тип органоидов — лизосомы (рис. 16). По размерам и форме они напоминают митохондрии, но легко отличаются от них по отсутствию тонкой внутренней структуры, столь характерной и типичной для митохондрий. По представлениям большинства современных цитологов, в лизосомах содержатся переваривающие ферменты, связанные с расщеплением крупных молекул органических веществ, поступающих в клетку. Это как бы резервуары ферментов, постепенно используемых в процессе жизнедеятельности клетки.
В цитоплазме животных клеток обычно по соседству с ядром располагается центросома. Этот органоид имеет постоянную структуру. Он слагается из девяти ультрамикроскопических палочковидных образований, заключенных в особо дифференцированную уплотненную цитоплазму. Центросома — органоид, связанный с делением клетки.
Кроме перечисленных цитоплазматических органоидов клетки, в ней могут присутствовать различные специальные структуры и включения, связанные с обменом веществ и выполнением различных специальных, свойственных данной клетке функций. В животных клетках обычно присутствует гликоген, или животный крахмал. Это резервное вещество, потребляемое в процессе обмена веществ как основной материал для окислительных процессов. Часто имеются жировые включения в форме мелких капель. В специализированных клетках, таких, как мышечные клетки, имеются особые сократимые волоконца, связанные с сократительной функцией этих клеток. Ряд специальных органоидов и включений имеется в растительных клетках. В зеленых частях растений всегда присутствуют хлоропласты — белковые тела, содержащие зеленый пигмент хлорофилл, при участии которого осуществляется фотосинтез — процесс воздушного питания растения. В качестве резервного вещества здесь обычно находятся крахмальные зерна, отсутствующие у животных. В отличие от животных, растительные клетки обладают, кроме наружной мембраны, прочными ободочками из клетчатки, что обусловливает особую прочность растительных тканей.
Клеточное ядро — второй основной компонент клетки, образующий вместе с цитоплазмой единую структурную и функциональную систему. Ядро отграничено от цитоплазмы оболочкой. Оболочка состоит из двух мембран, из которых наружная связана с эндоплазматической сетью цитоплазмы. Электронно-микроскопические исследования показали, что ядерная оболочка пронизана многочисленными мельчайшими порами диаметром около 600—700 ангстрем. Эти поры играют, вероятно, важную роль в обмене веществ между цитоплазмой и ядром. Внутри ядра имеется жидкий ядерный сок — кариолимфа, в которой расположены структурные компоненты ядра. Количество кариолимфы в разных ядрах различно. Иногда ее может быть очень много, и ядро приобретает пузырьковидное строение. В других случаях кариолимфы мало (пример — макронуклеусы инфузорий), и ядро становится массивным и плотным. В кариолимфе растворены различные органические, в том числе белковые, вещества. Основной структурный компонент ядра — хроматин (хромосом ы), который представлен обычно беспорядочно расположенными нитями и тяжами, нередко образующими скопления в виде гранул. С биохимической стороны хроматин состоит из особого содержащего фосфор вещества — нуклеопротеидов дезоксирибонуклеиновой кислоты (сокращенно ДНК). Нуклеопротеид ы—это белки (протеиды), химически связанные с нуклеиновой кислотой ДНК. Роль хромосом в жизни клетки чрезвычайно велика. Об этом будет сказано ниже. Наконец, в ядре всегда присутствует одно или несколько ядрышек (руклеол), которые тоже в основном состоят из нуклеопротеидов, но уже другой, а именно рибонуклеиновой кислоты (РНК).
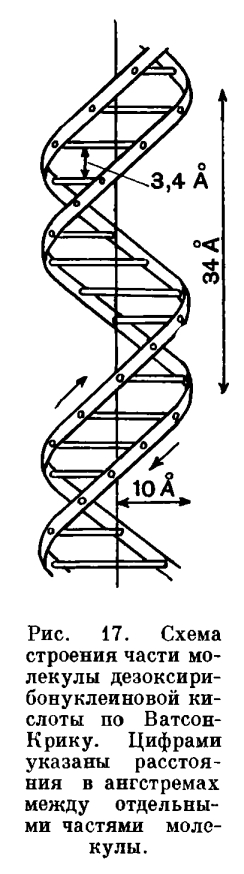
В настоящее время доказано, что ДНК обладает замечательной способностью к самовоспроизведению (ауторепредукции, репликации). Строение молекулы ДНК очень сложно. Она слагается из двух закрученных спирально одна вокруг другой нитей, в свою очередь состоящих из повторяющихся по продольной оси групп молекул (нуклеотидов, рис. 17). Каждый нуклеотид включает в свой состав органическое основание (из групп пуриновых и пиримидиновых оснований). Связь между двумя цепочками в молекуле ДНК осуществляется при помощи этих оснований, которые обращены друг к другу. Обе нити (цепи нуклеотид) относительно слабо связаны между собой. Эти связи могут нарушаться, в результате чего нити раскручиваются своими внутренними сторонами наружу. Из окружающей кариолимфы к ним на освободившиеся химические связи органических оснований присоединяются нуклеотиды, точно такие же, какие входили в состав второй цепи. В результате этого замечательного процесса из одной молекулы получается две, точно такие же.
Одиночная нить ДНК является как бы «матрицей» (формой), воспроизводящей вторую нить. Этот процесс является молекулярной основой размножения клетки, который мы рассмотрим ниже.
Молекулы ДНК способны не только воспроизводить себе подобные, но и участвовать через посредство РНК (в рибосомах) в синтезе белков. За последние годы этот сложный процесс в основных своих чертах изучен. Сущность его сводится к следующему.
На «матрице» ДНК из нуклеотидов кариолимфы синтезируются молекулы РНК, отличающиеся от ДНК по химическому составу некоторых нуклеотидов, а именно органических оснований.
Синтезированная в ядре РНК выходит в цитоплазму и локализуется на рибосомах. Эта РНК в свою очередь служит «матрицей» для синтеза белков. Как известно, в основе строения молекулы белка лежат аминокислоты — органические соединения, обладающие одновременно кислотными и щелочными свойствами. Основу белковой молекулы составляют цепочки аминокислот, соединенные в строго определенном порядке. Число входящих в состав белков аминокислот невелико, оно равняется всего 20. Количество же различных белков поистине колоссально, ибо не только в каждом организме имеется много разных белков, но и разные виды организмов обладают различными белками. Каждому виду животных и растений свойственны свои специфические для данного вида белки. В этом заключается одно из замечательных биологических свойств организмов. Все это разнообразие белков определяется последовательностью аминокислот в цепочке белковой молекулы. Достаточно изменить эту последовательность или на место одной аминокислоты поставить другую, как свойства белков меняются.
Вернемся к вопросу о синтезе белка на «матрицах» РНК — на рибосомах. Аминокислоты, находящиеся в цитоплазме, переносятся на цепочки РНК, где и располагаются в строго определенном порядке. Этот порядок определяется последовательностью нуклеотидов, вернее, органических оснований (известных в органической химии под именем пуриновых и пиримидиновых оснований). Каждая аминокислота связывается тремя основаниями. Таким образом создается «триплетный» (состоящий из трех расположенных рядом оснований) код для каждой аминокислоты. Последовательно «триплеты» цепочки РНК определяют последовательность аминокислот, а следовательно, и первичную структуру синтезирующих белков (последовательность аминокислот). Поскольку структура РНК, в которой «закодирована» структура белка, в свою очередь определяется химической структурой ДНК хромосом ядра, то очевидно, что именно в хромосомах «закодированы» все свойства белков организма.
Разгадка механизма синтеза белка в клетке представляет собой величайшее открытие биологии за последнее десятилетие. Удалось поднять завесу над одной из основных проблем науки о жизни — проблемой образования белка. Ее решение осуществлено на основе тесного сотрудничества двух биологических наук — цитологии и биохимии.
Наряду с проблемой синтеза белка основным вопросом физиологии клетки является вопрос об источниках энергии. Все те синтетические процессы, которые мы только что рассмотрели, протекают с затратой энергии. Энергия необходима и для ряда других жизненных процессов, в частности движения. В отношении клетки справедливо будет утверждение, что самосохранение ее сложной структуры и основные жизненные функции осуществляются лишь благодаря непрерывному потреблению энергии. Где же источники этой энергии? В каких формах происходит превращение энергии в клетке? Основным источником энергии в клетке являются процессы, связанные в конечном счете с окислением углеводов и других органических веществ вплоть до образования углекислого газа и воды. Наряду с окислением источником энергии могут являться и расщепительные анаэробные процессы, ведущие к образованию из более сложных органических соединений (например, глюкозы) менее сложных (например, молочной кислоты). Материальным субстратом, на котором протекают окислительные процессы, служат митохондрии. Однако нужно подчеркнуть, что окислительные процессы в клетке с химической стороны протекают совсем не так, как горение органических тел на воздухе, хотя и в том и в другом случае конечные продукты одинаковы — углекислый газ и вода. Окисление в клетке протекает при температурах относительно низких, при которых вне организма органические вещества не окисляются. Процессы, протекающие в живой клетке, обусловлены наличием сложной системы ферментов (органических катализаторов), каждый из которых обусловливает строго определенную реакцию. Процесс этот очень сложен и состоит из ряда этапов. Во время первого этапа углевод (глюкоза), обладающий шестью атомами углерода, дает начало двум трехуглеродным молекулам молочной кислоты. На втором этапе, слагающемся из множества промежуточных звеньев, рассматривать которые мы не имеем здесь возможности (эта серия последовательных превращений известна под названием цикла Кребса), часть вещества дает начало углекислому газу и воде. Все эти превращения связаны с освобождением энергии. Одной из самых замечательных сторон этого процесса является связь окисления с фосфорилированием. Под фосфорилированием понимают процесс образования молекул особого органического вещества — аденозинтрифосфата (сокращенно — АТФ), в состав молекулы которого входят три фосфатные группы (фосфатная группа — это атом фосфора, соединенный с атомами кислорода и гидроксильной группой). Две фосфатные группы АТФ соединены с остальной частью молекулы особой химической связью, носящей название макроэргической, что означает «богатая энергией». Один из фосфатных остатков может легко отделяться от АТФ, и, высвобождая энергию, АТФ при этом переходит в аденозиндифосфат (АДФ), который гораздо беднее химической энергией, чем АТФ. За счет энергии, освобождаемой при окислении, АДФ вновь может подвергаться фосфорилированию, в результате чего происходит присоединение фосфатной группы и восстанавливается макроэргическая связь. АТФ, таким образом, можно рассматривать как богатую энергией «заряженную» форму, тогда как АДФ — как «разряженную», относительно более бедную энергией форму аденозинфосфата. АТФ в клетке является своеобразным химическим аккумулятором энергии, за счет которого выполняется самая различная работа: механическая, химическая (в том числе синтез белков), осмотическая, электрическая.
Мы видим, таким образом, что в животных клетках в ходе сложной цепи превращений, из которых слагается дыхание, энергия, заключенная в питательных веществах, в результате окисления расходуется на построение АТФ из АДФ. Если этим процессам дать количественное выражение, то оказывается, что немного более половины высвобождаемой при окислении энергии идет на фосфорилирование, на «зарядку» аденозинфосфатов — этих замечательных органических аккумуляторов энергии.
Хорошо известно, что животный организм не способен создавать органические вещества из неорганических. В качестве пищи животное получает органические вещества, о судьбе которых в клетке мы только что говорили. Лишь зеленое растение при помощи хлорофилла создает органические вещества из неорганических в результате как воздушного, так и минерального питания из почвы. Эти процессы требуют затраты энергии. Источник ее — солнечный луч. Энергия солнца переходит в потенциальное состояние в форме органических соединений, создаваемых растением. Эта энергия с пищей передается животному, где она претерпевает ряд превращений, в которых особо важная роль принадлежит АТФ — органическому аккумулятору энергии в клетке.

Одним из основных биологических процессов, обеспечивающих преемственность форм жизни и лежащих в основе всех форм размножения, является процесс деления клетки. Этот процесс, известный под названием кариокинеза, или митоза, с удивительным постоянством, лишь с некоторыми вариациями в деталях, осуществляется в клетках всех растений и животных, в том числе и простейших. При митозе происходит равномерное распределение хромосом, претерпевающих удвоение между дочерними клетками. От любого участка каждой хромосомы дочерние клетки получают половину. Не вдаваясь в детальное описание митоза, отметим лишь его основные моменты (рис. 18).
В первой стадии митоза, называемой профазой, в ядре становятся отчетливо видимыми хромосомы в форме нитей разной длины. В неделящемся ядре, как мы видели, хромосомы имеют вид тонких, неправильно расположенных нитей, переплетающихся друг с другом. В профазе происходит их укорачивание и утолщение. Вместе с тем каждая хромосома оказывается двойной. По длине ее проходит щель, разделяющая хромосому на две рядом лежащие и совершенно подобные друг другу половины.
На следующей стадии митоза — метафазе — оболочка ядра разрушается, ядрышки растворяются и хромосомы оказываются лежащими в цитоплазме. Все хромосомы располагаются при этом в один ряд, образуя так называемую экваториальную пластинку. Существенные изменения претерпевает центросома. Она делится на две части, которые расходятся, и между ними образуются нити, формирующие ахроматиновое веретено. Экваториальная пластинка хромосом располагается по экватору этого веретена.
На стадии анафазы происходит процесс расхождения к противоположным полюсам дочерних хромосом, образовавшихся, как мы видели, в результате продольного расщепления материнских хромосом. Расходящиеся в анафазе хромосомы скользят по нитям ахроматинового веретена и в конце концов собираются двумя группами в области центросом.
Во время последней стадии митоза — телофазы — происходит восстановление структуры неделящегося ядра. Вокруг каждой группы хромосом образуется ядерная оболочка. Хромосомы вытягиваются и утончаются, превращаясь в длинные, беспорядочно расположенные тонкие нити. Выделяется ядерный сок, в котором появляется ядрышко.
Одновременно со стадиями анафазы и телофазы происходит разделение на две половины цитоплазмы клетки, которое осуществляется обычно путем простой перетяжки.
Как видно из нашего краткого описания, процесс митоза сводится в первую очередь к правильному распределению хромосом между дочерними ядрами. Хромосомы состоят из пучков нитевидных молекул ДНК, расположенных по продольной оси хромосомы. Видимому началу митоза предшествует, как это теперь установлено точными количественными измерениями, удвоение ДНК, молекулярный механизм которого мы уже рассмотрели выше.
Таким образом, митоз и расщепление хромосом во время него является лишь видимым выражением процессов удвоения (ауторепродукции) молекул ДНК, осуществляемого на уровне молекул. ДНК определяет через посредство РНК белковый синтез. Качественные особенности белков «закодированы» в структуре ДНК. Поэтому очевидно, что точное разделение хромосом в митозе, базирующееся на редупликации (ауторепродукции) молекул ДНК, лежит в основе «наследственной информации» в ряде следующих друг за другом поколений клеток и организмов.
Число хромосом, так же как их форма, размеры и т. п., является характерным признаком каждого вида организмов. У человека, например, имеется 46 хромосом, у окуня — 28, у мягких пшениц — 42 и т. п.
Жизнь животных: в 6-ти томах. — М.: Просвещение. Под редакцией профессоров Н.А.Гладкова, А.В.Михеева. 1970.
dic.academic.ru







