Система мононуклеарных фагоцитов — это… Что такое Система мононуклеарных фагоцитов?
физиологическая защитная система клеток, обладающих способностью поглощать и переваривать чужеродный материал. Клетки, входящие в состав этой системы, имеют общее происхождение, характеризуются морфологическим и функциональным сходством и присутствуют во всех тканях организма.
Основой современного представления о С. м. ф. является фагоцитарная теория, разработанная И.И. Мечниковым в конце 19 в., и учение немецкого патолога Ашоффа (К. А.L. Aschoff) о ретикулоэндотелиальной системе (РЭС). Первоначально РЭС была выделена морфологически как система клеток организма, способных накапливать витальный краситель кармин. По этому признаку к РЭС были отнесены гистиоциты соединительной ткани, моноциты крови, клетки Купфера печени, а также ретикулярные клетки кроветворных органов, эндотелиальные клетки капилляров, синусов костного мозга и лимфатического узлов. По мере накопления новых знаний и совершенствования морфологических методов исследования стало ясно, что представления о ретикулоэндотелиальной системе расплывчаты, не конкретны, а в ряде положений просто ошибочны. Так, например, ретикулярным клеткам и эндотелию синусов костного мозга и лимфатических узлов длительное время приписывалась роль источника фагоцитирующих клеток, что оказалось неверным. В настоящее время установлено, что мононуклеарные фагоциты происходят из циркулирующих моноцитов крови. Моноциты созревают в костном мозге, затем поступают в кровяное русло, откуда мигрируют в ткани и серозные полости, становясь макрофагами. Ретикулярные клетки выполняют опорную функцию и создают так называемое микроокружение для кроветворных и лимфоидных клеток.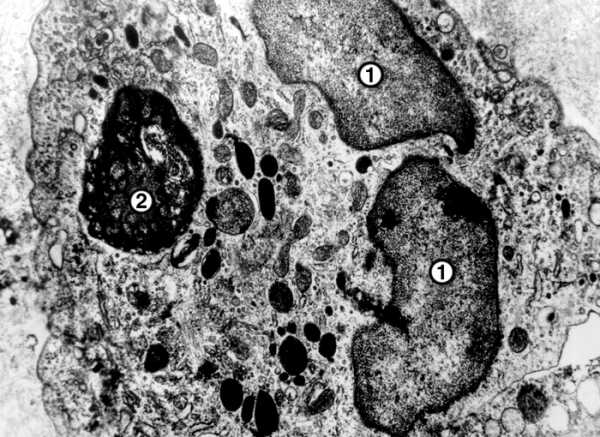
Рис. 2. Электронограмма макрофага очага асептического воспаления: 1 — фрагменты бобовидного ядра; 2 — фагоцитированный материал в пищеварительной вакуоли; ×21000.
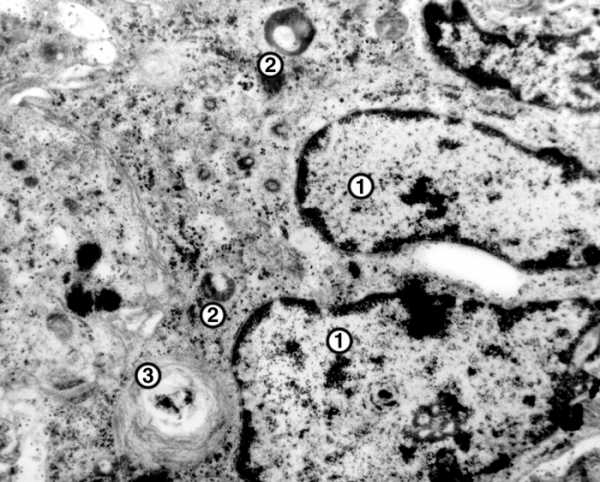
Рис. 1. Электронограмма участка гигантской многоядерной клетки инородных тел: 1 — ядра, входящие в состав одной клетки; 2 — лизосомы; 3 — фагосомы; ×15000.
dic.academic.ru
СИСТЕМА МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ — Большая Медицинская Энциклопедия
СИСТЕМА МОНОНУКЛЕАРНЫХ ФАГОЦИТОВ (син.: макрофагальная система, моноцитарно-макрофагальная система) — система, объединяющая клетки, к-рые обладают способностью к эндоцитозу, имеют общее происхождение, морфологическое, цитохимическое и функциональное сходство. Концепция С. м. ф. впервые предложена в 1969 г. на конференции в Лейдене вместо устаревшей концепции ретикулоэндотелиальной системы (см. Ретикулоэндотелиальная система). На последующих конференциях в Лейдене (1973, 1978) представления о С. м. ф. продолжали совершенствоваться, и в настоящее время эта концепция принята большинством исследователей.
В основу концепции С. м. ф. положены современные представления об общности происхождения и кинетике этих клеток, их морфологическом, цитохимическом и функциональном сходстве. Мононуклеарные фагоциты присутствуют во всех тканях, но в нормальных условиях пролиферация их предшественников происходит только в костном мозге (см.). Наиболее рано распознаваемыми предшественниками ряда дифференцировки этих клеток являются монобласты — прямые «потомки» коммутированных стволовых клеток. В результате деления монобластов возникают промоноциты — прямые предшественники моноцитов (см. Кроветворение). Моноциты поступают в кровеносное русло, а затем мигрируют в различные ткани и полости тела, где становятся макрофагами (см.). Экспериментальные исследования подтвердили происхождение макрофагов самой разной локализации из циркулирующих в крови моноцитов. Было также показано, что деление макрофагов в тканях существенного значения для их обновления не имеет, тогда как ретикулярные клетки, дендритные ретикулярные клетки, фибробласты, эндотелиальные и мезотелиальные клетки не имеют предшественников в костном мозге, а обновляются путем локального деления в тканях. На схеме показаны происхождение клеток, входящих в систему мононуклеарных фагоцитов, и их локализация в органах и тканях, разновидности макрофагов в норме и при воспалении в зависимости от его характера (рис. 1).
Функция системы мононуклеарных фагоцитов контролируется сложными регуляторными механизмами, обеспечивающими поступление макрофагов в ткани в условиях нормы и патологии. Для описания функционального состояния макрофагов используются разнообразные определения (активированные, иммунные, вооруженные, индуцированные, стимулированные, экссудативные и т. д.). Активирование макрофагов происходит при культивировании in vitro, при фагоцитировании бактерий, контакте с антигеном, иммунными комплексами, бактериальными липополисахари-дами, полинуклеотидами и при взаимодействии с лимфокинами (см. Медиаторы клеточного иммунитета). В частности, in vitro показано участие в моноцитопоэзе (и гранулоцитопоэ-зе) гликопротеидов-регуляторов, или так наз. колониестимулирующих факторов, к-рые влияют на скорость дифференцировки предшественников макрофагов и относятся к аз-глобулинам с молекулярным весом (массой) от 13 000 до 93 000 . При различных патологических процессах, когда повышается потребность в моноцитах, продукция последних увеличивается за счет вступления в цикл непролиферирующих промоноцитов (в норме у человека активно пролиферирует только ок. 40% промоноцитов) и укорочения клеточного цикла, к-рый в норме составляет в среднем ок. 30 часов. В условиях воспаления макрофаги очага повреждения вырабатывают и освобождают в циркуляторное русло фактор, к-рый усиливает моноцитопоэз и, достигая костного мозга, стимулирует продукцию моноцитов. Этот фактор представляет собой белок с молекулярным весом (массой) ок. 20 000. После устранения повреждающего агента макрофаги начинают вырабатывать другой фактор — ингибитор моноцитопоэза с молекулярным весом (массой) ок. 50 000.
Активированные макрофаги характеризуются увеличенными размерами, усиленными фагоцитарной, переваривающей и бактерицидной функциями. В них повышаются активность кислых гидролаз, обменные процессы. Морфологически активированные макрофаги характеризуются увеличением числа и размеров лизосом, расширением комплекса Гольджи, увеличением складчатости плазматической мембраны. Активированные макрофаги с увеличенным числом рецепторов для IgG описаны у больных, страдающих саркоидозом (см.), болезнью Крона (см. Крона болезнь) и туберкулезом (см.).
Стимулятором, обладающим выраженным и направленным действием на макрофаги, является глюкан (сложный полисахарид из оболочек дрожжевых клеток Saccharomyces cerevisiae). Введение глюкана мышам приводит к резкому увеличению фагоцитарной активности макрофагов, стимуляции гуморального и клеточного иммунитета (см.). При этом ярко проявляется противоопухолевый эффект макрофагов. Параллельно отмечено накопление макрофагов в печени, селезенке и легких. Исследователи, применявшие глюкан, подчеркивают отсутствие у экспериментальных животных каких-либо побочных явлений.
Препараты, блокирующие, или элиминирующие, макрофаги, прежт де всего препятствуют их участию в различных иммунных реакциях. Так, частицы захваченного коллоидного угля приводят к потере способности макрофагов в процессе развития иммунного ответа перерабатывать антиген или подготавливать его для взаимодействия с соответствующими лимфоцитами. В основе иммунодепрессивного действия на макрофаги каррагинанов (высокомолекулярных полигалактоз) и частиц кварца лежит их избирательный токсический эффект. Эти же агенты используются для изучения участия макрофагов в тех или иных процессах.
Пути миграции моноцитов в ткани различны и не до конца изучены. В легких, напр., моноциты прямо дифференцируются в альвеолярные макрофаги, минуя фазу созревания в интерстиции. В брюшную полость часть макрофагов поступает из млечных пятен (см.), где они дифференцируются из моноцитов. Способность макрофагов к рециркуляции через кровеносные сосуды весьма ограничена, однако доказано, что они хмогут мигрировать в близлежащие лимф, узлы, где погибают.
Морфофизиология
Рис. 2. Электронограмма альвеолярного макрофага: стрелками указаны фаголизосомы, содержащие пылевые частицы; X 5 000. Рис. 3. Электронограмма альвеолярного макрофага, полученная в помощью сканирующего микроскопа: стрелками указаны поверхностные складки и гребни, образованные плазматической мембраной макрофага; X 5 000.Характерными качествами, присущими клеткам С. м. ф., в частности макрофагам (см.), являются способность к эндоци-тозу, включающему фагоцитоз (см.) и пиноцитоз (см.), адгезии, миграции. Макрофаги тканей и серозных полостей имеют более или менее сферическую форму, складчатую плазматическую мембрану (цитолемму) и характеризуются прежде всего присутствием в цитоплазме многочисленных лизосом (см.) и фаголизосом, или пищеварительных вакуолей (рис. 2). В сканирующем электронном микроскопе (см. Электронная микроскопия) хорошо видны поверхностные складки и гребни макрофагов (рис. 3). Обладая выраженной способностью к адгезии, в условиях культивирования макрофаги сильно распластываются на поверхности субстрата и приобретают уплощенную форму. При перемещении по субстрату они образуют множество полиморфных псевдоподий (см. Клетка), причем на сканограммах видны складчатый ведущий край, направленный в сторону перемещения клетки, и длинные отростки, фиксирующие клетку к субстрату. Наряду с этим макрофаги различной локализации, даже в пределах одного органа, напр. лимф, узла, отличаются как морфологически, так и функционально. Так, макрофаги светлых (герминативных) центров в отличие от фиксированных и свободных макрофагов синусов лимф, узлов не фагоцитируют антигены, но поглощают другие инородные частицы и лимфоциты. Их обычно выделяют как макрофаги с окрашивающимися включениями.
Внутриклеточный метаболизм мононуклеарных фагоцитов зависит от стадии дифференцировки, тканевой локализации, активирования и эндоцитоза. Основными источниками энергии для мононуклеарных фагоцитов являются гликолиз, гек-созомонофосфатный шунт и аэробный метаболизм. Исследования последних лет показали, что макрофаги являются активными секреторными клетками, к-рые освобождают в окружающую их среду ферменты, ингибиторы, факторы и компоненты комплемента (см.). Основным секреторным продуктом макрофагов является лизоцим (см.), к-рый вырабатывается и секретирует-ся с постоянной скоростью. В отличие от лизоцима нек-рые нейтральные протеиназы секретируются в основном активированными макрофагами. Среди них лучше всего изучены эластаза (см.), коллагеназа (см.) и активаторы плазминогена (см. Фибринолиз), участвующие в разрушении и перестройке тканей (напр., при резорбции кости, инволюции молочных желез и послеродовой инволюции матки). Как фиксированные, так и свободные макрофаги секретируют нек-рые факторы комплемента, такие, как С2, СЗ, С4, С5, фактор В, а также интерферон (см.).
Методы исследования
Традиционные морфол. методы, особенно на светооптическом и даже на электронно-микроскопическом уровне, часто бывают недостаточными для идентификации мононуклеарных фагоцитов. Даже при изучении изолированных клеток иногда трудно отличить моноцит от лимфоцита или предшественников моноцита (монобласта и промоноцита), от предшественников гранулоцитов (миелобластов и промиелоцитов). Кроме того, тканевые макрофаги часто путают с ретикулярными клетками, фибробластами, эндотелиальными и мезотелиаль-ными клетками, хотя разделение этих клеток имеет принципиальное значение, т. к. их происхождение и функция совершенно различны.
Лишь использование специфических маркеров в сочетании с электронной микроскопией позволяет надежно идентифицировать и оценить участие мононуклеарных фагоцитов в тех или иных процессах. Одним из наиболее надежных маркеров для идентификации мононуклеарных фагоцитов человека и животных является фермент эстераза (КФ 3. 1. 1. 1.), к-рый определяется гистохимически при использовании в качестве субстрата а-нафтилбути-рата или а-нафтилацетата. При этом окрашиваются почти все моноциты и макрофаги, хотя интенсивность гистохим. реакции может варьировать в зависимости от вида и функционального состояния организма, а также от условий культивирования клеток. В мононуклеарных фагоцитах фермент локализуется диффузно, тогда как в Т-лимфоцитах выявляется в виде одной-двух точечных гранул.
Другой надежный маркер — лизоцим (КФ 3. 2. 1. 17.) — фермент, секретируемый макрофагами, к-рый может быть выявлен с помощью им-мунофлюоресцентного метода с использованием антител к лизоциму (см. Иммунофлюоресценция).
Выявлять различные стадии дифференцировки мононуклеарных фагоцитов позволяет пероксидаза (см.). Гранулы, содержащие фермент, окрашиваются положительно только в монобластах, промоноцитах, моноцитах и макрофагах экссудата; резидентные (т. е. постоянно присутствующие в нормальных тканях) макрофаги не окрашиваются.
В качестве ферментов-маркеров мононуклеарных фагоцитов используются также 51-нуклеотидаза, (КФ 3. 1. 3. 5), лейцинаминопептидаза (КФ 3. 4. 11. 1.), фосфодиэстёраза I (КФ 3. 1. 4. 1.), локализующиеся в плазматической мембране. Активность этих ферментов определяют либо в гомогенатах клеток, либо цитохимически. Выявление Б^нук-леотидазы позволяет отличать нормальные (резидентные) макрофаги от активированных (активность этого фермента высока в первых и низка во вторых). Активность лейцин-аминопептидазы и фосфодиэстеразы, наоборот, возрастает по мере активирования макрофагов.
Компоненты комплемента, в частности СЗ, также могут являться маркером, поскольку этот белок синтезируется только моноцитами и макрофагами. Он может быть выявлен в цитоплазме с помощью иммуно-цитохимических методов; компоненты комплемента у разных видов животных различаются по антигенным свойствам.
Весьма характерно для мононуклеарных фагоцитов наличие иммунол. рецепторов для Fc-фрагмента JgG (см. Иммуноглобулины) и для компонента СЗ комплемента. Мононук-леарные фагоциты несут названные рецепторы на всех стадиях развития, но среди незрелых клеток число мононуклеарных фагоцитов с рецепторами ниже, чем среди зрелых (моноцитов и макрофагов). Мононуклеарных фагоциты обладают способностью к эндоцитозу. Поэтому поглощение опсонизированных бактерий или покрытых IgG эритроцитов (иммунный фагоцитоз) является важным критерием, позволяющим отнести клетку к С. м. ф. Однако поглощения покрытых комплементом эритроцитов не происходит, если мо-нонуклеарные фагоциты не были предварительно активированы. Кроме фагоцитоза, все мононуклеар-ные фагоциты характеризуются интенсивным пиноцитозом. В макрофагах преобладает макропиноцитоз, к-рый лежит в основе захвата всех растворов; везикулы, образующиеся в результате интернализации мембраны (впячивания участка мембраны внутрь клетки), транспортируют вещества и за пределы клетки. Пи-ноцитоз отмечен и у других клеток (напр., у фибробластов), но в более слабой степени. Нетоксические витальные красители и коллоидный уголь мало подходят для характеристики эндоцитозной активности мононуклеарных фагоцитов, поскольку поглощаются и другими типами клеток.
Для выявления специфических для мононуклеарных фагоцитов антигенов могут быть использованы антисыворотки, однако получение антител, специфичных для этих клеток, все еще представляет большие трудности, т. к. многие из антисывороток содержат антитела, перекрестно реагирующие с другими типами клеток.
На клеточном уровне о способности клеток к делению судят по включению меченого предшественника ДНК 3Н-тимидина или по содержанию ДНК в ядрах.
Роль системы мононуклеарных фагоцитов в физиологических и патологических процессах
Мононуклеарные фагоциты — полифункциональ-ные клетки, к-рые, обладая выраженной способностью к эндоцитозу, выполняют в организме защитную функцию, принимают участие в процессах воспаления, иммунных реакциях, обладают противоопухолевой активностью, участвуют в регуляции кроветворения и обмена веществ.
Защитная функция
В основе защитной функции мононуклеарных фагоцитов лежит их способность избирательно поглощать и разрушать различные чужеродные агенты. За ними закрепился термин «профессиональные фагоциты», поскольку поглощение (эндоцитоз) — их основная функция. Моноциты и макрофаги способны к направленному движению, определяемому специфическими хемотаксическими факторами. Регуляция этих факторов сложна; в сыворотке крови человека выявлены их ингибиторы и инактиваторы. In vivo хемотаксис (см. Таксисы) вызывается компонентами комплемента СЗ и С4, калликреином, компонентами фибринолиза, продуктами лимфоцитов — лимфокинами. Привлекаются макрофаги также веществами, освобождающимися из бактерий. Благодаря хемотаксису макрофаги мигрируют в очаги инфекции и воспаления. После фагоцитоза микроорганизмов происходит их умерщвление и переваривание. По мере продвижения фагоцитарных вакуолей внутрь клетки в них освобождаются вещества, находящиеся в лизосомах, способные гидролизировать белки, липиды и углеводы, входящие в состав микроорганизмов. Нек-рые из освобождаемых компонентов макрофагов, такие, как пероксида-за, лизоцим и др., обладают антимикробной активностью. Лизоцим является антибактериальным агентом и вне клеток. Среда в фаго-лизосомах становится кислой, что способствует проявлению оптимальной активности ферментов лизосом. Одновременно в фагоцитирующих клетках происходит резкое повышение метаболизма. Переваривание завершается в течение одного-двух часов. Активированные макрофаги подобно нейтрофилам освобождают в окружающую среду перекись водорода и анионы супероксида и с их помощью могут лизировать различные клетки-мишени. Макрофаги захватывают также вирусы, причем нек-рые из них поступают в клетку путем пиноцитоза. Основной функцией клеток Купфера печени является клиренс (очищение) крови от бактерий и вирусов. Старые или поврежденные эритроциты фагоцитируются макрофагами костного мозга, селезенки и печени, а затем подвергаются внутриклеточному перевариванию (эритрофагоцитоз).
Участие в воспалении
Повреждающие агенты (агенты-раздражители) различной природы вызывают в общем однотипную реакцию организма — воспаление (см.). Однократное кратковременное раздражение индуцирует миграцию нейт-рофилов и их скопление в зоне повреждения. Через 6 час. приток нейт-рофилов постепенно ослабевает, после чего начинается миграция макрофагов, к-рая продолжается примерно в течение Зсут., а затем снижается. Макрофаги в очаге острого воспаления образуются только из циркулирующих моноцитов. При подостром и хроническом воспалении макрофаги часто становятся доминирующими клетками, причем если острый воспалительный процесс переходит в хрон. форму, то наблюдаются местная пролиферация и селекция долгоживущих макрофагов, направленные на поддержание численности макрофагов в очаге воспаления.
Рис. 4. Электронограмма эпителиоидных клеток из очага асептического воспаления: 1 — эксцентрично расположенные ядра; 2 — границы между соседними эпителиоидными клетками; 3 — пузырьки, вакуоли и гранулы в цитоплазме; X 5 000. Рис. 5. Электронограмма участка многоядерной гигантской клетки инородного тела из очага асептического воспаления: стрелками указаны ядра, входящие в состав одной клетки; X 5 000.От природы раздражающего агента зависит сменяемость макрофагов в очаге повреждения. В случае устранения провоцирующего агента они исчезают (гибнут или мигрируют в лимф. узлы). При сохранении действия возбудителя воспаления макрофагальный инфильтрат остается. Если в процессе ответной реакции, направленной на устранение токсического и устойчивого раздражителя (напр., двуокиси кремния, бактерий), происходит потеря большого числа макрофагов, то формируется гранулема (см.) с высоким уровнем сменяемости клеток. Если раздражитель устойчив к действию макрофагов и в то же время нетоксичен, возникает гранулема с низким уровнем сменяемости клеток; в такой гранулеме преобладают долгоживущие макрофаги. Во многих специфических гранулемах (напр., при туберкулезе, саркоидо-зе, лепре) мононуклеарные фагоциты превращаются в эпителиоидные клетки (рис. 4) со слабой фагоцитарной активностью, но сильно выраженным пиноцитозом и способностью к секреции. В очагах хрон. воспаления мононуклеарные фагоциты при слиянии дают начало так наз. макрофагальным поликарионам, или многоядерным гигантским клеткам инородных тел (рис. 5) и клеткам типа Пирогова — Лангханса (см. Гигантские клетки). Последние обычно сохраняют очень слабую фагоцитарную активность, напр, по отношению к бактериям туберкулеза. В хрон. гранулемах, вызванных частицами кварца, происходит непрерывная гибель макрофагов в результате разрушения лизосом и са-мопереваривания клеток. При этом из клеток освобождается фиброгенный фактор, стимулирующий синтез коллагена фибробластами. Кроме того, активированные макрофаги вырабатывают фибронектин—гликопротеид с высокой молекулярной массой, являющийся, в частности, хемо-аттрактантом (привлекающим агентом) для фибробластов.
Участие в иммунных процессах
Клетки С. м. ф. принимают участие в иммунных процессах. Первичное взаимодействие макрофага с антигеном (см.) — непременное условие развития направленного и максимального иммунного ответа (см. Иммунитет). В результате такого взаимодействия антиген поглощается и перерабатывается внутри макрофага (процессинг), после чего секретируется в иммуно-генной форме, оказываясь фиксированным на его плазматической мембране. Иммунная стимуляция лимфоцитов происходит в результате их непосредственного контакта с макрофагами. В дальнейшем иммунная реакция протекает с участием В-лимфоцитов, Т-лимфоцитов и макрофагов (см. Иммунокомпетентные клетки).
Противоопухолевая активность
Макрофаги обладают противоопухолевой активностью и проявляют специфические и неспецифические цитотоксиче-ские свойства благодаря присутствию цитофильных антител или факторов, продуцируемых сенсибилизированными Т-лимфоцитами. Разрушение клеток-мишеней обычно оценивается по освобождению связанного с ними радиоактивного хрома после ицкубации с цито-токсическими макрофагами — эффекторами. Проявляемая макрофагами цитотоксичность имеет отношение к ряду иммунных реакций, таких, как отторжение аллотрансплантатов (см. Иммунитет трансплантационный) и противоопухолевый иммунитет (см. Иммунитет противоопухолевый) .
Цитотоксическими свойствами обладают две категории макрофагов— эффекторов: иммунные, или так наз. вооруженные, макрофаги, активно разрушающие специфические клет-ки-мишени, и неспецифические активированные макрофаги с менее избирательными свойствами. Цитотоксичность иммунных макрофагов по отношению к опухолевым клеткам продемонстрирована в опытах in vitro, в к-рых использовали макрофаги от мышей, иммунизированных син-генными (генетически идентичными) опухолевыми клетками. В то же время макрофаги не были способны разрушать опухолевые клетки, если были получены от мышей, иммунизированных аллогенными опухолевыми клетками (взятыми от другого животного того же вида). Специфическая подготовка (вооружение) макрофагов зависит от продукции специфического фактора сенсибилизированными Т-лимфоцитами. Точный механизм деструкции клеток вооруженными макрофагами пока неизвестен. Для лизиса опухолевых клеток необходим контакт между ними и макрофагами. Процесс разрушения опухолевых клеток включает в себя остановку их пролиферации и лизис. После специфической иммунной реакции между макрофагом и опухолевой клеткой-мишенью макрофаг может потерять специфичность. В этом случае он превращается в неспецифическую клетку-эффектор. Неспецифическая цитотоксичность может наблюдаться после инкубации макрофагов с различными веществами: эндотоксином, двуцепочечной РНК и адъювантом Фрейнда (см. Адъюванты).
Участие в регуляции кроветворения
Клетки С. м. ф. принимают участие в регуляции миелоидного и лимфоидного кроветворения (см.). В красном костном мозге, селезенке, печени и желточном мешке эмбриона описан так наз. центральный макрофаг, окруженный одним-двумя рядами эрит-робластов. Тонкие цитоплазматические отростки центрального макрофага проникают между эрит-робластами, а иногда их полностью окружают. Центральный макрофаг всегда становится центром эритропоэза, вместе с прилежащими к нему эритробластами он получил название эритробластического островка, к-рый рассматривается как функционально-анатомическая единица очагов эритропоэза. Центральный макрофаг поглощает ядра эрит-робластов, переваривает старые эритроциты и переносит накапливаемое железо в развивающиеся эритробласты. Нек-рые продукты распада поглощенных ядер могут реутилизироваться для нового синтеза ДНК кроветворными клетками. Центральный макрофаг отличается высокой устойчивостью к воздействию ионизирующего облучения и гипоксии. Центральные макрофаги являются стромальны-ми элементами и выполняют регулирующую функцию при созревании эритроидных клеток-предшественни-ков, напр. при фенилгидразино-вой анемии (см. Анемия, анемия экспериментальная). Появление новых интраваскулярных эритроб-ластических островков в костном мозге, печени и селезенке всегда связано с наличием фагоцитирующих макрофагов, дифференцирующихся из циркулирующих в крови моноцитов.
Клетки Купфера печени участвуют в регуляции эритропоэза посредством выработки эритропоэтина (см.).
С помощью агаровых культур установлено, что моноциты и макрофаги вырабатывают факторы, стимулирующие продукцию моноцитов, нейтрофилов и эозинофилов, а также пролиферацию макрофагов, в результате чего возникают дискретные клеточные колонии. С другой стороны, они могут оказывать ингибирующий эффект на рост колоний, синтезируя простагландин Е (см. Простагландины) .
В мозговом веществе и внутренней зоне коркового вещества долек тимуса и тимусзависимых зонах всех периферических лимф, органов (лимф, узлов, селезенки, скоплениях лимф, ткани жел.-киш. тракта) сравнительно недавно были описаны так наз. интердигитирующие клетки. Они характеризуются неправильной формой ядер и наличием в цитоплазме тубуловезикулярных структур. Их плазматическая мембрана образует многочисленные выпячивания, проникающие между аналогичными образованиями соседних клеток того же типа или лимфоцитов. Эти клетки морфологически очень сходны с макрофагами, а также клетками Лангерганса, локализующимися в эпидермисе (см. Кожа). В настоящее время большинство исследователей склоняется к тому, что интердигитирующие клетки — специфические стромальные элементы тимусзависимых зон, ответственные за миграцию и дифференцировку Т-лим-фоцитов.
Макрофаги участвуют в синтезе веществ, модулирующих пролиферацию и дифференцировку лимфоидных клеток. К ним относится фактор, активирующий лимфоциты и обеспечивающий митогенный (бластогенный) ответ Т-лимфоцитов на лектин и антигены гистосовместимости (см. Бластотрансформация лимфоцитов), а также факторы, усиливающие хелперную функцию Т-лимфоцитов (усиление антитело-образования в В-лимфоцитах). С помощью клонирования В-лимфоцитов показано, что макрофаги вырабатывают диффузный фактор, способствующий образованию колоний субпопуляцией В-лимфоцитов. Избыточное число макрофагов, наоборот, приводит к подавлению роста колоний в результате выработки простаг-ландина Е.
Обменная функция
Обменным процессом, в к-ром достоверно доказана роль макрофагов, является обмен железа. В результате эритрофагоцитоза в макрофагах костного мозга и селезенки происходит накопление железа в виде специфических игольчатых или палочковидных включений ферритина и гемосидерина. Ферритин затем поступает путем пиноцитоза (см.) в прилежащие эритробласты. При фе-нилгидразиновой анемии в макрофагах наблюдается увеличение палочковидных включений, содержащих ферритин.
Библиография: Mononuclear phagocytes, ed. by R. van Furth, Oxford — Edinburgh, 1970; Mononuclear phagocytes, In immunity, infection and pathology, ed. by R. van Furth, Oxford a. o., 1975; Mononuclear phagocytes, Functional aspects, ed. by R. van Furth, pt 1—2, Hague a. o., 1980.
H. Г. Хрущов, В. И. Старостин.
xn--90aw5c.xn--c1avg
Смф клетки это — Здоровье феникса
Система мононуклеарных фагоцитов (греч. monox один + лат. nucleos ядро: греч. рhagos пожирающий, поглощающий + гистол. суtus клетка; синоним: макрофагальная система, моноцитарно-макрофагальная система) — физиологическая защитная система клеток, обладающих способностью поглощать и переваривать чужеродный материал. Клетки, входящие в состав этой системы, имеют общее происхождение, характеризуются морфологическим и функциональным сходством и присутствуют во всех тканях организма.Основой современного представления о cистема мононуклеарных фагоцитов является фагоцитарная теория, разработанная И.И.
Мечниковым в конце 19 в., и учение немецкого патолога Ашоффа (К. А.L. Aschoff) о ретикулоэндотелиальной системе (РЭС). Первоначально РЭС была выделена морфологически как система клеток организма, способных накапливать витальный краситель кармин. По этому признаку к РЭС были отнесены гистиоциты соединительной ткани, моноциты крови, клетки Купфера печени, а также ретикулярные клетки кроветворных органов, эндотелиальные клетки капилляров, синусов костного мозга и лимфатического узлов. По мере накопления новых знаний и совершенствования морфологических методов исследования стало ясно, что представления о ретикулоэндотелиальной системе расплывчаты, не конкретны, а в ряде положений просто ошибочны. Так, например, ретикулярным клеткам и эндотелию синусов костного мозга и лимфатических узлов длительное время приписывалась роль источника фагоцитирующих клеток, что оказалось неверным. В настоящее время установлено, что мононуклеарные фагоциты происходят из циркулирующих моноцитов крови. Моноциты созревают в костном мозге, затем поступают в кровяное русло, откуда мигрируют в ткани и серозные полости, становясь макрофагами. Ретикулярные клетки выполняют опорную функцию и создают так называемое микроокружение для кроветворных и лимфоидных клеток. Эндотелиальные клетки осуществляют транспорт веществ через стенки капилляров. Непосредственного отношения к защитной системе клеток ретикулярные клетки и эндотелий сосудов не имеют. В 1969 г. на конференции в Лейдене, посвященной проблеме РЭС, понятие «ретикулоэндотелиальная система» было признано устаревшим. Вместо него принято понятие «система мононуклеарных фагоцитов». К этой системе относят гистиоциты соединительной ткани, клетки Купфера печени (звездчатые ретикулоэндотелиоциты), альвеолярные макрофаги легких, макрофаги лимфатических узлов, селезенки, костного мозга, плевральные и перитонеальные макрофаги, остеокласты костной ткани, микроглию нервной ткани, синовиоциты синовиальных оболочек, клетки Лангергаиса кожи, беспигментные гранулярные дендроциты. Различают свободные, т.е. перемещающиеся по тканям, и фиксированные (резидентные) макрофаги, имеющие относительно постоянное место.
Макрофаги тканей и серозных полостей, по данным сканирующей электронной микроскопии, имеют форму, близкую к сферической, с неровной складчатой поверхностью, образованной плазматической мембраной (цитолеммой). В условиях культивирования макрофаги распластываются на поверхности субстрата и приобретают уплощенную форму, а при перемещении образуют множественные полиморфные псевдоподии. Характерным ультраструктурным признаком макрофага служит наличие в его цитоплазме многочисленных лизосом и фаголизосом, или пищеварительных вакуолей. Лизосомы содержат различные гидролитические ферменты, обеспечивающие переваривание поглощенного материала. Макрофаги — активные секреторные клетки, которые освобождают в окружающую среду ферменты, ингибиторы, компоненты комплемента. Основным секреторным продуктом макрофагов является лизоцим. Активированные макрофаги секретируют нейтральные протеиназы (эластазу, коллагеназу), активаторы плазминогена, факторы комплемента, такие как С2, С3, С4, С5, а также интерферон.
Клетки cистема мононуклеарных фагоцитовобладают рядом функций, в основе которых лежит их способность к эндоцитозу, т.е. поглощению и перевариванию инородных частиц и коллоидных жидкостей. Благодаря этой способности они выполняют защитную функцию. Посредством хемотаксиса макрофаги мигрируют в очаги инфекции и воспаления, где осуществляют фагоцитоз микроорганизмов, их умерщвление и переваривание. В условиях хронического воспаления могут появляться особые формы фагоцитов — эпителиоидные клетки (например, в инфекционной гранулеме) и гигантские многоядерные клетки типа клеток Пирогова — Лангханса и типа клеток инородных тел. которые образуются путем слияния отдельных фагоцитов в поликарион — многоядерную клетку. В гранулемах макрофаги вырабатывают гликопротеид фибронектин, который привлекает фибробласгы и способствует развитию склероза.
Клетки cистема мононуклеарных фагоцитов принимают участие в иммунных процессах. Так, непременным условием развития направленного иммунного ответа является первичное взаимодействие макрофага с антигеном. При этом антиген поглощается и перерабатывается макрофагом в иммуногенную форму. Иммунная стимуляция лимфоцитов происходит при непосредственном контакте их с макрофагом, несущим преобразованный антиген. Имунный ответ в целом осуществляется как сложное многоэтапное взаимодействие Г- и В-лимфоцитов с макрофагами.
Макрофаги обладают противоопухолевой активностью и проявляют цитотоксические свойства в отношении опухолевых клеток. Эта активность особенно выражена у так называемых иммунных макрофагов, осуществляющих лизис опухолевых клеток-мишеней при контакте с сенсибилизированными Т-лимфоцитами, несущими цитофильные антитела (лимфокины).
Клетки cистема мононуклеарных фагоцитов принимают участие в регуляции миелоидного и лимфоидного кроветворения. Так, островки кроветворения в красном костном мозге, селезенке, печени и желточном мешке эмбрионе формируются вокруг особой клетки — центрального макрофага, организующего эритропоэз эритробластического островка. Клетки Купфера печени участвуют в регуляции кроветворения путем выработки эритропоэтина. Моноциты и макрофаги вырабатывают факторы, стимулирующие продукцию моноцитов, нейтрофилов и эозинофилов. В вилочковой железе (тимусе) и тимусзависимых зонах лимфоидных органов обнаружены так называемые интердигитирующие клетки — специфические стромальные элементы, также относящиеся к cистемs мононуклеарных фагоцитов, ответственные за миграцию и дифференцировку лимфоцитов.
Обменная функция макрофагов заключается в их участии в обмене железа. В селезенке и костном мозге макрофаги осуществляют эритрофагоцитоз, при этом в них происходит накопление железа в форме гемосидерина и ферритина, которое питом может реутилизироваться эритробластами.
phoenix-pharma.su
Органо- и тканеспецифические макрофаги
СТРУКТУРА И ФУНКЦИИ МОНОЦИТОВ И МАКРОФАГОВ
За последние годы достигнут значительный прогресс в изучении биологических свойств моноцитов и макрофагов, составляющих в кроветворной системе уникальную линию — систему мононуклеарных фагоцитов(СМФ), или макрофагальную систему. В конце 60-х годов нашего столетия были получены доказательства костномозгового происхождения тканевых макрофагов. В
1970г.на 1 Международной конференции, посвященной макрофагам,моноцитами их костномозговым предшественникам,циркулирующие и тканевые макрофаги на основании общих функционально-морфологических признаков выделены из ретикулоэндотелиальной системы, объединяющей их с ретикулярными, эндотелиальными клетками, фибробластами, и включены в СМФ. С небольшими поправками и дополнениями СМФ официально утверждена и опубликована в бюллетене ВОЗ в 1972 г. 136].
Клетки, объединенные в СМФ, включают костномозговые предшественники, пул циркулирующих вкрови моноцитов и органо- и тканеспецифические макрофаги. Начиная с 4-5-й недели эмбрионального кроветворения в желточном мешке методами клоногенного культивирования обнаруживают первые грануло-
цитарные и макрофагальные предшественники. В дальнейшем, когда гемопоэз перемещается из желточного мешка в печень, макрофаги в ней наблюдают уже на 5-й неделе развития плода. Концентрация гранулоцитарно-моноцитарных предшественников сохраняется на высоком уровне в течение 5 мес и снижается с 24-26-й недели эмбриогенеза. Отмечаются 2 волны пролифера-
тивной активности коммитированных гранулоцитарномоноцитарных предшественников печени. Наибольшая интенсивность пролиферации приходится на 9-10-ю
Схема дифференцировки клеток моноцитопоэза
СКК
ИЛ-3
КСФ-ГМ
КОЕ-ГЭММ
КОЕ-ГМ
КСФ-ГМ
КОЕ-М
КСФ-М
Монобласт
Промоноцит
Моноцит
Макрофаг
неделю, что соответствует становлению активного кроветворения в печени, 2-й подъем — на 21-ю неделю,когда начинается кроветворение в костном мозге. Увеличение пролиферативной активности этих клеток связано с необходимостью увеличения их пула: в 1-м случае из-за нарастания гемопоэза в печени, во 2-м —
вследствие переселения клеток печени в костный мозг. В селезенке незрелые и зрелые клетки моноцитарного ряда обнаруживают на 13-й неделе развития плода. Концентрация кроветворных предшественников в ней намного ниже, чем в печени. В 80% культур клеток селезенки преобладают моноцитарно-макрофагальные колонии. В костном мозге эмбриона представлены
клетки всех ростков кроветворения различной степени зрелости. Коммитированные клетки предшественники гранулоцитомоноцитопоэза в костном мозге плода впервые обнаруживаются на 12-13-й неделе. Их число увеличивается с развитием плода. Таким образом, в разные сроки эмбрионального развития плода содержание гемопоэтических клеток и их активность различаются .
Ранние предшественники мононуклеарных фагоцитов развиваются из полипотентной стволовой клетки костного мозга и являются быстро делящимся пулом клеток-предшественников грануломоноцитопоэза(КОЕ-ГМ). Коммитированные КОЕ-ГМ дают начало пролиферирующему пулу монобластов, последние —
пулу промоноцитов, являющихся наиболее раннимиморфологически идентифицированными клетками СМФ в костном мозге (см. схему).
Дифференцировка моноцитов из монобластов происходит в костном мозге в течение 5 дней, после чего они сразу выходят в кровоток, не формируя в отличие от гранулоцитов костномозговой резерв. Их общее количество в костном мозге не превышает 1,5% от всех ядросодержащих клеток гемопоэза. Промоноциты обла-
дают высоким пролиферативным потенциалом; индекс метки Н-тимидином равен 78,8 ± 7,7% . Небольшая часть моноцитов дифференцируется в макрофаги костного мозга, количество которых в норме варьирует в пределах 30 ± 12в 1 мм Общее количество моноцитов крови включает циркулирующий и пристеночный пулы. У человека циркулирующий пул моноцитов
насчитывает в норме 18 • 10^ клеток на 1 кг массы тела,а маргинальный пул, который не принимает участия в циркуляции, примыкая к внутренней стенке микрососуда, -в 3,5 раза больше (63 • 10^ клеток/кг). В целом общий пул моноцитов крови человека включает 81 • 10^ клеток/кг. В периферической крови моноциты
составляют 1-10% всех лейкоцитов, что соответствует абсолютному количеству, равному 80-600 клеток в 1 мм^ у взрослых. Моноциты циркулируют в крови 36-104 ч и затем покидают ее по стохастическому принципу, а не по мере старения, взаимодействуя с эндотелием посредством поверхностных структур типа LFA-1.Увеличение экспрессии молекул адгезии на эндотелиальных клетках происходит под действием интерлейки-
на-1 (ИЛ-1), фактора некроза опухоли (х (ФНО-а) и у-интерферон. Из крови в ткани за 1 ч уходит 7 • 10^моноцитов, или 1,68 * 10^ в сутки. В тканях под влиянием неустановленных факторов моноциты дифференцируются в органе- и тканеспецифические макрофаги . Внесосудистый пул моноцитов в 25 раз
превышает циркулирующий. По мере прохождения
клетки «по маршруту» монобласт-промоноцит- моноцит- макрофаг она претерпевает ряд как морфологических, так и функциональных изменений.
Впервые морфология моноцитов была описана в
1891 г. Эрлихом, который назвал их «большие мононуклеарные клетки с вдавленным ядром». Позднее Паппенгейм дал этим клеткам название «моноцит».
Морфология.Моноцит— крупная клетка диаметром 14-20 мкм,
ядро отличается разнообразием форм: бобовидной, округлой, многолопастной, подковообразной. Хроматин ядер рыхлый, распределен равномерно, образуя ячейки разной величины и формы, ядрышки не обнаруживаются. Цитоплазма широкая, серо-голубого цвета, часто содержит азурофильную зернистость, более выраженную по периферии клетки, вакуолизацию. Среди моно-цитов крови выделяют 3 морфологические группы: с овальным или округлым ядром, с бобовидным или полиморфным ядром, с сегментированным лопастным ядром. Моноциты 1 группы в норме составляют 20%,II группы — 30%, III группы — 50%. При введении ^Н-тимидина метка обнаруживается в основном в моноци-
тах с округлым или овальным ядром, а моноциты III группы ее почти не включают и представляют более зрелую популяцию. В целом индекс метки в моноцитах костного мозга и периферической крови низкий и составляет 0,1 ± 0,2%. Наименее зрелые моноциты отличаются от зрелых более выраженной цитохимической
реакцией на пероксидазу, хлорацетатэстеразу и слабой реакцией на неспецифическую эстеразу
В электронном микроскопе мембрана моноцитов представляется неровной, образует ряд микроворсинок, под ней видны многочисленные пузырьки пиноцитоза. Эксцентрично расположенное бобовидное ядро содержит мелкодисперсный хроматин. В цитоплазме находятся относительно слаборазвитая эндоплазматическая сеть в виде пузырьков разной величины и небольших канальцев и различное количество рибосом. Мно-
гочисленные митохондрии небольшие, продолговатые.Аппарат Гольджи хорошо развит. Имеются многочисленные микротрубочки, пучки фибрилл, расположенные вокруг и вблизи ядра. В цитоплазме обнаруживаются вакуоли, вероятно, пиноцитозного характера. Гранулы, встречающиеся в цитоплазме моноцита, различны по виду и структуре. Некоторые из них крупные, с неоднородным содержимым, возможно, они представ-
ляют собой образования типа фагосом. Другие, более мелкие (0,05-0,2 мкм), плотные, гомогенные, окружены мембраной и соответствуют азурофильным гранулам. Эти гранулы содержат кислую фосфатазу, арилсульфатазу. В отличие от промоноцитов пероксидаза обнаруживается лишь в небольшом числе гранул, большинство из них пероксидазоотрицательны, чем и отли-
чаются от нейтрофилов
Моноциты крови, как и другие клетки, содержат множество различных химических веществ, необходимых для поддержания их структуры и жизнедеятельности, для взаимодействия с другими клетками. Активность пероксидазы выявляется у значительного числа моноцитов, но в среднем она ниже, чем в нейтрофилах.-
По мере созревания клеток моноцитарного ряда активность миелопероксидазы в них снижается. Характерной для моноцитов является активность неспецифической эстеразы. Хотя этот фермент неспецифичен для клеток СМФ, его высокая активность в
клетках этой системы полностью или почти полностью ингибируется фторидом натрия, чем он и отличается от неспецифической эстеразы гранулоцитов, в которых фермент не инактивируется этим веществом. Результаты реакции одинаковы при использовании в качестве субстрата (х-нафтилацетата, нафтол-А8-ацетата или анафтилбутирата. Нафтол-АЗО-хлорацетатэстераза выявляется в 90% моноцитов в виде слабой реакции. Ре-
акция с Суданом черным В в части моноцитов положительна.Активность щелочной фосфатазы в моноцитах не выявляется. Достаточно интенсивно выражена в моноцитах активность кислой фосфатазы, ингибируемой тартратом, которая
составляет 0,29-1,68 ед. Положительная реакция обнаружена в 21-91% моноцитов. ШИК-реакция в моноцитах слабоположительная, в виде диффузного розового окрашивания и мелких гранул по периферии клетки.Концентрация гликогена в моноцитах людей разного возраста колеблется от 0,11 до 0,81, при этом число
клеток с положительной ШИК-реакцией составляет 9-64%. Среди клеток периферической крови моноциты являются носителями наибольшей активности дегидрогеназ, что свидетельствует об интенсивных процессах дыхания и гликолиза, необходимых для осуществления фагацитарной функции моноцитов .
Макрофаг имеет диаметр 15-80 мкм (иногда его диаметр может превышать диаметр моноцита в 10 раз).Форма клеток неправильная, ядро овальное или продолговатое, хроматин неплотный, цитоплазма обильная, без четких границ, голубая с азурофильными гранулами и вакуолями, придающими клетке пенистый
вид. Трансформация в макрофаги сопровождается возрастанием числа неровностей на ее наружной мембране(что повышает способность клетки прочно прилипать к чужеродной поверхности из стекла или пластика),увеличением количества митохондрии, развитием аппарата Гольджи. Количество гранул, пузырьков, вакуолей значительно больше, чем у моноцита. Для макрофагов
Печень Клетки Купфера
Легкие Альвеолярные макрофаги
Почки Мезангиальные клетки
Мозг Микроглия
Кости Остеокласты
Селезенка Синусовые макрофаги
Лимфатические узлы Синусовые макрофаги
Интердигитирующие клетки
Костный мозг Макрофаги
Соединительная ткань, плев- Макрофаги (гистиоциты)
ральная, перитонеальная,
перикардиальная полости
Антигенпредставляющие клетки
Кожа Клетки Лангерганса
Тимус Интердигитирующие клетки
Зародышевые центры лимфа- Фолликулярные дендритные
тических узлов клетки
особенно характерно максимальное содержание лизосом и образование псевдоподий. Повышается активность многих ферментов (а-нафтилацетатэстеразы, кислой фосфатазы, арилсульфатазы, 5-нуклеотидазы, цитохромоксидазы), теряется активность пероксидазы. В циркулирующих моноцитах основная ее активность сконцентрирована в цитоплазматических гранулах, в
первичных и вторичных лизосомах, в то время как в зрелых макрофагах фермент обнаруживается в эндоплазматической сети, аппарате Гольджи и перинуклеар-ной цистерне. Возрастанию интенсивности синтеза многих ферментов соответствует увеличение числа лизосом в клетках. Снижение активности пероксидазы по мере созревания клетки может служить показателем степени ее дифференцировки: в промоноцитах опреде-
ляется много гранул, содержащих пероксидазу, в моноцитах их меньше, а в зрелых макрофагах пероксидаза сосредоточена в мембранах эндоплазматического ретикулума, аппарата Гольджи. Количество макрофагов,синтезирующих ДНК, составляет 1,5 ± 0,9%. Макрофаги костного мозга связаны с эритроидными и миелоидными клетками. Они находятся в тесном контакте с
эритробластами, так что цитоплазматические отростки макрофагов охватывают поверхность эритробластов на значительном протяжении. В цитоплазматических отростках макрофагов довольно мало везикул, однако много лизосом с большим количеством ферритина
Внесосудистый пул мононуклеарных фагоцитов значительно превышает их содержание вкрови;наибольшее количествомакрофагов содержится в печени
(56,4%), легких (14,9%), селезенке (15%), перитонеальной полости (7,6%) и других тканях (16,1%) Тканевые макрофаги, как правило, имеют длительный жизненный цикл. Клетка долгое время пребывает в Go-фазе и может повторно вступать в процесс эндоцитоза и сопряженной секреции в отличие от нейтрофилов
крови и тканей — клеток «разового пользования». Под влиянием микроокружения и специализации функции макрофаги органов и тканей приобретают ярко выраженные морфологические и функциональные особенности.
В соответствии с установленными структурно-функциональными параметрами макрофаги разделены на 2 основных класса: антигенперерабатывающие (синоним- профессиональные фагоциты) и антигенпредставляющие дендритные клетки (синонимы — клетки-помощники в реализации иммунного ответа, иммунные акцессоры) (см.табл.). В настоящее время существу-
ет точка зрения на различные клетки-предшественники в костном мозге для антигенперерабатывающих и антигенпредставляющих макрофагов .
Класс профессиональных фагоцитов включает в себя свободные макрофаги соединительной ткани, подкожного жирового слоя, серозных полостей, альвеолярные макрофаги легких, фиксированные макрофаги печени,центральной нервной системы, костного мозга, селезенки и лимфатических узлов, остеокласты, эпителиоидные клетки и гигантские многоядерные клетки оча-
гов воспаления, образующиеся в результате слияния макрофагов . Термин «гистиоцит», предложенный Kiyond (1914 г.) для обозначения макрофага соединительной ткани, в настоящее время используется в качестве синонима термина «макрофаг». Несмотря на значительные различия морфологических характеристик,
перечисленные клетки имеют сходные цитохимические (а-нафтилацетатэстераза+, кислая фосфатаза+, лизоцим+) и иммунофенотипические признаки (CD64-FcR, CD4, GDI 1, CD14), что подтверждает принадлежность их к одной линии. Основной функцией профессиональных фагоцитов является поглощение и
уничтожение внедрившихся микроорганизмов, поврежденных.дегенерированных, вирусинфицированных и
опухолевых клеток, циркулирующих иммунных комплексов и других антигенов. Эта функция опосредуется многочисленными эффекторными молекулами, такими как монокины, лизосомальные ферменты, активные формы кислорода, оказывающие токсическое действие на наружную оболочку и внутриклеточные ком-
поненты микроорганизмов и опухолевых клеток. Микробицидная функция макрофагов реализуется через дыхательный взрыв и продукцию специфических молекул
(02, Н2О2, ОН-), которые направлены на киллинг внеклеточных объектов и деструкцию фагоцитированных микроорганизмов и вирусов. Функции профессиональных фагоцитов включают также секрецию биологически активных веществ, представление антигенов лимфоцитами, последнее осуществляется менее эффективно, чем у антигенпредставляющих макрофагов
К антигенпредставляющим макрофагамотносят фолликулярные дендритные (ретикулярные) клетки, интердигитирующие клетки, клетки Лангерганса, специфической функцией которых являются захват, переработка и представление антигенов лимфоцитам. Фолликулярные дендритные клетки локализуются в зародышевых
центрах и первичныхх лимфоидных фолликулах лимфатических узлов, а также в селезенке. Эти клетки имеют длинные ветвящиеся отростки, образующие плотную сеть в зародышевых центрах и проникающие в мантийную зону. Они осуществляют представление антигена В-лимфоцитам. Интердигитирующие клетки и клетки
Лангерганса располагаются в паракортикальных зонахлимфатических узлов и соответствующих Т-зависимых
зонах селезенки, миндалин, мозговом веществе тимуса.
Они соединяются между собой и с другими клетками посредством субмикроскопических отростков. Эти клетки, являющиеся составным элементом микроокружения тимусзависимых зон, играют важную роль в заселении их предшественниками Т-лимфоцитов и в представлении антигенов Т-лимфоцитами. В небольших количествах эти клетки присутствуют практически
во всех органах и тканях
Отличительными признаками иммунных акцессоров являются низкая способность к фагоцитозу, отсутствие в цитоплазме лизоцима, наличие протеина S-100 и АТФазы. Специфический ультраструктурный маркер клеток Лангерганса — цитоплазматические органеллы (гранулы Бирбека), функциональное значение которых до настоящего времени не определено
Профессиональные фагоциты и антигенпредставляющие клетки имеют сходные рецепторы на поверхности клеточной мембраны, в том числе рецепторы для компонентов комплемента (СЗ, С4) .Фц-фрагментов иммуноглобулинов, лимфокинов, трансферрина, мно-
гих гормонов. Помимо указанных антигенов, на поверхности мононуклеарных фагоцитов обнаружено большое количество других антигенов, которые, однако, не являются строго специфичными для клеток этой линии. Наиболее характерным является антиген CD 14,который выявляется практически на 100% моноцитов и антигенперерабатывающих макрофагов, но может от-
сутствовать на антигенпредставляющих макрофагах
Для клеток СМФ характерны изобилие лизосом и высокая активность лизосомалазных ферментов, особенно таких, как ос-нафтилацетатэстераза и кислая фосфатаза. Биологическая роль неспецифических эстераз окончательно не установлена, предполагают, что они являются частью детоксицирующих систем моноцитов макрофагов. Наиболее высокая активность а-нафтил-
ацетатэстеразы,подавляемой фторидом натрия, свойственна моноцитам. В зрелых макрофагах активность фермента значительно варьирует и зачастую не подавляется ингибитором. Кислая фосфатаза — маркер лизосом, ее высокая активность соответствует обилию лизосом в клетке и может отражать уровень ее дифференцировки и/или функциональной зависимости. Наиболее
высокая активность кислой фосфатазы регистрируется в зрелых антигенперерабатывающих макрофагах
Можно выделить следующие функции макрофагов:
фагоцитоз, пиноцитоз; участие в иммунном ответе; цитотоксическую; медиаторную; участие в регуляции кро-ветворения; участие в гемостазе; участие в метаболизме липидов и железа.
Мононуклеарные фагоциты участвуют в обеспечении неспецифической защиты организма посредством фагоцитоза, секреции гуморальных факторов, таких как лизоцим, (х-интерферон, ФНО, компоненты компле-
мента. Фагоцитоз является наиболее хорошо изученной функцией клеток СМФ. Он включает в себя несколько стадий: хемотаксис, адгезию, поглощение и переваривание. Фагоцитоз антигена осуществляется с помощью рецепторов, не обладающих специфичностью к фагоцитируемому объекту. В случае, если антиген представлен в виде комплекса с антителами, фагоцитоз осу-
ществляется посредством Fc-рецептора и характеризуется специфичностью, ограниченной типом Fc-рецептора. Иммунный фагоцитоз сопровождается выбросом токсичных метаболитов кислорода, арахидоновой кислоты. Фагоцитоз может быть завершенным и незавершенным, в последнем случае микроорганизмы (микобактерии, вирусы, токсоплазмы, лейшмании, хламидии и др.) живут в симбиозе с макрофагами длительное время, способствуя хроническому течению заболевания.
Важнейшей функцией моноцитов/макрофагов являетсямикробицидная, которая опосредуется многочисленнымиэффекторными молекулами, такими как мо-
нокины, лизосомальные ферменты, активные формы кислорода, оказывающие токсическое действие на наружную оболочку и внутриклеточные компоненты микроорганизмов и опухолевых клеток. Микробицидная функция моноцитов/макрофагов реализуется через «дыхательный или метаболический взрыв». В клетках повышаются уровни синтеза и секреции монокинов, актив-
ность лизосомальных ферментов, экспрессия поверхностных рецепторов и антигенов (Fc, СЗ-, С4-рецепторы,CD 14,), что в функциональном отношении проявляется усилением фагоцитарной активности, цитотоксичности, микробицидности макрофагов. При этом макрофаги генерируют высокоактивные нестабильные продукты восстановления кислорода, оказывающие мощное ан-
тимикробное и цитотоксическое действие. Активные формы кислорода вступают в окислительные реакции с
субстратами фаголизосом и служат источником повы-
шенной хемилюминесценции макрофагов. Окислительные реакции сопровождаются накоплением токсичных метаболитов, в том числе продуктов перекисного окисления липидов, которые в физиологических условиях нейтрализуются защитной антиоксидантной системой клетки. При недостаточности антиоксидантной защиты концентрация продуктов перекисного окисления липидов может нарастать до критического уровня, при
котором происходит утечка активированных гидролаз и токсичных метаболитов в окружающую среду с последующими повреждающими эффектами.
В цитоплазматической мембране макрофагов содержится значительное количество арахидоновой кислоты, поэтому данные клетки являются источником простагландинов и лейкотриенов. Дериваты арахидоновой кислоты дают многочисленные биологические эффекты, в том числе оказывают мощное противовоспалительное действие за счет ингибиции секреции макрофагами цитокинов. У активированных макрофагов суще-
ственно изменяются морфологические характеристики:увеличиваются размеры клетки и складчатость цитоплазматической мембраны, нарастает количество цито-
плазматических гранул и вакуолей, появляются включе-
ния фагоцитированного материала
В 1973 г. Rosenthal и соавт. доказали роль макрофагов в представлении антигена Т-лимфоцитам. Моноциты/макрофаги являются ведущими клетками иммунного ответа организма, при этом их основные функции состоят в эндоцитозе, переработке антигенов и представлении их Т-хелперам в комплексе с la-антигеном.Эта презентация необходима для запуска иммунного
ответа на многие Т-зависимые антигены и делает Т-
клетки компетентными, индуцируя экспрессию ИЛ-2-
рецепторов. ИЛ-1 играет роль кофактора антигенов и вместе с la-антигеном стимулирует продукцию ИЛ-2,который в свою очередь способствует переходу клеток в S-фазу, связываясь с этими рецепторами. В процессе представления антигена активированные макрофаги синтезируют и секретируют или содержат на мембране
такие цитокины, как ФНО и ИЛ-6. Связь между Т-хелпером и макрофагом осуществляется также с помощью адгезионной молекулы 1САМ, синтез которой зависит от действия тех же цитокинов. ИЛ-1 может запускать пролиферацию и секрецию иммуноглобулинов зрелыми В-клетками . Мононуклеарные
фагоциты секретируют более 100 биологически активных веществ.
Продуктами секреции макрофагов являются протеазы (активатор плазминогена, коллагеназа, эластаза, ангиотензин, конвертаза), медиаторы воспаления и иммуномодуляции (ИЛ-1, ФНО-а, у-интерферон, лизоцим,фактор активации нейтрофилов, компоненты комплемента С 1, С2, СЗ, С5, пропердин, факторы В, Д, ИЛ-
3, ИЛ-6, ИЛ-8, ИЛ-10, ИЛ-12, ИЛ-15), факторы роста
(КСФ-ГМ, КСФ-Г, КСФ-М, фактор роста фибробластов, трансформирующий фактор роста), факторы свертывающей системы и ингибиторы фибринолиза (V, VI 1,IX, X, ингибиторы плазминогена, ингибиторы плазмина), адгезивные вещества (фибронектин, тромбоспондин, протеогликаны).
Макрофагальные цитокины участвуют в неспецифическом звене защиты организма, индуцируя и развивая воспалительные реакции, призванные к деструкции и удалению чужеродного антигена. Цитокины участвуют в хемотаксисе нейтрофилов, увеличивают их адгезивность к эндотелию капилляров, активируют микроби-цидность и цитотоксичность макрофагов и лейкоцитов, являются инициаторами специфического иммунитета, его развития и реализации .Большинство цитокинов может продуцироваться
моноцитами/макрофагами и действовать на них. Это свидетельствует об аутокринной регуляции функции
макрофагов или паракринной регуляции, когда сходные цитокины секретируются другими клетками (лимфоцитами, кератиноцитами, гепатоцитами, глиальными клетками и др.), но действуют на моноциты/макрофаги.
Участие мононуклеарных фагоцитов в противоопухолевой и противовирусной защите связано с секрецией а-и в- интерферонов. Активированные под влиянием р-интерферона моноциты/макрофаги активно синтезируют ФНО-(х, который усиливает цитотоксические функции этих клеток и киллерную активность естественных клеток-киллеров, представляющих собой один из эффективных механизмов противовирусной и противоопухолевой защиты организма
СМФ в целом рассматривается как своеобразный биологический фильтр крови и лимфы, удаляющий из них микроорганизмы, опухолевые и инфицированные вирусами клетки, токсины, различные метаболиты, некоторые лекарственные препараты и циркулирующие иммунные комплексы. Основную роль в процессе клиренса играют макрофаги печени, селезенки, легких, а
также макрофаги других органов. 85 — 95% внутрисосудистого фагоцитарного клиренса является функцией макрофагов печени Эффективность фагоцитарного клиренса резко снижается под действием препаратов, блокирующих мононуклеарные фагоциты, что приводит к значительному ослаблению резистентности ор-
ганизма к инфекциям и другим неблагоприятным факторам .
Перечисленные функции мононуклеарных фагоцитов дают основание считать их ключевыми клетками в инициации и регуляции иммунного ответа, в реализации неспецифической резистентности организма, а также в регуляции гемопоэза.
studfile.net
11. Общая характеристика лейкопоэза, стадии, значение лейкопоэтинов.
Лейкопоэз – процесс образования лейкоцитов, последовательность клеточных превращений,которые происходят в органах кроветворения,обычно протекает в кроветворной тканикостного мозга. Различают миелопоэз – созревание гранулоцитов и моноцитов, и лимфопоэз – процесс образования лимфоцитов.
лейкопоэз начинается в костном мозге со стволовой клетки (I класс), которая способна к неограниченному самоподдержанию и может дать начало для процесса созревания любой клетки периферической крови (полипотентная клетка). Под влиянием гемопоэтических факторов роста (колониестимулирующих факторов, интерлейкин-3, -6, -7, гранулоцитарно-макрофагальный колониестимулирующий фактор) деление стволовой клетки может привести к образованию частично детерминированных клеток-предшественников миелопоэза (КОЕ-ГЭММ) или лимфопоэза (II класс). Клетки II класса образуют унипотентные клетки-предшественники, или колониеобразующие клетки (III класс), которые дифференцируются в строго определенном направлении: гранулоцитопоэз (КОЕ-Гн, КОЕ-Ба, КОЕ-Эо), моноцитопоэз (КОЕ-М), В-лимфопоэз (КОЕ-В), Т-лимфопоэз (КОЕ-Т). Клетки I, II и III класса морфологически недифференцируемы, выглядят как малые темные лимфоциты с большим интесивно окрашенным плотным ядром с узким ободком базофильной цитоплазмы. Каждая колониеобразующая клетка дифференцируется в зрелый лейкоцит через определенное количество стадий, которое у различных видов лейкоцитов неодинаково. Клетки III класса превращаются в бласты (IV класс). Миелобласты имеют большое круглое ядро с нежной сетчатой структурой хроматина, а также 2-5 ядрышек, узкий ободок цитоплазмы, не содержащий гранул. Лимфобласты, в отличие от миелобластов, имеют четкую перинуклеарную зону, более грубую структуру хроматина и 1-2 ядрышка. Клетки V класса (созревающие) проходят через различное количество стадий. В процессе созревания гранулоцитов (нейтрофилов, эозинофилов и базофилов) их ядро уплотняется и подвергается сегментации. В цитоплазме при окраске по Райту появляются специфические нейтро-, эозино- или базофильные гранулы. Промиелоцит – самая крупная из клеток (диаметр до 25 мкм) имеет большое количество азурофильной зернистости, в ядре находится 1-2 ядрышка. Миелоцит (диаметр 14-16 мкм) – последняя способная к делению клетка, в ядре отсутствуют ядрышки. Метамиелоцит (диаметр 12-15 мкм) имеет бухтообразное вдавление ядра, цитоплазма содержит нежную специфическую зернистость. В палочкоядерных лейкоцитах ядро имеет форму изогнутой палочки. Сегментоядерные гранулоциты — это зрелые клетки (VI класс), ядро которых состоит из 2-4 сегментов.
Все стадии лейкопоэза регулируются гуморальными факторами, относящимися к цитокинам. Главными из них являютсяколониестимулирующие (CSF) и гемопоэтические факторы. CSF по своей природе являются гликопротеидами. Все они поддерживают созревание и дифференцировку различных кроветворных колоний, начиная с полипотентной или кроветворной стволовой клетки. Это так называемый стволово-клеточный фактор или белковый фактор стила (SCF или SF), гранулоцитарно-макрофагальный (GM-CSF),гранулоцитарный (G-CSF) и макрофагальный (М-CSF)колониестимулирующий фактор, эритропоэтин, тромбопоэтин и другие. Все колониестимулирующие факторы (CSF) образуются стромальными элементами костного мозга, фибробластами, эндотелиоцитами, макрофагами, а также некоторыми видами Т-лимфоцитов. Предполагается, что физиологический уровень этих соединений в костном мозге достигается в результате действия слабых активирующих импульсов, появляющихся в результате контактного взаимодействия стромальных клеток. Однако усиленное образование CSF может происходить и в процессе иммунного ответа, возникающего под воздействием различных антигенов. Ниже приводится их краткое описание.
SCF– гемопоэтический и тканевой ростовой фактор или фактор стила(SF), служащий лигандом для С-Kit-oнкогена и продуцируемый самыми различными клетками – стромой костного мозга, фибробластами, эпителиальными клетками и эндотелием сосудов. Существует растворимый и мембрансвязанный SCF. Действие фактора стила чрезвычайно разнообразно. Это соединение способствует пролиферации и дифференцировке пСКК, а также клеток-предшественников различных ростков кроветворения. Выявлен синергизм в действии SCF и IL-11 на стволовые клетки, а также с IL-2 на лимфоциты, получившие наименование натуральные киллеры, или NK-лимфоциты. Высказывается мнение, что SCF образуется локально в костном мозге и оказывает влияние как «якорный фактор», способствуя действию других цитокинов на кроветворные клетки.
За последнее время установлено, что на созревание эозинофилов влияет эозинофильный колониестимулирующий фактор (ЕО-CSF), а на базофилы –колониестимулирующий фактор тучных клеток. Однако их свойства пока еще мало изучены.
В лейкопоэзе принимают участие практически все интерлейкины. Основным из них является IL-3,представляющий собой выделяется стимулированными Т-лимфоцитами, моноцитами, макрофагами, эпителиальными клетками тимуса, кератиноцитами, тучными и даже нервными клетками. Он стимулирует гемопоэтические клетки-предшественники, т.е. является полипоэтином. обеспечивает рост и развитие гранулоцитарно-макрофагальных колоний, эритроцитарного и мегакариоцитарных ростков, тучных клеток, локализующихся в слизистых оболочках, базофилов, эозинофилов, а также предшественников Т- и В-лимфоцитов. Особенно выраженное действие IL-3 оказывает на эозинофилопоэз, благодаря чему его относят к эозинофилопоэтическим
Следует заметить, что большинство цитокинов оказывает влияние на процессы кроветворения лишь тогда, когда они действуют совместно в едином ансамбле. Более того, один и тот же цитокин способен влиять на разные клетки мишени. И, наконец, нередко эффект индивидуальных цитокинов существенно меняется не только количественно, но и качественно в присутствии других представителей этих важнейших регуляторов кроветворения.
Таким образом в организме существует единая сложно организованная система регуляции гемопоэза, включающая тесно взаимосвязанные между собой дистантные и локальные контролирующие структуры. При действии на организм различных экстремальных факторов происходит последовательная активация отдельных звеньев единого каскада механизма регуляции кроветворения. При этом пусковыми являются центральные нейроэндокринные механизмы, осуществляющие своё влияние через универсальные стрессреализующие и стресслимитирующие системы. В то же время основным звеном, оказывающим вегетативное влияние на гемопоэз, является симпатико-адреналовая система. Под её воздействием усиливаются процессы костномозгового кроветворения, и увеличивается «клеточность» крови.
12. Гранулоцитопоэз. Стадии. Факторы и механизмы регуляции.
Дифференцировка и созревание клеток гранулоцитопоэза происходит в костном мозге, где из коммитированных, морфологически неидентифицируемых клеток-предшественников КОЕ-ГМ (колониеобразующая единица грануломоноцитопоэза) и КОЕ-Г (колониеобразуюшая единица гранулоцитопоэза) формируется пул пролиферирующих гранулоцитов, состоящий из миелобластов, промиелоцитов и миелоцитов. Все эти клетки характеризуются способностью к делению. Другой пул, образующийся в костном мозге — это непролиферирующие (созревающие) клетки — метамиелоциты, палочкоядерные и сегментоядерные гранулоциты. Созревание клеток сопровождается изменением их морфологии: уменьшением ядра, конденсацией хроматина, исчезновением ядрышек, сегментацией ядра, появлением специфической зернистости, утратой базофилии и увеличением объема цитоплазмы. Процесс формирования зрелого гранулонита из миелобласта осуществляется в костном мозге в течение 10-13 дней. Регуляция гранулоцитопоэза обеспечивается колониестимулирующими факторами: ГМ-КСФ (гранулоцитарно-макрофагальный фактор) и Г-КСФ (гранулоцитарный колониестимулирующий фактор), действующими до конечной стадии созревания гранулоцитов.
На стадии поздних миелобластов и промиелоцитов происходит образование первичных гранул (азурофильной зернистости), специфическим маркером которых является миелопероксидаза. В цитоплазме миелоцитов начинается формирование специфической зернистости (вторичные гранулы). Маркерами вторичных гранул являются лактоферрин, катионный белок кателицидии, В12-связываюший белок и другие факторы. В состав вторичных гранул также входит лихоцим, коллагеназа, металлопротеиназы. Количество вторичных гранул увеличивается в клетке но мере ее созревания, в зрелых сегмеитоядериых гранулоцитах на их долю приходится 70-90%, остальные 10-30% составляет азурофильная зернистость. Зрелые гранулоциты костного мозга образуют гранулоцитарный костномозговой резерв, насчитывающий около 8,8 млрд/кг и мобилизуемый в ответ на специфический сигнал при бактериальных инфекциях. Покидая костный мозг, гранулоциты представляют собой полностью дифференцированные клетки, имеющие полный спектр поверхностных рецепторов и цитоплазматических гранул с набором многочисленных биологически активных веществ.
Нейтрофилы составляют 60-70% общего числа лейкоцитов крови. После выхода нейтрофильных гранулоцитов из костного мозга в периферическую кровь часть их остается в свободной циркуляции в сосудистом русле (циркулирующий пул), другие занимают пристеночное положение, образуя маргинальный пул. Зрелый нейтрофил пробывает в циркуляции 8-10 часов, затем поступает в ткани, образуя по численности значительный пул клеток. Продолжительность жизни нейтрофильного гранулоцита в тканях составляет 2-3 дня. Функцией нейтрофилов является участие в борьбе с микроорганизмами путем их фагоцитоза. Содержимое гранул способно разрушить практически любые микробы. В нейтрофилах содержатся многочисленные ферменты (кислые протениазы, миелопероксидаза, лизоцим, лактоферрин, целочная фосфатаза и др.), вызывающие бактериолиз и переваривание микроорганизмов.
Эозинофилы составляют 0.5-5% от всех лейкоцитов крови, циркулируют в течение 6-12 часов, после чего поступают в ткани, срок полужизни — 12 суток. В клетках содержится значительное количество гранул, основным компонентом которых является главный щелочной белок, а также перекиси, обладающие бактерицидной активностью. В гранулах выявляются кислая фосфатаза, арилсульфатаза, коллагеназа, эластаза, глюкуроиидаза, катепсин, миелонероксидаза и другие ферменты. Обладая слабой фагоцитарной активностью, эозинофилы обусловливают внеклеточный цитолиз, тем самым участвуя в противогельминтном иммунитете. Другой функцией этих клеток является участие в аллергических реакциях.
Базофилы и тучные клетки имеют костномозговое происхождение. Предполагают, что предшественники тучных клеток покидают костный мозг и через периферическую кровь попадают в ткани. Дифференцировка базофилов в костном мозг длится 1,5-5 суток. Ростовым фактором базофилов и тучных клеток являются ИЛ-3, ИЛ-4. Созревшие базофилы поступают в кровоток, где период их полужизни составляет около 6 часов. На долю базофилов приходится всего 0,5% от общего числа лейкоцитов крови. Базофилы мигрируют в ткани, где через 1-2 суток после осуществления основной эффекторной функции гибнут. В гранулах этих клеток содержатся гистамин, хондроигинсульфаты А и С, гепарин, серотонин, ферменты (трипсин, химотринсии, пероксидаза, РНК-аза и др.). Базофилы имеют на клеточной мембране высокую плотность рецепторов к IgE, обеспечивающих не только связывание IgE, но и освобождение гранул, содержимое которых обусловливает развитие аллергических реакций. Базофилы также способны к фагоцитозу. Тучные клетки крупнее базофилов, имеют округлое ядро и много гранул, которые по составу аналогичны гранулам базофилов.
13. Агранулоцитопоэз. Моноцитопоэз. Стадии. Факторы и механизмы регуляции формирования макрофагов. Разновидности макрофагов (+Лейкопоэз)
Моноциты и макрофаги являются основными клетками системы мононуклеарных фагоцитов (СМФ) или макрофагальной системы И.И. Мечникова. Клетки, объединенные в эту систему, составляют единую линию дифференцировки, включающую:
• костномозговых предшественников,
• пул относительно незрелых клеток, циркулирующих
в крови (моноциты),
• конечную стадию дифференцировки – органо- и тканеспецифические макрофаги.
Ранние предшественники мононуклеарных фагоцитов ведут свое происхождение от полипотентной стволовой кроветворной клетки и являются быстро делящимся пулом клеток-предшественниц грануломоноцитопоэза — КОЕ-ГМ. Коммитированные КОЕ-ГМ дают начало пролиферирующему пулу монобластов, а монобласты — пулу промоноцитов. Последние являются наиболее ранними морфологически идентифицированными в составе нормального костного мозга клетками СМФ, обладающими высоким пролиферативным потенциалом.
В физиологических условиях промоноциты после 2-3 делений дифференцируются в моноциты, которые, в отличие от клеток гранулоцитарного ряда, не проходят стадии созревания в костном мозге, а сразу выходят в кровоток. Вследствие этого в костном мозге отсутствует сколько-нибудь значительный резервный пул моноцитов, их общее количество не превышает 1,5% от всех ядерных элементов гемопоэза. Сравнительно небольшая часть моноцитов дифференцируется в макрофаги костного мозга [7, 16].
Продукция моноцитов находится под контролем целой группы ростовых факторов, одни из которых (IL-3, GM-CSF и M-CSF) стимулируют митотическую активность предшественников моноцитов, другие (PgE, INFa и ингибируют деление этих клеток. Закономерная миграция моноцитов из кровотока в ткани опосредована экспрессией на моноцитах и эндотелиальных клетках специализированных адгезионных молекул. Экспрессия этих молекул усиливается под влиянием провоспалительных цитокинов: IL-1, TNFa, IL-6, INF-y. Адгезия моноцитов к активированным эндотелиальным клеткам опосредуется поверхностными молекулами CD11a/CD18, VLA-4, ICAM-1, VCAM-1. Далее следует распластывание моноцитов на поверхности эндотелиальных клеток, проникновение между двух соседних эндотелиоцитов, преодоление базальной мембраны и выход в ткани. Этот процесс является обычной стадией жизненного цикла моноцитов [6, 17, 24]. После выхода из кровотока в ткани моноциты дифференцируются в органо- и тканеспецифические макрофаги и не способны к рециркуляции [7, 16].
МАКРОФАГИ. Зрелые макрофаги имеют ряд общих морфологических признаков: значительные размеры (диаметр от 20-25 до 80 мкм), овальное ядро, с петлистостью хроматина и остатками ядрышек, широкую цитоплазму без четких границ с наличием псевдоподий. Внесосудистый пул клеток макрофагальной системы значительно превышает их содержание в крови; наибольшее количество макрофагов содержится в печени, селезенке и легких. Тканевые макрофаги относятся к долгоживущим клеткам, продолжительность их жизни исчисляется месяцами и годами. Если не происходит их мобилизации в очаг инфекции или воспаления, они погибают, мигрируя в селезенку или лимфатические узлы. Легочные макрофаги покидают легкие через воздухоносные пути [17]. Обновление пула тканевых макрофагов происходит за счет притока моноцитов из кровеносного русла, лишь незначительная часть (менее 5%) макрофагов проявляет способность к однократному делению.
Под влиянием микроокружения и специализации функций макрофаги органов и тканей приобретают ярко выраженные морфологические и функциональные особенности, в соответствии с которыми выделяют два основных класса клеток: антигенперерабатывающие макрофаги (синоним — профессиональные фагоциты) и антигенпредставляющие дендритные клетки (синоним — иммунные акцессоры).
Класс профессиональных фагоцитов включает свободные макрофаги соединительной ткани, подкожного жирового слоя, серозных полостей, альвеолярные макрофаги легких, фиксированные макрофаги печени, центральной нервной системы, костного мозга, селезенки и лимфатических узлов, а также остеокласты, эпителиоидные клетки и гигантские многоядерные клетки очагов воспаления [7, 15, 16]. Несмотря на резкие отличия морфологических характеристик, перечисленные клетки имеют сходные цитохимические (альфа-нафтилацетат-эстераза+, кислая фосфатаза+, лизоцим+) и иммунофенотипические признаки (Fc-lgG+, CD4+, CD11+, CD14+), что подтверждает принадлежность их к общей линии. Основной функцией профессиональных фагоцитов являются поглощение и уничтожение внедрившихся микроорганизмов, поврежденных, дегенерирующих и инфицированных вирусами клеток, а также иммунных комплексов и различных объектов органической и неорганической природы, попавших в организм. Функции профессиональных фагоцитов включают также секрецию биологически активных продуктов (монокинов) и представление антигенов лимфоцитам, однако, в последнем отношении они гораздо менее эффективны, чем дендритные клетки.
Моноциты крови в присутствии определенных факторов (цитокины GMCSF, TNFa и IL-4) дифференцируются в дендритные клетки.
studfile.net
Макрофаги: общие сведения
Макрофаги: общие сведения
В 1882 г. И.И. Мечников впервые описал фагоцитоз. Вонзая в прозрачное тело личинки морской звезды шип розы, он наблюдал, что через несколько часов шип был окутан слоем «подвижных клеток». Если заноза была предварительно обмазана порошком кармина или краски индиго, то надвинувшиеся клетки оказывались наполненными этими красками. Клетки эти очень прожорливы и вбирают в себя все, что толъко могут захватить.» И.И. Мечников назвал эти клетки макрофагами и указал на их связь с моноцитами крови. В 70-х гг. XX в. сформировалось представление о системе мононуклеарных фагоцитов (СМФ) , включающей в себя группу клеток, объединенных общностью происхождения (из моноцитов крови), строения и функций (активный фагоцитоз и пиноцитоз ). Особенностью структуры макрофагов является большое количество лизосом в их цитоплазме. Основные функции макрофагов — это участие в естественном, специфическом, противоопухолевом иммунитете и секреции различных биологически активных веществ.Мононуклеарные фагоциты (макрофаги) составляют наиболее важную группу способных к фагоцитозу долгоживущих клеток.
Макрофаги (МФ) млекопитающих — наиболее филогенетически древние элементы соединительной ткани и иммунной системы, ведущие происхождение от амебоцитов беспозвоночных и подвижных клеток кишечнополостных . Разнообразие МФ млекопитающих, представленных моноцитами крови , альвеолярными макрофагами легких , клетками Купфера в печени , клетками Лангерганса в коже и др., служит ярким примером разделения исходного клеточного типа на несколько более специализированных.
Все перечисленные разновидности МФ имеют характерные морфологические черты, биохимические и функциональные особенности. В то же время МФ позвоночных обладают широким спектром функций, что позволяет им осуществлять интегративные и регуляторные взаимодействия при реализации иммунного ответа. Таким образом, МФ позвоночных сочетают черты прогрессивной филогенетической дифференцировки и высокую степень полипотентности, характерную для неспециализированных клеток.
Макрофаги человека являются акцепторами любого внешнего воздействия: бактериальных и вирусных инфекций, лучевого и химиотерапевтического воздействия, а также эндогенных раздражителей (вторичные инфекции опухолей, сапрофитная флора, продукты клеточного распада). Спектр патогенов, с которыми взаимодействуют макрофаги, необыкновенно широк. Макрофаги обладают чрезвычайно чувствительными рецепторами, позволяющими им распознавать чужеродные молекулы, и толерантностью к нормальным клеткам собственного организма. Если Т-лимфоцитам для приобретения толерантности к «своему» необходим специальный инструктаж в процессе онтогенеза, то толерантность МФ по отношению к собственным клеткам организма можно считать врожденной.
Тканевые макрофаги и их предшественники — моноциты , промоноциты и монобласты — образуют систему мононуклеарных фагоцитов . Макрофаги — это долгоживущие фагоциты , имеющие много общих функций с нейтрофилами . Кроме того, макрофаги в качестве секреторных клеток участвуют во многих сложных иммунных и воспалительных реакциях, в которых не участвуют нейтрофилы.
Моноциты, как и нейтрофилы, покидают сосудистое русло путем диапедеза , но дольше циркулируют в крови: их период полуциркуляции составляет от 12 до 24 ч. После того как моноциты попадают в ткани, они превращаются в макрофаги, выполняющие специфические функции в зависимости от анатомической локализации. Особенно богаты этими клетками селезенка , печень , костный мозг и легкие , где функция макрофагов состоит в удалении из крови микроорганизмов и других вредных частиц.
Альвеолярные макрофаги , купферовские клетки , клетки микроглии , дендритные клетки , макрофаги селезенки, брюшины, костного мозга и лимфоузлов — все они выполняют специфические функции.
Мононуклеарные фагоцитов выполняет две основные функции, осуществляемые двумя разными типами клеток костномозгового происхождения:
— «профессиональными» макрофагами, главная роль которых — устранение корпускулярных антигенов, и
— антигенпрезентирующими клетками (АПК) , роль которых заключается в поглощении, процессинге и представлении антигена T-клеткам.
Макрофаги образуются из промоноцитов костного мозга , которые после дифференцировки в моноциты крови задерживаются в тканях в виде зрелых макрофагов, где и формируют систему мононуклеарных фагоцитов . Особенно высоко их содержание в печении медулярных синусах лимфатических узлов .
Макрофаги — долгоживущие клетки с хорошо развитыми митохондриями и шероховатым эндоплазматическим ретикулумом .
Роль макрофагов в иммунитете исключительно важна — они обеспечивают фагоцитоз , переработку и представление антигена T-клеткам. Макрофаги вырабатывают ферменты, некоторые белки сыворотки , кислородные радикалы , простагландины и лейкотриены , цитокины ( интерлейкины , фактор некроза опухолей и другие). Макрофаги секретируют лизоцим, нейтральные протеазы, кислые гидролазы, аргиназу, многие компоненты комплемента, ингибиторы ферментов ( антиактиватор плазминогена , альфа2-макроглобулин ), транспортные белки ( трансферрин , фибронектин , транскобаламин II ), нуклеозиды и цитокины ( ФНО альфа , ИЛ-1 , ИЛ-8 , ИЛ-12 ). ИЛ-1 выполняет много важных функций: воздействуя на гипоталамус, вызывает лихорадку ; стимулирует выход нейтрофилов из костного мозга; активирует лимфоциты и нейтрофилы . ФНОальфа (называемый также кахектином ) — это пироген . Во многом он дублирует действие ИЛ-1, но кроме того, играет важную роль в патогенезе септического шока , вызванного грамотрицательными бактериями. Под влиянием ФНОальфа резко увеличивается образование макрофагами и нейтрофилами перекиси водорода и других свободных радикалов . При хроническом воспалении ФНОальфа активирует катаболические процессы и тем самым способствует развитию кахексии — симптома многих хронических заболеваний.
Макрофаги продуцируют также активные формы кислорода , производные арахидоновой кислоты , фактор активации тромбоцитов , хемокины , колониестимулирующие факторы , факторы, стимулирующие пролиферацию фибробластов и разрастание мелких сосудов. Макрофаги регулируют пролиферацию лимфоцитов, разрушают опухолевые клетки, вирусы и некоторых бактерий ( Mycobacterium tuberculosis , Listeria monocytogenes ). В уничтожении внутриклеточных паразитов макрофагам принадлежит ключевая роль. Для этого они сливаются в гигантские клетки, которые под влиянием провоспалительных цитокинов объединяются в гранулемы. Образование гигантских клеток, возможно, регулирует интерферон гамма .
Основная функция макрофагов сводится к борьбе с теми бактериями, вирусами и простейшими, которые могут существовать внутри клетки-хозяина, при помощи мощных бактерицидных механизмов, которыми обладают макрофаги.
Таким образом, макрофаги являются одним из орудий врожденного иммунитета . Кроме того макрофаги наряду с B — и T-лимфоцитами участвуют и в приобретенном иммунном ответе , являясь «дополнительным» типом клеток иммунного ответа: макрофаги являются фагоцитирующими клетками, чья функция — «проглатывание» иммунногенов и процессирование их для представления T-лимфоцитам в форме, пригодной для иммунного ответа. Основные функции макрофагов представлены на рис. 10-9 .
T-лимфоциты распознают инфицированный макрофаг по экспонированию на его поверхности микробного антигена, находящегося в комплексе с гликопротеином MHC класса II , который в данном случае служит сигналом макрофага. В результате распознавания T-клетки выделяют лимфокины , стимулирующие внутриклеточное уничтожение возбудителя макрофагом (см. Макрофаги: уничтожение паразитов, избегающих фагоцитоза ; и Лимфокины, действующие на макрофаги ).
В отличие от лимфоцитов, макрофаги не обладают способностью специфичного узнавания. Кроме того, макрофаги, по-видимому, отвечают за индукцию толерантности (см. T-лимфоциты: толерантность ).
При аутоиммунных заболеваниях макрофаги удаляют из крови иммунные комплексы и другие иммунологически активные вещества.
Макрофаги участвуют в заживлении ран , удалении отживших клеток и образовании атеросклеротических бляшек .
medbiol.ru
Моноцитопоэз
Всякий прогресс, способствующий продолжительности жизни человека, увеличивает важность службы здравоохранения. — Хернес Гудмунд |
|
hematologiya.ru
