Лимфолейкоз: симптомы и лечение хронического лимфолейкоза, прогнозы на выздоровление и продолжительность жизни
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Антибиотики
- Антисептики
- Биологически активные добавки
- Витамины
- Гинекологические
- Гормональные
- Дерматологические
- Диабетические
- Для глаз
- Для крови
- Для нервной системы
- Для печени
- Для повышения потенции
- Для полости рта
- Для похудения
- Для суставов
- Для ушей
- Желудочно-кишечные
- Кардиологические
- Контрацептивы
- Мочегонные
- Обезболивающие
- От аллергии
- От кашля
- От насморка
- Повышение иммунитета
- Противовирусные
- Противогрибковые
- Противомикробные
- Противоопухолевые
- Противопаразитарные
- Противопростудные
- Сердечно-сосудистые
- Урологические
- Другие лекарства
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и тра
medside.ru
Хронический лимфолейкоз — Википедия
| Хронический лимфолейкоз | |
|---|---|
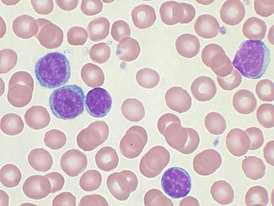 Злокачественные клетки в мазке периферической крови | |
| МКБ-10 | C91.191.1 |
| МКБ-10-КМ | C91.1 и C91.10 |
| МКБ-9 | 204.9204.9 |
| МКБ-9-КМ | 204.1[1][2] |
| МКБ-О | 9823/3 |
| OMIM | 109543, 151400, 609630, 612557, 612558, 612559, 151400, 609630, 109543, 612557, 612559 и 612558 |
| DiseasesDB | 2641 |
| MedlinePlus | 000532 |
| eMedicine | med/370 |
| MeSH | D015462 |
| Медиафайлы на Викискладе | |
Хронический лимфолейкоз, или хронический лимфоцитарный лейкоз (ХЛЛ), — злокачественное клональное лимфопролиферативное заболевание, характеризующееся накоплением атипичных зрелых CD5/CD19/CD23-положительных В-лимфоцитов преимущественно в крови, костном мозге, лимфатических узлах, печени и селезёнке
Хронический лимфолейкоз — одно из наиболее распространённых онкогематологических заболеваний[4]. Также это наиболее частый вариант лейкоза среди представителей европеоидной расы. По непонятным причинам редко встречается среди населения стран Восточной Азии. Дебют заболевания, как правило, происходит в пожилом возрасте — медианный возраст на момент постановки диагноза составляет 70—72 года. Мужчины болеют в 1,5—2 раза чаще, чем женщины. Ежегодная заболеваемость составляет 6,8 случаев на 100 тыс. мужчин и 3,5 случая на 100 тыс. женщин[5].
Предрасположенность к заболеванию передаётся по наследству — риск развития хронического лимфоцитарного лейкоза у непосредственных родственников в 8,5 раз превышает популяционный, однако даже при этом остается ниже 1%
Наследственные факторы[править | править код]
Анализ генома людей с наследственным ХЛЛ позволил идентифицировать однонуклеотидные полиморфизмы, ассоциированные с этим состоянием. Полиморфизмы были обнаружены примерно в 30 локусах, например, в генах
Факторы окружающей среды[править | править код]
Контакт с агентом «оранж»[8] и инсектицидами[9] повышает риск развития ХЛЛ.
Этиологическая связь ХЛЛ с ионизирующим излучением, вирусными инфекциями, питанием и образом жизни не доказана[5].
Первоначально хронический лимфоцитарный лейкоз рассматривали как онкологическое заболевание, характеризующееся накоплением долгоживущих, но очень редко делящихся иммунологически некомпетентных B-лимфоцитов[10]. Однако исследования с использованием тяжёлой воды показали, что злокачественные клетки пролиферируют, и достаточно быстро — количество новых клеток, образующихся за день, составляет от 0,1 до более чем 1 % от общего числа клеток клона
Клеточное микроокружение (ниша) играет большую роль в патогенезе хронического лимфолейкоза. Пролиферация злокачественных клеток происходит в микроанатомических структурах, которые называются пролиферативными центрами, или псевдофолликулами. Псевдофолликулы представляют собой скопления лейкозных клеток, находящихся в контакте со вспомогательными клетками (например, стромальными клетками), которые стимулируют их пролиферацию и выживание[12]. Пролиферативные центры в основном находятся в лимфатических узлах и в меньшей степени в костном мозге
Происхождение злокачественного клона[править | править код]
Злокачественные клетки имеют CD19/CD5/CD23-положительный иммунофенотип и низкий уровень мембранных иммуноглобулинов. Нормальные популяции В-клеток с таким набором поверхностных маркеров неизвестны, что мешает установить, какой тип клеток может давать начало злокачественному клону при ХЛЛ. Анализ транскриптома показал, что опухолевые клетки по набору синтезируемых мРНК похожи на зрелые В-клетки, которые прошли активацию антигеном. В норме таким профилем экспрессии генов обладают В-клетки памяти и В-клетки краевой зоны лимфатических фолликулов, поэтому предполагают, что именно они могут быть предшественниками лейкозных клеток
В отличие от других B-клеточных лейкозов, для ХЛЛ не удалось выявить типичных хромосомных транслокаций, затрагивающих онкогены. Кроме того, крупные хромосомные перестройки редко наблюдаются на ранних стадиях заболевания, так что маловероятно, что они являются первичной причиной ХЛЛ. Однако по мере прогрессирования заболевания такие перестройки происходят: чаще всего это делеции участков хромосом 11, 13 и 17[3].
Характерен абсолютный лимфоцитоз в периферической крови (по данным гемограммы) и костном мозге (по данным миелограммы). На ранних стадиях лимфоцитоз является единственным проявлением заболевания. Пациенты могут предъявлять жалобы на так называемые «конституциональные симптомы» — астению, повышенную потливость, спонтанное снижение массы тела.
Характерна генерализованная лимфаденопатия. Увеличение внутригрудных и внутрибрюшных лимфатических узлов выявляется при ультразвуковом или рентгенологическом обследовании, периферические лимфоузлы доступны пальпации. Лимфатические узлы могут достигать значительных размеров, образовывать мягкие или плотноватые конгломераты. Сдавление внутренних органов не характерно.
На более поздних стадиях заболевания присоединяется гепатомегалия и спленомегалия. Увеличение селезёнки может проявляться ощущением тяжести или дискомфорта в левом подреберье, феноменом раннего насыщения.
За счёт накопления опухолевых клеток в костном мозге и вытеснения нормального гемопоэза на поздних стадиях могут развиваться анемия, тромбоцитопения, редко нейтропения. Поэтому пациенты могут жаловаться на общую слабость, головокружения, петехии, экхимозы, спонтанную кровоточивость.
Анемия и тромбоцитопения также могут иметь аутоиммунный генез.
Для заболевания характерна выраженная иммуносупрессия, затрагивающая преимущественно гуморальный иммунитет (гипогаммаглобулинемия). Из-за этого имеется предрасположенность к инфекциям, например, рецидивирующим простудным заболеваниям и пневмонии.
Необычным клиническим проявлением заболевания может быть гиперреактивность на укусы насекомых.
Для дифференциальной диагностики хронического лимфоцитарного лейкоза с другими лимфопролиферативными заболеваниями необходимо проанализировать количество В-клеток в периферической крови, мазок крови и провести иммунофенотипирование циркулирующих в крови лимфоцитов. Дополнительно для определения прогноза (но не схемы лечения) иногда проводят цитогенетическое исследование, определяют мутационный статус локуса IgV
Анализ крови[править | править код]
Тени Гумпрехта в мазке кровиНеобходимым критерием диагноза хронического лимфоцитарного лейкоза является повышение абсолютного числа В-лимфоцитов в крови до или более 5×109/л. Кроме того, эти лимфоциты должны иметь характерный иммунофенотип: на их поверхности должны обнаруживаться CD19, CD5, CD23, небольшие количества CD20 и CD79b, а также лёгкие цепи иммуноглобулинов[15].
В мазке крови обнаруживаются опухолевые клетки, которые имеют морфологию зрелых (малых) лимфоцитов: «штампованное» ядро с конденсированным хроматином без ядрышка, узкий ободок цитоплазмы. Характерно наличие так называемых теней Гумпрехта, которые представляют собой лейкозные клетки, разрушившиеся в процессе приготовления мазка. Помимо малых лимфоцитов в мазке могут присутствовать более крупные или атипичные клетки, иногда отмечается существенная (более 10 %) примесь омоложенных клеток (пролимфоцитов и параиммунобластов), требующая проведения дифференциального диагноза с пролимфоцитарным лейкозом[14].
Иммунофенотипирование[править | править код]
Иммунофенотипирование лимфоцитов методом проточной цитометрии обязательно для подтверждения диагноза. Высокочувствительная проточная цитометрия позволяет обнаруживать одну злокачественную клетку на 10 000 нормальных лейкоцитов[15]. В качестве диагностического материала обычно используется периферическая кровь. Для клеток ХЛЛ характерен аберрантный иммунофенотип: одновременная экспрессия (коэкспрессия) Т-клеточного маркера CD5 и В-клеточных маркеров CD19 и CD23[14]. Количество В-клеточных маркеров CD20, CD79b и мембраносвязанных иммуноглобулинов IgM и IgD понижено по сравнению с нормальными В-клетками[3]. В дополнение к этому выявляется клональность. Диагноз ХЛЛ также может быть установлен на основании данных иммуногистохимического исследования биоптата лимфатического узла или селезёнки.
Подозрение на хронический лимфоцитарный лейкоз также возникает в случае обнаружения у в остальном здоровых людей увеличения абсолютного числа клональных B-лимфоцитов соответствующего иммунофенотипа, даже если общее их количество в периферической крови меньше 5000/микролитр. Если этому признаку не сопутствует лимфаденопатия или органомегалия, цитопении или другие признаки заболевания, такое состояние диагностируется как моноклональный B-лимфоцитоз[14]. Согласно исследованию, проведённому на 1520 участниках в возрасте от 62 до 80 лет с нормальными показателями крови, моноклональный B-лимфоцитоз с иммунофенотипом ХЛЛ обнаруживается у 5 % людей в этой возрастной группе. Такой лимфоцитоз может прогрессировать в ХЛЛ со скоростью около 1 % в год[15].
Цитогенетическое исследование[править | править код]
Цитогенетическое исследование проводится методом стандартного кариотипирования или FISH. Задача исследования — выявление хромосомных мутаций, часть из которых имеет прогностическую значимость. Из-за возможности клональной эволюции исследование должно повторяться перед каждой линией терапии и в случае возникновения рефрактерности.
Стандартное кариотипирование возможно только для клеток в метафазе клеточного цикла. Так как злокачественные клетки при ХЛЛ обладают низкой митотической активностью, для получения необходимого для анализа количества метафаз требуется применение митогенов. Но даже в таком случае хромосомные мутации удаётся обнаружить только в 40—50 % случаев[16].
Интерфазная FISH при хроническом лимфоцитарном лейкозе не требует применения митогенов и отличается большей чувствительностью. При анализе используют локус-специфичные зонды, позволяющие выявлять наиболее распространённые хромосомные перестройки (как правило делеции). Этот метод позволяет детектировать хромосомные мутации в более чем 80 % случаев хронического лимфоцитарного лейкоза[16].
У каждого отдельного пациента может быть обнаружена одна, две и более стандартных мутации. Исследование, проведённое на 325 пациентах с хроническим лимфоцитарным лейкозом, позволило установить иерархию кариопитов по их прогностической способности: del17p, del11q, трисомия 12, нормальный кариотип и del13q. Если у пациента обнаружено больше одной мутации, то прогноз делают по той из них, которая находится выше в этом списке[16].
Результат FISH-исследования. Определяется только один аллель гена ATM (зеленая метка). У пациента имеется del11q22.3.Хромосомные перестройки ассоциированы с определёнными клиническими характеристиками заболевания[16]:
- del13q14 выявляется в ~55 % случаев, делеция может быть моно- и биаллельной, заболевание, как правило, диагностируется на ранней стадии и развивается медленно, прогноз благоприятный;
- трисомия по хромосоме 12 выявляется в ~15 % случаев, прогноз обычный;
- del11q выявляется в ~15 % случаев, болезнь диагностируют на более поздних стадиях, выше вероятность проявления конституциональных симптомов, болезнь быстро прогрессирует, прогноз неблагоприятный, данная мутация может ассоциироваться с резистентностью к алкилирующим химиопрепаратам;
- del17p13 выявляется в ~7 % случаев, болезнь диагностируют на более поздних стадиях, выше вероятность проявления конституциональных симптомов, болезнь быстро прогрессирует, прогноз наиболее неблагоприятный, клоны часто бывают устойчивы к стандартным схемам химиотерапии с использованием алкилирующих препаратов и/или аналогов пурина[14];
- del6q21 характеризуется неблагоприятным прогнозом[3].
Другие методы[править | править код]
Рутинный физикальный осмотр позволяет получить достаточное представление о клинической динамике, поскольку заболевание носит системный характер. Выполнение УЗИ и компьютерной томографии для оценки объёма внутренних лимфоузлов не является обязательным вне клинических исследований.
Тест на гемолитическую анемию из-за высокой частоты аутоиммунных осложнений при ХЛЛ необходим даже при отсутствии её явных клинических проявлений. Рекомендуется проводить прямую пробу Кумбса, подсчёт числа ретикулоцитов и определение уровня фракций билирубина.
Как правило проведение биопсии костного мозга не требуется для поставки диагноза. Анализ биоптата может помочь сделать прогноз относительно скорости развития болезни, но последние наблюдения показывают, что использование других прогностических маркеров может давать лучшие результаты. Однако анализ аспирата или пунктата костного мозга может понадобиться для выяснения причин цитопении (специфическое поражение костного мозга или аутоиммунное осложнение) путём исследования миелограммы[14].
Некоторые дополнительные тесты используются для предсказания скорости прогрессирования заболевания, но не влияют на выбор схемы лечения. К таким тестам относится определение наличия соматических мутаций в вариабельной области генов тяжёлых цепей иммуноглобулинов (IgVH) и определение количества CD38 и ZAP-70 в клетках, поражённых хроническим лимфоцитарным лейкозом. IgVH без мутаций указывают для более агрессивную болезнь и менее благоприятный прогноз[17][18][19]. Экспрессия CD38 и ZAP-70 коррелирует с отсутствием мутаций в IgVH и плохим прогнозом. Однако пока не до конца ясно, являются ли эти молекулы независимыми прогностическими факторами[14]. Также на агрессивность болезни указывают повышенное количество тимидинкиназы[20], CD23[21] и β2-микроглобулина[22] в сыворотке крови.
Используются системы стадирования, предложенные K. Rai[23] и J. Binet[24]. Оригинальная система Rai была модифицирована с целью снизить количество определяемых групп риска с 5 до 3[14]. Обе системы опираются на данные физического осмотра и стандартные лабораторные анализы и легки в применении. В них отражено естественное течение заболевания — постепенное накопление опухолевой массы. Стадирование позволяет делать прогнозы о выживаемости: прогноз пациентов на поздних стадиях может быть хуже, чем на более ранних. Однако эти системы не дают возможности прогнозировать индивидуальный риск прогрессирования заболевания и выживания на ранних стадиях (стадии 0-II по Rai, A по Binet)[16]. По этой причине стали широко использовать другие прогностические маркеры, такие как цитогенетические характеристики злокачественных клонов, мутационный статус локуса IgVH и количество ZAP-70 или CD38.
|
| |||||||||||||||||||||||
Хронический лимфолейкоз является практически неизлечимым медленнопрогрессирующим (индолентным) заболеванием.
Лечение не начинается сразу после подтверждения диагноза. Заболевание может сохранять стабильность годами, иногда в течение всей жизни больного. Часто наблюдается волнообразное течение с периодами увеличения и уменьшения опухолевого объема. Решение о необходимости начала терапии принимается обычно после периода более или менее длительного наблюдения.
Показания для начала лечения сформулированы в современных рекомендациях. Они отражают картину активной прогрессии заболевания, приводящей к ухудшению медицинского состояния больного и/или качества его жизни.
Из-за системного характера заболевания радиотерапия при хроническом лимфоцитарном лейкозе не применяется. Стандартом терапии являются химиотерапевтические режимы с включением нуклеотидных аналогов, алкилирующих препаратов и моноклональных антител.
Один из наиболее эффективных режимов — «FCR» (англ. fludarabine, cyclophosphamide, rituximab). Он позволяет получить полную ремиссию примерно у 85 % больных низкой группы риска. Однако этот режим имеет побочные эффекты, которые не позволяют использовать его для пациентов пожилого возраста. Кроме того, режим малоэффективен для больных группы высокого риска (например, имеющих делецию 17p)[25].
Активно исследуется возможность применения в терапии алкилирующего препарата бендамустин.
Резистентость к цитостатикам, как правило, обусловлена нарушением механизмов инициации апоптоза в ответ на повреждения ДНК в клетках опухоли. Наиболее типичны мутации гена TP53, приводящие к его инактивации. Клетки с инактивированным p53 не погибают при накоплении повреждений генома. Более того, мутации, индуцированные цитостатиками, могут давать таким клеткам дополнительное преимущество за счет активации онкогенов или инактивации антионкогенов. Таким образом, мутагенез, индуцированный цитостатиками, может являться двигателем клональной эволюции.
У пациентов с резистентным течением в настоящее время используются высокие дозы глюкокортикостероидов, алемтузумаб (моноклональное антитело к CD52[26]), режимы, его содержащие, а также аллогенная трансплантация костного мозга.
Проведение интенсивной химиотерапии и трансплантации костного мозга у пожилых может быть затруднено плохим соматическим статусом и наличием серьезных сопутствующих заболеваний. В этой группе больных часто используется хлорамбуцил или комбинации на его основе.
Новые препараты (леналидомид, BGB-3111, акалабрутиниб, дувелисиб, умбралисиб) и комбинированные режимы на их основе в настоящее время проходят заключительные этапы клинических испытаний.
Существует также значительное количество новых экспериментальных подходов к терапии хронического лимфоцитарного лейкоза, эффективность и безопасность которых окончательно не установлена.
В последние годы показана высокая эффективность ингибиторов тирозинкиназ Btk[27][28] (ибрутиниб, акалабрутиниб и др.) и PI3Kdelta (иделалисиб и др.), а также высокоселективного ингибитора Bcl-2 (венетоклакс). В 2014 году FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США) выдало разрешение на применение ибрутиниба у больных ХЛЛ, предварительно прошедших как минимум один курс лечения[29]. Данные таргетные препараты обладают высокой активностью даже у пациентов с неблагоприятным прогнозом (del17p) и относительно малотоксичны. В то же время, недостатком является их крайне высокая стоимость.
По клиническим проявлениям хронический лимфоцитарный лейкоз является довольно гетерогенным заболеванием: болезнь может протекать длительно без прогрессии или, наоборот, очень агрессивно[7]. Примерно в 30 % случаев болезнь прогрессирует медленно, так что смерть наступает по причине, не связанной с болезнью. В 15 % случаев смерть от болезни и/или побочных эффектов лечения наступает в течение 2—3 лет с момента постановки диагноза. В остальных случаях болезнь медленно прогрессирует в течение 5—10 лет, после чего наступает терминальная стадия заболевания, за которой следует смерть[30]. В случае пациентов из группы низкого риска медиана выживаемости от момента постановки диагноза достигает 8—10 лет. Известен ряд факторов, которые позволяют прогнозировать результаты лечения и продолжительность жизни, в том числе:
- Наличие или отсутствие признаков соматической гипермутации в генах вариабельных фрагментов иммуноглобулинов В-клеточного рецептора,
- Использование определенных V-генов в структуре В-клеточного рецептора (например, VH3—21),
- Уровень экспрессии тирозинкиназы Zap-70,
- Уровень экспрессии поверхностного маркера CD38,
- Хромосомные мутации del17p, del11q, затрагивающие гены TP53 и ATM,
- Уровень бета-2-микроглобулина в сыворотке крови,
- Стадия заболевания по Rai и Binet,
- Время удвоения числа лимфоцитов периферической крови и т. д.
Опухолевая трансформация, при которой клетки клона приобретают новые характеристики, делающие их похожими на диффузную крупноклеточную лимфому, носит название синдром Рихтера. Прогноз при наличии трансформации крайне неблагоприятный.
- ↑ Disease Ontology release 2019-05-13 — 2019-05-13 — 2019.
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- ↑ 1 2 3 4 Chiorazzi N., Rai K. R., Ferrarini M. Chronic lymphocytic leukemia // N Engl J Med. — 2005. — Т. 352, вып. 8. — С. 804—815. — PMID 15728813.
- ↑ Jemal A., Siegel R., Xu J., Ward E. Cancer statistics, 2010 // CA Cancer J Clin. — 2010. — Т. 60, вып. 5. — С. 277—300. — DOI:10.3322/caac.20073. — PMID 20610543.
- ↑ 1 2 3 Kipps T. J., Stevenson F. K., Wu C. J., Croce C. M., Packham G., Wierda W. G., O’Brien S., Gribben J., Rai K. Chronic lymphocytic leukaemia. (англ.) // Nature reviews. Disease primers. — 2017. — Vol. 3. — P. 16096. — DOI:10.1038/nrdp.2016.96. — PMID 28102226. [исправить]
- ↑ Cerhan J. R., Slager S. L. Familial predisposition and genetic risk factors for lymphoma. (англ.) // Blood. — 2015. — Vol. 126, no. 20. — P. 2265—2273. — DOI:10.1182/blood-2015-04-537498. — PMID 26405224. [исправить]
- ↑ 1 2 3 Gaidano G., Foà R., Dalla-Favera R. Molecular pathogenesis of chronic lymphocytic leukemia // J Clin Invest. — 2012. — Т. 122, вып. 10. — С. 3432-3438. — DOI:10.1172/JCI64101. — PMID 23023714.
- ↑ Baumann Kreuziger L. M., Tarchand G., Morrison V. A. The impact of Agent Orange exposure on presentation and prognosis of patients with chronic lymphocytic leukemia. (англ.) // Leukemia & lymphoma. — 2014. — Vol. 55, no. 1. — P. 63—66. — DOI:10.3109/10428194.2013.794267. — PMID 23573826. [исправить]
- ↑ Schinasi L. H., De Roos A. J., Ray R. M., Edlefsen K. L., Parks C. G., Howard B. V., Meliker J. R., Bonner M. R., Wallace R. B., LaCroix A. Z. Insecticide exposure and farm history in relation to risk of lymphomas and leukemias in the Women’s Health Initiative observational study cohort. (англ.) // Annals of epidemiology. — 2015. — Vol. 25, no. 11. — P. 803—810. — DOI:10.1016/j.annepidem.2015.08.002. — PMID 26365305. [исправить]
- ↑ Dameshek W. Chronic lymphocytic leukemia — an accumulative disease of immunologically incompetent lymphocytes // Blood. — 1967. — Т. 29, вып. 4:Suppl. — С. 566—584. — PMID 6022294.
- ↑ Messmer B. T., Messmer D., Allen S. L., Kolitz J. E., Kudalkar P., Cesar D., Murphy E. J., Koduru P., Ferrarini M., Zupo S., Cutrona G., Damle R. N., Wasil T., Rai K. R., Hellerstein M. K., Chiorazzi N. In vivo measurements document the dynamic cellular kinetics of chronic lymphocytic leukemia B cells // J Clin Invest. — 2005. — Т. 115, вып. 3. — С. 755—764. — DOI:10.1172/jci23409.
- ↑ D’Cruz O. J., Uckun F. M. Novel Bruton’s tyrosine kinase inhibitors currently in development // Onco Targets Ther. — 2013. — Т. 6. — С. 161—176. — DOI:10.2147/OTT.S33732. — PMID 23493945.
- ↑ Krysov S., Dias S., Paterson A., Mockridge C. I., Potter K. N., Smith K. A., Ashton-Key M., Stevenson F. K., Packham G. Surface IgM stimulation induces MEK1/2-dependent MYC expression in chronic lymphocytic leukemia cells. (англ.) // Blood. — 2012. — Vol. 119, no. 1. — P. 170—179. — DOI:10.1182/blood-2011-07-370403. — PMID 22086413. [исправить]
- ↑ 1 2 3 4 5 6 7 8 Hallek M., Cheson B. D., Catovsky D. et al. Guidelines for the diagnosis and treatment of chronic lymphocytic leukemia: a report from the International Workshop on Chronic Lymphocytic Leukemia updating the National Cancer Institute-Working Group 1996 guidelines // Blood. — 2008. — Т. 111, вып. 12. — С. 5446-5456. — DOI:10.1182/blood-2007-06-093906. — PMID 18216293.
- ↑ 1 2 3 Rawstron A. C., Bennett F. L., O’Connor S. J., Kwok M., Fenton J. A., Plummer M., de Tute R., Owen R. G., Richards S. J., Jack A. S., Hillmen P. Monoclonal B-cell lymphocytosis and chronic lymphocytic leukemia // N Engl J Med. — 2008. — Вып. 359. — № 6. — С. 575-83. — DOI:10.1056/NEJMoa075290. — PMID 18687638.
- ↑ 1 2 3 4 5 Döhner H., Stilgenbauer S., Benner A., Leupolt E., Kröber A., Bullinger L., Döhner K., Bentz M., Lichter P. Genomic aberrations and survival in chronic lymphocytic leukemia // N Engl J Med. — 2000. — Т. 343, № 26. — С. 1910-6. — PMID 11136261.
- ↑ Damle R. N., Wasil T., Fais F., Ghiotto F., Valetto A., Allen S. L., Buchbinder A., Budman D., Dittmar K., Kolitz J., Lichtman S. M., Schulman P., Vinciguerra V. P., Rai K. R., Ferrarini M., Chiorazzi N. Ig V gene mutation status and CD38 expression as novel prognostic indicators in chronic lymphocytic leukemia. (англ.) // Blood. — 1999. — Vol. 94, no. 6. — P. 1840—1847. — PMID 10477712. [исправить]
- ↑ Hamblin T. J., Davis Z., Gardiner A., Oscier D. G., Stevenson F. K. Unmutated Ig V(H) genes are associated with a more aggressive form of chronic lymphocytic leukemia. (англ.) // Blood. — 1999. — Vol. 94, no. 6. — P. 1848—1854. — PMID 10477713. [исправить]
- ↑ Hamblin T. J., Orchard J. A., Ibbotson R. E., Davis Z., Thomas P. W., Stevenson F. K., Oscier D. G. CD38 expression and immunoglobulin variable region mutations are independent prognostic variables in chronic lymphocytic leukemia, but CD38 expression may vary during the course of the disease. (англ.) // Blood. — 2002. — Vol. 99, no. 3. — P. 1023—1029. — PMID 11807008. [исправить]
- ↑ Hallek M., Langenmayer I., Nerl C., Knauf W., Dietzfelbinger H., Adorf D., Ostwald M., Busch R., Kuhn-Hallek I., Thiel E., Emmerich B. Elevated serum thymidine kinase levels identify a subgroup at high risk of disease progression in early, nonsmoldering chronic lymphocytic leukemia. (англ.) // Blood. — 1999. — Vol. 93, no. 5. — P. 1732—1737. — PMID 10029603.
ru.wikipedia.org
Хронический лимфолейкоз — причины, симптомы, диагностика и лечение, прогноз
Хронический лимфолейкоз – онкологическое заболевание, сопровождающееся накоплением атипичных зрелых В-лимфоцитов в периферической крови, печени, селезенке, лимфоузлах и костном мозге. На начальных стадиях проявляется лимфоцитозом и генерализованной лимфоаденопатией. При прогрессировании хронического лимфолейкоза наблюдаются гепатомегалия и спленомегалия, а также анемия и тромбоцитопения, проявляющиеся слабостью, утомляемостью, петехиальными кровоизлияниями и повышенной кровоточивостью. Отмечаются частые инфекции, обусловленные снижением иммунитета. Диагноз устанавливается на основании лабораторных исследований. Лечение – химиотерапия, пересадка костного мозга.
Общие сведения
Хронический лимфолейкоз – заболевание из группы неходжкинских лимфом. Сопровождается увеличением количества морфологически зрелых, но неполноценных В-лимфоцитов. Хронический лимфолейкоз является самой распространенной формой гемобластозов, составляет треть всех лейкозов, диагностируемых в США и странах Европы. Мужчины страдают чаще женщин. Пик заболеваемости приходится на возраст 50-70 лет, в этом периоде выявляется около 70% от общего количества хронических лимфолейкозов.
Пациенты молодого возраста страдают редко, до 40 лет первые симптом болезни возникают всего у 10% больных. В последние годы специалисты отмечают некоторое «омоложение» патологии. Клиническое течение хронического лимфолейкоза очень вариативно, возможно как продолжительное отсутствие прогрессирования, так и крайне агрессивный вариант с летальным исходом в течение 2-3 лет после постановки диагноза. Существует ряд факторов, позволяющих прогнозировать течение заболевания. Лечение осуществляют специалисты в области онкологии и гематологии.
Хронический лимфолейкоз
Этиология и патогенез хронического лимфолейкоза
Причины возникновения окончательно не выяснены. Хронический лимфолейкоз считается единственным лейкозом с неподтвержденной связью между развитием заболевания и неблагоприятными факторами внешней среды (ионизирующим излучением, контактом с канцерогенными веществами). Специалисты считают, что основным фактором, способствующим развитию хронического лимфолейкоза, является наследственная предрасположенность. Типичные хромосомные мутации, вызывающие повреждения онкогенов на начальной стадии болезни, пока не выявлены, однако исследования подтверждают мутагенную природу заболевания.
Клиническая картина хронического лимфолейкоза обусловлена лимфоцитозом. Причиной лимфоцитоза становится появление большого количества морфологически зрелых, но иммунологически дефектных В-лимфоцитов, неспособных к обеспечению гуморального иммунитета. Ранее считали, что аномальные В-лимфоциты при хроническом лимфолейкозе являются долго живущими клетками и редко подвергаются делению. В последующем эта теория была опровергнута. Исследования показали, что В-лимфоциты быстро размножаются. Ежедневно в организме больного образуется 0,1-1% от общего количества атипичных клеток. У разных больных поражаются различные клоны клеток, поэтому хронический лимфолейкоз можно рассматривать как группу близкородственных заболеваний с общим этиопатогенезом и сходной клинической симптоматикой.
При изучении клеток выявляется большое разнообразие. В материале могут преобладать широкоплазменные либо узкоплазменные клетки с молодыми либо сморщенными ядрами, почти бесцветной либо ярко окрашенной зернистой цитоплазмой. Пролиферация аномальных клеток происходит в псевдофолликулах – скоплениях лейкозных клеток, располагающихся в лимфоузлах и костном мозге. Причинами цитопении при хроническом лимфолейкозе являются аутоиммунное разрушение форменных элементов крови и подавление пролиферации стволовых клеток, обусловленное повышением уровня Т-лимфоцитов в селезенке и периферической крови. Кроме того, при наличии киллерных свойств разрушение кровяных клеток могут вызывать атипичные В-лимфоциты.
Классификация хронического лимфолейкоза
С учетом симптомов, морфологических признаков, скорости прогрессирования и реакции на терапию различают следующие формы болезни:
- Хронический лимфолейкоз с доброкачественным течением. Состояние больного долго остается удовлетворительным. Отмечается медленное увеличение количества лейкоцитов в крови. С момента постановки диагноза до стабильного увеличения лимфоузлов может пройти несколько лет или даже десятилетий. Больные сохраняют трудоспособность и привычный образ жизни.
- Классическая (прогрессирующая) форма хронического лимфолейкоза. Лейкоцитоз нарастает в течение месяцев, а не лет. Отмечается параллельное увеличение лимфоузлов.
- Опухолевая форма хронического лимфолейкоза. Отличительной особенностью этой формы является нерезко выраженный лейкоцитоз при выраженном увеличении лимфоузлов.
- Костномозговая форма хронического лимфолейкоза. Выявляется прогрессирующая цитопения при отсутствии увеличения лимфатических узлов, печени и селезенки.
- Хронический лимфолейкоз с увеличением селезенки.
- Хронический лимфолейкоз с парапротеинемией. Отмечаются симптомы одной из вышеперечисленных форм заболевания в сочетании с моноклональной G- или M-гаммапатией.
- Прелимфоцитарная форма хронического лимфолейкоза. Отличительной особенностью этой формы является наличие лимфоцитов, содержащих нуклеолы, в мазках крови и костного мозга, образцах ткани селезенки и лимфоузлов.
- Волосатоклеточный лейкоз. Выявляются цитопения и спленомегалия при отсутствии увеличения лимфоузлов. При микроскопическом исследовании обнаруживаются лимфоциты с характерным «моложавым» ядром и «неровной» цитоплазмой с обрывами, фестончатыми краями и ростками в виде волосков либо ворсинок.
- Т-клеточная форма хронического лимфолейкоза. Наблюдается в 5% случаев. Сопровождается лейкемической инфильтрацией дермы. Обычно быстро прогрессирует.
Выделяют три стадии клинических стадии хронического лимфолейкоза: начальную, развернутых клинических проявлений и терминальную.
Симптомы хронического лимфолейкоза
На начальной стадии патология протекает бессимптомно и может выявляться только по анализам крови. В течение нескольких месяцев или лет у больного хроническим лимфолейкозом выявляется лимфоцитоз 40-50%. Количество лейкоцитов приближено к верхней границе нормы. В обычном состоянии периферические и висцеральные лимфоузлы не увеличены. В период инфекционных заболеваний лимфатические узлы могут временно увеличиваться, а после выздоровления снова уменьшаться. Первым признаком прогрессирования хронического лимфолейкоза становится стабильное увеличение лимфоузлов, нередко – в сочетании с гепатомегалией и спленомегалией.
Вначале поражаются шейные и подмышечные лимфоузлы, затем – узлы в области средостения и брюшной полости, потом – в паховой области. При пальпации выявляются подвижные безболезненные плотноэластические образования, не спаянные с кожей и близлежащими тканями. Диаметр узлов при хроническом лимфолейкозе может колебаться от 0,5 до 5 и более сантиметров. Крупные периферические лимфоузлы могут выбухать с образованием видимого косметического дефекта. При значительном увеличении печени, селезенки и висцеральных лимфоузлов может наблюдаться сдавление внутренних органов, сопровождающееся различными функциональными нарушениями.
Пациенты с хроническим лимфолейкозом жалуются на слабость, беспричинную утомляемость и снижение трудоспособности. По анализам крови отмечается увеличение лимфоцитоза до 80-90%. Количество эритроцитов и тромбоцитов обычно остается в пределах нормы, у некоторых больных выявляется незначительная тромбоцитопения. На поздних стадиях хронического лимфолейкоза отмечаются снижение веса, ночные поты и повышение температуры до субфебрильных цифр. Характерны расстройства иммунитета. Больные часто страдают простудными заболеваниями, циститом и уретритом. Наблюдается склонность к нагноению ран и частое образование гнойников в подкожной жировой клетчатке.
Причиной летального исхода при хроническом лимфолейкозе часто становятся тяжелые инфекционные заболевания. Возможны воспаления легких, сопровождающиеся спаданием легочной ткани и грубыми нарушениями вентиляции. У некоторых больных развивается экссудативный плеврит, который может осложняться разрывом или сдавлением грудного лимфатического протока. Еще одним частым проявлением развернутого хронического лимфолейкоза является опоясывающий лишай, который в тяжелых случаях становится генерализованным, захватывая всю поверхность кожи, а иногда и слизистые оболочки. Аналогичные поражения могут наблюдаться при герпесе и ветряной оспе.
В числе других возможных осложнений хронического лимфолейкоза – инфильтрация преддверно-улиткового нерва, сопровождающаяся расстройствами слуха и шумом в ушах. В терминальной стадии хронического лимфолейкоза может наблюдаться инфильтрация мозговых оболочек, мозгового вещества и нервных корешков. По анализам крови выявляются тромбоцитопения, гемолитическая анемия и гранулоцитопения. Возможна трансформация хронического лимфолейкоза в синдром Рихтера – диффузную лимфому, проявляющуюся быстрым ростом лимфоузлов и формированием очагов за пределами лимфатической системы. До развития лимфомы доживает около 5% пациентов. В остальных случаях смерть наступает от инфекционных осложнений, кровотечений, анемии и кахексии. У некоторых больных хроническим лимфолейкозом развивается тяжелая почечная недостаточность, обусловленная инфильтрацией почечной паренхимы.
Диагностика хронического лимфолейкоза
В половине случаев патологию обнаруживают случайно, при обследовании по поводу других заболеваний или при проведении планового осмотра. При постановке диагноза учитывают жалобы, анамнез, данные объективного осмотра, результаты анализов крови и иммунофенотипирования. Диагностическим критерием хронического лимфолейкоза является увеличение количества лейкоцитов в анализе крови до 5×109/л в сочетании с характерными изменениями иммунофенотипа лимфоцитов. При микроскопическом исследовании мазка крови выявляются малые В-лимфоциты и тени Гумпрехта, возможно – в сочетании с атипичными или крупными лимфоцитами. При иммунофенотипировании подтверждается наличие клеток с абберантным иммунофенотипом и клональность.
Определение стадии хронического лимфолейкоза осуществляют на основании клинических проявлений заболевания и результатов объективного осмотра периферических лимфоузлов. Для составления плана лечения и оценки прогноза при хроническом лимфолейкозе проводят цитогенетические исследования. При подозрении на синдром Рихтера назначают биопсию. Для определения причин цитопении выполняют стернальную пункцию костного мозга с последующим микроскопическим исследованием пунктата.
Лечение и прогноз при хроническом лимфолейкозе
На начальных стадиях хронического лимфолейкоза применяют выжидательную тактику. Пациентам назначают обследование каждые 3-6 месяцев. При отсутствии признаков прогрессирования ограничиваются наблюдением. Показанием к проведению активного лечения является увеличение количества лейкоцитов вдвое и более в течение полугода. Основным методом лечения хронического лимфолейкоза является химиотерапия. Наиболее эффективной комбинацией лекарственных препаратов обычно становится сочетание ритуксимаба, циклофосфамида и флударабина.
При упорном течении хронического лимфолейкоза назначают большие дозы кортикостероидов, осуществляют пересадку костного мозга. У больных пожилого возраста с тяжелой соматической патологией использование интенсивной химиотерапии и пересадка костного мозга могут быть затруднены. В подобных случаях проводят монохимиотерапию хлорамбуцилом или применяют данный препарат в сочетании с ритуксимабом. При хроническом лимфолейкозе с аутоиммунной цитопенией назначают преднизолон. Лечение осуществляют до улучшения состояния больного, при этом продолжительность курса терапии составляет не менее 8-12 месяцев. После стабильного улучшения состояния пациента лечение прекращают. Показанием для возобновления терапии является клиническая и лабораторная симптоматика, свидетельствующая о прогрессировании болезни.
Хронический лимфолейкоз рассматривается как практически неизлечимое длительно текущее заболевание с относительно удовлетворительным прогнозом. В 15% случаев наблюдается агрессивное течение с быстрым нарастанием лейкоцитоза и прогрессированием клинической симптоматики. Летальный исход при этой форме хронического лимфолейкоза наступает в течение 2-3 лет. В остальных случаях отмечается медленное прогрессирование, средняя продолжительность жизни с момента постановки диагноза колеблется от 5 до 10 лет. При доброкачественном течении срок жизни может составлять несколько десятилетий. После прохождения курса лечения улучшение наблюдается у 40-70% больных хроническим лимфолейкозом, однако полные ремиссии выявляются редко.
www.krasotaimedicina.ru
Хронический лимфолейкоз и его лечение | #04/07
Хронический лимфолейкоз (ХЛЛ) — опухолевое заболевание, возникающее вследствие мутаций в геноме В-лимфоцита. Основная функция В-лимфоцитов — обеспечение гуморального иммунитета. Конечная стадия развития В-лимфоцита в организме — иммуноглобулинсекретирующая плазматическая клетка. В-лимфоциты при ХЛЛ вследствие изменений в клеточном геноме не развиваются до плазматических клеток. Это ведет к резкому уменьшению в организме больного выработки иммуноглобулинов, к которым относятся все антитела.
ХЛЛ — наиболее распространенный вид лейкоза в странах Европы и Северной Америки, в которых на его долю приходится около 30% всех лейкозов. Ежегодная заболеваемость им составляет 3–3,5 случая на 100 000 человек, увеличиваясь для лиц старше 65 лет до 20, а старше 70 — до 50 случаев на 100 000 человек.
Как самостоятельное заболевание ХЛЛ выделен в 1856 г. знаменитым немецким патологом Р. Вирховым.
Мужчины заболевают ХЛЛ в 2 раза чаще женщин. ХЛЛ в основном болезнь людей пожилого возраста, средний возраст заболевших составляет 65—69 лет. Более 70% заболевают в возрасте старше 60 лет, менее 10% — до 40 лет.
Не наблюдается увеличения частоты ХЛЛ среди лиц, подвергавшихся воздействию ионизирующей радиации или часто контактировавших с бенолом и автомобильным бензином, т. е. факторами, играющими ведущую роль в возникновении миелоидных лейкозов.
Диагностика ХЛЛ в подавляющем большинстве случаев не вызывает трудностей. Это заболевание должно быть заподозрено при увеличении в крови количества лейкоцитов и лимфоцитов. Если абсолютное количество лимфоцитов достигает 5х109/л, диагноз ХЛЛ становится очень вероятным. Нужно иметь в виду, что абсолютное количество лимфоцитов 5х109/л — это 55% при общем количестве лейкоцитов 9х109/л, и такая картина крови часто не привлекает внимания врача. Иногда на протяжении 2–3 лет при нормальном количестве лейкоцитов наблюдается постепенно нарастающий лимфоцитоз — 55–60–70% лимфоцитов в формуле крови. Пациенту с такой картиной крови обязательно нужно повторять анализ крови не реже 1 раза в полгода, так как после длительного периода спокойного течения может начаться быстрое прогрессирование заболевания. В настоящее время в терапии ХЛЛ имеются широкие возможности, поэтому каждый больной с подозрением на это заболевание должен быть проконсультирован гематологом, независимо от наличия у него другой патологии.
В большинстве случаев при установлении диагноза ХЛЛ количество лейкоцитов составляет 20–50х109/л, но иногда при первом обращении к врачу имеется высокий лейкоцитоз, достигающий 100–500х109/л и свидетельствующий о длительном недиагностированном периоде заболевания. При подсчете лейкоцитарной формулы содержание лимфоцитов обычно составляет 60–70%, при высоком лейкоцитозе достигает 95–99%. Уровень гемоглобина и число тромбоцитов обычно бывают нормальными, но при высоком лейкоцитозе и лимфоцитозе, превышающем 85–90%, может быть некоторое снижение показателей гемоглобина и числа эритроцитов и тромбоцитов. При биохимическом анализе крови вначале никаких изменений не отмечается, с течением времени в большинстве случаев выявляются гипопротеинемия и гипогаммаглобулинемия.
В костно-мозговом пунктате на ранних этапах болезни обнаруживается небольшое содержание лимфоцитов (40–50%), при высоком лейкоцитозе лимфоциты могут составлять 95–98% костно-мозговых элементов.
Только морфологического исследования недостаточно для установления диагноза ХЛЛ, поскольку аналогичная картина крови и костного мозга может наблюдаться при некоторых видах лимфом. Согласно современным критериям, диагноз ХЛЛ может считаться установленным только после иммунологического исследования. Лимфоциты при ХЛЛ имеют абсолютно характерный иммунофенотип. Они экспрессируют на своей поверхности антигены CD19, CD5, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов (экспрессируются IgM, нередко одновременно с IgD) и антигенов CD20 и CD22.
ХЛЛ чаще всего начинается исподволь и в большинстве случаев на ранних этапах развивается очень медленно, а у ряда больных признаки прогрессирования могут отсутствовать годами. При первом обращении к врачу-гематологу больные чаще всего не предъявляют жалоб, а причиной визита являются изменения в анализе крови, сделанном по другому поводу. В большинстве случаев даже при нерезко выраженных изменениях крови при осмотре удается обнаружить небольшое увеличение лимфоузлов. Они имеют «тестоватую» консистенцию, мягкие, подвижные, не спаянные между собой и с окружающими тканями. Без сопутствующей инфекции лимфоузлы совершенно безболезненны. Иногда реакция лимфоузлов на инфекцию —первый признак их поражения: больной жалуется, что при острых респираторных заболеваниях у него появляются увеличенные лимфоузлы на шее. Нередко в этот момент у больного снижается слух и появляется чувство «заложенности» в ушах, вызванное разрастанием лимфатической ткани в устьях евстахиевых труб и ее отеком в момент инфекции. У некоторых больных имеется значительное увеличение глоточных миндалин, иногда при присоединении респираторной инфекции появляется легкое затруднение при глотании твердой пищи.
При значительном увеличении периферических лимфоузлов, как правило, оказываются увеличенными лимфоузлы брюшной полости, что выявляется при УЗИ. Лимфоузлы могут сливаться между собой, образуя конгломераты. Медиастинальные лимфоузлы увеличиваются редко и обычно незначительно. Размеры лимфоузлов у разных больных могут изменяться в очень широких пределах — от 1,5–2 до 10–15 см в диаметре. У одного больного эти размеры в разных областях варьируются, однако резкое увеличение лимфоузлов какой-либо одной области нехарактерно. В подобных случаях обязательна пункция или биопсия данного узла для исключения трансформации ХЛЛ в агрессивную лимфому.
Спленомегалия у большинства больных появляется позже, чем увеличение лимфоузлов. Увеличение селезенки без увеличения лимфоузлов совершенно не характерно для ХЛЛ и чаще всего в таких случаях речь идет о других заболеваниях. Гепатомегалия наблюдается нечасто и обычно появляется позже, чем спленомегалия.
В начале заболевания жалобы обычно отсутствуют. С течением времени появляются жалобы на повышенную утомляемость, слабость и главным образом на резкую потливость, особенно в жаркое время года.
Темпы развития болезни, скорость увеличения количества лейкоцитов, размеров лимфоузлов и селезенки колеблются в широких пределах. У ряда больных болезнь неуклонно прогрессирует, и, несмотря на лечение, даже при современной терапии продолжительность жизни составляет всего 4–5 лет. В то же время примерно у 15–20% больных клинические и гематологические признаки заболевания на протяжении многих лет остаются стабильными и минимально выраженными. В течение 10–15 лет, а в отдельных случаях 20–30 лет имеется увеличение количества лейкоцитов до 10–20х109/л, увеличение лимфоцитов в крови — до 60–70%, в костном мозге до — 45–55%; содержание гемоглобина, число эритроцитов и тромбоцитов — нормальные. При этой «застывшей», или «тлеющей», форме ХЛЛ продолжительность жизни может вообще не зависеть от наличия данного заболевания. У некоторых больных, однако, спустя несколько лет и при этом варианте также появляются признаки прогрессирования.
У большинства пациентов процесс отличается медленным развитием и в течение ряда лет довольно успешно контролируется терапией. При современной терапии продолжительность жизни большинства больных составляет 7–10 лет и более.
Существуют две современные классификации ХЛЛ, делящие его на стадии в зависимости от клинических проявлений. Одна из них предложена в 1975 г. американскими учеными K. Rai и его коллегами, она используется преимущественно в США (табл. 1). Другая классификация опубликована в 1981 г. французскими учеными J. L. Binet и соавторами, она получила распространение в Европе и в нашей стране (табл. 2). В основу обеих классификаций положен единый принцип: учет массы опухоли и ее распространения, отражением чего являются: количество лейкоцитов, лимфоцитоз, размеры лимфоузлов, печени и селезенки, наличие или отсутствие угнетенных здоровых ростков кроветворения. Этот последний фактор оказывает даже большее влияние на продолжительность жизни больных, чем объем опухолевой массы.
В связи с гипогаммаглобулинемией, которая постепенно углубляется по мере прогрессирования заболевания и к 7–8 годам болезни отмечается у 70% больных, при ХЛЛ имеется повышенная склонность к развитию оппортунистических инфекций, чаще всего легочных.
Инфекционные осложнения при ХЛЛ могут возникнуть в любой стадии заболевания, в том числе и в начальной, но гораздо чаще они развиваются у больных с выраженными клинико-гематологическими проявлениями болезни. Этот факт показывает, что не следует откладывать лечение больного даже в пожилом возрасте и при наличии других заболеваний, если есть признаки прогрессирования ХЛЛ.
Терминальная стадия ХЛЛ чаще всего характеризуется рефрактерностью к терапии и учащением инфекционных эпизодов без каких-либо изменений прежней картины крови. Инфекции становятся причиной смерти большинства больных. Лечение инфекций у больных ХЛЛ должно начинаться немедленно при их возникновении и до получения данных бактериологического анализа проводиться антибиотиками широкого спектра, лучше всего в стационаре.
Помимо инфекционных, для ХЛЛ характерны аутоиммунные осложнения — аутоиммунная гемолитическая анемия (АИГА) и аутоиммунная тромбоцитопения. АИГА развивается в течение заболевания у 10–25% больных ХЛЛ. Аутоиммунный гемолиз эритроцитов может носить характер остро и бурно развившегося гемолитического криза, сопровождаясь повышением температуры, появлением желтушного окрашивания кожи и темной окраски мочи, увеличением содержания непрямого билирубина в сыворотке. Быстрое развитие и прогрессирование анемии становится причиной резкого ухудшения состояния больного и может быть опасным для жизни, особенно при наличии сопутствующих заболеваний сердца или легких. Чаще аутоиммунный гемолиз развивается постепенно. Иммунная тромбоцитопения встречается реже, чем АИГА, всего в 2–3% случаев, но может быть опасней, чем АИГА, из-за часто возникающих жизненно опасных кровотечений или кровоизлияний в головной мозг, становящихся причиной смерти больных.
Аутоиммунные осложнения всегда требуют лечения. Чаще всего для этого применяются кортикостероидные гормоны в высоких дозах — 1–2 мг/кг веса в расчете на преднизолон.
В лечении ХЛЛ в настоящее время имеются широкие возможности. До начала ХХ в. терапия всех лейкозов была одинаковой: мышьяк, уретан, симптоматическое лечение. С 1902 г. основным средством лечения хронических лейкозов стала рентгенотерапия, которая при ХЛЛ оставалась ведущим лечебным методом на протяжении 50 лет. Она давала хороший местный эффект, но не меняла темпов развития болезни: средняя продолжительность жизни при симптоматическом лечении составляла 40 мес, при рентгенотерапии — 42 мес.
Современная эра в терапии ХЛЛ началась с середины ХХ столетия, когда были получены данные об уменьшении лимфоидной пролиферации под влиянием стероидных гормонов. Широкий диапазон действия быстро сделал стероидные гормоны универсально используемым средством при этом заболевании. Однако кратковременность достигнутого эффекта, неизбежно наступающая при длительном приеме, снижение эффективности, наличие серьезных побочных явлений и нередкие осложнения сузили область применения гормональной терапии при ХЛЛ, оставив на первом месте среди показаний к ее назначению аутоиммунные осложнения.
Важнейшим событием в развитии терапии ХЛЛ было появление алкилирующих препаратов. Первый из них — хлорамбуцил — используется в настоящее время. Терапия хлорамбуцилом или его комбинация с преднизолоном в случаях медленного нарастания лейкоцитоза позволяет на определенное время контролировать проявления болезни. Продолжительность жизни больных ХЛЛ при такой терапии составляет 55–60 мес. Вместо хлорамбуцила нередко используется циклофосфамид. Терапия хлорамбуцилом или циклофосфамидом и их комбинация с преднизолоном у подавляющего числа больных позволяют получать лишь частичные ремиссии. Стремление улучшить имеющиеся результаты привело к созданию в 70–80-е годы ХХ в. комбинированных лечебных схем, включающих циклофосфамид, преднизолон, винкристин и какой-либо из антрациклинов (Рубомицин, Адрибластин или Идарубицин). Наибольшее распространение получили схемы COP, CHOP и CAP. Эти схемы позволяют у большинства больных добиться сокращения размеров лимфоузлов и селезенки и уменьшить количество лейкоцитов, а в результате проведения нескольких курсов у 30–50% больных получить даже полные ремиссии, которые, однако, всегда оказываются кратковременными. Международные рандомизированные исследования показали, что продолжительность жизни при использовании этих лечебных схем не превосходит полученную при лечении ХЛЛ хлорамбуцилом и преднизолоном.
В 80-х годах ХХ в. произошло важнейшее событие в терапии ХЛЛ — были синтезированы и внедрены в клиническую практику пуриновые аналоги, появление которых было названо «мирной революцией» в лечении ХЛЛ. Наиболее эффективным из них при ХЛЛ является флударабин.
При лечении флударабином ремиссии, нередко полные, удается получить у большинства больных, в том числе и рефрактерных ко всем другим средствам. Однако со временем выяснилось, что даже полные ремиссии после лечения флударабином, хоть и являются, как правило, довольно длительными, все же временны. Это стало причиной разработки комбинированных схем терапии, содержащих флударабин и какой-либо другой препарат — циклофосфамид, митоксантрон, доксорубицин.
Наиболее эффективным и вызывающим менее всего серьезные побочные явления оказалось сочетание флударабина с циклофосфамидом. Многочисленные исследования, проведенные в разных странах, показали, что эта комбинация препаратов позволяет получить ремиссии у 70–80% ранее леченных и у 90–95% ранее нелеченных больных ХЛЛ, при этом у многих ремиссии, особенно полные, имеют продолжительность 20–28 мес. Эта комбинация оказалась эффективной даже у ряда больных, рефрактерных к предыдущей комбинированной терапии и, что не менее важно, при повторном использовании в случае возникновения рецидива.
В конце 1990-х годов появился флударабин для перорального приема. Его эффективность в соответствующей дозе аналогична эффективности внутривенного препарата. Появление флударабина для приема внутрь позволяет комбинировать его с пероральной формой циклофосфамида. Эта комбинация очень удобна для больных, особенно пожилого возраста, так как избавляет их от необходимости посещения поликлиники для внутривенных инъекций препаратов.
Новым и важнейшим этапом в лечении ХЛЛ стало появление и внедрение в клиническую практику моноклональных антител. Первым в терапии ХЛЛ стал применяться препарат ритуксимаб (Мабтера) — моноклональные антитела к антигену CD20. Антиген CD20 — это фосфопротеин, часть молекулы которого располагается на поверхности клетки, другая — в цитоплазме. Он участвует в доставке кальция к ядру клетки. Антитела к антигену CD20 — это химерные антитела, имеющие вариабельный мышиный и константный человеческий регион IgG. Соединение антител с антигеном CD20 индуцирует в клетке сигналы апоптоза.
При ХЛЛ имеется малая плотность молекул антигена CD20 на лимфоцитах, поэтому антитела к этому антигену при ХЛЛ в монорежиме оказались эффективными лишь в больших дозах. Ко времени появления ритуксимаба (Мабтеры) флударабин показал себя как наиболее эффективный препарат в терапии ХЛЛ, поэтому были предприняты исследования эффективности сочетания ритуксимаба и флударабина. Они показали, что это сочетание высокоэффективно как у ранее леченных, так и у нелеченых больных: частота ремиссий у ранее леченных составляет 60–70%, у нелеченых — 90–95%, у половины больных достигаются полные ремиссии. После такого лечения у большинства ранее нелеченных больных ремиссии сохраняются 2 года и дольше. Сочетание флударабина, циклофосфамида и ритуксимаба позволяет получить эффект у 95–100% ранее нелеченных больных и у ранее получавших терапию хлорамбуцилом (Лейкераном) или сочетанием преднизолона, винкристина, циклофосфамида (СОР), а у 70–75% больных достигаются полные ремиссии.
Терапия ритуксимабом оказалась эффективной и у ряда больных с аутоиммунной анемией и тромбоцитопенией. В этих случаях ее применяют либо в монорежиме, либо в сочетании с преднизолоном или с СОР.
Еще более высокие результаты могут быть достигнуты при использовании антител к антигену CD52 (Alemtuzumab, Campath-1H).
Антиген CD52 — это гликопротеин, который экспрессирован на мембране большинства зрелых нормальных и опухолевых Т- и В- лимфоцитов, эозинофилов, моноцитов и макрофагов, но не обнаружен на мембране стволовых клеток, эритроцитов и тромбоцитов. Его функция в клетке до сих пор не выяснена. В то время как антиген CD20 экспрессирован на патологических лимфоцитах при ХЛЛ с плотностью примерно 8000 молекул на клетку, плотность молекул антигена CD52 очень высока — примерно 500 000 молекул на клетку.
Campath-1H — это гуманизированные антитела, в которых только маленький участок, непосредственно связывающийся с антигеном, является крысиным IgG2a, вся остальная часть молекулы антитела — человеческий IgG1.
Применение Campath-1H часто оказывается эффективным даже у больных, получивших несколько курсов лечения флударабином и ставших к нему резистентными. В большом многоцентровом международном исследовании Campath-1H получили 152 пациентов, рефрактерных к флударабину, у 42% получены ремиссии, в том числе у 5% — полные. Этот результат свидетельствует о высокой эффективности Campath-1H, поскольку резистентность к флударабину — крайне неблагоприятный прогностический признак.
Чрезвычайно обнадеживающей оказалась эффективность препарата у ряда больных с делецией короткого плеча хромосомы 17(17р-) или мутацией локализованного в этом регионе гена ТР53. Этот ген называют «стражем генома», при всех нарушениях ДНК в клетке ген ТР53 активизируется, в результате чего включается сигнал апоптоза и такая клетка погибает. До появления Campath-1H больные ХЛЛ с делецией 17р считались рефрактерными к терапии, поскольку в большинстве случаев эффекта от лечения либо не было, либо он оказывался очень непродолжительным. При использовании Campath-1H у больных с делецией 17р ремиссии, в том числе и полные, удается получить в 30–40% случаев. В нашем наблюдении у больной с делецией 17р, у которой терапия флударабином была неэффективна, удалось получить не только полную клинико-гематологическую, но и молекулярную ремиссию — ни в крови, ни в костно-мозговом пунктате при иммунологическом исследовании не обнаружено патологических лимфоцитов.
Дальнейшие исследования показали, что применение препарата у ранее нелеченных больных позволяет получить эффект в 80% случаев, у 2/3 больных можно получить полную костно-мозговую ремиссию.
Еще лучшие результаты были получены при комбинации Campath-1H с флударабином (FluCam) у 36 больных ХЛЛ, которые ранее получали флударабин с ритуксимабом или ритуксимаб в сочетании с комбинацией препаратов, включающей алкилирующие агенты. Эффект был достигнут у 83% этих тяжелых и плохо отвечающих на терапию больных, при этом у 30% были получены полные ремиссии. Медиана продолжительности жизни в этой группе составила 35,6 мес и не была достигнута за время наблюдения у больных с полной ремиссией. У двух больных с аутоиммунной анемией, имевшейся до начала лечения, к концу терапии уровень гемоглобина полностью нормализовался без гемотрансфузий и все признаки гемолиза исчезли.
В нескольких исследованиях Campath-1H был использован в качестве консолидирующей терапии у больных, эффективно леченных флударабином. В самом большом исследовании, включившем 56 больных, после флударабина полные ремиссии отмечены у 4%, частичные у 52% больных, после добавочного лечения Campath-1H число полных ремиссий возросло до 42%, число частичных ремиссий составило 50%, таким образом общий эффект увеличился с 56% после лечения флударабином до 92% после добавочного лечения Campath-1H.
Лечение Campath-1H должно проводиться только в стационаре под наблюдением гематологов, так как в связи с резким уменьшением в результате лечения количества не только В-, но и Т-лимфоцитов без профилактических мер у больного часто развиваются осложнения. Наиболее грозное осложнение лечения Campath-1H — частое присоединение инфекций. Самым опасным является развитие септицемии, пневмоцистной пневмонии, системного аспергиллеза или кандидоза, появление распространенного herpes zoster, реактивация цитомегаловирусной инфекции. Учитывая эту опасность, при проведении лечения и не менее 2 мес после его окончания больной профилактически должен получать Бисептол (для профилактики пневмоцистной пневмонии), противогрибковые и антивирусные средства. При обнаружении реактивации цитомегаловируса проводится лечение ганцикловиром, при появлении грибковой инфекции — лечение противогрибковыми препаратами высокой эффективности.
Несмотря на возможные осложнения, применение Campath-1H становится все более распространенным. Те положительные результаты, которые достигаются при его применении, поставили его в ряд наиболее эффективных препаратов в терапии ХЛЛ.
Анализ возможностей терапии ХЛЛ на протяжении столетия показывает, что в течение последних двух десятилетий ХЛЛ из неизлечимого заболевания превратился в заболевание, которое в большинстве случаев при своевременном начале можно успешно лечить, продлевая жизнь и соматическое благополучие больных, и которое в настоящее время стало принципиально излечимым.
Литература
- Руководство по гематологии/ под ред. А. И. Воробьева. М.: Ньюдиамед, 2005.
- Клиническая онкогематология / под ред. М. А. Волковой. М.: Медицина, 2001.
- Chronic lymphoid leukemias edited by B. D. Cheson, Marcell Dekker A.G. New York, 2001.
- Волкова М. А., Бялик Т. Е. Ритуксимаб в терапии аутоиммунных осложнений при хроническом лимфолейкозе// Гематология и трансфузиология. 2006. № 3. С. 11–17.
- Волкова М. А. Моноклональные антитела к антигену CD52: оптимизация терапии хронического лимфолейкоза// Гематология и трансфузиология. 2006. № 2. С. 27–33.
М. А. Волкова, доктор медицинских наук, профессор
Онкологический научный центр им. Н. Н. Блохина РАМН, Москва
www.lvrach.ru
лечение, показатели анализа крови, симптомы, причины, стадии и продолжительность жизни
Лимфолейкоз – это злокачественная опухоль, поражающая клетки лимфоидной ткани, из которой состоят лимфоузлы и другие внутренние органы. Согласно международной классификации заболеваний присвоен код по МКБ-10 С91.
Находящиеся в крови клетки – лейкоциты призваны для защиты человеческого организма от заболеваний и формируют иммунитет. При лимфолейкозе анализ крови показывает, что лимфоцит мутировал и изменил строение. Постепенно накопленные мутированные клетки начинают вытеснять здоровые и, когда превышают количество, отмечается снижение иммунитета. На последней стадии болезни анализ крови включает 98% нетипичных клеток и 2% здоровых.
Признаки лимфолейкоза
Проявления патологии отмечаются на последней стадии болезни. Но возникают тревожные признаки заболевания, на которые стоит обратить внимание. Симптомы лимфолейкоза:
- воспаление лимфоузлов, которое диагностируется при прощупывании;
- болезненные ощущения в селезенке и печени из-за увеличения размера;
- появление желтушного оттенка кожи;
- признаки анемии: предобморочные состояния, бледная кожа;
- ломота в суставах, слабость;
- частые простудные заболевания.
По статистике, заболеванию подвергаются дети возрастом от 5 лет, а также возможно возникновение у пожилых людей после 70 лет.
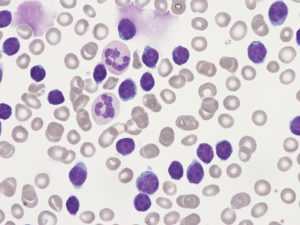
Кровь под микроскопом при лимфолейкозе
Медицина не может сказать, каковы причины возникновения патологии. Одна из главных версий – генетическая предрасположенность. На генетическом уровне в хромосомах лимфоцитов происходит бесконтрольное деление и рост. Предрасположенность, передающаяся по наследству, зафиксирована при хроническом лимфолейкозе. Ученые выяснили, что в семьях со случаями болезни риск заболевания родственников увеличивается в 6 раз.
Выделяют 2 формы лимфоидного лейкоза: острую и хроническую.
Хронический лимфолейкоз
Хронический лимфатический лейкоз – это процесс, при котором нарушается b-клеточный круговорот лимфоцитов. Изменённые лимфоциты воспроизводятся, не погибают и накапливаются в органах. Создаваемые антитела не выполняют защитную функцию.
Распространённость ХЛЛ составляет третью часть заболеваний. В 90% случаев болезнь развивается после 50 лет, при этом мужчины болеют чаще в 2 раза. Причины возникновения заболевания: наследственность, иммунитет, нарушения на генетическом уровне. Для хронического лимфолейкоза характерно развитие иммунодефицита, который повышает чувствительность к вирусам и порождает опухолевые клетки.
Виды и стадии заболевания
Классификация форм хронического типа:
- Доброкачественный лимфолейкоз характеризуется удовлетворительным состоянием пациента. Показатели лейкоцитов в крови растут медленно. Продолжительность жизни с момента констатирования болезни составляет 15-30 лет.
- Прогрессирующий лимфоидный лейкоз начинается так же, как и доброкачественный. Однако повышение лейкоцитов в крови наблюдается из месяца в месяц. Отмечается характерный симптом: увеличение лимфоузлов с мягкой консистенцией.
- Спленомегалическая форма характеризуется увеличением селезёнки и выраженными признаками анемии.
- Опухолевый вид ХХЛ характеризуется такой клинической картиной: лимфоузлы увеличены, с плотной консистенцией. Из-за поражения медиастинальных лимфоузлов происходит сдавливание органов. Показатель лейкоцитов в крови около 100 тыс.
- Т-клеточный лимфолейкоз может характеризоваться увеличением лимфоузлов, поражением кожи в виде бляшек, язв и опухоли.
Обследование лимфатических узлов
Выделяют стадии протекания болезни: начальную, развернутую и терминальную. При начальной стадии жалобы отсутствуют. Но с течением времени человек ощущает постоянную утомляемость, слабость, повышенную потливость. В крови количество лейкоцитов превышают 50 тыс., констатируется наличие клеток Боткина-Гумпрехта. Костный мозг характеризуется большим количеством лимфоцитов. Развёрнутая стадия представляет генерализованное увеличение лимфоузлов, увеличение размеров печени и селезенки. Из характерных признаков: отек лица, анемия, шум в ушных раковинах. При хроническом лимфолейкозе терминальной стадии выражен интоксикационный синдром. Увеличенные лимфоузлы сдавливают ткани, на фоне этого возникает болевой синдром. Развивается бластный криз.
Инфекционные осложнения при ХЛЛ возникают на любой стадии, наиболее часто проявляются в виде лёгочных инфекций.
Помимо доброкачественного течения болезни, хронический лимфоцитарный лейкоз становится причиной развития таких патологий, как волосатоклеточный лейкоз (ВЛЛ) и болезнь Рихтера. ВВЛ – редкая опухоль, поражающая лимфоидные клетки костного мозга, селезенки и крови. Синдром Рихтера – заболевание, при котором происходит развитие крупноклеточного образования – лимфомы.
Лечение
Хронический лимфолейкоз обычно имеет доброкачественный характер. Начальные стадии отличаются отсутствием симптоматики. При большой скорости прогрессирования назначается химиотерапия. Показаниями к терапии являются такие симптомы: увеличение лимфоузлов, провоцирующих сдавливание внутренних органов, потеря веса и анемические признаки. Выбор терапии основан на 3 факторах: характер болезни, возраст и состояние пациента, наличие сопутствующих осложнений. В зависимости от возрастной категории, в развитии патологии выделяют пациентов молодого, преклонного и старческого возраста.
Используется также метод лучевой терапии. Он эффективен при лечении лимфоузлов, находящихся в локальной зоне.

Острый лимфолейкоз
Острый лимфолейкоз – злокачественный вид поражения кровеносной системы, характеризующийся увеличением количества лимфобластов. Для типичного течения болезни характерно наличие анемии, увеличения лимфоузлов, постоянная кровоточивость, расстройство дыхательной системы и поражение центральной нервной системы.
ОЛЛ – онкологическое образование, которое имеет распространение среди детей дошкольного возраста. У детей наблюдается первичное появление болезни, у взрослых выступает в виде осложнения после хронического лимфолейкоза. Прогнозы выздоровления у ребенка являются неоднозначными, так как патология характеризуется рецидивами.
Причины возникновения
Этиология болезни основана на предположениях ученых о возможных факторах риска. Болезнь возникает из-за образования быстроразмножающихся клеток. Генетические нарушения, вызывающие патологические изменения, возникают ещё в утробе матери.
В группу повышенного риска также попадают люди, подвергнутые воздействию радиационных лучей.
Лучевые воздействия от радиотерапии, которыми устранялась опухоль другого вида, или облучение рентгенологическим аппаратом тоже могут способствовать развитию патологии. Риск развития острого лейкоза повышается при контакте беременной женщины с некоторыми группами токсических веществ.
Симптомы
Болезнь характеризуется стремительным развитием и разнообразной симптоматикой. Наиболее часто начало болезни носит симптомы: повышенная и субфебрильная температура, слабость, признаки интоксикации, дискомфорт и ощущение распирания в животе, частые боли. А также кровотечения из носа, отёки ног, появление кожных высыпаний, ноющие суставы.
Группы симптомов формируют синдромы, приводящие к сбою работы внутренних органов:
- анемический синдром – характеризуется субфебрильной температурой, предобморочным состоянием, быстрой утомляемостью;
- гиперпластический – внутренние органы увеличиваются в размере;
- геморрагический – кровоизлияния на кожных участках проявляются в виде мелких точек и крупных бляшек;
- болевой синдром – из-за интоксикации организма ощущается боль и ломота в суставах.
Происходит повреждение костной системы, головного мозга, черепно-мозговых нервов, органов пищеварения, почек. Есть вероятность лейкозной инфильтрация яичников.
Рак может привести также к патологии под названием миелолейкоз, при которой поражаются стволовые клетки костного мозга.
Диагностика
Формулировка диагноза осуществляется с помощью результатов ОАМ и биохимического анализа крови. Обязательный метод исследования – миелограмма. С его помощью берут мазок из костного мозга для дальнейшего исследования. В крови выявляется повышенное СОЭ, анемия и лейкоцитоз. Результат миелограммы говорит о наличии бластных клеток. Чтобы отследить онкологический процесс, назначается спинномозговая пункция. С помощью этого метода отслеживается состояние нервной системы.
На основании результатов исследования пациенту присваивают группу риска и назначают лечение. УЗИ проводят с целью обследовать селезёнку и печень, отследить размеры и степень поражения. Рентген помогает выявить распространение метастазов.
Дополнительная диагностика осуществляется методом иммунофенотипирования. Он дает возможность определить иммунофенотип бластных клеток опухолевого образования костного мозга. Это помогает достоверно диагностировать патологию, разделить пациентов на группы риска и предупредить возможные рецидивы.
Проводится также дифференциальная диагностика, исключающая все возможные варианты болезней и помогающая поставить правильный диагноз.
Лечение
Для лечения ОЛЛ используется химиотерапия. Выделяют регионарную, комбинированную и интратекальную химиотерапии.

Проведение процедуры химиотерапии
При регионарной химиотерапии вещество препарата вводится во внутренние органы. Комбинированная терапия предполагает введение нескольких противораковых препаратов. При интратекальной терапии препараты вводятся прямо в позвоночник, при наличии опухоли в спинном мозге. При этом пациент дополнительно лечится с помощью внутримышечных инъекций.
Химическая терапия имеет 3 этапа:
- Этап индукции характеризуется введением в организм вещества с целью достичь первой ремиссии. На этапе индукции происходит разрушение раковых клеток. Длительность лечения составляет 2 недели.
- На этапе консолидации уничтожается оставшаяся часть клеток. Для этой цели препараты вводятся через вену.
- Этап реиндукции длится несколько лет для поддержки ремиссии и исключения вероятности рецидивов. Во время поддерживающей терапии применяются антибиотики.
Переносимость химиотерапии носит личностный характер. Применение противоопухолевых препаратов имеет достаточно тяжелые последствия для организма. Это связано с активным распадом злокачественных клеток, которые приводят к образованию большого количества продуктов обмена, что вызывает интоксикацию организма. Также из-за низкого содержания лейкоцитов в крови высока вероятность заражения инфекциями. Поэтому важно соблюдать принципы ухода за пациентами в клиниках: полная изоляция, частые влажные уборки в палате, использование стерильной одежды медперсонала.
Если по истечению 33 дней терапии не наступает улучшений либо происходят ранние рецидивы, пациенту назначается пересадка костного мозга.

Внутренняя и внешняя лучевая терапия используются при распространении опухоли в спинном мозге. Применяется в виде излучения радиации в области опухолевого образования или введения специального вещества в ткань опухоли.
Лечить острый лимфолейкоз у детей и взрослых наиболее эффективно в зарубежных странах. В благоприятном исходе лечения способна помочь клиника в Израиле. Медики страны применяют в своей практике высококачественные препараты и современные технологии.
Прогноз жизни
Хронический лимфолейкоз – заболевание, не поддающееся лечению, но имеющее удовлетворительный прогноз. Агрессивное течение болезни с возможным летальным исходом составляет 15%. В других случаях продолжительность жизни составляет 15-20 лет с момента заболевания. Пациент может жить полноценной жизнью, выполняя при этом клинические рекомендации – систематически обследоваться, соблюдать здоровый образ жизни, наладить питание и исключить алкоголь. Обязательным условием является постоянная диета.
Острый лимфолейкоз имеет большую вероятность неблагоприятных прогнозов. По статистике, дети лучше поддаются лечению. У 70% детей после лечения наступает 5-летний период ремиссии. Взрослые поддаются ремиссии в 40-45% случаев. Детям с диагнозом возможно оформить инвалидность и получать денежное пособие.
Если своевременно начать лечить заболевание у детей, есть вероятность полного выздоровления. Для взрослых вероятность подобного исхода достаточно низкая.
onko.guru
Как лечить хронический лимфоцитарный лейкоз
Хронический лимфоцитарный лейкоз – это размножение перерождаются лимфоцитов при одновременном увеличении размеров лимфатических узлов. Такой недуг, как лимфоидный лейкоз имеет разные формы, которые зависят от видов лимфоцитов, прошедших фазу перерождения в злокачественные образования.

Какие существуют виды этого недуга
Наиболее широко распространена такая форма ХЛЛ, как В – лимфоцитарный лейкоз. Она составляет около 75% всех случаев появления этого заболевания.
Другой вид подобного поражения носит название Т – лимфоцитарного лейкоза. Она встречается в медицинской практике гораздо реже, чем В – клеточная форма.
Есть и другие типы лейкозов, например, синдром Сезари и волосковоклеточний вид поражения. Первый из них является лейкемической стадией грибовидной микоза, а второй – очень редкий недуг, при котором появляются перерождение лейкоциты в больших количествах, имеют хорошо видимые в микроскоп специфические отростки.
Еще один вид этой болезни – лимфобластный лейкоз. Он возникает в костном мозге, его еще называют «раком крови». При нем растет производство аномальных недозрелых кровяных клеток, что нарушает нормальное воспроизводство крови. Образуются так называемые бластные клетки, которые размножаются в костном мозге и мешают нормальной выработке кровяных тел. При этом злокачественные бластные клетки могут накапливаться в лимфатических узлах, что вызывает резкое увеличение их размеров.
Вернуться к змистуЗагальни симптомы при хроническом лимфолейкозе
На первых этапах развития заболевания нет никаких других признаков, если не брать во внимание увеличение лимфатических узлов. Во время ранней стадии Т – лейкоза может появиться на кожном покрове человека сыпь, что имеет необычную форму. Такой же процесс наблюдается и при синдроме Сезари. По мере развития болезни на коже проявляется бледность, а под ее основным слоем видны кровоизлияния. После этого, на более позднем этапе, к основному поражению могут добавиться вирусные, бактериальные, грибковые инфекции. Основная симптоматика заболевания при различных ее формах такая:
Человек обязательно должен обратиться в медицинское учреждение, если заметил у себя такие признаки недуга.
Вернуться к змистуПричини возникновения заболевания
На начальном этапе количество клеток перерождаются растет и локализуется в лимфатических узлах больного. Затем лимфоциты проникают в селезенку и печень, что приводит к резкому увеличению их размеров. После этого перерождения лимфоциты вторгаются в костный мозг, где выгоняют нормальные кровяные клетки, что способствует развитию анемии.
Картина крови при этом резко меняется – в ней снижается количество здоровых тромбоцитов и лейкоцитов. Антитела (белки, которые защищают организм от болезнетворных структур) теряют свою активность, их число резко уменьшается.
Иммунная система больного человека в таком случае начинает бороться не с чужеродными телами, а разрушает нормальные ткани организма пациента. Такая деятельность системы иммунитета приводит к гибели эритроцитов и тромбоцитов, что вызывает воспалительный процесс на кровеносных сосудах. При этом могут пострадать и суставы организма больного развивается ревматоидный артрит. Поражается и щитовидная железа – появляются признаки тиреоидита.
Вернуться к змистуДиагностика болезни различными методами
Иногда болезнь обнаруживают абсолютно случайно. Это происходит при общем анализе крови, который предназначается для выявления совсем другого заболевания. При этом зачастую обнаруживается повышенное число лимфоцитов. Обычно эта цифра равна 1200-3000 клеточных структур на 1 мкл, а при болезни она может превысить 5000.
Если это случилось, то больного отправляют на биопсию костного мозга. Если это метод показал, что у человека увеличена в этом органе количество лейкоцитов, то ставится диагноз хронического лейкоза. Анализ крови показывает при этом наличие анемии, падение уровней тромбоцитов и антител. Для постановки точного диагноза применяют такие способы диагностики недуга:
После постановки точного диагноза врачи рекомендуют больному начать лечебный курс.
Вернуться к змистуЛикування хронического лейкоза
Прогресс в основном форм этой болезни идет сравнительно медленно. Возможности выздоровления больного человека завися от степени развития заболевания. Чтобы определить стадию, на которой находится болезнь, основываются на таких данных, как: число лимфоцитов в костном мозге и крови, размеры печени и селезенки, появление признаков анемии, количество тромбоцитов.
Больные В – клеточным лейкозом чаще всего живут 15-20 лет после постановки первого диагноза, им обычно не требуется никакого лечения. Это в том случае, если у них не оказалась анемия. При наличии этого фактора прогноз ухудшается. Смерть больного чаще всего наступает при прекращении функционирования костного мозга, уже не способного продуцировать необходимое количество здоровых клеток, которые поставляют различным органам кислород.
При этом происходит такое снижение иммунитета, при котором организм не может побороть различные инфекции, даже остановить кровотечение. Если у пациента определено Т – лейкоз, то прогноз выглядит значительно хуже.
Так как при хроническом лейкозе подавляется защитная система человека, то наиболее вероятно развитие поражения – это появление других болезней онкологического характера. Поскольку основное заболевание (лейкоз) развивается очень медленно, то многие больные практически не нуждаются в лечении в течение нескольких лет. Это продолжается до тех пор, пока в них не начинают увеличиваться лимфатические узлы, а в крови не возрастает количество лимфоцитов при снижении числа эритроцитов и тромбоцитов.
Основными методами лечения при хроническом лейкозе является:
Анемию у таких больных лечат инъекциями эритропоэтина и с помощью переливания так называемой эритроцитарной массы. Если снизилось количество тромбоцитов, то назначают переливание крови. При поражениях различными патогенными инфекциями врачи выписывают больному антибиотики.
Если человек испытывает дискомфорт от увеличения в размерах печени, селезенки и лимфатических узлов, то ему рекомендуют лучевую терапию.
Есть некоторые типы лекарств, которыми медики предлагают лечить лейкоз. Но они только снимают некоторые признаки болезни, не излечивают от недуга, не могут продлить пациенту жизнь. Однако они обладают многими побочными эффектами, которые могут нанести больному непоправимый вред.
При значительном увеличении количества лимфоцитов врачи могут рекомендовать пациенту применить противоопухолевые препараты. Иногда их используют совместно с кортикостероидами, которые являются медикаментами гормонального происхождения. Часто прием “Преднизолона” и подобных ему средств может резко улучшить состояние больного, у которого лейкоз зашел достаточно далеко. Но не стоит обольщаться – действие лекарства кратковременно, а такие кортикостероиды, как “Преднизолон”, имеют при длительном использовании много побочных эффектов. Это может привести к поражению тяжелыми инфекциями.
В – клеточный лейкоз излечивается алкирующими препаратами, которые ликвидируют перерождение клетки. Этого они достигают, проникая в ДНК злокачественных клеточных структур. Если надо лечить волосковоклеточний лейкоз, то врачи выписывают больным очень эффективные лекарства – “Альфа интерферон”.
Лимфобластный лейкоз можно вылечить несколькими методами. Для этого всех больных разделяют на группы риска. Затем для каждой категории назначается один из ниже перечисленных методов терапии:
При появлении симптоматики болезни не надо пытаться заниматься самолечением – это к добру не приведет. Лучше всего сразу обратиться в соответствующее медицинское учреждение и пройти полное обследование.
Чем раньше будет поставлен точный диагноз, тем больше шансов у больного, что он проживет 15-20 (может и больше) лет.
ok-doctor.xyz
Хронический лимфолейкоз — анализы крови, продолжительность жизни, лечение
Хронический лимфоцитарный лейкоз — одно из самых распространённых онкогематологических заболеваний, на долю которого приходится треть всех лейкозов. Болеют, как правило, люди старше 60 лет, мужчины — в 2-3- раза чаще женщин. Часто используется аббревиатура — ХЛЛ.Причина болезни до сих пор неизвестна. Основной теорией считается (т.е. неясно вообще ничего) генетическая.
При хроническом лимфолейкозе в костном мозге вырабатываются зрелые, но ненормальные лимфоциты. Атипичные клетки (в 2-5% случаев — Т-лимфоциты, в остальных — В-лимфоциты) постепенно скапливаются в костном мозге, вытесняя клетки других ростков крови, а затем попадают в другие органы.
Узнать точные ценыЛучшие клиники Израиля по лечению рака
Симптомы хронического лимфолейкоза
Опухолевый процесс развивается очень медленно. Чаще всего заболевание выявляют случайно при сдаче планового анализа крови. Его симптомы похожи на симптомы других опухолей крови:
- слабость;
- похудение;
- потливость;
- увеличение лимфузлов в области шеи, подмышек, паха;
- боль или чувство распирания в животе при увеличении селезенки.
На поздних стадиях болезни возникает анемия и тромбоцитопения. Клинически они проявляются:
- одышкой;
- повышенной утомляемостью;
- повышенной кровоточивостью слизистых;
- образованием на коже синяков.
При лимфолейкозе у больных резко снижается сопротивляемость инфекции. Они часто страдают опоясывающим лишаем, воспалением легких, даже укусы комаров могут вызвать тяжелую интоксикацию. Инфекционный процесс может стать причиной смерти пациента.
К другим тяжелым осложнениям болезни относятся саркомный рост лимфузла (он приобретает каменистую плотность, сдавливает соседние ткани и прорастает в них, вызывая боль) и почечная недостаточность (внезапное прекращение мочевыделения).
Ведущие израильские онкологи
Диагностика лимфолейкоза — анализы крови, другие методы
В норме содержание лимфоцитов составляет 19-39% от всех лейкоцитов. Если их количество возрастает до 40% и более, можно заподозрить наличие хронического лимфолейкоза.
80-90% лимфоцитов говорит о практически полном замещении атипичными клетками костного мозга.
Характерный признак заболевания – т.н. «тени Гумпрехта» в мазке крови, представляющие собой полуразрушенные ядра лимфоцитов.
Чтобы подтвердить диагноз, проводятся следующие исследования:
- костномозговая пункция;
- клеточное иммунофенотипирование;
- биопсия пораженного лимфузла;
- определение уровня иммуноглобулинов;
- определение уровня бета2-микроглобулина.
Лечение хронической формы лимфолейкоза
На ранней стадии хронического лимфолейкоза лечение не проводится. У большинства людей он протекает так медленно, что они могут долго обходиться без медицинского вмешательства, нормально себя чувствуя. Не бегите «впереди паровоза» — можно навредить себе.
Тактика лечения зависит от стадии лимфолейкоза:
- А — увеличены одна-две группы лимфузлов, тромбоцитопении и анемии нет;
- В – увеличены 3 или более групп лимфузлов, тромбоцитопении и анемии нет;
- С – есть анемия или тромбоцитопения, независимо от числа увеличенных лимфузлов.
Лечение начинают при признаках прогрессирования процесса:
- быстром нарастании в крови числа лимфоцитов;
- прогрессирующем увеличении лимфузлов;
- выраженном увеличении селезенки;
- нарастании тромбоцитопении и анемии;
- появлении признаков опухолевой интоксикации.
Какие методы лечения показаны при хроническом лимфолейкозе?
Рассчитать стоимость леченияПрогноз для хронического лимфолейкоза
Хронический лимфолейкоз считается неизлечимым заболеванием. Неблагоприятными в плане прогноза являются анемия и тромбоцитопения, двукратное увеличение лимфоцитов в крови меньше чем за год, повышение бета2-микроглобулина. При появлении осложнений прогноз значительно ухудшается.
Продолжительность жизни пациентов колеблется в широких пределах — от 10-12 лет в стадии А до 1-2 лет в стадии С.
Вывод: если у Вас случайно обнаружили хронический лимфолейкоз, желательно вести «умеренно-здоровый» образ жизни без существенных физических нагрузок — есть шанс «пережить» заболевание.
onkolog-light.ru
