список препаратов, инструкция по использованию
Международная система классификации препаратов лекарственного происхождения делит все медикаменты на группы. Основой для этого является фармакологическое действие веществ. Представленная статья расскажет вам об одной из таких групп. В нее входят ингибиторы нейраминидазы. Вы узнаете, какие действующие вещества являются их основой, а также ознакомитесь с их торговыми наименованиями.
Ингибиторы нейраминидазы
Перед тем как говорить о препаратах, необходимо дать характеристику данной фармакологической группе. Нейраминидаза – это своеобразный фермент. Он присутствует на поверхности мембраны всех вирусов гриппа. После контакта с клеткой человеческого организма происходит выделение токсичных веществ. Именно они и вызывают появление симптомов болезни: повышение температуры, слабость, головную боль и так далее.
Ингибиторы нейраминидазы проникают внутрь вируса. Они подавляют активность патогенных микроорганизмов, предотвращая их последующее размножение и контакт со здоровыми клетками. Разработка таких препаратов началась еще в 1960-х годах. Первые произведенные средства позволили детально изучить их воздействие на вирусные инфекции.

Ингибиторы нейраминидазы: препараты и их действующие компоненты
Современная фармакология предлагает приобрести два основных препарата, которые могут характеризоваться подобным действием. Их торговые наименования «Тамифлю» и «Реленза». Оба средства применяются для профилактики и лечения гриппа разных штаммов. Продаются ингибиторы нейраминидазы только по назначению врача. Также допускается использование медикаментов в условиях стационара по показаниям. Не рекомендуется принимать такие лекарства беременным женщинам и кормящим матерям. Противопоказанием к применению будет детский возраст до 5 лет. Почечная и печеночная недостаточность является поводом для отдельной консультации перед использованием.
Действующие вещества указанных препаратов отличаются названием и способом приема. Лекарство «Тамифлю» содержит в своем составе осельтамивир. Медикамент выпускается в виде капсул с сыпучим содержимым для внутреннего употребления. Препарат «Реленза» — это ингаляционное средство. Действующим компонентом является занамивир.
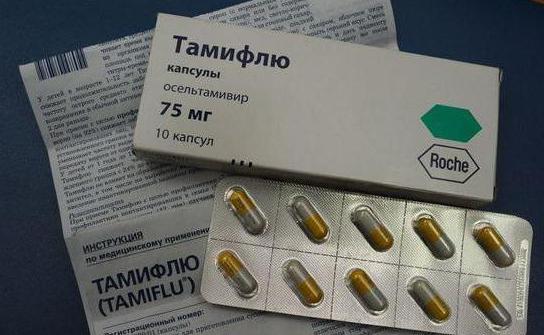
Способ применения препаратов
Каким способом используются ингибиторы нейраминидазы (гриппа)? Вы уже знаете, что оба медикамента прописываются врачом. Для приобретения препаратов вам потребуется соответствующий рецепт. Поэтому дозировку и продолжительность применения обычно выбирает специалист. Но в инструкции также имеется информация по этому поводу:
- Препарат «Тамифлю» у взрослых пациентов и детей после 12 лет используется дважды в сутки по одной таблетке. Продолжительность курса составляет 5 дней. Для малышей до 12 лет предпочтительно использовать суспензию в количестве 30-75 мг осельтамивира (в зависимости от массы тела) дважды в сутки.
- Лекарство «Реленза» поставляется ингаляционно. Инструкция рекомендует использовать 10 мг вещества (2 ингаляции) дважды в день. Продолжается терапия 5 суток. Для профилактики используется 10 мг препарата один раз в сутки на протяжении 10 дней.

Эффективность и побочные реакции
Специалисты говорят, что ингибиторы нейраминидазы вирусов гриппа будут тем эффективнее, чем раньше начато лечение. Поэтому нужно при первых же симптомах обращаться к врачу. Доктор назначит вам необходимые исследования, которые помогут определить дальнейшую тактику действий. Оба препарата эффективны в борьбе с вирусами гриппа (в том числе и мутировавшими). В отличие от других противовирусных средств, ингибиторы нейраминидазы показывают высокую работоспособность. Уже через несколько часов после первого применения пациенту становится легче.
Важно, что «Реленза» и «Тамифлю» могут совмещаться с другими препаратами для лечения гриппа, его симптомов и осложнений. Кстати, лекарства имеют и побочные эффекты. Например, ингалятор «Реленза» может вызвать одышку и бронхоспазмы. Редко возникает аллергия в виде отека. Средство «Тамифлю» принимается внутрь. Поэтому оно имеет больше негативных последствий: боль в животе, аллергия, обострение почечных и печеночных заболеваний, психоневрологические нарушения.
Подведем итоги
Ингибиторы нейраминидазы являются отличным средством в борьбе с вирусами гриппа. В период эпидемий они могут приниматься с целью профилактики. Но специалисты не рекомендуют использовать указанные медикаменты без особой нужды. К тому же вы не можете приобрести лекарства по собственному желанию. Если фармацевт вам предлагает купить препарат «Тамифлю» или «Реленза» без рецепта, то знайте, что он может быть поддельным. Применение таких медикаментов не только ухудшает течение болезни, но может оказаться опасным для жизни. Будьте здоровы!
fb.ru
противовирусное действие и механизмы резистентности — PubMed сайт на русском
Influenza neuraminidase inhibitors: antiviral action and mechanisms of resistanceИсточник: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4942987/
Просим ссылаться на эту статью: McKimm-Breschkin (2012) Ингибиторы нейраминидазы гриппа: противовирусное действие и механизмы резистентности. Грипп и другие респираторные вирусы 7 (Suppl.1), 25-36.
Существуют два основных класса противовирусных препаратов, доступных для лечения и профилактики гриппа, ингибиторов М2 и ингибиторов нейраминидазы (NAIs). Ингибиторы M2 дешевы, но они эффективны только против вирусов гриппа A, и сопротивление возникает быстро. Нынешние вирусы гриппа A h4N2 и pandemic A (h2N1) pdm09 уже устойчивы к ингибиторам M2, как и многие вирусы H5N1. В некоторых частях мира лицензированы четыре NAI, занамивир, озелтамивир, перимивир и NAI, ланинамивир длительного действия. В этом обзоре основное внимание уделяется сопротивлению NAI. Из-за различий в их химии и тонких различиях в структурах NA сопротивление может быть как NAI, так и специфичным подтипом. Это приводит к различным профилям лекарственной устойчивости, например, мутация h374Y придает устойчивость к озельтамивиру и перимивиру, но не к занамивиру и только в N1 NA. Мутации в E119, D198, I222, R292 и N294 также могут снизить чувствительность NAI. Зимой 2007-2008 гг. В северном полушарии появился осельтамивир-устойчивый штамм сезонного гриппа A (h2N1) с мутацией h374Y и быстро распространился по всему миру. В отличие от более ранних доказательств того, что такие устойчивые вирусы непригодны, этот мутантный вирус оставался полностью трансмиссивным и патогенным и стал основным сезонным вирусом A (h2N1) глобально в течение года. Этот резистентный вирус A (h2N1) был замещен чувствительным вирусом A (h2N1) pdm09. Приблизительно 0 · 5-1 · 0% изолятов сообщества A (h2N1) pdm09 в настоящее время устойчивы к озельтамивиру. Теперь очевидно, что вариабельность аминокислот неактивного сайта может влиять на пригодность фермента и компенсировать мутации, которые придают устойчивость к осельтамивиру высокого уровня, что приводит к минимальному влиянию на ферментную функцию.
Вирионы гриппа имеют три поверхностных белка, гемагглютинин (НА), нейраминидазу (NA) и белок M2. HA связывается с терминальными сиаловыми кислотами на клеточных рецепторах, после чего вирус эндоцитоз. Низкий pH (5 · 5-6 · 0) эндосомы активирует протонный канал M2 в мембране вируса гриппа A, чтобы кислота попала в вирус до HA-опосредованного слияния, вызывая высвобождение вируса рибонуклеопротеина (RNP ). После репликации NA вирионов потомства расщепляет сиаловые кислоты из клеточных рецепторов и из HA и NA, которые также гликозилированы, чтобы высвободить вирионы потомства с поверхности клетки и предотвратить самоагрегацию. Существует два основных класса противовирусных препаратов, лицензированных для лечения и профилактики гриппа, ингибиторов M2 и ингибиторов NA (NAI). Блокируя протонный канал M2, ингибиторы M2 предотвращают высвобождение вируса RNP для миграции в ядро клетки. Ингибиторы NA (NAI) предотвращают высвобождение вновь образованных вирионов с поверхности клетки.
Ингибиторы M2, амантадин и римантадин действуют только на вирусы гриппа A. Хотя вирусы гриппа B имеют белок BM2, который аналогичен белку M2 при гриппе A, он не чувствителен к ингибиторам M2. Ингибиторы M2 имеют два потенциальных участка связывания на белке M2: сайт с высоким сродством в порах ионного канала и второй сайт с низкой аффинностью на липидной поверхности поры.
1
Две наиболее распространенные мутации V27A и S31N находятся в порах ионного канала, подтверждая это как фармакологически релевантный сайт.
Однако, несмотря на то, что ингибиторы M2 являются дешевыми и находятся около 50 лет,
2
их использование для лечения гриппа было ограничено, отчасти потому, что устойчивые вирусы быстро появляются у леченных пациентов и в одном проходе в тканевой культуре.
Вирус pdm09 пандемии A (h2N1) был уже устойчивым
4
, и большинство сезонных вирусов A (h4N2) были устойчивыми с середины 2000-х годов, а также наблюдалось увеличение сезонных сезонных вирусов h2N1, вызванных озельтамивиром.
5
,
6
Многие из штаммов H5N1, циркулирующих в Юго-Восточной Азии, особенно во Вьетнаме и Таиланде, также устойчивы к ингибиторам M2.
7
,
8
Из-за сопротивления полезность этих препаратов в настоящее время ограничена. Поэтому в этом обзоре основное внимание уделяется недавно разработанным NAI.
В настоящее время существует два лицензированных NAI для лечения и профилактики гриппа. Реленца (занамивир) была первой в этом классе
а затем Тамифлю (озелтамивир).
10
Занамивир был разработан на основе двух основных результатов. Во-первых, известно, что аналог переходного состояния 2,3-дегидро-2-дезокси-N-ацетилнейраминовой кислоты (DANA) является слабым ингибитором NA. Во-вторых, структура субстрата сиаловой кислоты в комплексе с активным сайтом фермента выявила пустой отрицательно заряженный карман в области С4 на сахарном кольце. Это говорит о том, что замещение C4-OH более крупным основным остатком может привести к более высокоаффинному связыванию.
11
Отдельная замена C4-OH группой с 4-гуанидиновым связыванием более чем в 10 000 раз по сравнению с DANA (рисунок 1). Занамивир вводится пероральной ингаляцией, поскольку он не абсорбируется. Затем Озелтамивир был разработан на основе знаний из занамивира. На основе DANA он имеет циклогексеновое кольцо с двумя заменами по сравнению с DANA. Он имеет C4-аминогруппу и объемную гидрофобную пентильную эфирную боковую цепь вместо боковой цепи глицерина. Его вводят в виде пролекарства оселтамивир фосфата и превращают печеночными эстеразами в карбоксилат активного соединения осельтамивир.
Химические структуры ингибиторов нейраминидазы (A) DANA, (B) занамивир, (C) озелтамивир карбоксилат, (D) перимивир и (E) ланинамивир. Структуры ориентированы на демонстрацию различий по сравнению с DANA — группой C4-гуанидиния на занамивир, перомивир и ланинамивир, C4-аминогруппу на озелтамивире и пентильные боковые цепи на озельтамивире и перимивире.
Впоследствии Перамивир был разработан
12
и в настоящее время лицензируется в Японии и для экстренного использования в некоторых других странах при проведении дальнейших клинических испытаний. Он основан на DANA, но имеет циклопентановое кольцо и особенности как занамивира, так и осельтамивира, замещения C4-гуанидино и гидрофобной боковой цепи, соответственно. Он эффективен только при внутривенном введении. Четвертое соединение, ланинамивир (инавир), основанный на занамивире с замещением 7-OCh4, представляет собой NAI длительного действия
13
NAI предотвращают выброс и распространение вирионов потомства, блокируя функцию NA. Чувствительность фермента NA к NAI оценивают в анализе ингибирования фермента in vitro, используя либо флуоресцентный
14
или хемилюминесцентный субстрат.
15
IC50 определяется как концентрация, ингибирующая 50% активности фермента по сравнению с неингибированным контролем. Снижение чувствительности из-за мутации в NA идентифицируется повышенным IC50.
16
,
17
Чувствительность варьируется в разных лабораториях из-за тонких различий в методологии анализа, но в целом вирусы гриппа A (h4N2) несколько более чувствительны к озельтамивиру, чем вирусы подтипа N1. И наоборот, вирусы подтипа N1 немного чувствительны к занамивиру, чем к вирусам подтипа N2. IC50 обычно составляют
Озелтамивир принимается перорально два раза в день с дозой 75 мг для взрослых. Уровни озельтамивира в плазме оцениваются в диапазоне от 400 до 1200 нм
19
,
20
и в слюне
Дозировка Занамивира составляет 10 мг вдыхаемого два раза в день, обеспечивая высокий уровень в верхних дыхательных путях, по оценкам, до 10 000 нм.
22
,
23
Это будет в 5000 раз выше, чем средний IC50 для вирусов гриппа A.
В ранних исследованиях резистентность к озельтамивиру проявлялась как в исследованиях по поводу заражения, так и в естественно приобретенных инфекциях, с устойчивым вирусом, выделенным от 1 до 4% пациентов, получавших осельтамивир.
,
25
,
26
Впоследствии устойчивые вирусы были выделены у пациентов после лечения или профилактики осельтамивиром или без видимой истории воздействия препарата. Из-за различий в химических структурах ингибиторов многие из мутаций не придают пониженной чувствительности ко всем NAI. Кроме того, несмотря на высокую сохранность остатков в активном участке, существуют мутации, которые придают устойчивость только одному подтипу, например h374Y (h375Y в нумерации N1), обеспечивают устойчивость к осельтамивиру только в N1, E119V и R292K, придают устойчивость к осельтамивиру высокого уровня только в N2. (Примечание. Существуют тонкие различия в длинах последовательностей различных NA, однако традиционно нумерация NA основана на выравнивании с N2 NA, который используется повсюду, если не указано иное.) Хотя устойчивый вирус гриппа B с мутацией R152K предоставление сниженной чувствительности ко всем NAIs было выделено у детей с ослабленным иммунитетом на терапию занамивиром,
резистентный вирус еще не изолирован от иммунокомпетентного пациента, получавшего занамивир.
В ранних исследованиях устойчивые вирусы могли быть выделены от 4 до 8% педиатрических пациентов, озельтамивир, возможно, из-за длительного проливания вируса у детей.
,
28
Тем не менее, три исследования после освидетельствования детей, оседтамивир, показали гораздо более высокие частоты резистентных вирусов. Первые два исследования были проведены в Японии, где для детей использовалось взвешивание по весу 2 мг / кг осельтамивира. В одном исследовании, в котором вирусы были в основном h2N1, озельтамивир-резистентные вирусы h374Y были выделены из 7 из 43 детей (16%).
29
Мутация h374Y снижает чувствительность как к осельтамивиру, так и к периомивиру, но не к занамивиру. Во втором исследовании, преимущественно вирусы h4N2, резистентные вирусы с мутациями E119V (2), R292K (6) или N294S (1) были выделены из 9 из 50 детей (18%).
30
Первые две мутации были клинически обнаружены только в вирусах подтипа N2, при этом E119V и N294S придают сниженную чувствительность к озельтамивиру. Мутация N294S также наблюдалась в подтипе N1 (N295S в нумерации N1), что давало умеренное снижение чувствительности занамивира, но большее снижение чувствительности озелтамивира.
31
,
32
Имелись опасения, что применяемая в Японии дозировка на основе веса обеспечивала субоптимальные концентрации осельтамивира, способствуя выбору устойчивых вирусов. Следовательно, другое исследование было проведено в Соединенном Королевстве, в котором использовалось многоуровневое дозирование осельтамивира на основе веса.
33
Несмотря на небольшое количество пациентов, наблюдалась значительная резистентность. Три из 11 пациентов (27%), инфицированных вирусами h2N1, пролили h374Y-резистентный вирус, и один из 34 пациентов (3%), инфицированных вирусами h4N2, пролил R292K-резистентный вирус. Ни у одного из 19 пациентов, инфицированных вирусом гриппа B, не было стойкого вируса.
Из-за опасений относительно высокого уровня сопротивления осельтамивиру, наблюдаемого в японских детях, в Японии было проведено 3-летнее исследование для наблюдения за появлением резистентного вируса после терапии занамивиром. В общей сложности 273 ребенка были зачислены в течение трех сезонов гриппа с 2006 по 2009 год.
34
Все дети, обучающиеся, были
Ранние результаты показали, что мутации в НС, которые способствовали снижению чувствительности НАИ, также влияли на функцию НС, так что устойчивые вирусы были скомпрометированы в их пригодности и вряд ли были переданы.
35
,
36
Однако в конце 2007 года в Норвегии были выделены несколько сезонных вирусов h2N1 с мутацией h374Y. В Норвегии было минимальное использование осельтамивира, и ни у одного из пациентов не было истории воздействия препарата. Последующее тестирование показало, что 183 из 272 изолятов (67%) имеют эту мутацию. Этот вирус был явно пригоден, а в Северной Америке, Европе и Азии были обнаружены трансмиссивные и в течение недели устойчивые вирусы.
37
,
38
,
39
Устойчивые вирусы продолжали распространяться в южном полушарии,
40
в конечном счете вытесняя чувствительный вирус. Более 90% изолятов h2N1 были устойчивы к 2008-2009 годам, а IC50 — к флуоресцентному анализу в целом в диапазоне 500-1000 нм. По-видимому, эволюционировали разрешительные мутации, которые позволили NA переносить мутацию h374Y, поддерживая пригодность фермента.
41
,
42
,
43
,
44
Подстановки включают R193G, R221Q, V233M и D343N (R194G, R222Q, V234M и D344N в нумерации N1). В то время как h374Y является первичной мутацией, наблюдаемой в N1-вирусах, сезонный вирус h2N1 с мутацией I222V, снижающий восприимчивость к озельтамивиру, также был обнаружен при наблюдении за изолятами сообщества от необработанных пациентов.
45
Внезапное появление и распространение вируса гриппа свиней из Мексики привело к смещению осельтамивир-резистентного сезонного вируса h2N1 новым вирусом A (h2N1) pdm09. Однако, учитывая осознание устойчивости озелтамивира, проводился гораздо более тщательный мониторинг, как фенотипическим тестированием с помощью анализа фермента и секвенирования. Вирусы с мутацией h374Y были обнаружены у пациентов после лечения или профилактики осельтамивиром или перимивиром
46
,
47
,
48
а также у нелеченных пациентов. Сопротивление было обнаружено уже через 48 часов после лечения.
46
Одним из самых ранних сообщений о сопротивлении были летние туристы в США, проходящие профилактику осельтамивира. Устойчивый вирус был изолирован от второго пациента через несколько дней после контакта с первым. В дополнение к мутации h374Y оба вируса имели общую мутацию I222V (I223V в N1-нумерации), что указывало на возможное распространение человека и человека.
49
Другой случай был сообщен после профилактики семейного контакта инфицированного пациента.
50
Поскольку доза осельтамивира для профилактики составляет лишь половину, что для терапии (75 мг один раз в день), введение субтерапевтических доз, когда вирусная репликация уже началась, может увеличить выбор резистентного вируса A (h2N1) pdm09.
Существует множество сообщений о появлении устойчивых вирусов среди пациентов с ослабленным иммунитетом, проходящих лечение осельтамивиром или профилактики, что не является неожиданным из-за более длительных периодов терапии.
51
,
52
,
53
,
54
,
55
Имеются также сообщения о передаче устойчивых вирусов в госпитализированных условиях среди пациентов с ослабленным иммунитетом.
56
,
57
Больше озабоченностью является изоляция и передача вирусов в сообществе среди пациентов без истории употребления наркотиков. Путешественник из США, идентифицированный как лихорадочный при въезде в Гонконг, был одним из первых пациентов, из которых был выделен резистентный вирус без какого-либо известного воздействия осельтамивира.
58
В образце носоглотки содержалась смесь вирусов типа 47 (47%) и h374Y (53%). После культивирования в клетках MDCK образец содержал 98% h374Y-вирус. Следовательно, мутация не нарушала репликацию in vitro. h374Y-устойчивый вирус был также обнаружен у 7 из 10 необработанных студентов, путешествующих на поезде во Вьетнаме.
59
Совсем недавно в Австралии был обнаружен общинный кластер из 29 пациентов, инфицированных вирусом h374Y, 28 из которых не имели никакого известного лекарственного воздействия,
60
таким образом демонстрируя пригодность и способность к передаче вируса h374Y A (h2N1) pdm09. Существуют различные отчеты об оценке пригодности резистентных вирусов A (h2N1) pdm09 in vitro и моделей на животных. Некоторые сообщают о компромиссе в фитнесе,
61
,
62
в то время как другие демонстрируют снижение работоспособности.
63
,
64
В дополнение к раннему отчету о мутации I222V (I223V в нумерации N1)
49
Сообщалось о мутациях I222R. Варианты I222R возникали у двух пациентов с ослабленным иммунитетом, один из которых последовательно обрабатывался осельтамивиром, чем занамивир, а второй обработан осельтамивиром.
65
,
66
Один вирус имел как мутации I222R, так и h374Y. Существует также недавний отчет об изоляции варианта I222R от третьего пациента без истории воздействия препарата.
67
Единственная мутация I222R давала пониженную чувствительность к озельтамивиру, занамивиру и перимивиру с 45-, 10- и 7-кратным сокращениями соответственно по чувствительности в анализе ингибирования фермента NA.
66
Двойная мутация I222R / h374Y дополнительно увеличивала IC50 на 10-90 раз по сравнению с той, что из-за только мутации h374Y до примерно 10 000 нм как для осельтамивира, так и для peramivir. Хотя эта двойная мутация также уменьшала чувствительность к занамивиру в 10 раз по сравнению с одной мутацией h374Y, IC50 все еще составляла
ВОЗ поддерживала веб-сайт для регистрации количества устойчивых вирусов a (h2N1) pdm09, о которых сообщалось.
68
К октябрю 2011 года, после чего не было никаких дополнительных добавок, было зарегистрировано только 605 случаев осельтамивира в мире. Это явно недопредставлено истинное число случаев резистентного вируса, поскольку во многих странах сообщается о заболеваемости 0-5-1% изолятов, устойчивых к осельтамивиру, в их наблюдении за населением.
69
,
70
,
71
Это эквивалентно 5000-10 000 устойчивым вирусам на 1 миллион случаев инфекции. Как было подсчитано, в США было около 60 миллионов случаев,
72
в США может быть много тысяч случаев сопротивления осельтамивиру. Хотя данные ВОЗ вводят в заблуждение с точки зрения общего количества резистентных изолятов, сайт ВОЗ предоставил полезную статистику по истории болезни и об осельтамивиру. Из всех случаев 28% резистентных изолятов в 2009-2010 гг. Были от пациентов с ослабленным иммунитетом. Из 72% иммунокомпетентных пациентов 63% имели некоторое обследование осельтамивира, но у 37% не было ни одного случая контакта с наркотиками или лицами, получавшими лекарственные средства. В 2010-2011 гг. Наблюдалось увеличение частоты обнаружения резистентности в США от 0,5 до 1% изолятов, но дополнительно 74% пациентов не подвергались озельтамивиру против 11% в сезоне 2009-2010 гг. что указывает на большую передачу вируса, устойчивого к озельтамивиру, в сообществе.
71
В описанных выше педиатрических исследованиях выделены осельтамивир-резистентные вирусы h4N2, частота обнаружения резистентных вирусов h4N2 либо после воздействия лекарственного средства, либо среди зараженных сообществом инфекций остается низкой.
16
,
18
,
26
,
45
E119V и R292K были обнаружены двумя наиболее распространенными мутациями, о которых N294S также сообщалось в педиатрическом исследовании. Мутация E119V придает устойчивость только осельтамивиру с 20-100-кратным увеличением IC50 в зависимости от того, были ли они проверены в анализе ингибирования хемилюминесценции или флуоресцентного фермента соответственно.
16
,
17
,
18
,
73
,
74
,
75
Мутация R292K обеспечивает очень высокий уровень устойчивости к осельтамивиру, обычно в диапазоне мкм, промежуточную устойчивость к перимивиру и меньшее снижение чувствительности к занамивиру, обычно с IC50
Хотя вирусы гриппа B не вызывают пандемий, поскольку у них нет резервуара для животных, они часто вызывают значительную долю сезонного гриппа. Сообщается, что Озелтамивир имеет более низкую клиническую эффективность у детей, инфицированных гриппом В, по сравнению с гриппом А,
82
в соответствии с наблюдениями за более высокими IC50 в ферментных анализах.
16
,
17
,
18
,
45
Вирусы с мутациями, сообщающими резистентность к осельтамивиру, были обнаружены у 4,4% (1/74) педиатрических пациентов, получавших осельтамивир (G402S), но также у 7,72 (7/422) нелеченных пациентов. Мутации, обнаруженные в изолятах из этого исследования, и другие необработанные пациенты включают D198N, D198E, I222T и S250G (нумерация N2).
45
,
83
,
84
IC50 для NA с мутациями составляли 50 нм для занамивира и 250 нм для осельтамивира для G402S и D198N, 25 нм для занамивира и 450-500 нм для озелтамивира для I222T и 190 нм для занамивира и 50 нм (что эквивалентно дикому типу) для осельтамивира для мутации S250G. Инфекция этими резистентными изолятами могла быть получена путем контакта с обработанными контактами, но другие не знали контакта. Существует также недавний отчет о группе из 14 случаев вирусов гриппа B с мутацией I222V, снижающей восприимчивость как к осельтамивиру, так и к периомивиру.
85
Хотя частота резистентности к гриппу B низка, из обоих исследований в Японии и США видно, что устойчивые вирусы гриппа B подходят и передаются.
86
Как и сезонные и пандемические штаммы A (h2N1) pdm09, мутации h374Y наблюдались в изолятах H5N1 у инфицированных пациентов, получавших осельтамивир.
32
,
87
Один из этих пациентов содержал смешанную популяцию вируса дикого типа и вирусов с мутациями h374Y или N294S.
32
Мутация N294S также, по-видимому, возникла спонтанно в вирусах H5N1 в Египте
31
и дает снижение чувствительности озелтамивира в 57-138 раз.
Существуют опасения, что вирусы H5N1 еще могут вызвать пандемию; следовательно, эпиднадзор за птичьими вирусами был проведен с использованием молекулярных методов для идентификации известных мутаций, придающих устойчивость, а также фенотипического тестирования с помощью анализа ингибирования фермента. Каждый метод имеет свои преимущества и недостатки. Последовательность может обнаруживать смеси дикого типа и известных мутантных НС. Напротив, скрининг на изменение чувствительности фермента в анализе NAI выявит как известные, так и новые мутации; однако устойчивая популяция вирусов должна превышать население дикого типа, чтобы обнаружить сдвиг чувствительности.
17
Анализ последовательностей НС вирусов H5N1 выявил смешанные популяции вирусов дикого типа и h374Y в образцах от цыплят, уток и лебедей, а вирус с мутацией N294S был обнаружен уток.
88
Анализ ингибирования фермента показал, что вирусы clade 2 из Индонезии имеют естественную 15-30-кратную более низкую чувствительность к осельтамивиру in vitro по сравнению с вирусами clade 1 из вирусов Вьетнама и человека h2N1.
16
,
17
,
89
Мы предположили, что это можно объяснить различием h352Y между кладами 1 и кладами 2 NA.
89
Последующий мутагенез подтвердил, что Y252 действительно снижает чувствительность озелтамивира,
90
,
91
в то время как чувствительность занамивира не затрагивается. Показано, что снижение чувствительности осельтамивира in vitro соответствует снижению чувствительности в моделях на животных.
92
,
93
Несколько мутаций I222T / V / M также были идентифицированы в изолятах H5N1. В то время как мутации в I222 уменьшали чувствительность озелтамивира лишь в несколько раз в генах 1 вируса H5N1,
94
казалось бы, они действуют синергетически с h352Y в вирусах клады 2, потому что IC50s для мутантов I222V / T находились в диапазоне 40-70 нм и для мутанта I222M> 250 нм.
95
Скрининг 29 clade 2 · 3 · 2 изолятов из Республики Лаос идентифицировал три с пониженной чувствительностью NAI из-за различных мутаций. V116A уменьшал чувствительность к осельтамивиру в 18 раз и занамивиру в 10 раз, I222L способствовал 77-кратному снижению восприимчивости к озельтамивиру, а S246N уменьшал чувствительность к озельтамивиру в 24 раза.
96
Это подчеркивает важность постоянного наблюдения в популяции птиц.
Знания, полученные из структуры NA с сиаловой кислотой, связанной на активном участке, были использованы для конструирования занамивира.
11
Впоследствии мы использовали структурный анализ для понимания механизмов устойчивости к NAI. Первая структура устойчивой к озельтамивиру НС была опубликована в 1998 году, даже до введения препаратов в клиническую практику, и дала важные сведения о взаимосвязи между химической структурой ингибиторов и вероятностью возникновения резистентности.
97
Мы продемонстрировали, что высокоаффинное связывание озелтамивира требует переориентации E276 (E277 в нумерации N1), чтобы создать карман для размещения объемной гидрофобной боковой цепи (рис. 2). Мутация R292K предотвратила вращение E276, что привело к потере высокоаффинного связывания. Поэтому мы разработали нашу минималистскую гипотезу о разработке лекарств, поскольку чем ближе лиганд к естественному субстрату, тем менее вероятна резистентность. Занамивир имеет только одну разницу по сравнению с природным лигандом DANA и не нуждается в каких-либо структурных изменениях NA для связывания (рисунок 1). Следовательно, мутации, придающие резистентность к занамивиру, скорее всего, повлияют на связывание субстрата, что ухудшит пригодность NA. И наоборот, чем больше отличий от природного лиганда, тем больше потенциальных целей для сопротивления. Следовательно, мы предсказывали, что сопротивление, скорее всего, возникнет с озельтамивиром, как это было теперь видно. Перамивир имеет как C4-гуанидиногруппу, такую как занамивир, так и гидрофобную боковую цепь, такую как осельтамивир (фиг. 1). Мы показали структурно, что это также требует переориентации E276 (рис. 2).
77
Мы продемонстрировали структурные и функциональные исследования, что перекрестная резистентность к перимивиру может быть вызвана мутациями, придающими устойчивость к занамивиру или осельтамивиру.
77
Ланинамивир похож на занамивир, и, следовательно, ожидается, что резистентность к ланинамивиру также будет менее вероятной.
Структуры N9 NA со связанными ингибиторами (A, B) занамивир (PDB NNC), (C) осельтамивир (PDB QWK), (D) перимивир (PDB IL7F). Чтобы свести к минимуму переполненность, на каждой фигуре помечены только некоторые аминокислоты, которые влияют на связывание NAI. (B) слегка повернут из (A), чтобы показать Y252, расположенный за h374. Остаток 252 представляет собой Y в N9, но разность h352Y между кланами 1 и кланами 2 avian H5N1 NA уменьшает связывание озелтамивира. Стрелки показывают вращение E276 с образованием солевого моста к R224, создавая гидрофобный карман для размещения пентильных боковых цепей осельтамивира и перимивира.
Многие мутации, придающие уменьшенную чувствительность к озельтамивиру кластеру вокруг гидрофобного кармана, ухудшают вращение E276 (рис. 2). Структурный анализ мутантного h374Y NA подтвердил, что, как и наши предыдущие результаты R292K, это также предотвращает полное вращение E276.
90
Структура N1 NA из вируса H5N1 дикого типа также не показывала полного вращения E276.
98
Интересно, что хотя это была клада 1 NA, авторы мутировали h352 на Y252, что предотвращало полное вращение E276, что коррелировало с пониженной чувствительностью вирусов clade 2, у которых Y252.
89
В N1 NA мутация N294S ослабляет взаимодействие водородной связи Y344 с карбоксилатом, общим для сиаловой кислоты и всех NAI, что приводит к небольшому уменьшению связывания субстрата и занамивира.
44
S294 также образует водородную связь с карбоксилатом E276, нарушающим гидрофобный карман, в котором связывается боковая цепь осельтамивира, что приводит к дальнейшему уменьшению связывания осельтамивира.
Сообщения о I222 (I223 в нумерации N1), связанные с уменьшенной чувствительностью NAI, появляются чаще. В отличие от других мутаций, мутации I222 не являются специфическими по типу или подтипу и дают пониженную чувствительность к N1, N2 и B NA. Они возникли либо спонтанно, либо после озельтамивира. Мутации I222T наблюдались в Н,
45
,
83
,
99
I222V / M / T / R в N1,
45
,
49
,
65
,
66
,
67
,
94
и I222V в N2.
45
,
79
I222 расположен вблизи боковых цепей N-ацетила и глицерина занамивира или пентилоэфирной группы осельтамивира (фиг. 2). Он также находится вблизи R224, что важно при образовании солевой связи с E276, участвующей в образовании гидрофобного кармана для связывания осельтамивира. Мутации при I222 приводят к потере взаимодействия между боковой цепью I222 и пентилоэфирной группой осельтамивира, что оказывает большее влияние на связывание осельтамивира, чем с занамивиром.
E119 имеет решающее значение для взаимодействий либо с группой C4-гуанидинозанамивира, либо с перомивиром или с C4-аминогруппой осельтамивира. Мутанты E119G / A / D устойчивы только в лабораторных исследованиях.
94
,
100
,
101
,
102
В то время как E119A / D снижает чувствительность ко всем NAI, E119G обеспечивает высокоуровневое сопротивление только занамивиру и перимивиру.
77
Однако E119G также делает NA неустойчивым.
102
,
103
,
104
Напротив, вирусы с E119V / I были обнаружены как у пациентов, получавших осельтамивир, так и у пациентов без лечения, что указывает на то, что они пригодны и передаются. E119V обеспечивает устойчивость на высоком уровне только к осельтамивиру.
18
,
30
,
75
,
79
,
105
,
106
Мы показали структурно, что мутация E119G вызывает устойчивость к занамивиру из-за потери взаимодействий боковой цепи карбоксилата с группой C4-гуанидиния, а также изменений структуры растворителя, поскольку молекула воды занимает положение, ранее занимаемое карбоксилатная боковая цепь.
101
Сопротивление E119G-мутанту NA к peramivir не столь велико, как занамивир. Это может быть связано с тем, что занамивир имеет более сильное взаимодействие с E119 из-за образования слабой ионной водородной связи.
77
Структурная основа селективности E119V для озелтамивира еще не выяснена.
Наши структуры штаммов гриппа B и D198E дикого типа (D197 в Н-нумерации) предоставили информацию об уменьшенном связывании не только этого мутанта, но и НД дикого типа гриппа B с озельтамивиром.
107
Мы показали, что мутация D198E влияет на взаимодействие R152 (R150 в нумерации B) с N-ацетильной группой на лиганде, тем самым снижая чувствительность ко всем NAI. Однако мы также показали, что, хотя E276 вращается при связывании peramivir как у дикого типа, так и у E198 NA, полное вращение не происходит при связывании озелтамивира, что дает структурное объяснение уменьшенной чувствительности NA гриппа B к озелтамивиру.
NAI описываются как зависящие от времени или замедляющие ингибиторы. Следовательно, в анализе ингибирования фермента, используемом для определения чувствительности лекарственного средства, вирус и ингибитор предварительно инкубируют, чтобы облегчить максимальное размещение активного сайта фермента. Потеря медленного связывания часто происходит с мутациями NA, придающими лекарственную устойчивость.
101
,
108
,
109
,
110
,
111
Недавно мы разработали анализ кинетики IC50 в режиме реального времени,
107
,
112
который сравнивает скорость связывания ингибитора с и без предварительной инкубации (рис. 3). Этот простой фенотипический анализ позволяет легко идентифицировать медленное и быстрое связывание нескольких ингибиторов и множественных вирусов без необходимости очищенного вируса или NA или подробное знание кинетики ферментов. Следуя изменениям IC50 каждые 10 минут в течение 60 минут после добавления субстрата, мы продемонстрировали, что предварительная инкубация только усиливает связывание с NA с медленным связыванием дикого типа, что приводит к снижению IC50. Потеря медленного связывания с резистентными НС показана минимальным изменением IC50 с предварительной инкубацией или без нее в течение 60 минут реакции. На рисунке 3 показаны различия в связывании осельтамивира и занамивира с дикими и устойчивыми НС. Наркотики, к которым НС остаются чувствительными, по-прежнему являются медленными связями. Впоследствии мы продемонстрировали, что снижение чувствительности NAI вируса к мутации Y155H NA
45
,
113
было связано с еще более медленным связыванием, чем с NA NA дикого типа. Тесты на кинетику IC50 также предполагают наличие различий в скоростях диссоциации NAI после предварительной инкубации с ингибиторами. Озельтамивир, по-видимому, диссоциирует быстрее, чем занамивир. Мы разрабатываем новый твердофазный анализ диссоциации, который подтверждает эти тенденции.
114
Графики кинетики IC50 показывают, как изменения IC50 во время анализа ингибирования фермента могут идентифицировать медленные и быстрые ингибиторы связывания. IC50s сравнивают либо с предварительной инкубацией с ингибиторами (+), либо без предварительной инкубации, где одновременно добавляют вирус, ингибитор и субстрат (-). Предварительная инкубация усиливает связывание, что приводит к снижению IC50 для ингибиторов медленного связывания по сравнению с отсутствием предварительной инкубации. В тех случаях, когда ингибиторы больше не являются медленными связями, в IC50 с небольшим разрывом с предварительной инкубацией или без нее, например, вирус B дикого типа с осельтамивиром, мутантом D198E с обоими ингибиторами и h374Y и E119V только с озельтамивиром. Последние два остаются чувствительными к занамивиру и все еще демонстрируют медленное связывание. Поскольку субстрат конкурирует с ингибитором в реакциях до инкубации, наблюдается увеличение IC50. Для вирусов дикого типа происходит более быстрая диссоциация озельтамивира, чем у занамивира.
Сопротивление NAI может быть как лекарственным, так и вирусным типом или специфичным подтипом. Краткое описание эффектов мутаций, упомянутых в этом обзоре, представлено в таблице 1. Обозначение низкого, среднего или высокого сопротивления основано на зарегистрированных различиях в разнице чувствительности по отношению к вирусу дикого типа. Однако, хотя сопротивление часто определяется как 10-кратное изменение IC50 по сравнению с диким типом, поскольку у некоторых вирусов есть более высокая базовая линия IC50, например штаммы гриппа B и clade 2 H5N1, такие вирусы могут быть клинически устойчивыми с небольшим увеличением IC50. Может быть более уместным определить резистентность в отношении IC50 и концентрации лекарств, доставляемых в верхние дыхательные пути. Существует также вопрос о том, как измеряется IC50, потому что значения хемолюминесцентного анализа часто ниже, чем результаты флуоресцентного анализа, и наши эксперименты по кинетике IC50 демонстрируют, как IC50 может меняться со временем инкубации в анализах NAI. Следовательно, в настоящее время нет никакого консенсуса в отношении определения сопротивления, поскольку это действительно может быть продемонстрировано только отсутствием ответа на лечение.
Мутации и относительная восприимчивость к NAIs *
S, чувствительный; L, с низким 50-кратное изменение по сравнению с диким типом.
* Более полный список как выделенных in vitro, так и in vivo изолятов приведен в Nguyen et al.
115
** N2 нумерация.
*** Изоляты Clade 2 имеют более высокий базовый IC50, и эти мутации действуют синергически, принося более высокие IC50 по сравнению с вирусами clade 1.
В отличие от более ранних результатов, мы теперь видели, что вирусы с мутациями, дающими сопротивление, могут быть пригодными и передаваемыми. Сопротивление чаще возникает у озелтамивира из-за структурных изменений, необходимых для осельтамивира для связывания с высокой аффинностью. Сопротивление еще не появилось при стандартном лечении занамивиром иммунокомпетентных пациентов. Устойчивость к NAI может также снизить чувствительность к peramivir. Следовательно, диверсификация антивирусных запасов с включением занамивира, а также озелтамивира является важной стратегией для минимизации воздействия сопротивления озелтамивира. Приоритетом также должно стать разработка новых ингибиторов с различными режимами действия.
Д-р МакКимм-Брешкин получил гонорары и / или помощь от поездки от GlaxoSmithKline (GSK) и Хоффмана Ла-Роше за участие в консультативных группах и научных совещаниях. Она также получила исследовательскую поддержку от GSK и Biota за исследования по устойчивости к ингибиторам нейраминидазы.
Части этой работы были профинансированы через CSIRO, GlaxoSmithKline, грантом Национального института здоровья (NIAID RO1A1062721, присужденным JMB), грантом пандемического гриппа 595625 от NHMRC Australia и грантом ID 77869 от MRC UK. Финансисты не играли роли в анализе данных или подготовке рукописи.
rupubmed.com
Препараты ингибиторы нейраминидазы
Заболеваемость гриппом ежегодно повышается в осенне-зимний период. Это широко распространенная респираторная инфекция, борьба с которой требует специфических препаратов, воздействующих непосредственно на самого возбудителя. Средствами выбора в таком случае становятся так называемые ингибиторы нейраминидазы.
Общие сведения
Возбудителем гриппа является вирус, который, исходя из антигенной структуры, бывает трех типов – A, B и C. Дальнейшая классификация патогенов происходит по наличию у них на внешней поверхности двух белков (гликопротеидов): гемагглютинина и нейраминидазы. Эти компоненты являются одновременно антигенами и ферментами агрессии, обеспечивающими патогенность возбудителя.
Вирусы гриппа A и B содержат оба белка. При этом эпидемическое значение имеют несколько подтипов гемагглютинина и нейраминидазы (h2, h3, h4 и N1, N2), хотя на самом деле их значительно больше. Необходимо также отметить, что им присуща высокая антигенная изменчивость под воздействием факторов окружающей среды. Что касается вируса гриппа C, то он вместо гемагглютинина содержит другой белок со схожими свойствами.
Гемагглютинин и нейраминидаза играют важное значение в жизненном цикле вируса. Первый способствует прикреплению возбудителя к поверхности клеток, а второй разрушает рецепторы к нему, расщепляя при этом сиаловые кислоты. Предполагается что нейраминидаза помогает вирусу проникать сквозь слизь, достигая эпителия дыхательных путей. Подтверждена способность фермента облегчать высвобождение вновь образованных частиц из зараженных клеток.
Вирусные ферменты обеспечивают патогенность возбудителя и обладают антигенными свойствами. Именно они являются основной мишенью для специфических препаратов.
Свойства
Современные данные о строении и свойствах вирусных антигенов дали толчок для разработки новых препаратов, используемых в лечении гриппа. Механизм действия этих медикаментов связан с блокированием нейраминидазы путем образования конкурирующего субстрата. В результате фермент теряет свою активность, что предотвращает размножение вирусных частиц и заражение новых клеток.
На фоне терапии препаратами происходит уменьшение симптоматики, сокращение длительности патологии и предотвращение осложнений. Помимо лечебного эффекта, ингибиторы нейраминидазы позволяют провести профилактику развития инфекции после контакта с заболевшим. При использовании указанных средств предотвращается и передача возбудителей гриппа здоровым лицам, а значит, снижается риск развития эпидемий.
Представители
В настоящее время синтезировано несколько молекул, угнетающих нейраминидазу вируса гриппа. Одни из них изучены достаточно хорошо, доказав свою эффективность во многих клинических испытаниях и получив большой опыт использования, а другие еще продолжают разрабатываться. Речь идет о следующих препаратах:
- Озельтамивир (Тамифлю).
- Занамивир (Реленза).
- Перамивир (Рапиваб).
- Ланинамивир.
Широкое применение в практической медицине получили первые два препарата из указанных. Они рекомендованы ВОЗ как средства выбора при спорадических случаях или эпидемиях гриппа, включая штаммы h2N1 («свиной»), H5N1 («птичий»), h4N2 («гонконгский»).
Применение
Использование препаратов – ингибиторов нейраминидазы должно быть согласовано с врачом. Это лекарства, назначить которые можно лишь после клинико-лабораторного подтверждения болезни или при точной уверенности в циркуляции того или иного штамма возбудителя.
Озельтамивир применяется внутрь в капсулах или суспензии, а занамивир выпускается в порошке для ингаляций (Дискхалер). Первый разрешен к применению в возрасте с 1 года, а второй – с 5 лет. Для лечения обычно используют 1 капсулу или 2 ингаляционных дозы дважды в сутки, а с целью экстренной профилактики препарат принимается 1 раз в сутки. Продолжительность терапии ингибиторами нейраминидазы составляет 5 дней.
Использовать медикаменты, ингибирующие вирусную нейраминидазу, необходимо по рекомендации врача и в комплексе с другими средствами.
Побочные эффекты
Принимая лекарства, необходимо быть осведомленными о риске побочных эффектов. На фоне лечения озельтамивиром чаще всего возникали следующие явления (согласно клиническим испытаниям и постмаркетинговым исследованиям):
- Тошнота.
- Головные боли.
- Головокружение.
- Бессонница.
- Инфекции дыхательных путей.
У детей также возникали диарея, лимфаденопатия, заложенность носа, нарушения слуха, дерматиты. Что касается занамивира, то при ингаляционном введении он переносится хорошо. Редко отмечалось появление бронхоспазма, аллергических реакций, лихорадки.
Противопоказания
Любой препарат имеет ограничения к применению, в том числе и угнетающий вирусную нейраминидазу. Однако у рассматриваемой группы препаратов из абсолютных противопоказаний в инструкции присутствует лишь индивидуальная непереносимость активного компонента. Безопасность занамивира при беременности не установлена, а озельтамивир может быть рекомендован к приему женщинам в положении, если польза от него превышает вероятный риск.
Нейраминидаза вируса гриппа – это один из важных белковых компонентов, обеспечивающих патогенные и антигенные свойства возбудителя. Поэтому была создана группа препаратов, блокирующих этот фермент. Они широко применяются в медицинской практике для лечения и профилактики инфекции среди взрослых и детей.
Вконтакте
Google+
elaxsir.ru
Открытие и разработка ингибиторов нейраминидазы — Discovery and development of neuraminidase inhibitors
Ингибиторы нейраминидазы ингибируют ферментативную активность фермента нейраминидазы (сиалидазный). Эти типы ингибиторов были введены в качестве противогриппозных лекарственных средств , поскольку они предотвращают вирус от выхода из инфицированных клеток и , таким образом , остановить дальнейшее распространение вируса. Ингибиторы нейраминидазы для человеческого нейраминидазы (^ Neu) имеют потенциал , чтобы быть полезным в качестве лекарства фермент играет роль в нескольких сигнальных путей в клетках и участвует в таких заболеваний, как диабет и рак .
история
Первые ингибиторы нейраминидазы (ИНА) были синтезированы в 1960 — х годах Эдмон и др., Через попытку понять каталитический механизм этого фермента нейраминидазы. Они обнаружили , что N-замещенная оксаминовая кислота была ферментные ингибирующие свойства. Затем было обнаружено , что синтетическое соединение , 2-дезокси-2,3-дидегидро-N-ацетилнеураминовая кислота (neu5Ac2en или ДАНА) , который является аналогом N-ацетилнейраминовой кислоты (Neu5Ac), ингибирует высвобождение вируса потомства в культуре ткани , но не было обнаружено противовирусной активности у животных. В начале 1990 — х годов, определение биологической кристаллической структуры поверхностного белка вируса гриппа привело к открытию АЦ и предоставил возможности для обнаружения и проектирования новых и специфических ингибиторов.
вирус гриппа
Вирус гриппа представляет собой РНК — вирус , который разделен на три серологических типа: A, B и C. гемагглютинина (НА) и нейраминидазы (NA) являются двумя важными гликопротеинов вируса гриппа на мембранах. Гемагглютинин представляет собой молекулу кислоты , сиаловой рецептор-связывающий и опосредует проникновение вируса в клетку — хозяина, в то время как нейраминидазы расщепляет клеточный рецептор сиаловой кислоты с образованием новых частиц. Нейраминидазы является exoglycosidase , который разрушает рецептор гемагглютинина расщепления & alpha ; (2,6) — или & alpha ; (2,3) -ketosidic св зи , котор существует между терминальной сиаловой кислотой и сахаром остатком , содержащим рецептором neu5Ac на поверхности хозяина клетки. Это помогает распространению инфекции путем предотвращения самоагрегации новых вирусов на поверхности клетки и возможной иммобилизацию в муцина на гемагглютинина (HA) во время репликации вируса. Вирус затем будет выпущен из клеток — хозяев и впоследствии заражать другие клетки. Нейраминидазы также помогает вторжению вируса в верхних дыхательных путях, возможно , путем расщепления молекул сиаловых кислот на муцин из эпителиальных клеток . Нейраминидазы встречается в вирусах гриппа типов А и В. нейраминидазы роль в инфекции, репликации и доставки вируса гриппа А и вируса B. Тип C гриппа выражает фермент эстеразы вместо нейраминидазы.
субстрат
 N-ацетилнеураминовая кислота (Neu5Ac)
N-ацетилнеураминовая кислота (Neu5Ac)N-ацетилнеураминовая кислота (Neu5Ac) является одним из двух наиболее распространенных сиаловых кислот у млекопитающих. Это моносахарид с позвоночником 9 атомов углерода. Это, как правило , прилагается к гликопротеинов или ганглиозидов на терминальном конце с помощью & alpha ; (2,3), & alpha ; (2,6), и & alpha ; (2,8) связи. Нейраминидазы представляет собой фермент , который гидролизует , что связь с получением свободной кислоты и нейраминовой гликопротеин или сахарной цепью. Вирус гриппа связывается с помощью белка гемагглютинина на этих присоединенных сиаловой кислоты гликопротеинов на клеточной мембране.
Механизм действия
Механизм ферментативного катализа
Механизм НС было показано , чтобы продолжить с сохранением конфигурации , которая означает , что она сохраняет абсолютную конфигурацию на атоме в стереоцентру. Есть четыре шага каталитических путей. На первой стадии, стадии связывания, то карбоксилат группа изменяется от осевого положения в псевдо-экваториальное положение. Вторым шагом является протон донорство из молекулы воды и образования эндоциклических sialosyl катионов переходного состояния промежуточного. Шаг три вовлекает нуклеофильную атаку тирозина на sialosyl катиона. Четвертый шаг является формирование и выпуск neu5Ac. Аналогичный механизм был предложен Janakiraman и соавт. где двойная связь neu5Ac2en заставляет пиранозную сахарного кольцо в плоской структуру были напоминал переходное состояние структуру.
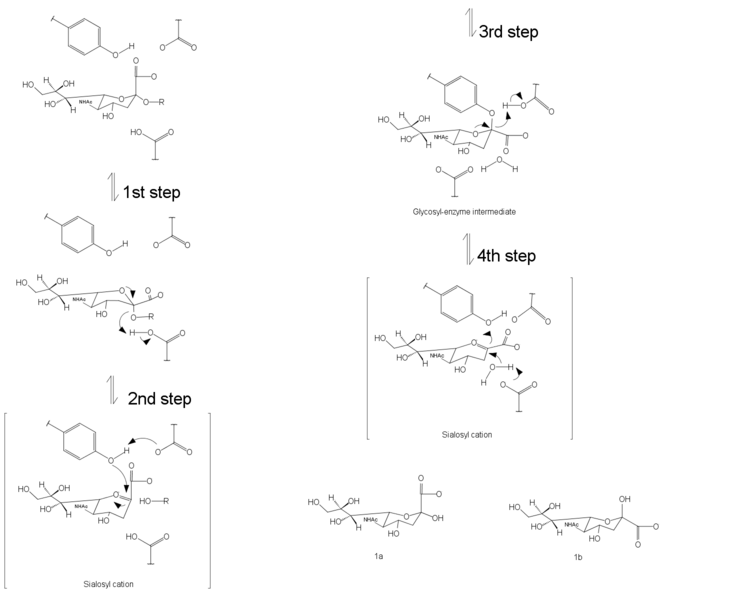 Механизм реакции, катализируемой нейраминидазы
Механизм реакции, катализируемой нейраминидазыМеханизм ингибирования
Есть два типа ингибиторов нейраминидазы обычно доступных для лечения и профилактики инфекций , гриппа: Занамивир и Оселтамивир . Они мешают освобождению потомства вирионов из инфицированных клеток — хозяев, предотвратить процесс заражения новых клеток — хозяев и остановить распространение инфекции в дыхательных путях, имитируя естественный субстрат и фитинга в активном центре фермента нейраминидазы. Они прерывают отряд вирионов потомства. Вирусный скорость репликации затем снижается, что позволяет иммунной системе человека уничтожить оставшиеся вирусы.
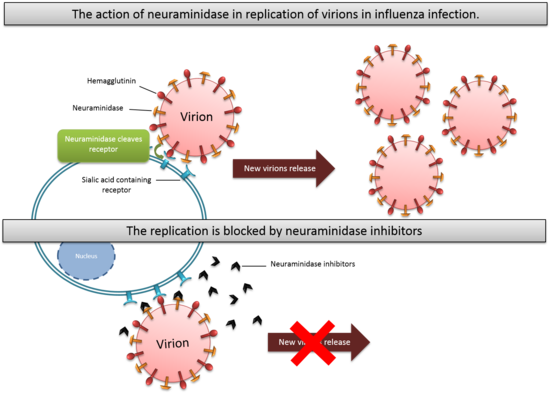 Механизм действия ингибиторов нейраминидазы.
Механизм действия ингибиторов нейраминидазы.развитие
Binding сайт
Вирусные нейраминидазы
Углерод-карте N-ацетилнеураминовой кислота (Neu5Ac)Вирус гриппа нейраминидаза (vNEU) состоит из 4 копланарных примерно сферических субъединиц главным образом из беты-листов , отличающихся тем, как 6-кратное беты-пропеллер и гидрофобная область , встроенной в мембране вируса. Активный участок расположен вблизи середины псевдо-симметричной сферы. Вирус гриппа нейраминидазы только расщепляет концевые neu5Ac остатки. Рентгеновская кристаллография показала искаженное расположение половины стула подложки neu5Ac в активном центре. Эта искаженный структура образует катион sialosyl после высвобождения агликона и затем в ловушке в активном сайте путем нуклеофильной атакой остатка тирозина. Ориентация субстрата в активном центре способствует в основном три штамму сохранился остатками аргинина , связывающих группа C1 кислоты с солевыми мостиками. Кроме того, активный сайт состоит из восьми других высоко консервативных аминокислотных-остатков , которые делают непосредственный контакт с подложкой или его производными. В том числе остатка глутаминовой кислоты , связывающий спиртовые группы С7 и С9 на глицериновой боковой цепи (у С6) с водородными связями и несколько гидрофобных остатками , коррелирующих с метильной группой на C5 N-ацетиле и гидрофобной основной цепи глицерина.
человек нейраминидазы
Человек нейраминидазы (^ Neu) разделяет многие сходные черты с vNEU. Геном человека состоит из четырех различных ферментов , нейраминидазы (NEU1, NEU2, NEU3, NEU4) , и только один из них (NEU2) не ассоциированных с мембранами или в мембранно-комплекса и была изучена методом рентгеновской кристаллографии. Три остатков аргинина , которые связывают C1 кислотно-группу с солевыми мостиками в vNEU также присутствуют в ^ Neu. Активный сайт топология и взаимодействие с подложкой очень похожи , за исключением глицерина боковой цепи , которая предлагает некоторые стратегические варианты при разработке ингибиторов таргетинга либо vNEU или ^ Neu. В ^ Neu глицерина гидроксильные -группы связаны через несколько тирозиновых остатков , но в vNEU главным взаимодействие с остатком глутаминовой кислоты. Эти общие черты призвали к озабоченности по поводу возможных побочных эффектов от лекарств , ориентированных на vNEU. Тем не менее, большинство из хорошо изученных ингибиторов vNEU показали очень мало сродство к ^ Neu к наркотику гриппа , за исключением занамивиром , который является эффективным ингибитором hNEU2.
Вирусные ингибиторы нейраминидазы
2-дезокси-2,3-дидегидро-N-ацетилнеураминовая кислота (neu5Ac2en) является пан-селективным ингибитором нейраминидазы. Neu5Ac2en является дегидрированию Neu5Ac и могут быть синтезированы с помощью фермента ^ Neu, если Neu5Ac в достаточно высокой концентрации. Neu5Ac также мягкий ингибитор фермента, а как neu5Ac2en переход состояния аналог это гораздо лучше ингибитор.
Zanamivir
В начале рентгеновской кристаллографии не имеют очень хорошее разрешение таким образом , первоначальный акцент был сделан на субстрат , полученный ингибиторы вместо структурно основе. Neu5Ac производных 2-дезокси-α-Ду-ацетилнеураминовой кислоты (2-дезокси — α-Neu5Ac) был первый шаблон используется , а также первый ингибитор пытался в естественных условиях в мышиной модели инфекции гриппа. Незамещенный шаблон показал незначительный эффект. Другой шаблон neu5Ac2en (ДАНА) судили по же условиях и показали хорошие в естественных условиях эффекта. С новыми кристаллической структурой образами фермента и комплексом neu5Ac возникающими и neu5Ac2en подтвержденными как в естественных условиях ингибитора, внимание было сосредоточено на создание производных Dana структуры на основе. С лучшей кристаллической структурой рентгеновской был выявлен ряд важных остатков в активном центре, в частности , C4 — гидроксильная группа. Лучше эффект был достигнут путем замещения гидроксильной группы C4 с более основной группой, например аминогруппой. Дальнейший анализ показал , что большая группа может быть размещена в активном сайте. 4-амино-4-дезокси-neu5Ac2en и 4-дезокси-4-гуанидино-neu5Ac2en были синтезированы и оказались конкурентными ингибиторами нейраминидазы для вирусного и значительно ингибирует как А , так и репликацию вируса гриппа B в пробирке и в естественных условиях . 4-дезокси-4-гуанидино-neu5Ac2en показал не только быть лучшим ингибитором , но также показала значительное более низкое сродство к другому изоформу нейраминидазы. По этим причинам 4-дезокси-4-гуанидино-neu5Ac2en был выбран в качестве основного кандидата наркотиков под названием занамивир. Высокая полярная природа и быстрое выведение способствуют препаратов низкой биодоступности и быстрой ликвидации.
Профилактически
Были синтезированы несколько новых ингибиторов на основе шаблонов без углеводов. С акцентом на позиционирование двойной связи в ингибиторе более близко напоминают переходное состояние подложки и замену бокового глицерина цепи с липофильной группой на основе гидрофобной основной цепи глицерина , взаимодействующую с белком приводит к открытию GS 4071. С. 4071 является циклогексна основой и имеет 3-пентил эфир, найденный быть оптимальными, вместо глицерина в качестве боковой цепи. Ингибитор GS 4071 является более липофильным , чем предшественник Занамивир , но не больше биодоступности. Профилактически, этиловый эфир GS 4071 был получен в качестве пролекарства , и активно превращают в активное лекарственное средство в естественных условиях .
Peramivir
Перамивир разработан на основе структуры дизайна лекарств. После гриппа NA ингибитора активности & alpha ; / β-6-ацетил-амино-3,6-дидезокси — D-глицеро-Альтро-2-nonulofuranosonic кислоты было сообщено Ямамото и др., В циклопентан производные был разработан с группой гуанидино замена С4-гидроксил положение ДАНА в активном центре, подобно Занамивир. Баба и соавт. Установлено , что добавление н-бутилового боковой цепи делает соединение лучше подходят к гидрофобной области фермента. Тем не менее, было обнаружено , что конформация н-бутила , чтобы быть различным при связывании вируса гриппа А от его конформации при связывании с вирусом гриппа B. Поскольку соединение обработано подобное связывания взаимодействие с активным сайтом НС к занамивир , и из — за мутации в некоторых штаммах занамивир-сопротивлении, положение гуанидина группа было изменено , и н-бутильная группа была заменена , с тем чтобы изменить его активное взаимодействие сайта.
Структуры вирусных ингибиторов нейраминидазы в использовании
* Только Zanamivir и Oseltamivir является одобрена FDA. Peramivir используется в Японии и Южной Корее. Laninamivir используется только в Японии.
Последние разработки и проектирования аналогов вирусных ингибиторов
Новая NA аналоги ингибиторов были синтезированы на основе занамивира, Оселтамивир и Peramivir, с рациональной структурой на основе разработки лекарственных препаратов и могут быть разделены на четыре группы.
Аналоги Занамивира
Аналоги Занамивира предназначены для улучшения терапевтического использования. Замена карбоксильной группы в С1-фосфонат группы под руководством препарата , чтобы быть более мощным , с высокой аффинностью с образованием ионного взаимодействия с активным сайтом. Кроме того, нажмите-химии реакции использовали для синтеза C4-триазол-модифицированный аналог занамивир , который показывает ингибирующей активностью близко к занамивир. Laninamivir предназначен замена C7 гидроксигруппы с небольшой липофильной группой, -ОСН3 , что привело к превосходной ингибирующей активности. Диол С8 и С9 играет важную роль в аффинности связывания с нейраминидазой, продлевая эффект. Полимерные каркасы в положении С7 занамивир через алкиловым эфир приобрели большее внимание , так как это показало улучшенную противовирусную активность.
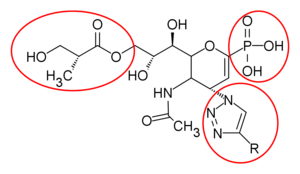 |  |
| C4-trizole | 4-aminophosphono-ДАНА |
 |  |
| Фосфоно-занамивир | Пролекарство фосфонокарбонового занамивира |
Аналогов Оселтамивир
Знание государственной структуры перехода было использовано для разработки аналогов Озелтамивира. Например, триазол , содержащий карбоциклы по Von Itzstein и Pinto группы и фосфонат аналогу осельтамивира сообщались , чтобы показать более сильную активность в результате связывания с соответствующим режимом фосфоната с тремя аргининовыми остатками в активном сайте.
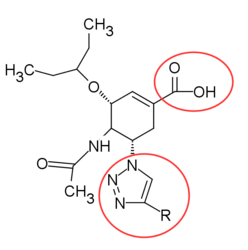 |  |
| Триазола, содержащие карбоциклы аналог | Фосфонатный аналог. R 1 , R 2 = -H или -СН2СН3 |
,
Аналогов Peramivir
Перамивир является производной циклопентана разработан с гуанидина группой замены С-4 гидроксильной группы neu5Ac2en в активном центре, с отрицательно заряженной карбоксилатный группой и боковой цепью н-бутилом. 1-ethylpropylamide, диэтиламид, dipropylamide и 4-morpholinylamide группы все показали отличную ингибиторную активность. Изменение циклопентанового кольца к пирролидиновому кольцу показало высокую ингибиторную активность , а также.
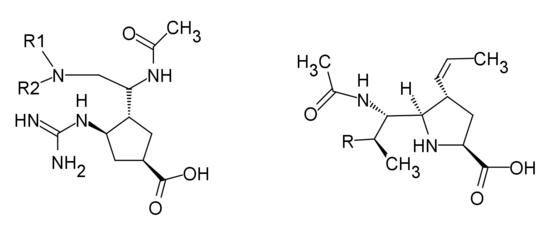 |
Аналоги бензойной кислоты
Замена дигидропирано кольцо с бензольным кольцом увеличивает липофильность препарата и делает препарат гораздо более стабильным и более доступным синтетический. На основе взаимодействия DANA и НС, были синтезированы производные бензойной. Они показали аналогичные или более ингибирующая активность по сравнению с neu5Ac.
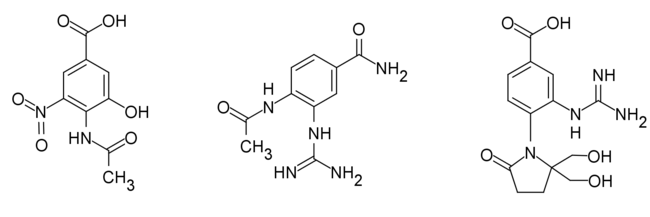 |
ингибиторы нейраминидазы человека
Занамивир и Профилактический были испытаны в качестве ингибиторов ^ Neu. Только Zanamivir показывает умеренное ингибирующее действие на ^ Neu. Изоферментов селективные ингибиторы потенциально может быть очень важным. В настоящее время существуют ограниченные исследования для субстратной специфичности ^ Neu. ДАНА является пан-селективным ингибитором для всех изоферментов ^ Neu, с разницей от 2 до 10 кратного ингибирования активности, наиболее эффективной для hNEU3 и hNEU4. Несколько сообщений тестировали Dana-производные в качестве ингибиторов для hNEU2 и hNEU3. Большинство производных показали пониженное ингибирование в пробирке . Тем не менее, N5-азидоуксусная кислота-С9-азида производная ДАНА показала улучшенное ингибирование для hNEU2 и hNEU3. Эти исследования пришли к выводу , что активный сайт в ферментах может переносить большие изменения у С9 лучше , чем в N5. Тестирование производных С9 амидных из ДАНА показали hNEU1-селективных ингибиторов. Эти соединения показывают большую активность затем DANA и лишь незначительную активность по hNEU3 с около 25-кратной селективности в отношении hNEU1. Эти исследования показали , что глицерин боковой цепи кармана в активном сайте потенциально можно манипулировать при разработке селективных ингибиторов изоферментов для ^ Neu. Сочетание C4 и C7 производные модифицированного DANA сообщается с умеренной селективностью по отношению к hNEU2 и hNEU3. Наконец С9-триазол производные ДАНА , содержащая алкоксигруппу с наномолярной активностью в отношении изофермента hNEU4 сообщались. С 500-кратной селективностью в отношении hNEU4, это Максимальные селективности для изофермента ^ Neu до настоящего времени.
использование
Есть 2 подгруппы ингибиторов NA, которые были одобрены регулирующими органами в США и Европе, Занамивире и Оселтамивире. Оба предназначены для лечения и профилактики гриппа. Кроме того, Peramivir и Laninamivir были одобрены регулирующими органами в некоторых частях Азии.
Laninamivir
Laninamivir одобрен для лечения гриппа под торговым названием Inavir в Японии, но это все еще в клинических испытаниях в США. Laninamivir является длительным действием вдыхаемого лекарственного средства задается как пролекарства (laninamivir октаноата). Laninamivir дается в виде однократной дозы и остается активным в течение по крайней мере 5 дней и до 7 дней.
Профилактически
Профилактически можно найти под торговыми названиями, такими как Agucort®, Antiflu, Fluvir, Fluhalt, GPO-A-Flu ™, Omiflu, Rimivat, Virobin, Оселтамивир и Тамифлю. Профилактически используется для пациентов 1 года и старше. Она дается в виде одной дозы, два раза в день для лечения гриппа. В профилактике гриппа, озельтамивир даются в виде одной дозы, один раз в день в течение по крайней мере 10 дней после контакта с инфицированным человеком и до шести месяцев (во время эпидемии гриппа). Наиболее распространенными побочными эффектами являются головная боль Оселтамивир и тошнота (у взрослых) и рвота, кашель и заложенность носа (у детей).
Peramivir
Peramivir одобрен для лечения гриппа под торговым названием Rapiacta® в Японии и Peramiflu в Южной Корее. В США и в других странах, перамивир проходит в поздней фазе клинических испытаний. Peramivir используется как внутривенные и был использован в экстренном лечении h2N1 2009 в некоторых пациентах.
Zanamivir
Занамивир можно найти под торговыми названиями, такими как Relenza ™, Verenza и Z-Flu DPI. Занамивир используется для пациентов 5 лет и старше. Оно дается как одна доза 10 мг, два раза в день для лечения гриппа. В профилактике гриппа, занамивир даются как один 10 мг дозы, один раз в день в течение 10 дней после контакта с инфицированным человеком или до 28 дней (во время эпидемии гриппа). Наиболее распространенный побочный эффект Занамивира, как сообщается, сыпь.
Устойчивость к лекарству
В настоящее время существует два класса антивирусных препаратов, одобренных для лечения и профилактики инфекций, гриппа. Они адамантаны и ИН. В адамантанах работают только на грипп А так с 2010 г. ВОЗ рекомендовали использование ИНА для лечения и профилактики гриппа А и инфекций B. В отличии от адамантанов, ИНА является менее токсичной и менее склонна к содействию лекарственной устойчивости гриппа. Кроме того, они эффективны против всех нейраминидазы подтипа и всех штаммов гриппа. После пандемии гриппа в 2009 году, было большое беспокойство о резистентности вируса к ИНУ. Вирусы гриппа, которые пониженные чувствительность к Nais часто содержат мутации, которые влияют на форму каталитического сайта НСА и, следовательно, снизить связывающую способность ингибиторов. Каталитический сайт НС имеет восемь функциональных остатков (R118, D151, R152, R224, E276, R292, R371 и Y406) в окружении одиннадцати каркасных остатков (E119, R156, W178, S179, D198, I222, E227, h374, E277, N294 и E425).
Сопротивление Оселтамивир
Профилактически имеет большую гидрофобную боковую цепь, и НС должен пройти перегруппировку с образованием карманы для связывания лекарственного средства пути вращения аминокислотного E276 и связи с R224. Мутации, как h374Y, R292K и N294S, что эффект этого формования может снизить эффективность ингибиторов.
Сопротивление Занамивир
Устойчивость к занамивиру была низкой как для сезонных и пандемических вирусов по сравнению с осельтамивир. Молекулярная структура занамивира имеет гуанидиногруппу, эта группа взаимодействует с остатком E119 в активном центре кармана. Устойчивость к занамивир может быть из — за мутации , которые влияют сродство связывания между ферментом и ингибитором. Мутация по остатку E119 Было показано , что снижает эффективность ингибиторов в пробирке .
Сопротивление Peramivir
Peramivir имеет гуанидиногруппу аналогичный занамивир и гидрофобную группу , подобный осельтамивир. Мутации , которые влияют на эффективность осельтамивира и занамивира может также влиять на эффективность Peramivir. Сопротивляемость к перамивиру было замечена на мутации h374Y остатка в пробирке . Один из этих сопротивлений связанно с перекрестной устойчивостью к перамивиру и озельтамивир. Peramivir одобрен в Японии как Rapiacta , а также доступен в Южной Корее как Peramiflu.
Сопротивление Laninamivir
Нулевое сопротивление laninamivir не сообщалось. Однако это опасение, что устойчивость к laninamivir подобна занамивир из-за сходства в свойстве связывания с белком NA. Laninamivir октаноат (CS-8958), который является пролекарством laninamivir (другой вдохнул NAI с пролонгированных свойствами), также был одобрен в Японии и является коммерчески доступным под названием Inavir (Daiichi Sankyo Company Ltd.
Смотрите также
Нейраминидазы
ингибиторов нейраминидазы
вирус гриппа
адамантан
Рекомендации
- ^ Б с д е е Christopher W. Cairo. (2014) Ингибиторы ферментов нейраминидазы человека. Med. Химреагент Commun. , 2014, 5, 1067.DOI: 10.1039 / c4md00089g
- ^ Edmond, JD, Джонстон, RG, Kidd, Д., Rylance, HJ и Соммервилль, RG (1966) Ингибирование нейраминидазы и противовирусное действия. Br. J. Pharmacol. Chemother , 1966, 27:. 415-426. DOI: 10.1111 / j.1476-5381.1966.tb01673.x
- ^ Ким, Choung U, Xiaowu Чен, и Dirk B Мендель. Ингибиторы нейраминидазы как анти-вирус грипп агенты. Противовирусные химия и химиотерапия 10,4 (1999): 41-154
- ^ Фон Itzstein, Марк. Война против гриппа: открытия и развития сиалидазы ингибиторов. Природа рассматривает открытие снадобья 6.12 (2007): 967-974
- ^ Воздух, Джиллиан M и W Graeme Умывальник. Нейраминидазы вируса гриппа. Белки: структура, функции, и биоинформатика 6,4 (1989): 341-356
- ^ Б с Varghese, Ю.Н. (1999). Разработка ингибиторов нейраминидазы как анти-вирус грипп наркотики. Исследования Drug Development , 46 (3-4), 176-196
- ^ Du, Хуан, Тимоти Кросс, и Хуан Сян Чжоу. Недавний прогресс в основе структурыборьбе с гриппом разработки лекарств. Открытие Drug сегодня 17,19 (2012): 1111-1120
- ^ Wagaman PC, Спенс HA и О’Каллаган RJ. 1989. Обнаружение гриппа С Вирусом с помощью In Situ эстеразы пробирного Журнала клинической микробиологии . 1: 832-836.
- ^ Варка, NM, и Варка, A. (2007). Разнообразие в клеточной поверхности презентациях сиаловой кислоты: последствия для биологии и болезней. Lab Invest , 87 (9), 851-857. DOI: 10.1038 / labinvest.3700656
- ^ Варка, Ажит; Roland Schauer (2008). в Основах гликобиологии. Cold Spring Harbor Press . стр. Ch. 14
- ^ Racaniello, Винсент. (2009). Грипп прикрепление вируса к клеткам. Источник октября 2014, от http://www.virology.ws/2009/05/04/influenza-virus-attachment-to-cells/
- ^ Тейлор, NR & фон Itzstein, М. (1994). Молекулярное моделирование исследования лиганда связывания с сиалидазой от вируса гриппа и механизм катализа. Журнал медицинской химии , 37 (5), 616-624
- ^ Janakiraman, MN, белый, CL, Умывальник, WG, Воздух, GM, и Л, M. (1994). Структура вирус гриппа нейраминидаза B / Lee / 40комплексе с сиаловой кислотой и дегидр аналогом в 1.8. ANG. Разрешение: последствия для каталитического механизма. Биохимический , 33 (27), 8172-8179
- ^ Moscona, A. (2005). Ингибиторы нейраминидазы по гриппу. New England Journal медицины , 353 (13), 1363-1373. DOI: DOI: 10,1056 / NEJMra050740
- ^ Колман, П. М. (1994) нейраминидазы вируса гриппа: структура, антитела и ингибиторы. Protein Science . 3: 1687-1696. DOI: 10.1002 / pro.5560031007
- ^ Б с д Марк фон Itzstein (2007) Война против гриппа: открытие и развитие сиалидазы ингибиторов. Природа издательской группы . Том 6. 967-974
- ^ Нар LMG, Tringali С, Р Фуси, Venerando В, Г Tettamanti, Като R, Monti E, Wakatsuki С. Кристаллическая структура человеческого цитозольного сиалидазной Neu2 — Доказательства динамической природы распознавания субстрата. J Biol Chem. 2005; 280: 469-475.
- ^ Б с Бабу, YS (и 13 других) 2000 BCX-1812 (RWJ-270201): открытие романа, сильнодействующим, перорально активным и селективным ингибитором в uenza нейраминидазы фунтов через структуру на основе дизайна лекарств. J. Med. Химреагент 43, 3482 ^ 3486.
- ^ Б Варгезе, Ю.Н.; Смит, PW; Sollis, SL; Blick, TJ; Sahasrabudhe, A .; McKimm-Breschkin, ДЛ; Колман, PM (1998). «Разработка лекарств против сдвига цели: Структурная основа для устойчивости к ингибиторам в варианте нейраминидазы вируса гриппа». Структура . 6 (6): 735. DOI : 10.1016 / S0969-2126 (98) 00075-6 .
- ^ Ямамото Т., Kumazawa, Х., Ины, К., Тешимы, Т. & Сиб, Т. 1992. Синтез изомеров сиаловой кислоты с itory активностьюуспешной против нейраминидазы. Tetrahedron Lett. 33, 5791 ^ 5794
- ^ Сми, DF, Хаффман, JH, Моррисон, переменный ток, Барнард, Д.Л., & Сидуэллы, RW (2001). Циклопентановые ингибиторы нейраминидазы с мощным в пробирке вирусной активности против гриппа. Antimicrob Agents Chemother, 45 (3), 743-748. DOI: 10,1128 / AAC.45.3.743-748.2001
- ^ Янг, Диана, Синтия Фоулер, и Карен Буш. RWJ-270201 (BCX-1812): роман ингибитор нейраминидазы гриппа. Филос Транс R Soc Лонд B Biol Научно 356.1416 (2001): 1905-1913
- ^ Б с д Берны, AJ, Баранович, Т., & Говорков, Е. (2013). Ингибиторы нейраминидазы для гриппа B вирусной инфекции: эффективность и устойчивость. Противовирусная Res, 100 (2), 520-534. DOI: 10.1016 / j.antiviral.2013.08.023
- ^ Абдель-Маджид, Ахмед F, Синтия Maryanoff, и Стивен Дж Mehrman. Синтез ингибиторов нейраминидазы гриппа. Current Opinion в Discovery и разработки лекарственных средств 4.6 (2001): 776-791.
- ^ Рассел, Руперт Jсоавт. Структура вируса H5N1 птичьего гриппа нейраминидазы предлагает новые возможности для разработки лекарств. Природа 443.7107 (2006): 45-49
- ^ Б Feng, Enguang и др. Последние достижения в области нейраминидазы ингибиторного развития в качестве лекарственных средств против гриппа. ChemMedChem 7,9 (2012): 1527-1536
- ^ Чанд, Pooranдр. Систематическая структураоснове дизайн и стереоселективный синтез новых производных multisubstituted циклопентановых с мощной antiinfluenza активностью. Журнал медицинской химии 44.25 (2001): 4379-4392
- ^ Albohy А., Чжан Ю., Smutova В., Pshezhetsky, AV, и Каир, CW (2013). Идентификация Selective наномолярных ингибиторов нейраминидазы человека NEU4. ACS Medicinal Chemistry Letters, 4 (6), 532-537. DOI: 10.1021 / ml400080t
- ^ Laninamivir октаноат (LANI) — грипп).. Проверено 27 октября 2014 г., из http://www.biotapharma.com/index.php/pipeline
- ^ Б с Херт, AC (2014). Эпидемиология и распространение устойчивых вирусов гриппа человека наркотиков. Curr Opin Virol , 8С, 22-29. DOI: 10.1016 / j.coviro.2014.04.009
- ^ Ikematsu, H., и Kawai, N. (2011). Laninamivir октаноят: новый ингибитор нейраминидазы длительного действия для лечения гриппа. Эксперт Rev Анти Инфекционный Ther , 9 (10), 851-857. DOI: 10,1586 / eri.11.112
- ^ J05AH02 — Профилактический. (2014). Проверено 2 ноября 2014 года, с http://www.medicatione.com/?c=atc&s=j05ah02
- ^ Агентство, европейские Медикаменты. (2012). Тамифлю. Проверено 15 октября, из Европейского агентства по лекарственным средствам http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-_Summary_for_the_public/human/000402/WC500033101.pdf
- ^ Peramivir.). Проверено 27 октября 2014 г., из http://www.biocryst.com/peramivir
- ^ Манкузо, CE, Габай, MP, Steinke, LM, и Vanosdol, SJ (2010). Peramivir: внутривенный ингибитор нейраминидазы для лечения гриппа h2N1 2009 года. Ann Pharmacother , 44 (7-8), 1240-1249. DOI: 10,1345 / aph.1P031
- ^ J05AH01 — Zanamivir. (2014). Проверено 2 ноября 2014 года, с http://www.medicatione.com/?c=atc&s=j05ah01
- ^ Исландский агентстволекарственным средствам. (2014). Samantek á eiginleikum lyfs Источник 15 октября из исландского агентство по лекарственным средствам «архивной копии» (PDF) . Архивировано из оригинального (PDF) на 2014-12-25 . Источник 2014-11-04 .CS1 садоводы: архивная копия в качестве заголовка ( ссылка )
- ^ Б с д е е г Samson, М., Пиззорен, А., Абед Ю., & Буав, Г. (2013). Устойчивость вируса гриппа к ингибиторам нейраминидазы. Противовирусная Res , 98 (2), 174-185. DOI: 10.1016 / j.antiviral.2013.03.014
- ^ Диксит, Р., Khandaker Г., Ilgoutz С., Рашид, H., & Booy, R. (2013). Возникновение устойчивостиозельтамивиру: контроль и управление гриппом до, во время и после пандемии. Infect Цели Disord наркотиков, 13 (1), 34-45
ru.qwertyu.wiki
Нейраминидаза — это… Что такое Нейраминидаза?
Нейраминида́за (КФ 3.2.1.18) — фермент, относящийся к гликозил-гидролазам. Номенклатурное название — экзо-α-сиалидаза. Также употребимы названия: α-нейраминидаза, N-ацилнейраминидатгликогидролаза, сиалидаза. Катализируемые реакции: гидролиз α-2→3-, α-2→6-, α-2→8-кетозидных связей концевых остатков сиаловой кислоты в олигосахаридах, гликопротеинах, гликолипидах и синтетических соединениях.
Разнообразие нейраминидаз
Нейраминидаза широко распространена в природе, она входит в состав оболочек некоторых вирусов. Обнаружена в ряде патогенных микроорганизмов (впервые была открыта в культуре возбудителей газовой гангрены Clostridium perfringens), a также у позвоночных и беспозвоночных животных. У растений нейраминидаза не обнаружена.
Фермент строго специфичен по отношению к конфигурации кетозидной связи и относительно специфичен к положению этой связи в молекуле. Нейраминидаза из холерного вибриона и возбудителя газовой гангрены, обычно применяющиеся в лабораторной практике, могут расщеплять α-2→3- и α-2→6-кетозидные связи. Вирусные нейраминидазы, как правило, обладают более строгой специфичностью по отношению к положению α-кетозидной связи. Фермент не требует кофакторов, но некоторые из нейраминидаз активируются ионами Са2+.
α-2→3-сиалилгалактоза. Стрелкой показана связь, разрываемая нейраминидазой.К настоящему времени ферменты с сиалидазной активностью входят в состав 3-х семейств гликозил-гидролаз: Gh43, Gh44, GH83.[1] Для всех трех семейств характерна структура 6-лопастного-β-пропеллера. В семейство Gh43 включены ферменты, обнаруженные у бактерий, различных эукариот и вирусов. Для них также характерно наличие транссиалидазной активности КФ 2.4.1.-.[2] К семейству Gh44 принадлежат молекулы вирусного происхождения.[3] В семейство GH83 входят вирусные гемагглютинин-нейраминидазы.[4]
Является одним из двух основных поверхностных антигенов вируса гриппа. Указание типа нейраминидазы используется в обозначении подтипа вируса: например, H5N1 (буква H от «гемагглютинин»).
Нейраминидаза вируса гриппа
Открытие
Существование ферментативной активности на поверхности вириона вируса гриппа было открыто Хёрстом в 1942 году[5]. Он инкубировал эритроциты с вирусом, наблюдая за реакцией гемагглютинации, и отметил, что агглютинация не является устойчивой.
 Шестилопастной β-пропеллер нейраминидазы вируса гриппа.
Шестилопастной β-пропеллер нейраминидазы вируса гриппа.Биологическая роль
Как известно на сегодняшний день, один из поверхностных гликопротеинов вириона гриппа, гемагглютинин, прикрепляется к полисахаридным цепочкам на поверхности эритроцитов, содержащим остатки сиаловой кислоты. Другой поверхностный гликопротеин, нейраминидаза, специфически отщепляет остаток сиаловой (N-ацетилнейраминовой) кислоты от полисахаридов мембраны эритроцита, тем самым разрушая рецепторы к вирусу на клетках организма-хозяина. Нейраминидаза разрушает α-кето-связь между концевой N-ацетилнейраминовой кислотой и соседним углеводным остатком, обычно, галактозой. Вирусный фермент демонстрирует некоторое «предпочтение» α-2→3 связям[6].
Роль фермента, разрушающего рецепторы к вирусу, не ясна до конца. Предполагается, что активность нейраминидазы помогает вирусным частицам проникать через секреты слизистых, богатых сиаловой кислотой, для достижения вирионами клеток-мишеней эпителия дыхательных путей.[7] Также экспериментально подтверждена роль фермента в облегчении высвобождения вновь образованных вирусных частиц с поверхности зараженных клеток, где те могут агрегироваться в результате взаимодействия вирусного гемагглютинина с сиаловой кислотой на мембране клетки[8].
Антигенная специфичность
Как и гемагглютинин, нейраминидаза — очень важный поверхностный антиген вируса. Для вируса гриппа типа А обнаружено две антигенные вариации. Изменения в аминокислотной последовательности антигенов идут постоянно из-за давления отбора антител иммунизированной популяции. В результате генетической рекомбинации появляются вирусы с антигенной последовательностью, значительно (до 50 %) отличающейся от таковой у циркулирующих штаммов. Такие изменения в подтипах как по гемагглютинину, так и нейраминидазе произошли у человеческого гриппа в 1957 году (когда вирус h2N1 перешел в h3N2), в 1968 (h3N2 в h4N2) и в 1977 (h4N2 в h2N1, хотя вирус h4N2 продолжил циркулировать)[9]. Подобные мутации ответственны за большинство пандемий, прошедших в последнее время. Различия между подтипами выявляются по отрицательной перекрестной реакции на сыворотку к каждому из них. Вирус гриппа типа B не выявляет подобной смены антигенной специфичности, хотя изменения в строении антигенов также происходят.
Антитела к нейраминидазе снижают тяжесть заболевания [10], но не приводят к излечению от инфекции, что согласуется с ролью нейраминидазы в жизненном цикле вируса.
Структура
Нейраминидаза — это тетрамер, заякоренный в вирусной мембране с помощью одной гидрофобной последовательности из 29 аминокислот, расположенной возле N-конца белка. Из разрушенной вирусной мембраны выделяется белок с молекулярной массой 200 кДа, содержащий 4 идентичные гликозилированные субъединицы, который обладает всеми антигенными и ферментативными свойствами мембрансвязанной нейраминидазы[11]. Этот белок был кристаллизован и его структура изучена с помощью УФ-дифракции.
Схематично структуру нейраминидазы можно представить как 6 4-цепочечных антипараллельных β-слоя, расположенных как лопасти пропеллера.[12] Центральная (первая) цепь каждого слоя параллельна оси пропеллера, остальные же располагаются практически перпендикулярно относительно нее. Крайняя цепь первого слоя соединена с центральной цепью слоя, следующего за ним. Это соединение расположено на поверхности молекулы фермента и несет множество антигенно и энзиматически важных аминокислот.[13][14][15]
Четыре одинаковых субъединицы расположены радиально. Активный центр фермента расположен по центру каждой из субъединиц. Он представляет собой глубокий карман, окруженный стенками, аминокислотная последовательность которых инвариантна для всех известных штаммов вируса. Эти аминокислоты активного центра можно разделить на 2 типа: одни участвуют в непосредственном контакте с субстратом, другие же выполняют лишь функцию поддержания структуры.[16]
С помощью кристаллографии определено наличие олигосахаридных цепочек, прикрепленных к протеину и имеющих вид антенн.[9]
Ингибиторы нейраминидазы гриппа
Поиск ингибиторов нейраминидазы гриппа начался в 1966 году [17]. Поводом для этого послужило предположение, что подобные вещества будут проявлять противовирусную активность.
Первый ингибитор, диен α-сиаловой кислоты (Neu5Ac2en), был синтезирован в 1969 году[18]. Множество аналогов вещества Neu5Ac2en было синтезировано в 70-е годы XX столетия, наиболее сильным ингибитором оказалось трифторацетил-производное Neu5Ac2en. Данное вещество использовалось для изучения роли нейраминидазы в жизненном цикле вируса, но противовирусной его активности обнаружено не было.[19]
См. также
Литература
- ↑ CAZy — GH
- ↑ CAZy — Gh43
- ↑ CAZy — Gh44
- ↑ CAZy — GH83
- ↑ Hirst G.K. Adsorption of influenza haemagglutinins and virus by red blood cells. // J Exp Med 76, 1942, 195—209.
- ↑ Corfield A.P., Wember M., Schauer R., Rott R. The specificity of viral sialidases. The use of oligosaccharide substrates to probee nzyme characteristics and strain specific differences. // Eur JBiochem 124, 1982, 521—525.
- ↑ Allen A. Mucus — A protective secretion of complexity. // Trends Biochem Sci, 1983, 169—173.
- ↑ Palese P., Tobita K., Ueda M., Compans R.W. Characterisation of temperature sensitive influenza virus mutants defective in neuraminidase. // Virology 61, 1974, 397—410.
- ↑ 1 2 Colman P.M. Influenza virus neuraminidase: Structure, antibodies, and inhibitors. // Protein Science. — 1994. — 3:1687-1696. Cambridge University Press.
- ↑ Kilbourne E.D., Laver W.G., Schulman J.L., Webster R.G. Antiviral activity of antiserum specific for an influenza virus neuraminidase. // J Virol 2, 1968, 281—288.
- ↑ Laver W.G. Crystallisation and peptide maps of neuraminidase heads from h3N2 and h4N2 influenza virus strains. // Virology 86, 1978, 87.
- ↑ Varghese J.N., Laver W.G., Colman P.M. Structure of the influenza virus glycoprotein antigen neuraminidase at 2.9 Å resolution. // Nature. — 1983. — 303: 35-40.
- ↑ Colman P.M., Varghese J.N., Laver W.G. Structure of the catalytic and antigenic sites in influenza virus neuraminidase. // Nature. — 1983. — 303:41-44.
- ↑ Varghese J.N., Colman P.M. Three-dimensional structure of the neuraminidase of influenza virus A/Tokyo/3/67 at 2.2 Å resolution. // JMol Biol221. — 1991. — p. 473—486.
- ↑ Varghese J.N., McKimm-Breschkin J., Caldwell J.B., Kortt A.A., Colman P.M. The structure of the complex between influenza virus neuraminidase and sialic acid, the viral receptor. Proteins Struct Funct Genetics. — 1992. — 14:327-332.
- ↑ Colman P.M., Hoyne P.A., Lawrence M.C. Sequence and structure alignment of paramyxovirus haemagglutinin-neuraminidase (HN) with influenza virus neuraminidase. // J Virol. — 1993. — 67:2972-2980.
- ↑ Edmond J.D., Johnston R.G., Kidd D., Rylance H.J., Sommerville R.G. The inhibition of neuraminidase and antiviral action. // Br J Pharmacol Chemother. — 1966. — 27, p. 415—426.
- ↑ Meindl P., Tuppy H. 2-Deoxy-2,3-dehydrosialica cids. I. Synthesis and properties of 2-deoxy-2,3-dehydro-N-acylneuraminic acids and their methyl esters. // Monatsh Chem. — 1969. — 100, p. 1295—1306.
- ↑ Palese P., Schulman J.L. Inhibitors of viral neuraminidase as potential antiviral drugs. In: Oxford JS, ed. Chemoprophylaxis and virus infections of the upper respiratory tract. — 1977. — vol I . Boca Raton, Florida: CRC Press. p. 189—205.
dic.academic.ru
Пилюля от гриппа: современные противовирусные средства
Противовирусная терапия — важнейшая составляющая «ответного удара» со стороны здравоохранения во время эпидемий гриппа. Но постоянно вырабатывающаяся устойчивость к большинству видов лечения заставляет медицинских работников и ученых искать все новые варианты.
Специальная серия статей «Биомолекулы», посвященных различным аспектам проблемы гриппа. Источник — сборник Influenza Outlook, опубликованный в декабре 2011 г. журналом Nature.
Вирусы гриппа отправили лекарства «первого поколения» на свалку фармакологии, и есть намеки на то, что продолжающая развиваться устойчивость скоро сделает то же самое и с более новыми препаратами. В конце августа 2011 года Международное общество по инфекционным заболеваниям (Бостон, Массачусетс, США) сделало доклад о 25 пациентах в восточной Австралии, зараженных пресловутым вирусом свиного гриппа (штамм A (h2N1)), устойчивым к широко распространенному препарату осельтамивиру («Тамифлю»), производимому компанией Roche (Базель, Швейцария). На данный момент это самый значительный случай распространения вирусов, устойчивых к осельтамивиру.
Хорошие новости состоят в том, что устойчивость к противовирусной терапии не распространяется на штаммы гриппа, которые будут циркулировать в сезон 2011–2012. По крайней мере, пока. «В циркулирующих среди людей штаммах гриппа мы не видим резистентности к осельтамивиру, — говорит Чарльз Пенн (Charles Penn), эксперт по противовирусным препаратам, участник мировой программы по гриппу Всемирной организации здравоохранения в Женеве. — Хотя устойчивость к „Тамифлю“ наблюдается уже у 1% образцов вируса h2N1, собранных в ходе зимы 2010–2011, этот уровень недостаточен для того, чтобы ВОЗ поменяла свои рекомендации относительно лечения гриппа» [1].
Это не значит, что устойчивость к лекарствам — не проблема. Осельтамивир, начиная с 1999 года, успешно вылечил миллионы пациентов, но мутации, обусловливающие резистентность, были описаны еще в 1998-м. Учитывая постоянно меняющийся молекулярный облик гриппа, предсказать эволюционную траекторию устойчивости к осельтамивиру непросто. «В течение двух-трех прошлых лет мы наблюдали рост устойчивости. Вся эта игра может измениться в любое время», — говорит Захари Тейлор (Zachary Taylor), исследователь инфекционных болезней в медицинском центре Kaiser Permanente Fontana в Сакраменто (Калифорния, США). В попытке застраховать себя от таких «обходных маневров» разработчики лекарств понемногу внедряют новые препараты (таб. 1). Каждое новое лекарство имеет свои побочные действия, что делает его применение оправданным только в случае, если грипп угрожает смертью — например, для пожилых людей или пациентов с ослабленным иммунитетом.
| Действующее вещество | Тип лекарства | Торговое название | Статус |
|---|---|---|---|
| Осельтамивир (таблетки) | Ингибитор нейраминидазы | «Тамифлю» (Roche) | В продаже в большинстве стран |
| Занамивир (ингаляция) | Ингибитор нейраминидазы | «Реленза» (GSK) | В продаже в большинстве стран |
| Перамивир (внутривенно) | Ингибитор нейраминидазы | «Рапиакта» в Японии, «Перамифлю» в Южной Корее (BioCryst) | В продаже в Японии и Южной Корее. На третьей стадии испытаний в США |
| DAS181 (ингаляция) | Рекомбинантный белок | «Флюдаза» (NexBio) | На второй стадии испытаний в США |
| ADS-8902 (амантадин, рибаварин, осельтамивир) (таблетки) | Комбинация трех видов лекарств | Без названия (Adamas) | На второй стадии испытаний в США |
| Амантадин (таблетки) | Производное адамантана | «Симметрел» (Endo Pharmaceuticals) | В продаже в большинстве стран; не рекомендуется из-за устойчивости к препарату |
| Римантадин (таблетки) | Производное адамантана | «Флюмадин» (Forest Pharmaceuticals) | В продаже в большинстве стран; не рекомендуется из-за устойчивости к препарату |
Осельтамивир принадлежит к классу лекарств, которые называются ингибиторами нейраминидазы. Подобные агенты блокируют активность вирусного фермента нейраминидазы, тем самым не давая вирусу покинуть клетку после размножения. Наиболее распространенным способом со стороны вируса избежать «ловушки» является мутация h375Y (или h374Y), которая заключается в замене одного аминокислотного остатка в молекуле нейраминидазы (гистидина) на другой (тирозин). Эта мутация «мешает» лекарству связаться с белком — проблема, признанная разработчиками осельтамивира. (Подробнее см. в статье «„Костыль“ для нейраминидазы» [2].) «Существует потребность разработки новых видов терапии острых инфекций и мероприятий по подготовке к пандемиям», — говорит Клаус Клампп (Klaus Klumpp), ведущий вирусолог компании Roche. Клампп сообщает, что Roche разрабатывает новые способы лечения, направленные на молекулярные пути вирусной репликации и ряд других механизмов, но уточняет, что все эти исследования находятся пока на стадии доклинических испытаний.
К счастью, вирусы с мутацией h375Y все еще чувствительны к другому ингибитору нейраминидазы — занамивиру (он поставляется компанией GlaxoSmithKline (GSK) под маркой Реленза). Занамивир — первый открытый ингибитор нейраминидазы — применяется в основном в форме ингаляций; его побочными эффектами является головокружение и раздражение слизистой носа. ВОЗ рекомендует лечить занамивиром только пациентов, зараженных штаммами вируса, устойчивыми к осельтамивиру.
Если занамивир используется как «запасной вариант» в случае заражения осельтамивир-резистентным штаммом, то третий препарат из группы ингибиторов нейраминидазы — перамивир — может быть назначен пациентам, не переносящим первые два ингибитора. Перамивир разработан компанией BioCryst Pharmaceuticals в городе Дарем (Северная Каролина, США). Это лекарство доступно в Японии (под маркой Рапиакта) и Южной Корее (Перамифлю), но в США оно все еще проходит испытания. Его побочные эффекты, как и у осельтамивира, — диарея, тошнота и рвота. Внутривенно перамивир назначают только тяжелобольным пациентам, не способным проглотить осельтамивир или принять ингаляцию занамивира.
В разнообразии — сила
Другие компании, осознавшие риски, связанные с устойчивостью к ингибиторам нейраминидазы, пробуют атаковать вирус со всех возможных флангов. Одно из лекарств, выделяющееся в общем потоке, — DAS181, разработанное компанией NexBio (Сан Диего, Калифорния, США). Этот препарат, зарегистрированный под маркой «Флюдаза», сейчас проходит вторую фазу клинических испытаний; это составной рекомбинантный белок, ориентированный на предотвращение инфекции путем инактивации рецепторов клетки, коварно позволяющих вирусной частице проникнуть внутрь. Исследование, опубликованное NexBio в 2009 году, сообщает, что Флюдаза эффективна против 11 осельтамивир-резистентных штаммов гриппа h2N1, включая пару штаммов с устойчивостью к занамивиру тоже. Согласно недавно представленным результатам второй фазы клинических испытаний, Флюдаза сокращает количество вирусных частиц в крови пациента уже на второй день терапии, что превосходит показатели осельтамивира и занамивира. Однако количество частиц слабо коррелирует с тем, насколько остро протекает заболевание, что делает представленные выводы достаточно противоречивыми.
Каждое лекарство от гриппа имеет свои недостатки. Комбинирование препаратов может быть лучшей стратегией борьбы с вирусом, и в ряде случаев даже позволить преодолеть резистентность. Компания Adamas Pharmaceuticals (Эмеривилль, Калифорния, США) разрабатывает стратегию лечения, основанную на сочетании осельтамивира, амантадина (считающегося устаревшим) и рибавирина (еще одного противовирусного препарата, применяемого для лечения гепатита С). В культурах клеток эта комбинация работала лучше, чем любая из пар по отдельности, и даже была способна подавлять вирусную активность штаммов, устойчивых к осельтамивиру. Никто точно не знает, как эти три препарата работают вместе. Возможно, механизм «тройного удара» — добить вирусы, ускользнувшие от действия двух других препаратов.
В апреле 2010 г. Adamas опубликовали результаты пилотного исследования своего трехкомпонентного препарата, проведенного на выборке из семи пациентов с ослабленным иммунитетом. Пять из шести пациентов среагировали на тройное лечение на десятый день терапии. У одного из пациентов улучшения не произошло и через 20 дней. Национальный институт аллергии и инфекционных болезней США (Бетесда, Мериленд, СЩА) набирает 720 добровольцев для второй стадии испытаний эффективности тройной терапии от Adamas. Тестироваться будут пациенты с острыми заболеваниями, такими как сердечная и легочная недостаточность, делающими их более уязвимыми перед осложнениями гриппа.
Прорабатываются и другие возможности. Недавно ученые из Исследовательского института Скриппс (Ла Хойя, Калифорния, США) заразили подопытных мышей летальной дозой вируса гриппа, а затем ввели части животных соединения, ингибирующие синтез цитокинов — сигнальных молекул, привлекающих Т-лимфоциты и другие компоненты иммунной системы к месту заражения. Мыши, получившие блокаторы цитокинов в сочетании с осельтамивиром, почти все выжили (96%), тогда как при одном осельтамивире выживаемость была 50%, а без лечения — 21%. Это указывает, что урон, причиняемый гриппом организму, не столько последствие действий самого вируса, сколько результат гиперактивного ответа со стороны иммунной системы [4], [5]. «Цитокиновые штормы», запущенные избытком сигнальных молекул, могут нанести организму существенный вред. Подозревают, что этот феномен ответственен за существенную часть жертв пандемии гриппа 1918 года [6].
Несмотря на такие многообещающие успехи, нацеливание на пациента, а не на вирус, влечет новые риски. «Когда вы „тюнингуете“ иммунную систему, есть опасность не скорректировать иммунный ответ, а полностью отключить его, — объясняет Дин Блумберг (Dean Blumberg), глава отдела детских инфекционных болезней (Дэвис, Университет Калифорнии, США). — Если переборщить, можно усугубить проблему „цитокиновых штормов“ и даже оставить организм беззащитным перед другими патогенами».
Блумберг говорит, что некоторые пациенты просто пожимают плечами, когда речь заходит об антивирусной терапии, отмечая, что болезнь, скорее всего, пройдет и сама. В большинстве случаев ингибиторы нейраминидазы сокращают срок протекания заболевания лишь на один день. И это при условии, что лекарство было принято в течение 48 часов после появления первых симптомов. Но все же, «как врач и как отец», Блумберг рекомендует пройти антивирусный курс, чтобы сократить срок болезни.
…Пока эпидемия птичьего или свиного гриппа далеко, такое пристальное внимание к разнообразным антивирусным препаратам может показаться излишней предосторожностью. Но когда воюешь с вирусами не понарошку, хорошая подготовка, полученная в мирное время, очень пригодится на поле брани.
Написано по материалам Nature Outlook Influenza [1].
- Roxanne Palmer. (2011). Drugs: Lines of defence. Nature. 480, S9-S10;
- «Костыль» для нейраминидазы;
- Победить «дракона»;
- Ваши личные счеты с гриппом;
- Молекулярное двурушничество: гены человека работают на вирус гриппа;
- Объяснена различная вирулентность вирусов гриппа — возбудителей «испанки».
biomolecula.ru
Ингибиторы нейраминидазы для профилактики и лечения гриппа у здоровых взрослых и детей
Осельтамивир и занамивир были складированы во многих странах для лечения и профилактики сезонного и пандемического гриппа, [чтобы использовать] до того как вакцина против гриппа, соответствующая циркулирующему вирусу, станет доступной. Осельтамивир классифицируется Всемирной организацией здравоохранения как основное (жизненно-важное) лекарственное средство.
Какие подходы к этому обзору использовались
Мы обновили и объединили наши обзоры по противовирусным средствам занамивир и осельтамивир при гриппе у взрослых и детей на основании отчетов производителей в регуляторные органы (отчеты о клинических исследованиях) и комментариев регуляторов. Мы назвали эти комментарии и отчеты «регуляторная информация’. Отчеты о клинических исследованиях не опубликованы, это обширные документы с очень подробными деталями испытаний, которые сформировали базу для маркетингового одобрения. Они включают в себя протоколы, методы и результаты. Отчеты о клинических исследованиях до сих пор были конфиденциальными, их видели только производители и регуляторы.
Почему мы предприняли этот подход
В предыдущих версиях этого обзора мы выявили неразрешенные несоответствия в данных, представленных в опубликованных отчетах по клиническим испытаниям, и существенную предвзятость публикаций (публикационное смещение). Исходя из этого, мы решили не использовать данные из журнальных статей, а включили документы, созданные во время процессов лицензирования (маркетингового одобрения). Мы получили доступ к таким данным из Великобритании, США, Европейского лекарственного агентства (EMA), от японских регуляторов и к отчетам по клиническим исследованиям от производителей (после затяжной кампании в средствах массовой информации). Это позволило нам проверить информацию из рандомизированных плацебо-контролируемых клинических испытаний на взрослых и детях с подтвержденным или предполагаемым контактом с естественно встречающимся гриппом.
Исходя из наших оценок регуляторных документов (более 160 000 страниц), мы пришли к выводу, что были существенные проблемы с дизайном, проведением, отчетностью и доступностью информации во многих из этих клинических испытаний.
Что мы нашли
Мы использовали в этом обзоре данные из 46 клинических испытаний (20 по осельтамивиру и 26 исследований по занамивиру). Мы определили проблемы в дизайне многих исследований, которые мы включили, и которые отразились на нашей уверенности в их результатах. Мы обнаружили, что оба лекарства сокращали продолжительность симптомов гриппоподобного заболевания (неподтвержденный грипп или «грипп») менее, чем на один день. Осельтамивир, на основании данных от всех людей, включенных в клинические испытания по лечению осельтамивиром, не влиял на число госпитализаций. Клинические испытания по занамивиру этот исход не регистрировали. Сообщения о влиянии на пневмонии и другие осложнения гриппа, такие как бронхит, инфекции среднего уха (средний отит) и синуситы, были не надёжны, как показали истории болезни по документам клинического испытания. Некоторые формы показали ограничения (проблемы) диагностических критериев пневмонии. Регуляторные комментарии отметили проблемы с недостающими дневниками наблюдения у участников. У детей с астмой не было ясного влияния на время до первого облегчения симптомов.
Клинические испытания по профилактике (заболевания) показали, что осельтамивир и занамивир снижали риск симптоматического гриппа у отдельных лиц и в семье. Не было доказательств влияния на бессимптомный грипп или на не грипп, на гриппоподобные заболевания, но проблемы в проведении испытаний препятствуют любому определённому заключению.
Применение осельтамивира было связано с тошнотой, рвотой, головными болями, почечными и психиатрическими событиями; последние три случались, когда его [осельтамивир] применяли для профилактики гриппа. Его [осельтамивира] действие на сердце остается неясным: он может уменьшать симптомы со стороны сердца, но может и вызывать серьезные проблемы сердечного ритма. В клинических испытаниях занамивира у взрослых не было повышенного риска по сообщённым неблагоприятным событиям. Свидетельства возможного вреда, связанного с лечением детей занамивиром, были разрозненные.
Соответствие другим результатам
Отсутствие качественных доказательств, демонстрирующих влияние на осложнения [гриппа], согласуется с осторожными выводами по обоим лекарствам, сделанными Администрацией по контролю за лекарствами и пищевыми продуктами США (FDA). FDA разрешила заявления только по эффективности обоих лекарств в профилактике и лечении симптомов гриппа, но не по другим эффектам (в том числе прерывание распространения вируса от человека к человеку или профилактика пневмонии). FDA описала эффективность обоих препаратов в целом, как «скромную».
Механизм развития благоприятных эффектов
Эти результаты позволяют предположить, что низкий иммунный ответ с низким уровнем прововоспалительных цитокинов, вызванный действием осельтамивира карбоксилата, может уменьшать симптомы гриппа, не связанные с подавлением размножения (репликации) вируса гриппа. Потенциальный гипотермический или жаропонижающий эффект осельтамивира как депрессанта центральной нервной систем, также может вносить вклад в очевидное сокращение симптомов пораженного организма. Заявления о способности осельтамивира прерывать передачу [от человека к человеку] вируса и уменьшать осложнения не поддерживаются никакими данными, к которым мы имели доступ.
Механизм действия, предложенный производителем, (специфичный для вируса гриппа) не соответствует клиническим доказательствам, что позволяет предполагать мультисистемное и центральное действие.
www.cochrane.org
