Гастроинтестинальная стромальная опухоль (GIST) — ФГБУ «Национальный медицинский исследовательский центр хирургии имени хирургии им. А.В. Вишневского»
Распространенность и локализация
Гастроинтестинальная стромальная опухоль (GIST) составляет примерно 1% от всех злокачественных опухолей желудочно-кишечного тракта, но 80% от сарком данной локализации. В последние два десятилетия заболеваемость в странах Европы и Северной Америки выросла в 2-3 раза.
GIST могут развиваться в любом отделе пищеварительного тракта, но с разной частотой: в желудке – 60%; в тонкой кишке – 25%; в толстой кишке — 8%; в прямой кишке – 5%; в пищеводе – 2%.
GIST имеют сходство с гладкомышечными (лейомиомами, лейомиосаркомами) и нейрогенными (шваномами) опухолям. Однако принципиальные особенности, выявляемые при иммуногистохимическом исследовании, позволяют выделить эти опухоли в отдельную нозологическую группу.
Все виды GIST потенциально злокачественны и метастазируют преиму-щественно гематогенным путем.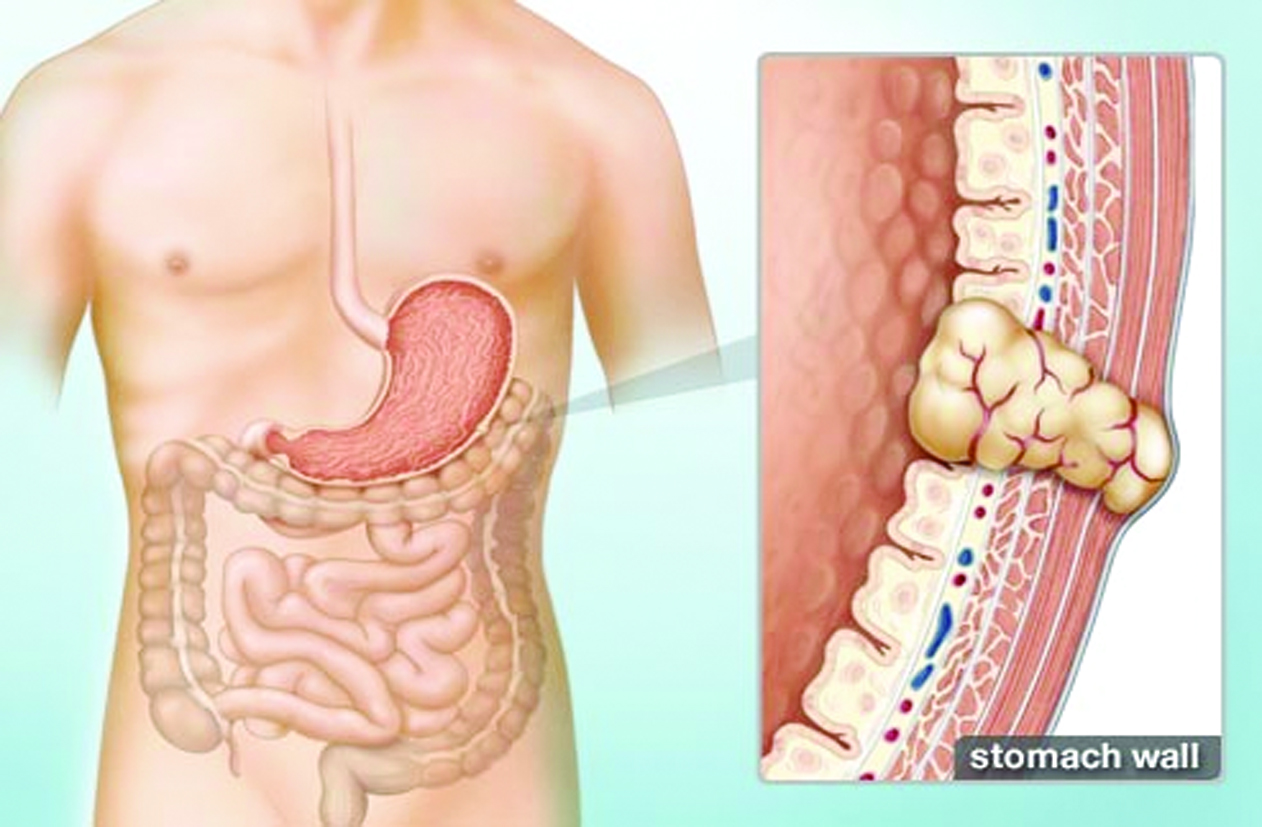 Злокачественный потенциал опухоли зависит от ее локализации, размера и показателя митотической активности клеток. Так, опухоли размером 2-5 см обладают низким злокачественным потенциалом, то образования диаметром более 10 см — высоким
Злокачественный потенциал опухоли зависит от ее локализации, размера и показателя митотической активности клеток. Так, опухоли размером 2-5 см обладают низким злокачественным потенциалом, то образования диаметром более 10 см — высоким
Наиболее часто метастазы обнаруживают в печени (60%), на брюшинном покрове (30%), в костях (6%) и в легких (2%). Регионарные лимфоузлы поражаются редко (6-8%). Именно это обстоятельство позволяет рассчитывать на радикальное вмешательство даже при опухолях больших размеров.
GIST представляют собой внутристеночный (подслизистый) узел, кото-рый вдается в просвет органа (склонны к экзофитному, экстраорганному росту).
Жалобы и симптомы
Специфических проявлений GIST не существует.
На ранних стадиях большинство GIST остаются нераспознанными. Более того, даже большие по размерам опухоли могут никак себя не проявлять и протекать бессимптомно.
Основными симптомами GIST являются дискомфорт и боль в животе , тошнота, потеря массы тела, общее недомогание, быстрая утомляемость.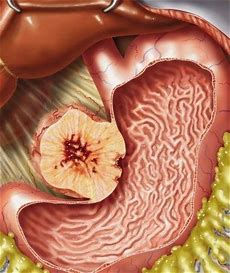
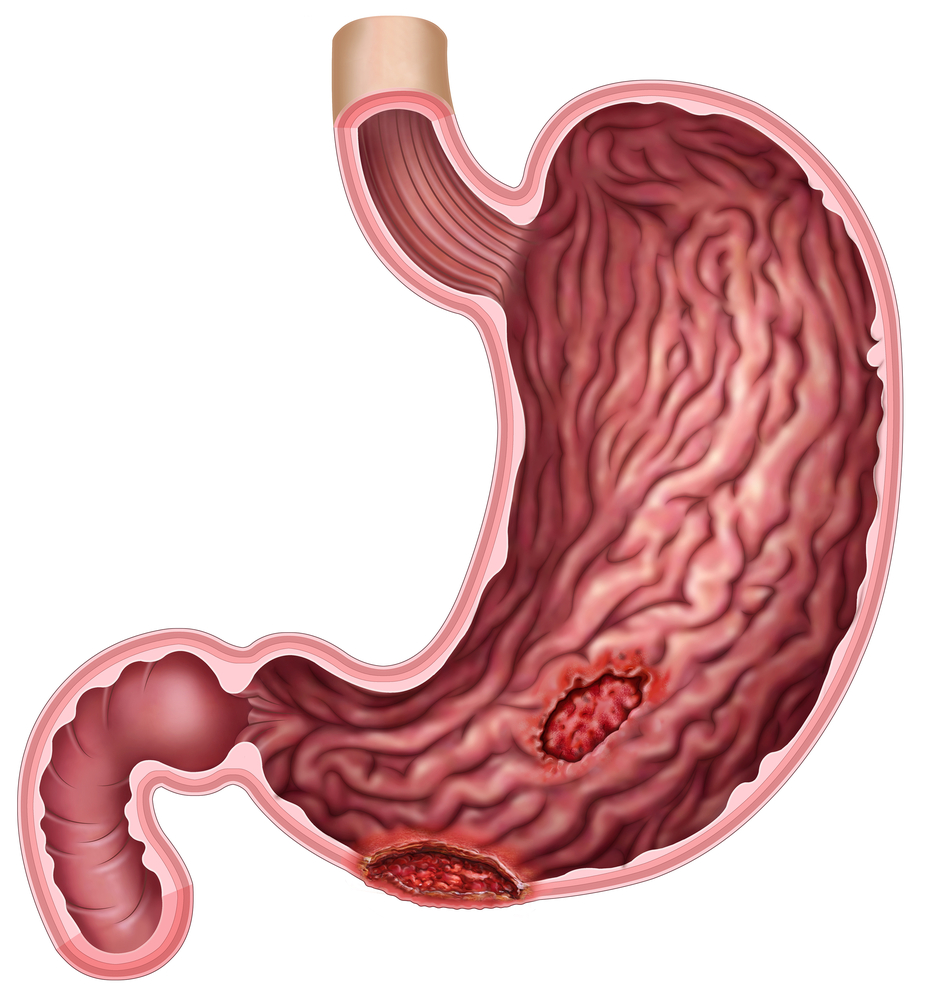
Над опухолевым узлом на слизистой оболочке может образоваться язва и послужить источником желудочно-кишечного кровотечения (от скрытого до массивного). После этого естественно развивается вторичная железодефицитная анемия. GIST при прорастании серозного покрова может также изъязвится и стать источником внутрибрюшного кровотечения.
Опухоль антрального отдела желудка может вызвать стеноз выходного отдела желудка
Диагностика
Примерно 20% опухолей являются случайной находкой при стандартных контрастной рентгенографии желудка и эзофагогастродуоденоскопии (в сочетании с эндосонографией). В обязательном порядке берут тонкоигольную бипсию опухоли для гистологического, иммуногистохимического и молекулярногенетического анализа.
При выявлении опухоли подозрительной на GIST показана рентгеновская компьютерная томография брюшной полости с внутривенным контрастированием.
Окончательная верификация диагноза GIST проводится только при им-муногистохимическом (специфический маркер — CD 117) и молекулярно-генетическом анализах биопсийного материала.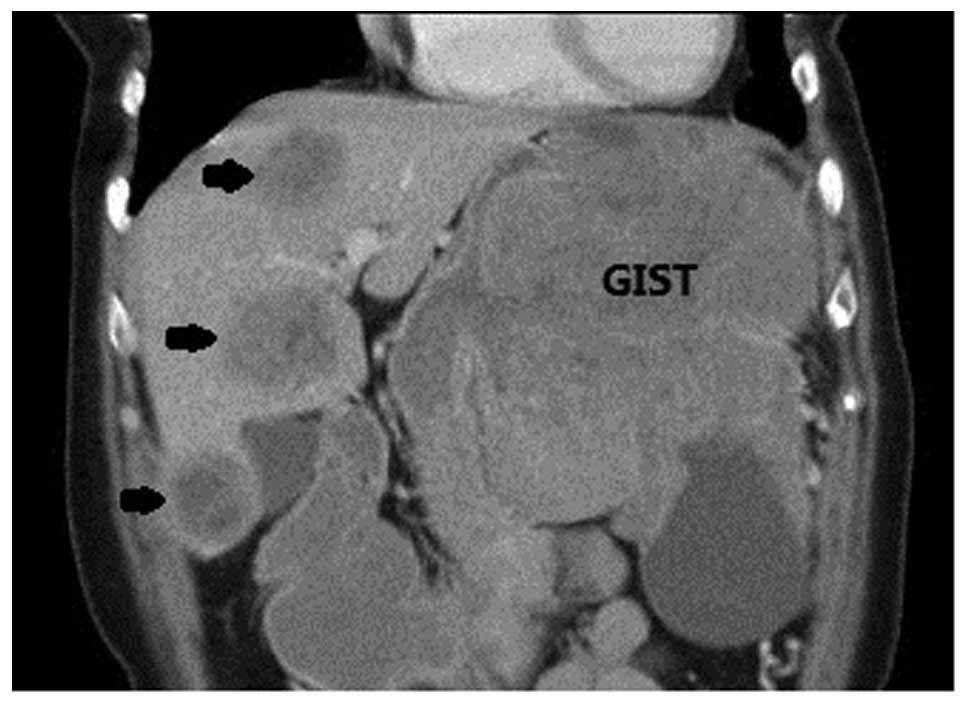
Лечение
Сегодня основным методом лечения GIST является хирургический, при котором стремятся максимально радикально удалить опухолевые узлы. После радикальной операции пациенты несколько лет находятся под наблюдением специалистов с тщательным обследованием 2 раза в год. Распространенные формы заболевания (неудалимые опухоли и/или отдаленные метастазы) достаточно успешно лечат консервативно современным системным химиотерапевтическим препаратом — иматинибом (Гливеком). В настоящее время обсуждается вопрос о целесообразности комбинированного (операция + Гливек) лечения GIST.;
На практике тактика лечения GIST всегда выбирается индивидуально в каждом случае. Так, за опухолями диаметром до 2,0 см наблюдают с контрольными эндоскопическим исследованием 1-2 раза в год. От вылущивания даже небольших опухолей воздерживаются из-за угрозы распространения злокачественных клеток по брюшине. Опухоль более 2,0 см – служит показанием к операции.
Резекцию желудка выполняют в стандартном объеме в пределах здоро-вых тканей – отступя не менее 2,0 см от края опухоли.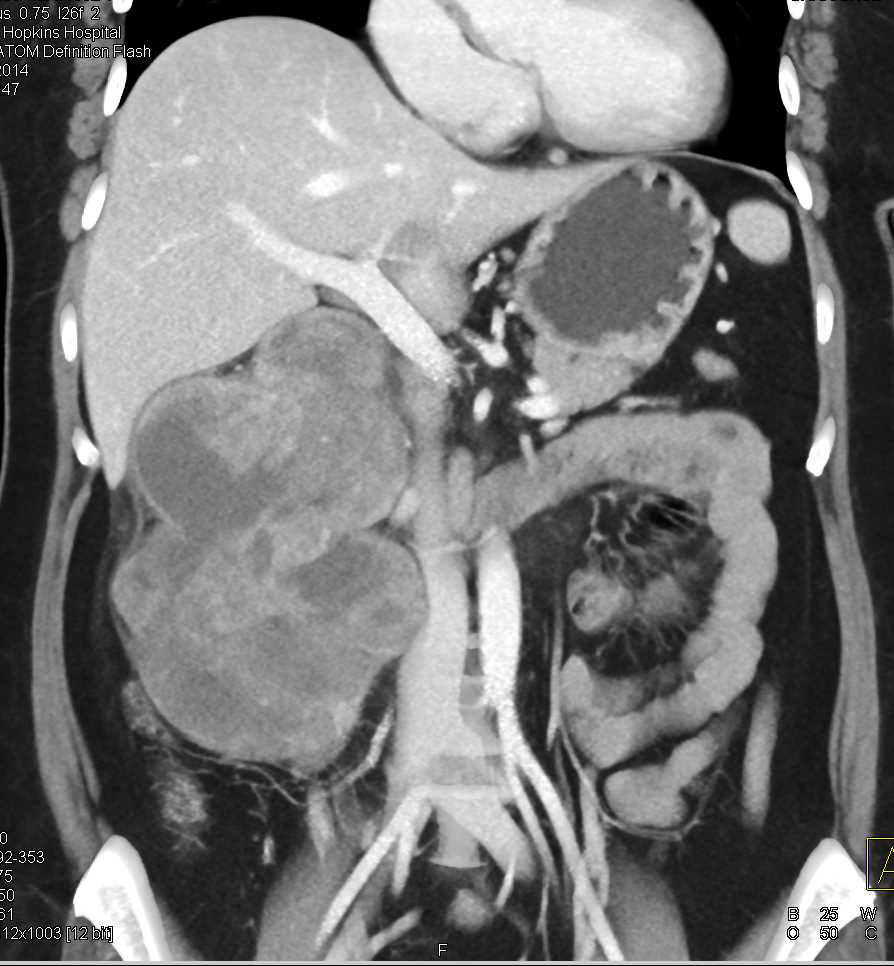 При гигантских опухолях выполняют гастрэктомию. Резекцию органа предпочтительнее дополнять удалением регионарных лимфоузлов (лимфодисекцией).
При гигантских опухолях выполняют гастрэктомию. Резекцию органа предпочтительнее дополнять удалением регионарных лимфоузлов (лимфодисекцией).
ЛЕЧЕНИЕ СТРОМАЛЬНЫХ ОПУХОЛЕЙ ЖЕЛУДОЧНОКИШЕЧНОГО ТРАКТА (GIST) — Онкология
ВВЕДЕНИЕ
GIST (gastrointestinal stromal tumors) представляют собой гетерогенную группу c-Kit-позитивных мезенхимальных (стромальных или соединительнотканных) опухолей со специфическими гистологическими характеристиками, которые поражают желудочнокишечный тракт (ЖКТ). В 10–30% первичных случаев диагностируют злокачественные GIST, хотя во всех остальных случаях опухоли также обладают злокачественным потенциалом [1, 2]. Термин «GIST» предложен в 1983 г. М. Mazur и Н. Clark для описания лейомиом и лейомиосарком, имеющих признаки гладкомышечной и нейрогенной дифференцировки. Ключевым моментом в появлении GIST как самостоятельной нозологической единицы стало открытие мутации в гене c-Kit в некоторых мезенхимальных и нейрогенных опухолях, экспрессирующих маркер CD-117. С-Kit — это тирозинкиназный рецептор на клеточной мембране, который связывает фактор роста, называемый стволовым клеточным фактором (SCF), что приводит к активации комплекса внутриклеточных сигналов, результатом которых является стимуляция митотической активности и пролиферация клеток. Таким образом, GIST, экспрессирующие СD-117, обладают совокупностью гистологических и иммуногистохимических признаков, которые отличают их от других гладкомышечных и нейрогенных новообразований, а основной механизм, ответственный за развитие GIST — гиперэкспрессия клетками опухоли тирозинкиназного рецептора с-Kit (CD-117) и его гиперактивация [2–4]. Гладкомышечные и нейрогенные опухоли, не экспрессирующие СD-117, по результатам световой и электронной микроскопии подразделяются на лейомиомы, лейомиосаркомы и шванномы.
С-Kit — это тирозинкиназный рецептор на клеточной мембране, который связывает фактор роста, называемый стволовым клеточным фактором (SCF), что приводит к активации комплекса внутриклеточных сигналов, результатом которых является стимуляция митотической активности и пролиферация клеток. Таким образом, GIST, экспрессирующие СD-117, обладают совокупностью гистологических и иммуногистохимических признаков, которые отличают их от других гладкомышечных и нейрогенных новообразований, а основной механизм, ответственный за развитие GIST — гиперэкспрессия клетками опухоли тирозинкиназного рецептора с-Kit (CD-117) и его гиперактивация [2–4]. Гладкомышечные и нейрогенные опухоли, не экспрессирующие СD-117, по результатам световой и электронной микроскопии подразделяются на лейомиомы, лейомиосаркомы и шванномы.
Принципы диагностики GIST, их лечения и оцен-
ки его эффективности активно обсуждаются на протяжении последних лет. В марте 2005 г. впервые опубликованы рекомендации международного соглашения, принятого ведущими специалистами Европы, Японии, Австралии. В разработке рекомендаций приняли участие морфологи, молекулярные биологи, рентгенологи, хирурги, медицинские онкологи, врачи общей практики. Согласно этим рекомендациям диагноз GIST должен быть установлен мор-
В разработке рекомендаций приняли участие морфологи, молекулярные биологи, рентгенологи, хирурги, медицинские онкологи, врачи общей практики. Согласно этим рекомендациям диагноз GIST должен быть установлен мор-
фологически до начала лечения (хирургического или лекарственного). При обычном морфологическом исследовании большинство GIST могут быть классифицированы как веретеноклеточный (70%), эпителиоидный (20%) и смешанный (10%) варианты.
Наиболее часто GIST выявляют в желудке (60– 70%), за ним следует тонкая кишка (25–35%), толстая кишка (5%), пищевод и аппендикс (< 2%). GIST также определяют в сальнике, брыжейке кишечника и забрюшинном пространстве. Число внеорганных GIST может быть больше, чем предполагалось ранее. Например, некоторые авторы указывают на то, что в ⅓ случаев забрюшинные лейомиосаркомы являются GIST. Тестирование экспрессии c-Kit в опухолях брюшной полости очень важно для уверенности в правильной тактике лечения [5, 6]. Риск развития заболевания повышается после 40 лет.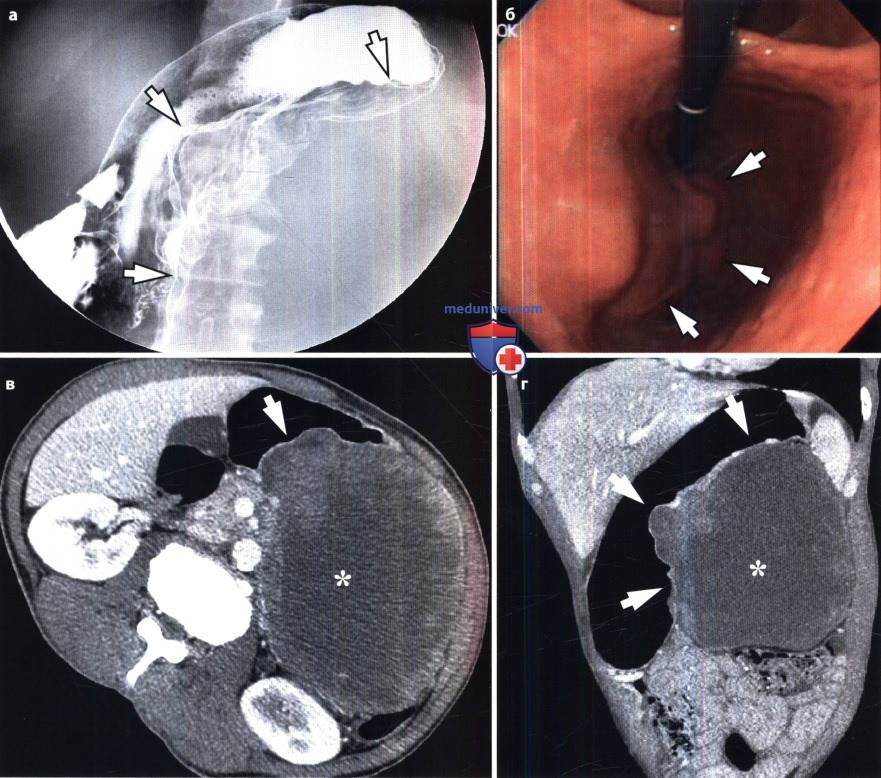 Средний возраст составляет 55–60 лет. Клиническая картина стромальных опухолей не имеет специфических симптомов, более 90% из них являются злокачественными [5, 7].
Средний возраст составляет 55–60 лет. Клиническая картина стромальных опухолей не имеет специфических симптомов, более 90% из них являются злокачественными [5, 7].
Результаты проведенных клинических исследований свидетельствуют, что около 30% GIST размером более 5 см — быстро растущие опухоли, часто инфильтративные, с наличием метастазов. Эти опухоли имеют высокий митотический индекс, как правило, Ki67-позитивны. Более важным критерием, легко доступным в использовании, является гистологически определяемая митотическая активность. Объем
< 5 митозов на 50 полей обычно используют как границу доброкачественного поведения опухоли, но согласно ряду исследований, этот показатель пригоден для сравнения между доброкачественными и злокачественными опухолями желудка, но не кишечника. GIST в тонком кишечнике более склонны к метастазированию, чем опухоли в желудке, даже если эти опухоли имеют малый размер и относительно низкий митотический индекс. Среди митотически неактивных опухолей имеется незначительная часть опухолей, которые поздно метастазируют, что свидетельствует о том, что низкий митотический уровень не исключает возможности злокачественного поведения. Опухоли с объемом > 5 митозов на 50 полей обычно рассматриваются как высокозлокачественные. Однако по этому критерию только очень незначитель-
Опухоли с объемом > 5 митозов на 50 полей обычно рассматриваются как высокозлокачественные. Однако по этому критерию только очень незначитель-
ная часть GIST является высокозлокачественными, а большинство GIST обладают низкой степенью злокачественности и растут медленно, а рецидивы и метастазы развиваются годами — иногда 10–15 лет после первичной операции [5, 8].
Опухоли, которые имеют высокую митотическую активность, достигающую 5/50 полей, или опухоли размером > 5 см имеют высокую частоту интраабдоминальных рецидивов и метастазов в печени. В противоположность с этим, опухоли < 2 см и опухоли, у которых митотическая активность < 5/50 полей, весьма вероятно являются доброкачественными. Эти диагностические критерии создают трудноуловимую границу, которая отделяет доброкачественные и злокачественные области [5, 9].
Хирургическое лечение. Ведущим методом лечения, позволяющим надеяться на полное выздоровление, является хирургический. Стандарт операции — радикальное удаление опухолевых очагов единым блоком с морфологически негативными краями резекции (R0). При опухолевых клетках по линии разреза (R1) показана ре-резекция. При оставлении каких-либо участков ткани показатель резектабельности снижается с 55 до 40%. При характерном для GIST местном обсеменении брюшины опухолью рекомендуется выполнять локальную перитонеумэктомию. Большинство авторов не рекомендуют выполнять регионарную лимфоаденэктомию, поскольку GIST редко распространяются в лимфатические узлы [1, 10, 11]. Однако при локализации опухоли в области прямой кишки, случаи метастазирования в регионарные лимфоузлы наблюдают достаточно часто (25–30%), что обусловливает необходимость выполнения лимфаденэктомии [12].
При опухолевых клетках по линии разреза (R1) показана ре-резекция. При оставлении каких-либо участков ткани показатель резектабельности снижается с 55 до 40%. При характерном для GIST местном обсеменении брюшины опухолью рекомендуется выполнять локальную перитонеумэктомию. Большинство авторов не рекомендуют выполнять регионарную лимфоаденэктомию, поскольку GIST редко распространяются в лимфатические узлы [1, 10, 11]. Однако при локализации опухоли в области прямой кишки, случаи метастазирования в регионарные лимфоузлы наблюдают достаточно часто (25–30%), что обусловливает необходимость выполнения лимфаденэктомии [12].
Показатель резектабельности для GIST зависит от типа заболевания. При первичном заболевании по наблюдению исследователей число резекций составляет 70–86%. В целом резекция злокачественных GIST редко является радикальной, поскольку рецидивы заболевания наблюдаются очень часто. Показатель числа рецидивов заболевания у пациентов с локальным заболеванием составляет 35%, в то время как у пациентов с местно-распространенным (диссеминированным) заболеванием этот показатель достигает 90% после резекции. Печень является наиболее частым местом метастазирования опухоли, в половине всех случаев возникают местные рецидивы заболевания, в 15% случаев — экстраабдоминально [13].
Печень является наиболее частым местом метастазирования опухоли, в половине всех случаев возникают местные рецидивы заболевания, в 15% случаев — экстраабдоминально [13].
5-летняя выживаемость после хирургической резекции у пациентов значительно варьирует. Многие из исследований включают пациентов, наблюдаемых за период больше 20 лет, и редко включают более 100 пациентов. Например, в исследовании MDACC из 197 пациентов, наблюдаемых в 1957–1997 гг., только 99 были подвержены резекции, при этом показатель 5-летней выживаемости составил 48%; в других исследованиях показатели 5-летней выживаемости варьировали от 35 до 65% [7, 10, 14, 15]. Прогноз течения заболевания после резекции определяют различные факторы: размер опухоли, митотический индекс, ло-
кализация. Опухоль меньше 5 см в диаметре ассоциируется с лучшей выживаемостью. Опухоли с митотическим индексом ниже 5/50 полей также показывают лучшую выживаемость. GIST, с локализацией в желудке, ассоциированы с лучшей выживаемостью, чем GIST с локализацией в тонком кишечнике.
Радикальная хирургическая резекция опухоли до настоящего времени является единственным методом лечения, который может полностью излечить пациента. Однако даже у больных после радикального удаления опухоли имеется высокий риск возникновения местного рецидива опухоли в брюшной полости. Данные о среднем времени возникновения рецидивов широко варьируют по результатам ряда авторов (7–24 мес). Однако в литературе имеются сведения о возникновении рецидивов GIST спустя более 20 лет после первичного хирургического лечения, что свидетельствует о необходимости длительного наблюдения больных. В случае нерезектабельной опухоли медиана выживаемости пациентов коротка и составляет от 10 до 21 мес. Вероятность рецидивов достигает 100% после повторных операций по поводу метастазов опухоли с медианой прогрессии менее чем 4 мес [7, 11, 16, 17].
Лекарственная терапия. Результаты лечения пациентов с GIST кардинально изменились с 2000 г., после внедрения в клиническую практику иматиниба — специфического ингибитора тирозинкиназной активности c-Kit-рецептора, ставшего великолепным примером возможностей целенаправленной терапии.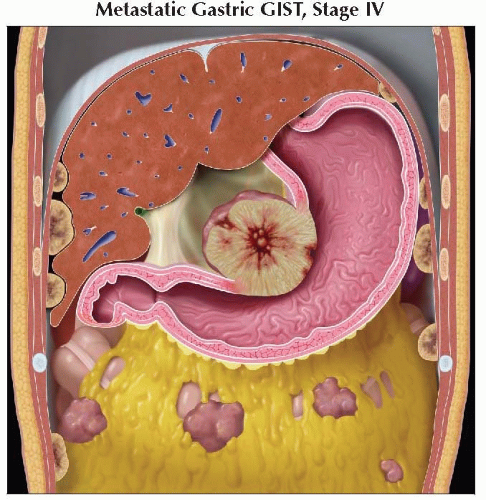 Появилась возможность специфического патогенетического лечения этим препаратом, показавшим свою эффективность в качестве препарата адъювантной терапии у 80% больных. Основным механизмом действия иматиниба является блокирование связывания АТФ с ферментами, что приводит к ингибированию активности киназ. Иматиниб принимается внутрь, пожизненно, обладает низкой токсичностью. Общая эффективность лечения при распространенных формах заболевания составляет порядка 50–60%, стабилизация процесса наблюдается у каждого 3-го больного. Среднее время достижения ремиссии при дозе 400 мг/сут составляет 13 нед, медиана ремиссии — 24 нед. Применение иматиниба в клинической практике значительно повысило эффективность лечения указанных новообразований с увеличением общей выживаемости до 36 мес [15, 18–20].
Появилась возможность специфического патогенетического лечения этим препаратом, показавшим свою эффективность в качестве препарата адъювантной терапии у 80% больных. Основным механизмом действия иматиниба является блокирование связывания АТФ с ферментами, что приводит к ингибированию активности киназ. Иматиниб принимается внутрь, пожизненно, обладает низкой токсичностью. Общая эффективность лечения при распространенных формах заболевания составляет порядка 50–60%, стабилизация процесса наблюдается у каждого 3-го больного. Среднее время достижения ремиссии при дозе 400 мг/сут составляет 13 нед, медиана ремиссии — 24 нед. Применение иматиниба в клинической практике значительно повысило эффективность лечения указанных новообразований с увеличением общей выживаемости до 36 мес [15, 18–20].
Лечение распространенных форм заболевания предполагает назначение иматиниба сразу после установления диагноза GIST. Лечение проводят до прогрессирования заболевания или развития побочных эффектов (когда возможно снижение дозы).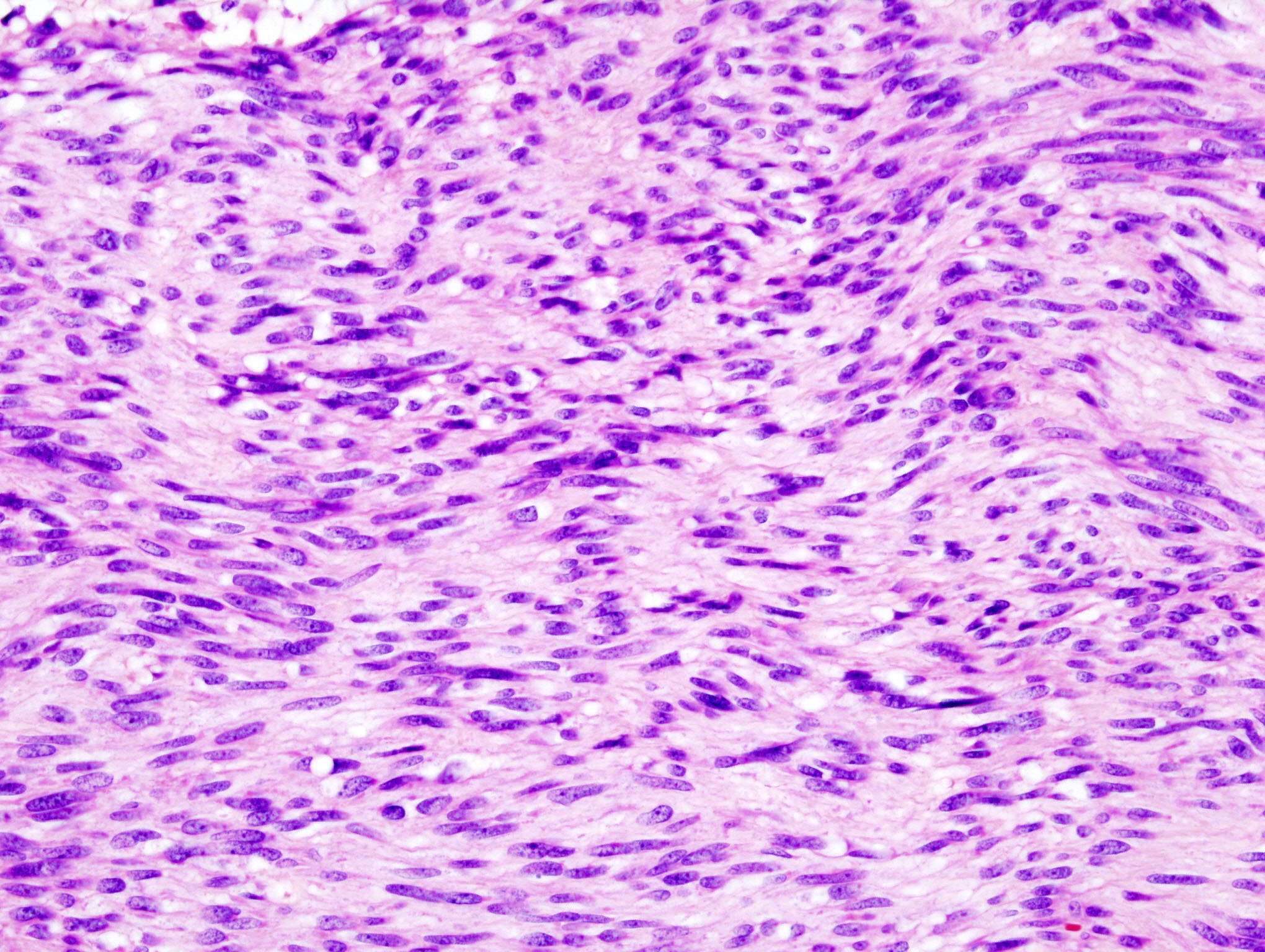 Рекомендованная суточная доза составляет 400 мг. При развитии (частичной) резистентности показано повышение суточной дозы до 800 мг [15]. К лечебным ответам при терапии больных GIST относят не только полную или частичную регрессию опухолевых очагов, но и стабилизацию заболевания, а также снижение плотности опухолевых очагов по данным компьютерной томографии
Рекомендованная суточная доза составляет 400 мг. При развитии (частичной) резистентности показано повышение суточной дозы до 800 мг [15]. К лечебным ответам при терапии больных GIST относят не только полную или частичную регрессию опухолевых очагов, но и стабилизацию заболевания, а также снижение плотности опухолевых очагов по данным компьютерной томографии
и снижение метаболической активности по данным позиционно-эмиссионной томографии. Для ряда пациентов стабилизация заболевания или даже небольшое увеличение размеров опухолевых очагов ассоциируется с морфологическим ответом на терапию иматинибом, причем общая продолжительность жизни в этой группе аналогична показателям выживаемости после объективных ответов или стабилизации процесса.
Методы лечения при метастатических и рецидивных GIST ограничены. Лучевая терапия редко используется в лечении больных GIST из-за высокой радиорезистентности этих опухолей и высокой лучевой чувствительности прилежащих органов. Несмотря на низкий уровень терапевтического ответа, большинство пациентов с метастатическими GIST подвергаются многочисленным курсам химиотерапии (ХТ) из-за отсутствия других методов лечения.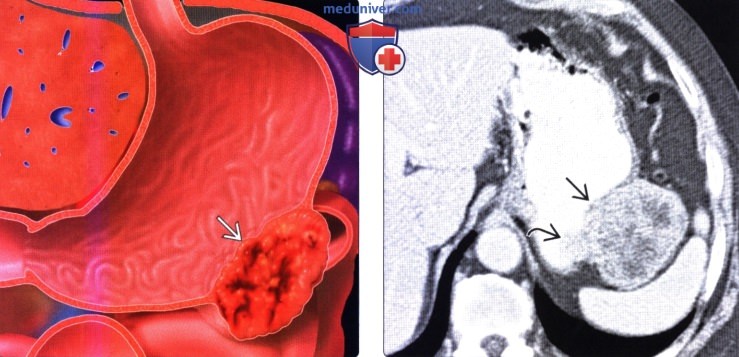 Существуют разнообразные режимы применения различных ХТ-препаратов (таких как доксорубицин, дакарбазин и т.д.), интерферона-α, но в целом результаты минимальны или совсем негативны. Несмотря на самые агрессивные схемы системной ХТ, средняя выживаемость у неоперабельных и метастатических больных с GIST остается менее 2 лет. Эффективность ХТ не превышает 10%, а общая выживаемость составляет 8–9 мес [1, 9, 15, 16]. Проблема также состоит в необходимости определения, можно ли провести выборку внутри популяции GIST-пациентов, определяющую, кому следует, а кому не следует получать агрессивную терапию после первичной хирургической резекции.
Существуют разнообразные режимы применения различных ХТ-препаратов (таких как доксорубицин, дакарбазин и т.д.), интерферона-α, но в целом результаты минимальны или совсем негативны. Несмотря на самые агрессивные схемы системной ХТ, средняя выживаемость у неоперабельных и метастатических больных с GIST остается менее 2 лет. Эффективность ХТ не превышает 10%, а общая выживаемость составляет 8–9 мес [1, 9, 15, 16]. Проблема также состоит в необходимости определения, можно ли провести выборку внутри популяции GIST-пациентов, определяющую, кому следует, а кому не следует получать агрессивную терапию после первичной хирургической резекции.
По окончании III фазы рандомизированных исследований, начатых в марте 2001 г. в 56 медицинских центрах Европы и Австралии при координации EORTC Soft Tissue and Bone Sarcoma Group, в 2008 г. на АSCO было доложено о целесообразности применения адъювантной терапии иматинибом после радикального хирургического удаления опухолевых очагов. Получено повышение безрецидивной выживаемости в группе больных с размером опухоли > 3 см. Проводятся исследования по оценке эффективности иматиниба в неоадъювантном режиме с последующим хирургическим лечением и адъювантной терапией тем же препаратом. [21]. Таким образом, терапия иматинибом может остановить и обратить рост GIST у большинства пациентов. Это первая эффективная системная терапия 1-й линии у пациентов с неоперабельными GIST. Более того, понимание механизма его действия является основой дальнейших исследований сигнальной трансдукции в патогенезе рака.
Проводятся исследования по оценке эффективности иматиниба в неоадъювантном режиме с последующим хирургическим лечением и адъювантной терапией тем же препаратом. [21]. Таким образом, терапия иматинибом может остановить и обратить рост GIST у большинства пациентов. Это первая эффективная системная терапия 1-й линии у пациентов с неоперабельными GIST. Более того, понимание механизма его действия является основой дальнейших исследований сигнальной трансдукции в патогенезе рака.
К сожалению, более 20% пациентов обладают первичной резистентностью к иматинибу, у большинства других спустя 18–26 мес развивается вторичная резистентность, связанная с вторичной мутацией Kit или PDGFR-альфа [22]. Непереносимость терапии иматинибом отмечают у 7%. Почти в 85% случаев при GIST определяют мутацию рецептора фактора роста стволовых клеток (Kit), в 5% случаев — мутацию PDGFR- альфа. Иматиниб — единственный препарат с доказанной высокой эффективностью при этой опухоли.
Еще одним препаратом целенаправленной терапии, который одобрен FDA (январь 2006 г.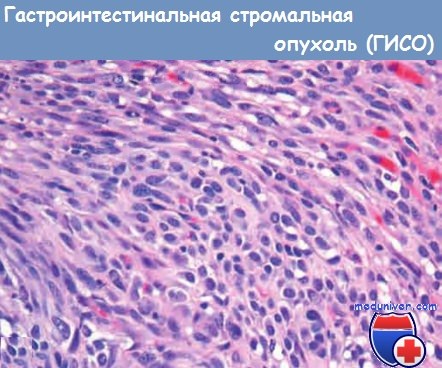 ), стал сунитиниб (Сутент® «Pfizer Inc.», США) — новый пероральный многоцелевой ингибитор тирозинкиназы, обладающий противоопухолевой и антиангиогенной активностью.
), стал сунитиниб (Сутент® «Pfizer Inc.», США) — новый пероральный многоцелевой ингибитор тирозинкиназы, обладающий противоопухолевой и антиангиогенной активностью.
Сунитиниб (Sutent, SU11248, SU011248, sunitinib, sunitinib malate) — низкомолекулярный ингибитор тирозинкиназы, способный поражать сразу несколько молекул, в частности рецепторы фактора роста эндотелия сосудов (VEGFR), рецепторы тромбоцитарного фактора роста (PDGFR), а также тирозинкиназы Kit и Flt3. VEGFR экспрессируется в клетках эндотелия, формирующих выстилку внутриопухолевой капиллярной сети. В свою очередь PDGFR представлен на поверхности перицитов, то есть клеток, формирующих каркас для эндотелиоцитов. VEGFR и PDGFR присутствуют в сосудистых компонентах практически всех типов опухолей, что обеспечивает потенциально широкий противоопухолевый спектр их ингибиторов. Предклинические данные свидетельствуют о том, что антиангиогенный эффект, ассоциированный с комбинированным поражением эндотелиоцитов и перицитов, выражен в значительно большей степени, чем при изолированном угнетении VEGFR-каскада в эндотелии посредством монотерапии VEGF-антителами (такими как бевацизумаб).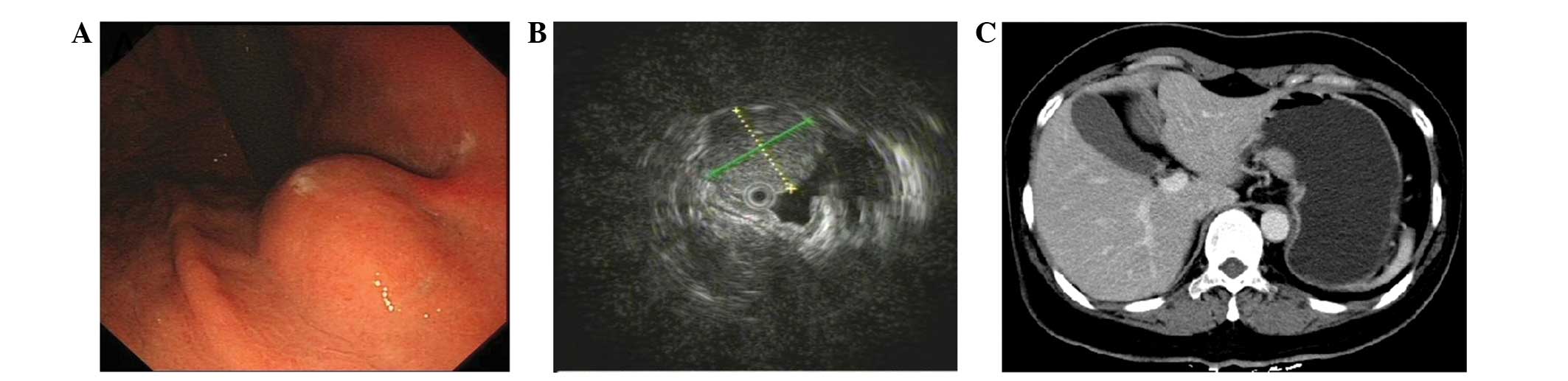 Kit является рецептором фактора роста SCF и экспрессируется в мелкоклеточных раках легкого, гастроинтестинальных стромальных опухолях (GIST), новообразованиях нейроэндокринного происхождения и т.д.
Kit является рецептором фактора роста SCF и экспрессируется в мелкоклеточных раках легкого, гастроинтестинальных стромальных опухолях (GIST), новообразованиях нейроэндокринного происхождения и т.д.
В исследовании I фазы [23] установлено, что время полувыведения препарата составляет 40 ч, а его активных метаболитов — около 80 ч. Препарат метаболизируется в печени изоферментом CYP 3A4 системы цитохрома Р450. Установлена лечебная доза препарата — 50 мг/сут, независимо от приема пищи. Сунитиниб принимают в течение 4 нед ежедневно с интервалом в 2 нед.
В исследование J.A. Morgan и соавторов [24] были включены 97 больных с гливекрезистентными GIST. Пациенты принимали сунитиниб в дозе 50 мг/сут в течение 4 нед с 2-недельным перерывом. Частичный эффект был зарегистрирован у 8% пациентов, стабилизация болезни более 6 мес — у 37%, а от 6 нед до 6 мес — у 32%. Медиана времени до прогрессирования составила 7,8 мес, общая выживаемость — 19,8 мес.
В исследовании III фазы участвовали 357 пациентов, получавших cунитиниб в обычном режиме или плацебо. При оценке эффективности препарата частичный эффект отмечали у 6,8% больных, стабилизацию более 22 нед — у 17,4% (0,0 и 1,9% соответственно в группе плацебо). Время до прогрессирования составило при применении сунитиниба – 27,3 нед против 6,4 нед при приеме плацебо (р < 0,0001). Медиана общей выживаемости не была достигнута [25]. Проявлениями токсичности III–IV степени были: повышение уровня липазы (13%), артериальная гипертензия (11%), слабость (8%),
При оценке эффективности препарата частичный эффект отмечали у 6,8% больных, стабилизацию более 22 нед — у 17,4% (0,0 и 1,9% соответственно в группе плацебо). Время до прогрессирования составило при применении сунитиниба – 27,3 нед против 6,4 нед при приеме плацебо (р < 0,0001). Медиана общей выживаемости не была достигнута [25]. Проявлениями токсичности III–IV степени были: повышение уровня липазы (13%), артериальная гипертензия (11%), слабость (8%),
диарея (4%), тошнота (4%), стоматит (1%).
Как и большинство многоцелевых препаратов, сунитиниб оказывает побочные эффекты, однако последние в большинстве случаев не превышают II или III степени тяжести. К наиболее характерным неблагоприятным последствиям применения препарата относятся утомляемость, гипертония, диарея, нейтропения, тромбоцитопения, депигментация волос, анорексия, а также осложнения со стороны ротовой полости [22, 25].
Как уже отмечено, сунитиниб ингибирует различные типы тирозинкиназных рецепторов, в частности рецепторы к PDGF, SCF, факторам роста эндотелия, колониестимулирующему и нейротрофическому факторам. То есть спектр мишеней, посредством которых сунитиниб реализует свое действие на рост опухоли, патологический ангиогенез и метастазирование, намного шире в сравнении с иматинибом. Больным с GIST сунитиниб назначают в случае неэффективности (2-я линия) или непереносимости терапии иматинибом [26, 27].
То есть спектр мишеней, посредством которых сунитиниб реализует свое действие на рост опухоли, патологический ангиогенез и метастазирование, намного шире в сравнении с иматинибом. Больным с GIST сунитиниб назначают в случае неэффективности (2-я линия) или непереносимости терапии иматинибом [26, 27].
Обобщая доступные в настоящее время данные, можно сказать, что новое направление лекарственного лечения — многоцелевая (multitarget) терапия молекулярного действия — имеет большой потенциал к развитию.
ЛИТЕРАТУРА
Sepe PS, Brugge WR. A guide for the diagnosis and management of gastrointestinal stromal cell tumors. Nat Rev Gastroenterol Hepatol 2009; 6 (6): 363–71.
Italiano A, Bui B. [Gastrointestinal stromal tumors: molecular aspects and therapeutic implications]. Bull Cancer 2008; 95 (1): 107–16.
Miettinen M, Majiadi M, Lasota J. Pathology and diagnostic criteria of gastrointestinal stromal tumors (GISTs): a review. EJС 2002; 38 (5): 39–50.

Demetri GD. Targeting c-kit mutations in solid tumors: scientific rationale and novel therapeutic options. Semin Oncol 2001; 28 (17): 19–26.
Nishida T, Hirota S. Biological and clinical review of stromal tumors in the gastrointestinal tract. Histol Histopathol 2000; 15: 1293–301.
Степанова ЕВ, Кешта РА, Бохян БЮ и др. Экспрессия с-Kit в саркомах мягких тканей: перспективы использования Гливек. Росс биотерапевт ж 2002; 4 (1): 21–3.
Steigen SE, Eide TJ. Gastrointestinal stromal tumors (GISTs): a review. APMIS 2009; 117 (2): 73–86.
Berman J, O̓Leary TJ. Gastrointestinal stromal tumor workshop. Hum Pathol 2001; 32: 578–82.
Pidhorecky I, Cheney RT. Kraybill WG, et al. Gastrointestinal stromal tumors: current diagnosis, biologic behavior, and management. Ann Surg Oncol 2000; 7: 705–12.
Burkill GJ, Badran M, Al-Muderis O,
et al. Malignant gastrointestinal stromal tumors: distribution, imaging, features, and pattern of metastatic spread. Radiology 2003; 22 (6): 527–32.
Radiology 2003; 22 (6): 527–32.Pierie JP, Choudry U, Muzikansky A,
et al. The effect of surgery and grade on outcome of gastrointestinal stromal tumors. Arch Surg 2001; 136: 383–9.Кныш ВИ, Тимофеев ЮМ. Злокачественные опухоли анального канала. Москва: Медицина, 1997. 304 с.
Ray-Coquard I, Le Cesne A, Michallet V,
et al. Gastrointestinal stromal tumors: news and comments. Bull Cancer 2003; 90 (1): 69–76.Fong Y, Coit DG, Woodruff JM,
et al. Lymph node metastasis from soft tissue sarcoma in adults. Analysis of data from a prospective database of 1772 sarcoma patients. Ann Surg 1993; 217: 72–7.Blay JY, Reichardt P. Advanced gastrointestinal stromal tumor in Europe: a review of updated treatment recommendations. Expert Rev Anticancer Ther 2009; 9 (6): 831–8.
Casper ES. Gastrointestinal stromal tumors. Curr Treat Options Oncol 2000; l: 267–73.
Dirnhofer S, Leyvraz S.
 Current standarts and progress in understanding and treatment of GIST. Swissmedkly 2009; 139 (7–8): 90–102.
Current standarts and progress in understanding and treatment of GIST. Swissmedkly 2009; 139 (7–8): 90–102.Demetri GD. Identification and treatment of chemoresistent inoperable or metastatic GIST: experience with the selective tyrosine kinase ingibitor imatinib mesylate (STI571). EJС 2002; 38 (5): 51–9.
Croom KF, Perry CM. Imatinib mesylate: in the treatment of gastrointestinal stromal tumors. Drugs 2003; 63 (5): 513–22.
Reichardt P. Novel approaches to imatinib- and sunitinib- resistant GIST. Curr Oncol Rep 2008; 10 (4): 344–9.
Cassier PA, Dufresne A, Blay JY. Controversies in the Adjuvant Treatment of Gastrointestinal Stromal Tumors (GIST) with Imatinib ASCO Educational Book; 2008.
Demetri G, van Oosterom A, Garrett C,
et al. Sunitinib malate (SU11248) pro longs progression-free and overall survival for GIST patients after failure of ima tinib mesylate therapy: update of a phase III trial. Eur J Cancer 2005; 3 (Suppl): 203, abstr 716.
Faivre S, Delbaldo C, Vera K,
et al. Safety, pharmacokinetic, and antitumor activity of SU11248, a novel oral multitarget tyrosine kinase inhibitor, in patients with cancer. J Clin Oncol 2006; 24: 25–35.Morgan JA,
et al. Patients with Imatinib-mesylate-resistant GIST exhibit durable responses to Sunitinib malate (SU11248). 17th ICACT, 2008, poster session.Miller KD, Burstein HJ, Elias AD,
et al. Safety and efficacy of sunitinib malate (SU11248) as second-line therapy in metastatic breast cancer (MBC) patients: preliminary results from a Phase II study. Eur J Cancer 2005; 3 (Suppl): 113, abstr 406.Nilsson B, Nilsson O, Ahlman H. Treatment of gastrointestinal stromal tumours: imatinib, sunitinib – and then? Expert Opin Investig Drugs 2009; 18 (4): 457–68.
Hopkins TG, Marples M, Stark D. Sunitinib in the management of gastrointestinal stromal tumours (GISTs). Eur J Surg Oncol 2008; 34 (8): 844–50.

ГИСО (GIST)
ГИСО (GIST)
ГИСО – гастроинтестинальная стромальная опухоль (GIST)
ГИСО – один из самых распространенных видов неэпителиальных опухолей желудочно-кишечного тракта. Обладают потенциалом злокачественности. Относится к неэпителиальным опухолям. Другими словами – рак – это эпителиальная опухоль – возникает из самого поверхностного слоя – агрессивно распространяется, однако проще диагностируется т.к. слой поверхностный. Неэпителиальные опухоли чаще всего менее агрессивны, однако располагаются глубже и, следовательно, их сложнее диагностировать .
К неэпителиальным опухолям относят: GIST, опухоли гладкомышечной ткани (лейомиома, лейомиосаркома), жировой ткани (липома, фибролипома), нейрогенные опухоли (невринома, шваннома), опухоли сосудистой природы (лимфангиома, гемангиома), нейроэндокринные опухоли, зерниcтоклеточная опухоль и др..
Какие органы может поражать ГИСО
Любой орган желудочно-кишечного тракта:
гастроинтестинальная стромальная опухоль пищевода
гастроинтестинальная стромальная опухоль желудка (наиболее часто)
гастроинтестинальная стромальная опухоль двенадцатиперстной кишки
гастроинтестинальная стромальная опухоль тонкой кишки
гастроинтестинальная стромальная опухоль прямой кишки
Как проявляется ГИСО (клиника)
Длительное время подслизистые опухоли протекают бессимптомно. Возможные варианты проявлений:
Возможные варианты проявлений:
— желудочно-кишечное кровотечение, в том числе, неуточненное и скрытое.
— острая кишечная непроходимость
— слабость, похудание, анемия
— пальпируемое образование в животе
— боли в животе
В ряде случаев опухоль обнаруживают при эндоскопии, КТ или УЗИ без каких-либо клинических проявлений.
В любой из вышеперечисленных ситуаций срочно обратитесь к специалисту.
Как поставить диагноз гастроинтестинальной стромальной опухоли
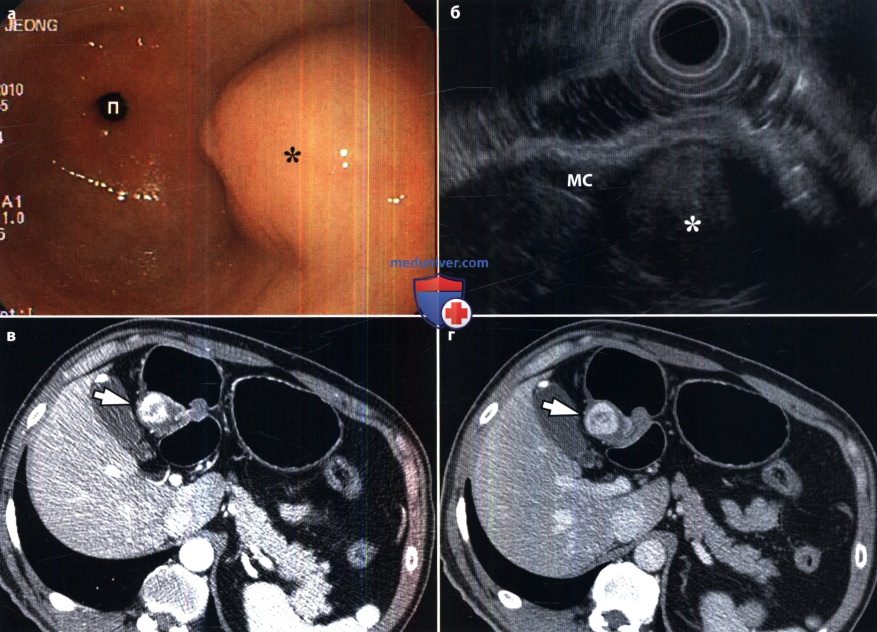
ГИСО располагаются глубже, чем рак. Поэтому стандартная поверхностная биопсия чаще всего безрезультатна. Прорыв в предоперационной диагностике произошел с внедрением в клинику эндоскопического ультразвукового исследования (эндосонография, эндоУЗИ, ЭУС). Данный метод позволяет не только визуализировать опухоль, но и произвести точную морфологическую диагностику.
Новые эффективные методы лечения гастроинтестинальных стромальных опухолей..jpg)
Таргетная терапия (иматиниб, гливек)
Лапароскопические операции (лапароскопическая резекция желудка).
МАТЕРИАЛЫ КОНГРЕССОВ И КОНФЕРЕНЦИЙ: VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
VII РОССИЙСКАЯ ОНКОЛОГИЧЕСКАЯ КОНФЕРЕНЦИЯ
ГАСТРОИНТЕСТИНАЛЬНЫЕ СТРОМАЛЬНЫЕ ОПУХОЛИ: НОВАЯ НОЗОЛОГИЧЕСКАЯ ЕДИНИЦА И СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ
Д.А. Носов
ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России, Москва
Гастроинтестинальные стромальные опухоли (GIST-Gastrointestinal Stromal Tumors) составляют по разным данным от 0,1% до 3% от всех злокачественных новообразований желудочно-кишечного тракта и принадлежат к наиболее часто встречаемым мезенхимальным опухолям данной локализации (1).
Термин GIST впервые был предложен в 1983 г. для описания гастроинтестинальных неэпителиальных опухолей, которые отличаются по своим иммуногистохимическим и ультраструктурным характеристикам от опухолей с истинной нейрогенной и гладкомышечной дифференцировкой (2).
Общий фенотип (экспрессия CD117) и морфологическое сходство с интерстициальными клетками Кахала позволили предположить, что GIST развивается из этих клеток или их предшественников. Интерстициальные клетки Кахала формируют сеть в мышечной стенке желудочно-кишечного тракта и регулируют его автономную перистальтическую активность, т.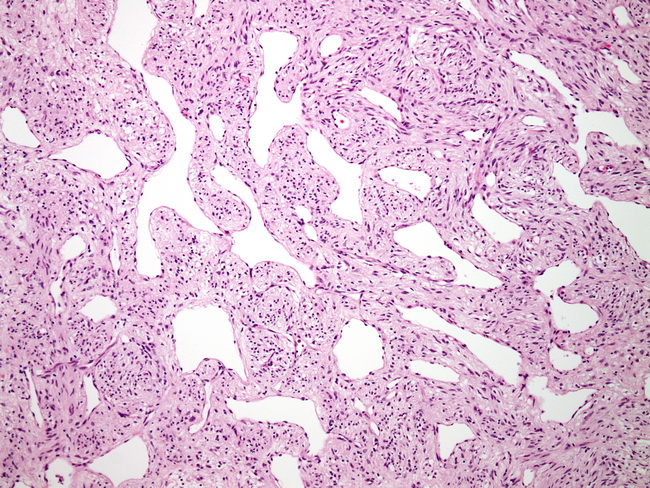 е. являются пейсмекерными клетками, обеспечивающими связь между гладкомышечными клетками и нервными окончаниями. Именно наличие или отсутствие активированного c-KIT рецептора определяет дальнейшую дифференцировку примитивных мезенхимальных клеток-предшественников, которая может пойти в направлении как интерстициальных клеток Кахала, так и гладкомышечной ткани соответственно.
е. являются пейсмекерными клетками, обеспечивающими связь между гладкомышечными клетками и нервными окончаниями. Именно наличие или отсутствие активированного c-KIT рецептора определяет дальнейшую дифференцировку примитивных мезенхимальных клеток-предшественников, которая может пойти в направлении как интерстициальных клеток Кахала, так и гладкомышечной ткани соответственно.
В настоящее время к GIST относят мехенхимальные опухоли гастроинтестинального тракта, позитивные по CD117, а результаты иммуногистохимического анализа на наличие экспрессии CD117 являются определяющими в проведении дифференциальной диагностики. Другими маркерами, которые помогают иммунофенотипировать и дифференцировать GIST от других опухолей желудочно-кишечного тракта мезенхимального происхождения, являются CD34-антиген, S-100 протеин, гладкомышечный актин (SMA) и десмин (табл. 1). Таким образом, иммуногистохимическое исследование является неотъемлемой частью диагностического процесса и должно проводиться в специализированном лечебном учреждении при всех мезенхимальных новообразованиях желудочно-кишечного тракта и забрюшинного пространства.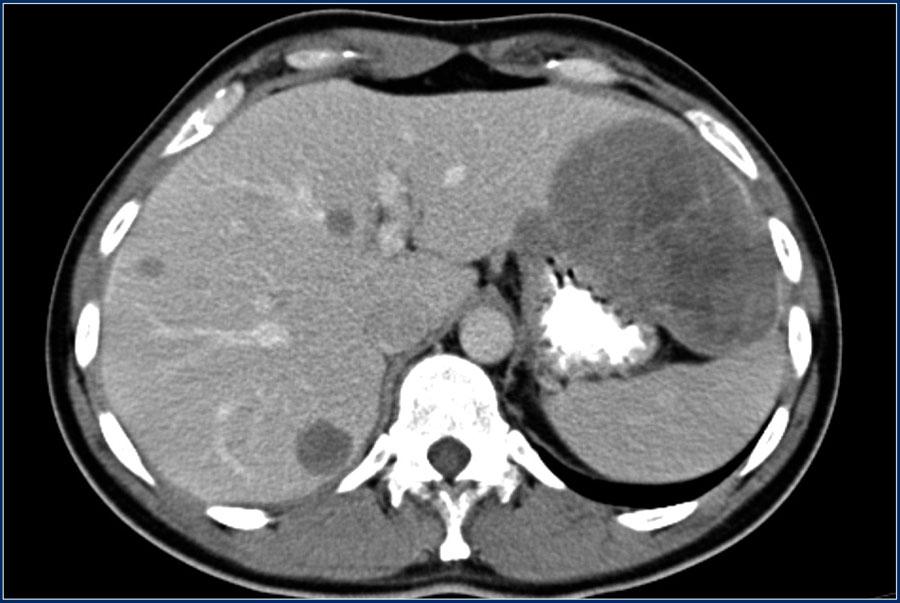
Таблица 1.
Иммуногистохимические маркеры, используемые для дифференциальной диагностики мезенхимальных опухолей желудочно-кишечного тракта (цит. по C. Fletcher et al., Human Pathology, Vol 33, №5, p.461, 2002).
| с-KIT (СD117) | СD34 | SMA | Десмин | S-100 | |
|---|---|---|---|---|---|
| GIST | + | + (60-70%) |
+ (30-40%) |
+ (1-2%) |
+ (5%) |
| Гладкомышечные опухоли | — | + (10-15%) |
+ | + | — |
| Шваннома | — | + | — | — | + |
| Фиброматоз | ? | — | + | + | — |
 Более того, экспрессия данного рецептора наблюдается при мелкоклеточном раке легкого, семиноме, саркоме Юинга, ангиосаркоме, меланоме, остром миелолейкозе, раке яичников, нейробластоме. Однако эти опухоли крайне редко приходится дифференцировать с GIST, поскольку они обладают достаточно яркими собственными морфологическими особенностями и не вызывают существенных трудностей у патоморфологов.
Более того, экспрессия данного рецептора наблюдается при мелкоклеточном раке легкого, семиноме, саркоме Юинга, ангиосаркоме, меланоме, остром миелолейкозе, раке яичников, нейробластоме. Однако эти опухоли крайне редко приходится дифференцировать с GIST, поскольку они обладают достаточно яркими собственными морфологическими особенностями и не вызывают существенных трудностей у патоморфологов.В нормальных условиях c-KIT-тирозинкиназный рецептор (белковый продукт с-kit протоонкогена) активизируется в результате связывания внеклеточного домена рецептора с соответствующим лигандом – фактором роста стволовых клеток (stem cell factor, SCF). В дальнейшем происходит гомодимеризация рецептора, активация его внутриклеточного АТФ-связывающего и тирозинкиназного доменов с последующим фосфорилированием тирозиновых остатков целого ряда внутриклеточных сигнальных белков, передающих импульс к ядру клетки. В результате инициируется клеточная пролиферация, дифференцировка и включаются механизмы, регулирующие процессы апоптоза.
В зависимости от преобладания того или иного компонента при морфологическом исследовании выделяют веретеноклеточный (70%), эпителиоидный (20-25%) и смешанный варианты GIST. Большинство опухолей на этапе их первичного диагностирования при отсутствии диссеминации и инфильтрации органов/тканей выглядят как доброкачественные новообразования (до 70%). Однако морфологи предпочитают не использовать термин “доброкачественный”, поскольку считается, что практически все GIST имеют злокачественный потенциал и, вероятно, при длительном периоде наблюдения опухоль приобретает черты “злокачественного” новообразования. Поэтому в клиническом отношении более важно другое деление, которое на основании митотической активности и размеров образования позволяет оценить риск агрессивности опухолевого процесса (табл. 2) (9).
Однако морфологи предпочитают не использовать термин “доброкачественный”, поскольку считается, что практически все GIST имеют злокачественный потенциал и, вероятно, при длительном периоде наблюдения опухоль приобретает черты “злокачественного” новообразования. Поэтому в клиническом отношении более важно другое деление, которое на основании митотической активности и размеров образования позволяет оценить риск агрессивности опухолевого процесса (табл. 2) (9).
Таблица 2.
Определение риска агрессивности (злокачественности) GIST.
| Риск агрессивности | Размер опухоли (см) | Митотическая активность (на 50 ПЗ)* |
|---|---|---|
| Очень низкий | ||
| Низкий | 2-5 | |
| Умеренный | 6-10 | |
| 5-10 | ||
| Высокий | >5 | >5 |
| >10 | Любая | |
| Любой | >10 |
*ПЗ – поле зрения при сильном увеличении
Типичной локализацией GIST является желудок (60-70%), тонкая кишка (25-35%), толстая и прямая кишка (5%). В редких случаях опухоль может выявляться в пищеводе, брыжейке, сальнике, забрюшинном пространстве (10). Поскольку первичная опухоль локализуется в подслизистом слое, то существуют определенные трудности в гистологической верификации диагноза на предоперационном этапе. С помощью эндоскопических методов гистологический диагноз удается установить лишь в 50% случаев. Небольшие образования, чаще всего, не дают клинических симптомов и являются случайными находками при проведении эндоскопических исследований или лапаротомии вследствие других причин. Нередко GIST диагностируется в ходе экстренных операций, связанных с перфорацией органа или кровотечением. На момент диагностирования заболевания у 15-50% больных уже имеются метастазы, но степень распространения болезни, как правило, ограничена пределами брюшной полости. При этом в 65% случаев выявляются метастазы в печень, в 21% наблюдается диссеминация по брюшине. Крайне редко поражаются регионарные лимфатические узлы, кости и легкие (12).
В редких случаях опухоль может выявляться в пищеводе, брыжейке, сальнике, забрюшинном пространстве (10). Поскольку первичная опухоль локализуется в подслизистом слое, то существуют определенные трудности в гистологической верификации диагноза на предоперационном этапе. С помощью эндоскопических методов гистологический диагноз удается установить лишь в 50% случаев. Небольшие образования, чаще всего, не дают клинических симптомов и являются случайными находками при проведении эндоскопических исследований или лапаротомии вследствие других причин. Нередко GIST диагностируется в ходе экстренных операций, связанных с перфорацией органа или кровотечением. На момент диагностирования заболевания у 15-50% больных уже имеются метастазы, но степень распространения болезни, как правило, ограничена пределами брюшной полости. При этом в 65% случаев выявляются метастазы в печень, в 21% наблюдается диссеминация по брюшине. Крайне редко поражаются регионарные лимфатические узлы, кости и легкие (12).
Хирургический подход остается основным при отсутствии признаков диссеминации процесса. Однако его эффективность ограничена и определяется степенью локальной распространенности болезни и радикальностью операции. При локальном поражении частота рецидивов после радикальной операции приближается к 35%, при местно-распространенном заболевании (т.е. при вовлечении окружающих органов и тканей) достигает 90%. При рецидивах опухолевый процесс в основном локализован интраабдоминально. В среднем 5-летняя выживаемость больных после хирургического лечения варьирует от 35% до 65%. Прогноз больных зависит от митотической активности опухоли, размеров первичного образования и его локализации. Последние исследования также выявляют корреляцию между характером мутации с-KIT и безрецидивной выживаемостью больных (8).
Однако его эффективность ограничена и определяется степенью локальной распространенности болезни и радикальностью операции. При локальном поражении частота рецидивов после радикальной операции приближается к 35%, при местно-распространенном заболевании (т.е. при вовлечении окружающих органов и тканей) достигает 90%. При рецидивах опухолевый процесс в основном локализован интраабдоминально. В среднем 5-летняя выживаемость больных после хирургического лечения варьирует от 35% до 65%. Прогноз больных зависит от митотической активности опухоли, размеров первичного образования и его локализации. Последние исследования также выявляют корреляцию между характером мутации с-KIT и безрецидивной выживаемостью больных (8).
В случае рецидива заболевания или при первичном диагностировании диссеминированного/неоперабельного процесса медиана выживаемости не превышает 10-20 мес. (11-14). Хирургическое удаление рецидивных образований в целом не приводит к улучшению выживаемости больных. По данным Mudan с соавт., медиана выживаемости больных после повторной операции составила всего лишь 15 мес. (15).
По данным Mudan с соавт., медиана выживаемости больных после повторной операции составила всего лишь 15 мес. (15).
Данные о выживаемости больных в первую очередь свидетельствуют о низкой эффективности имеющихся химиотерапевтических подходов при этом заболевании, что объясняется высокой экспрессией Р-гликопротеина и MDR1-протеина опухолевыми клетками. В настоящее время трудно интерпретировать результаты исследований, проведенных до введения в клиническую практику основного диагностического критерия – наличие экспрессии CD117, — позволяющего дифференцировать GIST и лейомиосаркомы. Учитывая, что на долю GIST приходится до 80% всех мезенхимальных гастроинтестинальных опухолей, большинство “лейомиосарком” данной локализации на сегодняшний день следует классифицировать как GIST. Опираясь на данные исследований, посвященных изучению эффективности химиотерапии при лейомиосаркомах желудочно-кишечного тракта, можно предположить, что активность цитотоксических агентов при GIST колеблется от 0% до 15%, составляя в среднем 5% (16-18)..jpg)
Идентификация основного патогенетического механизма, ответственного за развитие GIST, — гиперактивации c-KIT рецептора, а также результаты предклинических исследований послужили основанием для клинического изучения эффективности препарата STI-571 (иматиниб, Гливек) при данном заболевании. Гливек является низкомолекулярным ингибитором ряда рецепторных (с-KIT, PDGFR) и нерецепторных тирозинкиназ (Abl, Bcr-Abl). Конкурируя с АТФ за АТФ-связывающий домен рецептора с-KIT, препарат предотвращает фосфорилирование тирозиновых остатков внутриклеточных белков, тем самым, блокируя передачу сигнала к ядру клетки. Необходимо заметить, что к этому времени иматиниб уже демонстрировал впечатляющую клиническую эффективность у больных хроническим миелолейкозом, при котором ключевым механизмом патогенеза является активность другой тирозинкиназы — внутриклеточного Bcr-Abl протеина.
Результаты клинических исследований I и II фазы, представленные в 2001 году, произвели незабываемое впечатление на онкологов и вселили надежду в пациентов, страдающих GIST.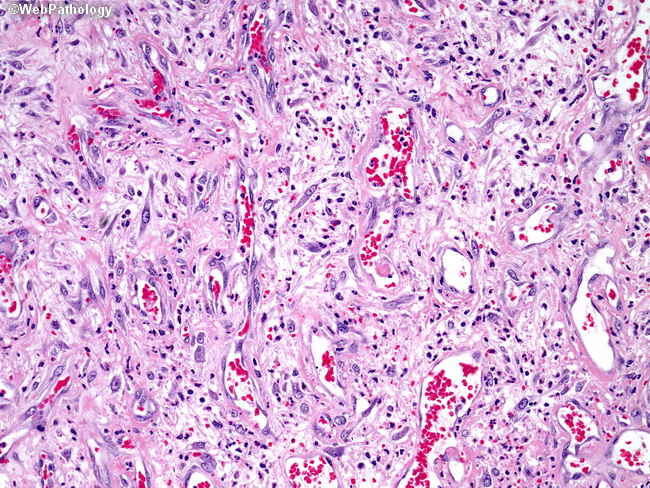 В ходе этих исследований была изучена безопасность препарата и определена эффективная терапевтическая доза. В первом исследовании изучались дозовые режимы 400-1000 мг/сут. у 40 больных с прогрессирующими саркомами, в том числе у 35 больных с GIST (19). Частичная регрессия была зафиксирована у 19 (54%) из 35 пациентов с GIST. Еще у 13 (37%) больных отмечена стабилизация процесса. В итоге клиническое улучшение было зарегистрировано у 91% больных. При минимальном времени наблюдения 10 мес. частичный эффект и стабилизация сохраняются соответственно у 18 (51%) и 11 (31%) больных.
В ходе этих исследований была изучена безопасность препарата и определена эффективная терапевтическая доза. В первом исследовании изучались дозовые режимы 400-1000 мг/сут. у 40 больных с прогрессирующими саркомами, в том числе у 35 больных с GIST (19). Частичная регрессия была зафиксирована у 19 (54%) из 35 пациентов с GIST. Еще у 13 (37%) больных отмечена стабилизация процесса. В итоге клиническое улучшение было зарегистрировано у 91% больных. При минимальном времени наблюдения 10 мес. частичный эффект и стабилизация сохраняются соответственно у 18 (51%) и 11 (31%) больных.
Препарат демонстрировал свою активность на всех дозовых уровнях. Максимальной переносимой дозой (МПД) была признана доза 800 мг/сут., но оставалось неясным, есть ли преимущество у данного дозового режима с точки зрения его эффективности в сравнении с минимальной дозой препарата 400 мг/сут. Токсичность Гливека оказалась невысокой и в основном не выходила за пределы III степени. В 5% случаев отмечалась нейтропения IV степени..png) Гематологическая токсичность III степени в виде лейкопении, нейтропении и анемии наблюдалась у 10%, 12% и 12% больных соответственно. В основном преобладала негематологическая токсичность II-III степени, выражающаяся в виде периорбитальных (40%) и периферических отеков (37%), кожной сыпи (30%), слабости (30%) и тошноты/рвоты (25%). Негематологическая дозолимитирующая токсичность не регистрировалась у пациентов, получавших Гливек в дозе 400 мг/сут. Все токсические явления легко контролировались и, в целом, препарат обладал хорошей переносимостью. В ходе исследования были сделаны интересные наблюдения. У 2 больных с прогрессированием заболевания через 4 мес. и 5 мес. после начала терапии была проведена эскалация дозы с 400 до 800 мг/сут. и были зарегистрированы частичный эффект и стабилизация соответственно.
Гематологическая токсичность III степени в виде лейкопении, нейтропении и анемии наблюдалась у 10%, 12% и 12% больных соответственно. В основном преобладала негематологическая токсичность II-III степени, выражающаяся в виде периорбитальных (40%) и периферических отеков (37%), кожной сыпи (30%), слабости (30%) и тошноты/рвоты (25%). Негематологическая дозолимитирующая токсичность не регистрировалась у пациентов, получавших Гливек в дозе 400 мг/сут. Все токсические явления легко контролировались и, в целом, препарат обладал хорошей переносимостью. В ходе исследования были сделаны интересные наблюдения. У 2 больных с прогрессированием заболевания через 4 мес. и 5 мес. после начала терапии была проведена эскалация дозы с 400 до 800 мг/сут. и были зарегистрированы частичный эффект и стабилизация соответственно.
В данном исследовании эффективность терапии оценивалась в соответствии с RECIST критериями с помощью стандартных методов (КТ и МРТ), а также с помощью позитронно-эмиссионной томографии (ПЭТ). При этом снижение метаболической активности опухоли, определяемое на 0, 8 и 28 день терапии с помощью радиоактивного аналога глюкозы F-фтор-2-деокси-D-глюкозы (FDG), коррелировало с объективными эффектами или стабилизациями, зарегистрированными КТ исследованием на 8-ой неделе лечения. Предпосылками для использования ПЭТ послужили данные о трудностях в интерпретации результатов лечения цитостатическими агентами, когда (в отличие от цитотоксических препаратов) метаболический эффект значительно опережает лизис опухоли, а размеры образований в течение длительного времени могут оставаться стабильными или даже несколько увеличиться вследствие перифокального отека. Причем, если медиана времени до наступления полной или частичной ремиссии (по данным КТ или МРТ) составляет 13 недель, то метаболический эффект может быть зарегистрирован уже через 24-48 ч после начала терапии иматинибом (20, 21). Таким образом, в проблемных случаях ПЭТ может оказать существенную помощь клиницистам в правильной оценке эффективности лечения.
При этом снижение метаболической активности опухоли, определяемое на 0, 8 и 28 день терапии с помощью радиоактивного аналога глюкозы F-фтор-2-деокси-D-глюкозы (FDG), коррелировало с объективными эффектами или стабилизациями, зарегистрированными КТ исследованием на 8-ой неделе лечения. Предпосылками для использования ПЭТ послужили данные о трудностях в интерпретации результатов лечения цитостатическими агентами, когда (в отличие от цитотоксических препаратов) метаболический эффект значительно опережает лизис опухоли, а размеры образований в течение длительного времени могут оставаться стабильными или даже несколько увеличиться вследствие перифокального отека. Причем, если медиана времени до наступления полной или частичной ремиссии (по данным КТ или МРТ) составляет 13 недель, то метаболический эффект может быть зарегистрирован уже через 24-48 ч после начала терапии иматинибом (20, 21). Таким образом, в проблемных случаях ПЭТ может оказать существенную помощь клиницистам в правильной оценке эффективности лечения.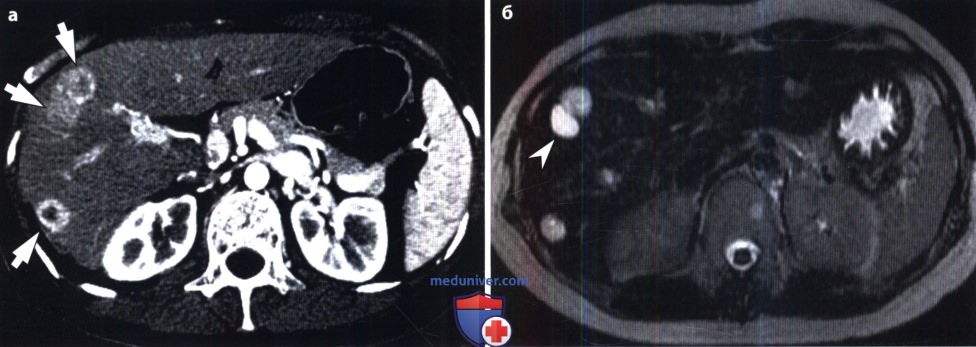
В другом исследовании, проведенном в рамках II фазы, 147 пациентов были рандомизированы в две группы (21). В первой группе Гливек использовался в дозе 400 мг/сут., во второй – 600 мг/сут. Общая частота объективных эффектов составила 54%, стабилизаций – 28%. Непосредственные результаты лечения в обеих группах статистически не отличались. Медиана выживаемости на момент публикации не была достигнута, в то время как 1-летняя выживаемость составила 88%. Медиана продолжительности ремиссии также не достигнута при медиане наблюдения 24 недели после регистрации эффекта. У всех больных с зарегистрированным по КТ/МРТ эффектом метаболическая активность опухоли, измеряемая ПЭТ, значительно снижалась уже через 24 ч после начала терапии. Частота и степень выраженности побочных эффектов терапии не зависели от дозовых режимов. Наиболее опасными осложнениями являлись интратуморальные (2,7%) и желудочно-кишечные кровотечения (2,7%). В этом исследовании еще раз была подтверждена безопасность Гливека и терапевтическая эффективность дозы 400 мг/сут.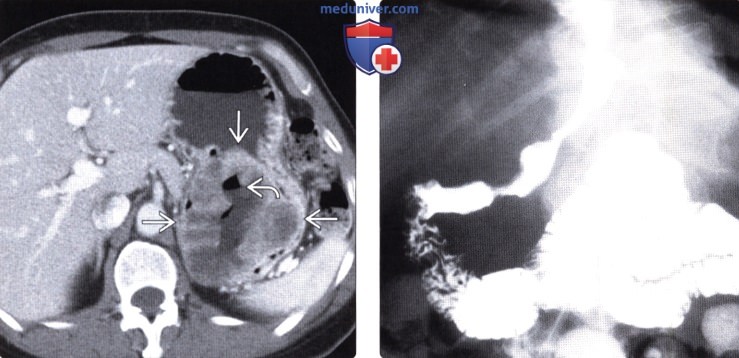
Предварительные результаты последующих многоцентровых исследований III фазы, результаты которых были впервые представлены на 39 ежегодной конференции ASCO в 2003 г., пока также указывают на равную эффективность двух дозовых режимов иматиниба — 400 мг/сут. и 800 мг/сут. (табл. 3) (22-23).
Таблица 3.
Предварительные результаты рандомизированных исследований III фазы.
| Исследование | Число больных | Доза (мг/сут.) | ПР+ЧР | СБ | Выживаемость без прогрес- сирования через 6 мес. |
|---|---|---|---|---|---|
| EORTC, AGITG,ISG | 946 | 400 | 43% | Нет данных | 73% |
| 800 | 43% | 78% | |||
| S0033 | 746 | 400 | 43% | 32% | 80% |
| 800 | 41% | 32% | 82% |
Большое внимание уделяется изучению причин исходной и приобретенной резистентности к Гливеку.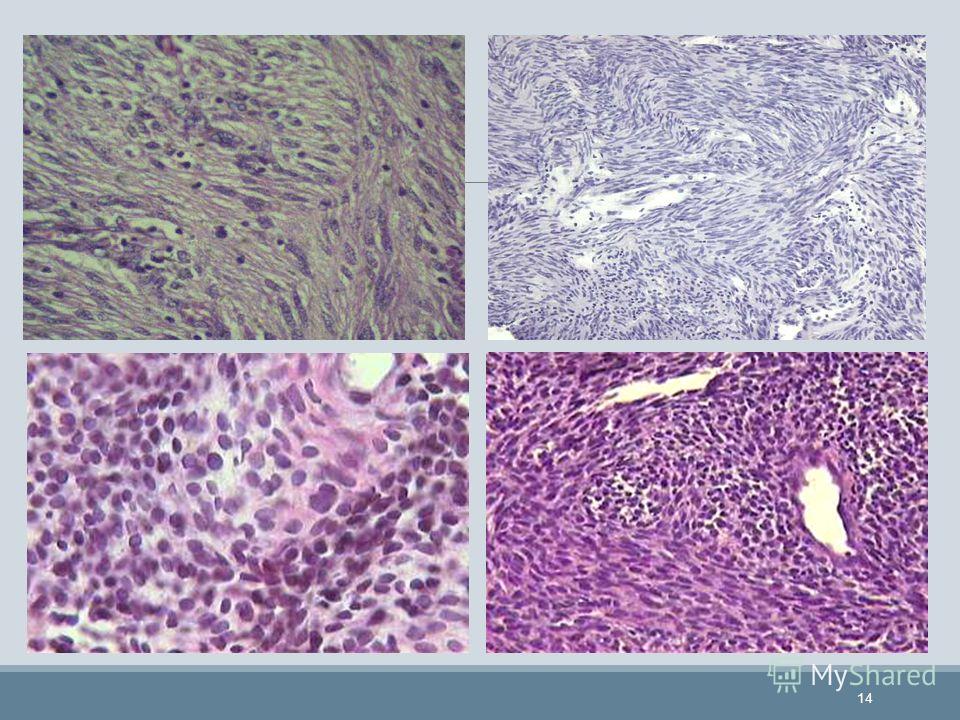 J. Fletcher с соавт. (24), анализируя данные генетических и биохимических исследований у 26 больных с прогрессирующим течением заболевания, выделили 4 механизма рефрактерности к иматинибу:
J. Fletcher с соавт. (24), анализируя данные генетических и биохимических исследований у 26 больных с прогрессирующим течением заболевания, выделили 4 механизма рефрактерности к иматинибу:
- сохраняющаяся активность с-KIT рецептора вследствие мутации его АТФ-связывающего (эксон 13) и тирозинкиназного (эксон 17) доменов;
- гиперэкспрессия с-KIT рецептора;
- активация альтернативной рецепторной тирозинкиназы, сопровождающаяся потерей экспрессии с-KIT;
- новые приобретенные точечные мутации с-KIT или PDGFR.
Параллельно изучаются факторы прогноза эффективности и токсичности терапии Гливеком. Уже выделены клинические параметры, ассоциированные с высокими показателями выживаемости без прогрессирования, к которым на сегодняшний день относят хороший общий соматический статус пациента, высокий уровень гемоглобина и локализацию первичной опухоли в желудке (25). Требуют своего решения и ряд других клинических вопросов. Какова оптимальная продолжительность терапии иматинибом? Как влияет характер мутации на вероятность развития рецидива заболевания после хирургического лечения? Должен ли использоваться Гливек у больных при отсутствии мутации с-KIT? Целесообразно ли проводить адъювантную терапию больным после радикально выполненной операции? Каково место неоадъювантной терапии в комплексном лечении больных GIST? Вероятно, проводимые клинические исследования в скором будущем ответят на поставленные вопросы. Но уже сейчас можно с уверенностью сказать, что это один из первых позитивных примеров рационального использования в онкологии препарата с молекулярно направленным действием, который открыл дорогу интенсивному клиническому изучению ингибиторов внутриклеточной передачи сигнала при других злокачественных новообразованиях.
Какова оптимальная продолжительность терапии иматинибом? Как влияет характер мутации на вероятность развития рецидива заболевания после хирургического лечения? Должен ли использоваться Гливек у больных при отсутствии мутации с-KIT? Целесообразно ли проводить адъювантную терапию больным после радикально выполненной операции? Каково место неоадъювантной терапии в комплексном лечении больных GIST? Вероятно, проводимые клинические исследования в скором будущем ответят на поставленные вопросы. Но уже сейчас можно с уверенностью сказать, что это один из первых позитивных примеров рационального использования в онкологии препарата с молекулярно направленным действием, который открыл дорогу интенсивному клиническому изучению ингибиторов внутриклеточной передачи сигнала при других злокачественных новообразованиях.
Список литературы:
1. 1.Sakurai S, Fukasawa T, Chong J, et al. C-kit gene abnormalities in gastrointestinal stromal tumors. Jpn J cancer Res, V 90: 1321-1328, 1999.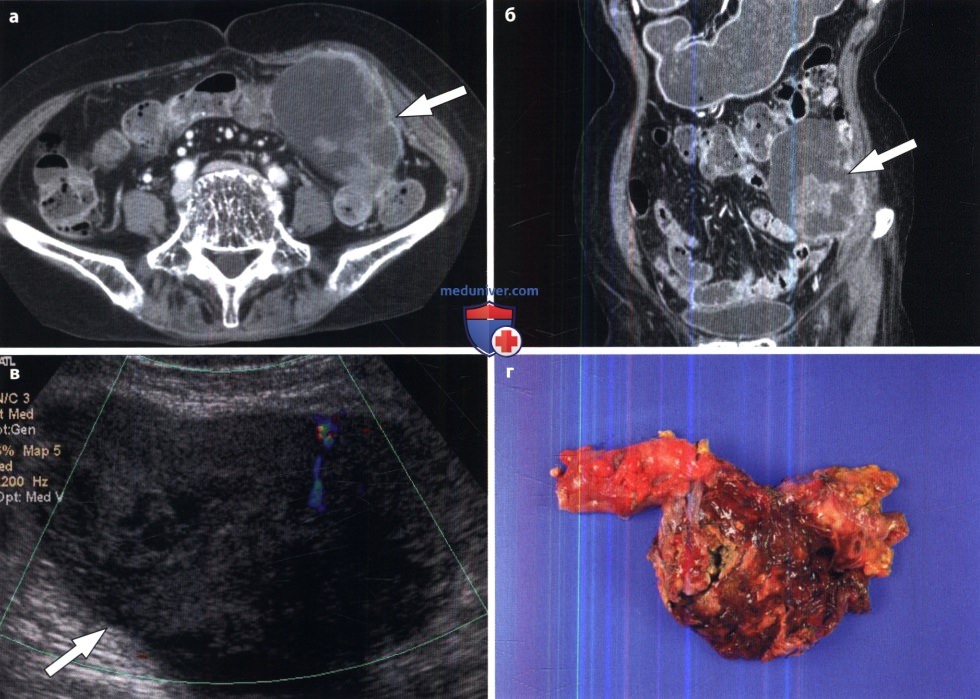
2. Mazur MT, Clark HB. Gastric stromal tumors: R=re appraisal of histogenesis. Am J Surg pathol, V 7: 507-519, 1983.
3. Sarlomo-Rikala M., Kovatich AJ, Barusevicius A, et al: CD117: A sensitive marker for gastrointestinal stromal tumors that is more specific than CD34. Mod Pathology 11: 728-734, 1998.
4. Kindblom LG, Remotti HE, Aldenborg F, et al.: Gastrointestinal pacemaker cell tumor: Gasrtrointestinal stromal tumors show phenotypic characteristics of the intestinal cells of Cajal. Am J Pathology 152: 1259-1269, 1998.
5. Hirota S, Isozaki K, Moriyama Y, et al.: Gain-function mutations of c-kit in human gastrointestinal stromal tumors. Science 279:577-580, 1998.
6. Tsuura Y, Hiraki H, Watanabe K, et al. Preferential localization of c-kit product in tissue mast cells, basal cell of skins, epithelial cells of breast, small cell lung carcinoma, and seminoma/dysgerminoma in humans: immunohistochemical study of formalin-fixed, paraffin-embedded tissues.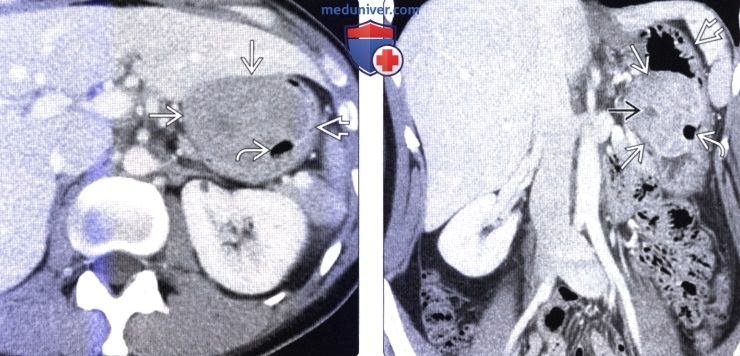 Virchows Arch; 424: 135-141,1994.
Virchows Arch; 424: 135-141,1994.
7. Arber DA, Tamayo R, Weiss LM. Paraffin section detection of the c-kit gene product (CD117) in human tissues: value in the diagnosis of mast cell disorders. Hum Pathology; 28: 498-504, 1998.
8. Singer S. Rubin B, Fletcher A, et al. Prognostic value of kit mutation type, mitotic activity, and histological subtype in gastrointestinal stromal tumors. J of Clin Oncol, V 20, №18: 3898-3905, 2002.
9. Fletcher C, Berman J, Corless C, et al. Diagnosis of gastrointestinal stromal tumors: a consensus approach. Human Pathology, V 33, №5: p.459-465, 2002.
10. Miettinen M, Lasota J. Gastrointestinal stromal tumors – definition, clinical, histological, immunohistochemical, and molecular genetic features and differential diagnoses. Virchows Arch, V 438:1-12, 2001.
11. Dougherty M, Compton C, Talbert M, et al. Sarcomas of the gastrointestinal tract.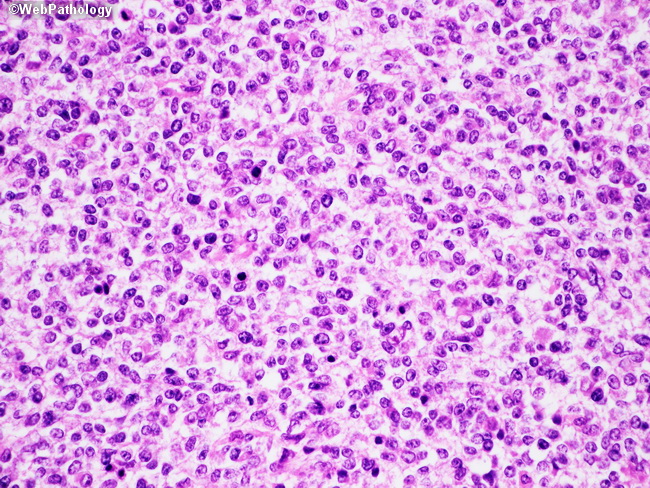 Separation into favorable and unfavorable prognostic groups by mitotic count. Annal Surg, V 214: 569-574, 1991.
Separation into favorable and unfavorable prognostic groups by mitotic count. Annal Surg, V 214: 569-574, 1991.
12. De Matteo R, Lewis J, Leung D, et al. Two hundred gastrointestinal stromal tumors: recurrence patterns and prognostic factors for survival. Ann Surgery, V 231: 51-58, 2000.
13. Crossby J, Catton C, Davis A, et al. Malignant gastrointestinal stromal tumors of the small intestine: a review of 50 cases from prospective database. Ann Surg Oncol, V 8: 50-59, 2001.
14. Plaat B, Hollema H, Molenaar W, et al. Soft tissue leiomyosarcomas and malignant gastrointestinal stromal tumors: differences in clinical outcome and expression a multidrug resistance proteins. J Clin Oncol, V 18: 3211-3220, 2000.
15. Mudan S, Conlon K, Woodruff J, et al. Salvage surgery in recurrent gastrointestinal sarcoma: prognostic factors to guide patient selection. Cancer, V 88: 66-74, 1999.
16. Zalupski M, Metch B, Balcerzak S, et al. Phase III comparison of doxorubicin and dacarbazine given by bolus vs infusion in patients with soft tissue sarcomas. SWOG study. Jour Nath Cancer Inst, V 83: 926-932, 1991.
Zalupski M, Metch B, Balcerzak S, et al. Phase III comparison of doxorubicin and dacarbazine given by bolus vs infusion in patients with soft tissue sarcomas. SWOG study. Jour Nath Cancer Inst, V 83: 926-932, 1991.
17. Edmonson J, Maarks R, Buckner J, et al. Contrast of response to D-MAP plus sargramostin between patients with advanced malignant gastrointestinal stromal tumors and patients with other advanced leiomyosarcomas. Proc Am Assoc Cancer Res, V 18: abst 541, 1999.
18. Antman K, Crowley J, Balcerzak S, et al. An intergroup phase III randomized study of doxorubicin and dacarbazine with or without ifosfamide and mesna in advanced soft tissue and bone sarcomas. J Clin Oncol, V 11: 1276-1285, 1993.
19. van Oosterom AT, Judson IR, Verweij J, et al. Update of phase I study of imatinib (STI571) in advanced soft tissue sarcomas and gastrointestinal stromal tumors: a report of the EORTC Soft Tissue and Bone Sarcoma Group. Eur J Cancer, V 38, Suppl 5: S83-87, 2002.
Eur J Cancer, V 38, Suppl 5: S83-87, 2002.
20. Van den Abbelle AD, for the GIST Collaborative PET Study group at OHSU; F18-FDG-PET provides early evidence of biological response to STI-571 in patients with malignant gastrointestinal stromal tumors (GIST). Proc Am Soc Clin Oncol, 20: 362a, 2001.
21. Demetri G, von Mehren M, Blanke C, et al. Efficacy and safety of imatinib mesylate in advanced gastrointestinal stromal tumors. N Engl J Med, V 347: 472-480, 2002.
22. Verweij J, Casali P, Zalcberg J, Cesne A, et al. Early efficacy comparison of two doses of imatinib for the treatment of advanced gastrointestinal stromal tumors: interim results of a randomized phase III trial from the EORTC-STBSG, ISG and AGITG. Proc Am Soc Clin Oncol, V 22: 3272a, 2003.
23. Benjamin R, Rankin C, Fletcher C, et al. Phase III dose-randomized study of imatinib mesylate (STI571) for GIST: intergroup S0033 early results. Proc Am Soc Clin Oncol, V 22: 3271a, 2003.
Proc Am Soc Clin Oncol, V 22: 3271a, 2003.
24. Fletcher J, Corless C, Dimitrijevic S, et al. Mechanisms of resistance to imatinib mesylate in advanced gastrointestinal stromal tumors. Proc Am Soc Clin Oncol, V 22: 3275a, 2003.
25. Van Glabbeke M., Verweij J., Casali P, et al. Prognostic factors of toxicity and efficacy in patients with gastrointestinal stromal tumors (GIST) treated with imatinib: a study of the EORTC-STBSG, ISG and AGITG. Proc Am Soc Clin Oncol, V 22: 3286a, 2003.
Внимание, GIST: редко, но очень опасно!
Пациент Н. поступил во 2 хирургическое отделение с жалобами на общую слабость и черный стул — признаками желудочно-кишечного кровотечения. Из истории заболевания известно, что заболел за три дня до поступления, когда появились боли в верхних отделах живота и спине, черный стул. Слабость нарастала, в связи с чем обратился в ГКБ №29.
При обследовании: во время гастроскопии выявлено подслизистое образование стенки желудка, поверхностный гастрит, недостаточность кардии, объективных источников перенесенного кровотечения не выявлено.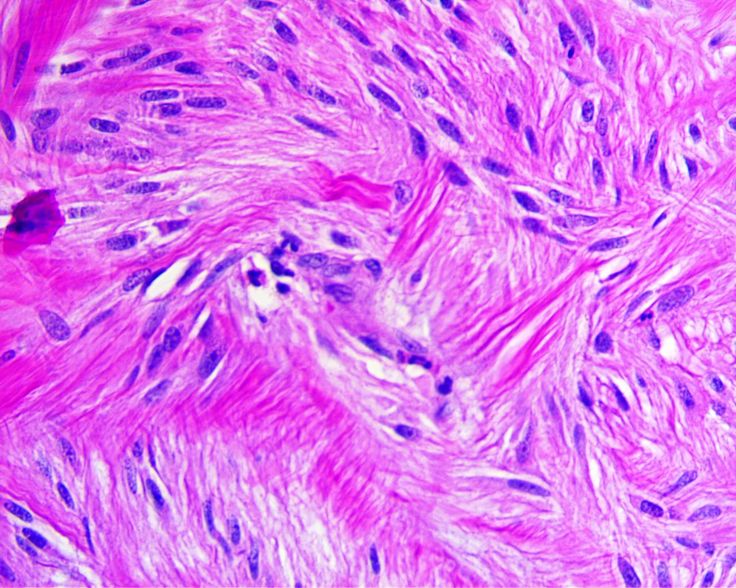
При колоноскопии — патологии не выявлено. Через 4 суток от поступления у пациента вновь отмечены жалобы, характерные для рецидива кровотечения. В связи с этим выполнена гастроинтестиноскопия (эндоскопическое исследование тонкой кишки), осмотрены начальные отделы тонкой кишки, при которой в 30 см от связки Трейца обнаружена изъязвленная подслизистая опухоль 2,5 х 3,0 см.
Пациент в экстренном порядке оперирован, произведено удаление подслизистого образования желудка, резекция участка тонкой кишки с опухолью.
Послеоперационная рана зажила первичным натяжением.
Гистологическое заключение: Гастроинтестинальные стромальные опухоли желудка и тонкой кишки. Диагноз был подтвержден при иммунногистохимическом исследовании.
Пациент в удовлетворительном состоянии был выписан и сейчас продолжает лечение в онкологическом диспансере по месту жительства.
Гастроинтестинальные стромальные опухоли относят к группе редких опухолей желудочно-кишечного тракта мезенхимального происхождения с характерной морфологической и иммунногистохимической картиной. На повестке дня остро стоят вопросы лечения данной категории больных. Поскольку первичная опухоль локализуется в подслизистом слое, то существуют определенные трудности в гистологической верификации диагноза на предоперационном этапе.
На повестке дня остро стоят вопросы лечения данной категории больных. Поскольку первичная опухоль локализуется в подслизистом слое, то существуют определенные трудности в гистологической верификации диагноза на предоперационном этапе.
Термин «Гастроинтестинальные стромальные опухоли» ( «gastrointestinal stromal tumors» – GIST) ввели в 1983 г. M.T. Mazur и H.B. Clark. Они являются наиболее распространенными саркомами (опухолями соединительной ткани) желудочно-кишечного тракта, составляя 1% всех злокачественных новообразований указанной локализации, но 80% от всех сарком ЖКТ.
С помощью эндоскопических методов, таких как эзофагогастродуоденоскопия (ЭГДС) и колоноскопия, гистологический диагноз удается установить лишь в 50% случаев. Небольшие образования чаще всего не дают клинических симптомов и вследствие других причин являются случайными находками при проведении эндоскопических исследований или операции. Нередко GIST диагностируется в ходе экстренных операций, связанных с перфорацией органа или кровотечением.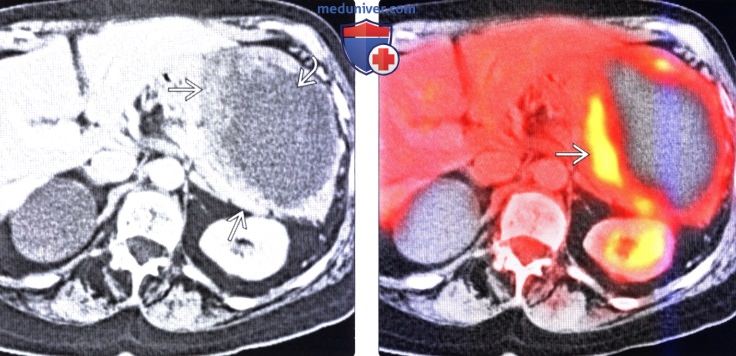 Развитие острых кровотечений из различных отделов желудочно-кишечного тракта диагностируют в 50% наблюдений. В спектре симптомов также – увеличение в объеме живота, анемия, слабость, потеря массы тела, тошнота, рвота, пальпируемые опухолевые массы. Но перечисленные признаки не являются строго специфичными и могут быть присущи любым опухолям брюшной полости.
Развитие острых кровотечений из различных отделов желудочно-кишечного тракта диагностируют в 50% наблюдений. В спектре симптомов также – увеличение в объеме живота, анемия, слабость, потеря массы тела, тошнота, рвота, пальпируемые опухолевые массы. Но перечисленные признаки не являются строго специфичными и могут быть присущи любым опухолям брюшной полости.
Гастроинтестинальная стромальная опухоль ЖКТ — центр лечения онкологии СМ-Клиники
Виды и причины
Как и в случае с другими видами онкологических новообразований, эффективность лечения гастроинтестинальных стромальных опухолей напрямую зависит от ранней диагностики. При этом ГИСО длительное время протекает бессимптомно. Чтобы выявить заболевание вовремя врачи «СМ-Клиника» рекомендуют регулярно проходить профилактическое обследование, особенно по достижении зрелого возраста.
Обычно гастроинтестинальные стромальные опухоли обнаруживаются в желудке (около двух третей всех случаев), реже в кишечнике (примерно 20 %), ещё реже — в пищеводе..jpg) ГИСО склонны к метастазированию — вредоносные клетки распространяются через кровь, поражая печень, лёгкие, кости.
ГИСО склонны к метастазированию — вредоносные клетки распространяются через кровь, поражая печень, лёгкие, кости.
Причина возникновения гастроинтестинальных стромальных опухолей ЖКТ — мутации в гене KIT или PDGFRA. Это нарушение приводит к аномальному росту клеток, из которых состоит новообразование.
Симптомы
Клиническая картина заболевания проявляется по мере роста опухоли. При значительных размерах новообразования наблюдаются следующие симптомы:
- плохой аппетит;
- затруднённое глотание;
- потеря веса;
- вздутие живота;
- кровь в кале;
- тошнота, рвота;
- слабость.
Диагностика и лечение
В медицинском центре «СМ-Клиника» диагностика гастроинтестинальных стромальных опухолей ЖКТ осуществляется с помощью инструментальных и лабораторных методик, среди которых:
- биопсия;
- КТ с контрастом;
- эндоскопия;
- УЗИ.
Лечение гастроинтестинальных стромальных опухолей ЖКТ носит комплексных характер, сочетая хирургическое удаление опухоли и таргетную терапию.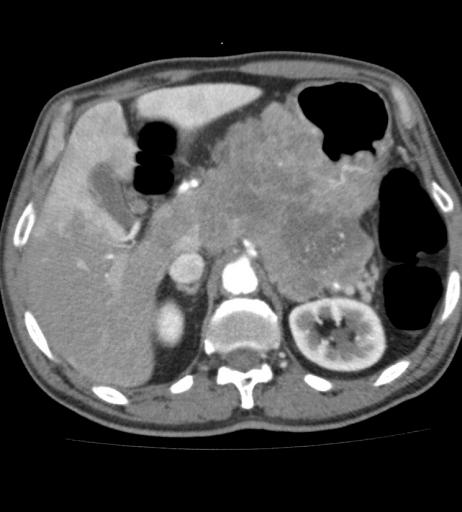
Тактика лечения разрабатывается с учетом рекомендаций и международных протоколов. Разработка методики борьбы с ГИСО учитывает особенности новообразования, стадию болезни, состояние здоровья и возраст пациента.
Узнайте подробности о лечении гастроинтестинальных стромальных опухолей ЖКТ и пройдите диагностику в медицинском центре «СМ-Клиника». Оставьте заявку или запишитесь на приём по телефону, указанному на сайте.
Информация в статье предоставлена в справочных целях и не заменяет консультации квалифицированного специалиста. Не занимайтесь самолечением! При первых признаках заболевания необходимо обратиться к врачу.
Читайте также
🩺 Гастроинтестинальные стромальные опухоли ЖКТ КТ
Почему нужна операция
Медикаментозная терапия в качестве самостоятельного метода лечения стромальных опухолей не обладает достаточной эффективностью. Основным методом лечения ГИСО является оперативное вмешательство. Стандарт хирургического лечения – радикальная операция, направленная на одномоментное иссечение опухолевого очага в границах здоровой ткани. Удаленные ткани отправляют на гистологический анализ. Результативность терапии обусловлена локализацией и распространенностью патологического процесса.
Удаленные ткани отправляют на гистологический анализ. Результативность терапии обусловлена локализацией и распространенностью патологического процесса.
Преимущества лечения ГИСО в клинике GMS
Отделение оперативной онкологии GMS Hospital использует весь арсенал современных методик хирургического лечения стромальных опухолей ЖКТ. Центр онкологии располагает современным операционным блоком, отделением интенсивной терапии и комфортабельным стационаром с одноместными палатами класса «люкс».
Обратившись к нам за медицинской помощью, каждый пациент получает:
- комплексный подход к лечению – пациента наблюдает не только онколог, но и другие узкие специалисты;
- малотравматичные хирургические технологии;
- современный безопасный наркоз;
- врачебное сопровождение пациента в послеоперационном периоде, помощь в быстром восстановлении;
- минимальный риск послеоперационных осложнений и рецидива болезни.

Наши операционные оснащены передовым оборудованием, необходимым для проведения операций на самом высоком уровне. Большая часть вмешательств выполняются эндоскопическим доступом. Для каждого пациента разрабатывается персональный план лечения, основанный на особенностях клинического случая.
Советуем ознакомиться
Причины болезни
Стромальные новообразования возникают из-за сбоя нормальной работы клеток, образующих гладкомышечную ткань. Причиной формирования ГИСО является мутация генов KIT или PDGFRA, обуславливающая аномальное разрастание клеток. Гастроинтестинальные опухоли уверенно можно назвать подслизистыми узлами, растущими внутрь органа. По мнению специалистов, спровоцировать генные мутации могут частые стрессы и психоэмоциональные потрясения, нарушение иммунитета, вредные привычки, нерациональное питание и другие неблагоприятные факторы.
Диагностика ГИСО
Отделение онкологии оснащено современным диагностическим оборудованием, которое обеспечивает достоверные результаты обследования и четкую визуализацию злокачественного процесса..jpg) В распоряжении наших пациентов самые современные методы диагностики:
В распоряжении наших пациентов самые современные методы диагностики:
- лабораторные анализы – тесты на скрытую кровь, генетические исследования, анализы на онкомаркеры, микроскопия биоптата, гистологические и иммунохимические тесты и т.д.;
- рентгенография, УЗИ, КТ, МРТ брюшной полости с контрастированием;
- гастроскопия;
- колоноскопия;
- ректороманоскопия;
- при подозрении на метастазы – КТ и рентген грудной клетки, рентген позвоночника, сцинтиграфия костей скелета и т.д.;
- при необходимости – консультации смежных специалистов (терапевта, гастроэнтеролога, проктолога, анестезиолога и других).
Какие методы исследования понадобятся в вашем случае, врач определит на консультации. Для уточнения диагноза могут потребоваться и другие виды обследований.
Методы лечения
Основной способ лечения GIST – оперативный. Объем хирургического вмешательства определяют в зависимости от местоположения опухоли и распространенности патологического процесса. Стандартом оперативного вмешательства является радикальное иссечение опухолевого очага вместе с 1-2 см близлежащих здоровых тканей. При больших размерах опухоли, выполняется частичное или тотальное удаление органа (резекция кишки, гастрэктомия, гемиколэктомия).
Стандартом оперативного вмешательства является радикальное иссечение опухолевого очага вместе с 1-2 см близлежащих здоровых тканей. При больших размерах опухоли, выполняется частичное или тотальное удаление органа (резекция кишки, гастрэктомия, гемиколэктомия).
Для предупреждения рецидива болезни, в комплексе с хирургическим лечением используется химиотерапия или таргетная терапия. Таргетные препараты действуют только на патологически измененные клетки, перекрывая к ним доступ кислорода и питательных элементов, в результате чего последние погибают.
При неоперабельных опухолях (на поздней стадии болезни) применяют медикаментозные средства, которые не оказывают влияния на саму опухоль, но устраняют негативную симптоматику и облегчают состояние пациента.
Профилактика ГИСО
Специфической профилактики стромальных опухолей не существует. Следите за общим состоянием здоровья и не пускайте на самотек болезнь– при первых тревожных симптомах обращайтесь за помощью к врачу! Записаться на консультацию к специалисту можно онлайн или по телефону.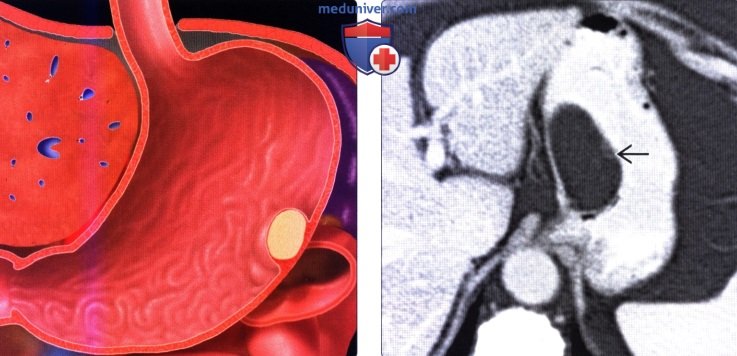
Стромальная опухоль желудочно-кишечного тракта (GIST) — Обзор
Желудочно-кишечная стромальная опухоль (GIST)
Желудочно-кишечные стромальные опухоли (GIST) — это саркомы мягких тканей, которые могут располагаться в любой части пищеварительной системы. Чаще всего они находятся в желудке и тонком кишечнике.
GIST начинается со специализированных нервных клеток, расположенных в стенках вашей пищеварительной системы. Эти клетки являются частью вегетативной нервной системы.Специфическое изменение ДНК одной из этих клеток, которые контролируют такие пищеварительные процессы, как движение пищи через кишечник, дает начало GIST .
Small GIST могут не вызывать никаких симптомов, и они могут расти настолько медленно, что не вызывают серьезных последствий.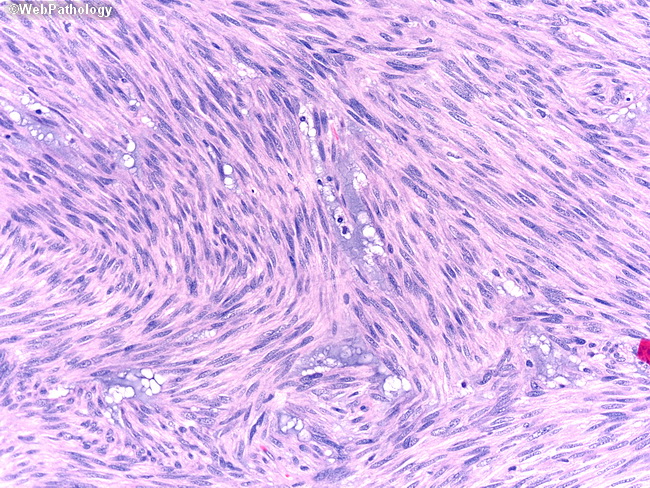 Люди с более крупными GIST обычно обращаются за медицинской помощью, когда у них рвота кровью или кровь в стуле из-за быстрого кровотечения из опухоли.
Люди с более крупными GIST обычно обращаются за медицинской помощью, когда у них рвота кровью или кровь в стуле из-за быстрого кровотечения из опухоли.
Другие возможные симптомы GIST включают:
- Анемия, вызванная медленно кровоточащей опухолью
- Боль в животе
- Рост, который вы чувствуете в животе
- Тошнота
- Рвота
- Потеря аппетита
- Похудание
- Затруднения при глотании
GIST могут развиваться у людей любого возраста, но чаще всего они возникают в возрасте от 50 до 70 лет и почти никогда не возникают до 40 лет.В редких случаях наследственное генетическое изменение (мутация) вызывает GIST s.
Диагноз
После того, как вы зададите вопросы о ваших симптомах и истории болезни, ваш врач внимательно осмотрит вас, проверив наличие опухоли в брюшной полости. Если признаки и симптомы предполагают, что у вас может быть GIST , последуют тесты для его определения и определения вероятности распространения (метастазирования) в другие органы.Эти тесты могут включать:
Если признаки и симптомы предполагают, что у вас может быть GIST , последуют тесты для его определения и определения вероятности распространения (метастазирования) в другие органы.Эти тесты могут включать:
- Компьютерная томография (КТ) с контрастным усилением. Для этого теста вы проглатываете жидкость, которая делает ваш желудок и тонкий кишечник более заметными на рентгеновских снимках. Вы также можете получить инъекцию аналогичного вещества. Затем сканер делает множество рентгеновских снимков, когда он перемещается по вашей брюшной полости. Компьютер объединяет рентгеновские снимки в подробные изображения поперечного сечения органов брюшной полости, показывающие размер и положение опухоли.
- Верхняя эндоскопия. Врач исследует внутреннюю оболочку пищевода, желудка и первую часть тонкой кишки с помощью гибкой трубки с подсветкой (эндоскоп), пропущенной через ваш рот. Во время верхней эндоскопии можно взять небольшие образцы патологической ткани.
 Во время этого теста вы получите мягкое расслабляющее лекарство (седативное средство) через внутривенную трубку.
Во время этого теста вы получите мягкое расслабляющее лекарство (седативное средство) через внутривенную трубку. - Эндоскопическое ультразвуковое исследование (EUS). В этом тесте также используется эндоскоп, но с ультразвуковым датчиком на конце эндоскопа.Поскольку звуковые волны от датчика создают эхо, которое отражается от датчика, компьютер преобразует эхо в изображение структур в брюшной полости, показывая точное местоположение опухоли. Если опухоль метастазировала в вашу печень или слизистую оболочку живота, эти области также могут быть видны. EUS также помогает определить глубину опухоли в стенке желудка или других местах желудочно-кишечного тракта.
Тонкоигольная аспирационная биопсия. Небольшой образец ткани опухоли необходим для точного диагноза GIST . Предпочтительным методом взятия биопсийного образца является эндоскопическое ультразвуковое исследование с тонкоигольной аспирацией.
 Эта процедура аналогична EUS , но с тонкой полой иглой на конце эндоскопа. Игла используется для удаления небольшого количества ткани для лабораторного анализа.
Эта процедура аналогична EUS , но с тонкой полой иглой на конце эндоскопа. Игла используется для удаления небольшого количества ткани для лабораторного анализа.Иногда эти тесты невозможны или их результаты неубедительны, поэтому подозреваемый GIST не может быть обнаружен без хирургического вмешательства.Затем после удаления опухоли проводится анализ тканей.
- Лабораторные исследования биопсий. Эти тесты предоставляют информацию о белках, производимых опухолевыми клетками. Один из этих тестов, иммуногистохимия, выявляет специфические белки, контролируемые генами, в клетках GIST . Идентификация этих белков помогает принимать решения о лечении. Иногда для обнаружения генов GIST в ДНК опухоли необходимо фактическое генетическое тестирование образцов биопсии.
 Клетки GIST также исследуют под микроскопом, чтобы увидеть, сколько клеток из 50 различных микроскопических полей активно делятся.Это число известно как скорость митоза. Чем выше скорость митоза в опухоли, тем она агрессивнее и тем выше вероятность распространения на другие органы.
Клетки GIST также исследуют под микроскопом, чтобы увидеть, сколько клеток из 50 различных микроскопических полей активно делятся.Это число известно как скорость митоза. Чем выше скорость митоза в опухоли, тем она агрессивнее и тем выше вероятность распространения на другие органы.
Лечение
Маленькие, бессимптомные GIST , обнаруженные в ходе тестов для другого состояния, в тщательно отобранных случаях можно приближаться с осторожным ожиданием.
Хирургия
Обычно большие или симптоматические GIST удаляются хирургическим путем, если они не слишком велики или не затрагивают слишком много органов и тканей для операции.Резекция также откладывается или избегается у людей, общее состояние здоровья которых делает любую операцию слишком рискованной, а также у тех, у кого есть метастазы GIST s.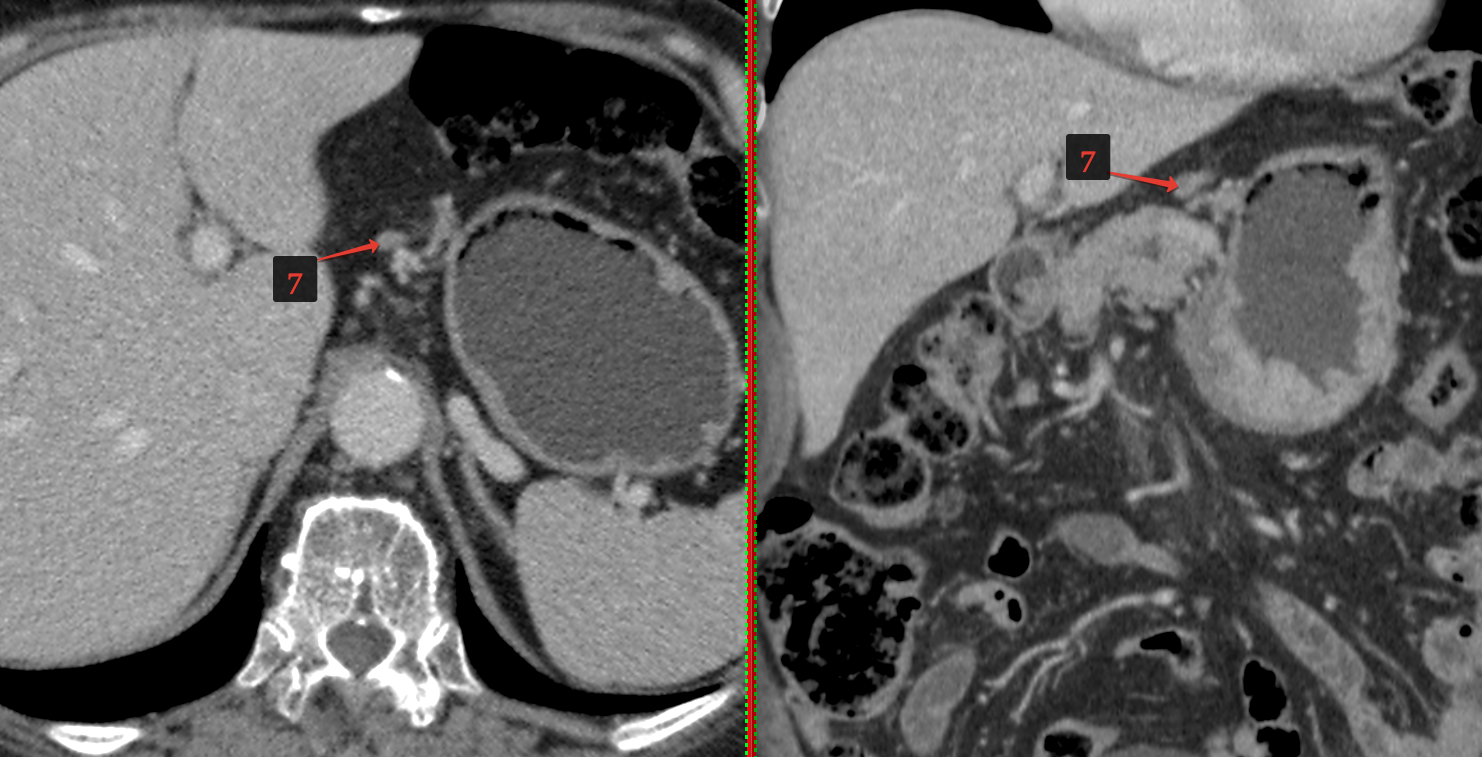
Часто можно выполнить резекцию GIST с помощью минимально инвазивной хирургии, которая включает введение смотровой трубки (лапароскопа) и хирургических инструментов через небольшие разрезы в брюшной полости.
Таргетная лекарственная терапия
Таргетная лекарственная терапия направлена на конкретные аномалии, присутствующие в раковых клетках.Блокируя эти аномалии, целевые лекарственные препараты могут вызывать гибель раковых клеток. Для GIST s мишенью этих лекарств является фермент, называемый тирозинкиназа, который помогает раковым клеткам расти.
Иматиниб (Гливек) — это таргетная терапия первой линии, используемая для предотвращения рецидива GIST после операции. Препарат также используется для уменьшения опухоли перед операцией, в ситуациях, когда операция невозможна, а также для контроля рецидивирующего GIST .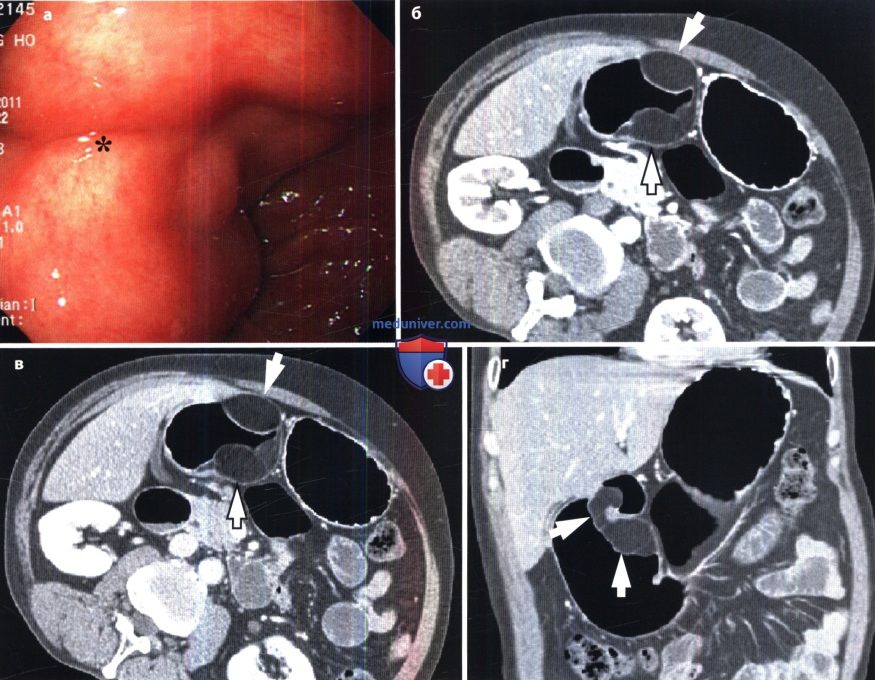 Лечение обычно продолжается до тех пор, пока действует препарат.
Лечение обычно продолжается до тех пор, пока действует препарат.
Могут быть рекомендованы другие препараты, нацеленные на тирозинкиназу, если ваш GIST не реагирует на иматиниб или становится устойчивым к нему со временем. Таргетная лекарственная терапия — активная область исследований рака, и в будущем, вероятно, появятся новые лекарства.
2 декабря 2020 г.
Если у вас стромальная опухоль желудочно-кишечного тракта (GIST)
Что такое ГИСО?
Рак может начаться в любом месте тела.GIST (произносится «jist») — это необычный тип рака, который начинается в пищеварительном тракте, также известном как желудочно-кишечный тракт (GI). Это путь внутри нашего тела, по которому проходит еда. Большинство GIST начинаются в желудке или тонком кишечнике, но они также могут начинаться в пищеводе (трубке, соединяющей горло с желудком), толстой, прямой кишке или других местах.
ГИСО — это не то же самое, что более распространенные типы рака, которые начинаются в желудочно-кишечном тракте, такие как рак толстой кишки и рак желудка .ГИСО не лечатся так же, как эти виды рака.
GIST запускаются, когда определенные клетки, которые помогают перемещать пищу по желудочно-кишечному тракту, начинают бесконтрольно расти. Они могут вытеснять нормальные клетки, что затрудняет нормальную работу организма.
GIST-клетки иногда могут распространяться на другие части тела. Например, клетки желудка GIST могут перемещаться в печень и расти там. Когда раковые клетки делают это, это называется метастаз . Для врачей раковые клетки на новом месте выглядят точно так же, как и в желудке.
Рак всегда называют по месту, где он начинается. Поэтому, когда ГИСО распространяется в печень (или любое другое место), он все еще называется ГИСО. Это не рак печени, если он не начинается с клеток печени.
Существуют ли разные виды ГИСО?
Не все GIST одинаковы. Некоторые из них, вероятно, будут медленно расти и распространяться. Другие с большей вероятностью будут быстро расти и распространяться. У вашего врача есть способы определить, что с наибольшей вероятностью может произойти с вашей опухолью.
Вопросы к врачу
- Как вы думаете, почему у меня рак?
- Есть шанс, что у меня нет рака?
- Не могли бы вы записать, какой, по вашему мнению, у меня вид рака?
- Где рак?
- Что будет дальше?
Как врач узнает, что у меня ГИСО?
Многие ГИСО вызывают симптомы не сразу. Иногда они обнаруживаются, когда человек сдает экзамен или тест по другой проблеме.
Если GIST действительно вызывает симптомы, они могут включать рвоту с кровью, кровянистый или темный стул. Они также могут вызвать боль в животе, потерю аппетита или потерю веса. Некоторые люди с ГИСО чувствуют усталость из-за того, что они потеряли кровь из опухоли в стул. Ваш врач задаст вопросы о ваших симптомах и проведет физический осмотр.
Ваш врач задаст вопросы о ваших симптомах и проведет физический осмотр.
Тесты на поиск GIST
Если ваш врач считает, что у вас может быть ГИСО (или какой-либо другой тип опухоли желудочно-кишечного тракта), будут проведены дополнительные анализы.Вот некоторые из тестов, которые могут вам понадобиться:
CT или Компьютерная томография: В этом тесте используются рентгеновские лучи для получения подробных снимков внутренней части вашего тела. КТ часто может показать размер, форму и место опухолей в желудочно-кишечном тракте. Этот тест также может быть проведен, чтобы узнать, распространился ли рак.
МРТ: МРТ используют радиоволны и сильные магниты вместо рентгеновских лучей, чтобы делать очень подробные снимки внутренней части вашего тела. МРТ может помочь увидеть размер и форму опухоли.
Рентгеновские исследования с барием: Для исследования внутренней части желудочно-кишечного тракта можно использовать различные типы рентгеновских исследований. Для этих тестов вы либо проглатываете меловую жидкость, либо вводите ее через прямую кишку. Барий в жидкости очерчивает внутреннюю выстилку желудочно-кишечного тракта на рентгеновских снимках. Эти типы тестов не используются так часто, как раньше.
Для этих тестов вы либо проглатываете меловую жидкость, либо вводите ее через прямую кишку. Барий в жидкости очерчивает внутреннюю выстилку желудочно-кишечного тракта на рентгеновских снимках. Эти типы тестов не используются так часто, как раньше.
ПЭТ сканирование: В этом тесте вам дается особый вид сахара, который можно увидеть внутри вашего тела с помощью специальной камеры.Если есть рак, этот сахар проявляется как «горячие точки», где обнаруживается рак. Этот тест может помочь показать, где распространился GIST.
Эндоскопия: Для этих тестов врач вводит гибкую трубку с подсветкой с крошечной видеокамерой на конце в тело, чтобы увидеть внутреннюю оболочку желудочно-кишечного тракта. В зависимости от того, где предположительно находится опухоль, трубку можно ввести в горло (для верхней эндоскопии) или ввести в прямую кишку (для колоноскопии). Если видны аномальные области, можно взять небольшие образцы для биопсии (см. Ниже).
Эндоскопия также может использоваться для проведения своего рода ультразвукового исследования, называемого эндоскопическим ультразвуком (EUS). Ультразвук использует звуковые волны для создания снимков внутренней части тела. Для EUS маленький ультразвуковой датчик находится на конце эндоскопа, что позволяет ему подобраться очень близко к опухоли. Этот тест может показать, насколько далеко опухоль прорастает в стенку желудочно-кишечного тракта. Это также может помочь определить, достигла ли опухоль близлежащих лимфатических узлов.
Биопсия
При биопсии врач извлекает небольшие кусочки аномальной области для проверки на наличие раковых клеток.Если обнаружен рак, будут проведены лабораторные анализы, чтобы выяснить, какой это тип рака. Но не всем, у кого есть опухоль, которая может быть GIST, нужно делать биопсию перед лечением.
Есть разные способы сделать биопсию. Это можно сделать во время эндоскопии или хирургического вмешательства, а иногда и с использованием тонкой полой иглы для взятия образцов биопсии. Используемый тип будет зависеть от размера опухоли и того, где она находится в вашем теле. Спросите своего врача, какой вид вам понадобится.
Используемый тип будет зависеть от размера опухоли и того, где она находится в вашем теле. Спросите своего врача, какой вид вам понадобится.
При обнаружении ГИСО образцы биопсии можно провести, чтобы определить, насколько быстро опухоль может расти и распространяться.Это может повлиять на ваше лечение.
Вопросы к врачу
- Какие тесты мне нужно будет пройти?
- Кто будет проводить эти тесты?
- Где они будут делать?
- Кто мне их объяснит?
- Как и когда я получу результаты?
- Кто мне объяснит результаты?
- Что мне делать дальше?
Насколько серьезен мой рак?
Если у вас есть GIST, врач захочет выяснить, распространился ли он, и если да, то как далеко он распространился.Это называется постановкой рака. Ваш врач захочет определить стадию, чтобы решить, какой тип лечения лучше всего подходит для вас.
Этап зависит от того, насколько опухоль выросла в том месте, где она началась, или распространилась на другие части вашего тела. Это также зависит от того, где находится опухоль в желудочно-кишечном тракте и насколько быстро она будет расти и распространяться (на основе лабораторных тестов биоптатов).
Это также зависит от того, где находится опухоль в желудочно-кишечном тракте и насколько быстро она будет расти и распространяться (на основе лабораторных тестов биоптатов).
Ваш рак может быть 1, 2, 3 или 4. Чем меньше число, тем меньше рак распространился.Более высокое число, например стадия 4, означает более серьезный рак, который распространился от того места, где он впервые появился. Спросите врача о стадии рака и о том, что это значит для вас.
При принятии решения о лечении врачи часто используют более простую систему, которая разделяет GIST на 2 основные группы:
- Резектабельные опухоли: те, которые можно безопасно удалить хирургическим путем
- Неоперабельные опухоли: те, которые невозможно удалить безопасно
Вопросы к врачу
- Вы знаете стадию рака?
- Если нет, как и когда вы узнаете стадию рака?
- Не могли бы вы объяснить мне, что означает стадия моего рака?
- Как стадия рака влияет на варианты лечения?
- Что будет дальше?
Какое лечение мне понадобится?
Не все ГИСО требуют немедленного лечения..bmp) За некоторыми небольшими опухолями, которые могут расти медленно, можно просто внимательно наблюдать. Но если лечение необходимо, хирургия обычно является основным лечением, если это возможно. Таргетные препараты с большей вероятностью будут использованы, если опухоль распространилась. Реже используются другие виды лечения.
За некоторыми небольшими опухолями, которые могут расти медленно, можно просто внимательно наблюдать. Но если лечение необходимо, хирургия обычно является основным лечением, если это возможно. Таргетные препараты с большей вероятностью будут использованы, если опухоль распространилась. Реже используются другие виды лечения.
Лучший план лечения зависит от:
- Стадия опухоли и где она находится
- Можно ли безопасно удалить опухоль хирургическим путем
- Вероятность рецидива опухоли после лечения
- Ваш возраст и общее состояние здоровья
- Ваши впечатления от лечения и возможные побочные эффекты
Хирургический
Операция используется для удаления опухоли и края здоровой ткани вокруг нее.Это основное лечение GIST, если это возможно. Тип операции зависит от того, где находится опухоль. Спросите своего врача, какая операция вам понадобится и чего ожидать.
Побочные эффекты операции
Любая операция может иметь риски и побочные эффекты. Спросите врача, чего вам ожидать. Если у вас возникнут проблемы, сообщите об этом своим врачам и медсестрам. Они могут помочь вам с любыми возникающими проблемами.
Таргетные препараты
Таргетные препараты атакуют некоторые изменения в раковых клетках, которые помогают им расти.Эти препараты влияют в основном на раковые клетки, а не на нормальные клетки организма. Они часто являются основным методом лечения ГИСО, если операция невозможна. Их также можно использовать до или после операции по поводу некоторых опухолей.
Эти препараты представляют собой таблетки, которые вы принимаете дома. Они, как правило, имеют побочные эффекты, отличные от химиопрепаратов.
Побочные действия таргетных препаратов
Побочные эффекты зависят от того, какой препарат используется. Некоторые из этих препаратов могут вызывать расстройство желудка, жидкий стул, боль в мышцах, изменения кожи и могут вызывать у человека чувство усталости. Также возможны более тяжелые побочные эффекты.
Также возможны более тяжелые побочные эффекты.
Есть способы лечения многих побочных эффектов, вызванных таргетными лекарствами. Если у вас есть побочные эффекты, поговорите со своей командой по лечению рака, чтобы они могли помочь.
Chemo
Химиотерапия, или для краткости химиотерапия, — это использование определенных типов лекарств для борьбы с раком. Химиотерапия проводится циклами или раундами. После каждого цикла лечения следует перерыв. Наркотики часто вводятся через иглу в вену. Эти препараты попадают в кровь и распространяются по организму.
Химиотерапия не часто помогает при лечении ГИСО, поэтому ее мало используют.
Побочные эффекты химиотерапии
Химиотерапия может вызвать сильную усталость, тошноту в животе, а иногда и выпадение волос. Но эти проблемы, как правило, проходят после окончания лечения.
Есть способы лечения большинства побочных эффектов химиотерапии. Если у вас есть побочные эффекты, поговорите со своей командой по лечению рака, чтобы они могли помочь.
Лучевая терапия
Радиация использует лучи высокой энергии (например, рентгеновские лучи) для уничтожения раковых клеток.Радиация не очень помогает при лечении ГИСО, поэтому используется нечасто. Но иногда его можно использовать для облегчения таких симптомов, как боль в костях.
Радиация для GIST направлена на опухоль от аппарата вне тела. Это называется излучением внешнего пучка.
Побочные эффекты лучевой терапии
Если ваш врач предлагает лучевую терапию, спросите, какие побочные эффекты могут возникнуть. Побочные эффекты зависят от обрабатываемой области. Некоторые общие побочные эффекты радиации:
- Изменения кожи в местах облучения
- Чувство усталости
Большинство побочных эффектов проходят после окончания лечения.Спросите свою команду по лечению рака, чего вы можете ожидать во время и после лечения.
Клинические испытания
Клинические испытания — это исследования, в ходе которых проверяются новые лекарства или другие методы лечения на людях. Они сравнивают стандартные методы лечения с другими, которые могут быть лучше.
Они сравнивают стандартные методы лечения с другими, которые могут быть лучше.
Если вы хотите узнать больше о клинических испытаниях, которые могут вам подойти, сначала спросите своего врача, проводятся ли клинические испытания в вашей клинике или больнице. См. «Клинические испытания», чтобы узнать больше.
Клинические испытания — один из способов получить новейшее лечение рака.Это лучший способ для врачей найти лучшие способы лечения рака. Но они могут быть не для всех. Если ваш врач сможет найти того, кто изучает ваш тип рака, вам решать, участвовать ли вам. И если вы все же запишетесь на клиническое испытание, вы всегда можете прекратить его в любой момент.
Как насчет других методов лечения, о которых я слышал?
Когда у вас есть ГИСО, вы можете услышать о других способах его лечения или лечения ваших симптомов. Это не всегда может быть стандартное лечение.Эти методы лечения могут быть витаминами, травами, диетами и другими вещами. Вы можете задаться вопросом об этих методах лечения.
Некоторые из них могут помочь, но многие из них не тестировались. Было показано, что некоторые не помогают. Некоторые даже оказались вредными. Поговорите со своим врачом обо всем, что вы думаете об употреблении, будь то витамины, диета или что-нибудь еще.
Вопросы к врачу
- Нужно ли мне обращаться к другим врачам?
- Какое лечение, по вашему мнению, лучше всего для меня?
- Какова цель этого лечения? Как вы думаете, он может вылечить рак?
- Будет ли лечение включать хирургическое вмешательство? Если да, то кто будет делать операцию?
- Какая будет операция?
- Как мое тело будет выглядеть и работать после операции?
- Потребуются ли мне и другие виды лечения?
- Каким будет это лечение?
- Какова цель этих процедур?
- Какие побочные эффекты могут возникнуть у меня от этих процедур?
- Что я могу сделать с возможными побочными эффектами?
- Подходит ли мне клиническое испытание?
- А как насчет витаминов или диет, о которых мне рассказывают друзья? Как я узнаю, что они в безопасности?
- Как скоро мне нужно начать лечение?
- Что мне делать, чтобы быть готовым к лечению?
- Могу ли я что-нибудь сделать, чтобы лечение улучшилось?
- Что делать дальше?
Что будет после лечения?
Будете рады, когда лечение закончится. Но трудно не беспокоиться о возвращении рака. Даже когда рак больше не возвращается, люди все равно беспокоятся об этом. В течение многих лет после окончания лечения вы будете посещать своего онколога. Сначала ваши посещения могут быть каждые несколько месяцев. Затем, чем дольше вы не страдаете от рака, тем реже вам нужны посещения.
Но трудно не беспокоиться о возвращении рака. Даже когда рак больше не возвращается, люди все равно беспокоятся об этом. В течение многих лет после окончания лечения вы будете посещать своего онколога. Сначала ваши посещения могут быть каждые несколько месяцев. Затем, чем дольше вы не страдаете от рака, тем реже вам нужны посещения.
Обязательно ходите на все последующие визиты. Врачи спросят о ваших симптомах, осмотрят вас и могут назначить анализы, чтобы определить, вернулся ли рак.
Заболеть раком и лечиться может быть непросто, но это также может быть временем, чтобы взглянуть на свою жизнь по-новому.Возможно, вы думаете о том, как улучшить свое здоровье. Позвоните нам по телефону 1-800-227-2345 или поговорите со своим врачом, чтобы узнать, что вы можете сделать, чтобы почувствовать себя лучше.
Вы не можете изменить тот факт, что у вас рак. Что вы можете изменить, так это то, как вы проживете остаток своей жизни — делая выбор в пользу здорового образа жизни и чувствуя себя настолько хорошо, насколько это возможно.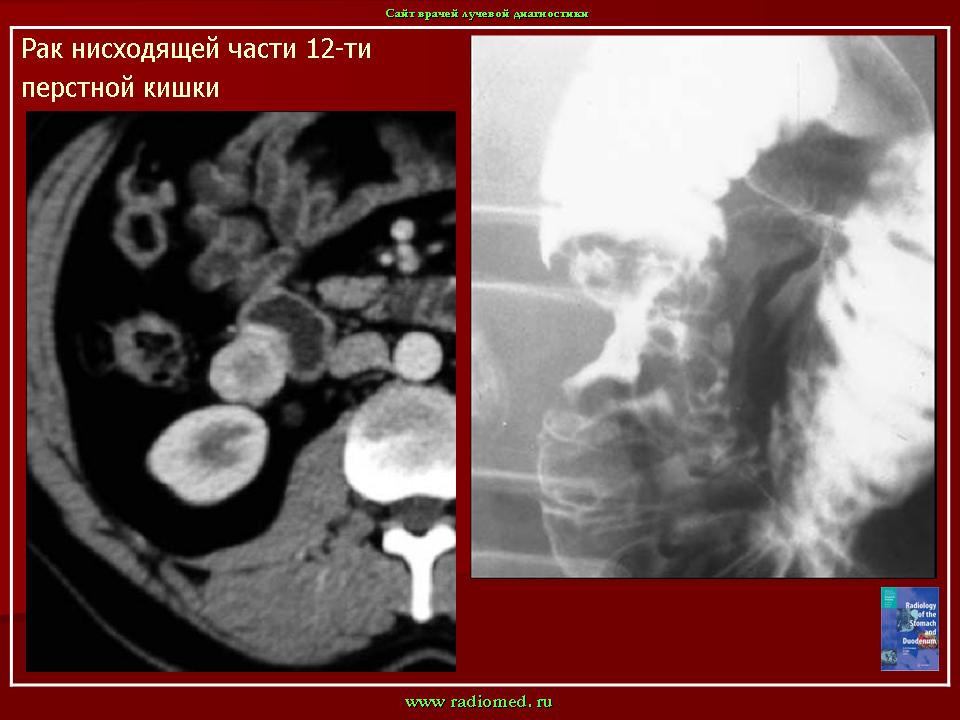
Лечение стромальных опухолей желудочно-кишечного тракта (взрослые) (PDQ®) — версия для пациента
О PDQ
Запрос данных врача (PDQ) — это обширная база данных по раку Национального института рака (NCI).База данных PDQ содержит резюме последней опубликованной информации о профилактике, обнаружении, генетике, лечении, поддерживающей терапии, а также дополнительной и альтернативной медицине. Большинство резюме представлено в двух версиях. Версии для медицинских работников содержат подробную информацию на техническом языке. Версии для пациентов написаны понятным, нетехническим языком. Обе версии содержат точную и актуальную информацию о раке, и большинство версий также доступно на испанском языке.
PDQ — это услуга NCI. NCI входит в состав Национальных институтов здравоохранения (NIH). NIH — это центр биомедицинских исследований при федеральном правительстве. Обзоры PDQ основаны на независимом обзоре медицинской литературы. Это не политические заявления NCI или NIH.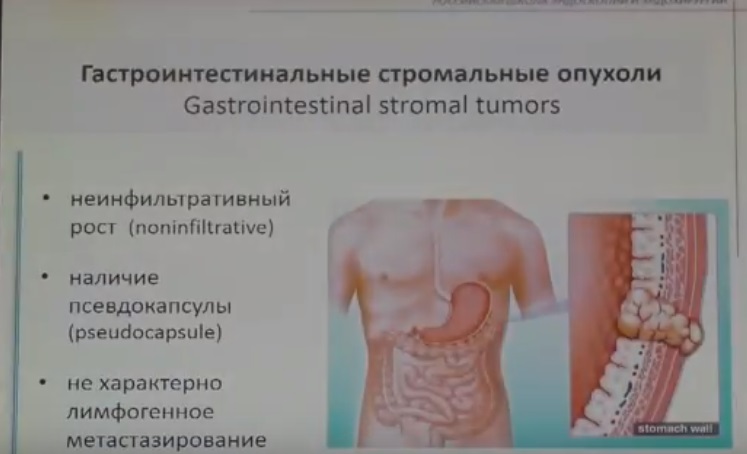
Цель этого обзора
В этом обзоре информации о раке PDQ содержится текущая информация о лечении стромальных опухолей желудочно-кишечного тракта у взрослых. Он предназначен для информирования и помощи пациентам, семьям и лицам, осуществляющим уход.Он не дает официальных руководящих принципов или рекомендаций для принятия решений в отношении здравоохранения.
Рецензенты и обновления
Редакционные коллегии составляют сводки информации о раке PDQ и поддерживают их в актуальном состоянии. Эти советы состоят из экспертов в области лечения рака и других специальностей, связанных с раком. Резюме регулярно пересматриваются, и в них вносятся изменения при появлении новой информации. Дата в каждой сводке («Обновлено») — это дата самого последнего изменения.
Информация в этом обзоре пациентов была взята из версии для медицинских работников, которая регулярно проверяется и обновляется по мере необходимости редакционной коллегией PDQ по лечению взрослых.
Информация о клиническом испытании
Клиническое испытание — это исследование, призванное ответить на научный вопрос, например, лучше ли одно лечение, чем другое. Испытания основаны на прошлых исследованиях и на том, что было изучено в лаборатории. Каждое испытание отвечает на определенные научные вопросы, чтобы найти новые и лучшие способы помочь больным раком. Во время клинических испытаний лечения собирается информация об эффектах нового лечения и о том, насколько хорошо оно работает. Если клинические испытания покажут, что новое лечение лучше, чем то, что используется в настоящее время, новое лечение может стать «стандартным».«Пациенты могут захотеть принять участие в клиническом испытании. Некоторые клинические испытания открыты только для пациентов, которые еще не начали лечение.
Клинические испытания можно найти в Интернете на сайте NCI. Для получения дополнительной информации позвоните в Информационную службу рака (CIS), контактный центр NCI, по телефону 1-800-4-CANCER (1-800-422-6237).
Разрешение на использование данного обзора
PDQ является зарегистрированным товарным знаком. Содержимое документов PDQ можно свободно использовать как текст. Его нельзя идентифицировать как сводную информацию о раке NCI PDQ, если не отображается вся сводка и не обновляется регулярно.Тем не менее, пользователю будет разрешено написать такое предложение, как «Сводка информации о раке PDQ NCI о профилактике рака груди указывает риски следующим образом: [включить выдержку из резюме]».
Лучше всего процитировать это резюме PDQ:
Редакционная коллегия PDQ® Adult Treatment. PDQ Лечение стромальных опухолей желудочно-кишечного тракта (взрослые). Бетесда, Мэриленд: Национальный институт рака. Обновлено <ММ / ДД / ГГГГ>. Доступно по адресу: https://www.cancer.gov/types/soft-tissue-sarcoma/patient/gist-treatment-pdq.Дата обращения <ММ / ДД / ГГГГ>. [PMID: 26389367]
Изображения в этом обзоре используются с разрешения автора (ов), художника и / или издателя только для использования в обзорах PDQ.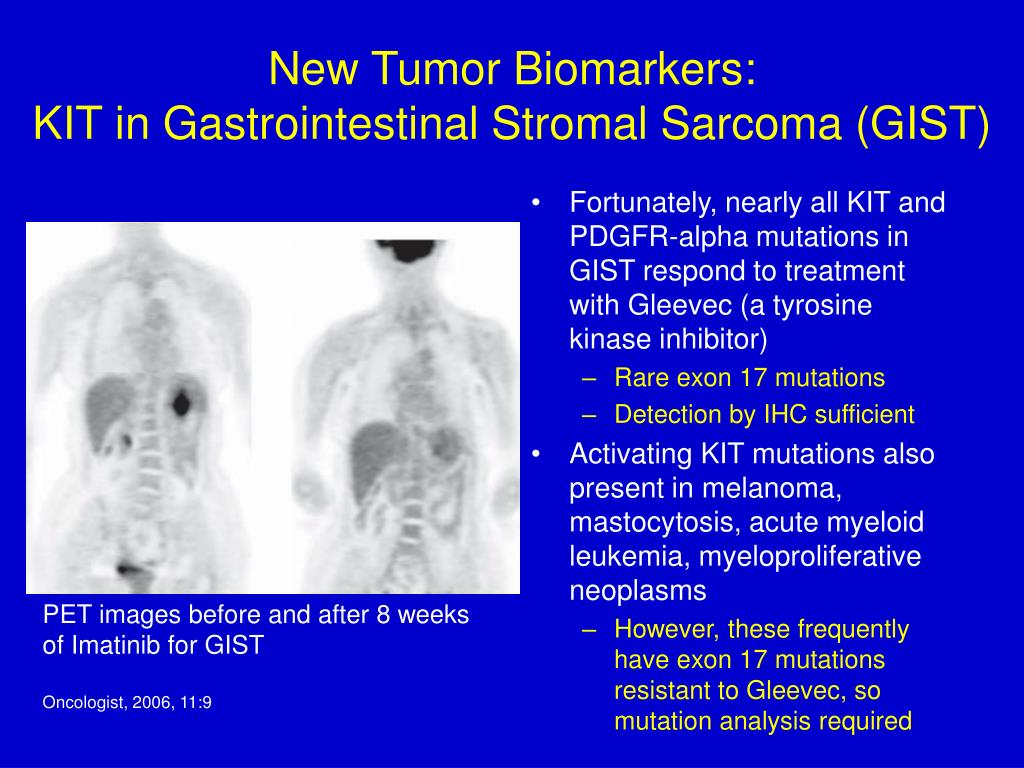 Если вы хотите использовать изображение из сводки PDQ, но не полностью, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Если вы хотите использовать изображение из сводки PDQ, но не полностью, вы должны получить разрешение от владельца. Он не может быть предоставлен Национальным институтом рака. Информацию об использовании изображений в этом обзоре, а также многих других изображений, связанных с раком, можно найти в Visuals Online. Visuals Online — это коллекция из более чем 3000 научных изображений.
Заявление об ограничении ответственности
Информация, содержащаяся в этих сводках, не должна использоваться для принятия решений о страховом возмещении. Более подробная информация о страховом покрытии доступна на сайте Cancer.gov на странице «Управление онкологическими услугами».
Свяжитесь с нами
Более подробную информацию о том, как связаться с нами или получить помощь на веб-сайте Cancer.gov, можно найти на нашей странице «Свяжитесь с нами для получения помощи». Вопросы также можно отправить на Cancer.gov через электронную почту веб-сайта.
Стромальные опухоли желудочно-кишечного тракта — NORD (Национальная организация редких заболеваний)
СТАТЬИ В ЖУРНАЛЕ
Генрих М. С., Джонс Р.Л., фон Мерен М. и др.Клиническая активность авапритиниба при опухолях стромы желудочно-кишечного тракта (GIST) ≥ четвертой линии (4L +) и PDGFRA Exon 18. Журнал клинической онкологии. 2019; 37: 15_suppl: 11022-11022. https://ascopubs.org/doi/abs/10.1200/JCO.2019.37.15_suppl.11022
С., Джонс Р.Л., фон Мерен М. и др.Клиническая активность авапритиниба при опухолях стромы желудочно-кишечного тракта (GIST) ≥ четвертой линии (4L +) и PDGFRA Exon 18. Журнал клинической онкологии. 2019; 37: 15_suppl: 11022-11022. https://ascopubs.org/doi/abs/10.1200/JCO.2019.37.15_suppl.11022
Neppala P, Banerjee S, Fanta PT, et al. Текущее лечение стромальных опухолей желудочно-кишечного тракта с дефицитом сукцинатдегидрогеназы. Обзоры метастазов рака 2019; 38 (3): 525–535. https://doi.org/10.1007/s10555-019-09818-0
Singh AS, Chmielowski B.J., Hecht R, et al.Рандомизированное исследование фазы II монотерапии ниволумабом в сравнении с ниволумабом в сочетании с ипилимумабом при распространенной стромальной опухоли желудочно-кишечного тракта (GIST). Журнал клинической онкологии. 2019; 37: 15_suppl, 11017-11017. https://ascopubs.org/doi/abs/10.1200/JCO.2019.37.15_suppl.11017
Wu C E, Tzen C Y, Wang S Y, et al. Клиническая диагностика стромальной опухоли желудочно-кишечного тракта (ГИСО): с молекулярно-генетической точки зрения. Раки. 2019; 11 (5): 679. https://doi.org/10.3390/cancers11050679
Раки. 2019; 11 (5): 679. https://doi.org/10.3390/cancers11050679
Чаро Л. М., Бургойн А. М., Фанта П. Т. и др.Новое слияние PRKAR1B-BRAF при опухолях стромы желудочно-кишечного тракта позволяет принимать решения по адъювантному лечению во время беременности. Журнал Национальной комплексной онкологической сети. 2018; 16 (3): 238–242. https://doi.org/10.6004/jnccn.2017.7039
Drilon A, Laetsch TW, Kummar S и др. Эффективность ларотректиниба при положительном слиянии TRK раке у взрослых и детей. Медицинский журнал Новой Англии. 2018; 378 (8): 731–739. https://doi.org/10.1056/NEJMoa1714448
Alkhuziem M, Burgoyne A. M, Fanta P T и др.Призыв «дикого» типа GIST: время для приручения. Журнал Национальной комплексной онкологической сети. 2017; 15 (5): 551–554. https://doi.org/10.6004/jnccn.2017.0057
Burgoyne A M, De Siena M, Alkhuziem M, et al. Стромальная опухоль желудочно-кишечного тракта изгиба двенадцатиперстной кишки и тощей кишки часто предвещает соматические мутации NF1 и пути надреза. Прецизионная онкология JCO, 2017; 10.1200 / ПО.17.00014. https://doi.org/10.1200/PO.17.00014
Прецизионная онкология JCO, 2017; 10.1200 / ПО.17.00014. https://doi.org/10.1200/PO.17.00014
Д’Анджело С. П., Шуштари А. Н., Кеохан М. Л. и др. Комбинированная блокада KIT и CTLA-4 у пациентов с рефрактерной GIST и другими распространенными саркомами: исследование фазы Ib дазатиниба плюс ипилимумаб.Клинические исследования рака. 2017; 23 (12): 2972–2980. https://doi.org/10.1158/1078-0432.CCR-16-2349
Ши Э., Хмелецкий Дж., Тан С.М. и др. Активные изменения FGFR1 и NTRK3 в желудочно-кишечных стромальных опухолях «дикого типа». Журнал трансляционной медицины. 2016; 14 (1): 339. https://doi.org/10.1186/s12967-016-1075-6
Ma GL, Murphy JD, Martinez ME и Sicklick JK. Эпидемиология стромальных опухолей желудочно-кишечного тракта в эпоху гистологических кодов: результаты популяционного исследования.Эпидемиология рака, биомаркеры и профилактика: публикация Американской ассоциации исследований рака. 2015; 24 (1): 298–302. https://doi.org/10.1158/1055-9965.EPI-14-1002
Белинский М. Г., Ринк Л., фон Мерен М. Дефицит сукцинатдегидрогеназы при стромальных опухолях желудочно-кишечного тракта у детей и взрослых. Фасад Онкол. 2013; 3: 117. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3656383/
Г., Ринк Л., фон Мерен М. Дефицит сукцинатдегидрогеназы при стромальных опухолях желудочно-кишечного тракта у детей и взрослых. Фасад Онкол. 2013; 3: 117. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3656383/
Demetri GD, Reichardt P, Kang YK, et al. Эффективность и безопасность регорафениба при запущенных стромальных опухолях желудочно-кишечного тракта после неэффективности иматиниба и сунитиниба (GRID): международное многоцентровое рандомизированное плацебо-контролируемое исследование фазы 3.Ланцет. 2013; 381: 295-302. http://www.ncbi.nlm.nih.gov/pubmed/23177515
Falchook GS, Trent JC, Heinrich MD, et al. Мутантная стромальная опухоль желудочно-кишечного тракта BRAF: первое сообщение о регрессии с ингибитором BRAF дабрафенибом (GSK2118436) и полное экзомное секвенирование для анализа приобретенной устойчивости. Oncotarget. 2013; 4: 310-315. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3712576/
Beham AW, Schaefer IM, Schuler P, Cameron S, Ghadimi BM. Опухоли стромы желудочно-кишечного тракта..jpg) Int J Colorectal Dis.2012; 27: 689-700. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3359441/#!po=18.7500
Int J Colorectal Dis.2012; 27: 689-700. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3359441/#!po=18.7500
Blay J, Le Cesne A, Cassier PA, Ray-Coquard IL. Опухоли стромы желудочно-кишечного тракта (ГИСО): редкое образование, модель опухоли для персонализированной терапии, и все же десять различных молекулярных подтипов. Discov Med. 2012; 13: 357-367. http://www.ncbi.nlm.nih.gov/pubmed/22642917
George S, Wang Q, Heinrich MC, et al. Эффективность и безопасность регорафениба у пациентов с метастатической и / или неоперабельной стромальной опухолью желудочно-кишечного тракта после неэффективности иматиниба и сунитиниба: многоцентровое исследование фазы II.J Clin Oncol. 2012; 30: 2401-2407. http://www.ncbi.nlm.nih.gov/pubmed/22614970
Джейнвей К.А., Паппо А. Руководство по лечению стромальных опухолей желудочно-кишечного тракта у детей и молодых людей. J Pediatr Hematol Oncol. 2012; 34: S69-S72. http://www.ncbi.nlm.nih.gov/pubmed/22525410
Koontz MZ, Visser BM, Kunz PL. Неоадъювантный иматиниб для погранично-операбельной ГИСО. J Natl Compr Canc Netw. 2012; 10: 1477-1482. http://www.ncbi.nlm.nih.gov/pubmed/23221786
Неоадъювантный иматиниб для погранично-операбельной ГИСО. J Natl Compr Canc Netw. 2012; 10: 1477-1482. http://www.ncbi.nlm.nih.gov/pubmed/23221786
Lamba G, Ambrale S, Lee B и др.Последние достижения и новые средства для лечения стромальной опухоли желудочно-кишечного тракта (GIST). J Hematol Oncol. 2012; 5:21. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3405472/
Postow MA, Robson ME. Унаследованные синдромы опухоли стромы желудочно-кишечного тракта: мутации, клинические особенности и терапевтическое значение. Clin Sarcoma Res. 2012; 2: 16. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3496697/#!po=46.8750
Роггин К.К., Познер М.С. Современное лечение стромальных опухолей желудочно-кишечного тракта. Мир Дж. Гастроэнтерол.2012; 18: 6720-6728. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3520160/
Janeway KA, Kim SY, Lodish M, et al. Дефекты сукцинатдегидрогеназы в стромальных опухолях желудочно-кишечного тракта, лишенные мутаций KIT и PDGFRA. Proc Natl Acad Sci USA. 2011; 108: 314-318. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3017134/
2011; 108: 314-318. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC3017134/
Kim SY, Janeway K, Pappo A. Педиатрические и желудочно-кишечные стромальные опухоли дикого типа (GIST): новые терапевтические подходы. Curr Opin Oncol. 2010; 22: 347-350. http: //www.ncbi.nlm.nih.gov/pmc/articles/PMC2949288/
DeMatteo RP, Ballman KV, Antonescu CR, et al. Плацебо-контролируемое рандомизированное испытание адъюванта мезилата иматиниба после резекции локализованной первичной стромальной опухоли желудочно-кишечного тракта (GIST). Ланцет. 2009; 373: 1097-1104. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC2915459/
Li FP, Fletcher JA, Heinrich MC, et al. Синдром семейной стромальной опухоли желудочно-кишечного тракта: фенотипические и молекулярные особенности в родстве. J Clin Oncol. 2005; 23: 2735-2743.http://www.ncbi.nlm.nih.gov/pubmed/15837988
Corless CL, Fletcher JA, Heinrich MC. Биология стромальных опухолей желудочно-кишечного тракта. J Clin Oncol. 2004; 22: 3813-25. http://www.ncbi.nlm.nih.gov/pubmed/15365079
http://www.ncbi.nlm.nih.gov/pubmed/15365079
Eisenberg BL, Judson I. Хирургия и иматиниб в лечении GIST: новые подходы к адъювантной и неоадъювантной терапии. Энн Сург Онкол. 2004; 11: 465-75. http://www.ncbi.nlm.nih.gov/pubmed/15123459
Sattler M, Salgia R. Нацеливание на мутации c-Kit: фундаментальные науки к новым методам лечения.Leuk Res. 2004; 28 Приложение 1: S11-20. http://www.ncbi.nlm.nih.gov/pubmed/15036937
Tosoni A, Nicolardi L, Brandes AA. Текущее клиническое ведение стромальных опухолей желудочно-кишечного тракта. Эксперт Rev Anticancer Ther. 2004; 4: 595-605. http://www.ncbi.nlm.nih.gov/pubmed/15270663
ИНТЕРНЕТ
МакКусик В.А., изд. Интернет-Менделирующее наследование в человеке (OMIM). Университет Джона Хопкинса. Стромальная опухоль желудочно-кишечного тракта; СУТЬ. Регистрационный номер; 606764: Дата последнего редактирования: 09.12.2019. Доступно по адресу: http: // omim.org / entry / 606764 По состоянию на 20 февраля 2020 г.
FDA одобряет ларотректиниб для лечения солидных опухолей со слияниями генов NTRK. Дата последнего редактирования: 14.12.2018. Доступно по адресу:
Дата последнего редактирования: 14.12.2018. Доступно по адресу:
https://www.fda.gov/drugs/fda-approves-larotrectinib-solid-tumors-ntrk-gene-fusions-0 Доступно 2/14/2020
FDA одобряет авапритиниб для лечения опухоли стромы желудочно-кишечного тракта с редкая мутация. Дата последнего редактирования: 09.01.2020. Доступно по адресу: https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-avapritinib-gastrointestinal-stromal-tumor-rare-mutation, дата обращения 18.02.2020.
Желудочно-кишечная стромальная опухоль — GIST: Статистика
НА ЭТОЙ СТРАНИЦЕ: Вы найдете информацию о количестве людей, которым ежегодно ставится диагноз GIST. Вы также прочтете общую информацию о том, как пережить болезнь. Помните, что выживаемость зависит от нескольких факторов. Используйте меню для просмотра других страниц.
ГИСО встречаются редко, составляя менее 1% всех опухолей желудочно-кишечного тракта. Ежегодно приблизительно от 4000 до 6000 взрослых в США будут диагностированы GIST. Около 60% GIST начинаются в желудке, а около 35% развиваются в тонком кишечнике. Остальные типы GIST обычно начинаются в прямой кишке, толстой кишке и пищеводе.
Около 60% GIST начинаются в желудке, а около 35% развиваются в тонком кишечнике. Остальные типы GIST обычно начинаются в прямой кишке, толстой кишке и пищеводе.
5-летняя выживаемость показывает, какой процент людей живет 5 или более лет после обнаружения рака. Процент означает, сколько из 100. 5-летняя выживаемость для людей с GIST составляет 83%. Однако выживаемость для этого типа опухоли зависит от нескольких факторов, включая конкретные биологические характеристики опухоли, тип лечения и риск того, что опухоль вернется после лечения.
Если опухоль не распространилась из органа, в котором она возникла, 5-летняя выживаемость составляет 93%. Если рак распространился на окружающие ткани или органы, 5-летняя выживаемость составляет 80%. Если при первом диагнозе рак распространился на отдаленную часть тела, выживаемость составляет 55%.
Важно помнить, что статистика выживаемости людей с GIST является приблизительной. Оценка основана на годовых данных, основанных на количестве людей с GIST в Соединенных Штатах.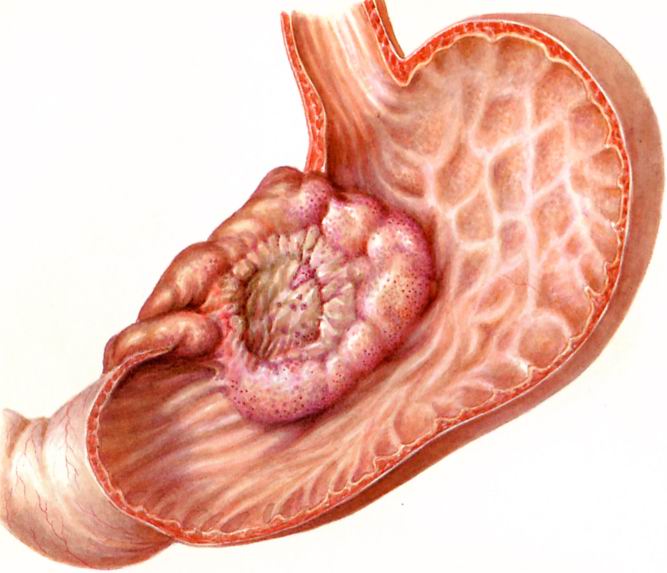 Также каждые 5 лет специалисты измеряют статистику выживаемости. Таким образом, оценка может не отражать результаты более точной диагностики или лечения, доступного менее чем за 5 лет. Если у вас есть какие-либо вопросы по поводу этой информации, поговорите со своим врачом. Узнайте больше о статистике.
Также каждые 5 лет специалисты измеряют статистику выживаемости. Таким образом, оценка может не отражать результаты более точной диагностики или лечения, доступного менее чем за 5 лет. Если у вас есть какие-либо вопросы по поводу этой информации, поговорите со своим врачом. Узнайте больше о статистике.
Статистика адаптирована с веб-сайта Американского онкологического общества и с веб-сайта Национального института рака (источники по состоянию на январь 2021 г.).
Следующий раздел в этом руководстве — Факторы риска .В нем объясняется, какие факторы могут увеличить вероятность развития ГИСО. Используйте меню, чтобы выбрать другой раздел для чтения в этом руководстве.
Желудочно-кишечная стромальная опухоль (GIST) | Сидарс-Синай
Не то, что вы ищете?Что такое стромальная опухоль желудочно-кишечного тракта (ГИСО)?
Рак состоит из измененных клеток, которые бесконтрольно разрастаются. В
измененные (аномальные) клетки часто растут, образуя комок или массу, называемую опухолью.Рак
клетки также могут прорастать (вторгаться) в близлежащие области. И они могут распространяться на другие части
тела. Это называется метастазированием.
В
измененные (аномальные) клетки часто растут, образуя комок или массу, называемую опухолью.Рак
клетки также могут прорастать (вторгаться) в близлежащие области. И они могут распространяться на другие части
тела. Это называется метастазированием.
Стромальная опухоль желудочно-кишечного тракта (ГИСО) — редкая опухоль желудочно-кишечный тракт. Они начинаются в специальных ячейках, называемых межстраничными. клетки Кахала (МКК). ICC являются частью вегетативной нервной системы и координируют автоматические движения тракта GI.ИКК иногда называют «кардиостимуляторами». желудочно-кишечного тракта, потому что они посылают сигналы мышцам пищеварительной системы, велит им перемещать пищу и жидкость через желудочно-кишечный тракт.
Большинство GIST начинаются в желудке или тонком кишечнике. Но они могут
возникают в любом месте пищеварительного тракта от пищевода до
анус.
Ученые начинают разгадывать некоторые процессы, которые происходят на внутренних клетках, которые заставляют их развиваться в GIST.Обычно эти клетки, например другие клетки в организме растут и делятся контролируемым образом. Но иногда дела идут не так. Это позволяет этим клеткам выйти из-под контроля и в конечном итоге стать рак.
Ученые обнаружили, что клетки растут в неконтролируемом
образом в результате дефекта (мутации) в их ДНК. В большинстве ГИСО конкретная
дефект гена заставляет клетки вырабатывать слишком много фермента под названием KIT.KIT — это
фермент под названием тирозинкиназа. Он отвечает за рост и выживание
сигналы внутри клетки. Если ген, производящий KIT, включен, клетка остается живой и
растет в количестве. Сверхактивный неконтролируемый мутантный ген KIT запускает побег
рост клеток GIST.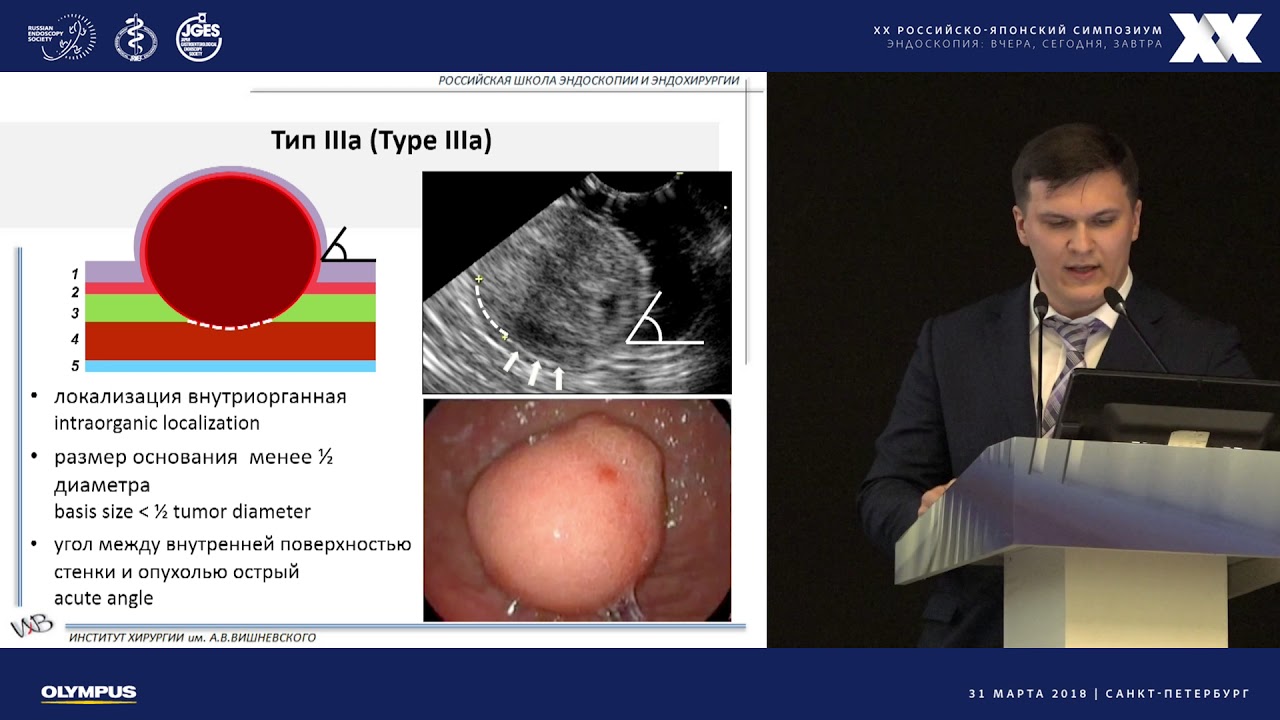
Гораздо реже клетки GIST производят слишком много другого белка. называется PDGFRA. Этот белок также может вызывать рост клеток.Эти взгляды на способ развития GIST уже помог найти новые методы лечения.
Кто подвержен риску развития стромальной опухоли желудочно-кишечного тракта?
Фактором риска является все, что может увеличить ваши шансы на болезнь. Точная причина рака может быть неизвестна. Но факторы риска может повысить вероятность заболевания раком. Некоторые факторы риска могут отсутствовать ваш контроль.Но другие вещи можно изменить.
Факторы риска GIST включают:
- В анамнезе нейрофиброматоз 1 типа, также известный как фон Болезнь Реклингхаузена
- Быть мужчиной
- Возраст 50 и старше
- Редкие наследственные синдромы, такие как синдром Карни-Стратакиса синдром
- Семейная история ГИСО
Поговорите со своим врачом о факторах риска
GIST и что вы можете с ними сделать.
Можно ли предотвратить стромальную опухоль желудочно-кишечного тракта?
В настоящее время скрининговый тест для проверки GIST не проводится. Тем не менее, чем раньше будет обнаружена и лечится какая-либо опухоль, тем больше шансов на выживание. По этой причине, если вы заметили возможные признаки или симптомы GIST, обсудите их. немедленно обратитесь к своему врачу.
Каковы симптомы стромы желудочно-кишечного тракта? опухоль?
Люди с ГИСО на ранней стадии часто не имеют никаких симптомов болезнь.Большинство GIST диагностируются после появления симптомов. Сюда могут входить:
- Дискомфорт или боль в животе (брюшной полости)
- Шишка или образование в животе, которое вы можете почувствовать
- Рвота
- Кровь в стуле или рвоте
- Усталость из-за низкого количества эритроцитов (анемия), вызванная по кровотечению
- Чувство сытости после небольшого приема пищи (раннее сытости)
- Потеря аппетита или похудание
Многие из них могут быть вызваны другими проблемами со здоровьем. Но это
Если у вас есть эти симптомы, важно обратиться к врачу. Только
врач может определить, есть ли у вас рак.
Но это
Если у вас есть эти симптомы, важно обратиться к врачу. Только
врач может определить, есть ли у вас рак.
Как диагностируется стромальная опухоль желудочно-кишечного тракта?
Если ваш поставщик медицинских услуг считает, что у вас может быть GIST, вы для уверенности нужны определенные экзамены и тесты. Ваш лечащий врач спросит вас о история вашего здоровья, симптомы, факторы риска и семейный анамнез заболевания.Он или она также сделает вам медицинский осмотр. У вас также может быть один или несколько из них тестов:
- Эндоскопия. В этом тесте используется тонкая, освещенная трубка с крошечной видеокамерой на конце, которая проходит по горло. Через эту трубку врач может заглянуть внутрь желудка.
- Визуализирующие тесты, такие как КТ
сканирование или МРТ.
 Это может быть сделано для поиска аномального роста. Они могут
показать, где рост и распространился ли он.
Это может быть сделано для поиска аномального роста. Они могут
показать, где рост и распространился ли он. - Биопсия. Биопсия — это единственный способ подтвердить рак. Из опухоли берут небольшие кусочки ткани. и проверили на наличие раковых клеток. Врач может получить образцы биопсии во время эндоскопия. В других случаях он или она может взять образец, приложив тонкий полый иглой через кожу и в опухоль, или возьмите образец во время хирургия.
После биопсии образец ткани исследуют под
микроскоп врачом-патологом. Одна из вещей, которые патологоанатом
тест на фермент KIT. Большинство GIST производят KIT, также называемый CD117. Поиск KIT — это
называется «экспрессией CD117» или «положительностью CD117». Это помогает доказать, что рост
это ГИСО.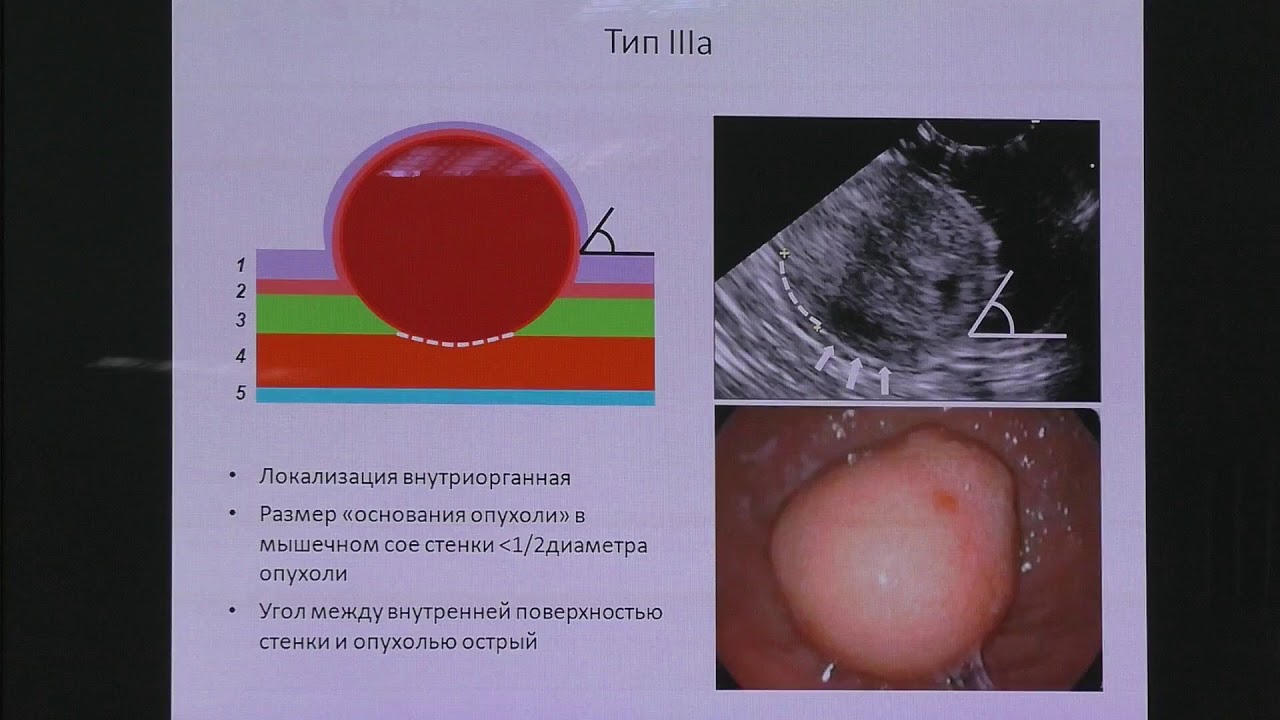 Если CD117 не обнаружен, образец можно проверить на PDGFRA.
белок.
Если CD117 не обнаружен, образец можно проверить на PDGFRA.
белок.
После диагностики GIST вам могут потребоваться другие тесты. Эти помогают Ваши врачи узнают больше о вашем раке. Они могут помочь определить стадия рака. Стадия — насколько и насколько далеко распространился рак (с метастазами) в вашем теле. Это одна из самых важных вещей, которую нужно знать, когда решая, как лечить рак.
Как только ваш рак будет поставлен на стадию, ваш врач поговорит с вами о том, что означает этап для вашего лечения.Обязательно спросите у своего поставщик медицинских услуг, чтобы объяснить вам стадию вашего рака так, как вы можете понимать.
Как лечится стромальная опухоль желудочно-кишечного тракта?
GIST растет у каждого человека по-разному. Размер и расположение
опухоль и скорость ее роста важны для определения риска
опухоль присутствует. Риск распространения на другие части тела (метастазирование) может варьироваться.
много.
Риск распространения на другие части тела (метастазирование) может варьироваться.
много.
Иногда трудно отличить доброкачественную опухоль от рака (злокачественный). Но большинство экспертов сходятся во мнении, что все ГИСО имеют некоторый риск развития злокачественных новообразований. поведение. В некоторых случаях может распространяться даже небольшая опухоль, которая не растет быстро. Расположение опухоли, похоже, влияет на ее поведение. Когда GIST метастазирует, обычно распространяется в печень или слизистую оболочку брюшной полости. стена.
Хирургия
В большинстве случаев следует рассмотреть возможность хирургического вмешательства.Это должно быть сделано
опытным хирургом, имеющим опыт лечения GIST. Цель операции
заключается в полном удалении опухоли. Но операция сама по себе может не сработать для большего
GIST или GIST, который распространился. Иногда врач лечит большие
опухоль с помощью таргетной терапии, чтобы она сморщилась настолько, чтобы ее можно было удалить
хирургия.
Но операция сама по себе может не сработать для большего
GIST или GIST, который распространился. Иногда врач лечит большие
опухоль с помощью таргетной терапии, чтобы она сморщилась настолько, чтобы ее можно было удалить
хирургия.
Лекарственные средства таргетной терапии
Таргетная терапия — это использование лекарств, направленных на определенные части раковые клетки, которые отличают их от нормальных клеток.Таргетированная терапия лекарства, используемые для лечения GIST, включают:
- Иматиниб. Это
часто первое лекарство, используемое для GIST. Его можно дать перед операцией
попытаться уменьшить опухоль или после операции, чтобы снизить риск
рак возвращается.
 Возможно, он не излечивает распространенный ГИСО, но часто может помочь
люди живут дольше и чувствуют себя лучше.Лекарство принимают внутрь как
таблетка. Побочные эффекты в основном от легких до умеренных. Самый частый побочный эффект
легкая тошнота. Другие побочные эффекты также обычно незначительны. Они включают
диарея, задержка жидкости и частые отеки вокруг глаз, расстройство желудка,
мышечные спазмы, кровотечение из опухоли GIST, усталость и кожная сыпь.
Возможно, он не излечивает распространенный ГИСО, но часто может помочь
люди живут дольше и чувствуют себя лучше.Лекарство принимают внутрь как
таблетка. Побочные эффекты в основном от легких до умеренных. Самый частый побочный эффект
легкая тошнота. Другие побочные эффекты также обычно незначительны. Они включают
диарея, задержка жидкости и частые отеки вокруг глаз, расстройство желудка,
мышечные спазмы, кровотечение из опухоли GIST, усталость и кожная сыпь. - Сунитиниб. Это
лекарство часто используется, когда иматиниб не работает или если побочные эффекты
иматиниб — это проблема. Сунитиниб часто может уменьшить опухоль или остановить ее развитие.
растет какое-то время. Это может помочь людям с GIST прожить дольше. Это занято
рот как таблетка.
 Наиболее частые побочные эффекты — диарея, ротовая полость.
раздражение, изменение цвета кожи и волос. Более серьезные побочные эффекты
может включать высокое кровяное давление, повышенный риск кровотечения, отек и
проблемы с сердцем и печенью.
Наиболее частые побочные эффекты — диарея, ротовая полость.
раздражение, изменение цвета кожи и волос. Более серьезные побочные эффекты
может включать высокое кровяное давление, повышенный риск кровотечения, отек и
проблемы с сердцем и печенью. - Регорафениб. Это лекарство часто используется, если другие лекарства больше не действуют. Может часто уменьшает опухоль или на время замедляет ее рост. Принимается внутрь как таблетка. Побочные эффекты могут включать диарею, чувство усталости, повышенное кровяное давление. давление, язвы во рту, выпадение волос, потеря аппетита и проблемы с покраснение и боль в ладонях и подошвах стоп.
Применяются такие методы лечения, как лучевая терапия и химиотерапия
гораздо реже.
Ваш лечащий врач обсудит с вами лечение, которое лучше всего подходит для вас. Составьте список вопросов. Подумайте о преимущества и возможные побочные эффекты каждого варианта. Поговорите о своих проблемах с Ваш лечащий врач, прежде чем принимать решение.
Какие стороны лечения стромальных опухолей желудочно-кишечного тракта? последствия?
Важно знать, какие лекарства вы принимаете. Написать свой лекарства и спросите свою медицинскую бригаду, как они работают и какие побочные эффекты они могли бы иметь.
Поговорите со своими поставщиками медицинских услуг о том, на какие признаки следует обращать внимание.
и когда им звонить.Например, иматиниб может вызывать кожные зудящие высыпания, которые могут
привести к инфекциям. Убедитесь, что вы знаете, по какому номеру обращаться с вопросами. Здесь
другой номер для вечеров и выходных?
Убедитесь, что вы знаете, по какому номеру обращаться с вопросами. Здесь
другой номер для вечеров и выходных?
Может быть полезно вести дневник побочных эффектов. Записывать физические, мыслительные и эмоциональные изменения. Письменный список облегчит чтобы вы запомнили свои вопросы, когда идете на прием. Это также сделает вам будет проще работать с вашей медицинской командой, чтобы составить план управления вашим побочные эффекты.
Как справиться со стромальной опухолью желудочно-кишечного тракта
Многие люди чувствуют беспокойство, депрессию и стресс, когда имеют дело
с раком. Лечение рака может быть тяжелым для души и тела. Держать
обсуждение любых проблем или опасений со своим лечащим врачом. Работа
вместе, чтобы ослабить влияние рака и его симптомов на вашу повседневную жизнь.
Обязательно:
- Поговорите с семьей или друзьями.
- Обратитесь за помощью к своему лечащему врачу или социальному работнику.
- Поговорите с консультантом.
- Поговорите с духовным наставником, например, священником или раввин.
- Спросите у своего лечащего врача о лекарствах от депрессии или беспокойство.
- Сохраняйте социальную активность.
- Присоединяйтесь к группе поддержки рака.
Лечение рака также тяжело сказывается на теле.Чтобы помочь себе остаться здоровее, постарайтесь:
- Придерживайтесь здоровой диеты, включая столько белковой пищи, сколько возможный.
- Пейте много воды, фруктовых соков и других жидкостей.
- Сохраняйте физическую активность.

- Отдыхайте сколько угодно.
- Поговорите со своим лечащим врачом о способах лечения побочные эффекты лечения.
- Принимайте лекарства в соответствии с указаниями вашей команды.
Когда мне следует позвонить своему врачу?
Ваш лечащий врач обсудит с вами, когда звонить. Вас могут попросить позвонить, если у вас есть один из следующих номеров:
- Новые симптомы или симптомы, которые усиливаются
- Признаки инфекции, например лихорадки
- Побочные эффекты лечения, влияющие на вашу повседневную жизнь или не поправляйся лечением
Спросите своего лечащего врача, на какие признаки нужно обращать внимание и когда
вызов.Знайте, как получить помощь в нерабочее время, а также в выходные и праздничные дни.
Следующие шаги
Советы, которые помогут вам получить максимальную пользу от посещения вашего врача провайдер:
- Знайте причину вашего визита и то, что вы хотите случаться.
- Перед визитом запишите интересующие вас вопросы ответил.
- Возьмите с собой кого-нибудь, кто поможет вам задать вопросы и помните, что вам говорит ваш провайдер.
- При посещении запишите название нового диагноза и любые новые лекарства, методы лечения или тесты. Также запишите все новые инструкции ваш провайдер дает вам.
- Узнайте, почему прописано новое лекарство или лечение и как это поможет вам. Также знайте, какие бывают побочные эффекты.
- Спросите, можно ли вылечить ваше состояние другими способами.

- Знайте, почему рекомендуется тест или процедура и какие результаты могут означать.
- Знайте, чего ожидать, если вы не примете лекарство или тест или процедура.
- Если вам назначена повторная встреча, запишите дату, время и цель этого визита.
- Узнайте, как можно связаться со своим поставщиком услуг, если у вас вопросов.
Желудочно-кишечная стромальная опухоль | саркома мягких тканей
GIST — это редкий тип саркомы, обнаруживаемый в пищеварительной системе, чаще всего в стенке желудка.Саркома мягких тканей — это разновидность рака.
Кто получает GIST
GIST чаще всего встречается у пожилых людей.
Люди с генетическим заболеванием, называемым нейрофиброматозом (НФ), имеют повышенный риск развития ГИСО.
GIST у детей встречается редко.
Симптомы
Люди с ранней стадией GIST часто не имеют никаких симптомов. Таким образом, ГИСО на ранней стадии может быть обнаружен, когда люди проходят тесты на другие заболевания. Большинство ГИСО диагностируются на более поздних стадиях заболевания.Симптомы расширенного ГИСО, вероятно, включают:
- боль или дискомфорт в животе (животе)
- ощущение полноты
- тошнота
- кровь в стуле или рвота
- чувство сильной усталости
- низкое количество эритроцитов (анемия)
Другое медицинское эти симптомы могут быть вызваны другими заболеваниями, помимо рака. Если у вас есть эти симптомы, вам следует обратиться к врачу. GIST встречается редко, поэтому с большей вероятностью они будут вызваны чем-то менее серьезным, но всегда лучше проверить.
Лечение
Ваше лечение зависит от размера и расположения рака, а также от вашего общего состояния здоровья.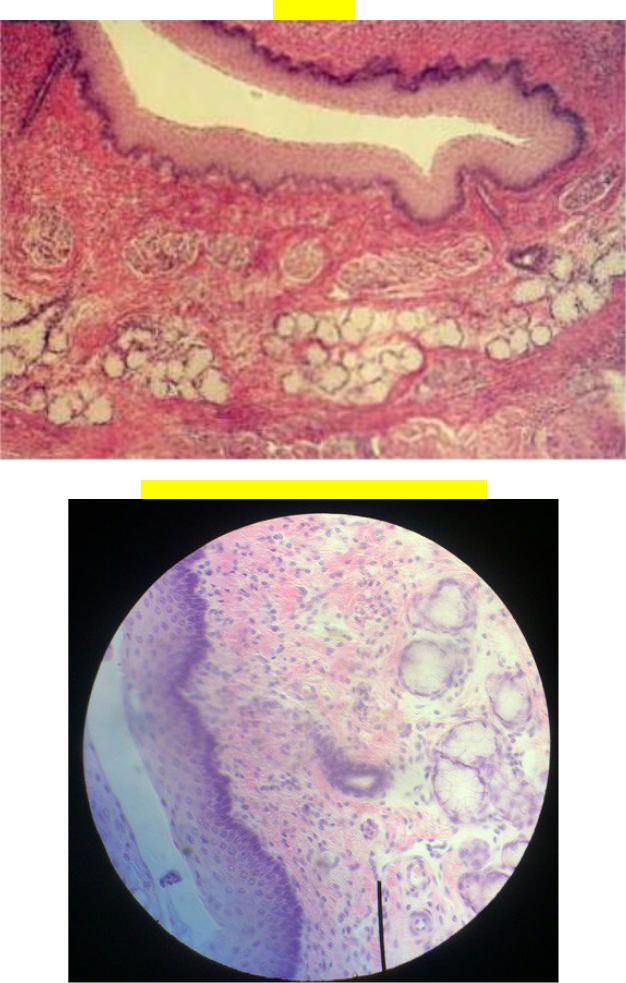 Ваш специалист обсудит это с вами.
Ваш специалист обсудит это с вами.
Хирургия
Хирургия обычно является основным методом лечения GIST. Ваш хирург стремится удалить как можно большую часть рака с границей здоровой ткани (чистой границей) вокруг нее. Наличие границы здоровой ткани без каких-либо раковых клеток важно, поскольку это снижает риск рецидива рака.
Хирургическое вмешательство может вылечить ГИСО меньшего размера.Но, возможно, хирургу не удастся полностью удалить ГИСО большего размера.
GIST может иногда распространяться на другие части тела. Это распространение называется вторичным или метастазами. В некоторых ситуациях хирург может удалить эти вторичные образования.
GIST в желудке означает, что вашему хирургу может потребоваться удалить весь желудок или его часть. Также может потребоваться удаление селезенки. Операция на желудке — сложная операция, и впоследствии потребуется некоторое время, чтобы скорректировать режим питания.Вам, вероятно, придется есть часто и небольшими порциями (примерно два часа в сутки) в течение довольно долгого времени после операции.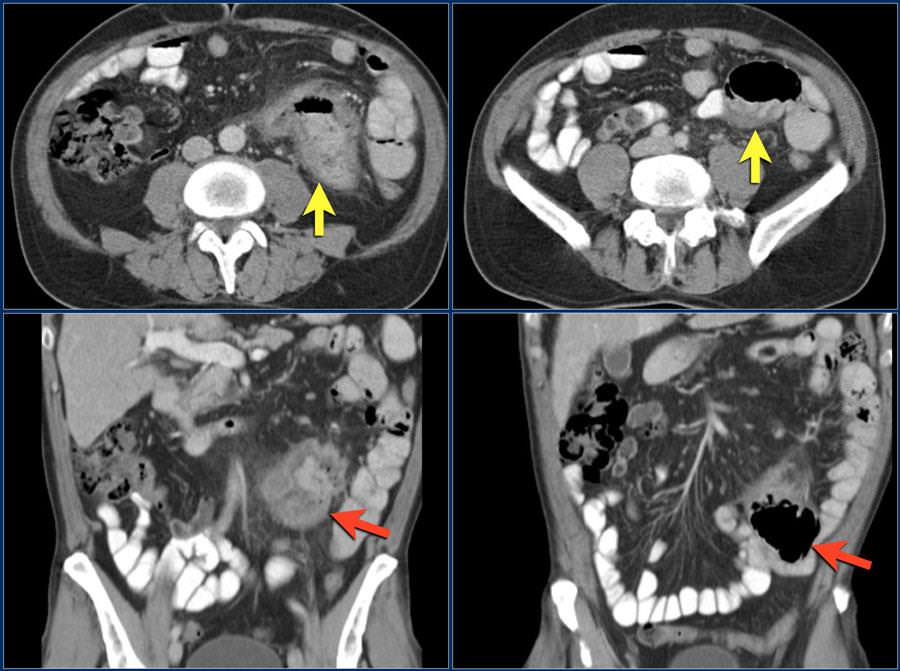
Целевые противораковые препараты
Раковые клетки имеют изменения в генах (ДНК), которые отличают их от нормальных клеток. Эти изменения означают, что они ведут себя иначе. Раковые клетки могут расти быстрее нормальных клеток и иногда распространяться. Таргетные противораковые препараты действуют, «нацеливая» те различия, которые есть у раковой клетки.
Тип направленного противоракового препарата, используемый для GIST, называется ингибитором тирозинкиназы (TKI).Они блокируют химические мессенджеры (ферменты), называемые тирозинкиназами. Тирозинкиназы помогают посылать в клетки сигналы роста, поэтому их блокирование останавливает рост и деление клеток.
Примеры TKI, используемых для лечения GIST, включают:
- иматиниб (Гливек)
- сунитиниб (Сутент)
- регорафениб (Стиварга)
Иматиниб (Гливек)
Возможно, вам назначили иматиниб для лечения ГИСО, который нельзя полностью удалить хирургическим путем или который распространился до операции.
Некоторые люди с ГИСО имеют более высокий риск рецидива рака после операции. Это называется GIST высокого риска. Иматиниб может помочь снизить вероятность возврата ГИСО. Поэтому в этой ситуации ваш врач может порекомендовать вам принимать иматиниб в течение 3 лет после операции.
Вам также может быть назначен иматиниб для уменьшения ГИСО перед операцией, чтобы хирург мог легче его удалить. Иногда хирург может полностью удалить ГИСО после лечения иматинибом.
Анализ белков на иматиниб
Вашему врачу нужен образец вашего ГИСО для проведения тестирования на белок. Этот образец может быть взят из того, когда вам делали биопсию для диагностики GIST или операцию по удалению GIST. Клетки проверяются, чтобы увидеть, есть ли на их поверхности рецептор под названием CD117.
Этот белок CD117 производится геном под названием c-kit. Ошибка в этом гене заставляет ген c-kit производить слишком много белка CD117. Большинство GIST имеют мутации гена c-kit.
Если клетки GIST положительны по CD117, иматиниб, вероятно, будет работать очень хорошо. Но это может работать даже для GIST, которые отрицательны по CD117.
Сунитиниб (Сутент)
Ваш врач может порекомендовать вам сунитиниб (Сутент) в одной из следующих ситуаций:
- иматиниб перестал работать
- У вас наблюдались серьезные побочные эффекты при лечении иматинибом
У вас должен быть ГИСО, который нельзя полностью удалить или который распространился.
Регорафениб (Стиварга)
Регорафениб (Стиварга) используется для лечения расширенного ГИСО. Ваш врач может порекомендовать регорафениб, если вы проходили лечение иматинибом и сунитинибом и этими препаратами:
- не работали
- или вызывает серьезные побочные эффекты
Расширенный GIST означает, что вам нельзя делать операцию по удалению GIST, или он распространился. Чтобы принимать это лекарство, вы должны быть в хорошей физической форме.
Как справиться
Справиться с диагнозом редкого рака может быть особенно сложно, как с практической, так и с эмоциональной точки зрения.Если вы хорошо осведомлены о своем раке и его лечении, вам будет легче принимать решения и справляться с происходящим.
Разговор с другими людьми
Разговор с другими людьми, у которых есть то же самое, также может помочь.
Наш дискуссионный форум Cancer Chat — это место для всех, кто страдает раком. Вы можете поделиться своим опытом, историями и информацией с другими людьми, которые знают, что вы переживаете.
Некоторые организации по лечению саркомы предлагают информацию и поддержку, особенно GIST Support UK.Это организация людей с GIST и их семей
Что такое GIST?
Желудочно-кишечный тракт означает, что они запускаются в пищеварительной системе (желудочно-кишечном тракте). Стромальный означает, что они развиваются из тканей, которые поддерживают соединительные ткани, контролируя движения кишечника. Опухоль означает образование в теле, которое может быть раком, а может и не быть.
Опухоль означает образование в теле, которое может быть раком, а может и не быть.
Некоторые GIST ведут себя незлокачественным (доброкачественным) образом. Как правило, опухоль, которая ведет себя доброкачественно, имеет тенденцию к относительно медленному росту и с меньшей вероятностью вернется.
Опухоль, которая ведет себя раковым (злокачественным) образом, растет быстрее и с большей вероятностью вернется или распространится.
Чем больше GIST, тем больше вероятность того, что он будет вести себя как рак. И если не лечить, доброкачественная опухоль может начать действовать как рак. Большинство этих опухолей возникают в стромальной ткани желудка. Но они могут начаться в любом месте пищеварительной системы, например в кишечнике или пищеводе (пищеводе). Очень редко они развиваются вне желудочно-кишечного тракта.
.

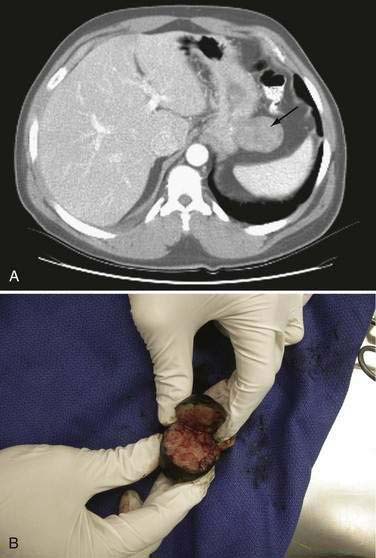
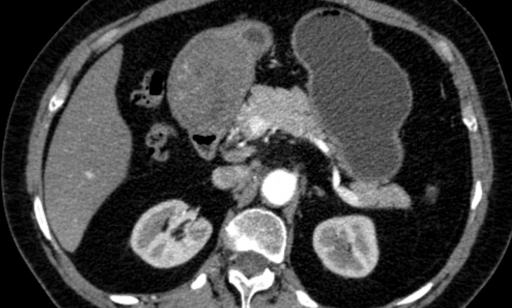 Radiology 2003; 22 (6): 527–32.
Radiology 2003; 22 (6): 527–32. Current standarts and progress in understanding and treatment of GIST. Swissmedkly 2009; 139 (7–8): 90–102.
Current standarts and progress in understanding and treatment of GIST. Swissmedkly 2009; 139 (7–8): 90–102.

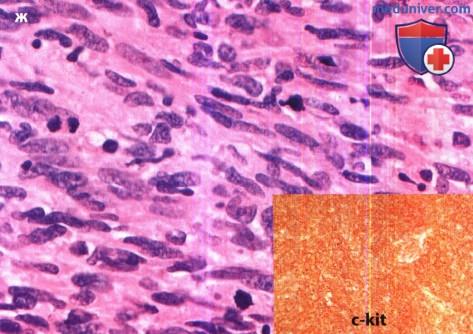
 Во время этого теста вы получите мягкое расслабляющее лекарство (седативное средство) через внутривенную трубку.
Во время этого теста вы получите мягкое расслабляющее лекарство (седативное средство) через внутривенную трубку. Эта процедура аналогична EUS , но с тонкой полой иглой на конце эндоскопа. Игла используется для удаления небольшого количества ткани для лабораторного анализа.
Эта процедура аналогична EUS , но с тонкой полой иглой на конце эндоскопа. Игла используется для удаления небольшого количества ткани для лабораторного анализа. Клетки GIST также исследуют под микроскопом, чтобы увидеть, сколько клеток из 50 различных микроскопических полей активно делятся.Это число известно как скорость митоза. Чем выше скорость митоза в опухоли, тем она агрессивнее и тем выше вероятность распространения на другие органы.
Клетки GIST также исследуют под микроскопом, чтобы увидеть, сколько клеток из 50 различных микроскопических полей активно делятся.Это число известно как скорость митоза. Чем выше скорость митоза в опухоли, тем она агрессивнее и тем выше вероятность распространения на другие органы. Это может быть сделано для поиска аномального роста. Они могут
показать, где рост и распространился ли он.
Это может быть сделано для поиска аномального роста. Они могут
показать, где рост и распространился ли он. Возможно, он не излечивает распространенный ГИСО, но часто может помочь
люди живут дольше и чувствуют себя лучше.Лекарство принимают внутрь как
таблетка. Побочные эффекты в основном от легких до умеренных. Самый частый побочный эффект
легкая тошнота. Другие побочные эффекты также обычно незначительны. Они включают
диарея, задержка жидкости и частые отеки вокруг глаз, расстройство желудка,
мышечные спазмы, кровотечение из опухоли GIST, усталость и кожная сыпь.
Возможно, он не излечивает распространенный ГИСО, но часто может помочь
люди живут дольше и чувствуют себя лучше.Лекарство принимают внутрь как
таблетка. Побочные эффекты в основном от легких до умеренных. Самый частый побочный эффект
легкая тошнота. Другие побочные эффекты также обычно незначительны. Они включают
диарея, задержка жидкости и частые отеки вокруг глаз, расстройство желудка,
мышечные спазмы, кровотечение из опухоли GIST, усталость и кожная сыпь. Наиболее частые побочные эффекты — диарея, ротовая полость.
раздражение, изменение цвета кожи и волос. Более серьезные побочные эффекты
может включать высокое кровяное давление, повышенный риск кровотечения, отек и
проблемы с сердцем и печенью.
Наиболее частые побочные эффекты — диарея, ротовая полость.
раздражение, изменение цвета кожи и волос. Более серьезные побочные эффекты
может включать высокое кровяное давление, повышенный риск кровотечения, отек и
проблемы с сердцем и печенью.